Композиции, повышающие число копий вектора (чкв), и способы их применения - RU2744603C2
Код документа: RU2744603C2
Чертежи























Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в соответствии со статьей 35 §119(e) Свода законов США на основании предварительной заявки на патент США №62/429,514, поданной 2 декабря 2016 г., 62/417,085, поданной 3 ноября 2016 г., предварительной заявки на патент США №62/313,571, поданной 25 марта 2016 г., и предварительной заявки на патент США №62/294,615, поданной 12 февраля 2016 г., описание каждой из которых полностью включено в данную заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Область техники
Настоящее изобретение в общем смысле относится, в том числе, к улучшенным композициям для генной терапии и способам их получения.
Описание предшествующего уровня техники
Генотерапия имеет огромный потенциал в новой эре медицины человека. Методики генотерапии позволят лечить состояния, лечение которых было недоступно в рамках стандартной медицинской практики. Тем не менее, Управление по надзору за качеством пищевых продуктов и лекарственных средств США (FDA) еще не одобрило продажу ни одного продукта для генотерапии человека. Современная генотерапия экспериментальна и приводит к неоднозначным результатам в клинических испытаниях. Ginn и др., J Gene Med 2013 и Naldini и др., Nature Review 2015.
В 1999 г. генотерапия потерпела главную неудачу со смертью 18-летнего Jesse Gelsinger. Jesse участвовал в генотерапевтическом испытании для лечения недостаточности орнитинтранскарбоксилазы (OTCD). Он умер от полиорганной недостаточности через 4 дня после начала лечения. Считают, что к его смерти привел сильный иммунный ответ на аденовирусный носитель. Sibbald и др., СМА J 2001.
Другой крупный провал произошел в январе 2003 г., когда FDA временно приостановили все генотерапевтические испытания с применением ретровирусных векторов в стволовых клетках крови. FDA предприняло такое действие после того, как стало известно о том, что у второго ребенка, которого лечили во французском генотерапевтическом испытании, развилось подобное лейкозу состояние. Hacein-Bey-Abina и др., Science 2003. Как этого ребенка, так и другого, у которого развилось аналогичное состояние в августе 2002, успешно лечили путем генотерапии Х-сцепленного тяжелого комбинированного иммунодефицита (X-SCID), также известного как "синдром мальчика в пузыре". Консультативный комитет FDA по проблемам модификаторов биологического ответа (BRMAC) встретился в конце февраля 2003 г., чтобы обсудить возможные меры, которые могли бы позволить проводить множество генотерапевтических испытаний с использованием ретровирусов для лечения опасных для жизни заболеваний с подходящими мерами обеспечения безопасности. В апреле 2003 г. FDA сняло запрет на генотерапевтические испытания с применением ретровирусных векторов в стволовых клетках крови.
Тем не менее, недавно несколько групп исследователей провели умеренно успешные генотерапевтические испытания для борьбы с несколькими заболеваниями. В 2008 г. исследователи из Великобритании из Института офтальмологии UCL и Центра биомедицинских исследований NIHR Больницы глаз Moorfields доложили об успешном генотерапевтическом клиническом испытании для лечения врожденного амавроза Лебера - одного из типов наследственной слепоты. Полученные результаты показали, что экспериментальное лечение безопасно и способно улучшить зрение (Maguire и др., N Engl J Med. 358(21):2240 (2008)).
В 2009 г. группа французских ученых доложила о применении генотерапии, опосредованной гематопоэтическими стволовыми клетками, для успешного лечения Х-сцепленной адренолейкодистрофии (ALD). Carrier и др., Science 2009. Аутологические стволовые клетки удаляли из пациентов, вносили в них генетические изменения ex vivo, а затем вводили их обратно пациенту путем инфузии после того, как пациент получал миелоаблативную терапию. На протяжении 24-30 месяцев последующего наблюдения обнаружили поликлональное восстановление с 9-14% гранулоцитов, моноцитов и Т- и В-лимфоцитов, экспрессирующих белок ALD. Данные результаты убедительно указывают на то, что гематопоэтические стволовые клетки были трансдуцированы у данных пациентов. Начиная с 14-16 месяца после инфузии генетически скорректированных клеток, прогрессирующая церебральная демиелинизация у двух пациентов остановилась.
В 2011 г. Neurologix, Inc. объявила о положительных результатах фазы 2 испытаний экспериментальной генотерапии поздней стадии болезни Паркинсона (БП) - NLX-P101. У участников исследования, которые получали NLX-P101, выявили статистически значимые и клинически значимые улучшения показателей двигательной активности при воздержании от приема лекарств по сравнению с контрольными субъектами, которым провели фиктивное хирургическое вмешательство. В данном исследовании такое благоприятное действие наблюдали через один месяц и продолжали наблюдать практически неизменно на протяжении периода слепого исследования, составляющего шесть месяцев. Полученные результаты также продемонстрировали положительный профиль безопасности NLX-P101, при этом не сообщалось о серьезных нежелательных явлениях, связанных с генотерапией или хирургической процедурой. У пациентов, включенных в данное исследование, была БП средней - поздней стадии, и они не были в достаточной мере восприимчивы к современным методам лечения.
Недавний прогресс в области генотерапии дал надежду на то, что для пациентов, страдающих от гемоглобинопатии, таких как β-талассемия и серповидноклеточная анемия, будут полезны новые терапевтические подходы. Cavazzana-Calvo и др., Nature 2010. Трансплантация гематопоэтических клеток (ГСК), модифицированных лентивирусными векторами, несущими ген β-глобина, привела к длительной коррекции гемоглобиновых расстройств в нескольких моделях на мышах, например, Imren и др., Proc Natl Acad Set USA. 2002; 99(22):14380-14385; Malik и др., Ann NY Acad Sci. 2005; 1054:238-249; May и др., Nature. 2000; 406(6791):82-86; Pawliuk и др., Science. 2001; 294(5550): 2368-2371).
Хотя основные преимущества введения путем инфузии генетически модифицированных аутологических клеток состоят в том, что удается избежать риска реакции «трансплантат против хозяина» (РТПХ) и дотрансплантационной иммунодепрессивной подготовки, а также проблемы отсутствия совместимых доноров, для современной терапии существует по меньшей мере три важных предостережения: необходимость токсичной миелоабляции (Dunbar и др.,. Hum Gene Ther. 1998; 9(17):2629-2640); современные способы переноса генов не позволяют транедуцировать более некоторой фракции гематопоэтических стволовых клеток (ГСК) (Santoni de Sio и Naldini, Methods Mol Biol. 2009; 506:59-70); число копий вектора в транедуцированных ГСК часто находится на нижнем пределе для терапевтической эффективности; и эффективность и безопасность различных доступных стратегий селекции in vivo субоптимальны (Beard и др., J Clin Invest. 2010; 120(7):2345-2354; Cornetta и др., Cancer Gene Ther. 2006; 13(9):886-895; Milsom и др., Cancer Res. 2008; 68(15): 6171-6180).
На сегодняшний день существует огромное количество протоколов, которые используют исследовательские и клинические группы для введения лентивирусных генотерапевтических векторов в целевые клетки. В прошлом добивались высокой эффективности переноса генов в различные типы клеток, применяя различные стратегии. Тем не менее, большинство из данных стратегий, например, поликатионы, катионные липосомы, полибрен, включают применение адъювантной терапии, которая токсична для клеток, что ограничивает их применение с чувствительными целевыми клетками первичного происхождения, такими как гематопоэтические стволовые клетки и клетки-предшественники.
Известно, что гематопоэтические стволовые клетки и клетки-предшественники очень трудно эффективно трансдуцировать, и, следовательно, неэффективная трансдукция является одним из первичных ограничивающих факторов, предотвращающих внедрение генотерапии на основе ГСК в клиническую практику. Неэффективная трансдукция также повышает расходы на разработку генотерапевтических методов лечения, так как необходимы большие количества вектора для получения необходимого количества трансдуцированных клеток. Таким образом, повышение эффективности трансдукции гематопоэтических стволовых клеток и клеток-предшественников не только приведет к значительному клиническому результату, но и уменьшит количество вируса, необходимого для получения лекарственных продуктов и, таким образом, уменьшит стоимость клинических испытаний.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данной заявке предложены улучшенные способы генотерапии. В конкретных вариантах реализации генотерапия включает композиции гематопоэтических стволовых клеток и клеток-предшественников с повышенной терапевтической эффективностью и способы их получения и применения. В других конкретных вариантах реализации настоящего изобретения предложены композиции и способы повышения эффективности трансдукции и числа копий вектора (ЧКВ) в гематопоэтических стволовых клетках и клетках-предшественниках человека (ГСПК) с получением улучшенных генотерапевтических композиций.
В различных вариантах реализации настоящего изобретения предложена, в том числе, популяция гематопоэтических клеток, содержащая гематопоэтические стволовые клетки и клетки-предшественники (ГСПК), трансдуцированные ретровирусным вектором, при этом по меньшей мере 50% ГСПК трансдуцированы, и при этом среднее число копий вектора (ЧКВ) ГСПК составляет приблизительно от 0,5 до 5.
В конкретных вариантах реализации ретровирусный вектор представляет собой лентивирусный вектор.
В конкретных вариантах реализации лентивирусный вектор трансдуцирует ГСПК при множественности инфекции (МИ), составляющей от приблизительно 10 до приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор трансдуцирует ГСПК при множественности инфекции (МИ), составляющей от приблизительно 10 до приблизительно 25.
В конкретных вариантах реализации лентивирусный вектор трансдуцирует ГСПК при множественности инфекции (МИ), составляющей от приблизительно 10 до приблизительно 20.
В конкретных вариантах реализации ГСПК включают CD34+ клетки или CD133+ клетки.
В некоторых вариантах реализации ГСПК включают CD34+CD38LoCD90+CD45RA- клетки.
В дополнительных вариантах реализации по меньшей мере 75% клеток были трансдуцированы.
В дополнительных вариантах реализации по меньшей мере 90% клеток были трансдуцированы.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 1,0.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 1,5.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 2,0.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 2,5.
В некоторых вариантах реализации жизнеспособность популяции клеток составляет по меньшей мере 75%.
В дополнительных вариантах реализации жизнеспособность популяции клеток составляет по меньшей мере 85%.
В дополнительных вариантах реализации жизнеспособность популяции клеток составляет по меньшей мере 95%.
В дополнительных вариантах реализации уровень эндотоксина в популяции гематопоэтических клеток составляет не более 5,0 единиц эндотоксина (ЕЭ)/мл.
В некоторых вариантах реализации уровень эндотоксина в популяции гематопоэтических клеток составляет не более, чем 0,5 ЕЭ/мл.
В дополнительных вариантах реализации популяция клеток содержит по меньшей мере 1×106 клеток ГСПК.
В конкретных вариантах реализации популяция клеток содержит по меньшей мере 1×107 клеток ГСПК.
В конкретных вариантах реализации популяция клеток содержит по меньшей мере 1×108 клеток ГСПК.
В некоторых вариантах реализации популяция клеток содержит по меньшей мере 1×109 клеток ГСПК.
В конкретных вариантах реализации лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В дополнительных вариантах реализации лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В некоторых вариантах реализации лентивирусный вектор кодирует аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
В конкретных вариантах реализации лентивирусный вектор кодирует трипептидилпептидазу 1.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
В конкретных вариантах реализации лентивирусный вектор кодирует альфа-L-идуронидазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
В конкретных вариантах реализации лентивирусный вектор кодирует идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор, содержащий один или более элементов из области контроля локуса (LCR) β-глобина человека.
В некоторых вариантах реализации указанная LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
В конкретных вариантах реализации лентивирусный вектор дополнительно содержит 3'-энхансерный элемент β-глобина человека.
В дополнительных вариантах реализации представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
В конкретных вариантах реализации представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
В конкретных вариантах реализации лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 и вектор BCL11A shmir.
В различных вариантах реализации настоящего изобретения предложена, в том числе, популяция гематопоэтических клеток, содержащая гематопоэтические стволовые клетки и клетки-предшественники (ГСПК), трансдуцированные ретровирусом, при этом указанная популяция гематопоэтических клеток содержит по меньшей мере 85% ГСПК, при этом по меньшей мере 50% ГСПК трансдуцированы, при этом среднее число копий вектора (ЧКВ) в ГСПК составляет от приблизительно 0,5 до приблизительно 5,0, при этом жизнеспособность популяции клеток составляет по меньшей мере 75%, при этом уровень эндотоксина в популяции гематопоэтических клеток составляет от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл, и при этом указанная популяция гематопоэтических клеток содержит по меньшей мере 1×106 ГСПК.
В различных вариантах реализации настоящего изобретения предложена, в том числе, популяция гематопоэтических клеток, содержащая CD34+CD38LoCD90+CD45RA- клетки, трансдуцированные ретровирусом, при этом по меньшей мере 50% CD34+CD38LoCD90+CD45RA- клеток трансдуцированы, при этом CD34+CD38LoCD90+CD45RA- клетки содержат среднее ЧКВ от приблизительно 0,5 до приблизительно 5,0, при этом жизнеспособность популяции гематопоэтических клеток составляет по меньшей мере 75%, при этом уровень эндотоксина в популяции гематопоэтических клеток составляет от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл, и при этом указанная популяция гематопоэтических клеток содержит по меньшей мере 1×106 CD34+ клеток.
В различных вариантах реализации настоящего изобретения предложена, в том числе, популяция гематопоэтических клеток, содержащая CD34+ клетки, трансдуцированные ретровирусом, при этом по меньшей мере 50% CD34+ трансдуцированы, при этом CD34+ клетки содержат среднее число копий вектора (ЧКВ) от приблизительно 0,5 до приблизительно 5,0, при этом жизнеспособность популяции гематопоэтических клеток составляет по меньшей мере 75%, при этом уровень эндотоксина в популяции гематопоэтических клеток составляет от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл и при этом популяция содержит по меньшей мере 2×106 CD34+ клеток.
В конкретных вариантах реализации ретровирусный вектор представляет собой лентивирусный вектор.
В конкретных вариантах реализации лентивирусный вектор трансдуцирует ГСПК или CD34+ клетки при множественности инфекции (МИ) от приблизительно 10 до приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор трансдуцирует ГСПК или CD34+ при множественности инфекции (МИ) от приблизительно 10 до приблизительно 25.
В конкретных вариантах реализации лентивирусный вектор трансдуцирует ГСПК или CD34+ при множественности инфекции (МИ) от приблизительно 10 до приблизительно 20.
В некоторых вариантах реализации МИ составляет приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
В некоторых вариантах реализации по меньшей мере 75% клеток были трансдуцированы.
В дополнительных вариантах реализации по меньшей мере 90% клеток были трансдуцированы.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 1,0.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 1,5.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 2,0.
В конкретных вариантах реализации среднее ЧКВ составляет по меньшей мере 2,5.
В некоторых вариантах реализации жизнеспособность популяции клеток составляет по меньшей мере 85%.
В некоторых вариантах реализации жизнеспособность популяции клеток составляет по меньшей мере 95%.
В дополнительных вариантах реализации уровень эндотоксина в популяции гематопоэтических клеток составляет не более 5,0 ЕЭ/мл.
В некоторых вариантах реализации уровень эндотоксина в популяции гематопоэтических клеток составляет не более, чем 0,5 ЕЭ/мл.
В дополнительных вариантах реализации популяция клеток содержит по меньшей мере 1×107 клеток ГСПК.
В дополнительных вариантах реализации популяция клеток содержит по меньшей мере 1×108 клеток ГСПК.
В некоторых вариантах реализации популяция клеток содержит по меньшей мере 1×109 клеток ГСПК.
В некоторых вариантах реализации источником клеток является пуповинная кровь, костный мозг или мобилизованная периферическая кровь.
В некоторых вариантах реализации источником клеток является мобилизованная периферическая кровь.
В дополнительных вариантах реализации ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
В некоторых вариантах реализации ретровирусный вектор получен из лентивируса ВИЧ.
В дополнительных вариантах реализации ретровирусный вектор получен из лентивируса ВИЧ-1.
В некоторых вариантах реализации ретровирусный вектор содержит: а) 5' длинный концевой повтор (LTR); b) элемент экспорта РНК; с) центральный полипуриновый тракт (сРРТ) лентивируса; d) промотор, функционально связанный с представляющим интерес геном; и е) 3'-LTR самоинактивирующейся конструкции (SIN).
В некоторых вариантах реализации модифицированный 5'-LTR дополнительно содержит делецию относительно 5'-LTR дикого типа.
В конкретных вариантах реализации промотор 5'-LTR заменяют на гетерологичный промотор, выбранный из группы, состоящей из: промотора цитомегаловируса (CMV), промотора вируса саркомы Рауса (RSV) или промотора вируса обезьян 40 (SV40).
В дополнительных вариантах реализации элемент экспорта РНК включает посттранскрипционный регуляторный элемент вируса гепатита В (PRE) или Rev- чувствительный регуляторный элемент вируса иммунодефицита человека (ВИЧ).
В некоторых вариантах реализации 3'-LTR содержит последовательность полиаденилирования.
В конкретных вариантах реализации лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В дополнительных вариантах реализации лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В некоторых вариантах реализации лентивирусный вектор кодирует аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
В конкретных вариантах реализации лентивирусный вектор кодирует трипептидилпептидазу 1.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
В конкретных вариантах реализации лентивирусный вектор кодирует альфа-L-идуронидазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
В конкретных вариантах реализации лентивирусный вектор кодирует идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
В некоторых вариантах реализации промотор содержит один или более элементов LCR β-глобина человека.
В некоторых вариантах реализации LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
В конкретных вариантах реализации лентивирусный вектор дополнительно содержит З'-энхансерный элемент β-глобина человека.
В дополнительных вариантах реализации представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
В конкретных вариантах реализации представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
В конкретных вариантах реализации лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 и вектор BCL11A shmir.
В конкретных вариантах реализации клетки, трансдуцированные векторами и композициями, предложенными в данной заявке, содержат аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β+, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βD или βS/βS.
В конкретных вариантах реализации клетки, трансдуцированные векторами и композициями, предложенными в данной заявке, содержат аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+ или β+/β+.
В конкретных вариантах реализации клетки, трансдуцированные векторами и композициями, предложенными в данной заявке, содержат аллели β-глобина: βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В различных вариантах реализации настоящего изобретения предложена, в том числе, композиция, содержащая популяцию гематопоэтических клеток, предложенных в данной заявке.
В различных вариантах реализации настоящего изобретения предложена, в том числе, фармацевтическая композиция, содержащая популяцию гематопоэтических клеток, предложенных в данной заявке, и фармацевтически приемлемый носитель.
В различных вариантах реализации настоящего изобретения предложена, в том числе, композиция, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; ретровирусный вектор или лентивирусный вектор и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена, при этом необязательно полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; ретровирусный вектор и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; ретровирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; ретровирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: CD34+ гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; лентивирусный вектор и полоксамер 338.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: CD34+ гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; лентивирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер 338.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: CD34+ гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; лентивирусный вектор и полоксамер 407.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: CD34+ гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; лентивирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер 407.
В некоторых вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2; и его производных и аналогов.
В конкретных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-гидроксиоктадекадиеновой (13(s)-HODE) кислоты; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
В дополнительных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина Е2 (PGE2) или 16,16-диметил-PGE2.
В конкретных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
В конкретных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники представляют собой CD34+ или CD 133+ клетки.
В некоторых вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцировали в присутствии полоксамера, выбранного из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В конкретных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцировали в присутствии полоксамера 288.
В некоторых вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцировали в присутствии полоксамера 335.
В дополнительных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцировали в присутствии полоксамера 338.
В дополнительных вариантах реализации указанные гематопоэтические стволовые клетки или клетки-предшественники трансдуцировали в присутствии полоксамера 407.
В некоторых вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы в присутствии поликатионного полимера.
В дополнительных вариантах реализации поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
В некоторых вариантах реализации ретровирусный вектор представляет собой лентивирусный вектор.
В некоторых вариантах реализации ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
В некоторых вариантах реализации ретровирусный вектор получен из лентивируса ВИЧ.
В конкретных вариантах реализации ретровирусный вектор получен из лентивируса ВИЧ-1.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 25.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 20.
В некоторых вариантах реализации лентивирусный вектор присутствует при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В дополнительных вариантах реализации лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В некоторых вариантах реализации лентивирусный вектор кодирует аденозин дезаминазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
В конкретных вариантах реализации лентивирусный вектор кодирует трипептидилпептидазу 1.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
В конкретных вариантах реализации лентивирусный вектор кодирует альфа-L-идуронидазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-Ь-идуронидазу.
В конкретных вариантах реализации лентивирусный вектор кодирует идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор, содержащий один или более элементов LCR β-глобина человека.
В некоторых вариантах реализации LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
В конкретных вариантах реализации лентивирусный вектор дополнительно содержит 3'-энхансерный элемент β-глобина человека.
В дополнительных вариантах реализации представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
В конкретных вариантах реализации представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
В конкретных вариантах реализации лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 и вектор BCL11A shmir.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; стауроспорин; ретровирусный вектор и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон, при этом необязательно клетки приводят в контакт со стауроспорином перед приведением в контакт с ретровирусным вектором и полоксамером.
В различных вариантах реализации настоящего изобретения предложена, в том числе, культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; стауроспорин; ретровирусный вектор и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена.
В некоторых вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники представляют собой CD34+ или CD 133+ клетки.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцировали в присутствии полоксамера, выбранного из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 288.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 335.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 338.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 407.
В некоторых вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы в присутствии поликатионного полимера.
В дополнительных вариантах реализации поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
В дополнительных вариантах реализации ретровирусный вектор представляет собой лентивирусный вектор.
В дополнительных вариантах реализации ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
В некоторых вариантах реализации ретровирусный вектор получен из лентивируса ВИЧ.
В конкретных вариантах реализации ретровирусный вектор получен из лентивируса ВИЧ-1.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 25.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 20.
В некоторых вариантах реализации лентивирусный вектор присутствует при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В дополнительных вариантах реализации лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В некоторых вариантах реализации лентивирусный вектор кодирует аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
В конкретных вариантах реализации лентивирусный вектор кодирует трипептидилпептидазу 1.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
В конкретных вариантах реализации лентивирусный вектор кодирует альфа-L-идуронидазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
В конкретных вариантах реализации лентивирусный вектор кодирует идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор, содержащий один или более элементов LCR β-глобина человека.
В некоторых вариантах реализации LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
В конкретных вариантах реализации лентивирусный вектор дополнительно содержит З'-энхансерный элемент β-глобина человека.
В дополнительных вариантах реализации представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
В конкретных вариантах реализации представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-'T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
В конкретных вариантах реализации лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 и вектор BCL11A shmir.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии лентивируса и полоксамера 338, при этом необязательно клетки приводят в контакт со стауроспорином, если он присутствует, перед приведением в контакт с ретровирусным вектором и полоксамером.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии лентивируса, агента, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорина и полоксамера, молекулярная масса которого составляет по меньшей мере 10000 дальтон, при этом необязательно клетки приводят в контакт со стауроспорином, если он присутствует, перед приведением в контакт с ретровирусным вектором и полоксамером.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии лентивируса и полоксамера 407, при этом необязательно клетки приводят в контакт со стауроспорином, если он присутствует, перед приведением в контакт с ретровирусным вектором и полоксамером.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии лентивируса, агента, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорина и полоксамера со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон и содержащего более чем приблизительно 40% оксида полиэтилена, при этом необязательно клетки приводят в контакт со стауроспорином, если он присутствует, перед приведением в контакт с ретровирусным вектором и полоксамером.
В некоторых вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2; и его производных и аналогов.
В дополнительных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15метил-PGE2 и 15(R)-15-метил-PGE2.
В конкретных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина Е2 (PGE2) или 16,16-диметил-PGE2.
В конкретных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В некоторых вариантах реализации популяцию гематопоэтических клеток трансдуцируют в присутствии полоксамера, выбранного из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 288.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 335.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 338.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 407.
В некоторых вариантах реализации популяцию гематопоэтических клеток трансдуцируют в присутствии поликатионного полимера.
В конкретных вариантах реализации поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
В дополнительных вариантах реализации лентивирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
В некоторых вариантах реализации лентивирусный вектор получен из лентивируса ВИЧ.
В конкретных вариантах реализации лентивирусный вектор получен из лентивируса ВИЧ-1.
В дополнительных вариантах реализации ретровирусный вектор представляет собой лентивирусный вектор, который содержит: а) 5' длинный концевой повтор (LTR); b) сигнал упаковки Psi Ψ); с) элемент экспорта РНК; d) центральный полипуриновый тракт (сРРТ) лентивируса; е) промотор, функционально связанный с представляющим интерес полинуклеотидом; и f) 3'-LTR SIN.
В некоторых вариантах реализации модифицированный 5'-LTR дополнительно содержит делецию относительно 5'-LTR дикого типа.
В некоторых вариантах реализации промотор 5'-LTR заменяют на гетерологичный промотор, выбранный из группы, состоящей из: промотора цитомегаловируса (CMV), промотора вируса саркомы Рауса (RSV) или промотора вируса обезьян 40 (SV40)
В некоторых вариантах реализации элемент экспорта РНК включает посттранскрипционный регуляторный элемент вируса гепатита В (PRE) или Rev-чувствительный регуляторный элемент вируса иммунодефицита человека (ВИЧ).
В некоторых вариантах реализации 3'-LTR содержит последовательность полиаденилирования.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 25.
В конкретных вариантах реализации лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 20.
В некоторых вариантах реализации лентивирусный вектор присутствует при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
В конкретных вариантах реализации лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В дополнительных вариантах реализации лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В некоторых вариантах реализации лентивирусный вектор кодирует аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
В конкретных вариантах реализации лентивирусный вектор кодирует трипептидилпептидазу 1.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
В конкретных вариантах реализации лентивирусный вектор кодирует альфа-L-идуронидазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
В конкретных вариантах реализации лентивирусный вектор кодирует идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор, содержащий один или более элементов LCR β-глобина человека.
В некоторых вариантах реализации LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
В конкретных вариантах реализации лентивирусный вектор дополнительно содержит 3'-энхансерный элемент β-глобина человека.
В дополнительных вариантах реализации представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
В конкретных вариантах реализации представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
В конкретных вариантах реализации лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 и вектор BCL11A shmir.
В некоторых вариантах реализации популяцию гематопоэтических клеток трансдуцируют в течение по меньшей мере приблизительно 2 часов.
В некоторых вариантах реализации популяцию гематопоэтических клеток трансдуцируют в течение по меньшей мере приблизительно 24 часов.
В некоторых вариантах реализации популяцию гематопоэтических клеток трансдуцируют в течение от приблизительно 2 часов до приблизительно 24 часов.
В дополнительных вариантах реализации гематопоэтические клетки включают гематопоэтические стволовые клетки или клетки-предшественники.
В конкретных вариантах реализации гематопоэтические клетки включают CD34+ или CD133+ клетки.
В некоторых вариантах реализации проводят селекцию популяции гематопоэтических клеток по экспрессии CD34+ или CD133+ перед трансдукцией.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения гемоглобинопатии у субъекта, включающий введение указанному субъекту популяции клеток, предложенных в данной заявке.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ облегчения по меньшей мере одного симптома гемоглобинопатии у субъекта, включающий введение указанному субъекту популяции клеток, предложенных в данной заявке, или композиции, предложенной в данной заявке.
В конкретных вариантах реализации аллели β-глобина у субъекта следующие: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β+, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения талассемии у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В некоторых вариантах реализации талассемия представляет собой α-талассемию.
В дополнительных вариантах реализации талассемия представляет собой β-талассемию.
В конкретных вариантах реализации аллели β-глобина у субъекта следующие: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+или β+/β+.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения серповидноклеточной болезни у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В дополнительных вариантах реализации аллели β-глобина у субъекта следующие: βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения Р-талассемии у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В дополнительных вариантах реализации аллели β-глобина у субъекта следующие: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+или β+/β+.
В различных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения адренолейкодистрофии или адреномиелонефропатии у субъекта, включающий введение указанному субъекту некоторого количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В конкретных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения тяжелого комбинированного иммунодефицита, вызванного дефицитом аденозиндезаминазы (ADA-SCID), у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В некоторых вариантах реализации настоящего изобретения предложен, в том числе, способ лечения Х-сцепленного тяжелого комбинированного иммунодефицита (X-SCID) у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В некоторых вариантах реализации настоящего изобретения предложен, в том числе, способ лечения болезни Баттена у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В дополнительных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения мукополисахаридоза I типа (MPS I) у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В дополнительных вариантах реализации настоящего изобретения предложен, в том числе, способ лечения мукополисахаридоза II типа (MPS II) у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток, предположенных в данной заявке, или композиции, предложенной в данной заявке.
В некоторых вариантах реализации популяцию гематопоэтических стволовых клеток вводят внутривенным путем, интрамедуллярным путем или внутрикостным путем.
В конкретных вариантах реализации популяцию гематопоэтических стволовых клеток вводят внутривенно.
В различных вариантах реализации настоящего изобретения предложен, в том числе, набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорин и полоксамер.
В различных вариантах реализации настоящего изобретения предложен, в том числе, набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорин и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
В различных вариантах реализации настоящего изобретения предложен, в том числе, набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорин и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
В некоторых вариантах реализации полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В некоторых вариантах реализации полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В конкретных вариантах реализации полоксамер представляет собой полоксамер 288.
В некоторых вариантах реализации полоксамер представляет собой полоксамер 335.
В дополнительных вариантах реализации полоксамер представляет собой полоксамер 338.
В дополнительных вариантах реализации полоксамер представляет собой полоксамер 407.
В различных вариантах реализации настоящего изобретения предложен, в том числе, набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, и полоксамер 338.
В различных вариантах реализации настоящего изобретения предложен, в том числе, набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, и полоксамер 407.
В дополнительных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2; и его производных и аналогов.
В дополнительных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
В дополнительных вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина Е2 (PGE2) или 16,16-диметил-PGE2.
В некоторых вариантах реализации агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
В некоторых вариантах реализации набор дополнительно содержит поликатионный полимер.
В конкретных вариантах реализации поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 показан анализ in vivo обработанных PGE2 hCD34+ клеток. (А) Приживление hCD34+ клеток измеряли по положительному окрашиванию антителом к hCD45. (В) Анализ ЧКВ в клетках человека, приживленных в костный мозг (КМ) мыши.
На фигуре 2 показано, что для hCD34+ клеток, трансдуцированных в присутствии возрастающих концентраций F108, выявили зависимое от дозы повышение (А) проникновения вируса и (В) ЧКВ.
На фигуре 3 показано, что для hCD34+ клеток, трансдуцированных в присутствии F108, PGE2 или F108 и PGE2 не выявили пониженную жизнеспособность клеток по сравнению с контрольной обработкой клеток.
На фигуре 4 показано, что для hCD34+ клеток, трансдуцированных в присутствии возрастающих концентраций F68, не выявили зависимое от дозы повышение (А) проникновения вируса и (В) ЧКВ.
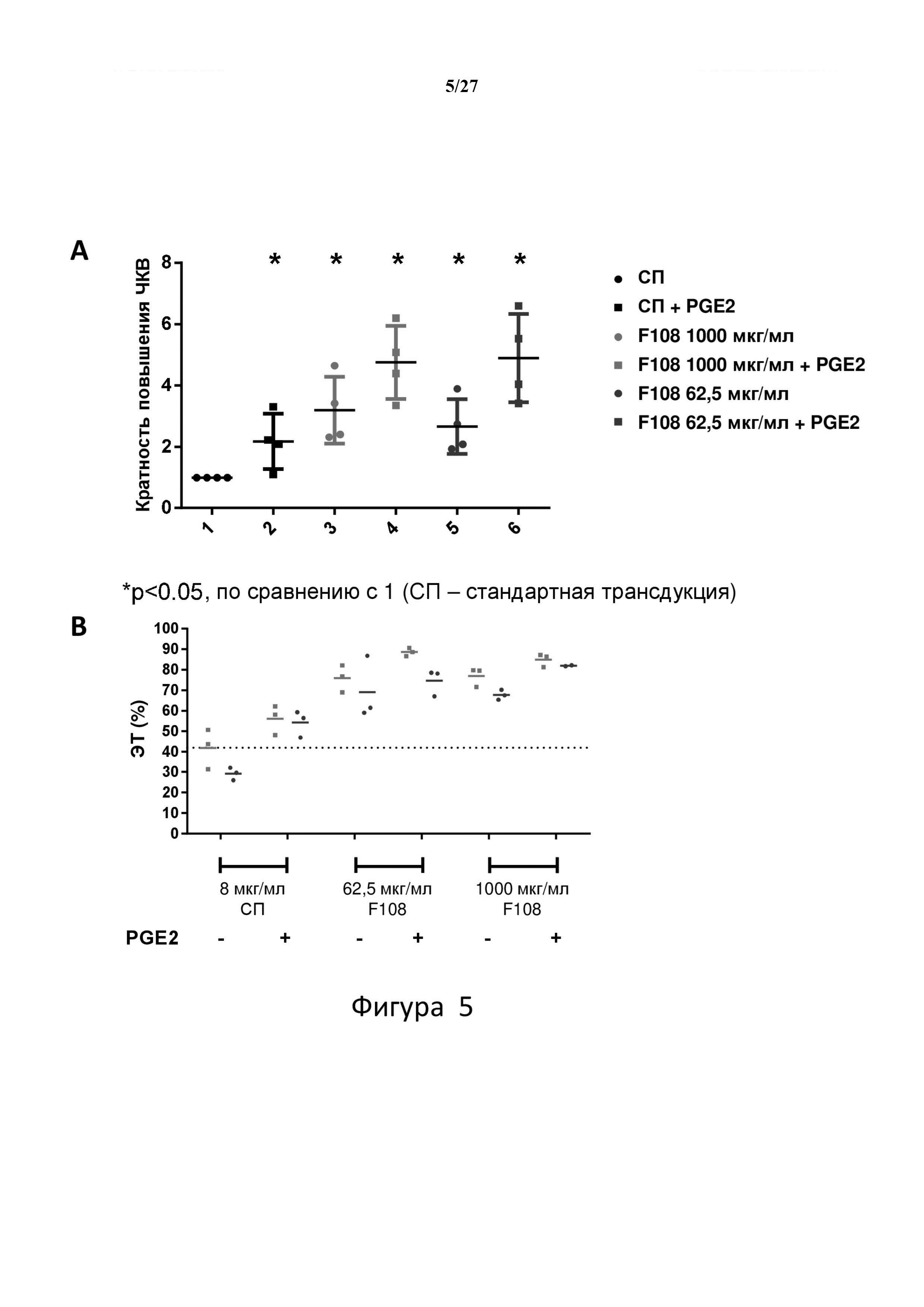
На фигуре 5 показано повышение ЧКВ и эффективности трансдукции для hCD34+ клеток, трансдуцированных в присутствии F108 и PGE2, по сравнению с клетками, трансдуцированными в присутствии F108 отдельно, или контролями.
На фигуре 6 показан анализ отдельных колоний в двух независимых экспериментах, который демонстрирует повышение среднего ЧКВ при комбинированной обработке F108 и PGE2, а также существенное уменьшение количества предшественников, которые не трансдуцированы.
На фигуре 7 показано, что в hCD34+ клетках, трансдуцированных в присутствии возрастающих концентраций PGE2 и фиксированной концентрации F108, не выявили зависимое от дозы повышение ЧКВ.
На фигуре 8 показано, что как для общей популяции гематопоэтических клеток, так и для фенотипа стволовых клеток (CD34+CD38LoCD90+CD45RA-), трансдуцированных в присутствии обработки PGE2 и F108, выявили повышенную эффективность трансдукции по сравнению со стандартными условиями трансдукции с применением сульфата протамина.
На фигуре 9 показано, что в hCD34+ клетках, трансдуцированных в присутствии F108 или F108 и PGE2; выявили повышенное ЧКВ по сравнению с контролями.
На фигуре 10 показан анализ ЧКВ и эффективности трансдукции hCD34+ клеток, обработанных PGE2, F108 или их комбинацией. (A) F108, отдельно или в комбинации с PGE2, повышает ЧКВ в партии клеток с низким уровнем трансдукции. (В) F108, отдельно или в комбинации с PGE2, повышает эффективность трансдукции в партии клеток с низким уровнем трансдукции. (С) Анализ ЧКВ через 2 месяца после трансплантации выявил, что F108, отдельно или в комбинации с PGE2, повышает ЧКВ in vivo в приживленных hCD34+ клетках. (D) Анализ ЧКВ через 4 месяца после трансплантации выявил, что F108, отдельно или в комбинации с PGE2, повышает ЧКВ in vivo в приживленных hCD34+ клетках.
На фигуре 11 показан уровень приживления и способности к дифференцировке hCD34+ клеток, обработанных PGE2, F108 или их комбинацией, через 2 и 4 месяца после трансплантации. (А) Ни F108, ни PGE2, ни комбинация не влияли на уровни приживления трансдуцированных hCD34+ клеток в условиях ксенотрансплантации. (В) Способность к миелоидной дифференцировке приживленных клеток сохранялась. (С и D) Способность к лимфоидной дифференцировке приживленных клеток сохранялась.
На фигуре 12 показано, что в hCD34+ клетках, трансдуцированных в присутствии стауроспорина, F108, или F108 и стауроспорина, выявили повышенное ЧКВ по сравнению с контролями.
На фигуре 13 показано, что как F108, так и F127 повышают ЧКВ в hCD34+ клетках относительно стандартной трансдукции сульфатом протамина. ЧКВ дополнительно повышается при добавлении PGE2 к обоим вариантам трансдукции F108 и F127.
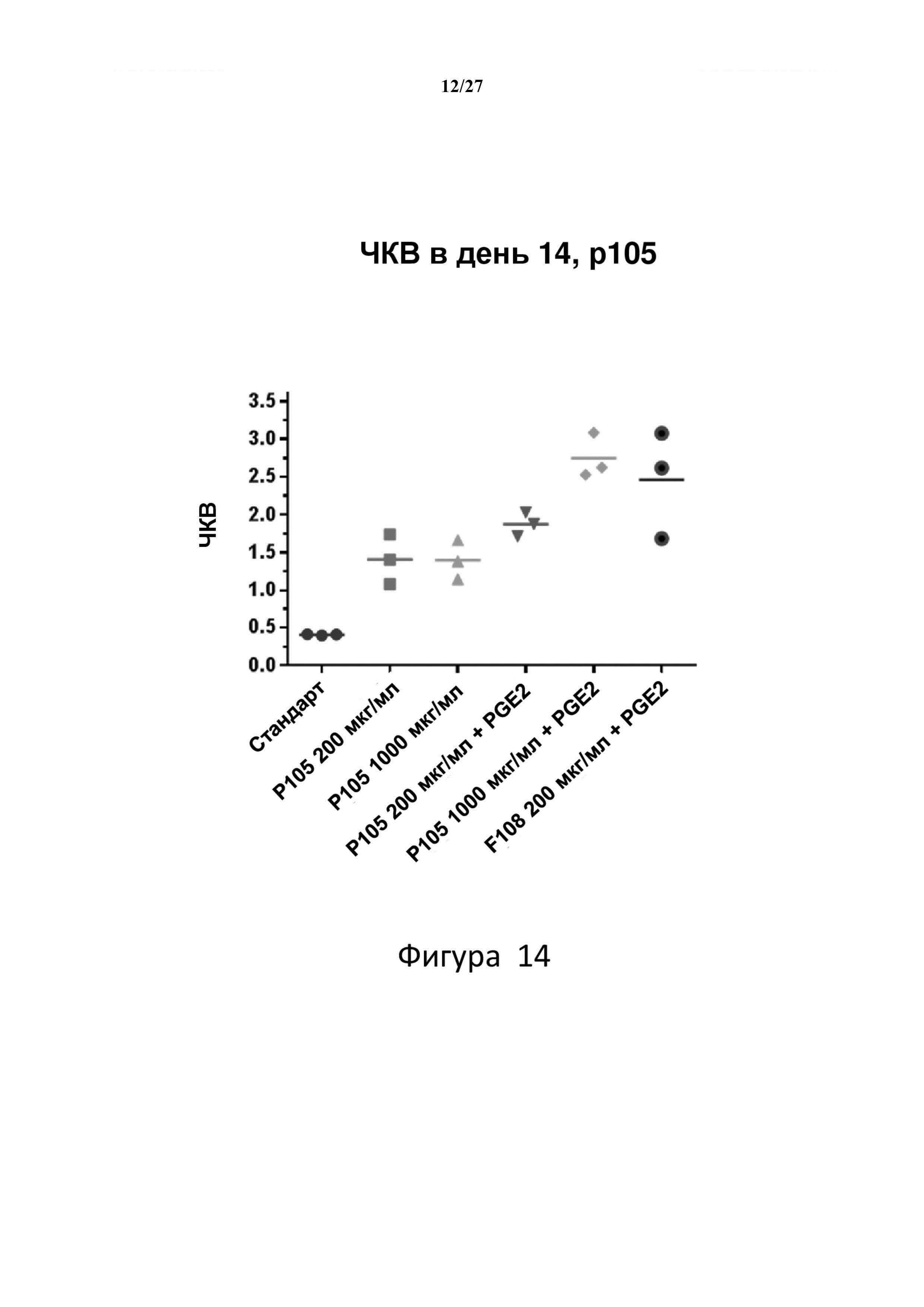
На фигуре 14 показано, что как F108, так и Р105 повышают ЧКВ в hCD34+ клетках относительно стандартной трансдукции сульфатом протамина. ЧКВ дополнительно повышается при добавлении PGE2 к обоим вариантам трансдукции Р105 и F108.
На фигуре 15 показано, что Р105 (данные с фигуры 14), F127 (данные с фигуры 13), F108 и F98 повышают ЧКВ в hCD34+ клетках относительно стандартной трансдукции сульфатом протамина. ЧКВ дополнительно повышается при добавлении PGE2. На фигуре 15 также показано, что трансдукция hCD34+ клеток в присутствии Р105, F127, F108 или F98 и необязательно PGE2 не влияла на рост клеток.
На фигуре 16 показано, что Р123, Р104, L101, и F108 повышают ЧКВ в hCD34+ клетках относительно стандартной трансдукции сульфатом протамина, но также что Р123, Р104 и L101 уменьшают рост клеток. ЧКВ повышается при добавлении P123 и PGE2.
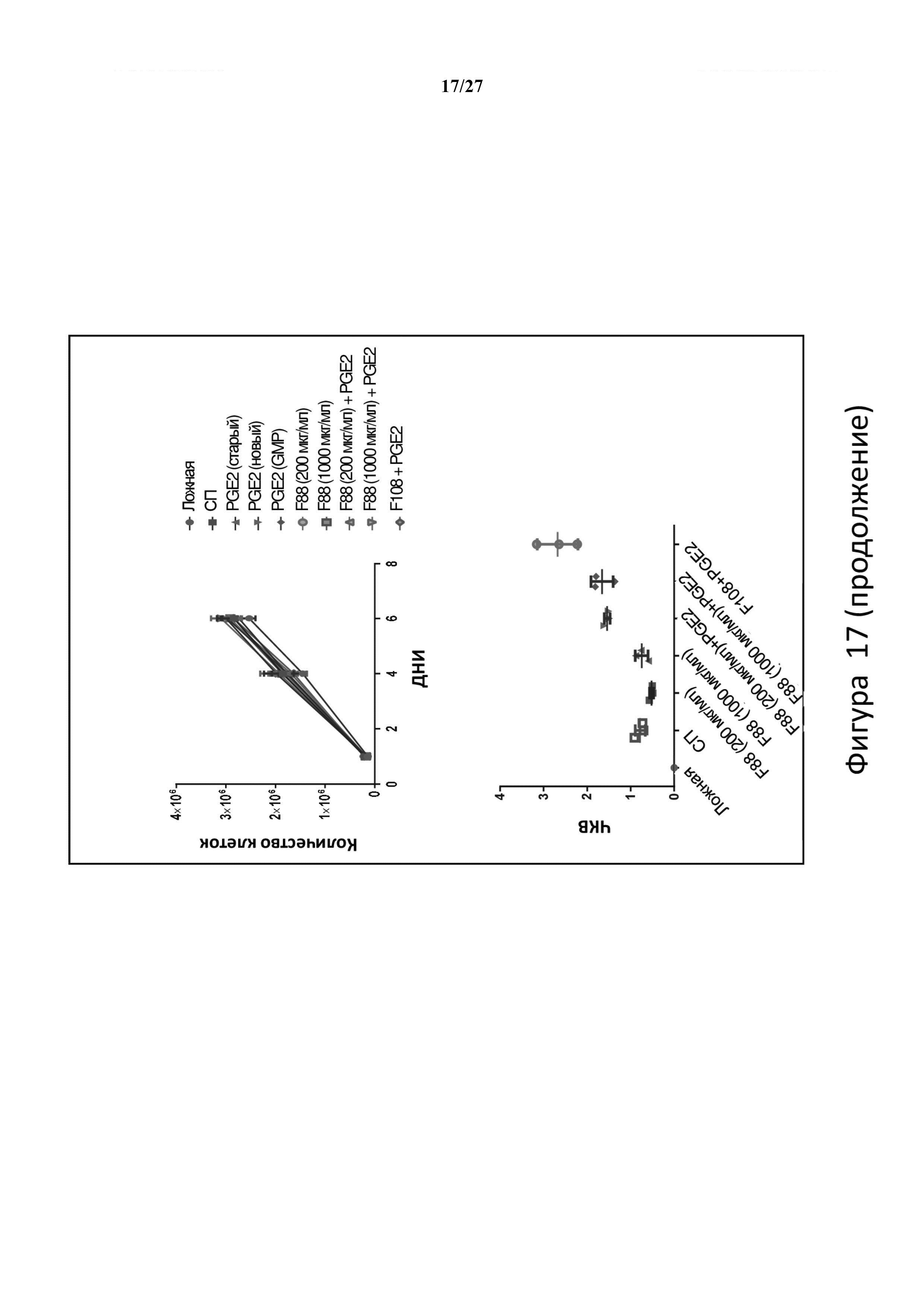
На фигуре 17 показано, что F87, F88 и F68 не повышают ЧКВ в hCD34+ клетках относительно стандартной трансдукции сульфатом протамина и не влияют на рост клеток.
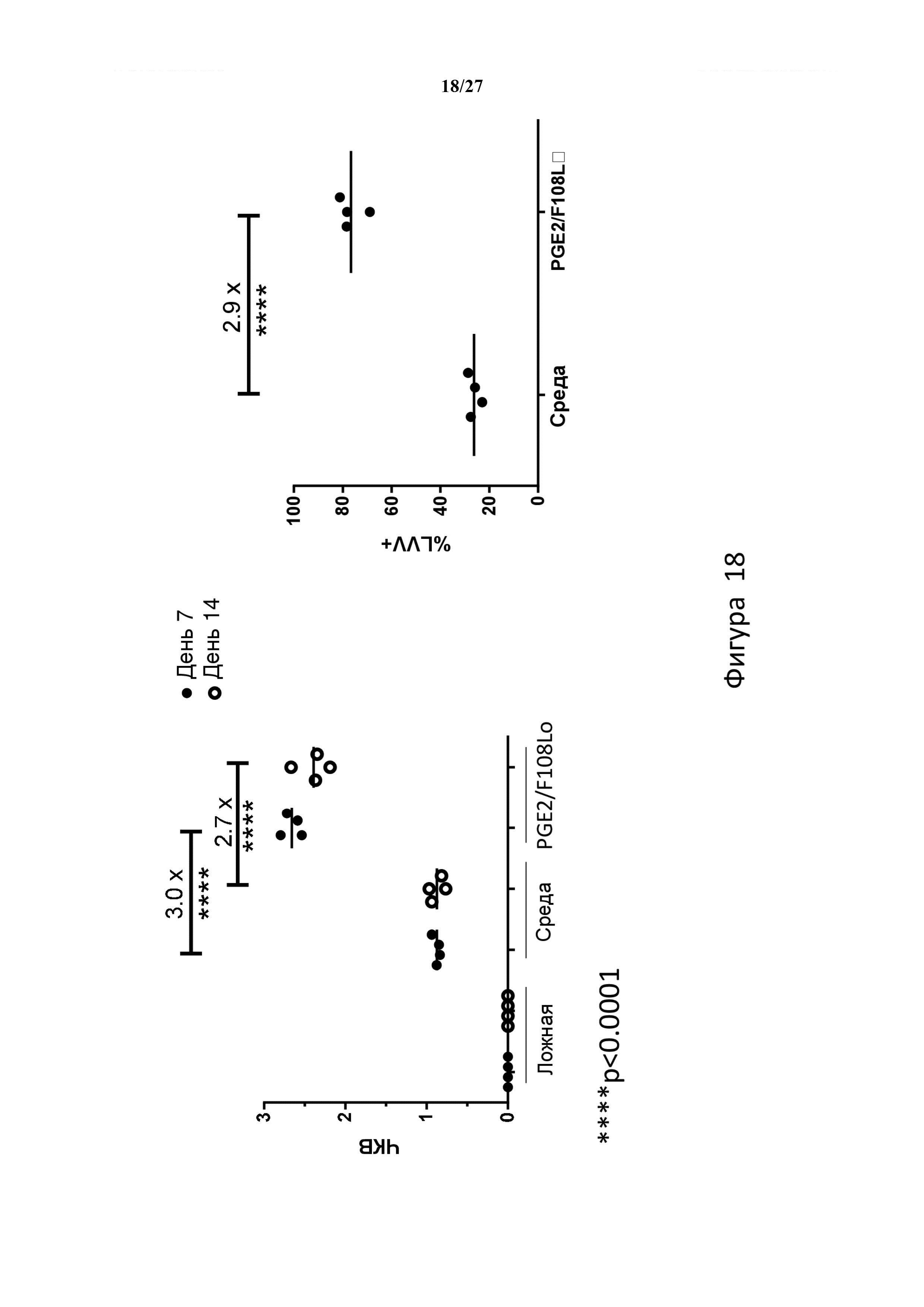
На фигуре 18 показано, что в β0/β0 hCD34+ клетках, трансдуцированных в присутствии PGE2 и F108, приблизительно в три раза повышено ЧКВ и процент трансдуцированных клеток (% LVV+) по сравнению с контрольными трансдуцированными клетками.
На фигуре 19 показано, что количество безъядерных эритроидных клеток, дифференцированных из β0/β0 hCD34+ клеток, трансдуцированных в присутствии PGE2 и F108, было сопоставимо с количеством безъядерных эритроидных клеток, дифференцированных из hCD34+ клеток, полученных из здоровых доноров.
На фигуре 20 показано, что количество HbA, продуцированного безъядерными эритроидными клетками, дифференцированными из β0/β0 hCD34+ клеток, трансдуцированных в присутствии PGE2 и F108, было сопоставимо с количеством HbA, продуцированного безъядерными эритроидными клетками, дифференцированными из hCD34+ клеток, полученных из здоровых доноров.
На фигуре 21 показаны анализы образования колоний гематопоэтическими клетками-предшественниками, трансдуцированными 8 мкг/мл сульфата протамина (СП), 10 мкг/мл F108 (F108Lo), 1000 мкг/мл F108 (F108Hi) или 1000 мкг/мл F108 в комбинации с 8 мкг/мл сульфата протамина (F108Hi/СП). Обработки значительно не влияли на образование колоний.
На фигуре 22 показано, что F108 повышает эффективность трансдукции фенотипически долговременных ГСК (CD34+CD38-CD45RA-CD90+CD49f+) лентивирусным вектором с GFP.
На фигуре 23 показаны три различные партии клеток (629, 703, 010), являющиеся примерами клеток с низкой, средней и высокой способностью к трансдукции, трансдуцированных LentiGlobin ВВ305 при двух МИ.
Трансдуцированные колонии объединяли и анализировали в них ЧКВ (СП=8 мкг/мл сульфата протамина, F108Hi/PGE2=1000 мкг/мл F108 и 10 мкМ PGE2). F108 и PGE2 повышали ЧКВ во всех партиях клеток.
На фигуре 24 показаны клетки CD34+ человека, трансдуцированные лентивирусным вектором, кодирующим IL2Rγ, в присутствии либо сульфата протамина (верхний ряд), либо F108 и PGE2 (нижний ряд), при этом лентивирусный вектор получали путем временной трансфекции или из клонов клеток-продуцентов (PrCL1, PrCL2). ЧКВ из объединенных колоний в метилцеллюлозе в день 14 (Д14) показаны на крайних левых панелях; ЧКВ в отдельных колониях из собранных колоний и %LVV+ колонии в Д14 показаны на центральных панелях; и подсчет колоний показан на крайних правых панелях.
На фигуре 25 показано, что F108 и PGE2 повышают трансдукцию лентивирусными векторами, кодирующими трипептидилпептидазу 1 (ТРР1).
CD34+ человека трансдуцировали LVV, кодирующими либо EF1α-TPP1, либо MND-TPP1 при МИ 5 или 15 с добавлением и без F108 и PGE2. ЧКВ в объединенных колониях в метилцеллюлозе в день 14 показаны на верхней левой панели. Активность фермента ТРР-1 из культур с цитокинами в день 7 показана на верхней средней панели (осадок клеток) и на верхней правой панели (кондиционированный клетками супернатант). Клетки костного мозга мыши без маркеров линейной принадлежности (Lin-) трансдуцировали MND-TPP1 LVV при МИ, составляющей 5, 15 или 30, с добавлением и без F108 и PGE2. ЧКВ в жидких культурах в Д7 показаны на нижней левой панели; ЧКВ в отдельных колониях, определенные с помощью количественной ПЦР, показаны на нижней средней панели; и %LVV+ колоний показан на нижней правой панели.
На фигуре 26 CD34+ человека из пациентов с AMN (фигура 26, панели А-D), пациентов с ALD (фигура 26, панели Е-Н) и здоровых доноров (ЗД; фигура 26, панели I-L) трансдуцировали MND-ABCD1 LVV в присутствии либо сульфата протамина, либо F108, либо PGE2, либо F108 и PGE2. Экспрессия белка ALDP показана на панелях А, Е и I; ЧКВ в объединенных колониях показано на панелях В, F и J; ЧКВ в отдельных колониях показано на панелях С, G и K; и анализ образования колоний показан на панелях D, Н и L.
На фигуре 27 показано ЧКВ в объединенных колониях (левая панель), анализ образования колоний (средняя панель) и ЧКВ в отдельных колониях и %LVV+ клетки (правая панель) из hCD34+ клеток, трансдуцированных при МИ, равных 10 или 25, с добавлением и без F108 и PGE2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Обзор
В различных типичных вариантах реализации настоящего изобретения представлены генотерапевтические средства, содержащие композиции гематопоэтических стволовых клеток и клеток-предшественников с повышенной терапевтической эффективностью, и способы их получения и применения.
Генотерапия, в том числе, основывается на достаточной экспрессии терапевтического гена и соответствующего белка. Одним из факторов, которые влияют на экспрессию генов, является число копий, или как много копий терапевтического гена присутствует в клетке. Вирусы, такие как ретровирус, например, лентивирус, аденовирус и аденоассоциированный вирус, представляют собой часто используемые генотерапевтические векторы для внедрения терапевтического гена в клетку - процесса, известного как трансдукция. Неэффективная вирусная трансдукция гематопоэтических стволовых клеток и клеток-предшественников является одним из наиболее важных факторов, которые ограничивают сферу и применимость генотерапии при многих заболеваниях и расстройствах, для лечения которых были бы полезны генетически модифицированные клетки, полученные из гематопоэтической системы. Недостаточная трансдукция вируса проявляется низким числом копий вектора (ЧКВ) и/или низким процентом трансдуцированных клеток. Таким образом, существенной проблемой, связанной с генотерапией, в которой используют вирусные векторы для доставки терапевтических трансгенов в гематопоэтические стволовые клетки и клетки-предшественники, является неэффективная трансдукция вируса, которая может привести к субтерапевтическому уровню лекарственного продукта. Неэффективная трансдукция также приводит к более высокой стоимости товаров, например, она повышает стоимость получения лентивируса, так как чем более неэффективна трансдукция, тем больше лентивируса потребуется.
Генотерапевтические средства на основе гематопоэтических стволовых клеток и клеток-предшественников, предложенные в данной заявке, и способы их получения и применения решают данные и другие проблемы, существующие в данной области.
В конкретных типичных вариантах реализации предложена популяция гематопоэтических клеток, трансдуцированных ретровирусным вектором, при этом указанная популяция клеток содержит повышенное количество или процент трансдуцированных гематопоэтических стволовых клеток и клеток-предшественников по сравнению с популяциями клеток, трансдуцированных с помощью способов и композиций, существующих в данной области. В другом варианте реализации популяция гематопоэтических клеток, трансдуцированных ретровирусным вектором, содержит повышенное ЧКВ по сравнению с ЧКВ в популяциях клеток, трансдуцированных с помощью способов и композиций, существующих в данной области.
В других типичных вариантах реализации предложены композиции, фармацевтические композиции и культуры клеток, содержащие трансдуцированные гематопоэтические клетки.
В некоторых вариантах реализации предложены культуры клеток, содержащие популяцию гематопоэтических клеток, ретровирус и полоксамер.
В некоторых вариантах реализации предложены культуры клеток, содержащие популяцию гематопоэтических клеток, ретровирус, агент, который увеличивает передачу сигналов рецептора простагландина ЕР, и полоксамер.
В конкретных вариантах реализации предложены способы трансдукции гематопоэтических клеток, включающие приведение в контакт гематопоэтической клетки с ретровирусом и культивирование указанной гематопоэтической клетки и ретровируса в присутствии полоксамера.
В конкретных вариантах реализации предложены способы трансдукции гематопоэтических клеток, включающие приведение в контакт гематопоэтической клетки с ретровирусом и культивирование указанной гематопоэтической клетки и ретровируса в присутствии агента, который увеличивает передачу сигналов рецептора простагландина ЕР, и полоксамера.
В конкретных вариантах реализации предложены способы лечения субъекта, страдающего моногенным заболеванием, включающие введение указанному субъекту любого из генотерапевтических средств на основе гематопоэтических клеток, предложенных в данной заявке.
В различных вариантах реализации, предложенных в данной заявке, будут использовать, если конкретно не указано противоположное, обычные способы химии, биохимии, органической химии, молекулярной биологии, микробиологии, технологии рекомбинантной ДНК, генетики, иммунологии и клеточной биологии, которые находятся в рамках компетенции в данной области, многие из которых описаны ниже с целью пояснения. Такие методики в полном объеме объяснены в литературе. См., например, Sambrook, и др., Molecular Cloning: A Laboratory Manual (3е издание, 2001); Sambrook, и др., Molecular Cloning: A Laboratory Manual (2ое издание, 1989); Maniatis и др., Molecular Cloning: A Laboratory Manual (1982); Ausubel и др., Current Protocols in Molecular Biology (John Wiley and Sons, доработанное в июле 2008 г. ); Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates и Wiley-Interscience; Glover, DNA Cloning: A Practical Approach, тома I и II (IRL Press, Oxford, 1985); Anand, Techniques for the Analysis of Complex Genomes (Academic Press, Нью-Йорк, 1992); Transcription and Translation (B. Hames и S. Higgins, ред., 1984); Perbal, A Practical Guide to Molecular Cloning (1984); Harlow и Lane, Antibodies (Cold Spring Harbor Laboratory Press, Колд Спринт Харбор, Нью-Йорк, 1998) Current Protocols in Immunology, Q. E. Coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach и W. Strober, ред., 1991); Annual Review of Immunology; а также монографии в таких журналах как Advances in Immunology.
В. Определения
Если не указано иначе, все технические и научные термины, используемые в данной заявке, имеют те же значения, которые обычно понимают средние специалисты в области, к которой относится настоящее изобретение. Хотя при осуществлении или проверке настоящего изобретения можно применять любые способы и материалы, аналогичные или эквивалентные описанным в данной заявке, предпочтительные варианты реализации композиций, способов и материалов описаны в данной заявке. Для целей настоящего изобретения следующие термины определены ниже.
Термины, описанные в данной заявке в единственном числе, используют в данной заявке для описания одного или более чем одного (т.е., по меньшей мере одного, или одного или более) грамматического объекта данной статьи. В качестве примера, "элемент" означает один элемент или один или более элементов.
Использование альтернативы (например, "или") следует понимать как означающее одну, обе или любую комбинацию перечисленных альтернатив.
Термин "и/или" следует понимать как означающий либо одну, либо обе из альтернатив.
В данной заявке термин "около" или "приблизительно" относится к количеству, уровню, значению, числу, частоте, проценту, величине, размеру, объему, массе или длине, которое изменяется в пределах до 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% от указанного количества, уровня, значения, числа, частоты, процента, величины, размера, объема, массы или длины. В конкретных вариантах реализации термины "около" или "приблизительно", когда они стоят перед числовым значением, указывают на значение плюс или минус диапазон 15%, 10%, 5% или 1%.
В данной заявке термин "по существу" относится к количеству, уровню, значению, числу, частоте, проценту, величине, размеру, объему, массе или длине, составляющим 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более от указанного количества, уровня, значения, числа, частоты, процента, величины, размера, объема, массы или длины. В одном варианте реализации "по существу такой же" относится к количеству, уровню, значению, числу, частоте, проценту, величине, размеру, объему, массе или длине, которые оказывают эффект, например, физиологический эффект, приблизительно такой же, как и эффект, оказываемый указанным количеством, уровнем, значением, числом, частотой, процентом, величиной, размером, объемом, массой или длиной.
По всему тексту настоящего описания, если в контексте не требуется иное, термины "включать", "включает" и "включающий" следует понимать как подразумевающие включение указанного этапа или элемента или группы этапов или элементов, но не исключение какого-либо другого этапа или элемента или группы этапов или элементов. В данной заявке термины "содержат" и "включают" используют как синонимы. Под термином "состоящий из" подразумевают содержащий, и он ограничен любыми терминами, которые следуют после формулировки "состоящий из". Таким образом, формулировка "состоящий из" указывает на то, что перечисленные элементы необходимы или обязательны и что не могут присутствовать другие элементы. Под термином "состоящий по существу из" подразумевают включающий любые элементы, перечисленные после указанной формулировки, и он ограничен другими элементами, которые не препятствуют или не способствуют активности или действию, установленным в указанном описании для перечисленных элементов. Таким образом, формулировка "состоящий по существу из" указывает на то, что перечисленные элементы необходимы или обязательны, но что не присутствуют другие элементы, которые материально влияют на активность или действие перечисленных элементов.
По всему тексту настоящего описания ссылка на "один вариант реализации," "вариант реализации", "конкретный вариант реализации", "связанный вариант реализации", "некоторый вариант реализации", "дополнительный вариант реализации" или "добавочный вариант реализации" или комбинации перечисленных формулировок означает, что конкретная особенность, структура или свойство, описанные в связи с указанным вариантом реализации, включены в по меньшей мере один вариант реализации настоящего изобретения. Таким образом, появления указанных выше формулировок в различных местах по всему тексту настоящего описания не обязательно все относятся к одному и тому же варианту реализации. Более того, конкретные особенности, структуры или свойства можно объединить любым подходящим способом в один или более вариантов реализации. Также следует понимать, что позитивное перечисление некоторой особенности в одном варианте реализации служит основой для исключения указанной особенности из некоторого варианта реализации.
"Трансфекция" относится к процессу внедрения "голой" ДНК в клетки с помощью невирусных способов.
"Инфекция" относится к процессу внедрения чужеродной ДНК в клетки с применением вирусного вектора.
"Трансдукция" относится к внедрению чужеродной ДНК в геном клетки с применением вирусного вектора.
"Число копий вектора" или "ЧКВ" относится к количеству копий вектора или его части в геноме клетки. Среднее ЧКВ можно определить для популяции клеток или для отдельных колоний клеток. Примеры способов определения ЧКВ включают полимеразную цепную реакцию (ПЦР) и проточную цитометрию.
"Эффективность трансдукции" относится к проценту клеток, трансдуцированных по меньшей мере одной копией вектора. Например, если 1×106клеток подвергли воздействию вируса и у 0,5×106 клеток выявили по меньшей мере одну копию вируса в их геноме, то эффективность трансдукции составляет 50%. Примеры способов определения эффективности трансдукции включают ПЦР и проточную цитометрию. В различных вариантах реализации формулировки "количество положительных по лентивирусному вектору клеток" или "процент положительных по лентивирусному вектору клеток" используют для указания эффективности трансдукции.
В данной заявке термин "ретровирус" относится к РНК-содержащему вирусу, который путем обратной транскрипции своей геномной РНК образует копию линейной двухцепочечной ДНК, а затем ковалентно встраивает свою геномную ДНК в геном хозяина. Ретровирусы представляют собой общепринятое средство доставки генов (Miller, 2000, Nature. 357: 455-460). После того, как вирус встроился в геном хозяина, его называют "провирусом". Провирус служит в качестве матрицы для РНК-полимеразы II и направляет экспрессию молекул РНК, кодируемых указанным вирусом.
Типичные ретровирусы включают, но не ограничены перечисленными: вирус лейкоза мыши Молони (M-MuLV), вирус саркомы мыши Молони (MoMSV), вирус саркомы мыши Харви (HaMuSV), вирус опухоли молочной железы мыши (MuMTV), вирус лейкоза гиббонов (GaLV), вирус лейкоза кошек (FLV), спумавирус, вирус лейкоза мыши Фрейнда, вирус стволовых клеток мыши (MSCV), вирус саркомы Рауса (RSV) и лентивирус.
В данной заявке термин "лентивирус" относится к группе (или роду) сложных ретровирусов. Типичные лентивирусы включают, но не ограничены перечисленными: ВИЧ (вирус иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вирус висна-маеди (VMV); вирус артрита-энцефалита коз (CAEV); вирус инфекционной анемии лошадей (EIAV); вирус иммунодефицита кошек (FIV); вирус иммунодефицита крупного рогатого скота (BIV) и вирус иммунодефицита обезьян (SIV). В одном варианте реализации остовы вектора на основе ВИЧ (т.е., элементы цис-действующей последовательности ВИЧ) предпочтительны.
Ретровирусные векторы и, в частности, лентивирусные векторы, можно применять для осуществления настоящего изобретения. Соответственно, в данной заявке подразумевают, что термин "ретровирус" или "ретровирусный вектор" включает "лентивирус" и "лентивирусные векторы", соответственно.
Термин "вектор", используемый в данной заявке, относится к молекуле нуклеиновой кислоты, способной переносить или транспортировать другую молекулу нуклеиновой кислоты. Переносимая нуклеиновая кислота, как правило, связана, например, встроена в молекулу нуклеиновой кислоты вектора. Вектор может включать последовательности, которые направляют автономную репликацию в клетке, или может включать последовательности, достаточные для того, чтобы позволить встраивание в ДНК клетки-хозяина. Полезные векторы включают, например, плазмиды (например, ДНК-плазмиды или РНК-плазмиды), транспозоны, космиды, бактериальные искусственные хромосомы и вирусные векторы. Полезные вирусные векторы включают, например, неспособные реплицироваться ретровирусы и лентивирусы.
Для специалиста в данной области будет очевидно, что термин "вирусный вектор" широко используют для обозначения либо молекулы нуклеиновой кислоты (например, переносящей плазмиды), которая содержит элементы нуклеиновых кислот из вируса, которые, как правило, способствуют переносу молекулы нуклеиновой кислоты или встраиванию в геном клетки, либо вирусной частицы, которая опосредует перенос нуклеиновой кислоты. Вирусные частицы, как правило, будут содержать различные вирусные компоненты и иногда также компоненты клетки-хозяина дополнительно к нуклеиновой(-ым) кислоте(-ам).
Термин вирусный вектор может относиться либо к вирусу или к вирусной частице, способной переносить нуклеиновую кислоту в клетку, либо к самой переносимой нуклеиновой кислоте. Вирусные векторы и переносящие плазмиды содержат структурные и/или функциональные генетические элементы, которые, главным образом, получены из вируса. Термин "ретровирусный вектор" относится к вирусному вектору или плазмиде, содержащей структурные и функциональные генетические элементы, или их части, которые, главным образом, получены из ретровируса. Термин "лентивирусный вектор" относится к ретровирусному вектору или плазмиде, содержащей структурные и функциональные генетические элементы, или их части, включая LTR, которые, главным образом, получены из лентивируса. Термин "гибридный" относится к вектору, LTR или другой нуклеиновой кислоте, содержащей как ретровирусные, например, лентивирусные, последовательности, так и нелентивирусные вирусные последовательности. В одном варианте реализации гибридный вектор относится к вектору или переносящей плазмиде, содержащей ретровирусные, например, лентивирусные, последовательности для обратной транскрипции, репликации, встраивания и/или упаковки.
В конкретных вариантах реализации термины "лентивирусный вектор" и "лентивирусный вектор экспрессии" можно применять для обозначения лентивирусных переносящих плазмид и/или инфекционных лентивирусных частиц. Когда в данной заявке упоминаются такие элементы, как сайты клонирования, промоторы, регуляторные элементы, гетерологичные нуклеиновые кислоты и т.д., должно быть очевидно, что последовательности данных элементов присутствуют в виде РНК в лентивирусных частицах согласно настоящему изобретению и присутствуют в виде ДНК в ДНК-плазмидах согласно настоящему изобретению.
На каждом конце провируса находятся структуры, называемые "длинными концевыми повторами" или "LTR". Термин "длинный концевой повтор (LTR)" относится к доменам из пар оснований, расположенных на концах ретровирусных ДНК, которые, в контексте их природных последовательностей, представляют собой прямые повторы и содержат области U3, R и U5. LTR, как правило, осуществляют функции, необходимые для экспрессии ретровирусных генов (например, индукцию, инициацию и полиаденилирование транскриптов генов) и для репликации вируса. LTR содержит множество регуляторных сигналов, включая регулирующие транскрипцию элементы, сигналы полиаденилирования и последовательности, необходимые для репликации и встраивания вирусного генома. LTR вирусов подразделяют на три области, называемые U3, R и U5. Область U3 содержит элементы энхансера и промотора. Область U5 представляет собой последовательность между сайтом связывания праймера и областью R и содержит последовательность полиаденилирования. Область R (повтор) фланкирована областями U3 и U5. LTR состоит из областей U3, R и U5 и находится на обоих 5'- и 3'-концах генома вируса. Рядом с 5'-LTR расположены последовательности, необходимые для обратной транскрипции генома (сайт связывания праймера тРНК) и для эффективной упаковки вирусной РНК в частицы (сайт пси).
В данной заявке термин "сигнал упаковки" или "последовательность упаковки" относится к последовательностям, расположенным внутри ретровирусного генома, которые необходимы для встраивания вирусной РНК в капсид или частицу вируса, см., например, Clever и др., 1995. J. of Virology, том 69, №4; стр. 2101-2109. В нескольких ретровирусных векторах используются минимальные сигналы упаковки (также называемые последовательностью пси [Ψ] или [Ψ+]), необходимые для заключения в капсид генома вируса. Таким образом, в данной заявке термины "последовательность упаковки", "сигнал упаковки", "пси" и символ "Ψ" используют для обозначения некодирующей последовательности, необходимой для заключения в капсид цепей ретровирусной РНК в процессе образования вирусной частицы.
В различных вариантах реализации векторы содержат модифицированные 5'-LTR и/или 3'-LTR. Модификации 3'-LTR часто осуществляют, чтобы улучшить безопасность лентивирусных или ретровирусных систем, делая вирусы неспособными реплицироваться. Квалифицированный специалист сможет определить, был ли модифицирован LTR, путем сравнения с исходным LTR. В данной заявке термин "неспособный реплицироваться" относится к вирусу, который не способен осуществить полную эффективную репликацию, так что инфекционные вирионы не образуются (например, неспособное реплицироваться потомство лентивируса). Термин "способный реплицироваться" относится к вирусу дикого типа или мутантному вирусу, который способен реплицироваться, так что репликация указанного вируса способна приводить к продукции инфекционных вирионов (например, способного реплицироваться лентивирусного потомства).
"Самоинактивирующиеся" (SIN) векторы относятся к неспособным реплицироваться векторам, например, ретровирусным или лентивирусным векторам, в которых область энхансера-промотора правого (3') LTR, известная как область U3, была модифицирована (например, путем делеции и/или замены) для предотвращения транскрипции вируса после первого раунда репликации вируса. Это происходит, так как область U3 правого (3') LTR используется в качестве матрицы для области U3 левого (5') LTR в процессе репликации вируса, и, таким образом, транскрипт вируса не может образоваться без энхансера-промотора U3. В дополнительном варианте реализации настоящего изобретения 3'-LTR модифицирован таким образом, что область U5 заменена, например, на гетерологичную или синтетическую последовательность поли(А), один или более инсуляторных элементов и/или индуцируемый промотор. Следует отметить, что модификации LTR, такие как модификации 3'-LTR, 5'-LTR или обоих 3' и 5'-LTR, также входят в объем настоящего изобретения.
Дополнительное улучшение безопасности обеспечивается заменой области U3 5'-LTR на гетерологичный промотор, чтобы запускать транскрипцию генома вируса во время образования вирусных частиц. Примеры гетерологичных промоторов, которые можно применять, включают, например, промоторы вируса обезьян 40 (SV40) (например, ранний или поздний), цитомегаловируса (CMV) (например, немедленно-ранний), вируса лейкоза мыши Молони (MoMLV), вируса саркомы Рауса (RSV) и вируса простого герпеса (HSV) (тимидинкиназы). Типичные промоторы способны запускать высокие уровни транскрипции Tat-независимым образом. Такая замена уменьшает вероятность рекомбинации с образованием способного реплицироваться вируса, так как в системе продукции вируса отсутствует полноразмерная последовательность U3. В некоторых вариантах реализации гетерологичный промотор может быть индуцируемым, так что транскрипция полноразмерного или части генома вируса будет происходить, только когда присутствует один или более факторов индукции. Факторы индукции включают, но не ограничены одним или более химическими соединениями или физиологическими условиями, например, температурой или рН, в которых культивируют клетки-хозяева.
В некоторых вариантах реализации вирусные векторы содержат элемент TAR. Термин "TAR" относится к генетическому элементу "ответа на трансактивацию", расположенному в области R лентивирусного (например, ВИЧ) LTR. Данный элемент взаимодействует с лентивирусным генетическим трансактивирующим элементом (tat) с повышением репликации вируса. Тем не менее, данный элемент не требуется в вариантах реализации, в которых область U3 5'-LTR заменена на гетерологичный промотор.
"Область R" относится к области внутри ретровирусных LTR, которая начинается в начале кэп-группы (т.е., в начале транскрипции) и заканчивается сразу перед началом поли(А)-тракта. Область R также определяют как фланкированную областями U3 и U5. Область R играет роль в процессе обратной транскрипции, позволяя перенос образующейся ДНК с одного конца генома к другому.
В данной заявке термин "элемент FLAP" относится к нуклеиновой кислоте, последовательность которой содержит центральный полипуриновый тракт и центральные последовательности терминации (сРРТ и CTS) ретровируса, например, ВИЧ-1 или ВИЧ-2. В некоторых вариантах реализации термины "элемент FLAP" и "cPPT/FLAP" используют взаимозаменяемо для обозначения упомянутого выше элемента FLAP. Подходящие элементы FLAP описаны в патенте США номер 6682907 и в Zennou, и др., 2000, Cell, 101:173. В процессе обратной транскрипции ВИЧ-1 центральное инициирование плюс-цепи ДНК в центральном полипуриновом тракте (сРРТ) и центральная терминация в центральной терминирующей последовательности (CTS) приводят к образованию трехцепочечной структуры ДНК с центральным вытесненным участком ДНК (flap) ВИЧ-1. Без привязки к какой-либо конкретной теории, указанный вытесненный участок ДНК может действовать как цис-активная детерминанта импорта в ядро генома лентивируса и/или может повышать титр вируса. В конкретных вариантах реализации остовы ретровирусного или лентивирусного вектора содержат один или более элементов FLAP против хода транскрипции или по ходу транскрипции от представляющих интерес гетерологичных генов в указанных векторах. Например, в конкретных вариантах реализации вектор содержит элемент FLAP. В одном варианте реализации вектор согласно настоящему изобретению содержит элемент FLAP, выделенный из ВИЧ-1.
В одном варианте реализации ретровирусные или лентивирусные переносящие векторы содержат один или более элементов экспорта. Термин "элемент экспорта" относится к цис-действующему посттранскрипционному регуляторному элементу, который регулирует транспорт РНК-транскрипта из ядра в цитоплазму клетки. Примеры элементов экспорта РНК включают, но не ограничены перечисленными: Rev-чувствительный регуляторный элемент вируса иммунодефицита человека (ВИЧ) (см., например, Cullen и др., 1991. J. Virol. 65: 1053; и Cullen и др., 1991. Cell 58: 423) и посттранскрипционный регуляторный элемент вируса гепатита В (HPRE). Как правило, элемент экспорта РНК размещают внутри 3'-НТО гена, и его можно встроить в виде одной или множества копий.
В конкретных вариантах реализации экспрессию гетерологичных последовательностей в вирусных векторах повышают путем внедрения в векторы посттранскрипционных регуляторных элементов, эффективных сайтов полиаденилирования и необязательно сигналов терминации транскрипции. Различные посттранскрипционные регуляторные элементы могут повышать уровень экспрессии гетерологичной нуклеиновой кислоты на уровне белка, например, посттранскрипционный регуляторный элемент вируса гепатита сурка (WPRE; Zufferey и др., 1999, J. Virol., 73:2886); посттранскрипционный регуляторный элемент, присутствующий в вирусе гепатита В (HPRE) (Huang и Yen, 1995, Mol. Cell. Biol., 5:3864); и тому подобные посттранскрипционные регуляторные элементы (Liu и др., 1995, Genes Dev., 9:1766). В конкретных вариантах реализации векторы согласно настоящему изобретению лишены или не содержат посттранскрипционный регуляторный элемент, такой как WPRE или HPRE, так как в некоторых случаях данные элементы увеличивают риск трансформации клеток и/или по существу или значительно не повышают количество мРНК-транскрипта или не повышают стабильность мРНК. Следовательно, в некоторых вариантах реализации векторы согласно настоящему изобретению лишены или не содержат WPRE или HPRE в качестве дополнительной меры безопасности.
В конкретных вариантах реализации векторы содержат последовательность полиаденилирования с 3'-стороны от полинуклеотида, кодирующего полипептид, который нужно экспрессировать. Термин "сайт поли(А)" или "последовательность поли(А)" в данной заявке обозначает последовательность ДНК, которая направляет как терминацию, так и полиаденилирование образующегося РНК-транскрипта РНК-полимеразой II. Последовательности полиаденилирования могут способствовать стабильности мРНК путем добавления поли(А)-хвоста к 3'-концу кодирующей последовательности и, таким образом, вносят вклад в повышенную эффективность трансляции. Отщепление и полиаденилирование направляет последовательность поли(А) в РНК. Коровая последовательность поли(А) для пре-мРНК млекопитающих содержит два элемента узнавания, фланкирующих сайт отщепления-полиаденилирования. Обычно, почти неизменный гексамер AAUAAA находится в 20-50 нуклеотидах против хода транскрипции от более вариабельного элемента, богатого остатками U или GU. Отщепление образующегося транскрипта происходит между данными двумя элементами и сопровождается добавлением до 250 аденозинов к 5'-отщепленному продукту. В конкретных вариантах реализации коровая последовательность поли(А) представляет собой идеальную последовательность поли(А) (например, ААТААА, АТТААА, AGTAAA). В конкретных вариантах реализации последовательность поли(А) представляет собой последовательность поли(А) SV40, последовательность поли(А) бычьего гормона роста (BGHpA), последовательность поли(А) β-глобина кролика (rβgpA) или другую подходящую гетерологичную или эндогенную последовательность поли(А), известную в данной области.
В некоторых вариантах реализации ретровирусный или лентивирусный вектор дополнительно содержит один или более инсуляторных элементов. Инсуляторные элементы могут способствовать защите экспрессируемых с лентивируса последовательностей, например, терапевтических полипептидов, от влияния сайта встраивания, которое может быть опосредовано цис-действующими элементами, присутствующими в геномной ДНК, и приводить к нарушению регуляции экспрессии перенесенных последовательностей (т.е., эффект положения; см., например, Burgess-Beusse и др., 2002, Proc. Natl. Acad. Set, USA, 99:16433; и Zhan и др., 2001, Hum. Genet., 109:471). В некоторых вариантах реализации переносящие векторы содержат один или более инсуляторных элементов в 3'-LTR, и после встраивания провируса в геном хозяина указанный провирус содержит один или более инсуляторов на 5'-LTR и/или 3'-LTR благодаря дупликации 3'-LTR. Подходящие инсуляторы для применения в настоящем изобретении включают, но не ограничены инсулятором β-глобина цыпленка (см. Chung и др., 1993. Cell 74:505; Chung и др., 1997. PNAS 94:575; и Bell и др., 1999. Cell 98:387, включены в данную заявку посредством ссылки). Примеры инсуляторных элементов включают, но не ограничены инсулятором из локуса β-глобина человека, таким как HS4 цыпленка.
Согласно некоторым конкретным вариантам реализации, большая часть или все последовательности остова вирусного вектора получены из лентивируса, например, ВИЧ-1. Тем не менее, должно быть очевидно, что можно использовать множество различных источников лентивирусных последовательностей, и можно ввести множество замен и изменений в некоторых из лентивирусных последовательностей, не нарушая способность переносящего вектора осуществлять функции, описанные в данной заявке. Более того, в данной области известны различные лентивирусные векторы, см. Naldini и др., (1996а, 1996b, и 1998); Zufferey и др., (1997); Dull и др., 1998, патенты США №6013516; и 5994136, многие из которых можно приспособить для продукции вирусного вектора или переносящей плазмиды согласно настоящему изобретению.
В данной заявке в объем термина "агент" входят полоксамеры, поликатионные полимеры, стауроспорин, малые органические молекулы, простагландины, энхансеры цАМФ, агонисты сигнального пути Wnt, агонисты сигнального пути цАМФ/PI3K/AKT, агонисты сигнального пути вторичного мессенджера Са2+, агонисты сигнального пути оксида азота (NO)/ангиотензина и неорганические химические вещества, включая, без ограничения, все их аналоги и производные.
"Малая молекула", "малая органическая молекула" или "низкомолекулярное соединение" относится к соединению с низкой молекулярной массой, молекулярная масса которого меньше чем приблизительно 5 кДа, меньше чем приблизительно 4 кДа, меньше чем приблизительно 3 кДа, меньше чем приблизительно 2 кДа, меньше чем приблизительно 1 кДа или меньше чем приблизительно 5 кДа. В конкретных вариантах реализации малые молекулы могут включать нуклеиновые кислоты, пептиды, пептидомиметики, пептоиды, другие малые органические соединения или лекарственные средства и тому подобные молекулы. Библиотеки химических и/или биологических смесей, таких как экстракты грибов, бактерий или водорослей, известны в данной области, и их можно подвергнуть скринингу с помощью любого из анализов согласно настоящему изобретению. Примеры способов синтеза молекулярных библиотек можно найти в Carell и др., 1994а; Carell и др., 1994b; Cho и др., 1993; DeWitt и др., 1993; Gallop и др., 1994; Zuckermann и др., 1994.
По отношению к агентам, таким как органические молекулы, термин "аналог" или "производное" относится к молекуле, которая аналогична другому химическому веществу по структуре и функции и часто отличается структурно одним элементом или группой, но может отличаться модификацией более чем одной группы (например, 2, 3 или 4 групп), если она сохраняет ту же функцию, что и исходное химическое вещество. Такие модификации стандартно используют специалисты в данной области, и они включают, например, дополнительные или замещающие химические молекулы, такие как сложные эфиры или амиды кислоты, защитные группы, такие как бензильная группа для спирта или тиола и трет-бутоксилкарбонильные группы для амина. Также в объем данного термина входят модификации алкильных боковых цепей, таких как алкильные замены (например, метил, диметил, этил и т.д.), изменения уровня насыщенности или ненасыщенности боковых цепей и добавление модифицированных групп, таких как содержащий заместители фенил и феноксил. Производные также могут включать конъюгаты, такие как молекулы биотина или авидина, ферменты, такие как пероксидаза хрена и тому подобные, и содержать радиоактивно меченые, биолюминесцентные, хемилюминесцентные или флуоресцентные молекулы. Также к агентам, описанным в данной заявке, можно добавить молекулы для изменения их фармакокинетических свойств, например, для увеличения времени их полужизни in vivo или ex vivo, или для повышения их способности проникать в клетку, среди прочих желательных свойств. Также включены пролекарства, которые, как известно, улучшают многочисленные желательные свойства фармацевтических средств (например, растворимость, биодоступность, производство и т.д.) (примеры агонистических пролекарств ЕР см., например, в WO/2006/047476, который включен посредством ссылки в отношении описания таких агонистов).
В данной заявке термины "полинуклеотид" или "нуклеиновая кислота" относятся к геномной ДНК (гДНК), комплементарной ДНК (кДНК) или ДНК. Полинуклеотиды включают одно- и двухцепочечные полинуклеотиды, либо рекомбинантные, либо синтетические, либо изолированные. В некоторых вариантах реализации полинуклеотид относится к информационной РНК (мРНК), РНК, геномной РНК (гРНК), плюс-цепи РНК (РНК(+)), минус-цепи РНК (РНК(-)). В данной заявке термины "полирибонуклеотид" или "рибонуклеиновая кислота" также относятся к информационной РНК (мРНК), РНК, геномной РНК (гРНК), плюс-цепи РНК (РНК(+)), минус-цепи РНК (РНК(-)) и ингибиторным РНК, включая, но не ограничиваясь перечисленными: миРНК, короткую шпилечную РНК (кшРНК), взаимодействующую с piwi РНК (пиРНК), миРНК или микроРНК, и кшРНК, заключенные в остов микроРНК (shmir). Предпочтительно полинуклеотиды согласно настоящему изобретению включают полинуклеотиды или варианты, последовательность которых по меньшей мере приблизительно на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична любой из эталонных последовательностей, описанных в данной заявке (см., например, перечень последовательностей), обычно при этом вариант сохраняет по меньшей мере одну биологическую активность эталонной последовательности. В различных типичных вариантах реализации предложены полинуклеотидные последовательности вирусного вектора и переносящей плазмиды и содержащие их композиции. В конкретных вариантах реализации предложены полинуклеотиды, кодирующие терапевтический полипептид, включая, но не ограничиваясь перечисленными: полипептид глобина, полипептид глобина, предотвращающего образование серповидноклеточных эритроцитов, полипептид аденозиндезаминазы, полипептид рецептора интерлейкина-2 гамма, полипептид трипептидилпептидазы 1, полипептид альфа-L-идуронидазы, полипептид идуронат-2-сульфатазы или полипептид представителя 1 подсемейства D (ALD) белков с АТФ-связывающей кассетой (ABCD1), которые обсуждались в других местах в данной заявке.
В данной заявке термины "вариант полинуклеотида", "вариант" и тому подобные термины относятся к полинуклеотидам, проявляющим существенную идентичность последовательности с эталонной полинуклеотидной последовательностью, или к полинуклеотидам, которые гибридизуются с эталонной последовательностью при строгих условиях, которые описаны далее в данной заявке. В объем данных терминов входят полинуклеотиды, в которых один или более нуклеотидов были вставлены, или удалены, или заменены на отличные нуклеотиды по сравнению с эталонным полинуклеотидом. В этом отношении, в данной области известно, что в эталонный полинуклеотид можно внести некоторые изменения, включая мутации, вставки, делеции и замены, при условии, что измененный полинуклеотид сохраняет биологическую функцию или активность эталонного полинуклеотида.
В данной заявке термин "изолированный" означает материал, например, полинуклеотид, полипептид, клетку, который по существу или главным образом свободен от компонентов, которые обычно сопровождают его в нативном состоянии. В конкретных вариантах реализации термин "полученный" или "происходящий" используют синонимично с термином "изолированный". Например, "изолированный полинуклеотид" в данной заявке относится к полинуклеотиду, который был очищен от последовательностей, которые фланкируют его во встречающемся в природе состоянии, например, к фрагменту ДНК, который был удален из последовательностей, которые обычно расположены рядом с указанным фрагментом.
Термины, которые описывают ориентацию полинуклеотидов, включают: 5' (обычно конец полинуклеотида, содержащий свободную фосфатную группу) и 3' (обычно конец полинуклеотида, содержащий свободную гидроксильную (ОН) группу). Полинуклеотидные последовательности можно обозначить как находящиеся в ориентации от 5' к 3' или в ориентации от 3' к 5'.
Термины "комплементарный" и "комплементарность" относятся к полинуклеотидам (т.е., к последовательностям нуклеотидов), связанным по правилам спаривания оснований. Например, комплементарная цепь для последовательности ДНК 5'-AGTCATG-3' представляет собой 3'-TCAGTAC-5'. Последнюю из упомянутых последовательностей часто записывают как обратный комплемент с 5'-концом слева и 3'-концом справа: 5'-CATGACT-3'. Последовательность, которая одинакова со своим обратным комплементом, называют палиндромной последовательностью. Комплементарность может быть "частичной", при которой лишь некоторые из оснований нуклеиновых кислот соответствуют друг другу согласно правилам спаривания оснований. Или может быть "полная" или "абсолютная" комплементарность между нуклеиновыми кислотами.
Термин "кассета нуклеиновых кислот" или "кассета экспрессии" в данной заявке относится к генетическим последовательностям внутри вектора, которые могут экспрессировать РНК и, впоследствии, полипептид. В одном варианте реализации кассета нуклеиновых кислот содержит представляющий(-е) интерес ген(ы), например, представляющий(-е) интерес полинуклеотид(ы). В другом варианте реализации кассета нуклеиновых кислот содержит одну или более контролирующих экспрессию последовательностей, например, промотор, энхансер, последовательность поли(А), и представляющий(-е) интерес ген(ы), например, представляющий(-е) интерес полинуклеотид(ы). Векторы могут содержать одну, две, три, четыре, пять или более кассет нуклеиновых кислот. Указанная кассета нуклеиновых кислот позиционно и последовательно ориентирована внутри вектора таким образом, что нуклеиновая кислота в кассете может транскрибироваться в РНК и, при необходимости, транслироваться в белок или полипептид, подвергнуться подходящим посттрансляционным модификациям, необходимым для активности в трансформированной клетке, и переместиться в подходящий компартмент для проявления биологической активности путем нацеливания на подходящие внутриклеточные компартменты или секреции во внеклеточные компартменты. Предпочтительно кассета содержит 3'- и 5'-концы, приспособленные для быстрой вставки в вектор, например, содержит на каждом конце сайты рестрикции эндонуклеазами. В предпочтительном варианте реализации кассета нуклеиновых кислот содержит последовательность терапевтического гена, используемую для лечения, предотвращения или снижения выраженности генетического расстройства. Указанную кассету можно удалить и встроить в плазмиду или вирусный вектор в виде единого элемента.
В данной заявке термин "представляющий(-е) интерес полинуклеотид(ы)" относится к одному или более полинуклеотидам, например, полинуклеотиду, кодирующему полипептид (т.е., представляющий интерес полипептид), встроенный в вектор экспрессии, который необходимо экспрессировать. В предпочтительных вариантах реализации векторы и/или плазмиды содержат один или более представляющих интерес полинуклеотидов, например, полинуклеотид, кодирующий полипептид глобина, полипептид глобина, предотвращающего образование серповидноклеточных эритроцитов, полипептид аденозиндезаминазы, полипептид рецептора интерлейкина-2 гамма, полипептид трипептидилпептидазы 1, полипептид альфа-L-идуронидазы, полипептид идуронат-2-сульфатазы или полипептид представителя 1 подсемейства D (ALD) белков с АТФ-связывающей кассетой (ABCD1). В некоторых вариантах реализации представляющий интерес полинуклеотид кодирует полипептид, который оказывает терапевтическое действие для лечения, предотвращения или снижения выраженности гематопоэтического заболевания или расстройства, который можно назвать "терапевтическим полипептидом", например, ген глобина. См., например, патенты США 6051402 и 7901671, полные описания и формулы изобретения которых особо включены в данную заявку посредством ссылки.
В некоторых других вариантах реализации представляющий интерес полинуклеотид кодирует полипептид, который оказывает терапевтическое действие, приводящее к лечению, предотвращению или снижению выраженности адренолейкодистрофии или адреномиелонейропатии, который можно назвать "терапевтическим полипептидом", например, ген ABCD1. См., например, патенты США 5869039 и 6013769, полные описания и формулы изобретения которых явно включены в данную заявку посредством ссылки.
Термин "глобин" в данной заявке относится к белкам или субъединицам белков, которые способны ковалентно или нековалентно связывать молекулу гема и, следовательно, могут транспортировать или запасать кислород. Субъединицы гемоглобинов позвоночных и беспозвоночных, миоглобинов позвоночных и беспозвоночных или их мутантов входят в объем термина глобин. В объем данного термина не входят гемоцианины. Примеры глобинов включают α-глобин или его вариант, β-глобин или его вариант, γ-глобин или его вариант и δ-глобин или его вариант.
В одном варианте реализации представляющий интерес полинуклеотид представляет собой трансген, который кодирует полипептид, который предоставляет терапевтическую функцию для лечения гемоглобинопатии, например, α-глобин, γ-глобин, β-глобин или предотвращающий образование серповидноклеточных эритроцитов β-глобин, например, β-глобинА-T87Q. Представляющие интерес полинуклеотиды и кодируемые с них полипептиды включают как полинуклеотиды, которые кодируют полипептиды дикого типа, так и их функциональные варианты и фрагменты. В конкретных вариантах реализации последовательность функционального варианта по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична соответствующей последовательность эталонного полинуклеотида или полипептида дикого типа. В некоторых вариантах реализации функциональный вариант или фрагмент обладает по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 100% или по меньшей мере 110% или более биологической активности соответствующего полипептида дикого типа. Примеры полинуклеотидных последовательностей, подходящих для применения в типичных вариантах реализации, включают, но не ограничены перечисленными: полинуклеотиды, кодирующие α-глобин, β-глобин, β-глобинА-T87Q, предотвращающие образование серповидноклеточных эритроцитов глобины, γ-глобин и δ глобин.
Полинуклеотиды, независимо от длины кодирующей последовательности самой по себе, можно комбинировать с другими последовательностями ДНК, такими как промоторы и/или энхансеры, нетранслируемые области (НТО), последовательности Козак, сигналы полиаденилирования, дополнительные сайты для ферментов рестрикции, сайты множественного клонирования, внутренние участки посадки рибосомы (IRES), участки распознавания рекомбиназой (например, сайты LoxP, FRT и Att), терминирующие кодоны, сигналы терминации транскрипции, полинуклеотиды, кодирующие самоотщепляющиеся полипептиды, эпитопные метки, описанные в других местах в данной заявке или известные в данной области, так что их суммарная длина может значительно изменяться. Следовательно, предполагается, что можно использовать фрагмент полинуклеотида практически любой длины, при этом общая длина предпочтительно ограничивается простотой получения и применения в предполагаемом протоколе для рекомбинантной ДНК.
Термин "контролирующая экспрессию последовательность" относится к полинуклеотидной последовательности, которая содержит один или более промоторов, энхансеров или других регулирующих транскрипцию элементов или комбинации перечисленных элементов, которые способны направлять, повышать, регулировать или контролировать транскрипцию или экспрессию функционально связанного с ними полинуклеотида. В конкретных вариантах реализации векторы согласно настоящему изобретению содержат одну или более контролирующих экспрессию последовательностей, которые специфичны для конкретных клеток, типов клеток или линий дифференцировки клеток, например, для целевых клеток; то есть, полинуклеотиды, функционально связанные с контролирующей экспрессию последовательностью, специфичной для конкретных клеток, типов клеток или линий дифференцировки клеток, экспрессируются в целевых клетках, но не в других нецелевых клетках. Каждая из одной или более контролирующих экспрессию последовательностей в векторе, которая специфична для конкретных клеток, может экспрессироваться в одной и той же или в различных типах клеток в зависимости от желательной терапии. В предпочтительных вариантах реализации векторы содержат одну или более контролирующих экспрессию последовательностей, специфичных для гематопоэтических клеток, например, гематопоэтических стволовых клеток или клеток-предшественников. В других предпочтительных вариантах реализации векторы содержат одну или более контролирующих экспрессию последовательностей, специфичных для гематопоэтических и/или эритроидных клеток.
Термин "промотор" в данной заявке относится к участку распознавания в полинуклеотиде (ДНК или РНК), с которым связывается РНК-полимераза.
Термин "энхансер" относится к фрагменту ДНК, который содержит последовательности, способные обеспечивать повышенную транскрипцию и, в некоторых случаях, может функционировать независимо от его ориентации по отношению к другой контролирующей последовательности. Энхансер может функционировать совместно или дополнительно к промоторам и/или другим энхансерным элементам. Термин "промотор/энхансер" относится к фрагменту ДНК, который содержит последовательности, способные осуществлять функции как промотора, так и энхансера.
В конкретных вариантах реализации вектор содержит экзогенные, эндогенные или гетерологичные контролирующие последовательности, такие как промоторы и/или энхансеры. "Эндогенная" контролирующая последовательность представляет собой такую последовательность, которая в природе связана с данным геном в геноме. "Экзогенная" контролирующая последовательность представляет собой такую последовательность, которую поместили рядом с геном с помощью генетических манипуляций (т.е., методик молекулярной биологии), так что транскрипция данного гена направляется связанным с ним энхансером/промотором. "Гетерологичная" контролирующая последовательность представляет собой экзогенную последовательность, которая получена из вида, отличного от вида, к которому принадлежит подвергнутая генетической манипуляции клетка. "Синтетическая" контролирующая последовательность может содержать элементы из одной или более эндогенных и/или экзогенных последовательностей и/или последовательностей, определенных in vitro или in silico, которые обеспечивают оптимальную активность промотора и/или энхансера для конкретной генотерапии.
Термин "функционально связанный" относится к расположению рядом, при котором описанные компоненты находятся во взаимосвязи, позволяющей им функционировать предполагаемым образом. В одном варианте реализации данный термин относится к функциональной связи между контролирующей экспрессию нуклеиновой кислоты последовательностью (такой как промотор, и/или энхансер, или другая контролирующая экспрессию последовательность) и второй полинуклеотидной последовательностью, например, представляющим интерес полинуклеотидом, при этом контролирующая экспрессию последовательность направляет транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
В данной заявке термин "конститутивная контролирующая экспрессию последовательность" относится к промотору, энхансеру или промотору/энхансеру, который позволяет непрерывную или постоянную транскрипцию функционально связанной с ним последовательности. Конститутивная контролирующая экспрессию последовательность может представлять собой "общераспространенный" промотор, энхансер или промотор/энхансер, который позволяет экспрессию в большом разнообразии типов клеток и тканей, или "специфичный для клетки", "специфичный для типа клеток", "специфичный для линии дифференцировки клеток" или "тканеспецифический" промотор, энхансер, или промотор/энхансер, который позволяет экспрессию в ограниченных разновидностях типов клеток и тканей, соответственно. Типичные общераспространенные контролирующие экспрессию последовательности включают, но не ограничены перечисленными: немедленно-ранний промотор цитомегаловируса (CMV), промотор вируса обезьян 40 (SV40) (например, ранний или поздний), промотор LTR вируса лейкоза мыши Молони (MoMLV), контролирующую экспрессию последовательность LTR вируса саркомы Рауса (RSV), промотор вируса простого герпеса (HSV) (тимидинкиназы), промоторы Н5, Р7.5 и Р11 из вируса коровьей оспы, промотор фактора элонгации 1-альфа (EF1a), контролирующую экспрессию последовательность белка раннего ростового ответа 1 (EGR1), ферритина Н (FerH), ферритина L (FerL), глицеральдегид-3-фосфатдегидрогеназы (GAPDH), эукариотического фактора инициации трансляции 4А1 (EIF4A1), белка теплового шока 5 массой 70 кДа (HSPA5), представителя 1 белков теплового шока бета массой 90 кДа (HSP90B1), белка теплового шока массой 70 кДа (HSP70), β-кинезина (β-KIN), локуса ROSA 26 человека (Irions и др., (2007) Nature Biotechnology 25, 1477-1482), промотор убиквитина С (UBC), промотор фосфоглицераткиназы-1 (PGK), энхансер цитомегаловируса/промотор β-актина цыпленка (CAG) и промотор β-актина.
В некотором варианте реализации может быть желательно применение специфичной для клетки, типа клеток, линии дифференцировки клеток или ткани контролирующей экспрессию последовательности для достижения специфичной для типа клеток, специфичной для линии дифференцировки или тканеспецифической экспрессии желательной полинуклеотидной последовательности (например, для экспрессии конкретной нуклеиновой кислоты, кодирующей полипептид только в подгруппе типов клеток, линий дифференцировки клеток или тканей или во время конкретной стадии развития).
Наглядные примеры тканеспецифических промоторов включают, но не ограничены перечисленными: промотор В29 (экспрессия в В-клетках), промотор родственного runt фактора транскрипции (CBFa2) (специфическая экспрессия в стволовых клетках), промотор CD14 (экспрессия в моноцитарных клетках), промотор CD43 (экспрессия в лейкоцитах и тромбоцитах), промотор CD45 (экспрессия в гематопоэтических клетках), промотор CD68 (экспрессия в макрофагах), промотор CYP450 3А4 (экспрессия в гепатоцитах), промотор десмина (экспрессия в мышцах), промотор эластазы 1 (экспрессия в ацинарных клетках поджелудочной железы), промотор эндоглина (экспрессия в эндотелиальных клетках), промотор фибробласт-специфичного белка 1 (FSP1) (экспрессия в фибробластах), промотор фибронектина (экспрессия в фибробластах), промотор fms-родственной тирозинкиназы 1 (FLT1) (экспрессия в эндотелиальных клетках), промотор глиального фибриллярного кислого белка (GFAP) (экспрессия в астроцитах), промотор инсулина (экспрессия в бета-клетках поджелудочной железы), промотор интегрина альфа 2b (ITGA2B) (мегакариоциты), промотор молекулы межклеточной адгезии 2 (ICAM-2) (эндотелиальные клетки), промотор интерферона бета (IFN-β) (гематопоэтические клетки), промотор кератина 5 (экспрессия в кератиноцитах), промотор миоглобина (MB) (экспрессия в мышцах), промотор гена миогенной дифференцировки 1 (MYOD1) (экспрессия в мышцах), промотор нефрина (экспрессия в подоцитах), промотор белка гамма-карбоксиглутамата 2 кости (OG-2) (экспрессия в остеобластах), промотор трансферазы 2В 3-оксокислотной СоА (Oxct2B) (экспрессия в гаплоидной сперматиде), промотор поверхностно-активного белка В (SP-B) (экспрессия в легком), промотор синапсина (экспрессия в нейронах), промотор белка синдрома Вискотта-Олдрича (WASP) (экспрессия в гематопоэтических клетках).
В одном варианте реализации вектор содержит один или более специфичных для гематопоэтических клеток или тканеспецифических промоторов и/или энхансеров, выбранных из группы, состоящей из: промотора β-глобина человека; LCR β-глобина человека; и энхансера HS40 α-глобина человека и промотора анкирина-1, функционально связанных с полинуклеотидом, кодирующим полипептид глобина.
В другом варианте реализации вектор согласно настоящему изобретению содержит промотор, активный в микроглиальной клетке, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1). В некоторых вариантах реализации промотор содержит энхансер миелопролиферативного вируса саркомы, промотор MND с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент.
В данной заявке "условная экспрессия" может относиться к любому типу условной экспрессии, включая, но не ограничиваясь перечисленными: индуцируемую экспрессию; репрессируемую экспрессию; экспрессию в клетках или тканях, находящихся в определенном физиологическом, биологическом или болезненном состоянии и т.д. Не предполагается, что данное определение исключает специфическую для типа клеток или тканеспецифическую экспрессию. В некоторых вариантах реализации настоящего изобретения предложена условная экспрессия представляющего интерес полинуклеотида, например, экспрессию контролируют, подвергая клетку, ткань, организм и т.д. обработке или помещая в условия, которые вызывают экспрессию полинуклеотида или которые вызывают повышение или снижение экспрессии полинуклеотида, кодируемого представляющим интерес полинуклеотидом.
Наглядные примеры индуцируемых промоторов/систем включают, но не ограничены перечисленными: индуцируемые стероидами промоторы, такие как промоторы для генов, кодирующих рецепторы глюкокортикоидов или эстрогенов (индуцируемые обработкой соответствующим гормоном), промотор металлотионеина (индуцируемый обработкой различными тяжелыми металлами), промотор МХ-1 (индуцируемый интерфероном), регулируемую мифепристоном систему "GeneSwitch" (Sirin и др., (2003), Gene, 323:67), индуцируемый куматом переключатель генов (WO 2002/088346), тетрациклин-зависимые регуляторные системы и т.д.
Условной экспрессии также можно добиться, применяя сайт-специфическую ДНК-рекомбиназу. Согласно некоторым вариантам реализации вектор может содержать по меньшей мере один (обычно два) сайт для рекомбинации, опосредованной сайт-специфической рекомбиназой. В данной заявке термины "рекомбиназа" или "сайт-специфическая рекомбиназа" включают вырезающие или объединяющие белки, ферменты, кофакторы или ассоциированные с ними белки, которые участвуют в реакциях рекомбинации с вовлечением одного или более сайтов рекомбинации (например, двух, трех, четырех, пяти, семи, десяти, двенадцати, пятнадцати, двадцати, тридцати, пятидесяти и т.д.), которые могут представлять собой белки дикого типа (см. Landy, (1993) Current Opinion in Biotechnology 3:699-707) или их мутанты, производные (например, слитые белки, содержащие рекомбинационные белковые последовательности или их фрагменты), фрагменты и варианты. Наглядные примеры рекомбиназ, подходящих для применения в конкретных вариантах реализации настоящего изобретения, включают, но не ограничены перечисленными: Cre, Int, IHF, Xis, Flp, Fis, Hin, Gin, ФС31, Cin, резольвазу Tn3, TndX, XerC, XerD, TnpX, Hjc, Gin, SpCCE1 и ParA.
Указанные векторы могут содержать один или более сайтов рекомбинации для любой из большого разнообразия сайт-специфических рекомбиназ. Должно быть очевидно, что целевой сайт для сайт-специфической рекомбиназы встраивают дополнительно к какому-либо сайту(-ам), необходимому(-ым) для встраивания вектора, например, ретровирусного вектора или лентивирусного вектора. В данной заявке термины "последовательность рекомбинации", "сайт рекомбинации" или "участок сайт-специфической рекомбинации" относятся к конкретной последовательности нуклеиновой кислоты, которую распознает и связывает рекомбиназа.
Например, один сайт рекомбинации для рекомбиназы Cre представляет собой 1охР, который представляет собой последовательность из 34 пар оснований, содержащую два инвертированных повтора по 13 пар оснований (которые служат в качестве сайтов связывания рекомбиназы), фланкирующих коровую последовательность из 8 пар оснований (см. фиг. 1 в Sauer, В., (1994) Current Opinion in Biotechnology 5:521-527). Другие примеры сайтов loxP включают, но не ограничены перечисленными: 1ох511 (Hoess и др., 1996; Bethke и Sauer, 1997), lox5171 (Lee и Saito, 1998), lox2272 (Lee и Saito, 1998), m2 (Langer и др., 2002), lox71 (Albert и др., 1995) и lox66 (Albert и др., 1995).
Подходящие сайты распознавания для рекомбиназы FLP включают, но не ограничены перечисленными: FRT (McLeod, и др., 1996), F1, F2, F3 (Schlake и Bode, 1994), F4, F5 (Schlake и Bode, 1994), FRT(LE) (Senecoff и др., 1988), FRT(RE) (Senecoff и др., 1988).
Другими примерами последовательностей узнавания являются последовательности attB, attP, attL и attR, которые узнаются рекомбиназным ферментом λ интегразой, например, phi-c31. ϕС31 SSR опосредует рекомбинацию только между гетеротипическими сайтами attB (длиной 34 п. о.) и attP (длиной 39 п. о.) (Groth и др., 2000). Оба сайта attB и attP (сайты присоединения (от attachment) интегразы фага в геномах бактерии (В) и фага (Р), соответственно) содержат неидеальные инвертированные повторы, которые вероятно связаны гомодимерами ϕС31 (Groth и др., 2000). Полученные сайты attL и attR активно инертны к дальнейшей опосредованной ϕС31 рекомбинации (Belteki и др., 2003), что делает данную реакцию необратимой. В отношении катализа вставок было обнаружено, что несущая attB ДНК встраивается в геномный сайт attP легче, чем сайт attP в геномный сайт attB (Thyagarajan и др., 2001; Belteki и др., 2003). Таким образом, в обычных стратегиях несущий attP "сайт присоединения" располагают путем гомологичной рекомбинации в определенном локусе, который затем образует пару с несущей attB образующейся последовательностью для вставки.
В данной заявке "внутренний участок посадки рибосомы" или "IRES" относится к элементу, который вызывает непосредственную внутреннюю посадку рибосомы на инициирующий кодон, такой как ATG, цистрона (кодирующей белок области), тем самым приводя к кэп-независимой трансляции гена. См., например, Jackson и др., (1990) Trends Biochem Sci 15(12):477-83) и Jackson и Kaminski. (1995) RNA 1(10):985-1000. В конкретных вариантах реализации вектор содержит один или более представляющих интерес полинуклеотидов, которые кодируют один или более полипептидов. В конкретных вариантах реализации для достижения эффективной трансляции каждого из множества полипептидов, указанные полинуклеотидные последовательности можно разделить одной или более последовательностями IRES или полинуклеотидными последовательностями, кодирующими самоотщепляющиеся полипептиды.
В данной заявке термин "последовательность козак" относится к короткой последовательности нуклеотидов, которая значительно способствует первоначальному связыванию мРНК с малой субъединицей рибосомы и повышает уровень трансляции. Консенсусная последовательность козак представлена далее: (GCC)RCCATGG, где R представляет собой пурин (А или G) (Kozak, (1986) Cell. 44(2):283-92, и Kozak, (1987) Nucleic Acids Res. 15(20):8125-48). В конкретных вариантах реализации векторы, предложенные в настоящем изобретении, содержат полинуклеотиды, которые содержат консенсусную последовательность козак и которые кодируют желательный полипептид.
В некоторых вариантах реализации векторы содержат ген селекции, также называемый селектируемым маркером. Обычные гены селекции кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, гигромицину, метотрексату, зеоцину, бластицидину или тетрациклину, (b) восполняют ауксотрофный дефицит или (с) предоставляют необходимые питательные вещества, которые не доступны в комплексной среде, например, ген, кодирующий D-аланинрацемазу для бацилл. Можно применять любое количество систем селекции для получения линий трансформированных клеток. Они включают, но не ограничены перечисленными: гены тимидинкиназы вируса простого герпеса (Wigler и др., (1977) Cell 11:223-232) и аденинфосфорибозилтрансферазы (Lowy и др., (1990) Cell 22:817-823), которые можно использовать в клетках tk- или aprt-, соответственно.
В различных вариантах реализации векторы применяют для повышения, установления и/или поддержания экспрессии одного или более полипептидов. Термины "полипептид" и "белок" используют взаимозаменяемо в данной заявке по отношению к полимеру из аминокислотных остатков и к его вариантам и синтетическим аналогам. Таким образом, данные термины используют по отношению как к полимерам аминокислот, в которых один или более аминокислотных остатков являются синтетическими не встречающимися в природе аминокислотами, такими как химический аналог соответствующей встречающейся в природе аминокислоты, так и к полимерам встречающихся в природе аминокислот. Наглядные примеры полипептидов включают, но не ограничены полипептидами глобинов, подходящими для применения в композициях и способах конкретных вариантов реализации. Также см., например, патенты США 6051402; 7901671 и 9068199, полные описания и формулы изобретения которых явно включены в данную заявку посредством ссылки.
Наглядные примеры полипептидов также включают полипептиды ABCD1. Также см., например, патенты США 5869039; 6013769; 8858928 и 9061031, полные описания и формулы изобретения которых явно включены в данную заявку посредством ссылки.
Дополнительно наглядные примеры полипептидов включают, но не ограничены перечисленными: полипептид глобина, полипептид глобина, предотвращающего образование серповидноклеточных эритроцитов, полипептид аденозиндезаминазы, полипептид рецептора интерлейкина-2 гамма, полипептид трипептидилпептидазы 1, полипептид альфа-L-идуронидазы, полипептид идуронат-2-сульфатазы или полипептид представителя 1 подсемейства D (ALD) белков с АТФ-связывающей кассетой (ABCD1).
Конкретные варианты реализации, предложенные в данной заявке, также включают "варианты" полипептидов. Термин "вариант" полипептида относится к полипептидам, которые отличаются от исходного полипептида вставкой, делецией, укорачиванием, модификациями и/или заменой по меньшей мере одного аминокислотного остатка, и которые сохраняют биологическую активность. В некоторых вариантах реализации вариант полипептида отличается от исходного полипептида одной или более заменами, которые могут быть консервативными или неконсервативными, как известно в данной области.
В некоторых вариантах реализации последовательность аминокислот варианта полипептида по меньшей мере приблизительно на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более процентов идентична или подобна соответствующей последовательности исходного полипептида. В некоторых вариантах реализации вставки или делеции аминокислот встречаются на С-конце и/или N-конце исходного полипептида.
Выше отмечено, что полипептиды согласно настоящему изобретению можно изменить различными способами, включая замены аминокислот, делеции, укорачивания и вставки. Способы таких манипуляций, как правило, известны в данной области. Например, варианты последовательности аминокислот исходного полипептида можно получить, внося мутации в ДНК. Способы мутагенеза и изменений последовательности нуклеотидов хорошо известны в данной области. См., например, Kunkel (1985) Proc. Natl Acad. Sci. USA. 82: 488-492, Kunkel и др., (1987) Methods in Enzymol, 154: 367-382, патент США номер 4873192, Watson, J.D. и др., (1987) Molecular Biology of the Gene, четвертое издание, Benjamin/Cummings, Менло Парк, Калифорния, и ссылки, цитированные в указанных источниках. Руководство по подходящим заменам аминокислот, которые не влияют на биологическую активность представляющего интерес белка, можно найти в модели Dayhoff и др., (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Вашингтон, округ Колумбия).
"Клетка-хозяин" включает клетки, трансфицированные, инфицированные или трансдуцированные in vivo, ex vivo или in vitro рекомбинантным вектором или полинуклеотидом, предложенным в данной заявке. Клетки-хозяева могут включать пакующие клетки, клетки-продуценты и клетки, инфицированные вирусными векторами. В конкретных вариантах реализации клетки-хозяева, инфицированные вирусным вектором согласно настоящему изобретению, вводят нуждающемуся в терапии субъекту. В некоторых вариантах реализации термин "целевая клетка" используют взаимозаменяемо с термином клетка-хозяин, и он относится к трансфицированным, инфицированным или трансдуцированным клеткам желательного типа. В предпочтительных вариантах реализации целевая клетка представляет собой стволовую клетку или клетку-предшественника. В некоторых предпочтительных вариантах реализации целевая клетка представляет собой соматическую клетку, например, стволовую клетку взрослого, клетку-предшественника или дифференцированную клетку. В особо предпочтительных вариантах реализации целевая клетка представляет собой гематопоэтическую клетку, например, гематопоэтическую стволовую клетку или клетку-предшественника. Дополнительные терапевтические целевые клетки обсуждаются ниже.
В конкретных вариантах реализации целевые клетки представляют собой первичную клетку. Термин "первичная клетка", используемый в данной заявке, известен в данной области как относящийся к клетке, которую выделили из ткани и приспособили для роста in vitro или ex vivo. Соответствующие клетки претерпевают очень малое число удвоений популяции, если вообще претерпевают, и, следовательно, лучше представляют основной функциональный компонент ткани, из которой они получены, по сравнению с непрерывными линиями клеток, следовательно, являются более репрезентативной моделью состояния in vivo. Способы получения образцов из различных тканей и способы получения линий первичных клеток хорошо известны в данной области (см., например, Jones и Wise, Methods Mol Biol. 1997). Первичные клетки для применения в способе согласно настоящему изобретению получены, например, из крови, лимфомы и эпителиальных опухолей. В одном варианте реализации первичная клетка представляет собой гематопоэтическиую стволовую клетку или клетку-предшественника.
Термин "стволовая клетка" относится к клетке, которая представляет собой недифференцированную клетку, способную к (1) длительному самообновлению или способную образовывать по меньшей мере одну идентичную копию исходной клетки, (2) дифференцировке на уровне одной клетки во множество, а в некоторых случаях только в один специализированный тип клеток, и (3) функциональной регенерации тканей in vivo. Стволовые клетки разделяют на следующие подклассы в соответствии с их способностью к дифференцировке: тотипотентные, плюрипотентные, мультипотентные и олиго/унипотентные. "Самообновление" относится к клетке с уникальной способностью производить неизмененные дочерние клетки и образовывать специализированные типы клеток (потентность). Самообновления можно добиться двумя путями. В результате асимметричного деления клетки образуется одна дочерняя клетка, которая идентична исходной клетке, и одна дочерняя клетка, которая отличается от исходной клетки и представляет собой клетку-предшественника или дифференцированную клетку. В результате симметричного деления клетки образуется две идентичные дочерние клетки. "Пролиферация" или "размножение" клеток относится к симметрично делящимся клеткам.
В данной заявке термин "предшественник" или "клетки-предшественники" относится к клеткам, обладающим способностью к самообновлению и дифференцировке в более зрелые клетки. Многие клетки-предшественники дифференцируются по одной линии дифференцировки, но могут обладать достаточно обширной способностью к пролиферации.
Гематопоэтические стволовые клетки (ГСК) порождают коммитированные гематопоэтические клетки-предшественники (ГКП), которые способны образовывать весь репертуар зрелых клеток крови на всем протяжении жизни организма. Термин "гематопоэтическая стволовая клетка" или "ГСК" относится к мультипотентным стволовым клеткам, которые порождают все типы клеток крови организма, включая миелоидные (например, моноциты и макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки) и лимфоидные линии дифференцировки (например, Т-клетки, В-клетки, NK-клетки), а также другие типы клеток, известные в данной области (см. Fei, R., и др., патент США №5635387; McGlave, и др., патент США №5460964; Simmons, Р., и др., патент США №5677136; Tsukamoto, и др., патент США №5750397; Schwartz, и др., патент США №5759793; DiGuisto, и др., патент США №5681599; Tsukamoto, и др., патент США №5716827). После трансплантации облученным летальной дозой животным или людям гематопоэтические стволовые клетки и клетки-предшественники могут восстановить популяцию эритроидных клеток, нейтрофилов-макрофагов, мегакариоцитов и лимфоидных гематопоэтических клеток.
Крупномасштабное получение вирусных частиц часто необходимо для достижения приемлемого титра вируса. Вирусные частицы получают путем трансфекции переносящим вектором пакующей линии клеток, которая содержит структурные и/или вспомогательные гены вируса, например, гены gag, pol, env, tat, rev, vif, vpr, vpu, vpx, или nef, или другие гены ретровирусов.
В данной заявке термин "пакующий вектор" относится к вектору экспрессии или вирусному вектору, в котором отсутствует сигнал упаковки, и включает полинуклеотид, кодирующий один, два, три, четыре или более структурных и/или вспомогательных генов вируса. Обычно пакующие векторы содержатся в пакующей клетке, и их внедряют в указанную клетку путем трансфекции, трансдукции или инфекции. Способы трансфекции, трансдукции или инфекции хорошо известны специалистам в данной области. Ретровирусный/лентивирусный переносящий вектор, предложенный в конкретных вариантах реализации, можно внедрить в пакующую линию клеток путем трансфекции, трансдукции или инфекции с получением клетки-продуцента или линии клеток-продуцентов. Пакующие векторы можно внедрить в клетки или линии клеток человека с помощью стандартных способов, включая, например, кальций-фосфатную трансфекцию, липофекцию или электропорацию. В некоторых вариантах реализации пакующие векторы внедряют в клетки вместе с доминантным селектируемым маркером, таким как неомицин, гигромицин, пуромицин, бластицидин, зеоцин, тимидинкиназа, DHFR, синтетаза Gin или ADA, а затем подвергают селекции в присутствии подходящего препарата и выделяют клонов. Ген селектируемого маркера может быть физически связан с генами, кодирующими пакующий вектор, например, посредством IRES или самоотщепляющихся пептидов вируса.
Белки оболочки вируса (env) определяют диапазон клеток-хозяев, которые в конечном итоге могут быть инфицированы и трансформированы рекомбинантными ретровирусами, полученными из линий клеток. В случае лентивирусов, таких как ВИЧ-1, ВИЧ-2, SIV, FIV и EIV, белки env включают gp41 и gpl20. Предпочтительно, белки env вируса, которые экспрессируются пакующими клетками согласно настоящему изобретению, кодируются отдельным вектором от кодирующего гены gag и pol вируса, что было описано ранее.
Наглядные примеры полученных из ретровируса генов env, которые можно применять в настоящем изобретении, включают, но не ограничены перечисленными: гены оболочек MLV, оболочки 10А1, оболочек эндогенного вируса бабуинов (BAEV), вируса лейкоза кошачьих типа В (FeLV-B), эндогенного вируса кошачьих RD114, ассоциированного с саркомой вируса обезьян (SSAV), вируса эбола, вируса сендай, вируса чумы домашней птицы (FPV) и вируса гриппа. Аналогично, можно применять гены, кодирующие оболочки из РНК-содержащих вирусов (например, РНК-содержащего вируса из семейства Picornaviridae, Calciviridae, Astroviridae, Togaviridae, Flaviviridae, Coronaviridae, Paramyxoviridae, Rhabdoviridae, Filoviridae, Orthomyxoviridae, Bunyaviridae, Arenaviridae, Reoviridae, Bimaviridae, Retroviridae), а также из ДНК-вирусов (семейства Hepadnaviridae, Circoviridae, Parvoviridae, Papovaviridae, Adenoviridae, Herpesviridae, Poxyiridae и Iridoviridae). Типичные примеры включают: FeLV, VEE, HFVW, WDSV, SFV, вирус бешенства, ALV, BIV, BLV, EBV, CAEV, SNV, ChTLV, STLV, MPMV, SMRV, RAV, FuSV, MH2, AEV, AMV, CT10 и EIAV.
В других вариантах реализации белки оболочки для псевдотипирования вируса согласно настоящему изобретению включают, но не ограничены белками оболочки из любого из следующих вирусов: вируса гриппа А, такого как H1N1, H1N2, H3N2 и H5N1 (птичий грипп), вируса гриппа В, вируса гриппа С, вируса гепатита А, вируса гепатита В, вируса гепатита С, вируса гепатита D, вируса гепатита Е, ротавируса, любого вируса из группы вирусов норфолк, кишечных аденовирусов, парвовируса, вируса лихорадки денге, вируса оспы обезьян, Mononegavirales, лиссавируса, такого как вирус бешенства, вируса лагосских летучих мышей, вируса мокола, вируса Duvenhage, вируса европейский летучих мышей 1 и 2 и вируса австралийских летучих мышей, эфемеровируса, везикуловируса, вируса везикулярного стоматита (VSV), герпесвирусов, таких как вирус простого герпеса типа 1 и 2, ветряная оспа, опоясывающий лишай, цитомегаловирус, вирус Эпштейна-Барр (EBV), герпесвирусов человека (HHV), герпесвируса типа 6 и 8 человека, вируса иммунодефицита человека (ВИЧ), вируса папилломы, гаммагерпесвируса мыши, аренавирусов, таких как вирус аргентинской геморрагической лихорадки, вирус боливийской геморрагической лихорадки, сэбия-ассоциированный вирус геморрагической лихорадки, вирус венесуэльской геморрагической лихорадки, вирус лихорадки ласса, вирус мачупо, вирус лимфоцитарного хориоменингита (LCMV), Bunyaviridiae, таких как вирус конго-крымской геморрагической лихорадки, хантавирус, вирус, вызывающий геморрагическую лихорадку с почечным синдромом, вирус лихорадки долины Рифт, Filoviridae (филовирусы), включая вирус геморрагической лихорадки эбола и вирус марбургской геморрагической лихорадки, Flaviviridae, включая вирус болезни Кьясанурского леса, вирус омской геморрагической лихорадки, вирус, вызывающий переносимый клещами энцефалит, и Paramyxoviridae, такие как вирус Хендра и вирус Нипах, Variola major и Variola minor (малая оспа), альфавирусы, такие как вирус венесуэльского лошадиного энцефалита, вирус восточного лошадиного энцефалита, вирус западного лошадиного энцефалита, SARS-ассоциированный коронавирус (SARS-CoV), вирус лихорадки Западного Нила, любой вызывающий энцефалит вирус.
В одном варианте реализации предложены пакующие клетки, которые продуцируют рекомбинантный ретровирус, например, лентивирус, псевдотипированные гликопротеином VSV-G.
Термины "псевдотип" или "псевдотипирование" в данной заявке относятся к вирусу, белки оболочки которого были заменены на таковые из другого вируса, обладающего предпочтительными свойствами. Например, ВИЧ можно псевдотипировать G-белками оболочки вируса везикулярного стоматита (VSV-G), что позволяет ВИЧ инфицировать более широкий диапазон клеток, так как белки оболочки ВИЧ (кодируемые геном env) обычно нацеливают вирус на CD4+-представляющие клетки. В предпочтительном варианте реализации белки оболочки лентивируса псевдотипируют VSV-G. В одном варианте реализации пакующие клетки продуцируют рекомбинантный ретровирус, например, лентивирус, псевдотипированный гликопротеином оболочки VSV-G.
В данной заявке термин "линии пакующих клеток" используют для обозначения линий клеток, которые не содержат сигнал упаковки, но стабильно или временно экспрессируют структурные белки и ферменты репликации вируса (например, gag, pol и env), которые необходимы для правильной упаковки вирусных частиц. В конкретных вариантах реализации для получения пакующих клеток согласно настоящему изобретению можно применять подходящую линию клеток. Как правило, указанные клетки представляют собой клетки млекопитающих. В некотором варианте реализации клетки, используемые для получения линии пакующих клеток, представляют собой клетки человека. Подходящие линии клеток, которые можно применять, включают, например, клетки СНО, клетки BHK, клетки MDCK, клетки С3Н 10Т1/2, клетки FLY, клетки Psi-2, клетки BOSC 23, клетки РА317, клетки WEHI, клетки COS, клетки BSC 1, клетки BSC 40, клетки ВМТ 10, клетки VERO, клетки W138, клетки MRC5, клетки А549, клетки НТ1080, клетки 293, клетки 293Т, клетки В-50, клетки 3Т3, клетки NIH3T3, клетки HepG2, клетки Saos-2, клетки Huh7, клетки HeLa, клетки W163, клетки 211 и клетки 211А. В предпочтительных вариантах реализации пакующие клетки представляют собой клетки 293, клетки 293Т, клетки 293F или клетки А549.
В данной заявке термин "линия клеток-продуцентов" относится к линии клеток, которые способны продуцировать рекомбинантные ретровирусные частицы, включающей линию пакующих клеток и конструкцию переносящего вектора, содержащую сигнал упаковки. Получение инфекционных вирусных частиц и исходных растворов вируса можно осуществить, применяя обычные методики. Способы получения исходных растворов вируса известны в данной области и проиллюстрированы, например, в Y. Soneoka и др. (1995) Nucl. Acids Res. 23:628-633, и N. R. Landau и др. (1992) J. Virol. 66:5110-5113. Инфекционные вирусные частицы можно собрать из пакующих клеток, применяя обычные методики. Например, инфекционные частицы можно собрать путем лизиса клеток или сбора супернатанта из культуры клеток, как известно в данной области. Необязательно собранные вирусные частицы можно очистить, если требуется. Подходящие методики очистки хорошо известны специалистам в данной области, например, Kutner и др., ВМС Biotechnol. 2009; 9:10. doi: 10.1186/1472-6750-9-10; Kutner и др. Nat. Protoc. 2009; 4(4):495-505. doi: 10.1038/nprot.2009.22.
Термины "улучшать", или "стимулировать", или "увеличивать", или "расширять", как правило, относятся к способности указанных композиций и/или способов, предложенных в данной заявке, вызывать, обусловливать или создавать более высокие количества трансдуцированных клеток по сравнению с количеством клеток, трансдуцированных либо средой, либо контрольной молекулой/композицией. В одном варианте реализации трансдукция гематопоэтической стволовой клетки или клетки-предшественника с помощью композиций и способов, предложенных в данной заявке, позволяет получить повышенное количество трансдуцированных клеток по сравнению с существующими композициями и способами трансдукции. Повышение уровня трансдукции клеток можно установить, применяя способы, известные в данной области, такие как анализы по гену-репортеру, ОТ-ПЦР и экспрессия белка на поверхности клетки, среди прочих. "Повышенный" или "увеличенный" уровень трансдукции обычно представляет собой "статистически значимый" уровень и может включать увеличение в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, в 500, 1000 раз) (включая все целые числа и десятичные знаки между и выше 1, например, 1,5, 1,6, 1,7, 1,8, и т.д.) относительно количества клеток, трансдуцированных средой, контрольной композицией или другим способом трансдукции.
Термины "уменьшать", или "снижать", или "убавлять", или "сокращать", или "ослаблять", как правило, относятся к композициям или способам, которые приводят к сравнительно меньшему количеству трансдуцированных клеток по сравнению с клетками, трансдуцированными с помощью композиций и/или способов согласно настоящему изобретению. "Уменьшенное" или "сокращенное" количество трансдуцированных клеток обычно представляет собой "статистически значимое" количество и может включать уменьшение в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между и выше 1, например, 1,5, 1,6, 1,7, 1,8, и т.д.) относительно количества трансдуцированных клеток (эталонного ответа), полученных с помощью композиций и/или способов согласно настоящему изобретению.
Термины "сохранять", или "предохранять", или "поддержание", или "нет изменений", или "нет существенных изменений", или "нет существенного снижения", как правило, относятся к физиологическому ответу, который сопоставим с ответом, вызванным либо средой, либо контрольной молекулой/композицией, или к ответу в конкретной клетке. Сопоставимый ответ представляет собой такой ответ, который значительно не отличается или измеримо не отличается от эталонного ответа.
В следующем далее описании приведены некоторые конкретные подробности, чтобы дать полное понимание различных пояснительных вариантов реализации настоящего изобретения, предложенных в данной заявке. Тем не менее, для специалиста в данной области должно быть очевидно, что конкретные пояснительные варианты реализации можно осуществить без данных подробностей. Кроме того, должно быть очевидно, что отдельные векторы или группы векторов, полученных из различных комбинаций структур и замещающих групп, описанных в данной заявке, раскрыты в настоящей заявке в той же степени, как если бы каждый вектор или группа векторов был описан отдельно. Таким образом, выбор конкретных структур вектора или конкретных замещающих групп входит в объем настоящего описания.
С. Агенты
Различные варианты реализации, предложенные в данной заявке, обусловлены неожиданным открытием, что эффективность трансдукции и/или ЧКВ значительно повышается при приведении в контакт клеток in vitro, ex vivo или in vivo с ретровирусом и одним или более агентами, которые повышают эффективность трансдукции или ЧКВ, предложенными в данной заявке. В различных вариантах реализации эффективность трансдукции значительно повышается при приведении в контакт клеток in vitro, ex vivo или in vivo с ретровирусом и полоксамером. В различных вариантах реализации эффективность трансдукции значительно повышается при приведении в контакт клеток in vitro, ex vivo или in vivo с ретровирусом и полоксамером, возможно в комбинации с одним или более поликатионными полимерами или пептидами. В различных вариантах реализации эффективность трансдукции значительно повышается при приведении в контакт клеток in vitro, ex vivo или in vivo с ретровирусом, полоксамером и одним или более агентами, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, и/или стауроспорином, необязательно в комбинации с одним или более поликатионными полимерами или пептидами.
1. АГОНИСТЫ ПУТИ ПЕРЕДАЧИ СИГНАЛОВ РЕЦЕПТОРА ПРОСТАГЛАНДИНА ЕР.
Неожиданно авторы настоящего изобретения обнаружили, что эффективность трансдукции и/или ЧКВ в популяциях клеток, содержащих гематопоэтические стволовые клетки и клетки-предшественники, можно повысить путем культивирования указанных клеток в присутствии ретровируса, полоксамера и одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, и их аналогов и производных.
В конкретных вариантах реализации популяцию клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, трансдуцируют путем культивирования клеток в присутствии ретровируса в присутствии одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, т.е. агониста пути передачи сигналов рецептора простагландина ЕР, и полоксамера.
Агенты, которые стимулируют передачу сигналов рецептора простагландина ЕР, включают, но не ограничены малыми молекулами или соединениями, описанными в WO 2007/112084 и WO 2010/108028, каждый из которых полностью включен в данную заявку посредством ссылки. В данной заявке формулировки "стимулируют передачу сигналов рецептора простагландина ЕР", "активируют передачу сигналов рецептора простагландина ЕР" или "повышают передачу сигналов рецептора простагландина ЕР" в общем смысле относятся к способности агента повышать активность передачи сигнала от рецептора простагландина ЕР в клетке, которую приводят в контакт с одним или более агентами, по сравнению с активностью передачи сигнала в клетке от рецептора простагландина ЕР в отсутствие одного или более указанных агентов. Анализы, которые можно применять для измерения активации или стимуляции пути передачи сигналов рецептора простагландина ЕР, известны в данной области и описаны, например, в WO 20107108028, который полностью включен в данную заявку посредством ссылки.
Наглядные примеры агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, включают, но не ограничены перечисленными: малые молекулы, например, малые органические молекулы, простагландины, агонисты сигнального пути Wnt, агонисты сигнального пути сАМР/PI3K/AKT, агонисты сигнального пути вторичного мессенджера Са2+, агонисты сигнального пути оксида азота (NO)/ангиотензина и другие соединения, которые, как известно, стимулируют сигнальный путь простагландина, выбранные из группы, состоящей из: мебеверина, флурандренолида, атенолола, пиндолола, габоксадола, кинуреновой кислоты, гидралазина, тиабендазола, бикукуллина, везамикола, перувозида, имипрамина, хлорпропамида, 1,5-пентаметилентетразола, 4-аминопиридина, диазоксида, бенфотиамина, 12-метоксидодеценовой кислоты, N-формил-Met-Leu-Phe, галламина, IAA 94, хлортрианизена и производных данных соединений.
В конкретных вариантах реализации агент, который стимулирует сигнальный путь простагландина, представляет собой встречающуюся в природе или синтетическую химическую молекулу или полипептид, который связывается и/или взаимодействует с рецептором ЕР, обычно чтобы активировать или усилить один или более нисходящих сигнальных путей, связанных с рецептором простагландина ЕР.
В одном варианте реализации агент, который стимулирует сигнальный путь простагландина, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1 (алпростадила); PGE2; PGF2; PGI2 (эпопростенола); PGH2; PGJ2; и их производных и аналогов.
Дополнительные типичные агенты, которые стимулируют сигнальный путь простагландина, включают, но не ограничены перечисленными: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновую кислоту (ННТ); тромбоксан (ТХА2 и ТХВ2); аналоги PGI2, например, илопрост и трепростинил; аналоги PGF2, например, травопрост, трометамин карбопроста, талфупрост, латанопрост, биматопрост, изопропил унопростона, клопростенол, эстрофан и суперфан; аналоги PGE1, например, 11-дезокси-PGE1, мизопростол и бутапрост; и спирт кори-А [[3аα,4а,5β,6аα]-(-)-[гексагидро-4-(гидроксиметил)-2-оксо-2Н-циклопента[b]фуран-5-ил][1,1'-бифенил]-4-карбоксилат]; спирт кори-В [2Н-циклопента[b]фуран-2-он,5-(бензоилокси)гексагидро-4-(гидроксиметил)[3aR-(3аα,4α,5β,6аα)]]; и диол кори ((3aR,4S,5R,6aS)-гексагидро-5-гидрокси-4-(гидроксиметил)-2Н-циклопента[b]фуран-2-он).
В одном варианте реализации агент представляет собой лиганд рецептора простагландина ЕР, включая, но не ограничиваясь простагландином Е2 (PGE2), а также его "аналогами" или "производными". Простагландины в целом относятся к подобным гормонам молекулам, которые получают из жирных кислот, содержащих 20 атомов углерода, включая 5-углеродное кольцо, описанное в данной заявке и известное в данной области.
Наглядные примеры "аналогов" или "производных" PGE2 включают, но не ограничены перечисленными: 16,16-диметил-PGE2, 16-16 диметил-PGE2 п-(п-ацетамидобензамидо)фениловый эфир, 11-дезокси-16,16-диметил-PGE2, 9-дезокси-9-метилен-16, 16-диметил-PGE2, 9-дезокси-9-метилен-PGE2, 9-кетофлупростенол, 5-транс-PGE2, 17-фенил-омега-тринор-PGE2, сериноламид PGE2, метиловый эфир PGE2, 16-фенилтетранор PGE2, 15(S)-15-метил-PGE2, 15(R)-15-метил-PGE2, 8-изо-15-кето-PGE2, изопропиловый сложный эфир 8-изо-PGE2, 20-гидрокси-PGE2, ноклопрост, сульпростон, бутапрост, 15-кето-PGE2 и 19(R)-гидрокси-PGE2.
Также в данной заявке предложены аналоги или производные простагландина со сходной с PGE2 структурой, которые содержат в качестве заместителя галоген в 9 положении (см., например, WO 2001/12596, который полностью включен в данную заявку посредством ссылки), а также производные 2-декарбокси-2-фосфиникопростагландина, такие как описанные в публикации патента США №2006/0247214, который полностью включен в данную заявку посредством ссылки).
В некоторых вариантах реализации соединение представляет собой лиганд не на основе PGE2. В некоторых вариантах реализации лиганд не на основе PGE2 выбран из группы, состоящей из агониста EP1, агониста ЕР2, агониста ЕР3 и агониста ЕР4.
В конкретных вариантах реализации рецептор простагландина ЕР выбран из ЕР1, ЕР2, ЕР3 и ЕР4.
Наглядные примеры агонистов EP1 не на основе PGE2 включают, но не ограничены перечисленными: ONO-DI-004 и ONO-8713. Наглядные примеры агонистов ЕР2 не на основе PGE2 включают, но не ограничены перечисленными: CAY10399, ONO_8815Ly, ONO-AE1-259 и СР-533,536. Дополнительные примеры агонистов ЕР2 не на основе PGE2 включают карбазолы и флуорены, описанные в WO 2007/071456, включенном в данную заявку посредством ссылки в отношении описания таких агентов. Наглядные примеры агонистов ЕР3 не на основе PGE2 включают, но не ограничены перечисленными: АЕ5-599, МВ28767, GR 63799Х, ONO-NT012 и ONO-AE-248. Наглядные примеры агонистов ЕР4 не на основе PGE2 включают, но не ограничены перечисленными: ONO-4819, APS-999 Na, АН23848 и ONO-AE 1-329. Дополнительные примеры агонистов ЕР4 не на основе PGE2 можно найти в WO 2000/038663; патенте США №6747037 и патенте США №6610719, каждый из которых включен посредством ссылки в отношении описания таких агонистов.
В одном варианте реализации агент, который стимулирует путь передачи сигналов рецептора простагландина ЕР, представляет собой агонист Wnt. Наглядные примеры агонистов Wnt включают, но не ограничены полипептидами Wnt и ингибиторами киназы 3 гликогенсинтазы (GSK3). Наглядные примеры полипептидов wnt, подходящих для применения в качестве соединений, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, включают, но не ограничены перечисленными: Wnt1, Wnt2, Wnt2b/13, Wnt3, Wnt3a, Wnt4, Wnt5a, Wnt5b, Wnt6, Wnt7a, Wnt7b, Wnt7c, Wnt8, Wnt8a, Wnt8b, Wnt8c, Wnt10a, Wnt10b, Wnt11, Wnt14, Wnt15 или Wnt15 и их биологически активные фрагменты.
Ингибиторы GSK3, подходящие для применения в качестве агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, связывают и снижают активность GSK3α или GSK3β. Наглядные примеры ингибиторов GSK3 включают, но не ограничены перечисленными: BIO (6-бромоиндирубин-3'-оксим), LiCl или другие ингибиторы GSK-3, приведенные в качестве примера в патентах США 6057117 и 6608063 и заявках на патенты США 2004/0092535 и 2004/0209878; АТР-конкурентные селективные ингибиторы GSK-3-CHIR-911 и CH1R-837 (также называемые СТ-99021 и СТ-98023, соответственно). Chiron Corporation (Эмеривилл, Калифорния).
В другом варианте реализации агент, который стимулирует путь передачи сигналов рецептора простагландина ЕР, повышает передачу сигналов через сигнальный путь вторичного мессенджера сАМР/PI3K/AKT и выбран из группы, состоящей из дибутирил-сАМР (DBcAMP), форболового эфира, форсколина, скларелина, 8-бром-сАМР, токсина холеры (СТх), аминофиллина, 2,4-динитрофенола (DNP), норэпинефрина, эпинефрина, изопротеренола, изобутилметилксантина (IBMX), кофеина, теофиллина (диметилксантина), дофамина, ролипрама, илопроста, полипептида, активирующего аденилатциклазу гипофиза (РАСАР), вазоактивного полипептида кишечника (VIP) и производных данных агентов.
В еще одном варианте реализации агент, который стимулирует путь передачи сигналов рецептора простагландина ЕР, повышает передачу сигналов через сигнальный путь вторичного мессенджера Са2+ и выбран из группы, состоящей из Bapta-AM, фендилина, никардипина и производных данных агентов.
В другом варианте реализации агент, который стимулирует путь передачи сигналов рецептора простагландина ЕР, повышает передачу сигналов через сигнальный путь NO/ангиотензина и выбран из группы, состоящей из L-Arg, нитропруссида натрия, ванадата натрия, брадикинина и производных перечисленных агентов.
В одном варианте реализации предложен способ улучшения эффективности трансдукции, включающий культивирование популяции клеток с ретровирусом и полоксамером и одним или более агентами, которые повышают передачу сигналов рецептора простагландина ЕР, выбранными из группы, состоящей из: простагландина, PGE2; PGD2; PGI2; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; бутапроста; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2; 15(R)-15-метил-PGE2; BIO; 8-бром-сАМР; форсколина; Bapta-AM; фендилина; никардипина; нифедипина; пимозида; строфантидина; ланатозида; L-Arg; нитропруссида натрия; ванадата натрия; брадикинина; мебеверина; флурандренолида; атенолола; пиндолола; габоксадола; кинуреновой кислоты; гидралазина; тиабендазола; бикукуллина; везамикола; перувозида; имипрамина; хлорпропамида; 1,5-пентаметилентетразола; 4-аминопиридина; диазоксида; бенфотиамина; 12-метоксидодеценовой кислоты; N-формил-Met-Leu-Phe; галламина; IAA 94 и хлортрианизена.
В некотором варианте реализации способ улучшения эффективности трансдукции включает культивирование популяции клеток с ретровирусом и полоксамером и одним или более агентами, которые представляют собой лиганды рецептора простагландина ЕР, выбранными из группы, состоящей из: PGE2, 16,16-диметил-PGE2, п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2, 11-дезокси-16,16-диметил-PGE2, 9-дезокси-9-метилен-16, 16-диметил-PGE2, 9-дезокси-9-метилен-PGE2, 9-кетофлупростенола, 5-транс-PGE2, 17-фенил-омега-тринор-PGE2, сериноламида PGE2, метилового эфира PGE2, 16-фенилтетранора PGE2, 15(S)-15-метил-PGE2, 15(R)-15-метил-PGE2, 8-изо-15-кето-PGE2, изопропилового сложного эфира 8-изо-PGE2, 20-гидрокси-PGE2, ноклопроста, сульпростона, бутапроста, 15-кето-PGE2 и 19(R)-гидрокси-PGE2.
В конкретных вариантах реализации агент, который стимулирует рецептор пути передачи сигналов простагландина ЕР, представляет собой PGE2 или 16,16-диметил-PGE2.
В одном варианте реализации агент, который стимулирует рецептор пути передачи сигналов простагландина ЕР, представляет собой PGE2.
В различных вариантах реализации популяцию клеток культивируют в присутствии ретровируса, одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, и полоксамера со средней молекулярной массой, составляющей приблизительно 10000 дальтон.
В различных вариантах реализации популяцию клеток культивируют в присутствии ретровируса, одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, и полоксамера, средняя молекулярная масса субъединиц полипропилена в котором составляет более чем приблизительно 2250 дальтон и который содержит более чем приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В некоторых вариантах реализации полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В одном варианте реализации полоксамер представляет собой полоксамер 288.
В одном варианте реализации полоксамер представляет собой полоксамер 335.
В одном варианте реализации полоксамер представляет собой полоксамер 338.
В одном варианте реализации полоксамер представляет собой полоксамер 407.
2. СТАУРОСПОРИН
Стауроспорин - алкалоид, исходно полученный в Streptomyces staurospores в 1977 г. как противогрибковый агент. Стауроспорин представляет собой ингибитор протеинкиназ широкого спектра, ингибирующий такие киназы как, например, протеинкиназа С (PKC), сАМР-зависимая протеинкиназа (PKA), киназа фосфорилазы, киназа рибосомного белка S6, киназа рецептора эпидермального фактора роста (EGF-R) и Са2+/кальмодулин-зависимая протеинкиназа II (Са/СаМ PKII). Наибольшая эффективность ингибирования наблюдается в отношении PKC (IC50=2,7 нМ), и в несколько раз более низкая в отношении других протеинкиназ. Стауроспорин проявляет сильную цитотоксичность в отношении линий опухолевых клеток млекопитающих, индуцирует апоптоз клеток и останавливает рост поделившихся дрожжевых клеток, в частности, на стадии сразу после деления клетки.
Неожиданно авторы настоящего изобретения также обнаружили, что эффективность трансдукции и/или ЧКВ в популяциях клеток, содержащих гематопоэтические стволовые клетки и клетки-предшественники, можно повысить путем культивирования указанных клеток в присутствии ретровируса, полоксамера и стауроспорина, и их аналогов и производных.
В различных вариантах реализации популяцию клеток культивируют в присутствии ретровируса, стауроспорина и полоксамера, средняя молекулярная масса которого составляет приблизительно 10000 дальтон.
В различных вариантах реализации популяцию клеток культивируют в присутствии ретровируса, стауроспорина и полоксамера, средняя молекулярная масса субъединиц полипропилена в котором составляет более чем приблизительно 2250 дальтон, и который содержит более чем приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В некоторых вариантах реализации полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В одном варианте реализации полоксамер представляет собой полоксамер 288.
В одном варианте реализации полоксамер представляет собой полоксамер 335.
В одном варианте реализации полоксамер представляет собой полоксамер 338.
В одном варианте реализации полоксамер представляет собой полоксамер 407.
3. ПОЛОКСАМЕРЫ И ПОЛИКАТИОННЫЕ ПОЛИМЕРЫ
В конкретных вариантах реализации повышают эффективность трансдукции популяции клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники, путем культивирования клеток в присутствии ретровируса и полоксамера.
В конкретных вариантах реализации повышают эффективность трансдукции популяции клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники, путем культивирования клеток в присутствии ретровируса в присутствии одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорина и полоксамера.
В конкретных вариантах реализации ЧКВ повышается в популяции клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники, эффективно трансдуцированной путем культивирования клеток в присутствии ретровируса в присутствии одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорина и полоксамера.
"Полоксамер" относится к неионному триблок-сополимеру, состоящему из центральной гидрофобной цепи полиоксипропилена, фланкированной двумя гидрофильными цепями полиоксиэтилена. Полоксамеры также известны под торговым наименованием "плюроники" или "синпероники" (BASF). Указанный блок-сополимер может быть представлен следующей формулой: HO(C2H40)×(C3H60)y(C2H40)zH.
Длины блоков полимера могут быть различными в зависимости от требований; в результате можно получить различные полоксамеры. Средняя молекулярная масса полоксамеров, подходящих для применения в конкретных вариантах реализации, составляет по меньшей мере приблизительно 10 кДа, по меньшей мере приблизительно 11,4 кДа, по меньшей мере приблизительно 12,6 кДа, по меньшей мере приблизительно 13 кДа, по меньшей мере приблизительно 14,6 кДа или по меньшей мере приблизительно 15 кДа. В конкретных вариантах реализации у может находиться в диапазоне от приблизительно 39 до приблизительно 70.
В конкретных вариантах реализации у составляет по меньшей мере приблизительно 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 или 70 или более.
В конкретных вариантах реализации x+z может находиться в диапазоне от приблизительно 70 до приблизительно 275.
В конкретных вариантах реализации x+z может находиться в диапазоне от приблизительно 200 до приблизительно 275.
В конкретных вариантах реализации x+z составляет по меньшей мере приблизительно 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 191, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274 или 275.
В конкретных вариантах реализации x+z составляет по меньшей мере приблизительно 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274 или 275, или больше.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамерах, подходящих для применения в конкретных вариантах реализации, составляет более чем приблизительно 2250 дальтон, по меньшей мере приблизительно 2300 дальтон, по меньшей мере приблизительно 2350 дальтон, по меньшей мере приблизительно 2400 дальтон, по меньшей мере приблизительно 2450 дальтон, по меньшей мере приблизительно 2500 дальтон, по меньшей мере приблизительно 2550 дальтон, по меньшей мере приблизительно 2600 дальтон, по меньшей мере приблизительно 2650 дальтон, по меньшей мере приблизительно 2700 дальтон, по меньшей мере приблизительно 2750 дальтон, по меньшей мере приблизительно 2800 дальтон, по меньшей мере приблизительно 2850 дальтон, по меньшей мере приблизительно 2900 дальтон, по меньшей мере приблизительно 2950 дальтон, по меньшей мере приблизительно 3000 дальтон, по меньшей мере приблизительно 3050 дальтон, по меньшей мере приблизительно 3100 дальтон, по меньшей мере приблизительно 3150 дальтон, по меньшей мере приблизительно 3200 дальтон, по меньшей мере приблизительно 3250 дальтон, по меньшей мере приблизительно 3300 дальтон, по меньшей мере приблизительно 3350 дальтон, по меньшей мере приблизительно 3400 дальтон, по меньшей мере приблизительно 3450 дальтон, по меньшей мере приблизительно 3500 дальтон, по меньшей мере приблизительно 3550 дальтон, по меньшей мере приблизительно 3600 дальтон, по меньшей мере приблизительно 3650 дальтон, по меньшей мере приблизительно 3700 дальтон, по меньшей мере приблизительно 3750 дальтон, по меньшей мере приблизительно 3800 дальтон, по меньшей мере приблизительно 3850 дальтон, по меньшей мере приблизительно 3900 дальтон, по меньшей мере приблизительно 3950 дальтон, по меньшей мере приблизительно 4000 дальтон, по меньшей мере приблизительно 4050 дальтон или по меньшей мере приблизительно 4100 дальтон.
В конкретных вариантах реализации полоксамеры, подходящие для применения в конкретных вариантах реализации, содержат приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, или приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамерах, подходящих для применения в конкретных вариантах реализации, составляет более чем приблизительно 2250 дальтон, по меньшей мере приблизительно 2300 дальтон, по меньшей мере приблизительно 2350 дальтон, по меньшей мере приблизительно 2400 дальтон, по меньшей мере приблизительно 2450 дальтон, по меньшей мере приблизительно 2500 дальтон, по меньшей мере приблизительно 2550 дальтон, по меньшей мере приблизительно 2600 дальтон, по меньшей мере приблизительно 2650 дальтон, по меньшей мере приблизительно 2700 дальтон, по меньшей мере приблизительно 2750 дальтон, по меньшей мере приблизительно 2800 дальтон, по меньшей мере приблизительно 2850 дальтон, по меньшей мере приблизительно 2900 дальтон, по меньшей мере приблизительно 2950 дальтон, по меньшей мере приблизительно 3000 дальтон, по меньшей мере приблизительно 3050 дальтон, по меньшей мере приблизительно 3100 дальтон, по меньшей мере приблизительно 3150 дальтон, по меньшей мере приблизительно 3200 дальтон, по меньшей мере приблизительно 3250 дальтон, по меньшей мере приблизительно 3300 дальтон, по меньшей мере приблизительно 3350 дальтон, по меньшей мере приблизительно 3400 дальтон, по меньшей мере приблизительно 3450 дальтон, по меньшей мере приблизительно 3500 дальтон, по меньшей мере приблизительно 3550 дальтон, по меньшей мере приблизительно 3600 дальтон, по меньшей мере приблизительно 3650 дальтон, по меньшей мере приблизительно 3700 дальтон, по меньшей мере приблизительно 3750 дальтон, по меньшей мере приблизительно 3800 дальтон, по меньшей мере приблизительно 3850 дальтон, по меньшей мере приблизительно 3900 дальтон, по меньшей мере приблизительно 3950 дальтон, по меньшей мере приблизительно 4000 дальтон, по меньшей мере приблизительно 4050 дальтон или по меньшей мере приблизительно 4100 дальтон; и они содержат по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, или по меньшей мере приблизительно 80% оксида полиэтилена.
В одном варианте реализации средняя молекулярная масса субъединиц полипропилена в полоксамерах, подходящих для применения в конкретных вариантах реализации, составляет по меньшей мере приблизительно 3200 дальтон, и они содержат по меньшей мере приблизительно 50% оксида полиэтилена.
Так как синтез блок-сополимеров не может быть точным, точные приведенные выше значения могут быть недостижимы при синтезе, и среднее значение будет отличаться в некоторой степени. Таким образом, термин "полоксамер" в данной заявке можно использовать взаимозаменяемо с термином "полоксамеры" (представляющим собой молекулу из нескольких полоксамеров, также называемую смесью полоксамеров), если явно не указано противоположное. Термин "средний" в отношении количества мономерных единиц или молекулярной массы (а) полоксамера(-ов) в данной заявке является следствием технической невозможности получить все полоксамеры с идентичным составом и, следовательно, идентичной молекулярной массой. Полоксамеры, полученные согласно способам существующего уровня техники, будут представлены в виде смеси полоксамеров, молекулярная масса каждого из которых будет изменяться, но молекулярная масса смеси как целого в среднем будет такой, как указано в данной заявке. BASF и Sigma Aldrich являются подходящими источниками полоксамеров для применения в конкретных вариантах реализации, предложенных в данной заявке.
Авторы настоящего изобретения неожиданно обнаружили, что полоксамеры, описанные в данной заявке, отдельно или в комбинации с агентом, который стимулирует путь передачи сигналов рецептора простагландина ЕР, или стауроспорином значительно повышают эффективность трансдукции и/или ЧКВ ретровирусных векторов в адгерентных и суспензионных целевых клетках, по существу не влияя на их жизнеспособность.
В одном варианте реализации полоксамер, подходящий для применения в конкретных вариантах реализации, предложенных в данной заявке, выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В одном варианте реализации полоксамер, подходящий для применения в конкретных вариантах реализации, предложенных в данной заявке, представляет собой полоксамер 288.
В одном варианте реализации полоксамер, подходящий для применения в конкретных вариантах реализации, предложенных в данной заявке, представляет собой полоксамер 335.
В одном варианте реализации полоксамер, подходящий для применения в конкретных вариантах реализации, предложенных в данной заявке, представляет собой полоксамер 338.
В одном варианте реализации полоксамер, подходящий для применения в конкретных вариантах реализации, предложенных в данной заявке, представляет собой полоксамер 407.
В одном варианте реализации полоксамер 288 (F98; НО(С2Н40)х(С3Н60)у(С2Н40)zH; х+у=236,36, z=44,83; средняя молекулярная масса составляет 13 кДа) применяют для повышения эффективности трансдукции и/или ЧКВ в популяции гематопоэтических клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники. F98 можно применять отдельно или в комбинации с агентом, который стимулирует путь передачи сигналов рецептора простагландина ЕР, или стауроспорином для повышения эффективности трансдукции и/или ЧКВ.
В одном варианте реализации полоксамер 335 (Р105; НО(С2Н40)х(С3Н60)у(С2Н40)2Н; х+у=73,86, z=56,03; средняя молекулярная масса составляет 6,5 кДа) применяют для повышения эффективности трансдукции и/или ЧКВ в популяции гематопоэтических клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники. Р105 можно применять отдельно или в комбинации с агентом, который стимулирует путь передачи сигналов рецептора простагландина ЕР, или стауроспорином для повышения эффективности трансдукции и/или ЧКВ.
В одном варианте реализации полоксамер 338 (F108; НО(С2Н40)х(С3Н60)у(С2Н40)zH; х+у - 265,45, z=50,34; средняя молекулярная масса составляет 14,6 кДа) применяют для повышения эффективности трансдукции и/или ЧКВ в популяции гематопоэтических клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники. F108 можно применять отдельно или в комбинации с агентом, который стимулирует путь передачи сигналов рецептора простагландина ЕР, или стауроспорином для повышения эффективности трансдукции и/или ЧКВ.
В одном варианте реализации полоксамер 407 (F127; НО(С2Н40)х(С3Н60)у(С2Н40)zH; х+у - 200,45, z=65,17; средняя молекулярная масса составляет 12,6 кДа) применяют для повышения эффективности трансдукции и/или ЧКВ в популяции гематопоэтических клеток, содержащей гематопоэтические стволовые клетки или клетки-предшественники. F127 можно применять отдельно или в комбинации с агентом, который стимулирует путь передачи сигналов рецептора простагландина ЕР, или стауроспорином для повышения эффективности трансдукции и/или ЧКВ.
В некотором варианте реализации популяцию гематопоэтических клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, культивируют в присутствии ретровируса и полоксамера для повышения эффективности трансдукции и/или ЧКВ.
В некотором варианте реализации популяцию гематопоэтических клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, культивируют в присутствии ретровируса, полоксамера, агента, который стимулирует путь передачи сигналов рецептора простагландина ЕР, или стауроспорина, и поликатионного полимера. для повышения эффективности трансдукции и/или ЧКВ.
"Поликатионные полимеры" относится к заряженным полимерам, повторяющиеся единицы которых несут положительный заряд, в которых положительный заряд на повторяющейся единице возникает от протонированных молекул азота. Наглядные примеры поликатионных полимеров, которые подходят для применения в конкретных вариантах реализации, предложенных в данной заявке, включают, но не ограничены перечисленными: полиэтиленимин (PEI), блок-сополимер поли(этиленгликоля)-поли-L-лизина (PEG-PLL), 1,5-диметил-1,5-диазаундекаметилена полиметобромид (полибрен), поликатионные пептиды, например, поли-L-лизин и сульфат протамина.
D. Вирусные векторы
Ретровирусные и лентивирусные векторы подвергли анализу и обнаружили, что они являются подходящими средствами доставки для стабильного внедрения представляющих интерес генов, например, кодирующих терапевтические полипептиды, в геном широкого спектра целевых клеток. Конкретные варианты реализации, предложенные в данной заявке, обеспечивают повышенную эффективность трансдукции и/или ЧКВ генотерапевтических векторов в популяции клеток, которую вводят субъекту для осуществления генотерапии.
В одном варианте реализации вектор представляет собой переносящий вектор. Хотя для квалифицированного специалиста должно быть очевидно, что такие переносящие векторы можно получить, применяя разнообразие различных вирусных векторов, в конкретных вариантах реализации переносящий вектор представляет собой ретровирусный вектор или лентивирусный вектор, в том числе поскольку лентивирусные векторы способны осуществлять эффективную доставку, встраивание и длительную экспрессию трансгенов в неделящихся клетках как in vitro, так и in vivo. Различные лентивирусные векторы известны в данной области: см. Naldini и др., (1996а, 1996b и 1998); Zufferey и др., (1997); Dull и др., 1998, патенты США №6013516 и 5994136, - любой из которых может быть пригоден для получения переносящего вектора, предложенного в данной заявке.
Обычно, данные векторы получают на основе плазмиды или на основе вируса и сконфигурированы таким образом, что они несут последовательности, необходимые для переноса нуклеиновой кислоты, кодирующей терапевтический полипептид, в клетку-хозяина.
В наглядных вариантах реализации ретровирусный вектор представляет собой лентивирусный вектор. Таким образом, указанные векторы можно получить из вируса иммунодефицита человека 1 (ВИЧ-1), вируса иммунодефицита человека 2 (ВИЧ-2), вируса иммунодефицита обезьян (SIV), вируса иммунодефицита кошек (FIV), вируса иммунодефицита крупного рогатого скота (BIV), вируса болезни Джембрана (JDV), вируса инфекционной анемии лошадей (EIAV), вируса артрита-энцефалита коз (CAEV) и тому подобных вирусов. Остовы вектора на основе ВИЧ (т.е., цис-действующие элементы последовательности ВИЧ и гены gag, pol и rev ВИЧ), как правило, предпочтительны в рамках большинства аспектов настоящего изобретения в том отношении, что конструкции на основе ВИЧ наиболее эффективно трансдуцируют клетки человека.
Хотя в конкретных наглядных вариантах реализации содержится более подробное описание векторов, композиций и способов, применяемых для купирования гематопоэтических расстройств, например, гемоглобинопатии, указанные варианты реализации, предложенные в данной заявке, не следует считать ограниченными настоящим описанием. Квалифицированный специалист в данной области с легкостью поймет, что принципы, проиллюстрированные в данной заявке, можно применять по отношению к генотерапии в других системах, например, нервной системе, включая глаз, центральную нервную систему и периферическую нервную систему; кровеносной системе; мышечной системе; скелетной системе; органах, включая кожу, сердце, легкие, поджелудочную железу, печень, почку, кишечник и тому подобные органы.
В одном варианте реализации ретровирусные векторы содержат контролирующую экспрессию последовательность, которая направляет экспрессию представляющего интерес полинуклеотида, например, гена глобина, в конкретном типе клеток или линии дифференцировки клеток. Применение контролирующей экспрессию в типе клеток или линии дифференцировки клеток последовательности дает преимущества в отношении безопасности, ограничивая экспрессию полинуклеотида желательной стадией дифференцировки клеток в одной линии дифференцировки; и, следовательно, векторы согласно настоящему изобретению уменьшают опасения, касающиеся эктопической экспрессии полипептидов в нежелательных типах клеток.
В одном неограничивающем примере указанная контролирующая экспрессию последовательность может представлять собой общераспространенную контролирующую экспрессию последовательность, описанную в других местах в данной заявке.
В другом неограничивающем примере контролирующая экспрессию последовательность может представлять собой контролирующую экспрессию последовательность, специфичную для стволовых клеток, которая направляет специфичную для стволовых клеток экспрессию представляющего интерес полинуклеотида в эмбриональной стволовой клетке, нервной стволовой клетке, мезенхимальной стволовой клетке, стволовой клетке печени, стволовой клетке поджелудочной железы, стволовой клетке сердца, стволовой клетке почки или гематопоэтической стволовой клетке.
В еще одном неограничивающем примере контролирующая экспрессию последовательность может представлять собой контролирующую экспрессию последовательность, специфичную для типа клеток или линии дифференцировки клеток, которая направляет экспрессию представляющего интерес полинуклеотида в гематопоэтической стволовой клетке, гематопоэтической клетке-предшественнике, миелоидной клетке, лимфоидной клетке, клетке тромбопоэтической линии дифференцировки, тучной клетке, клетке эритропоэтической линии дифференцировки, клетке гранулопоэтической линии дифференцировки и клетке моноцитопоэтической линии дифференцировки.
В конкретных вариантах реализации вектор, предложенный в данной заявке, экспрессирует полинуклеотид, например, представляющий интерес ген, в одной или более или всех гематопоэтических клетках, включая, но не ограничиваясь перечисленными: гематопоэтические стволовые клетки, гематопоэтические клетки-предшественники, миелоидные предшественники, лимфоидные предшественники, тромбопоэтические предшественники, эритроидные предшественники, гранулопоэтические предшественники, моноцитопоэтические предшественники, мегакариобласты, промегакариоциты, мегакариоциты, тромбоциты/кровяные пластинки, проэритробласты, базофильные эритробласты, полихроматические эритробласты, ортохроматические эритробласты, полихроматические эритроциты, эритроциты (RBC), базофильные промиелоциты, базофильные миелоциты, базофильные метамиелоциты, базофилы, нейтрофильные промиелоциты, нейтрофильные миелоциты, нейтрофильные метамиелоциты, нейтрофилы, эозинофильные промиелоциты, эозинофильные миелоциты, макрофаги, дендритные клетки, лимфобласты, пролимфоциты, клетки-естественные киллеры (NK), малые лимфоциты, Т-лимфоциты, В-лимфоциты, плазматические клетки и лимфоидные дендритные клетки.
В предпочтительных вариантах реализации вектор экспрессирует полинуклеотид, например, представляющий интерес ген, в одной или более эритроидных клетках, например, проэритробласте, базофильном эритробласте, полихроматическом эритробласте, ортохроматическом эритробласте, полихроматическом эритроците и эритроците (RBC).
В одном варианте реализации вектор содержит промотор, энхансер или промотор/энхансер гематопоэтической клетки, функционально связанный с представляющим интерес геном, например, геном глобина.
Подходящие специфичные для типа клеток или линии дифференцировки клеток контролирующие экспрессию последовательности включают, но не ограничены перечисленными: последовательности, контролирующие экспрессию в гематопоэтической клетке, такие как, например, промотор для гематопоэтической стволовой клетки и промотор для гематопоэтической клетки-предшественника. В вариантах реализации, в которых желательна экспрессия представляющего интерес гена в одной или более эритроидных клетках, подходящая контролирующая экспрессию в гематопоэтической клетке последовательность может включать, но не ограничена специфичным для эритроидных клеток промотором и необязательно специфичным для эритроидных клеток энхансером, промотором β-глобина человека, промотором LCR β-глобина человека или энхансером HS40 α-глобина человека и промотором анкирина-1.
В одном варианте реализации подходящие специфичные для типа клеток или линии дифференцировки клеток контролирующие экспрессию последовательности включают, но не ограничены промотором, активным в микроглиальной клетке. В некоторых вариантах реализации указанный промотор включает промотор MND или его транскрипционно активный фрагмент, функционально связанный с представляющим интерес геном, например, с ABCD1.
Применение специфичной для типа клеток или линии дифференцировки клеток контролирующей экспрессию последовательности дает преимущества в отношении безопасности, ограничивая экспрессию полинуклеотида данной желательной стадией дифференцировки клеток в одной линии дифференцировки; и, следовательно, векторы, предложенные в данной заявке, уменьшают опасения, касающиеся эктопической экспрессии полипептидов в нежелательных типах клеток. В одном варианте реализации вектор содержит один или более LTR и контролирующую экспрессию последовательность, функционально связанную с представляющим интерес геном. В сходном варианте реализации контролирующая экспрессию последовательность представляет собой специфичную для эритроидной клетки контролирующую экспрессию последовательность, выбранную из группы, состоящей из: промотора β-глобина человека; промотора LCR β-глобина человека; и энхансера HS40 α-глобина человека и промотора анкирина-1.
В различных вариантах реализации разработку вектора будут осуществлять с целью лечения, предупреждения или снижения выраженности конкретного гематопоэтического заболевания, расстройства или состояния. Например, в настоящем изобретении предложены векторы для генотерапии гемоглобинопатии, которые содержат представляющий интерес ген, выбранный из группы, состоящей из: α-глобина человека, β-глобина человека, δ-глобина человека и γ-глобина человека, или их биологически активных вариантов или фрагментов. В одном варианте реализации ген глобина выбран из группы, состоящей из гена β-глобина человека дикого типа, гена β-глобина человека с делецией, включающего одну или более делеций последовательностей интронов, и мутированного гена β-глобина человека, кодирующего по меньшей мере один аминокислотный остаток, предотвращающий образование серповидноклеточных эритроцитов.
В некотором варианте реализации, в котором состояние, которое лечат, представляет собой гемоглобинопатию, например, талассемию или серповидноклеточную болезнь, представляющий интерес ген может представлять собой белок, предотвращающий образование серповидноклеточных эритроцитов. В данной заявке формулировка "белок, предотвращающий образование серповидноклеточных эритроцитов", относится к полипептиду, который предотвращает или обращает патологические события, приводящие к образованию серповидноклеточных эритроцитов в состояниях с образованием серповидноклеточных эритроцитов. В одном варианте реализации настоящего изобретения трансдуцированные клетки согласно настоящему изобретению используют для доставки предотвращающих образование серповидноклеточных эритроцитов белков субъекту с гемоглобинопатическим состоянием. Предотвращающие образование серповидноклеточных эритроцитов белки также включают β-глобины с мутированным геном, содержащие предотвращающие образование серповидноклеточных эритроцитов аминокислотные остатки.
В предпочтительном варианте реализации один такой вариант глобина представляет собой ген βА-глобина человека, кодирующий замену треонина на глутамин в кодоне 87 (βA-T87Q), или ген βА-глобина человека (зрелую форму полипептида глобина подвергли процессингу путем отщепления N-концевого метионина, кодон 87 зрелого полипептида глобина представляет собой треонин; кодон 88 полноразмерного нерасщепленного полипептида глобина представляет собой треонин). Другие предотвращающие образование серповидноклеточных эритроцитов аминокислотные остатки известны в данной области и могут быть полезны в настоящем изобретении. Например, см. патент США 6051402; патент США 5861488; патент США 6670323; патент США 5864029; патент США 5877288; и Levasseur и др., Blood 102:4312-4319 (2003), которые включены в данную заявку посредством ссылки.
В некоторых вариантах реализации вектор, который содержит специфичную для эритроидной линии клеток контролирующую экспрессию последовательность, применяют для лечения, предупреждения или снижения выраженности огромного количества расстройств, отличных от гемоглобинопатии. Предшественники красных кровяных клеток представляют собой полезную популяцию клеток для экспрессии в них полипептидов, которые могут секретироваться в кровоток и, следовательно, доставляться системно. Примером такой доставки белка in vivo является фактор IX человека - фактор свертывания крови, которого не хватает у пациентов с гемофилией В, см., например, А.Н. Chang, и др., Molecular Therapy (2008), который включен в данную заявку посредством ссылки.
В одном варианте реализации клетки, трансдуцированные векторами согласно настоящему изобретению, можно использовать в качестве "фабрик" для секреции белка in vitro, ex vivo или in vivo. Например, вектор, содержащий специфичную для эритроидной клетки контролирующую экспрессию последовательность, можно применять для крупномасштабного получения белков in vitro из эритроидных клеток, дифференцированных из ГСК или из эмбриональных стволовых клеток.
Представляющие интерес полинуклеотиды, которые можно экспрессировать таким способом, включают, но не ограничены перечисленными: аденозиндезаминазу, ферменты, пораженные при лизосомальных болезнях накопления, аполипопротеин Е, нейротрофический фактор головного мозга (BDNF), костный морфогенетический белок 2 (ВМР-2), костный морфогенетический белок 6 (ВМР-6), костный морфогенетический белок 7 (ВМР-7), кардиотрофин 1 (СТ-1), CD22, CD40, цилиарный нейротрофический фактор (CNTF), CCL1-CCL28, CXCL1-CXCL17, CXCL1, CXCL2, CX3CL1, фактор роста клеток эндотелия сосудов (VEGF), дофамин, эритропоэтин, фактор IX, фактор VIII, эпидермальный фактор роста (EGF), эстроген, FAS-лиганд, фактор роста фибробластов 1 (FGF-1), фактор роста фибробластов 2 (FGF-2), фактор роста фибробластов 4 (FGF-4), фактор роста фибробластов 5 (FGF-5), фактор роста фибробластов 6 (FGF-6), фактор роста фибробластов 1 (FGF-7), фактор роста фибробластов 1 (FGF-10), Flt-3, колониестимулирующий фактор гранулоцитов (G-CSF), колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF), гормон роста, фактор роста гепатоцитов (HGF), интерферон альфа (IFN-a), интерферон бета (IFN-b), интерферон гамма (IFNg), инсулин, глюкагон, инсулиноподобный фактор роста 1 (IGF-1), инсулиноподобный фактор роста 2 (IGF-2), интерлейкин 1 (IL-1), интерлейкин 2 (IL-2), интерлейкин 3 (IL-3), интерлейкин 4 (IL-4), интерлейкин 5 (IL-5), интерлейкин 6 (IL-6), интерлейкин 7 (IL-7), интерлейкин 8 (IL-8), интерлейкин 9 (IL-9), интерлейкин 10 (IL-10), интерлейкин 11 (IL-11), интерлейкин 12 (IL-12), интерлейкин 13 (IL-13), интерлейкин 15 (IL-15), интерлейкин 17 (IL-17), интерлейкин 19 (IL-19), колониестимулирующий фактор макрофагов (M-CSF), хемотаксический белок моноцитов 1 (МСР-1), воспалительный белок макрофагов 3а (MIP-3а), воспалительный белок макрофагов 3b (MIP-3b), фактор роста нервов (NGF), нейротрофин 3 (NT-3), нейротрофин 4 (NT-4), гормон паращитовидной железы, фактор роста тромбоцитов АА (PDGF-AA), фактор роста тромбоцитов АВ (PDGF-AB), фактор роста тромбоцитов ВВ (PDGF-BB), фактор роста тромбоцитов СС (PDGF-CC), фактор роста тромбоцитов DD (PDGF-DD), RANTES, фактор стволовых клеток (SCF), фактор стромальных клеток 1 (SDF-1), тестостерон, трансформирующий фактор роста альфа (TGF-a), трансформирующий фактор роста бета (TGF-b), фактор некроза опухоли альфа (TNF-a), Wnt1, Wnt2, Wnt2b/13, Wnt3, Wnt3a, Wnt4, Wnt5a, Wnt5b, Wnt6, Wnt7a, Wnt7b, Wnt7c, Wnt8, Wnt8a, Wnt8b, Wnt8c, Wnt10a, Wnt10b, Wnt11, Wnt14, Wnt15 или Wnt16, белки Sonic hedgehog, Desert hedgehog и Indian hedgehog.
В одном варианте реализации вектор согласно настоящему изобретению содержит по меньшей мере один модифицированный или немодифицированный ретровирусный LTR, например, лентивирусный LTR, промотор β-глобина и область контроля локуса β-глобина (LCR), функционально связанные с представляющим интерес полинуклеотидом, например, кодирующим полипептид глобина. Подходящие модификации LTR включают, но не ограничены перечисленными: замену 5'-LTR на гетерологичный промотор, например, промотор цитомегаловируса (CMV), промотор вируса саркомы Рауса (RSV), промотор тимидинкиназы или промотор вируса обезьян 40 (SV40); и одну или более модификаций, вставок и/или делеций 3'-LTR, которые обсуждались в других местах в данной заявке.
В некотором варианте реализации специфичной для эритроидных клеток экспрессии полинуклеотида добивались, применяя промотор β-глобина человека, LCR β-глобина, который содержит один или более гиперчувствительных к ДНКазе I участков 2, 3 и 4 из LCR β-глобина человека, и/или 3'-энхансерный элемент β-глобина человека.
В различных вариантах реализации вектор, предложенный в данной заявке, содержит один или более элементов, выбранных из группы, состоящей из: последовательности упаковки пси (ψ+), центрального полипуринового тракта/вытесненного участка ДНК (cPPT/FLAP), ретровирусного элемента экспорта, посттранскрипционного регуляторного элемента, одного или более инсуляторных элементов, последовательности полиаденилирования, селектируемого маркера и гена самоубийства клетки, которые обсуждались в других местах в данной заявке.
В различных вариантах реализации вектор, предложенный в данной заявке, содержит промотор, функционирующий в гематопоэтической клетке, функционально связанный с геном, кодирующим полипептид, который применяют для лечения гемоглобинопатии. Указанные векторы могут содержать один или более LTR, при этом любой LTR содержит одну или более модификаций, таких как одна или более замен, вставок или делеций нуклеотидов. Указанные векторы могут дополнительно содержать один или более вспомогательных элементов для повышения эффективности трансдукции (например, cPPT/FLAP), упаковки вируса (например, сигнал упаковки пси (VP), RRE), и/или другие элементы, которые повышают экспрессию терапевтического гена (например, последовательности поли(А)).
В одном варианте реализации вектор содержит левый (5') ретровирусный LTR, последовательность упаковки пси (ψ+), центральный полипуриновый тракт/вытесненный участок ДНК (cPPT/FLAP), ретровирусный элемент экспорта, промотор β-глобина, область контроля локуса β-глобина (LCR) и необязательно 3' энхансер β-глобина, функционально связанные с представляющим интерес полинуклеотидом, и правый (3') ретровирусный LTR, который содержит один или более инсуляторных элементов, или последовательность полиаденилирования.
В конкретном варианте реализации вектор представляет собой лентивирусный вектор, который содержит левый (5') LTR ВИЧ-1, последовательность упаковки пси (ψ+), центральный полипуриновый тракт/вытесненный участок ДНК (cPPT/FLAP) ВИЧ-1, Rev-чувствительный регуляторный элемент (RRE), промотор β-глобина, область контроля локуса β-глобина (LCR) и необязательно 3' энхансер β-глобина, функционально связанные с представляющим интерес полинуклеотидом, и правый (3') ретровирусный LTR, который содержит один или более инсуляторных элементов и последовательность поли(А) β-глобина кролика (rβgpA).
В различных вариантах реализации вектор, предложенный в данной заявке, содержит промотор, функционирующий в микроглиальных клетках, функционально связанный с геном, кодирующим полипептид, который применяют для лечения адренолейкодистрофий и/или адреномиелонейропатий. Указанные векторы могут содержать один или более LTR, при этом любой LTR содержит одну или более модификаций, таких как одна или более замен, вставок или делеций нуклеотидов. Указанные векторы могут дополнительно содержать один или более вспомогательных элементов для повышения эффективности трансдукции (например, cPPT/FLAP), упаковки вируса (например, сигнал упаковки пси (ψ), RRE) и/или другие элементы, которые повышают экспрессию терапевтического гена (например, последовательности поли(А)).
В некотором варианте реализации переносящий вектор, предложенный в данной заявке, содержит левый (5') ретровирусный LTR; центральный полипуриновый тракт/вытесненный участок ДНК (cPPT/FLAP); ретровирусный элемент экспорта; промотор, активный в микроглиальной клетке, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1); и правый (3') ретровирусный LTR.
В некотором варианте реализации лентивирусный вектор, предложенный в данной заявке, содержит: левый (5') LTR ВИЧ-1; сигнал упаковки пси (ψ); cPPT/FLAP; RRE; промотор MND, функционально связанный с полинуклеотидом, кодирующим полипептид ABCD1 человека; правый (3') самоинактивирующийся (SIN) LTR ВИЧ-1; и последовательность полиаденилирования β-глобина кролика.
В конкретных вариантах реализации лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В дополнительных вариантах реализации лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
В некоторых вариантах реализации лентивирусный вектор кодирует аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
В некоторых вариантах реализации лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
В конкретных вариантах реализации лентивирусный вектор кодирует трипептидилпептидазу 1.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
В конкретных вариантах реализации лентивирусный вектор кодирует альфа-L-идуронидазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
В конкретных вариантах реализации лентивирусный вектор кодирует идуронат-2-сульфатазу.
В некоторых вариантах реализации лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
В некоторых вариантах реализации промотор содержит один или более элементов LCR β-глобина человека.
В некоторых вариантах реализации LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
В конкретных вариантах реализации лентивирусный вектор дополнительно содержит 3'-энхансерный элемент β-глобина человека.
В дополнительных вариантах реализации представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
В конкретных вариантах реализации представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-T87Q-глобина человека, белок βА-G16D/Е22АГ/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
В конкретных вариантах реализации лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 и вектор BCL11A shmir, см., например, патент США, №публикации 20150307867; Arumugam и Malik, Hematology Am Soc Hematol Educ Program. 2010; 2010(1):445-50; Hoban и др., Blood. 2016 127:839-848; Scott и DeFrancesco, Nature Biotechnology 34, 600-607 (2016); Finotti и др., Journal of Blood Medicine. 2015:6 69-85; Pestina и др., Molecular Therapy. 2009; 17(2): 245-252, описания каждого из которых полностью включены в данную заявку посредством ссылки, и в конкретных вариантах реализации вектор подробно описан и упомянут в указанных источниках.
Для квалифицированного специалиста должно быть очевидно, что можно смоделировать другие различные варианты реализации из существующих вариантов реализации настоящего изобретения, так что терапевтический трансген или представляющий интерес ген экспрессируется в целевом типе клеток или линии дифференцировки клеток, отличных от гематопоэтической линии дифференцировки, например, в нейрональной линии дифференцировки.
E. Композиции и составы
Составы и композиции, предложеные в данной заявке, могут содержать комбинацию из любого количества трансдуцированных или нетрансдуцированных клеток или их комбинации, вирусных векторов, полипептидов, полинуклеотидов и одного или более агентов, которые повышают эффективность трансдукции и/или ЧКВ, например, полоксамеров, агентов, которые повышают передачу сигналов простагландина, стауроспорина, поликатионных полимеров и поликатионных пептидов, описанных в данной заявке, в составе фармацевтически приемлемых или физиологически приемлемых растворов (например, культуральной среды) для введения в клетку, ткань, орган или животному либо отдельно, либо в комбинации с одним или более другими возможными способами терапии. Композиции включают, без ограничения, культуры, предложенные в данной заявке, и в конкретных вариантах реализации термины композиция и культура можно использовать синонимично.
Конкретные составы и композиции ex vivo и in vitro, предложеные в данной заявке, могут содержать комбинацию трансдуцированных или нетрансдуцированных клеток или их комбинации, вирусных векторов и одного или более агентов, которые повышают эффективность трансдукции и/или ЧКВ, например, полоксамеров, агентов, которые повышают передачу сигналов простагландина, стауроспорина, поликатионных полимеров и поликатионных пептидов, описанных в данной заявке, в составе фармацевтически приемлемых или физиологически приемлемых растворов (например, культуральной среды) для введения в клетку, ткань, орган или животному либо отдельно, либо в комбинации с одним или более другими возможными способами терапии.
Конкретные составы и композиции in vivo, предложенные в данной заявке, могут содержать комбинацию вирусных векторов и одного или более агентов, которые повышают эффективность трансдукции и/или ЧКВ, например, полоксамеров, агентов, которые повышают передачу сигналов простагландина, стауроспорина, поликатионных полимеров и поликатионных пептидов, описанных в данной заявке, в составе фармацевтически приемлемых или физиологически приемлемых растворов (например, культуральной среды) для введения в клетку, ткань, орган или животному, либо отдельно, либо в комбинации с одним или более другими возможными способами терапии.
В некоторых вариантах реализации композиции, предложенные в данной заявке, содержат популяцию клеток, содержащую терапевтически эффективное количество трансдуцированных клеток, описанных в данной заявке, в составе с одним или более фармацевтически приемлемыми носителями (вспомогательными веществами) и/или разбавителями (например, фармацевтически приемлемой культуральной средой).
В некоторых других вариантах реализации настоящего изобретения предложены композиции, содержащие ретровирусный вектор и один или более агентов, которые повышают эффективность трансдукции и/или ЧКВ, например, полоксамеры, агенты, которые повышают передачу сигналов простагландина, стауроспорин, поликатионные полимеры и поликатионные пептиды, описанные в данной заявке, в составе с одним или более фармацевтически приемлемыми носителями (вспомогательными веществами) и/или разбавителями (например, фармацевтически приемлемой культуральной средой).
В некоторых других вариантах реализации настоящего изобретения предложены композиции, содержащие ретровирусный вектор и один или более полоксамеров, например, полоксамер 338, полоксамер 407, в составе с одним или более фармацевтически приемлемыми носителями (вспомогательными веществами) и/или разбавителями (например, фармацевтически приемлемой культуральной средой).
В конкретных вариантах реализации композиции содержат популяцию клеток, содержащую стволовые клетки или клетки-предшественники, ретровирусный вектор и один или более агентов, которые повышают эффективность трансдукции и/или ЧКВ, например, полоксамеры, агенты, которые повышают передачу сигналов простагландина, стауроспорин, поликатионные полимеры и поликатионные пептиды, описанные в данной заявке, в составе с одним или более фармацевтически приемлемыми носителями (вспомогательными веществами) и/или разбавителями (например, фармацевтически приемлемой культуральной средой). В связанном варианте реализации популяция клеток содержит гематопоэтические стволовые клетки и клетки-предшественники. В одном варианте реализации популяция клеток содержит CD34+ клетки. В одном варианте реализации популяция клеток представляет собой прошедшие селекцию CD34+ клетки.
В предпочтительных вариантах реализации популяция клеток содержит CD34+ клетки, в которых содержится одна из следующих аллелей β-глобина: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βС/β+, βЕ/β+, β0/β+, β+/β+, βC/βС, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В предпочтительных вариантах реализации популяция клеток содержит CD34+ клетки, в которых содержится одна из следующих аллелей β-глобина: βЕ/β0, βC/β0, βC/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+ или β+/β+.
В предпочтительных вариантах реализации популяция клеток содержит CD34+ клетки, в которых содержится одна из следующих аллелей β-глобина: βE/βS, β0/βS, βС/βЫ, β+/βS или βS/βS.
Фармацевтические композиции, предложенные в данной заявке, содержат трансдуцированные клетки, полученные с помощью способов, описанных в данной заявке, и фармацевтически приемлемый носитель.
В других вариантах реализации фармацевтические композиции содержат ретровирусный вектор и агенты, которые повышают эффективность трансдукции и/или ЧКВ: полоксамеры и агенты, которые повышают передачу сигналов простагландина, или стауроспорин, и необязательно поликатионные полимеры и поликатионные пептиды, описанные в данной заявке.
В одном варианте реализации фармацевтические композиции содержат ретровирусный вектор и полоксамеры и агенты, которые повышают передачу сигналов простагландина, и необязательно поликатионные полимеры и поликатионные пептиды, описанные в данной заявке.
В одном варианте реализации фармацевтические композиции содержат ретровирусный вектор и полоксамеры и стауроспорин, и необязательно поликатионные полимеры и поликатионные пептиды, описанные в данной заявке.
В одном варианте реализации фармацевтические композиции содержат ретровирусный вектор и полоксамер. В предпочтительных вариантах реализации полоксамер представляет собой полоксамер 288, полоксамер 335, полоксамер 338 или полоксамер 407.
Формулировка “фармацевтически приемлемый” относится к молекулярным сущностям и композициям, которые не вызывают аллергической или аналогичной нежелательной реакции при введении человеку. В конкретном варианте реализации термин “фармацевтически приемлемый” означает одобренный федеральным или государственным регулирующим органом или перечисленный в фармакопее США или другой общеизвестной фармакопее для применения у животных и, в частности, у людей.
Термин “носитель” относится к разбавителю, адъюванту, вспомогательному веществу или среде, вместе с которыми вводят терапевтические клетки. Наглядные примеры фармацевтических носителей могут представлять собой стерильные жидкости, такие как культуральные среды, вода и масла, включая таковые нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные масла. Солевые растворы и водные растворы декстрозы и глицерина также можно применять в качестве жидких носителей, особенно для инъецируемых растворов. Подходящие фармацевтические вспомогательные вещества в конкретных вариантах реализации включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобные вещества. За исключением случаев, когда какая-либо обычная среда или агент несовместимы с активным ингредиентом, предполагается их применение в указанных терапевтических композициях. Дополнительные активные ингредиенты также могут входить в состав указанных композиций.
В одном варианте реализации композиция, содержащая носитель, подходит для парентерального введения, например, внутрисосудистого (внутривенного или интраартериального), интраперитонеального или внутримышечного введения. Фармацевтически приемлемые носители включают стерильные водные растворы, культуральные среды или дисперсии. Применение таких сред и агентов с фармацевтически активными веществами хорошо известно в данной области. За исключением случаев, когда какая-либо обычная среда или агент несовместимы с трансдуцированными клетками, предполагается их применение в указанных фармацевтических композициях.
В конкретных вариантах реализации композиции, предложенные в данной заявке, содержат генетически модифицированные гематопоэтические стволовые и/или клетки-предшественники и фармацевтически приемлемый носитель, например, фармацевтически приемлемую культуральную среду. Композицию, содержащую основанную на клеточной системе композицию, предложенную в данной заявке, можно вводить отдельно с помощью энтеральных или парентеральных способов введения или в комбинации с другими подходящими соединениями для достижения желательных целей лечения.
У фармацевтически приемлемого носителя должна быть достаточно высокая чистота и достаточно низкая токсичность, чтобы он подходил для введения человеку, которого нужно лечить. Дополнительно он должен сохранять или повышать стабильность указанной композиции. Фармацевтически приемлемый носитель может быть жидким или твердым, и его выбирают, с учетом планируемого пути введения, для получения желательного объема, консистенции и т.д. при объединении с другими компонентами композиции. Например, фармацевтически приемлемый носитель может представлять собой, без ограничения, связывающий агент (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу и т.д.), наполнитель (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты, вторичный кислый фосфат кальция и т.д.), лубрикант (например, стеарат магния, тальк, кремний, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т.д.), дезинтегрирующий агент (например, крахмал, крахмал гликолят натрия и т.д.) или смачивающий агент (например, лаурилсульфат натрия и т.д.). Другие подходящие фармацевтически приемлемые носители для композиций, предложеных в данной заявке, содержат, но не ограничены перечисленными: воду, солевые растворы, спирты, полиэтиленгликоли, желатины, амилозы, стеараты магния, тальки, кремниевые кислоты, вязкие парафины, гидроксиметилцеллюлозы, поливинилпирролидоны и тому подобные вещества.
Такие растворы носителей также могут содержать буферы, разбавители и другие подходящие вспомогательные вещества. Термин “буфер” в данной заявке относится к раствору или жидкости, химический состав которых нейтрализует кислоты или основания без значительного изменения рН. Примеры буферов, предложенных в данной заявке, включают, но не ограничены перечисленными: фосфатно-солевой буферный раствор Дульбекко (ФБР), раствор Рингера, 5% декстрозу в воде (D5W), нормальный/физиологический солевой раствор (0,9% NaCl).
Указанные фармацевтически приемлемые носители и/или разбавители могут присутствовать в количествах, достаточных для поддержания рН терапевтической композиции на уровне приблизительно 7. В качестве альтернативы рН терапевтической композиции находится в диапазоне от приблизительно 6,8 до приблизительно 7,4, например, составляет 6,8, 6,9, 7,0, 7,1, 7,2, 7,3 и 7,4. В другом дополнительном варианте реализации рН терапевтической композиции составляет приблизительно 7,4.
Композиции, предложенные в данной заявке, могут содержать нетоксичную фармацевтически приемлемую среду. Указанные композиции могут представлять собой суспензию. Термин “суспензия” в данной заявке относится к неадгерентным условиям, при которых клетки не присоединены к твердой подложке. Например, клетки, поддерживаемые в виде суспензии, можно перемешивать или взбалтывать, чтобы они не прицеплялись к подложке, такой как культуральная чашка.
В конкретных вариантах реализации композиции, предложенные в данной заявке, представлены в виде суспензии, в которой гематопоэтические стволовые клетки и/или клетки-предшественники диспергированы в приемлемой жидкой среде или растворе, например, солевом растворе или бессывороточной среде, в пакете для внутривенного (в/в) вливания или тому подобном средстве доставки. Приемлемые разбавители включают, но не ограничены перечисленными: воду, PlasmaLyte, раствор Рингера, изотонический раствор хлорида натрия (солевой раствор), бессывороточную культуральную среду и среду, подходящую для низкотемпературного хранения, например, среду Cryostor®.
В некоторых вариантах реализации фармацевтически приемлемый носитель по существу не содержит природные белки человеческого или животного происхождения и подходит для хранения композиции, содержащей популяцию клеток, например, гематопоэтических стволовых клеток и клеток-предшественников. Указанная терапевтическая композиция предназначена для введения пациенту-человеку и, следовательно, по существу не содержит компоненты культуры клеток, такие как сывороточный альбумин крупного рогатого скота, сыворотка лошади и фетальная бычья сыворотка.
В некоторых вариантах реализации композиции входят в состав в фармацевтически приемлемой культуральной среде. Такие композиции подходят для введения людям. В конкретных вариантах реализации фармацевтически приемлемая культуральная среда представляет собой бессывороточную среду.
Бессывороточная среда обладает рядом преимуществ над содержащей сыворотку средой, включая упрощенный и более определенный состав, меньшее количество примесей, устранение потенциального источника инфекционных агентов и более низкую стоимость. В различных вариантах реализации бессывороточная среда не содержит компонентов животного происхождения и необязательно может не содержать белков. Необязательно среда может содержать биофармацевтически приемлемые рекомбинантные белки. “Не содержащая компонентов животного происхождения” среда относится к среде, компоненты которой получены из не относящихся к животным источников. В не содержащей компонентов животного происхождения среде нативные белки животных заменяют рекомбинантными белками и питательные вещества получают из синтетических, растительных или микробных источников. “Не содержащая белков” среда, напротив, определена как по существу не содержащая белков.
Наглядные примеры бессывороточных сред, применяемых в конкретных композициях, включают, но не ограничены: QBSF-60 (Quality Biological, Inc.), StemPro-34 (Life Technologies) и X-VIVO 10.
В предпочтительном варианте реализации указанные композиции, содержащие гематопоэтические стволовые клетки и/или клетки-предшественники, входят в состав в PlasmaLyte.
В различных вариантах реализации композиции, содержащие гематопоэтические стволовые клетки и/или клетки-предшественники, входят в состав в среде для криоконсервации. Например, можно применять среды для криоконсервации с агентами для криоконсервации для сохранения высокой жизнеспособности клеток после размораживания. Наглядные примеры сред для криоконсервации, используемых в конкретных композициях, включают, но не ограничены CryoStor CS10, CryoStor CS5 и CryoStor CS2.
В одном варианте реализации указанные композиции входят в состав в растворе, содержащем 50:50 PlasmaLyte А и CryoStor CS10.
В конкретных вариантах реализации композиция по существу не содержит микоплазму, эндотоксин и микробные примеси. Формулировка "по существу не содержит" по отношению к эндотоксину означает, что содержится меньше эндотоксина на дозу клеток, чем допускается FDA для биологического агента, то есть всего эндотоксина 5 ЕЭ/кг массы тела в день, что для среднего человека с массой тела 70 кг составляет 350 ЕЭ на суммарную дозу клеток. В конкретных вариантах реализации композиции, содержащие гематопоэтические стволовые клетки или клетки-предшественники, трансдуцированные ретровирусным вектором, предложенным в данной заявке, содержат от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл, или приблизительно 0,5 ЕЭ/мл, 1,0 ЕЭ/мл, 1,5 ЕЭ/мл, 2,0 ЕЭ/мл, 2,5 ЕЭ/мл, 3,0 ЕЭ/мл, 3,5 ЕЭ/мл, 4,0 ЕЭ/мл, 4,5 ЕЭ/мл или 5,0 ЕЭ/мл.
В некоторых вариантах реализации предложены композиции и составы, подходящие для доставки вирусных векторных систем (т.е., опосредованной вирусом трансдукции), включая, но не ограничиваясь ретровирусными (например, лентивирусными) векторами.
В типичных составах для доставки ex vivo также могут применять различные агенты для трансфекции, известные в данной области, такие как фосфат кальция, электропорация, тепловой шок и различные липосомальные составы (т.е., опосредованная липидами трансфекция). Липосомы, описанные более подробно ниже, представляют собой липидные бислои, заключающие в себе фракцию жидкости на водной основе. ДНК спонтанно ассоциируется с внешней поверхностью катионных липосом (благодаря ее заряду), и данные липосомы будут взаимодействовать с мембраной клетки.
В конкретных вариантах реализации композиции, предложеные в данной заявке, могут содержать один или более полипептидов, полинуклеотидов, содержащих их векторов, агентов, которые повышают эффективность трансдукции и/или ЧКВ, описанных в данной заявке, и трансдуцированных клеток и т.д., в составе с фармацевтически приемлемыми или физиологически приемлемыми растворами для введения в клетку или животному, либо отдельно, либо в комбинации с одним или более другими возможными способами терапии. Также следует понимать, что, при необходимости, указанные композиции также можно вводить в комбинации с другими агентами, такими как, например, цитокины, факторы роста, гормоны, низкомолекулярные соединения или различные фармацевтически-активные агенты. Практически нет ограничений на другие компоненты, которые также могут входить в состав указанных композиций в конкретных вариантах реализации в том случае, если указанные дополнительные агенты не оказывают отрицательного влияния на способность композиции доставлять предполагаемое генотерапевтическое средство.
В конкретных вариантах реализации получение фармацевтически-приемлемых вспомогательных веществ и растворов носителя хорошо известно специалистам в данной области, как и разработка подходящих схем приема и лечения для применения конкретных композиций, описанных в данной заявке, в различных схемах лечения, включая, например, энтеральное и парентеральное, например, внутрисосудистое, внутривенное, внутриартериальное, внутрикостное и интрамедуллярное введение и состав для данных способов введения. Квалифицированный специалист поймет, что конкретные варианты реализации, предложенные в данной заявке, могут включать другие составы, такие как составы, хорошо известные в фармацевтической области и описанные, например, в Remington: The Science and Practice of Pharmacy, 20oe издание. Балтимор, Мэриленд: Lippincott Williams & Wilkins, 2005, который полностью включен в данную заявку посредством ссылки.
F. Композиции с культурой клеток
В других местах в данной заявке обсуждалось, что в конкретных вариантах реализации композиции и способы, предложенные в данной заявке, пригодны для основанных на клеточной системе способов генотерапии ex vivo и in vivo, В конкретных вариантах реализации композиции могут содержать клетки в культуре, т.е., представлять собой композицию с культурой клеток. Композиция с культурой клеток может содержать популяцию клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, подходящую культуральную среду и один или более полоксамеров. Композиция с культурой клеток может содержать популяцию клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, подходящую культуральную среду, один или более полоксамеров, один или более агентов, которые повышают передачу сигналов простагландина, или стауроспорин, и необязательно один или более поликатионных полимеров.
В конкретных вариантах реализации культивированные клетки представляют собой гематопоэтические стволовые клетки или клетки-предшественники или CD34+ клетки.
В конкретных вариантах реализации культивированные клетки представляют собой гематопоэтические стволовые клетки или клетки-предшественники, или CD34+ клетки, которые содержат следующие аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β+, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В конкретных вариантах реализации культивированные клетки представляют собой гематопоэтические стволовые клетки или клетки-предшественники, или CD34+ клетки, которые содержат следующие аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βC/βС, βЕ/βЕ, βЕ/β+, βС/βЕ, βС/β+, β0/β+ или β+/β+.
В конкретных вариантах реализации культивированные клетки представляют собой гематопоэтические стволовые клетки или клетки-предшественники, или CD34+ клетки, которые содержат следующие аллели β-глобина: βE/βЫ, β0/βS, βC/βS, β+/βS или βS/βS.
В одном варианте реализации композиция с культурой клеток содержит популяцию клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, культуральную среду, подходящую для введения человеку, и полоксамер. В одном варианте реализации композиция с культурой клеток содержит популяцию клеток, содержащую гематопоэтические стволовые клетки или клетки-предшественники, культуральную среду, подходящую для введения человеку, полоксамер и агент, который повышает передачу сигналов простагландина, и необязательно один или более поликатионных полимеров.
В одном варианте реализации композиция с культурой клеток содержит популяцию клеток, содержащую генетически модифицированные гематопоэтические стволовые клетки или клетки-предшественники, культуральную среду, подходящую для введения человеку, и полоксамер.
В одном варианте реализации композиция с культурой клеток содержит популяцию клеток, содержащую генетически модифицированные гематопоэтические стволовые клетки или клетки-предшественники, культуральную среду, подходящую для введения человеку, полоксамер и стауроспорин, и необязательно один или более поликатионных полимеров.
В некоторых вариантах реализации культуральная среда представляет собой фармацевтически приемлемую культуральную среду.
Композиции с культурой клеток, предложенные в данной заявке, которые содержат трансдуцированные гематопоэтические стволовые клетки или клетки-предшественники, можно вводить системно или путем направленной инъекции нуждающемуся в этом субъекту для того, чтобы осуществить необходимую генотерапию.
G. Способы трансдукции
Способы и композиции, предложенью в данной заявке, значительно повышают эффективность трансдукции (ЭТ) и число копий вектора (ЧКВ) в целевых клетках. Без привязки к какой-либо конкретной теории предполагается, что композиции и способы, предложенные в данной заявке, можно применять для повышения ЧКВ и трансдукции значительно большего количества клеток с помощью значительно меньшего количества вируса, тем самым минимизируя риск изменения генома и/или инсерционной активации протоонкогенов в геноме терапевтической клетки, одновременно повышая терапевтическую эффективность полученного лекарственного продукта. Таким образом, композиции и способы, предложенные в данной заявке, приводят не только к созданию безопасной генотерапии, но и к получению более надежного и терапевтически эффективного лекарственного продукта. Кроме того, более эффективная трансдукция позволяет использовать меньше вируса для трансдукции и, следовательно, снижает себестоимость лентивирусной генотерапии.
Доставку гена(-ов) или других полинуклеотидных последовательностей с применением ретровирусного или лентивирусного вектора посредством вирусной инфекции вместо трансфекции называют трансдукцией. В одном варианте реализации ретровирусные векторы трансдуцируют в клетку посредством инфекции и встраивания провируса. В некоторых вариантах реализации клетка, например, целевая клетка, трансдуцирована, если она содержит ген или другую полинуклеотидную последовательность, доставленную в указанную клетку путем инфекции с применением вирусного или ретровирусного вектора. В конкретных вариантах реализации трансдуцированная клетка содержит один или более генов или других полинуклеотидных последовательностей, доставленных с помощью ретровирусного или лентивирусного вектора в геном указанной клетки.
В конкретных вариантах реализации клетки-хозяева или целевые клетки, трансдуцированные вирусным вектором, экспрессируют терапевтический полипептид, и их вводят субъекту для лечения и/или предотвращения заболевания, расстройства или состояния.
Получение инфекционных вирусных частиц и исходных растворов вируса можно осуществить, применяя обычные методики. Способы получения исходных растворов вируса известны в данной области и освещены, например, в Y. Soneoka и др. (1995) Nucl. Acids Res. 23:628-633, и N.R. Landau и др. (1992) J. Virol. 66:5110-5113.
В конкретных вариантах реализации вирусные частицы на основе ВИЧ 1 типа (ВИЧ-1) можно получить путем совместной экспрессии элементов упаковки вириона и переносящего вектора в клетке-продуценте. Данные клетки можно временно трансфицировать множеством плазмид. Обычно используют от трех до пяти плазмид, но их количество может быть и больше в зависимости от степени разбиения компонентов лентивируса на отдельные единицы. Например, одна плазмида может кодировать остов и ферментативные компоненты вириона, полученные из ВИЧ-1. Данную плазмиду называют пакующей плазмидой. Другая плазмида обычно кодирует белок(-ки) оболочки, чаще всего G-белок вируса везикулярного стоматита (VSV-G), по причине его высокой стабильности и широкого круга хозяев. Данную плазмиду можно назвать плазмидой экспрессии оболочки. Еще одна плазмида кодирует геном, который необходимо перенести в целевую клетку, то есть, сам вектор, и он называется переносящим вектором. Пакующие плазмиды можно внедрить в линии клеток человека с помощью известных методик, включая кальций-фосфатную трансфекцию, липофекцию или электропорацию. Рекомбинантные вирусы с титрами, составляющими несколько миллионов единиц трансдукции на миллилитр (ТЕ/мл), можно получить с помощью данной методики и ее вариантов. После ультрацентрифугирования можно получить концентрированные исходные растворы приблизительно с 108 ТЕ/мл, 109 ТЕ/мл, 1010 ТЕ/мл, 1011 ТЕ/мл, 1012 ТЕ/мл или приблизительно с 1013 ТЕ/мл.
Инфекционные вирусные частицы можно собрать из пакующих клеток, применяя обычные методики. Например, инфекционные частицы можно собрать путем лизирования клеток или сбора супернатанта из культуры клеток, как известно в данной области. Необязательно, собранные вирусные частицы при необходимости можно очистить. Подходящие методики очистки хорошо известны специалистам в данной области, см., например, Kutner и др., ВМС Biotechnol. 2009;9:10. doi: 10.1186/1472-6750-9-10; Kutner и др., Nat. Protoc. 2009;4(4):495-505. doi: 10.1038/nprot.2009.22.
Вирусы можно применять для инфицирования клеток in vivo, ex vivo или in vitro с применением методик, хорошо известных в данной области. Например, когда клетки, например, мобилизованные клетки периферической крови, клетки костного мозга, CD34+ клетки или гематопоэтические стволовые клетки или клетки-предшественники трансдуцируют ex vivo, частицы вектора можно инкубировать с указанными клетками, используя дозу, как правило, порядка 1-50 множественностей инфекции (МИ), которая также соответствует 1×105 - 50×105 единиц трансдукции вирусным вектором 105 клеток. Это количество, разумеется, включает количество вектора, соответствующее 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 и 50 МИ и всем целым числам между ними.
В конкретных вариантах реализации для трансдукции популяции клеток лентивирусный вектор используют при МИ от приблизительно 10 до приблизительно 25.
В конкретных вариантах реализации для трансдукции популяции клеток лентивирусный вектор используют при МИ от приблизительно 10 до приблизительно 20.
В некоторых вариантах реализации для трансдукции популяции клеток лентивирусный вектор используют при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
Вирусы также можно доставлять субъекту in vivo путем непосредственной инъекции в клетку, ткань или орган, нуждающиеся в терапии. Для непосредственной инъекции требуется порядка 1-100 множественностей инфекции (МИ), что также соответствует 1×105 - 100×105 единицам трансдукции вирусным вектором 105 клеток. Это количество, разумеется, включает количество вектора, соответствующее 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 50, 65, 70, 75, 80, 85, 90, 95 и 100 МИ и все целым числам между ними.
Вирусы также можно доставлять соразмерно титру вируса (ТЕ/мл), который можно измерить, например, применяя доступный для приобретения набор для анализа титра р24, который представляет собой твердофазный иммуноферментный анализ (ELISA) белка оболочки вируса р24. Для расчета пг/мл р24 можно применять следующую формулу: на физической частице (ФЧ) лентивируса присутствует приблизительно 2000 молекул р24: (2×103)×(24×103 Да р24 на ФЧ), 48×106/число Авогадро = (48×106)/(6×1023)=8×10-17 г р24 на ФЧ, приблизительно 1 ФЧ на 1×10-16 г р24, 1×104 ФЧ на пг р24. Показатель инфективности довольно хорошо упакованного псевдотипированного VSV-G лентивирусного вектора будет находиться в диапазоне от 1 ТЕ на 1000 физических частиц (ФЧ) до 1 ТЕ на 100 ФЧ (или менее). Таким образом, указанный диапазон составляет приблизительно от 10 до 100 ТЕ/пг р24. Через данное преобразование получают ТЕ/мл.
На основании предшествующего опыта, количество лентивируса для непосредственного введения путем инъекции определяют по суммарным ТЕ, и оно может изменяться в зависимости от объема, который есть возможность ввести путем инъекции в место и в тип ткани, в которые его будут вводить. Например, в место инъекции в костный мозг будет возможно ввести путем инъекции лишь очень малый объем вируса, следовательно, препарат с высоким титром будет предпочтителен, можно применять ТЕ приблизительно от 1×106 до 1×107, приблизительно от 1×106 до 1×108, от 1×106 до 1×109, приблизительно от 1×107 до 1×1010, от 1×108 до 1×1011, приблизительно от 1×108 до 1×1012 или приблизительно от 1×1010 до 1×1012 или более на инъекцию. Тем не менее, при системной доставке можно использовать гораздо большие ТЕ, можно доставить нагрузку, составляющую 1×108, 1×109, 1×1010, 1×1011, 1×1012, 1×1013, 1×1014 или 1×1015.
Композиции и способы, предложенные в данной заявке, обеспечивают высокую эффективность трансдукции и ЧКВ в гематопоэтических клетках in vitro, ex vivo и in vivo при применении более низких титров вируса, чем описанные выше, для достижения эффективностей трансдукции, сравнимых с таковыми в отсутствие композиций и способов, предложенных в данной заявке.
Некоторые варианты реализации, предложенные в данной заявке, являются результатом неожиданного открытия того, что эффективность трансдукции и/или ЧКВ значительно повышаются при приведении в контакт гематопоэтических клеток in vitro, ex vivo или in vivo с ретровирусом и полоксамером или полоксамером и одним или более агентами, которые стимулируют путь передачи сигналов рецептора простагландина ЕР (см., например, WO 2007/112084 и WO 2010/108028), и необязательно поликатионным полимером.
В различных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере больше, чем приблизительно 2250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
В различных вариантах реализации полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
В конкретных вариантах реализации полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В конкретных вариантах реализации средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
В некоторых вариантах реализации полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
В одном варианте реализации полоксамер представляет собой полоксамер 288.
В одном варианте реализации полоксамер представляет собой полоксамер 335.
В одном варианте реализации полоксамер представляет собой полоксамер 338.
В одном варианте реализации полоксамер представляет собой полоксамер 407.
Типичные конечные концентрации полоксамера, используемые для трансдукции гематопоэтических клеток, включают, но не ограничены перечисленными: от приблизительно 10 мкг/мл до приблизительно 5000 мкг/мл, от приблизительно 10 мкг/мл до приблизительно 2500 мкг/мл, от приблизительно 10 мкг/мл до приблизительно 1000 мкг/мл, от приблизительно 50 мкг/мл до приблизительно 1000 мкг/мл, от приблизительно 100 мкг/мл до приблизительно 1000 мкг/мл, от приблизительно 200 мкг/мл до приблизительно 1000 мкг/мл, от приблизительно 200 мкг/мл до приблизительно 500 мкг/мл, или составляют приблизительно 10 мкг/мл, приблизительно 20 мкг/мл, приблизительно 30 мкг/мл, приблизительно 40 мкг/мл, приблизительно 50 мкг/мл, приблизительно 60 мкг/мл, приблизительно 70 мкг/мл, приблизительно 80 мкг/мл, приблизительно 90 мкг/мл, приблизительно 100 мкг/мл, приблизительно 200 мкг/мл, приблизительно 300 мкг/мл, приблизительно 400 мкг/мл, приблизительно 500 мкг/мл, приблизительно 600 мкг/мл, приблизительно 700 мкг/мл, приблизительно 800 мкг/мл, приблизительно 900 мкг/мл, приблизительно 1000 мкг/мл, приблизительно 1250 мкг/мл, приблизительно 1500 мкг/мл, приблизительно 1750 мкг/мл, приблизительно 2000 мкг/мл, приблизительно 2500 мкг/мл или приблизительно 5000 мкг/мл или более, и любую концентрацию в промежутке между указанными значениями.
В одном варианте реализации агент представляет собой лиганд рецептора простагландина ЕР, включая, но не ограничиваясь простагландином Е2 (PGE2), а также его "аналогами" или "производными".
В одном варианте реализации агент, который стимулирует путь передачи сигналов рецептора простагландина ЕР, представляет собой PGE2.
Типичные конечные концентрации агониста пути передачи сигналов рецептора простагландина ЕР, используемые для трансдукции гематопоэтических клеток, включают, но не ограничены перечисленными: от приблизительно 10 мкМ до приблизительно 200 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 50 мкМ до приблизительно 100 мкМ, или составляют приблизительно 10 мкМ, приблизительно 20 мкМ, приблизительно 30 мкМ, приблизительно 40 мкМ, приблизительно 50 мкМ, приблизительно 60 мкМ, приблизительно 70 мкМ, приблизительно 80 мкМ, приблизительно 90 мкМ или приблизительно 100 мкМ или более, и любую концентрацию в промежутке между указанными значениями.
В одном варианте реализации поликатионный полимер представляет собой сульфат протамина или полибрен.
В одном варианте реализации поликатионный полимер представляет собой сульфат протамина. Сульфат протамина или полибрен можно применять в конечной концентрации от приблизительно 5 мкг/мл до приблизительно 15 мкг/мл, от приблизительно 5 мкг/мл до приблизительно 10 мкг/мл, или составляющей приблизительно 5 мкг/мл, приблизительно 6 мкг/мл, приблизительно 7 мкг/мл, приблизительно 8 мкг/мл, приблизительно 9 мкг/мл, приблизительно 10 мкг/мл, приблизительно 11 мкг/мл, приблизительно 12 мкг/мл, приблизительно 13 мкг/мл, приблизительно 14 мкг/мл или приблизительно 15 мкг/мл или более.
В другом варианте реализации эффективность трансдукции и/или ЧКВ значительно повышаются при приведении в контакт клеток in vitro, ex vivo или in vivo с ретровирусом и полоксамером и стауроспорином, и необязательно поликатионным полимером.
Типичные конечные концентрации стауроспорина, используемые для трансдукции гематопоэтических клеток, включают, но не ограничены перечисленными: от приблизительно 100 нМ до приблизительно 1000 нМ, от приблизительно 110 нМ до приблизительно 800 нМ, от приблизительно 200 нМ до приблизительно 800 нМ, от приблизительно 400 нМ до приблизительно 800 нМ, от приблизительно 200 нМ до приблизительно 400 нМ, от приблизительно 200 нМ до приблизительно 500 нМ, или составляют приблизительно 100 нМ, приблизительно 200 нМ, приблизительно 300 нМ, приблизительно 400 нМ, приблизительно 500 нМ, приблизительно 600 нМ, приблизительно 700 нМ, приблизительно 800 нМ, приблизительно 900 нМ или приблизительно 1000 нМ или более, и любую концентрацию в промежутке между указанными значениями.
В конкретных вариантах реализации гематопоэтические клетки можно культивировать в присутствии ретровируса, и их можно подвергнуть воздействию (привести в контакт) полоксамера и одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорина и необязательно поликатионного полимера в течение периода времени от приблизительно 10 минут до приблизительно 72 часов, от приблизительно 30 минут до приблизительно 72 часов, от приблизительно 30 минут до приблизительно 48 часов, от приблизительно 30 минут до приблизительно 24 часов, от приблизительно 30 минут до приблизительно 12 часов, от приблизительно 30 минут до приблизительно 8 часов, от приблизительно 30 минут до приблизительно 6 часов, от приблизительно 30 минут до приблизительно 4 часов, от приблизительно 30 минут до приблизительно 2 часов или от приблизительно 1 часа до приблизительно 2 часов.
В конкретных вариантах реализации гематопоэтические клетки можно культивировать в присутствии ретровируса, и их можно подвергнуть воздействию (привести в контакт) полоксамера или полоксамера и одного или более агентов, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорина и необязательно поликатионного полимера в течение периода времени, составляющего приблизительно 10 минут, приблизительно 30 минут, приблизительно 1 час, приблизительно 2 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов, приблизительно 12 часов, приблизительно 13 часов, приблизительно 14 часов, приблизительно 15 часов, приблизительно 16 часов, приблизительно 17 часов, приблизительно 18 часов, приблизительно 19 часов, приблизительно 20 часов, приблизительно 21 часов, приблизительно 22 часа, приблизительно 23 часа, приблизительно 24 часа, приблизительно 48 часов или приблизительно 72 часа, или любого периода времени в промежутке между указанными значениями.
В другом варианте реализации гематопоэтические клетки можно культивировать с ретровирусом перед культивированием с одним или более агентами, которые повышают эффективность трансдукции и/или ЧКВ, во время культивирования с одним или более агентами, которые повышают эффективность трансдукции и/или ЧКВ, или после культивирования с одним или более агентами, которые повышают эффективность трансдукции и/или ЧКВ в течение любого из указанных выше периодов времени, описанных в данной заявке.
В некоторых вариантах реализации предполагается, что гематопоэтические клетки можно культивировать с полоксамером или полоксамером и одним или более агентами, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорином и необязательно поликатионным полимером перед культивированием с ретровирусом, во время культивирования с ретровирусом или после культивирования с ретровирусом, или при любой комбинации перечисленных вариантов, в течение любого из указанных выше периодов времени, описанных в данной заявке.
В одном варианте реализации гематопоэтические клетки приводят в контакт с ретровирусом и, в то же время, с полоксамером или полоксамером и одним или более агентами, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорином и необязательно поликатионным полимером в течение любого из указанных выше периодов времени, описанных в данной заявке.
Более того, для среднего специалиста в данной области должно быть очевидно, что в конкретных вариантах реализации эффективность трансдукции и ЧКВ повышаются при культивировании гематопоэтических клеток с ретровирусом и полоксамером или полоксамером и одним или более агентами, которые стимулируют путь передачи сигналов рецептора простагландина ЕР, или стауроспорином и необязательно поликатионным полимером в течение первых 6 часов трансдукции, первых 12 часов трансдукции, первых 24 часов трансдукции, первых 48 часов трансдукции или первых 72 часов трансдукции, или в течение любой промежуточной продолжительности трансдукции.
В некоторых вариантах реализации предполагается, что гематопоэтические клетки можно культивировать со стауроспорином перед культивированием с ретровирусом, промыть и привести в контакт с ретровирусом и, в то же время, с полоксамером и необязательно поликатионным полимером в течение любого из указанных выше периодов времени, описанных в данной заявке.
В конкретных вариантах реализации гематопоэтические клетки трансдуцируют в сосуде, таком как пакет, например, пакет для крови и взбалтывают в процессе трансдукции.
В других местах в данной заявке описано, что композиции и способы, предложенные в данной заявке, приводят к неожиданному повышению эффективности трансдукции и ЧКВ в гематопоэтических клетках, которые, как известно, трудно трансдуцировать, и в которых обычно наблюдают низкие ЧКВ.
В различных вариантах реализации композиции и способы, предложенные в данной заявке, повышают эффективность трансдукции до по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или по меньшей мере приблизительно 100%, включая любые промежуточные проценты.
В различных вариантах реализации композиции и способы, предложенные в данной заявке, повышают среднее ЧКВ до значений от по меньшей мере приблизительно 0,5 до по меньшей мере приблизительно 5,0, от по меньшей мере приблизительно 0,5 до по меньшей мере приблизительно 3, от по меньшей мере приблизительно 0,5 до по меньшей мере приблизительно 1,0, от по меньшей мере приблизительно 1,0 до по меньшей мере приблизительно 5,0, от по меньшей мере приблизительно 1,0 до по меньшей мере приблизительно 3,0 или составляющих по меньшей мере приблизительно 0,5, по меньшей мере приблизительно 1,0, по меньшей мере приблизительно 1,5, по меньшей мере приблизительно 2,0, по меньшей мере приблизительно 2,5, по меньшей мере приблизительно 3,0, по меньшей мере приблизительно 3,5, по меньшей мере приблизительно 4,0, по меньшей мере приблизительно 4,5 или по меньшей мере приблизительно 5,0.
В различных вариантах реализации эффективность трансдукции гематопоэтических клеток, трансдуцированных с помощью композиций и способов, предложенных в данной заявке, составляет по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или по меньшей мере приблизительно 100% и среднее ЧКВ составляет по меньшей мере приблизительно 0,5, по меньшей мере приблизительно 1,0, по меньшей мере приблизительно 1,5, по меньшей мере приблизительно 2,0 или по меньшей мере приблизительно 2,5.
В конкретных вариантах реализации повышение эффективности трансдукции представляет обогащение гематопоэтическими клетками, трансдуцированными с помощью композиций и способов, предложенных в данной заявке, по меньшей мере в 2 раза, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 25 раз, по меньшей мере в 50 раз или по меньшей мере в 100 раз или более по сравнению с гематопоэтическими клетками, трансдуцированными только вектором.
В конкретных вариантах реализации среднее ЧКВ повышается по меньшей мере в 2 раза, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 25 раз, по меньшей мере в 50 раз, или по меньшей мере в 100 или более раз в гематопоэтических клетках, трансдуцированных с помощью композиций и способов, предложенных в данной заявке, по сравнению с гематопоэтическими клетками, трансдуцированными вектором отдельно.
После трансдукции трансдуцированные клетки можно культивировать при условиях, подходящих для их поддержания, роста или пролиферации. В конкретных вариантах реализации трансдуцированные клетки культивируют в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней перед трансплантацией.
До, во время и/или после трансдукции указанные клетки можно культивировать при условиях, которые вызывают размножение стволовых клеток или клеток-предшественников. Можно применять любой способ, известный в данной области. В некоторых вариантах реализации до, во время или после трансдукции указанные клетки культивируют в присутствии одного или более факторов роста, которые вызывают размножение стволовых клеток или клеток-предшественников. Примеры факторов роста, которые вызывают размножение стволовых клеток или клеток-предшественников, включают, но не ограничены перечисленными: лиганд тирозинкиназы эмбриональной печени (Flt3), фактор стволовых клеток и интерлейкины 6 и 11, которые, как было продемонстрировано, вызывают самообновление гематопоэтических стволовых клеток мышей. Другие факторы роста включают белок Sonic hedgehog, который вызывает пролиферацию зародышевых гематопоэтических клеток-предшественников путем активации костного морфогенетического белка 4, Wnt3a, который стимулирует самообновление ГСК, нейротрофический фактор головного мозга (BDNF), эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), цилиарный нейротрофический фактор (CNF), трансформирующий фактор роста-β (TGF-β), фактор роста фибробластов (FGF, например, основный FGF, кислый FGF, FGF-17, FGF-4, FGF-5, FGF-6, FGF-8b, FGF-8c, FGF-9), колониестимулирующий фактор гранулоцитов (GCSF), фактор роста тромбоцитов (PDGF, например, PDGFAA, PDGFAB, PDGFBB), колониестимулирующий фактор гранулоцитов-макрофагов (GMCSF), фактор стволовых клеток (SCF), фактор стромальных клеток (SCDF), инсулиноподобный фактор роста (IGF), тромбопоэтин (ТРО) или интерлейкин-3 (IL-3). В конкретных вариантах реализации до, во время или после трансдукции указанные клетки культивируют в присутствии одного или более факторов роста, которые вызывают размножение стволовых клеток или клеток-предшественников.
Композиции и способы, предложенные в данной заявке в конкретных вариантах реализации, применимы для трансдукции любого типа клеток. Клетки, подходящие для применения в композициях и способах, предложенных в данной заявке, можно получить из любого животного, предпочтительно млекопитающего, например, не относящегося к человеку примата или человека, и более предпочтительно человека, и их можно трансплантировать любому животному, предпочтительно млекопитающему и более предпочтительно человеку.
В некоторых вариантах реализации предложены выделение и трансдукция популяции клеток. В данной заявке термин “популяция клеток” относится к множеству клеток, которое может состоять из любого количества и/или комбинации гомогенных или гетерогенных типов клеток, описанных в других местах в данной заявке. Например, для трансдукции гематопоэтических стволовых клеток или клеток-предшественников популяцию клеток можно выделить или получить из пуповинной крови, плацентарной крови, костного мозга или периферической крови. Популяция клеток может содержать приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 100% целевого типа клеток, который нужно трансдуцировать. В некоторых вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники можно выделить или очистить из популяции гетерогенных клеток, применяя способы, известные в данной области.
Предпочтительные целевые типы клеток, трансдуцированные с помощью композиций и способов, предложенных в данной заявке, включают, гематопоэтические клетки, например, гематопоэтические клетки человека.
В предпочтительных вариантах реализации указанные композиции и способы, предложенные в данной заявке, применяют для повышения эффективности трансдукции и/или ЧКВ в гематопоэтических стволовых клетках или клетках-предшественниках.
Типичные источники получения гематопоэтических клеток, трансдуцированных с помощью способов и композиций, предложенных в данной заявке, включают, но не ограничены перечисленными: пуповинную кровь, костный мозг или мобилизованную периферическую кровь.
Наглядные примеры гематопоэтических клеток, подходящих для трансдукции с помощью способов и композиций, предложенных в данной заявке, включают CD34+клетки. Термин "CD34+ клетка" в данной заявке относится к клетке, экспрессирующей белок CD34 на своей поверхности. "CD34" в данной заявке относится к гликопротеину на поверхности клетки (например, белку сиаломуцину), который часто действует как фактор межклеточной адгезии. CD34+ представляет собой маркер на поверхности как гематопоэтических стволовых клеток, так и клеток-предшественников.
Дополнительные наглядные примеры гематопоэтических стволовых клеток или клеток-предшественников, подходящих для трансдукции с помощью способов и композиций, предложенных в данной заявке, включают гематопоэтические клетки, которые представляют собой CD34+CD38LoCD90+CD45RA-, гематопоэтические клетки, которые представляют собой CD34+, CD59+, Thyl/CD90+, CD38Lo/-, C-kit/CD117+ и Lin(-), и гематопоэтические клетки, которые представляют собой CD133+.
Существуют различные способы описания гематопоэтической иерархии. Одним из способов описания является SLAM-код. Семейство SLAM (сигнальная молекула активации лимфоцитов) представляет собой группу из >10 молекул, гены которых расположены по большей части тандемно в одном локусе на хромосоме 1 (мыши), все относятся к подгруппе из суперсемейства генов иммуноглобулинов, и исходно считали, что они участвуют в стимуляции Т-клеток. Данное семейство включает CD48, CD150, CD244 и т.д., CD150 считают исходным представителем и, следовательно, также называют slamF1, т.е., представитель 1 семейства SLAM. Типичный SLAM-код для гематопоэтической иерархии следующий: гематопоэтические стволовые клетки (ГСК) - CD150+CD48-CD244-; мультипотентные клетки-предшественники (МПП) - CD150-CD48-CD244+; линейно-специфические клетки-предшественники (ЛСП) - CD150-CD48+CD244+; общая миелоидная клетка-предшественник (ОМП) - lin-SCA-1-c-kit+CD34+CD16/32mid; клетка-предшественник гранулоцитов-макрофагов (ГМП) - lin-SCA-1-с-kit+CD34+CD16/32hi и клетка-предшественник мегакариоцитов-эритроцитов (МЭП) - lin-SCA-1-c-kit+CD34-CD16/32low.
В конкретных вариантах реализации в CD34+ клетках, которые трансдуцируют с помощью векторов и композиций, предложенных в данной заявке, содержатся следующие аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βС/β+, βЕ/β+, β0/β+, β+/β+, βС/βС, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В конкретных вариантах реализации в CD34+ клетках, которые трансдуцируют с помощью векторов и композиций, предложенных в данной заявке, содержатся следующие аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+ или β+/β+.
В конкретных вариантах реализации в CD34+клетках, которые трансдуцируют с помощью векторов и композиций, предложенных в данной заявке, содержатся следующие аллели β-глобина: βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
H. Способы генотерапии
Лекарственные продукты с более высоким содержанием трансдуцированных клеток, причем число копий терапевтических генов в каждой клетке также выше, позволяют получить более терапевтически эффективные генотерапевтические средства. В данной заявке термин "лекарственный продукт" относится к генетически модифицированным клеткам, полученным с применением композиций и способов, предложенных в данной заявке. В конкретных вариантах реализации лекарственный продукт содержит генетически модифицированные гематопоэтические стволовые клетки или клетки-предшественники, например, CD34+ клетки. Без привязки к какой-либо конкретной теории, повышение количества терапевтического гена в лекарственном продукте может позволить лечение субъектов, у которых не наблюдается или наблюдается на минимальном уровне экспрессия соответствующего гена in vivo, что значительно расширяет возможности по доставки генотерапии субъектам, для которых генотерапия ранее не являлась осуществимым способом лечения.
Трансдуцированные клетки и соответствующие ретровирусные векторы, предложенные в данной заявке, обеспечивают улучшенные способы генотерапии. В данной заявке термин "генотерапия" относится к внедрению гена в геном клетки. В различных вариантах реализации вирусный вектор согласно настоящему изобретению содержит контролирующую экспрессию в гематопоэтических клетках последовательность, которая экспрессирует терапевтический трансген, кодирующий полипептид, который оказывает благоприятное излечивающее, предупредительное или улучшающее действие на субъекта, у которого диагностировано или подозревают наличие моногенного заболевания, расстройства или состояния или заболевания, расстройства или состояния, которое поддается терапии гематопоэтическими стволовыми клетками.
В одном предпочтительном варианте реализации трансдуцированные клетки обладают потенциалом превратиться в микроглиальные клетки головного мозга (макрофаги). В конкретных вариантах реализации гематопоэтические стволовые клетки трансдуцируют вектором, предложенным в данной заявке, и вводят индивиду, нуждающемуся в терапии лизосомальной болезни накопления, адренолейкодистрофии или адреномиелонейропатии. Гематопоэтические стволовые клетки являются источником микроглиальных клеток головного мозга и, следовательно, предпочтительны в таких вариантах реализации.
В конкретных вариантах реализации трансдуцированные гематопоэтические стволовые клетки или клетки-предшественники содержат вирусные векторы, содержащие контролирующую экспрессию в гематопоэтических клетках последовательность, которая экспрессирует терапевтический трансген, кодирующий полипептид, который оказывает благоприятное излечивающее, предупредительное или улучшающее действие на субъекта, у которого диагностировано или подозревают наличие моногенного заболевания, расстройства или состояния или заболевания, расстройства или состояния гематопоэтической системы.
В некоторых вариантах реализации векторы, вирусные частицы и/или трансдуцированные клетки, предложенные в данной заявке, предназначены для лечения, предотвращения и/или снижения выраженности моногенного заболевания, расстройства или состояния или заболевания, расстройства или состояния гематопоэтической системы у субъекта, например, гемоглобинопатии.
Наглядные примеры моногенных расстройств и соответствующего(-их) терапевтического(-их) гена(-ов), которые подходят для применения в конкретных вариантах реализации, предложенных в данной заявке, включают, но не ограничены перечисленными: X-SCID (IL2Rγ), ADA-SCID (аденозиндезаминаза), болезнь Баттена (трипептидилпептидаза 1), мукополисахаридоз 1 типа - синдром Гурлер (альфа-L-идуронидаза), мукополисахаридоз 2 типа - синдром Хантера (идуронат-2-сульфатаза), мукополисахаридоз 3 типа - синдром Санфилиппо (сульфогидролаза N-сульфоглюкозамина), мукополисахаридоз типа 4А - синдром Моркио А (галактозамин-6-сульфатаза), мукополисахаридоз типа 4В - синдром Моркио В (бета-галактозидаза), мукополисахаридоз 6 типа - синдром Марото-Лами (N-ацетилгалактозамин-4-сульфатаза), болезнь Гоше (глюкоцереброзидаза), метахроматическую лейкодистрофию (арилсульфатаза А), хронические гранулематозные болезни (альфа цепь цитохрома b-245, бета цепь цитохрома b-245, цитозольный фактор нейтрофилов 1, цитозольный фактор нейтрофилов 2, цитозольный фактор нейтрофилов 4), синдром Вискотта-Олдрича (белок синдрома Вискотта-Олдрича), дефицит перфорина (PRF1), анемию Фанкони (гены FANC, например, FANCA, FANCC, FANCG), Х-сцепленный лимфопролиферативный синдром (SH2D1A), дефицит RAG (RAG1/2), дефицит белка Artemis (DCLRE1C), гемофилию А (фактор VIII), гемофилию В (фактор IX) и нарушение адгезии лейкоцитов (CD18).
В данной заявке термин "гематопоэз" относится к формированию и развитию кровяных клеток из клеток-предшественников, а также к формированию клеток-предшественников из стволовых клеток. Кровяные клетки включают, но не ограничены перечисленными: эритроциты или красные кровяные клетки (RBC), ретикулоциты, моноциты, нейтрофилы, мегакариоциты, эозинофилы, базофилы, В-клетки, макрофаги, гранулоциты, тучные клетки, тромбоциты и лейкоциты.
В данной заявке термин "гемоглобинопатия" или "гемоглобинопатическое состояние" относится к разнообразной группе наследственных болезней крови, при которых присутствуют аномальные молекулы гемоглобина, возникшие в результате изменений в структуре и/или синтезе гемоглобина. Обычно гемоглобин состоит из четырех белковых субъединиц: двух субъединиц β-глобина и двух субъединиц α-глобина. Каждая из данных белковых субъединиц присоединена (связана) к железосодержащей молекуле, называемой гемом; в центре каждого гема содержится молекула железа, которая может связывать одну молекулу кислорода. Гемоглобин внутри красных кровяных клеток связывается с молекулами кислорода в легких. Данные клетки затем перемещаются по кровотоку и доставляют кислород к тканям по всему организму.
Гемоглобин А (HbA) - это обозначение нормального гемоглобина, который присутствует с момента рождения. Гемоглобин А представляет собой тетрамер с двумя альфа-цепями и двумя бета-цепями (α2β2). Гемоглобин А2 представляет собой минорный компонент гемоглобина, находящийся в эритроцитах после рождения, и состоит из двух альфа-цепей и двух дельта-цепей (α2δ2). Гемоглобин А2, как правило, составляет менее 3% от всего гемоглобина эритроцитов. Гемоглобин F является преобладающим гемоглобином в процессе эмбрионального развития. Данная молекула представляет собой тетрамер из двух альфа-цепей и двух гамма-цепей (α2γ2).
Наиболее распространенные гемоглобинопатии включают серповидноклеточную болезнь, β-талассемию и α-талассемию.
В конкретных вариантах реализации композиции и способы, предложенные в данной заявке, предоставляют генотерапию субъектам, страдающим серповидноклеточной болезнью. В данной заявке в объем термина "серповидноклеточная анемия" или "серповидноклеточная болезнь" входит любое симптоматическое анемическое состояние, которое возникает в результате образования серповидных форм эритроцитов. Серповидноклеточная анемия βS/βS, обычная форма серповидноклеточной болезни (SCD), вызывается гемоглобином S (HbS). HbS образуется в результате замены глутаминовой кислоты (Е) на валин (V) в положении 6 β-глобина, которая обозначаетя Glu6Val или E6V. Замена глутаминовой кислоты на валин вызывает слипание аномальных субъединиц HbS друг с другом и образование длинных, жестких молекул, которые сгибают эритроциты в серповидную форму (полумесяц). Клетки серповидной формы погибают до созревания, что может приводить к нехватке эритроцитов (анемии). Кроме того, клетки серповидной формы жесткие и могут блокировать малые кровеносные сосуды, вызывая сильную боль и повреждение органов.
Дополнительные мутации в гене β-глобина также могут вызывать другие отклонения β-глобина от нормы, приводя к другому типу серповидноклеточной болезни. Данные аномальные формы β-глобина часто обозначают буквами алфавита или иногда дают им название. В данных других типах серповидноклеточной болезни одна субъединица β-глобина заменена на HbS и другая субъединица β-глобина заменена на отличный аномальный вариант, такой как гемоглобин С (HbC; аллель β-глобина обозначена βC) или гемоглобин Е (HbE; аллель β-глобина обозначена βЕ).
При заболевании, вызванном гемоглобином SC (HbSC), субъединицы β-глобина заменены на HbS и HbC. HbC возникает в результате мутации в гене β-глобина, и он является преобладающим гемоглобином, обнаруженным у людей с заболеванием HbC (α2βC2). HbC возникает, когда аминокислота лизин заменяет аминокислоту глутаминовую кислоту в положении 6 β-глобина, данная мутация обозначается Glu6Lys или E6K. Заболевание НЬС относительно доброкачественное, вызывает легкую гемолитическую анемию и спленомегалию. Тяжесть заболевания HbSC может быть различной, но оно может быть таким же тяжелым как серповидноклеточная анемия.
HbE образуется, когда аминокислота глутаминовая кислота заменяется на аминокислоту лизин в положении 26 β-глобина, данная мутация обозначается Glu26Lys или E26K. У людей с заболеванием HbE наблюдают легкую гемолитическую анемию и легкую спленомегалию. HbE чрезвычайно распространен в Юго-восточной Азии, и в некоторых регионах его частота приравнивается к таковой у гемоглобина А. В некоторых случаях мутацию HbE наблюдают вместе с HbS. В данных случаях у индивида могут наблюдаться более тяжелые признки и симптомы, связанные с серповидноклеточной анемией, такие как эпизоды боли, анемия и отклоняющееся от нормы функционирование селезенки.
Другие состояния, известные как серповидный гемоглобин-β-талассемии (HbSBetaThal), вызываются одновременным присутствием мутаций, которые вызывают образование гемоглобина S и возникновение β-талассемии. Мутации, в результате которых серповидноклеточная болезнь присутствует в комбинации с талассемией бета-ноль (β0; мутации гена β-глобина, которые предотвращают его продукцию), приводят к тяжелому заболеванию, тогда как серповидноклеточная болезнь в комбинации с талассемией бета-плюс (β+; мутации гена β-глобина, которые снижают его продукцию) протекает легче.
В данной заявке термин "талассемия" относится к наследственному расстройству, отличительным признаком служит нарушенная продукция гемоглобина. Примеры талассемий включают α- и β-талассемию.
В конкретных вариантах реализации композиции и способы, предложенные в данной заявке, предоставляют генотерапию субъектам, страдающим β-талассемией. β-талассемии вызываются мутацией в цепи β-глобина и могут встречаться в основной или малой форме. Обнаружили, что β-талассемию вызывают почти 400 мутаций в гене β-глобина. При большинстве указанных мутаций происходит замена одного строительного блока ДНК (нуклеотида) внутри или рядом с геном β-глобина. При других мутациях вставляется или удаляется небольшое количество нуклеотидов гена β-глобина. Выше отмечено, что мутации гена β-глобина, которые снижают продукцию β-глобина, приводят к типу данного состояния, называемому бета-плюс (β+) талассемией. Мутации, которые совсем предотвращают продукцию бета-глобина в клетках, приводят к бета-ноль (β0) талассемий. При основной форме β-талассемии дети нормальные при рождении, но у них развивается анемия в течение первого года жизни. При малой форме β-талассемии продуцируются малые эритроциты. Малая талассемия возникает, когда человек наследует дефектный ген только от одного родителя. Люди с данной формой расстройства являются носителями заболевания, и обычно у них не наблюдаются симптомы.
HbE/β-талассемия возникает в результате комбинации HbE и β-талассемии (βЕ/β0, βЕ/β+), которая вызывает более тяжелое состояние, чем наблюдаемое либо при признаке НЬЕ, либо при признаке β-талассемии отдельно. Данное расстройство проявляется как умеренно тяжелая талассемия, которая относится к категории промежуточной талассемий. HbE/β-талассемия наиболее распространена среди людей из Юго-Восточной Азии.
В конкретных вариантах реализации композиции и способы, предложенные в данной заявке, предоставляют генотерапию субъектам, страдающим α-талассемией. α-талассемия представляет собой достаточно распространенное заболевание крови во всем мире. Ежегодно рождаются тысячи младенцев с синдромом Hb Барта и заболеванием HbH, особенно в Юго-Восточной Азии, α-талассемия также часто встречается у людей из средиземноморских стран, Северной Африки, Среднего Востока, Индии и Центральной Азии, α-талассемия обычно возникает в результате делеций в генах НВА1 и НВА2, В обоих данных генах записана информация для создания белка, названного α-глобином, который представляет собой компонент (субъединицу) гемоглобина. У людей в каждой клетке есть по две копии гена НВА1 и по две копии гена НВА2. Различные типы α-талассемии возникают в результате утраты некоторых или всех аллелей НВА1 и НВА2.
Синдром Hb Барта, наиболее тяжелая форма α-талассемии, возникает в результате утраты всех четырех аллелей альфа-глобина. Болезнь HbH вызывается утратой трех из четырех аллелей α-глобина. При данных двух состояниях нехватка α-глобина не позволяет клеткам продуцировать нормальный гемоглобин. Вместо этого клетки продуцируют аномальные формы гемоглобина, называемые гемоглобином Барта (Hb Барта) или гемоглобином Н (HbH). Данные аномальные молекулы гемоглобина не могут эффективно переносить кислород к тканям организма. Замена нормального гемоглобина на Hb Барта или HbH вызывает анемию и другие серьезные проблемы со здоровьем, связанные с α-талассемией.
При двух дополнительных вариантах α-талассемии продуцируется пониженное количество α-глобина. Так как клетки все же продуцируют некоторое количество нормального гемоглобина, данные варианты склонны вызывать меньше проблем со здоровьем или не вызывать их вообще. Утрата двух из четырех аллелей α-глобина приводит к признаку α-талассемии. У людей с признаком α-талассемии могут наблюдаться малые бледные эритроциты и легкая анемия. Утрату одной аллели α-глобина обнаруживают у бессимптомных носителей α-талассемии. У данных индивидов обычно отсутствуют связанные с талассемией признаки или симптомы.
В предпочтительном варианте реализации способы генотерапии, предложенные в данной заявке, применяют для лечения, предотвращения или снижения выраженности гемоглобинопатии, выбранной из группы, состоящей из: болезни гемоглобина С, болезни гемоглобина Е, серповидноклеточной анемии, серповидноклеточной болезни (SCD), талассемиии, β-талассемии, основной талассемии, промежуточной талассемии, α-талассемии, синдрома гемоглобина Барта и болезни гемоглобина Н.
В предпочтительном варианте реализации способы генотерапии, предложенные в данной заявке, применяют для лечения, предотвращения или снижения выраженности гемоглобинопатии у субъекта с генотипом β-глобина, выбранным из группы, состоящей из: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β0, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В различных вариантах реализации ретровирусные векторы вводят путем непосредственной инъекции in vivo в клетку, ткань или орган субъекта, нуждающегося в генотерапии. В различных других вариантах реализации клетки трансдуцируют in vitro или ex vivo векторами, предложенными в данной заявке, и необязательно размножают ex vivo. Указанные трансдуцированные клетки затем вводят нуждающемуся в генотерапии субъекту.
Клетки, подходящие для трансдукции и введения в способах генотерапии, предложенных в данной заявке, включают, но не ограничены перечисленными: стволовые клетки, клетки-предшественники и дифференцированные клетки, описанные в других местах в данной заявке. В некоторых вариантах реализации трансдуцированные клетки представляют собой гематопоэтические стволовые клетки или клетки-предшественники, описанные в других местах в данной заявке.
Предпочтительные клетки для применения в генотерапевтических композиция и способах, предложенных в данной заявке, включают аутологические/аутогенные ("свои")клетки.
В конкретных вариантах реализации в клетках, применяемых в качестве исходных для генотерапии, содержатся следующие аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β+, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
В конкретных вариантах реализации в клетках, применяемых в качестве исходных для генотерапии, содержатся следующие аллели β-глобина: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βС/β+, β0/β+ или β+/β+.
В конкретных вариантах реализации в клетках, применяемых в качестве исходных для генотерапии, содержатся следующие аллели β-глобина: βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
Термин "субъект" в данной заявке включает любое животное, которое проявляет симптом моногенного заболевания, расстройства или состояния, которое можно лечить генотерапевтическими векторами, лекарственными средствами, основанными на клеточной системе, и способами, описанными в других местах в данной заявке. В предпочтительных вариантах реализации субъект включает любое животное, которое проявляет симптомы заболевания, расстройства или состояния гематопоэтической системы, например, гемоглобинопатии, которые можно лечить генотерапевтическими векторами, лекарственными средствами, основанными на клеточной системе, и способами, описанными в других местах в данной заявке. Подходящие субъекты (например, пациенты) включают лабораторных животных (таких как мышь, крыса, кролик или морская свинка), сельскохозяйственных животных и домашних животных или комнатных животных (таких как кошка или собака). В объем данного термина входят не относящиеся к человеку приматы и, предпочтительно, пациенты-люди. Обычные субъекты включают животных, у которых выявили аберрантные величины (более низкие или более высокие количества, чем у "нормального" или "здорового" субъекта) одной или более физиологических активностей, которые можно модулировать с помощью генотерапии.
В данной заявке в объем термина "лечение" или "лечить" входит любое полезное или желательное влияние на симптомы или патологию заболевания или патологического состояния, и он может включать даже минимальные снижения количества одного или более поддающихся измерению маркеров заболевания или состояния, которое лечат. Лечение может включать необязательно либо уменьшение или снижение выраженности симптомов заболевания или состояния, либо отсрочивание прогрессирования заболевания или состояния. "Лечение" не обязательно означает полное устранение или излечение заболевания или состояния или связанных с ним симптомов.
В данной заявке термин "предотвращать" и аналогичные термины, такие как "предотвратили", "предупреждение" и т.д., указывают на подход к предотвращению, ингибированию или уменьшению вероятности возникновения или рецидива заболевания или состояния. В объем данного термина также входит отсрочивание начала или рецидива заболевания или состояния или отсрочивание возникновения или рецидива симптомов заболевания или состояния. В данной заявке в объем термина "предотвращение" и аналогичных терминов также входит снижение интенсивности, влияния, симптомов и/или тяжести заболевания или состояния до начала или рецидива указанного заболевания или состояния.
В данной заявке термин "количество" относится к "количеству, эффективному" или "эффективному количеству" вируса или трансдуцированной терапевтической клетки для достижения полезного или желательного профилактического или терапевтического результата, включая клинические результаты.
"Профилактически эффективное количество" относится к количеству вируса или трансдуцированной терапевтической клетки, эффективному для достижения желательного профилактического результата. Обычно, но не обязательно, поскольку профилактическую дозу субъекты применяют до или на ранней стадии заболевания, профилактически эффективное количество меньше, чем терапевтически эффективное количество.
"Терапевтически эффективное количество" вируса или трансдуцированной терапевтической клетки может изменяться в зависимости от таких факторов, как конкретное болезненное состояние, возраст, пол и масса тела индивида, и способность стволовых клеток и клеток-предшественников вызвать желательный ответ у индивида. Терапевтически эффективное количество также представляет собой такое количество, при котором терапевтически полезные эффекты превосходят любые токсичные или вредные действия вируса или трансдуцированных терапевтических клеток. В объем термина "терапевтически эффективное количество" входит количество, которое эффективно для "лечения" субъекта (например, пациента).
Без привязки к какой-либо конкретной теории, важным преимуществом, которое дают векторы, композиции и способы согласно настоящему изобретению, является высокая эффективность генотерапии, которой можно добиться путем введения популяций клеток, содержащих высокие проценты трансдуцированных клеток, по сравнению с существующими способами.
Указанные трансдуцированные клетки можно вводить в составе трансплантата костного мозга или пуповинной крови индивиду, которого подвергли или не подвергли разрушающей костный мозг терапии. В одном варианте реализации трансдуцированные клетки согласно настоящему изобретению вводят в трансплантат костного мозга индивида, которого подвергли разрушающей костный мозг химиотерапии или радиотерапии.
В одном варианте реализации дозу трансдуцированных клеток доставляют субъекту внутривенно. В предпочтительных вариантах реализации трансдуцированные гематопоэтические стволовые клетки вводят субъекту внутривенно.
В одном пояснительном варианте реализации эффективное количество трансдуцированных клеток, которое дают субъекту, составляет по меньшей мере 2×106 клеток/кг, по меньшей мере 3×106 клеток/кг, по меньшей мере 4×106 клеток/кг, по меньшей мере 5×106 клеток/кг, по меньшей мере 6×106 клеток/кг, по меньшей мере 7×106 клеток/кг, по меньшей мере 8×106 клеток/кг, по меньшей мере 9×106 клеток/кг, или по меньшей мере 10×106 клеток/кг, или более клеток/кг, включая все промежуточные дозы клеток.
В другом пояснительном варианте реализации эффективное количество трансдуцированных клеток, которое дают субъекту, составляет приблизительно 2×106 клеток/кг, приблизительно 3×106 клеток/кг, приблизительно 4×106 клеток/кг, приблизительно 5×106 клеток/кг, приблизительно 6×106 клеток/кг, приблизительно 7×106 клеток/кг, приблизительно 8×106 клеток/кг, приблизительно 9×106 клеток/кг, или приблизительно 10×106 клеток/кг, или более клеток/кг, включая все промежуточные дозы клеток.
В другом пояснительном варианте реализации эффективное количество трансдуцированных клеток, которое дают субъекту, составляет от приблизительно 2×106 клеток/кг до приблизительно 10×106 клеток/кг, от приблизительно 3×106 клеток/кг до приблизительно 10×106 клеток/кг, от приблизительно 4×106 клеток/кг до приблизительно 10×106 клеток/кг, от приблизительно 5×106 клеток/кг до приблизительно 10×106 клеток/кг, от 2×106 клеток/кг до приблизительно 6×106 клеток/кг, от 2×106 клеток/кг до приблизительно 7×106 клеток/кг, от 2×106 клеток/кг до приблизительно 8×106 клеток/кг, от 3×106 клеток/кг до приблизительно 6×106 клеток/кг, от 3×106 клеток/кг до приблизительно 7×106 клеток/кг, от 3×106 клеток/кг до приблизительно 8×106 клеток/кг, от 4×106 клеток/кг до приблизительно 6×106 клеток/кг, от 4×106 клеток/кг до приблизительно 7×106 клеток/кг, от 4×106 клеток/кг до приблизительно 8×106 клеток/кг, от 5×106 клеток/кг до приблизительно 6×106 клеток/кг, от 5×106 клеток/кг до приблизительно 7×106 клеток/кг, от 5×106 клеток/кг до приблизительно 8×106 клеток/кг или от 6×106 клеток/кг до приблизительно 8×106 клеток/кг, включая все промежуточные дозы клеток.
Небольшие изменения дозировки обязательно будут происходить в зависимости от состояния субъекта, которого лечат. Человек, отвечающий за введение, в любом случае, будет определять подходящую дозу индивидуально для субъекта.
В различных вариантах реализации векторы, композиции и способы, предложенные в данной заявке, предлагают улучшенные способы генотерапии с применением генотерапии ex vivo и аутологической трансплантации. В одном предпочтительном варианте реализации трансдуцированные клетки представляют собой стволовые клетки или клетки-предшественники, например, гематопоэтические стволовые клетки или клетки-предшественники, или CD34+ клетки. В конкретных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы вектором, предложенным в данной заявке, в присутствии одного или более агентов, которые повышают эффективность трансдукции ретровирусом, например, лентивирусом, и ЧКВ, и указанные трансдуцированные клетки вводят индивиду, нуждающемуся в терапии гемоглобинопатии.
В конкретных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы вектором, предложенным в данной заявке, в присутствии одного или более агентов, которые повышают эффективность трансдукции ретровирусом, например, лентивирусом, и ЧКВ, и указанные трансдуцированные клетки вводят индивиду, нуждающемуся в терапии адренолейкодистрофии или адреномиелонейропатии.
В конкретных вариантах реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы вектором, предложенным в данной заявке, в присутствии одного или более агентов, которые повышают эффективность трансдукции ретровирусом, например, лентивирусом, и ЧКВ, и указанные трансдуцированные клетки вводят индивиду, нуждающемуся в терапии ADA-SCID, X-SCID, болезни Баттена, MPS I или MPS II.
В одном предпочтительном варианте реализации системы вирусных векторов внедряют в гематопоэтические стволовые клетки или клетки-предшественники для экспрессии высоких уровней одного или более терапевтических белков в эритроидных клетках или эритроидных клетках-предшественниках. Ретровирусные векторы, включая лентивирусные векторы, предложенные в данной заявке, содержат представляющий интерес полинуклеотид, включая, например, ген глобина или ген, который кодирует белок, предотвращающий образование серповидноклеточных эритроцитов. В одном варианте реализации ген глобина, экспрессированный в ретровирусном векторе согласно настоящему изобретению, представляет собой β-глобин, δ-глобин или γ-глобин. В другом варианте реализации ген β-глобина человека представляет собой ген β-глобина человека дикого типа или ген βА-глобина человека. В другом варианте реализации ген β-глобина человека включает одну или более делеций последовательностей интронов или представляет собой мутированный ген β-глобина человека, кодирующий по меньшей мере один предотвращающий образование серповидноклеточных эритроцитов аминокислотный остаток. Предотвращающие образование серповидноклеточных эритроцитов аминокислоты могут быть получены из δ-глобина человека или γ-глобина человека. В другом варианте реализации мутированный ген β-глобина человека кодирует замену треонина на глутамин в кодоне 87 (βA-T87Q).
В другом варианте реализации мутированный ген β-глобина человека кодирует одну или более или все из следующих мутаций: замену треонина на глутамин в кодоне 87 (βA-T87Q), мутацию лизина на глутамат в кодоне 120 (βA-K120E) и мутацию лизина на глутамат в кодоне 95 (βА-K95E).
В другом варианте реализации мутированный ген β-глобина человека кодирует одну или более или все из следующих мутаций: замену треонина на глутамин в кодоне 87 (βA-T87Q), мутацию глицина на аспартат в кодоне 16 (βA-G16D) и мутацию глутамата на аланин в кодоне 22 (βА-Е22А).
В другом предпочтительном варианте реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцируют с помощью способов и композиций, предложенных в данной заявке, для получения лекарственных продуктов, применяемых в генотерапии, включая генотерапию для лечения гемоглобинопатии. В конкретных вариантах реализации полученные лекарственные продукты вызывают достаточно стабильные уровни экспрессии генов в эритроидных клетках, например, для лечения поражающих эритроидные клетки заболеваний. В некотором варианте реализации указанные лекарственные продукты применяют для лечения гемоглобинопатии, включая, например, серповидноклеточную болезнь (SCD). В другом предпочтительном варианте реализации лекарственные продукты применяют для лечения талассемии, включая, но не ограничиваясь β-талассемией.
В другом предпочтительном варианте реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы с помощью способов и композиций, предложенных в данной заявке, для получения лекарственных продуктов, которые экспрессируют достаточно стабильные уровни ABCD1 для лечения адренолейкодистрофий и/или адреномиелонейропатий.
В другом варианте реализации гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы с помощью способов и композиций, предложенных в данной заявке, для получения лекарственных продуктов, которые экспрессируют достаточно стабильные уровни аденозиндезаминазы для лечения ADA-SCID; достаточно стабильные уровни рецептора интерлейкина-2 гамма для лечения X-SCID; достаточно стабильные уровни трипептидилпептидазы 1 для лечения болезни Баттена; достаточно стабильные уровни альфа-L-идуронидазы для лечения мукополисахаридоза I типа (MPS I); или достаточно стабильные уровни идуронат-2-сульфатазы для лечения мукополисахаридоза II типа (MPS II).
Средний специалист в данной области сможет использовать стандартные способы для определения подходящего пути введения и правильной дозировки эффективного количества композиции, содержащей трансдуцированные клетки и/или один или более агентов, которые повышают эффективность трансдукции или ЧКВ, предложенные в данной заявке. Средним специалистам в данной области также будет известно, что при некоторых методах лечения может потребоваться множество введений фармацевтических композиций согласно настоящему изобретению для осуществления терапии.
Одним из главных способов, применяемых для лечения субъектов, поддающихся лечению генотерапией на основе гематопоэтических стволовых клеток и клеток-предшественников, является переливание крови. Таким образом, одной из важнейших целей для композиций и способов, предложенных в данной заявке, является уменьшение количества или освобождение от необходимости переливаний.
В конкретных вариантах реализации лекарственный продукт вводят однократно.
В некоторых вариантах реализации лекарственный продукт вводят 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более раз в течение 1 года, 2 лет, 5 лет, 10 лет или более.
Все публикации, заявки на патент и изданные патенты, цитированные в настоящем описании, включены в данную заявку посредством ссылки, как если бы каждая отдельная публикация, заявка на патент или изданный патент были конкретно и отдельно указаны как включенные посредством ссылки.
Хотя описанное выше изобретение было описано с некоторыми подробностями с целью иллюстрирования и приведения примера для ясности понимания, для среднего специалиста в данной области в свете идеи настоящего изобретения будет очевидно, что можно внести в него некоторые изменения и модификации, не отклоняясь от сущности или объема прилагаемой формулы изобретения. Следующие примеры предложены только с целью иллюстрирования, но не ограничения. Специалисты в данной области легко распознают различные некритические параметры, которые можно изменить или модифицировать для получения по существу сходных результатов.
ПРИМЕРЫ
Пример 1
Подтверждающие анализы
Число копий вектора (ЧКВ) и эффективность трансдукции
Промытые клетки ресуспендировали в 2 мл среды для роста стволовых клеток (SCGM) + цитокины и переносили в стандартный 12-луночный планшет для неадгерентной культуры ткани. Клетки поддерживали в течение дополнительных 6 дней в стандартном термостате для культуры ткани с поддержанием влажности (5% CO2), а затем подвергали анализу числа копий вектора (ЧКВ) или гнездовой ПЦР отдельных клеток, чтобы определить эффективность трансдукции. Как анализ ЧКВ, так и анализ отдельных клеток методом гнездовой ПЦР проводили с помощью количественной ПЦР, применяя праймеры и зонды, специфичные как к вектору, так и к эндогенному контрольному гену. ЧКВ определяли путем деления величины сигнала вектора на величину сигнала эндогенного контрольного гена. Для анализа отдельных клеток методом гнездовой ПЦР лунки, которые содержали клетку, положительную по эндогенному контрольному гену, и лунки, которые содержали меченую клетку, положительную как по вектору, так и по эндогенному контрольному гену, подсчитывали и рассчитывали процент меченых клеток или эффективность трансдукции.
Анализы в метилцеллюлозе
Промытые клетки ресуспендировали в 200 мкл среды SCGM, а затем переносили в аликвоты дополненной цитокинами метилцеллюлозы (например, Methocult М4434 Classic) объемом 3 мл. 1,1 мл затем переносили в параллельные культуральные чашки диаметром 35 мм, используя тупую иглу 16 калибра. 4ашки выдерживали в стандартном термостате для культуры ткани с поддержанием влажности в течение 12-16 дней, и оценивали размер, морфологию и клеточный состав колоний. Отдельные колонии затем снимали для последующего анализа ЧКВ или содержимое всей чашки диаметром 35 мм объединяли, а затем подвергали анализу ЧКВ.
Анализ BlaM для оценки проникновения вируса
Клетки трансдуцировали в течение 2 часов в присутствии F108, PGE2 и вируса, кодирующего слитый белок β-лактамаза-Vpr. После трансдукции клетки промывали и инкубировали с флуоресцентным субстратом β-лактамазы в течение 30-60 минут. Расщепление β-лактамазы анализировали с помощью проточной цитометрии: нерасщепленный субстрат является GFP+, и расщепление флуоресцентной β-лактамазы приводит к сигналу Pacific Blue+. Расщепление β-лактамазы указывает на проникновение лентивируса в клетку. См. также Cavrois и др. Nature Biotechnology. 2002.
Трансдукция длительных гематопоэтических стволовых клеток (Д-ГСК)
ГСК, трансдуцированные лентивирусом, трансплантировали мышам NOD/SCID Gamma (NSG), чтобы оценить влияние кандидатных соединений на трансдукцию вирусом длительных гематопоэтических стволовых клеток человека. Трансдуцированные клетки промывали, ресуспендировали в фосфатно-солевом буферном растворе (ФБР) и трансплантировали в хвостовую вену подвергнутых частичной миелоабляции взрослых мышей NSG с минимальной остаточной токсичностью. Мышей поселяли в не содержащей патогены среде в соответствии со стандартными руководствами по уходу за животными Институционального комитета по содержанию и использованию лабораторных животных (IACUC). 4ерез 4 месяца после трансплантации собирали костный мозг (КМ) из обеих бедренных костей и анализировали как ЧКВ, так и приживление клеток человека путем окрашивания антителом к CD45 человека (hCD45) (BD №561864) с последующим анализом методом проточной цитометрии.
Пример 2
Анализ in vivo обработанных PGE2 CD34+ клеток человека
Метаанализ трансплантатов NSG с обработанными PGE2 трансдуцированными лентивирусом hCD34+ клетками из здоровых доноров (n=3). CD34+ клетки человека трансплантировали подвергнутым частичной миелоабляции самкам мышей NSG и анализировали костный мозг (КМ) через 4 месяца после трансплантации. КМ собирали из обеих бедренных костей мышей NSG и половину образца окрашивали антителом к hCD45 в течение приблизительно 30 минут при 4°С. После инкубации образцы промывали и анализировали наличие в них CD45+ клеток человека с помощью анализа методом проточной цитометрии, применяя антитело к hCD45 (BD №561864). Не обнаружили статистически значимого различия в проценте hCD45+ клеток в КМ мыши между обработанными контролем и обработанными PGE2 образцами. Данные результаты указывают на то, что обработка PGE2 hCD34+ клеток значительно не повышала приживление ГСК. Фигура 1А. Среднее ЧКВ приживленных обработанных PGE2 hCD34+ клеток было приблизительно в два раза выше, чем среднее ЧКВ контрольных клеток через 4 месяца после трансплантации. Фигура 1В.
Пример 3
Для HCD34+ клеток, трансдуцированных в присутствии возрастающих концентраций F108, выявили зависимое от дозы повышение проникновения вируса и ЧКВ
hCD34+ клетки трансдуцировали в течение 2 или 24 часов лентивирусом в присутствии сульфата протамина или возрастающих концентраций F108. Влияние F108 на проникновение лентивируса в CD34+ клетки человека анализировали, применяя анализ BlaM. Клетки трансдуцировали лентивирусным вектором, кодирующим слитый белок β-лактамаза-Vpr. После трансдукции в течение 2 часов клетки промывали и инкубировали с флуоресцентным субстратом β-лактамазы. Затем с помощью проточной цитометрии анализировали расщепление субстрата β-лактамазы в клетках, которое коррелирует с проникновением лентивируса в CD34+клетки. Анализ методом проточной цитометрии выявил, что возрастающие концентрации F108 во время трансдукции повышали проникновение LVV в hCD34+ клетки, наблюдаемое как повышение процента клеток с расщепленным субстратом BlaM. Эффект повышенного проникновения лентивируса, похоже, достигал плато в диапазоне концентраций F108 62,5 - 200 мкг/мл. Фигура 2А. CD34+ клетки трансдуцировали LVV, кодирующим β-глобин. Через 24 часа указанные клетки промывали и высевали в MethoCult для культивирования в течение 14 дней. Через 14 дней анализировали ЧКВ в объединенных колониях. Возрастающие концентрации F108 во время трансдукции повышали ЧКВ по сравнению с контрольной обработкой клеток. Фигура 2В.
Пример 4
Не выявили пониженную жизнеспособность CD34+ клеток, трансдуцированных в присутствии F108
hCD34+ клетки трансдуцировали вектором, F108 и PGE2 в течение 24 часов после 14 дней в культуре в MethoCult. Колонии в MethoCult подсчитывали, применяя STEMvision (Stemcell Technologies). Трансдукция в присутствии F108 отдельно, PGE2 отдельно и F108 и PGE2 в комбинации не влияла на способность трансдуцированных CD34+ клеток образовывать колонии, что свидетельствует об отсутствии значительного их влияния на жизнеспособность клеток или их способность к дифференцировке. Фигура 3.
Пример 5
Трансдукция в присутствии блок-сополимеров
hCD34+ клетки трансдуцировали LVV в течение 2 или 24 часов в присутствии сульфата протамина или возрастающих концентраций плюроника F68. После 2 часов трансдукции клетки промывали и обрабатывали для анализа проникновения BlaM. Проточный анализ показал, что добавление F68 к hCD34+ клеткам во время трансдукции негативно влияет на проникновение LVV. Фигура 4А.
После трансдукции в течение 24 часов клетки промывали и культивировали в течение 14 дней в MethoCult. Объединенные колонии собирали и анализировали в них ЧКВ. Присутствие F68 во время трансдукции не влияло на ЧКВ hCD34+ клеток. Следовательно, способность F108 повышать проникновение вируса и ЧКВ не является свойством всех блок-сополимеров полоксамера. Фигура 4В.
Пример 6
F108 и PGE2 повышают ЧКВ и эффективность трансдукции
нCD34+ клеток, трансдуцированных LVV
hCD34+ клетки трансдуцировали в течение 24 часов LVV в присутствии сульфата протамина, PGE2, F108 или комбинации F108 и PGE2. После трансдукции клетки промывали и культивировали в MethoCult в течение 14 дней или в содержащих цитокины средах в течение 7 дней.
После культивирования в течение 14 дней в MethoCult объединенные колонии собирали и анализировали в них ЧКВ. Усредненные данные ЧКВ показаны в виде кратности повышения ЧКВ по сравнению со стандартной процедурой трансдукции с применением сульфата протамина в средах для трансдукции. Фигура 5А. Добавление PGE2 в реакцию трансдукции приводит к повышению ЧКВ в 2 раза. Добавление F108 превосходит добавление PGE2, и комбинация F108 и PGE2 приводит к неожиданному повышению ЧКВ. Кроме того, комбинация F108 и PGE2 эффективна, когда концентрация F108 составляет либо 62,5 мкг/мл, либо 1000 мкг/мл.
После 7 дней в жидкой культуре клетки собирали и сортировали на отдельные клетки в 96-луночный планшет. Клетки лизировали и подвергали гнездовой ПЦР, чтобы определить присутствие LVV в отдельной клетке. Процент клеток, содержащих как LVV, так и эндогенный контрольный ген, определяли по количеству клеток, содержащих эндогенный контрольный ген. Эффективность трансдукции LVV повышалась в hCD34+ клетках, трансдуцированных в присутствии F108 и PGE2, по сравнению с клетками, трансдуцированными F108 отдельно, или клетками с контрольной обработкой. Фигура 5В.
Пример 7
Анализ отдельных колоний HCD34+ клеток, трансдуцированных в присутствии F108 и PGE2, показал повышенные эффективность трансдукции и ЧКВ
hCD34+ клетки трансдуцировали в течение 24 часов LVV в присутствии PGE2, F108 или комбинации PGE2 и F108. Трансдуцированные клетки затем культивировали в MethoCult в течение 14 дней. После культивирования отдельные колонии снимали и анализировали в них ЧКВ. Комбинация PGE2 и F108 приводила к повышению среднего ЧКВ, а также к существенному уменьшению количества колоний с ЧКВ=0. Фигуры 6А и 6В. Полученные результаты дополнительно подтверждают, что эффективность трансдукции hCD34+ клеток повышалась при комбинированной обработке во время трансдукции.
Пример 8
В нСD34+ клетках, трансдуцированных в присутствии возрастающих концентраций PGE2 в комбинации с фиксированными концентрациями F108, не повышалось ЧКВ
hCD34+ клетки трансдуцировали в течение 24 часов LVV в присутствии либо сульфата протамина, либо F108 и возрастающих концентраций PGE2. Через 24 часа клетки промывали, высевали в MethoCult и культивировали в течение 14 дней. Объединенные колонии затем собирали и анализировали в них ЧКВ. В присутствии сульфата протамина возрастающие концентрации PGE2 привели к зависимому от дозы повышению ЧКВ. Тем не менее, в присутствии F108 повышение концентрации PGE2 по меньшей мере в 10 раз не приводило к зависимому от дозы повышению ЧКВ. Фигура 7.
Пример 9
Для нСD34+CD38LoCD90+CD45RA клеток, трансдуцированных в присутствии F108 и PGE2, показали повышенную эффективность трансдукции
Препараты общей массы клеток трансдуцировали в присутствии вектора или вектора, F108 и PGE2 в течение 24 часов. После трансдукции клетки окрашивали антителами к маркерам на поверхности клетки (CD34+CD38LoCD90+CD45RA клетки). Окрашенные клетки затем сортировали, применяя сортировщик клеток Sony. Из каждого образца общей массы клеток приблизительно 20000 клеток сортировали, используя дискриминационные окна прямого рассеяния и бокового рассеяния. Кроме того, из каждого образца сортировали 10000-16000 клеток, которые представляли собой CD34+CD38LoCD90+CD45RA клетки (фенотипические ГСК). Сортированные клетки затем культивировали в содержащих цитокины средах в течение дополнительных 4 дней, чтобы исключить псевдотрансдукцию из анализа. После культивирования клетки затем сортировали на отдельные клетки в 96-луночные планшеты и анализировали с помощью анализа ПНР отдельных клеток, чтобы оценить эффективность трансдукции. Эффективность трансдукции общей массы клеток и CD34+CD38LoCD90+CD45RA клеток, трансдуцированных с помощью стандартной процедуры трансдукции (n=2), была эквивалентной. Эффективность трансдукции общей массы клеток и CD34+CD38LoCD90+CD45RA клеток, трансдуцированных F108 и PGE2 (n=2), также была эквивалентной. Кроме того, эффективность трансдукции как общей массы клеток, так и CD34+CD38LoCD90+CD45RA клеток, трансдуцированных в присутствии F108 и PGE2 была приблизительно в 3-4 раза выше, чем эффективность трансдукции данных образцов клеток при стандартных условиях трансдукции. Фигура 8.
Пример 10
Для нСD34+ клеток, трансдуцированных в присутствии F108 и PGE2, выявили повышенную эффективность трансдукции лентивирусом, полученным из суспензионных культур
Примеры 2-9 осуществляли, применяя лентивирус, полученный из адгерентных культур клеток. В данном примере лентивирус получали из суспензионных культур. Хотя схема очистки лентивируса отличается для лентивируса, полученного из адгерентных культур, по сравнению с таковым, полученным из суспензионных культур, различия в продукции и очистке не влияли на способность комбинации F108 и PGE2 повышать ЧКВ в клетках в день 14 культивирования в MethoCult. Наблюдали приблизительно двухкратное повышение ЧКВ для F108 отдельно, и комбинация F108 и PGE2 приводила приблизительно к 5-кратному повышению относительно стандартных способов трансдукции. Фигура 9.
Пример 11
F108 и PGE2 повышают трансдукцию HCD34+ клеток in vivo
Партию клеток hCD34+ с низким уровнем трансдукции (ЧКВ составляет 0,3 при стандартных условиях) трансдуцировали лентивирусным вектором в присутствии сульфата протамина, PGE2, F108 (200 мкг/мл или 1000 мкг/мл) или комбинации PGE2 и F108 в течение 24 часов. После трансдукции, клетки промывали и незамедлительно вводили путем инъекции мышам NSG, которым вводили бусульфан.
Аликвоту клеток из трансплантата оставляли для анализа ЧКВ и эффективности трансдукции. В обработанных PGE2 и F108 hCD34+ клетках среднее ЧКВ повышалось приблизительно в 3 раза по сравнению с контрольными клетками, обработанными сульфатом протамина. Фигура 10А. ЧКВ дополнительно повышалось, когда PGE2 и F108 использовали в комбинации. Фигура 10А. Анализ отдельных колоний методом количественной ПЦР использовали для измерения эффективности трансдукции hCD34+ клеток, обработанных различными агентами. Эффективности трансдукции hCD34+ клеток повышались от ~20% (контроль, сульфат протамина) до ~40% (обработанные PGE2 или F108 клетки) или до ~65 - 80% (обработанные PGE2 и F108 клетки). Фигура 10В.
4ерез два месяца после трансплантации по 5 мышей/группу умерщвляли, собирали КМ и анализировали для оценки ЧКВ in vivo. ЧКВ in vivo в приживленных клетках, трансдуцированных в присутствии сульфата протамина, было очень сходно с ЧКВ трансплантата (~0,3). ЧКВ in vivo повышалось приблизительно в 2 раза в обработанных PGE2 клетках. В клетках, обработанных F108 либо отдельно, либо в комбинации с PGE2, выявили сопоставимое повышение ЧКВ in vivo приблизительно в 1,2 раза и 4-кратное улучшение по сравнению со стандартными условиями трансдукции (сульфат протамина). Фигура 10С. Относительные повышения ЧКВ in vivo были сопоставимы с относительными эффективностями трансдукции трансплантатов.
Через четыре месяца после трансплантации по 5 мышей/группу умерщвляли, собирали КМ и анализировали для оценки ЧКВ in vivo. ЧКВ in vivo в приживленных клетках, трансдуцированных в присутствии сульфата протамина, было очень сходно с ЧКВ трансплантата (~0,3). ЧКВ in vivo повышалось приблизительно в 1,6 раз в обработанных PGE2 клетках. В клетках, обработанных F108 либо отдельно, либо в комбинации с PGE2, выявили сопоставимое повышение ЧКВ in vivo приблизительно в 1,0-1,2 раза и от приблизительно 2,6-кратного до приблизительно 3-кратного улучшения по сравнению со стандартными условиями трансдукции (сульфат протамина). Фигура 10D.
Относительные повышения ЧКВ in vivo, измеренного через четыре месяца после трансплантации, были сопоставимы с относительными эффективностями трансдукции трансплантатов.
Пример 12
Приживление и способность к дифференцировке нСD34+ клеток, обработанных в присутствии F108 и PGE2
4ерез два месяца и 4 месяца после трансплантации собирали КМ из подвергнутых трансплантации мышей, как обсуждалось в примере 11. Анализировали приживление hCD34+ клеток в КМ. Клетки окрашивали коктейлем антител, распознающих различные маркеры на поверхности клетки (CD45, CD33, CD3, CD19), и анализировали с помощью проточной цитометрии. Для всех групп продемонстрировали высокий уровень (~80%) приживления hCD34+, и не наблюдали статистически значимого влияния F108 или PGE2. Фигура 11 А - Е. Кроме того, не наблюдали значительного различия в пропорции миелоидных (CD33+) или лимфоидных (CD3+ или CD19+) клеток независимо от обработки (F108, PGE2 или их комбинация). Полученные результаты свидетельствуют о том, что повышающие ЧКВ агенты, например, F108, PGE2, не влияют на способность трансдуцированных клеток hCD34+ приживаться, а также не смещают потенциал приживленных клеток к дифференцировке.
Пример 13
F108 и стауроспорин повышают ЧКВ в HCD34+ клетках, трансдуцированных LVV
hCD34+ клетки трансдуцировали в течение 24 часов LVV в присутствии сульфата протамина (стандарта), стауроспорина, F108 или комбинации F108 и стауроспорина. После трансдукции клетки промывали и культивировали в MethoCult в течение 14 дней.
После культивирования в течение 14 дней в MethoCult объединенные колонии собирали и анализировали в них ЧКВ. Результаты ЧКВ показаны в виде кратности повышения ЧКВ по сравнению со стандартной процедурой трансдукции с применением сульфата протамина в средах для трансдукции. Добавление F108 в смесь для трансдукции приводит к 2-кратному повышению ЧКВ; добавление стауроспорина превосходит добавление F108, и комбинация F108 и стауроспорина приводит к неожиданному повышению ЧКВ по сравнению с обработкой F108 или стауроспорином отдельно. Фигура 12.
Пример 14
нCD34+ клетки, трансдуцированные в присутствии F127 отдельно или в комбинации с PGE2, содержат повышенное ЧКВ
hCD34+ клетки трансдуцировали в течение 24 часов LVV в присутствии либо сульфата протамина, либо одного из двух полоксамеров: F108 или F127, - с добавлением или без PGE2. Молекулярная масса F127 больше, чем молекулярная масса F108.
Через 24 часа клетки промывали и высевали в MethoCult для культивирования в течение 14 дней. Объединенные колонии затем собирали и анализировали в них ЧКВ. F108 повышал ЧКВ ~ в 2 раза по сравнению с сульфатом протамина и дополнительно повышал ЧКВ в присутствии PGE2. Другой полоксамер - F127 - повышал ЧКВ ~ в 2 раза при двух исследованных концентрациях 100 мкг/мл и 1000 мкг/мл по сравнению с сульфатом протамина. Кроме того, F127, комбинированный с PGE2, повышал ЧКВ аналогично комбинации F108 и PGE2. Фигура 13. Напротив, F68 (см. пример 5), молекулярная масса которого составляет приблизительно половину от таковой у F108, не повышал ЧКВ или эффективность трансдукции hCD34+ клеток.
Пример 15
нCD34+ клетки, трансдуцированные в присутствии Р105 отдельно или в комбинации с PGE2, содержат повышенное ЧКВ
hCD34+ клетки трансдуцировали в течение 24 часов LVV в присутствии либо сульфата протамина, либо одного из двух полоксамеров: F105 или F108, и F105 с PGE2. Молекулярная масса F127 больше, чем молекулярная масса F108.
4ерез 24 часа клетки промывали и высевали в MethoCult для культивирования в течение 14 дней. Объединенные колонии затем собирали и анализировали в них ЧКВ. Р105 повышал ЧКВ ~ в 3 раза при обеих тестируемых концентрациях по сравнению с сульфатом протамина (стандартом) и дополнительно повышал ЧКВ в присутствии PGE2. Фигура 14. Напротив, F68 (см. пример 5) не повышал ЧКВ или эффективность трансдукции hCD34+ клеток.
Пример 16
Полоксамеры, которые повышают ЧКВ в нСD34+ клетках
hCD34+ клетки выделяли путем обогащения из мобилизованной периферической крови и трансдуцировали в течение 24 часов LVV в присутствии либо сульфата протамина, либо Р105, F127, F108 или F98 с добавлением и без добавления PGE2. Клетки затем культивировали в SCGM для отслеживания роста клеток и высевали в MethoCult для образования колоний и анализа ЧКВ. Р105, F127, F108 и F98 не влияют на способность клеток расти. Замена сульфата протамина на P105, F127, F108 или F98 повышала ЧКВ, которое дополнительно повышалось при добавлении PGE2. Фигура 15.
Пример 17
Полоксамеры, которые повышают ЧКВ и снижают выживаемость нСD34+ клеток
hCD34+ клетки выделяли путем обогащения из мобилизованной периферической крови и трансдуцировали в течение 24 часов LVV в присутствии либо сульфата протамина, либо Р123, Р104, L101 или F108 с добавлением и без добавления PGE2. Клетки затем культивировали в SCGM для отслеживания роста клеток и высевали в MethoCult для образования колоний и анализа ЧКВ. Замена сульфата протамина на Р123, Р104 или L101 повышала ЧКВ, но также снижала рост клеток. PGE2 дополнительно повышал ЧКВ в комбинации с Р123. ЧКВ рассчитывали в культурах SCGM в день 7 для Р123 и L101 из-за недостаточного образования колоний в образцах MethoCult. Фигура 16.
Пример 18
Полоксамеры, которые не повышают ЧКВ или не влияют на выживаемость нСD34+ клеток
hCD34+ клетки выделяли путем обогащения из мобилизованной периферической крови и трансдуцировали в течение 24 часов LVV в присутствии либо сульфата протамина, либо F87, F88, F68 или F108 с добавлением и без добавления PGE2. Клетки затем культивировали в SCGM для отслеживания роста клеток и высевали в MethoCult для образования колоний и анализа ЧКВ. F87, F88 и F68 не влияли на рост клеток или повышение ЧКВ. Фигура 17.
Пример 19
F108 и PGE2 повышают ЧКВ в β0/β0 нСD34+ клетках
hCD34+ клетки выделяли путем обогащения из мобилизованной периферической крови пациента с генотипом β0/β0 и трансдуцировали в течение 24 часов клиническим LVV ВВ305, кодирующим βA-T87Q человека при МИ, составляющей 20, в присутствии 200 мкг/мл F108 и 10 мкМ динопростона (PGE2). Аликвоты трансдуцированных hCD34+ клеток культивировали ex vivo в дополненной цитокинами SCGM в течение 7 дней, чтобы очистить от невстроившихся последовательностей LVV, для определения %LVV + клеток или культивировали клетки в MethoCult в течение 14 дней для образования колоний и анализа ЧКВ.
%LVV+: Отдельные клетки выделяли с помощью FACS и помещали в 96-луночные планшеты, содержащие лизирующий буфер. После лизиса специфическую для вируса последовательность из лентивирусного вектора, кодирующего вариант β-глобина, амплифицировали с помощью ПЦР наряду с контрольной геномной последовательностью, не присутствующей в векторе. Затем анализировали с помощью количественной ПЦР присутствие геномной последовательности в продуктах ПЦР из каждой отдельной клетки, что свидетельствовало об успешном захвате клетки. Для каждой захваченной клетки использовали количественную ПЦР, чтобы определить, присутствует ли также последовательность вируса, что свидетельствовало о том, что клетка была трансдуцирована лентивирусным вектором. Затем рассчитывали фракцию положительных по вектору клеток по всему набору выбранных клеток. %LVV + клеток из β0/β0 hCD34+ клеток составлял приблизительно 77%. Фигура 18, правая панель.
ЧКВ: В день 14 колонии снимали и подвергали анализу отдельных клеток методом гнездовой ПЦР, чтобы определить ЧКВ. ЧКВ в hCD34+ клетках составляло приблизительно 2,9 копий на диплоидный геном. Фигура 18, левая панель.
Пример 20
F108 и PGE2 повышают энуклеацию
Эритроидных дифференцированных β0/β0 нСD34+ клеток
hCD34+клетки выделяли путем обогащения из мобилизованной периферической крови и трансдуцировали в течение 24 часов LVV при МИ, составляющей 20, в присутствии либо сульфата протамина, либо F108 с PGE2. Трансдуцированные hCD34+ клетки высевали для культивирования в условиях размножения эритроидных клеток в течение 7 дней, а затем в условиях дифференцировки эритроидных клеток в течение 10 дней. Дифференцированные клетки затем собирали путем центрифугирования, окрашивали красителем ДНК DRAQ5 и анализировали с помощью FACS, чтобы подсчитать фракцию ДНК-отрицательных безъядерных клеток. Комбинация F108 с PGE2 восстанавливала количество безъядерных эритроидных клеток из β0/β0 доноров до почти нормального количества безъядерных эритроидных клеток у здоровых доноров. Фигура 19.
Пример 21
F108 и PGE2 повышают %НвА в
Дифференцированных по эритроидной линии β0/β0 нСD34+ клетках
hCD34+ клетки выделяли путем обогащения из мобилизованной периферической крови и трансдуцировали в течение 24 часов LVV при МИ, составляющей 20, в присутствии либо сульфата протамина, либо F108 с PGE2. Трансдуцированные hCD34+ клетки высевали для культивирования в условиях размножения эритроидных клеток в течение 7 дней, а затем в условиях дифференцировки эритроидных клеток в течение 10 дней. Дифференцированные клетки затем собирали путем центрифугирования, окрашивали красителем ДНК DRAQ5 и анализировали с помощью FACS, чтобы подсчитать фракцию ДНК-отрицательных безъядерных клеток. Дифференцированные клетки также лизировали в буфере ACK и анализировали лизаты с помощью ионнообменной высокоэффективной жидкостной хроматографии (ВЭЖХ), чтобы подсчитать фракцию белка гемоглобина А (HbA). Комбинация F108 с PGE2 восстанавливала уровень HbA из β0/β0 доноров до почти нормального уровня HbA у здоровых доноров. Фигура 20.
Пример 22
F108 и PGE2 повышают ЧКВ в нСD34+ клетках пациента с SCD
hCD34+ клетки собирали из костного мозга пациента с SCD. Указанные клетки трансдуцировали в течение 24 часов клиническим LVV ВВ305, кодирующим βА-T87Q человека, при МИ, составляющей 30, в присутствии 200 мкг/мл F108 и 10 мкМ динопростона (PGE2). Аликвоты трансдуцированных hCD34+ клеток культивировали ex vivo в дополненной цитокинами SCGM в течение 7 дней, чтобы очистить от невстроившихся последовательностей LVV, для определения %LVV + клеток или культивировали клетки в MethoCult в течение 14 дней для образования колоний и анализа ЧКВ.
%LVV+: Отдельные клетки выделяли с помощью FACS и помещали в 96-луночные планшеты, содержащие лизирующий буфер. После лизиса специфическую для вируса последовательность из лентивирусного вектора, кодирующего вариант β-глобина, амплифицировали с помощью ПЦР наряду с контрольной геномной последовательностью, не присутствующей в векторе. Затем анализировали с помощью количественной ПЦР присутствие геномной последовательности в продуктах ПЦР из каждой отдельной клетки, что свидетельствовало об успешном захвате клетки. Для каждой захваченной клетки использовали количественную ПЦР, чтобы определить, присутствует ли также последовательность вируса, что свидетельствовало о том, что клетка была трансдуцирована лентивирусным вектором. Затем рассчитывали фракцию положительных по вектору клеток по всему набору выбранных клеток. %LVV + клеток из hCD34+ клеток SCD составлял приблизительно 83%.
ЧКВ: В день 14 колонии снимали и подвергали анализу отдельных клеток методом гнездовой ПЦР, чтобы определить ЧКВ. ЧКВ в hCD34+ клетках составляло приблизительно 3,3 копии на диплоидный геном.
Пример 23
F108 значительно не изменяет дифференцировку колонии
CD34+ клетки человека трансдуцировали 8 мкг/мл сульфата протамина (СП), 10 мкг/мл F108 (F108Lo), 1000 мкг/мл F108 (F108Hi) или 1000 мкг/мл F108 в комбинации с 8 мкг/мл сульфата протамина (F108Hi/СП). Колонии подсчитывали и определяли, относятся ли они к эритроидной или миелоидной линии дифференцировки. Ни СП, ни F108 значительно не влияли на способность гематопоэтических предшественников образовывать колонии. Фигура 21.
Пример 24
F108 и PGE2 повышают эффективность трансдукции лентивирусом фенотипических ГСК
CD34+ клетки человека трансдуцировали лентивирусным вектором с GFP (LVV), а затем культивировали в содержащей цитокины среде. После 4 дней культивирования данные клетки окрашивали для выявления присутствия маркеров на поверхности клеток, которые фенотипически описывают долговременные ГСК (CD34+CD38-CD45RA-CD90+CD49f+). Анализ методом проточной цитометрии трансдуцированных клеток показал, что доля клеток, экспрессирующих GFP, при трансдукции в стандартных условиях с применением сульфата протамина составляла приблизительно 30% и повышалась до 45% при добавлении PGE2. Доля трансдуцированных фенотипических долговременных ГСК повышалась до >90% в клетках, трансдуцированных в присутствии F108, с добавлением или без PGE2. Фигура 22.
Пример 25
F108 и PGE2 повышают ЧКВ во всех партиях ГСК с различной способностью к трансдукции
Партии CD34+ клеток человека классифицировали как клетки с низкой, средней или высокой способностями к трансдукции путем трансдукции лентивирусом в присутствии сульфата протамина (СП). В партиях клеток с низкой способностью к трансдукции ЧКВ составляло ≤0,5 копий/диплоидный геном (к/дг); в партиях клеток со средней способностью к трансдукции ЧКВ составляло от 0,5 к/дг до 1,0 к/дг; и в партиях клеток с высокой способностью к трансдукции ЧКВ составляло ≥1 к/дг.
Три партии клеток (629, 702 и 010), представляющие клетки с низкой, средней и высокой способностью к трансдукции, соответственно, трансдуцировали вектором LentiGlobin ВВ305 при МИ, составляющей 25 или 50. Клетки трансдуцировали, применяя стандартные условия трансдукции (СП), или с добавлением F108 и PGE2. Повышенное ЧКВ коррелировало с повышенной способностью к трансдукции партии клеток, когда клетки трансдуцировали в присутствии СП, но не когда клетки трансдуцировали в присутствии F108 и PGE2. Полученные результаты показывают, что для партий клеток с более низкой способностью к трансдукции выявили большее повышение ЧКВ, чем в партиях клеток с более высокой способностью к трансдукции, в присутствии F108 и PGE2, позволяя предположить, что эффект повышения ЧКВ достигал плато и приводил практически к нормировке ЧКВ в лекарственном продукте. Фигура 23.
Пример 26
F108 и PGE2 повышают эффективность трансдукции и ЧКВ в нСD34+клетках, трансдуцированных лентивирусным вектором X-SCID
CD34+ клетки человека трансдуцировали лентивирусным вектором (LVV), содержащим промотор EF1α, функционально связанный с полинуклеотидом, кодирующим IL2Rγ. LVV получали путем временной трансфекции (временная) или получали в линиях клеток-продуцентов (PrCL1 и PrCL2). Клетки предварительно стимулировали в содержащих цитокины средах в течение 48 часов и трансдуцировали в течение 24 часов при МИ, составляющей либо 10, либо 30, применяя либо стандартные условия трансдукции с 8 мкг/мл сульфата протамина (СП), либо 200 мкг/мл F108 и 10 мкМ PGE2. После трансдукции клетки высевали в метилцеллюлозу и культивировали в течение приблизительно 14 дней, чтобы позволить гематопоэтическим предшественникам образовать колонии. Получали изображения колоний для подсчета, а затем либо объединяли их для анализа ЧКВ, либо отдельные колонии собирали для проведения количественной ПЦР отдельных колоний, чтобы определить среднее ЧКВ и процент трансдуцированных колоний (%LVV+).
Трансдукция в сульфате протамина приводила к ЧКВ ниже 1,5; ЧКВ повышалось при повышении МИ для полученного путем временной трансфекции LVV или LVV, продуцированного в PrCL1, но не когда LVV продуцировали в PrCL2 (фигура 24, верхняя левая панель). Трансдукция в сульфате протамина позволяла получить приблизительно 50-60% LVV+ колоний для полученного путем временной трансфекции LVV и приблизительно 20-30% LVV+ колоний, когда использовали LVV, продуцированный в PrCL1 или PrCL2 (фигура 24, верхняя средняя панель). Сульфат протамина значительно не влиял на образование колоний (фигура 24, верхняя правая панель). Трансдукция в присутствии F108 и PGE2 повышала ЧКВ более чем в 2 раза при МИ, составляющей 10, для полученного путем временной трансфекции LVV и более чем в 4 раза при МИ, составляющей 30, для полученного путем временной трансфекции LVV и LVV, продуцированного в PrCL1 или PrCL2 (фигура 24, нижняя левая панель). Кроме того, трансдукция при МИ, составляющей 30, в присутствии F108 и PGE2 позволяла получить более 95% LVV+ колоний для полученного путем временной трансфекции LVV и LW, продуцированного в PrCL1 (фигура 24, нижняя средняя панель). F108 и PGE2 значительно не влияли на образование колоний (фигура 24, нижняя правая панель).
Пример 27
F108 и PGE2 повышают эффективность трансдукции и ЧКВ в ГСК, трансдуцированных лентивирусным вектором с трипептидилпептидазой (ТРР1)
CD34+ клетки человека трансдуцировали лентивирусным вектором (LVV), содержащим промотор EF1α или промотор MND, функционально связанный с полинуклеотидом, кодирующим ТРР1. Клетки предварительно стимулировали в содержащих цитокины средах в течение 48 часов и трансдуцировали в течение 24 часов при МИ, составляющей либо 5, либо 15, применяя либо стандартные условия трансдукции с 8 мкг/мл сульфата протамина (СП), либо 200 мкг/мл F108 и 10 мкМ PGE2. После трансдукции клетки высевали в метилцеллюлозу и культивировали в течение приблизительно 14 дней, чтобы позволить гематопоэтическим предшественникам образовать колонии. Колонии объединяли для анализа ЧКВ.
Трансдукция в сульфате протамина позволяла получить ЧКВ ниже 1,5, и ЧКВ повышалось при повышении МИ. Существенные повышения ЧКВ наблюдали в клетках, трансдуцированных в присутствии F108 и PGE2 при любой МИ (фигура 25, верхняя левая панель). После культивирования трансдуцированных клеток в цитокинах в течение 7 дней в осадках клеток и супернатантах анализировали активность ТРР-1. Активность ТРР-1 была выше в клетках с более высокими ЧКВ, т.е., в клетках, трансдуцированных в присутствии F108 и PGE2 (фигура 25, верхняя средняя и верхняя правая панели).
Костный мозг мыши, лишенный клеток линий дифференцировки, трансдуцировали MND-TPP1 LVV при МИ, равных 5, 15 или 30, в присутствии СП или F108 и PGE2. ЧКВ повышалось в культивированных с цитокинами клетках в день 7 при всех МИ, равных 5, 15 и 30 (фигура 25, нижняя левая панель). Отдельные колонии собирали и анализировали в них с помощью количественной ПЦР ЧКВ из гематопоэтических предшественников мыши; F108 и PGE2 повышали ЧКВ в данных клетках (фигура 25, нижняя средняя панель). F108 и PGE2 также существенно повышали эффективность трансдукции (фигура 25, нижняя правая панель).
Пример 28
F108 и PGE2 повышение эффективности трансдукции и ЧКВ в нСD34+клетках, трансдуцированных лентивирусным вектором, содержащим представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1)
CD34+ клетки человека из пациентов с AMN (фигура 26, панели А-D), пациентов с ALD (фигура 26, панели Е - Н) и здоровых доноров (ЗД; Фигура 26, панели I-L) трансдуцировали лентивирусным вектором (LVV), не содержащим WPRE и содержащим промотор MND, функционально связанный с полинуклеотидом, кодирующим ABCD1. Клетки предварительно стимулировали в содержащих цитокины средах в течение 48 часов и трансдуцировали в течение 24 часов, применяя либо стандартные условия трансдукции с добавлением 8 мкг/мл сульфата протамина (СП), либо 200 мкг/мл F108, 10 мкМ PGE2 или F108 и PGE2. После трансдукции клетки высевали в метилцеллюлозу и культивировали в течение приблизительно 14 дней, чтобы позволить гематопоэтическим предшественникам образовать колонии, или культивировали в содержащих цитокины средах в течение 7 дней. Культивированные клетки окрашивали для выявления внутриклеточной экспрессии ALDP в день 4 или 5 и анализировали с помощью проточной цитометрии. F108, PGE2 и F108 и PGE2 повышали количество клеток, экспрессирующих ALDP, которое также повышалось при повышении МИ (фигура 26, панели А, Е, I). F108, PGE2 и F108 и PGE2 повышали ЧКВ в Д7 в культивированных с цитокинами клетках (фигура 26, панели В, F, J) и в объединенных в Д14 колониях в метилцеллюлозе (фигура 26, панели С, G, K). Более высокие ЧКВ, полученные при применении MND-ABCD1 LVV, коррелировали с пониженным количеством колоний (фигура 26, панели D, Н, L). На панелях Н и L фигуры 26 показано, что F108 отдельно повышал ЧКВ, оказывая меньшее влияние на количество колоний, особенно при более низких МИ. Таким образом, в некоторых случаях, например, когда высокие ЧКВ конкретных LVV ассоциированы с пониженным количеством колоний, можно применять полоксамеры отдельно для повышения ЧКВ при низких МИ, не оказывая влияния на образование колоний, тем самым повышая экспрессию белка с преимуществом применения меньшего количества LVV.
Пример 29
Планирование конкретных ЧКВ для F108 и PGE2
CD34+ клетки человека трансдуцировали LVV при МИ, составляющей 25, в присутствии сульфата протамина или при МИ, составляющей 10, в присутствии F108 и PGE2 с целью получения сходных ЧКВ в конечном продукте. Не наблюдали значительного различия в ЧКВ между условиями обработки, когда ЧКВ анализировали в день 7 в культивированных с цитокинами клетках или в день 14 в культивированных в метилцеллюлозе клетках (фигура 27, левая панель). Также не наблюдали значительного различия в образовании колоний между условиями обработки (фигура 27, средняя панель).
Количественную ПЦР отдельных колоний использовали для оценки каких-либо различий в составе. Средние ЧКВ указанных продуктов были сходны. Клетки, трансдуцированные при МИ, составляющей 10, с добавлением F108 и PGE2, содержали более высокий %LVV+ по сравнению с клетками, трансдуцированными при МИ, составляющей 25, с добавлением сульфата протамина, и распределение ЧКВ в отдельных колониях составляло 0-4 для клеток, трансдуцированных при МИ, составляющей 10, с добавлением F108 и PGE2, и 0-6 в клетках, трансдуцированный при МИ, составляющей 25, с добавлением сульфата протамина (фигура 27, правая панель). Таким образом, F108 и PGE2 можно использовать для уменьшения себестоимости, при этом получая лекарственный продукт с пониженной степенью риска и другими желательными свойствами.
Пример 30
Анализ in vivo обработанных F127 CD34+ клеток человека
В качестве исходного материала для трансдукции, нормальные CD34+ клетки человека выделяли путем лейкафереза из одного здорового добровольного донора после мобилизации колониестимулирующим фактором гранулоцитов (G CSF). Клетки разделяли на различные аликвоты и подвергали крупномасштабной трансдукции LentiGlobin ВВ305 LVV при значении множественности инфекции (МИ) от приблизительно 25 до приблизительно 50, применяя 8 мкг/мл сульфата протамина или 200 мкг/мл F127 и 10 мкМ PGE2. ГСК криоконсервировали после трансдукции и впоследствии вводили мышам NSG после размораживания, что приводило к одному циклу замораживания/размораживания после трансдукции.
После трансдукции контрольные и тестируемые лекарственные продукты подвергали тщательной оценке. Культуры CFC анализировали, чтобы определить сводные значения ЧКВ, значения ЧКВ в отдельных колониях и %LVV+ колоний. Эритроидные культуры анализировали, чтобы определить % продуцированного βАT87Q-глобина. Трансдукция F127 повышала сводные ЧКВ, ЧКВ в отдельных колониях и %LVV+ колоний по сравнению с клетками, трансдуцированными сульфатом протамина. Костный мозг характеризовали через 2 и 4 месяца, чтобы оценить ЧКВ и %LVV+ в кратковременных и долговременных репопулирующих ГСК.
Пример 31
Анализ in vivo обработанных P105 CD34+ клеток человека
В качестве исходного материала для трансдукции, нормальные CD34+ клетки человека выделяли путем лейкафереза из одного здорового добровольного донора после мобилизации колониестимулирующим фактором гранулоцитов (G CSF). Клетки разделяли на различные аликвоты и подвергали крупномасштабной трансдукции LentiGlobin ВВ305 LVV при значении множественности инфекции (МИ) от приблизительно 25 до приблизительно 50, применяя 8 мкг/мл сульфата протамина или 200 мкг/мл Р105 и 10 мкМ PGE2. ГСК криоконсервировали после трансдукции и впоследствии вводили мышам NSG после размораживания, что приводило к одному циклу замораживания/размораживания после трансдукции.
После трансдукции контрольные и тестируемые лекарственные продукты подвергали тщательной оценке. Культуры CFC анализировали, чтобы определить сводные значения ЧКВ, значения ЧКВ в отдельных колониях и %LVV+ колоний. Эритроидные культуры анализировали, чтобы определить % продуцированного βА T87Q-глобина. Трансдукция Р105 повышала сводные ЧКВ, ЧКВ в отдельных колониях и %LVV+ колоний по сравнению с клетками, трансдуцированными сульфатом протамина. Костный мозг характеризовали через 2 и 4 месяца, чтобы оценить ЧКВ и %LVV+ в кратковременных и долговременных репопулирующих ГСК.
Пример 32
Анализ in vivo обработанных F98 CD34+ клеток человека
В качестве исходного материала для трансдукции, нормальные CD34+ клетки человека выделяли путем лейкафереза из одного здорового добровольного донора после мобилизации колониестимулирующим фактором гранулоцитов (G CSF). Клетки разделяли на различные аликвоты и подвергали крупномасштабной трансдукции LentiGlobin ВВ305 LVV при значении множественности инфекции (МИ) от приблизительно 25 до приблизительно 50, применяя 8 мкг/мл сульфата протамина или 200 мкг/мл F98 и 10 мкМ PGE2. ГСК криоконсервировали после трансдукции и впоследствии вводили мышам NSG после размораживания, что приводило к одному циклу замораживания/размораживания после трансдукции.
После трансдукции контрольные и тестируемые лекарственные продукты подвергали тщательной оценке. Культуры CFC анализировали, чтобы определить сводные значения ЧКВ, значения ЧКВ в отдельных колониях и %LVV+ колоний. Эритроидные культуры анализировали, чтобы определить % продуцированного βА T87Q-глобина. Трансдукция F98 повышала сводные ЧКВ, ЧКВ в отдельных колониях и %LVV+ колоний по сравнению с клетками, трансдуцированными сульфатом протамина. Костный мозг характеризовали через 2 и 4 месяца, чтобы оценить ЧКВ и %LVV+ в кратковременных и долговременных репопулирующих ГСК.
Как правило, термины, используемые в следующей формуле изобретения, не должны истолковываться как ограничивающие формулу изобретения конкретными вариантами реализации, изложенными в настоящем описании и формуле изобретения, но должны истолковываться как включающие все возможные варианты реализации наряду с полным объемом эквивалентов, на которые такие пункты формулы изобретения дают права. Соответственно, формула изобретения не ограничена настоящим описанием.
Настоящее изобретение дополнительно проиллюстрировано следующими вариантами осуществления.
1. Популяция гематопоэтических клеток, содержащая гематопоэтические стволовые клетки и клетки-предшественники (ГСПК), трансдуцированные ретровирусным вектором, в которой по меньшей мере 50% ГСПК трансдуцированы и в которой среднее число копий вектора (ЧКВ) ГСПК составляет приблизительно от 0,5 до 5.
2. Популяция по п. 1, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ) от приблизительно 10 до приблизительно 30.
3. Популяция по п. 1, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ) от приблизительно 10 до приблизительно 25.
4. Популяция по п. 1, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ) от приблизительно 10 до приблизительно 20.
5. Популяция по п. 1, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
6. Популяция гематопоэтических клеток по п. 1, отличающаяся тем, что ГСПК включают CD34+ клетки или CD133+ клетки.
7. Популяция гематопоэтических клеток по п. 1 или по п. 2, отличающаяся тем, что ГСПК включают CD34+CD38LoCD90+CD45RA- клетки.
8. Популяция гематопоэтических клеток по любому из пп. 1-3, отличающаяся тем, что по меньшей мере 75% клеток были трансдуцированы.
9. Популяция гематопоэтических клеток по любому из пп. 1-4, отличающаяся тем, что по меньшей мере 90% клеток были трансдуцированы.
10. Популяция гематопоэтических клеток по любому из пп. 1-5, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 1,0.
11. Популяция гематопоэтических клеток по любому из пп. 1-6, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 1,5.
12. Популяция гематопоэтических клеток по любому из пп. 1-7, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 2,0.
13. Популяция гематопоэтических клеток по любому из пп. 1-8, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 2,5.
14. Популяция гематопоэтических клеток по любому из пп. 1-9, отличающаяся тем, что жизнеспособность указанной популяции клеток составляет по меньшей мере 75%.
15. Популяция гематопоэтических клеток по любому из пп. 1-10, отличающаяся тем, что жизнеспособность указанной популяции клеток составляет по меньшей мере 85%.
16. Популяция гематопоэтических клеток по любому из пп. 1-11, отличающаяся тем, что жизнеспособность указанной популяции клеток составляет по меньшей мере 95%.
17. Популяция гематопоэтических клеток по любому из пп. 1-12, отличающаяся тем, что уровень эндотоксина в указанной популяции гематопоэтических клеток составляет не больше, чем 5,0 ЕЭ/мл.
18. Популяция гематопоэтических клеток по любому из пп. 1-13, отличающаяся тем, что уровень эндотоксина в указанной популяции гематопоэтических клеток составляет не больше, чем 0,5 ЕЭ/мл.
19. Популяция гематопоэтических клеток по любому из пп. 1-14, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×106 клеток ГСПК.
20. Популяция гематопоэтических клеток по любому из пп. 1-15, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×107 клеток ГСПК.
21. Популяция гематопоэтических клеток по любому из пп. 1-16, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×108 клеток ГСПК.
22. Популяция гематопоэтических клеток по любому из пп. 1-16, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×109 клеток ГСПК.
23. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
24. Популяция гематопоэтических клеток по любому из пп. 1-23, отличающаяся тем, что ретровирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
25. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор кодирует аденозиндезаминазу.
26. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
27. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор кодирует рецептор интерлейкина-2 гамма.
28. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
29. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор кодирует трипептидилпептидазу 1.
30. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
31. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор кодирует альфа-L-идуронидазу.
32. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что ретровирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
33. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
34. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что лентивирусный вектор кодирует идуронат-2-сульфатазу.
35. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
36. Популяция гематопоэтических клеток по любому из пп. 1-22, отличающаяся тем, что лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 или вектор BCL11A shmir.
37. Популяция гематопоэтических клеток по любому из пп. 1-36, отличающаяся тем, что ретровирусный вектор представляет собой лентивирусный вектор.
38. Популяция гематопоэтических клеток, содержащая гематопоэтические стволовые клетки и клетки-предшественники (ГСПК), трансдуцированные ретровирусом, при этом указанная популяция гематопоэтических клеток содержит по меньшей мере 85% ГСПК, при этом по меньшей мере 50% ГСПК трансдуцированы, при этом среднее число копий вектора (ЧКВ) в ГСПК составляет от приблизительно 0,5 до приблизительно 5,0, при этом жизнеспособность указанной популяции клеток составляет по меньшей мере 75%, при этом уровень эндотоксина в указанной популяции гематопоэтических клеток составляет от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл, и при этом указанная популяция гематопоэтических клеток содержит по меньшей мере 1×106 ГСПК.
39. Популяция гематопоэтических клеток, содержащая CD34+CD38LoCD90+CD45RA- клетки, трансдуцированные ретровирусом, в которой по меньшей мере 50% CD34+CD38LoCD90+CD45RA- клеток трансдуцированы, при этом CD34+CD38LoCD90+CD45RA- клетки содержат среднее ЧКВ от приблизительно 0,5 до приблизительно 5,0, при этом жизнеспособность указанной популяции гематопоэтических клеток составляет по меньшей мере 75%, при этом уровень эндотоксина в указанной популяции гематопоэтических клеток составляет от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл, и при этом указанная популяция гематопоэтических клеток содержит по меньшей мере 1×106 CD34+ клеток.
40. Популяция гематопоэтических клеток, содержащая CD34+ клетки, трансдуцированные ретровирусом, в которой по меньшей мере 50% CD34+ трансдуцированы, при этом CD34+ клетки содержат среднее число копий вектора (ЧКВ) от приблизительно 0,5 до приблизительно 5,0, при этом жизнеспособность указанной популяции гематопоэтических клеток составляет по меньшей мере 75%, при этом уровень эндотоксина в указанной популяции гематопоэтических клеток составляет от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл и при этом популяция содержит по меньшей мере 2×106 CD34+ клеток.
41. Популяция гематопоэтических клеток по любому из пп. 38-40, отличающаяся тем, что лентивирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ) от приблизительно 10 до приблизительно 30.
42. Популяция гематопоэтических клеток по любому из пп. 38-40, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ) от приблизительно 10 до приблизительно 25.
43. Популяция гематопоэтических клеток по любому из пп. 38-40, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ) от приблизительно 10 до приблизительно 20.
44. Популяция гематопоэтических клеток по любому из пп. 38-40, отличающаяся тем, что ретровирусный вектор трансдуцировал ГСПК при множественности инфекции (МИ), составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
45. Популяция гематопоэтических клеток по любому из пп. 38-44, отличающаяся тем, что по меньшей мере 75% клеток были трансдуцированы.
46. Популяция гематопоэтических клеток по любому из пп. 38-45, отличающаяся тем, что по меньшей мере 90% клеток были трансдуцированы.
47. Популяция гематопоэтических клеток по любому из пп. 38-46, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 1,0.
48. Популяция гематопоэтических клеток по любому из пп. 38-47, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 1,5.
49. Популяция гематопоэтических клеток по любому из пп. 38-48, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 2,0.
50. Популяция гематопоэтических клеток по любому из пп. 38-49, отличающаяся тем, что среднее ЧКВ составляет по меньшей мере 2,5.
51. Популяция гематопоэтических клеток по любому из пп. 38-50, отличающаяся тем, что жизнеспособность указанной популяции клеток составляет по меньшей мере 85%.
52. Популяция гематопоэтических клеток по любому из пп. 38-51, отличающаяся тем, что жизнеспособность указанной популяции клеток составляет по меньшей мере 95%.
53. Популяция гематопоэтических клеток по любому из пп. 38-52, отличающаяся тем, что уровень эндотоксина в указанной популяции гематопоэтических клеток составляет не более, чем 5,0 ЕЭ/мл.
54. Популяция гематопоэтических клеток по любому из пп. 38-53, отличающаяся тем, что уровень эндотоксина в указанной популяции гематопоэтических клеток составляет не более, чем 0,5 ЕЭ/мл.
55. Популяция гематопоэтических клеток по любому из пп. 38-54, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×107 клеток ГСПК.
56. Популяция гематопоэтических клеток по любому из пп. 38-55, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×108 клеток ГСПК.
57. Популяция гематопоэтических клеток по любому из пп. 38-56, отличающаяся тем, что указанная популяция клеток содержит по меньшей мере 1×109 клеток ГСПК.
58. Популяция гематопоэтических клеток по любому из пп. 38-57, отличающаяся тем, что источником клеток является пуповинная кровь, костный мозг или мобилизованная периферическая кровь.
59. Популяция гематопоэтических клеток по любому из пп. 38-58, отличающаяся тем, что источником клеток является мобилизованная периферическая кровь.
60. Популяция гематопоэтических клеток по любому из пп. 38-59, отличающаяся тем, что ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
61. Популяция гематопоэтических клеток по любому из пп. 38-60, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ.
62. Популяция гематопоэтических клеток по любому из пп. 38-61, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ-1.
63. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
64. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
65. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует аденозиндезаминазу.
66. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
67. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
68. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
69. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует трипептидилпептидазу 1.
70. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
71. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует альфа-L-идуронидазу.
72. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
73. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует идуронат-2-сульфатазу.
74. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
75. Популяция гематопоэтических клеток по любому из пп. 38-62, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 или вектор BCL11A shmir.
76. Популяция гематопоэтических клеток по любому из пп. 38-75, отличающаяся тем, что ретровирусный вектор представляет собой лентивирусный вектор, содержащий:
a) 5' длинный концевой повтор (LTR);
b) элемент экспорта РНК;
c) центральный полипуриновый тракт (сРРТ) лентивируса;
d) промотор, функционально связанный с представляющим интерес геном; и
e) 3'-LTR SIN.
77. Популяция гематопоэтических клеток по п. 76, отличающаяся тем, что 5'-LTR представляет собой модифицированный 5'-LTR.
78. Популяция гематопоэтических клеток по п. 77, отличающаяся тем, что модифицированный 5'-LTR дополнительно содержит делецию относительно 5'-LTR дикого типа.
79. Популяция гематопоэтических клеток по любому из пп. 76-78, отличающаяся тем, что промотор 5'-LTR заменяют на гетерологичный промотор, выбранный из группы, состоящей из: промотора цитомегаловируса (CMV), промотора вируса саркомы Рауса (RSV) или промотора вируса обезьян 40 (SV40)
80. Популяция гематопоэтических клеток по любому из пп. 76-79, отличающаяся тем, что элемент экспорта РНК включает посттранскрипционный регуляторный элемент вируса гепатита В (PRE) или Rev-чувствительный регуляторный элемент вируса иммунодефицита человека (ВИЧ).
81. Популяция гематопоэтических клеток по любому из пп. 76-80, отличающаяся тем, что 3'-LTR содержит последовательность полиаденилирования.
82. Популяция гематопоэтических клеток по любому из пп. 76-81, отличающаяся тем, что промотор содержит один или более элементов LCR β-глобина человека.
83. Популяция гематопоэтических клеток по п. 82, отличающаяся тем, что LCR β-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
84. Популяция гематопоэтических клеток по любому из пп. 76-83, отличающаяся тем, что лентивирусный вектор дополнительно содержит 3'-энхансерный элемент β-глобина человека.
85. Популяция гематопоэтических клеток по любому из пп. 76-84, отличающаяся тем, что представляющий интерес ген кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
86. Популяция гематопоэтических клеток по п. 85, отличающаяся тем, что представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βA-T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека
87. Популяция гематопоэтических клеток по любому из пп. 1-86, отличающаяся тем, аллели β-глобина в клетках следующие: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β+, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
88. Популяция гематопоэтических клеток по любому из пп. 1-86, отличающаяся тем, аллели β-глобина в клетках следующие: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+или β+/β+.
89. Популяция гематопоэтических клеток по любому из пп. 1-86, отличающаяся тем, аллели β-глобина в клетках следующие: βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
90. Композиция, содержащая популяцию гематопоэтических клеток по любому из пп. 1-89.
91. Фармацевтическая композиция, содержащая популяцию гематопоэтических клеток по любому из пп. 1-89 и фармацевтически приемлемый носитель.
92. Культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; ретровирусный вектор и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
93. Культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; ретровирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
94. Культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; ретровирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер, средняя молекулярная масса субъединиц полипропилена в котором более чем приблизительно 2250 дальтон, и который содержит более чем приблизительно 40% оксида полиэтилена.
95. Культура по любому из пп. 92-94, отличающаяся тем, что ретровирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 30.
96. Культура по любому из пп. 92-94, отличающаяся тем, что ретровирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 25.
97. Культура по любому из пп. 92-94, отличающаяся тем, что ретровирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 20.
98. Культура по любому из пп. 92-94, отличающаяся тем, что ретровирусный вектор присутствует при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
99. Культура по любому из пп. с 92 по 98, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
100. Культура по любому из пп. с 92 по 98, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
101. Культура по любому из пп. 99-101, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
102. Культура по любому из пп. 99-101, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
103. Культура по любому из пп. 99-101, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
104. Культура по любому из пп. 99-101, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
105. Культура по любому из пп. 99-101, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
106. Культура по любому из пп. 99-105, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
107. Культура по любому из пп. 99-105, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
108. Культура по любому из пп. 99-105, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
109. Культура по любому из пп. 92-108, отличающаяся тем, что полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
110. Культура по любому из пп. 92-109, отличающаяся тем, что полоксамер представляет собой полоксамер 288.
111. Культура по любому из пп. 92-109, отличающаяся тем, что полоксамер представляет собой полоксамер 335.
112. Культура по любому из пп. 92-109, отличающаяся тем, что полоксамер представляет собой полоксамер 338.
113. Культура по любому из пп. 92-109, отличающаяся тем, что полоксамер представляет собой полоксамер 407.
114. Культура по любому из пп. 93-113, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2; и его производных и аналогов.
115. Культура по любому из пп. 93-114, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
116. Культура по любому из пп. 93-115, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина E2(PGE2) или 16,16-диметил-PGE2.
117. Культура по любому из пп. 93-116, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
118. Культура по любому из пп. 92-117, отличающаяся тем, что гематопоэтические стволовые клетки или клетки-предшественники представляют собой CD34+ клетки или CD133+ клетки.
119. Культура по любому из пп. 92-118, отличающаяся тем, что гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы в присутствии поликатионного полимера.
120. Культура по п. 119, отличающаяся тем, что поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
121. Культура по любому из пп. 92-120, отличающаяся тем, что ретровирусный вектор представляет собой лентивирусный вектор.
122. Культура по любому из пп. 92-121, отличающаяся тем, что ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
123. Культура по любому из пп. 92-122, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ.
124. Культура по любому из пп. 92-122, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ-1.
125. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
126. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
127. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует аденозиндезаминазу.
128. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
129. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
130. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
131. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует трипептидилпептидазу 1.
132. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
133. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует альфа-L-идуронидазу.
134. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
135. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует идуронат-2-сульфатазу.
136. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
137. Культура по любому из пп. 92-124, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 или вектор BCL11A shmir.
138. Культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; стауроспорин; ретровирусный вектор и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон, при этом необязательно клетки приводят в контакт со стауроспорином перед приведением в контакт с ретровирусным вектором и полоксамером.
139. Культура, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; культуральную среду; стауроспорин; ретровирусный вектор и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон и который содержит более чем приблизительно 40% оксида полиэтилена, при этом необязательно клетки приводят в контакт со стауроспорином перед приведением в контакт с ретровирусным вектором и полоксамером.
140. Культура по п. 138 или по п. 139, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
141. Культура по п. 138 или по п. 139, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
142. Культура по п. 138 или по п. 139, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
143. Культура по любому из пп. 140-142, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
144. Культура по любому из пп. 140-142, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
145. Культура по любому из пп. 140-142, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
146. Культура по любому из пп. 140-142, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
147. Культура по любому из пп. 140-146, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
148. Культура по любому из пп. 140-146, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
149. Культура по любому из пп. 140-146, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
150. Культура по любому из пп. 140-149, отличающаяся тем, что полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
151. Культура по любому из пп. 140-150, отличающаяся тем, что полоксамер представляет собой полоксамер 288.
152. Культура по любому из пп. 140-150, отличающаяся тем, что полоксамер представляет собой полоксамер 335.
153. Культура по любому из пп. 140-150, отличающаяся тем, что полоксамер представляет собой полоксамер 338.
154. Культура по любому из пп. 140-150, отличающаяся тем, что полоксамер представляет собой полоксамер 407.
155. Культура по любому из пп. 138-154, отличающаяся тем, что гематопоэтические стволовые клетки или клетки-предшественники представляют собой CD34+ клетки или CD133+ клетки.
156. Культура по любому из пп. 138-155, отличающаяся тем, что гематопоэтические стволовые клетки или клетки-предшественники трансдуцированы в присутствии поликатионного полимера.
157. Культура по п. 156, отличающаяся тем, что поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
158. Культура по любому из пп. 138-157, отличающаяся тем, что ретровирусный вектор представляет собой лентивирусный вектор.
159. Культура по любому из пп. 138-158, отличающаяся тем, что ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
160. Культура по любому из пп. 138-159, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ.
161. Культура по любому из пп. 138-160, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ-1.
162. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
163. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
164. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует аденозиндезаминазу.
165. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
166. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
167. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
168. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует трипептидилпептидазу 1.
169. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
170. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует альфа-L-идуронидазу.
171. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
172. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует идуронат-2-сульфатазу.
173. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
174. Культура по любому из пп. 138-161, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 или вектор BCL11A shmir.
175. Способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии ретровируса и полоксамера, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
176. Способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии ретровируса и полоксамера со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащего более чем приблизительно 40% оксида полиэтилена.
177. Способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии ретровируса, агента, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорина и полоксамера, молекулярная масса которого составляет по меньшей мере 10000 дальтон, при этом необязательно клетки приводят в контакт со стауроспорином, если он присутствует, перед приведением в контакт с ретровирусным вектором и полоксамером.
178. Способ трансдукции популяции гематопоэтических клеток, включающий культивирование указанных клеток в культуральной среде в присутствии ретровируса.
179. Способ по любому из пп. 175-178, отличающийся тем, что лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 30 или при МИ от приблизительно 10 до приблизительно 25.
180. Способ по любому из пп. 175-178, отличающийся тем, что лентивирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 20.
181. Способ по любому из пп. 175-178, отличающийся тем, что лентивирусный вектор присутствует при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
182. Способ по любому из пп. 175-181, включающий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорин и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена, отличающийся тем, что необязательно клетки приводят в контакт со стауроспорином, если он присутствует, перед приведением в контакт с ретровирусным вектором и полоксамером.
183. Способ по любому из пп. 175-182, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
184. Способ по любому из пп. 175-182, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
185. Способ по любому из пп. 175-182, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
186. Способ по любому из пп. 183-185, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
187. Способ по любому из пп. 183-185, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
188. Способ по любому из пп. 183-185, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
189. Способ по любому из пп. 183-185, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
190. Способ по любому из пп. 175-189, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
191. Способ по любому из пп. 175-189, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
192. Способ по любому из пп. 175-189, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
193. Способ по любому из пп. 175-192, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2 и его производных и аналогов.
194. Способ по любому из пп. 175-193, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
195. Способ по любому из пп. 175-194, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина E2(PGE2) или 16,16-диметил-PGE2.
196. Способ по любому из пп. 175-195, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
197. Способ по любому из пп. 175-196, отличающийся тем, что полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
198. Способ по любому из пп. 175-197, отличающийся тем, что полоксамер представляет собой полоксамер 288.
199. Способ по любому из пп. 175-197, отличающийся тем, что полоксамер представляет собой полоксамер 335.
200. Способ по любому из пп. 175-197, отличающийся тем, что полоксамер представляет собой полоксамер 338.
201. Способ по любому из пп. 175-197, отличающийся тем, что полоксамер представляет собой полоксамер 407.
202. Способ по любому из пп. 175-201, отличающийся тем, что популяцию гематопоэтических клеток трансдуцируют в присутствии поликатионного полимера.
203. Способ по п. 202, отличающийся тем, что поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
204. Способ по любому из пп. 175-203, отличающийся тем, что лентивирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
205. Способ по любому из пп. 175-204, отличающийся тем, что лентивирусный вектор получен из лентивируса ВИЧ.
206. Способ по любому из пп. 175-205, отличающийся тем, что лентивирусный вектор получен из лентивируса ВИЧ-1.
207. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
208. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
209. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор кодирует аденозиндезаминазу.
210. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
211. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
212. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
213. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор кодирует трипептидилпептидазу 1.
214. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
215. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор кодирует альфа-L-идуронидазу.
216. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
217. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор кодирует идуронат-2-сульфатазу.
218. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
219. Способ по любому из пп. 175-206, отличающийся тем, что ретровирусный вектор или лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 или вектор BCL11A shmir.
220. Культура по любому из пп. 92-174 или способ по любому из пп. 175-219, отличающиеся тем, что ретровирусный вектор представляет собой лентивирусный вектор, который содержит:
a) 5' длинный концевой повтор (LTR);
b) сигнал упаковки пси (Ψ);
c) элемент экспорта РНК;
d) центральный полипуриновый тракт (сРРТ) лентивируса;
e) промотор, функционально связанный с представляющим интерес полинуклеотидом; и
f) 3'-LTR SIN.
221. Культура или способ по п. 220, отличающиеся тем, что 5'-LTR представляет собой модифицированный 5'-LTR, который дополнительно содержит делецию относительно 5'-LTR дикого типа.
222. Культура или способ по п. 220 или по п. 221, отличающиеся тем, что промотор 5'-LTR заменяют на гетерологичный промотор, выбранный из группы, состоящей из: промотора цитомегаловируса (CMV), промотора вируса саркомы Рауса (RSV) или промотора вируса обезьян 40 (SV40)
223. Культура или способ по любому из пп. 220-222, отличающиеся тем, что элемент экспорта РНК включает посттранскрипционный регуляторный элемент вируса гепатита В (PRE) или Rev-чувствительный регуляторный элемент вируса иммунодефицита человека (ВИЧ).
224. Культура или способ по любому из пп. 220-223, отличающиеся тем, что 3'-LTR содержит последовательность полиаденилирования.
225. Культура или способ по любому из пп. 220-224, отличающиеся тем, что промотор содержит один или более элементов LCR β-глобина человека.
226. Культура или способ по любому из пп. 220-225, отличающиеся тем, что LCR В-глобина человека содержит гиперчувствительные к ДНКазе I участки 2, 3 и 4 из LCR β-глобина человека.
227. Культура или способ по любому из пп. 220-226, отличающиеся тем, что лентивирусный вектор дополнительно содержит 3'-энхансерный элемент β-глобина человека.
228. Культура или способ по любому из пп. 22-227, отличающиеся тем, что представляющий интерес полинуклеотид кодирует белок, предотвращающий образование серповидноклеточных эритроцитов, или ген глобина.
229. Культура или способ по п. 228, отличающиеся тем, что представляющий интерес ген кодирует белок β-глобина человека, белок δ-глобина человека, белок γ-глобина человека, белок βА-T87Q-глобина человека, белок βА-G16D/Е22А/T87Q-глобина человека или белок βА-T87Q/K95E/K120E-глобина человека.
230. Способ по любому из пп. 175-229, отличающийся тем, что популяцию гематопоэтических клеток трансдуцируют в течение по меньшей мере приблизительно 2 часов.
231. Способ по любому из пп. 175-230, отличающийся тем, что популяцию гематопоэтических клеток трансдуцируют в течение по меньшей мере приблизительно 24 часов.
232. Способ по любому из пп. 175-229, отличающийся тем, что популяцию гематопоэтических клеток трансдуцируют в течение от приблизительно 2 часов до приблизительно 24 часов.
233. Способ по любому из пп. 175-232, отличающийся тем, что гематопоэтические клетки включают гематопоэтические стволовые клетки или клетки-предшественники.
234. Способ по любому из пп. 175-233, отличающийся тем, что гематопоэтические клетки включают CD34+ клетки или CD133+ клетки.
235. Способ по любому из пп. 175-234, отличающийся тем, что проводят селекцию популяции гематопоэтических клеток по экспрессии CD34+ или CD133+ перед трансдукцией.
236. Способ лечения гемоглобинопатии у субъекта, включающий введение указанному субъекту популяции клеток по любому из пп. 1-62 и 75-89.
237. Способ облегчения по меньшей мере одного симптома гемоглобинопатии у субъекта, включающий введение указанному субъекту популяции клеток по любому из пп. 1-62 и 75-89, или композиции согласно п. 90 или 91.
238. Способ по п. 236 или по п. 237, отличающийся тем, что аллели β-глобина у субъекта следующие: βЕ/β0, βC/β0, β0/β0, βЕ/βЕ, βC/β+, βЕ/β+, β0/β+, β+/β+, βC/βC, βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
239. Способ лечения талассемии у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62 и 75-89, или композиции согласно п. 90 или 91.
240. Способ по п. 239, отличающийся тем, что талассемия представляет собой α-талассемию.
241. Способ по п. 239, отличающийся тем, что талассемия представляет собой β-талассемию.
242. Способ по п. 239, отличающийся тем, что аллели β-глобина у субъекта следующие: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+ или β+/β+.
243. Способ лечения серповидноклеточной болезни у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62 и 75-89 или композиции согласно п. 90 или 91.
244. Способ по п. 243, отличающийся тем, что аллели β-глобина у субъекта следующие: βE/βS, β0/βS, βC/βS, β+/βS или βS/βS.
245. Способ лечения β-талассемии у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62 и 75-89 или композиции согласно п. 90 или 91.
246. Способ по п. 245, отличающийся тем, что аллели β-глобина у субъекта следующие: βЕ/β0, βC/β0, β0/β0, βC/βC, βЕ/βЕ, βЕ/β+, βC/βЕ, βC/β+, β0/β+ или β+/β+.
247. Способ лечения адренолейкодистрофии или адреномиелонефропатии у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-64 и 75-89 или композиции согласно п. 90 или 91.
248. Способ лечения ADA-SCID у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62, 65, 66 и 75-89 или композиции согласно п. 90 или 91.
249. Способ лечения X-SCID у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62, 67, 68 и 75-89 или композиции согласно п. 90 или 91.
250. Способ лечения болезни Баттена у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62, 69, 70 и 75-89 или композиции согласно п. 90 или 91.
251. Способ лечения MPS I у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62, 71, 72 и 75-89 или композиции согласно п. 90 или 91.
252. Способ лечения MPS II у субъекта, включающий введение указанному субъекту эффективного количества популяции гематопоэтических клеток согласно любому из пп. 1-62, 73, 74 и 75-89 или композиции согласно п. 90 или 91.
253. Способ по любому из пп. 236-252, отличающийся тем, что популяцию гематопоэтических стволовых клеток вводят внутривенным путем, интрамедуллярным путем или внутрикостным путем.
254. Способ по любому из пп. 236-253, отличающийся тем, что популяцию гематопоэтических стволовых клеток вводят внутривенно.
255. Набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
256. Набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена.
257. Набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорин и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
258. Набор, содержащий агент, который увеличивает передачу сигналов рецептора простагландина ЕР, или стауроспорин и полоксамер со средней молекулярной массой субъединиц полипропилена более чем приблизительно 2250 дальтон, содержащий более чем приблизительно 40% оксида полиэтилена.
259. Набор по любому из пп. 255-258, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
260. Набор по любому из пп. 255-258, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
261. Набор по любому из пп. 255-258, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
262. Набор по любому из пп. 259-261, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
263. Набор по любому из пп. 259-261, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
264. Набор по любому из пп. 259-261, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
265. Набор по любому из пп. 259-261, отличающийся тем, что полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
266. Набор по любому из пп. 259-265, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
267. Набор по любому из пп. 259-265, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
268. Набор по любому из пп. 259-265, отличающийся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
269. Набор по любому из пп. 259-268, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2 и их производных и аналогов.
270. Набор по любому из пп. 259-269, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
271. Набор по любому из пп. 259-270, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина E2(PGE2) или 16,16-диметил-PGE2.
272. Набор по любому из пп. 259-271, отличающийся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
273. Набор по любому из пп. 259-272, отличающийся тем, что полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
274. Набор по любому из пп. 259-273, отличающийся тем, что полоксамер представляет собой полоксамер 288.
275. Набор по любому из пп. 259-273, отличающийся тем, что полоксамер представляет собой полоксамер 335.
276. Набор по любому из пп. 259-273, отличающийся тем, что полоксамер выбран из полоксамера 338.
277. Набор по любому из пп. 259-273, отличающийся тем, что полоксамер представляет собой полоксамер 407.
278. Набор по любому из пп. 259-277, отличающийся тем, что популяцию гематопоэтических клеток трансдуцируют в присутствии поликатионного полимера.
279. Набор по п. 278, отличающийся тем, что поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
280. Композиция, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; ретровирусный вектор и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
281. Композиция, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; ретровирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер, молекулярная масса которого составляет по меньшей мере 10000 дальтон.
282. Композиция, содержащая: гематопоэтическую стволовую клетку или клетку-предшественника; ретровирусный вектор; агент, который увеличивает передачу сигналов рецептора простагландина ЕР; и полоксамер, средняя молекулярная масса субъединиц полипропилена в котором более чем приблизительно 2250 дальтон, и который содержит более чем приблизительно 40% оксида полиэтилена.
283. Композиция по любому из пп. 280-282, отличающаяся тем, что ретровирусный вектор присутствует при МИ от приблизительно 10 до приблизительно 30.
284. Композиция по любому из пп. 280-282, отличающаяся тем, что ретровирусный вектор присутствует при МИ приблизительно 10 до приблизительно 25.
285. Композиция по любому из пп. 280-282, отличающаяся тем, что ретровирусный вектор присутствует при МИ приблизительно 10 до приблизительно 20.
286. Композиция по любому из пп. 280-282, отличающаяся тем, что ретровирусный вектор присутствует при МИ, составляющей приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или приблизительно 30.
287. Композиция по любому из пп. 280-286, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон.
288. Композиция по любому из пп. 280-286, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон.
289. Композиция по любому из пп. 280-286, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 4000 дальтон.
290. Композиция по любому из пп. 280-289, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
291. Композиция по любому из пп. 280-289, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 60% оксида полиэтилена.
292. Композиция по любому из пп. 280-289, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 70% оксида полиэтилена.
293. Композиция по любому из пп. 280-289, отличающаяся тем, что полоксамер содержит по меньшей мере приблизительно 80% оксида полиэтилена.
294. Композиция по любому из пп. 280-293, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 40% оксида полиэтилена.
295. Композиция по любому из пп. 280-293, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 2750 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
296. Композиция по любому из пп. 280-293, отличающаяся тем, что средняя молекулярная масса субъединиц полипропилена в полоксамере составляет по меньшей мере приблизительно 3250 дальтон, и указанный полоксамер содержит по меньшей мере приблизительно 50% оксида полиэтилена.
297. Композиция по любому из пп. 280-296, отличающаяся тем, что полоксамер выбран из группы, состоящей из: полоксамера 288, полоксамера 335, полоксамера 338 и полоксамера 407.
298. Композиция по любому из пп. 280-297, отличающаяся тем, что полоксамер представляет собой полоксамер 288.
299. Композиция по любому из пп. 280-297, отличающаяся тем, что полоксамер представляет собой полоксамер 335.
300. Композиция по любому из пп. 280-297, отличающаяся тем, что полоксамер представляет собой полоксамер 338.
301. Композиция по любому из пп. 280-297, отличающаяся тем, что полоксамер представляет собой полоксамер 407.
302. Композиция по любому из пп. 281-301, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: PGA2; PGB2; PGD2; PGE1; PGE2; PGF2; PGI2; PGH2; PGJ2 и их производных и аналогов.
303. Композиция по любому из пп. 281-302, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: 15d-PGJ2; дельта-12-PGJ2; 2-гидроксигептадекатриеновой кислоты (ННТ); тромбоксана А2; тромбоксана В2; илопроста; трепростинила; травопроста; карбопроста трометамина; талфупроста; латанопроста; биматопроста; унопростона изопропила; клопростенола; эстрофана; суперфана; мизопростола; бутапроста; линолевой кислоты; 13(s)-HODE; LY171883; мидовой кислоты; эйкозатриеновой кислоты; эпоксиэйкозатриеновой кислоты; ONO-259; Сау1039; агониста рецептора PGE2; 16,16-диметил-PGE2; 19(R)-гидрокси-PGE2; п-(п-ацетамидобензамидо)фенилового эфира 16,16-диметил-PGE2; 11-дезокси-16,16-диметил-PGE2; 9-дезокси-9-метилен-16,16-диметил-PGE2; 9-дезокси-9-метилен-PGE2; сульпростона; сериноламида PGE2; метилового эфира PGE2; 16-фенилтетранора PGE2; 15(S)-15-метил-PGE2 и 15(R)-15-метил-PGE2.
304. Композиция по любому из пп. 281-303, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, выбран из группы, состоящей из: простагландина E2(PGE2) или 16,16-диметил-PGE2.
305. Композиция по любому из пп. 281-304, отличающаяся тем, что агент, который увеличивает передачу сигналов рецептора простагландина ЕР, представляет собой PGE2.
306. Композиция по любому из пп. 280-305, отличающаяся тем, что гематопоэтические стволовые клетки или клетки-предшественники представляют собой CD34+ клетки или CD133+ клетки.
307. Композиция по любому из пп. 280-306, дополнительно содержащая поликатионный полимер.
308. Композиция по п. 307, отличающаяся тем, что поликатионный полимер представляет собой полибрен, сульфат протамина, полиэтиленимин или блок-сополимер полиэтиленгликоля/поли-L-лизина.
309. Композиция по любому из пп. 280-308, отличающаяся тем, что ретровирусный вектор представляет собой лентивирусный вектор.
310. Композиция по любому из пп. 280-309, отличающаяся тем, что ретровирусный вектор получен из лентивируса, выбранного из группы, состоящей из: ВИЧ (вируса иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вируса висна-маеди (VMV); вируса козьего артрита-энцефалита (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
311. Композиция по любому из пп. 280-310, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ.
312. Композиция по любому из пп. 280-310, отличающаяся тем, что ретровирусный вектор получен из лентивируса ВИЧ-1.
313. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
314. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev или его транскрипционно активный фрагмент, функционально связанный с полинуклеотидом, кодирующим полипептид представителя 1 подсемейства D белков с АТФ-связывающей кассетой (ABCD1).
315. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует аденозиндезаминазу.
316. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим аденозиндезаминазу.
317. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует рецептор интерлейкина-2 гамма.
318. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа, функционально связанный с полинуклеотидом, кодирующим рецептор интерлейкина-2 гамма.
319. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует трипептидилпептидазу 1.
320. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим трипептидилпептидазу 1.
321. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует альфа-L-идуронидазу.
322. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим альфа-L-идуронидазу.
323. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор кодирует идуронат-2-сульфатазу.
324. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор содержит промотор фактора элонгации 1 альфа или содержит энхансер миелопролиферативного вируса саркомы, промотор (MND) с удаленной областью отрицательного контроля и с заменой участка связывания праймера на d1587rev, функционально связанный с полинуклеотидом, кодирующим идуронат-2-сульфатазу.
325. Композиция по любому из пп. 280-311, отличающаяся тем, что ретровирусный вектор или лентивирусный вектор представляет собой вектор AnkT9W, вектор T9Ank2W, вектор TNS9, вектор LentiGlobin HPV569, вектор LentiGlobin ВВ305, вектор BG-1, вектор BGM-1, вектор d432βAγ, вектор mLARβΔγV5, вектор GLOBE, вектор G-GLOBE, вектор βAS3-FB, вектор V5, вектор V5m3, вектор V5m3-400, вектор G9 или вектор BCL11A shmir.
326. Композиция по любому из пп. 280-325, дополнительно содержащая культуральную среду.
Реферат
Изобретение относится к области биохимии, в частности к способу трансдукции популяции CD34+гематопоэтических стволовых клеток или клеток-предшественников, включающему культивирование указанных клеток в культуральной среде в присутствии лентивирусного вектора, агента, который усиливает передачу сигналов рецептора простагландина EP, и полоксамера. Изобретение позволяет повышать эффективность трансдукции гематопоэтических стволовых клеток и клеток-предшественников. 10 з.п. ф-лы, 27 ил., 32 пр.

Комментарии