Среда для формирования колоний и её применение - RU2756561C2
Код документа: RU2756561C2
Чертежи
















































































Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу дифференцировки плюрипотентной стволовой клетки (PSC) человека в мезенхимальную стволовую клетку (MSC) и к композициям, пригодным для такой дифференцировки. Изобретение также относится к MSC, дифференцированной посредством этого способа, популяции MSC, дифференцированных посредством этого способа, и к способам и применениям MSC или популяции MSC.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Плюрипотентные стволовые клетки (PSC), в частности PSC человека, которые включают эмбриональные стволовые клетки (ESC) и индуцированные плюрипотентные стволовые клетки (iPSC), обеспечивают возможность изучать развитие человека in vitro и разрабатывать новые терапевтические продукты на клеточной основе. Использование PSC в качестве исходного материала для изготовления терапевтических продуктов имеет несколько преимуществ, включая возможность производить практически неограниченное количество клеток из банка одиночных клеток, в результате способности PSC репродуцироваться неопределенно долго in vitro и дифференцироваться в любой тип клеток.
В большинстве протоколов дифференцируют PSC человека, выращенные на мышиных эмбриональных фибробластах (MEF) или MATRIGEL®, препарате солюбилизированных базальных мембран, выделенных из мышиной саркомы Энгельбрета-Хольма-Сварма (EHS). Была описана химически определенная, не содержащая ксеногена среда и матрица для получения и поддержания PSC человека. Протокол дифференцировки, направленной посредством химически определенной, не содержащей ксеногена среды, для получения гемопоэтических предшественников из PSC человека также описан в US 2014/0273211 А1.
В частности, в US 2014/0273211А1 описан способ дифференцировки плюрипотентных стволовых клеток человека, включающий: (а) получение плюрипотентных стволовых клеток человека; и (б) культивирование плюрипотентных стволовых клеток человека в гипоксических условиях в среде для культивирования клеток, содержащей FGF2 (фактор роста фибробластов 2), ВМР4 (костный морфогенетический белок 4), активин А и LiCl, в течение периода примерно двух суток с образованием клеточной популяции первичных мезодермальных клетокEMHlin-KDR+APLNR+РDGFRальфа+ с мезенхимоангиобластным потенциалом. В US 2014/0273211 А1 также описана не содержащая ксеногена среда для культивирования для дифференцировки плюрипотентных стволовых клеток человека, содержащая среду IF9S с добавлением: от примерно 50 до примерно 250 нг/мл ВМР4; от примерно 10 до примерно 15 нг/мл активина А; от примерно 10 до примерно 50 нг/мл FGF2; и от примерно 1 мМ до примерно 2 мМ LiCl.
Однако US 2014/0273211 А1 умалчивает относительно какой-либо улучшенной среды для формирования мезенхимальных колоний (M-CFM).
Мезенхимальные стволовые клетки (MSC) являются перспективными в качестве клеточной терапии и используются в настоящее время в клинических испытаниях для лечения многочисленных заболеваний, включая реакцию «трансплантат против хозяина». MSC, полученные из индуцированной плюрипотентной стволовой клетки (iPSC), имеют уникальное преимущество по сравнению с MSC, полученными непосредственно из источника, то есть полученными из тканей, таких как костный мозг, пуповинная кровь, жировая ткань, так как размножение iPSC in vitro может обеспечить практически неограниченный источник MSC.
Тем не менее, несмотря на их перспективность, остаются проблемы в продуцировании MSC in vitro, например в масштабировании производства с лабораторного масштаба до масштаба надлежащей производственной практики (GMP), что для любого биологического продукта не является ни легко достижимым, ни безусловно предсказуемым, как признано в данной области техники.
Следовательно, существует потребность в улучшенных и масштабируемых способах дифференцировки PSC, включая iPSC, в MSC.
Любые публикации, упоминаемые в данном описании изобретения, включены в данное описание изобретения посредством ссылки. Однако, если на какую-либо публикацию имеется ссылка в данном описании изобретения, такая ссылка не является признанием того, что эта публикация является частью общеизвестных знаний в данной области техники в Австралии или любой другой стране.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы изобретения идентифицировали конкретную композицию среды для дифференцировки, которая дифференцирует PSC в MSC, где такие MSC обладают улучшенными иммуносупрессорными свойствами по сравнению с MSC, дифференцированными в отсутствие среды для дифференцировки, раскрытой в данном описании изобретения. Кроме того, данный способ применим в масштабе GMP, то есть в масштабе, достаточном для поставки MSC для терапевтического применения.
В первом аспекте изобретения предлагается MSC, экспрессирующая miR-145-5p, miR-181b-5p и miR-214-3р, но не miR-127-3р или miR-299-5p.
В одном воплощении MSC имеет фенотип CD73+CD105+CD90+CD146+CD44+CD10+CD31-CD45-.
Во втором аспекте изобретения предлагается способ получения MSC, включающий:
а) культивирование первичной мезодермальной клетки в M-CFM, содержащей LiCl и FGF2, но в отсутствие PDGF (тромбоцитарный фактор роста), в условиях с нормальным содержанием кислорода в течение достаточного времени для формирования мезенхимальных колоний; и
б) культивирование мезенхимальных колоний (а) в адгезивном состоянии с получением MSC,
где MSC со стадии (б) имеет улучшенные свойства иммуносупрессии Т-клеток по сравнению с MSC, не полученной в указанной M-CFM.
В одном воплощении первичная мезодермальная клетка представляет собой первичную мезодермальную клетку с мезенхимоангиобластным (МСА) потенциалом. В одном воплощении первичная мезодермальная клетка с МСА-потенциалом имеет фенотипEMHlin-KDR+APLNR+PDGFRaльфa+.
В одном воплощении достаточное время для получения мезенхимальных колоний составляет от примерно 8 суток до примерно 14 суток. В одном воплощении достаточное время для получения мезенхимальных колоний составляет примерно 12 суток.
В одном воплощении свойства иммуносупрессии Т-клеток клеток MSC определяют по сравнению с MSC, полученными способом, включающим:
а') культивирование первичной мезодермальной клетки в среде, содержащей FGF2 и возможно PDGF, но в отсутствие LiCl, в условиях с нормальным содержанием кислорода в течение достаточного времени для образования мезенхимальных колоний; и
б') культивирование мезенхимальных колоний со стадии (а') в адгезивном состоянии с получением MSC.
В одном воплощении свойства иммуносупрессии Т-клеток клеток MSC определяют по сравнению с MSC, продуцированной из первичной мезодермальной клетки, дифференцированной из PSC в среде для дифференцировки, содержащей FGF2, ВМР4, активин А и LiCl, в гипоксических условиях в течение примерно двух суток.
В третьем аспекте изобретения предлагается MSC, полученная способом согласно второму аспекту.
В четвертом аспекте изобретения предлагается популяция MSC, содержащая MSC по первому или третьему аспекту.
В пятом аспекте изобретения предлагается терапевтическая композиция, содержащая MSC по первому или третьему аспекту или популяция MSC по четвертому аспекту.
В шестом аспекте изобретения предлагается набор, включающий контейнер, содержащий MSC по первому или третьему аспекту, популяцию MSC по четвертому аспекту или терапевтическую композицию по пятому аспекту.
В седьмом аспекте изобретения предлагается среда для формирования мезенхимальных колоний (M-CFM), содержащая примерно 1 мМ LiCl и от примерно 5 нг/мл до примерно 100 нг/мл FGF2, или от примерно 10 нг/мл до примерно 50 нг/мл FGF2, примерно 10 нг/мл FGF2 или примерно 20 нг/мл FGF2, но в отсутствие PDGF.
В восьмом аспекте изобретения предлагается композиция, содержащая LiCl и FGF2, но в отсутствие PDGF, которая, при смешивании с жидкостью, содержащей воду, образует M-CFM, содержащую примерно 1 мМ LiCl и от примерно 5 нг/мл до примерно 100 нг/мл FGF2, или от примерно 10 нг/мл до примерно 50 нг/мл FGF2, примерно 10 нг/мл FGF2, или примерно 20 нг/мл FGF2, но в отсутствие PDGF.
В девятом аспекте изобретения предлагается применение MSC по первому или третьему аспекта или популяции MSC по четвертому аспекту в изготовлении лекарственного средства для лечения или предупреждения состояния, такого как костные кисты, костные новообразования, переломы, дефекты хрящей, остеоартрит, повреждение связок, несовершенный остеогенез, остеонекроз, остеопороз, апластическая анемия, реакция «трансплантат против хозяина» (GvHD), миелодиспластический синдром; диабет 1 типа, диабет 2 типа, аутоиммунный гепатит, цирроз печени, печеночная недостаточность, дилатационная кардиомиопатия, сердечная недостаточность, инфаркт миокарда, ишемия миокарда, болезнь Крона, язвенный колит, ожоги, буллезный эпидермолиз, красная волчанка, ревматоидный артрит, синдром Шегрена, системный склероз, бронхолегочная дисплазия, хроническая обструктивная болезнь дыхательных путей, эмфизема, фиброз легких, боковой амиотрофический склероз (ALS), болезнь Альцгеймера, травма головного мозга, атаксия, дегенеративное заболевание межпозвонковых дисков, мультисистемная атрофия, рассеянный склероз, болезнь Паркинсона, пигментный ретинит, болезнь Ромберга, повреждение спинного мозга, инсульт, мышечная дистрофия, ишемия конечностей, повреждение почки, волчаночный нефрит, эндометриоз и осложнения при трансплантации костного мозга или солидного органа.
В десятом аспекте изобретения предлагается способ лечения или предупреждения состояния, такого как костные кисты, костные новообразования, переломы, дефекты хрящей, остеоартрит, повреждение связок, несовершенный остеогенез, остеонекроз, остеопороз, апластическая анемия, реакция «трансплантат против хозяина» (GvHD), миелодиспластический синдром; диабет 1 типа, диабет 2 типа, аутоиммунный гепатит, цирроз печени, печеночная недостаточность, дилатационная кардиомиопатия, сердечная недостаточность, инфаркт миокарда, ишемия миокарда, болезнь Крона, язвенный колит, ожоги, буллезный эпидермолиз, красная волчанка, ревматоидный артрит, синдром Шегрена, системный склероз, бронхолегочная дисплазия, хроническая обструктивная болезнь дыхательных путей, эмфизема, фиброз легких, ALS (боковой амиотрофический склероз), болезнь Альцгеймера, травма головного мозга, атаксия, дегенеративное заболевание межпозвонковых дисков, мультисистемная атрофия, рассеянный склероз, болезнь Паркинсона, пигментный ретинит, болезнь Ромберга, повреждение спинного мозга, инсульт, мышечная дистрофия, ишемия конечностей, повреждение почки, волчаночный нефрит, эндометриоз и осложнения при трансплантации костного мозга или солидного органа, включающий введение субъекту MSC по первому или третьему аспекту, популяции MSC по четвертому аспекту или терапевтической композиции по пятому аспекту.
Также раскрыт способ дифференцировки плюрипотентной стволовой клетки (PSC) в мезенхимальную стволовую клетку (MSC), включающий:
а) культивирование PSC в среде для дифференцировки, содержащей FGF2, ВМР4, активин А и LiCl, в гипоксических условиях в течение примерно двух суток с образованием первичной мезодермальной клетки;
б) замену среды для дифференцировки со стадии (а) средой для формирования мезенхимальных колоний (M-CFM), содержащей LiCl и FGF2, но в отсутствие PDGF;
в) культивирование первичной мезодермальной клетки со стадии (б) в M-CFM со стадии (б) в условиях с нормальным содержанием кислорода в течение достаточного времени для формирования мезенхимальной колонии; и
г) культивирование мезенхимальной колонии со стадии (в) в адгезивном состоянии с получением MSC,
где MSC имеет улучшенные свойства иммуносупрессии Т-клеток по сравнению с MSC, полученной не в указанной M-CFM.
В одном воплощении приведенный выше способ дополнительно включает:
д) размножение MSC со стадии (г).
В одном воплощении первичная мезодермальная клетка представляет собой первичную мезодермальную клетку с мезенхимоангиобластным потенциалом (МСА). В одном воплощении первичная мезодермальная клетка с МСА-потенциалом представляет собой первичную мезодермальную клеткуEMHlin-KDR+APLNR+РDGFRальфа+ с МСА-потенциалом.
В одном воплощении достаточное время для формирования мезенхимальной колонии составляет от примерно 8 суток до примерно 14 суток. В одном воплощении достаточное время для формирования мезенхимальных колоний составляет примерно 12 суток.
В одном воплощении свойства иммуносупрессии Т-клеток MSC определяют по сравнению с MSC, полученной из первичной мезодермальной клетки, культивированной в среде, содержащей FGF2 и возможно PDGF, но в отсутствие LiCl.
В одном воплощении свойства иммуносупрессии Т-клеток MSC определяют по сравнению с MSC, полученной из первичной мезодермальной клетки, дифференцированной из PSC в среде для дифференцировки, содержащей FGF2, ВМР4, активин А и LiCl, в гипоксических условиях в течение примерно двух суток.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Воплощения изобретения описывают ниже только в качестве примера со ссылкой на прилагаемые графические материалы, где:
Фиг. 1 представляет собой аминокислотную последовательность (SEQ ID NO: 1), представляющую собой полипептид, такой как гомодимер, являющийся одним из примеров активина А человека.
Фиг. 2 представляет собой аминокислотную последовательность (SEQ ID NO: 2), представляющую собой полипептид, такой как гомодимер, являющийся одним из примеров ВМР4 человека. SEQ ID NO: 2 соответствует аминокислотам 303-408 аминокислотной последовательности полноразмерного предшественника ВМР4.
Фиг. 3 представляет собой аминокислотную последовательность (SEQ ID NO: 3), представляющую собой полипептид, являющийся одним из примеров альфа-1 цепи коллагена I типа человека. Коллаген I типа человека (коллаген I) представляет собой трехспиральный тример, который в одном примере имеет две альфа-1 цепи, представленные SEQ ID NO: 3, и одну альфа-2 цепь. SEQ ID NO: 3 соответствует аминокислотам 162-1218 полноразмерного предшественника альфа-1 цепи коллагена I типа.
Фиг. 4 представляет собой аминокислотную последовательность (SEQ ID NO: 4), представляющую собой полипептид, являющийся одним из примеров альфа-1 цепи коллагена IV типа человека. Коллаген IV типа человека (коллаген IV) представляет собой трехспиральный гетеротример, который в одном примере содержит одну альфа-1 цепь, представленную SEQ ID NO: 4. SEQ ID NO: 4 соответствует аминокислотам 173-1669 полноразмерного предшественника альфа-1 цепи коллагена IV типа.
Фиг. 5 представляет собой аминокислотную последовательность (SEQ ID NO: 5), представляющую собой полипептид, являющийся одним из примеров FGF2 человека.
Фиг. 6 представляет собой аминокислотную последовательность (SEQ ID NO: 6), представляющую собой полипептид, который в виде димера является одним примером фибронектина человека. SEQ ID NO: 6 соответствует аминокислотам 32-2446 полноразмерного предшественника фибронектина.
Фиг. 7 представляет собой аминокислотную последовательность (SEQ ID NO: 7), представляющую собой полипептид, который в виде гомодимера является одним примером PDGF человека (PDGF-BB). SEQ ID NO: 7 соответствует аминокислотам 82-190 полноразмерного предшественника субъединицы В фактора PDGF.
Фиг. 8 представляет собой аминокислотную последовательность (SEQ ID NO: 8), представляющую собой полипептид, который в виде гексамера является одним примером тенасцина С человека. SEQ ID NO: 8 соответствует аминокислотам 23-2201 полноразмерного предшественника тенасцина С.
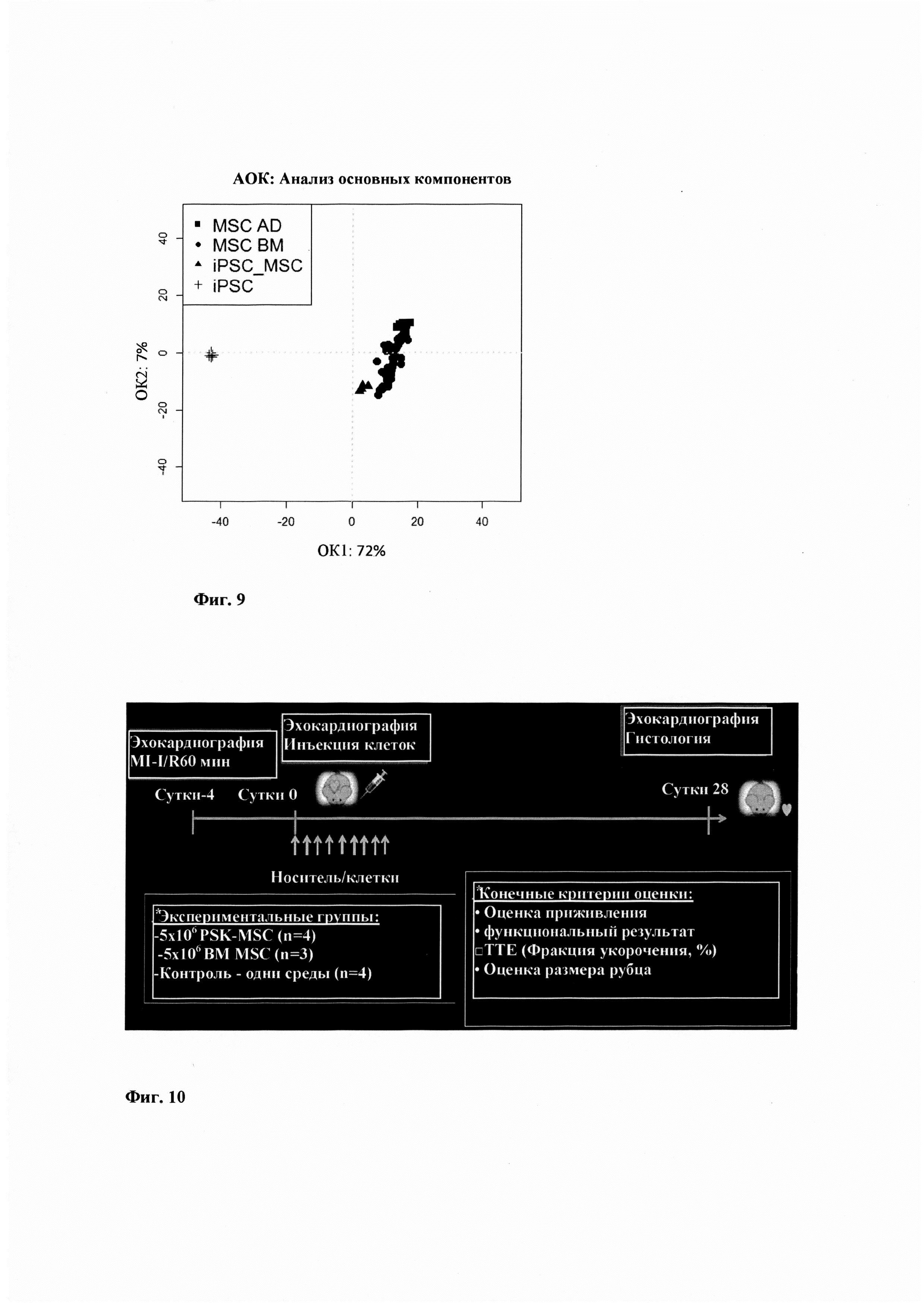
Фиг. 9 представляет собой диаграмму, представляющую анализ основных компонентов экспрессии miRNA MSC по изобретению и другие образцы MSC в количестве 71, полученные посредством другого способа. AD, жировая ткань (



Фиг. 10 представляет собой схематическое изображение исследования из примера.
Фиг. 11 представляет собой схематическое изображение гистологии в исследовании из примера 6.
Фиг. 12 содержит флуоресцентные микрофотографии приживления (окрашивание ядер клеток человека) MSC в сердца из примера 6. Окрашивание ядер клеток человека выполняли на всех уровнях в средних отделах LV (левого желудочка) (криосрезы). Не было свидетельств приживления клеток на 28 сутки. Окрашивание митохондрий человека выполняли на базальных отделах LV (парафиновые срезы). Не было свидетельств приживления клеток на 28 сутки.
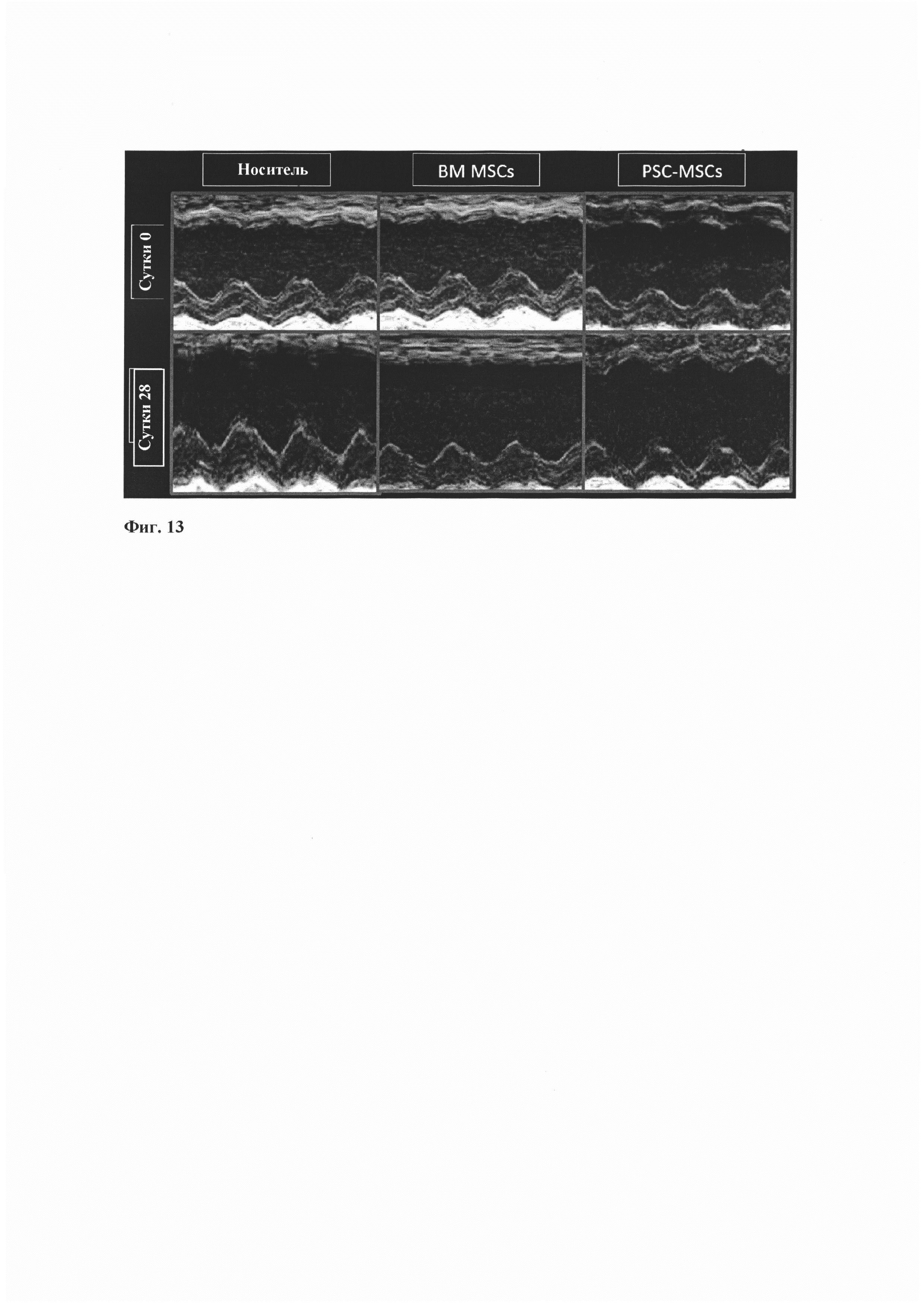
Фиг. 13 демонстрирует функциональную оценку (ТТЕ) и содержит изображения по короткой оси в М-режиме для сердец реципиентов с носителем, ВМ MSC и PSC-MSC из примера 6 на исходном уровне и в моменты времени 1 месяц. Эти изображения демонстрируют пониженную дилатацию желудочка и повышенную сократимость желудочка у реципиентов с PSC-MSC по сравнению с реципиентами с носителем и ВМ MSC.
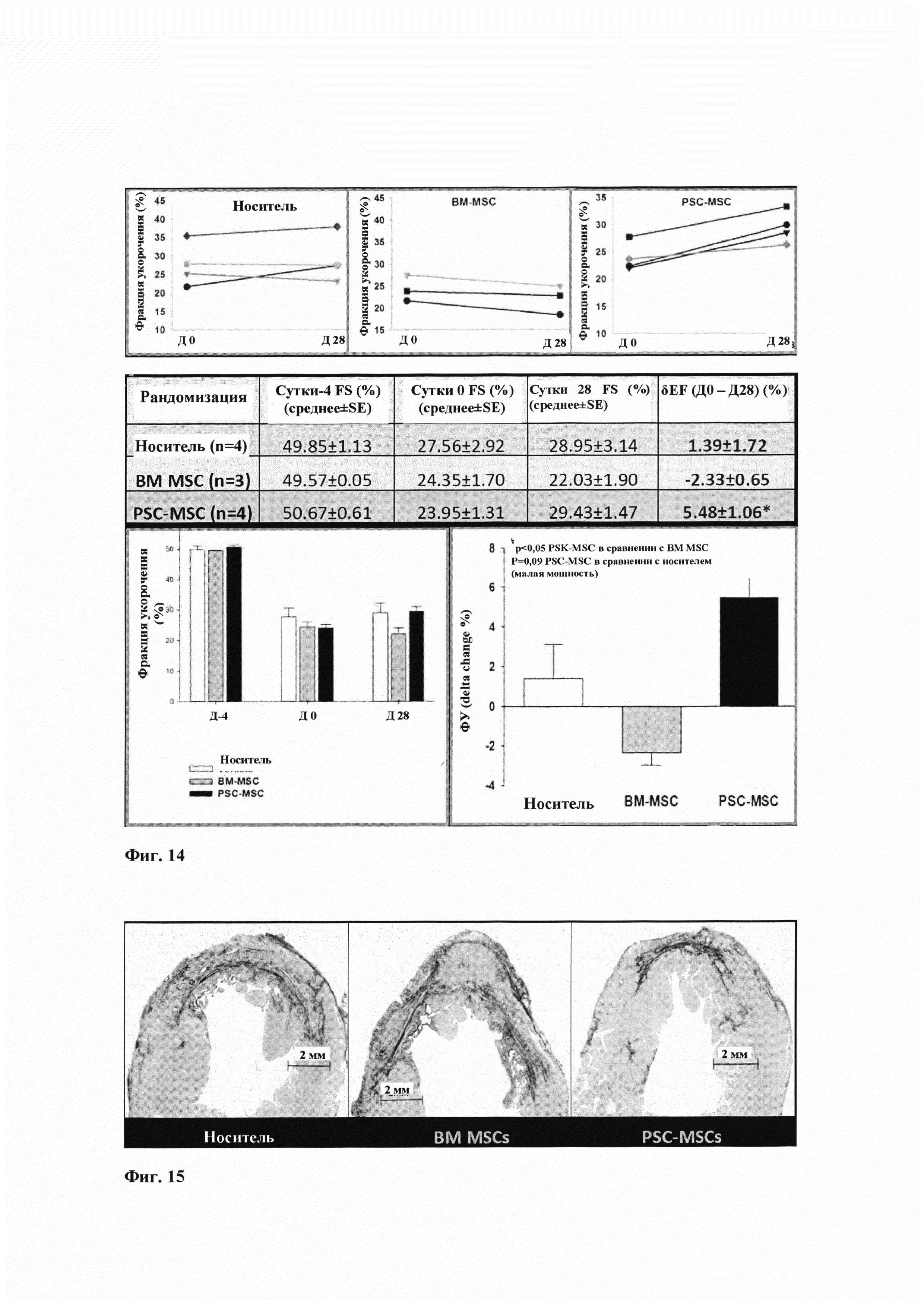
Фиг. 14 демонстрирует функциональную оценку (ТТЕ) и содержит линейные графики, показывающие отдельные оценки, и столбчатые диаграммы, показывающие групповую оценку фракции укорочения (FS) инфарктных сердец из примера 6. В группе носителя исходное значение FS было выше у 1 крысы с инъекцией носителя, но в целом, изменения FS на 28 сутки по сравнению с 0 сутками, за исключением 1 крысы (среднее увеличение 1,39%), отсутствовали или были минимальными. В группе ВМ MSC 3/3 крыс имели ухудшение FS на 28 сутки по сравнению с 0 сутками (среднее снижение 2,3%). В группе PSC-MSC 4/4 крыс имели увеличение FS на 28 сутки по сравнению с 0 сутками (среднее увеличение 5,48%).
Фиг. 15 содержит микрофотографии, показывающие размер рубца с использованием окрашивания пикросириусом красным в инфарктных сердцах из примера 6. На изображениях показано заметное уменьшение размера рубца с использованием окрашивание пикросириусом красным в группах, обработанных PSC-MSC, по сравнению с группами, обработанных носителем и BM-MSC.
Фиг. 16 содержит флуоресцентные микрофотографии оценки ангиогенеза (окрашивание vWF (фактор фон Виллебранда)) в сердцах из примера 6. Изображения демонстрируют отсутствие разницы в размере и количестве сосудов между группами.
Фиг. 17 представляет собой схематическое изображение исследования, аналогичного примеру 6.
Фиг. 18 представляет собой график разброса данных для связанного с GvHD изменения массы в процентах на +19 сутки у мышей из примера 7.
Фиг. 19 представляет собой линейный график, показывающий тяжесть заболевания GvHD (трансплантат против хозяина) у мышей из примера 7.
Фиг. 20 представляет собой график Каплана-Мейера, показывающий GvHD-выживаемость мышей их примера 7.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторами изобретения был определен улучшенный химически определенный, без использования ксеногена, протокол дифференцировки, включающий, в частности, улучшенный, химически определенный, без использования ксеногена, протокол формирования мезенхимальных колоний. Неожиданно, улучшенные протоколы обеспечивают получение MSC с улучшенными иммуносупрессорными свойствами по сравнению с существующими протоколами дифференцировки и формирования мезенхимальных колоний.
В ходе разработки улучшенного, химически определенного, без использования ксеногена, протокола дифференцировки, включающего улучшенный протокол формирования мезенхимальных колоний, авторы изобретения исследовали некоторые переменные, включая: наличие/отсутствие PDGF; наличие/отсутствие LiCl; низкую/высокую концентрацию активина А; и низкую/высокую плотность посева.
Испытывали PDGF, так как в US 7615374 утверждалось, что "PDGF-BB улучшал рост мезенхимальных клеток, но не был существенным для формирования колоний". Однако неожиданно авторы изобретения описывают в данном описании изобретения, что вопреки данному прежнему руководству, в отсутствие PDGF образовывались MSC с улучшенными иммуносупрессорными свойствами по сравнению с MSC, образующимися при помощи дифференцировки в среде, содержащей PDGF.
В отношении активина А, авторы изобретения неожиданно обнаружили, что иммуносупрессия была улучшенной в MSC, дифференцированными в среде, содержащей более низкую концентрацию активина А по сравнению с более высокой концентрацией активина А.
LiCl активирует сигнальный путь Wnt и его включают в среду для дифференцировки для улучшения индукции мезодермы в течение первых 48 часов дифференцировки, что является очевидным в данной области техники.
Однако до настоящего изобретения LiCl не использовали в M-CFM для улучшения формирования колоний в клоногенных культурах. И опять, это являлось неожиданным преимуществом способа, раскрытого в данном описании изобретения.
Таким образом, в данном описании изобретения раскрыты способы дифференцировки PSC (например ESC человека или iPSC человека) в определенный условиях. Такая дифференцировка обеспечивает получение MSC или популяций MSC, которые могут являться источником для функциональных исследований этих клеточных линий, а также источником для клинических лекарственных средств.
Способность MSC проявлять иммуномодулирующие/иммуносупрессорные эффекты, в частности посредством супрессии Т-клеток, считается главной в терапевтических эффектах MSC в широком спектре состояний, включая GvHD, иммунные расстройства, включая аутоиммунные расстройства, сердечнососудистые расстройства, ортопедические расстройства и отторжение трансплантированных солидных органов. Некоторые конкретные примеры включают костные кисты, костные новообразования, переломы, дефекты хрящей, остеоартрит, повреждение связок, несовершенный остеогенез, остеонекроз, остеопороз, апластическую анемию, миелодиспластический синдром; диабет 1 типа, диабет 2 типа, аутоиммунный гепатит, цирроз печени, печеночную недостаточность, дилатационную кардиомиопатию, сердечную недостаточность, инфаркт миокарда, ишемию миокарда, болезнь Крона, язвенный колит, ожоги, буллезный эпидермолиз, красную волчанку, ревматоидный артрит, синдром Шегрена, системный склероз, бронхолегочную дисплазию, хроническую обструктивную болезнь дыхательных путей, эмфизему, фиброз легких, ALS (боковой амиотрофический склероз), болезнь Альцгеймера, травму головного мозга, атаксию, дегенеративное заболевание межпозвонковых дисков, мультисистемную атрофию, рассеянный склероз, болезнь Паркинсона, пигментный ретинит, болезнь Ромберга, повреждение спинного мозга, инсульт, мышечную дистрофию, ишемию конечностей, повреждение почки, волчаночный нефрит, эндометриоз и осложнения при трансплантации костного мозга или солидного органа.
Считается, что MSC играют важную роль в лечении повреждений и было показано, что они являются эффективными в лечении повреждения ткани и дегенеративных заболеваний, включая пищеварительную систему, например цирроза печени и печеночной недостаточности, в костно-мышечной системе, в периодонтальной ткани, при диабетической критической ишемии конечностей, остеонекрозе, связанных с ожогами расстройствах, инфаркте миокарда, повреждении роговицы, в головном мозге, в спинном мозге, в легких, и в лечении радиационного облучения.
MSC показали терапевтические результаты при иммунных расстройствах, включая реакцию «трансплантат против хозяина», системную красную волчанку (SLE), болезнь Крона, мультисистемную атрофию, рассеянный склероз, боковой амиотрофический склероз и инсульт.
Было показано, что MSC проявляют иммуносупрессорные активности против Т-клеток, В-клеток, дендритных клеток, макрофагов и естественных клеток-киллеров. Без связи с какой-либо теорией, лежащие в основе механизмы могут включать иммуносупрессорные медиаторы, например оксид азота, индоламин-2,3-диоксигеназу, простагландин Е2, белок 6 гена индуцируемого фактором некроза опухоли, CCL-2 (С-С-мотив-лиганд 2) и лиганд 1 программируемой смерти. Эти медиаторы экспрессируются на низком уровне до стимуляции, например воспалительными цитокинами, такими как IFNγ, TNFα и IL-17.
В некоторых воплощениях MSC согласно данному описанию изобретения могут быть пересажены в поврежденные ткани после введения и миграции.
MSC могут быть введены системно или периферически, например посредством путей, включающих внутривенный (вв), внутриартериальный, внутримышечный, внутрибрюшинный, интрацереброспинальный, подкожный (пк), внутрисуставный, интрасиновиальный, интратекальный, внутрикоронарный, трансэндокардиальный, хирургическую имплантацию, местный путь введения и ингаляцию (например внутрилегочную). MSC могут быть введены в комбинации с подложкой из биосовместимого вещества.
MSC могут быть введены перед, во время или после повреждения, расстройства или развития заболевания. В одном воплощении MSC вводят во время воспалении. MSC можно вводить (а) в качестве предупредительной меры, (б) сразу после того, как было диагностировано соответствующее состояние, (в) когда другие способы лечения не дали результатов и/или (г) когда состояние приближается к предопределенной степени тяжести.
В одном воплощении MSC предварительно обрабатывают перед введением. Предварительная обработка может быть выполнена с использованием фактора роста или путем редактирования гена, например, когда фактор роста может примировать MSC и редактирование гена может придать MSC новое терапевтическое свойство.
Если не указано иное в данном описании изобретения, технические и научные термины, используемые в данном описании изобретения, имеют такое же значение, которое обычно подразумевается специалистом в области техники, к которой принадлежит данное изобретение, и в ссылках на опубликованные тексты.
Следует отметить, что "а" или "an" относится к одному или более, например подразумевается, что "молекула" обозначает одну или более молекул. Соответственно, "а" или "an", "один или более" и "по меньшей мере один" могут быть использованы взаимозаменяемо в данном описании изобретения.
В формуле изобретения, которая следует ниже, и в описании изобретения, за исключением случаев, когда контекст требует иное из-за языка выражения или необходимо подразумеваемого положения, слово "содержать" или варианты, такие как "содержит" или "содержащий", используются в инклюзивном смысле, то есть для указания на присутствие указанных признаков, но не для исключения присутствия или добавления дополнительных признаков в различных воплощениях изобретения.
Термин "примерно" при использовании в данном описании изобретения подразумевает диапазон значений для заданного числа плюс/минус 25% от величины этого числа. В других воплощениях термин "примерно" подразумевает диапазон значений для заданного числа плюс/минус 20%, плюс/минус 15%, плюс/минус 10% или плюс/минус 5% от величины этого числа. Например, в одном воплощении "примерно 3 грамма" указывает на значение от 2,7 до 3,3 граммов (то есть 3 грамма плюс/минус 10%) и тому подобное.
Аналогично, в то время как способы дифференцировки включают упорядоченные, последовательные события, момент осуществления этих событий может варьироваться по меньшей мере на 25%. Например, в то время как конкретная стадия может быть раскрыта в одном воплощении как продолжающаяся одни сутки, это событие может продолжаться в течение более или менее одних суток. Например, "одни сутки" могут включать период от примерно 18 до примерно 30 часов. В других воплощениях периоды времени могут изменяться на плюс/минус 20%, плюс/минус 15%, плюс/минус 10% или плюс/минус 5% от этого периода времени. Периоды времени указанные как многодневные периоды могут быть кратными "одним суткам", так, например, двое суток могут охватывать период от примерно 36 до примерно 60 часов и тому подобное. В другом воплощении отклонение времени может быть уменьшено, например, когда сутки 2 представляют собой 48±3 часа от суток 0; сутки 4 представляют собой 96±3 часов от суток 0, и сутки 5 представляют собой 120 часов ±3 часа от суток 0.
При использовании в данном описании изобретения "плюрипотентная стволовая клетка" или "PSC" относится к клетке, которая обладает способностью неограниченно воспроизводить себя и дифференцироваться в любой другой тип клеток. Существует два главных типа плюрипотентных стволовых клеток: эмбриональные стволовые клетки (ESC) и индуцированные плюрипотентные стволовые клетки (iPSC).
При использовании в данном описании изобретения "эмбриональные стволовые клетки" или "ESC" относится к клетке, выделенной из пяти-семисуточного эмбриона, предоставленного с согласия пациентов, которые завершили экстракорпоральное оплодотворение и имеют избыточные эмбрионы. Использование ESC в некоторой степени было затруднено по этическим соображениям относительно выделения клеток из человеческих эмбрионов.
Подходящие PSC человека включают эмбриональные стволовые клетки человека H1 и Н9.
При использовании в данном описании изобретения "индуцированная плюрипотентная стволовая клетка" или "iPSC" относится к ESC-подобной клетке, полученной из зрелых клеток. Индуцированные PSC имеют очень похожие характеристики с ESC, но исключают этические соображения, связанные с ESC, так как iPSC не получают из эмбрионов. Вместо этого iPSC обычно получают из полностью дифференцированных зрелых клеток, которые "перепрограммированы" обратно в плюрипотентное состояние.
Подходящие iPSC человека включают, но без ограничения ими, iPSC 19-9-7Т, MIRJT6i-mND1-4 и MIRJT7i-mND2-0, полученные из фибробластов, и iPSC ВМ119-9, полученные из мононуклеарных клеток костного мозга. Другие подходящие iPSC могут быть получены от Cellular Dynamics International (CDI; Nasdaq: ICEL) Madison, WI, USA.
В некоторых воплощениях PSC высевают на чашки с начальной плотностью от примерно 5000 клеток/кв. см до примерно 15000 клеток/кв. см, например 6000 клеток/кв. см, 7000 клеток/кв. см, 8000 клеток/кв. см, 9000 клеток/кв. см, 10000 клеток/кв. см, 11000 клеток/кв. см, 12000 клеток/кв. см, 13000 клеток/кв. см или 14000 клеток/кв. см.
В одном воплощении достаточное время для получения мезенхимальной колонии составляет от примерно 8 суток до примерно 14 суток. В одном воплощении достаточное время для получения мезенхимальной колонии составляет от примерно 10 суток до примерно 14 суток. В одном воплощении достаточное время для получения мезенхимальной колонии составляет от примерно 11 суток до примерно 13 суток. В одном воплощении достаточное время для получения мезенхимальной колонии составляет примерно 8 суток, примерно 9 суток, примерно 10 суток, примерно 11 суток, примерно 13 суток или примерно 14 суток. В одном воплощении достаточное время для получения мезенхимальной колонии составляет примерно 12 суток.
При использовании в данном описании изобретения "первичная мезодермальная клеткаEMHlin-KDR+APLNR+РDGFRальфа+ с мезенхимоангиобластным (МСА) потенциалом" относится к клетке, экспрессирующей гены типичной первичной полоски и боковой пластинки/внеэмбриональной мезодермы. Эти клетки обладают способностью формировать колонии мезенхимоангиобластов (МСА) и гемангиобластов в среде, не содержащей сыворотку, в ответ на FGF2. Согласно способу по настоящему изобретению эти клетки становятся мезенхимальными стволовыми клетками (MSC).
ТерминEMHlin- означает отсутствие экспрессии CD31, эндотелиальных маркеров VE-кадгерина, мезенхимальных/эндотелиальных маркеров CD73 и Cd105 и гемопоэтических маркеров CD43 и CD45.
При использовании в данном описании изобретения "мезенхима" или "мезенхимальный" относится к эмбриональной соединительной ткани, которая происходит из мезодермы и которая дифференцирует в гемопоэтическую ткань (лимфатическая и кровеносная системы) и соединительную ткань, такую как кость и хрящ. Однако MSC не дифференцируются в гемопоэтические клетки.
При использовании в данном описании изобретения "мезенхимальная колония" относится к мезенхимальным предшественникам CD73, которые являются предшественниками истинным MSC. Для продуцирования CD73+ MSC требуется дополнительная адгезивная культура мезенхимальных колоний, например на чашках, по крытых фибронектином/коллагеном.
При использовании в данном описании изобретения "мезенхимальная стволовая клетка" или "MSC" относится к особому типу стволовой клетки, которая может быть выделена из широкого спектра тканей, включая костный мозг, жировую ткань (жир), плаценту и пуповинную кровь. MSC также известны как "мезенхимальные стромальные клетки". Согласно способу по настоящему изобретению MSC образуются из первичных мезодермальных клетокEMHlin-KDR+APLNR+РDGFRальфа+ с мезенхимоангиобластным потенциалом (МСА).
MSC секретируют биоактивные молекулы, такие как цитокины, хемокины и факторы роста, и обладают способностью модулировать иммунную систему. Было доказано, что MSC облегчают регенерацию и влияют на иммунную систему независимо от приживления. Другими словами, сами по себе MSC необязательно становятся встроенными в хозяина - скорее, они проявляют свои эффекты и затем элиминируются в течение короткого периода времени. Однако MSC могут быть приживлены.
Терапевтические MSC могут быть либо "аутогенными", либо "аллогенными". При использовании в данном описании изобретения "аутогенный" означает, что пациента лечат его собственными клетками, выделенными, например, из костного мозга или жировой ткани, тогда как "аллогенный" означает, что клетки донора используют для лечения других людей. Согласно настоящему изобретению аллогенные MSC получают от донора при помощи iPSC.
Не было показано, что аллогенные MSC вызывают иммунные реакции у других людей, таким образом, они не требуют иммунной совместимости донора с реципиентом. Это имеет важные коммерческие преимущества.
При использовании в данном описании изобретения, "мезенхимоангиобласт" или "МСА" относится к клетке, которая является предшественником MSC. MSC может быть получена способом по изобретению.
При использовании в данном описании изобретения "дифференцировка" относится к процессу преобразования клетки из одного типа клеток в другой, в частности, когда менее специализированный тип клетки становится более специализированным типом клетки.
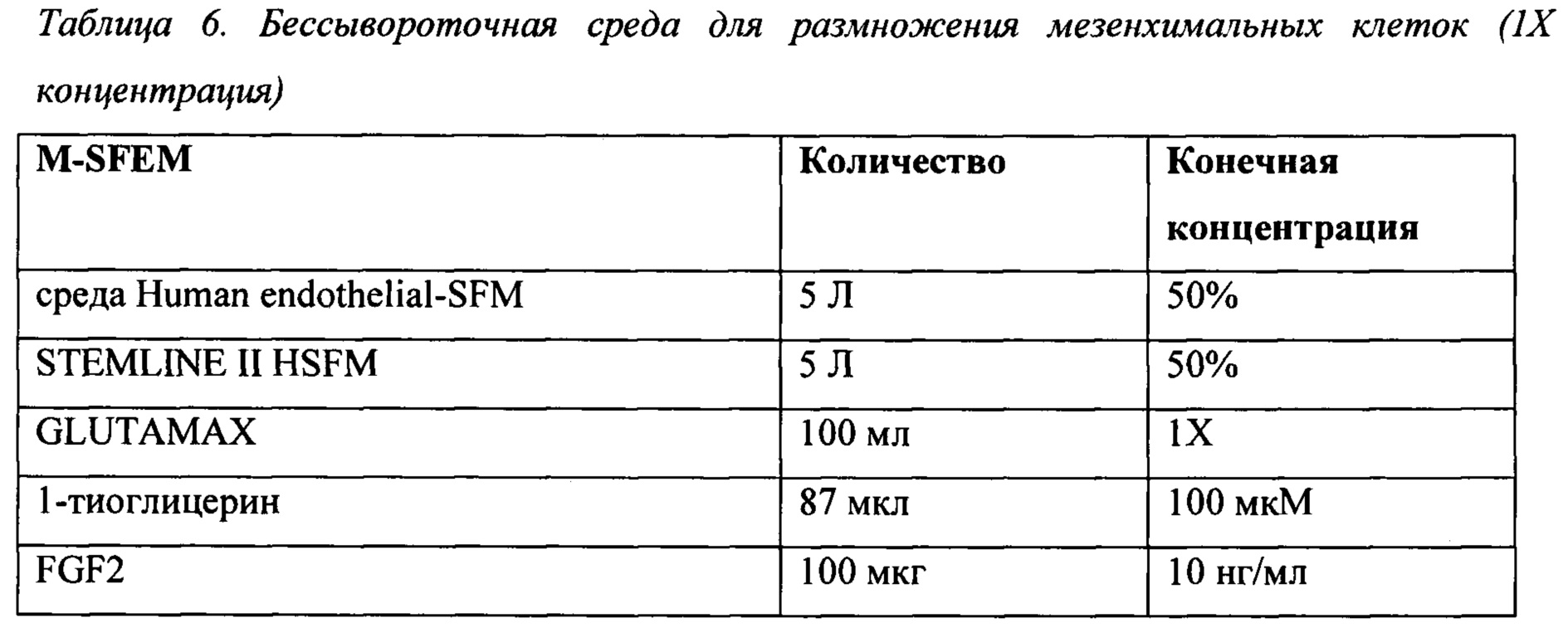
При использовании в данном описании изобретения "среда" или ее множественное число "среды" относится к жидкости или гелю, предназначенным для поддержания роста клеток. В некоторых воплощениях среда для культивирования клеток содержит среду IF9S. В некоторых воплощениях в среде используют концентрированную добавку для среды 9S, где в результате разбавления концентрированной добавки для среды 9S в основной среде IMDM/F12 получают среду IF9S для культивирования клеток. Концентрированная добавка для среды 9S содержит 9 следующих добавок: Mg2+ соль 2-фосфатной формы L-аскорбиновой кислоты, l-тиоглицерин (монотиоглицерин), добавочный селенит натрия, поливиниловый спирт, GLUTAMAX™ (или глутамин), заменимые аминокислоты, химически определенный липидный концентрат, голотрансферрин и инсулин. В некоторых воплощениях концентрированная добавка для среды 9S содержит каждый компонент в концентрации от 10× до 1000× конечной рабочей концентрации, однократно разбавленной в основной среде. В одном воплощении среда IF9S содержит IMDM, F12 и 9S, как изложено ниже: IMDM 0,5х, F12 0,5х, бикарбонат натрия 2,1 мг/мл, Mg2+ соль 2-фосфатной формы L-аскорбиновой кислоты (64 мкг/мл), l-тиоглицерин (50 мкг/мл (460 мкМ, 40 мкл/л)), селенит натрия (в дополнение к любому, присутствующему в основной среде; 8,4 нг/мл), поливиниловый спирт (10 мг/мл), GLUTAMAX™ (1×), заменимые аминокислоты (1×), химически определенный липидный концентрат (1×), голотрансферрин (10,6 мкг/мл) и инсулин (20 мкг/мл).
Хотя раскрытые здесь среды могут включать специальные компоненты (например морфогены, малые молекулы и гемопоэтические цитокины), предполагается, что можно использовать другие компоненты с такими же, эквивалентными или аналогичными свойствами в дополнение к раскрытым или вместо них, как это известно в данной области техники.
В некоторых воплощениях компоненты среды IF9S можно замещать. Например, аскорбиновая кислота и l-тиоглицерин могут быть замещены возможной добавкой соединения и/или тиолсодержащего соединения с антиоксидантными свойствами. GLUTAMAX™ может быть замещен возможной добавкой L-глутамина. Термин "заменимые аминокислоты", который является общим термином для аминокислот, которые организм человека может продуцировать из других аминокислот, могут быть замещены возможной добавкой аминокислот."Химически определенный липидный концентрат", который представляет собой раствор, конкретно распространяемый Life Technologies, может быть заменен возможной добавкой липидов. Добавочный селенит, инсулин и голотрансферрин могут быть замещены любой добавкой инсулин-трансферрин-селенит. Поливиниловый спирт может быть замещен возможной добавкой биологически неактивного загущающего соединения для сред.
При использовании в данном описании изобретения "среда для дифференцировки" относится к среде, предназначенной для поддерживания дифференцировки клетки, то есть поддерживания процесса преобразования клетки из одного типа клеток в другой. В соответствии со способом по настоящему изобретению, среду для дифференцировки используют для поддерживания процесса преобразования PSC человека в первичную мезодермальную клеткуEMHlin-KDR+APLNR+PDGFRaльфa+ с мезенхимоангиобластным (МСА) потенциалом.
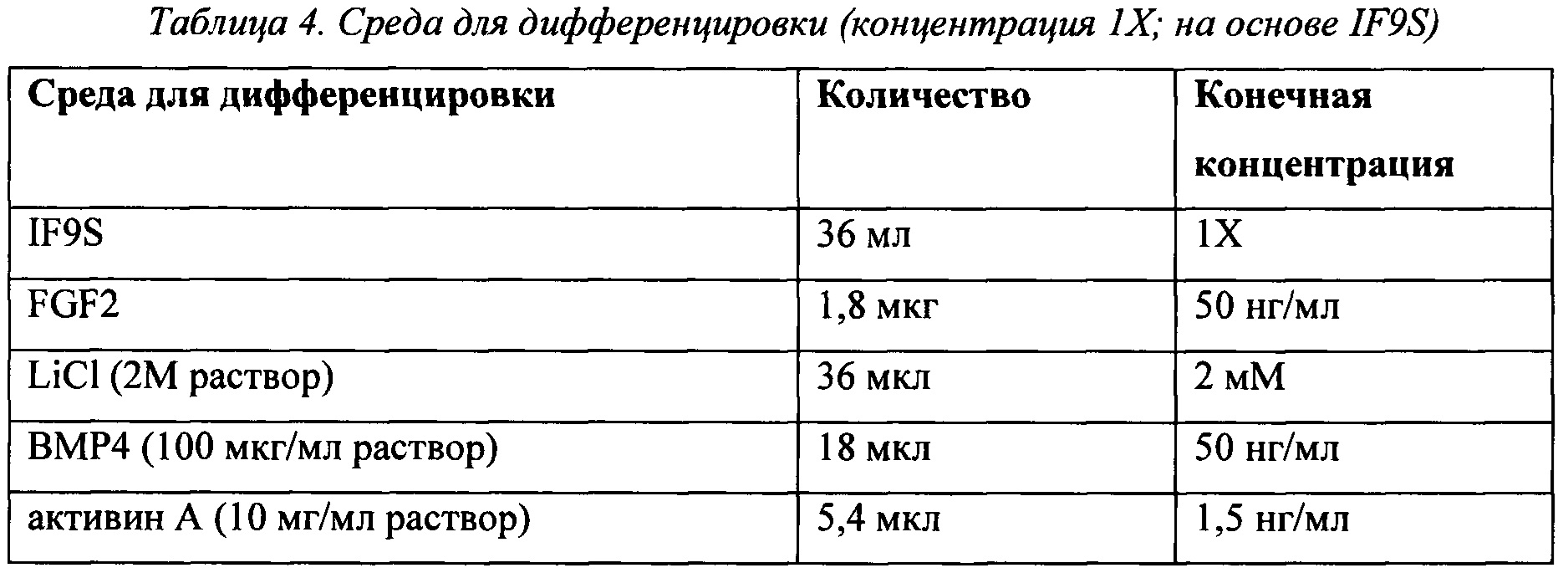
В некоторых воплощениях в среде для дифференцировки концентрация ВМР4 составляет от примерно 10 нг/мл до примерно 250 мг/мл; концентрация активина А составляет от примерно 1 нг/мл до примерно 15 нг/мл; концентрация FGF2 составляет от примерно 5 нг/мл до примерно 50 нг/мл; и концентрация LiCl составляет от примерно 1 мМ до примерно 2 мМ.
В некоторых воплощениях концентрация ВМР4 в среде для дифференцировки составляет примерно 10 нг/мл, примерно 15 нг/мл, примерно 20 нг/мл, примерно 25 нг/мл, примерно 30 нг/мл, примерно 35 нг/мл, примерно 40 нг/мл, примерно 45 нг/мл, примерно 50 нг/мл, примерно 60 нг/мл, примерно 70 нг/мл, примерно 80 нг/мл, примерно 90 нг/мл, примерно 100 нг/мл, примерно 110 нг/мл, примерно 120 нг/мл, примерно 130 нг/мл, примерно 140 нг/мл, примерно 150 нг/мл, примерно 160 нг/мл, примерно 170 нг/мл, примерно 180 нг/мл, примерно 190 нг/мл, примерно 200 нг/мл, примерно 210 нг/мл, примерно 220 нг/мл, примерно 230 нг/мл, примерно 240 нг/мл или примерно 250 нг/мл.
Концентрация активина А в среде для дифференцировки может представлять собой примерно 1 нг/мл, примерно 2 нг/мл, примерно 3 нг/мл, примерно 4 нг/мл, примерно 5 нг/мл, примерно 6 нг/мл, примерно 7 нг/мл, примерно 8 нг/мл, примерно 9 нг/мл, примерно 10 нг/мл, примерно 11 нг/мл, примерно 12 нг/мл, примерно 13 нг/мл, примерно 14 нг/мл или примерно 15 нг/мл.
Концентрация FGF2 в среда для дифференцировки может представлять собой примерно 1 нг/мл, примерно 5 нг/мл, примерно 10 нг/мл, примерно 15 нг/мл, примерно 20 нг/мл, примерно 25 нг/мл, примерно 30 нг/мл, примерно 35 нг/мл, примерно 40 нг/мл, примерно 45 нг/мл или примерно 50 нг/мл.
Концентрация LiCl в среде для дифференцировки может представлять собой примерно 0,5 мМ, примерно 0,6 мМ, примерно 0,7 мМ, примерно 0,8 мМ, примерно 0,9 мМ, примерно 1 мМ, примерно 1,1 мМ, примерно 1,2 мМ, примерно 1,3 мМ, примерно 1,4 мМ, примерно 1,5 мМ, примерно 1,6 мМ, примерно 1,7 мМ, примерно 1,8 мМ, примерно 1,9 мМ, примерно 2 мМ, примерно 2,1 мМ, примерно 2,2 мМ, примерно 2,3 мМ, примерно 2,4 мМ, или примерно 2,5 мМ. Предпочтительно, как подразумевается в данной области техники, концентрация LiCl в среде для дифференцировки может составлять примерно 2 мМ.
В некоторых воплощениях среда для дифференцировки содержит основную среду, Мg2+ соль 2-фосфатной формы L-аскорбиновой кислоты, 1-тиоглицерин, селенит натрия (в дополнении к любому, присутствующему в основной среде), поливиниловый спирт, GLUTAMAX™, заменимые аминокислоты, химически определенный липидный концентрат, голотрансферрин и инсулин. Подходящие основные среды для сред для дифференцировки, описанные в данном описании изобретения, включают, но без ограничения ими, среду Дульбекко, модифицированную по способу Исков/F12 (IMDM/F12), основную среду TeSR1 (основная среда mTeSR1™, Stem Cell Technologies) без FGF2 и TGF-бета; основную среду DF4S, которая представляет собой среду Essential 8™ (Life Technologies; также известную как среда "Е8") без FGF2 и TGF-бета, основную среду I4S, которая представляет собой основание DF4S со средой Дульбекко, модифицированной по способу Исков (IMDM), вместо DMEM/F12 и основание IF4S представляет собой основание DF4S с IMDM/F12 вместо DMEM/F12. Предпочтительно, основная среда для использования не содержит альбумин. IMDM/F12 представляет собой высокообогащенную синтетическую среду, подходящую для быстропролиферирующих клеточных культур с высокой плотностью, с добавленной питательной смесью. Эти среды известны специалисту в данной области техники.
В некоторых воплощениях среда, упоминаемая в данном описании изобретения как "IF9S", содержит IMDM/F12, Mg2+ соль 2-фосфатной формы L-аскорбиновой кислоты, 1-тиоглицерин, селенит натрия (в дополнению к любому, присутствующему в основной среде), поливиниловый спирт, GLUTAMAX™, заменимые аминокислоты, химически определенный липидный концентрат, голотрансферрин и инсулин.
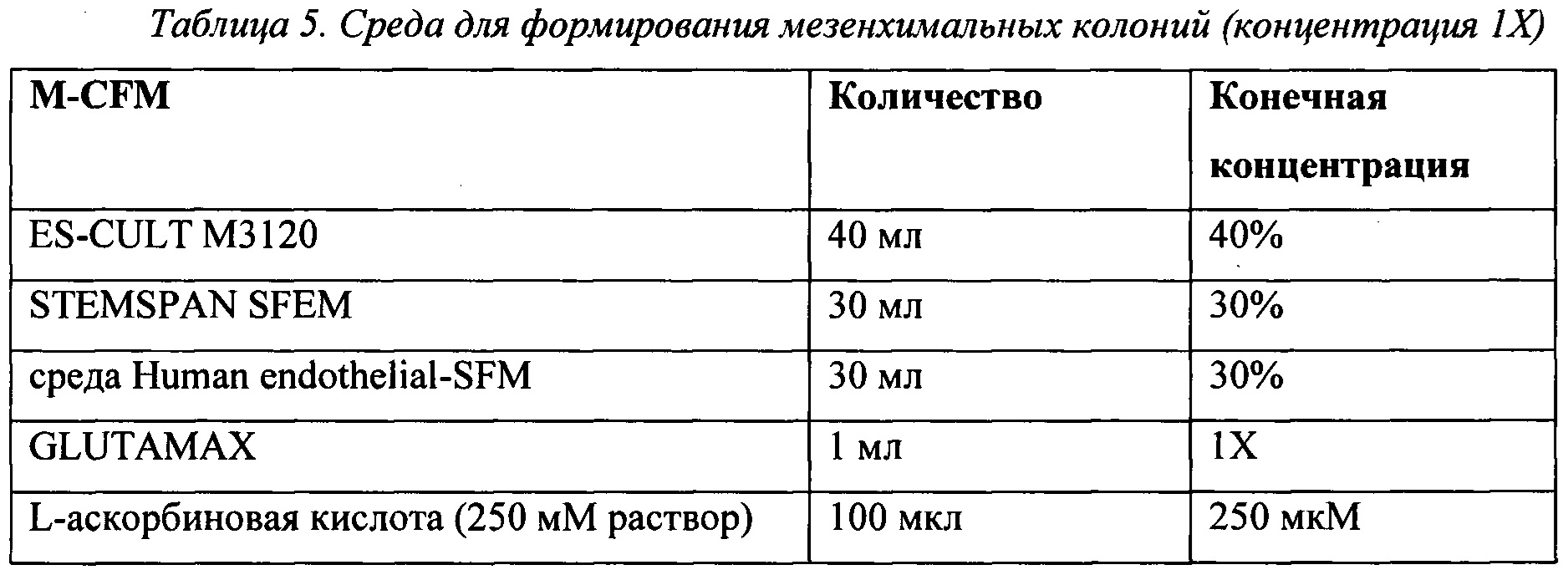
При использовании в данном описании изобретения "среда для формирования мезенхимальных колоний (М-CFM)" относится к среде, предназначенной поддерживать формирование мезенхимальных колоний из первичной мезодермальной клеткиEMHlin-KDR+APLNR+РDGFRальфа+ с мезенхимоангиобластным потенциалом (МСА).
В некоторых воплощениях концентрация в M-CFM LiCl составляет примерно 1 мМ и концентрация FGF2 составляет примерно 10 нг/мл; или концентрация LiCl составляет примерно 1 мМ и концентрация FGF2 составляет примерно 20 нг/мл.
Концентрация FGF2 в М-CFM может составлять примерно 1 нг/мл, примерно 5 нг/мл, примерно 10 нг/мл, примерно 15 нг/мл, примерно 20 нг/мл, примерно 25 нг/мл, примерно 30 нг/мл, примерно 35 нг/мл, примерно 40 нг/мл, примерно 45 нг/мл или примерно 50 нг/мл.
Концентрация LiCl в М-CFM может составлять примерно 0,5 мМ, примерно 0,6 мМ, примерно 0,7 мМ, примерно 0,8 мМ, примерно 0,9 мМ, примерно 1 мМ, примерно 1,1 мМ, примерно 1,2 мМ, примерно 1,3 мМ, примерно 1,4 мМ, примерно 1,5 мМ, примерно 1,6 мМ, примерно 1,7 мМ, примерно 1,8 мМ, примерно 1,9 мМ, примерно 2 мМ, примерно 2,1 мМ, примерно 2,2 мМ, примерно 2,3 мМ, примерно 2,4 мМ, или примерно 2,5 мМ. Предпочтительно, концентрация LiCl в М-CFM составляет 1 мМ. Как указано выше, включение LiCl в М-CFM для улучшения колониеобразования у клоногенных культур не было известно до настоящего изобретения и обеспечивает явные преимущества способа, раскрытого в данном описании изобретения, по сравнению со способами, известными в данной области техники.
При упоминании в данном описании изобретения, термин "определенная среда" означает, что наименование и количество каждого компонента среды известно.
В некоторых воплощениях среда, раскрытая в данном описании изобретения, содержит ксеногенные вещества. При использовании в данном описании изобретения "ксеноген" или "ксеногенный" относится к полученным биологическим методом веществам, не являющимся человеческими. При этом ксеногенные вещества могут быть определены. Например, ксеногенное вещество может представлять собой рекомбинантный белок ксеногенного происхождения. В одном воплощении среда для дифференцировки и/или М-CFM содержит один или более ксеногенных (например рекомбинантных) белков, не являющихся человеческими.
В некоторых воплощениях среда или среды не содержат ксеногенов. Особо важным для клинической терапии является отсутствие ксеногенных веществ в полученных клеточных популяциях, то есть отсутствие не являющихся человеческими клеток, клеточных фрагментов, сывороток, белков и тому подобного. В одном воплощении не содержащие ксеногена дифференцированные клетки получают, используя тенасцин С или коллаген IV, что по существу заменяет контакт с клетками ОР9, используемыми в предыдущих системах дифференцировки.
Предпочтительно, заданные среды могут не содержать ксеноген и включают белки человека, выделенные из естественных источников, таких как плацента или другие ткани человека, или которые могут быть получены с использованием рекомбинантной технологии. В некоторых воплощениях все белки, используемые в данном изобретении, представляют собой белки человека. В некоторых воплощениях все белки, используемые в среде для дифференцировки, представляют собой белки человека. В некоторых воплощениях все белки, используемые в среде М-CFM, представляют собой белки человека. В некоторых воплощениях все белки, описанные в данном описании изобретения, представляют собой рекомбинантные белки человека. В некоторых воплощениях все белки, используемые в среде для дифференцировки, представляют собой рекомбинантные белки человека. В некоторых воплощениях все белки, используемые в среде М-CFM, представляют собой рекомбинантные белки человека.
Все белки, описанные в данном описании изобретения, известны специалисту в данной области техники, и большинство, если не все, белки, описанные в данном описании изобретения, имеются в продаже.
Среды, раскрытые в данном описании изобретения, также могут быть изготовлены в концентрированных, включающих сухие, формах, которые разбавляют перед применением, например в 2×, 10×, 100× или 1000× концентрациях.
При использовании в данном описании изобретения "культивирование" относится к процессу, посредством которого клетки выращивают в контролируемых условиях.
Клетки нельзя поддерживать в культуре неограниченно из-за увеличения концентрации токсичных метаболитов, снижения концентрации питательных веществ и, для делящихся клеток, увеличения количества клеток. При использовании в данном описании изобретения, "пассирование" относится к процессу получения новой культуры с восстановленными концентрациями питательных веществ, отсутствием токсичных метаболитов и возможно более низкой плотностью клеток, чем в исходной культуре.
В одном воплощении пассирование включает: культивирование мезенхимальной колонии в течение примерно 3 суток; культивирование мезенхимальной колонии на фибронектине и/или коллагене I; и/или 1, 2, 3, 4, 5 или 6 пассажей. Количество пассажей может составлять 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. Предпочтительно, количество пассажей составляет 10 или менее. Более предпочтительно, количество пассажей составляет 5 или 6.
При использовании в данном описании изобретения "гипоксический" относится к условиям, в которых концентрация кислорода в газовой смеси составляет от примерно 3% О2 до примерно 10% О2. В некоторых воплощениях гипоксические условия представляют собой примерно 5% О2, но могут представлять собой примерно 4% О2, примерно 6% О2, примерно 7% О2, примерно 8% О2 или примерно 9% О2. В воплощениях, где среду для культивирования клеток оставляют уравновешиваться в гипоксических условиях, среда для культивирования клеток становится гипоксической из-за более низкой концентрации кислорода, растворенного в среде, по сравнению со средой для культивирования клеток, уравновешенной в условиях с нормальным содержанием кислорода.
При использовании в данном описании изобретения "нормальное содержание кислорода" относится к условиям, в которых концентрация кислорода в газовой смеси составляет примерно 20% О2, но может составлять примерно 18% О2, примерно 19% О2, примерно 21% О2 или примерно 22% О2.
При использовании в данном описании изобретения "АА" относится к активину А. В одном воплощении активин А существует в виде гомодимера полипептида, представленного аминокислотной последовательностью, показанной на Фиг. 1 как SEQ ID NO: 1.
При использовании в данном описании изобретения "ВМР4" относится к костному морфогенетическому белку 4. В одном воплощении ВМР4 существует в виде гомодимера полипептида, представленного аминокислотной последовательностью, показанной на Фиг. 2 как SEQ ID NO: 2.
В одном воплощении "коллаген I типа" или "коллаген I" существует в виде трехспирального тримера, содержащего два полипептида, представленных аминокислотной последовательностью, показанной на Фиг. 3 как SEQ ID NO: 3, и третью цепь коллагена I.
В одном воплощении "коллаген IV типа" или "коллаген IV" существует в виде трехспирального гетеротримера, содержащего один полипептид, представленный в виде аминокислотной последовательности, показанной на Фиг. 4 как SEQ ID NO: 4, и две дополнительные цепи коллагена IV.
При использовании в данном описании изобретения "FGF2" относится к фактору роста фибробластов 2, также известному как основной фактор роста фибробластов. В одном воплощении FGF2 существует в виде полипептида, представленного в виде аминокислотной последовательности, показанной на Фиг. 5 как SEQ ID NO: 5.
В одном воплощении фибронектин существует в виде димера полипептида, представленного аминокислотной последовательностью, показанной на Фиг. 6 как SEQ ID NO: 6.
При использовании в данном описании изобретения "PDGF" относится к тромбоцитарному фактору роста. В одном воплощении PDGF существует в виде гомодимера полипептида В-субъединицы, представленного аминокислотной последовательностью, показанной на Фиг. 7 как SEQ ID NO: 7 (PDGF-BB). В данном описании изобретения раскрыто, что добавление PDGF (10 нг/мл) в М-CFM во время культивирования сопровождалось значительным негативным воздействием на иммуносупрессию MSC, полученных из iPSC (4-кратное снижение).
В одном воплощении "тенасцин С" существует в виде гексамера полипептида, представленного аминокислотной последовательностью, показанной на Фиг. 8 как SEQ ID NO: 8.
В некоторых воплощениях адгезивные PSC человека культивируют на тенасцине С или предоставляют на субстрате, обработанном тенасцином С. В некоторых воплощениях любые из вышеуказанных клеток (например PSC человека, iPSC человека) культивируют на тенасцине С. В некоторых воплощениях любые из описанных клеток высевают на субстрат, обработанный некоторым количеством тенасцина С, достаточным для адгезии на субстрат 10000 клеток/кв. см. В некоторых воплощениях тенасцин С представляет собой тенасцин С человека (например содержащий аминокислотную последовательность, представленную SEQ ID NO: 8, или предоставленную GenBank, учетный номер САА55309.1, или имеющуюся в продаже, например у Millipore, номер по каталогу СС065). В некоторых воплощениях субстрат обрабатывают тенасцином С в количестве от по меньшей мере примерно 0,25 мкг/кв. см до примерно 1 мкг/кв. см, например 0,3 мкг/кв. см, 0,4 мкг/кв. см, 0,5 мкг/кв. см, 0,6 мкг/кв. см, 0,7 мкг/кв. см, 0,8 мкг/кв. см или 0,9 мкг/кв. см. Клетки можно выращивать, например, на чашках для культуры клеток, покрытых тенасцином С, многолуночных планшетах для культуры клеток или гранулах-микроносителях.
Использование тенасцина С и гипоксических условий может обеспечить возможность образования первичных мезодермальных клетокEMHlin-KDR+APLNR+РDGFRальфа+ с мезенхимоангиобластным (МСА) потенциалом и мезенхимальных стволовых клеток в более высоких процентных концентрациях по сравнению с клетками, культивированными на коллагене IV или клетками ОР9, например выше чем на 10%, или выше чем на примерно 20%, или выше чем на примерно 30%, или выше чем на примерно 35%, или выше чем на примерно 40%, или выше чем на примерно 50%, или выше чем на примерно 60%, или выше чем на примерно 70%, или выше чем на примерно 80%, при сравнении на стадию на платформу.
При использовании в данном описании изобретения термин "улучшенные свойства иммуносупрессии Т-клеток" относится к способности MSC обеспечивать большую величину подавления пролиферации Т-хелперных (CD4+) лимфоцитов по сравнению с контролем, определенную, например, с использованием анализа иммуногенной потенции (ImmunoPotency Assay).
Улучшенные свойства иммуносупрессии Т-клеток могут представлять собой примерно 1%-ное увеличение, примерно 2%-ное увеличение, примерно 3%-ное увеличение, примерно 4%-ное увеличение, примерно 5%-ное увеличение, примерно 6%-ное увеличение, примерно 7%-ное увеличение, примерно 8%-ное увеличение, примерно 9%-ное увеличение, примерно 10%-ное увеличение, примерно 20%-ное увеличение, примерно 30%-ное увеличение, примерно 40%-ное увеличение, примерно 50%-ное увеличение, примерно 60%-ное увеличение, примерно 70%-ное увеличение, примерно 80%-ное увеличение, примерно 90%-ное увеличение, примерно 100%-ное или более увеличение свойств иммуносупрессии Т-клеток у MSC или популяции MSC, полученных согласно способу, раскрытому в данном описании изобретения. Альтернативно, улучшенные свойства иммуносупрессии Т-клеток могут представлять собой примерно 2-кратное, примерно 3-кратное, примерно 4-кратное, примерно 5-кратное, примерно 6-кратное, примерно 7-кратное, примерно 8-кратное, примерно 9-кратное, примерно 10-кратное или более увеличение свойств иммуносупрессии Т-клеток у MSC или популяции MSC, полученных согласно способу, раскрытому в данном описании изобретения.
В подходящем анализе иммуногенной потенции используют облученные тестируемые MSC (например iPSC-MSC, полученные согласно способу, раскрытому в данном описании изобретения) и облученный контрольный образец MSC, которые высевают на чашки раздельно в различных концентрациях с очищенными из периферической крови здорового донора лейкоцитами, мечеными карбоксифлуоресцеин-сукцинимидиловым эфиром. Т-хелперные (CD4+) лимфоциты, которые представляют собой подгруппу контрольного образца, стимулируют путем добавления CD3- и CD28-антител. Т-клетки, меченные CD4, подсчитывают, используя проточную цитометрию, чтобы оценить пролиферацию Т-клеток. Значения IC50 регистрируют как функцию контрольного образца. Более высокое значение IC50 указывает на большую величину подавления пролиферации Т-хелперных (CD4+) лимфоцитов и, таким образом, является показателем улучшенных свойств иммуносупрессии Т-клеток. Образцы MSC облучают до использования в этом анализе для исключения фактора, искажающего их пролиферативный потенциал.
Специалисту в данной области техники понятно, что точный способ введения субъекту терапевтически эффективного количества MSC или популяции MSC, дифференцированной согласно настоящему способу, для лечения состояния, заболевания или расстройства, остается на усмотрение лечащего врача. На режим введения, включая дозировку, комбинацию с другими агентами, выбор времени и частоты введения, и тому подобное может оказывать влияние диагноз вероятной восприимчивости субъекта к лечению с помощью MSC или популяции MSC, а также состояние и история болезни субъекта.
При использовании в данном описании изобретения термин "терапевтическая композиция" относится к композиции, содержащей MSC или популяцию MSC, как описано в данном описании изобретения, которая приготовлена в виде лекарственного препарата для введения субъекту. Предпочтительно, терапевтическая композиция является стерильной. В одном воплощении терапевтическая композиция является апирогенной.
MSC или популяцию MSC готовят в виде препарата, дозируют и вводят способом, согласующимся с надлежащей медицинской практикой. Факторы для рассмотрения в данном контексте включают конкретный тип расстройства, подлежащего лечению, конкретного субъекта, подлежащего лечению, клиническое состояние субъекта, место введения, способ введения, схему введения, возможные побочные эффекты и другие факторы, известные лечащим врачам. Терапевтически эффективное количество MSC или популяции MSC, подлежащее введению, будет регулироваться такими соображениями.
MSC или популяция MSC может быть введена субъекту любым подходящим способом, включая внутривенный (ВВ), внутриартериальный, внутримышечный, внутрибрюшинный, интрацереброспинальный, подкожный (ПК), внутрисуставный, интрасиновиальный, интратекальный, внутрикоронарный, трансэндокардиальный, хирургическую имплантацию, местный и ингаляционный (например внутрилегочный) пути. Наиболее предпочтительно MSC или популяцию MSC вводят ВВ (внутривенно).
Термин "терапевтически эффективное количество" относится к количеству MSC или популяции MSC, эффективному для лечения состояния, заболевания или расстройства у субъекта.
Термины "лечить", "лечащий" или "лечение" относятся как к терапевтическому лечению, так и к профилактическим или предупредительным мерам, целью которых является предупреждение или улучшение состояния, заболевания или расстройства у субъекта или замедление (уменьшение) прогрессирования состояния, заболевания или расстройства у субъекта. Субъекты, нуждающиеся в лечении, включают тех, кто уже имеет это состояние, заболевание или расстройство, а также тех, у которых это состояние, заболевание или расстройство следует предупредить.
Термины "предупреждающий", "предупреждение", "превентивный" или "профилактический" относятся к предотвращению возникновения, или к затруднению, защите или предохранению от возникновения состояния, заболевания или расстройства, включая отклонение от нормы или симптом. Субъект, нуждающийся в предупреждении, может быть предрасположенным к развитию состояния, заболевания или расстройства.
Термин "улучшать" или "улучшение" относится к уменьшению, снижению или ликвидации состояния, заболевания или расстройства, включая отклонение от нормы или симптом. Субъект, нуждающийся в лечении, может уже иметь состояние, заболевание или расстройство, или может быть предрасположенным к состоянию, заболеванию или расстройству, или может представлять собой того, у кого состояние, заболевание или расстройство следует предупредить.
При использовании в данном описании изобретения термин "субъект" относится к млекопитающему. Млекопитающее может представлять собой примата, в частности человека, или может представлять собой домашнее животное, животное из зоопарка или животное-компаньон. Хотя, в частности, предполагается, что способ и полученная в результате MSC или популяция MSC, раскрытые в данном описании изобретения, являются подходящими для лечения людей, они также применимы в ветеринарном лечении, включая лечение домашних животных, таких как лошади, крупный рогатый скот и овцы, животные-компаньоны, такие как собаки и кошки, или животные из зоопарка, такие как животные семейства кошачьих, псовых, полорогих и копытных.
ПРИМЕРЫ
Пример 1 - Реагенты
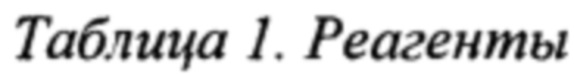

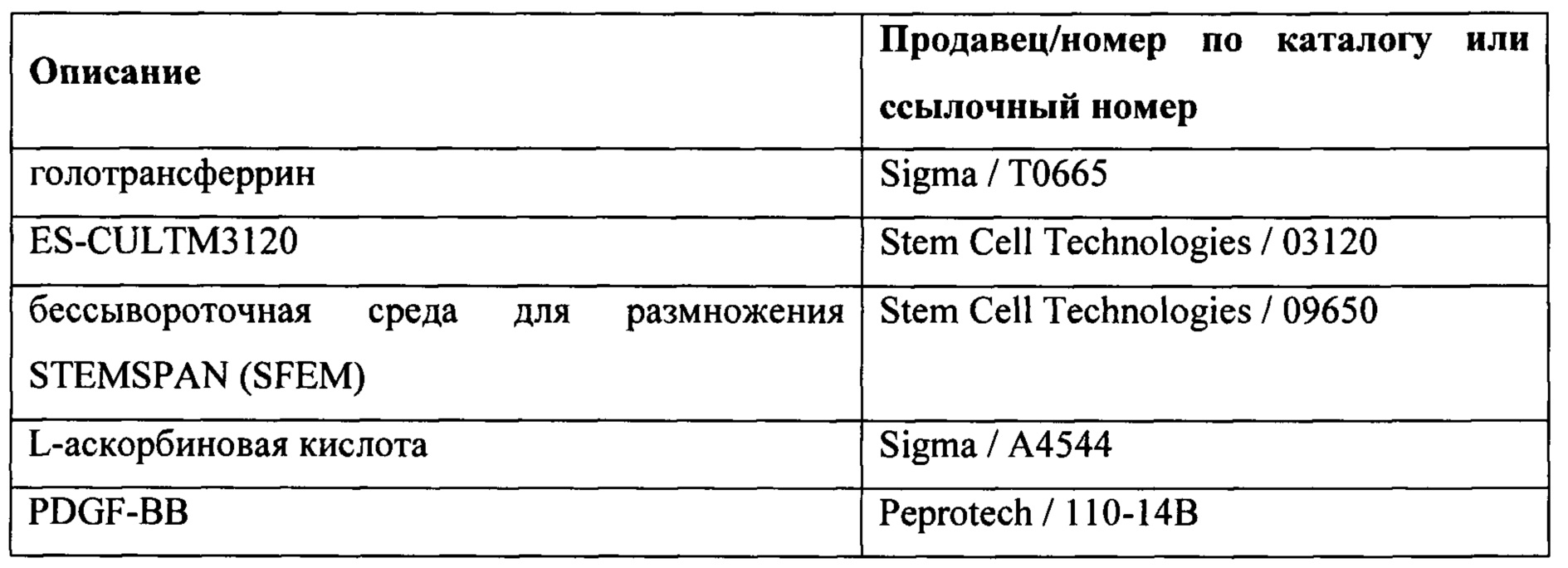
Реагенты, перечисленные в Таблице 1, известны специалисту в данной области техники и имеют общеизвестные составы, например IMDM и F12 Хама. GLUTAMAX содержит L-аланил-L-глутамин-дипептид, обычно поставляемый в концентрации 200 мМ в 0,85% NaCl. GLUTAMAX высвобождает L-глутамин при расщеплении дипептидной связи культивируемыми клетками. Химически определенный липидный концентрат содержит арахидоновую кислоту 2 мг/л, холестерин 220 мг/л, DL-альфа-токоферола ацетат 70 мг/л, линолевую кислоту 10 мг/л, линоленовую кислоту 10 мг/л, миристиновую кислоту 10 мг/л, олеиновую кислоту 10 мг/л, пальмитиновую кислоту 10 мг/л, пальмитолеиновую кислоту 10 мг/л, плюроник F-68 90 г/л, стеариновую кислоту 10 мг/л, TWEEN 80® 2,2 г/л и этиловый спирт. Н-1152 и Y27632 представляют собой высокоактивные, клеточно-проникающие, селективные ингибиторы ROCK (Rho-ассоциированная серин/треониновая протеинкиназа, образующая скрученную спираль).




Пример 2 - Протокол дифференцировки PSC человека в MSC
1 - Оттаивали iPSC в полной среде Е8 (основная среда DMEM/F12 + добавка Е8) + 1 мкМ H1152 на покрытой витронектином (0,5 мкг/кв. см) пластмассовой посуде. Инкубировали посеянные iPSC при 37°С, 5% CO2, 20% O2 (с нормальным содержанием кислорода).
2 - Размножали iPSC в трех пассажах в полной среде Е8 (без ингибитора ROCK) на покрытой витронектином (0,5 мкг/кв. см) пластмассовой посуде и инкубировали при 37°С, 5% СО2, 20% O2 (с нормальным содержанием кислорода), чтобы инициировать процесс дифференцировки.
3 - Собирали и высевали iPSC в виде отдельных клеток/небольших колоний в количестве 5×103 клеток/кв. см на покрытую коллагеном IV (0,5 мкг/кв. см) пластмассовую посуду в полной среде Е8 + 10 мкМ Y27632 и инкубировали при 37°С, 5% СО2, 20% О2 (с нормальным содержанием кислорода) в течение 24 ч.
4 - Заменяли полную среду Е8 + 10 мкМ Y27632 средой для дифференцировки и инкубировали при 37°С, 5% СО2, 5% O2 (гипоксия) в течение 48 ч.
5 - Собирали колониеобразующие клетки из адгезивной культуры клеток в среде для дифференцировки в виде суспензии отдельных клеток, переносили в суспензионную культуру М-CFM и инкубировали при 37°С, 5% CO2, 20% O2 (с нормальным содержанием кислорода) в течение 12 суток.
6 - Собирали и высевали колоний (пассаж 0) на покрытую смесью фибронектин/коллаген I (0,67 мкг/кв. см фибронектина, 1,2 мкг/кв. см коллагена I) пластмассовую посуду в M-SFEM и инкубировали при 37°С, 5% CO2, 20% O2 (с нормальным содержанием кислорода) в течение 3 суток.
7 - Собирали колонии и высевали в виде отдельных клеток (пассаж 1) в количестве 1,3×104 клеток/кв. см на покрытую смесью фибронектин/коллаген 1 пластмассовую посуду в M-SFEM и инкубировали при 37°С, 5% СО2, 20% О2 (с нормальным содержанием кислорода) в течение 3 суток.
8 - Собирали и высевали в виде отдельных клеток (пассаж 2) в количестве 1,3×104 клеток/кв. см на покрытую смесью фибронектин/коллаген 1 пластмассовую посуду в M-SFEM и инкубировали при 37°С, 5% CO2, 20% O2 (с нормальным содержанием кислорода) в течение 3 суток.
9 - Собирали и высевали в виде отдельных клеток (пассаж 3) в количестве 1,3×104 клеток/кв. см на покрытую смесью фибронектин/коллаген 1 пластмассовую посуду в М-SFEM и инкубировали в концентрации 37°С, 5% CO2, 20% O2 (с нормальным содержанием кислорода) в течение 3 суток.
10 - Собирали и высевали в виде отдельных клеток (пассаж 4) в количестве 1,3×104 клеток/кв. см на покрытую смесью фибронектин/коллаген 1 пластмассовую посуду в M-SFEM и инкубировали при 37°С, 5% СО2, 20% О2 (с нормальным содержанием кислорода) в течение 3 суток.
11 - Собирали и высевали в виде отдельных клеток (пассаж 5) в количестве 1,3×104 клеток/кв. см на покрытую смесью фибронектин/коллаген 1 пластмассовую посуду в M-SFEM и инкубировали при 37°С, 5% СО2, 20% О2 (с нормальным содержанием кислорода) в течение 3 суток.
12 - Собирали в виде отдельных клеток и замораживали конечный продукт.
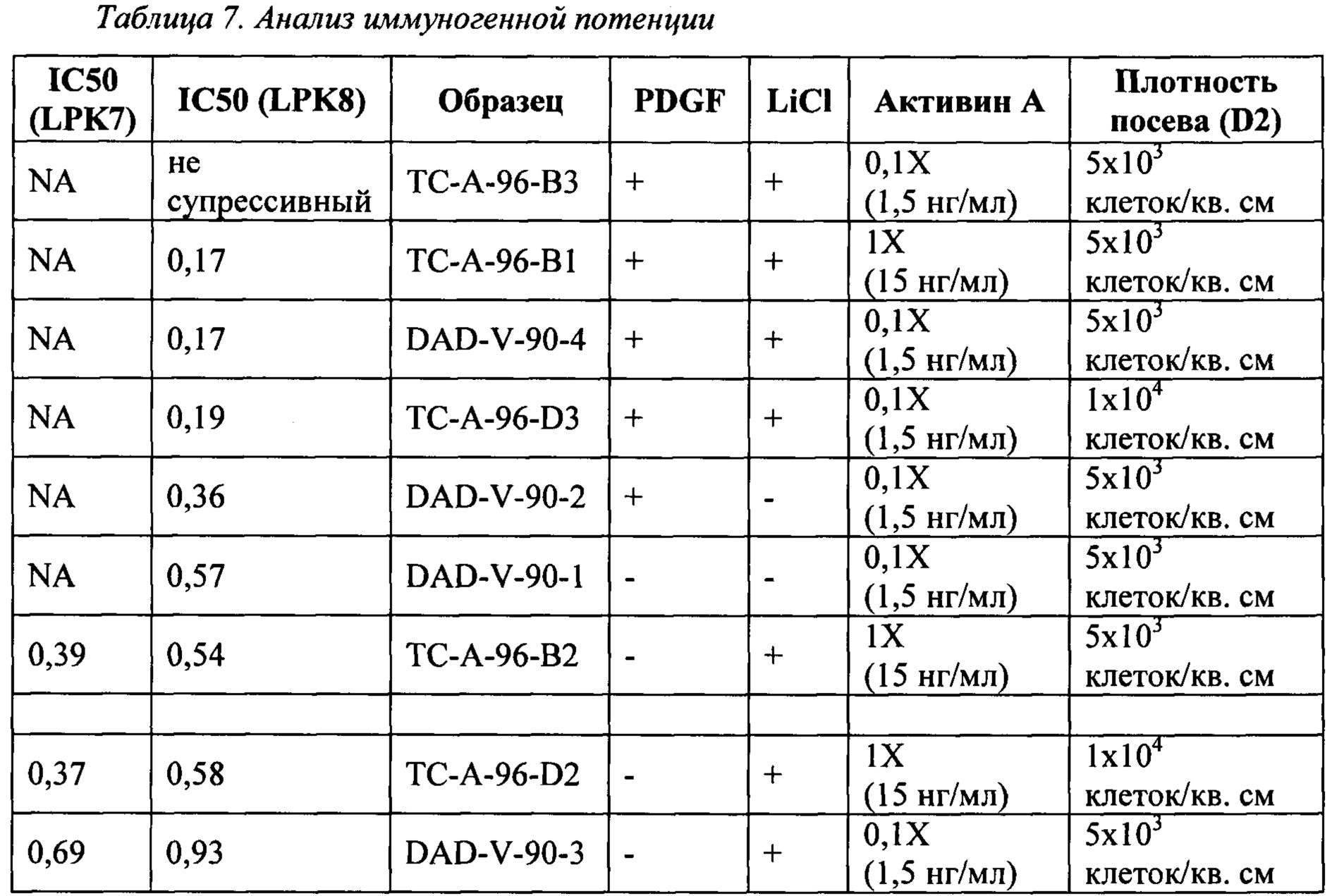
Для исследования воздействия добавления PDGF-BB (10 нг/мл) и/или LiCl (1 мМ) к М-CFM на Т-клеточную супрессию iPSC-MSC выполняли два эксперимента (ТС-А-96 и DAD-V-90). Супрессию Т-клеток оценивали, используя анализ иммуногенной потенции (IPA), Waisman Biomanufacturing.
Как указано в Таблице 7, оценивали следующие комбинации PDGF и LiCl: PDGF+/LiCl+, PDGF-/LiCl-, PDGF+/LiCl- и PDGF-/LiCl+. Следует отметить, что в эксперименте ТС-А-96 сравнивали две разные плотности посева Dnegl (5×103 клеток/кв. см и 1×104 клеток/кв. см) и две разные концентрации активина А (АА) в среде для дифференцировки (1X АА=15 нг/мл и 0,1Х АА=1,5 нг/мл). В эксперименте DAD-V-90 использовали одну плотность посева Dnegl (5×10е3 клеток/кв.см) и концентрацию активина А (1,5 нг/мл). Также следует отметить, что в первом IPA (IPA 1) использовали один лейкопак (LPK7) и во втором IPA (IPA 2) использовали два лейкопака (LPK7 и LPK8).
Этот анализ предназначен для оценки степени, до которой каждая линия MSC может подавлять пролиферацию Т-хелперных (CD4+) лимфоцитов. Криоконсервированные MSC тестировали, используя криоконсервированные лейкоциты, очищенные из периферической крови здоровых субъектов (мононуклеарные клетки периферической крови (РВМС), полученные из Leucopaks (LPK)). Таким образом, ожидается изменчивость клеточной популяции LPK от донора к донору. Каждый тестируемый образец MSC тестируют против РМВС от двух разных субъектов для вещества для клинического применения с возможностью ограничения тестирования единственным образцом РМВС для вещества исследовательской степени чистоты. Анализ для каждого тестируемого образца MSC выполняют одновременно с контрольной стандартной линией MSC для обеспечения чистоты/воспроизводимости анализа и для нормализации тестируемых образцов. Анализ описан в Bloom et al. Cytotherapy, 2015, 17(2): 140-51.
В кратком изложении, тестируемые MSC подвергают гамма-облучению 21 Гр. В 48-луночный планшет для тканевой культуры в отдельные лунки помещают 4×10е5, 2×10е5, 4×10е4 и 2×10е4 облученных MSC. РМВС отдельно метят с помощью арбоксифлуоресцеин-сукцинимидилового сложного эфира. Меченые клетки РМВС помещают в количестве 4×105 клеток на лунку, содержащую MSC, как указано выше. Это приводит к титруемым соотношениям PBMC:MSC 1:1, 1:0,5, 1:0,1 и 1:0,05. В дополнительную лунку помещают только стимулированные РВМС, в другую - только клетки MSC и в еще одну в соотношении 1:0,05 без стимулирования, все из которых служат в качестве контролей. Затем в каждую лунку добавляют стимулирующие Т-клетки моноклональные антитела против СD3-эпсилон человека и против CD28 человека (R&DSystems, Inc., Minneapolis, MN).
На четвертые сутки культивирования клетки из отдельных лунок собирают. Клетки из каждой лунки инкубируют с мечеными аллофикоцианином антителами против CD4 человека. Затем клетки CD4+ анализируют в отношении пролиферацию по интенсивности карбоксифлуоресцеина, используя проточный цитометр. Контроль с одними MSC служит для выделения сигнала MSC из лунок с совместным культивированием. Контроль с одними РВМС служит в качестве положительного контроля для максимальной пролиферации Т-клеток, по отношению к которой измеряют степень супрессии, опосредованной MSC. Нестимулированную лунку с соотношением 1:0,05 используют для получения отрицательного контроля, относительно которого измеряют пролиферацию.
Кривую наилучшей аппроксимации из соотношений тестируемых образцов используют для получения значений IC50. Значения IC50 нормализуют по отношению к контрольному образцу (IC50 контрольного образца/IC50 тестируемого образца). Такая нормированная IC50 имеет большие значения для более активных (более супрессивных) образцов и меньшие значения для менее активных образцов.
Результаты
Данные IC50, представленные в Таблице 7, показывают, что М-CFM с добавлением LiCl, но в отсутствие PDGF (то есть PDGF-/LiCl+), является оптимальной для дифференцировки iPSC с получением iPSC-MSC, которые являются иммуносупрессивными. Кроме того, более низкая концентрация активина А также улучшала иммуносупрессию iPSC-MSC.
NA - не применимо
Пример 3 - Анализ микроРНК MSC
MSC, полученную согласно Примеру 2, подвергали анализу относительно микроматрицы микроРНК (мРН), содержащей 1194 мРНК, и запатентованной панели мРНК, состоящей из miR-127-3р, miR-145-5p, miR-181b-5p, miR-214-3р, miR-299-5p. Каждая панель из 5 мРНК экспрессировалась во всех 71 образцах MSC, но не в 94 образцах не-MSC, обеспечивая тем самым классификацию клеток как MSC или не-MSC.
MSC, полученная согласно Примеру 2, экспрессировала каждую из miR-145-5p, miR-181b-5p и miR-214-3р, но не miR-127-3р и miR-299-5p.
Анализ главных компонентов 233 miPHK микроматрицы, достоверно определенных в нормализованных данных (представленных по меньшей мере в одном тестируемом образце), произведенный для всех тестируемых образцов, показал, что MSC, полученная согласно Примеру 2, отличалась от каждой из других 71 образцов MSC (Фиг. 9).
Пример 4 - Альтернативный анализ иммуногенной потенции 1
Иммуногенную потенцию MSC оценивают следующим образом: РВМС человека от разных доноров объединяют (чтобы минимизировать изменчивость индивидуальных значений иммунного ответа) в фосфатно-солевом буферном растворе и окрашивают сукцинимидиловым сложным эфиром карбоксифлуоресцеина (CFSE, 2 мкМ) в течение 15 минут при 37°С в темноте, с плотностью клеток 2×107 РВМС/мл. Взаимодействие останавливают добавлением равного количества среды RPMI-1640 с добавлением 10% сыворотки крови человека группы АВ. 3×105 РВМС, меченных CFSE, ресуспендировали в среде RPMI-1640 с добавлением 10% объединенного лизата тромбоцитов человека, 2 ЕМ/мл гепарина без консерванта (Biochrom), 2 мМ L-глутамина, 10 мМ (4-(2-гидроксиэтил)-1-пиперазинэтан-сульфоновой кислоты) (HEPES; Gibco), 100 МЕ/мл пенициллина (Sigma) и 100 мкг/мл стрептомицина (Sigma) на лунку затем помещают в трех повторах в 96-луночные планшеты с плоским дном (Corning). Пролиферацию Т-клеток определяют, используя 10-цветный проточный цитометр Gallios и программу Kaluza G1.0 (оба Coulter). Жизнеспособные, не содержащие 7-аминоактиномицин-D (7-AAD-; BD Pharmingen) Т-клетки CD3-APC+ (eBioscience) анализируют через 4-7 суток. Кинетику пролиферации и распределение популяции анализируют, используя программу Modfit 4.1 (Verity).
Пример 5 - Альтернативный анализ иммуногенной потенции 2
Иммуногенную потенцию MSC оценивают следующим образом: Т-хелперные (CD4+) лимфоциты окрашивают CellTrace violet (CTV; Invitrogen) согласно инструкциям изготовителя и затем стимулируют при помощи гранул, покрытых анти-CD3/CD28 (Dynabeads, Invitrogen), в соотношении Т-клетка/гранула 5:1 в 96-луночных планшетах с U-образным дном. Затем CD4 Т-клетки-респондеры инкубируют с облученными (100 Гр) клетками Karpas 299 (клетки К299; Sigma) в качестве контрольного образца или MSC. Совместно культивируемые клетки инкубируют при 37°С в 5% СО2 в среде RPMI-1640 в течение 72 часов. Затем клетки промывают при помощи связывающего буфера AnnexinV (BD Biosciences) и окрашивают AnnexinV флуоресцеинизотиоцианатом или АРС (BD Biosciences) в течение 15 мин в темноте при комнатной температуре. После этой инкубации клетки окрашивают пропидия иодидом (PI) (Molecular Probes) и затем немедленно анализируют на LSRII Fortessa (BD Biosciences). Собранные данные анализируют с использованием программы FlowJo (версия 8.8.6; Tree Star). Жизнеспособность определяют по популяции AnnexinV-отрицательных и PI-отрицательных Т-клеток. Эту часть жизнеспособных клеток анализируют в отношении CTV dim (% пролиферации). Супрессию пролиферации Т-клеток вычисляют с помощью уравнения: % супрессии = 100-(а/b*100), где «а» представляет собой пролиферацию в процентах в присутствии клеток-супрессоров и «b» представляет собой пролиферацию в процентах в отсутствие клеток-супрессоров.
Пример 6 - Лечение инфаркта миокарда
Мезенхимальные стволовые клетки (MSC) по настоящему изобретению использовали в экспериментальной модели инфаркта миокарда (сердечного приступа) у крыс для восстановления сердца крысы после сердечного приступа.
Сердечную функцию и размер рубца оценивали в течение периода 28 суток после сердечного приступа, индуцированного в общей сложности у 11 крыс. Четырех животных лечили при помощи MSC по изобретению, трех животных лечили при помощи MSC, полученных из костного мозга, и еще четверо животных получали контроль плацебо/носитель (Фиг. 10).
Оценка приживления клеток (Фиг. 11 и 12) показала:
- Отсутствие признаков приживления клеток при использовании окрашивания клеточных ядер человека и митохондрий человека в 28 сутки в группах BM-MSC и PSC-MSC.
Функциональная оценка (Фиг. 13 и 14) с применением фракции укорочения (FS %) в 28 сутки по сравнению с 0 сутками показала:
- минимальное изменение/отсутствие изменения в LV-сократимости в группе носителя;
- LV-сократимость левого желудочка в группе ВМ MSC;
- LV-сократимость левого желудочка в группе PSC-MSC.
Оценка размера рубца (Фиг. 15) показала:
- Заметное снижение размера рубца в 28 сутки в группе PSC-MSC (пикросириус красный) по сравнению с носителем и группой BM-MSC.
Оценка ангиогенеза (Фиг. 16) показала:
- Отсутствие заметной разницы в размере и количестве сосудов между группами (vWF окрашивание).
Результаты показали, что сердечная функция улучшалась и размер рубца уменьшался у реципиентов MSC в 28 сутки по сравнению с животными в двух других группах. Результаты показали, что MSC по изобретению вызывали существенное функциональное и структурное улучшение после сердечного приступа.
В модификации исследования примера 6, как показано на Фиг. 17, оценивают аритмию с использованием программируемой стимуляции желудочков (EPS).
Пример 7 - Лечение GvHD
Животных случайным образом разделяли на группы лечения и во всех случаях релевантное лекарственное средство инъецировали через хвостовую вену. В сутки 0 шестинедельных самок мышей NOD.Cg-Prkdcscid

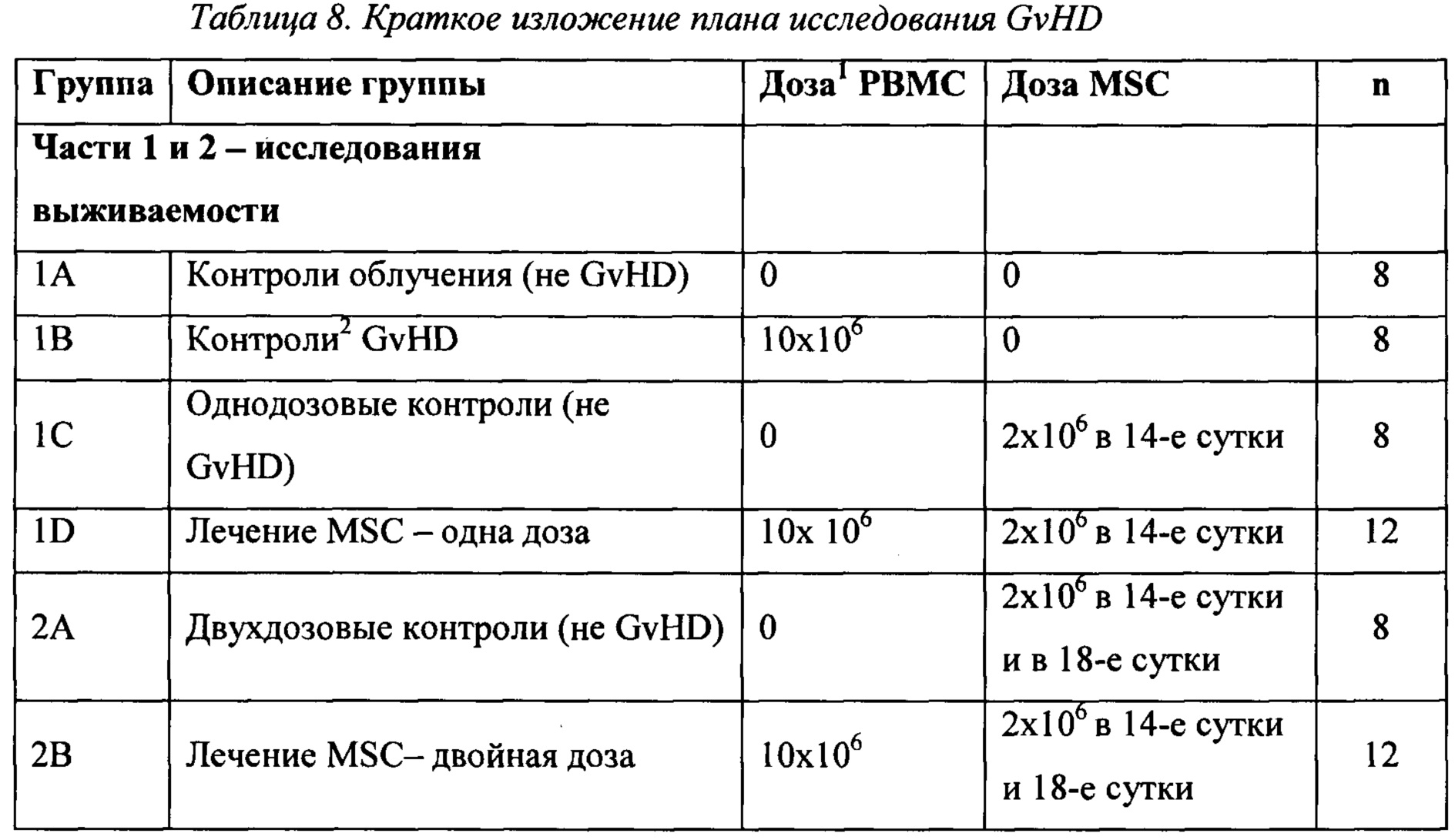
1. Всех животных слегка облучали (2,5 Гр) в сутки 0. РВМС вводили через 4 часа после облучения, чтобы индуцировать GvHD (если необходимо).
2. GvHD-контроли получали фосфатно-солевой буферный раствор (PBS) вместо лечения MSC.
Животных оценивали ежедневно в отношении признаков/симптомов GvHD - то есть потери массы, положения тела, активности, текстуры шерсти и целостности кожи -как описано в Таблице 9. Общую оценку GvHD вычисляли, присваивая 1 балл за каждый признак/симптом в степени 1 и 2 балла за каждый признак/симптом в степени 2. Как только оценка GvHD достигала 8 или выше у любого животного, его усыпляли.

Основным конечным показателем являлась продолжительность выживания.
Результаты
PSC-MSC оттаивали, промывали и ресуспендировали в стерильном PBS. Два миллиона iPSC-MSC вводили релевантным животным через хвостовую вену в сутки +14 (сутки 14, однодозовый режим) или в сутки +14 и +18 (сутки 14, сутки 18, двухдозовый режим).
Тяжесть GvHD оценивали, используя стандартизированную систему баллов, которая включала пять разных критериев: потерю массы, положение тела, активность, текстуру шерсти и целостность кожи. Мышей оценивали ежедневно и ставили оценку от 0 (наименьшая тяжесть) до 2 (наибольшая тяжесть) для каждого критерия. Клинические оценки получали путем сложения оценок для пяти критериев. Когда клиническая оценка достигала "8", мышей удаляли из исследования и гуманно усыпляли. Сутки удаления из исследования регистрировали как сутки индукции летальной GvHD. Преимущество в выживаемости определяли, используя анализ Каплана-Мейера с применением логрангового критерия. Значения р меньше или равные 0,05 считали достоверно различными.
Животные с режимами одной или двух доз iPSC-MSC показывали значительное ослабление потери массы, обычно ассоциированное с этой доклинической моделью (Фиг. 18).
Мыши, обработанные с использованием одно- или двухдозовых режимов, показывали значительное ослабление симптомов заболевания с дополнительными значительными различиями в симптомах, отмеченными между одно- и двухдозовыми обработками в сутки +24 и +25 после индукции GvHD (Фиг. 19).
В исследованиях выживания одно- и двухдозовые обработки обеспечивали значительные преимущества в выживаемости по сравнению с GvHD-контролями (р менее 0,0001). Выживание животных, получавших двухдозовые режимы, было немного лучше, чем у животными, обработанных одной дозой, хотя это увеличение не достигало статистической значимости (р равно 0,0715) (Фиг. 20).
Исходя из этих исследований выживания, авторы изобретения приходят к выводу, что iPSC-MSC CYMERUS™ защищает мышей от потери массы, значительно ослабляет тяжесть заболевания и обеспечивает устойчивое преимущество в выживаемости при введении либо в однодозовой, либо в двухдозовой обработке в доклинической модели GvHD.
Реферат
Изобретение относится к биотехнологии и клеточной биологии, в частности к способу получения мезенхимальных стволовых клеток (MSС) путём дифференцировки индуцированных плюрипотентных клеток (iPSC). Для осуществления способа сначала культивируют первичную мезодермальную клетку, дифференцированную из iPSC, в среде для формирования мезенхимальных колоний (M-CFM), содержащей LiCl и FGF2, но в отсутствие PDGF, в условиях с нормальным содержанием кислорода в течение достаточного времени для формирования мезенхимальной колонии. Затем культивируют мезенхимальную колонию в адгезивном состоянии с получением MSС. Полученная MSC обладает улучшенными свойствами иммуносупрессии Т-клеток по сравнению с MSС, не продуцированной в указанной M-CFM. Изобретение также относится к способу лечения состояний, при которых полезен иммуносупрессорный эффект, выбранных из следующих: реакции «трансплантат против хозяина», системной красной волчанки (SLE), болезни Крона, мультисистемной атрофии, рассеянного склероза, бокового амиотрофического склероза, инсульта, сердечно-сосудистых расстройств, ортопедических расстройств или отторжения трансплантированных солидных органов. Настоящее изобретение позволяет улучшить и масштабировать способы дифференцировки iPSC в MSC. 2 н. и 11 з.п. ф-лы, 20 ил., 9 табл., 7 пр.

Комментарии