Композиции и способы для лечения гемоглобинопатий - RU2707540C2
Код документа: RU2707540C2
Чертежи



































































































































































Описание
Ссылка на родственную заявку
Настоящая заявка представляет собой международную заявку, по которой испрашивается приоритет в соответствии с 35 U.S.C. §119(e) предварительной заявки США №61/984247, зарегистрированной 25 апреля 2014 года, и предварительной заявки США №62/066783, зарегистрированной 21 октября 2014 года, при этом содержание каждой из заявок полностью включено в настоящий документ посредством ссылки.
Правительственная поддержка
Настоящее изобретение осуществлено с правительственной поддержкой в виде гранта №5U01HL117720-03, выданного National Institutes of Health. Правительство США обладает определенными правами на это изобретение.
Область техники, к которой относится настоящее изобретение
Варианты осуществления, описываемые в настоящем документе, относятся к композициям и способам для лечения гемоглобинопатии. Более конкретно, варианты осуществления относятся к композициям и способы увеличения уровня фетального гемоглобина в клетке посредством селективного нокдауна эндогенного BCL11A.
Предшествующий уровень техники настоящего изобретения
Гемоглобинопатии, включая серповидно-клеточную болезнь/анемию (SCD) и талассемию (THAL), являются наиболее распространенными наследственными моногенными нарушениями у человека. Мутации в глобиновых генах несет приблизительно 5% населения Земли. По расчетам всемирной организации здравоохранения каждый год со значимыми нарушениями гемоглобина рождается приблизительно 300000 грудных детей. SCD сегрегирована по популяциям из Африки, южнее Сахары, Индии, Саудовской Аравии и стран Средиземноморья, где с этим патологическим состоянием рождается до 2% детей, вследствие преимущества в выживании в отношении заражения малярией, придаваемого обуславливающей серповидноклеточную анемию мутацией β-глобина (PS) в гетерозиготном состоянии (WHO Report on Sickle-cell anaemia - A59.9. Fifty-ninth World Health Assembly-Provisional agenda item 114: United Nations; 2006: 1-5). Вследствие исторической и/или недавней миграции в развитых странах в настоящее время можно наблюдать растущие количества групп пациентов, и последствия SCD для здравоохранения становятся значимыми (Kauf et al., American Journal of Hematology. 2009; 84: 323-327; Amendah et al., American Journal of Preventive Medicine. 2010; 38: S550-556). В Соединенных Штатах Америки определено, что средняя продолжительность жизни пациентов с гемоглобинопатией в 1994 составляла 42 года у мужчин и 48 лет у женщин (Piatt et al., New England Journal of Medicine. 1994; 330: 1639-1644). На молекулярном уровне SCD стало первым заболеванием, сцепленным с молекулярной модификацией (Pauling et al., Science. 1949; 110: 543-548). Однонуклеотидная мутация приводит к замене глутаминовой кислоты на валин в положении 6 белка β-глобина. Эта модификация приводит к полимеризации молекулы в восстановленном состоянии и последующему преобразованию эритроцита в "сервопидную" форму, в конечном итоге приводящую к анемии вследствие гемолиза и острых и хронических вазоокклюзивных и ишемических осложнений, поражающих множество органов, включая почки, головной мозг, легкие и другие). Хотя профилактические меры (включая химиопрофилактическое средство гидроксимочевину) привели к умеренному снижению тяжести у выбранных групп пациентов, в настоящее время единственным доступным действенным лечением SCD является трансплантация аллогенных гемопоэтических стволовых клеток (HSCT) (Hsieh et al., New England Journal of Medicine. 2009; 361: 2309-2317; Hsieh et al., Blood; предварительная электронная публикация 31 июня 2011 года). К сожалению, при условии SCD и THAL HSCT ассоциирована со значительной смертностью и заболеваемостью, что отчасти, наряду с другими, является следствием предшествующего трансфузии HSCT перенасыщения железом, реакции "трансплантат против хозяина" и высоких доз химиотерапевтических средств/радиации, необходимых в условиях перед трансплантацией хозяину.
В разработке находятся новые терапевтические средства. Например, в патенте США №8383604 описано, что проводятся исследования BCL11A, как ключевого регулятора глобиновых генов. В частности, BCL11A при развитии плода обеспечивает транзиторное переключение с экспрессии генов фетального гемоглобина на экспрессию генов гемоглобина взрослых. Супрессия BCL11A снижает это транзиторное переключение и поддерживает значимо более высокую экспрессию генов фетального гемоглобина в послеутробном развитии. Большее количество экспрессируемых генов фетального гемоглобина смягчает симптомы, ассоциированные с различными гемоглобинопатиями.
Краткое раскрытие настоящего изобретения
В конкретных иллюстративных вариантах осуществления настоящее изобретение в числе прочего относится к улучшенным композициям и способам проведения генотерапии гемопоэтических клеток и предшественников гемопоэтических клеток, включая эритроциты, предшественники эритроцитов и эмбриональные стволовые клетки. Изобретение дополнительно относится к улучшенным генотерапевтическим способам лечения связанных с системой гемопоэза нарушений.
Целью является эффективный нокдаун BCL11A в клетках, получаемых из трансдуцируемых, трансплантируемых гемопоэтических стволовых клеток. Успех индукции γ-глобина и, таким образом, одновременное увеличение HbF и снижение мутантного HbS зависит от количественного снижения транскрипта и белка ВСL11А. Авторы изобретения встроили кшРНК (shRNA) к BCL11A в петлю мкР-223 (miR-223). Этот подход обеспечивает транскрипцию кшРНК к BCL11А посредством промоторов полимеразы II (PoIII), а не промоторов полимеразы III. Это позволяет использовать для получения миРНК (siRNA), действующей на экспрессию BCL11A в трансплантируемых HSC, путь биосинтеза микроРНК (microRNA). Сконструированы лентивирусные трансгены для экспрессии кшРНК, воспроизводящей первичную микро-РНК (при-мкРНК, pri-miRNA), и подвергаемой последовательному процессингу эндогенными микропроцессорным комплексом и комплексом Dicer с получением малых интерферирующих РНК (миРНК, siRNA) с последовательностью, комплементарной матричной РНК (мРНК, mRNA) ВСL11А.
Согласно одному из аспектов предоставлены композиции и способы, которые обеспечивают эффективный нокдаун BCL11A в клетках, получаемых из трансдуцируемых, трансплантируемых гемопоэтических стволовых клеток. Согласно одному из вариантов осуществления количественное снижение транскрипта и белка BCL11A индуцирует продукцию γ-глобина и, таким образом, одновременное увеличение количества HbF и уменьшение количества мутантного HbS. В конкретном варианте осуществления кшРНК к BCL11A встроена в петлю мкР-223 (miR-223). В конкретных вариантах осуществления сконструирован лентивирус для экспрессии кшРНК, воспроизводящей при-мкРНК, которую подвергают последовательному процессингу эндогенными микропроцессорным комплексом и комплексом Dicer с получением миРНК с последовательностью, комплементарной мРНК BCL11A.
Таким образом, в различных иллюстративных вариантах осуществления в настоящем описании в числе прочих предоставлена синтетическая микроРНК к BCL11A, содержащая первый участок BCL11A, участок петли и второй участок BCL11A, расположенные последовательно в направлении от 5' к 3', где участок петли расположен между первым и вторым участками BCL11A и непосредственно связан с ними, и где второй участок BCL11А комплементарен первому участку BCL11А так, что основания первого и второго участков BCL11A спарены с формированием петли шпильки с участком петли, формирующим область петли сформированной, таким образом, петли шпильки.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, длина первого и второго участков BCL11А составляет приблизительно от 18 до 25 нуклеотидов. Первый участок BCL11A получен из последовательности BCL11A и служит источником сопровождающей цепи при процессинге кшРНК в дуплексную миРНК, а второй участок BCL11A комплементарен первому участку BCL11A, где второй участок BCL11A служит источником направляющей цепи, которая встраивается в комплекс обеспечения специфичности РНК-интерференции (RISC) для РНК-интерференции или сайленсинга гена BCL11A.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый и второй участки BCL11A содержат последовательности, которые получают из последовательности мРНК BCL11A.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A начинается с -GCGC- на 5'-конце, а второй участок BCL11А заканчивается -GCGC- на 3'-конце.
Согласно одному из вариантов осуществления любой из, синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A на 5'-конце дополнительно содержит -GCGC, а второй участок BCL11A на 3'-конце заканчивается -GCGC-.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A на 5'-конце начинается с -GCGA-, -TCTG- или -TG-, а второй участок BCL11A комплементарен первому участку BCL11А.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A на 5'-конце дополнительно содержит -GCGA-, -TCTG- или -TG-.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, второй участок BCL11A на 3'-конце заканчивается -ТТТТ-.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11А, описываемых в настоящем документе, синтетическая микроРНК к BCL11A содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11А, описываемых в настоящем документе, синтетическая микроРНК к BCL11A содержит нуклеотидную последовательность или ее участок, описанные в настоящем описании.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, синтетическая микроРНК к BCL11A состоит из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, синтетическая микроРНК к BCL11A по существу состоит из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A выбран из группы, состоящей из CGCACAGAACACTCATGGATT (SEQ ID NO: 46; получаемой из олигонуклеотида мкР1 (miR1) BCL11A, описываемого в настоящем документе), CCAGAGGATGACGATTGTTTA (SEQ ID NO: 47; получаемой из олигонуклеотида мкР2 (miR2) BCL11A, описываемого в настоящем документе), TCGGAGACTCCAGACAATCGC (SEQ ID NO: 48; получаем из олигонуклеотида Е3 BCL11A или кшРНK1 (shRNA1) или Е3, описываемых в настоящем документе), CCTCCAGGCAGCTCAAAGATC, (SEQ ID NO: 49; получаемой из кшРНК2 (shRNA2) или В5, описываемых в настоящем документе), TCAGGACTAGGTGCAGAATGT (SEQ ID NO: 50; получаемой из кшРНК4 (shRNA4) или В11, описываемых в настоящем документе), TTCTCTTGCAACACGCACAGA (SEQ ID NO: 51; получаемой из олигонуклеотида D8 BCL11A или кшРНК3 (shRNA3) или D8, описываемых в настоящем документе), GATCGAGTGTTGAATAATGAT (SEQ ID NO: 52; получаемой из кшРНК5 (shRNA5) или 50D12 или D12, описываемых в настоящем документе), CAGTACCCTGGAGAAACACAT (SEQ ID NO: 53; получаемой из кшРНК5 (shRNA5) или 50А5, описываемых в настоящем документе), CACTGTCCACAGGAGAAGCCA (SEQ ID NO: 54; получаемой из кшРНК7 (shRNA7) или 50В11, описываемых в настоящем документе), ACAGTACCCTGGAGAAACACA (SEQ ID NO: 55; получаемой из XLC4 BCL11A, кшРНК8 (shRNA8) и 50С4, описываемых в настоящем документе), CAACAAGATGAAGAGCACCAA (SEQ ID NO: 56; получаемой из ненаправленных олигонуклеотидов BCL11A, описываемых в настоящем документе), gcgcCGCACAGAACACTCATG (SEQ ID NO: 57; получаемой из олигонуклеотида miR1G5, описываемого в настоящем документе), GCGCTCGGAGACTCCAGACAA (SEQ ID NO: 58; получаемой из E3G5 или модифицированного олигонуклеотида Е3 или кшРНК1мод (shRNA1mod), описываемых в настоящем документе), gcgcCCTCCAGGCAGCTCAAA (SEQ ID NO: 59; получаемой из B5G5 или кшРНК2 мод (shRNA2mod), описываемых в настоящем документе); gcgcTCAGGACTAGGTGCAGA (SEQ ID NO: 60; получаемой из B11G5 или кшРНК4 мод (shRNA4mod), описываемых в настоящем документе); gcgcGATCGAGTGTTGAATAA (SEQ ID NO: 61; получаемой из 50D12G5, D12G4 или кшРНК5 мод (shRNA5mod), описываемых в настоящем документе); gcgcCAGTACCCTGGAGAAAC (SEQ ID NO: 62; получаемой из 50A5G5 или кшРНК6мод (shRNA6mod), описываемых в настоящем документе); gcgcCACTGTCCACAGGAGAA (SEQ ID NO: 63; получаемой из 50B11G5 или кшРНК7 мод (shRNA7mod), описываемых в настоящем документе); GCGCTTCTCTTGCAACACGCA (SEQ ID NO: 64; получаемой из D8G5 BCL11A или модифицированного D8 или кшРНК3мод (shRNA3mod), описываемых в настоящем документе), GCGCACAGTACCCTGGAGAAA (SEQ ID NO: 65; получаемой из C4G5 BCL11A или модифицированного С4 или кшРНК8 мод (shRNA8mod), описываемых в настоящем документе), CGCACAGAACACTCATGGATT (SEQ ID NO: 66; получаемой из D12G5-2 BCL11A, описываемых в настоящем документе) и ACGCTCGCACAGAACACTCATGGATT (SEQ ID NO: 67; получаемой из D12G5-2 BCL11А, описываемых в настоящем документе).
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, участок петли получают из микроРНК. Согласно одному из вариантов осуществления микроРНК представляет собой специфичную в отношении системы гемопоэза микроРНК. Например, мкР-142 (miR-142), мкР-155 (miR-155), мкР-181 (miR-181) и мкР-223 (miR-223).
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, микроРНК представляет собой мкР-223 (miR-223).
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, участок петли представляет собой ctccatgtggtagag (SEQ ID NO: 68).
Таким образом, согласно одному из аспектов в настоящем описании предоставлена выделенная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Таким образом, согласно одному из аспектов в настоящем описании предоставлена композиция, содержащая по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Таким образом, согласно одному из аспектов в настоящем описании предоставлена композиция, содержащая по меньшей мере вектор, содержащий молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 1.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 2.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO:3.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO:4.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO:5.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 6.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 7.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 8.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 9.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 10.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 13.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 14.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 15.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 16.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 17.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 18.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 25.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 26.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 27.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 28.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 29.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 30.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 31.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 32.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 33.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO:34.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 35.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 36.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 37.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO:38.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO:39.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 40.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 41.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 42.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 43.
Согласно одному из вариантов осуществления любой описанной выделенной молекулы нуклеиновой кислоты, молекула содержит нуклеотидную последовательность SEQ ID NO: 44.
Согласно одному из аспектов в настоящем описании предоставлен вектор, содержащий по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Согласно одному из вариантов осуществления любого описанного вектора, вектор дополнительно содержит промотор вируса некроза селезенки, индуцируемый тетрациклином промотор или контрольную область локуса β-глобина и промотор β-глобина. Промотор обеспечивает специфичную экспрессию контролируемой молекулы нуклеиновой кислоты или контролируемой синтетической микроРНК к BCL11А.
Согласно одному из аспектов в настоящем описании предоставлена клетка-хозяин, содержащая вектор, содержащий по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Согласно одному из вариантов осуществления любой клетки-хозяина, описываемой в настоящем документе, клетка-хозяин представляет собой эмбриональную стволовую клетку, соматическую стволовую клетку, клетку-предшественника, клетку костного мозга, гемопоэтическую стволовую клетку или гемопоэтическую клетку-предшественника. Согласно одному из вариантов осуществления клетку-хозяина выделяют у индивидуума. Согласно одному из вариантов осуществления клетку-хозяина выделяют у индивидуума с диагностированной гемоглобинопатией. Диагноз можно ставить любым известным в данной области способом. Например, посредством генетического анализа, посредством ОТ-ПЦР и посредством цитологического исследования крови.
Согласно одному из вариантов осуществления любой клетки-хозяина, описываемой в настоящем документе, клетка-хозяин представляет собой эритроцит.
Согласно одному из аспектов в настоящем описании предоставлена клетка-хозяин, содержащая вектор или бактерию, содержащие по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из аспектов в настоящем описании предоставлена клетка-хозяин, содержащая вирус, содержащий по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Согласно одному из вариантов осуществления любого вируса или вектора, описываемого в настоящем документе, вирус представляет собой лентивирус.
Согласно одному из вариантов осуществления любого вектора или вируса, описываемого в настоящем документе, лентивирус выбран из группы, состоящей из: вируса иммунодефицита человека типа 1 (ВИЧ-1), вируса иммунодефицита человека типа 2 (ВИЧ-2), вируса артрита-энцефалита коз и овец (CAEV), вируса инфекционной анемии лошадей (EIAV), вируса иммунодефицита кошек (FIV), вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
Таким образом, согласно одному из аспектов в настоящем описании предоставлены способы увеличения уровней фетального гемоглобина, экспрессируемого клеткой, включающие этапы приведения эмбриональной стволовой клетки, соматической стволовой клетки, клетки-предшественника, клетки костного мозга, гемопоэтической стволовой клетки или гемопоэтической клетки-предшественника в контакт с эффективным количеством композиции, описываемой в настоящем документе, или эффективным количеством по меньшей мере выделенной молекулы нуклеиновой кислоты, описываемой в настоящем документе, в соответствии с чем в клетке или ее потомстве возрастает экспрессия фетального гемоглобина относительно клетки до такого контакта. В определенных вариантах осуществления композиция содержит по меньшей мере один вектор или клетку, содержащие по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе. Согласно одному из вариантов осуществления способ дополнительно включает предоставление образца стволовых клеток или клеток-предшественников для приведения в контакт. Согласно одному из вариантов осуществления образец клеток, содержит выбранные СD34+-клетки. Согласно одному из вариантов осуществления композиция содержит смесь нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44. Например, композиция содержит 2-5 различных нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44. Например, композиция содержит SEQ ID NO: 34, 37, 39,41 и 43.
Согласно одному из аспектов в настоящем описании предоставлены способы лечения или снижения риска развития гемоглобинопатии, например, SCD и THAL, у индивидуума. Способы могут включать селективный нокдаун гена ВСL11А в гемопоэтических стволовых клетках индивидуумов. У этих индивидуумов существует риск развития гемоглобинопатии.
Согласно одному из вариантов осуществления любого из описанных способов селективный нокдаун гена BCL11A в гемопоэтических стволовых клетках включает использование выделенной молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 1-10, 13-18, 25-44, или использование вектора (например, вирусного вектора), содержащего молекулу нуклеиновой кислоты, содержащую любую из нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из вариантов осуществления любого из описанных способов селективный нокдаун гена BCL11A в гемопоэтических стволовых клетках включает приведение гемопоэтических стволовых клеток в контакт с композицией, содержащей по меньшей мере выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность SEQ ID NO: 1-10, 13-18, 25-44, или с композицией, содержащей по меньшей мере вектор (например, вирусный вектор), содержащий молекулу нуклеиновой кислоты, содержащую любую из нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе. Согласно одному из вариантов осуществления до контакта производят выделение гемопоэтических стволовых клеток.
Согласно одному из вариантов осуществления любого из описанных способов селективный нокдаун гена BCL11A в гемопоэтических стволовых клетках происходит in vivo, in vitro или ex vivo. Согласно дополнительному варианту осуществления гемопоэтическая клетка-предшественник, являющаяся мишенью для селективного нокдауна, принадлежит эритроидной линии.
Согласно одному из вариантов осуществления любого из описанных способов контакт гемопоэтических стволовых клеток с любыми композициями, описываемыми в настоящем документе, происходит in vivo, in vitro или ex vivo. Согласно дополнительному варианту осуществления гемопоэтические клетки-предшественники, подвергаемые контакту, принадлежат эритроидной линии.
Согласно одному из вариантов осуществления любого из описанных способов контакт гемопоэтических стволовых клеток с любыми композициями, описываемыми в настоящем документе, происходит in vivo, in vitro или ex vivo.
Согласно другим вариантам осуществления любого из описанных способов селективный нокдаун гена BCL11A в дополнение к гемопоэтической стволовой клетке или гемопоэтической клетке-предшественнике происходит в эмбриональной стволовой клетке, соматической стволовой клетке, клетке-предшественнике, клетке костного мозга. Согласно одному из вариантов осуществления в контакт с описываемой композицией приводят эмбриональную стволовую клетку, соматическую стволовую клетку, клетку-предшественник или клетку костного мозга. Эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники или клетки костного мозга перед контактом выделяют. Согласно одному из вариантов осуществления контакт эмбриональной стволовой клетки, соматической стволовой клетки, клетки-предшественника или клетки костного мозга с любой из композиций, описываемых в настоящем документе, происходит in vivo, in vitro или ex vivo.
Согласно другим вариантам осуществления любого из описанных способов гемопоэтические стволовые клетки получают из периферической крови, пуповинной крови, хориональных ворсин, амниотической жидкости, плацентарной крови или костного мозга.
Согласно другим вариантам осуществления любого из описанных способов эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники или клетки костного мозга получают из периферической крови, пуповинной крови, хориональных ворсин, амниотической жидкости, плацентарной крови или костного мозга.
Согласно одному из аспектов в настоящем описании предоставлен способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает: введение индивидууму терапевтически эффективного количества одной или нескольких выделенных молекул нуклеиновых кислот, описываемых в настоящем документе, вируса или вектора, описываемых в настоящем документе или клетки, описываемой в настоящем документе, таким образом, производя лечение или снижение риска развития гемоглобинопатии у индивидуума, где вирус, вектор или клетка содержат по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе. Например, эффективное количество одной или нескольких выделенных молекул нуклеиновых кислот, описываемых в настоящем документе, вируса или вектора, описываемых в настоящем документе, или клеток, описываемых в настоящем документе, инъецируют непосредственно в костный мозг индивидуума.
Согласно одному из аспектов в настоящем описании предоставлен способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает приведение популяции гемопоэтических стволовых клеток in vitro или ex vivo в контакт с композицией, описываемой в настоящем документе, или по меньшей мере с одной или несколькими выделенными молекулами нуклеиновых кислот, описываемыми в настоящем документе, вирусом или вектором, описываемым в настоящем документе, и имплантацию или введение приводимых в контакт гемопоэтических стволовых клеток или их клеток-потомков индивидуумам. Согласно одному из вариантов осуществления приводимые в контакт гемопоэтические стволовые клетки или клетки-потомки трансплантируют индивидууму. Согласно одному из вариантов осуществления для содействия приживлению приводимых в контакт клеток приводимые в контакт гемопоэтические стволовые клетки или их клетки-потомки имплантируют с использованием простагландина Е2 и/или антиоксиданта N-ацетил-L-цистеина (NAC).
Согласно одному из аспектов в настоящем описании предоставлен способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает экспрессию по меньшей мере одной синтетической микроРНК к BCL11A, описываемой в настоящем документе, в эмбриональных стволовых клетках, соматических стволовых клетках, клетках-предшественниках, клетках костного мозга, гемопоэтических стволовых клетках или гемопоэтических клетках-предшественниках индивидуума, где экспрессия происходит ex vivo или in vitro, и имплантацию или введение клеток индивидууму.
Согласно одному из аспектов в настоящем описании предоставлен способ увеличения уровней фетального гемоглобина, экспрессируемого клетками, где способ включает экспрессию по меньшей мере одной синтетической микроРНК к BCL11A, описываемой в настоящем документе, в эмбриональной стволовой клетке, соматической стволовой клетке, клетке-предшественнике, клетке костного мозга, гемопоэтической стволовой клетке или гемопоэтической клетке-предшественнике индивидуума, где экспрессия происходит ex vivo или in vitro или in vivo. Согласно одному из вариантов осуществления экспрессию происходит посредством приведения клетки в контакт с эффективным количеством композиции, описываемой в настоящем документе, или эффективным количеством по меньшей мере выделенной молекулы нуклеиновой кислоты, описываемой в настоящем документе.
Согласно одному из аспектов в настоящем описании предоставлен способ снижения уровней BCRLLA, экспрессируемого клеткой, где способ включает экспрессию по меньшей мере одной синтетической микроРНК к BCL11А, описываемой в настоящем документе, в эмбриональной стволовой клетке, соматической стволовой клетке, клетке-предшественнике, клетке костного мозга, гемопоэтической стволовой клетке или гемопоэтической клетке-предшественнике индивидуума, где экспрессия происходит ex vivo, или in vitro, или in vivo. Согласно одному из вариантов осуществления экспрессия включает этапы приведения эмбриональной стволовой клетки, соматической стволовой клетки, клетки-предшественника, клетки костного мозга, гемопоэтической стволовой клетки или гемопоэтической клетки-предшественника в контакт с эффективным количеством композиции, описываемой в настоящем документе, или эффективным количеством по меньшей мере выделенной молекулы нуклеиновой кислоты, описываемой в настоящем документе, в соответствии с чем в клетке или ее потомстве возрастает экспрессия фетального гемоглобина относительно клетки до такого контакта. В определенных вариантах осуществления композиция содержит по меньшей мере один вектор или клетку, содержащую по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно дополнительному варианту осуществления любого из способов, описываемых в настоящем документе, гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники, подвергаемые контакту, принадлежат эритроидной линии.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники получают из периферической крови, пуповинной крови, хориональных ворсин, амниотической жидкости, плацентарной крови или костного мозга.
Согласно дополнительному варианту осуществления любого из способов, описываемых в настоящем документе, индивидууму-реципиенту до имплантации подвергнутых контакту или трансфекции клеток проводят химиотерапию и/или радиационное облучение.
Согласно одному из вариантов осуществления химиотерапию и/или радиацию применяют для снижения количества эндогенных стволовых клеток для облегчения приживления имплантируемых клеток.
Согласно одному из аспектов в настоящем описании предоставлен способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает получение гемопоэтических стволовых клеток у индивидуума, приведение гемопоэтических стволовых клеток in vitro или ex vivo в контакт с композицией, описываемой в настоящем документе или по меньшей мере с одной или несколькими выделенными молекулами нуклеиновых кислот, описываемыми в настоящем документе, вирусом или вектором, описываемыми в настоящем документе, и имплантацию или обратное введение приводимых в контакт гемопоэтических стволовых клеток обратно тому же индивидууму. Согласно одному из вариантов осуществления приводимые в контакт гемопоэтические стволовые клетки или клетки-потомки приживаются у индивидуума.
Согласно одному из аспектов любого из способов приводимые в контакт гемопоэтические стволовые клетки, эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или их клетки-потомки обрабатывают ex vivo простагландином Е2 и/или антиоксидантом N-ацетил-L-цистеином (NAC) для обеспечения последующего приживления у индивидуума-реципиента.
Согласно одному из аспектов любого из способов популяцию гемопоэтических стволовых клеток или клеток-хозяев получают у индивидуума с риском развития гемоглобинопатии или с диагнозом гемоглобинопатия.
Согласно одному из аспектов любого из способов популяция гемопоэтических стволовых клеток является аутологичной или аллогенной для индивидуума.
Согласно одному из аспектов любого из способов популяция гемопоэтических стволовых клеток или клеток-хозяев перед приведением в контакт с композицией, описываемой в настоящем документе, или по меньшей мере с одной или несколькими выделенными молекулами нуклеиновых кислот, описываемыми в настоящем документе, вирусом или вектором, описываемыми в настоящем документе, наращивают в культуре ex vivo.
Согласно одному из аспектов любого из способов популяцию гемопоэтических стволовых клеток или клеток-хозяев наращивают в культуре ex vivo после приведения в контакт с композицией, описываемой в настоящем документе, или по меньшей мере с одной или несколькими выделенными молекулами нуклеиновых кислот, описываемыми в настоящем документе, вирусом или вектором, описываемыми в настоящем документе.
Согласно одному из аспектов любого из способов приводимую в контакт популяцию гемопоэтических стволовых клеток или клеток-хозяев перед имплантацией индивидууму подвергают предварительной дифференцировке ex vivo в культуре.
Согласно одному из аспектов любого из способов приводимые в контакт гемопоэтические стволовые клетки до введения индивидууму наращивают in vitro или ex vivo. Согласно одному из аспектов любого из способов приводимые в контакт гемопоэтические стволовые клетки до введения индивидууму подвергают криоконсервации. В другом аспекте любого из способов приводимые в контакт гемопоэтические стволовые клетки до введения индивидууму наращивают in vitro или ex vivo и подвергают криоконсервации. В другом аспекте любого из способов приводимые в контакт гемопоэтические стволовые клетки наращивают in vitro или ex vivo после криоконсервации до введения индивидууму.
Согласно одному из аспектов любого из способов индивидуум представляет собой человека. Согласно одному из аспектов любого из способов у индивидуума диагностирована гемоглобинопатия.
Согласно одному из аспектов любого из способов способ дополнительно включает отбора индивидуума с диагнозом гемоглобинопатия или индивидуума с риском развития гемоглобинопатии.
Согласно одному из аспектов любого из способов гемоглобинопатия представляет собой серповидноклеточную анемию (SCD) или талассемию (THAL). Например, β-талассемию.
Согласно одному из аспектов способа способ дополнительно включает проведение индивидууму лечения, включающего кислород, гидроксимочевину, фолиевую кислоту или переливание крови.
Согласно одному из аспектов в настоящем описании предоставлен способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает экспрессию in vivo у индивидуума по меньшей мере одной синтетической микроРНК к BCL11А, описываемой в настоящем документе.
Согласно одному из аспектов любого из способов экспрессия in vivo происходит в эмбриональной стволовой клетке, соматической стволовой клетке, клетке- предшественнике, клетке костного мозга, гемопоэтической стволовой клетке или гемопоэтической клетке-предшественнике.
Согласно одному из аспектов любого из способов эмбриональная стволовая клетка, соматическая стволовая клетка, клетка-предшественник, клетка костного мозга, гемопоэтическая стволовая клетка или гемопоэтическая клетка-предшественник является для индивидуума аутологичной или аллогенной.
Согласно одному из аспектов любого из способов эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники, экспрессирующие по меньшей мере одну синтетическую микроРНК к BCL11A, описанную в настоящем документе, наращивают in vitro или ex vivo до введения индивидууму. Согласно дополнительному варианту осуществления клетка-предшественник, клетка костного мозга, гемопоэтическая стволовая клетка и гемопоэтическая клетка-предшественник принадлежат эритроидной линии.
Согласно одному из аспектов любого из способов эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетка или гемопоэтические клетки-предшественники, экспрессирующие по меньшей мере одну синтетическую микроРНК к BCL11A, описанную в настоящем документе, до введения индивидууму подвергают криоконсервации.
В другом аспекте любого из способов эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники, экспрессирующие по меньшей мере одну синтетическую микроРНК к BCL11A, описанную в настоящем документе, до введения индивидууму наращивают in vitro или ex vivo и подвергают криоконсервации.
В другом аспекте любого из способов эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники, экспрессирующие по меньшей мере одну синтетическую микроРНК к BCL11A, описанную в настоящем документе, наращивают in vitro или ex vivo после криоконсервации до введения индивидууму.
Согласно одному из аспектов любого из способов по меньшей мере одна синтетическая микроРНК к BCL11А функционально связана с промотором и встроена в вектор для экспрессии в эукариотической клетке.
Согласно одному из аспектов любого из способов по меньшей мере одна синтетическая микроРНК к BCL11А экспрессирована РНК-полимеразой II.
Согласно одному из аспектов любого из способов по меньшей мере одна синтетическая микроРНК к BCL11А не экспрессирована РНК-полимеразой III.
Согласно одному из аспектов любого из способов промотор выбран из группы, состоящей из промотора вируса некроза селезенки, индуцируемого тетрациклином промотора или контрольной области локуса β-глобина и промотора β-глобина или специфичного в отношении системы гемопоэза промотора.
Согласно одному из аспектов любого из способов вектор представляет собой вирус.
Согласно одному из аспектов любого из способов вирус представляет собой лентивирус.
Согласно одному из аспектов любого из способов лентивирус выбран из группы, состоящей из вируса иммунодефицита человека типа 1 (ВИЧ-1), вируса иммунодефицита человека типа 2 (ВИЧ-2), вируса артрита-энцефалита коз и овец (CAEV), вируса инфекционной анемии лошадей (EIAV), вируса иммунодефицита кошек (FIV), вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
Согласно одному из аспектов любого из способов индивидуум представляет собой животное, человека или не являющегося человеком индивидуума и грызуна или не являющегося грызуном животного. Например, индивидуум может представлять собой любого из млекопитающих, например, человека, другого примата, свинью, грызуна, такого как мышь или крыса, кролика, морскую свинку, хомяка, корову, лошадь, кошку, собаку, овцу или козу, или не являющихся млекопитающим животных, таких как птица.
Согласно одному из аспектов любого из способов способ включает получение образца или популяции эмбриональных стволовых клеток, соматических стволовых клеток, клеток-предшественников, клеток костного мозга, гемопоэтических стволовых клеток или предшественников гемопоэтических клеток у индивидуума.
Согласно одному из вариантов осуществления эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки, предшественники гемопоэтических клеток выделяют у индивидуума-хозяина, трансфицируют, культивируют (не обязательно) и трансплантируют обратно тому же хозяину, т.е. они представляют собой трансплантат из аутологичных клеток. В другом варианте осуществления эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки или предшественники гемопоэтических клеток выделяют у донора, который по типу HLA совпадает с индивидуумом (реципиентом), у которого диагностирована или существует риск развития гемоглобинопатии. Проведение подбора донора, совпадающего по типу антигена с реципиентом, хорошо известно в данной области. Типы HLA включают HLA-A, HLA-В, HLA-C и HLA-D. Они представляют собой минимальное количество совпадающих клеточных поверхностных антигенов, требуемое для трансплантации. Таким образом, трансфицированные клетки трансплантируют другому хозяину, т.е., они аллогенны для являющегося реципиентом индивидуума-хозяина. Эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки или предшественники гемопоэтических клеток донора или индивидуума можно трансфицировать вектором или нуклеиновой кислотой, содержащими молекулу нуклеиновой кислоты, описываемую в настоящем документе, трансфицированные клетки наращивать в культуре, а затем трансплантировать индивидууму-хозяину. Согласно одному из вариантов осуществления трансплантированные клетки приживаются у индивидуума-хозяина. Также трансфицированные клетки после трансфекции можно криоконсервировать и хранить, или криоконсервировать после наращивания клеток и хранить.
Как используют в настоящем документе, лечение или снижение риска развития гемоглобинопатии у индивидуума означает уменьшение по меньшей мере одного симптома гемоглобинопатии. Согласно одному из аспектов изобретение относится к способам лечения, например, уменьшение тяжести или прогрессирования гемоглобинопатии у индивидуума. В другом аспекте способы также можно использовать для снижения риска развития гемоглобинопатии у индивидуума, задержки манифестации симптомов гемоглобинопатии у индивидуума или увеличения продолжительности жизни индивидуума с гемоглобинопатией. Согласно одному из аспектов способы могут включать отбор индивидуума на основе наличия у него гемоглобинопатии или наличия риска развития гемоглобинопатии, но пока еще не самой гемоглобинопатия, или индивидуума с фоновой гемоглобинопатией. Отбор индивидуума может включать определение симптомов гемоглобинопатии, анализ крови, генетический анализ или клинические данные. Если результаты анализа(ов) свидетельствуют, что у индивидуума присутствует гемоглобинопатия, способы также включают введение композиций, описываемых в настоящем документе, таким образом, обеспечивая лечение или снижение риска развития гемоглобинопатии у индивидуума. Например, индивидуум с диагнозом SCD с генотипом HbSS, HbS/β0-талассемия, HbSD или HbSO и/или HbF <10% при электрофорезе.
Как используют в настоящем документе, термин "гемоглобинопатия" относится к состоянию, характеризующемуся присутствием в крови аномальных молекул гемоглобина. Примеры гемоглобинопатии в качестве неограничивающих примеров включают SCD и THAL. Также включены гемоглобинопатии, при которых в крови присутствует комбинация аномальных форм гемоглобина (например, серповидноклеточная/Hb-С анемия). Иллюстративные примеры таких заболеваний в качестве неограничивающих примеров включает SCD и THAL. SCD и THAL и их симптомы хорошо известны в данной области и более подробно описаны ниже. Диагностировать индивидуумов как индивидуумов с гемоглобинопатией могут медицинский работник, лицо, осуществляющее медицинский уход, врач, медицинская сестра, член семьи или знакомый, которые распознают, понимают, допускают, определяют, заключают, полагают или решают, что у индивидуума присутствует гемоглобинопатия.
Термин "SCD" определен в настоящем документе как включающий любое симптоматическое состояние анемии, которое является результатом образования серповидных форм эритроцитов. Проявления SCD включают: анемию; боль и/или органные дисфункции, такие как почечная недостаточность, ретинопатия, острый грудной синдром, ишемия, приапизм и инсульт. Как используют в настоящем документе термин "SCD" относится к ряду клинических расстройств, сопровождающих SCD, особенно у индивидуумов, гомозиготным по замене серповидных клеток в HbS. В числе существенных проявлений, указываемых в настоящем документе при использовании термина SCD, находятся задержка роста и развития, повышенная тенденция к развитию тяжелых инфекций, в обуславливаемых пневмококками, существенное нарушение функции селезенки, предотвращение эффективного клиренса циркулирующих бактерий, с рецидивирующими инфарктами и последующим разрушением ткани селезенки. Также в термин "SCD" включены острые эпизоды костно-мышечной боли, которые преимущественно затрагивают поясничный отдел позвоночника, живот и тело бедренной кости и которые сходны по механизму и тяжести. У взрослых такие приступы, как правило, манифестируют в виде слабых или умеренных приступов с малой длительностью каждые несколько недель или месяцев, чередуемых с резкими приступами, длящимися от 5 до 7 суток, которые происходят в среднем приблизительно один раз в год. В числе событий, для которых известно, что они вызывают такие кризы, находятся ацидоз, гипоксия и дегидратация, все из которых стимулируют внутриклеточную полимеризацию HbS (J. Н. Jandl, Blood: Textbook of Hematology, 2nd Ed., Little, Brown and Company, Boston, 1996, pages 544-545).
Как используют в настоящем документе, "THAL" относится к наследственному нарушению, характеризуемому дефектной продукцией гемоглобина. Согласно одному из вариантов осуществления термин включает наследственные анемии, которые происходят вследствие мутаций, влияющих на синтез различных видов гемоглобина. Согласно другим вариантам осуществления термин включает любую симптоматическую анемию, являющуюся результатом талассемических состояний, таких как тяжелая или β-талассемия, большая талассемия, промежуточная талассемия, α-талассемии, такие как Н-гемоглобинопатия. β-талассемии вызваны мутациями в цепи β-глобина и могут возникать в большой или малой форме. В большой форме Р-талассемии состояние детей при рождении является нормальным, но в течение первого года жизни развивается анемия. При умеренной форме β-талассемии развиваются маленькие эритроциты. Альфа-талассемии вызваны делециями в гене или в генах цепи глобина.
Под фразой "риск развития заболевания" подразумевают относительную вероятность того, что у индивидуума разовьется гемоглобинопатия в будущем по сравнению с контрольными индивидуумом или популяцией (например, здоровый индивидуум или популяция здоровых индивидуумов). Например, индивидуум, несущий генную мутацию, ассоциированную с SCD, мутацию А на Т в гене β-глобина, и гетерозиготное или гомозиготное состояние этой мутации у индивидуума увеличивает этот риск у индивидуума.
Термин "ингибирующая РНК" предназначен для включения молекулы нуклеиновой кислоты, которая содержит последовательность, комплементарную нуклеиновой кислоте-мишени (например, направленной микроРНК), которая опосредует снижение уровня или активности нуклеиновой кислоты-мишени. Неограничивающие примеры ингибирующих РНК включают интерферирующую РНК, кшРНК, миРНК, рибозимы, антагомиры и антисмысловые олигонуклеотиды. Способы получения ингибирующих РНК описаны в настоящем документе. Дополнительные способы получения ингибирующих РНК известны в данной области. Согласно одному из вариантов осуществления микроРНК к BCL11A в настоящем документе описана ингибирующая РНК, вызывающая снижение активности мРНК BCL11А.
Как используют в настоящем документе, "интерферирующая РНК" относится к любой двухцепочечной или одноцепочечной последовательности РНК, способной к прямому или непрямому (т.е., после преобразования) ингибированию или подавлению экспрессии гена, опосредуя РНК-интерференцию. Интерферирующая РНК в качестве неограничивающих примеров включает малую интерферирующую РНК ("миРНК", siRNA) и корошкошпилечную РНК ("кшРНК", shRNA). "РНК-интерференция" относится к селективному разрушению совместимого по последовательности транскрипта матричной РНК.
Как используют в настоящем документе "кшРНК" (корошкошпилечная РНК, small hairpin RNA) относится к молекуле РНК, содержащей антисмысловую область, область петли и смысловую область, где смысловая область содержит комплементарные нуклеотиды, которые образуют пары оснований с антисмысловой областью с формированием дуплексного стебля. После посттранскрипционного процессинга корошкошпилечная РНК преобразуется в малую интерферирующую РНК вследствие события расщепления, опосредуемого ферментом Dicer, являющегося представителем семейства РНКазы III. Как используют в настоящем документе, фраза "посттранскрипционн процессинг" относится к процессингу мРНК, который происходит после транскрипции и опосредован, например, ферментами Dicer и/или Drosha.
Как используют в настоящем документе, "малая интерферирующая РНК" или "миРНК" относится к любой малой молекуле РНК, способной к ингибированию или подавлению экспрессии гена, опосредуя РНК-интерференцию зависимым от последовательности образом. Длина малых РНК может составлять, например, приблизительно от 18 до 21 нуклеотидов. Каждый дуплекс миРНК сформирован направляющей цепью и сопровождающей цепью. Расплетение дуплекса миРНК катализирует эндонуклеаза Argonaute 2 (Ago 2). После расплетения направляющая цепь встраивается в комплекс обеспечения специфичности РНК-интерференции (RISC), тогда как сопровождающая цепь ликвидируется. RISC использует направляющую цепь для нахождения мРНК с комплементарной последовательностью, что приводит к эндонуклеолитическому расщеплению мРНК-мишени.
Ретровирусы представляют собой РНК-содержащие вирусы, которые в своем цикле репликации используют обратную транскриптазу. Термин "ретровирус" относится к любому известному ретровирусу (например, к ретровирусам типа с, таким как вирус саркомы мышей Молони (MoMSV), вирус саркомы мышей Харви (HaMuSV), вирус опухоли молочной железы мышей (MuMTV), вирус лейкоза гиббонов (GaLV), вирус лейкоза кошек (FLV), спумавирус, вирус Фрэнд, вирус стволовых клеток мышей (MSCV) и вирус саркомы Рауса (RSV)). "Ретровирусы" по изобретению также включают вирусы Т-клеточных лейкозов человека, HTLV-1 и HTLV-2 и вирусы лентивирусного семейства ретровирусов, такие как вирусы иммунодефицита человека, ВИЧ-1, ВИЧ-2, вирус иммунодефицита обезьян (SW), вирус иммунодефицита кошек (FIV), вирус иммунодефицит лошадей (EIV) и другие классы ретровирусов.
Геномная РНК ретровирусов преобразует в двухцепочечную ДНК обратная транскриптаза. Эта форма двухцепочечной ДНК вируса способна к интеграции в хромосому инфицированной клетки; после интеграции ее обозначают как "провирус". Провирус служит в качестве матрицы для РНК-полимеразы II и обеспечивает экспрессию молекул РНК, которые кодируют структурные белки и ферменты, необходимые для продукции новых вирусных частиц.
На каждом конце провируса расположены структуры, называемые "длинными концевыми повторами" или "LTR". Термин "длинный концевой повтор (LTR)" относится к доменам пар оснований, расположенным на концах ретровирусной ДНК, которые в случае их природной последовательности представляют собой прямые повторы и содержат области U3, R и U5. Как правило, LTR обеспечивают функции, существенные для экспрессии ретровирусных генов (например, промоторную, функции инициации и полиаденилирования генных транскриптов) и для репликации вирусов. LTR содержит многочисленные регуляторные сигналы, включая элементы контроля транскрипции, сигналы полиаденилирования и последовательности, необходимые для репликации и интеграции вирусного генома. Вирусные LTR делятся на три области, называемые U3, R и U5. Область U3 содержит энхансерные и промоторные элементы. Область U5 представляет собой последовательность между участком связывания праймера и областью R и содержит последовательность полиаденилирования. Область R (повтор) фланкирована областями U3 и U5. LTR, состоящие из областей U3, R и U5, находятся на обоих 5'- и 3'-концах вирусного генома. Согласно одному из вариантов осуществления изобретения промотор в LTR, включая 5'-LTR, заменен гетерологичным промотором. Примеры гетерологичных промоторов, которые можно использовать, включают, например, промотор вируса некроза селезенки (SFFV), индуцируемый тетрациклином (ТЕТ) промотор, контрольную область локуса β-глобина и промотор β-глобина (LCR) и промотор цитомегаловируса (CMV).
Термин "лентивирус" относится к группе (или роду) ретровирусов, которые обуславливают медленно развивающиеся заболевания. Вирусы, входящие в эту группу, включают ВИЧ (вирус иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2), возбудитель синдрома приобретенного иммунодефицита человека (СПИД); вирус висна-маэди, вызывающий энцефалит (висна) или пневмонию (мэди) у овец, вирус артрита-энцефалита коз и овец, который вызывает иммунодефицит, артрит и энцефалопатию у коз; вирус инфекционной анемии лошадей, который вызывает аутоиммунную гемолитическую анемию и энцефалопатию у лошадей; вирус иммунодефицита кошек (FIV), который вызывает иммунодефицит у кошек; вирус иммунодефицита крупного рогатого скота (BIV), который вызывает лимфаденопатию, лимфоцитоз и возможно инфекцию центральной нервной системы у крупного рогатого скота; и вирус иммунодефицита обезьян (SIV), который вызывает иммунодефицит и энцефалопатию у человекообразных приматов. Заболевания, вызываемые этими вирусами характеризуются длительными периодами инкубации и продолжительным течением. Как правило, вирусы скрытно инфицируют моноциты и макрофаги, из которых они распространяются в другие клетки. ВИЧ, FIV и SIV также легко инфицируют Т-лимфоциты, т.е., Т-клетки.
Термин "область R" относится к области в ретровирусных LTR, начинающейся в начале кэпирующей группы (т.е., старта транскрипции) и заканчивающейся непосредственно перед стартом участка поли-А. Область R также определяют, как фланкируемую областями U3 и U5. Область R играет важную роль при обратной транскрипции, обеспечивая перенос образующейся ДНК от одного конца генома к другому.
Термин "промотор/энхансер" относится к участку ДНК, содержащему последовательности, способные к обеспечению промоторной и энхансерной функций. Например, длинные концевые повторы ретровирусов обладают промоторной и энхансерной функциями. Энхансер/промотор может быть "эндогенным", "экзогенным" или "гетерологичным". "Эндогенный" энхансер/промотор представляет собой энхансер/промотор, который связан с данным геном в геноме в природе. "Экзогенный" или "гетерологичный" энхансер/промотор представляет собой энхансер/промотор, который помещают рядом с геном посредством генетических манипуляций (т.е., способами молекулярной биологии), так что транскрипцию этого гена начинает контролировать связанный энхансер/промотор.
Если не определено иначе, все используемые в настоящем документе технические термины имеют то же значение, как обычно понимает специалист в области, к которой принадлежит данное изобретение. Способы и материалы описаны в настоящем документе для использования в настоящем изобретении; также можно использовать другие подходящие способы и материалы, известные в данной области. Материалы, способы и примеры являются исключительно иллюстративными и не предназначены для ограничения. Все публикации, патентные заявки, патенты и другие ссылочные материалы, указываемые в настоящем документе, полностью включены в качестве ссылки. В случае противоречия руководствоваться следует настоящим описанием, включая определения. Другие особенности и преимущества изобретения будут понятны из приводимых далее подробного описания и фигур и из формулы изобретения.
Краткое описание чертежей
Фиг. 1 представляет собой диаграмму двух вариантов осуществления предлагаемых синтетических микроРНК к BCL11A: олигонуклеотидов мкР1 (miR1) BCL11A и мкР2 (miR2) BCL11A. Структуру стебля/петли получают посредством комплементарных последовательностей, направленных к BCL11A последовательностей (нуклеотидные основания, приведенные прописными символами полужирным шрифтом) в нуклеотидах. Направленные к BCL11A последовательности являются участками BCL11A. Затем структуру стебля/петли клонируют в окружение мкР-223 (miR-223)/мкP-30 (miR-30) (окружение микроРНК). Затем всю структуру мкРНК/кшРНК клонируют в кассету SFFV/LCR/TET, содержащую лентивирусный вектор SIN, содержащий репортерный трансген (Venus).
Фиг. 2 представляет собой схематическое представление провирусов лентивирусных векторов с SFFV, ТЕТ и промоторами LCR.
Фиг. 3 представляет собой панель из двух столбчатых диаграмм, демонстрирующих, что SFFV-LV осуществляет эффективный нокдаун BCL11A и индуцирует экспрессию εγ-глобина.
Фиг. 4 представляет собой панель из двух столбчатых диаграмм, демонстрирующих что LCR/TET-LV осуществляет эффективный нокдаун BCL11A и индуцирует экспрессию εy-глобина.
Фиг. 5 представляет собой панель микрофотографий и диаграмм, демонстрирующих, что трансдуцированные CD34+-HSC дифференцируются ex vivo в эритроциты и экспрессируют HbF.
Фиг. 6 представляет собой панель диаграмм рассеяния, демонстрирующих трансдуцированные LCR-LV CD34+-HSC пациентов с SCD, трансплантированные мышам NSG.
Фиг. 7 представляет собой панель микрофотографий и диаграмм, демонстрирующих исследование потенциальной токсичности BCL11A для развития лимфоидных клеток.
Фиг. 8А-8Е демонстрируют скрининг и оценку кшРНК, направленных к BCL11А в экспрессирующих системах для pol III и pol II.
Фиг. 8А. Схематическое представление кассет с контролируемыми РНК-полимеразой III (pol III, промотор U6, слева) и РНК-полимеразой II (pol II, промотор SFFV, справа) кшРНК и мкРНК(223) со встроенной кшРНК, соответственно. Обе экспрессирующие кассеты встраивали в лентивирусные векторы. Различные блоки представляют сопровождающую цепь, направляющую цепь и структуру петли, как указано. Каркас мкРНК-223 (miRNA-223) представлен блоком с точечными линиями. Разные последовательности кшРНК, направленные к BCL11A, экспрессировали в этих двух каркасах и оценивали на эффективность нокдауна.
Фиг. 8В. Высокопроизводительный скрининг нескольких последовательностей кшРНК, направленных к различным областям мРНК BCL11A (общим для изоформ XL/L последовательностям, уникальным для XL кодирующим последовательностям и 3'-UTR изоформы XL, как указано), по эффективности нокдауна с использованием основанных на pol III лентивирусных векторов. В качестве функционального индикатора нокдауна BCL11A использовали индукцию ε-Y с анализом посредством кПЦР и индукцию репортера mCherry с анализом посредством FACS (в качестве заменителя индукции эпсилон-у в репортерной линии клеток). На ось y нанесена нормализованная относительно ненаправленного контроля экспрессия мРНК ε-γ, а на ось x нанесена средняя интенсивность флуоресценции (MFI) при экспрессии mCherry относительно нетрансдуцированного контроля. 11 кшРНК, которые тестировали далее, отмечены кругами.
Фиг. 8С и 8D. Сравнение эффективности нокдауна выбранных кшРНК в системах на основе pol III и на основе pol II. Клетки MEL трансдуцировали вектором LKO или вектором LEGO с экспрессией указанных кшРНК и трансдуцированные клетки отбирали в присутствии пуромицина (LKO) или отсортировывали по экспрессии Venus (LEGO). кшРНК мкР1 (miR1 ) ранее опубликована Sankaran et al. (). Уровни белка BCL11A представлены (фиг. 8С) посредством иммуноблота с β-актином в качестве контроля. XL и L демонстрируют положение каждой из изоформ белка BCL11A. (фиг. 8D) Интенсивность полос анализировали с использованием программного обеспечения ImageJ.
Фиг. 8Е. Кратность индукции нормализованной экспрессии ε-γ по сравнению с ненаправленным контролем определяют посредством кПЦР. Использовали трансдуцированные ненаправленными кшРНК клетки MEL и экспрессию принимали за 1. Данные представляют среднее ±SD характерного эксперимента из трех независимых экспериментов, проводимых в трех повторениях. *Р<0,05, **Р<0,01, ***Р<0,001.
Фиг. 9A-9F представляют собой данные, собранные после анализа секвенирования малых РНК, выявившего различный процессинг транскриптов pol III и pol II.
Фиг. 9А и 9В. Из трансдуцированных, отсортированных или отобранных на пуромицине клеток MEL, экспрессирующих мкР1 (miR1) или кшРНК С4 выделяли тотальную РНК. Затем полученную РНК подвергали глубокому секвенированию РНК. Процессированные конечные последовательности направляющих и сопровождающих цепей, транскрибируемые (фиг. 9А) pol III (LKO) или (фиг. 9В) pol II (LEGO) представлены на оси x, а соответствующие количества считываний на миллион общих считываний каждой цепи нанесены на оси y.
Фиг. 9C-9F. На оси y нанесены последовательности процессированных вариантов направляющей цепи мкР1 (miR1), транскрибируемые под контролем (фиг.9С) промотора pol III или (фиг. 9D) под контролем промотора pol II, а на оси х нанесены количества общих считываний. Последовательности процессированных вариантов молекул направляющей цепи С4, транскрибируемых с (фиг. 9Е) промотора pol III или (фиг. 9F) промотора pol II, нанесены на оси y, а количества общих считываний нанесены на оси x.
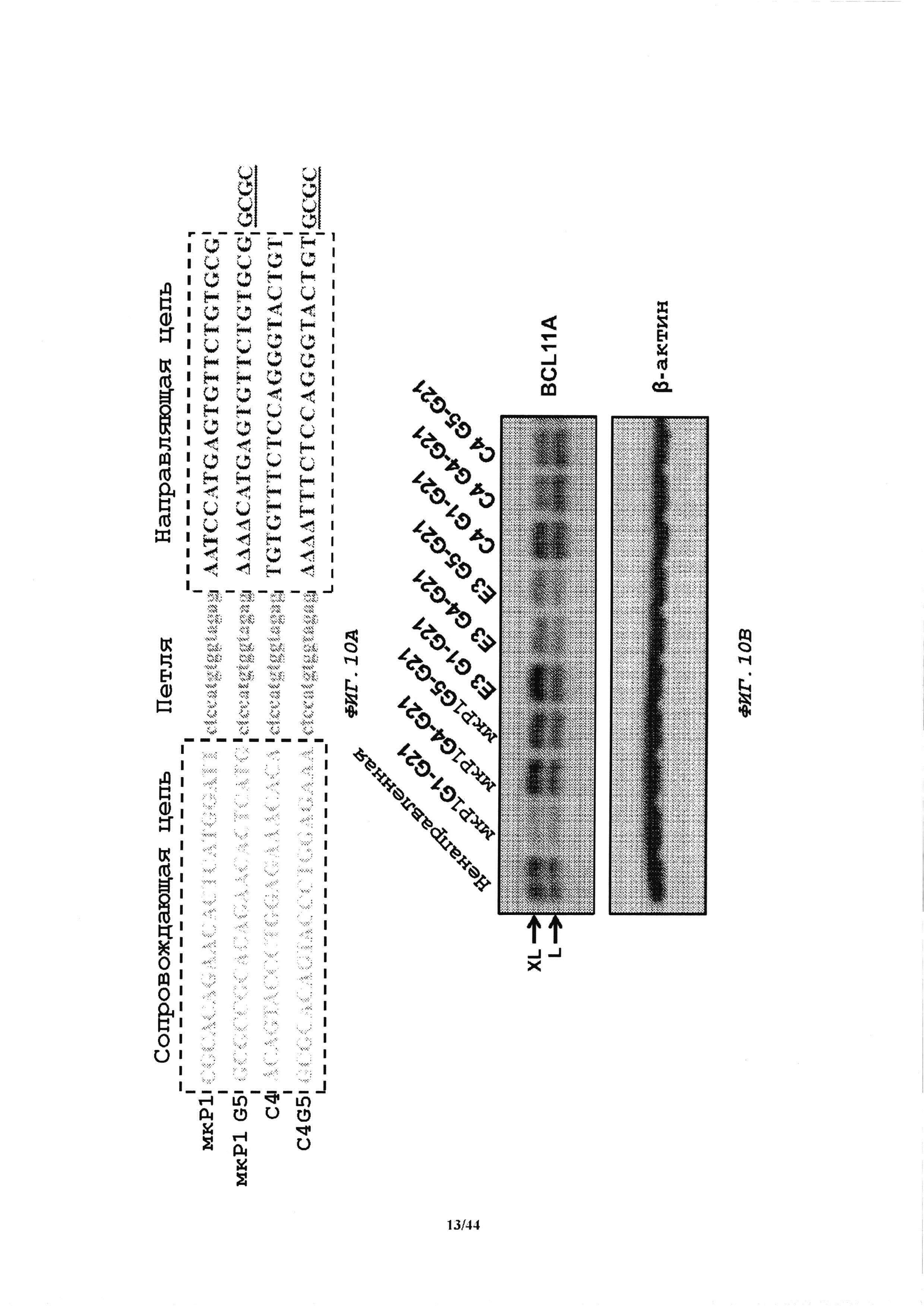
Фиг. 10A-10D демонстрируют, что модификация последовательностей кшРНК приводят к увеличенному нокдауну и улучшенному соотношению направляющей и сопровождающей цепей.
Фиг. 10А. miR1 и кшРНК С4 модифицировали так, что на 5'-конце удаляли четыре основания, а на 3'-конце добавляли GCGC с получением модифицированной кшРНК, обозначенной мкР1 (miR1) G5 и C4G5.
Фиг. 10В. Сравнение эффективности нокдауна модифицированных и исходных последовательностей кшРНК. Клетки MEL трансдуцировали LEGO с экспрессией указанных кшРНК посредством промотора pol II и трансдуцированные клетки отсортировывали по экспрессии Venus. Уровни белка BCL11A определяли посредством иммуноблота с β-актином в качестве контроля нагрузки. XL и L указывают положения этих изоформ белка BCL11А.
Фиг. 10С. Интенсивность полос иммуноблота анализировали с использованием программного обеспечения ImageJ.
Фиг. 10D. Кратность индукции нормализованной экспрессии ε-γ модифицированными/немодифицированными последовательностями кшРНК по сравнению с ненаправленным контролем определяют посредством кПЦР. Данные представляют среднее ±SD характерного эксперимента из трех независимых экспериментов, проводимых в трех повторениях, демонстрирующих сходные результаты. *Р<0,05, **Р<0,01.
Фиг. 11А-11С демонстрируют, что анализ последовательностей РНК четырех кшРНК с модифицированными парами оснований выявляет правильный процессинг.
Фиг. 11А. Тотальную малую РНК выделяли из трансдуцированных, отсортированных MEL, экспрессирующих модифицированную miR1 и модифицированную кшРНК С4 и секвенировали. Распределение частот молекул процессированных направляющих цепей модифицированной мкР1 (miR1) (miR1-G5 и C4G5), транскрибируемых под контролем промотора pol II, нанесены на оси y, а доля считываний на миллион общих считываний нанесена на оси x.
Фиг. 11В и 11С. Последовательности молекул процессированных вариантов направляющей цепи miR1-G5 и C4-G5 представлены на оси y, а частоты считываний представлены на оси x.
Фиг. 12А. Кандидаты после скрининга кшРНК, направленные к BCL11A с использованием вектора pLKO.
Фиг. 12В. Состав последовательностей направляющей цепи и их распределение в pLKO. При использовании конструкций pLKO всегда наблюдают сдвиг на 5'-конце, который может являться результатом достройки богатой остатками Т последовательности на 3'-конце. Добавляемые остатки Т являются частью терминирующей последовательности pol III. Этот сдвиг в зрелой последовательности кшРНК указывает, что в течение опосредованного Dicer процессинга доминирующим является правило отсчета с 3'-конца, означающее, что инициация расщепления кшРНК происходит на расстоянии 21 нуклеотида от 3'-конца. Это приводит к сдвигу в 3 или 4 пары нуклеотидов на 5'-конце, а также к идентично сдвинутой затравочной области (основания 2-7 направляющей цепи), предназначенной для распознавания мишени.
Фиг. 13. Состав последовательностей направляющей цепи и их распределение в LEGO. Глубокий анализ последовательностей малых РНК выявил различный процессинг транскриптов pol III и pol II. При использовании конструкций LEGO сдвига на 5'-конце не наблюдают, и направляющая цепь подвергается правильному процессингу Dicer, что приводит к теоретически рассчитанному продукту. Таким образом, конечные направляющие цепи при использовании конструкций под контролем pol III и pol II различаются.
Фиг. 14А. Конструкция новых кшРНК, воспроизводящих зрелые направляющие цепи, продуцируемые в векторе вектор pLKO. Все кшРНК модифицировали так, что на 5'-конце удаляли четыре основания и а на 3'-конце добавляли GCGC с получением модифицированных кшРНК, обозначенных miR1 G5, E3G5, B5G5, D8G5, B11G5, 50D12G5, 50В11G5, 50A5G5, 50C4G5. При проведении этого сдвига при использовании E3G5, D8G5 и C4G5 наблюдали значительное улучшение в отношении нокдауна BCL11А и индукции эпсилон-гамма, "хххх" означает положение сдвига рамки из 4 пар оснований (п.о.), которое приводит к 4 основаниям, удаленным из немодифицированных miR1 , Е3, В5, D8, В11, 50D12 (также обозначаемой D12), 50 В11, 50А5 (также обозначаемой А5) и 50С4 (также обозначаемой С4).
Фиг. 14В. Состав последовательностей направляющей цепи и их распределение в модифицированном LEGO. Глубокий анализ последовательностей РНК модифицированных кшРНК демонстрирует правильный процессинг со сдвигом 4 п.о., который указывает, что проводя сдвиг авторы могут точно воспроизводить продукт векторов pLKO. Так как для скрининга эффективных кшРНК использовали векторы pLKO, эта модификация при переносе кассеты кшРНК в каркасы под контролем pol II точно воспроизводит продукт зрелой направляющей последовательности.
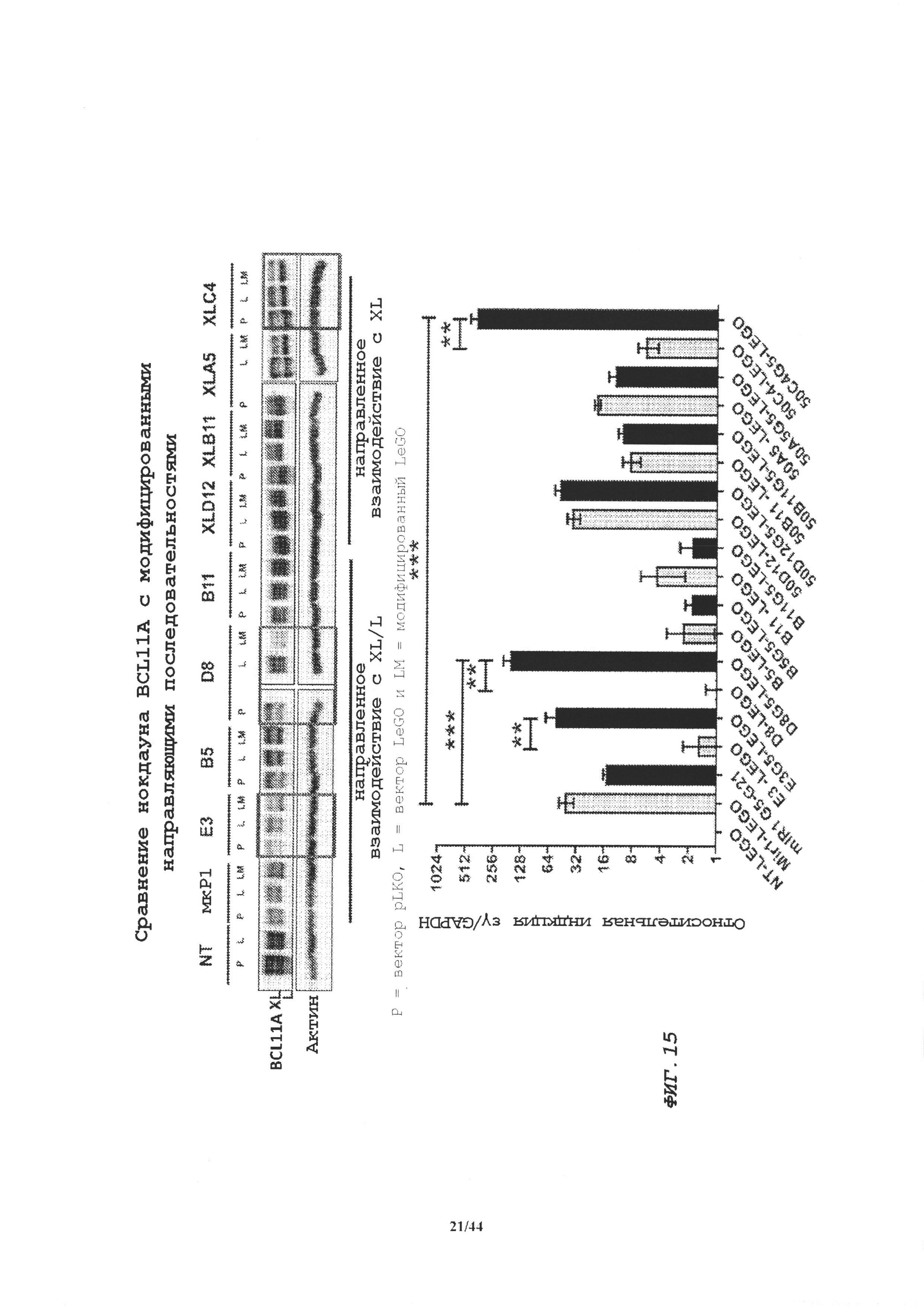
Фиг. 15. Сравнение нокдауна BCL11A модифицированными направляющими последовательностями. Сравнение эффективности нокдауна модифицированными и исходными последовательностями кшРНК. Вестерн-блоттинг, демонстрирующий экспрессию BCL11A (изоформы XL и L, верхняя панель). Красные круги указывают кшРНК, где достигнут улучшенный нокдаун BCL11А после проведения сдвига на 4 п.о. Нижняя панель: кратность индукции нормализованной экспрессии ε-γ модифицированными/немодифицированными последовательностями кшРНК сравнивали с ненаправленным контролем с определением посредством кПЦР.
Фиг. 16. Сравнение экспрессии мкР (miR) с модифицированными направляющими последовательностями. В соответствии с увеличением эффективности нокдауна и индукции эпсилон-у при проведении нозерн-блоттинга модифицированных конструкций по сравнению с модифицированными, особенно с E3G5, D8G5 и C4G5, выявлена высокая экспрессия направляющей цепи (что приводит к увеличению эффективности нокдауна).
Фиг. 17. Эффективность нокдауна BCL11A и индукции εγ векторами LEGO. Сравнение эффективности нокдауна выбранных кшРНК в системах pLKO на основе pol III и pLEGO на основе pol II. Клетки MEL трансдуцировали указанными кшРНК в векторе pLKO или в векторе pLEGO и трансдуцированные клетки отбирали в присутствии пуромицина (pLKO) или отсортировывали по экспрессии Venus (pLEGO). Уровни белка BCL11A определяли посредством иммуноблота с β-актином в качестве контроля. Кратность индукции нормализованного ε-γ по сравнению с ненаправленным контролем определяют посредством кПЦР. В качестве отрицательных контролей использовали трансдуцированные ненаправленными кшРНК клетки MEL. Сдвиг рамки оказывал сильное влияние на эффективность нокдауна и индукцию εγ. кшРНК, направленные только к изоформе XL, оказывают сильное влияние на индукцию εγ. Данные представляют среднее ±SD из трех независимых экспериментов, где каждый проводили в трех повторениях. *P<0,05.
На фиг. 18 представлен различный процессинг в векторах кшРНК для pol-III и в векторах, адаптированных к микроРНК кшРНК для pol-II.
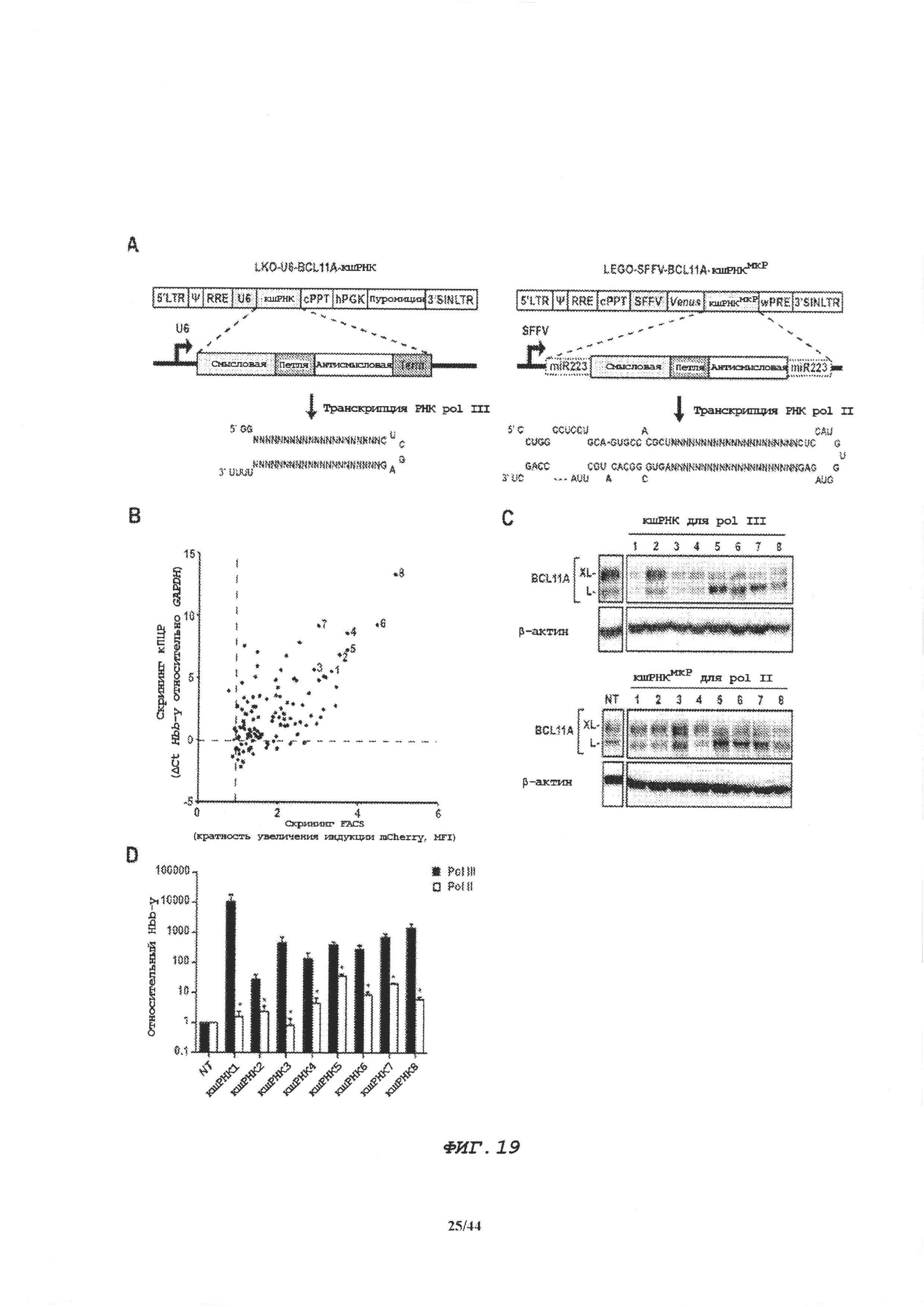
Фиг. 19A-19D демонстрируют скрининг и оценку кшРНК, направленных к BCL11А в экспрессирующих системах для pol III и pol II.
Фиг. 19А. Схематическое представление LKO-U6-BCL11A-кшPHK (левая сторона) и LEGO-SFFV-BCL11А-кшРНКмкР (правая сторона). Обе экспрессирующие кассеты сконструированы в лентивирусных векторах, как описано в материалах и методах. Левые серые блоки представляют смысловую цепь; белые блоки представляют антисмысловую цепь; темно-серые блоки представляют структуру петли, и каркас miRNA223 указан точечными линиями. Ниже представлены структуры шпилек. Различные последовательности кшРНК, направленные к BCL11A, экспрессировали в этих двух каркасах и оценивали на эффективность нокдауна.
Фиг. 19В. Высокопроизводительный скрининг нескольких последовательностей кшРНК, направленных к мРНК BCL11А, на эффективность нокдауна с использованием лентивирусных векторов на основе pol III. В качестве функционального индикатора нокдауна BCL11A использовали индукцию мРНК Hbb-y с анализом посредством кОТ-ПЦР и индукцию репортера mCherry с анализом посредством FACS (в качестве заменителя индукции ε-γ в репортерной линии клеток). На ось y нанесена нормализованная относительно ненаправленного контроля экспрессия мРНК Hbb-y, а на ось x нанесена кратность индукции экспрессии mCherry (в виде средней интенсивности флуоресценции, MFI) относительно нетрансдуцированного контроля. Восемь наиболее эффективных кшРНК, выделенных на основе скрининга тестировали дополнительно и обозначили как 1-8.
Фиг. 19С. Сравнение эффективности нокдауна выбранных кшРНК в системах на основе pol III (U6) и pol II (SFFV). Клетки MEL трансдуцировали векторами с U6 (верхняя панель) или с SFFV (нижняя панель) с экспрессией указанных кшРНК и трансдуцированные клетки выбирали в присутствии пуромицина (pol III) или отсортировывали по экспрессии Venus (pol II). Уровни белка BCL11A представлены посредством иммуноблота с β-актином в качестве контроля. XL и L слева от панели обозначают положение каждой из изоформ белка BCL11А.
Фиг. 19D. Кратность индукции нормализованной экспрессии Hbb-y по сравнению с ненаправленным контролем, определяемая посредством кПЦР. Экспрессия в трансдуцированных ненаправленными (NT) кшРНК клетках MEL принимали за 1. Черные столбцы представляют относительную экспрессию посредством кшРНК под контролем промотора U6, а белые столбцы представляют кшРНК под контролем промотора SFFV. Данные представляют среднее ±SD характерного эксперимента из трех независимых экспериментов, проводимых в трех повторениях. * Р<0,05.
Фиг. 20А и 20В демонстрируют, что анализ последовательностей малых РНК выявляет различный процессинг транскриптов pol III и pol II. Результаты секвенирования малых РНК клеток MEL, трансдуцированных U6-кшРНК и SFFV-кшРНКмкР1, 2, 3, 4, 7 или 8. Последовательности РНК выравнивали по соответствующей референсной последовательности направляющей цепи, представленной вверху каждой панели полужирным шрифтом с фланкирующими последовательностям, представленными серым цветом. Различные варианты направляющей цепи, полученные с (фиг. 20А) U6-кшРНК или (фиг. 20В) SFFV-кшРНКмкР нанесены на оси y. На оси x представлен относительный % распределения каждого из вариантов, рассчитанный на основе общего количества считываний, совпадающих с референсной последовательностью кшРНК.
Фиг. 21А-21Е демонстрирует модификацию последовательностей кшРНК приводящую к увеличенному нокдауну и улучшенному соотношению направляющей и сопровождающей цепи в клетках MEL.
Фиг. 21А. SFFV-кшРНКмкР модифицировали, удаляя первые четыре основания из направляющей последовательность и добавляя GCGC на 3'-конце (модифицированная кшРНК)
Фиг. 21В. Сравнение эффективности нокдауна модифицированных и исходных последовательностей кшРНКмкР, экспрессируемых под контролем промотора pol II SFFV в клетках MEL. Уровни белка BCL11А измеряли в отсортированных посредством FACS трансдуцированных клетках посредством иммуноблота с β-актинов в качестве контроля нагрузки. XL и L слева на верхней панели указывают положение этих изоформ белка BCL11А. РIII: вектор с промотором pol III; РII: вектор с промотором pol II; РIIМ: вектор с промотором pol II, содержащий модифицированные последовательности кшРНКмкР.
Фиг. 21С. Кратность индукции немодифицированными (белые столбцы) и модифицированными (заштрихованные столбцы) последовательности кшРНКмкР Hbb-у по сравнению с ненаправленным контролем, определенная посредством кОТ-ПЦР. Данные представляют среднее ±SD. **Р<0,01.
Фиг. 21D. Анализ "нозерн"-блот тотальной РНК, выделенной из клеток, трансдуцированных несколькими кшРНК и кшРНКмкР. Для определения содержания процессированных малых РНК использовали зонды (20 н.), комплементарные направляющим и сопровождающим цепям в положениях от 1 до 20 кшРНК и кшРНКмкР. В качестве внутреннего контроля для определения загрузки РНК использовали зонд, комплементарный 5S РНК. РIII: вектор с промотором pol III; РII: вектор с промотором pol II; РИМ: вектор с промотором pol II, содержащий модифицированные последовательности кшРНКмкР.
Фиг. 21Е. Результаты секвенирования РНК гомогенных популяций трансдуцированных клеток MEL, экспрессирующих кшРНК1, 2, 3, 4, 7 или 8. Последовательности этих РНК выравнивали в соответствии с референсной последовательностью направляющей цепи, представленной сверху каждой панели. На оси y расположены последовательности различных молекул направляющих цепей, а на оси х представлены частоты в виде процента выровненных считываний.
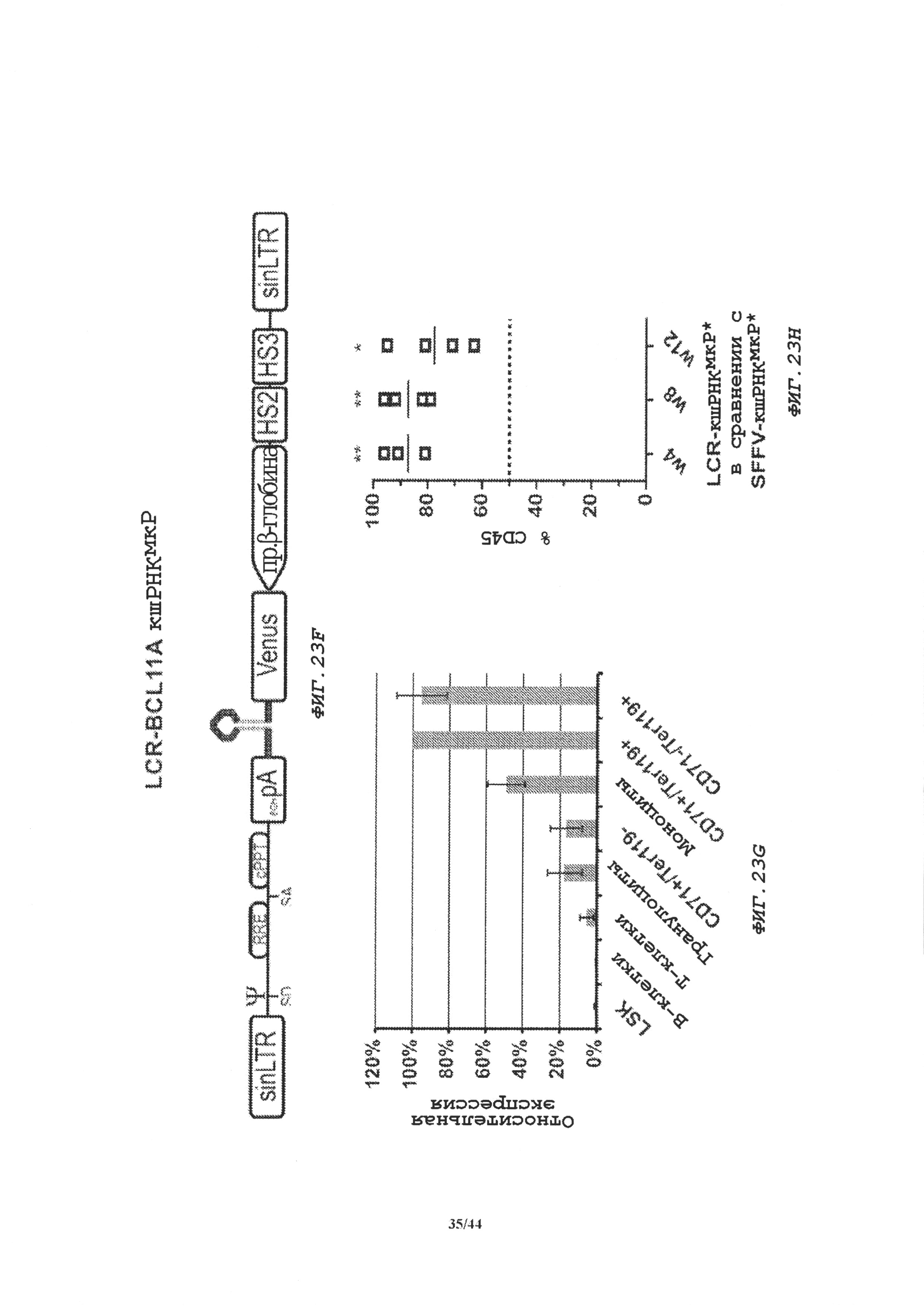
Фиг. 22А-22Е демонстрирует модифицированные кшРНКмкР, приводящие к увеличенной эффективности нокдауна BCL11A и индукции гамма-глобина в полученных из CD34+-клеток эритроидных клетках человека.
Фиг. 22А. СВ34+-клетки, трансдуцированные векторами pol III или pol II, экспрессирующими различные кшРНК с модификацией и без, выбирали в присутствии пуромицина (pol III) или отсортировывали по экспрессии Venus (pol II и модифицированные pol II). Экспрессию BCL11А определяли посредством иммуноблота с β-актином в качестве контроля нагрузки на сутки 11 дифференцировки.
Фиг. 22В. Индукцию мРНК γ-глобина определяли на сутки 18 дифференцировки посредством кОТ-ПЦР. Данные представляют процент γ-глобина от общей продукции β-локуса (у+Р-глобин) для pol III (черные столбцы), pol II (белые столбцы) и модифицированных pol II (серые столбцы). *р>0,05; ***р>0,001.
Фиг. 22С. Количественное определение и статистический анализ маркеров эритроидной дифференцировки (CD71, GpA) и оценку энуклеации проводили посредством проточной цитометрии. CTRL: контрольные векторы SFFV-shRNAmiRNT и SEW; РIII: векторы pol III; РII: векторы pol II; РIIМ: векторы pol II, содержащие модифицированные последовательности кшРНКмкР. Данные представляют среднее ±SD из трех независимых экспериментов. ***р>0,001.
Фиг. 22D. Гемоглобин F в лизатах клеток измеряли посредством ВЭЖХ на сутки 18 дифференцировки. Стрелка указывает пики HbF, а процентное содержание HbF от общего гемоглобина предоставлено ниже хроматограммы.
Фиг. 22Е. Диаграмма корреляции экспрессии мРНК γ-глобина, анализируемой посредством кОТ-ПЦР, и HbF, анализируемого посредством ВЭЖХ. Черные круги, представляют векторы pol III, незаштрихованные и серые круги представляют pol II или модифицированные кшРНКмкР, соответственно. Коэффициент корреляции (r2) представлен для всех данных.
Фиг. 23A-23I демонстрируют, что отрицательное влияние нокдауна BCL11A на HSC in vivo предотвращено ограничением экспрессии эритроидными клетками.
Фиг. 23А. Линейные негативные клетки костного мозга, выделенные из P-YAC мыши (CD45.2) трансдуцировали ex vivo векторами LeGO, экспрессирующими кшРНКмкР*, направленными к BCL11A, или ненаправленным контрольным вектором (SFF-shRNAmiRNT) и трансплантировали летально облученным реципиентам BoyJ (CD45.1). В качестве контроля трансплантировали нетрансдуцированные контрольные клетки. Анализ приживления проводили через 4, 8 и 12 недель после трансплантации в периферическую кровь и костный мозг, соответственно. (n=4 мышей на группу)
Фиг. 23В. Фракцию геномодифицированных клеток (клетки Venus+) у этих мышей определяли через 4, 8 и 12 недель после трансплантации в периферическую кровь и костный мозг.
Фиг. 23С. Проводили конкурирующие трансплантации с использованием донорских клеток с CD45.1 и CD45.2, трансдуцированных указанными векторами и трансплантированными гетерозиготным мышам с CD45.1/2 (верхние панели). Альтернативно для идентификации конкурирующей популяции донора CD45.1 в условиях реципиента CD45.2 использовали нейтральный вектор, кодирующий синий флуоресцентный белок (SFFV-BFP) использовали (нижние панели). Представлены характерные дот-блоты различных смешанных популяций, используемых для трансплантации, через трое суток после трансдукции. Два конкурирующих вектора указаны над каждой из панелей, первый указывает трансдуцированные популяции CD45.2 или SFFV-BFP, соответственно.
Фиг. 23D. Распределение геномодифицированных клеток у мышей с восстановленной на конкурентной основе популяцией анализировали через 4 и 8 недель после трансплантации в периферическую кровь (РВ) или на неделе 12, при трансплантации в костный мозг (ВМ) и селезенку (Sp1). Представлено относительное распределение геномодифицированных клеток, трансдуцированных двумя конкурирующими векторами. Первый указанный вектор преобладал в гемопоэтических продуктах. Каждая точка относится к индивидуальной мыши-реципиенту.
Фиг. 23Е. Парное сравнение фракции В-клеток костного мозга в трансдуцированной фракции клеток, направленных к BCL11A векторов и контрольных векторов (SFF-shRNAmiRNT и SFFV-BFP, левая панель). Подобным образом, во фракциях трансдуцированных клеток анализировали содержание LSK. Каждая точка относится к индивидуальному реципиенту. * и ** означают значения p≤0,05 и 0,01, соответственно.
Фиг. 23F. Конфигурация вектора LCR-кшРНКмкР, используемого для специфичной для эритроидных клеток экспрессии (подробности в тексте).
Фиг. 23G. Через 12 недель после трансплантации в различных гемопоэтических линиях анализировали профиль экспрессии вектора LCR in vivo. Процентное содержание клеток Venus+ у каждой мыши нормализовали на эритроидные клетки CD71+/Ter119+ (n=4).
Фиг. 23Н. Эксперимент с конкурирующей трансплантацией, как описано в с и d, проводили с использованием векторов LCR или SFFV, экспрессирующих кшРНКмкР*. Каждая точка относится к индивидуальному реципиенту.
Фиг. 23I. Мобилизованные СВ34+-клетки периферической крови трансдуцировали LCR-кшРНКмкР*, 3 и 8 или контрольным вектором SFFV-GFP и подвергали эритроидной дифференцировке in vitro. На сутки 7 после трансдукции оценивали промоторную активность векторов SFFV-GFP и LCR в различных эритроидных субпопуляциях. Представлены характерные потоковые диаграммы. Величины ошибок на всех фигурах = SD. Статистический анализ: t-критерий.
Фиг. 24A-24F демонстрируют специфичный для линий нокдаун BCL11A и индукцию гамма-глобина модифицированными кшРНКмкР.
Фиг. 24А. CD34+-HSPC, трансдуцированные LCR-кшРНКмкР 3, 8 или контрольным вектором SFFV-GFP подвергали сортировке FACS по экспрессии флуоресцентного репортера, а экспрессию BCL11A измеряли посредством иммуноблота с β-актином в качестве контроля нагрузки на сутки 11 дифференцировки.
Фиг. 24В. Индукция мРНК γ-глобина определяли на сутки 18 дифференцировки посредством кОТ-ПЦР. Данные представляют процентное содержание γ/(γ+β)-глобина.
Фиг. 24С. Количественное определение и статистический анализ маркеров эритроидной дифференцировки (CD71, GpA) и оценка энуклеации посредством проточного цитометрического анализа. CTRL: контрольный вектор SFFV-GFP; LCRM: модифицированные кшРНКмкР, представленные на фиг. 23А, экспрессируемые посредством промотора LCR. Данные представляют среднее ±SD из трех независимых экспериментов.
Фиг. 24D. Уровень HbF в лизатах клеток измеряли посредством ВЭЖХ на сутки 18 дифференцировки. Стрелки указывают пики HbF, и под хроматограммой представлено процентное содержание HbF от всего гемоглобина.
Фиг. 24Е. Диаграмма корреляции индукции γ-глобина с анализом посредством кОТ-ПЦР по и HbF с анализом посредством ВЭЖХ. Величины ошибок означают ±SD из трех независимых экспериментов.
Фиг. 24F. CD34+-HSPC костного мозга трансдуцировали LCR-кшРНКмкР3 или NT и трансплантировали сублетально облученным мышам NSG (n=3 на группу). В качестве контроля использовали нетрансдуцированные клетки. Через четырнадцать недель из костного мозга подвергнутых трансплантации животных выделяли CD34-клетки и подвергали эритроидной дифференцировке in vitro в течение 14 суток. Экспрессия γ-глобина и β-глобина оценивали в клетках, отсортированных по экспрессии репортера Venus.
На фиг. 25 представлено глубокое секвенирование 247 процессированных продуктов кшРНК TRC в четырех линиях клеток.
На фиг. 26 представлен профиль экспрессии вектора LCR-кшРНКмкР in vivo.
Фиг. 27А представляет собой вестерн-блоттинг дифференцированных in vitro эритроидных клеток, получаемых из трансдуцированных CD34+-клеток здоровых доноров, демонстрирующий изоформы BCL11A (L и XL) и β-актин в качестве контроля нагрузки и демонстрирующий эффективный нокдаун XL BCL11A. Под каждой дорожкой представлено VCN, определенное посредством ПЦР ДНК.
На фиг. 27В представлено количественное определение нокдауна BCL11A в эритроидных клетках. Данные получают посредством вестерн-блоттинга, как представлено на фиг. 27А. Данные обобщают три независимых эксперимента с использованием клеток одного донора, (величины ошибок: SD)
На фиг. 27С представлена индукция гамма-глобина в эритроидных клетках с анализом посредством ОТ-кПЦР и гемоглобина (HbF) с анализом посредством ВЭЖХ. (величины ошибок: SD)
На фиг. 28 представлена индукция гамма-глобина в эритроидных клетках с анализом посредством ОТ-кПЦР. Количество индуцированного гамма-глобина в эритроидных клетках представляет собой меру нокдауна BCL11A в клетках in vivo. Величины ошибок: SD. Приведены данные для трех трансплантированных животных на группу.
На фиг. 29А представлен вестерн-блоттинг, демонстрирующий BCL11A (изоформы L и XL) и β-актин в качестве контроля нагрузки и демонстрирующий эффективный нокдаун XL BLC11А. Каждая панель (отмеченная как 1-6 под дорожкой) представляет независимый эксперимент с использованием клеток одного донора.
На фиг. 29В представлено количественное определение нокдауна BCL11A в эритроидных клетках. Данные получают посредством вестерн-блоттинга, представленного на фиг. 29А. (величина ошибки: SD)
На фиг. 29С представлена итоговая индукция HF с анализом посредством ВЭЖХ. (величины ошибок: SD)
На фиг. 30 представлены последовательности, используемые в каркасах SFFV и LCR для нокдауна BCL11A в дифференцированных эритроидных СD34+-клетках.
На фиг. 31 представлен вестерн-блоттинг нокдауна BCL11A в дифференцированных эритроидных СВ34+-клетках.
Подробное раскрытие настоящего изобретения
Описываемое в настоящем документе изобретение частично основано на разработке лентивирусных генотерапевтических векторов, которые селективно экспрессируют направленные к BCL11A кшРНК в потомстве гемопоэтических стволовых клеток (HSC). Таким образом, изобретение включает новые способы регулировки экспрессии γ-глобина в эритроидных клетках. Более конкретно, эти способы можно использовать в способах лечения гемоглобинопатии, включая SCD и THAL, посредством индукции γ-глобина посредством ингибирования продукта гена BCL11A. В конкретных вариантах осуществления предоставлены лентивирусные генотерапевтические векторы, которые селективно экспрессируют направленные к BCL11A кшРНК в потомстве HSC, предшественников гемопоэтических клеток или других стволовых клеток, таких как эмбриональные клетки.
Нормальный гемоглобин взрослых содержит четыре глобиновых белка, два из которых являются белками альфа (α) и два из которых являются белками бета (β). В течение эмбрионального развития млекопитающих, в частности людей, плод продуцирует фетальный гемоглобин, содержащий два белка гамма (γ)-глобина вместо двух белков β-глобина. В определенный момент эмбрионального развития, происходит эмбриональное переключение глобинов в результате чего эритроциты плода переключаются с продукции преимущественно γ-глобина на продукцию преимущественно β-глобина. Онтогенетическое переключение с продукции преимущественно фетального гемоглобина или HbF (α2γ2) на продукцию гемоглобина взрослых или НbА (α2β2) начинается приблизительно в период от 28 до 34 недели беременности и продолжается недолго после рождения, пока НbА не станет преобладающим. Это переключение преимущественно является результатом уменьшенной транскрипции генов γ-глобина и увеличенной транскрипции генов β-глобина. В среднем кровь нормального взрослого содержит приблизительно только 2% HbF, хотя остаточные уровни HbF у здоровых взрослых колеблются более чем в 20 раз (Atweh, Semin. Hematol. 38: 367-73 (2001)).
Гемоглобинопатии включают ряд анемий генетического происхождения, при которых происходит уменьшенная продукция и/или увеличенное разрушение (гемолиз) эритроцитов (RBC). Также они включают генетические дефекты, которые приводят к продукции аномального гемоглобина, с сопутствующей ухудшенной способностью к поддержанию концентрации кислорода. Некоторые из таких нарушений включают невозможность продукции нормального β-глобина в достаточных количествах, тогда как другие включают полную невозможность продукции нормального β-глобина. Эти нарушения, ассоциированные с белком β-глобином в целом обозначают как гемоглобинопатии. Например, SCD является результатом точечной мутации в структурном гене β-глобина, приводящей к продукции аномального (серповидноклеточного) гемоглобина (HbS). RBC с HbS являются менее прочными, чем нормальные RBC и легче подвергаются гемолизу, что в конечном счете приводит к анемии (Atweh, Semin. Hematol. 38 (4): 367-73 (2001)). THAL является результатом частичной или полной недостаточности экспрессии гена β-глобина, приводящей к недостаточности или отсутствию НbА.
Поиск лечения с целью снижения дисбаланса цепей глобинов у пациентов с гемоглобинопатиями был сфокусирован на фармакологических манипуляциях с фетальным HbF. Терапевтический потенциал таких подходов демонстрируется теми наблюдениями, что в определенных группах взрослых пациентов с аномалиями р-цепи и более высокими чем в норме уровнями HbF наблюдают более мягкое клиническое течение заболевания, чем у пациентов с нормальными для взрослых уровнями HbF. Например, группа в группе пациентов с серповидноклеточной анемией из Саудовской Аравии с экспрессией 20-30% HbF наблюдают только слабо выраженные клинические проявления заболевания (Pembrey, et al., Br. J. Haematol. 40: 415-429 (1978)). В настоящее время признано, что течение таких гемоглобинопатии, как SCD и THAL, при увеличенной продукции HbF смягчается (Jane et al., Br. J. Haematol. 102: 415-422 (1998); Bunn, N. Engl. J. Med. 328: 129-131 (1993)).
Терапевтической мишенью при β-гемоглобинопатиях является репрессор транскрипции BCL11A. Для снижения экспрессии BCL11A в гемопоэтических клетках использовали РНК-интерференцию с использованием экспрессируемых под контролем промотора pol III короткошпилечных РНК (кшРНК). Нокдаун BCL11A в гемопоэтических стволовых клетках (HSC) мышей снижал долгосрочное приживление. Во избежание токсичности для HSC экспрессию BCL11A в эритроидных клетках селективно супрессировали посредством экспрессируемых под контролем промотора pol II адаптированных к микроРНК кшРНК (кшРНКмкР). При наличии идентичных соответствующих мишеням последовательностей при использовании векторов для pol II наблюдали заметно сниженный нокдаун вследствие различий направляющих цепей в 3-5 н. с системами, которые сильно влияют на нокдаун мишени. В направляющих цепях кшРНКмкР был сконструирован соответствующий сдвиг в 4 н., который неожиданно и непредвиденно улучшил нокдаун BCL11A и дерепрессию Hbb-y, функционального гомолога гена γ-глобина человека в эритроидной линии клеток мышей. Модифицированные кшРНКмкР экспрессировали специфичным для эритроидных клеток способом для преодоления неблагоприятных воздействий на приживление HSC у мышей, и это привело к эффективному нокдауну BCL11А и высоким уровням HbF в полученных у человека эритроидных СD34-клетках. Была разработана стратегия для проспективного конструирования кшРНКмкР из получаемых при скрининге экспрессируемых с pol III кшРНК. Эта стратегия составляет улучшенный подход к генетической терапии гемоглобинопатии и других заболеваний, требующих специфичной для линий экспрессии последовательностей сайленсинга генов. Ретровирусные и лентивирусные векторы
В определенных вариантах осуществления в настоящем изобретении предоставлены улучшенные композиции и способы лечения гемоглобинопатии с использованием основанных на ретровирусах, например, основанных на лентивирусах векторов для доставки генов, которые обеспечивают длительную, высокоуровневую экспрессию трансфицированных терапевтических генов в эритроидных клетках или клетках-предшественниках эритроидных клеток. Согласно одному из вариантов осуществления изобретения вектор содержит искусственную мкРНК, содержащую направленные к BCL11A последовательности клонированные в петлю стебля эндогенной последовательности мкР-223 (miR-223) (Amendola et al., Mol. Ther. 17: 1039-52, 2009). Структуру стебля/петли в векторах по настоящему изобретению получают посредством комплементарных последовательностей олигонуклеотидов SEQ ID NO: 1-18 и 25-44, описываемых в настоящем документе. См. фиг. 1, 12А, 14А, 21А и пример 11. Эту структуру стебля/петли клонировали в окружение мкР-223 (miR-223)/мкP-30 (miR-30). Затем всю структуру мкРНК/кшРНК клонировали в кассету с содержащим промотор SFFV, ТЕТ или LCR самоинактивирующимся (SIN) вектором. Конкретные лентивирусные векторы по изобретению описаны в Pawliuk et al. (2001) Science 294: 2368 и Imren et al. (2002) PNAS 99: 14380, включенные в настоящий документ в качестве ссылки.
Таким образом, согласно одному из аспектов в настоящем документе предоставлена синтетическая микроРНК к BCL11A, содержащая первый участок BCL11A, участок петли и второй участок BCL11A, расположенные последовательно в направлении от 5' к 3', где участок петли расположен между первым и вторым участками BCL11A и непосредственно связан с ними, и где второй участок BCL11A комплементарен первому участку BCL11A так, что основания первого и второго участков BCL11A спарены с формированием петли шпильки с участком петли, формирующим область петли сформированной, таким образом, петли шпильки.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, длина первого и второго участков BCL11А составляет приблизительно от 18 до 25 нуклеотидов. Первый участок BCL11A получают из последовательности BCL11A и он служит источником сопровождающей цепи при процессинге кшРНК в дуплексную миРНК, а второй участок BCL11A комплементарен первому участку BCL11A, где второй участок BCL11A служит источником направляющей цепи, которая встраивается в комплекс обеспечения специфичности РНК-интерференции (RISC) для РНК-интерференции или сайленсинга гена BCL11A.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый и второй участки BCL11А получают из последовательности мРНК BCL11A.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A начинается с -GCGC- на 5'-конце, а второй участок BCL11A заканчивается -GCGC- на 3'-конце.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A на 5'-конце дополнительно содержит -GCGC, а второй участок BCL11A на 3'-конце заканчивается -GCGC-.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A на 5'-конце начинается с -GCGA-, -TCTG- или -TG-, а второй участок BCL11A комплементарен первому участку BCL11А.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A на 5'-конце дополнительно содержит -GCGA-, -TCTG- или -TG-.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, второй участок BCL11A на 3'-конце заканчивается -ТТТТ-.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11А, описываемых в настоящем документе, синтетическая микроРНК к BCL11A содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, синтетическая микроРНК к BCL11A состоит из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11А, описываемых в настоящем документе, синтетическая микроРНК к BCL11A по существу состоит из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44.
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, первый участок BCL11A выбран из группы, состоящей из CGCACAGAACACTCATGGATT (SEQ ID NO: 46; получаемой из олигонуклеотида мкР1 (miR1) BCL11A, описываемого в настоящем документе), CCAGAGGATGACGATTGTTTA (SEQ ID NO: 47; получаемой из олигонуклеотида мкР2 (miR2) BCL11A, описываемого в настоящем документе), TCGGAGACTCCAGACAATCGC (SEQ ID NO: 48; получаем из олигонуклеотида Е3 BCL11A или кшPHK1 (shRNA1) или Е3, описываемых в настоящем документе), CCTCCAGGCAGCTCAAAGATC, (SEQ ID NO: 49; получаемой из кшРНК2 (shRNA2) или В5, описываемых в настоящем документе), TCAGGACTAGGTGCAGAATGT (SEQ ID NO: 50; получаемой из кшРНК4 (shRNA4) или В11, описываемых в настоящем документе), TTCTCTTGCAACACGCACAGA (SEQ ID NO: 51; получаемой из олигонуклеотида D8 BCL11A или кшРНК3 (shRNA3) или D8, описываемых в настоящем документе), GATCGAGTGTTGAATAATGAT (SEQ ID NO: 52; получаемой из кшРНК5 (shRNA5) или 50D12 или D12, описываемых в настоящем документе), CAGTACCCTGGAGAAACACAT (SEQ ID NO: 53; получаемой из кшРНК5 (shRNA5) или 50А5, описываемых в настоящем документе), CACTGTCCACAGGAGAAGCCA (SEQ ID NO: 54; получаемой из кшРНК7 (shRNA7) или 50В11, описываемых в настоящем документе), ACAGTACCCTGGAGAAACACA (SEQ ID NO: 55; получаемой из XLC4 BCL11A, кшРНК8 (shRNA8) и 50С4, описываемых в настоящем документе), CAACAAGATGAAGAGCACCAA (SEQ ID NO: 56; получаемой из ненаправленных олигонуклеотидов BCL11A, описываемых в настоящем документе), gcgcCGCACAGAACACTCATG (SEQ ID NO: 57; получаемой из олигонуклеотида miR1G5, описываемого в настоящем документе), GCGCTCGGAGACTCCAGACAA (SEQ ID NO: 58; получаемой из E3G5 или модифицированного олигонуклеотида Е3 или кшРНR1мод (shRNA1mod), описываемых в настоящем документе), gcgcCCTCCAGGCAGCTCAAA (SEQ ID NO: 59; получаемой из B5G5 или кшРНК2 мод (shRNA2mod), описываемых в настоящем документе); gcgcTCAGGACTAGGTGCAGA (SEQ ID NO: 60; получаемой из B11G5 или кшРНК4 мод (shRNA4mod), описываемых в настоящем документе); gcgcGATCGAGTGTTGAATAA (SEQ ID NO: 61; получаемой из 50D12G5, D12G4 или кшРНК5 мод (shRNA5mod), описываемых в настоящем документе); gcgcCAGTACCCTGGAGAAAC (SEQ ID NO: 62; получаемой из 50A5G5 или кшРНК6мод (shRNA6mod), описываемых в настоящем документе); gcgcCACTGTCCACAGGAGAA (SEQ ID NO: 63; получаемой из 50B11G5 или кшРНК7 мод (shRNA7mod), описываемых в настоящем документе); GCGCTTCTCTTGCAACACGCA (SEQ ID NO: 64; получаемой из D8G5 BCL11A или модифицированного D8 или кшРНК3мод (shRNA3mod), описываемых в настоящем документе), GCGCACAGTACCCTGGAGAAA (SEQ ID NO: 65; получаемой из C4G5 BCL11A или модифицированного С4 или кшРНК8 мод (shRNA8mod), описываемых в настоящем документе), CGCACAGAACACTCATGGATT (SEQ ID NO: 66; получаемой из D12G5-2 BCL11A, описываемых в настоящем документе) и ACGCTCGCACAGAACACTCATGGATT (SEQ ID NO: 67; получаемой из D12G5-2 BCL11А, описываемых в настоящем документе).
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, участок петли получают из микроРНК. Согласно одному из вариантов осуществления микроРНК представляет собой специфичную в отношении системы гемопоэза микроРНК. Например, мкР-142 (miR-142), мкР-155 (miR-155), мкР-181 (miR-181) и мкР-223 (miR-223).
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, микроРНК представляет собой мкР-223 (miR-223).
Согласно одному из вариантов осуществления любой из синтетических микроРНК к BCL11A, описываемых в настоящем документе, участок петли представляет собой ctccatgtggtagag (SEQ ID NO: 68).
Согласно одному из аспектов в настоящем описании предоставлена выделенная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Таким образом, согласно одному из аспектов в настоящем описании предоставлена композиция, содержащая по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Таким образом, согласно одному из аспектов в настоящем описании предоставлена композиция, содержащая по меньшей мере вектор, содержащий молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из аспектов в настоящем описании предоставлена клетка-хозяин, содержащая вектор или вирус, содержащий по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из аспектов в настоящем описании предоставлена клетка-хозяин, содержащая вектор, вирус или бактерию, содержащие по меньшей мере одну молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из вариантов осуществления вектор представляет собой вирусный вектор или вирус.
РНК-интерференция (РНКи), опосредуемая малыми интерферирующими РНК (миРНК) или микроРНК (мкРНК), представляет собой высокоэффективный способ посттранскрипционной регуляции экспрессии генов. РНКи широко использовали для исследования биологических процессов в клетках млекопитающих, и она может представлять собой терапевтический подход к заболеваниям человека, в которых необходима селективная модуляций экспрессии генов. В зависимости от степени комплементарности между последовательностями мкРНК и мРНК-мишени снижение экспрессии генов происходит вследствие индукции разрушения сходной мРНК или посредством аттенуации транскрипции. Эндогенные мкРНК транскрибируются в виде первичных транскриптов, и затем подвергаются процессингу ферментом РНКазой III Drosha (1) с получением структуры стебля/петли. Экспорт из ядра и расщепление Dicer приводят к образованию короткой двухцепочечной молекулы (миРНК), которая разделяется на направляющую и сопровождающую цепи. Направляющая цепь встраивается в индуцируемый РНК комплекс сайленсинга (RISC), эффекторный комплекс, опосредующий расщепление мРНК-мишеней, где функциональная направляющая цепь, связывается с белками RISC (2), тогда как сопровождающая цепь разрушается [рассмотрено в (3)]. Встраивание в RISC направляющей, а не сопровождающей цепи во многом зависит от стабильности 5'-конца миРНК, где в RISC предпочтительно встраивается менее стабильная цепь (4, 5), хотя точное регулирование в клетках млекопитающих понятно не полностью. 5'-конец направляющей цепи содержит "затравочную область", которая является ключевой для распознавания мишени (6, 7). Точное расщепление под действием Drosha и Dicer является ключевым для получения направляющих РНК с определенными затравочными областями, которые опосредуют эффективное связывание с соответствующими мРНК-мишенями. Неточный процессинг приводит к связыванию с не являющимися мишенями молекулами, но также сдвиг участков расщепления изменяет состав нуклеотидов концов дуплексов, что может иметь огромное влияние на встраивание цепи в RISC (8).
Ингибирование экспрессии выбранных полипептидов-мишеней проводят, используя осуществляющие РНК-интерференцию средства. При РНК-интерференции (РНКи) для селективного разрушения используют дуплексы малых интерферирующих РНК (миРНК), которые направлены к матричной РНК, кодирующей полипептид-мишень. Зависимый от миРНК посттранскрипционный сайленсинг экспрессии генов включает расщепление матричной молекулы РНК-мишени по участку, определяемому миРНК. РНКи представляет собой эволюционно консервативный процесс, в результате которого экспрессия или введение последовательностей РНК, которые идентичны или очень сходны с геном-мишенью, приводят к специфичному для последовательности разрушению или специфичному для последовательности посттранскрипционному генному сайленсингу (PTGS) матричной РНК (мРНК), транскрибированной с гена-мишени (см. Coburn, G. and Cullen, В. (2002) J. Virology 76 (18): 9225), таким образом, ингибируя экспрессию гена-мишени. Согласно одному из вариантов осуществления РНК представляет собой двухцепочечную РНК (дцРНК). Этот процесс описан в клетках растений, беспозвоночных и млекопитающих. В природе, РНКи инициирует специфичная к дцРНК эндонуклеаза Dicer, которая способствует последовательному расщеплению длинной дцРНК на двухцепочечные фрагменты, называемые миРНК. миРНК встраиваются в белковый комплекс (называемый "индуцируемым РНК комплексом сайленсинга" или "RISC"), который распознает и расщепляет мРНК-мишени. Также РНКи можно инициировать, внося молекулы нуклеиновой кислоты, например, синтетические миРНК или осуществляющие РНК-интерференцию средства, с ингибированием или сайленсингом экспрессии генов-мишеней. Как используют в настоящем документе, "ингибирование экспрессии гена-мишени" включает снижение экспрессии или активности или уровня белка гена-мишени или белка, кодируемого геном-мишенью, по сравнению с состоянием, где РНК-интерференция не индуцирована. Снижение составляет по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или более по сравнению с экспрессией гена-мишени или активностью или уровнем белка, кодируемого геном-мишенью, которые не являются мишенью осуществляющего РНК-интерференцию средства.
Термины "осуществляющее РНК-интерференцию средство" и "РНК-интерференция", как их используют в настоящем документе, предназначены для включения форм сайленсинга генов, опосредуемых двухцепочечными РНК, вне зависимости от того содержит ли осуществляющее РНК-интерференцию средства миРНК, мкРНК, кшРНК или другую двухцепочечную молекулу РНК. миРНК определена как средство на основе РНК, которое функционирует, ингибируя экспрессию гена-мишени, например, посредством РНКи. МиРНК можно синтезировать химически, можно получать посредством транскрипции in vitro или можно получать в клетке-хозяине. Согласно одному из вариантов осуществления миРНК представляет собой молекула двухцепочечной РНК (дцРНК) длиной приблизительно от 15 до приблизительно 40 нуклеотидов, предпочтительно приблизительно от 15 до приблизительно 28 нуклеотидов, более предпочтительно приблизительно от 19 до приблизительно 25 нуклеотидов, а более предпочтительно приблизительно 19, 20, 21, 22 или 23 нуклеотидов, и может содержать выступы на 3'- и/или 5'-концах каждой цепи с длиной приблизительно 0, 1, 2, 3, 4 или 5 нуклеотидов. Длина выступов у двух цепей независима, т.е., длина выступа на одной цепи не зависит от длины выступа на второй цепи. Предпочтительно миРНК может способствовать РНК-интерференции посредством разрушения или специфичного посттранскрипционного генного сайленсинга (PTGS) матричной РНК-мишени (мРНК).
миРНК также включает корошкошпилечные (также называемые стебель/петля) РНК (кшРНК). Согласно одному из вариантов осуществления эти кшРНК состоят из короткой (например, приблизительно от 19 до приблизительно 25 нуклеотидов) антисмысловой цепи с последующими петлей из нуклеотидов длиной приблизительно от 5 до приблизительно 9 нуклеотидов и аналогичной смысловой цепью. Альтернативно, смысловая цепь может находиться перед структурой петли из нуклеотидов, а антисмысловая цепь может находиться после нее. Эти кшРНК могут находиться в плазмидах, ретровирусах и лентивирусах и экспрессироваться, например, под контролем промотора pol III U6 или другого промотора (см., например, Stewart, et al. (2003) RNA April; 9 (4): 493-501, полностью включенной в настоящий документ в качестве ссылки). Ген-мишень или последовательность осуществляющего РНК-интерференцию средства могут представлять собой клеточный ген или геномную последовательность, например, последовательность BCL11A. МиРНК может быть в значительной степени гомологична гену-мишени или геномной последовательности или их фрагменту. Как используют в этом случае, термин "гомологичная" определен в качестве по существу идентичной, в значительной степени комплементарной или сходной с мРНК-мишенью или ее фрагментом для осуществления РНК-интерференции мишени. Кроме природных молекул РНК, РНК, подходящие для ингибирования или интерференции экспрессии последовательности-мишени, включают производные и аналоги РНК. Предпочтительно миРНК идентична ее мишени. МиРНК предпочтительно направлена только к одной последовательности. Каждое из осуществляющих РНК-интерференцию средств, таких как миРНК, можно подвергать скринингу на потенциальное побочное действие, например, посредством определения профиля экспрессии. Такие способы известны специалисту в данной области и описаны, например, в Jackson et al. Nature Biotechnology 6: 635-637, 2003. В дополнение к определению профиля экспрессии также можно подвергать скринингу возможные последовательности-мишени для сходных последовательностей в базах данныхпоследовательностей с идентификацией потенциальных последовательностей, которые могут обладать побочным действием. Например, для сайленсинга не являющихся мишенью транскриптов достаточно 15 или, возможно, только 11 смежных нуклеотидов, идентичных последовательности. Таким образом, исходно можно проводить скрининг предлагаемых миРНК во избежание потенциального побочного сайленсинга с использованием анализа идентичности последовательностей любыми известными способами сравнения последовательностей, такими как BLAST. Последовательности миРНК выбирают с максимизацией захвата антисмысловой (направляющей) цепи миРНК в RISC и, таким образом, максимизацией способности RISC направляться к мРНК BCL11A для разрушения. Это можно проводить, перебирая последовательности с наименьшей свободной энергией связывания на 5'-конце антисмысловой цепи. Более низкая свободная энергия приводит к улучшению расплетения 5'-конца антисмысловой цепи дуплекса миРНК, таким образом, обеспечивая захват антисмысловой цепи RISC и контроль специфичного для последовательности расщепления мРНК BCL11А человека. Молекулы миРНК не обязательно должны быть ограничены молекулами, содержащими только РНК, но, например, могут дополнительно содержать химически модифицированные нуклеотиды и не являющиеся нуклеотидами молекулы, а также содержать молекулы, где молекула сахара рибозы замещена молекулой другого сахара или молекулой, выполняющей сходную функцию. Кроме того, между остатками нуклеотидов также можно использовать неприродные связи, такие как тиофосфатные связи. Можно получать производные цепи РНК с использованием реакционноспособной функциональной группы репортерной группы, такой как флуорофор. Особенно пригодные производные являются модифицированные на конце или концах цепи РНК, как правило, на 3'-конце смысловой цепи. Например, 2'-гидроксил на 3'-конце можно легко и селективно дериватизировать множеством групп. Другие пригодные производные РНК содержат нуклеотиды с модифицированными углеводными группами, такие как 2'O-алкилированные остатки или 2'-O-метилрибозил производные и 2'-O-фторрибозил производные. Также можно модифицировать основания РНК. Можно использовать любое модифицированное основание, пригодное для ингибирования или осуществления интерференции экспрессии последовательности-мишени. Например, можно встраивать галогенированные основания, такие как 5-бромурацил и 5-йодурацил. Основания также могут быть алкилированными, например, вместо остатка гуанозина можно встраивать 7-метилгуанозин. Также можно встраивать неприродные основания, которые приводят к успешному ингибированию. Наиболее предпочтительные модификации миРНК включают 2'-дезокси-2'-фторуридин или нуклеотиды закрытых нуклеиновых кислот (LAN) и дуплексы РНК, содержащие фосфодиэфирные или варьирующие количества тиофосфатных связей. Такие модификации известны специалисту в данной области и описаны, например, в Braasch et al., Biochemistry, 42: 7967-7975, 2003. Большинство подходящих модификации молекул миРНК можно проводить с использованием химических составов, полученных для технологии антисмысловых олигонуклеотидов. Предпочтительно, модификации включают минимум 2'-O-метильных модификаций, предпочтительно исключая такие модификации. Также предпочтительно из модификаций исключены модификации свободных 5'-гидроксильных группы миРНК. В примерах в настоящем документе предоставлены конкретные примеры осуществляющих РНК-интерференцию средств, таких как молекулы кшРНК, которые эффективно направлены к мРНК BCL11А.
Наиболее широко используемыми в биологических экспериментальных условиях являются короткошпилечные РНК (кшРНК) под контролем полимеразы (pol) III. кшРНК воспроизводят структуру промежуточных предшественников мкРНК и, таким образом, обходя этап первого расщепления, осуществляемого Drosha. Для обеспечения эффективного нокдауна кшРНК можно экспрессировать в большом количестве. Однако опубликовано, что при высокой множественности заражения (MOI), перенасыщение эндогенной системы РНКи в некоторых случаях ассоциировано с цитотоксическими эффектами вследствие нарушения регуляции эндогенных мкРНК (9-11). По-видимому, пропускную способность этого пути ограничивают два компонента процессинга микроРНК, Exportin5 и Ago2, а сверхэкспрессия этих белков приводит к увеличенной мощности нокдауна (12-15). Кроме того, цитотоксические побочные эффекты (16, 17), рассмотренные в (18), может опосредовать активация врожденного иммунного ответа, инициируемая малыми РНК специфичным, а также неспецифичным для последовательностей образом. Эти эффекты в определенных экспериментальных трансгенных модельных системах приводили к увеличенной смертности мышей, о которых опубликованы как о прямом побочном действии сверхэкспрессии кшРНК (14, 19).
Для перехода к клиническому применению основанных на РНКи терапевтических средств, вероятно, могут потребоваться альтернативные экспрессирующие системы с использованием промоторов полимеразы II. Этот класс промоторов предусматривает использованием соответствующих регуляторных элементов для специфичной для линий или даже типов клеток экспрессии. Также он может обеспечивать меньшие уровни экспрессии по сравнению с промоторами pol III, что может устранить перенасыщение системы процессинга, о которой сообщалось в отношении клеток, трансдуцированных при высоких MOI). Затруднением использования промоторов pol II для экспрессии кшРНК является то, что для эффективного процессинга необходимо встраивание последовательностей кшРНК во фланкирующие последовательности, как правило, получаемые из эндогенных мкРНК-предшественников. кшРНК, фланкированные каркасом мкРНК воспроизводят структуру эндогенных мкРНК (10, 20). В настоящее время для встраивания рекомбинантных кшРНК для экспрессии в клетках млекопитающих широко используют фланкирующие области, получаемые из мкРНК-30 (miRNA-30) и мкРНК-223 (miRNA-223) человека, и предприняты большие усилия для лучшего понимания и улучшения этой стратегии экспрессии (21). Показано, что последняя из двух указанных мкРНК особенно эффективна при использовании в качестве каркаса для экспрессии кшРНК в гемопоэтических клетках и опосредует существенный нокдаун мРНК-мишеней в результате эффективного процессинга и низкой активности сопровождающей цепи в нескольких типах гемопоэтических клеток (21, 22).
В настоящем изобретении авторы изобретения для исследования и оптимизации процессинга кшРНКмкР для потенциального терапевтического применения в качестве мишени использовали BCL11A. BCL11A представляет собой обоснованная терапевтическая мишень для реактивации гена γ-глобина и, таким образом, экспрессии HbF при больших гемоглобинопатиях, серповидноклеточной анемии (SCD) и β-талассемии. Подавление или делеция гена BCL11А снимает подавление γ-глобина (23), а инактивация BCL11A в эритроидной линии предотвращает фенотип SCD и органотоксичность у подвергнутых генетической инженерии мышей (24). Эмбриональный ген Hbb-y мыши представляет собой функциональный гомолог гена γ-глобина человека и, таким образом, он служит в качестве подходящего заменителя для оценки действия нокдауна BCL11A в клетках эритролейкоза мыши (MEL). Исходно авторы наблюдали заметно сниженную эффективность нокдауна BCL11A при экспрессии кшРНК с использованием векторов на основе pol II по сравнению с векторами на основе pol III. Как правило, конструкции кшРНКмкР для pol III и pol II в стебле палиндромной шпильки содержат соответствующие участку мишени последовательности длиной 21 основание, но ожидается, что транскрипты этих двух типов экспрессирующих кассет подвергаются процессингу различным образом (25). транскрипты кшРНКмкР pol II поступают в каскад процессинга РНКи выше процессинга, осуществляемого Drosha, тогда как для более коротких продукты pol III ожидают, что они поступят в каскад ниже Drosha и их расщепляет только Dicer на конце петли. В зависимости от последовательностей процессируемых малых РНК, получаемых под контролем промоторов pol III и pol II авторы наблюдали что кассеты кшРНК для pol III и кассеты кшРНКмкР для pol II приводили к получению различным образом процессированных кшРНК в отношении относительного расположения соответствующих мишени последовательностей длиной 21 основание. кшРНКмкР с измененной конструкцией, которые воспроизводили зрелые последовательности направляющих цепей, продуцируемых эффективными кшРНК под контролем pol III, обеспечивали увеличение эффективности процессинга и ингибирование мРНК-мишени. Проведение этих модификаций в специфичном для эритроидных клеток экспрессирующем векторе млекопитающих приводило к значительному нокдауну белка BCL11A и реиндукции фетального гемоглобина. Эта стратегия также позволяла избежать токсичности для компартментов гемопоэтических стволовых клеток и линии В клеток, которая сопровождает экспрессию кшРНК во всех гемопоэтических клетках. В итоге, данные демонстрируют критические характеристика процессинга РНК относящиеся к использованию кшРНК в случаях различных векторов, а также предоставляют стратегию для нокдауна генов, специфичного для линий, который преодолевает неблагоприятные последствия широкой экспрессии. Результаты авторов исследования имеют важные последствия для конструирования кшРНК, встроенных в микроРНК, и их применения в основанных на РНКи подходах к генотерапии.
Согласно одному из вариантов осуществления осуществляющее РНК-интерференцию средство доставляют или вводят в фармацевтически приемлемом носителе. В фармацевтически приемлемый носитель можно добавлять дополнительные средства-носители, такие как липосомы. В другом варианте осуществления осуществляющее РНК-интерференцию средство доставляют в клетки органе индивидуума посредством вектора, кодирующего малую или короткошпилечную РНК (кшРНК), в фармацевтически приемлемом носителе. После транскрипции клетки преобразуют кшРНК в миРНК, способную направленно взаимодействовать, например, c BCL11A.
Согласно одному из вариантов осуществления осуществляющее РНК-интерференцию средство представляет собой молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-18 и 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Согласно одному из вариантов осуществления вектор представляет собой индуцибельный вектор, такой как индуцируемый тетрациклином вектор. Можно использовать способы, описанные, например, в Wang et al. Proc. Natl. Acad. Sci. 100: 5103-5106, с использованием векторов pTet-On (BD Biosciences Clontech, Palo Alto, Calif.). Согласно одному из вариантов осуществления клетки in vivo после внутривенной инъекции, например, гидродинамической инъекции, активно захватывают средства для РНК-интерференции, используемые в способах, описываемых в настоящем документе, без использования вектора, иллюстрируя эффективную доставку осуществляющих РНК-интерференцию средств in vivo. Один способ доставки миРНК представляет собой катетеризация сосуда, кровоснабжающего орган-мишень, также можно использовать другие стратегии доставки средств для РНК-интерференции, например, миРНК или кшРНК, используемых в способах по изобретению, такие как, например, доставку вектором, например, плазмидным или вирусным вектором, например, лентивирусным вектором. Такие векторы можно использовать как описано, например, в Xiao-Feng Qin et al. Proc.Natl. Acad. Sci. U.S.A., 100: 183-188. Другие способы доставки включают доставку осуществляющих РНК-интерференцию средств, например, миРНК или кшРНК по изобретению, с использованием основного пептида посредством конъюгации или смешивания осуществляющего РНК-интерференцию средства с основным пептидом, например, фрагментом пептида ТАТ, смешивания с катионными липидами или формулируя в частицы. Средства для РНК-интерференции, например, миРНК, направленные к мРНК BCL11A, можно доставлять отдельно или в комбинации с другими средствами для РНК-интерференции, например, миРНК, такими как, например, миРНК, направленными к другим генам клеток. BCL11A миРНК также можно вводить в комбинации с другими фармацевтическими средствами, которые используют для лечения или профилактики заболеваний или нарушений, ассоциированных с окислительным стрессом, особенно заболеваний органов дыхания, а более конкретно астмы. Синтетические молекулы миРНК, включая молекулы кшРНК, можно получать рядом способов, известных специалистам в данной области. Например, молекулы миРНК можно синтезировать химически или получать рекомбинантным путем известными в данной области способами, такими как использование соответствующим образом защищенных рибонуклеозидфосфоамидитов и типичного ДНК/РНК- синтезатора (см., например, Elbashir, S.М. et al. (2001) Nature 411: 494-498; Elbashir, S.M., W. Lendeckel and T. Tuschl (2001) Genes & Development 15: 188-200; Harborth, J. et al. (2001) J. Cell Science 114: 4557-4565; Masters, J. R. et al. (2001) Proc. Natl. Acad. Sci., USA 98: 8012-8017 и Tuschl, T. et al. (1999) Genes & Development 13: 3191-3197). Альтернативно, доступно несколько коммерческих поставщиков, производящих синтез РНК, включая в качестве неограничивающих примеров, Proligo (Hamburg, Germany), Dharmacon Research (Lafayette, Colo., USA), Pierce Chemical (подрезделение Perbio Science, Rockford, 111., USA), Glen Research (Sterling, Va., USA), ChemGenes (Ashland, Mass., USA) и Cruachem (Glasgow, UK). В связи с этим молекулы миРНК не очень сложно синтезировать и их легко получить с качеством, подходящим для РНКи. Кроме того, дцРНК можно экспрессировать в виде структур стебля/петли, кодируемых плазмидными векторами, ретровирусами и лентивирусами (Paddison, P. J. et al. (2002) Genes Dev. 16: 948-958; McManus, M. T. et al. (2002) RNA 8:842-850; Paul, C.P. et al. (2002) Nat. Biotechnol. 20:505-508; Miyagishi, M. et al. (2002) Nat. Biotechnol. 20:497-500; Sui, G. et al. (2002) Proc. Natl. Acad. Sci., USA 99: 5515-5520; Brummelkamp, T. et al. (2002) Cancer Cell 2: 243; Lee, N.S., et al. (2002) Nat. Biotechnol. 20: 500-505; Yu, J.Y., et al. (2002) Proc. Natl. Acad. Sci., USA 99: 6047-6052; Zeng, Y., et al. (2002) Mol. Cell. 9: 1327-1333; Rubinson, D.A., et al. (2003) Nat. Genet. 33: 401-406; Stewart, S.A., et al. (2003) RNA 9: 493-501). Как правило, эти векторы содержат промотор polIII выше дцРНК и могут экспрессировать смысловые и антисмысловые цепи РНК раздельно и/или в виде структур шпилек. В клетках, Dicer процессирует короткошпилечную РНК (кшРНК) в эффективную миРНК. Направленную область молекулы миРНК по настоящему изобретению можно выбирать из данной последовательности гена-мишени, например, кодирующей последовательности BCL11A, начиная приблизительно с нуклеотида от 25 до 50, приблизительно от 50 до 75 или приблизительно от 75 до 100 ниже старт-кодона. Нуклеотидные последовательности могут содержать 5'- или 3'-UTR и области рядом со старт-кодоном. Один из способов конструирования молекулы миРНК по настоящему изобретению включает определение фрагмента последовательности из 23 нуклеотидов и выбор вариантов с содержанием G/C по меньшей мере 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75%. Альтернативно, если такой последовательности не найдено, поиск можно расширить с использованием мотива NA(N21), где N может представлять собой любой нуклеотид. В этом случае, 3'-конец смысловой миРНК можно преобразовывать в ТТ с обеспечением получения симметричного дуплекса относительно состава последовательности 3'-выступов смысловой и антисмысловой цепей. Затем можно синтезировать антисмысловую молекулу миРНК в виде комплементарной последовательности положениями нуклеотидов от 1 до 21 фрагмента последовательности из 23 нуклеотидов. Использование симметричных выступов ТТ на 3'-конце может быть удобным для гарантии того, что частицы малых интерферирующих рибонуклеопротеинов (миРНП) сформированы приблизительно в равных соотношениях смысловых и антисмысловых расщепляющих РНК-мишень миРНП (Elbashir et al., (2001) выше и Elbashir et al., 2001 выше). Также для выбора последовательностей миРНК по сравнению с библиотеками EST для гарантии того, что мишенью является только один ген, можно использовать анализ баз данных последовательностей, включая в качестве неограничивающих примеров NCBI, BLAST, Derwent и GenSeq, а также коммерчески доступные компании олигосинтеза, такие как OLIGOENGINE®.
Лентивирусные векторы по изобретению в качестве неограничивающих примеров включают вирус иммунодефицита человека (например, ВИЧ-1, ВИЧ-2), вирус иммунодефицита кошек (FIV), вирус иммунодефицита обезьян (SIV), вирус иммунодефицита крупного рогатого скота (BIV) и вирус инфекционной анемии лошадей (EIAV). Эти векторы можно конструировать и подвергать инженерии принятыми в данной области способами для увеличения их безопасности для применения в терапии и для встраивания подходящих для экспрессии элементов и терапевтических генов, таких как описаны ниже, которые кодируют миРНК для лечения патологических состояний, включая в качестве неограничивающих примеров, гемоглобинопатии.
Учитывая потенциальную токсичность лентивирусов, векторы можно различными путями конструировать для увеличения их безопасности для применения в генотерапии. Например, вектор можно делать безопасней, разделяя необходимые лентивирусные гены (например, gag и pol) по отдельным векторам, как описано, например, в патенте США №6365150, содержание которого включено в настоящий документ в качестве ссылки. Таким образом, рекомбинантный ретровирус можно конструировать так, что кодирующую последовательность ретровируса (gag, pol, env) замещает представляющий интерес ген делая репликацию ретровируса дефектной. Затем ретровирус с дефектной репликацией стандартными способами упаковывают в вирион посредством использования вируса-помощника или линии упаковывающих клеток. Протоколы получения рекомбинантных ретровирусов и инфицирования клеток in vitro или in vivo такими вирусами можно найти в Current Protocols in Molecular Biology, Ausubel, F. M. et al. (eds.) Greene Publishing Associates, (1989), Sections 9.10-9.14 и в других стандартных лабораторных руководствах.
Основным необходимым условием применения вирусов в качестве векторов для доставки генов является обеспечение безопасности их применения, в частности в отношении возможности распространения вируса дикого типа в популяции клеток. Разработка линий упаковывающих клеток, которые продуцируют только дефектные по репликации ретровирусы, увеличила пригодность вирусов для генотерапии, и дефектные ретровирусы хорошо охарактеризованы для применения в переносе генов с целью генотерапии (с целью обзора см. Miller, A.D. (1990) Blood 76: 271). Таким образом, согласно одному из вариантов осуществления изобретения для размножения векторов (например, лентивирусных векторы) по изобретению с увеличением титра вирусного вектора используют линии упаковывающих клеток. Использование линий упаковывающих клеток также считается безопасным способом размножения вируса, так как использование этой системы снижает вероятность прохождения рекомбинации с образованием вируса дикого типа. Кроме того, для снижения токсичности для клеток, которую вызывает экспрессия упаковывающих белков, можно использовать упаковывающие системы, в которых плазмиды, кодирующие упаковывающие элементы вируса трансфицированы только транзиторно, например, химическим способом.
В другом варианте осуществления вектор можно делать более безопасным, замещая определенные лентивирусные последовательности нелентивирусными последовательностями. Таким образом, лентивирусные векторы по настоящему изобретению могут содержать частичные (например, разделенные) генные лентивирусные последовательности и/или нелентивирусные последовательности (например, последовательности из других ретровирусов) при условии, что их функция (например, вирусный титр, инфекционность, интеграция и способность обеспечивать высокие уровни и длительность терапевтической экспрессии гена) значимо не уменьшается. Элементы, которые можно клонировать в вирусный вектор в качестве неограничивающих примеров включают, промотор, сигнал упаковки, LTR, полипуриновые участки и элемент обратного ответа (RRE).
Согласно одному из вариантов осуществления изобретения модифицирована область LTR посредством замены вирусного промотора LTR гетерологичным промотором. Согласно одному из вариантов осуществления гетерологичным промотором замещен промотор 5'-LTR. Примеры гетерологичных промоторов, которые можно использовать, в качестве неограничивающих примеров включают, промотор вируса некроза селезенки (SFFV), индуцируемый тетрациклином (ТЕТ) промотор, контрольную область локуса β-глобина и промотор β-глобина (LCR) и промотор цитомегаловируса (CMV).
В определенных вариантах осуществления лентивирусные векторы по изобретению также включают векторы, которые модифицированы для улучшения безопасности применения векторов в качестве средств доставки генов при генотерапии. Согласно одному из вариантов осуществления изобретения модифицирована область LTR вектора, такая как 3'-LTR, в областях U3 и/или U5, в результате чего получают вектор SIN. Такие модификации способствуют увеличению безопасности вектора для целей доставки генов. Согласно одному из вариантов осуществления вектор SIN по изобретению несет делецию в 3'-LTR, где часть области U3 замещена инсулятором. Инсулятор предотвращает влияние энхансерных/промоторных последовательностей в векторе на экспрессию генов в расположенных рядом геномных последовательностях и наоборот, с предотвращением влияния геномных последовательностей на экспрессию генов в векторе. Согласно дополнительному варианту осуществления изобретения 3'-LTR модифицирована так, что замещена область U5, например, идеальной последовательностью поли(А). Следует отметить, что модификации LTR, такие как модификации 3'-LTR, 5'-LTR, или одновременно 3'- и 5'-LTR, также включены в изобретение.
Промотор лентивирусного вектора может представлять собой промотор, который как в природе (т.е., как это происходит в клетке in vivo) или не так как в природе ассоциирован с 5'-фланкирующей областью конкретного ген. Промоторы можно получать из эукариотических геномов, вирусных геномов, или они могут представлять собой синтетические последовательности. Промоторы можно выбирать так, чтобы они были неспецифичными (активными во всех тканях) (например, SFFV), тканеспецифичными (например, (LCR), регулируемыми природными регуляторными процессами, регулируемыми экзогенно применяемыми лекарственными средствами (например, ТЕТ) или регулируемыми определенными физиологическими состояниями, такие как промоторы, активируемые при ответе острой фазы или активируемые только в реплицирующихся клетках. Неограничивающие примеры промоторов по настоящему изобретению включают промотор вируса некроза селезенки, индуцируемый тетрациклином промотор, контрольную область локуса β-глобина и промотор β-глобина (LCR), промотор цитомегаловируса (CMV), промотор LTR ретровирусов, предранний промотор цитомегаловирусов, промотор SV40 и промотор дигидрофолатредуктазы. Также промотор можно выбрать из промоторов, для которых показана специфичная экспрессия в выбранных типах клеток, для которых можно выявить ассоциации с состояниями, включающими в качестве неограничивающих примеров гемоглобинопатии. Согласно одному из вариантов осуществления изобретения промотор является клеточноспецифичным так, что экспрессия генов ограничена эритроцитами. Специфичной для эритроцитов экспрессии достигают использованием промоторной области и области контроля локуса (LCR) β-глобина человека.
Практикующим специалистам понятно, что выбор промотора для экспрессии представляющего интерес полинуклеотида зависит от вектора, кассеты нуклеиновой кислоты, типа клеток-мишеней и необходимого биологического действия. Также практикующим специалистам понятно, что при выборе промотора параметры могут включать: достижение достаточно высоких для достижения физиологического действия уровней экспрессии генов; поддержание критического уровня экспрессии генов; достижение временной регуляции экспрессии генов; достижение специфичной для определенного типа клеток экспрессии; достижение фармакологической, эндокринной, паракринной или аутокринной регуляции экспрессии генов и предотвращение несоответствующих или нежелательных уровней экспрессии. Любой конкретный набор требований отбора зависит от условий, но его легко может определить после определения конкретных требований. Согласно одному из вариантов осуществления изобретения промотор является клеточноспецифичным так, что экспрессия гена ограничена эритроцитами. Специфичной для эритроцитов экспрессии достигают использованием промоторной области и области контроля локуса (LCR) β-глобина человека.
Стандартные способы конструирования экспрессирующих векторов, пригодных для использования в настоящем изобретении, хорошо известны специалистам в данной области, и их можно найти в таких публикациях как Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed. Cold Spring Harbor, N.Y. Для лигирования фрагментов ДНК известен ряд стратегий, выбор которых зависит от характера концов фрагментов ДНК и выбор которых может легко сделать специалист в данной области.
Генотерапевтические векторы по настоящему изобретению, такие как указанные выше лентивирусные векторы, можно использовать для экспрессии ряда терапевтических миРНК в трансформированных эритроидных клетках. Согласно одному из вариантов осуществления представляющие интерес миРНК для экспрессии в векторе получают из гена, который можно использовать для лечения гемоглобинопатии, например, так как миРНК к BCL11А
Конкретные генотерапевтические конструкции по изобретению в качестве неограничивающих примеров включают конструкции, представленные на фиг. 2. Схематически представлены три лентивирусных вектора, описываемых в настоящем документе, со стеблем из кшРНК, содержащей направленную к мРНК BCL11A последовательность, тогда как петля характерна для мкР-223 (miR-223). Все эти векторы содержат флуорохромный маркер (Venus) и встроены в самоинактивирующийся (SIN) каркас дельта-U3 LEGO (Ferhse Lab, Germany). Лентивирус конститутивного нокдауна, где направленная кшРНК экспрессирована под контролем очень сильного, повсеместно экспрессируемого промотора SFFV, использовали для оценки функциональности и токсичности направленной кшРНК. Лентивирус индуцибельного нокдауна, где кшРНК экспрессирована под контролем индуцибельного промотора тетрациклина PGK, использовали для оценки функционального, дозо- и схемозависимого действия направленной кшРНК. Специфичный для линий лентивирус, где кшРНК экспрессирован под контролем промоторной области LCR β-глобина (гиперчувствительные участки ДНК HS2/3, Naldini Lab, Italy), является терапевтическим вариантом для оценки в системах in vivo. Области LTR дополнительно содержат области U3 и U5, а также область R. Области U3 и U5 можно модифицировать вместе или независимо с получением вектора, который является самоинактивирующимся, таким образом, увеличивая безопасность вектора для применения для доставки генов. Области U3 и U5 можно дополнительно модифицировать так, чтобы они содержали инсулятор.
Этап обеспечения продукции инфекционных вирусных частиц в клетках можно проводить общепринятыми способами, такими как стандартные способы ведения культуры клеток. При желании практикующий специалист может получать маточные растворы лентивирусов с использованием векторов и способов по настоящему изобретению. Способы получения маточных растворов вирусов известны в данной области и проиллюстрированы, например, в Y. Soneoka et al. (1995) Nucl. Acids Res. 23: 628-633 и N.R. Landau et al. (1992) J. Virol. 66: 5110-5113. В способе получения маточного раствора по настоящему изобретению, пермиссивные для лентивирусов клетки (указываемые в настоящем документе как продуцирующие клетки) трансфицируют векторной системой по настоящему изобретению. Затем клетки выращивают в подходящих условиях культивирования клеток, и лентивирусные частицы выделяют или из самих клеток, или из среды для клеток, как описано выше. Подходящие линии продуцирующих клеток в качестве неограничивающих примеров включают линию клеток эмбриональной почки человека 293, линию клеток дермы лошадей NBL-6 и линию клеток эмбрионального тимуса собаки Cf2TH.
Этап выделения инфекционных вирусных частиц также можно проводить общепринятыми способами. Например, инфекционные частицы можно выделять посредством лизиса клеток или получения супернатанта культуры клеток, как известно в данной области. Необязательно, выделенные вирусные частицы при желании можно очищать. Подходящие способы очистки хорошо известны специалистам в данной области.
Другие способы, относящиеся к использованию вирусных векторов в генотерапии можно найти, например, в Kay, М.А. (1997) Chest 111 (6 Supp.): 1385-1425; Ferry, N. and Heard, J.M. (1998) Hum. Gene Ther. 9: 1975-81; Shiratory, Y. et al. (1999) Liver 19: 265-74; Oka, K. et al. (2000) Curr. Opin. Lipidol. 11:179-86; Thule, P. M. and Liu, J. M. (2000) Gene Ther. 7: 1744-52; Yang, N.S. (1992) Crit. Rev. Biotechnol. 12: 335-56; Alt, M. (1995) J. Hepatol. 23: 746-58; Brody, S.L. and Crystal, R.G. (1994) Ann. N.Y. Acad. Sci. 716: 90-101; Strayer, D.S. (1999) Expert Opin. Investig. Drugs 8: 2159-2172; Smith-Arica, J.R. and Bartlett, J. S. (2001) Curr. Cardiol. Rep. 3: 43-49 и Lee, H. C. et al. (2000) Nature 408: 483-8.
Ретровирусные векторы, включая лентивирусные векторы, как описано выше, или содержащие их клетки, можно вводить in vivo индивидуумам любым подходящим маршрутом, как хорошо известно в данной области. Термин "введение" относится к маршруту введения сформулированного вектора в организм. Например, введение может являться внутрисосудистым, внутриартериальным, внутривенным, внутримышечным, местным, пероральным или посредством генной пушки или безыгольного инъекционного устройства. Таким образом, введение можно проводить непосредственно в ткань-мишень или посредством системной доставки. Введение может представлять собой прямую инъекцию в костный мозг. Введение непосредственно в ткань-мишень может включать игольную инъекцию, безыгольную инъекцию, электропорацию или генную пушку. См., например, WO 93/18759, включенную в настоящий документ в качестве ссылки.
Альтернативно, ретровирусные векторы по изобретению можно вводить ex vivo или in vitro в клетки или ткани с использованием стандартных способов трансфекции, хорошо известных в данной области.
Согласно одному из вариантов осуществления ретровирусные векторы по изобретению также можно трансдуцировать в клетки-хозяева, включающие эмбриональные стволовые клетки, соматические стволов клетки или клетки-предшественники. Примеры клеток-хозяева предшественников, которые можно трансдуцировать ретровирусными векторами по изобретению, включают предшественников эритроцитов и гемопоэтические стволовые клетки. В другом варианте осуществления клетка-хозяин представляет собой эритроцит. Трансдуцированные клетки-хозяева можно использовать в качестве способа обеспечения специфичной для эритроидных клеток экспрессии представляющего интерес гена при лечении гемоглобинопатии.
Другой аспект изобретения относится к фармацевтическим композициям лентивирусных векторов по изобретению. Согласно одному из вариантов осуществления композиция содержит лентивирусный вектор в терапевтически эффективном количестве, достаточном для лечения или снижения риска развития (например, уменьшения симптомов гемоглобинопатии), и фармацевтически приемлемый носитель. "Терапевтически эффективное количество" относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения необходимого терапевтического результата, такого как лечение или профилактика состояния гемоглобинопатии. Терапевтически эффективное количество лентивирусного вектора может варьировать в зависимости от таких факторов, как течение заболевания, возраст, пол и масса индивидуума и способности лентивирусного вектора вызывать у индивидуума необходимый ответ. Для обеспечения оптимального терапевтического ответа режимы дозирования можно корректировать. Также терапевтически эффективное количество является количеством, при котором любое токсическое или приносящее ущерб действие лентивирусного вектора перевешивается терапевтически положительным воздействием. Потенциальную токсичность лентивирусных векторов по изобретению можно оценивать с использованием клеточных анализов или принятых в данной области моделях на животных и можно выбирать терапевтически эффективный модулятор, который не проявляет значимой токсичности. В предпочтительном варианте осуществления терапевтически эффективное количество лентивирусного вектора является достаточным для лечения гемоглобинопатии.
Стерильные инъекционные растворы можно получать вводят лентивирусный вектор в требуемом количестве подходящего растворителя в один или комбинацию ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают вводя активное соединение в стерильный носитель, содержащий основную диспергирующую среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов предпочтительные способы получения представляют собой вакуумную сушку и лиофилизацию с получением порошка активного ингредиента и любого дополнительного необходимого ингредиента из предварительно простерилизованного фильтрованием их раствора.
Следует отметить, что величины доз могут варьировать в зависимости от тяжести улучшаемого состояния. Также следует дополнительно понимать, что для любого конкретного индивидуума конкретные режимы дозирования с течением времени можно корректировать в соответствии с потребностями индивидуума и профессионального решения лица, проводящего или контролирующего введение композиций, и что диапазоны доз, приводимые в настоящем документе, являются исключительно иллюстративными и не предназначены для ограничения области или практического применения заявляемой композиции. Согласно одному из вариантов осуществления доза находится в диапазоне 103-108 вирусных частиц/50 кг массы. Согласно другим вариантам осуществления доза находится в диапазоне 103-105 вирусных частиц/50 кг массы, 104-106 вирусных частиц/50 кг массы, 105-107 вирусных частиц/50 кг массы, 103-108 вирусных частиц/50 кг массы. Согласно одному из вариантов осуществления доза составляет приблизительно 104 вирусных частиц/50 кг массы.
Количество вирусного вектора в композиции может варьировать в соответствии с такими факторами, как течение заболевания, возраст, пол и масса индивидуума. Для обеспечения оптимального терапевтического ответа режимы дозирования можно корректировать. Например, можно проводить единичное болюсное введение, можно вводить несколько дробных доз в течение определенного периода времени или дозу можно пропорционально снижать или повышать в соответствии с требованиями терапевтической ситуации. Особенно предпочтительно для простоты введения и единообразия дозировки формулировать парентеральные композиции в стандартной лекарственной форме. Как используют в настоящем документе, стандартная лекарственная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для подлежащих лечению индивидуумов млекопитающих; где каждая единица содержит предопределенное количество активного соединения, рассчитанное так, чтобы обеспечивать необходимое терапевтическое действие, в ассоциации с необходимым фармацевтическим носителем. Характеристики стандартных лекарственных форм по изобретению продиктованы и непосредственно зависят от (а) уникальных характеристик активного соединения и конкретного терапевтического действия, которого необходимо добиться, и (b) ограничений, существующих в области формулирования такого активного соединения для лечения чувствительности у индивидуумов. Однако для любого конкретного случая специалист в данной области может определить соответствующее "эффективное количество" с использованием только общепринятого экспериментирования.
Настоящее изобретение в конкретных вариантах осуществления относится к клеткам, генетически модифицированным для экспрессии терапевтических полипептидов и ингибирующих РНК, предусмотренных по настоящему документу, для применения при лечении гемоглобинопатии. Как используют в настоящем документе, термин "подвергнутый генетической инженерии" или "генетически модифицированный" относится к добавлению, делеции или модификации генетического материала в клетке. Термины "генетически модифицированные клетки", "модифицированные клетки" и "перенаправленные клетки" используют взаимозаменяемо. В конкретных вариантах осуществления клетки, трансдуцированные векторами, предусмотренными по настоящему документу, являются генетически модифицированными. Как используют в настоящем документе, термин "генотерапия" относится к введению в тотальный генетический материал клетки внешнего генетического материала в форме ДНК или РНК, который восстанавливает, корректирует или модифицирует физиологические функции клетки с обеспечением необходимого терапевтического исхода.
В различных вариантах осуществления генетически модифицируемые клетки, предусмотренные по настоящему документу, трансдуцируют in vitro или ex vivo векторами по изобретению и необязательно наращивают ex vivo. Затем трансдуцированные клетки вводят индивидууму, нуждающемуся в генотерапии.
Клетки, подходящие для трансдукции и введения в способах генотерапии, предусмотренных по настоящему документу, в качестве неограничивающих примеров включают стволовые клетки, клетки-предшественники и дифференцированные клетки. В определенных вариантах осуществления трансдуцированные клетки представляют собой эмбриональные стволов клетки, стволовые клетки костного мозга, стволовые клетки пуповины, плацентарные стволовые клетки, мезенхимальные стволовые клетки, гемопоэтические стволов клетки, клетки-предшественники эритроидных клеток и эритроидные клетки.
Гемопоэтические стволов клетки (HSCs) являются источниками коммитированных предшественников гемопоэтических клеток (НРС), которые способны к продукции полного репертуара зрелых клеток крови в течение жизни организма. Термин "гемопоэтическая стволов клетка" или "HSC" относится к плюрипотентным стволовым клеткам, служащим источником всех типов клеток крови организма, включая миелоидные (например, моноциты и макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки) и лимфоидные линии (например, Т-клетки, В-клетки, NK-клетки) и другие известные в данной области (см. Fei, R., et al., патент США №5635387; McGlave, et al., патент США №5460964; Simmons, P., et al., патент США №5677136; Tsukamoto, et al., патент США №5750397; Schwartz, et al., патент США №5759793; DiGuisto, et al., патент США №5681599; Tsukamoto, et al., патент США №5716827). При трансплантации летально облученным животным или людям гемопоэтические стволовые клетки и клетки-предшественники могут восстанавливать популяции эритроидных, нейтрофильных-макрофагальных, мегакариоцитарных и лимфоидных гемопоэтических клеток.
В определенных вариантах осуществления трансдуцируемые клетки представляют собой гемопоэтические стволовые клетки и/или клетки-предшественники, выделяемые из костного мозга, пуповинной крови или периферической крови. В конкретных вариантах осуществления трансдуцированные клетки представляют собой гемопоэтические стволовые клетки, выделяемые из костного мозга, пуповинной крови или периферической крови.
Согласно одному из вариантов осуществления гемопоэтические клетки представляют собой СD34+-клетки.
Согласно одному из вариантов осуществления гемопоэтические клетки представляют собой клетки-предшественники эритроидных клеток.
Согласно одному из вариантов осуществления гемопоэтические клетки представляют собой эритроидные клетки.
Клетки по изобретению могут представлять собой аутологичными/аутогенными ("собственными") или неаутологичными ("несобственными", например, аллогенными, сингенными или ксеногенными). Как используют в настоящем документе, "аутологичные" относится к клеткам того же индивидуума. Как используют в настоящем документе, "аллогенные" относится к клеткам того же вида, которые генетически отличаются от клетки, с которой производится сравнение. Как используют в настоящем документе, "сингенные" относится к клеткам другого индивидуума, которые генетически идентичны клетке, с которой производится сравнение. Как используют в настоящем документе, "ксеногенные" относится к клеткам другого вида, чем клетка, с которой производится сравнение. В предпочтительных вариантах осуществления клетки по изобретению являются аллогенными. "Выделенные клетки" относится к клеткам, которые получают из ткани или органа in vivo и по существу не содержат внеклеточного матрикса.
Иллюстративные примеры генетически модифицированных клеток, подходящих для клеточной терапии, предусмотренной по настоящему документу, в качестве неограничивающих примеров включают: эмбриональные стволовые клетки, стволовые клетки костного мозга, стволовые клетки пуповины, плацентарные стволовые клетки, мезенхимальные стволов клетки, гемопоэтические стволовые клетки, предшественников гемопоэтических клеток, предшественников миелоидных клеток, предшественников эритроцитов и другие эритроидные клетки.
В предпочтительных вариантах осуществления клетки, подходящие для клеточной терапии, предусмотренной по настоящему документу, в качестве неограничивающих примеров включают: гемопоэтические стволовые клетки или клетки-предшественники, проэритробласты, базофильные эритробласты, полихромные эритробласты, ортохромные эритробласты, полихромные эритроциты и эритроциты (RBC) или любое их сочетание.
Способы лечения или снижения риска развития гемоглобинопатии
Настоящее изобретение относится к улучшенным композициям и способам увеличения продукции HbF в клетках посредством введения векторов, которые ингибируют экспрессию BCL11A. Данные демонстрируют, что ингибирование BCL11A приводит к увеличенной экспрессии генов γ-глобина. Как описано в настоящем документе, целью изобретения является предоставление композиций и способов увеличения уровней фетального гемоглобина в клетках. В определенных вариантах осуществления клетки представляют собой эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга, гемопоэтические стволовые клетки, гемопоэтические клетки-предшественники или их потомство.
Таким образом, согласно одному из аспектов изобретения предоставлены способы увеличения уровней фетального гемоглобина, экспрессируемого клеткой, включающие этапы приведения эмбриональной стволовой клетки, соматической стволовой клетки, клетки-предшественника, клетки костного мозга, гемопоэтической стволовой клетки или гемопоэтической клетки в контакт с эффективным количеством композиции, содержащей по меньшей мере вирус или вектор, содержащий молекулу нуклеиновой кислоты, описываемую в настоящем документе, вследствие чего снижается экспрессия BCL11A, и в клетке или ее потомстве возрастает экспрессия фетального гемоглобина относительно клетки до такого контакта. Согласно одному из вариантов осуществления вектор или вирус экспрессирует осуществляющее РНК-интерференцию средство, которое представляет собой микроРНК к BCL11A, которая ингибирует BCL11A, таким образом, снижая экспрессию BCL11А.
В отношении контакта клетки с ингибитором BCL11A "увеличение уровней фетального гемоглобина" в клетке означает, что HbF в популяциях, обработанных ингибитором BCL11А, содержится в количестве по меньшей мере на 5% большем, чем в сравнимой контрольной популяции, где ингибитор BCL11A не присутствует.Предпочтительно, чтобы процент экспрессии HbF в обработанной ингибитором BCL11А популяции бы по меньшей мере на 10% выше, по меньшей мере на 20% выше, по меньшей мере на 30% выше, по меньшей мере на 40% выше, по меньшей мере на 50% выше, по меньшей мере на 60% выше, по меньшей мере на 70% выше, по меньшей мере на 80% выше, по меньшей мере на 90% выше, по меньшей мере однократно выше, по меньшей мере в 2 раза выше, по меньшей мере в 5 раз выше, по меньшей мере в 10 раз выше, по меньшей мере в 100 раз выше, по меньшей мере в 1000 раз или более, чем в обработанной контролем популяции со сравнимыми размером и условиями культивирования. Термин "обработанная контролем популяция" используют в настоящем документе для описания популяции клеток, которую обрабатывали идентичными средами, подвергали идентичной вирусной индукции, обрабатывали идентичными последовательностями нуклеиновых кислот, подвергали идентичным температурам, конфлуэнтности, содержали в идентичных колбах, при идентичном рН и т.д., за исключением ненаправленного олигонуклеотида.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, у индивидуума предполагают наличие, или риск наличия, или у него присутствует гемоглобинопатия, например, SCD или THAL. Практикующий специалист в данной области может установить индивидуума с наличием или риском развития гемоглобинопатии.
Индивидуумы также могут представлять собой индивидуумов, проходящих любое из ряда дополнительных видов терапевтического лечения. Таким образом, например, индивидуумы могут представлять собой индивидуумов, подвергаемых лечению кислородом, гидроксимочевиной, фолиевой кислотой или переливанием крови.
Способы доставки средств для РНК-интерференции, например, миРНК, или векторов, содержащих осуществляющие РНК-интерференцию средства, в клетки-мишени, например, эритроциты или другие желаемые клетки-мишени, для захвата включают инъекцию композиции, содержащей осуществляющее РНК-интерференцию средство, например, миРНК, или прямой контакт клеток, например, эритроцитов, с композицией, содержащей осуществляющее РНК-интерференцию средство, например, миРНК. В другом варианте осуществления осуществляющее РНК-интерференцию средство, например, миРНК можно инъецировать непосредственно в любой кровеносный сосуд, такой как вена, артерия, венула или артериола, например, посредством гидродинамической инъекции или катетеризации. Введение может представлять собой единичную инъекцию или его можно проводить в виде двух или более инъекций. Осуществляющее РНК-интерференцию средство доставляют в фармацевтически приемлемом носителе. Одновременно можно использовать одно или несколько осуществляющих РНК-интерференцию средств. В одном из предпочтительных вариантов осуществления используют только одну миРНК, направленную к BCL11A человека. Согласно одному из вариантов осуществления мишенью РНК-интерференции являются конкретные клетки, что ограничивает возможность побочного действия РНК-интерференции, вызываемого неспецифической направленностью РНК-интерференции. В способе можно использовать, например, комплексную или слитую молекулу, содержащую молекулу, направленную к клеткам, и молекулу, связывающую индуцирующую РНК-интерференцию молекулу, которую используют для эффективной доставки индуцирующей РНК-интерференцию молекулы в клетки. Например, слитый белок антитела-протамина при смешивании с миРНК связывает миРНК и селективно доставляет миРНК в клетки, экспрессирующие антиген, распознаваемый антителом, что приводит к сайленсингу экспрессии генов только в тех клетках, которые экспрессируют антиген. Молекула, связывающая миРНК или индуцирующую РНК-интерференцию молекулу, представляет собой белок или связывающий нуклеиновую кислоту домен или фрагмент белка, и связывающая молекула слита с частью направленной молекулы. Направленная молекула может находиться на С-конце или N-конце конструкции или в середине слитого белка. Также для доставки миРНК в клетки in vitro и in vivo можно использовать механизм опосредуемой вирусами доставки, как описано в Xia, Н. et al. (2002) Nat. Biotechnol. 20 (10): 1006). Также можно использовать опосредуемый плазмидами или вирусами механизм доставки кшРНК для доставки в клетки in vitro и in vivo кшРНК, как описано в Rubinson, D.A., et al. ((2003) Nat. Genet. 33: 401-406) и Stewart, S.A., et al. ((2003) RNA 9: 493-501). Средства для РНК-интерференции, например, миРНК или кшРНК, можно вводить вместе с компонентами, которые проявляют один или несколько из следующих видов активности: увеличивают захват осуществляющих РНК-интерференцию молекул, например, миРНК, клетками, например, лимфоцитами или другими клетками, ингибируют отжиг одиночных цепей, стабилизируют одиночные цепи или иным образом облегчают доставку в клетку-мишень и увеличивают ингибирование гена-мишени, например, BCL11A. Доза конкретного осуществляющего РНК-интерференцию средства составляет количество, необходимое для осуществления РНК-интерференции, например, посттрансляционного сайленсинга гена, для конкретного гена-мишени, таким образом, приводя к ингибированию экспрессии гена-мишени или ингибированию активности или снижению уровня белка, кодируемого геном-мишени.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или гемопоэтические стволовые клетки (HSC) приводят в контакт ex vivo или in vitro. В конкретном варианте осуществления клетки, подвергаемые контакту, представляют собой клетки эритроидной линии. Согласно одному из вариантов осуществления композиция ингибирует экспрессию BCL11A.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или HSC перед контактом с композицией, описываемой в настоящем документе, или контактом с вирусом или вектором, несущим молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или контактом с вирусом или вектором, экспрессирующим синтетическую микроРНК к BCL11А, описываемую в настоящем документе, выделяют у индивидуума.
Продолжительность жизни зрелых клеток крови является ограниченной и их необходимо непрерывно замещать на всем протяжении жизни. Клетки крови продуцируются посредством пролиферации и дифференцировки очень небольшой популяции плюрипотентных гемопоэтических стволовых клеток (HSC), которые также обладают способностью к пополнять собственную популяцию посредством самоподцержания. HSC являются плюрипотентными, самообновляемыми клетками-предшественниками, которые развиваются из мезодермальных гемангиобластов. HSC представляют собой клетки крови, которые служат источником всех других клеток крови, которые включают все дифференцированные клетки крови из эритроидных, лимфоидных и миелоидных линий. HSC находятся в костном мозге взрослых, периферической крови и пуповинной крови.
При дифференцировке потомство HSC до достижения зрелого состояния проходит через различные промежуточные стадии созревания, образуя плюрипотентные предшественники гемопоэтических клеток и коммитированные в направлении дифференцировки предшественники гемопоэтических клеток. У людей основным местом гемопоэза является костный мозг (ВМ), и в нормальных условиях в периферической крови (РВ) могут находиться только небольшие количества HSC и предшественников гемопоэтических клеток. Обработка цитокинами (в частности гранулоцитарным колониестимулирующим фактором; G-CSF),
миелосупрессирующими лекарственными средствами, используемыми при лечении злокачественных опухолей, и соединениями, которые нарушают взаимодействие между гемопоэтическими клетками и ВМ, стромальные клетки могут быстро мобилизовать в кровоток большие количества стволовых клеток и клеток-предшественников.
"Гемопоэтические клетки-предшественники", как используемый в настоящем документе термин, относятся к клеткам линии гемопоэтических стволовых клеток, которые служат источником всем типам клеток крови, включая миелоидную (моноциты и макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки) и лимфоидную (Т-клетки, В-клетки, NK-клетки) линии. "Клетка эритроидной линии" означает, что клетка, подвергаемая контакту, представляет собой клетку, которая претерпевает эритропоэз так, что после конечной дифференцировки она формирует эритроцит или красную клетку крови (RBC). Такие клетки принадлежат к одной из трех линий, эритроидной, лимфоидной и миелоидной, происходящих из предшественников гемопоэтических клеток костного мозга. После воздействия специфичных факторов роста и других компонентов гемопоэтического микроокружения, предшественники гемопоэтических клеток могут созревать, проходя через ряд клеточных типов с промежуточной дифференцировкой, все промежуточные клетки эритроидной линии, в RBC. Таким образом, клетки "эритроидной линии", в качестве термина, используемого в настоящем документе, включают предшественников гемопоэтических клеток, рубрибласты, прорубрициты, эритробласты, метарубрициты, ретикулоциты и эритроциты.
Согласно определенному варианту осуществления любого из способов, описываемых в настоящем документе, гемопоэтическая клетка-предшественник несет по меньшей мере один поверхностный клеточный маркер, характерный для предшественников гемопоэтических клеток: CD34+, CD59+, Thy1/CD90+, CD38lo/- и C-kit/CD117+. Предпочтительно, предшественники гемопоэтических клеток несут несколько этих маркеров.
Согласно определенному варианту осуществления любого из способов, описываемых в настоящем документе, предшественники гемопоэтических клеток эритроидной линии несут поверхностный клеточный маркер, характерный для эритроидной линии: CD71 и Ter119.
Согласно определенному варианту осуществления любого из способов, описываемых в настоящем документе, HSC несет по меньшей мере один из поверхностных клеточных маркеров, характерных для предшественников гемопоэтических клеток: CD34+, CD59+, Thy1/CD90+, CD38lo/- и C-kit/CD117+.
HSC, подобно предшественникам гемопоэтических клеток, способны к пролиферации и являются источником множества клеток-предшественников со способностью порождать большие количества материнских клеток, которые в свою очередь являются источником дифференцированных или дифференцируемых дочерних клеток. У самих этих дочерних клетки можно индуцировать пролиферацию и продукцию потомства, которое затем дифференцируется в один или несколько типов зрелых клеток, в то же время сохраняя одну или несколько клеток с исходным дифференцировочным потенциалом. Таким образом, термин "стволовая клетка" относится к клетке со способностью или потенциалом в конкретных условиях дифференцироваться в более специализированный или дифференцированный фенотип, и которые сохраняют способность в определенных условиях пролиферировать по существу без значимой дифференцировки. Согласно одному из вариантов осуществления термин предшественник или стволовая клетка относится к универсальной материнской клетке, потомки которой, часто в различных направлениях, специализируются, например, посредством дифференцировки, достигая совершенно индивидуальных характеристик, так как происходит при последовательной дифференцировке эмбриональных клеток и тканей. Клеточная дифференцировка представляет собой сложный процесс, как правило, происходящий посредством множества клеточных делений. Дифференцированная клетка может происходить от плюрипотентной клетки, которая сама происходит от плюрипотентной клетки и так далее. Хотя каждую из этих плюрипотентных клеток можно считать стволовой клеткой, диапазон типов клеток, для которых каждая из них может служить источником, может значительно варьировать. Некоторые дифференцированные клетки также обладают способностью порождать клетки с большим дифференцировочным потенциалом. Такая способность может являться природной или ее можно индуцировать искусственным способом обработкой различными факторами. Во многих биологических случаях стволовые клетки также являются "плюрипотентными" так как они могут продуцировать потомство более чем одного определенного типа клеток, но это не является необходимым для "стволовости". Другой классической частью определения стволовых клеток является самоподдержание, и как используют в настоящем документе, это является решающим. В теории самоподцержание может реализовываться двумя основными механизмами. Стволовые клетки могут делиться ассиметрично, где одна дочерняя клетка сохраняет стволовое состояние, а другая дочерняя клетка проявляет какие-либо другие определенные конкретные функцию и фенотип. Альтернативно, некоторые из стволовых клеток в популяции могут делиться симметрично на две стволовые клетки, таким образом, поддерживая определенное количество стволовых клеток в популяции в целом, тогда как другие клетки в популяции порождают толькодифференцированное потомство. Как правило, "клетки-предшественники" обладают клеточным фенотипом, который является более примитивным (т.е., находится на более ранней стадии пути развития или прогрессирования, чем полностью дифференцированная клетка). Часто клетки-предшественники также обладают значительным или очень высоким пролиферативным потенциалом. Клетки-предшественники в зависимости от пути развития и от окружения, в котором клетки развиваются и дифференцируются, могут порождать несколько различных типов дифференцированных клеток или один тип дифференцированных клеток.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники получают из периферической крови, пуповинной крови, хориональных ворсин, амниотической жидкости, плацентарной крови или костного мозга.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, эмбриональные стволовые клетка, соматические стволовые клетка, клетки-предшественники или клетки костного мозга получают из периферической крови, пуповинной крови, хориональных ворсин, амниотической жидкости, плацентарной крови или костного мозга.
Клетки-предшественники периферической крови (РВРС) стали предпочтительным источником гемопоэтических клеток-предшественников для аллогенной и аутологичной трансплантации вследствие технической простоты получения и более короткого периода времени, необходимого для приживления. Традиционно, для стимуляции большего количества РВРС и выхода из костного мозга гемопоэтических клеток-предшественников использовали гранулоцитарный колониестимулирующий фактор (G-CSF). Хотя схемы лечения с использованием G-CSF, как правило, с успехом используют для получения у здоровых доноров достаточных количеств РВРС, у 5%-10% стволов клетки мобилизуются плохо и может требоваться несколько аферезов в большом объеме или получение костного мозга.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или HSC до осуществления контакта выбраны по поверхностному маркеру CD34+.
Таким образом, согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, в контакт с композицией, описываемой в настоящем документе или в контакт с вирусом или вектором, несущим молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или в контакт с вирусом или вектором, экспрессирующим синтетическую микроРНК к BCL11А, описываемую в настоящем документе, приводят выделенные эмбриональные стволовые СD34+-клетки, выделенные соматические стволовые СD34+-клетки, выделенные СD34+-клетки-предшественники, выделенные СD34+-клетки костного мозга, выделенные гемопоэтические СD34+-клетки-предшественники или выделенные CD34+-HSC.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или HSC до любого контакта с композицией, описываемой в настоящем документе, или контакта с вирусом или вектором, несущим молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или контакта с вирусом или вектором, экспрессирующим синтетическую микроРНК к BCL11А, описываемую в настоящем документе, подвергают криоконсервации.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, контакт производят in vitro, ex vivo или in vivo.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, контакт повторяют по меньшей мере один раз. Т.е., после исходного первого контакта эмбриональных стволовых клеток, соматических стволовых клеток, клеток-предшественников, клеток костного мозга или гемопоэтических клеток-предшественников или HSC с композицией, описываемой в настоящем документе, или контакта с вирусом или вектором, несущим молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или контакта с вирусом или вектором, экспрессирующим синтетическую микроРНК к BCL11A, описываемую в настоящем документе, клетки отмывают и затем отмытые клетки подвергают контакту с композицией, описываемой в настоящем документе, или контакту с вирусом или вектором, несущим молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или контакту с вирусом или вектором, экспрессирующим синтетическую микроРНК к BCL11A, описываемую в настоящем документе, второй раз.
Согласно другим вариантам осуществления контакт после исходного первого контакта повторяют по меньшей мере дважды.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, после осуществления контакта приводимые в контакт эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или HSC перед использованием, например, наращиванием ex vivo и/или имплантацией индивидууму, подвергают криоконсервации.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, после осуществления контакта приводимые в контакт эмбриональные стволовые клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или HSC перед использованием, например, криоконсервацией и/или имплантацией/приживлением индивидууму, наращивают в культуре ex vivo.
Согласно одному из вариантов осуществления любого из способов, описываемых в настоящем документе, после осуществления контакта приводимые в контакт эмбриональные стволов клетки, соматические стволовые клетки, клетки-предшественники, клетки костного мозга или гемопоэтические клетки-предшественники или HSC перед использованием, например, криоконсервацией и/или имплантацией/приживлением индивидууму подвергают дифференцировке в культуре ex vivo.
В рамках онтогенеза клетки, прилагательное "дифференцированная" или "дифференцирующаяся" является относительным термином. "Дифференцированная клетка" представляет собой клетку, которая прошла по пути развития дальше, чем клетка, с которой ее сравнивают. Таким образом, стволовые клетки могут дифференцироваться в линейно-ограниченные клетки-предшественники (такие как гемопоэтические клетки-предшественники), которые в свою очередь могут дифференцироваться в другие типы клеток-предшественником прошедших дальше по пути развития (такие как предшественники эритроцитов), а затем в дифференцированные до последней стадии клетки, такие как эритроциты, которые играют характеристическую роль в определенном типе тканей, и могут или не могут сохранять способность к дальнейшей пролиферации.
Согласно одному из вариантов осуществления ингибитор экспрессии BCL11A представляет собой специфичное для BCL11A осуществляющее РНК-интерференцию средство или вектор, кодирующий указанное специфичное для BCL11A осуществляющее РНК-интерференцию средство. В одном из конкретных вариантов осуществления осуществляющее РНК-интерференцию средство содержит одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44.
Как описано в настоящем документе, "нуклеиновая кислота", может представлять собой РНК или ДНК и может быть одно- или двухцепочечной, и ее можно выбирать, например, из группы, включающей: нуклеиновую кислоту, кодирующую представляющий интерес белок, олигонуклеотидов, аналогов нуклеиновых кислот, например, пептидную нуклеиновую кислоту (ПНК), псевдокомплементарную ПНК (пк-ПНК) и закрытую нуклеиновую кислоту (ЗНК). Например, такие последовательности нуклеиновой кислоты включают, но не ограничены ими, последовательности нуклеиновой кислоты, кодирующие белки, например, которые действуют в качестве репрессоров транскрипции, антисмысловые молекулы, рибозимы, малые ингибирующие последовательности нуклеиновой кислоты, в качестве неограничивающих примеров РНКи, кшРНКи, миРНК, микро-РНКи (мкРНК), и антисмысловые олигонуклеотиды.
Как описано в настоящем документе, целью изобретения является предоставление способа увеличения уровней фетального гемоглобина у индивидуума.
Таким образом, согласно одному из аспектов настоящего изобретения предоставлен способ увеличения уровней фетального гемоглобина у нуждающегося в этом индивидуума, где способ включает этап приведения гемопоэтических клеток-предшественников или HSC индивидуума в контакт с эффективным количеством композиции, содержащей ингибитор BCL11A, в результате чего возрастает экспрессия HbF относительно экспрессии до такого контакта. Согласно одному из вариантов осуществления ингибитор BCL11A представляет собой осуществляющее РНК-интерференцию средство, содержащее одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Относительно контакта клеток индивидуума с ингибитором BCL11A, "увеличение уровней HbF у индивидуума" означает, что уровень HbF у индивидуумов в группах, обработанных ингибитором BCL11A по меньшей мере на 5% выше, чем в сравнимой контрольной группе, где ингибитор BCL11А не вводили. Предпочтительно, чтобы экспрессия фетального гемоглобина у обработанного ингибитором BCL11A индивидуума была по меньшей мере на 10% выше, по меньшей мере на 20% выше, по меньшей мере на 30% выше, по меньшей мере на 40% выше, по меньшей мере на 50% выше, по меньшей мере на 60% выше, по меньшей мере на 70% выше, по меньшей мере на 80% выше, по меньшей мере на 90% выше, по меньшей мере однократно выше, по меньшей мере в 2 раза выше, по меньшей мере в 5 раз выше, по меньшей мере в 10 раз выше, по меньшей мере в 100 раз выше, по меньшей мере в 1000 раза выше или более, чем у сравнимо обработанного контролем индивидуума. Термин "сравнимо обработанный контролем индивидуум" используют в настоящем документе для описания индивидуума, который обработан идентично за исключением добавления ненаправленного олигонуклеотида.
Таким образом, согласно одному из вариантов осуществления у индивидуума диагностирована гемоглобинопатия. Согласно дополнительному варианту осуществления гемоглобинопатия представляет собой SCD. Как используют в настоящем документе, SCD может представлять собой серповидноклеточную анемию, заболевание с серповидноклеточным гемоглобином C (HbSC), серповидноклеточную бета-плюс-талассемию (HbS/β+) или серповидноклеточную бета-минус-талассемию (HbS/β0). В другом предпочтительном варианте осуществления гемоглобинопатия представляет собой THAL.
Лечение по настоящему изобретению уменьшает один или несколько симптомов, ассоциированных с нарушением, увеличивая количество фетального гемоглобина у индивидуума. Симптомы, как правило, ассоциированные с гемоглобинопатией, включают, например, анемию, тканевую гипоксию, органную дисфункцию, аномальные величины гематокрита, неэффективный эритропоэз, аномальное количество ретикулоцитов (эритроцитов), аномальное содержание железа, присутствие кольцевидных сидеробластов, спленомегалию, гепатомегалию, нарушенный кровоток периферической крови, одышку, повышенный гемолиз, желтуху, анемические болевые кризисы, острый грудной синдром, секвестрацию селезенки, приапизм, инсульт, ладонно-подошвенный синдром и боль, такую как при стенокардии.
Согласно одному из вариантов осуществления контакт гемопоэтических клеток-предшественников или HSC проводят ex vivo или in vitro, и клетки или их потомство вводят индивидууму. Согласно дополнительному варианту осуществления гемопоэтические клетки-предшественники представляют собой клетки эритроидной линии.
Согласно одному из вариантов осуществления гемопоэтические клетки-предшественники или HSC приводят в контакт с композицией, содержащей ингибитор BCL11A и фармацевтически приемлемый носитель или разбавитель. Согласно одному из вариантов осуществления композицию вводят посредством инъекции, вливания, инсталляции или глотания. Согласно одному из вариантов осуществления композицию вводят посредством непосредственной инъекции в костный мозг.
Согласно одному из вариантов осуществления любого из описываемых способов, генотерапевтический способ используют для лечения, профилактики или смягчения гемоглобинопатии, выбранной из группы, состоящей из: заболевания с гемоглобином C, серповидноклеточной болезни (SCD) вследствие поражения гемоглобина, серповидноклеточной анемии, наследственной анемии, талассемии, β-талассемии, большой талассемии, промежуточной талассемии, α-талассемии и Н-гемоглобинопатии.
В различных вариантах осуществления любого из описываемых способов ретровирусные векторы вводят in vivo посредством непосредственной инъекции в клетки, ткань или орган индивидуума, нуждающегося в генотерапии. В других различных вариантах осуществления любого из описываемых способов клетки трансдуцируют векторами по изобретению in vitro или ex vivo и необязательно наращивают ex vivo. Затем трансдуцированные клетки вводят индивидууму, нуждающемуся в генотерапии.
Как используют в настоящем документе, "индивидуум" включает любое животное, у которого выявляют симптом моногенного заболевания, нарушения или патологического состояния, которое можно лечить генотерапевтическими векторами, клеточными терапевтическими средствами и способами, описываемыми в других разделах настоящего документа. В предпочтительных вариантах осуществления индивидуум включает любое животное с симптомами заболевания, нарушения или патологического состояния системы гемопоэза, например, гемоглобинопатии, которые можно лечить генотерапевтическими векторами, клеточными терапевтическими средствами и способами, предусмотренными по настоящему документу. Подходящие индивидуумы (например, пациенты) включают лабораторных животных (таких как мышь, крыса, кролик или морская свинка), сельскохозяйственных животных и домашних животных или любимцев (таких как кошка или собака). Включены не являющиеся человеком приматы и, предпочтительно, люди. Типичные индивидуумы включают животных с выявляемыми аберрантными уровнями (меньшими или большими уровнями, чем у "нормального" или "здорового" индивидуума) одного или нескольких видов физиологической активности, которые можно модулировать генотерапией.
Как используют в настоящем документе, согласно одному из вариантов осуществления "обработка" или "лечение", включает любое лечебное или желаемое действие на симптомы или патологические признаки заболевания или патологического состояния и могут включать даже минимальное снижение одного или нескольких измеримых маркеров подвергаемого лечению заболевания или патологического состояния. В другом варианте осуществления лечение может необязательно включать снижение или смягчение симптомов заболевания или патологического состояния или задержку прогрессирования заболевания или патологического состояния. "Лечение" не обязательно означает полное устранение или излечение заболевания или патологического состояния или ассоциированных с ними симптомов.
Как используют в настоящем документе, согласно одному из вариантов осуществления, "профилактика" и подобные понятия, такие как "предотвращенный", "предотвращение" и т.д., означает подход для предотвращения, подавления или уменьшения вероятности дебюта или рецидива заболевания или патологического состояния. В другом варианте осуществления термин относится к задержке дебюта или рецидива заболевания или патологического состояния или задержки манифестации или рецидива симптомов заболевания или патологического состояния. В другом варианте осуществления, как используют в настоящем документе, "профилактика" и подобные понятия включают снижение интенсивности, эффектов, симптомов и/или тяжести заболевания или патологического состояния до дебюта или рецидива заболевания или патологического состояния.
Согласно одному из вариантов осуществления любого из описываемых способов, способ дополнительно включает выбор индивидуума, нуждающегося в описываемой генотерапии. Например, индивидуум, демонстрирующий симптомы или цитологию гемоглобинопатии выбран из группы, состоящей из заболевания с гемоглобином C, серповидноклеточной болезни (SCD) вследствие поражения гемоглобина, серповидноклеточной анемии, наследственной анемии, талассемии, β-талассемии, большой талассемии, промежуточной талассемии, α-талассемии и Н-гемоглобинопатии. Альтернативно, индивидуум несет генную мутацию, которая ассоциирована с гемоглобинопатией, где генная мутация описана в настоящем документе. Например, у индивидуума диагностируют SCD при генотипе HbSS, HbS/β0 талассемии, HbSD или HbSO и/или при HbF<10% при электрофорезе.
В различных вариантах осуществления любого из описываемых способов индивидууму, нуждающемуся в генотерапии, вводят популяцию клеток, содержащих эффективное количество генетически модифицированных клеток, предусмотренных по настоящему документу. Т.е. генетически модифицированных клеток, экспрессирующих одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Как используют в настоящем документе, термин "количество" относится к "количеству, эффективному для" или "эффективному количеству" вируса или трансдуцированных терапевтических клеток для достижения лечебного или желаемого профилактического или терапевтического результата, включая клинический результаты.
"Профилактически эффективное количество" относится к количеству вируса или трансдуцированных терапевтических клеток, эффективному для достижения желаемого профилактического результата. Как правило, но не обязательно, так как профилактическую дозу используют у индивидуумов до или на ранней стадии заболевания, профилактически эффективное количество является меньшим, чем терапевтически эффективное.
"Терапевтически эффективное количество" вируса или трансдуцированных терапевтических клеток может варьировать в соответствии с такими факторами, как течение заболевания, возраст, пол и масса индивидуума и способности стволовых клеток и клеток-предшественников взывать у индивидуума необходимый ответ. Терапевтически эффективное количество также представляет собой количество, при котором любое токсическое или приносящее ущерб действие вируса или трансдуцированных терапевтических клеток перевешивается терапевтически положительным воздействием. Термин "терапевтически эффективное количество" включает количество, которое эффективно для "лечения" индивидуума (например, пациента).
Согласно одному из вариантов осуществления настоящее изобретение относится к способу доставки трансдуцированных клеток индивидууму, который включает введение, например, парентерально, одной или нескольких клеток, трансдуцированных вектором, предусмотренным по настоящему документу индивидууму. Согласно одному из вариантов осуществления вектор представляет собой вектор, несущий одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
В конкретном варианте осуществления предоставлен способ профилактики, улучшение состояния или лечения гемоглобинопатия у индивидуума. Способ включает введение популяции клеток, содержащих гемопоэтические клетки, трансдуцированные вектором, предусмотренным по настоящему документу. Согласно одному из вариантов осуществления вектор представляет собой вектор, несущий одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
В конкретных вариантах осуществления популяция клеток, вводимых индивидууму, содержит гемопоэтические стволовые клетки или клетки-предшественники, проэритробласты, базофильные эритробласты, полихромные эритробласты, ортохромные эритробласты, полихромные эритроциты и эритроциты (RBC) или любое их сочетание, и любая часть из них может быть генетически модифицированной векторами, предусмотренными по настоящему документу. Согласно одному из вариантов осуществления вектор представляет собой вектор, несущий одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11A, описываемую в настоящем документе.
Генетически модифицированные клетки можно вводить как часть трансплантата костного мозга или пуповинной крови у индивидуума, подвергнутого или не подвергнутого албяционной терапии костного мозга. Согласно одному из вариантов осуществления генетически модифицированные клетки, предусмотренные по настоящему документу, вводят индивидууму, прошедшему хемоабляционную или радиоабляционную терапию костного мозга, в трансплантате костного мозга.
Согласно одному из вариантов осуществления дозу генетически модифицированных клеток доставляют индивидууму внутривенно. Согласно одному из вариантов осуществления индивидууму внутривенно вводят генетически модифицированные гемопоэтические клетки.
В конкретных вариантах осуществления пациенты получают дозу генетически модифицированных клеток, например, гемопоэтических стволовых клеток, приблизительно 1×105 клеток/кг, приблизительно 5×105 клеток/кг, приблизительно 1×106 клеток/кг, приблизительно 2×106 клеток/кг, приблизительно 3×106 клеток/кг, приблизительно 4×106 клеток/кг, приблизительно 5×106 клеток/кг, приблизительно 6×106 клеток/кг, приблизительно 7×106 клеток/кг, приблизительно 8×106 клеток/кг, приблизительно 9×106 клеток/кг, приблизительно 1×107 клеток/кг, приблизительно 5×107 клеток/кг, приблизительно 1×108 клеток/кг или более в одной внутривенной дозе. В определенных вариантах осуществления пациенты получают дозу генетически модифицированных клеток, например, гемопоэтических стволовых клеток, по меньшей мере 1×105 клеток/кг, по меньшей мере 5×105 клеток/кг, по меньшей мере 1×106 клеток/кг, по меньшей мере 2×106 клеток/кг, по меньшей мере 3×106 клеток/кг, по меньшей мере 4×106 клеток/кг, по меньшей мере 5×106 клеток/кг, по меньшей мере 6×106 клеток/кг, по меньшей мере 7×106 клеток/кг, по меньшей мере 8×106 клеток/кг, по меньшей мере 9×106 клеток/кг, по меньшей мере 1×107 клеток/кг, по меньшей мере 5×107 клеток/кг, по меньшей мере 1×108 клеток/кг или более в одной внутривенной дозе.
Согласно дополнительному варианту осуществления пациенты получают дозу генетически модифицированных клеток, например, гемопоэтических стволовых клеток, приблизительно 1×105 клеток/кг до приблизительно 1×108 клеток/кг, приблизительно 1×106 клеток/кг до приблизительно 1×108 клеток/кг, приблизительно 1×106 клеток/кг до приблизительно 9×106 клеток/кг, приблизительно 2×106 клеток/кг до приблизительно 8×106 клеток/кг, приблизительно 2×106 клеток/кг до приблизительно 8×106 клеток/кг, приблизительно 2×106 клеток/кг до приблизительно 5×106 клеток/кг, приблизительно 3×106 клеток/кг до приблизительно 5×106 клеток/кг, приблизительно 3×106 клеток/кг до приблизительно 4×108 клеток/кг или любую находящуюся между ними дозу клеток/кг.
В различных вариантах осуществления способы по изобретению обеспечивают более надежную и безопасную генотерапию, чем существующие в настоящее время способы, и включают введение индивидууму популяции или дозы клеток, содержащих приблизительно 5% трансдуцированных клеток, приблизительно 10% трансдуцированных клеток, приблизительно 15% трансдуцированных клеток, приблизительно 20% трансдуцированных клеток, приблизительно 25% трансдуцированных клеток, приблизительно 30% трансдуцированных клеток, приблизительно 35% трансдуцированных клеток, приблизительно 40% трансдуцированных клеток, приблизительно 45% трансдуцированных клеток или приблизительно 50% трансдуцированных клеток.
Согласно одному из вариантов осуществления изобретение относится к генетически модифицированным клеткам, таким как стволовые клетки, например, гемопоэтические стволовые клетки, с потенциалом к размножению или увеличению популяции эритроидных клеток. В конкретных вариантах осуществления гемопоэтические стволовые клетки трансдуцируют вектором по изобретению и вводят индивидууму, нуждающемуся в терапии гемоглобинопатии. Гемопоэтические стволовые клетки являются источником эритроидных клеток и, таким образом, являются предпочтительными. Согласно одному из вариантов осуществления вектор представляет собой вектор, несущий одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44, или синтетическую микроРНК к BCL11А, описываемую в настоящем документе.
Как используют в настоящем документе, термин "фармацевтически приемлемый" и его грамматические варианты, как они относятся к композициям, носителям, разбавителям и реагентам, используют взаимозаменяемо и указывают, что материалы можно вводить индивидууму или наносить на индивидуума без получения нежелательного физиологического действия, такого как тошнота, головокружение, расстройство желудка и т.п. Каждый носитель также должен являться "приемлемым" в смысле совместимости с другими ингредиентами состава. Фармацевтически приемлемый носитель не стимулирует активацию иммунного ответа на средство, с которым его смешивают, если это не желательно. Получение фармакологической композиции, содержащей активные ингредиенты, растворенные или диспергированные в ней хорошо известно в данной области и не нуждается в ограничении на основе состава. Фармацевтический состав содержит соединение по изобретению в комбинации с одним или несколькими фармацевтически приемлемыми ингредиентами. Носитель может находиться в форме твердого вещества, полутвердого вещества или жидкого разбавителя, крема или капсулы. Как правило, таки композиции получают в инъецируемом виде в качестве жидких растворов или суспензий, однако также можно получать твердые формы, подходящие для растворения или суспендирования перед использованием в жидкости. Препарат также можно эмульгировать или предоставлять в виде липосомной композиции. Активный ингредиент можно смешивать с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом и в количествах, пригодных для использования в терапевтических способах, описываемым в настоящем документе. Подходящие эксципиенты представляют собой, например, воду, солевой раствор, декстрозу, глицерин, этанол или т.п. и их сочетания. Кроме того, при желании, композиция могут содержать незначительные количества вспомогательных веществ, таких как увлажнители или эмульгаторы, средства для буферирования рН и т.п., которые увеличивают эффективность активного ингредиента. Терапевтическая композиция по настоящему изобретению может содержать фармацевтически приемлемые соли ее компонентов. Фармацевтически приемлемые соли включают соли присоединения кислот (сформированные свободными аминогруппами полипептида), которые сформированы такими неорганическими кислотами, как, например, соляная или фосфорная кислоты, или такими органическими кислотами, как уксусная, винная, миндальная и т.п. Также можно получать соли, формируемые свободными карбоксильными группами с неорганическими основаниями, такими как, например, гидроксиды натрия, калия, аммония, кальция или железа, и такими органическими основаниями ка изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п. Физиологически переносимые носители хорошо известны в данной области. Иллюстративные жидкие носители представляют собой стерильные водные растворы, не содержащие материалов в дополнение к активным ингредиентам и воде, или содержащие буфер, такой как фосфат натрия при физиологическом значении pH, физиологический солевой раствор или оба, например, фосфатно-солевой буфер. Кроме того, водные носители могут содержать более одной буферной соли, а также таких солей, как хлориды натрия и калия, декстрозы, полиэтиленгликоля и других растворов. Также жидкие композиции могут содержать жидкие фазы в дополнение к воде и для ее исключения. Иллюстрациями таких дополнительных жидких фаз являются глицерин, растительные масла, такое как хлопковое масло, и эмульсии вода-в-масле. Количество активного средства, используемого по изобретению, которое эффективно при лечении конкретного нарушения или патологического состояния зависит от характера нарушения или патологического состояния, и его можно определять стандартными клиническими способами. Фраза "фармацевтически приемлемый носитель или разбавитель" означает фармацевтически приемлемые материал, композицию или носитель, такие как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, включаемые в перенос или транспорт средств индивидууму из одного органа или отдела организма, в другой орган или отдел организма.
Согласно одному из вариантов осуществления любого из описанных способов, как используют в настоящем документе, "введенный" относится к введению ингибитора BCL11A индивидууму способом или маршрутом, который приводит к локализации по меньшей мере части ингибитора в необходимом участке. Средство, ингибирующее BCL11A, можно вводить любым подходящим маршрутом, который приводит к эффективному лечению индивидуума, т.е., введение приводит к доставке в желаемый участок у индивидуума, куда происходит доставка по меньшей мере части композиции, т.е., по меньшей мере одно средство, ингибирующее BCL11А, активно в желаемом участке в течение определенного периода времени. Период времени активности ингибитора зависит от времени полужизни in vivo после введения индивидууму и может составлять от нескольких часов, например, по меньшей мере 1 час, по меньшей мере 2 часа, по меньшей мере 3 часа, по меньшей мере 4 часа, по меньшей мере 5 часов, по меньшей мере 6 часов, по меньшей мере 8 часов, по меньшей мере 10 часов, по меньшей мере 12 часов, по меньшей мере 18 часов, по меньшей мере 24 часов, до нескольких суток, до нескольких лет. Способы введения включают инъекцию, вливание, инсталляцию или глотание. "Инъекция" в качестве неограничивающих примеров включает внутривенные, внутримышечные, внутриартериальные, интратекальные, внутрижелудочковые, внутрикапсулярные, внутриглазные, внутрисердечные, интрадермальные, интраперитонеальные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, интрацереброспинальные и интрастернальные инъекцию и вливание.
Согласно одному из вариантов осуществления композиция, описываемая в настоящем документе, или вирус или вектор, несущий молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или вирус или вектор, экспрессирующий синтетическую микроРНК к BCL11A, описываемую в настоящем документе, инъецируют в костный мозг.
Согласно одному из вариантов осуществления в контакт с композицией, ингибирующей экспрессию BCL11A, приводят гемопоэтические клетки-предшественники или HSC, полученные у индивидуума, нуждающегося в лечении. Согласно другим вариантам осуществления композиция содержит вирус или вектор, несущий молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18, 25-44, или вирус или вектор, экспрессирующий синтетическую микроРНК к BCL11A, описываемую в настоящем документе. Индивидуум, нуждающийся в лечении, представляет собой индивидуума, у которого диагностирована гемоглобинопатия, такая как SCD или THAL.
Под "ингибирует экспрессию BCL11A" подразумевают, что уровень экспрессии BCL11A в популяции, обработанной ингибитором BCL11A, является по меньшей мере на 5% ниже, чем в сравнимой, контрольной популяции, где ингибитор BCL11A не присутствует. Предпочтительно, чтобы процент экспрессии BCL11A в обработанной ингибитором BCL11А популяции был по меньшей мере на 10% ниже, по меньшей мере на 20% ниже, по меньшей мере на 30% ниже, по меньшей мере на 40% ниже, по меньшей мере на 50% ниже, по меньшей мере на 60% ниже, по меньшей мере на 70% ниже, по меньшей мере на 80% ниже, по меньшей мере на 90% ниже, по меньшей мере однократно ниже, по меньшей мере в 2 раза ниже, по меньшей мере в 5 раз ниже, по меньшей мере в 10 раз ниже, по меньшей мере в 100 раз ниже, по меньшей мере в 1000 раз ниже или более, чем в сравнимой обработанной контролем популяции, в которую ингибитор BCL11А не добавляют.
Согласно одному из вариантов осуществления нуклеиновая кислота представляет собой специфичное для BCL11A осуществляющее РНК-интерференцию средство или вектор, кодирующий осуществляющее РНК-интерференцию средство. Согласно одному из вариантов осуществления осуществляющее РНК-интерференцию средство содержит одну или несколько нуклеотидных последовательностей SEQ ID NO: 1-10, 13-18, 25-44.
В качестве примера способа лечения индивидуума или снижения риска развития гемоглобинопатии у индивидуума способ включает введение индивидууму композиции, содержащей модифицированные подвергнутые инженерии клетки, которые содержат вектор, несущий последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе. Согласно одному из вариантов осуществления способ дополнительно включает идентификацию индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии. В другом варианте осуществления способ дополнительно включает выбор идентифицированного индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии.
В качестве другого примера способа лечения индивидуума или снижение риска развития гемоглобинопатии у индивидуума способ включает следующие этапы: мобилизация гемопоэтических стволовых клеток и предшественников гемопоэтических клеток у индивидуума; получение периферической крови у индивидуума, положительный отбор СD34+-клеток из периферической крови, трансдукция или трансфекция выбранных СD34+-клеток in vitro вектором, несущим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе; отмывка трансдуцированных отобранных СD34+-клеток и введение клеток индивидууму. Согласно одному из вариантов осуществления способ дополнительно включает идентификацию индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии. Согласно одному из вариантов осуществления способ дополнительно включает отбор индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии. В другом варианте осуществления способ дополнительно включает наращивание отмытых трансдуцированных отобранных СD34+-клеток в культуре in vitro перед введением индивидууму. В другом варианте осуществления способ дополнительно включает дифференцировку отмытых трансдуцированных отобранных CD34+-клеток в культуре in vitro перед введением индивидууму.
В качестве другого примера способа лечения индивидуума или снижения риска развития гемоглобинопатии у индивидуума способ включает следующие этапы: мобилизацию гемопоэтических стволовых клеток и предшественников гемопоэтических клеток у индивидуума-донора; получение периферической крови у индивидуума-донора, положительный отбор СD34+-клеток из периферической крови, трансдукцию или трансфекцию отобранных СD34+-клеток in vitro вектором, несущим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе; отмывку трансдуцированных отобранных СD34+-клеток и введение клеток индивидууме-реципиенту. Согласно одному из вариантов осуществления способ дополнительно включает отбор индивидуума-реципиента с гемоглобинопатией или с риском развития гемоглобинопатии. В другом варианте осуществления способ дополнительно включает наращивание отмытых трансдуцированных отобранных СD34+-клеток в культуре in vitro перед введением индивидууму-реципиенту. В другом варианте осуществления способ дополнительно включает дифференцировку отмытых трансдуцированных отобранных СD34+-клеток в культуре in vitro перед введением индивидууму-реципиенту.
В качестве другого примера способа лечения индивидуума или снижение риска развития гемоглобинопатии у индивидуума способ включает следующие этапы: получение крови из костного мозга индивидуума, положительный отбор СD34+-клеток из крови костного мозга, трансдукцию или трансфекцию отобранных СD34+-клеток in vitro вектором, несущим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе; отмывку трансдуцированных отобранных СD34+-клеток и введение клеток индивидууму. Согласно одному из вариантов осуществления способ дополнительно включает идентификацию индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии. Согласно одному из вариантов осуществления способ дополнительно включает отбор индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии. В другом варианте осуществления способ дополнительно включает наращивание отмытых трансдуцированных отобранных СD34+-клеток в культуре in vitro перед введением индивидууму. В другом варианте осуществления способ дополнительно включает дифференцировку отмытых трансдуцированных отобранных СD34+-клеток в культуре in vitro перед введением индивидууму.
В качестве другого примера способа лечения индивидуума или снижение риска развития гемоглобинопатии у индивидуума способ включает следующие этапы: получение крови из костного мозга индивидуума-донора, положительный отбор CD34+-клеток из крови костного мозга, трансдукцию или трансфекцию отобранных CD34+-клеток in vitro вектором, несущим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе; отмывку трансдуцированных отобранных СD34+-клеток; и введение клеток индивидууму-реципиенту. Согласно одному из вариантов осуществления способ дополнительно включает идентификацию индивидуума-реципиента с гемоглобинопатией или с риском развития гемоглобинопатии. Согласно одному из вариантов осуществления способ дополнительно включает отбор индивидуума-реципиента с гемоглобинопатией или с риском развития гемоглобинопатии. В другом варианте осуществления способ дополнительно включает наращивание отмытых трансдуцированных отобранных CD34+-клеток в культуре in vitro перед введением индивидууму-реципиенту. В другом варианте осуществления способ дополнительно включает дифференцировку отмытых трансдуцированных отобранных CD34+-клеток в культуре in vitro перед введением индивидууму-реципиенту.
Согласно одному из вариантов осуществления изобретения в настоящем документе предоставлена модифицированная, подвергнутая инженерии клетка, содержащая последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе.
Согласно одному из вариантов осуществления в описании в настоящем документе предоставлен модифицированная, подвергнутая инженерии клетка, трансдуцированная или трансфицированная вектором, содержащим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе. Согласно одному из вариантов осуществления вектор представляет собой лентивирус.
Согласно одному из вариантов осуществления в описании в настоящем документе предоставлен способ лечения индивидуума или снижение риска развития гемоглобинопатии у индивидуума, где способ включает введение модифицированных, подвергнутых инженерии клеток, трансдуцированных или трансфицированных вектором, содержащим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11A, описываемую в настоящем документе. Согласно одному из вариантов осуществления вектор представляет собой лентивирус.
Согласно одному из вариантов осуществления в описании в настоящем документе предоставлен способ лечения индивидуума или снижение риска развития гемоглобинопатии у индивидуума, где способ включает введение модифицированных, подвергнутых инженерии клеток, содержащих последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44, или микроРНК к BCL11А, описываемую в настоящем документе.
Согласно одному из вариантов осуществления модифицированная, подвергнутая инженерии клетка представляет собой эмбриональную стволовую клетку, соматическую стволовую клетку, клетку-предшественника, клетку костного мозга, гемопоэтическую стволовую клетку или гемопоэтическую клетку-предшественник.
Согласно одному из вариантов осуществления модифицированная, подвергнутая инженерии клетка представляет собой клетку, дифференцированную из эмбриональной стволовой клетки, соматической стволовой клетки, клетки-предшественника, клетки костного мозга, гемопоэтической стволовой клетки или гемопоэтической клетки-предшественника.
Согласно одному из вариантов осуществления модифицированная, подвергнутая инженерии клетка представляет собой клетку, дифференцированную в эритроидную линию.
Согласно одному из вариантов осуществления модифицированная, подвергнутая инженерии клетка представляет собой клетку, дифференцированную в эритроцит.
Согласно одному из вариантов осуществления модифицированная, подвергнутая инженерии клетка представляет собой СD34+-клетку.
Настоящее изобретение можно определять любым из приведенных ниже пронумерованных абзацев.
[1] Синтетическая микроРНК к BCL11A, содержащая первый участок BCL11A, участок петли и второй участок BCL11A, расположенные последовательно в направлении от 5'-конца к 3'-концу, где участок петли расположен между первым и вторым участками BCL11A и непосредственно связан с ними, и где второй участок BCL11A комплементарен первому участку BCL11A так, что основания первого и второго участков BCL11А спарены с формированием петли шпильки с участком петли, формирующим область петли сформированной, таким образом, петли шпильки.
[2] Синтетическая микроРНК к BCL11A по п. 1, где длина первого и второго участков BCL11А составляет приблизительно от 18 до 25 нуклеотидов.
[3] Синтетическая микроРНК к BCL11A по пп. 1 или 2, где первый участок BCL11A содержит последовательность, получаемую из последовательности мРНК BCL11A.
[4] Синтетическая микроРНК к BCL11A по любому из пп. 1-3, где первый участок BCL11А комплементарен второму участку BCL11А.
[5] Синтетическая микроРНК к BCL11A по любому из пп. 1-4, где первый участок BCL11A на 5'-конце начинается с -GCGC-, а второй участок BCL11A на 3'-конце заканчивается -GCGC-.
[6] Синтетическая микроРНК к BCL11A по любому из пп. 1-5, где первый участок BCL11A выбран из группы, состоящей из CGCACAGAACACTCATGGATT (SEQ ID NO: 46; получаемой из олигонуклеотида мкР1 (miR1) BCL11А, описываемого в настоящем документе), CCAGAGGATGACGATTGTTTA (SEQ ID NO: 47; получаемой из олигонуклеотида мкР2 (miR2) BCL11A, описываемого в настоящем документе), TCGGAGACTCCAGACAATCGC (SEQ ID NO: 48; получаем из олигонуклеотида Е3 BCL11A или кшРНК1 (shRNA1) или Е3, описываемых в настоящем документе), CCTCCAGGCAGCTCAAAGATC, (SEQ ID NO: 49; получаемой из кшРНК2 (shRNA2) или В5, описываемых в настоящем документе), TCAGGACTAGGTGCAGAATGT (SEQ ID NO: 50; получаемой из кшРНК4 (shRNA4) или B11, описываемых в настоящем документе), TTCTCTTGCAACACGCACAGA (SEQ ID NO: 51; получаемой из олигонуклеотида D8 BCL11А или кшРНК3 (shRNA3) или D8, описываемых в настоящем документе), GATCGAGTGTTGAATAATGAT (SEQ ID NO: 52; получаемой из кшРНК5 (shRNA5) или 50D12 или D12, описываемых в настоящем документе), CAGTACCCTGGAGAAACACAT (SEQ ID NO: 53; получаемой из кшРНК5 (shRNA5) или 50A5, описываемых в настоящем документе), CACTGTCCACAGGAGAAGCCA (SEQ ID NO: 54; получаемой из кшРНК7 (shRNA7) или 50В11, описываемых в настоящем документе), ACAGTACCCTGGAGAAACACA (SEQ ID NO: 55; получаемой из XLC4 BCL11A, кшРНК8 (shRNA8) и 50С4, описываемых в настоящем документе), CAACAAGATGAAGAGCACCAA (SEQ ID NO: 56; получаемой из ненаправленных олигонуклеотидов BCL11A, описываемых в настоящем документе), gcgcCGCACAGAACACTCATG (SEQ ID NO: 57; получаемой из олигонуклеотида miR1G5, описываемого в настоящем документе), GCGCTCGGAGACTCCAGACAA (SEQ ID NO: 58; получаемой из E3G5 или модифицированного олигонуклеотида Е3 или кшРНK1мод (shRNA1mod), описываемых в настоящем документе), gcgcCCTCCAGGCAGCTCAAA (SEQ ID NO: 59; получаемой из B5G5 или кшРНК2 мод (shRNA2mod), описываемых в настоящем документе); gcgcTCAGGACTAGGTGCAGA (SEQ ID NO: 60; получаемой из B11G5 или кшРНК4 мод (shRNA4mod), описываемых в настоящем документе); gcgcGATCGAGTGTTGAATAA (SEQ ID NO: 61; получаемой из 50D12G5, D12G4 или кшРНК5 мод (shRNA5mod), описываемых в настоящем документе); gcgcCAGTACCCTGGAGAAAC (SEQ ID NO: 62; получаемой из 50A5G5 или кшРНК6мод (shRNA6mod), описываемых в настоящем документе); gcgcCACTGTCCACAGGAGAA (SEQ ID NO: 63; получаемой из 50B11G5 или кшРНК7 мод (shRNA7mod), описываемых в настоящем документе); GCGCTTCTCTTGCAACACGCA (SEQ ID NO: 64; получаемой из D8G5 BCL11A или модифицированного D8 или кшРНК3мод (shRNA3mod), описываемых в настоящем документе), GCGCACAGTACCCTGGAGAAA (SEQ ID NO: 65; получаемой из C4G5 BCL11A или модифицированного С4 или кшРНК8 мод (shRNA8mod), описываемых в настоящем документе), CGCACAGAACACTCATGGATT (SEQ ID NO: 66; получаемой из D12G5-2 BCL11A, описываемых в настоящем документе) и ACGCTCGCACAGAACACTCATGGATT (SEQ ID NO: 67; получаемой из D12G5-2 BCL11А, описываемых в настоящем документе).
[7] Синтетическая микроРНК к BCL11А по любому из пп. 1-6, где участок петли получают из микроРНК.
[8] Синтетическая микроРНК к BCL11A по п. 7, где микроРНК представляет собой специфичную в отношении системы гемопоэза микроРНК.
[9] Синтетическая микроРНК к BCL11A по п. 8, где микроРНК представляет собой мкР-223 (miR-223).
[10] Синтетическая микроРНК к BCL11A по п. 9, где участок петли представляет собой ctccatgtggtagag.
[11] Синтетическая микроРНК к BCL11А по любому из пп. 1-10, где микроРНК содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44.
[12] Способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает экспрессию у индивидуума in vivo по меньшей мере одной синтетической микроРНК к BCL11А по любому из пп. 1-11.
[13] Способ по п. 12, где экспрессия у индивидуума in vivo происходит в эмбриональной стволовой клетке, соматической стволовой клетке, клетке-предшественнике, клетке костного мозга, гемопоэтической стволовой клетке или гемопоэтической клетке-предшественнике.
[14] Способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает экспрессию по меньшей мере одной синтетической микроРНК к BCL11A по любому из пп. 1-11 в эмбриональных стволовых клетках, соматических стволовых клетках, клетках-предшественниках, клетках костного мозга, гемопоэтических стволовых клетках или гемопоэтических клетках-предшественниках индивидуума, где экспрессия происходит ex vivo, и имплантацию клеток индивидууму.
[15] Способ увеличения уровней фетального гемоглобина, экспрессируемого клеткой, включающий экспрессию в клетке по меньшей мере одной синтетической микроРНК к BCL11A по любому из пп. 1-11, где клетка представляет собой эмбриональную стволовую клетку, соматическую стволовую клетку, клетку-предшественника, клетку костного мозга, гемопоэтическую стволовую клетку или гемопоэтическую клетку-предшественника.
[16] Способ по любому из пп. 12-15, где по меньшей мере одна синтетическая микроРНК к BCL11A функционально связана с промотором и встроена в вектор для экспрессии в эукариотической клетке.
[17] Способ по любому из пп. 12-16, где по меньшей мере одна синтетическая микроРНК к BCL11А экспрессирована РНК-полимеразой II.
[18] Способ по любому из пп. 12-17, где по меньшей мере одна синтетическая микроРНК к BCL11А не экспрессирована РНК-полимеразой III.
[19] Способ по п. 18, где промотор выбран из группы, состоящей из промотора вируса некроза селезенки, индуцируемого тетрациклином промотора или контрольной области локуса β-глобина и промотора β-глобина.
[20] Способ по любому из пп. 16-19, где вектор представляет собой вирус.
[21] Способ по п. 20, где вирус представляет собой лентивирус.
[22] Способ по п. 21, где лентивирус выбран из группы, состоящей из: вируса иммунодефицита человека типа 1 (ВИЧ-1), вируса иммунодефицита человека типа 2 (ВИЧ-2), вируса артрита-энцефалита коз и овец (CAEV), вируса инфекционной анемии лошадей (EIAV), вируса иммунодефицита кошек (FIV), вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
[23] Выделенная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-10, 13-18 и 25-44.
[24] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 1.
[25] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 2.
[26] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 3.
[27] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 4.
[28] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 5.
[29] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 6.
[30] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 7.
[31] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 8.
[32] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 9.
[33] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 10.
[34] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 13.
[35] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 14.
[36] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 15.
[37] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 16.
[38] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 17.
[39] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 18.
[40] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 25.
[41] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 26.
[42] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 27.
[43] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 28.
[44] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 29.
[45] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 30.
[46] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 31.
[47] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 33.
[48] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 34.
[49] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 35.
[50] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 36.
[51] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 37.
[52] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 38.
[53] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 39.
[54] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 40.
[55] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 41.
[56] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 42.
[57] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 43.
[58] Выделенная молекула нуклеиновой кислоты по п. 23, где молекула содержит нуклеотидную последовательность SEQ ID NO: 44.
[59] Вектор, содержащий выделенную молекулу нуклеиновой кислоты по п. 23.
[60] Вектор по п. 59, где вектор дополнительно содержит промотор вируса некроза селезенки, индуцируемый тетрациклином промотор или контрольную область локуса β-глобина и промотор β-глобина.
[61] Клетка-хозяин, содержащая вектор по пп. 59 или 60.
[62] Клетка по п. 61, где клетка представляет собой эмбриональную стволовую клетку, соматическую стволовую клетку, клетку-предшественника, клетку костного мозга, гемопоэтическую стволовую клетку или гемопоэтическую клетку-предшественника.
[63] Клетка по п. 61, где клетка представляет собой эритроцит.
[64] Бактерия, содержащая выделенную молекулу нуклеиновой кислоты по п. 23.
[65] Вирус, содержащий выделенную молекулу нуклеиновой кислоты по п. 23.
[66] Вирус по п. 65, где вирус представляет собой лентивирус.
[67] Вирус по п. 66, где лентивирус выбран из группы, состоящей из: вируса иммунодефицита человека типа 1 (ВИЧ-1), вируса иммунодефицита человека типа 2 (ВИЧ-2), вируса артрита-энцефалита коз и овец (CAEV), вируса инфекционной анемии лошадей (EIAV), вируса иммунодефицита кошек (FIV), вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
[68] Композиция, содержащая выделенную молекулу нуклеиновой кислоты по любому из пп. 1-58, вектор по пп. 59 или 60, клетку-хозяина по любому из пп. 61-63 или вирус по любому из пп. 65-67.
[69] Композиция, содержащая вектор по пп. 59 или 60, клетку-хозяина по любому из пп. 61-63 или вирус по любому из пп. 65-67.
[70] Композиция по пп. 68 или 69, дополнительно содержащая фармацевтически приемлемый носитель или разбавитель.
[71] Композиция по любому из пп. 68-70 для применения для лечения или снижения риска развития гемоглобинопатии у индивидуума.
[72] Композиция по любому из пп. 68-70 для применения в производстве лекарственного средства для лечения или снижения риска развития гемоглобинопатии у индивидуума.
[73] Композиция по любому из пп. 68-70 для применения в увеличении уровней фетального гемоглобина, экспрессируемого клеткой.
[74] Композиция по п. 73, где клетка представляет собой эмбриональную стволовую клетку, соматическую стволовую клетку, клетку-предшественника, клетку костного мозга, гемопоэтическую стволовую клетку или гемопоэтическую клетку-предшественника.
[75] Способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает: введение индивидууму терапевтически эффективного количества выделенной молекулы нуклеиновой кислоты по любому из пп. 1-58, вектора по пп. 59 или 60, клеток-хозяев по любому из пп. 61-63, или вируса по любому из пп. 65-67 индивидууму, таким образом, обеспечивая лечение или снижение риска развития гемоглобинопатии у индивидуума.
[76] Способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает: введение индивидууму терапевтически эффективного количества композиции по любому из пп. 68-74 индивидууму, таким образом, обеспечивая лечение или снижение риска развития гемоглобинопатии у индивидуума.
[77] Способ лечения или снижения риска развития гемоглобинопатии у индивидуума, где способ включает увеличение у индивидуума уровней фетального гемоглобина, экспрессируемого клетками.
[78] Способ по любому из пп. 75-77, способ дополнительно включающий отбор индивидуума с гемоглобинопатией или с риском развития гемоглобинопатии.
[79] Способ по п. 78, где гемоглобинопатия представляет собой серповидноклеточную анемию или талассемию.
[80] Способ по любому из пп. 75-80, где способ дополнительно включает введение индивидууму лечебного средства, содержащего кислород, гидроксимочевину, фолиевую кислота или проведение переливания крови.
Далее изобретение описано в приводимых ниже примерах, которые не ограничивают объем изобретения, приведенного в формуле изобретения.
Примеры
Материалы и способы
Типичные условия реакции ПЦР являлись следующими: 1× реакционный буфер (состоит из MgCl2 при 1,5 мМ; 3,0 мМ; 4,5 мМ (конечная концентрация)); 0,2 мМ каждого из dATP, dCTP, dGTP и dTTP; 25 пмоль каждого праймера; 50 нг матричной ДНК; 3-10% (об./об.) DMSO для расплавления структуры (это необязательно) в общем объеме 100 мкл.
Приводимое ниже представляет собой типичные условия или установки реакции на термоциклере для реакции ПЦР: 94°C в течение 3-5 мин, в течение этого периода времени добавление 1 Ед ДНК-полимеразы или помещение реакционной смеси в лед, а затем помещение пробирок в устройство для ПЦР, когда температура доходит до 94°C; с последующими 25 циклами 94°C в течение 1 мин; 60°C в течение 1 мин и 70°C в течение 1 мин и окончание при 4°C до использования образцов ПЦР.
Пример 1
Получение синтетических мкР (miR)
Конструировали три различных синтетических мкР (miR), две из которых направлены к BCL11A в различных участках, а третья является ненаправленной, действуя в качестве контроля. Каждую из этих мкР (miR) встраивали в конститутивный экспрессирующий вектор, индуцируемый ТЕТ вектор и специфичный к эритроидным клеткам вектор.
мкР (miR) получали посредством отжига комплементарных олигонуклеотидов, содержащих на 5'-концах выступы из 4 пар оснований, соответствующих липкому концу, остающемуся после рестрикционного расщепления BbsI.
Олигонуклеотиды мкР1 (miR1) к BCL11А:
Смысловой
ACGCTCGCACAGAACACTCATGGATTctccatgtggtagagAATCCATGAGTGTTCTGTGCGAG (SEQ ID NO: 1)
Антисмысловой
CGCACTCGCACAGAACACTCATGGATTctctaccacatggagAATCCATGAGTGTTCTGTGCGA (SEQ ID NO: 2)
Олигонуклеотиды мкР2 (miR2) к BCL11A:
Смысловой
ACGCTCCAGAGGATGACGATTGTTTActccatgtggtagagTAAACAATCGTCATCCTCTGGag (SEQ ID NO: 3)
Антисмысловой
CGCActCCAGAGGATGACGATTGTTTActctaccacatggagTAAACAATCGTCATCCTCTGGa (SEQ ID NO: 4)
Ненаправленные олигонуклеотиды:
Смысловой
ACGCTCAACAAGATGAAGAGCACCAActccatgtggtagagTTGGTGCTCTTCATCTTGTTGAG (SEQ ID NO: 11)
Антисмысловой
CGCACTCAACAAGATGAAGAGCACCAActctaccacatggagTTGGTGCTCTTCATCTTGTTGA (SEQ ID NO: 12)
Пары олигонуклеотидов денатурировали, а затем повторно отжигали (как для кассеты олигонуклеотидов в протоколе ОЛ-ПЦР) с последующей очисткой кассеты с использованием микроцентрифужных концентрирующих устройств. В то же время, плазмиду O.6.pBKS (miR-223) расщепляли BbsI и очищали посредством запуска в агарозном геле (без обработки щелочной фосфатазой). Затем каждую олигонуклеотидную кассету лигировали в расщепленную конструкцию 0.6.pBKS и трансформировали в компетентные бактерии (Stbl3). Отбирали бактериальные клоны и проводили миниполучение с получением выделенных векторов. Синтетические мкР (miR) секвенировали с использованием праймеров miR-223 SEQ FOR и miR-223 SEQ REV с использованием DMSO для расплавления структуры.
miR-223 SEQ FOR TAAGCTTGATATCGAATTCC (SEQ ID NO: 19)
miR-223 SEQ REV GCTCTAGAACTAGTGGATCC (SEQ ID NO: 20)
Пример 2
Получение конститутивных векторов мкР (miR)
Каждую мкР (miR) клонировали в лентивирусный каркас LeGO-V2 так, что экспрессия Venus-мкР (miR) попадала под контроль конститутивного промотора SFFV.
Модификация кДНК Venus. кДНК Venus амплифицировали посредством ПЦР с добавлением участка рестрикции NaeI (а также сохранения хорошей консенсусной последовательности Козак) на 5'-конец и участка NotI на 3'-конец.
Venus Nael FOR: TTgccggcATGGTGAGCAAGGGCGAGG (SEQ ID NO: 21
Venus Notl REV: TAgcggccgcTTACTTGTACAGCTCGTCC (SEQ ID NO: 22)
Продукты ПЦР запускали на агарозном геле, а затем очищали. Очищенные продукты ПЦР подвергали ТА-клонированию в вектор pCR2.1-TOPO (Invitrogen™) с использованием набора для ТА-клонирования. Отбирали бактериальные клоны и подвергали миниполучению ДНК. С использованием анализа рестрикционным расщеплением выбирали клоны, которые а) содержат продукт ПЦР Venus (расщепление ЕсоRI) и b) содержат клон в ориентации, где добавленный участок NotI находится после участка NotI в полилинкере (т.е., так, что расщепление NotI не вырезает фрагмент ПЦР, но вместо этого только линеаризует вектор). Эти клоны секвенировали с использованием прямого и обратного праймеров М13.
Вставка последовательностей мкР (miR) в плазмиду Venus-pCR2.1-ТОРО. Плазмиду Venus-PCR2.1-TOPO расщепляли NotI, обрабатывали телячьей кишечной щелочной фосфатазой, затем запускали на агарозном геле и очищали. Синтетические конструкции мкР (miR) вырезали из плазмиды O.6.pBKS посредством двойного расщепления NotI и PspOMI с последующей очисткой посредством выделения из агарозного геля. Вырезанные вставки мкР (miR) лигировали в плазмиду Venus-pCR2.1-ТОРО и продукт лигирования использовали для трансформации компетентных бактерий (Stbl3). Отбирали отдельные бактериальные клоны и подвергали миниполучению. Выбирали плазмиды, которые содержат вставку мкР (miR) в правильной ориентации (т.е., обеспечивающие полный фрагмент при расщеплении NotI и NaeI).
Вставка кассеты Venus-мкР (miR) в LeGO-V2. Кассету Venus-мкР (miR) вырезали из pCR2.1-TOPO посредством двойного расщепления NotI и NaeI, с последующей обработкой большим фрагментом Кленова для получения тупого конца из липкого конца NotI. Эту кассету очищали посредством выделения из агарозного геля. LeGO-V2 или LeGO G2 расщепляли BamHI и EcoRI, что приводило к выделению кДНК Venus/eGFP. Этот линеаризованный вектор обрабатывали большим фрагментом Кленова для получения тупых концов из липких концов EcoRI и ВаmHI с последующей очисткой вектора посредством электрофореза в агарозном геле. Очищенную кассету Venus-мкР (miR) и вектор LeGO лигировали вместе и продукт использовали для трансформации компетентных бактерий. Отбирали отдельные бактериальные клоны и подвергали миниполучению ДНК. Клоны, которые содержат вставку в правильной ориентации, выбирали и выращивали и использовали для получения в большом масштабе с получением вирусного супернатанта.
Пример 3
Получение специфичных для эритроидных клеток векторов мкР (miR)
К кассетам Venus-мкР (miR), полученным, как описано выше, присоединяли сигнал полиаденилирования. Полученные кассеты Venus-мкР-ПолиА вставляли в антисмысловой ориентации в специфичный к эритроидным клеткам лентивирусный вектор pRRL-HS3-HS2-B-globin, предоставленный Guilianna Ferrari.
Модификация сигнала полиаденилирования BGH. Сигнал полиА BGH амплифицировали посредством ПЦР с получением участка рестрикции PspOMI рестрикции на 5'-конце и добавлением участков NaeI и NotI на 3'-конце.
BGHpA PspOMI FOR: CGCTCGAGCATGCATCTAGAGG (SEQ ID NO: 23)
BGHpA NaeI/NotI REV: TTgcggccgccggcCGCGCTTAATGCGCCGCTACAG (SEQ ID NO: 24)
Продукты ПЦР запускали на агарозном геле, а затем очищали. Очищенный продукт ПЦР подвергали ТА-клонированию в вектор pCR2.1-TOPO (Invitrogen™) с использованием набора для ТА-клонирования. Отбирали бактериальные клоны и подвергали миниполучению ДНК. С использованием анализа рестрикционным расщеплением выбирали клоны, которые содержат продукт ПЦР BGHpA (расщепление EcoRI и/или двойное расщепление NotI/PspOMI). Эти клоны секвенировали с использованием прямого и обратного праймеров М13.
Вставку последовательности BGHpA в плазмиды Venus-miR-pCR2.1-TOPO производили, как описано выше. Кассету BGHpA вырезали из pCR2.1-TOPO посредством расщепления PspOMI и NotI, после чего вставку очищали посредством выделения из агарозного геля. Конструкции Venus-miR-pCR2.1-TOPO, полученные на этапе В2 выше, расщепляли NotI, а затем обрабатывали телячьей кишечной щелочной фосфатазой. Линеаризованный вектор Venus-miR-pCR2.1-TOPO очищали, запуская на агарозном геле. Вставку BGHpA лигировали в вектор Venus-miR-pCR2.1-TOPO и продукт использовали для трансформации компетентных бактерий (Stbl3). Отбирали отдельные бактериальные клоны и подвергали миниполучению. Выбирали плазмиды, содержащие последовательность BGHpA, вставленную в правильной ориентации (обеспечивающей полную вставку после расщепления NaeI).
Вставка кассеты Venus-miR-BGHpA в вектор pRRL-HS3-HS2-B-globin. Кассеты Venus-miR-BGHpA вырезали из pCR2.1-TOPO посредством расщепления NaeI. Эти вставки очищали посредством электрофореза в агарозном геле. Вектор pRRL-HS3-HS2-B-globin расщепляли EcoRW и обрабатывали телячьей кишечной щелочной фосфатазой. Линеаризованный вектор очищали посредством электрофореза в агарозном геле. Кассеты Venus-miR-BGHpA лигировали в pRRL-HS3-HS2-B-globin и продукт лигирования использовали для трансформации компетентных бактерий. Отбирали отдельные бактериальные клоны и подвергали миниполучению. Плазмиды, содержащие кассеты Venus-miR-BGHpA в векторе pRRL-HS3-HS2-B-globin в правильной ориентации выращивали для получения в большом масштабе для того, чтобы их можно было использовать для получения супернатанта лентивирусных векторов.
Пример 4
Эксперименты по РНК-интерференции в клетках in vitro проводят, как указано ниже.
Клетки эритролейкоза мыши, выращиваемые в культуре в IMDM с ЭТС трансдуцировали на фибронектине SFFV-LV (NT = рандомизированная кшРНК, мкР (miR)-2 = направленная кшРНК) с MOI=2 и отсортировывали по флуоресценции Venus. Анализируемой временной точкой после трансдукции были сутки 7. Клетки были >95% положительными по Venus, и собирали 106 клеток и выделяли РНК, получали кДНК посредством обратной транскрипции и проводили кПЦР с детекцией в реальном времени на BCL11А и мРНК эпсилон-гамма-глобина с GAPDH в качестве транскрипта внутреннего контроля (фиг. 3). Для количественного определения экспрессии использовали способ с калибровочной кривой.
Эксперименты по РНК-интерференции у мышей in vivo проводят, как указано ниже.
Летально облученным мышам C57/BL6 после трансдукции на фибронектине SFFV-LV (NT = рандомизированная кшРНК, мкР (miR)-1=направленная кшРНК) трансплантировали полученные у доноров BojJ LSK HSC при MOI=2. Инъецируемая доза клеток составляла 100000 клеток на мышь. Несущих положительные по Venus WBC животных через 4 месяца объединяли (n=2) и клетки костного мозга после окрашивания витальным красителем отсортировывали по флуоресценции Venus (7-AAD) (фиг. 3). Выделение РНК и кПЦР проводили, как указано выше.
Пример 5
LCR-LV
Клетки эритролейкоза мыши, выращиваемые в культуре в IMDM с ЭТС трансдуцировали на фибронектине LCR-LV (NТ = рандомизированная кшРНК, мкР (miR)-1 = направленная кшРНК) при MOI=2 и МОI=100 и отсортировывали по флуоресценции Venus. Анализируемой временной точкой после трансдукции были сутки 7. Клетки были >95% положительными по Venus, и собирали 106 клеток и выделяли РНК, получали кДНК посредством обратной транскрипции и проводили кПЦР с детекцией в реальном времени на BCL11A и мРНК эпсилон-гамма-глобина с GAPDH в качестве транскрипта внутреннего контроля (фиг. 4). Для количественного определения экспрессии использовали способ с калибровочной кривой.
TET-LV
Клетки эритролейкоза мыши, выращиваемые в культуре в IMDM с ЭТС трансдуцировали на фибронектине TET-LV (NT = рандомизированная кшРНК, мкР (miR)-1 = направленная кшРНК) при MOI=2 и отсортировывали по флуоресценции Venus после воздействия доксициклина в различных концентрациях. Анализируемой временной точкой после трансдукции были сутки 7. Клетки были >95% положительными по Venus, и собирали 106 клеток и выделяли РНК, получали кДНК посредством обратной транскрипции и проводили кПЦР с детекцией в реальном времени на мРНК эпсилон-гамма-глобина с GAPDH в качестве транскрипта внутреннего контроля (фиг. 4). Для количественного определения экспрессии использовали способ с калибровочной кривой.
Пример 6
Происходящие из периферической крови пациента SCD циркулирующие CD34+-HSC фракционировали из отброшенного материала афереза (приблизительно 200 мл, 106 CD34+-клеток). Клетки трансдуцировали SFFV-LV (NT = рандомизированная кшРНК, мкР (miR)-1 = направленная кшРНК) при MOI=2 на фибронектине и дифференцировали модифицированным способом из Giarratana et al. (Nat. Biotech. 2005). У клеток посредством проточной цитометрии анализировали появление эритроидных поверхностных маркеров (GPA, CD71) по мере созревания. Эритроидные клетки последовательно приобретали морфологию эритробластов и эритроцитов и экспрессировали флуоресцентный Venus. Клетки собирали на конечной стадии дифференцировки и выделяли РНК и производили анализ кПЦР для определения индукции мРНК гамма-глобина посредством мкР (miR)-1 SFFV-IV по сравнению с рандомизированным (NT) контролем (фиг. 5).
Пример 7
Происходящие из периферической крови пациента SCD циркулирующие CD34+-HSC фракционировали из отброшенного материала афереза (приблизительно 200 мл, 106 CD34+-клеток). Клетки трансдуцировали LCR-LV (NT = рандомизированная кшРНК, мкР (miR)-1 = направленная кшРНК) при MOI=2 на фибронектине и инъецировали при 30000 клеток/животное сублетально облученным мышам NSG без предварительной сортировки. Через 4 недели после инъекции у животных забирали кровь и RBC фиксировали и пермеабилизировали. Проводили окрашивание на HbF и идентифицировали животное с LCR-LV-miR-1 с уровнями HbF человека 10% (фиг. 6).
Пример 8
Происходящие из пуповинной крови CD34+-HSC человека трансдуцировали на фибронектине SFFV-LV (NT = рандомизированная кшРНК, мкР (miR)-1 = направленная кшРНК) при MOI=2 и отсортировывали по флуоресценции Venus. Клетки также визуализировали посредством флуоресцентной микроскопии на стромальных клетках MS-5. Клетки дифференцировали по пути В-лимфопоэза модифицированными способами из Luo et al. (Blood 2009). У клеток раз в неделю анализировали появление поверхностных маркеров зрелых В-лимфоцитов и потерю маркеров незрелых предшественников для идентификации блока дифференцировки, вызываемого нокдауном BCL11A посредством SFFV-LV. Клетки собирали в еженедельных временных точках и выделяли РНК для проверки нокдауна мРНК BCL11А посредством направленного воздействия кшРНК посредством SFFV-LV-miR-1 (фиг. 7).
Пример 9
Оптимизация кшРНК, встроенных в микроРНК лентивирусных векторов под контролем РНК-полимеразы II, для улучшенного процессинга и эффективного нокдауна BCLI1A для индукции фетального гемоглобина в эритроидных клетках.
Технология РНК-интерференции (РНКи) с использованием короткошпилечных РНК (кшРНК), экспрессируемых под контролем промоторов pol III широко использовалась для модуляции экспрессия генов во множестве типов клеток млекопитающих. Для достижения специфичного для линий направленного воздействия на мРНК необходима экспрессия кшРНК посредством промоторов pol II, требующая встраивания кшРНК в последовательности микроРНК (кшРНКмкР) млекопитающих для экспрессии и процессинга. В настоящем примере для достижения нокдауна фактора транскрипции BCL11A в гемопоэтических клетках, что имеет прямое производное применение при гемоглобинопатиях, авторы сравнили эффективность модуляции мРНК посредством лентивирусных векторов под контролем pol III с лентивирусными векторами под контролем pol II. Репрессия белка BCL11A может представлять терапевтическую мишень при серповидноклеточной анемии и β-талассемии, так как показано, что его нокдаун индуцирует экспрессию ген фетального HBG (γ-глобина), в конечном итоге приводя к увеличению уровней тетрамера фетального гемоглобина (HbF, α2γ2). У мышей BCL11A является ключевым репрессором гена Hbb-y мыши, являющегося мышиным гомологом HBG. Авторы изобретения продемонстрировали сниженную в 100-1000 раз индукцию Hbb-y вследствие сниженной эффективности нокдауна BCL11A с использованием кшРНКмкР по сравнению с векторными каркасами с опосредуемыми pol III кшРНК. Для понимания молекулярных основ этих различий авторы изобретения провели в клетках, трансдуцированных несколькими парами кшРНК-кшРНКмкР, анализ последовательностей малых РНК. Авторы изобретения продемонстрировали, что кшРНК, экспрессируемые под контролем промотора U6 pol III, приводили к последовательностям направляющих цепей, которые по сравнению со зрелыми последовательностями направляющих цепей под контролем pol lI (кшРНКмкР) отличались сдвигом на 4 п.н. Секвенирование РНК продемонстрировало, что в векторном каркасе под контролем pol III происходит транскрипция участка из остатков уридина, составляющего часть сигнала терминации pol III, и его включение на 3'-конце зрелой кшРНК. Отсутствие этих дополнительных последовательностей ассоциировано с соответствующим сдвигом в участке расщепления Dicer, таким образом, формируя другую зрелую кшРНК с измененной затравочной последовательностью, что влияет на эффективность нокдауна гена-мишени в векторах под контролем pol II. Кроме того, в клетках, трансдуцированных векторами под контролем pol II или pol llI существенно отличается абсолютное содержание и соотношение направляющей и сопровождающей цепей. Осуществление в направляющей цепи кшРНКмкР сдвига в 4 п.н. приводило к правильно процессированной последовательности кшРНК (к зрелой последовательности направляющей цепи, идентичной кшРНК под контролем U6) и увеличенной эффективности нокдауна BCL11A на 50-70% на уровне белка и было ассоциировано с 100-300-кратным усилением индукции Hbb-y в клетках эритролейкоза мыши. Авторы изобретения выявили модифицированную стратегию для предполагаемых конструкций векторных каркасов кшРНКмкР для достижения специфичной для линий регуляции генов-мишеней.
Пример 10
Оптимизация встроенных в мкРНК кшРНК для специфичного для линий нокдауна BCL11A и индукции гемоглобина F.
Материалы и способы
Конструкция и скрининг кшРНК
Лентивирусные векторы под контролем промотора U6 (pol III-puro), экспрессирующие различные кшРНК, направленные к BCL11A/иРНК BCL11A получали из Broad Institute (Cambridge, MA), pol III-puro содержит селективный маркер пуромицина под контролем промотора hPGK. В клетках MEL в 96-луночном формате с использованием планшета Qiagen Turbocapture и с использованием мультиплексной реакции кОТ-ПЦР Taqman с определением GAPDH и Hbb-y подвергали скринингу более 100 кшРНК, направленных к обеим формам XL/L или только к форме XL и области 3'-UTR.
Получение конструкций кшРНКмкР
Векторы кшРНКмкР конструировали, клонируя последовательности кшРНК с фланкирующими последовательностями мкР (miR)-223 в лентивирусный вектор LeGO-V2, содержащий репортер Venus под контролем SFFV (28). Последовательности кшРНКмкР с петлей мкР (miR)-223 синтезировали в Genscript USA Inc. (NJ, USA) и полученные кшРНКмкР клонировали в каркас для pol II ниже кодирующей последовательности Venus с использованием участков Xba1 и BamH1. Все последовательности кшРНК перечислены на фиг. 21А. Конструировали последовательность кшРНК ненаправленного контроля и назвали SFFV-shRNAmiRNT или в сокращенной форме NT. В качестве имитирующего контроля использовали вектор SFFV-GFP, не содержащий кассеты кшРНК и экспрессирующий GFP под контролем промотора SFFV (33).
Получение и титрование вирусов
Супернатанты лентивирусных векторов получали посредством совместной трансфекции 10 мкг лентивирусных переносящих векторов, 10 мкг gag-pol, 5 мкг rev и 2 мкг пакующих плазмид VSVG в клетки НЕK293Т в чашку для культивирования диаметром 10 см с использованием реагента фосфата кальция (Invitrogen™). Супернатанты собирали через 24 час и 48 часов после трансфекции, фильтровали через 0,4-микронную мембрану (Corning®, NY, USA), а затем концентрировали посредством ультрацентрифугирования при 23000 об./мин. в течение 2 часов в центрифуге Beckmann XL-90 с использованием качающихся стаканов SW-28. Для определения титра клетки NIH 3Т3 инфицировали вирусом в присутствии полибрена (8 мкг/мл) и анализировали через 48 часов после трансдукции посредством FACS на экспрессию Venus (конструкции для pol II) или посредством отбора с пуромицином (1 мг/мл, конструкции для pol III).
Культура клеток
Клетки 3Т3, 293Т и MEL содержали в модифицированной Дульбекко среде Игла или в среде RPMI, дополненной 10% эмбриональной телячьей сывороткой, 2% пенициллином-стрептомицином и 2 мМ глутамином, соответственно.
Культура для эритроидной дифференцировки in vitro
Из мобилизованной периферической крови здоровых доноров (Center of Excellence in Molecular Hematology at Fred Hutchinson Cancer Research Center, Seattle or the Flow Core at Boston Children's Hospital) получали замороженные культуры первичных CD34+-клеток человека по протоколу, одобренному ВСН Institutional Review Board. Используемый протокол эритроидной дифференцировки основан на 3-этапном протоколе, адаптированном из (48). Клетки культивировали в среде для эритроидной дифференцировки (EDM) на основе IMDM (модифицированная Исков среда Дульбекко), (Cellgro®), дополненной стабилизированным глутамином, 330 мкг/мл холотрансферрина человека (Sigma®), 10 мкг/мл рекомбинантного инсулина человека (Sigma®), 2 МЕ/мл гепарина Choay (Sigma®) и плазма с инактивированными 5% растворителем/детергентом вирусами (S/D). В течение первого этапа наращивания (сутки 0-7), СD34+-клетки культивировали в EDM (среда для эритроидной дифференцировки) в присутствии 10-6 М гидрокортизона (НС) (Sigma®), 100 нг/мл SCF (R&D SYSTEMS™), 5 нг/мл IL-3 (R&D SYSTEMS™) и 3 МЕ/мл Еро (Amgen®). На сутки 4 клетки ресуспендировали в EDM, содержащей SCF, IL-3, Еро и НС. На втором этапе (сутки 7-11) клетки ресуспендировали в EDM, дополненной SCF и Еро. На третьем этапе (сутки 11-18) клетки культивировали в EDM, дополненной только Еро. Культуры поддерживали при 37°C в воздухе с 5% CO2.
Трансдукция и проточная цитометрия культуры in vitro
Клетки MEL и СD34+-клетки трансдуцировали лентивирусными векторами, экспрессирующими U6-кшРНК или SFFV-кшРНКмкР в присутствии полибрена (8 мкг/мл) (Sigma-Aldrich® Corp. St. Louis, MO, US) для клеток MEL и 10 мкМ простагландина Е2 и 2 мкг/мл полибрена для СD34+-клеток, и центрифугировали в течение два часов при (2000 об./мин.) при комнатной температуре. Живые клетки отсортировывали по экспрессии Venus (векторы для pol II) через 48 часов после трансдукция с использованием BD FACS Aria II (BD Biosciences®) или клетки выбирали в присутствии пуромицина (1 мг/мл, конструкции для pol III). Для анализа FACS в качестве маркера мертвых клеток добавляли 7AAD (Invitrogen™). CD34+-клетки метили конъюгированными с аллофикоцианином (АРС), фикоэритрином (РЕ) и PE-Cyanine7 антителами. Для фенотипирования использовали антитела к CD235 (гликофорин А)-РЕ, к CD71-APC или к CD71-PE-Cyanine7 и DRAQ-5 (все eBioscience®). Анализы проводили на проточном цитометре LSR-II (Becton Dickinson®) с использованием программного обеспечения Diva или FloJoX (Treestar™).
Выделение, трансдукция и проточная цитометрия для эксперименты по трансплантации мышам
Линейно-негативные клетки костного мозга мышь выделяли посредством промывки бедренной, болынеберцовой и тазовой костей мышей CD45.1 BoyJ (B6.SJL-Ptprca Pepcb/BoyJ) и CD45.2 В6 (C57BL/6J) с последующей линейным обеднением с использованием набора для обеднения линейных клеток мыши (Miltenyi, Biotec Inc., San Diego, USA). Клетки культивировали при плотности 0,2-1×106 клеток/мл в 100 нг/мл mSCF, 20 нг/мл mIL-3 (оба Peprotech®, Rocky Hill, USA), 100 нг/мл hFlt3-L и 100 нг/мл hTPO (оба Cellgenix®, Portsmouth, USA) в среде StemSpan™ SFEM (STEMCELL® Technologies, Vancouver, CA). Через предстимуляции в течение 24 часов клетки трансдуцировали при плотности 1×106 клеток/мл при MOI 40 и трансплантировали летально облученным (7+4 Гр, дробная доза) реципиентам через трое суток после выделения. Для экспериментов по конкурирующей репопуляции смешивали равные количества клеток из различных групп трансдукции с последующей трансплантацией CD45.2 или гетерозиготным CD45.1/CD45.2 двойным позитивным реципиентам (0,4-1×106 на животное). Смеси клеток анализировали посредством проточной цитометрии для подтверждения равных вкладов фракций конкурирующих клеток и при необходимости проводили повторную корректировку. Анализ периферической кровь, костного мозга и селезенки проводили в несколько моментов времени с использованием следующих антител: к CD45.1, CD45.2, В220, CD11b, CD3, CD71, Ter119 и фиксирующийся витальный краситель eFluor780®. Для анализа эритроидной линии лизис эритроцитов пропускали. Анализы проводили на проточных цитометрах LSR-II или LSRFortessa (Becton Dickinson®) и с программным обеспечением Diva или FloJoX (Treestar™). Анализ и статистическую обработку данных проводили с использованием Excel (Microsoft®) и Graphpad Prism® 5.
Для трансплантации hCD34+-клеток самок мышей NSG (NOD/LtSz-scid Il2rg-/-) (Jackson Laboratory, Bar Harbor, ME) в возрасте ≈10 недель облучали 2,7 Гр с последующей инъекцией ≈106 клеток на животное через трое суток после выделения. Облученных мышей кормили Baytril® с добавлением воды в течение 14 суток.
Выделение РНК и кОТ-ПЦР
Из клеток MEL через 7 суток после сортировки/после отбора с пуромицином или только что отсортированных клеток на сутки 18 эритроидной дифференцировки из СD34+-клеток выделяли тотальную РНК с использованием микронабора Qiagen® RNA Plus (Valencia, СА). Получали кДНК с использованием случайных гексамерных праймеров и Superscript III (Invitrogen™, Carlsbad, СА). Проводили количественную ПЦР с использованием готовой смеси для ПЦР SYBR® Green (Applied Biosystems®, Warrington UK) с захватывающими интроны праймерами для Hbb-y и GAPDH мыши (прямой праймер для Hbb-y 5'-TGGCCTGTGGAGTAAGGTCAA-3', обратный праймер 5'-GAAGCAGAGGACAAGTTCCCA-3' (SEQ ID NO: 69)), (прямой праймер для GAPDH 5'-TCACCACCATGGAGAAGGC-3' (SEQ ID NO: 70), обратный праймер 5'-GCTAAGCAGTTGGTGGTGCА-3' (SEQ ID NO: 71)) и праймерами для HBG, НВВ и GAPDH человека (прямой праймер для HBG 5'-TGGATGАТСТСAAGGGCАС-3' (SEQ ID NO: 72), обратный праймер 5'-ТСAGTGGTATCTGGAGGАСА-3' (SEQ ID NO: 73)) (прямой праймер для НВВ 5'-CTGAGGAGAAGTCTGCCGTTA-3' (SEQ ID NO: 74), обратный праймер 5'-AGCАТСAGGAGTGGACAGAT-3' (SEQ ID NO: 75)) и прямой праймер для GAPDH 5'-АСССAGAAGACTGTGGATGG-3' (SEQ ID NO: 76), обратный праймер 5'-ТТСAGCTCAGGGATGАССТТ-3' (SEQ ID NO: 77)). Условия амплификации ПЦР составляли: 95°C в течение 10 мин, с последующими 40 циклами по 15 сек при 95°C и 1 мин при 60°C. кПЦР проводили на устройстве ABI® 7500 (Applied Biosystems®, Foster City, СА). Для точного определения эффективности амплификации для каждой реакции использовали стандартную кривую с использованием серийных разведений кДНК. Уровни экспрессии Hbb-y и γ-глобина нормализовали по GAPDH в качестве внутреннего контроля, и относительную экспрессию генов (способ ΔΔCt) использовали для анализа данных ПЦР, включая коррекцию на различную эффективность амплификации.
Анализ "нозерн"-блот
Клетки MEL, трансдуцированные U6-кшРНК и SFFV-кшРНКмкР после селективного культивирования с пуромицином в течение 7 суток отсортировывали и собирали. Выделяли тотальную РНК с использованием 1 мл реагента TRIzol® (Ambion®) и 15 мкг растворяли в 15% акриламидном геле. Маленькие размеры транскриптов определяли с использованием лестничного маркера Decade (Ambion®, Austin, TX). РНК переносили на мембрану Hybond™-XL (Amersham™, Piscataway, NJ) и сшивали УФ. Блоты подвергали предгибридизации с использованием UltraHyb-Oligo (Ambion®, Austin, Тх) при 35°C, гибридизовали с меченными γ-32Р-олигонуклеотидами (полинуклеотидкиназа Т4; Amersham™, Piscataway, NJ) при 37°C в течение одного часа, отмывали в 2× цитрат натрия, 0,1% додецилсульфате натрия при 30-35°C и экспонировали на пленку. Последовательности зондов для детекции зрелой мкРНК являлись следующими: кшРНК1, 5' CGGAGACTCCAGACAATCGC 3' (SEQ ID NO: 78); кшРНК2, 5' CTCCAGGCAGCTCAAAGATC 3' (SEQ ID NO:79); кшРНК3, 5' TCTCTTGCAACACGCACAGA 3' (SEQ ID NO: 80); кшРНК4, 5' CAGGACTAGGTGCAGAATGT 3' (SEQ ID NO: 81); кшРНК5, 5' ATCGAGTGTTGAATAATGAT 3' (SEQ ID NO: 82); кшРНК6, 5' GTACCCTGGAGAAACACAT 3' (SEQ ID NO: 83); кшРНК7, 5' ACTGTCCACAGGAGAAGCCA 3' (SEQ ID NO: 84); кшРНК8, 5' CAGTACCCTGGAGAAACACA 3' (SEQ ID NO: 85).
Анализ "вестерн"-блоттинга
Трансдуцированные клетки MEL и СD34+-клетки лизировали в буфере для лизиса (RIPА) с протеазой (Roche®) и ингибиторами фосфатазы (Santa Cruz Biotechnolgy®), пепстатином и лейпептином (Sigma). Белковые лизаты оценивали посредством анализа белков ВСА (Thermo Scientific). 25 мкг белка суспендировали в 2× буфера для образцов Лэммли, кипятили и наносили на 8% SDS-полиакриламидный гель и затем переносили на поливинилиденфторидную (PVDF) мембрану (Millipore®). После блокирования в PBS с 0,1% Triton-X100 и 5% обезжиренным сухим молоком мембрану PVDF инкубировали с моноклональным антителом к BCL11A мыши (Abeam®) или антителом к β-актину мыши (Sigma®). Для детекции посредством хемилюминесцентного 20× реагента LumiGLO® и 20× пероксида (Cell signaling®) использовали связанное с HRP вторичное антитело к IgG мыши (Клеточн сигнализация®) использовали for detection by хемилюминесценция 20Х LumiGLO® Реагент и 20Х пероксид (Cell signaling®).
Анализ ВЭЖХ
на сутки 18 дифференцировки из клеток получали гемолизаты с использованием осмотического лизиса в воде и трех быстрых циклов замораживания-оттаивания. С использованием лизатов в клинических лабораториях Brigham and Women's Hospital проводили электрофорез гемоглобина на ацетате целлюлозы и высокоэффективную жидкостную хроматографию (ВЭЖХ) с использованием клинически-калиброванных стандартов для разновидностей гемоглобина человека.
Секвенирование и анализ РНК
Малые РНК выделяли из 6×106 клеток MEL с использованием набора для выделения мкРНК mirVana (Invitrogen™) по инструкциям производителя и передавали для глубокого секвенирования РНК с использованием Illumina® Hiseq2000. Для удаления адаптерных последовательностей использовали самостоятельно разработанный скрипт PERL и для дальнейшего анализа использовали малые РНК длиной 19-25 н. Для выравнивания использовали программное обеспечение Bowtie (полученное в интернет на веб-сайта по адресу bowtie-bio.sourceforge.net) и допускали 1 несоответствие. Для сравнения различных образцов уровень экспрессии малых РНК нормализовали на миллион общих считываний каждой библиотеки. Для эксперимента с 250 кшРНК TRC в 4 линиях клеток в Broad Institute получали лентивирус с использованием протокола высокопроизводительного получения вирусов и клетки инфицировали при высоких MOI с одной кшРНК на лунку в 96-луночных планшетах (протоколы получены в интернет на веб-сайте Broad Institute at Cambridge, MA, USA, в разделе общедоступных ресурсов по РНКи под заголовком "пуромицин") добавляли на 1 сутки после инфицирования и клетки на 4 сутки после инфицирования лизировали в Trizol®. Все лизаты для каждой линии клеток объединяли с последующим выделением тотальной РНК и получением библиотеки малых РНК (49). Считывания Illumina® сокращали, приводя к уникальным считываниям (>17 н.) с количествами и картируя на последовательности экспрессирующих векторов кшРНК TRC, не допуская несоответствий. Перед усреднением по всем кшРНК для каждой кшРНК рассчитывали распределение зрелых последовательностей кшРНК.
Статистический анализ
Для статистического анализа использовали пакет программного обеспечения GraphPad Prism® 5.0. Результаты выражены как среднее±стандартное отклонение (SD). Статистическую значимость оценивали посредством t-критерия.
Результаты
Сниженная эффективность нокдауна BCL11A посредством кшРНК, встроенных в каркас микроРНК (кшРНКмкР), по сравнению с простой кшРНК стебель-петля
Для идентификации кшРНК-кандидатов, опосредующих эффективный нокдаун BCL11A в клетках MEL проводили скрининг лентивирусной библиотеки из 118 кшРНК, направленных к кодирующим последовательностям мРНК BCL11A, консервативным у людей и мышей. кшРНК экспрессировали с промотора pol III U6 (фиг. 19А, левая панель) в лентивирусном каркасе LKO (26), содержащем ген устойчивости к пуромицину для отбора указанных LKO-U6-BCL11А-кшРНКмкР (далее U6-кшРНК). Клетки MEL, широко используемой линии клеток для исследования регуляции глобиновых генов, трансдуцировали лентивирусными векторами, экспрессирующими кшРНК с множественностью заражения (MOI) 2. Косвенным индикатором нокдауна BCL11A является нормализованная экспрессия мРНК эмбрионального Hbb-y мыши, который служит в качестве функционального гомолога гена γ-глобина человека (27) (фиг. 19В, ось y). В качестве второго индикатора также подвергали скринингу пул кшРНК с использованием линии репортерных клеток MEL, несущих нокин mCherry в локусе Hbb-y (D. Bauer, неопубликовано). Индукцию флуоресцентного репортера анализировали посредством проточной цитометрии (фиг. 19В, ось x). Восемь кшРНК (отмеченных и обозначенных как кшРНК1-8 на фиг. 19В), которые систематически индуцировали Hbb-y и экспрессию репортера mCherry в клетках MEL, клонировали во фланкирующие последовательности и последовательность петли микро-РНК223 человека (мкР (miR)-223) с получением синтетических микро-РНК (кшРНКмкР) с целью разработки специфичных для линий экспрессирующих векторов для нокдауна BCL11A. Для начального анализа эту кассету вставляли в лентивирусный вектор pLeGO (28) (фиг. 19А, правая панель) в 3'-нетранслируемую область флуоресцентного репортера Venus под контролем сильного и повсеместно экспрессируемого промотора/энхансера вируса некроза селезенки (SFFV), названный LEGO-SFFV-BCL11А-кшРНКмкР (далее SFFV-кшРНКмкР).
Эффективность нокдауна кшРНК, содержащих одинаковые соответствующие мишени последовательности длиной 21 основание, сравнивали напрямую, но в условиях экспрессирующих кассет для pol III и pol II (т.е. U6-кшPHK и SFFV-кшРНКмкР.) в клетках MEL с использованием ненаправленной (NT) кшРНК в качестве отрицательного контроля. Белок BCL11A детектировали посредством иммуноблота в клеточных лизатах клеток MEL, трансдуцированных с MOI 2 (фиг. 19С). Нокдаун BCL11A в клетках, экспрессирующих SFFV-кшРНКмкР, был регулярно менее эффективным по сравнению с U6-кшPHK (фиг. 19С). Для подтверждения функциональной значимости этого различия авторы изобретения определяли уровни индукцию мРНК Hbb-y посредством кОТ-ПЦР (фиг. 19D) в гомогенных популяциях трансдуцированных клеток, полученных посредством отбора с пуромицином или посредством активируемой флуоресценцией сортировки клеток (FACS). Сниженная эффективность нокдауна SFFV-кшРНКмкР по сравнению с U6-кшРНК (см. фиг. 19С) преобразовывалась в значимо меньшую индукцию Hbb-у посредством SFFV-кшРНКмкР (фиг. 19D) и различия в индукции Hbb-у выглядели более выраженными, чем различия нокдауна BCL11А.
SFFV-кшРНКмкР и U6-кшРНК приводят к образованию различных зрелых последовательностей направляющих цепей
Для понимания молекулярной основы этих различий проводили секвенирование малых РНК из клеток, трансдуцированных различными U6-кшРНК и их соответствующими аналогами SFFV-кшРНКмкР. Предполагалось, что значимые отличия индукции Hbb-у являлись результатом продукции различных зрелых направляющих цепей из различных содержащих кшРНК транскриптов, которые продуцировались в случаях pol II и pol III. Таким образом, проводили оценку процессированных последовательностей направляющих цепей в случаях U6-кшPHK и SFFV-кшРНКмкР (фиг. 20А и В). Выявленные в наибольшем количестве зрелые направляющие РНК, продуцируемые с SFFV-кшРНКмкР, близко соответствовали теоретически рассчитанной in silico зрелой последовательности (фиг. 20В). В отличие от этого большинство из U6-кшРНК приводили к образованию зрелых последовательностей направляющих цепей, которые соответствовали теоретически рассчитанным продуктам Dicer, состоящим из ≈22 н. с 3'-конца транскрипта pol III, включая участок из 3-5 н., получаемый из сигнала терминации pol III, но с отсутствием соответствующего количества нуклеотидов соответствующей мишени последовательности на 5'-конце. Сходное распределение процессированных продуктов наблюдали при крупномасштабном скрининге 247 различных U6-кшPHK в линиях клеток А549, MCF7, Jurkat и U937, в которых преобладающая последовательность направляющей цепи имела среднюю длину 22 н. с 5'-концом, начиная за 4 основания от константной последовательности петли. Проводили глубокое секвенирование 247 продуктов процессированных в этих четырех линиях клеток кшРНК TRC (фиг. 25). Результаты демонстрируют, что преобладающая зрелая направляющая цепь начинается в положении 4 антисмысловой последовательности кшРНК и содержит четыре 3'-концевых остатка U. Процессинг для разных линий клеток и для разных последовательностей кшРНК в основном совпадал. Средняя частота считываний для каждой зрелой последовательности имеет равный вес для кшРНК, хотя для определенных кшРНК поучали >1000 раз больше считываний, чем для других. Полуколичественный характер секвенирования малых РНК вследствие сильных систематических ошибок РНК-лигазы при получении библиотеки делает сравнения уровней относительной экспрессии или процессинга невозможными, но устойчивый тренд в линиях клеток и кшРНК демонстрирует возможные особенности преобладающей направляющей цепи. Также регистрировали считывания смысловых цепей (в среднем <30% на кшРНК), где абсолютное большинство начиналось с "GG" и продолжалось 20 н. последовательности смысловой цепи. Эти зрелые последовательности точно соответствовали продукту Dicer первичного транскрипта hU6 кшРНК без необходимости включения этапа обработки Drosha/DCGR8. Взятые вместе эти результаты указывают на то, что при переносе последовательностей кшРНК между векторами важно рассматривать события процессинга, которые формируют зрелые последовательности из транскриптов кшРНКмкР pol II и кшРНК pol III. Очень сходные распределения зрелых последовательностей, наблюдаемые для изучаемых четырех типов клеток, позволяют предполагать, что эти закономерности процессинга являются общими в случае различных клеток. Различия зрелых последовательностей направляющих цепей, получаемых посредством векторов под контролем pol III и pol II вносят значительный вклад в различное снижение экспрессии BCL11A, наблюдаемое для U6-кшРНК и SFFV-кшРНКмкР. Эти данные позволяют теоретически рассчитать возможные преобразования между векторами под контролем pol III и pol II, принимая во внимание расщепление Drosha и Dicer кшРНК после pol II в сравнении с расщеплением Dicer кшРНК после pol III.
Модификация последовательностей кшРНК в векторе под контролем pol II приводит к увеличенной эффективности нокдауна
На основе этих результатов авторы изобретения предположили, что использование теоретически рассчитанных зрелых последовательностей из векторов кшРНК для pol III при переносе последовательностей в SFFV-кшРНКмкР может приводить к увеличенной эффективности нокдауна. Таким образом, был сконструирован ряд SFFV-кшРНКмкР, с 4-нуклеотидным сдвигом на 5'-конце последовательности направляющей цепи (фиг. 21А). На 3'-конце добавляли нуклеотиды GCGC для достижения большей термодинамической стабильности 3'-конца в дуплексе миРНК, что может способствовать предпочтительной загрузке в RISC намеченной направляющей цепи. Действие модификаций на эффективность нокдауна и индукцию Hbb-y оценивали в клетках MEL посредством иммуноблота и кОТ-ПЦР, соответственно. Для SFFV-кшРНКмкР1, 3 и 8 наблюдали увеличенную эффективность нокдауна белка BCL11A (фиг. 21В). Усиленный нокдаун коррелировал с увеличенной индукцией транскриптов Hbb-y в 200-400 раз (фиг. 21С). Другие SFFV-кшРНКмкР не продемонстрировали ощутимого увеличения эффективности нокдауна. Для более полного понимания механизма, лежащего в основе увеличенной эффективности модифицированных SFFV-кшРНКмкР 1, 3 и 8 посредством "нозерн"-блота анализировали количество направляющих и сопровождающих цепей малых РНК и их соотношения. Во-первых, во всех случаях у векторов для pol III наблюдали большее количество направляющих цепей по сравнению с векторами для pol II. Кроме того, особенно для модифицированных SFFV-кшРНКмкР 1 и 3, выявлено большее количество и большие соотношения направляющих и сопровождающих цепей по сравнению с немодифицированными кшРНКмкР, хотя для SFFV-кшPHK8 эти параметры не изменялись (фиг. 21D). Для оценки влияния модификаций на последовательности направляющих цепей и для определения их корреляции с изменениями, наблюдаемыми для нокдауна BCL11A, проводили глубокое секвенирование малых РНК. Как правило, поученные процессированные последовательности отражали проведенный сдвиг в 4 н., образуя в результате направляющие цепи с затравочными областями, сходными с последовательностями, получаемыми из кшРНК pol III, экспрессируемыми в каркасе LKO. Для SFFV-кшРНКмкР 1, 3 и 8 найдена основная последовательность, которая отличается от менее эффективных SFFV-кшРНКмкР, которые продемонстрировали более широкое распределение последовательностей.
Действие модификаций кшРНКмкР на нокдаун BCL11A и индукцию γ-глобина в первичных полученных из CD34+-клеток эритроидных клеток человека
Реактивация фетального глобина нокдауном BCL11А обладает терапевтическим потенциалом для лечения серповидноклеточной анемии и β-талассемии. Для оценки действия модифицированных SFFV-кшРНКмкР на эффективность нокдауна BCL11A и индукцию γ-глобина и экспрессию HbF в первичных клетках человека CD34+-HSPC мобилизованной G-CSF периферической крови (mРВ) здоровых добровольцев трансдуцировали векторами, экспрессирующими U6-кшРНК, SFFV-кшРНКмкР и модифицированные SFFV-кшРНКмкР, а затем подвергали эритроидной дифференцировке. Через одиннадцать суток в культуре определяли уровни BCL11A посредством вестерн-блоттинга (фиг. 22А). В соответствии с этими результатами для клеток MEL наблюдали усиленный нокдаун модифицированными SFFV-кшРНКмкР 1, 3 и 8, который также приводил к увеличенной индукции транскриптов γ-глобина (фиг. 22В). Состояние эритроидной дифференцировки оценивали на сутки 18 культивирования посредством проточного цитометрического анализа на поверхностную экспрессию CD71 и GpA и энуклеацию. Значимых отличий между трансдуцированными SFFV-кшРНКмкР и контрольным вектором образцами не наблюдали (фиг. 22С). В отличие от этого U6-кшPHK приводили к незначительной задержке появлению маркеров дифференцировки на поздних этапах созревания, что может указывать на токсичность вследствие опосредованной промотором U6 сверхэкспрессии кшРНК. Наблюдения высокой индукции мРНК γ-глобина подтверждали по увеличенному количеству белка HbF, определяемому посредством высокоэффективной жидкостной хроматографии (ВЭЖХ). Все три тестируемых модифицированных кшРНКмкР по сравнению с немодифицированными SFFV-кшРНКмкР обеспечивали повышенный выход HbF (фиг. 22D), где 40-50% общего гемоглобина в эритроидных клетках составлял HbF. Корреляция между мРНК γ-глобина и белком HbF была высокой (r2=0,96), свидетельствуя о надежности анализов (фиг. 22Е).
В итоге авторы изобретения продемонстрировали, что кшРНК, встроенные в каркас мкРНК и экспрессируемые под контролем промоторов pol II, подвергаются процессингу с получением в трансдуцированных клетках отличающихся зрелых миРНК по сравнению с миРНК, экспрессируемыми под контролем промотора U6. Соответствующая мишени последовательность в зрелой кшРНК, получаемой из конструкции с промотором pol III, на 3'-конце однотипно смещена на 3-5 н. и это отличие ассоциировано со значимыми отличиями в эффективности нокдауна транскрипта мишени. В случае BCL11A, потенциальной терапевтической мишени, это приводило к значительным различиям в реактивации экспрессии γ-глобина. Эти данные демонстрируют важность оптимизации конструкции при переносе последовательностей кшРНК в каркас микроРНК для обеспечения опосредуемой pol II экспрессии.
Повсеместный нокдаун BCL11A в гемопоэтических стволовых клетках и клетках-предшественниках (HSPC) нарушает восстановление гемопоэтических клеток и может быть преодолен экспрессией направленной кшРНКмкР в эритроидных клетках
Влияние экспрессии SFFV-кшРНКмкР in vivo оценивали в модели трансдукции и трансплантации HSPC на мышах. Линейно-негативные (lin-) HSPC из костного мозга мышей β-YAC, экспрессирующие клеточный поверхностный маркер CD45.2, трансдуцировали ex vivo векторами SFFV-кшРНКмкР или ненаправленным вектором (SFFV-shRNAmiRNT) и трансплантировали летально облученным мышам-реципиентам BoyJ с CD45.1. Контрольной группе трансплантировали нетрансдуцированные клетки. Мыши β-YAC несут локус β-глобина человека в виде трансгена, который в ходе онтогенеза подвержен регуляции в организме мыши, демонстрируя различную экспрессию генов фетального глобина и β-глобина взрослых. С целью подтверждения и для лучшего сравнения с ранее опубликованными данными использовали хорошо описанные кшРНК (23, 27, 29) (называемые в настоящем документе кшРНКмкР*), встроенные во фланкирующие последовательности мкРНК (miRNA)223. Через 4, 8 и 12 недель после трансплантации определяли приживление донорских клеток на основе химеризма CD45.1 и CD45.2 (фиг. 23А). Приживление донорских клеток соответствовало ожидаемому профилю почти с полным приживлением в периферической крови (РВ) и костном мозге (ВМ) через 8 недель. Однако неожиданно фракция геномодифицированных клеток через определенное время скачкообразно снижалась (фиг. 23В). Несмотря на исходные доли трансдукции с использованием вектора для нокдауна BCL11A ≈40%, маркирование генов на неделе 12 составляло только 2-3% от общих полученных от донора СD45-клеток. Сверхэкспрессия SFFV-shRNAmiRNT также была ассоциирована со сниженным приживлением геномодифицированных клеток, но в меньшей степени, что указывало на специфичную для последовательности и неспецифичную токсичность в пересаженных клетках HSPC. Временные характеристики потери донорских клеток, экспрессирующих кшРНК, позволял предполагать действие на компартмент более примитивных гемопоэтических стволовых клеток.
Для дальнейшего исследования негативного влияния на восстановление гемопоэтических клеток проводили количественные эксперименты по конкурирующей репопуляции (фиг. 23C-23F). Линейно-негативные клетки животных-доноров с CD45.1 (BoyJ) и CD45.2 (Вl\6) трансдуцировали различными векторами, экспрессирующими SFFV-кшРНКмкР против BCL11A, shRNAmiRNT или только репортер синий флуоресцентный белок (BFP) под контролем повсеместно экспрессируемого промотора SFFV (SFFV-BFP). Клетки трансплантировали конгенным животным с CD45.1/CD45.2, обеспечивая идентификацию обеих донорских популяций и клеток реципиентов. В экспериментах, в которых использовали вектор SFFV-BFP, донорские клетки с CD45.1 трансплантировали животным с CD45.2 и популяции трансдуцированных донорских клеток идентифицировали и сравнивали на основе флуоресценции. Перед трансплантацией смешивали равные количества клеток двух популяций трансдуцированных конкурирующими векторами. Конечное соотношение геномодифицированных клеток, получаемых с использованием обоих векторов, в трансплантированной популяции анализировали проточной цитометрией, которая подтверждала сравнимые доли трансдукции в диапазоне 55-70% (фиг. 22С). Вклад геномодифицированных клеток у подвергаемых трансплантации животных оценивали в периферической крови, костном мозге и селезенке через 4, 8 и 12 недель после трансплантации (фиг. 23D) и для этого анализа учитывали незначительные отличия в соотношении вводимых трансдуцированных клеток. Во всех случаях и в каждый момент времени клетки, трансдуцированные NT или вектором SFFV-BFP, количественно превосходили клетки, трансдуцированные векторами, направленными к BCL11А, что указывает на селективное негативное воздействие при нокдауне BCL11А. Значимых отличий в восстановлении гемопоэтических клеток по сравнению с соотношением исходно трансплантируемых популяций при конкуренции двух направленных к BCL11A векторов не наблюдали. В соответствии с результатами, представленными на фиг. 23 В, сверхэкспрессия shRNAmiRNT также негативно влияла на восстановление гемопоэтических клеток, так как эта группа количественно проигрывала клеткам, трансдуцированным вектором, экспрессирующим только SFFV-BFP и не экспрессирующим кшРНК. Авторы изобретения провели более подробный анализ В-лимфоцитов и компартмента более примитивных HSC в трансдуцированной фракции клеток костного мозга (фиг. 23Е). Как и ожидалось на основе предшествующих исследований, продемонстрировавших отсутствие В-клеток у BCL11A-/- мышей (30, 31) количества положительных по В220 В-клеток после нокдауна BCL11А было значимо снижено. Несмотря на то, что значимости достигнуто не было, существовала тенденция в отношении потери более примитивных клеток lin-, Sca-1+, C-kit+ (LSK), которые включают компартмент приживляемых HSC.
Специфичный в отношении эритроидных клеток нокдаун BCL11A потенциально может преодолеть неблагоприятное воздействие нокдауна BCL11A на HSC и В-клетки, сохраняя терапевтический эффект индукции γ-глобина в эритроидных клетках. Для осуществления селективного для эритроидных клеток нокдауна получали лентивирусный вектор, в котором кассету кшРНКмкР и флуоресцентный репортер Venus экспрессированы под контролем минимального проксимального промотора β-глобина, связанного с гиперчувствительными участками 2 и 3 (HS2 и HS3) контрольной области локуса β-глобина (LCR) (32) (фиг. 23F), названный LV-LCR-BCL11A-кшРНКмкР (далее LCR-кшРНКмкР). Профиль экспрессии репортерного трансгена Venus в популяциях трансплантируемых in vivo гемопоэтических клеток сначала оценивали у мышей, которым трансплантировали трансдуцированные HSPC (фиг. 23G и фиг.26). На фиг. 26 линейно-негативные клетки трансдуцировали с использованием вектора LCR-кшРНКмкР и трансплантировали летально облученным мышам-реципиентам. Через двенадцать недель идентифицировали донорские клетки и различные типы гемопоэтических клеток с использованием поверхностных маркеров. В этом примере представлена характерная схема пропускания и гистограммы, демонстрирующие экспрессию Venus в различных линиях. Количества на гистограммах указывают процентное содержание на них положительные по Venus клеток и средние интенсивности флуоресценции (MFI). Экспрессия трансгена подвергалась сильной регуляции с отсутствием детектируемой экспрессии во фракциях клеток LSK и В-клеток, очень низкими уровнями экспрессии в Т-клетках и низкими уровнями экспрессии в миелоидных клетках у некоторых животных. В отличие от этого экспрессия трансгена при эритроидной дифференцировке была сильно активирована, начиная с СВ71+/Ter119+-клеток, представляющих предшественников эритроцитов и проэритробластов, и достигая пика на стадии двойных позитивных CD71+/Ter119+-клеток, представляющих базофильные эритробласты. В течение конечных этапов эритроидного созревания большая фракция CD71-/Ter119+-клеток, представляющих ретикулоциты и зрелые эритроциты, экспрессировала репортер со сходным по сравнению с CD71+/Ter119+-клетками процентным содержанием.
Далее, для определения возможности преодоления посредством использования вектора LCR дефекта восстановления, наблюдаемого при повсеместной сверхэкспрессии SFFV-кшРНКмкР, проводили эксперимент по конкурирующей трансплантации с использованием LCR-кшРНКмкР и SFFV-кшРНКмкР (фиг. 23Н). Так как вектор LCR транскрипционно неактивен в lin--клетках, аликвоту клеток для использования при трансплантации подвергали эритроидной дифференцировке in vitro и определяли соотношение клеток Venus+ в транскрипционно пермиссивной популяции CD71+/Ter119+ и использовали для нормализации соотношения трансдуцированных SFFV и LCR клеток. Экспрессию Venus у подвергаемых трансплантации животных сравнивали в эритроидных клетках, так как только эта популяция являлась равно пермиссивной для экспрессии с обоих векторов. Восстановление у подвергаемых трансплантации мышей демонстрировала явное преобладание клеток, получаемых из HSP, трансдуцированных вектором LCR, свидетельствуя о меньшей токсичности в HSPC, ассоциированных со специфичной для эритроидной линии экспрессией LCR-кшРНКмкР (фиг. 23Н). В итоге, эти данные демонстрируют, что неблагоприятное воздействие нокдауна BCL11A на приживление/функцию HSC можно преодолеть экспрессией специфичной для эритроидных клеток мкРНК.
Опосредуемый вектором LCR специфичный для эритроидных клеток нокдаун BCL11A с использованием модифицированных кшРНКмкР обеспечивает высокие уровни HbF в эритроидных клетках человека
Для тестирования эффективности опосредуемого LCR специфичного для эритроидных клеток нокдауна BCL11А в экспериментальной системе для исследования человека СD34+-клетки трансдуцировали векторами LCR-кшРНКмкР, содержащими модифицированные кшРНКмкР 3 или 8 (фиг. 23F). Авторы изобретения сначала сравнивали профиль экспрессии нескольких векторов LCR-кшРНКмкР (LCR-кшРНК*, LCR-кшРНКмкР 3 и 8) в клетках человека при эритроидной дифференцировке CD34+-клеток mРВ человека in vitro. Экспрессию Venus посредством векторов LCR и контрольного вектора под контролем SFFV без кассеты кшРНКмкР (SFFV-GFP) (33) оценивали на различных этапах эритроидного созревания, как определяют по окрашиванию на CD71 и GpA (фиг. 23I). В соответствии с результатами для клеток мышей, приведенными на фиг. 23G, в незрелых эритроидных клетках CD71-/GpA- наблюдали низкие уровни экспрессии. Наблюдали сильную активацию экспрессии в одинарно положительных CD71+ клетках с наибольшим уровнем экспрессии трансгена в более зрелых двойных положительных клетках CD71+/GpA+. Как и ожидалось, контрольный SFFV-GFP приводил к высоким уровням конститутивной экспрессии во всех субпопуляциях. В соответствии с ранее описанным протоколом дифференцировки уровни белка BCL11A измеряли на сутки 11 культивирования и сравнивали с ненаправленным и имитирующим контрольными векторами (LCR-shRNAmiRNT и SFFV-GFP). В клетках, экспрессирующих модифицированные кшРНКмкР, наблюдали значимое снижение BCL11A по сравнению с клетками, экспрессирующими ненаправленный (NT) и контрольный вектор (SEW) (фиг. 24А). мРНК гамма-глобина в клетках, получаемых из СD34+-клеток, трансдуцированных векторами, экспрессирующими кшРНКмкР3 и 8, составляла 40 и 70% от общих β-подобных глобинов, соответственно (фиг. 24В). Отличий клеточного роста у клеток, трансдуцированных векторами LCR-кшРНКмкР или контрольными векторами, не наблюдали. Эритроидная дифференцировка, как оценивали по поверхностной экспрессии CD71, GpA и посредством энуклеации, не отличалась от контроля (фиг. 24С), свидетельствуя об отсутствии влияния нокдауна BCL11A на специфичную для линий экспрессию кшРНКмкР к BCL11A. Наблюдали сильную корреляцию между уровнями мРНК γ-глобина (кОТ-ПЦР) и HbF, как оценивали посредством ВЭЖХ (фиг. 24D). HbF в клетках, трансдуцированных LCR-кшРНКмкР3 и LCR-кшhPHKмкP8, составлял до 35% и 55% от общего гемоглобина, представляя уровни, сравнимые с опосредуемой промотором SFFV экспрессией (фиг. 22D и фиг. 24Е). В заключение, для демонстрации доказательства того, что опосредуемый LCR-кшРНКмкР нокдаун обеспечивает эффективное приживление hCD34+-клеток и индукцию γ-глобина, проводили трансплантацию полученных из костного мозга CD34+-HSPC, трансдуцированных векторами LCR-кшРНКмкР3 или NT, сублетально облученным мышам NSG. Вследствие плохого развития эритроидных клеток человека в этой модели ксенотрансплантата, CD34+-HSPC выделяли из костного мозга подвергнутых трансплантации животных через 14 недель после трансплантация и подвергали эритроидной дифференцировке in vitro. Клетки Venus+ обогащали посредством FACS и определяли экспрессию γ- и β-глобина посредством ОТ-ПЦР (фиг. 24F). В соответствии с предшествующими данными фракция γ-глобина от общего выхода локуса β-глобина составляла 44,9%±5,5% для клеток, трансдуцированных LCR-кшРНКмкР3, по сравнению с ≈9%±0,5% в двух контрольных группах, состоящих из нетрансдуцированных или трансдуцированных LCR-shRNAmiRNT клеток.
кшРНК широко использовали для анализа функций генов в биологических исследованиях, и существует возрастающий интерес относительно использования РНКи с терапевтическими целями. BCL11A представляет собой привлекательную терапевтическую мишень для модуляции на основе РНКи. BCL11А представляет собой репрессор экспрессии γ-глобина и, таким образом, действует в качестве основного регулятора переключения с фетального гемоглобина на гемоглобин взрослых в эритроидных клетках. Важно, что высокие уровни фетального гемоглобина ассоциированы с более мягкими фенотипами заболевания при серповидноклеточной анемии (SCD) и β-талассемии и специфичный для линий нокаут BCL11A подтвержден как терапевтическая стратегия в моделях SCD. В приводимых в настоящем документе исследованиях целью авторов изобретения была разработка клинически применимого вектора для реактивации экспрессии фетального гемоглобина посредством опосредуемой РНКи супрессии BCL11А. Используя оптимизированный лентивирусный вектор, содержащий адаптированные к мкРНК кшРНК (кшРНКмкР), экспрессируемые под контролем специфичного для эритроидных линий промотора pol II, авторы изобретения достигали уровней HbF >50% от общего гемоглобина в первичных эритроидных клетках, получаемых из трансдуцированных CD34+-HSPC. Этот уровень индукции HbF вероятно является клинически эффективным и выигрывает в сравнении с ранее опубликованными векторами (23, 27, 29), использующими экспрессирующие кассеты под контролем pol III, у которых отсутствует специфичность для линий и показатели безопасности лентивирусных векторов SIN, описываемые в настоящем документе.
Лечение SCD можно проводить трансплантацией гемопоэтических стволовых клеток (HSCT). Благоприятные исходы при SCD в большой степени зависят от доступности подобранных доноров-сибсов. Менее 10% пациентов с SCD имеют здоровых совпадающих по HLA потенциальных доноров-сибсов (34). Генотерапия гемоглобинопатии обеспечивает явное преимущество в устранении риска GVHD вследствие использования аутологичных клеток. Долгосрочной целью исследований авторов изобретения является модуляция переключения гемоглобина, приводящая к эндогенной и физиологической индукции защитного HbF и супрессии серповидноклеточного глобина. Авторы изобретения предполагают, что эта двойная манипуляция с экспрессией является наиболее эффективным терапевтическим подходом для предотвращения токсичности при SCD, включая гемолиз и повреждения конечных органов мутантным полимеризованным гемоглобином. Для осуществления цели положительного терапевтического действия необходимо обеспечить достаточные нокдаун BCL11A и индукцию HbF в клетке и для уменьшения фенотипа заболевания необходимо трансплантировать достаточное количеством геномодифицированных долгоживущих HSC для обеспечения химеризма компартмента эритроцитов. Таким образом, как показано в настоящем документе, для долговременного успеха генотерапии при SCD оптимизация нокдауна BCL11A и сохранение способности трансдуцированных HSCP к восстановлению являются критичными. В отношении второго пункта, авторы изобретения полагают, что это в настоящее время является достижимым, так как предшествующие данные по аллогенным трансплантатам, приведшие к смешанному химеризму, продемонстрировали, что всего лишь 10% химеризма миелоидного компартмента ассоциированы с химеризмом эритроцитов в периферической крови 80-100% (35). Смещение массы эритроцитов после приживления вероятнее всего обусловлено улучшенным выживанием нормальных эритроцитов по сравнению с серповидными клетками. Этот уровень маркировки долгоживущих миелоидных клеток был недавно достигнут при исследованиях у человека с использованием лентивирусного вектора (36-38), включая βе-талассемию (39).
кшРНК под контролем Pol III являются наиболее часто используемыми векторными системами для проведения нокдауна генов посредством РНКи, но эти векторы опосредуют повсеместную экспрессия, которая может быть ассоциирована с неспецифичной токсичностью вследствие высоких уровней экспрессии и специфичной для последовательности токсичностью в определенных типах клеток. В настоящем документе авторы изобретения демонстрируют, что нокдаун BCL11A в HSC ухудшает приживление этих клеток в условиях трансплантации и развитие В-клеток in vivo. Хотя сниженное приживление в отсутствие BCL11A является неопубликованным феноменом, данные, приводимые в настоящем документе соответствуют известной экспрессии BCL11А в ранних HSPC и публикации о сниженном в два раза содержании HSC у мышей после генетической делеции BCL11A (31, 40, 41). Негативное влияние нокдауна BCL11А на приживление HSC может быть более очевидным в приводимых в настоящем документе анализах вследствие увеличенного селективного давления, существующего в этих экспериментальных условиях. Как правило, после культивирования ex vivo присутствуют ограниченные количества HSC и трансдукция этих клеток и конкуренция с контрольными HSC, используемыми в анализах по настоящему документу, может усилить детекцию токсичности на уровне HSC. В эритроидной линия BCL11A является необязательным (24). В данных, предоставляемых в настоящем документе, использование специфичного к эритроидным клеткам вектора LCR, содержащего регуляторные последовательности, получаем из локуса β-глобина (32, 42) преодолевает негативное влияние нокдауна BCL11A на приживление HSC. Вектор LCR продемонстрировал высокую степень специфичности в отношении линии при экспрессии кшРНКмкР, направленных к BCL11A. Кроме того, при использовании для экспрессии других трансгенов показано, что строение этого вектора снижает риск трансактивации соседних генов клетки (43), важная характеристика для перехода к клиническому применению. Таким образом, транскрипционная направленность кшРНКмкР в случае BCL11A представляется решающей, подчеркивая важность развития эффективных векторов для нокдауна под контролем pol II. Этот подход преодолевает негативное влияние нокдауна BCL11A на HSPC, а также развитие лимфоидных клеток (30, 31), избегает токсичности, связанной со сверхэкспрессией кшРНК (9, 11, 19) и улучшает показатель безопасности векторной системы, сохраняя терапевтическую эффективность.
Использование для экспрессии кшРНК промоторов pol II требует встраивания кшРНК в последовательности микроРНК. Так как большинство из ранее подтвержденных эффективных последовательностей кшРНК получают на основе анализов, проводимых с использованием промоторов pol III и большинство из коммерчески доступных систем нокдауна основано на промоторах pol III, конверсия последовательностей кшРНК в конфигурацию pol II является важной. Несмотря на серьезные исследования в этой области, руководства по конверсии последовательностей кшРНК, получаемых из эффективных векторов под контролем pol III в векторы кшРНКмкР под контролем pol II отсутствуют. В настоящем изобретении посредством сравнения результатов процессинга РНК в клетках, параллельно трансдуцированных обоими типами векторов, авторы изобретения подтвердили, что по отношению к соответствующей последовательности-мишени получают различные продукты малых РНК, что приводит к существенно меньшей эффективности направленного нокдауна посредством векторов под контролем pol II. Зрелые последовательности направляющих цепей, продуцируемые в системах под контролем pol II и pol III, содержащие идентичные соответствующие мРНК-мишени последовательности, как правило, сдвинуты относительно друг друга на 3-5 н. Добавление 3-5 остатков U из сигнала терминации pol III на 3'-конце транскрипта кшРНК приводит к соответствующему сдвигу участка расщепления Dicer, доказывая главенствующую роль правила отсчета с 3'-конца для расщепления Dicer (44, 45). Сдвиг направляющей цепи в pol III по сравнению с pol II обладает большим влиянием на эффективность нокдауна, так как изменяется затравочная область и изменяются термодинамические свойства и характеристики концевых нуклеотидов дуплексов малых РНК, таким образом влияя на встраивание направляющей цепи в эффекторный комплекс RISC (4, 5, 46, 47). Изменение конструкции кшРНКмкР с воспроизведением зрелых последовательностей направляющих цепей, получаемых посредством кшРНК под контролем pol III приводило к усилению процессинга и улучшенному нокдауну мРНК-мишени. Этот подход следует применять для разработки направленных к другим генам векторов с использованием промоторов pol II, включая другие специфичные для линий экспрессирующие кассеты.
В итоге, данные демонстрируют важные характеристики процессинга РНК, относящиеся к использованию кшРНК в случаях различных векторов, а также предоставляют стратегию специфичного для линий нокдаун генов, которая преодолевает неблагоприятные последствия повсеместной экспрессии. Результаты имеют важные последствия для конструирования встроенных в микроРНК кшРНК и их применения в подходах к генотерапии на основе РНКи.
Пример 11
Исследования эффективности трансдукции кшРНКмкР к BCL11A в CD34+-клетки здорового человека-донора.
Репрессор транскрипции BCL11A является терапевтической мишенью для лечения β-гемоглобинопатий. Селективная супрессия BCL11A в эритроидных клетках посредством экспрессируемых под контролем промотора pol II адаптированных к микроРНК кшРНК (кшРНКмкР) приводит к эффективному нокдауну BCL11A в клетках мыши и человека. Экспрессия модифицированных кшРНКмкР специфичным для эритроидных клеток образом преодолевает неблагоприятные воздействия на приживление HSC и развитие В-клеток мыши (см. пример 10 выше) и приводит к эффективному нокдауну BCL11А и высоким уровням HbF в первичных получаемых из CD34+ эритроидных клетках человека и в эритроидных клетках человека, дифференцируемых in vitro, после полного приживления модифицированных CD34+-клеток в ксенотрансплантатах мышей. Авторы изобретения также продемонстрировали эффективную индукцию HbF в эритроидных клетках, получаемых из трансдуцированных СD34+-клетках, получаемых у донора с серповидноклеточной анемией.
В ряде экспериментов эксперименты мобилизованные G-CSF СD34+-клетки здоровых доноров трансдуцировали вектором, экспрессирующим ненаправленные кшРНК (LCR-H.) или BMS11-D12G5, и подвергали эритроидной дифференцировке in vitro.
кшРНК к BCL11A D12G5-2: смысловая ACGCTCGCACAGAACACTCATGGATTctccatgtggtagagAATCCATGAGTGTTCTGTGCGAG (SEQ ID NO: 43)
Антисмысловая
CGCACTCGCACAGAACACTCATGGATTctctaccacatggagAATCCATGAGTGTTCTGTGCGA (SEQ ID NO: 44)
Фиг. 27A представляет собой вестерн-блоттинг дифференцированных in vitro эритроидных клеток, получаемых из трансдуцированных СD34+-клеток, демонстрирующий изоформы BCL11A (L и XL) и β-актин в качестве контроля нагрузки и демонстрирующий эффективный нокдаун BCL11A XL. На фиг. 27В представлено количественное определение нокдауна BCL11A в эритроидных клетках. Данные получают на основе вестерн-блоттингов, как представлено на фиг. 27А. Данные обобщают три независимых эксперимента с использованием клеток одного донора, (величины ошибок: SD)
На фиг. 27С представлена индукция гамма-глобина в эритроидных клетках, как определяли посредством ОТ-кПЦР, и гемоглобина (HbF), оценивая посредством ВЭЖХ.
Пример 12
Количественное определение нокдауна BCL11A в эритроидных клетках.
Исследовали приживление трансдуцированных CD34+-клетки у мышей NSG с иммунодефицитом, включая эффективность нокдауна экспрессии BCL11A in vivo. CD34+-клетки человека трансдуцировали LCR-H или BMS11-D8G5 и инъецировали сублетально облученным мыши-реципиентам NSG. Через 14 недель выделяли CD34+-клетки костного мозга и подвергали эритроидной дифференцировке in vitro. На фиг. 28 представлена индукция гамма-глобина в эритроидных клетках, как определяли посредством ОТ-кПЦР.
Пример 13
Нокдаун BCL11A и индукция фетального гемоглобина в эритроидных клетках, получаемых из трансдуцированных CD34+-клеток у пациента с серповидноклеточной анемией.
CD34+-клетки костного мозга выделяли у пациента с SCD, проходившего лечение в HU и с высоким исходным HBF. Клетки трансдуцировали LCR-H или LCR-D12G5 и подвергали эритроидной дифференцировке in vitro.
Исследовали нокдаун BCL11A в клетках пациента с серповидноклеточной анемией. CD34+-клетки костного мозга выделяли у пациента с серповидноклеточной анемией и клетки трансдуцировали LCR-H или LCR-D12G5-2 (в качестве дополнительного контроля использовали нетрансдуцированные клетки) и подвергали эритроидной дифференцировке in vitro. На фиг. 29А представлены вестерн-блоттинги, демонстрирующие BCL11A (L и XL изоформы) и β-актин в качестве контроля нагрузки и демонстрирующие эффективный нокдаун BLC11A-XL. Каждая панель (отмеченные 1-6 ниже дорожки) представляет независимый эксперимент с использованием клеток одного донора. На фиг. 29В представлено количественное определение нокдауна BCL11A в эритроидных клетках. Данные получают на основе вестерн-блоттингов, приведенных на фиг. 29А. На фиг. 29С представлена конечная индукция HF, определяемая ВЭЖХ. Этот пациент проходил лечение гидроксимочевиной, что служит основой для высокого исходного уровня Hb F.
Пример 14
Вариант осуществления протокола лечения
Начальная оценка
Пациентов подвергали стандартному для аутологичной трансплантации костного мозга клиническому обследованию в соответствии с инструкциями учреждения, а затем проводили получение двух образцов костного мозга с промежутком минимум 4 недели, который использовали в качестве резервного трансплантата костного мозга (минимум 2×106 СВ34+-клеток/кг) и для получения аутологичного костного мозга для переноса генов (с мишенью в количестве 5×106 СD34+-клеток/кг с минимумом 4×106 CD34+-клеток/кг).
Получение резервного аутологичного трансплантата
Перед лечением у пациента получали гемопоэтические клетки, чтобы они служили для процедуры восстановления ("резервный трансплантат") при отсутствии наблюдаемого восстановления гемопоэтических клеток через 6 недель после инъекции клеток, подвергнутых генетическим манипуляциям, или при неудовлетворении подвергнутыми манипуляциям клетками критериям выделения. Костный мозг (до 20 см3/кг) получали у пациента с общей анестезией из задней части гребня подвздошной кости на обеих сторонах посредством нескольких пункций минимум за 4 недели до генотерапии. Порцию костного мозга, содержащую 2×106 CD34+-клеток/кг замораживали и хранили без манипуляций в парах жидкого азота (162°C и -180°C) в соответствии со стандартными клиническими процедурами для забора аутологичного костного мозга с получением резервного трансплантата. Из оставшейся части собранного образца отбирали СD34+-клетки (описано ниже) и использовали для генной модификации (описано ниже).
Получение образцов костного мозга
Оставшуюся часть после первого получения образца костного мозга свыше необходимого резервного трансплантата костного мозга вместе с полученным вторым образцом костного мозга использовали для переноса генов. Второе получение производили не ранее чем через 4 недели после первого получения (описанного выше). Для второго получения костный мозг снова получали у пациента с общей анестезией из задней части гребня подвздошной кости на обеих сторонах посредством нескольких пункций. Количество получаемого мозга составляет до 20 мл/кг массы тела. Это обеспечивает общее количество ядросодержащих клеток более ≈4×108 клеток/кг. В свою очередь после отбора CD34+-клеток это обеспечивает дозу CD34+-клеток более 4×106 клеток/кг.
Индивидуумы у кого рассчитанное количество CD34+-клеток после двух получений составляет <4×106 клеток/кг кондиционирования не проводят. После периода по меньшей мере 6 недель, если индивидуум хотел остаться в исследовании, у него снова можно было проводить получение. Если индивидуум не хотел проходить получение, его отстраняли от исследования.
Индивидуумы, отстраненные от исследования перед введением трансдуцированных CD34+-клеток, получали нормальный клинический уход (симптоматическая терапия и/или аллогенные HSCT). Оценку эффективности и безопасности начиная с момента отстранения больше не проводили и данные в базу данные не собирали.
Выделение, предстимуляция и трансдукция CD34+-клеток
Очистка CD34+-клеток.
Для обеспечения достаточного времени для выведения кондиционирующего средства и для минимизации времени предстимуляции и культивирования, весь костный мозг хранили в течение ночи. Все этапы производства проводили в Connell & O'Reilly Families Cell Manipulation Core Facility при DFCI. В костном мозге проводили истощение эритроцитов посредством центрифугирования в градиенте плотности. Проводили позитивный отбор CD34+-клеток из мононуклеарных клеток костного мозга с использованием реагента и устройства CliniMACS. Получали образцы для контроля качества (QC) для оценки чистоты и стерильности. Очищенные клетки немедленно обрабатывали с целью предстимуляции и трансдукции.
Предстимуляция и трансдукция CD34+-клеток
Трансдукцию проводили в одном или обоих образцах. Клетки свыше резервного трансплантата после первого получения трансдуцировали и замораживали для дальнейшего использования. Образец после второго получения полностью использовали для переноса генов и в трансдуцированный продукт второго образца добавляли оттаявшие трансдуцированные клетки из первого образца после кондиционирования.
Очищенные CD34+-клетки высевают в закрытые культуральные пакеты при плотности 0,5-1×106/мл в среду, не содержащую сыворотки, дополненную факторами роста (IL-3, SCF, FLT3L, ТРО) и помещают в инкубатор при 37°C, 5% CO2. Через 24-30 часов клетки собирают и подсчитывают. Дополнительное тестирование для QC включает анализ жизнеспособности клеток и колониеобразующих единиц (КОЕ). Клетки переносят в новый культуральный пакет и обрабатывают лентивирусным супернатантом. В течение этого первого раунда трансдукции клетки инкубируют в течение 18-24 часов. Затем клетки собирают, подсчитывают и переносят в новый пакет, с лентивирусным супернатантом для второго раунда трансдукции.
Последний сбор и формулирование
После второго раунда трансдукции клетки собирают, отмывают в PlasmaLyte и ресуспендируют в их конечном составе (PLASMALYTE, 1% HSA) в объеме 50-100 мл. Все клетки, доступные после удаления образцов QC вливали пациенту. QC включал анализ количества клеток, жизнеспособности клеток, стерильности клеток при отмывке супернатанта, микоплазмы, эндотоксина в супернатанте, фенотипа, КОЕ, RCL (полученные и сохраненные образцы), анализ вставки и среднего количества копий вектора посредством кПЦР (культивируемые клетки). Непосредственно перед доставкой пациенту из продукта получают образец для окраски по Граму.
Тестирование перед обратным вливанием индивидууму
Образцы получали в течение и в конце процедуры подсчета клеток и анализа жизнеспособности (исключение трипанового синего или эквивалента), стерильности, микоплазмы, эффективности трансдукции (количества копий вектора), окрашивания по Граму, эндотоксина и тестирования RCL. Из них перед вливанием были доступны только определение жизнеспособности клеток, стерильности (в процессе, 72 часа), окрашивание по Граму и определение эндотоксинов.
Если в микробиологических культурах выявляли транзиторную бактериальную контаминацию, посредством окрашивания по Граму или позитивного культивирования через 72 часа, персонал центральной лаборатории обработки клеток контактировал с руководителем исследования, помощником главного врача и лечащим врачом для решения о том, проводить ли инфузию резервного трансплантата или инфузию продукта с добавлением антибиотика. Если вливали резервный трансплантат индивидуума исключали из протокола. Если жизнеспособность клеток составляла <70%, тест на стерильность был положительным или эндотоксин составлял >5 МЕ/кг/час, клетки не возвращали, проводили инфузию резервного трансплантата и индивидуума исключали из протокола.
Если количество жизнеспособных клеток после двух получений/трансдукций составляло более или равно 4×106 СD34+-клеток/кг в конце трансдукции, проводили вливание клеток. Если количество жизнеспособных клеток после двух получений/трансдукций составляло менее 4×106 CD34+-клеток/кг в конце трансдукции, вливания клеток не проводили и проводили вливание резервного трансплантата через 48 часов.
Режим кондиционирования индивидуума
У индивидуумов проводили миелоаблятивное кондиционирование бусульфаном (≈4 мг/кг внутривенно каждые сутки, с коррекцией на массу (вводимые в течение 3 часов раз в сутки), проводимое на сутки от -4 до -2 до вливания трансдуцированных клеток. Кондиционирование проводили совместно с очисткой и трансдукцией клеток костного мозга. Уровни бусульфана отображали на графика все 3 суток введения, и уровни на сутки 1 и 2 использовали для корректировки площади под кривой мишени.
Вливание трансдуцированных клеток
Клетки вливали внутривенно в течение 30-45 минут после стандартной предварительной гидратации и премедикации в соответствии со стандартными руководствами Boston Children's Hospital Hematopoietic Stem Cell Transplantation Unit. Этот стандарт требует, чтобы у пациента непрерывно проводился кардиомониторинг, мониторинг дыхания и контроль насыщения кислородом на всем протяжении вливание и в течение 30 минут после него. Перед трансфузией, 15 минут при трансфузии, каждый час в течение вливания и в конце трансфузии определяли и записывали основные жизненные показатели. Медицинская сестра оставалась с пациентом в течение первых 5 минут трансфузии. Если вводили два продукта трансдукции, второй трансдуцированный product вводили после первого без задержки.
Следует понимать, что хотя изобретение описано в отношении его подробного описания, указанное выше описание предназначено для иллюстрации, а не ограничения объема изобретения, которое определено областью прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в объеме приводимой далее формулы изобретения.
Ссылки
1. Lee, Y. et al., The nuclear RNase III Drosha initiates microRNA processing. Nature 425, 415-419 (2003).
2. Ha, M. and Kim, V.N., Regulation of microRNA biogenesis. Nature reviews. Molecular cell biology 15, 509-524 (2014).
3. Winter, J. et al., Many roads to maturity: microRNA biogenesis pathways and their regulation. Nature cell biology 11, 228-234 (2009).
4. Khvorova, A. et al., Functional siRNAs and miRNAs exhibit strand bias. Cell 115, 209-216 (2003).
5. Schwarz, D. S. et al., Asymmetry in the assembly of the RNAi enzyme complex. Cell 115, 199-208 (2003).
6. Lai, E.C., Micro RNAs are complementary to 3' UTR sequence motifs that mediate negative post-transcriptional regulation. Nature genetics 30, 363-364 (2002).
7. Lewis, B. P. et al., Prediction of mammalian microRNA targets. Cell 115, 787-798 (2003).
8. Park, J.E. et al., Dicer recognizes the 5' end of RNA for efficient and accurate processing. Nature 475, 201-205 (2011).
9. Grimm, D. et al., Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature 441, 537-541 (2006).
10. McBride, J.L. et al., Artificial miRNAs mitigate shRNA-mediated toxicity in the brain: implications for the therapeutic development of RNAi. Proc. Natl. Acad. Sci. USA 105, 5868-5873 (2008).
11. Khan, A.A. et al., Transfection of small RNAs globally perturbs gene regulation by endogenous microRNAs. Nat Biotechnol 27, 549-555 (2009).
12. Yi, R. et al., Overexpression of exportin 5 enhances RNA interference mediated by short hairpin RNAs and microRNAs. RNA 11, 220-226 (2005).
13. Borner, K. et al., Robust RNAi enhancement via human Argonaute-2 overexpression from plasmids, viral vectors and cell lines. Nucleic Acids Res 41, e199 (2013).
14. Grimm, D. et al., Argonaute proteins are key determinants of RNAi efficacy, toxicity, and persistence in the adult mouse liver. The Journal of clinical investigation 120, 3106-3119 (2010).
15. Diederichs, S. and Haber, D.A., Dual role for argonautes in microRNA processing and posttranscriptional regulation of microRNA expression. Cell 131, 1097-1108 (2007).
16. Persengiev, S.P. et al., Nonspecific, concentration-dependent stimulation and repression of mammalian gene expression by small interfering RNAs (siRNAs). RNA 10, 12-18 (2004).
17. Fish, R.J. and Kruithof, E.K., Short-term cytotoxic effects and long-term instability of RNAi delivered using lentiviral vectors. BMC Mol Biol 5, 9 (2004).
18. Jackson, A.L. and Linsley, P.S., Recognizing and avoiding siRNA off-target effects for target identification and therapeutic application. Nat Rev Drug Discov 9, 57-67 (2010).
19. Martin, J.N. et al., Lethal toxicity caused by expression of shRNA in the mouse striatum: implications for therapeutic design. Gene Ther 18, 666-673 (2011).
20. Zeng, Y. et al., Both natural and designed micro RNAs can inhibit the expression of cognate mRNAs when expressed in human cells. Molecular cell 9, 1327-1333 (2002).
21. Fellmann, C. et al., An optimized microRNA backbone for effective single-copy RNAi. Cell Rep 5, 1704-1713 (2013).
22. Amendola, M. et al., Regulated and multiple miRNA and siRNA delivery into primary cells by a lentiviral platform. Mol Ther 17, 1039-1052 (2009).
23. Sankaran, V.G. et al., Human fetal hemoglobin expression is regulated by the developmental stage-specific repressor BCL11A. Science (New York, N.Y 322, 1839-1842 (2008).
24. Xu, J. et al., Correction of sickle cell disease in adult mice by interference with fetal hemoglobin silencing. Science 334, 993-996 (2011).
25. Cullen, B.R., Derivation and function of small interfering RNAs and microRNAs. Virus Res 102, 3-9(2004).
26. Moffat, J. et al., A lentiviral RNAi library for human and mouse genes applied to an arrayed viral high-content screen. Cell 124, 1283-1298 (2006).
27. Xu, J. et al., Transcriptional silencing of {gamma}-globin by BCL11A involves long-range interactions and cooperation with SOX6. Genes Dev 24, 783-798 (2010).
28. Weber, K. et al., Lentiviral gene ontology (LeGO) vectors equipped with novel drug-selectable fluorescent proteins: new building blocks for cell marking and multi-gene analysis. Gene Ther 17, 511-520 (2010).
29. Wilber, A. et al., Therapeutic levels of fetal hemoglobin in erythroid progeny of beta-thalassemic CD34+cells after lentiviral vector-mediated gene transfer. Blood 117, 2817-2826 (2011).
30. Liu, P. et al., BCL11A is essential for normal lymphoid development. Nat Immunol 4, 525-532 (2003).
31. Yu, Y. et al., BCL11A is essential for lymphoid development and negatively regulates p53. J Exp Med 209, 2467-2483 (2012).
32. Miccio, A. et al., In vivo selection of genetically modified erythroblastic progenitors leads to long-term correction of beta-thalassemia. Proceedings of the National Academy of Sciences of the United States of America 105, 10547-10552 (2008).
33. Demaison, C. et al., High-level transduction and gene expression in hematopoietic repopulating cells using a human immunodeficiency [correction of imunodeficiency] virus type 1-based lentiviral vector containing an internal spleen focus forming virus promoter. Hum Gene Ther 13, 803-813 (2002).
34. Hansbury, E.N. et al., Bone marrow transplant options and preferences in a sickle cell anemia cohort on chronic transfusions. Pediatr Blood Cancer 58, 611-615 (2012).
35. Andreani, M. et al., Quantitatively different red cell/nucleated cell chimerism in patients with long-term, persistent hematopoietic mixed chimerism after bone marrow transplantation for thalassemia major or sickle cell disease. Haematologica 96, 128-133 (2011).
36. Cartier, N. et al., Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy. Science (New York, N.Y 326, 818-823 (2009).
37. Biffi, A. et al., Lentiviral Hematopoietic Stem Cell Gene Therapy Benefits Metachromatic Leukodystrophy. Science (New York, N.Y, (2013).
38. Aiuti, A. et al., Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science 341, 1233151 (2013).
39. Cavazzana-Calvo, M. et al., Transfusion independence and HMGA2 activation after gene therapy of human beta-thalassaemia. Nature 467, 318-322 (2010).
40. Wu, X. et al., BCL11A controls Flt3 expression in early hematopoietic progenitors and is required for pDC development in vivo. PLoS One 8, e64800 (2013).
41. Ippolito, G.C. et al., Dendritic cell fate is determined by BCL11A. Proc. Natl. Acad. Sci. USA 111, E998-1006 (2014).
42. Roselli, E. A. et al., Correction of beta-thalassemia major by gene transfer in haematopoietic progenitors of pediatric patients. EMBO Mol Med 2, 315-328 (2010).
43. Zychlinski, D. et al., Physiological promoters reduce the genotoxic risk of integrating gene vectors. Mol Ther 16, 718-725 (2008).
44. Zhang, H. et al., Single processing center models for human Dicer and bacterial RNase III. Cell 118, 57-68 (2004).
45. Vermeulen, A. et al., The contributions of dsRNA structure to Dicer specificity and efficiency. RNA 11, 674-682 (2005).
46. Chiang, H. R. et al., Mammalian microRNAs: experimental evaluation of novel and previously annotated genes. Genes Dev 24, 992-1009 (2010).
47. Frank, F. et al., Structural basis for 5'-nucleotide base-specific recognition of guide RNA by human AGO2. Nature 465, 818-822 (2010).
48. Giarratana, M.C. et al., Proof of principle for transfusion of in vitro-generated red blood cells. Blood 118, 5071-5079 (2011).
49. Grimson, A. et al., Early origins and evolution of microRNAs and Piwi-interacting RNAs in animals. Nature 455, 1193-1197 (2008).
Список синтетических олигонуклеотидов мкР (miR)
Олигонуклеотиды мкР1 (miR1) к BCL11А:
Смысловой
ACGCTCGCACAGAACACTCATGGATTctccatgtggtagagAATCCATGAGTGTTCTGTGCGag (SEQ ID NO: 1)
Антисмысловой
CGCActCGCACAGAACACTCATGGATTctctaccacatggaeAATCCATGAGTGTTCTGTGCGa (SEQ ID NO:2)
Олигонуклеотиды мкР2 (miR2) к BCL11A:
Смысловой
ACGCTCCAGAGGATGACGATTGTTTActccatgtggtagagTAAACAATCGTCATCCTCTGGag (SEQ ID NO:3)
Антисмысловой
CGCActCCAGAGGATGACGATTGTTTActctaccacatggagTAAACAATCGTCATCCTCTGGa (SEQ ID NO:4)
Олигонуклеотиды Е3 к BCL11A:
Смысловой
ACGCTTCGGAGACTCCAGACAATCGCctccatgtggtagagGCGATTGTCTGGAGTCTCCGAag (SEQ ID NO: 5)
Антисмысловой
CGCActTCGGAGACTCCAGACAATCGCctctaccacatggagGCGATTGTCTGGAGTCTCCGAa (SEQ ID NO: 6)
Олигонуклеотиды D8 к BCL11A:
Смысловой
ACGCTTTCTCTTGCAACACGCACAGActccatgtggtagagTCTGTGCGTGTTGCAAGAGAAag (SEQ ID NO: 7)
Антисмысловой
CGCActTTCTCTTGCAACACGCACAGActctaccacatggagTCTGTGCGTGTTGCAAGAGAAa (SEQ ID NO: 8)
Олигонуклеотиды XLC4 или C4 к BCL11A:
Смысловой
ACGCTACAGTACCCTGGAGAAACACActccatgtggtagagTGTGTTTCTCCAGGGTACTGTag (SEQ ID NO: 9)
Антисмысловой
CGCActACAGTACCCTGGAGAAACACActctaccacatggagTGTGTTTCTCCAGGGTACTGTa (SEQ ID NO: 10)
Ненаправленные олигонуклеотиды:
Смысловой
ACGCTCAACAAGATGAAGAGCACCAActccatgtggtagagTTGGTGCTCTTCATCTTGTTGag (SEQ ID NO: 11)
Антисмысловой
CGCActCAACAAGATGAAGAGCACCAActctaccacatggagTTGGTGCTCTTCATCTTGTTGa (SEQ ID NO: 12)
Модифицированные олигонуклеотиды E3G5 или Е3 к BCL11A: (модифицированный вариант)
Смысловой
ACGCTGCGCTCGGAGACTCCAGACAActccatgtggtagagTTGTCTGGAGTCTCCGAGCGCag (SEQ ID NO: 13)
Антисмысловой
CGCActGCGCTCGGAGACTCCAGACAActctaccacatggagTTGTCTGGAGTCTCCGAGCGCa (SEQ ID NO: 14)
Модифицированные олигонуклеотиды D8G5 или D8 к BCL11A: (модифицированный вариант)
Смысловой
ACGCTGCGCTTCTCTTGCAACACGCActccatgtggtagagTGCGTGTTGCAAGAGAAGCGCag (SEQ ID NO: 15)
Антисмысловой
CGCActGCGCTTCTCTTGCAACACGCActctaccacatggagTGCGTGTTGCAAGAGAAGCGCa (SEQ ID NO:16)
Модифицированные олигонуклеотиды XLC4G5 к BCL11A: (модифицированный вариант)
Смысловой
ACGCTGCGCACAGTACCCTGGAGAAActccatgtggtagagTTTCTCCAGGGTACTGTGCGCag (SEQ ID NO: 17)
Антисмысловой
CGCActGCGCACAGTACCCTGGAGAAActctaccacatggagTTTCTCCAGGGTACTGTGCGCa (SEQ ID NO: 18)
мкP1 CGCACAGAACACTCATGGATTctccatgtggtagagAATCCATGAGTGTTCTGTGCG (SEQ ID NO: 25)
(кшPHK1 или Е3) TCGGAGACTCCAGACAATCGCctccatgtggtagagGCGATTGTCTGGAGTCTCCGA (SEQ ID NO: 26)
(кшPHK2 или B5) CCTCCAGGCAGCTCAAAGATCctccatgtggtagagGATCTTTGAGCTGCCTGGAGG (SEQ ID NO: 27)
(кшРНК3 или D8) TTCTCTTGCAACACGCACAGActccatgtggtagagTCTGTGCGTGTTGCAAGAGAA (SEQ ID NO: 28)
(кшРНК4 или B11) TCAGGACTAGGTGCAGAATGTctccatgtggtagagACATTCTGCACCTAGTCCTGA (SEQ ID NO: 29)
(кшРНК5 или 50D12 или D12) GATCGAGTGTTGAATAATGATctccatgtggtagagATCATTATTCAACACTCGATC (SEQ ID NO: 30)
(кшРНК6 или 50A5 или A5) CAGTACCCTGGAGAAACACATctccatgtggtagagATGTGTTTCTCCAGGGTACTG (SEQ ID NO: 31)
(кшРНК7 или 50 В11) CACTGTCCACAGGAGAAGCCActccatgtggtagagTGGCTTCTCCTGTGGACAGTG (SEQ ID NO: 32)
(кшРНК8 или 50С4) ACAGTACCCTGGAGAAACACActccatgtggtagagTGTGTTTCTCCAGGGTACTGT (SEQ ID NO: 33)
мкP1G5 gcgcCGCACAGAACACTCATGctccatgtggtagagCATGAGTGTTCTGTGCGgcgc (SEQ ID NO: 34)
(кшРНК1мод (shRNA1mod) или E3G5) gcgcTCGGAGACTCCAGACAActccatgtggtagagTTGTCTGGAGTCTCCGAgcgc (SEQ ID NO: 35)
(кшРНК2 мод (shRNA2mod) или B5G5) gcgcCCTCCAGGCAGCTCAAActccatgtggtagagTTTGAGCTGCCTGGAGGgcgc (SEQ ID NO: 36)
(кшРНК3мод (shRNA3mod) или D8G5) gcgcTTCTCTTGCAACACGCActccatgtggtagagTGCGTGTTGCAAGAGAAgcgc (SEQ ID NO: 37)
(кшРНК4 мод (shRNA4mod) или B11G5) gcgcTCAGGACTAGGTGCAGActccatgtggtagagTCTGCACCTAGTCCTGAgcgc (SEQ ID NO: 38)
(кшРНК5 мод (shRNA5mod) или 50D12G5 или D12G5) gcgcGATCGAGTGTTGAATAActccatgtggtagagTTATTCAACACTCGATCgcgc (SEQ ID NO: 39)
(кшРНК6мод (shRNA6mod) или 50A5G5) gcgcCAGTACCCTGGAGAAACctccatgtggtagagGTTTCTCCAGGGTACTGgcgc (SEQ ID NO: 40)
(кшРНК7 мод (shRNA7mod) или 50B11G5) gcgcCACTGTCCACAGGAGAActccatgtggtagagTTCTCCTGTGGACAGTGgcgc (SEQ ID NO: 41)
(кшРНК8 мод (shRNA8mod) или 50C4G5 или C4G5) gcgcACAGTACCCTGGAGAAActccatgtggtagagTTTCTCCAGGGTACTGTgcgc (SEQ ID NO: 42)
(кшРНК D12G5-2 к BCL11A): Смысловой ACGCTCGCACAGAACACTCATGGATTctccatgtggtagagAATCCATGAGTGTTCTGTGCGAG (SEQ ID NO: 43)
(кшРНК D12G5-2 к BCL11A): Антисмысловой CGCACTCGCACAGAACACTCATGGATTctctaccacatggagAATCCATGAGTGTTCTGTGCGA (SEQ ID NO: 44)
5'-CCGGCGCACAGAACACTCATGGATTCTCGAGAATCCATGAGTGTTCTGTGCGTTTTT-3' (SEQ ID NO:86)
5'CGCTCGCACAGAACACTCATGGATTctccatgtggtagagAATCCATGAGTGTTCTGTGCGAGTG-3' (SEQ ID NO: 87)
5'CGCTGCGCCGCACAGAACACTCATGctccatgtggtagagCATGAGTGTTCTGTGCGGCGCAGTG-3' (SEQ ID NO: 88)
5'-CCGGACAGTACCCTGGAGAAACACACTCGAGTGTGTTTCTCCAGGGTACTGTTTTTT-3'(SEQ ID NO: 89)
5'-CGCTACAGTACCCTGGAGAAACACActccatgtggtagagTGTGTTTCTCCAGGGTACTGTAGTG-3' (SEQ ID NO: 90)
5'CGCTGCGCACAGTACCCTGGAGAAActccatgtggtagagTTTCTCCAGGGTACTGTGCGCAGTG-3'(SEQ ID NO: 91)
5'-CCGGTTCTCTTGCAACACGCACAGACTCGAGTCTGTGCGTGTTGCAAGAGAATTTTT-3' (SEQ ID NO: 92)
5'CGCTTTCTCTTGCAACACGCACAGActccatgtggtagagTCTGTGCGTGTTGCAAGAGAAAGTG-3' (SEQ ID NO: 93)
5'CGCTGCGCTTCTCTTGCAACACGCActccatgtggtagagTGCGTGTTGCAAGAGAAGCGCAGTG-3' (SEQ ID NO: 94)
5'-CCGGGATCGAGTGTTGAATAATGATCTCGAGATCATTATTCAACACTCGATCTTTTT-3' (SEQ ID NO: 95)
5'-CGCTGATCGAGTGTTGAATAATGATctccatgtggtagagATCATTATTCAACACTCGATCAGTG-3' (SEQ ID NO:96)
5'CGCTGCGCGATCGAGTGTTGAATAActccatgtggtagagTTATTCAACACTCGATCGCGCAGTG-3' (SEQ ID NO: 97)

Реферат
Изобретение относится к биотехнологии, предоставлены специально сконструированные синтетические микро-РНК, направленные к BCL11A для экспрессии РНК-полимеразой II, и способы их применения для лечения гемоглобинопатий, таких как серповидноклеточная анемия или талассемия посредством увеличения уровней экспрессии фетального гемоглобина.7 н. и 6 з.п. ф-лы, 57 ил., 14 пр.

Комментарии