Стромальные стволовые клетки жировой ткани для использования в лечении рефракторных сложных перианальных фистул при болезни крона - RU2742308C2
Код документа: RU2742308C2
Чертежи
Описание
Область, к которой относится изобретение
Настоящее изобретение относится к стволовым клеткам жировой ткани для использования в лечении рефракторных сложных перианальных фистул у пациентов с болезнью Крона.
Предпосылки создания изобретения
В общем, фистула представляет собой аномальное соединение или проход между органами или сосудами, которые обычно не соединяются. Фистулы могут развиваться в различных частях организма. Например, типы фистул, названных по участкам организма, где они возникают, включают аноректальную фистулу, или фистулу в ано, или фекальную фистулу (между прямой кишкой или другой зоной аноректального отдела и поверхностью кожи), артериовенозную фистулу или фистулу AV (между артерией и веной), билиарную фистулу (между желчными протоками к поверхности кожи, часто вызванную хирургической операцией желчного пузыря), цервикальную фистулу (аномальное открытие в шейке матки), краниальную фистулу (между внутричерепным пространством и параназальным синусом), энтероэнтеральную фистулу (между двумя частями кишечника), кишечно-кожную фистулу (между кишечником и поверхностью кожи, а именно из двенадцатиперстной кишки или тощей кишки или подвздошной кишки), энтеровагинальную фистулу (между кишечником и влагалищем), желудочную фистулу (между желудком и поверхностью кожи), метроперитонеальную фистулу (между маткой и брюшной полостью), перилимфатическую фистулу (разрыв между мембранами между средним и внутренним ухом), легочную артериовенозную фистулу (между артерией и веной легких, приводящую к шунтированию крови), ректовагинальную фистулу (между прямой кишкой и влагалищем), пупочную фистулу (между пуповиной и кишечником), трахеоэзофагеальную фистулу (между дыхательной и питательной трубками) и везиковагинальную фистулу (между мочевым пузырем и влагалищем). Причины фистул включают травму, осложнения в результате лечения и болезни.
Лечение фистул варьируется в зависимости от причины и степени фистулы, но обычно включает хирургическое вмешательство. Обычно используются различные хирургические процедуры, чаще всего фистулотомия, проведение лигатуры (шнура, который проходит через участок фистулы, чтобы держать ее открытой для дренирования), или процедура перемещения эндоректального лоскута (где здоровую ткань вытягивают по внутренней стороне фистулы, чтобы предотвратить повторное заражение канала фекалиями или другим материалом). Применение хирургии для аноректальных фистул не обходится без побочных эффектов, включающих рецидив, повторное инфицирование и недержание.
Воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит, являются основными причинами аноректальных, энтероэнтеральных и кишечно-кожных фистул. Зарегистрированные случаи фистул при болезни Крона варьируются от 17% до 50%. Лечение фистул у пациентов с болезнью Крона до сих пор представляет чрезвычайно сложную проблему, поскольку многие такие фистулы не отвечают на существующие лечения. Такие фистулы и их рецидив являются очень тревожным осложнением, которое значительно снижает качество жизни страдающих этим пациентов. Недавние улучшения в медикаментозном лечении (например, лечение Инфликсимабом®) и экспертное хирургическое лечение снизили потребность в сложной хирургии. Однако многие пациенты не вылечиваются. Причиной того, что фистула не поддается лечению, вероятно, является субоптимальное качество тканей, которые были затронуты болезнью Крона. Действительно, фистулы при болезни Крона обеспечивают модельную систему для заживления ран в некоторых из наиболее худших возможных условий.
Перианальные фистулы являются обычным осложнением болезни Крона,A1 которые, по оценкам, поражают до 28% пациентов в первые две декады после диагноза,A2, A3 особенно пациентов с заболеваниями толстой кишки и затронутой прямой кишкой.A4 Они серьезно ухудшают качество жизни пациентов и вызывают существенную частоту осложнений.A5, A6 Приблизительно 70-80% перианальных фистул являются сложными,A3, A7, и они являются проблемными для лечения, поскольку они особенно устойчивы к традиционным стратегиям лечения (антибиотики, иммунодепрессанты) и терапевтическим средствам против фактора некроза опухоли (анти-TNF).A8-A12. Кроме того, 60-70% пациентов имеют рецидивы при прекращении лечения,A13-A17 и лишь немногие пациенты достигают долгосрочной ремиссии.A18
Неэффективность или непереносимость лекарственной терапии может в конечном итоге привести к изнурительным хирургическим подходам, таким как отводящая стома или проктоктомия.A19 Таким образом, остается огромная неудовлетворенная потребность в альтернативных медикаментозных лечениях.
Мезенхимальные стромальные клетки (MSC) представляют собой не-гемопоэтические стромальные клетки, которые способны дифференцироваться в мезенхимальные ткани, такие как кости, хрящ, мышцы, связки, сухожилия и жировая ткань. MSCs можно легко выделить из тканей, таких как костный мозг или жировая ткань, и быстро размножить в культуре. В WO-A-2006/136244 описано лечение фистул с использованием композиций, содержащих стромальные стволовые клетки из жировой ткани. Мезенхимальные стромальные клетки, происходящие из жировой ткани, представляют собой новый перспективный терапевтический подход, который может быть полезен для лечения сложных перианальных фистул, благодаря их противовоспалительному и тканерегенерирующему потенциалу.A20-A22. Первоначальное доказательство концепции было ранее получено в открытой фазе 1/2a клинического исследования аллогенных размноженных стволовых клеток жировой ткани (eASC, Cx601) у 24 пациентов с болезнью Крона со сложными перианальными фистулами, при этом 56,3% пациентов показали полное закрытие наружного отверстия и отсутствие скоплений, как было показано при помощи МРТ вылеченной фистулы через 24 недели после лечения.A23
Сложные перианальные фистулы при болезни Крона особенно проблемны для лечения, и остается необходимость в создании клинически подтвержденных терапий сложных перианальных фистул при болезни Крона.
Сущность изобретения
Изобретение относится к обеспечению клинически подтвержденных терапевтических средств для лечения рефракторных сложных перианальных фистул при болезни Крона на основании результатов многоцентрового двойного слепого плацебо-контролируемого исследования, оценивавшего эффективность и безопасность eASC у 212 взрослых пациентов с болезнью Крона и невосприимчивых к лечению рефракторных дренирующих сложных перианальных фистул. В приведенных примерах описывается первое плацебо-контролируемое исследование фазы 3, в котором оценивается эффективность и безопасность размноженных аллогенных стволовых клеток из жировой ткани только или добавляемых к существующей медикаментозной терапии для лечения рефракторных сложных перианальных фистул у пациентов с болезнью Крона. Представленные результаты представляют собой первичные и вторичные конечные точки через 24 недели.
Новые данные клинических исследований неожиданно показали, что стволовые клетки жировой ткани особенно эффективно лечат множественные перианальные фистулы. Данные также показывают, что, в количественном отношении, наибольший эффект клеток наблюдали у пациентов, которые не получали ни одну или получали обе анти-TNF и иммуносупрессорную терапии во время вскрытия фистулы. Кроме того, клиническая ремиссия достигалась неожиданно быстро после лечения, причем медианное время до клинической ремиссии в группе лечения составляло 6,7 недели. Точно так же среднее время ответа составляло 6,3 недели. Улучшение индекса активности перианальной болезни (PDAI) было значительно выше к неделе 6, 12 и 18. В целом, данные показывают, что аллогенные eASC являются удивительно эффективной терапией сложных перианальных фистул у пациентов с болезнью Крона, поэтому одно введение может обеспечить быстрый и продолжительный терапевтический эффект даже в самых трудных случаях лечения чрезвычайно сложных фистул, когда предыдущая лекарственная терапия была неэффективной.
Первый аспект изобретения обеспечивает размноженные аллогенные стромальные стволовые клетки из жировой ткани для применения в способе лечения рефрактерной сложной перианальной фистулы у пациента с болезнью Крона.
Второй аспект настоящего изобретения обеспечивает применение размноженных аллогенных стромальных стволовых клеток из жировой ткани для получения лекарственного средства для лечения рефрактерной сложной перианальной фистулы у пациента с болезнью Крона.
Третий аспект изобретения обеспечивает способ лечения рефрактерной сложной перианальной фистулы у пациента с болезнью Крона, у пациента, нуждающегося в таком лечении, включающий стадию введения размноженных аллогенных стромальных стволовых клеток из жировой ткани в фистулу.
Также в настоящей заявке раскрываются, среди прочего, композиции, содержащие стромальные стволовые клетки из жировой ткани. Композиции, содержащие стромальные стволовые клетки из жировой ткани, описанные в настоящей заявке, имеют отчетливый фенотип и демонстрируют полезную гомогенность фенотипа, что делает их более подходящими для использования в лечении фистул. Композиции, содержащие стромальные стволовые клетки из жировой ткани, могут быть сформулированы с растворами или другими веществами для того, чтобы они могли служить в качестве лекарственных средств или медицинских устройств, например, в качестве швов или адгезивов. Кроме того, представлены новые способы лечения сложных перианальных фистул с использованием стромальных стволовых клеток из жировой ткани, а также наборы для их практического осуществления.
Краткое описание чертежей
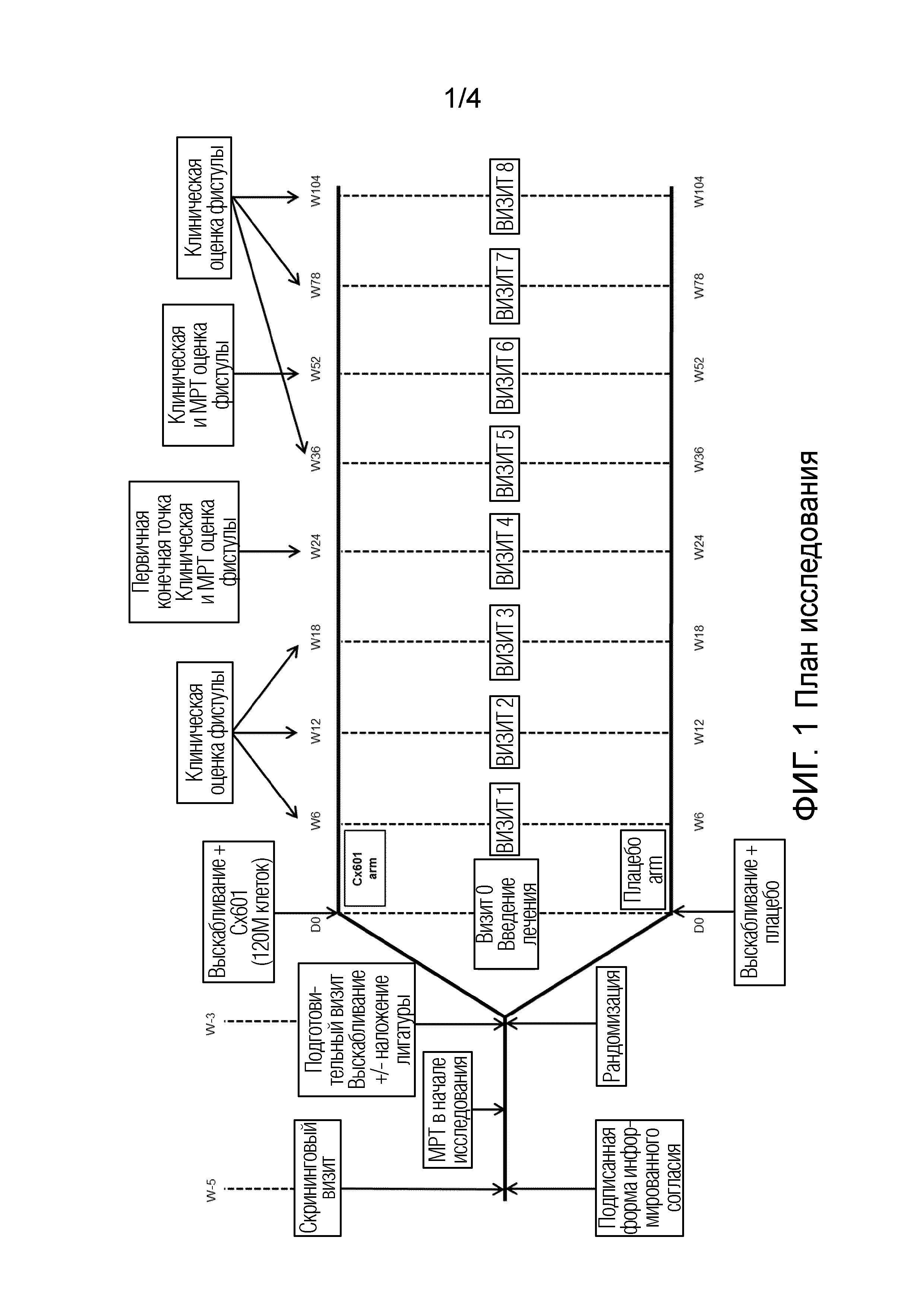
Фиг. 1 представляет план фазы III клинического исследования. Cx601 - аллогенные размноженные стволовые клетки жировой ткани; ICF - форма информированного согласия; МРТ - магнитно-резонансная томография.
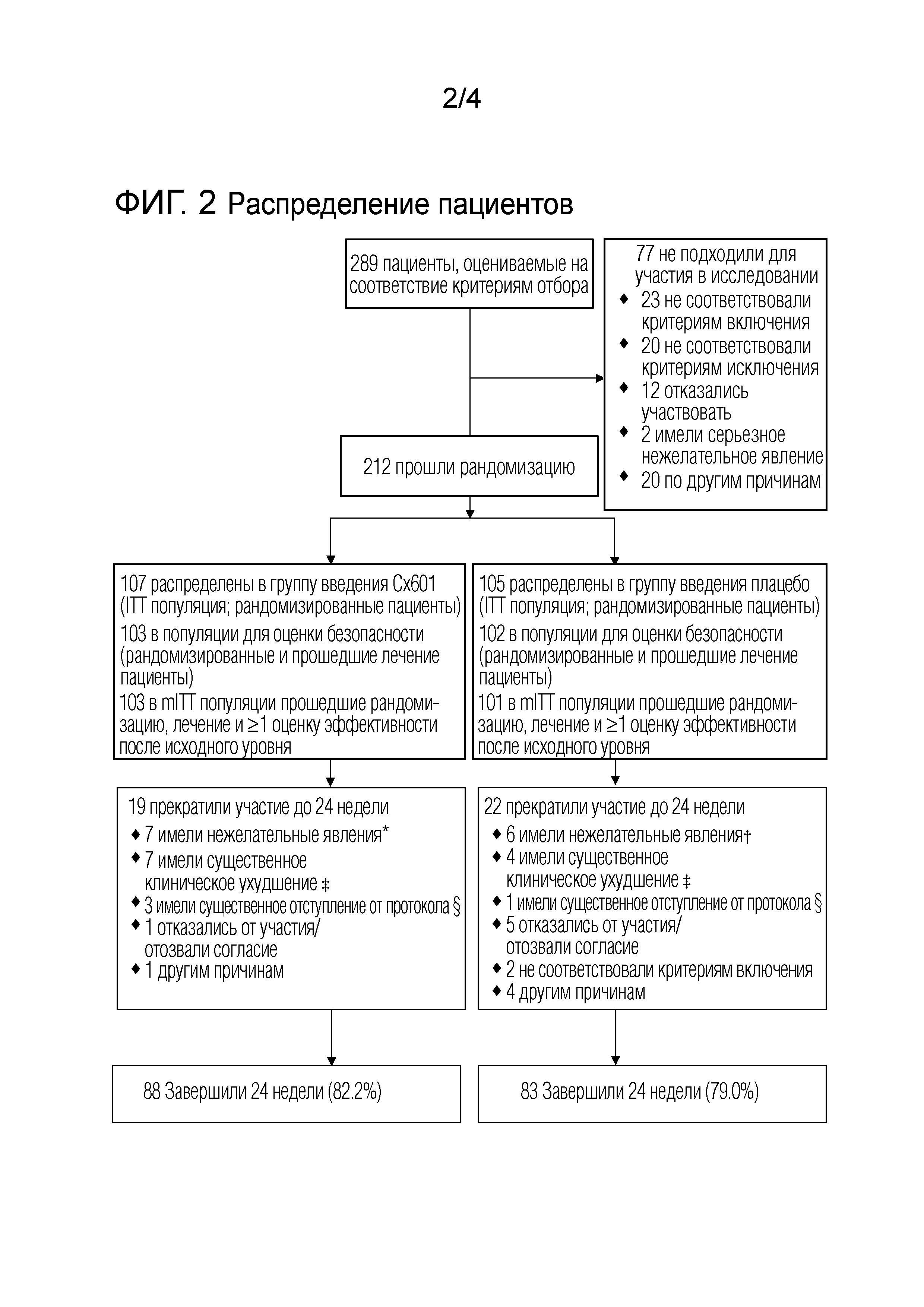
Фиг. 2 представляет распределение пациентов. Cx601 - аллогенные размноженные стволовые клетки жировой ткани; ITT - популяция начавших лечение пациентов; mITT - модифицированная популяция начавших лечение пациентов; *Тромбоз глубоких вен, внезапное обострение болезни Крона, кишечная непроходимость, болезнь Крона, анальный абсцесс (n=3); †Фистула, прокталгия, анальный абсцесс (n=4); ‡Не излечивается или ухудшение симптомов; новый курс антибиотиков; новая хирургическая операция в перианальной области; Ухудшение болезни Крона, требующее изменений в терапии.
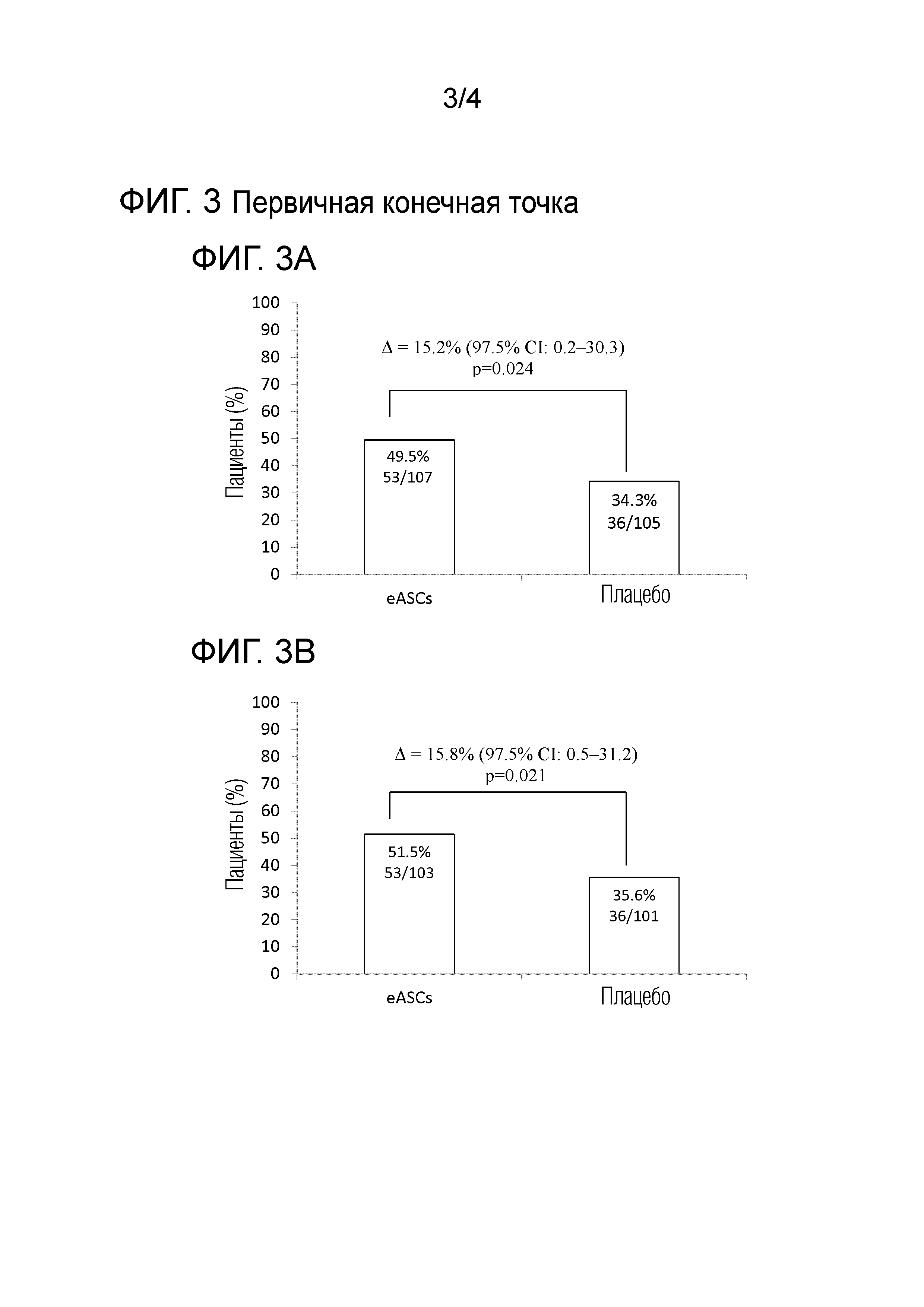
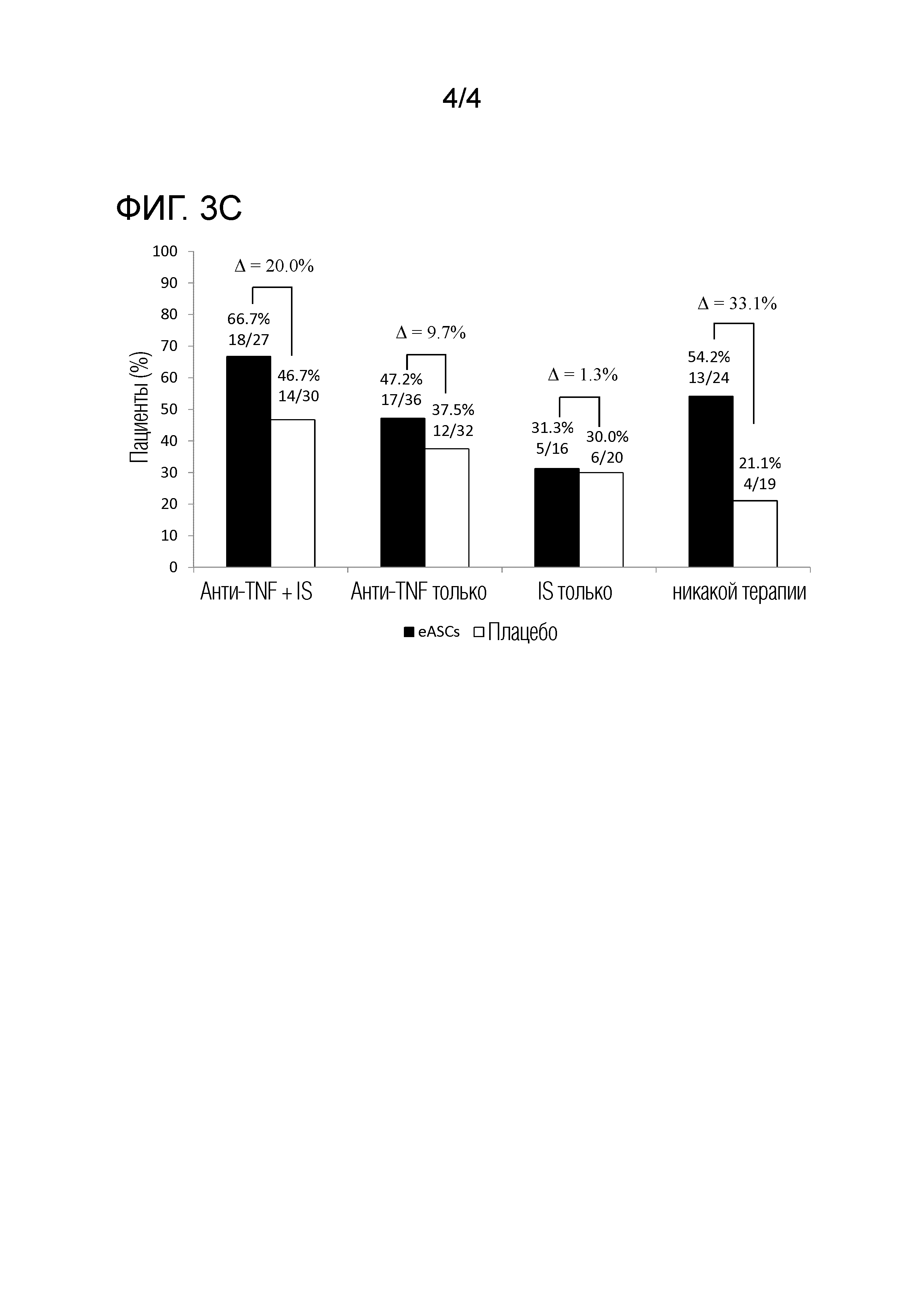
Фиг. 3 показывает первичную конечную точку: Комбинированная клиническая и радиологическая ремиссия* к недели 24 в ITT популяции (Панель A). Комбинированная клиническая и радиологическая ремиссия* к недели 24 в mITT популяции (Панель B). Комбинированная ремиссия* к недели 24 в соответствии с стратифицированной рандомизацией, т.е. лечение болезни Крона осуществлялось во время рандомизации, в mITT популяции (Панель C). Cx601 - аллогенные, размноженные, стволовые клетки жировой ткани; IS - иммуносупрессант; ITT - популяция начавших лечение пациентов; mITT - модифицированная популяция начавших лечение пациентов; TNF - фактор некроза опухоли. *Клиническая оценка закрытия всех пролеченных внешних отверстий, которые были дренирующими на базовом уровне, и отсутствие скоплений >2 см пролеченных перианальных фистул в ≥2 из 3 измерений при центральной МРТ оценке в слепом режиме к недели 24. Клиническую оценку закрытия определяли как отсутствие просачивания, несмотря на мягкое нажатие пальцами.
Подробное описание изобретения
1. Определения:
В контексте настоящей заявки, следующие термины и фразы должны иметь значения, указанные ниже. Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют то же значение, которое обычно известно специалистам в области техники, к которой относится настоящее изобретение.
Артикли «a» и «an» относятся к одному или нескольким (то есть, по меньшей мере, одному) из грамматического объекта артикля. В качестве примера «элемент» означает один элемент или больше чем один элемент.
Под «жировой тканью» понимается любая жировая ткань. Жировая ткань может быть коричневой или белой жировой тканью, происходящей из подкожного, сальникового/висцерального, молочной железы, гонадального или другого участка жировой ткани. Как правило, жировая ткань представляет собой подкожную белую жировую ткань. Такие клетки могут включать первичную клеточную культуру или иммортализованную клеточную линию. Жировая ткань может быть из любого организма, имеющего жировую ткань. Как правило, жировая ткань является тканью млекопитающего, наиболее типично жировой тканью человека. Удобным источником жировой ткани является операция липосакции, однако источник жировой ткани или способ выделения жировой ткани не являются критическими для изобретения.
«Стромальные стволовые клетки жировой ткани» или «ASCs», относятся к мезенхимальным стволовым клеткам, которые происходят из стромальной фракции жировой ткани, как правило, из жировой ткани человека (hASCs).
Термин «адгезив» относится к любому веществу, которое объединяет или связывает поверхности вместе; например, клей.
Термин «биологический лекарственный продукт» следует понимать как фармацевтическое вещество на основе белка или нуклеиновой кислоты для терапевтического применения, которое обычно получают другими способами, помимо прямого экстрагирования из природного (неинжинирингового) биологического источника.
Термин «клеточная композиция» относится к препарату клеток, при этом препарат может включать, помимо клеток, неклеточные компоненты, такие как среда для культивирования клеток, например, белки, аминокислоты, нуклеиновые кислоты, нуклеотиды, кофермент, антиоксиданты, металлы и т.п. Кроме того, клеточная композиция может содержать компоненты, которые не влияют на рост или жизнеспособность клеточного компонента, но которые используются для обеспечения клеток в определенном формате, например, в виде полимерной матрицы для инкапсуляции или фармацевтического препарата.
ʺСложная перианальная фистулаʺ представляет собой перианальную фистулу, имеющую одно или несколько из следующих:
(i) высокую интер-, транс-, экстра- или супра-сфинктерическую этиологию;
(ii) ≥2 внешних отверстия; или
(iii) ассоциированные скопления.
Сложная перианальная фистула необязательно может иметь максимум 2 внутренних и 3 внешних отверстия. Кроме того, сложная перианальная фистула может быть дренирующей в течение по меньшей мере 6 недель до лечения в соответствии с изобретением.
Термин «культура» относится к любому росту клеток, организмов, многоклеточных образований или ткани в среде. Термин «культивирование» относится к любому способу достижения такого роста и может включать несколько стадий. Термин «дальнейшее культивирование» относится к культивированию клетки, организма, многоклеточного образования или ткани до определенной стадии роста, а затем использованию другого метода культивирования для доведения указанной клетки, организма, многоклеточного образования или ткани до другой стадии роста. «Клеточная культура» относится к росту клеток in vitro. В такой культуре клетки размножаются, но они не организуются в ткань per se. «Тканевая культура» относится к поддержанию или росту ткани, например, эксплантатов примордиального органа или взрослого органа in vitro, чтобы сохранить его архитектуру и функцию. «Монослойная культура» относится к культуре, в которой клетки размножаются в подходящей среде, будучи в основном связанными друг с другом и с субстратом. Кроме того, «суспензионная культура» относится к культуре, в которой клетки размножаются, будучи суспендированными в подходящей среде. Аналогично, «непрерывно-проточная культура» относится к культивированию клеток или эксплантов в непрерывном потоке свежей среды для поддержания роста клеток, например, жизнеспособности. Термин «кондиционированные среды» относится к супернатанту, например, без культивируемых клеток/ткани, полученному после некоторого периода времени при контакте с культивируемыми клетками, так чтобы среда изменялась, чтобы включать определенные паракринные и/или аутокринные факторы, продуцируемые клетками и секретируемые в культуру. «Конфлюентная культура» представляет собой клеточную культуру, в которой все клетки находятся в контакте, и, следовательно, покрыта вся поверхность сосуда для культивирования, и подразумевается, что клетки также достигли максимальной плотности, хотя конфлюентность необязательно должна означать, что деление будет прекращаться или что популяция не будет увеличиваться в размере.
Термин «культуральная среда» или «среда» признан в данной области и относится, как правило, к любому веществу или препарату, используемому для культивирования живых клеток. Термин «среда», используемый в отношении культуры клеток, включает компоненты среды, окружающей клетки. Среды могут быть твердыми, жидкими, газообразным или смесью фаз и веществ. Среды включают жидкие среды роста, а также жидкие среды, которые не поддерживают рост клеток. Среды также включают гелеобразные среды, такие как агаровые, агарозные, желатиновые и коллагеновые матрицы. Примеры газообразных сред включают газовую фазу, воздействующую на клетки, растущие на чашке Петри или другой твердой или полутвердой подложке. Термин «среда» также относится к веществу, которое предназначено для использования в культуре клеток, даже если оно еще не контактирует с клетками. Другими словами, богатая питательными веществами жидкость, приготовленная для бактериальной культуры, является средой. Аналогично, порошковая смесь, которая при смешивании с водой или другой жидкостью становится подходящей для культуры клеток, может быть названа «порошкообразной средой». «Среда определенного состава» относится к средам, которые получены из химически определенных (обычно очищенных) компонентов. «Среды определенного состава» не содержат плохо охарактеризованные биологические экстракты, такие как дрожжевой экстракт и говяжий бульон. «Обогащенная среда» включает среды, которые предназначены для поддержания роста большинства или всех жизнеспособных форм конкретного вида. Обогащенные среды часто включают сложные биологические экстракты. «Среда, подходящая для роста культуры с высокой плотностью», представляет собой любую среду, которая позволяет культуре клеток достигать значения OD600 равного 3 или более, когда другие условия (такие как температура и скорость переноса кислорода) обеспечивают возможность такого роста. Термин «базальная среда» относится к среде, которая способствует росту многих типов микроорганизмов, которые не требуют каких-либо специальных питательных добавок. Большинство базальных сред обычно состоят из четырех основных химических групп: аминокислоты, углеводы, неорганические соли и витамины. Базальная среда обычно служит основой для более сложной среды, к которой добавляются добавки, такие как сыворотка, буферы, факторы роста, липиды и т.п. Примеры базальных сред включают, но не ограничиваются этим, базальную среду Игла, минимальную основную среду, модифицированную Дульбекко среду Игла, среду 199, питательные среды Хэма F-10 F-12, среду Маккоя 5A, среду Дульбекко MEM/F-I 2, RPMI 1640 и модифицированную Дульбекко среду Искова (IMDM).
Термины «включает» и «включающий» используются в инклюзивном открытом смысле, что означает включение дополнительных элементов.
Термин «Cx601» относится к клеточной суспензии в асептическом буферном солевом растворе, содержащем человеческие размноженные стволовые клетки жировой ткани (eASCs) аллогенного происхождения. Эти клетки предоставляются в одноразовых флаконах без консервантов. Клетки представлены в дозе 120 миллионов клеток (5 миллионов клеток/мл) для инъекции в очаг поражения.
Термин «дифференциация» относится к образованию клеток, экспрессирующих маркеры, которые, как известно, ассоцированы с клетками, которые более специализированы и ближе к тому, чтобы стать терминально-дифференцированными клетками, неспособными к дальнейшему делению или дифференцировке. Например, в панкреатическом контексте, можно наблюдать дифференциацию в продукции кластеров островково-подобных клеток, содержащих повышенную долю бета-эпителиальных клеток, которые продуцируют повышенное количество инсулина. Термины «дальнейшая» или «бóльшая» дифференциация относятся к клеткам, которые более специализированы и ближе к тому, чтобы стать терминально-дифференцированными клетками, неспособными к дальнейшему делению или дифференциации, чем клетки, из которых они были культивированы. Термин «терминальная дифференциация» относится к клеткам, которые стали терминально-дифференцированными клетками, неспособными к дальнейшему делению или дифференциации.
Термин «размноженные», используемый в настоящей заявке в отношении клеток, следует рассматривать как имеющий обычное понятное в данной области значение, а именно, клетки, которые пролиферировали in vitro. Способы получения eASC известны в данной области, например, как описано в WO2007/039150. ASC могут быть размножены, чтобы обеспечить популяцию клеток, которые сохраняют по меньшей мере одну биологическую функцию ASC, как правило, способность прилипать к пластиковой поверхности в стандартных условиях культивирования. Размноженная популяция клеток может сохранять способность дифференцироваться в один или несколько типов клеток.
Термин «фистула» относится к любому аномальному проходу или сообщению или соединению, обычно между двумя внутренними органами или ведущему от внутреннего органа к поверхности тела. Примеры фистул включают, но не ограничиваются этим, аноректальную фистулу, или фистулу в ано, или фекальную фистулу, артериовенозную фистулу или фистулу AV, билиарную фистулу, цервикальную фистулу, краниальную фистулу, энтероэнтеральную фистулу, кишечно-кожную фистулу, энтеровагинальную фистулу, желудочную фистулу, метроперитонеальную фистулу, перилимфатическую фистулу, легочную артериовенозную фистулу, ректовагинальную фистулу, пупочную фистулу, трахеоэзофагеальную фистулу и везиковагинальную фистулу. Изобретение относится к перианальной фистуле.
Термин «включая» используется в настоящей заявке для обозначения «включая, но не ограничиваясь». «Включая» и «включая, но не ограничиваясь», используются взаимозаменяемо.
«Маркер» относится к биологической молекуле, присутствие которой, концентрация, активность или состояние фосфорилирования могут быть обнаружены и использованы для идентификации фенотипа клетки.
«Мезенхимальные стромальные клетки» (также называемые в настоящей заявке «MSC») представляют собой мультипотентные стромальные клетки (т.е. они являются клетками, которые способны приводить к появлению нескольких разных типов клеток), как правило, происходящие из соединительной ткани, и являются негемопоэтическими клетками. MSC обладают способностью дифференцироваться в, или в направлении, соматические клетки, такие как мезодермальные клетки (например, адипозные, хондроциты, остеобласты) и, необязательно, в, или в направлении, эндодермальные и/или эктодермальные клеточные типы или линии. Обычно клетки обладают способностью дифференцироваться в, или в направлении, по меньшей мере два типа или все типы клеток, выбранные из группы, состоящей из адипоцитных, хондробластных и остеобластных линий. ASC представляют собой тип MSC, которые получены из стромальной фракции жировой ткани. MSC и ASCs прилипают к пластику в стандартных условиях культивирования.
«Пластырь» представляет собой повязку или покрытие, наносимое для покрытия или защиты раны или другой болячки.
«Пациент», «субъект» или «хозяин», подлежащий лечению способом по изобретению, может означать либо человека, либо животное, не являющееся человеком.
Фраза «фармацевтически приемлемый» используется в настоящей заявке для обозначения тех соединений, материалов, композиций и/или лекарственных форм, которые в рамках здравого медицинского суждения подходят для использования в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергических реакций или других проблем или осложнений, соизмеримо с разумным соотношением польза/риск.
Используемая в настоящей заявке фраза «фармацевтически приемлемый носитель» означает фармацевтически приемлемое вещество, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент или материал для инкапсулирования растворителя, который участвует в переносе или транспортировке данного соединения из одного органа или части тела к другому органу или части тела. Каждый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами композиции и не причинять вреда пациенту. Термин «фенотип» относится к наблюдаемым характеристикам клетки, таким как размер, морфология, экспрессия белка и т.д.
Термин «клетка-предшественник» относится к клетке, которая обладает способностью создавать потомство, которое более дифференцировано, чем она сама. Например, этот термин может относиться к недифференцированной клетке или клетке, дифференцированной до степени, не достигающей окончательной дифференцировки, которая способна к пролиферации и дает начало большему количеству клеток-предшественников, обладающих способностью генерировать большое количество материнских клеток, которые, в свою очередь, могут привести к образованию дифференцированных или дифференцируемых дочерних клеткок. В предпочтительном варианте осуществления термин «клетка-предшественник» относится к обобщенной материнской клетке, чьи потомки (потомство) специализируются, часто в разных направлениях, путем дифференциации, например, путем приобретения полностью индивидуальных признаков, как происходит при прогрессивной диверсификации эмбриональных клеток и тканей. Клеточная дифференциация представляет собой сложный процесс, обычно происходящий через множество клеточных делений. Дифференцированная клетка может происходить из мультипотентной клетки, которая сама происходит из мультипотентной клетки и т.д. Хотя каждые из этих мультипотентных клеток могут считаться стволовыми клетками, диапазон клеточных типов, которым каждая может давать начало, может значительно варьироваться. Некоторые дифференцированные клетки также способны генерировать клетки с большим потенциалом развития. Такая способность может быть природной или может индуцироваться искусственно при обработке различными факторами. Согласно этому определению, стволовые клетки также могут быть клетками-предшественниками, а также более непосредственными предшественниками терминально-дифференцированных клеток.
«Пролиферация» относится к увеличению числа клеток. «Пролиферирование» и «пролиферация» относятся к клеткам, делящимся путем митоза.
«Рефракторный» следует понимать как не имеющий существенной клинической пользы при лечении заболеваний, например, никакого значительного улучшения или улучшения симптомов.
Термин «ремиссия» относится к успешному лечению фистулы. «Клиническая ремиссия» означает закрытие всех пролеченных внешних отверстий, которые были дренирующими на базовом уровне, не смотря на осторожное нажатие пальцами. Время клинической ремиссии определяется как время от начала лечения до первой оценки пациента с клинической ремиссией. «Объединенная ремиссия» означает такую клиническую ремиссию плюс подтверждение с помощью МРТ (магнитно-резонансная томография) отсутствия скоплений более 2 см в пролеченных перианальных фистулах по меньшей мере в 2 из 3 измерений. Это обычно подтверждается центральной оценкой в слепом режиме методом МРТ. Отсутствие скоплений или абсцессов важно, потому что, если их не вылечить, это приведет к новой фистуле.
Термин «ответ» относится к закрытию по меньшей мере 50% всех пролеченных внешних отверстий (EO), которые были дренирующими на базовом уровне, не смотря на осторожное сжатие пальцами (то есть, как оценивается клинически). Таким образом, ответ присутствует, когда 1 EO закрывается, если количество EO на базовом уровне равно 1 или 2, и присутствует, когда 2 EO закрыты, если на базовом уровне было 3 EO. Время ответа определяется как время от начала лечения до первой оценки ответа.
Термин «рецидив» относится к пациентам с клинической ремиссией при предыдущей оценке, повторному открытию любого из пролеченных внешних отверстий с активным дренированием, согласно клинической оценке, или развитию перианального скопления более 2 см пролеченной перианальной фистулы (фистул), что подтверждено при помощи МРТ.
Используемый в настоящей заявке термин «раствор» включает фармацевтически приемлемый носитель или разбавитель, в котором клетки по изобретению остаются жизнеспособными.
Термин «по существу чистый», в отношении популяций стволовых клеток из жировой ткани, относится к популяции стволовых клеток жировой ткани, которая является по меньшей мере на около 75%, обычно по меньшей мере около 85%, более типично, по меньшей мере, около 90% и наиболее типично по меньшей мере около 95% чистой относительно стромальных стволовых клеткок жировой ткани, составляющих общую клеточную популяцию. Либо иначе, термин «по существу чистый» относится к популяции стромальных стволовых клеток жировой ткани по настоящему изобретению, которые содержат менее примерно 20%, более типично менее примерно 10%, наиболее типично менее примерно 5%, линия-коммитированных клеток в исходной неамплифицированной и изолированной популяции перед последующим культивированием и амплификацией.
Как используется в настоящей заявке, «подложка» относится к любому устройству или материалу, которые могут служить основой или матрицей для роста стромальных стволовых клеток жировой ткани.
Термин «шов» относится к нити или волокну или другому крепежному материалу, который можно использовать для сшивания раны.
«Однопроходная» фистула имеет одно внутреннее отверстие и одно внешнее отверстие. Фистула с «несколькими проходами(трактами)» имеет более 1 внешнего отверстия и/или более 1 внутреннего отверстия. Следовательно, многопроходная фистула имеет разные ветви. Каждое наружное отверстие обычно представляет собой тракт.
Используемый в настоящей заявке термин «лечение» относится к восстановлению фистулы или раны, а также к предотвращению ухудшения или рецидива фистулы или раны.
«Терапевтическое средство» или «терапевтический» относится к средству, способному оказывать желаемый биологический эффект на хозяина. Химиотерапевтические и генотоксические средства являются примерами терапевтических средств, которые обычно известны как химические по происхождению, в противоположность биологическим, или вызывают терапевтический эффект посредством определенного механизма действия, соответственно. Примеры терапевтических средств биологического происхождения включают факторы роста, гормоны и цитокины. Различные терапевтические средства известны в данной области и могут быть идентифицированы по их эффектам. Некоторые терапевтические средства способны регулировать пролиферацию и дифференцировку клеток. Примеры включают химиотерапевтические нуклеотиды, лекарственные средства, гормоны, неспецифические (не антитело) белки, олигонуклеотиды (например, антисмысловые олигонуклеотиды, которые связываются с нуклеиновокислотной последовательностью-мишенью (например, последовательностью мРНК)), пептиды и пептидомиметики.
2. Композиции, содержащие стромальные стволовые клетки жировой ткани
Изобретение включает композиции, содержащие стромальные стволовые клетки жировой ткани с определенными характеристиками, такими как конкретный фенотип. Например, стромальные стволовые клетки жировой ткани в клеточной композиции по изобретению могут характеризоваться экспрессией маркера на клеточной поверхности, размером, поглощением глюкозы, продукцией лактата и количеством/жизнеспособностью клеток. Еще один аспект настоящего изобретения относится к композициям, содержащим стромальные стволовые клетки жировой ткани, которые включают, в качестве клеточного компонента, по существу чистые препараты стромальных стволовых клеток жировой ткани, имеющих конкретный фенотип, или их потомство. Композиции, содержащие стромальные стволовые клетки жировой ткани по настоящему изобретению включают не только по существу чистые популяции клеток-предшественников, но могут также включать компоненты клеточных культур, например, культуральные среды, включая аминокислоты, металлы, факторы-коферменты, в также небольшие популяции других стромальных клеток, например, некоторые из которых могут возникать в результате последующей дифференциации клеток по изобретению. Кроме того, другие неклеточные компоненты могут включать компоненты, которые делают клеточный компонент подходящим для носителя в конкретных обстоятельствах, например, имплантации, например, непрерывные культуры, или подходящим для использования в качестве биоматериала или фармацевтической композиции.
В некоторых вариантах осуществления, композиции, содержащие стромальные стволовые клетки жировой ткани, получают способами культивирования, описанными в Разделе 3.
Предпочтительными ASCs являются Cx601 клетки. Предложенное (но не подтвержденное) международное непатентованное название для этих клеток ʺAdalextemcelʺ.
ASCs прилипают к пластику в стандартных условиях культивирования.
Размноженные ASC (eASC) демонстрируют фибробласт-подобную морфологию в культуре. В частности эти клетки большие и морфологически характеризуются плоским клеточным телом с несколькими клеточными выступами, которые являются длинными и тонкими. Ядро большое и круглое с четким ядрышком, придающим ядру прозрачный внешний вид. Большинство eASCS демонстрируют такую веретеноподобную морфологию, но обычным является то, что некоторые из этих клеток приобретают полигональные морфологии (Zuk et al., 2002).
Cx601 eASCs являются положительными для поверхностых маркеров HLA I, CD29, CD44, CD59, CD73, CD90 и CD105. Один вариант осуществления поэтому обеспечивает eASC-содержащую композицию, где по меньшей мере около 80%, по меньшей мере около 90%, или по меньшей мере около 95%, или типично по меньшей мере около 96%, 97%, 98% или 99% eASCs экспрессируют поверхностые маркеры HLA I, CD29, CD44, CD59, CD73, CD90 и CD105. Типично, по меньшей мере около 90% eASCs экспрессируют поверхностные маркеры HLA I, CD29, CD44, CD59, CD73, CD90 и CD105. Более типично, по меньшей мере около 95% eASCs экспрессируют поверхностные маркеры HLA I, CD29, CD44, CD59, CD73, CD90 и CD105.
CX601 eASCs являются отрицательными для HLAII, CD11b, CD11c, CD14, CD45, CD31, CD34, CD80 и CD86. Один вариант осуществления поэтому обеспечивает eASC-содержащую композицию, где меньше чем около 5% eASCs экспрессируют поверхностные маркеры HLAII, CD11b, CD11c, CD14, CD45, CD31, CD34, CD80 и CD86. Более типично, меньше чем около 4%, 3% или 2% eASCs экспрессируют поверхностные маркеры HLAII, CD11b, CD11c, CD14, CD45, CD31, CD34, CD80 и CD86. В одном варианте осуществления меньше чем около 1% eASCs экспрессируют поверхностные маркеры HLAII, CD11b, CD11c, CD14, CD45, CD31, CD34, CD80 и CD86.
В некоторых вариантах осуществления eASCs могут экспрессировать один или несколько (например, два или более, три или более, четыре или более, пять или более, шесть или семь) из HLA I, CD29, CD44, CD59, CD73, CD90 и CD105. В некоторых вариантах осуществления eASCs могут не экспрессировать один или несколько (например, два или более, три или более, четыре или более, пять или более, шесть или более, семь или восемь) из HLAII, CD11b, CD11c, CD14, CD45, CD31, CD34, CD80. В некоторых вариантах осуществления eASCs экспрессируют четыре или более из HLA I, CD29, CD44, CD59, CD73, CD90 и CD105 и не экспрессируют четыре или более из HLAII, CD11b, CD11c, CD14, CD45, CD31, CD34, CD80.
Размноженные человеческие ASCs в соответствии с некоторыми вариантами осуществления по изобретению описаны в DelaRosa et al (ʺRequirement of IFN-gamma-mediated indoleamine 2,3-dioxygenase expression in the modulation of lymphocyte proliferation by human adipose-derived stem cells.ʺ; Tissue Eng Part A. 2009 Oct;15(10):2795-806. doi: 10.1089/ten.TEA.2008.0630) и в Lopez-Santalla et al 2015 (ʺHuman Adipose-Derived Mesenchymal Stem Cells Modulate Experimental Autoimmune Arthritis by Modifying Early Adaptive T Cell Responses.ʺ STEM CELLS, 33: 3493-3503. doi: 10.1002/stem.2113)
В одном варианте осуществления (как описано в Lopez-Santalla et al 2015), аспираты жировой ткани человека от здоровых доноров промывали два раза фосфатно-солевым буферным раствором и расщепляли 0,075% коллагеназой (Type I; Invitrogen). Расщепленный образец промывали 10% фетальной бычьей сывороткой (FBS), обрабатывали при помощи 160 мМ NH4Cl для удаления оставшихся эритроцитов и суспендировали в культуральной среде [Модифицированная Дульбекко среда Игла (DMEM) с 10% FBS. Клетки высевали (2-3. 104клеток/см2) в колбы для тканевых культур и размножали (37°C, 5% CO2) с заменой культуральной среды через каждые 3-4 дня. Клетки переносили в новую колбу (103 клеток/см2), когда они достигали 90% конфлюентности. Клетки размножали до 12-14 удвоений и замораживали. Эксперименты осуществляли с клетками от взрослых доноров двух мужчин и двух женщин при 12-14 удвоениях популяции. ASCs оттаивали из тех же криобанков и высевали перед каждым экспериментом. ASCs определяли в соответствии с критериями Международного Общества Клеточной Терапии: как положительные для HLA-I, CD73, CD90 и CD105 и отрицательные для CD11b, CD14, CD31, CD34 и CD45.
В другом варианте осуществления (как описано DelaRosa et al 2009), липоаспираты, полученные из жировой ткани человека от здоровых взрослых доноров, промывали два раза при помощи PBS и расщепляли при 37°C в течение 30 минут при помощи 18Ед/мл коллагеназы типа I в PBS. Одна единица коллагеназы высвобождает 1 мМ L-лейциновых эквивалентов из коллагена за 5 часов при 37°C, pH 7,5 (Invitrogen, arlsbad, CA). Расщепленный образец промывали 10% фетальной бычьей сывороткой (FBS), обрабатывали при помощи 160 мМ ClNH4, суспендировали в культуральной среде (DMEM, содержащая 10% FBS) и фильтровали через найлоновое сито 40 меш. Клетки высевали (2-3 × 104 клеток/см2) на колбы для тканевых культур и размножали при 37°C и 5% CO2, заменяя культуральную среду каждые 7 дней. Клетки переносили в новую культуральную колбу (10008 клеток/см2), когда культуры достигали 90% конфлюентности. Клетки фенотипично характеризовали по их способности к дифференциации в хондро-, остео- и адипо-генные линии. Кроме того, hASCs подтверждали путем окрашивания специфическими поверхностными маркерами. hASCs были положительными для HLA-I, CD90 и CD105 и отрицательными для HLA-II, CD40, CD80, CD86 и CD34. В исследовани использовали группу из шести здоровых доноров (трое мужчин и три женщины, возраста между 35 и 47). Клетки использовали на 4-6 пассажах.
В некоторых вариантах осуществления ASCs (i) не экспрессируют маркеры, специфические из APCs; (ii) не экспрессируют IDO конститутивно; (iii) существенно не экспрессируют MHC II конститутивно. Типично, экспрессию IDO или MHC II можно индуцировать стимуляцией при помощи IFN-γ.
В некоторых вариантах осуществления ASCs могут экспрессировать один или несколько (например, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более или десять или более (например, до 13)) маркеров CD9, CD10, CD13, CD29, CD44, CD49A, CD51, CD54, CD55, CD58, CD59, CD90 и CD105. Например, ASCs могут экспрессировать один или несколько (например, два, три или все) из маркеров CD29, CD59, CD90 и CD105, например, CD59 и/или CD90.
В некоторых вариантах осуществления MSCs могут не экспрессировать один или несколько (например, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более, или десять или более (например, до 15)) из маркеров Фактор VIII, альфа-актин, десмин, S-100, кератин, CD11b, CD11c, CD14, CD45, HLAII, CD31, CD34, CD45, STRO-1 и CD133, например, MSCs не экспрессируют один или несколько (например, два, три или все) из маркеров CD34, CD45, CD31 и CD14, например, CD31 и/или CD34.
В одном варианте осуществления обеспечивается композиция, содержащая стромальные стволовые клетки жировой ткани, где по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95% или типично по меньшей мере около 96%, 97%, 98% или 99% стволовых клеток экспрессируют CD9, CD10, CD13, CD29, CD44, CD49A, CD51, CD54, CD55, CD58, CD59, CD90 и/или CD105 маркеры. В некоторых вариантах осуществления композиций, содержащих стромальные стволовые клетки жировой ткани, меньше чем около 15%, около 10%, около 5% и типично около 4%, 3%, 2% или 1% стволовых клеток экспрессируют CD34, CD11b, CD14, CD15, CD16, CD31, CD34, CD45, CD49f, CD102, CD104, CD106 и/или CD133 маркеры.
В другом варианте осуществления обеспечивается композиция, содержащая стромальные стволовые клетки жировой ткани, где по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95% или типично по меньшей мере около 96%, 97%, 98% или 99% стволовых клеток экспрессируют c-Kit, виментин и/или CD90 маркеры. В некоторых вариантах осуществления композиций, содержащих стромальные стволовые клетки жировой ткани, меньше чем около 15%, около 10%, около 5% и типично около 4%, 3%, 2% или 1% стволовых клеток экспрессируют маркеры CD34, Фактор VIII, альфа-актин, десмин, S-100 и/или кератин. Также обеспечивается популяция стромальных стволовых клеток жировой ткани, которые экспрессируют маркеры c-Kit, виментин и CD90 и не экспрессируют маркеры CD34, Фактор VIII, альфа-актин, десмин, S-100 и кератин.
Фенотипическую характеризацию клеточной популяции поверхностными маркерами можно осуществить либо путем индивидуального окрашивания клеток (проточная цитометрия), либо путем гистологических разрезов популяции in situ, осуществляемых в соответствии с обычными методами. Определение профиля экспрессии поверхностных маркеров при помощи антител, иммунофенотипической характеризации, можно осуществить непосредственно с использованием меченого антитела или опосредованно с использованием второго меченого антитела против первичного специфического антитела клеточного маркера, достигая, таким образом, амплификации сигнала. С другой стороны, присутствие или отсутствие связывания с антителом можно определить различными способами, которые включают, но не ограничиваются этим, иммунофлуоресцентную микроскопию и рентгенографию. Аналогичным образом, можно осуществлять контроль уровней связывания антитела при помощи проточной цитометрии, что позволяет соотносить уровни флуорохрома с количеством антигенов, присутствующих на поверхности клеток, связанным конкретно с мечеными антителами. Дифференциальная экспрессия ряда поверхностных маркеров на клеточной популяции обеспечивает метод идентификации и выделения этой популяции. Соответственно, обычно можно использовать FACS (сортинг клеток с активированной флуоресценцией).
В некоторых вариантах осуществления композиции, содержащие стромальные стволовые клетки жировой ткани, представляют собой суспензии стромальных стволовых клеток жировой ткани в различных растворах или веществах, например, для использования в качестве лекарственных средств или биоматериалов, как описано более подробно ниже. В одном варианте осуществления клеточная композиция включает суспензию стромальных стволовых клеток жировой ткани в растворе Рингера и HSA. В другом варианте осуществления клеточная композиция включает суспензию описанных стромальных стволовых клеток жировой ткани в веществе, таком как полимер, клей, гель и т.д. Такие суспензии могут быть получены, например, путем осаждения стромальных стволовых клеток жировой ткани из культуральной среды и их ресуспендирования в желаемом растворе или веществе. Клетки можно осадить и/или выделить из культуральной среды, например, путем центрифугирования, фильтрации, ультрафильтрации и т.д.
Концентрация стромальных стволовых клеток жировой ткани по изобретению в композициях по изобретению, содержащих стромальные стволовые клетки жировой ткани, может быть по меньшей мере около 5 × 106 клеток/мл, по меньшей мере около 10 × 106 клеток/мл, по меньшей мере около 20 × 106 клеток/мл, по меньшей мере около 30 × 106 клеток/мл или по меньшей мере около 40 × 106 клеток/мл. Типично концентрация находится между около 1 × 106 клеток/мл и 1 × 107 клеток/мл, например, между около между около 5 × 106 клеток/мл и 1 × 107 клеток/мл. В клинических испытаниях, описанных в Примерах, eASCs вводили при концентрации 5 миллионов клеток/мл.
Соответственно, еще один аспект настоящего изобретения относится к потомству стромальных стволовых клеток жировой ткани по изобретению, например, к клетам, происходящим из стромальных стволовых клеток жировой ткани. Такое потомство может включать последующие поколения стромальных стволовых клеток жировой ткани, а также линия-коммитированные клетки, генерируемые путем индукции дифференциации стромальных стволовых клеток жировой ткани после их выделения из эксплантата, например, индуцированных in vitro. В некоторых вариантах осуществления клетки потомства получают после около 2, около 3, около 4, около 5, около 6, около 7, около 8, около 9 или около 10 пассажей из родительской популяции. Однако клетки потомства могут быть получены после любого количества пассажей из родительской популяции.
В некоторых вариантах осуществления композиции, содержащие стромальные стволовые клетки жировой ткани по изобретению будут предоставлены как часть фармацевтического препарата, например, стерильного, свободного от присутствия нежелательных вирусов, бактерий и других патогенов, а также не содержащего пирогенов препарата. То есть для введения человеку композиции по изобретению должны соответствовать стандартам стерильности, пирогенности, а также общей безопасности и чистоты, как того требуют стандарты FDA Office of Biologics.
Размноженные стромальные стволовые клетки жировой ткани являются аллогенными по отношению к хозяину трансплантации. Из-за трудностей с получением достаточных аутологичных стволовых клеток стромальная стволовая клетка жировой ткани от аллогенного донора представляет собой ценный альтернативный источник стволовых клеток для терапевтического применения. В данной области известно, что стромальные стволовые клетки костного мозга и стромальные клетки жировой ткани не провоцировали ответ аллогенных лимфоцитов in vitro, и, следовательно, аллогенные стромальные стволовые клетки жировой ткани, полученные от донора, можно использовать для любого пациента, независимо от МНС несовместимости.
Способы введения композиций, содержащих стромальные стволовые клетки жировой ткани, субъектам, особенно людям, которые подробно описаны в настоящей заявке, включают инъекцию или имплантацию клеток в целевые участки у субъектов, клетки могут быть включены в устройство для доставки, которое облегчает введение, инъекцию или имплантацию клеток субъектам. Такие устройства доставки включают трубки, например катетеры, для инъекции клеток и жидкостей субъекту-реципиенту. В предпочтительном варианте осуществления трубки также имеют иглу, например шприц, через которую композиции, содержащие стромальные стволовые клетки жировой ткани, можно вводить субъекту в нужное место. Композиции, содержащие стромальные стволовые клетки жировой ткани, могут быть включены в такое устройство доставки, например шприц, в различных формах. Например, композиции, содержащие стромальные стволовые клетки жировой ткани, включают композиции стромальных стволовых клеток жировой ткани, которые суспендированы в растворе или заключены в поддерживающую матрицу, когда они содержатся в таком устройстве для доставки.
Фармацевтически приемлемые носители и разбавители включают физиологический раствор, водные буферные растворы, растворители и/или дисперсионные среды. Использование таких носителей и разбавителей хорошо известно в данной области. Раствор обычно является стерильным и жидким до такой степени, что он легко шприцуется. Как правило, раствор является стабильным в условиях получения и хранения, и устойчивость против загрязняющего действия микроорганизмов, таких как бактерии и грибы, достигается с использованием, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Растворы, которые представляют собой композиции стромальных стволовых клеток жировой ткани по изобретению, можно получить путем включения стромальных стволовых клеток жировой ткани, описанных в настоящей заявке, в фармацевтически приемлемый носитель или разбавитель с использованием, при необходимости, других ингредиентов, перечисленных выше, с последующей стерилизацией фильтрованием.
Некоторые примеры веществ и растворов, которые могут служить в качестве фармацевтически приемлемых носителей, включают следующие: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлоза и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этилаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический физиологический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) рН буферные растворы; (21) полиэфиры, поликарбонаты и/или полиангидриды; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических препаратах.
В некоторых вариантах осуществления композиции, содержащие стромальные стволовые клетки жировой ткани, дополнительно включают адгезив. В некоторых вариантах осуществления адгезив представляет собой адгезив на основе фибрина, такой как фибриновый гель или фибриновый клей, или полимер на основе фибрина или адгезив, или другой тканевый адгезив или хирургический клей, такой как, например цианоакрилат, коллаген, тромбин и полиэтиленгликоль. Другие вещества, которые можно использовать, включают, но не ограничиваются этим, альгинат кальция, агарозу, типы I, II, IV или другую изоформу коллагена, полимолочную/полигликолевую кислоту, гиалуронатные производные или другие вещества (Perka C. et al. 2000) J. Biomed, Mater. Res., 49: 305-311, Sechriest VF et al. (2000) J. Biomed. Mater. Res., 49: 534-541; Chu CR et al. (1995) J. Biomed Ment. Res., 29: 1147-1154; Hendrickson DA et al. (1994) Orthop. Res. 12: 485-497). В других вариантах осуществления адгезив представляет собой жидкую повязку, в которой композиции, содержащие стромальные стволовые клетки жировой ткани, смешаны с жидким перевязочным материалом. «Жидкая повязка» представляет собой раствор, содержащий соединение, например, полимерное вещество, которое наносят на рану распылителем или кистью, с последующим удалением растворителя путем испарения для обеспечения защитной пленки на ране.
Композиции, содержащие стромальные стволовые клетки жировой ткани, также можно использовать для покрытия подложки, например, медицинского устройства. Например, подложка может представлять собой шов или нить.
Покрытие подложки клетками можно осуществить любым способом, как известно специалистам в данной области техники, например, путем пропитки, распыления, окраски, импринтинга и т.д.
В одном варианте осуществления подложка представляет собой шов, шовную скобу, абсорбируемую нить, неабсорбируемую нить, натуральную нить, синтетическую нить, монофиламентную нить или мультифиламентную нить (также называемую шнуром). Предпочтительные способы получения швов и других подложек, используемых для закрытия ран, покрытых стромальными стволовыми клетками жировой ткани, раскрыты в патентной заявке США № 11/056241 «Biomaterial for Suturing», поданной 14 февраля 2005 года, которая включена посредством ссылки во всей полноте. Композиции, содержащие стромальные стволовые клетки жировой ткани, раскрытые в настоящей заявке, представляют собой новые композиции, которые можно использовать со способами, раскрытыми в патентной заявке США № 11/056241.
Кроме того, в любой композиции, содержащей стромальные стволовые клетки жировой ткани, по меньшей мере одно терапевтическое средство может быть включено в композицию (хотя и не требуется и, необязательно, может быть исключено). Например, композиция может содержать анальгетик, способствующий лечению воспаления или боли в месте фистулы, или противоинфекционное средство для предотвращения инфицирования участка, обрабатываемого композицией.
Более конкретно, неограничивающие примеры полезных терапевтических средств включают следующие терапевтические категории: анальгетики, такие как нестероидные противовоспалительные лекарственные средства, агонисты опиатов и салицилаты; противоинфекционные антибиотики, такие как антигельминтные средства, антианаэробные средства, аминогликозидные антибиотики, противогрибковые антибиотики, цефалоспориновые антибиотики, макролидные антибиотики, различные β-лактамные антибиотики, пенициллиновые антибиотики, хинолоновые антибиотики, сульфонамидные антибиотики, тетрациклиновые антибиотики, антимикобактериальные средства, антимикобактериальные средства против туберкулеза, антипротозойные средства, противомалярийные антипротозойные средства, антивирусные средства, антиретровирусные средства, скабициды, противовоспалительные средства, кортикостероидные противовоспалительные средства, противозудные средства/местные анестетики, противоинфекционные средства для местного применения, противогрибковые противовоспалительные средства для местного применения, антивирусные противовоспалительные средства для местного применения, электролитические и почечные средства, такие как подкисляющие средства, подщелачивающие средства, диуретики, диуретики-ингибиторы карбоангидразы, петлевые диуретики, осмотические диуретики, калийсберегающие диуретики, тиазидные диуретики, заменители электролитов и урикозурические средства; ферменты, такие как ферменты поджелудочной железы и тромболитические ферменты; желудочно-кишечные средства, такие как антидиарейные средства, противорвотные средства, желудочно-кишечные противовоспалительные средства, салицилатные желудочно-кишечные противовоспалительные средства, антацидные противоязвенные средства, противоязвенные средства ингибиторы протонного насоса-желудочной кислоты, средства против язвы слизистой оболочки желудка, противоязвенные средства H2-блокаторы, холелитолитические средства, средства, способствующие пищеварению, рвотные средства, слабительные и смягчающие стул средства и прокинетические средства; общие анестетики, такие как ингаляционные анестетики, галоидированные ингаляционные анестетики, внутривенные анестетики, барбитуратные внутривенные анестетики, бензодиазепиновые внутривенные анестетики и внутривенные анестетики, являющиеся опиатными агонистами; гормоны и модификаторы гормонов, такие как абортивные средства, адренергические средства, кортикостероидные адренергические средства, андрогены, антиандрогены, иммунобиологические средства, такие как иммуноглобулины, иммунодепрессанты, токсоиды и вакцины; местные анестетики, такие как амидные местные анестетики и эфирные местные анестетики; скелетно-мышечные средства, такие как противовоспалительные средства против подагры, кортикостероидные противовоспалительные средства, противовоспалительные средства, содержащие соединения золота, иммунодесупрессорные противовоспалительные средства, нестероидные противовоспалительные лекарственные средства (НПВЛС), салицилатные противовоспалительные средства, минералы; и витамины, такие как витамин А, витамин В, витамин С, витамин D, витамин Е и витамин К.
Предпочтительные классы полезных терапевтических средств из вышеуказанных категорий включают: (1) анальгетики в целом, такие как лидокаин или его производные, нестероидные противовоспалительные (НПВЛС) анальгетики, включая диклофенак, ибупрофен, кетопрофен и напроксен; (2) анальгетики, являющиеся опиатными агонистами, такие как кодеин, фентанил, гидроморфон и морфин; (3) салицилатные анальгетики, такие как аспирин (ASA) (ASA с энтеросолюбильным покрытием); (4) антигистаминовые H1-блокаторы, такие как клемастин и терфенадин; (5) противоинфекционные средства, такие как мупироцин; (6) антианаэробные противоинфекционные средства, такие как хлорамфеникол и клиндамицин; (7) противогрибковые антибиотические противоинфекционные средства, такие как амфотерицин b, клотримазол, флуконазол и кетоконазол; (8) макролидные антибиотические противоинфекционные средства, такие как азитромицин и эритромицин; (9) разные β-лактамные антибактериальные противоинфекционные средства, такие как азтреонам и имипенем; (10) противоинфекционные пенициллиновые антибиотики, такие как нафциллин, оксациллин, пенициллин G и пенициллин V; (11) противоинфекционные хинолоновые антибиотики, такие как ципрофлоксацин и норфлоксацин; (12) противоинфекционные тетрациклиновые антибиотики, такие как доксициклин, миноциклин и тетрациклин; (13) противотуберкулезные антимикобактериальные противоинфекционные средства, такие как изониазид (INH) и рифампин; (14) антипротозойные противоинфекционные средства, такие как атоваквон и дапсон; (15) противомалярийные антипротозойные противоинфекционные средства, такие как хлорохин и пириметамин; (16) антиретровирусные противоинфекционные средства, такие как ритонавир и зидовудин; (17) антивирусные противоинфекционные средства, такие как ацикловир, ганцикловир, интерферон альфа и римантадин; (18) противогрибковые противовоспалительные средства, такие как амфотерицин B, клотримазол, миконазол и нистатин; (19) антивирусные противовоспалительные средства, такие как ацикловир; (20) электролитические и почечные средства, такие как лактулоза; (21) петлевые диуретики, такие как фуросемид; (22) калийсберегающие диуретики, такие как триамтерен; (23) тиазидные диуретики, такие как гидрохлоротиазид (HCTZ); (24) урикозурические средства, такие как пробенецид; (25) ферменты, такие как РНКаза и ДНКаза; (26) противорвотные средства, такие как прохлорперазин; (27) салицилатные желудочно-кишечные противовоспалительные средства, такие как сульфасалазин; (28) противоязвенные средства-ингибиторы протонного насоса-желудочной кислоты, такие как омепразол; (29) противоязвенные средства Н2-блокаторы, такие как циметидин, фамотидин, низатидин и ранитидин; (30) средства, способствующие пищеварению, такие как панкрелапаза; (31) прокинетические средства, такие как эритромицин; (32) эфирные местные анестетики, такие как бензокаин и прокаин; (33) костно-мышечные кортикостероидные противовоспалительные средства, такие как беклометазон, бетаметазон, кортизон, дексаметазон, гидрокортизон и преднизон; (34) костно-мышечные противовоспалительные иммуносупрессорные средства, такие как азатиоприн, циклофосфамид и метотрексат; (35) костно-мышечные нестероидные противовоспалительные лекарственные средства (НПВЛС), такие как диклофенак, ибупрофен, кетопрофен, кеторлак и напроксен; (36) минералы, такие как железо, кальций и магний; (37) соединения витамина В, такие как цианокобаламин (витамин B12) и ниацин (витамин B3); (38) соединения витамина С, такие как аскорбиновая кислота; и (39) соединения витамина D, такие как кальцитриол.
В некоторых вариантах осуществления терапевтическое средство может представлять собой фактор роста или другую молекулу, которая влияет на дифференциацию и/или пролиферацию клеток. Факторы роста, которые индуцируют конечные состояния дифференциации, хорошо известны в данной области и могут быть выбраны из любого такого фактора, который, как было показано, индуцирует конечное состояние дифференциации. Факторы роста для использования в описанных в настоящей заявке способах могут, в некоторых вариантах осуществления, представлять собой варианты или фрагменты природного фактора роста. Например, вариант может быть получен путем внесения консервативных аминокислотных изменений и тестирования полученного варианта в одном из описанных выше функциональных анализов или в другом функциональном анализе, известном в данной области. Консервативные аминокислотные замены относятся к взаимозаменяемости остатков, имеющих сходные боковые цепи. Например, группа аминокислот, имеющих алифатические боковые цепи, включает глицин, аланин, валин, лейцин и изолейцин; группа аминокислот, имеющих алифатические-гидроксильные боковые цепи, включает серин и треонин; группа аминокислот, имеющих амид-содержащие боковые цепи, включает аспарагин и глутамин; группа аминокислот, имеющих ароматические боковые цепи, включает фенилаланин, тирозин и триптофан; группа аминокислот, имеющих основные боковые цепи, включает лизин, аргинин и гистидин; и группа аминокислот, имеющих серосодержащие боковые цепи, включает цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин.
Как будет понятно специалистам в данной области, варианты или фрагменты полипептидных факторов роста могут быть получены с использованием обычных методов, таких как мутагенез, включая создание дискретной точечной мутации(мутаций), или путем усечения. Например, мутация может приводить к вариантам, которые сохраняют по существу такую же или просто подкласс биологической активности полипептидного фактора роста, из которого они происходят.
3. Способы получения композиций, содержащих стромальные стволовые клетки жировой ткани
Способы для выделения и культивирования ASCs для получения eASCs и клеточных популяций по изобретению и композиций, включающих клеточные популяции по изобретению, известны в данной области техники. Типично способы для получения композиций, включающих клеточные популяции, включают следующие стадии:
(i) выделение ASCs из стромальной фракции жировой ткани и отбор на основании адгезии к подходящей поверхности, например, пластику
(ii) размножение ASCs с обеспечением клеточных популяций по изобретению, включающих eASCs.
Необязательно, клеточные популяции по изобретению могут быть криоконсервированы во время и/или после стадии размножения (ii). Необязательно, фенотип клеточных популяций по изобретению можно оценить во время и/или после стадии размножения (ii). Необязательно, клеточные популяции по изобретению можно выделить после стадии размножения (ii) и ресуспендировать в фармацевтически приемлемом носителе и/или разбавителе.
ASC можно получить любыми стандартными способами, импользуемыми в данной области техники. Обычно указанные клетки получают путем диссоциации клеток из исходной ткани (например, липоаспирата или жировой ткани), как правило, путем обработки ткани расщепляющим ферментом, таким как коллагеназа. Затем расщепленную ткань фильтруют через фильтр примерно от 20 микрон до 1 мм. Затем клетки выделяют (обычно путем центрифугирования) и культивируют на адгезивной поверхности (типично планшеты или колбы для тканевых культур). Такие способы известны в данной области и, например, описаны в патенте США № 6777231. Согласно этой методике липоаспираты получают из жировой ткани и клетки выделяют из них. В этом методе клетки можно промыть для удаления загрязняющего дебриса и красных клеток крови, предпочтительно при помощи PBS. Клетки расщепляют коллагеназой (например, при 37°C в течение 30 минут, 0,075% коллагеназы, тип I, Invitrogen, Carlsbad, CA) в PBS. Для удаления оставшихся эритроцитов расщепленный образец можно промыть (например, 10% фетальной бычьей сывороткой), обработать при помощи 160 ммоль/л ClNH4 и, наконец, суспендировать в полной среде DMEM (DMEM, содержащая 10% FBS, 2 ммоль/л глутамина и 1% пенициллина/стрептомицина). Клетки можно фильтровать через 40-мкм нейлоновое сито.
Клетки культивируют в подходящем сосуде для культивирования ткани, имеющем поверхность, подходящую для адгезии ASC, например, пластик. Неадгезивные клетки удаляют, например, путем промывки в подходящем буфере, чтобы обеспечить выделенную популяцию прилипающих стромальных клеток (например, ASC). Выделенные, таким образом, клетки могут быть посеяны (предпочтительно 2-3 × 104 клеток/см2) в колбы для тканевых культур и размножены при 37°C и 5% CO2, с заменой культуральной среды каждые 3-4 дня. Клетки предпочтительно отделяют от адгезивной поверхности (например, с помощью трипсина) и пропускают («пересаживают») в новую культуральную колбу (1000 клеток/см2), когда культуры достигают около 90% конфлюентности.
Выделение клеток предпочтительно осуществляют в стерильных или GMP условиях.
В одном варианте осуществления способ включает: (а) сбор жировой ткани у субъекта; (b) получение суспензии клеток ферментативным расщеплением; (c) осаждение клеточной суспензии и ресуспендирование клеток в культуральной среде; (d) культивирование клеток в течение по меньшей мере 10 дней; и (g) размножение клеток по меньшей мере в течение двух пассажей культуры.
Стромальные стволовые клетки жировой ткани являются аллогенными, то есть не выделенными из жировой ткани субъекта, которому должна быть введена конечная композиция, содержащая стромальные стволовые клетки жировой ткани.
В некоторых вариантах осуществления клетки культивируют в течение по меньшей мере около 15, по меньшей мере около 20 дней, по меньшей мере около 25 дней или по меньшей мере около 30 дней. Как правило, размножение клеток в культуре улучшает гомогенность клеточного фенотипа в клеточной популяции, таким образом, получают по существу чистую или гомогенную популяцию.
В некоторых вариантах осуществления клетки размножают в культуре по меньшей мере в течение трех пересевов культуры или «по меньшей мере трех пассажей». В других вариантах осуществления пассаж клеток осуществляют по меньшей мере четыре раза, по меньшей мере пять раз, по меньшей мере шесть раз, по меньшей мере семь раз, по меньшей мере восемь раз, по меньшей мере девять раз или по меньшей мере десять раз. Предпочтительно, когда пассаж клеток осуществляют более трех раз, чтобы улучшить гомогенность клеточного фенотипа в клеточной популяции. Действительно, клетки можно размножать в культуре неограниченно, при условии, что гомогенность клеточного фенотипа улучшается и способность к дифференциации сохраняется.
В некоторых вариантах осуществления клетки размножаются в культуре до по меньшей мере трех удвоений популяции. В некоторых вариантах осуществления клетки размножаются в культуре по меньшей мере до четырех, пяти, шести, семи, восьми, девяти, десяти, 15 или 20 удвоений популяции. В некоторых вариантах осуществления клетки размножаются в культуре до менее чем семи, восьми, девяти, десяти, 15 или 20 удвоений популяции. В некоторых вариантах осуществления клетки размножаются в культуре до примерно от 5 до 10 удвоений популяции. В некоторых вариантах осуществления клетки размножаются в культуре в пределах от 10 до 15 удвоений популяции.
В некоторых вариантах осуществления клетки размножаются в культуре до примерно от 15 до 20 удвоений популяции, например, около 16 удвоений в популяции.
Клетки можно культивировать любым способом, известным в данной области для культивирования стволовых клеток. Обсуждение различных методов культивирования, а также увеличение их масштаба можно найти в Freshney, RI, Culture of Animal Cells: A Manual of Basic Technique, 4th Edition, Wiley-Liss 2000. Клетки можно размножать с использованием культуральных колб или биореакторов, подходящих для крупномасштабного размножения. Биореакторы, подходящие для крупномасштабного размножения мезенхимальных стромальных клеток, являются коммерчески доступными и могут включать как 2D (то есть, по существу, планарные), так и 3D биореакторы для размножения клеток. Примеры таких биореакторов включают, но не ограничиваются этим, биореактор с пробковым поршневым потоком, перфузионный биореактор, биореактор с непрерывным перемешиванием, биореактор с неподвижным слоем. В некоторых вариантах осуществления клетки культивируют путем монослойного культивирования. В одном варианте осуществления клетки культивируют и осуществляют их пересев, как описано в примере А ниже.
Можно использовать любую среду, способную поддерживать стромальные клетки в тканевой культуре. Композиции сред, которые будут поддерживать рост фибробластов, включают, но не ограничиваются этим, модифицированную Дульбекко среду Игла (DMEM), альфа-модифицированную минимальную основную среду (alpha.MEM) и среду Roswell Park Memorial Institute Media 1640 (RPMI Media 1640) и т.п. Как правило, к вышеуказанным средам добавляют 0-20% фетальной бычьей сыворотки (FBS) или 1-20% лошадиной сыворотки для поддержания роста стромальных клеток и/или хондроцитов. Однако среду с определенным составом можно использовать, если необходимые факторы роста, цитокины и гормоны в FBS для стромальных клеток и хондроцитов идентифицированы и обеспечиваются при соответствующих концентрациях в среде роста. Среды, полезные в способах по изобретению, могут содержать одно или несколько представляющих интерес соединений, включая, но не ограничиваясь ими, антибиотики, митогенные или дифференцирующие соединения для стромальных клеток. Клетки следует выращивать при температуре от 31°С до 37°С в увлажненном инкубаторе. Содержание диоксида углерода необходимо поддерживать от 2% до 10%, а содержание кислорода от 1% до 22%. Клетки могут оставаться в этой среде до 4 недель.
Антибиотики, которые можно добавить в среду, включают, но не ограничиваются этим, пенициллин и стрептомицин. Концентрация пенициллина в химически определенной культуральной среде составляет от около 10 до около 200 единиц на мл. Концентрация стрептомицина в химически определенной культуральной среде составляет от примерно 10 до примерно 200 мкг/мл.
Стромальные стволовые клетки жировой ткани можно стабильно или транзиентно трансфицировать или трансдуцировать представляющей интерес нуклеиновой кислотой с использованием плазмидной, вирусной или альтернативной векторной стратегии. Нуклеиновые кислоты, представляющие интерес, включают, но не ограничиваются этим, кодирующие генные продукты, которые усиливают продуцирование компонентов внеклеточного матрикса, обнаруженных в типе ткани, подлежащем восстановлению, например, стенки кишечника или стенки влагалища.
Трансдукцию вирусных векторов, несущих регуляторные гены, в стромальные стволовые клетки, можно осуществить при помощи вирусных векторов (аденовирусного, ретровирусного, аденоассоциированного вирусного или другого вектора), очищенных путем связывания с хлоридом цезия или другим методом при множественности заражения (вирусные единицы:клетка) от 10:1 до 2000:1. Клетки будут подвергаться воздействию вируса в бессывороточной или в содержащей сыворотку среде в отсутствие или в присутствии катионного детергента, такого как полиэтиленимин или Липофектамин ТМ, в течение от 1 часа до 24 часов (Byk T. et al., 1998) Human Gene Therapy 9: 2493-2502, Sommer B. et al. (1999) Calcif. Tissue Int., 64: 45-49).
Другие подходящие способы переноса векторов или плазмид в стволовые клетки включают липид/ДНК комплексы, такие как комплексы, описанные в патентах США №№ 5578475; 5627175; 5705308; 5744335; 5976567; 6020202; и 6051429. Подходящие реагенты включают липофектамин, липосомную композицию 3:1 (масс/масс) поликатионного липида 2,3-диолеилокси-N-[2 (сперминкарбоксиамидо)этил]-N,N-диметил-1-пропанаминий трифторацетата (DOSPA) (зарегистрированное название Chemical Abstracts: N-[2-(2,5-бис[(3-аминопропил)амино]-1-окспентил}амино)этил]-N,N-диметил-2,3-бис(9-октадеценилокси)-1-пропанаминий трифторацетат) и нейтрального липида диолеоилфосфатидилэтаноламина (DOPE) в отфильтрованной через мембранный фильтр воде. Примером может служить препарат Липофектамина 2000TM (доступен от Gibco/Life Technologies # 11668019). Другие реагенты включают: реагент для трансфекции FuGENETM 6 (смесь липидов в не-липосомной форме и других соединений в 80% этаноле, доступный от Roche Diagnostics Corp. # 1814443); и реагент для трансфекции LipoTAXITM (липидный препарат от Invitrogen Corp., № 204110). Трансфекцию стволовых клеток можно осуществлять электропорацией, например, как описано в M.L. Roach and J.D. McNeish (2002) Methods in Mol. Biol. 185: 1. Подходящие вирусные векторные системы для продукции стволовых клеток со стабильными генетическими изменениями могут быть основаны на аденовирусах и ретровирусах, и их можно получить с использованием коммерчески доступных вирусных компонентов.
Трансфекцию плазмидных векторов, несущих регуляторные гены, в стромальные стволовые клетки можно осуществить в монослойных культурах с использованием метода осаждения ДНК при помощи фосфата кальция или методов с использованием катионных детергентов (Lipofectamine®, DOTAP) или в трехмерных культурах путем включения векторов на основе плазмидной ДНК непосредственно в биосовместимый полимер (Bonadio J. et al., 1999) Nat. Med., 5: 753-759).
Для отслеживания и детекции функциональных белков, кодируемых этими генами, векторы на основе вирусной или плазмидной ДНК будут содержать легко обнаруживаемый маркерный ген, такой как зеленый флуоресцентный белок или фермент бета-галактозидазу, которые оба могут отслеживаться гистохимическими средствами.
4. Лечение сложных перианальных фистул
Изобретение относится к лечению сложных перианальных фистул у пациентов с болезнью Крона с использованием размноженных аллогенных стромальных стволовых клеток жировой ткани. Стромальные стволовые клетки жировой ткани типично представляют собой композицию, содержащую стромальные стволовые клетки жировой ткани, описанную в настоящей заявке, иногда указываемую как ʺCx601ʺ. Однако другие препараты стромальных стволовых клеток жировой ткани можно использовать в способах, описанных в настоящей заявке, например, такие, которые описаны в патентах США №№ 6777231 и 6555374 и патентной заявке США № 11/065461 ʺIdentification and Isolation of Multipotent Cells From Non-Osteochondral Mesenchymal Tissueʺ, поданной 25 февраля 2005 года.
Примеры показывают, что аллогенные eASC представляют собой удивительно эффективную терапию сложных перианальных фистул у пациентов с болезнью Крона, благодаря чему одно введение способно обеспечить быстрый и продолжительный терапевтический эффект даже при самых трудно поддающихся лечению очень сложных фистулах, которые не отвечали на предыдущие лечения. Например, пользу обычно наблюдают примерно через 6 недель, и такая польза обычно поддерживается до 24 недель после лечения.
В одном варианте осуществления способ лечения сложной рефракторной перианальной фистулы у пациента с болезню Крона включает инъекцию около 120 млн размноженных аллогенных стромальных стволовых клеток жировой ткани внутрь пораженной ткани, во все проходы фистулы. Во избежание сомнений, в этом варианте осуществления 120 миллионов клеток вводят пациенту за одну процедуру, причем каждый фистулярный тракт получает по меньшей мере часть этой дозы. Приблизительно половина дозы вводится в ткань, окружающую внутреннее отверстие или отверстия. Другая половина вводится в стенки фистул (не глубже 2 мм) по всему проходу (проходам) фистулы, образуя несколько микроподушечек. Данные в примерах показывают, что такое разовое введение способно обеспечить комбинированную ремиссию через 24 недели или менее, даже примерно через 6 недель или примерно через 8 недель. Соответственно, в одном варианте осуществления лечение состоит из этого разового внутривенного введения 120 миллионов eASC.
Инъекцию внутрь пораженной ткани обычно осуществляют, как в приведенном в качестве примера клиническом испытании, где клеточную суспензию вводят через внутреннее отверстие (при этом шприц проходит через анус) и через стенки фистулярного тракта (при этом шприц проходит через внешнее отверстие фистулы).
Пациентом может быть субъект мужского или женского пола. Пациент обычно является взрослым.
В одном варианте осуществления любой шовный материал, который может присутствовать, сначала удаляется. Как правило, перед введением eASC фистулу выскабливают. Необязательно, внутренние отверстия можно зашить. Затем вводят eASC через тонкую длинную иглу. Как отмечалось выше, примерно половина дозы вводится в ткань, окружающую зашитое внутреннее отверстие (отверстия). Другая половина вводится в стенки фистул (не глубже 2 мм) по всему проходу(проходам) фистулы, образуя несколько микроподушечек.
Перед проведением терапии в соответствии с настоящим изобретением МРТ-исследование области таза можно осуществить при скрининге для направления хирургических процедур. Пациенты могут также проходить процедуру выскабливания фистул и наложения лигатуры, как клинически показано, за ≥2 недели до введения исследуемого продукта (Фиг.1). Если осуществляли наложение лигатуры, ее удаляют непосредственно перед введением исследуемого продукта.
Пациент, подлежащий лечению, имеет болезнь Крона, как правило, люминальную форму болезни Крона. Как правило, пациент имеет неактивную или умеренно активную люминальную форму болезни Крона, например, как определено на основании индекса активности болезни Крона (CDAI) ≤220 A24. У пациента может быть болезнь Крона в течение как минимум 6 месяцев.
Пациент имеет по крайней мере одну сложную перианальную фистулу. В одном варианте осуществления у пациента нет ректавовагинальной фистулы, ректального стеноза, анального стеноза, активного тяжелого проктита (определяемого присутствием поверхностных или глубоких язв), отводящих стом или абсцесса или скоплений >2 см, которые не были устранены хирургической подготовительной процедурой.
Пациенты невосприимчивы, по меньшей мере, к одной предыдущей лекарственной терапии. Предыдущая терапия может представлять собой низкомолекулярное лекарственное средство или биологический лекарственный продукт. Обычно пациент получал указанное лечение в течение по меньшей мере около 4, 6, 12, 18, 24 или 36 недель, и у него все еще имеются симптомы активного заболевания. Другими словами, даже после лечения по меньшей мере около 4, 6, 12, 18, 24 или 36 недель тяжесть фистулы не улучшается. Предыдущая терапия может включать терапию антибиотиками, такими как ципрофлоксацин или метронидазол, иммуносупрессорную терапию (например, пуриновый аналог, такой как азатиоприн или 6-меркаптопурин, пирминидиновый аналог, такой как фторурацил, или аналог фолиевой кислоты, такой как метотрексат) или анти-TNF терапию, такую как Адалимумаб (Humira), Цертолизумаб (Cimzia), Этанерцепт (Enbrel), Голимумаб (Simponi) или Инфликсимаб (Remicade). Подходящие пациенты обычно являются резистентными (без ответа) по меньшей мере к одному из следующих лечений: после 1 месяца введения антибиотиков (например, ципрофлоксацин, метронидазол); и/или после 3 месяцев введения иммунодепрессантов (например, азатиоприн, 6-меркаптопурин); и/или индукции или поддержания анти-TNF терапии (например, инфликсимаб, этанерцепт, адалимумаб, цертолизумаб, голимумаб) при стабильной дозе.
В одном варианте осуществления пациент резистентен к лечению иммунодепрессантом (например, азатиоприн, 6-меркаптопурин) и ингибитором TNF-альфа (например, инфликсимаб или адалимумаб).
Таким образом, типичный пациент имеет неактивную люминальную форму болезни Крона (CDAI ≤220), диагностированную в течение по меньшей мере шести месяцев, со сложной перианальной фистулой, имеющей 1 или 2 внутренних отверстия и 2 или 3 внешних отверстия, которая показала неадекватный ответ на один или несколько антибиотиков, иммунодепрессантов или анти-TNF терапий. Фистула с 1 или 2 внутренними отверстиями и 3 внешними отверстиями является чрезвычайно сложной и до сих пор трудно поддается лечению. В другом варианте осуществления во время лечения в соответствии с изобретением пациент (а) не получает никакой анти-TNF терапии и никакой терапии иммунодепрессантами или (b) получает как анти-TNF терапию, так и терапию иммунодепрессантами. Особенно удивительно то, что eASC способны значительно улучшить комбинированную ремиссию (к неделе 24) у пациентов, получающих как анти-TNF терапию, так и терапию иммунодепрессантами, которые являются лучшими доступными в настоящее время терапиями (см. Фиг. 3C).
Сложная перианальная фистула имеет по меньшей мере два внешних отверстия, например, 3 или более внешних отверстий. Некоторые фистулы могут иметь 4 или 5 внешних отверстий.
Сложная перианальная фистула обычно имеет несколько проходов, по меньшей мере два внутренних отверстия или три внешних отверстия. Фистула необязательно может иметь два или три из этих признаков, например: несколько проходов и по меньшей мере два внутренних отверстия; несколько проходов и три внешних отверстия; по меньшей мере два внутренних отверстия и три внешних отверстия; или несколько проходов, по меньшей мере два внутренних отверстия и три внешних отверстия. В одном варианте осуществления сложная перианальная фистула имеет не более двух внутренних отверстий и трех внешних отверстий, например, фистула состоит из 1 или 2 внутренних отверстий(IO) и 2 или 3 внешних отверстий(EO) (например, 1IO/2EO, 1IO/3EO, 2IO/2EO или 2IO/3EO).
После введения eASC пациентов необязательно можно лечить антибиотиками в течение не более 4 недель. Иммунодепрессанты и анти-TNF средства можно поддерживать при стабильных дозах на протяжении всего периода лечения, например, вплоть до ответа, клинической ремиссии или комбинированной ремиссии.
Пациенты, которые не получали предшествующего лечения перианально фистулизирующей болезни Крона, включая антибиотики, и те, которые ранее перенесли операцию по поводу активной фистулы, отличную от дренирования или наложения лигатуры, как правило, исключаются. Пациенты обычно не являются подходящими для лечения, если они получали глюкокортикостероиды в течение 4 недель непосредственно перед eASC лечением. Курс стероидов может быть разрешен для лечения вспышек люминальной болезни во время последующего наблюдения с начальной дозой 40 мг в течение максимум 12 недель.
В некоторых вариантах осуществления, например, в которых первая доставка клеток недостаточна, способ может дополнительно включать дальнейшее введение eASC. Это дополнительное введение может включать: (c) доставку второй дозы по меньшей мере около 20 × 106 клеток, по меньшей мере около 30 × 106 или, по меньшей мере около 40 × 106 стромальных стволовых клеток жировой ткани, например около 120 миллионов клеток, например, в композиции, содержащей стромальные стволовые клетки жировой ткани, во внутреннее отверстие (необязательно закрытое наложением швов) и стенки фистулы.
В некоторых вариантах осуществления способ лечения рефракторной сложной перианальной фистулы у субъекта включает: (а) закрытие внутреннего отверстия швом, который включает аллогенные eASC. Такие швы, покрытые клетками в композициях, содержащих стромальные стволовые клетки жировой ткани, описаны подробно в патентной заявке США № 11/056241, поданной 14 февраля 2005 г., которая включена в настоящую заявку посредством ссылки.
Способы могут в некоторых вариантах осуществления дополнительно включать: глубокое выскабливание по меньшей мере одного фистулярного тракта; и/или заполнение указанного фистулярного тракта материалом. В некоторых вариантах осуществления способ может дополнительно включать доставку по меньшей мере около 10 × 106 стромальных стволовых клеток жировой ткани, например, из рассматриваемой клеточной композиции в материал. Как правило, материал представляет собой полимер или адгезив на основе фибрина, такой как фибриновый клей или гель. В некоторых вариантах осуществления доза по меньшей мере около 10 × 106 стромальных стволовых клеток жировой ткани уже включена в материал, например, чтобы материал включал композицию, содержащую стволовые клетки жировой ткани.
В еще одном варианте осуществления способ лечения фистулы у субъекта включает:
(i) глубокое выскабливание по меньшей мере одного фистулярного тракта
(ii) закрытие внутреннего отверстия вычещенного тракта наложением шва
(iii) доставку около 120 миллионов аллогенных размноженных стромальных стволовых клеток жировой ткани в (необязательно закрытое швом) внутреннее отверстие и стенки фистулы,
например, в композиции, содержащей стромальные стволовые клетки жировой ткани по изобретению.
Дополнительное введение клеток не требуется и необязательно может быть исключено. Однако в некоторых вариантах осуществления способ может дополнительно включать:
(iv) доставку второй дозы по меньшей мере около 20 × 106 клеток, по меньшей мере около 30 × 106 или по меньшей мере около 40 × 106 стромальных стволовых клеток жировой ткани, например, около 120 миллионов eASCs, типично в закрытое швом внутреннее отверстие,
например, в композиции, содержащей стромальные стволовые клетки жировой ткани по изобретению.
Стадию (i) типично осуществляют путем глубокого выскабливания всех фистулярных проходов, подлежащих обработке, например, кюретажную иглу вводят в фистулярный тракт и индуцируют кровотечение путем выскабливания стенки фистулы для получения природного фибрина, который будет заполнять фистулярный тракт. Предыдущие клинические исследования, осуществленные авторами настоящего изобретения, говорят о том, что природный фибрин, получаемый таким способом выскабливания, является предпочтительным вариантом по сравнению с использованием искусственных фибриновых тканевых клеев, поэтому в предпочтительном варианте осуществления способа по изобретению фистулярные проходы, подлежащие обработке, не заполняют такими материалами.
Стадию (iv) осуществляют путем целенаправленной доставки клеток, например композиции, содержащей стромальные стволовые клетки жировой ткани, путем инъекции в стенки фистулы вдоль фистулярного тракта. Например, несколько инъекций по 10 миллионов клеток вдоль 3 см фистулярного тракта.
Фистулу можно оценить для восстановления хирургическим путем любым способом, известным в данной области техники, например, при помощи разреза, катетера и т.д.
Способы, описанные выше, также могут включать введение терапевтического средства субъекту, которого лечат, например, системно или местно в место сшивания. В некоторых вариантах осуществления стромальные стволовые клетки жировой ткани сформулированы в композицию, содержащую стромальные стволовые клетки жировой ткани, которая содержит терапевтическое средство, описанное выше. В других вариантах осуществления терапевтическое средство вводят отдельно, например, одновременно с осуществлением способа, до осуществления способа или после осуществления способа. В некоторых вариантах осуществления терапевтическое средство вводят субъекту до, во время и после осуществления способов для субъекта. Иллюстративные терапевтические средства описаны выше. В предпочтительных вариантах осуществления субъекту вводят терапевтические средства для лечения болезни Крона. Иллюстративные терапевтические средства от болезни Крона представляют собой противовоспалительные средства, такие как средства, включающие месаламин, иммуносупрессорные средства, такие как 6-меркаптопурин и азатиоприн; биологические средства, такие как инфликсимаб (Remicade®), антибиотики и средства против диареи, такие как дифеноксилат, лоперамид и кодеин.
Может потребоваться поддерживающее лечение. Например, иммуносупрессанты можно вводить до, во время и/или после лечения для предотвращения GVHD в соответствии со способами, известными в данной области техники. Перед введением клетки также могут быть модифицированы для подавления иммунной реакции субъекта на клетки, или наоборот, в соответствии со способами, известными в данной области техники.
Доза любого терапевтического средства будет варьироваться в зависимости от симптомов, возраста и массы тела пациента, природы и тяжести расстройства, подлежащего лечению или предотвращению, пути введения и формы средства. Любую из рассматриваемых композиций можно вводить в разовой дозе или в виде дробных доз. Дозы для терапевтических средств легко можно определить методами, известными специалистам в данной области техники, или раскрытыми в настоящей заявке. Также можно вводить смеси более чем одного терапевтического средства или вводить несколько терапевтических средств в отдельных композициях.
Точное время введения и количество любого конкретного средства, которое обеспечит наиболее эффективное лечение для данного пациента, будут зависеть от активности, фармакокинетики и биодоступности конкретного соединения, физиологического состояния пациента (включая возраст, пол, тип и стадию заболевания, общее физическое состояние, респонсивность к данной дозе и тип лечения), пути введения и т.п. Руководство, представленное в настоящей заявке, можно использовать для оптимизации лечения, например, определения оптимального времени и/или вводимого количества, для чего потребуется не более чем рутинное экспериментирование, состоящее из наблюдения субъекта и коррекции доз и/или времени введения.
Во время лечения субъекта здоровье пациента можно контролировать путем измерения одного или нескольких соответствующих показателей в определенное время в течение 24-часового периода. Лечение, включая вспомогательные средства, количества, время введения и композицию, можно оптимизировать в соответствии с результатами такого контроля. Пациента можно периодически оценивать для определения степени улучшения путем измерения тех же параметров, при этом первую такую повторную оценку типично осуществляют через четыре недели после начала терапии, и последующие повторные оценки осуществляют через каждые четыре-восемь недель в период лечения, а затем через каждые три месяца после этого. Лечение может продолжаться в течение нескольких месяцев или даже лет, при этом типичная продолжительность лечения для человека составляет минимум один месяц. Корректировку количества вводимого средства и, возможно, времени введения можно осуществлять на основании этих повторных оценок.
Комбинированная ремиссия фистулы, описанная в настоящей заявке в качестве примера, включает как клиническую, так и радиологическую ремиссию. Радиологическую оценку ремиссии обычно осуществляют при помощи МРТ, что является хорошо известной методикой. В качестве альтернативы, можно использовать другие методы визуализации, например, эндоректальную ультрасонографию. Эти методы визуализации оценивают наличие абсцессов или скоплений.
Лечение можно начинать с более низких доз, которые меньше чем оптимальная доза соединения. После этого дозировку можно увеличивать с небольшими приращениями до достижения оптимального терапевтического эффекта.
Совместное использование нескольких терапевтических средств может уменьшить требуемую дозу для любого отдельного компонента, поскольку начало и продолжительность воздействия различных компонентов могут быть комплементарными. В такой комбинированной терапии различные активные средства могут доставляться вместе или отдельно, и одновременно или в разное время в течение дня.
Токсичность и терапевтическую эффективность исследуемых соединений можно определить стандартными фармацевтическими процедурами в клеточных культурах или на экспериментальных животных, например, для определения LD50 и ED50. Предпочтительными являются композиции, демонстрирующие большие терапевтические индексы. Хотя можно использовать соединения, которые проявляют токсичные побочные эффекты, необходимо позаботиться о разработке системы доставки, которая обеспечивает направленную доставку средств к желаемому участку, чтобы уменьшить побочные эффекты.
Данные, полученные при помощи анализов клеточных культур и исследований на животных, можно использовать для определения диапазона доз для использования у людей. Дозировка любого терапевтического средства или, альтернативно, любых его компонентов обычно находится в диапазоне циркулирующих концентраций, которые включают ED50 с незначительной токсичностью или с отсутствием токсичности. Доза может варьироваться в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого способа введения. Для средств по настоящему изобретению терапевтически эффективную дозу можно первоначально определить на основании анализов клеточной культуры. Подбор дозы можно осуществить на животных моделях для достижения диапазона циркулирующих в плазме концентраций, который включает значение IC50 (то есть концентрацию испытываемого соединения, которая достигает полумаксимального ингибирования симптомов), определенное в клеточной культуре. Такую информацию можно использовать для более точного определения полезных доз для человека. Уровни в плазме можно измерить, например, при помощи высокоэффективной жидкостной хроматографии.
5. Клинический ответ и ремиссия
Аллогенные eASC по изобретению обладают удивительной эффективностью при лечении рефракторных сложных перианальных фистул у пациентов с болезнью Крона. Первичная конечная точка, комбинированная ремиссия к 24 неделе, статистически достигается; Cx601 статистически превосходит плацебо. Обе ключевые вторичные конечные точки, клиническая ремиссия и ответ к 24-й неделе, соответствуют пограничной статистической значимости (p=0,064 & p=0,054 в ITT популяции, p=0,057 и 0,045 в mITT популяции, соответственно).
Данные свидетельствуют о том, что пациенты, получающие разовое введение eASC, имеют на 30% больший шанс достичь клинической ремиссии, по сравнению с плацебо. Данные также указывают на то, что у пациентов, получающих eASC, вероятность достижения клинического ответа на 35% больше по сравнению с плацебо.
В некоторых вариантах осуществления клиническая ремиссия достигается через 24 недели, обычно через 18 недель. Клиническая ремиссия может достигаться через 12 недель или менее, например, через 10 недель или через 8 недель. Клиническая ремиссия необязательно может достигаться через 6 недель. Данные показывают, что среднее время до клинической ремиссии примерно в 2 раза короче с Cx601, чем плацебо (6,7 недели против 14,6 недели). Соответственно, в одном варианте клиническая ремиссия достигается через 14 недель.
В некоторых вариантах осуществления объединенная ремиссия достигается через 24 недели, обычно через 18 недель. Комбинированная ремиссия необязательно может достигаться через 12 недель или менее, например, через 10 недель или через 8 недель. Комбинированная ремиссия необязательно может достигаться через 6 недель.
В некоторых вариантах осуществления клинический ответ достигается через 11 недель или менее. Данные показывают, что среднее время до клинического ответа также примерно в 2 раза короче по сравнению с плацебо (6,3 недели против 11,7 недели). Время до клинического ответа может в некоторых вариантах осуществления составлять 10 недель или менее, 9 недель или менее, 8 недель или менее. Время до клинического ответа необязательно может составлять 7 недель или менее, например, около 6 недель.
Эти результаты особенно удивительны, когда отмечается, что эти улучшения наблюдаются после разового введения eASC.
Индекс активности перианального заболевания «PDAI» включает пять категорий: выделения, боль, ограничение сексуальной активности, тип перианального заболевания и степень уплотнения. Каждая категория оценивается по пятибалльной шкале, начиная от отсутствия симптомов (оценка 0) и заканчивая тяжелыми симптомами (оценка 4). Наблюдается, что улучшение индекса активности перианального заболевания значительно выше для eASC, чем для плацебо к неделе 6, 12 и 18. Поэтому в некоторых вариантах осуществления улучшение PDAI достигается через 6 недель, через 12 недель или через 18 недель. Улучшение PDAI, может быть, но необязательно, улучшением более чем на 1,5 PDAI пункта, необязательно, по меньшей мере, на два PDAI пункта. Улучшение PDAI необязательно может представлять собой уменьшение (улучшение) в каждом из пяти компонентов этого индекса.
6. Наборы
В других вариантах осуществления изобретения рассматриваются наборы, включающие композиции, содержащие стромальные стволовые клетки жировой ткани и, необязательно, инструкции по их применению. Наборы, включающие фармацевтические композиции и биоматериалы по настоящему изобретению, также входят в объем изобретения. Компоненты наборов могут быть упакованы либо для ручного, либо частично или полностью автоматизированного осуществления вышеописанных способов. Такие наборы могут иметь множество применений, включая, например, терапию, восстановление, подготовку биоматериалов и другие применения.
Примеры
Настоящее изобретение было описано в общем виде, и оно будет более понятным со ссылкой на следующие примеры, которые включены только в целях иллюстрации некоторых аспектов и вариантов осуществления настоящего изобретения и не предназначены для ограничения изобретения.
ФАЗА III КЛИНИЧЕСКИХ ИСПЫТАНИЙ
Настоящее исследование является первым плацебо-контролируемым исследованием фазы 3, которое оценивает эффективность и безопасность Cx601 отдельно или добавляемых к применяемой медикаментозной терапии для лечения рефракторных сложных перианальных фистул у пациентов с болезнью Крона.
В целом, результаты показывают, что аллогенные eASC показаны для лечения сложной перианальной фистулы (фистул) у взрослых пациентов с неактивной/умеренно активной люминальной формой болезни Крона, когда фистула(фистулы) показала неадекватный ответ по меньшей мере на одну традиционную или биологическую терапию.
Способы
Контроль исследования
Эту фазу 3, рандомизированного, двойного слепого, параллельного группового плацебо-контролируемого исследования (NCT01541579, EUDRACT 2011-006064-43) осуществляли в 49 медицинских центрах в 7 европейских странах и Израиле с июля 2012 года по июль 2015 года. Протокол был одобрен центральным или местным комитетом по этике. Все пациенты дали письменное информированное согласие.
Исследование было разработано и осуществлено Руководящим комитетом ADMIRE Steering Committee (см. Приложение). Спонсор собрал данные, которые были проанализированы Департаментом биостатистики Chiltern International, а спонсор вместе с Руководящим комитетом интерпретировали данные. Все авторы имели полный доступ к данным, соглашались с решением представить окончательную рукопись для публикации и ручались за точность и полноту представленных данных. Рукопись была подготовлена первым автором, и все авторы внесли свой вклад в последующие проекты.
Пациенты
Удовлетворяющими критериям пациентами были взрослые в возрасте от 18 лет и старше, которые имели неактивную или умеренно активную люминальную форму болезни Крона в течение ≥ 6 месяцев, определяемую Индексом активности болезни Крона (CDAI) как ≤220A24, и имели сложные перианальные фистулы (определенные как одно или более следующего: высокая интер-, транс-, экстра- или супра-сфинктерическая этиология, ≥2 внешних отверстий или ассоциированные скопления) с максимум двумя внутренними и тремя внешними отверстиями, которые были дренирующими в течение ≥6 недель перед включением. Пациентов исключали, если у них были ректовагинальные фистулы, ректальный и/или анальный стеноз и/или активный тяжелый проктит (определяемый наличием поверхностных или глубоких язв), отводящие стомы или абсцесс или скопления >2 см, которые не были устранены хирургической подготовительной процедурой. Удовлетворяющие критериям пациенты должны были быть резистентными по меньшей мере к одному из следующих лечений, что документально подтверждается как отсутствие ответа после 1 месяца приема антибиотиков (ципрофлоксацин, метронидазол) и/или после 3 месяцев приема иммунодепрессантов (азатиоприн, 6-меркаптопурин) и/или индукции или поддержания анти-TNF терапии при стабильной дозе. Пациенты, резистентные только к антибиотикам, должны были составлять <25% от общей популяции.
После введения исследуемого продукта пациенты могли лечиться антибиотиками не более 4 недель. Прием иммунодепрессантов и анти-TNF средств поддерживали при стабильных дозах на протяжении всего исследования. Инициирование или увеличение дозы этих средств не допускалось.
Пациенты, которые не получали предшествующего лечения перианальной фистулизирующей болезни Крона, в том числе антибиотиков, и те, которые ранее перенесли операцию активной фистулы, отличную от дренирования или наложения лигатуры, также были исключены. Пациенты не удовлетворяли критерим включения, если они получали глюкокортикостероиды в течение предыдущих 4 недель. Курс стероидов был разрешен для лечения вспышек люминальной болезни в период последующего наблюдения с начальной дозой 40 мг в течение максимум 12 недель.
Рандомизация и лечение
МРТ сканирование тазовой области осуществляли при скрининге для направления хирургических процедур и центрального чтения данных в слепом режиме. Кроме того, пациенты проходили обследование под анестезией, выскабливание фистул и наложение лигатуры, как клинически показано за ≥2 недели до введения исследуемого продукта (Фиг. 1). Если осуществляли наложение лигатуры, ее следовало удалить непосредственно перед введением исследуемого продукта.
Пациентов рандомизированно назначали в соотношении 1:1 в группы Cx601 или плацебо после визита для подготовки фистулы за ≥2 недели до введения исследуемого продукта (Фиг.1). Пациентов стратифицировали на основании сопутствующего лекарственного средства при рандомизации (анти-TNF и/или иммунодепрессант или никакое). Лечения назначали с использованием заранее установленного рандомизационного списка, составленного Департаментом биостатистики Linical.
Пациенты в группе Cx601 получали однократную внутриочаговую инъекцию 120 миллионов Cx601, распределенных в фистулярных проходах. Выделение и размножение Cx601 осуществляли, как описано выше.A23. Пациенты в группе плацебо получали идентичный объем физиологического раствора. Исследуемые лечения вводили при помощи тонкой длинной иглы после удаления лигатуры, если она присутствовала, и выскабливания фистулы. Половину дозы вводили в ткань, окружающую зашитое внутреннее отверстие (отверстия). Другую половину вводили в стенки фистул (не глубже 2 мм) по всему фистулярному проходу (проходам), с образованием нескольких микроподушечек.
Лечение в слепом режиме невозможно, так как клеточная суспензия явно отличалась от солевого раствора. Дизайн двойного слепого исследования поддерживали при осуществлении лечения хирургом в открытом режиме и не осведомленными о лечении гастроэнтерологом и радиологом, оценивающими ответ.
Процедуры исследования и последующее наблюдение
Закрытие фистулы клинически оценивал на 6, 12, 18 и 24 неделях исследователь, исследуя на присутствие спонтанного просачивания и после осторожного нажатия пальцами на обработанных внешних отверстияхА12, и оценивали радиологически путем центральной оценки в слепом режиме МРТ скана тазовой области на неделе 24; исследователям, осуществляющим центральную оценку, были предоставлены изображения для идентификации обработанных фистул, но они не были осведомлены о данных пациента, порядке исследований и полученного лечения. Нежелательные явления, возникшие на фоне лечения (TEAE), оценивались во время всех визитов исследования. Тяжесть перианальной болезни Крона оценивали на исходном уровне и во время всех визитов исследования при помощи индекса активности перианальной болезни (PDAI).A25 Качество жизни оценивали с использованием вопросника для больных с воспалительным заболеванием кишечника (IBDQ)A26 на базовом уровне и на 24-й неделе, как и CDAI.A24
Конечные точки эффективности и безопасности
Первичной конечной точкой была комбинированная ремиссия на 24 неделе, определяемая как клиническая оценка закрытия всех обработанных внешних отверстий, которые были дренирующими на исходном уровне, и отсутствия скоплений >2 см в пролеченных перианальных фистулах в ≥2 из 3-х измерениях, подтвержденная центральным чтением данных МРТ в слепом режиме (Bioclinica GmbH, Мюнхен, Германия). Клиническую оценку закрытия определяли как отсутствие просачивания, несмотря на мягкое нажатие пальцами.A12
Были две ключевые вторичные конечные точки эффективности: клиническая ремиссия (т.е. закрытие всех обработанных внешних отверстий, в которых наблюдалось просачивание на исходном уровне, несмотря на мягкое нажатие пальцами) и ответ (т.е. закрытие ≥50% всех обработанных внешних отверстий, в которых наблюдалось просачивание на исходном уровне) к неделе 24. Другие вторичные конечные точки эффективности включали время до клинической ремиссии, время до ответа, оценки PDAI, CDAI и IBDQ вплоть до недели 24.
TEAEs были закодированы в соответствии с Medical Dictionary for Regulatory Activities version 17.0.
Статистистический анализ
Запланированный размер выборки, подлежащий скринингу, включал 278 пациентов для рандомизации ≥208 пациентов (по 104 для каждой группы). Размер выборки был достаточным для выявления минимальной 25% разницы в процентах пациентов с комбинированной ремиссией между группами Cx601 и плацебо (ожидаемые минимальные комбинированные оценки ремиссии составляли 50% для Cx601 и 25% для плацебоA8, A12, A23, A27) с ошибкой первого рода 0,025 и мощностью 80%, делая поправку на 20% пациентов, прекращающих исследование.
Анализ эффективности осуществляли на популяции начавших лечение пациентов (ITT), которая включала всех рандомизированных пациентов, модифицированной популяции начавших лечение пациентов (mITT), которая включала всех рандомизированных пациентов, которые принимали исследуемое лечение и имели оценку эффективности после исходного уровня ≥1, и протокольной популяции (PP), которая включала всех принимающих лечение пациентов, у которых не было серьезных отклонений от протокола. TEAEs анализировали в популяции для оценки безопасности, определяемой как все пациенты, получавшие исследуемое лечение.
Первичную конечную точку анализировали с использованием стратифицированного теста Кохрана-Мантеля-Гензеля, делая поправку на рандомизационную страту (например, лечения болезни Крона при рандомизации). Первичный анализ осуществляли с использованием ITT популяции. Также предоставлялись результаты для mITT популяции, поскольку ее определение более близко напоминает ITT популяцию в других рандомизированных клинических испытаниях и обеспечивает более надежную оценку эффектов лечения. Отсутствующие данные замещали с использованием последнего документированного значения (LOCF). Отсутствие ответа/отсутствие ремиссии замещали, если к недели 24 не были получены результаты МРТ сканирования после исходного уровня или клинической оценки. Данные отсутствие ответа/отсутствие ремиссии также замещали, если событие экстренного лечения произошло до недели 24. Ограничения, накладываемые эффектами экстренных событий и отсутствующими данными на эффективность, использовали в анализах чувствительности первичной конечной точки.
Чтобы решить проблему множественности, две ключевые вторичные конечные точки (клиническая ремиссия и ответ к 24-й неделе) были сгруппированы в краткосрочное семейство с использованием метода входного контроля, использующего процедуру тестирования ХохбергаА28 для контроля общей ошибки типа I, при этом первичная конечная точка эффективности действует в качестве гейткипера. Статистическую значимость оценивали с уровнем двухсторонней ошибки I типа 0,05. Никакой статистической корректировки на множественность не делали для неключевых вторичных конечных точек. Различия в процентах и лечении выражали с 95% доверительными интервалами (CI), рассчитанными с использованием асимптотического метода Вальда. Время до клинической ремиссии и ответа анализировали методом Каплана-Майера. Результаты оценки безопасности были представлены при помощи описательной статистики.
Для статистических анализов использовали SAS Систему v9.1.3 или более позднюю (SAS Institute Inc., Cary, NC, USA).
Результаты
Было скринировано 289 пациентов, из которых 212 были рандомизированы в группы Cx601 или плацебо (Фиг.2). Базовые характеристики двух групп были одинаковыми (Таблица 1). Большинство пациентов получили ≥1 лечение болезни Крона за последние 6 месяцев. Более высокая доля пациентов в группе Cx601 имела фистулы с несколькими проходами по сравнению с группой плацебо (46,6% и 30,4% соответственно). В общей сложности 171 пациент (80,7%) завершили 24-недельное последующее наблюдение. Во время исследования 1 пациент в группе Cx601 и 4 пациента в группе плацебо получали стероиды при вспышке болезни Крона.
Эффективность
Существенно бóльшая доля Cx601-принимающих пациентов достигала первичной конечной точки комбинированной ремиссии к недели 24 по сравнению с плацебо в ITT (49,5% и 34,3%, соответственно; разница [97,5% CI]: 15,2% [0,2-30,3]; p=0,024]) и mITT популяциях (51,5% и 35,6%; 15,8% [0,5-31,2]; p=0,021; Фиг. 3A и B). Эти результаты были подтверждены в PP популяциях и в дополнительных анализах чувствительности (Таблица S1). Эффект Cx601 был больше, чем у плацебо в 4 рандомизационных стратах, при этом наибольший в количественном выражении эффект Cx601 наблюдали у пациентов, не принимающих никакую из анти-TNF и иммуносупрессорной терапий или принимающих обе эти терапии при рандомизации (разница в лечении 33,1% и 20,0%, соответственно; Фиг. 3C).
В mITT популяции большее количество пациентов в группе Cx601 по сравнению с группой плацебо достигали клинической ремиссии (55,3% и 42,6%, соответственно; разница [95% CI]: 12,8% [-0,8-26,4]; p=0,057) и имели ответ (68,9% и 55,4%, соответственно; 13,5% [0,3-26,7] p=0,045) к недели 24.
Медианное время до клинической ремиссии было примерно в 2 раза меньше для Cx601 по сравнению с плацебо (6,7 [95% CI, 6,4-11,9] недель и 14,6 [11,9-22,9] недель), также как и медианное время до ответа (6,3 [6,0-6,6] недель и 11,7 [6,7-12,9] недель).
Улучшение в PDAI в группе Cx601 в mITT популяции было существенно больше, чем в группе плацебо к неделе 6 (разница в изменении от базового уровня в группах лечения [95% CI]: -1,0 [-1,7 до -0,3]), к неделе 12 (-1,2 [-2,0 до -0,4]) и к неделе 18 (-1,2 [-2,0 до -0,3]), но не к неделе 24 (-0,8 [-1,8 до 0,2]). Что касается общих и поддоменных IBDQ и CDAI оценок, не было никакой существенной разницы между группами лечения (Таблица S2).
Безопасность
Процент пациентов в группах Cx601 и плацебо, которые испытывали TEAE, был аналогичным (66,0% и 64,7%, соответственно, Таблица 2). Наиболее часто сообщаемыми TEAE были прокталгия, анальный абсцесс и назофарингит. Более высокая доля пациентов в группе плацебо против группы Cx601 испытывала связанные с лечением TEAE (29,4% и 17,5% соответственно), наиболее распространенными из которых были анальный абсцесс и прокталгия. Большинство TEAE были легкой или умеренной тяжести. Несколько пациентов выбыли из исследования из-за TEAE (4,9% и 5,9%), тогда как несколько более высокая доля пациентов в группе Cx601 испытала серьезные TEAE (17,5% и 13,7%). Наиболее распространенным серьезным TEAE был анальный абсцесс (Cx601: 8,7%, плацебо: 6,9%). Смертей не было.
Обсуждение и обзор
Это первое крупномасштабное рандомизированное плацебо-контролируемое клиническое исследование лечения сложных рефракторных перианальных фистул у пациентов с болезнью Крона. В сложной для лечения исследуемой популяции пациентов, у которых были сложные перианальные фистулы и которым не помогла традиционная или биологическая терапия, 1 из 2 пациентов, получавших только Cx601 или как добавление к применяемой в настоящее время медикаментозной терапии, достигал комбинированной клинической и радиологической ремиссии к неделе 24. Этот результат был одинаковым во всех статистических популяциях, несмотря на то, что пациенты в группе Cx601 имели фистулы с большим количеством проходов. Таким образом, результаты исследования показывают, что Cx601 предлагает резистентным к лечению пациентам первую реальную альтернативу радикальным хирургическим подходам для закрытия сложных перианальных фистул.
Первичная конечная точка комбинированной клинической и радиологической ремиссии является более строгой, чем используемые в других рандомизированных клинических исследованиях лечений перианальных фистул при болезни Крона, которые обычно оценивали клинические ответы (т.е. ≥50% уменьшение количества дренирующих фистул) или клиническую ремиссию.A8, A12 Это первое крупномасштабное рандомизированное клиническое исследование, в котором используется клиническая оценка закрытия фистулы и МРТ оценка отсутствия абсцессов, как рекомендовано в руководящих указаниях European Crohn's and Colitis Organisation.A29
Вторичные анализы эффективности подтверждают клиническую пользу Cx601. При применении Cx601 время до клинической ремиссии и ответа было быстрым, в два раза меньше этого времени в группе плацебо. Разница в процентах клинической ремиссии между группами Cx601 и плацебо не достигала статистической значимости из-за значительно более высокого эффекта «плацебо» (42,6%), чем ожидалось и наблюдалось в предыдущих исследованиях (13-19%).A8, A12, A27. Эффекты плацебо в соответствии с рандомизационными стратами (т.е. самые высокие с сопутствующими анти-TNF и иммунодепрессантом [46,7%] и самые низкие без какого-либо лечения [21,1%]) показывают, что более высокий эффект плацебо в этом исследовании, возможно, был обусловлен использованием сопутствующих лекарственных средств. Хирургическое дренирование и закрытие внутреннего отверстия также могут повысить плацебо ответ. В то время как положительные улучшения PDAI оценок наблюдались в группе Cx601, не было никакой разницы в IBDQ и CDAI оценках между группами лечения. Вероятно, это было связано с низкой оценкой CDAI (критерий включения) и высокой IBDQ на исходном уровне.
Данные безопасности показывают, что Cx601 хорошо переносится в исследуемой популяции, что соответствует результатам предыдущего исследования фазы 1/2a.A23 Связанные с лечением TEAE чаще встречались в группе плацебо, и поэтому они могут быть связаны с естественным течением заболевания или хирургическими процедурами в период исследования. Благоприятный профиль безопасности может представлять собой преимущество по сравнению с анти-TNF терапиями, которые ассоциируются с рядом серьезных проблем безопасности, вызванных иммуногенностью препарата и повышенным риском инфекций, включая туберкулез.A30, A31
Результаты этого исследования обнадеживают, учитывая необходимость в эффективных и хорошо переносимых новых вариантах лечения для пациентов с болезнью Крона и сложными перианальными фистулами. Это исследование также имеет большое значение для лечения пациентов с болезнью Крона с трудно поддающимися лечению сложными перианальными фистулами, так как многие из них в настоящее время подвергаются повторной операции с риском повреждения сфинктерных мышц, что приводит к недержанию кала. В результате для 12-38% пациентов с перианальной фистулизирующей болезнью требуется проктоктомия.A32. Напротив, введение Cx601 является минимально инвазивным и может выполняться в амбулаторных условиях.
Ограничениями этого исследования были исключение пациентов с более чем двумя внутренними и тремя внешними отверстиями, а также с предыдущей хирургической операцией, отличной от дренирования и наложения лигатуры. Кроме того, не было установлено, были ли TEAE связаны с хирургической процедурой.
В заключение, Cx601 представляет собой эффективную и безопасную терапию сложных перианальных фистул при болезни Крона, которые не отвечали на традиционные и/или биологические методы лечения.
CD - болезнь Крона; Cx601 - аллогенные размноженные стволовые клетки жировой ткани; TNF - фактор некроза опухоли.
Данные представляют собой средние значения (стандартное отклонение), если не указано иное.
*Оценки для индекса активности перианальной болезни Крона могут варьироваться от 0 до 20; более высокие оценки указывают на более тяжелое заболевание.
†Оценки для индекса активности болезни Крона могут варьироваться от 0 до 600; более высокие оценки указывают на более тяжелое заболевание.
‡Оценки для опросника для пациентов с воспалительным заболеванием кишечника могут варьироваться от 32 до 224; более высокие оценки указывают на лучшее качество жизни.
TEAE - неблагоприятное явление, возникающее на фоне лечения; Cx601 - аллогенные размноженные стволовые клетки жировой ткани; *В любой группе лечения.
CI - доверительный интервал; Cx601 - аллогенные размноженные стволовые клетки жировой ткани; ITT - популяция начавших лечение пациентов; LOCF - замена пропущенных данных последним значением; NA - не установлено; PP - протокольный; TNF - фактор некроза опухоли.
Резервная терапия определяется как кортикоиды при 40 мг преднизонового эквивалента в течение ≥12 недель; новое анти-TNF лечение по сравнению с базисной терапией в течение ≥8 недель; новый иммуносупрессант по сравнению с базисной терапией в течение ≥12 недель; или хирургическое вмешательство для подвергаемой лечению фистулы.
*Клиническая оценка закрытия всех пролеченных внешних отверстий, которые были дренирующими на базовом уровне, и отсутствие скоплений >2 см в пролеченных перианальных фистулах в ≥2 из 3 измерений при центральной МРТ оценке в слепом режиме к недели 24. Клиническая оценка закрытия определялась как отсутствие просачивания, несмотря на мягкое нажатие пальцами.
†PP1 популяция включает пациентов без существенных отклонений от протокола (Cx601, n=86; Плацебо, n=84).
‡PP2 популяция включает PP1 пациентов, которые завершили визит на 24 неделе (Cx601, n=76; Плацебо, n=73).
CI - доверительный интервал; Cx601 - аллогенные размноженные стволовые клетки жировой ткани; mITT - модифицированная популяция начавших лечение пациентов.
Данные представляют собой средние значения (стандартное отклонение).
*Оценки для индекса активности болезни Крона (CDAI) могут варьироваться от 0 до 600; более высокие оценки указывают на более тяжелое заболевание.
†Оценки для опросника для пациентов с воспалительным заболеванием кишечника (IBDQ) могут варьироваться от 32 до 224; более высокие оценки указывают на лучшее качество жизни.
Литература
Для осуществления настоящего изобретения будут использовать, если не указано иное, обычные методы клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые находятся в компетенции специалистов. Такие методы подробно объясняются в литературе. См., например, Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); DNA Cloning, Volumes I and II (D. N. Glover ed., 1985); Oligonucleotide Synthesis (M. J. Gait ed., 1984); Mullis et al. U.S. Patent No: 4,683,195; Nucleic Acid Hybridization(B. D. Hames & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986); Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986).
Все публикации и патенты, указанные в настоящей заявке, включая перечисленные ниже, включены в настоящую заявку посредством ссылки во всей полноте, как если бы каждая отдельная публикация или патент были конкретно и индивидуально указаны для включения в качестве ссылки. В случае конфликта преимущество имеет настоящая заявка, включая любые содержащиеся в ней определения.
1. American Gastroenterological Association Medical Position Statement: Perianal Crohn's Disease. Gastroenterology (2003) 125:1503-1507.
2. Levy C, Tremaine WJ. Inflamm Bowel Dis (2002) 8(2):106-11.
3. Pennincke F, D'Hoore A, Filez L. Acta Gastroenterol Belg (2001) 64(2):223-226.
4. Rius J, Nessim A, Nogueras JJ, Wexner SD. Eur J Surg (2000) 166(3):218-222.
5. Mizuno H, Zuk PA, Zhu M, Lorenz HP, Benhaim P, Hedrick MH. Plastic Reconstr Surg (2002) 109(1): 199-209.
6. Zuk PA, Zhu M, Mizuno H, et al. Tissue Eng (2001) 7(2): 211-228.
7. Garcia-Olmo D, Garcia-Arranz M, Gomez-Garcia L et al. Int J Colorectal Dis (2003) 18: 451-454.
8. Abkowitz JL. New Engl J Med (2002) 346(10): 770-772.
9. Matsubara H. Lancet (2004) 363:746-747.
10. Cowan CM, Shi YY, Aalami 00, et al. Nat Biotechnol. (2004) 22(5):560-7
11. Garcia-Olmo D, Garcia-Olmo MA. New Eng J Med (2003) 349: 1480-1481.
12. Osawa M., Hanada K., Hanada H. and Nakauchi H. (1996) Science 273, 242-245.
13. Morrison S.J., Uchida N. and Weissman I.L. (1995) Annu. Rev. Cell Dev. Biol. 11, 35-71.
14. Ivanova N.B., Dimos J.T., Schaniel C., Hackney J. A., Moore K.A., Lemischka* I.R. (2002) Science 298, 601-604.
15. Phillips RL. (2000) Curr Top Microbiol Immunol. 251, 13-19.
16. Ramalho-Santos M, Yoon S, Matsuzaki Y, Mulligan RC, Melton DA. (2002) Science 298, 597-600.
17. De Ugarte DA, Morizono K, Elbarbary, AAlfonso Z, Zuk PA, Zhu M, Dragoo JL, Ashjian P, Thomas B, Benhaim P, Chen I, Fraser J, Hedrick MH. (2003) Cells Tissues Organs 174 (3), 101-109.
18. Friedenstein AJ, Gorskaja JF, Kulagina NN, Exp Hematol. (1976) Sep;4(5):267-74.
19. Caplan AI J Orthop Res. (1991) Sep;9(5):641-50
20. Pittenger, M.F. et al. (1999) Science 284: 143-147
21. Beresford JN, Bennett JH, Devlin C, Leboy PS, Owen ME, J Cell Sci. (1992) Jun;102 ( Pt 2):341-51
22. Yoo JU, Johnstone B, Clin Orthop. (1998) Oct;(355 Suppl):S73-81
23. Wakitani S. et al. (1995) Muscle Nerve 18: 1417-1426.
24. Haynesworth SE, Goshima J, Goldberg VM, Caplan AI, Bone. 1992;13(1):81-8.
25. Sanchez-Ramos J, Song S, Cardozo-Pelaez F, Hazzi C, Stedeford T, Willing A, Freeman TB, Saporta S, Janssen W, Patel N, Cooper DR, Sanberg PR, Exp Neurol. (2000) Aug;164(2):247-56.
26. Rogers JJ, Young HE, Adkison LR, Lucas PA, Black AC Jr, Am Surg. (1995) Mar;61(3):231-6.
27. Jiang Y, Vaessen B, Lenvik T, Blackstad M, Reyes M, Verfaillie CM, Exp Hematol. (2002) Aug;30(8):896-904.
28. Caplan AI, Bruder SP, Trends Mol Med. (2001) Jun;7(6):259-64.
29. Stanford, C.M. et al. (1995) J Biol Chem 270: 9420-9428.
Ссылочные документы ʺAʺ
A1. Baumgart DC, Sandborn WJ. Crohn's disease. Lancet 2012; 380:1590-605.
A2. Schwartz DA, Loftus EV, Jr., Tremaine WJ, et al. The natural history of fistulizing Crohn's disease in Olmsted County, Minnesota. Gastroenterology 2002;122:875-80.
A3. Eglinton TW, Barclay ML, Gearry RB, Frizelle FA. The spectrum of perianal Crohn's disease in a population-based cohort. Dis Colon Rectum 2012; 55:773-7.
A4.Hellers G, Bergstrand O, Ewerth S, Holmstrom B. Occurrence and out come after primary treatment of anal fistulae in Crohn's disease. Gut 1980; 21:525-7.
A5. Scharl M, Rogler G. Pathophysiology of fistula formation in Crohn's disease. World J Gastro in test Pathophysiol 2014; 5:205-12.
A6. Nielsen OH, Rogler G, Hahnloser D, Thomsen OO. Diagnosis and management of fistulizing Crohn's disease. Nat Clin Pract Gastroenterol Hepat ol 2009; 6:92-106.
A7. Bell SJ, Williams AB, Wiesel P, Wilkinson K, Cohen RC, Kamm MA. The clinical course of fistulating Crohn's disease. Aliment Pharmacol Ther 2003; 17:1145-51.
A8. Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn's disease. N Engl J Med 2004; 350:876-85.
A9. Thia KT, Mahadevan U, Feagan BG, et al. Ciprofloxacin or metronidazole for the treatment of perianal fistulas in patients with Crohn's disease: a randomized, double-blind, placebo-controlled pilot study. Inflamm Bowel Dis 2009; 15:17-24.
A10. Present DH, Korelitz BI, Wisch N, Glass JL, Sachar DB, Pasternack BS. Treatment of Crohn's disease with 6-mercaptopurine. A long-term, randomized, double-blind study. N Engl J Med 1980; 302:981-7.
A11. Pearson DC, May GR, Fick GH, Sutherland LR. Azathioprine and 6-mercaptopurine in Crohn disease. A meta-analysis. Ann Intern Med 1995; 123:132-42.
A12. Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn's disease. N Engl J Med 1999; 340:1398-405.
A13. Domenech E, Hinojosa J, Nos P, et al. Clinica levolution of luminal and perianal Crohn's disease after inducing remission with infliximab: how long should patients be treated? Aliment Pharmacol Ther 2005; 22:1107-13.
A14. Goldstein ES, Marion JF, Present DH. 6-Mercaptopurine is effective in Crohn's disease without concomitant steroids. Inflamm Bowel Dis 2004; 10:79-84.
A15. Korelitz BI, Present DH. Favorable effect of 6-mercaptopurine on fistulae of Crohn's disease. Dig Dis Sci 1985; 30:58-64.
A16. Brandt LJ, Bernstein LH, Boley SJ, Frank MS. Metronidazole therapy for perineal Crohn's disease: a follow-up study. Gastroenterology 1982; 83:383-7.
A17. Solomon MJ, Mc Leod RS, O'Connor BI, Steinhart AJ, et al. Combination ciprofloxacin and metronidazole in severe perianal Crohn's disease. Can J Gastroenterol 1993; 7:571-3.
A18. Molendijk I, Nuij VJ, Van der Meulen-de Jong AE, Van der Woude CJ. Disappointing durable remission rates in complex Crohn's disease fistula. Inflamm Bowel Dis 2014; 20:2022-8.
A19. Gecse K, Khanna R, Stoker J, et al. Fistulizing Crohn's disease: Diagnosis and management. United European Gastroenterol J 2013; 1:206-13.
A20. Singer NG, Caplan AI. Mesenchymal stem cells: mechanisms of inflammation. Annu Rev Pathol 2011; 6:457-78.
A21. DelaRosa O, Dalemans W, Lombardo E. Mesenchymal stem cells as therapeutic agents of inflammatory and autoimmune diseases. Curr Opin Biotechnol 2012; 23:978-83.
A22. Garcia-Olmo D, Guadalajara H, Rubio-Perez I, Herreros MD, De La Quintana P, Garcia-Arranz M. Recurrent anal fistulae: limited surgery supported by stem cells. World J Gastroenterol 2015; 21:3330-6.
A23. de la Portilla F, Alba F, Garcia-Olmo D, Herrerias JM, Gonzalez FX, Galindo A. Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn's disease: results from a multicenter phase I/IIa clinical trial. Int J Colorectal Dis 2013; 28:313-23.
A24. Best WR, Becktel JM, Singleton JW, Kern F, Jr. Development of a Crohn's disease activity index. National Cooperative Crohn's Disease Study. Gastroenterology 1976; 70:439-44.
A25. Irvine EJ. Usual therapy improves perianal Crohn's disease as measured by a new disease activity index. McMaster IBD Study Group.J Clin Gastroenterol 1995; 20:27-32.
A26. Guyatt G, Mitchell A, Irvine EJ, et al. A new measure of health status for clinical trials in inflammatory bowel disease. Gastroenterology 1989; 96:804-10.
A27. Colombel JF, Schwartz DA, Sandborn WJ, et al. Adalimumab for the treatment of fistulas in patients with Crohn's disease. Gut 2009; 58:940-8.
A28. Hochberg Y. A sharper Bonferroni procedure for multiple tests of significance. Biometrica 1988; 75:800-2.
A29. Van Assche G, Dignass A, Reinisch W, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn's disease: Special situations. J Crohns Colitis 2010; 4:63-101.
A30. Schwartz DA, Herdman CR. Review article: The medical treatment of Crohn's perianal fistulas. Aliment Pharmacol Ther 2004; 19:953-67.
A31. American Gastroenterological Association medical position statement: perianal Crohn's disease. Gastroenterology 2003; 125:1503-7.
A32. Geltzeiler CB, Wieghard N, Tsikitis VL. Recent developments in the surgical management of perianal fistula for Crohn's disease. Ann Gastroenterol 2014; 27:320-30.
Эквиваленты
Настоящее изобретение обеспечивает, среди прочего, способы и композиции для лечения и профилактики фистул. Хотя обсуждались конкретные варианты осуществления настоящего изобретения, приведенное выше описание является иллюстративным, а не ограничивающим. Многие варианты изобретения будут очевидными для специалистов в данной области после рассмотрения настоящего описания. Прилагаемая формула изобретения не предназначена для заявления всех таких вариантов осуществления и вариантов, и полный объем изобретения должен определяться ссылкой на формулу изобретения вместе с полным объемом ее эквивалентов и на описание изобретения вместе с такими вариантами.
Реферат
Изобретение относится к области биотехнологии, а именно к применению размноженных аллогенных стромальных стволовых клеток жировой ткани для лечения многопроходной рефракторной сложной перианальной фистулы у пациента с болезнью Крона. Дозу в 120 миллион клеток вводят за одну процедуру, где каждый проход фистулы получает часть этой дозы, и где половину дозы вводят в ткань, окружающую внутреннее отверстие или отверстия, а другую половину вводят в стенки фистулы по всем проходам фистулы. Изобретение позволяет расширить арсенал технических средств. 10 з.п. ф-лы, 5 ил., 4 табл., 1 пр.

Комментарии