Улучшение органов для трансплантации - RU2665364C2
Код документа: RU2665364C2
Чертежи














Описание
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка включает список последовательностей, поданный в электронном виде в формате ASCII и включенный, таким образом, в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 8 апреля 2014 года, названа ATH-022234USORD_SL.txt, и ее размер составляет 7517 байтов.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Областью изобретения является трансплантация органов и разработка способов и композиций, улучшающих успех трансплантации органов. Способы и композиции направлены на подверганию желаемого органа, до или в течение трансплантации, воздействию стволовых клеток. В одном из вариантов осуществления стволовые клетки снижают вредные воздействия ишемии на орган, предназначенный для забора для трансплантации или забранный для трансплантации. В другом варианте осуществления органом является легкое. В дополнительном варианте осуществления, в котором орган, предназначенный для трансплантации, перфузируют ex vivo, способ включает снижение ишемического реперфузионного повреждения посредством перфузии органа средой, содержащей стволовые клетки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Трансплантация органов представляет собой получение и забор органа от донора или из донорного участка (если донор и реципиент являются одним и тем же) и имплантацию, поддержание и/или использование органа в реципиенте или реципиентом донорского органа. По имеющимся оценкам, на основных рынках здравоохранения (например, США, Европа и Япония) осуществляют более 50000 трансплантаций органов в год, и более 170000 пациентов находятся в листах ожидания для трансплантации органов. Спрос на здоровые органы значительно превышает предложение.
Основной проблемой при трансплантации органов является отторжение трансплантата, которое может приводить к значительным осложнениям в функционировании органа или недостаточности трансплантата. В основном, ее решают с помощью подбора доноров и реципиентов, имеющих очень схожие серотипы, и с использованием иммуносупрессорных лекарственных средств для контроля иммунного ответа, лежащего в основе отторжения трансплантата.
Другой основной проблемой является сохранение жизнеспособности органов до процедуры имплантации и в течение нее. Удаление, хранение и трансплантация органа может значительно влиять на внутреннюю структуру и функцию органа и может существенно повлиять на степень, с которой замедляется или предотвращается возвращение нормальной функции органа после завершения трансплантации. Такое повреждение органа, главным образом, происходит в результате ишемии и гипотермии, но также может относиться к реперфузии органа ex vivo или в течение имплантации. Способы консервации органов, включая перфузию ex vivo, служат для минимизации этого повреждения для обеспечения оптимального срока жизнеспособности и функционирования трансплантата. Но, даже с использованием этих способов, во многих случаях здоровое состояние органа будет снижаться, влияя на исход трансплантации, и в некоторых случаях снижение является настолько значительным, что донорские органы забраковывают до трансплантации как нежизнеспособные.
Технология, направленная на решение этих важных проблем в трансплантации органов, должна оказывать существенное влияние на качество жизни и выживаемость пациентов и на лечение осложнений, ассоциированных с трансплантацией.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу, включающему трансплантацию органа, подвергнутого воздействию экзогенных стволовых клеток до, в течение и/или после трансплантации. Воздействие стволовых клеток может повышать вероятность успешной трансплантации органов. Таким образом, изобретение относится к следующим вариантам осуществления.
В одном из вариантов осуществления способ может включать толеризацию органа посредством приведения органа в контакт с экзогенными стволовыми клетками до, в течение и/или после трансплантации. С помощью толеризации органа его лучше подготавливают к приживлению реципиентом без значительного иммунологического противодействия. Толеризации можно достигать, например, посредством индукции T-регуляторных клеток в органе (см., например, Eggenhofer et al., Stem Cells Translation Medicine 2013;2:000-000).
В одном из вариантов осуществления изобретение относится к способу снижения повреждения органа ex vivo посредством приведения органа в контакт со средой, содержащей экзогенные стволовые клетки, до, в течение и/или после трансплантации.
В одном из вариантов осуществления повреждение происходит в результате ишемического реперфузионного повреждения.
В одном из вариантов осуществления способ направлен на снижение общей деградации ткани или клетки в органе, подлежащем трансплантации. Это может являться результатом действия факторов, включающих, в качестве неограничивающих примеров, ишемию, гипотермию и реперфузию. Таким образом, в одном из вариантов осуществления изобретение относится к снижению повреждения в результате одного или нескольких из этих явлений. Такие явления могут быть вызваны, по меньшей мере частично, одним или комбинацией следующего: (1) иммуномодуляции T-клеток TH1 в T-клетки TH2; (2) иммуномодуляции макрофагов М1 в макрофаги M2 (например, вызывающей сдвиг от провоспалительного ответа в сторону противовоспалительного ответа); (3) ингибирования инфильтрации нейтрофилами (например, посредством снижения рецепторов поверхности клеток); (4) сдвиг нейтрофилов от провоспалительных в сторону противовоспалительных; и (5) цитопротекции или антиапоптотических эффектов, вызванных экзогенными стволовыми клетками.
Явления, представленные в настоящем описании, могут приводить к воспалению, другому иммунному ответу, продукции цитокинов, апоптозу клеток и другим событиям, влияющим на жизнеспособность органа и пригодность для трансплантации. Таким образом, в одном из вариантов осуществления изобретение относится к снижению вредных воздействий этих явлений посредством введения экзогенных стволовых клеток в орган, являющийся объектом этих явлений или в котором эти явления уже происходят.
Примеры явлений, которые могут приводить к воспалению, другому иммунному ответу, продукции цитокинов, апоптозу клеток и другим явлениям, влияющим на жизнеспособность органа и пригодность для трансплантации, могут включать, в качестве неограничивающих примеров, явления, ассоциированные с эндотелиальным ответом, активными формами кислорода, комплементом и лейкоцитами. Явления, ассоциированные с эндотелиальным ответом, могут включать, в качестве неограничивающих примеров, экспрессию конкретных провоспалительных продуктов генов (например, молекул адгезии лейкоцитов, цитокинов) и/или биоактивных средств (например, эндотелина, тромбоксана A2) и/или репрессию других "протективных" продуктов генов (например, конститутивной синтазы оксида азота, тромбомодулина) и/или биоактивных средств (например, простациклина, оксида азота). Явления, ассоциированные с активными формами кислорода (например, (O2-), (OH-), (HOCl), (H2O2) и образующимся из оксида азота пероксинитритом), могут включать, в качестве неограничивающих примеров, прямое повреждение клеточных мембран посредством перекисного окисления липидов, стимуляцию активации лейкоцитов и хемотаксис посредством активации фосфолипазы A2 цитоплазматической мембраны для образования арахидоновой кислоты (тромбоксана A2 и лейкотриена B4), и/или повышение активации лейкоцитов, хемотаксиса и адгезии лейкоцитов к эндотелию после ишемической реперфузии. Явления, ассоциированные с активацией комплемента, такого как C3a, C5a, iC3b, C5b9 (C5a является наиболее активным), могут включать, в качестве неограничивающих примеров, образование нескольких провоспалительных медиаторов, изменяющих сосудистый гомеостаз, например, посредством нарушения кровотока в ишемизированном органе посредством изменения сосудистого гомеостаза и повышения адгезии лейкоцитов к эндотелию. Явления, ассоциированные с лейкоцитами, могут включать, в качестве неограничивающих примеров, активацию лейкоцитов, хемотаксис, адгезию лейкоцитов к эндотелию и трансмиграцию, которые в дальнейшем могут приводить к механической обструкции, т.к. лейкоциты высвобождают токсичные ROS, протеазы и эластазы, что приводит к проницаемости микрососудов, отеку, тромбозу и гибели паренхиматозных клеток.
В одном из вариантов осуществления орган выбран из группы, включающей, в качестве неограничивающих примеров, легкое, почку, сердце, печень, поджелудочную железу, тимус, желудочно-кишечный тракт и композитные аллотрансплантаты, такие как конечности, лица и т.п., и ткани, включая, в качестве неограничивающих примеров, роговицу, кожу, вены, артерии, кости, сухожилия и клапаны, такие как клапаны сердца и т.п.
В одном из вариантов осуществления стволовые клетки снижают воспаление в органе. Например, орган можно подвергать воздействию стволовых клеток в течение периода времени и при дозе, достаточных для снижения воспаления в органе.
В одном из вариантов осуществления стволовые клетки снижают наличие воспалительных клеток в органе. Например, орган можно подвергать воздействию стволовых клеток в течение периода времени и при дозе, достаточных для снижения наличия воспалительных клеток в органе.
В одном из вариантов осуществления стволовые клетки снижают воспалительные цитокины в органе. Например, орган можно подвергать воздействию стволовых клеток в течение периода времени и при дозе, достаточных для снижения воспалительных цитокинов в органе.
В одном из вариантов осуществления стволовые клетки снижают наличие отека легких. Например, орган можно подвергать воздействию стволовых клеток в течение периода времени и при дозе, достаточных для снижения наличия отека легких.
В одном из вариантов осуществления стволовые клетки повышают наличие экспрессии ИЛ-10 (белка и/или мРНК) в легочной ткани. Например, орган можно подвергать воздействию стволовых клеток в течение периода времени и при дозе, достаточных для повышения наличия экспрессии ИЛ-10 в легочной ткани.
В одном из вариантов осуществления повреждение является результатом гипоксии в органе.
В одном из вариантов осуществления стволовые клетки снижают эффекты гипоксии в органе.
В одном из вариантов осуществления стволовые клетки вводят в любое время между удалением органа у донора и трансплантацией реципиенту.
В одном из вариантов осуществления органа подвергают воздействию стволовых клеток в течение процедуры трансплантации.
В одном из вариантов осуществления орган можно подвергать воздействию стволовых клеток, в то время как орган все еще является интактным у донора, но до удаления органа у донора.
В одном из вариантов осуществления орган можно подвергать воздействию стволовых клеток в течение периода времени. Период времени может зависеть от конкретного органа. Например, период времени может составлять приблизительно 1-2 часа, приблизительно 2-3 часа, приблизительно 3-4 часа, приблизительно 4-5 часов, приблизительно 5-6 часов, приблизительно 7-8 часов, приблизительно 8-9 часов, приблизительно 9-10 часов или приблизительно 10 часов или более. Один из примеров подходящего периода времени описывают в Zhao et al., BMC Medicine 2012, 10:3, включенном в настоящее описание в качестве ссылки в качестве руководства по способу ex vivo, включая подходящие периоды времени, для внутривенной обработки клеток ex vivo.
В одном из вариантов осуществления концентрация стволовых клеток, воздействию которых подвергают орган, может зависеть от конкретного органа. Например, концентрация клеток, воздействию которых подвергают орган, может составлять от приблизительно 0,01 до приблизительно 5×107 клеток/мл, от приблизительно 1×105клеток/мл до приблизительно 5×107 клеток/мл, или приблизительно 10×106 клеток/мл.
В другом варианте осуществления концентрация стволовых клеток, подвергаемых воздействию органа, может составлять от приблизительно 1×105 клеток/кг органа до приблизительно 5×105 клетки/кг органа, от приблизительно 5×105 клеток/кг органа до 1×106 клеток/кг органа и до 5×106 клеток/кг органа, от приблизительно 5×106 клеток/кг органа до 1×107 клеток/кг органа, от приблизительно 1×107 клеток/кг органа до 1,5×107 клеток/кг органа или от приблизительно 1×107 клеток/кг органа до 2×108 клеток/кг органа.
В других вариантах осуществления стволовые клетки содержатся в жидкости для перфузии в органе или в носителе для внутриорганного (такого как внутрибронхиальное) введения.
В другом варианте осуществления стволовые клетки содержатся в среде, в которой орган приводят в контакт до трансплантации, такой как среда, в которую орган погружают, а не перфузируют.
Авторы настоящего изобретения предполагают использование любой желаемой стволовой клетки в способах по изобретению. Они включают, в качестве неограничивающих примеров, эмбриональные стволовые клетки, неэмбриональные мультипотентные стволовые клетки, мезенхимальные стволовые клетки, нейрональные стволовые клетки, индуцированные плюрипотентные стволовые клетки и т.п. В одном из вариантов осуществления стволовые клетки могут являться несовпадающими по HLA, аллогенными клетками.
Клетки включают, в качестве неограничивающих примеров, клетки, не являющиеся эмбриональными стволовыми клетками и половыми клетками, имеющие некоторые характеристики эмбриональных стволовых клеток, но полученные из неэмбриональной ткани и обеспечивающие эффекты, описываемые в настоящей заявке. Клетки могут от природы обеспечивать эти эффекты (т.е. являться генетически или фармацевтически немодифицированными). Однако для повышения активности природные экспрессоры можно генетически или фармацевтически модифицировать.
Клетки могут экспрессировать маркеры плюрипотентности, такие как oct4. Они также могут экспрессировать маркеры, ассоциированные с длительной репликативной способностью, такие как теломераза. Другие характеристики плюрипотентности могут включать способность дифференцироваться в типы клеток из нескольких зародышевых листков, таких как два или три из эктодермального, эндодермального и мезодермального эмбриональных зародышевых листков. Такие клетки могут являться или не являться иммортализованными или трансформированными в культуру. Клетки могут значительно размножаться без трансформации, а также поддерживать нормальный кариотип. В одном из вариантов осуществления неэмбриональные стволовые, неполовые клетки можно подвергать желаемому количеству делений клеток в культуре. Например, неэмбриональные стволовые, неполовые клетки можно подвергать по меньшей мере 10-40 делениям клеток в культуре, например, 30-35 делениям клеток, где клетки не трансформируют и они имеют нормальный кариотип. Клетки могут дифференцироваться по меньшей мере в один тип клеток из каждой из двух из эндодермальной, эктодермальной и мезодермальной эмбриональной линий и могут включать дифференцировку во все три из них. Кроме того, клетки могут не являться туморогенными, например, не приводить к тератомам. Если клетки являются трансформированными или туморогенными, и желательно использовать их для инфузии, такие клетки можно деактивировать таким образом, что они не могут образовывать опухоли in vivo, например, посредством обработки, предотвращающей клеточную пролиферацию в опухоли. Такие обработки хорошо известны в этой области.
Клетки включают, в качестве неограничивающих примеров, следующие пронумерованные варианты осуществления:
1. Выделенные наращенные неэмбриональные стволовые, неполовые клетки, клетки, подвергнутые по меньшей мере 10-40 делениям клеток в культуре, где клетки экспрессируют oct4, не являются трансформированными и имеют нормальный кариотип.
2. Неэмбриональные стволовые, неполовые клетки по п. 1 выше, дополнительно экспрессирующие один или несколько из теломеразы, rex-1, rox-1 или sox-2.
3. Неэмбриональные стволовые, неполовые клетки по п. 1 выше, которые могут дифференцироваться по меньшей мере в один тип клеток по меньшей мере из двух из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
4. Неэмбриональные стволовые, неполовые клетки по п. 3 выше, дополнительно экспрессирующие один или несколько из теломеразы, rex-1, rox-1 или sox-2.
5. Неэмбриональные стволовые, неполовые клетки по п. 3 выше, которые могут дифференцироваться по меньшей мере в один тип клеток из каждой из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
6. Неэмбриональные стволовые, неполовые клетки по п. 5 выше, дополнительно экспрессирующие один или несколько из теломеразы, rex-1, rox-1 или sox-2.
7. Выделенные наращенные неэмбриональные стволовые, неполовые клетки, получаемые посредством культивирования неэмбриональной, незародышевой ткани, клеток, подвергнутых по меньшей мере 40 делениям клеток в культуре, где клетки не являются трансформированными и имеют нормальный кариотип.
8. Неэмбриональные стволовые, неполовые клетки по п. 7 выше, экспрессирующие один или несколько из oct4, теломеразы, rex-1, rox-1 или sox-2.
9. Неэмбриональные стволовые, неполовые клетки по п. 7 выше, которые могут дифференцироваться по меньшей мере в один тип клеток по меньшей мере из двух из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
10. Неэмбриональные стволовые, неполовые клетки по п. 9 выше, экспрессирующие один или несколько из oct4, теломеразы, rex-1, rox-1 или sox-2.
11. Неэмбриональные стволовые, неполовые клетки по п. 9 выше, которые могут дифференцироваться по меньшей мере в один тип клеток из каждой из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
12. Неэмбриональные стволовые, неполовые клетки по п. 11 выше, экспрессирующие один или несколько из oct4, теломеразы, rex-1, rox-1 или sox-2.
13. Выделенные наращенные неэмбриональные стволовые, неполовые клетки, клетки, подвергнутые по меньшей мере 10-40 делениям клеток в культуре, где клетки экспрессируют теломеразу, не являются трансформированными и имеют нормальный кариотип.
14. Неэмбриональные стволовые, неполовые клетки по п. 13 выше, дополнительно экспрессирующие один или несколько из oct4, rex-1, rox-1 или sox-2.
15. Неэмбриональные стволовые, неполовые клетки по п. 13 выше, которые могут дифференцироваться по меньшей мере в один тип клеток по меньшей мере из двух из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
16. Неэмбриональные стволовые, неполовые клетки по п. 15 выше, дополнительно экспрессирующие один или несколько из oct4, rex-1, rox-1 или sox-2.
17. Неэмбриональные стволовые, неполовые клетки по п. 15 выше, которые могут дифференцироваться по меньшей мере в один тип клеток из каждой из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
18. Неэмбриональные стволовые, неполовые клетки по п. 17 выше, дополнительно экспрессирующие один или несколько из oct4, rex-1, rox-1 или sox-2.
19. Выделенные наращенные неэмбриональные стволовые, неполовые клетки, которые могут дифференцироваться по меньшей мере в один тип клеток по меньшей мере из двух из эндодермальной, эктодермальной и мезодермальной эмбриональных линий, подвергнутые по меньшей мере 10-40 делениям клеток в культуре.
20. Неэмбриональные стволовые, неполовые клетки по п. 19 выше, экспрессирующие один или несколько из oct4, теломеразы, rex-1, rox-1 или sox-2.
21. Неэмбриональные стволовые, неполовые клетки по п. 19 выше, которые могут дифференцироваться по меньшей мере в один тип клеток из каждой из эндодермальной, эктодермальной и мезодермальной эмбриональных линий.
22. Неэмбриональные стволовые, неполовые клетки по п. 21 выше, экспрессирующие один или несколько из oct4, теломеразы, rex-1, rox-1 или sox-2.
В одном из вариантов осуществления вместо стволовых клеток используют кондиционированную среду.
В одном из вариантов осуществления орган имеет человеческое происхождение.
В силу свойства клеток обеспечивать желаемые эффекты, можно создавать банки клеток, содержащие клетки, выбранные в качестве имеющих желаемую активность (уровень способности) для обеспечения эффектов. Таким образом, настоящее изобретение относится к анализу клеток на способность. Банк может представлять собой источник для получения фармацевтической композиции для введения в орган. Можно использовать клетки непосредственно из банка или наращивать перед использованием. Особенно в случае, когда клетки подвергают дополнительному наращиванию, после наращивания желательно проверять, имеют ли клетки по-прежнему желаемую активность. Банки делают возможным использование клеток "в готовом виде", являющихся аллогенными в отношении донора и реципиента орган.
Таким образом, изобретение также относится к диагностическим способам, осуществляемым перед подверганием органа воздействию стволовых клеток. Способы включают оценку активности клеток для обеспечения эффектов, описываемых в настоящей заявке. Клетки можно получать из банка клеток и использовать напрямую или наращивать перед введением. В любом случае, клетки можно анализировать на желаемую активность. Особенно в случае, когда клетки подвергают дополнительному наращиванию, после наращивания желательно проверять, имеют ли клетки по-прежнему желаемую активность.
Хотя клетки, выбранные по эффектам, обязательно анализируют в течение селекции, для подтверждения того, что клетки по-прежнему обеспечивают эффекты на желаемом уровне, предпочтительным и целесообразным может являться повторный анализ клеток перед введением индивидууму для лечения. Это является особенно предпочтительным, если клетки сортируют в течение любого периода времени, например, в банке клеток, где клетки, скорее всего, замораживают при хранении.
Между исходным выделением клеток и введением в орган, можно осуществлять многочисленные (т.е. последовательные) анализы на эффекты. Они предназначены для подтверждения того, что клетки могут по-прежнему обеспечивать эффекты на желаемом уровне после манипуляций, осуществляемых в течение этого периода времени. Например, анализ можно осуществлять после каждого наращивания клеток. Если клетки хранят в банке клеток, их можно анализировать после прекращения хранения. Если они заморожены, их можно анализировать после размораживания. Если клетки из банка клеток наращивают, их можно анализировать после наращивания. Предпочтительно, можно анализировать часть конечного клеточного продукта (физически вводимого в орган).
Поскольку стволовые клетки могут обеспечивать эффекты, представленные в настоящем описании, с помощью секретируемых молекул, различные варианты осуществления для введения стволовых клеток, представленные в настоящем описании, можно осуществлять посредством введения одной или нескольких секретируемых молекул, таких как те, которые могут находиться в кондиционированной среде для культивирования.
Изобретение также относится к композициям, содержащим популяцию клеток, имеющих желаемую активность для обеспечения желаемых эффектов. Такие популяции можно находить в виде фармацевтических композиций, подходящих для введения в орган, и/или в банках клеток, клетки из которых можно использовать непосредственно для введения или наращивать перед введением. В одном из вариантов осуществления клетки имеют усиленную (повышенную) активность по сравнению с предыдущей (родительской) популяцией клеток. Родительские клетки определены в настоящем описании. Усиление можно осуществлять посредством селекции природных экспрессоров или с помощью внешних факторов, действующих на клетки.
Клетки можно получать с помощью условий выделения и культивирования, представленных в настоящем описании. В конкретном варианте осуществления их получают с помощью условий культивирования, представленных в настоящем описании, включающих более низкие концентрации кислорода в комбинации с более высокими концентрациями сыворотки, такой как используемая для получения клеток, обозначенная как "MultiStem®".
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Схема дизайна исследования.
Фигура 2. Репрезентативная макроскопическая картина правой нижней доли (RLL) и левой нижней доли (LLL) легкого №2 после реперфузии. MSC-обработанная LLL выглядит нормальной, в то время как обработанная наполнителем RLL выглядит отечной и воспаленной.
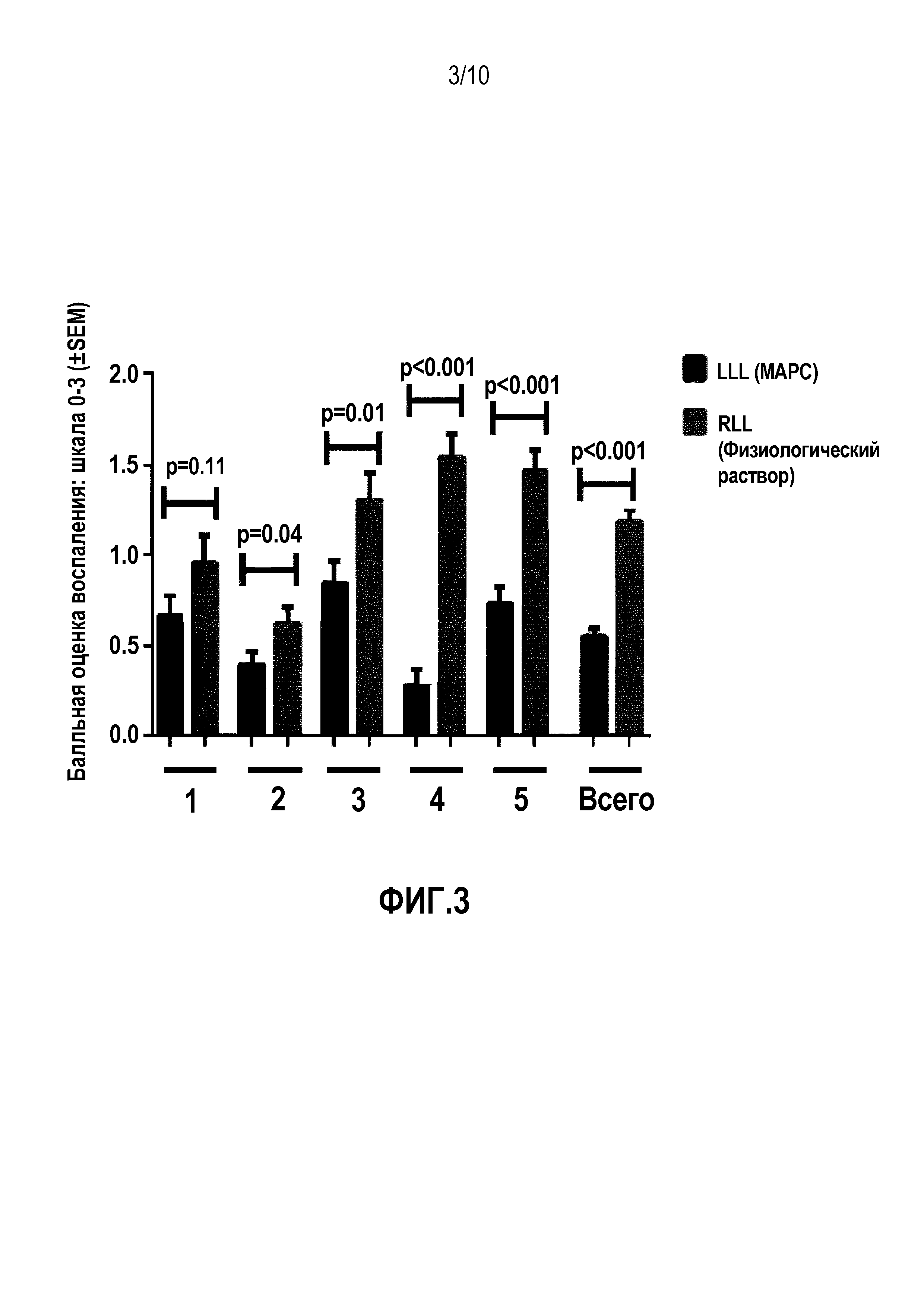
Фигура 3. Полуколичественная балльная оценка демонстрирует значимое снижение общего воспаления в MSC-обработанной LLL по сравнению с обработанной наполнителем RLL в 4 из 5 легких и в совокупности. Представлено среднее ± SD для объединенных наблюдений 3 "слепых" наблюдателей.
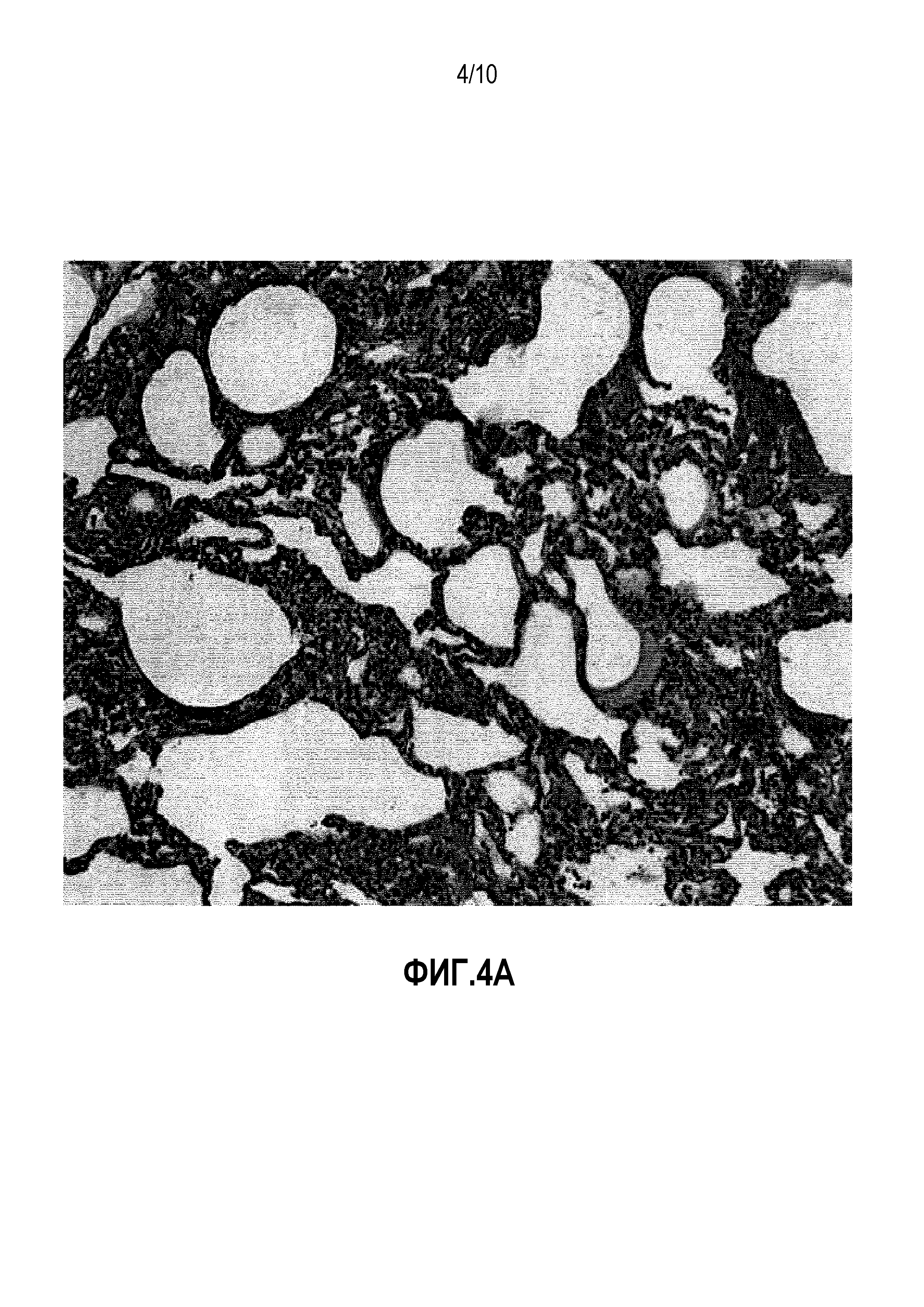
Фигуры 4A-B. Репрезентативные микрофотографии легкого 1 демонстрируют воспаление от минимального до незначимого в MSC-обработанной LLL по сравнению с утолщением альвеолярной перегородки, отеком и периваскулярными и перибронхиальными воспалительными клеточными инфильтратами. Исходное увеличение 200X.
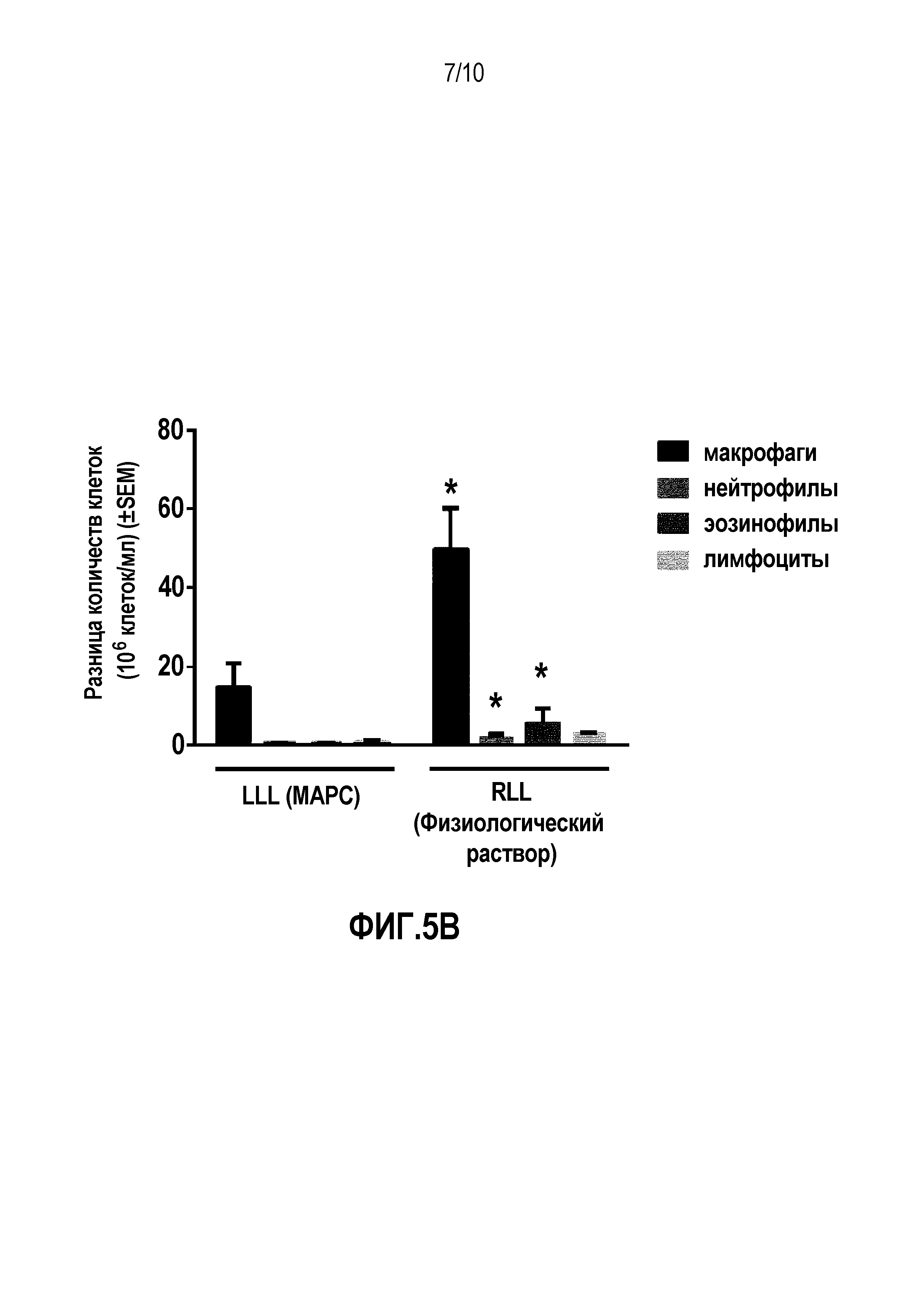
Фигуры 5A-C. Снижение общего количества клеток в жидкости BAL в MSC-обработанной LLL в легких №№3-5 (фиг. 5A). Общее количество клеток не анализировали в легких №1 или №2. Инстилляция MSC также приводила к значимому снижению повышенных количеств общих нейтрофилов и эозинофилов в жидкости BAL во всех 5 легких (фиг. 5B-C). Данные представляют собой среднее ± SEM для объединенных наблюдений 3 "слепых" наблюдателей.
Фигура 6. Репрезентативный анализ цитокинов в жидкости BAL из легкого №4 демонстрирует значимое повышение ИЛ-10 в MSC-обработанной LLL, но отсутствие значимого изменения iNOS, STC-1 или TSG-6. Данные представляют собой среднее + стандартное отклонение для определения в трех повторениях для каждого образца LLL или RLL.
Фигура 7. Анализ цитокинов в ткани легкого. Анализ qPCR осуществляли с использованием образцов легочной ткани, собранных из LLL и RLL легких 2-5 при t=0, 2 и/или 4 часов. Кратная экспрессия представляет собой уровни гена-мишени по сравнению со значением t=0. Все данные нормировали по гену домашнего хозяйства GAPDH. Данные представляют собой среднее + стандартное отклонение для образцов LLL и RLL из легких 2-5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что настоящее изобретение не ограничено конкретной методологией, протоколами, реагентами и т.д., представленными в настоящем описании и, таким образом, может варьироваться. Терминология, используемая в настоящем описании, предназначена исключительно для описания конкретных вариантов осуществления и не предназначена для ограничения объема описываемого изобретения, определенного исключительно в формуле изобретения.
В настоящем описании заголовки разделов используют исключительно в организационных целях, и не следует рассматривать их в качестве какого-либо ограничения описываемого объекта изобретения.
Способы по настоящему изобретению, как правило, осуществляют в соответствии с обычными способами, хорошо известными в этой области и описываемыми в различных общих и более конкретных ссылках, цитируемых и обсуждаемых на всем протяжении настоящего описания, если не указано иное. См., например, Sambrook et al, Molecular Cloning: A Laboretory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001) and Ausubel et al., Current Protocols in Molecular Biology. Greene Publishing Associates (1992), and Harlow and Lane, Antibodies: A Laboratory Manual Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1990).
Определения
В настоящем описании единственное число означает один или несколько; по меньшей мере один. Если в настоящем описании используют форму во множественном числе, она, как правило, включает форму в единственном числе.
"Банк клеток" представляет собой промышленную номенклатуру для клеток, выращиваемых и хранимых для последующего использования. Клетки можно хранить в аликвотах. Их можно использовать непосредственно из хранилища или можно выращивать после хранения. Это удобно, поэтому существуют "готовые к использованию" клетки, доступные для введения. Клетки можно хранить уже в фармацевтически приемлемом эксципиенте таким образом, что их можно вводить напрямую или их можно смешивать с соответствующим эксципиентом после прекращения хранения. Клетки можно замораживать или иным образом хранить в форме для сохранения жизнеспособности. В одном из вариантов осуществления изобретения создают банки клеток, в которых клетки выбирают по повышенной активности для достижения эффектов, описываемых в настоящей заявке. После прекращения хранения и до введения предпочтительным может являться повторный анализ клеток на активность. Его можно осуществлять с использованием любого из анализов, прямых или непрямых, описываемых в настоящей заявке или иначе известных в этой области. Затем можно вводить клетки, имеющие желаемую активность. Банки можно создавать с использованием аутологичных клеток (полученных от донора органа или реципиента). Или банки могут содержать клетки для аллогенного использования.
Термин "совместное введение" означает введение в комбинации друг с другом, совместно, скоординированно, включая одновременное или последовательное введение двух или более средств.
Термин "содержащий" означает, без других ограничений, включение объекта обязательно без какого-либо ограничения или исключения того, что еще можно включать. Например, "композиция, содержащая x и y" включает любую композицию, содержащую x и y, независимо от того, какие другие компоненты могут присутствовать в композиции. Аналогично, "способ, включающий этап x" включает любой способ, в котором осуществляют x, является ли x единственным этапом способа или лишь одним из этапов, независимо от того, сколько других этапов могут присутствовать, и независимо от того, насколько простым или сложным является x по сравнению с ними. Термин "состоящий из" и аналогичные фразы с использованием слов с корнем "содержать" в настоящем описании используют в качестве синонимов термина "содержащий", и они имеют одно и то же значение.
Термин "состоящий из" является синонимом термина "содержащий" (см. выше).
Термин "контакт" при использовании в отношении стволовой клетки и органа, подлежащего трансплантации, может означать, что после подвергания органа воздействию стволовая клетка физически соприкасается с органом. В таких случаях стволовая клетка находится в прямом контакте с органом. В других случаях стволовая клетка может косвенно контактировать с органом, если одна или несколько структур (например, другая клетка) и/или жидкостей (например, кровь) физически располагается между стволовой клеткой и органом.
"EC-клетки" обнаруживали при анализе типа злокачественного новообразования, называемого тератокарциномой. В 1964 году исследователи отметили, что одну клетку в тератокарциномах можно выделять и сохранять недифференцированной в культуре. Этот тип стволовой клетки стал известен как клетка эмбриональной карциномы (EC-клетка).
Термин "эффективное количество", как правило, означает количество, обеспечивающее желаемый местный или системный эффект, например, эффективный для улучшения нежелательных эффектов воспаления, включая достижение конкретных желаемых эффектов, описываемых в настоящей заявке. Например, эффективное количество является количеством, достаточным для достижения благоприятного или желаемого клинического результата. Эффективные количества можно вводить все сразу за одно введение или в небольших количествах, обеспечивающих эффективное количество за несколько введений. Точное определение того, что будут рассматривать как эффективное количество, может быть основано на факторах, отдельных для каждого органа, включая тип органа, заболевание или повреждение, подвергаемое лечению, способ, которым обрабатывают орган, длительность времени с момента забора и т.д. Специалист в этой области будет способен определять эффективное количество для указанного органа с учетом этих соображений, общепринятых в этой области. В рамках изобретения, термин "эффективная доза" означает то же, что и "эффективное количество".
Термин "эффективный путь", как правило, означает путь, обеспечивающий доставку средства в желаемый компартмент, систему или место. Например, эффективный путь является путем, которым можно вводить средство для обеспечения нахождения в желаемом месте действия количества средства, достаточного для осуществления благоприятного или желаемого клинического результата (в данном случае, эффективной трансплантации).
"Эмбриональные стволовые клетки (ESC)" хорошо известны в этой области, и их получают из множества различных видов млекопитающих. Эмбриональные стволовые клетки являются стволовыми клетками, полученными из внутренней клеточной массы ранней стадии развития эмбриона, известной как бластоциста. Они способны дифференцироваться во все производные трех первичных зародышевых листков: эктодермы, эндодермы и мезодермы. Они включают каждый из более 220 типов клеток взрослого организма. ES-клетки могут становиться любой тканью в организме, за исключением плаценты. Только клетки морулы являются тотипотентными, способными становиться всеми тканями и плацентой. Некоторые клетки, схожие с ESC, можно получать с помощью ядерного переноса ядра соматической клетки в энуклеированную оплодотворенную яйцеклетку.
Термин "экзогенный" при использовании в отношении стволовой клетки, как правило, относится к стволовой клетке, являющейся внешней по отношению к органу, и воздействию которой подвергают (например, приводят в контакт) орган, предназначенный для трансплантации эффективным путем. Экзогенная стволовая клетка может происходить из того же индивидуума или из другого индивидуума. В одном из вариантов осуществления экзогенные стволовые клетки могут включать стволовые клетки, собранные из индивидуума, выделенные, наращиваемые ex vivo, а затем воздействию которых подвергают орган, предназначенный для трансплантации эффективным путем.
Термин "подвергать воздействию" может включать действие по введению одной или нескольких стволовых клеток в орган, предназначенный для трансплантации. Введение в орган можно осуществлять ex vivo или in vivo (например, посредством перфузии индивидууму).
Использование термина "включает" не предназначено для ограничения.
Термин "повышать" или "повышение" означает индуцирование биологического явления полностью или повышение степени явления.
"Индуцированные плюрипотентные стволовые клетки (клетки IPSC или IPS)" являются соматическими клетками, перепрограммированными, например, посредством встраивания экзогенных генов, придающих соматической клетке менее дифференцированный фенотип. Затем эти клетки можно и индуцировать для дифференцировки в менее дифференцированное потомство. Клетки IPS получают с использованием модификаций подхода, исходно созданного в 2006 году (Yamanaka, S. et al., Cell Stem Cell, 1:39-49 (2007)). Например, в одном случае, для получения клеток IPS исследователи начинают с клеток кожи, которые затем модифицируют стандартным лабораторным способом с использованием ретровирусов для встраивания генов в клеточную ДНК. В одном случае, встроенными генами являлись Oct4, Sox2, Lif4 и c-myc, как известно, действующие совместно в качестве природных регуляторов для сохранения клеток в состоянии, подобном эмбриональным стволовым клеткам. Эти клетки описывают в литературе. См., например, Wernig et al., PNAS, 105:5856-5861 (2008); Jaenisch et al., Cell, 132:567-582 (2008); Hanna et al., Cell, 133:250-264 (2008); и Brambrink et al, Cell Stem Cell, 2:151-159 (2008). Эти ссылки включены в качестве ссылки на руководство по IPSC и способам их получения. Также возможно, что такие клетки можно получать с помощью конкретных условий культивирования (подвергания воздействию конкретных средств).
Термин "ишемическое реперфузионное повреждение" известен в этой области и описан, например, в http://emedicine.medscape.eom/article/431140-overview#aw2aab6b3 (о консервации органа), а также de Groot, H. et al., Transplant Proc. 39(2):481-4 (Mar. 2007), включенных в настоящее описание в качестве ссылок в качестве руководства по ишемическому реперфузионному повреждению и его механистическим подробностям.
"Ишемия" происходит в две фазы. Первую фазу обозначают как фаза теплой ишемии, и она включает время от удаления донорского органа и прерывания кровотока до введения в орган гипотермического раствора для консервации. Фаза холодной ишемии происходит, когда орган поддерживают в гипотермическом состоянии перед трансплантацией и нормальной рециркуляцией у реципиента.
Термин "выделенный" относится к клетке или клеткам, не ассоциированным с одной или несколькими клетками или одним или несколькими клеточными компонентами, ассоциированными с клеткой или клетками in vivo. Термин "обогащенная популяция" означает относительное повышение количества желаемых клеток относительно одного или нескольких других типов клеток in vivo или в первичной культуре.
Однако, в рамках изобретения, термин "выделенный" не указывает на наличие только клеток по изобретению. Вернее, термин "выделенный" указывает на то, что клетки по изобретению удаляют из их природного тканевого окружения, и они присутствуют в более высокой концентрации по сравнению с нормальным тканевым окружением. Таким образом, "выделенная" популяция клеток может дополнительно включать типы клеток в дополнение к клеткам по изобретению и может включать дополнительные тканевые компоненты. Это также можно выражать в терминах делений клеток, например. Клетка можно подвергать 10, 20, 30, 40 или более делениям in vitro или ex vivo таким образом, что она становится обогащенной по сравнению с ее исходными количествами in vivo или в ее исходном тканевом окружении (например, костном мозге, периферической крови, плаценте, пуповине, пуповинной крови, жировой ткани и т.д.).
"MAPC" является аббревиатурой для "мультипотентных зрелых клеток-предшественников". Она относится к клетке, не являющейся эмбриональной стволовой клеткой или половой клеткой, но имеющей некоторые из их характеристик. MAPC можно охарактеризовать с помощью ряда альтернативных характеристик, каждая из которых придает новизну клеткам при их открытии. Таким образом, они могут отличаться одной или несколькими из этих характеристик. Во-первых, они имеют длительную репликативную способность в культуре без трансформации (туморогенные) и с нормальным кариотипом. Во-вторых, они могут давать начало потомству клеток из нескольких зародышевых листков, таких как два или все три зародышевых листка (т.е. эндодерма, мезодерма и эктодерма), после дифференцировки. В-третьих, хотя они не являются эмбриональными стволовыми клетками или половыми клетками, они могут экспрессировать маркеры этих незрелых типов клеток таким образом, что MAPC могут экспрессировать один или несколько из Oct 3/4 (т.е. Oct 3A), rex-1 и rox-1. Они также могут экспрессировать один или несколько из sox-2 и SSEA-4. В-четвертых, как и стволовая клетка, они могут самоподдерживаться, т.е. имеют длительную репликативную способность без трансформации. Это означает, что эти клетки экспрессируют теломеразу (т.е. имеют теломеразную активность). Таким образом, тип клеток, обозначаемый как "MAPC", может отличаться альтернативными основными характеристиками, описывающими клетку посредством некоторых из этих новых свойств.
Термин "зрелый" в отношении MAPC является неограничивающим. Он относится к неэмбриональной соматической клетке. MAPC являются кариотипически нормальными и не образуют тератомы in vivo. Эту аббревиатуру впервые использовали в патенте США № 7015037 для описания плюрипотентной клетки, выделенной из костного мозга. Однако впоследствии открыли клетки с плюрипотентными маркерами и/или дифференцировочным потенциалом, и в целях по настоящему изобретению они могут являться эквивалентными клетками, сначала обозначенными "MAPC". Основное описание типа клеток MAPC представлено выше в сущности изобретения.
MAPC представляют собой популяцию более незрелых клеток-предшественников, чем MSC (Verfaillie, CM., Trends Cell Biol 12:502-8 (2002), Jahagirdar, B.N., et al., Exp Hematol, 29:543-56 (2001); Reyes, M. and CM. Verfaillie, Ann N Y Acad Sci, 938:231-233 (2001); Jiang, Y. et al., Exp Hematol, 30896-904 (2002); и Jiang, Y. et al, Nature, 418:41-9. (2002))
Термин "MultiStem®" является торговым названием клеточного препарата на основе MAPC по патенту США № 7015037, т.е. неэмбриональной стволовой, неполовой клеткой, как описано выше. MultiStem® получают способами культивирования клеток, описываемыми в этой патентной заявке, в частности, с использованием более низкой концентрации кислорода и более высокой сыворотки. MultiStem® хорошо размножаются, кариотипически нормальны и не образуют тератомы in vivo. Они могут дифференцироваться в клеточные линии нескольких зародышевых листков и могут экспрессировать один или несколько из теломеразы, oct3/4, rex-1, rox-1, sox-2 и SSEA4.
Термин "орган" можно использовать в соответствии с его общепринятым и понятным значением в этой области как целый интактный орган, удаленный у донора для трансплантации или предназначенный для удаления у донора для трансплантации реципиенту. Хотя термин "орган" особенно отмечен в этой заявке, способы используют по отношению к тканям, которые могут не составлять целые органы. Т.е. к частям органов, таким, как описывают где-либо в настоящей заявке. Таким образом, при необходимости, термином "ткань" можно соответствующим образом заменять термин "орган".
"Фармацевтически приемлемый носитель" является любой фармацевтически приемлемой средой для клеток, используемых в настоящем изобретении. Такая среда может поддерживать изотоничность, метаболизм клеток, pH и т.п. Она совместима при введении в орган и, таким образом, ее можно использовать для доставки клеток и лечения.
Термин "активность" относится к способности клеток обеспечивать эффекты, описываемые в настоящей заявке. Таким образом, активность относится к эффекту на различных уровнях, включая, в качестве неограничивающих примеров, повышение вероятности успешной трансплантации, замедление разрушения органа до трансплантации, снижение воспалительной активности в органе, обеспечение иммунологической толерантности по отношению к органу, повышение продукции противовоспалительных цитокинов в органе, повышение наличия нейропротекторных T-клеток в органе, снижение наличия реактивных T-клеток в органе, снижение уровня провоспалительных цитокинов в органе, снижение эффектов гипоксии в органе, реверсирование уровня отека в органе и снижение эффектов гипотермии в органе. Повреждение, возникающее при удалении, консервации и трансплантации, происходит, в основном, в результате ишемии и гипотермии. Они могут влиять на органы различными способами. Их описывают в ссылке Medscape, процитированной выше, и в настоящей заявке приведена ссылка на нее. Согласной этой ссылке, механизмы повреждения ткани включают утрату целостности структуры клеток, нарушение ионной композиции клетки, нарушение образования АТФ, и в результате реперфузии повреждение может происходить в течение реперфузии в результате токсического накопления свободных радикалов кислорода.
Что касается целостности структуры клетки, она может нарушаться в результате утраты структурной целостности мембраны клетки. Поддержание целостности мембраны клетки зависит от контроля температуры, pH, осмоляльности. Ишемия органа и консервация нарушают все эти параметры.
"Примордиальные эмбриональные половые клетки" (PG- или EG-клетки) можно культивировать и стимулировать для получения многих менее дифференцированных типов клеток.
"Клетки-предшественники" являются клетками, образующимися при дифференцировке стволовой клетки, имеющей некоторые, но не все, характеристики их терминально-дифференцированного потомства. Определенные клетки-предшественники, такие как "сердечные клетки-предшественники", коммитированы по отношению к линии, но не к конкретному или терминально-дифференцированному типу клеток. Термин "предшественник", как используют в аббревиатуре "MAPC", не ограничивает эти клетки конкретной линией. Клетка-предшественник может образовывать клетку-потомство, более высокодифференцированную, чем клетка-предшественник.
В рамках изобретения, термин "снижает" означает предотвращение, а также снижение. В отношении лечения органа, "снижать" - это предотвращать или ослаблять отторжение органа. Это включает причины или симптомы отторжения органа. Это применяют, например, по отношению к основополагающей биологической причине отторжения, например, улучшение вредных воздействий воспаления.
"Селекция" клетки с желаемым уровнем активности может означать идентификацию (например, посредством анализа), выделение и наращивание клеток. С помощью нее можно получать популяцию, имеющую более высокую активность, чем родительская популяция клеток, из которой клетку выделяли. "Родительская" популяция клеток относится к родительским клеткам, из которых делились выбранные клетки. "Родительский" относится к точной взаимосвязи P1 → F1 (т.е. клетке-потомству). Таким образом, если клетку X выделяют из смешанной популяции клеток X и Y, в которой X является экспрессором, а Y - нет, нельзя классифицировать всего лишь изолят X как имеющий повышенную экспрессию. Но, если клетка-потомство X является более высоким экспрессором, можно классифицировать клетку-потомство как имеющую повышенную экспрессию.
Выбор клетки, обеспечивающей желаемый эффект, будет включать анализ для определения того, обеспечивают ли клетки желаемый эффект, а также будет включать получение этих клеток. Клетка может от природы обеспечивать желаемый эффект в том смысле, что эффект не обеспечивается экзогенным трансгеном/ДНК. Но эффективную клетку можно улучшать посредством инкубации или подвергания воздействию средства, повышающего эффект. Популяция клеток, из которой выбирают эффективную клетку, может быть известна в качестве имеющей активность до осуществления анализа. Клетка может не быть известна в качестве обеспечивающей желаемый эффект до осуществления анализа. Т.к. эффект может зависеть от экспрессии гена и/или секреции, также можно выбирать клетки с учетом одного или нескольких генов, вызывающих эффект.
Селекцию можно осуществлять из клеток в ткани. Например, в этом случае клетки будут выделять из желаемой ткани, наращивать в культуре, выбирать по обеспечению желаемого эффекта и дополнительно наращивать выбранные клетки.
Селекцию также можно осуществлять из клеток ex vivo, таких как клетки в культуре. В этом случае одну или несколько клеток в культуре будут анализировать на обеспечение желаемого эффекта, и можно дополнительно наращивать полученные клетки, обеспечивающие желаемый эффект.
Клетки также можно выбирать по повышенной способности обеспечивать желаемый эффект. В этом случае популяция клеток, из которой получают улучшенную клетку, уже имеет желаемый эффект. Усиленный эффект означает более высокое среднее количество на клетку, чем в родительской популяции.
Родительская популяция, из которой выбирают улучшенную клетку, может являться, по существу, гомогенной (один тип клеток). Одним из путей получения такой улучшенной клетки из этой популяции, является получение отдельных клеток или совокупностей клеток и анализ этих клеток или совокупностей клеток для получения клонов, от природы имеющих усиленный (больший) эффект (в противоположность обработке клеток модулятором, индуцирующим или повышающим эффект), а затем наращивание этих клеток, улучшенных от природы.
Однако клетки можно обрабатывать одним или несколькими средствами, которые будут индуцировать или повышать эффект. Таким образом, по существу, гомогенные популяции можно обрабатывать для усиления эффекта.
Если популяция не является, по существу, гомогенной, то предпочтительно, чтобы родительская популяция клеток, подлежащая обработке, содержала по меньшей мере 100 из желаемого типа клеток, у которых ищут усиленный эффект, более предпочтительно - по меньшей мере 1000 клеток, и еще более предпочтительно - по меньшей мере 10000 клеток. После обработки эту субпопуляцию можно выделять из гетерогенной популяции известными способами селекции клеток и, при желании, дополнительно наращивать.
Таким образом, желаемые уровни эффекта могут быть выше уровней в указанной предшествующей популяции. Например, клетки, помещаемые в первичную культуру из ткани и наращиваемые и выделяемые с помощью условий культивирования, не предназначенных специально для получения эффекта, могут представлять родительскую популяцию. Такую родительскую популяцию можно обрабатывать для усиления среднего эффекта на клетку или подвергать скринингу на клетку или клетки в популяции, демонстрирующие эффект более высокой степени без умышленной обработки. Затем такие клетки можно наращивать для получения популяции с более высокой (желаемой) экспрессией.
"Самоподдержание" стволовой клетки относится к способности образовывать реплицированные дочерние стволовые клетки, имеющие дифференцировочный потенциал, идентичный тем клеткам, из которых они образовывались. Аналогичным термином, используемым в этом контексте, является "пролиферация".
Термин "стволовая клетка" означает клетку, которая может подвергаться самоподдержанию (т.е. потомству с тем же дифференцировочным потенциалом), а также образовывать клетки-потомство, более ограниченные по дифференцировочному потенциалу. В контексте изобретения стволовая клетка также будет включать более дифференцированную клетку, подвергнутую дедифференцировке, например, в результате ядерного переноса, в результате слияния с более незрелой стволовой клеткой, в результате встраивания конкретных факторов транскрипции или в результате культивирования в конкретных условиях. См., например, Wilmut et al., Nature, 385:810-813 (1997); Ying et al, Nature, 416:545-548 (2002); Guan et al, Nature, 440: 1199-1203 (2006); Takahashi et al., Cell, 126:663-676 (2006); Okita et al., Nature, 448:313-317 (2007); и Takahashi et al, Cell, 131:861-872 (2007).
Дедифференцировку также может вызывать введение конкретных соединений или воздействие физического окружения in vitro или in vivo, которое будет вызывать дедифференцировку. Стволовые клетки также можно получать из аномальной ткани, такой как тератокарцинома, и некоторых других источников, таких как эмбриоидные тельца (хотя их можно считать эмбриональными стволовыми клетками в том смысле, что их получают из эмбриональной ткани, хотя и не напрямую из внутренней клеточной массы). Стволовые клетки также можно получать, встраивая гены, ассоциированные с функционированием стволовых клеток, в нестволовую клетку, такую как индуцированная плюрипотентная стволовая клетка.
Термин "индивидуум" означает позвоночного, такого как млекопитающее, такого как человек. Млекопитающие включают, в качестве неограничивающих примеров, людей, собак, кошек, лошадей, коров и свиней.
Термин "терапевтически эффективное количество" относится к количеству средства, определенному как приводящее к какому-либо терапевтическому ответу у млекопитающего. Например, эффективные противовоспалительные терапевтические средства могут пролонгировать выживаемость пациента и/или ингибировать очевидные клинические симптомы. Способы лечения, являющиеся терапевтически эффективными в значении термина, в рамках изобретения, включают способы лечения, улучшающие качество жизни индивидуума, даже если они не улучшают исход заболевания сам по себе. Специалист в этой области легко определит такие терапевтически эффективные количества. Таким образом, термин "лечить" означает доставлять такое количество. Таким образом, лечение может предотвращать или улучшать любые патологические симптомы.
Термин "толеризация" или "толеризировать" относится к обработке органа перед трансплантацией (трансплантата) стволовыми клетками для снижения иммуногенности трансплантата, чтобы сделать возможной толерантность реципиента к органу или облегчить ее развитие. Термин в широком смысле относится к концепции снижения иммуногенности трансплантируемого органа, делающего возможной толерантность у реципиента или способствующего ее развитию. Таким образом, толеризация органа делает орган переносимым реципиентом. Другими словами, термин может относиться к тому, чтобы сделать иммунную систему неспособной вызывать иммунный ответ на клетку или ткань, в норме вызывающие иммунный ответ. Примером этого является секреция T-регуляторной клеткой факторов, супрессирующих активированную T-клетку таким образом, что она больше не может секретировать провоспалительные цитокины.
Это можно осуществлять с помощью обработки ex vivo перед трансплантацией или даже с помощью местного введения до забора.
Термины "лечить" или "лечение" используют в широком смысле в отношении изобретения, и каждый такой термин включает, среди прочего, профилактику, улучшение, ингибирование или излечение недостаточности, дисфункции, заболевания или другого вредного процесса, включая те, которые мешают терапии и/или являются ее результатом.
Термин "проверять" означает подтверждение. В контексте изобретения подтверждают, что клетка является экспрессором с желаемой активностью. Таким образом, затем эту клетку можно использовать (в лечении, банкировании, скрининге лекарственных средств и т.д.) с разумным ожиданием эффективности. Таким образом, проверять означает подтверждать, что клетки, которые, как исходно обнаруживали, имеют/получены в качестве имеющих желаемую активность, фактически, сохраняют активность. Таким образом, валидация является событием проверки в процессе с двумя событиями, включающем исходное определение и последующее определение. Второе событие в настоящем описании обозначают как "валидация".
Стволовые клетки
Настоящее изобретение можно осуществлять на практике, предпочтительно, с использованием стволовых клеток вида позвоночных, такого как люди, не являющиеся человеком приматы, домашние животные, сельскохозяйственные животные и другие неотносящиеся к человеку млекопитающие. Они включают, в качестве неограничивающих примеров, клетки, описываемые ниже.
Эмбриональные стволовые клетки
Наиболее хорошо изученной стволовой клеткой является эмбриональная стволовая клетка (ESC), т.к. она обладает неограниченным самоподдержанием и мультипотентным дифференцировочным потенциалом. Эти клетки получают из внутренней клеточной массы бластоцисты, или их можно получать из примордиальных половых клеток постимплантационного эмбриона (эмбриональные половые клетки или EG-клетки). ES- и EG-клетки впервые получили из мыши, а позднее из многих других животных, а недавно также из не являющихся человеком приматов и людей. При встраивании в бластоцисты мыши или бластоцисты других животных ESC могут вносить свой вклад во все ткани животного. ES- и EG-клетки можно идентифицировать по положительному окрашиванию с использованием антител против SSEA1 (мышь) и SSEA4 (человек). См., например, патенты США №№ 5453357; 5656479; 5670372; 5843780; 5874301; 5914268; 6110739 6190910; 6200806; 6432711; 6436701, 6500668; 6703279; 6875607; 7029913; 7112437; 7145057; 7153684; и 7294508, каждый из которых включен в настоящее описание в качестве ссылки в качестве руководства по эмбриональным стволовым клеткам и способам их получения и наращивания. Таким образом, ESC и способы их выделения и наращивания хорошо известны в этой области.
Идентифицирован ряд факторов транскрипции и экзогенных цитокинов, влияющих на статус активности эмбриональных стволовых клеток in vivo. Первым описываемым фактором транскрипции, вносящим вклад в плюрипотентность стволовой клетки, является Oct4. Oct4 принадлежит к семейству факторов транскрипции POU (Pit-Oct-Unc) и является ДНК-связывающим белком, способным активировать транскрипцию генов, содержащим октамерную последовательность, названную "октамерный мотив" в области промотора или энхансера. Oct4 экспрессируется во время стадии расщепления оплодотворенной зиготы до образования зародышевого цилиндра. Функцией Oct3/4 является репрессия индуцирующих дифференцировку генов (т.е. FoxaD3, hCG) и активация генов, способствующих плюрипотентности (FGF4, Utfl, Rel). Sox2, член факторов транскрипции из группы белков с высокой подвижностью (HMG), взаимодействует с Oct4 для активации транскрипции генов, экспрессирующихся во внутренней клеточной массе. Важно, чтобы экспрессия Oct3/4 в эмбриональных стволовых клетках поддерживалась между конкретными уровнями. Гиперэкспрессия или негативная регуляция >50% уровня экспрессии Oct4 будет изменять направление развития эмбриональной стволовой клетки с образованием примитивной эндодермы/мезодермы или трофэктодермы, соответственно. In vivo эмбрионы с недостаточностью Oct4 развиваются до стадии бластоцисты, но клетки внутренней клеточной массы не являются плюрипотентными. Вместо этого они дифференцируются в направлении экстраэмбриональной трофобластной линии. Sall4, фактор транскрипции Spalt млекопитающих, является вышележащим регулятором Oct4 и, таким образом, важен для поддержания соответствующих уровней Oct4 в течение ранних фаз эмбрионального развития. Если уровни Sall4 опускаются ниже конкретного порога, трофэктодермальные клетки будут размножаться эктопически во внутренней клеточной массе. Другим фактором транскрипции, необходимым для плюрипотентности, является Nanog, названный в честь кельтского племени "Tir Nan Og": "земля вечно молодых". In vivo Nanog экспрессируется со стадии компактной морулы, впоследствии определяется во внутренней клеточной массе и негативно регулируется к стадии имплантации. Негативная регуляция Nanog может быть важна для избежания неконтролируемого размножения плюрипотентных клеток и чтобы сделать возможной многолинейную дифференцировку в течение гаструляции. Эмбрионы без Nanog, выделенные в день 5,5, состоят из неорганизованной бластоцисты, в основном, содержащей экстраэмбриональную эндодерму, но без различимого эпибласта.
Неэмбриональные стволовые клетки
Стволовые клетки идентифицированы в большинстве тканей. Вероятно, лучше всего охарактеризованной является гематопоэтическая стволовая клетка (HSC). HSC являются клетками, происходящими из мезодермы, их можно выделять с использованием поверхностных клеточных маркеров и функциональных характеристик. Их выделяют из костного мозга, периферической крови, пуповинной крови, зародышевой печени и желточного мешка. Они инициируют гемопоэз и образуют множество гематопоэтических линий. При трансплантации летально облученным животным они могут репопулировать эритроидный, нейтрофил-макрофагальный, мегакариоцитарный и лимфоидный пул гематопоэтических клеток. Также можно индуцировать несколько их самоподдерживающих делений клеток. См., например, патенты США №№ 5635387; 5460964; 5677136; 5750397; 5681599 и 5716827. В патенте США № 5192553 описывают способы выделения неонатальных или фетальных гематопоэтических стволовых клеток или клеток-предшественников человека. В патенте США № 5716827 описывают гематопоэтические клетки человека, являющиеся Thy-1+ предшественниками, и соответствующие среды для выращивания для регенерации их in vitro. В патенте США № 5635387 описывают способ и устройство для культивирования гематопоэтических клеток человека и их предшественников. В патенте США № 6015554 описывают способ восстановления лимфоидных и дендритных клеток человека. Таким образом, HSC и способы их выделения и наращивания хорошо известны в этой области.
Другой стволовой клеткой, хорошо известной в этой области, является нейрональная стволовая клетка (NSC). Эти клетки могут пролиферировать in vivo и непрерывно регенерировать, по меньшей мере, некоторые нервные клетки. При культивировании ex vivo нейрональные стволовые клетки можно индуцировать для пролиферации, а также дифференцировки в различные типы нейронов и глиальных клеток. При трансплантации в головной мозг нейрональные стволовые клетки могут приживаться и давать начало нейронам и глиальным клеткам. См., например, Gage F.H., Science, 287:1433-1438 (2000), Svendsen S.N. et al., Brain Pathology, 9:499-513 (1999), и Okabe S. et al, Mech Development, 59:89-102 (1996). В патенте США № 5851832 описывают мультипотентные нейрональные стволовые клетки, полученные из ткани головного мозга. В патенте США № 5766948 описывают получение нейробластов из полушарий головного мозга новорожденного. В патентах США №№ 5564183 и 5849553 описывают применение стволовых клеток нервного гребня млекопитающего. В патенте США № 6040180 описывают получение in vitro дифференцированных нейронов из культур мультипотентных стволовых клеток ЦНС млекопитающего. В WO 98/50526 и WO 99/01159 описывают получение и выделение нейроэпителиальных стволовых клеток, предшественников олигодендроцитов-астроцитов и линиеспецифичных нейрональных предшественников. В патенте США № 5968829 описывают нейрональные стволовые клетки, полученные из эмбрионального переднего мозга. Таким образом, нейрональные стволовые клетки и способы их получения и наращивания хорошо известны в этой области.
Другой стволовой клеткой, интенсивно исследуемой в этой области, является мезенхимальная стволовая клетка (MSC). MSC получают из эмбриональной мезодермы, и их можно выделять из многих источников, включая, среди прочего, костный мозг взрослого, периферическую кровь, жировую ткань, плаценту и пуповинную кровь. MSC могут дифференцироваться во многие мезодермальные ткани, включая мышцы, кости, хрящи, жировую ткань и сухожилие. Существует большое количество работ на тему этих клеток. См., например, патенты США №№ 5486389; 5827735; 5811094; 5736396; 5837539; 5837670 и 5827740. См. также Pittenger, M. et al, Science, 284:143-147 (1999).
Другим примером зрелой стволовой клетки являются стволовые клетки жировой ткани взрослых (ADSC), выделенные из жировой ткани, как правило, посредством липосакции с последующим высвобождением ADSC с использованием коллагеназы. ADSC во многом схожи с MSC, полученными из костного мозга, за исключением того, что из жировой ткани можно выделять гораздо больше клеток. Сообщают, что эти клетки дифференцируются в костную ткань, жировую ткань, мышцы, хрящи и нейроны. Способ выделения описывают в патентной публикации США № 2005/0153442 A1.
Другие стволовые клетки, известные в этой области включают желудочно-кишечные стволовые клетки, эпидермальные стволовые клетки и печеночные стволовые клетки, также обозначаемые как "овальные клетки" (Potten, C, et al., Trans R Soc Lond B Biol Sci, 353:821-830 (1998), Watt, F., Trans R Soc Lond B Biol Sci, 353:831 (1997); Alison et al., Hepatolog, 29:678-683 (1998).
Другие неэмбриональные клетки, которые, как сообщают, способны дифференцироваться в типы клеток нескольких эмбриональных зародышевых листков, включают, в качестве неограничивающих примеров, клетки из пуповинной крови (см. патентную публикацию США № 2002/0164794), плаценты (см. патентную публикацию США № 2003/0181269), матрикса пуповины (Mitchell, K.E. et al., Stem Cells, 21:50-60 (2003)), небольшие эмбрионально-подобные стволовые клетки (Kucia, M. et al., J Physiol Pharmacol, 57 Suppl 5:5-18 (2006)), стволовые клетки амниотической жидкости (Atala, A., J Tissue Regen Med, 1:83-96 (2007)), клетки-предшественники, полученные из кожи (Toma et al, Nat Cell Biol, 3:778-784 (2001)), костный мозг (см. патентные публикации США №№ 2003/0059414 и 2006/0147246), выделенные из костного мозга взрослые мультилинейные индуцибельные клетки (MIAMI) (см. PCT US2004/002580) и клетки эндометрия (см. патентную публикацию США № 2013/0156726), каждая из ссылок включена в настоящее описание в качестве ссылки в качестве руководства по этим клеткам.
Стратегии перепрограммирования соматических клеток
Для индуцирования преобразования дифференцированных клеток в эмбриональное состояние используют несколько различных стратегий, таких как ядерная трансплантация, слияние клеток и индуцируемое культивированием перепрограммирование. Ядерный перенос включает инъекцию соматического ядра в энуклеированный ооцит, который после переноса в суррогатную мать может давать начало клону ("репродуктивное клонирование") или после эксплантации в культуре может давать начало генетически соответствующим эмбриональным стволовым клеткам (ES) ("перенос ядра соматической клетки", SCNT). Слияние соматических клеток с ES-клетками приводит к образованию гибридов, проявляющих все черты плюрипотентных ES-клеток. При эксплантации соматических клеток в культуре осуществляют селекцию иммортализованных клеточных линий, которые могут являться плюрипотентными или мультипотентными. К настоящему моменту, сперматогониальные стволовые клетки являются единственным источником плюрипотентных клеток, которые можно получать из постнатальных животных. Посредством трансдукции соматических клеток с использованием определенных факторов можно инициировать перепрограммирование в плюрипотентное состояние. Эти экспериментальные подходы подробно рассмотрены (Hochedlinger and Jaenisch, Nature, 441: 1061-1067 (2006) и Yamanaka, S., Cell Stem Cell, 1:39-49 (2007)).
Ядерный перенос
Ядерная трансплантация (NT), также обозначаемая как перенос ядра соматической клетки (SCNT), означает встраивание ядра из донорной соматической клетки в энуклеированный ооцит для получения клонированного животного, такого как овца Dolly (Wilmut et al., Nature, 385:810-813 (1997). Получение живых животных с помощью NT показало, что эпигенетическое состояние соматических клеток, включая терминально-дифференцированные клетки, хотя и стабильно, но не является необратимо фиксированным, и его можно перепрограммировать в эмбриональное состояние, способное направлять развитие нового организма. В дополнение к обеспечению исключительного экспериментального подхода для выявления основных эпигенетических механизмов, участвующих в эмбриональном развитии и патологии, технология ядерного клонирования представляет потенциальный интерес для персонализированной трансплантационной медицины.
Слияние соматических клеток и эмбриональных стволовых клеток
Эпигенетическое перепрограммирование соматических ядер в недифференцированное состояние показано на гибридах мыши, полученных слиянием эмбриональных клеток с соматическими клетками. Гибриды между различными соматическими клетками и клетками эмбриональной карциномы (Solter, D., Nat Rev Genet, 7:319-327 (2006), эмбриональными зародышевыми (EG) или ES-клетками (Zwaka and Thomson, Development, 132:227-233 (2005)) обладают многими чертами родительских эмбриональных клеток, что свидетельствует о том, что плюрипотентный фенотип является доминантным в таких продуктах слияния. Как и у мыши (Tada et al., Curr Biol, 11:1553-1558 (2001)), ES-клетки человека обладают потенциалом для перепрограммирования соматических ядер после слияния (Cowan et al., Science, 309:1369-1373(2005)); Yu et al., Science, 318: 1917-1920 (2006)). Активация молчащих маркеров плюрипотентности, таких как Oct4, или реактивация неактивной соматической X-хромосомы представляет молекулярное доказательство перепрограммирования соматического генома в гибридных клетках. Предполагают, что репликация ДНК необходима для активации маркеров плюрипотентности, что впервые наблюдают через 2 для после слияния (Do and Scholer, Stem Cells, 22:941-949 (2004)), и что форсированная гиперэкспрессия Nanog в ES-клетках способствует плюрипотентности при слиянии с нейрональными стволовыми клетками (Silva et al., Nature, 441:997-1001 (2006)),
Индуцируемое культивированием перепрограммирование
Плюрипотентные клетки получают из эмбриональных источников, таких как бластомеры и внутренняя клеточная масса (ICM) бластоцисты (ES-клетки), эпибласт (EpiSC-клетки), примордиальные половые клетки (EG-клетки) и постнатальные сперматогониальные стволовые клетки ("maGSCsm" "ES-подобные" клетки). Плюрипотентные клетки и их донорская клетка/ткань являются следующими: партеногенетические ES-клетки получают из ооцитов мыши (Narasimha et al, Curr Biol, 7:881-884 (1997)); эмбриональные стволовые клетки получают из бластомеров (Wakayama et al., Stem Cells, 25:986-993 (2007)); клетки внутренней клеточной массы (источник недоступен) (Eggan et al., Nature, 428:44-49 (2004)); эмбриональные зародышевые клетки и клетки эмбриональной карциномы получают из примордиальных половых клеток (Matsui et al, Cell, 70:841-847 (1992)); GMCS, maSSC, и MASC получают из сперматогониальных стволовых клеток (Guan et al., Nature, 440:1199-1203 (2006); Kanatsu-Shinohara et al, Cell, 119:1001-1012 (2004); и Seandel et al, Nature, 449:346-350 (2007); EpiSC-клетки получают из эпибластов (Brons et al, Nature, 448:191-195 (2007); Tesar et al, Nature, 448:196-199(2007)); партеногенетические ES-клетки получают из ооцитов человека (Cibelli et al, Science, 295L819 (2002); Revazova et al, Cloning Stem Cells, 9:432-449 (2007)); ES-клетки человека получают из бластоцисты человека (Thomson et al, Science, 282:1145-1147 (1998)); MAPC получают из костного мозга (Jiang et al, Nature, 418:41-49 (2002); Phinney and Prockop, Stem Cells, 25:2896-2902 (2007)); клетки пуповинной крови (полученные из пуповинной крови) (van de Ven et al, Exp Hematol, 35:1753-1765 (2007)); клетки, полученные из нейросферы, получают из нервной клетки (Clarke et al, Science, 288:1660-1663 (2000)). Известно, что донорские клетки из линии половых клеток, такие как PGC или сперматогониальные стволовые клетки, являются унипотентными in vivo, но показано, что плюрипотентные ES-подобные клетки (Kanatsu-Shinohara et al, Cell, 119:1001-1012 (2004) или maGSC (Guan et al, Nature, 440:1199-1203 (2006) можно выделять после длительного культивирования in vitro. В то время как большинство этих плюрипотентных типов клеток были способны к дифференцировке in vitro и образованию тератом, только ES, EG, EC и maGCS, полученные из сперматогониальных стволовых клеток, или ES-подобные клетки являлись плюрипотентными по более строгим критериям, т.к. они были способны образовывать постнатальные химеры и вносить вклад в зародышевую линию. Недавно мультипотентные взрослые сперматогониальные стволовые клетки (MASC) получили из тестикулярных сперматогониальных стволовых клеток взрослых мышей, и эти клетки имели профиль экспрессии, отличающийся от такового у ES-клеток (Seandel et al, Nature, 449:346-350 (2007)), но схожий с EpiSC-клетками, которые получали из эпибласта постимплантационных эмбрионов мыши (Brons et al, Nature, 448:191-195 (2007); Tesar et al., Nature, 448: 196-199 (2007)).
Перепрограммирование с помощью определенных факторов транскрипции
Takahashi и Yamanaka описали перепрограммирование соматических клеток обратно в ES-подобное состояние (Takahashi and Yamanaka, Cell, 126:663-676 (2006)). Они успешно перепрограммировали эмбриональные фибробласты мыши (MEF) и зрелые фибробласты в плюрипотентные ES-подобные клетки после вирусно-опосредованной трансдукции четырех факторов транскрипции Oct4, Sox2, c-myc и Klf4 с последующей селекцией для активации гена-мишени Oct4 Fbx15. Клетки, имеющие активированный Fbx15, называли iPS (индуцированными плюрипотентными стволовыми) клетками, и показано, что они являются плюрипотентными, по их способности образовывать тератомы, хотя они были неспособны образовывать живые химеры. Это плюрипотентное состояние зависело от непрерывной вирусной экспрессии трансдуцированных генов Oct4 и Sox2, в то время как эндогенные гены Oct4 и Nanog не экспрессировались или экспрессировались на более низком уровне, чем в ES-клетках, и обнаруживали, что их соответствующие промоторы являлись, в значительной степени, метилированными. Это согласуется с выводом о том, что клетки Fbx15-iPS не соответствуют ES-клеткам, а могут представлять собой неполное состояние перепрограммирования. В то время как с помощью генетических экспериментов установили, что Oct4 и Sox2 важны для плюрипотентности (Chambers and Smith, Oncogene, 23:7150-7160 (2004); Ivanona et al, Nature, 442:5330538 (2006); Masui et al., Nat Cell Biol, 9:625-635 (2007)), роль двух онкогенов c-myc и Klf4 в перепрограммировании менее ясна. Некоторые из этих онкогенов, фактически, могут являться необязательными для перепрограммирования, т.к. получали iPS-клетки мыши и человека в отсутствие трансдукции c-myc, хотя и с низкой эффективностью (Nakagawa et al, Nat Biotechnol, 26: 191-106 (2008); Werning et al, Nature, 448:318-324 (2008); Yu et al, Science, 318: 1917-1920 (2007)).
MAPC
MAPC человека описывают в патенте США № 7015037. MAPC идентифицированы у других млекопитающих. Например, MAPC мыши также описывают в патенте США № 7015037. MAPC крысы также описывают в патенте США № 7838289.
Эти ссылки включены в настоящее описание в качестве ссылок для описания MAPC, впервые выделенных Catherine Verfaillie.
Выделение и выращивание MAPC
В этой области известны способы выделения MAPC. См., например, патент США № 7015037, и эти способы, вместе с определением характеристик (фенотипа) MAPC, включены в настоящее описание в качестве ссылки. MAPC можно выделять из множества источников, включая, в качестве неограничивающих примеров, костный мозг, плаценту, пуповину и пуповинную кровь, мышцы, головной мозг, печень, спинной мозг, кровь или кожу. Таким образом, можно получать аспираты костного мозга, биоптаты головного мозга или печени и других органов и выделять клетки с использованием способов положительной или отрицательной селекции, доступных специалистам в этой области, в зависимости от генов, экспрессирующихся (или не экспрессирующихся) в этих клетках (например, с помощью функциональных или морфологических анализов, таких как описываемые в процитированных выше заявках, включенных в настоящее описание в качестве ссылок).
MAPC также получают модифицированными способами, описываемыми в Breyer et al, Experimental Hematology, 34: 1596-1601 (2006) и Subramanian et al., Cellular Programming and Reprogramming: Methods and Protocols; S. Ding (ed.), Methods in Molecular biology, 636:55-78 (2010), включенных в качестве ссылок на эти способы.
MAPC из костного мозга человека, описываемые в патенте США № 7015037
MAPC не экспрессируют общий лейкоцитарный антиген CD45 или эритробласт-специфичный гликофорин-A (Gly-A). Смешанную популяцию клеток подвергали разделению в фиколл-гипаке. Затем клетки подвергали отрицательной селекции с использованием антитела против CD45 и против Gly-A, истощая популяцию CD45+ и Gly-A+ клеток, и затем выделяли оставшиеся приблизительно 0,1% мононуклеарных клеток костного мозга. Клетки также можно помещать в покрытые фибронектином лунки и культивировать, как описано ниже, в течение 2-4 недель для истощения клеток CD45+ и Gly-A+. В культурах адгезивных клеток костного мозга многие адгезивные стромальные клетки подвергаются репликативному старению около 30 деления клеток, и более гомогенная популяция клеток продолжает размножаться и сохранять длинные теломеры.
Альтернативно, можно использовать положительную селекцию для выделения клеток с помощью комбинации клеточно-специфичных маркеров. Способы положительной и отрицательной селекции доступны специалистам в этой области, и многочисленные моноклональные и поликлональные антитела, подходящие для целей отрицательной селекции, также доступны в этой области (см., например, Leukocyte Typing V, Schlossman, et al., Eds. (1995) Oxford University Press) и являются коммерчески доступными в ряде источников.
Способы разделения клеток млекопитающего из смеси популяций клеток также описывают Schwartz, et al., в патенте США № 5759793 (магнитное разделение), Basch et al., 1983 (иммуноаффинная хроматография) и Wysocki and Sato, 1978 (активируемая флуоресценцией сортировка клеток).
Клетки можно культивировать в среде для культивирования с низким содержанием сыворотки или без сыворотки. Бессывороточную среду, используемую для культивирования MAPC, описывают в патенте США № 7015037. Общепринято используемые факторы роста включают, в качестве неограничивающих примеров, фактор роста тромбоцитов и эпидермальный фактор роста. См., например, патенты США №№ 7169610; 7109032; 7037721; 6617161; 6617159; 6372210;6224860; 6037174; 5908782; 5766951; 5397706 и 4657866; все из которых включены в настоящее описание в качестве ссылок в качестве руководства по выращиванию клеток в бессывороточной среде.
Дополнительные способы культивирования
В дополнительных экспериментах плотность, при которой культивируют MAPC, может варьироваться от приблизительно 100 клеток/см2 или приблизительно 150 клеток/см2 до приблизительно 10000 клеток/см2, включая от приблизительно 200 клеток/см2 до приблизительно 1500 клеток/см2, до приблизительно 2000 клеток/см2. Плотность может варьироваться в зависимости от вида. Кроме того, оптимальная плотность может варьироваться в зависимости от условий культивирования и источника клеток. Специалист в этой области может определять оптимальную плотность для указанного набора условий культивирования и клеток.
Кроме того, можно использовать эффективные концентрации атмосферного кислорода менее приблизительно 10%, включая приблизительно 1-5% и, в частности, 3-5%, в любое время в течение выделения, выращивания и дифференцировки MAPC в культуре.
Клетки можно культивировать при различных концентрациях сыворотки, например, приблизительно 2-20%. Можно использовать эмбриональную телячью сыворотку. Можно использовать более высокую концентрацию сыворотки в комбинации с более низким давлением кислорода, например, приблизительно 15-20%. Клетки не нужно подвергать селекции до адгезии к чашкам для культивирования. Например, после использования градиента фиколла клетки можно высевать напрямую, например, при 250000-500000/см2. Адгезивные колонии можно выбирать, возможно, объединять, и наращивать.
В одном из вариантов осуществления, используемом в экспериментальных способах в примерах, для культивирования клеток использовали условия высокой концентрации сыворотки (приблизительно 15-20%) и низкого кислорода (приблизительно 3-5%). Конкретно, адгезивные клетки из колоний помещали и пассировали при плотностях приблизительно 1700-2300 клеток/см2 при 18% сыворотки и 3% кислорода (с PDGF и EGF).
В варианте осуществления конкретно в случае MAPC добавками являются клеточные факторы или компоненты, позволяющие MAPC сохранять способность дифференцироваться в типы клеток нескольких эмбриональных линий, таких как все три линии. Об этом может свидетельствовать экспрессия конкретных маркеров недифференцированного состояния, таких как Oct 3/4 (Oct 3A), и/или маркеров высокой способности к размножению, таких как теломераза.
Культура клеток
В случае всех компонентов, указанных ниже, см. патент США № 7015037, включенный в настоящее описание в качестве ссылки в качестве руководства по этим компонентам.
В основном, клетки, применимые для изобретения, можно поддерживать и наращивать в среде для культивирования, доступной и хорошо известной в этой области. Также рассматривают дополнение среды для культивирования клеток сыворотками млекопитающих. Также можно использовать дополнительные добавки, преимущественно, для снабжения клеток необходимыми микроэлементами для оптимального роста и размножения. Предпочтительно, в культивировании клеток также можно использовать гормоны. Для дополнения сред для культивирования клеток также можно использовать липиды и липидные носители, в зависимости от типа клетки и направления развития дифференцированной клетки. Также рассматривают использование слоев фидерных клеток.
Клетки в культуре можно поддерживать в суспензии или прикрепленными к твердой подложке, такой как компоненты внеклеточного матрикса. Для стволовых клеток часто необходимы дополнительные факторы, способствующие их прикреплению к твердой подложке, такие как коллаген типа I и типа II, хондроитинсульфат, фибронектин, "суперфибронектин" и фибронектин-подобные полимеры, желатин, поли-D- и поли-L-лизин, тромбоспондин и витронектин. В одном из вариантов осуществления настоящего изобретения используют фибронектин. См., например, Ohashi et al., Nature Medicine, 13:880-885 (2007); Matsumoto et al, J Bioscience and Bioengineering, 105:350-354 (2008); Kirouac et al., Cell Stem Cell, 3:369-381 (2008); Chua et al., Biomateriah, 26:2537-2547 (2005); robinskaya et al, Stem Cells, 26:2245-2256 (2008); Dvir-Ginzberg et al, FASEB J, 22:1440-1449 (2008); Turner et al, J Biomed Mater Res Part B: Appl Biomater, 82B: 156-168 (2007); и Miyazawa et al, Journal of Gastroenterology and Hepatology, 22: 1959-1964 (2007)).
Клетки также можно выращивать в "3D" (агрегированных) культурах. См. пример в PCT US2009/31528, зарегистрированной 21 января 2009 года.
После выращивания в культуре клетки можно использовать свежими или замороженными и хранить в виде замороженных стоков с использованием, например, DMEM с 40% FCS и 10% DMSO. Другие способы получения замороженных стоков для культивированных клеток также доступны специалистам в этой области.
Фармацевтические составы
Патент США № 7015037 включен в настоящее описание в качестве ссылки в качестве руководства по фармацевтическим составам. В определенных вариантах осуществления популяции клеток находятся в композиции, адаптированной и подходящей для доставки, т.е. физиологически совместимой.
Составы будут ориентированы на степень желаемого эффекта, такого как снижение воспаления, снижение апоптоза, отека и т.д., положительная регуляция конкретных факторов и т.д.
В некоторых вариантах осуществления чистота клеток для введения в орган составляет приблизительно 100% (по существу, гомогенные). В других вариантах осуществления она составляет от 95% до 100%. В некоторых вариантах осуществления она составляет от 85% до 95%. В частности, в случае смесей с другими клетками процентная доля может составлять приблизительно 10%-15%, 15%-20%, 20%-25%, 25%-30%, 30%-35%, 35%-40%, 40%-45%, 45%-50%, 60%-70%, 70%-80%, 80%-90% или 90%-95%. Или чистоту выделения можно выражать в терминах делений клеток, где клетки подвергают, например, 10-20, 20-30, 30-40, 40-50 или более делениям клеток.
Выбор состава для введения клеток будет зависеть от множества факторов. Главными среди них будут вид донора/реципиента, природа органа, подвергаемого лечению, природа другой терапии и вводимых средств, оптимальный путь введения, выживаемость эффективным путем, схема дозирования и другие факторы, которые будут очевидны специалистам в этой области. Например, выбор подходящих носителей и других добавок будет зависеть от конкретного пути введения и природы конкретной лекарственной формы.
Конечные составы водной суспензии клеток/среды, как правило, будут включать коррекцию ионной силы суспензии до изотоничности (т.е. от приблизительно 0,1 до 0,2) и физиологического pH (т.е. приблизительно pH от 6,8 до 7,5). Кроме того, конечный состав, как правило, будет содержать жидкое смазочное средство.
Специалисты в этой области легко могут определять количество клеток и необязательные добавки, наполнители и/или носитель в композициях, подлежащих введению в способах по изобретению. Как правило, любые добавки (в дополнение к клеткам) присутствуют в количестве от 0,001 до 50% масс. в растворе, таком как фосфатно-солевой буфер. Активный ингредиент присутствует в порядке от микрограммов до миллиграммов, например, от приблизительно 0,0001 до приблизительно 5% масс., предпочтительно - от приблизительно 0,0001 до приблизительно 1% масс., наиболее предпочтительно - от приблизительно 0,0001 до приблизительно 0,05% масс. или от приблизительно 0,001 до приблизительно 20% масс., предпочтительно - от приблизительно 0,01 до приблизительно 10% масс., и наиболее предпочтительно - от приблизительно 0,05 до приблизительно 5% масс.
В некоторых вариантах осуществления клетки инкапсулируют для введения, в частности, когда инкапсулирование повышает эффективность или обеспечивает преимущества в отношении эксплуатации и/или срока годности. Клетки можно инкапсулировать с помощью мембран, а также капсул. Предполагают, что можно использовать любой из множества доступных способов инкапсулирования клеток.
В различных вариантах осуществления для микрокапсулирования клеток можно использовать широкий спектр материалов. Такие материалы включают, например, полимерные капсулы, альгинат-поли-L-лизин-альгинатные микрокапсулы, капсулы поли-L-лизин-альгината бария, капсулы альгината бария, полые волокна из полиакрилонитрила/поливинилхлорида (PAN/PVC) и полые волокна из полиэфирсульфона (PES).
Способы микрокапсулирования клеток, которые можно использовать для введения клеток, известны специалистам в этой области и описаны, например, в Chang, P., et al, 1999; Matthew, H.W., et al, 1991; Yanagi, K., et al, 1989; Cai Z.H., et al, 1988; Chang, T.M., 1992 и в патенте США № 5639275 (в котором, например, описывают биосовместимую капсулу для длительного поддержания клеток, стабильно экспрессирующих биологически активные молекулы). Дополнительные способы инкапсулирования приведены в европейской патентной публикации № 301777 и патентах США №№ 4353888; 4744933; 4749620; 4814274; 5084350; 5089272; 5578442; 5639275 и 5676943. Все из указанных выше источников включены в настоящее описание в качестве ссылок в частях, относящихся к инкапсулированию клеток.
В конкретных вариантах осуществления клетки включают в полимер, такой как биополимер или синтетический полимер. Примеры биополимеров включают, в качестве неограничивающих примеров, фибронектин, фибрин, фибриноген, тромбин, коллаген и протеогликаны. В полимер также можно включать другие факторы, такие как цитокины, обсуждаемые выше. В других вариантах осуществления изобретения клетки можно включать в пустоты трехмерного геля. Большой полимер или гель, как правило, будут имплантировать хирургически. Полимер или гель, который можно составлять в достаточно небольших частицах или волокнах, можно вводить другими общепринятыми, более удобными, нехирургическими путями.
Дозировка клеток будет варьироваться в широких пределах и будет соответствовать индивидуальным требованиям в каждом конкретном случае. Количество клеток будет варьироваться в зависимости от типа, массы и состояния органа, количества или частоты введений и других переменных, известных специалистам в этой области. Клетки можно вводить путем, подходящим для ткани или органа. Примеры подходящих путей доставки могут включать интратрахеальную доставку (например, в случае легкого), внутривенную доставку, внутриартериальную доставку (например, внутрикоронарную), прямую инъекцию в орган и доставку в лимфатическую систему.
Клетки можно суспендировать в подходящем эксципиенте в концентрации от приблизительно 0,01 до 1×105 клеток/мл, от приблизительно 1×105 клеток/мл до 10×106 клеток/мл или от приблизительно 10×106 клеток/мл до 5×107 клеток/мл. Подходящими эксципиентами являются те, которые биологически и физиологически совместимы с клетками и с органом реципиента, такие как забуференный физиологический раствор или другие подходящие эксципиенты. Композицию для введения можно составлять, получать и хранить стандартными способами, соблюдая надлежащую стерильность и стабильность.
Дозировка
Дозы (т.е. количество клеток) для людей или других млекопитающих специалисты в этой области могут определять без излишнего экспериментирования с помощью этого описания, документов, процитированных в настоящем описании, и познаний в этой области. Оптимальная доза, подлежащая использованию в соответствии с различными вариантами осуществления изобретения, будет зависеть от множества факторов, включая следующие: подлежащее лечению заболевание и его стадия; вид донора, состояние его здоровья, пол, возраст, массу и уровень метаболизма; иммунокомпетентность донора; другие вводимые терапевтические средства; и ожидаемые потенциальные осложнения исходя из анамнеза или генотипа донора. Параметры также могут включать: являются ли клетки сингенными, аутологичными, аллогенными или ксеногенными; их активность; участок и/или распределение, которые должны быть целью; и такие характеристики участка, как доступность для клеток. Дополнительные параметры включают совместное введение с другими факторами (такими как факторы роста и цитокины). Оптимальная доза в указанной ситуации также будет зависеть от способа составления клеток, способа их введения (например, перфузии, внутриорганного введения и т.д.) и степени, с которой клетки будут локализоваться в целевых участках после введения.
В конечном итоге, уровни доз, режим и частоту будут определять по эффективности. Ее будут измерять по состоянию здоровья и жизнеспособности органа и, возможно, по функционированию органа и клиническим показателям после трансплантации. Такие показатели будут варьироваться в зависимости от органа. В одном из вариантов осуществления они могут включать показатели функционирования органа. Можно оценивать показатели жизнеспособности органа для трансплантации с помощью клинической литературы. В другом варианте осуществления для определения эффективности можно анализировать (например, с использованием qPCR) уровни или профили конкретных маркеров (например, уровни мРНК в ткани, уровни цитокинов и количества воспалительных клеток). Например, для определения эффективности можно анализировать уровень мРНК ИЛ-10 из легочной ткани с помощью qPCR. В другом примере можно оценивать дозу в легком по воздействию на: уровни цитокинов; другие маркеры воспаления в жидкостях (например, полученных посредством бронхоальвеолярного лаважа); уровни отека; гемодинамические и дыхательные показатели; и оценку газообмена в реперфузируемых легких ex vivo.
В различных вариантах осуществления клетки/среду можно вводить в начальной дозе, а затем поддерживать посредством дополнительного введения. Клетки можно вводить исходно одним способом, а затем вводить тем же способом или одним или несколькими различными способами. Уровни можно поддерживать с помощью непрерывного введения клеток/среды. В различных вариантах осуществления клетки вводят исходно, или для поддержания их уровня у индивидуума, или для того и другого, посредством внутривенной инъекции. Во многих вариантах осуществления используют другие формы введения в зависимости от типа и состояния органа и других факторов, обсуждаемых где-либо в настоящем описании.
Клетки/среду можно вводить с различной частотой в течение широкого диапазона периодов времени. Как правило, длительность лечения будет пропорциональна длительности сбора и транспортировки, эффективности используемых способов терапии и состоянию и ответу органа, подвергаемого лечению.
В других вариантах осуществления клетки можно вводить (например, посредством внутривенной, внутриартериальной, интратрахеальной, прямой инъекции и т.д.) индивидууму-донору перед забором органа. В зависимости от пути введения, клетки можно вводить в течение подходящего периода времени (например, от минут до приблизительно 1-4 часов, приблизительно 4-8 часов, приблизительно 8-12 часов, приблизительно 12-16 часов, приблизительно 16-20 часов, приблизительно 20-24 часов). Орган можно забирать общепринятыми хирургическими способами после периода времени. После забора клетки приводят в контакт (например, незамедлительно приводят в контакт) с органом в течение периода времени, достаточного, чтобы позволить клеткам распределиться по всему органу (например, менее приблизительно 1 часа, приблизительно 1-2 часа, приблизительно 2-3 часа, приблизительно 3-4 часа). Клетки можно приводить в контакт с органом посредством инфузии и/или погружения органа в резервуар, содержащий клетки. Затем орган можно хранить на льду и/или подключать к системе реперфузии, после чего орган доставляют в место проведения трансплантации.
После прибытия в место проведения трансплантации орган можно помещать в систему реперфузии (если этого еще не было сделано), содержащую клетки. Затем можно проводить инфузию клеток в орган в течение периода времени (например, менее приблизительно часа, приблизительно 1-2 часа, приблизительно 2-3 часа, приблизительно 3-4 часа) в зависимости от органа и системы реперфузии. В течение трансплантации клетки можно приводить в контакт с органом посредством инфузии реципиенту (например, внутривенно), прямой инъекции в орган и/или прямого нанесения на поверхность органа. Инфузию можно осуществлять, например, перед закрытием приносящих и выносящих сосудов органа. При трансплантации печени, например, клетки можно подвергать инфузии в воротную вену печени перед присоединением вены к трансплантированной печени. Дополнительно или альтернативно, клетки можно доставлять в орган после трансплантации (например, после закрытия приносящих и выносящих сосудов органа) в течение подходящего периода времени (например, от минут до приблизительно 1-4 часов, приблизительно 4-8 часов, приблизительно 8-12 часов, приблизительно 12-16 часов, приблизительно 16-20 часов, приблизительно 20-24 часов) в зависимости от системы доставки и органа.
Композиции
Изобретение также относится к популяциям клеток с конкретными активностями для обеспечения любого из эффектов, представленных в настоящем описании. Как описано выше, эти популяции получают посредством селекции на предмет клеток, имеющих желаемую активность. Эти популяции используют для получения других композиций, например, банка клеток, содержащего популяции с конкретными желаемыми активностями, и фармацевтических композиций, содержащих популяцию клеток с конкретной желаемой активностью.
ПРИМЕРЫ
Способы
Забор легкого и перфузия ex vivo
После получения разрешения на исследование от местного Organ Procurement Agency, LifeGift, для настоящего исследования приобретали отбракованные донорские легкие в соответствии с установленным протоколом IRB в Houston Methodist (IRB(2)111 1-0205). Легкие от каждого из пяти пациентов приобретали стандартным образом с использованием антеградного Perfadex (Vitrolife AB, Gothenburg, Sweden) с притоком 60 мл/кг с ретроградной перфузией Perfadex через легочные вены. Затем легкие хранили в пластиковых мешках, содержащих 1 литр Perfadex, и хранили на льду в течение транспортировки. Затем, после транспортировки легких в Houston Methodist, их хранили в холодильной камере при 4°C всего в течение 8 часов холодового статического хранения для индукции холодового ишемического повреждения.
Перфузию легкого ex vivo (EVLP) осуществляли с использованием CE-маркированного Vivoline LSI (Vivoline Medical AB, Lund, Sweden) (фиг. 1) (Wierup, P. et al., Ann Thorac Surg 2006;81(2):460-6; Ingemansson, R. et al., Ann Thorac Surg 2009;87(1):255-60; и Cypel, M. et al., N Engl J Med 2011;364(15):1431-40). Систему заправляли 2,5 л раствора Steen (XVIVO Perfusion). Избегали использования отмытых эритроцитов или крови для снижения количества переменных в анализе осуществимости. В перфузат добавляли 100 мг меропенема (AstraZeneca AB, Sodertalje, Sweden) и 10000 ед. гепарина (LEO Pharmaceutical, Copenhagen, Denmark). Перед присоединением легких к модулю EVLP pH раствора доводили до 7,35-7,45 с использованием трометамола (Addex-THAM, Fresenius Kabi AB, Uppsala, Sweden). В одном случае, когда также получали сердце, с помощью Dacron Graft накладывали швы на разделенные ветви легочной артерии для восстановления целостности легочной артерии (PA) и облегчения присоединения легкого к циклу EVLP. Трахею соединяли с механическим вентилятором с помощью силиконовой трубки размера, совпадающего с диаметром трахеи. В левое предсердие помещали температурный зонд. Сначала, для удаления воздуха из цикла легкие перфузировали при скорости потока 0,5 л/мин. Шунт для удаления воздуха на входной канюле держали открытым до достижения температуры органа 32°C, а затем закрывали на оставшуюся часть процедуры. Затем поток повышали до 100% предполагаемого сердечного выброса для конкретного набора легких. Затем легкие нагревали в течение 30 минут до заданных 36°C и не позволяли разнице температур между притоком и оттоком крови в легких превышать 8°C. Затем скорость потока постепенно повышали до заданного уровня 70 мл/мин на килограмм массы донора, в течение чего непрерывно измеряли давление PA и ограничивали его 15 мм рт.ст. Повторного нагревания достигали в течение 20-30 минут. Когда температура перфузата достигала 32°C, начинали механическую вентиляцию с контролем объема при исходном дыхательном объеме 3 мл на килограмм массы донора с уровнем положительного давления конца выдоха (PEEP) 5 см H2O, частотой 7-10 вдохов/мин и FiO2 0,5. Затем дыхательный объем постепенно повышали до максимума 7 мл на килограмм массы донора. Образцы перфузата для анализов газов крови забирали через специальный порт системы.
Клетки
MAPC, полученные из костного мозга человека (Human MultiStem®, Athersys Inc., Cleveland) выделяли из одного аспирата костного мозга, полученного у здорового донора при его согласии, и обрабатывали согласно описанным ранее способам (Perm, MS et al., Circ Res 2012; 110(2):304-11; Maziarz, RT et al., Biology of Blood and Marrow Transplantation 2012;18(2 Sup):S264-S265; и clinicaltrials.gov #NCT01436487, #NCT01240915 и #NCT01841632). Вкратце, MAPC культивировали в покрытых фибронектином пластиковых флаконах для тканевых культур при низком давлении кислорода во влажной атмосфере 5% CO2.
Клетки культивировали в средах для культивирования MAPC (DMEM с низким содержанием глюкозы [Life Technologies Invitrogen], дополненной FBS (Atlas Biologicals, Fort Collins, CO), добавкой жидких сред ITS [Sigma], MCDB [Sigma], фактором роста тромбоцитов (R&D Systems, Minneapolis, MN), эпидермальным фактором роста (R&D Systems), дексаметазоном ([Sigma], пенициллином/стрептомицином [Life Technologies Invitrogen], 2-фосфо-L-аскорбиновой кислотой [Sigma, St. Louis, MO) и линолевой кислотой-альбуминой (Sigma). Клетки пассировали каждые 3-4 дня, собирали с использованием трипсина/ЭДТА (Life Technologies Invitrogen, Carlsbad, CA). Клетки являлись положительными по CD49c и CD90 и отрицательными по MHC класса II и CD45 (все Ab от BD Biosciences, Franklin Lakes, NJ). Затем клетки замораживали при 30-35 удвоениях популяции в криопробирках в газообразной фазе жидкого азота в концентрации 1-10×106 в 1 мл (PiasmaLyte, 5% HSA и 10% DMSO). Непосредственно перед их использованием MAPC размораживали и напрямую использовали.
Инокуляции клеток, инкубации легких и анализы жидкости, полученной посредством бронхоальвеолярного лаважа (BAL), и ткани
Когда температура, измеряемая с помощью внутрипредсердного зонда, достигала приблизительно 32°C, размораживали пробирки MultiStem емкостью 1 мл, содержимое разводили в 19 мл стерильного физиологического раствора и вводили с помощью бронхоскопа в проксимальную часть бронха LLL. Аналогичный объем наполнителя (20 мл стерильного физиологического раствора) аналогично вводили в проксимальную часть бронха RLL. Через пять минут после доставки MultiStem легкие подсоединяли к механическому вентилятору Hamilton-C2. Через 2 или 4 часа перфузии с помощью системы Vivoline эксперименты прекращали. За пять минут до прекращения перфузии те же субсегменты RLL и LLL, которые ранее инокулировали клетками или наполнителем, подвергали лаважу 60 мл физиологического раствора. Затем полученную жидкость BAL разделяли на аликвоты неочищенной жидкости BAL для оценки общих количеств клеток и разницы количества клеток или центрифугировали (1200 g × 10 мин при 4°C) и собирали супернатант в отдельные пробирки, быстро замораживали и хранили при -70°C (Lathrop, MJ et al, Stem Cells Translational Medicine (in press); и Goodwin, M. et al, Stem Cells 2011:29(7): 1137-48). Для одного легкого также получали образцы жидкости BAL в течение фазы нагревания до начала вентиляции, непосредственно перед доставкой MSC или наполнителя.
Общие количества клеток в жидкости BAL определяли с использованием ADVIA® Hematology Analyzer (Siemens Diagnostics, Johnson City, TN). Цитоспиновые образцы получали с использованием 5×104 клеток, центрифугированных на предварительно очищенных, предварительно обработанных предметных стеклах (Corning Incorporate, Coming, NY) при 800 об./мин. в течение 8 мин, высушенных в течение ночи и окрашенных с использованием DiffQuick (Hema 3 Stain Set, Fisher Scientific, Pittsburgh, PA). Популяции клеток определяли с помощью "слепого" ручного подсчета 200 клеток, осуществляемого тремя разными индивидуумами (Lathrop, MJ et al., Stem Cells Translational Medicine (in press); и Goodwin, M. et al., Stem Cells 2011:29(7):1137-48). Содержание белка в неразбавленной жидкости BAL анализировали с помощью метода Бредфорда (Bio-Rad, Hercules, CA). Использовали набор Human Cytokine Array Kit, панель A (R&D Systems, Minneapolis, MN) для анализа супернатантов жидкости BAL на растворимые цитокины, хемокины и другие вещества, включая C5/Ca, CD40L, CD54, CXCL1, CXCL10, Г-КСФ, Gro-1α, ИЛ-1α, ИЛ-1β, ИЛ-1RA, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-16, ИЛ-23, IP-10, I-TAC, MCP-1, MIF, PAI-1, RANES, серпин E1, sICAM, sTREM-1, ФНО, и относительное количество цитокинов по сравнению с внутренними контролями, определяемыми с помощью системы UVP Bioimaging system (Upiand, CA). ELISA на другие конкретные цитокины осуществляли по инструкциям производителя, ИЛ-10 (R&D Systems, Minneapolis, MN, кат. №:D1000B) и STC1, TSG-6 и iNOS (MyBioSource, San Diego, CA, кат. №: MBS946255, MBS926793, MBS723617).
Гистологические анализы
После BAL в конце периода перфузии легкие гравитационно фиксировали 10%-ным формалином при комнатной температуре в течение 1 часа. Фиксированные легкие рассекали и области, в которые вводили клетки, хранили в 10%-ном формалине перед заливкой парафином. Затем заключенные срезы 5 мкм оценивали на гистологические признаки. Три индивидуума "слепым" образом оценивали воспаление легких на 10 дыхательных путях на животное с учетом наличия и интенсивности перибронхиальных клеточных инфильтратов по сравнению с известными положительными и отрицательными контролями с использованием общепринятой полуколичественной системы балльной оценки с использованием диапазона 0-3 и шага шкалы 0,5, как описано ранее (Lathrop, MJ et al., Stem Cells Translational Medicine (in press); и Goodwin, M. et al., Stem Cells 2011:29(7): 1137-48).
Анализы qPCR тканевых воспалительных маркеров
Биоптаты легкого из легких №№ 2-5 получали с использованием автоматического сшивающего аппарата (Covidien GIA™ DST Series™ 80 мм) с периферии LLL и RLL непосредственно перед инфузией клеток или наполнителя, через 2 и 4 часа после инфузии клеток или наполнителя и в конце эксперимента. Образцы быстро замораживали, а затем гомогенизировали и определяли уровни экспрессии мРНК воспалительных цитокинов с помощью qPCR (см. подробности ниже).
Образцы гомогенизировали в РНК-лизирующем буфере и экстрагировали РНК с использованием набора RNeasy kit (Qiagen, Gennantown, MD) по инструкциям производителя. Осуществляли дополнительную обработку ДНКазой с использованием набора, не содержащего ДНК (Life Technologies, Carlsbad, CA). Концентрацию РНК измеряли с помощью NanoDrop 2000 (Thermo Scientific, Waltham, MA) и 1 мкг РНК подвергали обратной транскрипции с использованием обратной транскриптазы M-MLV (Promega, Madison, WI) с последующей обработкой РНКазой с использованием RNace-it Cocktail (Agilent, Santa Clara, CA). В качестве контролей использовали образцы, отрицательные по обратной транскриптазе, и воду. 5 мкл кДНК смешивали с SYBR green (Promega) и праймерами (IDT) и анализировали с помощью системы ABI 7500 FAST system (Applied Biosystems, Foster City, CA). Образцы нормировали по GAPDH и выражали как процент Human Reference (Agilent) +/- стандартное отклонение.
Последовательности праймеров являлись следующими:
VEGFA-F1 (SEQ ID NO: 1);
VEGFA-R1 (SEQ ID NO: 2);
IGF1-F4 (SEQ ID NO: 3);
IGF1-R4 (SEQ ID NO: 4);
EGF-F1 (SEQ ID NO: 5);
EGF-R1 (SEQ ID NO: 6);
IL-10-F2 (SEQ ID NO: 7);
IL-10-R2 (SEQ ID NO: 8);
FGF2-F1 (SEQ ID NO: 9);
FGF2-R1 (SEQ ID NO: 10);
HGF-F1 (SEQ ID NO: 11);
HGF-R1 (SEQ ID NO: 12);
CCL5-F1 (SEQ ID NO: 13);
CCL5-R1 (SEQ ID NO: 14);
TGFB1-F1 (SEQ ID NO: 15);
TGFB1-R1 (SEQ ID NO: 16)
CXCL10-F1 (SEQ ID NO: 17);
CXCL10-R1 (SEQ ID NO: 18);
NOS3-F2 (SEQ ID NO: 19);
NOS3-R2 (SEQ ID NO: 20);
STC1-F1 (SEQ ID NO: 21);
STC1-R1 (SEQ ID NO: 22);
GAPDH-F1 (SEQ ID NO: 23);
GAPDH-R1 (SEQ ID NO: 24);
ANGPT1-F2 (SEQ ID NO: 25);
ANGPT1-R2 (SEQ ID NO: 26);
NOS2-F1 (SEQ ID NO: 27);
NOS2-R1 (SEQ ID NO: 28);
TNFAIP6-F1 (SEQ ID NO: 29);
TNFAIP6-R1 (SEQ ID NO: 30);
FGF7-F1 (SEQ ID N0: 31); и
FGF7-R1 (SEQ ID NO: 32).
Статистический анализ
Группы сравнивали с использованием одностороннего или двухстороннего ANOVA с апостериорным критерием Фишера или с помощью прямого анализа двух групп с использованием критерия Стьюдента, при необходимости, с использованием поправки Уэлча для неодинаковой дисперсии (Lathrop, MJ et al., Stem Cells Translational Medicine (in press); и Goodwin, M. et al., Stem Cells 2011:29(7):1137-48).
Результаты
Соответствующие клинические характеристики донорских легких приведены в таблице 1.
CVA: острое нарушение мозгового кровообращения; SH: субарахноидальное кровоизлияние; IH: внутричерепное кровотечение; MVA: дорожно-транспортное происшествие.
Возраст доноров находился в диапазоне 44-66 лет и три из пяти донорских легких получали от пациентов с катастрофическими неврологическими нарушениями, одного с асфиксией и одного после дорожно-транспортного происшествия. Четыре из пяти легких не посчитали подходящими для трансплантации из-за плохого функционального статуса, включая низкие значения PaO2 со средним значением 184,75 мм рт.ст. при 100% FiO2 при + PEEP 10 мм рт.ст. В этих легких также наблюдали рентгенографические нарушения, по-отдельности включающие ушибы, выраженную эмфизему или коллапс доли легкого, не отвечающий на маневр раскрытия альвеол, проводимый в операционной. В каждом из этих легких также наблюдали рентгенографические признаки отека легких, при этом у двух также наблюдали плевральный выпот и все из них отмечали как в разной степени отечные после хирургического удаления. В легком №5 наблюдали коллапс RLL на CXR, но оно расправлялось после удаления и бронхоскопического извлечения слизистых пробок. Одно из легких (легкое №4) являлось физиологически подходящим для донорства, с нормальным внешним видом, чистым CXR и хорошей оксигенацией при PEEP 5 мм рт.ст., но его не использовали по причине наличия небольших поверхностных узелков, которые затем признавали доброкачественными при биопсии.
Резюме протокола, используемого для каждого легкого, представлено в таблице 2, а также в схематической форме на фиг. 1.
В целом, легкие подвергали схожему времени холодового хранения (8 часов) и нагрева (25+2,2 минут), а затем схожему времени реперфузии (3,7±0,6 часов) после бронхоскопического введения клеток или наполнителя. В конце периода реперфузии наблюдали некоторую степень дополнительного отека, развивавшегося в легких, и в легком № 4 также заново развилась некоторая степень отека. Однако в целом, наблюдали меньше видимого отека и воспаления в MSC-обработанной доле (LLL) по сравнению с обработанной наполнителем доле (RLL), даже при том, что для легкого №4 использовали меньшую дозу MAPC. Типичные изображения представлены на фиг. 2.
Гистологическая оценка легких в конце периода реперфузии показала, что, хотя можно было обнаружить очаги областей воспаления в некоторых из MAPC-обработанных LLL, наблюдали значимо меньшее общее воспаление в 4 из 5 легких, а также в среднем для всех 5 легких, как определяли с помощью полуколичественной балльной оценки перибронхиального, периваскулярного отека и отека альвеолярной перегородки и по наличию воспалительных клеточных инфильтратов (фиг. 3). Типичные микрофотографии представлены на фиг. 4.
Общие количества клеток в жидкости BAL получали в двух из четырех легких (легкие 3 и 5), в которые вводили более высокие дозы клеток. В обоих случаях наблюдали значимое снижение в MSC-обработанной LLL по сравнению с обработанной наполнителем RLL (фиг. 5A). Тенденцию в сторону снижения общих количеств клеток в жидкости BAL также наблюдали в легком, в которое вводили меньшую дозу MSC (легкое 4, фиг. 5A). Разница количеств клеток, полученная на образцах жидкости BAL из всех пяти легких, демонстрирует соответствующее повышение нейтрофилов и эозинофилов в обработанной наполнителем RLL, улучшающееся в MSC-обработанной LLL (фиг. 5B). Результаты измерений общих уровней белка в жидкости BAL варьировались между легкими, но во всех 5 легких наблюдали соответствующее снижение общего уровня белка в MSC-обработанной LLL по сравнению с обработанной наполнителем RLL (фиг. 5C).
Наблюдали повышение уровней ИЛ-10 в MSC-обработанной LLL по сравнению с обработанной наполнителем RLL (фиг. 6). Однако, другие растворимые противовоспалительные медиаторы, включенные в доклинические модели действия MSC при повреждении легких и другие модели, такие как ИЛ-1RA, STC, TGS-6 и iNOS, не повышались достоверно в MSC-обработанной LLL какого-либо из 5 легких (фиг. 6). Уровни мРНК в ткани анализировали в 4 из 5 легких (легкие 2-5) с помощью анализов qPCR биоптатов, полученных перед введением клеток или наполнителя, а затем после 2 или 4 часов периода реперфузии. В целом, профили уровней мРНК в ткани являлись более схожими для 4 легких. Наблюдали сравнимое с уровнями белка ИЛ-10 в жидкости BAL 3,5-кратное повышение уровней мРНК ИЛ-10 в ткани в MSC-обработанной LLL по сравнению с лишь 1,6-кратным повышением в обработанной наполнителем RLL, оцениваемым через 2 часа (фиг. 7). Аналогичное повышение в LLL по сравнению с RLL также наблюдали через 2 часа для уровней мРНК Angpt1 и STC1. Примечательно, что и в LLL, и в RLL наблюдали значительное повышение кратной экспрессии TSG6 с 2 до 4 часов.
Обсуждение
Исследовали ряд различных способов улучшения жизнеспособности донорских легких и снижения теплового или холодового ишемического воспалительного повреждения. Они включают промывание раствором с внеклеточными параметрами, вводимым антеградным и ретроградным образом, и использование портативной системы консервации ex vivo, в настоящее время проходящей клинические исследования для применения в транспортировке донорских легких (Machuca, TN et al., Surg Clin North Am 2013;93(6): 1373-94). Различные области исследований терапевтических вмешательств имеют целью модулировать ответ, индуцируемый ишемией и реперфузией. Например, экспериментальные модели на животных демонстрируют положительное воздействие геннотерапевтической доставки ИЛ-10 (Cypel, M. et al., Sci Transl Med. 2009;l(4):4-9) и активации рецепторов аденозина (Fernandez, LG et al., J Thorac Cardiovasc Surg 2013; 145(6):1654-9; и Mulloy, DP et al, Ann Thorac Surg 2013;95(5): 1762-7). Однако, хотя экспериментальные данные являются многообещающими, маловероятно, что модуляция одного из множества воспалительных путей может регулировать явление, изменяющее несколько задействованных клеточных механизмов, таких как врожденный и адаптивный иммунитет, активация каскада комплемента, дисфункция эндотелия и запуск гибели клеток. В отличие от этого, полученные из костного мозга MSC и MAPC обладают уникальным потенциалом воздействия на множество воспалительных путей, задействованных в ишемическом/реперфузионном повреждении.
Исходно перфузию легких ex vivo (EVLP) создавали в качестве способа оценки качества легких при донорстве после остановки сердца (DCD) и других неприемлемых донорских легких (Wierup, P. et al., Ann Thorac Surg 2006;81(2):460-6; и Ingemansson, R. et al., Ann Thorac Surg 2009;87(l):255-60). В настоящее время этот способ проходит клиническое испытание для оценки и восстановления потенциальных донорских легких, не считающихся подходящими для трансплантации по существующим критериям (Cypel, M. et al., N Engl J Med 2011;364(15): 1431-40). EVLP дополнительно предоставляет возможность вводить MSC или MAPC непосредственно в донорское легкое интратрахеальным или внутрисосудистыми путями перед имплантацией. Используя этот подход, авторы настоящего изобретения выбирали исходную оценку прямого введения MAPC в дыхательные пути в одну долю с противоположным легким в качестве сравнения для непосредственной оценки эффектов в каждом отдельном легком. Хранение с холодной ишемией (8 часов общего холодового хранения) продлевали за рамки фактического времени, общепринятого для легких, для усиления какого-либо IRI, которое могло развиться, и, таким образом, для максимизации потенциального противовоспалительного действия MSC. Авторы настоящего изобретения также выбрали использование "готовых к использованию" несовпадающих по HLA MAPC в качестве доказательства осуществимости. Кроме того, авторы настоящего изобретения демонстрируют согласованный и мощный противовоспалительный эффект MAPC. Примечательно, что изменение профиля цитокинов, в частности, повышение ИЛ-10, может являться особенно благоприятным при IRI.
Из приведенного выше описания настоящего изобретения специалистам в этой области будут понятны усовершенствования, изменения и модификации. Такие усовершенствования, изменения и модификации доступны специалистам в этой области и должны охватываться прилагаемой формулой изобретения. Все патенты, патентные заявки и публикации, процитированные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме.
Реферат
Изобретение относится к медицине и касается трансплантации органа. Для этого проводят воздействие на орган экзогенных стволовых клеток, причем стволовые клетки представляют собой неэмбриональные неполовые стволовые клетки, экспрессирующие теломеразу, имеют нормальный кариотип, не являются туморогенными. Стволовые клетки были подвергнуты по меньшей мере 10-40 делениям клеток в культуре до их воздействия на орган, и причем орган подвергают воздействию стволовых клеток до трансплантации реципиенту. Изобретение обеспечивает благотворное влияние на орган в отношении пролиферации Т-клеток, ишемической реперфузии за счет обработки органа стволовыми клетками до его трансплантации реципиенту. 17 з.п. ф-лы, 2 табл., 7 ил.

Комментарии