Стромальные стволовые клетки - RU2636551C2
Код документа: RU2636551C2
Чертежи










Описание
Введение
Данное изобретение относится к способам выделения стволовых клеток, к популяциям стволовых клеток, полученных из выделенных клеток, и к применению таких популяций клеток и ткани, выведенной из них.
Уровень техники
В 1960-70-е Фредештайн и его коллеги продемонстрировали, что остеогенный потенциал, выявляемый гетеротопической трансплантацией клеток костного мозга (КМ, bone marrow BM), был ассоциирован с минорной субпопуляцией мононуклеарных клеток (МНК, MNC) КМ (рассмотрено в Friedenstein, 1990). Эти МНК являлись отличимыми от большинства гемопоэтических МНК по их быстрой адгезии к пластиковому сосуду для культивирования тканей и по подобному фибробластам внешнему виду их потомства в культуре, что предполагает происхождение из стромального компартмента КМ. Наряду с установлением стромы КМ в качестве источника, Фредештайн, Оуэн и их коллеги осуществили второе важное открытие посредством демонстрации того, что посев клеточных суспензий КМ с клональной плотностью приводит к установлению раздельных колоний, инициированных одиночными клетками (колониеобразующая единица фибробластов, КОЕ-Ф [Friedenstein et al., 1970]).
Фредештайн и Оуэн позже назвали эту генерирующую КОЕ-Ф клетку стромальная стволовая клетка (ССК, SSC) (Owen and Friedenstein, 1988), и ссылки на ССК в данном документе основаны на этом исходном определении клетки.
Полученные из КМ ССК могут быть идентифицированы в смешанной популяции адгезивных пластику (ПА), фибробластных МНК, которые являются источником кости, жира или хряща и секретируют сильнодействующие иммуномодулирующие и ангиогенные белки. Преклинические исследования демонстрируют, что ПА-ССК опосредуют сильные иммуномодулирующие и ангиопоэтические реакции in vivo. В настоящее время в клинических испытаниях тестируют ПА-ССК в 40 различных дегенеративных, аутоиммунных и ишемических заболеваниях.
В человеческом мозговом веществе приблизительно 1 мононуклеарная клетка (МНК) в КМ из каждых 80000 МНК представляет собой КОЕ-Ф, образующую ССК. До настоящего времени наиболее простой и часто применяемый способ выделения таких ССК из КМ обусловлен ранее отмеченной адгезией к пластику для тканевой культуры, в соответствии с которой МНК оставляют инкубироваться на 10-14 дней, и за это время КОЕ-Ф прикрепляются и формируют колонии с определенной частотой 1:80000. Через 10-14 дней эти КОЕ-Ф собирают трипсиновым гидролизом и повторно высевают на чашки в обогащенную сывороткой среду с плотностью 3-8000 КОЕ-Ф в расчете на см2. Эти КОЕ-Ф затем размножают in vitro до тех пор, пока не получены достаточные количества клеток для обеспечения биохимической и цитологической оценки. Этот подход является широко используемым, но считается неадекватным для определения или очистки ССК для клинического применения, так как только 1:80000 из высеянных КММНК являются ССК, и способы не будут соответствовать требованиям хороших производственных протоколов, необходимых для клинического одобрения связанных с этим сопутствующих продуктов.
Следовательно, в предшествующем уровне техники популяции стволовых клеток идентифицировали на основании первоначальной способности к адгезии к пластиковой поверхности. В этом первоначальном скрининге получают клеточные популяции в виде клональных популяций из индивидуальных колониеобразующих единиц на поверхности. Это также может быть обозначено в литературе "мезенхимальные стволовые клетки", хотя термин может являться некорректным, так как в выделенных клетках могут содержаться немезенхимальные стволовые клетки. В известном подходе к выделению эти известные клеточные популяции производят из стволовых клеток, которые являются позитивными к щелочной фосфатазе (ЩФ) и CD271. Тем не менее, в клиническом смысле клетка является по существу неидентифицированной.
Клеточные популяции готовят из этих известных выделенных клеток, как, например, клональным размножением из одиночной выделенной клетки, и применяют для трансплантации. Результаты являются переменными, однако, трансплантированные клеточные популяции иногда ведут себя довольно разнообразно от партии к партии, и имеет место элемент непредсказуемости.
Клеточные популяции в предшествующем уровне техники имеют склонность к образованию кости, и жира, и хряща, но с ограниченным контролем, часто производя жир, когда необходимы кость или хрящ. И, наоборот, к примеру, где предпочтительно получить клетки, которые производят жир, эти продуцирующие жир клетки получаются лишь ненадежно.
Существенная проблема заключается в том, что начальная клеточная популяция является по существу неопределенной, так как выделение на основании адгезии к пластику не является достаточным техническим определением клеточного типа. Даже при отборе, например, на упомянутые маркеры (ЩФ и CD271) экспрессия этих маркеров в клетках или в потомстве быстро исчезает при культивировании, что оставляет практически неопределенную популяцию. Полезные свойства клеток также снижаются или исчезают со временем - это другая проблема неопределенной клеточной популяции.
Задачи изобретения
Общая задача изобретения заключается в предоставлении способов выделения стромальных стволовых клеток и клеточных популяций и тканей, произведенных из них, которые являются по меньшей мере альтернативой предшествующему уровню техники, и задача конкретных вариантов осуществления изобретения заключается в предоставлении способов, которые являются улучшенными, например, посредством повышенного определения полученных клеток или клеток и тканей, которые являются улучшенными, например, посредством повышенной стабильности их свойств, что делает их более пригодными для клинических применений.
Сущность изобретения
Данное изобретение основано на проспективном выделении стромальных стволовых клеток, особенно человеческих стромальных стволовых клеток, на основании экспрессии маркеров или антигенов, которые экспрессируются во множестве видов млекопитающих. В способах и клеточных популяциях по изобретению клетки сортируют на основании экспрессии конкретного межвидового маркера, так называемое выделение, и затем полученную культуру клеток оставляют для идентификации клеток, а именно колониеобразующих единиц фибробластов (КОЕ-Ф), которые могут быть клонально размножены. Клеточная популяция, полученная после клонального размножения, затем предназначена для терапевтического средства, трансплантата и других применений.
Соответственно, изобретение предоставляет способ выделения стромальной стволовой клетки, содержащий выделение клетки из смешанной популяции клеток млекопитающих на основании экспрессии маркера, в котором:
маркер связывает антитело и в котором
указанное антитело перекрестно реагирует с маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из человеческих, мышиных, крысиных, лошадиных, кроличьих и свиных клеток.
Изобретение предоставляет способ выделения стромальной стволовой клетки, содержащий выделение клетки из смешанной популяции клеток млекопитающих на основании экспрессии маркера, в котором маркер экспрессируется клеткой млекопитающего и в котором соответствующий маркер также экспрессируется на клетке по меньшей мере одного из других видов млекопитающих, выбранной из человеческих, мышиных, крысиных, лошадиных, кроличьих и свиных клеток.
Предпочтительно маркер является обнаруживаемым на человеческих стромальных стволовых клетках и мышиных стромальных стволовых клетках, или на человеческих стромальных стволовых клетках и крысиных стромальных стволовых клетках или на всех трех. В вариантах осуществления маркер представляет собой SDC2.
Более конкретно, изобретение предоставляет способ выделения человеческой стромальной стволовой клетки, содержащий выделение клетки из человеческого костного мозга, которая негативна по CD45 и позитивна по дополнительному поверхностному клеточному маркеру, в котором дополнительный поверхностный клеточный маркер связывает антитело и в котором указанное антитело перекрестно реагирует с поверхностным клеточным маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из клеток мыши, крысы, лошади, кролика и свиньи. Более конкретно, изобретение предоставляет способ выделения человеческой стромальной стволовой клетки, содержащий выделение клетки из человеческого костного мозга, которая позитивна по FAP альфа и позитивна по дополнительному поверхностному клеточному маркеру, в котором дополнительный поверхностный клеточный маркер связывает антитело и в котором указанное антитело перекрестно реагирует с поверхностным клеточным маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из клеток мыши, крысы, лошади, кролика и свиньи.
Предпочтительно дополнительный маркер обнаруживается на человеческих стромальных стволовых клетках и мышиных стромальных стволовых клетках или на человеческих стромальных стволовых клетках и крысиных стромальных стволовых клетках или на всех трех. В вариантах осуществления дополнительный маркер представляет собой NG2 или, в особенности, SDC2.
Также предоставлены способы получения популяции клеток, содержащие выделение клеток в соответствии с изобретением и выведение популяции из этих выделенных клеток; и предоставлены способы получения клональной популяции клеток, содержащие выделение одиночной клетки в соответствии с изобретением и выведение клональной популяции клеток из одиночной клетки.
Также изобретением предоставлены клетки, полученные посредством этого, и, следовательно, популяции стромальных клеток, предпочтительно стромальных стволовых клеток, обогащенные относительно маркера. Обогащение может составлять 30% или более, 35% или более или 40% или более клеток, являющихся позитивными по маркеру. В вариантах осуществления маркер представляет собой NG2 или, в особенности, SDC2.
Специфическую популяцию клеток по изобретению получают посредством:
предоставления человеческой стромальной стволовой клетки,
выведения клональной популяции клеток из человеческой стромальной стволовой клетки и,
необязательно, дополнительного выращивания, и/или размножения, и/или пассирования клеток в культуре,
где человеческая стромальная стволовая клетка является выделяемой из костного мозга, является негативной по экспрессии CD45 и является позитивной по экспрессии дополнительного поверхностного клеточного маркера, где дополнительный поверхностный клеточный маркер связывает антитело и где указанное антитело перекрестно реагирует с поверхностным клеточным маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из клеток мыши, крысы, лошади, кролика и свиньи.
Дополнительная специфическая популяция клеток по изобретению является получаемой посредством:
предоставления человеческой стромальной стволовой клетки,
выведения клональной популяции клеток из человеческой стромальной стволовой клетки и,
необязательно, дополнительного выращивания, и/или размножения, и/или пассирования клеток в культуре,
где человеческая стромальная стволовая клетка является выделяемой из костного мозга, является позитивной по экспрессии FAP альфа и является позитивной по экспрессии дополнительного поверхностного клеточного маркера, где дополнительный поверхностный клеточный маркер связывает антитело и где указанное антитело перекрестно реагирует с поверхностным клеточным маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из клеток мыши, крысы, лошади, кролика и свиньи.
Продукты из клеток, такие как кость, хрящ, сухожилие, и другие продукты стромальной стволовой клетки предусмотрены изобретением, как, например, применение клеток, например, в анализах.
Изобретение позволяет идентификацию требуемых стромальных стволовых клеток на основании экспрессии специфического маркера, предоставление проспективно очищенных и определенных клеток и популяций, произведенных из них.
Подробное описание изобретения
Следовательно, изобретение предоставляет способ выделения стромальной стволовой клетки, содержащий выделение клетки из смешанной популяции клеток млекопитающих на основании экспрессии клеточного поверхностного маркера, в котором:
поверхностный клеточный маркер связывается с антителом, и в котором
указанное антитело перекрестно реагирует с поверхностным клеточным маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из человеческих, мышиных, крысиных, лошадиных, кроличьих и свиных клеток.
Антитело может распознавать клеточный поверхностный маркер на человеческой клетке и перекрестно реагировать с поверхностным клеточным маркером на клетке по меньшей мере одного другого млекопитающего, выбранной из клеток мыши, крысы, лошади, кролика и свиньи. При применении такие способы пригодны для выделения человеческих, мышиных, крысиных, кроличьих и свиных клеток, в особенности, человеческих клеток.
Антитело может распознавать клеточный поверхностный маркер на лошадиной клетке и перекрестно реагировать с поверхностным клеточным маркером на клетке по меньшей мере одного другого млекопитающего, выбранной из человеческих, мышиных, крысиных, кроличьих и свиных клеток. При применении такие способы пригодны для выделения человеческих, мышиных, крысиных, кроличьих и свиных клеток, в особенности, лошадиных клеток.
Подобным образом, изобретение предоставляет способ выделения стромальной стволовой клетки, содержащий выделение клетки из смешанной популяции клеток млекопитающих на основании экспрессии клеточного поверхностного маркера, в котором клеточный поверхностный маркер экспрессируется клеткой млекопитающего и в котором соответствующий клеточный поверхностный маркер также экспрессируется на клетке по меньшей мере одного из других видов млекопитающих, выбранной из человеческих, мышиных, крысиных, лошадиных, кроличьих и свиных клеток.
Маркер может быть экспрессирован на человеческой клетке, и соответствующий маркер может быть экспрессирован на клетке по меньшей мере одного другого млекопитающего, выбранной из мышиных, крысиных, лошадиных, кроличьих и свиных клеток, для выделения, например, человеческих клеток. Антитело может быть экспрессировано на лошадиной клетке, и соответствующий маркер может быть экспрессирован на клетке по меньшей мере одного другого млекопитающего, выбранной из человеческих, мышиных, крысиных, кроличьих и свиных клеток, для выделения, например, лошадиных клеток. Маркер является соответствующим маркером, если антитело может быть применено для сортировки человеческих клеток на основании связывания с маркером на человеческих клетках, и то же антитело может быть применено для сортировки клеток других видов млекопитающих.
В проспективном выделении стромальной стволовой клетки по изобретению таким образом применяются маркеры, обнаруживаемые среди видов, при этом это называется связывание маркеров в различных видах млекопитающих с общим антителом. В конкретном варианте осуществления, описанном далее, антитело к человеческому SDC2 связывается с и может быть применено для выделения человеческих стромальных стволовых клеток и также связывается с и может быть применено для выделения стромальных стволовых клеток в мыши, крысе, лошади и кролике.
Антитело может связываться с или перекрестно реагировать с маркерами на клетках по меньшей мере трех видов млекопитающих, по меньшей мере четырех или по меньшей мере пяти видов.
Отдельно, изобретение предоставляет способ получения или выведения стромальной стволовой клеточной популяции, содержащий проспективное выделение клеток на основании экспрессии маркера, который схожим образом экспрессирован в человеческой клетке и по меньшей мере в одной другой из мышиных, крысиных, кроличьих, лошадиных и свиных клеток для выделения, например, человеческих стромальных стволовых клеток.
В вариантах осуществления изобретения стромальные стволовые клетки выделяют в соответствии с экспрессией маркера, экспрессированного в по меньшей мере человеческих и мышиных стромальных стволовых клетках, в по меньшей мере человеческих и крысиных стромальных стволовых клетках или в по меньшей мере человеческих, мышиных и крысиных стромальных стволовых клетках. Следовательно, например, антитело к SDC2 может быть применено для выделения соответствующей популяции стромальных стволовых клеток в человеке, мыши, кролике, лошади и крысе. Другие известные антитела к NG2 и FAP альфа, подробности о которых приведены далее, могут быть применены для выделения соответствующей популяции стромальных стволовых клеток в человеке, мыши и крысе. Соответствующие стромальные популяции стволовых клеток, и их производные, из обоих или всех трех видов могут быть, вследствие этого, получены параллельно или для сравнения, или для выполнения анализа стромальных клеток одного из видов перед работой со стромальными стволовыми клетками другого.
Пригодны разнообразные источники начальных клеток, из которых могут быть выделены стволовые клетки. Источник смешанной популяции клеток млекопитающих может представлять собой костный мозг, жировую ткань, скелетную мышцу, эндометрий, плаценту, пуповину, пуповинную кровь и Вартонов студень. Источники человеческих, мышиных, крысиных, кроличьих, лошадиных и свиных клеток могут быть использованы, и в конкретных примерах использованы человеческие клетки. Один источник, примененный в примерах, представляет собой костный мозг, и конкретный предпочтительный источник представляет собой человеческий костный мозг. Другим источником являются клетки, например ССК, произведенные из человеческих плюрипотентных клеток. В одном примере применяли человеческие ССК из клеток hES.
В применении изобретения первоначальная сортировка может быть выполнена на основании только первого маркера, например, эксрессии SDC2. В этом способе обычно также выделяются ненужные клетки, что означает, что клетки не являются стромальными стволовыми клетки и могут являться, например, B-клетками или T-клетками. Однако, в дополнительном этапе выделения КОЕ, эти ненужные клетки могут быть утеряны, так как они не формируют колонии, так что уровень сортировки может являться приемлемым, только если требуемые стромальные клетки, способные к формированию КОЕ, затем будут продуцировать клональные популяции.
В некоторых вариантах осуществления изобретения клетки выделяют на основании экспрессии двух отдельных маркеров. Комбинированная селекция клеток может являться селекцией на позитив/позитивные клетки, что означает, что клетки отбирают, если они являются позитивными по экспрессии первого маркера и позитивными по экспрессии второго маркера. Селекция может также являться позитив/негативной, негатив/позитивной или негатив/негативной.
Комбинированный способ по изобретению, как правило, комбинирующий одну или более или все особенности любого способа, описанного в другом месте в данном документе, вследствие этого содержит выделение клеток на основании экспрессии дополнительного поверхностного клеточного маркера, отличного от первого. Это может именоваться второй маркер, хотя номенклатура предназначена только для обозначения того, что маркеры являются отличными друг от друга, и не указывает на временное различие распределения во времени селекции или выделения в соответствии с этим маркером. Селекция на основании маркеров может быть последовательной, в любом порядке, хотя обычно осуществляется в виде одиночной сортировки или выделения, что может быть одновременным, когда доступная технология позволяет это.
Одним пригодным вторым маркером является CD45. Соответствующим образом отбирают клетки, которые являются CD45 негативными. Дополнительным пригодным маркером является FAP альфа; соответствующим образом отбирают FAP альфа позитивные клетки. Пригодные первые поверхностные клеточные маркеры содержат SDC2 и NG2.
В другом применении изобретения первоначальная сортировка осуществляется на основании экспрессии CD45, при этом выбирается негативная фракция. Отдельная сортировка осуществляется на основании экспрессии первого маркера, например, SDC2. Может быть взята позитивная фракция или может быть взята негативная фракция. На практике сортировка обычно осуществляется одновременно. Клеточная выживаемость может быть значительно снижена в последовательной сортировке.
В конкретном способе по изобретению отбирают клетки, позитивные по первому маркеру; эти способы пригодны для выделения остеогенных клеток и ангиопоэтических клеток.
В другом конкретном способе по изобретению отбирают клетки, которые являются негативными по первому маркеру; эти способы пригодны для выделения адипогенных клеток.
Конкретный способ выделения человеческой стромальной стволовой клетки содержит выделение клетки из человеческого костного мозга, которая позитивна по первому маркеру и негативна по CD45, где первый маркер связывает антитело и где указанное антитело перекрестно реагирует с маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из клеток мыши, крысы, лошади, кролика и свиньи. Первый маркер предпочтительно представляет собой SDC2, и в выделении применяется антитело, которое связывает SDC2 и перекрестно реагирует с соответствующим маркером на всех человеческих, мышиных, крысиных, лошадиных, кроличьих. Первый маркер может представлять собой NG2, и в выделении применяется антитело, которое связывает человеческий NG2 и перекрестно реагирует с маркером, соответствующим NG2, на одной или более из клеток мыши, крысы, лошади, кролика и свиньи.
Комбинационная маркерная сортировка также может содержать сортировку в соответствии с тремя различными маркерами, например, на основании второго маркера и затем двух или более первых маркеров. Сортировка по NG2 может быть применена для подразделения популяции SDC2 +ve.
Специфическими выделенными стромальными стволовыми клетками по изобретению являются:
(i) CD45 -ve, SDC2 +ve
(ii) CD45 -ve, SDC2 -ve
(iii) CD45 -ve, SDC2 +ve, NG2 +ve
(iv) CD45 -ve, SDC2 +ve, NG2 -ve
(v) FAP альфа +ve, SDC2 +ve
(vi) FAP альфа +ve, SDC2 -ve
(vii) FAP альфа +ve, SDC2 +ve, NG2 +ve
(viii) FAP альфа +ve, SDC2 +ve, NG2 -ve.
Из клеток, которые были выделены, могут быть получены клеточные культуры и популяции. Это может быть достигнуто клональным размножением выделенной клетки (например, клетка по меньшей мере первоначально CD45 негативна и SDC2 позитивна или CD45 негативна и SDC2 негативна) и затем продолжающимся выращиванием или культивированием полученных клеток. Следует отметить, что клетки, полученные этим продолжающимся выращиванием, и культивированием, и пассированием, склонны первоначально демонстрировать тот же спектр маркеров, как исходно выделенная клетка или клетки. Со временем модель экспрессии может измениться. Но свойства результирующей популяция связаны с критериями первоначального выделения (например, клетка, которая по меньшей мере первоначально является CD45 негативной и SDC2 позитивной или CD45 негативной и SDC2 негативной).
Из клеток, которые были выделены, обычно могут быть получены клеточные культуры и популяции, имеющие высокую гомогенность, измеряемую экспрессией маркера или антигена, применяемых для выделения. Следовательно, также изобретением предусмотрены стромальные клеточные популяции млекопитающих, экспрессирующие высокие уровни первого поверхностного клеточного маркера. Процент клеток, экспрессирующих первый маркер, может составлять 50% или более, 60% или более, 70% или более, 75% или более, 80% или более или 90% или более. В конкретном варианте осуществления изобретения, описанном далее более подробно, первоначальные клеточные популяции экспрессируют первый маркер с уровнем 95% или более. При обозначении того, что клетки являются позитивными, ссылка относится к позитивным, как измерено в или на клеточной поверхности, например, как обнаруживается с применением меченого антитела к маркеру.
Клеточные популяции могут также быть произведены, как приведено выше, например, культивированием и/или пассированием, и при осуществлении этого пропорция клеток, которые сохраняют экспрессию первого маркера, может снизиться, но, тем не менее, оставаться выше, чем в популяции, не отобранной на основании маркера. Следовательно, также изобретением предоставлены дополнительные клеточные популяции млекопитающих, экспрессирующие высокие уровни первого маркера. Процент клеток, экспрессирующих первый маркер, может составлять 30% или более, 40% или более, 50% или более или находиться на уровнях, непосредственно приведенных выше. Клеточные популяции по изобретению имеют заданную чистоту и являются определенными. Клетки могут быть идентифицированы/отобраны на основании экспрессии маркера и применены непосредственно, без необходимости в культивировании для определения того, если была получена достаточно чистая популяция клеток.
В конкретных вариантах осуществления изобретения маркер представляет собой NG2 или, в особенности, SDC2.
Таким образом, предоставлена популяция стромальных стволовых клеток млекопитающих, в которой 75% или более клеток являются позитивными по поверхностному клеточному маркеру и в которой соответствующий клеточный поверхностный маркер также экспрессируется на клетке по меньшей мере одного из других видов млекопитающих, выбранной из человеческих, мышиных, крысиных, лошадиных, кроличьих и свиных клеток. Маркер соответствующим образом экспрессируется на человеческой клетке, и соответствующий маркер экспрессируется на мышиной клетке и также необязательно на клетке по меньшей мере одного другого млекопитающего, выбранной из крысиных, лошадиных, кроличьих и свиных клеток. Маркер соответствующим образом экспрессируется на человеческой клетке, и соответствующий маркер экспрессируется на крысиной клетке и также необязательно на клетке по меньшей мере одного другого млекопитающего, выбранной из мышиных, кроличьих и свиных клеток. В другой иллюстративной популяции стромальных стволовых клеток 75% или более клеток являются SDC2 позитивными, и эти клетки являются остеогенными. Дополнительно, клетки могут в дополнение характеризоваться уровнями экспрессии второго маркера. % клеток, экспрессирующих второй маркер, может составлять 50% или более, 60% или более, 70% или более, 75% или более, 80% или более или 90% или более. В конкретном варианте осуществления изобретения, описанном далее более подробно, 95% или более клеток в первоначальных клеточных популяциях являются позитивными по второму маркеру. Клетки могут являться отдельно негативными по второму маркеру. Процент клеток, неэкспрессирующих второй маркер, может составлять 50% или более, 60% или более, 70% или более, 75% или более, 80% или более или 90% или более. В конкретном варианте осуществления изобретения, описанном далее более подробно, 95% или более клеток в первоначальных клеточных популяциях являются негативными по второму маркеру. В одной иллюстративной популяции остеогенных и ангиопоэтических стромальных стволовых клеток 75% или более клеток являются SDC2 позитивными и 7 5% или более клеток являются CD4 5 негативными.
Также изобретением предусмотрены клеточные популяции, экспрессирующие низкие уровни первого маркера. Процент клеток, неэкспрессирующих первый маркер, может составлять 50% или более, 60% или более, 70% или более, 75% или более, 80% или более или 90% или более. В конкретном варианте осуществления изобретения, описанном далее более подробно, первоначальные клеточные популяции экспрессируют первый маркер с уровнем 5% или менее или считаются негативными по этому первому маркеру. В одной иллюстративной популяции стромальных стволовых клеток 75% или более клеток являются SDC2 негативными и являются адипогенными клетками. Дополнительно, клетки могут в дополнение характеризоваться экспрессией уровней второго маркера. Процент клеток, экспрессирующих второй маркер, может составлять 50% или более, 60% или более, 70% или более, 75% или более, 80% или более или 90% или более. Клетки могут отдельно являться негативными по второму маркеру. Процент клеток, неэкспрессирующих второй маркер, может составлять 50% или более, 60% или более, 70% или более, 75% или более, 80% или более или 90% или более. В конкретном варианте осуществления изобретения, описанном далее более подробно, 95% или более клеток в первоначальных клеточных популяциях являются негативными по второму маркеру. В одной иллюстративной популяции адипогенных стромальных стволовых клеток 7 5% или более клеток являются SDC2 негативными и 75% или более клеток являются CD45 негативными.
Соответственно, изобретение также предоставляет способ получения популяции клеток, содержащий выделение клеток в соответствии с описанными способами и выведение популяции из таким образом выделенных клеток; и изобретение дополнительно предоставляет способ получения клональной популяции клеток, содержащий выделение одиночной клетки в соответствии с описанными способами и выведение клональной популяции клеток из одиночной клетки. Обычно культивирование содержит получение первоначальной популяции клеток и затем дополнительное выращивание, и/или размножение, и/или пассирование клеток в культуре. SDC2 является характеризующим маркером в конкретных примерах, описанных далее.
Клеточные популяции, описанные в конкретных примерах далее, были получены, и было обнаружено, что они проявляют полезные свойства. Следовательно, дополнительно изобретением еще предусмотрена популяция клеток, получаемая в соответствии со способами в описании и формуле изобретения. Клеточные популяции предпочтительно являются человеческими, лошадиными, кроличьими, мышиными и/или крысиными клетками.
Популяция клеток конкретного варианта осуществления является получаемой посредством:
предоставления человеческой стромальной стволовой клетки,
выведения клональной популяции клеток из человеческой стромальной стволовой клетки и,
необязательно, дополнительного выращивания, и/или размножения, и/или пассирования клеток в культуре,
где человеческая стромальная стволовая клетка является выделяемой из костного мозга, является негативной по экспрессии CD45 и является позитивной по экспрессии дополнительного поверхностного клеточного маркера, где дополнительный поверхностный клеточный маркер связывает антитело и где указанное антитело перекрестно реагирует с поверхностным клеточным маркером, обнаруживаемым на клетке по меньшей мере одного из других видов млекопитающих, выбранной из клеток мыши, крысы, лошади, кролика и свиньи.
Изобретением предусмотрены ткани посредством получения клеток в соответствии с описанными способами и получения тканей из них. Ткань, выбранная из кости, хряща и сухожилия, может быть получена таким путем. Жировая ткань или ткань для реконструктивной хирургии также может быть получена.
Дополнительное применение изобретения лежит в области предоставления клеток для и анализов с применением выделенных клеток и их потомства. Следовательно, способ проведения анализа содержит получение клетки в соответствии с описанными способами и применение таких клеток в анализе.
Клеточные популяции в предшествующем уровне техники, как упомянуто, имеют склонность к образованию кости, жира и хряща с ограниченным контролем, таким образом, иногда образуя жир, когда требуется кость или хрящ. Могут быть приготовлены клеточные популяции по изобретению, которые имеют тенденцию не образовывать жир. Это является преимуществом. Могут быть приготовлены отдельные клеточные популяции по изобретению, которые действительно имеют тенденцию к формированию жира. Потребитель может таким образом быть обеспечен улучшенным контролем и предсказуемостью свойств клеток на основании критерия селекции специфического клеточного маркера.
Преимущество специфических клеточных популяций по изобретению может быть выражено иными словами, а именно CD45 негативные, SDC2 позитивные клетки имеют склонность являться остеогенными, генерируют продуцирующие кость и хрящ клеточные популяции с большей частотой. Трудность предшествующего уровня техники, связанная с смешанными результатами и низкой воспроизводимостью получения кости и хряща, может посредством этого быть разрешена. Специфические клеточные популяции, получаемые в настоящее время, могут иметь дополнительные преимущества; например, SDC2 позитивные популяции, как оказывается, являются более ангиопоэтическими, индуцируя соседние клетки к формированию сосудистой сети. Это выгодно в лечении заболеваний, когда будет извлекаться польза от улучшенной сосудистой сети, например, ишемических заболеваний.
Вдобавок SDC2 позитивные популяции получают в конкретных способах изобретения из начальных клеток, которые являются более существенно определенными, чем в предшествующем уровне техники, на основании маркера, который продолжает существовать в клетках и потомстве. Само по себе это является преимуществом. Клеточная популяция является приемлемо определенной популяцией.
Дополнительное существенное преимущество изобретения заключается в том, что маркер, применяемый для проспективного выделения первоначальной клеточной популяции, является также полезным для проспективного выделения клеточных популяций в других видах. Таким образом, в конкретном варианте осуществления SDC2 является общим среди человеческих, мышиных, крысиных, лошадиных, кроличьих. В результате, возможно выделить соответствующую популяцию в, например, мышиных клетках и затем осуществить экстраполяцию работы с мышиными клетками на работу с человеческими клетками. Определенная популяция в мыши может быть применена для получения данных, которые могут быть приняты дополнительно для соответствующей определенной популяции в других видах, особенно для человеческих клеток. Проблема, которая, как полагалось, имела место в предшествующем уровне техники для мезенхимальных популяций стволовых клеток, т.е. полученных с применением известного проспективного выделения, заключалась в том, что маркер, применяемый для выделения, например, мышиных клеток не имеет соответствующей модели экспрессии в человеческих клетках. Изобретение может таким образом предоставить определенные клеточные популяции с перекрестными между видами параллельными популяциями, такими как мышиные и человеческие или мышиные и лошадиные и т.д. Это облегчает преклиническую и клиническую работу потому, что сведения, полученные в экспериментах, осуществленных первоначально на клетках одного из видов, могут быть позднее перенесены на соответствующую определенную клеточную популяцию в других видах.
Клетки и ткань по изобретению, и композиции, содержащие клетки и ткани, могут быть применены для лечения разнообразных состояний и заболеваний млекопитающих, включая в особенности поддающиеся излечению с применением клеток и продуктов, произведенных из существующих ССК продуктов. Клетки и ткань могут взаимодействовать с дендритными клетками и запускать секрецию IFN-β, и, следовательно, могут быть использованы в качестве опухолевого супрессора. Раки в целом можно подвергать лечению с применением изобретения, в частности, включая гепатоклеточную карциному, рак шейки матки, рак поджелудочной железы, рак простаты, фибросаркому, медуллобластому и астроцитому. Легочные заболевания могут подвергаться лечению, включая острое повреждение легких (ОПЛ); синдром острой дыхательной недостаточности (СОДН); хроническую обструктивную болезнь легких (ХОБЛ); идиопатический легочный фиброз (ИЛФ). Клетки и ткани могут быть применены для лечения сепсиса и индуцированной сепсисом мультиорганной недостаточности, отторжения трансплантата костного мозга (ТКМ) или гемопоэтической стволовой клетки (ГСК); отторжения транспланта цельного органа (ТЦО) (включая печень, почку, кожу, роговицу, сердце, легкое); острой индуцированной токсином печеночной недостаточности; аутоиммунного гепатита; первичного биллиарного цирроза (ПБЦ) и первичного склерозирующего холангита (ПСХ); остеонекроза; дегенеративной болезни диска; ревматоидного артрита; остеоартрита и замедленного срастания перелома у пациентов с диабетом; аутоиммунного нефрита, включая гранулематоз Вегенера (ГВ); ожогов, тяжелых ожогов; состояния мышечного истощения и атрофических синдромов, включая саркопению; кахексии и других состояний мышечного истощения, включая мышечные дистрофии (Дюшенна и Беккера); застойной сердечной недостаточности, острого инфаркта миокарда и инсульта; диабета типа 1; диабета типа 2; диабетической ретинопатии и других ретинопатий; диабетической нефропатии и других нефропатий; незаживающих диабетических язв; диабетической кардиомиопатии и других миопатий; атеросклероза; заболевания периферических артерий и критической ишемии конечностей; увеита; (влажной и сухой) острой макулярной дегенерации (ОМД); повреждения сетчатки и роговицы; аутоиммунных состояний, таких как аутоиммунный гастрит (АИГ); болезни трансплантат против хозяина (БТПХ); множественного склероза и демиелинизирующих заболеваний; заболеваний щитовидной железы; воспалительных заболеваний кишечника, включая болезнь Крона, язвенный колит и болезнь Крона с образованием фистул; склеродермии; волчанки (СКВ); болезни Грейвcа и аутоиммунного лимфопролиферативного заболевания (АЛПЗ).
Клетки и ткань также могут быть применены для лечения конкретных разнообразных состояний лошади, включая ламинит, повреждения сухожилия и вызванное физической нагрузкой легочное кровоизлияние (EIPH), также известные как "кровотечение" или "приступ кровотечения".
Также данным изобретением предусмотрена фармацевтическая композиция для лечения заболевания или нарушения у животного, в особенности млекопитающего и, например, человека или лошади. Фармацевтическая композиция соответствующим образом содержит клетки или ткань по изобретению в количестве, эффективном для лечения заболевания или нарушения у животного. Клетки таким образом могут быть введены с приемлемым фармацевтическим носителем. Например, клетки могут быть введены в виде клеточной суспензии в фармацевтически приемлемой жидкой среде для инъекции. Примерами жидкой среды являются солевой раствор, фосфатно-буферный солевой раствор, также необязательно содержащий добавочные вещества, такие как диметилсульфоксид (ДМСО) и человеческий сывороточный альбумин. Клетки и ткань обычно могут быть введены посредством разнообразных форматов, которые известны для существующих мезенхимальных стволовых клеток и подобных продуктов и ткани, произведенной из них. Они могут быть введены системно, например, внутривенным вливанием, или прямой инъекцией. Композиции могут содержать матрицу или остов, или клетки или ткань могут быть введены инъекцией в участок, уже содержащий матрикс или остов in situ. Клетки или ткань могут таким образом быть введены в комбинации с гиалуроновой кислотой, коллагеном или другим внеклеточным матриксом. Дополнительные примеры состава и введения, которые могут быть применены с необходимыми изменениями к клеткам и ткани по изобретению, могут быть обнаружены в данной области, например, в WO 2001080865, EP 2545928 и WO 1999061587. Представлен способ лечения животного, содержащий введение животному композиции по изобретению. Клетки или ткань в соответствии с изобретением предоставлены для применения в лечении заболевания или нарушения у животного. Варианты осуществления способов и применений содержат варианты осуществления обычно изобретения, описанные в данном документе.
Пригодные антитела доступны специалисту для выполнения сортировки и выделения на основании идентифицированных маркеров. Человеческое антитело NG2/MCSP доступно у R&D Systems, Inc. (614 McKinley Place NE, Minneapolis, MN 55413, USA), в виде моноклонального мышиного IgG1 Клон # 7.1, номер по каталогу: MAB25851. Антитело NG2 (G-20) доступно у: Santa Cruz Biotechnology, Inc. (2145 Delaware Avenue, Santa Cruz, California, 5060, USA), ref: sc-30923, реагирующее с мышиными, крысиными, человеческими, лошадиными, собачьими, бычьими и свиными; блокирующий пептид, sc-30923 P, также доступен. Белок-активатор α человеческих фибробластов/FAP антитело, номер по каталогу: AF3715, доступно у R&D Systems, Inc. FAP альфа (Y-16) антитело доступно у Santa Cruz Biotechnology, Inc., реагирующее по меньшей мере с человеческими, крысиными и мышиными и также лошадиными, собачьими, бычьими, свиными и птичьими. Белок против белка-активатора фибробластов, альфа антитело, ab28243, доступен у Abcam (330 Cambridge Science Park, Cambridge, CB4 0FL, UK), реагирующий по меньшей мере с мышиными, крысиными и человеческими. Антитело к синдекану 2, orb13481, реагирующее по меньшей мере с человеческими, мышиными и крысиными доступно у Biorbyt Ltd. (12 Pembroke Avenue, Denny Industrial Centre, Waterbeach, Cambridge, CB25 9QR, UK). SDC2 антитело, применяемое в конкретных примерах, номер по каталогу: MAB29651 (Клон 305507), доступно у R&D Systems, Inc, реагирующее с человеческими, мышиными, крысиными, лошадиными, кроличьими и свиными.
SDC2, также называемый фиброгликан и в настоящее время, CD362, был исходно биохимически охарактеризован как один из главных гепарансульфат (ГС) гликозаминогликан (ГАГ)-содержащих белков клеточной поверхности, экспрессируемый в легком. SDC2 является одним из четырех членов этого однопроходного трансмембранного семейства позвоночных. В данном документе обозначение "S2" и "SDC2" обозначает SDC2.
Изобретение далее описано посредством конкретных вариантов осуществления, ссылаясь на прилагаемые чертежи, в которых:
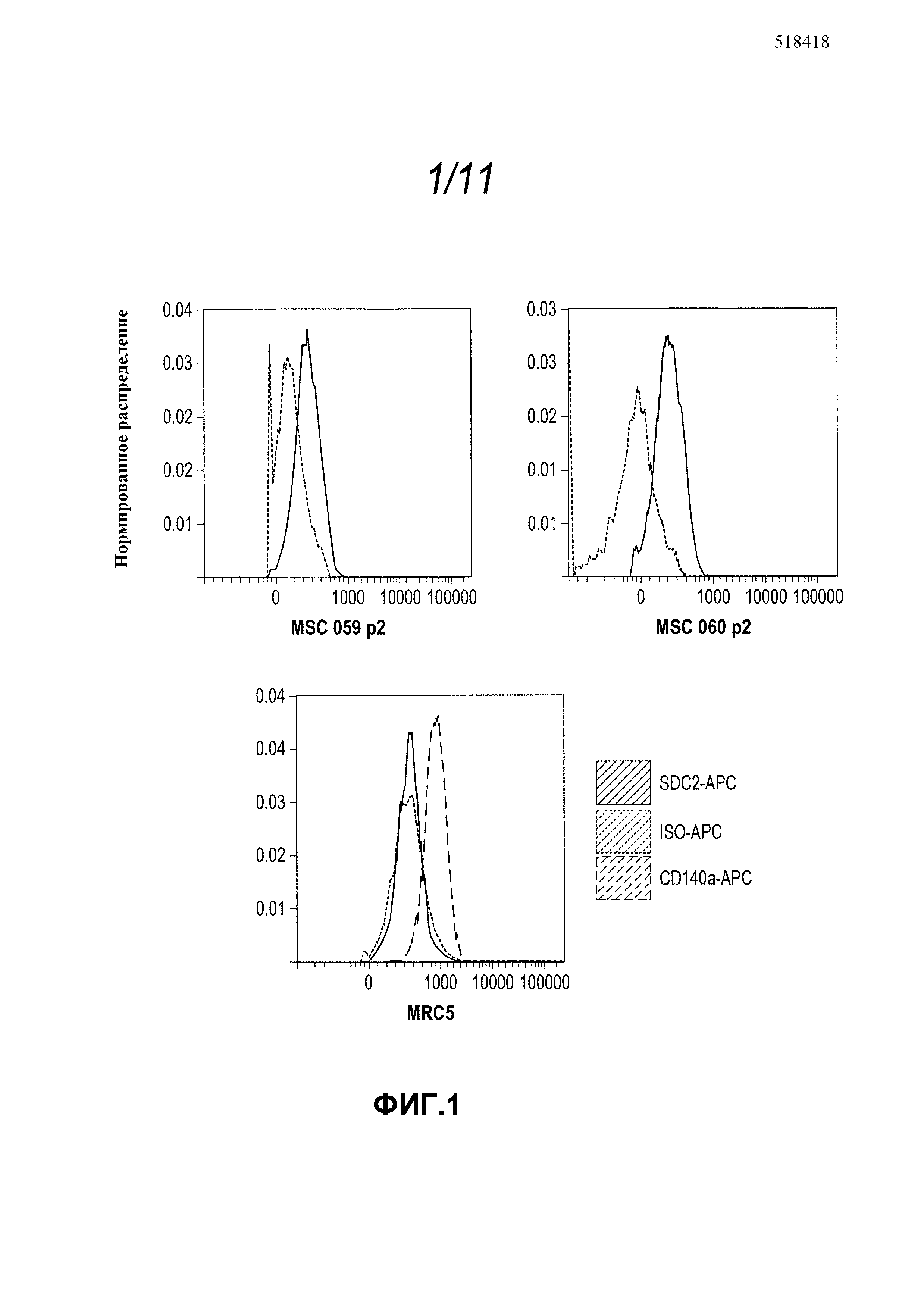
Фиг. 1 демонстрирует мечение анти-SDC2 антителом человеческих стромальных стволовых клеток, но нечеловеческих фибробластов легкого. Зеленые линии указывают анти-SDC2-APC окрашивание клеток. Красные линии указывают мечение с соответствующим контрольным антителом (крысиный IgG2B Isotype control-APC; R&D # IC013A; Клон - 141945). Синие линии указывают позитивное контрольное мечение MRC5 с анти-PDGFRa-APC антителом (R&D Systems # FAB1264A; Клон - PRa292);
Фиг. 2 демонстрирует мечение SDC2-APC антителом CD271bright/DC45low мононуклеарных клеток человеческого костного мозга. Данные демонстрируют профиль сортировки флуоресцентно-активированных клеток (FACS) 3,5×107 BMМНК, окрашенных ранее упомянутыми SDC2-APC, CD271-PE и CD45-FITC (оба из BD). CD45-FITC окрашивание позволило разделение BMМНК на 3 популяции, (A) CD45-ve - СИНИЙ, (B) CD45low - ОРАНЖЕВЫЙ, и (C) CD45high - ЗЕЛЕНЫЙ. На (B) редкие TP SDC+ve/CD271bright/CD45low клетки являются СИНИМИ;
Фиг. 3 демонстрирует повышенное обогащение в КОЕ-Ф в SDC+/CD271bright/DC45low сортированных мононуклеарных клетках костного мозга. Данные демонстрируют профиль сортировки флуоресцентно-активированных клеток (FACS) 107 BMМНК, окрашенных ранее упомянутыми SDC2-APC, CD271-PE и CD45-FITC (оба из BD);
Фиг. 4 демонстрирует процентное содержание лунок 96-луночного планшета, в которых не был сформировано ни одного клона, в качестве функции от количества SDC+/CD271bright/DC45- мононуклеарных клеток в расчете на клетку;
Фиг. 5 демонстрирует количество популяционных удвоений клонов;
Фиг. 6 демонстрирует in vitro ГАГ депонирование SDC2+ стромальных стволовых клеток при 2% и 19% кислородном потенциале. Показаны иллюстративные окрашенные сафранином-O гистологические срезы осадков микромассы, произведенной из SDC2+CCК;
Фиг. 7 демонстрирует in vitro липидное депонирование SDC2+ и SDC2- (обозначены как S2+ и S2- соответственно) стромальных стволовых клеток;
Фиг. 8 демонстрирует кальциевое депонирование SDC2+ и SDC2- стромальных стволовых клеток в ответ на остеогенные стимулы in vitro;
Фиг. 9 демонстрирует ГАГ депонирование SDC2+ и SDC- стромальных стволовых клеток в ответ на in vitro хондрогенную стимуляцию;
Фиг. 10 демонстрирует формирование корда относительно HUVEC SDC2+ и SDC2- стромальных стволовых клеток в ответ на ангиогенную стимуляцию in vitro;
Фиг. 11 демонстрирует, что редкие CD45-/SDC+ мононуклеарные клетки человеческого костного мозга экспрессируют маркер стромальных стволовых клеток CD271, CD146 и NG2;
Фиг. 12 демонстрирует SDC2 экспрессию стромальных стволовых клеток, выделенных из козьего и кроличьего костного мозга;
Фиг. 13 демонстрирует увеличение уровней SDC2 в стромальных стволовых клетках, произведенных из лошадиного костного мозга при слиянии, и что стромальные стволовые клетки, произведенные из костного мозга свиньи, экспрессируют SDC2 в низком кислородном потенциале;
Фиг. 14 демонстрирует увеличение уровней SDC2 в стромальных стволовых клетках, произведенных из костного мозга трех штаммов крысы при слиянии;
Фиг. 15 демонстрирует FACS выделение CD45- мононуклеарной клетки с совместным окрашиванием с SDC2 и ScaI; и
Фиг. 16 демонстрирует повышенное обогащение по КОЕ-Ф в SDC+/ScaI отобранных мышиных мононуклеарных клетках.
Мы применяли крысиное моноклональное антитело IgG2B к человеческому SDC2, конъюгированное с флуорохромом аллофикоцианином (АФЦ) (R&D Systems номер FAB2965A; клон 305515) для индикации того, если экспрессия белка SDC2 обогащена на клеточной поверхности человеческой ССК по сравнению с контрольной человеческой эмбриональной клеточной линией фибробластов легкого, MRC5. Фибробласты легкого MRC5, культивированные в среде для выращивания ССК (aMEM/10% PAA FSC; NUNC колбы T175), не экспрессировали SDC2 (Фиг. 1). В качестве контроля, мы продемонстрировали, что MRC5 фибробласты действительно экспрессируют маркер PDGFRa (CD140a-APC). Эти данные предполагают, что экспрессия белка SDC2 обогащена на поверхности человеческой ССК по сравнению с контрольными фибробластами легкого (Фиг. 1).
На данный момент в существующем уровне техники очистка ССК из КМ на основании антитела состоит из применения комбинации антитела анти-CD271 (LNGFR) и анти-CD45, как сообщают из Университета Лидса (Drs. McGonagle and Jones). В этом выделении клеток CD45low/CD271bright, как было продемонстрировано, улавливаются все КОЕ-Ф (ССК).
Однако, определение клеток CD271 'bright' может быть затруднительно для стандартизации от лаборатории к лаборатории. Для исследования того, если это анти-SDC2 антитело совместно окрашивает CD45low/CD271bright BMМНК, 30 мл человеческих КМ аспирировали от донора CRFG#0007 в Клиническом исследовательском центре (CRF) в Университетской клинике г. Голуэй (GUH) Dr Ruth Morrell.
BMМНК (5×108) выделяли центрифугированием в фиколле, промывали в PBS, ресуспендировали в буфере MACS и блокировали человеческим FC-Block (Miltenyi, UK). BMМНК (4×107) окрашивали с анти-SDC2-APC (R&D), анти-CD271-PE (BD), анти-CD45-FITC (BD) и красителем выживаемости Sytox/DAPI. Клетки анализировали FACS в Becton Dickinson Ariall в NUI Голуэй.
Фиг. 2 показывает иллюстративные гистограммные/точечные диаграммы из цитометрических экспериментов тройного SDC2/CD271/CD45 окрашивания. Фиг. 2B показывает BMМНК, которые экспрессируют низкие/средние уровни маркера CD45 (оранжевый). Согласно другим докладам, мы обнаружили, что CD271-позитивные клетки обнаруживаются среди CD45low популяции (Фиг. 2B), и в этих экспериментах мы отметили, что анти-SDC2-APC антитело метит CD45low/CD271-позитивные клетки. В частности, анти-SDC2-APC антитело метит CD45low/CD271bright BMМНК. Тройная SDC2+/CD45low/CD271+ позитивная (ТП) популяция является редкой среди BMМНК с частотой, варьирующейся от 1:16000 до 1:23000.
Фиг. 3 демонстрирует, что SDC2+/CD271+/CD45- фракция МНК содержит в 3000 раз больше КОЕ-Ф/ССК по сравнению с природными пресортированными BMМНК. Напротив SDC2-негативная фракция CD271+ популяции не сохраняет существенное количество КОЕ-Ф/ССК.
Эксперименты FACS сортировки одиночной клетки выполняли для подсчета количества клоногенных клеток в SDC2+/CD271+ популяции. Одиночные SDC2+/CD271+/CD45- МНК сортировали по 1, 3 и 20 клеток в расчете на лунку в 96-луночном планшете. Анализ предельного разведения выявляет, что с 1 клеткой в расчете на лунку 16-17 клонов формировалось в расчете на 96-луночный планшет (Фиг. 4). Все 16 клонов являлись пролиферативными и были способны подвергаться 15-20 удвоениям популяции (Фиг. 5). Необходимо отметить, что отобранные SDC2+ клоны были способны подвергаться существенному хондрогенезу в ответ на in vitro культивирование в микромассе. Все пять клонов проявляли повышенное депонирование гликозаминогликана (ГАГ) при культивировании в низких (2%) потенциалах кислорода (Фиг. 6).
При сравнении с пресортированными (родительскими) ССК, FACS-сортированные и размноженные культивированием SDC2+ССК проявляют существенно аттенуированное депонирование липидов в ответ на in vitro стимуляцию с сильнодействующей адипогенной средой после 14 дня режима дифференциации (Фиг. 7), как визуализировано окрашиванием масляным красным О, экстракциями и количественным определением. Напротив, по сравнению с SDC2-ССК и пресортированными ССК, SDC2+ССК выявляют повышенное депонирование кальция и повышенную минерализацию матрикса в ответ на 14-дневную индукцию с остеогенными средами, как измеряли экстракцией кальция и окрашиванием ализариновым красным S соответственно (Фиг. 8). Необходимо отметить, что не наблюдали различия между тремя популяциями ССК при подвергании хондрогенному культивированию в микромассе (Фиг. 9).
Человеческие васкулярные эндотелиальные клетки (HUVEC) могут формировать ангиогенные подобные корду трубочки в пределах 24 часов после высевания на чашки на богатый нутриентами матригель. Совместное культивирование SDC2+ССК в соотношении 1:1 с HUVEC на матригеле выявляет 3-кратное возрастание количества стабильных васкулярных трубочек за 24 часа (Фиг. 10).
В заключение, человеческий SDC2+/CD45- МНК также экспрессируют ключевые стромальные маркеры, включая CD146, NG2 (CSPG4) и CD271 (Фиг. 11).
Фиг. 12 представляет гистограммы проточной цитометрии ССК, произведенных из КМ и жировой МНК козьей и кроличьей ткани КМ. Хотя SDC2 маркер, по-видимому, не обнаруживается на козьих ССК, существенные уровни белка SDC2 могут быть детектированы на кроличьих ССК (Фиг. 12).
Повышенная детекция белка SDC2 повышена в культивируемой лошадиной ССК в ответ на конфлюэнтное культивирование (Фиг. 13). SDC2 белок может также быть культивирован в субпопуляции свиных ССК при культивировании с низким содержанием кислорода (Фиг. 13).
SDC2 маркер экспрессируется на поверхности крысиных ССК (Фиг. 14). Как видно по лошадиным ССК, SDC2 белок возрастает в поверхности крысиных ССК в ответ на слияние. Эту модель можно увидеть в ССК, произведенных из мозгового вещества трех обычно применяемых лабораторных штаммов крыс, а именно Дарк Агути, Спрег-Доули и Льюиса (Фиг. 14).
ПРИМЕРЫ
Пример 1.1 - Выделение аспиратов костного мозга
Образцы человеческого костного мозга получали из заднего подвздошного гребня здоровых добровольцев (n=3) после письменного согласия от пациентов. Пациентов подвергали вирусологическому тестированию на ВИЧ I и II, Гепатит A/C, HBsAg, анти-HB core, сифилис и ЦМВ в соответствии с требованиями директивы ЕС по тканям 2006/17/EC. В BSC, образцы объединяли и разделяли на аликвоты по 7,5 мл и подвергали центрифугированию в градиенте плотности.
Пример 1.2 - Выделение и размножение человеческих ССК центрифугированием в градиенте плотности (Фиколл)
В боксе биологической безопасности асептическими методами отмеряли пипеткой 7,5 мл фиколла в 50 мл пробирки для центрифугирования. Для удаления сгустков 30 мл КМ фильтровали через фильтр для клеток 100 микрон (BD Falcon) в 50 мл пробирку для центрифугирования. Отфильтрованное мозговое вещество разбавляли 1/1 в D-PBS и затем разделяли равномерно между 4 пробирками, содержащими фиколл, медленно пипетируя КМ на стенку пробирки, лежащей под углом от 35° до 45°, для обеспечения медленного высвобождения КМ, без разрушения фиколла или образования пузырей. Затем пробирки центрифугировали в течение 22 мин при 900 g с выставленными на ноль тормозами центрифуги для образования фракционированного образца. После центрифугирования содержимое пробирок сформировало три слоя; верхний слой плазмы, тонкий слой - лейкоцитарная пленка, содержала МНК, светлый слой фиколла и нижний слой, содержащий компоненты красных кровяных клеток - эритроциты и гранулоциты. Лейкоцитарную пленку осторожно аспирировали, соблюдая осторожность, чтобы не задеть окружающие клетки. Эти клетки затем переносили в другую 50 мл пробирку для центрифугирования и ресуспендировали в 45 мл D-PBS. Эти пробирки затем центрифугировали 10 мин при 350 g. Супернатант аспирировали и осадки ресуспендировали в 5 мл полной среды. Это затем центрифугировали 10 мин при 350 g. Супернатант аспирировали и осадки объединяли в 5 мл D-PBS.
Пример 1.3 - Посев КОЕ-Ф на чашки
После выделения мононуклеарных клеток посредством прямого посева на чашки или фиколла 9×106 клеток выделяли из обеих совокупностей клеток и производили посев в 10 см планшеты в трех повторах с посевной плотностью 3×106 МНК/планшет. Эти клетки промывали и подпитывали одновременно с клетками в культуре, как изложено выше.
Пример 1.4 - Окрашивание КОЕ-Ф кристаллическим фиолетовым
На дни 12-14 клетки фиксировали и окрашивали для анализа КОЕ-Ф. Среды аспирировали из планшетов и планшеты промывали три раза в D-PBS для удаления оставшейся среды. Клетки фиксировали пипетированием 8 мл 95% метанола, который хранили при -20°C, на клетки в течение 10 мин и осторожным взбалтыванием. Метанол аспирировали из планшетов и клетки промывали один раз с D-PBS. Затем на планшеты добавляли 8 мл кристаллического фиолетового (0,5% кристаллического фиолетового, 99,5% метанола) и планшеты осторожно взбалтывали. Планшеты оставляли на 10-15 мин. Избыток кристаллического фиолетового аспирировали и клетки промывали три раза с D-PBS для удаления оставшегося избытка красителя. Планшеты затем переворачивали и оставляли высушиваться в течение ночи. Затем сухие планшеты визуализировали с применением сканера плоскостного типа. Колонии затем подсчитывали и характеризовали визуальным обследованием под инвертированным оптическим микроскопом (Olympus CKx41). Колонии, содержавшие кластеры больше 50+, считали КОЕ.
Пример 2 - Антительный анализ мононуклеарных клеток и стромальных стволовых клеток
Таблица 1 демонстрирует компоненты антител, применяемых для создания профиля мононуклеарных клеток и стромальных стволовых клеток, полученных в примере 1.
Приготовление блокирующего раствора
Блокирующий раствор готовили добавлением 1 мл FBS к 49 мл D-PBS в 50 мл пробирке.
Приготовление образца
Клетки трипсинизировали при 37°C и переносили в культуральную среду в 15 мл пробирку. Клетки центрифугировали в течение 5 мин при 400 g. Супернатант аспирировали и клетки ресуспендировали в 5 мл полной культуральной среды. Подсчет клеток и испытание выживаемости выполняли с применением трипанового синего. Затем клетки центрифугировали 5 мин при 400 g и супернатант аспирировали. Затем к клеточным осадкам добавляли блокирующий раствор для ресуспендирования клеток с 1×106 клеток/мл.
Окрашивание ССК (Анализ на FACS Canto)
PE-меченые антитела извлекали из морозильника и помещали на лед вместе с 96-луночным планшетом с круглым дном (Sarstedt) и блокирующим раствором. 1×105 клеток (100 мкл) отмеряли пипеткой в каждую из 12 лунок 96-луночного планшета на льду, одна для каждого антитела и 1 для неокрашенных клеток. Затем планшет центрифугировали в течение 4 мин при 400g, 4°C. Супернатант аспирировали осторожно, чтобы не задеть клеточный осадок, и добавляли 50 мкл блокирующего раствора в каждую лунку и осадок ресуспендировали пипетированием раствора.
Пример 3 - Хондрогенная дифференциация ССК
Таблица 2 демонстрирует композицию неполной хондрогенной среды (НХС).
Клетки размораживали с применением водяной бани при 37°C и быстро переносили в культуральную среду в 15 мл пробирку, промывая криопробирку с 1 мл среды. Клетки центрифугировали в течение 5 мин при 400 g. Супернатант аспирировали и клетки ресуспендировали в 5 мл полной культуральной среды. Выполняли подсчет клеток и достаточное количество клеток собирали для образования осадков между 2-2,5×105 клеток/осадок. 4 позитивных культуры и 2 негативных культуры устанавливали для каждого образца. Клетки центрифугировали еще раз в течение 5 мин при 400 g для удаления культуральной среды. Супернатант аспирировали и клетки ресуспендировали в 3 мл неполной хондрогенной среды (НХС). 3 мл клеточной суспензии разделяли в 15 мл пробирки (2 мл для позитивных осадков, 1 мл для негативных осадков). Пробирки центрифугировали в течение 5 мин при 100 g. Клетки для позитивных осадков ресуспендировали в 500 мкл полной хондрогенной среды (ПХС) для каждого образованного осадка. ПХС состояла из НХС с 0,5 мкл TGF-β в расчете на мл НХС.
Клетки для негативного осадка ресуспендировали в 500 мкл НХС для каждого образованного осадка. Клетки переносили в пробирки Эппендорф с колпачком с резьбой и центрифугировали в течение 5 мин при 100 g в колебательном роторе. Колпачки пробирок приоткрывали для того, чтобы позволить газовый обмен, и инкубировали в BSC при 37°C, 5% CO2. Среду заменяли каждый второй день аспирированием такого количества среды, которое возможно без разрушения осадка, и замещали или с ПХС, или с НХС для позитивных осадков и негативных осадков соответственно. В день 21 клеточные осадки собирали аспирированием всей среды и двукратным промыванием в D-PBS. Осадкам позволяли высушиваться на воздухе и 3 из 4 позитивных осадков применяли для измерения ГАГ и другой использовали для гистологии. Осадки для измерений ГАГ хранили при -20°C, и осадок, используемый для гистологии, фиксировали в 10% формалине в течение 1 ч и затем хранили в воде до готовности к обработке.
Пример 4 - Хондрогенный анализ
Приготовление cтокового раствора DMMB
16 мг DMMB растворяли в течение ночи в 5 мл чистого для анализа 100% этанола. 2,73 г NaCl и 3,04 г глицина добавляли к 975 мл деионизированной воды. 0,69 мл концентрированной HCl (11,6 M) добавляли к этому раствору и смешивали. Растворенный DMMB добавляли в этот раствор. Затем емкость из-под DMMB многократно промывали с ДИ водой, пока весь раствор DMMB не был перенесен. pH доводили до 3,0 с 1 M HCl. Объем доводили до 1 л деионизированной водой и раствор защищали от света заворачиванием в оловянную фольгу.
Раствор папаина готовили растворением 1 мг папаина (Sigma P4762) в 9,75 мл теплого разбавленного буфера. Разбавленный папаин готовили добавлением 250 мкл этого раствора к 10 мл буфера для разбавления.
200 мкл раствора папаина добавляли к каждому осадку и позволяли расщепляться в течение ночи в печи с 60°C. Затем образцы взбалтывали, чтобы диспергировать осадок. Стандарты готовили с применением хондроитин-6-сульфата (Sigma C4384) добавлением 4 мг хондроитин-6-сульфата к 10 мл буфера для разбавления, получая сток 400 мкг/мл. Это затем разбавляли для получения раствора 40 мкг/мл. Разбавления осуществляли следующим образом из этого раствора 40 мкг/мл, как приведено в таблице 3.
50 мкл стандартов и образцы добавляли в трех повторах в каждую лунку 96-луночного планшета. 200 мкл стокового раствора DMMB добавляли в каждую лунку и инкубировали при комнатной температуре (КТ) в течение 5 мин. Планшеты измеряли планшет-ридером поглощательной способности при 595 нм. Показания оптической поглощательной способности для стандартов, содержащих 0 мкл ГАГ/лунку, применяли в качестве холостого значения и вычитали из других показаний оптической плотности.
Измерение ДНК с применением PicoGreen
1xTE раствор готовили разбавлением 20x стокового раствора, предоставляемого в наборе Quant-iT (Sigma P7589), 1 части в 20 частях дистиллированной воды. Разбавленный раствор PicoGreen готовили разбавлением 1 части ДМСО в 200 частях dH2O. Сток ДНК (100 мкг/мл) разбавляли в 1xTE 50-кратно для получения конечной концентрации 2 мкг/мл. ДНК стандарты готовили, как приведено в таблице 4.
Расщепленные папаином образцы (изложено выше) дополнительно разбавляли в 25 раз в 1xTE. 100 мкл стандартов и образцов добавляли в трех повторах в 96-луночный черный планшет. Планшет должен быть черным, так как реакция подвержена воздействию света. 100 мкл раствора PicoGreen добавляли в каждую лунку со стандартом и образцом и позволяли инкубироваться 2-3 мин. Планшеты считывали планшет-ридером флуоресценции первоначальным возбуждением планшета при 485 нм и затем считыванием планшета при 538 нм.
Пример 5 - Адипогенная дифференциация ССК
Таблица 5 демонстрирует композицию адипогенной индукцирующей среды.
Таблица 6 демонстрирует композицию адипогенной поддерживающей среды.
Клетки размораживали, используя водяную баню 37°C, и быстро переносили в культуральную среду в 15 мл пробирку, промывая криопробирку с 1 мл среды. Клетки центрифугировали в течение 5 мин при 400 g. Супернатант аспирировали и клетки ресуспендировали в 5 мл полной культуральной среды. Выполняли подсчет клеток и достаточное количество клеток собирали для посева клеток с конфлюэнтностью (4×104 клеток/лунку) в 24-луночный планшет с плоским дном. Устанавливали 4 тестовых лунки и 4 контрольные лунки. Клетки сеяли в 1 мл культуральной среды в каждую лунку. Клетки инкубировали при 37°C, 5% CO2 и после 48 ч клетки визуально наблюдали на обладание адгезии к пластику и проявляемую конфлюэнтность. В тестовых лунках полную культуральную среду замещали с 1 мл адипогенной индукционной среды и оставляли на 3 дня. Контрольные лунки замещали полной культуральной средой. После 3 дней в адипогенной культуральной среде среду в тестовых лунках замещали с 1 мл/лунку поддерживающей среды и оставляли на 1-3 дня. Затем это замещали с 1 мл/лунку поддерживающей среды. Этот процесс повторяли три раза. После окончательной замены среды на поддерживающую среду клетки оставляли в среде на от 5 до 7 дней перед сбором.
Пример 6 - Адипогенный анализ
Окрашивание масляным красным О
Рабочий раствор масляного красного О готовили смешиванием 6 частей стокового раствора масляного красного О с 4 частями dH2O. Раствору позволяли отстояться в течение 10 мин и затем фильтровали через фильтровальную бумагу Whatman no.1.
Среды аспирировали и клетки два раза промывали в D-PBS. Затем клетки фиксировали в 10% формалине в течение 1 ч при КТ. Формалин аспирировали и планшеты ополаскивали в dH2O. 500 мкл рабочего раствора масляного красного О отмеряли пипеткой в каждую лунку для покрытия слоя клеток. Планшет медленно вращали движением на фигуре 8 для распределения масляного красного О равномерно по клеткам и оставляли на 5 мин. Краситель аспирировали и избыток красителя удаляли добавлением 2 мл/лунку 60% изопропанола. Планшеты еще раз взбалтывали движением на фигуре 8 и изопропанол аспирировали. Планшеты споласкивали водопроводной водой, пока вода не истекала равномерно из планшета. Образцы затем хранили в dH2O до визуализации.
Экстракция окрашенного липида
После визуализации образцов воду аспирировали из лунок. Масляный красный О экстрагировали пипетированием изопропанола (2×500 мкл) по поверхности лунок несколько раз. Изопропанол и краситель затем переносили в пробирку Эппендорф. Образцы центрифугировали в течение 2 мин при 500 g для отделения осадка и дебриса в образцах. 200 мкл экстрагированного красителя для каждого образца добавляли в трех повторах в 96-луночный планшет. Окрашивание измеряли с применением планшет-ридера при 520 нм.
Пример 7 - Остеогенная дифференциация ССК
Таблица 7 демонстрирует композицию среды для остеогенной дифференциации.
Клетки размораживали с применением водяной бани при 37°C и быстро переносили в культуральную среду в 15 мл пробирку, промывая криопробирку с 1 мл среды. Клетки центрифугировали в течение 5 мин при 400 g. Супернатант аспирировали и клетки ресуспендировали в 5 мл полной культуральной среды. Выполняли подсчет клеток и достаточное количество клеток собирали для посева клеток с конфлюэнтностью (4×104 клеток/лунку) в 24-луночный планшет с плоским дном. Устанавливали 4 тестовых лунки и 4 контрольных лунки. Клетки сеяли в 1 мл культуральной среды в каждую лунку. Клетки инкубировали при 37°C, 5% CO2 и после 48 ч клетки проверяли визуально на адгезию к пластику и проявляемую конфлюэнтность. Среду в тестовых лунках замещали остеогенной средой и среду в контрольных лунках замещали полной культуральной средой. Среду во всех лунках заменяли два раза в неделю. Клетки собирали между днями 10 и 17.
Остеогенный анализ
1 из 4 тестовых лунок и контрольных лунок использовали для окрашивания ализариновым красным. Другие 3 применяли для количественного определения кальция.
Окрашивание ализариновым красным
2% раствор ализаринового красного S готовили растворением 2 г ализаринового красного S в 100 мл dH2O. Раствор перемешивали и pH доводили до приблизительно 4,1-4,3 с применением 1% гидроксида аммония, так как pH является важным для процесса окрашивания. Среду аспирировали из лунок. Клетки промывали два раза в D-PBS для удаления оставшейся среды для обеспечения отсутствия окрашивания среды. 95% метанол готовили разбавлением 95 мл 100% метанола в 5 мл воды. Затем метанол хранили на льду для достижения низкой температуры. Клетки фиксировали в холодном как лед метаноле в течение 10 мин. Метанол аспирировали и клетки ополаскивали dH2O. 500 мкл 2% ализаринового красного S добавляли в лунки и оставляли на 5 мин, изредка слегка встряхивая планшет движением на фигуре 8. После 5 мин окрашивание кальция было различимым. Клетки ополаскивали dH2O и визуализировали с применением Olympus CKx41.
Кальциевый анализ
0,5 M HCl готовили разбавлением 4,3 мл 11,6 M HCl в 95,7 мл воды. Среду аспирировали из лунок и лунки промывали два раза в D-PBS для удаления всей оставшейся среды. 0,2 мл 0,5 M HCl добавляли в каждую лунку и клетки отскабливали от лунок с применением отскабливателя для клеток и собирали в меченые пробирки Эппендорф. Раствор оставляли встряхиваться в течение ночи на встряхивателе для клеток в темной холодной комнате. Образцы быстро центрифугировали для осаждения клеточного дебриса. Кальциевый анализ выполняли с применением набора Stanbio. Готовили рабочий раствор 1:1 связывающего реагента и рабочего красителя.
Таблица 8 демонстрирует композицию стандартов для кальциевого анализа.
Стандарты и образцы высевали в трех повторах на 96-луночный планшет. 10 мкл 0,5 M HCl добавляли в каждую лунку со стандартом. 10 мкл образцов добавляли в каждую лунку. 200 мкл рабочего раствора добавляли в каждую лунку со стандартом и образцом. Поглощательную способность считывали при 550-650 нм с применением Victor3™ 1420.
SDC2 совместно окрашивали Sca1 на поверхности CD45-ve мышиных КММНК из штамма C57/Bl6. Кроме того, FACS сортировка SDC2+/Sca1+ МНК из мышиного мозгового вещества выявляет, что SDC2 маркирует самообновляющуюся субпопуляцию ССК, которая может формировать КОЕ-Ф с существенно повышенными частотами по сравнению с высеянными пресортированными МНК.
Пример 8 - SDC2+ клетки из человеческих плюрипотентных клеток
Нами были получены популяции клеток, экспрессирующие SDC2 из человеческих плюрипотентных клеток, в этом случае ES клеток (ES-), для сравнения с клетками, выведенными из костного мозга (BM-).
BM-ССК и ES-ССК (человеческие мезенхимальные cтволовые клетки миллипор (произведенные из клеток hES)) высевали с плотностью 105 клеток в расчете на лунку 6-луночного планшета (Nunc) в полную среду (BM-ССК: α-MEM, 10% ФБС; ES-ССК: Millipore FibroGRO™ LS Complete Media Kit) и оставляли для адгезии в течение ночи. Клетки собирали, когда они достигали субконфлюэнтных уровней (~60% конфлюэнтности) и конфлюэнтных уровней (100% конфлюэнтности).
Результаты проточно-цитометрического анализа "классических" маркеров ССК проиллюстрировали, что BM-ССК и ES-ССК имели схожую экспрессию CD73. Экспрессия маркера CD105 оставалась одинаковой как для конфлюэнтных, так и для субконфлюэнтных культур; оказалось, что экспрессия CD105 снижалась с увеличением конфлюэнтости. Экспрессия SDC2 в BM- и ES-ССК оставалась совместимой в конфлюэнтных и субконфлюэнтных условиях культивирования; процентное содержание популяции BM-ССК, экспрессирующей SDC2, возрастает в конфлюэнтной культуре и является соответственно высоким для ES-ССК как в конфлюэнтных, так и неконфлюэнтных культурах. RFI экспрессии SDC2 ES-ССК был выше.
Следовательно, произведенные из hES стромальные стволовые клетки экспрессировали SDC2, и вследствие этого клеточные популяции, обогащенные по SDC2, могут быть получены напрямую из человеческих плюрипотентных клеток, включая клетки hES и hiPS.
Пример 9 - SDC2+ клетки в лечении вентилятор-индуцированного повреждения легких у крыс
Способы и материалы
Вся работа была одобрена Комитетом по этике по работе с животными Ирландского национального университета г. Голуэй и выполнялась по лицензии Департамента здравоохранения Ирландии.
Выделение и культивирование чССК
Человеческие ССК (hSSCs) выделяли от взрослых добровольцев, как описано ранее. После аспирации костный мозг высевали в колбы для тканевого культивирования. Прикрепившиеся клетки выращивали до 80% конфлюэнтности и затем трипсинизировали и размножали культивированием до пассажа 4, после чего их использовали для экспериментов. ССК характеризовали в соответствии с международными стандартами. Фибробласты, применяемые в качестве контрольных клеток, получали из стабильной клеточной линии, как описано ранее.
Последовательность 1 [Вентилятор-индуцированное повреждение легких]
- Взрослых самцов крыс Спрег-Доули анестезировали, оротрахеально интубировали и рандомизировали для подвергания вредоносной механической вентиляции.
- Применяли следующие установки винтилятора: Pinsp(давление на вдохе)35 cм H2O, скорость респирации 18 мин-1, и ПДКВ 0 см H2O. Когда респираторная статическая эластичность снижалась на 50%, животным позволяли восстановиться.
- После восстановления животных рандомизировали для внутривенного введения: (i) носителя (PBS, 300 мкл); (ii) фибробластов (4×106 клеток); (iii) человеческих ССК (4×106 клеток) или (iv) клеток по изобретению, обозначаемых человеческие S2+ССК (4×106 клеток); в схеме из четырех групп.
- Степень восстановления после ALI (acute lung injury, острое повреждение легких) и ответ оценивали после 24 часов.
Последовательность 2 [Вентиляция с низким вытягиванием 'протективная']
- Взрослых самцов крыс Спрег-Доули анестезировали, оротрахеально интубировали и рандомизировали для механической вентиляции с низким вытягиванием.
- Протокол 'с низким вытягиванием' содержал механическую вентиляцию в течение 90 минут со следующими установками: FiO2 (фракция О2 во вдыхаемом воздухе) 0,3, скорость респирации 80 мин-1, дыхательный объем 6 мл кг-1 и положительное давление в конце выдоха 2 см H2O.
- После восстановления животных рандомизировали для внутривенного введения: (i) носителя (PBS, 300 мкл); (ii) фибробластов (4×106 клеток); или (iii) внутритрахеально человеческих ССК (4×106клеток); в схеме из шести групп.
- Степень восстановления после ALI и воспалительный ответ оценивали после 24 часов.
Статистический анализ
Распределение всех данных проверяли на нормальность с применением критериев Колмогорова-Смирнова. Данные анализировали однопроходным ANOVA, с последующим тестом Стьюдента-Ньюмана-Кейлса или тестом Краскела-Уоллиса, с последующим U-критерием Манна-Уитни с поправкой Бонферрони для множественных сравнений, по обстоятельствам. Допущения основополагающей модели считались целесообразными на основании пригодных графиков остатков. Двустороннее p-значение <0,05 считалось значимым.
Результаты
Эффективность S2+ССК в увеличении восстановления от индуцированного вентиляцией ALI
40 животных вводили в экспериментальный протокол, с 10 распределенными в каждую из групп VILI (вентилятор-индуцированное повреждение легких). Четыре VILI животных, два, распределенных для получения носителя, и два, распределенных для получения фибробластов, не выживали в протоколе повреждения. Все другие животные выживали в протоколе повреждения и дальнейшем лечебном распределении. По 8 животных вводили в группы, контрольную с носителем и с фибробластами, в то время как 10 животных получали чССК и S2+ССК.
Характеристики исходного состояния: Не имело место различий среди VILI групп в исходном состоянии с точки зрения показателей до повреждения, продолжительности вредоносной вентиляции или степени легочного повреждения (таблица 9).
S2+ССК восстанавливали легочную функцию и структуру после VILI: терапия с S2+ССК повышала восстановление артериальной оксигенации, о чем свидетельствует редуцированный альвеолярно-артериальный кислородный градиент по сравнению с носителем (p<0,05). Дополнительное функциональное восстановление в легочной физиологии в ответ на терапию с S2+ССК продемонстрировано посредством существенных улучшений (p<0,01) в статической эластичности респираторной системы по сравнению с носителем.
S2+ССК усовершенствовали легочную микроваскулярную проницаемость, о чем свидетельствует снижение отека легкого: соотношения сухих масс и снижение концентрации белка альвеолярной жидкости (таблица 10). Повышенное чССК восстановление легочной структуры. S2+ССК снижали альвеолярное утолщение, о чем свидетельствует сниженный объем фракции альвеолярной ткани, и повышали восстановление воздушного объема пространства, о чем свидетельствует повышенный объем фракции альвеолярного воздушного пространства (таблица 10).
S2+ССК модулировали воспаление после VILI: S2+ССК снижали общие количества клеток с воспалением в BAL (бронхоальвеолярный лаваж) жидкости и существенно аттенуировали (p<0,001) накопление нейтрофилов в легких. Как S2+ССК, так и недифференцированные чССК были одинаково эффективными в модулировании воспалительного ответа после VILI (таблица 11).
Эффект на 'неповреждаемые' параметры: не было никакого эффекта S2+ССК или недифференцированных чССК на артериальные pH, PCO2, гидрокарбонат, избыток основания, лактат или среднее артериальное давление (данные не приведены).
Эффект S2+ССК на животных после вентиляции с низким вытягиванием
16 животных вводили в экспериментальный протокол, с 4 распределенными в каждую из групп. Все животные выживали в протоколе повреждения и дальнейшем распределении на лечение.
Характеристики исходного состояния: Не было никаких различий среди групп с протективной вентиляцией в исходном состоянии с точки зрения показателей перед повреждением, продолжительности вредоносной вентиляции или выработанной степени легочного повреждения (данные не приведены).
S2+ССК не воздействовали на легочную функцию или структуру: Не было никакого эффекта от терапии с S2+SSC на легочную структуру или функцию после протективной вентиляции (таблица 12).
S2+ССК не вызывали воспаление: не было никакого эффекта S2+ССК терапии на воспалительный ответ в легочной структуре после протективной вентиляции (таблица 13).
Эффект на 'неповреждаемые' параметры: Не было никакого эффекта S2+ССК или недифференцированных чССК на артериальные pH, PCO2, бикарбонат, избыток основания, лактат или среднее артериальное давление (таблица 14).
Выводы
S2+ССК по изобретению восстанавливали легочную функцию и структуру после VILI, о чем свидетельствует редуцированный альвеолярно-артериальный кислородный градиент, существенные улучшения (p<0,01) в статической эластичности респираторной системы и увеличенная легочная микроваскулярная проницаемость. Также они повышали восстановление легочной структуры после VILI. Клетки модулировали воспаление после VILI, снижая общее количество клеток с воспалением в BAL жидкости и существенно снижая (p<0,001) накопление нейтрофилов в легких. Не было никакого эффекта терапии с S2+ССК на легочную структуру или функцию или на воспалительный ответ после протективной вентиляции. Эти обнаружения предполагают, что клетки по изобретению являются хорошо переносимыми в этой модели.
Изобретение, таким образом, предоставляет способы получения определенных стромальных популяций стволовых клеток и их применения.
Реферат
Изобретение относится к области биотехнологии, а именно к получению популяции стромальных стволовых клеток из человеческого костного мозга. Способ включает выделение популяции стромальных стволовых клеток на основании экспрессии синдекана-2 из смешанной популяции стромальных клеток взрослых млекопитающих. Изобретение позволяет получить популяцию стромальных стволовых клеток. 7 з.п. ф-лы, 16 ил., 14 табл., 9 пр.

Комментарии