Материал стромальных клеток костного мозга для применения в формировании кровеносных сосудов и выработки факторов ангиогенеза и трофических факторов - RU2332223C2
Код документа: RU2332223C2
Чертежи




Описание
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к методам и композициям для применения в качестве терапевтических. Более конкретно, настоящее изобретение относится к применению терапевтической стимуляции ангиогенеза и выработке трофических факторов и факторов ангиогенеза.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Паралич (инсульт) является третьей по частоте встречаемости причиной смертности в популяции взрослого населения в Соединенных Штатах и главнейшей причиной нетрудоспособности. Паралич происходит, когда в части мозга развивается инфаркт, приводя к гибели мозговой ткани вследствие нарушения мозгового кровообращения. Инфаркты мозга, ассоциируемые с остро возникающим параличом, вызывают внезапное и драматическое неврологическое расстройство. Другие неврологические заболевания также приводят к гибели мозговой ткани и неврологическому расстройству.
Фармакологические воздействия ограничивались попытками максимизирования кровотока в поврежденной инсультом области мозга, чтобы последняя могла сохраниться, но клиническая эффективность оказалась недостаточной. Как указывается в Harrison Principles of Internal medicine (9th Ed., 1980, p.1926), "несмотря на экспериментальные данные о том, что ... (церебральные вазодилататоры) повышают мозговой кровоток, измеренный методом с оксидом азота, они оказались при тщательном анализе не обладающими преимуществом в случаях паралича у человека на этапе переходящих ишемических атак, постепенном развитии тромбоза или при развившемся параличе. Указанное верно в отношении никотиновой кислоты, Priscoline, спирта, папаверина и ингаляции 5% углекислоты. Против использования указанных методов имеется указание на то, что вазодилататоры являются более опасными, чем полезными, так как вследствие снижения системного кровяного давления они уменьшают внутричерепной анастомотический кровоток, или вследствие расширения кровеносных сосудов в неизмененной части мозга отбирают кровь из зоны инфаркта".
Кроме того, нарушения сердечно-сосудистой системы являются главной причиной заболеваемости и смертности во всем мире. Например, сердечная недостаточность увеличилась по распространенности. Сердечная недостаточность характеризуется неспособностью сердца в достаточной степени обеспечивать кровью различные органы организма. Текущая оценка показала, что более 5 миллионов американцев имеют диагноз "сердечная недостаточность", из них около 500 000 новых случаев диагностируется ежегодно и 250 000 смертей ежегодно вызвано указанным заболеванием. Несмотря на значительные терапевтические достижения за последние двадцать лет, случаи сердечной недостаточности продолжают расти, достигая эпидемических отметок и представляя наибольшее бремя на экономику в развитых странах.
Сердечная недостаточность является клиническим синдромом, отличающимся характерными симптомами и признаками, возникающими в результате нарушений сердечного выброса или повышенного венозного давления. Более того, сердечная недостаточность является прогрессирующим нарушением, вследствие которого функция сердца продолжает ухудшаться со временем, несмотря на отсутствие неблагоприятных событий. Вследствие сердечной недостаточности происходят неадекватные показатели сердечного выброса.
В основном, имеется два типа сердечной недостаточности. Правосторонней сердечной недостаточностью является неспособность правых отделов сердца прокачивать венозную кровь по легочному кругу кровообращения. Замедление оттока крови в организме проявляется отеком и опуханием. Левосторонней сердечной недостаточностью является неспособность левых отделов сердца прокачивать кровь по системной циркуляции. Замедление оттока из левого желудочка проявляется застоем жидкости в легких.
Основным проявлением сердечной недостаточности является застой жидкости. Если сердце менее эффективно как насос, организм пытается компенсировать это, например, выбросом гормонов и сигналами нервной системы для повышения объема циркулирующей крови.
Сердечная недостаточность имеет ряд причин. Например, нарушения ткани сердца приводят к гибели клеток миокарда, которые больше не функционируют. Прогрессирование левожелудочковой недостаточности частично отнесено за счет происходящей потери кардиомиоцитов.
Имеется ряд методов лечения и профилактики сердечной недостаточности. Например, стволовые клетки используются для регенерации кардиальных клеток при острой ишемии сердца и/или инфаркте или повреждениях в моделях на животных. В одном из конкретных примеров, жизнеспособные стромальные клетки костного мозга, взятые от донорских костей голени, были культивированы, обогащены, помечены и затем инъецированы в миокард изогенной взрослой крысы-реципиента. После удаления сердец через 4 дня - 12 недель после имплантации, места имплантации обследовали и обнаружили, что имплантированные стромальные клетки обнаруживают потенциал роста в среде миокарда (Wang et al.)
Как было показано, кардиомиоциты дифференцируют in vitro из плюрпотентных эмбриональных стволовых (ES) клеток линии D3 через эмбриоподобные аггрегаты (эмбриональные тельца). Эти клетки были охарактеризованы с помощью метода фиксации потенциала цельной клетки, морфологии и сходства генной экспрессии на протяжении всего периода дифференциации (Maltsev et al., 1994). Дополнительно, плюрипотентные ES клетки мышей были способны дифференцироваться в кардиомиоциты, проявляющие главные признаки клеток млекопитающих (Maltsev et al., 1993).
Стволовые клетки, независимо от их происхождения (эмбриональные клетки, клетки костного мозга, скелетной мускулатуры и т.п.), имеют потенциал дифференцировки в различные, если не во все, типы клеток организма. Стволовые клетки способны дифференцироваться в функциональные кардиальные миоциты. Таким образом, разработка лечения для сердечной недостаточности, основанного на стволовых клетках, имеет много преимуществ перед существующими способами лечения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В изобретении предлагается терапевтическое средство для применения в индукции ангиогенеза и васкулогенеза. Терапевтическое средство может включать индуцирующие ангиогенез и васкулогенез факторы, изолированные из стволовых клеток, в сочетании с фармацевтически приемлемым клеточным терапевтическим средством для индукции ангиогенеза и васкулогенеза. Также представлен метод усиления продукции ангиогенез- и васкулогенез-индуцирующих факторов, секретируемых посредством экспонирования и совместного культивирования стромальных клеток с соединением для увеличения продукции факторов, индуцирующих ангиогенез и васкулогенез. Также представлены факторы, индуцирующие ангиогенез и васкулогенез, изолированные и очищенные из стволовых клеток, для применения в терапии. В данном патенте представлен процесс получения факторов, индуцирующих ангиогенез и васкулогенез, указанных выше, включающий этапы изолирования и очистки мезенхимальных стволовых клеток человека из ткани до дифференции и затем размножения в культуре мезенхимальных стволовых клеток для производства средства для неврологической терапии и терапии скелетной мускулатуры. Изолированные и размноженные в культуре мезенхимальные стволовые клетки под воздействием необходимого соединения, способные к дифференциации и продукции желаемого клеточного фенотипа, необходимого для восстановления ткани, также предлагаются.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Дальнейшие преимущества настоящего изобретения легче оценить по мере того, как тоже самое становится более понятным с помощью следующего детального описания при рассмотрении в связи с сопровождающими чертежами, где
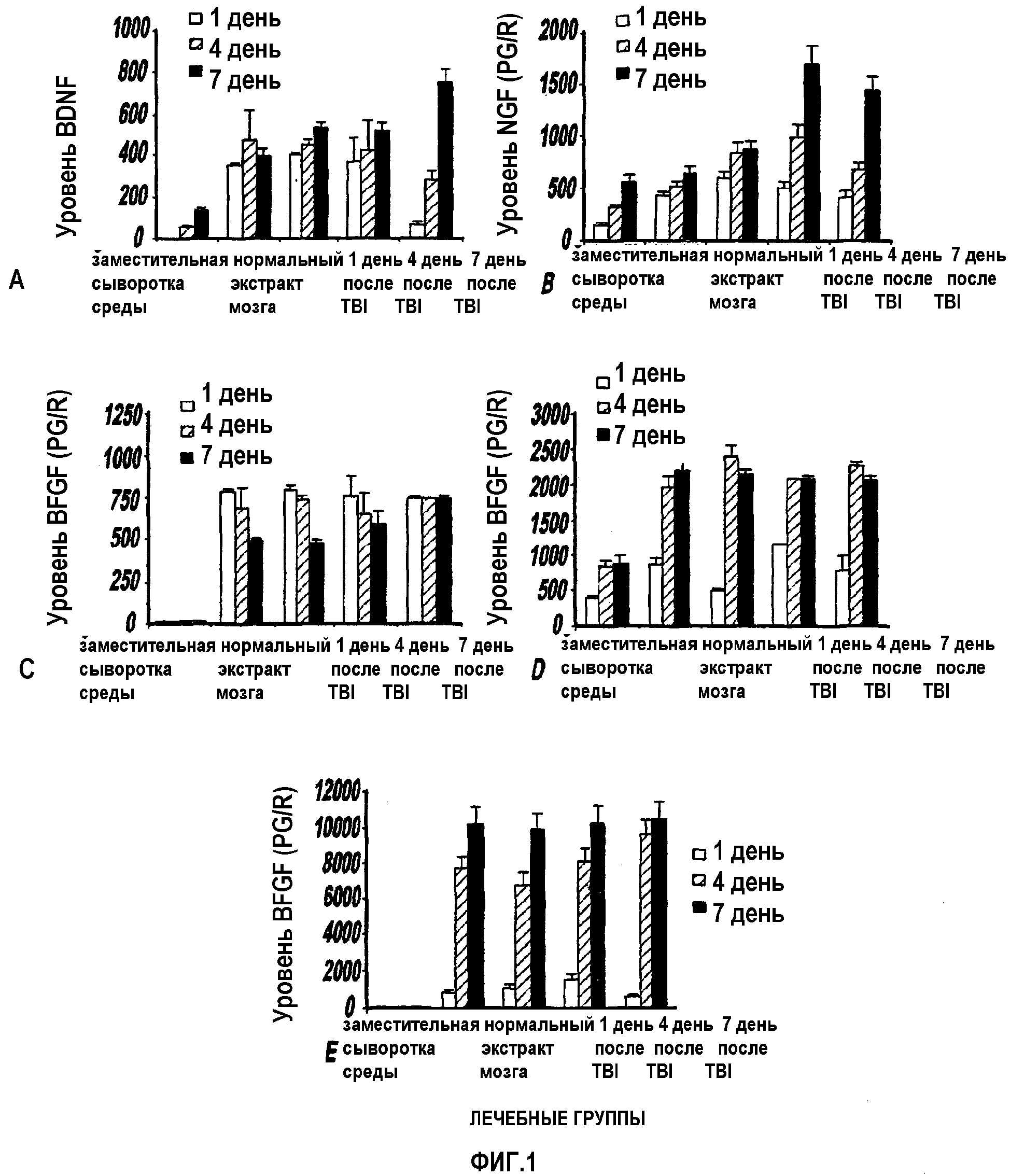
Фигуры 1 от А до Е представляют фотографии, отображающие секрецию фактора роста BDNF (Фиг.1А), NGF (Фигура 1B), bFGF (Фигура 1C), VEGF (Фигура 1D)и HGF (Фигура 1E);
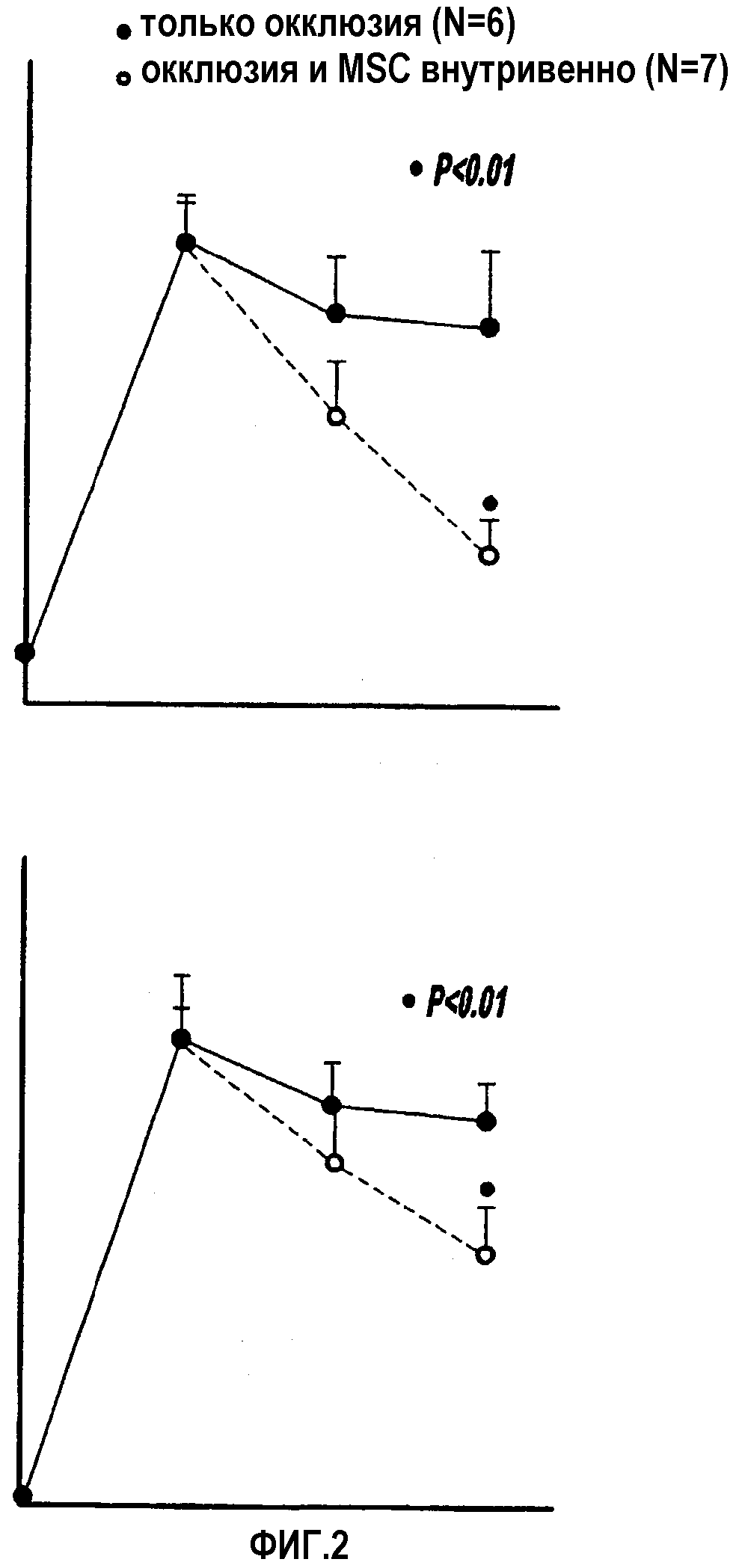
Фигуры 2А и В представляют графики, отражающие результаты поведенческих функциональных тестов у крыс до и после окклюзии срединной артерии мозга и обработки интравенозными MSC или без обработки;
Фигуры 3А и В представляют фотографии, отражающие применение модели неоваскуляризации роговицы крыс для определения того, индуцирует ли MSC-секреция ангиогенез in vivo, фигура 3А отражает симулированно оперированную роговицу без признаков неоваскуляризации, а Фиг.3В отображает MSC-супернатант, размещенный в коллагеновой облатке, вставленный в роговичный карман, где очевидна неоваскуляризация здоровой роговицы;
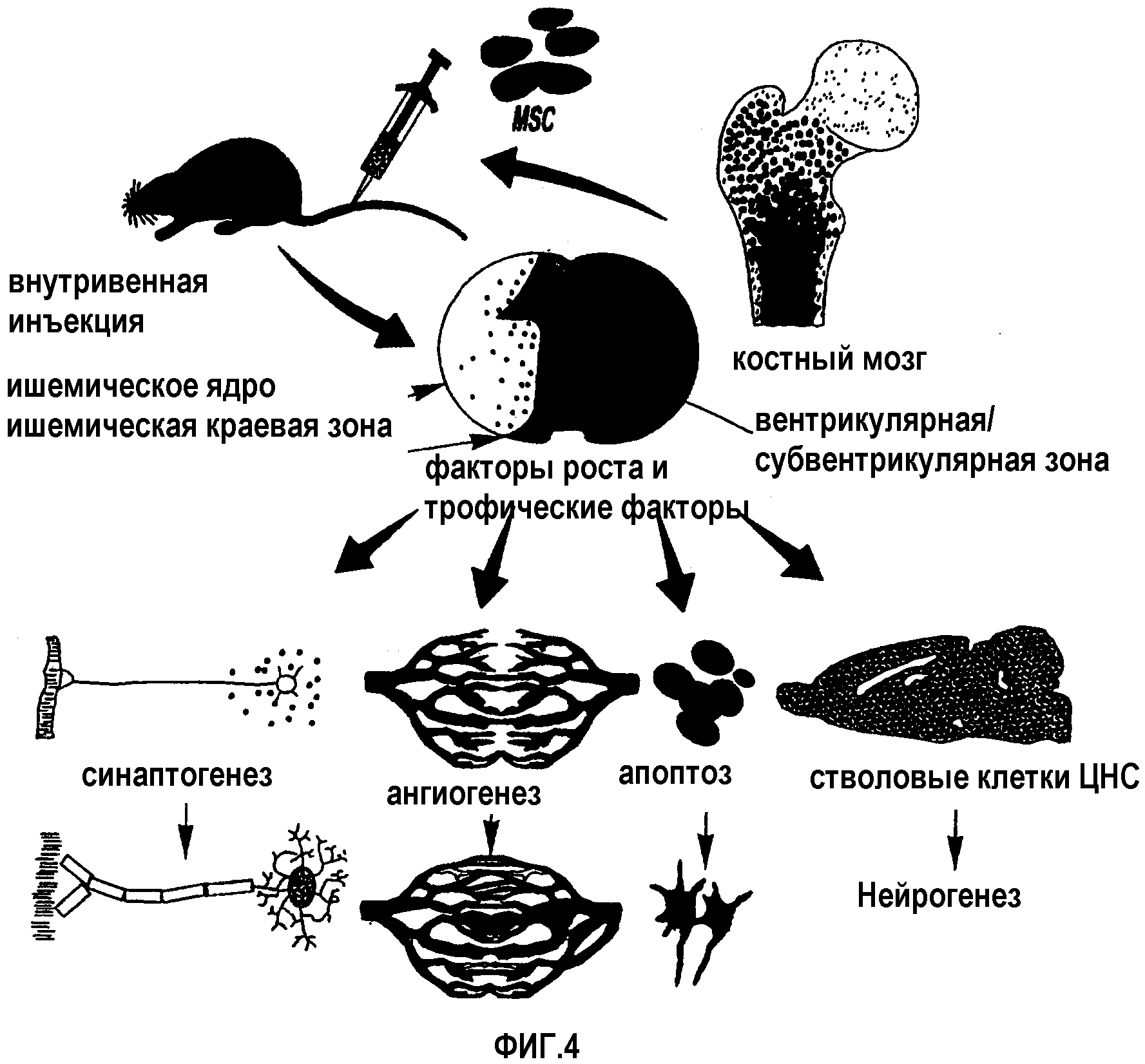
Фигура 4 представляет иллюстрацию экспериментов, выполненных для поддержки настоящего изобретения, где костный мозг экстрагируют из животного и MSC сепарируют и культивируют в трех-пяти пассажах, MSC инъецируют животному с нервным повреждением и клетки избирательно мигрируют в поврежденную ткань и локализируются в пограничной зоне повреждения, MSC затем активируют ряд восстановительных событий, опосредованных MSC, паренхимоклеточной секрецией и факторами роста и трофическими факторами, улучшая, таким образом, неврологическую функцию;
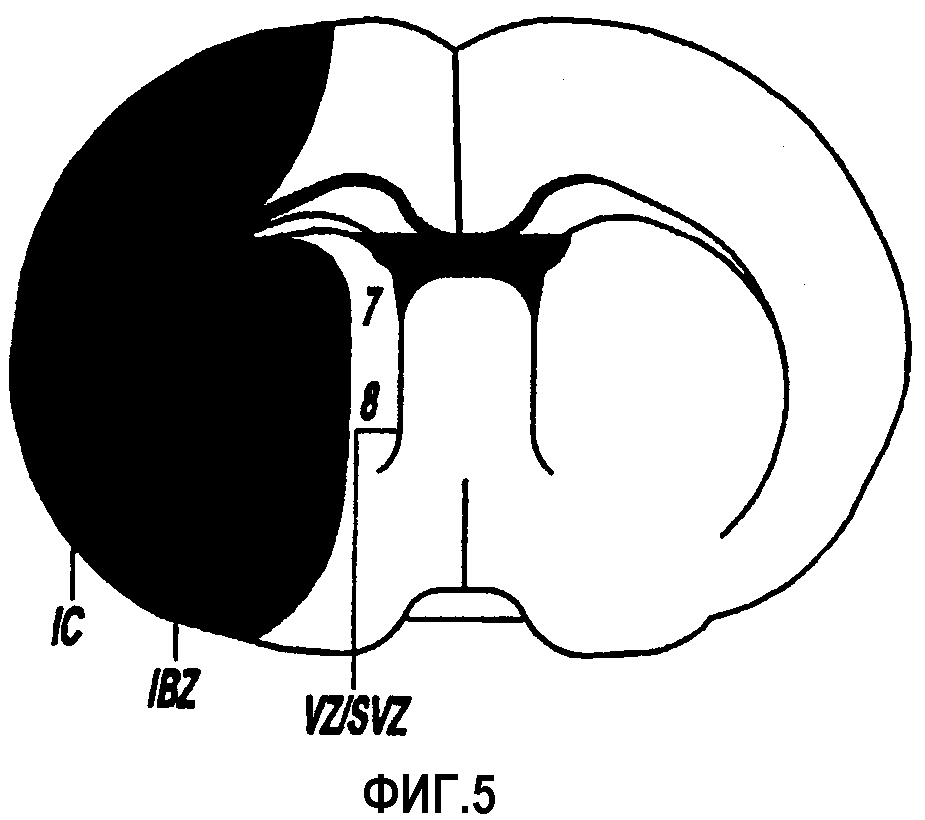
Фигура 5 отражает стандартный коронарный срез, идентифицированных на уровне внутренней комиссуры в головном мозге крысы, которая разделяет правое полушарие на три субрегиона и восемь полей;
Фигуры 6А и В представляют графики, отражающие результаты поведенческого функционального теста до и после окклюзии средней церебральной артерии;
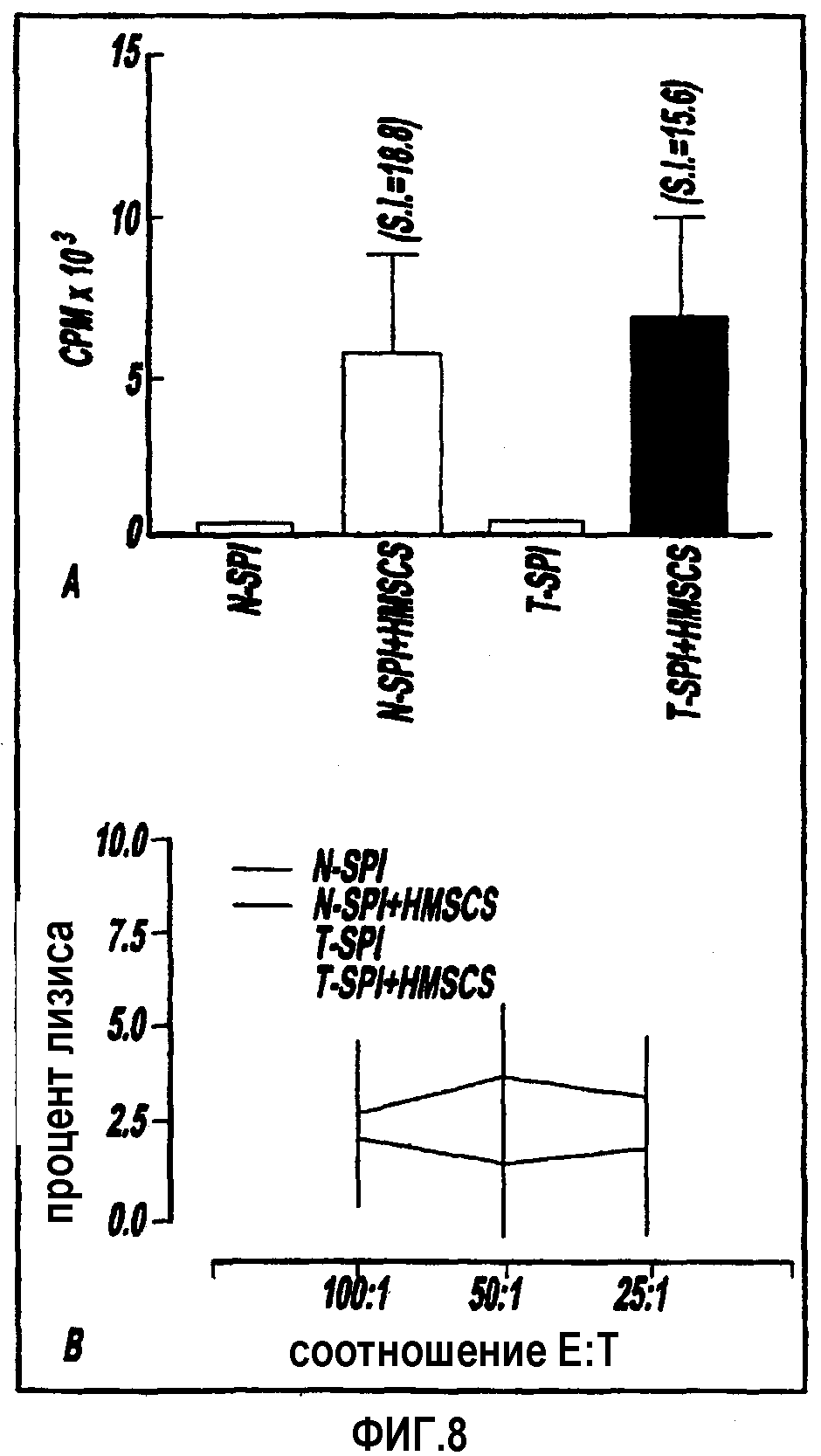
Фигуры 8А и В представляют графики, отражающие смешанную лимфоцитарную реакцию между клетками селезенки крысы и hMSC; и
Фигура 9 является микрофотографией, отражающей морфологические характеристики экзогенных стромальных клеток костного мозга человека (hMSC) и эндогенных клеток головного мозга в головном мозге крысы.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В общих чертах, в настоящем изобретении предлагаются для применения факторы индукции ангиогенеза и васкулогенеза из стромальных клеток костного мозга или других стволовых клеток в качестве составной части клеточной терапии для индукции ангиогенеза и васкулогенеза. Более конкретно, в настоящем изобретении предлагается метод усиления продукции факторов, индуцирующих ангиогенез и васкулогенез (например, ангиогенных, трофических факторов и факторов роста), вырабатываемых стромальными или другими стволовыми клетками, для использования в терапии, факторов, индуцирующих ангиогенез или других благоприятствующих росту при введении. Указанное увеличение происходит при экспозиции и совместном культурировании клеток с экстрактом головного мозга и/или с кальцием.
Термин "ангиогенез" определяется как процесс тканевой васкуляризации, включающий рост новых и/или развитие новых кровеносных сосудов в тканях, и также называется нео-васкуляризацией. Процесс опосредован инфильтрацией эндотелиальных клеток и гладкомышечных клеток. Процесс может происходить по одному из трех путей: сосуды могут прорастать из существующих ранее сосудов, образование сосудов de-novo может происходить из клеток-предшественников (васкулогенез), и/или существующие мелкие сосуды могут расширяться в диаметре.
Термины "повышать" или "повышение", используемые здесь, включают, но не ограничены указанным, обогащение путем добавления или увеличения определенного желаемого количества или качества субстанции.
Фраза "экстракт мозга", используемая здесь, означает, но не ограничивается указанным, клетки мозга или другие аналогичные клетки, полученные из мозга. Указанные клетки могут также быть культивированы с веществом, и надосадочная жидкость может быть использована в качестве экстракта мозга.
Термин "повреждение", используемый здесь, включает, но не ограничен указанным, физические или биологические повреждения, включая генетические нарушения, заболевания и обусловленные возрастом нарушения. Например, пациенты страдают неврологическими и функциональными недостатками после инфаркта, повреждений ЦНС и нейродегенеративных заболеваний.
Термин "клеточная терапия", используемый здесь, включает, но не ограничен указанным, терапевтическое использование стволовых клеток, стволовая клетка представляет собой общую материнскую клетку, потомки которой превращаются в различные типы клеток. Стволовые клетки имеют различное происхождение, включая, но не ограничиваясь указанным, эмбриональное происхождение, из костного мозга, печени, стромальное происхождение из жировой ткани и другие происхождения, известные квалифицированным в данной области специалистам. Эти стволовые клетки могут быть помещены в желаемые области, когда они имеют природное происхождение или могут быть сконструированы любым способом, известным специалистам в данной области техники. Таким образом, посредством различных методов генной инженерии, включающих, но не ограниченных указанным, трансфекции, делеции и т.п., стволовые клетки могут быть сконструированы для увеличения вероятности их выживаемости или для других желаемых целей.
Стволовые клетки способны к саморегенерации в случае предоставления субъекту-человеку in vivo и способны превратиться в ограниченные по дифференцировке клетки-предшественники, которые в дальнейшем дифференцируются и развиваются по специфическим линиям. Обозначенные здесь как "стволовые клетки" имеют отношение к стромальным клеткам человека и не относятся к стволовым клеткам других клеточных типов. Предпочтительно, термин "стромальные клетки" относится к стромальным клеткам костного мозга человека.
Термин "стволовые клетки" или "плюрипотентные" стволовые клетки используется взаимозаменяемо и означает стволовые клетки, имеющие (1) способность давать потомство во все определенные гемопоэтические линии, и (2) стволовые клетки, способные к полному восстановлению у хозяина в значительной степени ослабленных иммунитетом кровяных клеточных типов и их прародителей, включающих плюрипотентные гемопоэтические стволовые клетки, посредством самообновления.
Костный мозг является мягкой тканью, занимающей мозговые полости длинных костей, некоторые каналы остеона и пространства между трабекулами в губчатом веществе костей. Костный мозг представлен двумя типами: красный, который располагается во всех костях в раннем возрасте и в ограниченных локализациях во взрослом возрасте (т.е. в губчатом веществе костей) и связан с продукцией кровяных телец (т.е. гемопоэзом) и гемоглобина (поэтому красного цвета); и желтый, обширно представленный жировыми клетками (поэтому желтого цвета) и соединительной тканью.
В целом, костный мозг является комплексной тканью, включающей гемопоэтические стволовые клетки, красные и белые кровяные тельца и их предшественники, мезенхимальные стволовые клетки, стромальные клетки и их предшественники и группы клеток, включающие фибробласты, ретикулоциты, адипоциты и эндотелиальные клетки, формирующие соединительную сетчатую ткань, называемую "строма". Клетки стромы морфологически регулируют дифференциацию гемопоэтических стволовых клеток посредством прямого взаимодействия через белки клеточной поверхности и секрецию факторов роста и вовлечены в образование фундамента и поддержку костной структуры.
Исследования, использующие модели на животных, предполагают, что костный мозг содержит "пре-стромальные" клетки, имеющие способность к дифференцировке в хрящевые, костные и другие соединительно-тканные клетки (Beresford, J.N.: Osteogenic Stem Cells and the Stromal System of Bone and Marrow, Clin. Orthop., 240:270, 1989). Последние данные показывают, что указанные клетки, называемые плюрипотентными стромальными стволовыми клетками или мезенхимальными стволовыми клетками, при активации имеют способность к дифференцировке в несколько различных типов клеточных линий (т.е. остеоциты, хондроциты, адипоциты и т.п.). Однако мезенхимальные стволовые клетки представлены в тканях в весьма ничтожных количествах в сравнении с широким спектром других клеток (т.е. эритроцитов, тромбоцитов, нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов, адипоцитов и т.п.) и обратно пропорционально возрасту, они способны к дифференцировке в составляющие соединительных тканей в зависимости от воздействия ряда биологически активных факторов.
Целью настоящего изобретения является использование стромальных клеток костного мозга, надосадочной жидкости стромальных клеток костного мозга или результата секреции вследствие взаимодействия стромальных клеток костного мозга и других стволовых клеток для лечения заболеваний. Эта секреция включает, но не ограничивается указанным, совокупность факторов роста, трофических факторов и факторов ангиогенеза. Метод настоящего изобретения способствует улучшению результата по восстановлению нейронного повреждения или других повреждений, посредством увеличения эффектов лечения, например ангиогенеза и увеличения роста сосудов, формирующихся из не существовавших и существовавших сосудистых сетей. Настоящее изобретение может также применяться для обеспечения средств усиления компенсаторного механизма мозга для улучшения функции после повреждений ЦНС или дегенерации. Дополнительно, методы и композиции настоящего изобретения могут увеличить эффективность клеточной терапии.
Обогащение и/или репопуляция поврежденных клеток посредством трансплантированных стволовых клеток, которые дифференцируются в поврежденные клетки, усиливает функцию. Например, если терапия применяется в лечении заболеваний сердца, может увеличиваться число сократительных единиц (клеток) сердца. Увеличение сократительных единиц улучшает функцию сердца. Дополнительно, стволовые клетки также могут быть ответственны за высвобождение различных веществ, таких как трофические факторы. Так, например, высвобождение трофических факторов индуцирует ангиогенез (увеличивает число кровеносных сосудов) с целью улучшения сердечной функции и/или лечения сердечной недостаточности. Следовательно, стволовые клетки воздействуют на улучшение функции сердца и/или лечат сердечную недостаточность посредством различных механизмов, а не просто дифференцируются в функциональные клетки сердечной мускулатуры.
Продукция трофических факторов, факторов роста и факторов ангиогенеза обычно является требующим больших затрат и сложным процессом. Метод и композиция настоящего изобретения представляют недорогой и простой метод продукции чистых трофических факторов, факторов роста и других родственных факторов просто путем назначения лечения по настоящему изобретению. Указанные факторы могут применяться для лечения пациентов. Например, факторы могут использоваться для индукции ангиогенеза, васкулогенеза и для усиления функции и восстановления тканей как in vivo, так и in vitro. Вследствие этого целесообразно определить, какие стромальные клетки костного мозга могут быть использованы в качестве клеточных факторов для продуцирования и секреции трофических факторов, факторов роста, и факторов ангиогенеза. Указанные факторы могут включать, но не ограничены указанным: VEGF, HGF, BDNF, NGF, bFGF и т.п. Методы настоящего изобретения дают возможность управлять продукцией указанных факторов посредством культуральных условий. Например, культуральные условия могут управляться посредством совместного культурирования клеток с тканью и/или различными концентрациями кальция в среде для культивирования.
Настоящее изобретение основывается на использовании клеточной терапии для лечения заболевания. Несмотря на то, что стволовые клетки имеют различное происхождение (эмбриональные, костного мозга, печени, жировой ткани и т.п.), их важной общей характеристикой является то, что они имеют потенциал дифференцировки в различные, но не во все, клеточные типы организма. Как упомянуто ранее, стволовые клетки показали способность дифференцировки в клетки сердечной мускулатуры (Maltsev et al., 1993-1994).
Авторы настоящей заявки разработали процесс изолирования и очистки мезенхимальных стволовых клеток человека из тканей, до дифференцировки, и затем культурального размножения мезенхимальных стволовых клеток с получением ценного инструмента для неврологической терапии и терапии скелетной мускулатуры. Целью такого рода приема является значительное увеличение количества мезенхимальных стволовых клеток и использование указанных клеток для переадресации и/или усиления нормальной репаративной способности организма. Мезенхимальные стволовые клетки получают в большом количестве и применяют в областях тканевого повреждения для увеличения или стимуляции роста in vivo для регенерации и/или восстановления, для улучшения адгезии имплантанта в различных протезных приспособлениях посредством последовательной активации и дифференциации, увеличения продукции клеток гемопоэза и т.п.
Авторами настоящего изобретения предусмотрены различные методики для переноса, иммобилизации и активации размноженных в культуре, очищенных мезенхимальных стволовых клеток в области восстановления, имплантации и т.п., включая инъецирование клеток в область скелетного дефекта, инкубацию клеток с протезом и имплантирование протеза и т.п. Таким образом, посредством изоляции, очистки и значительного увеличения количества клеток до дифференцировки и затем активного контроля процесса дифференциации посредством их расположения в области тканевого повреждения или посредством предварительной обработки in vitro перед их трансплантацией, размноженные в культуре, недифференцированные мезенхимальные стволовые клетки могут быть использованы для различных терапевтических целей, таких как выявление клеточных, молекулярных и генетических нарушений в широком ряде неврологических заболеваний, нервных повреждений, метаболических костных нарушений, скелетных дисплазий, хрящевых дефектов, повреждений связок и сухожилий и других нарушений скелетной мускулатуры и соединительной ткани.
Различные процедуры предполагаются авторами настоящего изобретения для переноса, иммобилизации и активации мезенхимальных стволовых клеток или клеток-предшественников в месте восстановления, имплантации и т.п. посредством применения различных пористых керамических носителей, включая инъекцию клеток в место повреждения.
Мезенхимальные стволовые клетки человека могут быть получены из ряда различных источников, включая костные пломбы из губчатого вещества головки бедренной кости, полученные от пациентов с дегенеративными заболеваниями суставов во время заместительной хирургии таза или бедра или посредством аспирации костного мозга, полученного от нормального донора и онкологических пациентов, имеющих собранный для будущей трансплантации костный мозг. Несмотря на то, что собранный костный мозг был приготовлен для клеточной культуральной сепарации посредством ряда различных механических изолирующих процессов, зависящих от источника подобранного костного мозга (т.е. наличия костных осколков, периферической крови и т.п.), критический шаг включал процессы изоляции с использованием специально приготовленных сред, содержащих агенты, допускавшие не только рост мезенхимальных стволовых клеток без дифференциации, но и прямую адгезию только мезенхимальных стволовых клеток на пластиковые или стеклянные поверхности чашки для культивирования. Благодаря получению среды, дающей возможность для селективного присоединения желаемых мезенхимальных стволовых клеток, представленных в образцах костного мозга в ничтожных количествах, стало возможным отделить мезенхимальные стволовые клетки от других клеток (например, красных и белых кровяных телец, других дифференцированных мезенхимальных клеток и т.п.), представленных в костном мозге.
Как указано выше, полная культуральная среда может быть использована в ряде различных изолирующих процессов, зависимых от специфического типа первоначальных процессов сбора, применяемых для подготовки полученного костного мозга для клеточной культуральной сепарации. Если используется пломба из губчатого вещества костного мозга, костный мозг добавляли в полную среду и встряхивали до дисперсной формы, которую затем центрифугировали для отделения клеток мозга от костных фрагментов и т.п. Клетки костного мозга (состоящие преимущественно из красных и белых клеток крови и очень незначительного количества мезенхимальных клеток и т.п.) далее диссоциировали на отдельные клетки путем пассирования полной среды, содержащей клетки костного мозга, через шприцы с иглами серий из 16, 18 и 20. Принято считать, что преимущества, полученные благодаря использованию механических процессов сепарации, в противоположность некоторым энзиматическим процессам сепарации, заключались в том, что механические процессы производят небольшие клеточные изменения, в то время как энзиматические процессы могут производить клеточные повреждения, в особенности в сайтах связывания белка, необходимых для культуральной адгезии и селективной сепарации, и/или в сайтах белка, необходимых для продукции моноклональных антител, специфичных для указанных мезенхимальных стволовых клеток. Моноклональную клеточную суспензию (изготовленную из приблизительно 50-100×106 ядерных клеток) затем последовательно размещали в 100-мм чашках для целей селективного сепарирования и/или изоляции мезенхимальных стволовых клеток от остальных клеток, находящихся в суспензии.
Если аспирированный костный мозг использовался в качестве источника мезенхимальных стволовых клеток человека, клетки костного мозга (содержащие мало или не содержащие костных фрагментов, но множество крови) были добавлены в полную среду и фракционированы с помощью градиентов Перколла (Sigma, St. Louis, Mo.), подробно описанных ниже. Градиенты Перколла отделяли большой процент эритроцитов и мононуклеарных гемопоэтических клеток от низкоплотной тромбоцитарной фракции, которая содержит происходящие из костного мозга мезенхимальные стволовые клетки. Тромбоцитарная фракция, содержащая приблизительно 30-50×106 клеток, состояла из неопределенного количества тромбоцитов, 30-50× 106 ядерных клеток и только приблизительно 50-500 мезенхимальных стволовых клеток, в зависимости от возраста донора костного мозга. Низкоплотные фракции тромбоцитов затем были размещены в чашки Петри для селективной сепарации, основанной на клеточной адгезии.
Клетки костного мозга, полученные или из губчатого вещества костей, или из аспирата подвздошной кости (т.е. первичные культуры), выращивали в полной культуральной среде и им предоставляли возможность адгезироваться на поверхности чашек Петри от одного до семи дней в соответствии с условиями, установленными ниже. Поскольку после третьего дня прекращалось увеличение клеточного прикрепления, три дня были выбраны в качестве стандартной продолжительности времени, в течение которого неадгезировавшие клетки удалялись из культуры путем замещения первоначальной полной культуральной среды свежей полной средой. Последующие замещения среды выполнялись через каждые четыре дня до достижения культуральными чашками конфлюентности, что обычно требовало 14-21 день. Это приводило к 103-104-кратному увеличению количества недифференцированных мезенхимальных стволовых клеток человека.
Клетки затем были отделены от культуральных чашек, используя высвобождающие агенты, такие как трипсин с EDTA (этилендиаминтетрауксусная кислота) (0,25% трипсина, 1 мМ EDTA (1х), Gibco, Grand Island, N.Y.) или хелатный агент, такой как EGTA (этиленгликоль-бис-(2-аминоэтиловый эфир) N,N'- тетрауксусная кислота, Sigma Chemical Co., St. Louis, Mo.) Преимущество использования хелатных агентов перед триписином заключалось в том, что трипсин может, вероятно, отщепить ряд связывающих белков мезенхимальных стволовых клеток. Поскольку указанные связывающие протеины содержат сайты узнавания, при намерении получить моноклональные антитела хелатные агенты, такие как EGTA, в противоположность трипсину, использовали в качестве высвобождающего агента. Высвобождающий агент затем инактивировали и открепленные культурированные недифференцированные мезенхимальные стволовые клетки отмывали полной культуральной средой для дальнейшего применения.
При определенных условиях выращенные в культуре мезенхимальные стволовые клетки имеют способность к дифференцировке в кость при инкубации в качестве трансплантанта в пористые керамические изделия с фосфатом кальция. Хотя внутренние факторы, влияющие на дифференциацию мезенхимальных стволовых клеток в кости, в противоположность хрящевым клеткам, хорошо не изученным, по-видимому, прямая доступность мезенхимальных стволовых клеток для факторов роста и питательных факторов, подставляемых сосудистой сетью в пористую керамику с фосфатом кальция, в противоположность камере диффузии, влияло на дифференциацию мезенхимальных стволовых клеток в кости. Кроме того, экстракт головного мозга приводит стволовые клетки к выработке дополнительных трофических факторов, увеличивая эффект стволовых клеток.
В результате, изолированные и культурально размноженные мезенхимальные стволовые клетки могут быть использованы при определенных специфических условиях и/или под воздействием определенных факторов, с целью дифференцировки и выработки желаемых клеточных фенотипов, необходимых для восстановления тканей.
Введение единичной дозы мезенхимальных стволовых клеток может быть эффективным для снижения или устранения Т-клеточного ответа на ткань, аллогенную по отношению Т-клеткам, или к "не своим" тканям, в частности в случае, когда Т-лимфоциты сохраняют свой неответный характер (то есть толерантность или анергию) к аллогенным клеткам после сепарирования от мезенхимальных стволовых клеток.
Основной метод трансплантации стволовых клеток с экстрактом головного мозга в миокард осуществляется путем следующие процедуры. Стволовые клетки и экстракт головного мозга вводятся пациенту. Введение может быть подкожным, парентеральным, включая внутривенное, внутриартериальное, внутримышечное, интраперитонеальное и интраназальное введение наряду с интратекальными и инфузионными техниками.
Дозирование мезенхимальных стволовых клеток варьируется в широких пределах и соответствует индивидуальным требованиям в каждом конкретном случае. Как правило, в случае парентерального введения, традиционно следует вводить от около 0,01 до около 5 миллионов клеток на килограмм веса тела реципиента. Количество используемых клеток будет зависеть от веса и состояния реципиента, количества или частоты введений и других переменных, известных специалистам в данной области техники. Мезенхимальные стволовые клетки могут быть введены путем, который является подходящим для трансплантируемых клеток, ткани, органа. Они могут быть введены системно, т.е. парентерально, посредством внутривенной инъекции или могут быть нацелены на конкретный орган или ткань, такую как костный мозг. Мезенхимальные стволовые клетки человека могут быть введены путем подкожной имплантации клеток или путем инъекции стволовых клеток в соединительную ткань, например в мышцу.
Клетки могут быть суспендированы в подходящем растворителе, в концентрации от около 0,01 до около 5×106 клеток/мл. Приемлемыми наполнителями для инъекционных растворов являются такие, которые биологически и физиологически совместимы с клетками и реципиентом, такие как забуференный солевой раствор или другие приемлемые наполнители. Композиции для введения должны быть сформулированы, произведены и храниться в соответствии со стандартными методами, удовлетворяющими требования стерильности и стабильности.
Хотя изобретение не ограничивается указанным, мезенхимальные стволовые клетки могут быть изолированы, предпочтительно из костного мозга, очищены и выращены в культуре, т.е. in vitro, для получения достаточного количества клеток для применения в описанных в настоящем изобретении методах. Мезенхимальные стволовые клетки, формирующие плюрипотентный бласт клеток в костях, в норме представлены как очень редко встречающиеся в костном мозге (1:100000) и в других мезенхимальных тканях. См. Caplan and Haynesworth, патент США № 5486359. Генная трансдукция мезенхимальных стволовых клеток описывается в Gerson et.al., патент США № 5591625.
Если не указано особо, генетические манипуляции выполняют, как описано в Sambrook and Maniats, MOLECULAR CLONING: A LABORATORY MANUAL, 2nd. Ed.; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989).
Настоящее изобретение значимо, так как стало очевидно, что один из механизмов ухудшения функции при сердечной недостаточности или какой-либо другой этиологии, частично обусловлен постоянной гибелью клеток сердечной мышцы (Sabbah, 2000). Решение этой проблемы заключается в обогащении и/или репопуляции миокарда новыми клетками сердца, которые занимают место утраченных клеток или обеспечивают дополнительное усиление функционирующих в данное время кардиальных клеток, улучшая тем самым насосную функцию ослабленного сердца.
Настоящее изобретение превосходит все существующие в настоящее время методы лечения вследствие неизвестности побочных эффектов и относительной неинвазивности лечения. Например, лечение сердечной недостаточности в настоящее время преимущественно основано на использовании лекарственных средств, которые взаимодействуют с нейрогуморальными системами. Дополнительно, существует хирургическое лечение, включающее трансплантацию сердца, а также использование вентрикулярных или бивентрикулярных вспомогательных устройств. Преимущества, открываемые настоящим изобретением, предоставляют возможность лечить сердечную недостаточность, непосредственно обращаясь к первопричине заболевания, а именно потери сократительных единиц. Поэтому репопуляция миокарда стволовыми клетками, которые дифференцируются в сократительные единицы, которые вносят свой вклад в целостную функцию ослабленного сердца, является новым методом и проникает в суть проблемы. Другие преимущества включают отсутствие побочных эффектов, часто связанных с использованием фармакологической терапии, отсутствие иммунного отторжения, которое является "чумой" трансплантации сердца или трансплантации других органов, и способность увеличить трофические факторы, вырабатываемые стволовыми клетками.
Настоящее изобретение имеет потенциал к замещению многих существующих в настоящее время хирургических методов лечения и возможно даже фармакологическую терапию. Устройства, существующие в настоящее время, позволяют доставлять стволовые клетки в сочетании с экстрактом головного мозга в ослабленное сердце, используя подходы, базирующиеся на катетеризации, устраняя, таким образом, необходимость в хирургии на открытой грудной полости. Дополнительно, настоящее изобретение применимо как в лечении людей, так и в ветеринарии.
Метод и композиция настоящего изобретения представлены в качестве примеров во включенных в данное описание примерах. Примеры осуществления изобретения, раскрытые здесь, не являются исчерпывающими и могут включать другие приемлемые разработки, варьирующие в дизайне и методологиях, известных специалистам в данной области техники. В своей основе различные разработки, методы, структуры и материалы, известные специалистам в данной области техники, могут быть использованы без отклонений от характера настоящего изобретения.
ПРИМЕРЫ
МЕТОДЫ:
Основные методы в молекулярной биологии: в основном следовали стандартным молекулярно-биологическим способам, известным из данной области техники и не описанным конкретно, таким как способы, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (1989, и в Ausubel et al., Current Protocol in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1989) и в Perbal, A Practical Guide to Molecular Cloning, John Willey & Sons, New York (1988) и в Watson et.al., Recombinant DNA, Scientific American Books, New York и в Birren et al (eds) Genome Analysis: A Laboratory Manual Series, Vols.1-4 Gold Spring Harbor Laboratory Press, New York (1998), и методологии, представленной в патентах США №№ 4666828; 4683202; 4801531; 5192659 и 5272057, включенных в данное описание посредством ссылки. Полимеразная цепная реакция (ПЦР) проводилась обычно, как описано в PCR Protocols: A Guide To Methods And Applications, Academic Press, San Diego, CA (1990). In-situ (внутриклеточная) ПЦР в комбинации с проточной цитометрией может применяться для распознавания клеток, содержащих специфические и последовательности ДНК и мРНК (Testoni et al, 1996, Blood 87:3822)
Основные методы в иммунологии: в основном следовали стандартным методам в иммунологии, известным из данной области техники и не описанным конкретно, таким как методы, описанные в Sites et al. (eds), Basic and Clinical Immunology (8th Edition), Appleton & Lange, Norwalk, CT (1994) и Mishell and Shiigi (eds), Selected Method in Cellular immunology, W.H. Freeman and Co., New York (1980).
Доставка терапевтических средств
Клетки по настоящему изобретению вводятся и дозируются в соответствии с хорошо известной медицинской практикой, принимая во внимание клинические условия индивидуального патента, место и метод введения, график введений, возраст пациента, пол, вес тела и другие факторы, известные медицинским практикам. Таким образом, фармацевтически "эффективное количество" для указанных здесь целей определяется по таким соображениям, которые известны в данной области техники. Указанное количество должно быть эффективным для достижения улучшения, включая, но не ограничиваясь указанным, улучшенный показатель выживаемости или более быстрое выздоровление к норме или улучшение или устранение симптомов и других показателей, выбранных в качестве адекватных измерений, известных специалистам в данной области техники.
В методе настоящего изобретения, клетки по настоящему изобретению могут быть введены различными путями. Следует отметить, что они могут быть введены в виде клеток или в виде фармацевтически приемлемой соли и могут быть введены отдельно или в качестве активного ингредиента в сочетании с фармацевтически приемлемыми носителями, разбавителями и адъювантами. Клетки могут быть введены перорально, подкожно или парентерально, включая внутривенное, внутриартериальное, внутримышечное, внутрибрюшинное и интраназальное введение, а также интратекальные и инфузионные способы. Также используются имплантаты клеток. Пациент, подвергаемый лечению, представляет собой теплокровное животное и, в частности, млекопитающее, включая человека. Фармацевтически приемлемые носители, растворители, адъюванты и транспортеры, а также имплантируемые носители в основном относятся к инертным, нетоксическим твердым или жидким наполнителям, растворителям или капсулированным материалам, не реагирующим с активными ингредиентами по изобретению.
Отмечено, что для лечения людей, как правило, требуется больше времени, чем для мышей или других экспериментальных животных, приведенных в данном описании в качестве примеров, лечение которых имеет продолжительность, пропорциональную продолжительности процесса заболевания и эффективности лекарственного средства. Дозы могут быть единичными дозами или множественными дозами на протяжении периода нескольких дней, но предпочтительнее единичные дозы.
Дозировки могут быть единичными дозами на протяжении периода нескольких дней. Лечение, как правило, имеет продолжительность, пропорциональную продолжительности процесса заболевания и лекарственной эффективности, а также вида пациента, подвергаемого лечению.
Если введение клеток по настоящему изобретению осуществляют парентерально, в основном в виде формы дозированной единицы для инъекции (раствор, суспензия, эмульсия). Фармацевтическая композиция, приемлемая для инъекции, включает стерильные водные растворы или дисперсии и стерильные порошки для восстановления в стерильные инъекцируемые растворы или дисперсии. Носитель может быть растворителем или дисперсной средой, содержащей, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и подобные вещества), приемлемые смеси вышеуказанного и растительные масла.
Необходимое жидкое состояние может быть сохранено, например, посредством использования защитного слоя, такого как лецитин, посредством поддержания необходимого размера частиц в случае дисперсии или при использовании сурфактантов. Неводные носители, такие как хлопковое масло, кунжутное масло, оливковое масло, соевое масло, маисовое масло, подсолнечное масло или арахисовое масло и эфиры, такие как изопропиловый эфир миристиновой кислоты, также могут быть использованы как системы растворитель для клеточных композиций. Дополнительно могут быть добавлены различные вспомогательные вещества, увеличивающие стабильность, стерильность и изотоничность композиции, включая антимикробные консерванты, антиоксиданты, хелатные агенты и буферы. Профилактика воздействия микроорганизмов может быть обеспечена с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты и подобных веществ. Во многих случаях, может быть желательным включение изотонических агентов, например сахаров, хлорида натрия и подобных веществ. Пролонгированная абсорбция фармацевтических форм для инъекции может быть осуществлена посредством использования агентов, задерживающих абсорбцию, например, алюминия моностеарат и желатин. Однако, в соответствии с настоящим изобретением, любой используемый носитель, растворитель или добавочное вещество, должен быть совместим с клетками.
Стерильные растворы для инъекции могут быть приготовлены посредством включения клеток, используемых в практике настоящего изобретения в требуемом количестве адекватного растворителя с рядом других ингредиентов, как обозначено.
Фармакологическая композиция настоящего изобретения может быть введена пациенту в пригодной для инъекций формулировке, содержащей любой совместимый носитель, такой как различные наполнители, адъюванты, добавки и растворители; или клетки, используемые в настоящем изобретении, могут быть введены пациенту парентерально в форме медленно высвобождающегося подкожного имплантата или целенаправленных систем доставки, таких как моноклональные антитела, система доставки на основе векторов, ионофоры, полимерные матрицы, липосомы и микросферы. Примеры систем доставки, применимых в настоящем изобретении, включают: 5225182; 5169383; 5167616; 4959217; 4925678; 4487603; 4486194; 4447233; 4447224; 4439196; и 4475196. Многие другие подобные имплантаты, системы доставки и молекулы хорошо известны специалистам в данной области техники.
Фармакологическая композиция клеток, используемая в настоящем изобретении, может быть введена пациенту перорально. Традиционные методы, такие как введение клеток в таблетках, суспензиях, растворах, эмульсиях, капсулах, порошках, сиропах и подобные методы, применимы. Предпочтительны известные техники, такие как доставка перорально или внутривенно, которые сохраняют биологическую активность.
В одном осуществлении изобретения, клетки в соответствии с настоящим изобретением могут быть введены первоначально посредством внутривенной инъекции, для достижения приемлемого уровня в крови. Указанные уровни затем поддерживаются посредством пероральной дозированной формы, хотя другие формы введения, зависящие от состояния пациента и указанные выше, могут быть использованы. Количество, необходимое для введения, может варьироваться у пациента, проходящего лечение, и колеблется от около 100 нг/кг веса тела до 100 мг/кг веса тела в день и предпочтительно должно быть от 10 мг/кг до 10 мг/кг в день.
Пример 1:
Лечение травматического повреждения мозга (TBI - traumatic brain injury) стромальными клетками костного мозга (MSC) улучшает функциональный выход у крысы. Тканевое замещение является не только компенсаторным методом в клеточной трансплантационной терапии. В то время как различные факторы роста, как было показано, опосредуют восстановление и замещение поврежденной ткани, MSC обеспечивают трофическую поддержку, играющую роль в лечении поврежденной ткани. Ответная реакция MSC человека (hMSC) на церебральный тканевой экстракт из TBI была изучена и проверена для определения того, индуцирует ли состояние TBI дифференциацию hMSC и секрецию факторов роста. hMSC были культурированы с TBI-экстрактом in vitro и были выполнены иммуноцитохимический анализ и количественный энзимоподобное иммуноферментный сэндвич-анализ (ELISA). Результаты показали, что hMSC под воздействием TBI-экстракта экстрагируют специфические маркеры - клеточные белки: NeuN для нейронных ядерных клеток (0,2-0,5% от общего hMSC), Tuj-1 для ранней нейронной дифференциации и аксона нейронов (6-10%), GFAP для астроцитов (4-7%) и MBP для олигодендроцитов (3-5%). В дополнение, hMSC обработанные TBI-экстрактом, отвечают повышением секреции происходящего из головного мозга нейротрофического фактора (BDNF), фактора роста нейронов (NGF), основного фактора роста фибробластов (bFGF), фактора роста эндотелия сосудов (VEGF) и фактора роста гепатоцитов (HGF) зависимым от времени образом. Указанные данные демонстрируют, что TBI-экстракты запускают hMSC для выражения нейронной морфологии и фенотипических для ткани головного мозга белков. Кроме того, данные ELISA демонстрируют, что трансплантированные hMSC обеспечивают терапевтическую пользу путем ответной секреции ряда факторов роста, которые могут способствовать нейропротекции и ангиогенезу.
Стромальные клетки костного мозга (MSC), в случае внутривенной трансплантации крысам с травматическим повреждением мозга (TBI), содействовали неврологическому функциональному восстановлению (Lu et. al., 2001a). При трансплантации MSC мигрируют преимущественно в место нарушенной ткани, и некоторые клетки экспрессируют белки, фенотипические подобным эндогенным клеткам головного мозга (Lu et al., 2001b; Lu et al., 2001a; Mahmood et. al., 2001). Несмотря на то, что долговременная стратегия замещения поврежденной ткани популяцией стволовых клеток является прямым подходом к лечению невральных повреждений, низкий уровень дифференцировки MSC при срочных и кратковременных терапевтических трансплантациях модели TBI, c малой вероятностью обеспечивает функциональную выгоду (Lu et.al., 2001b; Lu et.al., 2001a; Mahmood et.al., 2001) и механизмы, обеспечивающие преимущества, остаются неизвестными.
MSC естественно продуцируют ряд цитокинов и факторов роста (Takai et al., 1997; Labouyrie et al., 1999; Bjorklund and Lindvall, 2000; Dormady et al., 2001), секреторные свойства которых зависимы от их микроокружения (Dormady et al., 2001). Нейротрофины, такие как происходящий из головного мозга нейротрофический фактор (BDNF) и фактор роста нерва (NGF), увеличивают выживаемость поврежденной ткани ЦНС (CNS) как in vivo, так и in vitro (Hefti, 1986; Kromer, 1987; Koliatsos et al., 1993; Bullock et al., 1999; Gage, 2000). Широко изученным в преклинических исследованиях фактором роста является основной фактор роста фибробластов (bFGF) (Ay et al., 1999). BFGF, введенный внутривенно в течение нескольких часов после начала ишемической атаки, снижает размер инфаркта, вероятно благодаря прямой защите клеток на границе (penumbra) церебрального инфаркта (Ay et al., 1999). Экспрессия фактора роста эндотелия сосудов (VEGF) также способствует ангиогенезу и невральному восстановлению (Papavassiliou et al., 1997). Лечение паралича с помощью VEGF улучшает функциональный выход (Zhang et al., 2000b). Экспрессия фактора роста гепатоцитов (HGF) естественно повышается в головном мозге после повреждения и проявляется в анти-апоптозных эффектах на церебральные нейроны in vitro (Zhang et.al., 2000a).
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты
Сбалансированный солевой раствор Хенко (HBSS), модифицированная Дульбекко среда Игла (DMEM), фильтрованная DMEM, фильтрованный сывороточный заместитель, фетальная бычья сыворотка (FBS), трипсин и этилендиаминтетрауксусная кислота (EDTA) были приобретены у GIBCO (Grand Island, NY.). Фикол был закуплен у Pharmacia (Piscataway, NJ). Антитела против моноклональных нейронных ядерных антигенов (NeuN), поликлонального β-тубулина изотипа 1 (Tuj-1), фибриллярного кислого белка глии (GFAP) и основного белка миелина (MBP) были приобретены у CHEMICON (Temecula, CA). Наборы для сэндвич-ELISA для BDNF, bFGF, VEGF и HGF были получены от R&D systems (Minneapolis, MN). Набор ELISA для NGF был произведен в лаборатории. Анти-β (2,5S, 7S) NGF моноклональные антитела, анти-β (2,5S, 7S) NGF-β-gal, NGF-β-стандарт были приобретены от Roche Molecular Biochemicals (Indianapolis, IN). Другие, не обозначенные реагенты, были получены от Sigma Chemical Co. (St. Louis, MO).
Первичная культура hMSC
Первичный костный мозг был получен из 15-16 мл аспирата из подвздошной кости трех нормальных доноров-людей. Каждый аспират разводили 1:1 с помощью HBSS и наслаивали на приблизительно 10 мл Фикола. После центрифугирования при 2500×g в течение 30 минут слой моноядерных клеток был удален из интерфазы и суспендирован в HBSS. Клетки центрифугировали при 1000×g в течение 10 минут и 5× 106 клеток ресуспендировали в 100-мм чашке для культуры ткани (Falcon, Becton-Dickinson, NJ) в полной DMEM, дополненной 10% FBS. Клетки инкубировали при 37°С в 5% СО2 в колбах в течение 3 дней и неприкрепившиеся клетки удаляли посредством замещения среды. После достижения культурами конфлюентности, обычно на 2-3 неделю, клетки собирали при помощи обработки 0,05% вес/объем трипсина и 0,02% вес/объем EDTA в фосфатно-буферном солевом растворе (PBS, pH 7,4) в течение 5 минут при 37°С, перемещали в новые чашки и снова культивировали в течение 2 недель и собрали. Клетки замораживали для дальнейшего использования. Клетки, использованные в указанных экспериментах, собирали из 3-5 пассажей.
Экстракты из травматически поврежденного головного мозга
Эксперименты были выполнены на крысах-самцах Wistar весом от 250 до 350 г (n=21). Анестезия была проведена интраперитонеальным введением хлоралгидрата (35 мг/100 г веса тела). Ректальная температура поддерживалась около 37°С во всех хирургических процедурах использованием регулирующейся по типу обратной связи водонагревательной системе. Крысы были помещены в стереотаксическое устройство. Повреждение было индуцировано сдавлением левой коры (ipsilateral cortex) пневматическим поршнем, имеющим диаметр головки 6 мм, с мощностью 4 м/секунду и 2,5 мм компрессии (Dixon et al., 1991). Контрольные животные подвергались краниотомии, но не получали повреждений. Крыс умерщвляли через 1,4 и 7 дней (n=6 на временную точку) после операции. Экстракты тканей головного мозга были немедленно получены от экспериментальных и нормальных контрольных (n=3) крыс. Сегменты левого полушария экспериментальных крыс и контрольных крыс были помещены на лед, и "сырой" вес в граммах был быстро определен. Впоследствии, кусочки тканей гомогенизировали добавлением DMEM (150 мг ткани/мл DMEM) и инкубировали на льду в течение 10 минут. Гомогенат центрифугировали в течение 10 минут при 10000×g при 4°С. Надосадочную жидкость собирали и сохраняли при -80°С для обработки hMSC.
Дифференциация клеток
Фенотипическое исследование белков было выполнено путем засевания 1,0×106 клеток в 35 мм-чашку и обработки их свежеотфильтрованной DMEM с 20% фильтрованного заместителя сыворотки, содержащей 10%, 20% или 40% надосадочной жидкости от тканевого экстракта TBI. Все клетки инкубировали в течение 7 дней. Подсчеты иммунореактивных нейроноподобных клеток основывались на подсчете клеток в 10 выборочных полях зрения (10×объектив) в трех культуральных чашках в минимум трех различных экспериментах. Процентное содержание фенотипичных нейронных клеток рассчитывали из общего количества клеток.
Двойное и Тройное иммуноцитохимическое окрашивание
hMSC помещали при плотности 1,0×106 на покровное стекло (18×18 мм) в 35-мм чашку с использованием различных обработок, отмеченных выше. Клетки на покровном стекле были использованы для иммуноцитохимии. Надосадочная жидкость была использована для количественного измерения методом ELISA, как описано ниже. Клетки были отмыты с помощью PBS (pH 7,4) и зафиксированы 4% параформальдегидом в течение 10 минут. Неспецифические сайты связывания были блокированы 4% нормальной лошадиной сывороткой, 2% бычьим сывороточным альбумином и 0,1% Triton-X-100 в течение 1 часа. Покровные стекла отмывали PBS и инкубировали с первичными антителами против Tuj-1, GFAP или MBP в течение 1 часа. Они снова были отмыты PBS и инкубированы с флюоресцеин-изотиоцинат (FITC)-коньюгированными козьими вторичными антителами к мышиным или кроличьим IgG в течение 1 часа. Покровные стекла, содержащие Tuj-1-окрашенные hMSC, были снова еще раз отмыты и инкубированы со вторым первичным антителом к NeuN в течение ночи, затем промыты PBS и инкубированы с цианин-5,18 (Cy5)-коньюгированными вторичными антителами против мышиных IgG в течение 1 часа. Красящее вещество 4'b-диамидин-2-фенилиндол дигидрохлорид (DAPI) было применено для определения количества клеток путем подсчета ядер в поле зрения. Покровные стекла затем были монтированы с монтирующей средой - глицергелем.
ELISA
ELISA использовался для измерения секреции BDNF, NGF, bFGF, VEGF и HGF клетками hMSC на 1, 4 и 7 дни в культуре, кондиционированной супернатантом экстракта головного мозга с TBI и нормального головного мозга. Вкратце, все реагенты и рабочие стандарты были изготовлены в соответствии с рекомендациями производителя, и 50-150 мкл стандартного или экспериментального раствора растворителя было добавлено в каждую лунку в 96-луночного планшета. Лунки были тщательно перемешаны и инкубированы в течение 2-4 часов при комнатной температуре. Каждая лунка была аспирирована и промыта, процесс повторяли три раза. После последнего отмывания, некоторое количество оставшегося буфера было удалено посредством аспирации или декантирования лунки и 200 мкл различных конъюгатов фактора роста были добавлены в каждую лунку. Затем планшет инкубировали в течение 2-4 часов при комнатной температуре. Аспирация и отмывание были повторены. 200 мкл раствора субстрата добавляли в каждую лунку и инкубировали в течение 15-30 минут при комнатной температуре, 50 мкл раствора для остановки реакции добавляли и осторожно перемешивали. Оптическая плотность каждой лунки определялась в пределах 30 минут, используя микропланшетную счетную установку, при 450-620 нм.
Статистический анализ
t-критерий Стьюдента использовался для оценки морфологических различий между стимулированными образцами и соответствующими контролями. Значимость ответа от времени была оценена дисперсионным анализом (ANOVA) повторных измерений. Данные ELISA подвергали линеаризации посредством построения кривой зависимости логарифма различных концентраций фактора роста от оптической плотности, и наилучшим образом подходящая линия определялась посредством регрессивного анализа. Среднее от двух считываний было рассчитано для каждого стандарта, контроля и образца, средняя оптическая плотность нулевого стандарта была вычтена. Все величины выражаются в виде среднего арифметического значения ± среднеквадратическое отклонение (SD). p<0,05 рассматривалось как статистически значимое.
РЕЗУЛЬТАТЫ
Морфологическая дифференциация hMSC в нейроноподобные клетки
Фазово-контрастная микроскопия показала нормальную морфологию фибробластоподобных hMSC, культивированных в полной DMEM, дополненной 10% FBS. После 7 дней экспозиции, в фильтрованной DMEM с 20% фильтрованного заместителя сыворотки у некоторых клеток с преломляющей способностью были обнаружены короткие отростки. Несколько клеток (˜2-3% от общего количества клеток, таблица 1) имели нейроноподобную морфологию среди hMSC, культивированных в надосадочной жидкости экстракта нормальной ткани головного мозга. Однако экстракты из нормального головного мозга индуцировали пролиферацию hMSC (1,56×104±0,2×104/мл), сравнимую с пролиферацией hMSC, культивированных в фильтрованной DMEM с 20% фильтрованного заместителя сыворотки (1,24× 104±0,5×104/мл) (р<0,05). Разнообразная морфология, но обычно клетки с преломляющей способностью с длинными разветвляющимися отростками (длина отростка >10 мкл) и с конусоподобными концевыми структурами роста (˜13-30% нейроноподобных клеток от общего количества клеток, таблица) и звездчатые клетки с небольшими или мультиполярными отростками были определены среди hMSC, культивированных в 20%-40% супернатанте от TBI-экстракта. Была отмечена тенденция к снижению общего количества клеток в культурах TBI-экстракта (1,08× 104±0,3×104/мл), но указанное не имело статистической значимости. Все из различных концентраций TBI-тканевого экстракта индуцировали превращение hMSC в клетки, морфологически напоминающие нейроны.
Экспрессия нейронных маркеров клетками hMSC
По истечении 7 дней культивирований в фильтрованной DMEM с 20% фильтрованного заместителя сыворотки, содержащей 10%, 20% или 40% TBI-тканевого экстракта, hMSC были подвергнуты иммуноцитофлюоресценции. Это давало возможность двойного мечения с помощью DAPI (сине-фиолетовый для идентификации ядер), FITC (зеленый) или тройного мечения CY5 (красный) hMSC для определения того, экспрессируют ли клетки костного мозга нейроспецифические маркеры для нейронов (NeuN, Tuj-1), астроцитов (GFAP) и олигодендроцитов (MBP). Клеточные ядра были окрашены DAPI. В культурах, окрашенных на иммунореактивность, 0,2-0,5% hMSC экспрессировал белок NeuN, и 6-10% hMSC были помечены по Tuj-1 фенотипу. Neu-N- и Tuj-1-иммунореактивности были солокализованы в одних и тех же клетках (розовый). От 4 до 7% hMSC-производных клеток проявили GFAP имунореактивность. От 3 до 5% hMSC-производных клеток проявили MBP-имунореактивность. Все из различных протестированных концентраций TBI-экстрактов индуцировали проявление hMSC нервной фенотипической иммунореактивности.
Секреция факторов роста клетками hMSC, обработанными супернатантом TBI-тканевого экстракта
Секреция факторов роста клетками hMSC после 1, 4 и 7 дня культивирования в фильтрованной DMEM с 20% фильтрованного заместителя сыворотки, содержащей 20% супернатанта TBI-экстракта, показаны на Фиг.1. Экстракт ткани нормального головного мозга и TBI-тканевой экстракт влияли на секреции BDNF (Фиг.1а), NGF (Фиг.1b), bFGF (Фиг.1с), VEGF (Фиг.1d) и HGF (Фиг.1е) in vitro клетками hMSC. Экстракт ткани нормального головного мозга повышал секрецию всех выявленных факторов роста in vitro по сравнению со средой - только в качестве контроля. В каждой экспериментальной группе, BDNF-, NGF- и HGF-секреция повышалась с 1 дня до 7 дня в кондиционированном TBI-экстракте. Секреция VEGF была похожей в группах нормального головного мозга и головного мозга после TBI. Секреция VEGF была постоянно больше на 4 день и 7 день пребывания в культуре, чем за 1 день. Профили bFGF-секреции отличались от других трофических факторов. Величины секреции bFGF на 1 день пребывания в культуре, в отличие от других факторов роста, превышали или были равны величинам секреции на 4 и 7 день. Эти данные указывают на то, что TBI содействует секреции NGF и BDNF клетками hMSC in vitro и что и нейротропин и протестированные факторы роста, демонстрируют значительное увеличение секреции hMSC в нормальном головном мозге по сравнению с hMSC в среде с заместителем сыворотки.
ОБСУЖДЕНИЕ
Стромальные клетки костного мозга человека, обработанные TBI-экстрактом, морфологически могут дифференцироваться в нейроноподобные клетки и экспрессировать белки, фенотипические для церебральных паренхиматозных клеток. hMSC секретируют BDNF, NGF, bFGF, VEGF, HGF и уровни секреции зависят как от времени экспозиции TBI-экстрактом в культуре, так и от времени, в течение которого ткань TBI была экстрагирована.
Приведенные данные демонстрируют, что hMSC могут быть превращены в похожие на субпопуляции клеток, морфологически подобных нейронам при экспозиции TBI-тканевым экстрактом in vitro. Обработанные hMSC также экспрессируют специфические церебральные белковые маркеры, такие как NeuN (для нейронов), Tuj-1 (для ранней дифференцировки и аксона нейрона), GFAP (для астроцитов) и MBP (для олигодендроцитов). Таким образом, hMSC способны дифференцироваться во множественные клеточные линии. Исследования показали, что можно запустить дифференцировку hMSC в нейроноподобные клетки в культуре посредством реагента (Sanchez-Ramos et. al., 2000; Woodbury et.al., 2000; Deng et al., 2001) и в поврежденной ЦНС (Azizi et. al., 1998; Kopen et al., 1999; Chopp et al., 2000; Li et al., 2000; Chen et al., 2001; Lu et al., 2001b; Lu et al., 2001a; Mahmood et al., 2001). Данные настоящего изобретения впервые демонстрируют, что некоторые hMSC, помещенные in vitro в специфичное микроокружение, содержащее TBI-тканевой экстракт, отвечают приобретением морфологических, а также фенотипических характеристик церебральных паренхиматозных клеток. После терапевтической трансплантации, эти клетки могут обеспечивать источник клеточного замещения в TBI-поврежденном мозге.
Стромальные клетки костного мозга требуются для нормального гемопоэза. Ряд растворимых факторов, секретируемых MSC, которые опосредуют гемопоэз, был охарактеризован (Berezovskaya et. al., 1995; Majumdar et al., 1998; Majumdar et al., 2000). MSC продуцирует IL-6, -7, -8, -11, -12, -14, -15 и Flt-3 лиганд и индуцирует стабильные уровни M-CSF, G-CSF, GM-CSF и SCF. Однако вряд ли указанные факторы в одиночку обеспечивают механизм, лежащий в основе терапевтической пользы MSC-лечения TBI. Существование других, еще неизвестных стромальных факторов, было постулировано. В представленных здесь экспериментах, количественные данные ELISA демонстрируют, что обработанные TBI-тканевым экстрактом hMSC сопутственно секретируют BDNF, NGF, bFGF, VEGF и HGF, зависимым как от возраста культуры, так и от времени, в которое был получен TBI-тканевой экстракт, образом. Внутривенное введение BDNF уменьшает объем повреждения после TBI у крыс и поддерживает нейропротективное назначение BDNF в повреждении головного мозга (Koliatsos et al., 1993; Bullock et al., 1999). Продемонстрирован нейропротективный потенциал после инъекции NGF или посредством имплантации NGF-продуцирующих фибробластов или NGF-трансгенных мышей, в различных моделях экспериментального повреждения мозга (Hefti, 1986; Kromer, 1987; Caneva et al., 1995; Gage, 2000). Внутривенное введение bFGF уменьшало зону инфаркта в моделях фокальной церебральной ишемии у крыс, мышей и кошек (Sugimori et al., 2001). VEGF, мощный стимулятор ангиогенеза, также стимулирует аксональный прирост, выживание нервных клеток и пролиферацию Шванновских клеток (Sondell et al., 1999). Увеличение VEGF вслед за повреждением вследствие сдавления седалищного нерва позволяет предположить, что VEGF играет роль в регенерации нерва (Sondell and Kanje, 2001). Обработка экспериментального инсульта у крысы VEGF значительно снижает дефицит функции (Zhang et al., 2000). hMSC конститутивно продуцируют HGF (Takai et al., 1997), и HGF является важной молекулой для тканевого восстановления (Mizuno et al., 2000). Таким образом, находки четко показывают, что hMSC чувствительны к нормальному головному мозгу и TBI-окружению и отвечает значительным увеличением продукции многих факторов. С учетом выживаемости трансплантированных MSC в травматически поврежденной нервной ткани (Lu et al., 2001b; Lu et al., 2001a; Mahmood et al., 2001), непрерывная и ответная на микроокружение секреция нейропротективных и ангиогенных факторов клетками MSC в месте поврежденной ткани является ключевым фактором в функциональной пользе, обеспечиваемой трансплантацией MSC.
Приведенные результаты показали, что MSC взрослых могут быть индуцированы для преодоления мезенхимальной детерминации, и образовать обильный и доступный клеточный и молекулярный резервуар для лечения разнообразных неврологических заболеваний. Результаты, представленные здесь, показывают, что трансплантированные MSC обеспечивают функциональную пользу после TBI (Lu et al., 2001b; Lu et al., 2001a; Mahmood et al., 2001). В частности, MSC могут быть легко получены из небольшого количества костного мозга из собственного подвздошного гребня пациента и размножены в культуру. Таким образом, MSC обеспечивают легко доступный и пополняемый источник аутологичных клеток для трансплантации. Эти клетки в поврежденной ткани обеспечивают постоянный источник жизненно важных факторов роста для восстановления и пластификации поврежденного головного мозга.
Фиг.1 показывает секрецию фактора роста BDNF (Фиг.1А), NGF (Фиг.1В), bFGF (Фиг.1С), VEGF (Фиг.1D) и HGF (Фиг.1Е) из hMSC, обработанных супернатантом TBI-тканевого экстракта. Количественный анализ секреции произведен с помощью ELISA. Экстракт ткани нормального головного мозга увеличивал секрецию всех выявленных факторах роста in vitro по сравнению со средой - в чистом виде в качестве контроля. В каждой экспериментальной группе секреция BDNF, NGF и HGF повышалось на протяжении периода от 1 до 7 дней в кондиционированном экстракте TBI. Секреция VEGF была сходной для групп нормального головного мозга и мозга после TBI. Секреция VEGF была постоянно больше на 4-7 день пребывания в культуре, чем за 1 день в культуре. Профили секреции bFGF отличались от других трофических факторов. Величины секреции в FGF на 1 день пребывания в культуре, в противоположность другим факторам роста, превышали или были равны величинам секреции на 4 и 7 день.
Пример 2:
Методы:
Крысы были подвергнуты преходящей окклюзии средней церебральной артерии и IV инъекции 3×106 hMSC в 1 день после инсульта. Функциональный выход был измерен перед инсультом и в 1, 7 и 14 дни после инсульта. Смешанной лимфоцитарной реакцией и развитием цитотоксических Т-лимфоцитов измеряли иммунное отторжение hMSC. Моноклональные антитела, специфические к человеческим клеточным ядрам (mAb1281), были использованы для идентификации hMSC и для определения неврального фенотипа. ELISA анализировала уровни нейротропина в ткани головного мозга у обработанных hMSC или необработанных крыс. Инъекции бромдезоксиуридина были использованы для идентификации вновь сформированных клеток. Результаты: Достоверное восстановление функции было обнаружено у крыс, обработанных hMSC, на 14 день по сравнению с контрольными крысами с ишемией. Некоторые (от 1 до 5%) hMSC экспрессировали белки, фенотипические для паренхиматозных клеток мозга. Происходящие из головного мозга нейротрофический фактор и фактор роста нервов значительно увеличивались, и количество клеток с апоптозом значительно снижалось в ишемической пограничной зоне; значительно больше бромдезоксиуридин-реактивных клеток было обнаружено в субвентрикулярной зоне ишемизированного полушария крыс, обработанных hMSC. hMSC индуцировали пролиферацию лимфоцитов без индукции цитотоксических T-лимфоцитов.
Заключение:
Неврологическая польза в результате лечения с помощью hMSC инсульта у крыс может быть производным от увеличения факторов роста в ишемической ткани, снижения апоптоза в полусветлой зоне повреждения и пролиферации эндогенных клеток в субвентрикулярной зоне.
Стромальные клетки костного мозга (MSC; также именуемые мезенхимальными стволовыми клетками и клетками-предшественниками) являются плюрипотентными и способными к содействию в восстановлении тканей in vivo и in vitro. MSC, как правило, дают прирост костей, хряща и мезенхимальных клеток, и MSC могут дифференцироваться в миоциты, гепатоциты, глиальные клетки и нейроны. MSC могут проникать через гематоэнцефалический барьер и мигрировать через передний мозг и мозжечок. Клетки костного мозга от самцов, систематически внедряемые в ишемических крыс-самок, мигрируют предпочтительно в ишемическую кору. Клетки костного мозга мышей-самцов, введенные в облученных мышей-самок, попадают в головной мозг на протяжении от нескольких дней до недель и дифференцируются в микроглию и астроглию.
Ни один нейропротективный реагент не улучшил выход после инсульта. Терапевтическая польза от человеческих MSC (hMSC) для ишемии миокарда и заболевания сердца у крыс, по-видимому, происходит от замещения ткани и индукции ангиогенеза и васкулогенеза. MSC секретируют ряд факторов роста и цитокинов, которые в норме поддерживают пролиферацию и дифференцировку гемопоэтических клеток-предшественников. Костный мозг содержит различные недифференцированные клетки, которые секретируют различные ангиогенные факторы роста, включая VEGF и bFGF. Таким образом, MSC могут развиться в жизнеспособную терапию для лечения неврологических заболеваний. В данной патентной заявке продемонстрировано значительное функциональное восстановление на модели окклюзии срединной церебральной артерии (MCAO) у крысы при лечении посредством MSC грызунов.
Материалы и методы
Приготовление hMSC и кинетика роста in vitro. Для исследования кинетики роста клеток и размножения hMSC in vitro пункции заднего подвздошного гребня были получены у трех здоровых доноров-людей при местной анестезии. Мононуклеарные клетки образцов костного мозга (от 15 до 16 мл на человека) были отделены на градиенте плотности Фиколла (Ficoll-Paque [плотность, 1,073], Pharmacia, CA). Изоляцию и установление культуры hMSC проводили как описано Digirolamo et. al. Вкратце, мононуклеарные клетки помещали в концентрации 1×106 клеток/75 см2 - флаконы для тканевой культуры в 20 мл низкоглюкозной модифицированной Дульбекко среде Игла (Gibco-BRL, Grand Island NY), дополненной 20% фетальной бычьей сывороткой (Gibco-BRL), 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина и 2 ммоль/л L-глютамина. После 72 часов инкубации неадгезировавшие клетки были удалены из культуры, и свежая культуральная среда была добавлена во флаконы. Адгезированные к пластику hMSC были разделены по флаконам на 14 день (90% конфлюентности) и каждые 7 дней после этого оценивался рост клеток и выход клеток. Ядерные клетки костного мозга были подсчитаны, используя цитометр для уверенности в адекватности количества клеток для трансплантации. Доза в 3×106 hMSC была инъецирована каждой крысе. HMSC, собранные из пяти пассажей и в дальнейшем культивированные в фильтрованной модифицированной Дульбекко среде Игла (без сыворотки; Gibco-BRL) с 20% фильтрованного заместителя сыворотки (Gibco-BRL), были использованы для измерения в ELISA (n=6). Секреция происходящего из головного мозга нейротрофического фактора (BDNF) и фактора роста нерва (NGF) клетками hMSC была измерена на 1, 4 и 7 день в бессывороточной модифицированной Дульбекко среде Игла.
Смешанная лимфоцитарная реакция между клетками селезенки крысы и hMSC in vitro. Для изучения антиген-индуцированной лимфоцитарной пролиферации, 2×105 клеток селезенки от здоровых крыс или крыс, которым инъецировали 3×106 hMSC 2 неделями раньше, культивировали в трех повторах с облучением или без (20 Gy) hMSC в течение 96 часов в отношении 10:1 ответчик (клетки селезенки): стимулятор (hMSC). Смешанные клетки импульсно пометили (0,25 мкКи/лунку) в течение 16 часов. Индукцию пролиферации лимфоцитов селезенки с помощью hMSC измеряли по включению 3Н-тимидина в делящиеся клетки селезенки. Культуры собирали с помощью автоматического устройства для сбора клеток, и включение 3Н-тимидина измерялось путем жидкой сцинтилляции.
Ответ в виде цитотоксических Т-лимфоцитов крыс на hMSC in vitro
Полагают, что Т-лимфоциты служат в качестве инициатора фатального ятрогенного заболевания "трансплантант-против-хозяина". Поэтому реакция "человеческий трансплантант-против-Т-клеток хозяина-крысы" была измерена с использованием 51Cr-анализа для определения литического действия. Клетки селезенки здоровой крысы или клетки крыс, подвергнутые инъекции 3×106 hMSC 2 неделями ранее, культивировал с облученным hMSC в течение 5 дней при соотношении 10:1: ответчик (клетки селезенки) - стимулятор (hMSC). В конце периода инкубации, жизнеспособные клетки были извлечены из культуры и протестированы на цитотоксичность по отношению к 51Cr-меченым hMSC в 8-часовом 51Cr-высвобождающем анализе.
Модель MCAO на животных
Взрослые крысы-самцы Wistar (весом от 270 до 300 г) были приобретены в Charles River Breeding Company (Wilmington, MA). Крысы были изначально анестезированы 3,5% галотаном и поддерживались 1,0% до 2,0% галотаном в 70% N2O и 30% О2, используя масочный наркоз. Ректальная температура поддерживалась на уровне 37°С на протяжении хирургической процедуры, используя регулируемый по принципу обратной связи водно-нагревательную систему. Преходящая MCAO была индуцирована, используя метод внутрипросветной васкулярной окклюзии, модифицированной в лаборатории. Правая восходящая сонная артерия, наружная сонная артерия и внутренняя сонная артерии были обнажены. Длина 4-0 одноволоконного нейлонового шовного материала (18,5 до 19,5 мм), определенная по весу животного, с кончиком, закругленным нагреванием над пламенем, была продвинута от наружной сонной артерии в просвет внутренней сонной артерии до блокирования начала MCA. Два часа спустя после MCAO животные были реанестезированы галотаном, и реперфузия была выполнена извлечением шовного материала до тех пор, пока кончик не освободил просвет наружной сонной артерии.
Экспериментальные группы
Группа 1
Для измерения нейротропина, крысы были подвергнуты MCAO без обработки (n=3) или была проведена инъекция 3×106 MSC (n=3) или 3×106 фибробластов печени (n=3) в 1 мл общего объема в хвостовую вену в 1 день после инсульта. Исследование печеночных фибробластов представляет собой ограниченный контроль, в котором фибробласты были собраны от того же самого штамма крыс Wistar во избежание неожиданных иммунных ответов на контрольные клетки в крысах-хозяевах. Крысы были умерщвлены через 7 дней после MCAO для измерения нейротропина. Три здоровые крысы были также использованы в качестве контрольных субъектов.
Группа 2
Крысы были подвергнуты MCAO c 3×106 hMSC (n=9) или 3×106 печеночных фибробластов крысы (n=9, контроль) инъецированных в 1 день, или только MCAO без клеток-доноров (n=10; контроль). Крысы были умерщвлены через 14 дней после МСАО для измерения клеточной морфологии. Поскольку МСАО индуцирует пролиферацию эндогенных невральных стволовых клеток и клеток-предшественников в эпендимной и субэпендимной зонах (также называемых вентрикулярная зона/субвентрикулярная зона [VZ/SVZ]), 17 крыс в Группе 2 получали ежедневно интраперитонеальную инъекцию бромдезоксиуридина (BrdU, аналог тимидина, который метит вновь синтезированную ДНК [50 мг/кг]; SIGMA, St. Louis, MO) последовательно в течение 14 дней после MCAO с или без IV инъекции донорских клеток для идентификации клеточной пролиферации. В качестве контроля, дополнительно два здоровых животных получили 14 ежедневных инъекций по 50 мг/кг BrdU интраперитонеально до смерти.
Тестирование поведения
Животные были подвергнуты тестированию поведения перед MCAO и на 1, 7 и 14 дни после MCAO исследователем, не знавших об экспериментальных группах. Для измерения соматосенсорной ассимерии передних конечностей, небольшие липкие с тыльной стороны бумажные маркеры (113,1 мм2) были использованы в качестве билатеральных тактильных стимулов и наносились на радиальную поверхность лучезапястного сустава каждой передней конечности в пяти испытаниях в день в домашней клетке. Время, которое крыса контактировала и удаляла стимул, записывалось. Индивидуальные испытания разделялись, по меньшей мере, 5 минутами. Животные были тренированы в тесте приклеивания-удаления маркера в течение 3 дней до операции. Когда крысы были способны удалить маркер в течение 10 секунд, они были подвергнуты MCAO. Модифицированный оценочный тест состояния нервной системы (mNSS) был использован для градуирования различных аспектов неврологический функции. mNSS представляет собой комплекс моторных (мышечный статус и ненормальное передвижение), чувствительных (зрительных, тактильных и проприоцептивных) и рефлекторных тестов.
Приготовление экстракта из ишемического мозга:
Через семь дней после MCAO крысы в группе 1 были анестезированы галотаном; мозг был удален, и ишемические полушария были разделены на части на льду. Образцы были затем сохранены при -80°С. Впоследствии, каждый образец ткани был гомогенизирован в 1 г/мл гомогенизирующем буфере. Гомогенат был центрифугирован (10000×g) в течение 10 минут при 4°С, и супернатант был собран для измерения секреции.
Измерение секреции факторов роста с использованием сэндвич-ELISA
Набор BDNF-ELISA был получен от R & D Systems (Minneapolis, MN), и ELISA производили в соответствии с рекомендациями производителя. Раствор ELISA был изготовлен для NGF. Анти-β (2,5S, 7S) NGF моноклональные антитела, анти-β (2,5S, 7S) NGF-β-gal и стандартные NGF-β были закуплены в Roche Molecular Biochemicals (Indianapolis, IN). Вкратце, супернатант, собранный от ишемической ткани или от безсывороточной культуральной среды для hMSC, был разделен на образцы от 100- до 200-мкл в трех повторах. Моноклональные антитела к BDNF и NGF были использованы в соответствии с инструкциями производителя. Впоследствии, были добавлены вторичные специфичные поликлональные антитела к каждому первичному антителу. После инкубационного периода с хромогенным субстратом окрашивание развивается пропорционально количеству факторов роста и измеряется с использованием микропланшет-ридера (450-620 нм).
Гистологическая, иммуногистохимическая оценка и оценка апоптоза
Приготовление препарата для микроскопии
Группа крыс 2, оставленная жить до 14 дней после MCAO, была использована для морфологического анализа. В это время крысы были анестезированы кетамином (44-80 мг/кг интраперитонеально) и ксилазином (13 мг/кг интраперитонеально), и сосудистая система была перфузирована транскардиально с помощью гепаринизированного фосфатно-солевого раствора (PBS) c последующим 4% параформальдегидом в PBS. Головной мозг был погружен в 4% параформальдегид в PBS на 2 дня, а затем ткань головного мозга была разрезана на семь коронарных блоков равной толщины (2 мм). Ткани были обработаны, и коронарные слайды от каждого блока толщиной 100-мкм были нарезаны вибратомом со свободноплавающим срезом (пять вибратомных слайдов на блок). Все остающиеся блоки головного мозга были помещены в парафин, и была нарезана серия смежных слайдов толщиной 6 мкм.
Измерение объема инфаркта
Каждый один из коронарных парафиновых слайдов (толщиной 6 мкм) из семи блоков был окрашен гематоксилин-эозином (H-E). Семь слайдов головного мозга были исследованы, используя систему анализа изображения Global Lab Image analysis System (Data Translation, Marlboro, MA). Были подсчитаны зоны с непосредственным повреждением, где интактные зоны ипсилатеральных полушарий отнимали от зоны контратерального полушария. Объем повреждения представлен в процентах объема повреждения по сравнению с контрлатеральным полушарием.
Иммуногистохимическое окрашивание
После блокирования в нормальной сыворотке, все вибратомные слайды были обработаны моноклональными антителами, специфическими к ядрам человека (mAb1281; Chemicon, Temecula, CA), разведенными 1:100 в PBS, в течение трех дней при 4°С. После последующей инкубации с флюоресциин изотиоцианат-коньюгированными антителами кролика к мышиным IgG (разведение 1:100; Dakopatts, CA), вторичные антитела были связаны с первыми антителами mAb1281. Клетки, производные от hMSC, были идентифицированы с использованием морфологического критерия и иммуногистохимического окрашивания с помощью с mAb1281, представленного в клетках донора, но не представленного в паренхиматозных клетках. Для визуализации клеточной колокализации mAb1281 и специфичных для типа клеток маркеров в тех же самых клетках, было использовано двойное окрашивание серийных исходных вибратомных слайдов (100 мкм), центрированных по срединной зоне ишемии (координаты брегмы-1,0 1,0 мм). Каждый коронарный слайд был обработан первичным антителом, mAb1281, описанным выше, а затем клеточно-специфическими вторичными антителами, коньюгированными с цианином-5,18 (Calbiochem, CA)в течение трех дней при 4°C: нейрональный ядерный антиген (NeuN для нейронных ядер [разведение 1:200]; Chemicon), ассоциированный с микротрубочками белок 2 (MAP-2 для нейрональных дендритов [разведение 1:200]; Sigma), фибриллярный кислый белок глии (GFAP для астроцитов [разведение 1:1000]; DAKO, Carpinteria, CA), и vWF (для эндотелиальных клеток [разведение 1:400]; DAKO0. Негативные контрольные слайды для каждого животного получены идентичными способами приготовления для иммуногистохимического окрашивания, исключая то, что первичные антитела не использовались.
Лазер-сканирующая конфокальная микроскопия
Коронарные вибратомные слайды были анализированы при помощи лазер-сканирующей конфокальной системы получения изображений Bio-Rad MRC 1024 (аргон и криптон), смонтированной в микроскопе фирмы Zeiss (Bio-Rad, Cambridge, MA). Для иммунофлюоресцентно помеченных слайдов, зеленых (флюоресцеин изотиоцианат) и красных (цианин-5,18) флюорохромы на слайдах возбуждали лазерным пучком лучей при 488 нм и 647 нм, и эмиссии были последовательно синхронизированы трубкой фотоумножителя при фильтре для эмиссии 522 нм и 670 нм. Общее количество mAb1281-позитивных клеток было измерено в пяти последовательных слайдах (толщиной 100 мкм) для каждого блока из всех семи блоков с использованием XYZ стадийного кодера для подсчета клеток. Затем было подсчитано общее число mAb1281-позитивных клеток всего переднего мозга путем суммирования количеств mAb1281-позитивных клеток всех семи блоков. Всего 500 mAb1281-позитивных клеток на одно животное было подсчитано для получения процента mAb1281-позитивных клеток, колокализованных со специфическими для клеточных типов маркерами (NeuN, MAP-2, vVF и GFAP) при двойном окрашивании.
Окрашивание апоптозных клеток
Пять коронарных парафиновых слайдов (толщиной 6 мкм; интервал 25 мкм) из вышеупомянутых блоков, координированных в брегме-1,0 1,0 мм, были использованы для анализа апоптозных клеток. Указанные слайды были окрашены методом опосредованного концевой дезоксинуклеотидилтрансферазой dUTP-биотинового концевого мечения в месте одноцепочечного разрыва (TUNEL) для детекции апоптоза in situ (ApopTag набор; Oncor, Gaitersburg, MD). После блокирования активности эндогенной пероксидазы при помощи Н2О2 в PBS, слайды были размещены в концевой дезоксинуклеотидилтрансферазе. Анти-дигоксигенин-пероксидаза была применена к слайдам, и пероксидаза была определена с помощью 3,3'-диаминобензидина. После TUNEL-окрашивания, слайды были контрастно окрашены гематоксилином Майера. Использовались негативные контрольные слайды из каждого блока. В TUNEL-препаратах к апоптозным клеткам были отнесены только клетки, содержащие темно-коричневые апоптозные тельца (>2).
Фигура 2 отображает стандартный коронарный срез, идентифицированный на уровне передней комиссуры головного мозга крысы, которая делит правое полушарие на три субрегиона (ишемический центр, ишемическая пограничная зона и VZ/SVZ) (mAb1281). Были измерены экзогенные hMSC клетки, позитивные по клеточному типу (NeuN, MAP-2, GFAP и VWF), и апоптозные клетки (TUNEL-позитивные клетки) в указанных регионах ипсилатеральных и коллатеральных полушарий. Гистологические особенности рутинного Н-Е-окрашивания были использованы для идентификации трех регионов: ишемического центра (диффузная бледность эозинофильного фона) и внутренняя (вакуолизация или пастозность нейропиля) и внешние пограничные зоны (от пастозности до полностью интактной ткани [многие клетки были интактны; однако, могут быть отмечены рассеянные поврежденные и погибшие клетки]) ишемического повреждения и изменения в форме и способности клеток к окрашиванию. Фигура 2 показывает стандартный коронарный срез, идентифицированный на уровне передней комиссуры головного мозга крысы, которая делит на три субрегиона правое полушарие (ишемический центр [IC]; ишемическая краевая зона [IBZ], вентрикулярная/субвентрикулярная зона [VZ/SVZ]) и восемь полей (1, кора в IC; 2, неостриатум (полосатое тело) в IC; 3-4, кора в IBZ; 5-6 неостриатум в IBZ; и 7-8, неостриатум в VZ/SVZ) для анализа ответа на лечение.
Статистический анализ
Все измерения были выполнены "слепым" методом. Поведенческие показатели (тест на приклеивание-удаление маркера и mNSS) были оценены на нормальное состояние. Анализ повторных измерений был проведен для проверки лечебного эффекта на поведенческие показатели. Анализ начинали с проверки связи время - лечение при уровне значимости в 0,01. Проверку на общий эффект лечения проводили, если не было обнаружено связи при уровне значимости 0,05. Подгруппный анализ эффекта лечения на каждый поведенческий показатель каждый раз был проведен при уровне значимости 0,05, если связь время - лечение находилась на уровне значимости в 0,1 или общий эффект лечения находился на уровне значимости в 0,05. В противном случае, подгруппные анализы рассматривались как исследовательские. t-критерии Стьюдента использовались для оценки различий между контрольной группой и подвергнутой обработке группой с точки зрения повреждения и количества клеток. Данные ELISA подвергали линеаризации путем построения кривых зависимости log BDNF и концентрацию NGF от log оптической плотности, и наилучшим образом подходящая линия определялась регрессивным анализом. Среднее от двух испытаний было рассчитано для каждого стандарта, контроля и образца и была вычтена средняя оптическая плотность нулевого стандарта. Представлены средние арифметические значения (SD) и величина р для тестирования различий между подвергнутой обработке и контрольной группой.
Результаты
Кинетика роста hMSC in vitro
Происходящие из костного мозга hMSC от трех здоровых доноров-людей были протестированы посредством размножения в культуре. В первичных культурах hMSC росли как морфологически гомогенная популяция фибробластоподобных клеток. Во время последующих пассажей, обычно с 7-дневными интервалами, hMSC росли как завиток плотно упакованных клеток веретенообразной формы. В конце 5-й недели (четыре пассажа), выход hMSC находился в диапазоне между 5,4 и 6,6×107 клеток (таблица 2).
Смешанная лимфоцитарная реакция и ответ в виде цитотоксических Т-лимфоцитов между клетками селезенки крысы и hMSC in vitro. hMSC значительно увеличивали пролиферацию здоровых клеток селезенки крысы (индекс стимуляции = 18,8) по сравнению с нестимулированными клетками селезенки (Фиг.2А). Пролиферация клеток селезенки от крыс, инъецированных hMSC, также увеличивалась после рестимуляции с помощью hMSC in vitro (индекс стимуляции = 15,6); однако пролиферационный ответ в данных клетках не отличался значительно от указанного ответа для клеток селезенки здоровой крысы. Эти данные указывают на то, что хотя hMSC способны индуцировать первичный пролиферативный ответ в лимфоцитах селезенки крысы, введение hMSC крысам не сенсибилизирует лимфоциты in vivo для вторичного пролиферативного ответа in vitro.
Фигура 8А показывает смешанную лимфоцитарную реакцию между клетками селезенки крысы и стромальными клетками костного мозга человека (hMSC): 2×105 клеток селезенки здоровых крыс (N-Spl) или клеток селезенки крыс, подвергнутых обработке IV с hMSC (T-Spl) 2-мя неделями раньше, культивировали в трех повторах с или без облучения (20 Gy) hMSC в течение 96 часов в соотношении 10:1 ответчик/стимулятор. Культуры импульсно метили 3Н-тимидином (0,25 мкКи/на лунку) в течение 16 часов и затем собирали с помощью автоматического устройства для сбора клеток. Включение3Н-тимида измеряли с помощью жидкой сцинтилляции. Не было отмечено никаких отличий между клетками селезенки, полученными от подвергнутых обработке hMSC и необработанных крыс. SI = индекс стимуляции. (В) Клетки селезенки (1×107) культивировали с 1×106 облученными (20 Gy) hMSC в течение 5 дней. В конце периода инкубации жизнеспособные клетки были извлечены из культур и протестированы на цитотоксичность к меченым Cr51 hMSC в 8-часовом анализе высвобождения Cr51 при соотношении эффектор/мишень (E:Т). Клетки селезенки крыс не генерировали ответ на hMSC в виде цитотоксических Т-лимфоцитов. Все значения выражались как среднее арифметическое значение ± SD. Фиг.8В демонстрирует <4% лизиса клеток-мишеней (hMSC) клетками селезенки крысы, и инкубированными со стимуляторами или без них (hMSC). Аналогично, примирование клеток селезенки in vivo путем введения hMSC и последующая рестимуляция с помощью hMSC в культуре в течение 5 дней не вызвали цитотоксичности в них, что указывает на то, что hMSC не индуцируют ответа в виде цитотоксических Т-лимфоцитов в клетках селезенки крысы.
Неврологическое функциональное тестирование
На 14-й день после инсульта функциональное выздоровление, продемонстрированное с помощью теста приклеивания-удаления маркера (р<0,05; см. Фиг.3А) и mNSS-теста (р<0,05; см. Фиг.3В), было обнаружено у крыс, инъецированных 3×106 hMSC через один день после МСАО, по сравнению с контрольными крысами, подвергнутыми только МСАО, и крысами, инъецированными 3×106 фибробластами печени крыс.
Фигура 3 показывает результаты поведенческого функционального тестирования (А: тест на приклеивание-удаление маркера; В: модифицированный оценочный тест на состояние нервной системы [mNSS]) до и после окклюзии срединной церебральной артерии (МСАО). Крысы были подвергнуты только 2-часовой МСАО или были инъецированы культуральными стромальными клетками костного мозга человека (hMSC) (n=9) или клетками печеночных фибробластов крысы (LC; n=9) через 1 день после МСАО. Значительное функциональное выздоровление было обнаружено у крыс, обработанных hMSC, по сравнению с контрольными субъектами. Открытый кружок = МСАО; заполненный кружок = +LC; треугольник = +hMSC.
Количественное определение методом сэндвич-ELISA
При использовании методов сэндвич-ELISA уровни секреции BDNF (969±198 пг/мл против 434±59 пг/мл и 498±76 пг/мл) и NGF (1227±111 пг/мл против 834±123 пг/мл и 980±55 пг/мл) увеличивались (р<0,05) в ишемическом полушарии hMSC-обработанных крыс по сравнению c животными на 7 день после только МСАО без обработки клетками и крысами, обработанными печеночными фибробластами крыс. In vitro данные показывают, что hMSC секретирует BDNF и NGF, зависимым от времени образом. Значительное увеличение BDNF-NGF определялось в безсывороточной среде на 4 и 7 день в культуре по сравнению с 1 днем (таблица 3).
Увеличение BDNF и NGF определялось в безсывороточной среде на 4 и 7 день в культуре, по сравнению с 1 днем в культуре.
*р<0,05
hMSC = стромальные клетки костного мозга;
BDNF = происходящий из головного мозга нейротрофический фактор;
NGF = фактор роста нервов.
Морфологический анализ
Крысам, подвергнутым на 2 часа МСАО, была проведена инфузия 3×106 hMSC на 1 день после ишемии, и затем крысы были умерщвлены на 14 день после МСАО для морфологического анализа. На коронарных слайдах, окрашенных Н-Е, темные и красные нейроны наблюдались в центре ишемии всех крыс, подвергнутых МСАО с инъекцией hMSC и без указанной инъекции. Не было обнаружено никакого значительного снижения объема ишемического повреждения у крыс, обработанных hMSC (объем повреждения (33,3%±7,6%), по сравнению с контрольными крысами, подвергнутыми только МСАО (36,3%±10,5%), или крысами, инъецированными фибробластами печени крыс на 14 день после МСАО (34,6%±9,1%).
Внутри ткани головного мозга клетки, производные от hMSC, характеризовались кругло-овальными ядрами, идентифицированными с помощью человеческих специфических антител mAb1281. hMSC (124×103±46×103; 4% от 3×106 hMSC) выжили и были распределены во всем ишемически поврежденном головном мозге крысы-реципиента. Хотя mAb1281-реактивные клетки наблюдались во множественных зонах ипсилатерального полушария, включая кору и неостриатум, большинство mAb1281-меченых hMSC (60% от общего количества, составляющего 124×103±46×103) было локализовано в пограничной ишемической зоне. Некоторые клетки также были обнаружены в зоне контрлатерального полушария (9×103±2×103; 0,3% от 3×106 hMSC).
Иммуногистохимия с двойным окрашиванием выявила, что некоторые mAb1281-позитивные клетки были реактивны в отношении использованных невральных маркеров. Проценты mAb1281-меченых hMSC, экспрессирующих NeuN, MAP-2, GFAP и vWF, были 1%, 1%, 5% и 2%. Изображения, полученные с помощью лазер-сканирующей конфокальной микроскопии, продемонстрировали колокализацию моноклональных антител, специфических к ядрам человека, mAb1281 (зеленые для идентификации hMSC) с NeuN, MAP-2, GFAP, или vWF (красные для специфичных для типов клеток маркеров) в головном мозге крысы-реципиента (Фиг.4, а-h). Большинство из mAb1281-позитивных клеток окружали сосуды, некоторые клетки располагались в паренхиме.
Фиг.9 представляет собой микрофотографии, демонстрирующие морфологические характеристики экзогенных стромальных клеток костного мозга (hMSC) и эндогенных клеток головного мозга в головном мозге крыс. Используя двойное иммунофлюоресцентное окрашивание, mAb1281 (моноклональные антитела, специфичные к ядрам человека) - реактивные клетки были обнаружены в поврежденной области головного мозга. Изображения, полученные с помощью лазер-сканирующей конфокальной микроскопии, продемонстрировали mAb1281 (зеленый цвет для hMSC [a,c,d,f-h]), нейрональный ядерный антиген (NeuN) (b,c), ассоциированный с микротрубками белок 2 (МАР-2) (e,f), фибриллярный кислый белок глии (GFAP) (g) и vWF (h) (красный для специфичных типов клеток маркеров) в головном мозге крысы-реципиента. Масштабная линейка = 50 мкм.
Используя TUNEL (Фиг.7, а, с и d) и H-E окрашивание (см. Фиг.7b), апоптозные клетки с типичными темно-коричневыми круглыми или овальными апоптозными тельцами были подсчитаны в ишемической пограничной зоне. Внутри эталонных коронарных толщиной 6-мкм срезов, измеренное количество апоптозных клеток было уменьшено (38,5±3,4 против 82,6±3,8 или 76,4±6,8, р<0,05) в ишемической краевой зоне у обработанных hMSC крыс по сравнению с животными на 14 день после только МСАО или ишемическими крысами, обработанными фибробластами печени.
Фиг.7 показывает апоптозные клетки (а: клетки, позитивные по окрашиванию методом опосредованного дезоксинуклеотидилтрансферазой dUTP-биотинного концевого мечения в месте одноцепочечного разрыва [TUNEL] [стрелки]; b: окрашивание гематоксилин-эозином [H&E]) представлено в ишемической краевой зоне после только окклюзии срединной церебральной артерии (МСАО). Уменьшенное количество апоптозных клеток (d: большее выживание клеток, зафиксированных голубым-гематоксилином; головки стрелок) было обнаружено у крыс, инъецированных стромальными клетками костного мозга человека (hMSC), по сравнению с крысами, инъецированными фибробластами печени (с). Несколько бромдезоксиуридин-(BrdU; маркер для вновь синтезированной ДНК)-позитивных клеток (стрелки) были представлены в вентрикулярной зоне/субвентрикулярной зоне (VZ/SVZ) здорового головного мозга (е). Увеличение количеств BrdU-позитивных клеток было обнаружено в VZ/SVZ ипсилатеральных полушариях крыс, подвергнутых только МСАО (f) и крыс, инъецированных фибробластами печени (g). Значительно увеличенное количество BrdU-позитивных клеток было обнаружено в VZ/SVZ у крыс, обработанных hMSC (h), по сравнению с крысами, подвергнутыми МСАО с обработкой клетками печени или без такой обработки. Масштабная линейка = 15 мкм.
Небольшое количество BrdU-позитивных клеток присутствовало в VZ/SVZ (см. Фиг.7, е-h). Значительно больше BrdU-реактивных клеток было обнаружено в VZ/SVZ ипсилатеральных полушарий крыс, подвергнутых МСАО с обработкой hMSC (смотри Фиг.7h), чем у крыс, подвергнутых только МСАО (см. Фиг.7f), или у крыс, обработанных фибробластами печени (см. Фиг.7g). Пять коронарных парафиновых слайдов (толщиной 6 мкм; с интервалом 25 мкм) из стандартного эталонного среза с координатами и брегмы-1,0 1,0 мм были использованы для анализа BrdU-реактивных клеток. Количество BrdU-позитивных клеток на слайд в VZ/SVZ крыс, подвергнутых МСАО с обработкой hMSC (95,3±24,1), было значительно выше, чем количество указанных клеток в VZ/SVZ крыс, подвергнутых только МСАО (27,5±18,5), или ишемических крыс, обработанных фибробластами печени (37,8±11,2). Более высокое количество BrdU-позитивных клеток на слайд экспрессировало NeuN (2,5±0,4 против 0,5±0,6 или 0,6±0,4; р<0, 05) и GFAP (4,4±2,3 против 1,4±1,1 или 1,7±0,5; р<0,05) для крыс, подвергнутых МСАО с обработкой hMSC, чем для крыс, подвергнутых только МСАО, или крыс, обработанных фибробластами печени на 14 день после инфаркта.
Обсуждение
IV инъекция hMSC через 1 день после инсульта значительно улучшила функциональный выход крыс в соответствии с соматосенсорным оценочным тестом и mNSS по сравнению с крысами, подвергнутыми только МСАО или инъецированными фибробластами печени крыс. Указанная польза может отражать продукцию факторов роста, включая нейротропины, которые могут способствовать восстановлению поврежденных паренхиматозных клеток, снизить апоптоз в ишемической пограничной зоне, и повысить пролиферацию и дифференциацию эндогенных нервных стволовых клеток и клеток-предшественников в VZ/SVZ после инсульта у крыс.
Нейронные трансплантанты реверсировали функциональный дефицит, вызванный повреждением головного мозга. Представленные данные реакции трансплантант человека-против крысы-хозяина соответствуют найденным при других исследованиях, демонстрирующих предпочтительное возвращение IV трансплантированных аллогенных клеток костного мозга в место повреждения после возникновения перманентной МСАО и облученных животных, и преходящей в течение 2 часов МСАО у необлученных животных. Морфологический анализ показал, что hMSC способны к селективной миграции в ишемический поврежденный головной мозг крысы. hMSC выживают, и рассеянные немногочисленные hMSC экспрессируют белковые маркеры для паренхиматозных клеток мозга.
Хотя hMSC имеют потенциал к замещению утраченных нейронов, вероятно, что механизм, обеспечивающий терапевтическую пользу, является многосторонним. Представленные данные показывают, что инъекция 3×106 hMSC в 1 день после инсульта улучшает функциональный выход крыс в соответствии с соматосенсорным оценочным тестом и mNSS по сравнению с необработанными крысами на 7 и 14 дни (р<0,01) после введения. Однако только 1%, 5% и 2% hMSC экспрессируют белки нейронных, астроцитарных и эндотелиальных клеток, что слишком рано для полной клеточной дифференциации и интеграции в ткани. Поэтому более вероятным медиатором краткосрочной пользы является то, что hMSC дополняют нарушенные ткани совокупностью факторов роста, способствующих функциональному восстановлению сохранившихся нейронов, и снижают апоптоз в ишемической краевой зоне. MCS могут быть непосредственно вовлечены в обеспечение пластичности ишемически поврежденных нейронов или в стимуляцию глиальных клеток для секреции нейротропинов (например, BDNF и NGF). Взаимодействие hMSC с головным мозгом хозяина может привести hMSC и паренхиматозные клетки к продукции большого количества трофических факторов, которые могут внести свой вклад в восстановление функции, утраченной в результате повреждения. 30,31. С использованием методов сэндвич-ELISA в данном исследовании демонстрируется, что уровни секреции BDNF и NGF значительно увеличиваются в ишемическом полушарии у крыс, обработанных hMSC, по сравнению с животными через 7 дней после только МСАО без клеточной обработки и с обработкой клетками печени крысы. Хотя присутствие BDNF и NGF в ишемическом головном мозге было определено, не исключается возможность того, что другие факторы роста (такие как факторы ангиогенеза VEGF32 и HGF33) могут улучшить функциональный выход, по меньшей мере, частично путем повышения ангиогенеза. Ангиогенез ассоциируется с улучшенным неврологическим выходом из инсульта.
MSC работают как маленькая молекулярная "фабрика". Указанные клетки продуцируют ряд цитокинов и трофических факторов. Также указанные клетки продуцируют упомянутые факторы в течение длительного периода и не в единичной болюсной дозе. MSC экспрессируют многие цитокины, известные как играющие роль в гематопоэзе и также поставляющие аутокринные, паракринные и юкстакринные факторы, самостоятельно воздействующие на клетки микроокружения костного мозга. Вероятно, что MSC внутри церебральной ткани экспрессируют указанные факторы, и именно эффект указанных цитокинов и трофических факторов на ткани головного мозга быстро и эффективно способствует восстановлению функции. Указанные клетки при культивировании при различном ионном микроокружении (например, кальция) отвечают на стимулы ионного микроокружения регулированием экспрессии факторов роста. Указанное наводит на мысль о том, что клетки внутри поврежденной ткани экспрессируют факторы трофики и роста, титруемые до потребностей ткани. В головном мозгу, лечение инсульта с помощью MCS продуцирует ряд трофических факторов и цитокинов, анатомически распределенным, тканечувствительным и временно происходящим образом, в резком контрасте с единичной локализованной инъекцией специфического фактора.
Стволовые нервные клетки находятся внутри VZ/SVZ, и указанные клетки мигрируют по своему предназначению в развивающемся мозге. В головном мозге здорового взрослого отсутствие нейрональной продукции переднего мозга может отражать не отсутствие соответствующих нейрональных клеток-предшественников, а скорее тонизирующее ингибирование и/или недостаток постмитотической трофической и миграционной поддержки. В данном исследовании, количество BrdU-реактивных клеток увеличивалось в VZ/SVZ после МСАО с лечением hMSC по сравнению с только МСАО, что предполагает, что IV инъецированные hMSC могут стимулировать эндогенные клетки головного мозга для пролиферации и участия в восстановлении ишемически поврежденного мозга. Указанные находки согласуются с данными, полученными при использовании IV введения MSC, происходящих от крысы.
IV трансплантация hMSC в крыс не сенсибилизирует крыс против hMSC, как определено при смешанной лимфоцитарной реакции in vitro. Также клетки селезенки здоровых крыс или крыс, инъецированных hMSC, не генерируют ответ на hMSC в виде цитотоксических Т-клеток, функциональный иммунный ответ, вовлеченный в отторжение чужеродного трансплантанта органа/ткани. Указанные данные наводят на мысль о том, что иммунологическое отторжение hMSC у крыс не является проблемой при тестировании hMSC в качестве лечения инсульта. Возможно, более важным является то, что селезенка крысы продемонстрировала небольшую чувствительность к введенным hMSC или ее отсутствие. Неспособность hMSC индуцировать сильный иммунный ответ может быть связана со слабой иммуногенностью этих клеток вследствие отсутствия или низкой экспрессии молекул главного комплекса гистосовместимости (класс I - класс II) и костимулирующих молекул (CD40, CD80 и CD86). Кроме того, hMSC могут также секретировать растворимые медиаторы, которые уменьшают развитие иммунных ответов, вовлеченных в отторжение ксено-трансплантантов. Эти данные требуют дополнительных исследований с целью изучения иммуногенности аллогенных клеточных популяций MSC.
Приведенные данные показывают, что IV введенные hMSC способствуют неврологическому функциональному восстановлению в течение 2 недель после инсульта. hMSC селективно входят церебральный ишемический регион. Взаимодействие между hMSC и ишемическим мозгом повышает секрецию нейротропинов, что может снизить нейрональный апоптоз в ишемической краевой зоне и способствовать клеточной пролиферации из относительно интактной SVZ в ишемическом мозге. Однако мигрируют ли клетки, образующиеся в SVZ, и интегрируют ли они в ишемический головной мозг, еще не определено. В ЦНС эффективное лечение нейронного повреждения может потребовать активации эндогенного компенсаторного механизма, включая ремоделирование церебрального кровообращения, при этом точные механизмы являются неизвестными. С выяснением механизмов, лежащих в основе MSC-индуцированного уменьшения неврологического дефицита, а также демонстрацией долгосрочного терапевтического эффекта, hMSC могут обеспечить действенную молекулярную и клеточную терапию инсульта и возможно широкого ряда неврологических нарушений у человека.
Пример 3:
Лечение нейронного повреждения: преклинические протоколы
При рассмотрении гипотезы о том, что MSC способствуют функциональному восстановлению после инсульта, авторы настоящего заявки столкнулись с различными вариантами выполнения преклинических протоколов клеточной терапии. В числе поднятых вопросов были, когда и куда имплантировать клетки. Поскольку интерес представляет восстановительная терапия, с гипотезой о том, что размер ишемического повреждения не изменяется посредством эффективной восстановительной терапии, авторы настоящей заявки изначально выбрали лечить животных через 1 день или более после инсульта. Указанный интервал времени клинически обоснован. Если дефициты сохраняются на следующий день после инсульта, событие классифицируется как инсульт, а не как приходящая ишемическая атака. В 1 день пациенты имеют тенденцию к стабилизации, и степень неврологических дефицитов может быть легко оценена.
Самый прямой способ размещения клеток в мозге производится путем хирургической трансплантации. Должны ли клетки размещаться в повреждении, в здоровой неишемической ткани или в пограничной зоне? Основываясь на наблюдении головного мозга, в частности, с пограничной зоной повреждения, находящейся в развивающейся фазе, в начальных исследованиях авторы настоящей заявки выбрали разместить недифференцированные клетки костного мозга в пограничной ткани. Так, клетки были экстрагированы от крысы-донора и хирургически и стереотактически имплантированы в пограничную зону ишемического повреждения внутри субкортикальной и кортикальной ткани. Основная проверяемая гипотеза заключалась в том, что указанные клетки способствуют функциональному восстановлению, так что неврологические и функциональные тесты были проведены на животных. Было проведено комплексное неврологическое обследование (таблица 1). Указанное обследование, модифицированный оценочный тест состояния нервной системы (mNSS), обеспечивает индекс моторного и сенсорного рефлекса и мышечный статус. В дополнение, авторы настоящей заявки использовали соматосенсорный тест, который включает удаление липкого ярлычка с лапы, и ротационный тест, который измеряет время устойчивости крысы на ускоряющемся беговом колесе. Измерения были проведены перед инсультом и через 7 и 14 дней сразу после события. Животные были умерщвлены на 14 день, и трансплантированные клетки в церебральных тканях искали по гистологии. Вопрос, адресованный данному гистологическому анализу, звучал так: дифференцируют ли MSC в паренхиматозные клетки головного мозга? Подобные эксперименты были проведены на мышах, подвергнутых эмболической окклюзии срединной артерии мозга и подвергнутых лечению внутрицеребральной трансплантацией недифференцированных клеток всего костного мозга от мыши-донора. Функциональные измерения были проведены на 28 день после трансплантации. Наблюдалось замечательное и быстрое функциональное восстановление после помещения указанных клеток в пограничную зону ишемического повреждения. Подобные исследования интрапаренхимальной трансплантации MSC в стриатум (полосатое тело) мыши, у которой паркинсоноподобное повреждение было индуцировано 1-метил-4-фенил-1,2,3,6-тетрагидропиридином, продемонстрировали значительное восстановление моторной функции. Аналогично, MSC имплантировали в смежную к контузионному повреждению область спинного мозга, и значительная функциональная польза была очевидной.
Вариации указанных экспериментов показали, что совместное введение MSC c трофическими факторами, такими как происходящий из головного мозга фактор роста нерва, способствует функциональному восстановлению, а предварительное культивирование указанных клеток с факторами роста содействует функциональной пользе, а также повышению количества клеток, которые экспрессируют белки, фенотипические для клеток головного мозга. Акклиматизация клеток в культуре к окружению головного мозга, вероятно, облегчает переход от in vitro к in vivo. Многие из трансплантированных клеток костного мозга подверглись апоптозу в ишемическом головном мозге. В силу указанных причин, авторы настоящего изобретения вводили совместно с клетками костного мозга Z-Val-Ala-DL-Asp-фторметилкетон (Z-VAD), ингибитор каспазы. Гипотеза была подтверждена; количество апоптозных клеток значительно уменьшилось, и функция, измеренная в ротаторном тесте, показала приращенную выгоду. Таким образом, даже с клеточной терапией, дополнительная терапия может улучшить желаемый выход.
Подобные терапевтические вмешательства также были эффективны в моделях на животных травматического повреждения головного мозга, повреждении спинного мозга и болезни Паркинсона; во всех трех моделях имелось значительное снижение неврологического дефицита с проведением хирургической имплантации MSC. Терапевтическая польза стала очевидной через несколько дней после трансплантации. Однако, только 1-3% клеток экспрессировали белки, фенотипические для паренхиматозных клеток. Хотя пропорция клеток, экспрессирующих такие белки, может быть повышена путем предварительного культивирования, количества трансплантированных клеток были ничтожными по сравнению с количеством клеток ткани полушарий головного мозга, подвергнутых инфаркту после окклюзии срединной артерии мозга (примерно 40%). На 14 день после окклюзии выжило около 5000 клеток (SE 18000) или 12,5% от трансплантированных 400000 клеток; небольшой процент клеток экспрессировали нейронные белки - весьма незначительный для замещения ткани, подвергнувшейся инфаркту.
Успех прямой трансплантации в головной мозг указанных клеток побудил к экспериментам по исследованию менее инвазивных сосудистых способов введения. Крысы были подвергнуты окклюзии срединной артерии мозга, и сонная артерия ипсилатеральнее полушария с ишемическим повреждением была канюлирована для инъекции клеток. Около 2 миллионов MSC было инъецировано в 1 день после инфаркта. Был проведен ряд неврологических тестов до и после лечения. Гистологический анализ показал малое число клеток, экспрессирующих белки, фенотипические для паренхиматозных клеток. Однако значительная функциональная польза была очевидной. Авторы настоящей заявки также протестировали потенциал артериального пути введения MSC для лечения травматического повреждения головного мозга. Хотя клетки входили в головной мозг при введении через каротидный путь, не имелось функциональной пользы, возможно из-за того, что указанный путь введения требовал перевязки внутренней сонной артерии, вызывая существенную гипоперфузию, отягощающую имеющееся травматическое повреждение головного мозга.
Авторы настоящей заявки затем рассмотрели пригодность более клинически адекватного внутривенного пути введения. Указанный подход с очевидностью менее инвазивен и имеет меньше побочных эффектов, чем каротидная или прямая тканевая инъекция. Венозные пути введения также позволяют проводить многократное и долговременное лечение клетками.
Другие исследователи показали, что клетки, введенные внутривенно, находят свой путь в головной мозг. Однако не имелось исследований, показывающих, что при повреждении, таком как инсульт или травма, внутривенно введенные клетки могут селективно мигрировать в место ишемического повреждения и обеспечивать функциональную пользу. Поэтому авторы настоящей заявки протестировали данную гипотезу на крысах, подвергнутых окклюзии срединной артерии мозга. В первый день или позже после инфаркта, 1-3 миллиона MSC были инъецированы в хвостовую вену. Авторы настоящей заявки провели серию измерений неврологических выходов (таблица 1). Животные, которым в 1 день после инфаркта были введены клетки, были умерщвлены на 14 день после инсульта (фигура 1), а животные, подвергнутые лечению 7 дней после инфаркта, были умерщвлены на 35 день. Как и в предыдущих экспериментах, клетки были помечены бромодезоксиуридином, маркером вновь синтезированной ДНК, для индикации образования новых клеток. Также, MSC от крыс-самцов были инъецированы животным-самкам, и клетки были идентифицированы путем гибридизации с Y-хромосомой in situ. Подвергнутые лечению животные показали значительное функциональное улучшение в связи с лечением (фигура 2). Контрольные популяции клеток были также использованы для тестирования специфичности клеточного типа в способствовании улучшению функции. Убитые MSC и фибробласты печени и легких (в качестве немезенхимальных клеточных контролей) показали отсутствие терапевтической пользы и были не лучше, чем фосфатно-буферный солевой контроль. Таким образом, внутривенный путь введения обеспечивает значительное функциональное улучшение после инсульта и травмы. Сказанное было также справедливо при лечении, начатом через 7 дней после инсульта, и функциональная польза была сходной у крыс-самцов и крыс-самок.
В попытке приближения к условиям теста у человека, стромальные клетки костного мозга человека были использованы в качестве популяции донорских клеток, вместо MSC крыс. Клетки человека были получены путем пункции заднего подвздошного крестцового сочленения у здоровых доноров под местной анестезией. Мононуклеарные клетки экстракта костного мозга (15-16 мл) были отделены. Доза в 3 миллиона MSC человека была введена внутривенно каждой крысе, в 1 день после окклюзии или после травматического повреждения головного мозга. Значительное функциональное улучшение было обнаружено как после инсульта, так и после травмы. Клетки человека могут быть легко получены от доноров. Они могут быть легко размножены до очень больших количеств, и антитела являются доступными для разделения путем проточной цитометрии или магнитного сортирования клеток. MSC человека были использованы для лечения пациентов с раком или рассеянным склерозом. Таким образом, доступны данные о безопасности, полученные на людях.
Авторы настоящего изобретения не наблюдали какого-либо указания на иммунное отторжение (неопубликованные наблюдения). Селезенки неподвергнутых лечению крыс и животных, подвергнутых лечению MSC человека, удаляли и культивировали с MSC человека. Пролиферация клеток селезенок от крыс, инъецированных MSC человека, увеличивалась после рестимуляции указанными клетками in vitro; однако пролиферативный ответ не отличался значительно от указанного ответа в клетках селезенки у неподвергнутых лечению крыс. Таким образом, несмотря на то, что MSC человека могут индуцировать первичный пролиферативный ответ в селезеночных лимфоцитах крыс, введение указанных клеток крысам не сенсибилизирует лимфоциты in vivo для вторичного пролиферативного ответа in vitro. Т-лимфоциты, как полагают, являются инициатором заболевания "трансплантант-против хозяина". Поэтому, ответ Т-клеток крыс-хозяев на трансплантант человека был измерен при помощи стандартного Хром-51 анализа для оценки литического эффекта. MSC человека не индуцировали цитотоксичный Т-лимфоцитарный ответ в клетках селезенки крыс. Авторы настоящей заявки не могут исключить возможности того, что грызуны и люди могут по-разному отвечать на лечение. Однако другой возможностью является то, что универсальная клетка, аллогенные клетки, а не аутологичные клетки, может быть использована для лечения пациентов. Ясно, что получение большего количества данных на людях требуется для проверки данной гипотезы. Начальное клиническое применение может повлечь за собой аутологическую трансплантацию.
Имеется еще много поднятых вопросов, требующих ответа, включая, как указанные клетки целенаправленно попадают в места повреждения и каким образом они обеспечивают пользу. Как клетки знают, куда направляться? Какой механизм нацеливает указанные клетки специфично на места повреждения? Однако самым интересным вопросом является исследование эффектов клеток на головной мозг, и как указанные эффекты превращаются в терапевтический эффект.
Целевое направление MSC в места церебрального повреждения
Куда направляются внутривенно введенные клетки? Во-первых, инъецированные клетки должны быть помечены для того, чтобы иметь возможность их идентификации в тканях. MSC можно идентифицировать посредством реактивности антител с различными метками. MSC можно пометить бромдезоксиуридином; полученные от самцов клетки могут быть инъецированы животным-самкам, и Y-хромосома идентифицируется путем гибридизации in-situ; или клетки человека могут быть инъецированы крысам, и могут использоваться антитела к антигенам человека. Внутривенно введенные клетки были обнаружены в печени, почках, селезенке и костном мозге. Однако большинство идентифицированных MSC окружают микрососуды этих органов, и малое число клеток локализуется в паренхиме. Очень немногие клетки (1,5-3,0% из 3 миллионов инъецированных MSC на 14-35 день после лечения) были обнаружены в паренхиме ткани головного мозга. В поврежденном головном мозге, или после инсульта или после травматического повреждения, огромное большинство клеток было нацелено в область повреждения. Например, после инсульта, более чем 80% клеток было в поврежденном полушарии, причем большинство указанных клеток накапливается в зонах вокруг повреждения. Многие клетки также были представлены прилегающими к сосудам или находящимися внутри сосудов. Как клетки нацеливаются в поврежденную ткань, и является ли важной локализация этих клеток в микроциркуляторной части сосудистого русла?
Стремление MSC в места повреждения напоминает ответ клеток воспаления на поврежденные ткани. Нейтрофилы и моноциты нацелены в поврежденные и воспалительные ткани с помощью «оркестрированной» последовательности сосудистых и клеточно-молекулярных сигналов. Молекулы адгезии и их рецепторы, экспрессированные на воспалительных клетках и сосудистой системе, направляют клетки в поврежденную ткань и транспортируют указанные клетки через сосудистую границу, обычно проникая через гематоэнцефалический барьер. Указанные молекулы нацеливания и адгезии действуют вместе с хемокинами. Поэтому авторы настоящей заявки протестировали, руководят и нацеливают ли молекулы адгезии и хемоаттрактивные агенты MSC в головной мозг. Авторы настоящего изобретения использовали камеру Boyden, исследование для миграции клеток между двумя камерами, разделенными проницаемой мембраной. MSC доводили до 5×105 клеток/мл в миграционной среде (модифицированная Исков среда Дульбекко с 5% бычьим сывороточным альбумином). 50 л клеточной суспензии было добавлено в каждую верхнюю ячейку. Количество MSC, мигрировавших в нижнее пространство, было подсчитано в пяти оптических полях (поле 0-12 мм2). Поскольку ткань ишемического головного мозга экспрессирует хемотактические белки, такие как хемоаттрактивный белок 1 моноцита и воспалительный белок 1 макрофага, авторы настоящего изобретения поместили указанные субстанции в нижнюю камеру, для обеспечения дозозависимого увеличения миграции. Похожие ответы были обнаружены, когда молекулы адгезии, такие как внутриклеточная молекула 1 адгезии, были помещены в нижнюю камеру. Повышенная миграция была эффективно блокирована добавлением антител к молекулам адгезии или хемокинов в нижнюю камеру. Когда ткань головного мозга, подвергнутого травматическому повреждению или инсульту, помещалась в нижнюю камеру, клеточная миграция также значительно повышалась. Указанные находки обеспечивают понимание того, как клетки приобретают воспалительно-подобную идентичность и как они достоверно "узнают" как цель поврежденную ткань. Таким образом, любое повреждение, которое имеет воспалительный ответ, включая нейродегенеративные процессы, такие как болезнь Паркинсона и рассеянный склероз, может направить MSC в поврежденные места. Зависимость руководства от степени повреждения также обеспечивает форму титрации "эффективной дозы" клеток. Чем большей является степень повреждения и сопутствующей воспалительной реакции, тем большее количество клеток направляется в данное место.
Механизм действия
Каким образом клетки воздействуют на головной мозг и тем самым способствуют функциональному восстановлению от повреждения и патологических процессов? Возможность того, что MSC приносят пользу мозговой ткани, становясь клетками головного мозга, является маловероятной. При внутривенной инъекции и количестве интрапаренхиматозных клеток, исчисляемом, самое большое несколькими сотнями тысяч, присутствует очень мало клеток, даже если они становятся клетками головного мозга, чтобы заместить объем ткани более чем пять кубических миллиметров. Польза определяется во многих случаях через несколько дней после лечения. Самое большее, лишь небольшая часть клеток экспрессирует белки, фенотипические для паренхиматозных клеток. Экспрессия указанных белков не указывает на достоверную дифференциацию и нейронную или глиально-клеточную функцию. После только короткого периода является крайне невероятным, что дифференцировавшие клетки интегрируют точно в ткань и формируют сложные связи, которые улучшают функцию. Таким образом, замещение ткани как механизм, с помощью которого MSC способствуют их полезному эффекту, является крайне невероятным. Намного более приемлемое объяснение пользы заключается в том, что MSC индуцируют мозговую ткань к активации эндогенных восстановительных действий мозга. MSC могут запускать реакции и взаимодействовать с головным мозгом для активации восстановительных механизмов и возможно регенеративных механизмов.
MSC подобны маленькой молекулярной фабрике, продуцирующей много различных цитокинов и трофических факторов. Вероятно, MSC в ткани головного мозга или в микрососудистом русле поврежденного головного мозга экспрессируют указанные факторы и действие трофических факторов на ткань головного мозга представляет собой механизм, который быстро и эффективно способствует восстановлению функции. Авторы настоящей заявки показали, что MSC продуцируют фактор роста гепатоцитов, VEGF, фактор роста нервов (NGF), и происходящий из головного мозга нейротрофический фактор (BDNF), среди многих других трофических факторов и факторов роста. Указанное разнообразие факторов, а не единичный конкретный фактор роста, содействует полезному эффекту. Очень важным наблюдением является то, что MSC при культурировании при различном ионном микроокружении отвечают за стимулы регулированием экспрессии факторов роста. Указанная находка наводит на мысль о том, что клетки в поврежденной ткани экспрессируют трофические факторы и факторы роста, скорректированные к нуждам ткани. Различное окружение воздействует на секрецию указанных факторов. Так, степень тканевого повреждения и соответствующего нарушения ионного окружения будет диктовать секрецию трофических факторов. Авторы настоящей заявки протестировали эту гипотезу при нескольких экспериментальных условиях. Культура MSC в тканях, экстрагированных из головного мозга, подвергнутого инсульту или повреждению, значительно увеличивает секрецию трофических факторов. Ответные секреции MSC на поврежденный головной мозг отличаются в соответствии со временем, в которое ткань экстрагируют из подвергнутого воздействию мозга. Указанные эксперименты являлись шагом вперед к измерению экспрессии факторов роста в головном мозге, подвергнутом лечению MSC. Авторы настоящей заявки использовали количественный сэндвич-ELISA, измеряющий путем методов иммунного мечения экспрессию факторов роста в головном мозге. Экспрессия трофических факторов была значительно больше у MSC-леченных животных, чем у нелеченных животных, подвергнутых инсульту или травме.
Предположив, что MSC селективно входят в поврежденный головной мозг и секретируют факторы роста и трофические факторы в замкнутой системе обратной связи с тканью, каким образом указанные факторы изменяют головной мозг для индукции терапевтического эффекта? Рабочая гипотеза состоит в том, что терапевтическая польза индуцируется рядом событий, ассоциированных с пластичностью головного мозга; но указанный процесс включает, но не ограничивается указанным, ангиогенез, нейрогенез, синаптогенез, разветвление дендритов и снижение апоптоза в стратегически важных тканях в пограничной зоне ткани.
VEGF и основной фактор роста фибробластов являются мощными ангиогенными агентами. Авторы настоящей заявки протестировали эффект MSC или супернатанта MSC на индукцию ангиогенеза. Измерения были проведены с помощью анализа на эндотелиальных клетках головного мозга человека, в котором супернатанты от MSC, как было показано, индуцируют быстрое формирование сосудов, что отражает структурный и ангиогенный процесс. Анализ, использованный in vivo, являлся классическим аваскулярным роговичным анализом. Хирургический разрез формирует карман в роговице, и коллагеновая облатка, покрытая MSC-супернатантом или самими MSC, вставляется в карман. Контрольные условия состояли из хирургического разреза и помещения только коллагеновой облатки или помещения VEGF непосредственно в карман. Авторы настоящей заявки наблюдали быстрый и сильный ангиогенез в роговице, обработанной облаткой, покрытой супернатантом MSC. Несмотря на то, что многие из клеток, напрямую помещенных в роговичный разрез, диффундируют из места помещения, ангиогенез был очевидным. У контрольных животных ангиогенеза не имелось (фигура 2). Индукция ангиогенеза была более сильной в случае с супернатантом MSC по сравнению с прямым использованием VEGF, что наводит на мысль о том, что супернатант является высоко эффективным источником факторов ангиогенеза. Предварительные исследования индукции ангиогенеза при лечении MSC ткани головного мозга также предполагают повышение формирования новых кровеносных сосудов (неопубликованные наблюдения). Хотя индукция ангиогенеза напрямую не переходит в усиление функции, авторы настоящей заявки предварительно показали, что лечение инсульта VEGF на следующий день после инсульта или позже, значительно улучшает функциональное восстановление и повышает ангиогенез.
Индукция нейрогенеза с помощью MSC также может вносить вклад в функциональное улучшение после инсульта. Важным местом нейрогенеза является область, прилежащая к латеральным желудочкам - субвентрикулярная зона. Нейрогенез также обнаружен в обонятельных луковицах и зубчатой извилине головного мозга грызунов. Церебральное повреждение, такое как инсульт, усиливает продукцию нейронов в определенных областях головного мозга. Функциональное восстановление, особенно при длительном сроке после инсульта, может быть отнесено к продукции новых клеток головного мозга. Механизм, обеспечивающий продукцию указанных клеток, может улучшить выход. Авторы настоящей заявки протестировали эффекты лечения инсульта клетками MSC на индукцию нейрогенеза. Значительное повышение количества клеток было измерено в субвентрикулярной зоне после инсульта. Многие из указанных клеток имели маркеры вновь сформированных клеток-предшественников, как показано при экспрессии специфических молекулярных маркеров, таких как TUJ-1. Церебральная ткань в ипсилатеральном полушарии также показала массивное увеличение экспрессии маркеров стволовых клеток, нестина, и указывает на активацию церебральной ткани в исходное состояние или состояние развития. Гистологический анализ церебральной ткани, трансплантированной MSC, также показал присутствие розеток нейросфер в ишемической ткани. Указанные розетки нейронных клеток подобны таковым, найденным в развивающемся головном мозге. Миграция данных клеточных систем в церебральную ткань может направляться астроцито-подобными проекциями, происходящими из вентрикулярной зоны, вновь напоминая о событии, происходящем в развивающемся мозге. Таким образом, присутствие клеток костного мозга, очевидно, обеспечивает быструю индукцию и миграцию новых клеток из первичного источника в желудочковой зоне и хориоидном сплетении в поврежденный головной мозг. Указанные клетки могут вносить вклад в функциональное восстановление, хотя отношение индукции нейрогенеза и миграции указанных клеток к восстановлению функции непосредственно не протестировано.
Факторы роста и трофические факторы, продуцируемые MSC, могут воздействовать на синаптогенезис и увеличивать разветвление дендритов в поврежденном и ишемическом мозге. Прямой эффект от лечения инсульта клетками MSC на разветвление дендритов ожидает дальнейших экспериментов. В предварительных экспериментах авторы настоящего изобретения показали повышенную экспрессию синаптофизина, синаптического белка, в пограничной зоне ишемического повреждения после инсульта.
Глиоз может быть сдерживающим фактором прироста аксонов и разветвления после неврального повреждения. Трансформирующие факторы роста - белки, являются наиболее важным для заживления ран и, как полагают, игибирования рубцевания на коже и в миокарде и восстановления без рубцов, обнаруженного у плода. Поскольку MSC продуцируют указанный фактор роста, терапевтическая польза также может быть результатом снижения рубцевания и последующего улучшения синаптогенеза и разветвления дендритов.
В дополнение к цитокинам и факторам роста и трофическим факторам, MSC экспрессируют факторы, связанные с формированием кости, такие как остеобласт-специфический фактор 2 и костный морфогенетический белок 1. Они также экспрессируют нейронную клеточно-адгезивную молекулу нейрофилин и нейротрофические факторы, включая NGF и BDNF. Недавние исследования показали, что костные морфогенетические белки, слуховая улитка, паратиреоидный гормон и фактор роста фибробластов восемь имеют регуляторную роль во время дифференциации эмбриональных клеток, путем модификации мезодермального и нейроэктодермального путей. Тщательное рассмотрение и дальнейшие эксперименты подтверждают, вносит ли вклад секреция клетками MSC каскада цитокинов в поврежденном головном мозге в функциональную пользу.
Область перед повреждением является высоко восприимчивой к гибели апоптозных клеток. Апоптоз персистирует в течение нескольких месяцев после инсульта и травмы головного мозга? Эффекты на восстановление неизвестны. Авторы настоящего изобретения показали, что лечение инсульта и травмы головного мозга клетками MSC значительно уменьшает апоптоз в данной области. Эффект может быть опосредован продукцией факторов роста, таких как NGF, в поврежденном головном мозге. Авторы настоящей заявки делают предположение о том, что селективное снижение апоптоза в этой области может поддерживать восстановление в проводящей системе головного мозга.
Механизм, благодаря которому ремоделирование головного мозга, нейрогенез и нейропротективный механизм вызывают функциональное улучшение после повреждения, является неопределенным и важной темой исследования. Вопрос, вносят ли действительно все указанные события, усиленные лечением MSC, вклад в улучшение выхода после инсульта и травмы, находится в стадии исследования.
В настоящее время, специфические события, способствующие восстановлению неврологической функции, не могут быть изолированы. Однако авторы настоящего изобретения делают предположение, что процесс, способствующий восстановлению функции, не является простой модификацией ткани (например, нейрогенез), но, наиболее вероятно, сплетенным рядом событий, ангиогенеза, нейрогенеза, синаптогенеза и пограничного снижения рубцевания и апоптоза, которые вносят вклад в сопряженные, если не синергические, способы улучшения функции. Хотя проверка данной гипотезы и идентификация специфических факторов, вносящих вклад в улучшение неврологической функции, является высоко оцениваемой, авторы настоящего изобретения ограничили способность селективного повышения апоптоза в пограничной зоне с целью снижения ангиогенеза без воздействия на нейрогенез.
Поврежденная церебральная ткань во многих аспектах повторяет онтогенез. После инсульта или повреждения, ткань головного мозга возвращается на ранние стадии развития и таким образом становится высокочувствительной к стимуляции цитокинами и трофическими факторами и факторами роста от инвазирующих MSC. MSC возможно стимулируют в псевдоразвивающейся церебральной ткани структурные и регенеративные изменения, включая ангиогенез, васкулогенез, нейрогенез и разветвление дендритов. Примитивное состояние ткани, являющейся высокочувствительной к различным стимуляторам и факторам роста, а не примитивное состояние MSC, первично благоприятствует терапевтическому ответу. MSC могут просто обеспечивать ресурсы, необходимые онтогеннной ткани головного мозга для стимуляции ремоделирования головного мозга. Авторы настоящего изобретения не исключают возможности того, что другие клетки ли оркестрованная последовательность титруемых инфузий цитокинов и факторов роста могут стимулировать поврежденные клетки головного мозга к ответу и восстановлению функции. Аналогично, авторы настоящего изобретения не могут исключить возможность того, что субпопуляция MSC является подобной стволовым клеткам или клеткам-предшественникам и может синергически реагировать с поврежденной тканью. Однако авторы настоящего изобретения уверены в том, что MSC не восстанавливают ткань в головном мозге и не дифференцируются в функционирующие нейроны и поддерживающие астроциты, по крайней мере, во временной шкале, в которой авторы настоящей заявки видят функциональную пользу. Первичную пользу получают путем активации поврежденной ткани для ремоделирования и компенсирования повреждения. Фигура 3 иллюстрирует настоящее понимание процесса, при котором MSC могут быть собраны и использованы для лечения поврежденной ткани головного мозга.
Трансплантация пациентам
Очевидно, что вопросы безопасности должны быть подняты прежде, чем указанная форма клеточной терапии может быть использована у пациентов с инсультом. Несмотря на то, что трансплантация костного мозга является обычной процедурой в лечении рака, и использовалась в качестве дополнительной терапии в лечении рассеянного склероза, исследования I фазы на безопасность при инсульте подтверждаются. На сегодняшний день, в исследованиях на почти 2000 животных с инсультом, авторы настоящего изобретения не определили какого-либо побочного эффекта терапии или проявлений формирования опухоли. Должны ли пациенты лечиться собственными клетками, HLA-совместимыми клетками или универсальной донорской популяцией? Данные преклинических исследований до сих пор показывают, что лечение клетками донора является возможным. Однако, преклинические исследования и клинические исследования фазы I должны быть проведены, чтобы ответить на этот вопрос. Преклинические и фундаментальные исследования, описанные в данном обзоре, показывают, что лечение инсульта при помощи MSC может обеспечить жизнеспособную и высоко эффективную восстановительную терапию. Таким образом, клинические исследования являются обоснованными.
В продолжение указанной заявке имеются ссылки на различные публикации, включая патенты Соединенных Штатов, путем указания автора, года и номера патента. Полный список публикаций приведен ниже. Полное раскрытие указанных публикаций и патентов включается таким образом посредством ссылки в данную заявку для того, чтобы более полно описать состояние предшествующего уровня техники, к которому относится данное изобретение.
Изобретение описано иллюстративным образом, и следует понимать, что терминология, которая использовалась, предназначена для характеристики слов описания, а не ограничения.
Безусловно, многие модификации и вариации настоящего изобретения являются возможными в свете вышеприведенного руководства. Вследствие этого, следует понимать, что в пределах объекта описанного изобретения изобретение может быть осуществлено иначе, чем как конкретно описано.
ССЫЛКИ
Burke and Olson, "Preparation of Clone Libraries in Yeast Artificial-Chromosome Vectors" in Methods in Enzymology, Vol.194, "Guide to Yeast Genetics and Molecular Biology", eds. C. Guthrie and G. Fink, Academic Press, Inc., Chap. 17, pp. 251-270 (1991).
Capecchi, "Altering the genome by homologous recombination" Science 244: 1288-1292 (1989).
Davies et al., "Targeted alterations in yeast artificial chromosomes for interspecies gene transfer", Nucleic Acids Research, Vol.20, No.11, pp.2693-2698 (1992).
Dickinson et al., "High frequency gene targeting using insertional vectors", Human Molecular Genetics, Vol.2, No.8, pp.1299-1302 (1993).
Duff and Lincoln, "Insertion of pathogenic mutation into a yeast artificial chromosome containing the human APP gene and expression in ES cells", Research Advances in Alzheimer's Disease and Related Disorders, 1995.
Huxley et al., "The human HPRT gene on a yeast artificial chromosome is functional when transferred to mouse cells by cell fusion", Genomics, 9:742-750 (1991).
Jacobovits et al., "Germ-line transmission and expression of a human-derived yeast artificial chromosome", Nature, Vol.362, pp.255-261 (1993).
Lamb et al., "Introduction and expression of the 400 kilobase precursor amyloid protein gene in transgenic mice", Nature Genetics, Vol.5, pp.22-29 (1993).
Pearson and Choi, Expression of the human b-amyloid precursor protein gene from a yeast artificial chromosome in transgenic mice. Proc. Natl.Acad.Sci. USA, 1993. 90:10578-82.
Rothstein, "Targeting, disruption, replacement, and allele rescue: integrative DNA transformation in yeast" in Methods in Enzymology, Vol. 194, "Guide to Yeast Genetics and Molecular Biology", eds. C. Guthrie and G. Fink, Academic Press, Inc., Chap. 19, pp. 281-301 (1991).
Schedl et al., "A yeast artificial chromosome covering the tyrosinase gene confers copy number-dependent expression in transgenic mice", Nature, Vol. 362, pp.258-261 (1993).
Strauss et al., "Germ line transmission of a yeast artificial chromosome spanning the murine a1 (I) collagen locus", Science, Vol. 259, pp. 1904-1907 (1993).
Gilboa, E, Eglitis, MA, Kantoff, PW, Anderson, WF: Transfer and expression of cloned genes using retroviral vectors. Bio Techniques 4(6):504-512, 1986.
Cregg JM, Vedvick TS, Raschke WC: Recent Advances in the Expression of Foreign Genes in Pichia pastoris, Bio/Technology 11:905-910, 1993.
Culver, 1988. Site-Directed recombination for repair of mutations in the human ADA gene. (Abstract) Antisense DNA & RNA based therapeutics, February, 1988, Coronado, CA.
Huston et al, 1991 "Protein engineering of single-chain Fv analogs and fusion proteins" in Methods in Enzymology (JJ Langone, ed.; Academic Press, New York, NY) 203:46-88.
Johnson and Bird, 1991 "Construction of single-chain Fvb derivatives of monoclonal antibodies and their production in Escherichia coli" in Methods in Enzymology (JJ Langone, ed.; Academic Press, New York, NY) 203:88-99.
Mernaugh and Mernaugh, 1995 "An overview of phage-displayed recombinant antibodies" in Molecular Methods In Plant Pathology (RP Singh and US Singh, eds.; CRC Press Inc., Boca Raton, FL) pp. 359-365.
AY H, AY I, KOROSHETZ WJ, et al. (1999) Potential usefulness of basic fibroblast growth factor as a treatment for stroke. Cerebrovasc Dis 9:131-135.
AZIZI SA, STOKES D, AUGELLI BJ, et al., (1998) Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats-similarities to astrocyte grafts. Proc Natl Acad Sci USA 95:3908-3913.
BEREZOVSKAYA O, MAYSINGER D, and FEDOROFF S (1995) The hematopoietic cytokine, colony-stimulating factor 1, is also a growth factor in the CNS: congential absence of CSF-1 in mice results in abnormal microglial response and increased neuron vulnerability to injury. Int J Dev Neurosci 13:285-299.
BJORKLUND A, and LINDVALL O (2000) Cell replacement therapies for central nervous system disorders. Nat Neurosci 3:357-544.
BULLOCK MR, LYETH BG, and MUIZELAAR JP (1999) Current status of neuroprotection trials for traumatic brain injury: lessons from animal models and clinical studies, Neurosurgery 45:207-217; discussion 217-220.
CANEVA L, SOLIGO D, CATTORETTI G, et al. (1995) Immuno-electron microscopy characterization of human bone marrow stromal cells with anti-NGFR antibodies. Blood Cells Mol Dis 21:73-85.
CHEN J, LI Y, WANG L, et al. (2000) Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke 32:1005-1011.
CHOPP M, ZHANG XH, LI Y et al. (2000) Spinal cord injury in rat: treatment with bone marrow stromal cells transplantation. Neuroreport 11:3001-3005.
DENG W, OBROCKA M, FISCHER I et al. (2001) In vitro differentiation of human marrow stromal into early progenitors of neural cells by conditions that increase intracellular cyclic AMP. Biochem Biophys Res Commun 282:148-152.
DIXON CE, CLIFTON GL, LIGHTHALL JW, et al. (1991) A controlled cortical impact model of traumatic brain injury in the rat. J Neurosci Methods 39:253-262.
DORMADY SP, BASHAYAN O, DOUGHERTY R, et al. (2001) Immortalized multipotential mesenchymal cells and the hematopoietic microenvironment. J Hematother Stem Cell Res 10:125-140.
GAGE FH (2000) Mammalian neural stem cells. Science 287:1433-1438.
HEFTI F (1986) Nerve growth factor promotes survival of septal cholinergic neurons after neurons after fimbrial transections. J Neurosci 6:2155-2162.
KOLIATSOS VE, CLATTERBUCK RE, WINSLOW JW, et al. (1993) Evidence that brain-derived neurotrophic factor is a trophic factor for motor neurons in vivo. Neuron 10:359-367.
KOPEN GC, PROSCKOP DJ, and PHINNEY DG (1999) Marrow stromal cells migrate throughout forebrain and cerebellum, and they differentiate into astrocytes after injection into neonatal mouse brains. Proc Natl Acad Sci U S A 96:10711-10716.
KROMER LF (1987) Nerve growth factor treatment after brain injury prevents neuronal death. Science 235:214-216.
LABOUYRIE E, DUBUS P, GROPPI A, et al. (1999) Expression of neurotrophins and their receptors in human bone marrow. Am J Pathol 154:405-415.
LI Y, CHOPP M, CHEN J, et al (2000) Intrastriatal transplantation of bone marrow nonhematopoietic cells improves functional recovery after stroke in adult mice. J Cereb Blood Flow Metab 20:1311-1319.
LU D, MAHMOOD A, WANG L, et al. (2001a) Adult bone marrow stromal cells administered intravenously to rats after traumatic brain injury migrate into brain and improve neurological outcome. Neuroreport 12:559-563.
LU D, LI Y, WANG L, et al. (2001b) Intraarterial administration of marrow stromal cells in a rat model of traumatic brain injury. J Neurotrauma 18:813-819.
MAHMOOD A, LU D, YI L, et al. (2001) Intracranial bone marrow transplantation after traumatic brain injury improving functional outcome in adult rats. J Neurosurg 94:589-595.
MAJUMDAR MK, THIEDE MA, MOSCA JD, et al. (1998) Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J Cell Physiol 176:57-66.
MAJUMDAR MK, THIEDE MA, HAYNESWORTH SE, et al. (2000) Human marrow-derived mesenchymal stem-cells (MSCs) express hematopoietic cytokines and support long-term hematopoiesis when differentiated toward stromal and osteogenic lineages. J Hematother Stem Cell Res 9:841-848.
MIZUNO S, MATSUMOTO K, KUROSAVA T, et al. (2000) Reciprocal balance of hepatocyte growth factor and transforming growth factor-beta 1 in renal fibrosis in mice. Kidney Int 57:937-948.
PAPAVASSILIOU E, GOGATE N, PROESCHOLDT M, et al. (1997) Vascular endothelial growth factor (vascular permeability factor) expression in injured rat brain. J Neurosci Res 49:451-460.
SANCHEZ-RAMOS J, SONG S, CARDOZO-PELAEZ F et al. (2000) Adult bone marrow stromal cells differentiate into neural cells in vitro. Exp Neurol 164:247-256.
SONDELL M, and KANJE M (2001) Postnatal expression of VEGF and its receptor flk-1 in peripheral ganglia. Neuroreport 123:105-108.
SONDELL M, LUNDBORG G and KANJE M (1999) Vascular endothelial growth factor has neurotrophic activity and stimulates axonal outgrowth, enhancing cell survival and Schwann cell proliferation in the peripheral nervous system. J Neurosci 19:5731-5740.
SUGIMORI H, SPELLER H, and FINKLESTEIN SP (2001) Intravenous basic fibroblast growth factor produces a persistent reduction in infarct volume following permanent focal ischemia in rats. Neurosci Lett 300:13-16.
TAKAI K, HARA J, MATSUMOTO K et al. (1997) Hepatocyte growth factor is constitutively produced by human bone marrow stromal cells and indirectly promotes hematopoiesis. Blood 89:1560-1565.
WOODBURY D, SHWARZ EJ, PROCKOP DJ, et al. (2000) Adult rat and human bone marrow stromal cells differentiate into neurons. J Neurosci Res 61:364-370.
ZHANG L, HIMI T, MORITA I et al. (2000a) Hepatocyte growth factor protects cultured rat cerebellar granule neurons from apoptosis via the phosphatidylinisitol-3 kinase/Akt pathway. J. Neurosci Res 59:489-496.
ZHANG ZG, ZHANG L, JIANG Q, et al. (2000b) VEGF enhances angiogenesis and promotes blood-brain barrier leakage in the ischemic brain. J Clin Invest 106:829-838.
Реферат
Группа изобретений относится к медицине, точнее к терапевтической стимуляции ангиогенеза и выработке трофических факторов и факторов ангиогенеза, и может быть использовано для обеспечения средств усиления компенсаторного механизма мозга для улучшения функции после повреждений ЦНС или дегенерации. Предложено терапевтическое средство, содержащее индуцирующие ангиогенез и васкулогенез факторы, для использования в неврологической и скелетно-мышечной терапии, включающее индуцирующие ангиогенез и васкулогенез факторы, изолированные от стволовых клеток костного мозга человека, в сочетании с фармацевтически приемлемым клеточным терапевтическим средством. Предложен метод усиления продукции индуцирующих ангиогенез и васкулогенез факторов, секретируемых стволовыми клетками, путем экспонирования и совместного культивирования стволовых клеток с соединением для повышения продукции факторов, индуцирующих ангиогенез и васкулогенез. Предложены индуцирующие ангиогенез и васкулогенез факторы, изолированные и очищенные от стволовых клеток для использования в терапии. Предложен процесс получения индуцирующих ангиогенез и васкулогенез факторов, указанных выше, включающий этапы изоляции и очистки мезенхимальных стволовых клеток человека из ткани до дифференцировки и затем культурального выращивания мезенхимальных стволовых клеток для получения средства для неврологической и скелетно-мышечной терапии. Предложены изолированные и выращенные в культуре мезенхимальные стволовые клетки под воздействием требуемого соединения, которые способны к дифференциации и продукции желаемого клеточного фенотипа, необходимого для тканевого восстановления. Методы и композиции настоящего изобретения позволяют увеличить эффективность клеточной терапии. 8 н. и 9 з.п. ф-лы, 4 табл., 9 ил.

Комментарии