Композиции стволовых клеток и способы получения стволовых клеток для применения в терапии - RU2714236C2
Код документа: RU2714236C2
Чертежи




Описание
УРОВЕНЬ ТЕХНИКИ
Стволовые клетки представляют собой перспективный источник клеток для применения в терапии, в медицинских исследованиях, фармакологических испытаниях и т.п.К сожалению, применение указанных клеток в качестве аллотрансплантата проблематично. Необходимым условиям для клеточной терапии является размножение стволовых клеток в больших количествах, но мезенхимальные стволовые клетки (МСК) взрослого организма имеют ограниченную способность к пролиферации. В области техники общепризнанным основным способом, применяемым для выделения МСК из костного мозга (КМ) является способ, который основан на способности указанных клеток прикрепляться к пластику, в рамках данного способа цельный костный мозг помещают в пластиковые культуральные планшеты и через 4 часа не прикрепившиеся клетки смывают. Данный протокол также может включать центрифугирование КМ в градиенте плотности в растворах с высокой плотностью при низкой вязкости и низком осмотическом давлении (например, фикол, перколл) для получения фракции мононуклеаров КМ, которая содержит МСК. Кроме того, можно выделить МСК из твердых тканей, таких как костная ткань, путем помещения маленького фрагмента кости во флакон, что приводит к разрастанию клеток вне эксплантированной кости. В качестве альтернативы, можно также применять процесс расщепления коллагеназой. Однако загрязнение клеток другими типами клеток, такими как гемопоэтические стволовые клетки, приводит к вероятному получению гетерогенной популяции, что нарушает чистоту образца МСК. Для преодоления данной проблемы были разработаны две сходных технологии - сортировка с помощью магнитных микроносителей и сортировка флуоресцентно-активированных клеток (FACS). В других случаях сортировка флуоресцентно-активированных клеток (FACS) является способом выделения МСК. После выделения МСК следующим необходимым этапом является этап размножения ex-vivo, который обеспечивает свободное самовозобновление МСК, задачей которого является получение терапевтически значимого количества клеток, что зависит от нескольких факторов, таких как связанные с донором факторы (возраст, пол, наличие травмы и наличие системного заболевания) или факторы, связанные с применяемым способом. Несмотря на то, что МСК могут быть быстро размножены за относительно короткий период времени благодаря быстрой пролиферации, в настоящее время в данной области техники не существует способов, которые бы позволяли получать указанные клетки в терапевтически значимых количествах без масштабного культивирования in vitro, которое включает множественные циклы пересева клеток из флакона во флакон с применением ферментативной обработки. Было показано, что размножение МСК при таких условиях постепенно уменьшает максимальный потенциал дифференцировки МСК. Интенсивный пересев ухудшает функцию клеток, что ведет к клеточному старению, которое ассоциировано с остановкой роста и апоптозом. С другой стороны, есть данные, свидетельствующие о том, что длительное культивирование может приводить к спонтанной трансформации, которая может приводить к образованию опухолей. Кроме того, было показано, что во время культивирования утрачиваются определенные свойства МСК. Кардиопротекторное действие МСК снижается у клеток, которые пересевали от 5-ти и 10-ти раз по сравнению с клетками, которые пересевали меньшее количество раз. Это может объясняться снижением способности к высвобождению фактора роста эндотелия (Crisostomo et al., 2006; Digirolamo et al., 1999; Muraglia et al., 2000; Rubio et al., 2005; Stenderup et al., 2003). Следовательно, все способы, известные из уровня техники в настоящее время, должны быть основаны на компромиссе между производительностью и качеством размноженных клеток, что ограничивает применение данных способов в клеточной терапии.
Способ и композиция клеток, описанные в настоящем изобретении, позволяют преодолеть перечисленные выше ограничения, такие как множественные пересевы клеток, старение клеток, сниженная дифференцировка и сниженная продукция факторов роста, ограниченное количество криоконсервированных клеток. Напротив, в рамках настоящего изобретения предложено уменьшение числа пересевов клеток, уменьшение манипуляций in vitro с клетками и параллельное увеличение способности к дифференцировке и выработке факторов роста, стабильный кариотип, практически неограниченное количество криоконсервированных клеток.
Все публикации, патенты и публикации патентов, цитируемые в настоящей заявке, включены в нее посредством ссылки на их полную версию.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам получения и/или размножения in vitro популяции стволовых клеток, выделенных из эксплантированной ткани. Указанный способ предпочтительно включает этап культивирования ткани в питательной среде в течение по меньшей мере одного цикла сбора клеток. Как правило указанный цикл сбора клеток включает этапы поддержания указанной ткани в питательной среде для эксплантации (культивирования вне организма) клеток в течение периода времени, достаточного для получения полуконфлюэнтной культуры стволовых клеток, и сбор указанных клеток с получением конечной популяции стволовых клеток. Предпочтительно перед каждым циклом сбора клеток с тканью проводят минимум манипуляций.
Согласно конкретному варианту реализации, в настоящем изобретении предложен in vitro способ получения из эксплантированной ткани размноженной популяции первично полученных стволовых клеток, при этом указанный способ включает:
a. промывку и минимальные манипуляции (минимальное воздействие) с указанной эксплантированной тканью;
b. культивирование указанной эксплантированной ткани in vitro на первой поверхности для культивирования в питательной среде с целью образования культуры первично полученных стволовых клеток;
c. сбор первично полученных стволовых клеток из указанной питательной среды; и
d. перенос указанной эксплантированной ткани на вторую поверхность для культивирования с питательной средой;
e. повторение этапов b, с и d по меньшей мере один раз с указанной эксплантированной тканью, и получение таким образом размноженной популяции первично полученных стволовых клеток из указанной эксплантированной ткани.
Указанные способы предпочтительно включают промывку и минимальные манипуляции с эксплантированной тканью. Предпочтительно, эксплантированную ткань не обрабатывают ферментативно или химически или не разрезают (не препарируют) перед каждым циклом сбора клеток. Способ получения размноженной популяции первично полученных стволовых клеток из эксплантированной ткани также предпочтительно включает этап пересева первично полученных стволовых клеток и сбор стволовых клеток из питательной среды. Пересев можно проводить после каждого цикла сбора клеток несколько раз или в конце.
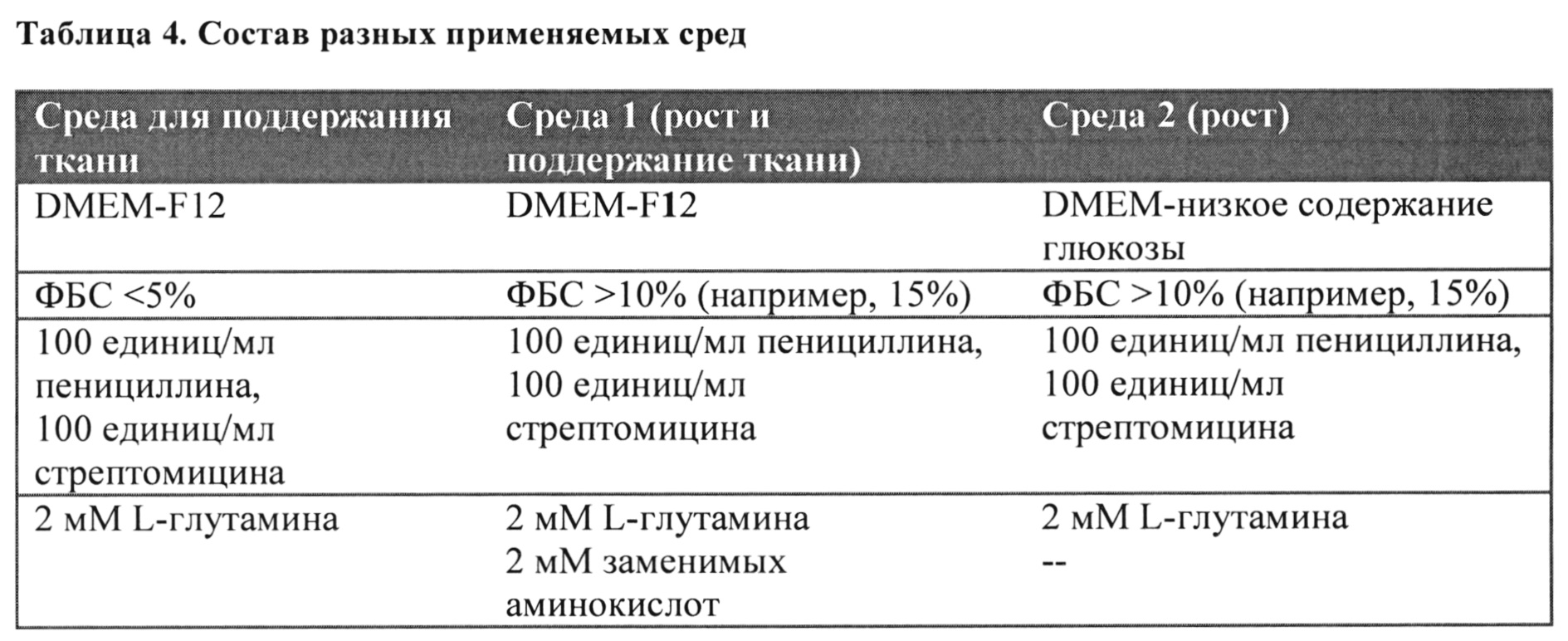
Указанные способы могут также включать пересев эксплантированных клеток и культивирование пересеваемых клеток в питательной среде. Согласно некоторым аспектам культивирование ткани в питательной среде по меньшей мере в течение одного цикла сбора клеток включает культивирование ткани в питательной среде, содержащей менее 5% сыворотки, а затем культивирование ткани в среде, содержащей 15% сыворотки. Продолжительность культивирования ткани в питательной среде, содержащей менее 5% сыворотки, составляет 3 дня. Продолжительность культивирования ткани в питательной среде, содержащей 15% сыворотки, составляет семь дней. Согласно некоторым вариантам реализации питательной средой и средой для роста является среда DMEM (среда Игла, модифицированная по способу Дульбекко), например, питательная среда может представлять собой DMEM-F12 и/или среда для роста может представлять собой DMEM с низким содержанием глюкозы. Согласно некоторым аспектам в среду для роста не добавлены заменимые аминокислоты. Согласно некоторым вариантам реализации эксплантированные клетки и/или пересеваемые клетки обладают стабильным кариотипом.
Также настоящее изобретение относится к терапевтическим композициям стволовых клеток, которые содержат эксплантированные клетки, полученные по меньшей мере после первого цикла сбора клеток. Согласно некоторым вариантам реализации такая композиция содержит эксплантированные клетки, полученные после первых трех циклов сбора клеток, первых 65 циклов сбора клеток или первых 100 циклов сбора клеток. Согласно некоторым аспектам такая композиция содержит пересеваемые клетки, полученные по меньшей мере после пересева 1 (Р1), после P1 - Р3 или после P1 - Р50. Согласно некоторым вариантам реализации такую композицию можно хранить в состоянии заморозки, без изменения экспрессии в ней маркеров стволовых клеток после размораживания указанной композиции.
Согласно некоторым вариантам реализации способов и композиций согласно настоящему изобретению стволовая клетка представляет собой клетку, полученную из нервного гребня или периферической нервной системы. Согласно некоторым аспектам указанные стволовые клетки представляют собой стволовые клетки взрослого или постнатального организма, неэмбриональные стволовые клетки. Согласно некоторым вариантам реализации указанной тканью является пульпа зуба или послеродовая ткань, например, пуповина или плацента.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
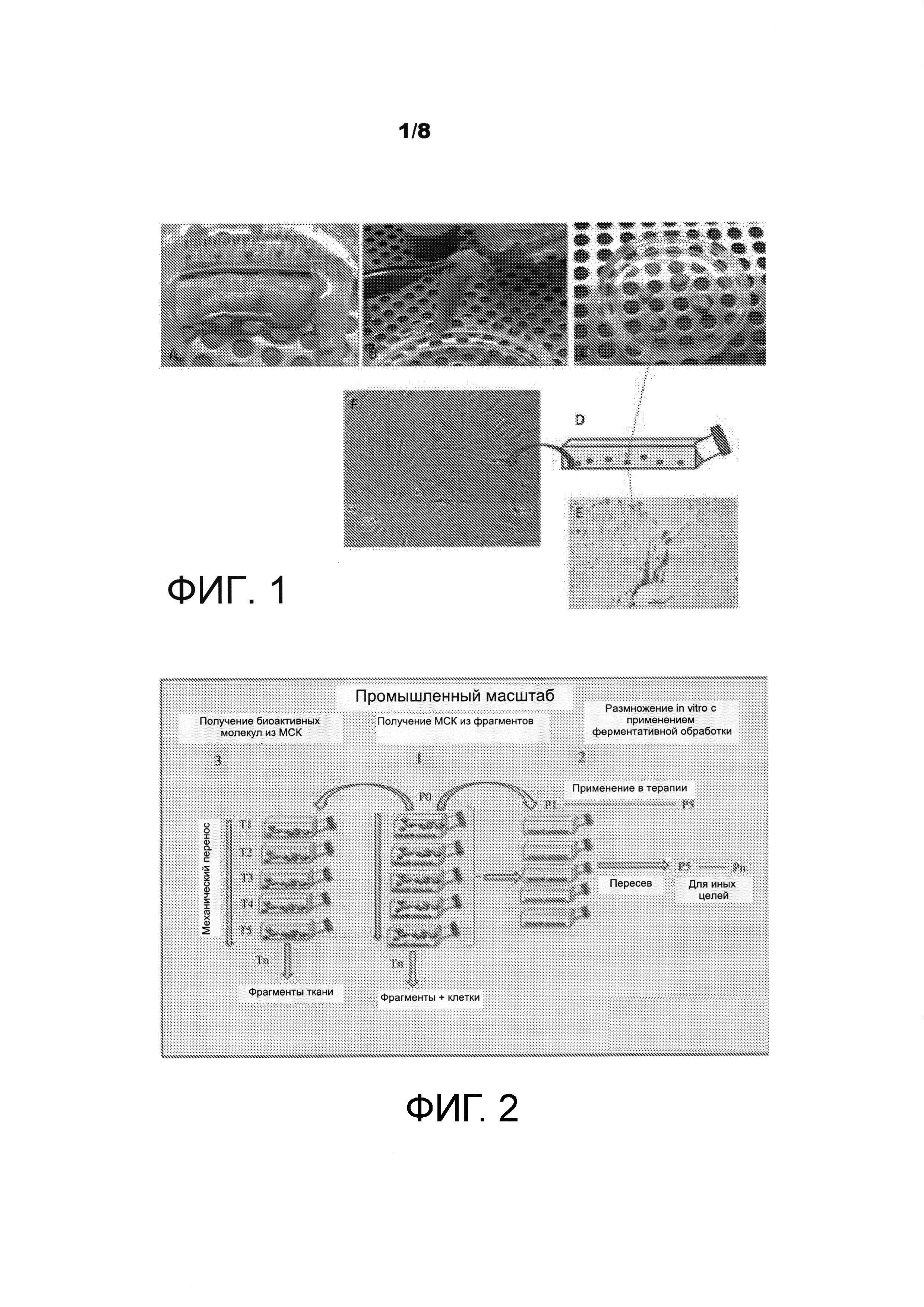
На ФИГ. 1 показана схема выделения стволовых клеток из пуповины. На панели А показано выделение 5-см фрагмента пуповины. На панели В показана промывка ткани пуповины; на панели С показано нарезание ткани пуповины на маленькие куски. На панели D показаны маленькие куски ткани пуповины, которые были механическим путем перенесены в минимальную среду и которые культивировали в пластиковом культуральном планшете. На панели Е показано прикрепление стволовых клеток, положительных по CD105, к поверхности для культивирования. На панели F показана культура мезенхимальных стволовых клеток.
На ФИГ. 2 показаны способы культивирования стволовых клеток в промышленном масштабе.
На ФИГ. 3 показано применение неферментативного способа выделения и механического переноса стволовых клеток в биотехнологии, медицине, фармацевтике, косметологии, питании и т.д.
На ФИГ. 4 показано выделение фрагментов от разных доноров и совместное культивирование указанных фрагментов в одном флаконе. Фрагменты, полученные от разных сингенных по HLA-антигенам, частично сингенных и/или не сингенных доноров, можно культивировать в одном и том же флаконе для получения МСК, поскольку они не презентируют сигналы, которые вызывают иммунный ответ.
На ФИГ. 5 показан традиционный способ криоконсервации исходной ткани для «одноразового» выделения стволовых клеток (а) и криоконсервации исходной ткани согласно настоящей заявке (b).
На ФИГ. 6 показаны принципиальные отличия между нормальными МСК и ЕР или iPS клетками.
На ФИГ. 7 показан рост IDPSC человека в двух типах среды для роста.
На ФИГ. 8 показано влияние внутрибрюшинного введения IDPSC на выработку цитокинов клетками легких мышей С57 В 1/6, инфицированных штаммами Mtb и М. bovis.
На ФИГ. 9 показано иммунное окрашивание маркеров лимбальных стволовых клеток в IDPSC для визуализации трансплантации роговицы посредством флуоресцентной микроскопии. Масштабная линейка соответствует 50 мкм. На панели А показана локализация в ядре IDPSC р53. На панели В показано изображение, являющееся результатом совмещения изображения на панели А и изображения, полученного после окрашивания ядра DAPI. На панели С показана локализация в мембране интегрина β1. На панели D показано определение виментина - промежуточного филамента. На панели Е показано определение коннексина 43, который является белком мембраны клетки. На панели F показано определение ABCG2 - белка плазматической мембраны. На панели G показано слабое положительное иммунное окрашивание К3/12. На панели Н показан отрицательный контроль.
На ФИГ. 10 показан анализ посредством ПЦР-РВ (полимеразная цепная реакция в реальном времени) экспрессии маркеров лимбальных стволовых клеток (ABCG2, коннексин 43 и К12) в IDPSC. Дорожка 1 представляет лесенку с шагом 100 п.о.. На дорожке 2 - образец ткани роговицы человека. На дорожке 3 - образец лимбальной ткани человека. На дорожке 4 - образец IDPSC.
На ФИГ. 11 показаны ниши стволовых клеток в пульпе зуба. На панели А показано, что зуб состоит из коронки и корня. На панели В показана локализация периваскулярной ниши (а) и нервное сплетение (b) для пульпы зуба. На панели С показано иммунное окрашивание нестина в периваскулярной нише (а) и нервном сплетении (b). На панели D показана локализация пододонтобластической ниши (с) и бесклеточных и богатых клетками зон (d). На панелях Е и F показано иммунное окрашивание нестина в пододонтобластической нише (с) и бесклеточных и богатых клетками зонах (d), соответственно.
На ФИГ. 12 показаны предполагаемые ниши нервных стволовых клеток в пуповине. На панели А показана экспрессия нейрофиламентов (НФ) в субамниотическом эпителии. На панели В показана экспрессия фактора роста нервов с низким сродством (р75 или CD271) в вене. На панели С показано положительное иммунное окрашивание на бета-III-тубулин стволовых клеток, выделенных из предполагаемых ниш нервных стволовых клеток. На панели В показано положительное иммунное окрашивание на GFAP стволовых клеток, выделенных из предполагаемых ниш нервных стволовых клеток.
На ФИГ. 13 показана экспрессия факторов транскрипции, таких как Oct 3/4, nanog и Sox2 в разных нишах стволовых клеток в ткани пуповины. Белыми стрелками показаны клетки с экспрессией указанных факторов транскрипции, а черными стрелками - клетки, где экспрессия данных факторов транскрипции отсутствует.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В публикации заявки на патент США №2004/0136967 описан способ получения стволовых клеток из матрикса пуповины, включающий выделение клеток из эксплантированной пуповины или высвобождение клеток ферментативным путем, например, при помощи коллагеназы или трипсина. Срезы ткани затем накрывают другим предметным стеклом и культивируют в полной среде. Таким образом в уровне техники не описано многократное применение эксплантированных культур.
В отличие от способов увеличения масштаба популяций стволовых клеток, известных из уровня техники, согласно настоящему изобретению применяют множественные циклы сбора клеток для увеличения популяции культивируемых стволовых клеток. Также в отличие от способов из уровня техники исходную ткань не разрезают (не препарируют), а получают из нее слои механически или измельчают для многократных циклов сбора клеток. С тканью должно проводиться минимум манипуляций. Под циклом сбора клеток понимают цикл переноса ткани на свежую поверхность для культивирования для образования новой эксплантированной культуры, например, стволовых клеток. Согласно настоящему изобретению циклы сбора клеток (перенос ткани для источника стволовых клеток) могут повторяться многократно, например, от 1 до 100 переносов. Множественные циклы сбора клеток приводят к образованию множественных первичных культур для обеспечения крупномасштабного запаса стволовых клеток с уникальными свойствами. Иными словами, согласно настоящему изобретению предложен способ надежного культивирования стволовых клеток в крупном масштабе путем многократного первичного культивирования стволовых клеток, собираемых из источника ткани, подвергнутой минимальным манипуляциям, в ходе многократных циклов сбора клеток из одной и той же ткани. Неожиданно, многократные циклы сбора клеток приводят к увеличенному числу прикрепившихся клеток, получаемых в каждом цикле. И неожиданно авторы настоящего изобретения показали, что повторное культивирование эксплантата посредством неферментативного сбора клеток из фрагментов ткани, подвергшихся минимальным манипуляциям, при воздействии питательной среды для роста, не содержащей антибиотиков/противогрибковых агентов и добавок, позволяет инициировать условия пересева 0 (Р0) много раз, что повышает шансы на безопасность вследствие стабильности кариотипа при малом числе пересевов при одновременном обеспечении достаточного количества стволовых клеток посредством многократных циклов сбора клеток.
Способ минимальных манипуляций с тканью был известен частично из предшествующего уровня техники для нетерапевтических применений, в основном в целях диагностики. В частности, указанные цели включали культивирование органа (например, роговицы) и эксплантированной ткани для оценки действия токсических, канцерогенных, терапевтических веществ, биологических агентов или для оценки чувствительности. Недавно авторы настоящего изобретения показали применимость данной технологии для выделения стволовых клеток из пульпы зуба. Основной целью данного подхода является сохранение архитектуры культивируемой ткани, например, паренхима и строма остаются сохранными в точки зрения их структуры и функции. Таким образом, функции органа во время культивирования in vitro имеют сходство с функциями органа in vivo. Кроме того, авторы настоящего изобретения также применили подход, который применялся ранее на предшествующем уровне техники в способах диагностики и скрининга, для культивирования эксплантированной ткани для выделения клеток из фрагмента органа,: выделяемую ткань выделяют, минимально обрабатывают в асептических условиях, измельчают на маленькие фрагменты и помещают в чашку для культивирования ткани, содержащую питательную среду.
Эксплантированная культура представляет собой культуру, где клетки остаются в своем окружающем внеклеточном матриксе, что более точно отражает миграцию in vivo стволовых клеток/предшественников из ниш во внешнюю среду, и клетки-предшественники мигрируют из ткани и прикрепляются к поверхности чашки для культивирования. Оба подхода являются сходными, поскольку они позволяют сохранить окружение и ниши стволовых клеток. Применение данного способа для размножения стволовых клеток полезно, поскольку во время культивирования ткань подвергается гипоксии. Однако питательная среда обеспечивает достаточный запас питательных веществ для поддержания экспланированных клеток ткани, подвергшейся минимальным манипуляциям, и клеток в ткани, чтобы поддерживать жизнеспособность. Данное улучшение оказалось неожиданным по сравнению со информацией, известной из уровня техники, и обеспечило большое преимущество при поддержании недифференцированного состояния стволовых клеток. Следовательно, механический перенос пульпы зуба, которая является маленьким органом, и эксплантирование является стратегией для непрерывного выделения стволовых клеток для сохранения неизменными их изначальных характеристик после выделения. Пульпа зуба представляет собой рыхлую соединительную ткань, и масса данного органа может варьировать. Пульпа зуба, которая более легкая, имеет склонность стекать, не прикрепляясь и не демонстрируя роста клеток. Чтобы ускорить прикрепление ткани пульпы к субстрату, можно применять стерильные покровные стекла, что обеспечивает более гипоксические условия. Применение покровных стекол представляет еще один пример индукции гипоксии в нише стволовых клеток в ткани во время многократных циклов сбора клеток.
Согласно одному варианту реализации настоящее изобретение относится к способам размножения клеток in vitro посредством по меньшей мере одного цикла сбора клеток из ткани, подвергнутой минимальным манипуляциям, для увеличения популяции первично полученных и пересеянных стволовых клеток. Во время каждого цикла сбора клеток количество эксплантированных клеток по меньшей мере удваивается по сравнению с количеством выделенных клеток посредством размножения клеток, полученных классическим ферментативным способом. Количество циклов сбора клеток может составлять по меньшей мере три (H1 - Н3), по меньшей мере 65 (H1 - Н65) или до 100 (H1 - H100). Каждый цикл сбора клеток включает поддержание фрагмента ткани, подвергнутой минимальным манипуляциям (например, обработанной неферментативно или химически, не разрезанной) в питательной среде с добавками и антибиотиками для эксплантации клеток в течение периода времени, достаточного, чтобы получить полуконфлюэнтную культуру стволовых клеток, и сбор указанных клеток для формирования конечной популяции стволовых клеток. Такое генерирование культивируемых клеток представляет собой первичный пересев (Р0) цикла сбора клеток.
Указанные способы включают промывание ткани, которая подверглась минимальным манипуляциям, и поддержание ткани in vitro на протяжении по меньшей мере одного сбора клеток, так чтобы стволовые клетки, например, мезенхимальные мультипотентные и плюрипотентные стволовые клетки, прикрепились к поверхности или гранулам для культивирования. Каждая культура, выращиваемая вне организма, из цикла сбора клеток представляет собой Р0 и служит источником для повторного пересева или биореакторной системы. Культура, выращиваемая вне организма, может пересеваться на протяжении 50 пересевов. Клетки можно пересевать ферментативным или неферментативным способом. Во время повторных циклов сбора клеток ткань и клетки можно поддерживать при помощи факторов роста и/или среды для роста с добавками DMEM, содержащей противомикробный раствор. Согласно некоторым аспектам общее количество стволовых клеток, полученных из фрагмента ткани с применением способов согласно настоящему изобретению, по меньшей мере в три раза больше, чем количество стволовых клеток, которое можно получить классическим размножением стволовых клеток, полученных ферментативным путем. Согласно некоторым вариантам реализации общее количество стволовых клеток, полученных при помощи способов согласно настоящему изобретению, по меньшей мере от 3 до по меньшей мере 65 раз превосходит количество стволовых клеток, получаемых классическим способом размножения стволовых клеток, полученных ферментативным путем. Следовательно, настоящее изобретение относится к способам увеличения количества стволовых клеток, получаемых из одного источника или источника ткани/жидких сред от смешанных доноров, по сравнению с классическим способом для того же источника ткани.
Ткань можно криоконсервировать перед образованием культур вне организма. Прикрепленные клетки из культур, культивируемых вне организма, и последующих пересевов, также можно криоконсервировать. Жизнеспособность клеток после заморозки составляет более 50-90%, что делает их пригодными для промышленного и терапевтического применения. Согласно некоторым аспектам данного способа терапевтическая композиция, получена из партии, в которой смешаны замороженные-размороженные мезенхимальные стволовые клетки, полученные при множественных циклах сбора клеток согласно описанным способам. Такая партия может содержать смешанные пересевы клеток из смеси циклов сбора клеток или из одного цикла сбора клеток. Партия клеток для исследовательских и клинических приложений может быть композицией, содержащей клетки Р0 из разных циклов сбора клеток.
Согласно еще одному варианту реализации настоящее изобретение относится к способам клеточной терапии, включающим введение и/или имплантацию партии выделенных согласно способам настоящего изобретения клеток человеку или животному в ту часть тела, где требуется лечение. Партия клеток может представлять смешанную партию клеток, полученных из разных циклов сбора клеток и пересевов напрямую после низкотемпературного хранения. Указанная партия клеток также может быть партией, культивированной из хранимых при низких температурах клеток, перед введением человеку или животному. Согласно некоторым вариантам реализации указанную партию клеток проверяют, оценивая функциональные показатели, которые требуются для предполагаемой терапии, такие как значимые выделяемые факторы и/или значимые исследуемые биомаркеры. Конечная популяция стволовых клеток, выделенных согласно способам настоящего изобретения, экспрессирует маркеры мезенхимы. Также конечная популяция стволовых клеток может экспрессировать маркеры плюрипотентных клеток, маркеры нейроэктодермы, и/или маркеры адвентициальных клеток. Согласно некоторым вариантам реализации конечная популяция стволовых клеток предпочтительно экспрессирует маркеры мезенхимальных клеток и некоторые маркеры плюрипотентных клеток, особенно нейроэктодермы, эпителиальных клеток и/или периваскулярных клеток. Согласно некоторым вариантам реализации указанные стволовые клетки не экспрессируют главного комплекса гистосовместимости (МНС) II класса, такого как HLA II (HLA-DR). Для применения в нервной ткани проверяемыми маркерами являются факторы ЦНС, такие как бета-тубулин, SOX2 или SOX10; или факторы роста нейронов и пептиды, такие как GDNF (глиальный нейротрофический фактор), NGF (фактор роста нервной ткани) и BDNF (нейротрофический фактор головного мозга). У партии клеток можно проверить способность к дифференцировке. Согласно некоторым аспектам настоящее изобретение также относится к буферной терапевтической композиции для клеточной терапии, в которой значение рН не является кислотным и не является токсичным для клеток.
В одном варианте реализации настоящее изобретение также относится к способам получения первичных стволовых клеток в размноженной культуре in vitro из ткани, которая подверглась минимальным манипуляциям, причем указанная ткань не подвергалась обработке или разрезанию с целью полной дезинтеграции химическим или ферментативным путем. Указанные способы включают: непрерывный, периодический или дискретный сбор прикрепившихся стволовых клеток из указанной ткани в камере для культивирования клеток, содержащихся в среде для роста с добавками, содержащей противомикробный раствор; и пересев культивируемых клеток из первых повторяющихся этапов. Согласно предпочтительным вариантам реализации этап сбора клеток повторяют, и этап пересева повторяют по меньшей мере один, два или три раза для каждого этапа сбора клеток. Получаемые в результате стволовые клетки в культуре после множества циклов сбора клеток можно смешивать и проверять на функциональность путем количественного контроля значимых биомаркеров. Указанные клетки можно заморозить перед применением в терапии.
В Таблице 1 сравнивается количество клеток, получаемых способами согласно настоящему изобретению, и способами, известными на предшествующем уровне техники.

Согласно одному варианту реализации способ согласно настоящему изобретению включает промывание избытка крови с ткани и разрезание отобранной ткани с применением растворов антибиотиков и буферных растворов. Также ткань диссоциируют механически на фрагменты, при этом ткань нарезают на куски, видные глазом без микроскопа. Например, фрагменты ткани должны быть более 1 мм. Фрагменты ткани помещают в питательную среду с добавками. Согласно предпочтительным вариантам реализации указанная питательная среда с добавками основана на DMEM, более предпочтительно DMEM F12. После непродолжительного культивирования, когда прикрепившиеся клетки образуют полуконфлюэнтный слой, фрагмент ткани переносят в новый планшет для еще одного цикла сбора клеток.
Согласно некоторым вариантам реализации стволовые клетки после каждого цикла сбора клеток (Р0) культивируют с множественными пересевами, чтобы увеличить количество клеток в культуре. Стволовые клетки можно пересевать три, пятнадцать, 50 раз, пока сохраняется нормальный кариотип. Согласно некоторым вариантам реализации в каждом повторном цикле стволовые клетки получают из кусков ткани, смешанных от нескольких доноров, или из нескольких образцов, отобранных у одного донора (например, пульпа молочных зубов от одного донора, разные образцы ткани, полученные в ходе хирургических операций) предшествующего цикла сбора клеток. Источник ткани может быть свежим или размороженным после хранения клеток и криоконсервации.
После сбора эксплантированных клеток можно проводить ферментативное расщепления/пересев недифференцированных или дифференцированных клеток в классических условиях культивирования клеток, известных из уровня технике, или в условиях биореактора, в стерильных пластиковых флаконах, стеклянной посуде, стерильных пакетах, на микроносителях или в реакторах с микроволокнами и т.д.
Согласно одному варианту реализации способ размножения стволовых клеток может быть ускорен путем механического переноса, лишения питательных веществ и гипоксических условий. Согласно некоторым вариантам реализации указанный способ включает следующие этапы:
(i) получение мезенхимальных стволовых клеток и клеток-предшественников, из постнатального, молодого или взрослого организма, из ткани, подвергшейся минимальным манипуляциям (предпочтительно выделенных из ткани, содержащей ниши стволовых клеток нейроэктодермального происхождения и адвентициальных клеток, и/или эпителиального источника, т.е. ткани зуба, послеродовой ткани, такой как плацента, амнион, пуповина; фолликулов волос и жировой ткани подэктодермального происхождения; и т.д.
(ii) причем указанная ткань по существу проходит проверку на жизнеспособность, поддерживается в противомикробных и противогрибковых условиях, по существу очищается от крови, механически разделяется на маленькие куски (предпочтительно приблизительно 0,5-5 мм для помещения в среду с добавками).
(iii) Образование колоний указанных стволовых клеток из ткани, подвергшейся минимальным манипуляциям, проводят неферментативным/механическим способом.
(iv) Образование указанных колоний по существу вызывают механическими манипуляциями и воздействием среды и прикреплением клеток к стеклянной посуде, грануле или адгезивной поверхности, причем указанная инициация колоний начинается приблизительно через 3 или более дней после применения условий гипоксии/истощения, которые включают содержание сыворотки в среде 5% или менее, или позже в условиях нормальной среды для роста.
(v) Повторный многократный сбор клеток предусматривает применение малого числа пересевов при большом числе клеток, причем каждый сбор клеток приводит к инициации первичной культуры, причем после первичного сбора клеток ткань уменьшается в размерах, подвергается стрессу, и продолжительность сбора клеток в последующих циклах сбора короче приблизительно в два раза, чем в начальной первичной культуре для сбора.
(vi) Указанные клетки, полученные из такой ткани, подвергшейся минимальным манипуляциям, экспрессируют одинаковые маркеры in vivo и in vitro, происходящие из множественных ниш стволовых клеток, которые имитируют условия in vivo.
(vii) На срок образования указанной колонии можно повлиять и уменьшить его по существу по меньшей мере в два раза при условиях стресса и гипоксии, которые можно вызвать путем химического стресса, например, гипоксией, механическим стрессом, например, под давлением покровного стекла; и/или ограничением добавок, предпочтительно содержанием сыворотки 5% или менее (см. Пример MS2 ниже).
(viii) После того как колониеобразующие единицы из первичного сбора стволовых клеток, собранных многократно, пересевают ферментативным или неферментативным способом при действии условий, пригодных для пролиферации клеток, причем в предпочтительном примере добавка сыворотки составляет 15%, или добавлены факторы роста и дополнительные добавки. Указанную пролиферацию можно значительно ускорить, если применять среду DMEM с низким содержанием глюкозы, которая хорошо известна в технике для усиления условий гипоксии/стресса (см. Пример MS3 ниже).
Трансплантацию в целях клеточной терапии можно проводить в составе фармацевтической композиции, содержащей буфер, гидрогеля, имплантационной матрицы, с дополнительной активной добавкой или синергетическим лекарственным препаратом или биологическими ингредиентами и т.д., или без них.
Полученные клетки можно применять для разных вариантов клеточной терапии путем введения клеток системно и/или местно, однократно, но предпочтительно многократно, как описано в примере ниже для лечения собак от множественного склероза - в этом случае оптимальные результаты достигаются при двух-трех, предпочтительно более чем двух, трех или четырех повторных инъекциях клеток с целью улучшения симптомов. Согласно более предпочтительному подходу клетки следует вводить на относительно ранней стадии указанного заболевания, когда клеточная терапия позволяет модулировать обратимость процесса.
Перечисленные выше преимущества могут быть преобразованы в несколько преимуществ для потребителя:
- Ожидается, что будет возможно надежное и воспроизводимое промышленное получение четко определенных и охарактеризованных стволовых клеток
- Более высокое качество сырья из ранних пересевов для будущего размножения в биореакторе
- Уникальный характер экспрессии белков клеток Cellavita позволяет легко и стандартным образом его описывать
Возможные области применения неферментативного способа выделения стволовых клеток и механического переноса фрагментов показаны на ФИГ. 3. Клетки или выделенные фрагменты можно лиофилизировать, осаждать, экстрагировать и очищать или подвергать дальнейшей обработке для выделения биологически активных молекул. Указанные молекулы можно применять в качестве матрицы для секвенирования и синтеза новых неизвестных молекул для создания «коктейлей» или терапевтических кремов для эстетического (омоложение) наружного и внутреннего применения. С другой стороны, МСК можно применять при лечении разных заболеваний, повреждений и травм, в качестве терапии стволовыми клетками. Указанные клетки также могут служить для доставки разнообразных терапевтических или суицидных молекул при лечении рака. Также указанные клетки можно применять при генной и тканевой инженерии, печати органов на подложке или без подложки (или матрицы) и в сочетании с другими типами клеток и/или стволовых клеток при многих заболеваниях.
Однако авторы настоящего изобретения обнаружили, что конечная популяция выделенных стволовых клеток может проявлять в то же время сходные, но четко выраженные свойства, как продемонстрировано в Таблице 2, в зависимости от ниш стволовых клеток, которые могут влиять на свойства стволовых клеток.
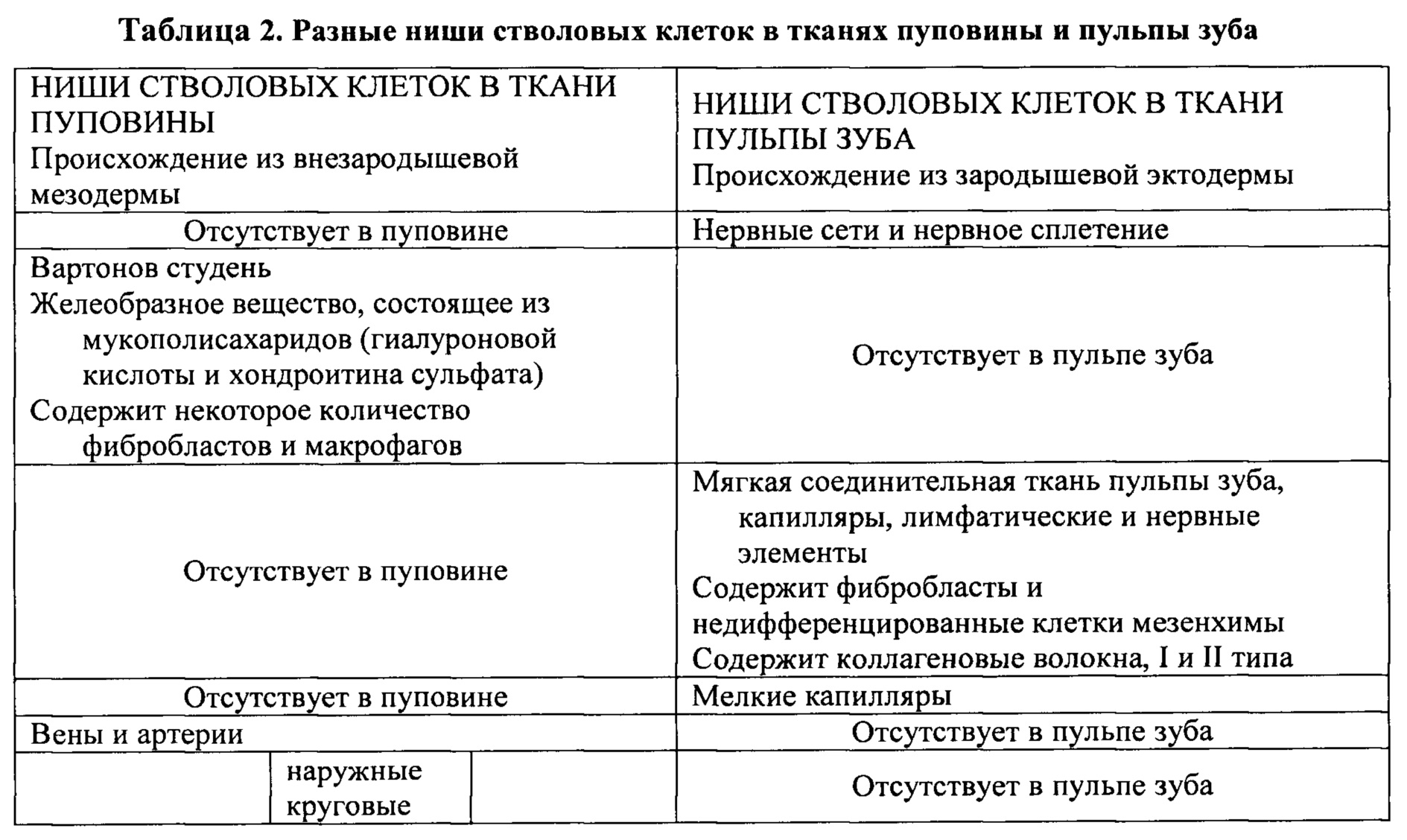
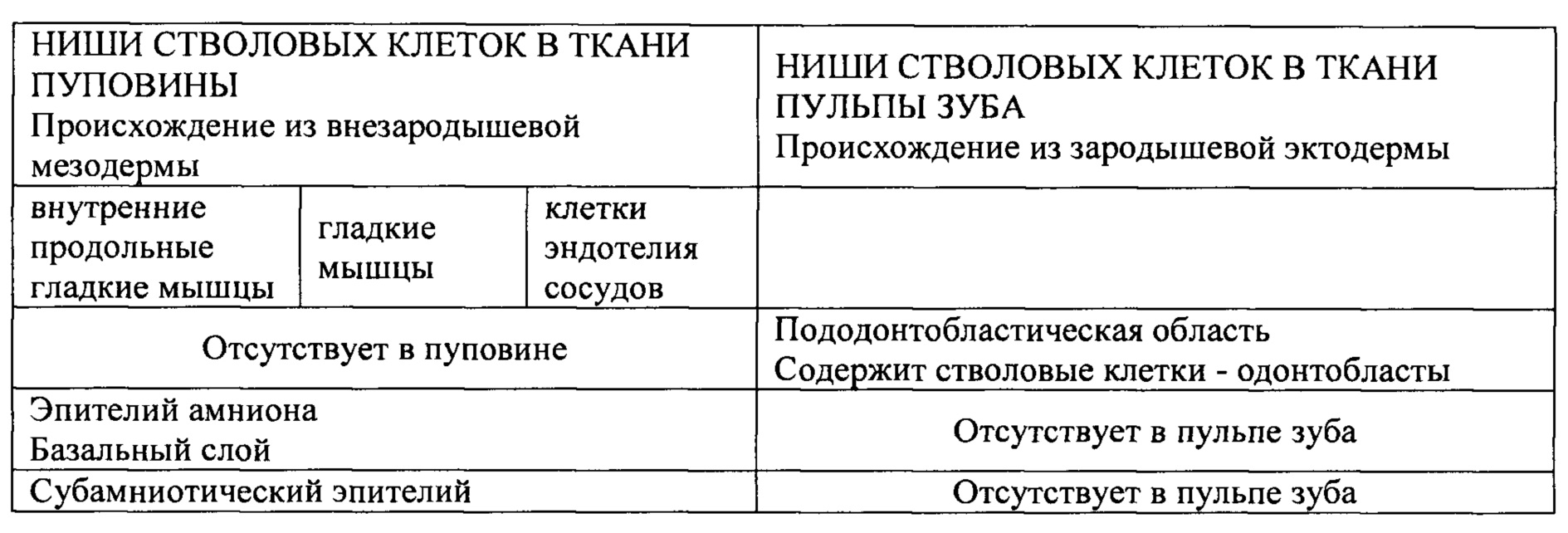
Хотя в Таблице 2 приведены примеры для двух тканей, настоящая заявка не ограничивается указанными тканями и может включать ткани любого типа:
a. полученные из зародышевой эктодермы и нервного гребня (подъязычная и поднижнечелюстная ткань, слюнные и слезные железы, зубной сосочек, зубная пластинка, эпителиальное влагалище корня Гертвига, зубной фолликул, периодонтальная связка, кожа, родимое пятно и др.);
b. полученные из внезародышевой мезодермы (желточный пузырь и амнион, пуповина, плацента и плодные оболочки); и
c. полученные из зародышевой мезодермы (жировая ткань и костный мозг).
Все указанные ткани могут служить источником фрагментов, которые можно обрабатывать, как показано на Фигуре 1 и 2, и применять, как показано на Фигуре 3 и 4.
Каждый из типов стволовых клеток, полученных из тканей из разных источников, описанных в a, b и с, не ограничиваясь данными примерами, можно применять в клеточной терапии и регенеративной медицине для разных целей и при многих показаниях. В то же время, поскольку указанные стволовые клетки имеют разное эмбриональное происхождение, их можно применять в сочетании, чтобы обеспечить усиление, синергию или взаимное дополнение действия при терапии. Примеры тканей-источников включают: пуповину, ткань зуба/околозубную ткань, ткань нижней челюсти, ткань слизистой оболочки, ткань желудочно-кишечного тракта, плаценту, амниотические жидкости или амнион, нервную ткань (например, ткань, содержащую нервные или глиальные клетки), ткань, полученную из нервного гребня или периферической нервной системы, мышц, костей, кожи (дерма, эпидермис, ткань, содержащая кератиноциты, или ткань, содержащая меланоциты, крайняя плоть, кожа, полученная при пластической операции или биопсии), жировую ткань, кровь и другие жидкие среды организма, ткань молочной железы, эндотелий, ткань яичек, ткань яичников, ткань сердца, ткань печени, ткань легких, ткань слюнных желез, ткань поджелудочной железы, сердца и селезенки.
Неферментативный способ выделения стволовых клеток и механический перенос также можно распространить на другие ткани с минимальными изменениями, такие как пуповина (ФИГ. 1). Например, выделяют фрагмент пуповины 5 см (ФИГ. 1А), промывают его, чтобы удалить избыток крови (ФИГ. 1В), стерильным раствором, например, физиологическим раствором. Исходный фрагмент ткани пуповины разрезают на одинаковые меньшие по размеру фрагменты для культивирования (панель С) и механическим путем переносят в базовую среду (ФИГ. 1D). Базовая среда может быть специфичной в отношении каждого типа стволовых клеток, и ее специфический состав зависит от происхождения ткани. Стволовые клетки, положительные по CD105, мигрируют из ткани, чтобы прикрепиться к поверхности для культивирования (ФИГ. 1E). На ФИГ. 1F можно видеть культуру мезенхимальных стволовых клеток (МСК), возникших из маленьких фрагментов ткани пуповины.
Данный способ можно легко адаптировать для промышленного масштаба, как показано на ФИГ. 2. Из пуповины выделяют несколько фрагментов и помещают их во флакон для культивирования для производства МСК. После размножения in vitro путем ферментативной обработки указанные клетки можно применять в клеточной терапии и в других целях. Несколько этапов механического переноса фрагментов пуповины может обеспечить большое количество МСК, которые можно применять для получения биологически активных молекул.
Другой вариант реализации настоящего изобретения относится к режиму лечения пациента, включающему применение стволовых клеток, выделенных в соответствии с данным способом. Указанный режим начинается с системного введения стволовых клеток для защитной модуляции иммунного и воспалительного статуса пациента. Когда противовоспалительное иммуномодулирующее действие подтверждается путем измерения уровня цитокинов и иммноглобулинов и других иммномодулирующих факторов у пациента (например, путем проведения анализа крови), то местную имплантацию стволовых клеток можно применить для регенеративной клеточной терапии.
Функциональная проба может включать описание свойств синергических факторов, например, таких как противовоспалительные, противомикробные и регенеративные в отношении заболевания, которое несет риск инфекции, например, внутрибольничной инфекции, заживление ран, например, диабетических язв, операционных ран и т.д.
Согласно предпочтительному варианту реализации технологию Cellavita, в которой применяется клеточная терапия, следует сочетать с другими принятыми медикаментозными и поддерживающими способами лечения, но совместимость сопутствующего препарата должна оцениваться in vitro, чтобы он не подавлял иммуномодулирующего и регенеративного потенциала клеток. Например, антибиотики, стероиды, антипролиферативные препараты и иммуносупрессоры могут быть токсичными или подавлять активность клеток, следовательно, режим следует корректировать, чтобы он сочетался с соответствующим режимом лечения.
Настоящая заявка, ее аспекты и варианты реализации не ограничиваются конкретными типами материалов, компонентов, способов или другими примерами, раскрываемыми в настоящей заявке. Предполагается, что большое количество дополнительных типов материалов, компонентов, способов и методик, известных из уровня техники, могу быть применены в конкретных вариантах реализации настоящего изобретения в соответствии с настоящим описанием. Соответственно, например, хотя раскрываются конкретные варианты реализации, такие варианты реализации и реализуемые компоненты могут включать любые компоненты, модели, типы, материалы, клетки, варианты, количества и/или т.п., которые известны в области техники для таких систем и реализуемых компонентов, в соответствии с планируемой операцией.
Слова «примерный», «пример» или разные их формы служат для обозначения примера, случая или иллюстрации. Любой аспект или дизайн, описываемые в настоящей заявке, как «примерные» или как «пример» не обязательно подразумеваются как предпочтительные или преимущественные по сравнению с другими аспектами или дизайнами. Кроме того, примеры приведены исключительно в целях ясности и понимания, и никоим образом не предназначены для ограничения раскрываемого предмета или значимых частей настоящего изобретения. Следует понимать, что можно было бы предложить огромное количество дополнительных или альтернативных примеров из разных областей, но они не приведены для краткости.
Хотя настоящая заявка включает варианты реализации многих других форм, на фигурах показаны и будут подробно описаны варианты реализации с пониманием того, что настоящее описание должно рассматриваться как иллюстрация принципов раскрываемых способов и систем, и не предназначено для ограничения широкого взгляда на раскрываемые концепции вариантов реализации, проиллюстрированные здесь.
ПРИМЕРЫ
Пример 1: Жизнеспособность пульпы зуба
У Maher Al-Atari Abou-Asi et al. (2011) заявлено, что источник плюрипотентных клеток, извлекаемых из пульпы зуба в соответствии с публикацией Kerkis et al., 2006, не может представлять собой пульпу зуба, поскольку у пациентов в возрасте 5-7 лет пульпа зуба отсутствует, и более правильно называть это закладкой зуба, которая представляет собой скопление недифференцированных клеток, которые образуют в будущем зуб и его различные части: эмаль, пульпу, цемент, кость, кровеносные сосуды и нервы. Однако Cordeiro et al. (2008) показали, что стволовые клетки из удаленных молочных зубов человека генерируют ткань, подобную пульпе зуба in vivo. Авторы трансплантировали SHED (стволовые клетки из удаленных молочных зубов человека), помещенные в биодеградируемые матрицы, подготовленные в срезах зубов человека, в организм мышей с иммунодефицитом. Они наблюдали, что ткань, образуемая данными клетками, демонстрировала архитектуру и насыщение клетками, которые сильно напоминали архитектуру и насыщение клетками в физиологической пульпе зуба. Ультраструктурный анализ посредством трансмиссионной электронной микроскопии и иммуногистохимии на сиалопротеин дентина показали, что SHED in vivo дифференцировались в одонтобласт-подобные клетки. Примечательно, что SHED также дифференцировались в клетки, напоминающие эндотелий, что было продемонстрировано окрашиванием на β-галактозидазу клеток, выстилающих стенки сосудов, содержащих кровь, в ткани, сконструированной из SHED, которая стабильно трансдуцирована LacZ. Данная работа свидетельствует о том, что удаленные молочные зубы представляют собой жизнеспособный источник стволовых клеток для конструирования ткани пульпы зуба.
Перед культивированием клеток авторы настоящего изобретения проводили скрининг для определения жизнеспособной пульпы на основании цвета пульпы в момент удаления. Удаленные зубы должны иметь красную пульпу, что указывает на ее жизнеспособность. Красный цвет пульпы свидетельствует, что она получала приток крови в момент удаления. Если пульпа серая, вероятно, приток крови к пульпе был нарушен. Таким образом, стволовые клетки, вероятно, некротизированы и не являются жизнеспособными и не обладают способностью к восстановлению (Arora et al., 2009).
Пример извлечения пульпы и культивирования, проведенного из материала, свежеизвлеченного из удаленного молочного зуба здорового субъекта, после получения информированного согласия, одобренного этическим комитетом (Хельсинкская декларация в Европе, IBR (Институт биосоциальных исследований) В США), включал многократную промывку в стерильном растворе, содержащем 50% раствор пенициллина/стрептомицина (100 единиц/мл пенициллина, 100 единиц/мл стрептомицина) и 50% фосфатно-солевого буфера (ФСБ); только что извлеченную пульпу промывали снова, и проводили оценку жизнеспособности пульпы в среде для поддержания жизнеспособности ткани пульпы зуба (DP Tissue Maintenance Medium) с добавлением 3-20% фетальной бычьей сыворотки (ФБС), 100 единиц/мл пенициллина и 100 единиц/мл стрептомицина. Как только из подвергнутой минимальным манипуляциям пульпы начиналось образование колоний, и клетки прикреплялись к пластиковой поверхности для культивирования клеток, проводили испытания на безопасность (испытание на стерильность и пробу на микоплазму) перед последующими циклами сбора клеток и/или размножением клеток посредством пересева и/или криоконсервацией ткани или клеток.
Извлечение пульпы и культивирование проводили следующим образом:
- Молочный зуб, только что удаленный у задорого субъекта, многократно промывали в стерильном растворе, содержащем 50% раствор пенициллина/стрептомицина (100 единиц/мл пенициллина, 100 единиц/мл стрептомицина) и 50% фосфатно-солевого буфера (ФСБ).
- Пульпу зуба извлекали из зуба посредством стерильной иглы. Свежевыделенную пульпу промывали в растворе, содержащем 3% раствор пенициллина/стрептомицина. Оценку жизнеспособности пульпы проводили в среде для поддержания жизнеспособности ткани пульпы зуба с добавлением 15% фетальной бычьей сыворотки (ФБС, Hyclone), 100 единиц/мл пенициллина, 100 единиц/мл стрептомицина, 2 мМ L-глутамина и 2 мМ заменимых аминокислот.
- После того как пульпа зуба прикреплялась к пластиковой поверхности для культивирования клеток, образование колоний наблюдали через 5 дней - две недели.
- Проводимые испытания безопасности включали испытания на стерильность и пробу на микоплазму.
Пример 2: стволовые клетки из эксплантированной пульпы зуба
В разных примерах, связанных с тканью зубов, подробно рассмотренных в недавнем обзоре по стволовым клеткам зубного происхождения (Deepa Ponnaiyan 2014), описаны разные характеристики биомаркеров стволовых клеток из тканей зуба, таких как стволовые клетки пульпы зуба, стволовые клетки периодонтальной связки, стволовые клети из удаленных молочных зубов человека, стволовые клетки-предшественники зубного фолликула из апикального сосочка, стволовые клетки надкостницы костей ротовой полости и недавно описанные клетки из соединительной ткани десны. Примечательно, что большинство маркеров для разных стволовых клеток, полученных из зуба, сходны, но маркеры Notch и CD29 различаются по экспрессии между стволовыми клетками из разных источников в зубе. Экспрессия маркеров in vitro и in vivo в клетках, полученных способом согласно настоящему изобретению, одинакова.
Пример 3: Образование тератомы из IDPSC при многократном сборе клеток при раннем пересеве
Образование тератом является важным способом определения плюрипотентности клеток, таких как эмбриональные стволовые клетки (ЭСК) или индуцированные плюрипотентные стволовые клетки (клетки iPS). В исследованиях согласно настоящей заявке был применен последовательный протокол для оценки способности к образованию тератомы из клеток, сходный с протоколом, опубликованным недавно Gropp et al. (2012). Было показано, что способ согласно настоящему изобретению обладает высокой воспроизводимостью и эффективностью, при этом указанный способ включал подкожную трансплантацию совместно с Мартигелем 106 (Gropp et al. применяли 105 клеток) ЭСК мыши и клеток iPS человека мышам с иммунодефицитом. В 100% случаев авторы настоящего изобретения наблюдали образование тератомы у большого числа животных и даже во время обследования при наблюдении до 6 месяцев после трансплантации. Авторы настоящего изобретения применяли указанный способ для анализа биологической безопасности других мезенхимальных стволовых клеток (МСК) взрослого организма, например, клеток, полученных из пульпы молочных зубов, пуповины, жировой ткани и других. Помимо экспериментальных систем, описанных в настоящей заявке, настоящий способ прошел проверку с МСК плодов собак из костного мозга, печени, желточного мешка, зародышевого мочевого мешка и амниотической жидкости, которая также частично экспрессирует плюрипотентные маркеры.
Способы анализы тератомы:
Развитие опухоли отслеживали в течение 4 месяцев (~16 недель). Для плюрипотентных клеток гистологические критерии на тератому включали развитие ткани, полученной из всех трех зародышевых листков. Указанный анализ проводил патологоанатом. Для стволовых клеток взрослого организма/мезенхимальных стволовых клеток учитывали любой тип или любые изменения целостности нормальной ткани в месте введения клеток.
Результаты
ЭКСПЕРИМЕНТАЛЬНЫЕ СИСТЕМЫ:
a. Эмбриональные стволовые клетки мыши
b. Фибробласты мыши 3Т3
c. Постоянная линия клеток мыши 3Т3, клон A31
d. Клетки iPS-IDPSC человека
e. Эмбриональные стволовые клетки человека
f. IDPSC человека
Мы применяли вышеописанный способ в разнообразных исследованиях, чтобы охарактеризовать плюрипотентность разных линий ЭСК мышей, установленную нами, а также, чтобы подтвердить плюрипотентность ЭСК при пересеве 25 и более, и чтобы охарактеризовать субклоны, полученные из линий ЭСК мышей (Sukoyan et al., 2002; Carta et al., 2006; Kerkis et al., 2007; Lavagnolli et al., 2007; Hayshi et al., 2010). Кроме того, данный способ применяли, чтобы охарактеризовать плюрипотентность клеток iPS, полученных из стволовых клеток незрелой пульпы зуба (IDPSC), в более поздней публикации нашей группы (

ЭКСПЕРИМЕНТАЛЬНЫЕ СИСТЕМЫ:
a. Три разных первичных культуры IDPSC на ранних (n=10) и поздних пересевах (n=10)
b. Первичные фибробласты человека
Ранее авторы настоящего изобретения сообщали о выделении популяции IDPSC, которая экспрессирует маркеры эмбриональных стволовых клеток Oct-4, Nanog, SSEA-3, SSEA-4, TRA-1-60 и TRA-1-81, а также несколько маркеров мезенхимальных стволовых клеток по меньшей мере в первые 25 пересевов и одновременно сохраняют нормальный кариотип и характерную скорость размножения стволовых клеток. Кроме того, указанные клетки можно подвергнуть индукции in vitro, для прохождения однородной дифференцировки в гладкие и скелетные мышцы, нейроны, хрящ и кость под действием заданных химических условий питательной среды. Хотя IDPSC имеют малые размеры и малое число клеточных органелл в цитоплазме, они отличаются от «наивных» плюрипотентных клеток, проявляющих типичную мезенхимальную фибробласт-подобную морфологию (Lizier et al., 2012). IDPSC представляют собой мезенхимальные клетки в отличие от ЭСК и клеток iPS, которые являются эпителиальными клетками (Фигура 5). Принципиальное различие между клетками МСК и ЭСК (или клетками iPS) состоит в том, что МСК являются мигрирующими пластичными и заякоривающимися. Клетки МСК синтезируют внеклеточный матрикс и не содержат межклеточных контактов.
Образование опухоли связано с вышеупомянутыми ЭСК и клетками iPS, но не с нормальными МСК. IDPSC состоят из популяции МСК с разным количеством стволовых клеток, экспрессирующих плюрипотентные маркеры (1-25%) (Kerkis et al., 2006; Lizier et al., 2012). Данный протокол был адаптирован для популяции IDPSC, особенно в отношении количества применяемых клеток, которое рассчитывали, исходя из того, что 20% IDPSC экспрессирует плюрипотентные маркеры. Вместо испытания 106 клеток тератогенность IDPSC оценивали для количества 5×106. Хотя во всех исследуемых органах обнаруживали ДНК IDPSC, образования опухолей или каких-либо морфологических изменений не наблюдали (Lizier et al.)
Пример 4: Криоконсервирование пульпы зуба не влияет на характер экспрессии основных маркеров стволовых клеток
Благодаря незрелой природе клеток новорожденных, извлекаемых из пуповины, амниона, плаценты и из пульпы зуба молодых людей, они демонстрируют более высокую пролиферативную активность и более высокую скорость размножения по сравнению с их аналогами в организме взрослого человека (костный мозг и жировая ткань). Так, клетки из пуповины, амниона, плаценты и пульпы зуба можно криоконсервировать для будущего применения в качестве аллогенной терапии (криоконсервацию фрагментов ткани и/или клеток проводят сначала в холодильнике (приблизительно t -80°С), а затем в жидком азоте (приблизительно -196°С)).
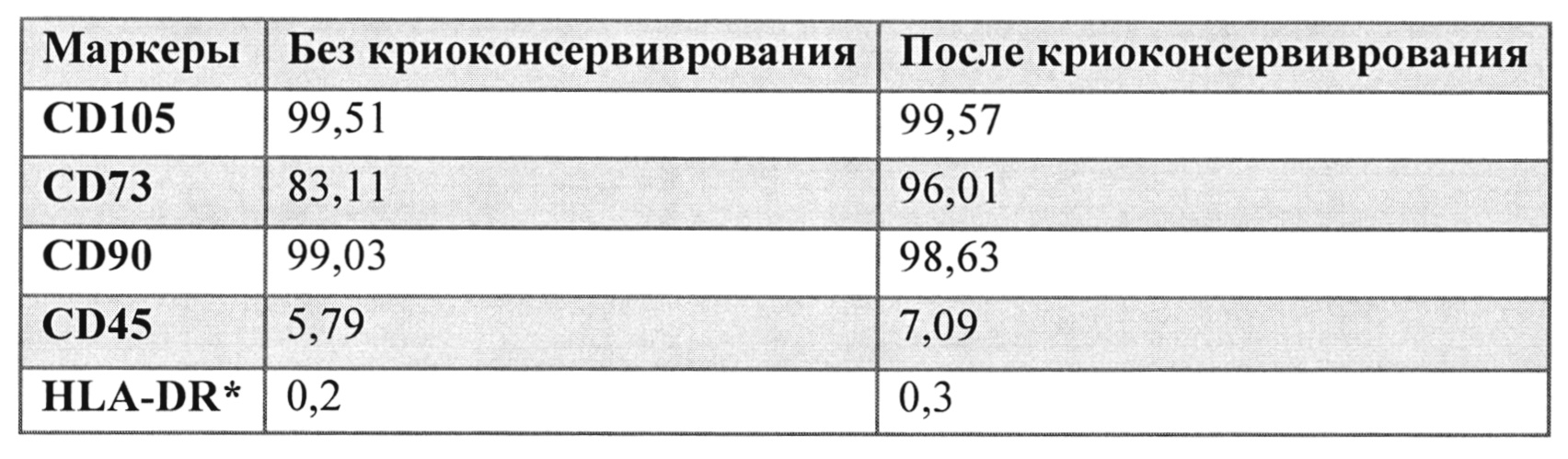
Авторы настоящего изобретения показали, что клетки, отобранные до и после криоконсервации и размораживания эксплантата, сохраняют одинаковый характер экспрессии факторов. Авторы настоящего изобретения показали, что клетки, полученные из эксплантатов после минимальных манипуляций при многократном сборе клеток при долгосрочном культивировании из пульпы зуба и пуповины до и после криоконсервации, экспрессируют мезенхимальные маркеры (т.е., CD 73, CD 105, CD90), не экспрессируют гемопоэтических факторов (т.е., CD34, CD45) и не экспрессируют по меньшей мере один маркер гистосовместимости HLA-DR, и сохраняют стабильность кариотипа, мультипотентность (дифференцируются в разные ростки, включая нейрональный, под действием факторов индукции, таких как ретиноевая кислота, BMP (Морфогенетический белок кости), ФНО (фактор некроза опухоли), NGF (фактор роста нервной ткани), и т.д.)
Например, пульпу зуба, извлеченную из молочного зуба, криоконсервировали, а затем размораживали для выделения IDPSC. IDPSC культивировали до момента сбора клеток 0/пересева 3 (H0P3) и сравнивали посредством анализа FACS со стволовыми клетками пульпы зуба человека из того же пересева, полученного из свежей пульпы зуба. Было показано, что характер экспрессии обоих клеток сходен (Таблица 3). IDPSC обоих типов показывали положительный результат в отношении экспрессии мезенхимальных маркеров (CD105, CD73, CD90) и отрицательный результат для экспрессии гемопоэтического маркера CD45 и фактора гистосовместимости HLA-DR.

Пример 5: Влияние среды для роста на скорость роста IDPSC человека
С целью оценки оптимальных условий роста для культивирования IDPSC равное количество клеток высевали и культивировали в течение 5 дней в двух типах среды для роста (Таблица 4). Было показано, что скорость роста клеток была выше в среде для роста 2 типа (ФИГ. 7), следовательно, среда для роста, содержащая DMEM и с низким содержанием глюкозы и добавкой 15% ФБС более оптимальная для культивирования клеток.
Пример 5: Инициация разрастания клеток из пульпы зуба
В культуре ткани поддерживали два одинаковых фрагмента пульпы зуба. Один из указанных фрагментов культивировали в присутствии 15% ФБС, а второй культивировали в условиях стресса с ограничением сыворотки (4,8% ФБС). Инициация прорастания клеток из пульпы зуба происходила в течение 3 дней в присутствии 4,8% ФБС и 7 дней в присутствии 15% ФБС. Таким образом, ограничение сыворотки может уменьшать время, которое требуется для переноса пульпы. Таким образом, инициация прорастания клеток из пульпы зуба должна быть быстрее в среде с ограничением сыворотки.
Пример 7: Паракринные эффекты поздней популяции (ПП) IDPSC человека включают противовоспалительные, иммуномодулирующие и противомикробные свойства
МСК оказывают полезное действие за счет паракринных механизмов и модулируют восстановительное окружение за счет противовоспалительных и иммуномодулирующих механизмов.
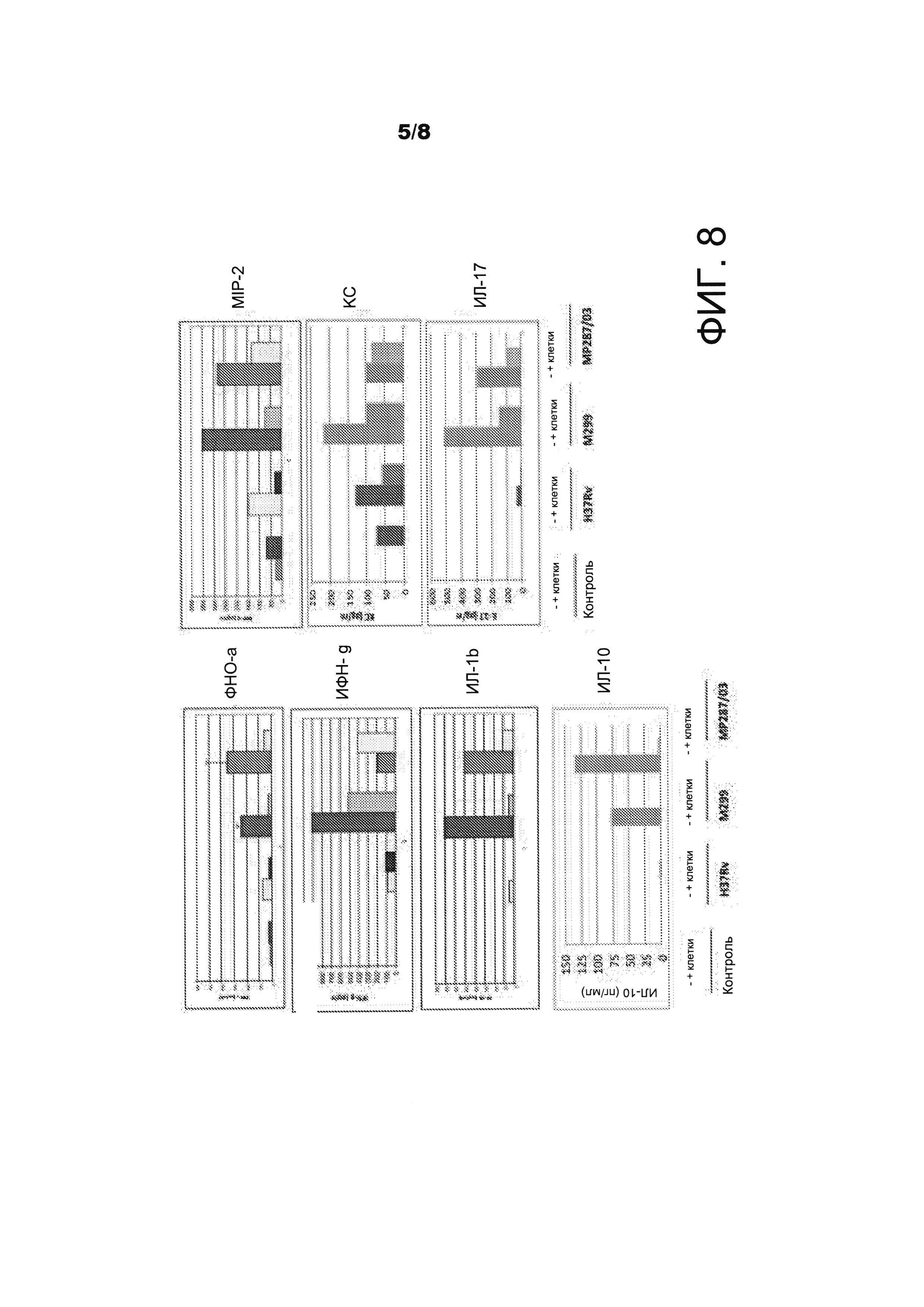
Действие внутрибрюшинной прививки IDPSC на выработку цитокинов клетками легких мышей С57Вl/6, которые были внутривенно инфицированы штаммами Mycobacteria tuberculosis (Mtb) и Mycobacteriaum bovis, которые отличаются по вирулентности. Как показали данные испытания NIOLEX, прививка IDPSC уменьшала выработку цитокинов инфицированными клетками легких (ФИГ. 8). В легких, инфицированных высоковирулентными штаммами Mtb, наблюдалось значительное уменьшение уровня провоспалительных (ФНО-а, ИЛ-1b, MIP-2, ИЛ-17) и противовоспалительных (ИЛ-10) цитокинов. Уменьшение выработки ИФН-g и КС было менее выраженным. Индукция выработки ИЛ-4 наблюдалась только у мышей, которым были привиты IDPSC.
Фактор некроза опухоли (ФНО, кахексии или кахектин, и ранее также известный под названием фактор некроза опухоли - альфа или ФНО-α) является адипокином, участвующим в системном воспалении. Основной функцией ФНО является регуляция иммунных клеток. ФНО, будучи эндогенным пирогеном, способен вызывать лихорадку, гибель клеток по пути апоптоза, кахексию, воспаление и подавлять развитие опухоли и репликацию вирусов, а также реагировать на сепсис через клетки, вырабатывающие ИЛ-1 и ИЛ-6. Было показано, что нарушение регуляции выработки ФНО разными путями участвует в развитии заболеваний человека, включая болезнь Альцгеймера.
Интерферон гамма (ИФНγ или ИФН-g) представляет собой димеризованный растворимый цитокин, который является единственным членом интерферонов II класса, известен как иммунный интерферон и цитокин, который важен для врожденного и приобретенного иммунитета против вирусных и внутриклеточных бактериальных инфекций и для контроля над опухолями. ИФНγ является важным активатором макрофагов. Неправильная экспрессия ИФНγ ассоциирована с целым рядом воспалительных и аутоиммунных заболеваний. Важность ИФНγ в иммунной системе проистекает отчасти из способности ИФНγ подавлять прямо вирусную репликацию и, что наиболее важно, из иммуностимулирующего и иммуномодулирующего действия ИФНγ.
Интерлейкин 17 представляет собой цитокин, который действует как мощный медиатор в реакциях гиперчувствительности замедленного типа за счет увеличения выработки хемокинов в разных тканях для рекрутинга моноцитов и нейтрофилов в очаг воспаления, аналогично ИФНγ. Интерлейкин 17 является провоспалительным цитокином, который отвечает на инвазию в иммунную систему внеклеточных патогенов и вызывает разрушение клеточного матрикса патогена.
Интерлейкин-1 бета (ИЛ-1β) также известен под названием катаболин, представляет собой цитокин, который является важным медиатором воспалительного ответа. Он участвует в целом ряде функций клетки, включая пролиферацию, дифференцировку клеток и апоптоз. Наиболее примечательной функцией ИЛ-17 является его участие в индукции и опосредовании провоспалительных реакций. ИЛ-7 обычно связывают с аллергическими реакциями.
Интерлейкин-10 (ИЛ-10), также известный под названием ингибирующий фактор цитокинов человека (CSIF), является противовоспалительным цитокином. ИЛ-10 является цитокином с плейотропными эффектами при иммуномодуоляции и воспалении.
Лиганд хемокина 2 (CXCL2), также именуемый воспалительным белком макрофагов 2 (MIP-2), играет ведущую роль в опосредовании воспалительной реакции нейтрофилов и является медиатором при развитии сепсиса. КС и воспалительный белок макрофагов (MIP-2) являются хемокинами с С=Х=С мотивом, который проявляет особенный временной характер экспрессии в коже после хирургического вмешательства. КС и MIP-2 являются хемоаттрактантами нейтрофилов. Известно, что оба хемокина экспрессируются при целом ряде острых и хронических воспалительных состояний, и предполагается, что они являются важными факторами, определяющими природу и величину при обеспечении воспалительной реакции.
Пример 8: Стойкая иммуномодулирующая способность IDPSC человека, полученных при многократном сборе клеток (ПП) из ткани, подвергшейся минимальным манипуляциям
IDPSC демонстрируют иммуномодулирующее действие, когда их культивируют совместно с полученными из моноцитов дендритными клетками. Совместное культивирование приводило к уменьшению способности пролиферации Lin Т (50% и более) и вызывало дифференцировку Lin Т в сторону значительного увеличения доли Lin Т CD4+/FoxP3+/IL10+и Lin Т CD4+/FoxP3+/IFN-γ+-клеток. Никакого действия на экспрессию HLA-DR в клетках IDPSC не наблюдалось.
Авторы настоящего изобретения подтвердили, что, хотя стволовые клетки, полученные из ткани, подвергшейся минимальным манипуляциям, собираемые в ходе многократных циклов сбора клеток (способ Cellavita), экспрессируют большинство плюрипотентных маркеров, инъекции таких стволовых клеток мышам не приводят к образованию тератом.


Пример 9: Открытие новых ниш стволовых клеток в нервных сплетениях и пульпе зуба
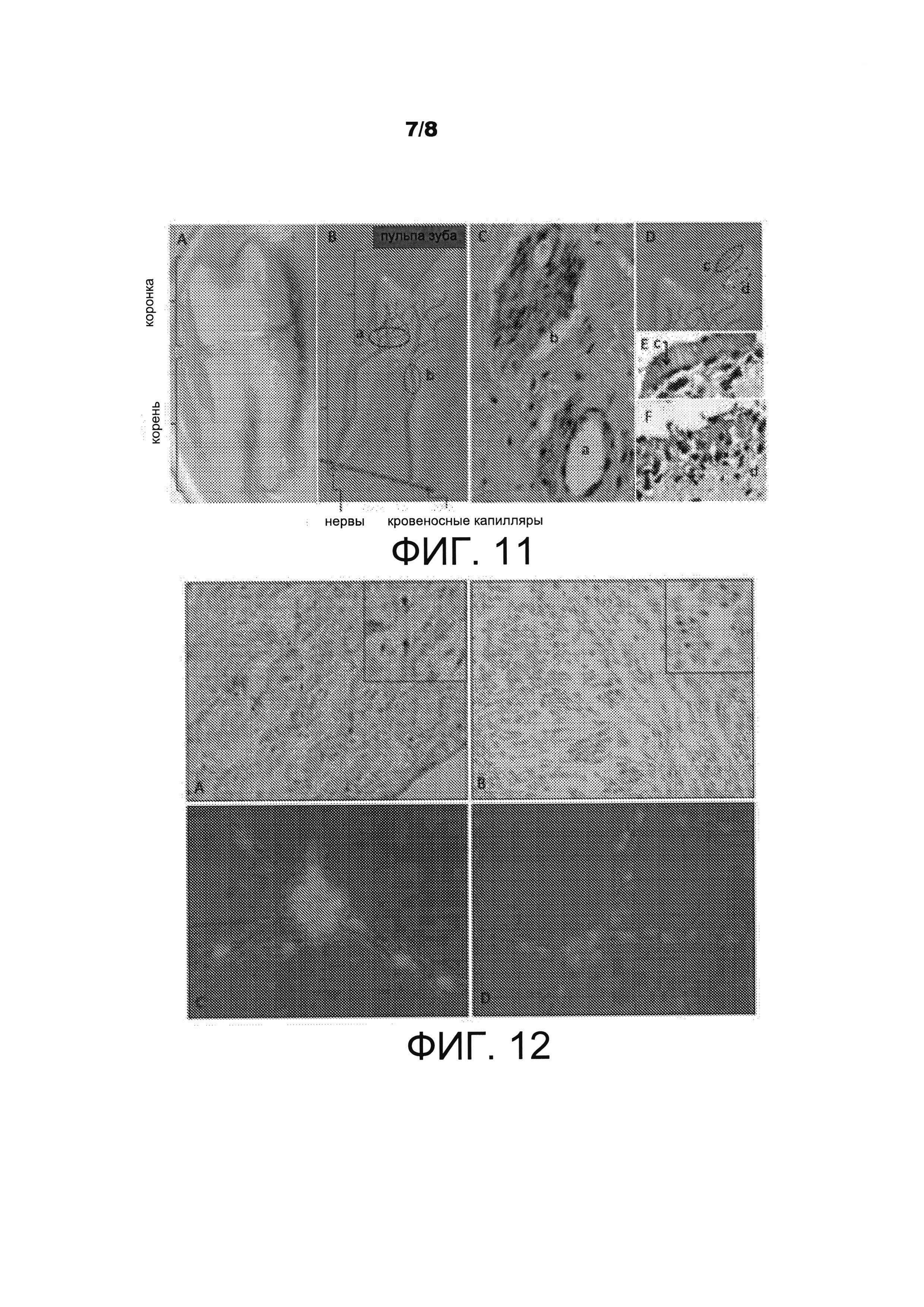
Иммунное окрашивание на ранний маркер нейронов нестин выявило различия в экспрессии между нервным сплетением, периваскулярной нишей и субодонтобластической нишей. Клетки в нервном сплетении были положительны на нестин (ФИГ. 11С, b), тогда как клетки в периваскулярной нише не давали окрашивания на нестин (ФИГ. 11С, а). Клетки в субодонтобластической нише также были положительны на нестин (ФИГ. 11D, с и 11Е, с), тогда как бесклеточные зоны и богатые клетками зоны ниш не давали окрашивания на нестин (ФИГ. 11D, d и 11F, d).
Пример 10: Открытие предполагаемых ниш стволовых клеток в пуповине
Предполагаемые ниши стволовых клеток в пуповине определяли по выявлению нейрофиламентов (НФ) и низкоаффинного рецептора фактора роста нервов (р75 или CD271). НФ представляют собой филаменты длиной 10 нм или промежуточные филаменты, обнаруживаемые в нейронах. CD271 представляет собой один из двух типов рецепторов на нейротрофины, которые являются семейством белков-факторов роста, которые стимулируют выживание и дифференцировку нейронов. В ткани пуповины были найдены и НФ, и CD271. Экспрессия НФ происходила преимущественно в субамниотической эпителиальной зоне (ФИГ. 12А), тогда как экспрессия CD271 происходила преимущественно в вене и артериях (ФИГ. 12 В). Стволовые клетки, выделенные из указанных ниш, могли подвергаться дифференцировке в нейроны in vitro, экспрессирующие бета-III-тубулин и глиофибриллярный кислый белок (GFAP) (ФИГ. 12С и 12D).
Пример 11: Открытие ниш плюрипотентных стволовых клеток или незрелых предшественников в пуповине
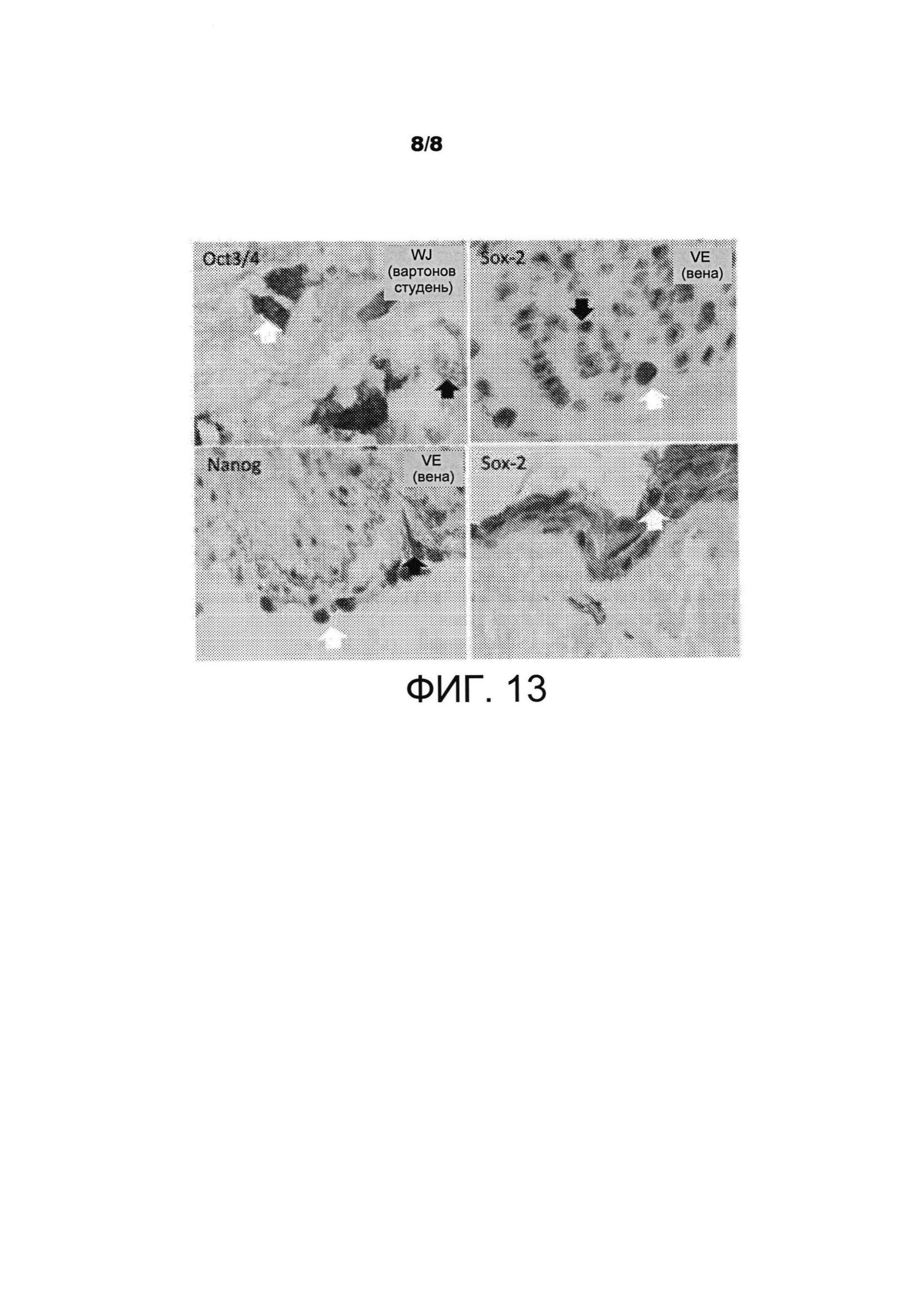
Определяли экспрессию факторов транскрипции, таких как Oct 3/4, nanog и Sox2. Экспрессия белка Oct 3/4 детектировали соответственно в ядерной локализации в клетках WJ, венах (VE), артериях (AR) и в клетках, локализованных в базальном слое (BL) эпителия амниона (АЕР) (ФИГ. 13). Небольшое количество клеток, экспрессирующих все три указанных маркера, определялось в ядрах, аналогично плюрипотентным клеткам. Следовательно, авторы настоящего изобретения могут прогнозировать выделение небольшого количества «истинных» плюрипотентных стволовых клеток из VE и AR, и из АЕР пуповины. Указанные клетки могут также обнаруживаться в других родственных тканях, таких как плацента и ткань, полученная из внезародышевой мезодермы.
Пример 12: Анализ безопасности - культивирование ниш стволовых клеток in vitro после нескольких механических переносов
Общеизвестно, что стволовые клетки находятся в конкретных анатомических областях организма человека, которые называются нишами стволовых клеток (НСК). В каждой ткани есть свои НСК, которые в ответ на сигналы, поступающие от микроокружения, принимают решение о судьбе стволовых клеток. Однако мало что известно о биологических характеристиках стволовых клеток in situ в их естественных нишах, и как указанные характеристики могут изменяться во время культивирования МСК in vitro. Например, клетки могут перестать экспрессировать некоторые белки или начать экспрессировать новые белки. Данный вопрос очень важен, поскольку это может иметь далеко идущие последствия в клинических исследованиях и может объяснять успех и/или неуспех применения стволовых клеток в регенеративной медицине. Клетки, культивируемые in vitro, лишены архитектуры ткани, а также всех функций, основанных на контексте ткани (межклеточные взаимодействия, секреция специфических факторов и т.д.). По этой причине линии клеток могут терять тканеспецифичные функции и могут приобретать молекулярный фенотип, значительно отличающийся от клеток в ЦНС. Исследование характера экспрессии маркеров стволовыми клетками в ЦНС важно для оценки безопасности стволовых клеток, особенно для их применения у людей.
В Таблице 6 авторы настоящего изобретения в обобщенном виде представили данные, полученные в ходе иммуногистохимического анализа для образцов ткани с клетками in vivo после выделения и проточной цитомерии для in vitro образцов клеток, культивированных с применением нескольких механических переносов. Данные в Таблице 6 демонстрируют, что большинство маркеров экспрессируется стволовыми клетками и in vivo, и in vitro, особенно пульпой зуба, и не продемонстрировано отсутствия маркеров в выделенных клетках, полученных после механического переноса. Клетки, полученные после механического переноса ткани пуповины, продемонстрировали небольшие отличия по проценту клеток, экспрессирующих c-kit и виментин. Хотя указанные результаты относятся к стволовым клеткам, выделенным из пульпы зуба и ткани пуповины, такой анализ безопасности можно применять для стволовых клеток из других источников, даже для клеток в жидкой фазе.


Если не указано другое, все технические и научные термины в настоящей заявке имеют те же значения, которые обычно под ними понимают специалисты в той области техники, к которому относится настоящее изобретение. Хотя любые способы и материалы, сходные или эквивалентные тем, которые описаны в настоящей заявке, можно применять при реализации на практике или при проверке настоящего изобретения, в заявке описаны предпочтительные способы и материалы. Все публикации, патенты и публикации патентов, цитируемые в настоящей заявке, включены в нее посредством ссылки на их полную версию для любых целей.
Публикации, обсуждаемые в настоящей заявке, приведены исключительно с целью раскрыть предшествующий уровень техники, существующий до даты подачи настоящей заявки. Ничто в настоящей заявке не предполагает признания того, что настоящее изобретение не позволяет датировать задним числом такую публикацию благодаря предыдущему изобретению.
Следует понимать, что раскрываемое изобретение не ограничивается конкретной описываемой терминологией, протоколами и материалами, поскольку они могут варьировать. Также следует понимать, что применяемая в настоящей заявке терминология предназначена только для целей описания конкретных вариантов реализации, но не должна ограничивать область настоящего изобретения, которая ограничивается только прилагаемой формулой изобретения.
Специалисты в данной области техники должны понимать, или должны быть способны удостовериться при помощи стандартных экспериментов, что существует много эквивалентов специфическим вариантам реализации настоящего изобретения, описанным в настоящей заявке. Предполагается, что такие эквиваленты включены в нижеследующую формулу изобретения.
ССЫЛКИ
1. Chen VC et al. (2012) "Scalable GMP compliant suspension culture system for human ES cells" Stem Cell Res. 2012 May; 8(3):388-402.
2. Schirmaier et al: Scale-up of adipose tissue-derived mesenchymal stem cell production in stirred single-use bioreactors under low-serum conditions. Eng. Life Sci. 2014, 14, 292-303,
3. Vallee et al: Adipose-tissue engineering: taking advantage of the properties of human adipose-derived stem/stromal cells. Pathol Biol (Paris). 2009 Jun; 57(4):309-17
4. Nekanti et al: Optimization and scale-up of Wharton's jelly-derived mesenchymal stem cells for clinical applications. Stem Cell Research (2010) 5, 244-254.
5. Brooke G, Rossetti T, Pelekanos R, et al: Manufacturing of human placenta-derived mesenchymal stem cells for clinical trials. Br J Haematol. 144:571-579. 2008.
6. Govindasamy et al: Human platelet lysate permits scale-up of dental pulp stromal cells for clinical applications. Cytotherapy, 2011; Early Online, 1-13
7. Hanley et al: Efficient manufacturing of therapeutic mesenchymal stromal cells with the use of the Quantum Cell Expansion System; Cytotherapy, 2014-08-01, Volume 16, Issue 8, 1048-1058
8. Lizier NF, Kerkis A, Gomes CM, Hebling J, Oliveira CF, Caplan AI, Kerkis I. Scaling-up of dental pulp stem cells isolated from multiple niches. PLoS One. 2012; 7(6):e39885; Kerkis I, Caplan AI. Stem cells in dental pulp of deciduous teeth. Tissue Eng Part В Rev. 2012 Apr; 18(2):129-38.
9. Maher Al-Atari Abou-Asi





10. Cordeiro MM, Dong Z, Kaneko T, Zhang Z, Miyazawa M, Shi S, Smith AJ,

11. Arora V, Arora P, Munshi AK. Banking Stem Cells from Human Exfoliated Deciduous Teeth (SHED): Saving for the Future J Clin Pediatr Dent 33(4): 289-294, 2009
12. Sukoyan MA, Kerkis AY, Mello MR, Kerkis IE, Visintin JA, Pereira LV. Establishment of new murine embryonic stem cell lines for the generation of mouse models of human genetic diseases. Braz J Med Biol Res. 2002 May; 35(5):535-42.
13. Carta L, Pereira L, Arteaga-Solis E, Lee-Arteaga SY, Lenart B, Starcher B, Merkel CA, Sukoyan M, Kerkis A, Hazeki N, Keene DR, Sakai LY, Ramirez F. Fibrillins 1 and 2 perform partially overlapping functions during aortic development. J Biol Chem. 2006 Mar 24; 281(12):8016-23
14. Kerkis A, Fonseca SA, Serafim RC, Lavagnolli TM, Abdelmassih S, Abdelmassih R, Kerkis I. In vitro differentiation of male mouse embryonic stem cells into both presumptive sperm cells and oocytes. Cloning Stem Cells. 2007 Winter; 9(4):535-48.
15. Lavagnolli TM, Fonseca SA, Serafim RC, Pereira VS, Santos EJ, Abdelmassih S, Kerkis A, Kerkis I. Presumptive germ cells derived from mouse pluripotent somatic cell hybrids. Differentiation. 2009 Sep-Oct; 78(2-3):124-30
16. Hayashi MA, Guerreiro JR, Cassola AC, Lizier NF, Kerkis A, Camargo AC, Kerkis I. Long-term culture of mouse embryonic stem cell-derived adherent neurospheres and functional neurons. Tissue Eng Part С Methods. 2010 Dec; 16(6):1493-502.
17. Lima BL, Santos EJ, Fernandes GR, Merkel C, Mello MR, Gomes JP, Soukoyan M, Kerkis A, Massironi SM, Visintin JA, Pereira LV A new mouse model for marfan syndrome presents phenotypic variability associated with the genetic background and overall levels of Fbn1 expression. PLoS One. 2010 Nov 30; 5(1l):e14136.
18.
19. Deepa Ponnaiyan - Do dental stem cells depict distinct characteristics? - Establishing their "phenotypic fingerprint" Dent Res J (Isfahan). 2014 Mar-Apr; 11(2):163-172
20. Brito et al., Imbalance of p75NTR/TrkB protein expression in Huntington's disease: implication for neuroprotective therapies. Cell Death and Disease (2013) 4, e595; doi:10.138/cddis.2013.116
21. Crisostomo PR, Wang M, Wairiuko GM, et al. High passage number of stem cells adversely affects stem cell activation and myocardial protection. Shock. 2006; 26:575-80.
22. Digirolamo CM, Stokes D, Colter D, et al. Propagation and senescence of human marrow stromal cells in culture: a simple colony-forming assay identifies samples with the greatest potential to propagate and differentiate. Br J Haematol. 1999; 107:275-81.
23. Muraglia A, Cancedda R, Quarto R. Clonal mesenchymal progenitors from human bone marrow differentiate in vitro according to a hierarchical model. J Cell Sci. 2000; 113:1161-6.
24. Rubio D, Garcia-Castro J, Martin MC, et al. Spontaneous human adult stem cell transformation. Cancer Res. 2005; 65:3035-9.
25. Stenderup K, Justesen J, Clausen C, Kassem M. Aging is associated with decreased maximal life span and accelerated senescence of bone marrow stromal cells. Bone. 2003; 33:919-26.
Реферат
Изобретение относится к области биотехнологии, а именно к получению и размножению популяции первично полученных стволовых клеток in vitro из эксплантированной ткани. Способ включает промывку указанной эксплантированной ткани, которая представляет собой послеродовую ткань, и минимальные манипуляции с указанной эксплантированной тканью. Затем осуществляют культивирование указанной эксплантированной ткани in vitro в течение цикла сбора клеток на первой поверхности для культивирования с питательной средой для формирования культуры первично полученных стволовых клеток, сбор первично полученных стволовых клеток из указанной питательной среды и перенос указанной эксплантированной ткани на вторую поверхность для культивирования с питательной средой. Указанные этапы осуществляют в течение по меньшей мере трёх циклов сбора клеток в отношении указанной эксплантированной ткани с получением размноженной популяции первично полученных стволовых клеток из указанной эксплантированной ткани. Изобретение позволяет получить клетки с повышенной экспрессией биомаркеров. 2 н. и 19 з.п. ф-лы, 13 ил., 6 табл., 11 пр.

Комментарии