Органоиды, содержащие изолированные почечные клетки, и их применение - RU2722361C2
Код документа: RU2722361C2
Чертежи











Описание
ОБЛАСТЬ ТЕХНИКИ
[001] Изобретение относится к смесям отобранных биоактивных первичных клеток почек и дополнительных популяций биоактивных клеток, и способам лечения субъекта, имеющего для этого показания. Изобретение дополнительно относится к органоидам, содержащим изолированные почечные клетки, включая популяции канальцевых и эритропоэтин (ЭПО)-продуцирующих клеток почки, и способам лечения субъекта, имеющего показания для терапии этими органоидами.
УРОВЕНЬ ТЕХНИКИ
[002] Хроническое заболевание почек (ХЗП) регистрируется более чем у 19 миллионов людей в Соединенных Штатах, и часто является следствием нарушения обмена веществ, связанных с ожирением, сахарным диабетом и гипертензией. Обзор данных показывает, что темп роста связан с развитием почечной недостаточности, вторичной по отношению к артериальной гипертензии и инсулиннезависимому сахарному диабету (ИНСД) (база данных США по заболеваниям почек: Costs of CKD and ESRD. ed. Bethesda, MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2007 pp 223-238) - двум заболеваниям, уровень регистрации которых также на подъеме во всем мире. Доказано, что ожирение, гипертензия и недостаточный контроль гликемии являются независимыми факторами риска развития патологии почек, вызывая клубочковые и канальцевые поражения, ведущие к протеинурии и другим системно-выявляемым изменениям функции почечной фильтрации (Aboushwareb, et al., World J Urol, 26: 295-300, 2008; Amann, K. et al., Nephrol Dial Transplant, 13: 1958-66, 1998). Тактика ведения пациентов с ХЗП в стадии 1-3 прогрессирования основана на изменении образа жизни и фармакологических вмешательствах, направленных на контроль состояния (состояний) основного заболевания, в то время как пациентам в стадии 4-5 назначается диализ и медикаментозное лечение, которое, как правило, включает антигипертензивные средства, агенты, стимулирующие эритропоэз (АСЭ), восполняющее введение железа и витамина D. Согласно службе данных США по заболеваниям почек (USRDS), в среднем на одного пациента при терминальной стадии хронической почечной недостаточности (ТХПН) затрачивается > $ 600 в месяц на инъекционные агенты, стимулирующие эритропоэз (АСЭ), восполняющее введение витамина D и железа (база данных США по заболеваниям почек: Costs of CKD and ESRD. ed. Bethesda, MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2007 pp 223-238). При учете ежегодной средней стоимости диализа ($ 65405), стоимость лечения одного пациента возрастает до > $ 72000 в год (база данных США по заболеваниям почек: Costs of CKD and ESRD. ed. Bethesda, MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2007 pp 223-238) – сумма, которая отражает только расходы на стандартные процедуры, и не включает лечение других осложнений, неотложных мер или вспомогательных процедур, таких как установка сосудистых имплантатов для диализного доступа. Общая стоимость лечения пациентов с ХЗП и ТХПН в 2005 году составила $ 62 миллиарда – это 19% бюджета всей медицинской помощи за этот год (база данных США по заболеваниям почек: Costs of CKD and ESRD. ed. Bethesda, MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2007 pp 223-238). Трансплантация почки представляет собой эффективный способ лечения пациентов с 4-5 стадиями заболевания, так как является упреждающей мерой для избежания диализа, или в случаях, когда для контроля за состоянием заболевания диализа уже не достаточно, но количество пациентов с 5 стадией ХЗП в США (> 400000), которые могли бы извлечь преимущество от пересадки целой почки, существенно превышает количество подходящих донорских почек в любом отдельно взятом году (~ 16000) (Powe, NR et al., Am J Kidney Dis, 53: S37-45, 2009). Таким образом, необходимы новые парадигмы лечения, обеспечивающие замедление или снижение зависимости от диализа и заполнение пробелов, возникших в результате нехватки донорских почек.
[003] Прогрессирование заболевания почек происходит в результате сочетания первичного поражающего состояния (например, гипертензии) и дальнейшей неадекватной ответной реакции почки на это поражение. Такая ответная реакция включает продукцию провоспалительных и профиброзных цитокинов и факторов роста. Таким образом, одной из стратегий замедления прогрессирования ХЗП является усовершенствование воспалительной и фиброзной ответных реакций, а также смягчение или обратное развитие дегенерации почек путем восстановления и/или регенерации их ткани.
[004] Хроническая почечная недостаточность распространена среди людей, а также некоторых домашних животных. У пациентов с почечной недостаточностью происходит не только утрата функции почек (уремия), но и развивается анемия, вызванная невозможностью костного мозга продуцировать достаточное количество красных кровяных телец (эритроцитов) путем эритропоэза. Эритроидный гомеостаз зависит как от продукции эритропоэтина (ЭПО) специализированными интерстициальными фибробластами, которые находятся в почках, так и способности целевых эритроидных клеток-предшественников в костном мозге отвечать на ЭПО и продуцировать больше эритроцитов. Анемия при почечной недостаточности развивается в результате снижения продукции ЭПО в почке и негативных последствий уремических факторов на активность ЭПО в костном мозге.
[005] На сегодняшний день клинические подходы к лечению хронической почечной недостаточности включают диализ и трансплантацию почки с целью восстановления почечной фильтрации и выработки мочи, и системную доставку рекомбинантных ЭПО или аналогов ЭПО для возмещения эритроидной массы. Диализ эффективен относительно выживаемости пациентов, имеющих уже не начальные стадии почечной недостаточности, но вызывает значительные ухудшения показателей качества жизни. Трансплантация почки является весьма желательным (и зачастую единственным) вариантом лечения для пациентов с поздними стадиями почечной недостаточности, но поставка высококачественных донорских почек не удовлетворяет потребности людей с почечной недостаточностью. Применение болюсных доз рекомбинантного ЭПО для лечения анемии в настоящее время связано с серьезными последующими рисками для здоровья, повлекшие за собой особые предостережения FDA относительно препарата и необходимость дополнительной разработки альтернативных способов лечения с целью восстановления эритроидного гомеостаза в этой категории пациентов. Доклинические исследования изучали эффективность и безопасность ЭПО-продуцирующих клеток in vivo, которые были получены с помощью способов генной терапии. Эти исследования показали возможность временной стимуляции эритропоэза и количества эритроцитов путем доставки ЭПО-продуцирующих клеток in vivo. Тем не менее, на сегодняшний день, ни один из этих подходов не предложил возможности регуляции эритроидного гомеостаза или долгосрочной функциональности in vivo. Следовательно, гематокрит и количество эритроцитов часто повышаются, превышая пределы нормальных значений, что приводит к полицитемии и другим осложнениям. Введение ЭПО-продуцирующих клеток, которые являются терапевтически значимыми и обеспечивают преимущества по сравнению с введением рекомбинантного ЭПО, должна не только увеличить гематокрит, но и восстановить эритроидный гомеостаз, как с положительными, так и отрицательными регуляторными интактными механизмами. Важно отметить, что ЭПО-дефицитные анемии, которые распространены у пациентов с заболеваниями почек, также могут развиваться в следствие других патологий, включая сердечную недостаточность, полиоргананную системную недостаточность и другие хронические заболевания.
[006] Восстановительные технологии в медицине обеспечивают ультрасовременные терапевтические возможности для пациентов с хроническим заболеванием почек (ХЗП). Presnell et al. WO/2010/056328 и Ilagan et al. PCT/US2011/036347 описывают изолированные биоактивные почечные клетки, включая популяции канальцевых и эритропоэтин (ЭПО)-продуцирующих клеток почки и способы их изолирования и культивирования, а также способы лечения субъекта, имеющего показания для терапии клеточными популяциями.
[007] Существует потребность в усовершенствованных и более целенаправленных регенеративных терапевтических возможностях медицины для лечения субъектов, имеющих для этого показания.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[008] В настоящем описании представлены органоиды, способы их получения и применения.
[009] С помощью органоидов, как описано в настоящем описании, обеспечивается терапевтическое преимущество для субъекта, имеющего показания для лечения без использования скаффолд-технологий.
[0010] В одном аспекте предлагается способ формирования органоида, содержащего гетерогенную популяцию клеток почек и популяцию биоактивных клеток. В одном варианте реализации изобретения способ включает культивирование гетерогенной популяции клеток почек и популяции биоактивных клеток в культуральной системе, выбранной из группы, состоящей из i) культуры 2D; ii) культуры 3D: гель COL(I); iii) культуры 3D : Матригель; iv) культуры 3D: с постоянным перемешиванием, за которым следует COL(I)/Матригель; и v) культуры 3D: гель COL(IV). В некоторых вариантах реализации изобретения гетерогенная популяция клеток почек содержит популяцию биоактивых клеток почек. В определенных вариантах реализации изобретения гетерогенная популяция клеток почек содержит клеточную популяцию В2, содержащую обогащенную популяцию канальцевых клеток, и при этом гетерогенная популяция клеток почек обеднена клеточной популяцией В1 и/или клеточной популяцией В5 или их комбинацией. В некоторых вариантах реализации изобретения гетерогенная популяция клеток почек содержит клеточную популяцию, выбранную из B2, B2/B3, B2/B4 и B2/B3/B4. В некоторых вариантах реализации изобретения гетерогенная популяция клеток почек содержит эритропоэтин (ЭПО)-продуцирующие клетки.
[0011] В некоторых вариантах реализации изобретения популяция биоактивных клеток представляет собой популяцию эндотелиальных клеток. В некоторых вариантах реализации изобретения популяция эндотелиальных клеток представляет собой клeточную линию. В некоторых вариантах реализации изобретения популяция эндотелиальных клеток является производной от пуповины человека. В некоторых вариантах реализации изобретения популяция биоактивных клеток содержит эндотелиальные клетки-предшественники. В некоторых вариантах реализации изобретения популяция биоактивных клеток содержит мезенхимальные стволовые клетки. В некоторых вариантах реализации изобретения популяция эндотелиальных клеток происходит от взрослой особи. В некоторых вариантах реализации изобретения клеточные популяции выбираются из группы ксеногенных, сингенных, аллогенных, аутологичных популяции и их комбинаций.
[0012] В другом варианте реализации изобретения в течение первого периода времени гетерогенная популяция клеток почек и популяция биоактивных клеток культивируются отдельно, а в течение второго периода времени - культивируются сочетанно. В определенных вариантах реализации изобретения популяция клеток почек и популяция биоактивных клеток объединены в соотношении 1:1. В большинстве вариантов реализации изобретения популяция клеток почек и популяция биоактивных клеток объединены, например, суспендированными, в среде роста. В некоторых вариантах реализации изобретения продолжительность второго периода времени составляет от 24 до 72 часов, предпочтительно 24 часа.
[0013] В другом аспекте предлагается органоид. В некоторых вариантах реализации изобретения органоиды получены в соответствии с способами, описанными в настоящем документе. Во всех вариантах реализации изобретения органоиды содержат гетерогенную популяцию клеток почек и популяцию биоактивных клеток. В некоторых вариантах реализации изобретения популяция биоактивных клеток представляет собой популяцию эндотелиальных клеток. В некоторых вариантах реализации изобретения популяция эндотелиальных клеток представляет собой клeточную линию. В определенных вариантах реализации изобретения популяция эндотелиальных клеток содержит ЭКПВЧ-клетки (эндотелиальные клетки пупочной вены человека).
[0014] В некоторых вариантах реализации изобретения гетерогенная популяция клеток почек содержит клеточную популяцию В2, содержащую обогащенную популяцию канальцевых клеток, и при этом гетерогенная популяция клеток почек обеднена клеточной популяцией В1. В определенных вариантах реализации изобретения гетерогенная популяция клеток почек дополнительно обедняется клеточной популяцией B5. В выбранных вариантах реализации изобретения гетерогенная популяция клеток почек содержит клеточную популяцию, выбранную из B2, B2/B3, B2/B4 и B2/B3/B4. В некоторых вариантах реализации изобретения гетерогенная популяция клеток почек содержит эритропоэтин(ЭПО)-продуцирующие клетки.
[0015] В дополнительном аспекте предлагается состав для инъекций, содержащий по меньшей мере один органоид и жидкую среду. В одном варианте реализации изобретения жидкая среда выбирается из среды роста клеток, DPBS (фосфатно-солевой буфер Дюльбекко) и их комбинаций. В другом варианте реализации изобретения органоиды суспендируют в жидкой среде.
[0016] Во втором варианте реализации изобретения состав для инъекций содержит органоиды и биоматериал, стабилизирующий клетки, чувствительный к температуре и поддерживающий (I) по существу твердое состояние при температуре около 8°С или ниже, и (II) по существу жидкое состояние при температуре окружающей среды или выше. В одном ином варианте реализации изобретения биоактивные клетки содержат почечные клетки, как описано в настоящем документе. В другом варианте реализации изобретения биоактивные клетки по существу равномерно диспергированы по всему объему биоматериала, стабилизирующего клетки. В других вариантах реализации изобретения биоматериал характеризуется переходным состояниям "из твердого вещества в жидкость" в диапазоне от около 8°С и приблизительно до значения температуры окружающей среды или выше. В одном варианте реализации изобретения по существу твердое состояние является гелеобразным состоянием. В другом варианте реализации изобретения биоматериал, стабилизирующий клетки, содержит гидрогель. В одном ином варианте реализации изобретения гидрогель содержит желатин. В других вариантах реализации изобретения желатин присутствует в составе в количествах от около 0,5% до около 1% (масса/объем). В других вариантах реализации изобретения желатин присутствует в составе в количестве около 0,75% (масса/объем).
[0017] В одном аспекте предлагается способ лечения заболевания почек у пациента, имеющего для этого показания, который предусматривает введение по меньшей мере одного органоида, содержащего гетерогенную популяцию клеток почек и популяцию биоактивных клеток. В некоторых вариантах реализации изобретения популяция биоактивных клеток представляет собой популяцию эндотелиальных клеток. В некоторых вариантах реализации изобретения популяция эндотелиальных клеток представляет собой клeточную линию. В одном варианте реализации изобретения популяция эндотелиальных клеток содержит ЭКПВЧ-клетки (эндотелиальные клетки пупочной вены человека).
[0018] В большинстве вариантов реализации изобретения гетерогенная популяция клеток почек содержит клеточную популяцию В2, содержащую обогащенную популяцию канальцевых клеток, и при этом гетерогенная популяция клеток почек обеднена клеточной популяцией В1. В выбранных вариантах реализации изобретения гетерогенная популяция клеток почек дополнительно обедняется клеточной популяцией B5. В некоторых вариантах реализации изобретения гетерогенная популяция клеток почек содержит клеточную популяцию, выбранную из B2, B2/B3, B2/B4 и B2/B3/B4. В большинстве вариантов реализации изобретения гетерогенная популяция клеток почек содержит эритропоэтин(ЭПО)-продуцирующие клетки.
[0019] В одном варианте реализации изобретения способ лечения заболевания почек у пациента, имеющего для этого показания, включает введение состава для инъекций, как описано в настоящем документе. Во всех вариантах реализации изобретения субъектом является млекопитающее, выбранное из собак, кошек, лошадей, кроликов, животных зоопарка, коров, свиней, овец и приматов. В конкретном варианте реализации изобретения млекопитающее представляет собой человека. Во всех вариантах реализации изобретения субъект имеет заболевание почек. В вариантах реализации изобретения наблюдается улучшение любого из следующих показателей: анемии (гематокрит, гемоглобин, эритроциты), воспаления (лейкоциты), концентрации мочи (spGrav) и азотемии (АМК - азот мочевины крови).
[0020] В другом аспекте предлагается использование органоида в изготовлении лекарственного средства для лечения болезни почек.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
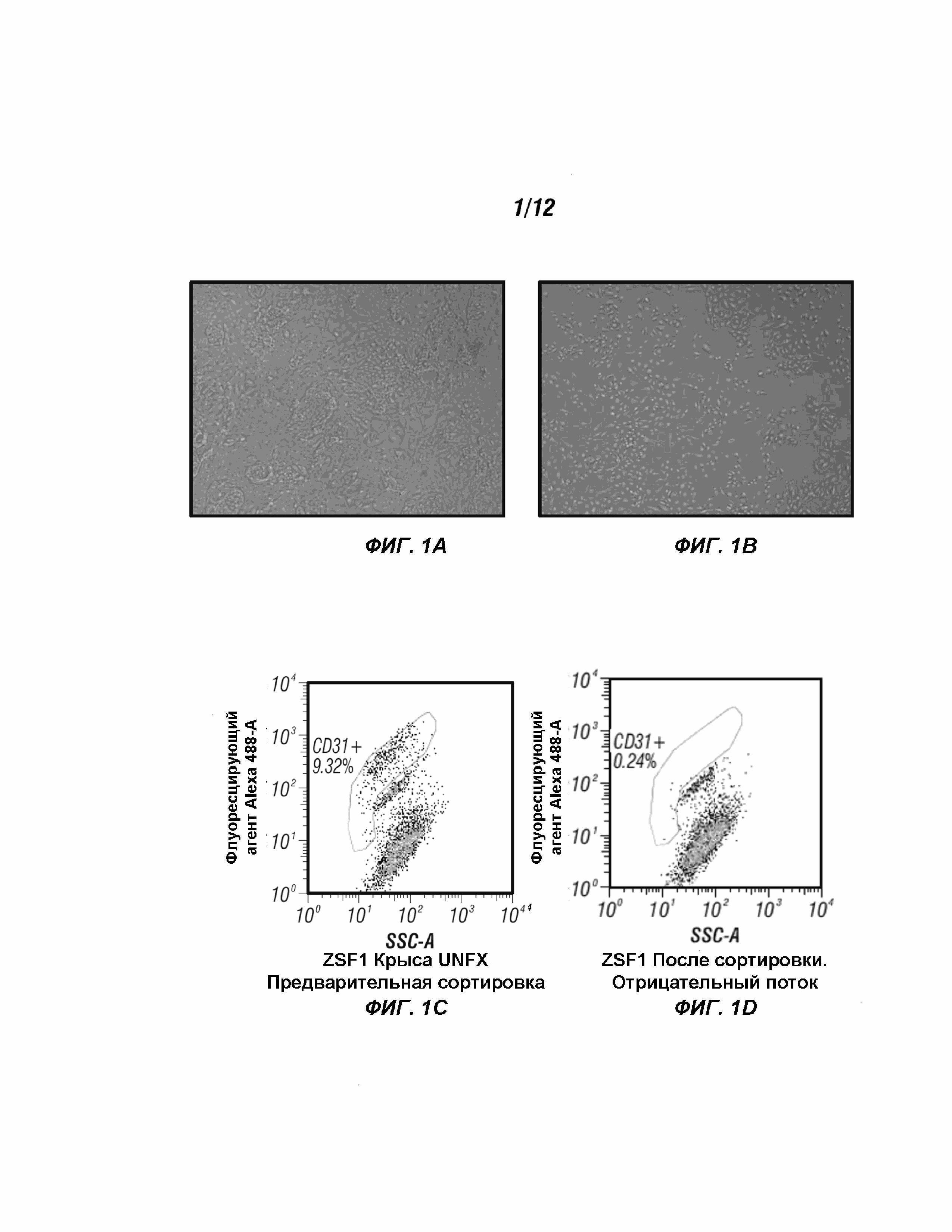
[0021] Фиг. 1 демонстрирует морфологию культуры первичных клеток ZSF1 на планшетах, покрытых фибронектином. A. p0 нефракционированная предварительная сортировка, наблюдаемая при 5-кратном увеличении; B. p1 CD31+, наблюдаемые при 5-кратном увеличении; C. первичная культура нефракционированных почечных клеток в конце пассажа 0, выращенные в 21% O2 на культуральном матрасе, обработанном фибронектином в KGM; D. отрицательный поток через (CD31-) в результате отбора микрогранулами Miltenyi; и E.90% CD31+ клетки, отобранные в конце пассажа 1, выращенные на культуральных матрасах, покрытых фибронектином, в среде, полностью обогащенной EGM2.
[0022] Фиг. 2 демонстрирует морфологию клеточной культуры человека при 5-кратномувеличении. A. Нефракционированные клетки почки в конце p0, выращенные в 21% O2 на культуральном матрасе, обработанном TC в KGM; B. Нефракционированные клетки почки в конце пассажа 0, выращенные под воздействием 2%O2 O/N на культуральном матрасе, обработанном TC в KGM; C. Нефракционированные клетки почки в конце пассажа 0 на культуральных матрасах, покрытых фибронектином, в среде, полностью обогащенной EGM2; D. CD31+, положительно отобранные в конце пассажа 1, выращенные на культуральных матрасах, покрытых фибронектином, в среде, полностью обогащенной EGM2.
[0023] Фиг. 3 изображен анализ FACS, демонстрирующий процент положительных эндотелиальных клеток CD31 в отобранных образцах в период культивирования. Нефракционированный (UNFX) эндотелиальный состав составлял <3% при р0 и был обогащен ~ 15 раз в p1 при посеве на фибронектин и культивировался в среде EGM-2.
[0024] Фиг. 3-1 продемонстрированы репортеры Bigeneic Cre/loxP для исследований отслеживания линии дифференцировки.
А. Перекресные следы эпителиальных клеток Six2-Cre x R26td Tomato Red: париетальные, проксимальные и дистальные эпителиальные клетки, за исключением клеток интерстициального или собирательного протока. В. Немеченный контроль. С. Положительность Six-2 от культуры p1 (3 дня нормоксическая культура, затем 1 день - гипоксическая культура).
[0025] Фиг. 4 продемонстрированы вращающиеся культуральные матрасы (А) и планшеты с низким связыванием на ротаторе (B), используемые для формирования органоида SRC.
[0026] Фиг. 5 продемонстрировано фазовое изображение (в 10-кратном увеличении) из А. крысиного и B. человеческого SRC, имеющих однинаковый размер. С. Органоиды, экспрессирующие пан-кадгериновый фенотип (зеленый), ядерный (синий) (в 20-кратном увеличении).
[0027] Фиг. 6 продемонстрированыорганоиды человека, культивированные в 3D-коллагеновом геле I/IV. А. Фазовое изображение, показывающее небольшое увеличение образования органоидного канальца (в белом кольце). B. Фазовое изображение при большем увеличении (в белом кольце) наряду с остаточными органоидами. С. Фенотипическая экспрессия GGT-1 (зеленый), ядерная (синий) D. Экспрессия CK18 (зеленый), ядерная (синий) при 20-кратном увеличении.
[0028] Фиг. 7 изображены органоиды, помеченные мембранным красителем. А. SRC, меченные только DiL (красный) при 100-кратном увеличении. B. Органоид плюс, SRC, меченные DiL (красный) ЭКПВЧ, меченные DiO (зеленый) при 100-кратном увеличении.
[0029] Фиг. 8 продемонстрирован 3D анализ генеза канальцев в геле Col I/IV самогенерируемых органоидов плюс в панелях А, В и С, показывающих присутствие как популяции SRC (красный), так и эндотелиальных клеток (зеленый). При объединении популяции проявляются желтым. Ядерное окрашивание (синий) при 20-кратном увеличении.
[0030] Фиг. 9 изображены органоиды, меченные SPIO Rhodamine перед введением.
[0031] Фиг. 10 продемонстрировано магнитно-резонансное изображение (МРИ) сохранения органоида после имплантации зеленый = клетки А. 24 часа. Б. 48 часов после введения.
[0032] Фиг. 11 изображено окрашивание имплантированных органоидов прусской синей лазурью с демонстрацией сохранения клеток и биораспределения при малом и большом увеличении. А. Имплантированная левая почка по истечению 24 часов после имплантации. А. Имплантированная левая почка по истечению 48 часов после имплантации.
[0033] Фиг. 12 представляет собой панель фотографий, демонстрирующих окрашивание HLA1 клеток человека в почке крысы, которые были введены в органоиды, описанные в настоящем документе. А. Нормальная человеческая почка; B. Клетки почки человека в почке крысы. С. Нефрэктомированная почка крысы, не поддававшаяся воздействию. D. После воздействия NKO (микроскопия с малым увеличением). E. После воздействия NKO (микроскопия с большим увеличением). F. Второе животное, получавшее NKO. Панели А и В демонстрируют окрашенные (коричневый) нормальные ткани почки человека, а также клетки почки человека (зеленые стрелки), четко внедренные в почку грызуна. Фоновое окрашивание присутствует в конце исследования необработанных больных крысиных почек предположительно из-за «вязкой» структуры белковоподобных цилиндров и поврежденных канальцев, на которые указывают желтые стрелки в панели C и F. Это окрашивание обычно светлее по цвету, но иногда - темное и имеющее размер меньше клеток. Панели D, Е и F демонстрируют меньшее увеличение, используемое для скрининга с целью выявления темноокрашенных клеток, и большее увеличение - для подтверждения наличия окрашенных клеток HLA1 (зеленые стрелки).
[0034] Этот патент или поданная заявка содержит по меньшей мере один графический материал, выполненный в цвете. Копии этого патента или опубликованный патент с цветным графическим материалом (материалами) будут предоставлены Бюро по запросу и после уплаты необходимой пошлины.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0035] Нефрон, который является функциональной единицей паренхимы почки, состоит из многих типов клеток. Недавно была установлена возможность изолировать терапевтически биоактивные почечные клетки как от здоровых, так и больных животных и людей1-3. Метод, используемый в этих исследованиях, зависит от изолирования смеси почечных клеток, которые существуют в биоптате пораженной ткани, и предусматривает центрифугирование с помощью градиента плавучей плотности.
[0036] Настоящее изобретение, в одном аспекте, относится к изолированию, идентификации и разрастанию выбранных отдельных клеточных популяций различных отделов нефрона или ниш, в результате чего новые, многократно обогащенные типы клеток могут быть объединены в выбранных смесях. Новые выбранные смеси по настоящему изобретению предназначены для оптимизированного влияния на специфические структурные и функциональные недостатки, связанные с клиническим и патофизиологическим фоном заболеваний почек. Изоляция и обогащение множества отдельных типов клеток, которые составляют нефрон, и комбинация их в выбранные смеси, позволяют усовершенствовать направленность лечения отдельных групп почечных заболеваний.
[0037] Типы клеток, такие как сосудистый эндотелий, эпителий канальцев и собирающего протока, интерстициальные клетки, клетки клубочков, мезенхимальные стволовые клетки и т.д., могут быть изолированы, идентифицированы и увеличены в своем количестве ex-vivo. Несмотря на то, что для каждого типа клеток может понадобиться уникальный способ и состав среды для субкультуры, они могут быть добавлены обратно в селективные комбинации или смеси в качестве органоидных кластеров с целью обеспечения оптимизации введения и усовершенствования воздействия на подлежащую почечную ткань/неполноценные клетки, ассоциированные со специфическим синдром острого и/или хронического заболевания почек у пациента/группы8.
[0038] Настоящее изобретение предусматривает способы лечения нарушенной функции почек, связанной с заболеваниями сосудистой системы (например, гипертензия, микроангиопатическая анемия), с использованием определенного соотношения эпителия почечных канальцев к эндотелиальным клеткам. Возможность изолировать, охарактеризовать и увеличить количество постоянных эндотелиальных клеток почек с использованием систем селективных культур и магнитной сортировки позволяет обогатить ранее охарактеризованную популяцию селективных регенеративных эпителиальных клеток почек (SRC)2,4 с определенным процентом очищенных эндотелиальных клеток почек (SRC+). Популяции клеток SRC+ по настоящему изобретению состоят из отобранных клеток почек (SRC или BRC), как описано выше, а также как описано в настоящем документе, и дополнительной популяции биоактивных клеток, включая, но не ограничиваясь ими, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки и/или клетки-предшественники, полученные из жировой ткани. В одном варианте реализации изобретения источником для дополнительных популяций биоактивных клеток является почка. В одном варианте реализации изобретения для дополнительных популяций биоактивных клеток источником является не почка.
[0039] Настоящее изобретение, в одном аспекте, относится к органоидам, содержащим и/или формируемым из гетерогенных смесей или фракций, отобранных или биологически активных клеток почек (SRC или BRC) или популяции клеток SRC+, способам их изолирования и культивирования, а также способам лечения с использованием органоидов, как описано в настоящем документе. Ожидается, что направленное введение популяций SRC или SRC + к почке в качестве органоидов улучшит сохранение клеток, что приведет к улучшению результатов лечения в целом. Настоящее изобретение также относится к способам лечения с использованием клеточной популяции SRC+.
Определения
[0040] Если не указано иное, технические и научные термины, используемые в настоящем документе, имеют то же значение, что обычно понимается специалистом в данной области техники, к которой относится настоящее изобретение. Принципы тканевой инженерии, 3rd Ed. (под редакцией R Lanza, R Langer, & J Vacanti), 2007 предоставляет специалисту в данной области техники общее руководство для понимания большинства терминов, используемых в настоящей заявке. Специалисту в данной области техники будут понятны многие способы и вещества, аналогичные или эквивалентные описанным в настоящем документе, которые могут быть использованы в практике настоящего изобретения. Более того, настоящее изобретение никоим образом не ограничивается описанными способами и материалами.
[0041] В данном контексте термин «клеточная популяция» относится к количеству клеток, полученных путем изолирования непосредственно из пригодного тканевого источника, обычно от млекопитающих. Популяция изолированных клеток может впоследствии культивироваться in vitro. Специалист обычной квалификации в данной области техники оценит, что для использования в настоящем изобретении пригодными являются различные способы изолирования и культивирования клеточных популяций и различные количества клеток в клеточной популяции. Клеточная популяция может быть нефракционированной, гетерогенной клеточной популяцией, полученной из почки. Например, гетерогенная клеточная популяция может быть изолирована из биоптата почки или из всей почечной ткани. В альтернативном варианте, гетерогенная клеточная популяция может быть получена из культуры клеток млекопитающих in vitro, из биоптатов почки или из всей почечной ткани. Нефракционированная гетерогенная клеточная популяция может также именоваться как необогащенная клеточная популяция.
[0042] Термин «нативная почка» означает почку живого субъекта. Субъект может быть здоровым или нездоровым. Нездоровый субъект может иметь заболевание почек.
[0043] Термин «регенеративный эффект» означает эффект, который обеспечивает преимущества для нативной почки. Эффект может включать, без ограничения, снижение степени поражения родной почки или улучшение, восстановление или стабилизацию функции нативной почки. Поражение почки может быть в виде фиброза, воспаления, клубочковой гипертрофии и т.д. и связанное с заболеванием почек у субъекта.
[0044] В данном контексте термин «регенеративный потенциал» или «потенциал регенеративной биоактивности» относится к потенциалу органоидов, состоящих из клеток биологически активных препаратов и/или смесей, описанных в настоящем документе и обеспечивающих регенеративный эффект.
[0045] В данном контексте термин «смесь» относится к комбинации двух или более изолированных, обогащенных клеточных популяций, полученных из нефракционированных, гетерогенных клеточных популяций. Согласно некоторым вариантам реализации изобретения клеточные популяции по настоящему изобретению являются популяциями клеток почек.
[0046] Термин "обогащенная" популяция клеток или препарат относится к клеточной популяции, полученной из исходной популяции клеток почки (например, нефракционированной, гетерогенной клеточной популяции), и содержащей процент специфического типа клеток больший, чем процент этого типа клеток в исходной популяции. Например, исходная популяции клеток почки может быть обогащена для первой, второй, третьей, четвертой, пятой и так далее клеточной популяции, представляющей интерес. В данном контексте термины «клеточная популяция», «клеточный препарат» и «клеточный прототип» используются взаимозаменяемо.
[0047] В одном аспекте термин «обогащенная» популяция клеток, используемый в данном контексте, относится к клеточной популяции, полученной из исходной популяции клеток почки (например, клеточной суспензии из биоптата почки или культивируемых клеткок почки млекопитающих), и содержащей процент клеток, способных продуцировать ЭПО, больший, чем процент клеток, способных продуцировать ЭПО в исходной популяции. Например, термин «B4» означает клеточную популяцию, полученную из исходной популяции клеток почки и содержащую более высокий процент ЭПО-продуцирующих клеток, клеток клубочков и сосудистых клеток, по сравнению с исходной популяцией. Клеточные популяции по настоящему изобретению могут быть обогащены одним или более типами клеток и обеднены одним или более другими типами клеток. Например, обогащенная ЭПО-продуцирующая клеточная популяция может быть обогащена интерстициальными фибробластами и обеднена клетками почечного канальца и эпителиальными клетками собирающего протока по сравнению с интерстициальными фибробластами и клетками почечного канальца в необогащенной клеточной популяции, т.е. исходной клеточной популяции, из которой обогащенная клеточная популяция получена. Во всех вариантах реализации изобретения упоминаемые ЭПО-обогащенные популяции или популяции «B4», обогащенные клеточные популяции являются гетерогенными популяциями клеток, содержащими клетки, имеющие возможность продуцировать ЭПO с помощью способа, в котором регулируется уровень кислорода, что подтверждается экспрессией ЭПО, полученной от эндогенного нативного гена ЭПО, и регулируемой кислородом.
[0048] В другом аспекте, обогащенная клеточная популяция, которая содержит больший процент специфического типа клеток, например, сосудистых, клубочковых или эндокринных клеток, чем процент этого типа клеток в исходной популяции, может также отсутствовать или быть дефицитной в одном или более специфических типах клеток, например, сосудистых, клубочковых или эндокринных клетках, по сравнению с исходной популяцией клеток почек, полученной от здорового человека или субъекта. Например, в одном аспекте термин «B4», «или прайм B4» означает клеточную популяцию, полученную из исходной популяции клеток почки, которая отсутствует или является дефицитной в одном или более специфических типах клеток, например, сосудистых, клубочковых или эндокринных, в зависимости от патологического состояния исходных образцов по сравнению со здоровыми индивидумами. В одном варианте реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего хроническое заболевание почек. В одном варианте реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего фокальный сегментарный гломерулосклероз (ФСГС). В другом варианте реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего аутоиммунный гломерулонефрит. В другом аспекте, В4' представляет собой клеточную популяцию, полученную из исходной клеточной популяции, включая все типы клеток, например, сосудистые, клубочковые или эндокринные клетки, которые впоследствии обедняются или стают лишенными одного или более типов клеток, например, сосудистых, клубочковых или эндокринных клеток. В еще одном аспекте В4' представляет собой клеточную популяцию, полученную из исходной клеточной популяции, включая все типы клеток например, сосудистые, клубочковые или эндокринные клетки, в которых один или более типов клеток, например, сосудистые, клубочковые или эндокринные клетки, впоследствии обогащаются. Например, в одном варианте реализации изобретения клеточная популяция В4' может быть обогащена сосудистыми клетками, но обеднена клубочковыми и/или эндокринными клетками. В другом варианте реализации изобретения клеточная популяция В4' может быть обогащена клубочковыми клетками, но обеднена сосудистыми и/или эндокринными клетками. В другом варианте реализации изобретения клеточная популяция В4' может быть обогащена эндокринными клетками, но обеднена сосудистыми и/или клубочковыми клетками. В другом варианте реализации изобретения клеточная популяция В4' может быть обогащена сосудистыми и эндокринными клетками, но обеднена клубочковыми клетками. В предпочтительных вариантах реализации изобретения клеточная популяция В4', отдельно или в смеси с другой обогащенной клеточной популяцией, например, B2 и/или B3, сохраняет терапевтические свойства. Клеточная популяция В4', например, описана в настоящем документе в Примерах, например, Примеры 7-9.
[0049] В другом аспекте, обогащенная клеточная популяция может также относиться к клеточной популяции, полученной из исходной популяции клеток почки, как описано выше, в которой процент клеток, экспрессирующих один или более сосудистых, клубочковых маркеров и маркеров проксимальных канальцев с отдельными ЭПО-продуцирующими клетками, является выше, чем процент клеток, экспрессирующих один или более сосудистых, клубочковых маркеров и маркеров проксимальных канальцев с отдельными ЭПО-продуцирующими клетками в исходной популяции. Например, термин «B3» означает клеточную популяцию, полученную из исходной популяции клеток почки и содержащую более высокий процент клеток проксимальных канальцев, также как и сосудистых и клубочковых клеток, по сравнению с исходной популяцией. В одном варианте реализации изобретения клеточная популяция В3 содержит больший процент клеток проксимальных канальцев по сравнению с исходной популяцией, но меньший процент клеток проксимальных канальцев по сравнению с клеточной популяцией В2. В другом варианте реализации изобретения клеточная популяция В3 содержит больший процент маркеров сосудистых и клубочковых клеток с отдельными ЭПО-продуцирующими клетками по сравнению с исходной популяцией, но меньший процент маркеров сосудистых и клубочковых клеток с отдельными ЭПО-продуцирующими клетками по сравнению с клеточной популяцией В4.
[0050] В другом аспекте, обогащенная клеточная популяция может также относиться к клеточной популяции, полученной из исходной популяции клеток почки, как описано выше, в которой процент клеток, экспрессирующих один или более маркеров клеток канальцев, является выше, чем процент клеток, экспрессирующих один или более маркеров клеток канальцев в исходной популяции. Например, термин «B2» означает клеточную популяцию, полученную из исходной популяции клеток почки, и содержащую более высокий процент клеток канальцев по сравнению с исходной популяцией. Кроме того, клеточная популяция, обогащенная клетками, которые экспрессируют один или более маркеров клеток канальцев (или «В2»), может содержать отдельные эпителиальные клетки системы собирающего протока. Несмотря на то, что клеточная популяция, обогащенная клетками, которые экспрессируют один или более маркеров клеток канальцев (или «В2»), является относительно обедненной ЭПО-продуцирующими клетками, клубочковыми клетками и сосудистыми клетками, обогащенная популяция может содержать меньший процент этих клеток (ЭПO-продуцирующих, клубочковых и сосудистых) по сравнению с исходной популяцией. В большинстве случаев гетерогенная клеточная популяция является обедненной одним или более типами клеток, в результате чего обедненная клеточная популяция содержит меньшую долю типа (типов) клеток по сравнению с долей типа (типов) клеток, содержащейся в гетерогенной клеточной популяции до обеденения. Типы клеток, которые могут быть обеднены, представляют собой любой тип клеток почек. Например, в определенных вариантах реализации изобретения типы клеток, которые могут быть обеднены, включают высокогранулярные клетки собирающего протока и канальцевой системы с плотностью < около 1,045 г/мл, называемые «B1». В определенных вариантах реализации изобретения типы клеток, которые могут быть обеднены, включают дебрис и мелкие низкогранулярные клетки с низкой жизнеспособностью и плотностью < около 1,095 г/мл, называемые «B5». В некоторых вариантах реализации изобретения клеточная популяция, обогащенная клетками почечного канальца, является относительно обедненной всеми нижеуказанными элементами: «B1», «B5», регулируемые с помощью кислорода ЭПО-экспрессирующие клетки, клетки клубочков и сосудистые клетки.
[0051] В данном контексте термин «гипоксические» условия культивирования означают условия культивирования, при которых в культуральной системе клетки подвергаются снижению уровней свободного кислорода по сравнению со стандартными условиями культивирования, при которых клетки культивируют при атмосферных уровнях кислорода (около 21%). Негипоксическими условиями в настоящем документе называются нормальные или нормоксические условиях культивирования.
[0052] В данном контексте термин «регулируемый кислородом» означает способность клеток модулировать экспрессию генов (усиливать или ослаблять) в зависимости от количества кислорода, доступного для клеток. «Индуцированный гипоксией» относится к активации экспрессии генов в ответ на снижение давления кислорода (независимо от предварительной индукции или исходного давления кислорода).
[0053] Термин «сфероид» означает скопление или набор клеток, культивируемых с целью получения роста 3D, в отличие от роста в виде монослоя. Следует отметить, что термин «сфероид» не означает, что скопление представляет собой геометрическую сферу. Скопление может быть высокоорганизованным с четко определенной морфологией или может быть неорганизованной массой; оно может включать в себя один тип клеток или более чем один тип клеток. Эти клетки могут быть первичными изолятами или постоянной клеточной линией или их комбинацией. Включенными в это определение являются органоиды и органотипические культуры.
[0054] В данном контексте термин «органоид» означает гетерогенную 3D агломерацию клеток, которая повторяет характеристики клеточной самоорганизации, архитектуры и сигнальных взаимодействий, присутствующих в нативном органе. Термин «органоид» включает в себя сфероиды или клеточные кластеры, формируемые из суспензии клеточных культур.
[0055] В данном контексте термин «биоматериал» означает естественный или синтетический биологически совместимый материал, который пригоден для введения в живую ткань. Естественный биоматериал представляет собой материал, который производится живой системой. Синтетические биоматериалы представляют собой материалы, которые не производятся живой системой. Биоматериалы, описанные в настоящем документе, могут представлять собой сочетание естественных и синтетических биосовместимых материалов. В данном контексте биоматериалы, включают, например, полимерные матрицы и каркасы. Специалистам в данной области техники будет понятно, что биоматериал (ы) может быть сконфигурирован в различных формах, например, в виде жидких гидрогелевых суспензий, поропласта, и может содержать один или более естественных или синтетических биосовместимых материалов.
[0056] Термин «конструкция» относится к одной или более клеточным популяциям, осажденных на поверхность или во внутрь каркаса или матрицы, которые состоят из одного или более синтетических или встречающихся в природе биосовместимых материалов. Одна или более клеточных популяций могут покрывать, осаждаться, встраиваться, прикрепляться, обсеменять или захватываться биоматериалом, состоящим из одного или более синтетических или встречающийся в природе полимеров, биосовместимых белков или пептидов. Одна или более клеточных популяций могут быть объединены с биоматериалом или каркасом или матрицей in vitro или in vivo. В большинстве случаев один или более биосовместимых материалов, используемых для формирования каркаса/биоматериала, выбирается с целью направления, облегчения или возможности формирования многоклеточной, трехмерной организации по меньшей мере одной из клеточных популяций, депонируемой после того. Один или более биоматериалов, используемых для формирования конструкции, также может быть выбран с целью направления, облегчения или возможности дисперсии и/или интеграции конструкции или клеточных компонентов конструкции с эндогенной тканью хозяина, или с целью направления, облегчения или возможности выживания, приживления, устойчивости или функциональной активности конструкции или клеточных компонентов конструкции.
[0057] Термин «маркер» или «биомаркер» относится в большинстве случаев к ДНК, РНК, белку, углеводу или молекулярному маркеру на основе гликолипида, экспрессия или наличие которых в культивируемой клеточной популяции могут быть обнаружены с помощью стандартных способов (или способов, описанных в настоящем документе) и которые соответствуют одной или более клеткам в культуре клеточной популяции, характеризующейся определенным типом клетки. Маркер может быть полипептидом, экспрессированным клеткой или иметь идентифицируемое физическое местоположение на хромосоме, такое как ген, сайт узнавания рестрикционной эндонуклеазой или нуклеиновая кислота, кодирующая полипептид (например, мРНК), экспрессируемый нативной клеткой. Маркер может быть экспрессированной областью гена и называться «маркером генной экспрессии», или отдельным сегментом ДНК с неизвестными кодирующими функциями. Биомаркеры могут быть продуктами, получаемыми из клеток, например, секретируемыми клеткой.
[0058] Термины «дифференциально экспрессированный ген», «дифференциальная экспрессия гена» и их синонимы, которые используются взаимозаменяемо, относятся к гену, экспрессия которого активирована с высоким или низким уровнем в первой клетке или клеточной популяции по сравнению с его экспрессией во второй клетке или клеточной популяции. Термины также включают гены, экспрессия которых активируется в высоком или низком уровне на различных этапах в течение некоторого времени при пассаже первой или второй клетки в культуре. Следует также понимать, что дифференциально экспрессированный ген может быть активированным или ингибированным при уровне нуклеиновой кислоты или уровне белка, или может быть подвергнут альтернативному сплайсингу для получения отличающегося полипептидного продукта. Такие различия могут быть доказаны изменением уровней мРНК, поверхностной экспрессией, секрецией или иным фракционированием полипептида, например. Дифференциальная экспрессия гена может включать сравнение экспрессии между двумя или более генами или их генными продуктами, или сравнение соотношений экспрессии между двумя или более генами или их генными продуктами, или даже сравнение двух дифференцировано обработанных продуктов одного и того же гена, которые отличаются между первой клеткой и второй клеткой. Дифференциальная экспрессия включает как количественные, так и качественные различия в темпоральном или клеточном профиле экспрессии в гене или его продуктах экспрессии среди, например, первой клетки и второй клетки. Для целей настоящего изобретения считается, что термин «дифференциальная экспрессия гена» актуален при наличии различий между экспрессией данного гена в первой клетке и второй клетке. Дифференциальная экспрессия маркера может происходить в клетках, полученных от пациента, перед введением клеточной популяции, смеси или конструкции (первая клетка) по сравнению с экспрессией в клетках от пациента после введения (вторая клетка).
[0059] Термины «ингибировать», «понижающе регулировать», «недостаточно экспрессировать» и «уменьшать» используются взаимозаменяемо и означают, что экспрессия гена или уровня молекул РНК или эквивалентных молекул РНК, кодирующей один или более белков или белковых субъединиц, или активность одного или болеех белков или белковых субъединиц, уменьшается по сравнению с одним или более контролями, такими, как, например, один или более положительных и/или отрицательных контролей. Недостаточное экспрессирование может происходить в клетках от пациента перед введением клеточной популяции, смеси или конструкции по сравнению с экспрессией в клетках от пациента после введения.
[0060] Термины «повышающе регулировать», «сверхэкспрессировать» означают, что экспрессия гена или уровня молекул РНК или эквивалентных молекул РНК, кодирующей один или более белков или белковых субъединиц, или активность одного или более белков или белковых субъединиц, повышается по сравнению с одним или более контролями, такими, как, например, один или более положительных и/или отрицательных контролей. Сверхэкспрессирование может происходить в клетках от пациента перед введением клеточной популяции, смеси или конструкции по сравнению с экспрессией в клетках от пациента после введения.
[0061] В данном контексте термин «анемия» означает дефицит эритроцитов крови и/или уровня гемоглобина из-за недостаточной продукции функционального белка ЭПО-продуцирующими клетками субъекта и/или недостаточного выделения белка ЭПО в системное кровообращение, и/или неспособности эритробластов костного мозга на ответную реакцию на белок ЭПО. Субъект с анемией не в состоянии поддерживать эритроидный гомеостаз. В большинстве случаев анемия может проявляться при снижении или утрате почечной функции (например, хроническая почечная недостаточность), анемия, ассоциированная с относительным дефицитом ЭПО, анемия, ассоциированная из застойной сердечной недостаточностью, анемия, ассоциированная с миелосупрессивной терапией, такой как химиотерапия или антивирусная терапия (например, АЗТ), анемия, ассоциированная с немиелоидными раковыми заболеваниями, анемия, ассоциированная с вирусными инфекциями, такими как ВИЧ, и анемия при хронических заболеваниях, таких как аутоиммунные заболевания (например, ревматоидный артрит), заболевания печени, и полиорганная системная недостаточность.
[0062] Термин «ЭПО-дефицитный» относится к любому состоянию или патологии, которые поддаются лечению агонистом рецептора эритропоэтина (например, рекомбинантный ЭПО или аналоги ЭПО), в том числе анемии.
[0063] В данном контексте термин «органоспецифическое заболевание», относится к патологиям, ассоциированным с любой стадией и степенью острой или хронической органной недостаточности, что приводит к потере способности органа выполнять свою функцию.
[0064] В данном контексте термин «заболевание почек», относится к патологиям, ассоциированным с любой стадией и степенью острой или хронической почечной недостаточности, что приводит к потере способности почки выполнять функцию фильтрации крови и элиминации избыточной жидкости, электролитов и шлаков из крови. Заболевания почек также включают эндокринные дисфункции, такие как анемия (ассоциированная с недостаточностью эритропоэтина), и минеральный дисбаланс (дефицит витамина D). Заболевание почек может возникать в почках или может быть вторичным по отношению к различным состояниям, включая (но не ограничиваясь этим) сердечную недостаточность, гипертензию, диабет, аутоиммунное заболевание или заболевание печени. Заболевание почек может быть состоянием при хронической почечной недостаточности, которое развивается после острого поражения почки. Например, ишемическое поражение почки и/или воздействие токсикантов могут вызвать острую почечную недостаточность; неполное восстановление после острого поражения почек может привести к развитию хронической почечной недостаточности.
[0065] Термин «лечение» относится как к терапевтическому лечению, так и профилактическим или превентивным мерам относительно заболевания почек, анемии, дефицита ЭПO, транспортной недостаточности канальцев или фильтрационной недостаточности клубочков, при этом целью является обратное развитие, предотвращение или замедление (облегчение) течения патологии, представляющие интерес. Лица, которым показано лечение, включают лиц, уже имеющих заболевание почек, анемию, дефицит ЭПО, транспортную недостаточность канальцев или фильтрационную недостаточность клубочков, а также лиц, склонных к развитию болезни почек, анемии, дефицита ЭПО, транспортной недостаточности канальцев или фильтрационной недостаточности клубочков, или тех, у кого болезнь почек, анемия, дефицит ЭПО, транспортная недостаточность канальцев или фильтрационная недостаточность клубочков подлежит предотвращению. В данном контексте термин «лечение» включает стабилизацию и/или улучшение функции почек.
[0066] Под термином «субъект» понимают любого одного субъекта-человека, включая пациента, приемлемого для лечения, который имеет или имел один или более признаков, симптомов и других показателей заболевания почек, анемии или дефицита ЭПО. К таким субъектам относятся, без ограничения, субъекты, у которых впервые диагностировали или ранее диагностировали, а в настоящее время имеется рецидив или обострение, или они подвержены риску развития заболевания почек, анемии или дефицита ЭПО, независимо от причины. Субъект может быть предварительно пролечен по поводу заболевания почек, анемии или дефицита ЭПО, или совсем не леченный.
[0067] Термин «пациент» означает любого одного животного, более предпочтительно млекопитающего (включая таких животных, не относящийся к человеку, как, например, собаки, кошки, лошади, кролики, животные зоопарка, коровы, свиньи, овцы и приматы, не относящиеся к человеку), лечение которого является желательным. Наиболее предпочтительно, чтобы пациент, описанный в настоящем документе, представлял собой человека.
[0068] Термин «образец» или «образец пациента» или «биологический образец», как правило, должен означать любой биологический образец, полученный от субъекта или пациента, жидкости организма, ткани организма, клеточной линии, тканевой культуры или другого источника. Этот термин включает биоптаты тканей, такие как, например, биоптаты почки. Этот термин включает культивированные клетки, такие как, например, культивированные клетки почек млекопитающих. Способы получения тканевых биоптатов и культивированных клеток млекопитающих хорошо известны в данной области техники. Если термин «образец» используется самостоятельно, под ним следует тем не менее понимать, что «образец» является «биологическим образцом» или «образцом пациента», т.е. термины используются как синонимы.
[0069] Термин «испытуемый образец» относится к образцу от субъекта, который был пролечен согласно способу настоящего изобретения. Испытуемый образец может исходить от различных источников в млекопитающего, включая, без ограничения, кровь, сперму, сыворотку, мочу, костный мозг, слизистые оболочки, ткани и т.д.
[0070] Термин «контроль» или «контрольный образец» означает отрицательный или положительный контроль, в котором отрицательный или положительный результат, как ожидается, поможет соотнести результат в испытуемом образце. Контроли, которые пригодны для настоящего изобретения, включают, без ограничения, образец, известный своей ингибицией индикаторных свойств нормального эритроидного гомеостаза, образец, известный своей ингибицией индикаторных признаков анемии, образец, полученный от субъекта, заведомо не имеющего анемии, и образец, полученный от субъекта, заведомо имеющего анемию. Дополнительные контроли, пригодные для использования в способах настоящего изобретения, включают, без ограничения, образцы, полученные от субъектов, которые были пролечены с помощью фармакологических агентов, известных своей модуляцией эритропоэза (например, рекомбинантный ЭПО или аналоги ЭПО). Кроме того, контролем может быть образец, полученный от субъекта перед лечением с помощью способа по настоящему изобретению. Дополнительный пригодный контроль может быть испытуемым образцом, полученным от субъекта, заведомо имеющего любой тип или стадию заболевания почек, и образец от субъекта, заведомо не имеющего какого-либо типа или стадии заболевания почек. Контролем может быть нормальный здоровый подходящий контроль. Специалистам в данной области техники должно быть известно о других контролях, пригодных для использования в настоящем изобретении.
[0071] «Прогноз регенерации», «регенеративный прогноз» или «прогноз для регенерации» в целом относится к прогнозу или предсказанию вероятного регенеративного курса или результата введения или имплантации клеточной популяции, смеси или конструкции, описанных в настоящем документе. Для прогноза регенерации, прогноз или предсказание может учитывать одну или более следующих позиций: положительная динамика функционального органа (например, почки) после имплантации или введения, становление функциональной почки после имплантации или введения, формирование улучшенной функции или активности почек после имплантации или введения и экспрессия определенных маркеров нативной почки после имплантации или введения.
[0072] Термин «регенерированный орган» относится к нативному органу после имплантации или введения клеточной популяции, смеси или конструкции, как описано в настоящем документе. Регенерированный орган характеризуется различными показателями, включая, без ограничения, развитие функции или активности в нативном органе, улучшение функции или активности в нативном органе, и экспрессию определенных маркеров в нативном органе. Специалистам в данной области техники должно быть известно о других показателях, которые могут быть пригодны для характеристики регенерированного органа.
[0073] Термин «регенерированная почка» относится к нативной почке после имплантации или введения клеточной популяции, смеси или конструкции, как описано в настоящем документе. Регенерированная почка характеризуется различными показателями, включая, без ограничения, развитие функции или активности в нативной почке, улучшение функции или активности в нативной почке, и экспрессию определенных маркеров в нативной почке. Специалистам в данной области техники должно быть известно о других показателях, которые могут быть пригодны для характеристики регенерированной почки.
Клеточная популяция SRC+
[0074] В настоящем изобретении предлагаются клеточные популяции, содержащие изолированные, гетерогенные популяции клеток почек, обогащенные специфическими биологически активными компонентами или типами клеток, и/или обедненные специфическими неактивными или нежелательными компонентами или типами клеток, и дополнительные популяции биоактивных клеток, включая, но не ограничиваясь этим, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки, и/или клетки-предшественники, полученные из жировой ткани, для применения в лечении острого или хронического заболевания почек. Изолированные, гетерогенные популяции клеток почек, обогащенные специфическими биологически активными компонентами или типами клеток, и/или обедненные специфическими неактивными или нежелательными компонентами или типами клеток, могут включать в себя любую из клеточных популяций, как описано в настоящем документе. В одном варианте реализации изобретения дополнительные биоактивные компоненты например, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки, и/или клетки-предшественники, полученные из жировой ткани, смешиваются с изолированными, гетерогенными популяциями клеток почек, обогащенными специфическими биологически активными компонентами или типами клеток, и/или обедненные специфическими неактивными или нежелательными компонентами или типами клеток. В настоящем изобретении, в другом аспекте, предлагаются способы получения клеточной популяции SRC+, как описано в настоящем документе. Дополнительные биоактивные компоненты, например, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки, и/или клетки-предшественники, полученные из жировой ткани, содержащиеся в клеточной популяции, могут присутствовать в любом процентном количестве, достаточном для улучшения клеточной или тканевой недостаточности.
[0075] Клеточные популяции по настоящему изобретению могут содержать один или более дополнительных биологически активных компонентов, например, но не ограничиваясь этим, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки, и/или клетки-предшественники, полученные из жировой ткани, содержащиеся в клеточной популяции. В определенных вариантах реализации изобретения клеточная популяция содержит два дополнительных биологически активных компонента. В определенных вариантах реализации изобретения клеточная популяция содержит три дополнительных биологически активных компонента. В определенных вариантах реализации изобретения клеточная популяция содержит четыре дополнительных биологически активных компонента. В определенных вариантах реализации изобретения клеточная популяция содержит пять дополнительных биологически активных компонентов. В определенных вариантах реализации изобретения клеточная популяция содержит шесть дополнительных биологически активных компонентов. В определенных вариантах реализации изобретения клеточная популяция содержит семь дополнительных биологически активных компонентов. В определенных вариантах реализации изобретения клеточная популяция содержит восемь дополнительных биологически активных компонентов. В определенных вариантах реализации изобретения клеточная популяция содержит девять дополнительных биологически активных компонентов. В определенных вариантах реализации изобретения клеточная популяция содержит десять дополнительных биологически активных компонентов.
[0076] В одном варианте реализации изобретения дополнительный биологически активный компонент представляет собой эпителиальную клетку. В одном варианте реализации изобретения эпителиальная клетка представляет собой эпителиальную клетку проксимального канальца. В другом варианте реализации изобретения эпителиальная клетка представляет собой эпителиальную клетку дистального канальца. В другом варианте реализации изобретения эпителиальная клетка представляет собой париетальную эпителиальную клетку.
[0077] В другом варианте реализации изобретения дополнительный биологически активный компонент представляет собой эпителиальную клетку. В одном варианте реализации изобретения эпителиальная клетка представляет собой венозную эпителиальную клетку. В одном варианте реализации изобретения эпителиальная клетка представляет собой артериальную эпителиальную клетку. В одном варианте реализации изобретения эпителиальная клетка представляет собой капиллярную эпителиальную клетку. В одном варианте реализации изобретения эпителиальная клетка представляет собой лимфатическую эпителиальную клетку.
[0078] В другом варианте реализации изобретения дополнительный биологически активный компонент представляет собой клетку собирающего протока. В еще одном варианте реализации изобретения дополнительный биологически активный компонент представляет собой гладкомышечную клетку. В другом варианте реализации изобретения дополнительный биологически активный компонент представляет собой мезенхимальную стволовую клетку. В другом варианте реализации изобретения дополнительный биологически активный компонент представляет собой предшественника эндотелиальной, мезенхимальной, эпителиальной или кроветворной линии. В другом варианте реализации изобретения дополнительный биологически активный компонент представляет собой предшественника энтодермального, эктодермального или мезенхимально эмбрионального происхождения. В определенных вариантах реализации изобретения дополнительный биоактивный компонент представляет собой стволовую клетку любого происхождения или источника, включая, но не ограничиваясь этим, эмбриональную (ES) и индуцированную плюрипотентную (iPS) стволовую клетку. В некоторых вариантах реализации изобретения дополнительный биоактивный компонент представляет собой дериват стволовой клетки любого происхождения или источника, включая, но не ограничиваясь этим, эмбриональную (ES) и индуцированную плюрипотентную (iPS) стволовую клетку, при этом дериват может быть образован путем направленной дифференцировки стволовых клеток определенными комбинациями или коктейлями малых молекул и/или белка и/или молекул нуклеиновых кислот. В одном варианте реализации изобретения дополнительный биоактивный компонент представляет собой дериват предшественника эндотелиальной, мезенхимальной, эпителиальной или кроветворной линии, при этом дериват может быть образован путем направленной дифференцировки стволовых клеток определенными комбинациями или коктейлями малых молекул и/или белка и/или молекул нуклеиновых кислот. В одном варианте реализации изобретения дополнительный биоактивный компонент представляет собой дериват предшественника энтодермального, эктодермального или мезенхимально эмбрионального происхождения, при этом дериват может быть образован путем направленной дифференцировки стволовых клеток определенными комбинациями или коктейлями малых молекул и/или белка и/или молекул нуклеиновых кислот. В одном варианте реализации изобретения биоактивный компонент является генетически модифицированной клеткой любой линии или источника.
[0079] В еще одном варианте реализации изобретения дополнительный биологически активный компонент представляет собой интерстициальную клетку. В одном варианте реализации изобретения интерстициальная клетка представляет собой поддерживающий фибробласт. В другом варианте реализации изобретения интерстициальная клетка представляет собой специализированный кортикальный эритропоэтин-продуцирующий фибробласт.
[0080] В одном варианте реализации изобретения дополнительный биоактивный компонент получен из источника, который является аутологичным для субъекта. В одном ином варианте реализации изобретения дополнительный биоактивный компонент получен из источника, который является аллогенным для субъекта. В определенных вариантах реализации изобретения дополнительный биоактивный компонент получен из источника, аутологичного для субъекта, при этом дополнительный биоактивный компонент представляет собой комбинированную смесь с дополнительными биологически активными компонентами, которых получают из источника, аллогенного для субъекта.
[0081] В определенных аспектах настоящего изобретения предлагаются способы целевой регенерации почечной массы и функциональности путем направленной доставки клеточных популяций и/или органоидов и/или биоматериалов, описанных в настоящем документе. В других аспектах настоящего изобретения предлагаются способы сохранения и/или восстановления функциональности почек у пациентов, имеющих острые или хронические заболевания почек, путем введения клеточных популяций и/или органоидов и/или биоматериалов, описанных в настоящем документе.
Органоиды, применяемые в лечении
[0082] В настоящем изобретении также предлагаются органоиды, содержащие и/или формируемые из биоактивных компонентов, описанных в настоящем документе, например, В2, В4 и В3, которые обеднены неактивными или нежелательными компонентами, например, В1 и В5, отдельно или в смеси для использования в лечении острых и/или хронических заболеваний почек. В одном аспекте настоящего изобретения предлагаются органоиды, содержащие и/или формируемые из специфической субфракции, В4, обедненной или лишенной одного или более типов клеток, например, сосудистых, эндокринных или эндотелиальных, т.е, В4', с сохранением лечебных свойств, например, стабилизации и/или улучшения и/или воcстановления функции почек, при применении отдельно или в смеси с другими биологически активными субфракциями, например, B2 и/или B3.В предпочтительном варианте реализации изобретения популяцией биоактивных клеток является В2. В определенных вариантах реализации изобретения клеточная популяция B2 является смешанной с В4 или В4'. В других вариантах реализации изобретения клеточная популяция B2 является смешанной с В3. В других вариантах реализации изобретения клеточная популяция B2 является смешанной как с В3, так и с B4, или специфическими клеточными компонентами B3 и/или B4. Во всех вариантах реализации изобретения органоиды по настоящему изобретению являются сформированными и культивированными ex vivo. Во всех вариантах реализации изобретения органоиды могут дополнительно содержать и/или могут быть сформированы из дополнительной популяции биологически активных клеток, включая, но не ограничиваясь ими, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки, клетки-предшественники, полученные из жировой ткани. В одном варианте реализации изобретения дополнительные популяции биологически активных клеток, включая, но не ограничиваясь ими, эндотелиальные клетки, эндотелиальные предшественники, мезенхимальные стволовые клетки, клетки-предшественники, полученные из жировой ткани, смешиваются с изолированными, гетерогенными популяциями клеток почек, обогащенными специфическими биологически активными компонентами или типами клеток, и/или обедненные специфическими неактивными или нежелательными компонентами или типами клеток.
[0083] В одном варианте реализации изобретения органоиды по настоящему изобретению содержат или сформированы из клеточной популяции В2, при этом клеточная популяция В2 содержит обогащенную популяцию клеток почечного канальца. В другом варианте реализации изобретения гетерогенная популяция клеток почек дополнительно содержит клеточную популяцию B4. В еще одном варианте реализации изобретения гетерогенная популяция клеток почек дополнительно содержит клеточную популяцию B3. В еще одном варианте реализации изобретения гетерогенная популяция клеток почек дополнительно содержит клеточную популяцию B5.
[0084] В определенных вариантах реализации изобретения клеточная популяция содержит клеточную популяцию В2, причем клеточная популяция В2 содержит обогащенную популяцию клеток почечного канальца, и обеднена клеточной популяцией В1 и/или клеточной популяцией В5.
[0085] В другом аспекте настоящего изобретение предлагаются способы формирования органоидов, содержащих и/или формируемых из биоактивных компонентов по настоящему изобретению, например, B2, B4 и B3, которые обеднены неактивными или нежелательными компонентами, например, В1 и В5, отдельно или в смеси. В одном аспекте настоящего изобретения предлагаются органоиды, содержащие и/или формируемые из специфической субфракции, В4, обедненной или лишенной одного или более типов клеток, например, сосудистых, эндокринных или эндотелиальных, т.е, В4', с сохранением лечебных свойств, например, стабилизации и/или улучшения и/или восстановления функции почек, при применении отдельно или в смеси с другими биологически активными субфракциями, например,B2 и/или B3. В предпочтительном варианте реализации изобретения популяцией биоактивных клеток является В2. В определенных вариантах реализации изобретения клеточная популяция B2 является смешанной с В4 или В4'. В других вариантах реализации изобретения клеточная популяция B2 является смешанной с В3. В других вариантах реализации изобретения клеточная популяция B2 является смешанной как с В3, так и с B4, или специфическими клеточными компонентами B3 и/или B4.
[0086] В одном варианте реализации изобретения органоиды по настоящему изобретению содержат или сформированы из клеточной популяции В2, при этом клеточная популяция В2 содержит обогащенную популяцию клеток почечного канальца. В другом варианте реализации изобретения гетерогенная популяция клеток почек дополнительно содержит клеточную популяцию B4. В еще одном варианте реализации изобретения гетерогенная популяция клеток почек дополнительно содержит клеточную популяцию B3. В еще одном варианте реализации изобретения гетерогенная популяция клеток почек дополнительно содержит клеточную популяцию B5.
[0087] В определенных вариантах реализации изобретения клеточная популяция содержит клеточную популяцию В2, причем клеточная популяция В2 содержит обогащенную популяцию клеток почечного канальца, и обеднена клеточной популяцией В1 и/или клеточной популяцией В5.
[0088] В одном аспекте настоящего изобретения предлагаются способы формирования органоидов с использованием биологически активных препаратов клеток и/или смесей, описанных в настоящем документе. Основные способы формирования канальцев из первичной популяции клеток почки с использованием гелевой культуры 3D COL (I) известны в данной области техники, например, как в Joraku et al., Methods. 2009 Feb;47(2):129-33. Во всех вариантах реализации изобретения органоиды по настоящему изобретению являются сформированными и культивированными ex vivo.
[0089] В некоторых вариантах реализации изобретения формирование органоидов и канальцев из биоактивных препаратов клеток и/или смесей, описанных в настоящем документе, может быть индуцировано, например, и без ограничения, с использованием следующих культуральных способов или систем: i) культура 2D; ii) культура 3D: гель COL(I); iii) культуры 3D : Матригель; iv) культура 3D: с постоянным перемешиванием, за которым следует COL(I)/Матригель; и v) культура 3D: гель COL(IV). Конкретные примеры формирования органелл и канальцев из NKA представлены в 2 и 4 ниже.
[0090] В одном варианте реализации изобретения органоиды, формируемые из биоактивных препаратов клеток и/или смесей, описанных в настоящем документе, могут быть индуцированы в культуре 2D. В одном варианте реализации изобретения биоактивные препараты клеток и/или смеси, описанные в настоящем документе, высевают на стандартную посуду из пластика 2D. В одном варианте реализации изобретения клетки высевают с плотностью около 5000 клеток/см2. Клетки могут быть высеяны в соответствующую среду, такую как, например, комплексная среда роста для клеток почки (RCGM). В большинстве случаев клеточные популяции могут быть выращены с раниим слиянием в течение около 7, 8, 9, 10, 11, 12, 13, 14, 15 дней или более, с регулярными заменами сред приблизительно каждые 3-4 дня. В одном варианте реализации изобретения клетки демонстрируют спонтанную самоорганизацию в сфероидальные структуры, т.е., органоиды и канальцы за период от около 7 до около 15 дней.
[0091] В другом варианте реализации изобретения органоиды, формируемые из биоактивных препаратов клеток и/или смесей, описанных в настоящем документе, могут быть индуцированы в культуре 3D. В одном варианте реализации изобретения органоиды образовываются клеточными популяциями по настоящему изобретению вместе с каркасом биоматериала естественного или синтетического происхождения. В одном варианте реализации изобретения сформированные препараты биоактивных клеток и/или смесей, описанных в настоящем документе, могут быть включены в коллагеновый (I) гель, коллагеновый (IV) гель, Матригель или смесь любых из них, как было описано выше (см. Guimaraes-Souza et al., 2012. In vitro reconstitution of human kidney structures for renal cell therapy. Nephrol Dial Transplant 0: 1-9). Жидкий гель может быть доведен до нейтральной рН, а биоактивные препараты клеток и/или смеси, описанные в настоящем документе, смешаны в концентрации около 500-2500 клеток/мкл. В одном варианте реализации изобретения смешиваются около 1000 клеток/мкл. Клеточная/гелевая смесь может быть аликвотирована в лунки 24-луночного планшета, например (от около 200 до около 400 мкл на лунку) и оставлена для отвердевания на несколько часов при температуре 37 градусов С. В последствии может быть добавлена питательная среда для выращивания культур клеток, а культуры оставляют для созревания в течение около 4, около 5, около 6, около 7, около 8, около 9 или около 10 дней с регулярными заменами сред. В одном варианте реализации изобретения сети канальцевых структур организовываются в форме решеток и колец по всей гелевой матрице с помощью биоактивных препаратов клеток и/или смесей, описанных в настоящем документе.
[0092] В другом варианте реализации изобретения органоиды могут быть сформированы из суспензионной культуры биоактивных препаратов клеток и/или смесей, описанных в настоящем документе, на культуральных матрасах или изделиях из пластика низкого связывания. В одном варианте реализации изобретения клетки могут культивироваться в средах до 4 дней при скорости около 80 оборотов в минуту на вращающихся культуральных матрасах. В последствии сфероиды могут быть дополнительно культивированы в течение около 7, около 8, около 9 или около10 дней на планшетах, покрытых Матригелем, например. В одном варианте реализации изобретения органоиды, формируемые из биоактивных препаратов клеток и/или смесей, описанных в настоящем документе, демонстрируют потенциал тубулогенеза, о чем свидетельствует почкование канальцевых структур de novo у культивированных сфероидов.
Клеточные популяции
[0093] Клеточные популяции SRC+ и/или органоиды по настоящему изобретению могут содержать и/или быть сформированными из изолированных гетерогенных популяций клеток почек и их смесей, обогащенных специфическими биологически активными компонентами или типами клеток, и/или обедненными специфическими неактивными или нежелательными компонентами или типами клеток для использования при лечении заболеваний почек, т.е. обеспечения стабилизации и/или улучшения и/или восстановления функции почек, что ранее было описано Presnell et al. U.S. 2011-0117162 и Ilagan et al. PCT/US2011/036347, полное содержание которой включено в настоящий документ посредством ссылки. Органоиды могут содержать изолированные фракции клеток почки, в которых недостаточно клеточных компонентов, по сравнению со здоровым индивидуумом, но сохранены лечебные свойства, т.е. возможно обеспечение стабилизации и/или улучшения и/или восстановления функции почек. Клеточные популяции, клеточные фракции и/или смеси клеток, описанные в настоящем документе, могут быть получены от здоровых индивидуумов, индивидуумов с заболеванием почек, или субъектов, как описано в настоящем документе.
Популяции биоактивных клеток
[0094] Настоящее изобретение предусматривает клеточные популяции SRC + и терапевтические органоиды, содержащие популяции биоактивных клеток, которые должны быть введены в целевые органы или ткани субъекта, имеющего для этого показания. Популяция биоактивных клеток в целом относится к популяции клеток, потенциально характеризующихся терапевтическими свойствами при введении субъекту. Например, введение субъекту, имеющего для этого показания, органоида, содержащего популяцию биологически активных клеток почек, может обеспечить стабилизацию и/или улучшение и/или восстановление функции почек у субъекта. Лечебные свойства могут включать в себя регенерирующее действие.
[0095] Популяции биологически активных клеток включают, без ограничения, стволовые клетки (например, плюрипотентные, мультипотентные, олигопотентные или унипотентные), такие как эмбриональные стволовые клетки, амниотические стволовые клетки, стволовые клетки взрослых (например, кроветворные, маммарные, кишечные, мезенхимальные, плацентарные, легочные, костномозговые, кровяные, пуповинные, эндотелиальные, клетки пульпы зуба, жировые, нервные, обонятельные, клетки нервного гребня, тестикулярные), индуцированные плюрипотентные стволовые клетки; генетически модифицированные клетки; а также клеточные популяции или ткани эксплантов, полученные из любого источника организма. Популяции биоактивных клеток по своей природе могут быть изолированными, обогащенными, очищенными, гомогенными или гетерогенными. Специалистам в данной области техники должно быть известно о других популяциях биоактивных клеток, которые пригодны для использования в создании органоидов по настоящему изобретению.
[0096] В одном варианте реализации изобретения источником клеток и предполагаемым целевым объектом является один и тот же орган или ткань. Например, почечные клетки могут быть получены из почки с целью создания органоида для введения в почку. В другом варианте реализации изобретения источником клеток и предполагаемым целевым объектом не является один и тот же орган или ткань. Например, эритропоэтин-экспрессирующие клетки могут быть получены из жировой ткани почки с целью создания органоида для введения в почку.
[0097] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие определенные субфракции гетерогенной популяции клеток почки, обогащенные биоактивными компонентами и обедненные неактивными или нежелательными компонентами, для обеспечения лучших терапевтических и регенеративных результатов лечения в сравнении с исходной популяцией. Например, биологически активные клетки почек, описанные в настоящем документе, например, B2, B4 и B3, которые обеднены неактивными или нежелательными компонентами, например, В1 и В5, отдельно или в смеси, могут быть использованы для создания органоида, который будет использоваться для стабилизации и/или улучшения и/или восстановления функции почек.
[0098] В другом аспекте органоиды содержат специфическую субфракцию, В4, обедненную или лишенную одного или более типов клеток, например, сосудистых, эндокринных или эндотелиальных, т.е, В4', с сохранением лечебных свойств, например, стабилизации и/или улучшения и/или восстановления функции почек, при применении отдельно или в смеси с другими биологически активными субфракциями, например,B2 и/или B3.В предпочтительном варианте реализации изобретения популяцией биоактивных клеток является В2. В определенных вариантах реализации изобретения клеточная популяция B2 является смешанной с В4 или В4'. В других вариантах реализации изобретения клеточная популяция B2 является смешанной с В3. В других вариантах реализации изобретения клеточная популяция B2 является смешанной как с В3, так и с B4, или специфическими клеточными компонентами B3 и/или B4.
[0099] Клеточная популяция В2 характеризуется экспрессией маркера клеток почечного канальца, выбранного из группы, состоящей из одного или более из следующих веществ: мегалин, кубилин, синтаза гиалуроновой кислоты 2 (HAS2), 25-гидроксилаза витамина D3 (CYP2D25), N-кадгерин (Ncad), Е-кадгерин (Ecad), аквапорин-1 (Aqp1), аквапорин-2 (Aqp2), RAB17, элемент RAS онкогенного семейства (Rab17), GATA-связывающий белок 3 (Gata3), FXYD-доменсодержащий регулятор ионного транспорта 4 (Fxyd4), элемент 4 семейства транспортеров растворенных веществ 9 (натрий/ионобменник водорода) (Slc9a4), элемент В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), элемент А3 семейства альдегиддегидрогеназы 1, (Aldh1a3), и калпаин-8 (Capn8 ) и маркер собирающего протока аквапорин-4 (Aqp4). В2 является большей и более гранулированной, чем B3 и/или В4 и, следовательно, имеет плавучую плотность в диапазоне от около 1,045 г/мл и до около 1,063 г/мл (грызун), от около 1,045 г/мл и до около1,052 г/мл (человек), и от около 1,045 г/мл до около 1,058 г/мл (собака).
[00100] Клеточная популяция В3 характеризуется экспрессией сосудистых, клубочковых маркеров и маркеров проксимальных канальцев с отдельными ЭПО-продуцирующими клетками, имея промежуточный размер и гранулярность по сравнению с B2 и B4, и, таким образом, характеризуется плотностью от около 1,063 г/мл и до около 1,073 г/мл (грызун), от около 1,052 г/мл и до около 1,063 г/мл (человек), и от около 1,058 г/мл до около 1,063 г/мл (собака). В3 характеризуется экспрессией маркеров, выбранных из группы, состоящей из одного или более из следующих веществ: аквапорин 7 (Aqp7), FXYD-доменсодержащий регулятор ионного транспорта 2 (Fxyd2), элемент 3 семейства транспортеров растворенных веществ 17 (фосфат натрия) (Slc17a3), элемент 1 семейства транспортеров растворенных веществ 3 (Slc3a1), клаудин 2 (Cldn2), напсин A аспарагиновая пептидаза (Napsa), элемент 2 семейства транспортеров растворенных веществ 2 (облегченый транспортер глюкозы) (Slc2a2), аланил (мембрана) аминопептидаза (Anpep), трансмембранный белок 27 (Tmem27), представитель семейства ацил-КоА-синтетазы со средней длиной цепи 2 (Acsm2), глутатионпероксидаза 3 (Gpx3), фруктозо-1,6-бифосфатаза 1 (Fbp1), и аланин-глиоксилат-аминотрансфераза 2 (Agxt2). В3 также характеризуется сосудистым маркером экспресии молекулы адгезии тромбоцит-эндотелиальных клеток (Pecam) и клубочковым маркером экспресии - подоцином (Podn).
[00101] Клеточная популяция В4 характеризуется экспрессией набора сосудистых маркеров, содержащего один или более из следующих элементов: PECAM, VEGF, KDR, HIF1a, CD31, CD146; набора клубочковых маркеров, содержащего один или более из следующих элементов: Подоцин (Podn) и нефрин (Neph); и популяции, обогащенной ЭПО,регулируемым кислородом, по сравнению с нефракционированным (UNFX), В2 и В3. В4 также характеризуется экспрессией одного или более из следующих маркеров: хемокинового (мотив C-X-C) рецептора 4 (Cxcr4), рецептора эндотелина типа B (Ednrb), коллагена типа V, альфа 2 (Col5a2), кадгерина 5 (Cdh5), активатора плазминогена, ткани (Plat), ангиопоэтина 2 (Angpt2), белкового рецептора, содержащего домен вставки киназы (Kdr), секретируемого кислого цистеин-богатого белка (остеонектин) (Sparc), серглицина (Srgn), TIMP ингибитора металлопептидазы 3 (Timp3), элемента 4 семейства интеграционного сайта MMTV бескрылого типа (Wnt4), регулятора передачи сигналов G-белка 4 (Rgs4), молекулы адгезии тромбоцит-эндотелиальных клеток (Pecam) и эритропоэтина (ЭПО). В4 также характеризуется меньшим размером и менее гранулированными клетками по сравнению с В2 или В3, имея плавучую плотность в диапазоне от около 1,073 г/мл до около 1.091 г/мл (грызун), от около 1,063 г/мл до около 1,091 г/мл (человек и собака).
[00102] Клеточная популяция В4' определяется как имеющая плавучую плотность в диапазоне от около 1,063 г/мл до около 1,091 мкг/мл и характеризуется экспрессией одного или более из следующих маркеров: PECAM, vEGF, KDR, HIF1a, подоцина, нефрина, ЭПО, CK7, CK8/18/19. В одном варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией набора сосудистых маркеров, содержащего один или более из следующих элементов: PECAM, vEGF, KDR, HIF1a, CD31, CD146. В другом варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией эндокринного маркера ЭПО. В одном варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией набора клубочковых маркеров, содержащего один или более из следующих элементов: подоцин (Podn) и нефрин (Neph). В определенных вариантах реализации изобретения клеточная популяция B4’ характеризуется экспрессией набора сосудистых маркеров, содержащего один или более из следующих элементов: PECAM, vEGF, KDR, HIF1a и экспрессией эндокринного маркера ЭПО. В другом варианте реализации изобретения В4’ также характеризуется меньшим размером и менее гранулированными клетками по сравнению с В2 или В3, имея плавучую плотность в диапазоне от около 1,073 г/мл до около 1.091 г/мл (грызун), от около 1,063 г/мл до около 1,091 г/мл (человек и собака).
[00103] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие изолированную, обогащенную популяцию B4' человеческих почечных клеток, включающую по меньшей мере одну из эритропоэтин(ЭПO)-продуцирующих клеток, сосудистых клеток и клеток клубочков, имеющую плотность в диапазоне от 1,063 г/мл до 1,091 г/мл. В одном варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией сосудистого маркера. В определенных вариантах реализации изобретения клеточная популяция B4’ характеризуется экспрессией клубочкового маркера. В некоторых вариантах реализации изобретения клеточная популяция B4’ способна к экспрессии эритропоэтина (ЭПO), регулируемой кислородом.
[00104] В одном варианте реализации изобретения органоид по настоящему изобретению содержит клеточную популяцию B4', но не включает клеточную популяцию В2, содержащую клетки почечного канальца и имеющую плотность от 1.045 г/мл до 1,052 г/мл. В другом варианте реализации изобретения органоид, содержащий клеточную популяцию В4', не включает клеточную популяцию В1, содержащую большие гранулярные клетки собирающего протока и канальцевой системы и имеющую плотность <1,045 г/мл. В еще одном варианте реализации изобретения органоид, содержащий клеточную популяцию В4', не включает клеточную популяцию В5, содержащую дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, с плотностью > 1,091 г/мл.
[00105] В одном варианте реализации изобретения органоид, содержащий клеточную популяцию В4', не включает клеточную популяцию В2, содержащую клетки почечного канальца и имеющую плотность от 1,045 г/мл до 1,052 г/мл; и клеточную популяцию В1, содержащую большие гранулярные клетки собирающего протока и канальцевой системы, и имеющую плотность <1,045 г/мл; и клеточную популяцию В5, содержащую дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, с плотностью > 1,091 г/мл. В некоторых вариантах реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего заболевание почек.
[00106] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие смеси человеческих почечных клеток, содержащие первую клеточную популяцию, В2, включающую изолированную, обогащенную популяцию клеток почечного канальца, имеющую плотность от 1,045 г/мл до 1,052 г/мл, и вторую клеточную популяцию, В4', включающую эритропоэтин(ЭПО)-продуцирующие клетки и сосудистые клетки, но обедненную клубочковыми клетками и имеющую плотность от 1,063 г/мл до 1,091 г/мл, при этом смесь не включает клеточную популяцию В1, содержащую большие гранулярные клетки собирающего протока и канальцевой системы и имеющую плотность <1,045 г/мл, или клеточную популяцию В5, содержащую дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, и имеющую плотность >1,091 г/мл. В определенных вариантах реализации изобретения клеточная популяция B4’ характеризуется экспрессией сосудистого маркера. В одном варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией клубочкового маркера. В определенных вариантах реализации изобретения B2 дополнительно содержит эпителиальные клетки собирающего протока. В одном варианте реализации изобретения органоид содержит или формируется из смеси клеток, которые способны к рецепторно опосредованному поглощению альбумина. В другом варианте реализации изобретения смесь клеток способна к экспрессии эритропоэтина (ЭПО), регулируемой кислородом. В одном варианте реализации изобретения смесь содержит HAS-2-экспрессирующие клетки, способные продуцировать и/или стимулировать продукцию высокомолекулярных видов гиалуроновой кислоты (ГК) как in vitro, так и in vivo. Во всех вариантах реализации изобретения первая и вторая клеточные популяции могут быть получены из почечной ткани или культивированных почечных клеток (Basu et al. Lipids in Health and Disease, 2011, 10:171).
[00107] В одном варианте реализации изобретения органоид содержит смесь, которая способна обеспечить регенеративный стимул при введении in vivo. В других вариантах реализации изобретения смесь способна уменьшить снижение клубочковой фильтрации, канальцевой резорбции, продукции мочи и/или эндокринной функции, а также стабилизировать или оптимизировать эти процессы при введении in vivo. В одном варианте реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего заболевание почек.
[00108] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие изолированную, обогащенную популяцию B4' человеческих почечных клеток, включающую по меньшей мере одну из эритропоэтин(ЭПO)-продуцирующих клеток, сосудистых клеток и клеток клубочков, имеющую плотность в диапазоне от 1,063 г/мл до 1,091 г/мл. В одном варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией сосудистого маркера. В определенных вариантах реализации изобретения клеточная популяция B4’ характеризуется экспрессией клубочкового маркера. Клубочковой маркер, который не экспрессирован, может быть подоцином (Пример 10). В некоторых вариантах реализации изобретения клеточная популяция B4’ способна к экспрессии эритропоэтина (ЭПO), регулируемой кислородом.
[00109] В одном варианте реализации изобретения органоид, содержащий клеточную популяцию B4', не включает клеточную популяцию В2, содержащую клетки почечного канальца и имеющую плотность от 1.045 г/мл до 1,052 г/мл. В другом варианте реализации изобретения органоид, содержащий клеточную популяцию В4', не включает клеточную популяцию В1, содержащую большие гранулярные клетки собирающего протока и канальцевой системы и имеющую плотность <1,045 г/мл. В еще одном варианте реализации изобретения органоид, содержащий клеточную популяцию В4', не включает клеточную популяцию В5, содержащую дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, с плотностью > 1,091 г/мл.
[00110] В одном варианте реализации изобретения органоид, содержащий клеточную популяцию В4', не включает клеточную популяцию В2, содержащую клетки почечного канальца и имеющую плотность от 1,045 г/мл до 1,052 г/мл; и клеточную популяцию В1, содержащую большие гранулярные клетки собирающего протока и канальцевой системы, и имеющую плотность <1,045 г/мл; и клеточную популяцию В5, содержащую дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, с плотностью > 1,091 г/мл. В некоторых вариантах реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего заболевание почек.
[00111] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие смеси человеческих почечных клеток, содержащие первую клеточную популяцию, В2, включающую изолированную, обогащенную популяцию клеток почечного канальца и имеющую плотность от 1,045 г/мл до 1,052 г/мл, и вторую клеточную популяцию, В4', включающую эритропоэтин(ЭПО)-продуцирующие клетки и сосудистые клетки, но обедненную клубочковыми клетками, имеющую плотность от 1,063 г/мл до 1,091 г/мл, при этом смесь не включает клеточную популяцию В1, содержащую большие гранулярные клетки собирающего протока и канальцевой системы и имеющую плотность <1,045 г/мл, или клеточную популяцию В5, содержащую дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, с плотностью >1,091 г/мл. В определенных вариантах реализации изобретения клеточная популяция B4’ характеризуется экспрессией сосудистого маркера. В одном варианте реализации изобретения клеточная популяция B4’ характеризуется экспрессией клубочкового маркера. В определенных вариантах реализации изобретения B2 дополнительно содержит эпителиальные клетки собирающего протока. В одном варианте реализации изобретения смесь клеток способна к рецепторно опосредованному поглощению альбумина. В другом варианте реализации изобретения смесь клеток способна к экспрессии эритропоэтина (ЭПО), регулируемой кислородом. В одном варианте реализации изобретения смесь содержит HAS-2-экспрессирующие клетки, способные продуцировать и/или стимулировать продукцию высокомолекулярных видов гиалуроновой кислоты (ГК) как in vitro, так и in vivo. Во всех вариантах реализации изобретения первая и вторая клеточные популяции могут быть получены из почечной ткани или культивированных почечных клеток.
[00112] В другом аспекте настоящего изобретения предлагаются органоиды, содержащие гетерогенную популяцию клеток почек, включающую комбинацию клеточных фракций или обогащенных клеточных популяций (например, В1, В2, В3, В4 (или В4') и В5). В одном варианте реализации изобретения комбинация имеет плавучую плотность от около 1,045 мкг/мл до около 1,091 г/мл. В одном варианте реализации изобретения комбинация имеет плавучую плотность менее чем от около 1,045 г/мл до около 1,099 г/мл или до около 1,100 г/мл. В другом варианте реализации изобретения комбинация имеет плавучую плотность, определенную путем разделения на градиенте плотности,например, центрифугированием. В еще одном варианте реализации изобретения комбинация клеточных фракций содержит В2, В3 и В4 (или В4') и обеднена B1 и/или B5. В некоторых вариантах реализации изобретения комбинация клеточных фракций содержит В2, В3 и В4 (или В4') и B5, но обеднена B1. После того, как произведено обеднение B1 и/или B5, комбинация может быть впоследствии культивирована in vitro перед приготовлением органоида, включающего комбинацию В2, В3, В4 и (или В4') клеточных фракций.
[00113] Авторы настоящего изобретения неожиданно обнаружили, что культивирование in vitro B1-обедненной комбинации B2, B3, B4 и B5 приводит к обеднению B5. В одном варианте реализации изобретения В5 обедняется по меньшей мере после одного, двух, трех, четырех или пяти пассажей. В одном варианте реализации изобретения комбинация клеточных фракции В2, В3, В4 и В5, пассаж которой произведен в условиях, описанных в данном документе, формирует популяцию перевиваемых клеток, содержащую B5 в процентом значении, составляющим менее чем около 5%, менее чем около 4%, менее чем около 3%, менее чем около 2%, менее чем около 1%, или менее чем около 0,5% популяции перевиваемых клеток.
[00114] В другом варианте реализации изобретения В4' является частью комбинации клеточных фракций. В одном ином варианте реализации изобретения обеднение В5 при культивировании in vitro осуществляется в гипоксических условия.
[00115] В одном варианте реализации изобретения органоид содержит смесь, которая способна обеспечить регенеративный стимул при введении in vivo. В других вариантах реализации изобретения смесь способна уменьшить снижение клубочковой фильтрации, канальцевой резорбции, продукции мочи и/или эндокринной функции, а также стабилизировать или оптимизировать эти процессы при введении in vivo. В одном варианте реализации изобретения клеточную популяцию В4' получают от субъекта, имеющего заболевание почек.
[00116] В предпочтительном варианте осуществления органоид содержит и/или формируется из смеси, которая содержит В2 в комбинации с B3 и/или B4. В другом предпочтительном варианте реализации изобретения смесь содержит В2 в комбинации с с B3 и/или В4'. В других предпочтительных вариантах реализации изобретения смесь состоит или по существу состоит из (i) B2 в комбинации с B3 и/или B4; или (ii) В2 в комбинации с В3 и/или В4'.
[00117] Смеси, которые содержат клеточную популяцию B4', могут содержать клеточные популяции B2 и/или B3, которые также получают от нездорового субъекта. Нездоровым субъектом может быть один и тот же субъект, от которого была получена фракция В4'. В отличие от клеточной популяции B4', клеточные популяции B2 и B3, полученные от нездоровых субъектов, как правило, не являются лишенными одного или более специфических типов клеток, по сравнению с исходной популяцией клеток почки, полученной от здорового индивидуума.
[00118] Как описано в Presnell et al. WO/2010/056328, обнаружено, что клеточные препараты B2 и B4 способны экспрессировать высокомолекулярные виды гиалуроновой кислоты (ГК) как in vitro, так и in vivo, посредством действия синтазы-2 (HAS-2) гиалуроновой кислоты - маркера, который является обогащенным более специфично в клеточной популяции В2. Воздействие с применением B2 в модели 5/6 Nx было проведено с целью уменьшения фиброза, одновременно с сильной экспрессией HAS-2 in vivo и ожидаемой продукцией высомолекулярной ГК в обработанной ткани. Следует отметить, что в модели 5/6 Nx, на которую не осуществлялось воздействия, развился фиброз с ограниченным обнаружением HAS-2 и небольшой продукцией высокомолекулярной ГК. Не ограничиваясь рамками теории, существует предположение, что эти противовоспалительные высокомолекулярные виды ГК, продуцируемые преимущественно В2 (и в некоторой степени B4), действуют синергически с клеточными препаратами, уменьшая фиброз почек и способствуя почечной регенерации. Соответственно, настоящее изобретение включает органоиды, содержащие биологически активные почечные клетки, описанные в настоящем документе, вместе с биоматериалом, содержащим гиалуроновую кислоту. Также предметом настоящего изобретения является предоставление компонента биоматериала регенеративного стимула посредством непосредственной продукции или стимуляции продукции имплантированными клетками.
[00119] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие и/или полученные из изолированных гетерогенных популяций ЭПО-продуцирующих клеток почек для применения в лечении заболевания почек, анемии и/или дефицита ЭПО у субъекта, имеющего для этого показания. В одном варианте реализации изобретения клеточную популяцию получают из почечного биоптата. В одном варианте реализации изобретения клеточную популяцию получают из всей ткани почки. В одном ином варианте реализации изобретения клеточные популяции являются производными из культур почечных клеток млекопитающих in vitro, полученных из биоптатов почки или из всей почечной ткани. Во всех вариантах реализации изобретения эти популяции являются нефракционированными клеточными популяциями, также называемые в настоящем документе необогащенными клеточными популяциями.
[00120] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие и/или полученные из изолированных гетерогенных популяций ЭПО-продуцирующих клеток почек, которые дополнительно обогащены таким образом, что доля ЭПО-продуцирующих клеток в обогащенной субпопуляции больше, по сравнению с долей ЭПО-продуцирующих клеток в исходной или первичной популяции клеток. В одном варианте настоящего изобретения обогащенная фракция ЭПО-продуцирующих клеток содержит большую долю интерстициальных фибробластов и меньшую долю клеток почечных канальцев по сравнению с долей интерстициальных фибробластов и клеток почечных канальца, содержащихся в необогащенной исходной популяции. В определенных вариантах реализации изобретения обогащенная фракция ЭПО-продуцирующих клеток содержит большую долю клубочковых клеток и сосудистых клеток и меньшую долю клеток собирающего протока по сравнению с долей клубочковых клеток, сосудистых клеток и клеток собирающего протока, содержащихся в необогащенной первичной популяции. В таких вариантах реализации изобретения эти популяции называются в настоящем документе как клеточные популяции "B4".
[00121] В другом аспекте настоящего изобретения предлагаются органоиды, содержащие и/или полученные из популяции ЭПО-продуцирующих клеток почек, которая смешивается с одной или более дополнительными популяциями клеток почек. В одном варианте реализации изобретения популяция ЭПО-продуцирующих клеток является первой клеточной популяцией, обогащенной ЭПО-продуцирующими клетками, например, B4. В другом варианте реализации изобретения популяция ЭПО-продуцирующих клеток является первой клеточной популяцией, необогащенной ЭПО-продуцирующими клетками, например, B2. В другом варианте реализации изобретения первая клеточная популяция смешивается со второй популяцией клеток почки. В некоторых вариантах реализации изобретения вторая клеточная популяция, обогащенная клетками почечного канальца, может быть обнаружена при наличии фенотипа клеток почечного канальца. В другом варианте реализации изобретения фенотип клеток почечного канальца может быть обнаружен при наличии одного маркера клеток канальцев. В другом варианте реализации изобретения фенотип клеток почечного канальца может быть обнаружен при наличии одного или более маркеров клеток канальцев. Маркеры клеток почечных канальцев включают, без ограничения, мегалин, кубилин, синтаза гиалуроновой кислоты 2 (HAS2), 25-гидроксилаза витамина D3 (CYP2D25), N-кадгерин (Ncad), Е-кадгерин (Ecad), аквапорин-1 (Aqp1), аквапорин-2 (Aqp2), RAB17, элемент RAS онкогенного семейства (Rab17), GATA-связывающий белок 3 (Gata3), FXYD-доменсодержащий регулятор ионного транспорта 4 (Fxyd4), элемент 4 семейства транспортеров растворенных веществ 9 (натрий/ионобменник водорода) (Slc9a4), элемент В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), элемент А3 семейства альдегиддегидрогеназы 1 (Aldh1a3) и калпаин-8 (Capn8). В другом варианте реализации изобретения первая клеточная популяция смешивается по меньшей мере с одним из несколькими типами клеток почек, включая, без ограничения, клетки, полученные из интерстиция, клетки почечного канальца, клетки, полученные из собирающего протока, клетки, полученные из клубочков и/или клетки, полученные из крови или сосудистой сети.
[00122] Органоиды по настоящему изобретению могут включать или быть сформированы из популяции ЭПО-продуцирующих клеток почки, содержащих B4 или B4' в виде смеси с B2 и/или B3 или в виде обогащенной клеточной популяции, например, В2 + В3+В4/B4'.
[00123] В одном аспекте органоиды содержат и/или формируются из популяций ЭПО-продуцирующих клеток почки, которые характеризуются экспрессией ЭПО и биочувствительностью к кислороду, в результате чего снижение напряжения кислорода культуральной системы приводит к индукции экспрессии ЭПО. В одном варианте реализации изобретения популяции ЭПО-продуцирующих клеток обогащены ЭПО-продуцирующими клетками. В одном варианте реализации изобретения экспрессия ЭПО индуцируется, когда клеточную популяцию культивируют в условиях воздействия на клетки пониженных уровней свободного кислорода в культуральной системе, по сравнению с клеточной популяцией, культивируемой при нормальных атмосферных уровнях свободного кислорода (~ 21%). В одном варианте реализации изобретения ЭПО-продуцирующие клетки, культивируемые в условиях низких уровней кислорода, экспрессируют более высокие уровни ЭПО по отношению к ЭПО-продуцирующим клеткам, культивируемым в нормальных кислородных условиях. В большинстве случаев культивирование клеток при пониженных уровнях свободного кислорода (также называемых гипоксическими условиями культивирования) означает, что уровень восстановленного кислорода уменьшается по отношению к культивированию клеток при нормальных атмосферных уровнях свободного кислорода (также называемых нормальными или гипоксическими условиями культивирования). В одном варианте реализации изобретения гипоксические условия клеточной культуры включают культивирование клеток при уровнях кислорода около менее чем 1% кислорода, около менее чем 2% кислорода, около менее чем 3% кислорода, около менее чем 4% кислорода или около менее чем 5% кислорода. В другом варианте реализации изобретения нормальные или нормоксические условия клеточной культуры включают культивирование клеток при уровнях кислорода около 10% кислорода, около 12% кислорода, около 13% кислорода, около 14% кислорода, около 15% кислорода, около 16% кислорода, около 17% кислорода, около 18 % кислорода, около 19% кислорода, около 20% кислорода или около 21% кислорода.
[00124] В одном варианте реализации изобретения индукция или повышенная экспрессия ЭПО происходят и могут обнаруживаться при культивировании клеток при уровне около менее чем 5% свободного кислорода и при сравнении уровней экспрессии ЭПО-клеток, культивируемых при атмосферном уровне кислорода (около 21%). В другом варианте реализации изобретения индукцию ЭПО получают в культуре клеток, способных экспрессировать ЭПО в способ, включающий первый этап культивирования, в котором культура клеток культивируется при атмосферном уровне кислорода (около 21%) в течение некоторого периода времени, и второй этап культурования, в котором уровни свободного кислорода понижаются, и те же самые клетки культивируются при уровне свободного кислорода, составляющем около менее 5%. В другом варианте реализации изобретения экспрессия ЭПО, которая реагирует на гипоксические условия, регулируется HIF1α. Специалисты в данной области техники должны знать о других изменениях кислородных условий при культивировании, известных в данной области, которые могут быть использованы для клеток, описанных в настоящем документе.
[00125] В одном аспекте органоид содержит и/или формируется из обогащенных популяций ЭПО-продуцирующих клеток млекопитающих, характеризующихся биочувствительностью (например, экспрессия ЭПО) к условиям перфузии. В одном варианте реализации изобретения условия перфузии включают кратковременный, прерывистый или непрерывный поток жидкости (перфузии). В одном варианте реализации изобретения экспрессия ЭПО является механически индуцированной в тех случаях, когда среда, в которой культивируются клетки, прерывисто или непрерывно двигается по кругу или перемешивается таким образом, что динамические силы передаются к клеткам посредством потока. В одном варианте реализации изобретения клетки, подвергшиеся воздействию кратковременного, прерывистого или непрерывного потока жидкости, культивируют таким образом, что они присутствуют в виде трехмерных структур в материале или на материале, который обеспечивает каркас и/или пространство для таких трехмерных структур с целью формирования. В одном варианте реализации изобретения клетки культивируют на пористых гранулах и подвергают воздействию прерывистого или непрерывного потока жидкости с помощью качающейся платформы, вращающейся платформы или вращающегося культурального матраса. В другом варианте реализации изобретения клетки культивируют на трехмерном каркасе и помещают в устройство, с помощью которого каркас становится неподвижным, а жидкость течет направленно вдоль или поперек каркаса. Специалисты в данной области техники должны знать о других условиях перфузии при культивировании, известных в данной области, которые могут быть использованы для клеток, описанных в настоящем документе.
Неактивные клеточные популяции
[00126] Как описано в настоящем документе, данное изобретение частично основано на неожиданном открытии того, что органоиды, включающие и/или сформированные из определенных субфракций гетерогенной популяции клеток почки, обогащенной биоактивными компонентами и обедненной неактивными или нежелательными компонентами, обеспечивают лучшие терапевтические и регенеративные результаты лечения в сравнении с исходной популяцией. В предпочтительных вариантах реализации изобретения органоиды, предлагаемые настоящим изобретением, содержат клеточные популяции, которые обеднены клеточными популяциями B1 и/или B5. Например, обедненными на B1 и/или B5 могут быть: смеси двух или более популяций из В2, В3 и В4 (или В4'); обогащенная клеточная популяция В2, В3 и В4 (или В4').
[00127] Клеточная популяция В1 состоит из больших, гранулярных клеток собирающего протока и канальцевой системы, с клетками популяции, имеющими плавучую плотность менее чем около 1,045 г/м. Клеточная популяция В5 состоит из дебриса и мелких низкогранулярных клеток с низкой жизнеспособностью, имеющих плавучую плотность более чем около 1,091 г/мл.
Способы изолирования и культивирования клеточных популяций
[00128] В одном аспекте, клеточные популяции SRC+ и/или органоиды по настоящему изобретению содержат и/или формируются из клеточных популяций, которые были изолированы и/или культивированы из почечной ткани. В настоящем описании приведены способы для разделения и изолирования почечных клеточных компонентов, например, обогащенных клеточных популяций, которые содержатся в органоидах для терапевтического применения, в том числе для лечения заболеваний почек, анемии, дефицита ЭПО, недостаточности канальцевого транспорта и недостаточности клубочковой фильтрации. В одном варианте реализации изобретения клеточные популяции являются изолированными из свежерасщепленной, т.е. механически или ферментативно расщепленной почечной ткани или из гетерогенных культур почечных клеток млекопитающих in vitro. Способы изолирования дополнительных биологически активных клеточных популяций, содержащих клеточные популяции SRC+ по настоящему изобретению, дополнительно описаны в Примерах.
[00129] Органоиды могут содержать и/или формироваться из гетерогенных смесей почечных клеток, которые были культивированы в гипоксических условиях культивирования перед разделением на градиенте плотности с обеспечением улучшенного разделения и состава клеток как фракций В4, в том числе В4', так и В2 и/или B3.Обогащение кислород-зависимых клеток в B4 из B2 наблюдалось среди почечных клеток, изолированных как из пораженных, так и непораженных почек. Не ограничиваясь рамками теории, это может быть следствием одного или нескольких из следующих явлений: 1) селективная выживаемость, гибель или пролиферация специфических клеточных компонентов в течение периода гипоксического культивирования; 2) изменения в клеточной гранулярности и/или в размере в ответ на гипоксическое культивирование, обуславливающие возникающие изменения плавучей плотности и последующей локализации во время разделения градиента плотности; и 3) изменения в экспрессии клеточного белка/гена в ответ на гипоксический период культивирования, тем самым приводящие к отличительным особенностям клеток в той или иной фракции градиента. Таким образом, в одном варианте реализации изобретения органоиды содержат и/или формируются из клеточных популяций, обогащенных клетками почечного канальца,например, B2, которые являются резистентными к гипоксии.
[00130] Типовые способы разделения и выделение клеточных популяций по настоящему изобретению включают разделение на градиенте плотности, основанное на различном удельном весе разных типов клеток, содержащихся в популяции, представляющей интерес. Удельный вес того или иного типа клеток может зависеть от степени гранулярности в клетках, внутриклеточного объема воды и других факторов. В одном аспекте настоящего изобретения предлагаются оптимальные условия градиента для изолирования клеточных препаратов по настоящему изобретению, например, B2 и B4, в том числе В4', у множества видов, включая, но не ограничиваясь ими, человека, собаку и грызуна. В предпочтительном варианте реализации изобретения градиент плотности используется для получения новой обогащенной популяции фракции канальцевых клеток, т.е. клеточной популяции B2, производной от гетерогенной популяции почечных клеток. В одном варианте реализации изобретения градиент плотности используется для получения новой обогащенной популяции фракции ЭПО-продуцирующих клеток, т.е. клеточной популяции B4, производной от гетерогенной популяции почечных клеток. В других вариантах реализации изобретения градиент плотности используется для получения обогащенной субпопуляций канальцевых клеток, клубочковых клеток и эндотелиальных почечных клеток. В одном варианте реализации изобретения ЭПО-продуцирующие и канальцевые клетки отделяют от эритроцитов и клеточного дебриса. В одном варианте реализации изобретения ЭПО-продуцирующие, клубочковые и сосудистые клетки отделяют от других типов клеток, эритроцитов и клеточного дебриса, а субпопуляцию канальцевых клеток и клетки собирающего протока одновременно отделяют от других типов клеток, эритроцитов и клеточного дебриса. В одном варианте реализации изобретения эндокринные, клубочковые и/или сосудистые клетки отделяют от других типов клеток, эритроцитов и клеточного дебриса, а субпопуляцию канальцевых клеток и клетки собирающего протока одновременно отделяют от других типов клеток, эритроцитов и клеточного дебриса.
[00131] В одном аспекте органоиды по настоящему изобретению содержат и/или формируются из клеточных популяций, полученных с помощью, в частности, среды градиента плотности OPTIPREP® (Axis-Shield), включающей 60% неионных йодированных соединении иодиксанола в воде, основанной на некоторых ключевых характеристиках, которые описаны ниже. Специалисту в данной области техники, тем не менее, будет понятно, что любой градиент плотности или другие способы, например, иммунологическое разделение с помощью маркеров клеточной поверхности, известные в данной области, имеют необходимые характеристики для изолирования клеточных популяций по настоящему изобретению, которые могут быть использованы в соответствии с настоящим изобретением. Специалистам в данной области техники следует также понимать, что те же самые клеточные характеристики, которые способствуют разделению клеточных субпопуляций с помощью градиентов плотности (размер и грануляция), могут быть использованы для разделения клеточных субпопуляций с помощью проточной цитометрии (прямое рассеяние = отражение размера с помощью проточной цитометрии, и боковое рассеяние = отражение гранулярности). Важно отметить, что среда градиент плотности должна иметь низкую токсичность по отношению к специфическим клеткам, представляющим интерес. В то время как среда градиента плотности должна иметь низкую токсичность по отношению к специфическим клеткам, представляющим интерес, настоящее изобретение предполагает применение градиентных сред, которые играют роль в процессе отбора клеток, представляющих интерес. Не ограничиваясь рамками теории, представляется, что клеточные популяции по настоящему изобретению, полученные с помощью градиента, содержащего иодиксанол, являются иодиксанол-резистентными, так как наблюдается существенная потеря клеток между этапами загрузки и получения, с предположением, что воздействие иодиксанола в условиях градиента приводит к элиминации определенных клеток. Клетки, наблюдаемые в специфических группах после иодиксанолового градиента, являются резистентными к каким-либо неблагоприятным эффектам иодиксанола и/или воздействия градиента плотности. Таким образом, при изолировании и/или отборе клеточных популяций для органоидов, описанных в настоящем документе, также предполагается использование дополнительной контрастной среды, характеризующейся нефротоксичностью от легкой до умеренной степени. Кроме того, среда градиента плотности также не должна связываться с белками плазмы человека или отрицательно влиять на ключевые функции клеток, представляющих интерес.
[00132] В другом аспекте настоящего изобретения предлагаются органоиды, содержащие и/или сформированные из клеточных популяций, которые были обогащены и/или обеднены типами почечных клеток с помощью сортировки флюоресцентно-активированных клеток (FACS). В одном варианте реализации изобретения типы почечных клеток могут быть обогащены и/или обеднены с помощью BD FACSAria™ или эквивалента.
[00133] В другом аспекте настоящего изобретения органоиды содержат и/или сформированы из клеточных популяций, которые были обогащены и/или обеднены типами почечных клеток с помощью магнитной сортировки клеток. В одном варианте реализации изобретения типы почечных клеток могут быть обогащены и/или обеднены с помощью системы Miltenyi autoMACS® или эквивалента.
[00134] В другом аспекте органоиды могут включать и/или могут быть сформированы из популяций клеток почек, которые подвергались трехмерному культивированию. В одном аспекте способы культивирования клеточных популяций осуществляются при непрерывной перфузии. В одном варианте реализации изобретения клеточные популяции, культивированные с помощью трехмерного культивирования и непрерывной перфузии, демонстрируют большую насыщенность клетками и взаимосвязанность по сравнению с популяцией клеток, культивированных статически. В другом варианте реализации изобретения клеточные популяции, культивированные с помощью трехмерного культивирования и непрерывной перфузии, демонстрируют большую экспрессию ЭПО, а также повышенную экспрессию генов, ассоциированных с почечными канальцами, таких как е-кадгерин, по сравнению со статическими культурами таких клеточных популяций. В еще одном варианте реализации изобретения клеточные популяции, культивированные с помощью непрерывной перфузии, демонстрируют больший уровень потребления глюкозы и глутамина по сравнению с популяцией клеток, культивированных статически.
[00135] Как описано в настоящем документе, низкие уровни кислорода или гипоксические кислородные условия могут быть использованы в способах для получения клеточных популяций для органоидов по настоящему изобретению. Тем не менее, способы получения клеточных популяций могут быть осуществлены без этапа модификации условий относительно низкого уровня кислорода. В одном варианте реализации изобретения могут использоваться гипоксические условия.
[00136] Специалисты в данной области техники должны знать о других способах изолирования и культивирования, известных в данной области, которые могут быть использованы для клеток, описанных в настоящем документе.
Биоматериалы
[00137] Как описано Bertram et al. в опубликованной заявке США 20070276507, полимерные матрицы или каркасы могут быть сформированы во всевозможные желаемые конфигурации для удовлетворения всевозможных комплексных систем, геометрии или пространственных ограничений. В одном варианте реализации изобретения матрицы или каркасы по настоящему изобретению могут быть трехмерным и сформированы таким образом, чтобы соответствовать размерам и форме органа или структуре ткани. Например, при использовании полимерного каркаса для лечения заболеваний почек, анемии, дефицита ЭПО, транспортной недостаточности канальцев или фильтрационной недостаточности клубочков может быть использована трехмерная (3-D) матрица. Может использоваться большое разнообразие различных форм каркасов 3-D. Естественно, полимерная матрица может быть сформирована в различных размерах и формах с целью соответствия неодинаковым размерам пациентов. Полимерная матрица может быть также сформирована другими способами для удовлетворения особых потребностей пациента. В другом варианте реализации изобретения полимерная матрица или каркас могут представлять собой биосовместимый, пористый полимерный каркас. Каркасы могут быть сформированы из различных синтетических или встречающихся в природе материалов, включая, но не ограничиваясь ими, открытопористую полимолочную кислоту (OPLA®), простой эфир целлюлозы, целлюлозу, сложный эфир целлюлозы, фторированный полиэтилен, фенольный полимер, поли-4-метилпентен, полиакрилонитрил, полиамид, полиамидоимид, полиакрилат, полибензоксазол, поликарбонат, полицианоакрилэфир, сложный полиэфир, полиэфиркарбонат, простой полиэфир, полиэфирэфиркетон, полиэфиримид, полиэфиркетон, полиэфирсульфон, полиэтилен, полифторолефин, полиимид, полиолефин, полиоксадиазол, полифениленоксид, полифениленсульфид, полипропилен, полистирол, полисульфид, полисульфон, политетрафторэтилен, политиоэфир, полиаминотриазол, полиуретан, поливинилхлорид, поливинилиденфторид, регенерированную целлюлозу, силикон, мочевиноформальдегид, коллагены, ламинины, фибронектин, гликозаминогликаны, шелк, эластин, альгинат, гиалуроновую кислоту, агарозу или сополимеры или их физические смеси. Конфигурации каркасов могут варьироваться от жидких гидрогелевых суспензий до мягких пористых каркасов для образования жестких, удерживающих форму, пористых каркасов.
[00138] Каркас может быть сформирован из биоматериала любой материальной формы, включая, но не ограничиваясь ими, разбавители, носители клеток, микрогранулы, материальные фрагменты, каркасы синтетического состава, включая, но не ограничиваясь ими, PGA, PLGA, PLLA, OPLA, электроспряденные нановолокна и пены синтетического состава, включая, но не ограничиваясь ими, PGA PLGA, PLLA, OPLA, электроспряденные нановолокна.
[00139] Гидрогели могут быть образованы из различных полимерных материалов и могут использоваться для различных биомедицинских целей. С физической точки зрения гидрогели могут быть описаны как трехмерные сетки гидрофильных полимеров. В зависимости от типа гидрогеля, они содержат разное процентное количество воды, но полностью в воде не растворяются. Несмотря на высокое содержание в них воды, гидрогели способны к дополнительному связыванию больших объемов жидкости за счет наличия гидрофильных остатков. Гидрогели сильно набухают, не меняя своей гелеобразной структуры. Основные физические характеристики гидрогеля могут быть целенаправленно модифицированы, в соответствии со свойствами используемых полимеров и дополнительными специальными оснащениями продуктов.
[00140] Предпочтительно, чтобы гидрогель, сформированный из полимера, материал, полученный биологическим способом, материал, полученный синтетическим способом или их комбинации, были биологически инертны и физиологически совместимы с тканями млекопитающих. Предпочтительно, чтобы гидрогелевый материал не вызывал воспалительной реакции. Примеры других материалов, которые могут быть использованы для формирования гидрогеля, включают (а) модифицированные альгинаты, (b) полисахариды (например, геллановая камедь и каррагенаны), которые превращаются в гель под воздействием одновалентных катионов, (c) полисахариды (например, гиалуроновая кислота), которые представляют собой очень вязкие жидкости или являются тиксотропными и формируют гель через какое-то время в результате медленной эволюции структуры, и (d) полимерные предшественники гидрогеля (например, блок-сополимеры полиэтиленоксид-полипропиленгликоля и белки). Патент США номер 6224893 В1 предлагает подробное описание различных полимеров и химических свойств таких полимеров, которые пригодны для изготовления гидрогелей согласно настоящему изобретению.
[00141] Характеристики каркаса или биоматериала могут позволить клеткам прикрепиться и взаимодействовать с материалом каркаса или биоматериалом, и/или могут обеспечить пористые пространства, в которые клетки могут быть захвачены. В одном варианте реализации изобретения пористые каркасы или биоматериалы по настоящему изобретению позволяют добавлять или осаждать одну или более популяций или смесей клеток на биоматериал, сконфигурированный как пористый каркас (например, путем прикрепления клеток) и/или в пределах пор каркаса(например, путем захвата клеток). В другом варианте реализации изобретения каркасы или биоматериалы позволяют или способствуют взаимодействию "клетка:клетка" и/или "клетка:биоматериал" в пределах каркаса с целью формирования конструкции, как описано в настоящем документе.
[00142] В одном варианте реализации изобретения биоматериал, используемый согласно настоящему изобретению, состоит из гиалуроновой кислоты (ГК) в виде гидрогеля, содержащего молекулы ГК размером от 5,1 кДа до > 2 х 106 кДа. В другом варианте реализации изобретения биоматериал, используемый согласно настоящему изобретению, состоит из гиалуроновой кислоты (ГК) в виде поропласта, и также содержит молекулы ГК с диапазоном размера от 5,1 кДа до > 2 х 106 кДа. В еще одном варианте реализации изобретения биоматериал, используемый согласно настоящему изобретению, состоит из пены на основе полимолочной кислоты (ПМК), имеющей открытопористую структуру и размер пор от около 50 микрон до около 300 микрон. В еще одном варианте реализации изобретения специфические популяции клеток, преимущественно В2, но также В4, непосредственно обеспечивают и/или стимулируют синтез высокомолекулярной гиалуроновой кислоты посредством синтазы-2 гиалуроновой кислоты (HAS-2), особенно после внутрипочечной имплантации.
[00143] Биоматериалы, описанные в настоящем документе, могут быть также разработаны или адаптированы к реакции на определенные внешние условия, например, in vitro или in vivo. В одном варианте реализации изобретения биоматериалы являются термочувствительными (например, либо in vitro либо in vivo). В другом варианте реализации изобретения биоматериалы являются адаптированными к воздействию ферментативного расщепления (например, либо in vitro либо in vivo). Ответную реакцию биоматериалов на внешние условия можно точно модифицировать, как описано в настоящем документе. Температурную чувствительность описанного органоида можно изменять, регулируя процентное количество биоматериала в органоиде. В альтернативном варианте биоматериалы могут быть химически перекрестно сшитыми с целью обеспечения большей устойчивости к ферментативному разложению. Например, сшивающий агент - карбодиимид может быть использован для химического сшивания желатиновых гранул, тем самым обеспечивая снижение восприимчивости к эндогенным ферментам.
[00144] В одном аспекте ответная реакция биоматериала на внешние условия представляет собой потерю структурной целостности биоматериала. Несмотря на то, что чувствительность к температуре и резистентность к ферментативному расщеплению приведены выше, существуют и другие механизмы, посредством которых различные биоматериалы могут терять физическую целостность. Эти механизмы могут включать, но не ограничиваются этим, термодинамические (например, фазовый переход, такой как плавление, диффузия (например, диффузия ионного сшивающего агента из биоматериала в окружающую ткань)), химические, ферментативные, рН (например, рН-чувствительные липосомы), ультразвуковые и фотолабильные (проникновение света) процессы. Конкретный механизм, посредством которого биоматериал теряет структурную целостность, может варьироваться, но обычно механизм срабатывает либо в момент имплантации, либо после имплантации.
[00145] Специалисты в данной области техники должны знать, что для формирования каркасов могут быть использованы и другие типы синтетических или встречающихся в природе материалов, известных в данной области техники, как описано в настоящем документе.
[00146] В одном аспекте настоящего изобретения предлагаются конструкции, как описано в настоящем документе, сделаны из вышеупомянутых каркасов или биоматериалов.
Конструкции
[00147] В одном аспекте настоящего изобретения предлагаются органоиды, содержащие имплантируемые конструкции с одной или более клеточными популяциями, описанными в настоящем документе, для лечения заболевания почек, анемии или дефицита ЭПО у субъекта, имеющего для этого показания. В одном варианте реализации изобретения конструкция состоит из биосовместимого материала или биоматериала, каркаса или матрицы, сформированных из одного или более синтетических или встречающихся в природе биосовместимых материалов и одной или более клеточных популяций или смесей клеток, описанных в настоящем документе, осажденных или встроенных в поверхность каркаса путем прикрепления и/или захвата. В определенных вариантах реализации изобретения конструкция состоит из биоматериала и одной или более клеточных популяций или смесей клеток, описанных в настоящем документе, которые нанесены, осаждены на поверхности или внутри, прикреплены, захвачены, встроены, высеяны или комбинированы с компонентом (компонентами) биоматериала. Любая из клеточных популяций, описанных в настоящем документе, в том числе обогащенные клеточные популяции или их смеси, могут быть использованы в комбинации с матрицей для формирования конструкции.
[00148] В другом варианте реализации изобретения осажденная клеточная популяция или клеточный компонент конструкции является первой почечной клеточной популяцией, обогащенной ЭПО-продуцирующими клетками, регулируемых с помощью кислорода. В другом варианте реализации изобретения первая почечная клеточная популяция содержит клубочковые и сосудистые клетки в дополнение к ЭПО-продуцирующим клеткам, регулируемых с помощью кислорода. В одном варианте реализации изобретения первая почечная клеточная популяция представляет собой клеточную популяцию В4'. В одном ином варианте реализации изобретения осажденная клеточная популяция или клеточный компонент (ы) конструкции включают как первую обогащенную почечной клеточной популяции, так и вторую почечную клеточную популяцию. В некоторых вариантах реализации изобретения вторая клеточная популяция не обогащена ЭПО-продуцирующими клетками, регулируемыми с помощью кислорода. В другом варианте реализации изобретения вторая клеточная популяция обогащена клетками почечных канальцев. В другом варианте реализации изобретения вторая клеточная популяция обогащена клетками почечных канальцев и содержит эпителиальные клетки собирающего протока. В других вариантах реализации изобретения клетки почечных канальцев характеризуются экспрессией одного или более маркеров клеток почечных канальцев, которые могут включать, без ограничения, мегалин, кубилин, синтазу гиалуроновой кислоты 2 (HAS2), 25-гидроксилазу витамина D3 (CYP2D25), N-кадгерин (Ncad), Е-кадгерин (Ecad), аквапорин-1 (Aqp1), аквапорин-2 (Aqp2), RAB17, элемент RAS онкогенного семейства (Rab17), GATA-связывающий белок 3 (Gata3), FXYD-доменсодержащий регулятор ионного транспорта 4 (Fxyd4), элемент 4 семейства транспортеров растворенных веществ 9 (натрий/ионобменник водорода) (Slc9a4), элемент В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), элемент А3 семейства альдегиддегидрогеназы 1 (Aldh1a3) и калпаин-8 (Capn8).
[00149] В одном варианте реализации изобретения клеточные популяции осаждаются на поверхности или комбинируются с биоматериалами или каркасами с целью формирования конструкции по настоящему изобретению, производной от различных источников, таких как аутологичные источники. Неаутологичные источники также пригодны для использования, включая без ограничения, аллогенные или сингенные (аутогенные или изогенные) источники.
[00150] Специалисты в данной области техники должны знать о существовании нескольких пригодных способов осаждения или иной комбинации клеточных популяций с биоматериалами с целью формирования конструкции.
[00151] В одном аспекте конструкции по настоящему изобретению являются пригодными для использования в способах использования, описанных в настоящем документе. В одном варианте реализации изобретения конструкции являются пригодными для введения субъекту, имеющего показания для лечения заболевания почек любой этиологии, анемии или дефицита ЭПО любой этиологии. В других вариантах реализации изобретения конструкции являются пригодными для введения субъекту, нуждающемуся в улучшении или восстановлении эритроидного гомеостаза. В другом варианте реализации изобретения конструкции являются пригодными для введения субъекту, нуждающемуся в улучшении функции почек.
[00152] В еще одном аспекте настоящего изобретения предлагаются конструкции для имплантации пациенту, нуждающемуся в улучшении функции почек, и содержащие: а) биоматериал, включающий один или более биосовместимых синтетических полимеров или встречающихся в природе белков или пептидов; и b) смесь почечных клеток млекопитающих, полученных от субъекта, имеющего заболевание почек, которая содержит первую клеточную популяцию, В2, включающую изолированную, обогащенную популяцию клеток почечного канальца, с плотностью от 1,045 г/мл до 1,052 г/мл, и вторую клеточную популяцию, В4', включающую эритропоэтин (ЭПО)-продуцирующие клетки и сосудистые клетки, но обедненную клубочковыми клетками, с плотностью от 1,063 г/мл до 1,091 г/мл, которые покрыты, осаждены на поверхности или внутри, захвачены, суспендированы, встроены или иным образом комбинированы с биоматериалом. В определенных вариантах реализации изобретения смесь не содержит клеточной популяции В1, имеющей большие гранулярные клетки собирающего протока и канальцевой системы, и характеризующейся плотностью <1,045 г/мл; или клеточной популяции В5, содержащей дебрис и малые клетки с низкой степенью грануляции и жизнеспособности, с плотностью > 1,091 г/мл.
[00153] В одном варианте реализации изобретения конструкция включает клеточную популяцию B4’, характеризующуюся экспрессией сосудистого маркера. В некоторых вариантах реализации изобретения клеточная популяция B4’ не характеризуется экспрессией клубочкового маркера. В определенных вариантах реализации изобретения смесь способна к экспрессии эритропоэтина (ЭПО), регулируемой кислородом. Во всех вариантах реализации изобретения смесь может быть получена из почечной ткани или культивированных почечных клеток млекопитающих.
[00154] В одном варианте реализации изобретения конструкция включает биоматериал, сконфигурированный в виде трехмерного (3-D) пористого биоматериала, пригодного для захвата и/или прикрепления смеси. В другом варианте реализации изобретения конструкция включает биоматериал, сконфигурированный в виде жидкости или полужидкого геля, пригодных для встраивания, прикрепления, суспендирования или покрытия клеток млекопитающих. В еще одном варианте реализации изобретения конструкция включает сконфигурированный биоматериал, состоящий из преимущественно высокомолекулярных видов гиалуроновой кислоты (ГК) в виде гидрогеля. В еще одном варианте реализации изобретения конструкция включает биоматериал, состоящий из преимущественно высокомолекулярных видов гиалуроновой кислоты (ГК) в виде поропласта. В еще одном варианте реализации изобретения конструкция включает биоматериал, состоящий из пены на основе полимолочной кислоты (ПМК), имеющей размер пор от около 50 микрон до около 300 микрон. В еще одном варианте реализации изобретения конструкция включает одну или более клеточных популяций, которые могут быть получены из образца почки, аутологичного для субъекта, нуждающегося в улучшении функции почек. В некоторых вариантах реализации изобретения образец представляет собой биоптат почки. В некоторых вариантах реализации изобретения субъект имеет заболевание почек. В других вариантах реализации изобретения клеточную популяцию получают от неаутологичного образца почек. В одном варианте реализации изобретения конструкция обеспечивает эритроидный гомеостаз.
Способы применения
[00155] В одном аспекте настоящего изобретения предлагаются способы лечения заболевания почек, анемии или дефицита ЭПО у субъекта, имеющего показания для применения клеточных популяций SRC+ и/или органоидов, содержащих и/или сформированных из популяций клеток почек и смесей клеток почек, описанных в настоящем документе. В одном варианте реализации изобретения способ включает введение субъекту органоида (органоидов), который включает и/или сформирован из первой почечной клеточной популяции, обогащенной ЭПО-продуцирующими клетками. В другом варианте реализации изобретения первая клеточная популяция обогащена ЭПО-продуцирующими клетками, клетками клубочков и сосудистыми клетками. В другом варианте реализации изобретения органоид (органоиды) может дополнительно включать и/или может быть сформированы из одной или более дополнительных популяций клеток почек. В одном варианте реализации изобретения дополнительная клеточная популяция является второй клеточной популяции, необогащенной ЭПО-продуцирующими клетками. В другом варианте реализации изобретения дополнительная клеточная популяция является второй клеточной популяцией, необогащенной ЭПО-продуцирующими клетками, клетками клубочков или сосудистыми клетками В другом варианте реализации изобретения органоид (органоиды) также включает и/или сформирован из популяции клеток почки или смеси клеток почки, осажденных на поверхности или внутри биоматериала, встроенных внутрь, покрывающих биоматериал или захваченных им с целью формирования имплантируемой конструкции, как описано в настоящем документе, для лечения заболевания или патологии, приведенных в данном описании. В одном варианте реализации изобретения органоиды используются отдельно или в комбинации с другими клетками или биоматериалами, например, гидрогелями, пористыми каркасами или нативными или синтетическими пептидами или белками с целью стимуляции регенерации при острых или хронических патологиях.
[00156] В другом аспекте, эффективное лечение заболевания почек, анемии, или дефицита ЭПO у субъекта с использованием способов по настоящему изобретению можно наблюдать с помощью различных показателей эритропоэза и/или функции почек. В одном варианте реализации изобретения показатели эритроидного гомеостаза включают, без ограничения, гематокрит (HCT), гемоглобин (НВ), средний эритроцитарный гемоглобин (MCH), количество эритроцитов (RBC), количество ретикулоцитов, % ретикулоцитов, средний объем эритроцитов (MCV) и относительную ширину распределения эритроцитов по объему (RDW). В одном ином варианте реализации изобретения показатели функции почек включают, без ограничения, сывороточный альбумин, соотношение альбумина к глобулину (соотношение А/Г), сывороточный фосфор, сывороточный натрий, размер почек (измеряемый с помощью ультразвука), сывороточный кальций, соотношение "фосфор:кальций", сывороточный калий, протеинурию, креатинин мочи, сывороточный креатинин, азот мочевины крови (АМК), уровни холестерина, триглицеридов и скорость клубочковой фильтрации (СКФ). Кроме того, несколько показателей общего состояния здоровья и благополучия включают, без ограничения, прирост или потерю веса, выживаемость, артериальное давление (среднее системное артериальное давление, диастолическое артериальное давление или систолическое артериальное давление) и проявления физической выносливости.
[00157] В другом варианте реализации изобретения эффективное лечение клеточными популяциями SRC+ или биоактивными почечно-клеточными органоидами подтверждается стабилизацией одного или более показателей почечной функции. Стабилизация функции почек подтверждается наблюдаемым изменением показателя у субъекта, пролеченного с применением способа по настоящему изобретению, по сравнению с аналогичным показателем у субъекта, который не был пролечен по способу настоящего изобретения. В альтернативном варианте стабилизация функции почек может быть подтверждена наблюдаемым изменением показателя у субъекта, пролеченного с применением способа по настоящему изобретению, по сравнению с аналогичным показателем у того же субъекта перед лечением. Изменение первого показателя может представлять собой увеличение или уменьшение его значения. В одном варианте реализации изобретения лечение, предлагаемое настоящим изобретением, может включать стабилизацию уровней азота мочевины в крови (АМК) у субъекта, когда уровни АМК, наблюдаемые у субъекта, являются более низкими по сравнению с субъектом, имеющим аналогичное заболевание, который не получал лечения с применением способов по настоящему изобретению. В одном варианте реализации изобретения лечение может включать стабилизацию уровней креатинина у субъекта, когда уровни креатинина, наблюдаемые у субъекта, являются более низкими по сравнению с субъектом, имеющим аналогичное заболевание, который не получал лечения с применением способов по настоящему изобретению. В другом варианте реализации изобретения лечение может включать стабилизацию уровней гематокрита (HCT) у субъекта, когда уровни HCT, наблюдаемые у субъекта, являются более высокими по сравнению с субъектом, имеющим аналогичное заболевание, который не получал лечения с применением способов по настоящему изобретению. В другом варианте реализации изобретения лечение может включать стабилизацию уровней эритроцитов (RBC) у субъекта, когда уровни RBC, наблюдаемые у субъекта, являются более высокими по сравнению с субъектом, имеющим аналогичное заболевание, который не получал лечения с применением способов по настоящему изобретению. Специалисты в данной области техники должны знать, что с целью определения эффективности лечения заболевания почек у субъекта могут быть измерены один или более дополнительных показателей, описанных в настоящем документе или известных в данной области техники.
Способы и пути введения
[00158] Клеточные популяции SRC+ и/или биологически активные клеточные органоиды по настоящему изобретению могут введиться отдельно или в комбинации с другими биологически активными компонентами. Клеточные популяции SRC+ и/или органоиды являются пригодными для введения или имплантации инкорпорированных элементов тканевой инженерии во внутрь паренхиматозных органов с целью регенерации ткани.
[00159] В одном аспекте настоящего изобретения предлагаются способы введения биоактивного клеточного органоида (органоидов), описанного в настоящем документе, субъекту, имеющего для этого показания. В одном варианте реализации изобретения источник биоактивной клетки может быть аутологичным или аллогенным, сингенным (аутогенным или изогенным) и любой их комбинацией. В случаях, когда источник не аутологичный, способы могут включать введение иммунодепрессанта. Пригодные иммунодепрессанты включают, без ограничения, азатиоприн, циклофосфамид, мизорибин, циклоспорин, такролимуса гидрат, хлорамбуцил, лобензарита динатрий, ауранофин, алпростадил, гусперимуса гидрохлорид, биосинсорб, муромонаб, алефацепт, пентостатин, даклизумаб, сиролимус, микофенолата мофетил, лефлономид, базиликсимаб, дорназу α, биндарид, кладрибин, пимекролимус, илодекакин, цеделизумаб, эфализумаб, эверолимус, анисперимус, гавилимомаб, фаралимомаб, клофарабин, рапамицин, сиплизумаб, саиреито, LDP-03, CD4, SR-43551, SK&F-106615, IDEC-114, IDEC-131, FTY-720, TSK-204, LF-080299, A-86281, A-802715, GVH-313, HMR-1279, ZD-7349, IPL-423323, CBP-1011, MT-1345, CNI-1493, CBP-2011, J-695, LJP-920, L-732531, ABX-RB2, AP-1903, IDPS, BMS-205820, BMS-224818, CTLA4-1g, ER-49890, ER-38925, ISAtx-247, RDP-58, PNU-156804, LJP-1082, TMC-95A, TV-4710, PTR-262-MG и AGI-1096 (см. Патент США № 7563822). Специалистам в данной области техники должно быть известно о других пригодных иммунодепрессантах.
[00160] Спопобы лечения по настоящему изобретению включают введение клеточной популяции SRC+ и/или органоидов, описанных настоящем документе. В одном варианте реализации изобретения является предпочтительным непосредставенное введение клеток к месту предполагаемого эффекта.
[00161] Ввиду этого описания специалистам в данной области техники будут очевидны разнообразные средства введения органоидов субъектам. Такие способы включают, но не ограничиваются ими, введение внутрь паренхимы, субкапсульное размещение, трансуретральную катетеризацию и катетеризацию внутрипочечной артерии.
[00162] Клетки могут быть помещены в устройство доставки или средство доставки, что облегчает введение путем инъекции или имплантации субъектам. В некоторых вариантах реализации изобретения средство доставки может включать природные материалы. В определенных вариантах реализации изобретения средство доставки может включать синтетические материалы. В одном варианте реализации изобретения средство доставки обеспечивает структуру для имитации или соответствующего встраивания в архитектуру органа. В других вариантах реализации изобретения средство доставки в природе является подобным жидкости. Такие устройства доставки могут включать трубки, например, катетеры, для инъекции клеток и жидкостей в организм субъекта-реципиента. В предпочтительном варианте реализации изобретения трубки дополнительно имеют иглу, например, шприц, посредством которого клетки по настоящему изобретению могут быть введены в необходимую часть тела субъекта. В некоторых вариантах реализации изобретения клеточные популяции, полученные из почек млекопитающих, сформированные для введения в кровеносный сосуд с помощью катетера (при этом термин "катетер" предназначен для обозначения любой из многооборазных трубчатых систем для доставки веществ в кровеносный сосуд). В альтернативном варианте клетки могут быть помещены внутрь биоматериала или на биоматериал или каркас, включая, но не ограничиваясь текстилем, таким как ткацкое переплетение, вязаное переплетение, плетения, сетки и нетканые материалы, перфорированные пленки, губки, пены и гранулы, такие как твердые или пористые гранулы, микрочастицы, наночастицы и т.п. (например, желатиновые гранулы Cultispher-S - Sigma). Клетки могут быть приготовлены для введения в разнообразных формах. Например, клетки могут быть суспендированы в растворе или геле. Клетки могут быть смешаны с фармацевтически приемлемым носителем или разбавителем, в котором клетки по настоящему изобретению сохраняют жизнеспособность. Фармацевтически приемлемые носители и разбавители включают физиологический раствор, водные буферные растворы, растворители и/или дисперсионную среду. Использование таких носителей и разбавителей хорошо известно в данной области техники. Раствор предпочтительно должен быть стерильным и жидким, и зачастую - изотоническим. Раствор предпочтительно должен быть стабилен в условиях производства и хранения и защищен от загрязняющего действия микроорганизмов, таких как бактерии и грибы посредством использования, например, парабенов, хлорбутанолв, фенолов, аскорбиновой кислоты, тимеросала и подобных веществ. Специалисту в данной области техники должно быть известно, что средство доставки, используемое при введении клеточных популяций и их смесей по настоящему изобретению, может иметь комбинации вышеуказанных свойств.
[00163] Способы введения органоидов, содержащих и/или сформированных из изолированной популяции (популяций) клеток почки, например, клеточной популяции B2 отдельно или в смеси с В4’ и/или B3, включают, но не ограничиваются ими, введение внутрь паренхимы, субкапсульное размещение или введение в почечную артерию. Дополнительные способы введения, которые будут использоваться согласно настоящему изобретению, включают одно или множество введений при прямой лапаротомии, прямой лапароскопии, трансабдоминальном или чрескожном доступе. Другие дополнительные способы введения, которые будут использоваться согласно настоящему изобретению, включают например, ретроградную и лоханочно-мочеточниковую инфузию. Хирургические способы введения включают одноэтапные процедуры, такие как, но не ограничиваясь, частичная резекция почки и имплантация конструкции, частичная резекция почки, частичная пиелоэктомия, васкуляризации с сальником ± брюшиной, мультифокальные ходы биопсийной иглы от конического или пирамидального до цилиндрического, полюсная замена почки, а также двухэтапные процедуры, включая, например, органоид-внутренний биореактор для пересадки. В одном варианте реализации изобретения, органоиды, содержащие и/или сформированные из смесей клеток, вводятся с помощью аналогичного способа и одновременно. В другом варианте реализации изобретения каждый из органоидов вводится в определенные места или с помощью конкретных методик, либо одновременно, либо через контролируемые периоды времени, с помощью одного или более способов, описанных в настоящем документе.
[00164] Соответствующее дозирование клеток или органоидов, необходимое для имплантации человеку, может быть определено на основании существующей информации, относящей к любому виду активности органоидов, например продукции ЭПО, или экстраполировано из проведенных доклинических исследований по изучению дозирования. Количество органоидов может быть определено количественно из культуры in vitro и экспериментов на животных in vivo и использоваться в расчете соответствующей дозы имплантируемого материала. Дополнительно, может быть организован мониторинг за пациентом с целью определения возможности проведения дополнительной имплантации или, следовательно, уменьшения имплантируемого материала.
[00165] Один или более дополнительных компонентов могут быть добавлены к органоидам, включающим и/или сформированным из клеточных популяций и их смесей по настоящему изобретению, включая выбранные компоненты внеклеточного матрикса, такие как один или более типов коллагена или гиалуроновой кислоты, известные в данной области техники, факторы роста и/или цитокины, включая, но не ограничиваясь ими, VEGF, PDGF, FGF, TGF-бета IGF, обогащенную тромбоцитами плазму и лекарственные средства.
[00166] Специалисты в данной области техники должны знать о различных способах введения пригодных органоидов, описанных в настоящем документе.
Изделия и наборы
[00167] Настоящее изобретение дополнительно включает наборы, содержащие полимерные матрицы и каркасы по изобретению, соответствующие материалы и/или клеточную культуральную среду и инструкции по применению. Инструкции по применению могут содержать, например, инструкции относительно культуры клеток в составе клеточных популяций SRC+ или органоидов по настоящему изобретению и/или введения клеточных популяций SRC+ или органоидов. В одном варианте настоящего изобретения предлагается набор, содержащий каркас, как описано в настоящем документе, и инструкции. В еще одном варианте реализации изобретения набор содержит агент для обнаружения маркера экспрессии, реагенты для функционирования агента и инструкции по применению. Этот набор может быть использован в целях определения регенеративного прогноза нативной почки у субъекта после имплантации или введения органоида (органоидов), описанных в настоящем документе. Набор также можно использовать для определения биотерапевтической эффективности органоида (органоидов), описанных в настоящем документе.
[00168] Другой вариант реализации настоящего изобретения представляет собой изделие, включающее органоиды, содержащие и/или сформированные из биологически активных клеток, пригодных для лечения пациентов, имеющих для этого показания. Изделие содержит контейнер, этикетку или листок-вкладыш, уложенный в упаковку или прикрепленный к контейнеру. Пригодные контейнеры включают, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния и может иметь стерильный входной порт (например, контейнер может представлять собой мешок с раствором или флакон, имеющий пробку, прокалываемую инъекционной иглой). На этикетке или листке-вкладыше указано, что органоид применяется для лечения определенного состояния. Этикетка или листок-вкладыш будет дополнительно содержать инструкции по введению органоида пациенту. Также рассматриваются изделия и наборы, содержащие комбинаторные способы терапевтического воздействия, описанные в настоящем документе. В листке-вкладыше приведена инструкция, которую обычно содержат заводские упаковки терапевтических средств, с информацией о показаниях, применении, дозировке, введении, противопоказаниях и/или предостережениях, касающихся использования таких терапевтических средств. В одном варианте реализации изобретения на листке-вкладыше указано, что органоид применяется для лечения заболевания или патологии, таких как, например, заболевание или патология почек. Упаковка может дополнительно включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы. Также предлагаются такие наборы, которые пригодны для использования в различных целях, например, для оценки результатов регенерации. Также могут быть предложены наборы, которые содержат агенты обнаружения везикул, полученных из мочи, и/или их содержимого, например, нуклеиновых кислот (таких как миРНК), везикул, экзосом и т.д., как описано в настоящем документе. Агенты обнаружения включают, без ограничения, праймеры нуклеиновых кислот и зонды, а также антитела для обнаружения желаемой цели in vitro. Как и в случае с изделием, набор содержит контейнер, этикетку или листок-вкладыш, уложенный в упаковку или прикрепленный к контейнеру. Контейнер содержит композицию, включающую по меньшей мере один агент обнаружения. Могут быть включены дополнительные контейнеры, например, с разбавителями и буферами или веществами, регулирующими агенты обнаружения. На этикетке или листке-вкладыше может быть приведено описание состава, а также инструкции для предполагаемого прогностического или диагностического использования in vitro.
[00169] Следующие примеры предлагаются только в ознакомительных целях, и никоим образом не ограничивают объем настоящего изобретения.
ПРИМЕРЫ
Пример 1 - Изоляция отобранных популяций клеток почки + (SRC+): Изоляция эндотелиальных клеток из биоптата почки
[00170] Следующий способ представляет пример изолирования эндотелиальных клеток после ферментативного расщепления, используя предварительно адаптированный протокол коллагеназного расщепления/диспазного расщепления2, 3, 5. Этот способ был применен к пораженным почкам крыс ZSF1 и биоптатам почек, полученных от пациента-человека на диализе с гипертензивной ТХПН.
Эндотелиальные клетки (ЭК), сосудистое и лимфатическое происхождение:
[00171] Расщепленную ферментами почку (почки) фильтруют через фильтр Steriflipс размером пор 100 мкм (Millipore) с помощью стандартных операционных процедур для изолирования почечных клеток почки, как описано ниже. Оставшуюся клеточную суспензию нейтрализуют DMEM (минимальная эссенциальная среда Игла, модифицированная по способу Дульбекко), содержащей 5% FBS (фетальная бычья сыворотка), и затем промывают центрифугированием при 300 х г в течение 5 минут. Клеточный осадок, извлеченный из фильтра с размером пор 100 мкм, ресуспендируют в ростовой среде, полностью обогащенной EGM-2 (Lonza), и высевают на чашки, покрытые фибронектином при плотности клеток 25 К/см2. Культуры подпитывают каждые 3 дня. Когда культуры ЭК сливаются на 80-90%, их обрабатывают трипсином и подсчитывают. Трипсинизированные клетки помечают первичным антителом CD31 (РЕСАМ) и положительно выбирают с помощью микрогранул анти-CD31 Miltenyi. Сортированные клетки CD31+ промывают, подсчитывают, покрывают и высевают при плотности 10 K/см2 в среду, полностью обогащенную ВОСА-2. Морфология эндотелиальных клеток должна проявиться через двадцать четыре часа, и эти клетки могут разрастаться за счет нескольких пассажей. Сосудистая и/или лимфатическая композиция может быть проанализирована с помощью линейно-специфических антител (например, VEGF3 – сосудистый капилляр; LYVE1 – лимфатический); специфическая эндотелиальная субпопуляция может быть дополнительно отобрана/отсортирована с помощью микрогранулярного способа отбора Miltenyi, предусматривающего использование тех же маркеров фенотипирования клеточной поверхности.
[00172] После разрастания и очистки, компонент эндотелиальных клеток NKA SRC может быть обогащен большим процентным количеством (> 30%), чем естественная частота, наблюдаемая при фракционировании плавучей плотности (<2%). В одном варианте реализации изобретения для контролирования активных биологических ингредиентов или композиции NKA, очищенные ЭК перед трансплантацией могут быть скомбинированы при выбранной частоте с фракциями B2 и/или B3-B2-B4, описанными ранее, в результате градиентного фракционирования плавучей плотности (например, 60% В2-В4 + 40% ЭК).
Сортировка эндотелиальных клеток с использованием магнитных микрогранул:
[00173] Клетки, собранные из культуральных матрасов, покрытых фибронектином в среде EGM2, окрашивают мышиным первичным антителом против человеческого CD31 в концентрации 0,4 мкг/миллионов клеток/100 мкл в среде EGM2 без добавок в течение 20 минут при 4°С. Через 20 минут клетки промывают и повторно суспендируют в 12 мл среды EGM2 без добавок и 200 мкл козьего антимышиного IgG1. Микрогранулы Miltenyi добавляют и инкубируют в течение дополнительных 20 минут при 4°С в защищенном от света месте. Через 20 минут клетки два раза промывают с помощью центрифугирования (5 мин @ 300 x г), ресуспендируют в 12 мл [10 миллионов клеток/мл] и очищают с использованием прибора Miltenyi auto-MACS (программа двойного положительного отбора в чувствительном режиме).
[00174] В примере, описанном на Фиг. 1, эндотелиальные клетки отбирали (отбор CD31+) из первичных клеток ZSF1. 3,6 миллионов клеток, полученных в результате этого процесса, подсчитывали и субкультивировали на два культуральных матраса T175, покрытых фибронектином, в концентрации 10K на см2. Клетки культивировали в течение четырех дней с 21% O2 и собирали при слиянии, составляющем 85%. После этого отбора и периода культивирования клетки подсчитывали и 9,5 миллионов клеток извлекали. Взятая проба для фенотипического анализа FACS была положительной ~ на 90% для CD31 (Фиг. 1E, правая панель FACS).
Изолирование эндотелиальных клеток человека с ХЗП, характеристика и разрастание
Культура клеток почки человека:
[00175] Почечные клетки человека (см. Таблицу 1 с информацией о доноре) были изолированы с использованием стандартных операционных процедур первичной ферментного изолирования клеток почки человека и культивирования, как описано ниже. Описывая кратко, клетки были изолированы и культивированы при 25 К/см2 либо на культуральном матрасе, обработанном T/C, со стандартным KGM, либо на культуральном матрасе, покрытым фибронектином, в среде, полностью обогащенной EGM2. Клетки выращивали в течение трех дней в среде 21% кислорода, а затем среду заменяли, а культуры переносили в среду 2% кислорода для воздействия O/N (в течение ночи). По истечению четырех дней формировали изображение клеток с целью анализа морфологии культуры (Фиг. 2A). Затем их собирали и подсчитывали с использованием стандартных способов (см. документацию на серию HK027). Отбирали образец и окрашивали для определения процентного содержания эндотелиальных клеток CD31+ (Фиг. 2). Эндотелиальные клетки сортировали с использованием мышиного первичного античеловеческого CD31 антитела (BD Biosciences) и магнитных микрогранул (Miltenyi). Клетки CD31+ затем повторно высевали на культуральные матрасы, покрытые фибронектином, с плотностью 10K/см2 и дополнительно культивировали четыре дня (Фиг. 2, морфология клеточной культуры). Клетки подсчитывали и отбирали образец с целью определения процентного количества положительных эндотелиальных клеток с помощью мышиного первичного антитела против человеческого CD31 и FACS-анализа (Фиг. 3).
Таблица 1. Информация о доноре человеческой почки
[00176] В заключение, первичная культура пораженных клеток ZSF1 на фибронектине продуцировала 9% культуры CD31+ (<2% от обработанных TC). На p1, 9% фракции CD31+, субкультивированной на фибронектине, произвели ~ 90% клеток CD31+, которые разрослись почти в 3 раза от p0 до p1. Первичная культура клеток человека с ХЗП на культуральных матрасах, как обработанных Т/С, так и покрытых фибронектином, продуцировала приблизительно такой же процент CD31-положительных клеток (2,1% по сравнению с 2,7%). Продемонстрирована возможность субкультивирования положительно отобранных CD31-положительных клеток на культуральных матрасах, покрытых фибронектином, в полностью обогащенной EGM2 среде и увеличения процента положительных клеток CD31 в 13-кратном размере (до 35,5% с 2,7%) после пассажа 1.
Изолирование клеточных популяций SRC+: Примеры изолирования дополнительных типов биологически активных клеток:
[00177] A. Почечный эпителий: Текущее функционирование оценивается наличием эпителиальных клеток различных отделов (париетального, проксимальных канальцев, петли Генле, дистальных канальцев) во фракциях, изолированных с помощью градиентов плавучей плотности. В частности, исследования отслеживания линии дифференцировки приводят прямое и выборочное подтверждение изолирования эпителиальных клеток Six2+; совместное мечение Six2 маркером, специфическим к эпителиальному отделу нефрона (см. Таблицы 2-3), подтверждает клеточно-специфическое обнаружение (см. Таблицу 4). В Таблице 4 приводится ограниченная группа эпителиальных маркеров, которые характеризуют культуру р0 ZSF1 (комбинированные фракции В2-В3-В4) в смеси типов клеток проксимальных и дистальных канальцев и клеток собирающего протока. Предполагается обогащение этих эпителиальных клеток из определенных отделов путем отбора культуры, как описано ранее (условия культивирования в сочетании с магнитной сортировкой), с использованием тех же антител обнаружения клеточной поверхности, приведенных в Таблицах 2-4.
Таблица 2. Маркерная панель для специфического окрашивания ткани нефрона
Пол.= положительная, Пол.-ind = положительная клетка в отобранной популяции клеток, Мед.–ind = пол. окрашивание медуляных собирающих протоков
Таблица 3. Источники антител
Вторичные антитела представляли собой молекулярные зонды Alexa 647 козьи анти-мышиные антитела IgG, козьи анти-кроличьи IgG и ослиные анти-козьи IgG, стрепавидин A647. Окрашивание в соответствии с СОП с 1 мкг/мл/1x106 клеток
Таблица 4. Предварительное специфическое обнаружение клеток ZSF1 р0
[00178] B. Клетки, полученные из клубочков (париетальные эпителиальные и подоциты): Анатомическое удаление лоханки позволяет оптимизировать изолирование клубочковой фракции. С использованием стандартной операционной процедуры ферментативного расщепления почки, описанной ниже, клетки выделяют и фильтруют через фильтр Steri-flip (Millipore) с размером пор 100 мкм, а клеточные частицы/сгустки больше, чем 100 мкм (содержат клубочковую фракцию), подвергаются повторному ферментативному расщеплению в течение дополнительных 20 минут. Расщепленную фракцию нейтрализуют в среде DMEM, содержащей 10% FBS и промывают центрифугированием (300x г в течение 5 минут). Ресуспендированный клеточный осадок культивируют в среде VRADD6 (DMEM/F 12,1 мкМ политрансретиноевой кислоты (Genzyme, Кембридж, Массачусетс), 0.1 мкМ дексаметазона (Sigma-Aldrich), 10-100 нМ витамина D (1,25(OH)2D3 в целях активации роста культуры подоцитов, или в бессывороточной среде, такой как (50:50 DMEM/KSFM), полностью обогащенной, не содержащей FBS и ориентированной на париетальные эпителиальные клетки, культивируемые на планшетах T/C, покрытых коллагеном типа 1. Клетки высевают с плотностью 25 K/см2 и субкультивируют, пока не появится разрастание клеток. Распространите и отсортируйте клетки с использованием первичных антител, связанных с микрогранулами Miltenyi при пассаже 1, используя либо специфические маркеры PEC (такие как, но не ограничиваясь им, клаудин-1), либо предшественников специфических маркеров (например, CD146, CD117, SOX2, Oct 4A, CD24, CD133), либо мезангиальные специфические маркеры (например, но не ограничиваясь ими, актин гладких мышц, виментин, миокардин, кальбиндин), либо клубочковые капиллярные эндотелиальные клетки (например, VEFG3 или CD31 или LIVE1). В случае, когда частота собранных оптимальных клеточных приростов и комбинированных с компонентом В2 является больше, чем естественная частота, более высокое процентное количество клеток, полученных из клубочков, может применяться у пациентов, имеющих патологию клубочков.
[00179] C. Эпителий собирающего протока: Анатомическое удаление коры и мозгового вещества области почек позволяет оптимизировать изолирование клеток, расположенных в пределах или вблизи лоханки. Стандартные операционные процедуры для изолирования, распространения и сбора первичных клеток почки у грызунов, собак и человека, как описано ниже, логически вытекают из процедур для изолирования и распространения эпителиальных клеток собирающего протока. Стандартные операционные процедуры для фракционирования субпопуляций первичных культивированных клеток почек, обогащенных клетками собирающих протоков в клеточной фракции В1, описаны в настоящем документе ниже. Эти клетки содержат высокий процент эпителиальных клеток собирающего протока, что подтверждается такими маркерами, как аквапорин 2 и агглютининиз Dolichos biflorus (DBA). В альтернативном варианте мы адаптировали протокол культуры папиллярных/интрамедуллярных клеток собирающего протока (IMCD), разработанный доктором Беном Хамфрисом (Dr. Ben Humphreys) (среда REGM с добавлением EGF; неопубликованные данные). В любом из этих вариантов, клеточная фракция, обогащенная эпителием собирающего протока, может быть использована в комбинации с компонентом В2 при частотах, более высоких, в сравнении с естественными, или разрастаться с использованием стандартной KGM или эквивалента, и применятся при лечении целевых этиологических патологических процессов, ассоциированных с концентрацией мочи, и может давать больше оснований для возможного применения активных биологических компонентов при нарушениях функции и/или заболеваниях почечной лоханки (например, гидронефроз, сосудисто-мочеточниковая обструкция)
Пример 2 - Формирование и характеристика органоидов из популяций SRC и SRC+.
Самогенерируемое образование органоидов/сфероидов
[00180] Органоиды получали после первичного культивирования клеток почки, разрастания и центрифугирования в градиенте плавучей плотности для изолирования SRC (стандартные операционные процедуры для формирования NKA, как описано ниже). Описывая кратко, SRC ресуспендировали в 100 мл ростовой среды для почечных клеток в концентрации [1 x106 клеток/мл] на вращающихся культуральных матрасах (Corning) в течение 24-48 часов на магнитной мешалке с установленными 80 оборотами в минуту (Фиг. 4). Клеточные органоиды/сфероиды состоят из кластеров клеток, размеры которых варьируются от 50-125 мкМ. Количество клеток в органоиде может варьироваться в зависимости от типа клеток и размера предварительной культуры, полученной на вращающемся культуральном матрасе. Органоид/сфероиды были сформированы из SRC как крысы, так и человека, и экспрессировали эпителиальный фенотип канальцев (Фиг. 5).
Функция органоида и генез канальцев
[00181] Способность SRC формировать канальцы может быть применена для оценки активности NKA. Этот анализ был применен к органоидам SRC, культивированных в смеси коллагена 1/коллагена IV желатина в соотношении 50:50 в 3D. При иммунофлуоресцентном окрашивании культивированные органоиды, полученные канальцы продолжают экспрессировать эпителиальный фенотип (Фиг. 6).
Органоид плюс
[00182] Способность SRC формировать самогенерируемые сфероиды может оказаться полезной при применении комбинации других типов клеток. Генез канальцев может быть усилен при добавлении компонента сосудистой или стволовой клетки. При добавлении выбранной клеточной популяции в культуру с популяцией SRC в течение периода формирования органоида, функциональный блок может быть сформирован с повторами ключевых клеточных сигнальных путей, активируемых при возникновении регенеративых эффектов. Примеры таких межклеточных взаимодействий включают, но не ограничиваются ими, эпителиальные-мезенхимальные сигнальные явления, известные своей ключевой ролью в органогенезе (см. Basu & Ludlow 2012, Developmental engineering the kidney-leveraging morphogenic principles for renal regeneration. Birth Defects Research Part C 96:30-38). Параллельно формированию SRC с помощью стандартных процедур, линия эндотелиальных клеток (ЭКПВЧ) использовалась в качестве примера комбинации с органоидом(+). Восемьдесят миллионов SRC были помечены мембранным красителем (красная метка Invitrogen DiL) и добавлены к 20 миллионам ЭКПВЧ, меченных мембранным красителем другого цвета (зеленая метка Invitrogen DiO ), в 100 мл среды RCGM на вращающиеся культуральные матрасы вместимостью 125 мл при 80 оборотах в минуту на 48 часов (Фиг. 7). Взятая отдельно популяция органоида SRC также выступала в качестве контроля. После формирования органоидов, для обеспечения способности к образованию канальцев с наличием и без сопутствующей потенциальной васкуляризации проводится анализ генеза канальцев in vitro в гелях Col I/IV 3D (Фиг. 8).
Пример 3 - Характеристика/биораспределение органоидов SRC в моделях заболевания почек у грызунов
[00183] Кратковременное исследование ZSF1, оценивающее биораспределение и клеточное сохранение органоидов, меченных SPIO, в течение 48 ч. Шести крысам ZSF1 в возрасте 40+ недель и старше в паренхиму вводили клетки, меченые SPIO Родамином в количестве 2.5x106 (что составляет примерно 25000 самогенерируемых органоидов в PBS) при концентрации 50x106/мл в левом каудальном полюсе. (Фигура 9.) Трое животных были взяты для исследования с интервалом 24 ч и 48 после имплантации. Почки оценивались с помощью МРИ и гистологической характеристики с применением способа окрашивания прусской синей лазурью и H&E для анализа сохранения и биораспределения клеток (Фиг. 10 и 11).
Результаты
[00184] Органоиды легко поддавались мечению и прослеживались по пути целевой доставки. Обработка органоидом хорошо переносится, не вызывая каких-либо морфологических изменений в отделах канальцев или клубочков. В почечном корковом веществе левой почки (внутри/между канальцами) часто наблюдались мультифокальные кластеры эпителоидных клеток (с положительным окрашиванием прусской синей лазурью) через 24 часа после введения и, в меньшей степени, через 48 часов.
Пример 4 - Исследования in vivo, которые демонстрируют терапевтическую эффективность органоидов, полученных из SRC + и SRC/SRC+. Исследования на грызунах с ХЗП (5/6 нефректомия) с нарушенным иммунитетом.
[00185] Терапевтическая эффективность органоидов, полученных из человеческих SRC+ и SRC/SRC+, была оценена с использованием 5/6-нефрэктомической модели хронического заболевания почек в грызунов с нарушенным иммунитетом (NIHRNU (без иммунитета); крысы без тимуса). Диагностирование патологического состояния, способы терапевтического вмешательства и клиническая оценка терапевтического ответа соответствовали описанным ранее (Genheimer et al., 2012. Molecular characterization of the regenerative response induced by intrarenal transplantation of selected renal cells in rodent model of chronic kidney disease. Cells Tissues Organs 196: 374-84).
[00186] Изоляция и отбор клеток. Человеческие почечные клетки из биоптата изолировали и увеличивали их количество, как описано в Presnell (2011). Клетки субкультивировали и криоконсервировали после пассажа 2 в буфере для криоконсервации (80% HTS/10%DMSO/10% FBS) при концентрации (20 x 106клеток/мл/флакон) и скорости замораживания -1°С/мин до -80°С, а затем переносили в криогенный аппарат на базе жидкого азота для длительного хранения. После криоконсервации клетки быстро размораживали при 37°С с целью оценки восстановления и жизнеспособности с использованием стандартного способа вытеснения трипанового синего. Затем клетки высевали в резервуары для тканевых культур с плотностью 3000 клеток/см2и культивировали в течение 4 дней в нормоксических условиях (21% O2/ 5% CO2/ 37°C) в среде для роста почечных клеток. По истечении 4 дней культуральную среду меняли, а культуры инкубировали в течение ночи в среде з низким содержанием кислорода (2% O2/ 5% CO2/ 37°C) перед сбором клеток и отбором SRC с помощью разделения градиентом плотности. Культуры эндотелиальных клеток пупочной вены человека (ЭКПВЧ) (Lonza 2389, CAT№ CC2517) разрастались от раннего пассажа после криоконсервации до пассажа 3 в среде, полностью обогащенной EGM2. Клетки собирали и оценивали их жизнеспособность с использованием стандартного способа вытеснения трипанового синего.
[00187] Образование органоида. Культуры органоидов создавали: 1) ресуспендированием человеческих SRC и ЭКПВЧ в концентрации 2 x 106 клеток/мл в их соответствующих средах; 2) комбинацией равных объемов каждого клеточного препарата клеток 25 мл (50 x 106 клеток/мл) на вращающемся культуральном матрасе объемом 125 мл (Corning). 25 мл каждой среды добавляли к комбинированной культуре на культуральные матрасы для получения конечной концентрации клеток 1 x 106 клеток/мл в 100 мл. Культуральные матрасы помещали на магнитную мешалку в инкубатор при скорости 80 оборотов в минуту и культивировали в течение 24 часов.
[00188] Испытуемые образцы. Дозу органоида регулировали таким образом, чтобы около (2-5 x 106клеток/50 мкл) приходилось на введение в одну почку крысы. Численность органоидов корректировали с вышеприведенной концентрацией в большем объеме 0,5 мл DPBS с целью подсчета каких-либо потерь во время транспортировки. Дополнительная пробирка присылалась в качестве дубликата. Дозы были присланы через FEDEX с целью имплантации средства в две микроцентрифужные пробирки вместимостью 0,5 мл с помощью кубического отправителя CREDO при 4-8°С.
[00189] Введение испытуемого образца. Доступ к остаточной левой почке получали через разрез левой боковой поверхности. Перед введением органоиды осторожно ресуспендировали нажатием или щелканием по основанию пробирки (не встряхивая). Органоиды аспирировали в шприц с помощью тупоконечной иглы 18G. Иглу затем заменяли на режущую иглу 23G для введения. Направленное введение осуществляли путем инъекции 50 мкл в кортико-медуллярную область почек. Интактные контрольные животные оставались без лечения и не подвергались процедуре.
[00190] Процедуры модели RKM. Крысы NIHRNU мужского пола в возрасте 8-12 недель (с приблизительным средним весом 200 г) подвергались 2-этапной процедуре нефрэктомии следующим образом. У каждого отдельного животного удаляли и взвешивали правую почку; в течение 1 недели проходил восстановительный период, а затем резецировали ткань из каудальных и краниальных полюсов левой почки, которую также взвешивали. Перед началом исследований был 2-3-недельный период восстановления и адаптации. После периода адаптации, в течение последующих 2 недель собирали и анализировали кровь и мочу. Последовательный отбор проб производился каждые 2 недели после этого. Все грызуны получали коммерчески доступный корм, вода была предоставлена неограниченно.
[00191] После нефрэктомии у животных контролировали наличие каких-либо признаков увеличения белка в моче/соотношения белок-креатинин в моче (UPC) и на 12 неделе после нефрэктомии вводили человеческие органоиды. В таблице 5 ниже приводится обзор исследования.
Таблица 5. Схема исследования
Измерения. Вес тела (г) контролировали два раза в неделю). Сывороточные биохимические и гематологические исследования проводились на протяжении всего исследования с периодичностью два раза в неделю. Общий анализ мочи проводили два раза в неделю. При запланированном вскрытии для изучения животных проводился макропатологический анализ, остаточную почку иссекали и фиксировали, а останки животных фиксировали в формалине. Всех животных и ткани собирали по мере необходимости, взвешивали, измеряли и подготавливали для гистологической обработки. Использовались способы, применяемые для гистологических оценок почек. СМП - снижение массы почек.
Результаты.
[00192] Эффективность человеческого NKO была продемонстрирована в модели почечной недостаточности бестимусных крыс.
Обзор модели RKM
[00193] Прогрессирование заболевания в бестимусной модели со СМП согласуется с ранее описанными нефрэктомическими моделями и последствиями, связанными с ХЗП, включая нарушения белкового обмена в почках, азотемию, гиперхолестеринемию, анемию и развивающуюся уремию. В результате анализа нефрэктомической модели NIHRNU относительно достигнутого патологического состояния отмечалась ее чувствительность к количеству резецированной почечной ткани при уменьшении массы, а у животных, вовлеченных в исследование, наблюдалась медленно прогрессирующая начальная стадия патологического состояния, подтвержденная на основании клинического мониторинга патологии и конечных гистологических оценок.
Влияние прототипа NKO на клиническую патологию при жизни
[00194] Оценка клинической патологии, относящейся к функции почек, включала анализ предварительного лечения и сравнение в парном режиме, используемое от начала и до конца исследования. Как представлено в таблице ниже, в результате этого сравнения в контрольных животных, не получавших лечения, отмечались изменения, соответствующие прогрессированию заболевания после 4 месяцяца исследования. Значительные различия были отмечены в парных исследованиях АМК (BUN), гематокрита (Hct), гемоглобина (Hgb), эритроцитов (RBC), лейкоцитов (WBC), сывороточного холестерина (sChol), сывороточного белка (sProt), сывороточного альбумина (sAlb), белка в моче (uPro), соотношения белок-креатинин в моче (UPC) и концентрации мочи (spGrav). Изменения этих маркеров характерны для начальной стадии ХЗП и свидетельствуют о снижении почечной функции, что еще может привести к острой азотемии, терминальной стадии недостаточности канальцевой фильтрации/концентрации и фосфотемии. У животных, получавших NKO, изменения АМК, гематокрита, гемоглобина, лейкоцитов и концентрации мочи были не значительными, что может быть спрогнозировано на основании результатов исследования контрольных животных, не получавших лечения (см. Таблицу 6 ниже).
Таблица 6. Клинические оценки в группах лечения до и после лечения.
*эритроциты в этом исследовании не будут отражать ответную реакцию, опосредованную Т-клетками, поскольку эти животные атимические
Гистологический обзор почек из модели
[00195] Гистопатологическое исследование продемонстрировало, что у контрольных животных нефропатия развивалась с прогрессированием до легкой степени, выявленной при умерщвлении животного по завершении исследования.
[00196] Выявленные изменения, связанные с поражением, по своей природе были первично канальцевыми с наличием белковых цилиндров, атрофией и дилятацией, как правило, легкой степени тяжести. Канальцевая базофилия и фиброз часто определялись минимальными, а интерстициальное воспаление, как правило, минимальным или вообще не регистрировалось. Изменения клубочков характеризовались минимальной степенью тяжести.
[00197] Капсульный фиброз/воспаление, как правило, выявлялся лишь в минимальной степени тяжести и характеризовался немассивным воспалительным клеточным составом; при неполноценной иммунной системе в бестимусных крыс реакция могла быть ослаблена. Минерализация и лимфоцитарная инфильтрация характеризовались низкой частотой регистрации и легкой степенью выраженности в животных серии 1. У лабораторных крыс наблюдались единичные случаи очаговой минерализации.
[00198] Других значимых различий между группой, пролеченной NKO, и группой, не получавшей лечения, не выявлено.
Таблица 7.
Влияние NKO на выживаемость
[00199] Все животные (59% СМП) дожили до конца исследования (119 дней после Tx и 204 дня после нефрэктомии), поэтому четко выраженного эффекта на выживаемость при лечении NKO не обнаружено.
Приживление человеческого NKO, обнаруженного способами окрашивания в электронно-оптической системе
[00200] Поскольку в этой модели предусмотрено ксеногенное применение человеческого препарата, в результате использования человеческих антител, идентифицирующих клетки, стало возможным отслеживание человеческих клеток в почках крыс. Окрашивание человеческого HLA1 на фоне выявленных почечных клеток крысы RKM через 4 месяца после лечения (см. Фигуру 12). Тот факт, что выявление окрашивания согласуется с приживлением человеческих клеток, был подтвержден двумя независимыми экспертами. Обычно 1 или 2 клетки определялись в одном из четырех срезов, окрашенных для каждого животного, и были инкорпорированы в канальцы, хотя один кластер определялся в интерстиции.
Выводы.
• Введение органоида (NKO) смягчало значимые изменения, связанные с прогрессированием заболевания почек у контрольных животных, а в моделях болезни на значения учитываемых показателей осуществляли влияния сингенные/аутологичные введения NKA.
• Осуществляемые оценки согласовывались с наблюдаемыми показателями при сингенных/аутологичных введениях NKA в моделях болезни - показателями анемии (гематокрит, гемоглобин, эритроциты), воспалительного процесса (лейкоциты), концентрации мочи и, возможно, азотемии (АМК).
• Человеческие клетки в очень малых количествах обнаруживались примерно на 4 месяце после лечения прототипом NKO.
• Нефрэктомия у крыс, не имеющих иммунитета (в среднем 59% СМП), приводила к начальной стадии почечной недостаточности и хронически прогрессирующей почечной недостаточности, характеризующейся развитием анемии, протеинурии, дислипидемии и возможными признаками ранней стадии азотемии.
• Все животные выжили до завершения исследования.
• Процедуры, используемые для введения человеческих органоидов в модели RKM, хорошо переносились.
Пример 5 - Изолирование и характеристика биочувствительности клеток почек
[00201] Случай идиопатического прогрессирующего хронического заболевания почек (ХЗП) с анемией у взрослого кабана (Sus scrofa) обеспечил свежую ткань больной почки для оценки клеточного состава и характеристик с прямым сравнением с почечной тканью здорового кабана соответствующего возраста. Результаты гистологического исследования почечной ткани во время отбора подтвердили наличие заболевания почек, характеризующееся тяжелым хроническим диффузным интерстициальным фиброзом и серповидным гломерулонефритом с мультифокальным фиброзом. Результаты биохимического исследования подтвердили наличие азотемии (повышение азота мочевины в крови и креатинина в сыворотке), и анемии легкой степени (небольшое снижение уровней гематокрита и гемоглобина). Клетки изолировали, увеличивали в количестве и оценивали как пораженную, так и здоровую почечную ткань. Как показано на Фигуре 1, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме), трихромная окраска Гомори в пораженной ткани почек выделяет светлые участки фиброза (синее окрашивание показано стрелками) по сравнению со здоровой почечной тканью. Функциональные клетки почечного канальца, экспрессирующие кубулин:мегалин и способные к рецептор-опосредованному транспорту альбумина, размножали как из здоровой, так и пораженной почечной ткани. Эритропоэтин (ЭПО)-экспрессирующие клетки были в наличии в культурах и сохранялись при многочисленных пассажах и циклах замораживания/оттаивания. Кроме того, молекулярный анализ подтвердил, что ЭПО-экспрессирующие клетки как из здоровой, так и пораженной ткани реагировали на условия гипоксии in vitro HIF1α-управляемой индукцией ЭПО и других генов-мишеней, регулируемых гипоксией, включая VEGF. Клетки были изолированы из почечной ткани свиньи ферментативным расщеплением с помощью коллагеназы + диспазы, а также были изолированы в отдельных экспериментах с применением простого механического расщепления и культуры эксплантов. При пассаже 2, клеточные культуры, полученные из эксплантов и содержащие ЭПО-экспрессирующие клетки, подвергали как атмосферным (21%), так и различным гипоксическим (<5%) условиям культивирования с целью определения, воздействует ли высшая степени гипоксии на активацию экспрессии гена ЭПО. Как отмечалось в культурах грызунов (см. Пример 3), у здоровой свиньи проявлялась кислородзависимая экспрессия и регуляция гена ЭПО. Неожиданно, несмотря на уремическическое/анемическое состояние свиньи с ХЗП (гематокрит <34, креатинин > 9,0), ЭПO-экспрессирующие клетки беспрепятственно изолировали и размножали из ткани, а экспрессия гена ЭПО оставалась регулируемой гипоксией, как показано на Фигуре 2, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме). Как показано на Фигуре 3, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме), клетки в размножающихся культурах демонстрировали способность к самоорганизации в структуры, подобные канальцам. Как показано на Фигуре 4, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме), наличие функциональных клеток почечного канальца в культуре (при пассаже 3) было подтверждено наблюдением, рецептор-опосредованного поглощение FITC-конъюгированного альбумина культивируемыми клетками. Зеленые точки (указанные тонкими белыми стрелками) представляют эндоцитированный флуоресцеин-конъюгированный альбумин, который является опосредуемый канальцевыми клеточно-специфическими рецепторами, мегалином и кубилином, указывающими на реабсорбцию белка функциональными клетками почечного канальца. Синее окрашивание (указано толстыми белыми стрелками) - это ядра, окрашенные красителем Хехст. Взятые в совокупности, эти данные свидетельствуют о том, что функциональные канальцевые и эндокринные клетки могут быть изолированы и размножены из почечных тканей свиньи, даже из тех почечных тканей, которые были сильно поражены ХЗП. Кроме того, эти данные содействуют разработке терапевтических средств на основе аутологичных клеток для лечения ХЗП.
[00202] Кроме того, ЭПО-продуцирующие клетки были ферментативно изолированы из почки здорового взрослого человека (как описано выше в Примере 1). Как показано на Фигуре 5, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме), процедура изолирования приводила к более связанной экспрессии ЭПО после изолирования по сравнению с первичной тканью. Как показано на Фигуре 6, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме), существует возможность поддерживать человеческие ЭПО-продуцирующие клетки в культуре с сохранением экспрессии гена ЭПО. Человеческие клетки культивировали/размножали на пластике, обработанном обычной тканевой культурой, или пластике, покрытом определенным внеклеточным матриксом, таким как, например, фибронектин или коллаген, и все они были созданы с целью поддержки супрессии ЭПО в течение продолжительного периода времени.
Пример 6 - Изолирование и обогащение специфических биореакивных почечных клеток
[00203] Изолирование почечных клеток: Описывая кратко, партии из 10 почек 2-недельных самцов крыс линии Lewis были получены от коммерческих поставщиков (Hilltop Lab Animals Inc.) и погружены на ночь в консервационную среду Viaspan при температуре около 4°C. Все этапы, описанные в настоящем документе, были проведены в шкафу биологической безопасности (ШББ) с целью сохранения стерильности. Почки 3 раза промывали в сбалансированном солевом растворе Хэнкса (HBSS), чтобы вымыть консервационную среду Viaspan. После третьего промывания удаляли сохранившиеся капсулы почки, а также всю сохранившуюся стромальную ткань. Также удаляли основную чашечку с помощью способов микрорассечения. Затем почки мелко измельчали в суспензию, используя стерильный скальпель. После этого суспензию переносили в коническую центрифужную пробирку объемом 50 мл и взвешивали. Небольшой образец отбирали для получения РНК и помещали в стерильную микроцентрифужную пробирку объемом 1,5 мл, не содержащую РНКазы, и замораживали в жидком азоте. После замораживания, перед анализом образец переносили в морозильную камеру -80 °C. Вес ткани 10 ювенильных почек составил около 1 грамма. Учитывая вес партии, объем расщепляющей среды доводили до 20 мл расщепляющей среды на 1 г ткани. Расщепляющий буфер для этой процедуры содержал 4 единицы диспазы 1 (Stem Cell Tech) в HBSS, 300 ед/мл коллагеназы типа IV (Worthington) с 5 мМ CaCl2(Sigma).
[00204] Соответствующий объем предварительно нагретого расщепляющего буфера добавляли в пробирку, которую затем герметически закрывали и помещали на качалку в инкубатор при 37°C на 20 минут. Этот первый этап расщепления устраняет большое количество эритроцитов и усиливает расщепление оставшейся ткани. Через 20 минут пробирку извлекали и помещали в ШББ. Ткани давали возможность осесть на дно пробирки, а затем удаляли супернатант. В оставшиеся ткани затем добавляли свежий расщепляющий буфер в объеме, равном начальному. Пробирку вновь помещали на качалку в инкубатор при 37°C еще на 30 минут.
[00205] Через 30 минут смесь для расщепления пипетировали через фильтр для клеток с размером пор 70 мкм (BD Falcon) в эквивалентный объем нейтрализирующего буфера (DMEM вес/ 10% FBS) для остановки реакции расщепления. Затем суспензию клеток промывали центрифугированием при 300 х г в течение 5 мин. После центрифугирования осадок затем ресуспендировали в среде 20 мл KSFM, а образец отбирали для подсчета клеток и оценки жизнеспособности с помощью вытеснения трипанового синего. После подсчета количества клеток, 1 миллион клеток отбирали для образца РНК, промывали в PBS и мгновенно замораживали в жидком азоте. Объем оставшейся клеточной суспензии доводили до 50 мл в среде KSFM и снова промывали центрифугированием при 300 х г в течение 5 минут. После промывания клеточный осадок повторно суспендировали в концентрации 15 миллионов клеток на мл KSFM.
[00206] Пять миллилитров суспензии клеток почки затем добавляли к 5 мл 30% (масса/объем) Optiprep® в конические центрифужные пробирки объемом 15 мл (BD Falcon) и смешивали с помощью переворачивания 6 раз. Таким образом формировали конечную смесь 15% (масса/объем) OptiPrep®. После переворачивания в пробирки осторожно наслаивали 1 мл PBS. Пробирки непрерывно центрифугировали при 800 х г в течение 15 минут. После центрифугирования пробирки вынимали, и в верхней части градиента смешивания формировалась группа клеток. Определялся также осадок, содержащий эритроциты, омертвевшие клетки и небольшую популяцию живых клеток, которая включала отдельные клетки с меньшей гранулярностью, отдельные ЭПО-продуцирующие клетки, отдельные клетки почечного канальца и отдельные эндотелиальные клетки. Группу тщательно удаляли с помощью пипетки и переносили в другую коническую пробирку объемом 15 мл. Градиентную среду удаляли путем аспирации, а осадок собирали путем повторного суспендирования в 1 мл KSFM. Групповые клетки и осадочные клетки затем рекомбинировали и ресуспендировали по меньшей мере в 3 разведениях собранного объема группы с использованием KSFM и промывали центрифугированием при 300 х г в течение 5 минут. После промывания клетки ресуспендировали в 20 мл KSFM и отбирали образец для подсчета клеток. После подсчета количества клеток с помощью вытеснения трипанового синего, 1 миллион клеток отбирали для образца РНК, промывали в PBS и мгновенно замораживали в жидком азоте.
[00207] Предкультуральная "Очистка" для повышения жизнеспособности и эффективности культуры специфических биологически активных клеток почек с использованием разделения градиентом плотности: Для получения чистой, жизнеспособной популяции клеток для культивирования, вначале формировали суспензию клеток, как описано выше в разделе "Изоляция почечных клеток". Как опциональный этап и в качестве способа очистки первичного препарата, в общей сложности до 100 миллионов клеток, суспендированных в стерильном изотоническом буфере, тщательно смешивали с эквивалентным объемом 30% Optiprep® в пропорции 1:1, приготовленным при комнатной температуре из 60% (масса/объем) маточного раствора иодиксанола (таким образом, получая конечный 15% (масса/объем) раствор OptiPrep) и тщательно перемешивали с помощью переворачивания шесть раз. После смешивания, 1 мл буфера PBS осторожно наслаивали на верхнюю часть смешанной клеточной суспензии. Затем градиентные пробирки осторожно загружали в центрифугу, обеспечивая соответствующий баланс. Градиентные пробирки непрерывно центрифугировали при 800 х г в течение 5 минут при 25˚C. Очищенную клеточную популяцию (содержащую жизнеспособный и функциональный собирающий проток, канальцевые, эндокринные, клубочковые и сосудистые клетки) сегментировали между 6% и 8% (масса/объем) Optiprep®, что соответствует плотности между 1,025 - 1.045 г/мл. Другие клетки и дебрис осаждались на дно пробирки.
[00208] Культура почечных клеток: Комбинированную группу клеток и осадок затем высевали на тройные культуральные матрасы, обработанные тканевой культурой (Nunc T500) или эквивалентом, при концентрации клеток 30000 клеток на см2 в 150 мл смеси DMEM (с высоким содержанием глюкозы)/KSFM в соотношении 50:50, содержащей 5% (объем/объем) FBS, 2,5 мкг EGF, 25 мг BPE, 1 x ITS (среда с добавлением инсулина/трансферрина/селенита натрия) с антибиотиком/противогрибковым средством. Клетки культивировали в инкубаторе, увлажненном 5% CO2, в течение 2-3 дней, обеспечивая 21% -ный уровень атмосферного кислорода для клеток. По истечении двух дней культуральную среду меняли, а культуры помещали в среду с 2%-ным уровнем кислорода, созданную с помощью мультигазового (CO2/азот) увлажненного инкубатора (Sanyo), на 24 часа. После 24 ч инкубации клетки промывали 60 мл 1 x PBS и затем удаляли с использованием 40 мл 0,25% (масса/объем) трипсина/EDTA (Gibco). После удаления клеточную суспензию нейтрализовали эквивалентным объемом KSFM, содержащим 10% FBS. Клетки затем промывали центрифугированием 300 x г в течение 10 минут. После промывания клетки ресуспендировали в 20 мл KSFM, переносили в коническую пробирку объемом 50 мл и отбирали образец для подсчета клеток. После подсчета количества жизнеспособных клеток с помощью вытеснения трипанового синего, 1 миллион клеток отбирали для образца РНК, промывали в PBS и мгновенно замораживали в жидком азоте. Клетки снова промывали в PBS и отбирали с помощью центрифугирования при 300 g в течение 5 минут. Промытый клеточный осадок клеток ресуспендировали в KSFM при концентрации 37,5 миллионов клеток/мл.
[00209] Обогащение специфических биологически активных клеток почек с использованием разделения ступенчатым градиентом плотности: Культивируемые почечные клетки, состоящие преимущественно из клеток почечных канальцев, но содержащие небольшие субпопуляции клеток других типов (собирающего протока, клубочковые, сосудистые и эндокринные), разделяли на составные субпопуляции с использованием ступенчатого градиента плотности, полученного из нескольких концентраций масса/объем иодиксанола (Optiрrep). Культуры помещали в гипоксическую среду на 24 часа до сбора и применения для градиента. Ступенчатый градиент создавали наслоением четырех сред с различной плотностью до верхней части стерильной конической пробирки объемом 15 мл, помещая раствор с самой высокой плотностью на дно и наслаивая среды одна на другую таким образом, чтобы наименее плотный раствор был на самом верху. Клетки применяли к верхней части ступенчатого градиента и центрифугировали, в результате чего популяция разделялась на несколько групп в зависимости от размера и гранулярности.
[00210] Описывая кратко, плотности 7, 11, 13 и 16% Optiprep® (60% иодиксанола(масса/объем)) получали с помощью среды KFSM в качестве разбавителей. Например: 50 мл 7% (масса/объем) Optiprep®, 5,83 мл 60% маточного раствора (масса/объем) иодиксанола добавляли в 44.17 мл среды KSFM и хорошо перемешивали с помощью переворачивания. Перистальтический насос (Master Flex L/S), оснащенный стерильной трубкой L/S 16 Tygon, соединенной со стерильными капиллярными пробирками, устанавливали на скорость потока 2 мл в минуту, и 2 мл каждого из четырех растворов помещали в стерильную коническую пробирку объемом 15 мл, начиная с 16% раствора, затем - 13% раствор, 11% раствор и 7% раствор. Наконец, 2 мл клеточной суспензии, содержащей 75 миллионов культивированных почечных клеток грызунов, помещали в самую верхнюю часть ступенчатого градиента (суспензии, которые были получены, как описано выше в разделе "Культура почечных клеток"). Когда насос начнет доставлять градиентные растворы в пробирку, важно помнить о необходимости принять меры, позволяющие текучей среде протекать медленно вниз по стенке пробирки под углом 45° для гарантии того, что между каждым слоем градиента сформируется надлежащая граница раздела. Ступенчатые градиенты, наполненные клетками, затем непрерывно центрифугировали при 800 х г в течение 20 минут. После центрифугирования пробирки тщательно извлекали таким образом, чтобы не нарушить каждую границу раздела. Получали пять различных клеточных фракций (4 группы и осадок) (В1 - В4 + осадок) (Фигура 26, левая коническая пробирка). Каждую фракцию собирали с использованием либо стерильной одноразовой шаровой пипетки, либо пипетки 5 мл, и описывали фенотипические и функциональные характеристики (см. Пример 10, Presnell et al. WO/2010/056328). В то время, когда суспензии клеток почки грызунов подвергаются фракционированию ступенчатым градиентом сразу после изолирования, фракция, обогащенная клетками почечного канальца (и содержащая несколько клеток из собирающего протока), сегментируется по плотности в диапазоне 1,062 - 1,088 г/мл. В противоположность этому, когда разделение в градиенте плотности проводили после культивирования ex vivo, фракция, обогащенная клетками почечного канальца (и содержащая несколько клеток из собирающего протока), сегментировалась по плотности в диапазоне 1,051 - 1,062 г/мл. Аналогичным образом, когда суспензии клеток почки грызунов подвергаются фракционированию ступенчатым градиентом сразу после изолирования, фракция, обогащенная ЭПО-продуцирующими клетками, клубочковыми подоцитами и сосудистыми клетками ("В4"), отделяется при плотности в диапазоне 1,025 - 1,035 г/мл. В противоположность этому, когда разделение в градиенте плотности проводили после культивирования ex vivo, фракция, обогащенная ЭПО-продуцирующими клетками, клубочковыми подоцитами и сосудистыми клетками ("В4"), отделялась при плотности в диапазоне 1,073 - 1,091 г/мл. Важно отметить, что разделение клеток как фракции "B2", так и "B4" после культивирования улучшалось в результате воздействия на культуры (в течение периода от около 1 часа до около 24 часов) гипоксических условий культивирования (гипоксия определялась как уровень кислорода <21% (атмосферный) перед сбором и процедурами ступенчатого градиента (дополнительные подробности относительно эффектов гипоксии и группового распределения приведены в Примере 7).
[00211] Каждую группу промывали путем разбавления 3-кратным объемом KSFM, тщательно перемешивали и центрифугировали в течение 5 минут при 300 х г. Осадок повторно суспендировали в 2 мл KSFM и подсчитывали количество жизнеспособных клеток с использованием вытеснения трипанового синего и гемоцитометра. 1 миллион клеток отбирали для образца РНК, промывали в PBS и мгновенно замораживали в жидком азоте. Клетки из В2 и В4, используемые исследований трансплантации в самок крыс с уремическим синдромом и анемией, получали с помощью двухэтапной процедуры 5/6 нефрэктомии у Charles River Laboratories. Характеристики B4 подтверждались количественной ПЦР в реальном времени, включая экспрессию эритропоэтина и VEGF, регулируемую кислородом, экспрессию клубочковых маркеров (нефрин, подоцин) и экспрессию сосудистых маркеров (РЕСАМ). Фенотип фракции "B2" подтверждался с помощью экспрессии Е-кадгерина, N-кадгерина и аквапорина-2. См. Фигуры 49a и 49b, Presnell et al. WO/2010/056328.
[00212] Таким образом, использование стратегии ступенчатого градиента позволяет не только обогатить редкую популяцию ЭПО-продуцирующих клеток (B4), но также разработать способ получения относительно обогащенных фракций функциональных клеток почечных канальцев (B2) (см. Фигуры 50 и 51, Presnell et al. WO/2010/056328). Стратегия ступенчатого градиента также позволяет отделять ЭПО-продуцирующие клетки и клетки почечного канальца от эритроцитов, клеточного дебриса и других потенциально нежелательных типов клеток, таких как крупные клеточные агрегаты и определенные типы иммунных клеток.
[00213] Для проведения процедуры ступенчатого градиента может понадобиться применение настройки к определенным используемым плотностям с целью обеспечения надлежащего разделения клеточных компонентов. Предпочтительный подход к настройке градиента включает 1) обеспечение функционирования непрерывного градиента плотности от высокой плотности в нижней части градиента (16-21% OptiPrep, например) к относительно низкой плотности в самой верхней части градиента (5-10%, например). Непрерывные градиенты могут быть приготовлены с помощью любого стандартного градиента плотности раствора (фиколл, перколл, сахароза, иодиксанол) согласно стандартным методикам (Axis Shield). Клетки, представляющие интерес, помещают в непрерывный градиент и непрерывно центрифугируют при 800 x г в течение 20 минут. Клетки аналогичного размера и гранулярности обычно разделяются в градиентах вместе, в результате чего может быть измерено относительное положение в градиенте и удельный вес раствора при таком положении. Таким образом, в дальнейшем, может быть получен определенный ступенчатый градиент, который фокусирует изолирование отдельных клеточных популяций на основании их способности изменять направление градиента плотности в определенных условиях. Потребность в такой оптимизации может возникнуть при изолировании клеток из пораженной ткани по сравнению со здоровой, или при выделении специфических клеток из различных видов организмов. Например, оптимизация проводилась на культурах почечных клеток собак и человека с целью гарантирования того, что специфические субпопуляции В2 и В4, которые были определены у крысы, могут быть выделены из других видов. Оптимальный градиент для изолирования субпопуляций В2 и В4 у грызунов состоит из (масса/объем) 7%, 11%, 13% и 16% Optiрrep. Оптимальный градиент для изолирования субпопуляций В2 и В4 у собак состоит из (масса/объем) 7%, 10%, 11% и 16% Optiрrep. Оптимальный градиент для изолирования субпопуляций В2 и В4 у человека состоит из (масса/объем) 7%, 9%, 11%, 16%. Так, диапазон плотности для локализации В2 и В4 культивированных почечных клеток грызунов, собак и человека приведен в Таблице 8.
Таблица 8. Видовые диапазоны плотности.
Пример 7 - Влияние культивирования при низком содержании кислорода, предшествующего градиенту, на групповое разделение, состав и экспрессию генов.
[00214] Для определения влияния кислородных условий на разделение и состав прототипов В2 и В4, неопочечные препараты клеток от различных видов подвергались влиянию различных кислородных условий перед ступенчатым градиентом. Клеточный препарат грызуна, дополненный неопочкой (NKA) (RK069), был создан с использованием стандартных процедур изолирования крысиных клеток и инициации культуры, как описано выше. Все культуральные матрасы культивировали в течение 2-3 дней в условиях 21% (атмосферного) кислорода. Среду меняли, половину культуральных матрасов затем переносили в инкубатор, имеющий характеристику контроля уровня кислорода, и установленный на поддержание его 2% уровня, в то время как остальные культуральные матрасы выдерживали в условиях 21% уровня кислорода в течение дополнительных 24 часов. После этого из каждого набора условий собирали клетки с использованием стандартных процедур ферментативного сбора, описанных выше. Ступенчатые градиенты готовили согласно стандартным процедурам, а "нормоксические" (21% кислорода) и "гипоксические" (2% кислорода) культуры собирали отдельно и задействовали параллельно для аналогичных ступенчатых градиентов. (Фигура 27.) Несмотря на то, что 4 группы и осадок получили при обоих условиях, разделения клеток по градиенту отличалось в зависимости от содержания кислорода (21% или 2%) при культивации партий (Таблица 3). В частности, при гипоксических условиях полученное количество B2 было увеличено, с сопутствующим снижением B3. Кроме того, экспрессия B4-специфических генов (таких как эритропоэтин) определялась усиленной в результате градиента, сформированного из клеток, культивированных в гипоксических условиях (Фигура 73, Presnell et al. WO/2010/056328).
[00215] Клеточный препарат NKA собаки (DK008) был создан с использованием стандартных процедур для изолирования и культивирования клеток собаки (аналогично процедурам изолирования и культивирования у грызунов), как описано выше. Все культуральные матрасы культивировали в течение 4 дней в условиях 21% (атмосферного) кислорода, затем полукомплект культуральных матрасов переносили в гипоксические условия (2%) на 24 часа, а второй полукомплект культуральных матрасов содержали при 21%. Затем все комплекты культуральных матрасов собирали и подвергали идентичным ступенчатым градиентам (Фигура 28). Аналогично результатам у крыс (Пример 6), клетки собак, культивированные в гипоксических условиях, распределялись по градиенту неодинаково по сравнению с клетками собак, культивируемыми при атмосферном уровне кислорода (Таблица 9). Опять же, полученное количество B2 увеличивалось при условии гипоксического воздействия перед градиентом, наряду с сопутствующим снижением разделения в B3.
Таблица 9.
[00216] Приведенные выше данные демонстрируют, что предградиентное воздействие гипоксией улучшает состав В2, а также разделение специфических специализированных клеток (эритропоэтин-продуцирующих клеток, сосудистых клеток и клубочковых клеток) в B4. Таким образом, гипоксическая культура с последующим разделением в градиенте плотности, как описано выше, является эффективным способом получения клеточных популяций "B2"' и "B4" среди видов.
Пример 8 - Изолирование канальцевых/клубочковых клеток из человеческой почки
[00217] Канальцевые и клубочковые клетки изолировали и размножали из непораженной почечной ткани человека с помощью ферментных способов изолирования, описанных в общедоступной литературе. До градиентного способа, описанного выше, фракцию канальцевых клеток обогащали ex vivo и после культивирования. Как показано на Фигуре 68, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме), фенотипические признаки поддерживались при изолировании и размножении. Функция канальцевых клеток, оцененная с помощью поглощения меченного альбумина, также сохранялась после многократных пассажей и криоконсервации. Фигура 69, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме) показывает, что при культивировании популяции, обогащенной канальцевыми клетками, и популяции, обедненной канальцевыми клетками, в динамической культуре 3D, в популяции, обогащенной канальцевыми клетками, отмечалось явное усиление экспрессии маркера канальцев и кадгерина. Это подтверждает, что обогащение канальцевых клеток может быть обеспечено вне первичного обогащения, когда клетки культивируются в динамичной среде 3D. Аналогичные культивированные популяции почечных клеток, описанные выше в Примере 7, анализировали с помощью проточной цитометрии с целью изучения прямого рассеяния и бокового рассеяния. Небольшая, менее гранулированная популяция ЭПО-продуцирующих клеток была четко выраженной (8,15%) и разделялась путем позитивного отбора небольшой, менее гранулированной популяции с помощью сортировочной способности проточного цитометра (см. Фигуру 70, Presnell et al. WO/2010/056328 (включен в настоящий документ посредством ссылки в полном объеме)).
Пример 9 - Характеристика нефракционированной смеси почечных клеток, изолированных из образца пациента с аутоиммунным гломерулонефритом.
[00218] Нефракционированную смесь почечных клеток изолировали, как описано выше, из образца пациента с аутоиммунным гломерулонефритом. Для определения объективного генотипического состава специфических субпопуляций почечных клеток, изолированных и размноженных из почечной ткани, проводили количественный ПЦР-анализ в режиме реального времени (qRTPCR) (Brunskill et al., выше2008) с целью выявления среди клеточных субфракций дифференциальных моделей генной экспрессии, специфичной для определенного типа клеток и путей. Как показано в Таблице 6.1, Ilagan et al. PCT/US2011/036347, HK20 представляет собой образец пациента с аутоиммунным гломерулонефритом. Как показано в Таблице 6.2, Ilagan et al. PCT/US2011/036347, среди клеток, полученных из HK20, отсутствуют клетки клубочков, что определено с помощью qRTPCR.
Пример 11 – Обогащение/обеднение жизнеспособных типов почечных клеток с помощью сортировки флюоресцентно-активированных клеток (FACS).
[00219] Одна или более изолированных почечных клеток может быть обогащены и/или один или более специфических типов почечных клеток могут быть обеденены из изолированной первичной почечной ткани с помощью сортировки флюоресцентно-активированных клеток (FACS).
[00220] Реагенты: 70% этанол; промывочный буфер (PBS), 50:50 среда клеток почки (50% DMEM с высоким содержанием глюкозы): 50% кератиноцит-SFM; трипановый синий 0,4%; первичные антитела к целевой популяции почечных клеток, такие как CD31 к почечным эндотелиальным клеткам и нефрин - к клеткам почечных клубочков. Подобранные по изотипу специфические флуоресцентные вторичные антитела; окрашивающий буфер (0,05% BSA в PBS).
[00221] Процедура: После стандартных процедур очистки шкафа биологической безопасности (ШББ), из любых первичных изолированных или культивированных клеток культурального матраса, обработанного T500 T/C, может быть получена единичная клеточная суспензия почечных клеток, которую ресуспендируют в среду почечных клеток и помещают на лед. Клетки подсчитывают, а затем оценивают их жизнеспособность с использованием способа вытеснения трипанового синего. Для обогащения/обеднения почечных клеток, например, клубочковых клеток или эндотелиальных клеток из гетерогенной популяции, применяют по меньшей мере от 10 до 50 × 106 живых клеток с жизнеспособностью по меньшей мере 70%. Гетерогенную популяцию почечных клеток затем окрашивают первичным антителом, специфичным к целевому типу клеток при начальной концентрации 1мкг/0,1 мл окрашивающего буфера/1 x 106 клеток (титруют при необходимости). Целевое антитело может быть конъюгированным, например, CD31 РЕ (специфическое для почечных эндотелиальных клеток) или неконъюгированное, например, нефрин (специфическое для клеток почечных клубочков).
[00222] Клетки затем окрашивают в течение 30 минут на льду или при 4°С в защищенном от света месте. После 30 минут инкубации клетки промывают центрифугированием при 300 х г в течение 5 мин. Затем ресуспендируют осадок в PBS или окрашивающем буфере в зависимости от того, требуется ли конъюгированное изотип-специфическое вторичное антитело. Если клетки были помечены флуорохром-конъюгированным первичным антителом, клетки ресуспендировали в PBS: 2 мл на 10×107 клеток и приступали к процедуре FACS aria или эквивалентной сортировке клеток. Если клетки не были помечены флуорохром-конъюгированным первичным антителом, клетки затем помечали изотип-специфическим вторичным антителом в исходной концентрации 1 мкг/0,1 мл/1x106 клеток.
[00223] Клетки затем окрашивают в течение 30 минут на льду или при 4°С в защищенном от света месте. После 30 минут инкубации клетки промывают центрифугированием при 300 х г в течение 5 минут. После центрифугирования осадок ресуспендируют в PBS при концентрации 5 x 106/мл PBS, а затем 4 мл на 12x75 мм переносят в стерильную пробирку.
[00224] FACs Aria готовится для стерильной сортировки живых клеток согласно инструкции изготовителя (Руководство пользователя для BD FACs Aria). Пробоотборная пробирка загружается в FACs Aria, а напряжения фотополимерной трубки (PMT) корректируются после начала сбора. Воротные механизмы протягиваются с целью отбора типов специфических почечных клеток, используя интенсивность флуоресценции с определенной длиной волны. Другой воротный механизм протягивается с целью отбора отрицательной популяции. После того, как желаемые воротный механизм были протянуты для инкапсуляции положительной целевой популяции и отрицательной популяции, клетки сортируют согласно инструкции производителя.
[00225] Положительную целевую популяцию собирают в одну коническую пробирку объемом 15 мл, а отрицательную популяцию - в другую коническую пробирку объемом 15 мл, наполненную средой почечных клеток в объеме 1 мл. После сбора образец из каждой пробирки анализируют с помощью проточной цитометрии для определения чистоты.
[00226] Собранные клетки промывают центрифугированием при 300 х г в течение 5 минут, а осадок ресуспендируют в среде почечных клеток для дальнейшего анализа и экспериментов.
Пример 12 – Обогащение/обеднение типов почечных клеток с помощью магнитной сортировки клеток.
[00227] Одна или более изолированных почечных клеток может быть обогащены и/или один или более специфических типов почечных клеток могут быть обеденены из изолированной первичной почечной ткани.
[00228] Реагенты: 70% этанол; промывочный буфер (PBS), 50:50 среда клеток почки (50% DMEM с высоким содержанием глюкозы): 50% кератиноцит-SFM; трипановый синий 0,4%; подвижный буфер (PBS, 2 мМ EDTA, 0,5% BSA), промывочный буфер (PBS, 2 мМ EDTA), очищающий раствор (70% об/об этанол), блокирующий реагент Miltenyi FCR, микрогранулы Miltenyi, специфичные для каждого изотипа IgG, целевое антитело, такое как CD31 (РЕСАМ) или нефрмн, или вторичное антитело.
[00229] Процедура: После стандартных процедур очистки шкафа биологической безопасности (ШББ), из любых первичных изолированных или культивированных клеток может быть получена единичная клеточная суспензия почечных клеток, которую ресуспендируют в среду почечных клеток. Клетки подсчитывают, а затем оценивают их жизнеспособность с использованием способа вытеснения трипанового синего. Для обогащения/обеднения клеток почки, например, клубочковых клеток или эндотелиальных клеток из гетерогенной популяции, применяют по меньшей мере от 10 х 106 до 4 x 109живых клеток с жизнеспособностью по меньшей мере 70%.
[00230] Наилучшее разделение для процесса обогащения/обеднения определяют исходя из целевой клетки, представляющей интерес. Для обогащения запланированной частотой менее чем 10%, например, клубочковых клеток с применением антитела нефрина, используется Miltenyi AutoMACS, или эквивалентная инструментальная программа POSSELDS (двойной положительный отбор в чувствительной режиме). Для обеднения запланированной частотой более чем 10%, используется Miltenyi AutoMACS, или эквивалентная инструментальная программа DEPLETES (обеднение в чувствительной режиме).
[00231] Живые клетки метят целевым специфическим первичным антителом, например, поликлональным антителом к клубочковым клеткам - нефрином rb, путем добавления 1 мкг/10x106 клеток/0,1 мл PBS с 0,05% BSA в коническую центрифужную пробирку объемом 15 мл, с последующей инкубацией в течение 15 минут при 4°
[00232] После мечения, клетки промывают для удаления несвязанного первичного антитела, путем добавления 1-2 мл буфера на 10 x107 клетокс последующим центрифугированием при 300 х г в течение 5 минут. После промывания добавляют изотипическое специфическое вторичное антитело, такое как куриный анти-кроличий PE 1 мкг/10 х 106/0.1 мл PBS с 0,05% BSA с последующей инкубацией в течение 15 минут при 4°С.
[00233] После инкубации клетки промывают для удаления несвязанного вторичного антитела путем добавления 1-2 мл буфера на 10 x 10 клеток7 с последующим центрифугированием при 300 x г в течение 5 минут. Супернатант удаляют, а осадок клеток ресуспендируют в 60 мкл буфера на 10 x 107 общих клеток с последующим добавлением 20 мкл блокирующего реагента FCR на 10 x 107 общих клеток, которые затем тщательно перемешивают.
[00234] Добавляют 20 мкл прямых микрогранул MACS (например, микрогранул анти-PE) и перемешивают, а затем инкубируют в течение 15 мин при 4°С.
[00235] После инкубации клетки промывают путем добавления10-20x меченного объема буфера и центрифугируют клеточную суспензию при 300 х г в течение 5 минут, а клеточный осадок ресуспендируют в 500 мкл - 2 мл буфера на10 x108 клеток.
[00236] Согласно инструкциям изготовителя, систему AutoMACS очищают и запускают при подготовке для магнитного разделения клеток с помощью AutoMACS. Новые стерильные пробирки для сбора помещают под выпускными отверстиями. Выбирают программу разделения клеток autoMACS. Для отбора выбирают программу POSSELDS. Для обеднения выбирают программу DEPLETES.
[00237] Меченые клетки помещают в порт ввода, затем начинают выполнение программы.
[00238] После отбора клеток или обеднения, образцы собирают и помещают на лед до использования. Чистоту обедненного или отобранного образца анлизируют с помощью проточной цитометрии.
ПРИМЕР 13 - Клетки, имеющие терапевтическую активность, могут быть изолированы и размножены из здоровой или пораженной хронической патологией почечной ткани.
[00239] Целью настоящего исследования было определение функциональной характеристики человеческих клеток NKA с помощью одновременного многопараметрического анализа (ОМA). Одновременное многопараметрическое построение изображения (ОМПИ) обеспечивает одновременную визуализацию нескольких субклеточных явлений в целом ряде образцов с помощью двух или более флуоресцентных зондов (мультиплексирование). Одновременный многопараметрический анализ (ОМА) обеспечивает одновременное количественное измерение нескольких клеточных параметров, зафиксированных в многопараметрических изображениях. Описывая кратко, были получены нефракционированные (UNFX) культуры (Aboushwareb et al., supra 2008), которые сохраняли независимо от основных биоптатов, взятых из пяти человеческих почек с поздними стадиями хронического заболевания почек (ХЗП) и трех почек без ХЗП с использованием стандартных процедур биопсии. После (2) пассажей UNFX ex vivo клетки собирали и подвергали способам градиента плотности (как в Примере 2) с целью получения субфракций, включая субфракции B2, B3 и/или B4.
[00240] Почечные ткани человека были заготовлены от здоровых людей-доноров и людей-доноров с ХЗП, как представлено в Таблице 10.1, Ilagan et al. PCT/US2011/036347. На Фигуре 4, Ilagan et al. PCT/US2011/036347 продемонстрированы гистопатологические особенности образцов HK17 и HK19. Культуры еx vivo были получены из всех почек без ХЗП (3/3) и почек с ХЗП (5/5). Одновременный многопараметрический анализ (ОМА) транспорта альбумина в человеческих клетках NKA, ограничивающий области, представляющие интерес (ROI), показан на Фигуре 5 (ОМА транспорта альбумина в человеческих клетках NKA), Ilagan et al. PCT/US2011/036347. Количественное сравнение транспорта альбумина в клетках NKA, полученных из почек без ХЗП и почек с наличием ХЗП продемонстрировано на Фигуре 6, Ilagan et al. PCT/US2011/036347.
[00241] Как показано на Фигуре 6, Ilagan et al. PCT/US2011/036347, транспорт альбумина не нарушается в культурах NKA, полученных из почек с ХЗП. Сравнительный анализ маркерной экспрессии между субфракцией В2, обогащенной клетками почечных канальцев, и субфракцией В4, обедненной клетками почечных канальцев, продемонстрирован на Фигуре 7 (CK8/18/19), Ilagan et al. PCT/US2011/036347.
[00242] Сравнительный функциональный анализ транспорта альбумина между субфракцией В2, обогащенной клетками почечных канальцев, и субфракцией В4, обедненной клетками почечных канальцев, продемонстрирован на Фигуре 8, Ilagan et al. PCT/US2011/036347. Субфракция В2 является обогащенной клетками проксимальных канальцев и таким образом характеризуется повышенной функцией относительно транспорта альбумина.
[00243] Поглощение альбумина: Культуральные среды клеток, выращенные до слияния на 24-луночных планшетах с коллагеном IV (BD Biocoat™), заменяли в течение 18-24 часов на DMEM с низким уровнем глюкозы, не содержащего фенолового красного и сыворотки (pr-/s-/lg DMEM), но включающего 1X противогрибковое средство/антибиотик и 2 мМ глутамина. Непосредственно перед проведением анализа клетки промывали и инкубировали в течение 30 минут с pr-/s-/lg DMEM + 10 мМ HEPES, 2 мМ глутамина, 1,8 мм CaCl2 и 1 мМ MgCl2. Клетки подвергали воздействию 25 мкг/мл бычьего альбумина, конъюгированного с родамином (Invitrogen), в течение 30 мин, промывали очень холодным PBS, чтобы остановить эндоцитоз, и немедленно фиксировали 2% параформальдегидом, содержащим 25 мкг/мл ядерного красителя Хехст. Для экспериментов по ингибированию, 1 мкМ рецептор-ассоциированного белка (RAP) (Ray Biotech, Inc., Норкросс, Джорджия) добавляли за 10 минут перед добавлением альбумина. Построение микроскопического изображения и анализ проводили с помощью BD Pathway™ 855 High-Content BioImager (Becton Dickinson) (см. Kelley et al. Am J Physiol Renal Physiol. 2010 Nov; 299(5):F1026-39. Epub Sep 8, 2010).
[00244] Таким образом, ОМА предоставляет данные на клеточном уровне и может выявить динамику популяций, которые невозможно обнаружить с помощью других анализов, т.е., генной или белковой экспрессией. Количественный ОМА ex-vivo для изучения функции транспорта альбумина (ОМА-AT) может быть использован для характеристики клеток почечных канальцев человека как компонентов человеческих прототипов NKA. С помощью ОМА-AT была возможность провести сравнительную оценку клеточной функции и доказать, что клетки, способные транспортировать альбумин, содержались в культурах NKA, полученных из почек человека, пораженых ХЗП. Также было продемонстрировано, что специфические субфракции культур NKA, В2 и В4, отличались по фенотипу и функциям от В2, представляющих фракцию обогащенную клетками почечных канальцев, с повышенной активностью относительно транспорта альбумина. Клеточная субпопуляция В2, полученная от человека с ХЗП, фенотипически и функционально аналогична клеточной субпопуляции В2 грызунов, которая демонстрировала эффективность in vivo (как показано выше).
Литературные ссылки
1. Kelley, R. et al. Intra-renal Transplantation of Bioactive Renal Cells Preserves Renal Functions and Extends Survival in the ZSFI model of Progressive Diabetic Nephropathy. 2011 American Diabetes Association (ADA) Conference. (2011).
2. Kelley, R. et al. Tubular cell-enriched subpopulation of primary renal cells improves survival and augments kidney function in rodent model of chronic kidney disease. Am J Physiol Renal Physiol299, F1026-1039.
3. Presnell, S.C. et al. (2011) Isolation, Characterization, and Expansion Methods for Defined Primary Renal Cell Populations from Rodent, Canine, and Human Normal and Diseased Kidneys. Tissue Eng Part C Methods17:261-273.
4. Humphreys, B.D. et al. Repair of injured proximal tubule does not involve specialized progenitors. Proc Natl Acad Sci U S A108, 9226-9231.
5. Aboushwareb, T. et al. Erythropoietin producing cells for potential cell therapy. World J Urol26, 295-300 (2008).
6. Takano, Y. et al. Recovery and maintenance of nephrin expression in cultured podocytes and identification of HGF as a repressor of nephrin. Am J Physiol Renal Physiol292, F1573-1582 (2007).
7. Basu, J. et al. Expansion of the human adipose-derived stromal vascular cell fraction yields a population of smooth muscle-like cells with markedly distinct phenotypic and functional properties relative to mesenchymal stem cells. Tissue Eng Part C Methods17, 843-860.
8. Basu, J. et al. Organ specific regenerative markers in peri-organ adipose: kidney. Lipids Health Dis10, 171.
9. Xinaris C, et al. In vivo maturation of functional renal organoids formed from embryonic cell suspensions. J Am Soc Nephrol23,1-12. (2012).
10. Buzhor et al.Kidney Spheroids Recapitulate Tubular Organoids Leading to Enhanced Tubulogenic Potency of Human Kideny-Derived Cells Tissue Engineering Part A, (2011).
11. Brown, SA et al., Impaired renal autoregulatory ability in dogs with reduced renal mass. J Am Soc Nephrol. 5:1768-74 (1995).
12. Robertson, J.L. et al., Long-term renal responses to high dietary protein in dogs with 75% nephrectomy. Kidney Int. 29:511-9 (1986).
13. Urie, B.K. et al., Evaluation of clinical status, renal function, and hematopoietic variables after unilateral nephrectomy in canine kidney donors. J Am Vet Med Assoc. 230:1653-6 (2007).
Реферат
Изобретение относится к биохимии и медицине и представляет собой способ формирования кластера клеток, включающий: (i) объединение популяции гетерогенных клеток почки и популяции биоактивных клеток, где популяция гетерогенных клеток почек содержит клетки, полученные из биоптата почки или из целой почки млекопитающего или происходящие из культуры клеток in vitro, полученных из биоптата почки или целой почки млекопитающего, и где популяция биологически активных клеток (а) содержит популяцию эндотелиальных клеток, полученных не из почек, или популяцию эндотелиальных клеток-предшественников, полученных не из почек, и (b) выделена из источника, происходящего из взрослой особи, или из клеточной линии, происходящей из взрослой особи, и (ii) культивирование популяции гетерогенных почечных клеток и популяции биоактивных клеток в трехмерной культуральной системе, содержащей вращающиеся колбы до образования кластера клеток, где популяцию гетерогенных клеток почки и популяцию биоактивных клеток культивируют независимо в течение первого периода времени, а затем объединяют и культивируют в трехмерной культуральной системе в течение второго периода времени, где второй период времени составляет не менее 24 часов. Изобретение эффективно используется для лечения хронического заболевания почек. 6 н. и 37 з.п. ф-лы, 12 ил., 10 табл., 13 пр.

Комментарии