Популяции клеток почек и их применение - RU2702721C2
Код документа: RU2702721C2
Чертежи








Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет по предварительной патентной заявке США, №61/718150, под названием «Выделенные регенеративные клетки почек и их применение», поданной 24 октября 2012 г., и №61/876616, под названием «Популяции клеток почек и их применение», поданной 11 сентября 2013 г.
ОБЛАСТЬ ТЕХНИКИ
Настоящее описание в целом относится к обогащенной гетерогенной популяции клеток почек млекопитающих, методам идентификации популяции клеток, способам их применения при проведении регенеративной медицинской терапии и в данном документе предложены способы лечения болезни почек путем введения обогащенной гетерогенной популяции клеток почек субъекту-млекопитающему.
УРОВЕНЬ ТЕХНИКИ
Биоматериалы на основе коллагена и желатина успешно применяются в разнообразных применениях в тканевой инженерии (Rohanizadeh et al. J Mater Sci Mater Med 2008; 19: 1173-1182; Takemoto et al. Tissue Eng Part A 2008; 14: 1629-1638; Young et al. J Control Release 2005; 109: 256-274). Обе эти макромолекулы характеризуются превосходной биосовместимостью и низкой антигенностью (Cenni et al. J Biomater Sci Polym Ed 2000; 11: 685-699; Lee et al. Int J Pharm 2001; 221: 1-22; Waksman et al. J Immunol 1949; 63: 427-433). Однако, поскольку желатин получают путем гидролиза коллагена, он обладает определенными преимуществами перед последним: (а) он легкодоступен и удобен в использовании; (b) предлагает возможность выбора в отношении молекулярной массы и растворения (т.е. допускает контроль над физическими свойствами) и (с) является более гибким в отношении химической модификации и более прост в производстве. Более того, с биологической точки зрения желатин обеспечивает цитосовместимость и имеет свойства клеточной адгезии, сходные с коллагеном (Engvall et al. Int J Cancer 1977; 20:1-5; Kim et al. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108: e94-100).
Известны различные способы для перекрестного сшивания этих макромолекул с целью замедления их биодеградации для продления их удержания in vivo (при применениях в тканевой инженерии) или для управления их способностью высвобождать лекарственные средства (при использовании в качестве носителей лекарственных средств). Опубликованы многочисленные способы химического и фотохимического перекрестного сшивания коллагена и желатина (Adhirajan et al. J Microencapsul 2007; 24: 647-659; Chang et al. Macromol Biosci 2007; 7: 500-507; Gagnieu et al. Biomed Mater Eng 2007; 17: 9-18; Kimura et al. J Biomater Sci Polym Ed 2010; 21: 463-476; Ma et al. J Biomed Mater Res A 2004; 71: 334-342; Vandelli et al. Int J Pharm 2001; 215:175-184; Vandelli et al. J Control Release 2004; 96: 67-84). Большинство из этих методик направлены на снижение чувствительности этих биоматериалов к ферментативной деградации и на продление времени их удержания in vivo (Chang et al. 2007, выше; Ma et al. 2004, выше). Другие способы перекрестного сшивания, как правило, применяют для получения биоматериалов на основе желатина или коллагена, пригодных в качестве носителей для медленного высвобождения лекарственных средств, белков или нуклеиновых кислот (Kimura 2010, выше; Vandelli 2004, выше; Kommareddy et al. Nanomedicine 2007; 3: 32-42; Sehgal et al. Expert Opin Drug Deliv 2009; 6: 687-695; Sutter et al. J Control Release 2007; 119: 301-312). Классом широко используемых агентов для перекрестного сшивания, а также для других совместимых с тканевой инженерией систем являются карбодиимиды (Adhirajan 2007, выше; Olde Damink et al. Biomateriais 1996; 17: 765-773; Pieper et al. Biomateriais 2000; 21: 581-593; Cornwell et al. Clin Podiatr Med Surg 2009; 26: 507-523). Эти молекулы известны как кросс-линкеры нулевой длины и действуют посредством образования амидных связей между карбоксильными и первичными аминными функциональными группами, присутствующим на объектах, требующих перекрестного сшивания. Кроме того, карбодиимиды менее цитотоксичны по сравнению с другими общепринятыми перекрестносшивающими агентами (например, глутаральдегидом) (Lai et al. J Mater Sci Mater Med 2010; 21: 1899-1911). Глутаральдегид применяют в качестве кросс-линкера при получении гранул Cultispher™. Burg в патенте США №6991652 описывает композиции для тканевой инженерии, содержащие трехмерные поддерживающие конструкции для клеток, которые могут доставляться субъекту.
Технологии регенеративной медицины обеспечивают терапевтические средства следующего поколения для лечения хронической болезни почек (ХБП). Presnell et al. в WO/2010/056328 и Ilagan et al. в PCT/US2011/036347 описывают выделенные биологически активные клетки почек, включая популяции тубулярных и эритропоэтин(ЭПО)-продуцирующих клеток почек, и способы их выделения и культивирования, а также способы лечения нуждающегося субъекта популяциями клеток.
Существует необходимость в терапевтических составах, которые подходят для доставки активных агентов, таких как, к примеру, биологически активные клетки, при применении в тканевой инженерии и регенеративной медицине для нуждающихся субъектов.
Почка представляет собой сложный орган, который выполняет много функций для поддержания чистоты и химического равновесия состава крови. В дополнение к удалению продуктов жизнедеятельности почки высвобождают три важных гормона:
эритропоэтин, или ЭПО, который стимулирует синтез красных клеток крови костным мозгом;
ренин, который регулирует артериальное давление; и
кальцитриол, активную форму витамина D, который помогает усваивать кальций костной тканью и обеспечивает нормальный химический баланс в организме.
Для выполнения этих функций почка содержит множество типов различных клеток. Однако не все клетки почек требуются для регенеративного ответа, и задачей исследования была идентификация комбинации клеток, пригодных для получения регенеративного ответа. Таким образом, сохраняется необходимость в способах, которые идентифицируют гетерогенную популяцию клеток почек, т.е. биологически активных клеток, которые найдут применение в терапевтических составах, описанных в данном документе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном документе описывается гетерогенная популяция клеток почек млекопитающих, полученная из ткани почек млекопитающих. Предложены способы выделения и очистки популяция клеток почек млекопитающих. Индивидуальную популяцию клеток почек млекопитающего характеризуют по фенотипическим признакам, к примеру, фенотипу биомаркеров. Фенотип экспрессии биомаркеров сохраняется в культуре после множества пассажей популяции клеток почек млекопитающего и подходит для применения при проведении регенеративной терапии.
В данном документе описаны отобранная популяция клеток почек человека, характеризующаяся специфическими биомаркерами, и ее применение.
Отобранная популяция клеток почек человека позволяет применять меньшие количества клеток для обеспечения регенеративного стимула. Это меньшее количество является преимуществом, поскольку оно снижает возможность нежелательных иммунологических явлений, а также обеспечивает регенеративный стимул. Отобранная популяция клеток почек не требует большого соотношения содержания стволовых клеток, чтобы быть эффективной в качестве регенеративного стимула. Отобранная популяция клеток почек может быть выделена из пораженной заболеванием почки.
В одном аспекте изобретения предложены способы идентификации и/или определения характеристик гетерогенной популяции клеток почек. В одном варианте реализации изобретения гетерогенную популяцию клеток почек характеризуют по ее фенотипической экспрессии биомаркеров. В некоторых вариантах реализации изобретения клетки почек идентифицируют с одним или более реагентами, которые позволяют проводить детекцию биомаркеров на/внутри гетерогенной популяции клеток почек. Детекцию биомаркеров могут проводить любым подходящим методом, к примеру, основанным на иммунофлуоресцентной микроскопии, проточной цитометрии, оптоволоконной сканирующей цитометрии или лазерной сканирующей цитометрии. В одном варианте реализации изобретения предложен способ идентификации гетерогенной популяции клеток почек, подходящей для имплантации и/или получения регенеративного ответа, указанный способ включает этапы:
Выделения клеток из образца почки млекопитающего;
Воздействия на указанные выделенные клетки одним или более мечеными компонентами для детекции, причем каждый меченый компонент для детекции нацелен на уникальный биомаркер и помечен уникальной меткой;
Определения процентного содержания клеток, которые экспрессируют каждый из указанных уникальных биомаркеров.
В одном варианте реализации изобретения популяция клеток представляет собой популяцию клеток SRC, которая экспрессирует два или более биомаркеров, перечисленных в Таблицах 12.2 и 12.3. В одном варианте реализации изобретения биомаркеры имеют уровни экспрессии, указанные в Таблице 12.4. В варианте реализации изобретения популяция клеток SRC имеет уровни экспрессии GGT-1 и CK18 более 18% и 80%, соответственно.
В одном аспекте изобретения предложены инъекционные терапевтические составы, содержащие активные агенты, например, биологически активные клетки. В одном варианте реализации изобретения инъекционный состав содержит биологически активные клетки и термочувствительный стабилизирующий клетки биоматериал. В другом варианте реализации изобретения термочувствительный стабилизирующий клетки биоматериал обеспечивает: (i) практически твердое состояние при температуре около 8°C или ниже и/или (ii) практически жидкое состояние при температуре окружающей среды или выше. В еще одном варианте реализации изобретения биологически активные клетки включают клетки почек, описанные в данном тексте. В другом варианте реализации изобретения биологически активные клетки практически равномерно диспергированы во всем объеме стабилизирующего клетки биоматериала. В других вариантах реализации изобретения биоматериал имеет переходное состояние твердое тело-жидкость между температурой около 8°C и температурой около температуры окружающей среды или выше. В одном варианте реализации изобретения практически твердое состояние представляет собой гелеобразное состояние. В другом варианте реализации изобретения стабилизирующий клетки биоматериал содержит гидрогель. В еще одном другом варианте реализации изобретения гидрогель содержит желатин. В других вариантах реализации изобретения желатин представлен в составе в концентрации от около 0,5% до около 1% (мас./об.). В одном варианте реализации изобретения желатин представлен составе в концентрации около 0,75% (мас./об.). В другом варианте реализации изобретения состав дополнительно содержит агент, обеспечивающий выживание клеток. В другом варианте реализации изобретения агент, обеспечивающий выживание клеток, включает агент, выбранный из группы, состоящей из антиоксиданта, переносчика кислорода, иммуномодулирующего фактора, фактора рекрутирования клеток, фактора прикрепления клеток, противовоспалительного агента, иммуносупрессанта, ангиогенного фактора и ранозаживляющего фактора. В некоторых вариантах реализации изобретения агент, обеспечивающий выживание клеток, представляет собой антиоксидант. В одном варианте реализации изобретения антиоксидант представляет собой 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновую кислоту. В другом варианте реализации изобретения 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота представлена в концентрации от около 50 мкМ до около 150 мкМ. В еще одном другом варианте реализации изобретения 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота представлена в концентрации около 100 мкМ. В некоторых вариантах реализации изобретения агент, обеспечивающий выживание клеток, представляет собой переносчик кислорода. В одном варианте реализации изобретения переносчик кислорода представляет собой перфторуглерод. В других вариантах реализации изобретения агент, обеспечивающий выживание клеток, представляет собой иммуномодулирующий агент. В одном варианте реализации изобретения агент, обеспечивающий выживание клеток, представляет собой иммуносупрессант.
В другом аспекте изобретения предложены инъекционные терапевтические составы, содержащие биологически активные клетки почек. В одном варианте реализации состав содержит биологически активные клетки почек, около 0,75% (мас./об.) желатина и около 100 мкМ 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты, причем данный состав обладает: (i) практически твердым состоянием при температуре около 8°C или ниже и (ii) практически жидким состоянием при температуре окружающей среды или выше. В другом варианте реализации изобретения биологически активные клетки почек практически равномерно диспергированы во всем объеме стабилизирующего клетки биоматериала. В еще одном другом варианте реализации изобретения биоматериал обладает переходным состоянием твердое тело-жидкость между температурой около 8°C и температурой около температуры окружающей среды. В других вариантах реализации изобретения практически твердое состояние представляет собой гелеобразное состояние. В некоторых вариантах реализации изобретения агент состав дополнительно включает агент, обеспечивающий выживание клеток. В еще одном варианте реализации изобретения агент, обеспечивающий выживание клеток, включает агент, выбранный из группы, состоящей из антиоксиданта, переносчика кислорода, иммуномодулирующего фактора, фактора рекрутирования клеток, фактора прикрепления клеток, противовоспалительного агента, ангиогенного фактора и ранозаживляющего фактора. В одном варианте реализации изобретения агент, обеспечивающий выживание клеток, представляет собой переносчик кислорода. В другом варианте реализации изобретения переносчик кислорода представляет собой перфторуглерод. В еще одном другом варианте реализации изобретения агент, обеспечивающий выживание клеток, представляет собой иммуномодулирующий агент. В других вариантах реализации изобретения агент, обеспечивающий выживание клеток, представляет собой иммуносупрессант.
В еще одном другом аспекте в настоящем описании изобретения предложен состав, описанный в данном документе, который дополнительно включает биосовместимые гранулы. В одном варианте реализации изобретения биосовместимые гранулы содержат биоматериал. В другом варианте реализации изобретения гранулы являются перекрестносшитыми. В еще одном другом варианте реализации изобретения перекрестносшитые гранулы обладают уменьшенной чувствительностью к ферментативной деградации по сравнению с неперекрестносшитыми биосовместимыми гранулами. В других вариантах реализации изобретения перекрестносшитые гранулы представляют собой гранулы перекрестносшитые карбодиимидом. В одном варианте реализации изобретения карбодиимид выбирают из группы, состоящей из: 1-этил-3-[3-диметиламинопропил]-карбодиимида гидрохлорида (EDC), DCC-N,N'-дициклогексилкарбодиимида (DCC) и N,N'-диизопропилкарбодиимида (DIPC). В другом варианте реализации изобретения карбодиимид представляет собой 1-этил-3-[3-диметиламинопропил]-карбодиимида гидрохлорид (EDC). В еще одном другом варианте реализации изобретения перекрестносшитые гранулы содержат уменьшенное количество свободных первичных аминогрупп по сравнению с неперекрестносшитыми гранулами. В других вариантах реализации изобретения количество свободных первичных аминогрупп может определяться спектрофотометрически при длине волны около 355 нм. В некоторых вариантах реализации изобретения гранулы засевают биологически активными клетками. В одном варианте реализации изобретения биологически активные клетки представляют собой клетки почек. В другом варианте реализации изобретения состав дополнительно содержит добавочные биосовместимые гранулы, которые включают темрочувствительный биоматериал, который обеспечивает: (i) практически твердое состояние при температуре окружающей среды или ниже и (ii) практически жидкое состояние при температуре около 37°C или выше. В еще одном другом варианте реализации изобретения биоматериал гранул имеет переходное состояние твердое тело-жидкость между температурой окружающей среды и температурой около 37°C. В других вариантах реализации изобретения практически твердое состояние представляет собой гелеобразное состояние. В одном варианте реализации изобретения биоматериал гранул содержит гидрогель. В другом варианте реализации изобретения гидрогель содержит желатин. В еще одном другом варианте реализации изобретения гранулы содержат желатин в концентрации от около 5% (мас./об.) до около 10% (мас./об.). В некоторых вариантах реализации изобретения добавочные биосовместимые гранулы представляют собой заполняемые гранулы. В других вариантах реализации изобретения заполняемые гранулы не засевают биологически активными клетками.
В другом аспекте изобретения составы по настоящему изобретению содержат продукты, секретируемые популяцией клеток почек. В одном варианте реализации изобретения составы содержат продукты, секретируемые популяцией клеток почек, и/или биологически активными клетками. В еще одном другом варианте реализации изобретения биологически активные клетки представляют собой клетки почек. В другом варианте реализации изобретения данные продукты содержат один или более паракринных факторов, эндокринных факторов и юкстакринных факторов. В еще одном другом варианте реализации изобретения данные продукты содержат везикулы. В других вариантах реализации везикулы содержат микровезикулы. В одном варианте реализации изобретения везикулы содержат экзосомы. В другом варианте реализации изобретения везикулы содержат секретируемый продукт, выбранный из группы, состоящей из паракринных факторов, эндокринных факторов, юкстакринных факторов и РНК.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фигуре 1 представлена блок-схема всего процесса изготовления препарата NKA, описанного в данном документе.
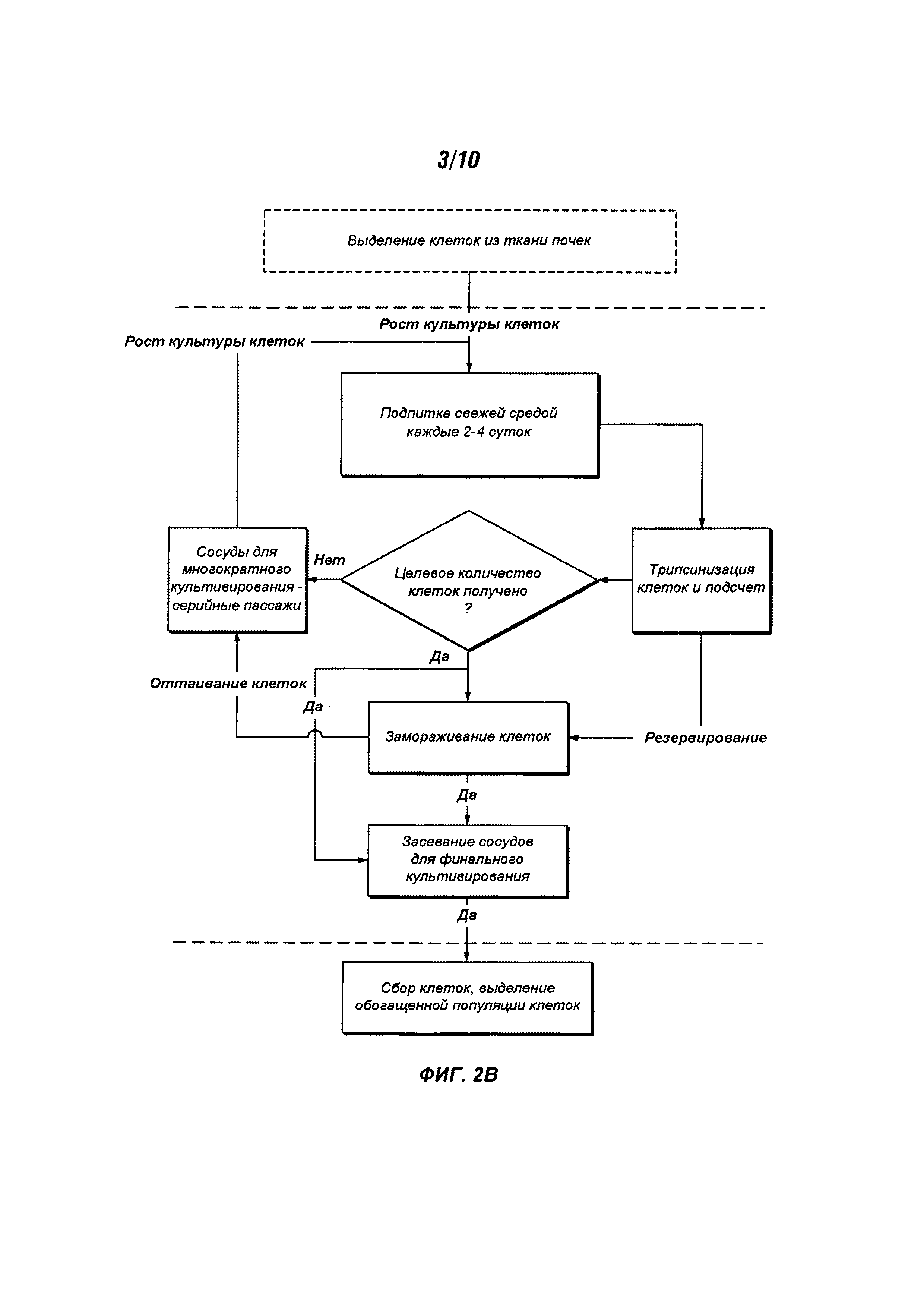
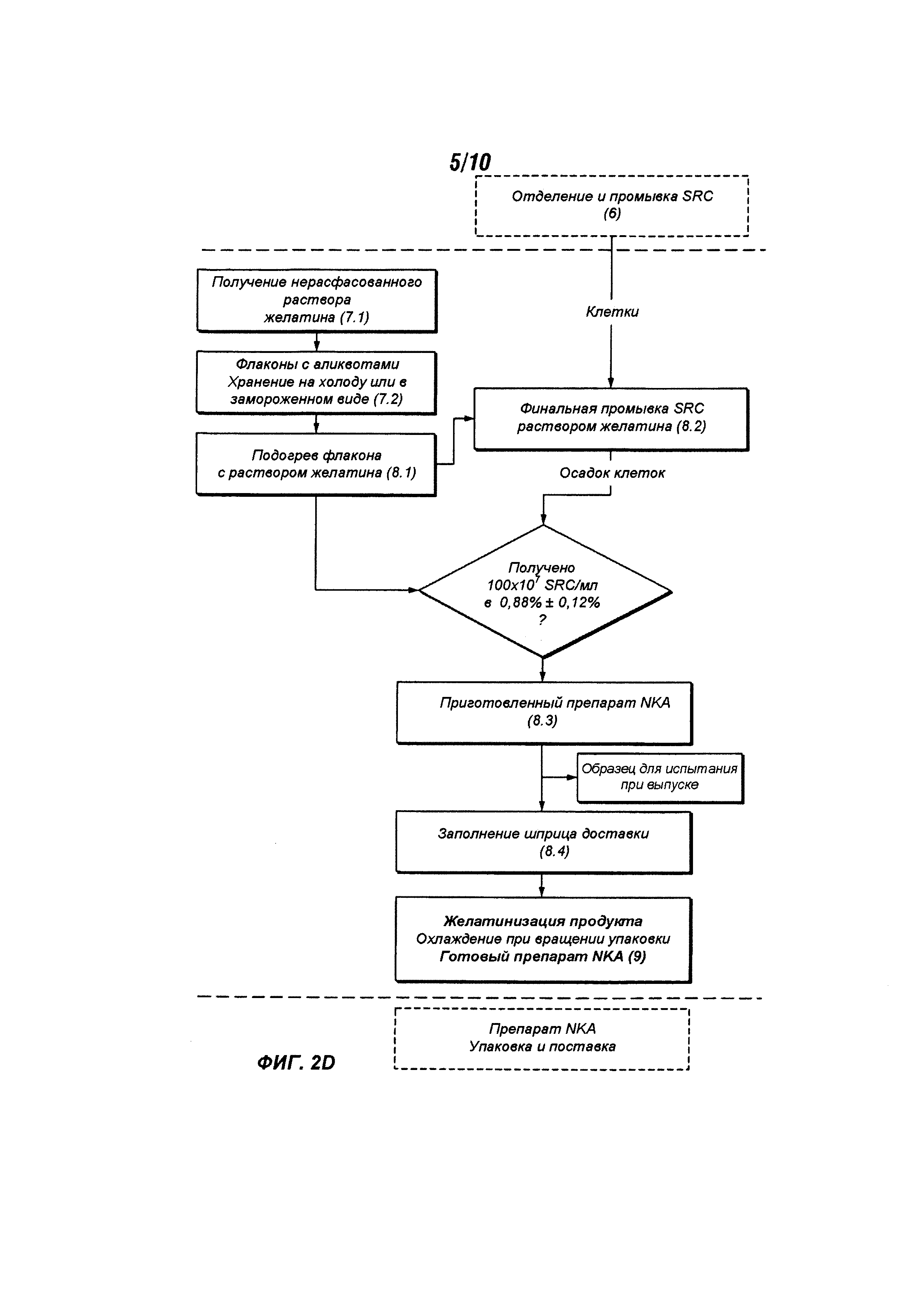
На Фигурах 2A-D представлена блок-схема, описывающая дополнительные подробности процесса, изображенного на Фигуре 1 и описанного в данном документе.
На Фигуре 3 представлен график, который иллюстрирует вариации длительности культивирования и выходы клеток, полученных от шести пациентов.
На Фигуре 4 представлено изображение зонального разделения SRC на градиенте плотности 7% раствора OptiPrep®. Справочная информация приведена в Примере 5.
На Фигуре 5 представлена гистограмма, изображающая экспрессию маркеров клеток почек в популяциях SRC человека. Справочная информация приведена в Примере 12.
На Фигуре 6 представлена гистограмма, изображающая ферментативную активность SRC человека. Справочная информация приведена в Примере 12.
На Фигурах 7A-D изображены результаты инъекции препарата NKA в почку: (а) игла введена в кортекс почки, (b) доставка препарата NKA, (с) точки множественной доставки в почку и (d) финальный имплантант препарата NKA (иллюстративный).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном документе описаны терапевтические составы активных агентов, таких как биологически активные клетки, а также способы их получения и способы лечения субъекта, нуждающегося в таких составах. Составы с биологически активными клетками могут подходить для гетерогенных смесей или фракций биологически активных клеток почек (БАКП). Биологически активные клетки почек могут представлять собой выделенные клетки почек, включая тубулярные и эритропоэтин(ЭПО)-продуцирующие клетки почек. Популяции клеток БАКП могут включать обогащенные популяции тубулярных и ЭПО-продуцирующих клеток почек. БАКП могут быть получены из или представлять собой фракции клеток почек, полученные от здоровых индивидов. Кроме того, предложены фракции клеток почек, полученных от больных индивидов, у которых может недоставать определенных клеточных компонентов, при сравнении с соответствующими фракциями клеток почек здоровых индивидов, тем не менее сохраняющих терапевтические свойства. В настоящем изобретении предложены терапевтически активные популяции клеток без клеточных компонентов по сравнению со здоровым индивидом. В одном варианте реализации изобретения такие популяции клеток могут быть выделенными и размножены из аутологических источников при различных болезненных состояниях.
Хотя в данном документе описываются составы с биологически активными клетками, настоящее раскрытие предполагает составы, содержащие множество других активных агентов. Другие подходящие активные агенты включают, в частности: агрегаты клеток, бесклеточные биоматериалы, секретируемые биологически активными клетками продукты, терапевтические средства с большими и малыми молекулами, а также их комбинации. К примеру, один тип биологически активных клеток можно комбинировать с микроносителями на основе биоматериалов с или без терапевтических молекул или другим типом биологически активных клеток, неприкрепленные клетки можно комбинировать с бесклеточными частицами.
1. Определения
Если не указано иное, технические и научные термины, использованные в данном документе, имеют то же значение, которое обычно подразумевается средним специалистом в данной области техники, к которой относится это изобретение. Издание Principles of Tissue Engineering. 3rd Ed, (Edited by R Lanza, R Langer, & J Vacanti), 2007 обеспечивает специалиста в данной области техники общими понятиями многих терминов, использованных в настоящей заявке. Специалист в данной области техники распознает в данном документе способы и материалы, сходные или эквивалентные, описанным в данном документе, которые могут быть использованы при осуществлении настоящего изобретения. В действительности, настоящее изобретение никоим образом не ограничено описанными способами и материалами.
Как используется в данном документе, термин «популяция клеток» относится к некоторому количеству клеток, полученных путем непосредственного выделения из подходящего тканевого источника, как правило, из организма млекопитающего. Выделенная популяция клеток может в дальнейшем культивироваться in vitro. Средним специалистам в данной области техники известно, что для применения в настоящем изобретении представлены различные способы для выделения и культивирования популяций клеток и различные количества клеток в популяции клеток, которые пригодны для применения в настоящем изобретении. Популяция клеток может быть нефракционированной гетерогенной популяцией клеток, полученной из органа или ткани, например, из почки. К примеру, гетерогенная популяция клеток может быть выделена из биоптата тканей или из ткани целого органа. В альтернативном варианте гетерогенная популяция клеток может быть получена из культур клеток млекопитающих in vitro, выведенных из биоптата ткани или из ткани целого органа. Нефракционированная гетерогенная популяция клеток также может называться необогащенной популяцией клеток. В одном варианте реализации изобретения популяции клеток содержат биологически активные клетки.
Под термином «нативный орган» понимают орган живого субъекта. Субъект может быть здоровым или больным. Больной субъект может иметь заболевание, ассоциированное с конкретным органом.
Под термином «нативная почка» следует понимать почку живого субъекта. Субъект может быть здоровым или больным. Больной субъект может иметь болезнь почек.
Под термином «регенеративный эффект» понимают эффект, оказывающий благоприятное воздействие на нативный орган, такой как почка. Эффект может включать, в частности, снижение степени повреждения нативного органа или улучшение, восстановление или стабилизацию функционирования нативного органа. Повреждение почек может происходить в форме фиброза, воспаления, гломерулярной гипертрофии и т.п. и относиться к заболеванию, ассоциированному с нативным органом субъекта.
Как используется в данном документе, термин «смесь» относится к комбинации двух или более выделенных обогащенных популяций клеток, полученных из нефракционированной гетерогенной популяции клеток. В соответствии с некоторыми вариантами реализации изобретения популяции клеток представляют собой популяции клеток почек.
Термин «обогащенная» популяция клеток или препарат относится к популяции клеток, полученной из исходной популяции клеток органа (например, нефракционированной гетерогенной популяции клеток), которая содержит большее процентное содержание клеток специфического типа, чем процентное содержание такого типа клеток в исходной популяции. К примеру, исходная популяция клеток почек может быть обогащена первой, второй, третьей, четвертой, пятой и так далее целевой популяцией клеток. Как используется в данном документе, термины «популяция клеток», «клеточный препарат» и «клеточный прототип» применяются взаимозаменяемо.
В одном аспекте изобретения, как используется в данном документе, термин «обогащенная» популяция клеток относится к популяции клеток, полученной из исходной популяции клеток органа (например, суспензии клеток из биоптата почки или культивированных клеток почек млекопитающего), которая содержит процентное содержание клеток, способных продуцировать ЭПО, в количестве, которое превышает процентное содержание клеток, способных продуцировать ЭПО, в исходной популяции. К примеру, термин «В4» означает популяцию клеток, полученных из исходной популяции клеток почек, которая содержит большее процентное содержание ЭПО-продуцирующих клеток, гломерулярных клеток и васкулярных клеток по сравнению с исходной популяцией. Популяции клеток могут быть обогащены одним или более типами клеток и обедненены одним или более типами других клеток. К примеру, обогащенная ЭПО-продуцирующирующими клетками популяция может быть обогащена интерстициальными фибробластами и обедненена тубулярными клетками и эпителиальными клетками собирательных протоков по отношению к интерстициальным фибробластам и тубулярным клеткам в необогащенной популяции клеток, т.е. в исходной популяции клеток из которой получена обогащенная популяция клеток. Во всех вариантах реализации изобретения, упоминающих ЭПО-обогащенные или «В4» популяции, обогащенные популяции клеток представляют собой гетерогенные популяции клеток, содержащие клетки, которые могут синтезировать ЭПО кислород-регулируемым образом, как показано с помощью кислород-регулируемой экспрессии ЭПО нативным эндогенным геном ЭПО.
В другом аспекте изобретения обогащенная популяция клеток почек, которая содержит большее процентное содержание клеток специфического типа, например, васкулярные, гломерулярные или эндокринные клетки, чем процентное содержание такого типа клеток в исходной популяции, также может быть дефицитной по одному или более типам специфических клеток, например, васкулярных, гломерулярных или эндокринных клеток, по сравнению с исходной популяцией клеток почек, полученной от здорового индивида или субъекта. К примеру, в одном аспекте изобретения термин «B4'» или «В4-прайм» означает популяцию клеток, полученную из исходной популяции клеток почек, в которой отсутствует или которая дефицитна по одному или более типам клеток, например, васкулярных, гломерулярных или эндокринных клеток, в зависимости от болезненного состояния исходного образца по сравнению со здоровым индивидом. В одном варианте реализации изобретения популяцию клеток В4' получают от субъекта, страдающего хронической болезнью почек. В одном варианте реализации изобретения популяцию клеток В4' получают от субъекта, страдающего фокально-сегментарным гломерулосклерозом (ФСГС). В другом варианте реализации изобретения популяцию клеток В4' получают от субъекта, страдающего аутоиммунным гломерулонефритом. В другом аспекте изобретения популяцию клеток В4' получают из исходной популяции клеток, включающей все типы клеток, например, васкулярные, гломерулярные или эндокринные клетки, которую впоследствии обедняют или делают дефицитной по одному или более типам клеток, например, васкулярных, гломерулярных или эндокринных клеток. В еще одном аспекте изобретения популяцию клеток В4' получают из исходной популяции клеток, включающей все типы клеток, например, васкулярные, гломерулярные или эндокринные клетки, которую впоследствии обогащают одним или более специфическими типами клеток, например, васкулярных, гломерулярных или эндокринных клеток. К примеру, в одном варианте реализации изобретения популяция клеток В4' может быть обогащена васкулярными клетками, но обедненена гломерулярными и/или эндокринными клетками. В другом варианте реализации изобретения популяция клеток В4' может быть обогащена гломерулярными клетками, но обедненена васкулярными и/или эндокринными клетками. В другом варианте реализации изобретения популяция клеток В4' может быть обогащена эндокринными клетками, но обедненена васкулярными и/или гломерулярными клетками. В другом варианте реализации изобретения популяция клеток В4' может быть обогащена васкулярными и эндокринными клетками, но обедненена гломерулярными клетками. В предпочтительных вариантах реализации изобретения популяция клеток В4' сама или в смеси с другой обогащенной популяцией, например В2 и/или В3, сохраняет терапевтические свойства. Популяция клеток В4', к примеру, описана в данном документе в Примерах, например, Примерах 11-13.
В другом аспекте изобретения обогащенная популяция клеток также может относиться к популяции клеток, полученной из исходной популяции клеток почек, как отмечено выше, которая содержит процентное содержание клеток, экспрессирующих один или более васкулярных, гломерулярных и проксимальных тубулярных маркеров с несколькими ЭПО-продуцирующими клетками, которое превышает процентное содержание клеток в исходной популяции, экспрессирующих один или более васкулярных, гломерулярных и проксимальных тубулярных маркеров с несколькими ЭПО-продуцирующими клетками. К примеру, термин «В3» относится к популяции клеток, полученной из исходной популяции клеток почек, которая содержит большее процентное содержание проксимальных тубулярных клеток, а также васкулярных и гломерулярных клеток, по сравнению с исходной популяцией. В одном варианте реализации изобретения популяция клеток В3 содержит большее процентное содержание проксимальных тубулярных клеток по сравнению с исходной популяцией, но меньше, чем процентное содержание проксимальных тубулярных клеток по сравнению с популяцией клеток В2. В другом варианте реализации изобретения популяция клеток В3 содержит большее процентное содержание васкулярных и гломерулярных клеточных маркеров с несколькими ЭПО-продуцирующими клетками по сравнению с исходной популяцией, но меньше, чем процентное содержание васкулярных и гломерулярных клеточных маркеров с несколькими ЭПО-продуцирующими клетками по сравнению с популяцией клеток В4.
В другом аспекте изобретения обогащенная популяция клеток также может относиться к популяции клеток, полученной из исходной популяции клеток почек, как отмечено выше, которая содержит процентное содержание клеток, экспрессирующих один или более тубулярных клеточных маркеров, которое превышает процентное содержание клеток в исходной популяции, экспрессирующих один или более тубулярных клеточных маркеров. К примеру, термин «В2» относится к популяции клеток, полученной из исходной популяции клеток почек, которая содержит большее процентное содержание тубулярных клеток по сравнению с исходной популяцией. Кроме того, популяция клеток, обогащенная клетками, которые экспрессируют один или более тубулярных клеточных маркеров (или «В2»), может содержать несколько эпителиальных клеток из собирательной дуктальной системы. Хотя популяция клеток, обогащенная клетками, которые экспрессируют один или более тубулярных клеточных маркеров (или «В2»), является относительно обедненной ЭПО-продуцирующими клетками, гломерулярными клетками и васкулярными клетками, данная обогащенная популяция может содержать меньшее процентное содержание этих клеток (ЭПО-продуцирующих, гломерулярных и васкулярных) по сравнению с исходной популяцией. В общем, гетерогенная популяция клеток является обедненной одним или более типами клеток, так чтобы данная обедненная популяция клеток содержала меньшее соотношение типа(ов) клеток относительно соотношения типа(ов) клеток, содержавшихся в гетерогенной популяции клеток до обедненения. Типы клеток, которые могут быть удалены, представляют любой тип клеток почек. К примеру, в некоторых вариантах реализации изобретения типы клеток, которые могут быть удалены, включают клетки с большой гранулярностью собирательной дуктальной и тубулярной системы, имеющие плотность приблизительно <1,045 г/мл и называемые «В1». В некоторых вариантах реализации изобретения типы клеток, которые могут быть удалены, включают дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, имеющие плотность приблизительно >1,095 г/мл и называемые «В5». В некоторых вариантах реализации изобретения популяция клеток, обогащенная тубулярными клетками, относительно обедненена всеми следующих типами клеток: «В1», «В5», кислород-регулируемые ЭПО-экспрессирующие клетки, гломерулярные клетки и васкулярные клетки.
Как используется в данном документе, термин «гипоксические» условия культивирования относится к условиям культивирования, в которых клетки подвержены воздействию в системе культивирования пониженных уровней доступного кислорода по отношению к стандартным условиям культивирования, в которых клетки культивируют при уровнях атмосферного кислорода (около 21%). Негипоксическими условиями в данном документе называют нормальные или нормоксические условия.
Как используется в данном документе, термин «кислород-регулируемый» относится к способности клеток модулировать (повышать или понижать) экспрессию генов, обусловленной количеством доступного для клеток кислорода. Термин «гипоксия-индуцированный» относится к активации экспрессии генов в ответ на снижение давления кислорода (независимо от предварительной индукции или исходного давления кислорода).
Как используется в данном документе, термин «биоматериал» относится к природному или синтетическому биосовместимому материалу, который пригоден для внедрения в живые ткани. Природный материал представляет собой материал, созданный с помощью или происходящий из живой системы. Синтетические материалы представляют собой материалы, которые не созданы с помощью или не происходят из живой системы. Биоматериалы, описанные в данном документе, могут быть комбинацией природных или синтетических биосовместимых материалов. Как используется в данном документе, биоматериалы включают, к примеру, полимерные матрицы и каркасы. Средний специалист в данной области техники знает, что биоматериал(ы) может иметь конфигурацию в виде различных форм, к примеру, пористой пены, гелей, жидкостей, гранул, твердых элементов, и может содержать один или более природных и синтетических биосовместимых материалов. В одном варианте реализации изобретения биоматериал представляет собой жидкую форму в виде раствора, которая способна становиться гидрогелем.
Термин «модифицированное высвобождение» или эквивалентные термины «контролируемое высвобождение», «отсроченное высвобождение» или «медленное высвобождение» относятся к составам, которые высвобождают активный агент, такой как биологически активные клетки, в течение времени или больше чем в один момент времени после введения индивиду. Модифицированное высвобождение активного агента, которое может происходить в диапазоне требуемых периодов времени, например, минут, часов, суток, недель или дольше, в зависимости от состава, отличается от стандартных составов, в которых практически вся единица дозирования доступна немедленно после введения. Для применения в тканевой инженерии и регенеративной медицине предложены предпочтительные составы с модифицированным высвобождением для высвобождения активного агента в множестве временных точек после местного введения (например, введение активного агента непосредственно в цельный орган). К примеру, состав с модифицированным высвобождением биологически активных клеток может обеспечить начальное высвобождение клеток немедленно во время введения, а позднее второе высвобождение клеток - в последующий период времени. Временная задержка второго высвобождения активного агента может составлять минуты, часы или сутки после начального введения. В общем, период времени задержки высвобождения соответствует периоду времени, которое необходимо носителю активного агента из биоматериала для потери своей структурной целостности. Отсроченное высвобождение активного агента начинается, как только начинает нарушаться целостность и завершается до момента, когда целостность полностью теряется. Средним специалистам в данной области техники известны другие подходящие механизмы высвобождения.
Как используется в данном документе, термин «анемия» относится к дефициту количества красных клеток крови и/или уровней гемоглобина из-за нарушенного синтеза функционального белка ЭПО ЭПО-продуцирующими клетками субъекта и/или нарушенного высвобождения белка ЭПО в системный кровоток и/или неспособности эритробластов костного мозга реагировать на белок ЭПО. Субъект с анемией неспособен поддерживать эритроидный гомеостаз. В общем, анемия может происходить с ухудшением или потерей функционирования почек (например, хроничечная почечная недостаточность), анемией, ассоциированной с относительным дефицитом ЭПО, анемией, ассоциированной с застойной сердечной недостаточностью, анемией, ассоциированной с миелосупрессивной терапией, такой как химиотерапия или противовирусная терапия (например, с АЗТ), анемией, ассоциированной с немиелоидными видами рака, анемией, ассоциированной с вирусными инфекциями, такими как ВИЧ, и анемией при хронических заболеваниях, таких как аутоиммунные заболевания (например, ревматоидный артрит), заболеванием печени и функциональной недостаточностью многих органов.
Термин «дефицит ЭПО» относится к любому состоянию или нарушению, которое поддается лечению с помощью агониста рецептора эритропоэтина (например, рекомбинантного ЭПО или аналогов ЭПО), включая анемию.
Как используется в данном документе, термин «заболевание, связанное с органом» относится к нарушениям, ассоциированным с любой стадией или степенью острой или хронической недостаточности органа, которая приводит к потере органом способности выполнять свои функции.
Как используется в данном документе, термин «болезнь почек» относится к нарушениям, ассоциированным с любой стадией или степенью острой или хронической почечной недостаточности, которая приводит к потере способности почки выполнять функцию фильтрации крови и удаления из крови избыточной жидкости, электролитов и продуктов жизнедеятельности. Болезнь почек также включает эндокринные дисфункции, такие как анемия (дефицит эритропоэтина) и минеральный дисбаланс (дефицит витамина D). Болезнь почек может возникать в почке или может быть вторичной относительно различных состояний, включая (в частности) сердечную недостаточность, гипертензию, диабет, аутоиммунное заболевание или заболевание печени. Болезнь почек может быть состоянием хронической болезни почек, которая развивается после острого повреждения почки. К примеру, повреждение почки вследствие ишемии и/или воздействия токсических веществ может вызвать острую почечную недостаточность; неполное восстановление после острого повреждения почки может привести к развитию хронической почечной недостаточности.
Термин «лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам в отношении болезни почек, анемии, дефицита ЭПО, недостаточности тубулярного транспорта или недостаточности гломерулярной фильтрации, причем целью лечения является устранение, предупреждение или замедление (облегчение) целевого нарушения. Лица, нуждающиеся в лечении, включают тех, кто уже поражены болезнью почек, анемией, недостаточностью ЭПО, недостаточностью тубулярного транспорта или недостаточностью гломерулярной фильтрации, а также тех, кто склонны к болезни почек, анемии, дефициту ЭПО, недостаточности тубулярного транспорта или недостаточности гломерулярной фильтрации, или тех, у которых необходимо предупредить развитие болезни почек, анемии, дефицита ЭПО, недостаточности тубулярного транспорта или недостаточности гломерулярной фильтрации. Как используется в данном документе, термин «лечение» включает стабилизацию и/или улучшение функционирования почек.
Как используется в данном документе, термин «приведение в контакт in vivo» относится к осуществлению прямого контакта in vivo между продуктом, секретируемым обогащенной популяцией клеток, и нативным органом. К примеру, продукты, секретируемые обогащенной популяцией клеток почек (или смесью или конструкцией, содержащей клетки почек/фракции клеток почек), могут контактировать с нативной почкой in vivo. Прямое приведение в контакт in vivo по природе может быть паракринным, эндокринным или юкстакринным. Секретируемые продукты могут быть гетерогенной популяцией разных продуктов, описанных в данном документе.
Как используется в данном документе, термин «рибонуклеиновая кислота» или «РНК» относится к цепи нуклеотидных единиц, в которой каждая единица состоит из азотистого основания, рибозного сахара и фосфата. РНК может существовать в одно- и двухцепочечной форме. РНК может быть частью, находиться внутри или быть ассоциирована с везикулой. Везикула может быть экзосомой. РНК включает без исключения: мРНК, рРНК, малые РНК, мяРНК, мякРНК, микроРНК (миРНК), короткие интерферирующие РНК (киРНК) и некодирующие РНК. РНК предпочтительно представляет собой РНК человека.
Термин «конструкция» относится к одной или более популяций клеток размещенных на или внутри поверхности каркаса или матрицы, сделанной из одного или более синтетических или встречающихся в природе биосовместимых материалов. Одна или более популяций клеток могут быть покрыты, осаждены на, внедрены в, прикреплены к, посажены на или захвачены биоматериалом, сделанным из одного или более синтетических или встречающихся в природе биосовместимых биоматериалов, полимеров, белков или пептидов. Одна или более популяций клеток могут быть соединены с биоматериалом или каркасом или матрицей in vitro или in vivo. В общем, один или более биосовместимых материалов, использованных для образования каркаса/биоматериала выбирают для направления, облегчения или обеспечения образования мультиклеточной трехмерной структуры из по меньшей мере размещенных на нем популяций клеток. Один или более биоматериалов, использованных для образования конструкции также могут выбираться для направления, облегчения или обеспечения диспергирования и/или интеграции конструкции или клеточных компонентов конструкции с эндогенной тканью хозяина или для направления, облегчения или обеспечения выживания, приживления или функциональных характеристик конструкции или клеточных компонентов конструкции.
Термин «маркер» или «биомаркер», как правило, относится к ДНК, РНК, белку, углеводу или молекулярному маркеру на основе гликолипида, экспрессия или наличие которых в культивируемой популяции клеток могут быть выявлены стандартными методами (или методами, описанными в данном документе), которые указывают на присутствие одной или более клеток в культивируемой популяции клеток, представляющих конкретный тип клеток. Такие биомаркеры включают, в частности: гены, описанные в Таблицах X и Y. Данный маркер может быть полипептидом, экспрессированным клеткой, или идентифицируемой физической локализацией на хромосоме, такой как ген, сайтом распознавания рестрикционной эндонуклеазы или нуклеиновой кислотой, кодирующей полипептид (например, мРНК), экспрессирущийся нативной клеткой. Маркер может быть экспрессирующимся участком гена, называемым «маркером экспрессии гена» или определенным сегментом ДНК без известной кодирующей функции. Биомаркеры могут быть клеточного происхождения, например, секретируемые продукты.
Термины «сигнатура биомаркера», «сигнатура», «сигнатура экспрессии биомаркера» или «сигнатура экспрессии» используют в данном документе взаимозаменяемо и относят к одному или комбинации биомаркеров, экспрессия которых является индикатором типа(ов) клеток, например, эпителиальных, тубулярных и т.п., включая популяцию клеток, например, биологически активные клетки почек. Сигнатура биомаркера может служить индикатором пригодности популяции клеток для применения в способах и при изготовлении, предложенных в данном документе. В некоторых вариантах реализации изобретения сигнатура биомаркера представляет собой «генную сигнатуру». Термин «генная сигнатура» применяется взаимозаменяемо с термином «сигнатура экспрессии гена» и относится к одному или комбинации полинуклеотидов, экспрессия которых является индикатором типа клеток, например, эпителиальных, тубулярных и т.п. В некоторых вариантах реализации изобретения сигнатура биомаркера представляет собой «белковую сигнатуру». Термин «белковая сигнатура» применяется взаимозаменяемо с термином «сигнатура экспрессии белка» и относится к одному или комбинации полипептидов, экспрессия которых является индикатором типа клеток, например, эпителиальных, тубулярных и т.п.
Термины «уровень экспрессии» или «экспрессионный уровень» применяются взаимозаменяемо и, как правило, относятся к количеству полинуклеотида или аминокислотного продукта или белка в биологическом образце или процентному содержанию клеток, экспрессирующих данный полинуклеотид или аминокислотный продукт или белок. «Экспрессирование» или «экспрессия» и их грамматические варианты относятся к наличию в биологическом образце полинуклеотида или аминокислотного продукта или белка в детектируемом количестве. К примеру, белок, который находится в детектируемом количестве (выше значения фона или контрольных значений), может быть назван экспрессирующимся белком. Аналогичным образом, если часть клеток в образце экспрессирует белок, то данный образец может быть назван экспрессирующим белок. Кроме того, данный образец может быть назван обладающим уровнем экспрессии относительно процентного содержания клеток, экспрессирующих этот белок, например, если 60% клеток в образце экспрессируют белок, тогда уровень экспрессии равен 60%.
Термин «дифференциально экспрессирующийся ген», «дифференциальная экспрессия гена» и их синонимы, которые используются взаимозаменяемо, относятся к гену, экспрессия которого активируется в первой клетке или популяции клеток на больший или меньший уровень по сравнению с его экспрессией во второй клетке или популяции клеток. Данные термины включают также гены, экспрессия которых активируется на больший или меньший уровень на разных этапах с течением времени при пассаже в культуре первой или второй клетки. Также понятно, что дифференциально экспрессирующийся ген может быть или активированным или ингибированным на уровне нуклеиновой кислоты или уровне белка или может быть объектом альтернативного сплайсинга, приводящего к получению отличного полипептидного продукта. Такие отличия могут подтверждаться, к примеру, изменением уровней мРНК, поверхностной экспрессии, секреции или другого разделения полипептида. Дифференциальная экспрессия гена может включать сравнение экспрессии двух и более генов или их генных продуктов или сравнение скоростей экспрессии двух и более генов или их генных продуктов или даже сравнение двух по-разному процессируемых продуктов одного и того же гена, которые отличаются у первой и второй клетки. Дифференциальная экспрессия включает количественные, а также качественные изменения временного или клеточного паттерна экспрессии гена или его продуктов экспрессии между, к примеру, первой и второй клетками. Для целей этого описания считают, что «дифференциальная экспрессия гена» имеет место, когда существует разница между экспрессией данного гена в первой и второй клетках. Дифференциальная экспрессия маркера может происходить в клетках пациента перед введением популяции клеток, смеси или конструкции (первая клетка) относительно экспрессии в клетках пациента после введения (вторая клетка).
Термины «ингибировать», «подавлять», «понижать экспрессию» и «снижать» применяют взаимозаменяемо и они означают, что экспрессия гена или уровень молекул РНК или молекул эквивалентных РНК, кодирующих один или более белков или белковых субъединиц или активность одного или более белков или белковых субъединиц, снижается относительно одного или более контрольных параметров, таких как, к примеру, один или более положительных и/или отрицательных контролей. Пониженная экспрессия может происходить в клетках пациента перед введением популяции клеток, смеси или конструкции относительно клеток пациента после введения.
Термин «активировать» или «сверхэкспрессировать» применяют для обозначения того, что экспрессия гена или уровень молекул РНК или молекул эквивалентных РНК, кодирующих один или более белков или белковых субъединиц или активность одного или более белков или белковых субъединиц, повышается относительно одного или более контрольных параметров, таких как, к примеру, один или более положительных и/или отрицательных контролей. Сверхэкспрессия может происходить в клетках пациента после введения популяции клеток, смеси или конструкции относительно клеток пациента перед введением.
Под термином «субъект» следует понимать любого субъекта-человека, включая пациента, подходящего для лечения, который проявляет или проявил один или более признаков, симптомов или других индикаторов зависимого от органа заболевания, такого как болезнь почек, анемия или дефицит ЭПО. Такие субъекты включают, в частности субъекты, у которых, независимо от причины, недавно диагностировали или ранее диагностировали и в данный момент проявляется рецидив или обострение или существует риск болезни почек, анемии или дефицита ЭПО. Субъект мог ранее проходить лечение болезни почек, анемии или дефицита ЭПО или не получать такого лечения.
Термин «пациент» относится к любому единичному животному, предпочтительнее млекопитающему (включая нечеловекообразных животных как, к примеру, собак, кошек, лошадей, кроликов, животных, содержащихся в зоопарке, коров, свиней, овец и приматов кроме человека), которым требуется лечение. В данном документе наиболее предпочтительным пациентом является человек.
Под термином «образец» или «образец от пациента» или «биологический образец», как правило, следует понимать любой биологический образец, полученный от субъекта или пациента, биологическую жидкость, линию клеток, культуру тканей или другой источник. Термин включает биоптаты тканей, такие как, к примеру, материалы, полученные при биопсии почек. Термин включает культивированные клетки, такие как, к примеру, культивированные клетки почек млекопитающих. Способы получения биоптата тканей и культивированных клеток млекопитающих хорошо известны в данной области техники. Если термин «образец» используют сам по себе, то следует понимать, что «образец», «биологический образец» или «образец от пациента», т.е. данные термины применяют взаимозаменяемо.
Термин «исследуемый образец» относится к образцу от субъекта, которого лечили способом, описанным в данном документе. Испытуемый образец может происходить из различных источников субъекта-млекопитающего, включая, в частности: кровь, семенную жидкость, сыворотку, мочу, костный мозг, слизистую оболочку, ткань и т.п.
Термин «контроль» или «контрольный образец» относится к отрицательному или положительному контролю, с помощью отрицательного и положительного результата которого ожидают провести корреляцию результата исследуемого образца. Подходящие для этого контроли включают, в частности: образец, о котором известно, что он проявляет индикаторные характеристики нормального эритроидного гомеостаза, образец, о котором известно, что он проявляет индикаторные характеристики анемии, образец, полученный от субъекта, о котором известно, что он не болен анемией и образец, полученный от субъекта, о котором известно, что он болен анемией. Дополнительные контроли, подходящие для использования в способах, предложенных в данном документе включают, в частности: образцы, полученные от субъектов, которых лечили фармакологическими агентами, которые, как известно, модулируют эритропоэз (например, рекомбинантный ЭПО или аналоги ЭПО). Кроме того, контроль может быть образцом, полученным от субъекта перед лечением способом, описанным в данном документе. Дополнительным подходящим контролем может быть исследуемый образец, полученный от субъекта, о котором известно, что он болен любым типом или находится на любой стадии болезни почек, и образец от субъекта, о котором известно, что он не болен любым типом или не находится на любой стадии болезни почек. Контроль может быть контролем от подходящего нормального здорового субъекта. Специалистам в данной области техники известны другие виды контролей, подходящие для применения согласно данному изобретению.
Термин «прогноз регенерации», «регенеративный прогноз» или «прогностический признак регенерации», как правило, относится к предвидению или прогнозированию вероятного регенеративного курса или результата введения или имплантации популяции клеток, смеси или конструкции, описанной в данном документе. Для прогноза регенерации предвидение или прогнозирование могут быть получены по одному или более из следующих признаков: улучшение функционального органа (например, почки) после имплантации или введения, развитие функциональной почки после имплантации или введения, достижение улучшенного функционирования или способности почки после имплантации или введения и экспрессия определенных маркеров нативной почкой после имплантации или введения.
Термин «регенерированный орган» относится к нативному органу после имплантации или введения популяции клеток, смеси или конструкции, описанной в данном документе. Регенерированный орган характеризуется различными индикаторами, включая, в частности: достижение функционирования или способности нативного органа, улучшение функционирования или способности нативного органа и экспрессию определенных маркеров нативного органа. Средним специалистам в данной области техники известно, что для описания характеристик регенерированного органа могут подходить другие индикаторы.
Термин «регенерированная почка» относится к нативной почке после имплантации или введения популяции клеток, смеси или конструкции, описанной в данном документе. Регенерированная почка характеризуется различными индикаторами, включая, в частности: развитие функционирования или способности нативной почки, улучшение функционирования или способности нативной почки и экспрессия определенных маркеров нативной почки. Средним специалистам в данной области техники известно, что для описания характеристик регенерированной почки могут подходить другие индикаторы.
Термин «клеточный агрегат» или «сфероид» относится к агрегату или скоплению клеток, культивированным так, чтобы обеспечить 3D-рост в противоположность росту в виде монослоя. Следует отметить, что термин «сфероид» не подразумевает, что данный агрегат представляет собой геометрическую сферу. Агрегат может быть высокоорганизованным с хорошо определенной морфологией или он может быть неорганизованной массой; он может включать единственный тип клеток или более одного типа клеток. Клетки могут быть первичными изолятами или постоянной линией клеток или комбинацией этих двух типов. В это определение включают органоиды и органотипические культуры.
Термин «температура окружающей среды» относится к температуре, при которой составы по настоящему изобретению будут вводить субъекту. Как правило, температура окружающей среды является температурой помещения с контролем температуры. Температура окружающей среды лежит в диапазоне от около 18°C до около 30°C. В одном варианте реализации изобретения температура окружающей среды составляет около 18°C, около 19°C, около 20°C, около 21°C, около 22°C, около 23°C, около 24°C, около 25°C, около 26°C, около 27°C, около 28°C, около 29°C или около 30°C.
Слово «метка» при использовании в данном документе относится к соединению или композиции, которая конъюгирована или гибридизирована непосредственно или опосредованно с реагентом, таким как нуклеиновая кислота-зонд или антитело, и облегчает детекцию реагента, с которым она конъюгирована или гибридизирована. Метка может быть детектируемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение соединения-субстрата или композиции, которое может быть детектировано. Данный термин подразумевает непосредственное маркирование зондом или антителом путем соединения (т.е. физического связывания) детектируемого вещества с зондом или антителом, а также опосредованное маркирование зондом или антителом путем обеспечения реактивности с другим реагентом, который маркирован непосредственно. Примеры опосредованного маркирования включают детекцию первичного антитела с помощью флуоресцентномеченого вторичного антитела и зонда ДНК, маркированного на конце биотином, таким образом, чтобы была возможность детектировать его флуоресцентномеченым стрептавидином.
Термин «детекция» включает любые способы детектирования, включая непосредственную или опосредованную детекцию.
Термин «набор» представляет собой любое промышленное изделие (например, упаковку или контейнер), содержащее по меньшей мере один реагент, например, лекарственное средство для лечения болезни почек или зонд для специфического детектирования гена или белка биомаркера, описанного в данном документе. Промышленное изделие преимущественно продвигается, распределяется или реализуется на рынке в виде единицы для осуществления способов лечения, описанных в данном документе.
2. Популяции клеток
Составы по настоящему изобретению могут содержать выделенные гетерогенные популяции клеток почек и их смеси, обогащенные специфическими биологически активными компонентами или типами клеток и/или обедненные специфическими неактивными или нежелательными компонентами или типами клеток, для применения при лечении болезни почек, т.е. обеспечивая стабилизацию и/или улучшение и/или восстановление функционирования почек, описанные ранее в заявках Presnell et al. U.S. 2011-0117162 и Ilagan et al. PCT/US2011/036347, полное содержание которых включено в данный документ посредством ссылки. Составы могут содержать выделенные фракции клеток почек, у которых недостаточно клеточных компонентов по сравнению с фракциями здорового индивида, но еще сохраняются терапевтические свойства, т.е. обеспечивается стабилизация и/или восстановление функционирования почек. Популяции клеток, фракции клеток и/или смеси клеток, описанные в данном документе, могут быть получены от здоровых индивидов, индивидов с болезнью почек или субъектов, описанных в данном документе.
В настоящем описании предложены составы, которые подходят для применения с различными биологически активными популяциями клеток, включая, в частности: выделенную(ые) популяцию(и) клеток, фракцию(и) клеток, смесь(и), обогащенную(ые) популяцию(и) клеток, агрегат(ы) клеток и их любые комбинации. В одном варианте реализации изобретения биологически активные популяции клеток представляют собой клетки почек.
Популяции биологически активных клеток
Настоящее описание предполагает терапевтические составы, подходящие для популяций биологически активных клеток, которые должны вводиться в целевые органы или ткани нуждающегося субъекта. Популяция биологически активных клеток, как правило, относится к популяции клеток потенциально обладающей терапевтическими свойствами при введении субъекту. К примеру, при введении нуждающемуся субъекту популяция биологически активных клеток почек может обеспечить стабилизацию и/или улучшение и/или восстановление функционирования почки у субъекта. Терапевтические свойства могут включать регенеративный эффект.
Популяции биологически активных клеток включают, в частности: стволовые клетки (например, плюрипотентные, мультипотентные, олигопотентные или унипотентные), такие как эмбриональные стволовые клетки, амниотические стволовые клетки, стволовые клетки взрослого человека (например, гемопоэтические, клетки молочной железы, интестинальные, мезенхимальные, плацентарные, клетки легкого, костного мозга, крови, пуповины, эндотелиальные, зубной пульпы, адипозные, нервные, обонятельные, нервного гребня, тестикулярные), индуцированные плюрипотентные стволовые клетки; генетически модифицированные клетки; а также популяции клеток или тканевых эксплантов, полученных их любого источника организма. Составы по настоящему изобретению также могут применяться с популяциями клеток, полученных из адипозной ткани почки, как описано в заявке Basu et al. PCT/US11/39859, поданной 9 июня 2011 г.; и с клетками гладких мышц, полученных из адипозной ткани или периферической крови, описанных в завке Ludlow et al. U.S. 2010-0131075 и Ludlow et al. PCT/US11/35058, поданной 3 мая 2011 г.; или с уротелиальными клетками или клетками гладких мышц, полученных из мочевого пузыря, как описано в патенте Atala U.S. 6576019, каждый из которых включен в данный документ в полном объеме посредством ссылки. Популяции биологически активных клеток могут быть выделены, обогащены, очищены и быть по своей природе гомогенными или гетерогенными. Средним специалистам в данной области техники известны другие популяции биологически активных клеток, которые пригодны для применения в составах по настоящему изобретению.
В одном варианте реализации изобретения источник клеток совпадает с предполагаемым целевым органом или тканью. К примеру, клетки почек, которые должны применяться в составе, предполагающем введение в почку, могут происходить из почки. В другом варианте реализации изобретения источник клеток не совпадает с предполагаемым целевым органом или тканью. К примеру, эритропоэтин-экспрессирующие клетки могут быть получены из адипозной ткани почки, которая должна применяться в составе, предполагающем введение в почку.
В одном аспекте изобретения в настоящем описании предложены составы, содержащие определенные субфракции гетерогенной популяции клеток почек, обогащенные биологически активными компонентами и обедненные неактивными или нежелательными компонентами, обеспечивающие превосходные терапевтические и регенеративные результаты по сравнению с исходной популяцией. К примеру, биологически активные клетки почек, описанные в данном документе, например, В2, В4 и В3, которые обеднены неактивными или нежелательными компонентами, например, В1 и В5, сами по себе или в смеси, могут составлять часть состава, применяемого для стабилизации и/или улучшения и/или восстановления функционирования почек.
В другом аспекте изобретения составы содержат специфическую субфракцию, В4, обедненную или дефицитную по одному или более типов клеток, например, васкулярных, эндокринных или эндотелиальных, т.е. В4', которые сохраняют терапевтические свойства, например, стабилизацию и/или улучшение и/или восстановление функционирования почек, сами по себе или в смеси с другими биологически активными субфракциями, например, В2 и/или В3. В предпочтительном варианте реализации изобретения популяция биологически активных клеток представляет собой популяцию В2. В некоторых вариантах реализации изобретения популяция клеток В2 смешана с популяциями В4 или В4'. В других вариантах реализации изобретения популяция клеток В2 смешана с популяцией В3. В других вариантах реализации изобретения популяция клеток В2 смешана как с популяцией В3, так и с В4, или со специфическими клеточными компонентами популяций В3 и/или В4.
Популяция клеток В2 характеризуется экспрессией маркера тубулярных клеток, выбранного из группы, состоящей из одного или более из следующих маркеров: мегалина, кубилина, синтазы 2 гиалуроновой кислоты (HAS2), 25-гидролазы витамина D3 (CYP2D25), N-кадгерина (Ncad), Е-кадгерина (Ecad), аквапорина-1 (Aqp1), аквапорина-2 (Aqp2), RAB17, представителя семейства онкогенов RAS (Rab17), GATA-связывающего белка 3 (Gata3), FXYD-домен-содержащего регулятора ионного транспорта 4 (Fxyd4), представителя 4 (Slc9a4) семейства 9 растворимых переносчиков (антипортер ионов натрия/водорода), представителя В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), представителя A3 семейства альдегиддегидрогеназы 1 (Aldh1a3) и кальпаина-8 (Capn8) и маркера собирательных протоков аквапорина-4 (Aqp4). Популяция В2 больше и более гранулярная, чем В3 и/или В4 и, поэтому, имеет плавучую плотность между около 1,045 г/мл и около 1,063 г/мл (грызуны), между около 1,045 г/мл и 1,052 г/мл (человек) и между около 1,045 г/мл и около 1,058 г/мл (собака).
Популяция клеток В3 характеризуется экспрессией васкулярных, гломерулярных и проксимальных тубулярных маркеров с некоторыми ЭПО-продуцирующими клетками, имеющими промежуточный размер и гранулярность по сравнению с популяциями В2 и В4 и, поэтому, имеет плавучую плотность между около 1,063 г/мл и около 1,073 г/мл (грызуны), между около 1,052 г/мл и 1,063 г/мл (человек) и между около 1,058 г/мл и около 1,063 г/мл (собака). Популяция В3 характеризуются экспрессией маркеров, выбранных из группы, состоящей из одного или более из следующих маркеров: аквапорина-7 (Aqp7), FXYD-домен-содержащего регулятора 2 ионного транспорта (Fxyd2), представителя 3 (Slc17a3) семейства 17 растворимых переносчиков (фосфат натрия), представителя 1 (Slc3a1) семейства 3 растворимых переносчиков, клаудина-2 (Cldn2), аспарагиновая пептидаза напсин A (Napsa), представителя 2 (Slc2a2) семейства 2 растворимых переносчиков (транспортер глюкозы облегченной диффузии), аланиламинопептидазы (Anpep) (мембранная), трансмебранного белка 27 (Tmem27), представителя 2 (Acsm2) семейства ацил-КоА-синтетаз средней длины цепей, глутатионпероксидазы 3 (Gpx3), фруктозо-1,6-бифосфатазы 1 (Fbp1) и аланинглиоксилат-аминотрансферазы 2 (Agxt2). Популяция В3 также характеризуются васкулярным маркером экспрессии, молекулой адгезии тромбоцитов/эндотелиальных клеток (Pecam) и гломерулярным маркером экспрессии подоцином (Podn).
Популяция клеток В4 характеризуется экспрессией набора васкулярных маркеров, содержащего один или более из следующих маркеров: РЕСАМ, VEGF, KDR, HIF1a, CD31, CD146; набора гломерулярных маркеров, содержащего один или более из следующих маркеров: подоцин (Podn) и нефрин (Neph); и кислород-регулируемой ЭПО-обогащенной популяцией по сравнению с нефракционированной (UNFX), В2 и В3. Популяция В4 также характеризуется экспрессией одного или более из следующих маркеров: рецептора 4 (Cxcr4) хемокинов (с мотивом С-Х-С), рецептора эндотелина В-типа (Ednrb), коллагена V-типа альфа 2 (Col5a2), кадгерина 5 (Cdh5), тканевого активатора плазминогена (Plat), ангиопоэтина 2 (Angpt2), белкового рецептора, содержащего домен киназной вставки (Kdr), кислого богатого цистеином секретируемого белка (остеонектин) (Sparc), серглицина (Srgn), ингибитора 3 металлопептидазы TIMP (Timp3), белка опухоли Вильмса 1 (Wt1), представителя 4 (Wnt4) семейства сайтов интеграции MMTV типа wingless, регулятора G-белкового сигналинга 4 (Rgs4), молекулы адгезии тромбоцитов/эндотелиальных клеток (Pecam) и эритропоэтина (Эпо). Популяция В4 также характеризуется меньшими менее гранулярными клетками по сравнению с популяцией В2 или В3 с плавучей плотностью между около 1,073 г/мл и около 1,091 г/мл (грызуны), между около 1,063 г/мл и около 1,091 г/мл (человек и собака).
Популяцию клеток В4' определяют как имеющую плавучую плотность между 1,063 г/мл и 1,091 г/мл и экспрессирующую один или более из следующих маркеров: РЕСАМ, vEGF, KDR, HIF1a, подоцин, нефрин, ЭПО, CK7, CK8/18/19. В одном варианте реализации изобретения популяция клеток В4' характеризуется экспрессией набора васкулярных маркеров, содержащего один или более из следующих маркеров: РЕСАМ, vEGF, KDR, HIF1a, CD31, CD146. В другом варианте реализации изобретения популяция клеток В4' характеризуется экспрессией эндокринного маркерного ЭПО. В одном варианте реализации изобретения популяция клеток В4' характеризуется экспрессией набора гломерулярных маркеров, содержащего один или более из следующих маркеров: подоцин (Podn) и нефрин (Neph). В некоторых вариантах реализации изобретения популяция клеток В4' характеризуется экспрессией набора васкулярных маркеров, содержащего один или более из следующих маркеров: РЕСАМ, vEGF, KDR, HIF1a, и экспрессией эндокринного маркерного ЭПО. В другом варианте реализации изобретения популяция В4' также характеризуются меньшими менее гранулярными клетками по сравнению с популяцией В2 или В3 с плавучей плотностью между около 1,073 г/мл и около 1,091 г/мл (грызуны), между около 1,063 г/мл и около 1,091 г/мл (человек и собака).
В одном аспекте изобретения в настоящем описании предложены составы, содержащие выделенную обогащенную популяцию клеток В4' почек человека, содержащую по меньшей мере одну из эритропоэтин(ЭПО)-продуцирующих клеток, васкулярных клеток и гломерулярных клеток, имеющую плотность между 1,063 г/мл и 1,091 г/мл. В одном варианте реализации изобретения популяция клеток В4' характеризуется экспрессией васкулярного маркера. В некоторых вариантах реализации изобретения популяция клеток В4' не характеризуется экспрессией гломерулярного маркера. В некоторых вариантах реализации изобретения популяция клеток В4' способна к кислород-регулируемой экспрессии эритропоэтина (ЭПО).
В одном варианте реализации изобретения состав содержит популяцию клеток В4', но не включает популяцию клеток В2, содержащую тубулярные клетки, имеющую плотность между 1,045 г/мл и 1,052 г/мл. В другом варианте реализации изобретения состав с популяцией клеток В4' не включает популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл. В еще одном варианте реализации изобретения состав с популяцией клеток В4' не включает популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл.
В одном варианте реализации изобретения состав, содержащий популяцию клеток В4' не включает популяцию клеток В2, содержащую тубулярные клетки, имеющую плотность между 1,045 г/мл и 1,052 г/мл; популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл и популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл. В некоторых вариантах реализации изобретения популяция клеток В4' может быть получена от субъекта, страдающего болезнью почек.
В одном аспекте изобретения в настоящем описании предложены составы, содержащие смеси клеток почек человека, включающие первую популяцию клеток, В2, содержащую выделенную обогащенную популяцию тубулярных клеток, имеющую плотность между 1,045 г/мл и 1,052 г/мл, и вторую популяцию клеток, В4', содержащую эритропоэтин(ЭПО)-продуцирующие клетки и васкулярные клетки, но обедненную гломерулярными клетками, имеющую плотность между около 1,063 г/мл и 1,091 г/мл, причем данная смесь не включает популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл, или популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл. В определенном варианте реализации изобретения популяция клеток В4' характеризуется экспрессией васкулярного маркера. В одном варианте реализации изобретения популяция клеток В4' не характеризуется экспрессией гломерулярного маркера. В некоторых вариантах реализации изобретения популяция В2 дополнительно содержит эпителиальные клетки собирательных протоков. В одном варианте реализации изобретения состав содержит смесь клеток, которая способна к рецептор-опосредованнному поглощению альбумина. В другом варианте реализации изобретения смесь клеток способна к кислород-регулируемой экспрессии эритропоэтина (ЭПО). В одном варианте реализации изобретения смесь содержит HAS-2-экспрессирующие клетки, способные продуцировать и/или стимулировать продукцию типов гиалуроновой кислоты (ГК) с высокой молекулярной массой как in vitro, так и in vivo. Во всех вариантах реализации изобретения первая и вторая популяция клеток может быть получена из ткани почек или культивированных клеток почек (Basu et al. Lipids in Health and Disease, 2011, 10: 171).
В одном варианте реализации изобретения состав содержит смесь, которая способна обеспечить регенеративный стимул при доставке in vivo. В других вариантах реализации изобретения смесь способна к уменьшению снижения, стабилизации или улучшению гломерулярной фильтрации, тубулярной резорбции, выработки мочи и/или эндокринной функции при доставке in vivo. В одном варианте реализации изобретения популяцию клеток В4' получают от субъекта, страдающего болезнью почек.
В одном аспекте изобретения в настоящем описании предложены составы, содержащие выделенную обогащенную популяцию клеток В4' почек человека, содержащую по меньшей мере одну из эритропоэтин(ЭПО)-продуцирующих клеток, васкулярных клеток и гломерулярных клеток, имеющую плотность между 1,063 г/мл и 1,091 г/мл. В одном варианте реализации изобретения популяция клеток В4' характеризуется экспрессией васкулярного маркера. В некоторых вариантах реализации изобретения популяция клеток В4' не характеризуется экспрессией гломерулярного маркера. Гломерулярный маркер, который не экспрессируется, может быть подоцином. В некоторых вариантах реализации изобретения популяция клеток В4' способна к кислород-регулируемой экспрессии эритропоэтина (ЭПО).
В одном варианте реализации изобретения состав, содержащий популяцию клеток В4', не включает популяцию клеток В2, содержащую тубулярные клетки, имеющую плотность между 1,045 г/мл и 1,052 г/мл. В другом варианте реализации изобретения состав с популяцией клеток В4' не включает популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл. В еще одном варианте реализации изобретения состав с популяцией клеток В4', не включает популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл.
В одном варианте реализации изобретения состав, содержащий популяцию клеток В4', не включает популяцию клеток В2, содержащую тубулярные клетки, имеющую плотность между 1,045 г/мл и 1,052 г/мл; популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл, и популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл. В некоторых вариантах реализации изобретения популяция клеток В4' может быть получена от субъекта, страдающего болезнью почек.
В одном аспекте изобретения в настоящем описании предложены составы, содержащие смесь клеток почек человека, включающие первую популяцию клеток, В2, содержащую выделенную обогащенную популяцию тубулярных клеток, имеющую плотность между 1,045 г/мл и 1,052 г/мл, и вторую популяцию клеток, В4', содержащую эритропоэтин(ЭПО)-продуцирующие клетки и васкулярные клетки, но обедненную гломерулярными клетками, имеющую плотность между 1,063 г/мл и 1,091 г/мл, причем данная смесь не включает популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл, или популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл. В одном варианте реализации изобретения популяция клеток В4' характеризуется экспрессией васкулярного маркера. В одном варианте реализации изобретения популяция клеток В4' не характеризуется экспрессией гломерулярного маркера. В некоторых вариантах реализации изобретения популяция В2 дополнительно содержит эпителиальные клетки собирательных протоков. В одном варианте реализации изобретения смесь клеток способна к рецептор-опосредованному поглощению альбумина. В другом варианте реализации изобретения смесь клеток способна к кислород-регулируемой экспрессии эритропоэтина (ЭПО). В одном варианте реализации изобретения смесь содержит HAS-2-экспрессирующие клетки, способные продуцировать и/или стимулировать продукцию типов гиалуроновой кислоты (ГК) с высокой молекулярной массой как in vitro, так и in vivo. Во всех вариантах реализации изобретения первая и вторая популяции клеток могут быть получены из ткани почек или культивированных клеток почек.
В другом аспекте изобретения в настоящем описании предложены составы, содержащие гетерогенные популяции клеток почек, включающие комбинацию фракций клеток или обогащенные популяции клеток (например, B1, В2, В3, В4 (или В4') и В5). В одном варианте реализации изобретения комбинация имеет плавучую плотность между около 1,045 г/мл и около 1, 091 г/мл. В еще одном другом варианте реализации изобретения комбинация имеет плавучую плотность между меньше чем около 1,045 г/мл и около 1,099 г/мл или около 1,100 г/мл. В другом варианте реализации изобретения комбинация имеет плавучую плотность, определенную при разделении на градиенте плотности, например, путем центрифугирования. В еще одном варианте реализации изобретения комбинация фракций клеток содержит популяции В2, В3 и В4 (или В4'), обедненена В1 и/или В5. В некоторых вариантах реализации изобретения комбинация фракций клеток содержит популяции В2, В3, В4 (или В4') и В5, но обедненена В1. После обедненения по В1 и/или В5 комбинацию можно культивировать in vitro перед приготовлением состава, содержащего комбинацию фракций клеток В2, В3 и В4 (или В4').
Изобретатели настоящего изобретения неожиданно обнаружили, что культивирование in vitro В1-обедненной комбинации популяций В2, В3, В4 и В5 приводит к обедненению по В5. В одном варианте реализации изобретения В5 обедняется после по меньшей мере одного, двух, трех, четырех или пяти пассажей. В еще одном другом варианте реализации изобретения комбинация фракций клеток В2, В3, В4 и В5, которая проходит пассажи в описанных в данном документе условиях, обеспечивает получение перевиваемой популяции клеток, содержащей популяцию В5 в процентном содержании, которое меньше чем около 5%, меньше чем около 4%, меньше чем около 3%, меньше чем около 2%, меньше чем около 1%, меньше чем около 0,5% от перевиваемой популяции клеток.
В другом варианте реализации изобретения популяция В4' являются частью комбинации фракций клеток. В другом варианте реализации изобретения обеднение В5 в процессе культивирования in vitro проводят в гипоксических условиях.
В одном варианте реализации изобретения состав содержит смесь, которая способна обеспечить регенеративный стимул при доставке in vivo. В других вариантах реализации изобретения смесь способна к уменьшению снижения, стабилизации или улучшению гломерулярной фильтрации, тубулярной резорбции, выработки мочи и/или эндокринной функции при доставке in vivo. В одном варианте реализации изобретения популяцию клеток В4' получают от субъекта, страдающего болезнью почек.
В предпочтительном варианте реализации изобретения состав содержит смесь, которая включает популяцию В2 в комбинации с В3 и/или В4. В другом предпочтительном варианте реализации изобретения смесь содержит популяцию В2 в комбинации с В3 и/или В4'. В других предпочтительных вариантах реализации изобретения смесь состоит из или преимущественно состоит из: (i) популяции В2 в комбинации с В3 и/или В4 или (ii) популяции В2 в комбинации с В3 и/или В4'.
Смесь, которая содержит популяцию клеток В4', может содержать популяции клеток В2 и/или В3, которые также получены от больного субъекта. Больной субъект может быть тем же субъектом, от которого получена фракция В4'. В противоположность популяции клеток В4' популяции клеток В2 и В3, полученные от больных субъектов, как правило, не являются дефицитными по одному или более специфических типов клеток по сравнению с исходной популяции клеток почек, полученной от здорового индивида.
Как описано в заявке Presnell et al. WO/2010/056328, было установлено, что препараты клеток В2 и В4 способны экспрессировать типы гиалуроновой кислоты (ГК) с высокой молекулярной массой как in vitro, так и in vivo посредством действия синтазы-2 гиалуроной кислоты (HAS-2) - маркера, которым более обогащена особенно популяция клеток В2. Показано, что лечение с помощью популяции В2 на модели 5/6 Nx снижает фиброз, сопровождается сильной экспрессией HAS-2, экспрессирующегося in vivo, и ожидаемой продукцией высокомолекулярной ГК внутри получившей лечение ткани. Примечательно, что в модели 5/6 Nx, у оставшихся без лечения в результате развился фиброз с ограниченной детекцией HAS-2 и небольшой продукцией высокомолекулярной ГК. Не предполагая связи с теорией, предложена гипотеза, что эти противовоспалительные типы ГК с высокой молекулярной массой, преимущественно синтезированные популяцией В2 (и в некоторой степени В4) действуют синергически с препаратами клеток в отношении снижения фиброза почек и помогая восстановлению почек. Соответственно, настоящее описание включает составы, содержащие биологически активные клетки почек, описанные в данном документе, вместе с биоматериалом, содержащим гиалуроновую кислоту. Настоящим описанием также подразумевается обеспечение компонентом биоматериала регенеративного стимула посредством прямой продукции или стимуляции продукции имплантированными клетками.
В одном аспекте изобретения в настоящем описании предложены составы, которые содержат выделенные гетерогенные популяции ЭПО-продуцирующих клеток почек для применения при лечении болезни почек, анемии и/или дефицита ЭПО у нуждающегося субъекта. В одном варианте реализации изобретения популяции клеток получают из биоптата почек. В другом варианте реализации изобретения популяции клеток получают из цельной ткани почек. В еще одном другом варианте реализации изобретения популяции клеток получают из культур клеток почек млекопитающих in vitro, выращенных из биоптатов почек или цельной ткани почек. Во всех вариантах реализации изобретения эти популяции представляют собой нефракционированные популяции клеток, также называемые в данном документе как необогащенные популяции клеток.
В другом аспекте изобретения в настоящем описании предложены составы, которые содержат выделенные популяции эритропоэтин(ЭПО)-продуцирующих клеток почек, которые дополнительно обогащены таким образом, чтобы соотношение ЭПО-продуцирующих клеток в обогащенной субпопуляции было больше в отношении соотношения ЭПО-продуцирующих клеток в исходной или начальной популяции клеток. В одном варианте реализации изобретения обогащенная ЭПО-продуцирующими клетками фракция содержит большее соотношение интерстициальных фибробластов и меньшее соотношение тубулярных клеток относительно интерстициальных фибробластов и тубулярных клеток, содержавшихся в необогащенной начальной популяции. В некоторых вариантах реализации изобретения обогащенная ЭПО-продуцирующими клетками фракция содержит большее соотношение гломерулярных клеток и васкулярных клеток и меньшее соотношение клеток собирательных протоков относительно гломерулярных клеток, васкулярных клеток и клеток собирательных протоков, содержавшихся в необогащенной начальной популяции. В таких вариантах реализации изобретения эти популяции называют в данном документе популяцией клеток «В4».
В другом аспекте изобретения в настоящем описании предложены составы, содержащие ЭПО-продуцирующую популяцию клеток почек, которая представляет собой смесь одной или более дополнительных популяций клеток почек. В одном варианте реализации изобретения ЭПО-продуцирующая популяция клеток представляет собой первую популяцию клеток, обогащенную ЭПО-продуцирующими клетками, например, В4. В другом варианте реализации изобретения ЭПО-продуцирующая популяция клеток представляет собой первую популяцию клеток, не обогащенную ЭПО-продуцирующими клетками, например, В2. В другом варианте реализации изобретения первая популяция клеток представляет собой смесь со второй популяцией клеток почек. В некоторых вариантах реализации изобретения вторая популяция клеток обогащена тубулярными клетками, которые могут быть обнаружены по наличию фенотипа тубулярных клеток. В другом варианте реализации изобретения фенотип тубулярных клеток может быть обнаружен по наличию одного маркера тубулярных клеток. В другом варианте реализации изобретения фенотип тубулярных клеток может быть обнаружен оказан по наличию одного или более маркеров тубулярных клеток. Маркеры тубулярных клеток включают, в частности: мегалин, кубилин, синтазу 2 гиалуроновой кислоты (HAS2), 25-гидролазу витамина D3 (CYP2D25), N-кадгерин (Ncad), Е-кадгерин (Ecad), аквапорин-1 (Aqp1), аквапорин-2 (Aqp2), RAB17, представителя семейства онкогенов RAS (Rab17), GATA-связывающий белок 3 (Gata3), FXYD-домен-содержащий регулятор 4 ионного транспорта (Fxyd4), представителя 4 (Slc9a4) семейства 9 растворимых переносчиков (антипортер ионов натрия/водорода), представителя В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), представителя A3 семейства альдегиддегидрогеназы 1 (Aldh1a3) и кальпаин-8 (Capn8). В другом варианте реализации изобретения первую популяцию клеток смешивают с по меньшей мере одним из нескольких типов клеток почек, включая, в частности: клетки интерстициальной ткани, тубулярные клетки, клетки собирательных протоков, клетки гломерул и/или клетки крови и сосудистой системы.
Составы по настоящему изобретению могут включать ЭПО-продуцирующие популяции клеток почек, содержащие популяции В4 или В4' в форме смеси с В2 и/или В3, или в форме обогащенной популяции клеток, например, В2+В3+В4/В4'.
В одном аспекте изобретения состав содержит популяции ЭПО-продуцирующих клеток почек, которые характеризуются экспрессией ЭПО и биовосприимчивостью к кислороду, так что снижение давления кислорода в культуральной системе приводит к индукции экспрессии ЭПО. В одном варианте реализации изобретения популяции ЭПО-продуцирующих клеток обогащены ЭПО-продуцирующими клетками. В одном варианте реализации изобретения экспрессия ЭПО индуцируется, когда популяцию клеток культивируют в условиях, в которых клетки подвергают действию пониженных уровней доступного кислорода в культуральной системе по сравнению с популяцией клеток, культивируемых при нормальных атмосферных уровнях (~21%) доступного кислорода. В одном варианте реализации изобретения ЭПО-продуцирующие клетки, культивируемые при более низких условиях содержания кислорода, экспрессируют более высокие уровни ЭПО относительно ЭПО-продуцирующих клеток, культивируемых в нормальных условиях содержания кислорода. В общем, культивирование клеток при пониженных уровнях доступного кислорода (также называемых гипоксическими условиями культивирования) означает, что пониженный уровень кислорода является пониженным относительно культивирования клеток при нормальных атмосферных уровнях доступного кислорода (также называемых нормальными или нормоксическими условиями культивирования). В одном варианте реализации изобретения гипоксическими условиями культивирования клеток включают культивирование клеток при содержании менее чем около 1% кислорода, менее чем около 2% кислорода, менее чем около 3% кислорода, менее чем около 4% кислорода или менее чем около 5% кислорода. В другом варианте реализации изобретения нормальные или нормоксические условиями культивирования включают культивирование клеток при около 10% кислорода, около 12% кислорода, около 13% кислорода, около 14% кислорода, около 15% кислорода, около 16% кислорода, около 17% кислорода, около 18% кислорода, около 19% кислорода, около 20% кислорода или около 21% кислорода.
В еще одном другом варианте реализации изобретения индукцию или увеличенную экспрессию ЭПО получают или могут наблюдать при культивировании клеток при содержании менее чем около 5% доступного кислорода и по сравнению с уровнями экспрессии ЭПО клетками, культивированными при атмосферном (около 21%) содержании кислорода. В другом варианте реализации изобретения индукцию ЭПО получают в культуре клеток, способных экспрессировать ЭПО способом, который включает первую фазу культивирования, в которой культуру клеток культивируют при атмосферном содержании кислорода (около 21%) в течении некоторого периода времени, и вторую фазу культивирования, в которой снижают уровни доступного кислорода и те же клетки культивируют при менее чем около 5% доступного кислорода. В другом варианте реализации изобретения экспрессия ЭПО, которая чувствительна к гипоксическим условиям, регулируется HIF1α. Средним специалистам в данной области техники известно, что для описанных в данном документе клеток могут применяться другие культуральные условия обработки кислородом, известные в данной области техники.
В одном аспекте изобретения состав содержит обогащенные популяции ЭПО-продуцирующих клеток млекопитающих, характеризующихся биовосприимчивостью (например, экспрессия ЭПО) в условиях перфузии. В одном варианте реализации изобретения условиях перфузии включают временный, периодический или непрерывный поток жидкости (перфузия). В одном варианте реализации изобретения экспрессия ЭПО является механически индуцируемой, если среда, в которой культивируют клетки, периодически или непрерывно циркулирует или перемешивается таким способом, что динамические силы передаются клеткам посредством потока. В одном варианте реализации изобретения клетки, повергаемые временному, периодическому или непрерывному действию потока жидкости, культивируют таким способом, что они присутствуют как трехмерные структуры в или на материале, который обеспечивает каркас и/или пространство для образования таких трехмерные структур. В одном варианте реализации изобретения клетки культивируют на пористых гранулах и подвергают временному или непрерывному действию потока жидкости с помощью качающейся платформы, орбитально вращающейся платформы или вращающейся колбы. В другом варианте реализации изобретения клетки культивируют на трехмерном каркасе, помещенном в устройство, при этом каркас является стационарным, а жидкость направленно течет через или вдоль каркаса. Средним специалистам в данной области техники известно, что для описанных в данном документе клеток могут применяться другие условия культивирования с перфузией, известные в данной области техники.
Агрегаты клеток
В еще одном другом аспекте изобретения составы по настоящему изобретению содержат агрегаты клеток или сфероиды. В одном варианте реализации изобретения агрегат клеток содержит популяцию биологически активных клеток, описанных в данном документе. В другом варианте реализации изобретения агрегат клеток содержит биологически активные клетки почек, такие как, к примеру, смеси клеток почек, обогащенные популяции клеток почек и комбинации фракций клеток почек.
В некоторых вариантах реализации изобретения биологически активные клетки почек данного описания могут культивироваться в вариантах 3D, дополнительно описанных в данном документе. В некоторых вариантах реализации изобретения термин «органоид» относится к скоплению клеток с фенотипом и/или функцией, соответствующими нативной почке. В некоторых вариантах реализации изобретения органоиды включают смешанные популяции клеток, разнообразных линий происхожения, которые обычно обнаруживают в данной ткани in vivo. В некоторых вариантах реализации изобретения органоиды этого описания образуются in vitro посредством любых способов, при которых клетки данного описания образуют агрегаты, которые в свою очередь могут образовать сфероиды, органоиды или их комбинации. В некоторых вариантах реализации изобретения такие агрегаты, сфероиды или органоиды принимают структуру соответствующую конкретному органу. В некоторых вариантах реализации изобретения такие агрегаты, сфероиды или органоиды экспрессируют поверхностные маркеры, которые обычно экспрессируются клетками конкретного органа. В некоторых вариантах реализации изобретения такие агрегаты, сфероиды или органоиды продуцируют соединения или вещества, которые обычно экспрессируются клетками конкретного органа. В некоторых вариантах реализации изобретения клетки данного описания могут культивироваться на природных субстратах, например, на желатине. В других вариантах реализации изобретения клетки данного описания могут культивироваться на синтетических субстратах, например, на PGLA.
Популяции неактивных клеток
Как используется в данном документе, определенные субфракции гетерогенной популяции клеток почек, обогащенные биологически активными компонентами и обедненные неактивными или нежелательными компонентами, обеспечивают превосходные терапевтические и регенеративные результаты по сравнению с исходной популяцией. В предпочтительных вариантах реализации изобретения составы, предложенные настоящим описанием, содержат клеточные популяции, которые обедненены популяциями клеток В1 и/или В5. Например, следующие популяции могут быть обедненены В1 и/или В5: смеси из двух или более популяций В2, В3 и В4 (или В4'); обогащенные популяции В2, В3 и В4 (или В4').
Популяция клеток В1 содержит большие гранулярные клетки собирательной дуктальной и тубулярной системы с клетками популяции, имеющими плавучую плотность менее чем около 1,045 г/мл. Популяция клеток В5 содержит дебрис и малые клетки с низкой гранулярностью и жизнеспособностью и имеющими плавучую плотность более чем около 1,091 г/мл.
Способы выделения и культивирования популяций клеток
В одном аспекте изобретения составы по настоящему изобретению содержат популяции клеток, которые были выделены и/или культивированы из ткани почек. Предложенные в данном документе способы разделения и выделения клеточных компонентов почек, например, обогащенных популяций клеток, которые будут использоваться в составах для целей терапевтического применения, включая лечение болезни почек, анемии, дефицита ЭПО, недостаточности тубулярного транспорта и недостаточности гломерулярного транспорта. В одном варианте реализации изобретения популяции клеток выделяют из свежерасщепленной, т.е. механически или ферментативно обработанной, ткани почек или из гетерогенных культур клеток почек млекопитающих, полученных in vitro.
Составы могут содержать гетерогенные смеси клеток почек, которых перед разделением на градиенте плотности культивировали в гипоксических условиях культивирования, для обеспечения получения улучшенного распределения и состава клеток как фракции В4, включая В4', так и фракций В2 и/или В3. Обогащение кислород-зависимыми клетками фракции В4 из В2 наблюдали для клеток почек, выделенных как из больных, так и здоровых почек. Не предполагая связи с теорией, это наблюдение может основываться из-за влияния одного или более из следующих явлений: 1) избирательному выживанию, гибели или пролиферации специфических клеточных компонентов во время периода гипоксического культивирования; 2) изменений гранулярности и/или размера клеток в ответ на гипоксическое культивирование, которое вызывает изменения плавучей плотности и последующего расположения во время разделения на градиенте плотности и 3) изменений экспрессии генов/белков клеток в ответ на период гипоксического культивирования, которые приводят к получению разных свойств клеток в пределах любой данной фракции градиента. Таким образом, в одном варианте реализации изобретения составы содержат популяции клеток, обогащенные тубулярными клетками, например, В2, которые являются гипоксия-устойчивыми.
Типовые методики разделения и выделения популяций клеток включают разделение на градиенте плотности на основании различного специфического удельного веса разных типов клеток, содержащихся в целевой популяции. Специфический удельный вес любого данного типа клеток может подвергаться влиянию степени гранулярности клеток, внутриклеточного объема воды и других факторов. В одном аспекте изобретения в настоящем описании предложены оптимальные условия градиента для выделения препаратов клеток, например, В2 и В4, включая В4', среди множества видов, включающих, в частности: человека, собаку и грызуна. В предпочтительном варианте реализации изобретения градиент плотности используют для получения новой обогащенной популяции фракции тубулярных клеток, т.е. популяции клеток В2, полученной из гетерогенной популяции клеток почек. В одном варианте реализации изобретения градиент плотности используют для получения новой обогащенной популяции фракции ЭПО-продуцирующих клеток, т.е. популяции клеток В4, полученной из гетерогенной популяции клеток почек. В других вариантах реализации изобретения градиент плотности используют для получения обогащенных субпопуляций тубулярных клеток, гломерулярных клеток и эндотелиальных клеток почек. В одном варианте реализации изобретения как ЭПО-продуцирующие клетки, так и тубулярные клетки отделяют от красных клеток крови и клеточного дебриса. В одном варианте реализации изобретения ЭПО-продуцирующие, гломерулярные и васкулярные клетки отделяют от других типов клеток и от красных клеток крови и клеточного дебриса, тогда как субпопуляцию тубулярных клеток и клеток собирательных протоков одновременно отделяют от других типов клеток и от красных клеток крови и клеточного дебриса. В еще одном другом варианте реализации изобретения эндокринные, гломерулярные и/или васкулярные клетки отделяют от других типов клеток и от красных клеток крови и клеточного дебриса, тогда как субпопуляцию тубулярных клеток и клеток собирательных протоков одновременно отделяют от других типов клеток и от красных клеток крови и клеточного дебриса.
В одном аспекте изобретения составы по настоящему изобретению содержат популяции клеток полученные применением, в частности, среды с градиентом плотности OPTIPREP® (Axis-Shield), содержащей 60% неионного йодированного соединения йодиксанола в воде, на основе определенных ключевых свойств, описанных ниже. Однако средний специалист в данной области техники знает, что можно использовать любой градиент плотности или другие способы, например, иммунологическое разделение с помощью поверхностных маркеров клеток, известных в данной области техники, включающих свойства необходимые для выделения популяций клеток по настоящему изобретению. Среднему специалисту в данной области также следует понимать, что одинаковые свойства клеток (размер и гранулярность), которые влияют на разделение клеточных субпопуляций посредством градиентов плотностей, могут использоваться для разделения клеточных субпопуляций посредством проточной цитометрии (прямое рассеивание = отражение размера при проточной цитометрии, а боковое рассеивание = отражение гранулярности). Важно, чтобы среда градиента плотности обладала низкой токсичностью в отношении специфических целевых клеток. Так как среда градиента плотности должна обладать низкой токсичностью в отношении специфических целевых клеток, настоящее описание подразумевает применение градиентных сред, которые играют роль в процессе разделения целевых клеток. Не предполагая связи с теорией, оказывается, что популяции клеток, описанные в данном документе, выделяемые с помощью содержащего йодиксанол градиента, являются йодиксанол-устойчивыми, поскольку существует заметная потеря клеток между этапами нанесения и сбора, вызывая предположение, что воздействие йодиксанола в условиях градиентного разделения приводит к удалению определенных клеток. Клетки, оказывающиеся в специфических слоях над градиентом йодиксанола, являются устойчивыми к любым неблагоприятным воздействиям йодиксанола и/или влиянию градиента плотности. Соответственно, также подразумевается применение дополнительной контрастирующей среды, которая умеренно ослабляет нефротоксины при выделении и/или разделении популяций клеток для составов, описанных в данном документе. Кроме того, среда градиента плотности также не должна связываться с белками плазмы человека или неблагоприятно влиять на ключевые функции целевых клеток.
В другом аспекте в настоящем описании предложены составы, содержащие популяции клеток, которые обогащены и/или обедненены типами клеток почек с помощью сортировку флуоресцентно активированных клеток (FACS). В одном варианте реализации изобретения типы клеток почек могут быть обогащены и/или обедненены с помощью оборудования BD FACSAria™ или эквивалентного.
В другом аспекте в настоящем описании предложены составы, содержащие популяции клеток, которые обогащены и/или обедненены типами клеток почек с помощью магнитной сортировки клеток. В одном варианте реализации изобретения типы клеток почек могут быть обогащены и/или обедненены с помощью системы Miltenyi autoMACS® или эквивалентной.
В другом аспекте изобретения составы могут включать популяции клеток почек, которые были объектом трехмерного культивирования. В одном аспекте изобретения способы культивирования популяции клеток осуществляют посредством непрерывной перфузии. В одном варианте реализации изобретения популяции клеток, культивированные посредством трехмерного культивирования и непрерывной перфузии, демонстрируют большую насыщенность клетками и взаимосвязь по сравнению с популяциями клеток, культивированными статично. В другом варианте реализации изобретения популяции клеток, культивированные посредством трехмерного культивирования и непрерывной перфузии, демонстрируют большую экспрессию ЭПО, а также усиленную экспрессию ассоциированных с трубочками генов почек, таких как е-кадгерин, по сравнению со статичными культурами таких популяций клеток. В еще одном варианте реализации изобретения популяции клеток, культивированные посредством непрерывной перфузии, демонстрируют большие уровни поглощения глюкозы и глутамина по сравнению с популяциями клеток, культивированными статично.
Как используется в данном документе, в способах получения популяций клеток для предложенных в данном документе составов могут применяться условия с низким содержанием кислорода или гипоксические условия. Впрочем, способы получения популяций клеток могут применяться без этапа кондиционирования с низким содержанием кислорода. В одном варианте реализации изобретения могут применяться нормоксичные условия.
Средним специалистам в данной области техники известно, что для описанных в данном документе клеток могут применяться другие способы выделения и культивирования, известные в данной области техники.
3. Биоматериалы
Разнообразные биоматериалы могут соединяться с активным агентом для обеспечения получения терапевтических составов по настоящему изобретению. Биоматериалы могут иметь любую подходящую форму (например, гранулы) или состояние (например, жидкое, гель и т.п.). Как описано в опубликованной патентной заявке США Bertram et al. 20070276507 (включенной в данный документ в полном объеме посредством ссылки) полимерные матрицы или каркасы могут быть оформлены любым количеством требуемых конфигураций для удовлетворения любого количества всех системных, геометрических или пространственных ограничений. В одном варианте реализации изобретения матрицы или каркасы по настоящему изобретению могут быть трехмерными и обладать формой соответствующей размерам и форме структуры органа или ткани. К примеру, при применении полимерного каркаса для лечения болезни почек, анемии, дефицита ЭПО, недостаточности тубулярного транспорта или недостаточности гломерулярной фильтрации может применяться трехмерная (3-D) матрица. Могут применяться разнообразные 3-D каркасы разной формы. Понятно, что полимерная матрица может иметь форму разных размеров и формироваться для соответствия пациентам разных размеров. Полимерная матрица также может обладать формой других вариантов для удовлетворения специальных потребностей пациента. В другом варианте реализации изобретения полимерная матрица или каркас может быть биосовместимым пористым полимерным каркасом. Каркасы могут быть образованы из различных синтетических или встречающих в природе материалов, включая, в частности: полимолочную кислоту с открытыми ячейками (OPLA®), эфир целлюлозы, целлюлозу, сложный эфир целлюлозы, фторированный полиэтилен, фенольную смолу, поли-4-метилпентен, полиакрилонитрил, полиамид, полиамидимид, полиакрилат, полибензоксазол, поликарбонат, полицианоакрилэфир, полиэстер, полиэстеркарбонат, полиэфир, полиэфирэфиркетон, полиэфиримид, полиэфиркетон, полиэфирсульфон, полиэтилен, полифторолефин, полиимид, полиолефин, полиоксадиазол, полифениленоксид, полифениленсульфид, полипропилен, полистирол, полисульфид, полисульфон, политетрафторэтилен, политиоэфир, политриазол, полиуретан, поливинил, поливинилиденфторид, регенерированную целлюлозу, силикон, мочевиноформальдегид, коллагены, желатин, альгинат, ламинины, фибронектин, шелк, эластин, альгинат, гиалуроновую кислоту, агарозу или сополимеры или их физические смеси. Конфигурации каркасов могут составлять диапазон от жидких суспензий, мягких пористых каркасов до жестких удерживающих форму пористых каркасов. В одном варианте реализации изобретения конфигурация имеет жидкую форму в виде раствора, которая способна становиться гидрогелем.
Гидрогели могут быть образованы из разнообразных полимерных материалов и быть пригодными для различных биомедицинских применений. Гидрогели физически могут быть описаны как трехмерные сетчатые структуры из гидрофильных полимеров. В зависимости от типа гидрогелей они содержат переменные процентные содержания воды, но полностью не растворяются в воде. Несмотря на высокое содержание воды в них, гидрогели способны дополнительно связывать большие объемы жидкости из-за наличия гидрофильных остатков. Гидрогели значительно набухают без изменения их желатинообразной структуры. Основные физические свойства гидрогеля могут быть специфически модифицированы в соответствии со свойствами использованных полимеров и дополнительных специальных компоновок препаратов.
Преимущественно гидрогель составлен из полимера, материала биологического происхождения, материала синтетического происхождения или их комбинации, которые биологически инертны и физиологически совместимы с тканями млекопитающих. Материал гидрогелей преимущественно не индуцирует воспалительную реакцию. Примеры других материалов, которые могут применяться для образования гидрогеля, включают: (а) модифицированные альгинаты, (b) полисахариды (например, геллановая камедь и каррагинаны), которые образуют гель при воздействии моновалентных катионов, (с) полисахариды (например, гиалуроновая кислота), которые представляют собой очень вязкие жидкости или являются тиксотропными и образуют гель с течением времени путем медленного изменения структуры, (d) желатин или коллаген и (е) полимерные предшественники гидрогелей (например, блок-сополимеры полиэтиленоксида-полипропиленгликоля и белки). В патенте США №6224893 В1 предложено подробное описание различных полимеров и химических свойств таких полимеров, которые подходят для получения гидрогелей.
Свойства каркасов или биоматериалов могут давать возможность клеткам присоединяться и взаимодействовать с материалом каркасов или биоматериалов и может обеспечивать пористые промежутки в которых могут захватываться клетки. В одном варианте реализации изобретения пористые каркасы и биоматериалы позволяют использовать добавление или осаждение одной или более популяций или смесей клеток на биоматериале, сконфигурированного в виде пористого каркаса (например, присоединением клеток) и/или включение внутрь пор каркаса (например, захватыванием клеток). В другом варианте реализации изобретения каркасы или биоматериалы позволяют или способствуют взаимодействиям клетка : клетка и/или клетка : биоматериал внутри каркаса с образованием конструкций, описанных в данном документе.
В одном варианте реализации изобретения биоматериал состоит из гиалуроновой кислоты (ГК) в форме гидрогеля, содержащей молекулы ГК в диапазоне размеров от 5,1 кДа до >2×106 кДа. В другом варианте реализации изобретения биоматериал состоит из гиалуроновой кислоты в форме пористой пены, также содержащей молекулы ГК в диапазоне размеров от 5,1 кДа до >2×106 кДа. В еще одном варианте реализации изобретения биоматериал состоит из пены на основе полимолочной кислоты (PLA), имеющей структуру с открытыми ячейками и размером пор от около 50 микрон до около 300 микрон. В еще одном варианте реализации изобретения специфические популяции клеток, предпочтительно В2, но также и В4, непосредственно обеспечивают и/или стимулируют синтез гиалуроновой кислоты с высокой молекулярной массой посредством синтазы-2 гиалуроновой кислоты (HAS-2), особенно после внутрипочечной имплантации.
Биоматериалы, описанные в данном документе, также могут быть сконструированы и адаптированы для ответа на определенные внешние условия, например, in vitro или in vivo. В одном варианте реализации изобретения биоматериалы являются термочувствительными (например, in vitro или in vivo). В другом варианте реализации изобретения биоматериалы адаптируют для ответа на воздействие ферментативной деградации (например, in vitro или in vivo). Реакция биоматериалов на внешние условия может быть точно настроена, как описано в данном документе.
Температурная чувствительность описанного состава может изменяться путем регулирования процентного содержания биоматериала в составе. К примеру, для модулирования температурной чувствительности желатина в готовом составе (например, в виде жидкости, геля, гранул и т.д.) может регулироваться процентное содержание желатина в растворе. В альтернативном варианте биоматериалы могут быть перекрестно сшитыми химически для обеспечения большей устойчивости к ферментативной деградации. К примеру, для перекрестного сшивания химическим способом желатиновых гранул могут применять кросслинкер карбодиимид, тем самым обеспечивая пониженную чувствительность к эндогенным ферментам.
В одном аспекте изобретения реакция биоматериала на внешние условия включает потерю структурной целостности биоматериала. Несмотря на то, что выше предложены способы обеспечения термочувствительности и устойчивости к ферментативной деградации, существуют механизмы, благодаря которым в разных биоматериалах может происходить потеря целостности материала. Эти механизмы могут включать, но не ограничиваться: термодинамическими (например, переход фаз, такой как плавление, диффузия (например, диффузия ионного кросслинкера из биоматериала в окружающую ткань)), химические, ферментативные, связанные с рН (например, чувствительные к изменению рН липосомы), ультразвуковые и фотолабильные (проникновение света) механизмы. Точный механизм, благодаря которому биоматериал теряет структурную целостность будет варьировать, но обычно данный механизм запускается или во время имплантации или после имплантации.
Средним специалистам в данной области техники известно, что для образования описанных в данном документе каркасов могут применяться другие типы синтетических или встречающихся в природе материалов, известных в данной области техники.
В одном аспекте изобретения конструкции, описанные в данном документе, изготовлены из вышеупомянутых каркасов или биоматериалов.
4. Конструкции
В одном аспекте изобретения в настоящем описании предложены составы, которые содержат имплантируемые конструкции, содержащие одну или более популяций клеток для лечения болезни почек, анемии и/или дефицита ЭПО у нуждающегося субъекта. В одном варианте реализации изобретения конструкция составлена из биосовместимого материала или биоматериала, каркаса или матрицы, состоящей из одного или более синтетических или встречающихся в природе биосовместимых материалов, и одной или более описанных в данном документе популяций клеток или смесей клеток, размещенных на или внедренных в поверхность каркаса путем прикрепления и/или захватывания. В некоторых вариантах реализации изобретения конструкция составлена из биоматериала и одной или более описанных в данном документе популяций клеток или смесей клеток, покрытых, размещенных на, размещенных в, присоединенных к, захваченных в, внедренных в, посаженных или соединенных с компонентом(ами) биоматериала. Любые из популяций клеток, описанных в данном документе, включая обогащенные популяции клеток или их смеси, могут применяться в комбинации с матрицей для образования конструкции.
В одном аспекте изобретения состав содержит конструкции, которые составлены из биоматериалов, разработанных или адаптированных для ответа на внешние условия, описанные в данном документе. В результате, природа ассоциации популяции клеток с биоматериалом в конструкции будет изменяться в зависимости от внешних условий. К примеру, ассоциация популяции клеток с термочувствительным биоматериалом изменяется с температурой. В одном варианте реализации изобретения конструкции содержит популяцию клеток и биоматериал, обладающий практически твердым состоянием при температуре около 8°C или ниже и практически жидким состоянием при температура окружающей среды или выше, причем популяция клеток суспендирована в биоматериале при температуре около 8°C или ниже.
Однако популяции клеток практически свободно проходят через объем биоматериала при температуре около температуры окружающей среды или выше. Суспендированные популяции клеток в практически твердой фазе при низкой температуре обладают преимуществами, связанными со стабильностью клеток, такими как использование зависимых от прикрепления клеток, по сравнению с клетками в жидкой фазе. Более того, суспендированные в практически твердой среде клетки обеспечивает одно или более из следующих преимуществ: i) предотвращает оседание клеток, ii) позволяет клеткам оставаться прикрепленным к биоматериалу в суспендированном состоянии; iii) позволяет клеткам оставаться более однородно диспергированными во всем объеме биоматериала; iv) предотвращает образование агрегатов клеток и v) обеспечивает лучшую защиту клеток во время хранения и транспортирования состава. Состав, который может сохранять такие свойства, предшествующему введению субъекту, обладает преимуществом по меньшей мере благодаря общему здоровому состоянию клеток в составе, будет лучше и при введении будет более однородным и обеспечивать унифицированную дозу клеток.
В другом варианте реализации размещенная популяция клеток или клеточных компонентов конструкции представляет собой первую популяцию клеток, обогащенную кислород-регулируемыми ЭПО-продуцирующими клетками. В другом варианте реализации изобретения первая популяции клеток почек содержит гломерулярные и васкулярные клетки в дополнение к кислород-регулируемым ЭПО-продуцирующим клеткам. В одном варианте реализации изобретения первая популяция клеток представляет собой популяцию клеток В4'. В одном варианте реализации размещенная популяция клеток или клеточного(ых) компонента(ов) конструкции включает как первую обогащенную популяцию клеток почек, так и вторую популяцию клеток почек. В некоторых вариантах реализации изобретения вторая популяция клеток не обогащена кислород-регулируемыми ЭПО-продуцирующими клетками. В другом варианте реализации изобретения вторая популяция клеток обогащена тубулярными клетками почек. В другом варианте реализации изобретения вторая популяция клеток обогащена тубулярными клетками почек и содержит эпителиальные клетки собирательных протоков. В других вариантах реализации изобретения тубулярные клетки почек характеризуются экспрессией одного или более тубулярных клеточных маркеров, которые включают, в частности: мегалин, кубилин, синтазу 2 гиалуроновой кислоты (HAS2), 25-гидроксилазу витамина D3 (CYP2D25), N-кадгерин (Ncad), Е-кадгерин (Ecad), аквапорин-1 (Aqp1), аквапорин-2 (Aqp2), PvAB17, представителя семейства онкогенов RAS (Rab17), GATA-связывающий белок 3 (Gata3), FXYD-домен-содержащий регулятор 4 ионного транспорта (Fxyd4), представителя 4 (Slc9a4) семейства 9 растворимых переносчиков (антипортер ионов натрия/водорода), представителя В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), представителя A3 семейства альдегиддегидрогеназы 1 (Aldh1a3) и кальпаин-8 (Capn8).
В одном варианте реализации изобретения популяции клеток, размещенные на или соединенные с биоматериалами или каркасами с образованием конструкций, получают из различных источников, таких как аутологичные источники. Для применения также подходят неаутологичные источники, включая, в частности алогенные или сингенные (аутогенные или изогенные) источники.
Средним специалистам в данной области техники известно, что существует несколько подходящих способов для осаждения или иного соединения популяций клеток с биоматериалами с образованием конструкции.
В одном аспекте изобретения конструкции подходят для применения в способах применения, описанных в данном документе. В одном варианте реализации изобретения конструкции подходят для введения субъекту, нуждающемуся в лечении болезни почек любой этиологии, анемии или дефицита ЭПО любой этиологии. В других вариантах реализации изобретения конструкции подходят для введения субъекту, нуждающемуся в улучшении или восстановлении эритроидного гомеостаза. В другом варианте реализации изобретения конструкции подходят для введения субъекту, нуждающемуся в улучшении функционирования почек.
В еще одном аспекте изобретения в настоящем описании предложена конструкция для имплантации субъекту, нуждающемуся в улучшении функционирования почек, включающая: а) биоматериал, содержащий один или более биосовместимых синтетических полимеров или встречающихся в природе белков и пептидов и b) смесь клеток почек млекопитающих, полученных от субъекта, страдающего болезнью почек, содержащую первую популяцию клеток, В2, содержащую выделенную обогащенную популяцию тубулярных клеток, имеющую плотность между 1,045 г/мл и 1,052 г/мл, и вторую популяцию клеток, В4', содержащую эритропоэтин(ЭПО)-продуцирующие клетки и васкулярные клетки, но обедненную гломерулярными клетками, имеющую плотность между 1,063 г/мл и 1,091 г/мл, покрытую, размещенную на или в, захваченную в, суспендированную в, внедренную в и/или иным образом соединенную с биоматериалом. В некоторых вариантах реализации изобретения смесь не включает популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл, или популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл.
В одном варианте реализации изобретения конструкция включает популяцию клеток В4', которая характеризуется экспрессией васкулярного маркера. В некоторых вариантах реализации изобретения популяция клеток В4' не характеризуется экспрессией гломерулярного маркера. В некоторых вариантах реализации изобретения смесь способна к кислород-регулируемой экспрессии эритропоэтина (ЭПО). Во всех вариантах реализации изобретения смесь может быть получена из ткани почек млекопитающих или культивированных клеток почек.
В одном варианте реализации изобретения конструкция включает биоматериал сконфигурированный в виде трехмерного (3-D) пористого биоматериала, подходящего для захватывания и/или прикрепления смеси. В другом варианте реализации изобретения конструкция включает биоматериал сконфигурированный в виде жидкого или полужидкого геля, подходящего для внедрения, прикрепления, суспендирования или покрытия клеток млекопитающих. В еще одном варианте реализации изобретения конструкция включает биоматериал сконфигурированный так, чтобы включать преимущественно типы гиалуроновой кислоты с высокой молекулярной массой в форме гидрогеля. В другом варианте реализации изобретения конструкция включает биоматериал преимущественно состоящий из типов гиалуроновой кислоты (ГК) с высокой молекулярной массой в форме пористой пены. В еще одном варианте реализации изобретения конструкция включает биоматериал состоит из пены на основе полимолочной кислоты, имеющей поры размером между около 50 микронами и около 300 микрон. В еще одном другом варианте реализации изобретения конструкция включает одну или более популяций клеток, которые могут быть получены из образца почки, который аутологичен субъекту, нуждающемуся в улучшении функционирования почек. В некоторых вариантах реализации изобретения образец представляет собой биоптат почки. В некоторых вариантах реализации изобретения субъект страдает болезнью почек. В еще одних вариантах реализации изобретения популяцию клеток получают из неаутологичного образца почки. В одном варианте реализации изобретения конструкция обеспечивает достижение эритроидного гомеостаза.
5. Определение фенотипических характеристик клеток почек
Клетки, выделенные на любом этапе процесса, могут быть исследованы на их фенотип. В одном варианте реализации изобретения клетки представляют собой гетерогенную популяции клеток почек, которая была обогащена. В дополнительном варианте реализации изобретения обогащенную гетерогенную популяции клеток почек культивировали в гипоксических условиях по меньшей мере 24 часа. В еще одном дополнительном варианте реализации изобретения обогащенную гетерогенную популяции клеток почек подвергли очистке на градиенте плотности.
Наличие (например, экспрессия) и/или уровень/количество различных биомаркеров в образце может быть проанализировано с помощью нескольких подходов, многие из которых известны в данной области техники и понятны специалисту, включая, в частности: иммуногистохимические анализы («ИГХ»), анализ Вестерн-блоттинга, иммунопреципитацию, исследования молекулярного связывания, ELISA, ELIFA, сортировку флуоресцентно активированных клеток («FACS»), MassARRAY, методы протеомики, биохимические анализы ферментативной активности, гибридизацию in situ, анализ Саузерн-блоттинга, анализ Нозерн-блоттинга, секвенирование целого генома, полимеразную цепную реакцию («ПЦР»), включая количественную ПЦР в режиме реального времени («кПЦР-РВ») и другие методы детекции с амплификацией, такие как, к примеру, метод разветвленной ДНК, SISBA, ТМА и им подобные), RNA-Seq, FISH, анализ на микрочипах, определения профилей экспрессии генов и/или серийный анализ экспрессии генов («SAGE»), также как и любой из большого разнообразия анализов, которые могут выполняться с помощью анализа на белковых, генных и/или тканевых чипах. Типовые протоколы для оценки состояния генов и продуктов генов могут быть найдены, к примеру, в публикациях Ausubel et al., eds., 1995, Current Protocols In Molecular Biology, Units 2 (Northern Blotting), 4 (Southern Blotting), 15 (Immunoblotting) и 18 (PCR Analysis). Могут также применяться мультиплексные иммуноанализы, такие как предлагаемые компаниями Rules Based Medicine или Meso Scale Discovery.
В одном аспекте изобретения предложен метод детектирования наличия двух или более биомаркеров в гетерогенном образце клеток почек, данный метод включает приведение образца в контакт с антителом, нацеленным на биомаркер, в условиях, допускающих связывание антитела со своим когнатным лигандом (т.е. биомаркером), и детектирование наличия связанного антитела, например, путем детектирования того образовался ли комплекс между антителом и биомаркером. В некоторых вариантах реализации изобретения изобретения детекцию одного или более биомаркеров проводят методом иммуногистохимии.
В некоторых вариантах реализации изобретения для детектирования наличия биомаркера в гетерогенном образце клеток почек пригодны антитела, представленные в данном документе. Как используется в данном документе, термин «детектирование» охватывает количественную или качественную детекцию. В некоторых вариантах реализации изобретения биологический образец включает образец SRC.
В некоторых вариантах реализации изобретения гетерогенные клетки почек идентифицируют с одним или более реагентами, которые позволяют детектировать биомаркер, выбранный из: AQP1, AQP2, AQP4, кальбиндина, кальпонина, CD117, CD133, CD146, CD24, CD31 (РЕСАМ-1), CD54 (ICAM-1), CD73, CK18, CK19, СК40 до 67, CK7, CK8, CK8/18, CK8/18/19, коннексина 43, кубилина, CXCR4 (фузин), DBA, Е-кадгерина (CD324), ЭПО (эритропоэтин), GGT1, GLEPP1 (гломерулярный эпителиальный белок 1), гаптоглобулина, Itgb1 (интегрин β1), KIM-1/TIM-1 (молекула повреждения почек-1/T-клеточный иммуноглобулин и муцин-содержащая молекула), МАР-2 (ассоциированный с микротрубочками белок 2), мегалина, N-кадгерина, нефрина, NKCC (Na-K-Cl-котранспортеры), OAT-1 (транспортер 1 органических анионов), остеопонтина, пан-кадгерина, PCLP1 (подобная подокаликсину 1 молекула), подоцина, SMA (альфа-актин гладких мышц), синаптоподина, ТНР (белок Тамма-Хорсфалла), виментина и αGST-1 (альфаглутатион-S-трансфераза). В некоторых вариантах реализации изобретения биомаркер детектируют с помощью моноклональных или полоклональных антител.
В одном варианте реализации изобретения детектируемая метка для образования радиоконъюгата содержит радиоактивный атом. Для получения радиоконъюгатов доступны разнообразные радиоактивные изотопы, примеры которых включают211At,131I,125I,90Y,186Re,188Re,153Sm,212Bi,32P,212Pb и радиоактивные изотопы Lu. Когда для детекции применяют радиоконъюгат, он может включать радиоактивный атом для сцинтиграфических исследований, к примеру,99Тс-m (неустойчивый ядерный изомер) или123I, или спиновая метка для исследования ядерным магнитным резонансом (ЯМР) (также известного как магнито-резонанстная томография, МРТ), такая как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
В случае, когда в одном исследовании применяется более одной детектируемой метки (включая краситель), детектируемые метки преимущественно выбирают таким образом, чтобы каждая метка могла бы независимо детектироваться без значительного влияния на любой другой из детектируемых сигналов, представленных в образце. К примеру, детектируемые метки (включая краситель) могут быть разными флуоресцентными молекулами, демонстрирующими разные цвета в условиях детекции.
Детекцию могут проводить любым подходящим методом, к примеру, основанном на иммунофлуоресцентной микроскопии, проточной цитометрии, оптоволоконной сканирующей цитометрии или лазерной сканирующей цитометрии.
В некоторых вариантах реализации изобретения экспрессию биомаркера в клетке определяют путем оценивания мРНК в клетке. Методы оценки мРНК в клетках хорошо известны и включают, к примеру, гибридизационные анализы с помощью комплементарных ДНК-зондов (такие как гибридизация in situ с применением рибозондов, специфичных к одному или более генам, Нозерн-блоттинг и родственные методики) и различные анализы, связанные с амплификацией нуклеиновых кислот (такие как ОТ-ПЦР с применением комплементарных праймеров, специфичных к одному или более генам, и другие методы детекции, связанные с амплификацией, такие как, к примеру, метод разветвленной ДНК, SISBA, ТМА и им подобные). В некоторых вариантах реализации изобретения экспрессию биомаркера в исследуемом образце сравнивают с эталонным образцом. К примеру, исследуемый образец может быть образцом пораженной ткани, а эталонный образец может быть взят из нормальной ткани.
В образцах, полученных из млекопитающих, мРНК могут привычно исследоваться с помощью Нозерн-блоттинга, дот-блота или ПЦР-анализа. Кроме того, такие методы могут включать один или более этапов, которые позволяют определять уровни целевой мРНК в биологическом образце (например, одновременным определением уровней сравнимой последовательности контрольной мРНК конститутивного гена, такого как представителя семейства актина). Необязательно могут определять последовательность амплифицированной целевой кДНК.
Необязательные методы включают протоколы, которые определяют или детектируют мРНК, такие как целевые мРНК в тканевом или клеточном образце методиками с применением микрочипов. С помощью микрочипов с нуклеиновыми кислотами образцы исследуемой и контрольной мРНК из исследуемого и контрольного образцов подвергают обратной транскрипции и маркированию для получения кДНК-зондов. Потом зонды гибридизируют с массивом нуклеиновых кислот, иммобилизированных на твердой подложке. Чип конфигурируют таким образом, что известна последовательность и положение каждого представителя массива. К примеру, на твердой подложке может быть организован массив для выбора генов, экспрессия которых коррелирует с популяцией клеток, способной вызвать регенеративную реакцию. Гибридизация меченого зонда с конкретным представителем массива показывает, что данный образец, из которого получен зонд, экспрессирует этот ген.
В соответствии с некоторыми вариантами реализации изобретения наличие и/или уровень/количество экспрессии измеряют путем обнаружения уровней экспрессии белка вышеуказанного гена. В некоторых вариантах реализации изобретения данный данный метод включает приведение биологического образца в контакт с описанным в данном документе биомаркером, в условиях, допускающих связывание биомаркера, и детектирования того образовался ли комплекс между антителами и биомаркером.
В некоторых вариантах реализации изобретения наличие и/или уровень/количество белков-биомаркеров в образце определяют с применением ИГХ и протоколов окрашивания. Показано, что окрашивание клеток методами ИГХ является надежным методом определения или детектирования наличия белков в образце. В одном аспекте изобретения уровень биомаркера определяют с помощью метода, включающего: (а) проведения анализа образца (такого как образца клеток почек) с антителом методом ИГХ и (b) определение уровня биомаркера в образце. В некоторых вариантах реализации изобретения интенсивность окрашивания методом ИГХ определяют относительно эталонного значения.
Анализ методом ИГХ может выполняться в комбинации с дополнительными методиками, такими как морфологическое окрашивание и/или флуоресценцией при гибридизации in-situ. Доступны два общих метода ИГХ - прямые и опосредованные анализы. В соответствии с первым анализом связывание антитела с целевым антигеном определяется непосредственно. В прямых анализах применяют меченый реагент, такой как флуоресцентный тэг или первичное антитело, меченое ферментом, которые могут быть визуализированы без дополнительного взаимодействия с антителами. В типичном опосредованном анализе неконъюгированное первичное антитело связывается с антигеном и далее метится вторичным антителом, связывающимся с первичным антителом. Если вторичное антитело конъюгировано с ферментативной меткой, то для обеспечения визуализации антигена добавляют хромогенный или флуорогенный субстрат. Из-за того, что несколько вторичных антител могут реагировать с разными эпитопами первичного антитела, может происходить амплификация сигнала.
Первичное и/или вторичное антитело, применяемое для ИГХ анализов, как правило, метят детектируемым компонентом. Доступны многочисленные метки, которые, как правило, группируют по следующим категориям: (а) радиоизотопы, такие как35S,14С,125I,3Н и131I; (b) коллоидные частицы золота; (с) флуоресцентные метки, включая, в частности: хелаты редкоземельных металлов (хелаты европия), красители техасский красный, родамин, флуоресцин, дансил, лиссамин, умбеллиферон, фикокритерин, фикоцианин или коммерчески доступные флуорофоры, такие как SPECTRUM ORANGE7 и SPECTRUM GREEN7 и/или производные любого одного или более из вышеуказанных веществ; (d) различные доступные фермент-субстратные метки, а обзор некоторых из них представлен в патенте США №4275149. Примеры ферментных меток включают: люциферазы (например, люциферазу светляков и бактериальную люциферазу; патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидазу хрена (ПХ), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), оксидазы гетероциклических соединений (таких как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и им подобные.
Примеры фермент-субстратных комбинаций включают, к примеру, пероксидазу хрена (ПХ) с субстратом пероксидом водорода; щелочную фосфатазу (АР) с хромогенным субстратом пара-нитрофенилфосфатом и β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-D-галактозидом) или флуорогенным субстратом (например, 4-метилумбеллиферил-β-D-галактозидом). Для общего обзора этих методов см. патенты США №4275149 и 4318980.
В типичном методе образец может контактировать с антителом специфическим к биомаркеру в условиях достаточных для образования комплекса антитело-биомаркер и последующего детектирования данного комплекса. Наличие биомаркера может быть обнаружено несколькими методами, такими как методики Вестерн-блоттинга и ELISA, применяемые для исследования большого разнообразия тканей и образцов, включая плазму и сыворотку. Доступен широкий диапазон методик иммунохимических анализов, в которых применяется такой формат исследования, см. например, патенты США №4016043, 4424279 и 4018653. Они включают как неконкурирующие типы с одним сайтом и двумя сайтами связывания или «сэндвич»-анализы, так и традиционные анализы определения конкурентного связывания. Эти анализы также включают прямое связывание меченого антитела с целевым биомаркером.
Наличие и/или уровень/количество содержания выбранного биомаркера в образце тканей или клеток может также исследоваться путем функциональных или основанных на определении активности анализов. К примеру, если биомаркер представляет собой фермент, может проводиться известный в данной области техники анализ для определения или детектирования наличия данной ферментативной активности в данном образце тканей или клеток.
В некоторых вариантах реализации изобретения образцы нормализуют как по отличиям в количестве анализируемого биомаркера и вариабельности качества использованных образцов, так и по вариабельности между проведениями анализов. Такая нормализация может выполняться путем детектирования и включения уровня определенных нормализующих биомаркеров, включая хорошо известные конститутивные гены, такие как АСТВ. В альтернативном варианте нормализация может быть основана на среднем или медианном сигнале всех анализируемых генов или их большого подмножества (общий подход к нормализации). На основе сравнения гена за геном, измеренное нормализованное количество мРНК или белка опухоли субъекта сравнивают с количеством обнаруженным в эталонном наборе. Нормализованные уровни экспрессии для каждой мРНК или белка на исследуемую опухоль одного субъекта могут экспрессироваться в виде процента уровня экспрессии, измеренного в эталонном наборе. Наличие и/или уровень/количество экспрессии, измеренные в конкретном образце субъекта, требующего проведения анализа, должно попасть в определенный персентиль в пределах того диапазона, который может быть определен методами хорошо известными в данной области техники.
В вариантах реализации изобретения цитокератин выбирают из CK8, CK18, CK19 или их комбинаций. В некоторых вариантах реализации изобретения цитокератин представляет собой CK8, CK18, CK19, CK8/CK18, CK8/CK19, CK18/CK19 или CK8/CK18/CK19, где символ «/» относится к комбинации цитокератинов соседствующих друг с другом. Во всех вариантах реализации изобретения цитокератин имеет уровень экспрессии более чем около 80%, около 85%, около 90% или около 95%.
В вариантах реализации изобретения GGT представляет собой GGT-1. Во всех вариантах реализации изобретения GGT имеет уровень экспрессии более чем около 10%, около 15%, около 18%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55% или около 60%.
6. Способы применения
В другом аспекте изобретения составы по настоящему изобретению могут вводиться для лечения заболеваний. К примеру, биологически активные клетки могут вводиться в нативный орган как часть состава, описанного в данном документе. В одном варианте реализации изобретения биологически активные клетки могут происходить из нативного органа, который находится у субъекта, получающего введение, или происходить из источника, который не является целевым нативным органом.
В одном аспекте изобретения в настоящем описании предложены способы лечения болезни почек, анемии или дефицита ЭПО у субъекта, нуждающегося в составах, содержащих популяции клеток почек и смеси клеток почек, описаные в данном документе. В одном варианте реализации изобретения данный способ включает введение субъекту состава, содержащего композицию, которая включает первую популяцию клеток почек, обогащенную ЭПО-продуцирующими клетками. В другом варианте реализации изобретения первая популяция клеток обогащена ЭПО-продуцирующими клетками, гломерулярными клетками и васкулярными клетками. В одном варианте реализации изобретения первая популяция клеток почек представляет собой популяцию клеток В4'. В другом варианте реализации изобретения композиция может дополнительно включать одну или более дополнительных популяций клеток почек. В одном варианте реализации изобретения дополнительная популяция клеток представляет собой вторую популяцию клеток, не обогащенную ЭПО-продуцирующими клетками. В другом варианте реализации изобретения дополнительная популяция клеток представляет собой вторую популяцию клеток, не обогащенную ЭПО-продуцирующими клетками, гломерулярными клетками или васкулярными клетками. В другом варианте реализации изобретения композиция также включает популяцию клеток почек или смесь клеток почек, размещенных в, размещенных на, внедренных в, покрытых, суспендированных в или захваченных биоматериалом с образованием имплантируемой конструкции, описанной в данном документе, для лечения заболевания или нарушения, описанного в данном документе. В одном варианте реализации изобретения популяции клеток применяют сами или в комбинации с другими клетками или биоматериалами, например, гидрогелями, пористыми каркасами или нативными или синтетическими пептидами или белками для стимулирования регенерации при острых или хронических болезненных состояниях.
В другом аспекте изобретения эффективное лечение болезни почек у субъекта способами, описанными в данном документе, может определяться по различным индикаторам эритропоэза и/или функционирования почек. В одном варианте реализации изобретения индикаторы эритроидного гомеостаза включают, в частности: гематокрит (ГКТ), уровень гемоглобина (ГБ), средний эритроцитарный гемоглобин (СЭГ), число красных клеток крови (ЧКК), число ретикулоцитов, % ретикулоцитов, средний объем эритроцитов (СОЭ) и ширину распределения красных клеток крови (ШРК). В другом варианте реализации изобретения индикаторы функционирования почек включают, в частности: содержание сывороточного альбумина, соотношение альбумина к глобулину (соотношение A/G), содержание сывороточного фосфора, сывороточного натрия, размер почек (измеряемый ультразвуком), сывороточного кальция, соотношение фосфоражальция, содержание сывороточного калия, протеинурию, креатинин мочи, сывороточный креатинин, азот мочевины крови (АМК), уровни холестерина, уровни триглицеридов и скорость гломерулярной фильтрации (СГФ). Кроме того, некоторые индикаторы общего состояния здоровья и самочувствия включают, в частности: набор или потерю веса, продолжительность жизни, давление крови (среднее общее давление крови, диастолическое давление крови или систолическое давление крови) и характеристики физической выносливости.
В другом варианте реализации изобретения эффективное лечение биологически активным составом клеток почек доказывают по стабилизации одного или более индикаторов функционирования почек. Стабилизацию функционирования почек демонстрируют путем определения изменения индикатора у субъекта, которого лечили способом, предложенным в данном документе, по сравнению с таким же индикатором у субъекта, который не проходил лечение описанным в данном документе способом. В альтернативном варианте, стабилизация функционирования почек может быть продемонстрирована путем определения изменения индикатора у субъекта, которого лечили способом, описанным в данном документе, по сравнению с таким же индикатором того же субъекта перед лечением. Изменение первого индикатора по величине может быть увеличивающимся или уменьшающимся. В одном варианте реализации изобретения предложенное настоящим описанием лечение может включать стабилизацию у субъекта уровня азота мочевины крови (АМК), когда уровни АМК, наблюдаемые у субъекта, оказываются ниже по сравнению с субъектом со схожим болезненным состоянием, который не получал лечение способами по настоящему изобретению. В еще одном другом варианте реализации изобретения лечение может включать стабилизацию у субъекта уровней сывороточного креатинина, когда уровни сывороточного креатинина, наблюдаемые у субъекта, оказываются ниже по сравнению с субъектом со схожим болезненным состоянием, который не получал лечение способами по настоящему изобретению. В другом варианте реализации изобретения лечение может включать стабилизацию у субъекта уровней гематокрита (ГКТ), когда уровни ГКТ, определяемые у субъекта, оказываются выше по сравнению с субъектом со схожим болезненным состоянием, который не получал лечение способами по настоящему изобретению. В другом варианте реализации изобретения лечение может включать стабилизацию у субъекта уровней красных клеток крови (RBC), когда уровни RBC, определяемые у субъекта, оказываются выше по сравнению с субъектом со схожим болезненным состоянием, который не получал лечение способами по настоящему изобретению. Средним специалистам в данной области техники известно, что для определения эффективного лечения болезни почек у субъекта могут измеряться один или более дополнительных индикаторов, описанных в данном документе или известных в данной области техники.
В другом аспекте изобретения настоящее описание касается составов, применяемых для способов, обеспечивающих достижение у субъекта эритроидного гомеостаза. В одном варианте реализации изобретения способ включает этап: (а) введения субъекту состава, содержащего популяцию клеток почек, например, В2 или В4', или смесь клеток почек, например, В2/В4' и/или В2/В3, или обогащенную популяцию клеток почек, описанную в данном документе и (b) определения в биологическом образце, полученном от субъекта, того, что уровень индикатора эритропоэза отличается относительно уровня индикатора в контроле, причем разница в уровне индикатора: (i) указывает, что субъект чувствительный к этапу введения (а) или (ii) является показателем возникновения у субъекта эритроидного гомеостаза. В другом варианте реализации изобретения способ включает этап: (а) введения субъекту состава, содержащего популяцию клеток почек или смесь клеток почек, описанные в данном документе, и (b) определения в биологическом образце, полученном от субъекта, того, что уровень индикатора эритропоэза отличается относительно уровня индикатора в контроле, причем разница в уровне индикатора: (i) указывает, что субъект чувствительный к стадии введения (s) или (ii) является показателем возникновения у субъекта эритроидного гомеостаза. В другом варианте реализации изобретения способ включает стадию: (а) создания биоматериала или биосовместимого полимерного каркаса; (b) осаждения популяции клеток почек или смеси клеток почек по настоящему изобретению на или внутрь биоматериала или каркаса способом, описанным в данном документе, с образованием имплантируемой конструкции; (с) получения состава, содержащего конструкцию; (d) имплантирования конструкции субъекту и (е) определения в биологическом образце, полученном от субъекта, того, что уровень индикатора эритропоэза отличается относительно уровня индикатора в контроле, причем разница в уровне индикатора: (i) указывает, что субъект чувствительный к этапу введения (а) или (ii) является показателем возникновения у субъекта эритроидного гомеостаза.
В другом аспекте изобретения настоящее описание касается составов, применяемых в способах, обеспечивающих как стабилизацию функционирования почек, так и восстановление эритроидного гомеостаза у нуждающегося субъекта, указанный субъект страдает как недостаточным функционированием почек, так и анемией и/или дефицитом ЭПО. В одном варианте реализации изобретения способ включает этап введения состава, содержащего популяцию клеток почек или смеси клеток почек, описанных в данном документе, которые содержат по меньшей мере один из следующих типов клеток: клеток трубочек, клеток гломерул, клеток межклеточной ткани, клеток собирательных протоков, клеток стромальной ткани или клеток сосудистой системы. В другом варианте реализации изобретения данная популяция или смесь содержит как ЭПО-продуцирующие клетки, так и тубулярные эпителиальные клетки, тубулярные клетки идентифицированые по по меньшей мере одному из следующих маркеров: мегалин, кубилин, синтаза 2 гиалуроновой кислоты (HAS2), 25-гидроксилаза витамина D3 (CYP2D25), N-кадгерин (Ncad), Е-кадгерин (Ecad), аквапорин-1 (Aqp1), аквапорин-2 (Aqp2), RAB17, представителя семейства онкогенов RAS (Rati 17), GATA-связывающий белок 3 (Gata3), FXYD-домен-содержащий регулятор 4 ионного транспорта (Fxyd4), представителя 4 (Slc9a4) семейства 9 растворимых переносчиков (антипортер ионов натрия/водорода), представителя В1 семейства альдегиддегидрогеназы 3 (Aldh3b1), представителя A3 семейства альдегиддегидрогеназы 1 (Aldh1a3) и кальпаин-8 (Capn8). В этом варианте реализации изобретения лечение субъекта может быть продемонстрировано путем улучшения по меньшей мере одного индикатора функционирования почек, сопровождающегося улучшением по меньшей мере одного индикатора эритропоэза, по сравнению с нелеченным субъектом или с индикаторами субъекта до лечения.
В одном аспекте изобретения в настоящем описании предложены составы для применения в способах: (i) лечения болезни почек, анемии или дефицита ЭПО; (ii) стабилизации функционирования почек, (iii) восстановления эритроидного гомеостаза или (iv) любой их комбинации введением популяции клеток почек, обогащенной ЭПО-продуцирующими клетками, или смесью клеток почек, содержащей популяцию клеток, обогащенную ЭПО-продуцирующими клетками, описанной в данном документе, причем благоприятные эффекты введения превышают эффекты введения популяции клеток, не обогащенной ЭПО-продуцирующими клетками. В другом варианте реализации изобретения обогащенная популяция клеток обеспечивает улученный уровень азота мочевины сыворотки крови (АМК). В другом варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенное удержание белка в сыворотке. В другом варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенные уровни сывороточного холестерина и/или триглицеридов. В другом варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенный уровень витамина D. В одном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенное соотношение фосфор: кальций по сравнению с необогащенной популяцией клеток. В другом варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенный уровень гемоглобина по сравнению с необогащенной популяцией клеток. В дополнительном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенный уровень сывороточного креатинина по сравнению с необогащенной популяцией клеток. В еще одном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенный уровень гематокрита по сравнению с необогащенной популяцией клеток. В дополнительном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенный уровень числа красных клеток крови (RBC#) по сравнению с необогащенной популяцией клеток. В одном варианте реализации изобретения улучшенный уровень гематокрита восстанавливается на 95% от нормального здорового уровня. В дополнительном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенное число ретикулоцитов по сравнению с необогащенной популяцией клеток. В других вариантах реализации изобретения обогащенная популяция клеток обеспечивает улучшенное процентное содержание ретикулоцитов по сравнению с необогащенной популяцией клеток. В еще одном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенную ширину распределения объема красных клеток крови (ШРК) по сравнению с необогащенной популяцией клеток. В еще одном варианте реализации изобретения обогащенная популяция клеток обеспечивает улучшенный уровень гемоглобина по сравнению с необогащенной популяцией клеток. В еще одном варианте реализации изобретения обогащенная популяция клеток обеспечивает эритропоэтический ответ в костном мозге, так что насыщенность клетками костного мозга становится почти нормальной и соотношение миелоидных : эритроидных клеток становится почти нормальным.
В другом аспекте изобретения в настоящем описании предложены составы для применения в способах: (i) лечения болезни почек, анемии или дефицита ЭПО; (ii) стабилизации функционирования почек, (iii) восстановления эритроидного гомеостаза или (iv) любой их комбинации введением обогащенной популяции клеток почек, причем благоприятные эффекты введения популяции клеток почек или смеси популяций клеток почек, описанной в данном документе, характеризуется достижением улучшенного эритроидного гомеостаза по сравнению с благоприятными эффектами, достигаемыми введением рекомбинантного ЭПО (рЭПО). В одном варианте реализации изобретения популяция или смесь при введении нуждающемуся субъекту обеспечивает улучшенный эритроидный гомеостаз (при определении по гематокриту, содержанию гемоглобина или RBC#) по сравнению с введением рекомбинантного белка ЭПО. В одном варианте реализации изобретения популяция или смесь при введении обеспечивает улучшенный гематокрит, RBC или уровень гемоглобина по сравнению с рекомбинантным ЭПО, превышая не более чем на 10% в меньшую или большую сторону гематокрит в контроле. В дополнительном варианте реализации изобретения одна доза или доставка популяции или смеси при введении обеспечивает улучшение у проходящего лечение субъекта эритроидного гомеостаза (при определении по гематокриту, уровню гемоглобина или RBC#) в течение периода времени, который значительно превышает период времени, который обеспечивает улучшение эритроидного гомеостаза от одной дозы или доставки рекомбинантного белка ЭПО. В другом варианте реализации изобретения популяция или смесь при введении в дозе, описанной в данном документе, не приводит к изменению гематокрита, уровня гемоглобина или RBC# более чем на 110% от нормальных уровней, соответствующих здоровым контролям. В дополнительном варианте реализации изобретения популяция или смесь при введении в дозе, описанной в данном документе, обеспечивает превосходный эритроидный гомеостаз (при определении по гематокриту, уровню гемоглобина или RBC#) по сравнению с рекомбинантным белком ЭПО, доставляемым в дозе, описанной в данном документе. В другом варианте реализации изобретения рекомбинантный ЭПО доставляют в дозе около 100 МЕ/кг, около 200 МЕ/кг, около 300 МЕ/кг, около 400 МЕ/кг или около 500 МЕ/кг. Средним специалистам в данной области техники известно, что могут подойти другие дозы рекомбинантного ЭПО, известные в данной области.
Другой вариант реализации настоящего изобретения направлен на применение составов, содержащих по меньшей мере одну популяцию клеток, включающую обогащенные популяции клеток и их смеси, описанные в данном документе, или имплантируемые конструкции, описанные в данном документе, или секретируемые продукты, описанные в данном документе, для получения лекарственного средства для лечения болезни почек, анемии или дефицита ЭПО у нуждающегося субъекта, обеспечения достижения эритроидного гомеостаза у нуждающегося субъекта, улучшения функционирования почек у нуждающегося субъекта или обеспечение регенеративного эффекта для нативной почки.
Другой вариант реализации настоящего изобретения направлен на составы, содержащие специфическую(ие) обогащенную(ые) популяцию(и) клеток (описанную(ые) в данном документе) для лечения болезни почек специфической этиологии, основанном на выборе специфической(их) субпопуляции(й) клеток на основании специфических проверяемых терапевтических аттрибутов.
В еще одном аспекте изобретения в настоящем описании предложены составы для применения в способах лечения болезни почек у нуждающегося субъекта, включающие: введение субъекту состава, содержащего смесь клеток почек млекопитающих, включающую первую популяцию клеток, В2, содержащую выделенную обогащенную популяцию тубулярных клеток, имеющую плотность между 1,045 г/мл и 1,052 г/мл, и вторую популяцию клеток, В4', содержащую эритропоэтин(ЭПО)-продуцирующие клетки и васкулярные клетки, но обедненную гломерулярными клетками, имеющую плотность между 1,063 г/мл и 1,091 г/мл, причем данная смесь не включает популяцию клеток В1, содержащую большие гранулярные клетки собирательной дуктальной и тубулярной системы, имеющую плотность <1,045 г/мл, или популяцию клеток В5, содержащую дебрис и малые клетки с низкой гранулярностью и жизнеспособностью, с плотностью >1,091 г/мл. В некоторых вариантах реализации изобретения способ включает определение в исследуемом образце, полученном от субъекта, того, что уровень индикатора функционирования клеток отличается относительно уровня индикатора в контроле, причем разница уровня индикатора указывает на уменьшение снижения, стабилизацию или улучшение у субъекта одной или более функций почек. В одном варианте реализации изобретения популяция клеток В4', применяемая в данном способе, характеризуется экспрессией васкулярного маркера. В некоторых вариантах реализации изобретения популяция клеток В4', применяемая в данном способе, не характеризуется экспрессией гломерулярного маркера. В одном варианте реализации изобретения смесь клеток, применяемая в данном способе, способна к кислород-регулируемой экспрессии эритропоэтина (ЭПО). В некоторых вариантах реализации изобретения болезнь почек, которыую следует лечить способами данного описания, сопровождается дефицитом эритропоэтина (ЭПО). В некоторых вариантах реализации изобретения дефицит ЭПО представляет собой анемию. В некоторых вариантах реализации изобретения дефицит ЭПО или анемия проявляются у субъекта как вторичное заболевание при почечной недостаточности. В некоторых других вариантах реализации изобретения дефицит ЭПО или анемия происходит как вторичное заболевание при нарушении, выбранном из группы, содержащей из: хронической почечной недостаточности, превичного дефицита ЭПО, химиотерапии или противовирусной терапии, немиелоидного рака, инфекции ВИЧ, болезни печени, сердечной недостаточности, ревматоидного артрита или функциональной недостаточности многих органов. В некоторых вариантах реализации изобретения композиция, применяемая в данном способе, дополнительно включает биоматериал, содержащий один или более биосовместимых синтетических полимеров и/или встречающихся в природе белков или пептидов, причем смесь покрывают, осаждают на или в, захватывают в, суспендируют в, внедряют в и/или иным образом комбинируют с биоматериалом. В некоторых вариантах реализации изобретения смесь, которую применяют в составах данного описания, получают из ткани почек млекопитающих или культивированных клеток почек млекопитающих. В других вариантах реализации изобретения смесь получают из образца почек, который аутологичен нуждающемуся субъекту. В одном варианте реализации изобретения образец представляет собой биоптат почек. В других вариантах реализации изобретения состав содержит смесь, которую получают из неаутологичного образца почки.
В еще одном аспекте изобретения в настоящем описании предложено применение состава, содержащего препараты клеток или смеси, описанные в данном документе, или имплантируемую конструкцию по настоящему изобретению для получения лекарственного средства, пригодного для лечения болезни почек, анемии и/или дефицита ЭПО у нуждающегося субъекта.
В другом аспекте изобретения в настоящем описании предложены составы для применения в способах регенерации нативной почки у нуждающегося субъекта. В одном варианте реализации изобретения данный способ включает этап введения или имплантирования субъекту популяции клеток, смеси или конструкции, описанной в данном документе. Регенерированная нативная почка может характеризоваться по нескольким индикаторам, включая, в частности: развитие функционирования или способности нативной почки, улучшение функционирования или способности нативной почки и экспрессии определенных маркеров нативной почки. В одном варианте реализации изобретения появившееся или улучшенное функционирование или способность могут определяться на основе различных индикаторов эритроидного гомеостаза и функционирования клеток, описанных выше. В другом варианте реализации изобретения регенерированная почка характеризуется отличающейся экспрессией одного или более маркеров стволовых клеток. Маркер стволовых клеток может быть одним или более из следующих маркеров: SRY (определяющий пол участок хромосомы Y)-бокс 2 (Sox2); фактор транскрипции недифференцированных эмбриональных клеток (UTF1); гомолог белка нодаль мыши (NODAL); проминин 1 (PROM1) или CD133 (CD133); CD24 и любая их комбинация (см. заявку Ilagan et al. PCT/US2011/036347, включенную в данный документ в полном объеме посредством ссылки). В другом варианте реализации изобретения экспрессия маркера(ов) стволовых клеток является активированной по сравнению с контролем.
Для обеспечения регенеративного эффекта нативной почки могут применяться популяции клеток, описанные в данном документе, включая обогащенные популяции клеток и их смеси, а также содержащие их конструкции. Данный эффект может обеспечиваться за счет самих клеток и/или благодаря продуктам, секретируемым клетками. Регенеративный эффект может быть охарактеризован одним или более из следующих показателей: снижение эпителиально-мезенхимального преобразования (которое может происходить посредством сигналинга TGF-β); снижение воспаления почек; измененная экспрессия маркера стволовых клеток в нативной почке; миграция имплантированных клеток и/или нативных клеток в место повреждения почки, например, повреждения трубочек, приживление имплантированных клеток в месте повреждения почки, например повреждения трубочек; стабилизация одного или более индикаторов функционирования почек (описанных в данном документе); восстановление эритроидного гомеостаза (как описано в данном документе) и любая их комбинация.
7. Способы мониторинга регенерации
В другом аспекте изобретения в настоящем описании предложен способ прогнозирования для мониторинга регенерации нативной почки после введения или имплантации субъекту состава, содержащего популяцию клеток, смесь или конструкцию, описанную в данном документе. В одном варианте реализации изобретения данный способ включает этап детектирования уровня экспрессии маркера в исследуемом образце, полученном от субъекта, и в контрольном образце, причем более высокий уровень экспрессии маркера в исследуемом образце по сравнению с контрольным образцом является прогностическим для регенерации нативной почки субъекта. В другом варианте реализации изобретения данный метод включает детекцию в образце экспрессии одного или более маркеров стволовых клеток. Маркер стволовых клеток может быть выбран из маркеров: Sox2; UTF1; MODAL; CD133; CD24 и любой их комбинации (см. Пример 11 заявки Ilagan et al. PCT/US2011/036347). Этап детектирования может включать определение того, активирована или превышена экспрессия маркера(ов) стволовых клеток в исследуемом образце относительно контрольного образца, причем более высокий уровень экспрессии является прогностическим для регенерации нативной почки субъекта. В еще одном другом варианте реализации изобретения детектируют экспрессию мРНК маркера(ов) стволовых клеток. В других вариантах реализации изобретения детекция экспрессии мРНК может происходить при использовании метода на основе ПЦР, например, кПЦР-РВ. Для детекции мРНК также может применяться гибридизация in situ. В другом варианте реализации изобретения полипептидная экспрессия маркера стволовых клеток также может детектироваться с помощью антительного агента маркера стволовых клеток. В другом варианте реализации изобретения агенты представляют собой антитела против данного маркера. В другом варианте реализации изобретения маркер полипептидной экспрессии стволовых клеток детектируют с помощью иммуногистохимического метода или методом Вестерн-блоттинга. Специалисты в данной области техники знают другие методы детектирования экспрессии мРНК и/или полипептидной экспрессии маркеров.
В другом аспекте изобретения в данном описании предложены способы прогностической оценки состояния пациента после имплантации или введения состава, содержащего популяцию клеток, смесь или конструкцию, описанную в данном документе. В одном варианте реализации изобретения данный способ включает этап детектирования уровня экспрессии маркера в исследуемом образце, полученном от указанного субъекта; (b) определения уровня экспрессии в исследуемом образце относительно уровня экспрессии маркера контрольного образца (или эталонного значения контроля) и (с) оценка прогноза регенерации для пациента на основе определения уровней экспрессии маркера, причем более высокий уровень экспрессии маркера в исследуемом образце по сравнению с контрольным образцом (или эталонным значением контроля) является прогностическим в отношении регенерации субъекта.
В еще одном другом аспекте изобретения в настоящем описании предложены способы прогнозирования для мониторинга регенерации нативной почки после введения или имплантации субъекту состава, содержащего популяцию клеток, смесь или конструкцию, описанную в данном документе, для которой применен неинвазивный способ введения. В качестве альтернативы проведению биопсии ткани результат регенерации у субъекта, получающего лечение, может быть оценен при исследовании жидкости организма, например, мочи. Обнаружено, что микровезикулы, полученные от источников мочи субъекта, содержат компоненты, включающие, в частности: специфические белки и миРНК, которые походят исключительно из популяций клеток почек, подвергшихся лечению популяциями клеток по настоящему изобретению. Эти компоненты могут включать факторы, участвующие в репликации и дифференциации стволовых клеток, апоптозе, воспалении и иммунной модуляции. Временной анализ паттернов экспрессии связанных с микровезикулами миРНК/белка позволяет проводить постоянный мониторинг результатов регенерации почек субъектов, получающих популяции клеток, смеси или конструкции по настоящему изобретению.
Эти везикулы почек и/или содержимое просвета везикул почек, собирающееся в мочу субъекта, может быть проанализировано на биомаркеры, являющиеся показателями результата регенерации.
В одном варианте реализации изобретения в настоящем описании предложены способы оценивания того, является ли пациент с болезнью почек (БП) чувствительным к лечению с помощью терапевтического состава. Способ может включать этап определения или детектирования количества везикул или содержимого их просвета в исследуемом образце, полученном от пациента с БП, лечившегося данным терапевтическим средством, по сравнению с или относительно количества везикул в контрольном образце, причем большее или меньшее количество везикул или содержимого их просвета в исследуемом образце по сравнению с количеством везикул или содержимым их просвета в контрольном образце является показателем восприимчивости лечившегося пациента к лечению данным терапевтическим средством.
В настоящем описании также предложен способ мониторинга эффективности лечения пациента с БП терапевтическим средством. В одном варианте реализации изобретения данный способ включает этап определения или детектирования количества везикул в исследуемом образце, полученном от пациента с БП, лечившегося данным терапевтическим средством, по сравнению с или относительно количества везикул или содержимого их просвета в контрольном образце, причем большее или меньшее количество везикул или содержимого их просвета в исследуемом образце по сравнению с количеством везикул или содержимым их просвета в контрольном образце является показателем эффективности лечения пациента с БП данным терапевтическим средством.
В настоящем описании предложен способ идентификации субпопуляции пациента, для которого агент является эффективным в отношении лечения болезни почек (БП). В одном варианте реализации изобретения данный способ включает этап определения корреляции между эффективностью агента и наличия определенного количества везикул или содержимого их просвета в исследуемых образцах из субпопуляции пациента по сравнению с количеством везикул или содержимым их просвета, полученных из контрольного образца, причем большее или меньшее количество везикул в образцах из субпопуляции пациента по сравнению с количеством везикул или содержимым их просвета в контрольном образце является показателем эффективности агента в отношении лечения БП в субпопуляции пациента.
Этап определения или детектирования может включать анализ количества миРНК и других секретируемых продуктов, которые могут существовать в исследуемом образце, например, моче.
Неинвазивные способы прогнозирования могут включать этап получения образца мочи субъекта перед и/или после введения или имплантации популяции клеток, смеси или конструкции, описанной в данном документе. Везикулы или другие секретируемые продукты могут быть выделены из образцов мочи с помощью стандартных методик, включающих, в частности, центрифугирование для удаления нежелательного дебриса (Zhou et al. 2008, Kidney Int. 74(5): 613-621; Skog et al. опубликованная патентная заявка США №20110053157, каждая из публикаций включена в данный документ в полном объеме посредством ссылки).
Настоящее описание относится к неинвазивным способам детектирования у субъекта результата регенерации после лечения. Данные способы включают детектирование количества везикул или содержимого их просвета в моче субъекта, получившего лечение. В содержимом просвета может содержаться одна или более миРНК. Для таких способов прогнозирования могут подходить наборы или панели для детектирования наличия отдельных миРНК. Типовые наборы включают две или более из следующих молекул: miR-24; miR-195; miR-871; miR-30b-5p; miR-19b; miR-99a; miR-429; let-7f; miR-200a; miR-324-5p; miR-10a-5p или любую их комбинацию. В одном варианте реализации изобретения такой набор миРНК может включать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или более отдельных миРНК. Средним специалистам в данной области техники известно, что для применения таких способов прогнозирования могут подойти другие миРНК и наборы миРНК. Источники дополнительных миРНК, включают молекулы базы данных miRBase на сайте http://mirbase.org, который размещен и поддерживается факультетом медико-биологических наук Университета Манчестера.
Специалисты в данной области техники знают, что способы прогнозирования для детектирования регенерации могут подходить для субъектов, которых лечили другими терапевтическими средствами, известными в данной области техники, отдельно от популяций клеток и конструкций, описанных в данном документе.
В некоторых вариантах реализации изобретения этап определения включает использование программного обеспечения, выполняемого соответствующим процессором, с целью: (i) измерения отличающегося уровня экспрессии маркеров (или количества везикул/содержимого везикул) в исследуемом образце и контроле; и/или (ii) анализа данных, полученных при измерении отличающегося уровня экспрессии маркеров в исследуемом образце и контроле. Подходящее программное обеспечение и процессоры хорошо известны в данной области знания и коммерчески доступны. Программа может быть воплощена в виде программного обеспечения на материальном носителе, таком как диск CD-ROM, гибкий диск, накопитель на жестких дисках, диск DVD или устройстве памяти, связанном с процессором, но средние специалисты в данной области техники обычно знают, что вся программа или ее части, в альтернативном варианте, могут выполняться устройством, отличным от процессора, и/или воплощаться в аппаратно-программном обеспечении и/или специализированном аппаратном обеспечении хорошо известным способом.
Последующий этап определения, измерения результатов, данные анализа, диагнозы, результаты предвидения и/или рекомендации по лечению, как правило, записываются и передаются, к примеру, техническим специалистам, врачам и/или пациентам. В некоторых вариантах реализации изобретения для передачи такой информации заинтересованным сторонам, таким как пациенты и/или лечащие врачи, должны применяться компьютеры. В некоторых вариантах реализации изобретения в стране или зоне юрисдикции, которая отличается от страны или зоны юрисдикции, в которую передаются результаты или диагнозы, должны выполняться анализы данных или анализироваться результаты исследований.
В предпочтительном варианте реализации изобретения прогноз, предвидение и/или рекомендации по лечению, основанные на уровне экспрессии маркеров, измеренном у исследуемого субъекта, имеющего отличающийся уровень экспрессии маркеров, передаются субъекту в максимально короткие сроки после завершения анализа и получения прогноза и/или предвидения. Результаты и/или сопутствующая информация могут передаваться субъекту лечащим врачом данного субъекта. В альтернативном варианте могут передаваться непосредственно исследуемому субъекту любыми средствами сообщения, включая письменную, электронную формы сообщения, такие как электронная почта или телефон. Предоставление информации может облегчаться путем использования компьютера, таким как в случае сообщении электронной почты. В некоторых вариантах реализации изобретения предоставление информации, содержащей результаты прогностического исследования и/или выводы, полученные из и/или по рекомендациям по лечению на основании данного исследования, может быть получено и передано субъекту автоматически с помощью комбинации компьютерного аппаратного и программного обеспечения, которое должно быть знакомо специалистам в области телекоммуникаций. Один пример коммуникационной системы, ориентированной для применения в сфере здравоохранения, описан в патенте США №6283761; однако, настоящее описание не ограничено способами, в которых используется эта конкретная коммуникационная система. В некоторых вариантах реализации изобретения способы данного описания, все или некоторые из этапов данного способа, включая исследование образцов, прогноз и/или предвидение регенерации, и передачи результатов исследования или прогнозов, могут выполнятся под различными (например, зарубежными) зонами юрисдикции.
В другом аспекте изобретения способы прогнозирования, описанные в данном документе, обеспечивают информацией заинтересованную сторону, рассматривающую успех регенерации имплантации или введения.
Во всех вариантах реализации изобретения способы обеспечения получения регенерированной почки у субъекта, нуждающегося в таком описанном в данном документе лечении, могут включать этап пост-имплантации прогностической оценки регенерации, описанной выше.
8. Составы с биологически активными клетками
Составы, описанные в данном документе, включают биоматериалы, обладающие свойствами, которые создают благоприятное окружение для активного агента, такого как вводимые субъекту биологически активные клетки почек. В одном варианте реализации изобретения состав содержит первый биоматериал, который обеспечивает благоприятное окружение с момента времени, когда активный агент вводят в состав с биоматериалом вплоть до момента введения субъекту. В еще одном другом варианте реализации изобретения под благоприятным окружением понимают преимущества от того, что биологически активные клетки перед введение субъекту суспендированы в биоматериале в практически твердом состоянии по сравнению с клетками в жидкости (описанной в данном документе). В другом варианте реализации изобретения первый биоматериал представляет собой термочувствительный биоматериал. Термочувствительный биоматериал может иметь: (i) практически твердое состояние при температуре около 8°C или ниже и (ii) практически жидкое состояние при температуре окружающей среды или выше. В одном варианте реализации изобретения температура окружающей среды приблизительно равна комнатной температуре.
В другом варианте реализации изобретения состав содержит биологически активные клетки, соединенные со вторым биоматериалом, который обеспечивает благоприятное окружение для объединенных клеток с момента времени приготовления состава вплоть до момента после введения субъекту. В одном варианте реализации изобретения благоприятное окружение, обеспечиваемое вторым биоматериалом, касаются получения преимуществ при введении клеток в биоматериал, который сохраняет структурную целостность вплоть до момента введения субъекту или в течение определенного периода времени после введения. В одном варианте реализации изобретения структурная целостность второго биоматериала после имплантации сохраняется минуты, часы, сутки или недели. В одном варианте реализации изобретения структурная целостность сохраняется менее одной недели, менее одних суток или менее одного часа. Относительно короткий период структурной целостности обеспечивает состав, который может доставлять активный агент и биоматериал в целевое место в ткани и органе, с контролируемым удержанием, расположением или дисперсией без препятствия или барьера для взаимодействия инкорпорированных элементов с тканью и органом, в который поместили состав.
В другом варианте реализации изобретения второй биоматериал представляет собой термочувствительный биоматериал, который имеет другую чувствительность чем первый биоматериал. Второй биоматериал может иметь: (i) практически твердое состояние при температуре около температуры окружающей среды или ниже и (ii) практически жидкое состояние при температуре около 37°C или выше. В одном варианте реализации изобретения температура окружающей среды приблизительно равна комнатной температуре.
В одном варианте реализации изобретения второй биоматериал представляет собой перекрестносшитые гранулы. Для перекрестносшитых гранул может быть достигнут точный контроль времени удержания in vivo, в зависимости от степени перекрестной сшивки, как описано в данном документе. В другом варианте реализации изобретения перекрестносшитые гранулы содержат биологически активные клетки и устойчивы к ферментативной деградации, как описано в данном документе.
Составы по настоящему изобретению могут включать первый биоматериал, соединенный с активным агентом, например, биологически активными клетками, с или без второго биоматериала, соединенного с активным агентом, например, биологически активными клетками. Если состав содержит второй биоматериал, то он может представлять собой термочувствительную гранулу и/или перекрестносшитую гранулу. Различные репрезентативные составы представлены ниже в примерах (см. также Фигуры 3-7).
Препараты биологически активных клеток, смесей и/или конструкций, описанных в данном документе, могут вводиться как составы биологически активных клеток. В одном аспекте изобретения составы включают клетки и один или более биоматериалов, которые обеспечивают стабильность препаратов биологически активных клеток, смесей и/или конструкций, описанных в данном документе. В одном варианте реализации изобретения биоматериал представляет собой термочувствительный биоматериал, который может поддерживать по меньшей мере две разные фазы или состояния, в зависимости от температуры. Данный биоматериал способен поддерживать первое состояние при первой температуре, второе состояние при второй температуре и/или третье состояние при третьей температуре. Первое, второе или третье состояние может быть практически твердым, практически жидким или практически полутвердым или полужидким состоянием. В одном варианте реализации изобретения данный биоматериал обладает первым состоянием при первой температуре и вторым состоянием при второй температуре, причем первая температура ниже, чем вторая температура.
В еще одном другом варианте реализации изобретения состояние термочувствительного биоматериала представляет собой практически твердое состояние при температуре около 8°C или ниже. В других вариантах реализации изобретения практически твердое состояние поддерживается при температуре около 1°C, около 2°C, около 3°C, около 4°C, около 5°C, около 6°C, около 7°C или около 8°C. В одном варианте реализации изобретения практически твердое состояние имеет форму геля. В других варианте реализации изобретения состояние термочувствительного биоматериала представляет собой практически жидкое состояние при температуре окружающей среды или выше. В одном варианте реализации изобретения практически жидкое состояние поддерживается при температуре около 31°C, около 32°C, около 33°C, около 34°C, около 35°C, около 36°C или около 37°C. В одном варианте реализации изобретения температура окружающей среды представляет собой приблизительно комнатную температуру.
В другом варианте реализации изобретения состояние термочувствительного биоматериала представляет собой практически твердое состояние при температуре около температуры окружающей среды или ниже. В одном варианте реализации изобретения температура окружающей среды представляет собой приблизительно комнатную температуру. В другом варианте реализации изобретения практически твердое состояние поддерживается при температуре около 17°C, около 16°C, около 15°C, около 14°C, около 13°C, около 12°C, около 11°C, около 10°C, около 9°C, около 8°C, около 7°C, около 6°C, около 5°C, около 4°C, около 3°C, около 2°C или около 1°C. В одном варианте реализации изобретения практически твердое состояние имеет форму гранулы. В другом варианте реализации изобретения состояние термочувствительного биоматериала представляет собой практически жидкое состояние при температуре около 37°C или выше. В одном варианте реализации изобретения практически твердое состояние среды поддерживается при температуре около 37°C, около 38°C, около 39°C или около 40°C.
Термочувствительные биоматериалы могут предлагаться в форме раствора, в форме гранул или других подходящих формах, описанных в данном документе, и/или известных средним специалистам в данной области техники. Популяций клеток и составы, описанные в данном документе могут быть покрыты, осаждены на, внедрены в, прикреплены к, посажены или захвачены термочувствительным биоматериалом. В альтернативном варианте термочувствительный биоматериал может быть предложен без каких-либо клеток, такой как, к примеру, в форме заполняемых гранул.
В других вариантах реализации изобретения термочувствительный биоматериал имеет переходное состояние между первым состоянием и вторым состоянием. В одном варианте реализации данное переходное состояние представляет собой переходное состояние твердое тело-жидкость между температурой около 8°C и температурой около температуры окружающей среды. В одном варианте реализации изобретения температура окружающей среды представляет собой приблизительно комнатную температуру. В еще одном другом варианте реализации изобретения переходное состояние твердое тело-жидкость проявляется при одной или более температурах около 8°C, около 9°C, около 10°C, около 11°C, около 12°C, около 13°C, около 14°C, около 15°C, около 16°C, около 17°C или около 18°C.
Температурочувствительные биоматериалы имеют определенную вязкость при заданной температуре, измеренной в сантипуазах (сП). В одном варианте реализации изобретения данный биоматериал имеет при температуре 25°C вязкость от около 1 сП до около 5 сП, от около 1,1 сП до около 4,5 сП, от около 1,2 сП до около 4 сП, от около 1,3 сП до около 3,5 сП, от около 1,4 сП до около 3,5 сП, от около 1,5 сП до около 3 сП, от около 1,55 сП до около 2,5 сП или от около 1,6 сР до около 2 сП. В другом варианте реализации изобретения 0,75% (мас./об.) раствор имеет вязкость при 37°C от около 1,0 сП до около 1,15 сП. Вязкость при температуре 37°C может составлять около 1,0 сП, около 1,01 сП, около 1,02 сП, около 1,03 сП, около 1,04 сП, около 1.05 сП, около 1,06 сП, около 1,07 сП, около 1,08 сП, около 1,09 сП, около 1,10 сП, около 1,11 сП, около 1,12 сП, около 1,13 сП, около 1,14 сП или около 1,15 сП. В еще одном другом варианте реализации изобретения биоматериал представляет собой раствор желатина. Желатин представлен в растворе в концентрации около 0,5%, около 0,55%, около 0,6%, около 0,65%, около 0,7%, около 0,75%, около 0,8%, около 0,85%, около 0,9%, около 0,95% или около 1% (мас./об.). В одном примере биоматериал представляет собой 0,75% (мас./об.) раствор желатина в ФСБ. В одном варианте реализации изобретения данный 0,75% (мас./об.) раствор имеет вязкость при 25°C от около 1,6 сП до около 2 сП. В одном варианте реализации изобретения данный 0,75% (мас./об.) раствор имеет вязкость при 37°C от около 1,07 сП до около 1,08 сП. Раствор желатина может быть приготовлен в ФСБ, среде DMEM или другом подходящем растворителе.
В одном аспекте изобретения состав с биологически активными клетками включает также агент, способствующий выживанию клеток. В одном варианте реализации изобретения агент, обеспечивающий выживание клеток, выбран из группы, состоящей из: антиоксиданта, переносчика кислорода, иммуномодулирующего фактора, фактора рекрутирования клеток, фактора прикрепления клеток, противовоспалительного агента, ангиогенного фактора, ранозаживляющего фактора и продуктов, секретируемых биологически активными клетками.
Антиоксиданты характеризуются способностью ингибировать окисление других молекул. Антиоксиданты включают, в частности одно или более из веществ: 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (Trolox®), каротиноиды, флавоноиды, изофлавоны, убихинон, глутатион, липоевую кислоту, супероксиддисмутазу, аскорбиновую кислоту, витамин Е, витамин А, смешанные каротиноиды (например, бета-каротин, альфа-каротин, гамма-каротин, лютеин, ликопин, фитопин, фитофлуин и астаксантин), селен, коэнзим Q10, индол-3-карбинол, проантоцианидины, ресвератрол, кверцетин, катехины, салициловую кислоту, куркумин, билирубин, щавелевую кислоту, фитиновую кислоту, липоевую кислоту, ванилиновую кислоту, полифенолы, феруловую кислоту, теафлавины и их производные. Средним специалистам в данной области техники известны другие антиоксиданты подходящие для применения в настоящем описании.
Переносчики кислорода представляют собой агенты, характеризующиеся способностью переносить и высвобождать кислород. Они, в частности включают: перфторуглероды и фармацевтические препараты, содержащие перфторуглероды. Подходящие переносчики кислорода на основе перфторуглеродов включают, в частности: перфтороктилбромид (C8F17Br); перфтордихлоротан (C8F16C12); перфтордецилбромид; перфлуброн; перфтордекалин; перфтортрипропиламин; перфторметиллциклопиперидин; Fluosol® (перфтордекалин и перфтортрипропиламин); Perftoran® (перфтордекалин и перфторметиллциклопиперидин); Oxygent® (перфтордецилбромид и перфлуброн); Ocycyte™ (перфтор(трет-бутилциклогексан)). Средним специалистам в данной области техники известны другие переносчики кислорода на основе перфторуглеродов подходящие для применения в настоящем описании.
Иммуномодулирующие факторы включают, в частности: остеопонтин, факторы-лиганды FAS, интерлейкины, трансформирующий фактор роста бета, тромбоцитарный фактор роста, кластерин, трансферрин, регулируемый при воздействии экспрессируемый нормальными Т-клетками секретирующийся белок (RANTES), ингибитор активации плазминогена-1 (Pai-1), фактор некроза опухолей альфа (ФНО-альфа), интерлейкин 6 (ИЛ-6), альфа-1-микроглобулин и бета-2-микроглобулин. Средним специалистам в данной области техники известны другие иммуномодулирующие факторы подходящие для применения в настоящем описании.
Противовоспалительные агенты или агенты-иммуносупрессанты (описанные ниже) также могут быть частью данного состава. Средним специалистам в данной области техники известны другие противовоспалительные агенты подходящие для применения в настоящих составах и/или способах лечения.
Факторы рекрутирования клеток включают, в частности: моноцитарный хемотаксический белок-1 (МСР-1) и CXCL-1. Средним специалистам в данной области техники известны другие факторы рекрутирования клеток подходящие для применения в настоящих составах и/или способах лечения.
Факторы прикрепления клеток включают, в частности: фибронектин, проколлаген, коллаген, ICAM-1, фактор роста соединительной ткани, ламинины, протеогликаны, пептиды специфической адгезии клеток, такие как RGD и YSIGR. Средним специалистам в данной области техники известны другие факторы прикрепления клеток подходящие для применения в настоящих составах и/или способах лечения.
Ангиогенные факторы включают, в частности: матриксную металлопротеазу 1 (ММР1), матриксную металлопротеазу 2 (ММР2), фактор роста эндотелия сосудов F (VEGF), матриксную металлопротеазу 9 (ММР-9), тканевый ингибитор металлопротеаз-1 (TIMP-1), фактор роста эндотелия сосудов F (VEGF), ангиопоэтин-2 (ANG-2). Средним специалистам в данной области техники известны другие ангиогенные факторы подходящие для применения в настоящих составах и/или способах лечения.
Ранозаживляющие факторы включают, в частности: фактор роста кератиноцитов 1 (KGF-1), тканевый активатор плазминогена (tPA), кальбиндин, кластерин, цистатин С, фактор трилистника 3. Средним специалистам в данной области техники известны другие ранозаживляющие факторы подходящие для применения в настоящих составах и/или способах лечения.
Секретируемые продукты биологически активных клеток, описанные в данном документе, также могут быть добавлены к составу с биологически активными клетками как агенты, способствующие выживанию клеток.
В другом аспекте изобретения состав включает термочувствительный биоматериал, описанный в данном документе, и совокупность биосовместимых гранул, содержащую биоматериал. В одном варианте реализации изобретения гранулы перекрестно сшиты. Перекрестное сшивание может быть достигнуто с помощью любого подходящего перекрестносшивающего агента, известного средним специалистам в данной области техники, такого как, к примеру: карбодиимиды; альдегиды (например, фурфурол, акролеин, формальдегид, глутаральдегид, глицерилальдегид), кросслинкеры на основе сукцинимида {бис(сульфосукцинимидил)суберат (BS3), дисукцинимидилглутарат (DSG), дисукцинимидилсуберат (DSS), дитиобис(сукцинимидилпропионат), этиленгликольбис(сульфосукцинимидилсукцинат), этиленгликольбис(сукцинимидилсукцинат) (EGS), бис(сульфосукцинимидил)глутарат (BS2G), дисукцинимидилтартрат (DST)}; эпоксиды (диглицидиловый эфир этиленгликоля, диглицидиловый эфир 1,4-бутандиола); сахариды (глюкозные и альдозные сахара); сульфоновые кислоты и n-толуолсульфоновая кислота; карбонилдиимидазол; генипин; имины; кетоны; дифенилфосфорилазид (DDPA); терефталоилхлорид; гексагидрат нитрата церия (III); микробная трансглутаминаза и пероксид водорода. Средним специалистам в данной области техники известны другие подходящие перекрестносшивающие агенты и способы перекрестного сшивания для применения в настоящих способах, составах и/или способах лечения.
В одном варианте реализации изобретения гранулы представляют собой гранулы перекрестносшитые карбодиимидом. Перекрестносшитые карбодиимидом гранулы могут быть перекрестно сшиты карбодиимидом, выбранным из группы, состоящей из: 1-этил-3-[3-диметиламинопропил]карбодиимид гидрохлорида (EDC), DCC-N,N'-дициклогексилкарбодиимида (DCC) и N,N'-диизопропилкарбодиимида (DIPC). Ожидается, что гранулы, обработанные более низкой концентрацией EDC, имеют большее количество свободных первичных аминогрупп, тогда как образцы, обработанные высокими концентрациями кросслинкера могут обладать главным образом первичными аминогруппами, участвующими в образовании амидных связей. Интенсивность оранжевого окрашивания, развивающегося при ковалентном связывании между первичным амином и пикрилсульфоновой кислотой и детектируемого спектрофотометрически при 335 нм, пропорциональна количеству первичных аминогрупп, присутствующих в образце. При нормализации на миллиграмм белка, присутствующего в образце, может наблюдаться универсальная корреляция между количеством свободных аминогрупп и начальной концентрацией EDC, использованной для перекрестного сшивания. Этот результат является показателем отличия перекрестного связывания гранул, обусловленного количеством использованного в реакции карбодиимида. В общем перекрестносшитые гранулы содержат уменьшенное количество свободных первичных аминогрупп по сравнению с неперекрестносшитыми гранулами. Количество свободных первичных аминогрупп может быть определено спектрофотометрически при длине волны около 335 нм.
Перекрестносшитые гранулы обладают уменьшенной чувствительностью к ферментативной деградации по сравнению с неперекрестносшитыми биосовместимыми гранулами, благодаря чему обеспечивается точный контроль времени удерживания гранулами in vivo. К примеру, перекрестносшитые гранулы устойчивы к эндогенным ферментам, таким как коллагеназы. Предложение перекрестносшитых гранул является частью системы доставки, сфокусированной на конструировании и производстве биоматериалов, которые облегчают один или более этапов: (а) обеспечивают доставку прикрепленных клеток к требуемым местам и создание пространства для регенерации и прорастания нативной ткани и обеспечения сосудами; (b) способствуют устойчивости в данном месте достаточно долго для того, чтобы позволить клеткам закрепиться, начать функционировать, модифицировать их микроокружение и секретировать их собственный внеклеточный матрикс (ВКМ); (с) стимулируют интеграцию трансплантированных клеток с окружающей тканью; (d) способствуют имплантации клеток в практически твердой форме; (е) обеспечивают краткосрочную структурную целостность, которая не является существенным препятствием для тканевого прорастания или интеграции доставленных клеток/материалов с тканями хозяина; (f) обеспечивают локализацию доставки in vivo в практически твердой форме, благодаря чему предотвращается диспергирование клеток в ткани во время имплантации; (g) улучшают стабильность и жизнеспособность зависимых от прикрепления клеток по сравнению с клетками, суспендированными в жидкости и (h) обеспечивают двухфазный профиль высвобождения после доставки клеток: i) в практически твердой форме (например, присоединенными к гранулам) и ii) в практически жидкой форме (например, суспендированными в жидкости).
В одном варианте реализации изобретения в настоящем описании предложены гранулы, содержащие желатин. Неперекрестносшитые желатиновые гранулы не подходят для получения состава с биологически активными клетками, потому что они быстро теряют целостность и клетки рассеиваются из места инъекции. В противоположность этому, сильно перекрестносшитые желатиновые гранулы могут сохраняться в месте инъекции слишком долго и могут мешать секреции ВКМ de-novo, интеграции клеток и регенерации тканей. Настоящее описание позволяет обеспечить точный контроль за временем удержания перекрестносшитых гранул in vivo. Для управления способностью к биодеградации биоматериалов применяют разные концентрации кросслинкера карбодиимида, в то время как все условия проведения реакции для всех образцов сохраняли постоянными. К примеру, ферментативная чувствительность перекрестносшитых карбодиимидом гранул может точно регулироваться путем варьирования концентрации перекрестносшивающего агента от почти нулевой до около 1М. В некоторых вариантах реализации изобретения концентрация составляет около 5 мМ, около 6 мМ, около 7 мМ, около 8 мМ, около 9 мМ, около 10 мМ, около 11 мМ, около 12 мМ, около 13 мМ, около 14 мМ, около 15 мМ, около 16 мМ, около 17 мМ, около 18 мМ, около 19 мМ, около 20 мМ, около 21 мМ, около 22 мМ, около 23 мМ, около 24 мМ, около 25 мМ, около 26 мМ, около 27 мМ, около 28 мМ, около 29 мМ, около 30 мМ, около 31 мМ, около 32 мМ, около 33 мМ, около 34 мМ, около 35 мМ, около 36 мМ, около 37 мМ, около 38 мМ, около 39 мМ, около 40 мМ, около 41 мМ, около 42 мМ, около 43 мМ, около 44 мМ, около 45 мМ, около 46 мМ, около 47 мМ, около 48 мМ, около 49 мМ, около 50 мМ, около 55 мМ, около 60 мМ, около 65 мМ, около 70 мМ, около 75 мМ, около 80 мМ, около 85 мМ, около 90 мМ, около 95 мМ или около 100 мМ, Концентрация кросслинкера также может составлять около 0,15 М, около 0,2 М, около 0,25 М, около 0,3 М, около 0,35 М, около 0,4 М, около 0,45 М, около 0,5 М, около 0,55 М, около 0,6 М, около 0,65 М, около 0,7 М, около 0,75 М, около 0,8 М, около 0,85 М, около 0,9 М, около 0,95 М или около 1 М. В другом варианте реализации изобретения перекрестносшивающий агент представляет собой 1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорид (EDC). В одном варианте реализации изобретения перекрестно сшитые EDC гранулы представляют собой желатиновые гранулы.
Перекрестносшитые гранулы могут обладать определенными свойствами, которые благоприятно сказываются на высаживании, присоединении и инкапсулировании клеток. К примеру, гранулы могут иметь пористую поверхность и/или могут быть практически полыми. Наличие пор обеспечивает увеличенную поверхность прикрепления клеток, позволяя прикрепляться большему количеству клеток по сравнению с непористой или гладкой поверхностью. Кроме того, пористая структура может поддерживать интеграцию ткани хозяина с пористыми гранулами, способствуя образованию ткани de novo. Гранулы имеют распределение размеров, которые могут быть подобраны по графику Вейбулла, соответствующего общему профилю распределения частиц. В одном варианте реализации изобретения перекрестносшитые гранулы обладают средним диаметром менее чем около 120 мкм, около 115 мкм, около 110 мкм, около 109 мкм, около 108 мкм, около 107 мкм, около 106 мкм, около 105 мкм, около 104 мкм, около 103 мкм, около 102 мкм, около 101 мкм, около 100 мкм, около 99 мкм, около 98 мкм, около 97 мкм, около 96 мкм, около 95 мкм, около 94 мкм, около 93 мкм, около 92 мкм, около 91 мкм или около 90 мкм. Свойства перекрестносшитых гранул изменяются в зависимости от условий процесса изготовления. К примеру, для получения гранул, обладающих вышеуказанными характеристиками, применяют процесс, в котором для аэрозольного распыления жидкого раствора желатина используют поток воздуха и распыляют раствор в жидкий азот с помощью устройства для распыления реагента для тонкослойной хроматографии (АСЕ Glassware). Специалистам в данной области техники известно, что регулирование параметров процесса изготовления дает возможность задавать разные характеристики гранул, например, разные распределения размеров.
Перед получением состава оценивают in vitro цитосовместимость перекрестносшитых гранул, применяя методики культивирования клеток, в которых гранулы культивируют с клетками, которые соответствуют готовому составу с биологически активными клетками. К примеру, гранулы культивируют с первичными клетками почек перед приготовлением состава с биологически активными клетками почек, а для подтверждения цитосовместимости используют анализы определения живых/мертвых клеток. В некоторых составах биосовместимые перекрестносшитые гранулы в растворе соединяют с термочувствительным биоматериалом в концентрации от около 5% (об./об.) до около 15% (об./об.) от объема раствора. Перекрестносшитые гранулы могут присутствовать в концентрации около 5% (w/w), около 5,5% (об./об.), около 6% (об./об.), около 6,5% (об./об.), около 7% (об./об.), около 7,5% (об./об.), около 8% (об./об.), около 8,5% (об./об.), около 9% (об./об.), около 9,5% (об./об.), около 10% (об./об.), около 10,5% (об./об.), около 11% (об./об.), около 11,5% (об./об.), около 12% (об./об.), около 12,5% (об./об.), около 13% (об./об.), около 13,5%) (об./об.), около 14% (об./об.), около 14,5% (об./об.) или около 15% (об./об.) от объема раствора.
В другом аспекте изобретения в настоящем описании предложены составы, которые содержат биоматериал, который деградирует в течение периода времени порядка минут, часов или суток. Эта длительность противоположна применению в большом организме или работе, касающейся имплантации твердых материалов, которые потом медленно деградируют в течение суток, недель или месяцев.
В другом аспекте изобретения в настоящее описание предложены составы, содержащие биосовместимые перекрестносшитые гранулы засеянные биологически активными клетками вместе с матрицей для доставки. В одном варианте реализации изобретения матрица для доставки обладает одним или более характеристиками: биосовместимостью, способностью к биодеградации/биоресорбции, практически твердым состоянием перед и во время имплантации в организм субъекта, способностью терять структурную целостность (практически твердое состояние) после имплантирования и цитосовместимым окружением для поддержания выживаемости клеток. Способность матрицы для доставки удерживать имплантированные частицы (например, перекрестносшитые гранулы) заполненные во время имплантации усиливает прорастание нативной тканью. Если матрица для доставки отсутствует, тогда уплотнение заполненных клетками гранул во время имплантации может привести к образованию пространства, недостаточного для прорастания ткани. Матрица для доставки облегчает имплантацию твердых составов. Кроме того, малая длительность структурной целостности означает, что вскоре после имплантации данная матрица не создает существенного препятствия для прорастания ткани или интеграции доставленных клеток/материалов с тканью хозяина. Матрица доставки обеспечивает локализацию состава, описанного в данном документе, поскольку вставка твердого элемента помогает предотвратить диспергирование доставленного материала в ткани во время имплантации. Для составов на основе клеток твердая матрица доставки улучшает стабильность и жизнеспособность зависимых от прикрепления клеток по сравнению с клетками, суспендированными в жидкости.
В одном варианте реализации изобретения матрица для доставки представляет собой совокупность биосовместимых гранул, которые не засеяны клетками. В другом варианте реализации изобретения незасеянные гранулы распределяют среди и между отдельных засеянных клетками гранул. Незасеянные гранулы действуют как «заполняемые гранулы» между засеянными клетками гранулами перед и непосредственно после трансплантации. Заполняемые гранулы содержат термочувствительный биоматериал, имеющий практически твердое состояние при первой температуре и практически жидкое состояние при второй температуре, причем первая температура ниже, чем вторая температура. К примеру, заполняемые гранулы содержат второй биоматериал, имеющий практически твердое состояние при температуре около температуры окружающей среды или ниже и практически жидкое состояние при температуре около 37°C, как это описано в данном документе. В одном варианте реализации изобретения температура окружающей среды представляет собой приблизительно комнатную температуру. В другом варианте реализации изобретения биоматериал представляет собой раствор желатина. Раствор желатина содержит концентрацию около 4,0%, около 4,5%, около 5%, около 5,5%, около 6%, около 6,5%, около 7%, около 7,5%, около 8%, около 8,5%, около 9%, около 9,5%, около 10%, около 10,5% или около 11% (мас./об.). Раствор желатина может быть приготовлен в ФСБ, среде для культивирования клеток (например, DMEM) или другом подходящем растворителе.
В одном аспекте изобретения в настоящем описании предложены составы, которые содержат биоматериалы, которые имплантируют в практически твердой форме (например, заполняемых гранул), которая потом становится жидкой/плавится или иным образом теряет структурную целостность после имплантации в организм. Эта длительность противоположна применению в значительном организме или при работе, касающейся применения материалов, которые могут инъецироваться как жидкость, которая потом затвердевает в организме.
Перед получением состава термочувствительные заполняемые гранулы могут проходить оценку in vitro. Заполняемые гранулы могут метить и смешивать с немечеными нетермочувствительными гранулами. Потом данную смесь инкубируют при 37°C для наблюдения изменений при переходе физического состояния. При превышении времени выдержки при повышенной температуре наблюдают потерю формы меченых термочувствительных гранул. К примеру, термочувствительные желатиновые гранулы могут быть приготовлены с красителем альциановым синим, который служит в качестве маркера перехода физического состояния. Синие желатиновые гранулы смешивают с гранулами Cultispher S (белыми), помещенными в катетер, потом их вытесняют и инкубируют в 1X ФСБ, рН 7,4, при 37°C. За потерей формы синих желатиновых гранул наблюдают в разные временные точки с помощью микроскопа. Изменения физического состояния синих желатиновых гранул становятся видимыми через 30 мин, становясь более выраженными при увеличении времени инкубации. Гранулы полностью не рассеиваются из-за вязкости материала.
Составы с биологически активными клетками, описанными в данном документе, могут применяться для приготовления составов для инъекций в почку. Однако, средним специалистам в данной области техники известно, что данные составы подойдут для многих других типов популяций биологически активных клеток. К примеру, настоящее описание подразумевает составы с биологически активными клетками для инъекции в любой цельный орган или ткань.
В одном аспекте изобретения составы биологически активных клеток, описанные в данном документе, будут содержать установленное количество клеток. В одном варианте реализации изобретения общее количество клеток в составе составляет около 104, около 105, около 106, около 107, около 108 или около 109. В одном варианте реализации изобретения дозировка клеток для состава, описанного в данном документе, может рассчитываться на основе оцененной массы или функциональной массы целевого органа или мишени. В некоторых вариантах реализации изобретения составы биологически активных клеток содержат дозировку, соответствующую количеству клеток, определенную на основании массы органа хозяина, который будет субъектом лечения данным составом. К примеру, расчет состава с биологически активными клетками почек основан на средней массе почки человека около 150 грамм. В одном варианте реализации изобретения количество клеток на грамм (г) почки составляет от около 600 клеток/г до около 7,0×107 клеток/г. В некоторых вариантах реализации изобретения количество клеток на грамм почки составляет около 600 клеток/г, около 1000 клеток/г, около 1500 клеток/г, около 2000 клеток/г, около 2500 клеток/г, около 3000 клеток/г, около 3500 клеток/г, около 4000 клеток/г, около 4500 клеток/г, около 5000 клеток/г, около 5500 клеток/г, около 6000 клеток/г, около 6500 клеток/г, около 7000 клеток/г, около 7500 клеток/г, около 8000 клеток/г, около 8500 клеток/г, около 9000 клеток/г, около 9500 клеток/г или около 10000 клеток/г.
В других вариантах реализации изобретения количество клеток на грамм почки составляет около 1,5×104 клеток/г, около 2,0×104 клеток/г, около 2,5×104 клеток/г, около 3,0×104 клеток/г, около 3,5×104 клеток/г, около 4,0×104 клеток/г, около 4,5×104 клеток/г, около 5,0×104 клеток/г, около 5,× 104 клеток/г, около 6,0×104 клеток/г, около 6,5×104 клеток/г, около 7,0×104 клеток/г, около 7,5×104 клеток/г, около 8,0×104 клеток/г, около 9,5×104 клеток/г.
В других вариантах реализации изобретения количество клеток на грамм почки составляет около 1,0×105 клеток/г, около 1,5×105 клеток/г, около 2,0×105 клеток/г, около 2,5×105 клеток/г, около 3,0×105 клеток/г, около 3,5×105 клеток/г, около 4,0×105 клеток/г, около 4,5×105 клеток/г, около 5,0×105 клеток/г, около 5,5×105 клеток/г, около 6,0×105 клеток/г, около 6,5×105 клеток/г, около 7,0×105 клеток/г, около 7,5×105 клеток/г, около 8,0×105 клеток/г, около 8,5×105 клеток/г, около 9,0×105 клеток/г или около 9,5×105 клеток/г.
В других вариантах реализации изобретения количество клеток на грамм почки составляет около 1,0×106 клеток/г, около 1,5×106 клеток/г, около 2,0×106 клеток/г, около 2,5×106 клеток/г, около 3,0×106 клеток/г, около 3,5×106 клеток/г, около 4,0×106 клеток/г, около 4,5×106 клеток/г, около 5,0×106 клеток/г, около 5,5×106 клеток/г, около 6,0×106 клеток/г, около 6,5×106 клеток/г, около 7,0×106 клеток/г, около 7,5×106 клеток/г, около 8,0×106 клеток/г, около 8,5×106 клеток/г, около 9,0×106 клеток/г, около 9,5×106 клеток/г, 1,0×107 клеток/г или около 1,5×107 клеток/г.
Для достижения правильной дозировки могут выбирать общее количество клеток состава и могут корректировать общий объем состава.
В некоторых вариантах реализации изобретения состав может содержать дозировку клеток для субъекта, которая представляет собой одну дозу или одну дозу плюс дополнительные дозы. В других вариантах реализации изобретения дозировки могут обеспечивать с помощью конструкции, описанной в данном документе. Терапевтически эффективное количество популяций клеток почек или смеси популяций клеток почек, описанных в данном документе, может находиться в диапазоне от максимального количества клеток, которое безопасно доставлять субъекту, до минимального количества клеток, требуемого для лечения болезни почек, например, стабилизации, уменьшения скорости снижения или улучшения одной или более функций почек.
Терапевтически эффективное количество популяций клеток почек или их смесей, описанных в данном документе, может быть суспендировано в фармацевтически приемлемом носителе или вспомогательном веществе. Такой носитель включает, но не ограничивается, основной средой для культивирования плюс 1% сывороточного альбумина, солевым раствором, забуференным солевым раствором, декстрозой, водой, коллагеном, альгинатом, гиалуроновой кислотой, фибриновым клеем, полиэтиленгликолем, поливиниловым спиртом, карбоксиметилцеллюлозой и их комбинацией. Состав должен соответствовать способу введения.
Соответственно в настоящем описании предложено применение состава, содержащего популяции клеток почек или их смеси, к примеру, одной популяции клеток В2 или в смеси с популяцией клеток В3 и/или В4 или В4', для изготовления лекарственного средства для лечения болезни почек у субъекта. В некоторых вариантах реализации изобретения данное лекарственное средство дополнительно содержит рекомбинантные полипептиды, такие как факторы роста, хемокины или цитокины. В дополнительных вариантах реализации изобретения лекарственные средства включают популяцию клеток, полученную из почки человека. Клетки, используемые при изготовлении лекарственных средств, могут быть выделены, получены или обогащены с помощью любых вариаций предложенных способов, описанных в данном документе.
Препарат(ы) клеток почек или их смеси или композиции составлены в соответствии с обычными процедурами, которые применяются для фармацевтической композиции, адаптированной для введения людям. Как правило, композиции для внутривенного введения, внутриартериального введения или введения в почечную капсулу, к примеру, представляют собой растворы в стерильном изотоническом водном буферном растворе. Если необходимо, данная композиция также может включать местный анестетик для облегчения боли в месте введения. Как правило, ингредиенты вводят в стандартную лекарственную форму по отдельности или смешанные вместе, к примеру, в виде криоконсервированного концентрата в герметически закрытом контейнере, таком как ампула, с указанием количества активного агента. Если композицию следует вводить путем инфузии, она может быть распределена в бутылке для инфузии, содержащей стерильную воду или солевой раствор фармацевтического качества. Если композицию следует вводить путем инъекции, то может быть приложена ампула со стерильной водой для инъекций или солевым раствором для того, чтобы ингредиенты могли быть смешаны перед введением.
Фармацевтически приемлемые носители частично определяются конкретной вводимой композицией, а также конкретным способом, применяемым для введения композиции. Соответственно существует большое разнообразие подходящих составов фармацевтических композиций (см., например, издание Alfonso R Gennaro (ed), Remington: The Science and Practice of Pharmacy, раннее Remington's Pharmaceutical Sciences 20th ed., Lippincott, Williams & Wilkins, 2003, которое включено в данный документ в полном объеме посредством ссылки). Фармацевтические композиции, как правило, приготовлены в виде стерильных, практически изотонические растворы в полном соответствии с требованиями всех руководств по Надлежащей производственной практике (GMP) Управления по контролю пищевых продуктов и лекарственных средств США.
В одном аспекте изобретения дополнительно предложен фармацевтический состав, содержащий препарат клеток почек, к примеру, один препарат клеток В2 или в комбинации с препаратом клеток В3 и/или В4 или В4', и фармацевтически приемлемый носитель. В некоторых вариантах реализации изобретения состав содержит от 104 до 109 клеток, полученных из почек млекопитающих.
Составы с модифицированным высвобождением
В одном аспекте изобретения составы по настоящему изобретению представлены в виде составов с модифицированным высвобождением. В общем, модифицированное высвобождение характеризуется предварительным высвобождением первого активного агента при введении с последующим по меньшей мере одним дополнительным повторным высвобождением второго активного агента. Первый и второй активные агенты могут быть одинаковыми или могут отличаться. В одном варианте реализации изобретения составы обеспечивают модифицированное высвобождение посредством содержания множества компонентов в одном и том же составе. В другом варианте реализации изобретения состав с модифицированным высвобождением содержит активный агент как часть первого компонента, которая позволяет активному агенту свободно переходить в весь объем состава, вследствие чего обеспечивается немедленное высвобождение в целевом месте при введении. Первый компонент может быть термочувствительным биоматериалом, обладающим практически жидкой фазой и практически твердой фазой, причем первый компонент в момент введения находится в практически жидкой фазой. В одном варианте реализации изобретения активный агент находится в практически жидкой фазе для того, чтобы практически свободно переходить в весь объем состава и, благодаря этому, немедленно высвобождаться в целевом месте при введении.
В другом варианте реализации изобретения состав с модифицированным высвобождением содержит активный агент как часть второго компонента, в котором активный агент прикреплен к, осажден на, покрыт, внедрен в, посажен на или захвачен вторым компонентом, который сохраняется перед и после введения в целевое место. Второй компонент содержит структурные элементы с которыми активный агент способен ассоциировать, благодаря чему предотвращается немедленное высвобождение активного агента из второго компонента в момент введения. К примеру, второй компонент предложен в виде практически твердой форме, например, биосовместимых гранул, которые могут быть перекрестносшиты для предотвращения или задержки ферментативной деградации in vivo. В одном варианте реализации изобретения активный агент в состоянии практически твердой фазы сохраняет свою структурную целостность в составе перед и после введения и, поэтому, не высвобождает немедленно активный агент в целевом месте при введении. В данном документе описаны подходящие носители для составов с модифицированным высвобождением, но средним специалистам в данной области техники известны другие носители, которые подходят для применения в настоящем описании.
В одном варианте реализации изобретения в составах предложены доставляемые элементы предварительной быстрой доставки/высвобождения, включающие клетки, наночастицы, терапевтические молекулы и т.п., сопровождающиеся элементами последующего высвобождения с задержкой. Составы по настоящему изобретению могут быть разработаны для такого профиля двухфазного высвобождения, в котором доставляемый агент содержится как в неприкрепленной форме (например, клетки в растворе), так и в прикрепленной форме (например, клетки вместе с гранулами или другим подходящим носителем). Первоначально при введении незахваченный агент высвобождается немедленно в месте доставки, тогда как высвобождение захваченного агента задерживается пока не разрушится структурная целостность носителя (например, гранул), в результате чего высвобождается раннее присоединенный агент. Как обсуждается ниже, средним специалистам в данной области техники известны другие подходящие механизмы высвобождения.
Время задержки высвобождения может регулироваться природой активного агента. К примеру, время задержки высвобождения из состава с биологически активными клетками может составлять порядка секунд, минут, часов или суток. При определенных обстоятельствах может быть приемлемой задержка порядка недель. Для других активных агентов, таких как малые или большие молекулы, время задержки высвобождения из состава может составлять порядка секунд, минут, часов, суток, недель и месяцев. Возможно также, чтобы состав содержал разные биоматериалы, которые обеспечивают разные профили времени отсроченного высвобождения. К примеру, первый биоматериал с первым активным агентом может иметь одно время высвобождения, а второй биоматериал со вторым активным агентом может иметь другое время высвобождения. Первый и второй активные агенты могут быть одинаковыми или могут отличаться.
Как обсуждалось в данном документе, период времени отсроченного высвобождения, как правило, может соответствовать периоду времени потери структурной целостности биоматериала. Однако, средним специалистам в данной области техники известны другие механизмы отсроченного высвобождения. К примеру, активный агент может постоянно высвобождаться в течение периода времени независимо от времени деградации любого конкретного материала, например, диффузии лекарственного средства из полимерной матрицы. В дополнение к этому, биологически активные клетки могут мигрировать из состава, содержащего биоматериал и биологически активные клетки, в нативную ткань. В одном варианте реализации изобретения биологически активные клетки мигрируют из биоматериала, например, гранулы, в нативную ткань.
Могут применяться способные к биодеградации биосовместимые полимеры, такие как: этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэстеры и полимолочная кислота. Пролонгированная абсорбция инъекционных составов может быть обусловлена включением в состав агента, который замедляет абсорбцию, к примеру, солей моностеаратов и желатина. Множество способов получения таких составов запатентовано или общеизвестно специалистам в данной области техники. См., например, публикацию Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978. Дополнительные способы, применяемые для контролируемого или отстроченного высвобождения полипептидных агентов, описаны, к примеру, в патентах США №6306406 и 6346274, а также, к примеру, в патентных заявках США № US 20020182254 и US 20020051808, все из которых включены в данный документ посредством ссылки.
9. Способы и пути введения
Составы с биологически активными клетками по настоящему изобретению могут вводиться одни или в комбинации с другими биологически активными компонентами. Данные составы подходят для инъекции или импланации внедренных элементов тканевой инженерии внутрь цельных органов для регенерации ткани. Кроме того, данные составы применяются для инъекции или имплантации элементов тканевой инженерии в стенки полых органов для регенерации ткани.
В одном аспекте изобретения в настоящем описании предложены способы введения состава с биологически активными клетками, описанного в данном документе, нуждающемуся субъекту. В одном варианте реализации изобретения источником биологически активных клеток могут быть аутологичные или аллогенные, сингенные (аутогенные или изогенные) и любые их комбинации. В случаях, когда источник не является аутологичным, способы могут включать введение иммуносупрессирующего агента. Подходящие лекарственные средства-иммуносупрессанты включают, в частности: азатиоприн, циклофосфамид, мизорибин, циклоспорин, такролимуса гидрат, хлорамбуцил, лобензарит динатрий, ауранофин, алпростадил, гусперимуса гидрохлорид, биосинсорб, муромонаб, алефасепт, пентостатин, даклизумаб, сиролимус, микофенолята мофетил, лефлономид, басиликсимаб, дорназа а, биндарид, кладрибин, пимекролимус, илодекакин, цеделизумаб, эфализумаб, эверолимус, анисперимус, гавилимомаб, фаралимомаб, клофарабин, рапамицин, сиплизумаб, сайрейто, соединения LDP-03, CD4, SR-43551, SK&F-106615, IDEC-114, IDEC-131, FTY-720, TSK-204, LF-080299, А-86281, А-802715, GVH-313, HMR- 1279, ZD-7349, IPL-423323, СВР-1011, МТ-1345, CNI-1493, СВР-2011, J-695, LJP-920, L-732531, ABX-RB2, АР-1903, IDPS, BMS-205820, BMS-224818, CTLA4-1g, ER-49890, ER-38925, ISAtx-247, RDP-58, PNU-156804, LJP-1082, TMC-95A, TV-4710, PTR-262-MG и AGI-1096 (см. патент США №7563822). Средним специалистам в данной области техники известны другие подходящие лекарственные средства-иммуносупрессанты.
Способы лечения субъекта данного описания включают доставку состава с биологически активными клетками, описанными в данном документе. В одном варианте реализации изобретения предпочтительным является непосредственное введение клеток в место ожидаемого получения пользы. Нуждающегося субъекта также могут лечить путем приведения в контакт нативной почки in vivo с составом с биологически активными клетками, описанными в данном документе, вместе с продуктами, секретируемыми одной или более обогащенных популяций клеток почек и/или смесью или конструкцией, содержащей их.
Этап приведения в контакт нативной почки с секретируемым продуктом in vivo может выполняться посредством применения/введения состава, содержащего популяцию секретируемых продуктов из среды для культивирования клеток, например кондиционированной среды, или путем имплантации обогащенной популяции клеток и смеси или конструкции, способной к секреции продуктов in vivo. Этап приведения в контакт in vivo обеспечивает регенеративный эффект в отношении нативной почки.
Разнообразие средств для введения клеток и/или секретируемых продуктов субъекту, учитывая это описание, известна специалистам в данной области техники. Такой способ включает инъекцию клеток в целевое место субъекта.
Клетки или секретируемые продукты могут вводиться в устройства доставки или носитель, который облегчает внедрение путем инъекции или имплантации субъектам. В некоторых вариантах реализации изобретения устройство доставки может включать природные материалы. В некоторых других вариантах реализации изобретения устройство доставки может включать синтетические материалы. В одном варианте реализации изобретения устройство доставки обладает структурой для имитации или соответствующего совпадения с архитектурой органа. В других вариантах реализации изобретения устройство доставки по природе является подобным жидкости. Такие устройства доставки могут включать трубки, например катетеры, для инъецирования клеток и жидкостей в организм субъекта-реципиента. В предпочтительном варианте реализации изобретения данные трубки дополнительно имеют иглу, например со шприцом, через которую клетки могут вводиться субъекту в требуемое место. В некоторых вариантах реализации изобретения популяции клеток, полученные из почек млекопитающих, готовят для введения в кровеносный сосуд через катетер (где под термином «катетер» подразумевают охватывание любых из различных трубкоподобных систем для доставки веществ в кровеносные сосуды). В альтернативном варианте, клетки могут вводить в или помещать на биоматериал или каркас, включая, в частности, ткани, такие как: плетенные, вязанные, сетчатые, и неплетенные, перфорированные пленки, губки и пены, и гранулы, такие как: цельные или пористые гранулы, микрочастицы, наночастицы и им подобные (например, желатиновые гранулы Cultispher-S компании Sigma). Клетки могут быть приготовлены для обеспечения доставки в множестве разных форм. К примеру, клетки могут суспендировать в растворе или геле. Клетки могут смешивать с фармацевтически приемлемым носителем или растворителем, в котором клетки остаются жизнеспособными. Фармацевтически приемлемые носители и растворители включают солевые водные буферные растворы, растворители и/или среду для диспергирования. Применение таких носителей и растворителей хорошо известно в данной области техники. Раствор предпочтительно является стерильным и жидким и часто должен быть изотоничным. Преимущественно, раствор является устойчивым в условиях производства и хранения и защищен от контаминирующего действия микроорганизмов, таких как бактерии и плесневые грибы, посредством применения, к примеру, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и им подобных веществ. Специалист в данной области техники знает, что устройство доставки, применяемое для доставки популяций клеток и их смесей, может обладать комбинациями вышеуказанных свойств.
Способы введения составов, содержащих выделенную(ые) популяцию(и) клеток почек, к примеру, одну популяцию клеток В2 или в смеси с В4' и/или В3, включают, но не ограничиваются: системной, внутрипочечной (например, паренхимальной), внутривенной или внутриартериальныой инъекцией или инъекцией непосредственно в ткань в предполагаемое место проявления активности. Дополнительные применяемые способы введения включают однократную или многократную инъекцию(и) непосредственно путем лапаротомии, непосредственно путем лапароскопии, трансабдоминально или через кожу. Другие дополнительные применяемые способы введения включают, к примеру, ретроградную инфузию и инфузию через мочеточник. Хирургические способы введения включают одностадийные процедуры, такие как,, в частности: частичная нефрэктомия и имплантация конструкций, частичная нефрэктомия, частичная пиелэктомия, васкуляризация из сальника ± брюшины, мультифокальная биопсия по ходу иглы, конусное или от пирамидального до цилиндрового замещения почечных полюсов, а также двухстадийные процедуры, к примеру, применение внутреннего органоидного биореактора для пересадки. В одном варианте реализации изобретения составы, содержащие смеси клеток, доставляют одинаковым путем одновременно. В другом варианте реализации изобретения каждую из композиций клеток, содержащую контролируемыю смесь, доставляют по отдельности в специальные места или посредством специальных подходов одновременно или способом с временным контролем, одним или более способами, описанными в данном документе.
Соответствующая дозировка имплантации клеток людям может быть определена по существующей информации, касающейся активности клеток, например, продукции ЭПО, или по экстраполированию данных исследований для определения дозировки, проведенных при доклинических исследованиях. По данным экспериментов на культурах in vitro и на животных in vivo может быть количественно определено количество клеток и использовано для расчета соответствующей дозировки имплантируемого материала. Дополнительно, пациента могут подвергать мониторингу для определения того, может ли быть проведена дополнительная имплантация или количество имплантируемого материала соответственно уменьшено.
К популяциям клеток или их смесям могут добавляться один или более других компонентов, включая выбранные компоненты внеклеточного матрикса, такие как один или более типов коллагена или гиалуроновой кислоты, известных в данной области техники, и/или факторов роста, обогащенной тромбоцитами плазмы и лекарственных средств.
Средним специалистам в данной области техники известны различные составы и способы введения подходящие для секретируемых продуктов, описанных в данном документе.
10. Промышленные препараты и наборы
Настоящее описание дополнительно включает наборы, содержащие полимерные матрицы и каркасы, описанные в данном документе, и сопутствующие материалы и/или среды для культивирования клеток, а также инструкции по применению. Данные инструкции по применению могут содержать, к примеру, инструкции по культивированию клеток или введению клеток и/или препаратов клеток. В одном варианте реализации изобретения в настоящем описании предложен набор, включающий каркас, описанный в данном документе, и инструкции по применению. В еще одном варианте реализации изобретения набор включает агент для детекции экспрессии маркера, реагенты для применения данного агента и инструкции по применению. Этот набор может применяться с целью определения прогноза регенерации нативной почки у субъекта с последующей имплантацией или введением популяции клеток, смеси или конструкции, описанной в данном документе. Данный набор также может применяться для определения биотерапевтической эффективности популяции клеток, смеси или конструкции, описанной в данном документе.
Другой вариант реализации изобретения представляет собой промышленное изделие, содержащее биологически активные клетки пригодные для лечения нуждающегося субъекта. Промышленное изделие включает контейнер и этикетку или листок-вкладыш, помещенный на или связанный с контейнером. Подходящие контейнеры включают, к примеру, бутылки, флаконы, шприцы и т.п. Контейнеры могут изготавливаться из различных материалов, таких как стекло и пластик. Контейнер содержит композицию, которая находится в эффективном для лечения состоянии, и могут иметь стерильный порт доступа (например, контейнер может представлять пакет для раствора или флакон, обладающий пробкой, протыкаемой инъекционной иглой). По меньшей мере один активный агент в составе представляет собой популяцию биологически активных клеток, описанных в данном документе. На этикетке или в листке-вкладыше указывается, что состав применяется для лечения конкретного состояния. Этикетка или листок-вкладыш дополнительно должен включать инструкции для введения состава пациенту. В данном документе также подразумеваются промышленные изделия и наборы, допускающие комбинированные способы лечения. Листки-вкладыши относятся к инструкциям традиционно включаемых в коммерческие упаковки для терапевтических препаратов, которые содержат информацию о показаниях, обращении, дозировке, введении, противопоказаниях и/или предостережениях, относящихся к применению таких терапевтических препаратов. В одном варианте реализации изобретения в листке-вкладыше указывается, что состав применяется для лечения заболевания или нарушения, к примеру, болезни или нарушению почек. Дополнительно он может содержать другие материалы, требуемые с точки зрения коммерческого распространения или потребителя, включая другие буферные вещества, растворители, фильтры, иглы и шприцы. Предложены также наборы, которые пригодны для различных целей, например, для оценки результата регенерации. Могут предлагаться наборы, которые содержат агенты для детекции уринопроизводящих везикул и/или их содержимого, например, нуклеиновых кислот (таких как миРНК), везикул, экзосом и т.п., описанных в данном документе. Агенты для детекции включают, в частности: праймеры нуклеиновых кислот и зонды, а также антитела для детекции in vitro требуемой мишени. Как в случае с промышленным изделием, набор включает контейнер и этикетку или листок-вкладыш, помещенный на или связанный с контейнером. Контейнер содержит композицию, включающую по меньшей мере один агент для детекции. Могут быть приложены дополнительные контейнеры, которые включают, например, растворители и буферные растворы или агенты для контрольной детекции. Этикетка или листок-вкладыш могут содержать описание композиции, а также инструкции для предполагаемого применения in vitro, прогностического или диагностического применения.
11. Отчеты
Способы этого описания при практическом воплощении с коммерческими целямикак правило, включают создание отчета или резюме прогноза регенерации. Способы этого описания должны включать создание отчета, включающего предвидение вероятного течения или результата регенерации перед и после любого введения или имплантации состава, содержащего популяцию клеток, смесь или конструкцию, описанную в данном документе. Данный отчет может включать информацию относительно любого индикатора, имеющего отношение к прогнозу. Способы и отчеты этого описания дополнительно включают хранение данного отчета в базе данных. В альтернативном варианте, способ может дополнительно создать для субъекта запись в базе данных и заполнить запись данными. В одном варианте реализации изобретения данный отчет представляет собой отчет на бумаге, в другом варианте реализации изобретения отчет представляет собой аудиторский отчет, в другом варианте реализации изобретения отчет представляет собой запись в электронном виде. Подразумевается, что отчет передается врачу и/или пациенту. Получение отчета может дополнительно включать установление сетевого соединения с серверным компьютером, который хранит данные и отчет, и запрос данных и отчета из серверного компьютера. Способы, предложенные в данном документе, также могут быть полностью или частично автоматизированы.
Изобретение, описанное в данном документе с целью иллюстрации, соответственно может быть воплощено при отсутствии любого элемента или элементов, ограничения или ограничений, которые конкретным образом не описаны в данном документе. Поэтому, к примеру, в каждом случае в данном документе любой из терминов «включающий», «преимущественно состоящий из» и «состоящий из» может быть заменен любым из двух других терминов. Поэтому, при применении одного из терминов в варианте реализации изобретения, данное изобретение также включает другой вариант реализации изобретения, в котором один из этих терминов заменен другим из этих терминов. В каждом варианте реализации изобретения термины имеют свои устоявшиеся значения. Поэтому, к примеру, один вариант реализации изобретения может охватывать состав «включающий» набор компонентов, другой вариант реализации изобретения мог бы охватывать состав «преимущественно состоящий из» таких же компонентов, а третий вариант реализации изобретения мог бы охватывать состав «состоящий из» таких же компонентов. Термины и выражения, которые были применены, использованы в качестве терминов описания, а не ограничения, и нет намерения, чтобы применение таких терминов и выражений исключало любые эквиваленты показанных и описанных признаков или их элементов, но признается, что возможны различные модификации в пределах объема заявленного изобретения. Поэтому, должно быть понятно, хотя настоящее изобретение было конкретно описано предпочтительными вариантами реализации и необязательными признаками, специалистами в данной области может быть проведена модификация и вариация концепций, описанных в данном документе, и такие модификации и вариации рассматриваются как находящиеся в пределах объема этого изобретения, определенного прилагаемой формулой изобретения.
Вышеизложенное написанное описание считается достаточным для того, чтобы специалист в данной области мог воплотить данное изобретение. Следующие Примеры предложены только с целью иллюстрации и не подразумевают ограничение объема настоящего изобретения любым способом. Конечно, различные модификации данного изобретения, в дополнение к показанным и описанным в данном документе, станут очевидны специалистам в данной области из вышеизложенного описания и попадут в объем прилагаемой формулы изобретения.
Все патенты, патентные заявки и литературные ссылки, приведенные в настоящем описании, тем самым включены в полном объеме посредством ссылки.
ПРИМЕРЫ
Пример 1
Приготовление растворов
В этом примере предложены композиции составов различных сред и растворов, примененные в последующих примерах, для выделения и определения характеристик гетерогенной популяции клеток почек и изготовления препарата для регенеративной терапии.

Для всех промываний клеток использовали фосфатно-солевой буферный раствор
Дюльбекко (ФСБД).
Пример 2
Выделение гетерогенной нефракционированной популяции клеток почек
Этот пример иллюстрирует выделение нефракционированной (UNFX) гетерогенной популяции клеток почек человека. Предварительную диссоциацию ткани выполняли для получения гетерогенных суспензий клеток из ткани почки человека.
Ткань почки, полученная посредством биопсии, представляла исходный материал для получения гетерогенной популяции клеток почек. Могли использовать ткань почки, содержащую одну или более тканей из кортикальной ткани, ткани кортикомедуллярного соединения или медуллярной ткани. Преимущественно использовали ткань кортикомедуллярного соединения. Для почки в состоянии ХБП требовалось взятие материала из многих фокусов биопсии (минимум 2), избегая повреждения ткани. Ткань почки пациента получал исследователь по клиническим испытаниям на клинической базе приблизительно за 4 недели до запланированной имплантации готового препарата NKA. Ткань транспортировали в среде для транспортировки из Примера 1.
Потом для того, чтобы уменьшить поступающую бионагрузку перед обработкой ткани для выделения клеток ткань промывали средой для промывания тканей из Примера 1.
Ткань почки измельчали, взвешивали и проводили диссоциацию в среде для расщепления из Примера 1. Конечную суспензию клеток нейтрализовали модифицированной Дульбекко средой Игла (D-MEM) + 10% фетальной бычьей сыворотки (ФБС) (Invitrogen, г. Карлсбад, Калифорния), промывали и ресуспендировали в бессывороточной среде для кераноцитов без комплемента (KSFM) (Invitrogen). Суспензии клеток потом подвергали разделению на градиенте 15% (мас./об.) йодиксанола (OptiPrep™, Sigma) для удаления красных клеток крови и дебриса перед началом культивирования в обработанных полистироловых колбах или чашках для культивирования тканей при плотности 25000 клеток на см2 в среде для выращивания клеток почек из Примера 1. К примеру, клетки могут быть высеяны в колбу Т500 Nunc в концентрации 25×106 клеток/колбу в 150 мл разбавленной 50:50 среды.
Пример 3
Размножение клеток выделенной популяции клеток почек
Размножение клеток почек зависит от количества ткани, полученных и успешно выделенных клеток почек из исходной ткани. Выделенные клетки могут быть, если требуется, криоконсервированными (см. ниже). Кинетика роста клеток почек может зависеть от образца к образцу из-за специфической вариабельности клеток, выделенных от отдельных пациентов.
Процесс размножения определенных клеток разрабатывали так, чтобы приспособиться к диапазону уровней воспроизведения клеток, обусловленных вариабельностью исходной ткани, Таблица 3.1. Размножение клеток почек включает серию пассажей в закрытых сосудах для культивирования (например, Т-колбах, клеточных фабриках, сосудах HyperStacks®) в среде для выращивания клеток из Таблицы 1.1, применяя определенные методики культивирования клеток.
Среду без ВРЕ разрабатывали для клинических исследований на людях во избежание характерных рисков, связанных с использованием ВРЕ. Размножение клеток, фенотип (CK18) и функционирование клеток (ферментативная активность GGT и LAP) оценивали в среде без ВРЕ и сравнивали с результатами использования среды, содержащей ВРЕ, в исследованиях на животных. Размножение, фенотип и функционирование клеток почек были эквивалентными для обеих сред (данные не показаны).

Как только наблюдали рост клеток в начальных Т-колбах (пассаж 0) и не было видимых признаков контаминации, культуральную среду заменяли и меняли каждые 2-4 дня, Фигура 2В. Клетки исследовали для проверки морфологии клеток почек путем визуального осмотра культур под микроскопом. Культуры характерным образом демонстрировали плотное прилегание или имели вид брусчатки, благодаря совместной кластерной группировке клеток. Эти морфологические характеристики варьируют при размножении и могут отсутствовать в каждом пассаже. Заполнение культурами клеток оценивали используя библиотеку изображений клеток с разными уровнями заполнения сосудов для культивирования, предназначенных для полноценного размножения клеток.
Клетки почек пересевали с помощью трипсинизации, когда сосуды для культивирования имели заполнение по меньшей на мере 50%, Фигура 2В. Отделившиеся клетки собирали в сосуды, содержащие среду для выращивания клеток почек, подсчитывали количество клеток и количество жизнеспособных клеток. При каждом пассаже клетки пересевали в достаточное количество сосудов в концентрации 500-4000 клеток/см2 для получения количества клеток, которое требовалось для приготовления препарата NKA, Фигура 2В. Сосуды для культивирования помещали в инкубатор при 37°C в атмосферу 5% CO2. Как описано выше, мониторили морфологию клеток и заполнение, среду для культивирования ткани меняли каждые 2-4 дня. В Таблице 3.2 приведены степени жизнеспособности клеток почек человека, наблюдавшиеся при выделении и размножении клеток шести биоптатов почек, полученных от людей-доноров.

Специфическая жизнеспособность ткани, полученной от разных пациентов, привела к разному выходу клеток при культивировании. Поэтому практически точно не определяют период времени пересевов клеток или количество и тип сосудов для культивирования, требуемых для каждого пассажа для достижения целевых количеств клеток. Как правило, клетки почек проводят через 2 или 3 пассажа, однако, длительность культивирования и выход клеток могут варьировать в зависимости от скорости роста клеточной культуры. Пример этого приведен на Фигуре 3, где показаны длительность культивирования и выходы клеток (расчетные), полученные от 6 пациентов.
Для сбора и пересева клетки отделяли с помощью 0,25% раствора трипсина с ЭДТА (Invitrogen). Жизнеспособность оценивали методом исключения с трипановым синим и проведением суммирования вручную с помощью гемоцитометра или с применением автоматизированной системы подсчета клеток Cellometer® (Nexcelom Bioscience, г. Лоренс, Массачусетс).
Пример 4
Криоконсервация культивированных клеток
Размноженные клетки почек традиционным способом криоконсервировали для согласования специфической вариабельности ростовых свойств клеток, полученных от отдельных пациентов, и для доставки препарата по предопределенному графику клинического лечения (Фигура 2В). Криоконсервированные клетки также обеспечивают резервный источник клеток в случае, когда требуются другие препараты NKA (например, при задержке вызванной недомоганием пациента, непредвиденными обстоятельствами в процессе лечения и т.д.). Определены условия, используемые при криоконсервации клеток и при восстановлении жизнеспособных функционирующих клеток после оттаивания.
Для криоконсервации клетки суспендировали до конечной концентрации около 50×106 клеток/мл в растворе для криоконсервации (см. Пример 1) и распределили по флаконам. Флаконы на один мл, содержащие около 50×106 клеток/мл, помещали в морозильную камеру морозильника с контролируемой скоростью замораживания и замораживали с предварительно запрограмированной скоростью. После замораживания клетки переносили в морозильник с жидким азотом для технологического хранения.
Пример 5
Приготовление популяции клеток SRC
Отобранные клетки почек (SRC) могут быть приготовлены из сосудов для финального культивирования, в которых выращивали криоконсервированные клетки, или непосредственно из размноженных культур в зависимости от графика, Фигура 2В.
При использовании криоконсервированных клеток проводили оттаивание и высаживание клеток в сосуды для культивирования тканей для осуществления финального этапа размножения. Когда сосуды для финального культивирования были заполнены клетками приблизительно на 50-100%, то они готовы для выполнения отделения SRC. Замены среды и конечные промывания NKA разбавляли в готовом препарате какие-либо остатки раствора для криоконсервации.
Как только в сосудах для финального культивирования достигали по меньшей мере 50% заполнения, сосуды для культивирования переносили в инкубатор с гипоксическими условиями, настроенном на атмосферу из 2% кислорода и 5% CO2 при 37°C и культивировали в течение ночи. См. Фигуру 2С. Клетки могли выдерживаться в инкубаторе с контролем содержания кислорода, настроенном на содержание 2%, на протяжении 48 часов. Воздействие более физиологически соответствующей атмосферы с низким содержанием кислорода (2%) улучшало эффективность отделения клеток и обеспечивает больший уровень детекции гипоксия-индуцированных маркеров, таких как VEGF.
После того, как клетки подвергали воздействию гипоксических условий в течении достаточного времени (например, в течение ночи до 48 часов), клетки отделяли с помощью 0,25% раствора трипсина с ЭДТА (Invitrogen). Жизнеспособность оценивали методом исключения с трипановым синим и проведением суммирования вручную с помощью гемоцитометра или с применением автоматизированной системы подсчета клеток Cellometer® (Nexcelom Bioscience, г. Лоренс, Массачусетс). Клетки один раз промывали ФСБД и ресуспендировали до концентрации около 850×106 клеток/мл в ФСБР.
Для отделения собранных популяций клеток почек на основанном плавучей плотности клеток применяли центрифугирование в градиенте плотности. Суспензии клеток почек отделяли в один этап в растворе градиента плотности 7% йодиксаноле (OptiPrep; 60% (мас./об.) в среде OptiMEM; см. Пример 1).
Перед применением готовили раствор градиента 7% OptiPrep и измеряли коэффициент преломления (R.1. 1,3456 +/-0,0004), показывающий требуемую плотность. Собранные клетки почек наслаивали поверх раствора градиента. Градиент плотности центрифугировали при 800 g в течение 20 мин при комнатной температуре (без времени торможения) в центрифужных пробирках или в устройстве для работы с клетками (например, СОВЕ 2991). После центрифугирования собирали фракцию клеток, проявившую плавучую плотность более чем приблизительно 1,045 г/мл, в виде явного осадка, Фигура 4. Исключали и отбрасывали клетки, обладавшие плавучей плотностью менее чем 1,045 г/мл.
Осадок SRC ресуспендировали в ФСБД (Фигура 2С). Перенос в конечный препарат остатков раствора OptiPrep, ФСБ, среды для культивирования и вспомогательных веществ минимизировали на этапах 4-х промываний ФСБД и 1-им внесением раствора желатина.
Пример 6
Клетки с терапевтическим потенциалом могут выделять и размножать из нормальной ткани почек и ткани хронически больных почек
Целью настоящего исследования было определение функциональных характеристик клеток NKA человека с помощью высокоинформативного анализа (НСА). Высокоинформативная визуализация (ВИВ) обеспечивает одновременную визуализацию множества субклеточных событий, используя два или более флуоресцентных зондов (мультиплексирование) на определенном наборе образцов. Высокоинформативный анализ (ВИА) обеспечивает одновременное количественное измерение множества параметров клеток, захваченных высокоинформативными изображениями. Вкратце, нефракционированные (UNFX) культуры получали (Aboushwareb et al., World J Urol 26, 295, 2008) и поддерживали независимо от основных биоптатов, отобранных из пяти почек людей с запущенной хронической болезнью почек (ХБП) и трех почек людей без ХБП, с помощью стандартных процедур проведения биопсии. Через (2) пассажа культур UNPX ех vivo, клетки собирали и подвергали методам отделения на градиенте плотности (как описано в Примере 2 заявки Basu et al., WO 2012/064369) для получения субфракций, включая субфракции В2, В3 и/или В4.
Ткани почек человека получали от доноров-людей с ХБП и без ХБП, собранных в Таблице 10.1 заявки Ilagan et al. PCT/US2011/036347. На Фигуре 4 заявки Ilagan et al PCT/US2011/036347 показаны гистопатологические признаки образцов HK17 и HK19. Культуры получили ex vivo из образцов всех почек без ХБП (3/3) и с ХБП (5/5). Высокоинформативный анализ (ВИА) транспорта альбумина в клетках NKA человека, определяющий целевые участки (R01), показан на Фигуре 5 (НСА транспорта альбумина в клетках NKA человека) заявки Ilagan et al. PCT/US2011/036347. Количественное сравнение транспорта альбумина в клетках NKA, полученных из почек без ХБП и с ХБП, показан на Фигуре 6 заявки Ilagan et al. PCT/US2011/036347. Как показано на Фигуре 6 заявки Ilagan et al. PCT/US2011/03S347, транспорт альбумина не поддерживался в культурах NKA, полученных при ХБП. Сравнительный анализ экспрессии маркеров между субфракциями обогащенными тубулярными клетками В2 и обедненными тубулярными клетками В4 показан на Фигуре 7 (CK8/18/19) заявки Ilagan et al. PCT/US2011/036347.
Сравнительный функциональный анализ транспорта альбумина между субфракциями обогащенными тубулярными клетками В2 и обедненными тубулярными клетками В4 показан на Фигуре 8 заявки Ilagan et al. PCT/US2011/036347. Субфракция В2 обогащена проксимальными тубулярными клетками и, поэтому, проявляет повышенное функционирование транспорта альбумина.
Потребление альбумина: Культуральную среду для роста клеток до заполнения 24-луночных планшетов, покрытых коллагеном IV (BD Biocoat™) заменяли на 18-24 часа средой DMEM без фенолового красного, без сыворотки, с низким содержанием глюкозы (pr-/s-/lg DMEM), содержащей 1X противогрибкового/антибиотического агента и 2 мМ глутамина. Непосредственно перед анализом клетки промывали и инкубировали 30 минут в среде pr-/s-/lg DMEM + 10 мМ ГЭПЭСа, 2 мМ глутамина, 1,8 мМ CaCl2 и 1 мМ MgCl2. Клетки подвергали действию раствора 25 мкг/мл конъюгированного с родамином бычьего альбумина (Invitrogen) в течение 30 мин, промывали ледяным ФСБ для остановки эндоцитоза и немедленно смешивали с 2% раствором параформальдегида, содержащего 25 мкг/мл красителя для ядер клеток Hoechst. Для проведения экспериментов по ингибированию 1 мкМ рецептор-ассоциированного белка (RAP) (Ray Biotech Inc., Norcross GA) добавляли за 10 минут до добавления альбумина. Визуализацию в микроскопическом масштабе и анализ выполняли с помощью устройства для высокоинформативной биовизуализации BD Pathway™ 855 High-Content Biolmager (Becton Dickinson) (см. статью Kelley et al. Am J Physiol Renal Physiol, 2010 Nov; 299(5): F1026-39. опубликованную в электронном виде 8 сентября 2010 г.).
В заключение, анализ НСА обеспечивает данными клеточного уровня и может выявлять динамические параметры популяций, недетектируемые другими анализами, т.е. экспрессию генов или белков. Для определения характеристик тубулярных клеток как компонентов прототипов NKA человека может применяться допускающий количественное определение анализ ВИА (НСА-АТ) ex-vivo для измерения функционирования транспорта альбумина. Анализ НСА-АТ позволяет проводить сравнительную оценку функционирования клеток, показывая, что клетки, компетентные по транспорту альбумина, сохраняются в культурах NKA, полученных из почек людей с ХБП. Было также показано, что специфические субфракции культур NKA, В2 и В4, отличались по фенотипу и функционированию, причем В2, репрезентирующая обогащенная тубулярными клетками фракция с повышенной активностью транспорта альбумина. Субпопуляция клеток В2, полученная от людей с ХБП, фенотипически и функционально аналогична клеткам В2 грызунов, которые продемонстрировали эффективность in vivo (как показано выше).
Пример 7
Культивирование при низком содержании кислорода, перед выделением на градиенте, влияет на распределение слоев, состав и экспрессию генов
Для определения влияния условий обеспечения кислородом на распределение и состав прототипов В2 и В4, свежевыделенные от разных видов препараты клеток почек подвергали воздействию разных условий обеспечения кислородом перед этапом выделения на градиенте. Препарат клеток (RK069), обеспечивающий нарастание новых почек (NKA) грызунов, получили, используя стандартные методики выделения клеток крыс и инициирования культивирования, как описано в статье Kelley et al., 2010, выше. Все колбы культивировали в течение 2-3 дней в условиях (атмосфере) содержания 21% кислорода. Среду заменяли и половину колб потом переносили в инкубатор, обеспечивающий контроль содержания кислорода, настроенный на содержание 2% кислорода, тогда как оставшиеся колбы находились в условиях содержания кислорода 21% дополнительные 24 часа. Потом клетки собирали для каждого набора условий, используя стандартные методики сбора с ферментами, описанные выше. Ступени градиента создавали в соответствии со стандартными методиками и культуры, выращенные в «нормоксических» (21% кислорода) и «гипоксических» (2% кислорода) условиях, собирали по отдельности и наносили параллельно на идентичные ступени градиента. В то время как при обоих условиях выращивания получали 4 слоя и осадок, распределение клеток в градиенте отличалось для серий, культивированных при содержании кислорода 21% и 2% (Таблица 7.1). Конкретно выход клеток В2 был больше для гипоксических условий с сопутствующим снижением содержания клеток В3. Более того, экспрессия В4-специфических генов (таких как ген эритропоэтина) была усилена по результатам выделения на градиенте, полученным для культивированных в гипоксических условиях клеток (Фигура 73 заявки Presnell et al WO/2010/056328).
Препарат клеток NKA собаки (DK008) получали, используя стандартные методики для выделения и культивирования клеток собаки (аналогичные методикам выделения и культивирования клеток грызунов), описанные в заявке Basu et al., WO 2012/064369. Все колбы культивировали в течение 4 дней в условиях содержания кислорода 21% (атмосферное содержание), потом часть колб переносили в гипоксические условия (2%) на 24 часа, тогда как часть колб поддерживалась в условиях с 21%. Впоследствии каждый набор колб использовали для сбора и подвергали идентичным этапам очистки на градиенте. Подобно результатам, полученным на клетках крысы, клетки собаки, культивированные в гипоксических условиях, распределялись в градиенте отличным образом от клеток собаки, культивированных в условиях атмосферного содержания кислорода (Таблица 7.1). Снова выход клеток В2 был увеличен при воздействии гипоксических условий перед выделением на градиенте вместе с сопутствующим снижением распределения по клеткам В3.

Вышеприведенные данные показывают, что воздействие гипоксических условий перед выделением на градиенте, улучшает состав популяции клеток В2, а также распределение специфических специализированных клеток (эритропоэтин-продуцирующих клеток, васкулярных клеток и гломерулярных клеток) в популяции В4. Таким образом, гипоксическое культивирование с последующим разделением на градиенте плотности, как описано в заявке Basu et al., выше, представляет собой эффективный способ получения популяций клеток «В2» и «В4» среди разных видов.
Пример 8
Определение характеристик нефракционированной смеси клеток почек, выделенных из образца, полученного от пациента с аутоиммунным гломерулонефритом
Выделяли нефракционированную смесь клеток почек, как описано выше, из образца, полученного от пациента с аутоиммунным гломерулонефритом. Для определения неискаженного генотипического состава специфических субпопуляций клеток почек, выделенных и размноженных из ткани почки, применяли количественный анализ ПЦР в режиме реального времени (кПЦР-РВ) (Brunskill et al., Dev. Cell. 2008 November; 15(5): 781-791) для идентификации среди субпопуляций клеток отличных специфических для типов клеток и специфических по механизмам паттернов экспрессии генов. Как показано в Таблице 6.1 заявки Ilagan et al. PCT/US2011/036347, HK20 представляет собой образец, полученный от пациента с аутоиммунным гломерулонефритом. Как показано в Таблице 6.2 заявки Ilagan et al. PCT/US2011/036347, в клетках, полученные из образца HK20, недостаточно гломерулярных клеток, как определено методом кПЦР-РВ.
Пример 9
Определение генетических профилей терапевтически соответствующих популяций биологически активных клеток почек, выделенных в случае фокально-сегментарного гломерулосклероза
Для определения неискаженного генотипического состава специфических субпопуляций клеток почек, выделенных и размноженных из ткани почки, применяли количественный анализ ПЦР в режиме реального времени (кПЦР-РВ) (Brunskill et al., 2008, выше) для идентификации среди субпопуляций клеток отличных специфических для типов клеток и специфических по механизмам паттернов экспрессии генов. Препарат клеток HK023 человека, полученных в случае фокально-сегментарного гломерулосклероза (ФСГС), при котором была разрушена значительная часть гломерул, оценивали на присутствие гломерулярных клеток во фракции В4 во время сбора. Вкратце, нефракционированные (UNFX) культуры получали (Aboushwareb et al., World J Urol 26, 295, 2008) и поддерживали независимо каждого из материалов (4) фокусов биопсий, отобранных из почек с помощью стандартных процедур проведения биопсии. Через (2) пересева культур UNPX ex vivo, клетки собирали и подвергали методам отделения на градиенте плотности (согласно Примеру 6 заявки Basu et al., WO 2012/064369) для получения субфракций, включая субфракцию В4, которая, как известно, обогащена эндокринными, васкулярными и гломерулярными клетками, на основе работы, проведенной для грызунов, собак, людей и других видов.
Фракции В4 собирали отдельно от каждого независимого образца UNFX HK023, проявившиеся как отчетливые слои клеток с плавучей плотностью между 1,063-1,091 г/мл. Из каждого образца выделяли РНК и проверяли на экспрессию подоцина (маркера гломерулярных клеток) и РЕСАМ (маркера эндотелиальных клеток) методом ПЦР в режиме реального в режиме реального времени. Как ожидали в случае тяжелого ФСГС в образце, полученного при биопсии, наличие гломерулярных клеток с подоцином (+) во фракциях В4 было недостаточным, подоцин не детектировался в 2/4 образцах. В противоположность этому РЕСАМ+васкулярные клетки присутствовали в достаточном количестве во фракциях В4 в 4/4 культур, полученных при биопсии. Поэтому фракция В4 может быть изолирована в диапазоне плотности 1,063-1,091 г/мл даже из почек людей с тяжелыми болезненными состояниями.

Дополнительно, как показано в Таблице 7.2 заявки Ilagan et al. PCT/US2011/036347, в образце HK018, полученном от человека, не детектировали подоцин (гломерулярный маркер) методом кПЦР-РВ после центрифугирования в градиенте плотности.
Пример 10
Обогащение/обедненение жизнеспособных типов клеток почек с помощью флуоресцентно-активированной сортировки клеток (FACS)
Один или более типов выделенных клеток почек могут быть обогащены и/или один или более специфических типов клеток почек могут быть обеднены из выделенной первичной ткани почки с помощью флуоресцентно-активированной сортировки клеток (FACS). РЕАГЕНТЫ: 70% этанол; буферный раствор для промывания (ФСБ); среда для клеток почек 50:50 (50% DMEM с высоким содержанием глюкозы) : 50% кератиноцит-SFM; 0,4% трипановый синий; первичные антитела целевой популяции клеток почек, такие как CD31 эндотелиальных клеток почек и нефрин для гломерулярных клеток почек. Соответствующие изотип-специфические флуоресцентные вторичные антитела; окрашивающий буферный раствор (0,05% БСА в ФСБ).
МЕТОДИКА: После проведения стандартных процедур по очистке бокса биологической безопасности (БББ), моноклеточную суспензию клеток почек, полученную при первичном выделении или из культивированных клеток, можно выращивать в обработанной колбе Т500 Т/С, ресуспендировать в среде для клеток почек и помещать на лед. Потом проводят подсчет клеток и определение их жизнеспособности методом исключения с трипановым синим. Для обогащения/обедненения клеток почек, к примеру, гломерулярных клеток или эндотелиальных клеток из гетерогенной популяции получают в пределах 10 и 50×106 живых клеток со степенью жизнеспособности по меньшей мере 70%). Потом гетерогенную популяцию клеток почек окрашивают первичным антителом, специфическим для целевого типа клеток в исходной концентрации 1 мкг/0,1 мл окрашивающего буферного раствора/1×106 клеток (если требуется, определяют титр). Целевое антитело может быть конъюгированным, таким как CD31 РЕ (специфическое для эндотелиальных клеток почек) или неконъюгированным, таким как нефрин (специфическое для гломерулярных клеток почек).
Потом клетки окрашивают в течение 30 минут на льду при 4°C, обеспечивая защиту от света. Через 30 минут инкубации, клетки промывают путем центрифугирования при 300xg в течение 5 минут. Затем осадок ресуспендируют в ФСБ или в окрашивающем буферном растворе в зависимости от того, какое конъюгированное изотип-специфическое вторичное антитело требуется. Если клетки метят первичным антителом, конъюгированным с флуорохромом, то клетки ресуспендируют в 2 мл ФСБ на 107 клеток и проводят сортировку на FACSAria или на эквивалентном сортировщике клеток. Если клетки не мечены антителом, конъюгированным с флуорохромом, то затем клетки метят изотип-специфическим конъюгированным с флуорохромом вторичным антителом в начальной концентрации 1 мкг/0,1 мл/106 клеток.
Потом клетки окрашивают в течение 30 мин на льду при 4°C, обеспечивая защиту от света. Через 30 минут инкубации, клетки промывают путем центрифугирования при 300xg в течение 5 минут. После центрифугирования осадок ресуспендируют в ФСБ в концентрации 5×106/мл ФСБ и далее переносят по 4 мл на стерильную пробирку размером 12×75 мм.
Сортировщик FACSAria готовят для проведения стерильной сортировки живых клеток согласно инструкции производителя (руководство по эксплуатации BD FACs). Пробирку для испытания загружают в сортировщик FACSAria и настраивают значения напряжений РМТ после начала определения. Гейты настраивают для отбора специфических типов клеток почек, используя интенсивность флуоресценции при специфической длине волны. Другой гейт настраивают для отбора отрицательной по признаку популяции. Как только требуемые гейты настроены для инкапсулирования положительной целевой популяции и отрицательной популяции, клетки сортируют согласно инструкций производителя.
Положительную целевую популяцию собирают в одну коническую пробирку объемом 15 мл, отрицательную популяцию - в другую коническую пробирку объемом 15 мл, заполненную 1 мл среды для клеток почек. После завершения сбора образец из каждой пробирки анализируют методом проточной цитометрии для определения степени чистоты. Собранные клетки промывают центрифугированием при 300xg в течение 5 мин, а осадок ресуспендируют в среде для клеток почек для дальнейшего анализа и проведения экспериментов.
Пример 11
Обогащение/обедненение жизнеспособных типов клеток почек с помощью магнитной сортировки клеток
Один или более типов выделенных клеток почек могут быть обогащены и/или один или более специфических типов клеток почек могут быть обеднены из выделенной первичной ткани почки.
РЕАГЕНТЫ: 70% этанол; буферный раствор для промывания (ФСБ); среда для клеток почек 50:50 (50% DMEM с высоким содержанием глюкозы) : 50% кератиноцит-SFM, 0,4% трипановый синий, подвижный буферный раствор (ФСБ, 2 мМ ЭДТА, 0,5% БСА), промывающий буферный раствор (ФСБ, 2 мМ ЭДТА), очищающий раствор (70% об./об. этанол), блокирующий реагент Miltenyi FCR, микрогранулы Miltenyi специфические по изотипу IgG, целевое антитело, такое как CD31 (РЕСАМ) или нефрин или вторичное антитело.
МЕТОДИКА: После проведения стандартных процедур для очистки бокса биологической безопасности (БББ), моноклеточную суспензию клеток почек, полученную при первичном выделении или культивировании, выращивают и ресуспендируют в среде для клеток почек. Проводят подсчет клеток и определение их жизнеспособности методом исключения с трипановым синим. Для обогащения/обедненения клеток почек, к примеру, гломерулярных клеток или эндотелиальных клеток из гетерогенной популяции получают в пределах 106 и 4×109 живых клеток со степенью жизнеспособности по меньшей мере 70%.
Наилучшие условия отделения для подхода обогащения/обедненения определяют на основе целевых требуемых клеток. Для обогащения на целевую частоту менее чем 10%, к примеру, гломерулярных клеток с помощью антитела нефрин, применяют прибор Miltenyi autoMACS, или эквивалентный, программу прибора POSSELDS (двойной положительный отбор в чувствительном режиме). Для обедненения на целевую частоту более чем 10% прибор Miltenyi autoMACS, или эквивалентный, программу прибора DEPLETES (обедненение в чувствительном режиме).
Живые клетки метят целевым специфическим первичным антителом, к примеру, добавлением поликлонального антитела нефрин rb для гломерулярных клеток в коническую центрифужную пробирку в количестве 1 мкг/106 клеток/0,1 мл ФСБ с 0,05% БСА с последующей инкубацией в течение 15 минут при 4°C.
После маркирования клетки промывают для удаления несвязанного первичного антитела путем добавления 1-2 мл буферного раствора на 107 клеток с последующим центрифугированием при 300xg в течение 5 минут. После промывания добавляют изотип-специфическое вторичное антитело, такое как антитело петуха против антитела кролика РЕ в количестве 1 мкг/106/0,1 мл ФСБ с 0,05% БСА, с последующим инкубацией в течение 15 минут при 4°C.
После инкубации клетки промывают для удаления несвязанного вторичного антитела добавлением 1-2 мл буферного раствора на 107 клеток с последующим центрифугированием при 300xg в течение 5 минут. Супернатант удаляют, а осадок клеток ресуспендируют в 60 мкл буферного раствора на общее количество клеток 107 с последующим добавлением 20 мкл блокирующего реагента FCR на общее количество клеток 107, которое потом хорошо перемешивают.
Добавляют 20 мкл микрогранул для прямого определения MACS (таких как анти-РЕ микрогранулы) и смешивают, а потом инкубируют при температуре 4°C в течение 15 минут.
После инкубации клетки промывают добавлением 10-20х объемов маркирующего буферного раствора, центрифугируют суспензию клеток при 300xg в течении 5 мин и ресуспендируют осадок клеток в 500 мкл - 2 мл буферного раствора на 108 клеток.
Систему autoMACS очищают согласно инструкций производителя и предварительно запускают для подготовки магнитной сепарации клеток с использованием системы autoMACS. Помещают новые стерильные пробирки для сбора под выводные порты. Выбирают программу сепарации клеток с помощью системы autoMACS. Для проведения отбора выбирают программу POSSELDS. Для проведения обедненения используют программу DEPLETES.
Меченые клетки помещают под порт подачи, потом начинают выполнение программы. После завершения отбора или обедненения образцы собирают и помещают до использования на лед. Степень чистоты обедненного или отобранного образца проверяют методом проточной цитометрии.
Пример 12
Определение фенотипических характеристик обогащенной гетерогенной популяции клеток почек
В следующем примере подробно описано применение проточной цитометрии для определения характеристик отобранных гетерогенных клеток почек человека из Примера 5. Гетерогенная популяции клеток почек состояла в основном из эпителиальных клеток почек, регенеративный потенциал которых хорошо известен. В аутологических популяциях клеток могут изредка присутствовать другие паренхимальные (васкулярные) и стромальные (собирательные дуктальные) клетки.
Фенотип клеток подвергают мониторингу путем анализа экспрессии маркеров клеток почек с помощью проточной цитометрии. Фенотипический анализ основан на применении антигенных маркеров, специфических для анализируемых типов клеток. Проточный цитометрический анализ обеспечивает количественное измерение клетки в исследуемой популяции, которая экспрессирует анализируемый антигенный маркер.
Для определения характеристик клеток почек пригодны разнообразные маркеры, о которых сообщалось в литературе: (i) цитокератины; (ii) транспортные мембранные белки (аквапорины и кубилин); (iii) молекулы связывания клеток (адгерины, кластер дифференциации и лектины) и (iv) метаболические ферменты (глутатион). Поскольку большинство клеток, обнаруженных в культурах, полученные при разрушении цельной почки, представляют собой эпителиальные и эндотелиальные клетки, по маркерам определяют фокус экспрессии белков, специфических для этих двух групп.
Цитокератины представляют собой семейство белков промежуточных филаментов, экспрессируемых в разной степени многими типами эпителиальных клеток. Подкласс экспрессируемых эпителиальными клетками цитокератинов зависит от типа эпителия. К примеру, цитокератины 7, 8, 18 и 19 все являются экспрессируемыми нормальным простым эпителием почек и остаточным урогенитальным трактом, а также пищеварительным и дыхательным трактом. Эти цитокератины в сочетании отвечают за структурную целостность эпителиальных клеток. Такое сочетание представлено как кислым (I тип), так и основным (II тип) семействами кератинов и обнаружено как избыточно экспрессируемое клетками почек (Oosterwijk et al., J Histochem Cytochem, 38(3): 385-392, 1990). Предпочитаемые для применения в данном документе цитокератины представляют собой CK8, CK18, CK19 или их комбинации.
Аквапорины представляют собой транспортные мембранные белки, которые позволяют проходить молекулам воды в и из клетки, в то же время препятствуя прохождению ионов и других растворенных веществ. Существует тринадцать аквапоринов, описанных в литературе, шесть из которых обнаружено в почках (Nielsen et al, J Histochem Cytochem, 38(3): 385-392, 2002). Аквапорин 2, благодаря участию в точном контроле регулирования оттока воды, отвечает за обеспечение высокой проницаемости для воды плазматических мембран эпителиальных клеток собирательных протоков почек, таким образом позволяя воде проходить по направлению осмотического градиента (Bedford et aL, J Am Soc Nephrol, 14(10): 2581-2587, 2003; Takata et al., Histochem Cell Biol, 130(2): 197-209, 2008; Tamma et al., Endocrinology, 148(3): 1118-1130, 2007). Аквапорин 1 характерен для проксимальных трубочек (Baer et al., Cells Tissues Organs: 184(1), 16-22, 2006; Nielsen et al., 2002, выше).
Кубилин представляет собой транспортный мембранный рецепторный белок. Когда он совместно размещается с белком мегалином, то они вместе способствуют интернализации связанных с кубилином лигандов, таких как альбумин. Кубилин локализован в эпителии кишечника и почек (Christensen, Am J Physiol Renal Physiol, 280(4): F562-573, 2001).
CXCR4 представляет собой транспортный мембранный белок, который служит хемокиновым рецептором для SDF1. При связывании лигандов увеличиваются уровни внутриклеточного кальция и возрастает активация MAPK1/MAPK3. CXCR4 конститутивно экспрессируется в почках и играет важную роль в развитии почек и тубулогенезе (Ueland et al., Dev Dyn, 238(5): 1083-1091, 2009).
Кадберины представляют собой кальций-зависимые белки клеточной адгезии. Они классифицированы по четырем группам, вместе с Е-кадгеринами обнаружены в эпителиальной ткани и вовлечены в регулирование мобильности и пролиферации клеток. Е-кадгерин представляет собой трансмебранный гликопротеин, который обнаружен локализованным в соединениях адгеринов эпителиальных клеток, которые образуют дистальные трубочки почки (Prozialeck et al., ВМС Physiol, 4:10, 2004; Shen et al., Mod Pathol, 18(7): 933-940, 2005).
DBA (агглютинин Dolichos biflorus) представляет собой лектин, связывающий a-N-ацетилгалактозамин (белок, связывающийся с клетками), который переносится на поверхность структур собирательных протоков почек, и рассматриваемый и используемый как общий маркер развивающихся собирательных протоков почек и дистальных трубочек (Michael et al., J Anat 210(1): 89-97, 2007; Lazzeri et al., J Am Soc Nephrol 18 (12): 3128-3138, 2007).
Кластер дифференциации 31 (CD31; также известный как молекула адгезии тромбоцитов/эпителиальных клеток, РЕСАМ-1) представляет собой белок адгезии клеток, который экспрессируется избранными популяциями иммунных клеток, а также эпителиальными клетками. В эндотелиальных клетках этот белок концентрируется на границах клеток (DeLisser, 1997). Кластер дифференциации 146 (CD146) вовлекается в адгезию клеток и когезию эндотелиальных клеток в межклеточных соединениях, связанных с актиновым цитоскелетом. Сильно экспрессируемый эпителием кровеносных сосудов и гладкими мышцами CD 146 в настоящее время применяется в качестве маркера линии эндотелиальных клеток (Malyszko et al., J Clin Endocrinol Metab, 89(9): 4620-4627, 2004) и является эквивалентом CD31 собаки.
Гамма-глутамилтранспептидаза (GGT) представляет собой фермент метаболизма, который катализирует перенос гамма-глутамила - фрагмента глутатиона на акцептор, который может быть аминокислотой, пептидом или молекулой воды с образованием глутамата. Этот фермент также играет роль в синтезе и деградации глутатиона и переносе аминокислот через клеточную мембрану. GGT присутствует на клеточных мембранах многих клеток, включая проксимальные тубулярные клетки, включающие проксимальные тубулярные клетки почек (Horiuchi et al, Eur J Biochem, 87(3): 429-437, 1978; Pretlow et al., J Histochem Cytochem, 35(4): 483-487, 1987; Welbourne et al., Am J Physiol, 277(4 Pt 2); F501-505, 1999). В Таблице 12.1 представлен перечень специфических типов клеток почек, экспрессирующих эти маркеры, определенные при детекции методом проточной цитометрии.

Клетки SRC Примера 5 исследовали на фенотип по специфическим биомаркерам.
Для иммунофенотипирования: Специфическое антитело добавляли к 100 микролитрам суспензии клеток и смесь инкубировали в темноте в течение 30-45 минут при температуре 4°C. После инкубации клетки промывали ФСБ и центрифугировали для отделения избыточных антител. Клетки ресуспендировали в требуемом соотношении клетки/микролитры ФСБ и анализировали методом проточной цитометрии. Проточный цитометрический анализ выполняли с помощью проточного питометра FACSAria (Becton Dickinson) и программного обеспечения FlowJo software (Treestar Inc.). Антитела, использованные для определения характеристик фенотипа по маркерам поверхности показаны в Таблицах 12.2 и 12.3. Во всех экспериментах использовали отрицательные контроли с изотип-специфическими первичными антителами. Для гейтов популяций с отрицательными признаками применяли контроли, соответствующие изотопам.






Суспензии клеток получали из исходной ткани диссоциацией или трипсинизацией соединенных культур и анализировали методом проточной цитометрии для идентификации клеточных компонентов. Примененные антитела перечислены в Таблицах 12.2 и 12.3 (выше). Во всех экспериментах использовали отрицательные контроли с изотип-специфическими первичными антителами. Меченые клетки анализировали с помощью проточного цитометра FACSAria (Becton Dickinson) и программного обеспечения FlowJo software (Treestar Inc.). Для гейтов популяций с отрицательными признаками применяли контроли, соответствующие изотипам. После инкубации в течение ночи при температуре 4°C клетки осаждали, дважды промывали буферным раствором с Тритоном (0,2% Тритон Х-100 в ФСБ), ресуспендируют в 1 мл ФСБД, содержащем вторичное антитело козла против IgG2A мыши, конъюгированного с флуорохромом Alexa А647 (Invitrogen), и инкубировали в течение дополнительных 30 минут.Потом клетки промывали и ресуспендировали в 1 мл ФСБ для анализа согласно инструкций производителя FACSAria и программного обеспечения FlowJo. В качестве отрицательного контроля клетки инкубировали параллельно с моноклональными антителами, соответствующими изотипу, конъюгированными с таким же флуорохромом.
На Фигуре 5 (фенотипное распределение) показана количественная экспрессия этих маркеров в популяциях SRC, фигуры построены как значения процентного содержания каждого фенотипа в популяции.
CK8/18/19 являются наиболее совместно экспрессируемыми белками клеток почек, обнаруженных среди разных видов. GGT1 и аквапорин-1 (AQP1) экспрессируются совместно, но в различной степени. DBA, аквапорин 2 (AQP2), Е-кадгерин (CAD), СК7 и CXCR4 также наблюдают в умеренной степени, хотя и более вариабельно, a CD31/146 и кубилин обладали наименьшей экспрессией. В Таблице 12.4 представлены выбранные маркеры, диапазон и значения среднего процентного содержания фенотипов в SRC и обоснования их выбора.


Экспрессия генов SRC
Профиль экспрессии генов SRC, выделенных из культур клеток почек человека, определенный методом количественной полимеразной цепной реакции в режиме реального времени (кПЦР), включая аквапорин 2, Е-кадгерин, кубилин, VEGF и CD31, также был исследован на продукцию белков. Генотипические маркеры из Таблицы 12.5 представляют популяции клеток, которые, как ожидается, могут быть обнаружены в культурах клеток почек. NCAD, кубилин и CYP2R1 представляют собой маркеры тубулярных эпителиальных клеток, AQP2 и ECAD представляют собой маркеры собирательных протоков и дистальных трубочек. Подоцин и нефрин представляют собой маркеры подоцитов. VEGF и CD31 представляют собой эндотелиальные маркеры. VEGF и ЭПО представляют собой кислород-чувствительные гены с соответствующими мРНК, представленные в множестве разных типов тканей и клеток.
Генетические зонды получали с помощью метода TaqMan. Клетки почек человека пассажа 2 собирали при заполнении 70-90%. РНК выделяли из клеток с помощью мини-набора RNeasy Plus компании Qiagen в соответствии с протоколом для выделения общей РНК из клеток животных. кДНК получали из количества РНК, эквивалентного 1,4 мкг, используя набор для синтеза кДНК Superscript® VILO™ компании Invitrogen в соответствии с инструкциями производителя. Усредненные данные кПЦР для популяций SRC (n=3) показаны в Таблице 12.5.
Данные результаты дают основание предположить, что присутствует популяция тубулярных эпителиальных клеток, что подтверждено относительно высоким уровнем экспрессии NCAD, кубилина и CYP2R1. Маркеры дистальных трубочек собирательных протоков и маркеры дистальных трубочек AQP2 и ECAD экспрессируются на относительно низком уровне, a CD31, эндотелиальный маркер, даже на более низком уровне (Таблица 12.5).
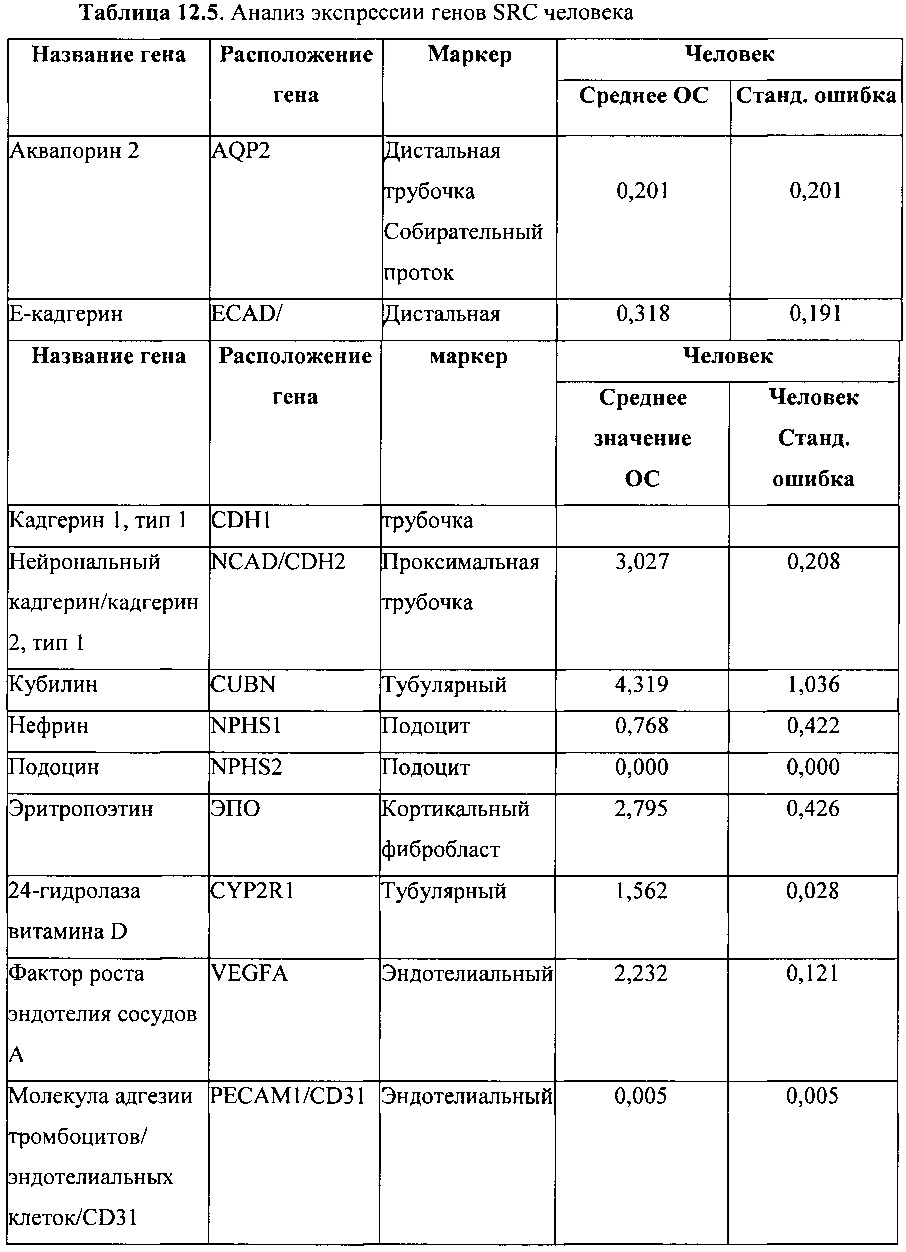
Фенотипические и функциональные маркеры были выбраны на основании ранней генотипической оценки, уровни экспрессии гена VEGF были высокими, а уровни экспрессии гена аквапорина 2 были низкими, что согласуется с данными анализа экспрессии белков (Таблица 12.4 и Таблица 12.6).
Ферментативная активность SRC
Наличие жизнеспособных клеток и функционирование SRC продемонстрировали по метаболизму PrestoBlue и продукции VEGF и KIM-1.
Клетки SRC активно секретируют белки, которые могут быть детектированы посредством анализа кондиционированной среды. Функционирование клеток оценивают по способности клеток метаболизировать PrestoBlue и секретировать VEGF (фактор роста эндотелия сосудов) и КГМ-1 (молекула повреждения почек 1).
В препарате NKA жизнеспособные фунционирующие клетки могут подвергать мониторингу по их способности метаболизировать PrestoBlue. Реагент для определения жизнеспособности клеток PrestoBlue представляет собой реагент для анализа на основе резазурина, который является проницаемым для клеток нефлуоресцентным синим красителем. При вхождении в клетки, которые обладают достаточной жизнеспособностью для пролиферации, краситель восстанавливается при участии естественных клеточных процессов, вовлекающих ферменты-дегидрогеназы, образуя красный флуорофор, который может быть измерен по флуоресценции или поглощению.
Биомолекулы VEGF и KIM-1 предоставляют возможность выбора молекул, из биомаркеров, предложенных, как определяющие чувствительность, и специфических аналитических неклинических биомаркеров повреждения и функционирования почек (Sistare, 2010; Warnock, 2010). Обе группы этих маркеров in vivo являются показателями тубулярного функционирования, повреждения и/или репарации, a in vitro являются признаками распознавания культур тубулярных эпителиальных клеток. KIM-1 представляет собой внеклеточный белок, закрепленный в мембране проксимальных тубулярных клеток почек, который служит для распознавания и фагоцитоза апоптических клеток, которые накапливаются во время повреждения и обновления клеток. VEGF, конститутивно экспрессируемый клетками почек, представляет собой основной ангиогенный и помогающий выживанию фактор, который способствует делению клеток, миграции, выживанию эндотелиальных клеток и прорастанию сосудов. SRC охарактеризовали как конститутивно экспрессирующие мРНК VEGF (Таблица 12.5) и активно продуцирующие белок (Таблиц 12.6). Эти белки могут детектироваться в среде среде для культивирования, засеянной клетками почек и SRC. На Таблице 12.6 представлены количества VEGF и KIM-1 в кондиционированной среде после выращивания клеток почек и культур SRC. Клетки почек культивировали до близкого заполнения. Кондиционированную выращиванием в течение ночи культуру клеток почек и SRC среду исследовали на наличие VEGF и KIM-1.
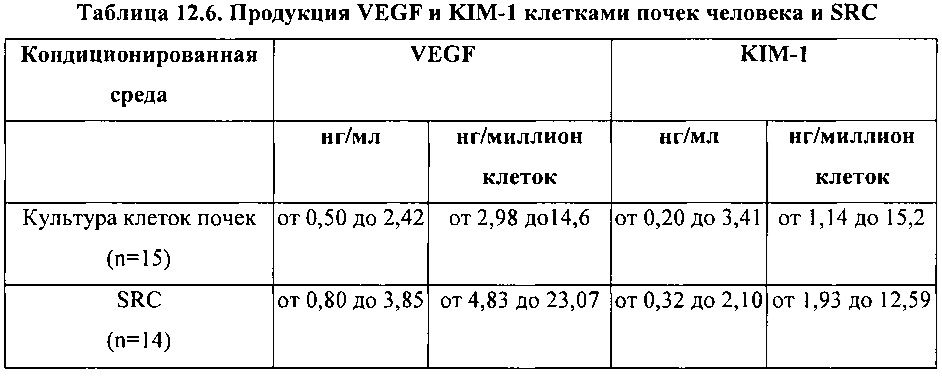
Функционирование клеток SRC, в предварительном составе, также оценивали измерением активности двух специфических ферментов; GGT (гамма-глутамилпептидаза) и LAP (лейцинаминопептидаза) (Chung, 1982, J Cell Biol 95(1): 118-126), обнаруженным в проксимальных трубочках почек. Методы измерения активности этих ферментов в клетках используют фермент-специфический субстрат в растворе так, что при добавлении к клеткам, экспрессирующим активный фермент, субстрат расщепляется, высвобождая хромогенный продукт (Nachlas, 1960 J Biophys Biochem Cytol 7: 261-264; Tate, 1974 Proc Natl Acad Sci USA 71(9): 3329-3333). Измеряют поглощение раствора, подвергшегося воздействию клеток, и поглощение связано с количеством продукта расщепления, получившегося в результате действия активного фермента. Субстрат используемый для GGT представляет собой гидрохлоридом γ-п-нитроанилида L-глутаминовой кислоты, а для LAP - L-лейцин-п-нитроанилидом. На Фигуре 6 показана активность LAP и GGT шести образцов SRC, полученных от людей-доноров (ВР1-ВР4).
Резюме определения характеристик SRC
Морфологию клеток мониторили во время размножения клеток путем сравнения результатов наблюдений культур с изображениями библиотеки изображений. Кинетику роста популяций клеток мониторили для каждого пассажа клеток. Ожидалось, что рост популяций клеток должен варьировать от пациента к пациенту. Числа клеток SRC и жизнеспособность мониторили методом исключения с трипановым синим и/или по метаболизму PrestoBlue. Клетки SRC характеризовали по фенотипической экспрессии CK18, GGT1. Дополнительно могли мониторить экспрессию AQP2. Метаболизм PrestoBlue и продукцию VEGF и KIM-1 использовали как маркеры присутствия жизнеспособных и функциональных клеток SRC. Функционирование клеток SRC может быть дополнительно исследовано с помощью определения профилей экспрессии генов и измерения ферментативной активности LAP и GGT.
Пример 13
Приготовление биоматериала
Биоматериал, применяемый в препарате NKA (раствор желатина) характеризуется двумя ключевыми параметрами:
Концентрация - концентрация раствора желатина измеряется по поглощению при 280 нм с помощью спектрофотометра. Концентрацию желатина определяют по калибровочному графику зависимости поглощения от концентрации.
Испытание на переворачивание - испытание на переворачивание обеспечивает визуальную оценку способности раствора желатина образовывать и поддерживать гель при температуре 2-8°C, а для геля - разжижаться при комнатной температуре.
Исследование других характеристик биоматериалов
Биоматериалы, применяемые для препаратов NKA, могут быть дополнительно охарактеризованы по реологическим свойствам и вязкости. Реологические и вязкостные испытания должны выполняться только с целью проверки и предназначены для применения при расширенном определении характеристик биоматериалов, полученных от других поставщиков.
Реологические свойства биоматериала могут измеряться сначала при температуре 4°C, потом при 25°C, с помощью реометра модели с кюветой-ячейкой. Образец при каждой температуре уравновешивается по меньшей мере 30 минут. Приемлемый модуль накопления (G'>10) при пониженной температуре отражает способность раствора образовывать и поддерживать гель при поставке и температуре транспортирования 2-8°C. Приемлемый модуль потерь (Gʺ<10) при повышенной температуре отражает способность геля превращаться в жидкость при комнатной температуре, что требуется при доставке и имплантации NKA.
Вязкость биоматериала измеряют с помощью вискозиметра «конус-плита» при 37°C и скорости сдвига 200-300 с-1. Растворы с вязкостями в диапазоне 1,05-1,35 сП могут эффективно доставляться через иглы 18-27 калибра.
При приготовлении состава NKA, желатин растворяют в ФСБД до установленной концентрации (0,88% ± 0,12% мас./об.) с образованием раствора желатина (Фигура 2D). Раствор желатина стерилизовали фильтрованием через фильтр с размером пор 0,1 мкм и разливали по аликвотам в пробирки. Образцы отбирали при выпуске раствора желатина перед замораживанием и приготовлением препарата NKA. Желатинизированный гидрогель хранили в холодильнике или замороженным как нерасфасованное вещество, готовое для приготовления препарата (Фигура 2D).
Пример 14
Приготовление препарата NKA
Промытые клетки SRC из Примера 5 подсчитывали, используя метод исключения с красителем трипановым синим. Раствор желатина извлекали из охлаждаемого хранилища и переводили в жидкое состояние подогреванием до 26-30°C. Объем суспензии SRC, содержащий требуемое количество клеток центрифугировали и ресуспендировали в расплавленном растворе желатина для финального этапа промывания. Эту суспензию центрифугировали и осадок SRC ресуспендировали в достаточном объеме раствора желатина для достижения итоговой концентрации SRC 100×106 клеток/мл в приготовленном препарате NKA (Фигура 2D).
Препарат NKA приготовлен в стерильном шприце для однократного применения объемом 10 мл. Конечный объем рассчитывали по концентрации NKA 100×106 клеток SRC/мл и целевой дозе 3,0×106 клеток SRC/г массы почки (оцененной методом МРТ).
Пример 15
Розлив и желатинизация NKA
Препарат NKA асептически разливали в шприцы упаковки NKA в БББ для работы с тканями и манипуляциями культурами клеток (Фигура 2D). Во время процесса розлива выполняли динамический отбор образцов воздуха, включающий отбор образцов для определения жизнеспособных микроорганизмов и механических частиц.
Приготовленный препарат NKA держали в стерильной центрифужной пробирке объемом 50 мл. Стерильную канюлю присоединяли к шприцу переноса объемом 10 мл. Из пробирки объемом 50 мл через канюлю вручную отбирали препарат NKA в шприц переноса. Канюлю удаляли шприц переноса присоединяли к фитингу с фиксатором Люэра на конце трубки упаковки NKA. Препарат NKA переносили в шприц упаковки препарата NKA вытягиванием поршня шпица переноса. В шприц упаковки препарата NKA переносили минимум 8,5 мл препарата. Захваченный в шприц воздух удаляли переворачиванием шприца и медленным нажатием на поршень. После завершения розлива трубку на упаковке препарата NKA закрывали пробкой RF. Препарат, оставшийся в шприце переноса, возвращали в пробирку объемом 50 мл. Образцы для контроля качества (испытание при выпуске) отбирали из пробирки объемом 50 мл. Упаковку препарата NKA вращали минимум 2 часа для поддержания клеток в суспензии при охлаждении до 2-8°C для образования готового желатинизированного препарата NKA (Фигура 2D).
Быстрое охлаждение требовалось для того, чтобы желатинизация прошла таким образом, чтобы клетки не оседали в растворе желатина. Температуру раствора желатина в шприце мониторили, как только его поместили в условия охлаждения. Наблюдали быстрое падение температуры. Через 1 час температура упала до конечной температуры 4,4°C в пределах 0,3°C.
Охлаждение раствора желатина инициировало процесс желатинизации, но требовался определенный период времени для стабилизации образовавшегося геля для того, чтобы клетки SRC оставались суспендированными в геле при хранении. Шприцы, содержащие приготовленный препарат NKA, вращали в течение ночи или в течении 1,25 часов с хранением в вертикальном положении в течение ночи. Впоследствии содержимое удаляли и измеряли концентрацию клеток в четырех разных сегментах препарата. Анализ показал, что разница между четырьмя сегментами отсутствовала, так как не происходило измеряемого оседания клеток после однократного поворачивания препарата NKA при температуре охлаждения в течение минимум 1,25 часов (данные не показаны).
Пример 16
Упаковка и поставка NKA
Препарат NKA упаковали вместе с соответствующей документацией в транспортную тару NKA. Транспортная тара сконструирована так, чтобы во время транспортирования на клиническую базу поддерживался температурный диапазон 2-8°C. Охлажденный (желатинизированный) приготовленный препарат имеет срок годности 3 дня.
Регистратор температуры помещали в упаковку препарата NKA для проведения мониторинга температуры во время поставки. Группа обеспечения качества сверяла номер серии препарата NKA с уникальным идентификатором пациента, записанным в журнале поставки/получения. Транспортную тару с препаратом NKA поставляли на клиническую базу с помощью курьера или сходный способом безопасной транспортировки.
Пример 17
Имплантация NKA (популяция клеток SRC)
В этом примере продемонстрированы регенеративные свойства отобранных гетерогенных клеток почек человека.
Система доставки NKA
Система доставки препарата NKA включала канюлю (иглу), совместимую с системой доставки клеток и шрицом. Различные поставщики для описания устройств доставки клеток применяют термины канюля или игла. Для этого описания термин канюля и игла являются взаимозаменяемыми. В предложенном клиническом исследовании использовали такую же систему доставки (канюля и шприц) адаптированную к размеру и анатомии человека, которую применяли в исследованиях на животных. Применяли лапараскопическую хирургическую процедуру.
Основным компонентом системы доставки препарата NKA была канюля.
Применяли канюлю, которая совместима с препаратом NKA.
Имплантация NKA
При подготовке к имплантации непосредственно перед инъекцией дали возможность препарату NKA нагреться до комнатной температуры для расплавления препарата.
Препарат NKA предназначался для инъекции в кортекс почки через иглу или канюлю и шприц, совместимый с системой доставки клеток. Применение прокалывающей иглы (канюли) для проникновения в капсулу почки позволяло провести введение иглы/канюли доставки в кортекс почки. Шприц, содержащий препарат NKA, присоединяли к игле доставки и препарат NKA инъецировали в несколько мест в кортексе почки. На Фигуре 7 проиллюстрирована методология инъецирования препарата NKA в почку с помощью иглы, совместимой с системой доставки, и распределения его в цельном органе.
Препарат NKA доставили непосредственно в кортекс почки. Для доставки препарата NKA в организм пациентов применяли стандартизированную лапароскопическую процедуру.
Понятно, что примеры и варианты реализации, описанные в данном документе, приведены только с иллюстративными целями и, что различные модификации или изменения в соответствующем свете будут предложены специалистами в данной области и должны быть включены в суть и область применения этой заявки и объем прилагаемой формулы изобретения. Все публикации, патенты и заявки на патенты, цитируемые в данном документе, тем самым включены посредством ссылки в их полноте во всех отношениях.
Реферат
Изобретение относится к биотехнологии, а именно к идентификации гетерогенной популяции клеток почек, пригодной для обеспечения регенеративного стимула для почки, и лечению болезни почек у человека. Способ включает выделение клеток из образца почки млекопитающего и воздействие на образец указанных выделенных клеток мечеными компонентами для детекции, причем каждый меченый компонент для детекции нацелен на уникальный биомаркер и помечен уникальной меткой, где указанные детектируемые биомаркеры представляют собой GGT-1, цитокератин, VEGF и KIM-1. Затем определяют, экспрессируют ли GGT-1 более 4,5% указанных выделенных клеток в указанной гетерогенной популяции клеток почек; экспрессируют ли цитокератин более 80% указанных выделенных клеток в указанной гетерогенной популяции клеток почек; и включают ли указанные выделенные клетки в указанной гетерогенной популяции клеток почек клетки, которые экспрессируют VEGF и KIM-1, чем осуществляется идентификация указанной гетерогенной популяции клеток почек. Затем осуществляют введение человеку эффективного количества клеток из указанной идентифицированной гетерогенной популяции клеток почек, выделенных из неэмбрионального аутологичного образца почки указанного человека. Изобретение позволяет расширить арсенал технических средств. 3 н. и 10 з.п. ф-лы, 7 ил., 9 табл., 17 пр.

Комментарии