Регулируемая кальцием активация тромбоцитов посредством электростимуляции - RU2742937C2
Код документа: RU2742937C2
Чертежи





Описание
Настоящее изобретение в общем относится к терапии тромбоцитами, используемой в различных медицинских областях применения, таких как хирургическое лечение или лечение травм. Некоторые воплощения относятся к активации тромбоцитов и регулированию свертывания крови посредством использования различных условий активации, включающих, но не ограничивающихся этим, присутствие импульсного электрического поля с определенными характеристиками и присутствие кальция в определенной концентрации.
Использование тромбоцитарного геля (также называемого «активированная обогащенная тромбоцитами плазма») является профилактической терапией, которая может быть использована в клинике или в другом учреждении здравоохранения в различных областях применения, включая способствование лечению ран (в частности, после хирургического вмешательства) и остановке кровотечения. В частности, интерес к использованию тромбоцитарной терапии в качестве лекарства для заживления ран существует для многих типов травм и условий повреждения, таких как повреждения нерва, тендиниты, остеоартриты, повреждение сердечной мышцы и восстановление и регенерация кости. Кроме того, тромбоцитарный гель, вводимый пациенту, должен быть аутологичным, т.е. тромбоциты должны иметь происхождение из собственных тканей и/или текучих сред пациента. Таким образом, образец крови от пациента можно использовать для получения тромбоцитарного геля, применяемого для лечения пациента.
В качестве примера, доктор может взять кровь у пациента. Кровь затем можно подвергнуть центрифугированию для получения обогащенной тромбоцитами плазмы (ОТП). После активации тромбоцитов стимулируется высвобождение факторов роста и белков в крови, что облегчает каскад заживления раны. Поэтому лечебный процесс в клинике может включать забор крови у пациента, центрифугирование крови для отделения тромбоцитов и выполнение активации тромбоцитов ex vivo, например с использованием бычьего тромбина. Активированные тромбоциты или тромбоцитарный гель можно затем наложить на рану или другую область лечения. В случаях, когда вместо этого используют активацию тромбоцитов in vivo, доктор может накладывать ОТП на место без добавления активатора тромбоцитов. Активация тромбоцитов, которая включает высвобождение факторов роста и свертывание, обычно вызывается коллагеном в соединительной ткани.
Для таких применений ex vivo, когда тромбин (например, бычий тромбин) используют для активации тромбоцитов, получаемые уровни факторов роста можно установить, исходя из биологического отклика. То есть, количество и/или соответствующие соотношения или пропорции различных факторов роста определяются природой активации на основе тромбина. Поэтому в таких реакциях врач не способен регулировать соответствующие количества или пропорции различных факторов роста или управлять ими, а вместо этого должен иметь дело с традиционными активирующими композициями. Кроме того, в обычных схемах лечения может быть желательно иметь свертывание или не иметь его, и/или в присутствии свертывания регулировать механическую прочность или другие характеристики сгустка.
Краткое описание изобретения
В одном воплощении предложен способ получения активированного продукта. Согласно этому способу, получают образец обогащенной тромбоцитами плазмы (ОТП). Образец ОТП получают посредством добавления ионов кальция при соответствующей концентрации. Соответствующую концентрацию выбирают, исходя из того, должны ли присутствовать сгустки в композиции активированного продукта, получаемого с использованием образца ОПТ, и если свертывание крови должно присутствовать, исходя из одного или более параметров из периода времени до образования сгустка или механической прочности сгустков. Образец ОТП размещают между электродами устройства для электромагнитной стимуляции. Устанавливают набор параметров электрического импульса. Образец ОТП подвергают воздействию одного или более электрических импульсов, генерируемых в соответствии со значениями параметров. Из образца ОТП после воздействия одного или более электрических импульсов получают композицию активированного продукта, включающую один или более факторов роста и имеющую определенные характеристики свертывания.
В другом воплощении предложен способ образования активированного продукта. Согласно этому способу, получают обработанный антикоагулянтом образец обогащенной тромбоцитами плазмы (ОТП) для активации. К образцу ОТП добавляют ионы кальция с получением концентрации ионов кальция, выбранной из интервала возможных концентраций. Концентрацию выбирают, исходя из целевых уровней одного или более факторов роста, которые должны присутствовать в композиции активированного продукта, полученной с использованием образца ОТП. Образец ОТП подвергают воздействию электрического импульса. Образец ОТП, подвергнутый воздействию активирующей электрической стимуляции, дает активированную готовую композицию, включающую один или более факторов роста в заданном количестве. Изменение концентрации ионов кальция без изменения параметров стимуляции электрической активацией изменяет один или оба из абсолютного или относительного количества одного или более факторов роста.
В дополнительном воплощении предложен способ регулирования механической прочности сгустка в тромбоцитарном геле. Согласно этому способу определяют предполагаемую механическую прочность одного или более сгустков, создаваемых в тромбоцитарном геле. Предполагаемая механическая прочность больше прочности, наблюдаемой в случает образования тромбоцитарного геля с использованием только тромбина. Исходя из предполагаемой механической прочности, из множества концентраций ионов кальция выбирают концентрацию ионов кальция, соответствующую предполагаемой механической прочности. Тромбоцитарный гель образуют посредством активации образца обогащенной тромбоцитами плазмы (ОТП), содержащего ионы кальция в выбранной концентрации. Образец ОТП активируют с использованием электрической стимуляции. Тромбоцитарный гель содержит сгустки, которые после их образования имеют предполагаемую механическую прочность.
Краткое описание чертежей Эти и другие признаки, аспекты и преимущества настоящего изобретения станут лучше понятны после прочтения нижеследующего подробного описания со ссылками на сопровождающие чертежи, на которых подобные элементы обозначены одинаковыми обозначениями, где
на Фиг. 1 схематично показана система генерирования импульсов в соответствии с аспектами настоящего изобретения;
на Фиг. 2 графически представлено время до начального образования сгустков (время образования сгустков), полученное в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 3 графически представлена кинетика сгустков, полученная в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 4 графически представлено содержание фибриногена, полученное в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 5 графически представлена прочность сгустков, полученная в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 6 показаны репрезентативные кривые механической прочности сгустков, (МА) в зависимости от времени, полученные на тромбоэластографе (ТЭГ) для одного участвующего в исследовании пациента, в соответствии с аспектами настоящего изобретения;
на Фиг. 7 графически представлено количество PF4, полученное в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 8 графически представлено количество PDGF, полученное в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 9 графически представлено количество VEGF, полученное в ряде экспериментов, в соответствии с аспектами настоящего изобретения;
на Фиг. 10 графически представлено количество EGF, полученное в ряде экспериментов, в соответствии с аспектами настоящего изобретения.
Подробное описание изобретения
Ниже описано одно или более конкретных воплощений настоящего изобретения. В попытке обеспечить четкое описание этих воплощений, все признаки фактической реализации могут быть не раскрыты в описании. Следует понимать, что при разработке любой такой фактической реализации, как в случае любого инженерного или технического проекта, следует выполнить ряд специфических для данной реализации решений, чтобы достичь конкретных целей разработчика, таких как соблюдение системных и финансово-хозяйственных ограничений, которые могут меняться от одного воплощения к другому. Кроме того, следует понимать, что такие усилия по разработке могут быть комплексными и затратными по времени, но тем не менее, они представляют собой обычную работу по проектированию, изготовлению и производству для специалистов в данной области техники, ознакомившихся с этим описанием.
Представленные здесь технические приемы применяют к материальным объектам, и конкретные примеры практического характера, которые демонстрируют улучшение в данной области техники, как таковые, не являются абстрактными или чисто теоретическими.
При описании элементов различных воплощений, указание элемента в единственном числе и употребление слова «указанный» подразумевает, что может присутствовать один или более элементов. Термины «включающий», «содержащий» и «имеющий» подразумевают, что могут присутствовать дополнительные элементы, отличные от перечисленных элементов.
Активацию и/или агрегацию тромбоцитов можно использовать для лечения ран in vivo и/или ex vivo. Для активации тромбоцитов in vivo неактивированную обогащенную тромбоцитами плазму (ОТП) наносят на место повреждения или вводят в него и активируют посредством соединений, естественно присутствующих в организме, таких как коллаген, присутствующий в соединительной ткани.
В традиционных способах ex vivo тромбоциты в отобранной и разделенной крови подвергают воздействию соединения, активирующего тромбоциты, такого как тромбин, что включает высвобождение факторов роста (например, тромбоцитарный фактор роста (PDGF)). Например, для активации тромбоцитов ex vivo врач может взять кровь у пациента и центрифугировать образец крови с получением образца обогащенной тромбоцитами плазмы (ОТП). К образцу ОТП можно добавить источник ионов кальция и активирующее тромбоциты соединение, такое как тромбин, для инициирования активации тромбоцитов и образования геля, содержащего факторы роста, который затем наносят на рану.
Обсуждаемые в этом документе подходы относятся к активации тромбоцитов (или других клеток) ex vivo и высвобождению факторов роста в присутствии ионов кальция (Са++) при различных концентрациях, которые могут быть введены в активирующую смесь в форме соли (например, CaCl2, при этом CaCl2 обеспечивают в диапазоне концентраций от 2,5 мМ до 20 мМ, включая, но не ограничиваясь перечисленным, 2,5 мМ 5,0 мМ, 7,5 мМ, 10 мМ, 15 мМ, 20 мМ и 25 мМ). Добавляемый кальций не следует путать с конечной концентрацией кальция в образце. Также следует понимать, что в некоторых воплощениях образец ОТП, к которому добавляют кальций, может включать известное количество антикоагулянта (например, цитратный антикоагулянт с декстрозой (ACD-A)), который может влиять на определение количества добавляемого кальция. Кроме того, активирующая смесь может быть подвергнута одному или более энергетическим воздействиям по требованию заказчика (например, одному или более электрическим импульсам). Присутствие ионов кальция в различной концентрации, при энергетическом воздействии или без него, можно использовать, в соответствии с некоторыми воплощениями, обсуждаемыми в этом документе, для регулирования или изменения образования сгустков, возникающих в процессе активации тромбоцитов, и в некоторых воплощениях можно предотвращать полное свертывание. Такое регулирование при образовании сгустков может быть полезным в случае, когда полученный продукт из активированных тромбоцитов наносят наружно (где свертывание может быть желательным), в противоположность случаю, когда продукт могут инъецировать (где сгустки нежелательны). Кроме того, изменения механической прочности сгустков можно достичь посредством регулирования одного или обоих параметров из концентрации ионов кальция в активирующей смеси или энергетического воздействия (например, электрического), как обсуждают в этом документе. Например, при добавлении ионов кальция в процессе активации, как обсуждают в данном документе, получаемая механическая прочность сгустков, образованных в продукте из активированных тромбоцитов, больше, чем она была бы, если бы активацию проводили только с использованием тромбина (т.е. без добавления ионов кальция). Наконец, изменение одного или обоих параметров из концентрации ионов кальция в активирующей смеси или энергетического воздействия (например, электрического), как обсуждают в этом документе, можно использовать для регулирования, приведения в соответствие с требованиями заказчика или оптимизации высвобождения одного или более факторов роста или соответствующих их пропорций в получаемом продукте из активированных тромбоцитов.
Таким образом, например, активация тромбоцитов ex vivo, как обсуждают в этом документе, может включать воздействие на образец крови, такой как образец ОТП, или на любую суспензию, содержащую тромбоциты (например, суспензию тромбоцитов или кровь в целом), электрическими импульсами (например, воздействие импульсными электрическими полями) или другой подходящей активирующей энергией в присутствии ионов Са++ для инициирования активации тромбоцитов. В некоторых воплощениях электрическую стимуляцию или активацию можно применять, используя различные электрические параметры (например, амплитуда, напряжение, электрическое поле, плотность энергии, ток, продолжительность импульса и т.д.) при сочетании различных параметров или сочетаний параметров с определенной концентрацией Са++ для достижения различного количества факторов роста и/или для регулирования аспектов образования сгустков. В результате можно получить активированную композицию, имеющую определенные характеристики в отношении факторов роста и свертывания, и наоборот, создание активированной композиции, имеющей конкретные характеристики в отношении факторов роста и свертывания может определять параметры электрических импульсов и концентрацию Са++, используемые при активации данной клеточной композиции.
Как отмечено выше, регулирование концентрации Ca++ в активирующей смеси является основой для различных воплощений, обсуждаемых в данном документе. В некоторых из этих воплощений можно также использовать импульсные электрические поля как часть процедуры активации. В связи с этим, на Фиг. 1 схематично показана система 10 генерирования импульсов для активации тромбоцитов ex vivo с использованием концентраций Ca++, подходящих для создания композиции, имеющей конкретный профиль факторов роста и характеристики свертывания. Система 10 включает электрическую цепь 12 для генерирования импульсов и расположенные друг напротив друга электроды 14 и 16 (или комплекты электродов). В показанном примере электроды 14 и 16 расположены на расстоянии на противоположных сторонах кюветы 18. То есть, кювета 18 размещена между электродами, и электроды 14 и 16 соединены с электрической цепью для генерирования импульсов через контакты 20. То есть, в показанном примере продемонстрировано электрическое соединение (т.е. контактное соединение). Однако следует понимать, что этот пример с контактным соединением приведен только для того, чтобы облегчить пояснение и обеспечить полезный контекст для пояснения настоящего подхода, и это соединение не является единственным подходящим механизмом для передачи образцу активирующей энергии (как обсуждается в этом документе). Например, в других воплощениях можно использовать неконтактные способы соединения (такие как емкостное или индуктивное соединение) для осуществления обсуждаемой передачи энергии. Таким образом, как обсуждается в этом документе, следует понимать, что передачу энергии суспензии тромбоцитов можно осуществлять посредством любого подходящего механизма, либо включающего контакт между контейнером с образцом и цепью с электродами (как показано в этом примере), либо не включающего такого контакта при использовании индуктивных или емкостных эффектов.
Вне зависимости от физического или конструкционного исполнения, электрическая цепь 12 для генерирования импульсов при эксплуатации электрически стимулирует или активирует образец 22 суспензии крови, компонента крови или тромбоцитов в присутствии Са++ в кювете 18, чтобы активировать тромбоциты или другие типы клеток в образце 22, в котором высвобождаются белки и/или факторы роста при активации или стимуляции. Как обсуждается в этом документе, это может принимать форму приложения импульсных электрических полей к образцу, содержащемуся в кювете 18, когда работает электрическая цепь 12 для генерирования импульсов, независимо от того, каким образом объединены или соединены электроды 14 и 16 и кювета 18. Система 10 может быть выполнена с возможностью приема или удерживания кювет различных размеров, например, кювет различного диаметра или ширины.
Кювета 18 может быть одноразовой и/или отсоединяемой от держателя 24 образца, который включает электроды 14 и 16. Вставка кюветы 18 в держатель 24 для образца и контакт электродов 14 и 16 с контактами 20 обеспечивают возможность вырабатывания электрических импульсов электрической цепью 12 для генерирования импульсов, которые воздействуют на образец 22. Как можно понять, кювета 18 представляет собой лишь один пример подходящего контейнера для образца, и в сочетании с системой 10 можно использовать другие типы сосудов, выполненных для удерживания образца 22, обеспечения контакта с электродами 14 и 16 и передачи электрических импульсов. Как обсуждаются в данном документе, расстояние между электродами 14 и 16 может влиять на напряженность импульсного электрического поля, которая определяется как отношение приложенного напряжения к ширине зазора для кюветы. Например, воздействие импульсом 1 кВ на кювету шириной 1 см дает напряженность поля 1 кВ/см. Напряженность поля, расстояние между электродами и другие параметры, относящиеся к генерированию импульсов, являются факторами, как обсуждается в данном документе, которые можно изменять или настраивать для изменения количества факторов роста по отношению друг к другу в течение операции активации.
Как можно понять, показанная система активации с контейнером или кюветой подходит для периодического процесса. Однако вместо этого можно использовать проточную систему, где через электроды 14 и 16 проходит трубопровод, причем электроды могут быть расположены на противоположных сторонах трубопровода или окружать трубопровод. Такая проточная компоновка обеспечивает возможность непрерывного протекания образца через трубопровод для воздействия на него импульсного электрического поля для активации, при этом активированный продукт собирают непрерывно или полунепрерывно. Помимо этого, или вместо этого, электрические параметры электродов и/или расстояние между электродами 14 и 16, другие параметры можно также регулировать для обеспечения процесса активации. Например, расход образца (например, суспензии тромбоцитов) в трубопроводе и/или диаметр трубопровода можно также учитывать или регулировать в качестве фактора или параметра процесса активации. То есть, помимо электрических параметров, задаваемых для электродов, один или оба параметра из расхода и расстояния между электродами могут определять воздействие электрического поля (или воздействие интенсивности поля) на образец в процессе активации.
Система может включать электрическую цепь ввода и управления и может быть выполнена в специально предназначенном для нее корпусе или может быть присоединена к компьютеру или к другой содержащей процессор системе управления. Например, система 10 может включать процессор 10 или сообщаться с ним, причем процессор осуществляет управление электрической цепью 12 для генерирования импульсов. Дополнительные компоненты системы 10 могут включать память 28, где хранятся инструкции, выполняемые процессором 26. Такие инструкции могут включать протоколы и/или параметры для генерирования электрических импульсов, используя электрическую цепь 12 для генерирования импульсов. Процессор 26 может включать, например, одно- или многокристальные микропроцессоры общего назначения. Кроме того, процессор 26 может представлять собой любой традиционный процессор специального назначения, такой как специализированный процессор или электрическая цепь. Память 28 может представлять собой энергонезависимый машиночитаемый носитель, такой как запоминающее устройство с произвольным доступом, запоминающее устройство большой емкости, твердотельное запоминающее устройство или съемное запоминающее устройство. Кроме того, монитор 30 может отображать показания для оператора, относящиеся к работе системы 10. Система может включать пользовательское устройство 32 ввода (например, клавиатуру, мышь, сенсорный экран, шаровой манипулятор, переносное устройство, такое как PDA, или смартфон, или любое их сочетание) для активации электрической цепи 12 генерирования импульсов, выбора или уточнения подходящих параметров импульса или выбора предварительно сконфигурированного профиля импульса из ряда таких профилей (например, профилей, каждый из которых соответствует различным составам или характеристиками активированного продукта (например, профили факторов роста, прочность сгустка, присутствие или отсутствие свертывания и т.д.).
Система 10 генерирования импульсов, как обсуждается в этом документе, может быть выполнена в виде одноцелевого устройства для активации тромбоцитов или других типов клеток или виде многоцелевого устройства, которое можно использовать в других областях применения с воздействием электрического поля, таких как электропорация, ускоренный рост клеток посредством электрической стимуляции, помимо активации тромбоцитов (или другого типа клеток). Кроме того, система 10 может быть выполнена с возможностью генерирования электрических импульсов в соответствии с одним или более определенными протоколами и/или с использованием одного или более параметров, которые можно изменять для получения активированных продуктов с различными характеристиками. Что касается различных факторов или параметров электрического импульса, эти факторы включают, но не ограничены перечисленным: пространство для кюветы (т.е. ширина кюветы 18, по которой прилагают импульс), расход (в проточном исполнении), напряжение, электрическое поле (например, напряженность или плотность), ток, ширина импульса, продолжительность импульса и количество прикладываемых импульсов.
Протоколы можно создавать посредством ввода их пользователем, и/или они могут храниться в памяти 28, чтобы их выбирал пользователь, например, из списка в меню. Электрическая цепь 12 для генерирования импульсов может работать под управлением процессора 26 для выполнения протоколов, где используют определенное электрическое поле, концентрацию Са++, длину импульса, общее время воздействия, расход (для проточного исполнения) или другие характеристики для получения активированной клеточной композиции, удовлетворяющей требованиям заказчика. Такой протокол может быть определен путем эмпирических или теоретических исследований, например, чтобы соответствовать требуемому применению в клинической практике. В других воплощениях система 10 может быть выполнена с возможностью приема данных, вводимых пользователем, относящихся к одному или более параметров из напряженности электрического поля, концентрации Са++, длины импульса, расхода и/или общего времени воздействия, т.е. пользователь может изменять или уточнять один или более из этих рабочих параметров. Кроме того, система 10 может быть выполнена с возможностью генерирования конкретной формы импульса или генерирования последовательности импульсов, которые могут отличаться друг от друга, в соответствии с данными, введенными пользователем и/или хранящимися установочными параметрами протоколов.
Например, импульс, генерируемый системой 10, может иметь продолжительность от примерно 1 наносекунды до примерно 100 микросекунд, и напряженность электрического поля может составлять от примерно 0,1 кВ/см до примерно 350 кВ/см, в зависимости от области применения. Как отмечено выше, напряженность электрического поля импульса равна приложенному напряжению, деленному на расстояние между электродами 14 и 16. Так как импульсы, генерируемые системой 10, обычно имеют напряженность электрического поля 0,1 кВ/см или выше, импульсы обычно не превышают поле пробоя для суспензии, которая включает клетки.
Система 10 генерирования импульсов может также включать функцию считывания. То есть, система 10 генерирования импульсов может быть выполнена с возможностью обеспечения воздействия на образец 22 сигнала считывания, который может быть электрическим импульсом с напряженностью электрического поля ниже этой величины для электрических импульсов, используемых для активации клеток. Как показано на Фиг. 1, система 10 генерирования импульсов может включать цепь 34 считывания током, которая может получать и/или обрабатывать сигнал считывания для оценки некоторых электрических или химических свойств образца 22, включая, но не ограничиваясь перечисленным, проводимость и диэлектрическую проницаемость. На практике такую цепь считывания можно использовать для определения концентрации Са++ в обрабатываемом образце, чтобы убедиться, что концентрация Са++ совпадает с выбранным протоколом и/или чтобы отрегулировать рабочие параметры, исходя из наблюдаемой или измеренной концентрации Са++, присутствующей в образце.
Цепь 34 считывания током может быть связана с процессором 26, который может управлять генерированием и обработкой сигнала считывания и выполнять часть обработки. В других воплощениях цепь 34 считывания током может включать специально предназначенный процессор для управлении обработкой сигнала считывания и может быть связана с процессором 26 для сообщения результатов. Альтернативно, цепь 34 считывания током может быть объединена с цепью 12 генерирования импульсов, обеспечивая входные данные, используемые при генерировании электрических импульсов последующей активации. В других воплощениях обработку сигналов считывания может осуществлять специально предназначенный для этого процессор, как описано выше, или процессор 26.
План исследования
В одном исследовании сочетание этих параметров определяли в сочетании с другими методами управления или активации. В этом исследовании приготавливали концентрированную обогащенную тромбоцитами плазму (ОТП) для исследования. Доноры допускались для участия, если им было 18 лет или более, они не принимали аспирина или других антиагрегантных лекарственных препаратов в течение 10 суток или более, и не принимали никаких других нестероидных противовоспалительных средств в течение 3 суток или более. После забора и слива 2 мл крови, 120 мл крови отбирали у каждого из 5 добровольных доноров в 1/10 объема раствора цитратного антикоагулянта с декстрозой A (ACD-A). ОТП приготавливали согласно рекомендации изготовителя, используя систему Harvest SmartPreP2 (Harvest Technologies, Плимут, Массачусетс, США) с двумя картриджами объемом 60 мл. Полученную ОТП объединяли перед дальнейшей обработкой. Общий анализ крови выполняли на обработанной антикоагулянтом ACD цельной крови и концентрированной ОТП в анализаторе крови Sysmex XN.
Приготовленную ОТП затем активировали с использованием одного из двух импульсных электрических полей (ИЭП), т.е. НЭП А или НЭП В, или в присутствии бычьего тромбина (конечная концентрация 1 Ед/мл, Biopharm Laboratories LLC, Блафдейл, Юта, США). Перед активацией ИЭП или тромбином образцы ОТП повторно кальцифицировали посредством добавления 1/100 объема CaCl2 (конечная концентрация 2,5 мМ или 20 мМ, Bachem, Торранс, Калифорния, США). Концентрированную плазму в общем количестве 2 мл обрабатывали при каждых условиях в 2 мм кювете для электропорации (Molecular BioProducts, Сан Диего, Калифорния, США) в системе, соответствующей системе, описанной в связи с Фиг. 1. ИЭП А имело следующие параметры: один импульс, продолжительность импульса составляла приблизительно 5 микросекунд, амплитуда напряжения ~ 3,3 кВ и ток более 300 А. ИЭП В имело следующие параметры: 120 биполярных импульсов, 1 импульс в секунду, ~ 800 В (напряжение) и ~ 70 А (ток). Контрольные образцы включали ОТП, обработанную только буфером (соляной раствор) с высоким содержанием CaCl2 (т.е. количество добавленного CaCl2составляло 20 мМ) и тромбином с низким (2,5 мМ) и высоким (20 мМ) содержанием добавленного CaCl2.
В таблице 1 приведены различные сочетания параметров исследования.

Измеренные конечные показатели включали: (1) кинетику образования сгустков и прочность, измеренные с помощью тромбоэластографии (ТЭГ) и образование фрагмента протромбина F1.2; (2) выявление на поверхности альфа гранул тромбоцитов (Р-селектин) и Т-гранул (толл-подобный рецептор 9 (TLR9)); маркеры протеин дисульфид изомеразы (PDI), измеренные посредством проточной цитометрии; (3) факторы, высвобожденные из тромбоцитов в надосадочную жидкость (EGF, PDGF, VEGF, PF4, PDI). Все конечные показатели, за исключением ТЭГ, измеряли на образцах, отобранных через 15 мин после активации.
Тромбоэластография и активация протромбина плазмы. Для анализа образования сгустков в активированном продукте (например, в тромбоцитарном геле) 360 мкл активированной ОТП переносили в чашку ТЕГ, и запись показаний начинали немедленно после воздействия на ОТП условий активации. Измерения получали с использованием анализирующей системы TEG 5000 Hemostasis (Haemonetics Corporation, Брайнтри, Минеаполис, США). Кинетику и характеристики свертывания отслеживали в течение 30 мин.
Для определения степени, до которой кальций, ИЭП, тромбин и контрольные условия вносят вклад в превращение протромбина плазмы в активный тромбин, образцы центрифугировали, извлекали надосадочную жидкость и измеряли F1.2 с помощью ELISA (Enzygnost, Siemens, Марбург, Германия), в соответствии с руководством дистрибьютора, в надосадочных жидкостях, отобранных через 15 мин полсе активации ОТП,
[0001] Высвобождение альфа гранул и Т-гранул тромбоцитов. После активации ОТП часть каждого образца смешивали с пептидом Gly-Pro-Arg-Pro (GPRP), который предотвращает полимеризацию фибринов в сгустки, таким образом обеспечивая возможность проточного цитометрического анализа маркеров на поверхности тромбоцитов посредством проточной цитометрии. В частности, проточную цитометрию использовали для оценки дифференциального высвобождения гранул тромбоцитов и содержания гранул, измеряемого посредством изменений Р-селектина (CD62P) (для альфа гранул) на поверхности тромбоцитов и PDI и TLR9 на поверхности тромбоцитов (для Т-гранул). Образцы для проточной цитометрии фиксировали в течение пятнадцати минут после активации посредством добавления эквивалентного объема 2% раствора формальдегида в 10 мМ HEPES, 0,15 М NaCl, рН 7,4. Образцы разбавляли в 12-кратном количестве буферного соляного раствора - HEPES (10 мМ HEPES, 0,15 М NaCl, рН 7.4; химикаты от Sigma, Сент-Луис, Минесота, США), затем добавляли к смеси меченых изоцианатом флуоресцеина антител TLR9 (клон 5G5, Abeam, Кэмбридж, Минеаполис, США), меченого фикоэритрином (ФЭ) Р-селектина (клон AK4, BD Pharmingen, Сан-Диего, Калифорния, США) и CD41-PerCP-Cy5.5 (клон HIP8, BD Pharmingen, Сан-Диего, Калифорния, США) или к смеси меченых изоцианатом флуоресцеина антител анти-Р-селектина (клон AK4, BD Pharmingen, Сан-Диего, Калифорния, США), меченого ФЭ PDI (клон 1D3, Abeam, Кэмбридж, Минеаполис, США) и CD41-PerCP-Cy5.5. Неспецифическое окрашивание определяли параллельно с использованием образца, реагирующего со смесью изотипически сходного изоцианата флуоресцеина, изотипически сходного ФЭ и меченого PerCP-Су5.5 нормального Ig. Спустя 30 мин окрашивания при комнатной температуре, добавляли 400 мкл 1% раствора формальдегида в буферном соляном растворе HEPES. Анализ посредством проточной цитометрии выполняли на калиброванном Becton Dickinson FACSCalibur.
Высвобождение Т-гранул дополнительно исследовали посредством измерения PDI с помощью ELISA (Cloud-Clone Corp., Хьюстон, Техас, США), в соответствии с руководством дистрибьютора, в надосадочных жидкостях, собранных через 15 мин после активации ОТП.
Дифференциальное высвобождение гранул и факторов роста тромбоцитов. Количество эпидермального фактора роста (EGF), тромбоцитарного фактора роста (PDGF), фактора роста сосудистого эндотелия (VEGF) и тромбоцитарного фактора 4 (PF4) в надосадочных жидкостях обработанной ОТП измеряли с использованием имеющихся в продаже наборов ELISA (EGF и PDGF R&D Systems, Минеаполис, Минеаполис, США; VEGF, Eagle Biosciences, Нашуа, Нью-Гемпшир, США; PF4, Abeam, Кэмбридж, Великобритания).
Анализ. Наблюдаемые данные анализировали с использованием GraphPad Prism version 5.0а (GraphPad Software, Ла Джолла, Калифорния, США). Данные нормального распределения (по оценке с помощью теста на нормальность распределения справочника D'Agostino and Pearson) сведены в виде среднего значения ± стандартное отклонение или среднего значения ± стандартная среднеквадратичная погрешность среднего значения, как указано. Непараметрические данные выведены в виде среднего значения выборки и интерквартильного диапазона или в виде среднего значения выборки и диапазона. Для сравнения трех или более групп использовали однофакторный дисперсионный анализ с использованием множественного сравнения Тьюки для сравнения отдельных групп.
Результаты: Кинетика и прочность сгустков (ТЭГ и тромбинообразование). Сравнение влияния условий импульсного электрического поля (ИЭП) и присутствия кальция с влиянием условий бычьего тромбина на кинетику и прочность сгустков по измерениям посредством тромбоэластографии представлено в таблице 2.

* р<0,05 относительно тромбина, 20 мМ CaCl2;
В отношении результатов ТЭГ, время до начального образования сгустков R для соответствующих исследуемых факторов графически показано на Фиг. 2. Более конкретно, R ТЭГ представляет ферментативный отрезок коагуляции и является периодом латентности (в минутах) от момента времени, когда кровь была помещена в ТЭГ анализатор до начального образования фибрина. К ТЭГ представляет собой время, требуемое для достижения заданного уровня прочности сгустка отражает кинетику свертывания (графически показано на Фиг. 3). Угол ТЭГ представляет собой наклон в градусах для изменения амплитуды со временем из-за скорости наращивания фибрина и сшивания и отражает уровень фибриногена (графически изображено на Фиг. 4). Максимальная амплитуда (МА) ТЭГ (графически изображено на Фиг. 5) представляет собой максимальную амплитуду в миллиметрах и является прямой функцией от максимальных динамический свойств фибрина и связывания тромбоцитов и конечной прочности фибринового сгустка. МА ТЭГ отражает тромбоцитарную функцию и/или агрегирование. На каждом из Фиг. 2-4 показаны отдельные результаты, наряду со средним значением и стандартной среднеквадратичной погрешностью среднего значения (СПС).
Как показано в таблице 2 (и графически изображено на Фиг. 2), время до начального образования сгустков было наименьшим для образцов, обработанных тромбином (опыты 5 и 6), где образование сгустков начиналось менее через минуту, напротив, в опыте 3 (ИЭП А, 20 мМ CaCl2) инициация свертывания происходила примерно через 4 мин, в опыте 4 (ИЭП В, 20 мМ CaCl2) инициация свертывания происходила примерно через 9 мин, и в случае обработке только высоким содержанием кальция (опыт 8) инициация сгустков происходила только примерно через 13 мин. Сгустки не регистрировали с помощью ТЭГ вплоть до 30 мин после активации в опыте 1 (ИЭП А, 2,5 мМ CaCl2), опыте 2 (ИЭП В, 2,5 мМ CaCl2) или опыте 7 (т.е. при обработке буферным раствором (без кальция)), причем указанные опыты не показаны в таблице 2.
Эти результаты согласовывались с результатами теста тромбинообразования, в котором наибольшее количество F1.2 наблюдали для ОТП, обработанных только раствором с высоким содержанием кальция (опыт 8), тогда как F1.2 не удалось обнаружить для контрольного опыта без кальция (опыт 7) и для опытов 1 и 2 (ИЭП А, 2,5 мМ CaCl2 и ИЭП В, 2,5 мМ CaCl2). Это соглалосывалось с результатами ТЭГ исследований, которые не показали обнаруживаемого свертывания в отсутствие кальция (опыт 7) или через 30 минут обработки ИЭП А, 2,5 мМ CaCl2 и ИЭП В, 2,5 мМ CaCl2 (опыты 1 и 2).
Таким образом, как показали эти результаты, ни при одном из испытанных импульсных электрических полей не получали активированного продукта, который свертывался, в случае низкого содержания Са++ (2,5 mM CaCl2). В других случаях время свертывания изменялось в зависимости от способа активации, при этом в случае ИЭП А и высокого содержания Са++ (20 мМ CaCl2) свертывание происходило за ~ 4 мин, ИЭП В и высокого содержания Са++ (20 мМ CaCl2) свертывание происходило за ~ 8 мин, и в случае тромбина с высоким или низким содержанием Са++ свертывание происходило за ~ 1 мин. Как можно понять, важное значение этого состоит в том, что уровни Са++ в сочетании с способом активации можно использовать для регулирования того, будет ли вообще происходить свертывание, и в случае его возникновения, регулирования времени до начального образования сгустков (например, времени до начала свертывания).
Несмотря на то, что требовалось больше времени до начала образования сгустков, прочность сгустка (МА) (показано на Фиг. 5) была самой высокой в опыте 4 (ИЭП В, 20 мМ CaCl2), и в контрольном опыте с использованием только кальция (опыт 8). Прочность сгустка (МА) была аналогична этой величине для опыта 6 (тромбин, 20 мМ CaCl2) и опыта 3 (ИЭП А, 20 мМ CaCl2), хотя плотность сгустка оказалась более непостоянной в опыте 3. В общем, добавление ионов кальция в процессе активации приводило к получению продукта со сгустками, имеющими механическую прочность выше, чем получаемая в процессах активации с использованием только тромбина, без добавленного кальция. В качестве дополнительного примера, на Фиг. 6 изображены кривые ТЭГ, изображающие механическую прочность сгустков (МА), наблюдаемые во времени для одного из добровольцев.
В отношении этих результатов и суммируя, повторное кальцифицирование обработанной антикоагулянтом ОТП с использованием 20 мМ CaCl2 приводит к расчетной концентрации свободного Са++, составляющей 5 мМ (рассчитанная исходя из полной константы связывания между цитратом и ионами кальция) и приводит к тромбинообразованию, что подтверждается выработкой F1.2 и образованием сгустка, прочность которого (модуль упругости, полученный из максимальной амплитуды ТЭГ) была больше этой величины для сгустков, образованных после прямого добавления тромбина. Добавление обработки ИЭП А или ИЭП В сразу после повторного кальцифицирования ОТП с использованием 20 мМ CaCl2 сокращало время, требующееся для инициации свертывания и все еще приводило к сгусткам, которые были такими же прочными (ИЭП А, 20 мМ CaCl2) или прочнее (ИЭП В, 20 мМ CaCl2), чем сгустки, получаемые при использовании тромбина, 20 мМ CaCl2. Таким образом, прочность тромбоцитарных гелей, образованных с 20 мМ CaCl2 и ИЭП А и ИЭП В позволяет манипулировать материалом и его размещением на ране. Когда ОТП с добавлением 2,5 мМ CaCl2 (расчетное значение свободных Са++, составляющее 90 мкМ) стимулировали ИЭП А или ИЭП В, сгустки не образовывались, что делает эти условия непригодными для приготовления тромбоцитарных гелей для заживления ран, но позволяет легко отделить высвобождающиеся факторы.
В отношении аспекта тромбинообразования для этих результатов, текущие результаты большего количества F1.2 в присутствии только высокого содержания кальция по сравнению с тромбином с низким или высоким содержанием кальция предполагают, что добавление кальция без тромбина способствует образованию фактора Ха (который вовлекается в активацию тромбина из протромбина), вероятно через путь тканевого фактора. ИЭП А и ИЭП В в присутствии высокого содержания кальция дают количество F1.2, которое больше, чем получаемое прямым добавлением бычьего тромбина, но меньше, чем получаемое только при высоком содержании кальция, в связи с чем можно предположить, что активированная кальцием выработка фактора Ха менее эффективна в присутствии ИЭП А и ИЭП В, но она больше, чем в присутствии низкого или высокого содержания кальция и тромбина.
Дифференциальное выявление маркеров альфа гранул и Т гранул тромбоцитов Результаты этой части исследования показаны в таблицах 3 и 4. Исследования с маркерами альфа гранул и Т гранул тромбоцитов, как показано в таблице 3, показывают, что более 80% тромбоцитов были положительными по отношению к Р-селектину, мембранному белку альфа гранул тромбоцитов, в опытах 5 и 6 (тромбин с 2,5 мМ или 20 мМ CaCl2), а также в опытах 1 и 3 (т.е. ИЭП А, 2,5 мМ или ИЭП А 20 мМ CaCl2), в то время как более низкая процентная доля (53,5±33, среднее значение ± СО) тромбоцитов было положительно в отношении Р-селектина в опыте 4 (ИЭП В, 20 мМ CaCl2). Использование только высокого содержания кальция (опыт 8) приводит к умеренному увеличению положительных в отношении Р-селектина тромбоцитов по сравнению с оптыом 2 (ИЭП В, 2,5 мМ CaCl2) и с контрольным опытом без кальция (опыт 7). Средняя интенсивность флуоресценции (СИФ) Р-селектина на частицу при обработке ИЭП была ниже, чем наблюдалась в случаях с тромбином и низким или высоким содержанием CaCl2.
Содержание толл-подобного рецептора 9 (TLR9) на поверхности тромбоцитов было наивысшим в опыте 5 (тромбин, 2,5 мМ CaCl2). Более низкое содержание TLR9 и сильно меняющееся количество TLR9 наблюдали в опыте 4 (ИЭП В, и незначительное выявление TLR9 наблюдали в опытах 1 и 3 (ИЭП А, 2,5 мМ CaCl2 и ИЭП А 20 мМ CaCl2) и в контрольных опытах без кальция и только с высоким содержанием кальция (опыты 7 и 8). В целом, в то время как количество TLR9 было меньше, чем количество Р-селектина, закономерность выявления TLR9 не заметно отличалась от того, что наблюдали для Р-селектина. Напротив, закономерность выявления PDI была уникальна в том, что наибольшее количество наблюдали в опыте 6 (тромбин, 20 мМ CaCl2), вместо опыта 5 (тромбин, 2,5 мМ CaCl2).

* р<0,05 относительно тромбина, 20 мМ CaCl2;


* р<0,05 относительно тромбина, 20 мМ CaCl2;

Обращаясь к таблице 4, высвобождение Т гранул также оценивали посредством высвобождения PDI в надосадочные жидкостиобработанных образцов ОТП, измеренного ELISA. Количество PDI было наибольшим в надосадочных жидкостях опыта 1, где ОТП была активирована ИЭП А и 2,5 мМ CaCl2, тогда как количество вблизи или ниже предела обнаружения регистрировали при анализе образцов, обработанных тромбином (опыты 5 и 6). Это противоречит содержанию PDI на поверхности тромбоцитов, измеренному проточной цитометрией, которое было наибольшим в опыте 6 (тромбин, 20 мМ CaCl2). Таким образом, проявляется различие условий активации в отношении свободного по сравнению с поверхностно-связанноым PDI Что интересно, количество растворимого PDI наилучшим образом коррелировало с количеством высвобождаемого EGF (r=0,566, p=0,0001).
Дифференциальное выявление гранул тромбоцитов и факторов роста Результаты этой части исследования показаны в таблицах 5 и 6. Количество факторов роста, высвобождаемых при каждых условиях обработки изменялось в широких пределах, но общая закономерность для фактора 4 тромбоцитов (PF4), тромбоцитарного фактора роста (PDGF) и фактора роста сосудистого эндотелия (VEGF), высвобождаемых при обработке, была аналогичной.
Более конкретно, относительная способность условий обработки к увеличению количества PF4, PDGF и VEGF в надосадочных жидкостях ОТП была следующей, от наибольшей к наименьшей: опыт 6 (тромбин, 20 мМ CaCl2) ≈ опыт 5 (тромбин, 2,5 мМ CaCl2) > опыт 4 (ИЭП В, 20 мМ CaCl2) ≈ опыт 1 (ИЭП А, 2,5 мМ CaCl2) > опыт 2 (ИЭП А, 20 мМ CaCl2) > опыт 8 (только 20 мМ CaCl2) > опыт 2 (ИЭП В, 2,5 мМ CaCl2) ≈ опыт без кальция. Эти относительные соотношения графически изображены на Фиг. 7, 8 и 9 (а также на Фиг. 10, обсуждаемом ниже), отдельные результаты показаны наряду со средним значением и СОС. Результаты ниже предела обнаружения анализом указаны на нижнем пределе обнаружения.

* р<0,05 относительно тромбина, 20 мМ CaCl2;

Напротив, условия, которые приводили к высвобождению EGF, от большего к меньшему, были следующими: опыт 1 (ИЭП А, 2,5 мМ CaCl2) ≈ опыт 3 (ИЭП А, 20 мМ CaCl2) ≈ опыт 6 (тромбин, 20 мМ CaCl2) ≈ опыт 5 (тромбин, 2,5 мМ CaCl2) ≈ опыт 4 (ИЭП В, 20 мМ CaCl2) ≈ опыт 8 (только высокое содержание кальция)>опыт 2 (ИЭП В, 2,5 мМ CaCl2) ≈ опыт 7 (без кальция). Эти результаты графически изображены на Фиг. 10. Следовательно, уровни PF4, PDGF и VEGF хорошо коррелировали друг с другом, в то время как уровни EGF не коррелировали с PF4, PDGF и VEGF, как показано в таблице 6 в виде корреляционной матрицы факторов роста с соответствующими коэффициентами (r) (верхнее число) и связанной с ними вероятностью (значения р) (нижнее число).
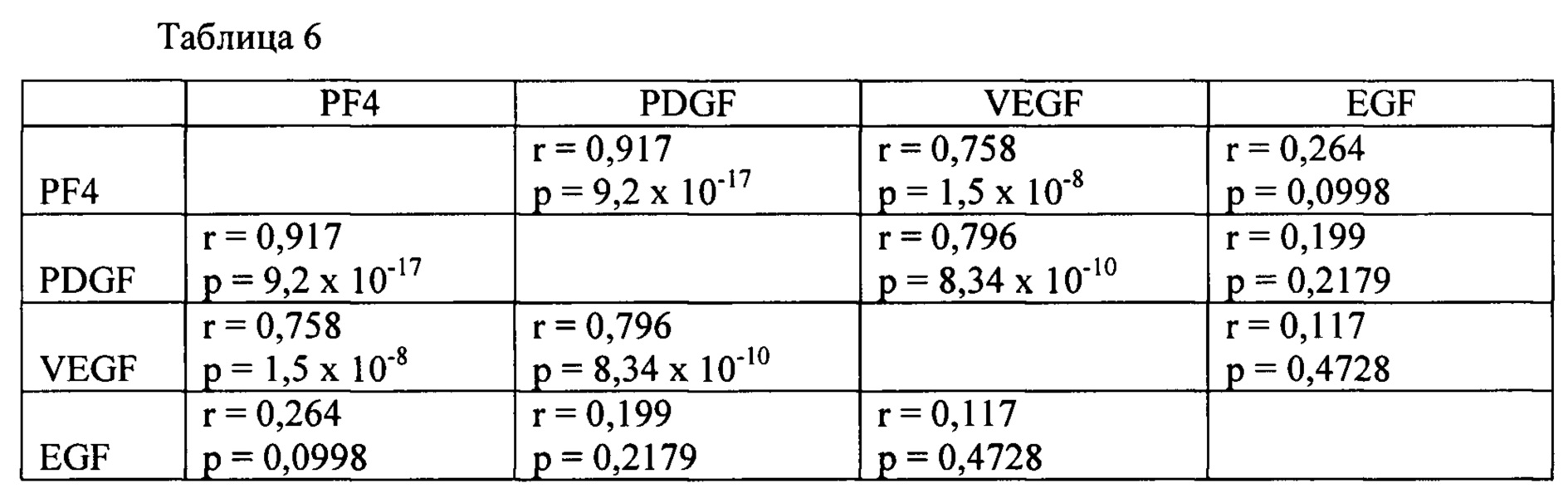
В отношении этих результатов и суммируя, несмотря на то, что при условиях ИЭП А, 2,5 мМ CaCl2 не удалось получить сгусток, эти условия все же приводили к значительному росту процентной доли Р-селектин положительных тромбоцитов и заметному высвобождению PF4, PDGF и VEGF и наиболее высокому содержанию высвобождаемого EGF по сравнению с другими условиями. Напротив, условия ИЭП В, 2,5 мМ CaCl2 не приводили к существенному увеличению содержания Р-селектина, TLR9, PDI и любого из факторов роста по сравнению с буферным раствором. В ОТП, в которую добавляли 20 мМ CaCl2, как ИЭП А, так и ИЭП В увеличивали содержание в плазме маркера альфа гранул, Р-селектина, в большей степени, чем в случае добавления только 20 мМ CaCl2, но в меньшей степени, чем в случае тромбина, 20 мМ CaCl2. Уровни PF4, PDGF и VEGF, но не EGF коррелировали с высвобождением альфа гранул тромбоцитов, как показало выявление Р-селектина на поверхности тромбоцитов (СИФ) и с высвобождением Т-гранул, как показало наличие TLR9 на поверхности тромбоцитов, в то время как уровни EGF, но не PF4, PDGF и VEGF, коррелировали с уровнем PDI в надосадочной жидкости после активации. Таким образом, закономерность высвобождения EGF отличается от закономерности высвобождения PF4, PDGF и VEGF, из чего можно предположить, что распределение EGF внутри тромбоцитов также отличается от распределения этих других факторов. Возможные причины корреляции высвобождения растворимой PDI и растворимого EGF включают совместную локализацию в выбранных гранулах тромбоцитов или локализацию в различных гранулах, высвобождение которых инициируется схожими стимулами. Повышенное высвобождение EGF под действием ИЭП А может быть полезным в клинических ситуациях, учитывая то, что EGF является важным для стадии эпителизации при заживлении раны.
Учитывая вышеизложенное, можно создать активированный тромбоцитарный продукт, который отвечает требованиям заказчика не только в отношении присутствующих факторов роста и их относительных долей, но также и в показателях наличия или отсутствия свертывания и/или времени образования сгустков. То есть, с точки зрения описанных здесь результатов свертывания, можно понять, что наличие свертывания или время до начала образования сгустков можно оптимизировать в сочетании с высвобождением факторов роста. Например, ИЭП А и ИЭП В в сочетании с высоким содержанием Са++ (20 мМ CaCl2) приводит к большему высвобождению всех исследованных выше факторов роста, чем в контрольном образце, хотя в различных относительных долях. Кроме того, как видно из приведенных выше результатов, ИЭП А в сочетании с низким содержанием Са++ (2,5 мМ CaCl2) дает активированный продукт, который не свертывается, но в котором высвобождаются все исследуемые факторы роста. Напротив, ИЭП В в сочетании с низким содержанием Са++ дает активированный продукт, которые не свертывается и в котором заметно не высвобождаются исследуемые факторы роста. Следовательно, подходящие сочетания электростимуляции и добавляемого Са можно использовать для регулирования и/или подбора количества высвобождаемых факторов роста и времени свертывания; когда свертывание не требуется, подходящие сочетания электростимуляции и добавляемого Са можно использовать для высвобождения факторов роста в требуемом количестве - высокая степень высвобождения или низкая степень высвобождения.
Сводные и дополнительные результаты по добавлению Са и условиям электростимуляции
Для дополнительного подтверждения вышеприведенного обсуждения и результатов дополнительный набор данных, показывающих диапазон условий электростимуляции и концентрации ионов кальция наряду с наблюдаемым временем свертывания, прочностью сгустка, высвобождением факторов роста и гемолизом представлен в таблице 7. Как показано в этом дополнительном примере, концентрацию ионов кальция и электрические параметры можно совместно варьировать, чтобы получить диапазон откликов по различным целевым параметрам (например, время свертывания, прочность сгустка, высвобождаемый фактор роста (для многих, независимо управляемых факторов роста), гемолиз и т.д.). Таким путем многочисленные характеристики активированного продукта можно задавать посредством тщательного выбора одного или более параметров из концентрации ионов кальция и/или одного или более параметров электрического импульса.
Например, как видно из таблицы 7, образцы 2, 3, 4 и 5 подвергали электростимуляции одинакового типа, но они имели различное содержание добавленного кальция. Время свертывания может варьироваться, в зависимости от количества добавленного Са, от 10,2 мин до 17,4 мин; для одной концентрации Са свертывания не происходило. Это предоставляет средство регулирования для этих образцов свертывания/отсутствия свертывания и дополнительно фактического времени свертывания просто посредством регулирования концентрации Са. По мере увеличения количества добавляемого кальция содержание высвобождаемого EGF в этих образцах 2, 3, 4 и 5 возрастало, что предоставляет средство для настройки высвобождения факторов роста посредством регулирования содержания Са, при сохранении в этом случае одного и того же типа электростимуляции. Аналогично можно регулировать уровень гемолиза.
Таким образом, как показано в таблице 7, множество различных электрических свойств и параметров импульса можно изменять в сочетании с концентрацией ионов кальция для достижения различного времени свертывания и прочности при сохранении регулирования уровней высвобождения отдельных факторов роста и гемолиза.
Технические результаты изобретения включают создание активированного тромбоцитарного продукта, в котором регулируют один или более параметров из наличия или отсутствия сгустков, времени образования сгустков (если они присутствуют) и/или механической прочности сгустков (если они присутствуют) посредством присутствия ионов кальция или их концентрации в процессе активации. Концентрацию ионов кальция регулируют или уточняют в присутствии импульсных электрических полей или химического активатора (например, тромбина) в процессе активации.


В этом описании используют примеры, чтобы раскрыть изобретение, включая наилучший режим его реализации, а также чтобы дать возможность любому специалисту в данной области техники реализовать изобретение на практике, включая изготовление и использование любых устройств или систем и выполнение всех включенных способов. Область защиты изобретения определена в формуле изобретения и может включать другие примеры, которые очевидны для специалистов в данной области техники. Эти другие примеры попадают в область защиты, определяемую формулой изобретения, если они имеют структурные элементы, которые не отличаются от элементов, буквально указанных в формуле изобретения, или если они включают эквивалентные структурные элементы, незначительно отличающиеся от буквального изложения в формуле изобретения.
Если любой пункт формулы изобретения, приложенный в конце этого описания, содержит один или более элементов, обозначенных как «средство выполнения функции…» или «стадия для выполнения функции…», такие элементы следует интерпретировать согласно 35 U.S.С.112(f). Однако, для любого пункта формулы, содержащего элементы, обозначенные любым другим образом, такие элементы не следует интерпретировать согласно 35 U.S.С.112(f).
Реферат
Группа изобретений относится к фармацевтической промышленности, а именно к способам ex-vivo получения активированного образца обогащенной тромбоцитами плазмы и к способу получения тромбоцитарного геля с заданной механической прочностью сгустков в тромбоцитарном геле. Способ ex-vivo получения активированного образца обогащенной тромбоцитами плазмы (ОТП) включает: получение образца обогащенной тромбоцитами плазмы для активации, добавление в полученный образец ОТП ионов кальция в концентрации, которую выбирают исходя из заданных параметров в активированном образце ОТП, выбранных из времени образования сгустка и/или механической прочности сгустков; размещение образца ОТП между электродами устройства для электромагнитной стимуляции; установление набора параметров электрического импульса исходя из указанной концентрации ионов кальция и указанных заданных параметров активированного образца ОТП и воздействие на образец ОТП с добавленными ионами кальция одним или более электрическими импульсами, генерируемыми в соответствии с установленными значениями параметров электрического импульса, с получением активированного образца ОТП, содержащего один или более факторов роста и имеющего указанные заданные параметры (варианты). Способ получения тромбоцитарного геля с заданной механической прочностью сгустков в тромбоцитарном геле, где заданная механическая прочность сгустков больше прочности, наблюдаемой в случае образования тромбоцитарного геля с использованием только тромбина, где способ включает: выбор концентрации ионов кальция исходя из заданной механической прочности сгустков в тромбоцитарном геле; образование тромбоцитарного геля посредством активации образца обогащенной тромбоцитами плазмы, содержащего ионы кальция в выбранной концентрации, где образец ОТП активируют с использованием электростимуляции с получением тромбоцитарного геля, содержащего сгустки, имеющие заданную механическую прочность. Вышеописанная группа решений позволяет создать активированный тромбоцитарный продукт, в котором регулируют один или более параметров из наличия или отсутствия сгустка, времени образования сгустков (если они присутствуют) и/или механической прочности сгустков (если они присутствуют) посредством присутствия ионов кальция или их концентрации в процессе активации. 3 н. и 15 з.п. ф-лы, 7 табл., 10 ил.

Комментарии