Клетка - RU2768019C2
Код документа: RU2768019C2
Чертежи














Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к клетке, которая содержит более чем один химерный рецептор антигена (CAR).
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Для применения в лечении рака был описан ряд иммунотерапевтических агентов, в том числе терапевтические моноклональные антитела (мАт), иммуноконъюгированные мАт, радиоконъюгированные мАт и биспецифические рекрутеры Т-клеток.
Как правило, мишенью этих иммунотерапевтических агентов является один антиген: например, мишенью ритуксимаба является CD20; мишенью миелотарга является CD33; а мишенью алемтузумаба является CD52.
Антиген CD19 человека представляет собой трансмембранный гликопротеин с М.м. 95 кДа, относящийся к суперсемейству иммуноглобулинов. CD19 экспрессируется в самом начале дифференцировки В-клеток и исчезает только при конечной дифференциации В-клеток в плазматические клетки. Следовательно, CD19 экспрессируется во всех В-клеточных злокачественных опухолях кроме множественной миеломы. Поскольку утрата нормального В-клеточного компартмента является приемлемой токсичностью, CD19 является привлекательной мишенью CAR, и клинические исследования, в которых CD19 является мишенью CAR, достигли обнадеживающих результатов.
Особая проблема в области онкологии предусматривается гипотезой Голди-Колдмена, которая гласит, что выбор в качестве единственной мишени одного антигена (единственное таргетирование одного антигена) может привести к ускользанию опухоли в результате модуляции указанного антигена из-за высокой частоты мутаций, присущей большинству видов рака. Эта модуляция экспрессии антигена может уменьшить эффективность известных иммунотерапевтических средств, в том числе тех, мишенью которых является CD19.
Таким образом, проблема с иммунотерапевтическими средствами против CD19 заключается в том, что B-клеточная злокачественная опухоль может мутировать и стать CD19-негативной. Это может привести к рецидиву с развитием CD19-негативных раков, которые не реагируют на терапию против CD19. Например, в одном исследовании в педиатрии Grupp et al. сообщили, что половина всех рецидивов после терапии с использованием химерного рецептора антигена против CD19 для лечения В-клеточного острого лимфобластного лейкоза (В-ALL) была связана с CD19-негативным заболеванием (56th American Society of Hematology Annual Meeting and Exposition).
Таким образом, существует потребность в иммунотерапевтических агентах, которые способны к таргетированию более чем одной структуры клеточной поверхности, чтобы отразить сложный характер экспрессии маркеров, который связан со многими видами рака, в том числе CD19-позитивными раками.
Химерные рецепторов антигенов (CAR)
Химерные рецепторы антигенов представляют собой белки, которые прививают специфичность, например, моноклонального антитела (мАт) эффекторной функции Т-клеток. Их обычной формой является таковая содержащего трансмембранный домен типа I белка с распознающим антиген амино-концом, спейсером, трансмембранным доменом, все из которых связаны с составным эндодоменом, который передает сигналы выживания и активации Т-клеток (смотрите фиг. 1А).
Самой распространенной формой этих молекул являются слияния одноцепочечных вариабельных фрагментов (scFv), полученных из моноклональных антител, которые распознают антиген-мишень, слитых через спейсер и трансмембранный домен с передающим сигналы эндодоменом. Такие молекулы приводят к активации Т-клеток в ответ на распознание scFv своей мишени. Когда Т-клетки экспрессируют такойCAR, они распознают и убивают клетки-мишени, которые экспрессируют антиген-мишень. Было разработано несколькоCAR против ассоциированных с опухолями антигенов, и методы адоптивного переноса с использованием таких экспрессирующих CAR Т-клеток проходят в настоящее время клиническое испытание в отношении лечения различных видов рака.
Было замечено, что при использовании метода с применением CAR для лечения рака, гетерогенность и иммуноредактирование опухолей может вызвать ускользание от лечения CAR. Например, в исследовании, описанном Grupp et al. (2013; New Eng. J. Med 368:1509-1518, paper No 380, ASH 2014), был использован метод с применением CAR-модифицированных Т-клеток для лечения острого В-лимфоцитарного лейкоза. В этом клиническом испытании было установлено, что 10 больных с полной ремиссией после одного месяца перенесли рецидив, и 5 из них перенесли рецидив с развитием CD19-негативного заболевания.
Таким образом, существует потребность в альтернативных подходах к лечению CAR, которые учитывают проблемы ускользания рака и гетерогенности опухолей.
Экспрессия двух специфичностей связывания CAR
Биспецифические CAR, известные как тандемные CAR или TanCAR, были разработаны в попытке таргетирования множества специфических для рака маркеров одновременно. В TanCAR, экстраклеточный домен содержит две специфичности связывания антигенов в тандеме, соединенные с помощью линкера. Обе из двух специфичностей связывания (scFv), таким образом, связаны с одной трансмембранной частью: при этом один scFv располагается рядом с мембраной, а другой находится в отдаленном (дистальном) положении.
Grada et al. (2013, Mol Ther Nucleic Acids 2:e105) описывают TanCAR, который включает CD19-специфический scFv, за которым следует линкер Gly-Ser, а затем HER2-специфический scFv. HER2-scFv находился в положении около мембраны, а CD19-scFv - в отдаленном положении. Было установлено, что TanCAR индуцирует отличную Т-клеточную реактивность против каждого из двух рестриктированных опухолью антигенов. Такое расположение было выбрано потому, что соответствующие длины HER2 (632 аа/125Å) и CD19 (280aa, 65Å) являются подходящими для этой конкретной пространственной организации. Было также известно, что HER2-scFv связывается с 4 самими дистальными петлевыми участками HER2.
Проблема с этим подходом заключается в том, что расположенный около мембраны scFv может быть недоступным из-за присутствия дистального scFv, особенно такого, который связан с антигеном. Ввиду необходимости выбора относительных положений двух scFv, с учетом пространственного расположения антигена на клетке-мишени, может быть невозможным использование этого подхода для всех связывающих пар scFv. Кроме того, маловероятно, что подход с использованием TanCar может быть использован для более чем двух scFv, TanCAR с тремя или более scFv был бы очень большой молекулой, и scFv могут также складываться назад друг на друга, скрывая антигенсвязывающие сайты. Также сомнительно, что связывание антигена самым дистальным scFv, который отделен от трансмембранного домена двумя или более дополнительными scFv, будет способно запустить активацию Т-клеток.
Таким образом, существует необходимость в альтернативном подходе к экспрессии двух специфичностей связывания CAR на поверхности клетки, такой как Т-клетка.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения разработали CAR+ T-клетку, которая экспрессирует два CAR на клеточной поверхности, один специфический для CD19 и один специфический для CD22.
Таким образом, в первом аспекте настоящее изобретение относится к клетке, которая коэкспрессирует первый химерный рецептор антигена (CAR) и второй CAR на клеточной поверхности, при этом каждый CAR включает антигенсвязывающий домен, причем антигенсвязывающий домен первого CAR связывается с CD19, а антигенсвязывающий домен второго CAR связывается с CD22.
Тот факт, что один CAR связывается с CD19, а другой CAR связывается с CD22, является преимуществом, поскольку некоторые лимфомы и лейкозы становятся CD19-негативными после таргетирования CD19, (или, возможно, CD22-негативными после таргетирования CD22), так что это дает «запасной» антиген, если это происходят.
Клетка может быть иммунной эффекторной клеткой, такой как Т-клетка или клетка-природный киллер (NK). Характеристики, упомянутые здесь в связи с Т-клеткой, в равной степени применимы к другим иммунным эффекторным клеткам, таким как клетки NK.
Каждый CAR может включать:
(i) антигенсвязывающий домен;
(ii) спейсер и
(iii) трансмембранный домен.
Каждый CAR может включать:
(i) антигенсвязывающий домен;
(ii) спейсер;
(iii) трансмембранный домен;
(iv) эндодомен.
Спейсер первого CAR может отличаться от спейсера второго CAR, так что первый и второй CAR не образуют гетеродимеры.
Спейсер первого CAR может иметь длину и/или конфигурацию, отличную от таковой спейсера второго CAR, так что каждый CAR адаптирован для распознания соответствующего ему антигена-мишени.
Антигенсвязывающий домен второго CAR может связываться с отдаленным от мембраны эпитопом CD22. Антигенсвязывающий домен второго CAR может связываться с эпитопом в Ig-домене 1, 2, 3 или 4 CD22, например, в Ig-домене 3 CD22.
Антигенсвязывающий домен первого CAR может связываться с эпитопом в CD19, который кодируется экзоном 1, 3 или 4.
Эндодомен одного CAR может включать костимулирующий домен и ITAM-содержащий домен; а эндодомен другого CAR может включать домен семейства рецепторов TNF и ITAM-содержащий домен.
Например, один CAR (который может быть CD19- или CD22- специфическим) может иметь структуру:
AgB1-spacer1-TM1-costim-ITAM,
где:
AgB1 представляет собой антигенсвязывающий домен;
spacer1 представляет собой спейсер;
TM1 представляет собой трансмембранный домен;
costim представляет собой костимулирующий домен; и
ITAM представляет собой ITAM-содержащий эндодомен;
а другой CAR (который может быть CD22- или CD19-специфическим) может иметь структуру:
AgB2-spacer2-TM2-TNF-ITAM,
где
AgB2 представляет собой антигенсвязывающий домен;
spacer2 представляет собой спейсер;
TM2 представляет собой трансмембранный домен;
TNF представляет собой эндодомен рецептора TNF; и
ITAM представляет собой ITAM-содержащий эндодомен.
Во втором аспекте настоящее изобретение относится к последовательности нуклеиновой кислоты, кодирующей как первый, так и второй химерные рецепторы антигенов (CAR), которые определены в первом аспекте настоящего изобретения.
Последовательность нуклеиновой кислоты может иметь следующую структуру:
AgB1-spacer1-TM1-coexpr-AbB2-spacer2-ТМ2,
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR;
coexpr представляет собой последовательность нуклеиновой кислоты, которая делает возможной коэкспрессию обоих CAR;
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR;
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR;
при этом указанная последовательность нуклеиновой кислоты, при экспрессии в Т-клетке, кодирует полипептид, который расщепляется в сайте расщепления таким образом, что первый и второй CAR совместно представлены на поверхности Т-клетки.
Последовательность нуклеиновой кислоты может иметь следующую структуру:
AgB1-spacer1-TM1-endo1-coexpr-AbB2-spacer2-TM2-endo2,
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR;
endo1 представляет собой последовательность нуклеиновой кислоты, кодирующую эндодомен первого CAR;
coexpr представляет собой последовательность нуклеиновой кислоты, которая делает возможной коэкспрессию обоих CAR;
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR;
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR;
endo2 представляет собой последовательность нуклеиновой кислоты, кодирующую эндодомен второго CAR;
при этом указанная последовательность нуклеиновой кислоты, при экспрессии в Т-клетке, кодирует полипептид, который расщепляется в сайте расщепления таким образом, что первый и второй CAR совместно представлены на поверхности Т-клетки.
Последовательность нуклеиновой кислоты, которая делает возможной коэкспрессию обоих CAR, может кодировать саморасщепляющийся пептид или последовательность, которая допускает альтернативные средства коэкспрессии двух CAR, такую как внутренний сайт связывания рибосом или второй промотор или другие подобные средства, при помощи которых квалифицированный в данной области техники специалист может экспрессировать два белка с одного и того же вектора.
Альтернативные кодоны могут быть использованы в районах последовательности, кодирующих одинаковые или схожие аминокислотные последовательности, такие как трансмембранный и/или внутриклеточный, передающий сигналы в Т-клетку домен (эндодомен), во избежание гомологичной рекомбинации. Например, альтернативные кодоны могут быть использованы в тех частях последовательности, которые кодируют спейсер, трансмембранный домен и/или весь или часть эндодомена, так что два CAR имеют одинаковые или схожие аминокислотные последовательности для этой или этих частей, но кодируются различными последовательностями нуклеиновых кислот.
В третьем аспекте настоящее изобретение относится к набору, который включает
(i) первую последовательность нуклеиновой кислоты, кодирующую первый химерный рецептор антигена (CAR), при этом эта последовательность нуклеиновой кислоты имеет следующую структуру:
AgB1-spacer1-TM1
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR; и
(ii) вторую последовательность нуклеиновой кислоты, кодирующую второй химерный рецептор антигена, при этом последовательность нуклеиновой кислоты имеет следующую структуру:
AgB2-spacer2-ТМ2
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR; и
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR.
Набор может включать
(i) первую последовательность нуклеиновой кислоты, кодирующую первый химерный рецептор антигена (CAR), при этом эта последовательность нуклеиновой кислоты имеет следующую структуру:
AgB1-spacer1-TM1-endo1
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR;
endo1 представляет собой последовательность нуклеиновой кислоты, кодирующую эндодомен первого CAR; и
(ii) вторую последовательность нуклеиновой кислоты, кодирующую второй химерный рецептор антигена (CAR), при этом эта последовательность нуклеиновой кислоты имеет следующую структуру:
AgB2-spacer2-ТМ2-endo2,
где
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR;
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR;
endo2 представляет собой последовательность нуклеиновой кислоты, кодирующую эндодомен второго CAR.
В четвертом аспекте настоящее изобретение относится к набору, включающему: первый вектор, который включает первую последовательность нуклеиновой кислоты; и второй вектор, который включает вторую последовательность нуклеиновой кислоты.
Векторы могут быть плазмидными векторами, ретровирусными векторами или векторами на основе транспозонов. Векторы могут быть лентивирусными векторами.
В пятом аспекте настоящее изобретение относится к вектору, включающему последовательность нуклеиновой кислоты в соответствии со вторым аспектом настоящего изобретения. Вектор может быть лентивирусным вектором.
Вектор может представлять собой плазмидный вектор, ретровирусный вектор или вектор на основе транспозона.
В шестом аспекте настоящее изобретение относится к способу получения клетки в соответствии с первым аспектом настоящего изобретения, который включает стадию введения одной или более последовательностей нуклеиновых кислот, кодирующей(их) первый и второй CAR; или одного или более векторов, определенных выше, в Т-клетку.
Клетка может быть из образца, выделенного из пациента, донора родственного или неродственного гемопоэтического трансплантата, совершенно не связанного донора, из пуповинной крови, подвергнутой дифференцировке от линии эмбриональных клеток, подвергнутой дифференцировке от линии индуцируемых клеток-предшественников или полученной из линии трансформированных клеток.
В седьмом аспекте настоящее изобретение относится к фармацевтической композиции, включающей множество клеток в соответствии с первым аспектом настоящего изобретения.
В восьмом аспекте настоящее изобретение относится к способу лечения и/или профилактики заболевания, который включает стадию введения пациенту фармацевтической композиции в соответствии с седьмым аспектом настоящего изобретения.
Способ может включать следующие стадии:
(i) выделение содержащего клетки образца из пациента;
(ii) трансдукцию или трансфекцию клеток одной или более последовательностей нуклеиновых кислот, кодирующей(их) первый и второй CAR, или одним или более векторов, включающим(их) такую последовательность(и) нуклеиновой кислоты; и
(iii) введение пациенту клеток из (ii).
Заболеванием может быть рак. Рак может представлять собой В-клеточную злокачественная опухоль.
В девятом аспекте настоящее изобретение относится к фармацевтической композиции в соответствии с седьмым аспектом настоящего изобретения для применения в лечении и/или профилактике заболевания.
В десятом аспекте настоящее изобретение относится к применению клетки в соответствии с первым аспектом настоящего изобретения в получении лекарственного средства для лечения и/или профилактики заболевания.
Настоящее изобретение также относится к последовательности нуклеиновой кислоты, которая включает:
a) первую нуклеотидную последовательность, кодирующую первый химерный рецептор антигена (CAR);
b) вторую нуклеотидную последовательность, кодирующую второй CAR;
причем один CAR связывается с CD19, а другой CAR связывается с CD22; и
c) последовательность, кодирующую саморасщепляющийся пептид, расположенный между первой и второй нуклеотидными последовательностями таким образом, что два CAR экспрессируются в виде отдельных объектов.
Альтернативные кодоны могут быть использованы в одной или более частей первой и второй нуклеотидных последовательностей в тех районах, которые кодируют одинаковую или схожую аминокислотную последовательность(и).
Настоящее изобретение также относится к вектору и клетке, содержащим такую нуклеиновую кислоту.
Авторы настоящего изобретения также разработали новые CAR против CD19 и CD22 с улучшенными свойствами.
Таким образом, в одиннадцатом аспекте, настоящее изобретение относится к химерному рецептору антигена (CAR), включающему CD19-связывающий домен, который включает
a) вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность (гипервариабельные) участки (CDR) со следующими последовательностями:
CDR1 - SYWMN (SEQ ID NO:15);
CDR2 - QIWPGDGDTNYNGKFK (SEQ ID NO:16);
CDR3 - RETTTVGRYYYAMDY (SEQ ID NO:17); и
b) вариабельную область легкой цепи (VL), содержащую CDR со следующими последовательностями:
CDR1 - KASQSVDYDGDSYLN (SEQ ID NO:18);
CDR2 - DASNLVS (SEQ ID NO:19);
CDR3 - QQSTEDPWT (SEQ ID NO:20).
CD19-связывающий домен может включать VH-домен, имеющий последовательность, представленную как SEQ ID NO:23 или SEQ ID NO:24; или VL-домен, имеющий последовательность, представленную как SEQ ID NO:25, SEQ ID NO:26 или SEQ ID NO:40, или его вариант, идентичный по последовательности на по меньшей мере 90%, который сохраняет способность связываться с CD19.
CD19-связывающий домен может включать последовательность, представленную как SEQ ID NO:21, SEQ ID NO:22 или SEQ ID NO:39, или ее вариант, идентичный по последовательности на по меньшей мере 90%, который сохраняет способность связываться с CD19.
В двенадцатом аспекте настоящее изобретение относится к химерному рецептору антигена (CAR), включающему CD22-связывающий домен, который включает
a) вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность участки (CDR) со следующими последовательностями:
CDR1 - NYWIN (SEQ ID NO:27);
CDR2 - NIYPSDSFTNYNQKFKD (SEQ ID NO:28);
CDR3 - DTQERSWYFDV (SEQ ID NO:29); и
b) вариабельную область легкой цепи (VL), содержащую CDR со следующими последовательностями:
CDR1 - RSSQSLVHSNGNTYLH (SEQ ID NO:30);
CDR2 - KVSNRFS (SEQ ID NO:31);
CDR3 - SQSTHVPWT (SEQ ID NO:32).
CD22-связывающий домен может включать VH-домен, имеющий последовательность, представленную как SEQ ID NO:35 или SEQ ID NO:36; или VL-домен, имеющий последовательность, представленную как SEQ ID NO:37, или SEQ ID NO:38, или его вариант, идентичный по последовательности на по меньшей мере 90%, который сохраняет способность связываться с CD22.
CD22-связывающий домен может включать последовательность, представленную как SEQ ID NO:33 или SEQ ID NO:34, или ее вариант, идентичный по последовательности на по меньшей мере 90%, который сохраняет способность связываться с CD22.
В тринадцатом аспекте изобретение относится к клетке, которая экспрессирует химерный рецептор антигена в соответствии с одиннадцатым аспектом настоящего изобретения или химерный рецептор антигена в соответствии с двенадцатым аспектом настоящего изобретения на клеточной поверхности.
В четырнадцатом аспекте изобретение относится к последовательности нуклеиновой кислоты, кодирующей химерный рецептор антигена в соответствии с одиннадцатым аспектом настоящего изобретения или химерный рецептор антигена в соответствии с двенадцатым аспектом настоящего изобретения.
В пятнадцатом аспекте настоящее изобретение относится к вектору, включающему последовательность нуклеиновой кислоты в соответствии с четырнадцатым аспектом настоящего изобретения. Вектор может представлять собой лентивирусный вектор.
Вектор может представлять собой плазмидный вектор, ретровирусный вектор или вектор на основе транспозона.
В шестнадцатом аспекте настоящее изобретение относится к способу получения клетки в соответствии с тринадцатым аспектом настоящего изобретения, который включает стадию введения одной или более последовательностей нуклеиновых кислот или одного или более векторов, определенных выше, в клетку.
Клетка может представлять собой Т-клетку или клетку-природный киллер (NK). Клетка может быть из образца, выделенного из пациента, донора родственного или неродственного гемопоэтического трансплантата, совершенно не связанного донора, из пуповинной крови, подвергнутой дифференцировке от линии эмбриональных клеток, подвергнутой дифференцировке от линии индуцируемых клеток-предшественников или полученной из линии трансформированных клеток.
В семнадцатом аспекте настоящее изобретение относится к фармацевтической композиции, включающей множество клеток в соответствии с тринадцатым аспектом настоящего изобретения.
В восемнадцатом аспекте настоящее изобретение относится к способу лечения и/или профилактики заболевания, который включает стадию введения пациенту фармацевтической композиции в соответствии с семнадцатым аспектом настоящего изобретения.
Способ может включать следующие стадии:
(i) выделение содержащего клетки образца из пациента;
(ii) трансдукцию или трансфекцию клеток последовательностью нуклеиновой кислоты, кодирующей CAR, или вектором, включающим такую последовательность нуклеиновой кислоты; и
(iii) введение пациенту клеток из (ii).
Заболеванием может быть рак. Рак может представлять собой В-клеточную злокачественная опухоль.
В девятнадцатом аспекте настоящее изобретение относится к фармацевтической композиции в соответствии с семнадцатым аспектом настоящего изобретения для применения в лечении и/или профилактике заболевания.
В двадцатом аспекте настоящее изобретение относится к применению клетки в соответствии с тринадцатым аспектом настоящего изобретения в получении лекарственного средства для лечения и/или профилактики заболевания.
Изобретение также относится к клетке в соответствии с первым аспектом настоящего изобретения, которая содержит первый CAR, определенный в одиннадцатом аспекте настоящего изобретения, и второй CAR, определенный в двенадцатом аспекте настоящего изобретения.
Изобретение также относится к последовательности нуклеиновой кислоты в соответствии со вторым аспектом настоящего изобретения, кодирующей первый CAR, определенный в одиннадцатом аспекте настоящего изобретения, и второй CAR, определенный в двенадцатом аспекте настоящего изобретения.
Изобретение также относится к набору в соответствии с третьим аспектом настоящего изобретения, в котором первая последовательность нуклеиновой кислоты кодирует первый CAR, определенный в одиннадцатом аспекте настоящего изобретения, а вторая последовательностью нуклеиновой кислоты кодирует второй CAR, определенный в двенадцатом аспекте настоящего изобретения.
Изобретение также относится к вектору в соответствии с пятым аспектом настоящего изобретения, который включает последовательность нуклеиновой кислоты, кодирующую первый CAR, определенный в одиннадцатом аспекте настоящего изобретения, и второй CAR, определенный в двенадцатом аспекте настоящего изобретения.
Авторы настоящего изобретения также обнаружили, что в системе элементов «ИЛИ», характеристики улучшаются, если костимулирующий домен и домен, порождающий сигнал выживания, «разделены» между двумя (или более) CAR.
Таким образом, в двадцать первом аспекте изобретение относится к клетке, которая коэкспрессирует первый химерный рецептор антигена (CAR) и второй CAR на клеточной поверхности, при этом каждый CAR включает внутриклеточный, передающий сигналы домен, причем внутриклеточный, передающий сигналы домен первого CAR включает костимулирующий домен; а внутриклеточный, передающий сигналы домен второго CAR включает эндодомен семейства рецепторов TNF.
Костимулирующим доменом может быть костимулирующий домен CD28.
Эндодоменом семейства рецепторов TNF может быть, например, эндодомен ОХ-40 или 4-1ВВ.
Внутриклеточный, передающий сигналы домен первого и второго CAR может также включать ITAM-содержащий домен, например, эндодомен CD3 дзета.
Первый CAR может иметь структуру:
AgB1-spacer1-TM1-costim-ITAM,
где
AgB1 представляет собой антигенсвязывающий домен первого CAR;
spacer1 представляет собой спейсер первого CAR;
TM1 представляет собой трансмембранный домен первого CAR;
costim представляет собой костимулирующий домен; и
ITAM представляет собой ITAM-содержащий эндодомен.
Второй CAR может иметь структуру:
AgB2-spacer2-TM2-TNF-ITAM,
где
AgB2 представляет собой антигенсвязывающий домен второго CAR;
spacer2 представляет собой спейсер второго CAR;
TM2 представляет собой трансмембранный домен второго CAR;
TNF представляет собой эндодомен рецептораTNF; и
ITAM представляет собой ITAM-содержащий эндодомен.
Мишенью одного CAR из первого и второго CAR может быть CD19, а мишенью другого CAR может быть CD22.
В двадцать втором аспекте изобретение относится к последовательности нуклеиновой кислоты, кодирующей как первый, так и второй химерные рецепторы антигенов (CAR), определенные в двадцать первом аспекте настоящего изобретения.
Последовательность нуклеиновой кислоты может иметь следующую структуру:
AgB1-spacer1-TM1-costim-ITAM1-coexpr-AbB2-spacer2-TM2-TNF-ITAM2,
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR;
costim представляет собой последовательность нуклеиновой кислоты, кодирующую костимулирующий домен;
ITAM1 представляет собой последовательность нуклеиновой кислоты, кодирующую ITAM-содержащий эндодомен первого CAR;
coexpr представляет собой последовательность нуклеиновой кислоты, которая делает возможной коэкспрессию обоих CAR;
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR;
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR;
TNF представляет собой последовательность нуклеиновой кислоты, кодирующую эндодомен рецептора TNF;
ITAM2 представляет собой последовательность нуклеиновой кислоты, кодирующую ITAM-содержащий эндодомен второго CAR.
Когда последовательность нуклеиновой кислоты экспрессируется в клетке, она может кодировать полипептид, который расщепляется в сайте расщепления таким образом, что первый и второй CAR совместно представлены на клеточной поверхности.
В двадцать третьем аспекте изобретение относится к набору, который включает
(i) первую последовательность нуклеиновой кислоты, кодирующую первый химерный рецептор антигена (CAR), определенный в двадцать первом аспекта настоящего изобретения, при этом эта последовательность нуклеиновой кислоты имеет следующую структуру:
AgB1-spacer1-TM1-costim- ITAM1,
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR;
costim представляет собой последовательность нуклеиновой кислоты, кодирующую костимулирующий домен;
ITAM1 представляет собой последовательность нуклеиновой кислоты, кодирующую ITAM-содержащий эндодомен первого CAR; и
(ii) вторую последовательность нуклеиновой кислоты, кодирующую второй химерный рецептор антигена (CAR), определенный в двадцать первом аспекте настоящего изобретения, при этом эта последовательность нуклеиновой кислоты имеет следующую структуру:
AbB2-spacer2-ТМ2-TNF-ITAM2,
где
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR;
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR;
TNF представляет собой последовательность нуклеиновой кислоты, кодирующую эндодомен рецептора TNF; и
ITAM2 представляет собой последовательность нуклеиновой кислоты, кодирующую ITAM-содержащий эндодомен второго CAR.
В двадцать четвертом аспекте изобретение относится к вектору, включающему последовательность нуклеиновой кислоты в соответствии с двадцать вторым аспектом настоящего изобретения, или определенную в двадцать третьем аспекте настоящего изобретения.
В двадцать пятом аспекте изобретение относится к способу получения клетки в соответствии с двадцать первым аспектом настоящего изобретения, который включает стадию введения в клетку: последовательности нуклеиновой кислоты в соответствии с двадцать вторым аспектом настоящего изобретения; первой последовательности нуклеиновой кислоты и второй последовательности нуклеиновой кислоты, которые определены в двадцать третьем аспекте настоящего изобретения; или вектора в соответствии с двадцать четвертым аспектом настоящего изобретения.
В двадцать шестом аспекте настоящее изобретение относится к фармацевтической композиции, включающей множество клеток в соответствии с двадцать первым аспектом настоящего изобретения.
Изобретение также относится к способу лечения и/или профилактики заболевания, который включает стадию введения пациенту фармацевтической композиции в соответствии с двадцать шестым аспектом настоящего изобретения.
Изобретение также относится к фармацевтической композиции в соответствии с двадцать шестым аспектом настоящего изобретения для применения в лечении и/или профилактике заболевания.
Изобретение также относится к применению клетки в соответствии с двадцать первым аспектом настоящего изобретения в получении лекарственного средства для лечения и/или профилактики заболевания.
В случае одного CAR, мишенью которого является CD19, и одного CAR, мишенью которого является CD22, возможно таргетирование каждого из этих маркеров с уменьшением тем самым проблемы ускользания рака.
Поскольку CAR экспрессируются на поверхности клетки в виде отдельных молекул, этот подход преодолевает пространственные проблемы и проблемы доступности, связанные с TanCAR. Эффективность активации клеток также увеличивается. Если каждый CAR имеет свой собственный спейсер, можно адаптировать спейсер, а, следовательно, расстояние, на которое связывающий домен выступает с поверхности клетки, и его гибкость и т.д. для конкретного антигена-мишени. Этот выбор является неограниченным конструктивными решениями, связанными с TanCAR, т.е. тем, что один CAR должен быть размещен рядом с мембраной Т-клетки, и один CAR должен быть дистальным, расположенным в тандеме с первым CAR.
В случае одной нуклеиновой кислоты, которая кодирует два CAR, разделенных сайтом расщепления, можно получить клетки, которые коэкспрессируют два CAR, используя простую процедуру единственной трансдукции. Процедура двойной трансфекции могла бы быть использована с кодирующими CAR последовательностями в отдельных конструкциях, но это было бы более сложным и дорогим и потребовало бы больше сайтов интеграции для нуклеиновых кислот. Процедура двойной трансфекции будет также сопровождаться неопределенностью относительно того, были ли обе кодирующие CAR нуклеиновые кислот трансдуцированы и экспрессированы эффективно.
CAR будут содержать участки высокой гомологии, например, трансмембранные и/или внутриклеточные, передающие сигналы домены, вероятно, будут в высокой степени гомологичными. Если одинаковые или схожие линкеры используются для двух CAR, то они также будут в высокой степени гомологичными. Это говорит о том, что подход, в котором оба CAR представлены в одной последовательности нуклеиновой кислоты, будет неподходящим из-за вероятности гомологичной рекомбинации между последовательностями. Однако авторы настоящего изобретения обнаружили, что при неоднозначном соответствии кодонов на участках последовательностей, кодирующих области высокой гомологии, можно экспрессировать два CAR с одной конструкции с высокой степенью эффективности. Неоднозначное соответствие кодонов включает в себя использование альтернативных кодонов на участках последовательности, кодирующих одинаковые или схожие аминокислотные последовательности.
ОПИСАНИЕ ФИГУР
Фиг. 1: а) Схема, иллюстрирующая классический CAR. (b)-(d): Различные поколения и перестановки эндодоменов CAR: (b) исходные конструкции передавали только ITAM-сигналы через эндодомен FcεR1-γ или CD3ζ, в то время как более поздние конструкции передавали дополнительный (с) один или (d) два костимулирующих сигнала по одному и тому же составному эндодомену.
Фиг. 2: Путь созревания В-клеток/В-клеточный онтогенез. DR=HLA-DR; cCD79=цитоплазматический CD79; cCD22=цитоплазматический CD22. Оба антигена CD19 и CD22 экспрессируются на ранних стадиях созревания В-клеток. Именно эти клетки развиваются в В-клеточные острые лейкозы. Одновременное таргетирование как CD19, так и CD22 наиболее подходит для целенаправленного воздействия на В-клеточные острые лейкозы.
Фиг. 3: Стратегии конструирования кассет CAR против CD19 ИЛИ CD22. Выбраны связующие элементы, которые распознают CD19, и связующие элементы, которые распознают CD22. Для каждого CAR выбран оптимальный спейсерный домен и передающий сигналы домен. (a) Конструируют кассету по схеме «ИЛИ», так что оба CAR коэкспрессируются, используя пептид FMD-2A. Любые гомологичные последовательности с неоднозначным соответствием кодонов во избежание гомологичной рекомбинации. (c) Два CAR коэкспрессируются в виде отдельных белков на поверхности Т-клеток.
Фиг. 4: Пример неоднозначного соответствия кодонов для допуска коэкспрессии в ретровирусном векторе идентичных пептидных последовательностей, но избегания гомологичной рекомбинации. Здесь HCH2CH3-CD28tmZeta дикого типа совмещен с HCH2CH3-CD28tmZeta с неоднозначным соответствием кодонов.
Фиг. 5: Демонстрация функциональности схемы CAR против CD19 «ИЛИ» CD22. (a) Рисунок конструкции: S1 - сигнальный пептид 1; HA - гемагглютиновая метка; HCH2CH3 - шарнирная область, СН2СН3 последовательности IgG1 дикого типа; CD28tmZ - трансмембранный домен CD28 и последовательность CD3-дзета с неоднозначным соответствием кодонов; 2A - 2A пептид ящура; S2 - сигнальный пептид 2; V5 - эпитопная метка v5; aCD22 - scFv против CD22; HCH2CH3' - шарнирная область, СН2СН3 последовательности IgG1 с неоднозначным соответствием кодонов; CD28tmZ - трансмембранный домен CD28 и последовательность CD3-дзета с неоднозначным соответствием кодонов; (b) Коэкспрессия двух рецепторов с одного вектора. Т-клетки периферической крови трансдуцировали бицистронным вектором после стимуляции с использованием OKT3 и анти-CD28. Клетки анализировали через пять дней после трансдукции путем окрашивания с использованием анти-V5-FITC (Invitrogen) и анти-HA-PE (Abcam). Два CAR могут быть обнаружены одновременно на поверхности Т-клеток, (с) Не трансдуцированные Т-клетки, Т-клетки, экспрессирующие только CAR против CD19, Т-клетки, экспрессирующие только CAR против CD22, и Т-клетки, экспрессирующие схему CAR против CD19 «ИЛИ» CD22, примировали клетками-мишенями, не экспрессирующими ни CD19, ни CD22, или CD19, или CD22 по отдельности, или оба антигена. Т-клетки, экспрессирующие схему CAR против CD19 «ИЛИ» CD22, могли уничтожать клетки-мишени, даже если отсутствовал один антиген.
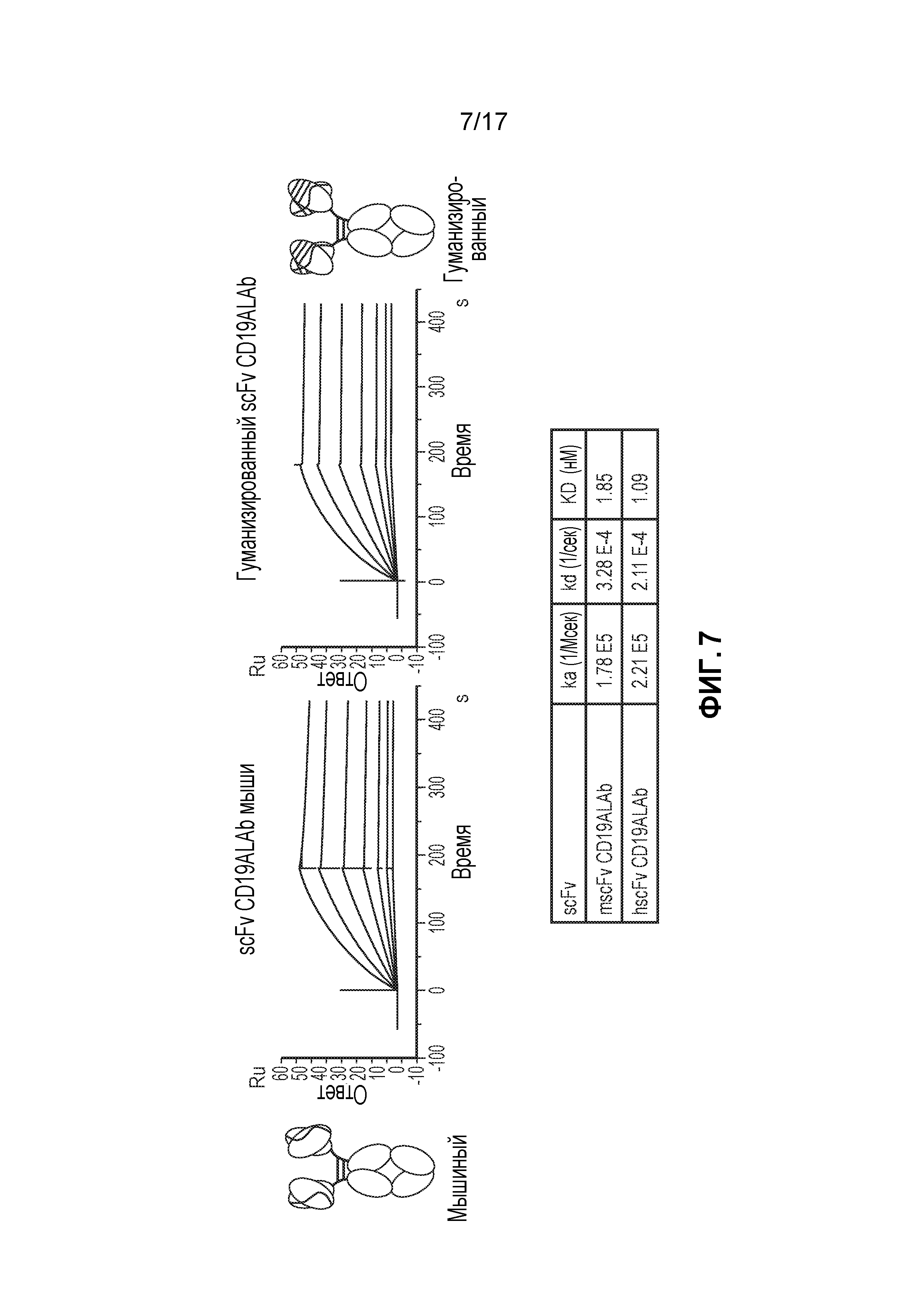
Фиг. 6: Определение аффинности с помощью Biacore для scFv CD22ALAb мыши, гуманизированного scFv CD22ALAb и scFv M971.
Фиг. 7: Определение аффинности с помощью Biacore для scFv CD19ALAb мыши и гуманизированного CD19ALAb.
Фиг. 8: Сравнение кинетики связывания между связываниями растворимого scFv-CD19 в случае scFv CD19ALAb и scFv fmc63.
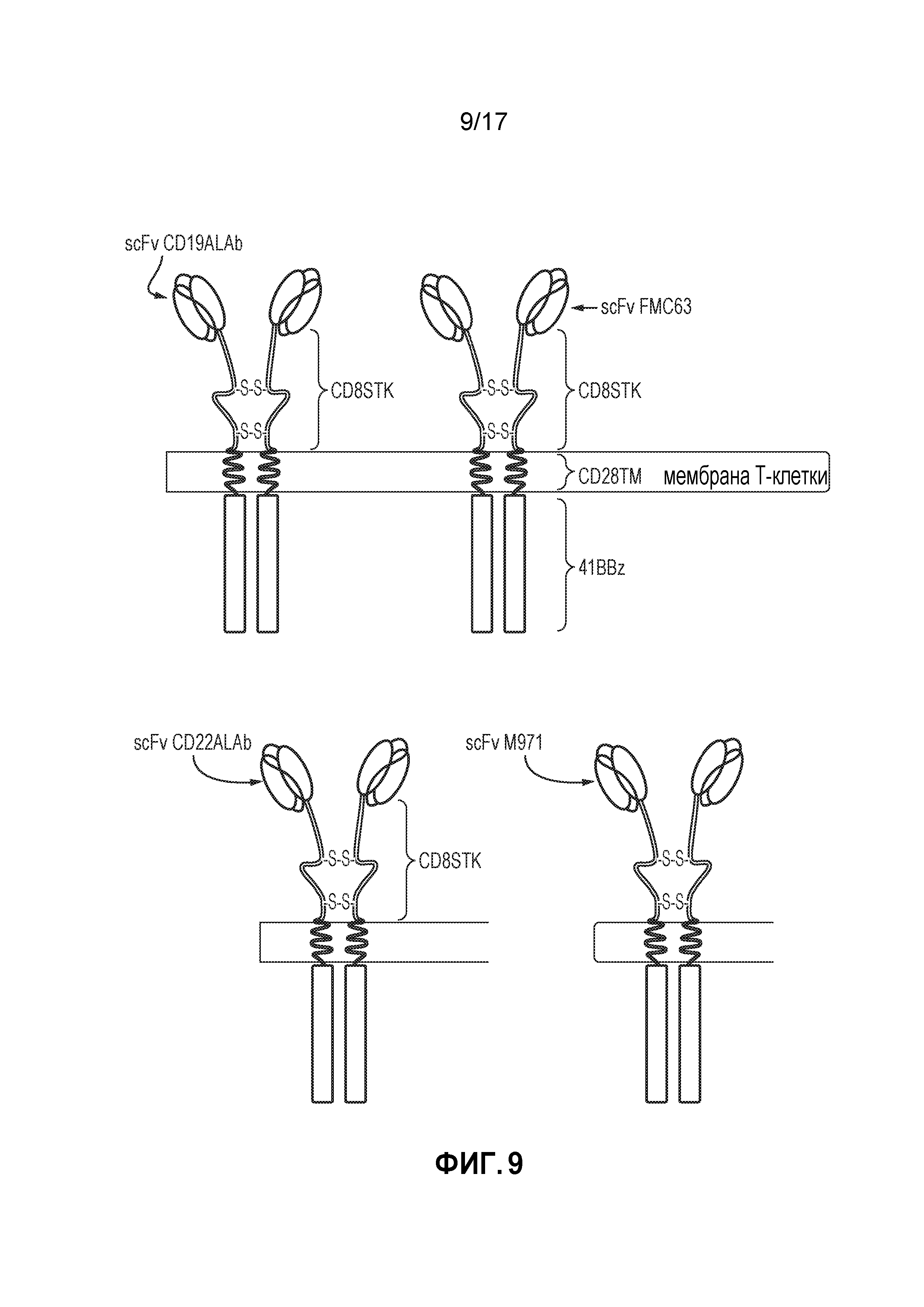
Фиг. 9: Схема, иллюстрирующая CAR на основе CD19ALAb, CAR на основе fmc63, CAR на основе CD22ALAb и CAR на основе M971, используемые в сравнительных исследованиях.
Фиг. 10: Анализ уничтожения CD19-позитивных клеток-мишеней при сравнении CAR с антигенсвязывающим доменом CD19ALAb и эквивалентного CAR со связывающим доменом fmc63.
Фиг. 11: А) Анализ уничтожения CD22-позитивных клеток-мишеней при сравнении CAR с антигенсвязывающим доменом CD22ALAb и эквивалентного CAR со связывающим доменом M971. В) Анализ, сравнивающий выброс IFNγ после сокультивирования в соотношении 1:1 с CD22-позитивными SupT1 клетками.
Фиг. 12: Структура CD19 и экзоны.
Фиг. 13: Схемы и карты конструкций, иллюстрирующие четыре конструкции, проверенные в примере 5. На карте конструкции, части, помеченные ', c неоднозначным соответствием кодонов. А: Оба CAR против CD19 и CD22 содержат составные эндодомены 41BB-CD3-дзета; В: Оба CAR против CD19 и CD22 содержат составные эндодомены OX40-CD3-дзета; С: CAR против CD19 содержит составной эндодомен 41ВВ-CD3-дзета, а CAR против CD22 содержит составной эндодомен CD28-CD3-дзета; и D: CAR против CD19 содержит составной эндодомен OX40-CD3-дзета, а CAR против CD22 содержит составной эндодомен CD28-CD3-дзета.
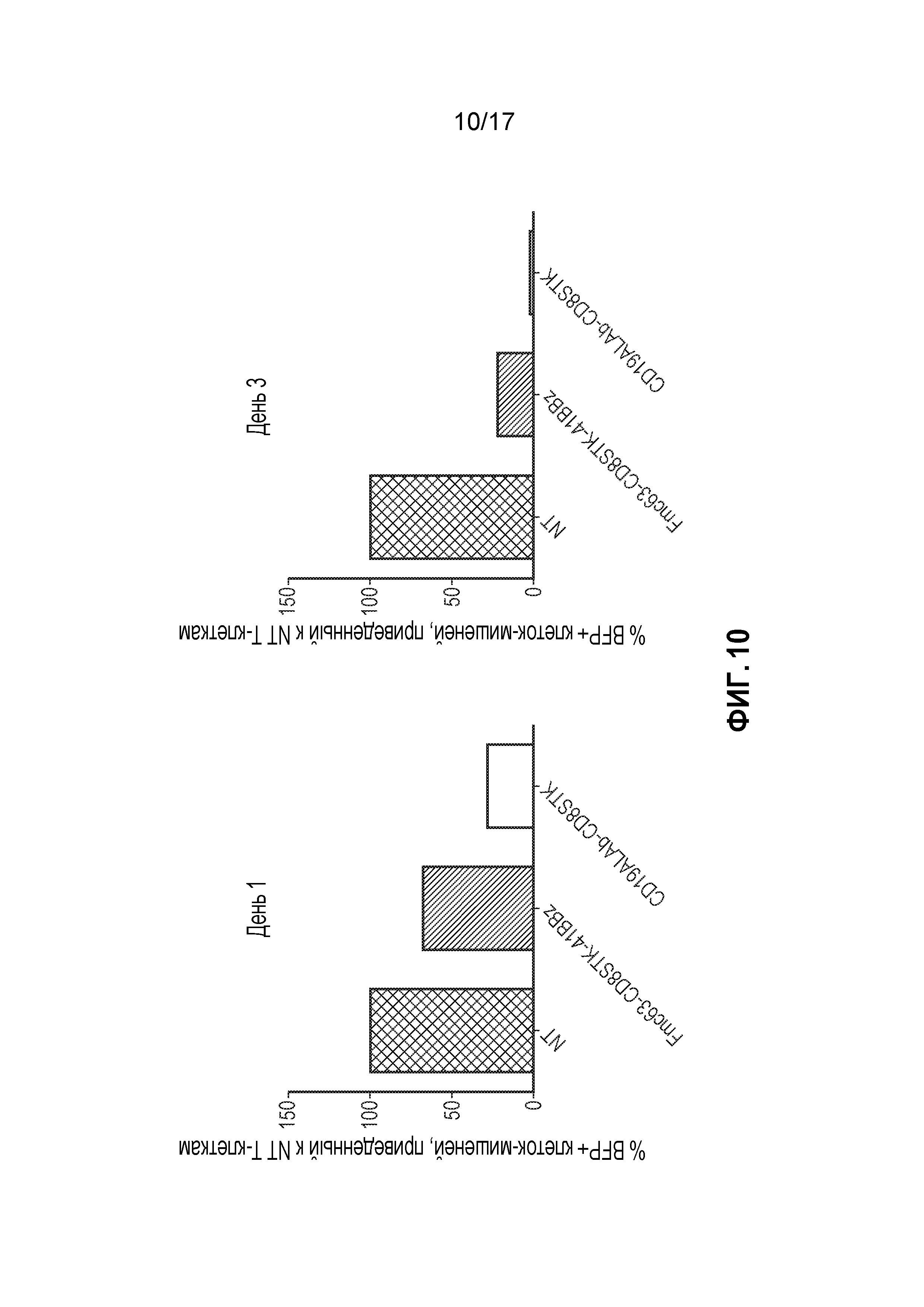
Фиг. 14: Уничтожение клеток-мишеней клетками, экспрессирующими конструкции, представленные на фиг. 13.
ПОДРОБНОЕ ОПИСАНИЕ
ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНОВ (CAR)
CAR, которые схематически представлены на фиг. 1, представляют собой химерные трансмембранные белки типа I, которые соединяют экстраклеточный распознающий антиген домен (связующий элемент) с внутриклеточным, передающим сигналы доменом (эндодоменом). Связующий элемент обычно представляет собой одноцепочечный вариабельный фрагмент (scFv), полученный из моноклонального антитела (мАт), но он может быть основан на других форматах, которые содержат подобный антителу антигенсвязывающий сайт. Спейсерный домен обычно необходим для отделения связующего элемента от мембраны и предоставления ему подходящей ориентации. Обычно используемым спейсерным доменом является Fc IgG1. Могут быть достаточными более компактные спейсеры, например, ножка из CD8α и даже просто только шарнирная область IgG1, в зависимости от антигена. Трансмембранный домен закрепляет белок в клеточной мембране и соединяет спейсер с эндодоменом.
Ранние конструкции CAR содержали эндодомены, происходящие от внутриклеточных частей либо γ-цепи FcεR1 или CD3ζ. В результате, эти рецепторы первого поколения передавали иммунологический сигнал 1, который был достаточным для запуска уничтожения Т-клетками узнаваемых клеток-мишеней, но не могли полностью активировать Т-клетку для пролиферации и выживания. С целью преодоления этого ограничения были сконструированы составные эндодомены: слияние внутриклеточной части Т-клеточной костимулирующей молекулы с таковой CD3ζ дает в результате рецепторы второго поколения, которые могут передавать активирующий и костимулирующий сигнал одновременно после распознавания антигена. Наиболее часто используемым костимулирующим доменом является таковой CD28. Он обеспечивает самый мощный костимулирующий сигнал, а именно - иммунологический сигнал 2, который вызывает пролиферацию Т-клеток. Также были описаны некоторые рецепторы, которые включают эндодомены семейства рецепторов TNF, такие как близкородственные OX40 и 41BB, которые передают сигналы выживания. Уже были описаны еще более мощные CAR третьего поколения, которые содержат эндодомены, способные передавать сигналы активации, пролиферации и выживания.
Кодирующие CAR нуклеиновые кислоты могут быть перенесены в Т-клетки, используя, например, ретровирусные векторы. Могут быть использованы лентивирусные векторы. Таким образом может быть создано большое число специфических для рака Т-клеток для адаптивного переноса клеток. Когда CAR связывается с антигеном-мишенью, это приводит к передаче активирующего сигнала на Т-клетку, в которой он экспрессируется. Таким образом, CAR направляет специфичность и цитотоксичность Т-клеток в сторону опухолевых клеток, экспрессирующих целевой антиген.
Первый аспект настоящего изобретения относится к клетке, которая коэкспрессирует первый CAR и второй CAR, причем один CAR связывается с CD-19, а другой CAR связывается с CD22, так что Т-клетка может распознавать клетки-мишени, экспрессирующие тот или другой из этих маркеров.
Таким образом, антигенсвязывающие домены первого и второго CAR настоящего изобретения связываются с различными антигенами, и оба CAR могут содержать активирующий эндодомен. Два CAR могут включать спейсерные домены, которые могут быть одинаковыми или достаточно различными, чтобы предотвратить перекрестное спаривание двух различных рецепторов. Следовательно, может быть получена клетка, которая активируется после распознания одного из двух или обоих из CD19 и CD22. Это применимо в области онкологии, о чем гласит гипотеза Голди-Колдмена: выбор в качестве единственной мишени одного антигена может привести к ускользанию опухоли в результате модуляции указанного антигена из-за высокой частоты мутаций, присущей большинству видов рака. При одновременном таргетировании двух антигенов, вероятность такого ускользания экспоненциально уменьшается.
Важно, чтобы два CAR не подвергались гетеродимеризации.
Первый и второй CAR Т-клетки настоящего изобретения могут быть получены в виде полипептида, включающего оба CAR, вместе с сайтом расщепления.
СИГНАЛЬНЫЙ ПЕПТИД
CAR клетки настоящего изобретения может включать сигнальный пептид, так что, когда CAR экспрессируется внутри клетки, такой как Т-клетка, образующийся белок направляется в эндоплазматический ретикулум, а затем к клеточной поверхности, где он представляется.
Центр сигнального пептида может содержать длинный участок гидрофобных аминокислот, который имеет тенденцию к образованию одной альфа-спирали. Сигнальный пептид может начинаться с короткого участка положительно заряженных аминокислот, который помогает обеспечить правильную топологию полипептида во время транслокации. В конце сигнального пептида обычно имеется участок аминокислот, который распознается и расщепляется с помощью сигнальной пептидазы. Сигнальная пептидаза может расщеплять или во время, или после завершения транслокации с образованием свободного сигнального пептида и зрелого белка. Свободные сигнальные пептиды затем расщепляются специфическими протеазами.
Сигнальный пептид может находиться на амино-конце молекулы.
Сигнальный пептид может включать последовательность SEQ ID NO:1, 2 или 3, или ее вариант, имеющий 5, 4, 3, 2 или 1 мутаций(ю) (вставок, замен или дополнений) аминокислот, при условии, что сигнальный пептид все еще функционирует с вызовом представления CAR на поверхности клетки.
SEQ ID NO:1: MGTSLLCWMALCLLGADHADG
Сигнальный пептид с SEQ ID NO:1 является компактным и высокоэффективным. По прогнозам, приблизительно 95% его расщепляется после концевого глицина, если имеется эффективное удаление с помощью сигнальной пептидазы.
SEQ ID NO:2: MSLPVTALLLPLALLLHAARP
Сигнальный пептид с SEQ ID NO: 2 получен из IgG1.
SEQ ID NO: 3: MAVPTQVLGLLLLWLTDARC
Сигнальный пептид с SEQ ID NO: 3 получен из CD8.
Сигнальный пептид для первого CAR может иметь последовательность, отличную от таковой сигнального пептида второго CAR.
CD19
Антиген CD19 человек представляет собой трансмембранный гликопротеин с М.м. 95 кДа, относящийся к суперсемейству иммуноглобулинов. CD19 относится к трансмембранному белку типа I, с одним трансмембранным доменом, цитоплазматическим С-концом и экстраклеточным N-концом. Общая структура для CD19 показана на фиг. 12.
CD19 является биомаркером нормальных и опухолевых В-клеток, а также фолликулярных дендритных клеток. На самом деле, он присутствует на В-клетках распознаваемой в самом начале линии дифференцировки В-лимфоцитов во время развития в бластные В-клетки, но теряется во время созревание в плазматические клетки. Он в основном функционирует в качестве В-клеточного корецептора в сочетании с CD21 и CD81. После активации цитоплазматический хвост CD19 становится фосфорилированным, что приводит к связывания киназами src-семейства и рекрутменту PI-3-киназы. CD19 экспрессируется в самом начале дифференцировки В-клеток и утрачивается лишь при конечной дифференциации В-клеток в плазматические клетки. Следовательно, CD19 экспрессируется во всех В-клеточных злокачественных опухолях кроме множественной миеломы.
Были проверены различные конструкции CAR против CD19 в различных центрах, как указано в следующей таблице:
Таблица 1
Как было показано выше, в большинстве исследований, проведенных до настоящего времени, использовали scFv, полученный из гибридомы fmc63, в качестве части связывающего домена, который распознает CD19.
Как показано на фиг. 12, ген, кодирующий CD19, включает десять экзонов: экзоны с 1 по 4 кодируют экстраклеточный домен; экзон 5 кодирует трансмембранный домен; а экзоны с 6 по 10 кодируют цитоплазматический домен.
В схеме «ИЛИ» CD19/CD22 настоящего изобретения, антигенсвязывающий домен CAR против CD19 может связываться с эпитопом CD19, кодируемым экзоном 1 гена CD19.
В схеме «ИЛИ» CD19/CD22 настоящего изобретения, антигенсвязывающий домен CAR против CD19 может связывать с эпитопом CD19, кодируемым экзоном 3 гена CD19.
В схеме «ИЛИ» CD19/CD22 настоящего изобретения, антигенсвязывающий домен CAR против CD19 может связываться с эпитопом CD19, кодируемым экзоном 4 гена CD19.
CD19ALAb
Авторы настоящего изобретения разработали новый CAR против CD19, который имеет улучшенные свойства по сравнению с известным CAR против CD19, который включает связующий элемент fmc63 (смотрите примеры 2 и 3). Антигенсвязывающий домен CAR основан CD19-связующем элементе CD19ALAb, который содержит CDR и VH/VL-области, определенные ниже.
Следовательно, изобретение также относится к CAR, который включает CD19-связывающий домен, который включает
a) вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность участки (CDR) со следующими последовательностями:
CDR1 - SYWMN (SEQ ID NO:15);
CDR2 - QIWPGDGDTNYNGKFK (SEQ ID NO:16);
CDR3 - RETTTVGRYYYAMDY (SEQ ID NO:17); и
b) вариабельную область легкой цепи (VL), содержащую CDR со следующими последовательностями:
CDR1 - KASQSVDYDGDSYLN (SEQ ID NO:18);
CDR2 - DASNLVS (SEQ ID NO:19);
CDR3 - QQSTEDPWT (SEQ ID NO: 20).
Может быть возможным введение одной или более мутаций (замен, добавлений или делеций) в CDR и каждый CDR без отрицательного влияния на CD19-связывающую активность. Каждый CDR может, например, иметь одну, две или три мутации аминокислот.
CAR настоящего изобретения может включать одну из следующих аминокислотных последовательностей:
SEQ ID NO:21 (последовательность scFv CD19ALAb мыши)
QVQLQQSGAELVRPGSSVKISCKASGYAFSSYWMNWVKQRPGQGLEWIGQIWP GDGDTNYNGKFKGKATLTADESSSTAYMQLSSLASEDSAVYFCARRETTTVGRYYYA MDYWGQGTTVTVSSDIQLTQSPASLAVSLGQRATISCKASQSVDYDGDSYLNWYQQIP GQPPKLLIYDASNLVSGIPPRFSGSGSGTDFTLNIHPVEKVDAATYHCQQSTEDPWTFGG GTKLEIK
SEQ ID NO:22 (гуманизированную последовательность scFv CD19ALAb - Тяжелая цепь 19, Легкая цепь каппа 16)
QVQLVQSGAEVKKPGASVKLSCKASGYAFSSYWMNWVRQAPGQSLEWIGQIW PGDGDTNYNGKFKGRATLTADESARTAYMELSSLRSGDTAVYFCARRETTTVGRYYYA MDYWGKGTLVTVSSDIQLTQSPDSLAVSLGERATINCKASQSVDYDGDSYLNWYQQKP GQPPKLLIYDASNLVSGVPDRFSGSGSGTDFTLTISSLQAADVAVYHCQQSTEDPWTFGQ GTKVEIKR
SEQ ID NO:39 (гуманизированную последовательность scFv CD19ALAb - Тяжелая цепь 19, Легкая цепь каппа 7)
QVQLVQSGAEVKKPGASVKLSCKASGYAFSSYWMNWVRQAPGQSLEWIGQIW PGDGDTNYNGKFKGRATLTADESARTAYMELSSLRSGDTAVYFCARRETTTVGRYYYA MDYWGKGTLVTVSSDIQLTQSPDSLAVSLGERATINCKASQSVDYDGDSYLNWYQQKP GQPPKVLIYDASNLVSGVPDRFSGSGSGTDFTLTISSLQAADVAVYYCQQSTEDPWTFG QGTKVEIKR
scFv может находиться в ориентации VH-VL (как показано в SEQ ID NO:21, 22 и 39) или ориентации VL-VH.
CAR настоящего изобретения может включать одну из следующих последовательностей VH:
SEQ ID NO:23 (последовательность VH CD19ALAb мыши)
QVQLQQSGAELVRPGSSVKISCKASGYAFSSYWMNWVKQRPGQGLEWIGQIWP GDGDTNYNGKFKGKATLTADESSSTAYMQLSSLASEDSAVYFCARRETTTVGRYYYA MDYWGQGTTVTVSS
SEQ ID NO:24 (гуманизированная последовательность VH CD19ALAb)
QVQLVQSGAEVKKPGASVKLSCKASGYAFSSYWMNWVRQAPGQSLEWIGQIW PGDGDTNYNGKFKGRATLTADESARTAYMELSSLRSGDTAVYFCARRETTTVGRYYYA MDYWGKGTLVTVSS
CAR настоящего изобретения может включать одну из следующих последовательностей VL:
SEQ ID NO:25 (последовательность VL CD19ALAb мыши)
DIQLTQSPASLAVSLGQRATISCKASQSVDYDGDSYLNWYQQIPGQPPKLLIYDA SNLVSGIPPRFSGSGSGTDFTLNIHPVEKVDAATYHCQQSTEDPWTFGGGTKLEIK
SEQ ID NO:26 (гуманизированную последовательность VL CD19ALAb, легкая цепь каппа 16)
DIQLTQSPDSLAVSLGERATINCKASQSVDYDGDSYLNWYQQKPGQPPKLLIYD ASNLVSGVPDRFSGSGSGTDFTLTISSLQAADVAVYHCQQSTEDPWTFGQGTKVEIKR
SEQ ID NO:40 (гуманизированную последовательность VL CD19ALAb, легкая цепь каппа 7)
DIQLTQSPDSLAVSLGERATINCKASQSVDYDGDSYLNWYQQKPGQPPKVLIYD ASNLVSGVPDRFSGSGSGTDFTLTISSLQAADVAVYYCQQSTEDPWTFGQGTKVEIKR
CAR настоящего изобретения может включать вариант последовательности, представленной как SEQ ID NO:21, 22, 23, 24, 25, 26, 39 или 40, идентичный по последовательности на по меньшей мере 80, 85, 90, 95, 98 или 99%, при условии, что вариант последовательности сохраняют способность связываться с CD19 (при объединении с комплементарным VL- или VH-доменом, если это необходимо).
Процент идентичности между двумя полипептидными последовательностями может быть легко определен с помощью таких программ, как BLAST, которая находится в свободном доступе на http://blast.ncbi.nlm.nih.gov.
CD22
Антиген CD22 человека является молекулой, относящейся к семейству лектинов SIGLEC. Он обнаруживается на поверхности зрелых В-клеток и на некоторых незрелых В-клетках. Вообще говоря, CD22 является регуляторной молекулой, которая препятствует сверхактивации иммунной системы и развитию аутоиммунных заболеваний.
CD22 представляет собой связывающий сахар, трансмембранный белок, который специфически связывается с сиаловой кислотой с помощью иммуноглобулинового (Ig) домена, расположенного на его N-конце. Наличие Ig-доменов делает CD22 одним из членов суперсемейства иммуноглобулинов. CD22 функционирует в качестве ингибиторного рецептора для передачи сигналов от В-клеточного рецептора (BCR).
CD22 представляет собой молекулу IgSF, которая может существовать в двух изоформах, одной с семью доменами и внутрицитоплазматическим хвостом, состоящим из трех ITIM (тирозиновых ингибирующих мотивов иммунных рецепторов) и ITAM; и в виде варианта сплайсинга, который взамен этого состоит из пяти экстраклеточных доменов и внутрицитоплазматического хвоста, несущего один ITIM. CD22, как полагают, является ингибиторным рецептором, участвующем в контролировании гуморальных иммунных ответов на антиген. Общепризнано, что, как и CD19, CD22 является пан-В антигеном, хотя была описана экспрессия в некоторых нелимфоидных тканях. Таргетирование CD22 с помощью терапевтических моноклональных антител и иммуноконъюгатов вступило в фазу клинического испытания.
Примеры CAR против CD22 описываются Haso и соавт. (Blood, 2013; 121 (7)). В частности, CAR против CD22 с антигенсвязывающими доменами, происходящими из scFv m971, HA22 и BL22, были описаны.
Антигенсвязывающий домен CAR против CD22 может связывать CD22 с KD, находящейся в диапазоне 30-50 нМ, например 30-40 нМ. KD может составлять приблизительно 32 нМ.
CD-22 содержит семь экстраклеточных IgG-подобных доменов, которые обычно определяют как Ig-домен 1 - Ig-домен 7, при этом Ig-домен 7 является самым проксимальным к В-клеточной мембране, а Ig-домен 7 является самым дистальным от клеточной мембраны (смотрите Haso et al., 2013, как указано выше на фиг. 2В).
Положения Ig-доменов относительно аминокислотной последовательности CD22 (http://www.uniprot,org/uniprot/P20273), приведены в следующей таблице:
Антигенсвязывающий домен второго CAR может связываться с дистальным от мембраны эпитопом в CD22. Антигенсвязывающий домен второго CAR может связываться с эпитопом в Ig-домене 1, 2, 3 или 4 CD22, например, в Ig-домене 3 CD22. Антигенсвязывающий домен второго CAR может связываться с эпитопом, расположенным между аминокислотами 20-416 CD22, например, между аминокислотами 242-326 CD22.
Антитела против CD22 HA22 и BL22 (Haso et al. 2013, как указано выше) и CD22ALAb, описанный ниже, связываются с эпитопом в Ig-домене 3 CD22.
Антигенсвязывающий домен второго CAR может не связываться с проксимальным к мембране эпитопом в CD22. Антигенсвязывающий домен второго CAR может не связываться с эпитопом в Ig-домене 5, 6 или 7 CD22. Антигенсвязывающий домен второго CAR может не связываться с эпитопом, расположенным между аминокислотами 419-676 CD22, например, между 505-676 из CD22.
CD22ALAb
Авторы настоящего изобретения разработали новый CAR против CD22, который имеет улучшенные свойства по сравнению с известным CAR против CD22, который включает связующий элемент m971 (смотрите примеры 2 и 3 и Haso et al. (2013), как указано выше). Антигенсвязывающий домен CAR основан на CD22-связующем элементе CD22ALAb, который содержит CDR и VH/VL-области, определенные ниже.
Следовательно, изобретение также относится к CAR, который включает CD22-связывающий домен, который включает
a) вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность участки (CDR) со следующими последовательностями:
CDR1 - NYWIN (SEQ ID NO:27);
CDR2 - NIYPSDSFTNYNQKFKD (SEQ ID NO:28);
CDR3 - DTQERSWYFDV (SEQ ID NO:29); и
b) вариабельную область легкой цепи (VL), содержащую CDR со следующими последовательностями:
CDR1 - RSSQSLVHSNGNTYLH (SEQ ID NO:30);
CDR2 - KVSNRFS (SEQ ID NO:31);
CDR3 - SQSTHVPWT (SEQ ID NO:32).
Может быть возможным введение одной или более мутаций (замен, добавлений или делеций) в CDR и каждый CDR без отрицательного влияния на CD22-связывающую активность. Каждый CDR может, например, иметь одну, две или три мутации аминокислот.
CAR настоящего изобретения может включать одну из следующих аминокислотных последовательностей:
SEQ ID NO:33 (последовательность scFv CD22ALAb мыши)
QVQLQQPGAELVRPGASVKLSCKASGYTFTNYWINWVKQRPGQGLEWIGNIYPS DSFTNYNQKFKDKATLTVDKSSSTAYMQLSSPTSEDSAVYYCTRDTQERSWYFDVWGA GTTVTVSSDVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLHWYLQKPGQSPKL LIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGLYFCSQSTHVPWTFGGGTKLEIK
SEQ ID NO:34 (гуманизированную последовательность scFv CD22ALAb)
EVQLVESGAEVKKPGSSVKVSCKASGYTFTNYWINWVRQAPGQGLEWIGNIYPS DSFTNYNQKFKDRATLTVDKSTSTAYLELRNLRSDDTAVYYCTRDTQERSWYFDVWG QGTLVTVSSDIVMTQSPATLSVSPGERATLSCRSSQSLVHSNGNTYLHWYQQKPGQAPR LLIYKVSNRFSGVPARFSGSGSGVEFTLTISSLQSEDFAVYYCSQSTHVPWTFGQGTRLEI K
scFv может находиться в ориентации VH-VL (как показано в SEQ ID NO:33 и 34) или в ориентации VL-VH.
CAR настоящего изобретения может включать одну из следующих последовательностей VH:
SEQ ID NO:35 (последовательность VH CD22ALAb мыши)
QVQLQQPGAELVRPGASVKLSCKASGYTFTNYWINWVKQRPGQGLEWIGNIYPS DSFTNYNQKFKDKATLTVDKSSSTAYMQLSSPTSEDSAVYYCTRDTQERSWYFDVWGA GTTVTVSS
SEQ ID NO:36 (гуманизированную последовательность VH CD22ALAb)
EVQLVESGAEVKKPGSSVKVSCKASGYTFTNYWINWVRQAPGQGLEWIGNIYPS DSFTNYNQKFKDRATLTVDKSTSTAYLELRNLRSDDTAVYYCTRDTQERSWYFDVWG QGTLVTVSS
CAR настоящего изобретения может включать одну из следующих последовательностей VL:
SEQ ID NO:37 (последовательность VL CD22ALAb мыши)
DVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLHWYLQKPGQSPKLLIYK VSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGLYFCSQSTHVPWTFGGGTKLEIK
SEQ ID NO:38 (гуманизированную последовательность VL CD22ALAb)
DIVMTQSPATLSVSPGERATLSCRSSQSLVHSNGNTYLHWYQQKPGQAPRLLIYK VSNRFSGVPARFSGSGSGVEFTLTISSLQSEDFAVYYCSQSTHVPWTFGQGTRLEIK
CAR настоящего изобретения может включать вариант последовательности, представленной как SEQ ID NO:33, 34, 35, 36, 37 или 38, идентичный по последовательности на по меньшей мере 80, 85, 90, 95, 98 или 99%, при условии, что вариант последовательности сохраняют способность связываться с CD22 (при объединении с комплементарным VL- или VH-доменом, если это необходимо).
ЭКСПРЕССИЯ АНТИГЕНОВ В В-КЛЕТАХ ВО ВРЕМЯ В-КЛЕТОЧНОГО ОНТОГЕНЕЗА И В ПОСЛЕДУЮЩИХ ОПУХОЛЯХ
Общепризнано, что CD19 является пан-В антигеном, хотя очень редко он может демонстрировать некоторую степень «неверности» линии дифференцировки. Молекула CD19 состоит из двух экстраклеточных IgSF-доменов, разделенных доменом меньшего размера, и длинного внутрицитоплазматического хвоста, почти столь же большого, как и экстраклеточная часть молекулы, несущего один ITAM. CD19 является ключевой молекулой в развитии и активации В-клеток. CD22 представляет собой молекулу IgSF, которая может существовать в двух изоформах, одной с семью доменами и внутрицитоплазматическим хвостом, состоящим из трех ITIM (тирозиновых ингибирующих мотивов иммунных рецепторов) и ITAM; и в виде варианта сплайсинга, который взамен этого состоит из пяти экстраклеточных доменов и внутрицитоплазматического хвоста, несущего один ITIM. CD22, как полагают, является ингибиторным рецептором, участвующем в контролировании гуморальных иммунных ответов на антиген. Общепризнано, что, как и CD19, CD22 является пан-В антигеном, хотя была описана экспрессия в некоторых нелимфоидных тканях (Wen et al. (2012) J. Immunol. Baltim Md. 1950 188, 1075-1082). Таргетирование CD22 с помощью терапевтических моноклональных антител и иммуноконъюгатов вступило в фазу клинического испытания. Было описано создание специфических для CD22 CAR (Haso et al., 2013, Blood: Volume 121; 7: 1165-74, и James et al., 2008, Journal of immunology, Volume 180; Issue 10; Pages 7028-38).
Детальные иммунофенотипические исследования В-клеточных лейкозов показывает, что в то время как CD19 на поверхности всегда присутствует, CD22 на поверхности почти всегда присутствует. Например, Raponi et al. (2011, как указано выше) изучили фенотип поверхностных антигенов в 427 случаях В-ALL и обнаружили, что CD22 присутствует в 341 исследованном случае.
Возможность уменьшения экспрессии CD19 после таргетирования с помощью CAR19, описанная выше, может быть объяснена гипотезой Голди-Колдмена. Гипотеза Голди-Колдмена предсказывает, что опухолевые клетки мутируют к устойчивому фенотипу с частотой, которая зависит от их внутренней генетической нестабильности, и что вероятность того, что рак будет содержать устойчивые клоны, зависит от частоты мутаций и размера опухоли. Хотя может быть трудным для раковых клеток стать внутренне устойчивыми к непосредственному уничтожению цитотоксическими Т-клетками, потеря антигена остается возможной. Действительно, об этом явлении сообщалось ранее при выборе в качестве мишеней антигенов меланомы и инициированных EBV лимфом. В соответствии с гипотезой Голди-Колдмена, лучшим шансом излечения была бы одновременная атака не являющихся перекрестно устойчивыми мишеней. Учитывая, что CD22 экспрессируется почти во всех случаях В-ALL, одновременное Таргетирование, используя CAR, CD19 вместе с CD22 может уменьшить появление устойчивых CD19-негаивных клонов.
АНТИГЕНСВЯЗЫВАЮЩИЙ ДОМЕН
Антигенсвязывающий домен представляет собой часть CAR, которая распознает антиген. В данной области техники известны многочисленные антигенсвязывающие домены, в том числе те, которые основаны на антигенсвязывающем сайте антитела, миметиков антител и Т-клеточных рецепторов. Например, антигенсвязывающий домен может включать: одноцепочечный вариабельный фрагмент (scFv), происходящий из моноклонального антитела; природный лиганд антигена-мишени; пептид с достаточным сродством к мишени; однодоменное антитело; искусственный одиночный связующий элемент, такой как Дарпин (названный белок с анкироновым повтором); или одну цепь, происходящую из Т-клеточного рецептора.
Антигенсвязывающий домен CAR, который связывается с CD19, может представлять собой любой домен, который способен к связыванию с CD19. Например, антигенсвязывающий домен может включать CD19-связующий элемент, описанный в таблице 1.
Антигенсвязывающий домен CAR, которое связывается с CD19, может включать последовательность, происходящую из одного из CD19-связующих элементов, представленных в таблице 2.
Таблица 2
Антигенсвязывающий домен CAR, который связывается с CD22, может представлять собой любой домен, который способен к связыванию с CD22. Например, антигенсвязывающий домен может включать CD22-связующий элемент, описанный в таблице 3.
Таблица 3
СПЕЙСЕРНЫЙ ДОМЕН
CAR включают спейсерную последовательность для соединения антигенсвязывающего домена с трансмембранным доменом и пространственного отделения антигенсвязывающего домена от эндодомена. Гибкий спейсер позволяет ориентировать антигенсвязывающий домен в различных направлениях для облегчения связывания.
В клетке настоящего изобретения, первый и второй CAR могут включать различные спейсерные молекулы. Например, последовательность спейсера может, например, включать Fc-область IgG1, шарнирную область IgG1 или ножку CD8 человека или ножку CD8 мыши. Альтернативно, спейсер может включать альтернативную линкерную последовательность, которая имеет длину и/или относящиеся к размещению доменов свойства, схожие с таковыми Fc-области IgG1, шарнирной области IgG1 или ножки CD8. Спейсер на основе IgG1 человека может быть изменен с удалением Fc-связывающих мотивов.
Спейсер для CAR против CD19 может включать спейсер на основе ножки CD8 или спейсер, имеющий длину, эквивалентную таковой спейсера на основе ножки CD8. Спейсер для CAR против CD19 может содержать по меньшей мере 30 аминокислот или по меньшей мере 40 аминокислот. Он может содержать между 35-55 аминокислот, например, между 40-50 аминокислот. Он может содержать приблизительно 46 аминокислот.
Спейсер для CAR против CD22 может включать спейсер на основе шарнирной области IgG1 или спейсер, имеющий длину, эквивалентную таковой спейсера на основе шарнирной области IgG1. Спейсер для CAR против CD22 может содержать менее чем 30 аминокислот или менее чем 25 аминокислот. Он может содержать между 15-25 аминокислот, например, между 18-22 аминокислот. Он может содержать приблизительно 20 аминокислот.
Примеры аминокислотных последовательностей для этих спейсеров приведены ниже:
SEQ ID NO:4 (шарнирная область-СН2СН3 IgG1 человека)
AEPKSPDKTHTCPPCPAPPVAGPSVFLFPPKPKDTLMIARTPEVTCVVVDVSHEDP EVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKA LPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPE NNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG KKD
SEQ ID NO:5 (ножка CD8 человека):
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDI
SEQ ID NO:6 (шарнирная область IgG1 человека):
AEPKSPDKTHTCPPCPKDPK
SEQ ID NO:7 (эктодомен CD2)
KEITNALETWGALGQDINLDIPSFQMSDDIDDIKWEKTSDKKKIAQFRKEKETFK EKDTYKLFKNGTLKIKHLKTDDQDIYKVSIYDTKGKNVLEKIFDLKIQERVSKPKISWTC INTTLTCEVMNGTDPELNLYQDGKHLKLSQRVITHKWTTSLSAKFKCTAGNKVSKESSV EPVSCPEKGLD
SEQ ID NO:8 (эктодомен CD34)
SLDNNGTATPELPTQGTFSNVSTNVSYQETTTPSTLGSTSLHPVSQHGNEATTNIT ETTVKFTSTSVITSVYGNTNSSVQSQTSVISTVFTTPANVSTPETTLKPSLSPGNVSDLSTT STSLATSPTKPYTSSSPILSDIKAEIKCSGIREVKLTQGICLEQNKTSSCAEFKKDRGEGLA RVLCGEEQADADAGAQVCSLLLAQSEVRPQCLLLVLANRTEISSKLQLMKKHQSDLKK LGILDFTEQDVASHQSYSQKT
Поскольку CAR представляют собой, как правило, гомодимеры (фиг. 1а), перекрестное спаривание может привести к гетеродимерному химерному рецептору антигена. Это является нежелательным по различным причинам, например: (1) эпитоп может не присутствовать на одном и том же «уровне» на клетке-мишени, так что подвергнутый перекрестному спариванию CAR может быть только способен связываться с одним антигеном; (2) VH и VL из двух различных scFv могут поменяться местами и либо не распознавать мишень, либо хуже распознавать неожиданный и непредвиденный антиген. Спейсер первого CAR может в достаточной степени отличаться от спейсера второго CAR во избежание перекрестного спаривания. Аминокислотная последовательность первого спейсера может быть идентична на аминокислотном уровне менее чем на 50%, 40%, 30% или 20% второму спейсеру.
ТРАНСМЕМБРАННЫЙ ДОМЕН
Трансмембранный домен является последовательностью CAR, которая охватывает мембрану.
Трансмембранным доменом может быть любая структура белка, которая является термодинамически стабильной в мембране. Она, как правило, представляет собой альфа-спираль, состоящую из нескольких гидрофобных остатков. Трансмембранный домен любого трансмембранного белка может быть использован для обеспечения трансмембранной части настоящего изобретения. Присутствие и диапазон трансмембранного домена белка могут быть определены специалистами в данной области техники, используя алгоритм TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2/). Кроме того, учитывая, что трансмембранный домен белка представляет собой относительно простую структуру, т.е. полипептидную последовательность, которая в соответствии с предсказаниями образует гидрофобную альфа-спираль достаточной длины, чтобы охватить мембрану, также может быть использован искусственно разработанный ТМ-домен (в US 7052906 В1 описываются синтетические трансмембранные компоненты).
Трансмембранный домен может быть получен из CD28, что дает хорошую стабильность рецептора.
Трансмембранный домен может быть получен из Tyrp-1 человека. Последовательность трансмембранного домена tyrp-1 представлена как SEQ ID NO:45.
SEQ ID NO:45
IIAIAWGALLLVALIFGTASYLI
АКТИВИРУЮЩИЙ ЭНДОДОМЕН
Эндодомен представляет собой передающую сигналы часть CAR. После распознавания антигена, рецепторы группируются, нативные CD45 и CD148 исключаются из синапса, и сигнал передается в клетку. Наиболее часто используемым компонентом эндодомена является таковой CD3-дзета, который содержит 3 ITAM. Он передает сигнал активации в Т-клетку после связывания антигена. CD3-дзета может не обеспечивать полностью соответствующий сигнал активации, и дополнительная костимулирующая сигнализация может потребоваться. Например, химерный CD28 и OX40 могут использоваться вместе с CD3-Дзета для передачи сигнала пролиферации/выживания, или все три из них могут использоваться вместе.
Клетка настоящего изобретения включает два CAR, каждый с эндодоменом.
Эндодомен первого CAR и эндодомен второго CAR могут включать:
(i) ITAM-содержащий эндодомен, такой как эндодомен из CD3- дзета; и/или
(ii) костимулирующий домен, такой как эндодомен из CD28; и/или
(iii) домен, который передает сигнал выживания, например, эндодомен семейства рецепторов TNF, такой как ОХ-40 или 4-1ВВ.
В одном из вариантов расположения, костимулирующий и порождающий сигнал выживания домены «разделены» между двумя (или более) CAR в схеме «ИЛИ». Например, в схеме «ИЛИ» содержится два CAR, CAR A и CAR B, CAR А может включать костимулирующий домен (например, эндодомен CD28), а CAR B может включать эндодомен семейства рецепторов TFN, такой как ОХ-40 или 4-1BB.
Эндодомен, который содержит мотив ITAM, может функционировать в качестве эндодомена активации в этом изобретении. Известно несколько белков, которые содержат эндодомены с одним или более мотивами ITAM. Примеры таких белков включают эпсилон-цепь CD3, гамма-цепь CD3 и дельта-цепь CD3, среди прочих. Мотив ITAM может быть легко идентифицирован как тирозин, отделенный от лейцина или изолейцина любыми двумя другими аминокислотами, давая отличительный признак YxxL/I. Как правило, но не всегда, два из этих мотивов разделены 6-8 аминокислотами в хвостовой части молекулы (YxxL/Ix(6-8)YxxL/I). Следовательно, специалист в данной области техники может легко найти существующие белки, которые содержат один или более ITAM, для передачи сигнала активации. Кроме того, учитывая то, что мотив является простым, и сложная вторичная структура не требуется, специалист в данной области может сконструировать полипептиды, содержащие искусственные ITAM, для передачи сигнала активации (смотрите WO 2000/063372, которая относится к синтетическим, передающим сигналы молекулам).
Трансмембранный домен и внутриклеточный, передающий сигналы в Т-клетку домен (эндодомен) CAR с активирующим эндодомен может включать последовательность, представленную как SEQ ID NO:9, 10 или 11, или ее вариант, идентичный по последовательности на по меньшей мере 80%.
SEQ ID NO:9, включающая трансмембранный домен CD28 и эндодомен CD3-Дзета
FWVLVVVGGVLACYSLLVTVAFIIFWVRRVKFSRSADAPAYQQGQNQLYNELN LGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRR GKGHDGLYQGLSTATKDTYDALHMQALPPR
SEQ ID NO:10, включающая трансмембранный домен CD28 и эндодомены CD28 и CD3-Дзета
FWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHY QPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPE MGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDT YDALHMQALPPR
SEQ ID NO:11, включающая трансмембранный домен CD28 и эндодомены CD28, OX40 и CD3-Дзета.
FWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHY QPYAPPRDFAAYRSRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKIRVKFSRSADA PAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDK MAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
Вариант последовательности может быть идентичен по последовательности на по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% SEQ ID NO:9, 10 или 11, при условии, что последовательность обеспечивает эффективный трансмембранный домен и эффективный внутриклеточный передающий сигналы в T-клетку домен.
«РАЗДЕЛЕННЫЕ» ЭНДОДОМЕНЫ В СХЕМЕ «ИЛИ»
Настоящее изобретение относится к схема «ИЛИ», в которой костимулирующий/передающий сигналы выживания домены «разделены» между двумя CAR.
В связи с этим, настоящее изобретение относится к клетка, которая коэкспрессирует первый химерный рецептор антигена (CAR) и второй CAR на клеточной поверхности, при этом каждый CAR включает внутриклеточный, передающий сигналы домен, причем внутриклеточный, передающий сигналы домен первого CAR включает костимулирующий домен; а внутриклеточный, передающий сигналы домен второго CAR включает эндодомен семейства рецепторов TFN.
Первый и второй CAR могут связываться с различными антигенами. Например, первый CAR может связываться с CD19, а второй CAR может связываться с CD22; альтернативно, первый CAR может связываться с CD22, а второй CAR может связываться с CD19.
Внутриклеточный, передающий сигналы домен первого CAR включает костимулирующий домен и не включает домен, который передает сигналы выживания (такой как эндодомен семейства рецепторов TFN). Внутриклеточный, передающий сигналы домен второго CAR включает эндодомен семейства рецепторов TFN и не включает костимулирующий домен (например, эндодомен CD28).
Костимулирующий домен может представлять собой костимулирующий домен CD28. Костимулирующий домен CD28 может иметь последовательность, представленную как SEQ ID NO:41.
SEQ ID NO:41 (костимулирующий эндодомен CD28)
SKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS
CAR настоящего изобретения может включать вариант последовательности, представленной как SEQ ID NO:41, идентичный по последовательности на по меньшей мере 80, 85, 90, 95, 98 или 99%, при условии, что вариант последовательности сохраняет способность к костимулированию Т-клеток после распознавания антигена, т.е. обеспечивать сигнал 2 в Т-клетки.
Эндодомен семейства рецепторов TFN может представлять собой эндодомен OX40 или 4-1ВВ. Эндодомен OX40 может иметь последовательность, представленную как SEQ ID NO:42. Эндодомен 4-1ВВ может иметь последовательность, представленную как SEQ ID NO: 43.
SEQ ID NO:42 (эндодомен OX40)
RDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKI
SEQ ID NO:43 (эндодомен 4-1ВВ)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
CAR настоящего изобретения может включать вариант последовательности, представленной как SEQ ID NO:42 или 43, идентичный по последовательности на по меньшей мере 80, 85, 90, 95, 98 или 99%, при условии, что вариант последовательности сохраняет способность к передаче сигнала выживания в Т-клетки после распознавания антигена
Внутриклеточный, передающий сигналы домен первого и/или второго CAR может также включать ITAM-содержащий домен, такой как домен CD3-дзета. Домен CD3-дзета может иметь последовательность, представленную как SEQ ID NO:44.
SEQ ID NO:44 (эндодомен CD3-дзета)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRK NPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQA LPPR
CAR настоящего изобретения может включать вариант последовательности, представленной как SEQ ID NO:41, идентичный по последовательности на по меньшей мере 80, 85, 90, 95, 98 или 99%, при условии, что вариант последовательности сохраняет способность к вызову передачи сигнала в Т-клетку после распознавания антигена, т.е. обеспечивать сигнал 1 в Т-клетки.
Первый CAR может иметь структуру:
AgB1-spacer1-TM1-costim-ITAM,
где
AgB1 представляет собой антигенсвязывающий домен первого CAR;
spacer1 представляет собой спейсер первого CAR;
TM1 представляет собой трансмембранный домен первого CAR;
costim представляет собой костимулирующий домен; и
ITAM представляет собой ITAM-содержащий эндодомен.
«Costim» может представлять собой костимулирующий домен CD28.
«ITAM» может представлять собой эндодомен CD3 дзета.
Второй CAR может иметь структуру:
AgB2-spacer2-TM2-TNF-ITAM,
где
AgB2 представляет собой антигенсвязывающий домен второго CAR;
spacer2 представляет собой спейсер второго CAR;
TM2 представляет собой трансмембранный домен второго CAR;
TNF представляет собой эндодомен рецептора TNF; и
ITAM представляет собой ITAM-содержащий эндодомен.
«TNF» может представлять собой эндодомен рецептора TNF, такой как эндодомены OX40 или 4-1BB.
Изобретение также относится к последовательность нуклеиновой кислоты, кодирующая как первый, так и второй химерные рецепторы антигенов (CAR) с «разделенными» эндодоменами; и набор, включающий две нуклеиновые кислоты, при этом одна кодирует первый CAR, а другая - кодирует второй CAR, содержащие разделенные эндодомены, определенные выше.
САЙТ КОЭКСПРЕССИИ
Второй аспект настоящего изобретения относится к нуклеиновой кислоте, которая кодирует первый и второй CAR.
С нуклеиновой кислоты может продуцироваться полипептид, который включает две молекулы CAR, соединенные сайтом расщепления. Сайт расщепления может быть саморасщепляющимся, так что, когда полипептид продуцируется, он сразу же расщепляется на первый и второй CAR без необходимости в какой-либо внешней активности расщепления.
Известны различные саморасщепляющиеся сайты, в том числе 2A пептид вируса ящура (FMDV) и подобная последовательность (Donnelly et al., Journal of General Virology (2001), 82, 1027-1041), например, 2А-подобная последовательность из вируса Thosea asigna, которая имеет последовательность, представленную как SEQ ID NO:12.
SEQ ID NO:12
RAEGRGSLLTCGDVEENPGP.
Коэкспрессирующаяся последовательность может представлять собой внутренний сайт связывания рибосом (IRES). Коэкспрессирующаяся последовательность может представлять собой внутренний промотор.
КЛЕТКА
Настоящее изобретение относится к клетке, которая коэкспрессирует первый CAR и второй CAR на поверхности клетки, причем один CAR связывается с CD19, а другой CAR связывается с CD22.
Клеткой может быть любая эукариотическая клетка, способная экспрессировать CAR на поверхности клетки, такая как иммунологическая клетка.
В частности, клеткой может быть эффекторная клетка иммунной системы, такая как Т-клетка или клетка-природный киллер (NK).
Т-клетки или Т-лимфоциты представляют собой тип лимфоцитов, которые играют центральную роль в клеточно-опосредованном иммунитете. Их можно отличить от других лимфоцитов, таких как В-клетки и клетки-природные киллеры (NK-клетки), по присутствию Т-клеточного рецептора (TCR) на поверхности клетки. Существуют различные типы Т-клеток, как представлено ниже.
Т-хелперы (TH-клетки) помогают другим лейкоцитам в иммунологических процессах, в том числе созревании В-клеток в плазматические клетки и В-клетки памяти, и активации цитотоксических Т-клеток и макрофагов. TH-клетки экспрессируют CD4 на своей поверхности. TH-клетки активируются при их примировании пептидными антигенами рядом с молекулами МНС класса II на поверхности антигенпрезентирующих клеток (АРС). Эти клетки могут дифференцироваться в один из нескольких подтипов, в том числе TH1, TH2, TH3, Th17, Th9 или TFH, которые секретируют различные цитокины для облегчения различных типов иммунных реакций.
Цитотоксические Т-клетки (TC-клетки или CTL) уничтожают инфицированные вирусом клетки и опухолевые клетки, а также участвуют в отторжения трансплантата. CTL экспрессируют CD8 на своей поверхности. Эти клетки распознают свои мишени путем связывания с антигеном, ассоциированным с МНС класса I, который присутствует на поверхности всех ядросодержащих клеток. С помощью IL-10, аденозина и других молекул, секретируемых регуляторными Т-клетки, CD8+ клетки могут быть инактивированы до анергетического состояния, что предотвращает аутоиммунные заболевания, такие как экспериментальный аутоиммунный энцефаломиелит.
Т-клетки памяти представляют собой подмножество специфических для антигенов Т-клеток, которые длительно сохраняются после устранения инфекции. Они быстро размножаются до большого числа эффекторных Т-клеток после повторного контакта с соответствующим им антигеном, обеспечивая тем самым иммунную систему «памятью» против последних инфекций. Т-клетки памяти включают три подтипа: центральные Т-клетки памяти (TCM-клетки) и два типа эффекторных Т-клеток памяти (клетки TEM и клетки ТЕМRА). Клетки памяти могут быть либо CD4+, либо CD8+. Т-клетки памяти, как правило, экрессируют белок CD45RO клеточной поверхности.
Регуляторные Т-клетки (Treg клетки), ранее известные как Т-клетки-супрессоры, имеют решающее значение для поддержания иммунологической толерантности. Их главная роль заключается в остановке T-клеточного иммунитета к концу иммунной реакции и подавлении аутореактивных Т-клеток, которые избежали процесса негативной селекции в вилочковой железе.
Были описаны два основных класса CD4+ Treg клеток - встречающиеся в природе Treg клетки и адаптивные Treg клетки.
Встречающиеся в природе Treg клетки (также известные как CD4+CD25+FoxP3+ Treg клетки) возникают в вилочковой железе и были связаны с взаимодействиями между развивающимися Т-клетками как с миелоидными (CD11с+), так и плазмоцитоидными (CD123+) дендритными клетки, которые были активированы с помощью TSLP. Встречающиеся в природе Treg клетки можно отличить от других Т-клеток по присутствию внутриклеточной молекулы под названием FoxP3. Мутации гена FOXP3 могут предотвратить развитие регуляторных Т-клеток, что приводит к смертельному аутоиммунному заболеванию IPEX.
Адаптивные Treg клетки (также известные как Th1 клетки или Th3 клетки) могут возникать во время нормального иммунного ответа.
Т-клетки настоящего изобретения могут быть любым из типов Т-клеток, упомянутых выше, в частности CTL.
Природные киллеры (NK-клетки) представляют собой тип цитолитической клетки, который является составной частью врожденной иммунной системы. NK-клетки обеспечивают быстрые реакции на возникающие сигналы от инфицированных вирусом клеток независимым от MHC образом.
NK-клетки (относящиеся к группе врожденных лимфоидных клеток) определяют как крупные зернистые лимфоциты (LGL) и представляют собой третий вид клеток, которые подверглись дифференцировке от общего лимфоидного предшественника, генерирующего В- и Т-лимфоциты. NK-клетки, как известно, дифференцируются и созревают в костном мозге, лимфатическом узле, селезенке, миндалинах и вилочковой железе, где они затем поступают в кровоток.
Экспрессирующие CAR клетки настоящего изобретения могут быть любым из типов клеток, перечисленных выше.
Экспрессирующие CAR клетки, такие как экспрессирующие CAR Т-клетки или НК-клетки, могут быть созданы ex vivo, или из собственной периферической крови пациента (1-я сторона), или в условиях трансплантации гемопоэтических стволовых клеток из периферической крови от донора (2-я сторона) или периферической крови от несвязанного донора (3-я сторона).
изобретение также относится кНастоящее изобретение также относится к композиция, включающая экспрессирующие CAR Т-клетки и/или экспрессирующие CAR NK-клетки в соответствии с настоящим изобретением. Клеточная композиция может быть получена путем трансдукции образца крови ex vivo нуклеиновой кислотой в соответствии с настоящим изобретением.
В качестве альтернативы, экспрессирующие CAR клетки могут быть получены путем ex vivo дифференциации индуцируемых клеток-предшественников или эмбриональных клеток-предшественников в соответствующий тип клеток, такой как Т-клетки. В качестве альтернативы, линия иммортализованных клеток, такая как линия Т-клеток, которая сохраняет свою литическую функцию и может функционировать в качестве терапевтического средства, может быть использована.
Во всех этих вариантах осуществления экспрессирующие CAR клетки создают путем введения ДНК или РНК, кодирующей CAR, одним из многих способов, включая трансдукцию с использованием вирусного вектора, трансфекцию с использованием ДНК или РНК.
Экспрессирующая CAR Т-клетка настоящего изобретения может быть ex vivo Т-клеткой от пациента. Т-клетка может быть из образца мононуклеарных клеток периферической крови (РВМС). Т-клетки могут быть активированы и/или размножены до трансдукции с использованием CAR-кодирующей нуклеиновой кислоты, например, путем обработки моноклональных антител против CD3.
Экспрессирующая CAR Т-клетка настоящего изобретения может быть получена путем:
(i) выделение содержащего Т-клетки образца из пациента или других источников, перечисленных выше; и
(ii) трансдукции или трансфекции Т-клеток одной или более последовательностей нуклеиновых кислот, кодирующей(их) первый и второй CAR.
Т-клетки могут быть затем подвергнуты очистке, например, отобраны на основе коэкспрессии первого и второго CAR.
ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВЫХ КИСЛОТ
Второй аспект настоящего изобретения относится к одной или более последовательностей нуклеиновых кислот, которая(ые) кодирует первый CAR и второй CAR, определенные в первом аспекте настоящего изобретения.
Последовательность нуклеиновой кислоты может представлять собой, например, последовательность РНК, ДНК или кДНК.
Последовательность нуклеиновой кислоты может кодировать один химерный рецептор антигена (CAR), который связывается с CD19 и другой CAR, который связывается с CD22.
Последовательность нуклеиновой кислоты может иметь следующую структуру:
AgB1-spacer1-TM1-coexpr-AbB2-spacer2-ТМ2,
где
AgB1 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен первого CAR;
spacer1 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер первого CAR;
ТМ1 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен первого CAR;
coexpr представляет собой последовательность нуклеиновой кислоты, которая делает возможной коэкспрессию обоих CAR;
AgB2 представляет собой последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен второго CAR;
spacer2 представляет собой последовательность нуклеиновой кислоты, кодирующую спейсер второго CAR;
ТМ2 представляет собой последовательность нуклеиновой кислоты, кодирующую трансмембранный домен второго CAR;
при этом эта последовательность нуклеиновой кислоты, при экспрессии в Т-клетке, кодирует полипептид, который расщепляется в сайте расщепления таким образом, что первый и второй CAR совместно представлены на поверхности клетки.
Первый CAR может связываться с CD19, а второй CAR может связываться с CD22. В качестве альтернативы, первый CAR может связываться с CD22, а второй CAR может связываться с CD19.
Альтернативные кодоны могут быть использованы в районах последовательности, кодирующих одинаковые или схожие аминокислотные последовательности, во избежание гомологичной рекомбинации.
Вследствие вырожденности генетического кода возможно использование альтернативных кодонов, которые кодируют одну и ту же аминокислотную последовательность. Например, оба кодона ccg» и «cca» кодируют аминокислоту пролин, а значит, использование «ccg» может быть заменено на «cca» без оказания влияния на аминокислоту в этом положении в последовательности транслированного белка.
Альтернативные кодоны РНК, которые могут быть использованы для кодирования каждой аминокислоты, представлены в таблице 3а.
Таблица 3а

Альтернативные кодоны могут быть использованы в тех частях последовательности нуклеиновой кислоты, которые кодируют спейсер первого CAR и спейсер второго CAR, особенно если одинаковые или схожие спейсеры используются в первом и втором CAR. На фиг. 4 представлены две последовательности, кодирующие спейсер на основе HCH2CH3-шарнирной области, в одном из которых были использованы альтернативные кодоны.
Альтернативные кодоны могут быть использованы в тех частях последовательности нуклеиновой кислоты, которые кодируют трансмембранный домен первого CAR и трансмембранный домен второго CAR, особенно если одинаковые или схожие трансмембранные домены используются в первом и втором CAR. На фиг. 4 представлены две последовательности, кодирующие трансмембранный домен CD28, в одном из которых были использованы альтернативные кодоны.
Альтернативные кодоны могут быть использованы в тех частях последовательности нуклеиновой кислоты, которые кодируют весь или часть эндодомен(а) первого CAR и весь или часть эндодомен(а) второго CAR. Альтернативные кодоны могут быть использованы в эндодомене CD3 дзета. На фиг. 4 представлены две последовательности, кодирующие эндодомен CD3 дзета, в одном из которых были использованы альтернативные кодоны.
Альтернативные кодоны могут быть использованы в одном или более костимулирующих доменов, таких как эндодомен CD28.
Альтернативные кодоны могут быть использованы в одном или более доменов, которые передают сигналы выживания, таких как эндодомены OX40 и 41BB.
Альтернативные кодоны могут быть использованы в тех частях последовательности нуклеиновой кислоты, которые кодируют эндодомен CD3 дзета, и/или тех частях последовательности нуклеиновой кислоты, которые кодируют один или более костимулирующих доменов, и/или тех частях последовательности нуклеиновой кислоты, которые кодируют один или более доменов, которые передают сигналы выживания.
ВЕКТОР
Изобретение также относится к вектору, или набору векторов, который включает одну или более кодирующих CAR последовательностей нуклеиновых кислот. Такой вектор может использоваться для введения последовательности(ей) нуклеиновой кислоты в клетку-хозяина для экспрессии в ней первого и второго CAR.
Вектор может, например, представлять собой плазмиду или вирусный вектор, такой как ретровирусный вектор или лентивирусный вектор, или вектор на основе транспозона, или синтетическую мРНК.
Вектор может быть способен к трансфекции или трансдукции Т-клетки.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
Настоящее изобретение также относится к фармацевтической композиции, содержащей множество экспрессирующих CAR клеток, таких как Т-клетки или NK-клеток в соответствии с первым аспектом настоящего изобретения. Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель, разбавитель или наполнитель. Фармацевтическая композиция необязательно может содержать один или более дополнительных фармацевтически активных полипептидов и/или соединений. Такая композиция может, например, быть в форме, подходящей для внутривенной инфузии.
СПОСОБ ЛЕЧЕНИЯ
Клетки настоящего изобретения способны уничтожать раковые клетки, такие как клетки В-клеточных лимфом. Экспрессирующие CAR клетки, такие как Т-клетки, могут быть созданы ex vivo, или из собственной периферической крови пациента (1-ая сторона), или в условиях трансплантации гемопоэтических стволовых клеток из периферической крови от донора (2-ая сторона) или периферической крови от несвязанного донора (3-ая сторона). В качестве альтернативы, экспрессирующие CAR клетки могут быть получены путем ex vivo дифференциации индуцируемых клеток-предшественников или эмбриональных клеток-предшественников в Т-клетки. В этих случаях экспрессирующие CAR Т-клетки создают путем введения ДНК или РНК, кодирующей CAR, одним из многих способов, включая трансдукцию с использованием вирусного вектора, трансфекцию с использованием ДНК или РНК.
Клетки настоящего изобретения могут быть способны уничтожать клетки-мишени, такие как раковые клетки. Клетку-мишень можно распознать по экспрессии CD19 или CD22.
Таблица 4 - Экспрессия лимфоидных антигенов в лимфоидных лейкозах
Взятые из Campana et al. (Immunophenotyping of leukemia. J. Immunol. Methods 243, 59-75 (2000)), cIg μ - тяжелая цепь цитоплазматического иммуноглобулина; sIg μ - тяжелая цепь поверхностного иммуноглобулина.
Экспрессия в большинстве случаев изученных лимфоидных антигенов в различных типах В-клеточных лейкозов близко отражает таковую В-клеточного онтогенеза (фиг. 2).
Т-клетка настоящего изобретения может быть использована для лечения рака, в частности В-клеточных злокачественных опухолей.
Примерами раков, которые экспрессируют CD19 или CD22, являются В-клеточные лимфомы, включая лимфому Ходжкина и неходжкинскую лимфому; и В-клеточные лейкозы.
Например, В-клеточная лимфома может быть диффузной В-крупноклеточной лимфомой (DLBCL), фолликулярной лимфомой, лимфомой маргинальной зоны (MZL) или ассоциированной со слизистой оболочной лимфомой лимфатической ткани (MALT), мелкоклеточный лимфоцитарной лимфомой (перекрывается с хроническим лимфоцитарным лейкозом), лимфомой из клеток мантийной зоны (MCL), лимфомой Беркитта, первичной медиастинальной (из вилочковой железы) В-крупноклеточной лимфомой, лимфоплазмоцитарной лимфомой (может проявляться как макроглобулинемия Вальденстрема), В-клеточной лимфомой маргинальной зоны узелковой формы (NMZL), лимфомой маргинальной зоны селезенки (SMZL), внутрисосудистой В-крупноклеточной лимфомой, первичной выпотной лимфомой, лимфоматоидным гранулематозом, богатой Т-клетками/гистиоцитами В-крупноклеточной лимфомой или первичной лимфомой центральной нервной системы.
В-клеточный лейкоз может быть острым лимфобластным лейкозом, хроническим В-лимфолейкозом, В-пролимфоцитарным лейкозом, лимфобластным лейкозом из предшественником В-клеток или волосатоклеточным лейкозом.
В-клеточный лейкоз может быть острым лимфобластным лейкозом.
Лечение с помощью Т-клеток настоящего изобретения может помочь предотвратить ускользание или утечку опухолевых клеток, которое часто происходит в случае стандартных подходов.
Настоящее изобретение будет теперь дополнительно описано с помощью примеров, которые, как подразумевается, призваны помочь специалисту со средним уровнем компетентности в данной области техники при осуществлении настоящего изобретения и не предназначены каким-либо образом ограничить объем настоящего изобретения.
ПРИМЕРЫ
Пример 1 - Доказательство правильности логической схемы «ИЛИ» CD19/CD22
Схема CAR против CD19 «ИЛИ» CD22 была создана путем коэкспрессии CAR против CD19 и CD22 в одном и том же векторе. CD19-связующим элементом был scFv, происходящий из антитела В4 с измененной поверхностью (Roguska et al. (1996) Protein Eng. 9, 895-904), а CD22-связующим элементом был scFv, происходящий из гуманизированного антитела RFB4. Для обоих CAR был использован спейсер на основе шарнирной области-СН2-СН3 IgG1, кодирующая последовательность которого была с неоднозначным соответствием кодонов во избежание гомологичной рекомбинации на основе интегрирующегося вектора. ТМ-домен в обоих CAR был производным такового CD28, и оба эндодомена CAR состояли из CD3-Дзета. Опять же, эти гомологичные последовательности были с неоднозначным соответствием кодонов. Коэкспрессия была достигнута путем клонирования двух CAR в рамке считывания, разделенных пептидом FMD-2A. Нуклеотидная и аминокислотная последовательности конструкции схемы «ИЛИ» CD19/CD22 представлены как SEQ ID NO:13 и 14, соответственно.
SEQ ID NO:13
ATGAGCCTGCCCGTGACCGCCCTGCTGCTGCCCCTGGCCCTGCTGCTGCACGC CGCCAGACCATACCCCTACGACGTGCCCGACTACGCCAGCCTGAGCGGAGGCGGCG GCAGCCAGGTGCAGCTGGTGCAGAGCGGAGCCGAGGTGAAGAAGCCTGGCGCCAG CGTGAAGGTGTCCTGTAAGGCCAGCGGCTACACCTTCACCAGCAACTGGATGCACT GGGTGAGGCAGGCCCCTGGACAGGGACTGGAGTGGATGGGCGAGATCGACCCCAG CGACAGCTACACCAACTACAACCAGAAGTTCAAGGGCCGGGTGACCATCACCGTGG ATAAGAGCGCCAGCACCGCCTACATGGAGCTGTCCAGCCTGAGAAGCGAGGATACC GCCGTGTACTACTGTGCCAGAGGCAGCAACCCCTACTACTACGCTATGGACTACTGG GGCCAGGGCACCCTGGTGACCGTGTCCAGCGGCGGAGGAGGAAGCGGAGGGGGCG GATCTGGCGGCGGAGGGAGCGAGATCGTGCTGACCCAGAGCCCCGCCACCCTGAGC CTGAGCCCTGGCGAGAGAGCCACCCTGTCCTGTAGCGCCAGCAGCGGCGTGAATTA CATGCACTGGTATCAGCAGAAGCCCGGCCAGGCCCCCAGAAGATGGATCTACGACA CCAGCAAGCTGGCCAGCGGCGTGCCCGCCAGATTCAGCGGCAGCGGCTCCGGCACC AGCTACAGCCTGACCATCAGCAGCCTGGAGCCTGAGGATTTCGCCGTGTATTATTGC CACCAGAGGGGCAGCTACACCTTTGGCGGCGGAACAAAGCTGGAGATCAAGCGCTC AGATCCCACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGT CGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTG CACACGAGGGGGCTGGACTTCGCCTGTGATATCTTTTGGGTGCTGGTGGTGGTTGGT GGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTGA GGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAA CCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACA AGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCA GGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAG ATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGG GTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCTC CTCGCAGAGCCGAGGGCAGGGGAAGTCTTCTAACATGCGGGGACGTGGAGGAAAAT CCCGGGCCCATGGAGTTTGGGCTGAGCTGGCTTTTTCTTGTGGCTATTTTAAAAGGT GTCCAGTGCGAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCAGGGGG GTCCCTGCGCCTCTCCTGTGCAGCCTCTGGATTCGCTTTCAGTATCTATGACATGTCT TGGGTCCGCCAGGTTCCGGGGAAGGGGCTGGAGTGGGTCTCATATATTAGTAGTGG TGGTGGTACCACCTATTACCCGGACACTGTGAAGGGCCGCTTCACCATCTCCCGTGA CAATTCCCGCAACACTCTGGATCTTCAAATGAACAGTCTGCGCGTCGAGGACACGGC TGTCTATTATTGTGCGCGTCATAGTGGCTACGGTAGTAGCTACGGGGTTTTGTTTGCT TACTGGGGCCAAGGAACCCTGGTCACCGTCTCCTCAGGTGGAGGCGGTTCAGGCGG AGGTGGCTCTGGCGGTGGCGGATCGGACATCCAGATGACTCAGTCTCCGTCCTCCCT GTCTGCATCTGTAGGAGACCGCGTCACCATCACCTGCCGTGCAAGTCAGGACATTAG CAATTATTTAAACTGGCTTCAACAGAAACCGGGGAAAGCCCCGAAGCTCCTGATTTA CTACACATCAATCTTACACTCAGGAGTCCCGTCACGCTTCAGCGGCAGTGGATCTGG GACAGAATTCACTCTCACAATCAGCAGCCTGCAGCCGGAAGATTTTGCAACTTATTA CTGTCAACAGGGTAATACGCTTCCGTGGACGTTTGGCCAGGGGACCAAACTGGAAA TCAAACGTTCGGATCCAGCCGAACCAAAGAGCCCCGATAAGACCCACACCTGTCCC CCCTGCCCAGCCCCAGAGCTGCTGGGAGGCCCCAGCGTGTTTCTGTTTCCACCCAAG CCAAAGGATACCCTGATGATTAGTAGAACACCCGAAGTGACCTGTGTGGTGGTGGA TGTGTCTCACGAGGACCCCGAGGTGAAATTTAATTGGTATGTTGATGGTGTTGAAGT GCACAACGCCAAAACCAAACCCAGAGAGGAGCAGTACAATTCTACCTATAGAGTCG TGTCTGTGCTGACAGTGCTGCATCAGGATTGGCTGAACGGAAAAGAATACAAATGT AAAGTGAGCAATAAGGCCCTGCCCGCTCCAATTGAGAAGACAATTAGCAAGGCCAA GGGCCAGCCAAGGGAGCCCCAGGTGTATACACTGCCACCCAGTAGAGACGAACTGA CAAAGAATCAGGTGTCTCTGACATGTCTGGTGAAGGGATTTTACCCATCTGATATCG CCGTGGAATGGGAATCTAACGGCCAGCCCGAGAATAACTATAAGACAACCCCACCA GTGCTGGATAGCGATGGCAGCTTTTTTCTGTATTCTAAGCTGACAGTGGATAAGTCC CGGTGGCAGCAGGGAAATGTGTTTAGCTGTAGTGTCATGCATGAGGCCCTGCACAA TCACTATACCCAGAAATCTCTGAGTCTGAGCCCAGGCAAGAAGGACCCCAAGTTCT GGGTCCTGGTGGTGGTGGGAGGCGTGCTGGCCTGTTACTCTCTCCTGGTGACCGTGG CCTTCATCATCTTTTGGGTGCGCTCCCGGGTGAAGTTTTCTCGCTCTGCCGATGCCCC AGCCTATCAGCAGGGCCAGAATCAGCTGTACAATGAACTGAACCTGGGCAGGCGGG AGGAGTACGACGTGCTGGATAAGCGGAGAGGCAGAGACCCCGAGATGGGCGGCAA ACCACGGCGCAAAAATCCCCAGGAGGGACTCTATAACGAGCTGCAGAAGGACAAA ATGGCCGAGGCCTATTCCGAGATCGGCATGAAGGGAGAGAGAAGACGCGGAAAGG GCCACGACGGCCTGTATCAGGGATTGTCCACCGCTACAAAAGATACATATGATGCC CTGCACATGCAGGCCCTGCCACCCAGATGA
SEQ ID NO:14
MSLPVTALLLPLALLLHAARPYPYDVPDYASLSGGGGSQVQLVQSGAEVKKPGA SVKVSCKASGYTFTSNWMHWVRQAPGQGLEWMGEIDPSDSYTNYNQKFKGRVTITVD KSASTAYMELSSLRSEDTAVYYCARGSNPYYYAMDYWGQGTLVTVSSGGGGSGGGGS GGGGSEIVLTQSPATLSLSPGERATLSCSASSGVNYMHWYQQKPGQAPRRWIYDTSKLA SGVPARFSGSGSGTSYSLTISSLEPEDFAVYYCHQRGSYTFGGGTKLEIKRSDPTTTPAPR PPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIFWVLVVVGGVLACYSLLVTV AFIIFWVRRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPR RKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHM QALPPRRAEGRGSLLTCGDVEENPGPMEFGLSWLFLVAILKGVQCEVQLVESGGGLVQP GGSLRLSCAASGFAFSIYDMSWVRQVPGKGLEWVSYISSGGGTTYYPDTVKGRFTISRD NSRNTLDLQMNSLRVEDTAVYYCARHSGYGSSYGVLFAYWGQGTLVTVSSGGGGSGG GGSGGGGSDIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWLQQKPGKAPKLLIYYTS ILHSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKLEIKRSDPAE PKSPDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFN WYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIE KTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYK TTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKKDP KFWVLVVVGGVLACYSLLVTVAFIIFWVRSRVKFSRSADAPAYQQGQNQLYNELNLGR REEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKG HDGLYQGLSTATKDTYDALHMQALPPR
Для демонстрации коэкспрессии обоих CAR, scFv каждого CAR был помечен эпитопной меткой (HA или V5, соответственно). Эта последующая одна открытая рамка считывания была клонирована в ретровирусный вектор SFG. Т-клетки были трансдуцированы этим вектором, и оба CAR можно было обнаружить на поверхности Т-клеток, экспрессирующих кассеты, с помощью окрашивания с использованием анти-HA и анти-V5 и изучения экспрессии с помощью проточной цитометрии.
Затем Т-клетки, экспрессирующие схему CAR против CD19 «ИЛИ» CD22, подвергали стимуляции с использованием клеток-мишеней, экспрессирующих ни тот ни другой, оба или один антиген, наряду с контрольными Т-клетками, которые не экспрессировали CAR, или только CAR против CD19, или только CAR против CD22. Авторы настоящего изобретения установили, что Т-клетки, экспрессирующие CAR по схеме «ИЛИ», могут уничтожать клетки-мишени, экспрессирующие один или оба антигена-мишени (фиг. 5).
Пример 2 - Идентификация и характеристика CD19ALAb и CD22ALAb
CD19-связующий элемент (CD19ALAb) был идентифицирован, гуманизирован, и аффинности как мышиных, так и гуманизированных IgG и scFv были определены и сравнены с CD19-связующим элементом, fmc63, в качестве «золотого стандарта». Параллельно с этим, и CD22-связующий элемент (CD22ALAb) был идентифицирован, гуманизирован, и аффинности как мышиных, так и гуманизированных IgG и scFv были определены и сравнены с CD22-связующим элементом, M971, в качестве «золотого стандарта».
Эксперименты проводились на приборе Biacore T200 с использованием HBS-P в качестве подвижного буфера и буфера для разведения. Программное обеспечение BIAevaluation версии 2.0 использовалось для обработки данных. Для анализа кинетики связывания, мышиное Ат против IgG человека или козье Ат против IgG мыши ковалентно связывали с сенсорным чипом CM5. IgG или белки scFv-Fc были захвачены, и различные концентрации белка-партнера по взаимодействию вводили через проточную ячейку со скоростью потока 30 мкл/мин. Кинетические константы скорости были получены путем подгонки кривой в соответствии с моделью связывания 1:1 Ленгмюра. Различия в величинах индекса преломления вычитали, используя проточную ячейку в качестве контроля, в которой использованное для захвата антитело были иммобилизовано на том же уровне, что и в случае активной поверхности. Вычитание двух контрольных точек выполняли, используя только буфер.
Результаты представлены на фиг. 6-8.
Данные показывают, что гуманизированное CD22ALAb имело аффинность связывания с CD22, сравнимую с таковой мышиного CD22ALAb (фиг. 6), и схожую кинетику связывания. И мышиное, и гуманизированное CD22ALAb в формате scFv имели значительно более высокую аффинность связывания с CD22, чем CD22-связывающее антитело, M971, в качестве «золотого стандарта» (фиг. 6).
Хотя было установлено, что аффинность связывания мышиного и гуманизированного CD19ALAb в формате IgG является схожей (не представленные данные), неожиданно было обнаружено, что аффинность гуманизированного CD19ALAb выше таковой мышиного CD19ALAb в формате scFv (фиг. 7). Аффинность CD19ALAb является сравнимой (возможно, немного лучше) с таковой Ат против CD-19, fmc63, в качестве «золотого стандарта» (фиг. 8).
Пример 3 - Сравнительные функциональные анализы с использованием CD19ALAb/fmc63 CAR и CD22ALAb/M971 CAR
Антигенсвязывающий домен CAR может повлиять на его функционирование. В этом исследовании были созданы CAR, включающие CD19ALAb и CD22ALAb, и функцию сравнивали с эквивалентным CAR, содержащим антигенсвязывающий домен на основе fmc63 или M971.
CAR, включающие scFv на основе fmc63 (против CD19) и M971 (против CD22), можно рассматривать в качестве являющихся золотым стандартом антител, поскольку оба CAR находятся в стадии клинической разработки.
Были сконструированы и экспрессированы CAR на основе CD19ALAb, fmc63, CD22ALAb и M971. Их структура представлена на фиг. 9. CAR отличались только их антигенсвязывающим доменом. Во всех конструкциях связывающие домены были связаны с мембраной с помощью спейсера на основе ножки CD8 и содержали внутриклеточные активирующие мотивы из 41BB и CD3-дзета.
Ретровирусы были получены путем кратковременной трансфекции клеток 293Т плазмидами, кодирующими CAR, gag/pol и белок оболочки RD114. Спустя 3 дня супернатанты собирали и использовали для трансдукции PHA/IL-2-активированных PBMC равными титрами ретровируса в покрытых ретронектином планшетах. Через шесть дней после трансдукции экспрессию CAR подтверждали с помощью проточной цитометрии, и РВМС сокультивировали в соотношении 1:1 или с CD19+ BFP SupT1 клетками (fmc63 и CD19ALAb CAR), или с CD22+ BFP SupT1 клетками (M971 и CD22ALAb CAR). Уничтожение клеток-мишеней оценивали через один и три дня. Также спустя один и три дня супернатанты удаляли, и уровни интерферона-γ анализировали с помощью ELISA.
Результаты представлены на фиг. 10 и 11.
Как показано на фиг. 10, CAR с антигенсвязывающим доменом CD19ALAb обеспечивал большее уничтожение CD19+ клеток-мишеней (фиг. 10) как в день 1, так и в 3ь, чем эквивалентный CAR с связывающим доменом fmc63.
Что касается CD22, CAR с антигенсвязывающим доменом CD22ALAb обеспечивал большее уничтожение CD22+ клеток-мишеней (фиг. 11а) спустя три дня, чем эквивалентный CAR со связывающим доменом M971. Выброс IFNγ был значительно выше в случае CAR на основе CD22ALAb, чем в случае CAR на основе M971 спустя тот же период времени.
Следовательно, CAR, содержащий антигенсвязывающий домен на основе CD19ALAb и CD22ALAb, обладает улучшенными свойствами в плане уничтожения клеток-мишеней, чем эквивалентные CAR на основе fmc63 и M971.
Результат, относящийся к CD22ALAb, является особенно удивительным, учитывая результаты, представленные в Haso et al. (2013), как указано выше. В этом исследовании были сконструированы и проверены различные CAR против CD22, со связывающими доменами на основе антител против CD22 HA22, BL22 и m971. scFv HA22 и BL22 связываются с Ig-доменом 3 CD22, тогда как m971 связывается в пределах Ig-домена 5-7 CD22 (смотрите Haso et al. (2013) фиг. 2B). Сообщалось, что происходящий от m971 CAR демонстрирует более высокую активность уничтожения клеток-мишеней, чем происходящий от HA22 CAR, при этом эти результаты связаны с важностью эпитопа CD22, который является мишенью CAR (Haso et al. (2013) стр. 1168, последний полный абзац). Сделан вывод, что таргетирование проксимального к мембране домена CD22 является «ключевым элементом» при разработке очень активного CAR против CD22 (Обсуждение, последний абзац). В противоположность этому результату, данные, приведенные здесь на фиг. 11, показывают, что CD22ALAb, мишенью которого является эпитоп в Ig-домене 3 CD22 - «дистальный от мембраны» эпитоп по сравнению с эпитопом в Ig-домене 5-7, который является мишенью m971 - обладает лучшей способностью к уничтожению клеток-мишеней, чем CAR против CD22 на основе m971.
Пример 4 - Исследование конструкций схемы «ИЛИ» с различными комбинациями эндодоменов
Были разработаны четыре конструкции схемы «ИЛИ», как показано на фиг. 13. Все они кодировали схемы «ИЛИ» CD19/CD22, содержащие одинаковые антигенсвязывающие домены, спейсерные домены и трансмембранные домены: единственное различие между конструкциями заключалось в эндодоменах, которые были эндодоменами, представленными в следующей таблице:
Способность клеток, экспрессирующих каждую схему «ИЛИ» CD19/CD22, к уничтожению клеток Raji in vivo анализировали, как описано выше. Трансдуцированные РВМС, экспрессирующие различные комбинации схемы «ИЛИ», сокультивировали в течение 72 часов с CD19+/CD22+ клетками Raji-мишенями при соотношении эффектор:клетка-мишень как 1:1, так и 1:10.
Результаты представлены на фиг. 14. Было установлено, что все четыре схемы «ИЛИ» уничтожают клетки-мишени значительно лучше, чем CAR на основе fmc63 и M971. Было установлено, что при соотношении эффектор:клетка-мишень, составляющем 1:10, схемы «ИЛИ» с «разделенными» эндодоменами, которые содержат 4-1BBдзета/OX40дзета в одном CAR и CD28-дзета в другом CAR, обладали наибольшей активностью уничтожения.
Все публикации, упомянутые в приведенном выше описании, включены сюда посредством ссылки. Различные модификации и вариации описанных способов и систем настоящего изобретения будут очевидны специалистам в данной области техники без отхода от объема и сущности настоящего изобретения. Хотя настоящее изобретение было описано в связи с конкретными предпочтительными вариантами осуществления, следует понимать, что заявленное изобретение не должно чрезмерно ограничиваться такими конкретными вариантами осуществления. В самом деле, различные модификации описанных способов осуществления настоящего изобретения, которые очевидны специалистам в области молекулярной биологии, клеточной биологии или смежных областях, как предполагается, находятся в пределах объема нижеследующей формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> UCL Business PLC
Autolus Ltd.
<120> КЛЕТКА
<130> P106469PCT
<150> GB 1423172.4
<151> 2014-12-24
<160> 49
<170> Патент в версии 3.5
<210> 1
<211> 21
<212> Белок
<213> Искусственная последовательность
<220>
<223> Сигнальный пептид
<400> 1
Met Gly Thr Ser Leu Leu Cys Trp Met Ala Leu Cys Leu Leu Gly Ala
1 5 10 15
Asp His Ala Asp Gly
20
<210> 2
<211> 21
<212> Белок
<213> Искусственная последовательность
<220>
<223> Сигнальный пептид
<400> 2
Met Ser Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 3
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Сигнальный пептид
<400> 3
Met Ala Val Pro Thr Gln Val Leu Gly Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Asp Ala Arg Cys
20
<210> 4
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> спейсерная последовательность, шарнирная область-CH2CH3
IgG1 человека
<400> 4
Ala Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys Lys Asp
225 230
<210> 5
<211> 46
<212> Белок
<213> Искусственная последовательность
<220>
<223> спейсерная последовательность, ножка CD8 человека
<400> 5
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
35 40 45
<210> 6
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> спейсерная последовательность, шарнирная область IgG1
человека
<400> 6
Ala Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
Lys Asp Pro Lys
20
<210> 7
<211> 185
<212> Белок
<213> Искусственная последовательность
<220>
<223> спейсерная последовательность, эктодомен CD2
<400> 7
Lys Glu Ile Thr Asn Ala Leu Glu Thr Trp Gly Ala Leu Gly Gln Asp
1 5 10 15
Ile Asn Leu Asp Ile Pro Ser Phe Gln Met Ser Asp Asp Ile Asp Asp
20 25 30
Ile Lys Trp Glu Lys Thr Ser Asp Lys Lys Lys Ile Ala Gln Phe Arg
35 40 45
Lys Glu Lys Glu Thr Phe Lys Glu Lys Asp Thr Tyr Lys Leu Phe Lys
50 55 60
Asn Gly Thr Leu Lys Ile Lys His Leu Lys Thr Asp Asp Gln Asp Ile
65 70 75 80
Tyr Lys Val Ser Ile Tyr Asp Thr Lys Gly Lys Asn Val Leu Glu Lys
85 90 95
Ile Phe Asp Leu Lys Ile Gln Glu Arg Val Ser Lys Pro Lys Ile Ser
100 105 110
Trp Thr Cys Ile Asn Thr Thr Leu Thr Cys Glu Val Met Asn Gly Thr
115 120 125
Asp Pro Glu Leu Asn Leu Tyr Gln Asp Gly Lys His Leu Lys Leu Ser
130 135 140
Gln Arg Val Ile Thr His Lys Trp Thr Thr Ser Leu Ser Ala Lys Phe
145 150 155 160
Lys Cys Thr Ala Gly Asn Lys Val Ser Lys Glu Ser Ser Val Glu Pro
165 170 175
Val Ser Cys Pro Glu Lys Gly Leu Asp
180 185
<210> 8
<211> 259
<212> Белок
<213> Искусственная последовательность
<220>
<223> спейсерная последовательность, эктодомен CD34
<400> 8
Ser Leu Asp Asn Asn Gly Thr Ala Thr Pro Glu Leu Pro Thr Gln Gly
1 5 10 15
Thr Phe Ser Asn Val Ser Thr Asn Val Ser Tyr Gln Glu Thr Thr Thr
20 25 30
Pro Ser Thr Leu Gly Ser Thr Ser Leu His Pro Val Ser Gln His Gly
35 40 45
Asn Glu Ala Thr Thr Asn Ile Thr Glu Thr Thr Val Lys Phe Thr Ser
50 55 60
Thr Ser Val Ile Thr Ser Val Tyr Gly Asn Thr Asn Ser Ser Val Gln
65 70 75 80
Ser Gln Thr Ser Val Ile Ser Thr Val Phe Thr Thr Pro Ala Asn Val
85 90 95
Ser Thr Pro Glu Thr Thr Leu Lys Pro Ser Leu Ser Pro Gly Asn Val
100 105 110
Ser Asp Leu Ser Thr Thr Ser Thr Ser Leu Ala Thr Ser Pro Thr Lys
115 120 125
Pro Tyr Thr Ser Ser Ser Pro Ile Leu Ser Asp Ile Lys Ala Glu Ile
130 135 140
Lys Cys Ser Gly Ile Arg Glu Val Lys Leu Thr Gln Gly Ile Cys Leu
145 150 155 160
Glu Gln Asn Lys Thr Ser Ser Cys Ala Glu Phe Lys Lys Asp Arg Gly
165 170 175
Glu Gly Leu Ala Arg Val Leu Cys Gly Glu Glu Gln Ala Asp Ala Asp
180 185 190
Ala Gly Ala Gln Val Cys Ser Leu Leu Leu Ala Gln Ser Glu Val Arg
195 200 205
Pro Gln Cys Leu Leu Leu Val Leu Ala Asn Arg Thr Glu Ile Ser Ser
210 215 220
Lys Leu Gln Leu Met Lys Lys His Gln Ser Asp Leu Lys Lys Leu Gly
225 230 235 240
Ile Leu Asp Phe Thr Glu Gln Asp Val Ala Ser His Gln Ser Tyr Ser
245 250 255
Gln Lys Thr
<210> 9
<211> 140
<212> Белок
<213> Искусственная последовательность
<220>
<223> включающая трансмембранный домен CD28 и эндодомен CD3-дзета
<400> 9
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Arg Val Lys Phe
20 25 30
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
35 40 45
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
50 55 60
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
65 70 75 80
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
85 90 95
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
100 105 110
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
115 120 125
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
130 135 140
<210> 10
<211> 180
<212> Белок
<213> Искусственная последовательность
<220>
<223> включающая трансмембранный домен CD28 и эндодомены CD28
и CD3-дзета
<400> 10
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
20 25 30
Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
35 40 45
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
50 55 60
Ala Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
65 70 75 80
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
85 90 95
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
100 105 110
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
115 120 125
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
130 135 140
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
145 150 155 160
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
165 170 175
Leu Pro Pro Arg
180
<210> 11
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> включающая трансмембранный домен CD28 и эндодомены CD28,
OX40 и CD3-дзета
<400> 11
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
20 25 30
Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
35 40 45
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
50 55 60
Ala Tyr Arg Ser Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro
65 70 75 80
Pro Gly Gly Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp
85 90 95
Ala His Ser Thr Leu Ala Lys Ile Arg Val Lys Phe Ser Arg Ser Ala
100 105 110
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
115 120 125
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
130 135 140
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
145 150 155 160
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
165 170 175
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
180 185 190
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
195 200 205
His Met Gln Ala Leu Pro Pro Arg
210 215
<210> 12
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> 2A-подобная последовательность
<400> 12
Arg Ala Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu
1 5 10 15
Asn Pro Gly Pro
20
<210> 13
<211> 3402
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Конструкция схемы «ИЛИ» CD19/CD22
<400> 13
atgagcctgc ccgtgaccgc cctgctgctg cccctggccc tgctgctgca cgccgccaga 60
ccatacccct acgacgtgcc cgactacgcc agcctgagcg gaggcggcgg cagccaggtg 120
cagctggtgc agagcggagc cgaggtgaag aagcctggcg ccagcgtgaa ggtgtcctgt 180
aaggccagcg gctacacctt caccagcaac tggatgcact gggtgaggca ggcccctgga 240
cagggactgg agtggatggg cgagatcgac cccagcgaca gctacaccaa ctacaaccag 300
aagttcaagg gccgggtgac catcaccgtg gataagagcg ccagcaccgc ctacatggag 360
ctgtccagcc tgagaagcga ggataccgcc gtgtactact gtgccagagg cagcaacccc 420
tactactacg ctatggacta ctggggccag ggcaccctgg tgaccgtgtc cagcggcgga 480
ggaggaagcg gagggggcgg atctggcggc ggagggagcg agatcgtgct gacccagagc 540
cccgccaccc tgagcctgag ccctggcgag agagccaccc tgtcctgtag cgccagcagc 600
ggcgtgaatt acatgcactg gtatcagcag aagcccggcc aggcccccag aagatggatc 660
tacgacacca gcaagctggc cagcggcgtg cccgccagat tcagcggcag cggctccggc 720
accagctaca gcctgaccat cagcagcctg gagcctgagg atttcgccgt gtattattgc 780
caccagaggg gcagctacac ctttggcggc ggaacaaagc tggagatcaa gcgctcagat 840
cccaccacga cgccagcgcc gcgaccacca acaccggcgc ccaccatcgc gtcgcagccc 900
ctgtccctgc gcccagaggc gtgccggcca gcggcggggg gcgcagtgca cacgaggggg 960
ctggacttcg cctgtgatat cttttgggtg ctggtggtgg ttggtggagt cctggcttgc 1020
tatagcttgc tagtaacagt ggcctttatt attttctggg tgaggagagt gaagttcagc 1080
aggagcgcag acgcccccgc gtaccagcag ggccagaacc agctctataa cgagctcaat 1140
ctaggacgaa gagaggagta cgatgttttg gacaagagac gtggccggga ccctgagatg 1200
gggggaaagc cgagaaggaa gaaccctcag gaaggcctgt acaatgaact gcagaaagat 1260
aagatggcgg aggcctacag tgagattggg atgaaaggcg agcgccggag gggcaagggg 1320
cacgatggcc tttaccaggg tctcagtaca gccaccaagg acacctacga cgcccttcac 1380
atgcaggccc tgcctcctcg cagagccgag ggcaggggaa gtcttctaac atgcggggac 1440
gtggaggaaa atcccgggcc catggagttt gggctgagct ggctttttct tgtggctatt 1500
ttaaaaggtg tccagtgcga ggtgcagctg gtggagtctg ggggaggctt ggtccagcca 1560
ggggggtccc tgcgcctctc ctgtgcagcc tctggattcg ctttcagtat ctatgacatg 1620
tcttgggtcc gccaggttcc ggggaagggg ctggagtggg tctcatatat tagtagtggt 1680
ggtggtacca cctattaccc ggacactgtg aagggccgct tcaccatctc ccgtgacaat 1740
tcccgcaaca ctctggatct tcaaatgaac agtctgcgcg tcgaggacac ggctgtctat 1800
tattgtgcgc gtcatagtgg ctacggtagt agctacgggg ttttgtttgc ttactggggc 1860
caaggaaccc tggtcaccgt ctcctcaggt ggaggcggtt caggcggagg tggctctggc 1920
ggtggcggat cggacatcca gatgactcag tctccgtcct ccctgtctgc atctgtagga 1980
gaccgcgtca ccatcacctg ccgtgcaagt caggacatta gcaattattt aaactggctt 2040
caacagaaac cggggaaagc cccgaagctc ctgatttact acacatcaat cttacactca 2100
ggagtcccgt cacgcttcag cggcagtgga tctgggacag aattcactct cacaatcagc 2160
agcctgcagc cggaagattt tgcaacttat tactgtcaac agggtaatac gcttccgtgg 2220
acgtttggcc aggggaccaa actggaaatc aaacgttcgg atccagccga accaaagagc 2280
cccgataaga cccacacctg tcccccctgc ccagccccag agctgctggg aggccccagc 2340
gtgtttctgt ttccacccaa gccaaaggat accctgatga ttagtagaac acccgaagtg 2400
acctgtgtgg tggtggatgt gtctcacgag gaccccgagg tgaaatttaa ttggtatgtt 2460
gatggtgttg aagtgcacaa cgccaaaacc aaacccagag aggagcagta caattctacc 2520
tatagagtcg tgtctgtgct gacagtgctg catcaggatt ggctgaacgg aaaagaatac 2580
aaatgtaaag tgagcaataa ggccctgccc gctccaattg agaagacaat tagcaaggcc 2640
aagggccagc caagggagcc ccaggtgtat acactgccac ccagtagaga cgaactgaca 2700
aagaatcagg tgtctctgac atgtctggtg aagggatttt acccatctga tatcgccgtg 2760
gaatgggaat ctaacggcca gcccgagaat aactataaga caaccccacc agtgctggat 2820
agcgatggca gcttttttct gtattctaag ctgacagtgg ataagtcccg gtggcagcag 2880
ggaaatgtgt ttagctgtag tgtcatgcat gaggccctgc acaatcacta tacccagaaa 2940
tctctgagtc tgagcccagg caagaaggac cccaagttct gggtcctggt ggtggtggga 3000
ggcgtgctgg cctgttactc tctcctggtg accgtggcct tcatcatctt ttgggtgcgc 3060
tcccgggtga agttttctcg ctctgccgat gccccagcct atcagcaggg ccagaatcag 3120
ctgtacaatg aactgaacct gggcaggcgg gaggagtacg acgtgctgga taagcggaga 3180
ggcagagacc ccgagatggg cggcaaacca cggcgcaaaa atccccagga gggactctat 3240
aacgagctgc agaaggacaa aatggccgag gcctattccg agatcggcat gaagggagag 3300
agaagacgcg gaaagggcca cgacggcctg tatcagggat tgtccaccgc tacaaaagat 3360
acatatgatg ccctgcacat gcaggccctg ccacccagat ga 3402
<210> 14
<211> 1133
<212> Белок
<213> Искусственная последовательность
<220>
<223> Конструкция схемы «ИЛИ» CD19/CD22
<400> 14
Met Ser Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Tyr Pro Tyr Asp Val Pro Asp Tyr Ala Ser Leu
20 25 30
Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu
35 40 45
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
50 55 60
Tyr Thr Phe Thr Ser Asn Trp Met His Trp Val Arg Gln Ala Pro Gly
65 70 75 80
Gln Gly Leu Glu Trp Met Gly Glu Ile Asp Pro Ser Asp Ser Tyr Thr
85 90 95
Asn Tyr Asn Gln Lys Phe Lys Gly Arg Val Thr Ile Thr Val Asp Lys
100 105 110
Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
115 120 125
Thr Ala Val Tyr Tyr Cys Ala Arg Gly Ser Asn Pro Tyr Tyr Tyr Ala
130 135 140
Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
145 150 155 160
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val
165 170 175
Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala
180 185 190
Thr Leu Ser Cys Ser Ala Ser Ser Gly Val Asn Tyr Met His Trp Tyr
195 200 205
Gln Gln Lys Pro Gly Gln Ala Pro Arg Arg Trp Ile Tyr Asp Thr Ser
210 215 220
Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
225 230 235 240
Thr Ser Tyr Ser Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
245 250 255
Val Tyr Tyr Cys His Gln Arg Gly Ser Tyr Thr Phe Gly Gly Gly Thr
260 265 270
Lys Leu Glu Ile Lys Arg Ser Asp Pro Thr Thr Thr Pro Ala Pro Arg
275 280 285
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
290 295 300
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
305 310 315 320
Leu Asp Phe Ala Cys Asp Ile Phe Trp Val Leu Val Val Val Gly Gly
325 330 335
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
340 345 350
Trp Val Arg Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg Arg Ala Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
465 470 475 480
Val Glu Glu Asn Pro Gly Pro Met Glu Phe Gly Leu Ser Trp Leu Phe
485 490 495
Leu Val Ala Ile Leu Lys Gly Val Gln Cys Glu Val Gln Leu Val Glu
500 505 510
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
515 520 525
Ala Ala Ser Gly Phe Ala Phe Ser Ile Tyr Asp Met Ser Trp Val Arg
530 535 540
Gln Val Pro Gly Lys Gly Leu Glu Trp Val Ser Tyr Ile Ser Ser Gly
545 550 555 560
Gly Gly Thr Thr Tyr Tyr Pro Asp Thr Val Lys Gly Arg Phe Thr Ile
565 570 575
Ser Arg Asp Asn Ser Arg Asn Thr Leu Asp Leu Gln Met Asn Ser Leu
580 585 590
Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg His Ser Gly Tyr
595 600 605
Gly Ser Ser Tyr Gly Val Leu Phe Ala Tyr Trp Gly Gln Gly Thr Leu
610 615 620
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
625 630 635 640
Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
645 650 655
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp
660 665 670
Ile Ser Asn Tyr Leu Asn Trp Leu Gln Gln Lys Pro Gly Lys Ala Pro
675 680 685
Lys Leu Leu Ile Tyr Tyr Thr Ser Ile Leu His Ser Gly Val Pro Ser
690 695 700
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
705 710 715 720
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn
725 730 735
Thr Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
740 745 750
Ser Asp Pro Ala Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro
755 760 765
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
770 775 780
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
785 790 795 800
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
805 810 815
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
820 825 830
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
835 840 845
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
850 855 860
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
865 870 875 880
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
885 890 895
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
900 905 910
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
915 920 925
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
930 935 940
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
945 950 955 960
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
965 970 975
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Lys Asp Pro Lys
980 985 990
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
995 1000 1005
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Arg Val
1010 1015 1020
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
1025 1030 1035
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
1040 1045 1050
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
1055 1060 1065
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
1070 1075 1080
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
1085 1090 1095
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
1100 1105 1110
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
1115 1120 1125
Ala Leu Pro Pro Arg
1130
<210> 15
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Определяющий комплементарность участок 1 (CDR1) вариабельной
области тяжелой цепи (VH)
<400> 15
Ser Tyr Trp Met Asn
1 5
<210> 16
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR2 VH
<400> 16
Gln Ile Trp Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe Lys
1 5 10 15
<210> 17
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR3 VH
<400> 17
Arg Glu Thr Thr Thr Val Gly Arg Tyr Tyr Tyr Ala Met Asp Tyr
1 5 10 15
<210> 18
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR1 вариабельной области легкой цепи (VL)
<400> 18
Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr Leu Asn
1 5 10 15
<210> 19
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR2 VL
<400> 19
Asp Ala Ser Asn Leu Val Ser
1 5
<210> 20
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR3 VL
<400> 20
Gln Gln Ser Thr Glu Asp Pro Trp Thr
1 5
<210> 21
<211> 235
<212> Белок
<213> Искусственная последовательность
<220>
<223> химерный рецептор антигена (CAR), последовательность scFv
CD19ALAb мыши
<400> 21
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Trp Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Glu Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Glu Thr Thr Thr Val Gly Arg Tyr Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Asp Ile Gln Leu
115 120 125
Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr
130 135 140
Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr
145 150 155 160
Leu Asn Trp Tyr Gln Gln Ile Pro Gly Gln Pro Pro Lys Leu Leu Ile
165 170 175
Tyr Asp Ala Ser Asn Leu Val Ser Gly Ile Pro Pro Arg Phe Ser Gly
180 185 190
Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His Pro Val Glu Lys
195 200 205
Val Asp Ala Ala Thr Tyr His Cys Gln Gln Ser Thr Glu Asp Pro Trp
210 215 220
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
225 230 235
<210> 22
<211> 236
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность scFv CD19ALAb –
Тяжелая цепь 19, Легкая цепь каппа 16
<400> 22
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Gln Ile Trp Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Glu Ser Ala Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Gly Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Glu Thr Thr Thr Val Gly Arg Tyr Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Lys Gly Thr Leu Val Thr Val Ser Ser Asp Ile Gln Leu
115 120 125
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
130 135 140
Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr
145 150 155 160
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
165 170 175
Tyr Asp Ala Ser Asn Leu Val Ser Gly Val Pro Asp Arg Phe Ser Gly
180 185 190
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
195 200 205
Ala Asp Val Ala Val Tyr His Cys Gln Gln Ser Thr Glu Asp Pro Trp
210 215 220
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
225 230 235
<210> 23
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, последовательность VH CD19ALAb мыши
<400> 23
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Trp Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Glu Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Glu Thr Thr Thr Val Gly Arg Tyr Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 24
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность VH CD19ALAb
<400> 24
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Gln Ile Trp Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Glu Ser Ala Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Gly Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Glu Thr Thr Thr Val Gly Arg Tyr Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Lys Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 25
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, последовательность VL CD19ALAb мыши
<400> 25
Asp Ile Gln Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Leu Asn Trp Tyr Gln Gln Ile Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Val Ser Gly Ile Pro Pro
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Lys Val Asp Ala Ala Thr Tyr His Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 26
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность VL CD19ALAb,
Легкая цепь каппа 16
<400> 26
Asp Ile Gln Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Val Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Ala Asp Val Ala Val Tyr His Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 27
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR1 VH
<400> 27
Asn Tyr Trp Ile Asn
1 5
<210> 28
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR2 VH
<400> 28
Asn Ile Tyr Pro Ser Asp Ser Phe Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 29
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR3 VH
<400> 29
Asp Thr Gln Glu Arg Ser Trp Tyr Phe Asp Val
1 5 10
<210> 30
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR1 VL
<400> 30
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 31
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR2 VL
<400> 31
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 32
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR3 VL
<400> 32
Ser Gln Ser Thr His Val Pro Trp Thr
1 5
<210> 33
<211> 232
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, последовательность scFv CD22ALAb мыши
<400> 33
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Phe Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Asp Thr Gln Glu Arg Ser Trp Tyr Phe Asp Val Trp Gly Ala
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Asp Val Val Met Thr Gln Thr Pro
115 120 125
Leu Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg
130 135 140
Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His Trp
145 150 155 160
Tyr Leu Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val
165 170 175
Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser
180 185 190
Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu
195 200 205
Gly Leu Tyr Phe Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly
210 215 220
Gly Gly Thr Lys Leu Glu Ile Lys
225 230
<210> 34
<211> 232
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность scFv CD22ALAb
<400> 34
Glu Val Gln Leu Val Glu Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Phe Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Arg Asn Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Asp Thr Gln Glu Arg Ser Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Asp Ile Val Met Thr Gln Ser Pro
115 120 125
Ala Thr Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg
130 135 140
Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His Trp
145 150 155 160
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Lys Val
165 170 175
Ser Asn Arg Phe Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser
180 185 190
Gly Val Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser Glu Asp Phe
195 200 205
Ala Val Tyr Tyr Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly
210 215 220
Gln Gly Thr Arg Leu Glu Ile Lys
225 230
<210> 35
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, последовательность VH CD22ALAb мыши
<400> 35
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Phe Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Asp Thr Gln Glu Arg Ser Trp Tyr Phe Asp Val Trp Gly Ala
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 36
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность VH CD22ALAb
<400> 36
Glu Val Gln Leu Val Glu Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Phe Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Arg Asn Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Asp Thr Gln Glu Arg Ser Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 37
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, последовательность VL CD22ALAb мыши
<400> 37
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 38
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность VL CD22ALAb
<400> 38
Asp Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ala Arg Phe Ser Gly Ser Gly Ser Gly Val Glu Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Ser Glu Asp Phe Ala Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 39
<211> 236
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность scFv CD19ALAb –
Тяжелая цепь 19, Легкая цепь каппа 7
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Gln Ile Trp Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Glu Ser Ala Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Gly Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Glu Thr Thr Thr Val Gly Arg Tyr Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Lys Gly Thr Leu Val Thr Val Ser Ser Asp Ile Gln Leu
115 120 125
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
130 135 140
Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr
145 150 155 160
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Val Leu Ile
165 170 175
Tyr Asp Ala Ser Asn Leu Val Ser Gly Val Pro Asp Arg Phe Ser Gly
180 185 190
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
195 200 205
Ala Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Thr Glu Asp Pro Trp
210 215 220
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
225 230 235
<210> 40
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> CAR, Гуманизированная последовательность VL CD19ALAb,
Легкая цепь каппа 7
<400> 40
Asp Ile Gln Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Val Leu Ile Tyr Asp Ala Ser Asn Leu Val Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Ala Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 41
<211> 40
<212> Белок
<213> Искусственная последовательность
<220>
<223> Костимулирующий эндодомен CD28
<400> 41
Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro
1 5 10 15
Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro
20 25 30
Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 42
<211> 36
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эндодомен OX40
<400> 42
Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro Pro Gly Gly Gly
1 5 10 15
Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser Thr
20 25 30
Leu Ala Lys Ile
35
<210> 43
<211> 42
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эндодомен 4-1BB
<400> 43
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 44
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эндодомен CD3-дзета
<400> 44
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 45
<211> 24
<212> Белок
<213> Искусственная последовательность
<220>
<223> Трансмембранная последовательность Tyrp-1
<400> 45
Ile Ile Ala Ile Ala Val Val Gly Ala Leu Leu Leu Val Ala Leu Ile
1 5 10 15
Phe Gly Thr Ala Ser Tyr Leu Ile
20
<210> 46
<211> 258
<212> Белок
<213> Homo sapiens
<400> 46
Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu
1 5 10 15
Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp
20 25 30
Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu
35 40 45
Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile
50 55 60
Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly
65 70 75 80
Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu
85 90 95
Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu
100 105 110
Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser
115 120 125
Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro
130 135 140
Glu Ile Trp Glu Gly Glu Pro Pro Cys Leu Pro Pro Arg Asp Ser Leu
145 150 155 160
Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu
165 170 175
Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu
180 185 190
Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu
195 200 205
Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr
210 215 220
Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr
225 230 235 240
Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala
245 250 255
Arg Pro
<210> 47
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> ITAM-мотив
<220>
<221> прочий_признак
<222> (2)..(3)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> прочий_признак
<222> (4)..(4)
<223> Xaa может быть лейцином или изолейцином
<400> 47
Tyr Xaa Xaa Xaa
1
<210> 48
<211> 1139
<212> ДНК
<213> Homo sapiens
<400> 48
atcccgccga gcccaaatct cctgacaaaa ctcacacatg cccaccgtgc ccagcacctg 60
aactcctggg gggaccgtca gtcttcctct tccccccaaa acccaaggac accctcatga 120
tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa gaccctgagg 180
tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca aagccgcggg 240
aggagcagta caacagcacg taccgtgtgg tcagcgtcct caccgtcctg caccaggact 300
ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca gcccccatcg 360
agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac accctgcccc 420
catcccggga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc aaaggcttct 480
atcccagcga catcgccgtg gagtgggaga gcaatgggca accggagaac aactacaaga 540
ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag ctcaccgtgg 600
acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcac gaggctctgc 660
acaaccacta cacgcagaag agcctctccc tgtctccggg taaaaaagat cccaaatttt 720
gggtgctggt ggtggttggt ggagtcctgg cttgctatag cttgctagta acagtggcct 780
ttattatttt ctgggtgagg agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc 840
agcagggcca gaaccagctc tataacgagc tcaatctagg acgaagagag gagtacgatg 900
ttttggacaa gagacgtggc cgggaccctg agatgggggg aaagccgaga aggaagaacc 960
ctcaggaagg cctgtacaat gaactgcaga aagataagat ggcggaggcc tacagtgaga 1020
ttgggatgaa aggcgagcgc cggaggggca aggggcacga tggcctttac cagggtctca 1080
gtacagccac caaggacacc tacgacgccc ttcacatgca ggccctgcct cctcgcgag 1139
<210> 49
<211> 1139
<212> ДНК
<213> Искусственная последовательность
<220>
<223> HCH2CH3-CD28tmZeta с неоднозначным соответствием кодонов
<400> 49
atccagccga accaaagagc cccgataaga cccacacctg tcccccctgc ccagccccag 60
agctgctggg aggccccagc gtgtttctgt ttccacccaa gccaaaggat accctgatga 120
ttagtagaac acccgaagtg acctgtgtgg tggtggatgt gtctcacgag gaccccgagg 180
tgaaatttaa ttggtatgtt gatggtgttg aagtgcacaa cgccaaaacc aaacccagag 240
aggagcagta caattctacc tatagagtcg tgtctgtgct gacagtgctg catcaggatt 300
ggctgaacgg aaaagaatac aaatgtaaag tgagcaataa ggccctgccc gctccaattg 360
agaagacaat tagcaaggcc aagggccagc caagggagcc ccaggtgtat acactgccac 420
ccagtagaga cgaactgaca aagaatcagg tgtctctgac atgtctggtg aagggatttt 480
acccatctga tatcgccgtg gaatgggaat ctaacggcca gcccgagaat aactataaga 540
caaccccacc agtgctggat agcgatggca gcttttttct gtattctaag ctgacagtgg 600
ataagtcccg gtggcagcag ggaaatgtgt ttagctgtag tgtcatgcat gaggccctgc 660
acaatcacta tacccagaaa tctctgagtc tgagcccagg caagaaggac cccaagttct 720
gggtcctggt ggtggtggga ggcgtgctgg cctgttactc tctcctggtg accgtggcct 780
tcatcatctt ttgggtgcgc tcccgggtga agttttctcg ctctgccgat gccccagcct 840
atcagcaggg ccagaatcag ctgtacaatg aactgaacct gggcaggcgg gaggagtacg 900
acgtgctgga taagcggaga ggcagagacc ccgagatggg cggcaaacca cggcgcaaaa 960
atccccagga gggactctat aacgagctgc agaaggacaa aatggccgag gcctattccg 1020
agatcggcat gaagggagag agaagacgcg gaaagggcca cgacggcctg tatcagggat 1080
tgtccaccgc tacaaaagat acatatgatg ccctgcacat gcaggccctg ccacccaga 1139
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к получению цитолитической иммунной эффекторной клетки для адоптивного клеточного переноса, и может быть использовано в медицине. Полученная клетка коэкспрессирует первый химерный антигенный рецептор (CAR), связывающийся с CD19, и второй CAR, связывающийся с CD22, на клеточной поверхности и может быть использована для эффективной терапии злокачественной опухоли, которая характеризуется присутствием клеток, которые экспрессируют CD19 и/или CD22. 11 н. и 8 з.п. ф-лы, 14 ил., 7 табл., 4 пр.

Комментарии