Способы получения т-клеток против антигена папилломавируса человека - RU2713333C2
Код документа: RU2713333C2
Чертежи


















Описание
Настоящее изобретение было создано при поддержке Правительства с №проекта ВС010984-05 Национальным институтом здоровья, Национальным институтом онкологии. Правительство имеет определенные права на изобретение.
Перекрестная ссылка на родственную заявку
В данной заявке на патент испрашивается приоритет предварительной заявки на патент США №61/846161, поданной 15 июля 2013 г., которая включена в данный документ посредством ссылки во всей ее полноте.
Предшествующий уровень техники
Первичной причиной некоторых типов рака, таких как, например, рак шейки матки, является инфекция папилломавирусом человека (HPV). Несмотря на успехи в лечении, таком как химиотерапия, прогноз для многих раковых заболеваний, включая раковые заболевания, ассоциированные с HPV, может быть плохим. Соответственно, существует неудовлетворенная потребность в дополнительных способах лечения рака, в частности, раковых заболеваний, ассоциированных с HPV.
Краткое изложение сущности изобретения
В одном воплощении изобретения предложен способ получения популяции HPV-специфичных Т-клеток, включающий: разделение образца HPV-позитивной опухоли на многочисленные фрагменты; культивирование по отдельности многочисленных фрагментов в присутствии только одного цитокина; получение Т-клеток из культивируемых многочисленных фрагментов; тестирование Т-клеток в отношении одного или обоих из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; отбор Т-клеток, которые демонстрируют одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; и увеличение числа отобранных Т-клеток с получением популяции HPV-специфичных Т-клеток.
В другом воплощении изобретения предложен способ получения популяции HPV-специфичных Т-клеток, включающий: разделение образца HPV-позитивной опухоли на многочисленные фрагменты; культивирование по отдельности многочисленных фрагментов; получение Т-клеток из культивируемых многочисленных фрагментов; тестирование Т-клеток в отношении одного или обоих из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; отбор Т-клеток, которые демонстрируют одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; и увеличение числа отобранных Т-клеток с использованием одного или обоих из (i) антитела ОКТ3 и (ii) интерлейкина-2 (IL-2) с получением популяции HPV-специфичных Т-клеток.
В еще одном воплощении изобретения предложен способ лечения или предупреждения рака у млекопитающего, включающий: разделение образца HPV-позитивной опухоли на многочисленные фрагменты; культивирование по отдельности многочисленных фрагментов; получение Т-клеток из культивируемых многочисленных фрагментов; тестирование Т-клеток в отношении одного или обоих из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; отбор Т-клеток, которые демонстрируют одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; увеличение числа отобранных Т-клеток с получением популяции HPV-специфичных Т-клеток для адоптивной клеточной терапии; и введение увеличенного числа Т-клеток млекопитающему в эффективном количестве для лечения или предупреждения рака у млекопитающего.
Краткое описание нескольких видов графических материалов
Фиг. 1А представляет собой график, показывающий концентрацию интерферона гамма (IFN-γ) (пг/мл), секретируемого эффекторными проникающими в опухоль лимфоцитами (TIL от англ. - tumor infiltrating lymphocytes), полученными из 22 фрагментов опухоли (F1-F22) от пациента 1, или TIL меланомы, при совместном культивировании с мишенью - пулом пептидов gp100 (от англ. - glycoprotein 100 - гликопротеин 100) (закрашенные столбики) или пулом пептидов Е7 HPV 18 (незакрашенные столбики).
Фиг. 1Б представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL меланомы или TIL, полученными из 22 фрагментов опухоли (F1-F22) от пациента 1, при совместном культивировании с мишенью - линией клеток аутологичной опухоли (незакрашенные столбики) или клетками 624 (линия клеток меланомы) (закрашенные столбики).
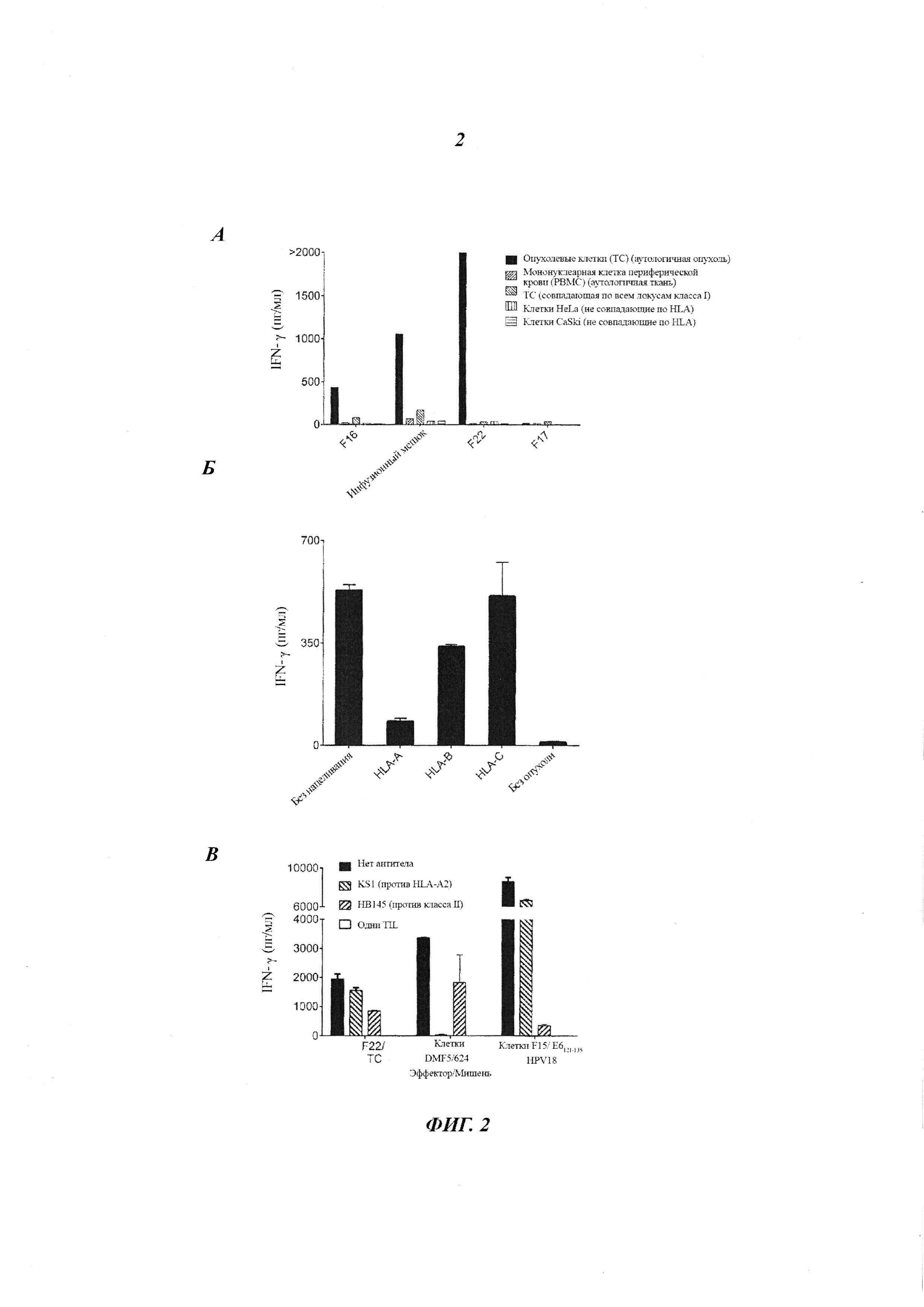
Фиг. 2А представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL, полученными из фрагмента опухоли F16, F17 или F22 пациента 1, или клетками, которые давали пациенту для лечения («инфузионный мешок»), при совместном культивировании с мишенью - клетками аутологичной опухоли (закрашенные столбики), одноядерными клетками периферической крови (РВМС от англ. - peripheral blood mononuclear cells) из аутологичной ткани (заштрихованные столбики с восходящей диагональной штриховкой), опухолевыми клетками, совпадающими по всем локусам класса I (заштрихованные столбики с нисходящей диагональной штриховкой), клетками HeLa, не совпадающими по HLA (антиген лимфоцитов человека от англ. - human leukocyte antigens) (столбики с вертикальной штриховкой) или клетками CaSki, не совпадающими по HLA (столбики с горизонтальной штриховкой).
Фиг. 2Б представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL от пациента 1, культивируемыми в одиночку (без опухоли) или при совместном культивировании с аутологичными опухолевыми клетками, которые были трансфицированы РНК сайленсинга против HLA-A, HLA-B, HLA-C, или РНК против иррелевантной мишени (на которую не осуществляется нацеливание).
Фиг. 2 В представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL при совместном культивировании с клетками-мишенями (эффектор/мишени: TIL Пациента 1/аутологичные опухолевые клетки; клетки DMF5/624; или F15/ E6121-135 HPV18) без антитела (черные столбики), с антителом против HLA-A2 (заштрихованные столбики с нисходящей диагональной штриховкой) или с антителом против класса II (заштрихованные столбики с восходящей диагональной штриховкой). Белые столбики указывают эффекторные клетки, культивируемые в одиночку.
Фиг. 3 представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL из фрагмента опухоли F16 или F22 Пациента 1; клетками, которые давали пациенту для лечения («инфузионный мешок»); TIL меланомы 1, 2 или 3 (культивируемые TIL из меланомных опухолей); TCR mE7 (Т-клетки, трансдуцированные для экспрессии TCR (рецептор Т-клетки) против E711-19 HPV 16); или TIL F15 (TIL от другого пациента, которые реагировали против Е6121-135 HPV 18, ограниченных классом II и, следовательно, блокируемыми НВ145) при совместном культивировании с пулом пептидов gp100 (белые столбики), антителом ОКТ3 (столбики с горизонтальной штриховкой) или дендритными клетками (DC), меченными пептидным пулом Е7 HPV 18 (черные столбики), пептидным пулом Е7 HPV 18 и W6/32 (заштрихованные столбики с тонкой восходящей диагональной штриховкой), Е711-19 HPV 16 (заштрихованные столбики с толстой восходящей диагональной штриховкой), Е711-19 HPV 16 и W6/32 (столбики в клетку), Е711-19 HPV 16 и НВ145 (столбики с перпендикулярными крестиками), Е6121-135 HPV 18 (заштрихованные столбики с нисходящей диагональной штриховкой), Е6121-135 HPV 18 и W6/32 (столбики с наклонным перекрещиванием) или Е6121-135 HPV 18 и НВ 145 (столбики с черными прямоугольниками с белым окаймлением).
Фиг. 4А и 4Б представляют собой графики, показывающий концентрацию IFN-γ (пг/мл), секретируемого клонами 1-24 (А) или клонами 24-48 (Б) эффекторных TIL, которые были клонированы из фрагмента опухоли F16 от Пациента 1, при совместном культивировании с пептидным пулом gp100 (серые столбики) или с пептидным пулом Е7 HPV 18 (черные столбики).
Фиг. 5 представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL из 36 разных фрагментов опухоли (F1-F36) от Пациента 12 или TIL меланомы (DM5) (контроль) при совместном культивировании с дендритными клетками, меченными пептидным пулом Е6 HPV 18 (черные столбики), пептидным пулом Е7 HPV 18 (серые столбики) или пептидным пулом gp100 (контроль).
Фиг. 6 представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL, полученными из фрагмента опухоли F1 пациента 12 или TIL меланомы 1, 2 или 3 при совместном культивировании с DC, которые были трансдуцированы лентивирусным вектором, кодирующим зеленый флуоресцентный белок (GFP от англ. - green fluorescent protein) (белые столбики) или Е6 HPV 18 (серые столбики), или меченными пептидным пулом gp100 (заштрихованные столбики с восходящей диагональной штриховкой) или пептидным пулом Е6 HPV 18 (заштрихованные столбики с нисходящей диагональной штриховкой). Столбики с горизонтальной штриховкой указывают TIL, культивируемые с антителом ОКТ3.
Фиг. 7А представляет собой график, показывающий концентрацию фактора некроза опухоли (TNF) α (пг/мл), секретируемого клонами 1, 3, 12 и 20, при культивировании в одиночку (серые столбики) или с пептидным пулом Е6 HPV 18 (черные столбики).
Фиг. 7Б представляет собой график, показывающий концентрацию TNFα (пг/мл), секретируемого клонами 3, 12 и 20, при культивировании в одиночку (белые столбики) или с пептидным пулом Е6 HPV 18 (серые столбики) или с пептидным подпулом 1 Е6 HPV 18 (заштрихованные столбики с восходящей диагональной штриховкой), подпулом 2 (заштрихованные столбики с нисходящей диагональной штриховкой), подпулом 3 (столбики с горизонтальной штриховкой), подпулом 4 (столбики с вертикальной штриховкой) или подпулом 5 (черные столбики).
Фиг. 7 В представляет собой график, показывающий концентрацию TNFα (пг/мл), секретируемого клонами 3, 12 и 20, при культивировании в одиночку (белые столбики) или с пептидом 30 Е6 HPV 18 (столбики с точками), пептидом 31 (черные столбики), пептидом 32 (серые столбики), пептидом 33 (столбики с вертикальной штриховкой), пептидом 34 (заштрихованные столбики с восходящей диагональной штриховкой), пептидом 35 (заштрихованные столбики с нисходящей диагональной штриховкой), пептидом 36 (столбики с квадратиками) или пептидом 37 (столбики с рисунком в виде наклонных прямоугольников).
Фиг. 8А-8В представляют собой графики, показывающие концентрацию TNFα (пг/мл), секретируемого клонами 3 (А), 12 (Б) и 20 (В), при совместном культивировании с аутологичными РВМС (мононуклеарная клетка периферической крови, от англ. - peripheral blood mononuclear cell) (P12) или РВМС от одного из Доноров 1-6.
Фиг. 9А представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого клоном 3 фрагмента опухоли F15 Пациента 12, при совместном культивировании с аутологичными РВМС (Р12) или РВМС донора DRB1*15, DQB1*06, РВМС донора DRB1*15 или РВМС донора DQB1*06, меченными пептидом Е677-91 HPV 18 (незакрашенные столбики) или E6121-135 HPV 18 (закрашенные столбики).
Фиг. 9Б представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого клоном 20 фрагмента опухоли F15 Пациента 12, при совместном культивировании с РВМС, меченными пептидом E6121-135 HPV 18, или Т-клетками mF5 (трансдуцированными для экспрессии TCR против MART-1), совместно культивируемыми с клетками 624 с антителами против HLA-DR (столбики с горизонтальной штриховкой), HLA-DQ (заштрихованные столбики с нисходящей диагональной штриховкой), HLA-DP (заштрихованные столбики с восходящей диагональной штриховкой), антителами против пан-класса I (черные столбики) или антителами против пан-класса II (белые столбики).
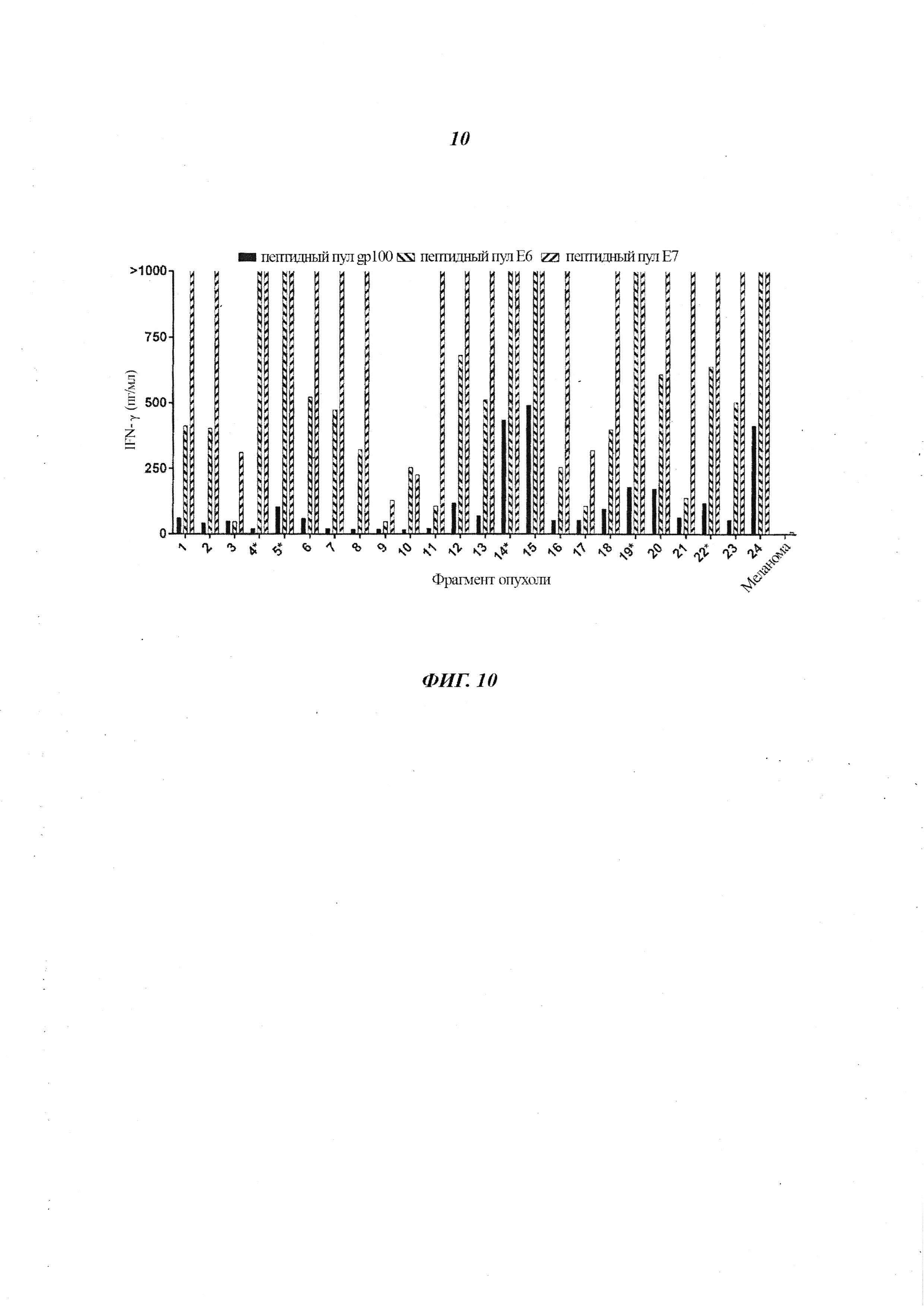
Фиг. 10 представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого эффекторными TIL из 24 разных фрагментов опухоли (F1-F24) от Пациента 4 или TIL меланомы (контроль), при совместном культивировании с дендритными клетками, меченными пептидным пулом Е6 HPV 16 (заштрихованные столбики с нисходящей диагональной штриховкой), пептидным пулом Е7 HPV 16 (заштрихованные столбики с восходящей диагональной штриховкой) или пептидным пулом gp100 (контроль) (черные столбики). Звездочка (*) показывает TIL, инфундированные пациенту.
Фиг. 11А представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого клонами CD8-позитивных эффекторных TIL от Пациента 4, при совместном культивировании с дендритными клетками, меченными пептидным пулом Е7 HPV 16 (закрашенные столбики), или без пептида (незакрашенные столбики).
Фиг. 11Б представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого клонами CD4-позитивных эффекторных TIL от Пациента 4, при совместном культивировании с дендритными клетками, меченными пептидным пулом Е7 HPV 16 (закрашенные столбики), или без пептида (незакрашенные столбики).
Фиг. 11В представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого клонами CD8-позитивных эффекторных TIL от Пациента 4, при совместном культивировании с дендритными клетками, меченными пептидным пулом Е6 HPV 16 (закрашенные столбики), или без пептида (незакрашенные столбики).
Фиг. 11Г представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретируемого клонами CD4-позитивных эффекторных TIL от Пациента 4, при совместном культивировании с дендритными клетками, меченными пептидным пулом Е6 HPV 16 (закрашенные столбики), или без пептида (незакрашенные столбики).
Фиг. 12А-Б представляют собой сканы компьютерной томографии (СТ от англ. - computed tomography) грудной клетки Пациента 4 до (А) и через девять месяцев после лечения (Б) адоптивной клеточной терапией. Стрелка в А указывает на раковое поражение в парааортальном лимфатическом узле.
Фиг. 12В-Г представляют собой сканы СТ грудной клетки Пациента 4 до (В) и через девять месяцев после лечения (Г) адоптивной клеточной терапией. Стрелка в B указывает на раковое поражение в левом лимфатическом узле корня легкого.
Фиг. 12Д-Е представляют собой сканы СТ таза Пациента 4 до (Д) и через девять месяцев после лечения (Е) адоптивной клеточной терапией. Стрелка в Д указывает на раковое поражение в общем подвздошном лимфатическом узле.
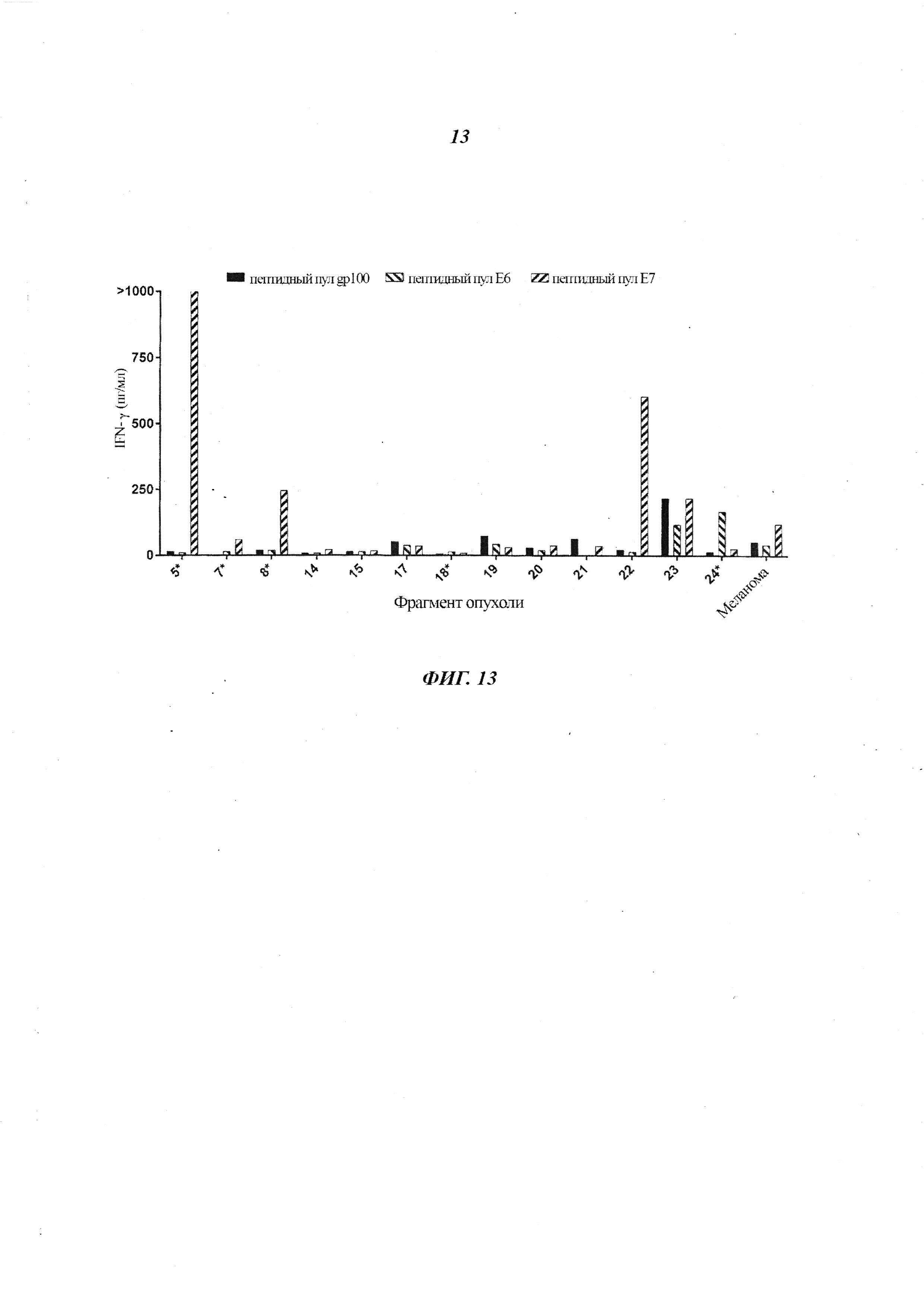
Фиг. 13 представляет собой график, показывающий концентрацию IFN-γ (пг/мл), секретированного эффекторными TIL из 24 разных фрагментов опухоли от Пациента 8 или TIL меланомы (контроль), при совместном культивировании с дендритными клетками, меченными пептидным пулом Е6 HPV 18 (заштрихованные столбики с нисходящей диагональной штриховкой), пептидным пулом Е7 HPV 18 (заштрихованные столбики с восходящей диагональной штриховкой) или пептидным пулом gp100 (контроль) (черные столбики). Звездочка (*) показывает TIL, инфундированные пациенту.
Фиг. 14А-Б представляют собой сканы магнитно-резонансной томографии (МРТ) печени Пациента 8 до (А) и через два месяца после лечения (Б) адоптивной клеточной терапией. Стрелка в А указывает на раковую массу в печени.
Фиг. 14В-Г представляют собой сканы СТ брюшной полости Пациента 8 до (В) и через два месяца после лечения (Г) адоптивной клеточной терапией. Стрелка в B указывает на раковое поражение в забрюшинном лимфатическом узле.
Фиг. 14Д-Е представляют собой сканы СТ брюшной полости Пациента 8 до (Д) и через два месяца (Е) после лечения адоптивной клеточной терапией. Стрелка в Д указывает на раковую массу в брюшной стенке.
Фиг. 14Ж-З представляют собой сканы СТ таза Пациента 8 до (Ж) и через два месяца (3) после лечения адоптивной клеточной терапией. Стрелка в Ж указывает на раковую массу в левой околотолстокишечной области.
Фиг. 15А представляет собой график, показывающий измерение размера опухоли (% изменения от исходного уровня) в парааортальном (кружки), в корне левого легкого (квадраты), в корне правого легкого (Δ) и общем подвздошном (∇) лимфатических узлах Пациента 4 в моменты времени (число месяцев) после инфузии HPV-TIL.
Фиг. 15Б представляет собой график, показывающий измерение размера опухоли (% изменения от исходного уровня) в желудочной стенке живота(кружки), парааортальном лимфатическом узле (квадраты), левой части таза (Δ) и правом мочеточнике (∇) Пациента 8 в моменты времени (число месяцев) после инфузии HPV-TIL.
Фиг. 16А-Г представляют собой замедленные, усиленные гадолинием Т1-взвешенные изображения МРТ Пациента 8. На каждом из А и В показана опухоль на поверхности печени до лечения. На Б и Г показано, что никакой опухоли не было через 11 месяцев после лечения. Стрелки в А и В показывают расположения опухолей.
Фиг. 17А представляет собой график, показывающий уровень сывороточного цитокина (пг/мл), измеренный у Пациента 4 в моменты времени (число суток) после лечения. Измеренные цитокины включают интерлейкин (IL-2 (закрашенные кружки), IL-4 (квадратики), IL-6 (


Фиг. 17Б представляет собой график, показывающий уровень сывороточного цитокина (пг/мл), измеренный у Пациента 8 в определенное число суток после лечения. Измеренные цитокины включают IL-2 (закрашенные кружки), IL-5 (закрашенные квадратики), IL-6 (


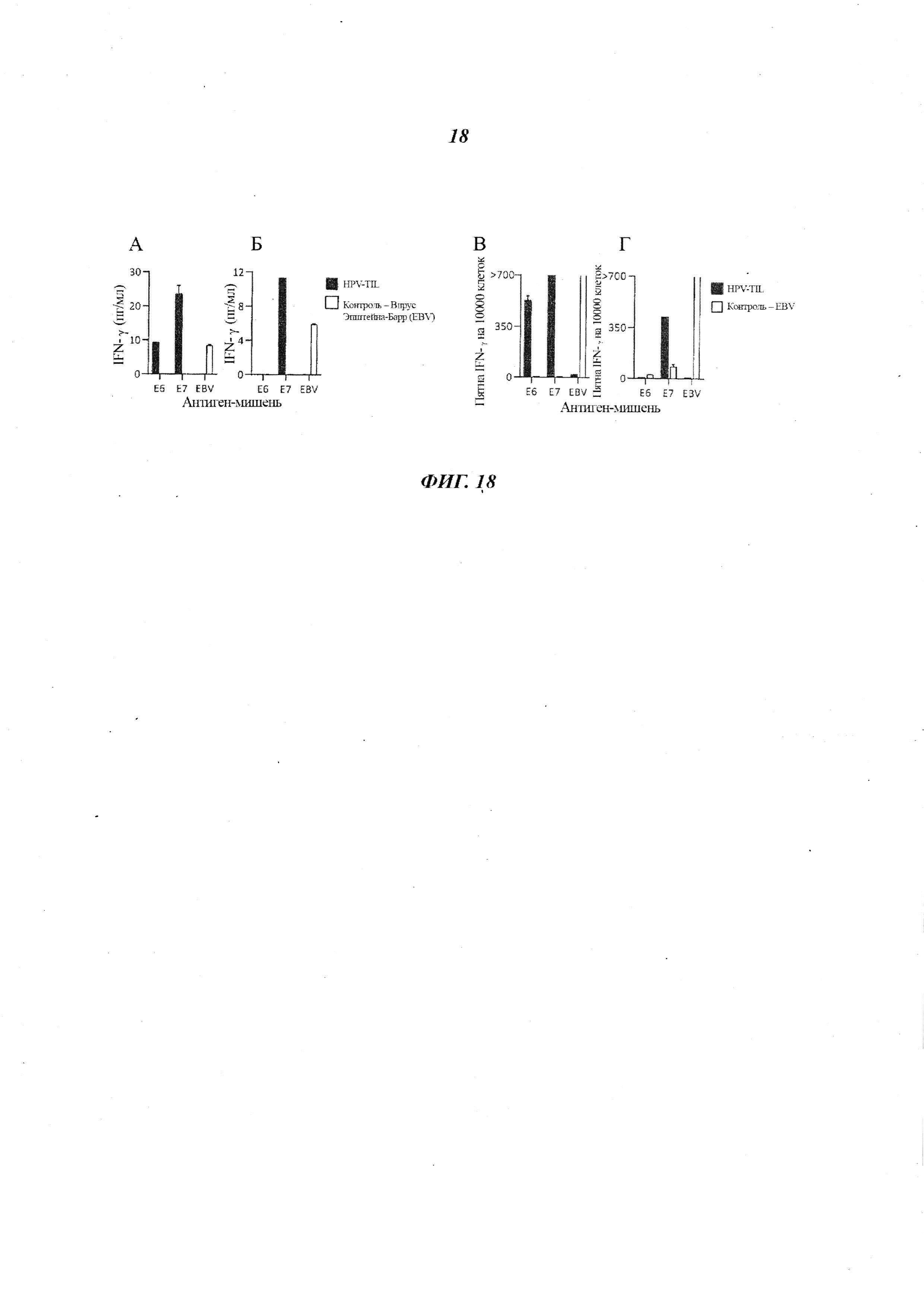
Фиг. 18А-Г представляют собой графики, показывающие реактивность TIL, подлежащих введению Пациенту 4 (А и В) или Пациенту 8 (Б и Г) (закрашенные столбики), против Е6 HPV, Е7 HPV или вируса Эпштейна-Барр (EBV) (контроль) при измерении анализами секреции IFN-гамма (пг/мл) (А и Б) и ELISPOT (метод иммуноферментных пятен, от англ. - Enzyme-Linked ImmunoSpot) (В и Г). Незакрашенные столбики представляют реактивность Т-клеток, реагирующих с EBV, от того же самого пациента (контроль).
Фиг. 19А-Б представляют собой графики, показывающие число лимфоцитов (клеток/мм3) для Пациента 4 (А) и Пациента 8 (Б) в разные моменты времени (сутки) после инфузии TIL. Подсчитанные клетки включают Т-клетки CD8 (квадратики), Т-клетки CD4 (кружки), клетки NK (натуральный киллер) (


Фиг. 19В-Г представляют собой графики, показывающие Т-клетки, реагирующие с HPV, выявленные в периферической крови пациента 4 (В) или пациента 8 (Г) в разные моменты времени (месяцы) после инфузии TIL при измерении по IFN-гамма (пг/мл). Измеряли реактивность против Е6 HPV (серые столбики), Е7 EPV (черные столбики) или gp100 (контроль) (незакрашенные столбики).
Фиг. 19Д-Е представляют собой графики, показывающие количественное измерение Т-клеток, реагирующих с HPV, выявленных в периферической крови Пациента 4 (Д) или Пациента 8 (Е), в разные моменты времени (месяцы) после инфузии TIL при измерении ELISPOT. Измеряли реактивность против Е6 HPV (серые столбики), Е7 EPV (черные столбики) или gp100 (контроль) (незакрашенные столбики).
Фиг. 20А-Й представляют собой сканы магнитно-резонансной томографии (МРТ) Пациента 13, который имел метастатический рак миндалины, до (А, В, Д, Ж и И) и через четыре месяца после лечения (Б, Г, Е, З и Й) адоптивной клеточной терапией. Стрелки указывают на многочисленные злокачественные опухоли в легких и в правом корне легкого.
Фиг. 21А-Б представляют собой сканы СТ грудной клетки Пациента 4 до (А) и через 18 месяцев после лечения (Б) адоптивной клеточной терапией. Стрелка в А указывает на раковое поражение в парааортальном лимфатическом узле.
Фиг. 21В-Г представляют собой сканы СТ грудной клетки Пациента 4 до (В) и через 18 месяцев после лечения (Г) адоптивной клеточной терапией. Стрелка в B указывает на поражение левого корня легкого и трахеобронхиальное поражение.
Фиг. 21Д-Е представляют собой сканы СТ грудной клетки Пациента 4 до (Д) и через 18 месяцев (Е) после лечения адоптивной клеточной терапией. Стрелка в Д указывает на двухсторонние поражения корней легких.
Фиг. 21Ж-З представляют собой сканы СТ таза Пациента 4 до (Ж) и через 18 месяцев после лечения (3) адоптивной клеточной терапией. Стрелка в Ж указывает на раковое поражение в общем подвздошном лимфатическом узле.
Фиг. 22А-Б представляют собой сканы СТ брюшной полости Пациента 8 до (A) и через 11 месяцев после лечения (Б) адоптивной клеточной терапией. Стрелка в А указывает на раковое поражение в забрюшинном лимфатическом узле.
Фиг. 22В-Г представляют собой сканы СТ брюшной полости Пациента 8 до (B) и через 11 месяцев после лечения (Г) адоптивной клеточной терапией. Стрелка в B указывает на раковую массу в брюшной стенке и забрюшинную опухоль.
Фиг. 22Д-Е представляют собой сканы СТ брюшной полости Пациента 8 до (Д) и через 11 месяцев после лечения (Е) адоптивной клеточной терапией. Стрелка в Д указывает на раковую массу около ободочной кишки.
Фиг. 22Ж-З представляют собой сканы СТ таза Пациента 8 до (Ж) и через 11 месяцев после лечения (3) адоптивной клеточной терапией. Стрелка в Ж указывает на раковую массу в левой части таза. Треугольник в 3 указывает на стент мочеточника.
Подробное описание изобретения
Открыли, что можно получать популяции Т-клеток, специфичных в отношении папилломавируса человека (HPV), для целого ряда применений, например, для адоптивной клеточной терапии. Согласно способам по изобретению можно получать клетки, которые являются полезными для лечения целого ряда состояний, например, рака.
Способы по изобретению дают многочисленные преимущества. Например, согласно способам по изобретению, преимущественно, можно получать Т-клетки из HPV-позитивных раковых опухолей с качеством и в масштабе, подходящих для клинического применения. Дополнительно, согласно способам по изобретению, преимущественно, можно получать Т-клетки, которые распознают антигены Е6 и Е7 HPV, которые конститутивно и специфично экспрессируются раковыми клетками и не экспрессируются нормальными клетками. Следовательно, не будучи связанными конкретной теорией или механизмом, считается, что Т-клетки, полученные способами по изобретению, преимущественно нацелены на разрушение раковых клеток при минимизации или устранении разрушения нормальных, нераковых клеток, посредством этого, уменьшая, например, посредством минимизации или устранения, токсичность. Кроме того, поскольку воплощение способов по изобретению включает немиелоаблативную химиотерапию, способы по изобретению можно преимущественно использовать для лечения пациентов, которые не подходили бы для лечения, которое включает облучение всего организма (TBI, от англ. - total body irradiation), таких как, например, пациенты, которые уже подвергались миелоаблативной терапии, например, лучевой терапии, до лечения; пациенты с сопутствующими состояниями и пациенты с менее чем 2×106 клеток CD34+/кг. Кроме того, способы лечения рака по изобретению, преимущественно, могут успешно лечить или предупреждать HPV-позитивные раковые заболевания, которые не отвечают на другие типы лечения, такие как, например, одна химиотерапия, хирургическая операция или облучение.
Одно воплощение изобретения включает получение образца HPV-позитивной опухоли от млекопитающего. Образец опухоли можно получать от млекопитающего любым подходящим способом, таким как, например, биопсия или хирургическая резекция.
В одном воплощении данный способ может включать тестирование образца опухоли на инфекцию HPV. HPV может представлять собой любой подтип HPV. Предпочтительно подтип HPV представляет собой HPV 16 или HPV 18. Тестирование может включать тестирование на экспрессию любого белка (например, антигена), специфично экспрессируемого клетками, инфицированными HPV, такого как, например, любой один или более чем один из Е6 HPV 16, Е7 HPV 16, Е6 HPV 18 и Е7 HPV 18, экспрессию любой РНК, кодирущей HPV-специфичный белок, или их комбинацию. Тестирование на инфекцию HPV можно проводить любым подходящим способом, известным в данной области. Типичные анализы на HPV могут включать любой один или более чем один из генотипирования на основе полимеразной цепной реакции (ПЦР) с обратной транскриптазой (ОТ) и вестерн-блоттингов. Образец опухоли может быть позитивным в отношении любого подтипа инфекции HPV, такой как, например, инфекция HPV 16 или HPV 18.
Одно воплощение изобретения включает разделение образца HPV-позитивной опухоли на многочисленные фрагменты. Образец опухоли можно делить на любое подходящее число фрагментов, как, например, на 4, 8, 12, 16, 20, 24, 28, 32, 36, 40 или более фрагментов. Предпочтительно, образец опухоли делят на 24 фрагмента. Образец опухоли можно делить любым подходящим способом, например, механически (разъединяя опухоль с использованием, например, диссоциатора gentleMACS™, Miltenyi Biotec, Оберн, Калифорния) или ферментативно (например, коллагеназа или ДНКаза).
Одно воплощение изобретения включает культивирование многочисленных фрагментов по отдельности. В данном отношении фрагменты можно культивировать в отдельных контейнерах, например, в отдельных чашках или отдельных лунках планшета. Многочисленные фрагменты можно культивировать любым подходящим способом. Например, фрагменты можно культивировать в газопроницаемом контейнере, как описано в публикации заявки на патент США №2012/0244133. В одном воплощении изобретения фрагменты опухоли культивируют в присутствии комбинации двух или более чем двух цитокинов. В предпочтительном воплощении, однако, способ включает культивирование фрагментов опухоли в присутствии только одного цитокина. Цитокин может представлять собой любой подходящий цитокин, такой как, например, интерлейкин (IL)-2, IL-7, IL-15 или IL-12. Предпочтительно цитокин представляет собой IL-2. Фрагменты опухоли можно культивировать в любом подходящем количестве цитокина (например, от примерно 30 IU (международная единица)/мл до примерно 6000 IU/мл, предпочтительно примерно 6000 IU/мл). Предпочтительно способ включает культивирование фрагментов опухоли в примерно 6000 IU/мл IL-2.
Способ может включать получение Т-клеток из культивируемых многочисленных фрагментов. Способ может включать культивирование Т-клеток до конфлюентности (например, примерно 2×106 лимфоцитов на мл в 24-луночном планшете), например, от примерно 12 до примерно 28 суток.
Способ может включать тестирование Т-клеток на одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV. Специфичное распознавание аутологичной HPV-позитивной опухоли можно тестировать любым способом, известным в данной области, например, измерением высвобождения цитокина (например, интерферона (IFN)-γ) после совместного культивирования с аутологичными HPV-позитивными опухолевыми клетками. Можно считать, что Т-клетки распознают HPV-позитивную опухоль, если, например, совместное культивирование с аутологичными HPV-позитивными опухолевыми клетками приводит к высвобождению IFN-γ, которое является одним или более чем одним из следующего: (i) в два раза больше, чем количество IFN-γ, которое измеряется при культивировании одних Т-клеток (фон); (ii) составляет по меньшей мере примерно 200 пг/мл или более (например, 200 пг/мл или более, 300 пг/мл или более, 400 пг/мл или более, 500 пг/мл или более, 600 пг/мл или более, 700 пг/мл или более, 1000 пг/мл или более, 5000 пг/мл или более, 7000 пг/мл или более, 10000 пг/мл или более, или 20000 пг/мл или более); и (iii) блокируется антителом против класса I МНС (главный комплекс гистосовместимости) более чем примерно на 40%, более чем примерно на 50% или более чем примерно на 60%.
Специфичное распознавание антигена HPV можно тестировать любым способом, известным в данной области, например, измерением высвобождения цитокина (например, IFN-γ) после совместного культивирования с антиген-негативными антигенпрезентирующими клетками (например, дендритными клетками), которые метили пептидом антигена HPV. Можно считать, что Т-клетки распознают антиген HPV, если, например, высвобождение IFN-γ является одним или обоими из следующего: (i) в два раза больше, чем количество IFN-γ, которое измеряется при культивировании Т-клеток с антигенпрезентирующими клетками, которые метили пептидом негативного контроля; и (ii) составляет по меньшей мере примерно 200 пг/мл или более (например, 200 пг/мл или более, 300 пг/мл или более, 400 пг/мл или более, 500 пг/мл или более, 600 пг/мл или более, 700 пг/мл или более, 1000 пг/мл или более, 5000 пг/мл или более, 7000 пг/мл или более, 10000 пг/мл или более, или 20000 пг/мл или более) IFN-γ при совместном культивировании с антиген-негативными антигенпрезентирующими клетками, меченными низкой концентрации пептида HPV 16 или HPV 18 (например, от примерно 0,05 нг/мл до примерно 5 нг/мл, 0,05 нг/мл, 0,1 нг/мл, 0,5 нг/мл, 1 нг/мл или 5 нг/мл). Т-клетки также могут секретировать IFN-γ при совместном культивировании с антиген-негативными антигенпрезентирующими клетками, меченными более высокими концентрациями пептида HPV.
Антиген HPV может представлять собой любой антиген HPV. Например, антиген HPV может представять собой любой один или более чем один из Е6 HPV 16, Е7 HPV 16, Е6 HPV 18 и Е7 HPV 18. В то время как в некоторых воплощениях популяция Т-клеток может специфично распознавать только один антиген HPV, в некоторых воплощениях популяция Т-клеток может специфично распознавать более чем один антиген HPV. В данном отношении популяция Т-клеток может содержать многочисленные Т-клетки, причем каждая имеет отличные специфичности в отношении HPV. Например, популяция Т-клеток может включать некоторые Т-клетки, которые специфично распознают Е6 HPV 16, и другие Т-клетки, которые специфично распознают Е7 HPV 16, или популяция может включать некоторые Т-клетки, которые специфично распознают Е6 HPV 18, и другие Т-клетки, которые специфично распознают Е7 HPV 18.
Способ может включать отбор Т-клеток, которые демонстрируют одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV. В одном воплощении изобретения при тестировании Т-клеток в отношении одного или обоих из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV можно идентифицировать те культуры, которые содержат Т-клетки, которые распознают HPV, те культуры, которые содержат Т-клетки, реагирующие с HPV, также могут содержать дополнительные Т-клетки, которые реагируют против других антигенов опухоли, не являющихся антигенами HPV.
Соответственно, отобранная популяция Т-клеток может включать поликлональные Т-клетки с многими специфичностями. В другом воплощении изобретения тестирование идентифицирует культуры, которые содержат только Т-клетки, которые распознают HPV. В данном отношении выбранная популяция Т-клеток может включать Т-клетки со специфичностью только в отношении HPV.
Способ может дополнительно включать увеличение числа отобранных Т-клеток с получением популяции HPV-специфичных Т-клеток. Быстрое размножение дает увеличение числа антигенспецифичных Т-клеток по меньшей мере примерно в 100 раз (или в 200, 300, 400, 500, 600, 700, 800, 900 раз или более) на протяжении периода от примерно 10 до примерно 14 суток, предпочтительно примерно 14 суток. Более предпочтительно, быстрое размножение дает увеличение по меньшей мере примерно в 1000 раз (или 1500, 2000, 2500, 3000 раз или более) на протяжении периода от примерно 10 до примерно 14 суток, предпочтительно примерно 14 суток. Наиболее предпочтительно, быстрое размножение дает увеличение по меньшей мере от примерно 1000-кратного до примерно 3000-кратного на протяжении периода от примерно 10 до примерно 14 суток, предпочтительно примерно 14 суток.
Увеличение числа Т-клеток может осуществляться любым числом способов, которые известны в данной области, как описано, например, в патенте США 8034334; патенте США 8383099; публикации заявки на патент США №2012/0244133; Dudley et al., J. Immunother., 26: 332-42 (2003) и Riddell et al., J. Immunol. Methods, 128: 189-201 (1990). Например, число Т-клеток можно быстро увеличивать с использованием стимуляции неспецифичного рецептора Т-клеток в присутствии питающих лимфоцитов и одного из интерлейкина-2 (IL-2) или интерейкина-15 (IL-15), причем IL-2 является предпочтительным. Стимул неспецифичного рецептора Т-клеток может включать около 30 нг/мл ОКТ3, мышиного моноклонального антитела против CD3 (доступно от Ortho-McNeil, Раритан, Нью Джерси). В качестве альтернативы, число Т-клеток может быстро увеличиваться посредством стимуляции in vitro раковым антигеном (одним или более чем одним, включая его антигенные части, такие как эпитоп(пы), или клеткой), который возможно может экспрессироваться из вектора, например, 0,3 мкМ MART-1: 26-35 (27L) или gp100: 209-217 (210М), в присутствии фактора роста Т-клеток, как, например, 300 IU/мл IL-2 или IL-5, причем IL-2 является предпочтительным. Число Т-клеток, индуцированных in vitro, может быстро увеличиваться посредством повторной стимуляции тем же самым раковым антигеном(нами), которым метятся антигенпрезентирующие клетки. В одном воплощении число Т-клеток увеличивается в газопроницаемом контейнере, как описано в публикации заявки на патент США №2012/0244133.
В одном воплощении изобретения способ включает увеличение числа Т-клеток с использованием одного или обоих из (i) облученных аллогенных питающих клеток и (ii) облученных аутологичных питающих клеток, и одного или обоих из (iii) антитела ОКТ3 и (iv) фактора роста Т-клеток, такого как IL-2 или IL-15, причем IL-2 является предпочтительным. Способ может включать увеличение числа Т-клеток с использованием одного или обоих из (i) облученных аллогенных питающих клеток и (ii) облученных аутологичных питающих клеток, и одного или обоих из (iii) антитела ОКТ3 и (iv) интерлейкина (IL)-2. Предпочтительно способ включает увеличение числа Т-клеток с использованием одного или обоих из (i) облученных аллогенных питающих клеток и (ii) облученных аутологичных питающих клеток, и обоих из (iii) антитела ОКТ3 и (iv) интерлейкина (IL)-2. В особенно предпочтительном воплощении способ включает увеличение числа Т-клеток с использованием (i) облученных аллогенных питающих клеток, (ii) антитела ОКТ3 и (iii) интерлейкина (IL)-2.
В еще одном воплощении способ включает увеличение числа отобранных Т-клеток с использованием одного или обоих из (i) антитела ОКТ3 и (ii) интерлейкина (IL)-2, с получением популяции HPV-специфичных Т-клеток, возможно в комбинации с одним или обоими из облученных аллогенных питающих клеток и облученных аутологичных питающих клеток. В данном отношении согласно одному воплощению изобретения предложен способ получения популяции HPV-специфичных Т-клеток, включающий: разделение образца HPV-позитивной опухоли на многочисленные фрагменты; культивирование многочисленных фрагментов по отдельности; получение Т-клеток из культивируемых многочисленных фрагментов; тестирование Т-клеток на одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; отбор Т-клеток, которые демонстрируют одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; и увеличение числа отобранных Т-клеток с использованием одного или обоих из (i) антитела ОКТ3 и (ii) интерлейкина (IL)-2 с получением популяции HPV-специфичных Т-клеток. Разделение образца опухоли, культивирование фрагментов опухоли, получение Т-клеток, тестирование Т-клеток, отбор Т-клеток и увеличение числа отобранных Т-клеток можно проводить, как описано в данном документе по отношению к другим аспектам данного изобретения.
Популяция увеличенного числа Т-клеток, полученная способами по изобретению, может специфично распознавать HPV-позитивные клетки, например, HPV-позитивные раковые клетки. Клетки, которые распознаются Т-клетками, могут быть позитивными в отношении любого подтипа HPV, такого как, например, HPV 16 или HPV 18. В качестве альтернативы или дополнительно, популяция Т-клеток, полученная способами по изобретению, может специфично распознавать любой антиген HPV, такой как, например, любой один или более чем один из Е6 HPV 16, Е7 HPV 16, Е6 HPV 18 и Е7 HPV 18. В то время как в некоторых воплощениях популяция Т-клеток может специфично распознавать только один антиген HPV, в некоторых воплощениях популяция Т-клеток может специфично распознавать более чем один антиген HPV. В данном отношении популяция увеличенного числа Т-клеток может содержать многочисленные Т-клетки, причем каждая имеет отличную специфичность в отношении HPV. Например, популяция увеличенного числа Т-клеток может включать некоторые Т-клетки, которые специфично распознают Е6 HPV 16, и другие Т-клетки, которые специфично распознают Е7 HPV 16, или популяция может включать некоторые Т-клетки, которые специфично распознают Е6 HPV 18, и другие Т-клетки, которые специфично распознают Е7 HPV 18. Способность популяции увеличенного числа Т-клеток, полученных способами по изобретению, специфично распознавать HPV-позитивные клетки и специфично распознавать антиген HPV можно измерять, как описано в данном документе в отношении других аспектов изобретения.
Популяция Т-клеток, полученных способами по изобретению, может быть полезной для лечения или предупреждения состояний, ассоциированных с HPV, например, рака. Соответственно, согласно другому воплощению изобретения предложен способ лечения или предупреждения рака у млекопитающего, включающий получение популяции HPV-специфичных Т-клеток согласно любому из описанных в данном документе способов изобретения и введение популяции Т-клеток млекопитающему в эффективном количестве для лечения или предупреждения рака у млекопитающего.
Согласно другому воплощению изобретения предложен способ лечения или предупреждения рака у млекопитающего, включающий: разделение образца HPV-позитивной опухоли на многочисленные фрагменты; культивирование многочисленных фрагментов по отдельности; получение Т-клеток из культивируемых многочисленных фрагментов; тестирование Т-клеток на одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; отбор Т-клеток, которые демонстрируют одно или оба из специфичных распознавания аутологичной HPV-позитивной опухоли и распознавания антигена HPV; увеличение числа отобранных Т-клеток с получением популяции HPV-специфичных Т-клеток для адоптивной клеточной терапии; и введение увеличенного числа Т-клеток млекопитающему в эффективном количестве для лечения или предупреждения рака у млекопитающего. Разделение образца опухоли, культивирование фрагментов опухоли, получение Т-клеток, тестирование Т-клеток, отбор Т-клеток и увеличение числа отобранных Т-клеток можно проводить, как описано в данном документе по отношению к другим аспектам данного изобретения. Согласно другому воплощению изобретения предложен способ лечения или предупреждения состояния у млекопитающего, включающий получение популяции HPV-специфичных Т-клеток согласно любому из способов по изобретению, описанных в данном документе, и введение популяции Т-клеток млекопитающему в эффективном количестве для лечения или предупреждения состояния у млекопитающего, где состояние представляет собой рак, инфекцию HPV 16 или HPV-позитивное предопухолевое состояние.
Одно воплощение изобретения включает введение млекопитающему немиелоаблативной антилимфоцитарной химиотерапии. Немиелоаблативная антилимфоцитарная химиотерапия может представлять собой любую такую подходящую терапию, которую можно вводить любым подходящим путем. Немиелоаблативная антилимфоцитарная химиотерапия может включать введение циклофосфамида и флударабина, в частности, если раковое заболевание представляет собой HPV-позитивный рак, который может быть метастатическим. Предпочтительным путем введения циклофосфамида и флударабина является внутривенный. Подобным образом, можно вводить любую подходящую дозу циклофосфамида и флударабина. Предпочтительно около 60 мг/кг циклофосфамида вводится в течение двух суток, после чего вводится около 25 мг/м2 флударабина в течение пяти суток, особенно если рак представляет собой HPV-позитивный рак. В одном воплощении изобретения немиелоаблативная антилимфоцитарная химиотерапия вводится до введения Т-клеток.
Одно воплощение изобретения включает, после введения немиелоаблативной антилимфоцитарной химиотерапии, введение млекопитающему популяции HPV-специфичных Т-клеток, полученных любыми способами по изобретению, описанными в данном документе.
Т-клетки можно вводить любым подходящим путем, как известно в данной области. Предпочтительно Т-клетки вводятся в виде внутриартериальной или внутривенной инфузии, которая предпочтительно продолжается от примерно 30 до примерно 60 минут. Другие примеры путей введения включают внутрибрюшинное, подоболочечное и внутрилимфатическое.
Подобным образом, может вводиться любая подходящая доза Т-клеток. Предпочтительно вводятся от примерно 1,0×1010 Т-клеток до примерно 13,7×1010 Т-клеток, со средним значением примерно 5,0×1010 Т-клеток, в частности, если раковое заболевание представляет собой HPV-позитивный рак. В качестве альтернативы, вводятся от примерно 1,2×1010 до примерно 4,3×1010 Т-клеток.
В одном воплощении изобретения любой из способов, описанных в данном документе, может дополнительно включать объединение популяции HPV-специфичных Т-клеток с фармацевтически приемлемым носителем. Фармацевтически приемлемый носитель может представлять собой любой фармацевтически приемлемый носитель, который подходит для адоптивной клеточной терапии. Например, фармацевтически приемлемый носитель может включать любой изотоничный носитель, такой как, например, нормальный физиологический раствор (примерно 0,90% масс./об. NaCl в воде, примерно 300 мОсм/л NaCl в воде, или примерно 9,0 г NaCl на литр воды), раствор электролита NORMOSOL R (Abbott, Чикаго, Иллинойс), PLASMA-LYTE A (Baxter, Дирфилд, Иллинойс), примерно 5% декстрозы в воде или лактат Рингера. В одном воплощении фармацевтически приемлемый носитель дополнен человеческим сывороточным альбумином.
Одно воплощение изобретения включает обогащение культивируемых Т-клеток в отношении Т-клеток CD8+ до быстрого размножения клеток. После культивирования Т-клеток Т-клетки обедняются клетками CD4+ и обогащаются клетками CD8+, например, с использованием разделения на CD8 микрошариках (например, с использованием системы микрошариков CliniMACSplus CD8 (Miltenyi Biotec)). He будучи связанными конкретной теорией, считается, что обогащение некоторых культур Т-клеток CD8+ выявляет in vitro распознавание опухоли, которое может не быть очевидным в смешанной культуре, и улучшает распознавание in vitro опухоли в других культурах. Дополнительно, считается, что обогащенные Т-клетки CD8+ ведут себя более надежно и прогнозируемо при быстрых размножениях в клиническом масштабе, чем смешанные Т-клетки.
Одно воплощение изобретения включает обогащение культивируемых Т-клеток в отношении Т-клеток CD4+ до быстрого размножения клеток. После культивирования Т-клеток Т-клетки обедняются клетками CD8+ и обогащаются клетками CD4+, например, с использованием разделения на CD4 микрошариках (например, с использованием системы микрошариков CliniMACSplus CD8 (Miltenyi Biotec)).
В одном воплощении млекопитающему вводится фактор роста Т-клеток, который стимулирует рост и активацию аутологичных Т-клеток, либо сопутствующе с аутологичными Т-клетками, либо после аутологичных Т-клеток. Фактором роста Т-клеток может быть любой подходящий фактор роста, который стимулирует рост и активацию аутологичных Т-клеток. Примеры подходящих факторов роста Т-клеток включают интерлейкин (IL)-2, IL-7, IL-15 и IL-12, которые можно использовать одни или в разных комбинациях, таких как IL-2 и IL-7, IL-2 и IL-15, IL-7 и IL-15, IL-2, IL-7 и IL-15, IL-12 и IL-7, IL-12 и IL-15, или IL-12 и IL2. IL-12 является предпочтительным фактором роста Т-клеток.
В одном воплощении аутологичные Т-клетки модифицируются для экспрессии фактора роста Т-клеток, который стимулирует рост и активацию аутологичных Т-клеток. Подходящие факторы роста Т-клеток включают, например, любые из факторов роста, описанных выше. Подходящие способы модификации известны в данной области. См., например, Green and Sambrook, Molecular Cloning: A Laboratory Manual, 4th ed., Cold Spring Harbor Press, Cold Spring Harbor, NY 2012 и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, NY, 1994. Желательно модифицированные аутологичные T-клетки экспрессируют фактор роста Т-клеток на высоком уровне. Кодирующие последовательности фактора роста Т-клеток, такие как кодирующая последовательность IL-2, легко доступны в данной области, как и промоторы, связывание которых функциональным образом с кодирующей последовательностью фактора роста Т-клеток стимулирует высокий уровень экспрессии.
Фактор роста Т-клеток можно вводить любым подходящим путем. При введении более чем одного фактора роста Т-клеток их можно вводить одновременно или последовательно в любом порядке и одинаковым путем или разными путями. Предпочтительно фактор роста Т-клеток, такой как IL-2, вводится внутривенно в виде болюсной инъекции. Дозировку фактора роста Т-клеток можно выбирать на основе переносимости пациента. Например, фактор роста Т-клеток может вводиться, пока не происходит одно или более чем одно лимитирующее нежелательное явление. Желательно дозировка фактора роста Т-клеток, такого как IL-2, является такой, которая считается высокой обычными специалистами в данной области. Предпочтительно вводится доза примерно 720000 IU/кг IL-2 три раза в сутки до переносимости, особенно когда рак представляет собой HPV-позитивный рак. Предпочтительно вводятся от примерно 5 до примерно 15 доз IL-2, в среднем около 9 доз.
В одном воплощении аутологичные Т-клетки могут быть модифицированы для экспрессии рецептора Т-клетки (TCR), имеющего антигенную специфичность в отношении антигена HPV, например, любого из антигенов HPV, описанных в данном документе. Подходящие способы модификации известны в данной области. См., например, Green and Sambrook и Ausubel выше. Например, Т-клетки могут быть трансдуцированы для экспрессии рецептора Т-клетки (TCR), имеющего антигенную специфичность в отношении антигена HPV, с использованием методик трансдукции, описанных в Heemskerk et al. Hum Gene Ther. 19:496-510 (2008) и Johnson et al. Blood 114: 535-46 (2009).
В том, что касается способов по изобретению, раковое заболевание может представлять собой любое раковое заболевание, включающее любое из следующих: острый лимфоцитарный рак, острый миелолейкоз, альвеолярная рабдомиосаркома, рак кости, рак мозга, рак молочной железы, рак ануса, анального канала или аноректума, рак глаза, рак внутрипеченочного желчного протока, рак суставов, рак шеи, желчного пузыря или плевры, рак носа, полости носа или среднего уха, рак полости рта, рак вагины, рак вульвы, хронический лимфолейкоз, хронический миелоидный рак, рак толстой кишки, рак пищевода, рак шейки матки, карциноидная опухоль желудочно-кишечного тракта, глиома, ходжкинская лимфома, рак гортанной части глотки, рак почки, рак гортани, рак печени, рак легкого, злокачественная мезотелиома, меланома, множественная миелома, рак носоглотки, неходжкинская лимфома, рак ротоглотки, рак яичника, рак пениса, рак пожделудочной железы, рак брюшины, сальника и брыжейки, рак глотки, рак предстательной железы, рак прямой кишки, рак почки, рак кожи, рак тонкой кишки, рак мягкой ткани, рак желудка, рак яичка, рак щитовидной железы, рак матки, рак мочеточника и рак мочевого пузыря. Предпочтительным раковым заболеванием является рак шейки матки, ротоглотки, ануса, анального канала, аноректума, вагины, вульвы или пениса. Особенно предпочтительным раковым заболеванием является HPV-позитивный рак. HPV-позитивный рак может представлять собой, например, HPV 16-позитивный или HPV 18-позитивный рак. В то время как раковые заболевания, чаще всего ассоциированные с инфекцией HPV, включают рак шейки матки, ротоглотки, ануса, анального канала, аноректума, вагины, вульвы или пениса, способы по изобретению можно использовать для лечения любого HPV-позитивного рака, включая раковые заболевания, которые встречаются в других анатомических областях.
Термин «млекопитающее» в том виде, как он используется в данном документе, относится к любому млекопитающему, включающему млекопитающих отряда Rodentia, таких как мыши и хомяки, и млекопитающих отряда Logomorpha, таких как кролики, но не ограничивается ими. Предпочтительно, что млекопитающие происходят из отряда Carnivora, включая кошачьих (кошки) и псовых (собаки). Более предпочтительно то, что млекопитающие происходят из отряда Artiodactyla, включая быковых (коров) и кабаньих (свиней), или отряда Perssodactyla, включая лошадиных (лошадей). Наиболее предпочтительно то, что млекопитающие происходят из отряда Primates, Ceboids или Simoids (обезьяны) или отряда Anthropoids (человек и человекообразные обезьяны). Особенно предпочтительным млекопитающим является человек.
Термины «лечить» и «предупреждать», а также слова, происходящие от них, в том виде, в котором они используются в данном документе, не обязательно подразумевают 100%-ное или полное излечение или предупреждение. Скорее имеются варьирующие степени лечения или предупреждения, среди которых обычный специалист в данной области узнает те, которые имеют потенциальную пользу или терапевтический эффект. В данном отношении способы по изобретению могут предоставлять любое количество любого уровня лечения или предупреждения рака у млекопитающего. Кроме того, лечение или предупреждение, предоставленное способом по изобретению, может включать лечение или предупреждение одного или более чем одного состояния или симптома заболевания, например, рака, который лечат или предупреждают. Например, лечение или предупреждение, предоставленное способом по изобретению, может включать стимуляцию регрессии опухоли. Также для целей, приведенных в данном документе, «предупреждение» может охватывать задержку начала заболевания или его симптома, или состояния.
Следующие примеры дополнительно иллюстрируют изобретение, но, конечно, не должны истолковываться как каким-либо образом ограничивающие его объем.
Пример 1
В данном примере продемонстрирован способ получения проникающих в HPV-позитивную опухоль лимфоцитов (TIL) для адоптивной клеточной терапии.
Пациенты входили в клинические протоколы и подписывали информированные согласия, которые были одобрены Экспертным советом Национального института рака до резекции опухоли. У пациентов вырезали опухоли. Опухоли тестировали на экспрессию Е6 HPV 16, Е7 HPV 16, Е6 HPV 18 и Е7 HPV 18 с использованием генотипирования полимеразной цепной реакцией (ПЦР) с обратной транскриптазой (ОТ).
Закладывали многочисленные (24) независимые культуры Е6 HPV 16-позитивных, Е7 HPV 16-позитивных, Е6 HPV 18-позитивных и Е7 HPV 18-позитивных TIL с использованием продуктов ферментативного расщепления и фрагментов опухоли (1-2 мм3), полученных острой диссекцией. TIL из продуктов расщепления опухоли получали культивированием суспензий одиночных клеток (5×105/мл), полученных посредством ферментативного расщепления фрагментов опухоли в течение ночи в средах, содержащих коллагеназу, гиалуронидазу и ДНКазу. Культуры фрагментов опухоли и продуктов расщепления инициировали в 2 мл лунках с полной средой (СМ) и IL-2 (6000 IU/мл, Chiron Corp., Эмервиль, Калифорния) в увлажненном инкубаторе при 37°C с 5% CO2. СМ включала RPMI1640 с глутамином плюс 10% человеческой АВ сыворотки, 25 мМ HEPES, 10 мкг/мл гентамицин и 5,5×10-5 М 2-меркаптоэтанол. Через пять суток после инициации из лунок отсасывали половину сред и заменяли свежей СМ и IL-2, и среды заменяли каждые двое-трое суток по мере необходимости. При данных условиях лимфициты сначала будут лизировать смежные клетки в лунке, а затем начнут размножаться и расти.
Культуры TIL достигали конфлюентного роста в исходной 2 мл лунке, и приросшие опухолевые клетки устраняли типично примерно через 12-28 суток после инициации. На практике это составляло примерно 4×106 лимфицитов из каждого исходного фрагмента опухоли или лунки с продуктами расщепления. Путем объединения всех лунок в одном 24-луночном планшете было бы получено приблизительно 5×107 клеток TIL.
При размножении культур, предназначенных для получения TIL, до конфлюентности в 2 мл лунках их тестировали на реактивность, специфичную в отношении HPV. Поскольку TIL были заложены в больших количествах (типично группы из 24 на опухоль), не было возможности индивидуально подсчитывать каждую культуру TIL. В анализе специфичности TIL измеряется активность на объем, а не активность на клетку. В каждой лунке осуществляли тщательное перемешивание, и сто микролитров лимфоцитов (оценочно 1×105 клеток) промывали и совместно культивировали в течение ночи с продуктом расщепления аутологичной опухоли или аутологичными дендритными клетками (DC), происходящими от моноцитов, меченными пептидными пулами Е6 и Е7 HPV 16 и HPV 18 MACS PEPTIVATOR. Пептидные пулы включали 15-мерные пептиды с 11-аминокислотными перекрываниями, которые покрывали полную последовательность Е6 или Е7 (HPV 16 или HPV 18). Пептидные пулы имели чистоту более 75% и имели низкое содержание эндотоксина. Затем измеряли высвобождение IFN-γ с использованием твердофазного иммуноферментного анализа (ELISA, от англ. - electronic intelligence search and analysis). Результаты показаны в Таблице А.


Осуществляли быстрое увеличение числа TIL, реагирующих с HPV, с использованием протокола быстрого размножения (REP), как описано ранее (Dudley et al., J. Immunother., 26: 332-42 (2003) и Riddell et al., J. Immunol. Methods, 128: 189-201 (1990)). Вкратце, клетки TIL культивировали в газопроницаемых колбах G-REX с 200-кратным избытком облученных (40 Гр) аллогенных «питающих» одноядерных клеток периферической крови в полной среде (СМ) с 30 нг/мл антитела против CD3 и 6000 IU/мл IL-2. Половину сред заменяли на сутки 5, используя СМ с 6000 IU/мл IL-2, и затем клетки по необходимости разделяли. TIL размножались в среднем более чем в 3000 раз.
Пример 2
Данный пример демонстрирует реактивность TIL от Пациента 1.
TIL получали, как описано в Примере 1, из 22 разных фрагментов опухоли (F1-F22) от Пациента 1. TIL от Пациента 1 или TIL меланомы (контроль) совместно культивировали с дендритными клетками, меченными пептидным пулом Е7 HPV 18 или пептидным пулом gp100 (контроль), и измеряли IFN-γ. Результаты показаны на Фиг. 1А-1Б. Как показано на Фиг. 1А-1Б, TIL из фрагмента опухоли 22 Пациента 1 распознавали линию аутологичной опухоли, но не пептиды Е7 HPV 18.
TIL из фрагментов опухоли F16, F17 или F22 пациента 1 или клетки, которые давали пациенту для лечения («инфузионный мешок»), совместно культивировали с аутологичной опухолью, одноядерными клетками периферической крови (РВМС) из аутологичной ткани, опухолевыми клетками, совпадающими по всем локусам класса I, клетками HeLa (несовпадающие по HLA) или клетками CaSki (несовпадающие по HLA). Измеряли IFN-γ. Результаты показаны на Фиг. 2А. Как показано на Фиг. 2А, TIL из фрагментов опухоли F16 и F22 демонстрировали распознавание аутологичной опухоли.
Аутологичные опухолевые клетки трансфицировали РНК сайленсинга против HLA-A, HLA-B, HLA-C или иррелевантной РНК (без направленного действия) и совместно культивировали с TIL от пациента 1. Измеряли IFN-γ. Результаты показаны на Фиг. 2Б. Как показано на Фиг. 2Б, распознавание TIL от Пациента 1 было ослаблено сайленсингом HLA-A.
Эффекторные клетки/клетки-мишени (TIL Пациента 1/аутологичные опухолевые клетки; клетки DMF5/624 или F15/HPV18E6121-135 Пациента 12 (Р12)) культивировали одни или совместно культивировали без антитела, с антителом против HLA-A2 или антителом против Класса II. Клетки DMF5 представляют собой Т-клетки, трансдуцированые для экспрессии TCR, ограниченного классом I МНС, против MART-1. Результаты показаны на Фиг. 2В. Как показано на Фиг. 2В, распознавание TIL от Пациента 1 не ингибировалось блокированием HLA-A*02, что свидетельствовало о распознавании опухоли, ограниченной HLA-А*01. Гаплотипом Пациента 1 был HLA-A*01, HLA-A*02.
TIL из фрагмента опухоли F16 или F22 Пациента 1; клетки, которые давали пациенту для лечения («инфузионный мешок»); TIL меланомы 1, 2 или 3 (TIL, культивируемые из меланомных опухолей); TCR mE7 (Т-клетки из РВМС, которые были трансдуцированы для экспрессии TCR против Е711-19 HPV 16) или TIL F15 (TIL от другого пациента, которые реагировали против E6121-135 HPV 18, ограниченные классом II и, следовательно, блокируемые НВ145) совместно культивировали с пептидным пулом gp100, антителом ОКТ3 или DC, меченными пептидным пулом Е7 HPV 18, пептидным пулом Е7 HPV 18 и W6/32, Е711-19 HPV 16, Е711-19 HPV 16 и W6/32, Е711-19 HPV 16 и НВ145, E6121-135 HPV 18, Е6121-135 HPV 18 и W6/32 или E6121-135 HPV 18 и НВ145. Результаты показаны на Фиг. 3. Как показано на Фиг. 3, TIL из фрагмента опухоли F16 от Пациента 1 демонстрировали ограниченное классом I распознавание пептидов Е7 HPV 18.
Пример 3
Данный пример демонстрирует клонирование TIL из фрагмента опухоли 16 Пациента 1 для выделения CD8-позитивных Т-клеток, реагирующих с Е7 HPV 18.
DC загружали Е7 HPV 18 и совместно культивировали с TIL из фрагмента опухоли 16 (F16) Пациента 1. TIL сортировали в отношении 4-1ВВ-позитивных клеток с использованием флуоресцентной сортировки клеток (FACS). Сортированные клетки культивировали в 96-луночных планшетах с двумя клетками на лунку. Клоны подвергали скринингу на реактивность к опухоли против пептидного пула gp100 или пептидного пула Е7 HPV 18. Результаты показаны на Фиг. 4А и 4Б. Как показано на Фиг. 4А и 4Б, клонирование CD8-позитивных Т-клеток из фрагмента опухоли F16 с использованием сортировки FACS на основе 4-1ВВ приводило к выделению двух клонов (12 и 21) с реактивностью к пептидному пулу Е7.
Пример 4
Данный пример демонстрирует реактивность TIL, полученных в Примере 1 от Пациента 12.
TIL получали, как описано в Примере 1, из 36 разных фрагментов опухоли (F1-F36) от Пациента 12. TIL от Пациента 12 или TIL меланомы (контроль) совместно культивировали с дендритными клетками, меченными пептидным пулом Е6 HPV 18, пептидным пулом Е7 HPV 18 или пептидным пулом gp100 (контроль), и измеряли IFN-γ. Результаты показаны на Фиг. 5. Как показано на Фиг. 5, TIL из фрагментов опухоли F1 и F15 от Пациента 12 демонстрировали наивысшие уровни продукции IFN-γ.
Аутологичные DC трансдуцировали лентивирусным вектором, кодирующим Е6 HPV 18, или лентивирусным вектором, кодирующим зеленый флуоресцентный белок (GFP). Другие аутологичные клетки метили пептидным пулом gp100 или пептидным пулом Е6 HPV 18. Трансдуцированные клетки совместно культивировали с TIL из фрагмента опухоли F1 Пациента 12 или TIL меланомы 1, 2 или 3. Результаты показаны на Фиг. 6. Как показано на Фиг. 6, TIL, полученные из фрагмента опухоли F1 Пациента 12 распознавали DC, трансдуцированные Е6 HPV 18, свидетельствуя о том, что TIL нацелены на антиген, подвергающийся природному процессингу и презентации.
Пример 5
Данный пример демонстрирует реактивность клонов TIL из фрагментов опухоли 1 и 15 Пациента 12 для выделения CD8-позитивных Т-клеток, реагирующих сЕ6 HPV18.
DC загружали Е6 HPV 18 и совместно культивировали с TIL из фрагментов опухоли 1 и 15 Пациента 12. TIL сортировали в отношении 4-1BB-позитивных клеток с использованием FACS. Клетки дополнительно сортировали на CD4-позитивные и CD8-позитивные популяции. Сортированные клетки культивировали в 96-луночных планшетах с двумя клетками на лунку. Клоны подвергали скринингу на реактивность в отношении опухоли против пептидного пула Е6 HPV 18. Из 480 лунок с CD4-позитивными клетками из F1 14 росли и 2 были реактивными. Из 912 лунок с CD8-позитивными клетками из F1 33 росли и ни одна не была реактивной. Из 470 лунок с CD4-позитивными клетками из F15 163 росли и 32 были реактивными. Из 960 лунок с CD8-позитивными клетками из F15 41 росли и ни одна не была реактивной.
Сортированные клетки CD4 также тестировали на реактивность при измерении по секреции фактора некроза опухоли (TNF) α при совместном культивировании с пептидным пулом Е6 HPV 18 (пул, охватывающий весь белок Е6), в отсутствие пептида, с подпулами белка Е6 HPV 18 или пптидами 30-37 пептидного пула Е6 HPV 18. Каждый подпул содержал часть исходного пептидного пула. Результаты показаны на Фиг. 7А-7В. Как показано на Фиг. 7А-7В, клоны 3, 12 и 20 фрагмента опухоли F1 от Пациента 12 реагировали против Е6 HPV 18. Клоны CD4-позитивных Т-клеток, которые были получены, распознавали два последовательных 15-мера с 11-аминокислотным перекрытием. Данные пептиды имели общий эпитоп Е6125-135 HPV 18.
Пример 6
Данный пример демонстрирует то, что клоны, полученные из фрагмента опухоли F15 Пациента 12, распознают E6121-135 HPV 18 HLA-DRB1*15-ограниченным путем.
Клоны 3, 12 и 20 совместно культивировали с РВМС донора с гаплотипами, изложенными в Таблице Б. РВМС доноров метили Е6121-135 HPV 18.

Измеряли секрецию TNFα. Результаты показаны на Фиг. 8А-8В. Как показано на Фиг. 8А-8В, клоны, полученные из фрагмента F15 Пациента 12, распознавали E6121-135 HPV 18, которым метили РВМС, которые совпадали и по HLA-DRB1*15 и по HLA-DQB1*06, но не РВМС, которые совпадали только по HLA-DQB1*06, свидетельствуя об ограничении по HLA-DRB1*15. Частота фенотипического аллеля HLA-DRB1*15 составляет 25 процентов.
TIL из клона 3 фрагмента опухоли F15 Пациента 12 совместно культивировали с аутологичными РВМС или РВМС донора, меченными Е677-91 HPV 18 или Е6121-135 HPV 18. Результаты показаны на Фиг. 9А. Как показано на Фиг. 9А, TIL из клона 3 фрагмента опухоли F15 Пациента 12 распознавали РВМС, совпадающие только по DRB1*15, но не только по DRB1*06.
TIL из клона 20 фрагмента опухоли F15 Пациента 12 совместно культивировали с E6121-135 HPV 18 в присутствии антител против HLA-DR, HLA-DQ, HLA-DP, антител против панкласса I или антител против панкласса II. Антитела против панкласса I и II блокируют связывание Т-клеток с молекулами МНС Класса I или Класса II соответственно. Результаты показаны на Фиг. 9Б. Как показано на Фиг. 9Б, распознавание когнатного пепида TIL из клона 20 фрагмента опухоли F15 Пациента 12 ингибировалось блокирующими антителами против HLA-DR. Как показано на Фиг. 9А и 9Б, TIL из фрагмента опухоли F15 Пациента 12 распознают Е6121-135 HPV 18 DRB1*15-ограниченным путем.
Пример 7
Данный пример демонстрирует реактивность TIL от Пациентов 4 и 8.
TIL получали, как описано в Примере 1, из 24 разных фрагментов опухоли (F1-F24) от Пациента 4 или Пациента 8. TIL от Пациента 4 или TIL меланомы (контроль) совместно культивировали с аутологичными DC, меченными пептидным пулом Е6 HPV 16, пептидным пулом Е7 HPV 16 или пептидным пулом gp100 (контроль), и измеряли IFN-γ. Результаты показаны на Фиг. 10. Как показано на Фиг. 10, TIL из фрагментов опухоли F4, F5, F14, F19 и F22 находились среди тех фрагментов опухоли, которые демонстрировали реактивность против аутологичных DC, меченных пептидными пулами Е6 и Е7 HPV 16.
TIL от Пациента 8 или TIL меланомы (контроль) совместно культивировали с аутологичными DC, меченными пептидным пулом Е6 HPV 18, пептидным пулом Е7 HPV 18 или пептидным пулом gp100 (контроль), и измеряли IFN-γ. Результаты показаны на Фиг. 13. Как показано на Фиг. 13, были получены TIL, которые демонстрировали реактивность против аутологичных DC, меченных пептидным пулом Е7 HPV18.
Пример 8
Данный пример демонстрирует клонирование TIL из фрагментов опухоли Пациента 4 для выделения CD4- и CD8-позитивных Т-клеток, реагирующих с HPV.
DC загружали Е6 HPV 16 или Е7 HPV 16 и совместно культивировали с TIL из фрагментов опухоли Пациента 4. TIL, реагирующие с Е6 HPV 16 и Е7 HPV 16, по отдельности сортировали на 4-1ВВ-позитивные клетки с использованием FACS. Число клеток увеличивали, как описано в Примере 1. Клетки дополнительно сортировали на 4-1ВВ-позитивные клетки посредством FACS. Сортированные клетки культивировали в 96-луночных планшетах с двумя клетками на лунку. Клетки дополнительно сортировали на CD4-позитивные и CD8-позитивные популяции. Клоны подвергали скринингу на реактивность с опухолью против пептидных пулов Е6 или Е7 HPV 16.
Результаты показаны на Фиг. 11А-11Г. Как показано на Фиг. 11А-11Г, были получены клоны CD8-позитивных и CD4-позитивных Т-клеток с реактивностью против Е6 и Е7 HPV 16.
Пример 9
Данный пример демонстрирует то, что адоптивная клеточная терапия с использованием Т-клеток против HPV лечит рак.
Критерии включения для исследования включали (1) рецидивирующий/не поддающийся лечению или метастатический рак шейки матки или высокий риск HPV-позитивного рака из любого места и (2) предшествующую химиотерапию платиной, включая химиолучевую терапию.
У пациентов производили резекцию опухолей. TIL получали из опухоли, выращивали, количество TIL увеличивали, и увеличенное количество TIL подвергали скринингу на реактвность с HPV, как описано в Примере 1.
Пациенты получали немиелоаблативную антилимфоцитарную подготовительную схему циклофосфамида (60 мг/кг/сутки) внутривенно (в.в.) в сутки -7 и -6, и флударабин (25 мг/м2/сутки) в.в. от суток -5 до -1.
TIL вводили пациентам внутривенно в сутки 0. Высокую дозу алдеслейкина (интерлейкин (IL)-2) (720000 IU/кг) вводили пациентам внутривенно в сутки 0-4.
Пациенты подвергались полной оценке опухоли через 4-6 недель после завершения исходной схемы лечения (определенной как последние сутки введения алдеслейкина). Если пациент имел стабильное заболевание или уменьшение опухоли, ежемесячно проводили повторные полные оценки в течение приблизительно 3-4 месяцев и затем каждые 3-4 месяца, пока не удовлетворялись критерии выхода из исследования. В качестве целевых поражений идентифицировали все измеримые поражения, вплоть до максимум 10 поражений, репрезентативных для всех вовлеченных органов, и записывали, и измеряли в исходный момент времени. Все другие поражения (или очаги заболевания) идентифицировали как нецелевые поражения и также записывали в исходный момент времени. Поражения оценивали согласно руководству по критериям оценки ответа при солидных опухолях (RECIST) (версия 1,0), как изложено в Таблице В (целевые поражения) и Таблице Г (нецелевые поражения).


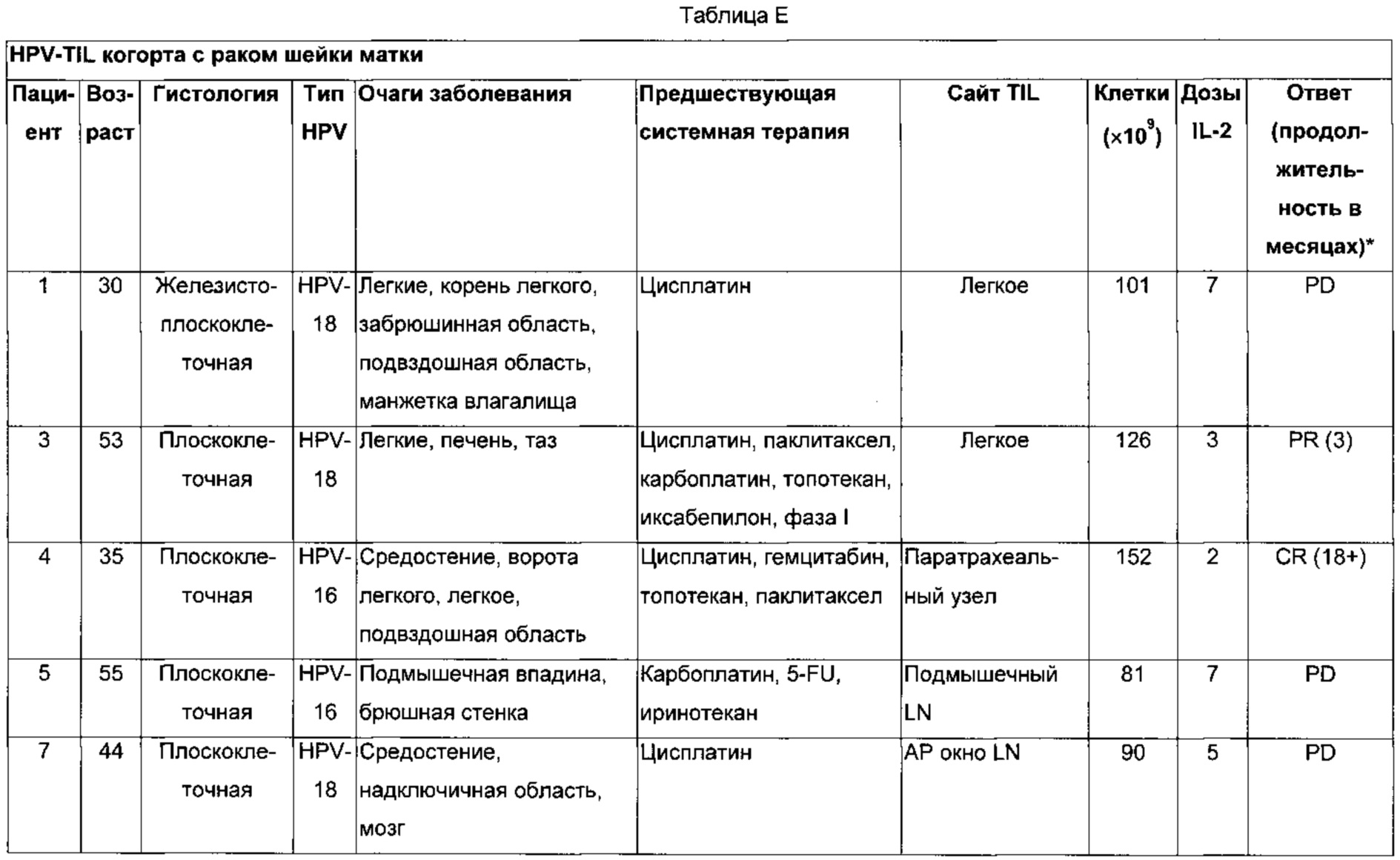
Лечили одиннадцать пациентов. Результаты обобщены в Таблице Д.




Как показано в Таблице Д, из восьми пациентов, для которых были доступны результаты, адоптивная клеточная терапия TIL, реагирующими на HPV, приводила к трем объективным респондерам (OR), которые все были частичными респондерами (PR). Два частичных ответа продолжались через два месяца (Пациенты 3 и 4) после лечения, и один частичный ответ (Пациент 8) продолжался в девять месяцев после лечения.
Сканы компьютерной томографии (СТ) грудной клетки и таза Пациента 4 проводили до лечения и через девять месяцев после лечения. Результаты показаны на Фиг. 12А-Е. Как показано на Фиг. 12А-Б, раковое поражение в парааортальном лимфатическом узле уменьшилось на 100% через девять месяцев после лечения. Как показано на Фиг. 12В-Г, раковое поражение в лимфатическом узле корня левого легкого также уменьшилось на 100% через девять месяцев после лечения. Как показано на Фиг. 12Д-Е, раковое поражение в общем подвздошном лимфатическом узле также уменьшилось на 100% через девять месяцев после лечения.
Проводили сканирования магнитно-резонансной томографией (МРТ) печени Пациента 8 до лечения и через два месяца после лечения. Результаты показаны на Фиг. 14А-Б. Как показано на Фиг. 14А-Б, раковая масса на печени уменьшилась на 100% через два месяца после лечения. Также проводили сканирования СТ брюшной полости и таза Пациента 8 до лечения и через два месяца после лечения. Результаты показаны на Фиг. 14В-З. Как показано на Фиг. 14В-Г, раковое поражение в забрюшинном лимфатическом узле также уменьшилось на 100%. Как показано на Фиг. 14Д-Е, раковая масса в брюшной стенке также уменьшилась на 100%. Кроме того, как показано на Фиг. 14Ж-З, левая околотолстокишечная раковая масса кардинально уменьшалась.
Пример 10
В данном примере приведены обновленные результаты клинического исследования, описанного в Примере 9, которые были получены через девять месяцев после результатов, описанных в Примере 9. Данный пример демонстрирует то, что адоптивная клеточная терапия с использованием Т-клеток против HPV лечит рак.
Способы: клиническое испытание для лечения метастатических HPV-позитивных раковых заболеваний лимфоцитами, проникающими в опухоль (TIL), отобранными по реактивности к Е6 и Е7 EPV (HPV-TIL), проводили, как описано в Примере 9. Инфузии HPV-TIL предшествовало немиелоаблативное кондиционирование с последующим болюсом алдеслейкина в высокой дозе, как описано в Примере 9. Реактивность в отношении HPV оценивали ELISPOT, по образованию IFN-гамма и анализами экспрессии CD137.
Результаты: в данном исследовании лечили девять пациентов с раком шейки матки. Они получали медианное значение Т-клеток 81×109 (в интервале от 33 до 152×109) в виде одной инфузии. Инфундированные клетки обладали реактивностью против Е6 и/или Е7 HPV, связанных с высоким риском, у 6 из 8 пациентов. Два пациента без реактивности на HPV не отвечали на лечение. Три из шести пациентов с реактивностью на HPV демонстрировали объективные ответы опухолией по RECIST (1 - PR и 2 - CR). Один пациент имел наилучший ответ - 39%. Два пациента с широко распространившимися метастазами имели полные ответы опухолей, которые продолжались через 18 и 11 месяцев после лечения. Один пациент с полным ответом имел не поддающуюся лечению химиотерапией HPV-16-позитивную плоскоклеточную карциному (Пациент 4 Примера 9), а другой - не поддающуюся лечению химиолучевой терапией HPV-18-позитивную аденокарциному (Пациент 8 Примера 9). Оба пациента демонстрировали длительное повторное заселение Т-клетками, реагирующими на HPV, после лечения. Повышенные частоты HPV-специфичных Т-клеток выявлялись через 13 месяцев у одного пациента и 6 месяцев у другого. Два пациента с TIL, реагирующими на HPV, которые не отвечали на лечение, не демонстрировали повторного заселения Т-клетками, реагирующими на HPV.
В данном исследовании также лечили шесть пациентов не с раком шейки матки. Один пациент испытал объективный клинический ответ, то есть, частичный ответ метастатического рака миндалины, который продолжался через четыре месяца после лечения (Фиг. 20А-Й).
Данные результаты показаны в Таблицах Е-Ж.



Эти данные показывают, что HPV-TIL могут опосредовать надежную полную регрессию метастатического рака шейки матки, и что клеточная терапия может опосредовать полную регрессию эпителиального злокачественного образования. Эти данные также показывают, что HPV-TIL могут опосредовать регрессию метастатического рака миндалины.
Пример 11
Данный пример дополнительно описывает полные ответы опухолей, полученные в Примере 10 посредством адоптивной клеточной терапии с использованием Т-клеток HPV.
Способы
Получение HPV-TIL: проникающие в опухоль лимфоциты (TIL) выращивали из 2 мм фрагментов вырезанных опухолей, как описано ранее (Dudley et al., J. Immunother., 26(4): 332-42 (2003)). После двух-трех недель разрастания лимфоцитов культуры оценивали на клеточный состав посредством проточной цитометрии и на реактивность против HPV-типоспецифичных Е6 и Е7 посредством анализа образования интерферона (IFN)-гамма, как описано в разделе Оценка реактивности на онкопротеин HPV, приведенном ниже. Анализ проточной цитометрией проводили с флуоресцентными антителами, специфичными в отношении CD3, CD4, CD8 и CD56 (BD Biosciences). Культуры отбирали для дополнительного размножения на основе реактивности против онкопротеинов HPV, быстрого роста, высокой чистоты Т-клеток и высокой частоты Т-клеток CD8+. Увеличение числа клеток, используемых для лечения, проводили с использованием протокола быстрого размножения с газопроницаемыми колбами G-REX (Dudley et al., J. Immunother., 26(4): 332-42 (2003); Jin et al., J. Immunother., 35(3): 283-92 (2012)). Инфузионные продукты сертифицировали в отношении числа жизнеспособных клеток, чистоты Т-клеток (проточная цитометрия), эффективности (образование IFN-γ), стерильности (микробиологические исследования) и отсутствия опухолевых клеток (цитопатология).
Лечение пациентов: пациенты имели метастатический рак шейки матки и поддающееся измерению заболевание. Требовалось предварительное лечение платиновым агентом либо в ходе первичной химиолучевой терапии, либо в ситуации с метастазами. Схема кондиционирования состояла во введении 60 мг/кг циклофосфамида в.в. ежесуточно в течение двух суток, с последующим 25 мг/м2 флударабином в.в. ежесуточно в течение пяти суток. Клетки вводили в.в. на протяжении 20-30 минут. В.в. введение 720000 IU/кг алдеслейкина начинали в пределах 24 часов от инфузии клеток и продолжали каждые восемь часов до прекращения из-за токсичности или максимум на протяжении 15 доз. Введение филграстима начинали в сутки после инфузии клеток и продолжали, пока не восстанавливалось число нейтрофилов.
Ответы опухолей: исследования по визуализации в исходный момент времени производили в пределах четырех недель перед началом схемы кондиционирования. Последующую визуализацию производили через шесть недель после лечения, ежемесячно для трех оценок, каждые три месяца для трех оценок и затем каждые 6 месяцев для двух оценок.
Оценка реактивности онкопротеина HPV: реактивность HPV определяли посредством совместного культивирования Т-клеток (от 40000 до 100000 клеток) с аутологичными незрелыми дендритными клетками (40000 клеток), загруженными 1 мкМ пептидных пулов, охватывающих Е6, Е7, gp100 или EBNA1 и BZLF1 (Miltenyi Biotec, Bergisch Gladbach, Германия). Пептидные пулы включали 15-мерные пептиды, перекрывающиеся на 11 аминокислот. Дендритные клетки получали из прикрепившейся фракции одноядерных клеток периферической крови (РВМС) или из клеток CD14+, выделенных из РВМС с использованием выделения с магнитными шариками (Miltenyi Biotec), путем культивирования в DMEM (среда Игла, модифицированная по Дульбекко), дополненной 10% человеческой сыворотки и 1000 IU/мл GM-CSF и 500 IU/мл IL-4, в течение пяти-шести суток. Контрольные Т-клетки против EBV получали перед лечением путем культивирования РВМС с пептидными пулами EBNA1 и BZLF1 (10 мкг/мл) в средах AIM-V/RPMI, дополненных 10% человеческой сыворотки и 3000 IU/мл IL-2. Для анализов образования IFN-γ концентрацию IFN-γ в супернатантах определяли после совместного культивирования в течение ночи (R&D Systems (Миннеаполис, Миннесота) или Thermo Fisher Scientific (Уолтем, Массачусетс)).
Анализ ELISPOT (Mabtech (Цинциннати, Огайо)) проводили согласно инструкциям изготовителя. Вкратце, планшеты ELIIP (WAIPSWU от Millipore (Биллерика, Массачусетс)), предварительно покрытые захватывающим антителом (клон 1-D1K, Mabtech), засевали 10000 эффекторных клеток и 40000 клеток-мишеней. После 16-18 часов инкубации определяли секрецию IFN-γ посредством добавления биотинилированного антитела против IFN-γ (7-В6-1 биотин, Mabtech) на два часа при комнатной температуре. После инкубации со стрептавидин-щелочной фосфатазой (Mabtech) в течение одного часа добавляли субстратный реактив (5-бром-4-хлор-3'-индолфосфат п-толуидин/хлорид тетразолия нитро-синий, Kirkegaard & Perry Laboratories, Inc. (Гейтерсберг, Мэриленд)) для обеспечения образования пятен. Образование пятен останавливали промывкой водопроводной водой. Пятна подсчитывали с использованием автоматизированного ридера IMMUNOSPOT (Cellular Technology, Ltd. (Шейкер Хайте, Огайо)). Ответы ELIPSOT против Е6 или Е7 определяли как положительные, если они более чем в два раза превышали негативный контроль и были больше, чем 10 пятен/лунку.
Анализы повышающей регуляции CD137 проводили посредством анализа проточной цитометрией после совместного культивирования в течение 20-24 часов (Wolfl et al., Blood, 110(1): 201-10 (2007)). Клетки метили флуоресцентными антителами против CD137, CD4, CD8 и CD3 (BD Biosciences, Сан Хосе, Калифорния). Перед получением данных клеточным анализатором BD FACSCANTO II (BD Biosciences) их контрастно окрашивали пропидия йодидом (BD Pharmingen, Франклин-Лейке, Нью-Джерси). Данные анализировали программой FLOWJO, Мас версии 10 (TreeStar, Ашленд, Орегон).
Иммуногистохимия: иммуногистохимические окрашивания проводили в Лаборатории патологии, NCl, на 4 мкМ срезах из зафиксированных в формалине, залитых в парафин метастатических опухолей согласно стандартным методикам. После депарафинизации, регидратации и демаскировки антигена срезы опухолей инкубировали с клоном 1F6 против человеческого CD4 (Novocastra, Вецлар, Германия) при разведении 1:80 в течение 2 часов, клоном CD8/144B против человеческого CD8 (Dako Corp., Глоструп, Дания) при разведении 1:50 в течение 2 часов или клоном JC8 против человеческого р16 (Santa Cruz, Даллас, Техас) при разведении 1:200 в течение 32 минут. Предметные стекла, окрашенные на CD4, окрашивали на AUTOSTAINER Link 48 (Dako Corp.) и визуализировали с использованием системы выявления ENVISION FLEX+ (Dako Corp.). Предметные стекла, окрашенные на CD8 и р16, окрашивали на VENTANA Benchmark XT (Ventana Medical Systems, Туксон, Аризона) и визуализировали с использованием системы выявления ULTRAVIEW (Ventana Medical Systems). Изображения получали с использованием микроскопии при 10× увеличении.
Определение поднаборов лимфоцитов из периферической крови: общий анализ крови с дифференциальным определением вручную проводился лабораторией гематологии клинического центра. Фенотипирование лимфоцитов в отношении Т-, В- и NK-клеток (естественный киллер) проводилось лабораторией иммунологии и проточной цитометрии NIH (Национальные институты здравоохранения) с использованием стандартизированных критериев.
Полимеразная цепная реакция с обратной транскриптазой (ПЦР-ОТ) в реальном времени: РНК выделяли из 2 мм фрагмента свежей опухолевой ткани с использованием набора RNEASY (Qiagen, Валенсия, Калифорния). Синтез первой нити ДНК посредством обратной транскрипции проводили с использованием суперсмеси кДНК QSCRIPT (Quanta Biosciences, Гейтерсберг, Мэриленд). Для HPV16-E6, HPV16-E7, HPV18-E6 и HPV18-E7 использовали сделанные на заказ последовательности праймеров и зондов TAQMAN (Applied Biosciences, Фостер-Сити, Калифорния). Для стандартизации уровней экспрессии онкопротеина использовали легко доступный набор праймеров и зондов для глицеральдегид-3-фосфатдегдрогеназы (GAPDH) (Hs02758991_g1, Applied Biosciences, Фостер-Сити, Калифорния). ПЦР-ОТ проводили на системе для ПЦР в реальном времени 7500 FAST (Applied Biosciences).
Анализ сывороточных уровней цитокинов: уровни 17 цитокинов (IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12p70, IL-13, IL-17, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF), IFN-γ, моноцитарный хемотактический белок (МСР)-1, воспалительный белок макрофагов (MIP)-1β и фактор некроза опухоли (TNF)-α) измеряли в сыворотках от пациентов, отобранных до и после лечения HPV-TIL, с использованием 17-плексного анализа человеческих цитокинов BIO-PLEX Pro (Bio-Rad Laboratories) согласно инструкциям изготовителя. Уровни цитокинов получали посредством системы BIO-PLEX 200 (Bio-Rad).
Описания клинических случаев
У Пациента 4 диагностировали плоходифференцированный плоскоклеточный рак шейки матки стадии 3В за четырнадцать месяцев до лечения HPV-TIL. Пациента исходно лечили цисплатином, винкристином и блеомицином, с последующей химиолучевой терапией гемцитабином плюс цисплатином и брахитерапией. Через два месяца был выявлен метастатический рак в паратрахеальном (подтвержден биопсией), трахеобронхиальном лимфатических узлах и лимфатических узлах корня легкого с двух сторон. Перед прогрессированием заболевания она получила четыре цикла топотекана и паклитаксела и затем была направлена для клинического испытания, описанного в Примерах 9 и 10. HPV-TIL были получены из резецированного паратрахеального лимфатического узла. Пациент получала антилимфоцитарную химиотерапию, с последующей однократной внутривенной инфузией 152×109 HPV-TIL и двумя дозами алдеслейкина. Дозирование алдеслейкина прекращали из-за утомляемости пациента. Ее выписывали из больницы после восстановления гематологических параметров через 12 суток после инфузии клеток.
За 17 месяцев до лечения HPV-TIL у Пациента 8 была диагностирована аденокарцинома шейки матки стадии IB2. Ее первичную опухоль лечили химиолучевой терапией с цисплатином, с последующей брахитерапией. Через пять месяцев она была отмечена как имеющая первичную опухоль, не поддающуюся лечению химиолучевой терапией (подтвержденную биопсией). Операция по жизненным показаниям идентифицировала участие парааортального и подвздошного лимфатического узла и остаточное заболевание в области таза. Ее раковое заболевание прогрессировало с затрагиванием дополнительных забрюшинных лимфатических узлов и поверхности печени, и у нее развились правый гидроуретеронефроз и двухсторонняя легочная эмболия, которые требовали мочеточникового стента и антикоагуляционной терапии. Данного пациента затем лечили согласно протоколу, описанному в данном Примере, с использованием HPV-TIL, полученных из двух брюшинных узлов. Она получала антилимфоцитарную химиотерапию, с последующим введением 75×109 клеток HPV-TIL и восьми доз алдеслейкина. Дозирование алдеслейкина останавливали из-за гипоксии, вторичной по отношению к отеку легкого, которая требовала дополнительного кислорода и проходила с диурезом. Выписка из больницы происходила через 11 суток после инфузии клеток.
Полные клинические ответы
Оба пациента до лечения имели диссеминированное прогрессирующее заболевание (Фиг. 12А-Е; Фиг. 14А-З; Фиг. 15А-Б; Фиг. 16А-Г; Фиг. 21А-З и Фиг. 22А-З). Пациент 4 имела метастатические опухоли, затрагивающие парааортальный медиастинальный лимфатический узел, корни легких с двух сторон, трахеобронхиальные лимфатические узлы и подвздошные лимфатические узлы (Фиг. 15А; Фиг. 12А-Е и Фиг. 21А-З). Пациент 8 имела метастатический рак, затрагивающий по меньшей мере семь сайтов: две опухоли на поверхности печени, парааортальный и аортокавальный лимфатические узлы, желудочная стенка, околотолстокишечная масса в левой части таза и узелок, закупоривающий правый мочеточник (Фиг. 15Б; Фиг. 14А-З; Фиг. 16А-Г и Фиг. 22А-З). Каждого пациента лечили одной инфузией Т-клеток, которая приводила к регрессии оухоли, которая происходила на протяжении месяцев (Фиг. 15А-Б). Оба пациента испытывали объективные полные ответы опухоли, которые продолжались через 18 и 11 месяцев после лечения (Фиг. 21А-З (Пациент 4) и Фиг. 22А-З (Пациент 8). У Пациента 8 удаляли установленный ранее стент мочеточника после регрессии опухоли, закупоривающей ее правый мочеточник (Фиг. 22Ж и З). Ни один из пациентов не получал дополнительной терапии. Оба пациента вернулись к полной занятости.
Токсичность HPV-TIL
Отсутствовали острые токсичности, связанные с инфузией клеток. Не происходило аутоиммунных нежелательных событий. Оба пациента демонстрировали кратковременные увеличения уровней сывороточных цитокинов (Фиг. 17А-Б), которые были ассоциированы с лихорадкой, но ни у одного пациента не развивался тяжелый синдром высвобождения цитокинов. Определяли уровни цитокинов в криоконсервированной сыворотке. Проводили тестирование в отношении следующих цитокинов: IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12(p70), IL-13, IL-17, G-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), IFN-γ, MCP-1, макрофагальный воспалительный белок 1 бета (MIP-1β) и TNF-α. Демонстрируются цитокины с уровнями, более чем в два раза превышающими исходный уровень при двух последовательных измерениях. Каждые восемь часов после инфузии клеток дозировали алдеслейкин (Пациент 4 получила две дозы, и Пациент 8 получила восемь доз). GCSF вводили ежесуточно, начиная с суток после инфузии клеток, и продолжали, пока не восстанавливалось количество нейтрофилов (Пациент 4 получила 11 доз, и Пациент 8 получила девять доз).
Алдеслейкин дозировали до переносимости по схеме протокола, прекращая дозирование из-за утомляемости у Пациента 4 и одышки у Пациента 8. Нежелательные события степени 3 и степени 4 перечислены в Таблице 3. Самыми обычными токсичностями были гематологические и ожидаемые эффекты антилимфоцитарной схемы кондиционирования (циклофосфамид и флударабин).

Экспрессия опухолевых антигенов и проникновение Т-клеток
Метастатическими опухолями, вырезанными для получения HPV-TIL, были плоскоклеточная карцинома от Пациента 4 и аденокарцинома от Пациента 8. Злокачественные клетки экспрессировали p161NK4A, чувствительный индикатор инфекции HPV высокого риска. Тип HPV и уровни экспрессии Е6 и Е7 - антигенов-мишеней HPV-TIL, определяли для каждой опухоли пациента посредством полимеразной цепной реакции с обратной транскрипцией (ПЦР-ОТ) в реальном времени. Пациент 4 имела HPV-16-позитивный рак, и Пациент 8 имела HPV-18-позитивный рак. Инфильтрат Т-клеток в опухолях от обоих пациентов демонстрировал смешанный состав с преимущественно клетками CD8+ у Пациента 4 и клеткми CD4+ у Пациента 8. И Т-клетки CD4+, и CD8+ вырастали из вырезанных опухолей. Инфундированные HPV-TIL состояли из 19% Т-клеток CD4+ и 79% CD8+ для Пациента 4 и 15% Т-клеток CD4+ и 87% CD8+ для Пациента 8.
Нацеливание HPV-TIL на онкопротеин HPV
HPV-TIL, введенные Пациенту 4, реагировали и против онкопротеина Е6, и против Е7, как демонстрируют анализы образования интерферона (IFN)-γ и ELISPOT (Фиг. 18А и В). Пять процентов и более чем семь процентов инфундированных клеток демонстрировали ответы на Е6 или Е7 соответственно, определенные анализом ELISPOT (Фиг. 18В и Г). Ответы на Е6 были опосредованы Т-клетками CD8+, и ответы на Е7 были опосредованы Т-клетками CD4+ и CD8+. Всего 14 процентов инфундированных клеток демонстрировали реактивность против HPV при измерении посредством анализа повышающей регуляции CD137. Для Пациента 8 HPV-TIL реагировали против Е7 (Фиг. 18Б), причем, при определении анализом ELISPOT, на данный антиген реагировали четыре процента Т-клеток (Фиг. 18Г). Данный ответ был в первую очередь опосредован Т-клетками CD4+.
Повторное заселение Т-клетками, реагирующими на онкопротеин После инфузии HPV-TIL следовало быстрое увеличение Т-клеток CD4+ и CD8+ периферической крови, но не NK и В-клеток (Фиг. 19А-Б). Увеличение числа инфундированных Т-клеток было ассоциировано с установлением и сохранением реактивности Т-клеток периферической крови против онкопротеинов HPV при измерении посредством анализов образования IFN-γ, ELISPOT и повышающей регуляции CD137 (Фиг. 19В-Е). Оба пациента имели слабую, если вообще имели, реактивность против Е6 или Е7 до лечения. После лечения Пациент 4 приобретала надежное распознавание Е6 и Е7 Т-клетками. Для Пациента 8 данное распознавание было слабее, но, тем не менее, было выявимым и, в соответствии с инфундированными Т-клетками, направленным только против Е7. Через один месяц после лечения 12 процентов Т-клеток периферической крови Пациента 4 реагировали с онкопротеином (семь процентов против Е6 и пять процентов против Е7) (Фиг. 19Д). Реактивность против данных антигенов поддерживалась, причем один процент Т-клеток периферической крови демонстрировал распознавание онкопротеина через четыре и 13 месяцев после инфузии клеток (Фиг. 19Д). Пациент 8 демонстрировала 0,4 процента Т-клеток, реагирующих на HPV, через один месяц после лечения (Фиг. 19Е). Данная реактивность поддерживалась, хотя и на меньшем уровне, через три и шесть месяцев после лечения (Фиг. 19Г и Е). В соответствии с реактивностью поднаборов Т-клеток в инфундированных HPV-TIL, HPV-специфичные Т-клетки, которые повторно зяселяли пациентов, были, главным образом, реагирующими на Е6 и Е7 Т-клетками CD8+ для Пациента 4 и реагирующими на Е7 Т-клетками CD4+ для Пациента 8.
Пример 12
В данном примере приведены обновленные результаты для Пациентов 4 и 8 из клинического исследования, описанного в Примерах 10 и 11, которые были получены через четыре месяца после результатов, описанных в Примерах 10 и 11. Данный пример демонстрирует то, что адоптивная клеточная терапия с использованием Т-клеток против HPV лечит рак.
Объективные полные ответы опухолей Пациентов 4 и 8, которых лечили, как описано в Примерах 10 и 11, продолжались через 22 и 15 месяцев после лечения соответственно.
Все ссылки, включая публикации, патентные заявки и патенты, процитированные в данном документе, являются тем самым включенными посредством ссылки в той же самой степени, как если бы каждая ссылка была бы индивидуально и конкретно указана как включенная посредством ссылки и была бы изложена в данном документе во всей ее полноте.
Применение терминов в единственном числе и «по меньшей мере» и аналогичных объектов в контексте описания изобретения (особенно в контексте следующей формулы изобретения) следует истолковывать как покрывающее объекты как в единственном, так и во множественном числе, если в данном документе не указано иное, или если это явно не противоречит контексту. Применение термина «по меньшей мере один», с последующим списком из одного или более чем одного предмета (например, «по меньшей мере один А и Б») следует истолковывать как означающее один предмет, выбранный из перечисленных предметов (А или Б), или любую комбинацию двух или более чем двух из перечисленных предметов (А и Б), если в данном документе не указано иное, или если это явно не противоречит контексту. Термины «вмещающий», «имеющий», «включающий» и «содержащий» следует истолковывать как неограничивающие термины (т.е. означающие «включающий, но не ограничивающийся»), если не указано иное. В данном документе просто подразумевается то, что перечисление интервалов значений служит в качестве сокращенного способа индивидуальной ссылки на каждое отдельное значение, попадающее в данный интервал, если в данном документе не указано иное, и каждое отдельное значение включено в описание, как если бы оно было индивидуально перечислено в данном документе. Все способы, описанные в данном документе, можно осуществлять в любом подходящем порядке, если в данном документе не указано иное, или если это явно не противоречит контексту. Применение любого и всех примеров или типичных формулировок (например, «такой как»), приведенных в данном документе, предназначено просто для лучшего освещения изобретения и не ставит ограничений на объем изобретения, если не заявлено иное. Никакую формулировку в описании изобретения не следует истолковывать как указывающую на какой-либо не заявленный в формуле изобретения элемент, являющийся существенным для воплощения изобретения на практике.
В данном документе описаны предпочтительные воплощения этого изобретения, включающие наилучший способ осуществления изобретения, известный авторам изобретения. При прочтении вышеизложенного описания обычным специалистам в данной области могут стать очевидными вариации данных предпочтительных воплощений. Авторы изобретения ожидают, что квалифицированные специалисты будет применять такие вариации сообразно обстоятельствам, и авторы изобретения подразумевают, что изобретение может воплощаться на практике иначе, чем конкретно описано в данном документе. Соответственно, данное изобретение включает все модификации и эквиваленты объекта изобретения, перечисленные в формуле изобретения, приложенной к нему, которые разрешаются применимым законом. Кроме того, данным изобретением охватывается любая комбинация вышеописанных элементов во всех их возможных вариациях, если в данном документе не указано иное, или если это явно не противоречит контексту.
Реферат
Настоящее изобретение относится к иммунологии. Предложены способы получения популяции Т-клеток, специфичных в отношении папилломавируса человека (HPV), включающие разделение образца HPV-позитивной опухоли головы и шеи на многочисленные фрагменты; культивирование многочисленных фрагментов по отдельности; получение Т-клеток из культивируемых многочисленных фрагментов; тестирование по отдельности Т-клеток из многочисленных фрагментов на специфичное распознавание HPV; отбор Т-клеток, которые демонстрируют специфичное распознавание HPV, и увеличение числа отобранных Т-клеток для получения популяции HPV-специфичных Т-клеток. Данное изобретение может найти дальнейшее применение в адоптивной клеточной терапии. 2 н. и 11 з.п. ф-лы, 22 ил., 8 табл., 12 пр.

Комментарии