Новые пептиды и комбинации пептидов для применения в иммунотерапии рака легких, в том числе немелкоклеточного рака легких (нмрл) и других видов рака - RU2723092C2
Код документа: RU2723092C2
Чертежи

















Описание
Настоящее изобретение относится к пептидам, белкам, нуклеиновым кислотам и клеткам для применения в иммунотерапевтических методах. В частности, настоящее изобретение относится к иммунотерапии рака. Настоящее изобретение относится далее к опухолеассоциированным пептидным эпитопам Т-клеток, в отдельности или в комбинации с другими опухолеассоциированными пептидами, которые могут, например, служить в качестве активных фармацевтических ингредиентов вакцинных композиций, стимулирующих противоопухолевые иммунные ответы, или стимулировать Т-клетки ex vivo с их перенесением в организм пациента. Пептиды, связанные с молекулами главного комплекса гистосовместимости (МНС), или пептиды в отдельности могут быть также мишенями антител, растворимых Т-клеточных рецепторов и других связывающих молекул.
Настоящее изобретение относится к нескольким новым пептидным последовательностям и их вариантам, образованным из молекул HLA I класса и HLA II класса человеческих опухолевых клеток, которые могут быть использованы в вакцинных композициях для вызывания противоопухолевых иммунных ответов или в качестве мишеней для разработки фармацевтически / иммунологически активных соединений и клеток.
УРОВЕНЬ ТЕХНИКИ
Рак легкого является наиболее частой причиной смертности от рака как среди мужчин, так и среди женщин. Рак легкого представляет собой наиболее распространенный вид рака в мире, как по частоте возникновения, так и по уровню смертности. В 2012 г. было зарегистрировано более 1,8 миллиона новых случаев (13% общего числа заболеваний раком) и 1,6 миллиона смертей (20% общего уровня смертности от рака) вследствие рака легких. Рак легких является основной причиной смертности от рака среди мужчин в 87 странах и среди женщин - в 26 странах. Более чем одна треть всех недавно диагностированных случаев приходится на Китай. Наиболее высокие показатели зафиксированы в Северной Америке, Европе и Восточной Азии (World Cancer Report, 2014).
Начиная с 1987 года, от рака легких ежегодно умирало больше женщин, чем от рака молочной железы. Число смертей среди мужчин значимо снижалось в период с 1991 по 2003 гг., примерно на 1,9% ежегодно. Смертность от рака легких среди женщин сохраняется на неизменном уровне после продолжительного роста на протяжении нескольких десятилетий. Данные тенденции по смертности от рака легких отражают снижение числа курящих на протяжении последних 30 лет.
Согласно данным Национального института рака (National cancer institute, NCI) в 2013 г. в США было зарегистрировано приблизительно 230000 новых случаев заболевания раком легких и 160000 смертельных исходов от него.
Исторически сложилось, что мелкоклеточный рак легких отличают от немелкоклеточного рака легких (НМРЛ), куда входят гистологические типы аденокарцинома, плоскоклеточная карцинома и крупноклеточная карцинома. Тем не менее, в течение последнего десятилетия все больше признается различие между аденокарциномой и плоскоклеточной карциномой вследствие существенных различий генетических свойств, а также ответов на специфические виды терапии. Исходя из этого, раковые заболевания легких все чаще классифицируют в соответствии с молекулярным подтипом на основании конкретных генетических изменений, которые вызывают и поддерживают развитие опухоли (Travis et al., 2013).
Прогноз при этом обычно неутешителен. Из всех пациентов после постановки диагноза рака легкого в течение 5 лет выживает 10-15%. Плохие показатели выживаемости пациентов с раком легких являются, хотя бы отчасти, следствием того, что у 80% пациентов на момент постановки диагноза есть метастазы, и у более половины пациентов имеются отдаленные метастазы (SEER Stat facts, 2014). На момент обнаружения IV стадия заболевания наблюдается в 30-40% всех случаев НМРЛ и 60% МРЛ.
Одногодичная относительная выживаемость для пациентов, больных раком легких, слегка возросла с 35% в 1975-1979 гг. до 44% в 2010 году, во многом благодаря усовершенствованиям в хирургической технике и комбинированным способам лечения. Однако 5-летний срок выживаемости для всех стадий в целом составляет лишь 17%. Процент выживаемости для всех случаев, обнаруживаемых, когда заболевание все еще локализовано, составляет 54%; однако только 16% всех случаев рака легких диагностируются на этой ранней стадии. (SEER Stat facts, 2014).
Вид лечения определяется типом (мелкоклеточный или немелкоклеточный) и стадией ракового заболевания и включают хирургическое вмешательство, лучевую терапию, химиотерапию, а также биологическую направленную (таргетную) терапию, такими препаратами как бевацизумаб (AVASTIN®) и эрлотиниб (TARCEVA®). Для локализованного вида рака в качестве лечения обычно выбирается операция. Последние исследования указывают на то, что выживаемость при немел коклеточном раке легких ранней стадии улучшается, если за операцией следует химиотерапия. Так как на момент своего обнаружения заболевание обычно уже распространено, часто используются лучевая терапия и химиотерапия, иногда в сочетании с операцией. Химиотерапия в отдельности или в сочетании с лучевой терапией является стандартным лечением, выбираемым для мелкоклеточного рака легких; при данной схеме лечения большой процент пациентов испытывает ремиссию, которая в некоторых случаях после хирургического вмешательства бывает продолжительной (S3-Leitlinie Lungenkarzinom, 2011).
Распространенный рак легких также имел резистентность к традиционной химиотерапии. Тем не менее, недавние успехи привели к впечатляющему прогрессу в методах лечения, основанных на гистологии и генетике. Уровень пристального внимания находит свое отражение в клинических исследованиях адъювантной химиотерапии, разработанной для разграничения не только мутаций в кодонах 12 и 13 гена KRAS, но и различных аминокислотных замен, как определено конкретными мутациями в кодоне 12 (Shepherd et al., 2013).
В целях расширения числа возможных способов лечения НМРЛ были изучены или продолжают исследоваться различные иммунотерапевтические подходы. В то время как с помощью вакцинации L-BLP25 или MAGEA3 у пациентов с НМРЛ не удалось продемонстрировать преимуществ по выживаемости, при введении вакцин, одна вакцина на основе аллогенной клеточной линии показала многообещающие результаты в рамках клинических исследований. Кроме того, в настоящий момент ведутся клинические исследования вакцин, мишенями которых являются ганглиозиды, рецептор эпидермального фактора роста и несколько других антигенов. Альтернативная стратегия для усиления противоопухолевого Т-клеточного ответа пациента состоит в блокировке ингибирующих Т-клеточных рецепторов или их лигандов специфическими антителами. Терапевтический потенциал нескольких из этих антител, включая ипилимумаб, ниволумаб, пембролизумаб, MPDL3280A и MEDI-4736, при НМРЛ оцениваются сейчас в клинических исследованиях (Reinmuth et al., 2015).
Принимая во внимание серьезные побочные эффекты и высокие расходы, связанные с лечением рака, существует необходимость идентифицировать факторы, которые могут быть использованы для лечения рака вообще и рака легких, в том числе немелкоклеточного рака легких в частности. Также существует необходимость идентифицировать факторы, представляющие собой биомаркеры рака в целом и рака легких в частности, что позволит лучше ставить диагноз, составлять прогноз и предсказывать успех лечения.
Иммунотерапия рака представляет собой вариант специфического воздействия на раковые клетки при снижении до минимума побочных эффектов. В иммунотерапии рака находит применение существование опухолеассоциированных антигенов.
Актуальная классификация опухолеассоциированных антигенов (ТАА) включает следующие основные группы:
а) Раково-тестикулярные антигены: первые в истории идентифицированные ТАА, которые могут распознаваться Т-клетками, принадлежат к этому классу, называвшемуся первоначально «раково-тестикулярные антигены» (СТ), так как его члены экспрессируются в отличных по гистологической структуре опухолях человека, а среди нормальных тканей - только в сперматоцитах/сперматогониях семенника и изредка в плаценте. Так как клетки семенника не экспрессируют молекулы HLA I и II класса, то эти антигены не могут быть распознаны Т-клетками в нормальных тканях и, поэтому, могут рассматриваться как иммунологически опухолеспецифические. Хорошо известными примерами антигенов СТ являются члены семейства MAGE и NY-ESO-1.
б) Антигены дифференциации: Данные ТАА встречаются в опухолевых и нормальных тканях, из которых образуется опухоль. Большинство из известных антигенов дифференциации обнаружено в меланомах и нормальных меланоцитах. Многие из этих линиеспецифических белков меланоцитов участвуют в биосинтезе меланина и поэтому не являются опухолеспецифическими, однако, несмотря на это, они широко применяются в противораковой терапии. Примеры включают, но не ограничиваются, тирозиназой и Melan-A/MART-1 для меланомы или ПСА для рака предстательной железы.
в) Избыточно экспрессируемые ТАА: гены, кодирующие широко экспрессированные ТАА, были обнаружены в различных по гистологической структуре опухолях, а также во многих нормальных тканях, в основном, с более низким уровнем экспрессии. Возможно, что многие эпитопы, процессируемые и потенциально презентируемые нормальными тканями, находятся ниже порогового уровня для распознавания Т-клетками, в то время как их избыточная экспрессия в опухолевых клетках может инициировать противораковый ответ, нарушая установившуюся ранее толерантность. Известными примерами ТАА этого класса являются Her-2/neu, сурвивин, теломераза или WT1.
г) Опухолеспецифические антигены: данные уникальные ТАА образуются в результате мутаций нормальных генов (таких как бета-катенин, CDK4 и т.д.). Некоторые из этих молекулярных изменений ассоциированы с неопластической трансформацией и/или прогрессией. Опухолеспецифические антигены, в основном, способны индуцировать сильные иммунные ответы, не заключая в себе риска аутоиммунных реакций по отношению к нормальным тканям. С другой стороны, данные ТАА в большинстве случаев релевантны только для определенной опухоли, на которой они были идентифицированы, и обычно не являются общими для многих отдельных опухолей. Опухолевая специфичность (или ассоциация) пептида может также возникнуть, если пептид образован из опухолевого (опухоль-ассоциированного) экзона в случае белков с опухоль-специфическими (-ассоциированными) изоформами.
д) ТАА, образующиеся в результате аномальных пост-трансляционных модификаций: такие ТАА могут образоваться из белков, которые не являются ни специфическими, ни избыточно экспрессируемыми в опухолях, однако, несмотря на это, становятся опухолеассоциированными в ходе посттрансляционных процессов, происходящих преимущественно в опухолях. Примеры для этого класса возникают в результате изменения характера гликозилирования, приводящему к появлению новых эпитопов в опухолях, как в случае MUC1, или при таких событиях как белковый сплайсинг во время деградации, которые могут быть опухолеспецифическими или могут не быть ими.
е) Онковирусные белки: данные ТАА являются вирусными белками и могут играть ведущую роль в онкогенном процессе, и, так как они являются чужеродными (не человеческого происхождения), они могут провоцировать Т-клеточный ответ. Примерами таких белков являются вирусные белки человеческой папилломы типа 16, Е6 и Е7, которые экспрессированы в карциноме шейки матки.
Мишенями иммунотерапии, основанной на Т-клетках, являются пептидные эпитопы, полученные из опухолеассоциированных или опухолеспецифических белков, которые презентируются молекулами главного комплекса гистосовместимости человека (МНС) (МНС). Антигены, которые распознаются опухолеспецифическими Т-лимфоцитами, то есть их эпитопами, могут быть молекулами, образованными из любого класса белков, таких как ферменты, рецепторы, факторы транскрипции и т.д., которые экспрессируются и, по сравнению с не измененными клетками того же происхождения, обычно имеют повышенный уровень в клетках соответствующей опухоли.
Существуют два класса молекул МНС, МНС I класса и МНС II класса. Молекулы МНС I класса состоят из альфа-тяжелой цепи и бета-2-микроглобулина, молекулы МНС II класса - из альфа- и бета-цепи. Их трехмерная форма образует связывающую бороздку, которая используется для нековалентного взаимодействия с пептидами.
Молекулы МНС I класса встречаются на большинстве клеток, имеющих ядро. Они презентируют пептиды, образующиеся при протеолитическом расщеплении преимущественно эндогенных белков, дефектных рибосомных продуктов (DRIP) и более крупных пептидов. Однако пептиды, образованные из эндосомальных компартментов или экзогенных источников, также часто встречаются на молекулах МНС I класса. Этот неклассический способ презентации I классом в литературе называется кросс-презентацией. (Brossart and Bevan, 1997; Rock et al., 1990). Молекулы МНС II класса могут встречаться преимущественно на профессиональных антигенпрезентирующих клетках (АПК) и, в первую очередь, презентировать пептиды экзогенных или трансмембранных белков, которые поглощаются АПК, например, во время эндоцитоза и впоследствии процессируются.
Комплексы пептида и молекул МНС I класса распознаются CD8-положительными Т-клетками, несущими подходящий Т-клеточный рецептор (ТКР), тогда как комплексы пептида и молекул МНС II класса распознаются CD4-положительными хелперными Т-клетками, несущими подходящий ТКР. Хорошо известно, что ТКР, пептид и МНС встречаются в стехиометрическом соотношении 1:1:1.
CD4-положительные хелперные Т-клетки играют важную роль в индуцировании и поддержании эффективных ответов CD8-положительных цитотоксических Т-клеток. Идентификация CD4-положительных Т-клеточных эпитопов, образованных из опухолеассоциированных антигенов (ТАА), может быть чрезвычайно важна для разработки фармацевтических препаратов для инициации противоопухолевых иммунных ответов (Gnjatic et al., 2003). В месте локализации опухоли Т-хелперные клетки поддерживают благоприятное для ЦТЛ цитокиновое окружение (Mortara et al., 2006) и привлекают эффекторные клетки, к примеру, ЦТЛ, естественные киллерные клетки (NK), макрофаги, гранулоциты (Hwang et al., 2007).
При отсутствии воспаления экспрессия молекул МНС II класса преимущественно ограничена клетками иммунной системы, в особенности профессиональными антигенпрезентирующими клетками (АПК), например, моноцитами, образованными из моноцитов клетками, макрофагами, дендритными клетками. Было обнаружено, что опухолевые клетки больных раком пациентов экспрессируют молекулы МНС II класса (Dengjel et al., 2006).
Удлиненные (более длинные) пептиды по изобретению могут выступать в качестве активных эпитопов МНС II класса.
Т-хелперные клетки, активированные эпитопами МНС II класса, играют важную роль в управлении эффекторной функцией ЦТЛ в противоопухолевом иммунитете. Эпитопы Т-хелперных клеток, инициирующие ответы Т-хелперных клеток типа ТН1, поддерживают эффекторные функции CD8-положительных киллерных Т-клеток, которые включают цитотоксические функции, направленные против опухолевых клеток, проявляющих комплексы опухолеассоциированный пептид / МНС на их клеточной поверхности. Таким образом, опухолеассоциированные пептидные эпитопы Т-хелперных клеток, одни или в комбинации с другими опухолеассоциированными пептидами, могут служить в качестве активных фармацевтических ингредиентов вакцинных композиций, которые стимулируют противоопухолевые иммунные ответы.
На моделях млекопитающих животных, например, мышах, было показано, что даже при отсутствии CD8-положительных Т-лимфоцитов, CD4-положительных Т-клеток достаточно для ослабления клинических проявлений опухолей посредством ингибирования ангиогенеза при секреции интерферон-гамма (IFN-гамма). (Beatty and Paterson, 2001; Mumberg et al., 1999). Существуют доказательства того, что CD4 Т-клетки являются эффекторными клетками прямого противоопухолевого действия (Braumuller et al., 2013; Tran et al., 2014).
Так как конститутивная экспрессия молекул HLA II класса обычно ограничена иммунными клетками, то выделение пептидов II класса непосредственно из первичных опухолей ранее считалось невозможным. Тем не менее, Dengjel с соавторами удалось идентифицировать ряд эпитопов МНС II класса непосредственно из опухолей (WO 2007/028574, ЕР 1760088 В1).
Так как оба вида ответов, зависящие от CD8 и от CD4, вносят свой вклад в противоопухолевый эффект сообща и синергически, то идентификация и характеристика опухолеассоциированных антигенов, распознаваемых как CD8+ Т-клетками (лиганд: молекула МНС I класса + пептидный эпитоп), так и CD4-положительными хелперными Т-клетками (лиганд: молекула МНС II класса + пептидный эпитоп) являются важными при разработке противоопухолевых вакцин.
Для того чтобы пептид МНС I класса инициировал (вызывал) клеточный иммунный ответ, он также должен связываться с молекулой МНС. Этот процесс зависит от аллеля молекулы МНС и специфических полиморфизмов аминокислотной последовательности пептида. Пептиды, связывающиеся с МНС I класса, как правило, имеют 8-12 аминокислотных остатков в длину и обычно содержат два консервативных остатка («якори») в их последовательности, которые взаимодействуют с соответствующей связывающей бороздкой молекулы МНС. Таким образом, каждый аллель МНС имеет «связывающий мотив», определяющий, какие пептиды могут специфически связываться со связывающей бороздкой.
В зависящей от МНС I класса иммунной реакции пептиды не только должны быть в состоянии связываться с конкретными молекулами МНС I класса, экспрессируемыми опухолевыми клетками, но они также должны затем распознаваться Т-клетками, несущими специфические Т-клеточные рецепторы (ТКР).
Для того чтобы белки были распознаны Т-лимфоцитами в качестве опухолеспецифических или -ассоциированных антигенов, и чтобы они могли использоваться в терапии, должны выполняться особые предварительные требования. Антиген должен экспрессироваться преимущественно опухолевыми клетками и не экспрессироваться или экспрессироваться в сравнительно малом количестве здоровыми тканями. В предпочтительном варианте осуществления пептид должен избыточно презентироваться опухолевыми клетками по сравнению с нормальными здоровыми тканями. Кроме того, желательно, чтобы соответствующий антиген не только присутствовал в каком-либо виде опухоли, но и также имел высокую концентрацию (т.е. несколько копий соответствующего пептида на клетку). Опухолеспецифические и опухолеассоциированные антигены часто образованы из белков, напрямую задействованных в трансформации нормальной клетки в опухолевую, в связи с их функцией, например, при контроле клеточного цикла или подавлении апоптоза. Кроме того, нисходящие мишени белков, напрямую являющихся причиной трансформации, могут быть представлены в повышенном количестве и, таким образом, быть косвенно опухолеассоциированными. Такие косвенно опухолеассоциированные антигены могут также быть мишенями вакцинационного подхода (Singh-Jasuja et al., 2004). Необходимо, чтобы эпитопы присутствовали в аминокислотной последовательности антигена, чтобы гарантировать, что такой пептид («иммуногенный пептид»), образованный из опухолеассоциированного антигена, ведет in vitro или in vivo к Т-клеточному ответу.
В сущности, любой пептид, способный связываться с молекулой МНС может выполнять функцию Т-клеточного эпитопа. Предварительным условием для индукции Т-клеточного ответа in vitro или in vivo является присутствие Т-клетки с соответствующим ТКР и отсутствие иммунологической толерантности к данному конкретному эпитопу.
Поэтому антигены ТАА являются отправной точкой для разработки терапии на основе Т-клеток, включающей противоопухолевые вакцины, но не ограничивающейся ими. Методы идентификации и определения характеристики ТАА обычно основаны на использовании Т-клеток, которые могут быть выделены из организма пациентов или здоровых субъектов, или же они могут быть основаны на генерировании различающихся транскрипционных профилей или различающихся паттернов экспрессии пептидов между опухолевыми и нормальными тканями. Однако идентификация генов, избыточно экспрессированных в опухолевых тканях или человеческих опухолевых клеточных линиях или же селективно экспрессированных в таких тканях или клеточных линиях, не дает точной информации об использовании антигенов, транскрибированных с данных генов, в иммунотерапии. Это обусловлено тем, что только отдельная субпопуляция эпитопов этих антигенов подходит для такого применения, так как Т-клетка с соответствующим ТКР должна быть в наличии, и необходимо, чтобы отсутствовала или была минимальной иммунологическая толерантность к этому конкретному эпитопу. Поэтому в наиболее предпочтительном варианте осуществления изобретения важно выбрать только те пептиды, презентируемые в избытке или селективно, против которых может быть обнаружена функциональная и/или пролиферирующая Т-клетка. Такая функциональная Т-клетка определяется как Т-клетка, которая при стимуляции специфическим антигеном может быть распространена посредством клонирования и способна к выполнению эффекторных функций («эффекторная Т-клетка»).
В случае нацеливания на комплексы пептида с МНС специфических ТКР (например, растворимых ТКР) и антител или других связывающихся с ними молекул (каркасов) в соответствии с изобретением иммуногенность лежащих в основе пептидов является второстепенной. В таких случаях презентация является определяющим фактором.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к пептиду, включающему аминокислотную последовательность, выбранную из группы, состоящей из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 110, или его варианту, который по меньшей мере на 77%, предпочтительно, по меньшей мере на 88% гомологичен (предпочтительно, по меньшей мере на 77% или по меньшей мере на 88% идентичен) последовательности с SEQ ID NO: 1 по SEQ ID NO: 110, где указанный вариант связывается с МНС и/или индуцирует Т-клеточную перекрестную реакцию с указанным пептидом, или его фармацевтически приемлемой соли, где указанный пептид не является базовым полипептидом полной длины.
Настоящее изобретение относится далее к пептиду по настоящему изобретению, включающему последовательность, которая выбрана из группы, состоящей из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 162, предпочтительно с SEQ ID NO: 1 по SEQ ID NO 110, или его варианту, который по меньшей мере на 77%, предпочтительно, по меньшей мере на 88% гомологичен (предпочтительно, по меньшей мере на 77% или по меньшей мере на 88% идентичен) последовательности с SEQ ID NO: 1 по SEQ ID NO 110, где указанный пептид или его вариант обладает общей длиной, составляющей 8-100, предпочтительно 8-30 и, наиболее предпочтительно, 8-20 аминокислот.
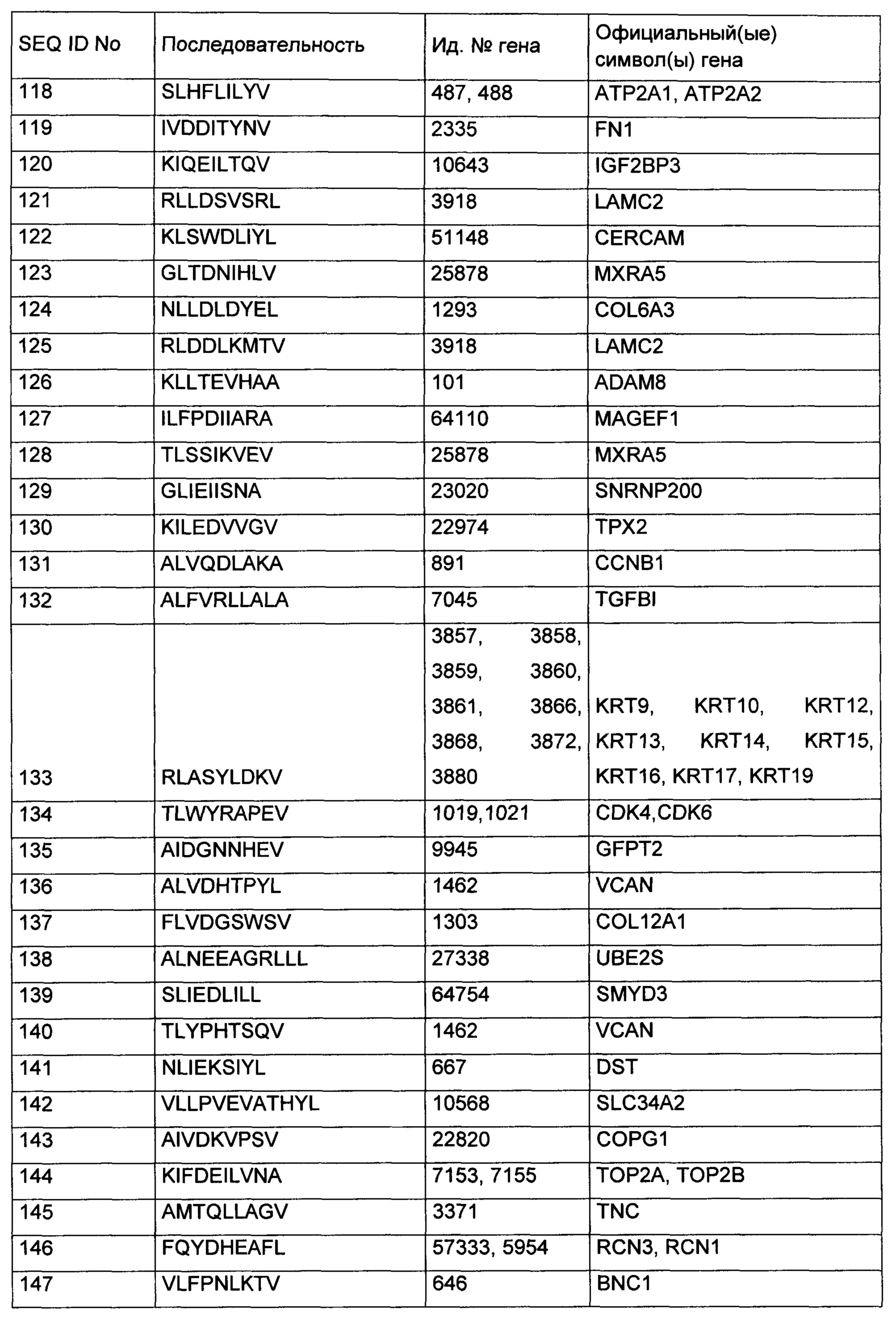
В последующих таблицах представлены пептиды в соответствии с настоящим изобретением, соответствующие им SEQ ID NO и потенциальные исходные (лежащие в основе) гены для данных пептидов. Все пептиды Таблицы 1 и Таблицы 4 связываются с HLA-А*02. Все пептиды Таблицы 2 связываются с аллелями HLA А*24. Все пептиды Таблицы 3 и Таблицы 5 связываются с HLA-DR. Пептиды Таблицы 4 и Таблицы 5 были раскрыты ранее в виде обширных списков в качестве результатов скринингов с высокой пропускной способностью с высокой долей ошибок или были вычислены с помощью алгоритмов, однако ранее ни в коей мере не были ассоциированы с раковыми заболеваниями. Пептиды Таблицы 6, Таблицы 7 и Таблицы 8 являются дополнительными пептидами, которые могут быть полезны в комбинации с другими пептидами по изобретению. Пептиды Таблицы 9 и Таблицы 10 полезны также для диагностики и/или лечения различных других злокачественных заболеваний, которые включают избыточную экспрессию или избыточную презентацию соответствующего базового полипептида.













Настоящее изобретение далее, в основном, относится к пептидам в соответствии с настоящим изобретением для применения в лечении пролисреративных заболеваний, таких как, например, рака головного мозга, молочной железы, колоректального рака, рака пищевода, рака почки, рака печени, рака яичника, рака поджелудочной железы, рака предстательной железы, рака желудка, меланомы, карциномы клеток Меркеля, лейкоза (ОМЛ, ХЛЛ), неходжкинской лимфомы (НХЛ), рака пищевода, в том числе рака желудочно-пищеводного соединения (РП), рака желчного пузыря и холангиокарциномы (РЖП_ХК), рака мочевого пузыря (РМП), рака матки (РМ).
Особенно предпочтительными являются пептиды - в отдельности или в комбинации - в соответствии с настоящим изобретением, выбранные из группы, состоящей из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 110. Более предпочтительными являются пептиды - в отдельности или в комбинации - выбранные из группы, состоящей из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 14 (см. Таблицу 1) и SEQ ID NO: 23 по SEQ ID NO: 47 (см. Таблицу 2), и их применение в иммунотерапии рака легких (в том числе НМРЛ), рака головного мозга, молочной железы, колоректального рака, рака пищевода, рака почки, рака печени, рака яичника, рака поджелудочной железы, рака предстательной железы, рака желудка, меланомы, карциномы клеток Меркеля, лейкоза (ОМЛ, ХЛЛ), неходжкинской лимфомы (НХЛ), рака пищевода, в том числе рака желудочно-пищеводного соединения (РП), рака желчного пузыря и холангиокарциномы (РЖП_ХК), рака мочевого пузыря (РМП), рака матки (РМ) и, предпочтительно, рака легких, в том числе НМРЛ.
Как показано в последующих Таблицах 9, 9-2 и Таблицах 10 и 10-2, многие из пептидов в соответствии с настоящим изобретением присутствуют в других видах опухолей и могут также применяться в иммунотерапии при других показаниях. См. также Фигуру 1 и Пример 1.
Таблица 9: Пептиды HLA-А*02 в соответствии с настоящим изобретением и их конкретное применение при других пролиферативных заболеваниях, в особенности при других раковых заболеваниях Для выбранных пептидов таблица демонстрирует, на каких дополнительных видах опухолей они были обнаружены с избыточной презентацией на более чем 5% исследованных опухолевых образцов, или презентацией на более чем 5% исследованных опухолевых образцов с соотношением среднего геометрического для опухоли и для нормальных тканей, составляющим более 3.





Таблица 9-2: Пептиды HLA-A*02 в соответствии с настоящим изобретением и их конкретное применение при других пролиферативных заболеваниях, в особенности при других раковых заболеваниях (поправка к Таблице 9). Для выбранных пептидов таблица демонстрирует, как и Таблица 9, на каких дополнительных видах опухолей они были обнаружены с избыточной презентацией (включая специфическую презентацию) на более чем 5% исследованных опухолевых образцов, или презентацией на более чем 5% исследованных опухолевых образцов с соотношением среднего геометрического для опухоли и для нормальных тканей, составляющим более 3. Избыточная презентация определяется как более высокая представленность на опухолевом образце по сравнению с образцом нормальной ткани с наивысшей презентацией. Нормальными тканями, на основе которых проводили испытание на избыточную презентацию, были: жировая ткань, ткань надпочечной железы, клетки крови, кровеносные сосуды, ткань костного мозга, головного мозга, хрящевая ткань, ткань пищевода, глаз, желчного пузыря, сердца, почек, толстой кишки, печени, легких, лимфатических узлов, нервная ткань, ткань поджелудочной железы, паращитовидной железы, брюшины, гипофиза, плевры, слюнной железы, скелетных мышц, кожа, ткань тонкого кишечника, селезенки, желудка, вилочковой железы, щитовидной железы, трахеи, мочеточника и мочевого пузыря.


МРЛ = мелкоклеточный рак легких, ПКК = рак почки, КРК = рак толстой или прямой кишки, РЖ = рак желудка, ГКК = рак печени, РПЖ = рак поджелудочной железы, РПрЖ = рак предстательной железы, РМЖ = рак молочной железы, ККМ = карцинома клеток Меркеля, РЯ = рак яичника, НХЛ = неходжкинская лимфома, ОМЛ = острый миелоидный лейкоз, ХЛЛ = хронический лимфоцитарный лейкоз.
Таблица 10: Пептиды HLA-А*24 в соответствии с настоящим изобретением и их конкретное применение при других пролиферативных заболеваниях, в особенности при других раковых заболеваниях Для выбранных пептидов таблица демонстрирует, на каких дополнительных видах опухолей они были обнаружены и имели либо избыточную презентацию на более чем 5% исследованных опухолевых образцов, либо презентацию на более чем 5% исследованных опухолевых образцов с соотношением среднего геометрического для опухоли и для нормальных тканей, составляющим более 3.


Таблица 10-2: Пептиды HLA-A*24 в соответствии с настоящим изобретением и их конкретное применение при других пролиферативных заболеваниях, в особенности при других раковых заболеваниях (поправка к Таблице 10) Для выбранных пептидов таблица демонстрирует, как и Таблица 10, на каких дополнительных видах опухолей они были обнаружены с избыточной презентацией (включая специфическую презентацию) на более чем 5% исследованных опухолевых образцов, или презентацией на более чем 5% исследованных опухолевых образцов с соотношением среднего геометрического для опухоли и для нормальных тканей, составляющим более 3. Избыточная презентация определяется как более высокая представленность на опухолевом образце по сравнению с образцом нормальной ткани с наивысшей презентацией. Нормальными тканями, на основе которых проводили испытание на избыточную презентацию, были: надпочечная железа, артерия, головной мозг, сердце, почки, толстая кишка, печень, легкие, поджелудочная железа, гипофиз, кожа, селезенка, желудок, вилочковая железа.

РЖ = рак желудка, ГКК = рак печени.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 7, 14, 15, 18, 94, 95, 97, 98, 101, 102, 105, 106, 111, 112, 117, 118, 120, 121, 122, 123, 126, 127, 128, 130, 131, 132, 136, 138, 139, 143, 146, 147, 150, 28, 29, 42, 47, 50, 54, 56, 59, 66, 67 и 161 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака почек.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 8, 9, 15, 16, 20, 94, 98, 100, 103, 104, 111, 114, 117, 118, 120, 127, 129, 132, 135, 138, 139, 145, 149, 150, 151, 29, 36, 37, 41, 45, 54, 59, 70, 73, 79, 80 и 82 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака головного мозга.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 2, 4, 18, 94, 105, 113, 114, 115, 117, 120, 124, 126, 128, 130, 131, 132, 134, 137, 138, 144, 146, 149, 153, 26, 31, 33, 36, 41, 42, 44, 49, 50, 56, 58, 63, 67, 77, 78, 85, 159, 160 и 161 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака желудка.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 2, 7, 11, 13, 94, 96, 98, 99, 100, 111, 113, 114, 115, 116, 117, 118, 120, 121, 122, 123, 124, 125, 126, 128, 129, 130, 131, 132, 137, 138, 139, 144, 145, 146, 149 и 152 - в одном предпочтительном варианте осуществления в комбинации - для лечения колоректального рака.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 7, 8, 9, 11, 15, 16, 18, 19, 20, 21, 94, 96, 98, 99, 101, 104, 111, 113, 114, 115, 117, 118, 119, 120, 121, 126, 129, 131, 132, 135, 136, 138, 139, 143, 149, 150, 152, 26, 27, 28, 29, 37, 38, 39, 41, 44, 46, 50, 51, 52, 56, 58, 59, 60, 61, 62, 63, 66, 67, 69, 70, 71, 72, 73, 75, 76, 77, 79, 81, 82, 84 и 161 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака печени.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 1, 2, 3, 4, 13, 18, 96, 101, 103, 104, 105, 112, 113, 114, 115, 117, 119, 120, 121, 123, 124, 125, 126, 128, 131, 132, 133, 135, 136, 137, 138, 139, 143, 146, 149 и 156 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака поджелудочной железы.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 8, 10, 16, 18, 114, 128, 139, 143, 153, 27, 37, 41, 43, 53, 59, 61, 67, 72, 76, 78, 80, 82 и 84 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака предстательной железы.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида в соответствии с настоящим изобретением в соответствии с любой из последовательностей с SEQ ID No. 19, 15, 96, 97, 120 и 127 - в одном предпочтительном варианте осуществления в комбинации - для лечения лейкоза (ОМЛ, ХЛЛ).
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 1, 3, 4, 5, 7, 13, 16, 18, 101, 102, 105, 112, 113, 115, 119, 124, 126, 128, 133, 145 и 156 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака молочной железы.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида в соответствии с настоящим изобретением в соответствии с любой из последовательностей с SEQ ID No. 95, 98, 100, 104, 138, 149 и 151 - в одном предпочтительном варианте осуществления в комбинации - для лечения карциномы клеток Меркеля.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 4, 5, 9, 16, 19, 20, 94, 98, 112, 115, 117, 118, 128, 130, 132, 134, 138, 139, 144, 146 и 148 - в одном предпочтительном варианте осуществления в комбинации - для лечения меланомы.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 4, 8, 9, 10, 16, 18, 94, 98, 99, 100, 101, 102, 104, 105, 111, 113, 114, 115, 117, 118, 120, 121, 123, 124, 125, 126, 128, 129, 130, 131, 132, 134, 137, 138, 139, 142, 143, 144, 148, 149, 150 и 152 - в одном предпочтительном варианте осуществления в комбинации -для лечения рака яичника.
Таким образом, другой аспект настоящего изобретения относится к применению по меньшей мере одного пептида по настоящему изобретению в соответствии с любой из последовательностей с SEQ ID NO: 5, 9, 13, 18, 19, 21, 95, 102, 104, 105, 113, 114, 115, 119, 120, 123, 124, 125, 127, 129, 130, 132, 133, 137, 138, 139, 141, 143, 144, 145, 146, 149, 150, 151, 153, 155, 156 и 157 - в одном предпочтительном варианте осуществления в комбинации - для лечения рака пищевода.
Таким образом, другой особенно предпочтительный аспект настоящего изобретения относится к применению по меньшей мере одного пептида в соответствии с настоящим изобретением в соответствии с любой из последовательностей с SEQ ID No. 13, 25, 113, 114, 115, 120, 121, 128, 159 и 161 - предпочтительно в комбинации - для лечения рака легких (в том числе НМРЛ).
Таким образом, другой аспект настоящего изобретения относится к применению пептидов в соответствии с настоящим изобретением для - предпочтительно комбинированного - лечения пролиферативного заболевания, выбранного из группы: рак легкого (в том числе НМРЛ), рак головного мозга, рак молочной железы, колоректальный рак, рак пищевода, рак почек, рак печени, рак яичника, рак поджелудочной железы, рак предстательной железы, рак желудка, меланома, карцинома клеток Меркеля, лейкоз (ОМЛ, ХЛЛ).
Настоящее изобретение, более того, относится к пептидам в соответствии с настоящим изобретением, имеющим способность связываться с молекулой главного комплекса гистосовместимости человека (МНС) I класса или - в удлиненной форме, такой как вариант по длине - МНС II класса.
Настоящее изобретение далее относится к пептидам в соответствии с настоящим изобретением, где указанные пептиды (каждый из них) состоят или состоят по существу из аминокислотной последовательности в соответствии с SEQ ID NO: 1 по SEQ ID NO: 162, предпочтительно с SEQ ID NO: 1 по SEQ ID NO: 110.
Настоящее изобретение далее относится к пептидам в соответствии с настоящим изобретением, где указанный пептид модифицирован и/или включает непептидные связи.
Настоящее изобретение далее относится к пептидам в соответствии с настоящим изобретением, где указанный пептид является частью слитого белка, в частности слитого с N-терминальными аминокислотами HLA-DR антиген-ассоциированной инвариантной цепи (li), или слитого с антителом (или встроенный в последовательность), таким как, например, антителом, специфичным для дендритных клеток.
Настоящее изобретение далее относится к нуклеиновой кислоте, кодирующей пептиды в соответствии с настоящим изобретением. Настоящее изобретение далее относится к нуклеиновой кислоте в соответствии с настоящим изобретением, которая является ДНК, кДНК, ПНК, РНК или их комбинациями.
Настоящее изобретение далее относится к вектору экспрессии, способному к экспрессии и/или экспрессирующему нуклеиновую кислоту в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к пептиду в соответствии с настоящим изобретением, к нуклеиновой кислоте в соответствии с настоящим изобретением или к вектору экспрессии в соответствии с настоящим изобретением для применения в лечении заболеваний и в медицине, в частности, в лечении рака.
Настоящее изобретение далее относится к антителам, которые является специфическими по отношению к пептидам в соответствии с настоящим изобретением или комплексам указанных пептидов в соответствии с настоящим изобретением и МНС и способам их получения.
Настоящее изобретение далее относится к Т-клеточным рецепторам (ТКР), в частности, к растворимым ТКР и клонированным ТКР, встроенным в аутологичные или аллогенные Т-клетки, и способам их получения, а также к естественным киллерным клеткам (NK) или другим клеткам, несущим указанный ТКР или вступающим в перекрестную реакцию с указанными ТКР.
Антитела и ТКР являются дополнительными вариантами осуществления иммунотерапевтического применения пептидов в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к клетке-хозяину, включающей нуклеиновую кислоту в соответствии с настоящим изобретением или вектор экспрессии, описанный ранее. Настоящее изобретение далее относится к клетке-хозяину в соответствии с настоящим изобретением, которая является антигенпрезентирующей клеткой, предпочтительно - дендритной клеткой.
Настоящее изобретение далее относится к способу получения пептида в соответствии с настоящим изобретением, причем указанный способ включает культивацию клетки-хозяина в соответствии с настоящим изобретением и выделение пептида из указанной клетки-хозяина или его культуральной среды.
Настоящее изобретение далее относится к указанному способу в соответствии с настоящим изобретением, где антиген нагружен на молекулы МНС I или II класса, экспрессированные на поверхности подходящей антигенпрезентирующей клетки или искусственной антигенпрезентирующей клетки, при контактировании достаточного количества антигена с антигенпрезентирующей клеткой.
Настоящее изобретение далее относится к способу в соответствии с настоящим изобретением, где антигенпрезентирующая клетка включает вектор экспрессии, способный экспрессировать или экспрессирующий указанный пептид, содержащий последовательности с SEQ ID No. 1 по SEQ ID No. 110, предпочтительно содержащий последовательности с SEQ ID No. 1 по SEQ ID No. 14 и с SEQ ID No. 23 по SEQ ID No. 47 или вариантную аминокислотную последовательность.
Настоящее изобретение далее относится к активированным Т-клеткам, полученным способом в соответствии с настоящим изобретением, где указанная Т-клетка селективно распознают клетку, которая экспрессирует полипептид, включающий аминокислотную последовательность в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к способу уничтожения клеток-мишеней у пациента, чьи клетки-мишени аберрантно экспрессируют полипептид, включающий любую аминокислотную последовательность в соответствии с настоящим изобретением, причем способ включает введение пациенту эффективного числа Т-клеток, полученных в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к применению любого описанного пептида, нуклеиновой кислоты в соответствии с настоящим изобретением, вектора экспрессии в соответствии с настоящим изобретением, клетки в соответствии с настоящим изобретением, активированного Т-лимфоцита, Т-клеточного рецептора или антитела или других молекул, связывающихся с пептидом и/или комплексом пептид-МНС в соответствии с настоящим изобретением в качестве медикамента или в производстве медикамента. Предпочтительно, если указанный медикамент обладает активным противораковым действием.
Предпочтительно, если указанный медикамент предназначен для клеточной терапии, является вакциной или белком на основе растворимого ТКР или антителом. Предпочтительно, если указанный медикамент является средством клеточной терапии, вакциной или белком, полученным из растворимого ТКР или антитела, например, рТКР, включающего антитело к CD3 или его часть.
Настоящее изобретение далее относится к к применению в соответствии с изобретением, где указанные раковые клетки являются клетками рака легких (в том числе НМРЛ), рака головного мозга, рака молочной железы, колоректального рака, рака пищевода, рака почек, рака печени, рака яичника, рака поджелудочной железы, рака предстательной железы, рака желудка, меланомы, карциномы клеток Меркеля, лейкоза (ОМЛ, ХЛЛ), неходжкинской лимфомы (НХЛ), рака пищевода, в том числе соединения желудка и пищевода (РП), рака желчного пузыря и холангиокарциномы (РЖП, ХК), рака мочевого пузыря (РМП), рака матки (РМ) и предпочтительно, клетками рака легких.
Настоящее изобретение далее относится к биомаркерам, основанным на пептидах в соответствии с настоящим изобретением, в контексте изобретения называемые «мишенями», которые могут быть использованы при постановке диагноза рака, предпочтительно рака легких (в том числе НМРЛ). В роли маркера может выступать избыточная презентация самого(их) пептида(ов), или избыточная экспрессия соответствующего(их) гена(ов). Эти маркеры могут также использоваться для предсказания вероятности успеха лечения, предпочтительно иммунотерапии, и, наиболее предпочтительно, иммунотерапии, направленной на ту же мишень, которая была идентифицирована биомаркером. Например, для окрашивания срезов опухоли для выявления присутствия интересующего пептида в комплексе с МНС может использоваться антитело или растворимый ТКР.
Факультативно антитело обладает дополнительной эффекторной функцией, например, несет иммуностимулирующий домен или токсин.
Настоящее изобретение относится также к применению этих новых мишеней в контексте лечения рака.
Коллаген тип VI альфа-3 (COL6A3) - Ген COL6A3 кодирует цепь альфа-3, одну из трех альфа-цепей коллагена типа VI. Как было продемонстрировано, белковые домены связываются с белками внеклеточного матрикса, что представляет собой взаимодействие, объясняющее значимость этого коллагена в организации компонентов матрикса. Ремоделирование внеклеточного матрикса посредством гиперэкспрессии коллагена типа VI вносит свой вклад в приобретение клетками рака яичника резистентности к цисплатину. Присутствие коллагена типа VI соотносилось со степенью злокачественности опухоли, он являлся прогностическим фактором для рака яичника (Sherman-Baust et al., 2003). COL6A3 экспрессируется в избытке в клетках колоректальных опухолей (Smith et al., 2009a), карцином слюнной железы (Leivo et al., 2005) и экспрессируется в различной степени в тканях рака желудка (Yang et al., 2007). COL6A3 был идентифицирован в качестве одного из семи генов с опухолеспецифическими сплайс-вариантами. Оцененные опухолеспецифические изменения в сплайсинге были высоко согласованными, позволяя сделать четкое подразделение на нормальные и раковые образцы, в некоторых случаях даже на различные стадии опухолей (Thorsen et al., 2008).
Семейство транспортера растворенных веществ 6 (транспортер аминокислот), член 14 (SLC6A14) - SLC6A14 кодирует семейство транспортера растворенных веществ 6, члена 14 (SLC6A14). SLC6A14 является транспортером аминокислот и членом семейства 6 транспортеров растворенных веществ. Членами этого семейства являются натрий- и хлорид-зависимые транспортеры аминокислот/нейротрансмиттеры. SLC6A14 переносит нейтральные аминокислоты и аминокислоты в катионной форме. Этот транспортер экспресиируется на низких уровнях в нормальных тканях (Sloan and Mager, 1999). Уровень SLC6A14, как было показано, повышен в тканях и клеточных линиях рака шейки матки (Gupta et al., 2006), колоректального рака (Gupta et al., 2005) и эстроген-рецептор (ЭР)-положительного рака молочной железы (Karunakaran et al., 2011), а также в клетках гепатомы (Fuchs et al., 2004). Тогда как SLC6A14 экспрессируется в минимальном количестве в соответствующих нормальных тканях/клетках, раковые клетки вызывают повышение уровня SLC6A14, чтобы покрыть их повышенные потребности в этих аминокислотах. Альфа-метил-DL-триптофан(альфа-МТ), селективный блокатор SLC6A14, вызывал аминокислотное истощение и приводил к апоптозу в клеточных линиях ЭР-положительного рака молочной железы (Karunakaran et al., 2011).
Фосфатаза 4 двойной специфичности (DUSP4) - Белок, кодируемый геном DUSP4, является членом подсемейства белков фосфатаз двойной специфичности. DUSP4 деактивирует ERK1, ERK2 и JNK, экспрессируется в ряде тканей и локализован в ядре. Сообщалось, что DUSP4 (или MKP2), в отличие от незлокачественных образцов, избыточно экспрессируется в образцах злокачественного рака молочной железы (Wang et al., 2003). В массивах данных микрочипов для пациентов с колоректальным раком, было обнаружено, что экспрессия DUSP4 является дифференциальной, причем наивысший уровень экспрессии наблюдался в опухолях с мутацией гена BRAF. Более того, высокий уровень DUSP4 ассоциировался с худшим общим исходом (De, V et al., 2013).
Гликопротеин (трансмембранный) nmb (GPNMB) - Ген GPNMB кодирует трансмембранный гликопротеин типа I. GPNMB, как было продемонстрировано, экспрессируется в обширном ряду различных видов раковых опухолей и, в основном, повышает агрессивность опухоли за счет стимуляции миграции, инвазии опухолевых клеток и образования метастазов. На молекулярном уровне, было продемонстрировано, что GPNMB повышает экспрессию ММР-2, 3 и 9, и сам регулируется р53 (Metz et al., 2005; Metz et al., 2007; Rose et al., 2007; Fiorentini et al., 2014). Высокие уровни GPNMB далее коррелируют с более низкой общей выживаемостью при МРЛ, ГБ и ПКК светлоклеточного типа (Qin et al., 2014; Li et al., 2014; Kuan et al., 2006).
Кератин цитоскелетный 80, тип II (KRT80) - KRT80 кодирует кератин 80 (KRT80). KRT80 был обнаружен практически во всех видах эпителия, и он связан с углубленной дифференциацией ткани или клетки. KRT80-содержащие промежуточные филаменты находятся на краях клетки рядом с десмосомальными бляшками, и только в клетках, входящих в стадию конечной дифференциации, KRT80 локализуется в цитоплазме (Langbein et al., 2010).
Белок 4 поддержания структуры хромосом (SMC4) - Белок SMC4 является центральным компонентом комплекса конденсина, который играет роль при конденсации хроматина, а также был связан с ядрышковой сегрегацией, репарацией ДНК и сохранением хроматинового каркаса (Cervantes et al., 2006).
Семейство транспортера растворенных веществ 1 (транспортер глутамата/нейтральных аминокислот), член 4 (SLC1A4) - SLC1A4 является транспортером аминокислот, который опосредует натрий-зависимый обмен малых нейтральных аминокислот (обзор представлен в работе (Kanai et al., 2013)). Было описано, что SLC1A4 экспрессируется существенно большим количеством аденокарцином пищевода по сравнению с плоскоклеточными карциномами (Younes et al., 2000). Как было показано, экспрессия SLC1A4 в клетках рака предстательной железы повышена в ответ на андрогенное лечение (Wang et al., 2013а).
Кератин 5 (KRT5), Кератин 6А (KRT6A), Кератин 6В (KRT6B), Кератин 6С (KRT6C) - KRT5, KRT6A, KRT6B и KRT6C являются гомологичными белками семейства кератинов, являющихся белками промежуточных филаментов. Кератины находят интенсивное применение в качестве белков-маркеров в диагностике опухолей, поскольку их паттерн экспрессии соотносится с тканью происхождения злокачественного образования (обзор представлен в работе (Karantza, 2011)). В нормальных условиях KRT6A и KRT6B, скорее всего, ингибируют клеточную миграцию за счет секвестирования способствующей миграции Src-киназы, ингибируя, таким образом, ее активность. Еще не было изучено, действует ли этот механизм также и в раковых клетках (Rotty and Coulombe, 2012). Окрашивание KRT5/6 было предложено в качестве одного из нескольких маркеров, чтобы отличить плохо дифференцированную аденокарциному от плоскоклеточной карциномы при НМРЛ (Zhao et al., 2014b; Xu et al., 2014). Нейроэндокринные опухоли легких также являются негативными для KRT5/6 (Zhang et al., 2014).
Хемокина (мотив С-С) лиганд 18 (легочный и регулируемый активацией (CCL18) - Этот антибактериальный ген является одним из нескольких генов цитокинов Cys-Cys (СС), находящихся в кластере на плече q хромосомы 17. Цитокин, кодируемый этим геном, проявляет хемотактическую активность по отношению к наивным Т-клеткам, CD4+ CD8+ Т-клеткам и неактивированным лимфоцитам, но не моноцитам или гранулоцитам. Повышенные уровни CCL18 как в опухолевой ткани, так и клетках крови были описаны при раке, и сывороточные уровни CCL18 были предложены в качестве биомаркера для некоторых видов опухолей. Во множестве случаев была продемонстрирована корреляция с поздними стадиями опухоли и неблагоприятным прогнозом (например, рак желудка (Wu et al., 2013а), рак молочной железы (Chen et al., 2011; Narita et al., 2011), рак предстательной железы (Chen et al., 2014), рак мочевого пузыря (Urquidi et al., 2012)). Сывороточные уровни CCL18 были повышены у пациентов с НМРЛ по сравнению со здоровыми контрольными добровольцами. Кроме того, повышенные уровни в сыворотке указывали на более короткий период выживаемости у пациентов с аденокарциномой (Plones et al., 2012). CCL18 является частью ряда сывороточных биомаркеров из 12 белков, предложенных для идентификации НМРЛ (Ostroff et al., 2010).
Матричная металлопротеиназа 12 (макрофаговая эластаза) (ММР12) - ММР12, известная также как человеческая металлоэластаза (НМЕ) или макрофаговая металлоэластаза (ММЕ), является цинк-зависимой эндопептидазой, обладающей способностью расщеплять эластин. Помимо этого, у нее имеется широкий спектр субстратов, распространяющийся на другие матричные белки, такие как коллагены, фибронектин, ламинин, протеогликаны и нематричные белки, такие как альфа-1-антитрипсин. При астме, эмфиземе и хроническом обструктивном заболевании легких (ХОБЛ) ММР12 может приводить к разрушению альвеолярной ткани и ремоделированию тканей дыхательных путей (Cataldo et al., 2003; Wallace et al., 2008). ММР12 участвует в миграции макрофагов и, поскольку с его участием из плазминогена может образовываться ангиостатин, он задействован в ингибировании ангиогенеза (Chakraborti et al., 2003; Chandler et al., 1996; Sang, 1998). Как и другие металлопротеиназы, ММР12 задействована в таких физиологических процессах как эмбриогенез, заживление ран и менструационный цикл (Chakraborti et al., 2003; Labied et al., 2009), но и также в патологических процессах деструкции тканей. Хотя данные основаны на небольшом количестве пациентов и случаев, в литературе представлены вполне достаточные доказательства того, что ММР12 часто экспрессируется в избытке раковыми клетками (Denys et al., 2004; Hagemann et al., 2001; Ma et al., 2009; Vazquez-Ortiz et al., 2005; Ye et al., 2008). Тем не менее, данные противоречивы в отношении влияния избыточной экспрессии ММР12 на клинические параметры и прогноз. Наряду с тем, что она может быть задействована в растворении матрикса, и таким образом, возникновении метастазов, она также может ингибировать рост опухоли посредством выработки ангиостатина, который отрицательно воздействует на ангиогенез (Gorrin-Rivas et al., 2000; Gorrin Rivas et al., 1998; Kim et al., 2004). В случае рака легких последствия экспрессии ММР12 носят противоречивый характер. Об избыточной экспрессии ММР12 в эпителиальных клетках сообщалось при ремоделировании ткани легких, вызванном воспалением. Повышенный уровень ММР12 может играть роль при переходе эмфиземы в рак легких (Qu et al., 2009). Исследования на животных позволяют предположить, что экспрессия ММР12 стромой или макрофагами подавляет рост опухолей легких (Acuff et al., 2006; Houghton et al., 2006). Тем не менее, имеются сообщения о том, что избыточная экспрессия ММР12 при опухолевых заболеваниях легких коррелирует с рецидивами, метастатической болезнью и более коротким периодом безрецидивной выживаемости после резекции (Cho et al., 2004; Hofmann et al., 2005).
Лизосомный мембранный белок 3 (LAMPS) - LAMPS является трансмембранным белком типа I, обнаруженным в лизосомном компартменте, с малым цитоплазматическим доменом и обильно гликозилированным люминальным доменом (Wilke et al., 2012). О повышенном уровне LAMP3 сообщалось для нескольких видов рака, те не менее, экспрессия LAMP3 самими опухолевыми клетками продемонстрирована не была. LAMP3(+) ДК были обнаружены в особенности на краях инвазивной опухоли, где они формируют кластеры с пролиферирующими Т-лимфоцитами, и таким образом, было сделано предположение, что это отражает местный противоопухолевый иммунный ответ, например, при почечноклеточной карциноме (Middel et al., 2010), плоскоклеточной карциноме пищевода (Liu et al., 2010), колоректальной карциноме (Yuan et al., 2008; Sandel et al., 2005), а также меланоме (Ladanyi et al., 2007). Мета-анализ данных транскриптомики позволяет предположить, что низкие уровни экспрессии LAMP3 при раке легких могут быть ассоциированы с более короткой общей выживаемостью (Lindskog et al., 2014).
Центромерный белок N (CENPN) - Белок, кодируемый геном CENPN, формирует часть ассоциированного с нуклеосомой комплекса и является важным для сборки кинетехора. CENPN распознает центромер-специфический вариант гистона (CENP-A) и, таким образом, он необходим для определения сайта рекрутинга для многих других центромерных белков (Carroll et al., 2009). Истощение CENPN и других белков ассоциированного с нуклеосомой комплекса (NAC) не вредит образованию биполярного веретена, но приводит к дефектам хромосомной конгрессии (McClelland et al., 2007). CENPN, вместе с другими белками NAC мобилизуется в места разрыва двойных спиралей ДНК и, таким образом, было сделано предположение, что комплекс играет роль в репарации ДНК (Zeitlin et al., 2009).
Проколлаген-лизин, 2-оксоглутарат-5-диоксигеназа 2 (PLOD2) - Белок, кодируемый этим геном, является связанным с мембраной гомодимерным ферментом, локализованном в цистернах гранулярного эндоплазматического ретикулума. Мутации кодирующего участка данного гена ассоциируются с с синдромом Брука. Повышенный уровень PLOD2 описывали в колоректальном раке (Nicastri et al., 2014), множественной миеломе (Slany et al., 2014) и раке шейки матки (Rajkumar et al., 2011), и он ассоциировался с образованием метастазов в костях (Blanco et al., 2012). Корреляция повышенных уровней экспрессии PLOD2 с неблагоприятным прогнозом была продемонстрирована для глиобластомы (Dong et al., 2005), а также рака молочной железы (Gilkes et al., 2013) и гепатоклеточной карциномы, где он также ассоциировался с увеличением размера опухоли и образованием метастазов внутри печени (Noda et al., 2012).
Матричная металлопротеиназа 1 (ММР1) - ММР1 является частью семейства матричных металлопротеиназ (ММП). Вообще, ММП играет незаменимую роль в регуляции функции, ремоделировании и ангиогенезе сосудов. За счет деградации внеклеточного матрикса и других внеклеточных молекул они способствуют миграции и инвазии эндотелиальных клеток и сосудистых гладкомышечных клеток и оказывают влияние на пролиферацию и апоптоз клеток сосудов (Chen et al., 2013). Избыточную экспрессию ММР1 описывали для нескольких видов рака, и она была ассоциирована с ангиогенезом, инвазией и плохой выживаемостью. Например, повышенные уровни ММР1 описывались в качестве независимого фактора для оценки выживаемости при раке толстой кишки (Langenskiold et al., 2013), и экспрессия ММР1 в опухоли и строме ассоциируется с прогрессированием опухоли и неблагоприятным прогнозом при раке молочной железы (Bostrom et al., 2011). Как было показано, уровни ММР1 повышены как в плазме, так и опухолевой ткани пациентов с раком легких, и они ассоциировались с поздней стадией и снижением срока выживаемости (Li et al., 2010b). Мета-анализ подтвердил ассоциацию полиморфизма 1G/2G ММР1-1607 с повышенным риском развития рака (Xiao et al., 2012).
Кератин 10 (KRT10), кератин 12 (KRT12), кератин 13 (KRT13), кератин 14 (KRT14), кератин 15 (KRT15), кератин 16 (KRT16), кератин 17 (KRT17), кератин 19 (KRT19) - Гомологичные белки семейства кератинов KRT10, KRT12, KRT13, KRT14, KRT15, KRT16, KRT17 и KRT19 являются белками промежуточных филаментов. Некоторые из кератинов ассоциируются со свойствами стволовых клеток, например, KRT14, который считается маркером раковых стволовых клеток (Hatina and Schuiz, 2012; Schalken and van, 2003). KRT15 используется в качестве маркера для идентификации и целенаправленного воздействия на эпидермальные стволовые клетки (Adhikary et al., 2013; Troy et al., 2011), a KRT17 экспрессируется в стволовых клетках в базальном слое утолщения волосяного фолликула (Bragulla and Homberger, 2009). Были проанализированы паттерны экспрессии разных кератинов в различных видах рака, и сообщалось как о их пониженном, так и повышенном уровне. Например, высокие уровни KRT17 ассоциировались с неблагоприятным прогнозом (Wang et al., 2013b; Escobar-Hoyos et al., 2014) и поздней стадией (Kim et al., 2012). В случае KRT13, в большинстве исследований получены свидетельства его пониженного уровня в раковой ткани (Hourihan et al., 2003; Ida-Yonemochi et al., 2012), и во время трансформации плоских клеток экспрессия KRT13, скорее всего, заменяется экспрессией KRT17 (Mikami et al., 2011). В случае KRT10 и KRT15 в различных клинических исследованиях были продемонстрированы как повышенные, так и пониженные уровни. Для KRT19 неизменно сообщается о его избыточной экспрессии во многих видах рака, и он ассоциируется с метастазированием и плохой выживаемостью (Zong et al., 2012; Lee et al., 2012). KRT12 экспрессируется в эпителии роговицы. В роговице наблюдается пониженный уровень кератина 12, который рассматривается в качестве маркера дифференциации (Zhang et al., 2010b).
Муцин 16, ассоциированный с клеточной поверхностью (MUC16) - MUC16 - это крупнейший из нескольких мембранно-связанных муцинов. MUC16 - это однопроходной трансмембранный белок с внеклеточным доменом с высоким уровнем гликозилирования. MUC16 является опухолеассоциированным антигеном, который отщепляется от поверхности раковых клеток яичника и выбрасывается в кровь; этот хорошо известный биомаркер используется для мониторинга роста раковых опухолей яичника (Bafna et al., 2010). Повышенные уровни MUC16 были продемонстрированы в клетках плоскоклеточной карциномы легких (Wang et al., 2014). Кроме того, высокие уровни MUC16 в сыворотке коррелировали с сокращением срока выживаемости пациентов с НМРЛ (Yu et al., 2013; Cedres et al., 2011). В комбинации с другими биомаркерами MUC16 может быть частью сигнатуры генной экспрессии для подтипов рака легких (Li et al., 2012).
Интегрин, альфа 2 (CD49B, субъединица альфа 2 VLA-2-рецептора) (ITGA2) - ITGA2 кодирует альфа-субъединицу трансмембранного рецептора коллагенов и родственных белков. В небольшом числе клинических исследований сообщалось о дерегуляции ITGA2 при раке со свидетельствами как повышенных, так и пониженных уровней: При протоковой аденокарциноме поджелудочной железы ITGA2 был гипометилирован и экспрессировался в избытке, а повышенный уровень экспрессии ассоциировался с плохой выживаемостью (Nones et al., 2014). Напротив, пониженный уровень ITGA2 был продемонстрирован для карциномы предстательной железы (Shaikhibrahim et al., 2011). Снижение уровня экспрессии ITGA2 ассоциировался с образованием метастазов и плохой выживаемостью при раке молочной железы и предстательной железы (Ramirez et al., 2011).
Ольфактомедин-подобный белок 2В (OLFML2B) - OLFML2B принадлежит к семейству белков ольфактомедина, которые являются гликопротеинами, в основном, задействованными в дифференциации хемосенсорных реснитчатых клеток, ранних стадиях нейрогенеза, дорсализации нервных трубок, нейромышечных сигнальных реакциях, экзоцитозе синаптических везикул и патогенезе глаукомы. Транскрипты OLFM2B могут быть обнаружены в ряду различных тканей у мышей, в том числе в легких, желудке и предстательной железе, но они отсутствуют в печени (Furutani et al., 2005). Ген OLFML2B картирован на участке хромосомы 1q23.3, который, как было показано в исследованиях генетического сцепления, является локусом предрасположенности к шизофрении (Puri et al., 2007).
Белок 13, содержащий домен тетратрикопептидного повтора (ТТС13) - ТТС13 принадлежит к семейству белков, содержащих домен тетратрикопептидного повтора (TPR). Домен TPR, видимо, важен для работы шаперонов, клеточного цикла, транскрипции [и] транспорта белков, и белки, содержащие мотив TPR, часто ассоциируются с мультибелковыми комплексами (Blatch and Lassle, 1999). Ген ТСС13 картирован на участке хромосомы 1q42.2. В одном из исследований генетического сцепления хромосому 1q42.2-43 описывали в качестве локуса предполагаемого гена предрасположенности к раку предстательной железы, однако это не было подтверждено в более крупной популяции пациентов в других исследованиях.
Посвященный цитокинезу 2 (DOCK2) - Белок, кодируемый геном DOCK2 принадлежит к семейству белков CDM. DOCK2 известен в качестве важного фактора для миграции и хемотаксиса лимфоцитов. В исследованиях экзомного и полногеномного секвенирования были обнаружены мутации гена DOCK2 при колоректальном раке, аденокарциноме пищевода и интрадуктальных папиллярных муцинозных опухолях поджелудочной железы (Yu et al., 2014; Dulak et al., 2013; Furukawa et al., 2011). Кроме того, как было показано, DOCK2 был дифференциально экспрессирован в образцах ткани астроцитомы у детей и, поэтому, возможно представляет собой интересную терапевтическую мишень при этом заболевании (Zhao et al., 2014a).
Белок 1, связанный с рецептором полиовируса (медиатор С проникновения вируса герпеса) (PVRL1) - PVRL1 кодирует белок адгезии, который играет роль в организации адгезивных соединений и плотных сочленений в эпителиальных и эндотелиальных клетках. Ген PVRL1 картирован на участке хромосомы 11q23, который как было обнаружено, амплифицирован при аденокистозной карциноме (Zhang et al., 2013). Имея важную функцию в клеточной адгезии, PVRL1 ассоциируется как с регуляцией клеточных свойств: инвазивности и миграции, так и с эпителиально-мезенхимальным переходом, - это важнейшие процессы при развитии опухоли. PVRL1 был идентифицирован как признак такого подтипа рака шейки матки как плоскоклеточная карцинома (Imadome et al., 2010). Повышенный уровень экспрессии PVRL1 был обнаружен в опухолях щитовидной железы по сравнению с нормальной тканью щитовидной железы, и более повышенным он был в ткани папиллярной карциномы щитовидной железы (Jensen et al., 2010). Экспрессия PVRL1 /2 ассоциируется с более благоприятным прогнозом при остром миелоидном лейкозе (Grafetal., 2005).
FK506-связывающий белок 106 65 кДа (FKBP10) - FK506-связывающий белок 10 (FKBP10) принадлежит к семейству пептидил-пролил-цис/транс-изомеразы типа FKBP. Он локализован в эндоплазматическом ретикулуме и выступает в качестве молекулярного шаперона (Ishikawa et al., 2008; Patterson et al., 2000). Он высоко экспрессирован при развитии легких и может быть реактивирован в согласованном порядке с помощью белков внеклеточного матрикса после повреждения легких (Patterson et al., 2005).
АТФ-связывающие кассетные транспортеры подсемейства С (CFTR/MRP), член 1 (АВСС1) - Белок, кодируемый геном АВСС1 является членом надсемейства транспортеров АТФ-связывающей кассеты (АВС). Белки АВС переносят различные молекулы через вне- и внутриклеточные мембраны. АВСС1 играет важную роль, действуя как эффлюксный насос для лекарственных средств как в нормальных, так и опухолевых клетках (Chen and Tiwari, 2011). В нескольких исследованиях была описаны избыточная экспрессия АВСС1 в различных видах опухолей, и во множестве случаев была обнаружена ассоциация уровней экспрессии АВСС1 со стадией опухоли, метастазами и неблагоприятным прогнозом (например, при раке молочной железы, предстательной железы и легких) (Deeley et al., 2006). В одном из исследований у пациентов из Китая в гене АВСС1 был обнаружен однонуклеотидный полиморфизм, повышающий предрасположенность к НМРЛ (Yin et al., 2011). В другом исследовании сообщалось об ассоциации между однонуклеотидными полиморфизмами гена АВСС1 и выживаемостью без прогрессирования заболевания у пациентов с НМРЛ (Lamba et al., 2014).
Арахидонат 15-липоксигеназа, типа В (ALOX15B) - ALOX15B кодирует члена семейства липоксигеназ, родственных по своей структуре негемовых железосодержащих диоксигеназ, задействованных в выработке гидропероксидаз жирной кислоты. Роль, которую играет ALOX15B в развитии опухоли, более известный как 15-ЛОГ-2, и его продукт ферментации, 15-S-гидроксиэйкозатетраеновая кислота (15S-HETE), наиболее интенсивно изучена в случае раке предстательной железы. В нескольких исследованиях было продемонстрировано, что уровни экспрессии ALOX15B, а также уровни выработки 15S-HETE, существенно понижены при раке предстательной железы по сравнению с нормальной тканью или клеточными линиями (Hu et al., 2013; Shappell et al., 2001). В нормальном легком экспрессия ALOX15B ограничена пневмоцитами II типа. Уровень экспрессии повышен при НМРЛ, и была описана обратная корреляция между уровнями ALOX15B и степенью злокачественности опухоли, а также индексом пролиферации опухолевых клеток (Gonzalez et al., 2004).
Сфингомиелинфосфодиэстераза, кислотоподобная 3В (SMPDL3B) - SMPDL3B - это Сфингомиелинфосфодиэстераза, экспрессируемая в подоцитах, экспрессия которой ассоциируется с заболеванием почек при сахарном диабете и фокальным сегментарном гломерулосклерозе. Пониженные уровни экспрессии SMPDL3B при заболевании почек ассоциировались с ремоделированием актинового цитоскелета и апоптозом (Merscher and Fornoni, 2014). Ген SMPDL3B картирован на участке хромосомы 1р35.3.
Глютамин-фруктозо-6-фосфаттрансаминаза 2 (GFPT2) - GFPT2 участвует в росте аксонов, ранних стадиях развития нейронов, сигнальной трансдукци и/синтезе нейропептидов и в реализации рецепторами нейромедиаторов их функций (Tondreau et al., 2008). Генетические варианты GFPT2 ассоциированы с диабетом 2 типа и диабетической нефропатией (Zhang et al., 2004). Кроме того, ассоциация однонуклеотидных полиморфизмов в GFPT2 предполагает, что ген, задействованный в модуляции пути окислительного распада, мог бы быть основным виновником хронической почечной недостаточности при сахарном диабете (Prasad et al., 2010). Метилирование ДНК гена GFPT2 оценивали в образцах первичной острой лимфобластной лейкемии (ALL). Пациенты с несколькими метилированными CpG-островками имели худшую общую выживаемость (Kuang et al., 2008). GFPT2 играет роль в метаболизме глютамина и, как наблюдалось, его уровни экспрессии выше в мезенхимальных клеточных линиях. Метаболизм глютамина может играть важную роль в прогрессировании опухоли, и ингибиторы путей клеточного метаболизма могут быть формой эпигенетической терапии (Simpson et al., 2012).
Геликаза бокса DEAD 5 (Asp-Glu-Ala-Asp) (DDX5) - DDX5 (р68) является АТФ-зависимой РНК-геликазой, которая играет роль в сплайсинге, процессинге рРНК и биогенезе рибосом, процессинге микроРНК, а также в регуляции транскрипции. DDX5 является транскрипционным коактиватором нескольких факторов, играющих роль в развитии ракового заболевания, таких как андрогенный рецептор, р53 и Runx2. Избыточная экспрессия DDX5 была продемонстрирована для ряда различных раковых заболеваний, как, например, колоректальный рак, рак молочной железы, рак предстательной железы, глиома, гепатоклеточная карцинома и лейкоз (Dai et al., 2014; Fuller-Pace, 2013).
Енолаза 1, (альфа) (ENO1) - Ген ENO1 кодирует альфа-енолазу (ENOA), один из трех белков енолазы, другие белки - это бета- и гамма-енолаза, соответственно. Избыточная экспрессия ENO1/ENOA была продемонстрирована для многих видов рака (Capello et al., 2011). ENOA является металлоферментом, задействованным в гликолизе при синтезе фосфоенолпирувата. Повышенные уровни ENOA коррелировали с плохой выживаемостью у пациентов с НМРЛ (Chang et al., 2006). В равной степени, другое клиническое исследование продемонстрировало повышенный уровень экспрессии ENO1 в группе неблагоприятного прогноза для пациентов с аденокарциномой легких (Pernemalm et al., 2013). ENOA был продемонстрирован в качестве опухолеассоциированного антигена, и антитела к ENOA, а также ENOA-специфические Т-клетки, были обнаружены у пациентов с аденокарциномой поджелудочной железы (Cappello et al., 2009). Аутоантитела к ENOA были также обнаружены у пациентов с НМРЛ, и, как было показано, экспрессия ENOA повышена в ткани НМРЛ (Не et al., 2007; Li et al., 2006).
Подсемейство D лектин-подобных рецепторов киллерных клеток, член 1 (KLRD1) - KLRD1, более хорошо известный как CD94, связывается с молекулами NKG2, образуя гетеродимер, который экспрессируется на естественных киллерных клетках (NK) и цитотоксических Т-лимфоцитах (ЦТЛ). Как было показано, ингибирующий рецептор KLRD1 (CD94): NKG2A избыточно экспрессируется в опухоль-инфильтрующих лимфоцитах, например, при почечноклеточной карциноме и раке шейки матки, что, возможно, способствует нарушению противоопухолевого иммунного ответа (Schleypen et al., 2003; Sheu et al., 2005). В равной степени, избыточная экспрессия HLA-E, лиганда KLRD1 (CD94): NKG2A, на опухолевых клетках, возможно, дополнительно способствует ускользанию опухоли от иммунного надзора (Bossard et al., 2012; Gooden et al., 2011).
Коллаген, тип XII, альфа 1 (COL12A1) - Ген COL12A1 кодирует альфа-цепь коллагена типа XII, члена семейства коллагенов FACIT (ассоциированные с фибриллами коллагены с прерываемыми тройными спиралями). Коллаген типа XII является гомотримером, взаимосвязанным, как было обнаружено, с коллагеном типа I. Как считается, эта взаимосвязь модифицирует взаимодействие коллагена типа I с фибриллами и окружающим матриксом (Oh et al., 1992). COL12A1 может быть задействован в регулировании базальных мембран, образуя специфические молекулярные мостики между фибриллами и другими компонентами матрикса (Thierry et al., 2004). COL12A1 экспрессируется в сердце, плаценте, легких, скелетных мышцах и поджелудочной железе (Dharmavaram et al., 1998), в разнообразных соединительных тканях, включая суставной и эпифизарный хрящ (Gregory et al., 2001; Walchli et al., 1994; Watt et al., 1992). Уровень экспрессии COL12A1 был понижен в опухолях, характеризующихся высокой микросателлитной нестабильностью, при сравнении со стабильной группой с низкой микросателлитной нестабильностью или без нее (Ortega et al., 2010).
АТФ-связывающая кассета подсемейства А (АВС1), член 13 (АВСА13) - У человека семейство АТФ-связывающих кассетных (ABC) трансмембранных транспортеров имеет по меньшей мере 48 генов и 7 подсемейств генов. Предсказанный белок АВСА13 состоит из 5058 аминокислотных остатков, что делает его наиболее крупным белком ABC, описанным до сих пор (Prades et al., 2002). Knight и соавторы определили, что белок АВСА13 экспрессируется у мышей и человека в гиппокампе и корковом веществе, обоих участках головного мозга, имеющих отношение к шизофрении и биполярным расстройствам (Knight et al., 2009). Ген АВСА13 картируется на хромосоме 7р12.3, участке, ответственном за наследственное нарушение, поражающее поджелудочную железу (синдром Швахмана-Даймонда), а также являющемся локусом, задействованным в инвазии Т-клеток в опухоли и развитии метастазов (INM7), являясь поэтому позиционным геном-кандидатом для данных патологий (Prades et al., 2002).
Циклин В2 (CCNB2) - CCNB2 является одним из нескольких циклинов, ассоциированных с основной киназой, регулирующей клеточный цикл CDK1 (CDC2). Во время клеточного цикла уровни циклина регулируются транскрипцией, обеспечивая наличие различных уровней активности и специфичности к CDK1, тем самым, контролируя ход клеточного цикла. Экспрессия В2 регулируется генами-супрессорами опухоли р53 и BRCA1, которые действуют при подавлении транскрипции циклина В2 (Quaas et al., 2012; De et al., 2011). Повышенный уровень CCNB2 описывали для нескольких видов опухолей, таких как рак шейки матки (Espinosa et al., 2013; Rajkumar et al., 2011), рак мочевого пузыря (Lu et al., 2010), колоректальная карцинома (Park et al., 2007), астроцитома (Liu et al., 2013) и глиобластома (Hodgson et al., 2009). Уровни экспрессии CCNB2 были ассоциированы с неблагоприятным прогнозом при раке молочной железы, и их идентифицировали как независимый прогностический маркер выживаемости (Shubbar et al., 2013). CCNB2 экспрессируется в избытке при НМРЛ (Hofmann et al., 2004), и он был идентифицирован в качестве маркера неблагоприятного прогноза у пациентов с аденокарциномой легких, но не плоскоклеточной карциномой (Takashima et al., 2014).
MutS гомолог 6 (MSH6) - MSH6 кодируется члена семейства MutS репарации ошибочно спаренных нуклеотидов ДНК. Белки MSH, в том числе MSH6, распознают ошибки в геномной последовательности во время репликации, предотвращая дупликацию поврежденной цепочки и производя репарацию одноцепочечных разрывов (Conde-Perezprina et al., 2012). В нескольких видах рака были описаны мутации MSH6 и неверно работающий механизм репарации ошибочно спаренных нуклеотидов ДНК (MMR) (например, колоректальный рак (Sameer et al., 2014; Vilar and Gruber, 2010; Silva et al., 2009; Kastrinos and Syngal, 2007; Davidson, 2007), рак поджелудочной железы (Solomon et al., 2012), рак яичника (Xiao et al., 2014), рак молочной железы (Mahdi et al., 2013)).
Гомолог PRP3 пре-мРНК процессинг-фактора 3 (S. cerevisiae) (PRPF3) - PRPF3 кодирует процессинг фактор 3 пре-мРНК. PRPF3 опосредует рекрутинг механизма деградации ядерной РНК в сплайсеосому (Nag and Steitz, 2012). Уровень PRPF3 повышен при гепатоклеточной карциноме за счет фетального/раковоспецифического сплайс-варианта фактора транскрипции НМF4альфа (Niehof and Borlak, 2008).
Лизофосфатидилхолинацилтрансфераза 1 (LPCAT1) - LPCAT1 катализирует превращение лизофосфатидилхолина (ЛФХ) в фосфатидилхолин. Кроме того, LPCAT1 способен превращать лизо-ФАТ (алкилированный ЛФХ) в фактор активации тромбоцитов (ФАТ). Избыточную экспрессию LPCAT1 описывали в колоректальном раке (Mansilla et al., 2009), гепатоклеточной карциноме (Morita et al., 2013), раке молочной железы (Abdelzaher and Mostafa, 2015), раке предстательной железы (Xu et al., 2013; Grupp et al., 2013; Zhou et al., 2012) и раке легких (Wu et al., 2013b). Избыточная экспрессия LPCAT1 способствовала клеточной пролиферации, миграции и инвазии in vitro (Morita et al., 2013).
Соседний белок SON по ходу транскрипции (DONSON) - DONSON кодирует соседний белок SON по ходу транскрипции (DONSON). DONSON - это центросомный белок, уровни которого регулируются в ходе клеточного цикла, их пик приходится на S-фазу. DONSON необходим для образования правильного митотического веретена и, по-видимому, играет роль в ответе на повреждение ДНК (Fuchs et al., 2010). Литература с описанием его связи с раком отсутствует.
Фактор почкования, неингибируемый гомологом бензимидазола 1 бета (дрожжи)) (BUB1B) - BUB1B кодирует серин/треонинкиназу В митотической сверочной точки, серин/треонинкиназу. Он действует как митотический регулятор, обеспечивающий точное расхождение хромосом за счет своей роли в митотической сверочной точке и образование правильного соединения микротрубочек и кинетохоров. Как о пониженных, так и о повышенных уровнях экспрессии BUB1B сообщалось для различных видов опухолей. Как правило, в литературе больше сообщается об избыточной экспрессии BUB1B в раковых клетках, также была описана ассоциация с прогрессированием опухоли и неблагоприятным прогнозом, например, при назофаренгеальной карциноме (Huang et al., 2012а), раке миндалин (Hannisdal et al., 2010), раке молочной железы (Maciejczyk et al., 2013), эпителиальном раке яичника (Lee et al., 2009) и аденокарциноме протоков поджелудочной железы (Gladhaug et al., 2010). В равной степени, пониженный уровень белка BUB1B ассоциировался с более длительным периодом выживаемости при раке предстательной железы (Cirak et al., 2013).
Компонент олигомерного комплекса Гольджи 4 (COG4) - COG4 - это компонент олигомерного белкового комплекса, задействованного в структуре и функционировании аппарата Гольджи. Исследования взаимодействия предполагают, что COG4 служит центральным компонентом комплекса и играет важнейшую роль в сборке/функционировании комплекса (Loh and Hong, 2004).Субъединицы комплекса Гольджи COG4, 6 и 8, способны взаимодействовать с определенными белками семейства SNARE в аппарате Гольджи, и они задействованы в определении специфичности сортировки везикул внутри аппарата Гольджи (Willett et al., 2013). Кроме того, комплекс COG, как было показано, регулирует сохранение механизма гликозилирования Гольджи (Pokrovskaya et al., 2011).
26S протеасома (просома, макропаин) не-АТФазная субъединица 14 (PSMD14) - PSMD14 является компонентом протеасомы 26S, мультибелкового комплекса, который расщепляет белки, направленные на нарушение сигнального пути убиквитина. Белок PSMD14 внутри комплекса 19S (19S кэп; РА700) отвечает за деубиквитинирование субстрата во время протеасомной деградации (Spataro et al., 1997). Аберрантная экспрессия и дисфункция протеасомных субъединиц были задействованы в злокачественной трансформации и развитии клеточной резистентности к различным цитотоксическим препаратам. Избыточная экспрессия PSMD14 в клетках млекопитающих влияет на клеточную пролиферацию и ответ на цитотоксические препараты, такие как винбластин, цисплатин и доксорубицин (Spataro et al., 2002). Снижение уровня PSMD14 с помощью трансфекции миРНК имело существенное влияние на жизнеспособность клеток, вызывая задержку клеток на фазе G0-G1, что в конце концов, приводит к старению (Byrne et al., 2010).
RAD54 гомолог В (S. cerevisiae) (RAD54B) - RAD54B, белок репарации и рекомбинации ДНК, у людей кодируется геном RAD54B. Связываясь с двухнитевой ДНК, RAD54 проявляет АТФазную активность в присутствии ДНК. Человеческий белок RAD54B является паралогом белка RAD54, который играет важные роли в гомологичной рекомбинации. Гомологичная рекомбинация (ГР) необходима для правильной репарации двухнитевых разрывов в ДНК (DSB) (Sarai et al., 2008). Нокдаун гена RAD54B, о котором известно, что он имеет соматические мутации при раке, вызывает хромосомную нестабильность (CIN) в клетках млекопитающих (McManus et al., 2009). Повышенная экспрессия гена RAD54B значимо ассоциирована с более кратким периодом времени до начала прогрессирования заболевания и плохой общей выживаемостью у пациентов с мультиформной глиобластомой (Grunda et al., 2010).
Рецептор семейства Frizzled 1 (FZD1), рецептор семейства Frizzled 2 (FZD2), рецептор семейства Frizzled 7 (FZD7)
Гены FZD2, FZD1 и FZD7 - все принадлежат к семейству Frizzled; члены этого семейства генов кодируют белки, имеющие 7 трансмембранных доменов, являющиеся рецепторами белков сигнального пути Wnt. Экспрессия гена FZD2, видимо, регулируется в соответствии с уровнем развития, имея высокие уровни экспрессии в эмбриональных почках и легких и во взрослом толстом кишечнике и яичнике (Sagara et al., 1998; Zhao et al., 1995). Белок FZD1 содержит сигнальный пептид, богатый цистеином домен в N-концевом внеклеточном участке, 7 трансмембранных доменов и С-концевой мотив, связывающий PDZ-домен. Транскрипт FZD1 экспрессирован в различных тканях, включая легкие, а также сердце, почки, поджелудочную железу, предстательную железу и яичник (Sagara et al., 1998). Повышенный уровень экспрессии рецепторов 1 и 2 семейства Frizzled был обнаружен в клетках рака молочной железы (Milovanovic et al., 2004). Белок FZD7 содержит N-концевую сигнальную последовательность, 10 остатков цистеина, типичных для богатого цистеином внеклеточного домена членов семейства Fz, 7 предполагаемых трансмембранных доменов и внутриклеточный С-концевой фрагмент («хвост») с мотивом, связывающим PDZ-домен. Экспрессия гена FZD7 может угнетать функцию АРС и усиливать передачу бета-катенин-опосредованных сигналов в плохо дифференцированных карциномах пищевода человека (Sagara et al., 1998; Tanaka et al., 1998).
Семейство сигнальных белков типа Wingless вирусов MMTV, имеющих интеграционные сайты, член 5А (WNT5A) - В целом, Wnt5a регулирует спектр различных клеточных функций, таких как пролиферация, дифференциация, миграция, адгезия и полярность (Kikuchi et al., 2012). Он экспрессирован в недифференцированных эмбриональных стволовых клетках человека (Katoh, 2008). WNT5A классифицируется как нетрансформирующий член семейства WNT, чья роль при онкогенезе все еще неоднозначна. Он проявляет активность белка-супрессора опухоли при некоторых видах рака (щитовидная железа, головной мозг, молочная железа и толстая и прямая кишка), но его экспрессия аберрантно повышена при раке легких, желудка и предстательной железы (Li et al., 2010а). Онкогенный белок WNT5A активирует канонический сигнальный путь WNT в стволовых раковых клетках для самообновления, а неканонический сигнальный путь WNT - в месте контакта опухоли и стромы для инвазии и метастазирования (Katoh and Katoh, 2007). Экспрессия WNT5A была описана для различных видов опухолей. Например, аномальная экспрессия белка Wnt5a наблюдалась в 28% образцов рака предстательной железы, где он способствует развитию агрессивной формы (Yamamoto et al., 2010). Более того, как было описано, избыточная экспрессия WNT5A ассоциируется с плохим прогнозом и/или повышением степени злокачественности опухоли при раке яичника (Badiglian et al., 2009), меланоме (Da Forno et al., 2008; Weeraratna et al., 2002), глиобластоме (Yu et al., 2007), раке легких (Huang et al., 2005) и раке поджелудочной железы (Ripka et al., 2007). При гепатоклеточной карциноме, по-видимому, канонический сигнальный путь Wnt содействует образованию опухоли, а неканонический сигнальный путь - прогрессированию опухоли (Yuzugullu et al., 2009).
Белок активации фибробластов, альфа (FAP) - Белок активации фибробластов (FAP) - это интегральный мембранный гликопротеин типа II, принадлежащий к семейству сериновых протеаз. Предполагаемая активность сериновой протеазы FAP-альфа и ее характер индукции in vivo могут указывать на роль этой молекулы в контроле роста фибробластов или эпителиально-мезенхимального взаимодействия во время развития, репарации тканей и эпителиального онкогенеза (Scanlan et al., 1994). Большинство взрослых тканей и доброкачественных эпителиальных опухолей демонстрируют невысокую или не поддающуюся измерению экспрессию FAP. Тем не менее, экспрессия FAP обнаруживается в стромальных клетках свыше 90% злокачественных опухолей молочной железы, толстой и прямой кишки, легких, кожи и поджелудочной железы, фибробластах при заживлении ран, сарком мягких тканей и некоторых мезенхимальных клетках эмбрионального происхождения. FAP играет важную роль в росте опухоли и развитии метастазов посредством клеточной адгезии и миграционных процессов, в равной степени как и быстрой деградации компонентов внеклеточного матрикса (ЕСМ). Таким образом, он присутствует на опухолевых клетках, поражающих ЕСМ, и в эндотелиальной клетке, задействованной в ангиогенезе, но не в неактивных клетках того же типа (Dolznig et al., 2005; Kennedy et al., 2009; Rettig et al., 1993; Rettig et al., 1994; Scanlan et al., 1994; Zhang et al., 2010a).
Циклин B1 (CCNB1) - Ген CCNB1 кодирует циклин В1, один из нескольких митотических циклинов, который ассоциируется с CDK1/CDC2 для ускорения фазы митоза. Избыточная экспрессия CNB1 описывалась в многочисленных видах рака и была ассоциирована с прогрессированием опухоли и неблагоприятным прогнозом, например, при колоректальной карциноме (Li et al., 2003), раке молочной железы (Aaltonen et al., 2009; Agarwal et al., 2009), НМРЛ (Cooper et al., 2009) и плоскоклеточной карциноме пищевода (Huang et al., 2014). При раке желудка экспрессия CCNB1 была ассоциирована с метастазами в регионарных лимфатических узлах и неблагоприятным клиническим прогнозом (Begnami et al., 2010; Fujita et al., 2012). Антитела против CCNB1, были обнаружены у пациентов с раком легких и предстательной железы и были предложены в качестве биомаркера для обнаружения раковых опухолей легких на ранних стадиях (Egloff et al., 2005; Zhang et al., 2003).
АТФаза, транспортирующая Ca++, сердечная мышца, быстрого типа 1 (АТР2А1), АТФаза, транспортирующая Са++, сердечная мышца, быстрого типа 2 (АТР2А2) - Оба гена (АТР2А1 и АТР2А2) кодируют SERCA Са(2+)-АТФазы. Кальциевые АТФазы саркоплазматического ретикулума (СР)1/ЭР (SERCA) являются кальциевыми насосами, которые объединяют гидролиз АТФ с транспортом кальция через мембрану CP/ЭР (MacLennan et al., 1997). SERCA кодируются тремя гомологичными генами: SERCA1 (АТР2А1), SERCA2 (АТР2А2) и SERCA3 (Wu et al., 1995). Появились некоторые доказательства того, что SERCA может оказывать прямое влияние на процессы апоптоза, дифференциации и клеточной пролиферации (Chami et al., 2000; Ma et al., 1999; Sakuntabhai et al., 1999). Мутации гена ATP2A1, кодирующего SERCA1, вызывают некоторые аутосомные рецессивные формы заболевания Броди, характеризующиеся увеличением нарушений релаксации мышц во время выполнения упражнений (Odermatt et al., 1996). АТР2А2 - это АТФаза, ассоциированная с болезнью Дарье, редким, наследственным аутосомно-доминантным заболеванием кожи, характеризующимся аномальной кератинизацией и акантолизом (Huo et al., 2010). Изменения зародышевой линии АТР2А2 могут предрасполагать к раку легких и толстой кишки, а повреждения гена АТР2А2, возможно, участвуют в процессе онкогенеза (Korosec et al., 2006). В клеточной линии мелкоклеточного рака легкого (Н1339) и аденокарциномы легкого содержание Са2+ в ЭР было пониженным в сравнении с нормальным человеческим эпителием бронхов. Пониженный уровень Са2+ коррелировал с пониженной экспрессией SERCA 2, перекачивающего кальций в ЭР (Bergner et al., 2009). АТР2А2 мог бы стать потенциальным прогностическим маркером для пациентов, больных колоректальным раком. Он был обнаружен в циркулирующих опухолевых клетках (ЦОК), и вероятность послеоперационного рецидива имела значимую корреляцию с избыточной экспрессией гена (Huang et al., 2012b).
Фибронектин 1 (FN1) - FN1 кодирует фибронектин, гликопротеин, присутствующий в димерной растворимой форме в плазме крови, и в димерной или мультимерной форме - на поверхности клетки и внеклеточном матриксе. Сообщалось, что в большинстве опухолей FN1 преимущественно экспрессируется ассоциированными с раком фибробластами (CAF) и эндотелиальными клетками, но не опухолевыми клетками (Berndt et al., 2010). О повышенных уровнях FN1 сообщалось для некоторых видов рака, и они были ассоциированы с неблагоприятным прогнозом или прогрессированием рака, как, например, при раке желчного пузыря (Cao et al., 2015), раке предстательной железы (von et al., 2013) и почечноклеточной карциноме (Steffens et al., 2012; Waalkes et al., 2010). FN1 также был задействован в стимуляции патогенеза рака легких, включая рост клеток, развитие химиорезистентности и ингибирование апоптоза (обзор дан в работе (Ritzenthaler et al., 2008)).
Белок 3, связывающий мРНК гена, кодирующего инсулиноподобный фактор роста 2 (IGF2BP3) - IGF2BP3 является членом белкового семейства инсулиноподобных факторов роста II, связывающих мРНК, вовлеченным в локализацию, оборот и трансляционный контроль мРНК. Этот белок содержит несколько КН-доменов (K-гомологичных), которые важны в связывании РНК, и о которых известно, что они вовлечены в синтез и метаболизм РНК. Экспрессия проявляется, главным образом, во время эмбрионального развития и была описана для некоторых опухолей. Таким образом, IGF2BP3 рассматривается как онкофетальный белок (Liao et al., 2005). IGF2BP3 может способствовать пролиферации опухолевых клеток, усиливая синтез белка IGF-II и индуцируя клеточную адгезию и инвазию за счет стабилизации CD44 мРНК (Findeis-Hosey and Xu, 2012). Более того, экспрессия IGF2BP3 исследовалась при многих неоплазиях человека с возрастающей очевидностью, что она опосредует миграцию, инвазию, клеточную выживаемость и распространение метастазов опухоли (Jeng et al., 2009; Kabbarah et al., 2010; Li et al., 2011; Liao et al., 2011; Lu et al., 2011; Hwang et al., 2012; Samanta et al., 2012), она также может быть причастна к ангиогенезу (Suvasini et al., 2011; Chen et al., 2012). При аденокарциноме легкого более высокая частота экспрессии IGF2BP3 может быть обнаружена в умеренно или плохо дифференцированных аденокарциномах, что может быть ассоциировано с агрессивным биологическим поведением (Findeis-Hosey et al., 2010; Beljan et al., 2012; Findeis-Hosey and Xu, 2012).
Ламинин, гамма 2 (LAMC2) -
Ламинины, семейство внеклеточных матричных гликопротеинов, являются основным неколлагеновым составляющим базальных мембран. Они задействованы во множестве биологических процессов, включая клеточную адгезию, дифференциацию, миграцию, передачу сигналов, отрастание нейритов и метастазирование. Ген LAMC2 кодирует цепь ламинин-5 гамма-2, которая является частью ламинина-5, одного из основных компонентов зоны базальной мембраны. Уровень LAMC2 был часто повышен при демитилировании промотора при раке желудка (Kwon et al., 2011). Как было обнаружено, LAMC2 экспрессируется в избытке в ангиотропных зонах меланомы по сравнению с аваскулярными зонами меланомы (Lugassy et al., 2009). LAMC2 является биомаркером распространения метастазов при раке мочевого пузыря, и уровни его экспрессии ассоциировались со степенью злокачественности опухоли (Smith et al., 2009b). Гены LAMB3 и LAMC2 совместно экспрессировались в 21 из 32 клеточных линий немелкоклеточного рака легкого (66%), но только в одной из 13 клеточных линий мелкоклеточного рака легкого (8%). Совместная экспрессия генов LAMB3 и LAMC2 наблюдалась также во всех 4 исследованных случаях клеток первичного немелкоклеточного рака легкого, но не в соответствующих нераковых клетках легкого (Manda et al., 2000).
Молекула адгезии эндотелиальных клеток головного мозга (CERCAM) - CERCAM локализован на поверхности эндотелиальных клеток (Starzyk et al., 2000) и картирован на хромосоме 9q34.11, регионе-кандидате на 9q, как было установлено, взаимосвязанном с наследственным идиопатическим сколиозом (Miller et al., 2012). Ген СЕЕСАМ1 широко транскрибируется в нервной системе и в нескольких секреторных тканях, таких как слюнные железы, поджелудочная железа, печень и плацента (Schegg et al., 2009).Белок CERCAM имеет схожую структуру с ColGalT-ферментами GLT25D1 и GLT25D2. Несмотря на то, что его функция до сих пор неизвестна, он, вероятно, функционально отличается от родственного белка GLT25D1 и не выполняет функции гликозилтрансферазы, как белки GLT25D1 и GLT25D2 (Perrin-Tricaud et al., 2011).
Фактор ремоделирования матрикса 5 (MXRA5) - MXRA5, известный также как адликан, кодирует протеогликан, влияющий на адгезию, и относится к группе генов, задействованных в ремоделировании внеклеточного матрикса (ЕСМ) и межклеточной адгезии (Rodningen et al., 2008). Хотя и функция белка MXRA5 при раке неизвестна, в пробах опухолей, поразивших различные ткани, такие как кожа, головной мозг, легкие и яичник, были выявлены соматические мутации MXRA5. ПЦР с обратной транскрипцией, проведенная для адликана (MXRA5), подтвердила результаты анализа на основе микрочипов, свидетельствующие об избыточной экспрессии при раковых заболеваниях толстой кишки в сравнении с нормальной тканью толстого кишечника (13 колоректальных опухолей и 13 нормальных тканей) (Zou et al., 2002). В недавнем исследовании белок 5, ассоциированный с ремоделированием матрикса, был вторым по частоте мутированным геном при НМРЛ (первым является ТР53) (Xiong et al., 2012).
Домен 8 металлопептидазы ADAM (ADAM8) - ADAM8 является членом семейства ADAM (домен дезинтегрина и металлопротеиназы). Многие виды ADAM, включая ADAM8, экспрессируют клетки злокачественных опухолей человека, в которых они участвуют в регуляции активности фактора роста и функций интегрина, способствуя росту и инвазии клеток (Mochizuki and Okada, 2007). Экспрессия ADAM8 имела положительную корреляцию с EGFR. Оба белка были главным образом экспрессированы в цитоплазме и на клеточной мембране (Wu et al., 2008). ADAM8 был экспрессирован в избытке в подавляющем большинстве исследованных проб рака легких. Экзогенная экспрессия ADAM8 повышала миграционную активность клеток млекопитающих, указывая на то, что ADAM8 может играть значительную роль в прогрессировании рака легких (Ishikawa et al., 2004). ADAM8 ассоциировался с плохим прогнозом при раке легких (Hernandez et al., 2010). Избыточная экспрессия ADAM8 была ассоциирована с более коротким периодом выживаемости пациента и была хорошим прогностическим фактором отдаленных метастазов при ПКК (Roemer et al., 2004b; Roemer et al., 2004a). Кроме того, уровни экспрессии и протеазная активность ADAM8 коррелировали с инвазивностью клеток глиомы, указывая на возможную значительную роль ADAM8 в опухолевой инвазии при раке головного мозга (Wildeboer et al., 2006).
Семейство антигенов меланомы F, 1 (MAGEF1) - Наиболее известные члены надсемейства MAGE (меланома-ассоциированный антиген) имеют такой паттерн экспрессии: они экспрессируются в опухолях, семеннике и эмбриональных тканях, что было описано как раковая/тестикулярная экспрессия (подгруппа MAGE I). Пептиды подгруппы MAGE I успешно использовали в рамках вакцинации пептидами и дендритными клетками (Nestle et al., 1998; Marchand et al., 1999; Marchand et al., 1999; Marchand et al., 1995; Thurner et al., 1999). Напротив, некоторые гены MAGE (MAGE подгруппа II), такие как MAGEF1, повсеместно экспрессируются в исследованных взрослых и фетальных тканях, а также в тканях многих видов опухолей, включая рак яичника, молочной железы, шейки матки, меланому и лейкемию (Nestle et al., 1998; Marchand et al., 1999; Marchand et al., 1999; Marchand et al., 1995; Thurner et al., 1999). Тем не менее, избыточная экспрессия MAGEF1 могла быть обнаружена в клетках НМРЛ (Tsai et al., 2007) и 79% когорты пациентов с колоректальным раком из Тайваня (Chung et al., 2010).
Малый ядерный рибонуклеопротеин 200 кДа (U5) (SNRNP200) - Сплайсинг пре-мРНК катализируется сплайсосомой, комплексом из специализированной РНК и белковых субъединиц, который удаляет интроны из транскрибированного сегмента пре-мРНК. Сплайсосома состоит из малых ядерных рибонуклеопротеинов (мяРНП) U1, U2, U4, U5 и U6, насчитывающих вместе приблизительно 80 консервативных белков. SNRNP200 - это ген, требуемый для расплетания дуплекса U4/U6, этапа, необходимого для каталитической активации сплайсосомы (Maeder et al., 2009). Экспрессия SNRNP200 была обнаружена в сердце, головном мозге, плаценте, легких, печени, скелетных мышцах, почках и поджелудочной железе (Zhao et al., 2009а). Недавно было обнаружено, что мутации в гене SNRNP200 ассоциированы с аутосомно-доминантной пигментной дегенерацией сетчатки (adRP) (Benaglio et al., 2011; Liu etal., 2012).
TPX2, ассоциированный с микротрубочками гомолог (Xenopus laevis) (TPX2) - TPX2 - это фактор сборки веретена деления. Он необходим для нормальной сборки митотических веретен и мукротрубочек во время апоптоза. ТРХ2 необходим для хроматин и/или кинетохор-зависимой нуклеации микротрубочек (Bird and Hyman, 2008; Moss et al., 2009). Вновь синтезированный TPX2 необходим на протяжении практически всего процесса активации киназы Aurora А и всего процесса синтеза и фосфорилирования р53 in vivo во время созревания ооцитов (Pascreau et al., 2009). ТРХ2 - это белок, ассоциированный с клеточным циклом, который экспрессируется в избытке клетками многих видов опухолей, таких как менингиомы (Stuart et al., 2010), плоскоклеточная карцинома гортани (SCCL) (Cordes et al., 2010), плоскоклеточные карциномы полости рта (SCC) (Shigeishi et al., 2009), гепатоклеточные карциномы (ГКК) (Satow et al., 2010), опухоль поджелудочной железы (Warner et al., 2009), рак яичника (Ramakrishna et al., 2010), плоскоклеточная карцинома легких (Lin et al., 2006; Ma et al., 2006). Он часто экспрессируется в избытке совместно с Aurora-А, приводя к зарождению новой функциональной единицы с онкогенными свойствами (Asteriti et al., 2010). Экспрессия ТРХ2 является прогностическим индикатором при раке легких (Kadara et al., 2009).
Трансформирующий фактор роста, бета-индуцированный 68 кДА (TGFBI) - TGFBI был первым геном, идентифицированным в качестве TGF-бета-индуцированного в клеточной линии человеческой аденокарциномы легких. Он кодирует секретируемый внеклеточный матричный белок, который, как предполагается, задействован в присоединении клеток и формировании внеклеточной матрицы. Обычно экспрессия TGFBI преимущественно обнаруживается в фибробластах, кератиноцитах и мышечных клетках (Bae et al., 2002). TGFBI избыточно экспрессируется в нескольких видах солидных опухолей, таких как опухоль толстой кишки (Kitahara et al., 2001), поджелудочной железы (Schneider et al., 2002) и почки (Ivanov et al., 2008). Уровень TGFBI понижен в клетках рака легких (Zhao et al., 2004; Shao et al., 2006), снижая метастатический потенциал опухолевых клеток легких (Wen et al., 2011), а когда он экспрессируется в избытке, он задействован в процессе гибели клеток посредством апоптоза (Zhao et al., 2006). В образцах НМРЛ наблюдалась тесная взаимосвязь между повышенным уровнем экспрессии TGFBI и ответом на химиотерапию (Irigoyen et al., 2010).
Циклин-зависимая киназа 4 (CDK4), циклин-зависимая киназа 6 (CDK6) - CDK4 является членом семейства Ser/Thr протеинкиназ. Она является каталитической субъединицей протеинкиназного комплекса, который играет важную роль при прохождении фазы G1 клеточного цикла. Активность этой киназы ограничена переходом от G1 к S-фазе во время клеточного цикла, и ее экспрессия контролируется, в первую очередь, на транскрипционном уровне (Xiao et al., 2007). Ферменты CDK4 и CDK6 и их регуляторы, например, циклины, играют важнейшие роли при эмбриогенезе, гомеостазе и онкогенезе (Graf et al., 2010). В тканях рака легких уровень экспрессии белка CDK4 был значимо повышен в сравнении с нормальными тканями (Р <0,001). Общей срок выживаемости был значительно более коротким у пациентов с более высоким уровнем экспрессии CDK4, чем у пациентов с низким уровнем экспрессии CDK4. Многомерный анализ позволяет предположить, что уровень экспрессии CDK4 был независимым прогностическим индикатором (Р <0,001) для выживаемости пациентов, больных раком легких. Более того, подавление экспрессии CDK4 также значительно повышало экспрессию регулятора клеточного цикла р21 (Wu et al., 2011). В клетках легких, которые экспрессируют эндогенный онкоген K-Ras, абляция Cdk4, но не Cdk2 или Cdk6, индуцирует немедленную реакцию клеточного старения. Эта реакция не происходит в клетках легких, экспрессирующих отдельный аллель Cdk4, или в других K-Ras-экспрессирующих тканях. Нацеливание на аллели Cdk4 в опухолях поздних стадий, обнаруживаемых с помощью компьютерной томографии, также индуцирует старение и предотвращает прогрессирование опухоли (Puyol et al., 2010).
Версикан (VCAN) - VCAN является членом семейства протеогликанов - аггрекана и версикана. Известно, что VCAN ассоциирован с множеством молекул внеклеточного матрикса, включая гиалуронан, тенасцин, фибулин-1, фибронектин, CD44 и L-селектин, фибрилин, интегрин и связующий белок (Zheng et al., 2004). VCAN экспрессируется во многих тканях. Он экспрессируется в большом количестве на ранних стадиях развития тканей, и уровень его экспрессии снижается после созревания ткани. Уровень его экспрессии также повышен во время репарации ран и роста опухоли (Ghosh et al., 2010). Нокдаун VCAN РНК-интерференцией в клетках аденокарциномы легких человека (А549) в значительной степени ингибировал рост опухоли in vivo, но не in vitro (Creighton et al., 2005). VCAN является непосредственной мишенью p53. Высокая экспрессия VCAN также была обнаружена в стромальной ткани перитуморальной области на ранних стадиях рака предстательной железы и рака молочной железы, и он ассоциирован с агрессивным поведением опухоли (Yoon et al., 2002).
Убиквитин-конъюгирующий фермент E2S (UBE2S) - UBE2S является вспомогательным фактором АПК, способствующим выходу из митотического цикла. Его истощение продлевает вызванную лекарственным препаратом задержку в фазе митоза и подавляет остановку митоза (Garnett et al., 2009). UBE2S избыточно экспрессируется в распространенных раковых опухолях человека. При раке пищевода UBE2S значимо ассоциируется с интенсивностью опухолевой нагрузки. Положительный результат анализа на этот белок был связан со слабым ответом на неоадъювантную терапию и худшей выживаемостью (Chen et al., 2009). В промоторе UBE2S были идентифицированы сайты связывания с фактором 1 транскрипции (белков раннего ответа) (Egr-1) и ответа сыворотки (SRF). Избыточная экспрессия этих факторов повышала уровень экспрессии UBE2S, что было необходимо для пролиферации раковых клеток (Lim et al., 2008).
Белок 3, содержащий SET и MYND-домены (SMYD3) - Первоначально сообщалось, что повышенный уровень SMYD3, лизин-4-специфичной метилтрансферазы гистона Н3, играет ключевую роль в пролиферации клеток колоректальной карциномы (КРК) и гепатоклеточной карциномы (ГКК). В другом исследовании было обнаружено, что экспрессия SMYD3 была также повышенной в значительном большинстве тканей рака молочной железы. В равной степени, что и при КРК и ГКК, сайленсинг гена SMYD3 с помощью введения малой интерферирующей РНК приводило к ингибированию роста раковых клеток молочной железы, позволяя сделать предположение, что повышенная экспрессия SMYD3 также необходима для пролиферации раковых клеток молочной железы (Hamamoto et al., 2006). Нокдаун SMYD3 РНК-интерференцией снижает уровень экспрессии c-Met и ингибирует миграцию и инвазию клеток, вызванную HGF (Zou et al., 2009). SMYD3 играет важнейшую роль в пролиферации и миграции/инвазии клеток HeLa и может быть полезной как терапевтическая мишень при карциномах шейки матки человека (Wang et al., 2008).
Дистонин (DST)
DST (BPAG1-e) кодирует члена семейства белков плакинов, адгезивных белков, участвующих в формировании бляшек сцепления. BPAG1-e экспрессируется в эпителиальной ткани, обеспечивая заякоривание промежуточных филаментов, содержащих кератин, на полудесмосомах (HD). Полудесмосомы представляют собой мультибелковые комплексы адгезии, поддерживающие эпителиально-стромальное соединение в стратифицированном и других сложных эпителиях. Модуляция их функции имеет решающее значение для различных биологических процессов, таких как дифференциация и миграция кератиноцитов во время заживления ран и инвазии карциномы, при которых клетки отделяются от субстрата и приобретают фенотип мигрирующих клеток (Litjens et al., 2006). Злокачественная меланома является одним из наиболее агрессивных видов опухолей. BPAG1 экспрессируется в клеточных линиях меланомы человека (А375 и G361) и нормальных человеческих меланоцитах. Уровни аутоантител к BPAG1 в сыворотке пациентов, больных меланомой, были значимо выше, чем в сыворотке здоровых добровольцев (р<0,01). Аутоантитела к BPAG1 могут быть многообещающим маркером для постановки диагноза меланомы (Shimbo et al., 2010). DST был ассоциирован с инвазией рака молочной железы (Schuetz et al., 2006). Ген BPAG1, скорее всего, участвует в процессах пролиферации, апоптоза, инвазии и метастазирования при назофаренгеальной карциноме (Fang et al., 2005).
Семейство транспортера растворенных веществ 34 (фосфат натрия), член 2 (SLC34A2) - SLC34A2 является рН-чувствительным натрий-зависимым транспортером фосфата. Повышенный уровень экспрессии гена SLC34A2 в хорошо дифференцированных опухолях может отражать процессы клеточной дифференциации во время онкогенеза в яичнике и мог бы служить потенциальным маркером для постановки диагноза рака яичника и прогноза его течения (Shyian et al., 2011). ПЦР с обратной транскрипцией подтвердила повышенный уровень экспрессии SLC34A2 в клетках папиллярной карциномы щитовидной железы (Kim et al., 2010b). Значительно повышенный уровень экспрессии гена SLC34A2 наблюдался также среди тканей рака молочной железы по сравнению с нормальными тканями (Chen et al., 2010).
Тенасцин-С (гексабрахион) (TNC) - Тенасцин-С (TNC) - белок внеклеточного матрикса, уровень которого сильно повышен в процессах, тесно связанных с повышенной миграционной активностью, таких как эмбриональное развитие (Bartsch et al., 1992), заживление ран (Mackie et al., 1988) и неопластические процессы (Chiquet-Ehrismann, 1993; Chiquet-Ehrismann and Chiquet, 2003). Кроме того, TNC экспрессируется в избытке в опухолевых сосудах, которые имеют высокий пролиферативный индекс, указывающий на то, что TNC задействован в неопластическом ангиогенезе (Kim et al., 2000). Об избыточной экспрессии TNC сообщалось, кроме того, в связи с раком толстой кишки (De et al., 2013), аденокистозной карциномой, где он был ассоциирован с наихудшим прогнозом (Siu et al., 2012), юношеской ангиофибромой носоглотки, при которой он, возможно, способствует ангиогенезу (Renkonen et al., 2012), распространенной меланомой (Fukunaga-Kalabis et al., 2010), раком поджелудочной железы, при котором он играет роль в пролиферации, миграции и метастазировании (Paron et al., 2011).
Ретикулокальбин 1, кальций-связывающий EF-hand домен (RCN1), ретикулокальбин 3, кальций-связывающий EF-hand домен (RCN3) -Ретикулокальбин 1 является кальций-связывающим белком, находящимся в полости эндоплазматического ретикулума. Иммуногистохимическое исследование продемонстрировало широкое распространение RCN в различных органах плода и взрослого человека, преимущественно в эндокринных и экзокринных органах. Избыточная экспрессия RCN может играть роль при онкогенезе, опухолевой инвазии и развитии резистентности к лекарственным средствам (Fukuda et al., 2007). Ретикулокальбин 1 (RCN1) -это белок, ассоциированный с клеточной поверхностью, как на клеточных линиях эндотелиального рака, так и рака предстательной железы. Высокий уровень экспрессии RCN1 на клеточной поверхности наблюдался при обработке эндотелиальных клеток костного мозга фактором некроза опухоли-альфа (Cooper et al., 2008). Уровень RCN1 повышен при колоректальной карциноме (КРК) и был локализован в раковых клетках или клетках стромы рядом с раковыми клетками. Он мог бы стать новым кандидатом в маркеры КРК (Watanabe et al., 2008). RCN3 является членом семейства CREC (Cab45/ретикулокальбин /ERC45/калуменин) домен Са2+ EF-hand-связывающих белков, локализованных в секреторном пути (Tsuji et al., 2006). RCN3 предлагается в качестве потенциально важного гена-кандидата при олигодендроглиомах. Несмотря на это, о функциях RCN3 известно мало (Drucker et al., 2009).
Базонуклин 1 (BNC1) - Базонуклин - это белок семейства цинковых пальцев с очень ограниченным распределением по тканям (Tseng, 1998). Вплоть до настоящего времени базонуклин был, в основном, обнаружен, на базальных кератиноцитах многослойного плоского эпителия (кожа, эпителий ротовой полости, пищевод, влагалище и роговая оболочка глаза) и в гаметогенных клетках семенника и яичника (Tseng and Green, 1994; Weiner and Green, 1998). Сейчас существует множество свидетельств того, что базонуклин является клеткоспецифическим транскрипционным фактором для генов рРНК (рДНК). Домены «zinc finger» базонуклина взаимодействуют с тремя эволюционно консервативными сайтами внутри промотора рДНК (luchi and Green, 1999; Tseng et al., 1999). Эпигенетическое регулирование с помощью метилирования CpG играет важную роль в онкогенезе, а также в ответе на противораковую терапию. BNC1 был гипометилирован в радиорезистентных клеточных линиях Н1299 немелкоклеточного рака легкого (НМРЛ) человека. Подавление мРНК-экспрессии BNC1 в клетках Н1299 также снижало устойчивость этих клеток к ионизирующему излучению (Kim et al., 2010а). Аберрантное ДНК-метилирование BNC1 было также обнаружено в образцах хронической лимфоцитарной лейкемии (CLL) (Tong et al., 2010). При почечно-клеточной карциноме (ПКК) метилирование BNC1 было ассоциировано с худшим прогнозом вне зависимости от размера, стадии и степени злокачественности опухоли (Morris et al., 2010).
Трансформирующий кислый белок, содержащий биспиральный домен 3 (ТАСС3) - ТАСС3 существует в комплексе с ch-TOG (ген, экспрессируемый в избытке при опухолях печени и толстой кишки) и клатрином, который перекрестно сшивает микротрубочки в волокнах кинетехора. ТАСС3 экспрессируется в некоторых пролиферативных тканях, включая семенник, легкие, селезенку, костный мозг, вилочковую железу и лейкоциты периферической крови. Экспрессия ТАСС3 изменена в некоторых видах опухолей человека. В клетках ТАСС3 локализован как на центросомах, так и микротрубочках веретена деления, но не на астральных микротрубочках (Hood and Royle, 2011). Экспрессия ТАСС3 коррелировала с экспрессией р53, и пациенты, чьи опухоли в высокой степени экспрессировали ТАСС3 и р53, имели значимо худший прогноз, чем пациенты, чьи опухоли имели низкий уровень экспрессии у обоих препаратов после иммуноокрашивания (Р=0,006). Предполагается, что повышение уровня ТАСС3 может обеспечивать пролиферативное преимущество для НМРЛ и способствовать прогрессированию опухоли, и что экспрессия ТАСС3 является сильным прогностическим индикатором клинического исхода при НМРЛ (Jung et al., 2006). Тасс3 может быть негативным регулятором сигнального пути Notch (Bargo et al., 2010).
Pecanex-подобный 3 (дрозофила) (PCNXL3) - Pecanex-подобный белок 3 (PCNXL3) является многопроходным мембранным белком; он относится к семейству Pecanex. Ген PCNXL3 был картирован на участке хромосомы 11q12.1-q13. Три новых опухолеассоциированных точки разрыва транслокации у человека были локализованы на участке хромосомы 11q13 между маркерами D11S4933 и D11S546. Таким образом, PCNXL3 может быть 11q13-ассоциированным геном предрасположенности к заболеванию (van et al., 2000).
Рибонуклеаза типа III, Drosha (DROSHA) - Drosha - это фермент РНаза III 2 класса, отвечающий за инициацию процессинга микроРНК (miPHK), или коротких молекул РНК, экспрессируемых клеткой в естественных условиях, которые регулируют широкий спектр других генов за счет взаимодействии с РНК-индуцированным комплексом сайленсинга (RISC) в целях инициации расщепления комплементарной информационной РНК (иРНК) как части процесса РНК-интерференции (RNAi). Молекула микроРНК синтезируется как первичный транскрипт (длинная молекула) РНК, известный как pri-miPHK, который расщепляется ферментом Drosha с получением характерной структуры типа «стебель-петля», имеющей около 70 пар нуклеотидов в длину и называемой pre-miPHK (Lee et al., 2003). Drosha существует как часть белкового комплекса, называемого «Микропроцессорный комплекс», который содержит также связывающий двухнитевую РНК белок Pasha (известный также как DGCR8) (Denli et al., 2004), который необходим для выполнения функций Drosha и способен связываться с одноцепочечными фрагментами pri-miPHK, необходимыми для правильного процессинга (Han et al., 2006). Drosha человека был клонирован в 2000 г., когда его идентифицировали как ядерную двухцепочечную рибонуклеазу dsPHK, задействованную в процессинге предшественников рибосомальной РНК (Wu et al., 2000). Drosha стал первым человеческим ферментом РНазой III, который был идентифицирован и клонирован. Два других человеческих фермента, которые участвуют в процессинге и функциональной активности микроРНК - это белки Дайсер (Dicer) и Аргонавт (Argonaute). Оба фермента, Drosha и Pasha, локализованы в клеточном ядре, где происходит процессинг pri-miPHK в pre-miPHK. Полученная в результате молекула процессируется затем в клеточной цитоплазме белком Dicer РНазой в зрелую miPHK (Lee et al., 2003). Drosha и другие ферменты, участвующие в процессинге miPHK, могут быть важны в прогнозе раковых заболеваний (Slack and Weidhaas, 2008).
Гомолог 6 белка цикла клеточного деления (S. cerevisiae) (CDC6) - Белок CDC6 выполняет функцию регулятора на ранних этапах репликации ДНК. Он находится в клеточном ядре во время фазы G1 клеточного цикла, но перемещается в цитоплазму в начале фазы S. Кроме того, предполагается, что в эукариотических клетках высших организмов CDC6 регулирует активацию репликации в сверочной точке за счет взаимодействия с ATR (Yoshida et al., 2010). CDC6 необходим для репликации ДНК и нарушение его регуляции играет роль в онкогенезе. Было обнаружено, что снижение экспрессии CDC6 с помощью РНК-интерференции (RNAi) предотвращало клеточную пролиферацию и стимулировало апоптоз (Lau et al., 2006). Избыточная экспрессия CDC6 была обнаружена при нескольких видах рака. К видам рака, при которых в избытке экспрессируется CDC6, относятся рак желудка (Tsukamoto et al., 2008), опухоли головного мозга (Ohta et al., 2001), плоскоклеточная карцинома полости рта (Feng et al., 2008), карцинома шейки матки (Wang et al., 2009) и злокачественная мезотелиома (Romagnoli et al., 2009).
Йодтиронин-дейодиназа, типа II (DIO2) - Белок, кодируемый геном DIO2, принадлежит к семейству йодтиронин-дейодиназ. Он в высокой степени экспрессируется клетками щитовидной железы и может вносить значительный вклад в относительное повышение выработки Т3 щитовидной железой у пациентов с базедовой болезнью и аденомами щитовидной железы (Meyer et al., 2008); (de Souza Meyer et al., 2005)). При назофарингеальной карциноме (NPC) паттерны экспрессии генов существенно различаются между типами распространения заболевания, вверх или вниз. Экспрессия гена DIO2 выше при распространении опухоли вниз (вниз = дистантные метастазы), чем при распространении вверх (местный рост и инвазия основания черепа), что может быть тесно взаимосвязано с метастатическим потенциалом NPC (Liang et al., 2008а). мРНК DIO2, а также собственно DIO2, экспрессируются клетками опухолей головного мозга (Murakami et al., 2000). Активность гена D2 присутствует в легких, и ее уровень сходен в тканях периферического и центрального рака легкого (Wawrzynska et al., 2003).
Член семейства кинезинов 26В (KIF26B) - Кинезин - это белок, принадлежащий к классу моторных белков, обнаруженных в эукариотических клетках. Кинезины движутся вдоль филаментов микротрубочек, получая энергию от гидролиза АТФ (таким образом, кинезины являются АТФазами). Kif26b, ген семейства кинезинов, представляет собой мишень для Sall1 по ходу транскрипции (Nishinakamura et al., 2011). Kif26b необходим для развития почек, поскольку он регулирует адгезию мезенхимальных клеток, находящихся в контакте с зачатком мочеточника. Избыточная экспрессия Kif26b in vitro вызывала повышенную клеточную адгезию за счет взаимодействий с немышечным миозином (Terabayashi et al., 2012; Uchiyama et al., 2010).
Ингибитор серпин-пептидазы, клада В (овальбумин), член 3 (SERPINB3) -Антиген плоскоклеточной карциномы (SCCA), также называемый SERPINB3, является членом семейства высокомолекулярных ингибиторов серин-протеазы (серпины) (Suminami et al., 1991). О высоких уровнях экспрессии сообщалось при раке тканей головы и шеи и других видах эпителиального рака (Torre, 1998). Сообщалось об избыточной экспрессии SCCA в опухолевых тканях в сравнении с тканью перитуморальной зоны, что позволяет предположить, что он может играть роль потенциального маркера для гистологического выявления гепатоклеточной карциномы (ГКК) (Pontisso et al., 2004). Серпин В3/В4, в особенности серпин В4, по всей видимости, играет важную роль в аберрантной пролиферации эпителия. Оценка серпина В3/В4 могла бы иметь прогностическое значение при прогнозе прогрессирования заболевания, в особенности у пациентов с повышенной предрасположенностью к раку легких (Calabrese et al., 2012). С одной стороны, SCCA1 (SERPINB3) ингибирует клеточную гибель, вызываемую повреждением лизосом, тогда как, с другой стороны, он сенсибилизирует клетки к ЭР-стрессу, активируя каспазу-8 вне зависимости от апоптотического пути гибели клеток (Ullman et al., 2011). Некоторые факты указывают на важную роль SERPINB3 в инициации разрушения эпидермального барьера. SERPINB3 может быть определяющим фактором барьерной функции в эпидермисе (Katagiri et al., 2010).
Циклин-зависимая киназа 1 (CDK1) - Белок CDC2 (белок 2 цикла клеточного деления), также известный как p34cdc2 или CDK1 (циклин-зависимая киназа 1), относится к CDK, семейству сериновых/треониновых протеинкиназ, и играет ключевую роль в контроле клеточного цикла (Vermeulen et al., 2003). Гиперэкспрессия CDC2 была обнаружена при нескольких видах рака, хотя согласно (Vermeulen et al., 2003) регулирование экспрессии других клеточных белков, таких как циклинов, нарушается еще чаще. Избыточную экспрессию CDC2 описывали при НМРЛ (Xu et al., 2011; Zhang et al., 2011). Perumal и соавт. (2012) сообщали, что избыточная экспрессия CDC2 коррелировала с неблагоприятным прогнозом (Perumal et al., 2012). Кроме того, в одном из исследований было выдвинуто предположение о возможном применении CDC2 в клинических целях в качестве прогностического фактора рецидивов при немелкоклеточном раке легких ранней стадии (Kubo et al., 2014).
Коллаген, тип XI, альфа1 (COL11A1) - COL11A1 кодирует одну из двух альфа-цепей коллагена XI типа, минорного фибриллярного коллагена. Как сообщалось, уровень COL11A1 был повышен при нескольких видах рака, например, при колоректальном раке (Freire et al., 2014), раке молочной железы (Ellsworth et al., 2009), раке желудка (Zhao et al., 2009b), опухолях мочевого пузыря (Ewald et al., 2013). Экспрессия COL11A1 в клетках рака яичника была связана с рецидивами и плохой выживаемостью. Нокдаун COL11A1 снижал клеточную миграцию, инвазию и прогрессирование опухоли in vitro у мышей (Cheon et al., 2014; Wu et al., 2014b). Дифференциальная экспрессия COL11A1 была обнаружена на основе микроматричного анализа в легочной ткани некурящих пациенток, больных раком легких, по сравнению со здоровой контрольной группой (Lv and Wang, 2015).
Коллаген, типа I, альфа 2 (COL1A2) - COL1A2 кодирует цепь про-альфа-2 коллагена I типа, тройная спираль которого включает две цепи альфа-1 и одну цепь альфа-2. В образцах рака желудка был обнаружен повышенный уровень COL1A2 по сравнению с нормальной тканью (Yan et al., 2014; Yang et al., 2007), и он ассоциировался с поздней стадией заболевания (Yasui et al., 2004). О повышенных уровнях COL1A2 сообщалось для остеосаркомы (Wu et al., 2014а), рака мочевого пузыря поздних стадий (Fang et al., 2013), плоскоклеточной карциномы головы и шеи/полости рта (ПККГШПР) (Ye et al., 2008) и медуллобластомы, наиболее распространенной злокачественной опухоли головного мозга детей (Liang et al., 2008b).
Периостин, остеобласт-специфический фактор (POSTN) - POSTN, ген, кодирующий белок со сходством с семейством фасциклинов и задействованный в процессах, связанных с выживаемостью клеток, и ангиогенезе, стал многообещающим маркером прогрессии опухоли при различных видах рака человека (Ruan et al., 2009). Высокий уровень экспрессии белка периостина или мРНК был обнаружен в большинстве солидных опухолей, включая карциному молочной железы (Zhang et al., 2010с), толстой кишки (Kikuchi et al., 2008), головы и шеи (Kudo et al., 2006), поджелудочной железы (Kanno et al., 2008), папиллярную карциному щитовидной железы (Puppin et al., 2008), предстательной железы (Tischler et al., 2010), яичника (Choi et al., 2010), легкого (Takanami et al., 2008) и печени (Utispan et al., 2010), а также плоскоклеточную карциному пищевода (Kwon et al., 2009). На аномально высоком уровне периостатин экспрессируют клетки рака легкого, что коррелирует с ангиогенезом, инвазией и метастазированием (Takanami et al., 2008). Сайленсинг периостатина в клетках немелкоклеточного рака легкого (НМРЛ) А549 ингибирует рост опухолевых клеток и уменьшает клеточную инвазию (Wu et al., 2013с).
Белок 1, содержащий домен AT-hook, ДНК-связывающий мотив (AHDC1) - Этот ген кодирует белок, содержащий два домена типа AT-hook, которые, скорее всего, задействованы в связывании ДНК. Мутации этого гена ассоциировались с церебрально-зрительными нарушениями (Bosch et al., 2015). Методом полноэкзомного секвенирования усекающие мутации de novo в AHDC1 были обнаружены у индивидов с синдромом задержки развития экспрессивной речи, гипотонией и синдромом ночного апноэ. Скорее всего, этот генетический синдром вызван этими мутациями (Xia et al., 2014).
Фактор, вызывающий апопотоз, митохондрия-ассоциированный, 2 (AIFM2) -Этот ген кодирует флавопротеин-оксидоредуктазу, которая связывается с одноцепочечной ДНК и, как считается, способствует апоптозу в присутствии бактериальной и вирусной ДНК. AIFM2 не достаточно хорошо охарактеризована, но ограниченные данные позволяют предположить, что она может выполнять функцию супрессора опухоли. Экспрессия AIFM2 активируется геном-супрессором опухоли р53, а эктопическая экспрессия р53, как было продемонстрировано, вызывает апоптоз. Более того было показано, что экспрессия AIFM2 понижена в ряду опухолей человека, включая образцы раковой ткани почки, желудка, колоректального рака и прочие (Ohiro et al., 2002; Wu et al., 2004). В мышиной модели с генным нокаутом, тем не менее, AIFM2 не была необходима для р53-зависимого подавления опухоли (Mei et al., 2006). В клеточной культуре AIFM2 задействована в опосредовании апоптоза, индуцированного аденозином (Yang et al., 2011).
Открытая рамка считывания 132 хромосомы 6 (C6orf132) - C6orf132 кодирует открытую рамку считывания 132 хромосомы 6. Ген C6orf132 локализован на участке хромосомы 6р21.1 (Mungall et al., 2003). Функция этого гена до сих пор не известна.
Гомолог белка CCZ1, ассоциированного с транспортом вакуолярных белков и биогенезом (S. cerevisiae) (CCZ1), гомолог В белка CCZ1, ассоциированного с транспортом вакуолярных белков и биогенезом (S. cerevisiae) (CCZ1В) - CCZ1 кодирует гомолог белка CCZ1, ассоциированного с транспортом вакуолярных белков и биогенезом (S. cerevisiae). CCZ1B кодирует CCZ1 гомолог В белка CCZ1, ассоциированного с транспортом вакуолярных белков и биогенезом (S. cerevisiae). Методом сравнительной протеомики CCZ1 и CCZ1B были идентифицированы как гены человека, эволюционно консервативные относительно нематоды Caenorhabditis (Lai et al., 2000). Гены CCZ1 и CCZ1B локализованы на участке хромосомы 7р22.1 (Hillier et al., 2003). Возможно, что CCZ1 участвует в биогенезе лизосом и созревании фагосом за счет рекрутинга RAB7A7 ГТФазы в фагосому (Nieto et al., 2010). CCZ1B является неохарактеризованным геном.
Коллаген, типа V, альфа-2 (COL5A2) - Этот ген кодирует альфа-цепь одного из минорных фибриллярных коллагенов. Как сообщалось, уровень COL5A2 повышен в образцах ткани колоректального рака по сравнению с прилегающими нераковыми тканями (Fischer et al., 2001). Сопоставимые образцы ткани протоковой карциномы in situ (DCIS), инвазивной протоковой карциномы (IDC) и стромы пациентов с раком молочной железы выявили повышенные уровни экспрессии COL5A2 в образцах IDC (Vargas et al., 2012). Как сообщалось, уровень COL5A2 повышен при остеосаркоме, и этот белок важен для онкогенеза.
Член подсемейства коллектинов 12 (COLEC12) - Этот ген кодирует члена семейства С-лектинов - белков, имеющих коллаген-подобные последовательности и домены распознавания углеводов. Белок COLEC12 - это скевенджер-рецептор, гликопротеин клеточной поверхности, имеющий несколько функций, ассоциированных с защитой хозяина. Ген COLEC12 был предложен в качестве возможного кандидата в биомаркеры для анапластичного рака щитовидной железы (Espinal-Enriquez et al., 2015). COLEC12 дифференциально экспрессировался в клеточных линиях ВТ474 HER2-положительного рака молочной железы и, возможно, вносит свой вклад в эффективность препарата трастузумаб (von der Heyde et al., 2015).
Коатомерный комплекс белков, субъединица гамма-1 (COPG1) - COPG1 кодирует белковую субъединицу 1 коатомерного комплекса (COPI). COPI-покрытые везикулы опосредуют ретроградный транспорт из аппарата Гольджи, назад в ЭР и транспорт внутри аппарата Гольджи. Можно представить, что цитозольный предшественник коатомера COPI, гептамерного цитозольного белкового комплекса, состоит из двух субкомплексов. Первый состоит из субъединиц бета-, гамма-, дельта- и зета-СОР, которые отдаленно гомологичны субъединицам клатринассоциированного белка АР (Watson et al., 2004). EGF (эпидермальный фактор роста)-зависимый ядерный транспорт рецептора EGFR регулируется ретроградным переносом из аппарата Гольджи в ЭР, включая ассоциацию рецептора EGFR с гамма-СОР, одной из субъединиц коатомера COPI (Wang et al., 2010b). Иммуногистохимический анализ подтвердил, что COPG1 обильно экспрессируется в эндотелиальных клетках, полученных из раковых клеток легких, и раковых клетках легких (Park et al., 2008).
CSNK2A2 - Казеинкиназа II субъединица альфа-прайм является ферментом, который у человека кодируется геном CSNK2A2. Ретроспективное исследование показало, что CSNK2A1 может быть полезным прогностическим маркером у больных НМРЛ после полной резекции, вне зависимости от статуса метастазов в лимфатические узлы (Wang et al., 2010с). CSNK2A2 был ассоциирован с прогрессированием опухоли при колоректальном раке поздней стадии у человека (Nibbe et al., 2009).
Ген семипроходного трансмембранного белка, экспрессируемый на поверхности дендроцитов (DCSTAMP) - Этот ген кодирует семипроходный трансмембранный белок, который экспрессируется главным образом в дендритных клетках. Кодируемый белок задействован в ряду иммунологических функций, выполняемых дендритными клетками. DCSTAMP был идентифицирован в качестве дифференциально экспрессируемого гена в клетках папиллярной карциномы щитовидной железы (Lee et al., 2009), и затем были подтверждены высокие уровни его экспрессии в этих образцах (Kim et al., 2010).
Врожденный дискератоз 1, дискерин (DKC1) - Ген DKC1 задействован в двух различных комплексах. Дискерин опосредует как модификацию уридина на рибосомальной и малой ядерной РНК, так и стабилизацию РНК-компонента теломеразы (TERC). Было обнаружено, что в опухолях человека экспрессия дискерина ассоциируется как с модификацией рРНК, так и уровнями TERC (Penzo et al., 2015). Более того, избыточная экспрессия дискерина была связана с неблагоприятным прогнозом в ряду опухолей, например, ГКК (Liu et al., 2012).
Киназа 2 двойной специфичности, регулируемая тирозин-(Y)-фосфорилированием 2 (DYRK2)/ киназа 4 двойной специфичности, регулируемая тирозин-(Y)-фосфорилированием (DYRK4) - DYRK2 и DYRK4 принадлежат к семейству протеинкиназ Dyrk (семейство млекопитающих с 5 членами), которые задействованы в регулировании клеточной дифференциации, пролиферации и выживаемости (Papadopoulos et al., 2011). DYRK2 контролирует эпителиально-мезенхимальный переход при раке молочной железы за счет деградации фактора Snail (Mimoto et al., 2013). DYRK2 регулирует p53 в целях индукции апоптоза и усиливает ответ на повреждение ДНК: под влиянием генотоксического стресса DYRK2 перемещается в ядро и активирует р53 путем фосфорилирования (Meulmeester and Jochemsen, 2008; Taira et al., 2007). Ген DYRK4 картирован на участке хромосомы 12р13.32, который описывали как локус предрасположенности к КРК, поскольку поврежден ген CCND2 (Jia et al., 2013; Peters et al., 2013). В некоторых исследованиях подчеркивалась роль DYRK4 в дифференциации нейронов (Leypoldt et al., 2001; Slepak et al., 2012).
ERO1-подобный белок (S. cerevisiae) ERO1L - ERO1-подобный белок альфа является белком, который у человека кодируется геном ERO1L. ERO1-альфа - это окислительный фермент, который существует в эндоплазматическом ретикулуме и индуцируется в условиях гипоксии. ERO1-альфа избыточно экспрессируется в нескольких различных видах опухолей. Более того, ассоциированный с раком ERO1-альфа регулирует экспрессию молекул МНС I класса путем окислительного фолдинга (Kukita et al., 2015). Было сделано предположение, что экспрессия hERO1-альфа в раковых клетках ассоциируется с худшим прогнозом и, таким образом, может быть прогностическим фактором для больных раком молочной железы (Kutomi et al., 2013). В природных опухолях человека мРНК ERO1L специфически индуцировалась в условиях гипоксии, что совпадает со случаем повышения экспрессии VEGF. Было показано, что снижение выработки ERO1L за счет миРНК приводит к существенному ингибированию секреции VEGF, нарушению способности пролиферировать и усиленному апоптозу (May et al., 2005).
Семейство со схожестью последовательности 83, член A (FAM83A) - Уровень FAM83A, как было определено, повышен в нескольких различных видах раковых тканей (Cipriano et al., 2014).Тем не менее, функция FAM83A остается неясной (Boyer et al., 2013).Было сделано предположение, что FAM83A является опухолеспецифическим геном при раке легких, и его экспрессия в образцах раковых опухолей легких была подтверждена экспериментально. Экспрессия была особенно высокой в клетках аденокарциномы (Li et al., 2005). Другие исследователи сообщали о корреляции с прогрессированием заболевания при раке легких (Liu et al., 2008).
Синдром умственной отсталости с ломкой Х-хромосомой, аутосомный гомолог 1 (FXR1) - Белок, кодируемый геном FXR1 является РНК-связывающим белком, который взаимодействует со схожими по функциям белками FMR1 и FXR2. Уровень FXR1 дерегулирован в ряду нарушений у человека, в том числе при раке. FXR1 выступал в качестве онкогена, который мог усиливать пролиферацию, миграцию и инвазию раковых клеток (Jin et al., 2015). FXR1 является новым раковым геном при НМРЛ, и FXR1 выполняет свою регулирующую функцию, образуя новый комплекс с двумя другими онкогенами, протеинкиназой С, йота (PRKCI) и геном 2, трансформирующим эпителиальные клетки (ЕСТ2), в пределах одного и того же ампликона в клетках рака легких (Qian et al., 2015b). Сообщалось, что повышенный уровень экспрессии FXR1 при НМРЛ является кандидатом в биомаркеры плохой выживаемости и, возможно, представляет собой новую терапевтическую мишень. Кроме того, экспрессия FXR1 коррелирует с неблагоприятным клиническим исходом при нескольких видах рака человека, позволяя сделать предположение о более масштабном участии этого РНК-связывающего белка в прогрессировании рака (Qian et al., 2015а).
С2/М-фаза-специфическая Е3 убиквитинлигаза (G2E3) - С2/М-фаза-специфическая Е3 убиквитинлигаза является ферментом, который у человека кодируется геном G2E3. G2E3 перемещается между цитоплазмой и ядром, концентрируясь в ядрышке и перемещаясь в нуклеоплазму в ответ на повреждение ДНК. G2E3 - это убиквитинлигаза с двоякой функцией, необходимая для предотвращения апоптоза в период раннего эмбриогенеза (Brooks et al., 2008). Некоторые результаты позволяют предположить, что G2E3 является молекулярной детерминантой ответа на повреждение ДНК и клеточной выживаемости, и что ее потеря повышает чувствительность опухолевых клеток к лечению, повреждающему ДНК (Schmidt et al., 2015b). Более того, потеря G2E3 вызывала апоптоз и снижала пролиферацию раковых клеток. Таким образом, G2E3 действует в качестве фактора выживаемости (Schmidt et al., 2015а).
Гуанилат-связывающий белок 5 (GBP5) - Человеческий гуанилат-связывающий белок 5 (hGBP5) принадлежит к семейству крупных ГТФаз, индуцируемых интерфероном-гамма, которые хорошо известны по их индукции воспалительными цитокинами (Wehner and Herrmann, 2010). hGBP5 существует в трех сплайс-вариантах, образующих два различных белка, опухолеспецифический из которых имеет усечение на С-конце на 97 аминокислот (Fellenberg et al., 2004).
Глутаминаза (GLS) - Ген GLS кодирует митохондриальную глутаминазу K-типа. Глутаминаза (GLS), превращающая глутамин в глутамат, играет ведущую роль в метаболизме, росте и пролиферации раковых клеток. Некоторые исследования демонстрируют, что GLS необходима для онкогенеза, и обосновывают ингибирование GLS малыми молекулами и генетическими методами в качестве потенциальных подходов по лечению рака, мишенью которых является автономная зависимость опухолевых клеток от GLS (Xiang et al., 2015). Кратковременный нокдаун сплайс-вариантов GLS указывал, что потеря GAC имела наибольшее негативное влияние на рост раковых клеток НМРЛ (van den Heuvel et al., 2012). Уровень экспрессии GLS1 повышен и коррелирует с клиникопатологическими факторами при колоректальном раке (Huang et al., 2014а), гепатоклеточной карциноме (ГКК) (Yu et al., 2015) и протоковой аденокарциномы поджелудочной железы (ПАПЖ) (Chakrabarti et al., 2015).
Белок теплового шока 2, 70 кДа (HSPA2) - HSPA2 был идентифицирован в качестве белка, потенциально способствующего развитию рака, экспрессируемого на аномально высоких уровнях при различных видах рака человека, таких как рак молочной железы (Mestiri et al., 2001), рак шейки матки (Garg et al., 2010а), уротелиальный рак мочевого пузыря (Garg et al., 2010с), носоглоточная карцинома (Jalbout et al., 2003) и злокачественные опухоли (Chouchane et al., 1997). Некоторый уровень активности гена HSPA2 наблюдался также в клеточных линиях, полученных из нескольких видов раковых опухолей человека (Scieglinska et al., 2008), тогда как сайленсинг гена HSPA2 в раковых клетках приводил к блокировке роста и снижению онкогенного потенциала (Rohde et al., 2005; Xia et al., 2008). Более того, полиморфизм гена HSPA2 ассоциируется с повышенным риском развития рака легких (Wang et al., 2010а). Избыточная экспрессия HSPA2 коррелируется с повышенной клеточной пролиферацией, плохой дифференциацией и метастазами в лимфатических узлах при раке молочной железы человека, раке шейки матки и уротелиальном раке мочевого пузыря (Garg et al., 2010а; Garg et al., 2010c; Mestiri et al., 2001).
Белок теплового шока 8, 70 кДа (HSPA8) - Ген HSPA8 кодирует члена 70 семейства белков теплового шока Hsc70, который содержит как индуцируемые теплом, так и конститутивно экспрессированные члены. HSPA8 связывается с формирующимися полипептидами, чтобы способствовать правильному сворачиванию белка (Beckmann et al., 1990). Hsc70 действует в качестве молекулярного шаперона, содействуя белковому синтезу, свертыванию, сборке, транспорту между клеточными компартментами и деградации (Bukau and Horwich, 1998; Hartl and Hayer-Hartl, 2002). Hsc70 экспрессирован в незлокачественных клетках млекопитающих, а также в раковых тканях молочной железы (Kao et al., 2003; Vargas-Roig et al., 1998), избыточная экспрессия Hsp/hsc70 в химиорезистентных раковых клетках (Ciocca et al., 1992; Lazaris et al., 1997) стала причиной исследований о возможных клинических маркерах этих белков (Ciocca and Calderwood, 2005). Существующая потенциальная функция этого секретируемого шаперона hsc70 при клеточной пролиферации может быть причиной более быстрого роста опухолевых клеток, экспрессирующих в избытке катепсин D (Nirde et al., 2010). Кроме того, Ruisin и соавт. сообщали об ассоциации между полиморфизмом этого гена и риском возникновения рака легких (Rusin et al., 2004).
Белок теплового шока 1А, 70 кДа (HSPA1A) - HSPA1A, также известный как HSP72, как было продемонстрировано, имел сильно повышенный уровень при раковых заболеваниях и играет важнейшую роль в росте опухолевых клеток за счет подавления р53-зависимого и р53-независимого механизма старения (Sherman, 2010). Избыточную экспрессию описывали для ПКК (Atkins et al., 2005) и гастроинтестинальных карцином (Wang et al., 2013а), в случае последних демонстрируется значимая корреляция с прогрессированием, инфильтрацией и присутствием метастазов в лимфатические узлы и отдаленных метастазов.
Белок теплового шока 1В, 70 кДа (HSPA1B) - HSPA1B, также известный как HSP70-2, кодирует белок теплового шока 70-2, специфический для семенника, необходимый для роста сперматоцитов и раковых клеток (Hatfield and Lovas, 2012). В различных исследованиях предполагается важная роль HSP70-2 в прогрессировании заболевания рака шейки матки (Garg et al., 2010b), почечноклеточной карциномы (Singh and Suri, 2014) и рака мочевого пузыря и полиморфизмы этого гена ассоциируются с развитием рака желудка (Ferrer-Ferrer et al., 2013). Некоторые функциональные варианты HSPA1B ассоциируются с риском заболевания раком легких и выживаемостью. Эти генетические варианты Hsp70 могут представлять собой полезные биомаркеры для предсказания риска заболевания раком легких и составления прогноза (Szondy et al., 2012; Guo et al., 2011).
Подобный белку теплового шока 1, 70 кДа (HSPA1L) - Белок теплового шока 1L, 70 кДа является белком, который у человека кодируется геном HSPA1L на хромосоме 6. Поэтому, хотя он имеет высокую гомологичность HSPA1A и HSPA1B, он регулируется по-другому и не индуцируется теплом (Ito et al., 1998). Полиморфизмы этого гена ассоциируются с предрасположенностью к раку предстательной железы и прогнозом (Sfar et al., 2010), а также с предрасположенностью к гепатоклеточной карциноме (Medhi et al., 2013).
Белок теплового шока 6, 70 кДа (HSP70B') (HSPA6) - Белок теплового шока (Hsp) 70В' является человеческим шапероном Hsp70, индуцируемым в строгой зависимости, при этом он не имеет экспрессии или имеет фоновые уровни экспрессии в большинстве клеток (Noonan et al., 2007). Было показано, что уровень HSPA6, также известного как белок теплового шока 70В', повышается в клетках глиобластомы после обработки Y15 (Huang et al., 2014b) и после теплового шока - в клетках рака головы и шеи (Narita et al., 2002). Высокие уровни HSPA6, возможно, могут ассоциироваться с ранними рецидивами ГКК (Yang et al., 2015).
Белок теплового шока 7, 70 кДа (HSP70B) (HSPA7) - HSPA7 является псевдогеном.
Цитоплазматический кошаперон 1, связывающийся с белком HSPA (теплового шока 70 кДа) (HSPBP1) - Белок, связывающийся с белком теплового шока HspBP1 является членом семейства кошаперонов Hsp70. HspBP1 является кошапероном, который связывается и регулирует шаперон Hsp70. Уровни HspBP1 и Hsp70 были существенно выше в сыворотке пациентов с раком молочной железы по сравнению с сывороточными уровнями здоровых индивидов (Souza et al., 2009). HSPBP1 избыточно экспрессировался клетками пациентов с лейкозом (Sedlackova et al., 2011). Уровень HspBP1 был повышен в клетках больных ГКК, инфицированных вирусным гепатитом С, - это повышение коррелировало с повышением уровней Hsp70 (Yokoyama et al., 2008).
Белок-активатор ГТФаз 1, содержащий IQ-мотив (IQGAP1) - IQGAP1, также известный как р195, является экспрессируемым повсеместно белком, который у человека кодируется геном IQGAP1. IQGAP1 играет ключевую роль в опосредовании нескольких различных клеточных процессов, в частности цитоскелетных перестроек. В недавних исследованиях заявляется о потенциальной роли IQGAP1 при раке, что обосновывается избыточной экспрессией и различной локализацией IQGAP1 на мембране, наблюдаемых в ряду опухолей (Johnson et al., 2009). Избыточная экспрессия IQGAP1 может играть важную роль при возникновении и прогрессировании рака поджелудочной железы (Wang et al., 2013с). Подавление экспрессии IQGAP1 снижало рост, миграцию и инвазию опухолевых клеток при плоскоклеточной карциноме пищевода (ПККП) (Wang et al., 2014с). Кроме того, повышенные уровни экспрессии IQGAP1 во время дифференциации клеток, подобных стволовым раковым клеткам яичника (CSC-LCs), регулируют агрессивное поведение клеток, что может вносить свой вклад в развитие метастазов при раке яичника (Huang et al., 2015а).
Интегрин, бета 6 (ITGB6) - ITGB6 является подтипом интегрина, который экспрессируется исключительно на поверхности эпителиальных клеток и является рецептором белков внеклеточного матрикса (Weinacker et al., 1994). В одном из исследований была обнаружена избыточная экспрессия ITGB6 в 10 видах опухолей человека, которые сравнивали с нормальными тканями. Наиболее часто об экспрессии ITGB6 сообщалось для плоскоклеточных карцином шейки матки, кожи, пищевода и головы и шеи. Примечательно, что опосредованная антителами блокировка ITGB6 ингибировала прогрессирование in vivo (Van Aarsen et al., 2008). ITGB6 использовали в качестве мишени для доставки опухолеспецифических лекарственных средств и повышения эффективности лечения при карциноме толстой кишки (Liang et al., 2015; Zhao-Yang et al., 2008). При раке молочной железы высокий уровень экспрессии мРНК или же белка ITGB6 ассоциировался с плохой выживаемостью и увеличением метастазов в отдаленные участки. Антитело, мишенью которого был ITGB6, ингибировало рост опухоли в мышиных моделях рака молочной железы (Allen et al., 2014).
Лизин (K)-специфическая деметилаза 6В (KDM6B) - KDM6B, также известная как JMJD3, является гистонной деметилазой, которая у человека кодируется геном KDM6B. KDM6B влияет на транскрипционную регуляцию за счет деметилирования остатка лизина 27 гистона 3. Низкая экспрессия KDM6B была независимым прогностическим фактором неблагоприятного прогноза (Р=0,042) для пациентов после хирургической резекции КРК (Yokoyama et al., 2008). Более того, избыточная экспрессия KDM6B ингибировала рост клеток за счет инициации апоптоза, зависимого от митохондрий, и за счет ингибирования сигнального пути инвазии и метастазирования в клетках НМРЛ (Ma et al., 2015). С другой стороны, KDM6B имеет высокий уровень экспрессии в почечноклеточной карциноме светлоклеточного типа (скПКК) и положительно коррелирует с неблагоприятным прогнозом при скПКК. Нокдаун KDM6B мог ингибировать онкогенез скПКК in vitro (Li et al., 2015). Более того, нарушение регуляции KDM6B может вносить свой вклад в развитие глиом за счет ингибирования сигнального пути р53, приводя к блокировке терминальной дифференциации (Ene et al., 2012).
Кератин 9, типа I (KRT9) - Кератин 9 - это цитокератин I типа, который у человека кодируется геном KRT9. Он был обнаружен только на конечно дифференцированных клетках эпидермиса ладоней и подошв стопы. Мутации гена, кодирующего этот белок, вызывают эпидермолитическую ладонно-подошвенную кератодермию (Reis et al., 1994). Уровень KRT9 повышен при ГКК. Данная избыточная экспрессия может играть решающую роль в метастазировании ГКК и может использоваться в качестве потенциального сывороточного маркера для предсказания метастазов при ГКК (Fu et al., 2009).
LINE1 ретротранспозон 1 (L1RE1) - Ген L1RE1, известный также как LRE1, кодирует «LINE» (длинный диспергированный ядерный элемент) ретротранспозон (LRE), мобильную последовательность ДНК с автономной активностью ретротранспозонов. Семейство ретротранспозонов LINE1, как сообщалось, гипометилировано при многих видах рака и отражает глобальный статус метилирования в геноме (Ostertag and Kazazian, Jr., 2001). Один длинный диспергированный повторяющийся ядерный сегмент, LRE1, локализованный на хромосоме 22q11-q12, является достоверным индикатором глобального статуса метилирования (Chalitchagorn et al., 2004; Ostertag and Kazazian, Jr., 2001). Некоторые данные позволяют предположить, что относительное метилирование LRE1 является независимым эпигенетическим биомаркером плоскоклеточной карциномы головы и шеи (ПККГШ) (Hsiung et al., 2007).
Ламинин, бета-3 (LAMB3) - LAMB3 кодирует субъединицу ламинина бета-3, которая вместе с субъединицами альфа и гамма образуют ламинин-5. Уровень LAMB3 был повышен в клетках папиллярной карциномы щитовидной железы (ПКЩЖ) (Barros-Filho et al., 2015), плоскоклеточной карциномы шейки матки (ПлКК шейки матки) (Yamamoto et al., 2013) и плоскоклеточной карциноме полости рта (ПлККПР) (Tanis et al., 2014). Анализ генной матрицы и данные, полученные методами биоинформатики, предполагают, что LAMB3 был ключевым геном, задействованным при раке легких. Нокдаун этого гена подавлял инвазию клеток рака легких и метастазирование у человека in vitro и in vivo. LAMB3 избыточно экспрессировался у пациентов с раком легких, и его экспрессия коррелировала с метастазами в лимфатические узлы (Wang et al., 2013b).
Лизосомальный трансмембранный белок 5 (LAPTM5) - Ген LAPTM5 кодирует мембранный белок на внутриклеточных везикулах, который ассоциируется с лизосомами. LAPTM5 аберрантно метилирован при раке легких, и метилирование коррелировало со статусом дифференциации опухоли (Cortese et al., 2008). Накопление LAPTM5-положительных везикул было тесно ассоциировано с программируемой смертью клеток, происходящей во время спонтанной регрессии нейробластом (Inoue et al., 2009). Белок CD1e участвует в презентации липидных антигенов в дендритных клетках. LATPM5 контролирует либо убиквитинирование CD1e, либо генерирование растворимых лизосомальных белков CD1e (Angenieux et al., 2012).
Компонент 4 комплекса обслуживания минихромосом (МСМ4) - Белок, кодируемый геном МСМ4 является одним из белков обслуживания минихромосом с высокой консервативностью, (МСМ), которые необходимы для инициации репликации генома у эукариот. Уровень МСМ4 был понижен при раке мочевого пузыря (Zekri et al., 2015) и дифференцированно экспрессировался при аденокарциноме легких по сравнению с нормальными тканями легких (Zhang et al., 2014). Избыточная экспрессия МСМ4 ассоциировалась с более короткой выживаемостью пациентов с раком молочной железы (Kwok et al., 2015).
Компонент 5 комплекса сохранения минихромосом (МСМ5) - МСМ5 участвует в репликации ДНК и регуляции клеточного цикла. Высокие уровни экспрессии МСМ5, как было продемонстрировано, ассоциировались с прогрессированием и худшим прогнозом при плоскоклеточной карциноме полости рта (Yu et al., 2014), раке шейки матки (Das et al., 2013), раке желудка (Giaginis et al., 2011) и раке толстой кишки (Burger, 2009).
Меланорегулин (MREG) - MREG играет роль в распространении меланосом внутри клетки (Wu et al., 2012), посредством регулирования ретроградного транспорта меланосом, зависимого от микротрубочек (Ohbayashi et al., 2012). Более того, MREG выполняет также функцию в регулировании включения пигмента в меланосомы (Rachel et al., 2012). Как было показано, MREG является мишенью миРНК-26 в его 3'-нетранслируемой области в клетках эстроген-рецептор-положительного рака молочной железы. Тем не менее, продемонстрировать непосредственное участие MREG в миРНК-26-опосредованной пролиферации клеток не удалось (Tan et al., 2014).
NODAL модулятор 1 (NOMO1) / NODAL модулятор 2 (NOMO2) / NODAL модулятор 3 (NOMO3) - Гены NOMO1, NOMO2 и NOMO3 - это три очень похожих гена участка дупликации, расположенного на р-плече хромосомы 16. Эти три гена кодируют близкородственные белки, которые могут иметь одинаковую функцию. Избыточная экспрессия гена NOMO1 была идентифицирована в клеточной линии НuТ78 Т-клеточной лимфомы кожи (ТКЛК) (Lange et al., 2009). NOMO1 является антагонистом сигнального пути Nodal. Белки Nodal являются факторами сигнального пути надсемейства трансформирующего фактора роста бета (TGFbeta), играющих ведущую роль в развитии позвоночных (Haffner et al., 2004).
Нуклеопорин 153 кДа (NUP153) - Нуклеопорин 153 (Nup153), компонент ядерного порового комплекса (NPC), был задействован во взаимодействии NPC с ядерной ламиной. Истощение Nup153 вызывает кардинальную цитоскелетную перестройку, которая нарушает процесс миграции клеток карциномы молочной железы человека (Zhou and Pante, 2010). Нуклеопорин NUP153 регулирует распределение специфических белков между ядром и цитоплазмой и, что примечательно, включая передатчика сигналов TGFβ, SMAD2 (Xu et al., 2002). Недавно проведенный анализ выявил новые возможные канцерогенные функции нуклеопорина NUP153 (предположительно, за счет модуляции сигнального пути TGFβ) при раке поджелудочной железы (Shain et al., 2013).
PERP, эффектор апоптоза ТР53 (PERP) - PERP является p53/p63-регулируемым геном, кодирующим десмосомальный белок, который играет важнейшую роль в межклеточной адгезии и подавлении опухоли. Потеря экспрессии PERP коррелирует с переходом к плоскоклеточной карциноме (ПлКК) и ростом числа локальных рецидивов у пациентов с ПлКК ротовой полости (Kong et al., 2013). Экспрессия PERP была понижена во многих клеточных линиях рака человека (Dusek et al., 2012). В некоторых исследованиях выдвигалось предположение, что недостаток Perp способствовал развитию рака, повышая выживаемость клеток, потерю десмосом и усиливая воспалительный процесс (Beaudry et al., 2010). PERP -это мишень р53, ассоциированная с апоптозом, и ее активации в отдельности достаточно для запуска апоптотического каскада, приводящего к гибели клетки (Chen et al., 2011).
Ген предполагаемого гомеодоменного фактора транскрипции 1 (PHTF1) / ген предполагаемого гомеодоменного фактора транскрипции 2 (PHTF2) - PHTF1 (ген предполагаемого гомеодоменного фактора транскрипции) является предполагаемым гомеобокс-содержащим геном, локализованным на участке 1р11-р13 человеческого генома. Этот ген является эволюционно консервативным и экспрессируется преимущественно в яичке (Manuel et al., 2000). Являясь фактором транскрипции, ген PHTF1, в основном, задействован в биологических процессах, таких как ДНК-зависимая транскрипция, и регуляции биологических процессов. Избыточная экспрессия PHTF1 отвечает за регуляцию клеточной пролиферации и апоптоз в клеточных линиях Т-клеточного острого лимфобластного лейкоза (Т-ОЛЛ). PHTF1 может быть геном, подобным гену-супрессору опухоли, и терапевтической мишенью для инициации сигнального пути апоптоза PHTF1-FEM1b-Apaf-1 (Huang et al., 2015b).
Предполагаемый гомеодоменный фактор транскрипции 2 является белком, кодируемым у человека геном PHTF2. PHTF2 экспрессируется преимущественно в мышцах и локализуется на участке 7q11.23-q21 человеческого генома (Manuel et al., 2000).
Белок, содержащий плекстрин-гомологичный домен, семейство М (с доменом RUN) член 1 (PLEKHM1) - Белок, кодируемый геном PLEKM1, необходим для резорбции костной ткани и может играть важнейшую роль в транспорте везикул в остеокластах. Мутации этого гена ассоциируются с аутосомно-рецессивным остеопетрозом типа 6 (ОРТВ6) (van et al., 2004). PLEKHM1 был предложен в качестве гена-кандидата предрасположенности к эпителиальному раку яичника (Permuth-Wey et al., 2013).
Фосфолипид-транспортный белок (PLTP) - Фосфолипид-транспортный белок (PLTP) играет важную роль в регуляции воспалительного процесса. Некоторые данные позволяют предположить, что в макрофагах PLTP способен оказывать противовоспалительное воздействие (Vuletic et al., 2011). Более того, PLTP необходим для опосредования ассоциации триацил-липида А с липопротеинами, приводя к увеличению времени взаимодействия и усилению его провоспалительных и противораковых свойств (Gautier et al., 2010). PLTP дифференциально экспрессировался у больного раком молочной железы и, возможно, ассоциируется с ответом на химиотерапию (Chen et al., 2012).
Протеинфосфатаза 2, регуляторная субъединица В", альфа (PPP2R3A) - Этот ген кодирует одну из регуляторных субъединиц протеинфосфатазы 2. Протеинфосфатаза 2 (ранее называвшаяся типа 2А) является одной из четырех основных Ser/Thr-фосфатаз, и она задействована в негативном контроле клеточного роста и деления (Ruediger et al., 2001). PPP2R3A была часто метилирована при остром лимфобластном лейкозе у детей (ОЛЛ) (Dunwell et al., 2009).
Гомолог протеинфосфатазы РТС7 (S. cerevisiae) (РРТС7) - РРТС7 кодирует гомолог протеинфосфатазы РТС7 и локализуется на участке хромосомы 12q24.11. РРТС7 был недавно идентифицирован в качестве нового гена предрасположенности к повышенному ответу на токсичные вещества окружающей среды (Zhu et al., 2015).
Протеинкиназа, ДНК-активируемая, каталитическая полипептидная (PRKDC) -PRKDC кодирует каталитическую субъединицу ДНК-зависимой протеинкиназы (ДНК-ПК), члена семейства Р13/Р14-киназ. Было показано, что PRKDC может стабилизировать онкогенный белок с-Мус за счет сигнального пути Akt/GSK3 (An et al., 2008). Активация PRKDC положительно коррелировала с пролиферацией ГКК, нестабильностью генома и плотностью микрососудов, а негативно - с апоптозом и выживаемостью пациента (Evert et al., 2013).
Протеасомная (просома, макропаин) субъединица 4, альфа-типа (PSMA4) - PSMA4 кодирует субъединицу протеасомы альфа 4, которая расщепляет пептиды в ходе АТФ/убиквитин-зависимого процесса в нелизосомном пути. Однонуклеотидные полиморфизмы гена PSMA4 ассоциировались с риском заболевания раком легких в популяции ханьцев в Китае (Wang et al., 2015). С другой стороны, сообщалось, что однонуклеотидные полиморфизмы гена PSMA4 не являются основными причинами предрасположенности к немелкоклеточному раку легких (Yongjun Zhang et al., 2013). Более того, избыточная экспрессия PSMA4 наблюдалась в опухолях легких по сравнению с нормальной тканью легких. Снижение экспрессии PSMA4 ослабляло активность протеасомы и вызывало апоптоз (Liu et al., 2009).
Белковая тирозинфосфатаза, нерецепторного типа 13 (PTPN13) - Этот ген кодирует члена семейства белковых тирозинфосфатаз (РТР). РТР являются сигнальными молекулами, регулирующими множество клеточных процессов, в том числе клеточный рост, дифференциацию, митотический цикл и онкогенную трансформацию. Было обнаружено, что PTPN13 взаимодействует с рецептором Fas и, возможно, поэтому играет роль в процессе запрограммированной гибели клеток, опосредуемой Fas. Более того, PTPN13 взаимодействует с ГТФаза-активирующим беком и, таким образом, может выполнять функцию регулятора сигнальных путей Rho. При гематологических злокачественных заболеваниях PTPN13 оказывает противоречивое влияние, подавляя или стимулируя рост опухоли, при лимфоме и миелоидном лейкозе, соответственно (Wang et al., 2014b). Этот факт может быть объяснен способностью PTPN13 препятствовать активности онкогенных тирозинкиназ и его ингибирующим взаимодействием с рецептором клеточной гибели Fas (Freiss and Chalbos, 2011). При раке молочной железы PTPN13 обозначался как единственный маркер ответа опухоли молочной железы на антиэстрогенные препараты и в качестве потенциальной терапевтической мишени для активации инициирующих апоптоз стимулов в опухолевых клетках (Freiss et al., 2004). Ингибирование связывания Fas и PTPN13, возможно, станет хорошей мишенью для разработок противораковых препаратов (Takahashi and Kataoka, 1997).
Белковый активатор 2 RAS р21 (RASA2) - Белковый активатор 2 RAS р21 кодирует члена семейства GAP1 ГТФаза-активирующих белков. Выступая в роли супрессора функции RAS, RASA2 усиливает слабую истинную ГТФазную активность белков RAS, приводя к инактивации ГДФ-связанной формы RAS, тем самым позволяя контролировать клеточную пролиферацию и дифференциацию. В зависимости от точного генетического изменения, его локализации в гене и воздействия, оказываемого им на функцию белка, RASA2 теоретически может выступать как в роли онкогена, так и гена-супрессора опухоли (Friedman, 1995). В условиях легкого стресса RASA2 расщепляется каспазой-3, что приводит к образованию фрагмента, называемого фрагмент N, стимулирующий сигнальный путь подавления гибели. При дальнейшем увеличении активности каспазы-3 образуется фрагмент, называемый N2, который более не защищает клетки. С другой стороны, полноразмерный RASA2 благоприятствует активности Akt, защищая от инактивации фосфатазами (Cailliau et al., 2015). При раке молочной железы активируемая в условиях стресса каспаза-3, возможно, вносит свой вклад в подавление метастазов за счет образования фрагмента N2 (Barras et al., 2014). RASA2 был идентифицирован в качестве гена-супрессора опухоли, имеющим мутации в 5% меланом (Arafeh et al., 2015).
Рекомбинационный сигнал-связывающий белок для сегмента J иммуноглобулина каппа (RBPJ) - Рекомбинационный сигнал-связывающий белок для сегмента J иммуноглобулина каппа кодирует транскрипционный регулятор, важный для сигнального пути Notch. RBPJ выступает в качестве репрессора, если он не связан с белками Notch, и в качестве активатора, если он связан с белками Notch. Считается, что он функционирует, выполняя рекрутинг хроматин-ремоделирующих комплексов, содержащих белки гистондеацетилазу или гистонацетилазу в гены сигнального пути Notch. Мышиные модели с ксенотрансплантатами показали, что нокдаун RBPJ ингибировал канцерогенность и уменьшал объем опухоли - это позволяет предположить, что условия гипоксии способствуют транскрипции белка Smoothened за счет повышения уровня RBPJ, приводя к индукции пролиферации, инвазивности и онкогенеза при раке поджелудочной железы (Onishi et al., 2016). Свидетельства того, что нокдаун RBPJ приводил к существенному снижению роста клеток, был также обнаружен в клетках рака предстательной железы и легких, позволяя предположить, что экспрессия RBPJ могла бы стать многообещающим терапевтическим подходом в лечении рака у человека (Xue et al., 2015; Lv et al., 2015). Более того, избыточная экспрессия RBPJ стимулировала свободный [«безъякорный»] рост клеток рабдомиосаркомы (Nagao et al., 2012). RBPJ-опосредованный сигнальный путь Notch необходим также для противоопухолевых иммунных ответов, зависимых от дендритных клеток (Feng et al., 2010).
Белок, подобный белку 9, содержащему домен стерильного альфа-мотива (SAMD9L) - SAMD9L кодирует белок, подобный белку 9, содержащему домен стерильного альфа-мотива, и локализован на участке хромосомы 7q21.2. Гены SAMD9 и SAMD9L имеют общую генную структуру и кодируют белки с 60%-ой идентичностью аминокислот, что предполагает их роль в подавлении запуска воспалительных каскадов. SAMD9L локализован в ранних эндосомах и способствует слиянию эндосом. Гаплонедостаточность гена SAMD9L вносит свой вклад в трансформацию миелоидных клеток, и ген SAMD9L был идентифицирован в качестве кандидата в гены-супрессоры миелоидных опухолей (Nagamachi et al., 2013). Нокдаун гена SAMD9L существенно стимулировал пролиферацию клеток и образование колоний клеточными линиями гепатоклеточной карциномы, поскольку подавление экспрессии SAMD9L способствовало переходу от G1 к S-фазе клеточного цикла и вело к повышению активности сигнального пути Wnt/бета-катенина. Недавно выявленные факты подчеркивают роль опухолевого супрессора деактивации SAMD9L соматической мутацией и пониженного уровня экспрессии при раке у человека (Wang et al., 2014а). SAMD9L имел существенно пониженный уровень экспрессии в Т- и В-клеточной популяции пациентов, больных метастатической меланомой, по сравнению с контрольной группой здоровых индивидов (Critchley-Thorne et al., 2007).
Фактор сплайсинга 3b, субъединица 3, 130 кДа (SF3B3) - SF3B3 кодирует субъединицу 3 белкового комплекса фактора сплайсинга 3b. Избыточная экспрессия SF3B3 значимо коррелирует с общей выживаемостью и резистентностью к эндокринной терапии в случае эстроген-рецептор-положительного рака молочной железы (Gokmen-Polar et al., 2015).
Сурфактантный белок А1 (SFTPA1) / сурфактантный белок А2 ( SFTPA2) - Эти гены кодируют легочные сурфактантные белки, являющиеся членами подсемейства лектинов С-типа, называемых коллектины. SFTPA связывают специфические углеводные фрагменты, находящиеся на липидах и на поверхности микроорганизмов, и играют важную роль в гомеостазе сурфактантов и защите от патогенов дыхательных путей. Мутации этих генов ассоциируются с идиопатическим фиброзом легких. Генетическая сигнатура, специфическая для рака легких, содержащая гены SFTPA1 и SFTPA2, четко отличала рак легких от образцов других видов рака (Peng et al., 2015). Мутации EGFR были распространены значительно больше при аденокарциноме легких с экспрессией SFTPA, чем без нее (Jie et al., 2014). SFTPA подавляет прогрессирование рака легких за счет регуляции поляризации опухолеассоциированных макрофагов (Mitsuhashi et al., 2013). Экспрессия мутантного SFTPA2 в клетках эпителия легких приводит к секреции латентного TGF-бета-1 и TGF-бета-1-опосредованному эпителиально-мезенхимальному переходу (ЕМТ) (Maitra et al., 2012). Более того, развитие рака предстательной железы может быть связано с пониженным уровнем SFTPA (Kankavi et al., 2014).
Семейство переносчиков растворенных веществ 25 (митохондриальный переносчик; адениннуклеотидный переносчик), член 31 (SLC25A31) / семейство переносчиков растворенных веществ 25 (митохондриальный переносчик; адениннуклеотидный переносчик), член 4 (SLC25A4) / семейство переносчиков растворенных веществ 25 (митохондриальный переносчик; адениннуклеотидный переносчик), член 5 (SLC25A5) / семейство переносчиков растворенных веществ 25 (митохондриальный переносчик; адениннуклеотидный переносчик), член 6 (SLC25A6) - Белки семейства переносчиков растворенных веществ 25 - это переносчики АДФ/АТФ, которые заменяют цитозольный АДФ на матричный АТФ в митохондриях. Они действуют как управляемая пора, которая перемещает АДФ/АТФ и образует гомодимер, внедренный во внутреннюю мембрану митохондрий. Как было показано, клетки, избыточно экспрессирующие это семейство генов, обладают антиапоптотическим фенотипом. Подавление экспрессии этого семейства генов, как было показано, вызывает апоптоз и ингибирует рост опухоли. Тогда как SLC25A4 преимущественно присутствует в дифференцированных тканях и является специфическим для мышц и головного мозга, SLC25A5 экспрессируется в пролиферирующих тканях, таких как опухоли. SLC25A6 экспрессируется повсеместно, a SLC25A31 присутствует в клетках печени и половых клетках (Dolce et al., 2005). В особенности SLC25A5 вносит свой вклад в канцерогенез. Поскольку экспрессия SLC25A5 тесно связана с митохондриальной биоэнергетикой опухолей, он представляет собой многообещающую мишень для индивидуализации лечения рака и для разработки противораковых стратегий (Chevrollier et al., 2011). Более того, постоянная избыточная экспрессия SLC25A31 предохраняла раковые клетки от апоптоза, опосредованного ионидамином и стауроспорином, вне зависимости от экспрессии Bcl-2. Исходя из этого, в подсемействе изоформ SLC25 человека была обнаружена двойственность, поскольку изоформы SLC25A4 и SLC25A6 имеют проапоптотическую функцию, а изоформы SLC25A5 и SLC25A31 придают клеткам резистентность по отношению к вызывающим гибель стимулам (Gallerne et al., 2010).
Белок ядерных телец SP140 (SP140) - SP140 кодирует белок тела ядра SP140 и локализован на участке хромосомы 2q37.1. Повышенный уровень SP140, как было показано, наблюдался при плоскоклеточной карциноме гортани. SP140 ассоциируется с хроническим лимфоцитарным лейкозом (Lan et al., 2010), множественной миеломой (Kortum et al., 2015) и острым промиелоцитарным лейкозом (Bloch et al., 1996).
Передатчик сигналов и активатор транскрипции 1, 91 кДа (STAT1) - STAT1 активируется фосфорилированием тирозина в ответ на все интерфероны (Decker et al., 2002) и вносит свой вклад в дифференциацию клеток Th1 (Schulz et al., 2009). На молекулярном уровне STAT1 ингибирует пролиферацию раковых клеток как мыши, так и человека, обработанных IFN-γ, за счет его способности увеличивать экспрессию ингибитора циклин-зависимой киназы p21Cip1 или снижать экспрессию c-myc (Ramana et al., 2000). Противоопухолевая активность STAT1 подтверждается, кроме того, его способностью ингибировать ангиогенез и метастазы опухоли в мышиных моделях (Huang et al., 2002). Повышенные уровни мРНК STAT1, как было показано, являются частью молекулярного портрета, ассоциированного с лучшим прогнозированием относительно метастазирования для пациента с рецептор-негативным статусом в отношении гормонов и трижды негативным раком молочной железы (Yau et al., 2010).
Трансмембранный белок 43 (ТМЕМ43) - Этот ген кодирует трансмембранный белок 43. Дефекты этого гена являются причиной семейной аритмогенной дисплазии правого желудочка 5 типа (ARVD5), известной также как аритмогенная кардиомиопатия правого желудочка 5 типа (ARVC5). ARVD - это наследственное нарушение и характеризуется желудочковой тахикардией, сердечной недостаточностью, внезапной сердечной смертью и замена кардиомиоцитов фиброзно-жировой тканью (Siragam et al., 2014). ТМЕМ43 может играть важную роль в сохранении структуры ядерной оболочки за счет организации белковых комплексов на внутренней ядерной мембране (Bengtsson and Otto, 2008).
Топоизомераза (ДНК) II альфа 170 кДа (ТОР2А) / топоизомераза (ДНК) II бета 180 кДа (ТОР2В) - ТОР2А и ТОР2В кодируют высоко гомологичные изоформы ДНК-топоизомеразы, фермента, который контролирует и изменяет топологические состояния ДНК во время транскрипции. Данный ядерный фермент задействован в таких процессах, как конденсация хромосом, сепарация хроматид и снятие торсионного напряжения, которое возникает во время транскрипции и репликации ДНК. ТОР2А необходима для клеточной пролиферации и в высокой степени экспрессируется в быстро растущих клетках, тогда как ТОР2В не является необходимой для роста, и по недавно полученным данным, участвовала в образовании вторичных злокачественных заболеваний, ассоциированных с лечением (Toyoda et al., 2008). Избыточная экспрессия ТОР2А была установлена в нескольких видах рака (например, злокачественной мезотелиоме плевры (Roe et al., 2010), злокачественной опухоли оболочки периферийных нервов (Kresse et al., 2008), клетках аденокарциномы легких (Kobayashi et al., 2004), раке мочевого пузыря (Simon et al., 2003), глиобластомах (van den Boom et al., 2003)). TOP2B задействована в транскрипции, репликации, рекомбинации ДНК и митозе и наряду с ТОР1 представляет второй ген-партнер слияния с NUP98, который принадлежит к семейству генов топоизомераз (Nebral et al., 2005).
Альфа-/бета-триптаза 1 (TPSAB1) / бета-триптаза 2 (TPSB2) - Альфа-/бета-триптаза 1 (TPSAB1) и бета-триптаза 2 (TPSB2) представлены вместе с двумя другими изоформами триптазы, экспрессируемыми мастоцитами. Триптазы задействованы в качестве медиаторов в патогенезе астмы и других аллергических и воспалительных заболеваниях. Триптаза, секретируемая мастоцитами, способствует ангиогенезу и вносит свой вклад в васкуляризацию опухоли. Триптаза действует путем активации рецептора-2, активируемого протеиназой (PAR-2), и кроме того, вносит свой вклад в деградацию внеклеточного матрикса, тем самым способствуя росту сосудов. Более того, присутствие триптаза-положительных мастоцитов в опухолевой ткани коррелирует с ангиогенезом при нескольких видах рака (Ammendola et al., 2014). О повышенном уровне триптаза-положительных мастоцитов сообщалось при раке предстательной железы, и он коррелировал с плотностью микрососудов, стадией опухоли и более короткой выживаемостью (Nonomura et al., 2007; Stawerski et al., 2013). В равной степени, триптаза-положительные мастоциты ассоциируются со стадией опухоли и ангиогенезом при раке желудка (Zhao et al., 2012; Ribatti et al., 2010), а также при аденокарциноме легких (Imada et al., 2000; Takanami et al., 2000).
Белок 11, содержащий трехсторонний мотив (TRIM11) - Белок 11, содержащий трехсторонний мотив, является белком, кодируемым у человека геном TRIM11. TRIM11, как известно, задействован в развитии центральной нервной системы, и он дестабилизирует белок гуманин, ингибитор повреждений нейронов, подобных болезни Альцгеймера (Niikura et al., 2003). TRIM11 избыточно экспрессируется при глиомах высокой степени злокачественности и способствует пролиферации, инвазии, миграции и росту глиальной опухоли (Di et al., 2013).
Катионный канал с транзиторным рецепторным потенциалом, подсемейство М, член 2 (TRPM2) - Белок, кодируемый этим геном, является кальций-проницаемым катионным каналом, который регулируется свободной внутриклеточной АДФ-рибозой. В определенных условиях TRPM2, возможно, задействован в опосредовании апоптоза (Ishii et al., 2007; Cao et al., 2015). Тем не менее, его влияние на пролиферацию клеточного роста менее понятно и, возможно, зависит от условий клеточной культуры и экспрессии изоформ альтернативного сплайсинга (Chen et al., 2014). В клетках меланомы и рака предстательной железы был идентифицирован антисмысловой РНК-транскрипт TRPM2, которым обогащены опухолевые клетки, который коррелировал с апоптозом и клиническим исходом (Orfanelli et al., 2015).
Белок 3, ассоциированный с комплексом гамма-тубулина (TUBGCP3) - Белок 3, ассоциированный с комплексом гамма-тубулина, является частью комплекса гамма-тубулина, содержащего несколько субъединиц, являющегося критическим компонентом для нуклеации микротрубочек в эукариотических клетках. Цитоплазматические комплексы гамма-тубулина направляются в центросомы или другие центры организации микротрубочек за счет набора так называемых белков, связывающихся с комплексом гамма-тубулина (Schiebel, 2000). Существенное повышение экспрессии транскриптов TUBGCP3 по сравнению с нормальными астроцитами человека было обнаружено в клетках глиобластомы, и иммунореактивность TUBGCP3 была существенно повышена по сравнению с ее уровнем в нормальных тканях головного мозга. TUBGCP3 был также ассоциирован с пролиферацией микрососудов и взаимодействием с сигнальными путями, приводящими к злокачественному фенотипу (Draberova et al., 2015). Более того, было обнаружено, что экспрессия TUBGCP3 значительно выше в образцах клеток лимфомы мантийной зоны с набором хромосом, близким к тетраплоидному, чем с диплоидным набором хромосом (Neben et al., 2007).
Фермент 6, активирующий убиквитин-подобный модификатор (UBA6) - Фермент 6, активирующий убиквитин-подобный модификатор, является белком, кодируемым у человека геном UBA6. UBA6 является убиквитин-активирующим ферментом, экспрессируемым наиболее обильно в семеннике. Более того, он необходим для клеточного ответа на повреждение ДНК (Moudry et al., 2012).
Рецептор 1 ксенотропного и политропного ретровируса (XPR1) - XPR1 - это многопроходная мембранная молекула, которая содержит аминоконцевой домен SPX (названный по SYG1, Pho81 и XPR1) из 180 остатков в длину. О XPR1 сообщалось, что он опосредует экспорт фосфата (Giovannini et al., 2013). Было обнаружено, что при дифференциации остеокластов число транскриптов мPHK XPR1 повышается (Sharma et al., 2010). Первоначально XPR1 описывали как ретровирусный рецептор, используемый ксенотропными и политропными вирусами (X-MLV и P-MLV), двумя гамма-ретровирусами, которые могут инфицировать как клетки человека, так и клетки различных других видов, таких как мышей и птиц (Kozak, 2010; Martin et al., 2013).
Белок 5, содержащий домен «zinc finger» типа BED 5 (ZBED5) - Белок 5, содержащий домен «zinc finger» типа BED, характеризуется кодирующей последовательностью, которая, в основном, образована из Charlie-подобного ДНК-транспозона, тем не менее, он, видимо, не является активным ДНК-транспозоном, поскольку он не связан с терминальными инвертированными повторами. ZBED5 относится к ДНК-транспозонам Buster и филогенетически отдален от других белков ZBED. Гены ZBED широко экспрессируется среди тканей позвоночных, и вместе они регулируют исключительное многообразие функций (Hayward et al., 2013).
Белок с доменом «zinc finger» 697 (ZNF697) - Ген ZNF697 кодирует белок с доменом «zinc finger» 697, локализованный на хромосоме 1р12 и, вероятно, играющий роль в связывании ДНК (Yu et al., 2011).
Стимуляция иммунных ответов зависит от присутствия антигенов, распознаваемых иммунной системой хозяина как чужеродные. Открытие существования опухолеассоциированных антигенов повысило возможность использования иммунной системы хозяина для вмешательства в рост опухоли. Различные механизмы управления обеими ветвями иммунной системы, как гуморальной, так и клеточной, исследуются в настоящее время для иммунотерапии рака.
Специфические элементы клеточных иммунных ответов способны к специфическому распознаванию и уничтожению опухолевых клеток. Выделение Т-клеток из популяций опухоль-инфильтрирующих клеток или из периферической крови предполагает, что такие клетки играют важную роль в естественной иммунной защите против рака. В частности, CD8-положительные Т-клетки, которые распознают пептиды, связанные с молекулами I класса главного комплекса гистосовместимости (МНС), играют важную роль в этом ответе. Эти пептиды обычно состоят из 8-10 аминокислотных остатков, полученных из белков или дефектных рибосомных продуктов (DRIP), находящихся в цитозоле. Молекулы МНС человека называются также человеческими лейкоцитарными антигенами (HLA).
Все термины, используемые здесь, если не указано иное, имеют значения, данные ниже.
Понятие «Т-клеточный ответ» означает специфическую пролиферацию и активацию эффекторных функций, индуцированных пептидом in vitro или in vivo. Для цитотоксических Т-клеток, рестриктированных по МНС I класса, эффекторными функциями может быть лизис клеток-мишеней, нагруженных пептидом, нагруженных предшественником пептида, или клеток-мишеней, естественно презентирующих пептид; секреция цитокинов, предпочтительно интерферона-гамма, TNF-альфа или ИЛ-2, индуцированная пептидом; секреция эффекторных молекул, предпочтительно гранзимов или перфоринов, индуцированная пептидом, или дегрануляция.
Понятие «пептид» в контексте настоящего описания обозначает серии аминокислотных остатков, связанных друг с другом обычно пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Пептиды предпочтительно имеют длину в 9 аминокислот, но могут быть короче - 8 аминокислот в длину, и длиннее - 10, 11, 12 или 13 аминокислот или длиннее и в случае пептидов, связанных с молекулами МНС II класса (удлиненные варианты пептидов по изобретению), они могут иметь длину в 14, 15, 16, 17, 18, 19 или 20 или более аминокислот.
Кроме того, понятие «пептид» включает в себя соли серий аминокислотных остатков, связанных друг с другом обычно пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Предпочтительно, если соли являются фармацевтически приемлемыми солями пептидов, такими как, например, хлорид или ацетат (трифторацетат). Было замечено, что соли пептидов в соответствии с настоящим изобретением существенно отличаются от пептидов в их состоянии(ях) in vivo, так как пептиды не являются солями in vivo.
Понятие «пептид» включает также понятие «олигопептид». Понятие «олигопептид» в контексте настоящего описания обозначает серии аминокислотных остатков, связанных друг с другом обычно пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Длина олигопептида не особенно важна для изобретения до тех пор, пока в нем сохраняются надлежащие эпитоп или эпитопы. Олигопептиды типично бывают менее чем около 30 аминокислотных остатков в длину и более чем около 15 аминокислот в длину.
Понятие «полипептид» обозначает серии аминокислотных остатков, связанных один с другим типично пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Длина полипептида не особенно важна для изобретения до тех пор, пока сохраняются надлежащие эпитопы. В отличие от терминов «пептид» или «олигопептид», термин «полипептид» введен для обозначения молекул, содержащих более приблизительно 30 аминокислотных остатков.
Пептид, олигопептид, белок или полинуклеотид, кодирующий такую молекулу, является «иммуногенным» (и, таким образом, «иммуногеном» в рамках настоящего изобретения), если он способен индуцировать иммунный ответ. В случае настоящего изобретения иммуногенность получает более специфическое определение как способность индуцировать Т-клеточный ответ. Таким образом, «иммуноген» будет представлять собой молекулу, которая способна индуцировать иммунный ответ, и, в случае настоящего изобретения, молекулу, способную индуцировать Т-клеточный ответ. В другом аспекте иммуноген может быть пептидом, комплексом пептида и МНС, олигопептидом и/или белком, используемым для получения специфических антител или ТКР против него.
Для Т-клеточного «эпитопа» I класса необходим короткий пептид, который связан с рецептором МНС I класса, образующим трехчленный комплекс (альфа-цепь МНС I класса, бета-2-микроглобулин и пептид), который может быть распознан Т-клеткой, несущей подходящий Т-клеточный рецептор, связывающийся с комплексом МНС/пептид с подходящей аффинностью. Пептиды, связывающиеся с молекулами МНС I класса, типично имеют длину в 8-14 аминокислот и, особенно типично, длину в 9 аминокислот.
У человека имеется три различных генетических локуса, которые кодируют молекулы МНС I класса (молекулы МНС человека называются также человеческими лейкоцитарными антигенами (HLA)): HLA-A, HLA-B и HLA-C. HLA-A*01, HLA-A*02 и HLA-A*07 являются примерами различных аллелей МНС I класса, которые могут экспрессироваться из этих локусов.
Таблица 11: Частоты экспрессии F HLA-A*02 и HLA-A*24 и наиболее частых серологических видов HLA-DR. Частоты экспрессии выведены из частот гаплотипа Gf среди американцев, приводимых в работе Mori и соавт. (Mori et al., 1997), с использованием формулы Харди-Вейнберга F=1-(1-Gf)2. Комбинации А*02 или А*24 с определенными аллелями HLA-DR вследствие неравномерного распределения связей могут быть обогащенными или менее частыми, чем ожидается от их индивидуальных частот выявления. Более подробная информация представлена в работе Chanock и соавт. (Chanock et al., 2004).


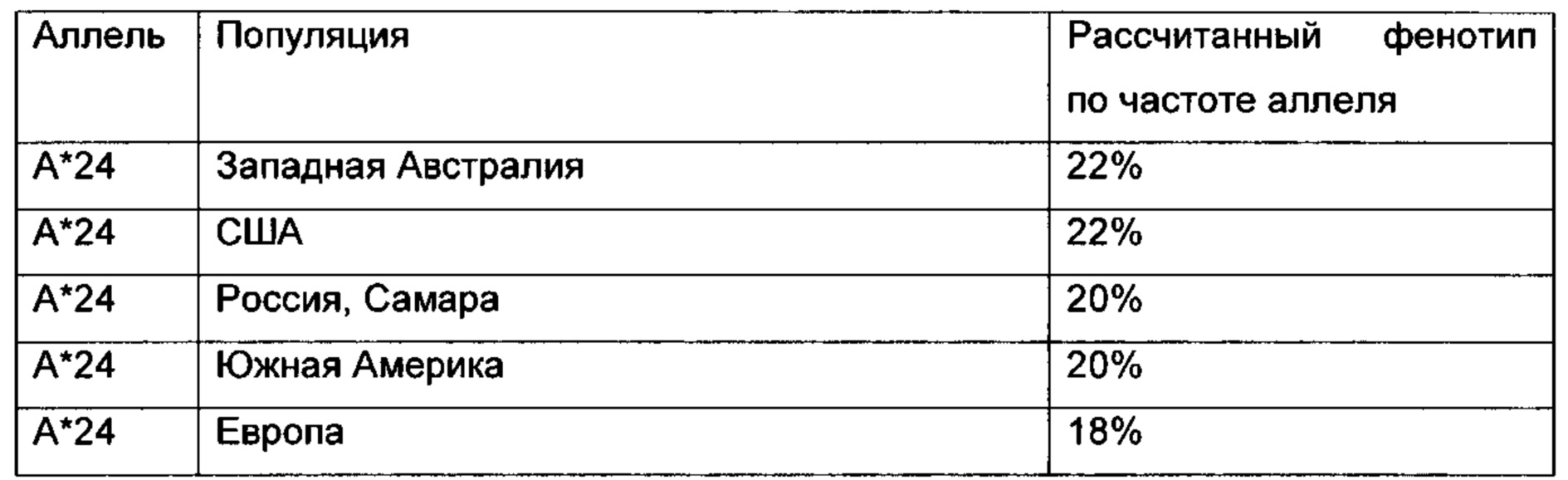
Пептиды по изобретению, предпочтительно когда они включены в состав вакцины по изобретению согласно описанию в настоящем документе, связываются с HLA-A*02 и HLA-A*24. Пептиды МНС II класса по изобретению связываются с несколькими различными молекулами HLA II класса и называются способными к промискуитетному связыванию (универсальные по связыванию пептиды). Вакцина также может включать универсальные пептиды, связывающиеся с МНС II класса. Поэтому вакцина по изобретению может применяться для лечения рака у пациентов, которые являются А*02 или А*24-положительными, причем в связи с универсальной по связыванию природе данных пептидов не нужен подбор аллотипов МНС II класса.
Если пептиды А*02 по изобретению скомбинировать с пептидами А*24 по изобретению, лечение может пройти более высокий процент любой популяции пациентов по сравнению с вакцинацией для каждого аллеля МНС I класса в отдельности. Тогда как в большинстве популяций любым одним аллелем могут быть охвачены менее чем 50% пациентов, вакциной, включающей эпитопы HLA-A*24 и HLA-A*02 можно лечить не менее 60% пациентов любой соответствующей популяции. Говоря конкретно, следующие процентные доли пациентов будут положительными по меньшей мере для одного из этих аллелей в различных регионах: США - 61%, Западная Европа - 62%, Китай - 75%, Южная Корея - 77%, Япония - 86% (рассчитано по данным www.allelefrequencies.net).
В предпочтительном варианте осуществления понятие «нуклеотидная последовательность» относится к гетерополимеру дезоксирибонуклеотидов.
Нуклеотидная последовательность, кодирующая конкретный пептид, олигопептид или полипептид, может быть встречающейся в природе или может быть синтезирована. В целом, сегменты ДНК, кодирующие пептиды, полипептиды и белки данного изобретения, собраны из фрагментов кДНК и коротких олигонуклеотидных линкеров или же из серий олигонуклеотидов для получения синтетического гена, который способен экспрессироваться в рекомбинантной транскрипционной единице, включающей регуляторные элементы, образованные из микробного или вирусного оперона.
В контексте настоящего описания понятие «нуклеотид, кодирующий пептид», относится к нуклеотидной последовательности, кодирующей пептид, включая искусственные (сделанные человеком) старт- и стоп-кодоны, совместимые с биологической системой, которой должна экспрессироваться последовательность, например, дендритная клетка или другая клеточная система, пригодная для получения ТКР.
Используемая в контексте данного описания ссылка на последовательность нуклеиновой кислоты включает как однонитевую, так и двухнитевую нуклеиновую кислоту. Таким образом, например, для ДНК специфическая последовательность, если в контексте не указано иное, относится к однонитевой ДНК такой последовательности, дуплексу такой последовательности с его комплементом (двухнитевая ДНК) и комплементу такой последовательности.
Понятие «кодирующая область» относится к тому участку гена, который в естественных или обычных условиях кодирует продукт экспрессии того гена в его естественном геномном окружении, т.е., участку, кодирующему т vivo нативный продукт экспрессии гена.
Кодирующая область может быть получена из не мутировавшего («нормального»), мутировавшего или измененного гена или может даже быть получена из последовательности ДНК, или же гена, целиком синтезированного в лаборатории с использованием методов, хорошо известных специалистам области синтеза ДНК.
Понятие «продукт экспрессии» означает полипептид или белок, являющийся природным продуктом трансляции гена и любой последовательности нуклеиновой кислоты, которая кодирует эквиваленты, образующиеся в результате вырождения генетического кода и, таким образом, кодирует ту/те же самую(ые) аминокислоту(ы).
Понятие «фрагмент», если относится к кодирующей последовательности, означает участок ДНК, включающий меньше, чем полную кодирующую область, продукт экспрессии которого по существу сохраняет ту же самую биологическую функцию или активность, что и продукт экспрессии полной кодирующей области.
Понятие «сегмент ДНК» относится к полимеру ДНК в виде отдельного фрагмента или в качестве компонента более крупной конструкции ДНК, которая была образована из ДНК, выделенной по меньшей мере один раз в по существу чистой форме, т.е., без контаминирующих эндогенных материалов и в количестве или с концентрацией, позволяющей идентификацию, манипуляцию и восстановление сегмента и его составных нуклеотидных последовательностей стандартными биохимическими методами, например, с использованием вектора для клонирования. Такие фрагменты предлагаются в форме открытой рамки считывания, не прерываемой внутренними не-транслированными последовательностями или интронами, которые обычно присутствуют в эукариотических генах. Последовательности нетранслированной ДНК могут присутствовать за открытой рамкой считывания, где она не интерферирует с манипуляцией или экспрессией кодирующих областей.
Понятие «праймер» означает короткую последовательность нуклеиновой кислоты, которая может быть спарена с одной нитью ДНК с получением свободного конца 3'OH, на котором ДНК-полимераза начинает синтезировать дезоксирибонуклеотидную цепь.
Понятие «промотор» означает участок ДНК, задействованный в связывании РНК-полимеразы для инициации транскрипции.
Понятие «выделенный» означает, что материал удален из его исходного окружения (к примеру, естественного окружения, если он встречается в природе). Например, встречающийся в природе полинуклеотид или полипептид, представленный в живых организмах, не является выделенным, но тот же самый полинуклеотид или полипептид, отделенный от некоторых или всех сосуществующих материалов природной системы, является выделенным. Такие полинуклеотиды могли быть частью вектора и/или такие полинуклеотиды или полипептиды могли быть частью композиции и все-таки могли быть выделены, так что такой вектор или композиция не является частью своего естественного окружения.
Полинуклеотиды и рекомбинантные или иммуногенные полипептиды, раскрытые в соответствии с настоящим изобретением, могут также быть в «очищенной» форме. Понятие «очищенный» не требует абсолютной чистоты; скорее оно предназначено для дачи относительного определения и может включать препараты с высокой очисткой или препараты только с частичной очисткой, в соответствии с тем, как эти термины понимаются специалистами соответствующей области. Например, отдельные клоны, выделенные из библиотеки кДНК, как обычно очищались до электрофоретической гомогенности. Очистка исходного материала или природного материала от примесей по меньшей мере на один порядок величины, предпочтительно два или три порядка, и, более предпочтительно, четыре или пять порядков величины определенно рассматривается в изобретении. Более того, определенно включен заявленный полипептид, чистота которого составляет, предпочтительно, 99,999% или по меньшей мере 99,99% или 99,9%; и даже желательно 99% по массе или более.
Нуклеиновые кислоты и полипептиды как продукты экспрессии, раскрываемые в соответствии с настоящим изобретением, в равной степени, как и векторы экспрессии, содержащие такие нуклеиновые кислоты и/или такие полипептиды, могут быть в «обогащенной форме». Используемый здесь термин «обогащенный» означает, что концентрация материала по меньшей мере приблизительно в 2, 5, 10, 100 или 1000 раз выше его естественной концентрации (например), преимущественно 0,01%, по массе, предпочтительно, по меньшей мере, около 0,1% по массе. Рассматриваются также обогащенные препараты с концентрацией примерно 0,5%, 1%, 5%, 10% и 20% по массе. Последовательности, конструкции, векторы, клоны и другие материалы, включенные в настоящее изобретение, могут быть предпочтительно в обогащенной форме или выделенными. Понятие «активный фрагмент» означает фрагмент - обычно пептида, полипептида или последовательности нуклеиновой кислоты, - который дает иммунный ответ (т.е. обладает иммуногенной активностью), если он введен отдельно или факультативно с подходящим адъювантом или в векторе животному, такому как млекопитающее, например, кролику или мыши, также включая человека; причем такой иммунный ответ принимает форму стимуляции Т-клеточного ответа у животного-реципиента, такого как человек. Альтернативно «активный фрагмент» может также быть использован для инициации ответа Т-клетки in vitro.
В контексте настоящего описания понятия «участок», «сегмент» и «фрагмент», если они использованы по отношению к полипептидам, относятся к непрерывной последовательности остатков, таких как аминокислотные остатки, последовательность которых формирует подкласс более крупной последовательности. Например, если полипептид был подвергнут обработке любой из известных эндопептидаз, таких как трипсин или химотрипсин, то полученные в результате такой обработки олигопептиды будут представлять участки, сегменты или фрагменты исходного полипептида. При использовании по отношению к полинуклеотидам эти понятия относятся к продуктам, полученным при обработке указанных полинуклеотидов любой из эндонуклеаз.
В соответствии с настоящим изобретением понятие «процентная доля идентичности» или «идентичный с процентной долей», если оно относится к последовательности, означает, что последовательность сравнивается с заявленной или описанной последовательностью после выравнивания сравниваемой последовательности («Сравниваемая последовательность») с описанной или заявленной последовательностью («Контрольная последовательность»). Процентная доля идентичности определяется затем по следующей формуле:
процентная доля идентичности = 100 [1-(C/R)]
где «С» является числом различий между Контрольной последовательностью и Сравниваемой последовательностью по длине выравнивания между Контрольной последовательностью и Сравниваемой последовательностью, где
(i) каждое основание или аминокислота в Контрольной последовательности, которые не имеют соответствующего выравненного основания или аминокислоты в Сравниваемой последовательности, и
(ii) каждая брешь в Контрольной последовательности и
(iii) каждое выравненное основание или аминокислота в Контрольной последовательности, которые отличаются от выравненного основания или аминокислоты в Сравниваемой последовательности, представляют собой различие; и
(iiii) выравнивание должно начинаться с позиции 1 выравненных последовательностей;
и «R» - это число оснований или аминокислот в Контрольной последовательности по длине выравнивания со Сравниваемой последовательностью с любой брешью, образующейся в Контрольной последовательности, считающейся также за основание или аминокислоту.
Если существует противопоставление между Сравниваемой последовательностью и Контрольной последовательностью, для которых процентная доля идентичности, по расчетам выше, приблизительно равна или выше установленной минимальной Процентной доли идентичности, тогда Сравниваемая последовательность имеет установленную минимальную процентную долю идентичности с Контрольной последовательностью, если даже могут существовать выравнивания, в которых подсчитанная здесь выше процентная доля идентичности меньше, чем установленная процентная доля идентичности.
Как было упомянуто ранее, в настоящем изобретении, таким образом, предложен пептид, включающий последовательность, которая выбрана из группы, состоящей из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 110 или ее вариант, который на 88% гомологичен последовательностям с SEQ ID NO: 1 по SEQ ID NO: 110, или их варианту, который будет индуцировать Т-клеточную перекрестную реакцию с указанным пептидом. Пептиды по изобретению обладают способностью связываться с молекулой главного комплекса гистосовместимости человека (МНС) I класса или - удлиненные версии упомянутых пептидов - с МНС II класса.
В настоящем изобретении термин «гомологичный» относится к степени идентичности (см. выше, Процентная доля идентичности) между последовательностями двух аминокислотных последовательностей, т.е. пептидных или полипептидных последовательностей. Упомянутая ранее «гомология» определяется при сравнении двух последовательностей, сопоставляемых в оптимальных условиях для сравниваемых последовательностей. Такая гомология последовательностей может быть подсчитана с помощью создания выравнивания, например, по алгоритму ClustalW. Широко распространено программное обеспечение для анализа последовательностей, в частности, Vector NTI, GENETYX или другие инструменты, предоставляемые банками данных свободного доступа.
Специалист данной области будет в состоянии оценить, будут ли Т-клетки, индуцированные вариантом конкретного пептида, способны к перекрестной реакции с самим пептидом (Аррау et al., 2006; Colombetti et al., 2006; Fong et al., 2001; Zaremba et al., 1997).
Под «вариантом» данной аминокислотной последовательности авторы изобретения имеют в виду, что боковые цепи, например, одного или двух аминокислотных остатков, изменены (например, при их замещении боковой цепью другого встречающегося в природе аминокислотного остатка или какой-либо другой боковой цепью), так что пептид по-прежнему способен связываться с молекулой HLA по существу таким же путем, как и пептид, состоящий из данной аминокислотной последовательности с SEQ ID NO: 1 по SEQ ID NO: 110. Например, пептид может быть модифицирован таким образом, что он по меньшей мере сохранит, если не улучшит, способность взаимодействовать и связываться со связывающей бороздкой подходящей молекулы МНС, такой как HLA-A*02 или -DR, и, таким образом, он по меньшей мере сохранит, если не улучшит, способность связываться с ТКР активированных Т-клеток.
Данные Т-клетки могут затем вступать в перекрестную реакцию с клетками и уничтожать клетки, которые экспрессируют полипептид, который содержит природную аминокислотную последовательность родственного пептида, как определено в аспектах этого изобретения. По информации из научной литературы и банков данных (Rammensee et al., 1999; Godkin et al., 1997), конкретные позиции связывающихся с HLA пептидов являются типичными якорными остатками, формирующими центральную последовательность, подходящую к соединительному элементу рецептора HLA, который определяется полярными, электрофизическими, гидрофобными и пространственными свойствами полипептидных цепей, образующих связывающую бороздку. Так, специалист данной области будет в состоянии модифицировать аминокислотные последовательности с SEQ ID NO: 1 по SEQ ID NO: 110, сохраняя известные якорные остатки, и будет в состоянии определить, сохранят ли такие варианты способность связываться с молекулами МНС I или II класса. Варианты по настоящему изобретению сохраняют способность связываться с ТКР активированных Т-клеток, которые могут впоследствии вступать в перекрестную реакцию и уничтожать клетки, экспрессирующие полипептид, который содержит природную аминокислотную последовательность родственного пептида, как определено в аспектах настоящего изобретения.
Исходные (немодифицированные) пептиды, раскрываемые в данном описании, могут быть модифицированы путем замены одного или нескольких остатков в различных, возможно отобранных, участках по длине пептидной цепи, если не заявлено иное. Предпочтительно, если такие замены расположены на конце аминокислотной цепи. Такие замены могут носить консервативный характер, например, когда одна аминокислота заменяется аминокислотой с похожей структурой и характеристиками, так же как при замене гидрофобной аминокислоты на другую гидрофобную аминокислоту. Еще более консервативной будет замена аминокислот одинакового или похожего размера и химического характера, как, например, при замене лейцина на изолейцин. В исследованиях вариаций последовательностей внутри семейств встречающихся в природе гомологичных белков определенные замены аминокислот допускаются чаще, чем другие, и они часто связаны со сходствами по размеру, заряду, полярности и гидрофобности между исходной аминокислотой и ее заменой; и таковой является основа определения «консервативных замен».
Консервативные замены определены в контексте настоящего описания как обмены внутри одной из последующих пяти групп: группа 1 - малые, алифатические, неполярные или слабо полярные остатки (Ala, Ser, Thr, Pro, Gly); группа 2 - полярные, отрицательно заряженные остатки и их амиды (Asp, Asn, Glu, Gln); группа 3 - полярные, положительно заряженные остатки (His, Arg, Lys); группа 4 - крупные, алифатические, неполярные остатки (Met, Leu, Ile, Val, Cys); и группа 5 - крупные, ароматические остатки (Phe, Tyr, Trp).
Менее консервативные замены могут охватывать замену одной аминокислоты другой, имеющей похожие характеристики, но отличающейся в какой-то степени по размеру, как в случае замены аланина остатком изолейцина. Высоко неконсервативные замены могут охватывать замену кислой аминокислоты полярной, или даже такой, которая имеет основный характер. Такие «радикальные» замены не могут, однако, быть отвергнуты как потенциально неэффективные из-за того, что химические эффекты не полностью предсказуемы, и радикальные замены могут неожиданно привести к благоприятным эффектам, не предсказуемым исходя из обычных химических принципов.
Разумеется, в таких заменах могут участвовать другие структуры, отличающиеся от обычных L-аминокислот. Таким образом, D-аминокислоты могут быть заменены L-аминокислотами, обычно встречающимися в антигенных пептидах по изобретению и также охватываемые настоящим раскрытием сущности изобретения. Кроме того, нестандартные аминокислоты (т.е. отличающиеся от повсеместно встречающихся протеиногенных аминокислот) могут быть также использованы в целях замены для получения иммуногенов и иммуногенных полипептидов в соответствии с настоящим изобретением.
Если были произведены замены в более чем одной позиции с получением пептида с по существу эквивалентной или большей антигенной активностью, как определено ниже, то комбинации таких замен будут проанализированы для определения того, приведут ли эти комбинации замен к дополнительным или синергическим эффектам по отношению к антигенности пептида. По большей части не более 4 позиций внутри пептида должны замещаться одновременно.
Пептид, состоящий по существу из аминокислотной последовательности, как указано в настоящей заявке, может иметь замену одной или двух неякорных аминокислот (см. ниже относительно якорного мотива), так что способность связываться с молекулой главного комплекса гистосовместимости человека (МНС) I или II класса не будет существенно изменена или подвергнута негативному влиянию по сравнению с немодифицированным пептидом. В другом варианте осуществления в пептиде, состоящем, по существу, из аминокислотной последовательности, как указано в настоящей заявке, одна или две аминокислоты могут быть заменены партнерами по консервативной замене (см. информацию ниже), так что способность связываться с молекулой главного комплекса гистосовместимости человека (МНС) I или II класса не будет существенно изменена или подвергнута негативному влиянию по сравнению с немодифицированным пептидом.
Аминокислотные остатки, которые не вносят существенный вклад во взаимодействие с Т-клеточным рецептором, могут быть модифицированы заменой на другую аминокислоту, включение которой существенно не влияет на реактивность Т-клетки и не устраняет связывание с соответствующим МНС. Таким образом, помимо данного условия, пептид по изобретению может быть любым пептидом (в этот термин авторы изобретения включают олигопептиды или полипептиды), который включает аминокислотные последовательности или их участок или их вариант, как дано.




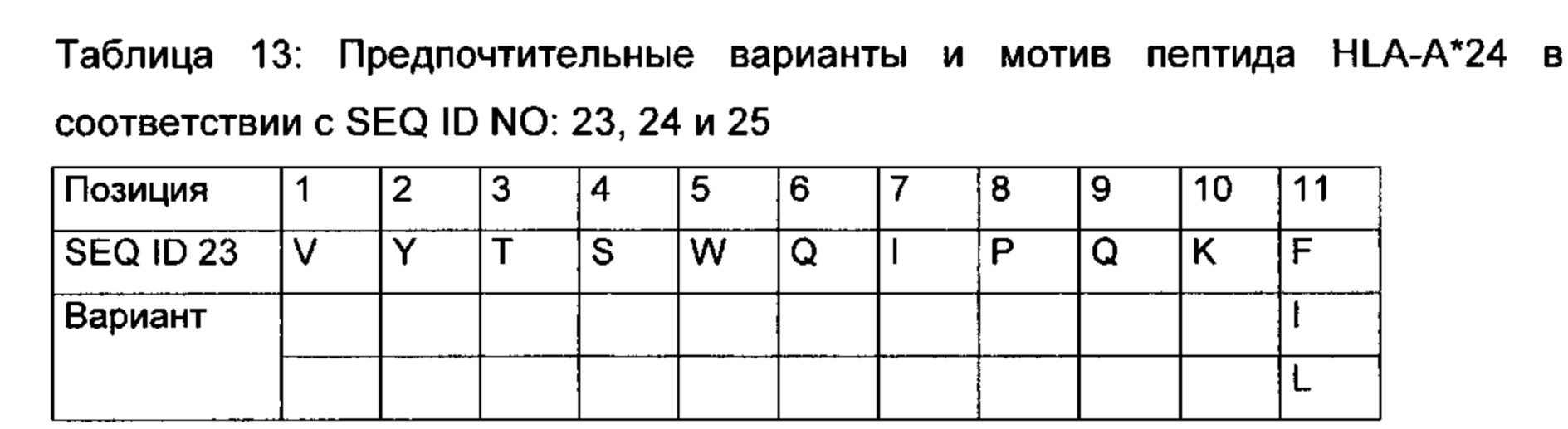

Более длинные (удлиненные) пептиды также могут быть пригодными. Возможно, чтобы эпитопы, связывающиеся с молекулами МНС I класса, хотя они обычно имеют длину между 8 и 11 аминокислотами, были получены при процессинге пептидов из более длинных пептидов или белков, включающих истинный эпитоп. Предпочтительно, чтобы остатки, которые примыкают к истинному эпитопу, существенно не влияли на протеолитическое расщепление, необходимое для презентации истинного эпитопа во время процессинга.
Пептиды по изобретению могут быть удлинены с помощью вплоть до четырех аминокислот, это значит, что 1, 2, 3 или 4 аминокислоты могут быть добавлены к одному из концов в любой комбинации, представленной между 4:0 и 0:4. Комбинации элонгации в соответствии с изобретением могут быть взяты из Таблицы 14.


Аминокислотами для элонгации/удлинения могут быть пептиды исходной последовательности белка или любая(ые) другая(ие) аминокислота(ы). Элонгация может быть использована для повышения стабильности или растворимости пептидов.
Таким образом, эпитопы настоящего изобретения могут быть идентичны встречающимся в природе опухолеассоциированным или опухолеспецифическим эпитопам или могут включать эпитопы, отличающиеся не более чем четырьмя остатками от контрольного пептида, при условии, что они имеют, по существу, идентичную антигенную активность.
В альтернативном варианте осуществления пептид удлинен с одной или другой стороны или с двух сторон одновременно добавлением более 4 аминокислот, предпочтительно, до общей длины вплоть до 30 аминокислот. Это может привести к образованию пептидов, связывающихся с МНС II класса. Связывание с МНС II класса может быть проверено известными из уровня техники способами.
Соответственно, в настоящем изобретении предлагаются пептидные эпитопы и эпитопы пептидных вариантов, связывающихся с молекулами МНС I класса, в которых указанный пептид или вариант имеет общую длину между 8 и 100, предпочтительно между 8 и 30, и, наиболее предпочтительно, между 8 и 14, а именно 8, 9, 10, 11, 12, 13, 14 аминокислот, в случае удлиненных пептидов, связывающихся с молекулами МНС II класса, длина может также быть 15, 16, 17, 18, 19, 20, 21 или 22 аминокислоты.
Разумеется, пептид или вариант в соответствии с настоящим изобретением будет обладать способностью связываться с молекулой главного комплекса гистосовместимости человека (МНС) I или II класса. Связывание пептида или варианта с комплексом МНС может быть проверено способами, известными из уровня техники.
Предпочтительно, чтобы Т-клетки, специфичные для пептида в соответствии с настоящим изобретением были испытаны относительно замещенных пептидов; концентрация пептида, при которой замещенные пептиды достигают половины максимального роста лизиса относительно фона, составляет не более чем около 1 мМ, предпочтительно, не более чем около 1 мкМ, более предпочтительно, не более чем около 1 нМ, и еще более предпочтительно не более чем около 100 пМ и, наиболее предпочтительно, не более чем около 10 пМ. Также предпочтительно, чтобы замещенный пептид распознавался Т-клетками более чем одного индивида, по меньшей мере двух и, более предпочтительно, трех индивидов.
В особенно предпочтительном варианте осуществления изобретения пептид состоит или по существу состоит из аминокислотной последовательности в соответствии с SEQ ID NO: 1 по SEQ ID NO: 110.
«Состоит по существу из» подразумевает, что пептид в соответствии с настоящим изобретением, помимо любой из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 110, или его вариант, содержит дополнительные находящиеся на N- и/или С-конце фрагменты последовательности аминокислот, которые не являются обязательно формирующими часть пептида, которая функционирует как эпитоп для молекул МНС.
Тем не менее, эти фрагменты могут быть важны для обеспечения эффективного введения пептида в соответствии с настоящим изобретением в клетки. В одном варианте осуществления настоящего изобретения пептид является частью слитого белка, которая включает, например, 80 N-терминальных аминокислот антиген-ассоциированной инвариантной цепи (p33, в дальнейшем "Ii") HLA-DR, как взятый из банка данных NCBI, инвентарный номер - GenBank Accession-number Х00497. В других видах слияния пептиды по настоящему изобретению могут быть слиты с антителом, описанным в настоящем документе, или его функциональной частью, в частности встроены в последовательность антитела, так чтобы быть специфической мишенью указанного антитела, или, например, слиты с или встроены в антитело, являющееся специфичным для дендритных клеток, описанных в настоящей заявке.
Кроме того, пептид или вариант может быть дополнительно модифицирован для улучшения стабильности и/или связывания с молекулами МНС в целях получения более сильного иммунного ответа. Методы такой оптимизации пептидной последовательности хорошо известны из уровня техники и включают, например, введение реверсированных пептидных или непептидных связей.
В реверсированной пептидной связи аминокислотные остатки присоединены не пептидными связями (-CO-NH-), а пептидная связь реверсируется. Такие ретро-обратные пептидомиметики могут быть получены методами, известными из уровня техники, например, такими, как описано в работе Meziere и соавт. (1997) (Meziere et al., 1997), включенной в настоящее описание по ссылке. Этот подход охватывает получение псевдопептидов, которые содержат изменения, охватывающие остов, но не ориентацию боковых цепей. Meziere и соавт. (Meziere et al., 1997) показывают, что эти псевдопептиды пригодны для связывания с МНС и индукции ответов Т-хелперных клеток.. Ретро-обратные пептиды, которые содержат связи NH-CO вместо пептидных связей CO-NH, намного более устойчивы к протеолизу.
Непептидной связью является, например, -СН2-NH, -CH2S-, -СН2СН2-, -СН=СН-, -СОСН2-, -СН(ОН)СН2- и -CH2SO-. В патенте США №4897445 предлагается метод твердофазного синтеза непептидных связей (-CH2-NH) в полипептидных цепях, который включает полипептиды, синтезированные с использованием стандартной методики, и непептидную связь, синтезированную при реакции аминоальдегида и аминокислоты в присутствии NaCNBH3.
Пептиды, включающие последовательности, описанные выше, могут быть синтезированы с дополнительными химическими группами, находящимися на их аминном и/или карбоксильном концах, для увеличения стабильности, биологической доступности и/или аффинности пептидов. Например, гидрофобные группы, такие как карбобензоксильные, данзильные или трет-бутилоксикарбонильные группы, могут быть добавлены к аминным концам пептидов. Подобным образом, ацетильная группа или 9-флуоренилметокси-карбонильная группа может быть размещена на аминных концах пептидов. Кроме того, гидрофобная группа, трет-бутилоксикарбонильная или амидная группа может быть добавлена к карбоксильным концам пептидов.
Кроме того, все пептиды по изобретению могут быть синтезированы в целях изменения их пространственной конфигурации. Например, может быть использован D-изомер одного или нескольких аминокислотных остатков пептида, а не обычный L-изомер. Более того, по меньшей мере один из аминокислотных остатков пептидов по изобретению может быть замещен одним из хорошо известных не встречающихся в природе аминокислотных остатков. Изменения, такие как данные, могут служить для повышения стабильности, биологической доступности и/или связывающих свойств пептидов по изобретению.
Подобным образом, пептид или вариант по изобретению может быть модифицирован химическим способом посредством реакции отдельных аминокислот как до, так и после синтеза пептида. Примеры таких модификаций хорошо известны из уровня техники и обобщаются, например, в работе R. Lundblad, Chemical Reagents for Protein Modification, 3rd ed. CRC Press, 2004 (Lundblad, 2004), которая включена в описание по ссылке. Химическая модификация аминокислот включает, но без ограничения, модификацию с помощью ацилирования, амидинирования, пиридоксилирования лизина, восстановительного алкилирования, тринитробензилирования аминных групп 2,4,6-тринитробензолсульфоновой кислотой (TNBS), амидную модификацию карбоксильных групп и сульфгидрильную модификацию с помощью окисления надмуравьиной кислотой цистеина до цистеиновой кислоты, образование производных ртути, образование смешанных дисульфидов с другими тиоловыми соединениями, реакцию с малеимидом, карбоксиметилирование йодоуксусной кислотой или йодацетамидом и карбамоилирование цианатом при щелочном уровне pH, хотя не ограничиваясь ими. В этой связи специалист данной области может проконсультироваться с главой 15 в работе Current Protocols In Protein Science, Eds. Hassan и соавт. (John Wiley and Sons NY 1995-2000) (Coligan et al., 1995) для получения более обширной информации о методах, связанных с химической модификацией белков.
Вкратце, модификация, например, аргинильных остатков в белках часто основана на реакции вицинальных дикарбонильных соединений, таких как фенилглиоксаль, 2,3-бутандион и 1,2-циклогександион, с образованием аддукта. Другим примером является реакция метилглиоксаля с остатками аргинина. Цистеин может быть модифицирован без сопутствующей модификации других нуклеофильных сайтов, таких как лизин и гистидин. В результате для модификации цистеина доступно большое число реагентов. Веб-сайты компаний, таких как Sigma-Aldrich (http://www.sigma-aldrich.com), предоставляют информацию по конкретным реагентам.
Распространено также избирательное восстановление дисульфидных связей в белках. Дисульфидные связи могут быть образованы и окислены во время тепловой обработки биофармацевтических средств. К-реагент Вудворда может использоваться для модификации определенных остатков глютаминовой кислоты. N-(3-(диметиламинопропил)-N'-этилкарбодиимид может использоваться для образования внутримолекулярных поперечных связей между остатком лизина и остатком глютаминовой кислоты. Например, диэтилпирокарбонат является реагентом для модификации гистидильных остатков в белках. Гистидин может также быть модифицирован при использовании 4-гидрокси-2-ноненаля. Реакция остатков лизина и других альфа-аминных групп полезна, например, при связывании пептидов с поверхностями или поперечной сшивке белков/пептидов. Лизин является сайтом присоединения полиэтиленгликоля и основным сайтом модификации при гликозилировании белков. Остатки метионина в белках могут быть модифицированы, например, с помощью йодацетамида, бромэтиламина и хлорамина Т.
Тетранитрометан и N-ацетилимидазол могут быть использованы для модификации тирозильных остатков. Поперечная сшивка посредством образования дитирозина может быть произведена с помощью перекиси водорода/ионов меди.
В последних исследованиях по модификации триптофана использовались N-бромсукцинимид, 2-гидрокси-5-нитробензилбромид или 3-бром-3-метил-2-(2-нитрофенилмеркапто)-3H-индол (BPNS-скатол).
Успешная модификация терапевтических белков и пептидов ПЭГ (полиэтиленгликолем) часто связана с увеличением полупериода циркуляции, тогда как поперечная сшивка белков глутаральдегидом, полиэтиленгликоль-диакрилатом и формальдегидом используется для получения гидрогелей. Химическая модификация аллергенов для иммунотерапии часто достигается при карбамоилировании цианатом калия.
Пептид или вариант, в котором пептид модифицирован или включает непептидные связи, является предпочтительным вариантом осуществления изобретения. Как правило, пептиды и варианты (по меньшей мере те, что содержат пептидные связи между аминокислотными остатками) могут быть синтезированы Fmoc-полиамидным способом твердофазного синтеза пептидов, как раскрыто у Lukas и соавт. (Lukas et al., 1981) и в прилагающихся ссылках. Временная защита N-аминогруппы производится 9-флуоренилметилоксикарбонильной (Fmoc) группой. Повторное расщепление этой высоко щелочелабильной защитной группы осуществляется при использовании 20% пиперидина в N, N-диметилформамиде. Функциональные группы боковой цепи могут быть защищены получением таких соединений, как их бутиловые эфиры (в случае серина, треонина и тирозина), бутиловые сложные эфиры (в случае глютаминовой кислоты и аспарагиновой кислоты), бутилоксикарбонильное производное (в случае лизина и гистидина), тритильное производное (в случае цистеина) и производное 4-метокси-2,3,6-триметилбензолсульфонила (в случае аргинина). Если глютамин или аспарагин являются C-терминальными остатками, для защиты амидогруппы боковой цепи используется 4,4'-диметоксибензгидрильная группа. Твердофазный носитель основан на полимере полидиметилакриламиде, состоящем из трех мономеров: диметилакриламида (каркасный мономер), бис-акрилоилэтилендиамина (компонент для перекрестной сшивки, линкер) и метилового эфира акрилоилсаркозина (функционализирующий агент). Для образования легкорасщепляемой связи пептида и смолы используется нестойкое к действию кислот производное 4-гидроксиметилфеноксиуксусной кислоты. Все аминокислотные производные добавляются в виде предварительно синтезированных симметричных ангидридных производных за исключением аспарагина и глютамина, которые добавляются с применением обратной реакции соединения, опосредованной N, N-дициклогексилкарбодиимид/1-гидроксибензотриазолом. Все реакции сочетания и снятия защитных групп отслеживались с помощью методов контроля с применением нингидрина, тринитробензолсульфоновой кислоты или изотина. После завершения синтеза пептиды отщепляются от смолы-носителя с сопутствующим удалением защитных групп боковой цепи при обработке 95% трифторуксусной кислотой, содержащей 50% смеси поглотителей. Обычно используемые поглотители включают этандитиол, фенол, анизол и воду, окончательный выбор зависит от составляющих аминокислот синтезируемого пептида. Также возможна комбинация твердофазных и жидкофазных методов синтеза пептидов (см., например, (Bruckdorfer et al., 2004), и прилагаемые ссылки).
Трифторуксусную кислоту удаляют выпариванием в вакууме с последующим измельчением с диэтиловым эфиром для получения сырого пептида. Любые присутствующие поглотители удаляются простой технологией экстракции, которая позволяет получить сырой пептид без поглотителей после лиофилизации водной фазы. Реагенты для синтеза пептидов, как правило, имеются в наличии, например, в Calbiochem-Novabiochem (Ноттингем, Великобритания).
Очистка может быть произведена любой методикой или комбинацией таких методик как перекристаллизация, эксклюзионная хроматография, ионообменная хроматография, хроматография гидрофобного взаимодействия и (обычно) обращено-фазовая высокоэффективная жидкостная хроматография с использованием, к примеру, градиентного разделения в системе ацетонитрил/вода.
Анализ пептидов может быть произведен при помощи тонкослойной хроматографии, электрофореза, в частности капиллярного электрофореза, твердофазной экстракции (ТФЭ), обращено-фазовой высокоэффективной жидкостной хроматографии, аминокислотного анализа после кислотного гидролиза и масс-спектрометрического анализа при бомбардировке быстрыми атомами (FAB), а также масс-спектрометрического анализа MALDI и ESI-Q-TOF.
В целях выбора презентируемых в избытке пептидов был рассчитан профиль презентации, позволяющий оценить медианное значение презентации образца, а также вариации повторных измерений. В профиле сравниваются образцы опухолевой формы, представляющей интерес, с фоновым уровнем образцов нормальной ткани. Каждый из этих профилей может быть затем консолидирован в показатель избыточной презентации путем расчета значения p по линейной модели со смешанными эффектами (Pinheiro et al., 2015), скорректировав ее для повторных анализов на уровень ложноположительных результатов (Benjamini and Hochberg, 1995).
Для идентификации и относительной количественной оценки лигандов HLA с помощью масс-спектрометрического анализа молекулы HLA из подвергнутых шоковой заморозке образцов тканей были очищены и из них выделены HLA-ассоциированные пептиды. Выделенные пептиды были разделены и последовательности были идентифицированы с помощью методов жидкостной хроматографии и масс-спектрометрии (LC-MS) с ионизацией электрораспылением (nanoESI) в режиме реального времени. Полученные пептидные последовательности подтверждали сравнением картины фрагментации природных пептидов TUMAP, записанной на образцах рака легких (НМРЛ) (N=91 А*02-положительный образец и N=80 А*24-положительных образца), с картинами фрагментации соответствующих синтетических контрольных пептидов с идентичными последовательностями. Поскольку пептиды были идентифицированы непосредственно в качестве лигандов молекул HLA первичных опухолей, то эти результаты дают прямое доказательство естественного процессирования и презентации идентифицированных пептидов на ткани первичной раковой опухоли, полученной от 155 пациентов с раком легких (НМРЛ).
Технологическая платформа лекарственных средств, находящихся в разработке, XPRESIDENT® v2.1 (см., например, патентную заявку США 2013-0096016, включенную в настоящее описание в своей полноте путем ссылки) позволяет произвести идентификацию и выбор соответствующих избыточно презентируемых пептидов в качестве кандидатов для вакцины, основываясь на прямом относительном количественном определении уровней HLA-рестриктированных пептидов на раковой ткани в сравнении с несколькими различными нераковыми тканями и органами. Это было осуществлено путем разработки дифференциального количественного определения на основе данных ЖХ-МС без использования изотопной метки (label-free), обработанных запатентованной технологической платформой для анализа данных, объединяющей алгоритмы для идентификации последовательности, спектральной кластеризации, подсчета ионов, выравнивания времени удерживания, деконволюции по состояниям заряда и нормализации.
Для каждого пептида и образца были подсчитаны уровни презентации, включающие оценки погрешности. Были идентифицированы пептиды, презентируемые исключительно на опухолевой ткани, и пептиды, избыточно презентируемые на опухолевых тканях в сравнении с не пораженными раком тканями и органами.
Комплексы HLA-пептид из образцов опухолевой ткани рака легких (НМРЛ) были очищены; HLA-ассоциированные пептиды были выделены и проанализированы методом ЖХ-МС (см. примеры). Все TUMAP, содержащиеся в настоящей патентной заявке, были идентифицированы с помощью этого подхода на образцах первичного рака легких (НМРЛ), что подтверждает их презентацию на клетках первичного рака легких (НМРЛ).
Пептиды TUMAP, идентифицированные на многочисленных образцах рака легких (НМРЛ) и нормальных тканей, были подвергнуты количественному анализу с помощью ЖХ/МС без изотопной метки, с использованием подсчета ионов. Метод основан на предположении, что площади пика пептида при анализе методом ЖХ/МС коррелируют с его содержанием в образце. Все количественные сигналы пептида в различных экспериментах с использованием ЖХ/МС были нормализованы, исходя из основной тенденции, было вычислено их среднее значение на образец, и сведены в гистограмму в т.н. профиль презентации. В профиле презентации консолидированы различные методы анализа, такие как поиск в банке данных белков, спектральная кластеризация, деконволюция состояния заряда (разряд) и выравнивание времени удерживания и нормализация.
Кроме того, технологическая платформа XPRESIDENT® v2.x позволяет поведение прямого абсолютного количественного определения уровня МНС-, предпочтительно HLA-рестриктированного, пептида на раковых или других пораженных заболеванием тканях. Вкратце, общее число клеток было подсчитано из общего содержания ДНК проанализированного образца ткани. Общее количество пептида TUMAP в образце ткани измеряли с помощью наноЖХ-МС/МС в виде соотношения природного пептида TUMAP и известного количества версии пептида TUMAP с изотопной меткой, так называемого внутреннего стандарта. Эффективность выделения пептида TUMAP определяли методом введения стандартной добавки комплекса пептид-МНС всех выбранных пептидов TUMAP в лизат ткани в самый ранний возможный момент процесса выделения пептида TUMAP и их обнаружением с помощью наноЖХ-МС/МС, за чем следовало завершение процедуры выделения пептида. Общее число клеток и общее количество пептида были подсчитаны по трем повторным измерениям на образец ткани. Пептид-специфическую эффективность выделения подсчитывали как средний показатель из 10 экспериментов с введением стандартных добавок с тремя повторными измерениями для каждого (см. примеры и Таблицу 22).
В настоящем изобретении предложены пептиды, которые пригодны для лечения раковых заболеваний/опухолей, предпочтительно рака легких, клетки которых презентируют в избытке или исключительно пептиды по изобретению. Как показал масс-спектрометрический анализ, эти пептиды естественно презентировались молекулами HLA на образцах первичного рака легких (НМРЛ) человека.
Многие из исходных генов/белков (называемых также «белками полной длины» или «базовыми белками»), из которых были получены пептиды, были в высокой степени избыточно экспрессированы в клетках рака по сравнению с нормальными тканями - понятие «нормальные ткани» в связи с настоящим изобретением подразумевает здоровые клетки легких или другие нормальные клетки ткани, демонстрирующие высокую степень ассоциации исходных генов с опухолью (см. Пример 2). Более того, сами пептиды в высшей степени избыточно презентируются на опухолевой ткани - понятие «опухолевая ткань» в связи с настоящим изобретением подразумевает образец ткани пациента, страдающего от рака легких (НМРЛ), но не на нормальных тканях (см. Пример 1).
Связанные с HLA пептиды могут распознаваться иммунной системой, конкретно Т-лимфоцитами. Т-клетки могут разрушать клетки, презентирующие распознанный комплекс HLA/пептид; к примеру, клетки рака легких, презентирующие полученные пептиды.
Было показано, что пептиды по настоящему изобретению способны стимулировать Т-клеточные ответы и/или избыточно презентируются и, поэтому, могут использоваться для получения антител и/или ТКР, такие как растворимые ТКР, в соответствии с настоящим изобретением (см. Пример 3, Пример 4). Кроме того, пептиды, если находятся в комплексе с соответствующей молекулой МНС, могут быть использованы для получения антител, их специфично связывающихся фрагментов, связывающихся по принципу антител, и/или ТКР, в частности растворимых ТКР, в соответствии с настоящим изобретением. Соответствующие способы хорошо известны специалисту данной области, а также могут быть найдены в соответствующих литературных источниках Таким образом, пептиды по настоящему изобретению пригодны для генерирования иммунного ответа в организме пациента для уничтожения опухолевых клеток. Иммунный ответ у пациента может быть индуцирован при непосредственном введении описанных пептидов или подходящих веществ-предшественников (к примеру, удлиненных пептидов, белков или нуклеиновых кислот, кодирующих эти пептиды) пациенту, в идеальном случае в комбинации с веществом, усиливающим иммуногенность (т.е. адъювантом). Можно ожидать, что иммунный ответ, вызванный такой терапевтической вакцинацией, будет высоко специфично направлен против опухолевых клеток, так как целевые пептиды по настоящему изобретению не презентируются на нормальных тканях в сравнимом количестве копий, предотвращая, тем самым, риск нежелательных аутоиммунных реакций против нормальных клеток у пациента.
В другом аспекте изобретения предложен способ получения растворимого Т-клеточного рецептора (ТКР), распознающего конкретный комплекс пептида и МНС. Такие растворимые Т-клеточные рецепторы могут быть получены из специфических Т-клеточных клонов, и их аффинность может быть повышена за счет мутагенеза, направленного на определяющие комплементарность участки. Для выбора Т-клеточного рецептора может использоваться фаговое отображение (заявка США 2010/0113300, (Liddy et al., 2012)). В целях стабилизации Т-клеточных рецепторов в процессе фагового отображения и в случае практического применения в качестве лекарственного средства альфа- и бета-цепи могут быть связаны, например, посредством не встречающихся в природе дисульфидных связей, других ковалентных связей (одноцепочечный Т-клеточный рецептор) или с помощью доменов димеризации (Boulter et al., 2003; Card et al., 2004; Willcox et al., 1999). В целях выполнения определенных функций на клетках-мишенях Т-клеточный рецептор может быть связан с токсинами, лекарственными средствами, цитокинами (см., например, заявку США 2013/0115191) и доменами, рекрутирующими эффекторные клетки, такими как анти-CD3 домен, и т.д. Более того, он может быть экспрессирован на Т-клетках, используемых для адоптивного переноса. Дополнительную информацию можно найти в патентных заявках WO 2004/033685А1 и WO 2004/074322 А1. Комбинация растворимых ТКР описывается в патентной заявке WO 2012/056407 А1. Дополнительные способы получения описаны в патентной заявке WO 2013/057586 А1.
«Фармацевтическая композиция» является композицией, подходящей для введения человеку в рамках лечения. Предпочтительно, если фармацевтическая композиция является стерильной и произведена в соответствии с правилами GMP (надлежащей производственной практики).
Фармацевтические композиции включают пептиды как в свободной форме, так и в форме фармацевтически приемлемой соли (см. также выше). Используемое в контексте данного изобретения понятие «фармацевтически приемлемая соль» относится к производным раскрытых пептидов, причем пептид модифицирован путем получения кислых или основных солей вещества. Например, кислые соли получают из свободного основания (как правило, где нейтральная форма лекарственного средства имеет нейтральную группу -NH2) с применением реакции с подходящей кислотой. Подходящие кислоты для получения кислых солей включают как органические кислоты, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфокислоту, салициловую кислоту и подобные, так и неорганические кислоты, например, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и тому подобные. И наоборот, приготовление основных солей кислотных компонентов, которые могут присутствовать на пептиде, производится при использовании фармацевтически приемлемого основания, такого как гидроксид натрия, гидроксид калия, гидроксид аммония, гидроксид кальция, триметиламин и тому подобных.
В одном особенно предпочтительном варианте осуществления фармацевтические композиции включают пептиды в виде солей уксусной кислоты (ацетаты), трифторацетатов или соляной кислоты (хлориды).
Предпочтительно, если медикамент по настоящему изобретению является иммунотерапевтическим препаратом, таким как вакцина. Она может вводиться непосредственно пациенту, в пораженный орган или системно в/к, в/м, п/к, в/б и в/в или вноситься ex vivo в клетки, полученные от пациента, или в человеческую клеточную линию, которые затем могут вводиться пациенту или использоваться in vitro для селекции субпопуляции из иммунных клеток, полученных от пациента, которые после этого вновь вводятся пациенту. Если нуклеиновая кислота введена в клетки in vitro, то может быть полезно, чтобы клетки были трансфицированными, чтобы совместно экспрессировать иммуностимулирующие цитокины, такие как интерлейкин-2. Пептид может быть по существу чистым или в комбинации с иммуностимулирующим адъювантом (см. ниже) или использоваться в комбинации с иммуностимулирующими цитокинами или же вводиться с подходящей системой доставки, например, липосомами. Пептид может быть также конъюгирован с подходящим носителем, таким как гемоцианин фиссуреллы (KLH) или маннан (см. WO 95/18145 и (Longenecker et al., 1993)). Пептид может быть также меченым или может быть слитым белком или гибридной молекулой. Пептиды, последовательность которых дана в настоящем изобретении, как ожидается, стимулируют CD4+ или CD8+ Т-клетки. Тем не менее, стимуляция CD8 Т-клеток более эффективна в присутствии поддержки, предоставляемой CD4 хелперными Т-клетками. Таким образом, для эпитопов МНС I класса, которые стимулируют CD8 Т-клетки, партнеры в слиянии или участки гибридной молекулы надлежащим образом предоставляют эпитопы, которые стимулируют CD4-положительные Т-клетки. CD4- и CD8-стимулирующие эпитопы хорошо известны из уровня техники и включают те, что были идентифицированы в настоящем изобретении.
В одном аспекте вакцина включает по меньшей мере один пептид, имеющий аминокислотную последовательность с SEQ ID No. 1 по SEQ ID No 110, и по меньшей мере один дополнительный пептид, предпочтительно от двух до 50, более предпочтительно от двух до 25, еще более предпочтительно от двух до 20 и, наиболее предпочтительно, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать или восемнадцать пептидов. Пептид(ы) может(могут) быть получен(ы) из одного или более специфических ТАА и может(могут) связываться с молекулами МНС I класса.
В еще одном аспекте изобретения предлагается нуклеиновая кислота (например, полинуклеотид), кодирующая пептид или вариант пептида по изобретению. Полинуклеотид может быть, например, ДНК, кДНК, ПНК, РНК или их комбинациями, как одно-, так и/или двухнитевыми; природными или стабилизированными формами полинуклеотидов, такими как, например, полинуклеотиды с фосфоротиоатным остовом, и может содержать или не содержать интроны при условии, что полинуклеотид кодирует пептид. Разумеется, только пептиды, которые содержат встречающиеся в природе аминокислотные остатки, присоединенные встречающимися в природе пептидными связями, могут кодироваться полинуклеотидом. В другом аспекте изобретения предложен вектор экспрессии, способный экспрессировать полипептид в соответствии с изобретением.
Был разработан ряд способов связывания полинуклеотидов, в особенности ДНК, с векторами, например, с помощью комплементарных липких концов. К примеру, к сегменту ДНК могут быть добавлены комплементарные гомополимерные хвосты для встраивания в векторную ДНК. Этот вектор и сегмент ДНК в таком случае соединены водородной связью между комплементарными гомополимерными хвостами, образуя молекулы рекомбинантной ДНК.
Синтетические линкеры, содержащие один или несколько сайтов рестрикции, обеспечивают альтернативный способ присоединения сегмента ДНК к векторам. Синтетические линкеры, содержащие ряд сайтов распознавания рестрикционной эндонуклеазы, имеются в продаже в различных источниках, включая International Biotechnologies Inc, Нью-Хейвен, Коннектикут, США.
Желательный способ модификации ДНК, кодирующей полипептид по изобретению, - это использование полимеразной цепной полимеразы, как раскрыто в работе Saiki RK и соавт. (Saiki et al., 1988). Этот способ может быть использован для введения ДНК в подходящий вектор, например, при конструировании в подходящих сайтах рестрикции, или же он может быть использован для модификации ДНК другими пригодными путями, известными из уровня техники. Если используются вирусные векторы, то предпочтительными являются поксвирусные или аденовирусные векторы.
Затем ДНК (или в случае ретровирусных векторов РНК) может экспрессироваться в подходящем хозяине для получения полипептида, включающего пептид или вариант по изобретению. Таким образом, ДНК, кодирующая пептид или вариант по изобретению, может быть использована в соответствии с известными методиками, модифицированными соответствующим образом с учетом раскрытых в данном описании идей, для конструирования вектора экспрессии, который затем используется для трансформации подходящей клетки-хозяина для экспрессии и получения полипептида по изобретению. Такие методики включают те, что раскрыты, например, в патентах США №№4440859, 4530901, 4582800, 4677063, 4678751, 4704362, 4710463, 4757006, 4766075 и 4810648
ДНК (или в случае ретровирусных векторов - РНК), кодирующая полипептид, представляющий собой соединение по изобретению, может быть присоединена к обширному ряду других последовательностей ДНК для введения в соответствующего хозяина. ДНК-спутник будет зависеть от природы хозяина, способа введения ДНК хозяину и от того, желательно ли поддержание в эписомальной или интеграционной форме.
Как правило, ДНК вводится в вектор экспрессии, такой как плазмида, с соответствующей ориентацией и правильной рамкой считывания для экспрессии. Если необходимо, то ДНК может быть соединена с соответствующими нуклеотидными последовательностями, обеспечивающими координацию транскрипции и трансляции, распознаваемыми желательным хозяином, хотя такие контрольные элементы обычно имеются в векторе экспрессии. Вектор вводится затем хозяину стандартными способами. Как правило, не все хозяева трансформируются вектором. Поэтому будет необходимо выделить трансформированные клетки-хозяева. Одна из методик отбора включает введение в вектор экспрессии последовательности ДНК с любыми необходимыми элементами контроля, которая кодирует выбранный признак в трансформированной клетке, такой как устойчивость к антибиотикам.
В качестве альтернативы ген для такого выбираемого признака может быть на другом векторе, который используется для совместной трансформации желаемой клетки-хозяина.
Клетки-хозяева, которые были трансформированы рекомбинантной ДНК по изобретению, культивируют затем в течение достаточного времени и при соответствующих условиях, известных специалистам данной области, с учетом раскрытых в данном описании идей, что ведет к экспрессии полипептида, который после этого может быть выделен.
Известно множество систем экспрессии, включающих бактерии (например, Е. coli и Bacillus subtilis), дрожжи (например, Saccharomyces cerevisiae), мицелиальные грибы (например, Aspergillus spec.), растительные клетки, клетки животных и насекомых. Предпочтительно, чтобы система была клетками млекопитающих, такими как клетки СНО, имеющимися в наличии в Американской коллекции типовых культур АТСС.
Типичная клеточная векторная плазмида млекопитающих для конститутивной экспрессии включает промотор CMV или SV40 с подходящим концевым участком поли-А и маркером устойчивости, таким как неомицин. Одним примером является pSVL, имеющимся в наличии в компании Pharmacia, Пискатеуэй, Нью-Джерси, США. Примером индуцируемого вектора экспрессии млекопитающих является pMSG, также имеющийся в наличии в Pharmacia. Пригодными плазмидными векторами дрожжей являются pRS403-406 и pRS413-416, и они, как правило, имеются в наличии у компании Stratagene Cloning Systems, Ла Джолла, Калифорния 92037, США. Плазмиды pRS403, pRS404, pRS405 и pRS406 являются дрожжевыми интегрирующими плазмидами (YIps) и включают дрожжевые селектируемые маркеры HIS3, TRP1, LEU2 и URA3. Плазмиды pRS413-416 являются дрожжевыми плазмидами с центромерами (Ycp). Основанные на промоторе CMV векторы (например, компании Sigma-Aldrich) обеспечивают кратковременную или устойчивую экспрессию, цитоплазмическую экспрессию или секрецию и N-терминальную или С-терминальную маркировку в различных комбинациях FLAG, 3xFLAG, c-myc или МАТ. Данные слитые белки позволяют проводить выявление, очистку и анализ рекомбинантного белка. Слияния с двойной меткой обеспечивают гибкость при выявлении.
Сильный регуляторный участок промотора цитомегаловируса человека (CMV) повышает уровни конститутивной экспрессии белка, достигающие 1 мг/л в клетках COS. Для менее активных клеточных линий белковые уровни обычно составляют ~0,1 мг/л. Присутствие точки начала репликации SV40 будет приводить к высоким уровням репликации ДНК в пермиссивных клетках COS. Векторы CMV, например, могут содержать точку начала репликации рМВ1 (производное pBR322) в бактериальных клетках, ген бета-лактамазы для отбора устойчивости к ампициллину у бактерий, polyA гормона роста человека, и точку начала репликации f1. Векторы, содержащие лидерную последовательность препротрипсина (РРТ), могут направлять секрецию слитых белков FLAG в культуральной среде для очистки с использованием антител к FLAG, смол и планшетов. Другие векторы и системы экспрессии для применения с различными клетками-хозяевами хорошо известны из уровня техники.
В другом предпочтительном варианте осуществления кодируются два или более пептида или варианта пептидов по изобретению и, таким образом, они экспрессируются последовательно (как в случае структуры типа «бусины на нити»). В этих целях пептиды или варианты пептидов могут быть соединены или слиты воедино с помощью фрагментов линкерных аминокислот, таких как, например, LLLLLL, или же могут быть соединены без какого(их)-либо дополнительного(ых) пептида(ов) между ними. Эти структуры могут быть также использованы в противораковой терапии и, возможно, индуцировать иммунные ответы с участием как молекул МНС I, так и МНС II класса.
Настоящее изобретение относится также к клетке-хозяину, трансформированной с помощью полинуклеотидной векторной конструкции по настоящему изобретению. Клетка-хозяин может быть как прокариотической, так и эукариотической. Бактериальные клетки могут быть, предпочтительно, прокариотическими клетками-хозяевами при некоторых условиях и обычно являются штаммом Е. coli, таким как, например, Е. coli штамма DH5, имеющимся в наличии в Bethesda Research Laboratories Inc., Бетесда, Мэриленд, США, и RR1, имеющимся в наличии в Американской коллекции типовых культур («American Type Culture Collection» (АТСС), Роквил, Мэриленд, США (№ АТСС 31343). Предпочтительные эукариотические клетки-хозяева включают дрожжи, клетки насекомых и млекопитающих, предпочтительно клетки позвоночных, таких как линии фибробластных клеток и клеток толстой кишки таких видов как мышь, крыса, обезьяна или человек. Дрожжевые клетки-хозяева включают YPH499, YPH500 и YPH501, которые, как правило, имеются в наличии в Stratagene Cloning Systems, Ла Джола, Калифорния 92037, США. Предпочтительные клетки-хозяева млекопитающих включают клетки яичника китайского хомяка (СНО), имеющиеся в наличии в АТСС как CCL61, эмбриональные клетки швейцарской мыши линии NIH/3T3, имеющиеся в наличии в АТСС как CRL 1658, клетки COS-1 из почек обезьяны, имеющиеся в наличии в АТСС как CRL 1650, и клетки 293, являющиеся эмбриональными клетками почек эмбрионов человека. Предпочтительными клетками насекомых являются клетки Sf9, которые могут трансфицироваться с помощью бакуловирусных векторов экспрессии. Обзор в отношении выбора подходящих клеток-хозяев для экспрессии представлен, например, в учебном пособии авторов Paulina

Трансформация соответствующих клеток-хозяев с помощью ДНК-конструкции по настоящему изобретению производится при помощи хорошо известных способов, которые обычно зависят от типа используемого вектора. Относительно трансформации прокариотических клеток-хозяев см., например, работу Cohen и соавт. (Cohen et al., 1972) и (Green and Sambrook, 2012). Трансформация дрожжевых клеток описывается в работе Sherman и соавт. (Sherman et al., 1986). Также подходит метод Бигса (Beggs) (Beggs, 1978). Что касается клеток позвоночных, то подходящие для трансфекции таких клеток реагенты, например, фосфат кальция и DEAE-декстран или липосомальные составы, имеются в наличии в Stratagene Cloning Systems или Life Technologies Inc., Гейтерсберг, Мэриленд 20877, США. Электропорация также подходит для трансформации и/или трансфекции клеток и хорошо известна из уровня техники для трансформации дрожжевых клеток, бактериальных клеток, клеток насекомых и клеток позвоночных.
Успешно трансформированные клетки, т.е. клетки, которые содержат конструкцию ДНК по настоящему изобретению, могут быть идентифицированы хорошо известными способами, такими как ПЦР. Альтернативно наличие белка в супернатанте может быть выявлено с применением антител.
Следует понимать, что некоторые клетки-хозяева по изобретению подходят для получения пептидов по изобретению, например, бактериальные, дрожжевые клетки и клетки насекомых. Тем не менее, в конкретных терапевтических методах могут использоваться другие клетки-хозяева. Например, антигенпрезентирующие клетки, такие как дендритные клетки, могут с пользой быть использованы для экспрессии пептидов по изобретению так, что их можно будет нагружать на подходящие молекулы МНС. Таким образом, в настоящем изобретении предложена клетка-хозяин, включающая нуклеиновую кислоту или вектор экспрессии в соответствии с изобретением.
В предпочтительном варианте осуществления клетка-хозяин является антигенпрезентирующей клеткой, в частности, дендритной клеткой или антигенпрезентирующей клеткой. АПК, нагруженные рекомбинантным слитым белком, содержащим простатическую кислую фосфатазу (РАР), были одобрены Управлением по контролю за продуктами питания и лекарственными средствам США (FDA) 29 апреля 2010 г. для применения при лечении метастатического HRPC (гормон-рефрактерного рака предстательной железы), протекающего бессимптомно или с минимально выраженными симптомами (сипулейцел-Т) (Rini et al., 2006; Small et al., 2006).
В другом аспекте изобретения предложен способ получения пептида или его варианта, причем способ включает культивацию клетки-хозяина и выделение пептида из клетки-хозяина или его культуральной среды.
В другом варианте осуществления пептид, нуклеиновая кислота или вектор экспрессии по изобретению применяются в медицине. Например, пептид или его вариант может приготавливаться для внутривенного (в/в) введения, подкожного (п/к) введения, внутрикожного (в/к) введения, внутрибрюшинного (в/б) введения, внутримышечного (в/м) введения. Предпочтительные способы введения пептидов включают п/к, в/к, в/б, в/м и в/в. Предпочтительные способы введения ДНК включают в/к, в/м, п/к, в/б и в/в. Вводиться могут, к примеру, дозы от 50 мкг до 1,5 мг, предпочтительно от 125 мкг до 500 мкг пептида или ДНК, в зависимости от соответствующего пептида или ДНК. Дозировка в данном диапазоне успешно использовалась в предыдущих клинических исследованиях (Walter et al., 2012).
Полинуклеотид, применяемый в активной вакцинации, может быть по существу чистым или содержаться в подходящем векторе или системе доставки. Нуклеиновая кислота может быть ДНК, кДНК, ПНК, РНК или их комбинацией. Методы конструирования и введения такой нуклеиновой кислоты хорошо известны из уровня техники. Обзор представлен, например, в работе Teufel и соавт. (Teufel et al., 2005). Полинуклеотидные вакцины просто получить, однако механизм действия этих векторов по индуцированию иммунного ответа понятен не полностью. Подходящие векторы и системы доставки включают вирусные ДНК и/или РНК, такие как системы, которые основаны на аденовирусе, вирусе осповакцины, ретровирусах, вирусе герпеса, аденоассоциированном вирусе или гибридах, содержащих элементы более чем одного вируса. Невирусные системы доставки включают катионные липиды и катионные полимеры и хорошо известны из уровня техники в области доставки ДНК. Также может быть использована физическая доставка, такая как посредством «генного пистолета». Пептид или пептиды, кодируемые нуклеиновой кислотой, могут быть слитым белком, например, с эпитопом, который стимулирует Т-клетки против соответствующего противоположного определяющего комплементарность участка CDR, как описывается выше.
Медикамент по изобретению может также включать один или более адъювантов. Адъюванты - это вещества, которые неспецифически усиливают или потенцируют иммунный ответ (например, иммунные ответы, опосредованные CD8-положительными Т-клетками или хелперными Т-клетками (ТН) на антиген, и могут, таким образом, рассматриваться как полезные в медикаменте по настоящему изобретению. Подходящие адъюванты включают, но без ограничения, 1018 ISS, соли алюминия, AMPLIVAX®, AS15, BCG, СР-870,893, CpG7909, CyaA, dSLIM, флагеллин или лиганды TLR5, полученные из флагеллина, лиганд FLT3, ГМ-КСФ, IC30, IC31, имиквимод (ALDARA®), резимиквимод, ImuFact IMP321, интерлейкины, такие как ИЛ-2, ИЛ-13, ИЛ-21, интерферон-альфа или бета или их пегилированные производные, IS Patch, ISS, ISCOMATRIX, иммуностимулирующие комплексы ISCOM, Juvlmmune®, LipoVac, MALP2, MF59, монофосфорил липид А, Монтанид IMS 1312, Монтанид ISA 206, Монтанид ISA 50V, Монтанид ISA-51, эмульсии «вода в масле» и «масло в воде», OK-432, ОМ-174, ОМ-197-МР-ЕС, ONTAK, OspA, векторную систему PepTel®, основанные на поли-(лактид когликолиде) [PLG] и декстране микрочастицы, талактоферрин SRL172, виросомы и другие вирусоподобные частицы, YF-17D, VEGF trap, R848, Бета-глюкан, Pam3Cys, стимулон Aquila QS21, который получают из сапонина, микобактериальные экстракты и синтетические имитаторы бактериальных клеточных стенок и другие запатентованные адъюванты, такие как Detox компании Ribi, Quil или Superfos. Предпочтительными адъювантами являются такие как адъювант Фрейнда или ГМ-КСФ. Несколько иммунологических адъювантов (например, MF59), специфических для дендритных клеток, и их получение были описаны ранее (Allison and Krummel, 1995). Также могут использоваться цитокины. Несколько цитокинов были непосредственно соотнесены с влиянием на миграцию дендритных клеток к лимфоидным тканям (например, TNF-), ускоряя созревание дендритных клеток до эффективных, презентирующих антиген Т-лимфоцитам, клеток (например, ГМ-КСФ, ИЛ-1 и ИЛ-4) (патент США №5849589, специально включенный сюда в полном объеме путем ссылки) и действуя как иммуноадъюванты (например, ИЛ-12, ИЛ-15, ИЛ-23, ИЛ-7, ИНФ-альфа, ИНФ-бета) (Gabrilovich et al., 1996).
Об иммуностимулирующих олигонуклеотидах CpG также сообщалось, что они усиливают эффекты адъювантов в составе вакцин. Не желая быть связанными соответствием какой-либо конкретной теории, авторы полагают, что CpG-олигонуклеотиды при активации врожденной (не приобретенной) иммунной системы действуют с помощью Toll-подобных рецепторов (TLR), в основном, TLR9. Вызванная CpG активация TLR9 усиливает антиген-специфичные гуморальные и клеточные ответы на широкий спектр антигенов, включая пептидные или белковые антигены, живые или убитые вирусы, вакцины из дендритных клеток, аутологичные клеточные вакцины и полисахаридные конъюгаты как в профилактических, так и терапевтических вакцинах. Более важно то, что улучшается созревание и дифференциация дендритных клеток, приводя к повышенной активации клеток типа ТН1 и интенсивной выработке цитотоксических Т-лимфоцитов (ЦТЛ) даже при отсутствии помощи со стороны CD4 Т-клеток. Активация ТН1, вызванная стимуляцией TLR9, сохраняется даже в присутствии вакцинных адъювантов, таких как квасцы или неполный адъювант Фрейнда (IFA), которые обычно способствуют активации ТН2. CpG-олигонуклеотиды проявляют даже

Другие примеры пригодных к использованию адъювантов включают, но без ограничения, химически модифицированные CpG (например, CpR, Idera), аналоги dsPHK, такие как поли-(I:C) и их производные (например, AmpliGen®, Hiltonol®, поли-(ICLC), поли(IC-R), поли(I:C12U), бактериальные ДНК или РНК, отличные от CpG, а также иммуноактивные малые молекулы и антитела, такие как циклофосфамид, сунитиниб, бевацизумаб®, целебрекс, NCX-4016, силденафил, тадалафил, варденафил, сорафениб, темозоломид, темсиролимус, XL-999, СР-547632, пазопаниб, VEGF Trap, ZD2171, AZD2171, анти-CTLA4, другие антитела, нацеленные на основные структуры иммунной системы (например, антитела к CD40, TGFбета, рецептору TMPальфа) и SC58175, которые могут действовать терапевтически и/или как адъюванты. Количества и концентрации адъювантов и добавок, пригодных для использования в контексте настоящего изобретения, могут быть легко определены опытным специалистом без проведения излишних экспериментов.
Предпочтительными адъювантами являются анти-CD40, имиквимод, резиквимод, ГМ-КСФ, циклофосфамид, сунитиниб, бевацизумаб, интерферон-альфа, CpG олигонуклеотиды и их производные, поли-(I:C) и ее производные, РНК, силденафил и составы из твердых микрочастиц с PLG или виросомы.
В предпочтительном варианте осуществления фармацевтической композиции в соответствии с изобретением адъювант выбран из группы, состоящей из колониестимулирующих факторов, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ, сарграмостим), циклофосфамид, имиквимод, резиквимод и интерферон-альфа.
В предпочтительном варианте осуществления фармацевтической композиции в соответствии с изобретением адъювант выбран из группы, состоящей из колониестимулирующих факторов, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ, сарграмостим), циклофосфамид, имиквимод и резиквимод. В предпочтительном варианте осуществления фармацевтической композиции в соответствии с изобретением адъювантом является циклофосфамид, имиквимод или резиквимод. Еще более предпочтительными адъювантами являются монтанид IMS 1312, монтанид ISA 206, монтанид ISA 50V, монтанид ISA-51, поли-ICLC (Hiltonol®) и моноклональные антитела к CD40 или их комбинации.
Эта композиция используется для парентерального введения, такого как подкожное, внутрикожное, внутримышечное или для перорального введения. Для этого пептиды и - факультативно - другие молекулы растворяют или суспендируют в фармацевтически приемлемом, предпочтительно водном, носителе. Помимо того, композиция может содержать вспомогательные вещества, такие как буферы, связующие агенты, балластные вещества, разбавители, ароматизаторы, смазочные вещества и т.д. Пептиды могут быть также введены вместе с иммуностимулирующими агентами, такими как цитокины. Обширный список вспомогательных веществ, которые могут быть использованы в такой композиции, может быть взят, например, из работы А. Kibbe, «Handbook of Pharmaceutical Excipients» (Kibbe, 2000). Композиция может использоваться для предупреждения, профилактики и/или лечения аденоматозных или раковых заболеваний. Примеры фармацевтических композиций могут быть взяты, например, из ЕР 2112253.
Важно понимать, что иммунный ответ, вызванный вакциной в соответствии с изобретением, направлен на раковые клетки на различных стадиях клеточного цикла и различных стадиях развития опухоли. Кроме того, атака направлена на различные сигнальные пути, ассоциированные с раковым заболеванием. Это является преимуществом в сравнении с вакцинами, направленными только на одну или немногие мишени, что может привести к тому, что опухоль легко приспособится к такой атаке (ускользание опухоли). Кроме того, не все отдельные опухоли имеют одинаковые паттерны экспрессии антигенов. Поэтому комбинация нескольких опухолеассоциированных пептидов гарантирует, что на каждой отдельной опухоли имеются по меньшей мере некоторые из этих мишеней. Композиция разработана исходя из того, что, как ожидается, каждая опухоль экспрессирует несколько антигенов и охватывает несколько независимых сигнальных путей, необходимых для роста и сохранения опухоли. Таким образом, вакцина в виде «готовой к применению» может быть легко использована для более крупной популяции пациентов. Это означает, что предварительный отбор пациентов для лечения вакциной может быть ограничен HLA-типированием, не требуя никакого дополнительного анализа биомаркеров экспрессии антигена, однако при этом остается гарантия одновременного воздействия на несколько мишеней в виде индуцированного иммунного ответа, что важно для эффективности (Banchereau et al., 2001; Walter et al., 2012).
В контексте настоящего описания понятие «каркас» относится к молекуле, которая специфически связывается с (например, антигенной) детерминантой. В одном варианте осуществления каркас способен направлять единицу, к которой он прикреплен (например, (второй) антиген-связывающий элемент) к сайту-мишени, например, к конкретному виду опухолевых клеток или стромы опухоли, несущих антигенную детерминанту (например, комплекс пептида с МНС в соответствии с настоящей патентной заявкой). В другом варианте осуществления каркас способен активировать пути передачи сигналов за счет его антигена-мишени, например, антигена комплекса Т-клеточного рецептора. Каркасы включают, но без ограничения, антитела и их фрагменты, антигенсвязывающие домены антитела, включающие вариабельный участок тяжелой цепи антитела и вариабельный участок легкой цепи антитела, связывающие белки, включающие по меньшей мере один мотив анкиринового повтора и однодоменные антигенсвязывающие (SDAB) молекулы, аптамеры, (растворимые) ТКР и (модифицированные) клетки, такие как аллогенные или аутологичные Т-клетки. Чтобы оценить, является ли молекула каркасом, связывающимся с мишенью, может быть проведен анализ связывания.
«Специфическое» связывание обозначает, что каркас связывается с представляющим интерес комплексом пептида с МНС лучше, чем с другими встречающимися в природе комплексами пептида с МНС, в такой степени, что каркас, снабженный активной молекулой, способной уничтожать клетку, несущую специфическую мишень, не способен уничтожить другую клетку без специфической мишени, но презентирующую другой(ие) комплекс(ы) пептида с МНС. Связывание с другими комплексами пептида с МНС не играет роли, если пептид перекрестно реагирующего комплекса пептида с МНС не является встречающимся в природе, т.е. не образован из человеческого HLA-пептидома. Испытания для оценки потенциала уничтожения клетки-мишени хорошо известны из уровня техники. Они должны проводиться с использованием клеток-мишеней (первичные клетки или клеточные линии) с неизмененной презентацией комплексов пептида с МНС или клеток, нагруженных пептидами, таким образом, что будет достигаться уровень встречающихся в природе комплексов пептида с МНС.
Каждый каркас может включать метку, которая обеспечивает возможность обнаружения связанного каркаса за счет определения наличия или отсутствия сигнала, подаваемого меткой. Например, каркас может быть помечен флуоресцентным красителем или любой другой применимой маркерной молекулы клетки. Такие маркерные молекулы хорошо известны из области техники. Например, флуоресцентное мечение, например, с помощью флуоресцентного красителя, может обеспечивать визуализацию связанного аптамера посредством флуоресцентной или лазерной сканирующей микроскопии или проточной цитометрии.
Каждый каркас может быть конъюгирован со второй активной молекулой, такой как, например, ИЛ-21, антитело к CD3 и антитело к CD28.
Для получения дальнейшей информации о полипептидных каркасах см., например, раздел уровня техники патентной заявки WO 2014/071978 А1 и цитируемую в ней литературу.
Настоящее изобретение далее относится к аптамерам. Аптамеры (см., например, заявку WO 2014/191359 и цитируемую в ней литературу) - это короткие одноцепочечные молекулы нуклеиновых кислот, которые могут сворачиваться в определенные трехмерные структуры и распознавать специфические структуры-мишени. Оказалось, что они представляют собой подходящую альтернативу для разработки таргетной терапии. Как было продемонстрировано, аптамеры селективно связываются с различными сложными мишенями с высокой аффинностью и специфичностью.
Аптамеры, распознающие молекулы, которые находятся на поверхности клеток, были идентифицированы в последнее десятилетие и предоставляют возможность для разработки диагностических и терапевтических подходов. Так как было продемонстрировано, что аптамеры практически не обладают токсичностью и иммуногенностью, они являются многообещающими кандидатами для биомедицинского применения. Действительно, аптамеры, например, аптамеры, распознающие простатический специфический мембранный антиген, были успешно задействованы в таргетной терапии и продемонстрировали функциональность в моделях с ксенотрансплантатами in vivo. Кроме того, были идентифицированы аптамеры, распознающие конкретные опухолевые линии.
Могут быть отобраны ДНК-аптамеры, проявляющие широкий спектр свойств по распознаванию различных раковых клеток, и, в частности, клеток, образованных из солидных опухолей, тогда как неопухолегенные и первичные здоровые клетки не распознаются. Если идентифицированные аптамеры распознают не только конкретный опухолевый подтип, но и взаимодействуют с различными опухолями, это делает возможным применение аптамеров в качестве так называемых диагностических и терапевтических средств широкого спектра действия.
Более того, исследование поведения по связыванию с клетками с помощью проточной цитометрии показало, что аптамеры проявляли очень хорошую кажущуюся аффинность, которая выражалась на наномолярном уровне.
Аптамеры пригодны для диагностических и терапевтических целей. Кроме того, как могло быть продемонстрировано, некоторые аптамеры захватываются опухолевыми клетками и, таким образом, могут действовать в качестве молекулярных носителей для направленной доставки противораковых средств, таких как миРНК, в опухолевые клетки.
Могут быть отобраны аптамеры к сложным мишеням, таким как клетки и ткани и комплексы пептидов, включающих, предпочтительно состоящих из последовательности в соответствии с любой из последовательностей с SEQ ID NO 1 по SEQ ID NO 110, в соответствии с представленным изобретением с молекулой МНС, используя метод cell-SELEX (Systematic Evolution of Ligands by Exponential enrichment - систематическая эволюция лигандов при экспоненциальном обогащении).
Пептиды по настоящему изобретению могут использоваться для получения и разработки специфических антител к комплексам МНС/пептид. Они могут быть использованы в терапии, нацеливающей токсины или радиоактивные вещества на пораженную ткань. Другим видом использования данных антител может быть «нацеливание» радионуклидов на пораженную ткань в целях визуализации, такой как ПЭТ (позитронно-эмиссионная томография). Это может помочь в обнаружении небольших метастазов или в определении размера и точной локализации пораженных тканей.
Таким образом, в другом аспекте изобретения предложен способ получения рекомбинантного антитела, специфически связывающегося с главным комплексом гистосовместимости человека (МНС) I или II класса в комплексе с рестриктированным по HLA антигеном, причем способ включает: иммунизацию генетически модифицированного, не являющегося человеком млекопитающего, содержащего клетки, экспрессирующие молекулы указанного главного комплекса гистосовместимости человека (МНС) I или II класса с растворимой формой молекулы МНС I или II класса в комплексе с указанным рестриктированным по HLA антигеном; выделение молекул мРНК из продуцирующих антитела клеток указанного не являющегося человеком млекопитающего; создание библиотеки фагового отображения, содержащей фаги, экспонирующие белковые молекулы, закодированные указанными молекулами мРНК; и выделение, по меньшей мере, одного фага из указанной библиотеки фагового отображения, причем указанный, по меньшей мере, один фаг, экспонирует на поверхности указанное антитело, специфически связывающееся с указанным главным комплексом гистосовместимости человека (МНС) I или II класса в комплексе с указанным рестриктированным по HLA антигеном.
В другом аспекте изобретения предложено антитело, которое специфически связывается с главным комплексом гистосовместимости человека (МНС) I или II класса в комплексе с рестриктированным по HLA антигеном, где антитело предпочтительно является поликлональным антителом, моноклональным антителом, биспецифичным антителом и/или химерным антителом.
Соответствующие способы получения таких антител и одноцепочечных главных комплексов гистосовместимости I класса, в равной степени как и другие инструменты для получения данных антител, раскрыты в патентных заявках WO 03/068201, WO 2004/084798, WO 01/72768, WO 03/070752 и в опубликованных работах (Cohen et al., 2003а; Cohen et al., 2003b; Denkberg et al., 2003), которые все в целях настоящего изобретения в явном виде включены во всей полноте путем ссылки.
Предпочтительно, если антитело связывается с аффинностью связывания ниже 20 наномолей, предпочтительно ниже 10 наномолей, с комплексом, который также называется «специфическим» в контексте настоящего изобретения.
Настоящее изобретение относится к пептиду, включающему последовательность, которая выбирается из группы, состоящей из последовательностей с SEQ ID NO 1 по SEQ ID NO 110 или их вариант, который по меньшей мере на 88% гомологичен (предпочтительно, если он идентичен) последовательности с SEQ ID NO 1 по SEQ ID NO 110, или их варианту, который индуцирует Т-клеточную перекрестную реакцию с указанным пептидом, где указанный пептид не является базовым полипептидом полной длины.
Настоящее изобретение далее относится к пептиду, включающему последовательность, которая выбирается из группы, состоящей из последовательностей с SEQ ID NO 1 по SEQ ID NO 110 или их вариант, который по меньшей мере на 88% гомологичен (предпочтительно, если он идентичен) SEQ ID NO 1 по SEQ ID NO 110, где указанный пептид или его вариант имеет общую длину от 8 до 100, предпочтительно от 8 до 30 и, наиболее предпочтительно, от 8 до 14 аминокислот.
Настоящее изобретение далее относится к пептидам в соответствии с изобретением, способным связываться с молекулой главного комплекса гистосовместимости человека (МНС) I или II класса.
Настоящее изобретение далее относится к пептидам в соответствии с изобретением, где пептид состоит или состоит по существу из аминокислотной последовательности в соответствии с SEQ ID NO: 1 по SEQ ID NO: 110.
Настоящее изобретение далее относится к пептидам в соответствии с изобретением, где пептид модифицирован (химическим способом) и/или включает непептидные связи.
Настоящее изобретение далее относится к пептидам в соответствии с изобретением, где пептид является частью слитого белка, в частности включающим N-терминальные аминокислоты HLA-DR антиген-ассоциированной инвариантной цепи (Ii), или где пептид слит с антителом (или слит с последовательностью антитела), например, таким антителом, которое является специфичным для дендритных клеток.
Настоящее изобретение далее относится к нуклеиновой кислоте, кодирующей пептиды в соответствии с изобретением, при условии, что пептид не является полностью (целиком) человеческим белком.
Настоящее изобретение далее относится к нуклеиновой кислоте в соответствии с изобретением, которая является ДНК, кДНК, ПНК, PHK или их комбинациями.
Настоящее изобретение далее относится к вектору экспрессии, способному экспрессировать нуклеиновую кислоту в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к пептиду в соответствии с настоящим изобретением, к нуклеиновой кислоте в соответствии с настоящим изобретением или к вектору экспрессии в соответствии с настоящим изобретением для применения в медицине, в частности, в лечении рака легких.
Настоящее изобретение далее относится к клетке-хозяину, включающей нуклеиновую кислоту в соответствии с изобретением или вектор экспрессии в соответствии с изобретением.
Настоящее изобретение далее относится к клетке-хозяину в соответствии с настоящим изобретением, которая является антигенпрезентирующей клеткой, предпочтительно - дендритной клеткой.
Настоящее изобретение далее относится к способу получения пептида в соответствии с настоящим изобретением, причем указанный способ включает культивацию клетки-хозяина в соответствии с настоящим изобретением и выделение пептида из указанной клетки-хозяина или его культуральной среды.
Настоящее изобретение далее относится к способу в соответствии с настоящим изобретением, где антиген нагружен на молекулы МНС I или II класса, экспрессированные на поверхности подходящей антигенпрезентирующей клетки, при контактировании достаточного количества антигена с антигенпрезентирующей клеткой.
Настоящее изобретение далее относится к способу в соответствии с изобретением, где антигенпрезентирующая клетка включает вектор экспрессии, способный экспрессировать указанный пептид, содержащий последовательность с SEQ ID NO 1 по SEQ ID NO 110 или указанную вариантную аминокислотную последовательность.
Настоящее изобретение далее относится к активированным Т-клеткам, полученным способом в соответствии с настоящим изобретением, где указанные Т-клетки селективно распознают клетку, которая аберрантно экспрессирует полипептид, включающий аминокислотную последовательность в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к способу уничтожения клеток-мишеней у пациента, чьи клетки-мишени аберрантно экспрессируют полипептид, включающий любую аминокислотную последовательность в соответствии с настоящим изобретением, причем способ включает введение пациенту эффективного числа Т-клеток в соответствии с настоящим изобретением.
Настоящее изобретение далее относится к применению любого описанного пептида, нуклеиновой кислоты в соответствии с настоящим изобретением, вектора экспрессии в соответствии с настоящим изобретением, клетки в соответствии с настоящим изобретением или активированного цитотоксического Т-лимфоцита в соответствии с настоящим изобретением в качестве медикамента или в производстве медикамента. Настоящее изобретение далее относится к способу применения в соответствии с настоящим изобретением, где медикамент проявляет противораковую активность.
Настоящее изобретение далее относится к способу применения в соответствии с изобретением, где медикамент является вакциной. Настоящее изобретение далее относится к способу применения в соответствии с изобретением, где медикамент проявляет противораковую активность.
Настоящее изобретение далее относится к применению в соответствии с изобретением, где указанные раковые клетки являются клетками рака легких или клетками других солидных или гематологических опухолей, например, рака головного мозга, рака молочной железы, колоректального рака, рака пищевода, рака почек, рака печени, рака яичника, рака поджелудочной железы, рака предстательной железы, рака желудка, меланомы, карциномы клеток Меркеля, лейкоза (ОМЛ, ХЛЛ), неходжкинской лимфомы (НХЛ), рака пищевода, в том числе соединения желудка и пищевода (РП), рака желчного пузыря и холангиокарциномы (РЖП, ХК), рака мочевого пузыря (РМП) и рака матки (РЭМ).
Настоящее изобретение далее относится к конкретным белкам-маркерам и биомаркерам, основанным на пептидах в соответствии с настоящим изобретением, в контексте изобретения называемые «мишенями», которые могут быть использованы при постановке диагноза и/или составлении прогноза течения рака легких. Настоящее изобретение относится также к применению этих новых мишеней для лечения рака.
Понятие «антитело» или «антитела» используется в контексте данного изобретения в широком смысле и включает как поликлональные, так и моноклональные антитела. В дополнение к интактным или «полным» молекулам иммуноглобулина в понятие «антитела» включены также фрагменты (например, участки CDR, фрагменты Fv, Fab и Fc) или полимеры таких молекул иммуноглобулина и гуманизированные версии молекул иммуноглобулина, при условии, что они проявляют любое из желаемых свойств (например, специфически связываются с (поли)пептидным маркером рака легких, доставляют токсин к клетке рака легких, экспрессирующей раковый ген-маркер на повышенном уровне и/или ингибируют активность полипептида-маркера рака легких) в соответствии с настоящим изобретением.
Если возможно, антитела по изобретению могут быть куплены в коммерческих источниках. Антитела по изобретению могут быть также получены при использовании хорошо известных способов. Опытному специалисту будет понятно, что для получения антител по изобретению могут использоваться как полипептидные маркеры рака легких полной длины, так и их фрагменты. Полипептид, необходимый для получения антитела по изобретению, может быть частично или полностью очищенным из природного источника или же может быть получен с использованием методики рекомбинантной ДНК.
Например, кДНК, кодирующая пептид в соответствии с настоящим изобретением, такой как пептид с последовательностью с SEQ ID NO: 1 по SEQ ID NO: 110, полипептид или вариант или его фрагмент может быть экспрессирована в прокариотических клетках (например, бактерий) или эукариотических клетках (например, дрожжей, насекомых или клетках млекопитающих), после чего рекомбинантный белок может быть очищен и использован в получении препарата из моноклональных или поликлональных антител, которые специфически связываются с полипептидным маркером рака легких, использованным для получения антитела по изобретению.
Специалисту данной области будет понятно, что получение двух или более различных наборов моноклональных или поликлональных антител увеличивает вероятность получения антитела со специфичностью и аффинностью, необходимыми для предназначенного для него использования (например, для ELISA, иммуногистохимии, визуализации in vivo, терапии на основе иммунотоксина). Антитела испытывают на желаемую для них активность с помощью известных методов в соответствии с целью применения антител (например, ELISA, иммуногистохимия, иммунотерапия и т.д.; для получения дальнейшей информации по генерированию и испытанию антител см., например, Greenfield, 2014 (Greenfield, 2014)). Например, антитела могут быть исследованы с помощью ELISA или метода иммунного блоттинга (Western-blot), иммуногистохимического окрашивания законсервированных формальдегидом образцов рака легкого или замороженных тканевых срезов. После первоначального определения их характеристик in vitro антитела, предназначаемые для терапевтического или диагностического применения in vivo исследуют в соответствии с известными клиническими методами анализа.
Понятие «моноклональное антитело» в контексте настоящего изобретения обозначает антитело, полученное из, по существу, гомогенной популяции антител, т.е. отдельные антитела внутри популяции идентичны за исключением возможных естественных мутаций, которые могут быть представлены в небольших количествах. Моноклональные антитела в контексте настоящего изобретения специфически включают «химерные» антитела, в которых участок тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям антител, полученных из конкретного вида или относящихся к конкретному классу или подклассу антител, в то время как остальная(ые) часть(и) цепи идентична(ы) или гомологична(ы) соответствующим последовательностям антител, полученных из другого вида или относящихся к другому классу или подклассу антител, в равной степени как и фрагментов таких антител, пока они проявляют желаемую антагонистическую активность (Патент США №4816567, который включен в настоящее описание в полном объеме).
Моноклональные антитела по изобретению могут быть получены при использовании гибридомного метода. В рамках гибридомного метода мышь или другое подходящее животное-хозяин обычно иммунизируется иммунизирующим веществом, чтобы инициировать лимфоциты, которые вырабатывают или способны вырабатывать антитела, которые будут специфически связываться с иммунизирующим веществом. Альтернативно лимфоциты могут быть иммунизированы in vitro.
Моноклональные антитела могут быть также получены с помощью технологий рекомбинантных ДНК, таких как описываемые в патенте США №4816567. ДНК, кодирующая моноклональные антитела по изобретению, может быть легко выделена и секвенирована с помощью стандартных методик (например, при использовании олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител).
In vitro-методы также подходят для получения моновалентных антител. Расщепление антител для получения их фрагментов, в особенности Fab-фрагментов, может быть произведено при использовании стандартных методик, известных из уровня техники. К примеру, расщепление может производиться при использовании папаина. Примеры расщепления под воздействием папаина описываются в заявке WO 94/29348 и в патенте США №4342566. Расщепление антител под воздействием папаина обычно приводит к двум идентичным фрагментам, связывающимся с антигеном и называемым Fab-фрагментами, каждый из которых имеет отдельный антиген-связывающий сайт и остаточный Fc-фрагмент. В результате обработки пепсином получается фрагмент F(ab')2 и фрагмент pFc'.
Фрагменты антител, как связанные с другими последовательностями, так и не связанные, могут также включать вставки, делеции, замещения или другие выбранные модификации конкретных участков или аминокислотных остатков при условии, что активность фрагмента незначительно изменена или повреждена по сравнению с немодифицированным антителом или фрагментом антитела. Данные модификации могут внести некоторые дополнительные свойства, такие как добавление/удаление аминокислот, способных к дисульфидному связыванию, увеличение их биологической стойкости, изменение их секреторных характеристик и т.д. В любом случае, фрагмент антитела должен обладать свойством биологической активности, таким как активностью связывания, регуляцией связывания на связывающем домене и т.д. Функциональные или активные участки антитела могут быть идентифицированы при мутагенезе конкретного участка белка с последующей экспрессией и исследованием экспрессированного полипептида. Такие способы полностью очевидны для опытного специалиста данной области и могут включать сайт-специфический мутагенез нуклеиновой кислоты, кодирующей фрагмент антитела.
Антитела по изобретению могут далее включать гуманизированные антитела или человеческие антитела. Гуманизированные формы нечеловеческих (например, мышиных) антител - это химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab' или другие антиген-связывающие субпоследовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Гуманизированные антитела включают человеческие иммуноглобулины (антитело-реципиент), в которых остатки из определяющего комплементарность участка (CDR) реципиента замещены остатками из CDR биологических видов, не являющихся человеком (донорское антитело), таких как мыши, крысы или кролики, имеющими желаемую специфичность, аффинность и связывающая способность. В некоторых случаях остатки Fv-каркаса (FR) человеческого иммуноглобулина замещены соответствующими остатками нечеловеческого происхождения. Гуманизированные антитела могут также включать остатки, которые не встречаются ни в антителе-реципиенте, ни в импортированном CDR или каркасных последовательностях. Как правило, гуманизированное антитело будет включать по сути все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все участки CDR соответствуют таковым нечеловеческого иммуноглобулина, и все или по сути все из участков FR являются таковыми консенсусной последовательности иммуноглобулина человека. Оптимально, чтобы гуманизированное антитело содержало также по меньшей мере часть константного участка иммуноглобулина (Fc), как правило, человеческого иммуноглобулина.
Способы гуманизации нечеловеческих антител хорошо известны из уровня техники. В целом, гуманизированное антитело имеет один или более аминокислотный остаток, введенный в него из источника, не являющегося человеческим. Такие аминокислотные остатки нечеловеческого происхождения часто называются «импортированными» остатками, которые обычно берутся из «импортированного» вариабельного домена. Гуманизация может быть по существу произведена посредством замены участков CDR или последовательностей CDR грызунов на соответствующие последовательности человеческого антитела. Соответственно, такие «гуманизированные» антитела являются химерными антителами (патент США №4816567), где существенно меньшая часть, чем один интактный человеческий вариабельный домен была заменена соответствующей последовательностью нечеловеческого вида. На практике гуманизированные антитела являются обычно человеческими антителами, в которых некоторые остатки CDR и, возможно, остатки FR заменены на остатки аналогичных сайтов антител грызунов.
Использоваться могут трансгенные животные (например, мыши), которые способны при иммунизации вырабатывать полный спектр человеческих антител при отсутствии выработки эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена, кодирующего участок присоединения тяжелой цепи антитела у химерных и мутантных мышей зародышевой линии, приводит к полному ингибированию выработки эндогенных антител. Перенос генной матрицы иммуноглобулина клеток зародышевой линии человека в таких мутантных мышей зародышевой линии будет приводить к выработке человеческих антител после антигенной стимуляции. Человеческие антитела могут быть также получены в библиотеках фагового отображения.
Антитела по изобретению предпочтительно вводятся субъекту в фармацевтически приемлемом носителе. Подходящее количество фармацевтически приемлемой соли обычно используется в составе для придания композиции изотоничности. Примеры фармацевтически приемлемых носителей включают физиологический раствор, раствор Рингера и раствор глюкозы. Уровень рН раствора составляет, предпочтительно, от около 5 до около 8 и, более предпочтительно, от около 7 до около 7,5. Кроме того, предлагаются носители, включающие препараты пролонгированного высвобождения, такие как полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, матрицы которых имеют вид профилированных объектов, к примеру, пленки, липосомы или микрочастицы. Для специалиста данной области будет очевидно, что определенные носители могут быть более предпочтительными в зависимости от, например, способа введения и концентрации вводимого антитела.
Антитела могут вводиться субъекту, пациенту или в клетку посредством инъекции (например, внутривенно, внутрибрюшинно, подкожно, внутримышечно) или другими способами, такими как вливание, которое гарантирует доставку к кровотоку эффективным образом. Антитела также могут вводиться внутритуморальными или перитуморальными способами, чтобы вызвать местные, а также и системные терапевтические эффекты. Предпочтительными являются местное или внутривенное введение.
Эффективная дозировка и режим введения антител могут быть определены эмпирически, а принятие таковых решений под силу специалисту данной области. Специалистам данной области будет понятно, что дозировка антител, которые должны быть введены, будет варьироваться в зависимости от, например, субъекта, которому будет вводиться антитело, способа введения, конкретного типа используемого антитела и других вводимых медикаментов. Типичная дневная дозировка антитела, используемого отдельно, может варьироваться от около 1 мкг/кг вплоть до 100 мг/кг массы тела или более в день, в зависимости от факторов, упоминаемых выше. После введения антитела, предпочтительно для лечения рака легких, эффективность терапевтического антитела может быть оценена различными способами, известными компетентному специалисту данной области. Например, размер, количество и/или распределение рака легкого в организме субъекта, проходящего лечение, может контролироваться с помощью стандартных методов визуализации опухоли. Введенное в терапевтических целях антитело, которое блокирует рост опухоли, приводит к уменьшению размера и/или предотвращает развитие новых опухолей в сравнении с течением болезни, которое бы имело место без введения антитела, и является эффективным антителом для лечения рака легкого.
В другом аспекте изобретения предложен способ получения растворимого Т-клеточного рецептора (ТКР), распознающего конкретный комплекс пептида и МНС. Такие растворимые Т-клеточные рецепторы могут быть получены из специфических Т-клеточных клонов, и их аффинность может быть повышена за счет мутагенеза, направленного на определяющие комплементарность участки. Для выбора Т-клеточного рецептора может использоваться фаговое отображение (заявка США 2010/0113300, (Liddy et al., 2012)). В целях стабилизации Т-клеточных рецепторов в процессе фагового отображения и в случае практического применения в качестве лекарственного средства альфа-и бета-цепи могут быть связаны, например, посредством не встречающихся в природе дисульфидных связей, других ковалентных связей (одноцепочечный Т-клеточный рецептор) или с помощью доменов димеризации (Boulter et al., 2003; Card et al., 2004; Willcox et al., 1999). В целях выполнения определенных функций на клетках-мишенях Т-клеточный рецептор может быть связан с токсинами, лекарственными средствами, цитокинами (см., например, заявку США 2013/0115191) и доменами, рекрутирующими эффекторные клетки, такими как анти-CD3 домен, и т.д. Более того, он может быть экспрессирован на Т-клетках, используемых для адоптивного переноса. Дополнительную информацию можно найти в патентных заявках WO 2004/033685 А1 и WO 2004/074322 А1. Комбинация растворимых ТКР описывается в патентной заявке WO 2012/056407А1. Другие способы получения описаны в патентной заявке WO 2013/057586 А1.
Помимо того, пептиды и/или ТКР или антитела или другие связывающиеся молекулы настоящего изобретения могут быть использованы для подтверждения диагноза рака, поставленного патоморфологом на основании исследования биоптата.
Антитела или ТКР могут также применяться для диагностики in vivo. Как правило, антитело помечают радионуклеотидом (таким как111In,99Тс,14С,131I,3Н,32Р или35S), так что опухоль может быть локализована с помощью иммуносцинтиграфии. В одном варианте осуществления антитела или их фрагменты связываются с внеклеточными доменами двух или более мишеней белка, выбранного из группы, состоящей из указанных выше белков, при показателе аффинности (Kd) ниже чем 1×10 мкМ.
Антитела для диагностических целей могут помечаться зондами, подходящими для обнаружения различными способами визуализации. Способы обнаружения зондов включают, но без ограничения, флуоресценцию, световую, конфокальную и электронную микроскопию; магнитно-резонансную томографию и спректроскопию; флюороскопию, компьютерную томографию и позитронно-эмиссионную томографию. Подходящие зонды включают, но без ограничения, флуоресцеин, родамин, эозин и другие флюорофоры, радиоизотопы, золото, гадолиний и другие лантаноиды, парамагнитное железо, фтор-18 и другие позитронно-активные радионуклиды. Более того, зонды могут быть би- или мультифункциональными и обнаруживаться более чем одним из приведенных способов. Данные антитела могут быть помечены напрямую или опосредованно указанными зондами. Присоединение зондов к антителам включает ковалентное присоединение зонда, внедрение зонда в антитело и ковалентное присоединение хелатирующего соединения для присоединения зонда, среди других широко признанных методов в данной области. Для иммуногистохимических исследований образец пораженной ткани может быть свежим или замороженным или может быть залит парафином и зафиксирован таким консервантом как формалин. Зафиксированный или залитый срез приводят в контакт с помеченным первичным антителом и вторичным антителом, где антитело используется для обнаружения экспрессии белков in situ.
Другой аспект настоящего изобретения включает способ получения активированных Т-клеток in vitro, причем способ включает контактирование Т-клеток in vitro с нагруженными антигеном молекулами МНС человека, экспрессированными на поверхности подходящей антигенпрезентирующей клетки на период времени, достаточного для активации антиген-специфическим образом Т-клетки, где антиген является пептидом в соответствии с изобретением. Предпочтительно, если с антигенпрезентирующей клеткой применяется достаточное количество антигена.
Предпочтительно, если в клетке млекопитающих не имеется пептидного транспортера ТАР или имеется его пониженный уровень или пониженная функциональная активность. Подходящие клетки с дефицитом пептидного транспортера ТАР, включают Т2, RMA-S и клетки дрозофилы. ТАР - это транспортер, связанный с процессингом антигена.
Линия человеческих клеток с недостаточностью Т2, на которые загружаются пептиды, имеется в наличии в Американской коллекции типовых культур, 12301 Parklawn Drive, Rockville, Maryland 20852, США под каталожным номером CRL 1992; клеточная линия дрозофилы, линия Schneider 2 имеется в наличии в АТСС под каталожным номером CRL 19863; клеточная линия мыши RMA-S описывается в работе Ljunggren и соавт. (Ljunggren and Karre, 1985).
Предпочтительно, если до трансфекции указанная клетка-хозяин, по существу, не экспрессирует молекулы МНС I класса. Также предпочтительно, если клетка-стимулятор экспрессирует молекулу, важную для обеспечения сигнала костимуляции для Т-клеток, такую как любая из В7.1, В7.2, ICAM-1 и LFA 3. Последовательности нуклеиновых кислот многочисленных молекул МНС I класса и костимуляторных молекул общедоступны в банках данных GenBank и EMBL.
В случае использования эпитопа МНС I класса в качестве антигена, Т-клетки являются CD8-положительными Т-клетками.
Если антигенпрезентирующая клетка трансфицирована для экспрессии такого эпитопа, то предпочтительно, чтобы клетка включала вектор экспрессии, способный экспрессировать пептид, содержащий SEQ ID №1 по SEQ ID №110 или вариант такой аминокислотной последовательности.
Для получения Т-клеток in vitro могут быть использованы многие другие способы. Например, для получения ЦТЛ используются аутологичные опухоль-инфильтрующие лимфоциты. Plebanski и соавт. (Plebanski et al., 1995) для получения Т-клеток использовали аутологичные лимфоциты периферической крови (ЛПК). Кроме того, возможно получение аутологичных Т-клеток посредством нагрузки дендритных клеток пептидом или полипептидом или посредством инфицирования рекомбинантным вирусом. Для получения аутологичных Т-клеток также можно использовать В-клетки. Кроме того, для получения аутологичных Т-клеток могут быть использованы макрофаги, нагруженные пептидом или полипептидом или инфицированные рекомбинантным вирусом. S. Walter и соавт. (Walter et al., 2003) описывают прайминг Т-клеток in vitro с использованием искусственных антигенпрезентирующих клеток (иАПК), что является также подходящим способом получения Т-клеток против выбранного пептида. В настоящем изобретении иАПК были получены прикреплением предварительно образованных комплексов МНС-пептид к поверхности полистироловых частиц (микросфер) с помощью биохимического способа с биотином-стрептавидином. Данная система допускает точный контроль плотности МНС на иАПК, который позволяет селективно вызвать высоко- или низкоавидные антигенспецифические Т-клеточные ответы с высокой эффективностью в образцах крови. Кроме комплексов МНС-пептид, иАПК должны нести другие белки с костимуляторной активностью, такие как антитела к CD28, прикрепленные к их поверхности. Кроме того, такая основанная на иАПК система часто требует добавления соответствующих растворимых факторов, к примеру, цитокинов, таких как интерлейкин-12.
При получении Т-клеток могут быть также использованы аллогенные клетки, и этот способ подробно описывается в патентной заявке WO 97/26328, включенной сюда путем ссылки. Например, кроме клеток дрозофилы и Т2-клеток, для презентации антигенов могут использоваться другие клетки, такие как клетки яичника китайского хомяка (СНО), бакуловирус-инфицированные клетки насекомых, бактерии, дрожжи и инфицированные осповакциной клетки-мишени. Кроме того, могут быть использованы растительные вирусы (см., например, работу Porta и соавт. (Porta et al., 1994) в которой описывается разработка мозаичного вируса китайской вигны как высокопродуктивной системы презентации чужеродных пептидов.
Активированные Т-клетки, которые направлены против пептидов по изобретению, пригодны для терапии. Таким образом, в другом аспекте изобретения предложены активированные Т-клетки, получаемые вышеупомянутыми способами по изобретению.
Активированные Т-клетки, полученные с помощью приведенного выше способа, будут селективно распознавать клетку, которая аберрантно экспрессирует полипептид, включающий аминокислотную последовательность с SEQ ID NO: 1 по 110.
Предпочтительно, чтобы Т-клетка распознавала клетку при взаимодействии посредством ее ТКР с комплексом HLA/пептид (например, при связывании). Т-клетки пригодны для способа уничтожения клеток-мишеней у пациента, клетки-мишени которого аберрантно экспрессируют полипептид, включающий аминокислотную последовательность по изобретению, где пациенту вводится эффективное число активированных Т-клеток. Т-клетки, которые введены пациенту, могут быть получены от пациента и активироваться, как описывалось выше (т.е. они являются аутологичными Т-клетками). Альтернативно Т-клетки получают не от пациента, а от другого индивида. Разумеется, предпочтительно, если индивид является здоровым индивидом. Под «здоровым индивидом» авторы изобретения имеют в виду, что индивид имеет хорошее общее состояние здоровья, предпочтительно, чтобы он имел компетентную иммунную систему и, более предпочтительно, не страдал ни одним заболеванием, которое можно легко проконтролировать и выявить.
Клетками-мишенями in vivo для CD8-положительных Т-клеток в соответствии с настоящим изобретением могут быть клетки опухоли (которые иногда экспрессируют молекулы МНС II класса) и/или стромальные клетки, окружающие опухоль (опухолевые клетки) (которые иногда также экспрессируют молекулы МНС II класса;; (Dengjel et al., 2006)).
Т-клетки по настоящему изобретению могут быть использованы в качестве активных ингредиентов в терапевтической композиции. Таким образом, в изобретении предложен также способ уничтожения клеток-мишеней у пациента, чьи клетки-мишени аберрантно экспрессируют полипептид, включающий аминокислотную последовательность по изобретению, причем способ включает введение пациенту эффективного числа Т-клеток, как определено выше.
Под понятием «аберрантно экспрессированный» авторы изобретения подразумевают также, что полипептид экспрессирован в избытке по сравнению с нормальными уровнями экспрессии, или что ген является «молчащим» в ткани, из которой образовалась опухоль, однако он экспрессирован в опухоли. Под понятием «экспрессирован в избытке» авторы изобретения понимают, что полипептид представлен на уровне, который, по меньшей мере, в 1,2 раза выше уровня, представленного в нормальной ткани; предпочтительно, по меньшей мере, в 2 раза и, более предпочтительно, по меньшей мере, в 5 или 10 раз выше уровня, представленного в нормальной ткани.
Т-клетки могут быть получены способами, известными из уровня техники, к примеру, теми, что описаны выше.
Протоколы для этого так называемого адоптивного переноса Т-клеток хорошо известны из уровня техники. С обзорами можно ознакомиться в работах Gattioni и соавт. и Morgan и соавт. (Gattinoni et al., 2006; Morgan et al., 2006).
Другой аспект настоящего изобретения включает применение пептидов в комплексе с МНС для получения Т-клеточного рецептора, нуклеиновая кислота которого клонирована и введена в клетку-хозяин, предпочтительно Т-клетку. Данная сконструированная Т-клетка может быть затем введена пациенту для лечения рака.
Любая молекула по изобретению, т.е. пептид, нуклеиновая кислота, антитело, вектор экспрессии, клетка, активированная Т-клетка, Т-клеточный рецептор или нуклеиновая кислота, кодирующая его, пригодна для лечения нарушений, характеризующихся клетками, ускользающими от иммунного ответа. Поэтому любая молекула по настоящему изобретению может применяться в качестве медикамента или в производстве медикамента. Молекула может быть использована сама по себе или в комбинации с другой(ими) молекулой(ами) по изобретению или известной(ыми) молекулой(ами).
В настоящем изобретении также предложен комплект, включающий:
(а) контейнер, который содержит фармацевтическую композицию, как описанная выше, в виде раствора или в лиофилизированной форме;
(б) факультативно - второй контейнер, содержащий разбавитель или восстанавливающий раствор для лиофилизированного состава; и
(в) факультативно - инструкции по (i) применению раствора или (ii) восстановлению раствора и/или по применению лиофилизированного состава.
Кроме того, комплект может также включать один или более (iii) буферов, (iv) разбавителей, (v) фильтров, (vi) игл или (vii) шприцев. Контейнер является, предпочтительно, бутылью, флаконом, шприцем или пробиркой; и он может быть контейнером многоразового применения. Фармацевтическая композиция предпочтительно является лиофилизированной.
Комплект согласно настоящему изобретению предпочтительно включает лиофилизированный состав по настоящему изобретению в подходящем контейнере и инструкции для его восстановления и/или по его применению. Подходящие контейнеры включают, например, бутыли, флаконы, (например, двухкамерные флаконы), шприцы (такие как двухкамерные шприцы) и пробирки. Контейнер может быть изготовлен из разных материалов, таких как стекло или пластмасса. Предпочтительно, если комплект и/или контейнер содержит(ат) инструкции по применению контейнера или связанные с ним инструкции, которые дают указания по восстановлению и/или применению. Например, на этикетке может быть указано, что лиофилизированный состав должен быть восстановлен до таких концентраций пептидов, как описано выше. На этикетке далее может быть указано, что состав применяется или предназначается для подкожного введения.
Контейнер с составом может быть флаконом многоразового использования, который позволяет повторное введение (например, от 2 до 6 введений) восстановленного состава. Комплект может дополнительно включать второй контейнер, включающий подходящий разбавитель (например, раствор бикарбоната натрия).
После смешивания разбавителя и лиофилизированного состава окончательная концентрация пептида в восстановленном составе составляет предпочтительно по меньшей мере 0,15 мг/мл/пептида (=75 мкг) и, предпочтительно, не более чем 3 мг/мл/пептида (=1500 мкг). Комплект может дополнительно включать другие материалы, желательные с коммерческой и с точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Комплекты по настоящему изобретению могут включать один контейнер, который содержит лекарственную форму фармацевтических композиций в соответствии с настоящим изобретением с другими компонентами или без них (например, другие соединения или фармацевтические композиции этих других соединений) или может иметь отдельные контейнеры для каждого компонента.
Комплект по изобретению предпочтительно включает состав по изобретению, упакованный для применения в комбинации с совместным введением второго соединения (такого как адъюванты (например, ГМ-КСФ), химиотерапевтического средства, природного продукта, гормона или антагониста, средства против ангиогенеза или ингибитора ангиогенеза; апоптоз-индуцирующего средства или хелатора) или их фармацевтической композиции. Компоненты комплекта до введения пациенту могут быть предварительно смешаны, или же каждый компонент может находиться в отдельном контейнере. Компоненты комплекта могут быть предоставлены в виде одного или нескольких жидких растворов, предпочтительно, водного раствора, более предпочтительно, стерильного водного раствора. Компоненты комплекта также могут быть предоставлены в виде твердой формы, которая может быть превращена в жидкость при добавлении подходящих растворителей, которые, предпочтительно, предоставляются в другом, отдельном, контейнере.
Контейнер терапевтического комплекта может быть флаконом, пробиркой, колбой, бутылью, шприцем или любыми другими средствами, заключающими в себе твердое вещество или жидкость. Обычно, если имеется более одного компонента, комплект содержит второй флакон или другой контейнер, что позволяет произвести отдельное введение. Комплект может также содержать другой контейнер для фармацевтически приемлемой жидкости. Лечебный комплект будет предпочтительно содержать аппарат (например, одну или более игл, шприцы, глазные пипетки, пипетки и т.д.), который обеспечивает введение веществ по изобретению, которые являются компонентами настоящего комплекта.
Настоящий состав подходит для введения пептидов любым приемлемым способом, таким как оральный (энтеральный), назальный, глазной, подкожный, внутрикожный, внутримышечный, внутривенный или чрескожный способ. Предпочтительно, чтобы введение было п/к и, наиболее предпочтительно, введение в/к с помощью инфузионного насоса.
Так как пептиды по изобретению были выделены из клеток рака легких, медикамент по изобретению предпочтительно используется для лечения рака легких.
Кроме того, настоящее изобретение далее относится к способу получения персонализированного фармацевтического препарата (композиция) для отдельного пациента, включающий производство фармацевтической композиции, включающей по меньшей мере один пептид, выбранный из хранилища предварительно прошедших скрининг пептидов TUMAP, где по меньшей мере один пептид, используемый в фармацевтической композиции, выбран по его пригодности для отдельного пациента. В одном варианте осуществления фармацевтическая композиция является вакциной. Способ может быть адаптирован для получения Т-клеточных клонов для дальнейшего применения, например, при выделении TKP или растворимых антител или других методов лечения.
«Персонализированный фармацевтический препарат» подразумевает разработанные специально для отдельного пациента терапевтические средства, которые будут применяться исключительно для лечения такого пациента, включая активно персонализированные противораковые вакцины и средства адоптивной клеточной терапии с использованием аутологичной ткани пациента.
В контексте настоящего изобретения термин «хранилище» относится к группе или набору пептидов, которые предварительно прошли скрининг на иммуногенность и/или избыточную презентацию в конкретном виде опухоли. Понятие «хранилище» не подразумевает, что конкретные пептиды, включенные в вакцину, были изготовлены заблаговременно и хранились в реальном помещении, хотя эта возможность также принимается во внимание. Во внимание определенно принимается тот факт, что пептиды могут быть изготовлены de novo для каждой производимой индивидуализированной вакцины, или могут быть получены заранее и находиться на хранении. Хранилище (например, в форме банка данных) состоит из опухолеассоциированных пептидов, которые в высокой степени избыточно экспрессировались в опухолевой ткани пациентов с раком легких с различными HLA-A, HLA-B и HLA-C-аллелями. Оно может содержать пептиды, связанные с молекулами МНС I класса и МНС II класса или удлиненные пептиды, связанные с молекулами МНС I класса. Помимо опухолеассоциированных пептидов, собранных из нескольких тканей рака легких, хранилище может содержать маркерные пептиды, связанные с HLA-А*02 и HLA-А*24. Эти пептиды позволяют произвести количественное сравнение интенсивности Т-клеточного иммунного ответа, индуцированного пептидами TUMAP, и, следовательно, позволяют сделать важный вывод о способности вакцины вызывать противоопухолевые ответы. Во-вторых, они выполняют функцию важных пептидов положительного контроля, полученных «не из собственного» антигена в случае, если у пациента не наблюдаются вызванные вакциной Т-клеточные ответы на пептиды TUMAP, полученные из «собственных» антигенов. И в-третьих, оно может позволить сделать заключения относительно статуса иммунокомпетентности пациента.
Пептиды TUMAP для хранилища были идентифицированы с помощью интегрированного подхода функциональной геномики, комбинирующего анализ экспрессии генов, масс-спектрометрию и Т-клеточную иммунологию (XPresident ®). Этот подход гарантирует, что только те пептиды TUMAP, которые действительно присутствуют в большом проценте опухолей, но не экспрессируются или экспрессируются лишь минимально на нормальной ткани, были выбраны для последующего анализа. В целях первоначального отбора пептидов образцы ткани рака легких пациентов и кровь здоровых доноров были проанализированы поэтапно:
1. HLA-лиганды из злокачественного материала идентифицировали с помощью масс-спектрометрии.
2. Для идентификации экспрессированных в избытке генов в злокачественной ткани (рак легких) по сравнению с рядом нормальных органов и тканей применяли анализ экспрессии информационной рибонуклеиновой кислоты (мРНК) всего генома.
3. Идентифицированные HLA-лиганды сравнивали с данными по экспрессии генов. Пептиды, презентируемые в избытке или селективно презентируемые на опухолевой ткани, предпочтительно кодируемые селективно экспрессированными или экспрессированными в избытке генами, выявленными на этапе 2, считали подходящими TUMAP-кандидатами для мультипептидной вакцины.
4. Было произведено изучение литературы для выявления дополнительных свидетельств, подтверждающих релевантность идентифицированных в качестве TUMAP пептидов.
5. Релевантность избыточной экспрессии на уровне мРНК подтверждали повторным обнаружением выбранных на этапе 3 пептидов TUMAP на опухолевой ткани и отсутствием (или нечастым обнаружением) на здоровых тканях.
6. В целях оценки того, может ли быть осуществима индукция in vivo Т-клеточных ответов выбранными пептидами, были проведены анализы иммуногенности in vitro при использовании человеческих Т-клеток здоровых доноров, а также пациентов, больных раком легких.
В одном из аспектов пептиды предварительно прошли скрининг на иммуногенность до их включения в хранилище. В качестве примера, но не для ограничения изобретения, иммуногенность пептидов, включенных в хранилище, определяется способом, включающим прайминг Т-клеток in vitro посредством повторных стимуляций CD8+ Т-клеток здоровых доноров клетками, презентирующими искусственный антиген, нагруженными комплексами пептид-МНС и антителами к CD28.
Этот способ является предпочтительным для редких видов рака и пациентов с редким профилем экспрессии. В отличие от мультипептидных коктейлей с постоянным составом, уже разработанных на данное время, «хранилище» позволяет достигнуть существенно более высокого соответствия фактической экспрессии антигенов в опухоли составу вакцины. Выбранные отдельные пептиды или комбинации из нескольких «готовых к применению» пептидов будут использоваться для каждого пациента в рамках мультитаргетного подхода. Теоретически, подход, основанный на выборе, например, 5 различных антигенных пептидов из библиотеки из 50 экземпляров, уже приведет приблизительно к 17 миллионам возможных составов лекарственного препарата (ЛП).
В одном аспекте для включения в вакцину пептиды выбирают по их пригодности для отдельного пациента на основе способа в соответствии с настоящим изобретением, как описано в настоящем документе или как изложено ниже.
Фенотип HLA, данные транскриптомики и протеомики собирают с опухолевого материала и образцов крови пациентов для идентификации наиболее подходящих пептидов для каждого пациента, в состав которых входят пептиды TUMAP как из хранилища, так и уникальные для пациента (т.е. мутированные). Выбирать будут те пептиды, которые селективно или избыточно экспрессируются в опухолях пациентов и, где это возможно, проявляют сильную иммуногенность in vitro при анализе с индивидуальными МКПК пациента.
Предпочтительно, чтобы пептиды, включенные в вакцину, были идентифицированы способом, включающим: (а) идентификацию опухолеассоциированных пептидов (TUMAP), презентируемых опухолевым образцом отдельного пациента; (б) сравнение идентифицированных на этапе (а) пептидов с хранилищем (банком данных) пептидов, как описано выше; и (в) выбор по меньшей мере одного пептида из хранилища (банка данных), который коррелирует с опухолеассоциированным пептидом, идентифицированным у пациента. Например, пептиды TUMAP, презентируемые опухолевым образцом, идентифицируют с помощью: (а1) сравнения данных по экспрессии в опухолевом образце сданными нормальной ткани, соответствующей типу ткани опухолевого образца, для идентификации белков, которые в опухолевом образце экспрессируются в избытке или аберрантно; и (а2) установления корреляции между данными экспрессии и последовательностями лигандов МНС, связанных с молекулами МНС I и/или II класса в опухолевом образце, в целях идентификации лигандов МНС, которые получены из белков, избыточно или аберрантно экспрессируемых опухолью. Предпочтительно, если последовательности лигандов МНС идентифицируются с помощью элюирования связанных пептидов из молекул МНС, выделенных из опухолевого образца, и секвенирования элюированных лигандов. Предпочтительно, если опухолевый образец и нормальная ткань получены от одного и того же пациента.
Помимо этого, или в качестве альтернативы этому, при выборе пептидов с использованием модели хранилища (банка данных) пептиды TUMAP могут быть идентифицированы у пациента de novo и затем быть включены в вакцину. В качестве одного примера: пептиды-кандидаты TUMAP могут быть идентифицированы у пациента с помощью (а1) сравнения данных по экспрессии в опухолевом образце с данными нормальной ткани, соответствующей типу ткани опухолевого образца, для идентификации белков, которые в опухолевом образце экспрессируются в избытке или аберрантно; и (а2) установления корреляции между данными экспрессии и последовательностями лигандов МНС, связанных с молекулами МНС I и/или II класса в опухолевом образце, в целях идентификации лигандов МНС, которые получены из белков, избыточно или аберрантно экспрессируемых опухолью. В качестве другого примера: могут быть идентифицированы белки, имеющие мутации, являющиеся уникальными для опухолевого образца, соотносимого с соответствующей нормальной тканью отдельного пациента, и могут быть идентифицированы пептиды TUMAP, специфической мишенью которых является мутация. Например, геном опухоли и соответствующей нормальной ткани могут быть секвенированы методом полногеномного секвенирования: для обнаружения несинонимичных мутаций на кодирующих белок участках генов геномную ДНК и PHK экстрагируют из опухолевых тканей, а нормальную, не имеющую мутаций геномную ДНК зародышевой линии экстрагируют из мононуклеарных клеток периферической крови (МПК). Применяемый подход секвенирования нового поколения (NGS) заключается в повторном секвенировании кодирующих белок участков (повторное секвенирование экзома). В этих целях экзонную ДНК из человеческих образцов фиксируют с помощью поставляемых изготовителем наборов для обогащения целевыми фрагментами, за чем следует секвенирование, например, с помощью системы HiSeq2000 (Illumina). В дополнение к этому опухолевую мРНК секвенируют для прямого количественного определения генной экспрессии и подтверждения того, что мутировавшие гены экспрессированы в опухолях пациентов. Считывание полученных в результате миллионов последовательностей осуществляется алгоритмами программного обеспечения. Получаемый список содержит мутации и экспрессию генов. Опухолеспецифические соматические мутации определяют сравнением с вариантами зародышевой линии из МПК и устанавливают приоритетность. Идентифицированные de novo пептиды могут быть затем испытаны на иммуногенность, как описывается выше в случае хранилища, и пептиды-кандидаты TUMAP, обладающие подходящей иммуногенностью, выбирают для включения в вакцину.
В отдельном варианте осуществления изобретения пептиды, включенные в вакцину, идентифицируют с помощью: (а) идентификации опухолеассоциированных пептидов (TUMAP), презентируемых опухолевым образцом отдельного пациента способами, описанными выше; (б) сравнения пептидов, идентифицированных на этапе (а) с хранилищем пептидов, как описано выше, которые предварительно прошли скрининг на иммуногенность и избыточную презентацию в опухолях по сравнению с соответствующими нормальными тканями; (в) выбора по меньшей мере одного пептида из хранилища, который коррелирует с опухолеассоциированным пептидом, идентифицированным у пациента; и (г) факультативно, выбора по меньшей мере одного пептида, идентифицированного de novo на этапе (а) с подтверждением его иммуногенности.
В отдельном варианте осуществления изобретения пептиды, включенные в вакцину, идентифицируют с помощью: (а) идентификации опухолеассоциированных пептидов (TUMAP), презентируемых опухолевым образцом отдельного пациента; и (б) выбора по меньшей мере одного пептида, идентифицированного de novo на этапе (а) и подтверждения его иммуногенности.
После того, как отобраны пептиды для персонализированной вакцины на основе пептидов, изготавливают вакцину. Вакцина - это предпочтительно жидкая лекарственная форма, состоящая из отдельных пептидов, растворенных в ДМСО в концентрации 20-40%, предпочтительно около 30-35%, такой как около 33% ДМСО.
Каждый пептид, включаемый в продукт, растворяют в ДМСО. Концентрация отдельных пептидных растворов должна выбираться в зависимости от числа пептидов, предназначенных для включения в продукт. Растворы отдельных пептидов в ДМСО смешивают в равном соотношении для получения раствора, содержащего все пептиды, предназначенные для включения в продукт, с концентрацией ~2,5 мг/мл на пептид. Смешанный раствор затем разбавляют водой для инъекций в соотношении 1:3 для достижения концентрации 0,826 мг/мл на пептид в 33% ДМСО. Разбавленный раствор фильтруют через стерильный фильтр с размером пор 0,22 мкм. Получают конечный нерасфасованный раствор.
Конечный нерасфасованный раствор разливают во флаконы и хранят при -20°C до использования. Один флакон содержит 700 мкл раствора, содержащего 0,578 мг каждого пептида. Из них 500 мкл (прибл. 400 мкг на пептид) будут вводить с помощью внутрикожной инъекции.
Кроме того, пептиды по настоящему изобретению пригодны не только для лечения рака, но и также в качестве диагностических средств. Так как пептиды были получены из клеток рака легкого, и так как было определено, что данные пептиды не присутствуют или присутствуют в небольшом количестве в нормальных тканях, то эти пептиды могут быть использованы для диагностики наличия рака.
Присутствие заявленных пептидов на тканевых биоптатах и в образцах крови может помочь патоморфологу в постановке диагноза рака. Выявление конкретных пептидов с помощью антител, масс-спектрометрии или других методов, известных из уровня техники, могут дать патоморфологу свидетельства того, что образец ткани является злокачественной или воспаленной или пораженной заболеванием вообще, или же может использоваться в качестве биомаркера рака легких. Присутствие групп пептидов может позволить классифицировать или выделить подклассы пораженных тканей.
Обнаружение пептидов на образцах пораженной заболеванием ткани может позволить принять решение о пользе от терапии, воздействующей на иммунную систему, в особенности, если Т-лимфоциты, как известно или ожидается, задействованы в механизме действия. Отсутствие экспрессии МНС является хорошо описанным механизмом, при котором инфицированные или злокачественные клетки уклоняются от иммунного контроля. Таким образом, присутствие пептидов показывает, что этот механизм не используется проанализированными клетками.
Пептиды по настоящему изобретению могут использоваться в анализе ответов лимфоцитов на действие этих пептидов, таких как Т-клеточные ответы или ответы в виде антител к пептиду или пептиду в комплексе с молекулами МНС. Данные ответы лимфоцитов могут использоваться в качестве прогностических маркеров для принятия решения о дальнейших этапах терапии. Данные ответы могут также использоваться в качестве суррогатных маркеров ответов в иммунотерапевтических подходах, направленных на индуцирование ответов лимфоцитов с помощью различных средств, например, вакцинации белком, нуклеиновыми кислотами, аутологичными материалами, адоптивным переносом лимфоцитов. В условиях, когда проводится генная терапия, в целях оценки побочных эффектов могут быть проанализированы ответы лимфоцитов на пептиды. Мониторинг реакций лимфоцитов может также быть ценным инструментом для обследований в рамках последующего наблюдения после трансплантации, к примеру, для выявления реакций «хозяин против трансплантата» и «трансплантат против хозяина».
Настоящее изобретение будет описано ниже с помощью примеров, которые описывают его предпочтительные варианты осуществления, со ссылкой на сопровождающие фигуры, тем не менее, не ограничивая объема изобретения. В соответствии с целями настоящего изобретения все цитируемые источники включены в данное описание во всей полноте путем ссылки.
На Фигурах:
На Фигурах 1A-D представлена избыточная презентация различных пептидов в нормальных тканях и образцах НМРЛ. На Фигурах 1E-F представлены все клеточные линии, нормальные ткани и раковые ткани, на которых были обнаружены отдельные пептиды (FVFSFPVSV, SEQ ID NO: 4 (А*02) и YYTKGFALLNF, SEQ ID NO: 29 (А*24)). Фигура 1А - ген: SLC6A14, пептид: FLIPYAIML (А*02; SEQ ID NO.:2) - ткани слева направо: 1 жировая ткань, 3 надпочечные железы, 5 артерий, 3 костных мозга, 8 головных мозгов, 3 молочных железы, 13 толстых кишок, 1 двенадцатиперстная кишка, 7 пищеводов, 2 желчных пузыря, 5 сердец, 16 почек, 4 образца лейкоцитов, 21 печень, 1 лимфатический узел, 1 яичник, 7 поджелудочных желез, 2 периферических нерва, 1 брюшина, 1 гипофиз, 1 плацента, 3 плевры, 6 прямых кишок, 2 слюнные железы, 3 скелетных мышцы, 3 образца кожи, 2 тонких кишки, 4 селезенки, 7 желудков, 3 семенника, 2 вилочковые железы, 3 щитовидные железы, 1 мочеточник, 2 матки, 2 вены, 46 легких, 91 НМРЛ. Этот пептид также был обнаружен на клетках рака поджелудочной железы, желудка, колоректального рака, рака пищевода (не показано). Фигура 1B - ген: COL6A3, пептид: FLFDGSANL (А*02; SEQ ID NO.:13) - ткани слева направо: 1 жировая ткань, 3 надпочечные железы, 5 артерий, 3 костных мозга, 8 головных мозгов, 3 молочных железы, 13 толстых кишок, 1 двенадцатиперстная кишка, 7 пищеводов, 2 желчных пузыря, 5 сердец, 16 почек, 4 образца лейкоцитов, 21 печень, 1 лимфатический узел, 1 яичник, 7 поджелудочных желез, 2 периферических нерва, 1 брюшина, 1 гипофиз, 1 плацента, 3 плевры, 6 прямых кишок, 2 слюнные железы, 3 скелетных мышцы, 3 образца кожи, 2 тонких кишки, 4 селезенки, 7 желудков, 3 семенника, 2 вилочковые железы, 3 щитовидные железы, 1 мочеточник, 2 матки, 2 вены, 46 легких, 91 НМРЛ. Этот пептид также был обнаружен на клетках рака предстательной железы, молочной железы, колоректального рака, рака печени, меланомы, рака яичника, пищевода, поджелудочной железы, желудка (не показано). Фигура 1С - ген: CCL18, пептид: VYTSWQIPQKF (А*24; SEQ ID NO.:23) - ткани слева направо: 2 надпочечные железы, 1 артерия, 4 головных мозга, 1 молочная железа, 5 толстых кишок, 1 сердце, 13 почек, 9 печеней, 3 поджелудочные железы, 1 гипофиз, 2 прямые кишки, 3 образца кожи, 1 селезенка, 12 желудков, 1 вилочковая железа, 2 матки, 9 легких, 80 НМРЛ. Пептид также был обнаружен на клетках рака предстательной железы, рака желудка (не показано). Фигура 1D - ген: CENPN, пептид: RYLDSLKAIVF (А*24; SEQ ID NO.:28) - ткани слева направо: 2 надпочечные железы, 1 артерия, 4 головных мозга, 1 молочная железа, 5 толстых кишок, 1 сердце, 13 почек, 9 печеней, 3 поджелудочные железы, 1 гипофиз, 2 прямые кишки, 3 образца кожи, 1 селезенка, 12 желудков, 1 вилочковая железа, 2 матки, 9 легких, 80 НМРЛ. Этот пептид также был обнаружен на клетках рака печени, рака желудка, ПКК (не показано). Фигура 1Е - ген: DUSP4, пептид: FVFSFPVSV (А*02; SEQ ID NO.:4) - ткани слева направо: 5 клеточных линий поджелудочной железы, 3 образца кожи, 15 нормальных тканей (2 пищевода, 7 легких, 3 селезенки, 3 желудка), 126 раковых тканей (1 рак головного мозга, 2 рака молочной железы, 5 раков толстой кишки, 5 раков пищевода, 2 рака желчного пузыря, 8 раков почки, 5 раков печени, 58 раков легких, 11 раков яичника, 9 раков поджелудочной железы, 2 рака предстательной железы, 1 рак прямой кишки, 4 рака кожи, 12 раков желудка, 1 рак яичка). Набор нормальных тканей был таким же, как и в А-В, но ткани, на которых пептид не был выявлен, не показаны. Фигура 1F - ген: PLOD2, пептид: YYTKGFALLNF (А*24; SEQ ID NO.:29) - ткани слева направо: 30 раковых тканей (1 рак головного мозга, 3 рака почки, 2 рака печени, 22 рак легких, 2 рака желудка), Набор нормальных тканей был таким же, как и в C-D, но ткани, на которых пептид не был выявлен, не показаны. На Фигуре 1G показана избыточная презентация пептида А*24 в нормальных тканях и образцах НМРЛ. Ген: LAMP3, пептид: RFMDGHITF (А*24; SEQ ID NO.:25) - ткани слева направо: 2 надпочечные железы, 1 артерия, 4 головных мозга, 1 молочная железа, 5 толстых кишок, 1 сердце, 13 почек, 9 печеней, 3 поджелудочные железы, 1 гипофиз, 2 прямые кишки, 3 образца кожи, 1 селезенка, 12 желудков, 1 вилочковая железа, 2 матки, 9 легких, 80 НМРЛ. Пептид также был обнаружен на клетках рака предстательной железы, рака желудка (не показано).
На Фигуре 2 представлены примеры профилей экспрессии (относительная экспрессия в сравнении с нормальной почкой) исходных генов настоящего изобретения, которые в высокой степени экспрессированы в избытке или исключительно экспрессированы в клетках рака легких в панели образцов нормальных тканей и 38 образцах рака легких. Ткани слева направо: надпочечная железа, артерия, костный мозг, головной мозг (целиком), молочная железа, толстая кишка, пищевод, сердце, почка (три повторных измерения), лейкоциты, печень, легкие, лимфатический узел, яичник, поджелудочная железа, плацента, предстательная железа, слюнная железа, скелетная мышца, кожа, тонкая кишка, селезенка, желудок, семенник, вилочковая железа, щитовидная железа, мочевой пузырь, шейка матки, матка, вена, 1 образец нормальной (здоровой) ткани легких, 38 образцов НМРЛ. А) SMC4, В) LAMB3; С) ММР12 и D) LAMP3.
На Фигуре 3 показаны типичные данные по иммуногенности: результаты проточного цитометрического анализа после пептид-специфического окрашивания мультимеров. A) SLC1A4-001 (SEQ ID No. 12), В) IGF2BP3-001 (SEQ ID No. 120), С) LAMC2-001 (SEQ ID No. 121), D) COL6A3-008 (SEQ ID No. 13) и E) LAMP3-001 (SEQ ID No. 25).
На Фигуре 4 представлены результаты пролиферации CD4+ Т-клеток после стимуляции антигенами: На Фигуре показано число положительных доноров для каждого пептида.
На Фигуре 5 представлены примеры CD4 Т-клеточного ответа на введение вакцины против СЕА-006, выявленного методом внутриклеточного окрашивания (ICS) II класса. После сенсибилизации in vitro МКПК пациента 36-031 были проанализированы на наличие CD4 Т-клеточных ответов на СЕА-006 (верхняя часть) и на имитатор (нижняя часть) во временной точке, совпадающей для Визита 8 и EOS. Клетки были простимулированы соответствующими пептидами и окрашены маркерами жизнеспособности, антителами к CD3, антителами к CD8, антителами к CD4 и эффекторными маркерами (справа налево: CD154, TNF-альфа, IFN-гамма, ИЛ-2, ИЛ-10), соответственно. Для жизнеспособных Т-клеток CD4 анализировали долю клеток, положительных по отношению к одной или нескольким эффекторным молекулам.
На Фиг. 6 показана иммуногенность контрольных пептидов II класса: График показывает уровень иммунных ответов на 5 пептидов II класса, выявленных у 16 пациентов в ответ на стимуляцию пептидами IMA950 и у 71 пациента в ответ на стимуляцию пептидами IMA910 с помощью ICS.
ПРИМЕРЫ
ПРИМЕР 1
Идентификация и количественное определение опухолеассоциированных пептидов, презентируемых на поверхности клетки
Образцы тканей
Опухолевые ткани пациентов были получены из Университетской клиники г. Гейдельберг; Университетской клиники г. Мюнхена. Нормальные (здоровые) ткани были получены из компаний Bio-Options Inc., Калифорния, США; BioServe, Белтсвиль, Мэриленд, США; Capital BioScience Inc., Роквиль, Мэриленд, США; Geneticist Inc., Глендейл, Калифорния, США; Университетской клиники г. Женевы; Университетской клиники г. Гейдельберг; Медицинского университета префектуры Киото (KPUM); Осакского университета (OCU); Университетской клиники г. Мюнхена; компании ProteoGenex Inc., Кальвер-Сити, Калифорния, США; Университетской клиники г. Тюбинген.
Перед проведением хирургического операции или аутопсии было получено информированное согласие всех пациентов в письменной форме. Сразу же после удаления ткани были подвергнуты шоковой заморозке и хранились до выделения TUMAP-пептидов при температуре -70°C или ниже.
Выделение пептидов HLA из образцов тканей
Пулы пептидов HLA из подвергнутых шоковой заморозке образцов тканей были получены методом иммунопреципитации из плотных тканей в соответствии с незначительно измененным протоколом (Falk et al., 1991; Seeger et al., 1999) при использовании HLA-А*02-специфического антитела ВВ7.2 или HLA-A, -В, -С-специфического антитела W6/32, CNBr-активированной сефарозы, кислотной обработки и ультрафильтрации.
Масс-спектрометрический анализ
Полученные пулы комплексов пептид-HLA были разделены в соответствии с их гидрофобностью обратнофазовой хроматографией (nanoAcquity UPLC system, Waters), и элюированные пептиды анализировали на гибридных масс-спектрометрах LTQ-velos и -fusion (ThermoElectron), снабженном источником ESI. Пулы пептидов наносили непосредственно на аналитическую микрокапиллярную колонку из плавленого кварца (75 мкм в/д × 250 мм) с обращеннофазовым сорбентом 1,7 мкм С18 (Waters) с применением скорости потока в 400 нл в минуту. Затем пептиды разделяли с использованием двухэтапного 180-минутного бинарного градиента от 10% до 33% растворителя В при скорости потока 300 нл в минуту. Для создания градиента использовали растворитель А (0,1% муравьиной кислоты в воде) и растворитель В (0,1% муравьиной кислоты в ацетонитриле). Позолоченный стеклянный капилляр (PicoTip, New Objective) использовали для введения в источник наноESI. Масс-спектрометры LTQ-Orbitrap работали в информационно-зависимом режиме с применением стратегии ТОР5. Вкратце, цикл сканирования начинался с полного сканирования с высокой точностью масс на спектрометре Orbitrap (R=30 000), за чем следовало сканирование МС/МС также на Orbitrap (R=7500) на 5 особенно многочисленных ионах-предшественниках с динамическим исключением отобранных ранее ионов. Тандемные масс-спектры интерпретировали при помощи программы SEQUEST с дополнительным контролем вручную. Идентифицированную пептидную последовательность подтверждали сравнением полученной картины фрагментации природного пептида с картиной фрагментации синтетического контрольного пептида с идентичной последовательностью.
Относительное количественное определение методом ЖХ/МС без изотопных меток проводили путем подсчета ионов, т.е. с помощью экстракции и анализа результатов ЖХ/МС (Mueller et al., 2007). Этот метод основан на предположении, что площадь пика ЖХ/МС сигнала пептида коррелирует с его концентрацией в образце. Извлеченные характеристики обрабатывали с помощью деконволюционного анализа состояния заряда и путем выравнивания времени удерживания (Mueller et al., 2008; Sturm et al., 2008). Наконец, все результаты спектров ЖХ/МС были сопоставлены методом перекрестных ссылок с результатами по идентификации последовательности, чтобы объединить количественные данные различных образцов и тканей в профили презентации пептидов. Количественные данные были нормализованы с применением двухуровневой системы в соответствии с центральной тенденцией с целью учета вариабельности внутри технических и биологических повторных измерений. Таким образом, каждый идентифицированный пептид может быть ассоциирован с количественными данными, позволяющими провести относительную количественную оценку образцов и тканей. Кроме того, все количественные данные, полученные для пептидов-кандидатов, были проконтролированы вручную в целях обеспечения взаимосогласованности данных и для проверки точности автоматического метода анализа. Для каждого пептида был рассчитан профиль презентации, показывающий средний уровень презентации в образце, а также вариабельность репликатов. В профиле сравниваются образцы раковой ткани легких с фоновым уровнем образцов нормальной ткани.
Профили презентации типичных пептидов, презентируемых в избытке, показаны на Фигуре 1. Показатели презентации отдельных пептидов показаны в Таблице 15 и Таблице 16.
Таблица 15: Показатели презентации. В таблице представлены пептиды HLA-А*02, которые в очень высокой степени избыточно презентируются на опухолях в сравнении с панелью нормальных тканей (+++), в высокой степени избыточно презентируются на опухолях в сравнении с панелью нормальных (здоровых) тканей (++) или избыточно презентируются на опухолях в сравнении с панелью нормальных тканей (+).



Таблица 16: Показатели презентации. В таблице представлены пептиды HLA-А*24, которые в очень высокой степени избыточно презентируются на опухолях в сравнении с панелью нормальных тканей (+++), в высокой степени избыточно презентируются на опухолях в сравнении с панелью нормальных тканей (++) или избыточно презентируются на опухолях в сравнении с панелью нормальных тканей (+).



ПРИМЕР 2
Определение профиля экспрессии генов, кодирующих пептиды по изобретению Избыточной презентации или специфической презентации пептида на опухолевых клетках по сравнению с нормальными клетками достаточно для его пригодности в иммунотерапии, и некоторые пептиды являются опухолеспецифическими, несмотря на присутствие их исходных белков также и в нормальных тканях. Тем не менее, выявление профилей экспрессии мРНК привносит дополнительный уровень безопасности при отборе пептидных мишеней для иммунотерапии. В особенности в случае терапевтических методов с высокой степенью риска для безопасности, таких как TKP с созревшей аффинностью, идеальный целевой пептид будет получен из белка, являющегося уникальным для опухоли и не встречающегося на нормальных тканях.
Источники и приготовление PHK
Хирургически удаленные тканевые препараты были предоставлены различными организациями, которые перечислены выше (см. Пример 1) после получения письменной формы информированного согласия от каждого пациента. Препараты опухолевой ткани были мгновенно заморожены после операции и впоследствии гомогенизированы с помощью ступки и пестика в жидком азоте. Суммарная PHK была приготовлена из данных образцов с использованием реагента TRI (Ambion, Дармштадт, Германия) с последующей очисткой на RNeasy (QIAGEN, Хильден, Германия); оба метода осуществлялись в соответствии с указаниями производителей.
Суммарная PHK здоровых человеческих тканей была куплена (Ambion, Хантингтон, Великобритания; Clontech, Гейдельберг, Германия; Stratagene, Амстердам, Нидерланды; BioChain, Хейард, Калифорния, США). PHK нескольких индивидов (от 2 до 123 индивидов) была смешана таким образом, что PHK каждого индивида имела равный вес.
Качество и количество всех образцов PHK оценивали на биоанализаторе Agilent 2100 (Agilent, Вальдбронн, Германия) с использованием набора RNA 6000 Pico LabChip Kit (Agilent).
Эксперименты с микрочипами
Анализ экспрессии генов всех образцов PHK из опухолевой и нормальной ткани был произведен с помощью олигонуклеотидных микрочипов Affymetrix Human Genome (HG) U133A или HG-U133 Plus 2.0 (Affymetrix, Санта Клара, Калифорния, США). Все этапы были выполнены в соответствии с руководством Affymetrix. Вкратце, двухнитевую кДНК синтезировали из 5-8 мкг суммарной PHK с использованием SuperScript RTII (Invitrogen) и олиго-dT-Т7 праймера (MWG Biotech, Эберсберг, Германия), как описывается в руководстве. Транскрипцию in vitro производили с использованием набора для мечения PHK-транскриптов BioArray High Yield RNA Transcript Labelling Kit (ENZO Diagnostics, Inc., Фармингейл, Нью-Йорк, США) для чипов U133A или набора GeneChip IVT Labelling Kit (Affymetrix) для чипов U133 Plus 2.0 с последующей фрагментацией, гибридизацией кPHK и окрашиванием стрептавидин-фикоэритрином и биотинилированным антистрептавидиновым антителом (Molecular Probes, Лейден, Нидерланды). Изображения сканировали на Agilent 2500А GeneArray Scanner (U133A) или Affymetrix Gene-Chip Scanner 3000 (U133 Plus 2.0), а данные анализировали в программе GCOS (Affymetrix) с использованием настроек по умолчанию для всех параметров. Для нормализации использовались 100 служебных генов, предоставленных Affymetrix. Относительные значения экспрессии были подсчитаны из отношений логарифмов зарегистрированных сигналов, полученных компьютерной программой, а значение для образца нормальной почки было произвольно задано значением 1,0. Типичные профили экспрессии исходных генов, предложенных в настоящем изобретении, которые в высокой степени экспрессированы в избытке или исключительно экспрессированы в клетках рака легких, представлены на Фигуре 2. Показатели экспрессии других отдельных генов показаны в Таблице 17 и Таблице 18.
Таблица 17: Показатели экспрессии. В таблице представлены пептиды HLA-А*02, которые в очень высокой степени избыточно экспрессируется в опухолях в сравнении с панелью нормальных тканей (+++), в высокой степени избыточно экспрессируется в опухолях в сравнении с панелью нормальных тканей (++) или избыточно экспрессируется в опухолях в сравнении с панелью нормальных тканей (+).


Таблица 18: Показатели экспрессии. В этой таблице представлены пептиды HLA-A*24, полученные из генов, которые в очень высокой степени избыточно экспрессируется в опухолях в сравнении с панелью нормальных тканей (+++), в высокой степени избыточно экспрессируется в опухолях в сравнении с панелью нормальных тканей (++) или избыточно экспрессируется в опухолях в сравнении с панелью нормальных тканей (+).

ПРИМЕР 3
Иммуногенность in vitro для пептидов, презентируемых МНС I класса
Для получения информации об иммуногенности пептидов TUMAP по настоящему изобретению заявители провели исследования с использованием прайминга Т-клеток in vitro на основе повторных стимуляций CD8+ Т-клеток искусственными антигенпрезентирующими клетками (иАПК), нагруженными комплексами пептид-МНС и антителом к CD28. Таким образом заявители могли показать иммуногенность для пока что 84 рестриктированных по HLA-A*02 пептидов TUMAP по изобретению, демонстрируя, что эти пептиды являются Т-клеточными эпитопами, против которых у человека имеются CD8+ Т-клетки-предшественники (Таблица 19).
Прайминг CD8+ Т-клеток in vitro
В целях проведения стимуляций in vitro искусственными антигенпрезентирующими клетками, нагруженными комплексом пептид-МНС (рМНС) и антителом к CD28, заявители сначала выделили CD8+ Т-клетки из свежего продукта лейкафереза HLA-A*02 методом позитивной селекции с помощью микросфер CD8 (Miltenyi Biotec, Бергиш-Гладбах, Германия). Кровь была получена от здоровых доноров (после подписания формы информированного согласия) из Университетской клиники г. Мангейм, Германия.
МКПК и выделенные CD8+ лимфоциты инкубировали до использования в Т-клеточной среде (ТСМ), состоящей из RPMI-Glutamax (Invitrogen, Карлсруэ, Германия) с добавлением 10% инактивированной нагреванием человеческой сыворотки АВ (PAN-Biotech, Эйденбах, Германия), 100 Ед/мл пенициллина / 100 мкг/мл стрептомицина (Cambrex, Кёльн, Германия), 1 мМ пирувата натрия (СС Pro, Обердорла, Германия) и 20 мкг/мл гентамицина (Cambrex). 2,5 нг/мл ИЛ-7 (PromoCell, Гейдельберг, Германия) и 10 Ед/мл ИЛ-2 (Novartis Pharma, Нюрнберг, Германия) также добавляли на этом этапе в среду ТСМ.
Получение микросфер, покрытых рМНС и антителами к CD28, стимуляции Т-клеток и считывание производили на хорошо исследованной системе in vitro, используя четыре различные молекулы рМНС для каждого цикла стимуляций и 8 различных молекул рМНС для каждого цикла считывания.
Очищенный костимуляторный IgG2a мыши к антителам человека CD28 Ab 9.3 (Jung et al., 1987) был химически биотинилирован с использованием сульфо-N-гидроксисукцинимидобиотина, как рекомендуется изготовителем (Perbio, Бонн, Германия).. Использованные микросферы представляли собой полистирольные частицы размером 5,6 мкм, покрытые стрептавидином (Bangs Laboratories, Иллинойс, США).
рМНС, использованные для положительных и отрицательных контрольных стимуляций, были А*0201/MLA-001 (пептид ELAGIGILTV (SEQ ID NO. 163) из модифицированного Melan-A/MART-1) и A*0201/DDX5-001 (YLLPAIVHI из DDX5, SEQ ID NO. 164), соответственно.
800000 микросфер / 200 мкл вносили в лунки 96-луночного планшета в присутствии 4×12,5 нг другого биотинилированного комплекса рМНС, промывали и затем добавляли 600 нг биотинилированных антител к CD28 в объеме 200 мкл. Стимуляцию проводили в 96-луночных планшетах путем совместной инкубации 1×106 CD8+ Т-клеток с 2×105 промытых покрытых микросфер в 200 мкл среды ТСМ с добавлением 5 нг/мл ИЛ-12 (PromoCell) в течение 3 дней при 37°C. Половина среды была затем заменена на свежую среду ТСМ с добавлением 80 Ед/мл ИЛ-2, и инкубация была продолжена в течение 4 дней при 37°C. Данный цикл стимуляций производили в общей сложности три раза. Для считывания с рМНС-мультимеров использовали 8 различных молекул рМНС на цикл. Использовался двумерный комбинаторный подход к кодировке, как было описано ранее (Andersen et al., 2012) с незначительными изменениями, относящимися к мечению с 5 различными флуорохромами. Наконец, проводили анализ мультимеров посредством окрашивания клеток набором для определения жизнеспособности клеток при воздействии ближнего ИК-излучения с красителем Live/dead (Invitrogen, Карлсруэ, Германия), клоном SK1 антител CD8-FITC (BD, Гейдельберг, Германия) и мультимерами рМНС с флуоресцентными метками. Для анализа использовали цитометр BD LSRII SORP, снабженный подходящими лазерами и фильтрами. Пептид-специфические клетки были подсчитаны как процентная доля от всех CD8+ клеток. Оценку результатов анализа мультимеров проводили с помощью программы FlowJo (Tree Star, Орегон, США). Прайминг in vitro специфических мультимер-положительных CD8+ лимфоцитов оценивали сравнением со стимуляциями отрицательного контроля. Иммуногенность для заданного антигена была определена, если было обнаружено, что по меньшей мере в одной подлежащей оценке простимулированной in vitro лунке одного здорового донора содержалась специфическая CD8+ Т-клеточная линия после стимуляции in vitro (т.е. когда данная лунка содержала по меньшей мере 1% специфичных мультимер-положительных среди CD8-положительных Т-клеток и процентная доля специфичных мультимер-положительных клеток была по меньшей мере в 10 раз выше медианного значения стимуляций отрицательного контроля).
Иммуногенность in vitro для пептидов рака легких
Для проанализированных пептидов, связанных с молекулами HLA I класса, иммуногенность in vitro могла быть продемонстрирована генерированием пептид-специфических Т-клеточных линий. Типичные результаты проточного цитометрического анализа после TUMAP-специфического окрашивания мультимеров для 3 пептидов по изобретению показаны на Фиг. 3 вместе с соответствующими отрицательными контролями. Результаты для 84 пептидов по изобретению обобщаются в Таблице 19.
Таблица 19: Иммуногенность in vitro пептидов по изобретению HLA-A*02
Отдельные результаты экспериментов по иммуногенности in vitro, проведенных заявителем для пептидов по изобретению. <20%=+; 20% - 49%=++; 50% -69%=+++; >=70%=++++



Таблица 20: Иммуногенность in vitro пептидов по изобретению HLA-А*24
Отдельные результаты экспериментов по иммуногенности in vitro, проведенных заявителем для пептидов по изобретению. <20%=+; 20% - 49%=++; 50% -69%=+++; >=70%=++++
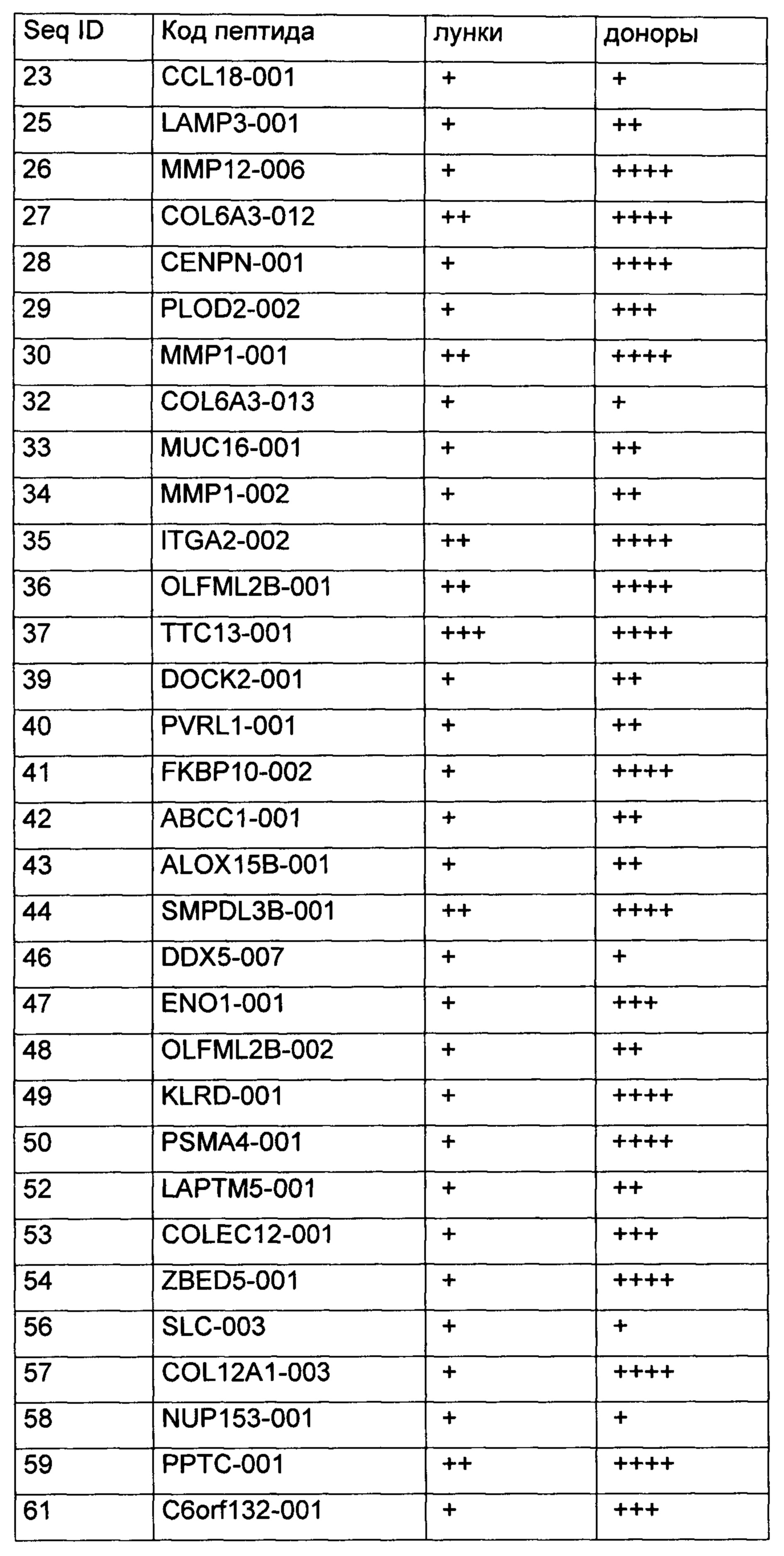

ПРИМЕР 4
Синтез пептидов
Все пептиды были синтезированы стандартным и общепринятым методом твердофазного синтеза пептидов с использованием Fmoc-методики. Идентичность и чистоту каждого отдельного пептида определяли с помощью масс-спектрометрии и аналитической ОФ ВЭЖХ. Были получены пептиды в виде белого или грязно-белого лиофилизата (соль трифторацетата) со степенью чистоты >85%. Все пептиды TUMAP предпочтительно вводят в виде солей трифторацетатов или ацетатов, возможны также другие фармацевтически приемлемые солевые формы.
ПРИМЕР 5
Анализ связывания МНС
Пептиды-кандидаты для Т-клеточной терапии в соответствии с настоящим изобретением далее были испытаны на их способность связываться с МНС (аффинность). Отдельные комплексы пептида и молекулы МНС были получены с помощью реакции обмена лигандами под воздействием УФ-излучения, при которой УФ-чувствительный пептид расщепляется под воздействием УФ-излучения, и получается продукт обмена с исследуемым пептидом. Только пептиды-кандидаты, которые могут эффективно связываться и стабилизировать восприимчивые к пептиду молекулы МНС, предотвращают диссоциацию комплексов с МНС. Для определения выхода продукта реакции обмена проводили анализ методом ELISA на основе обнаружения легкой цепи (β2m) стабилизированных комплексов с МНС. Этот анализ производили, в основном, как описано у Rodenko и соавт. (Rodenko et al., 2006).
В 96-луночные планшеты MAXISorp (NUNC) на ночь вносили 2 мкг/мл стрептавидина в PBS при комнатной температуре, промывали 4 раза и блокировали в течение 1 часа при 37°C в 2% БСА, содержащем блокирующий буфер. Полученные в результате рефолдинга мономеры HLA-A*02:01/MLA-001 служили в качестве стандарта, покрывающего диапазон 15-500 нг/мл. Мономерные комплексы пептид-МНС после реакции обмена под воздействием УФ-излучения 100-кратно разводили в блокирующем буфере. Образцы инкубировали в течение 1 ч при 37°C, промывали четыре раза, инкубировали в течение 1 ч при 37°C с 2 мкг/мл пероксидазы хрена, конъюгированной с антителом к β2m, снова промывали и проводили обнаружение с помощью раствора ТМБ; реакцию останавливали NH2SO4. Величину поглощения измеряли при длине волны 450 нм. Пептиды-кандидаты, которые демонстрировали высокий выход реакции обмена (предпочтительно более 50%, наиболее предпочтительно, более 75%) обычно являются предпочтительными для генерирования и получения антител или их фрагментов и/или Т-клеточных рецепторов или их фрагментов, поскольку они проявляют достаточную авидность по отношению к молекулам МНС и предотвращают диссоциацию комплексов МНС.

ПРИМЕР 6
Абсолютное количественное определение опухолеассоциированных пептидов, презентируемых на поверхности клетки
Получение связывающих компонентов, таких как антитела и/или TKP, является лабораторным процессом, который может проводиться лишь для ряда выбранных мишеней. В случае опухолеассоциированных и -специфических пептидов, критерии отбора включали, но не были ограничены, исключительностью презентации и плотностью пептида, презентируемого на поверхности клеток. В дополнение к выделению и относительному количественному определению пептидов, описанных в примере 1, заявители анализировали абсолютное число копий пептида на клетку. Количественное определение копий TUMAP на клетку в образцах солидных опухолей требует абсолютного количественного определения выделенного пептида TUMAP, эффективности выделения TUMAP и числа клеток проанализированного образца ткани. Этапы экспериментов описаны ниже.
Количественное определение пептида с помощью наноЖХ-МС/МС
Для точного количественного определения пептидов методом масс-спектрометрии проводили построение калибровочной кривой для каждого пептида при использовании метода внутреннего стандарта. Внутренний стандарт является вариантом каждого пептида с двойными изотопными метками, т.е. во время синтеза TUMAP были введены две аминокислоты с изотопными метками. От опухолеассоциированного пептида он отличается лишь по своей массе, но не имеет различий по другим физико-химическим свойствам (Anderson et al., 2012). Внутренний стандарт добавляли в известном количестве в каждый МС-образец, и все МС-сигналы были нормализованы относительно МС-сигнала внутреннего стандарта, чтобы сгладить потенциальные технические вариации МС-экспериментов. Калибровочные кривые были построены по меньшей мере в трех разных матрицах, т.е. элюатах пептида HLA из природных образцов, подобных обычным образцам для МС, и каждый препарат прошел два цикла измерений на МС. В целях оценки проводили нормализацию МС-сигналов относительно сигнала внутреннего стандарта и расчет калибровочной кривой методом логистической регрессии. Для количественного определения опухолеассоциированных пептидов из образцов тканей в соответствующие образцы также добавляли известное количество внутреннего стандарта; проводили нормализацию МС-сигналов относительно внутреннего стандарта и проводили количественное определение с помощью калибровочной кривой пептида.
Эффективность выделения комплексов пептид/МНС
Как в случае любого процесса очистки белков, выделение белков из образцов ткани связано с определенными потерями исследуемого белка. Для определения эффективности выделения пептида TUMAP для всех пептидов TUMAP, выбранных для абсолютного количественного определения, были получены комплексы пептид-МНС. Чтобы отличить комплексы пептид-МНС со стандартными добавками от комплексов с природным пептидом, использовали версии пептидов TUMAP с одной изотопной меткой, т.е. во время синтеза TUMAP вводили одну аминокислоту с изотопной меткой. Данные комплексы добавляли в качестве стандартной добавки в свежеприготовленные лизаты тканей, т.е. в самый ранний возможный момент процесса выделения пептида TUMAP, а затем проводили улавливание, как природных комплексов пептид-МНС в процессе последующей аффинной очистки. Таким образом, измерение степени извлечения однократно меченых пептидов TUMAP позволяет сделать заключения относительно эффективности выделения отдельных природных пептидов TUMAP. Эффективность выделения анализировали на небольшом числе образцов, и она была сопоставимой среди этих образцов тканей. Напротив, эффективность выделения отдельных пептидов различна. Поэтому можно предположить, что эффективность выделения, хотя она определялась только для ограниченного числа образцов тканей, может быть экстраполирована на любой другой препарат ткани. Тем не менее, необходимо проанализировать каждый пептид TUMAP в отдельности, поскольку эффективность выделения не может быть экстраполирована с одного пептида на другие.
Определение числа клеток в твердой замороженной ткани
В целях определения числа клеток образцов тканей, подлежащих абсолютному количественному определению пептида, авторы изобретения применяли анализ содержания ДНК. Этот метод применим к широкому диапазону образцов различного происхождения и, что наиболее важно, к замороженным образцам (Forsey and Chaudhuri, 2009; Alcoser et al., 2011; Silva et al., 2013). Во время выполнения протокола выделения образец ткани обрабатывают до получения гомогенного лизата, из которого берут небольшую аликвоту лизата. Аликвоту делят на три части, из которых выделяют ДНК (набор QiaAmp DNA Mini Kit, Qiagen, Хильден, Германия). Общее содержание ДНК из каждой процедуры выделения ДНК подвергается количественному определению с помощью количественного анализа ДНК на основе флуоресценции (набор для количественного анализа Qubit dsDNA HS, Life Technologies, Дармштадт, Германия) по меньшей мере на двух повторных циклах. В целях расчета числа клеток по результатам измерений на аликвотах отдельных здоровых клеток крови строят стандартную кривую для ДНК с диапазоном заданных количеств клеток. Стандартная кривая используется для расчета общего содержания клеток из общего содержания ДНК для каждой процедуры выделения ДНК. Среднее общее число клеток образца ткани, используемого для выделения пептида, экстраполируют с учетом известного объема аликвот лизата и общего объема лизата.
Число копий пептида на одну клетку
С помощью данных перечисленных ранее экспериментов авторы изобретения рассчитали число копий пептидов TUMAP на клетку, разделив общее количество пептида на общее число клеток в образце, а затем поделив на эффективность выделения. Число копий клеток для выбранных пептидов показано в Таблице 22.
Таблица 22: Абсолютное число копий. В таблице указаны результаты абсолютного количественного определения пептидов в опухолевых образцах НМРЛ. Медианное число копий на клетку указано для каждого пептида: <100=+; >=100=++; >=1,000+++; >=10,000=++++. Указано число образцов, для которых имеются поддающиеся оценке, высококачественные данные МС.


ПРИМЕР 6:
Анализ Т-клеточной пролиферации в ответ на пептиды HLA II класса
В последующем описании экспериментов обобщены результаты количественного анализа Т-клеточной пролиферации выбранных пептидов TUMAP МНС II класса. Девять из 10 испытанных пептидных антигенов дали положительные результаты по иммуногенности. Одиннадцать из 21 подлежащих оценке Т-клеточных образцов демонстрировали положительный ответ по меньшей мере на один пептид. Отдельные пептидные антигены стимулировали пролиферацию CD4+ Т-клеток у вплоть до 6 доноров. Эти показатели сравнимы с результатами для пяти контрольных пептидов, испытанных в тех же самых циклах анализа, и с иммуногенностью, продемонстрированной для большинства пациентов в условиях клинических исследований вакцин. Таким образом, можно сделать заключение, что недавно испытанные пептиды также обладают сильным потенциалом, чтобы индуцировать Т-клеточные ответы в рамках клинических испытаний вакцин.
Чтобы охарактеризовать выбранные пептиды в отношении их потенциала, в особенности в качестве кандидатов для включения в вакцины, с помощью анализа Т-клеточной пролиферации определяли их иммуногенность in vitro с использованием имеющегося в продаже набора для анализа Т-клеточной пролиферации компании Prolmmune.
Выбранные пептиды испытывали на образцах истощенных CD8 кровяных клеток здоровых доноров. Пептиды, индуцирующие пролиферацию CD4+ Т-клеток, могут потенциально привести к развитию иммунного ответа хелперных Т-клеток и, исходя из этого, рассматриваются как иммуногенные. Пролиферацию CD4+ Т-клеток определяли с помощью нанесения меток сукцинимидилового эфира карбоксифлуоресцеина (CFSE). Среди пролиферирующих клеток CFSE равномерно распределяется между делящимися клетками. Таким образом, пролиферация может быть измерена как снижение флуоресцентности CFSE в анализируемых клетках.

Принципы испытания
Образцы мононуклеарных клеток периферической крови (МКПК) здоровых доноров получали из банка клеток Prolmmune с учетом экспрессии аллеля HLA-DRB1. До использования CD8+ Т-клетки из образцов крови доноров подвергали истощению, чтобы избежать ложно-положительных ответов. Оставшиеся CD4+ Т-клетки метили CFSE и затем инкубировали с 5 мкМ каждого из выбранных пептидов. Параллельные измерения на каждом пептиде проводили в шести лунках. Фоновый уровень измеряли на каждом планшете в шести непростимулированных контрольных лунках.
После 7-дневного периода инкубации клетки совместно окрашивали антителом к CD4 и анализировали с помощью проточной цитометрии. Степень пролиферации определяли с помощью измерения снижения интенсивности CFSE.
Оценку данных проточной цитометрии проводили на программном обеспечении FlowJo (Tree Star, Inc.). Результаты цитометрического анализа выражены в виде соотношения популяции CD4+ dim-клеток к общей популяции CD4+ клеток. Степень пролиферации выражена в виде процентного соотношения стимуляции выше фонового значения, т.е. доля простимулированных антигеном CD4+ CFSE dim-клеток минус доля CD4+ CFSE dim-клеток из нестимулированных контрольных лунок. Для каждого образца рассчитывали среднее значение и соответствующее среднеквадратическую ошибку среднего значения (SEM) шести повторных измерений.
Отбор доноров
Доноров выбирали по экспрессии аллеля HLA-DRB1. Два других локуса HLA II класса (DQ и DP) в анализ включены не были. Интересующие аллели DRB1 выбирали в соответствии с предсказанной частотой связывания пептида на основе алгоритма SYFPEITHI (Rammensee et al., 1999). Для HLA-DR связывание определяли показателем связывания, предсказываемым SYFPEITHI, составляющим 18 или более. Это пороговое значение для показателя специфичности связывания было задано на основе анализа опубликованных показателей специфичности связывания для известных беспорядочно связывающихся лигандов HLA-DR (Таблица 24).
Таблица 24: Предсказанные SYFPEITHI показатели специфичности связывания для HLA-DR-связывания пептидов, которые, как было показано экспериментально, связываются с несколькими аллелями HLA-DR. Предсказанные показатели представлены только тогда, когда связывание с указанным DR-аллелем было продемонстрировано экспериментально. Если информация высокого разрешения о DR-аллеле отсутствует, эти случаи отмечены *, 23 из 26 (89%) показателей SYFPEITHI >=18, если связывание было экспериментально продемонстрировано для одного аллеля.

Для всех аллелей DRB1 с частотой связывания свыше 20% среди всех выбранных пептидов компанией Prolmmune был сделан запрос для включения в панель доноров. Дополнительно были запрошены 4 других редких аллеля DRB1 (DRB1*10:01, DRB1*16:01, DRB1*08:01 и DRB1*13:03). Укомплектованная панель доноров представлена на Таблице 26.
Таблица 25 Способность к связыванию выбранных пептидов с различными аллелями HLA-DRB1 с известным связывающим мотивом: Показатель SYFPEITHI свыше 17 считался 1 как одно событие связывания. Последний столбец показывает процентные доли событий связывания среди всех выбранных пептидов.

Таблица 26. Панель доноров. Распределение аллеля HLA-DRB1 у 21 выбранного донора

Результаты анализа иммуногенности in vitro
Простимулированная антигеном пролиферация CD4+ Т-клеток рассматривалась как индикатор иммуногенности in vitro и исследовалась с помощью имеющегося в продаже набора для анализа Т-клеточной пролиферации компании Prolmmune. Степень пролиферации простимулированных антигеном CD4+ Т-клеток выражена в виде процентной доли стимуляции выше фона. Ответ, представляющий стимуляцию на 0,02% выше фона со среднеквадратическим отклонением среднего значения SEM=2 (т.е. значения двух среднеквадратических ошибок среднего выше фона) считался положительным.
Девять из 10 выбранных пептидных антигенов (за исключением FN1-002) дали положительные результаты. Одиннадцать из 21 подлежащих оценке Т-клеточных образцов демонстрировали положительный ответ по меньшей мере на один пептид (Фигура 4). Отдельные пептидные антигены стимулировали пролиферацию CD4+ Т-клеток у вплоть до 6 доноров.
Сравнение иммуногенности in vivo и in vitro
В анализ Т-клеточной пролиферации в качестве положительного контроля были включены 5 пептидов с известной иммуногенностью in vivo. Иммуногенность этих пептидов in vivo определяли в образцах крови пациентов после введения вакцины из этих пептидов в рамках клинических исследований с помощью внутриклеточного окрашивания цитокинов (ICS) CD4 Т-клеток.
В принципе, анализы ICS исследуют качество конкретных Т-клеток в отношении эффекторных функций. Поэтому мононуклеарные клетки периферической крови (МКПК) повторно стимулировали in vitro исследуемым пептидом, контрольным пептидом и отрицательным контролем (здесь: MOCK). После этого повторно простимулированные клетки окрашивали для выявления выработки IFN-гамма, TNF-альфа, ИЛ-2 и ИЛ-10, а также экспрессии костимуляторной молекулы CD154. Подсчет окрашенных клеток производили на проточном цитометре (Фигура 5).
Анализ иммуногенности показал 100%-ый ответ иммунной системы при иммунизации пептидами IMA950 (BIR-002 и МЕТ-005) у 16 пациентов (исследование IMA950-101) и от 44% до 86% ответов иммунной системы на иммунизацию пептидами IMA910 (СЕА-006, TGFBI-004 и ММР-001) у 71 пациентов (исследование IMA910-101) (Фигура 6).
Результаты исследования иммуногенности in vitro пептидов с известной иммуногенностью in vivo сравнивали с выбранными пептидами (Таблица 27). Анализ показал, что пептиды положительного контроля стимулировали пролиферацию CD4+ Т-клеток в 7 из 21 исследованного образца доноров. Интенсивность ответа на стимуляцию в среднем находилась в диапазоне от 0,09 до 0,31% выше фонового значения среди вплоть до 4 образцов доноров на пептид. Например, интенсивность стимуляции для BIR-002 составила 0,24%. В различных клинических исследованиях было установлено, что BIR-002 является высоко иммуногенным. BIR-002 был испытан в качестве компонента пептидной вакцины, специфической для рака предстательной железы, в рамках клинического исследования с 19 подлежащими оценке пациентами, экспрессировавшими различные аллели HLA-DR (Feyerabend et al., 2009). У шестнадцати (84%) пациентов был выявлен сильный CD4+ Т-клеточный ответ на BIR-002 (Widenmeyer et al., 2008), демонстрируя его высокий иммуногенный потенциал. В клиническом исследовании IMA950, 100% (n=16) пациентов демонстрировали иммунный ответ на BIR-002.
При сравнении выбранные для настоящего анализа пептиды, за исключением FN1-002, стимулировали пролиферацию CD4+ Т-клеток в сумме в 11 исследованных образцах доноров. Таким образом, интенсивность ответа на стимуляцию в среднем варьировалась от 0,19 до 0,48% выше фонового уровня у вплоть 6 доноров на пептид. Данные значения были соотносимы с интенсивностью ответа на стимуляции высоко иммуногенным пептидом BIR-002. Интересно отметить, что для всех пептидов положительного контроля доля положительных образцов доноров в анализе иммуногенности in vitro (диапазон: 4-19%) была существенно ниже фракции пациентов, дающих иммунный ответ на эти пептиды в клинических исследованиях (диапазон: 44-100%). Это наблюдение указывает на то, что имеющийся протокол проведения анализа иммуногенности in vitro является достаточно консервативным и, скорее всего, занижает уровень иммуногенности пептидов в клинических условиях. Таким образом, можно ожидать, что 9 из 10 исследованных пептидов с высокой вероятностью будут вызывать иммунный ответ in vivo в клинических исследованиях у большинства пациентов.
Таблица 27. Результаты определения пролиферации Т-клеток под действием выбранных пептидов и пептидов положительного контроля с известной иммуногенностью in vivo.

Список цитируемй литературы
Aaltonen, K. et al., Br. J Cancer 100 (2009): 1055-1060
Abdelzaher, E. et al., Tumour.Biol. (2015)
Acuff, H.B. et al., Cancer Research 66 (2006): 7968-7975
Adhikary, G. et al., PLoS.ONE. 8 (2013): e84324
Agarwal, R. et al., Clinical Cancer Research 15 (2009): 3654-3662
Alcoser, S.Y. et al., BMC.Biotechnol. 11 (2011): 124
Allison, J.P. et al., Science 270 (1995): 932-933
Andersen, R.S. et al., Nat.Protoc. 7 (2012): 891-902
Anderson, N.L. et al., J Proteome.Res 11 (2012): 1868-1878
Appay, V. et al., Eur. J Immunol. 36 (2006): 1805-1814
Asteriti, I.A. et al., Biochim.Biophys.Acta 1806 (2010): 230-239
Badiglian, Filho L. et al., Oncol Rep. 21 (2009): 313-320
Bae, J.S. et al., Biochem.Biophys.Res.Commun. 294 (2002): 940-948
Bafna, S. et al., Oncogene 29 (2010): 2893-2904
Banchereau, J. et al., Cancer Res. 61 (2001): 6451-6458
Bargo, S. et al., Biochem.Biophys.Res Commun. 400 (2010): 606-612
Bartsch, S. et al., J Neurosci. 12 (1992): 736-749
Beatty, G. et al., J Immunol 166 (2001): 2276-2282
Beggs, J.D., Nature 275 (1978): 104-109
Begnami, M.D. et al., Hum.Pathol. 41 (2010): 1120-1127
Beljan, Perak R. et al., Diagn.Pathol. 7 (2012): 165
Benaglio, P. et al., Hum.Mutat. 32 (2011): E2246-E2258
Benjamini, Y. et al., Journal of the Royal Statistical Society.Series В (Methodological), Vol. 57 (1995): 289-300
Bergner, A. et al., J Exp.Clin Cancer Res. 28 (2009): 25
Berndt, A. et al., Histochem.Cell Biol. 133 (2010): 467-475
Berthon, P. et al., Am. J Hum.Genet. 62 (1998): 1416-1424
Bird, A.W. et al., J Cell Biol. 182 (2008): 289-300
Blanco, M.A. et al., Cell Res 22 (2012): 1339-1355
Blatch, G.L. et al., BioEssays 21 (1999): 932-939
Bossard, C. et al., Int. J Cancer 131 (2012): 855-863
Bostrom, P. et al., BMC.Cancer 11 (2011): 348
Boulter, J.M. et al., Protein Eng 16 (2003): 707-711
Bragulla, H.H. et al., J Anat. 214 (2009): 516-559
Braumuller, H. et al., Nature (2013)
Brossart, P. et al., Blood 90 (1997): 1594-1599
Bruckdorfer, T. et al., Curr.Pharm.Biotechnol. 5 (2004): 29-43
Byrne, A. et al., Exp.Cell Res 316 (2010): 258-271
Calabrese, F. et al., Pathology 44 (2012): 192-198
Cao, Y. et al., Cancer Lett. (2015)
Capello, M. et al., FEBS J 278 (2011): 1064-1074
Cappello, P. et al., Int J Cancer 125 (2009): 639-648
Card, K.F. et al., Cancer Immunol.Immunother. 53 (2004): 345-357
Carroll, C.W. et al., Nat Cell Biol. 11 (2009): 896-902
Cataldo, D.D. et al., Cell Mol.Biol. (Noisy.-le-grand) 49 (2003): 875-884
Cedres, S. et al., Clin Lung Cancer 12 (2011): 172-179
Cervantes, M.D. et al., Mol.Cell Biol. 26 (2006): 4690-4700
Chakraborti, S. et al., Mol.Cell Biochem. 253 (2003): 269-285
Chami, M. et al., Oncogene 19 (2000): 2877-2886
Chandler, S. et al., Biochem.Biophys.Res Commun. 228 (1996): 421-429
Chang, G.C. et al., Clinical Cancer Research 12 (2006): 5746-5754
Chanock, S.J. et al., Hum.lmmunol. 65 (2004): 1211-1223
Chen, D.R. et al., Anticancer Res. 30 (2010): 4135-4140
Chen, G. et al., Biomed.Res Int. 2014 (2014): 230183
Chen, J. et al., Cancer Cell 19 (2011): 541-555
Chen, M.F. et al., J Mol.Med 87 (2009): 307-320
Chen, P. et al., J Mol.Histol. 43 (2012): 63-70
Chen, Q. et al., Mediators.Inflamm. 2013 (2013): 928315
Chen, Z.S. et al., FEBS J 278 (2011): 3226-3245
Cheon, D.J. et al., Clin.Cancer Res. 20 (2014): 711-723
Chiquet-Ehrismann, R., Semin.Cancer Biol. 4 (1993): 301-310
Chiquet-Ehrismann, R. et al., J Pathol. 200 (2003): 488-499
Cho, N.H. et al., Oncogene 23 (2004): 845-851
Choi, K.U. et al., Int J Cancer (2010)
Chung, F.Y. et al., J Surg.Oncol 102 (2010): 148-153
Cirak, Y. et al., Med.Oncol 30 (2013): 526
Cohen, C.J. et al., J Mol.Recognit. 16 (2003a): 324-332
Cohen, C.J. et al., J Immunol. 170 (2003b): 4349-4361
Cohen, S.N. et al., Proc.Natl.Acad.Sci.U.S.A 69 (1972): 2110-2114
Coligan, J.E. et al., Current Protocols in Protein Science (1995)
Colombetti, S. et al., J Immunol. 176 (2006): 2730-2738
Conde-Perezprina, J.C. et al., Oxid.Med.Cell Longev. 2012 (2012): 728430
Cooper, C.R. et al., J Cell Biochem. 104 (2008): 2298-2309
Cooper, W.A. et al., Histopathology 55 (2009): 28-36
Cordes, C. et al., Anticancer Res 30 (2010): 3541-3547
Creighton, C.J. et al., Mol.Cancer Res 3 (2005): 119-129
Da Forno, P.D. et al., Clinical Cancer Research 14 (2008): 5825-5832
Dai, T.Y. et al., J Exp.Clin Cancer Res 33 (2014): 64
Davidson, N.O., Keio J Med. 56 (2007): 14-20
de Souza Meyer, E.L. et al., Clin Endocrinol. (Oxf) 62 (2005): 672-678
De, Boeck A. et al., Proteomics. 13 (2013): 379-388
De, Luca P. et al., Mol Cancer Res 9 (2011): 1078-1090
De, Vriendt, V et al., Biomarkers 18 (2013): 516-524
Deeley, R.G. et al., Physiol Rev. 86 (2006): 849-899
Dengjel, J. et al., Clin Cancer Res. 12 (2006): 4163-4170
Denkberg, G. et al., J Immunol. 171 (2003): 2197-2207
Denli, A.M. et al., Nature 432 (2004): 231-235
Denys, H. et al., Br. J Cancer 90 (2004): 1443-1449
Dharmavaram, R.M. et al., Matrix Biol. 16 (1998): 343-348
Dolznig, H. et al., Cancer Immun. 5 (2005): 10
Dong, S. et al., J Neuropathol.Exp.Neurol. 64 (2005): 948-955
Drucker, K.L. et al., Genes Chromosomes.Cancer 48 (2009): 854-864
Dulak, A.M. et al., Nat Genet. 45 (2013): 478-486
Egloff, A.M. et al., Ann N.Y.Acad.Sci. 1062 (2005): 29-40
Ellsworth, R.E. et al., Clin.Exp.Metastasis 26 (2009): 205-213
Escobar-Hoyos, L.F. et al., Mod.Pathol. 27 (2014): 621-630
Espinosa, A.M. et al., PLoS.ONE. 8 (2013): e55975
Ewald, J.A. et al., PLoS.ONE. 8 (2013): e55414
Falk, K. et al., Nature 351 (1991): 290-296
Fang, W.Y. et al., Acta Biochim.Biophys.Sin. (Shanghai) 37 (2005): 541-546
Fang, Z.Q. et al., Genet.Mol.Res. 12 (2013): 1479-1489
Feng, C.J. et al., Anticancer Res 28 (2008): 3763-3769
Findeis-Hosey, J.J. et al., Biotech.Histochem. 87 (2012): 24-29
Findeis-Hosey, J.J. et al., Hum.Pathol. 41 (2010): 477-484
Fiorentini, C. et al., Exp.Cell Res 323 (2014): 100-111
Fong, L. et al., Proc.Natl.Acad.Sci.U.S.A 98 (2001): 8809-8814
Forsey, R.W. et al., Biotechnol.Lett. 31 (2009): 819-823
Freire, J. et al., Pathol.Res.Pract. 210 (2014): 879-884
Fuchs, В.C. et al., Am.J Physiol Gastrointest.Liver Physiol 286 (2004): G467-G478
Fuchs, F. et al., Mol Syst.Biol. 6 (2010): 370
Fujita, A. et al., Virchows Arch. 460 (2012): 163-169
Fukuda, T. et al., J Histochem.Cytochem. 55 (2007): 335-345
Fukunaga-Kalabis, M. et al., Oncogene 29 (2010): 6115-6124
Fuller-Pace, F.V., RNA.Biol. 10 (2013): 121-132
Furukawa, T. et al., Sci.Rep. 1 (2011): 161
Furutani, Y. et al., Biochem.J 389 (2005): 675-684
Gabrilovich, D.I. et al., Nat.Med 2 (1996): 1096-1103
Garnett, M.J. et al., Nat.Cell Biol. 11 (2009): 1363-1369
Gattinoni, L. et al., Nat.Rev.Immunol. 6 (2006): 383-393
Ghosh, S. et al., Gynecol.Oncol 119 (2010): 114-120
Gibbs, M. et al., Am. J Hum.Genet. 64 (1999): 1087-1095
Gilkes, D.M. et al., Mol Cancer Res 11 (2013): 456-466
Gladhaug, I.P. et al., Histopathology 56 (2010): 345-355
Gnjatic, S. et al., Proc Natl.Acad.Sci.U.S.A 100 (2003): 8862-8867
Godkin, A. et al., Int.Immunol 9 (1997): 905-911
Gonzalez, A.L. et al., Hum.Pathol. 35 (2004): 840-849
Gooden, M. et al., Proc.Natl.Acad.Sci.U.S.A 108 (2011): 10656-10661
Gorrin Rivas, M.J. et al., Hepatology 28 (1998): 986-993
Gorrin-Rivas, M.J. et al., Ann Surg 231 (2000): 67-73
Graf, F. et al., Mini.Rev.Med.Chem. 10 (2010): 527-539
Graf, M. et al., Eur.J Haematol. 75 (2005): 477-484
Green, M.R. et al., Molecular Cloning, A Laboratory Manual 4th (2012)
Greenfield, E.A., Antibodies: A Laboratory Manual 2nd (2014)
Gregory, K.E. et al., J Bone Miner.Res. 16 (2001): 2005-2016
Grunda, J.M. et al., Clin Cancer Res. 16 (2010): 2890-2898
Grupp, K. et al., Mol Oncol 7 (2013): 1001-1011
Gupta, N. et al., Biochim.Biophys.Acta 1741 (2005): 215-223
Gupta, N. et al., Gynecol.Oncol 100 (2006): 8-13
Hagemann. T. et al., Eur.J Cancer 37 (2001): 1839-1846
Hamamoto, R. et al., Cancer Sci. 97 (2006): 113-118
Han, J. et al., Cell 125 (2006): 887-901
Hannisdal, K. et al., Head Neck 32 (2010): 1354-1362
Hatina, J. et al., Neoplasma 59 (2012): 728-736
He, P. et al., Cancer Sci. 98 (2007): 1234-1240
Hernandez, I. et al., Oncogene 29 (2010): 3758-3769
Hodgson, J.G. et al., Neuro Oncol 11 (2009): 477-487
Hofmann, H.S. et al., Am.J Respir.Crit Care Med. 170 (2004): 516-519
Hofmann, H.S. et al., Clinical Cancer Research 11 (2005): 1086-1092
Hood, F.E. et al., Bioarchitecture. 1 (2011): 105-109
Houghton, A.M. et al., Cancer Research 66 (2006): 6149-6155
Hourihan, R.N. et al., Anticancer Res 23 (2003): 161-165
Hu, Y. et al., Carcinogenesis 34 (2013): 176-182
Huang, C. et al., Cancer Epidemiol.Biomarkers Prev. 21 (2012a): 166-175
Huang, C.L. et al., J Clin Oncol 23 (2005): 8765-8773
Huang, M.Y. et al., DNA Cell Biol. 31 (2012b): 625-635
Huang, T. et al., Int.J Clin Exp.Pathol. 7 (2014): 1544-1552
Huo, J. et al., Arch.Dermatol.Res. 302 (2010): 769-772
Hwang, M.L. et al., J Immunol. 179 (2007): 5829-5838
Hwang, Y.S. et al., Head Neck 34 (2012): 1329-1339
Ida-Yonemochi, H. et al., Mod.Pathol. 25 (2012): 784-794
Imadome, K. et al., Cancer Biol.Ther 10 (2010): 1019-1026
Irigoyen, M. et al., Mol.Cancer 9 (2010): 130
Ishikawa, N. et al., Clin Cancer Res. 10 (2004): 8363-8370
Ishikawa, Y. et al., J Biol.Chem. 283 (2008): 31584-31590
Iuchi, S. et al., Proc.Natl.Acad.Sci.U.S.A 96 (1999): 9628-9632
Ivanov, S.V. et al., Biochem.Biophys.Res.Commun. 370 (2008): 536-540
Jeng, Y.M. et al., Br.J Surg 96 (2009): 66-73
Jensen, K. et al., J Pathol. 221 (2010): 193-200
Jung, С.K. et al., Pathol.lnt 56 (2006): 503-509
Jung, G. et al., Proc Natl Acad Sci U S A 84 (1987): 4611-4615
Kabbarah, O. et al., PLoS.ONE. 5 (2010): e10770
Kadara, H. et al., Cancer Prev.Res (Phila) 2 (2009): 702-711
Kanai, Y. et al., Mol Aspects Med. 34 (2013): 108-120
Kanno, A. et al., Int J Cancer 122 (2008): 2707-2718
Karantza, V., Oncogene 30 (2011): 127-138
Karunakaran, S. et al., J Biol.Chem. 286 (2011): 31830-31838
Kastrinos, F. et al., Semin.Oncol 34 (2007): 418-424
Katagiri, C. et al., J Dermatol.Sci. 57 (2010): 95-101
Katoh, M., Curr.Drug Targets. 9 (2008): 565-570
Katoh, M. et al., Int J Mol.Med 19 (2007): 273-278
Kennedy, A. et al., Int J Cancer 124 (2009): 27-35
Kibbe, A.H., Handbook of Pharmaceutical Excipients rd (2000)
Kikuchi, A. et al., Acta Physiol (Oxf) 204 (2012): 17-33
Kikuchi, Y. et al., J Histochem.Cytochem. 56 (2008): 753-764
Kim, С.H. et al., Surg Neurol. 54 (2000): 235-240
Kim, C.Y. et al., Oncol.Rep.27 (2012): 608-620
Kim, E.H. et al., Oncogene 29 (2010a): 4725-4731
Kim, H.S. et al., Korean J Intern.Med. 25 (2010b): 399-407
Kim, S. et al., Korean J Hepatol. 10 (2004): 62-72
Kitahara, O. et al., Cancer Res. 61 (2001): 3544-3549
Knight, H.M. et al., Am J Hum.Genet. 85 (2009): 833-846
Korosec, B. et al., Cancer Genet.Cytogenet. 171 (2006): 105-111
Krieg, A.M., Nat.Rev.Drug Discov. 5 (2006): 471-484
Kuan, С.T. et al., Clinical Cancer Research 12 (2006): 1970-1982
Kuang, S.Q. et al., Leukemia 22 (2008): 1529-1538
Kubo, H. et al., BMC.Cancer 14 (2014): 755
Kudo, Y. et al., Cancer Research 66 (2006): 6928-6935
Kwon, О.H. et al., Biochem.Biophys.Res.Commun. 406 (2011): 539-545
Kwon, Y.J. et al., Oncol Res 18 (2009): 141-151
Labied, S. et al., Hum.Reprod. 24 (2009): 113-121
Ladanyi, A. et al., Cancer Immunol.Immunother. 56 (2007): 1459-1469
Lamba, J.K. et al., Pharmacogenomics. 15 (2014): 1565-1574
Langbein, L. et al., J Biol.Chem. 285 (2010): 36909-36921
Langenskiold, M. et al., Scand.J Gastroenterol. 48 (2013): 563-569
Lau, E. et al., EMBO Rep.7 (2006): 425-430
Lee, J.I. et al., World J Gastroenterol. 18 (2012): 4751-4757
Lee, Y. et al., Nature 425 (2003): 415-419
Lee, Y.K. et al., Br. J Cancer 101 (2009): 504-510
Leivo, I. et al., Cancer Genet.Cytogenet. 156 (2005): 104-113
Li, C. et al., Proteomics. 6 (2006): 547-558
Li, H.G. et al., J Craniofac.Surg. 22 (2011): 2022-2025
Li, J. et al., Cancer Biol.Ther. 10 (2010a): 617-624
Li, J.Q. et al., Int.J Oncol 22 (2003): 1101-1110
Li, M. et al., Lung Cancer 69 (2010b): 341-347
Li, X. et al., Neoplasma 59 (2012): 500-507
Li, Y.N. et al., APMIS 122 (2014): 140-146
Liang, W.J. et al., Ai.Zheng. 27 (2008a): 460-465
Liang, Y. et al., J Neurooncol. 86 (2008b): 133-141
Liao, B. et al., J Biol.Chem. 286 (2011): 31145-31152
Liao, В. et al., J Biol.Chem. 280 (2005): 18517-18524
Liddy, N. et al., Nat.Med. 18 (2012): 980-987
Lim, J.H. et al., J Cell Biochem. 105 (2008): 1117-1127
Lin, D.M. et al., Zhonghua Bing.Li Xue.Za Zhi. 35 (2006): 540-544
Lindskog, C. et al., FASEB J (2014)
Litjens, S.H. et al., Trends Cell Biol. 16 (2006): 376-383
Liu, J. et al., Pathol.Res Pract. 206 (2010): 602-606
Liu, T. et al., PLoS.ONE. 7 (2012): e45464
Liu, Z. et al., Mol Neurobiol. 47 (2013): 325-336
Ljunggren, H.G. et al., J Exp.Med 162 (1985): 1745-1759
Loh, E. et al., J Biol.Chem. 279 (2004): 24640-24648
Longenecker, В. M. et al., Ann N.Y.Acad.Sci. 690 (1993): 276-291
Lu, D. et al., Am. J Surg.Pathol. 35 (2011): 1638-1645
Lu, Y. et al., Am. J Transl.Res 3 (2010): 8-27
Lugassy, C. et al., J Cutan.Pathol. 36 (2009): 1237-1243
Lukas, T.J. et al., Proc.Natl.Acad.Sci.U.S.A 78 (1981): 2791-2795
Lundblad, R.L., Chemical Reagents for Protein Modification 3rd (2004)
Lv, M. et al., Exp.Lung Res. 41 (2015): 74-83
Ma, L.J. et al., Arch.Med Res 40 (2009): 114-123
Ma, T.S. et al., Cell Calcium 26 (1999): 25-36
Ma, Y. et al., Clinical Cancer Research 12 (2006): 1121-1127
Maciejczyk, A. et al., J Histochem.Cytochem. 61 (2013): 330-339
Mackie, E.J. et al., J Cell Biol. 107 (1988): 2757-2767
MacLennan, D.H. et al., J Biol.Chem. 272 (1997): 28815-28818
Maeder, C. et al., Nat Struct.Mol.Biol. 16 (2009): 42-48
Mahdi, K.M. et al., Asian Рас.J Cancer Prev. 14 (2013): 3403-3409
Manda, R. et al., Biochem.Biophys.Res.Commun. 275 (2000): 440-445
Mansilla, F. et al., J Mol Med.(Berl) 87 (2009): 85-97
Marchand, M. et al., Int. J.Cancer 80 (1999): 219-230
Marchand, M. et al., Int. J Cancer 63 (1995): 883-885
McClelland, S.E. et al., EMBO J 26 (2007): 5033-5047
McManus, K.J. et al., Proc.Natl.Acad.Sci.U.S.A 106 (2009): 3276-3281
Merscher, S. et al., Front Endocrinol. (Lausanne) 5 (2014): 127
Metz, R.L. et al., Breast Cancer Res 9 (2007): R58
Metz, R.L. et al., Cell Cycle 4 (2005): 315-322
Meyer, E.L. et al., Mol.Cell Endocrinol. 289 (2008): 16-22
Meziere, C. et al., J Immunol 159 (1997): 3230-3237
Middel, P. et al., BMC.Cancer 10 (2010): 578
Mikami, T. et al., Oral Oncol. 47 (2011): 497-503
Miller, N.H. et al., Hum.Hered. 74 (2012): 36-44
Milovanovic, Т. et al., Int. J Oncol 25 (2004): 1337-1342
Mochizuki, S. et al., Cancer Sci. 98 (2007): 621-628
Morgan, R.A. et al., Science (2006)
Mori, M. et al., Transplantation 64 (1997): 1017-1027
Morita, Y. et al., J Hepatol. 59 (2013): 292-299
Morris, M.R. et al., Oncogene 29 (2010): 2104-2117
Mortara, L. et al., Clin Cancer Res. 12 (2006): 3435-3443
Moss, D.K. et al., J Cell Sci. 122 (2009): 644-655
Mueller, L.N. et al., J Proteome.Res. 7 (2008): 51-61
Mueller, L.N. et al., Proteomics. 7 (2007): 3470-3480
Mumberg, D. et al., Proc.Natl.Acad.Sci.U.S.A 96 (1999): 8633-8638
Murakami, M. et al., J Clin Endocrinol.Metab 85 (2000): 4403-4406
Nag, A. et al., RNA.Biol. 9 (2012): 334-342
Narita, D. et al., Rom.J Morphol.Embryol. 52 (2011): 1261-1267
Nestle, F.O. et al., Nat Med. 4 (1998): 328-332
Nicastri, A. et al., J Proteome.Res (2014)
Niehof, M. et al., Gastroenterology 134 (2008): 1191-1202
Nishinakamura, R. et al., Pediatr.Nephrol. 26 (2011): 1463-1467
Noda, T. et al., Liver Int. 32 (2012): 110-118
Nones, K. et al., Int. J Cancer 135 (2014): 1110-1118
Odermatt, A. et al., Nat Genet. 14 (1996): 191-194
Oh, S.P. et al., Genomics 14 (1992): 225-231
Ohta, S. et al., Oncol Rep.8 (2001): 1063-1066
Ortega, P. et al., Int. J Oncol 36 (2010): 1209-1215
Ostroff, R.M. et al., PLoS.ONE. 5 (2010): e15003
Park, S.H. et al., Clinical Cancer Research 13 (2007): 858-867
Paron, I. et al., PLoS.ONE. 6 (2011): e21684
Pascreau, G. et al., J Biol.Chem. 284 (2009): 5497-5505
Patterson, С.E. et al., Cell Stress.Chaperones. 10 (2005): 285-295
Patterson, С.E. et al., Mol.Biol.Cell 11 (2000): 3925-3935
Pernemalm, M. et al., J Proteome.Res 12 (2013): 3934-3943
Perrin-Tricaud, C. et al., PLoS.ONE. 6 (2011): e29390
Perumal, D. et al., PLoS.ONE. 7 (2012): e43589
Pinheiro, J. et al., nlme: Linear and Nonlinear Mixed Effects Models (http://CRAN.R-project.org/packe=nlme) (2015)
Plebanski, M. et al., Eur. J Immunol 25 (1995): 1783-1787
Plones, T. et al., PLoS.ONE. 7 (2012): e41746
Pokrovskaya, I.D. et al., Glycobiology 21 (2011): 1554-1569
Pontisso, P. et al., Br. J Cancer 90 (2004): 833-837
Porta, C. et al., Virology 202 (1994): 949-955
Prades, С. et al., Cytogenet.Genome Res 98 (2002): 160-168
Prasad, P. et al., BMC.Med.Genet. 11 (2010): 52
Puppin, C. et al., J Endocrinol. 197 (2008): 401-408
Puri, V. et al., Biol.Psychiatry 61 (2007): 873-879
Puyol, M. et al., Cancer Cell 18 (2010): 63-73
Qin, C. et al., Mol Med.Rep. 9 (2014): 851-856
Qu, P. et al., Cancer Research 69 (2009): 7252-7261
Quaas, M. et al., Cell Cycle 11 (2012): 4661-4672
Rajkumar, T. et al., BMC.Cancer 11 (2011): 80
Ramakrishna, M. et al., PLoS.ONE. 5 (2010): e9983
Ramirez, N.E. et al., J Clin Invest 121 (2011): 226-237
Rammensee, H.G. et al., Immunogenetics 50 (1999): 213-219
Reinmuth, N. et al., Dtsch.Med.Wochenschr. 140 (2015): 329-333
Renkonen, S. et al., Head Neck (2012)
Rettig, W.J. et al., Cancer Research 53 (1993): 3327-3335
Rettig, W.J. et al., Int J Cancer 58 (1994): 385-392
Rini, В.I. et al., Cancer 107 (2006): 67-74
Ripka, S. et al., Carcinogenesis 28 (2007): 1178-1187
Ritzenthaler, J.D. et al., Mol Biosyst. 4 (2008): 1160-1169
Rock, K.L. et al., Science 249 (1990): 918-921
Rodenko, В. et al., Nat.Protoc. 1 (2006): 1120-1132
Rodningen, О.K. et al., Radiother.Oncol 86 (2008): 314-320
Roemer, A. et al., Oncol Rep.11 (2004a): 529-536
Roemer, A. et al., J Urol. 172 (2004b): 2162-2166
Romagnoli, S. et al., Am J Pathol. 174 (2009): 762-770
Rose, A.A. et al., Mol Cancer Res 5 (2007): 1001-1014
Rotty, J.D. et al., J Cell Biol. 197 (2012): 381-389
Ruan, K. et al., Cell Mol.Life Sci. 66 (2009): 2219-2230
S3-Leitlinie Lungenkarzinom, 020/007, (2011)
Sagara, N. et al., Biochem.Biophys.Res.Commun. 252 (1998): 117-122
Saiki, R.K. et al., Science 239 (1988): 487-491
Sakuntabhai, A. et al., Nat Genet. 21 (1999): 271-277
Samanta, S. et al., Oncogene 31 (2012): 4689-4697
Sameer, A.S. et al., Eur. J Cancer Prev. 23 (2014): 246-257
Sandel, M.H. et al., Clinical Cancer Research 11 (2005): 2576-2582
Sang, Q.X., Cell Res 8 (1998): 171-177
Sarai, N. et al., Nucleic Acids Res. 36 (2008): 5441-5450
Satow, R. et al., Clinical Cancer Research 16 (2010): 2518-2528
Scanlan, M.J. et al., Proc Natl.Acad.Sci.U.S.A 91 (1994): 5657-5661
Schalken, J.A. et al., Urology 62 (2003): 11-20
Schegg, В. et al., Mol.Cell Biol. 29 (2009): 943-952
Schleypen, J.S. et al., Int. J Cancer 106 (2003): 905-912
Schneider, D. et al., Biochim.Biophys.Acta 1588 (2002): 1-6
Schuetz, C.S. et al., Cancer Research 66 (2006): 5278-5286
Seeger, F.H. et al., Immunogenetics 49 (1999): 571-576
SEER Stat facts, (2014), http://seer.cancer.gov/
Shaikhibrahim, Z. et al., Int. J Mol Med. 28 (2011): 605-611
Shao, G. et al., Cancer Res. 66 (2006): 4566-4573
Shappell, S.B. et al., Neoplasia. 3 (2001): 287-303
Shepherd, F.A. et al., J Clin.Oncol. 31 (2013): 2173-2181
Sherman, F. et al., Laboratory Course Manual for Methods in Yeast Genetics (1986)
Sherman-Baust, C.A. et al., Cancer Cell 3 (2003): 377-386
Sheu, В.C. et al., Cancer Res. 65 (2005): 2921-2929
Shigeishi, H. et al., Int J Oncol 34 (2009): 1565-1571
Shimbo, T. et al., PLoS.ONE. 5 (2010): e10566
Shubbar, E. et al., BMC.Cancer 13 (2013): 1
Shyian, M. et al., Exp.Oncol 33 (2011): 94-98
Silva, F.C. et al., Sao Paulo Med.J 127 (2009): 46-51
Silva, L.P. et al., Anal.Chem. 85 (2013): 9536-9542
Simpson, N.E. et al., Breast Cancer Res.Treat. 133 (2012): 959-968
Singh, R., Br. J Cancer 83 (2000): 1654-1658
Singh-Jasuja, H. et al., Cancer Immunol.Immunother. 53 (2004): 187-195
Siu, A. et al., Anticancer Res. 32 (2012): 3683-3688
Slack, F.J. et al., N.Engl.J Med. 359 (2008): 2720-2722
Slany, A. et al., J Proteome.Res 13 (2014): 844-854
Sloan, J.L. et al., J Biol.Chem. 274 (1999): 23740-23745
Small, E.J. et al., J Clin Oncol. 24 (2006): 3089-3094
Smith, M.J. et al., Br. J Cancer 100 (2009a): 1452-1464
Smith, S.C. et al., Am J Pathol. 174 (2009b): 371-379
Solomon, S. et al., Cancer J 18 (2012): 485-491
Spataro, V. et al., Anticancer Res 22 (2002): 3905-3909
Spataro, V. et al., J Biol.Chem. 272 (1997): 30470-30475
Starzyk, R.M. et al., J Infect.Dis. 181 (2000): 181-187
Steffens, S. et al., Oncol Lett. 3 (2012): 787-790
Stuart, J.E. et al., J Neuropathol.Exp.Neurol. (2010)
Sturm, M. et al., BMC.Bioinformatics. 9 (2008): 163
Suminami, Y. et al., Biochem.Biophys.Res.Commun. 181 (1991): 51-58
Suvasini, R. et al., J Biol.Chem. 286 (2011): 25882-25890
Takanami, I. et al., Int J Biol.Markers 23 (2008): 182-186
Takashima, S. et al., Tumour.Biol. 35 (2014): 4257-4265
Tanaka, S. et al., Proc.Natl.Acad.Sci.U.S.A 95 (1998): 10164-10169
Terabayashi, T. et al., PLoS.ONE. 7 (2012): e39714
Teufel, R. et al., Cell Mol.Life Sci. 62 (2005): 1755-1762
Thierry, L. et al., J Mol.Histol. 35 (2004): 803-810
Thorsen, K. et al., Mol.Cell Proteomics. 7 (2008): 1214-1224
Thurner, B. et al., J Exp.Med 190 (1999): 1669-1678
Tischler, V. et al., BMC.Cancer 10 (2010): 273
Tondreau, T. et al., BMC.Genomics 9 (2008): 166
Tong, W.G. et al., Epigenetics. 5 (2010): 499-508
Torre, G.C, Tumour.Biol. 19 (1998): 517-526
Tran, E. et al., Science 344 (2014): 641-645
Travis, W.D. et al., J Clin.Oncol. 31 (2013): 992-1001
Troy, Т.C. et al., Stem Cell Rev. 7 (2011): 927-934
Tsai, J.R. et al., Lung Cancer 56 (2007): 185-192
Tseng, H., Front Biosci. 3 (1998): D985-D988
Tseng, H. et al., J Cell Sci. 112 Pt 18 (1999): 3039-3047
Tseng, H. et al., J Cell Biol. 126 (1994): 495-506
Tsuji, A. et al., Biochem.J 396 (2006): 51-59
Tsukamoto, Y. et al., J Pathol. 216 (2008): 471-482
Uchiyama, Y. et al., Proc.Natl.Acad.Sci.U.S.A 107 (2010): 9240-9245
Ullman, E. et al., Mol.Cell Biol. 31 (2011): 2902-2919
Urquidi, V. et al., PLoS.ONE. 7 (2012): e37797
Utispan, K. et al., Mol.Cancer 9 (2010): 13
van, Asseldonk M. et al., Genomics 66 (2000): 35-42
Vazquez-Ortiz, G. et al., BMC.Cancer 5 (2005): 68
Vermeulen, K. et al., Cell Prolif. 36 (2003): 131-149
Vilar, E. et al., Nat Rev.Clin Oncol 7 (2010): 153-162
von, Au A. et al., Neoplasia. 15 (2013): 925-938
Waalkes, S. et al., BMC.Cancer 10 (2010): 503
Walchli, C. et al., J Cell Sci. 107 (Pt 2) (1994): 669-681
Wallace, A.M. et al., COPD. 5 (2008): 13-23
Walter, S. et al., J.Immunol. 171 (2003): 4974-4978
Walter S et al., J Immunother (SITC Annual Meeting 2011) 35, (2012)
Wang, H.Y. et al., Cancer Lett. 191 (2003): 229-237
Wang, L. et al., J Thorac.Dis. 6 (2014): 1380-1387
Wang, Q. et al., J Natl.Cancer Inst. 105 (2013a): 1463-1473
Wang, S.Z. et al., BMB.Rep. 41 (2008): 294-299
Wang, W.X. et al., Sichuan.Da.Xue.Xue.Bao.Yi.Xue.Ban. 40 (2009): 857-860
Wang, Y.F. et al., Tumour.Biol. 34 (2013b): 1685-1689
Warner, S.L. et al., Clinical Cancer Research 15 (2009): 6519-6528
Watanabe, M. et al., Proteomics.Clin Appl. 2 (2008): 925-935
Watt, S.L. et al., J Biol.Chem. 267 (1992): 20093-20099
Wawrzynska, L. et al., Monaldi Arch.Chest Dis. 59 (2003): 140-145
Weeraratna, A.T. et al., Cancer Cell 1 (2002): 279-288
Weiner, L. et al., Differentiation 63 (1998): 263-272
Wen, G. et al., Cancer Lett. 308 (2011): 23-32
Wildeboer, D. et al., J Neuropathol.Exp.Neurol. 65 (2006): 516-527
Wilke, S. et al., BMC.Biol. 10 (2012): 62
Willcox, В. E. et al., Protein Sci. 8 (1999): 2418-2423
Willett, R. et al., Nat Commun. 4 (2013): 1553
World Cancer Report, (2014)
Wu, A. et al., J Transl.Med. 9 (2011): 38
Wu, D. et al., Mol.Med.Rep. 10 (2014a): 2415-2420
Wu, G.C. et al., Ai.Zheng. 27 (2008): 874-878
Wu, H. et al., J Biol.Chem. 275 (2000): 36957-36965
Wu, J. et al., BMC.Clin Pathol. 13 (2013a): 15
Wu, K.D. et al., Am.J Physiol 269 (1995): C775-C784
Wu, M. et al., BMC.Cancer 13 (2013b): 44
Wu, S.Q. et al., Mol.Med.Rep. 7 (2013c): 875-880
Wu, Y.H. et al., Oncogene 33 (2014b): 3432-3440
Xiao, L. et al., Biochem.J 403 (2007): 573-581
Xiao, X. et al., Gynecol.Oncol 132 (2014): 506-512
Xiao, X.Y. et al., Tumour.Biol. 33 (2012): 2385-2392
Xiong, D. et al., Carcinogenesis 33 (2012): 1797-1805
Xu, B. et al., Br. J Cancer 109 (2013): 1279-1286
Xu, X.Y. et al., Pathol.Res Pract. (2014)
Xu, Y. et al., PLoS.ONE. 6 (2011): e21119
Yamamoto, H. et al., Oncogene 29 (2010): 2036-2046
Yan, Z. et al., Biomark.Insights. 9 (2014): 67-76
Yang, S. et al., Biochim.Biophys.Acta 1772 (2007): 1033-1040
Yasui, W. et al., Cancer Sci. 95 (2004): 385-392
Ye, H. et al., BMC.Genomics 9 (2008): 69
Yin, J.Y. et al., Clin Exp.Pharmacol.Physiol 38 (2011): 632-637
Yoon, H. et al., Proc Natl.Acad.Sci.U.S.A 99 (2002): 15632-15637
Yoshida, K. et al., J Cell Sci. 123 (2010): 225-235
Younes, M. et al., Anticancer Res 20 (2000): 3775-3779
Yu, D. et al., Int. J Mol Sci. 14 (2013): 11145-11156
Yu, J. et al., Gut (2014)
Yu, J.M. et al., Cancer Lett. 257 (2007): 172-181
Yuan, A. et al., APMIS 116 (2008): 445-456
Yuzugullu, H. et al., Mol.Cancer 8 (2009): 90
Zaremba, S. et al., Cancer Res. 57 (1997): 4570-4577
Zeitlin, S.G. et al., Proc.Natl.Acad.Sci.U.S.A 106 (2009): 15762-15767
Zhang, C. et al., PLoS.ONE. 6 (2011): e23849
Zhang, C. et al., Am.J Clin Pathol. 142 (2014): 320-324
Zhang, H. et al., J Clin Endocrinol.Metab 89 (2004): 748-755
Zhang, J. et al., Front Biosci.(Elite.Ed) 2 (2010a): 1154-1163
Zhang, J.Y. et al., Cancer Epidemiol.Biomarkers Prev. 12 (2003): 136-143
Zhang, L. et al., Am.J Pathol. 182 (2013): 2048-2057
Zhang, Y. et al., J Cell Sci. 123 (2010b): 1285-1294
Zhang, Y. et al., J Surg Res 160 (2010c): 102-106
Zhao, C. et al., Am. J Hum.Genet. 85 (2009a): 617-627
Zhao, H. et al., Cancer Gene Ther 21 (2014a): 448-455
Zhao, W. et al., Int.J Clin Exp.Pathol. 7 (2014b): 4247-4253
Zhao, Y. et al., Mol.Carcinog. 45 (2006): 84-92
Zhao, Y. et al., Radiat.Res. 162 (2004): 655-659
Zhao, Y. et al., Anat.Rec. (Hoboken.) 292 (2009b): 692-700
Zhao, Z. et al., Genomics 27 (1995): 370-373
Zheng, P.S. et al., FASEB J 18 (2004): 754-756
Zhou, X. et al., Exp.Mol Pathol. 92 (2012): 105-110
Zong, J. et al., Clin.Transl.Oncol. 14 (2012): 21-30
Zou, J.N. et al., Cancer Lett. 280 (2009): 78-85
Zou, Т.T. et al., Oncogene 21 (2002): 4855-4862
Allen, M.D. et al., Clin Cancer Res. 20 (2014): 344-357
Ammendola, M. et al., Biomed.Res.Int. 2014 (2014): 154702
An, J. et al., Mol Cancer 7 (2008): 32
Angenieux, C. et al., PLoS.ONE. 7 (2012): e42634
Arafeh, R. et al., Nat Genet. 47 (2015): 1408-1410
Atkins, D. et al., Contrib.Nephrol. 148 (2005): 35-56
Barras, D. et al., Int.J Cancer 135 (2014): 242-247
Barros-Filho, M.C. et al., J Clin Endocrinol.Metab 100 (2015): E890-E899
Beaudry, V.G. et al., PLoS.Genet. 6 (2010): e1001168
Beckmann, R.P. et al., Science 248 (1990): 850-854
Bengtsson, L. et al., J Cell Sci. 121 (2008): 536-548
Bloch, D.B. et al., J Biol Chem 271 (1996): 29198-29204
Bosch, D.G. et al., Eur.J Hum.Genet. (2015)
Boyer, A.P. et al., Mol.Cell Proteomics. 12 (2013): 180-193
Brooks, W.S. et al., J Biol Chem 283 (2008): 22304-22315
Bukau, B. et al., Cell 92 (1998): 351-366
Burger, M., Dig.Dis.Sci. 54 (2009): 197-198
Cailliau, K. et al., J Biol Chem 290 (2015): 19653-19665
Cao, Q.F. et al., Cancer Biother.Radiopharm. 30 (2015): 87-93
Chakrabarti, G. et al., Cancer Metab 3 (2015): 12
Chalitchagorn, K. et al., Oncogene 23 (2004): 8841-8846
Chen, K. et al., Cancer Biol Ther. 12 (2011): 1114-1119
Chen, S.J. et al., J Biol.Chem 289 (2014): 36284-36302
Chen, Y.Z. et al., Cancer Chemother.Pharmacol. 70 (2012): 637-644
Chevrollier, A. et al., Biochim.Biophys.Acta 1807 (2011): 562-567
Chouchane, L. et al., Cancer 80 (1997): 1489-1496
Ciocca, D.R. et al., Cell Stress.Chaperones. 10 (2005): 86-103
Ciocca, D.R. et al., Cancer Res. 52 (1992): 3648-3654
Cipriano, R. et al., Mol.Cancer Res. 12 (2014): 1156-1165
Cortese, R. et al., Int.J Biochem.Cell Biol 40 (2008): 1494-1508
Critchley-Thorne, R.J. et al., PLoS.Med. 4 (2007): e176
Das, M. et al., PLoS.ONE. 8 (2013): e69607
Decker, T. et al., J Clin Invest 109 (2002): 1271-1277
Di, K. et al., Oncogene 32 (2013): 5038-5047
Dolce, V. et al., FEBS Lett. 579 (2005): 633-637
Draberova, E. et al., J Neuropathol.Exp.Neurol. 74 (2015): 723-742
Dunwell, T.L. et al., Epigenetics. 4 (2009): 185-193
Dusek, R.L. et al., Breast Cancer Res 14 (2012): R65
Ene, С.I. et al., PLoS.ONE. 7 (2012): e51407
Espinal-Enriquez, J. et al., BMC.Genomics 16 (2015): 207
Evert, M. et al., Br. J Cancer 109 (2013): 2654-2664
Fellenberg, F. et al., J Invest Dermatol. 122 (2004): 1510-1517
Feng, F. et al., Mol.Cancer 9 (2010): 90
Ferrer-Ferrer, M. et al., Arch.Med.Res 44 (2013): 467-474
Fischer, H. et al., Carcinogenesis 22 (2001): 875-878
Freiss, G. et al., Bull.Cancer 91 (2004): 325-332
Freiss, G. et al., Anticancer Agents Med.Chem 11 (2011): 78-88
Friedman, E., Pathobiology 63 (1995): 348-350
Fu, B.S. et al., Nan.Fang Yi.Ke.Da.Xue.Xue.Bao. 29 (2009): 1775-1778
Gallerne, C. et al., Int.J Biochem.Cell Biol 42 (2010): 623-629
Garg, M. et al., Cancer 116 (2010a): 3785-3796
Garg, M. et al., Cancer 116 (2010b): 3785-3796
Garg, M. et al., Eur.J Cancer 46 (2010c): 207-215
Gautier, T. et al., FASEB J 24 (2010): 3544-3554
Giaginis, C. et al., Dig.Dis.Sci. 56 (2011): 777-785
Giovannini, D. et al., Cell Rep. 3 (2013): 1866-1873
Gokmen-Polar, Y. et al., Mod.Pathol. 28 (2015): 677-685
Guo, H. et al., Cancer Research 71 (2011): 7576-7586
Haffner, C. et al., EMBO J 23 (2004): 3041-3050
Hartl, F.U. et al., Science 295 (2002): 1852-1858
Hatfield, M. P. et al., Protein Pept.Lett. 19 (2012): 616-624
Hayward, A. et al., PLoS.ONE. 8 (2013): e59940
Hillier, L.W. et al., Nature 424 (2003): 157-164
Hsiung, D.T. et al., Cancer Epidemiol.Biomarkers Prev. 16 (2007): 108-114
Huang, F. et al., Int.J Clin Exp.Pathol. 7 (2014a): 1093-1100
Huang, G. et al., Anticancer Agents Med.Chem 14 (2014b): 9-17
Huang, L. et al., Int. J Gynecol.Cancer 25 (2015a): 559-565
Huang, S. et al., Oncogene 21 (2002): 2504-2512
Huang, X. et al., Cancer Cell Int. 15 (2015b): 93
Imada, A. et al., Eur.Respir.J 15 (2000): 1087-1093
Inoue, J. et al., PLoS.ONE. 4 (2009): e7099
Ishii, M. et al., Anticancer Res. 27 (2007): 3987-3992
Ito, Y. et al., J Biochem. 124 (1998): 347-353
Jalbout, M. et al., Cancer Lett. 193 (2003): 75-81
Jia, W.H. et al., Nat.Genet. 45 (2013): 191-196
Jie, Liu et al., Pathol.Res Pract. 210 (2014): 176-181
Jin, X. et al., Tumour.Biol (2015)
Johnson, M. et al., Cell Signal. 21 (2009): 1471-1478
Kankavi, O. et al., Ren Fail. 36 (2014): 258-265
Kao, R.H. et al., Int.J Exp.Pathol. 84 (2003): 207-212
Kim, H.S. et al., Korean J Intern.Med. 25 (2010): 399-407
Kobayashi, K. et al., Oncogene 23 (2004): 3089-3096
Kong, C.S. et al., Oral Surg.Oral Med.Oral Pathol.Oral Radiol. 115 (2013): 95-103
Kortum, K.M. et al., Ann.Hematol. 94 (2015): 1205-1211
Kozak, C.A., Retrovirology. 7 (2010): 101
Kresse, S.H. et al., Mol.Cancer 7 (2008): 48
Kukita, K. et al., J Immunol. 194 (2015): 4988-4996
Kutomi, G. et al., Cancer Sci. 104 (2013): 1091-1096
Kwok, H.F. et al., Am. J Cancer Res 5 (2015): 52-71
Lai, С.H. et al., Genome Res 10 (2000): 703-713
Lan, Q. et al., Eur.J Haematol. 85 (2010): 492-495
Lange, A. et al., Exp.Dermatol. 18 (2009): 527-535
Lazaris, A.C. et al., Breast Cancer Res.Treat. 43 (1997): 43-51
Lee, K.Y. et al., Yonsei Med.J 50 (2009): 60-67
Leypoldt, F. et al., J Neurochem. 76 (2001): 806-814
Li, Q. et al., Int.J Clin Exp.Pathol. 8 (2015): 6334-6344
Li, Y. et al., Neoplasia. 7 (2005): 1073-1080
Liang, В. et al., Clin Cancer Res. 21 (2015): 1183-1195
Liu, B. et al., PLoS.ONE. 7 (2012): e43147
Liu, L. et al., Biochem.Biophys.Res.Commun. 372 (2008): 756-760
Liu, Y. et al., Cancer Research 69 (2009): 7844-7850
Lv, Q. et al., Tumour.Biol 36 (2015): 3751-3756
Lynch, E.M. et al., Curr.Biol 24 (2014): 896-903
Ma, J. et al., Cell Physiol Biochem. 37 (2015): 201-213
Maitra, M. et al., Proc.Natl.Acad.Sci.U.S.A 109 (2012): 21064-21069
Manuel, A. et al., Genomics 64 (2000): 216-220
Martin, C. et al., J Virol. 87 (2013): 10094-10104
May, D. et al., Oncogene 24 (2005): 1011-1020
Medhi, S. et al., J Viral Hepat. 20 (2013): e141-e147
Mei, J. et al., Oncogene 25 (2006): 849-856
Mestiri, S. et al., Cancer 91 (2001): 672-678
Meulmeester, E. et al., Curr.Cancer Drug Targets. 8 (2008): 87-97
Mimoto, R. et al., Cancer Lett. 339 (2013): 214-225
Mitsuhashi, A. et al., Am.J Pathol. 182 (2013): 1843-1853
Moudry, P. et al., Cell Cycle 11 (2012): 1573-1582
Mungall, A.J. et al., Nature 425 (2003): 805-811
Nagamachi, A. et al., Cancer Cell 24 (2013): 305-317
Nagao, H. et al., PLoS.ONE. 7 (2012): e39268
Narita, N. et al., Int.J Radiat.Oncol Biol Phys. 53 (2002): 190-196
Neben, K. et al., Int.J Cancer 120 (2007): 1669-1677
Nebral, K. et al., Clinical Cancer Research 11 (2005): 6489-6494
Nibbe, R.K. et al., Mol.Cell Proteomics. 8 (2009): 827-845
Nieto, C. et al., J Cell Sci. 123 (2010): 2001-2007
Niikura, T. et al., Eur.J Neurosci. 17 (2003): 1150-1158
Nirde, P. et al., Oncogene 29 (2010): 117-127
Nonomura, N. et al., Br. J Cancer 97 (2007): 952-956
Noonan, E.J. et al., Cell Stress.Chaperones. 12 (2007): 219-229
Ohbayashi, N. et al., J Cell Sci. 125 (2012): 1508-1518
Ohiro, Y. et al., FEBS Lett. 524 (2002): 163-171
Onishi, H. et al., Cancer Lett. 371 (2016): 143-150
Orfanelli, U. et al., Oncogene 34 (2015): 2094-2102
Ostertag, E.M. et al., Annu.Rev Genet. 35 (2001): 501-538
Papadopoulos, C. et al., J Biol.Chem 286 (2011): 5494-5505
Park, H.J. et al., J Proteome.Res 7 (2008): 1138-1150
Peng, L. et al., Sci.Rep. 5 (2015): 13413
Penzo, M. et al., Oncotarget. 6 (2015): 21755-21760
Permuth-Wey, J. et al., Nat Commun. 4 (2013): 1627
Peters, U. et al., Gastroenterology 144 (2013): 799-807
Qian, J. et al., Proc.Natl.Acad.Sci.U.S.A 112 (2015a): 3469-3474
Qian, J. et al., Genom.Data 5 (2015b): 272-274
Rachel, R.A. et al., PLoS.ONE. 7 (2012): e42446
Ramana, С.V. et al., EMBO J 19 (2000): 263-272
Reis, A. et al., Nat Genet. 6 (1994): 174-179
Ribatti, D. et al., Int.J Exp.Pathol. 91 (2010): 350-356
Roe, O.D. et al., Lung Cancer 67 (2010): 57-68
Rohde, M. et al., Genes Dev. 19 (2005): 570-582
Ruediger, R. et al., Oncogene 20 (2001): 1892-1899
Rusin, M. et al., Mol.Carcinog. 39 (2004): 155-163
Schiebel, E., Curr.Opin.Cell Biol 12 (2000): 113-118
Schmidt, F. et al., Aging (Albany.NY) 7 (2015a): 527-528
Schmidt, F. et al., Oncotarget. 6 (2015b): 617-632
Schulz, E.G. et al., Immunity. 30 (2009): 673-683
Scieglinska, D. et al., J Cell Biochem. 104 (2008): 2193-2206
Sedlackova, L. et al., Tumour.Biol 32 (2011): 33-44
Star, S. et al., Hum.Immunol. 71 (2010): 377-382
Shain, A.H. et al., BMC.Genomics 14 (2013): 624
Sharma, P. et al., Biochem.Biophys.Res.Commun. 399 (2010): 129-132
Sherman, M., Ann.N.Y.Acad.Sci. 1197 (2010): 152-157
Simon, R. et al., Int J Cancer 107 (2003): 764-772
Singh, S. et al., Tumour.Biol 35 (2014): 12695-12706
Siragam, V. et al., PLoS.ONE. 9 (2014): e109128
Slepak, Т.I. et al., Cytoskeleton (Hoboken.) 69 (2012): 514-527
Souza, A.P. et al., Cell Stress.Chaperones. 14 (2009): 301-310
Stawerski, P. et al., Contemp.Oncol (Pozn.) 17 (2013): 378-382
Szondy, K. et al., Cancer Invest 30 (2012): 317-322
Taira, N. et al., Mol.Cell 25 (2007): 725-738
Takahashi, M. et al., Gan To Kagaku Ryoho 24 (1997): 222-228
Takanami, I. et al., Cancer 88 (2000): 2686-2692
Tan, S. et al., Breast Cancer Res 16 (2014): R40
Tanis, T. et al., Arch.Oral Biol 59 (2014): 1155-1163
Toyoda, E. et al., J Biol.Chem. 283 (2008): 23711-23720
Van Aarsen, L.A. et al., Cancer Res. 68 (2008): 561-570
van den Boom, J. et al., Am.J Pathol. 163 (2003): 1033-1043
van den Heuvel, A.P. et al., Cancer Biol Ther. 13 (2012): 1185-1194
van, Wesenbeeck L. et al., J Bone Miner.Res 19 (2004): 183-189
Vargas, A.C. et al., Breast Cancer Res.Treat. 135 (2012): 153-165
Vargas-Roig, L.M. et al., Int.J Cancer 79 (1998): 468-475
von der, Heyde S. et al., PLoS.ONE. 10 (2015): e0117818
Vuletic, S. et al., Biochim.Biophys.Acta 1813 (2011): 1917-1924
Wang, Q. et al., Int.J Biol Sci. 10 (2014a): 807-816
Wang, T. et al., Clin Transl.Oncol 17 (2015): 564-569
Wang, W.M. et al., Zhongguo Shi Yan.Xue.Ye.Xue.Za Zhi. 22 (2014b): 1744-1747
Wang, X. et al., Clin Chim.Acta 417 (2013a): 73-79
Wang, X.M. et al., PLoS.ONE. 8 (2013b): e55714
Wang, X.X. et al., Hepatobiliary.Pancreat.Dis.Int. 12 (2013c): 540-545
Wang, X.X. et al., PLoS.ONE. 9 (2014c): e96501
Wang, Y. et al., Clin Chem.Lab Med. 48 (2010a): 1657-1663
Wang, Y.N. et al., Biochem.Biophys.Res Commun. 399 (2010b): 498-504
Wang, Z. et al., Med.Sci.Monit. 16 (2010c): CR357-CR364
Watson, P.J. et al., Traffic. 5 (2004): 79-88
Wehner, M. et al., FEBS J 277 (2010): 1597-1605
Weinacker, A. et al., J Biol.Chem 269 (1994): 6940-6948
Wu, D. et al., Mol.Med.Rep. 10 (2014): 2415-2420
Wu, M. et al., Oncogene 23 (2004): 6815-6819
Wu, X.S. et al., Proc.Natl.Acad.Sci.U.S.A 109 (2012): E2101-E2109
Xia, F. et al., Am.J Hum.Genet. 94 (2014): 784-789
Xia, L.M. et al., Zhonghua Gan Zang.Bing.Za Zhi. 16 (2008): 678-682
Xiang, Y. et al., J Clin Invest 125 (2015): 2293-2306
Xu, L. et al., Mol.Cell 10 (2002): 271-282
Xue, L. et al., Cell Physiol Biochem. 36 (2015): 1982-1990
Yamamoto, N. et al., Int.J Oncol 42 (2013): 1523-1532
Yang, D. et al., Cell Physiol Biochem. 27 (2011): 37-44
Yang, Z. et al., Int.J Med.Sci. 12 (2015): 256-263
Yau, C. et al., Breast Cancer Res 12 (2010): R85
Yokoyama, Y. et al., Mol.Med.Rep. 1 (2008): 197-201
Yongjun Zhang, M.M. et al., J Cancer Res Ther. 9 (2013): 660-663
Yu, D. et al., Oncotarget. 6 (2015): 7619-7631
Yu, H. et al., Nat Methods 8 (2011): 478-480
Yu, S.Y. et al., J Oral Pathol.Med. 43 (2014): 344-349
Zekri, A.R. et al., Asian Рас.J Cancer Prev. 16 (2015): 3543-3549
Zhang, W. et al., Tumori 100 (2014): 338-345
Zhao, Y. et al., Oncol Lett. 4 (2012): 755-758
Zhao-Yang, Z. et al., Cancer Lett. 266 (2008): 209-215
Zhou, J.R. et al., Zhonghua Er.Bi Yan.Hou Tou.Jing.Wai Ke.Za Zhi. 42 (2007): 934-938
Zhou, L. et al., FEBS Lett. 584 (2010): 3013-3020
Zhu, J. et al., J Pharmacol.Toxicol.Methods 76 (2015): 76-82
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>ИММАТИКС БАЙОТЕКНОЛОДЖИЗ ГМБХ
<120> Новые пептиды и комбинации пептидов для применения в иммунотерапии рака легких,
в том числе немелкоклеточного рака легких (НМРЛ) и других видов рака
<130> I32809WO
<150> US 62/152,258
<151> 2015-04-24
<150> GB 1507030.3
<151> 2015-04-24
<160> 177
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> PRT
<213> Homo sapiens
<400> 1
Lys Leu Leu Pro Tyr Ile Val Gly Val
1 5
<210> 2
<211> 9
<212> PRT
<213> Homo sapiens
<400> 2
Phe Leu Ile Pro Tyr Ala Ile Met Leu
1 5
<210> 3
<211> 9
<212> PRT
<213> Homo sapiens
<400> 3
Phe Leu Tyr Asp Val Val Lys Ser Leu
1 5
<210> 4
<211> 9
<212> PRT
<213> Homo sapiens
<400> 4
Phe Val Phe Ser Phe Pro Val Ser Val
1 5
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<400> 5
Ala Leu Thr Ser Thr Leu Ile Ser Val
1 5
<210> 6
<211> 9
<212> PRT
<213> Homo sapiens
<400> 6
Ser Leu Gln Gly Ser Ile Met Thr Val
1 5
<210> 7
<211> 9
<212> PRT
<213> Homo sapiens
<400> 7
Asn Leu Leu Gln Val Leu Glu Lys Val
1 5
<210> 8
<211> 9
<212> PRT
<213> Homo sapiens
<400> 8
Ala Leu Leu Asn Ile Leu Ser Glu Val
1 5
<210> 9
<211> 9
<212> PRT
<213> Homo sapiens
<400> 9
Ala Leu Ser Gly Thr Leu Ser Gly Val
1 5
<210> 10
<211> 10
<212> PRT
<213> Homo sapiens
<400> 10
Lys Met Ala Gly Ile Gly Ile Arg Glu Ala
1 5 10
<210> 11
<211> 9
<212> PRT
<213> Homo sapiens
<400> 11
Tyr Leu Asn Val Gln Val Lys Glu Leu
1 5
<210> 12
<211> 9
<212> PRT
<213> Homo sapiens
<400> 12
Ile Val Asp Arg Thr Thr Thr Val Val
1 5
<210> 13
<211> 9
<212> PRT
<213> Homo sapiens
<400> 13
Phe Leu Phe Asp Gly Ser Ala Asn Leu
1 5
<210> 14
<211> 9
<212> PRT
<213> Homo sapiens
<400> 14
Leu Ile Gln Asp Arg Val Ala Glu Val
1 5
<210> 15
<211> 9
<212> PRT
<213> Homo sapiens
<400> 15
Glu Leu Asp Arg Thr Pro Pro Glu Val
1 5
<210> 16
<211> 12
<212> PRT
<213> Homo sapiens
<400> 16
Leu Ile Phe Asp Leu Gly Gly Gly Thr Phe Asp Val
1 5 10
<210> 17
<211> 11
<212> PRT
<213> Homo sapiens
<400> 17
Thr Leu Leu Gln Glu Gln Gly Thr Lys Thr Val
1 5 10
<210> 18
<211> 9
<212> PRT
<213> Homo sapiens
<400> 18
Ile Leu Leu Thr Glu Gln Ile Asn Leu
1 5
<210> 19
<211> 9
<212> PRT
<213> Homo sapiens
<400> 19
Val Leu Thr Ser Asp Ser Pro Ala Leu
1 5
<210> 20
<211> 9
<212> PRT
<213> Homo sapiens
<400> 20
Leu Met Thr Lys Glu Ile Ser Ser Val
1 5
<210> 21
<211> 9
<212> PRT
<213> Homo sapiens
<400> 21
Val Leu Ser Ser Gly Leu Thr Ala Ala
1 5
<210> 22
<211> 9
<212> PRT
<213> Homo sapiens
<400> 22
Asn Leu Ile Asn Gln Glu Ile Met Leu
1 5
<210> 23
<211> 11
<212> PRT
<213> Homo sapiens
<400> 23
Val Tyr Thr Ser Trp Gln Ile Pro Gln Lys Phe
1 5 10
<210> 24
<211> 9
<212> PRT
<213> Homo sapiens
<400> 24
Asn Tyr Pro Lys Ser Ile His Ser Phe
1 5
<210> 25
<211> 9
<212> PRT
<213> Homo sapiens
<400> 25
Arg Phe Met Asp Gly His Ile Thr Phe
1 5
<210> 26
<211> 9
<212> PRT
<213> Homo sapiens
<400> 26
Arg Tyr Leu Glu Lys Phe Tyr Gly Leu
1 5
<210> 27
<211> 9
<212> PRT
<213> Homo sapiens
<400> 27
Arg Tyr Pro Pro Pro Val Arg Glu Phe
1 5
<210> 28
<211> 11
<212> PRT
<213> Homo sapiens
<400> 28
Arg Tyr Leu Asp Ser Leu Lys Ala Ile Val Phe
1 5 10
<210> 29
<211> 11
<212> PRT
<213> Homo sapiens
<400> 29
Tyr Tyr Thr Lys Gly Phe Ala Leu Leu Asn Phe
1 5 10
<210> 30
<211> 9
<212> PRT
<213> Homo sapiens
<400> 30
Lys Tyr Leu Glu Lys Tyr Tyr Asn Leu
1 5
<210> 31
<211> 9
<212> PRT
<213> Homo sapiens
<400> 31
Ser Tyr Leu Asp Lys Val Arg Ala Leu
1 5
<210> 32
<211> 10
<212> PRT
<213> Homo sapiens
<400> 32
Glu Tyr Gln Pro Glu Met Leu Glu Lys Phe
1 5 10
<210> 33
<211> 9
<212> PRT
<213> Homo sapiens
<400> 33
Thr Tyr Ser Glu Lys Thr Thr Leu Phe
1 5
<210> 34
<211> 10
<212> PRT
<213> Homo sapiens
<400> 34
Val Phe Met Lys Asp Gly Phe Phe Tyr Phe
1 5 10
<210> 35
<211> 9
<212> PRT
<213> Homo sapiens
<400> 35
Thr Tyr Asn Pro Glu Ile Tyr Val Ile
1 5
<210> 36
<211> 9
<212> PRT
<213> Homo sapiens
<400> 36
Tyr Tyr Gly Asn Thr Leu Val Glu Phe
1 5
<210> 37
<211> 9
<212> PRT
<213> Homo sapiens
<400> 37
Arg Tyr Leu Glu Tyr Phe Glu Lys Ile
1 5
<210> 38
<211> 11
<212> PRT
<213> Homo sapiens
<400> 38
Val Phe Leu Asn Arg Ala Lys Ala Val Phe Phe
1 5 10
<210> 39
<211> 10
<212> PRT
<213> Homo sapiens
<400> 39
Lys Phe Leu Glu His Thr Asn Phe Glu Phe
1 5 10
<210> 40
<211> 11
<212> PRT
<213> Homo sapiens
<400> 40
Ile Tyr Asn Pro Ser Met Gly Val Ser Val Leu
1 5 10
<210> 41
<211> 9
<212> PRT
<213> Homo sapiens
<400> 41
Thr Tyr Ile Gly Gln Gly Tyr Ile Ile
1 5
<210> 42
<211> 11
<212> PRT
<213> Homo sapiens
<400> 42
Val Tyr Val Thr Ile Asp Glu Asn Asn Ile Leu
1 5 10
<210> 43
<211> 9
<212> PRT
<213> Homo sapiens
<400> 43
Arg Tyr Thr Leu His Ile Asn Thr Leu
1 5
<210> 44
<211> 9
<212> PRT
<213> Homo sapiens
<400> 44
Ile Tyr Asn Gln Ile Ala Glu Leu Trp
1 5
<210> 45
<211> 10
<212> PRT
<213> Homo sapiens
<400> 45
Lys Phe Leu Glu Ser Lys Gly Tyr Glu Phe
1 5 10
<210> 46
<211> 11
<212> PRT
<213> Homo sapiens
<400> 46
Asn Tyr Thr Asn Gly Ser Phe Gly Ser Asn Phe
1 5 10
<210> 47
<211> 11
<212> PRT
<213> Homo sapiens
<400> 47
Arg Tyr Ile Ser Pro Asp Gln Leu Ala Asp Leu
1 5 10
<210> 48
<211> 10
<212> PRT
<213> Homo sapiens
<400> 48
Tyr Tyr Tyr Gly Asn Thr Leu Val Glu Phe
1 5 10
<210> 49
<211> 10
<212> PRT
<213> Homo sapiens
<400> 49
Gln Tyr Leu Phe Pro Ser Phe Glu Thr Phe
1 5 10
<210> 50
<211> 11
<212> PRT
<213> Homo sapiens
<400> 50
Leu Tyr Ile Gly Trp Asp Lys His Tyr Gly Phe
1 5 10
<210> 51
<211> 10
<212> PRT
<213> Homo sapiens
<400> 51
Asn Tyr Leu Leu Glu Ser Pro His Arg Phe
1 5 10
<210> 52
<211> 11
<212> PRT
<213> Homo sapiens
<400> 52
Ser Tyr Met Glu Val Pro Thr Tyr Leu Asn Phe
1 5 10
<210> 53
<211> 9
<212> PRT
<213> Homo sapiens
<400> 53
Ile Tyr Ala Gly Gln Trp Asn Asp Phe
1 5
<210> 54
<211> 10
<212> PRT
<213> Homo sapiens
<400> 54
Ala Tyr Lys Asp Lys Asp Ile Ser Phe Phe
1 5 10
<210> 55
<211> 10
<212> PRT
<213> Homo sapiens
<400> 55
Ile Tyr Pro Val Lys Tyr Thr Gln Thr Phe
1 5 10
<210> 56
<211> 10
<212> PRT
<213> Homo sapiens
<400> 56
Arg Tyr Phe Pro Thr Gln Ala Leu Asn Phe
1 5 10
<210> 57
<211> 9
<212> PRT
<213> Homo sapiens
<400> 57
Ser Tyr Ser Ile Gly Ile Ala Asn Phe
1 5
<210> 58
<211> 13
<212> PRT
<213> Homo sapiens
<400> 58
Val Tyr Phe Lys Pro Ser Leu Thr Pro Ser Gly Glu Phe
1 5 10
<210> 59
<211> 9
<212> PRT
<213> Homo sapiens
<400> 59
His Tyr Phe Asn Thr Pro Phe Gln Leu
1 5
<210> 60
<211> 9
<212> PRT
<213> Homo sapiens
<400> 60
Ser Tyr Pro Ala Lys Leu Ser Phe Ile
1 5
<210> 61
<211> 9
<212> PRT
<213> Homo sapiens
<400> 61
Arg Tyr Gly Ser Pro Ile Asn Thr Phe
1 5
<210> 62
<211> 9
<212> PRT
<213> Homo sapiens
<400> 62
Ala Tyr Lys Pro Gly Ala Leu Thr Phe
1 5
<210> 63
<211> 9
<212> PRT
<213> Homo sapiens
<400> 63
Leu Tyr Ile Asn Lys Ala Asn Ile Trp
1 5
<210> 64
<211> 9
<212> PRT
<213> Homo sapiens
<400> 64
Val Tyr Pro Leu Ala Leu Tyr Gly Phe
1 5
<210> 65
<211> 9
<212> PRT
<213> Homo sapiens
<400> 65
Ile Tyr Gln Arg Trp Lys Asp Leu Leu
1 5
<210> 66
<211> 9
<212> PRT
<213> Homo sapiens
<400> 66
Asp Tyr Ile Pro Gln Leu Ala Lys Phe
1 5
<210> 67
<211> 12
<212> PRT
<213> Homo sapiens
<400> 67
Ile Phe Leu Asp Tyr Glu Ala Gly His Leu Ser Phe
1 5 10
<210> 68
<211> 9
<212> PRT
<213> Homo sapiens
<400> 68
Arg Tyr Leu Phe Val Val Asp Arg Leu
1 5
<210> 69
<211> 11
<212> PRT
<213> Homo sapiens
<400> 69
Thr Tyr Ala Ala Leu Asn Ser Lys Ala Thr Phe
1 5 10
<210> 70
<211> 9
<212> PRT
<213> Homo sapiens
<400> 70
Val Tyr His Ser Tyr Leu Thr Ile Phe
1 5
<210> 71
<211> 9
<212> PRT
<213> Homo sapiens
<400> 71
Thr Tyr Leu Thr Asn His Leu Arg Leu
1 5
<210> 72
<211> 10
<212> PRT
<213> Homo sapiens
<400> 72
Tyr Tyr Val Asp Lys Leu Phe Asn Thr Ile
1 5 10
<210> 73
<211> 10
<212> PRT
<213> Homo sapiens
<400> 73
Arg Tyr Leu His Val Glu Gly Gly Asn Phe
1 5 10
<210> 74
<211> 10
<212> PRT
<213> Homo sapiens
<400> 74
Glu Tyr Leu Pro Glu Phe Leu His Thr Phe
1 5 10
<210> 75
<211> 12
<212> PRT
<213> Homo sapiens
<400> 75
Ala Tyr Pro Asp Leu Asn Glu Ile Tyr Arg Ser Phe
1 5 10
<210> 76
<211> 9
<212> PRT
<213> Homo sapiens
<400> 76
Val Tyr Thr Glx Ile Gln Ser Arg Phe
1 5
<210> 77
<211> 12
<212> PRT
<213> Homo sapiens
<400> 77
Arg Tyr Leu Glu Ala Gly Ala Ala Gly Leu Arg Trp
1 5 10
<210> 78
<211> 9
<212> PRT
<213> Homo sapiens
<400> 78
Ile Tyr Thr Arg Val Thr Tyr Tyr Leu
1 5
<210> 79
<211> 9
<212> PRT
<213> Homo sapiens
<400> 79
Arg Tyr Gly Gly Ser Phe Ala Glu Leu
1 5
<210> 80
<211> 9
<212> PRT
<213> Homo sapiens
<400> 80
Ala Tyr Leu Lys Glu Val Glu Gln Leu
1 5
<210> 81
<211> 9
<212> PRT
<213> Homo sapiens
<400> 81
Lys Tyr Ile Glu Ala Ile Gln Trp Ile
1 5
<210> 82
<211> 9
<212> PRT
<213> Homo sapiens
<400> 82
Phe Tyr Gln Gly Ile Val Gln Gln Phe
1 5
<210> 83
<211> 11
<212> PRT
<213> Homo sapiens
<400> 83
Glu Tyr Ser Asp Val Leu Ala Lys Leu Ala Phe
1 5 10
<210> 84
<211> 11
<212> PRT
<213> Homo sapiens
<400> 84
Thr Phe Asp Val Ala Pro Ser Arg Leu Asp Phe
1 5 10
<210> 85
<211> 9
<212> PRT
<213> Homo sapiens
<400> 85
Pro Phe Leu Gln Ala Ser Pro His Phe
1 5
<210> 86
<211> 17
<212> PRT
<213> Homo sapiens
<400> 86
Leu Ser Ala Asp Asp Ile Arg Gly Ile Gln Ser Leu Tyr Gly Asp Pro
1 5 10 15
Lys
<210> 87
<211> 19
<212> PRT
<213> Homo sapiens
<400> 87
Glu Gly Asp Ile Gln Gln Phe Leu Ile Thr Gly Asp Pro Lys Ala Ala
1 5 10 15
Tyr Asp Tyr
<210> 88
<211> 17
<212> PRT
<213> Homo sapiens
<400> 88
Asn Pro Val Ser Gln Val Glu Ile Leu Lys Asn Lys Pro Leu Ser Val
1 5 10 15
Gly
<210> 89
<211> 14
<212> PRT
<213> Homo sapiens
<400> 89
Lys Leu Tyr Ile Gly Asn Leu Ser Glu Asn Ala Ala Pro Ser
1 5 10
<210> 90
<211> 16
<212> PRT
<213> Homo sapiens
<400> 90
Asp Ala Val Gln Met Val Ile Thr Glu Ala Gln Lys Val Asp Thr Arg
1 5 10 15
<210> 91
<211> 18
<212> PRT
<213> Homo sapiens
<400> 91
Val Ala Arg Leu Pro Ile Ile Asp Leu Ala Pro Val Asp Val Gly Gly
1 5 10 15
Thr Asp
<210> 92
<211> 20
<212> PRT
<213> Homo sapiens
<400> 92
Asn Lys Pro Ser Arg Leu Pro Phe Leu Asp Ile Ala Pro Leu Asp Ile
1 5 10 15
Gly Gly Ala Asp
20
<210> 93
<211> 18
<212> PRT
<213> Homo sapiens
<400> 93
Ser Arg Pro Gln Ala Pro Ile Thr Gly Tyr Arg Ile Val Tyr Ser Pro
1 5 10 15
Ser Val
<210> 94
<211> 9
<212> PRT
<213> Homo sapiens
<400> 94
Ile Leu Val Asp Trp Leu Val Gln Val
1 5
<210> 95
<211> 9
<212> PRT
<213> Homo sapiens
<400> 95
Lys Ile Ile Gly Ile Met Glu Glu Val
1 5
<210> 96
<211> 9
<212> PRT
<213> Homo sapiens
<400> 96
Ala Met Gly Ile Ala Pro Pro Lys Val
1 5
<210> 97
<211> 9
<212> PRT
<213> Homo sapiens
<400> 97
Thr Leu Phe Pro Val Arg Leu Leu Val
1 5
<210> 98
<211> 10
<212> PRT
<213> Homo sapiens
<400> 98
Val Leu Tyr Pro His Glu Pro Thr Ala Val
1 5 10
<210> 99
<211> 9
<212> PRT
<213> Homo sapiens
<400> 99
Ala Leu Phe Gln Arg Pro Pro Leu Ile
1 5
<210> 100
<211> 9
<212> PRT
<213> Homo sapiens
<400> 100
Lys Ile Val Asp Phe Ser Tyr Ser Val
1 5
<210> 101
<211> 9
<212> PRT
<213> Homo sapiens
<400> 101
Leu Leu Leu Glu Ile Leu His Glu Ile
1 5
<210> 102
<211> 9
<212> PRT
<213> Homo sapiens
<400> 102
Ser Leu Leu Ser Glu Leu Gln His Ala
1 5
<210> 103
<211> 10
<212> PRT
<213> Homo sapiens
<400> 103
Lys Leu Leu Ser Asp Pro Asn Tyr Gly Val
1 5 10
<210> 104
<211> 10
<212> PRT
<213> Homo sapiens
<400> 104
Ser Leu Val Ala Val Glu Leu Glu Lys Val
1 5 10
<210> 105
<211> 9
<212> PRT
<213> Homo sapiens
<400> 105
Ile Val Ala Glu Ser Leu Gln Gln Val
1 5
<210> 106
<211> 9
<212> PRT
<213> Homo sapiens
<400> 106
Ser Ile Leu Glu His Gln Ile Gln Val
1 5
<210> 107
<211> 9
<212> PRT
<213> Homo sapiens
<400> 107
Ala Leu Ser Glu Arg Ala Val Ala Val
1 5
<210> 108
<211> 9
<212> PRT
<213> Homo sapiens
<400> 108
Thr Leu Leu Asp Phe Ile Asn Ala Val
1 5
<210> 109
<211> 9
<212> PRT
<213> Homo sapiens
<400> 109
Asn Leu Ile Glu Val Asn Glu Glu Val
1 5
<210> 110
<211> 15
<212> PRT
<213> Homo sapiens
<400> 110
Ile Gln Leu Ile Val Gln Asp Lys Glu Ser Val Phe Ser Pro Arg
1 5 10 15
<210> 111
<211> 9
<212> PRT
<213> Homo sapiens
<400> 111
Ser Leu Tyr Lys Gly Leu Leu Ser Val
1 5
<210> 112
<211> 9
<212> PRT
<213> Homo sapiens
<400> 112
Val Leu Ala Pro Leu Phe Val Tyr Leu
1 5
<210> 113
<211> 9
<212> PRT
<213> Homo sapiens
<400> 113
Phe Leu Leu Asp Gly Ser Ala Asn Val
1 5
<210> 114
<211> 9
<212> PRT
<213> Homo sapiens
<400> 114
Ala Met Ser Ser Lys Phe Phe Leu Val
1 5
<210> 115
<211> 9
<212> PRT
<213> Homo sapiens
<400> 115
Tyr Val Tyr Gln Asn Asn Ile Tyr Leu
1 5
<210> 116
<211> 9
<212> PRT
<213> Homo sapiens
<400> 116
Lys Ile Gln Glu Met Gln His Phe Leu
1 5
<210> 117
<211> 9
<212> PRT
<213> Homo sapiens
<400> 117
Ile Leu Ile Asp Trp Leu Val Gln Val
1 5
<210> 118
<211> 9
<212> PRT
<213> Homo sapiens
<400> 118
Ser Leu His Phe Leu Ile Leu Tyr Val
1 5
<210> 119
<211> 9
<212> PRT
<213> Homo sapiens
<400> 119
Ile Val Asp Asp Ile Thr Tyr Asn Val
1 5
<210> 120
<211> 9
<212> PRT
<213> Homo sapiens
<400> 120
Lys Ile Gln Glu Ile Leu Thr Gln Val
1 5
<210> 121
<211> 9
<212> PRT
<213> Homo sapiens
<400> 121
Arg Leu Leu Asp Ser Val Ser Arg Leu
1 5
<210> 122
<211> 9
<212> PRT
<213> Homo sapiens
<400> 122
Lys Leu Ser Trp Asp Leu Ile Tyr Leu
1 5
<210> 123
<211> 9
<212> PRT
<213> Homo sapiens
<400> 123
Gly Leu Thr Asp Asn Ile His Leu Val
1 5
<210> 124
<211> 9
<212> PRT
<213> Homo sapiens
<400> 124
Asn Leu Leu Asp Leu Asp Tyr Glu Leu
1 5
<210> 125
<211> 9
<212> PRT
<213> Homo sapiens
<400> 125
Arg Leu Asp Asp Leu Lys Met Thr Val
1 5
<210> 126
<211> 9
<212> PRT
<213> Homo sapiens
<400> 126
Lys Leu Leu Thr Glu Val His Ala Ala
1 5
<210> 127
<211> 10
<212> PRT
<213> Homo sapiens
<400> 127
Ile Leu Phe Pro Asp Ile Ile Ala Arg Ala
1 5 10
<210> 128
<211> 9
<212> PRT
<213> Homo sapiens
<400> 128
Thr Leu Ser Ser Ile Lys Val Glu Val
1 5
<210> 129
<211> 9
<212> PRT
<213> Homo sapiens
<400> 129
Gly Leu Ile Glu Ile Ile Ser Asn Ala
1 5
<210> 130
<211> 9
<212> PRT
<213> Homo sapiens
<400> 130
Lys Ile Leu Glu Asp Val Val Gly Val
1 5
<210> 131
<211> 9
<212> PRT
<213> Homo sapiens
<400> 131
Ala Leu Val Gln Asp Leu Ala Lys Ala
1 5
<210> 132
<211> 10
<212> PRT
<213> Homo sapiens
<400> 132
Ala Leu Phe Val Arg Leu Leu Ala Leu Ala
1 5 10
<210> 133
<211> 9
<212> PRT
<213> Homo sapiens
<400> 133
Arg Leu Ala Ser Tyr Leu Asp Lys Val
1 5
<210> 134
<211> 9
<212> PRT
<213> Homo sapiens
<400> 134
Thr Leu Trp Tyr Arg Ala Pro Glu Val
1 5
<210> 135
<211> 9
<212> PRT
<213> Homo sapiens
<400> 135
Ala Ile Asp Gly Asn Asn His Glu Val
1 5
<210> 136
<211> 9
<212> PRT
<213> Homo sapiens
<400> 136
Ala Leu Val Asp His Thr Pro Tyr Leu
1 5
<210> 137
<211> 9
<212> PRT
<213> Homo sapiens
<400> 137
Phe Leu Val Asp Gly Ser Trp Ser Val
1 5
<210> 138
<211> 11
<212> PRT
<213> Homo sapiens
<400> 138
Ala Leu Asn Glu Glu Ala Gly Arg Leu Leu Leu
1 5 10
<210> 139
<211> 9
<212> PRT
<213> Homo sapiens
<400> 139
Ser Leu Ile Glu Asp Leu Ile Leu Leu
1 5
<210> 140
<211> 9
<212> PRT
<213> Homo sapiens
<400> 140
Thr Leu Tyr Pro His Thr Ser Gln Val
1 5
<210> 141
<211> 9
<212> PRT
<213> Homo sapiens
<400> 141
Asn Leu Ile Glu Lys Ser Ile Tyr Leu
1 5
<210> 142
<211> 12
<212> PRT
<213> Homo sapiens
<400> 142
Val Leu Leu Pro Val Glu Val Ala Thr His Tyr Leu
1 5 10
<210> 143
<211> 9
<212> PRT
<213> Homo sapiens
<400> 143
Ala Ile Val Asp Lys Val Pro Ser Val
1 5
<210> 144
<211> 10
<212> PRT
<213> Homo sapiens
<400> 144
Lys Ile Phe Asp Glu Ile Leu Val Asn Ala
1 5 10
<210> 145
<211> 9
<212> PRT
<213> Homo sapiens
<400> 145
Ala Met Thr Gln Leu Leu Ala Gly Val
1 5
<210> 146
<211> 9
<212> PRT
<213> Homo sapiens
<400> 146
Phe Gln Tyr Asp His Glu Ala Phe Leu
1 5
<210> 147
<211> 9
<212> PRT
<213> Homo sapiens
<400> 147
Val Leu Phe Pro Asn Leu Lys Thr Val
1 5
<210> 148
<211> 9
<212> PRT
<213> Homo sapiens
<400> 148
Ala Leu Phe Gly Ala Leu Phe Leu Ala
1 5
<210> 149
<211> 10
<212> PRT
<213> Homo sapiens
<400> 149
Lys Leu Val Glu Phe Asp Phe Leu Gly Ala
1 5 10
<210> 150
<211> 9
<212> PRT
<213> Homo sapiens
<400> 150
Gly Val Leu Glu Asn Ile Phe Gly Val
1 5
<210> 151
<211> 9
<212> PRT
<213> Homo sapiens
<400> 151
Ala Val Val Glu Phe Leu Thr Ser Val
1 5
<210> 152
<211> 9
<212> PRT
<213> Homo sapiens
<400> 152
Ile Leu Gln Asp Arg Leu Asn Gln Val
1 5
<210> 153
<211> 9
<212> PRT
<213> Homo sapiens
<400> 153
Ala Leu Tyr Asp Ser Val Ile Leu Leu
1 5
<210> 154
<211> 9
<212> PRT
<213> Homo sapiens
<400> 154
Ile Leu Phe Glu Ile Asn Pro Lys Leu
1 5
<210> 155
<211> 9
<212> PRT
<213> Homo sapiens
<400> 155
Ala Leu Asp Glu Asn Leu His Gln Leu
1 5
<210> 156
<211> 9
<212> PRT
<213> Homo sapiens
<400> 156
Thr Val Ala Glu Val Ile Gln Ser Val
1 5
<210> 157
<211> 9
<212> PRT
<213> Homo sapiens
<400> 157
Lys Leu Phe Gly Glu Lys Thr Tyr Leu
1 5
<210> 158
<211> 9
<212> PRT
<213> Homo sapiens
<400> 158
Lys Leu Asp Glu Thr Asn Asn Thr Leu
1 5
<210> 159
<211> 10
<212> PRT
<213> Homo sapiens
<400> 159
Thr Tyr Lys Tyr Val Asp Ile Asn Thr Phe
1 5 10
<210> 160
<211> 9
<212> PRT
<213> Homo sapiens
<400> 160
Ser Tyr Leu Gln Ala Ala Asn Ala Leu
1 5
<210> 161
<211> 10
<212> PRT
<213> Homo sapiens
<400> 161
Leu Tyr Gln Ile Leu Gln Gly Ile Val Phe
1 5 10
<210> 162
<211> 17
<212> PRT
<213> Homo sapiens
<400> 162
Thr Asn Gly Val Ile His Val Val Asp Lys Leu Leu Tyr Pro Ala Asp
1 5 10 15
Thr
<210> 163
<211> 10
<212> PRT
<213> Homo sapiens
<400> 163
Glu Leu Ala Gly Ile Gly Ile Leu Thr Val
1 5 10
<210> 164
<211> 9
<212> PRT
<213> Homo sapiens
<400> 164
Tyr Leu Leu Pro Ala Ile Val His Ile
1 5
<210> 165
<211> 15
<212> PRT
<213> Homo sapiens
<400> 165
Thr Leu Gly Glu Phe Leu Lys Leu Asp Arg Glu Arg Ala Lys Asn
1 5 10 15
<210> 166
<211> 17
<212> PRT
<213> Homo sapiens
<400> 166
Thr Phe Ser Tyr Val Asp Pro Val Ile Thr Ser Ile Ser Pro Lys Tyr
1 5 10 15
Gly
<210> 167
<211> 16
<212> PRT
<213> Homo sapiens
<400> 167
Ser Gln Asp Asp Ile Lys Gly Ile Gln Lys Leu Tyr Gly Lys Arg Ser
1 5 10 15
<210> 168
<211> 16
<212> PRT
<213> Homo sapiens
<400> 168
Ser Pro Gln Tyr Ser Trp Arg Ile Asn Gly Ile Pro Gln Gln His Thr
1 5 10 15
<210> 169
<211> 15
<212> PRT
<213> Homo sapiens
<400> 169
Thr Pro Pro Ile Asp Ala His Thr Arg Asn Leu Leu Arg Asn His
1 5 10 15
<210> 170
<211> 15
<212> PRT
<213> Homo sapiens
<400> 170
Lys Ile Phe Tyr Val Tyr Met Lys Arg Lys Tyr Glu Ala Met Thr
1 5 10 15
<210> 171
<211> 15
<212> PRT
<213> Homo sapiens
<400> 171
Arg Lys Val Ala Glu Leu Val His Phe Leu Leu Leu Lys Tyr Arg
1 5 10 15
<210> 172
<211> 15
<212> PRT
<213> Homo sapiens
<400> 172
Phe Phe Pro Val Ile Phe Ser Lys Ala Ser Ser Ser Leu Gln Leu
1 5 10 15
<210> 173
<211> 15
<212> PRT
<213> Homo sapiens
<400> 173
Gly Asp Asn Gln Ile Met Pro Lys Ala Gly Leu Leu Ile Ile Val
1 5 10 15
<210> 174
<211> 15
<212> PRT
<213> Homo sapiens
<400> 174
Thr Ser Tyr Val Lys Val Leu His His Met Val Lys Ile Ser Gly
1 5 10 15
<210> 175
<211> 18
<212> PRT
<213> Homo sapiens
<400> 175
Val Leu Leu Lys Glu Phe Thr Val Ser Gly Asn Ile Leu Thr Ile Arg
1 5 10 15
Leu Thr
<210> 176
<211> 17
<212> PRT
<213> Homo sapiens
<400> 176
Lys Val Pro Ile Lys Trp Met Ala Leu Glu Ser Ile Leu Arg Arg Arg
1 5 10 15
Phe
<210> 177
<211> 13
<212> PRT
<213> Homo sapiens
<400> 177
Ala Lys Ala Val Ala Ala Trp Thr Leu Lys Ala Ala Ala
1 5 10
<---
Реферат
Изобретение относится к биотехнологии. Описан пептид, который связывается с молекулой(ами) главного комплекса гистосовместимости (МНС), выбранный из группы: (а) пептид, состоящий из аминокислотной последовательности в соответствии с SEQ ID NO: 30, необязательно удлиненной на 1 аминокислоту на его N- и/или С-концевом участке; (б) пептид в соответствии с (а), где указанный пептид включает непептидные связи. Также описаны слитый пептид, набор и фармацевтическая композиция, содержащие описанный пептид. Раскрыты соответствующие описанному пептиду нуклеиновая кислота, вектор, клетка-хозяин. Изобретение расширяет арсенал средств для лечения рака. 11 н. и 9 з.п. ф-лы, 6 ил., 27 табл., 6 пр.

Комментарии