Биспецифические антитела, специфически связывающиеся с pd1 и lag3 - RU2778805C2
Код документа: RU2778805C2
Чертежи





















Описание
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к биспецифическим антителам, содержащим первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, в частности к биспецифическим антителам, дополнительно содержащим Fc-домен, который содержит одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором, в частности с Fcy-рецептором. Изобретение также относится к способам получения этих молекул и к способам их применения.
УРОВЕНЬ ТЕХНИКИ
Важность иммунной системы в защите от злокачественных новообразований основана на ее способности обнаруживать и уничтожать аномальные клетки. Тем не менее некоторые опухолевые клетки могут избегать иммунной системы, вызывая состояние иммуносупрессии (Zitvogel et al., Nature Reviews Immunology 6 (2006), 715-727). Т-клетки играют важную роль в противовирусных и противоопухолевых иммунных ответах. Соответствующая активация антигенспецифических Т-клеток приводит к их клональному размножению и приобретению ими эффекторной функции, а в случае цитотоксических Т-лимфоцитов (ЦТЛ) позволяет им специфически лизировать целевые клетки. Основные усилия были сосредоточены на Т-клетках в отношении терапевтического манипулирования эндогенным противоопухолевым иммунитетом благодаря их способности избирательно распознавать пептиды, полученные из белков во всех клеточных компартментах; их способности непосредственно распознавать и убивать антигенэкспрессирующие клетки (с помощью CD8+ эффекторных Т-клеток; также известных как цитотоксические Т-лимфоциты (ЦТЛ)) и их способности организовывать разнообразные иммунные ответы (с помощью CD4+ Т-хелперов), которые интегрируют адаптивный и врожденный эффекторные механизмы. Дисфункция Т-клеток возникает в результате длительного воздействия антигена: Т-клетка теряет способность пролиферировать в присутствии антигена и постепенно теряет способность продуцировать цитокины и лизировать целевые клетки1. Дисфункциональные Т-клетки были названы истощенными Т-клетками, и они не способны пролиферировать и выполнять эффекторные функции, такие как цитотоксичность и секреция цитокинов, в ответ на стимуляцию антигеном. Дальнейшие исследования показали, что истощенные Т-клетки характеризуются устойчивой экспрессией ингибирующей молекулы PD-1 (белок запрограммированной смерти клетки 1) и что блокирование взаимодействий PD-1 и PD-L1 (лиганд PD-1) может обратить истощение Т-клеток и восстановить антигенспецифические Т-клеточные ответы у мышей, инфицированных ВЛХМ (Barber et al., Nature 439 (2006), 682-687). Однако нацеливание только на путь PD-1 - PD-L1 не всегда приводит к обратимому истощению Т-клеток (Gehring et al., Gastroenterology 137 (2009), 682-690), что указывает на то, что другие молекулы, вероятно, вовлечены в истощение Т-клеток (Sakuishi, J. Experimental Med. 207 (2010), 2187-2194).
Ген активации лимфоцитов 3 (LAG3 или CD223) был первоначально обнаружен в эксперименте, предназначенном для селективного выделения молекул, экспрессируемых в ИЛ-2-зависимой линии NK-клеток (Triebel F et al., Cancer Lett. 235 (2006), 147-153). LAG3 является уникальным трансмембранным белком со структурной гомологией к CD4 с четырьмя внеклеточными доменами, подобными суперсемейству иммуноглобулинов (D1-D4). Мембранно-дистальный домен IgG содержит короткую аминокислотную последовательность, так называемую дополнительную петлю, которая не обнаружена в других белках суперсемейства IgG. Внутриклеточный домен содержит уникальную аминокислотную последовательность (KIEELE, SEQ ID NO: 75), которая необходима для того, чтобы LAG3 оказывал отрицательное влияние на функцию Т-клеток. LAG3 может расщепляться по соединительному пептиду (CP) с помощью металлопротеаз с образованием растворимой формы, которая обнаруживается в сыворотке. Как и CD4, белок LAG3 связывается с молекулами ГКГС класса II, однако с более высокой аффинностью и в отличном от CD4 сайте (Huard et al. Proc. Natl. Acad. Sci. USA 94 (1997), 5744-5749). LAG3 экспрессируется Т-клетками, В-клетками, NK-клетками и плазмоцитоидными дендритными клетками (pDC) и увеличивается количественно после активации Т-клеток. Он модулирует функцию Т-клеток, а также гомеостаз Т-клеток. Подмножество типичных Т-клеток, которые являются анергическими или проявляют нарушения своих функций, экспрессируют LAG3. LAG3+ Т-клетки накапливаются в местах опухолей и во время хронических вирусных инфекций (Sierro et al. Expert Opin. Ther. Targets 15 (2011), 91-101). Было показано, что LAG3 принимает участие в истощении CD8 Т-клеток (Blackburn et al. Nature Immunol. 10 (2009), 29-37). Таким образом, существует потребность в антителах, которые противодействуют активности LAG3 и могут быть использованы для генерации и восстановления иммунного ответа в отношении опухолей.
Моноклональные антитела к LAG3 были описаны, например, в WO 2004/078928, где заявлена композиция, содержащая антитела, специфически связывающиеся с CD223, и противораковая вакцина. В WO 2010/019570 раскрыты человеческие антитела, которые связывают LAG3, например антитела 25F7 и 26Н10. US 2011/070238 относится к цитотоксическому анти-LAG3 антителу, подходящему для лечения или профилактики отторжения трансплантата органа и аутоиммунного заболевания. В WO 2014/008218 описаны антитела к LAG3 с оптимизированными функциональными свойствами (то есть с уменьшенными сайтами дезамидирования) по сравнению с антителом 25F7. Кроме того, антитела к LAG3 раскрыты в WO 2015/138920 (например, ВАР050), WO 2014/140180, WO 2015/116539, WO 2016/028672, WO 2016/126858, WO 2016/200782 и WO 2017/015560.
Белок запрограммированной гибели клеток 1 (PD-1 или CD279) является ингибирующим членом семейства рецепторов CD28, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 является рецептором клеточной поверхности и экспрессируется на активированных В-клетках, Т-клетках и миелоидных клетках (Okazaki et al. (2002) Curr. Opin. Immunol. 14: 391779-82; Bennett et al. (2003) J. Immunol. 170: 711-8). Структурно PD-1 представляет собой мономерный трансмембранный белок типа 1, состоящий из одного внеклеточного вариабельного домена иммуноглобулина и цитоплазматического домена, содержащего иммунорецепторный тирозиновый ингибирующий мотив (ITIM) и иммунорецепторный тирозиновый переключающий мотив (ITSM).
Активированные Т-клетки временно экспрессируют PD1, но устойчивая гиперэкспрессия PD1 и его лиганда PDL1 способствует истощению иммунитета, что приводит к персистенции вирусных инфекций, уклонению опухоли от иммунологического ответа, увеличению числа инфекций и смертности. Экспрессия PD1 индуцируется узнаванием антигена через рецептор Т-клеток, и его экспрессия поддерживается главным образом посредством непрерывной передачи сигналов рецептора Т-клеток. После длительного воздействия антигена локус PD1 не может быть повторно метилирован, что способствует постоянной гиперэкспрессии. Блокирование пути PD1 может восстановить истощенную функциональность Т-клеток при злокачественном новообразовании и хронических вирусных инфекциях (Sheridan, Nature Biotechnology 30 (2012), 729-730). Моноклональные антитела к PD-1 были описаны, например, в WO 2003/042402, WO 2004/004771, WO 2004/056875, WO 2004/072286, WO 2004/087196, WO 2006/121168, WO 2006/133396, WO 2007/005874, WO 2008/083174, WO 2008/156712, WO 2009/024531, WO 2009/014708, WO 2009/101611, WO 2009/114335, WO 2009/154335, WO 2010/027828, WO 2010/027423, WO 2010/029434, WO 2010/029435, WO 2010/036959, WO 2010/063011, WO 2010/089411, WO 2011/066342, WO 2011/110604, WO 2011/110621, WO 2012/145493, WO 2013/014668, WO 2014/179664, и WO 2015/112900.
Биспецифические Fc-диатела, обладающие иммунореактивностью к PD1 и LAG3 для применения в лечении злокачественного новообразования или заболевания, связанного с патогеном, таким как бактерия, грибок или вирус, описаны в WO 2015/200119. Однако существует потребность в создании новых биспецифических антител, которые не только одновременно связываются с PD1 и LAG3 и, таким образом, избирательно нацеливаются на клетки, экспрессирующие как PD1, так и LAG3, но также исключают блокирование LAG3 на других клетках, учитывая широкий паттерн экспрессии LAG3. Биспецифические антитела согласно данному изобретению не только эффективно блокируют PD1 и LAG3 на Т-клетках со сверхэкспрессией как PD1, так и LAG3, они очень селективны в отношении этих клеток и, таким образом, можно избежать побочных эффектов при введении высокоактивных антител к LAG3.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к биспецифическим антителам, содержащим по меньшей мере один антигенсвязывающий домен, который специфически связывается с белком запрограммированной гибели клеток 1 (PD1), и по меньшей мере один второй антигенсвязывающий домен, который специфически связывается с геном активации лимфоцитов-3 (LAG3). Эти биспецифические антитела имеют преимущество, поскольку они обеспечивают лучшую селективность и, возможно, эффективность, чем стратегии комбинирования анти-PD1 и анти-LAG3. Кроме того, они характеризуются тем, что демонстрируют уменьшенный эффект поглощения (как показано при помощи уменьшенной интернализации Т-клеток), они преимущественно связываются с типичными Т-клетками, так и с Трег, и способны восстанавливать эффекторные функции Т-клеток за счет Трег подавления, они демонстрируют повышенную специфическую в отношении опухоли активность функций эффекторных Т-клеток и усиление эрадикации опухоли in vivo.
В одном аспекте изобретение обеспечивает биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с белком запрограммированной гибели клеток 1 (PD1), и второй антигенсвязывающий домен, который специфически связывается с геном активации лимфоцитов-3 (LAG3), при этом
указанный первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит: домен VH, содержащий:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4;
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В частности, предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с белком запрограммированной гибели клеток 1 (PD1), и второй антигенсвязывающий домен, который специфически связывается с геном активации лимфоцитов-3 (LAG3), при этом биспецифическое антитело содержит Fc-домен, который представляет собой Fc-домен IgG, в частности Fc-домен IgG1 или IgG4, и при этом Fc-домен содержит одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором, в частности, с Fcγ-рецептором.
В одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом второй антигенсвязывающий домен, который специфически связывается с LAG3, содержит
(а) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 14,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 15, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 16; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 19: или
(b) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 22,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 23, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 24; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 25,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 26, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 27; или
(c) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 30,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 31, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 32; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 33,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 34, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 35; или
(d) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 38,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 39, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 40; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 41,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 42, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 43; или
(e) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 46,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 47, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 48; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 49,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 50, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 51.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит:
(а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 7, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 8, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 11, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 12, или
(e) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 13.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 28, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 29, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 36, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 37, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 44, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 45, или
(e) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 54, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 55, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 62, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 63, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 64, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 65, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 66, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 67.
Кроме того, предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, или домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом
первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом
первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 56, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 57.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом биспецифическое антитело представляет собой гуманизированное или химерное антитело. В частности, биспецифическое антитело представляет собой гуманизированное антитело.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, при этом биспецифическое антитело содержит Fc-домен подкласса человеческого IgG1 с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Кабату).
Кроме того, предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом биспецифическое антитело содержит Fc-домен, содержащий модификацию, способствующую ассоциации первой и второй субъединиц Fc-домена. В одном аспекте предложено биспецифическое антитело, в котором первая субъединица Fc-домена содержит выступы, а вторая субъединица Fc-домена содержит отверстия в соответствии со способом «выступы-в-отверстия». В частности, первая субъединица Fc-домена содержит аминокислотные замены S354C и T366W (нумерация EU), а вторая субъединица Fc-домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно индексу EU по Кабату).
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, и второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3.
В одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом в одном из Fab-фрагментов вариабельные домены VL и VH заменены друг на друга, так, что домен VH является частью легкой цепи, а домен VL является частью тяжелой цепи. В частности, предложено биспецифическое антитело, в котором в первом Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fab-фрагмент, где в константном домене CL аминокислоту в положение 124 независимо замещают лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно индексу EU по Кабату), а в константном домене СН1 аминокислоты в положениях 147 и 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату). В частности, предложено биспецифическое антитело, в котором во втором Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с LAG3 константным доменом CL, аминокислоту в положении 124 независимо замещают лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно индексу EU по Кабату), а в константном домене СН1 аминокислоты в положениях 147 и 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату).
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий:
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 97, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 100, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 102, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 104, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105 или
(d) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 106, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 107, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
Более конкретно, предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 100, и вторую легкую цепь, содержащая аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом биспецифическое антитело содержит Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, который слит с С-концом Fc-домена.
В частности, предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 144, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом биспецифическое антитело содержит третий Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3. В одном аспекте предложено биспецифическое антитело, в котором два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, являются идентичными.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий:
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 118, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 119, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 120, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 121, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(с) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 122, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом один из фрагментов Fab, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, слит через пептидный линкер с С-концом одной из тяжелых цепей.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 145, и две вторых легких цепи, содержащих аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом биспецифическое антитело содержит четвертый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1. В одном аспекте предложено биспецифическое антитело, в котором два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с PD1, являются идентичными.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, при этом два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с PD1, и при этом каждый слит через пептидный линкер с С-концом одной из тяжелых цепей, соответственно.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий:
(a) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 114, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 116, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95 % идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(с) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 117, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
В еще одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит домен Fc, два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, и одноцепочечный Fab (scFab), содержащий антигенсвязывающий домен, который специфически связывается с PD1. В частности, scFab, содержащий антигенсвязывающий домен, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, содержащий:
(а) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 123, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 119, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 124, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 121, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 125, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
В еще одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит домен Fc, два фрагмента Fab, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, и домен VH и VL, содержащий антигенсвязывающий домен, который специфически связывается с PD1. В одном аспекте домен VH антигенсвязывающего домена, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей, а домен VL антигенсвязывающего домена, который специфически связывается с PD1, слит через пептидный линкер с С-концом другой тяжелой цепи. В конкретном аспекте предложено биспецифическое антитело, содержащее первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 126, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 127, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 109.
Согласно другому аспекту изобретения предложен полинуклеотид, кодирующий биспецифическое антитело, как описано в данном документе ранее. В изобретении дополнительно предложен вектор, в частности вектор экспрессии, содержащий полинуклеотид согласно изобретению и прокариотическую или эукариотическую клетку-хозяина, содержащую полинуклеотид или вектор согласно изобретению. В некоторых вариантах осуществления клетка-хозяин представляет собой эукариотическую клетку, в частности клетку млекопитающего.
В другом аспекте предложен способ получения биспецифического антитела, содержащего первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, включающий этапы а) трансформации клетки-хозяина векторами, содержащими полинуклеотиды, кодирующие указанное биспецифическое антитело, b) культивирования клетки-хозяина в условиях, подходящих для экспрессии биспецифического антитела, и с) выделения биспецифического антитела из культуры. Изобретение также охватывает биспецифическое антитело, полученное способом согласно изобретению.
Изобретение, кроме того, обеспечивает фармацевтическую композицию, содержащую биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, и по меньшей мере один фармацевтически приемлемый наполнитель.
Изобретение также охватывает биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, или фармацевтическую композицию, содержащую биспецифическое антитело, для применения в качестве лекарственного средства.
В другом аспекте изобретение обеспечивает биспецифическое антитело, содержащее биспецифическое антитело, содержащее первый
антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, или фармацевтическую композицию, содержащую биспецифическое антитело, для применения
i) при модуляции иммунных ответов, таких как восстановление активности Т-клеток,
ii) при стимуляции иммунного ответа или функционировании,
iii) при лечении инфекций,
iv) при лечении онкологического заболевания,
v) для задержки прогрессирования онкологического заболевания,
vi) в продлении жизни пациента, страдающего онкологическим заболеванием.
В одном аспекте предложены биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения в лечении заболевания у человека, нуждающегося в этом. В конкретном аспекте изобретение обеспечивает биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения в лечении онкологического заболевания. В дополнительном конкретном аспекте предложены биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения в модуляции иммунных ответов. В другом аспекте предложены биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения при лечении хронической вирусной инфекции.
Изобретение также обеспечивает специфическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, или к фармацевтической композиции, содержащей биспецифическое антитело, для применения в профилактике или лечении онкологического заболевания, при этом биспецифическое антитело вводят в комбинации с химиотерапевтическим агентом, облучением и/или другими агентами для применения в иммунотерапии онкологического заболевания. В конкретном аспекте предложены биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения в профилактике или лечении онкологического заболевания, при этом биспецифическое антитело вводят в комбинации с анти-СЕА/анти-CD3 биспецифическим антителом.
Также предложено применение биспецифического антитела, содержащего первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, для изготовления лекарственного средства для лечения заболевания у индивидуума, нуждающегося в этом, в частности, для производства лекарственного средства для лечения онкологического заболевания, а также способ лечения заболевания у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества композиции, содержащей биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, в фармацевтически приемлемой форме. В определенном аспекте заболевание представляет собой онкологическое заболевание. В другом конкретном аспекте заболевание представляет собой хроническую вирусную инфекцию. В другом аспекте предложен способ модуляции иммунных ответов у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества композиции, содержащей биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, в фармацевтически приемлемой форме. В любом из вышеуказанных аспектов индивидуумом предпочтительно является млекопитающее, в частности человек.
Изобретение также обеспечивает специфическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, или к фармацевтической композиции, содержащей биспецифическое антитело, для применения в профилактике или лечении онкологического заболевания, при этом биспецифическое антитело вводят в комбинации с химиотерапевтическим агентом, облучением и/или другими агентами для применения в иммунотерапии онкологического заболевания.
Кроме того, предложен способ ингибирования роста опухолевых клеток у индивидуума, включающий введение индивидууму эффективного количества биспецифического антитела, содержащего первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, чтобы ингибировать рост опухолевых клеток. Индивидуум предпочтительно представляет собой млекопитающее, в частности человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
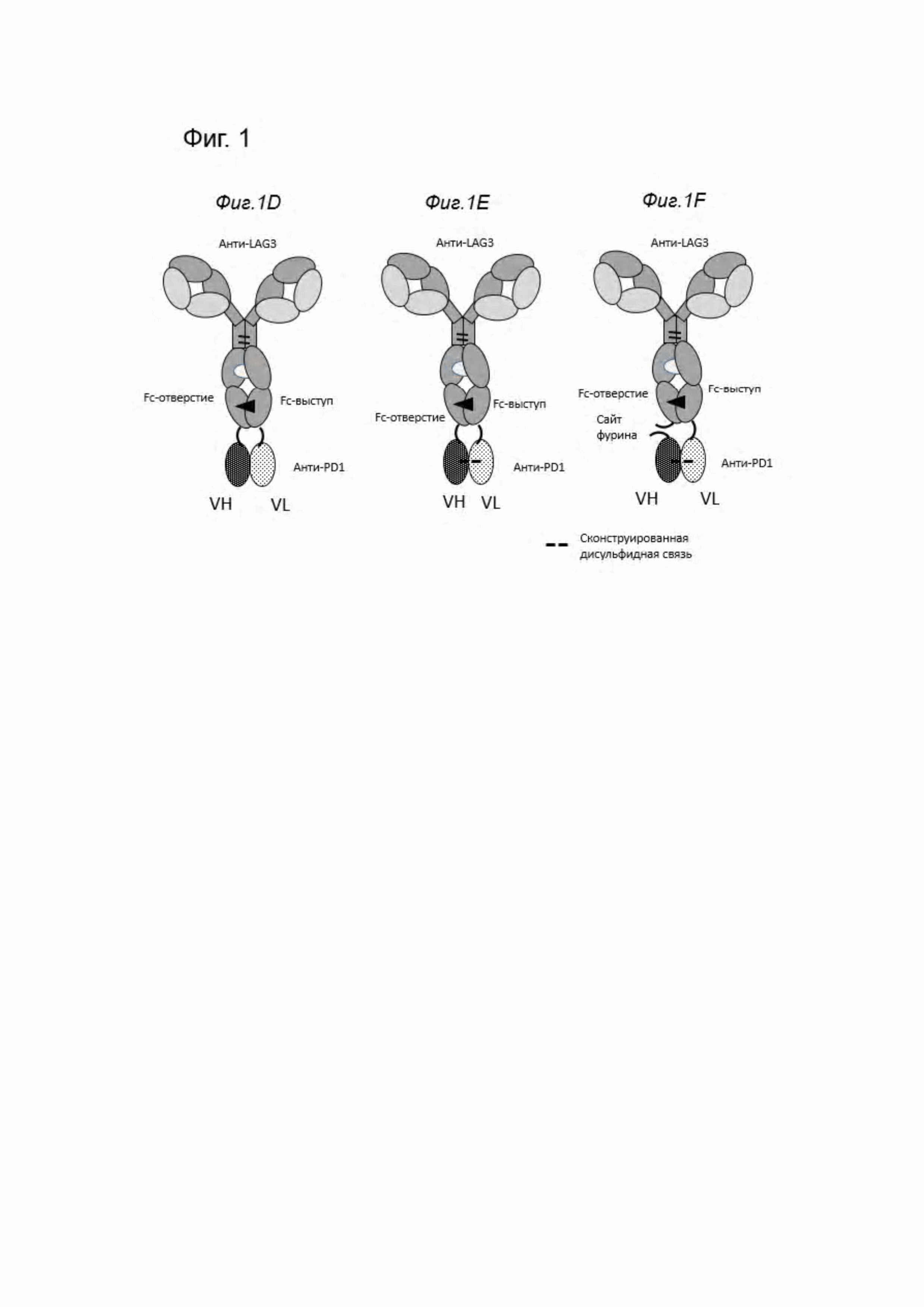
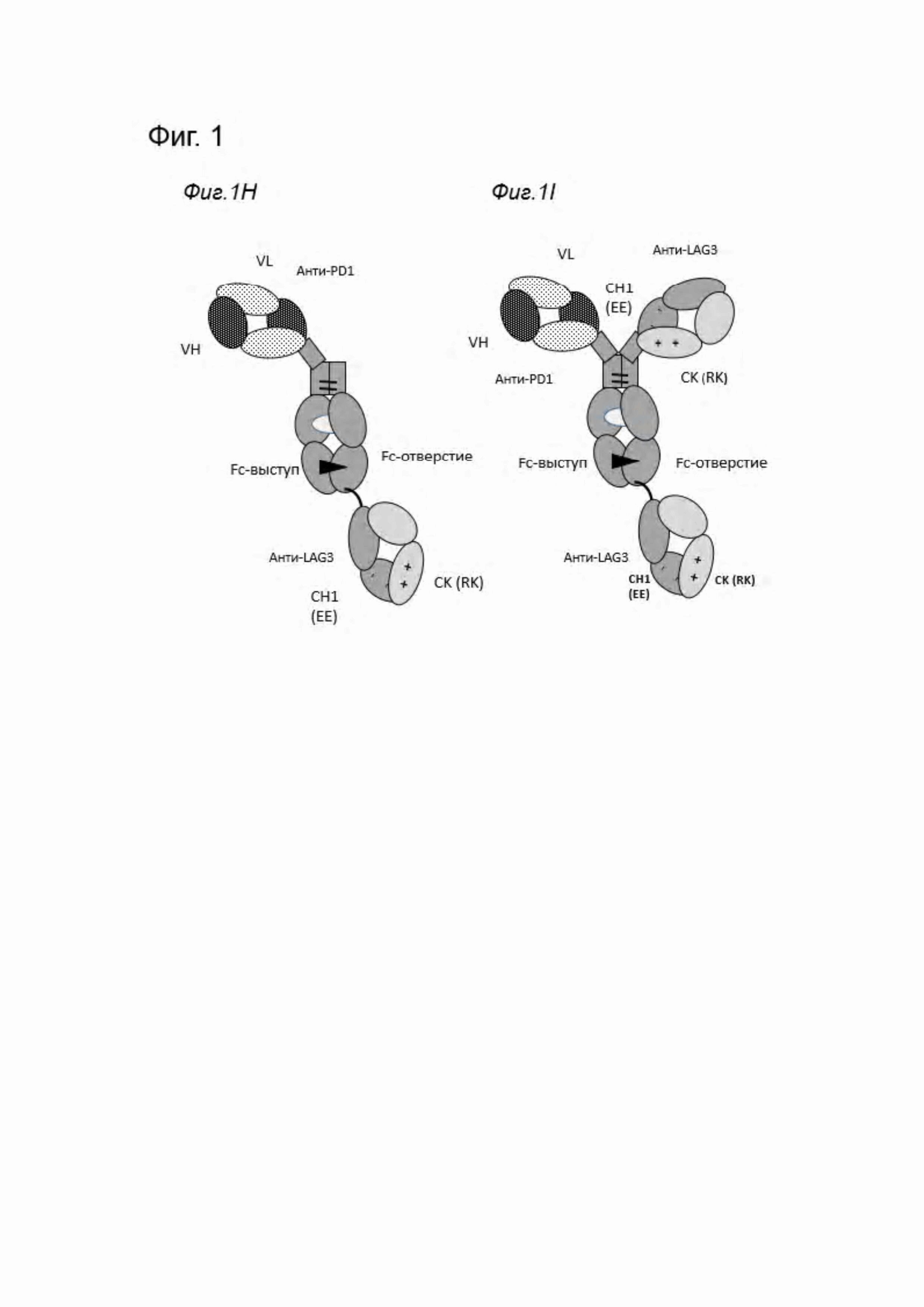
Фиг. 1. Схематическое изображение различных форматов биспецифических антител анти-PD1/анти-LAG3, описанных в данном документе. На Фиг. 1А изображен биспецифический формат 1+1, в котором PD1-связывающий домен содержит кроссоверный Fab (crossFab) (с обменом доменов VH/VL), a LAG3-связывающий домен содержит домены СН1 и CK с аминокислотными мутациями для поддержания соответствующего спаривания («заряженные варианты»). Fc-часть содержит мутации выступ-в-отверстие (показана черной стрелкой) и аминокислотные мутации L234A, L235A и P329G, почти полностью препятствующие связыванию с Fcγ-рецептором человеческого Fc-домена IgGl (показано белой областью). На Фиг. 1В продемонстрирован формат 2+1 с двумя анти-LAG3-связывающими Fab-доменами, содержащими мутации в СН1/CK, и PD1 -связывающим Fab-доменом, слитым на С-конце одной тяжелой цепи. На Фиг. 1С продемонстрирован аналогичный формат 2+1 с двумя анти-LAG3-связывающими FAB-доменами, содержащими мутации в СН1/CK, но PD1 -связывающий одноцепочечный scFab-домен, слит на С-конце одной тяжелой цепи. На Фиг. 1D продемонстрирован формат 2+1 с двумя Fab-доменами, связывающими анти-LAG3, и VH и VL, связывающими PD1, слитыми каждый с одним из С-концов тяжелых цепей. На Фиг. 1Е продемонстрирован конструкт, подобный приведенному на Фиг. 1D, однако со сконструированной дисульфидной связью между VH и VL, а на Фиг. 1F продемонстрирован вариант с сайтом фурина. На Фиг. 1G продемонстрирован биспецифический формат 2+2 с двумя анти-LAG3-связывающими Fab-доменами, содержащими мутации в СН1/CK и двумя PD1 -связывающими кроссоверными Fab-доменами, слитыми на С-конце каждой тяжелой цепи. На Фиг. 1Н продемонстрирован биспецифический формат 1+1 (называемый «транс»), в котором PD1-связывающий домен содержит кроссоверный Fab (с обменом доменов VH/VL), a LAG3-связывающий домен слит с его доменом VH на С-конце цепи с Fc-отверстием. Домен Lag3 содержит домены СН1 и CK с аминокислотными мутациями для поддержания соответствующего спаривания («заряженные варианты»). На Фиг. 1I продемонстрирован формат транс 2+1, в котором PD1 -связывающий домен содержит кроссоверный Fab (с обменом доменов VH/VL) и один LAG3-связывающий домен, содержащий домены СН1 и CK с мутациями аминокислот для поддержания соответствующего спаривания («заряженные варианты»), и второй LAG3-связывающий домен слит с его VH-доменом на С-конце цепи с Fc-отверстием.
Фиг. 2. Влияние антител aLAG-3 на цитотоксическое высвобождение гранзима В и секрецию ИЛ-2 CD4 Т-клетками человека, совместно культивируемыми с аллогенными зрелыми дендритными клетками. На Фиг. 2А продемонстрировано влияние антител aLAG3, как описано в данном документе, на секрецию гранзима В, а на Фиг. 2В продемонстрировано влияние антител aLAG3 на секрецию ИЛ-2.
Фиг. 3. Влияние антител aLAG3 в комбинации с антителом aPD1 (0376) на высвобождение цитотоксического гранзима В CD4 Т-клетками человека, совместно культивируемыми с лимфобластной В-клеточной линией (ARH77). Показано сравнение различных антител aLAG3 в комбинации с антителом aPD1 (0376) и одним только антителом aPD1 (0376).
Фиг. 4. Влияние антител aLAG3 в комбинации с антителом aPD1 (0376) на Трег подавление высвобождения гранзима В и ИФН-γ CD4 Т-клетками человека, совместно культивируемыми с облученными аллогенными МКПК. На Фиг. 4А продемонстрировано высвобождение гранзима В по сравнению с одним только aPD1 (0376), а на Фиг. 4В продемонстрировано высвобождение ИФН-у по сравнению с одним только aPD1 (0376).
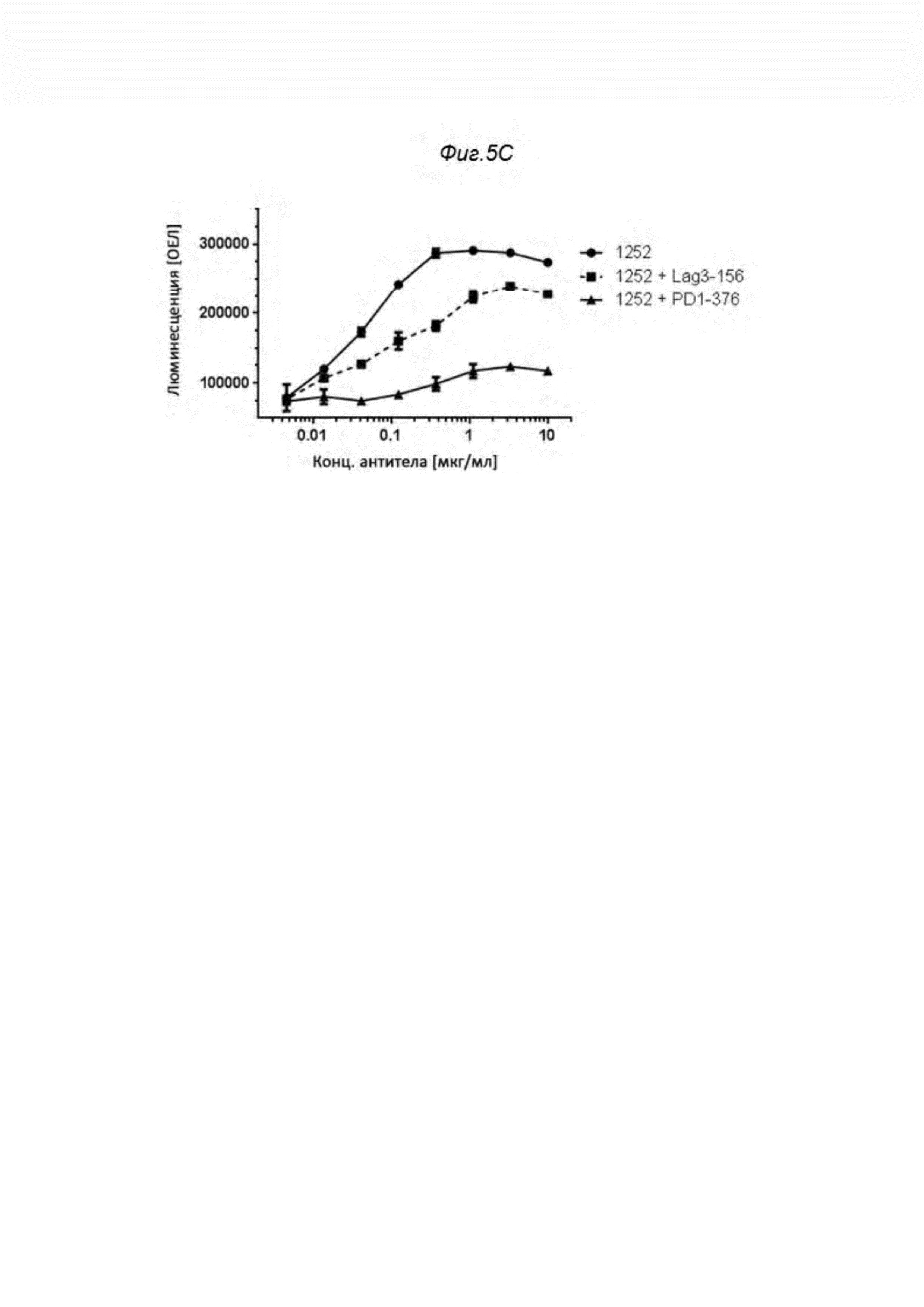
Фиг. 5. Одновременное связывание и димеризация рецептора, вызванные связыванием биспецифических анти-PD1/анти-LAG3 антител с рекомбинантными PD1+Lag3+ клетками. На графике показана хемилюминесценция (измеренная в ЕО) в зависимости от концентрации антитела. На Фиг. 5А и Фиг. 5В продемонстрировано сравнение биспецифических анти-PD1/анти-LAG3 антител и моноспецифических анти-LAG3 антител. Только биспецифические форматы были способны индуцировать хемилюминесценцию. Конкурентный эксперимент продемонстрирован на Фиг. 5С. Если одно и то же биспецифическое антитело вносилось в присутствии или антитела aLAG3 (0156, MDX25F7), или анти-PD1 антитела (0376), сигнал был или почти ингибирован (для конкуренции PD1), или по меньшей мере значительно снижен (Lag3). Дополнительный конкурентный эксперимент продемонстрирован на Фиг. 5D. Конкуренция биспецифического анти-PD1/анти-LAG3 антитела с тем же анти-PD1 антителом (0376), а также рекомбинантным белком LAG3:Fc (0160) практически устраняла сигнал, в то время как присутствие того же связывающего вещества aLAG3 (0156) приводило только к частичному ингибированию, и при этом два дополнительных анти-LAG3 антитела 0414 и 0416 значительно не модулировали сигнал.
Фиг. 6. Сравнение одновременного связывания биспецифических анти-PD1/анти-LAG3 антител в разных форматах (1+1 в сравнении с 2+1) и с различными связывающими веществами aLAG3. На Фиг. 6А продемонстрирована кривая связывания для конструкта 0799 (анти-PD1 (0376)/анти-LAG3 (0416) в формате 1+1). Кривая связывания для конструкта 8311 (анти-PD1 (0376)/анти-LAG3 (0416) в формате 1+2) продемонстрирована на Фиг. 6В. На Фиг. 6С продемонстрирована кривая связывания для конструкта 0927 (анти-PD1 (0376)/анти-LAG3 (0414) в формате 1+1). Кривая связывания для конструкта 8310 (анти-PD1 (0376)/анти-LAG3 (0414) в формате 1+2) продемонстрирована на Фиг. 6D
Фиг. 7. Сравнение одновременного связывания биспецифических анти-PD1/анти-LAG3 антител в разных форматах (2+1 в сравнении с 2+2) и с различными связывающими веществами aLAG3. На Фиг. 7А продемонстрирована кривая связывания для конструкта 8310 (анти-PD1 (0376)/анти-LAG3 (0414) в формате 1+2). Кривая связывания для конструкта 8970 (анти-PD1 (0376)/ анти-LAG3 (0414) в формате 2+2) продемонстрирована на Фиг. 7В. На Фиг. 7С продемонстрирована кривая связывания для конструкта 8311 (анти-PD1 (0376)/анти-LAG3 (0416) в формате 1+2). Кривая связывания для конструкта 8984 (анти-PD1 (0376)/анти-LAG3 (0416) в формате 2+2) продемонстрирована на Фиг. 7D. Кривые связывания для конструктов 0725 (анти-PD1 (0376)/анти-LAG3 (0414) в формате транс 1+1) и 0750 (анти-PD1 (0376)/анти-LAG3 (0414) в формате транс 1+2) продемонстрированы на Фиг. 7Е в сравнении с кривой связывания конструктов 0927 (анти-PD1 (0376)/анти-LAG3 (0414) в формате 1+1). Эти 3 конструкта также сравнивали в коммерчески доступном комбинированном анализе по гену-репортеру PD1/LAG3, и соответствующие кривые связывания продемонстрированы на Фиг. 7F.
Фиг. 8: Интернализация биспецифических анти-PD1/анти-LAG3 антител в различных форматах и исходного анти-LAG3 антитела через 3 часа после добавления к вводимым активированным Т-клеткам, как измерено при помощи проточной цитометрии. На Фиг. 8А продемонстрирована репрезентативная гистограмма эксперимента, процент интернализации для разных форматов приведен на Фиг. 8В.
Фиг. 9. Анализ во времени демонстрирует более высокую локализацию на мембране формата 1+1 биспецифического анти-PD1/анти-LAG3 антитела (0927) в сравнении с другими форматами, которые проявляют более высокую степень интернализации. На Фиг. 9А продемонстрированы флуоресцентные изображения, выполненные при помощи конфокальной микроскопии через 15 минут, 1 час и 3 часа. Активированные CD4 клетки изображены в виде черных шаров. Флуоресцентные изображения для антитела к TIM3 показаны в качестве примера сильной интернализации. Количественный анализ изображений продемонстрирован на Фиг. 9В.
Фиг. 10. Связывание с типичными Т-клетками в сравнении с Трег. На Фиг. 10А-10С продемонстрированы данные от одного репрезентативного донора, демонстрирующие связывание с типичными Т-клетками (черная кривая) и Трег (серая область). Связывание анти-LAG3 антитела 0414 (hu IgG1 PGLALA) продемонстрировано на Фиг. 10А, на Фиг. 10В и 10С продемонстрировано связывание анти-PD1 антитела 0376 и биспецифического анти-PD1/анти-LAG3 антитела (0927), соответственно. На Фиг. 10D продемонстрирована дельта геометрической средней интенсивности флуоресценции данной молекулы, связанной с типичными Т-клетками, в сравнении с Трег в том же образце. Результаты (медиана) взяты из 3 независимых экспериментов с 3 различными донорами.
Фиг. 11. Совместное блокирование PD1 и Трег сохраняет эффекторные функции Ттип (типичных Т-клеток) от Трег подавления. Продемонстрирован процент Трег подавления гранзима В, секретируемого Ттип после 5 суток совместного культивирования. Результаты (медиана) взяты из 10 независимых экспериментов с 10 различными донорами. Р-значение рассчитывали с использованием двухфакторного дисперсионного анализа.
Фиг. 12. Влияние блокирования PD-1 и LAG-3 на секрецию гранзима В и ИФН-γ CD4 Т-клетками из МКПК пациентов с помощью иммуногенных пептидных пулов меланома-антиген. На Фиг. 12 продемонстрировано сравнение влияния на высвобождение гранзима В и ИФН-γ, вызванное одним анти-PD1 (0376), комбинацией анти-PD1 (0376) с aLAG3 (0414) и биспецифическим антителом 0927 (анти-РБ1(0376)/анти-LAG3(0414) в формате 1+1). Продемонстрировано кратное увеличение продукции гранзима В и ИФН-γ в сравнении со стимулированным пептидным пулом CD4 Т-клеток от МКПК 12 пациентов с меланомой.
Фиг. 13. Влияние биспецифических антител aPD1/aLAG3 на цитотоксическое высвобождение гранзима В человеческими CD4 Т-клетками, совместно культивируемыми с лимфобластной В-клеточной линией (ARH77). Различные биспецифические анти-PD1/анти-LAG3 антитела, как описано в данном документе, сравнивают с антителами, используемыми в стандартах оказания медицинской помощи или клинических испытаниях.
Фиг. 14. Исследование эффективности у гуманизированных мышей, зараженных аденокарциномой поджелудочной железы, ВхРС3. В комбинации с СЕАСАМ CD3 ТСВ только биспецифическое антитело aPD1/aLAG3 обеспечивало статистически значимую защиту от опухолей в сравнении с типичными антителами к PD1. Изображены кривые роста опухоли у гуманизированных мышей, которым подкожно вводили клетки ВхРС3 и которых лечили указанными молекулами в комбинации с СЕАСАМ5-ТСВ.
Фиг. 15. Измерения объемов опухолей (мм3 +/- СОС) в течение 47 суток показаны для каждого отдельного животного, что демонстрирует однородность группового противоопухолевого ответа. Кривые роста опухоли продемонстрированы для группы носителя на Фиг. 15А, для одного СЕАСАМ5 CD3 ТСВ (2,5 мг/кг) на Фиг. 15В, для комбинации СЕАСАМ5 CD3 ТСВ с ниволумабом (1,5 мг/кг) на Фиг. 15С, для комбинации СЕАСАМ5 CD3 ТСВ с пембролизумабом (1,5 мг/кг) на Фиг. 15D, для комбинации СЕАСАМ5 CD3 ТСВ с PD1/LAG3 0927 на Фиг. 15Е (1,5 мг/кг) и на Фиг. 15F (3 мг/кг биспецифического антитела).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Определения
Если не указано иное, технические и научные термины, используемые в данном документе, имеют то же значение, что и в целом используемые в области техники, к которой относится данное изобретение. Для целей интерпретации данного описания будут применяться следующие определения, и при необходимости термины, используемые в единственном числе, будут также включать множественное число и наоборот.
Используемый в данном документе термин «антигенсвязывающая молекула» относится в самом широком смысле к молекуле, которая специфически связывает антигенную детерминанту. Примерами антигенсвязывающих молекул являются антитела, фрагменты антител и каркасные антигенсвязывающие белки.
Термин «антитело» в данном документе используется в самом широком смысле и охватывает различные структуры антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, моноспецифические и мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они демонстрируют желаемую антигенсвязывающую активность.
Используемый в данном документе термин «моноклональное антитело» относится к антителу, полученному из популяции по существу однородных антител, то есть отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержащих встречающиеся в природе мутации или возникающих во время получения препарата моноклонального антитела, такие варианты обычно присутствуют в небольших количествах. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене.
Термин «моноспецифическое» антитело в контексте данного описания обозначает антитело, которое имеет один или более сайтов связывания, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена. Термин «биспецифическое» означает, что антитело способно специфически связываться по меньшей мере с двумя различными антигенными детерминантами, например, с двумя сайтами связывания, каждый из которых образован парой вариабельного домена тяжелой цепи антитела (VH) и вариабельного домена легкой цепи антитела (VL), связывающимися с разными антигенами или с разными эпитопами на одном и том же антигене. Такое биспецифическое антитело имеет формат 1+1. Другие форматы биспецифических антител имеют форматы 2+1 (включая два сайта связывания для первого антигена или эпитопа и один сайт связывания для второго антигена или эпитопа) или форматы 2+2 (содержащие два сайта связывания для первого антигена или эпитопа и два связывания сайты для второго антигена или эпитопа). Как правило, биспецифическое антитело содержит два антигенсвязывающих сайта, каждый из которых специфичен для определенной антигенной детерминанты.
Термин «валентный», используемый в данной заявке, обозначает наличие определенного числа связывающих доменов в антигенсвязывающей молекуле. Как таковые, термины «двухвалентный», «четырехвалентный» и «шестивалентный» обозначают наличие в антигенсвязывающей молекуле двух связывающих доменов, четырех связывающих доменов и шести связывающих доменов, соответственно. Биспецифические антитела согласно изобретению являются по меньшей мере «двухвалентными» и могут быть «трехвалентными» или «мультивалентными» (например, «четырехвалентными» или «шестивалентными»). В конкретном аспекте антитела согласно данному изобретению имеют два или более сайтов связывания и являются биспецифическими. То есть антитела могут быть биспецифическими даже в тех случаях, когда имеется более двух сайтов связывания (то есть антитело является трехвалентным или мультивалентным).
Термины «полноразмерное антитело», «интактное антитело» и «полное антитело» используются в данном документе взаимозаменяемо для обозначения антитела, имеющего структуру, по существу сходную со структурой нативного антитела. «Нативные антитела» относятся к встречающимся в природе молекулам иммуноглобулина, имеющим разные структуры. Например, нативные антитела класса IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой около 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. В направлении от N- к С-концу каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которым следуют три константных домена (CH1, СН2 и СН3), также называемые константной областью тяжелой цепи. Аналогично, от N- к С-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которым следует константный домен легкой цепи (CL), также называемый константной областью легкой цепи. Тяжелая цепь антитела может быть отнесена к одному из пяти типов, называемых α (IgA), δ(IgD), ε (IgE), γ (IgG) или μ (IgM), некоторые из которых могут быть дополнительно разделены на подтипы, например γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
«Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывает антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются ими, Fv, Fab, Fab', Fab'-SH, F (ab')2; диатела, триатела, тетратела, фрагменты crossFab; линейные антитела; молекулы одноцепочечных антител (например, scFv); мультиспецифические антитела, образованные из фрагментов антител и однодоменных антител. Для обзора некоторых фрагментов антител см. Hudson et al., Nat Med 9, 129-134 (2003). Для обзора фрагментов scFv, см., например, Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); см. также WO 93/16185; и патенты США №№5571894 и 5587458. Обсуждение фрагментов Fab и F(ab')2, содержащих остатки эпитопа связывания рецептора реутилизации и имеющих увеличенное in vivo время полужизни, смотрите в патенте США №5869046. Диатела представляют собой фрагменты антител с двумя антигенсвязывающими доменами, которые могут быть двухвалентными или биспецифическими, см., например, ЕР 404097; WO 1993/01161; Hudson et al., Nat Med 9, 129-134 (2003); и Hollinger et al., Proc Natl Acad Sci USA 90, 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat Med 9, 129-134 (2003). Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В некоторых вариантах осуществления однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Уолтем, Массачусетс; см. например, патент США №6248516 В1). Кроме того, фрагменты антител содержат одноцепочечные полипептиды, имеющие характеристики домена VH, а именно, способность собираться вместе с доменом VL, или домена VL, а именно, способность собираться вместе с доменом VH в функциональный антигенсвязывающий сайт и тем самым обеспечивая антигенсвязывающее свойство полноразмерных антител. Фрагменты антител могут быть получены различными способами, включая, но не ограничиваясь этим, протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, E. coli или фагом), как описано в данном документе.
Расщепление интактных антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых «Fab-фрагментами», каждый из которых содержит вариабельные домены тяжелой и легкой цепей, а также константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Используемый в данном документе термин «Fab-фрагмент» относится к фрагменту антитела, содержащему фрагмент легкой цепи, содержащий домен VL и константный домен легкой цепи (CL), а также домен VH и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце СН1 домена тяжелой цепи, включая один или более цистеинов из шарнирной области антитела. Fab'-SH представляют собой Fab'-фрагменты, в которых остаток (остатки) цистеина константных доменов имеют свободную тиольную группу. Обработка пепсином дает Р(ab')2-фрагмент, который имеет два антигенсвязывающих сайта (два Fab-фрагмента) и часть Fc-области.
Термин «cross-Fab фрагмент» или «xFab фрагмент» или «кроссоверный Fab-фрагмент» относится к Fab-фрагменту, в котором осуществляется обмен вариабельных областей или константных областей тяжелой и легкой цепи. Возможны две различные композиции цепей кроссоверной молекулы Fab, которые включены в биспецифические антитела согласно изобретению: с одной стороны, вариабельные области тяжелой и легкой цепи Fab обмениваются, то есть кроссоверная молекула Fab содержит пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1), и пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL). Данная кроссоверная молекула Fab также называется CrossFab(VLVH). С другой стороны, когда константные области тяжелой и легкой цепи Fab обмениваются, кроссоверная молекула Fab содержит пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL), и пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1). Данная кроссоверная молекула Fab также называется CrossFab(CLCH1).
«Одноцепочечный Fab-фрагмент» или «scFab» представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), константного домена антитела 1 (СН1), вариабельного домена легкой цепи антитела (VL), константного домена легкой цепи антитела (CL) и линкера, причем указанные домены антител и указанный линкер имеют один из следующих порядков в направлении от N-конца к С-концу: а) VH-CH1-линкер-VL-CL, b) VL-CL-линкер -VH-CH1, с) VH-CL-линкер-VL-СН1 или d) VL-CH1-линкер-VH-CL; и при этом указанный линкер представляет собой полипептид по меньшей мере из 30 аминокислот, предпочтительно от 32 до 50 аминокислот.Указанные одноцепочечные Fab-фрагменты стабилизируются посредством природной дисульфидной связи между доменом CL и доменом СН1. Кроме того, эти одноцепочечные молекулы Fab могут быть дополнительно стабилизированы путем генерации межцепочечных дисульфидных связей посредством вставки остатков цистеина (например, положение 44 в вариабельной области тяжелой цепи и положение 100 в вариабельной области легкой цепи согласно нумерации Кабат).
«Кроссоверный одноцепочечный Fab-фрагмент» или «x-scFab» представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), константного домена антитела 1 (СН1), вариабельного домена легкой цепи антитела (VL), константного домена легкой цепи антитела (CL) и линкера, причем указанные домены антитела и указанный линкер имеют один из следующих порядков в направлении от N-конца к С-концу: a) VH-CL-линкер-VL-CH1 и b) VL-СН1-линкер-VH-CL; при этом VH и VL образуют вместе антигенсвязывающий домен, который специфически связывается с антигеном, и причем указанный линкер представляет собой полипептид, содержащий по меньшей мере 30 аминокислот. Кроме того, эти молекулы х-scFab могут быть дополнительно стабилизированы путем генерации межцепочечных дисульфидных связей посредством вставки остатков цистеина (например, положение 44 в вариабельной области тяжелой цепи и положение 100 в вариабельной области легкой цепи в соответствии с нумерацией Кабат).
«Одноцепочечный вариабельный фрагмент (scFv)» представляет собой слитый белок, состоящий из вариабельных областей тяжелой (VH) и легкой цепей (VL) антитела, связанных с коротким линкерным пептидом, содержащим от десяти до приблизительно 25 аминокислот. Линкер обычно богат глицином для гибкости, а также серином или треонином для растворимости и может или соединять N-конец VH с С-концом VL, или наоборот. Данный белок сохраняет специфичность исходного антитела, несмотря на удаление константных областей и введение линкера. scFv-антитела, например, описаны в Houston, J.S., Methods in Enzymol. 203 (1991) 46-96). Кроме того, фрагменты антител содержат одноцепочечные полипептиды, имеющие характеристики домена VH, а именно, способность собираться вместе с доменом VL, или домена VL, а именно, способность собираться вместе с доменом VH в функциональный антигенсвязывающий сайт и тем самым обеспечивая антигенсвязывающее свойство полноразмерных антител.
«Каркасные антигенсвязывающие белки» известны в данной области техники, например, фибронектин и сконструированные белки с анкириновым повтором (DARPin) были использованы в качестве альтернативных каркасов для антигенсвязывающих доменов, см., например, Gebauer and Skerra, Engineered protein scaffolds as next-generation antibody therapeutics. Curr Opin Chem Biol 13:245-255 (2009) и Stumpp et al., Darpins: A new generation of protein therapeutics. Drug Discovery Today 13: 695-701 (2008). В одном аспекте изобретения каркасный антигенсвязывающий белок выбирают из группы, состоящей из CTLA-4 (Evibody), липокалинов (антикалин), молекулы, полученной из белка А, такой как Z-домен белка А (аффитело), А-домена (Avimer/Maxibody), сывороточного трансферрина (транс-тело); сконструированного белка с анкириновым повтором (DARPin), вариабельного домена легкой цепи или тяжелой цепи антитела (однодоменное антитело, одАт), вариабельного домена тяжелой цепи антитела (нанотело, aVH), фрагментов VNAR, фибронектина (AdNectin), домена лектина С-типа (тетранектин); вариабельного домена нового рецептора антигена бета-лактамазы (фрагменты VNAR), человеческого гамма-кристаллина или убиквитина (молекулы аффилина); домена Кунитц-типа ингибиторов протеазы человека, микротела, такого как белки из семейства кноттинов, пептидные аптамеры и фибронектин (аднектин). CTLA-4 (белок 4, ассоциированный с цитотоксическими Т-лимфоцитами) представляет собой рецептор семейства CD28, экспрессируемый в основном на CD4+ Т-клетках. Его внеклеточный домен имеет конформацию, подобную вариабельному домену lg. Петли, соответствующие CDR антител, могут быть замещены гетерологичной последовательностью для придания различных свойств связывания. Молекулы CTLA-4, сконструированные так, чтобы иметь различную специфичность связывания, также известны как Evibody (например, US 7166697 В1). Evibody имеют примерно тот же размер, что и выделенная вариабельная область антитела (например, доменного антитела). Для получения дополнительной информации см. Journal of Immunological Methods 248 (1-2), 31-45 (2001). Липокалины представляют собой семейство внеклеточных белков, которые транспортируют небольшие гидрофобные молекулы, такие как стероиды, билины, ретиноиды и липиды. Они имеют жесткую вторичную структуру бета-складки с несколькими петлями на открытом конце конической структуры, которые могут быть сконструированы для связывания с различными целевыми антигенами. Антикалины имеют размер от 160 до 180 аминокислот и являются производными липокалинов. Для получения дополнительной информации см. Biochim Biophys Acta 1482: 337-350 (2000), US 7250297 B1 и US 20070224633. Аффитело представляет собой каркас, полученный из белка A Staphylococcus aureus, который может быть сконструирован для связывания с антигеном. Домен состоит из трехспирального пучка из приблизительно 58 аминокислот. Библиотеки были получены путем рандомизации поверхностных остатков. Для получения дополнительной информации см. Protein Eng. Des. Sel. 2004, 17, 455-462 и ЕР 1641818 А1. Авимеры представляют собой мультидоменные белки, полученные из семейства А-доменного каркаса. Нативные домены размером примерно 35 аминокислот принимают определенную структуру, связанную дисульфидными связями. Разнообразие получают путем перегруппировки природных вариаций, проявляемых семейством А-доменов. Для получения дополнительной информации см. Nature Biotechnology 23(12), 1556 - 1561 (2005) и Expert Opinion on Investigational Drugs 16(6), 909-917 (June 2007). Трансферрин представляет собой мономерный сывороточный транспортный гликопротеин. Трансферрины могут быть сконструированы для связывания различных целевых антигенов путем введения пептидных последовательностей в пермиссивную поверхностную петлю. Примеры сконструированных трансферриновых каркасов включают транс-тело. Для получения дополнительной информации см. J. Biol. Chem 274, 24066-24073 (1999). Сконструированные белки с анкириновым повтором (DARPin) получены из анкирина, который относится к семейству белков, которые обеспечивают прикрепление интегральных мембранных белков к цитоскелету. Один анкириновый повтор представляет собой мотив из 33 остатков, состоящий из двух альфа-спиралей и бета-изгиба. Они могут быть сконструированы так, чтобы связывать различные целевые антигены путем рандомизации остатков в первой альфа-спирали и бета-изгибе каждого повтора. Их поверхность связывания может быть увеличена путем увеличения количества модулей (способ созревания аффинности). Для получения дополнительной информации см. J. Mol. Biol. 332, 489-503 (2003), PNAS 100(4), 1700-1705 (2003) и J. Mol. Biol. 369, 1015-1028 (2007) и US 20040132028 A1.
Однодоменное антитело представляет собой фрагмент антитела, состоящий из одного мономерного вариабельного домена антитела. Первые единичные домены были получены из вариабельного домена тяжелой цепи антитела из верблюдов (нанотела или фрагменты VHH). Кроме того, термин «однодоменное антитело» включает автономный вариабельный домен тяжелой цепи человека (aVH) или фрагменты VNAR, полученные из акул. Фибронектин представляет собой каркас, который может быть сконструирован для связывания с антигеном. Аднектины состоят из основной цепи природной аминокислотной последовательности 10-го домена из 15 повторяющихся звеньев человеческого фибронектина типа III (FN3). Три петли на одном конце бета-сэндвича могут быть сконструированы так, чтобы позволить аднектину специфически распознавать представляющую интерес терапевтическую мишень. Для получения дополнительной информации см. Protein Eng. Des. Sel. 18, 435-444 (2005), US 20080139791, WO 2005056764 и US 6818418 B1. Пептидные аптамеры представляют собой комбинаторные молекулы распознавания, которые состоят из константного каркасного белка, обычно тиоредоксина (ТгхА), который содержит ограниченную вариабельную пептидную петлю, вставленную в активный сайт.Для получения дополнительной информации см. Epert Opin. Biol. Ther. 5, 783-797 (2005). Микротела получены из встречающихся в природе микропротеинов длиной 25-50 аминокислот, которые содержат 3-4 цистеиновых мостика. Примеры микропротеинов включают KalataBI, конотоксин и кноттины. Микропротеины имеют петлю, которая может включать до 25 аминокислот, не затрагивая общую складку микропротеина. Для получения дополнительной информации о сконструированных доменах ноттина см. WO 2008098796.
«Антигенсвязывающая молекула, которая связывается с тем же эпитопом», что и эталонная молекула, относится к антигенсвязывающей молекуле, которая блокирует связывание эталонной молекулы с ее антигеном в конкурентном анализе на 50% или более, и наоборот, эталонная молекула блокирует связывание антигенсвязывающей молекулы с ее антигеном в конкурентном анализе на 50% или более.
Используемый в данном документе термин «антигенсвязывающий домен» или «антигенсвязывающий сайт» относится к части антигенсвязывающей молекулы, которая специфически связывается с антигенной детерминантой. Более конкретно, термин «антигенсвязывающий домен» относится к части антитела, которая содержит область, которая специфически связывается с и комплементарна части или всему антигену. Когда антиген большой, антигенсвязывающая молекула может связываться только с определенной частью антигена, эта часть называется эпитопом. Антигенсвязывающий домен может быть обеспечен, например, одним или более вариабельными доменами (также называемыми вариабельными областями). Предпочтительно антигенсвязывающий домен содержит вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH). В одном аспекте антигенсвязывающий домен способен связываться с его антигеном и блокировать или частично блокировать его функцию. Антигенсвязывающие домены, которые специфически связываются с PD1 или с LAG3, включают антитела и их фрагменты, как дополнительно определено в данном документе. Кроме того, антигенсвязывающие домены могут включать каркасные антигенсвязывающие белки, например, связывающие домены, которые основаны на сконструированных повторяющихся белках или сконструированных повторяющихся доменах (см., например, WO 2002/020565).
Используемый в данном документе термин «антигенная детерминанта» является синонимом «антиген» и «эпитоп» и относится к сайту (например, непрерывному участку аминокислот или конформационной конфигурации, состоящей из различных областей несмежных аминокислот) на макромолекуле полипептида, с которым связывается антигенсвязывающий фрагмент, образуя комплекс антигенсвязывающий фрагмент-антиген. Пригодные антигенные детерминанты могут быть обнаружены, например, на поверхностях опухолевых клеток, на поверхностях инфицированных вирусом клеток, на поверхностях других пораженных клеток, на поверхности иммунных клеток, в сыворотке крови в свободном виде, и/или во внеклеточном матриксе (ВКМ). Белки, используемые в качестве антигенов в данном изобретении, могут представлять собой любую нативную форму белков из любого источника, относящегося к позвоночным, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы), если не указано иное. В конкретном варианте осуществления антиген представляет собой человеческий белок. Когда в данном документе делается ссылка на конкретный белок, этот термин охватывает «полноразмерный», непроцессированный белок, а также любую форму белка, которая является результатом процессинга в клетке. Термин также охватывает встречающиеся в природе варианты белка, например, сплайсинговые варианты или аллельные варианты.
Под «специфическим связыванием» подразумевается, что связывание является селективным для антигена и может быть отделено от нежелательных или неспецифических взаимодействий. Способность антигенсвязывающей молекулы связываться со специфическим антигеном может быть измерена или с помощью иммуноферментного анализа (ИФА), или с помощью других способов, известных специалисту в данной области техники, например, при помощи поверхностного плазмонного резонанса (ППР) (анализ на приборе BIAcore) (Liljeblad et al., Glyco J 17, 323-329 (2000)) и стандартных анализов связывания (Heeley, Endocr Res 28, 217-229 (2002)). В одном варианте осуществления степень связывания антигенсвязывающей молекулы с неродственным белком составляет менее чем около 10% от связывания антигенсвязывающей молекулы с антигеном, как измерено, например, при помощи ППР. В некоторых вариантах осуществления молекула, которая связывается с антигеном, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-7 М или менее, например, от 10-7 М до 10-13 М, например, от 10-9 М до 10-13 М).
«Аффинность» или «аффинность связывания» относится к силе общей суммы нековалентных взаимодействий между одним сайтом связывания молекулы (например, антителом) и его партнером по связыванию (например, антигеном). Если не указано иное, как используется в данном документе, «аффинность связывания» относится к внутренней аффинности связывания, которая отражает взаимодействие 1: 1 между членами пары связывания (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y обычно может быть представлена константой диссоциации (Kd), которая является соотношением констант скорости диссоциации и ассоциации (koff и kon, соответственно). Таким образом, эквивалентные аффинности могут включать разные константы скорости, при условии, что соотношение констант скорости остается неизменным. Аффинность может быть измерена общепринятыми способами, известными в данной области техники, в том числе описанными в данном документе. Конкретным способом измерения аффинности является поверхностный плазмонный резонанс (ППР).
Используемый в данном документе термин «высокая аффинность» антитела относится к антителу, имеющему для целевого антигена Kd 10-9 М или менее, а еще более конкретно, 10-10 М или менее. Термин «низкая аффинность» антитела относится к антителу, имеющему Kd 10-8 или выше.
Антитело с «созревшей аффинностью» относится к антителу с одним или более изменениями в одной или более гипервариабельных областях (HVR) по сравнению с исходным антителом, которое не обладает такими изменениями, такие изменения, приводят к улучшению аффинности антитела к антигену.
Термины «биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3», «биспецифическое антитело, которое специфически связывается с PD1 и LAG3», «биспецифическая антигенсвязывающая молекула, специфическая для PD1, и LAG3» или «анти-PD1/анти-LAG3 антитело» используются в данном документе взаимозаменяемо и относятся к биспецифическому антителу, которое способно связывать PD1 и LAG3 с достаточной аффинностью, так что антитело может использоваться в качестве диагностического и/или терапевтического агента при нацеливании на PD1 и LAG3.
Термин «PD1», также известный как белок запрограммированной гибели клеток 1, представляет собой мембранный белок типа I из 288 аминокислот, который был впервые описан в 1992 году (Ishida et al., EMBO J., 11 (1992), 3887-3895). PD-1 является членом расширенного семейства регуляторов Т-клеток CD28/CTLA-4 и имеет два лиганда, PD-L1 (В7-Н1, CD274) и PD-L2 (B7-DC, CD273). Структура белка включает внеклеточный домен IgV, за которым следует трансмембранная область и внутриклеточный хвост. Внутриклеточный хвост содержит два сайта фосфорилирования, расположенных в иммунорецепторном тирозиновом ингибирующем мотиве и иммунорецепторном тирозиновом переключающем мотиве, что свидетельствует о том, что PD-1 негативно регулирует сигналы ТКР. Это согласуется со связыванием фосфатаз SHP-1 и SHP-2 с цитоплазматическим хвостом PD-1 при связывании лиганда. Хотя PD-1 не экспрессируется на наивных Т-клетках, его экспрессия повышается после активации, опосредованной Т-клеточным рецептором (ТКР), и он наблюдается как на активированных, так и на истощенных Т-клетках (Agata et al., Int. Immunology 8 (1996), 765-772). Эти истощенные Т-клетки имеют дисфункциональный фенотип и неспособны ответить соответствующим образом. Хотя PD-1 имеет относительно широкий паттерн экспрессии, его наиболее важная роль, вероятно, заключается в том, что он является коингибирующим рецептором Т-клеток (Chinai et al., Trends in Pharmacological Sciences 36 (2015), 587-595). Таким образом, современные терапевтические подходы направлены на блокирование взаимодействия PD-1 с его лигандами для усиления Т-клеточного ответа. Термины «запрограммированная гибель клеток 1», «запрограммированная смерть клеток 1», «белок PD-1», «PD-1», «PD1», «PDCD1», «hPD-1» и «hPD-I» могут использоваться взаимозаменяемо и включают варианты, изоформы, видовые гомологи человеческого PD-1 и аналоги, имеющие по меньшей мере один общий эпитоп с PD-1. Аминокислотная последовательность человеческого PD1 приведена в UniProt (www.uniprot.org), номер доступа Q15116 (SEQ ID NO: 128).
Термины «анти-PD1 антитело» и «антитело, содержащее антигенсвязывающий домен, который связывается с PD1» относятся к антителу, которое способно связывать PD1, особенно полипептид PD1, экспрессируемый на поверхности клетки, с достаточной аффинностью, так что антитело может использоваться в качестве диагностического и/или терапевтического агента при нацеливании на PD1. В одном аспекте степень связывания анти-PD1 антитела с неродственным белком, не являющимся PD1, составляет менее чем около 10% от связывания антитела с PD1, как измерено, например, при помощи радиоиммуноанализа (РИА) или проточной цитометрии, включающей флуоресцентно-активированную сортировку клеток (FACS), или при помощи анализа методом поверхностного плазмонного резонанса с использованием биосенсорной системы, такой как система Biacore®. В определенных аспектах антигенсвязывающий белок, который связывается с человеческим PD1, имеет значение Ко аффинности связывания для связывания с человеческим PD1 ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В одном предпочтительном варианте осуществления соответствующее значение Ко аффинности связывания определяют в анализе методом поверхностного плазмонного резонанса с использованием внеклеточного домена (ECD) человеческого PD1 (PD1-ECD) для аффинности связывания PD1. Термин «анти-PD1 антитело» также охватывает биспецифические антитела, которые способны связывать PD1 и второй антиген.
Термины «LAG3» или «Lag-3» или «ген активации лимфоцитов 3 » или «CD223», используемые в данном документе, относятся к любому нативному LAG3 из любого источника, относящегося к позвоночным, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы), если не указано иное. Термин охватывает «полноразмерный» непроцессированный LAG3, а также любую форму LAG3, полученную в результате процессинга в клетке. Термин также охватывает встречающиеся в природе варианты LAG3, например, сплайсинговые варианты или аллельные варианты. В одном предпочтительном варианте осуществления термин «LAG3» относится к человеческому LAG3. Аминокислотная последовательность типичного процессированного (без сигнальных последовательностей) LAG3 приведена в SEQ ID NO: 73. Аминокислотная последовательность типичного внеклеточного домена (ECD) LAG3 приведена в SEQ ID NO: 74.
Термины «анти-LAG3 антитело» и «антитело, которое связывается с LAG3» относятся к антителу, которое способно связывать LAG3 с достаточной аффинностью, так что антитело может использоваться в качестве диагностического и/или терапевтического агента при нацеливании на LAG3. В одном аспекте степень связывания анти-LAG3 антитела с неродственным белком, не являющимся LAG3, составляет менее чем около 10% от связывания антитела с LAG3, как измерено, например, при помощи радиоиммуноанализа (РИА). В некоторых вариантах осуществления антитело, которое связывается с LAG3, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В определенных аспектах анти-LAG3 антитело связывается с эпитопом LAG3, который является консервативным среди LAG3 от разных видов. В одном предпочтительном варианте осуществления «анти-LAG3 антитело», «антитело, которое специфически связывается с LAG3 человека» и «антитело, которое связывается с LAG3 человека» относится к антителу, специфически связывающемуся с антигеном LAG3 человека или его внеклеточным доменом (ECD) с аффинностью связывания со значением KD 1,0×10-8 моль/л или ниже, в одном варианте осуществления со значением KD 1,0×10-9 моль/л или ниже, в одном варианте осуществления со значением KD от 1,0×10-9 моль/л до 1,0×10-13 моль/л. В данном контексте аффинность связывания определяют с помощью стандартного анализа связывания, такого как метод поверхностного плазмонного резонанса (BIAcore®, GE-Healthcare Уппсала, Швеция), например, с использованием внеклеточного домена LAG3. Термин «анти-LAG3 антитело» также охватывает биспецифические антитела, которые способны связывать LAG3 и второй антиген.
«Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. В некоторых вариантах блокирующие антитела или антагонистические антитела по существу или полностью ингибируют биологическую активность антигена. Например, биспецифические антитела согласно изобретению блокируют сигналинг через PD-1 и LAG3, чтобы восстановить функциональный ответ Т-клеток (например, пролиферацию, продукцию цитокинов, уничтожение целевых клеток) с дисфункционального состояния на стимуляцию антигеном.
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антигенсвязывающей молекулы с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). См., например, Kindt et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007). Одного домена VH или VL может быть достаточно для придания антигенсвязывающей специфичности.
Используемый в данном документе термин «гипервариабельная область» или «HVR» относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно определенные петли («гипервариабельные петли»). Как правило нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). HVR обычно содержат аминокислотные остатки из гипервариабельных петель и/или из «определяющих комплементарность областей» (CDR), причем последние имеют самую высокую вариабельность последовательности и/или участвуют в распознавании антигена. Типичные гипервариабельные петли располагаются у аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2), и 96-101 (Н3). (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987).) Типичные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2, и CDR-H3) располагаются у аминокислотных остатков 24-34 L1, 50-56 L2, 89-97 L3, 31-35 В H1, 50-65 Н2 и 95-102 Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).) Гипервариабельные области (HVR) также называют определяющими комплементарность областями (CDR) и эти термины используются в данном документе взаимозаменяемо в отношении частей вариабельной области, которые образуют антигенсвязывающие области. Эта конкретная область была описана Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) и Chothia et al., J. Mol. Biol. 196:901-917 (1987), причем определения включают перекрывающиеся или подмножества аминокислотных остатков при сравнении друг с другом. Тем не менее подразумевается, что применение любого определения для ссылки на CDR антитела или его вариантов находится в пределах объема термина, определенного и используемого в данном документе. Подходящие аминокислотные остатки, которые охватывают CDR, как определено в каждой из приведенных выше ссылок, приведены ниже в таблице А в качестве сравнения. Точные числа остатков, которые охватывают конкретный CDR, будут варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области техники могут обычно определять, какие остатки составляют конкретный CDR, учитывая аминокислотную последовательность вариабельной области антитела.

Kabat et al. также составили систему нумерации последовательностей вариабельной области, которая применима к любому антителу. Специалист в данной области техники может однозначно назначить эту систему «нумерации по Кабату» любой последовательности вариабельной области, не полагаясь на какие-либо экспериментальные данные, помимо самой последовательности. Используемый в данном документе термин «нумерация по Кабату» относится к системе нумерации, установленной Kabat et al., U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest" (1983). Если не указано иное, ссылки на нумерацию конкретных положений аминокислотных остатков в вариабельной области антитела соответствуют системе нумерации по Кабату.
За исключением CDR1 в VH, CDR обычно содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также содержат «определяющие специфичность остатки» или «SDR», которые представляют собой остатки, которые связываются с антигеном. SDR содержатся в областях CDR, называемых укороченными CDR, или a-CDR. Типичные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) располагаются у аминокислотных остатков 31-34 L1, 50-55 L2, 89-96 L3, 31-35 В H1, 50-58 H2 и 95-102 Н3. (См. Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008).) Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) пронумерованы в данном документе согласно Kabat et al.
«Каркасная область» или «FR» относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3, и FR4. Соответственно, последовательности HVR и FR, как правило, располагаются в следующем порядке в VH (или VL): FR 1-Н1 (L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
«Акцепторная человеческая каркасная область» для целей данного изобретения представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученную из каркасной области иммуноглобулина человека или человеческой консенсусной каркасной области, как определено ниже. Акцепторная человеческая каркасная область, «полученная из» каркасной области иммуноглобулина человека или человеческая консенсусная каркасная область, может содержать такую же аминокислотную последовательность или может содержать изменения аминокислотной последовательности. В некоторых вариантах осуществления число замен аминокислот составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления последовательность акцепторной человеческой каркасной области VL идентична с последовательностью каркасной области VL человеческого иммуноглобулина или человеческой консенсусной каркасной области.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или вида, в то время как остаток тяжелой и/или легкой цепи получен из другого источника или вида.
«Класс» антитела относится к типу константного домена или константной области, которой обладает его тяжелая цепь. Существует пять основных классов антител: IgA, IgD, IgE, IgG, и IgM, и некоторые из них могут быть далее разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1, и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ, и μ, соответственно.
«Гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления гуманизированное антитело будет содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют таковым из антител нечеловеческого происхождения, и все или по существу все FR соответствуют таковым из человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, полученной из человеческого антитела. «Гуманизированная форма» антитела, например нечеловеческого антитела, относится к антителу, которое подвергли гуманизации. Другими формами «гуманизированных антител», охватываемых данным изобретением, являются те, в которых константная область была дополнительно модифицирована или изменена по сравнению с формой исходного антитела для создания свойств согласно изобретению, особенно в отношении связывания C1q и/или связывания Fc-рецептора (FcR).
«Человеческое» антитело представляет собой антитело, которое имеет аминокислотную последовательность, которая соответствует
последовательности антитела, продуцируемого организмом человека или клеткой человека, или полученного из источника, отличного от человека, который использует репертуары антител человека или другие последовательности, кодирующие антитела человека. Такое определение человеческого антитела явным образом исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
Используемый в данном документе термин «моноклональное антитело» относится к антителу, полученному из популяции по существу однородных антител, то есть отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержащих встречающиеся в природе мутации или возникающих во время получения препарата моноклонального антитела, такие варианты обычно присутствуют в небольших количествах. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене. Таким образом, определение «моноклональный» указывает на характеристику антитела, полученного по существу из однородной популяции антител, и не должно быть истолковано как необходимость получения антитела каким-либо конкретным способом. Например, моноклональные антитела для использования согласно данному изобретению можно получить с помощью различных способов, включая, без ограничений, метод гибридомы, методы рекомбинантных ДНК, методы фагового дисплея и способы с использованием трансгенных животных, полностью или частично содержащих локусы человеческого иммуноглобулина, причем такие способы и другие типичные способы получения моноклональных антител описаны в данном документе.
Термин «Fc-домен» или «Fc-область» в данном описании используется для определения С-концевой области тяжелой цепи антитела, которая содержит по меньшей мере часть константной области. Термин включает нативные последовательности Fc-области и варианты Fc-областей. В частности, Fc-область тяжелой цепи человеческого IgG находится в пределах от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако Fc-область может содержать или не содержать С-концевой лизин (Lys447). Аминокислотные последовательности тяжелых цепей всегда представлены С-концевым лизином, однако варианты без С-концевого лизина включены в изобретение.
Fc-область IgG содержит домен СН2 IgG и домен СН3 IgG. «Домен СН2» Fc-области человеческого IgG обычно находится в пределах от аминокислотного остатка в положении около 231 до аминокислотного остатка в положении около 340. В одном варианте осуществления углеводная цепь присоединена к домену СН2. В данном документе домен СН2 может представлять собой домен СН2 с нативной последовательностью или вариант домена СН2. «Домен СН3» содержит участок с остатками С-конца к домену СН2 в Fc-области (то есть от аминокислотного остатка примерно в положении 341 до аминокислотного остатка Область СН3 в данном документе может представлять собой домен СН3 с нативной последовательностью или вариант домена СН3 (например, домен СН3 с введенным «выпячиванием» («выступом») в одной его цепи и соответствующей введенной «полостью» («отверстием») в другой его цепи; см. патент США №5821333, который включен в данный документ посредством ссылки). Такие варианты доменов СНЗ могут быть использованы для ускорения гетеродимеризации двух неидентичных тяжелых цепей антител, как описано в данном документе. Если не указано иное, нумерация аминокислотных остатков в Fc-области или константной области осуществляется в соответствии с системой нумерации EU, также называемой индексом EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Технология «выступ-в-отверстие» описана, например, в US 5731168; US 7695936; Ridgway et al., Prot Eng 9, 617-621 (1996) и Carter, J Immunol Meth 248, 7-15 (2001). Обычно способ включает введение выпячивания («выступа») на поверхности взаимодействия первого полипептида и соответствующей полости («отверстия») на поверхности взаимодействия второго полипептида, так что выпячивание может быть расположено в полости так, что способствует образованию гетеродимера и препятствует образованию гомодимера. Выпячивания конструируют путем замены небольших боковых цепей аминокислот с поверхности взаимодействия первого полипептида более крупными боковыми цепями (например, тирозином или триптофаном). Компенсаторные полости идентичного или сходного размера с выпячиваниями создаются на поверхности взаимодействия второго полипептида путем замены больших боковых цепей аминокислот более мелкими (например, аланином или треонином). Выпячивание и полость могут быть получены путем изменения нуклеиновой кислоты, кодирующей полипептиды, например, при помощи сайт-специфического мутагенеза или пептидного синтеза. В конкретном варианте осуществления модификация выступа содержит аминокислотную замену T366W в одной из двух субъединиц Fc-домена, а модификация отверстия содержит аминокислотные замены T366S, L368A и Y407V в другой из двух субъединиц Fc-домена. В еще одном конкретном варианте осуществления субъединица Fc-домена, содержащая модификацию выступа, дополнительно содержит аминокислотную замену S354C, а субъединица Fc-домена, содержащая модификацию отверстия, дополнительно содержит аминокислотную замену Y349C. Введение этих двух остатков цистеина приводит к образованию дисульфидного мостика между двумя субъединицами Fc-области, таким образом, дополнительно стабилизируя димер (Carter, J Immunol Methods 248, 7-15 (2001)).
Предполагается, что «область, эквивалентная Fc-области иммуноглобулина» включает встречающиеся в природе аллельные варианты Fc-области иммуноглобулина, а также варианты, имеющие изменения, которые вызывают замены, добавления или делеции, но которые существенно не снижают способность иммуноглобулина опосредовать эффекторные функции (например, антителозависимую клеточную цитотоксичность). Например, одна или более аминокислот могут быть удалены с N-конца или С-конца Fc-области иммуноглобулина без существенной потери биологической функции. Такие варианты могут быть выбраны в соответствии с общими правилами, известными в данной области техники, таким образом, чтобы оказывать минимальное влияние на активность (см., например, Bowie, J. U. et al., Science 247:1306-10 (1990)).
Термин «эффекторные функции» относится к тем биологическим активностям, связанным с Fc-областью антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплементзависимую цитотоксичность (КЗЦ); связывание с Fc-рецептором; антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ); антителозависимый клеточный фагоцитоз (АЗКФ); секрецию цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, снижение экспрессии клеточных поверхностных рецепторов (например, В-клеточного рецептора) и В-клеточную активацию.
«Активирующий Fc-рецептор» представляет собой Fc-рецептор, который после захвата Fc-областью антитела вызывает сигнальные события, которые стимулируют несущую рецептор клетку для выполнения эффекторных функций. Активирующие Fc-рецепторы включают FcγRIIIa (CD16a), FcγRI (CD64), FcγRIIa (CD32), и FcαRI (CD89). Конкретным активирующим Fc-рецептором является человеческий FcγRIIIa (см. UniProt, номер доступа № Р08637, версия 141).
Термин «пептидный линкер» относится к пептиду, содержащему одну или более аминокислот, обычно около 2-20 аминокислот.Пептидные линкеры известны в данной области техники или описаны в данном документе. Подходящими неиммуногенными линкерными пептидами являются, например, пептидные линкеры ((G4S)n, (SG4)n or G4(SG4)n, где «n» обычно представляет собой число от 1 до 10, как правило, от 2 до 4, в частности, 2, т.е. пептиды, выбранные из группы, состоящей из GGGGS (SEQ ID NO: 129) GGGGSGGGGS (SEQ ID NO: 130), SGGGGSGGGG (SEQ ID NO: 131) и GGGGS GGGGS GGGG (SEQ ID NO: 132), но также включают последовательности GSPGSSSSGS (SEQ ID NO: 133), (G4S)3 (SEQ ID NO: 134), (G4S)4 (SEQ ID NO: 135), GSGSGSGS (SEQ ID NO: 136), GSGSGNGS (SEQ ID NO: 137), GGSGSGSG (SEQ ID NO: 138), GGSGSG (SEQ ID NO: 139), GGSG (SEQ ID NO: 140), GGSGNGSG (SEQ ID NO: 141), GGNGSGSG (SEQ ID NO: 142) и GGNGSG (SEQ ID NO: 143). Представляющими особый интерес пептидными линкерами являются (G4S) (SEQ ID NO: 129), (G4S)2 или GGGGSGGGGS (SEQ ID NO: 130), (G4S)3 (SEQ ID NO: 134) и (G4S)4 (SEQ ID NO: 135), в частности, (G4S)2 или GGGGSGGGGS (SEQ ID NO: 130).
Термин «слитый с» или «связанный с» означает, что компоненты (например, антигенсвязывающий домен и FC-домен) связаны пептидными связями или напрямую, или через один или более пептидных линкеров.
Термин «аминокислота», используемый в данной заявке, обозначает группу встречающихся в природе карбокси-α-аминокислот, содержащих аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gin, Q), глутаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серин (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y), и валин (val, V).
«Процент (%) идентичности аминокислотной последовательности» в отношении последовательности эталонного полипептида (белка) определяется как процентная доля аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в последовательности эталонного полипептида после выравнивания последовательности и внесения, в случае необходимости, гэпов для достижения максимальной процентной идентичности последовательностей, но без учета каких-либо консервативных замен как части идентичности последовательностей. Выравнивание в целях определения процента идентичности аминокислотных последовательностей может осуществляться различными способами, которые известны специалисту в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, ALIGN. SAWI или программного обеспечения Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей данного изобретения значения % идентичности аминокислотных последовательностей генерируются с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана компанией Genentech Inc., и исходный программ был подан вместе с документацией пользователя в Бюро регистрации авторских прав США, Вашингтон, округ Колумбия, 20559, где она зарегистрирована под № регистрации авторского права США TXU510087. Программа ALIGN-2 находится в свободном доступе в Genentech, Inc., Южный Сан-Франциско, штат Калифорния, или ее можно скомпилировать из исходного кода. Для применения в операционной системе UNIX, включающей цифровую версию UNIX V4.0D, программу ALIGN-2 следует скомпилировать. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и остаются неизменными. В тех случаях, когда для сравнения аминокислотных последовательностей используется ALIGN-2, % идентичности аминокислотной последовательности данной аминокислотной последовательности А к, с, или по отношению к данной аминокислотной последовательности В (что в альтернативном варианте может быть сформулировано как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности к, с или по отношению к данной аминокислотной последовательности В) рассчитывают следующим образом:
100 умножить на соотношение X/Y,
где X представляет собой число аминокислотных остатков, оцененных программой выравнивания последовательностей ALIGN-2 как идентичные совпадения при программном выравнивании А и В, и где Y представляет общее количество аминокислотных остатков в В. Следует понимать, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности аминокислотных последовательностей А к В не равен % идентичности аминокислотных последовательностей В к А. Если специально не указано иное, все значения % идентичности аминокислотной последовательности, которые используется в данном документе, получают, как описано в предыдущем абзаце с использованием компьютерной программы ALIGN-2.
В определенных аспектах рассматриваются варианты аминокислотных последовательностей биспецифических антител согласно изобретению, представленных в данном документе. Например, может быть желательно улучшить аффинность связывания и/или другие биологические свойства биспецифических антител. Варианты аминокислотных последовательностей биспецифических антител могут быть получены путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую молекулы, или путем пептидного синтеза. Такие модификации включают, например, делеции, и/или вставки, и/или замены остатков в аминокислотных последовательностях антитела. Любая комбинация делеции, вставки и замены может быть сделана для достижения конечного конструкта, при условии, что конечный конструкт обладает желаемыми характеристиками, например, связыванием антигена. Представляющие интерес сайты для мутагенеза с заменами включают HVR и каркасные области (FR). Консервативные замены представлены в таблице В под заголовком «Предпочтительные замены» и дополнительно описаны ниже со ссылкой на классы аминокислотных боковых цепей (1)-(6). Аминокислотные замены можно вводить в представляющую интерес молекулу, и проводить скрининг полученных продуктов в отношении необходимой активности, например, сохраненного/улучшенного связывания антигена, сниженной иммуногенности или улучшенной АЗКЦ или КЗЦ.


Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепей: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены включают замещение представителя одного из этих классов другим классом.
Термин «варианты аминокислотной последовательности» включает существенные варианты, в которых имеются аминокислотные замены в одном или более остатках гипервариабельной области исходной антигенсвязывающей молекулы (например, гуманизированного или человеческого антитела). Как правило, полученный(ые) вариант(ы), выбранный для дальнейшего изучения, будет (будут) иметь модификации (например, улучшения) определенных биологических свойств (например, повышенную аффинность, сниженную иммуногенность) по сравнению с исходным антителом, и/или будет иметь по существу сохраненные определенные биологические свойства исходной антигенсвязывающей молекулы. Типичный вариант замены представляет собой антитело с созревшей аффинностью, которое может быть легко получено, например, с применением методов созревания на основе фагового дисплея, таких как те, что описаны в данном документе. Вкратце, один или более остатков HVR мутируют, и варианты антигенсвязывающих молекул отображаются на фаге и подвергают скринингу на предмет определенной биологической активности (например, аффинности связывания). В некоторых вариантах осуществления замены, вставки или делеции могут происходить в одном или более HVR, при условии, что такие изменения существенно не снижают способность антигенсвязывающей молекулы связывать антиген. Например, в HVR можно делать консервативные замены (например, консервативные замены, предложенные в данном документе), которые существенно не снижают аффинность связывания. Полезный способ идентификации остатков или областей антитела, которые могут быть мишенями для мутагенеза, называется «аланин-сканирующим мутагенезом», как описано Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе остаток или группа целевых остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируются и заменяются нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) с целью определить, влияет ли это на взаимодействие антитела с антигеном. Дополнительные замены могут быть внесены в те расположения аминокислот, которые проявляли функциональную чувствительность к начальным заменам. Альтернативно или дополнительно, кристаллическая структура комплекса антиген-антигенсвязывающая молекула позволяет идентифицировать точки контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут быть использованы в качестве мишеней или исключены в качестве кандидатов на замещение. Можно проводить скрининг вариантов, чтобы определить, имеют ли они необходимые свойства.
Аминокислотные вставки включают амино- и/или карбокси-концевые слияния с диапазоном длины от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или более аминокислотных остатков внутри последовательности. Примеры концевых вставок включают биспецифические антитела с N-концевым остатком метионила. Другие инсерционные варианты молекулы включают слияние с N- или С-концом с полипептидом, которое увеличивает период полужизни в сыворотке биспецифического антитела.
В определенных аспектах биспецифические антитела, представленные в данном документе, изменяют для увеличения или уменьшения степени, до которой антитело является гликозилированным. Варианты гликозилирования молекул могут быть легко получены путем изменения аминокислотной последовательности таким образом, что создается или удаляется один или более сайтов гликозилирования, например углеводы, присоединенные к Fc-домену, могут быть изменены. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный биантенный олигосахарид, который обычно присоединяется посредством N-связи к Asn297 домена СН2 Fc-области. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» биантенной олигосахаридной структуры. В некоторых вариантах осуществления модификации олигосахарида в биспецифических антителах согласно изобретению могут быть сделаны для создания вариантов с определенными улучшенными свойствами. В одном аспекте предложены варианты биспецифических антител, имеющих углеводную структуру, в которой отсутствует фукоза, присоединенная (прямо или опосредованно) к Fc-области. Такие варианты фукозилирования могут иметь улучшенную функцию АЗКЦ, см., например, публикации патентов США №№ US 2003/0157108 (Presta, L.) или US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Другие варианты биспецифических антител согласно изобретению включают варианты с разделенными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области, делится пополам GlcNAc. Такие варианты могут иметь сниженное фукозилирование и/или улучшенную функцию АЗКЦ, см., например, WO 2003/011878 (Jean-Mairet et al.); патент США №6602684 (Umana et al.); и US 2005/0123546 (Umana et al.). Также предлагаются варианты с по меньшей мере одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Такие варианты антител могут иметь улучшенную функцию КЗЦ и описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
В определенных аспектах может быть желательным создание цистеин-сконструированных вариантов биспецифических антител согласно изобретению, например, «тиоМкАт», в которых один или более остатков молекулы замещены остатками цистеина. В конкретных вариантах осуществления замещенные остатки расположены в доступных сайтах молекулы. Таким образом, в результате замены таких остатков на цистеин, реактивные тиольные группы располагаются в доступных сайтах антитела и могут быть использованы для конъюгации антитела с другими компонентами, такими как лекарственные компоненты или линкер-лекарственные компоненты, для создания иммуноконъюгата. В определенных вариантах осуществления любой один или более из следующих остатков могут быть замещены цистеином: V205 (нумерация по Кабату) легкой цепи; А118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) Fc-области тяжелой цепи. Цистеин-сконструированные антигенсвязывающие молекулы могут быть получены, как описано, например, в патенте США №7521541.
В определенных аспектах биспецифические антитела, предложенные в данном документе, могут быть дополнительно модифицированы, чтобы содержать дополнительные небелковые компоненты, которые известны в данной области техники и легко доступны. Компоненты, подходящие для дериватизации антитела, включают, но не ограничиваются ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, без ограничений, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (или гомополимеры, или статистические сополимеры), декстран или поли(н-винилпирролидон) полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры пролипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоля пропиональдегид может иметь преимущества в производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, прикрепленных к антителу, может варьироваться, и если присоединено более одного полимера, они могут быть одинаковыми или разными молекулами. В общем, количество и/или тип полимеров, используемых для дериватизации, может быть определен на основе соображений, включающих, но не ограничивающихся ими, конкретные свойства или функции антитела, подлежащего улучшению, независимо от того, будет ли производное биспецифического антитела использоваться в терапии при определенных условиях и т.д.
В другом аспекте предложены конъюгаты антитела и небелкового фрагмента, которые можно избирательно нагревать путем воздействия ионизирующего излучения. В одном варианте осуществления небелковый фрагмент представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Ионизирующее излучение может иметь любую длину волны и включает, но не ограничивается этим, длины волн, которые не наносят вред обычным клеткам, но которые нагревают небелковый фрагмент до температуры, при которой клетки, расположенные близко к конъюгату антитела и небелкового фрагмента, погибают.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более гетерологичными(ой) молекулами(ой), включая, но не ограничиваясь этим, цитотоксический агент.
Термин «полинуклеотид» относится к выделенной молекуле или конструкту нуклеиновой кислоты, например, матричной РНК (мРНК), полученной из вируса РНК, или плазмидной ДНК (пДНК). Полинуклеотид может содержать обычную фосфодиэфирную связь или нестандартную связь (например, амидную связь, такую как обнаруженная в пептидных нуклеиновых кислотах (ПНК). Термин «молекула нуклеиновой кислоты» относится к любому одному или более сегментам нуклеиновой кислоты, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде.
Под «выделенной» молекулой нуклеиновой кислоты или полинуклеотидом подразумевается молекула нуклеиновой кислоты, ДНК или РНК, которая была удалена из ее естественной среды. Например, рекомбинантный полинуклеотид, кодирующий полипептид, содержащийся в векторе, считается выделенным для целей данного изобретения. Дополнительные примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, которые содержатся в гетерологичных клетках-хозяевах, или очищенные (частично или практически) полинуклеотиды в растворе. Выделенный полинуклеотид включает полинуклеотидную молекулу, содержащуюся в клетках, которые обычно содержат полинуклеотидную молекулу, но полинуклеотидная молекула присутствует вне хромосомы или в области хромосомы, отличающейся от ее естественного расположения в хромосоме. Выделенные молекулы РНК включают РНК-транскрипты in vivo или in vitro согласно данному изобретению, а также формы положительных и отрицательных цепей и двухцепочечные формы. Выделенные полинуклеотиды или нуклеиновые кислоты согласно данному изобретению дополнительно включают такие молекулы, которые получены синтетическим путем. Кроме того, полинуклеотид или нуклеиновая кислота могут представлять собой или могут включать регуляторный элемент, такой как промотор, сайт связывания рибосомы или терминатор транскрипции.
Под нуклеиновой кислотой или полинуклеотидом, имеющим нуклеотидную последовательность по меньшей мере, например, на 95% «идентичную» эталонной нуклеотидной последовательности согласно данному изобретению, подразумевается, что нуклеотидная последовательность полинуклеотида идентична эталонной последовательности, за исключением того, что полинуклеотидная последовательность может включать до пяти точечных мутаций на каждые 100 нуклеотидов эталонной нуклеотидной последовательности. Другими словами, для получения полинуклеотида, имеющего нуклеотидную последовательность по меньшей мере на 95% идентичную эталонной нуклеотидной последовательности, вплоть до 5% нуклеотидов в эталонной последовательности может быть удалено или замещено другим нуклеотидом, или число нуклеотидов вплоть до 5% от общего количества нуклеотидов в эталонной последовательности может быть вставлено в эталонную последовательность. Эти изменения эталонной последовательности могут происходить в 5'- или 3'-концевых положениях эталонной нуклеотидной последовательности или в любом месте между этими концевыми положениями, чередуясь или индивидуально среди остатков в эталонной последовательности, или в одной или более смежных группах внутри эталонной последовательности. На практике, используя известные компьютерные программы, такие как обсуждаемые выше для полипептидов (например, ALIGN-2) можно определить обычным путем, является ли любая конкретная полинуклеотидная последовательность по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичной нуклеотидной последовательности согласно данному изобретению.
Термин «кассета экспрессии» относится к полинуклеотиду, генерируемому рекомбинантно или синтетически, с рядом определенных элементов нуклеиновой кислоты, которые обеспечивают транскрипцию конкретной нуклеиновой кислоты в целевой клетке. Рекомбинантная кассета экспрессии может быть включена в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Как правило, рекомбинантная часть кассеты экспрессии из вектора экспрессии включает, помимо других последовательностей, последовательность нуклеиновой кислоты, которая должна быть транскрибирована, и промотор. В некоторых вариантах осуществления кассета экспрессии согласно изобретению содержит полинуклеотидные последовательности, которые кодируют биспецифические антигенсвязывающие молекулы согласно изобретению или их фрагменты.
Термин «вектор» или «вектор экспрессии» является синонимом «конструкта экспрессии» и относится к молекуле ДНК, которая используется для введения и направления экспрессии конкретного гена, с которым он функционально связан в целевой клетке. Термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он был введен. Вектор экспрессии согласно данному изобретению содержит кассету экспрессии. Векторы экспрессии обеспечивают транскрипцию больших количеств стабильной мРНК. Как только вектор экспрессии находится внутри целевой клетки, молекула или белок рибонуклеиновой кислоты, который кодируется геном, продуцируется при помощи клеточной транскрипции и/или механизма трансляции. В одном варианте осуществления вектор экспрессии согласно изобретению содержит кассету экспрессии, которая содержит полинуклеотидные последовательности, которые кодируют биспецифические антигенсвязывающие молекулы согласно изобретению или их фрагменты.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первичную трансформированную клетку и ее потомство, независимо от количества пассажей. Потомство может не быть полностью идентичным по содержанию нуклеиновой кислоты с исходной клеткой, но может содержать мутации. Настоящее описание включает мутантное потомство, обладающее той же функцией или биологической активностью, которую наблюдали во время скрининга или отбора из первоначально трансформированных клеток. Клетка-хозяин представляет собой клеточную систему любого типа, которую можно использовать для получения биспецифических антигенсвязывающих молекул согласно данному изобретению. В частности, клетка-хозяин представляет собой прокариотическую или эукариотическую клетку-хозяин. Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, такие как клетки СНО, клетки BHK, клетки NS0, клетки SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, клетки PER, клетки PER.C6 или клетки гибридомы, клетки дрожжей, клетки насекомых и клетки растений, и это лишь некоторые из них, но также и клетки, содержащиеся в трансгенном животном, трансгенном растении или культивируемых растительных или животных тканях.
«Эффективное количество» агента относится к количеству, которое необходимо для того, чтобы привести к физиологическим изменениям в клетке или ткани, в которые он вводится.
«Терапевтически эффективное количество» агента, например, фармацевтической композиции относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата. Терапевтически эффективное количество агента, например, устраняет, уменьшает, задерживает, минимизирует или предотвращает неблагоприятные воздействия заболевания.
«Индивидуум» или «субъект» представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются ими, одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, не являющихся человеком, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В частности, индивидуум или субъект представляет собой человека.
Термин «фармацевтическая композиция» относится к препарату, который находится в такой форме, которая обеспечивает эффективность биологической активности активного ингредиента, содержащегося в нем, и которая не содержит дополнительных компонентов, которые неприемлемо токсичны для субъекта, которому композиция должна быть введена.
«Фармацевтически приемлемый наполнитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый наполнитель включает, но не ограничивается ими, буфер, стабилизатор или консервант.
Термин «листок-вкладыш в упаковку» относится к инструкциям, которые обычно вкладывают в коммерческие упаковки терапевтических продуктов для продажи, содержащие информацию о показаниях, использовании, дозах, приеме, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся использования таких терапевтических продуктов.
В данном документе термин «лечение» (и его грамматические варианты, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству при попытке изменить естественное течение заболевания у индивидуума, подвергаемого лечению, и может осуществляться для профилактики или в процессе клинического проявления патологии. Желаемые эффекты лечения включают, без ограничения, предотвращение возникновения или рецидива заболевания, частичное снятие симптомов, уменьшение каких-либо прямых или косвенных патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния, и ремиссию или улучшение прогноза. В некоторых вариантах осуществления молекулы согласно изобретению используются для задержки развития заболевания или для замедления прогрессирования заболевания.
Используемый в данном документе термин «онкологическое заболевание» относится к пролиферативным заболеваниям, таким как лимфомы, лимфоцитарные лейкозы, рак легкого, немелкоклеточный рак легкого (NSCL), бронхиолоальвеолярный рак легкого, рак костей, рак поджелудочной железы, рак кожи, рак головы или шеи, меланома кожи или интраокулярная меланома, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак желудочно-кишечного тракта, рак толстой кишки, рак молочной железы, рак матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома наружных женских половых органов, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягких тканей, рак мочеиспускательного канала, рак полового члена, рак простаты, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечной лоханки, мезотелиома, гепатоцеллюлярный рак, рак желчных путей, новообразования центральной нервной системы (ЦНС), опухоли оси позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза и саркома Юинга, в том числе рефрактерные виды любого из вышеуказанных видов злокачественных новообразований, или комбинация одного или более из вышеуказанных видов злокачественных новообразований.
Биспецифические антитела согласно изобретению
Изобретение обеспечивает новые биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с белком запрограммированной гибели клеток 1 (PD1), и второй антигенсвязывающий домен, который специфически связывается с геном активации лимфоцитов-3 (LAG3), с особенно полезными свойствами, такими как продуктивность, стабильность, аффинность связывания, биологическая активность, специфическое нацеливание на определенные Т-клетки, эффективность нацеливания и снижение токсичности.
В определенных аспектах предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, которое демонстрирует уменьшенную интернализацию при связывании с поверхностью Т-клеток. Интернализация представляет собой важное поглощение для молекулы, которая может разлагаться в течение нескольких часов, в то время как целевые рецепторы быстро повторно экспрессируются на поверхности клетки, готовой ингибировать ТКР-сигналинг. В дополнительных аспектах предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, которое преимущественно связывается с типичными Т-клетками, а не с Трег. Это выгодно, потому что нацеливание на LAG-3 на Трег с использованием блокирующих антител может быть вредным, увеличивая их подавляющую функцию и в конечном итоге маскируя положительный блокирующий эффект на другие Т-клетки. В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, которое способно восстанавливать эффекторные функции Т-клеток от Трег подавления. В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, которое способно индуцировать секрецию гранзима В CD4 Т-клетками при совместном культивировании с линией опухолевых клеток ARH77, как показано в представленном в данном документе анализе. В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, которое демонстрирует повышенные специфические для опухоли эффекторные функции Т-клеток и/или усиливает цитотоксический эффект Т-клеток. В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, которое демонстрирует повышенную эрадикацию опухоли in vivo.
А. Типичные биспецифические антитела, которые связываются с PD1 и LAG3
В одном аспекте изобретение обеспечивает биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом указанный первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит:
домен VH, содержащий:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4;
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В одном аспекте биспецифическое антитело содержит Fc-домен, который представляет собой Fc-домен IgG, в частности, Fc-домен IgG1 или Fc-домен IgG4, и в котором Fc-домен обладает сниженной или даже отмененной эффекторной функцией. В частности, Fc-домен содержит одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором, в частности, с Fcγ-рецептором.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, который представляет собой Fc-домен IgG, в частности Fc-домен IgG1 или Fc-домен IgG4, и при этом Fc-домен содержит одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором, в частности, с Fcγ-рецептором.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом второй антигенсвязывающий домен, который специфически связывается с LAG3, содержит
(a) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 14,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 15, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 16; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 19; или
(b) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 22,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 23, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 24; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 25,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 26, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 27; или
(c) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 30,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 31, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 32; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 33,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 34, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 35; или
(d) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 38,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 39, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 40; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 41,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 42, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 43; или
(e) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 46,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 47, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 48; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 49,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 50, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 51.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит:
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 7, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 8, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 11, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 12, или
(e) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 13.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом первый антигенсвязывающий домен, который специфически связывается с PD1, содержит
(a) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 80,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 81, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 82; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 83,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 84, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 85; или
(b) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 90; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 91,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 92, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 93.
В одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит:
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 86, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 95.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 28, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 29, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 36, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 37, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 44, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 45, или
(e) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
В другом аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом второй антигенсвязывающий домен, который специфически связывается с LAG3, содержит домен VH, содержащий:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 56,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 57, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 58; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 59,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 60, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 61.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 54, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 55, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 62, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 63, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 64, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 65, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 66, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 67.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом
первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит: домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, или домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
В одном аспекте биспецифическое антитело согласно изобретению содержит первый антигенсвязывающий домен, специфически связывающийся с PD1, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10, и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21.
В дополнительном аспекте биспецифическое антитело согласно изобретению содержит первый антигенсвязывающий домен, специфически связывающийся с PD1, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10, и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
В другом аспекте биспецифическое антитело согласно изобретению содержит первый антигенсвязывающий домен, специфически связывающийся с PD1, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10, и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 62, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 63.
В еще одном аспекте биспецифическое антитело согласно изобретению содержит первый антигенсвязывающий домен, специфически связывающийся с PD1, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 86, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87, и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 62, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 63.
В еще одном аспекте биспецифическое антитело согласно изобретению содержит первый антигенсвязывающий домен, специфически связывающийся с PD1, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 95, и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержащий домен VH, содержащий аминокислотную последовательность SEQ ID NO: 62, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 63.
В дополнительном аспекте биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, представляет собой человеческое, гуманизированное или химерное антитело. В частности, оно представляет собой гуманизированное или химерное антитело.
В одном аспекте биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, является двухвалентным. Это означает, что биспецифическое антитело содержит один антигенсвязывающий домен, который специфически связывается с PD1, и один антигенсвязывающий домен, который специфически связывается с LAG3 (формат 1+1).
В одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, причем биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, и второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3. В конкретном аспекте в одном из Fab-фрагментов вариабельные домены VL и VH заменены друг на друга, так что домен VH является частью легкой цепи, а домен VL является частью тяжелой цепи. В конкретном аспекте в первом Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 97, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 100, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 102, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 104, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105 или
(d) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 106, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 107, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
Более конкретно, биспецифическое антитело содержит
(a) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 98,
вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 97, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 99, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 98,
вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 100, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 101, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 102, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 104,
вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 105, или
(d) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 106, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107,
вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 105.
Более конкретно, биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 100, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 101.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, и второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, который слит с С-концом Fc-домена. В частности, Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, слит с С-концом FC-домена через его домен VH (формат транс 1+1).
В конкретном аспекте биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 144, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101. Более конкретно, биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 144, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 101.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, и третий Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3. В конкретном аспекте Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей.
В данном аспекте биспецифическое антитело является трехвалентным с двухвалентным связыванием с LAG3 и моновалентным связыванием с PD1. Это означает, что биспецифическое антитело содержит один антигенсвязывающий домен, который специфически связывается с PD1, и два антигенсвязывающих домена, которые специфически связываются с LAG3 (формат 2+1).
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 118, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 119, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 120, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 121, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 122, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
Более конкретно, биспецифическое антитело содержит
(a) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 118, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 119, и две вторые легкие цепи, содержащие аминокислотную последовательность SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 120, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 121, и две вторые легкие цепи, содержащие аминокислотную последовательность SEQ ID NO: 99, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 122, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 103, и две вторые легкие цепи, содержащие аминокислотную последовательность SEQ ID NO: 105.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, и третий Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, при этом один из Fab-фрагментов, содержащих антигенсвязывающий домен, который специфически связывается с LAG3, слит через пептидный линкер с С-концом одной из тяжелых цепей (формат транс 2+1).
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 145, и две вторых легких цепи, содержащих аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101. В частности, биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 145, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, и одноцепочечный Fab (scFab), содержащий антигенсвязывающий домен, который специфически связывается с PD1. В частности, scFab, содержащий антигенсвязывающий домен, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит
(а) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 123, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 119, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 124, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 121, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 125, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
Более конкретно, биспецифическое антитело содержит
(a) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 123, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 119, и две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 124, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 121, и две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 99, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 125, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 103, и две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 105.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, и домен VH и VL, содержащий антигенсвязывающий домен, который специфически связывается с PD1. В частности, домен VH антигенсвязывающего домена, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей, а домен VL антигенсвязывающего домена, который специфически связывается с PD1, слит через пептидный линкер с С-концом другой тяжелой цепи.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 126, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью последовательности к последовательности SEQ ID NO: 127, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 109. Более конкретно, биспецифическое антитело содержит первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 126, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 127, и две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 109.
В дополнительном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, третий Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3, и четвертый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1.
В данном аспекте биспецифическое антитело является четырехвалентным с двухвалентным связыванием с LAG3 и двухвалентным связыванием с PD1. Это означает, что биспецифическое антитело содержит два антигенсвязывающих домена, которые специфически связываются с PD1, и два антигенсвязывающих домена, которые специфически связываются с LAG3 (формат 2+2).
В одном аспекте биспецифическое антитело согласно изобретению содержит
(a) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, содержащих антигенсвязывающие домены, которые специфически связываются с LAG3, и
(b) два дополнительных Fab-фрагмента, содержащих антигенсвязывающие домены, которые специфически связываются с PD1, причем каждый из указанных дополнительных Fab-фрагментов соединен через пептидный линкер с С-концом тяжелых цепей (а).
В конкретном аспекте пептидный линкер представляет собой (G4S)4. В другом аспекте два дополнительных Fab-фрагмента, содержащие антигенсвязывающие домены, которые специфически связываются с PD1, представляют собой кроссоверные Fab-фрагменты, при этом вариабельные домены VL и VH заменены друг на друга, и каждая из цепей VL-CH соединена через пептидный линкер с С-концом тяжелых цепей (а).
В одном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом два каждый из двух Fab-фрагментов содержит антигенсвязывающий домен, который специфически связывается с PD1, и при этом каждый слит через пептидный линкер с С-концом одной из тяжелых цепей, соответственно.
В конкретном аспекте предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом биспецифическое антитело содержит
(a) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 114, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 116, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(c) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 117, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
Более конкретно, биспецифическое антитело содержит
(а) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 114, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 101, или
(b) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 116, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 99, или
(c) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 117, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 115, и две вторые легкие цепи, которые содержат аминокислотную последовательность SEQ ID NO: 105.
Модификации Fc-домена, снижающие связывание Fc-рецептора и/или эффекторную функцию
В определенных аспектах предложено биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, отличающееся тем, что биспецифическое антитело содержит Fc-домен, содержащий одну или более аминокислотных модификаций, которые уменьшают связывание с Fc-рецептором, в частности с Fcγ-рецептором, и уменьшают или отменяют эффекторную функцию.
В определенных аспектах одна или более аминокислотных модификаций могут быть введены в Fc-область антитела, предложенного в данном документе, тем самым генерируя вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-область IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или более аминокислотных положениях.
В следующем разделе описаны предпочтительные аспекты биспецифических антигенсвязывающих молекул согласно изобретению, содержащих модификации Fc-домена, снижающие связывание Fc-рецептора и/или эффекторную функцию. В одном аспекте изобретение относится к биспецифическому антителу, содержащему первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом Fc-домен содержит одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором, в частности, с Fcγ-рецептором. В частности, Fc-домен относится к подклассу IgG1 человека с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Кабату).
Fc-домен дает подходящие фармакокинетические свойства биспецифическим антителам согласно изобретению, включая длительный период полужизни в сыворотке, который способствует соответствующему накоплению в целевой ткани, и оптимальному соотношению в распределении между тканью и кровью. В то же время это может, однако, привести к нежелательному нацеливанию биспецифических антител согласно изобретению на клетки, экспрессирующие Fc-рецепторы, а не на предпочтительные несущие антиген клетки. Соответственно, в конкретных вариантах осуществления Fc-домен биспецифических антител согласно изобретению проявляет сниженную аффинность связывания с Fc-рецептором и/или сниженную эффекторную функцию по сравнению с нативным Fc-доменом IgG, в частности, Fc-доменом IgG1 или Fc-доменом IgG4. Более конкретно, Fc-домен представляет собой FC-домен IgG1.
В одном таком аспекте Fc-домен (или биспецифическая антигенсвязывающая молекула согласно изобретению, содержащая указанный Fc-домен) проявляет менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10% и наиболее предпочтительно менее чем 5% аффинности связывания с Fc-рецептором по сравнению с нативным Fc-доменом IgG1 (или биспецифической антигенсвязывающей молекулой согласно изобретению, содержащей нативный Fc-домен IgG1) и/или менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10% и наиболее предпочтительно менее чем 5% эффекторной функции по сравнению с нативным Fc-доменом IgG1 (или биспецифической антигенсвязывающей молекулой согласно изобретению, содержащей нативный Fc-домен IgG1). В одном аспекте Fc-домен (или биспецифическая антигенсвязывающая молекула согласно изобретению, содержащая указанный Fc-домен) по существу не связывается с Fc-рецептором и/или не индуцирует эффекторную функцию. В конкретном аспекте Fc-рецептор представляет собой Fcγ-рецептор. В одном аспекте Fc-рецептор представляет собой человеческий Fc-рецептор. В одном аспекте Fc-рецептор представляет собой активирующий Fc-рецептор. В конкретном аспекте Fc-рецептор представляет собой активирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIIa, FcγRI или FcγRIIa, наиболее конкретно человеческий FcγRIIIa. В одном аспекте Fc-рецептор представляет собой ингибирующий Fc-рецептор. В конкретном аспекте Fc-рецептор представляет собой ингибирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIB. В одном аспекте эффекторная функция представляет собой одну или более из КЗЦ, АЗКЦ, АЗКФ и секреции цитокинов. В конкретном аспекте эффекторная функция представляет собой АЗКЦ. В одном аспекте Fc-домен проявляет по существу сходную аффинность связывания с неонатальным Fc-рецептором (FcRn) по сравнению с нативным Fc-доменом IgG1. По существу аналогичное связывание с FcRn достигается, когда Fc-домен (или биспецифическая антигенсвязывающая молекула согласно изобретению, содержащая указанный Fc-домен) проявляет более чем около 70%, в частности, более чем около 80%, более конкретно, более чем около 90% аффинности связывания нативного Fc-домена IgG1 (или биспецифической антигенсвязывающей молекулы согласно изобретению, содержащей нативный Fc-домен IgG1) с FcRn.
В конкретном аспекте, Fc-домен конструируют так, чтобы иметь сниженную аффинность связывания с Fc-рецептором и/или сниженную эффекторную функцию по сравнению с несконструированным Fc-доменом. В конкретном аспекте Fc-домен биспецифической антигенсвязывающей молекулы согласно изобретению содержит одну или более аминокислотных мутаций, которые снижают аффинность связывания Fc-домена с Fc-рецептором и/или эффекторную функцию. Как правило, одна и та же или более аминокислотных мутаций присутствуют в каждой из двух субъединиц Fc-домена. В одном аспекте аминокислотная мутация снижает аффинность связывания Fc-домена с Fc-рецептором. В другом аспекте аминокислотная мутация снижает аффинность связывания Fc-домена с Fc-рецептором по меньшей мере в 2 раза, по меньшей мере в 5 или по меньшей мере в 10 раз. В одном аспекте биспецифическая антигенсвязывающая молекула согласно изобретению, содержащая сконструированный Fc-домен, проявляет менее 20%, в частности, менее 10%, более конкретно, менее 5% аффинности связывания с Fc-рецептором по сравнению с биспецифическими антителами согласно изобретению, содержащими несконструированный Fc-домен. В конкретном аспекте Fc-рецептор представляет собой Fcγ-рецептор. В других аспектах Fc-рецептор представляет собой человеческий Fc-рецептор. В одном аспекте Fc-рецептор представляет собой ингибирующий Fc-рецептор. В конкретном аспекте Fc-рецептор представляет собой ингибирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIB. В некоторых аспектах Fc-рецептор представляет собой активирующий Fc-рецептор. В конкретном аспекте Fc-рецептор представляет собой активирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIIa, FcγRI или FcγRIIa, наиболее конкретно человеческий FcγRIIIa. Предпочтительно связывание с каждым из этих рецепторов уменьшается. В некоторых аспектах аффинность связывания с компонента комплемента, в частности, аффинность связывания с C1q, также снижается. В одном аспекте аффинность связывания с неонатальным Fc-рецептором (FcRn) не снижается. По существу аналогичное связывание с FcRn, то есть сохранение аффинности связывания Fc-домена с указанным рецептором, достигается, когда Fc-домен (или биспецифическая антигенсвязывающая молекула согласно изобретению, содержащая указанный Fc-домен) проявляет более около 70% аффинности связывания несконструированной формы Fc-домена (или биспецифической антигенсвязывающей молекулы согласно изобретению, содержащей указанную несконструированную форму Fc-домена) с FcRn. Fc-домен или биспецифическая антигенсвязывающая молекула согласно изобретению, содержащая указанный Fc-домен, может проявлять более чем около 80% и даже более чем около 90% такой аффинности. В некоторых вариантах осуществления изобретения Fc-домен биспецифической антигенсвязывающей молекулы согласно изобретению обладает сниженной эффекторной функцией по сравнению с несконструированным Fc-доменом. Сниженная эффекторная функция может включать, но не ограничивается ими, одно или более из следующего: сниженную комплементзависимую цитотоксичность (КЗЦ), сниженную антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ), сниженный антителозависимый клеточный фагоцитоз (АЗФК), сниженную секрецию цитокинов, сниженное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, сниженное связывание с NK-клетками, сниженное связывание с макрофагами, сниженное связывание с моноцитами, сниженное связывание с полиморфно-ядерными клетками, сниженный сигналинг, индуцирующий апоптоз, уменьшенное созревание дендритных клеток, или сниженное примирование Т-клеток.
Антитела со сниженной эффекторной функцией включают антитела с заменой одного или более остатков Fc-области 238, 265, 269, 270, 297, 327 и 329 (патент США №6737056). Такие Fc-мутанты включают Fc-мутанты с заменами в двух или более аминокислотных положениях 265, 269, 270, 297 и 327, включая так называемый «DANA» Fc-мутант с заменой остатков 265 и 297 на аланин (патент США №7332581). Описаны некоторые варианты антител с улучшенным или уменьшенным связыванием с FcR. (например, патент США №6737056; WO 2004/056312 и Shields, R.L. et al., J. Biol. Chem. 276 (2001) 6591-6604).
В одном аспекте изобретения Fc-домен содержит аминокислотную замену в положении Е233, L234, L235, N297, Р331 и Р329. В некоторых аспектах Fc-домен содержит аминокислотные замены L234A и L235A («LALA»). В одном таком варианте осуществления Fc-домен представляет собой Fc-домен IgG1, в частности, Fc-домен человеческого IgG1. В одном аспекте Fc-домен содержит аминокислотную замену в положении Р329. В более конкретном аспекте аминокислотная замена представляет собой Р329А или P329G, в частности, P329G. В одном варианте осуществления Fc-домен содержит аминокислотную замену в положении Р329 и дополнительную аминокислотную замену, выбранную из группы, состоящей из Е233Р, L234A, L235A, L235E, N297A, N297D или P331S. В более конкретных вариантах осуществления Fc-домен содержит аминокислотные мутации L234A, L235A и P329G («P329G LALA»). Комбинация аминокислотных замен «P329G LALA» практически полностью устраняет связывание Fcγ-рецептора с Fc-доменом человеческого IgG1, как описано в заявке на патент РСТ № WO 2012/130831 А1. В указанном документе также описаны способы получения таких мутантных Fc-доменов и способы определения его свойств, таких как связывание с Fc-рецептором или эффекторные функции. Такое антитело представляет собой IgG1 с мутациями L234A и L235A или с мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Кабату, Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
В одном аспекте биспецифическое антитело согласно изобретению содержит (все положения в соответствии с индексом EU по Кабату) (i) гомодимерную Fc-область подкласса IgG1 человека необязательно с мутациями P329G, L234A и L235A, или (ii) гомодимерную Fc-область подкласса IgG4 человека необязательно с мутациями P329G, S228P и L235E или (iii) гомодимерную Fc-область подкласса IgG1 человека необязательно с мутациями P329G, L234A, L235A, I253A, Н310А и Н435А, или необязательно с мутациями P329G, L234A, L235A, Н310А, Н433А и Y436A, или (iv) гетеродимерную Fc-область, где один полипептид Fc-области содержит мутацию T366W, а другой полипептид Fc-области содержит мутации T366S, L368A и Y407V, или где один полипептид Fc-области содержит мутации T366W и Y349C, а другой полипептид Fc-области содержит мутации T366S, L368A, Y407V и S354C, или где один полипептид Fc-области содержит мутации T366W и S354C, и другой полипептид Fc-области содержит мутации T366S, L368A, Y407V и Y349C или (v) гетеродимерную Fc-область подкласса IgG1 человека, где оба полипептида Fc-области содержат мутации P329G, L234A и L235A и один полипептид Fc-области содержит мутацию T366W и другой полипептид Fc-области содержит мутации T366S, L368A и Y407V, или где один полипептид Fc-области содержит мутации T366W и Y349C, а другой полипептид Fc-области содержит мутации T366S, L368A, Y407V и S354C или где один полипептид Fc-области содержит мутации T366W и S354C, а другой полипептид Fc-области содержит мутации T366S, L368A, Y407V и Y349C.
В одном аспекте Fc-домен представляет собой Fc-домен IgG4. В более конкретном варианте осуществления Fc-домен представляет собой Fc-домен IgG4, содержащий аминокислотную замену в положении S228 (нумерация по Кабату), в частности аминокислотную замену S228P. В более конкретном варианте осуществления Fc-домен представляет собой Fc-домен IgG4, содержащий аминокислотные замены L235E и S228P и P329G. Данная аминокислотная замена снижает in vivo обмен Fab-фрагментами IgG4-антител (см. Stubenrauch et al., Drug Metabolism and Disposition 38, 84-91 (2010)). Таким образом, в одном аспекте предложено биспецифическое антитело, содержащее (все положения согласно индексу EU по Кабату) гетеродимерную Fc-область подкласса IgG4 человека, причем оба полипептида Fc-области содержат мутации P329G, S228P и L235E и один полипептид Fc-области содержит мутацию T366W, а другой полипептид Fc-области содержит мутации T366S, L368A и Y407V, или где один полипептид Fc-области содержит мутации T366W и Y349C, а другой полипептид Fc-области содержит мутации T366S, L368A, Y407V и S354C, или где один полипептид Fc-области содержит мутации T366W и S354C, а другой полипептид Fc-области содержит мутации T366S, L368A, Y407V и Y349C.
Антитела с увеличенным периодом полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за передачу материнских IgG к плоду (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593, и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), как описано US 2005/0014934. Эти антитела содержат Fc-область с одной или более заменами, которые улучшают связывание Fc-области с FcRn. Такие варианты Fc включают варианты с заменами при одном или более остатках Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка Fc-области 434 (патент США №7371826). См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5648260; US 5624821; и WO 94/29351, касающиеся других примеров вариантов Fc-области.
Связывание с Fc-рецепторами может быть легко определено, например, с помощью ИФА или поверхностного плазмонного резонанса (ППР) с использованием стандартных приборов, таких как прибор BIAcore (GE Healthcare), и такие Fc-рецепторы могут быть получены путем рекомбинантной экспрессии. В данном документе описан такой подходящий анализ. Альтернативно, аффинность связывания Fc-доменов или активирующих клетки биспецифических антигенсвязывающих молекул, содержащих Fc-домен для Fc-рецепторов, может быть оценена с использованием клеточных линий, о которых известно, что они экспрессируют конкретные Fc-рецепторы, например, человеческих NK-клеток, экспрессирующих FcγIIIa-рецептор. Эффекторная функция Fc-домена или биспецифических антител согласно изобретению, содержащих Fc-домен, может быть измерена способами, известными в данной области техники. Подходящий анализ для измерения АЗКЦ описан в данном документе. Другие примеры анализов in vitro для оценки активности АЗКЦ представляющей интерес молекулы описаны в патенте США №5500362; Hellstrom et al. Proc Natl Acad Sci USA 83, 7059-7063 (1986) и Hellstrom et al., Proc Natl Acad Sci USA 82, 1499-1502 (1985); патенте США №5821337; Bruggemann et al., J Exp Med 166, 1351-1361 (1987). В альтернативном варианте могут быть использованы способы нерадиоактивного анализа (см., например, способ нерадиоактивного анализа цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. г. Маунтин-Вью, штат Калифорния) и способ нерадиоактивного анализа цитотоксичности CytoTox 96® (Promega, г. Мэдисон, штат Висконсин)). Пригодные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (МКПК) и естественные клетки-киллеры (NK). Альтернативно или дополнительно, активность АЗКЦ представляющей интерес молекулы может быть оценена in vivo, например, на животной модели, такой как описанная в Clynes et al., Proc Natl Acad Sci USA 95, 652-656 (1998).
В следующем разделе описаны предпочтительные аспекты биспецифических антител согласно изобретению, содержащих модификации Fc-домена, снижающие связывание Fc-рецептора и/или эффекторную функцию. В одном аспекте изобретение относится к биспецифическому, содержащему первый антигенсвязывающий домен, который специфически связывает PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом Fc-домен содержит одну или более аминокислотных замен, которые уменьшают аффинность связывания антитела с Fc-рецептором, в частности, с Fcγ-рецептором. В другом аспекте изобретение относится к биспецифическому антителу, содержащему первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом Fc-домен содержит одну или более аминокислотных замен, которые снижают эффекторную функцию. В конкретном аспекте Fc-домен относится к подклассу IgG1 человека с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Кабату).
Модификации Fc-домена, способствующие гетеродимеризации
Биспецифические антигенсвязывающие молекулы согласно изобретению содержат разные антигенсвязывающие домены, слитые с одной или другой из двух субъединиц Fc-домена, по этой причине две субъединицы Fc-домена могут содержаться в двух неидентичных полипептидных цепях. Рекомбинантная коэкспрессия этих полипептидов и последующая димеризация приводит к нескольким возможным комбинациям двух полипептидов. Таким образом, для повышения выхода и чистоты биспецифических антител согласно изобретению при рекомбинантной продукции будет выгодно вводить в Fc-домен биспецифических антигенсвязывающих молекул согласно изобретению модификацию, способствующую ассоциации необходимых полипептидов.
Соответственно, в конкретных аспектах изобретение относится к биспецифическому антителу, содержащему первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, при этом Fc-домен содержит модификацию, способствующую ассоциации первой и второй субъединиц Fc-домена. Сайт наиболее значительного межбелкового взаимодействия между двумя субъединицами Fc-домена IgG человека находится в домене СН3 Fc-домена. Таким образом, в одном аспекте указанная модификация находится в домене СН3 Fc-домена.
В конкретном аспекте указанная модификация представляет собой так называемую модификацию «выступ-в-отверстие», содержащую модификацию «выступ» в одной из двух субъединиц Fc-домена и модификацию «отверстие» в другой из двух субъединиц Fc-домена. Таким образом, изобретение относится к биспецифическому антителу, содержащему первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий сайт, который специфически связывается с LAG3, при этом первая субъединица Fc-домена содержит выступы и вторая субъединица Fc-домена содержит отверстия в соответствии со способом «выступы-в-отверстия». В конкретном аспекте первая субъединица Fc-домена содержит аминокислотные замены S354C и T366W (нумерация EU), а вторая субъединица Fc-домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно индексу EU по Кабату).
Технология «выступ-в-отверстие» описана, например, в US 5731168; US 7695936; Ridgway et al., Prot Eng 9, 617-621 (1996) и Carter, J Immunol Meth 248, 7-15 (2001). Обычно способ включает введение выпячивания («выступа») на поверхности взаимодействия первого полипептида и соответствующей полости («отверстия») на поверхности взаимодействия второго полипептида, так что выпячивание может быть расположено в полости так, что способствует образованию гетеродимера и препятствует образованию гомодимера. Выпячивания конструируют путем замены небольших боковых цепей аминокислот с поверхности взаимодействия первого полипептида более крупными боковыми цепями (например, тирозином или триптофаном). Компенсаторные полости идентичного или сходного размера с выпячиваниями создаются на поверхности раздела второго полипептида путем замены больших боковых цепей аминокислот более мелкими (например, аланином или треонином).
Соответственно, в одном аспекте в домене СН3 первой субъединицы Fc-домена биспецифических антигенсвязывающих молекул согласно изобретению аминокислотный остаток заменен аминокислотным остатком, имеющим больший объем боковой цепи, тем самым создавая выпячивание внутри домена СН3 первой субъединицы, которое может размещаться в полости внутри домена СН3 второй субъединицы, а в домене СН3 второй субъединицы Fc-домена аминокислотный остаток заменен аминокислотным остатком, имеющим меньший объем боковой цепи, в результате чего образуется полость в домене СН3 второй субъединицы, внутри которой может размещаться выпячивание, находящееся в пределах доме на СН3 первой субъединицы. Выпячивание и полость могут быть получены путем изменения нуклеиновой кислоты, кодирующей полипептиды, например, при помощи сайт-специфического мутагенеза или пептидного синтеза. В конкретном аспекте в домене СН3 первой субъединицы Fc-домена остаток треонина в положении 366 заменен остатком триптофана (T366W), а в домене СН3 второй субъединицы Fc-домена остаток тирозина в положении 407 заменен остатком валина (Y407V). В одном аспекте во второй субъединице Fc-домена дополнительно остаток треонина в положении 366 заменен остатком серина (T366S), а остаток лейцина в положении 368 заменен остатком аланина (L368A).
В еще одном дополнительном аспекте в первой субъединице Fc-домена дополнительно сериновый остаток в положении 354 заменен остатком цистеина (S354C), а во второй субъединице Fc-домена дополнительно остаток тирозина в положении 349 заменен на остаток цистеина (Y349C). Введение этих двух остатков цистеина приводит к образованию дисульфидного мостика между двумя субъединицами Fc-домена, что дополнительно стабилизирует димер (Carter (2001), J Immunol Methods 248, 7-15). В конкретном аспекте первая субъединица Fc-домена содержит аминокислотные замены S354C и T366W (нумерация EU), а вторая субъединица Fc-домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно индексу EU по Кабату).
Но также могут использоваться альтернативно или дополнительно другие технологии «выступы-в-отверстия», описанные в ЕР 1870459. В одном варианте осуществления мультиспецифическое антитело содержит мутации R409D и K370E в домене СН3 «цепи с выступами» и мутации D399K и E357K в домене СН3 «цепи с отверстием» (нумерация согласно индексу EU по Кабату).
В одном аспекте биспецифическое антитело содержит мутацию T366W в домене СН3 «цепи с выступами» и мутации T366S, L368A и Y407V в домене СН3 «цепи с отверстием» и, кроме того, мутации R409D и K370E в домене СН3 «цепи с выступами» и мутации D399K и E357K в домене СН3 «цепи с отверстием» (нумерация согласно индексу EU по Кабату).
В одном аспекте биспецифическое антитело содержит мутации Y349C и T366W в одном из двух доменов СН3 и мутации S354C, T366S, L368A и Y407V в другом из двух доменов СН3, или мультиспецифическое антитело содержит мутации Y349C и T366W в один из двух доменов СН3 и мутации S354C, T366S, L368A и Y407V в другом из двух доменов СН3 и, кроме того, мутации R409D и K370E в домене СН3 «цепи с выступами» и мутации D399K и E357K в домене СН3 «цепи с отверстием» (нумерация согласно индексу EU по Кабату).
В альтернативном аспекте модификация, способствующая ассоциации первой и второй субъединиц Fc-области, содержит модификацию, опосредующую эффекты электростатических сил, например, как описано в публикации РСТ WO 2009/089004. Как правило, данный способ включает замену одного или более аминокислотных остатков на поверхности раздела двух субъединиц Fc-домена заряженными аминокислотными остатками, так что образование гомодимера становится электростатически невыгодным, а гетеродимеризация электростатически выгодной.
Помимо «технологии выступ-в-отверстие» в данной области техники известны другие способы модификации доменов СН3 тяжелых цепей мультиспецифического антитела для обеспечения гетеродимеризации. Данные технологии, особенно те, которые описаны в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954 и WO 2013/096291 рассматриваются в данном документе в качестве альтернативы «технологии выступ-в-отверстие» в комбинации с биспецифическим антителом.
В одном аспекте в биспецифическом антителе подход, описанный в ЕР 1870459, используется для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. Данный подход основан на введении заряженных аминокислот с противоположными зарядами в определенных положениях аминокислот на поверхности раздела доменов СН3/СН3 между как первой, так и второй тяжелой цепью.
Соответственно, в этом аспекте в третичной структуре мультиспецифического антитела домен СН3 первой тяжелой цепи и домен СН3 второй тяжелой цепи формируют поверхность взаимодействия, которая расположена между соответствующими доменами СН3 антитела, при этом каждая из соответствующих аминокислотных последовательностей домена СН3 первой тяжелой цепи и аминокислотной последовательности домена СН3 второй тяжелой цепи содержат набор аминокислот, который расположен на указанной поверхности взаимодействия в третичной структуре антитела, причем из набора аминокислот, который расположен на поверхности взаимодействия в домене СН3 одной тяжелой цепи, первая аминокислота заменяется положительно заряженной аминокислотой и из набора аминокислот, который находится на поверхности взаимодействия в домене СН3 другой тяжелой цепи, вторая аминокислота замещена отрицательно заряженной аминокислотой. Биспецифическое антитело в соответствии с этим аспектом в данном документе также обозначается как «СН3 (+/-)-сконструированное биспецифическое антитело» (где аббревиатура «+/-» обозначает противоположно заряженные аминокислоты, которые были введены в соответствующие домены СН3).
В одном аспекте в СН3 (+/-)-сконструированном биспецифическом антителе положительно заряженную аминокислоту выбирают из K, R и Н, а отрицательно заряженную аминокислоту выбирают из Е или D.
В одном аспекте в СН3 (+/-)-сконструированном биспецифическом антителе положительно заряженную аминокислоту выбирают из K и R, а отрицательно заряженную аминокислоту выбирают из Е или D.
В одном аспекте в СН3 (+/-)-сконструированном биспецифическом антителе положительно заряженная аминокислота представляет собой K, а отрицательно заряженная аминокислота представляет собой Е.
В одном аспекте в СН3 (+/-)-сконструированном биспецифическом антителе в домене СН3 одной тяжелой цепи аминокислоту R в положении 409 замещают на D, и аминокислоту K в положении замещают на Е, и в домене СН3 другой тяжелой цепи аминокислоту D в положении 399 замещают на K, и аминокислоту Е в положении 357 замещают на K (нумерация согласно индексу EU по Кабату).
В одном аспекте подход, описанный в WO 2013/157953, используется для поддержания гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном варианте осуществления в домене СН3 одной тяжелой цепи аминокислоту Т в положении 366 замещают на K, и в домене СН3 другой тяжелой цепи аминокислоту L в положении 351 замещают на D (нумерация согласно индексу EU по Кабату). В другом варианте осуществления в домене СН3 одной тяжелой цепи аминокислоту Т в положении 366 замещают на K, и аминокислоту L в положении 351 замещают на K, и в домене СН3 другой тяжелой цепи аминокислоту L в положении 351 замещают на D (нумерация согласно индексу EU по Кабату).
В другом аспекте в домене СН3 одной тяжелой цепи аминокислоту Т в положении 366 замещают на K, и аминокислоту L в положении 351 замещают на K, и в домене СН3 другой тяжелой цепи аминокислоту L в положении 351 замещают на D (нумерация согласно индексу EU по Кабату). Кроме того, по меньшей мере одна из следующих замен содержится в домене СН3 другой тяжелой цепи: аминокислоту Y в положении 349 замещают на Е, аминокислоту Y в положении 349 замещают на D, а аминокислоту L в положении 368 замещают на Е (нумерация согласно индексу EU по Кабату). В одном варианте осуществления аминокислоту L в положении 368 замещают на Е (нумерация согласно индексу EU по Кабату).
В одном аспекте подход, описанный в WO 2012/058768, используется для поддержания гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном аспекте в домене СН3 одной тяжелой цепи аминокислоту L в положении 351 замещают на Y, и аминокислоту Y в положении 407 замещают на А, и в домене СН3 другой тяжелой цепи аминокислоту Т в положении 366 замещают на А, и аминокислоту K в положении 409 замещают на F (нумерация согласно индексу EU по Кабату). В другом варианте осуществления, в дополнение к вышеупомянутым заменам, в домене СН3 другой тяжелой цепи по меньшей мере одну из аминокислот, которые находятся в положениях 411 (первоначально Т), 399 (первоначально D), 400 (первоначально S), 405 (первоначально F), 390 (первоначально N) и 392 (первоначально K), замещают (нумерация согласно индексу EU по Кабату). Предпочтительными заменами являются:
- замена аминокислоты Т в положении 411 аминокислотой, выбранной из N, R, Q, K, D, Е и W (нумерация согласно индексу EU по Кабату),
- замена аминокислоты D в положении 399 аминокислотой, выбранной из R, W, Y и K (нумерация согласно индексу EU по Кабату),
- замена аминокислоты S в положении 400 аминокислотой, выбранной из Е, D, R и K (нумерация согласно индексу EU по Кабату),
- замена аминокислоты F в положении 405 аминокислотой, выбранной из I, М, Т, S, V и W (нумерация согласно индексу EU по Кабату);
- замена аминокислоты N в положении 390 аминокислотой, выбранной из R, K и D (нумерация согласно индексу EU по Кабату); и
- замена аминокислоты K в положении 392 аминокислотой, выбранной из V, М, R, L, F и Е (нумерация согласно индексу EU по Кабату).
В другом аспекте биспецифическое антитело сконструировано в соответствии с WO 2012/058768), то есть в домене СН3 одной тяжелой цепи аминокислоту L в положении 351 замещают на Y, и аминокислоту Y в положении 407 замещают на А, и в домене СН3 другой тяжелой цепи аминокислоту Т в положении 366 замещают на V, и аминокислоту К в положении 409 замещают на F (нумерация согласно индексу EU по Кабату). В другом варианте осуществления мультиспецифического антитела в домене СН3 одной тяжелой цепи аминокислоту Y в положении 407 замещают на А, и в домене СН3 другой тяжелой цепи аминокислоту Т в положении 366 замещают на А и аминокислоту K в положении 409 замещают на F (нумерация согласно индексу EU по Кабату). В последнем вышеупомянутом варианте осуществления в домене СН3 другой тяжелой цепи аминокислоту K в положении 392 замещают на Е, аминокислоту Т в положении 411 замещают на Е, аминокислоту D в положении 399 замещают на R и аминокислоту S в положении 400 замещают R (нумерация согласно индексу EU по Кабату).
В одном аспекте подход, описанный в WO 2011/143545, используется для поддержания гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном аспекте аминокислотные модификации в доменах СН3 обеих тяжелых цепей осуществляются в положениях 368 и/или 409 (нумерация согласно индексу EU по Кабату).
В одном аспекте подход, описанный в WO 2011/090762, используется для поддержания гетеродимеризации первой тяжелой цепи и второй тяжелой цепи биспецифического антитела. WO 2011/090762 относится к аминокислотным модификациям в соответствии с технологией «выступ-в-отверстие» (KiH). В одном варианте осуществления в домене СН3 одной тяжелой цепи аминокислоту Т в положении 366 замещают на W, а в домене СН3 другой тяжелой цепи аминокислоту Y в положении 407 замещают на А (нумерация согласно индексу EU по Кабату). В другом варианте осуществления в домене СН3 одной тяжелой цепи аминокислоту Т в положении 366 замещают на Y, а в домене СН3 другой тяжелой цепи аминокислоту Y в положении 407 замещают на Т (нумерация согласно индексу EU по Кабату).
В одном аспекте подход, описанный в WO 2009/089004, используется для поддержания гетеродимеризации первой тяжелой цепи и второй тяжелой цепи биспецифического антитела. В одном варианте осуществления в домене СН3 одной тяжелой цепи аминокислоту K или N в положении 392 замещают отрицательно заряженной аминокислотой (в одном варианте осуществления на Е или D, в одном предпочтительном варианте осуществления на D) и в домене СН3 другой тяжелой цепи аминокислоту D в положении 399, аминокислоту Е или D в положении 356 или аминокислоту Е в положении 357 замещают положительно заряженной аминокислотой (в одном варианте осуществления на K или R, в одном предпочтительном варианте осуществления на K, в одном предпочтительном варианте осуществления аминокислоты в положениях 399 или 356 заменяют на K) (нумерация согласно индексу EU по Кабату). В одном дополнительном варианте осуществления, в дополнение к вышеупомянутым заменам, в домене СН3 одной тяжелой цепи аминокислоту K или R в положении 409 замещают отрицательно заряженной аминокислотой (в одном варианте осуществления на Е или D, в одном предпочтительном варианте осуществления на D) (нумерация согласно индексу EU по Кабату). В еще одном дополнительном аспекте, в дополнение или в качестве альтернативы вышеупомянутым заменам, в домене СН3 одной тяжелой цепи аминокислоту K в положении 439 и/или аминокислоту K в положении 370 независимо замещают друг от друга замещают отрицательно заряженной аминокислотой (в одном варианте осуществления на Е или D, в одном предпочтительном варианте осуществления на D) (нумерация согласно индексу EU по Кабату).
В одном аспекте подход, описанный в WO 2007/147901, используется для поддержания гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном варианте осуществления в домене СН3 одной тяжелой цепи аминокислоту K в положении 253 замещают на Е, аминокислоту D в положении 282 замещают на K, а аминокислоту K в положении 322 замещают на D, и в домене СН3 другой тяжелой цепи, аминокислоту D в положении 239 замещают на K, аминокислоту Е в положении 240 замещают на K, а аминокислоту K в положении 292 замещают на D (нумерация согласно индексу EU по Кабату).
С-конец тяжелой цепи биспецифического антитела, как указано в данном документе, может представлять собой полноразмерный С-конец, заканчивающийся аминокислотными остатками ФГК (фосфоглицераткиназа). С-конец тяжелой цепи может быть укороченным С-концом, в котором один или два С-концевых аминокислотных остатка были удалены. В одном предпочтительном аспекте С-конец тяжелой цепи представляет собой укороченный С-конец, заканчивающийся ФГ.
В одном аспекте из всех аспектов, описанных в данном документе, биспецифическое антитело, содержащее тяжелую цепь, включающую С-концевой домен СН3, как указано в данном документе, содержит С-концевой глицин-лизиновый дипептид (G446 и K447, нумерация согласно индексу EU по Кабату). В одном варианте осуществления всех аспектов, как указано в данном документе, биспецифическое антитело, содержащее тяжелую цепь, включающую С-концевой домен СН3, как указано в данном документе, содержит С-концевой остаток глицина (G446, нумерация согласно индексу EU по Кабату).
Модификации в Fab-доменах
В одном аспекте изобретение относится к биспецифическому антителу, содержащему первый Fab-фрагмент, который специфически связывается с PD1, и второй Fab-фрагмент, который специфически связывается с LAG3, при этом в одном из Fab-фрагментов осуществляют обмен или вариабельных доменов VH и VL, или константных доменов СН1 и CL. Биспецифические антитела получают по технологии Crossmab.
Полиспецифические антитела с заменой/обменом доменов в одном связывающем плече (CrossMabVH-VL или CrossMabCH-CL) подробно описаны в WO 2009/080252, WO 2009/080253 и Schaefer, W. et al., PNAS, 108 (2011) 11187-1191. Они отчетливо уменьшают побочные продукты, вызванные несоответствием легкой цепи против первого антигена с неправильной тяжелой цепью против второго антигена (в сравнении с подходами без такого обмена доменами).
В конкретном аспекте изобретение относится к биспецифическому антителу, содержащему первый Fab-фрагмент, который специфически связывается с PD1, и второй Fab-фрагмент, который специфически связывается с LAG3, при этом в одном из Fab-фрагментов вариабельные домены VL и VH заменены каждый друг на друга, так что домен VH является частью легкой цепи, а домен VL является частью тяжелой цепи. В конкретном аспекте биспецифическое антитело представляет собой антитело, в котором в первом Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
В другом аспекте и для дальнейшего улучшения соответствующего спаривания биспецифическое антитело, содержащее первый Fab-фрагмент, который специфически связывается с PD1, и второй Fab-фрагмент, который специфически связывается с LAG3, может содержать различные заряженные аминокислотные замены (так называемые «заряженные остатки»). Эти модификации вводятся в кроссоверные или некроссоверные домены СН1 и CL. Такие модификации описаны, например, в WO 2015/150447, WO 2016/020309 и РСТ/ЕР 2016/073408.
В конкретном аспекте изобретение относится к биспецифическому антителу, содержащему первый Fab-фрагмент, который специфически связывается с PD1, и второй Fab-фрагмент, который специфически связывается с LAG3, при этом в одном из Fab-фрагментов в константном домене CL аминокислоту в положении 124 независимо замещают лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно индексу EU по Кабату), а в константном домене СН1 аминокислоты в положениях 147 и 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату). В конкретном аспекте биспецифическое антитело представляет собой антитело, в котором во втором Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с TIM3 константным доменом CL, аминокислоту в положении 124 независимо замещают лизином (K), аргинином (R) или гистидин (Н) (нумерация согласно индексу EU по Кабату), а в константном домене СН1 аминокислоты в положениях 147 и 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату).
В конкретном аспекте изобретение относится к биспецифическому антителу, содержащему первый Fab-фрагмент, который специфически связывается с PD1, и второй Fab-фрагмент, который специфически связывается с LAG3, при этом в одном из доменов CL аминокислота в положении 123 (нумерация EU) была заменена аргинином (R), а аминокислота в положении 124 (нумерация EU) была заменена лизином (K), и при этом в одном из доменов СН1 аминокислоты в положении 147 (нумерация EU) и в положении 213 (нумерация EU) были заменены глутаминовой кислотой (Е). В конкретном аспекте биспецифическое антитело представляет собой антитело, в котором во втором Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с LAG3, аминокислота в положении 123 (нумерация EU) была заменена аргинином (R), а аминокислота в положении 124 (нумерация EU) была заменена лизином (К), и при этом в одном из доменов СН1 аминокислоты в положении 147 (нумерация EU) и в положении 213 (нумерация EU) были замещены глутаминовой кислотой (Е).
В дополнительном аспекте биспецифическое антитело представляет собой двухвалентное антитело, содержащее
a) первую легкую цепь и первую тяжелую цепь антитела, специфически связывающегося с первым антигеном, и
b) вторую легкую цепь и вторую тяжелую цепь антитела, специфически связывающегося со вторым антигеном, при этом вариабельные домены VL и VH второй легкой цепи и второй тяжелой цепи заменены друг на друга.
Антитело согласно а) не содержит модификацию, как описано согласно b), а тяжелая цепь и легкая цепь согласно а) являются изолированными цепями.
В антителе согласно b) в легкой цепи вариабельный домен легкой цепи VL заменен вариабельным доменом тяжелой цепи VH указанного антитела, а внутри тяжелой цепи вариабельный домен тяжелой цепи VH заменен вариабельным доменом легкой цепи VL указанного антитела.
В одном аспекте (i) в константном домене CL первой легкой цепи согласно а) аминокислоту в положении 124 (нумерация по Кабату) замещают положительно заряженной аминокислотой и при этом в константном домене СН1 первой тяжелой цепи согласно а) аминокислоту в положении 147 или аминокислоту в положении 213 (нумерация согласно индексу EU по Кабату) замещают отрицательно заряженной аминокислотой или (ii) в константном домене CL второй легкой цепи согласно b) аминокислоту в положении 124 (нумерация по Кабату) замещают положительно заряженной аминокислотой, и при этом в константном домене СН1 второй тяжелой цепи согласно b) аминокислоту в положении 147 или аминокислоту в положении 213 (нумерация согласно индексу EU по Кабату) замещают отрицательно заряженной аминокислотой.
В другом аспекте (i) в константном домене CL первой легкой цепи согласно а) аминокислоту в положении 124 независимо замещают лизином (K), аргинином (R) или гистидином (Н) (нумерация по Кабату) (в одном предпочтительном варианте осуществления независимо лизином (K) или аргинином (R)), и при этом в константном домене СН1 первой тяжелой цепи согласно а) аминокислоту в положении 147 или аминокислоту в положении 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату) или (ii) в константном домене CL второй легкой цепи согласно b) аминокислоту в положении 124 независимо замещают лизином (K), аргинином (R) или гистидином (Н) (нумерация по Кабату) (в одном предпочтительном варианте осуществления независимо на лизин (K) или аргинин (R)) и при этом в константном домене СН1 второй тяжелой цепи согласно b) аминокислоту в положении 147 или аминокислоту в положении 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату).
В одном аспекте в константном домене CL второй тяжелой цепи аминокислоты в положениях 124 и 123 замещают на K (нумерация согласно индексу EU по Кабату).
В одном аспекте в константном домене CL второй тяжелой цепи аминокислоту в положении 123 замещают на R, а аминокислоту в положении 124 замещают на K (нумерация согласно индексу EU по Кабату).
В одном аспекте в константном домене СН1 второй легкой цепи аминокислоты в положениях 147 и 213 замещают на Е (нумерация согласно индексу EU по Кабату).
В одном аспекте в константном домене CL первой легкой цепи аминокислоты в положении 124 и 123 замещают на K, а в константном домене СН1 первой тяжелой цепи аминокислоты в положении 147 и 213 замещают на Е (нумерация согласно индексу EU по Кабату).
В одном аспекте в константном домене CL первой легкой цепи аминокислоту в положении 123 замещают R, а аминокислоту в положении 124 замещают на K, а в константном домене СН1 первой тяжелой цепи аминокислоты в обоих положениях 147 и 213 замещают на Е (нумерация согласно индексу EU по Кабату).
В одном аспекте в константном домене CL второй тяжелой цепи аминокислоты в положении 124 и 123 замещены K, и при этом в константном домене СН1 второй легкой цепи аминокислоты в положении 147 и 213 замещают на Е, а в вариабельном домене VL первой легкой цепи аминокислоту в положении 38 замещают на K, в вариабельном домене VH первой тяжелой цепи аминокислоту в положении 39 замещают на Е в вариабельном домене VL из второй тяжелой цепи аминокислоту в положении 38 замещают на K, а в вариабельном домене VH второй легкой цепи аминокислоту в положении 39 замещают на Е (нумерация согласно индексу EU по Кабату).
В одном аспекте биспецифическое антитело представляет собой двухвалентное антитело, содержащее
a) первую легкую цепь и первую тяжелую цепь антитела, специфически связывающегося с первым антигеном, и
b) вторую легкую цепь и вторую тяжелую цепь антитела, специфически связывающегося со вторым антигеном, при этом вариабельные домены VL и VH второй легкой цепи и второй тяжелой цепи заменены друг на друга, и при этом константные домены CL и СН1 второй легкой цепи и второй тяжелой цепи заменены друг на друга.
Антитело согласно а) не содержит модификации, как описано согласно b), а тяжелая цепь и легкая цепь согласно а) являются изолированными цепями. В антителе согласно b) в легкой цепи вариабельный домен легкой цепи VL заменен вариабельным доменом тяжелой цепи VH указанного антитела, а константный домен легкой цепи CL заменен константным доменом тяжелой цепи СН1 указанного антитела; и внутри тяжелой цепи вариабельный домен тяжелой цепи VH заменен вариабельным доменом легкой цепи VL указанного антитела, а константный домен тяжелой цепи СН1 заменен константным доменом легкой цепи CL указанного антитела.
В одном аспекте биспецифическое антитело представляет собой двухвалентное антитело, содержащее
a) первую легкую цепь и первую тяжелую цепь антитела, специфически связывающегося с первым антигеном, и
b) вторую легкую цепь и вторую тяжелую цепь антитела, специфически связывающегося со вторым антигеном, при этом константные домены CL и СН1 второй легкой цепи и второй тяжелой цепи заменены друг на друга.
Антитело согласно а) не содержит модификацию, как описано согласно b), а тяжелая цепь и легкая цепь согласно а) являются изолированными цепями. В антителе согласно b) в легкой цепи константный домен CL легкой цепи заменен константным доменом тяжелой цепи СН1 указанного антитела; и внутри тяжелой цепи константный домен тяжелой цепи СН1 заменен константным доменом легкой цепи CL указанного антитела.
В одном аспекте биспецифическое антитело представляет собой биспецифическое антитело, содержащее
a) полноразмерное антитело, специфически связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
b) один, два, три или четыре одноцепочечных Fab-фрагмента, специфически связывающихся со вторым антигеном,
при этом указанные одноцепочечные Fab-фрагменты согласно b) слиты с указанным полноразмерным антителом согласно а) через пептидный линкер на С- или N-конце тяжелой или легкой цепи указанного полноразмерного антитела.
В одном аспекте один или два идентичных одноцепочечных Fab-фрагмента, связывающихся со вторым антигеном, слиты с полноразмерным антителом через пептидный линкер на С-конце тяжелой или легкой цепей указанного полноразмерного антитела.
В одном аспекте один или два идентичных одноцепочечных Fab (scFab)-фрагмента, связывающихся со вторым антигеном, слиты с полноразмерным антителом через пептидный линкер на С-конце тяжелых цепей указанного полноразмерного антитела.
В одном аспекте один или два идентичных одноцепочечных Fab (scFab)-фрагмента, связывающихся со вторым антигеном, слиты с полноразмерным антителом через пептидный линкер на С-конце легких цепей указанного полноразмерного антитела.
В одном аспекте два идентичных одноцепочечных Fab (scFab)-фрагмента, связывающихся со вторым антигеном, слиты с полноразмерным антителом через пептидный линкер на С-конце каждой тяжелой или легкой цепи указанного полноразмерного антитела.
В одном аспекте два идентичных одноцепочечных Fab (scFab)-фрагмента, связывающихся со вторым антигеном, слиты с полноразмерным антителом через пептидный линкер на С-конце каждой тяжелой цепи указанного полноразмерного антитела.
В одном аспекте два идентичных одноцепочечных Fab (scFab)-фрагмента, связывающихся со вторым антигеном, слиты с полноразмерным антителом через пептидный линкер на С-конце каждой легкой цепи указанного полноразмерного антитела.
В одном аспекте биспецифическое антитело представляет собой трехвалентное антитело, содержащее
a) полноразмерное антитело, специфически связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела,
b) первый полипептид, состоящий из
ba) вариабельного домена тяжелой цепи антитела (VH) или
bb) вариабельного домена тяжелой цепи антитела (VH) и константного домена антитела 1 (СН1),
при этом указанный первый полипептид слит с N-концом его VH-домена через пептидный линкер с С-концом одной из двух тяжелых цепей указанного полноразмерного антитела,
c) второй полипептид, состоящий из
ca) вариабельного домена легкой цепи антитела (VL) или
cb) вариабельного домена легкой цепи (VL) антитела и константного домена легкой цепи (CL) антитела,
при этом указанный второй полипептид слит с N-концом домена VL через пептидный линкер с С-концом другой из двух тяжелых цепей указанного полноразмерного антитела, и
при этом вариабельный домен тяжелой цепи (VH) антитела первого полипептида и вариабельный домен легкой цепи антитела (VL) второго полипептида вместе образуют антигенсвязывающий домен, специфически связывающийся со вторым антигеном.
В одном аспекте вариабельный домен тяжелой цепи антитела (VH) полипептида согласно b) и вариабельный домен легкой цепи антитела (VL) полипептида согласно с) связаны и стабилизированы посредством межцепочечного дисульфидного мостика путем введения дисульфидной связи между следующими положениями:
(i) от положения 44 вариабельного домена тяжелой цепи до положения 100 вариабельного домена легкой цепи, или
(ii) от положения 105 вариабельного домена тяжелой цепи до положения 43 вариабельного домена легкой цепи, или
(iii) от положения 101 вариабельного домена тяжелой цепи до положения 100 вариабельного домена легкой цепи (нумерация всегда согласно индексу EU по Кабату).
Способы введения неестественных дисульфидных мостиков для стабилизации описаны, например, в WO 94/029350, Rajagopal, V., et al., Prot. Eng. (1997) 1453-1459; Kobayashi, H., et al., Nucl. Med. Biol. 25 (1998) 387-393; и Schmidt, M., et al., Oncogene 18 (1999) 1711-1721. В одном варианте осуществления необязательная дисульфидная связь между вариабельными доменами полипептидов в положениях b) и с) находится между положением 44 вариабельного домена тяжелой цепи и положением 100 вариабельного домена легкой цепи. В одном варианте осуществления необязательная дисульфидная связь между вариабельными доменами полипептидов в положениях b) и с) находится между положением 105 вариабельного домена тяжелой цепи и положением 43 вариабельного домена легкой цепи (нумерация всегда согласно Кабату). В одном варианте осуществления предпочтительным является трехвалентное биспецифическое антитело без указанной необязательной дисульфидной стабилизации между вариабельными доменами VH и VL одноцепочечных Fab-фрагментов.
В одном аспекте биспецифическое антитело представляет собой триспецифическое или тетраспецифическое антитело, содержащее
a) первую легкую цепь и первую тяжелую цепь полноразмерного антитела, которое специфически связывается с первым антигеном, и
b) вторую (модифицированную) легкую цепь и вторую (модифицированную) тяжелую цепь полноразмерного антитела, которое специфически связывается со вторым антигеном, при этом вариабельные домены VL и VH заменены друг на друга, и/или при этом константные домены CL и СН1 заменены друг на друга, и
c) при этом от одного до четырех антигенсвязывающих доменов, которые специфически связываются с одним или двумя дополнительными антигенами (то есть с третьим и/или четвертым антигеном), слит через пептидный линкер с С- или N-концом легких цепей или тяжелых цепей а) и/или b).
Антитело согласно а) не содержит модификации, как описано согласно b), а тяжелая цепь и легкая цепь согласно а) являются изолированными цепями.
В одном аспекте триспецифическое или тетраспецифическое антитело содержит согласно с) один или два антигенсвязывающих домена, которые специфически связываются с одним или двумя дополнительными антигенами.
В одном аспекте антигенсвязывающие домены выбирают из группы scFv-фрагмента и scFab-фрагмента.
В одном аспекте антигенсвязывающие домены представляют собой scFv-фрагменты.
В одном аспекте антигенсвязывающие домены представляют собой scFab-фрагменты.
В одном аспекте антигенсвязывающие домены слиты с С-концом тяжелых цепей а) и/или b).
В одном аспекте триспецифическое или тетраспецифическое антитело содержит согласно с) один или два антигенсвязывающих домена, которые специфически связываются с одним дополнительным антигеном.
В одном аспекте триспецифическое или тетраспецифическое антитело содержит согласно с) два идентичных антигенсвязывающих домена, которые специфически связываются с третьим антигеном. В одном предпочтительном варианте осуществления такие два идентичных антигенсвязывающих домена слиты оба через один и тот же пептидный линкер с С-концом тяжелых цепей а) и b). В одном предпочтительном варианте осуществления два идентичных антигенсвязывающих домена представляют собой или scFv-фрагмент, или scFab-фрагмент.
В одном аспекте триспецифическое или тетраспецифическое антитело содержит согласно с) два антигенсвязывающих домена, которые специфически связываются с третьим и четвертым антигеном. В одном варианте осуществления указанные два антигенсвязывающих домена слиты через один и тот же пептидный элемент соединения с С-концом тяжелых цепей а) и b). В одном предпочтительном варианте осуществления указанные два антигенсвязывающих домена представляют собой или scFv-фрагмент, или scFab-фрагмент.
В одном аспекте биспецифическое антитело представляет собой биспецифическое, четырехвалентное антитело, содержащее
a) две легкие цепи и две тяжелые цепи антитела, которые специфически связываются с первым антигеном (и содержат два Fab-фрагмента),
b) два дополнительных Fab-фрагмента антитела, которые специфически связываются со вторым антигеном, при этом указанные дополнительные Fab-фрагменты слиты как через пептидный линкер, так и с С- или N-концом тяжелых цепей а), и
при этом в Fab-фрагментах были выполнены следующие модификации
(i) в обоих Fab-фрагментах а) или в обоих Fab-фрагментах b) вариабельные домены VL и VH заменены друг на друга, и/или константные домены CL и СН1 заменены друг на друга, или
(ii) в обоих Fab-фрагментах а) вариабельные домены VL и VH заменены друг на друга, а константные домены CL и СН1 заменены друг на друга, и в обоих Fab-фрагментах b) вариабельные домены VL и VH заменены друг на друга, или константные домены CL и СН1 заменены друг на друга, или
(iii) в обоих Fab-фрагментах а) вариабельные домены VL и VH заменены друг на друга, или константные домены CL и СН1 заменены друг на друга, и в обоих Fab-фрагментах b) вариабельные домены VL и VH заменены друг на друга, а константные домены CL и СН1 заменены друг на друга, или
(iv) в обоих Fab-фрагментах а) вариабельные домены VL и VH заменены друг на друга, и в обоих Fab-фрагментах b) константные домены CL и СН1 заменены друг на друга, или
(v) в обоих Fab-фрагментах а) константные домены CL и СН1 заменены друг на друга, и в обоих Fab-фрагментах b) вариабельные домены VL и VH заменены друг на друга.
В одном аспекте указанные дополнительные Fab-фрагменты слиты как через пептидный линкер, или с С-концом тяжелых цепей а), или с N-концом тяжелых цепей а).
В одном аспекте указанные дополнительные Fab-фрагменты слиты как через пептидный линкер, так и с С-концом тяжелых цепей а).
В одном аспекте указанные дополнительные Fab-фрагменты слиты как через пептидный линкер с N-концом тяжелых цепей а).
В одном аспекте в Fab-фрагментах осуществляют следующие модификации: в обоих Fab-фрагментах а) или в обоих Fab-фрагментах b) вариабельные домены VL и VH заменяют друг на друга, и/или константные домены CL и СН1 заменены друг на друга.
В одном аспекте биспецифическое антитело представляет собой четырехвалентное антитело, содержащее:
a) (модифицированную) тяжелую цепь первого антитела, которое специфически связывается с первым антигеном и содержит первую пару доменов VH-CH1, при этом С-конец указанной тяжелой цепи, N-конец второй пары доменов VH-CH1 указанного первого антитела слиты через пептидный линкер,
b) две легкие цепи указанного первого антитела а),
c) (модифицированную) тяжелую цепь второго антитела, которое специфически связывается со вторым антигеном и содержит первую пару доменов VH-CL, при этом С-конец указанной тяжелой цепи, N-конец второй пары доменов VH-CL указанного второго антитела слиты через пептидный линкер, и
d) две (модифицированные) легкие цепи указанного второго антитела с), каждая из которых содержит пару доменов CL-CH1.
В одном аспекте биспецифическое антитело содержит
а) тяжелую цепь и легкую цепь первого полноразмерного антитела, которое специфически связывается с первым антигеном, и
b) тяжелую цепь и легкую цепь второго полноразмерного антитела, которое специфически связывается со вторым антигеном, при этом N-конец тяжелой цепи соединен с С-концом легкой цепи через пептидный линкер.
Антитело согласно а) не содержит модификации, как описано в b), а тяжелая цепь и легкая цепь представляют собой изолированные цепи.
В одном аспекте биспецифическое антитело содержит
a) полноразмерное антитело, специфически связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
b) Fv-фрагмент, специфически связывающийся со вторым антигеном, содержащим домен VH2 и домен VL2, при этом оба домена связаны друг с другом через дисульфидный мостик,
где только или домен VH2, или домен VL2 слиты через пептидный линкер с тяжелой или легкой цепью полноразмерного антитела, специфически связывающегося с первым антигеном.
В биспецифическом антителе тяжелые цепи и легкие цепи согласно а) представляют собой изолированные цепи.
В одном аспекте другой домен VH2 или домен VL2 не слит через пептидный линкер с тяжелой или легкой цепью полноразмерного антитела, специфически связывающегося с первым антигеном.
Во всех аспектах, как указано в данном документе, первая легкая цепь содержит домен VL и домен CL, а первая тяжелая цепь содержит домен VH, домен СН1, шарнирную область, домен СН2 и домен СН3.
В одном аспекте биспецифическое антитело представляет собой трехвалентное антитело, содержащее
a) два Fab-фрагмента, которые специфически связываются с первым антигеном,
b) один кроссоверный Fab-фрагмент, который специфически связывается со вторым антигеном, в котором СН1 и домен CL заменены друг на друга,
с) одну Fc-область, содержащую первую тяжелую цепь Fc-области и вторую тяжелую цепь второй Fc-области,
при этом С-конец доменов СН1 двух Fab-фрагментов связан с N-концом полипептидов Fc-области тяжелой цепи, и при этом С-конец домена CL кроссоверного Fab-фрагмента связан с N-концом домена VH одного из фрагментов.
В одном аспекте биспецифическое антитело представляет собой трехвалентное антитело, содержащее
a) два Fab-фрагмента, которые специфически связываются с первым антигеном,
b) один кроссоверный Fab-фрагмент, который специфически связывается со вторым антигеном, в котором СН1 и домен CL заменены друг на друга,
c) одну Fc-область, содержащую первую тяжелую цепь Fc-области и вторую тяжелую цепь второй Fc-области,
при этом С-конец домена СН1 первого Fab-фрагмента связан с N-концом одного из полипептидов Fc-области тяжелой цепи, а С-конец CL-домена кроссоверного Fab-фрагмента связан с N-концом другого полипептида Fc-области тяжелой цепи, и при этом С-конец домена СН1 второго Fab-фрагмента связан с N-концом домена VH первого Fab-фрагмента или с N-концом VH домена кроссоверного Fab-фрагмента.
В одном аспекте биспецифическое антитело содержит
a) полноразмерное антитело, специфически связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
b) Fab-фрагмент, специфически связывающийся со вторым антигеном, содержащим домен VH2 и домен VL2, содержащий фрагмент тяжелой цепи и фрагмент легкой цепи, при этом внутри фрагмента легкой цепи вариабельный домен легкой цепи VL2 заменен вариабельным доменом тяжелой цепи VH2 указанного антитела, и внутри фрагмента тяжелой цепи вариабельный домен тяжелой цепи VH2 заменен вариабельным доменом легкой цепи VL2 указанного антитела
при этом Fab-фрагмент тяжелой цепи вставлен между доменом СН1 одной из тяжелых цепей полноразмерного антитела и соответствующей Fc-областью полноразмерного антитела, а N-конец Fab-фрагмента легкой цепи конъюгирован с С-концом легкой цепи полноразмерного антитела, который связан с тяжелой цепью полноразмерного антитела, в которую вставлен Fab-фрагмент тяжелой цепи.
В одном аспекте биспецифическое антитело содержит
a) полноразмерное антитело, специфически связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
b) Fab-фрагмент, специфически связывающийся со вторым антигеном, содержащим домен VH2 и домен VL2, содержащий фрагмент тяжелой цепи и фрагмент легкой цепи, при этом внутри фрагмента легкой цепи вариабельный домен легкой цепи VL2 заменен вариабельным доменом тяжелой цепи VH2 указанного антитела, и внутри фрагмента тяжелой цепи вариабельный домен тяжелой цепи VH2 заменен вариабельным доменом легкой цепи VL2 указанного антитела, и при этом С-конец фрагмента тяжелой цепи Fab-фрагмента конъюгирован с N- концом одной из тяжелых цепей полноразмерного антитела и С-конец фрагмента легкой цепи Fab-фрагмента конъюгирован с N-концом легкой цепи полноразмерного антитела, которое спаривается с тяжелой цепью полноразмерного антитела, с которым конъюгирован фрагмент тяжелой цепи Fab-фрагмента.
Полинуклеотиды
Изобретение, кроме того, относится к выделенным полинуклеотидам, кодирующим биспецифическое антитело, как описано в данном документе, или его фрагмент.
Термин «молекула нуклеиновой кислоты» или «полинуклеотид» включает любое соединение и/или вещество, которое содержит полимер нуклеотидов. Каждый нуклеотид состоит из основания, в частности пуринового или пиримидинового основания (то есть цитозина (С), гуанина (G), аденина (А), тимина (Т) или урацила (U)), сахара (то есть дезоксирибозы или рибозы) и фосфатной группы. Часто молекула нуклеиновой кислоты описывается последовательностью оснований, причем указанные основания представляют собой первичную структуру (линейную структуру) молекулы нуклеиновой кислоты. Последовательность оснований обычно представлена от 5' к 3'. В данном документе, термин молекула нуклеиновой кислоты охватывает дезоксирибонуклеиновую кислоту (ДНК), включая, например, комплементарную ДНК (кДНК) и геномную ДНК, рибонуклеиновую кислоту (РНК), в частности, матричную РНК (мРНК), синтетические формы ДНК или РНК и смешанные полимеры, содержащие две или более этих молекул. Молекула нуклеиновой кислоты может быть линейной или кольцевой. Кроме того, термин молекула нуклеиновой кислоты включает как смысловые, так и антисмысловые цепи, а также одноцепочечные и двухцепочечные формы. Кроме того, описанная в данном документе молекула нуклеиновой кислоты может содержать встречающиеся в природе или не встречающиеся в природе нуклеотиды. Примеры не встречающихся в природе нуклеотидов включают модифицированные нуклеотидные основания с дериватизированными сахарами или фосфатными основными цепями или химически модифицированными остатками. Молекулы нуклеиновой кислоты также включают молекулы ДНК и РНК, которые подходят в качестве вектора для прямой экспрессии антитела in vitro согласно изобретению и/или in vivo, например, у хозяина или пациента. Такие векторы ДНК (например, кДНК) или РНК (например, мРНК) могут быть немодифицированными или модифицированными. Например, мРНК может быть химически модифицирована для повышения стабильности вектора РНК и/или экспрессии кодируемой молекулы так, чтобы мРНК можно было ввести субъекту для выработки антитела in vivo (см., например, Stadler ert al, Nature Medicine 2017, опубликовано в сети 12 июня 2017 г., doi: 10.1038/nm.4356 или ЕР 2101823 В1).
«Выделенный» полинуклеотид относится к молекуле нуклеиновой кислоты, которая была выделена из компонента ее естественной среды. Выделенный полинуклеотид включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует внехромосомно или в месте локализации хромосом, которое отличается от его естественного хромосомного расположения.
Выделенные полинуклеотиды, кодирующие биспецифические антитела согласно изобретению, могут быть экспрессированы в виде одного полинуклеотида, который кодирует всю антигенсвязывающую молекулу, или в виде множества (например, двух или более) полинуклеотидов, которые совместно экспрессируются. Полипептиды, кодируемые полинуклеотидами, которые совместно экспрессируются, могут связываться, например, через дисульфидные связи или другими способами, с образованием функциональной антигенсвязывающей молекулы. Например, часть легкой цепи иммуноглобулина может кодироваться отдельным полинуклеотидом из части тяжелой цепи иммуноглобулина. При совместной экспрессии, полипептиды тяжелой цепи будут связываться с полипептидами легкой цепи с образованием иммуноглобулина.
В некоторых аспектах выделенный полинуклеотид кодирует полипептид, содержащийся в биспецифическом антителе согласно изобретению, как описано в данном документе.
В одном аспекте данное изобретение относится к выделенным полинуклеотидам, кодирующим биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с белком запрограммированной гибели клеток 1 (PD1), и второй антигенсвязывающий домен, который специфически связывается с геном активации лимфоцитов-3 (LAG3), при этом указанный первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2 и (iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; и домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В. Рекомбинантные способы
Антитела могут быть получены с использованием рекомбинантных способов и композиций, например, как описано в патенте США 4816567. Для этих способов предложена одна или более выделенных нуклеиновых кислот, кодирующих антитело.
В случае нативного антитела или фрагмента нативного антитела требуются две нуклеиновые кислоты, одна для легкой цепи или ее фрагмента и одна для тяжелой цепи или ее фрагмента. Такая(ие) нуклеиновая(ые) кислота(ы) кодирует(ют) аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепь(и) антитела). Эти нуклеиновые кислоты могут находиться в одном и том же векторе экспрессии или в разных векторах экспрессии. В случае некоторых биспецифических антител с гетеродимерными тяжелыми цепями требуются четыре нуклеиновые кислоты, одна для первой легкой цепи, одна для первой тяжелой цепи, содержащей первый гетеромономерный полипептид Fc-области, одна для второй легкой цепи и одна для второй тяжелой цепи, содержащая второй гетеромономерный полипептид Fc-области. Четыре нуклеиновые кислоты могут содержаться в одной или более молекулах нуклеиновых кислот или векторах экспрессии. Например, такая(ие) нуклеиновая(ые) кислота(ы) кодирует(ют) аминокислотную последовательность, содержащую первый VL, и/или аминокислотную последовательность, содержащую первый VH, включая первую гетеромономерную Fc-область, и/или аминокислотную последовательность, содержащую второй VL и/или аминокислотную последовательность, содержащую второй VH, включающий вторую гетеромономерную Fc-область антитела (например, первую и/или вторую легкие и/или первую и/или вторую тяжелые цепи антитела). Эти нуклеиновые кислоты могут находиться в одном и том же векторе экспрессии или в разных векторах экспрессии, обычно эти нуклеиновые кислоты расположены в двух или трех векторах экспрессии, то есть один вектор может содержать более одной из этих нуклеиновых кислот. Примерами этих биспецифических антител являются CrossMab и биспецифические Т-клетки (см., например, Schaefer, W. et al., PNAS, 108 (2011) 11187-1191). Например, одна из гетеромономерных тяжелых цепей содержит так называемые «мутации выступа» (T366W и необязательно одну из S354C или Y349C), а другая содержит так называемые «мутации отверстия» (T366S, L368A и Y407V и необязательно Y349C или S354C) (см., например, Carter, P. et al., Immunotechnol. 2 (1996) 73).
В одном аспекте предложена выделенная нуклеиновая кислота, кодирующая биспецифическое антитело, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL и/или аминокислотную последовательность, содержащую VH антигенсвязывающих доменов, которые специфически связываются с PD1 и LAG3 соответственно (например, в легкой и/или тяжелой цепях антитела). В дополнительном аспекте предложен один или более векторов (например, векторов экспрессии), содержащих такую нуклеиновую кислоту. В дополнительном аспекте предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком аспекте клетка-хозяин содержит (например, была трансформирована): (1) первый вектор, содержащий первую пару нуклеиновых кислот, которые кодируют аминокислотные последовательности, одна из которых содержит первый VL, а другая содержит первый VH антитела, и второй вектор, содержащий вторую пару нуклеиновых кислот, которые кодируют аминокислотную последовательности, одна из которых содержит второй VL, а другая содержит второй VH антитела, или (2) первый вектор, содержащий первую нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую один из вариабельных доменов (предпочтительно вариабельный домен легкой цепи), второй вектор, содержащий пару нуклеиновых кислот, которые кодируют аминокислотные последовательности, одна из которых содержит вариабельный домен легкой цепи, а другая содержит первый вариабельный домен тяжелой цепи, и третий вектор, содержащий пару нуклеиновых кислот, которые кодируют аминокислотную последовательности, одна из которых содержит соответствующий другой вариабельный домен легкой цепи, как во втором векторе, а другая содержит второй вариабельный домен тяжелой цепи, или (3) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую первый VL антитела, второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую первый VH антитела, третий вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую второй VL антитела, и четвертый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую второй VH антитела. В одном аспекте клетка-хозяин является эукариотической, например клетка яичника китайского хомячка (СНО) или лимфоидная клетка (например, клетка Y0, NS0, Sp20). В одном аспекте предложен способ получения биспецифического антитела, причем способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как указано выше, в условиях, подходящих для экспрессии антитела, и, возможно, извлечение антитела из клетки-хозяина (или среды для культивирования клеток-хозяев).
Для рекомбинантной продукции биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, нуклеиновую кислоту, кодирующую биспецифические антитела, например, как описано выше, выделяют и вставляют в один или более векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии кодирующих антитела векторов включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут продуцироваться в бактериях, в частности, когда гликозилирование и эффекторная функция Fc не нужны. Для экспрессии фрагментов антител и полипептидов в бактериях см., например, патенты США 5648237, 5789199 и 5840523. (См. также Charlton, K.А., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, где описана экспрессия фрагментов антител в Е. coli) После экспрессии антитело может быть выделено из массы бактериальных клеток в растворимой фракции и может быть дополнительно очищено.
В дополнение к прокариотам эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитела, включая грибы и штаммы дрожжей, пути гликозилирования которых были «гуманизированы», что приводит к образованию антитела с частично или полностью человеческим процессом гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414; и Li, Н. et al., Nat. Biotech. 24 (2006) 210-215.
Подходящие клетки-хозяева для экспрессии гликозилированных антител также получены из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать вместе с клетками насекомых, особенно для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также можно использовать в качестве хозяев. См., например, патенты США №5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIESTM для получения антител в трансгенных растениях).
Клетки позвоночных также можно использовать в качестве хозяев. Например, могут быть полезны клеточные линии млекопитающих, которые адаптированы для роста в суспензии. Другими примерами полезных линий клеток-хозяев млекопитающих являются линия CV1 почек обезьян, трансформированная SV40 (COS-7); эмбриональная почечная линия человека (клетки 293 или 293, как описано, например, в Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки почек детенышей хомяка (BHK); мышиные клетки Сертоли (клетки ТМ4, как описано, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы Buffalo (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); опухоль молочной железы мыши (ММТ 060562); клетки TRI, как описано, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5; и клетки FS4. Другие полезные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), включая клетки DHFR-CHO (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев млекопитающих, подходящих для получения антител, см., например, Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
С. Анализы
Биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, предложенные в данном документе, могут быть идентифицированы, подвергнуты скринингу или охарактеризованы на предмет их физических/химических свойств и/или биологических активностей с помощью различных анализов, известных в данной области техники.
1. Анализы аффинности
Аффинность биспецифических антигенсвязывающих молекул, антител и фрагментов антител, предложенных в данном документе, к соответствующим антигенам может быть определена в соответствии со способами, изложенными в Примерах, с помощью поверхностного плазмонного резонанса (ППР) с использованием стандартных приборов, таких как прибор Biacore® (GE Healthcare), и рецепторы или такие целевые белки могут быть получены путем рекомбинантной экспрессии. Конкретный типичный и илллюстративный вариант осуществления для измерения аффинности связывания описан в Примерах 2, 8 или 11. Согласно одному аспекту, Kd измеряют с помощью поверхностного плазмонного резонанса с использованием прибора BIACORE® Т100 (GE Healthcare) при 25°С.
2. Анализы связывания и другие анализы
В одном аспекте биспецифические антитела согласно изобретению тестируют на их антигенсвязывающую активность, например, с помощью известных способов, таких как ИФА, вестерн-блоттинг и т.д. Связывание биспецифических антител, представленных в данном документе, с соответствующим рекомбинантным антигеном или антигенэкспрессирующими клетками может быть оценено с помощью ИФА, как описано в Примере 8 или 11.
В дополнительном аспекте свежие мононуклеарные клетки периферической крови (МКПК) используют в анализах связывания, чтобы показать связывание с различными мононуклеарными клетками периферической крови (МКПК), такими как моноциты, NK-клетки и Т-клетки.
В другом аспекте клеточный димеризационный анализ использовали для демонстрации димеризации или в итоге связывания/взаимодействия двух разных рецепторов PD1 и LAG3, которые слиты в цитозоле с двумя фрагментами фермента, при лигировании или сшивании с биспецифическим антителом против обеих мишеней. Таким образом, только один рецептор не проявляет ферментативную активность. Для этого специфического взаимодействия цитозольные С-концы обоих рецепторов по отдельности были слиты с гетерологичными субъединицами репортерного фермента. Одна только субъединица фермента не проявляла репортерную активность. Однако ожидалось, что одновременное связывание с обоими рецепторами приведет к локальному цитозольному накоплению обоих рецепторов, комплементации двух субъединиц гетерологичного фермента и, наконец, к образованию специфического и функционального фермента, который гидролизует субстрат, тем самым генерируя хемилюминесцентный сигнал (Пример 11).
3. Анализы активности
В одном аспекте предложены анализы для идентификации биспецифического антитела, содержащего первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, обладающим биологической активностью. Биологическая активность может включать, например, способность усиливать активацию и/или пролиферацию различных иммунных клеток, особенно Т-клеток, секрецию иммуномодулирующих цитокинов, таких как ИФНγ или ИФН-альфа, блокирование пути PD1, блокирование пути LAG3, уничтожение опухолевых клеток. Предложены антитела, также обладающие такой биологической активностью in vivo и/или in vitro.
В определенных аспектах антитело согласно изобретению тестируют на такую биологическую активность. В одном аспекте предложен анализ иммунных клеток, который измеряет активацию лимфоцитов от одного индивидуума (донор X) до лимфоцитов от другого индивидуума (донор Y). Реакция смешанной культуры лимфоцитов (РСКЛ) может демонстрировать эффект блокирования пути PD1 к эффекторным клеткам лимфоцитов. Т-клетки в анализе тестировали на активацию и их секрецию ИФН-гамма в присутствии или отсутствии биспецифических антител согласно изобретению. Анализ более подробно описан в Примере 9.
D. Иммуноконъюгаты
Изобретение также обеспечивает иммуноконъюгаты, содержащие биспецифическое антитело согласно изобретению, конъюгированное с одним или более цитотоксическими агентами, такими как химиотерапевтические агенты или лекарственные средства, агенты, ингибирующие рост, токсины (например, белковые токсины, ферментативно активные токсины бактерий, грибков, растений или животных или их фрагменты) или радиоактивные изотопы.
E. Способы и композиции для диагностики и обнаружения
В определенных аспектах любое из биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, представленное в данном документе, может быть полезным для обнаружения в биологическом образце присутствия как PD1, так и LAG3. Используемый в данном документе термин «обнаружение» охватывает количественное или качественное обнаружение. В определенных вариантах осуществления биологический образец включает клетку или ткань, такую как стволовые раковые клетки ОМЛ (острого миелоидного лейкоза).
В одном аспекте предложено биспецифическое антитело для применения в способе диагностики или обнаружения. В дополнительном аспекте предложен способ обнаружения присутствия в биологическом образце как PD1, так и LAG3. В некоторых вариантах осуществления способ включает приведение в контакт биологического образца с биспецифическим антителом, как описано в данном документе, в условиях, допускающих связывание биспецифического антитела как с PD1, так и с LAG3, и выявление того, образуется ли комплекс между биспецифическим антителом и обоими антигенами. Такой способ может представлять собой способ in vitro или in vivo. В одном варианте осуществления биспецифическое антитело используется для отбора субъектов, подходящих для терапии биспецифическим антителом, содержащим первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с антителом LAG3, причем, например, PD1 и LAG3 представляют собой биомаркеры для отбора пациентов.
В определенных аспектах предложены меченые биспецифические антитела. Метки включают, но не ограничиваются ими, метки или фрагменты, которые обнаруживаются напрямую (такие как флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые обнаруживаются опосредованно, например, посредством ферментативной реакции или молекулярного взаимодействия. Типичные метки включают, но не ограничиваются ими, радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люцериферазы, например люцифераза светлячка и бактериальная люцифераза (патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридоксидазы, например глюкозооксидаза, галактозооксидаза и глюкоза-6-фосфатдегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, соединенные с ферментом, который использует перекись водорода для окисления предшественника красителя, та кого как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, метки бактериофага или стабильные свободные радикалы.
F. Фармацевтические композиции, составы и пути введения
В дополнительном аспекте изобретение относится к фармацевтическим композициям, содержащим любое из биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, предлагаемое в данном документе, например, для применения по любому из нижеприведенных терапевтических способов. В одном варианте осуществления фармацевтическая композиция содержит любое из биспецифических антител, предлагаемых в данном документе, и по меньшей мере один фармацевтически приемлемый наполнитель. В другом варианте осуществления фармацевтическая композиция содержит любое из биспецифических антител, предлагаемых в данном документе, и по меньшей мере один дополнительный терапевтический агент, например, как описано ниже.
Фармацевтические композиции по данному изобретению содержат терапевтически эффективное количество одного или более биспецифических антител, растворенных или диспергированных в фармацевтически приемлемом наполнителе. Фразы «фармацевтически или фармакологически приемлемый» относятся к молекулярным веществам и композициям, которые обычно нетоксичны для реципиентов в используемых дозировках и концентрациях, т.е. не вызывают нежелательных, аллергических или других неблагоприятных реакций при введении животному, такому как, например, человек, в зависимости от обстоятельств. Приготовление фармацевтической композиции, которая содержит по меньшей мере одно биспецифическое антитело и, необязательно, дополнительный активный ингредиент, будет известно специалистам в данной области техники в свете данного раскрытия, примером которого является Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, что включено в данный документ посредством ссылки. В частности, композиции представляют собой лиофилизированные составы или водные растворы. Используемый в данном документе термин «фармацевтически приемлемый наполнитель» включает все без исключения растворители, буферы, дисперсионные среды, покрывающие вещества, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, соли, стабилизаторы и их комбинации, как известно специалисту в данной области техники.
Парентеральные композиции включают композиции, предназначенные для введения путем инъекции, например, подкожная, внутрикожная, внутриочаговая, внутривенная, внутриартериальная, внутримышечная, интратекальная или внутрибрюшинная инъекция. Для инъекции биспецифические антитела согласно изобретению могут быть приготовлены в форме водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или физиологический солевой буфер. Раствор может содержать рецептурные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, биспецифические антитела могут быть в форме порошка для разведения перед применением подходящим носителем, например, стерильной апирогенной водой. Стерильные растворы для инъекций получают путем включения слитых белков согласно изобретению в необходимом количестве в соответствующем растворителе с различными другими ингредиентами, перечисленными ниже, по мере необходимости. Стерильность может быть легко достигнута, например, при помощи фильтрации через стерильные фильтрующие мембраны. Обычно дисперсии готовят путем включения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для приготовления стерильных растворов, суспензий или эмульсий для инъекций предпочтительными способами приготовления являются технологии вакуумной сушки или лиофильной сушки, которые дают выход в виде порошка активного ингредиента плюс любой дополнительный желаемый ингредиент из их жидких сред, предварительно подвергнутых стерилизующей фильтрации. Жидкая среда должна быть надлежащим образом забуферена, если необходимо, и жидкий разбавитель сначала должен быть изотоническим перед инъекцией с достаточным количеством физиологического раствора или глюкозы. Композиция должна быть стабильной в условиях производства и хранения, и защищаться от контаминирующего действия микроорганизмов, таких как бактерии и грибы. Понятно, что контаминация эндотоксином должна быть минимальна и поддерживаться на безопасном уровне, например, менее 0,5 нг/мг белка.
Подходящие фармацевтически приемлемые наполнители включают, но не ограничиваются ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Водные инъекционные суспензии могут содержать соединения, которые увеличивают вязкость суспензии, такие как натрий-карбоксиметилцеллюлоза, сорбит, декстран или тому подобное. Необязательно, суспензия также может содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость соединений, что позволяет получать высококонцентрированные растворы. Кроме того, суспензии активных соединений могут быть приготовлены в виде подходящих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеаты или триглицериды, или липосомы.
Активные ингредиенты могут быть заключены в микрокапсулы, приготовленные, например, при помощи способов коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли-(метилметацилата), соответственно, в коллоидных системах доставки лекарств (например, липосомы, альбумин), микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы раскрыты в Remington's Pharmaceutical Sciences (18th Ed. Mack Printing Company, 1990). Могут быть приготовлены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих полипептид, причем эти матрицы находятся в виде формованных изделий, например, пленок или микрокапсул. В конкретных вариантах осуществления пролонгированное всасывание инъецируемой композиции может быть вызвано применением в композициях агентов, замедляющих абсорбцию, таких как, например, моностеарат алюминия, желатин или их комбинации.
Примеры фармацевтически приемлемых наполнителей в данном документе дополнительно включают агенты для диспергирования лекарственных средств, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGP и способы их применения, включая rHuPH20, описаны в патентных публикациях США №2005/0260186 и 2006/0104968. В одном аспекте sHASEGP комбинируют с одним или более дополнительными гликозаминогликаназами, такими как хондроитиназы.
Типичные составы лиофилизированных антител описаны в патенте США №6267958. Водные составы антител включают препараты, описанные в патенте США №6171586 и WO 2006/044908, причем последние составы включают гистидин-ацетатный буфер.
В дополнение к композициям, описанным ранее, биспецифические антитела также могут быть составлены в виде депо-препарата. Такие препараты длительного действия могут вводиться путем имплантации (например, подкожно или внутримышечно) или при помощи внутримышечной инъекции. Так, например, биспецифические антитела могут быть составлены из подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле) или ионообменных смол или в виде труднорастворимых производных, например, в виде труднорастворимой соли.
Фармацевтические композиции, содержащие биспецифические антитела согласно изобретению, могут быть получены с помощью обычных процессов смешивания, растворения, эмульгирования, инкапсуляции, захвата или лиофилизации. Фармацевтические композиции могут быть составлены общепринятым способом с использованием одного или более физиологически приемлемых носителей, разбавителей, наполнителей или вспомогательных веществ, которые облегчают технологию изготовления белков в препараты, которые могут быть использованы фармацевтически. Подходящий состав зависит от выбранного пути введения.
Биспецифические антитела могут быть составлены в композицию в форме свободной кислоты или основания, нейтральной или солевой форме. Фармацевтически приемлемые соли представляют собой соли, которые по существу сохраняют биологическую активность свободной кислоты или основания. Они включают соли присоединения кислоты, например, те, которые образованы свободными аминогруппами белковой композиции, или которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная или миндальная кислота. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа; или таких органических оснований как изопропиламин, триметиламин, гистидин или прокаин. Фармацевтические соли имеют тенденцию быть более растворимыми в водных и других протонных растворителях, чем соответствующие формы свободного основания.
Композиция в данном документе может также содержать более одного активного ингредиента, если это необходимо для конкретного симптома, подлежащего к лечению, предпочтительно тех, которые обладают дополнительными активностями, которые не оказывают негативного влияния друг на друга. Такие активные ингредиенты подходящим образом присутствуют в комбинации в количествах, которые эффективны для предполагаемой цели.
Составы, используемые для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, при помощи фильтрации через стерильные фильтрующие мембраны.
G. Терапевтические способы и композиции
Любое из биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, предлагаемое в данном документе, можно использовать в терапевтических способах.
Для использования в терапевтических способах биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе, могут включать в состав препарата, дозировать и вводить с помощью способов, согласующихся с надлежащей медицинской практикой. Факторы для рассмотрения в этом контексте включают конкретное расстройство, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние отдельного пациента, причину расстройства, место доставки агента, способ введения, график введения и другие факторы, известные врачам.
В одном аспекте предложены биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе, для применения в качестве лекарственного средства. В дополнительных аспектах предложены биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе, для применения при лечении заболевания, в частности, для применения при лечении онкологического заболевания. В некоторых вариантах осуществления предложены биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, для использования в способе лечения. В одном варианте осуществления изобретение относится к биспецифическим антителам, содержащим первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, для применения при лечении заболевания у индивидуума, нуждающегося в этом. В некоторых вариантах осуществления изобретение относится к биспецифическим антителам, содержащим первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, для использования в способе лечения индивидуума, имеющего заболевание, включающем введение индивидууму терапевтически эффективного количества биспецифического антитела. В определенных вариантах осуществления заболевание, подлежащее лечению, представляет собой онкологическое заболевание. В другом аспекте заболевание, подлежащее лечению, представляет собой инфекционное заболевание, в частности хроническую вирусную инфекцию, такую как ВИЧ (вирус иммунодефицита человека), ВГВ (вирус гепатита В), ВГС (гепатит С), ВПГ1 (вирус простого герпеса типа 1), ЦМВ (цитомегаловирус), ВЛХМ (лимфоцитарный вирус хориоменингита) или ВЭБ (вирус Эпштейна-Барр). Субъект, пациент или «индивидуум», нуждающийся в лечении, обычно является млекопитающим, более конкретно человеком.
В дополнительном аспекте изобретение обеспечивает использование биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе ранее, при изготовлении или приготовлении лекарственного средства для лечения заболевания у индивидуума, нуждающегося в этом. В одном варианте осуществления лекарственное средство предназначено для применения в способе лечения заболевания, включающем введение индивидууму, страдающему этим заболеванием, терапевтически эффективного количества лекарственного средства.
В определенных аспектах заболевание, подлежащее лечению, представляет собой пролиферативное расстройство, в частности онкологическое заболевание. Примеры онкологических заболеваний включают рак мочевого пузыря, рак головного мозга, рак головы и шеи, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичников, рак матки, рак шейки матки, рак эндометрия, рак пищевода, рак толстой кишки, колоректальный рак, рак прямой кишки, рак желудка, рак простаты, рак крови, рак кожи, плоскоклеточный рак, рак костей и рак почек. Другие нарушения пролиферации клеток, которые можно лечить с использованием биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3 согласно изобретению, включают, но не ограничиваются этим, новообразования, расположенные в брюшной полости, кости, молочной железе, пищеварительной системе, печени, поджелудочной железе, брюшине, эндокринных железах (надпочечниках, околощитовидной железе, гипофизе, яичках, яичниках, тимусе, щитовидной железе), глазу, голове и шеи, нервной системе (центральной и периферической), лимфатической системе, тазу, коже, мягких тканях, селезенке, грудной области и мочеполовой системе. Также включены предраковые состояния или поражения и метастазы злокачественных новообразований. В определенных аспектах злокачественное новообразование выбирают из группы, состоящей из почечно-клеточного рака, рака кожи, рака легких, колоректального рака, рака молочной железы, рака головного мозга, рака головы и шеи. В дополнительных аспектах злокачественное новообразование выбирают из карциномы, лимфомы (например, лимфомы Ходжкина и неходжкинской лимфомы), бластомы, саркомы и лейкоза. В другом аспекте злокачественное новообразование, подлежащее лечению, выбирают из плоскоклеточного рака, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, плоскоклеточного рака легкого, рака брюшины, гепатоцеллюлярного рака, рака желудочно-кишечного тракта, рака поджелудочной железы, глиомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, колоректального рака, рака эндометрия или матки, рака слюнной железы, рака почки, рака печени, рака простаты, рака вульвы, рака щитовидной железы, рака печени, лейкоза и других лимфопролиферативных заболеваний, а также различных видов рака головы и шеи.
В дополнительном аспекте заболевание, подлежащее лечению, представляет собой инфекционное заболевание, в частности хроническую вирусную инфекцию. Термин «хроническая вирусная инфекция» относится к субъекту, пораженному или инфицированному хроническим вирусом. Примерами хронических вирусных инфекций являются вирус иммунодефицита человека (ВИЧ), вирусная инфекция гепатита В (ВГВ), вирусная инфекция гепатита С (ВГС), вирус простого герпеса 1 (ВПГ1), цитомегаловирус (ЦМВ), вирус лимфоцитарного хориоменингита (ВЛХМ) или вирус Эпштейна-Барр (ВЭБ).
Специалист в данной области техники легко признает, что во многих случаях биспецифическая молекула может не обеспечивать излечение, а может давать только частичную пользу. В некоторых вариантах осуществления физиологические изменения, имеющие определенную пользу, также считаются терапевтически полезными. Таким образом, в некоторых вариантах осуществления количество биспецифического антитела, которое обеспечивает изменение физиологического состояния, считается «эффективным количеством» или «терапевтически эффективным количеством».
В дополнительном аспекте изобретение относится к способу лечения заболевания у индивидуума, включающему введение указанному индивидууму терапевтически эффективного количества биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается к LAG3 согласно изобретению. В одном варианте осуществления указанному индивидууму вводят композицию, содержащую биспецифическое антитело согласно изобретению в фармацевтически приемлемой форме. В определенных вариантах осуществления заболевание, подлежащее лечению, представляет собой пролиферативное расстройство. В конкретном варианте осуществления заболевание представляет собой онкологическое заболевание. В некоторых вариантах осуществления способ дополнительно включает введение индивидууму терапевтически эффективного количества по меньшей мере одного дополнительного терапевтического агента, например противоракового средства, если заболевание, подлежащее лечению, представляет собой онкологическое заболевание. В другом аспекте заболевание представляет собой хроническую вирусную инфекцию. «Индивидуум» в соответствии с любым из вышеуказанных вариантов осуществления может быть млекопитающим, предпочтительно человеком.
Для предотвращения или лечения заболевания подходящая доза биспецифических антител, содержащих первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3 согласно изобретению (при использовании отдельно или в комбинации с одним или другими дополнительными терапевтическими агентами) будет зависеть от типа заболевания, подлежащего лечению, пути введения, массы тела пациента, типа слитого белка, тяжести и течения заболевания, от того, вводится ли биспецифическое антитело для профилактических или терапевтических целей, предыдущих или одновременных терапевтических вмешательств, истории болезни пациента и реакции на слитый белок, а также усмотрения лечащего врача. В любом случае, специалист, ответственный за введение, будет определять концентрацию активного(ых) ингредиента(ов) в композиции и соответствующую(ие) дозу(ы) для конкретного субъекта. В данном документе рассматриваются различные схемы применения препарата, включая, но не ограничиваясь, однократное или многократное введение в различные моменты времени, болюсное введение и импульсная инфузия.
Биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе, подходящим образом вводят пациенту за один раз или в течение серии процедур. В зависимости от типа и тяжести заболевания от приблизительно 1 мкг/кг до 15 мг/кг (например, от 0,1 мг/кг до 10 мг/кг) биспецифического антитела может быть начальной потенциальной дозой для введения пациенту, будь то, например, одним или более отдельными введениями или непрерывной инфузией. Одна типичная суточная доза может варьироваться от около 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких суток или дольше, в зависимости от состояния, лечение обычно будет продолжаться до тех пор, пока не произойдет желаемое подавление симптомов заболевания. Одна типичная доза биспецифического антитела должна находиться в диапазоне от около 0,005 мг/кг до около 10 мг/кг. В других примерах доза также может составлять от около 1 мкг/кг массы тела, около 5 мкг/кг массы тела, около 10 мкг/кг массы тела, около 50 мкг/кг массы тела, около 100 мкг/кг массы тела, около 200 мкг/кг массы тела, около 350 мкг/кг массы тела, около 500 мкг/кг массы тела, около 1 мг/кг массы тела, около 5 мг/кг массы тела, около 10 мг/кг массы тела, около 50 мг/кг массы тела, около 100 мг/кг массы тела, около 200 мг/кг массы тела, около 350 мг/кг массы тела, около 500 мг/кг массы тела, до около 1000 мг/кг массы тела или более на введение и любой диапазон, выведенный из описанного выше. В примерах производного диапазона из чисел, перечисленных в данном документе, диапазон от около 5 мг/кг массы тела до около 100 мг/кг массы тела, от около 5 мкг/кг массы тела до около 500 мг/кг массы тела и т.д., можно вводить, основываясь на числах, описанных выше. Таким образом, пациенту может быть введена одна или более доз около 0,5 мг/кг, 2,0 мг/кг, 5,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы могут вводить периодически, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от около двух до около двадцати или, например, около шести доз слитого белка). Может быть назначена изначально более высокая нагрузочная доза, за которой следует одна или несколько более низких доз. Тем не менее, могут быть полезны другие схемы лечения. Прогресс этой терапии легко контролировать с помощью традиционных способов и анализов.
Биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе, обычно используются в количестве, эффективном для достижения поставленной цели. Для применения в лечении или предотвращении болезненного состояния биспецифические антитела согласно изобретению или их фармацевтические композиции вводят или применяют в терапевтически эффективном количестве. Определение терапевтически эффективного количества находится в пределах возможностей специалистов в данной области техники, особенно в свете подробного описания, представленного в данном документе.
Для системного введения терапевтически эффективная доза может быть первоначально оценена из анализов in vitro, таких как анализы клеточных культур. Затем на животных моделях можно рассчитать дозу для достижения диапазона концентраций в кровотоке, который включает IC50, как определено в культуре клеток. Такая информация может быть использована для более точного определения полезных доз у человека.
Начальные дозы также могут быть оценены по данным in vivo, например, на животных моделях, с использованием методик, которые хорошо известны в данной области техники. Специалист в данной области техники может легко оптимизировать введение людям на основе данных, полученных из исследований на животных.
Количество и интервал дозировки можно регулировать индивидуально, чтобы обеспечить уровни биспецифического антитела в плазме, которые являются достаточными для поддержания терапевтического эффекта. Обычные дозы для пациентов для введения путем инъекции составляют от около 0,1 до 50 мг/кг/сутки, обычно от около 0,5 до 1 мг/кг/сутки. Терапевтически эффективные уровни в плазме могут быть достигнуты путем введения нескольких доз каждые сутки. Уровни в плазме могут быть измерены, например, с помощью ВЭЖХ.
В случаях местного введения или селективного поглощения эффективная локальная концентрация биспецифического антитела может не быть связана с концентрацией в плазме. Специалист в данной области техники сможет оптимизировать терапевтически эффективные местные дозы без чрезмерного экспериментирования.
Терапевтически эффективная доза биспецифических антител, описанных в данном документе, обычно обеспечивает терапевтическую пользу, не вызывая существенной токсичности. Токсичность и терапевтическая эффективность слитого белка могут быть определены стандартными фармацевтическими процедурами на клеточной культуре или экспериментальных животных. Анализы клеточных культур и исследования на животных можно использовать для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная в 50% популяции). Соотношение доз между токсическим и терапевтическим эффектами представляет собой терапевтический индекс, который может быть выражен как соотношение LD50/ED50. Биспецифические антитела, которые проявляют большие терапевтические показатели, являются предпочтительными. В одном варианте осуществления биспецифическое антитело согласно данному изобретению проявляет высокий терапевтический индекс. Данные, полученные из анализов клеточных культур и исследований на животных, могут быть использованы при составлении диапазона доз, подходящих для применения у людей. Доза предпочтительно находится в диапазоне концентраций в кровотоке, которые включают ED50 с минимальной токсичностью или без нее. Доза может варьироваться в этом диапазоне в зависимости от множества факторов, например, используемой лекарственной формы, используемого способа введения, состояния субъекта и тому подобного. Точный состав, способ введения и доза могут быть выбраны отдельным врачом с учетом состояния пациента (см., например, Fingl et al., 1975, in: The Pharmacological Basis of Therapeutics, Ch. 1, p. 1, включенный в данный документ посредством ссылки во всей своей полноте).
Лечащий врач пациентов, которых лечат биспецифическими антителами согласно изобретению, знает, как и когда прекратить, прервать или скорректировать введение из-за токсичности, дисфункции органов и тому подобного. И наоборот, лечащий врач также знал бы, как скорректировать лечение до более высоких уровней, если клинический ответ не был достаточным (исключая токсичность). Величина введенной дозы при лечении представляющего интерес расстройства будет варьироваться в зависимости от тяжести патологического состояния, подлежащего лечению, от пути введения и тому подобного. Тяжесть патологического состояния может, например, оцениваться частично при помощи стандартных способов оценки для прогнозирования. Кроме того, доза и, возможно, частота дозы также будут варьироваться в зависимости от возраста, массы тела и ответа отдельного пациента.
Другие агенты и способы лечения
Биспецифические антитела, содержащие первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе ранее, могут вводиться в комбинации с одним или более другими агентами в терапии. Например, биспецифическое антитело согласно изобретению можно вводить по меньшей мере с одним дополнительным терапевтическим агентом. Термин «терапевтический агент» охватывает любой агент, который можно вводить для лечения симптома или заболевания у индивидуума, нуждающегося в таком лечении. Такой дополнительный терапевтический агент может содержать любые активные ингредиенты, подходящие для конкретного показания, подвергаемого лечению, предпочтительно те, которые обладают комплементарными активностями, которые не оказывают вредного влияния друг на друга. В определенных вариантах осуществления дополнительный терапевтический агент представляет собой другой противораковый агент.
В одном аспекте изобретения биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, которое специфически связывается с LAG3, как описано в данном документе, или фармацевтическая композиция, содержащая указанное биспецифическое антитело, предназначены для применения в профилактике или лечении онкологического заболевания, при этом биспецифическое антитело вводят в комбинации с химиотерапевтическим агентом, облучением и/или другими агентами для применения при иммунотерапии онкологического заболевания.
В конкретном аспекте изобретения биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, которое специфически связывается с LAG3, как описано в данном документе, или фармацевтическая композиция, содержащая указанное биспецифическое антитело, предназначены для применения в профилактике или лечении онкологического заболевания, при котором биспецифическое антитело вводят в комбинации с активирующим Т-клетки анти-CD3 биспецифическим антителом, в частности, анти-СЕА/анти-CD3 биспецифическим антителом. В одном аспекте анти-СЕА/анти-CD3 биспецифическое антитело представляет собой активирующее Т-клетки анти-CD3 биспецифическое антитело, содержащее второй антигенсвязывающий домен, содержащий (а) вариабельную область тяжелой цепи (VHCEA), содержащую последовательность CDR-H1 SEQ ID NO: 154, последовательность CDR-H2 SEQ ID NO: 155 и последовательность CDR-H3 SEQ ID NO: 156, и/или вариабельную область легкой цепи (VLCEA), содержащую последовательность CDR-L1 SEQ ID NO: 157, последовательность CDR-L2 SEQ ID NO: 158 и последовательность CDR-L3 SEQ ID NO: 159, или (b) вариабельную область тяжелой цепи (VHCEA), содержащую последовательность CDR-H1 SEQ ID NO: 162, последовательность CDR-H2 SEQ ID NO: 163 и последовательность CDR-Н3 SEQ ID NO: 164, и/или вариабельную область легкой цепи (VLCEA), содержащую последовательность CDR-L1 SEQ ID NO: 165, последовательность CDR-L2 SEQ ID NO: 166 и последовательность CDR-L3 SEQ ID NO: 167. В одном аспекте анти-СЕА/анти-CD3 биспецифическое антитело представляет собой активирующее Т-клетки анти-CD3 биспецифическое антитело, содержащее вариабельную область тяжелой цепи (VHCEA), содержащую аминокислотную последовательность SEQ ID NO: 160, и/или вариабельную область легкой цепи (VLCEA), содержащую аминокислотную последовательность SEQ ID NO: 161, или второй антигенсвязывающий домен, содержащий вариабельную область тяжелой цепи (VHCEA), содержащую аминокислотную последовательность SEQ ID NO: 168, и/или вариабельная область легкой цепи (VLCEA), содержащую аминокислотную последовательность SEQ ID NO: 169.
В дополнительном аспекте анти-СЕА/анти-CD3 биспецифическое антитело содержит Fc-домен, содержащий одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию. В частности, анти-СЕА/анти-CD3 биспецифическое антитело содержит Fc-домен IgG1, содержащий аминокислотные замены L234A, L235A и P329G.
В конкретном аспекте анти-СЕА/анти-CD3 биспецифическое антитело содержит полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 146, полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 147, полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 148, и полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 149. В дополнительном конкретном варианте осуществления биспецифическое антитело содержит полипептидную последовательность SEQ ID NO: 146, полипептидную последовательность SEQ ID NO: 147, полипептидную последовательность SEQ ID NO: 148 и полипептидную последовательность SEQ ID NO: 149 (СЕА CD3 ТСВ).
В дополнительном аспекте анти-СЕА/анти-СОЗ биспецифическое антитело содержит полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 150, полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 151, полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 152, и полипептид, который по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичен последовательности SEQ ID NO: 153. В дополнительном конкретном варианте осуществления биспецифическое антитело содержит полипептидную последовательность SEQ ID NO: 150, полипептидную последовательность SEQ ID NO: 151, полипептидную последовательность SEQ ID NO: 152 и полипептидную последовательность SEQ ID NO: 153 (СЕАСАМ5 CD3 ТСВ).
В другом аспекте предложена фармацевтическая композиция, содержащая биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как описано в данном документе, и активирующее Т-клетки анти-СОЗ биспецифическое антитело, в частности, анти-СЕА/анти-СОЗ биспецифическое антитело. В конкретном аспекте фармацевтическая композиция предназначена для применения в комбинированном, последовательном или одновременном лечении заболевания, в частности, для лечения онкологического заболевания. Более конкретно, композиция предназначена для применения при лечении солидных опухолей.
В другом аспекте изобретение обеспечивает способ лечения или задержки прогрессирования злокачественного заболевания у индивидуума, включающий введение субъекту эффективного количества биспецифического антитела, содержащего первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается к LAG3, как описано в данном документе, в комбинации с активирующим Т-клетки анти-CD3 биспецифическим антителом, в частности, анти-СЕА/анти-CD3 биспецифическим антителом или анти-FolR1/анти-CD3 биспецифическим антителом.
Такие другие агенты подходящим образом присутствуют в комбинации в количествах, которые эффективны для предполагаемой цели. Эффективное количество таких других агентов зависит от количества используемого слитого белка, типа расстройства или лечения и других факторов, обсуждаемых выше. Биспецифические антитела обычно используются в тех же дозах и такими же способами введения, как описано в данном документе, или примерно от 1 до 99% доз, описанных в данном документе, или в любой дозе и любым способом, который эмпирически/клинически определен как подходящий.
Такие виды комбинированной терапии, отмеченные выше, включают комбинированное введение (где два или более терапевтических агента включены в одну и ту же или отдельные композиции) и раздельное введение, и в этом случае введение биспецифического антитела может происходить до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта.
Н. Продукты производства
В другом аспекте изобретения предложен продукт производства, содержащий вещества, полезные для лечения, профилактики и/или диагностики расстройств, описанных выше. Продукт производства содержит контейнер и этикетку или листок-вкладыш на контейнере или связан с ним. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты для внутривенного введения и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе или объединена с другой композицией, эффективной для лечения, предотвращения и/или диагностики патологического состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон с пробкой, которая прокалывается иглой для подкожных инъекций). По меньшей мере один активный агент в композиции представляет собой биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, как определено в данном документе ранее.
На этикетке или листке-вкладыше в упаковке указано то, что композиция используется для лечения выбранного патологического состояния. Кроме того, продукт производства может содержать (а) первый контейнер с содержащейся в нем композицией, причем композиция содержит биспецифическое антитело согласно изобретению; и (b) второй контейнер с содержащейся в нем композицией, причем композиция содержит дополнительный цитотоксический или иной терапевтический агент. Продукт производства в данном варианте осуществления изобретения может дополнительно содержать листок-вкладыш в упаковку, указывающий, что композиции можно использовать для лечения определенного патологического состояния.
Альтернативно или дополнительно, продукт производства может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (БВДИ), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Дополнительно могут быть включены другие вещества, желательные с коммерческой и потребительской точки зрения, включая другие буферы, растворители, фильтры, иглы и шприцы.




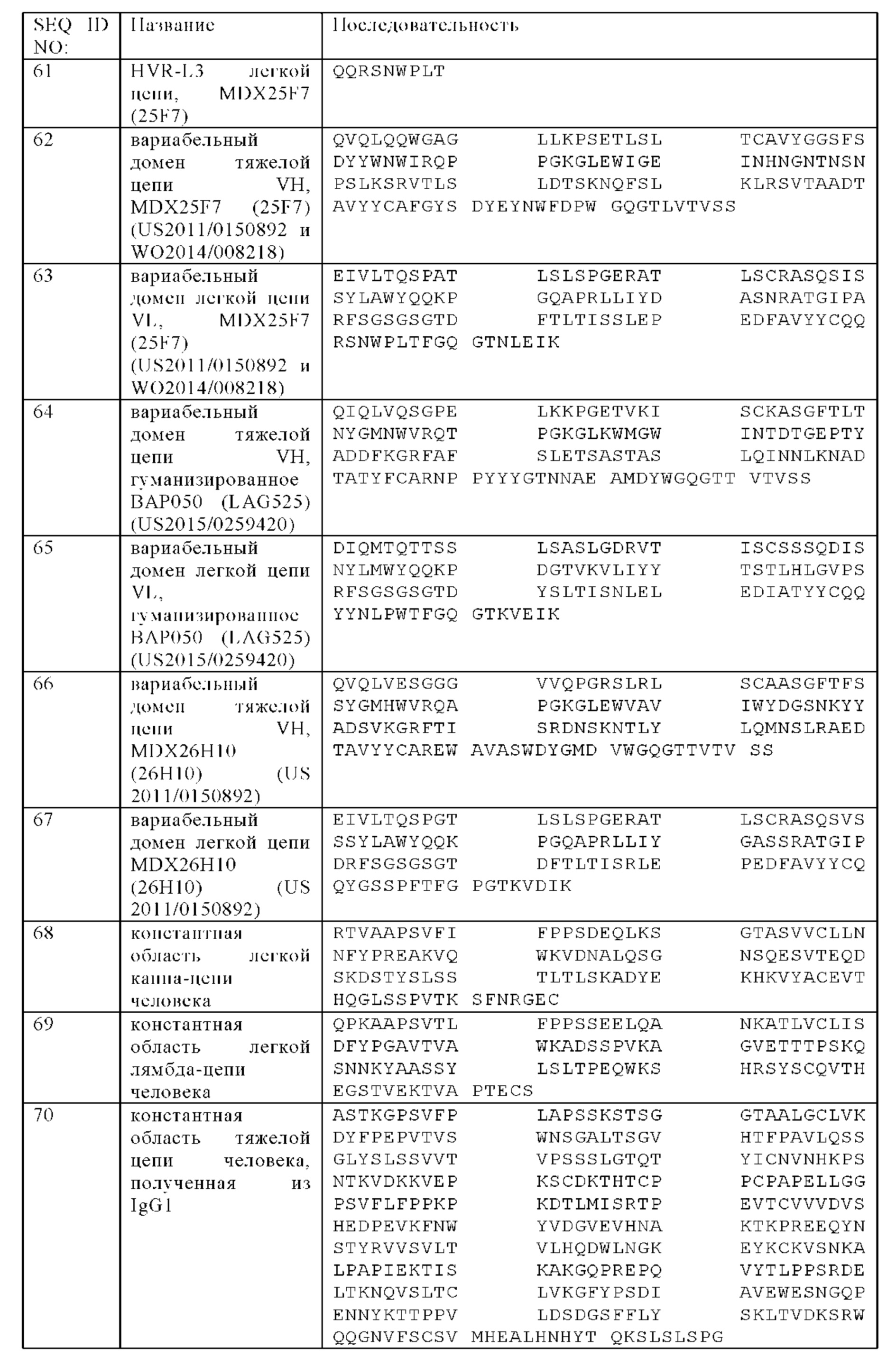













Следующие пронумерованные абзацы (пункты) описывают аспекты данного изобретения:
1. Биспецифическое антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с белком запрограммированной гибели клеток 1 (PD1), и второй антигенсвязывающий домен, который специфически связывается с геном активации лимфоцитов-3 (LAG3), причем
указанный первый антигенсвязывающий домен, специфически
связывающийся с PD1, содержит:
домен VH, содержащий:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4;
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
2. Биспецифическое антитело по п. 1, отличающееся тем, что биспецифическое антитело содержит Fc-домен, который представляет собой Fc-домен IgG, в частности, Fc-домен IgG1 или Fc-домен IgG4, и при этом Fc-домен содержит одну или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором, в частности с Fcγ-рецептором.
3. Биспецифическое антитело по п. 1 или п. 2, отличающееся тем, что второй антигенсвязывающий домен, который специфически связывается с LAG3, содержит
(a) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 14,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 15, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 16; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 19; или
(b) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 22,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 23, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 24; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 25,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 26, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 27; или
(c) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 30,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 31, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 32; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 33,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 34, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 35; или
(d) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 38,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 39, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 40; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 41,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 42, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 43; или
(е) домен VH, содержащий
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 46,
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 47, и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 48; и
домен VL, содержащий:
(i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 49,
(ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 50, и
(iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 51.
4. Биспецифическое антитело по любому из пп. 1-3, отличающееся тем, что первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит:
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 7, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 8, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 11, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 12, или
(е) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 13.
5. Биспецифическое антитело по любому из пп. 1-4, отличающееся тем, что второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 28, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 29, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 36, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 37, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 44, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 45, или
(e) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
6. Биспецифическое антитело по любому из пп. 1-4, отличающееся тем, что второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит
(a) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 54, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 55, или
(b) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 62, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 63, или
(c) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 64, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 65, или
(d) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 66, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 67.
7. Биспецифическое антитело по любому из пп. 1-5, отличающееся тем, что
первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит: домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, или домен VH, содержащий аминокислотную последовательность SEQ ID NO: 52, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 53.
8. Биспецифическое антитело по любому из пп. 1-5, отличающееся тем, что
первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит: домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 20, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21.
9. Биспецифическое антитело по любому из пп. 1-4 или 6, отличающееся тем, что
первый антигенсвязывающий домен, специфически связывающийся с PD1, содержит: домен VH, содержащий аминокислотную последовательность SEQ ID NO: 9, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 10,
и второй антигенсвязывающий домен, специфически связывающийся с LAG3, содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 56, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 57.
10. Биспецифическое антитело по любому из пп. 1-5, отличающееся тем, что биспецифическое антитело представляет собой гуманизированное или химерное антитело.
11. Биспецифическое антитело по любому из пп. 1-10, отличающееся тем, что биспецифическое антитело содержит Fc-домен подкласса IgG1 человека с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Кабату).
12. Биспецифическое антитело по любому из пп. 1-11, отличающееся тем, что биспецифическое антитело содержит Fc-домен, содержащий модификацию, способствующую ассоциации первой и второй субъединиц Fc-домена.
13. Биспецифическое антитело по любому из пп. 1-12, отличающееся тем, что первая субъединица Fc-домена содержит выступы, а вторая субъединица Fc-домена содержит отверстия в соответствии со способом «выступы-в-отверстия».
14. Биспецифическое антитело по любому из пп. 1-13, отличающееся тем, что первая субъединица Fc-домена содержит аминокислотные замены S354C и T366W (нумерация EU), а вторая субъединица Fc-домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно индексу EU по Кабату).
15. Биспецифическое антитело по любому из пп. 1-14, отличающееся тем, что биспецифическое антитело содержит Fc-домен, первый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, и второй Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3.
16. Биспецифическое антитело по любому из пп. 1-15, отличающееся тем, что в одном из Fab-фрагментов вариабельные домены VL и VH заменены друг на друга, так что домен VH является частью легкой цепи, а домен VL является частью тяжелой цепи.
17. Биспецифическое антитело по пп. 15 или 16, отличающееся тем, что в первом Fab-фрагменте, содержащем антигенсвязывающий домен, который специфически связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
18. Биспецифическое антитело по любому из пп. 1-17, отличающееся тем, что биспецифическое антитело содержит Fab-фрагмент, при этом в константном домене CL аминокислота в положении 124 независимо замещена лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно индексу EU по Кабату), а в константном домене СН1 аминокислоты в положениях 147 и 213 независимо замещены глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату).
19. Биспецифическое антитело по любому из пп. 15-18, отличающееся тем, что во втором Fab-фрагменте содержится антигенсвязывающий домен, который специфически связывается с LAG3, в константном домене CL аминокислоту в положении 124 независимо замещают лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно индексу EU по Кабату), а в константном домене СН1 аминокислоты в положениях 147 и 213 независимо замещают глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Кабату).
20. Биспецифическое антитело по любому из пп. 1-19, содержащее
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 97, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 96, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 98, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 100, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 102, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 104, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105 или
(d) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 106, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 107, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
21. Биспецифическое антитело по любому из пп. 1-19, отличающееся тем, что биспецифическое антитело содержит третий Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с LAG3.
22. Биспецифическое антитело по любому из пп. 1-19 или 21, отличающееся тем, что два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, являются идентичными.
23. Биспецифическое антитело по любому из пп. 1-19 или 21, или 22, отличающееся тем, что Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей.
24. Биспецифическое антитело по любому из пп. 1-19 или 21-23, содержащее
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 118, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 119, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 120, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 121, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(с) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 122, первую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
25. Биспецифическое антитело по любому из пп. 1-19 или 21-23, отличающееся тем, что биспецифическое антитело содержит четвертый Fab-фрагмент, содержащий антигенсвязывающий домен, который специфически связывается cPD1.
26. Биспецифическое антитело по любому из пп. 1-19 или 21-23, или 25, отличающееся тем, что два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с PD1, являются идентичными.
27. Биспецифическое антитело по любому из пп. 1-19, или 21-23, или 25, или 26, отличающееся тем, что каждый из двух Fab-фрагментов содержит антигенсвязывающий домен, который специфически связывается с PD1, и при этом каждый слит через пептидный линкер с С-концом одной из тяжелых цепей, соответственно.
28. Биспецифическое антитело по любому из пп. 1-19 или 21-23, или 25-27, содержащее
(а) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 114, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 116, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115, и две вторые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(c) две тяжелые цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 117, две первые легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 115 и две вторые легкие цепи, содержащие аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
29. Биспецифическое антитело по любому из пп. 1-14, отличающееся тем, что биспецифическое антитело содержит Fc-домен, два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, и одноцепочечный Fab (scFab), содержащий антигенсвязывающий домен, который специфически связывается с PD1.
30. Биспецифическое антитело по любому из пп. 1-14 или 29, отличающееся тем, что scFab, содержащий антигенсвязывающий домен, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей.
31. Биспецифическое антитело по любому из пп. 1-14, или 29, или 30, содержащее
(a) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 123, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 119, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 101, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 124, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 121, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 99, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 125, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 103, и вторую легкую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 105.
32. Биспецифическое антитело по любому из пп. 1-14, отличающееся тем, что биспецифическое антитело содержит Fc-домен, два Fab-фрагмента, каждый из которых содержит антигенсвязывающий домен, который специфически связывается с LAG3, и домен VH и VL, содержащий антигенсвязывающий домен, который специфически связывается с PD1.
33. Биспецифическое антитело по любому из пп. 1-14 или 32, отличающееся тем, что домен VH антигенсвязывающего домена, который специфически связывается с PD1, слит через пептидный линкер с С-концом одной из тяжелых цепей, и домен VL антигенсвязывающего домена, который специфически связывается с PD1, слит через пептидный линкер с С-концом другой тяжелой цепи.
34. Биспецифическое антитело по любому из пп. 1-14, или 32, или 33, содержащее первую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 126, вторую тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 127, и две легкие цепи, каждая из которых содержит аминокислотную последовательность по меньшей мере с 95% идентичностью к последовательности SEQ ID NO: 109.
35. Полинуклеотид, кодирующий биспецифическое антитело по любому из пп. 1-34.
36. Вектор, в частности, вектор экспрессии, содержащий полинуклеотид по п. 35.
37. Прокариотическая или эукариотическая клетка-хозяин, содержащая полинуклеотид по п. 35 или вектор по п. 36.
38. Способ получения биспецифического антитела по пп. 1-34, включающий культивирование клетки-хозяина по п. 37 в условиях, подходящих для экспрессии биспецифического антитела, и выделение биспецифического антитела из культуры.
39. Фармацевтическая композиция, содержащая биспецифическое антитело по любому из пп. 1-34 и по меньшей мере один фармацевтически приемлемый наполнитель.
40. Биспецифическое антитело по любому из пп. 1-34 или фармацевтическая композиция по п. 39 для применения в качестве лекарственного средства.
41. Биспецифическое антитело по любому из пп. 1-34 или фармацевтическая композиция по п. 39 для применения
i) при модуляции иммунных ответов, таких как восстановление активности Т-клеток,
ii) при стимуляции Т-клеточного ответа,
iii) при лечении инфекций,
iv) при лечении онкологического заболевания,
v) для задержки прогрессирования онкологического заболевания,
vi) в продлении жизни пациента, страдающего онкологическим заболеванием.
42. Биспецифическое антитело по любому из пп. 1-34 или фармацевтическая композиция по п. 39 для применения в профилактике или лечении онкологического заболевания.
43. Биспецифическое антитело по любому из пп. 1-34 или фармацевтическая композиция по п. 39 для применения в профилактике или лечении хронической вирусной инфекции.
44. Биспецифическое антитело по любому из пп. 1-34 или фармацевтическая композиция по п. 39 для применения в профилактике или лечении онкологического заболевания, отличающиеся тем, что биспецифическое антитело вводят в комбинации с химиотерапевтическим агентом, облучением и/или другими агентами для применения в иммунотерапии онкологического заболевания.
45. Способ ингибирования роста опухолевых клеток у индивидуума, включающий введение индивидууму эффективного количества биспецифического антитела по любому из пп. 1-34 для ингибирования роста опухолевых клеток.
ПРИМЕРЫ
Ниже приведены примеры способов и композиций согласно изобретению. Понятно, что различные другие варианты осуществления могут быть осуществлены на практике, учитывая общее описание, приведенное выше.
Материалы и общие способы
Общая информация о нуклеотидных последовательностях легких и тяжелых цепей иммуноглобулинов человека приведена в: Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991). Аминокислоты цепей антител пронумерованы и обозначены в соответствии с системами нумерации по Кабату (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)), как определено выше.
Технологии рекомбинантной ДНК
Для выполнения действия с ДНК использовали стандартные способы, как описано в Sambrook, J. et al., Molecular Cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реагенты использовали в соответствии с инструкциями производителя.
Синтез генов
Необходимые генные сегменты получали из олигонуклеотидов, полученных при помощи химического синтеза. Генные сегменты длиной 600-1800 п.н., которые были фланкированы единичными сайтами расщепления эндонуклеазой рестрикции, были собраны путем отжига и лигирования олигонуклеотидов, включая амплификацию ПНР, и впоследствии клонированы через указанные сайты рестрикции, например, KpnI/SacI или AscI/PacI в клонирующий вектор pGA4 на основе pPCRScript (Stratagene). Последовательности ДНК субклонированных фрагментов гена подтверждали при помощи секвенирования ДНК. Фрагменты для генного синтеза заказывали в соответствии с приведенными описаниями в Geneart (Регенсбург, Германия).
Определение последовательности ДНК
Последовательности ДНК определяли путем секвенирования двухцепочечной ДНК, проводимого в MediGenomix GmbH (Мартинсрид, Германия) или Sequiserve GmbH (Фатерштеттен, Германия).
Анализ последовательности ДНК и белка и управление данными последовательности
Пакет программного обеспечения GCG (Genetics Computer Group, г. Мэдисон, штат Висконсин) версии 10.2 и пакет Infomax Vector NT1 Advance suite версии 8.0 использовали для создания последовательностей, картирования, анализа, аннотации и иллюстрации.
Векторы экспрессии
Для экспрессии описанных антител были применены варианты плазмид экспрессии для транзиентной экспрессии (например, в HEK293) в клетках, основанных или на организации кДНК с промотором ЦМВ-интрон А или без него, или на геномной организации с промотором ЦМВ.
Помимо кассеты экспрессии антител векторы содержали:
- точку начала репликации, которая обеспечивает репликацию этой плазмиды в E.coli, и
- ген β-лактамазы, который придает устойчивость к ампициллину в Е. coli.
Транскрипционная единица гена антитела состояла из следующих элементов:
- уникальный(ые) сайт(ы) рестрикции на 5'-конце
- немедленно-ранний энхансер и промотор из цитомегаловируса человека,
- с последующей последовательностью интрона А в случае организации кДНК,
- 5'-нетранслируемая область гена антитела человека,
- сигнальная последовательность тяжелой цепи иммуноглобулина,
- цепь человеческого антитела (дикого типа или с обменом доменов) или в виде кДНК, или в виде геномной организации с экзон-интронной организацией иммуноглобулина
- 3'-нетранслируемая область с сигнальной последовательностью полиаденилирования, и
- уникальный(ые) сайт(ы) рестрикции на 3'-конце.
Слитые гены, содержащие цепи антител, как описано ниже, генерировали с помощью ПЦР и/или синтеза генов и собирали известными рекомбинантными способами и методиками путем соединения соответствующих сегментов нуклеиновой кислоты, например, используя уникальные сайты рестрикции в соответствующих векторах. Субклонированные последовательности нуклеиновых кислот были проверены при помощи секвенирования ДНК. Для транзиентных трансфекций большие количества плазмид получали путем изготовления препаратов плазмиды из трансформированных культур Е. coli (Nucleobond АХ, Macherey-Nagel).
Методы культивирования клеток
Использовали стандартные методы культивирования клеток, как описано в Current Protocols in Cell Biology (2000), Bonifacino, J.S., Dasso, M., Harford, J.В., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.
Мультиспецифические антитела экспрессировали путем временной транзиентной котрансфекции соответствующих плазмид экспрессии в адгезивно растущих HEK293-EBNA или в клетках HEK29-F, растущих в суспензии, как описано ниже.
Транзиентные трансфекции в системе HEK293
Все антитела и биспецифические антитела были получены путем транзиентной трансфекции клеток 293F с использованием системы Freestyle (ThermoFisher). В ней клетки 293F культивировали в среде F17, трансфицировали 293Free (Novagene) и через 4 часа подпитывали 4 мМ VPA и ингредиентом Feed 7 и 0,6% глюкозой через 16 часов. Кроме того, был использован набор для системы экспрессии Expi293F™ Expression System Kit (ThermoFisher). В ней клетки Expi293F™ культивировали в среде для экспрессии Expi293™ и трансфицировали с использованием набора для трансфекции ExpiFectamine™ 293 в соответствии с инструкциями производителя. Из-за улучшенной стабильности и чистоты и уменьшенной тенденции к агрегации биспецифических антител CrossMAbVh-VL с дополнительно введенными заряженными парами аминокислот на поверхности раздела CH1/CL (см. положения в соответствующих последовательностях для получения дополнительной информации) никаких изменений соотношения плазмид не применяли. Поэтому относительное соотношение плазмид 1:1:1:1 для 1+1 CrossMab или 1:1:1 для 2+2 CrossMab использовали для совместной трансфекции плазмид с LC, НС, кроссоверными LC и кроссоверными НС. Клеточные супернатанты собирали через 7 суток и очищали при помощи стандартных способов.
Определение белка
Концентрацию белка в очищенных антителах и производных определяли путем определения оптической плотности (ОП) при 280 нм, используя молярный коэффициент экстинкции, рассчитанный на основе аминокислотной последовательности в соответствии с Расе, et al., Protein Science, 1995, 4, 2411-1423.
Определение концентрации антител в супернатантах
Концентрацию антител и производных в супернатантах клеточных культур оценивали при помощи иммунопреципитации с использованием гранул агарозы с белком A (Roche). 60 мкл агарозных гранул с белком А промывают три раза в TBS-NP40 (50 мМ Трис, рН 7,5, 150 мМ NaCI, 1% Нонидет-Р40). Затем 1-15 мл супернатанта клеточной культуры наносят на агарозные гранулы с белком А, предварительно уравновешенные в TBS-NP40. После инкубации в течение 1 ч при комнатной температуре гранулы промывают на фильтрационной колонке Ultrafree-MC (Amicon) один раз 0,5 мл TBS-NP40, дважды 0,5 мл 2 х фосфатно-солевого буфера (2 × ФСБ, Roche) и кратковременно четыре раза 0,5 мл 100 мМ Na-цитратом рН 5,0. Связанное антитело элюируют добавлением 35 мкл буфера для образцов NuPAGE® LDS (Invitrogen). Половину образца объединяют с восстанавливающим агентом для образца NuPAGE® или оставляют невосстановленным, соответственно, и нагревают в течение 10 мин при 70°С. Затем 5-30 мкл наносят на 4-12% Бис-Трис ДСН-ПААГ NuPAGE® (Invitrogen) (с буфером MOPS для ДСН-ПААГ-электрофореза в невосстанавливающих условиях и с буфером MES с антиоксидантной добавкой для прогоночного буфера NuPAGE® (Invitrogen) для электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ) в восстанавливающих условиях) и окрашивают Кумасси синим.
Концентрацию антител и производных в супернатантах клеточных культур количественно измеряли при помощи аффинной ВЭЖХ хроматографии. Вкратце, супернатанты клеточных культур, содержащие антитела и производные, которые связываются с белком А, наносили на колонку Applied Biosystems Poros А/20 в 200 мМ KH2PO4, 100 мМ цитрата натрия, рН 7,4 и элюировали из матрицы с использованием 200 мМ NaCl, 100 мМ лимонной кислоты, рН 2,5 в системе Agilent HPLC 1100. Элюированный белок определяли количественно по поглощению в УФ-спектре и интеграции площадей пиков. Очищенное стандартное IgG1-антитело служило в качестве стандарта.
Альтернативно, концентрацию антител и производных в супернатантах клеточной культуры измеряли с помощью сэндвич-IgG-ИФА. Вкратце, 96-луночные микротитрационные планшеты StreptaWell с высоким связыванием стрептавидина A (Roche) покрывают 100 мкл/лунка биотинилированной захватывающей молекулы F(ab')2
Очистка белка
Белки очищали от фильтрованных супернатантов клеточных культур в соответствии со стандартными протоколами. Вкратце, антитела наносили на колонку с белком А-сефарозой (GE Healthcare) и промывали ФСБ. Элюирование антител выполняли при рН 2,8 с последующей немедленной нейтрализацией образца. Агрегированный белок отделяли от мономерных антител с помощью эксклюзионной хроматографии (Superdex 200, GE Healthcare) в ФСБ или в 20 мМ гистидине, 150 мМ NaCl, рН 6,0. Фракции мономерных антител объединяли, концентрировали (если необходимо), например, с использованием центробежного концентратора MILLIPORE Amicon Ultra (НОММ (номинальное отсечение по молекулярной массе) 30), замораживали и хранили при -20°С или -80°С. Часть образцов обеспечивали для последующего анализа белка и аналитического определения характеристик, например, с помощью ДСН-ПААГ-электрофореза, эксклюзионной хроматографии (ЭХ) или масс-спектрометрии.
ДСН-ПААГ-электрофорез
Гелевую систему NuPAGE® Pre-Cast (Invitrogen) использовали в соответствии с инструкцией производителя. В частности, были использованы 10% или 4-12% гели NuPAGE® Novex® Bis-TRIS Pre-Cast (pH 6,4) и NuPAGE® MES (восстановленные гели с антиоксидантной добавкой для прогоночного буфера NuPAGE®) или прогоночный буфер MOPS (невосстановленные г ели).
Аналитическая эксклюзионная хроматография
Эксклюзионную хроматографию (ЭХ) для определения агрегации и олигомерного состояния антител проводили методом ВЭЖХ хроматографии. Кратко, антитела, очищенные белком А, наносили на колонку Tosoh TSKgel G3000SW в 300 мМ NaCl, 50 мМ KH2PO4/K2HPO4, рН 7,5 на системе Agilent HPLC 1100 или на колонку Superdex 200 (GE Healthcare) в 2×ФСБ на системе Dionex HPLC. Элюированный белок определяли количественно по поглощению в УФ-спектре и интеграции площадей пиков. Стандарт для гель-фильтрации BioRad 151-1901 служил в качестве стандарта.
Масс-спектрометрия
В данном разделе описывается характеристика мультиспецифических антител с обменом VH/VL (VH/VL CrossMab) с акцентом на их правильную сборку. Ожидаемые первичные структуры были проанализированы с помощью масс-спектрометрии с ионизацией электрораспылением (ИЭР-МС) дегликозилированных интактных CrossMab и дегликозилированным / расщепленных плазмином или альтернативно дегликозилированных / ограниченно расщепленных LysC CrossMab.
VH/VL CrossMab подвергали дегликозилированию N-глюкозидазой F в фосфатном буфере или трис-буфере при 37°С в течение до 17 часов при концентрации белка 1 мг/мл. Расщепление плазмином или ограниченное расщепление LysC (Roche) проводили с использованием 100 мкг дегликозилированных VH/VL CrossMab в трис-буфере, рН 8, при комнатной температуре в течение 120 часов и при 37°С в течение 40 минут, соответственно. Перед масс-спектрометрией образцы обессоливали с помощью ВЭЖХ на колонке с сефадексом G25 (GE Healthcare). Общая масса была определена при помощи ИЭР-МС на системе MS MAXIS 4G UHR-QTOF (Bruker Daltonik), оснащенной источником TriVersa NanoMate (Advion).
Определение связывания и аффинности связывания мультиспецифических антител с соответствующими антигенами с использованием поверхностного плазмонного резонанса (ППР) (BIACORE)
Связывание полученных антител с соответствующими антигенами исследуют с помощью поверхностного плазмонного резонанса с использованием прибора BIACORE (GE Healthcare Biosciences AB, Упсала, Швеция). Соответствующее программное обеспечение Biacore Evaluation Software используется для анализа сенсограмм и для расчета данных аффинности.
Пример 1
Получение анти-PD-1 антител
Иммунизация мышей
Мышей NMRI иммунизировали генетически, используя вектор экспрессии плазмиды, кодирующий полноразмерный человеческий PD-1, путем внутрикожного введения 100 мкг векторной ДНК (plasmid15300_hPD1-fl) с последующей электропорацией (2 квадратных импульса по 1000 В/см, длительность 0,1 мс, интервал 0,125 с, за которым следуют 4 квадратных импульса 287,5 В/см, длительность 10 мс, интервал 0,125 с. Мыши получали по 6 последовательных иммунизации на 0, 14, 28, 42, 56, 70 и 84-е сутки. Кровь отбирали на 36, 78 и 92-е сутки и получали сыворотку, которую использовали для определения титра с помощью ИФА (см. ниже). Животных с наивысшими титрами отбирали для повторной иммунизации на 96-е сутки путем внутривенной инъекции 50 мкг рекомбинантной химеры человеческий PD1 - человеческий Fc, и через 3 суток после повторной иммунизации выделяли моноклональные антитела по технологии гибридомы путем слияния спленоцитов с клеточной линией миеломы.
Определение сывороточных титров (ИФА)
Химеру человеческого рекомбинантного PD1 с Fc человека иммобилизовали на 96-луночном планшете NUNC Maxisorp в концентрации 0,3 мкг/мл, 100 мкл/лунка в ФСБ с последующим: блокированием планшета 2% кротеина С в ФСБ, 200 мкл/лунка; применение серийных разведений антисывороток в двух повторностях, в 0,5% кротеина С в ФСБ, 100 мкл/лунка; обнаружение с помощью HRP-конъюгированного козьего антимышиного антитела (Jackson Immunoresearch/Dianova 115-036-071; 1/16000). Для всех этапов планшеты инкубировали в течение 1 ч при 37°С. Между всеми этапами планшеты промывали 3 раза 0,05% Твином 20 в ФСБ. Сигнал усиливали путем добавления растворимого субстрата ВМ Blue POD (Roche), 100 мкл/лунка; и останавливали добавлением 1 М HCl, 100 мкл/лунка. Оптическую плотность считывали при 450 нм против 690 нм в качестве эталона. Титр определяли как разведение антисыворотки, приводящее к полумаксимальному сигналу.
Пример 2
Характеристика анти-PD1 антител / связывание анти-PD1 антител с человеческим PD1
ИФА для hu PD1
Покрытые стрептавидином планшеты Nunc maxisorp (MicroCoat, №11974998001), покрывали 25 мкл/лунка биотинилированного PD1-ECD-AviHis и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл образцов анти-PD1 или эталонных антител (человеческие анти-PD1; Roche / мышиные анти-PD1; Biolegend; кат.: 329912) и инкубировали 1 ч при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка козьего античеловеческого Н+L-POD (JIR, JIR109-036-088) / овечьего антимышиного-POD (GE Healthcare; NA9310) в разведении 1: 2000/1: 1000 и инкубировали при комнатной температуре в течение 1 часа на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, кат. №11835033001) и инкубировали до достижения ОП 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА приведены в виде значений ЕС50 [нг/мл] в сводных Таблицах 1 и 2 ниже.
Клеточный ИФА для PD1
Адгезивную клеточную линию СНО-K1, стабильно трансфицированную плазмидой 15311_hPD1-fl_pUC_Neo, кодирующей полноразмерный человеческий PD1, и селекцию G418 (маркер устойчивости к неомицину в плазмиде) высевали в концентрации 0,01х10Е6 клеток/лунка в 384-луночные планшеты с плоским дном и культивировали в течение ночи.
На следующие сутки добавляли 25 мкл/лунка образца PD1 или эталонного антитела против PD1 человека (Roche)/ против PD1 мыши (Biolegend; кат.:329912) и инкубировали в течение 2 часов при 4°С (чтобы избежать интернализации). После тщательной промывки (1×90 мкл/лунка PBST) клетки фиксировали, добавляя 30 мкл/лунка 0,05% глутаральдегида (Sigma, кат. №: G5882, 25%), разведенного в буфере 1 × ФСБ, и инкубировали в течение 10 минут при комнатной температуре. После промывки (3×90 мкл/лунка PBST) для обнаружения добавляли 25 мкл/лунка вторичного антитела: козьего античеловеческого H+L-POD (JIR, JIR109-036-088)/овечьего антимышиного POD (GE NA9310) с последующей 1-часовой инкубацией при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка PBST) добавляли 25 мкл/лунка раствора субстрата ТМВ (Roche 11835033001) и инкубировали до достижения ОП 1,0-2,0. Измерение в планшетах проводили при 370/492 нм.
Результаты клеточного ИФА приведены в виде значений «ЭК50 СНО-PD1» [нг/мл] в Таблице 2 ниже.
ИФА для PD1 яванского макака (cyno)
Планшеты, покрытые стрептавидином Nunc maxisorp (MicroCoat, №11974998001), покрывали 25 мкл/лунка биотинилированного cynoPD1-ECD-биотин и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл образцов анти-PD1 или эталонных антител (человеческое анти-PD1; Roche) и инкубировали 1 ч при комнатной температуре на шейкере. После промывки (3×90 мкл / лунка буфером PBST) добавляли 25 мкл/лунка козьего античеловеческого Н+L-POD (JIR, JIR109-036-088) в разведении 1: 1000 и инкубировали при комнатной температуре в течение 1 ч на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, 11835033001) и инкубировали до достижения ОП 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА приведены в виде значений ЕС50 [нг/мл] в сводных Таблицах 1 и 2 ниже.
Анализ замены лиганда PD-L1
Покрытые стрептавидином планшеты Nunc maxisorp (MicroCoat, №11974998001), покрывали 25 мкл/лунка биотинилированного PD1-ECD-AviHis и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл образцов анти-PD1 или эталонных антител (мышиные анти-PD1; Biolegend; кат.: 329912) и инкубировали 1 ч при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл/лунка PD-L1 (рекомбинантная химера B7-H1/PD-L1 Fc человека; 156-В7, R&D) и инкубировали 1 ч при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка козьего античеловеческого Н+L-POD (JIR, 109-036-088) в разведении 1: 1000 и инкубировали при комнатной температуре в течение 1 ч на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, 11835033001) и инкубировали до достижения ОП 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА приведены в виде значений IC50 [нг/мл] в сводной Таблице 1 ниже.
Анализ замены лиганда PD-L2
Покрытые стрептавидином планшеты Nunc maxisorp (MicroCoat, №11974998001), покрывали 25 мкл/лунка биотинилированного PD1-ECD-AviHis и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл образцов анти-PD1 или эталонных антител (мышиное анти-huPD1; Roche) и инкубировали 1 ч при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл/лунка PD-L2 (рекомбинантная химера B7-DC/PD-L2 Fc человека; 1224-PL-100, R&D) и инкубировали 1 ч при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка козьего античеловеческого Н+L-POD (JIR, 109-036-088) в разведении 1: 2000 и инкубировали при комнатной температуре в течение 1 ч на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (тетраметилбензидина) (Roche, №11835033001) и инкубировали до ОП 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА приведены в виде значений ИК50 [нг/мл] в сводной Таблице 1 ниже.
Картирование эпитопов при помощи ИФА / конкурентного анализа связывания
Планшеты Nunc Maxisorp (Nunc №464718) покрывали 25 мкл/лунка захватывающего антитела (козье антимышиное IgG; JIR; 115-006-071) и инкубировали в течение 1 часа при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) планшеты блокировали в течение 1 часа 2%-ным БСА-содержащим буфером ФСБ при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл образцов мышиного анти-PDl и инкубировали 1 ч при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) захватывающее антитело блокировали при помощи 30 мкл/лунка мышиного IgG (JIR; 015-000-003) в течение 1 часа при комнатной температуре на шейкере. В то же время биотинилированное PD1-ECD-AviHis предварительно инкубировали со вторым образцом антител в течение 1 часа при комнатной температуре на шейкере. После промывки планшета для анализа (3×90 мкл/лунка с буфером PBST) смесь антител к PD1 переносили на планшет для анализа и инкубировали при комнатной температуре в течение 1 часа на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка стрептавидина-POD (Roche, №11089153001) в разведении 1: 4000 и инкубировали при комнатной температуре в течение 1 часа на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, №11089153001) и инкубировали до достижения ОП 1,5-2,5. Измерение проводили при 370/492 нм. Эпитопные группы определяли при помощи иерархической кластеризации против эталонных антител.


Характеристика гуманизированных анти-PD-1 антител при помощи Biacore
Анализ на основе поверхностного плазмонного резонанса (ППР) использовали для определения кинетических параметров связывания между несколькими мышиными PD1-связывающими веществами, а также между коммерческими стандартами, связывающими человеческий PD1. Следовательно, античеловеческий IgG был иммобилизован путем присоединения амина к поверхности сенсорного чипа СМ5 (Biacore). Затем проводили захват образцов и связывание с ними hu PD1-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. В результате получали константу равновесия и кинетические константы скорости путем подгонки данных к модели взаимодействия Ленгмюра 1:1.
Около 2000 единиц ответа (ЕО) 20 мкг/мл античеловеческого IgG (GE Healthcare, №BR-1008-39) были связаны с проточными ячейками 1 и 2 (альтернативно: 3 и 4) сенсорного чипа СМ5 в Biacore Т200 при рН 5,0 с использованием набора для аминного сопряжения, поставляемого GE Healthcare.
Образец и прогоночный буфер представляли собой HBS-EP + (0,01 М ГЭПЭС, 0,15 М NaCl, 3 мМ ЭДТА, 0,05% об./об. ПАВ Р20, рН 7,4). Температура проточной ячейки была установлена на 25°С, а температура в отсеке для образца - 12°С. Система была заполнена прогоночным буфером.
Образцы вводили в течение 20 секунд с концентрацией 10 нМ и связывали со второй проточной ячейкой. Затем полный набор концентраций человеческого PD1-ECD (144 нМ, 48 нМ, 16 нМ, 5,33 нМ, 1,78 нМ, 0,59 нМ, 0,20 нМ и 0 нМ) вводили в каждый образец в течение 120 с, после чего время диссоциации составляло 30/ 300 с и две стадии регенерации по 20 секунд с 3 М MgCl3, из которых на последней была «дополнительная промывка после инъекции» с прогоночным буфером.
В результате данные двойного контроля были аппроксимированы к модели взаимодействия Ленгмюра 1: 1 с использованием программного обеспечения Biacore Т200 Evaluation. Полученные значения KD, ka и kd приведены в Таблице 3.

Как показано в Таблице 3, все гуманизированные версии химерного PD1-0103 (получение см. в Примере 6) демонстрируют кинетические свойства, сходные с исходным антителом (химерное PD1-0103).
Кинетика
Сенсор СМ5 серии S был установлен в систему Biacore 4000, и точки обнаружения были гидродинамически приведены в соответствие с инструкциями производителя.
Поликлональное кроличье IgG-антитело
В одном варианте осуществления анализ проводили при 25°С. В другом варианте осуществления анализ проводили при 37°С. 50 нМ каждого мышиного моноклонального антитела захватывали на поверхности сенсора путем введения в течение 1 мин при 10 мкл/мин. Затем соответствующие антигены вводили в серии концентраций 100 нМ, 2×33 нМ, 11 нМ, 4 нМ, 1 нМ и системный буфер 0 нМ при 30 мкл/мин в течение 4 мин во время фазы ассоциации. Диссоциацию контролировали в течение еще 4 мин. Систему захвата регенерировали, используя 3-минутную инъекцию 10 мМ глицина рН 1,5 при 30 мкл/мин. Соответствующие кинетические данные были рассчитаны с использованием программного обеспечения Biacore evaluation в соответствии с инструкциями производителя.
Картирование эпитопов
Прибор Biacore 4000 был оснащен сенсором Biacore САР и был подготовлен в соответствии с рекомендациями производителя. Буфер для прибора представлял собой HBS-ET (10 мМ ГЭПЭС, рН 7,4, 150 мМ NaCl, 3 мМ ЭДТА, 0,005% мас/об Твин 20). Прибор запускали при 25°С.
Все образцы разводили в системном буфере. Биотинилированный антиген 35 кДа PD1-ECD-AviHis был захвачен при 200 ЕО на поверхности сенсора САР путем 1-минутной инъекции со скоростью 30 мкл/мин в проточных ячейках 1, 2, 3 и 4 в точках 1 и 5. Точки 2, 3 и 4 служили эталоном. В другом варианте осуществления биотинилированный антиген PD1-ECD-AviHis 35 кДа был захвачен при 200 ЕО на сенсоре САР подобным образом.
Затем первичное антитело вводили при 100 нМ в течение 3 минут со скоростью 30 мкл/мин с последующим введением вторичного антитела при 100 нМ в течение 3 минут при скорости 30 мкл/мин. Первичное антитело вводили до полного насыщения поверхности представленного антигена. В конце фаз отчета о первичном и вторичном введении антител были установлены точки «позднего связывания» (BL) для мониторинга реакции связывания соответствующих антител. Молярное соотношение вычисляли как отношение между ответом связывания вторичного антитела «BL2» и ответом первичного антитела «BL1». Молярное соотношение использовали в качестве индикатора доступности антигена вторичного антитела, когда антиген уже образовывал комплекс с первичным антителом.
Комплексы полностью удаляли с поверхности сенсора путем введения в течение 2 мин при 30 мкл/мин буфера для регенерации 2М гуанидин-HCL 250 мМ NaOH, как рекомендовано производителем, с последующим введением в течение 1 мин при 30 мкл/мин системного буфера.
Пример 192
Влияние различных анти-PD-1 антител на продукцию цитокинов в реакции смешанной культуры лимфоцитов (РСКЛ)
3А) Реакция смешанной культуры лимфоцитов (РСКЛ) представляет собой анализ иммунных клеток, который измеряет активацию лимфоцитов от одного индивидуума (донора X) относительно лимфоцитов от другого индивидуума (донора Y). Реакцию смешанной культуры лимфоцитов использовали для демонстрации эффекта блокирования пути PD1 к эффекторным клеткам лимфоцитов. Т-клетки в анализе тестировали на активацию и секрецию ИФНγ в присутствии или в отсутствии анти-PD1 мкАт.
Для выполнения аллогенной РСКЛ мононуклеарные клетки периферической крови (МКПК) по меньшей мере от четырех здоровых доноров неизвестного типа HLA были выделены центрифугированием в градиенте плотности с использованием пробирки Leukosep (Greiner Bio One, 227288). Вкратце, образцы гепаринизированной крови разбавляли трехкратным объемом ФСБ, и аликвоты по 25 мл разведенной крови наслаивали в пробирки Leukosep объемом 50 мл. После центрифугирования при 800g в течение 15 минут при комнатной температуре (без перерыва) фракции, содержащие лимфоциты, собирали, промывали в ФСБ и использовали непосредственно в функциональном анализе или ресуспендировали в замораживающей среде (10% ДМСО, 90% фетальной бычьей сыворотки (ФБС)) при 1.0Е+07 клеток/мл и хранили в жидком азоте. Отдельные двухфакторные РСКЛ были организованы путем смешивания МКПК от двух разных доноров при соотношении клеток 1:1 стимулятор/респондер, и совместные культуры анализировали по меньшей мере в двух повторностях в плоскодонных 96-луночных планшетах в течение 6 суток при 37°С, 5% СО2, в присутствии или без различного диапазона концентраций очищенных анти-PD1 моноклональных антител PD1-0050, PD1-0069, PD1-0073, PD1-0078, PD1-0098, PD1-0102, PD1-0103. В качестве эталонных анти-PD1 антител, антитела, содержащие домены VH и VL или ниволумаба (также известного как MDX-5C4 или MDX-1106), или пембролизумаба (также известного как MK-3475 или Org 1.09А), были синтезированы и клонированы с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Кабату)). В качестве отрицательного контроля не использовали ни антитело, ни антитело изотипического контроля, а в качестве положительного контроля использовали рекомбинантый ИЛ-2 человека (20 ЭЕ/мл (ЭЕ-экспериментальные единицы). Через 6 суток из каждой культуры отбирали 100 мкл среды для измерения цитокинов. Уровни ИФН-гамма измеряли с использованием набора ELISA OptEIA (BD Biosciences).
Результаты приведены в Таблице 4 (секреция/высвобождение ИФНγ). Анти-PD1 моноклональные антитела стимулировали активацию Т-клеток и секрецию ИФНγ зависимым от концентрации образом. Значение увеличения секреции ИФН-γ в % рассчитывали по отношению к выработке ИФН-γ в РСКЛ без добавления каких-либо блокирующих мкАт (значение ИФН-γ, индуцированное базальной аллогенной стимуляцией, как Е-с) и РСКЛ с добавлением 20 ЭЕ/мл рекомбинантного ИЛ-2 человека (положительный контроль = 100% значение ИФН-гамма как Е+с) и рассчитывали по формуле: Относительная стимуляция [%] = ((Пример - Е-с)/(Е+с - Е-с)*100.

Некоторые блокирующие антитела к PD1 PD1-0050, PD1-0069, PD1-0073, PD1-0078, PD1-0098, PD1-0102, PD1-0103 проявляли сильную иммуномодулирующую активность за счет усиления секреции интерферона-гамма (ИФНγ) (для всех антител данные не приведены).
3В) В следующем эксперименте оценивали химерный PD1-0103 (изотип человеческого IgG1 с мутациями L234A, L235A и P329G (индекс EU по Кабату)). Блокирование PD1 с помощью химерного PD1-0103 сильно усиливает секрецию ИФН-гамма посредством аллогенных стимулированных первичных Т-клеток человека. Химерное PD1-0103 было более сильным, чем эталонные анти-PD1 антитела. Для сравнения были синтезированы и клонированы эталонные анти-PD1 антитела, содержащие домены VH и VL или ниволумаба (также известного как MDX5C4 или MDX-1106), и пембролизумаба (также известного как MK-3475 или Org 1.09А), и клонированы с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Кабату)).
3С) В дополнительных экспериментах иммуномодулирующую активность гуманизированных вариантов анти-PD-1 антител PD1-0103 (гуманизированные антитела PD1-0103-0312, PD1-0103-0314, на Фиг. 2 и 3, см. также в Примере 9 ниже) а) высвобождение ИФНγ (секреция); b) высвобождение ФНО-альфа (секреция) оценивали в РСКЛ, как описано выше. Эффект химерного антитела PD1-0103 и его гуманизированных версий сравнивали с эталонными анти-PD1 антителами, содержащими домены VH и VL или ниволумаба (также известного как MDX5C4 или MDX-1106), или пембролизумаба (также известного как MK-3475 или Org 1.09А) с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Кабату)). После 6 суток культивирования из РСКЛ отбирали 50 мкл супернатанта и измеряли несколько цитокинов в одной культуре, используя анализ Bio-Plex Pro™ Human Cytokine Th1/Th2 Assay (Bio-Rad Laboratories Inc.) (данные приведены не для всех цитокинов). Химерное антитело PD1-0103 и его гуманизированные версии (PD1-0103_0312 и PD1-0103_0314) были более эффективными по сравнению с эталонными анти-PD1 антителами в усилении активации Т-клеток и секреции ИФН-гамма. Кроме того, химерное антитело PD1-0103 и его гуманизированные варианты усиливают секрецию фактора некроза опухоли альфа (ФНО-альфа) и ИЛ-12 антигенпрезентирующими клетками и увеличивают способность моноцитов/макрофагов или антигенпрезентирующих клеток стимулировать Т-клетки.
Пример 4
Влияние блокирования анти-PD-1 антител на цитотоксическое высвобождение гранзима В и секрецию ИФН-γ CD4 Т-клетками человека, совместно культивируемыми с аллогенными зрелыми дендритными клетками
Для дальнейшего изучения эффекта обработки анти-PD-1 в аллогенной обстановке мы разработали анализ, в котором свежеочищенные CD4 Т-клетки совместно культивируют в течение 5 суток в присутствии аллогенных зрелых дендритных клеток, полученных из моноцитов, (зДК). Моноциты были выделены из свежих МКПК за одну неделю до этого путем адгезии к пластику с последующим удалением неприкрепленных клеток. Затем мы получали незрелые ДК из моноцитов путем культивирования их в течение 5 суток в среде, содержащей ГМ-КСФ (50 нг/мл) и ИЛ-4 (100 нг/мл). Чтобы вызвать созревание незрелых ДК, мы добавляли ФНО-α, ИЛ-1β и ИЛ-6 (по 50 нг/мл каждый) в среду для культивирования в течение 2 дополнительных суток. Затем мы оценили созревание ДК, измерив на их поверхности экспрессию главного комплекса гистосовместимости класса II (ГКГС II), CD80, CD83 и CD86 с помощью проточной цитометрии (LSRFortessa, BD Biosciences).
В день минимальной реакции смешанной культуры лимфоцитов (мРСКЛ) CD4 Т-клетки обогащали с помощью набора с микрогранулами (Miltenyi Biotec) из 108 МКПК, полученных от неродственного донора. Перед культивированием CD4 Т-клетки метили 5 мкМ карбокси-флуоресцеин-сукцинимидиловым сложным эфиром (CFSE). 105 CD4 Т-клеток затем высевали в 96-луночный планшет вместе со зрелыми алло-ДК (5:1) в присутствии или в отсутствии блокирующего анти-PD1 антитела (или PD1-0103, химерного PD1-0103, или гуманизированных антител PD1-0103. -0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315, сокращенно 0312, 0313, 0314, 0315), в концентрации 10 мкг/мл, если не указано иное на фигурах.
Через пять суток супернатант клеточных культур собирали и использовали для измерения уровней ИФН-γ с помощью ИФА (R&D systems). Клетки оставляли при 37°С на дополнительные 5 суток в присутствии Golgi Plug (Брефельдин А) и Golgi Stop (Монензин). Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и фиксирующим красителем Aqua (Invitrogen) для прижизненного окрашивания/окрашивания мертвых клеток, после чего проводили фиксацию/пермеабилизацию в буфере Fix/Perm Buffer (BD Bioscience). Внутриклеточное окрашивание проводили для гранзима В (BD Bioscience), ИФН-γ и ИЛ-2 (оба от eBioscience).
Все гуманизированные варианты PD1-0103 (гуманизированные антитела PD1-0103-0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315, сокращенно 0312, 0313, 0314, 0315) оказались одинаково эффективными для повышения уровня гранзима В и гамма-интерферона (данные не приведены).
Пример 5
Химерные производные антитела к PD1
Химерные антитела к PD1 были получены путем амплификации вариабельных областей тяжелой и легкой цепей мышиных анти-PD1 антител PD1-0098, PD1-0103 с помощью ПЦР и клонирования их в векторы экспрессии тяжелых цепей в виде слитых белков с остовами человеческого IgG1/человеческого СН1-шарнир-СН2-СН3 с мутациями L234A, L235A и P329G (индекс EU по Кабату)) (лейцин 234 для аланина, лейцин 235 для аланина, пролин 329 для глицина), блокирующие эффекторные функции и векторы экспрессии легких цепей в виде слитых белков с человеческой константной областью каппа-цепи (С-kappa) Затем плазмиды LC и НС совместно трансфицировали в HEK293 и очищали через 7 суток из супернатанта стандартными способами очистки антител. Химерные анти-PDl антитела были переименованы в химерные chiPD1-0098 (chiPD1-0098) и химерные PD1-0103 (chiPD1-0103). Для сравнения были синтезированы и клонированы эталонные анти-PD1 антитела, содержащие домены VH и VL или ниволумаба (также известного как MDX-5C4 или MDX-1106), и пембролизумаба (также известного как MK-3475 или Org 1.09А), и клонированы с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Кабату)).
Пример 6
Получение, экспрессия и очистка гуманизированных вариантов анти-PD1 антитела PD-0103 (huMab PD-0103) и их характеристика
Гуманизация доменов VH и VL мышиного анти-PD1 антитела 0103
На основе аминокислотной последовательности мышиных доменов VH и VL мышиного анти-PD1 антитела PD1-0103 (SEQ ID NO: 7 и 8) были получены варианты гуманизированных анти-PD1 антител.
Гуманизированный VH-вариант основан на зародышевой линии человека IMGT_hVH_3_23 в комбинации с J-элементом зародышевой линией человека IGHJ5-01 с несколькими мутациями, (что заложено в основу SEQ ID NO: 9).
Гуманизированные варианты VL основаны на человеческих зародышевых линиях IMGT_hVK_4_l, IMGT_hVK_2_30, IMGT_hVK_3_11 и IMGT_hVK_l_39 в комбинации с J-элементом зародышевой линии человека IGKJ1-01. Различные мутации приводили к гуманизированным вариантам от SEQ ID NO: 10 до SEQ ID NO: 13.
Гуманизированные аминокислотные последовательности для вариабельных областей тяжелой и легкой цепей PD1-0103 были обратно транслированы в ДНК, в результате были получены cNDA (GenArt) и затем клонированы в векторы экспрессии тяжелой цепи в виде слитых белков с человеческими остовами IgG1/человеческим СН1-шарнир -СН2-СН3 с мутациями LALA и PG (лейцин 234 с аланином, лейцин 235 с аланином, пролин 329 с глицином) отменяет эффекторные функции или векторы экспрессии легких цепей в виде белков слияния с человеческой константной областью каппа-цепи (С-kappa). Затем плазмиды LC и НС совместно трансфицировали в HEK293 и очищали через 7 суток из супернатанта стандартными способами очистки антител. Полученные гуманизированные антитела к PD1 названы следующим образом:

Варианты гуманизированных антител PD1-0103 и исходное химерное антитело PD1-0103 были охарактеризованы, как описано выше. Результаты приведены в Таблице 6.

Гуманизированный вариант PD-0103-0312 далее обозначается как клон антитела aPD1 PD1-0376.
Пример 7
Получение анти-LAG3 антител
Иммунизация кроликов
Запатентованные трансгенные кролики Roche, экспрессирующие репертуар гуманизированных антител, были иммунизированы плазмидной ДНК, экспрессирующей LAG3.
Группу из 3 кроликов иммунизировали генетически, используя вектор экспрессии плазмиды, кодирующий полноразмерный LAG3 человека (15352_pIntronA_fl-hLag3_DNA-IMS), путем внутрикожного введения 400 мкг векторной ДНК с последующей электропорацией (5 квадратных импульсов по 750 В/см), длительность 10 мс, интервал 1 с). Кролики получили 7 последовательных иммунизации на 0, 14, 28, 49, 70, 98 и 126-е сутки. Кровь (10% от общего объема крови) отбирали на 35, 77, 105 и 133-е сутки. Готовили сыворотку, которую использовали для определения титра с помощью ИФА (см. ниже), и выделяли периферические мононуклеарные клетки, которые использовали в качестве источника антигенспецифических В-клеток в процессе клонирования В-клеток ниже.
Определение сывороточных титров (ИФА)
Человеческий рекомбинантный белок LAG3 иммобилизовали на 96-луночном планшете NUNC Maxisorp в концентрации 2 мкг/мл, 100 мкл/лунка в ФСБ с последующим: блокированием планшета 2% -ным кротеином С в ФСБ, 200 мкл/лунка; применением серийных разведений антисывороток в двух повторностях, в 0,5% кротеине С в ФСБ, 100 мкл/лунка; обнаружением или с (1) HRP-конъюгированным ослиным антителом против IgG кролика (Jackson Immunoresearch/Dianova 711-036-152; 1/16000), или (2) HRP-конъюгированным кроличьим антителом против IgG человека (Pierce/Thermo Scientific 31423; 1/5000) или с (3) биотинилированным козьим антитела против человеческой каппа (Southern Biotech/Biozol 2063-08, 1/5000) и стрептавидином-HRP; каждый разводится в 0,5% кротеине С в ФСБ, 100 мкл/лунка. Для всех этапов планшеты инкубировали в течение 1 ч при 37°С. Между всеми этапами планшеты промывали 3 раза 0,05% Твином 20 в ФСБ. Сигнал усиливали путем добавления растворимого субстрата ВМ Blue POD (Roche), 100 мкл/лунка; и останавливали добавлением 1 М HCl, 100 мкл/лунка. Оптическую плотность считывали при 450 нм против 690 нм в качестве эталона. Титр определяли как разведение антисыворотки, приводящее к полумаксимальному сигналу.
Выделение мононуклеарных клеток периферической крови кролика (МКПК)
Были отобраны образцы крови иммунизированных трансгенных кроликов. ЭДТА, содержащую цельную кровь, разбавляли в два раза 1× ФСБ (РАА, Пашинг, Австрия) перед центрифугированием в градиенте плотности с использованием среды для выделения лимфоцитов Lympholyte-Mammal (Cedarlane Laboratories, Берлингтон, Онтарио, Канада) в соответствии с инструкциями производителя. МКПК дважды промывали 1х ФСБ.
Среда EL-4 В5
RPMI 1640 (Pan Biotech, Айденбах, Германия) с добавлением 10% ФБС (Hyclone, Логан, Юта, США), 2 мМ глутамина, 1% раствора пенициллина/стрептомицина (РАА, Пашинг, Австрия), 2 мМ пирувата натрия, 10 мМ ГЭПЭС (PAN Biotech, Айденбах, Германия) и 0,05 мМ b-меркаптоэтанола (Gibco, Пейсли, Шотландия).
Покрытие планшетов белковым антигеном
6-луночные планшеты для стерильных клеточных культур покрывали ECD человеческого LAG3, конъюгированного с частью Fc человека (2 мкг/мл) в карбонатном буфере (0,1 М бикарбонат натрия, 34 мМ динатрийгидрокарбонат, рН 9,55) в течение ночи при 4°С. Планшеты трижды промывали в стерильном ФСБ перед использованием.
Истощение клеток
(а) Стерильные 6-луночные планшеты (со степенью чистоты для культуры клеток), покрытые слившимся монослоем клеток СНО, использовали для истощения макрофагов/моноцитов посредством неспецифической адгезии, а также неспецифически связывающихся лимфоцитов.
(b) Пустые стерильные 6-луночные планшеты (со степенью чистоты для культуры клеток) использовали для истощения макрофагов и моноцитов и других клеток посредством неспецифической адгезии.
Половина образца МКПК была использована для (а), а половина для (b).
Каждую лунку заполняли максимально 4 мл среды и до 6×106 МКПК от иммунизированного кролика и оставляли для связывания в течение 1 часа при 37°С в инкубаторе. Клетки в супернатанте (лимфоциты периферической крови (PBL)) использовали для стадии пэннинга антигеном.
Обогащение В-клеток на антигене LAG3
Белковый антиген: В покрытые белком 6-луночные планшеты для тканевых культур LAG3-ECD-huFc, высевали до 6×106 PBL на 4 мл среды из стадий истощения с использованием пустого 6-луночного планшета и оставляли для связывания в течение 1 часа при 37°С в инкубаторе. Неприкрепившиеся клетки удаляли путем осторожного промывания лунок 1-2 раза 1 × ФСБ. Оставшиеся прилипшие клетки отделяли трипсином в течение 10 мин при 37°С в инкубаторе. Обработку трипсином прекращали с помощью среды EL-4 В5. Клетки хранили на льду до иммунофлуоресцентного окрашивания.
Антиген клеточной поверхности: 6-луночные планшеты для тканевых культур, покрытые монослоем человеческих LAG3-положительных клеток СНО, высевали до 6×106 PBL на 4 мл среды со стадий истощения с использованием покрытого СНО 6-луночного планшета и оставляли связываться в течение 1 часа при 37°С в инкубаторе. Неприкрепившиеся клетки удаляли путем осторожного промывания лунок 1-2 раза 1× ФСБ. Оставшиеся прилипшие клетки отделяли трипсином в течение 10 мин при 37°С в инкубаторе. Обработку трипсином прекращали с помощью среды EL-4 В5. Клетки хранили на льду до иммунофлуоресцентного окрашивания.
Иммунофлуоресцентное окрашивание и проточная цитометрия
Анти-IgG ФИТЦ (AbD Serotec, Дюссельдорф, Германия) и анти-huCk ФЭ (Dianova, Гамбург, Германия) использовали для сортировки отдельных клеток. Для окрашивания поверхности клетки со стадии истощения и обогащения инкубировали с анти-IgG ФИТЦ и анти-huCk-ФЭ антителом в ФСБ и инкубировали в течение 45 минут в темноте при 4°С. После окрашивания МКПК дважды промывали ледяным ФСБ. Наконец, МКПК ресуспендировали в ледяном ФСБ и немедленно подвергали анализу при помощи проточной цитометрии. Йодид пропидия в концентрации 5 мкг/мл (BD Pharmingen, Сан-Диего, Калифорния, США) добавляли до анализа при помощи проточной цитометрии, чтобы различить мертвые и живые клетки. Becton Dickinson FACSAria, оснащенный компьютером и программным обеспечением FACSDiva (BD Biosciences, США), использовали для сортировки отдельных клеток.
Культивирование В-клеток
Культивирование В-клеток кролика проводили способом, описанным Seeber et al. (S Seeber et al. PLoS One 9 (2), e86184. 2014 Feb 04). Вкратце, одиночные отсортированные В-клетки кролика инкубировали в 96-луночных планшетах с 200 мкл/лунка среды EL-4 В5, содержащей клетки Pansorbin (1: 100000) (Calbiochem (Merck), Дармштадт, Германия), 5% супернатанта тимоцитов кролика (MicroCoat, Бернрид, Германия) и гамма-облученные мышиные клетки тимомы EL-4 В5 (5×105 клеток/лунка) в течение 7 суток при 37°С в инкубаторе. Супернатанты культуры В-клеток удаляли для скрининга, а оставшиеся клетки собирали немедленно и замораживали при -80°С в 100 мкл буфера RLT (Qiagen, Хильден, Германия).
Выделение V-доменов антител к LAG3
ПЦР-амплификация V-доменов
Общую РНК получали из лизата В-клеток (ресуспендировали в буфере RLT - Qiagen - кат. №79216), используя набор РНК NucleoSpin 8/96 (Macherey & Nagel; 740709.4, 740698) в соответствии с протоколом производителя. РНК элюировали с использованием 60 мкл РНКазы без воды. 6 мкл РНК использовали для генерации кДНК с помощью реакции обратной транскриптазы с использованием SuperMix для синтеза первой цепи Superscript III (Invitrogen 18080-400) и олиго-dT-праймера в соответствии с инструкциями производителя. Все этапы выполняли в системе Hamilton ML Star. 4 мкл кДНК использовали для амплификации вариабельных областей тяжелой и легкой цепей иммуноглобулина (VH и VL) с помощью AccuPrime Supermix (Invitrogen 12344-040) в конечном объеме 50 мкл с использованием праймеров rbHC.up и rbHC.do для тяжелой цепи и BcPCR_FHLC_leader.fw и BcPCR_huCkappa.rev для легкой цепи (Таблица 7). Все прямые праймеры были специфическими для сигнального пептида (соответственно VH и VL), тогда как обратные праймеры были специфическими для константных областей (соответственно VH и VL). Условия ПЦР для RbVH были следующими: Горячий старт при 94°С в течение 5 мин; 35 циклов по 20 с при 94°С, 20 с при 70°С, 45 с при 68°С и конечная элонгация при 68°С в течение 7 мин. Условия ПЦР для HuVL были следующими: Горячий старт при 94°С в течение 5 мин; 40 циклов по 20 с при 94°С, 20 с при 52°С, 45 с при 68°С и конечная элонгация при 68°С в течение 7 мин.

8 мкл из 50 мкл раствора для ПЦР загружали в 48 E-Gel 2% (Invitrogen G8008-02). Положительные реакции ПЦР очищали с использованием набора NucleoSpin Extract II (Macherey&Nagel; 740609250) в соответствии с протоколом производителя и элюировали в 50 мкл буфера для элюирования. Все этапы выполняли в системе Hamilton ML Starlet.
Рекомбинантная экспрессия кроличьих моноклональных двухвалентных антител
Для рекомбинантной экспрессии кроличьих моноклональных двухвалентных антител продукты ПЦР, кодирующие VH или VL, клонировали в виде кДНК в векторы экспрессии при помощи метода клонирования липких концов (RS Haun et al., Biotechniques (1992) 13, 515-518; MZ Li et al., Nature Methods (2007) 4, 251-256). Векторы экспрессии содержали кассету экспрессии, состоящую из 5'-промотора ЦМВ, включая интрон А, и последовательность полиаденилирования 3' BGH. В дополнение к кассете экспрессии плазмиды содержали точку начала репликации, полученную из pUC18, и ген бета-лактамазы, обеспечивающий устойчивость к ампициллину, для амплификации плазмиды в E.coli. Использовали три варианта базовой плазмиды: одну плазмиду, содержащую константную область кроличьего IgG, предназначенную для приема областей VH, и в то же время содержащую константную область LC каппа человека для приема областей VL. Линеаризованные плазмиды экспрессии, кодирующие константную область каппа или гамма и вставки VL/VH, амплифицировали с помощью ПЦР с использованием перекрывающихся праймеров. Очищенные продукты ПЦР инкубировали с ДНК-полимеразой Т4, которая генерировала одноцепочечные липкие концы. Реакцию останавливали добавлением дЦТФ.
На следующем этапе плазмиду и вставку объединяли и инкубировали с гесА, который индуцировал сайт-специфическую рекомбинацию. Рекомбинированные плазмиды были трансформированы в E.coli. На следующий день выращенные колонии отбирали и тестировали на правильную рекомбинированную плазмиду с использованием плазмидного препарата, рестрикционного анализа и секвенирования ДНК.
Для экспрессии антител выделенные плазмиды НС и LC транзиентно трансфицировали в клетки HEK293, и супернатанты собирали через 1 неделю.
Пример 8
Характеристика анти-LAG3 антител


ИФА для Lag3 человека
Планшеты Nunc Maxisorp (Nunc 464718) покрывали 25 мкл/лунка рекомбинантного химерного белка человеческого LAG-3 Fc (R&D Systems, 2319-L3) при концентрации белка 800 нг/мл и инкубировали при 4°С в течение ночи или в течение 1 ч при комнатной температуре. После промывки (3×90 мкл/лунка буфером PBST) каждую лунку инкубировали с 90 мкл блокирующего буфера (ФСБ + 2% БСА + 0,05% Твин-20) в течение 1 часа при комнатной температуре. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл образцов анти-Lag3 в концентрации 1-9 мкг/мл (разведения 1:3 в буфере OSEP) и инкубировали 1 ч при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка конъюгата HRP с козьим антителом против κ-цепи человеческого Ig (Milipore, АР502Р) в разведении 1: 2000 и инкубировали при комнатной температуре в течение 1 часа. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата TMB (Roche, 11835033001) и инкубировали в течение 2-10 мин. Измерения проводили на приборе Tecan Safire 2 при 370/492 нм.
ИФА для связывания Lag3 на клеточной поверхности
25 мкл/лунка Lag3 клеток (рекомбинантные клетки СНО, экспрессирующие Lag3, 10000 клеток/лунка) высевали в 384-луночные планшеты, предназначенные для культуры ткани, (Corning, 3701) и инкубировали при 37°С в течение одних или двух суток. На следующие сутки после удаления среды добавляли 25 мкл образцов анти-Lag3 (разведения 1:3 в буфере OSEP, начиная с концентрации 6-40 нМ) и инкубировали в течение 2 часов при 4°С. После промывки (1×90 мкл в PBST) клетки фиксировали добавлением 30 мкл/лунка глутаральдегида до конечной концентрации 0,05% (Sigma, кат. №: G5882), в течение 10 минут при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка конъюгата HRP с козьим антителом против к-цепи человеческого Ig (Milipore, АР502Р) в разведении 1: 1000 и инкубировали при комнатной температуре в течение 1 часа. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата TMB (Roche, 11835033001) и инкубировали в течение 6-10 мин. Измерения проводили на приборе Tecan Safire 2 при 370/492 нм.
Характеристика анти-LAG3 антител при помощи ППР (Biacore)
Анализ на основе поверхностного плазмонного резонанса (ППР) использовали для определения кинетических параметров связывания между анти-Lag3 антителами в двухвалентном формате или в виде моновалентных Fab-фрагментов и внеклеточными доменами (ECD), меченными человеческим Fc Lag3 человека, при 25°С.
Поэтому две проточные ячейки биосенсорного чипа С1 были приготовлены в Biacore Т200 путем иммобилизации нейтравидина, разбавленного до 25 мкг/мл в ацетатном буфере рН 4,5, на него с использованием «мастера иммобилизации». Это привело к уровню иммобилизации около 1900 ЕО. Затем конъюгат CaptureSelect™ Biotin Anti-IgG-Fc (человеческий) связывали с нейтравидином, используя разведение 20 мкг/мл в прогоночном буфере (HBS-EP+, GE Healthcare).
Сам способ состоял из четырех команд за цикл. Первая команда: захват ~46 ЕО huLag3-Fc (20 с, 10 мкл/мин). Вторая команда: введение пробы в течение 120 секунд с последующей диссоциацией в течение 1200 с при скорости потока 30 мкл/мин. Третья и четвертая команда: регенерация путем введения глицина-HCl рН 1,5 в течение 30 секунд. Ряд разведений (3,13 нМ - 200 нМ, двукратные разведения в прогоночном буфере) каждого Fab-фрагмента антитела и дополнительные холостые циклы затем измеряли с использованием ранее описанного способа. Затем использовали программное обеспечение Biacore Т200 Evaluation для получения кинетических значений путем применения аппроксимации с использованием уравнения Ленгмюра 1: 1 с параметром аппроксимации Rmax, установленным в «1оса1», поскольку уровни захвата не были полностью воспроизводимы. Результаты (значения KD и значения kd) приведены в Таблице 8.
Картирование эпитопов
Эпитоп-специфическую сортировку проводили с использованием анализа на основе поверхностного плазмонного резонанса (ППР). Поэтому связывающие вещества aLag3 были связаны с huLag3 на приборе Biacore Т200. Затем оценивали доступность других связывающих веществ к ранее сформированному комплексу связывающее вещество aLag3 - huLag3.
Для проведения данного анализа использовали набор SA CAP (GE Healthcare). Если не указано иное, анализ проводили в соответствии с руководством по набору SA САР. Прогон включал только один тип цикла. После гибридизации разведение в 10 нМ биотинилированного huFc-меченного huLag3 позволяло связываться со стрептавидином на сенсорном чипе в течение 20 с при скорости потока 10 мкл/мин. Затем первый 200 нМ образец, разведенный в прогоночном буфере, инъецировали в течение 180 с при скорости потока 30 мкл/мин, после чего сразу же следовал второй образец в тех же условиях. Затем поверхность регенерировали.
Затем образцы были распределены по разным эпитопным группам со сходными паттернами конкуренции. Была проведена первая грубая категоризация, основанная на относительном ответе второй инъекции с использованием порогового значения 6,1 ЕО, которое было чуть выше самого высокого значения, наблюдаемого при введении связывающего вещества в качестве первого и второго образца. Все значения и выводы были окончательно подтверждены визуальным осмотром сенсограмм.
Результаты приведены в Таблице 8. Были идентифицированы три основных структуры эпитопа (E1, Е2 и Е3). Поскольку aLag3-0416 и гуманизированное ВАР 050 совместно используют одну и ту же группу, но не полностью подавляют друг друга, они были отнесены к подгруппам E2b и Е2с.
Связывание анти-Lag3 антител от трансгенных (tg) кроликов с рекомбинантными cyno Lag3-положительными клетками HEK
В дополнение к анализу связывания с использованием клеток HEK, рекомбинантно экспрессирующих человеческий Lag3 на поверхности, также оценивали связывание с cyno Lag3-положительными клетками HEK. Для данного эксперимента замороженные клетки HEK293F, ранее транзиентно трансфицированные LAG-3 яванского макака, оттаивали, центрифугировали и повторно добавляли в ФСБ/2% ФБС. 1,5×105 клеток/лунка высевали в 96-луночные планшеты. Анти-Lag3 антитела добавляли до конечной нормированной концентрации 10 мкг/мл. Для стандартов и в качестве контролей, аутофлуоресценции и положительного контроля (Medarex 25F7), а также контроля изотипа (huIgG1 от Sigma, кат. №15154, данные не показаны) антитела были получены и измерены в эксперименте. Клетки HEK инкубировали с указанными антителами в течение 45 минут на льду, дважды промывали 200 мкл охлажденного на льду буфера ФСБ, содержащего 2% ФБС, перед вторичным антителом (меченным АФЦ козьим антителом против каппа IgG человека, Invitrogen, кат. № МН10515) добавляли (1:50 разбавляли в FACS-Puffer/лунка) и дополнительно инкубировали в течение 30 минут на льду. Клетки снова дважды промывали 200 мкл охлажденного на льду буфера ФСБ/2% ФБС, после чего образцы наконец ресуспендировали в 150 мкл буфера для проточной цитометрии и измеряли связывание на модуле HTS FACS CANTO-II.
Результаты: В приведенной ниже таблице показано связывание и перекрестная реактивность различных анти-Lag3 антител с клетками HEK293, экспрессирующими cynoLAG3, связывание или дано в % положительных клеток, или в геометрической средней интенсивности сигнала.

Связывание анти-Lag3 антител от tg кроликов с (активированными) МКПК/Т-клетками, экспрессирующими Lag3, яванского макака
После связывания с рекомбинантным белком Lag3 и Lag3, экспрессируемым рекомбинантно на клетках млекопитающих, также оценивали связывание с Lag3, экспрессированным на активированных Т-клетках яванского макака.
Характеристики связывания вновь созданных анти-Lag3 антител (полученных от трансгенных кроликов Roche) с Lag3, экспрессируемыми на клеточной поверхности Т-клеток или МКПК яванского макака, были подтверждены при помощи проточной цитометрии. Хотя Lag3 не экспрессируется на наивных Т-клетках, он активируется при активации и/или на истощенных Т-клетках. Таким образом, мононуклеарные клетки периферической крови (МКПК) яванского макака получали из свежей крови яванского макака и затем активировали путем предварительной обработки CD3/CD28 (1 мкг/мл) в течение 2-3 суток. Активированные клетки были впоследствии проанализированы на экспрессию Lag3: Вкратце, 1-3×105 активированных клеток окрашивали в течение 30-60 минут на льду указанными анти-Lag3 антителами и соответствующими контрольными антителами в конечной концентрации 10 мкг/мл. Связанные анти-Lag3 антитела обнаруживали с помощью конъюгированных с флуорохромом вторичных антител против IgG человека или вторичных антител против IgG кролика. После окрашивания клетки дважды промывали ФСБ/2% ФБС (фетальная телячья сыворотка) и анализировали на FACS Fortessa (BD).
Результаты: В следующей таблице приведен процент Lag3-положительных клеток в активированных МКПК яванского макака.

На активированных Т-клетках яванского макака все кроличьи анти-Lag3 антитела продемонстрировали значительное связывание с Lag3+ клетками. Таким образом, все вновь созданные антитела демонстрируют повышенный процент положительных клеток по сравнению с человеческими анти-Lag3 эталонными антителами (например, такими как MDX25F7, BMS-986016).
Ингибирование связывания LAG-3 с ГКГС-II, экспрессируемым на опухолевых клетках А375 человека (с помощью ИФА)
25 мкл/лунка клеток А375 (10000 клеток/лунка) высевали в 384-луночные планшеты, предназначенные для культуры ткани, (Corning, 3701) и инкубировали при 37°С в течение ночи. Анти-Lag3 антитела предварительно инкубировали в течение 1 часа с биотинилированным Lag3 (250 нг/мл) в среде для культивирования клеток в разведениях 1:3, начиная с концентрации антитела 3 мкг/мл. После удаления среды из лунок с засеянными клетками 25 мкл предварительно инкубированных смесей антитело-Lag3 переносили в лунки и инкубировали в течение 2 ч при 4°С. После промывки (1×90 мкл в PBST) клетки фиксировали добавлением 30 мкл/лунка глутаральдегида до конечной концентрации 0,05% (Sigma, кат. №: G5882), в течение 10 минут при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка поли-НКР40-стрептавидина (Fitzgerald, 65R-S104PHRPx) в разведении 1: 2000 или 1: 8000 и инкубировали при комнатной температуре в течение 1 часа. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата TMB (Roche, №11835033001) и инкубировали в течение 2-10 мин. Измерения проводили на приборе Tecan Safire 2 при 370/492 нм.
Ингибирование связывания LAG-3 с ГКГС-II, экспрессируемым на опухолевых клетках А375 человека (с помощью проточной цитометрии)
Принцип анализа: Для изучения антагонистической функции анти-Lag3 антител был проведен конкурентный анализ ГКГС-II: Lag3. ГКГС-II+ человеческие клетки A375 окрашивали биотинилированным слитым белком Lag3: Fc собственного производства с предварительной инкубацией или без предварительной инкубации с анти-Lag3 антителами. Данный анализ был изучен в конкурентном эксперименте с использованием проточной цитометрии: Клетки А375 (АТСС, № CRL-1619) культивировали в течение 2-3 пересевов в среде ЕМ Игла, дополненной солями Эрла (EBSS) (PAN, кат.№Р04-00509), 10% ФБС, 2 мМ L-глутамина и 1 × пирувата натрия Все антитела разводили в буфере для проточной цитометрии до конечной концентрации 20 мкг/мл в 25 мкл (в 96-луночных планшетах с U-образным дном). 25 мкл биотинилированного рекомбинантного слитого белка LAG-3: Fc собственного производства добавляли до конечной концентрации 10 мкг/мл или к среде, или к анти-Lag3 антителам или контролям и предварительно инкубировали в течение 30 мин при комнатной температуре. Клетки А375 промывали ФСБ и доводили до 3×106 клеток/мл в ФСБ. 100 мкл высевали на лунку в 96-луночный V-образный планшет. Планшеты центрифугировали и супернатант удаляли. Затем к клеткам добавляли предварительно инкубированную смесь слитого белка LAG-3: Fc/антитела (50 мкл/лунка) и инкубировали в течение 1 часа при комнатной температуре. После этого клетки промывали 200 мкл буфера для проточной цитометрии. Для обнаружения биотинилированного белка Lag3: Fc, связанного с клеточным ГКГС-II, использовали козье анти-биотиновое антитело, конъюгированное с АФК, в концентрации 3 мкл/образец (Miltenyi Biotec, кат. №130-090-856) и инкубировали в течение дополнительных 10-15 минут. После окрашивания клетки снова промывали и затем переносили в 150 мкл буфера для проточной цитометрии (ФСБ/2% ФБС) в U-образный планшет и анализировали на FACS Canto-II с использованием модуля HTS.
Два анти-Lag3 антитела (клоны 25F7 и 26Н10; Medarex) служили в качестве положительного контроля и IgG1 человека (Sigma, кат. №15154) в качестве подходящего изотипического контроля. Все антитела использовали в конечной концентрации 10 мкг/мл.
Результаты: В приведенной ниже таблице показан результат анализа методом проточной цитометрии, демонстрирующий процент ингибирования связывания белка Lag3 с ГКГС-II на клетках (рассчитанный как сниженный сигнал связывания по отношению к максимальному значению в отсутствии блокирующего антитела).


Эти данные подтверждают функциональное взаимодействие с Lag3 и блокирование клеточного взаимодействия всех тестируемых антител.
Нейтрализующая активность новых анти-Lag3 антител в стандартном биоанализе блокирования LAG3 Blockade Bio / репортерном анализе
Чтобы проверить нейтрализующую активность новых анти-Lag3 антител в восстановлении подавленного Т-клеточного ответа in vitro, использовали коммерчески доступную репортерную систему. Данная система состоит из эффекторных клеток Lag3+ NFAT Jurkat (Promega, кат.№CS194801), ГКГС-II + клеток Raji (АТСС, №CLL-86) и суперантигена. Короче говоря, система репортеров основана на трех этапах: (1) суперантиген-индуцированная активация клеток NFAT, (2) ингибирование активирующего сигнала, опосредованного ингибирующим взаимодействием между ГКГС-II (клетками Raji) и эффекторными клетками Lag3+ NFAT Jurkat, и (3) восстановление сигнала активации NFAT Lag3-антагонистами / нейтрализующими слитыми конструктами aVH-Fc.
Для этого эксперимента культивировали эффекторные Т-клетки Raji и Lag-3+ Jurkat / NFAT-luc2, как описано в инструкции поставщика. Серийные разведения (40 пг/мл-50 мкг/мл) нескольких aHTH-Lag3 и эталонных антител готовили в среде для анализа (RPMI 1640 (PAN Biotech, кат. №Р04-18047), 1% ФБС) в 96-луночных культуральных планшетах с плоским, белым дном (Costar, кат.№3917). 1×105 клеток Lag3+ NFAT-Jurkat/лунка) добавляли к раствору антитела. После этого этапа в смесь клеток Jurakt/антител добавляли 2,5×104 клеток Raji/лунка, а также суперантиген SED в конечной концентрации 50 нг/мл (Toxin technology, кат. №DT303). После инкубации в течение шести часов при 37°С и 5% CO2 субстрат Bio-Glo (Promega, №G7940) нагревали до комнатной температуры и добавляли 75 мкл на лунку, инкубировали в течение 5-10 минут, после чего измеряли общую люминесценцию на ридере Tecan Infinite в соответствии с рекомендациями производителя набора.
В таблице показано восстановление ГКГС-II/Lag3-опосредованного подавления сигнала NFAT-люциферазы различными анти-Lag3 антителами при стимуляции SED (дано в виде значений ЕС50):

Пример 9
Функциональная характеристика анти-LAG3 антител
В Таблице 13 обобщены биологическая активность и эффекты различных анти-LAG3 антител (по отдельности или в комбинации с анти-PD1 антителами) в различных анализах, как описано в данном документе.


Влияние блокирования PD-1 и LAG-3 на цитотоксическое высвобождение гранзима В и секрецию ИЛ-2 CD4 Т-клетками человека, совместно культивируемыми с аллогенными зрелыми дендритными клетками
Для скрининга анти-LAG-3 блокирующих антител в комбинации с анти-PD-1 в аллогенной обстановке был разработан анализ, в котором свежеочищенные CD4 Т-клетки совместно культивируют в течение 5 суток в присутствии аллогенных зрелых дендритных клеток, полученных из моноцитов, (зДК). Моноциты были выделены из свежих МКПК за одну неделю до этого путем адгезии к пластику с последующим удалением неприкрепленных клеток. Затем из моноцитов получали незрелые ДК путем культивирования их в течение 5 суток в среде, содержащей ГМ-КСФ (50 нг/мл) и ИЛ-4 (100 нг/мл). Чтобы вызвать созревание незрелых ДК, мы добавляли ФНО-альфа, ИЛ-1бета и ИЛ-6 (по 50 нг/мл каждый) в среду для культивирования в течение 2 дополнительных суток. Затем оценивали созревание ДК путем измерения на их поверхности экспрессии главного комплекса гистосовместимости класса II (ГКГС II), CD80, CD83 и CD86 с помощью проточной цитометрии (LSRFortessa, BD Biosciences).
В день минимальной реакции смешанной культуры лимфоцитов (мРСКЛ) CD4 Т-клетки обогащали с помощью набора с микрогранулами (Miltenyi Biotec) из 108 МКПК, полученных от неродственного донора. Перед культивированием CD4 Т-клетки метили 5 мкМ карбокси-флуоресцеин-сукцинимидиловым сложным эфиром (CFSE). 105 CD4 Т-клеток затем высевали в 96-луночный планшет вместе со зрелыми алло-ДК (5: 1) в присутствии или в отсутствии блокирующего анти-PD-1 антитела aPD1 (0376) (=PD1-0103-0312, как описано в данном документе ранее или в заявке РСТ РСТ/ЕР2016/073248) отдельно или в комбинации с химерными анти-LAG-3 антителами (aLAG3(0403) к aLAG(0418)) или эталонными антителами (гуманизированными ВАР050 (LAG525) и BMS 986016) в концентрации 10 мкг/мл. DP47 представляет собой несвязывающийся человеческий IgG с мутацией LALA в Fc-части, чтобы избежать распознавания FcγR, и его использовали в качестве отрицательного контроля.
Через пять суток супернатанты клеточных культур собирали и использовали для измерения уровней ИЛ-2 с помощью ИФА (R&D systems), и клетки оставляли при 37°С в течение дополнительных 5 часов в присутствии Golgi Plug (брефельдин А) и Golgi Stop (монензин). Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и фиксирующим красителем Aqua (Invitrogen) для прижизненного окрашивания/окрашивания мертвых клеток, после чего проводили фиксацию/пермеабилизацию в буфере Fix/Perm Buffer (BD Bioscience). Мы провели внутриклеточное окрашивание на гранзим В (BD Bioscience) и ИФН-γ (eBioscience). Результаты показаны на Фиг. 2А и 2В.
Влияние блокирования PD-1 и LAG-3 на цитотоксическое высвобождение гранзима В CD4 Т-клетками человека, совместно культивируемыми с лимфобластной В-клеточной линией (ARH77).
В функциональных исследованиях CD4 Т-клетки совместно культивировали с линией опухолевых клеток ARH77, лимфобластной В-клеточной линией, которая экспрессирует более низкие уровни PDL-1, чем зДК, чтобы лучше охарактеризовать вклад антагонизма LAG-3 в блокирование PD-1. Остальная часть экспериментальной установки и показания оставались неизменными по сравнению с мРСКЛ. Анти-LAG-3 антитела (aLAG3 (0414) и aLAG3 (0416), выбранные на основе их способности совместно секретировать ИЛ-2 и гранзим В в мРСКЛ) в комбинации с анти-PD-1 антителом, вызывали более значимое увеличение секреции гранзима В CD4 Т-клетками по сравнению с эталонными анти-LAG-3 антителами (гуманизированными ВАР050 (LAG525) и BMS 986016) (Р<0,05) и одним анти-PD-1 (Р<0,01), как продемонстрировано на Фиг. 3.
Влияние блокирования PD-1 и LAG-3 на Трег подавление высвобождения гранзима В и ИФН-γ CD4 Т-клетками человека, совместно культивируемыми с облученными аллогенными МКПК.
В функциональных исследованиях, включающих анализы подавления регуляторными Т-клетками (Трег), МКПК от одного и того же донора были разделены на две пробы: одна была обогащена CD4 Т-клетками, а другая - Трег, определенными как CD4+CD25high CD127low Т-клетками, с помощью набора микрогранул (Miltenyi Biotec). После очистки двух популяций CD4 Т-клетки метили 5 мкМ карбоксифлуоресцеин-сукцинимидилового эфира (CFSE), а Трег метили 5 мкМ Cell-Trace-Violet (CTV), чтобы потом можно было различить их при помощи проточной цитометрии.
Затем и CD4 Т-клетки (105), и Трег (105) совместно культивировали в 96-луночном планшете в соотношении 1: 1 вместе с облученными CD4-истощенными МКПК (105) от неродственного донора в присутствии или в отсутствии aHTH-LAG-3 антитела (aLAG3 (0414) и aLAG3 (0416) или эталонных анти-LAG-3 антител (гуманизированные ВАР050 (LAG525) и BMS 986016) в комбинации с анти-PD-1 антителом aPD1 (0376) в концентрации 10 мкг/мл. В качестве контроля для оценки величины подавления эффекторных функций CD4 Т-клеток при помощи Трег, CD4 Т-клетки (105) также культивировали совместно с облученными МКПК (105) в отсутствии Трег.
Через пять суток супернатанты клеточных культур собирали и использовали позже для измерения уровней ИФН-γ с помощью ИФА (R&D systems), и клетки оставляли при 37°С в течение дополнительных 5 часов в присутствии Golgi Plug (брефельдин А) и Golgi Stop (монензин). Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и фиксирующим красителем Aqua (Invitrogen) для прижизненного окрашивания/окрашивания мертвых клеток, после чего проводили фиксацию/пермеабилизацию в буфере Fix/Perm Buffer (BD Bioscience). Внутриклеточное окрашивание проводили на гранзим В (BD Bioscience) и ИФН-γ (eBioscience). Результаты показаны на Фиг. 4А и 4В.
Анти-LAG-3 антитела (aLAG3 (0414) и aLAG3 (0416), в комбинации с анти-PD-1 антителом aPD1(0376) (=PD1-0103-0312, из заявки РСТ РСТ/ЕР2016/073248) вызвали выход Ттип из жесткого контроля регуляторными Т-клетками, о чем свидетельствует секреция значительно более высокого количества гранзима В, чем Ттип, в присутствии только анти-PD-1 (Р<0,05) или в отсутствии ингибиторов контрольной точки (Р<0,001). Эталонные анти-LAG-3 антитела (гуманизированные ВАР050 (LAG525) и BMS 986016) в комбинации с анти-PD-1 не существенно сохраняли эффекторные функции Ттип от Трег подавления. Аналогичные результаты были получены для ИФН-γ, даже если разница не достигла статистической значимости только с 4 донорами.
Влияние блокирования PD-1 и LAG-3 на секрецию гранзима В и ИФН-γ CD4 Т-клетками из МКПК пациентов с меланомой после вторичного иммунного ответа с помощью иммуногенных пептидных пулов меланома-антиген.
Ранее было описано, что МКПК пациентов с меланомой содержат обнаруживаемую частоту неоантигенспецифических Т-клеток. Таким образом, для целей проверки концепции мы протестировали анти-LAG-3 антитело (0414) с анти-PD-1 по сравнению с одним анти-PD-l на МКПК пациентов с меланомой, повторно стимулированных в течение ночи иммуногенными пептидными пулами антигенов, ассоциированных с меланомой.
105-106 МКПК от пациентов с меланомой, которые инкубировали при комнатной температуре в присутствии или в отсутствии насыщающих концентраций (10 мкг/мл) с одним анти-PD-1 (0376), в комбинации с анти-LAG-3 антителом (aLAG3 (0414)=(0414), 10 мкг/мл). Затем Т-клетки повторно стимулировали в течение ночи пулом иммуногенных опухолевых антигенов, таких как MAGEA1, MAGEA3, MAGEA4, Melan-A/MART-1, NYESO-1, белок меланоцитов Pmel 17 gp100, тирозиназа, тирозиназа-зависимый белок 2 в присутствии ингибиторов транспорта белка Golgi Plug (брефельдина А) и Golgi Stop (монензина).
Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и фиксирующим красителем Aqua (Invitrogen) для прижизненного окрашивания/окрашивания мертвых клеток, после чего проводили фиксацию/пермеабилизацию в буфере Fix/Perm Buffer (BD Bioscience). Внутриклеточное окрашивание проводили на гранзим В (BD Bioscience) и ИФН-γ (eBioscience).
Комбинация анти-LAG-3 и анти-PD-1 антител(Р<0,01 и Р<0,001) значительно (Р<0,01 и Р<0,0001) усиливала специфические для опухолевого антигена эффекторные функции Т-клеток (т.е. секрецию гранзима В и ИФН-γ), в то время как только блокирование PD-1 не продемонстрировало никакого эффекта (данные не показаны).
Пример 10
Генерация и получение биспецифических анти-PD1/анти-LAG3 антител
10.1. Получение и экспрессия биспецифических антител, которые связываются с PD1 и LAG3 с обменом/заменой доменов VH/VL (CrossMAbVh-VL) в одном связывающем плече и с одиночными заряженными аминокислотными заменами на поверхности раздела CH1/CL
Мультиспецифические антитела, которые связываются с человеческим PD1 и человеческим LAG3, были получены с помощью классических методик молекулярной биологии, описанных в разделе общих способов, и транзиентно экспрессированы в 293F клеток Expi293F, как описано выше Мультиспецифические антитела 1+1 CrossMAbVh-Vl описаны также в WO 2009/080252. Мультиспецифические антитела были экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 14. Схематическая структура биспецифических антител 1+1 CrossMAbVh-Vl продемонстрирована на Фиг. 1А.


Для всех конструктов «выступы-в-отверстия» была использована технология гетеродимеризации с типичной заменой выступа (T366W) в первом домене СН3 и соответствующими заменами отверстий (T366S, L368A и Y410V) во втором домене СН3 (а также двумя дополнительными введенными остатками цистеина S354C/Y349'C) (содержится в соответствующих связанных последовательностях тяжелой цепи (НС), изображенных выше).
10.2. Получение и экспрессия мультиспецифических антител, которые связываются с PD1 и LAG3, с обменом/заменой доменов СН1/Ck (2+2 CrossMabCH1/Ck) в двух связывающих плечах и с заменами заряженных аминокислот на поверхностях раздела CH1/CL других
В данном примере мультиспецифические антитела, которые связываются с человеческим PD1 и человеческим TIM3, были получены с помощью классических методик молекулярной биологии, описанных в разделе общих способов, и транзиентно экспрессированы в 293F клеток Expi293F, как описано выше. Мультиспецифические антитела 2+2 CrossMAbCH1/Ck описаны также в WO 2010/145792. Мультиспецифические антитела были экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 15. Схематическая структура биспецифических антител 2+2 CrossMAbCH1/Ck продемонстрирована на Фиг. 1А.


10.3. Получение и экспрессия мультиспецифических антител, которые связываются с PD1 и LAG3, с обменом/заменой доменов СН1/Ck (2+1 CrossMabCH1/Ck) в одном связывающем плече (PD1 crossFab, слитое с С-концом тяжелой цепи выступа Fc), и с заряженными аминокислотными заменами на поверхностях раздела CH1/CL других
В данном примере мультиспецифические антитела, которые связываются с человеческим PD1 и человеческим TIM3, были получены с помощью классических методик молекулярной биологии, описанных в разделе общих способов, транзиентно экспрессированы в 293F клеток Expi293F, как описано выше. Мультиспецифические антитела 2+1 CrossMAbCH1/Ck описаны также в WO 2013/026831. Мультиспецифические антитела были экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 16. Схематическая структура биспецифических антител 2+1 CrossMAbCH1/Ck продемонстрирована на Фиг. 1В.

Альтернативно, PD1 crossFab, слитое с С-концом тяжелой цепи с выступом Fc, может быть заменен одноцепочечным Fab (scFab). Такие мультиспецифические 2+1 антитела, содержащие scFab, описаны также в WO 2010/136172 и могут быть экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 17. Схематическая структура биспецифических антител 2+1 с scFab, слитым на С-конце тяжелой цепи с выступом Fc, продемонстрирована на Фиг. 1С.

10.4. Получение и экспрессия мультиспецифических антител, которые связываются с PD1 и LAG3 с VH/VL, каждый из которых слит на С-конце тяжелых цепей (формат 2+1 PRIT)
В данном примере мультиспецифические антитела, которые связываются с человеческим PD1 и человеческим TIM3, были получены с помощью классических методик молекулярной биологии, описанных в разделе общих способов, и транзиентно экспрессированы в 293F клеток Expi293F, как описано выше. Данный тип мультиспецифических 2+1 антител также описан в WO 2010/115589. Мультиспецифические антитела были экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 18. Схематическая структура биспецифических антител типа 2+1 PRIT продемонстрирована на Фиг. 1D.

10.5. Получение и экспрессия мультиспецифических антител, которые связываются с PD1 и LAG3 с обменом/заменой доменов VH/VL (формат 1+1 CrossMabVH/VL транс) в одном связывающем плече и с заменами заряженных аминокислот на поверхностях раздела CH1/CL LAG3 Fab, слитого с С-концом тяжелой цепи с отверстием Fc
Были получены мультиспецифические антитела, которые моновалентно связываются как с человеческим PD1, так и с человеческим LAG3, причем Fab LAG3 слит через свой вариабельный домен тяжелой цепи с С-концом одной из тяжелых цепей, предпочтительно тяжелой цепи с отверстием Fc. Молекулы были получены с помощью классических методик молекулярной биологии, описанных в разделе общих способов, и транзиентно экспрессированы в 293F клеток Expi293F, как описано выше. Мультиспецифические антитела были экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 19. Схематическая структура биспецифических антител типа 1+1 CrossMabVH/VL транс продемонстрирована на Фиг. 1H.

10.6. Получение и экспрессия мультиспецифических антител, которые связываются с PD1 и LAG3 с обменом/заменой доменов VH/VL (формат 2+1 CrossMabVH/VL транс) в одном связывающем плече и с заменами заряженных аминокислот на поверхностях раздела CH1/CL двух LAG3 Fab, один из которых слит с С-концом тяжелой цепи с отверстием Fc
Были получены мультиспецифические антитела, которые моновалентно связываются с человеческим PD1 и двухвалентно связываются с человеческим LAG3, причем Fab LAG3 слит через свой вариабельный домен тяжелой цепи с С-концом одной из тяжелых цепей, предпочтительно тяжелой цепи с отверстием Fc. Молекулы были получены с помощью классических методик молекулярной биологии, описанных в разделе общих способов, и транзиентно экспрессированы в 293F клеток Expi293F, как описано выше. Мультиспецифические антитела были экспрессированы с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, приведенные в Таблице 20. Схематическая структура биспецифических антител типа 2+1 CrossMabVH/VL транс продемонстрирована на Фиг. 1I.

10.7 Очистка и характеристика мультиспецифических антител, которые связываются с PD1 и TIM3
Экспрессированные ранее мультиспецифические антитела очищали от супернатанта с помощью комбинации аффинной хроматографии с белком А и эксклюзионной хроматографии. Все мультиспецифические антитела могут быть получены с хорошими выходами и являются стабильными. Полученные продукты были охарактеризованы в отношении идентичности с помощью масс-спектрометрии и аналитических свойств, таких как чистота при помощи ДСН-ПААГ-электрофореза, содержание мономеров и стабильность.
Масс-спектрометрия
Ожидаемые первичные структуры были проанализированы с помощью масс-спектрометрии с ионизацией электрораспылением (ИЭР-МС) дегликозилированных интактных CrossMab и дегликозилированным / расщепленных плазмином или альтернативно дегликозилированных / ограниченно расщепленных LysC CrossMab.
CH1/Ck CrossMab подвергали дегликозилированию N-глюкозидазой F в фосфатном буфере или трис-буфере при 37°С в течение до 17 часов при концентрации белка 1 мг/мл. Расщепление плазмином или ограниченное расщепление LysC (Roche) проводили с использованием 100 мкг дегликозилированных CH1/Ck CrossMab в трис-буфере, рН 8, при комнатной температуре в течение 120 часов и при 37°С в течение 40 минут, соответственно. Перед масс-спектрометрией образцы обессоливали с помощью ВЭЖХ на колонке с сефадексом G25 (GE Healthcare). Общая масса была определена при помощи ИЭР-МС на системе MS MAXIS 4G UHR-QTOF (Bruker Daltonik), оснащенной источником TriVersa NanoMate (Advion).
Стабильность мультиспецифических антител
Чтобы оценить стабильность конструктов антител, термическую стабильность, а также температуры начала агрегации оценивают в соответствии со следующей процедурой. Образцы указанных антител готовят в концентрации 1 мг/мл в 20 мМ гистидин/гистидинхлорид, 140 мМ NaCl, рН 6,0, переносят в 10 мкл микрокювету и регистрируют данные статического рассеяния света, а также данные флуоресценции при возбуждении лазером с длиной волны 266 нм с помощью прибора Optim1000 (Avacta Inc.), в то время как образцы нагревают со скоростью 0,1°С/мин от 25°С до 90°С.
Температура начала агрегации (Tagg) определяется как температура, при которой интенсивность рассеянного света начинает увеличиваться. Температура плавления (Tm) определяется как инфлексная точка на графике зависимости интенсивности флуоресценции от длины волны.
Пример 11
Характеристика биспецифических анти-PD1/анти-LAG3 антител 11.1 Анализ связывания при помощи ИФА
ИФА для hu PD1
Покрытые стрептавидином планшеты Nunc maxisorp (MicroCoat, №11974998001), покрывали 25 мкл/лунка биотинилированного PD1-ECD-AviHis в концентрации 500 нг/мл и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл образцов анти-PD1 антител в возрастающих концентрациях и инкубировали в течение 1 часа при комнатной температуре. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл/лунка козьего античеловеческого Н+L-POD (JIR, JIR109-036-098) в разведении 1: 5000 и инкубировали при комнатной температуре в течение 1 ч на шейкере. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, 11835033001) и инкубировали до достижения ОП 2-3. Измерение проводили при 370/492 нм.
Клеточный ИФА для PD1 человека
Адгезивную клеточную линию СНО-K1, стабильно трансфицированную плазмидой 15311_hPD1-fl_pUC_Neo, кодирующей полноразмерный человеческий PD1, и селекцию G418 (маркер устойчивости к неомицину в плазмиде) высевали в концентрации 0,01×10Е6 клеток/лунка в 384-луночные планшеты с плоским дном и культивировали в течение ночи.
На следующие сутки добавляли 25 мкл/лунка образца PD1 или эталонного антитела против PD1 человека (Roche)/ против PD1 мыши (Biolegend; кат.:329912) и инкубировали в течение 2 часов при 4°С (чтобы избежать интернализации). После тщательной промывки (1 × 90 мкл/лунка PBST) клетки фиксировали, добавляя 30 мкл/лунка 0,05% глутаральдегида (Sigma, кат. №: G5882, 25%), разведенного в буфере 1× ФСБ, и инкубировали в течение 10 минут при комнатной температуре. После промывки (3×90 мкл/лунка PBST) для обнаружения добавляли 25 мкл/лунка вторичного антитела: козьего античеловеческого H+L-POD (JIR, JIR09-036-088)/овечьего антимышиного POD (GE NA9310) с последующей 1-часовой инкубацией при комнатной температуре на шейкере. После промывки (3×90 мкл/лунка PBST) добавляли 25 мкл/лунка раствора субстрата ТМВ (Roche 11835033001) и инкубировали до достижения ОП 1,0-2,0. Измерение в планшетах проводили при 370/492 нм.
Результаты клеточного ИФА приведены в виде значений «ЭК50 СНО-PD1» [нМ] в Таблице 21 ниже.
ИФА для Lag3 человека
Планшеты Nunc Maxisorp (Nunc 464718) покрывали 25 мкл/лунка рекомбинантного химерного белка человеческого LAG-3 Fc (R&D Systems, 2319-L3) при концентрации белка 800 нг/мл и инкубировали при 4°С в течение ночи или в течение 1 ч при комнатной температуре. После промывки (3×90 мкл/лунка буфером PBST) каждую лунку инкубировали с 90 мкл блокирующего буфера (ФСБ+2% БСА+0,05% Твин-20) в течение 1 часа при комнатной температуре. После промывки (3×90 мкл/лунка буфером PBST) добавляли 25 мкл образцов анти-Lag3 в концентрации 1-9 мкг/мл (разведения 1: 3 в буфере OSEP) и инкубировали 1 ч при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка конъюгата HRP с козьим антителом против κ-цепи человеческого Ig (Milipore, АР502Р) в разведении 1: 2000 и инкубировали при комнатной температуре в течение 1 часа. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, 11835033001) и инкубировали в течение 2-10 мин. Измерения проводили на приборе Tecan Safire 2 при 370/492 нм.
ИФА для связывания Lag3 на клеточной поверхности
25 мкл/лунка Lag3 клеток (рекомбинантные клетки СНО, экспрессирующие Lag3, 10000 клеток/лунка) высевали в 384-луночные планшеты, предназначенные для культуры ткани, (Corning, 3701) и инкубировали при 37°С в течение одних или двух суток. На следующие сутки после удаления среды добавляли 25 мкл образцов анти-Lag3 (разведения 1: 3 в буфере OSEP, начиная с концентрации 6-40 нМ) и инкубировали в течение 2 часов при 4°С.После промывки (1×90 мкл в PBST) клетки фиксировали добавлением 30 мкл/лунка глутаральдегида до конечной концентрации 0,05% (Sigma, кат.№: G5882), в течение 10 минут при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка конъюгата HRP с козьим антителом против κ-цепи человеческого Ig (Milipore, АР502Р) в разведении 1: 1000 и инкубировали при комнатной температуре в течение 1 часа. После промывки (3 × 90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, 11835033001) и инкубировали в течение 6-10 мин. Измерения проводили на приборе Tecan Safire 2 при 370/492 нм. Результаты клеточного ИФА приведены в виде значений «ЭК50 CHO-LAG3» [нМ] в Таблице 21 ниже.
Ингибирование связывания LAG-3 с ГКГС-II, экспрессируемым на опухолевых клетках А375 человека (с помощью ИФА)
25 мкл/лунка клеток А375 (10000 клеток/лунка) высевали в 384-луночные планшеты, предназначенные для культуры ткани, (Corning, 3701) и инкубировали при 37°С в течение ночи. Анти-Lag3 антитела предварительно инкубировали в течение 1 часа с биотинилированным Lag3 (250 нг/мл) в среде для культивирования клеток в разведениях 1: 3, начиная с концентрации антитела 3 мкг/мл. После удаления среды из лунок с засеянными клетками 25 мкл предварительно инкубированных смесей антитело-lag3 переносили в лунки и инкубировали в течение 2 ч при 4°С.После промывки (1×90 мкл в PBST) клетки фиксировали добавлением 30 мкл/лунка глутаральдегида до конечной концентрации 0,05% (Sigma кат. №: G5882), в течение 10 минут при комнатной температуре. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка поли-HRP40-стрептавидина (Fitzgerald, 65R-S104PHRPx) в разведении 1: 2000 или 1: 8000 и инкубировали при комнатной температуре в течение 1 часа. После промывки (3×90 мкл/лунка с буфером PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, 11835033001) и инкубировали в течение 2-10 мин. Измерения проводили на приборе Tecan Safire 2 при 370/492 нм. Результаты анализа ингибирования при помощи ИФА приведены в виде значений «ЭК50 ГКГС II/ ИФА» [нМ] в Таблице 21 ниже.

11.2 Связывание при помощи Biacore
Антигенсвязывающие свойства мультиспецифических антител, которые связываются с PD1 и LAG3
Связывание мультиспецифических антител с их соответствующими целевыми антигенами, т.е. PD1 и TIM3, оценивали с помощью Biacore®.
Связывание PD1 может быть оценено в соответствии со следующей процедурой:
Античеловеческий Fc IgG был иммобилизован путем присоединения амина к поверхности сенсорного чипа СМ5 (Biacore). Затем проводили захват образцов и связывание с ними hu PD1-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. В результате получали константу равновесия и кинетические константы скорости путем подгонки данных к модели взаимодействия Ленгмюра 1:1.
Около 10000 единиц ответа (ЕО) 20 мкг/мл античеловеческого IgG (GE Healthcare №BR-1008-39) были связаны со всеми проточным ячейкам сенсорного чипа СМ5 в Biacore Т200 с использованием набора для аминного сопряжения, поставляемого GE Healthcare. Образец и прогоночный буфер представляли собой HBS-EP + (0,01 М ГЭПЭС, 0,15 М NaCl, 3 мМ ЭДТА, 0,05% об./об. ПАВ Р20, рН 7,4). Температура проточной ячейки была установлена на 25°С, а температура в отсеке для образца - 12°С.Система была заполнена прогоночным буфером.
Различные образцы вводили в течение 15 секунд с концентрацией 10 нМ и последовательно связывали с проточными ячейками 2, 3 и 4. Затем полный набор концентраций человеческого PD1-ECD (300 нМ, 100 нМ, 2×33,3 нМ, 11,1 нМ, 3,7 нМ, 1,2 нМ и 2×0 нМ)) вводили в каждый образец в течение 300 с, после чего время диссоциации составляло 10/ 600 с и две стадии регенерации по 30 секунд с 3 М MgCl2, из которых на последней была «дополнительная промывка после инъекции» с прогоночным буфером. В результате данные двойного контроля были аппроксимированы к модели взаимодействия Ленгмюра 1:1 с использованием программного обеспечения Biacore Т200 Evaluation.
Связывание LAG3 оценивали в соответствии со следующей процедурой:
Для выполнения данного анализа использовали набор Biacore SA САР, обеспечиваемый GE Healthcare. Значения кинетических параметров были получены при 25°С в буфере HBS-EP+ (Ge Healthcare).
Чип SA САР был закреплен в Biacore Т200, как предписано в руководстве к набору САР. Метод прогона содержит четыре команды. Сначала реагент САР вводили в течение 300 с при скорости потока 10 мкл/мин для гибридизации иммобилизованных одноцепочечных ДНК с использованием команды «General». За этой командой следует 15-секундная инъекция разведения 1 мкг/мл внеклеточного домена, меченного биотинилированным человеческим Fc Lag3 человека, в прогоночном буфере. Это приводит к уровню захвата около 50 ЕО. Одноцикловую команду использовали для введения пяти различных концентраций образца (100 нМ - 6,25 нМ, 2-кратное разбавление) с последующей фазой диссоциации длительностью 1200 секунд. Затем чип был регенерирован, как предписано в руководстве к набору SA САР.
Наконец, полученные кривые были оценены с использованием программного обеспечения Biacore Т200 Evaluation версии 3.0.
Результаты: Взаимодействия не соответствовали модели связывания Ленгмюра 1:1, потому что все образцы, кроме 0799 и 0927, имеют два Lag3-связывающих фрагмента и, следовательно, демонстрируют авидность. Так как 0799 и 0927 содержали небольшие ошибки спаривания, пример популяции бивалента, они также демонстрировали некоторую авидность.
Поэтому сенсограммы были ранжированы только в соответствии с их скоростью диссоциации. Это было сделано путем визуального сравнения одноцикловых кинетических кривых. При этом было показано, что комплекс 0416-Lag3 ECD более стабилен, чем любой другой в этом наборе образцов. Моновалентный формат
Кроме того, было видно, что аффинный комплекс Lag3-0414/Lag3-0927 - Lag3 ECD является самым слабым из наблюдаемых в данном эксперименте. Аффинно-связывающие участки 0414 и 0416 примерно сопоставимы с аффинными участками их одновалентных встречных участков 0927 и 0799 Crossmab. Результаты приведены в Таблице 22.


Оценка авидности форматов транс по сравнению с 1+1 биспецифическими антителами 0927 и 0799:
Константы диссоциации биспецифических молекул (образец) и их отдельных мишеней, а также комбинации PD1 и LAG3 (аналит) были определены для оценки прироста авидности, обеспечиваемой связыванием со всеми валентностями одновременно.
Перед измерением на Biacore 8K был подготовлен сенсорный чип СМ5 с использованием стандартного набора для аминного соединения, предлагаемого GE Healthcare. Полученное в результате собственного производства антитело, направленное против специфической мутации в Fc-части образца (т.е. Fc-части, несущей мутации PGLALA), называемое в данном документе анти-PGLALA антителом (такие антитела описаны в WO 2017/072210), тем не менее было разбавлено до концентрации 50 мкг/мл в ацетатном буфере рН 5,0. Оно было связано всеми проточными ячейками и каналами со скоростью потока 8 мкл/мин в течение 1200 с, что привело к отклику связывания около 19000 ЕО.
Буфер HBS-EP+ (GE НС) использовали в качестве прогоночного буфера для подготовки сенсорного чипа, а также самого основного цикла. Анализ начинали после запуска, состоящего из трех 17-секундных инъекций образца с последующим этапом регенерации с использованием 10 мМ раствора NaOH. На первом этапе различные образцы были захвачены анти-PGLALA антителом на двух отдельных канальных проточных ячейках на поверхности сенсорного чипа путем инъекции его в течение 17 с при скорости потока 10 мкл/мин. Во-вторых, одно из трех анализируемых веществ (PD1, LAG3-Fc, слияние 2+2 PD1/LAG3-Fc) инъецировали в обе проточные ячейки в течение 200 с при скорости потока 50 мкл/мин, за которой следовал промежуток 1000 с (600 с в случае LAG3-Fc) фазы диссоциации. Наконец, комплекс анти-PGLALA антитело/образец растворяли двумя последовательными инъекциями (длительностью 30 с) 10 мМ NaOH. Каждое отдельное кинетическое определение состояло из четырех циклов с различными концентрациями аналита (0 нМ, 5 нМ, 25 нМ и 100 нМ).
Полученные данные были оценены с использованием программного обеспечения Biacore 8K Evaluation Software. Была применена соответствующая диссоциации 1:1, и полученные значения kd были преобразованы в комплекс периода полужизни в минутах. Разница между авидным связыванием связывающей молекулы слитого антигена PD1/Lag3-Fc, и ее основной конкретной части (или PD1, или Lag3) была рассчитана и отсортирована по одной из трех категорий, описывающих прирост стабильности при мультивалентном и биспецифическом связывании (Таблица 23).

11.3. Димеризация клеточного PD1 и LAG3 после одновременного взаимодействия посредством биспецифических анти-PD1/анти-LAG3 биспецифических антител
Биспецифические анти-PD1/анти-LAG3 антитела получали в различных форматах, как описано в Примере 10. Этот клеточный анализ использовали для демонстрации димеризации или, наконец, связывания/взаимодействия двух разных рецепторов, которые цитозольно слиты с двумя фрагментами фермента, при лигировании или перекрестном связывании с биспецифическим антителом против обеих мишеней. Таким образом, только один рецептор не проявляет ферментативную активность. Для этого специфического взаимодействия цитозольные С-концы обоих рецепторов по отдельности были слиты с гетерологичными субъединицами репортерного фермента. Одна только субъединица фермента не проявляла репортерную активность. Однако ожидалось, что одновременное связывание конструкта биспецифического анти-PD1/анти-LAG3 антитела с обоими рецепторами приведет к локальному цитозольному накоплению обоих рецепторов, комплементации двух субъединиц гетерологичного фермента и, наконец, к образованию специфического и функционального фермента, который гидролизует субстрат, тем самым генерируя хемилюминесцентный сигнал.
Чтобы проанализировать эффект перекрестного связывания биспецифических анти-PD1/анти-LAG3 антител, 10000 PD1+ LAG3+ человеческих клеток U2OS/лунка высевали в белые 96-луночные планшеты с плоским дном (costar, кат. №3917) и культивировали в течение ночи в среде для анализа. На следующий день клеточную среду удаляли и заменяли свежей средой. Готовили разведения антител или лигандов и добавляли титрованные количества указанных (биспецифических) антител и инкубировали при 37°С в течение 2 часов. Затем добавляли смесь субстрат/буфер (например, реагент для обнаружения PathHunterFlash) и снова инкубировали в течение 1 часа. Для измерения хемолюминесценции, индуцированной при одновременном связывании и димеризации, использовали множественный ридер Tecan.
Результаты показаны на Фиг. 5А и 5В. На графике показана хемилюминесценция (измеренная в ЕО) в зависимости от концентрации антитела. Моноспецифические (бивалентные) анти-LAG3 антитела не способны вызывать хемилюминесцентный сигнал, тогда как все биспецифические анти-PD1/анти-LAG3 антитела индуцируют хемолюминесцентный сигнал в зависимости от концентрации.
Чтобы показать специфичность одновременного связывания (и индукции сигнала люминесценции), был проведен конкурентный эксперимент: Как показано перед обработкой биспецифическим антителом (1252), индуцировался сигнал люминесценции в зависимости от дозы (Фиг. 5С). Если одно и то же биспецифическое антитело вносилось в присутствии или антитела aLAG3 (0156, MDX25F7), или анти-PD1 антитела (0376), сигнал был или почти ингибирован (для конкуренции PD1), или по меньшей мере значительно снижен (LAG3). Оба родительских антитела представляют собой те же связывающие вещества, что и биспецифические антитела (1252, формат 2+1 LAG3/PD1). Каждое из конкурирующих антител вводили в постоянной концентрации 20 м кг/мл.
Результаты дальнейшего эксперимента продемонстрированы на Фиг. 5D. Подобно предыдущему конкурентному эксперименту, инкубация с исходными антителами aLAG3 (0156) или PD1 (0376; каждое постоянно в концентрации 10 мкг/мл) оказывала влияние на свойства связывания биспецифического антитела (1252, формат 2+1 биспецифического aLAG3-0156 и PD1-0376) для PD1 клеток с двойной экспрессией Lag3, измеренных по сигналу люминесценции. Конкуренция с анти-PD1 антителом (0376), а также с рекомбинантным белком LAG3: Fc (0160) практически устраняла сигнал, тогда как присутствие единственного связывающего вещества aLAG3 (0156) приводило только к частичному ингибированию. Два других анти-LAG3 антитела 0414 и 0416, которые связываются с эпитопом, отличным от 0156, не конкурировали за связывание с биспецифическим антителом, содержащим связывающее вещество aLAG3 (0156), потому что они не модулировали сигнал значительно.
В следующем эксперименте сравнивали одновременное связывание биспецифических анти-LAG3/анти-PD1 антител, содержащих различное связывающее вещество aLAG3 (0414 против 0416) и разные форматы (1+1 в сравнении с 2+1) (Фиг. 6A-6D). Как описано выше, было протестировано несколько анти-LAG3/анти-PD1 биспецифических антител или в формате 1+1 CrossMab (0799 и 0927), или в формате 2+1 (два Lag3-связывающих плеча и один слитый С-концевой PD1 crossFab-фрагмент: 8311 и 8310). На Фиг. 6А и 6В продемонстрированы кривые (поглощение в зависимости от концентрации) для конструктов со связующим веществом aLAG3-0416, а на Фиг. 6С и 6D кривые для соответствующих конструктов с соединением aLAG4-0414. Все протестированные конструкты были способны связываться с клетками и вызывать хемолюминесценцию. Рассчитанные значения ЕС50 для кривых связывания приведены в Таблице 24 ниже.

В другом эксперименте сравнивали одновременное связывание биспецифических анти-LAG3/анти-PD1 антител, содержащих другое связывающее вещество aLAG3 (0414 в сравнении с 0416) и разные форматы (2+1 в сравнении с 2+2) (Фиг. 7A-7D). Были протестированы биспецифические анти-LAG3/анти-PD1 антитела в формате 2+1 (два LAG3-связывающих плеча и один слитый с С-концом PD1 crossFab-фрагмент: 8311 и 8310) или в формате 2+2 crossmab (два LAG3-связывающих плеча и два слитых с С-концом PD1 crossFab-фрагмента: 8970 и 8984). На Фиг. 7А и 7В продемонстрированы кривые (поглощение в зависимости от концентрации) для конструктов со связующим веществом aLAG3-0414, а на Фиг. 7С и 7D кривые для соответствующих конструктов с соединением aLAG4-0416. Все протестированные конструкты были способны связываться с клетками и вызывать хемолюминесценцию. Рассчитанные значения ЕС50 для кривых связывания приведены в Таблице 25 ниже.

В следующем эксперименте одновременное связывание биспецифического анти-LAG3/анти-PD1 антитела PD1/LAG3 0927 в классическом формате 1+1 CrossMAbVh-VL сравнивали с биспецифическими анти-LAG3/анти-PD1 антителами в формате транс 1+1 (PD1/LAG3 0725) и формате транс 2+1 (PD1/LAG3 0750). Для этого эксперимента были применены следующие изменения в способе. Чтобы проанализировать эффект перекрестного связывания различных форматов анти-LAG3/анти-PD1 антител, 7500 PD1+LAG3+ клеток U2OS человека/лунка высевали в белые 96-луночные планшеты с плоским дном вместе с непоследовательными разведениями антител (окончательный вариант) концентрации от 0,29 до 5484 пМ) и инкубировали в течение 20 ч при 37°С в СО2-инкубаторе. Затем планшеты для анализа доводили до комнатной температуры и добавляли смесь субстрат/буфер (реагент для обнаружения PathHunterFlash, Discoverx) и снова инкубировали в течение 4 часов. Для измерения хемилюминесценции, индуцированной при одновременном связывании и димеризации, использовали планшет-ридер SpectraMax L (Molecular Devices).
На Фиг. 7Е кривые зависимости доза-ответ (люминесценция от концентрации) биспецифических антител PD1-LAG3 1+1 CrossMab (0927), 1+1 транс-CrossMab с N-концевым aPD1 и С-концевым aLAG3 (0725), а также 2+1 транс CrossMab с N-концевым aPD1 и N-плюс С-концевым aLAG3 (0750). По сравнению с PD1/LAG3 0927 эффект перекрестного связывания рецептора LAG3 PD1 у PD1/LAG3 0725 явно выше, тогда как эффект для PD1/LAG3 0750 немного ниже.
11.4. Измерение биспецифических вариантов анти-LAG3/анти-PD1 транс-CrossMab в комбинированном репортерном анализе PD-1 и LAG-3
Чтобы проверить нейтрализующую активность различных форматов анти-PD1-LAG3 антител при восстановлении подавленного Т-клеточного ответа in vitro, использовали коммерчески доступную репортерную систему. Комбинированный биоанализ PD1&LAG3 состоит из репортерных клеток, экспрессирующих PD1-, LAG3- и Т-клеточный рецептор (ТКР), ГКГС-II- и PDL1-экспрессирующих опухолевых клеток и ТКР-активирующего антигена.
Эффекторными клетками являются Т-клетки Jurkat, экспрессирующие человеческий PD1, человеческий LAG3, человеческий ТКР и репортер люциферазы, регулируемый элементом ответа NFAT (NFAT-RE). Целевыми клетками являются клетки А375, экспрессирующие человеческий PD-L1. Короче говоря, система репортеров основана на трех этапах: (1) ТКР активированной антиген-индуцированной активации NFAT-клеток, (2) ингибировании активирующего сигнала, опосредованного взаимодействием между ГКГСII (клетки A375) и LAG3 + (клетки Jurkat), а также PD-L1 (клетки A375) и PD1 (клетки Jurkat) и (3) восстановлении сигнала активации NFAT с помощью PD1 и LAG3-антагонистических/нейтрализующих антител.
Для этого эксперимента 1×104 целевых клеток A375 на лунку инкубировали в течение ночи с активирующим ТКР антигеном (Promega) в 96-луночных планшетах для анализа с плоским дном в CO2-инкубаторе при 37°С. Затем среду из планшетов удаляли и добавляли серийные разведения (конечная концентрация для анализа от 0,01 нМ до 857 нМ) анти-LAG3/анти-PD1 антител, а также 5×104 эффекторных клеток Jurkat на лунку. После 6 часов инкубации при 37°С в СО2-инкубаторе аналитические планшеты доводили до комнатной температуры и в каждую лунку добавляли 80 мкл субстрата ONE-Glo Ex (Promega). После 10 мин инкубации люминесценцию измеряли в планшет-ридере SpectraMax L (Molecular Devices). Ожидалось, что одновременное связывание конструкта биспецифического анти-PD1/анти-LAG3 антитела с обоими рецепторами приведет к локальному цитозольному накоплению обоих рецепторов, комплементации двух гетерологичных субъединиц фермента и, наконец, к образованию специфического и функционального фермента, который гидролизует субстрат, тем самым генерируя хемилюминесцентный сигнал. На Фиг. 7F изображены кривые зависимости доза-ответ (люминесценция в зависимости от концентрации) биспецифических анти-PD1/анти- LAG3 антител 1+1 CrossMab (0927), 1+1 транс-CrossMab с N-концевым aPD1 и С-концевым aLAG3 (0725), а также 2+1 транс CrossMab с N-концевым aPD1 и N-плюс С-концевым aLAG3 (0750). Способность 0927 и 0725 восстанавливать активацию репортерных клеток путем блокирования взаимодействия PD1 и LAG3 с их соответствующими лигандами сопоставима, тогда как для 0750 она выше. Это также продемонстрировано значениями ЕС50, приведенными в Таблице 26.

Пример 12
Функциональная характеристика биспецифических анти-PD1/анти-LAG3 антител
12.1. Снижение интернализации при связывании с поверхностью Т-клеток
Измерение интернализации рецепторов проточной цитометрией
Интернализация рецепторов представляет собой важное поглощение для молекулы, которая может разлагаться в течение нескольких часов, в то время как целевые рецепторы быстро повторно экспрессируются на поверхности клетки, готовой ингибировать ТКР-сигналинг. Поэтому мы оценили интернализацию рецепторов при связывании наших конструктов при помощи проточной цитометрии, где образцы, окрашенные различными биспецифическими форматами при 4°С, использовали в качестве эталона для сравнения с образцами, инкубированными при 37°С в течение 3 часов после окрашивания при 4°С.
Поликлонально активированные CD4 Т-клетки на третьи сутки, предварительно культивированные с 1 мкг/мл связанного в планшете анти-CD3 и 1 мкг/мл растворимых анти-CD28 антител, инкубировали в присутствии анти-LAG3 или биспецифических анти-PD1/анти-LAG3 антител (в двух повторностях) в течение 30 минут при 4°С. Затем клетки отмывали, разделяли на две группы, одну из которых инкубировали в течение 3 дополнительных часов при 37°С, а другую немедленно окрашивали меченым вторичным антителом (eBioscience) перед фиксацией с помощью BD Cell Fix. После 3-часовых инкубации также вторую группу клеток окрашивали меченым вторичным антителом перед фиксацией. После окрашивания клетки дважды промывали ФСБ / 2% ФБС перед регистрацией.
Клетки были получены в LSRFortessa (BD Biosciences), и уровни экспрессии детектируемого антитела на клеточной поверхности сравнивались между двумя группами. Результаты показаны на Фиг. 8В. Мы наблюдали, что через 3 часа все биспецифические форматы, а также моноспецифическое двухвалентное антитело aLAG-3 были интернализованы, однако биспецифические анти-PD1/анти-LAG3 в формате 1+1 (PD1/LAG3 0799 и PD1 / LAG3 0927) были наименее интернализованы.
Визуализация локализации и интернализации антител с помощью флуоресцентной конфокальной микроскопии
Активированные CD4-положительные клетки окрашивали CMFDA (Invitrogen) и помещали на круглые покровные стекла, обработанные ретронектином (Takara Bio). Клеткам давали для адгезии 4 часа при 37°С перед мечением флуоресцентными антителами (1 мкг/мл: a-LAG3 (1256), 1+1 PD1/LAG3 биспецифические (0927), PD1-LAG3 1+2 биспецифические (8310) и PD1-LAG3 2+2 биспецифические (8970), меченные Alexa 647), добавляли непосредственно в питательную среду в течение различных периодов времени (15 минут, 1 час и 3 часа). Холодный ФСБ (Lonza) использовали для гашения реакции и вымывания несвязанных антител. Затем клетки фиксировали с помощью Cytofix (BD) в течение 20 минут при 4°С и дважды промывали ФСБ (Lonza). Затем покровные стекла переносили и монтировали на предметные стекла с помощью Fluoromount G (eBioscience) и выдерживали в темноте при 4°С в течение ночи перед получением изображения. А) Флуоресцентные изображения продемонстрированы на Фиг. 9А. Белый сигнал представляет локализацию меченого антитела. В) Интенсивность флуоресцентного сигнала от мембранной ROI (области представляющей интерес) целевых клеток была разделена на интенсивность флуоресцентного сигнала от ROI цитоплазмы тех же клеток, что привело к соотношению, отображаемому на диаграммах. Для сравнения образцов использовали однофакторный дисперсионный анализ с методом наименьшей значимой разности Фишера) (*=р<0,05; **=р<0,01). Результаты показаны на Фиг. 9В. Анализ во времени демонстрирует более высокую мембранную локализацию биспецифических антител и антител к LAG3 по сравнению с внутриклеточной кластеризацией антител к TIM3 (используется в качестве контроля). Мы наблюдали, что через 3 часа все биспецифические форматы, а также моноспецифическое двухвалентное антитело aLAG-3 были интернализованы, за исключением только биспецифического 1+1 PD1/LAG3 (0927) (Фиг. 9А).
Флуоресцентную конфокальную микроскопию выполняли на инвертированном LSM 700 Zeiss с масляно-иммерсионным объективом при 60-кратном увеличении. Изображения собирали с использованием программного обеспечения Zen (Zeiss), подключенного к микроскопу. Анализ изображений проводили с помощью программного обеспечения Imaris (Bitplane; Oxford Instrument), а статистический анализ выполняли с помощью программного обеспечения GraphPad Prism (Graphpad Software).
12.2. Связывание с типичными Т-клетками в сравнении с Трег
Желаемое свойство целевых PD1-LAG3 биспецифических антител заключается в способности преимущественно связываться с типичными Т-клетками, а не с Трег, поскольку LAG3 на Трег, по-видимому, негативно регулирует их супрессивную функцию. Поэтому нацеливание LAG3 на Трег с блокирующими антителами может быть негативным, увеличивая их подавляющую функцию и в конечном итоге маскируя положительный блокирующий эффект на другие Т-клетки. Поэтому мы оценили конкурентное связывание различных форматов биспецифических анти-PD1/анти-LAG3 с активированными типичными и регуляторными Т-клетками, культивируемыми вместе.
Регуляторные Т-клетки (Трег) и типичные Т-клетки (Ттип) были отсортированы от здоровых донорских МКПК (Miltenyi), меченных 5 мМ мембранными красителями CellTraceViolet или CFSE, соответственно, и культивировали вместе в соотношении 1:1 в течение 3 суток с 1 мкг/мл связанных на планшете анти-CD3 и 1 мкг/л растворимых анти-CD28 антител. На 3-и сутки клетки инкубировали в течение 30 мин при 4°С или с меченными непосредственно анти-PD1, анти-LAG3 или биспецифическими антителами, фиксировали с помощью BD Cell Fix, и сортировали в LSRFortessa (BD Biosciences).
В то время как моноспецифическое исходное анти- LAG3 антитело одинаково хорошо связывается с Трег и типичными Т-клетками (Фиг. 10А), аналог анти-PD1 связывается преимущественно с типичными Т-клетками из-за более высоких уровней экспрессии PD1 на эффекторных Т-клетках, чем на Трег (Фиг. 10В). Интересно, что также формат 1+1 биспецифического антитела PD1/LAG3 (0927) сохранял способность преимущественно связываться с типичными Т-клетками, чем с Трег (Фиг. 10С). Это предпочтительное связывание с типичными Т-клетками также можно визуализировать, изображая разницу (дельта) сигнала на типичных Т-клетках по сравнению с сигналом на Трег (Фиг. 10D). Форматы 2+1 и 2+2 не проявляют селективности, обусловленной авидностью, для эффекторных Т-клеток и сопоставимы по их связыванию с моноспецифическим анти-LAG3 антителом.
12.3 Влияние блокирования PD-1 и LAG-3 на Трег подавление высвобождения гранзима В и ИФН-γ CD4 Т-клетками человека, совместно культивируемыми с облученными аллогенными МКПК
Далее было проверено, будут ли различия в свойствах связывания форматов биспецифических антител обеспечивать какое-либо функциональное преимущество для Ттип по сравнению с Трег. В функциональных исследованиях, включающих анализы подавления регуляторными Т-клетками (Трег), МКПК от одного и того же донора были разделены на две пробы: одна была обогащена CD4 Т-клетками, а другая - Трег, определенными как CD4+CD25high CD127low Т-клетками, с помощью набора микрогранул (Miltenyi Biotec). После того как две популяции были очищены, CD4 Т-клетки были помечены 5 мкМ карбокси-флуоресцеин-сукцинимидиловым сложным эфиром (CFSE), в то время как Трег были помечены 5 мкМ красителем Cell-Trace-Violet (CTV), чтобы иметь возможность различать их позже на проточной цитометрии.
CD4 Т-клетки (105) и Трег (105) затем совместно культивировали в 96-луночном планшете в соотношении 1:1 вместе с облученными МКПК (105) от неродственного донора в присутствии или в отсутствии наших анти-LAG3 антител (целевое 0414 и резервное 0416) или конкурентных анти-LAGS антител (BMS-986016 и гуманизированных ВАР050) в комбинации с нашим анти-PD1 антителом в концентрации 10 мкг/мл. В качестве контроля для оценки величины подавления эффекторных функций CD4 Т-клеток при помощи Трег, CD4 Т-клетки (105) также культивировали совместно с облученными МКПК (105) в отсутствии Трег.
Пять суток спустя мы собрали супернатанты клеточных культур, которые позже использовали для измерения уровней ИФН-γ с помощью ИФА (R&D systems), и оставляли клетки при 37°С на дополнительные 5 часов в присутствии Golgi Plug (Брефельдин А) и Golgi Stop (Монензин). Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и прижизненных/мертвым фиксирующим красителем Aqua (Invitrogen), предварительно с фиксацией/премабилизацией в буфере Fix/Perm Buffer (BD Bioscience). Мы провели внутриклеточное окрашивание на гранзим В (BD Bioscience) и ИФН-γ (eBioscience). Результаты показаны на Фиг. 11.
Наше биспецифическое антитело PD1/LAG-3 (0927) вызывало выход Ттип из жесткого контроля регуляторными Т-клетками, о чем свидетельствует секреция значительно более высокого количества гранзима В, чем Ттип, в присутствии исходного анти-PD1 антитела или одного пембролизумаба (Р<0,05) или в отсутствии ингибиторов контрольной точки (Р<0,001). Конкурентное анти-LAGS антитело BMS-986016 в комбинации с ниволумабом существенно не сохраняло эффекторные функции Ттип от подавления Трег.
12.4 Влияние биспецифических антител к PD-1/LAG-3 на цитотоксическое высвобождение гранзима В человеческими CD4 Т-клетками, совместно культивируемыми с лимфобластной В-клеточной линией (ARH77)
Мы оценили способность наших различных форматов биспецифических антител индуцировать секрецию гранзима В Т-клетками CD4 при совместном культивировании с линией опухолевых клеток ARH77 по сравнению с комбинацией исходных анти-PD-1 и анти-LAG-З и с анти-PD1 антителами, используемым в стандарте лечения.
Всего было протестировано 6 форматов, 3 из которых были получены от комбинации анти-PD1 (0376) и анти-LAG3 (гуманизированных 1256, химерных 0414) и 3 дополнительных формата от анти-PD1 (0376) и анти-LAG-3 (гуманизированных 1257, химерных 0416) антител.
Как видно на Фиг. 13, два биспецифических формата, 1+1 (0927) и 2+2 (8970), полученных из анти-LAG3 (гуманизированного 1256, анти-LAG3 0414 как IgG1 PGLALA) и анти-PD1 (0376) также как и комбинация исходных антител значительно усиливала секрецию гранзима В CD4 Т-клетками по сравнению с необработанными CD4 Т-клетками (Р=0,0005, Р=0,01 и Р=0,0001, соответственно). Соответствующий формат 2+1 (8310) продемонстрировал аналогичную тенденцию, однако он не достиг статистической значимости (Р=0,07).
Что касается биспецифических антител, полученных комбинированием анти-LAG-3 (гуманизированных 1257, анти-LAG3 0416 в качестве IgG1 PGLALA) с анти-PD1 (0376), то формат 1+1 (0799) и 2+2 (8984) значительно увеличивал частоты гранзим-В-положительных CD4 Т-клеток по сравнению с необработанными CD4 клетками (Р=0,0032 и Р=0,0064, соответственно).
Ни ниволумаб, ни пембролизумаб существенно не способствовали более высокой секреции гранзима В CD4 Т-клетками по сравнению с клетками, культивируемыми в отсутствии ингибиторов контрольной точки. (Фиг. 13).

12.5 Влияние блокирования PD-1 и LAG-3 на секрецию гранзима В и ИФН-γ CD4 Т-клетками из МКПК пациентов с меланомой после вторичного иммунного ответа с помощью иммуногенных пептидных пулов меланома-антиген
Ранее было описано, что МКПК пациентов с меланомой содержат обнаруживаемую частоту неоантигенспецифических Т-клеток. Следовательно, для подтверждения концептуальных целей комбинация анти-LAG-3 антитела (0414) плюс анти-PD-1 (0376) в сравнении с производным биспецифического антитела в формате 1+1 (0927) или только анти-PD-1 была протестированы на МКПК пациентов с меланомой, повторно стимулированных в течение ночи пептидными пулами антигенов ассоциированных с меланомой.
105-106 МКПК от пациентов с меланомой, инкубировали при комнатной температуре в присутствии или в отсутствии насыщающих концентраций (10 мкг/мл) только анти-PD-1 (0376) в комбинации с анти-LAG-3 (0414, 10 мкг/мл) антителом или биспецифическим антителом формата 1+1 (0927, 20 мкг/мл). Затем Т-клетки повторно стимулировали в течение ночи пулом иммуногенных опухолевых антигенов, таких как MAGEA1, MAGEA3, MAGEA4, Melan-A/MART-1, NYESO-1, белок меланоцитов Pmel 17 gp100, тирозиназа, тирозиназа-зависимый белок 2 в присутствии ингибиторов транспорта белка Golgi Plug (брефельдина А) и Golgi Stop (монензина).
Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и фиксирующим красителем Aqua (Invitrogen) для прижизненного окрашивания/окрашивания мертвых клеток, после чего проводили фиксацию/пермеабилизацию в буфере Fix/Perm Buffer (BD Bioscience). Внутриклеточное окрашивание проводили на гранзим В (BD Bioscience) и ИФН-γ (eBioscience).
Обе комбинации анти-LAG-3 и анти-PD-1 антител (Р<0,01 и Р<0,001) и биспецифического антитела (Р<0,01 и Р<0,0001) значительно усиливали специфические для опухолевого антигена эффекторные функции Т-клеток (т.е. секрецию гранзима В и ИФН-γ), в то время как блокирование PD-1 само по себе не показала никакого эффекта (Фиг. 12).
Пример 13
Мощный противоопухолевый эффект при комбинированной терапии биспецифическими антителами PD1/LAG3 и CD3 ТСВ СЕАСАМ5 in vivo
Молекулы ТСВ были получены в соответствии со способами, описанными в WO 2014/131712 А1 или WO 2016/079076 А1. Получение анти-СЕА/анти-CD3 биспецифического антитела (СЕА CD3 ТСВ или СЕА ТСВ), использованного в экспериментах, описано в Примере 3 WO 2014/131712 А1. СЕА CD3 ТСВ представляет собой антитело «2+1 IgG CrossFab» и состоит из двух разных тяжелых цепей и двух разных легких цепей. Точечные мутации в домене СН3 («выступы-в-отверстия») были введены для ускорения сборки двух разных тяжелых цепей. Обмен доменов VH и VL в CD3-связывающем Fab осуществляли для того, чтобы способствовать правильной сборке двух разных легких цепей. 2+1 означает, что молекула имеет два антигенсвязывающих домена, специфических для СЕА, и один антигенсвязывающий домен, специфический для CD3. СЕА CD3 ТСВ содержит аминокислотные последовательности SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148 и SEQ ID NO: 149. CEACAM5 CD3 ТСВ имеет тот же формат, но содержит другое связующее СЕА и содержит точечные мутации в доменах СН и CL связующего CD3, чтобы поддерживать правильное спаривание легких цепей. СЕАСАМ5 CD ТСВ содержит аминокислотные последовательности SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152 и SEQ ID NO: 153.
а) Экспериментальный материал и способы
Биспецифическое антитело PD1/LAG3 0927 тестировали в концентрации 1,5 мг/кг или 3 мг/кг в комбинации с CD3 ТСВ человека СЕАСАМ5 на модели рака поджелудочной железы человека ВХРС3. Клетки ВХРС3 прививали подкожно с клеточной линией фибробластов мыши (3Т3) гуманизированным NSG мышам.
Приготовление линии клеток ВХРС3: Клетки ВХРС3 (клетки рака поджелудочной железы человека) были первоначально получены из ЕСАСС (Европейская коллекция клеточных культур) и после размножения депонированы во внутреннем банке клеток Glycart. Клетки ВХРС3 культивировали в RPMI, содержащем 10% ФБС (РАА Laboratories, Австрия), 1% Glutamax. Клетки культивировали при 37°С в водонасыщенной среде при 5% СО2.
Подготовка полностью гуманизированных мышей: Самок мышей NSG в возрасте 4-5 недель в начале эксперимента (лаборатория Джексона) содержали в условиях отсутствия специфических патогенов с ежедневными циклами 12 ч света/12 ч темноты в соответствии с установленными рекомендациями (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местным правительством (Р 2011/128). После прибытия животных содержали в течение одной недели, для привыкания к новой среде и наблюдения. Непрерывный мониторинг здоровья проводили на регулярной основе. Мышам NSG вводили внутрибрюшинно 15 мг/кг бусульфана, а через сутки внутривенную инъекцию 1×105 человеческих гемопоэтических стволовых клеток, выделенных из пуповинной крови. На 14-16 неделе после инъекции стволовых клеток у мышей отбирали кровь сублингвально и анализировали кровь методом проточной цитометрии в отношении успешной гуманизации. Эффективно привитых мышей рандомизировали в соответствии с частотой их Т-клеток в разных группах лечения.
Эффективность эксперимента: Полностью гуманизированных мышей HSC-NSG подкожно заражали 1×106 клеток ВХРС3 (клеточная линия карциномы поджелудочной железы человека, экспрессирующая СЕАСАМ5) на 0 сутки в присутствии матригеля в соотношении 1:1. Опухоли измеряли 2-3 раза в неделю в течение всего эксперимента с помощью штангенциркуля. На 15 сутки мышей рандомизировали по размеру опухоли со средним размером опухоли 250 мм3 и начинали еженедельную запланированную терапию (носитель (гистидиновый буфер), анти-PD1 (0376), ниволумаб, пембролизумаб или анти-PD1-LAG3 0927), посредством внутрибрюшинной инъекции максимально 400 мкл. Рост опухоли измеряли 2-3 раза в неделю с использованием штангенциркуля, а объем опухоли рассчитывали следующим образом:

Исследование было прекращено на 47 сутки.
b) Результаты
Измерения объемов опухоли (мм3 +/- СОС) в течение 47 суток показаны как средний объем в соответствующей группе лечения мышей на Фиг. 14. Лечение СЕАСАМ5-ТСВ демонстрирует только прогрессирование заболевания, идентичное необработанной группе носителя. Наоборот, ниволумаб и пембролизумаб уменьшали рост опухоли, однако, не достигая контроля роста опухоли. Неожиданно было обнаружено, что биспецифическое антитело PD1/LAG3 0927 в концентрации 3 мг/кг полностью подавляло рост опухоли у всех получавших лечение животных, демонстрируя синергизм совместного блокирования LAG-3 в дополнение к PD-1.
На Фиг. 15A-15F показаны измерения объемов опухолей (мм3 +/- СОС) в течение 47 суток для каждого отдельного животного, что демонстрирует однородность противоопухолевого ответа в каждой группе.
Статистическая значимость была рассчитана с использованием критерия Даннета на основании однократной обработки СЕАСАМ5 CD3 ТСВ. Для проверки значительных различий в групповых средних для множественных сравнений автоматически проводится стандартный дисперсионный анализ (ANOVA) с использованием критерия Даннета. Критерий Даннета проверяет, отличаются ли средние значения от контрольной группы.
Полученные значения TGI и TCR показаны в Таблице 28 (TGI означает ингибирование роста опухоли, TGI>100 означает регрессию опухоли, a TGI=100 определяется как остановка роста опухоли, TCR означает отношение лечения к контролю, TCR=1 означает отсутствие эффекта и TCR=0 определяется как полная регрессия).

Сравнение с контролем далее показано в виде р-значений с использованием критерия Даннета.
Лечение с помощью СЕАСАМ5 CD3 ТСВ не может контролировать рост опухоли в случае рака поджелудочной железы. Однако его комбинация с биспецифическим антителом анти-PD1/LAG3 0927 приводит к сильному влиянию на контроль опухоли дозозависимым образом. Статистический анализ продемонстрировал, что комбинация с анти-PD1/LAG3 0927, но не с анти-PD1 антителами ниволумабом и пембролизумабом, в обеих концентрациях приводила к статистически значимому различию в контроле роста опухоли по сравнению с однократным введением, что свидетельствует о превосходстве биспецифического анти-PD1/LAG3 антитела по сравнению с ингибированием только PD1, что приводит к остановке роста опухоли.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> F. Hoffmann-La Roche AG
<120> Биспецифические антитела, специфически связывающиеся с PD1 и LAG3
<130> P34215-WO
<150> EP17165125.0
<151> 2017-04-05
<160> 169
<170> PatentIn версии 3.5
<210> 1
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, PD1-0103
<400> 1
Gly Phe Ser Phe Ser Ser Tyr
1 5
<210> 2
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, PD1-0103
<400> 2
Gly Gly Arg
1
<210> 3
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, PD1-0103
<400> 3
Thr Gly Arg Val Tyr Phe Ala Leu Asp
1 5
<210> 4
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, PD1-0103
<400> 4
Ser Glu Ser Val Asp Thr Ser Asp Asn Ser Phe
1 5 10
<210> 5
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, PD1-0103
<400> 5
Arg Ser Ser
1
<210> 6
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, PD1-0103
<400> 6
Asn Tyr Asp Val Pro Trp
1 5
<210> 7
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, PD1-0103
<400> 7
Glu Val Ile Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Asp Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Met Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, PD1-0103
<400> 8
Lys Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 9
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный вариант - вариабельный домен тяжелой цепи VH PD1-0103_01
(PD1 0376)
<400> 9
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 10
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный вариант -вариабельный домен легкой цепи VL PD1-0103_01
(PD1 0376)
<400> 10
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 11
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный вариант -вариабельный домен легкой цепи VL PD1-0103_02
<400> 11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 12
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный вариант -вариабельный домен легкой цепи VL PD1-0103_03
<400> 12
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 13
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный вариант -вариабельный домен легкой цепи VL PD1-0103_04
<400> 13
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 14
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, aLAG3(0414)
<400> 14
Asp Tyr Thr Met Asn
1 5
<210> 15
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, aLAG3(0414)
<400> 15
Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val Lys
1 5 10 15
Gly
<210> 16
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, aLAG3(0414)
<400> 16
Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr
1 5 10
<210> 17
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, aLAG3(0414)
<400> 17
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 18
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, aLAG3(0414)
<400> 18
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 19
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, aLAG3(0414)
<400> 19
Gln Gln Thr Tyr Ser Ser Pro Leu Thr
1 5
<210> 20
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, aLAG3(0414)
<400> 20
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, aLAG3(0414)
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Ser Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 22
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, aLAG3(0403)
<400> 22
Asp Tyr Thr Met His
1 5
<210> 23
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, aLAG3(0403)
<400> 23
Leu Val Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asn Ser Val Lys
1 5 10 15
Gly
<210> 24
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, aLAG3(0403)
<400> 24
Ala Ile Thr Asp Thr Ser Leu Tyr Gly Tyr Asp Tyr
1 5 10
<210> 25
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, aLAG3(0403)
<400> 25
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 26
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, aLAG3(0403)
<400> 26
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 27
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, aLAG3(0403)
<400> 27
Gln Gln Thr Tyr Ser Thr Pro Leu Thr
1 5
<210> 28
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, aLAG3(0403)
<400> 28
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Val Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Lys Ala Ile Thr Asp Thr Ser Leu Tyr Gly Tyr Asp Tyr Trp Gly
100 105 110
Gln Gly Ile Leu Val Thr Val Ser Ser
115 120
<210> 29
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, aLAG3(0403)
<400> 29
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Asn Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 30
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, aLAG3(0411)
<400> 30
Asp Tyr Thr Met Asn
1 5
<210> 31
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, aLAG3(0411)
<400> 31
Val Ile Ser Trp Asp Gly Gly Ala Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 32
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, aLAG3(0411)
<400> 32
Gly Leu Thr Asp Asp Thr Leu Tyr Gly Ser Asp Tyr
1 5 10
<210> 33
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, aLAG3(0411)
<400> 33
Arg Ala Ser Gln Ser Ile Val Ser Tyr Leu Asn
1 5 10
<210> 34
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, aLAG3(0411)
<400> 34
Ala Ser Ser Ser Leu Gln Ser
1 5
<210> 35
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, aLAG3(0411)
<400> 35
Gln Gln Thr Tyr Ser Thr Pro Leu Thr
1 5
<210> 36
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, aLAG3(0411)
<400> 36
Glu Val His Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Val Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Trp Asp Gly Gly Ala Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Asp Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 37
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, aLAG3(0411)
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Val Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ser Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 38
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, aLAG3(0417)
<400> 38
Asp Tyr Ala Met Ser
1 5
<210> 39
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, aLAG3(0417)
<400> 39
Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val Lys
1 5 10 15
Gly
<210> 40
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, aLAG3(0417)
<400> 40
Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile
1 5 10
<210> 41
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, aLAG3(0417)
<400> 41
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 42
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, aLAG3(0417)
<400> 42
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 43
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, aLAG3(0417)
<400> 43
Gln Gln Thr Tyr Ser Thr Pro Leu Thr
1 5
<210> 44
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, aLAG3(0417)
<400> 44
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 45
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, aLAG3(0417)
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 46
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, aLAG3(0416)
<400> 46
Asp Tyr Ala Met Ser
1 5
<210> 47
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, aLAG3(0416)
<400> 47
Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val Lys
1 5 10 15
Gly
<210> 48
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, aLAG3(0416)
<400> 48
Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile
1 5 10
<210> 49
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, aLAG3(0416)
<400> 49
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 50
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, aLAG3(0416)
<400> 50
Asp Ala Ser Ser Leu Glu Ser
1 5
<210> 51
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, aLAG3(0416)
<400> 51
Gln Gln Ser Tyr Ser Thr Pro Leu Thr
1 5
<210> 52
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, aLAG3(0416)
<400> 52
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 53
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, aLAG3(0416)
<400> 53
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Ala Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 54
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, BMS-986016
<400> 54
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Arg Gly Ser Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 55
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL BMS-986016
<400> 55
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Asn Leu Glu Ile Lys
100 105
<210> 56
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, MDX25F7 (25F7)
<400> 56
Asp Tyr Tyr Trp Asn
1 5
<210> 57
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, MDX25F7 (25F7)
<400> 57
Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 58
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, MDX25F7 (25F7)
<400> 58
Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe
1 5 10
<210> 59
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, MDX25F7 (25F7)
<400> 59
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Ala
1 5 10
<210> 60
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, MDX25F7 (25F7)
<400> 60
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 61
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, MDX25F7 (25F7)
<400> 61
Gln Gln Arg Ser Asn Trp Pro Leu Thr
1 5
<210> 62
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, MDX25F7 (25F7)
<400> 62
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 63
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, MDX25F7 (25F7)
<400> 63
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Asn Leu Glu Ile Lys
100 105
<210> 64
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, гуманизированное BAP050 (LAG525)
<400> 64
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Leu Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Asp Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Ser
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Ala Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Asn Pro Pro Tyr Tyr Tyr Gly Thr Asn Asn Ala Glu Ala Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 65
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, гуманизированное BAP050 (LAG525)
<400> 65
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Ser Ser Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Met Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Val Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Leu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Leu
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 66
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, MDX26H10 (26H10)
<400> 66
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Trp Ala Val Ala Ser Trp Asp Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 67
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, MDX26H10 (26H10)
<400> 67
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 68
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> константная область легкой каппа-цепи человека
<400> 68
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 69
<211> 105
<212> Белок
<213> Искусственная последовательность
<220>
<223> константная область легкой лямбда-цепи человека
<400> 69
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 70
<211> 329
<212> Белок
<213> Искусственная последовательность
<220>
<223> константная область тяжелой цепи человека, полученная из IgG1
<400> 70
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 71
<211> 329
<212> Белок
<213> Искусственная последовательность
<220>
<223> константная область тяжелой цепи человека, полученная из IgG1 с
мутациями L234A, L235A и P329G
<400> 71
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 72
<211> 326
<212> Белок
<213> Искусственная последовательность
<220>
<223> константная область тяжелой цепи человека, полученная из IgG4
<400> 72
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 73
<211> 497
<212> Белок
<213> Homo sapiens
<400> 73
Val Pro Val Val Trp Ala Gln Glu Gly Ala Pro Ala Gln Leu Pro Cys
1 5 10 15
Ser Pro Thr Ile Pro Leu Gln Asp Leu Ser Leu Leu Arg Arg Ala Gly
20 25 30
Val Thr Trp Gln His Gln Pro Asp Ser Gly Pro Pro Ala Ala Ala Pro
35 40 45
Gly His Pro Leu Ala Pro Gly Pro His Pro Ala Ala Pro Ser Ser Trp
50 55 60
Gly Pro Arg Pro Arg Arg Tyr Thr Val Leu Ser Val Gly Pro Gly Gly
65 70 75 80
Leu Arg Ser Gly Arg Leu Pro Leu Gln Pro Arg Val Gln Leu Asp Glu
85 90 95
Arg Gly Arg Gln Arg Gly Asp Phe Ser Leu Trp Leu Arg Pro Ala Arg
100 105 110
Arg Ala Asp Ala Gly Glu Tyr Arg Ala Ala Val His Leu Arg Asp Arg
115 120 125
Ala Leu Ser Cys Arg Leu Arg Leu Arg Leu Gly Gln Ala Ser Met Thr
130 135 140
Ala Ser Pro Pro Gly Ser Leu Arg Ala Ser Asp Trp Val Ile Leu Asn
145 150 155 160
Cys Ser Phe Ser Arg Pro Asp Arg Pro Ala Ser Val His Trp Phe Arg
165 170 175
Asn Arg Gly Gln Gly Arg Val Pro Val Arg Glu Ser Pro His His His
180 185 190
Leu Ala Glu Ser Phe Leu Phe Leu Pro Gln Val Ser Pro Met Asp Ser
195 200 205
Gly Pro Trp Gly Cys Ile Leu Thr Tyr Arg Asp Gly Phe Asn Val Ser
210 215 220
Ile Met Tyr Asn Leu Thr Val Leu Gly Leu Glu Pro Pro Thr Pro Leu
225 230 235 240
Thr Val Tyr Ala Gly Ala Gly Ser Arg Val Gly Leu Pro Cys Arg Leu
245 250 255
Pro Ala Gly Val Gly Thr Arg Ser Phe Leu Thr Ala Lys Trp Thr Pro
260 265 270
Pro Gly Gly Gly Pro Asp Leu Leu Val Thr Gly Asp Asn Gly Asp Phe
275 280 285
Thr Leu Arg Leu Glu Asp Val Ser Gln Ala Gln Ala Gly Thr Tyr Thr
290 295 300
Cys His Ile His Leu Gln Glu Gln Gln Leu Asn Ala Thr Val Thr Leu
305 310 315 320
Ala Ile Ile Thr Val Thr Pro Lys Ser Phe Gly Ser Pro Gly Ser Leu
325 330 335
Gly Lys Leu Leu Cys Glu Val Thr Pro Val Ser Gly Gln Glu Arg Phe
340 345 350
Val Trp Ser Ser Leu Asp Thr Pro Ser Gln Arg Ser Phe Ser Gly Pro
355 360 365
Trp Leu Glu Ala Gln Glu Ala Gln Leu Leu Ser Gln Pro Trp Gln Cys
370 375 380
Gln Leu Tyr Gln Gly Glu Arg Leu Leu Gly Ala Ala Val Tyr Phe Thr
385 390 395 400
Glu Leu Ser Ser Pro Gly Ala Gln Arg Ser Gly Arg Ala Pro Gly Ala
405 410 415
Leu Pro Ala Gly His Leu Leu Leu Phe Leu Ile Leu Gly Val Leu Ser
420 425 430
Leu Leu Leu Leu Val Thr Gly Ala Phe Gly Phe His Leu Trp Arg Arg
435 440 445
Gln Trp Arg Pro Arg Arg Phe Ser Ala Leu Glu Gln Gly Ile His Pro
450 455 460
Pro Gln Ala Gln Ser Lys Ile Glu Glu Leu Glu Gln Glu Pro Glu Pro
465 470 475 480
Glu Pro Glu Pro Glu Pro Glu Pro Glu Pro Glu Pro Glu Pro Glu Gln
485 490 495
Leu
<210> 74
<211> 422
<212> Белок
<213> Homo sapiens
<400> 74
Val Pro Val Val Trp Ala Gln Glu Gly Ala Pro Ala Gln Leu Pro Cys
1 5 10 15
Ser Pro Thr Ile Pro Leu Gln Asp Leu Ser Leu Leu Arg Arg Ala Gly
20 25 30
Val Thr Trp Gln His Gln Pro Asp Ser Gly Pro Pro Ala Ala Ala Pro
35 40 45
Gly His Pro Leu Ala Pro Gly Pro His Pro Ala Ala Pro Ser Ser Trp
50 55 60
Gly Pro Arg Pro Arg Arg Tyr Thr Val Leu Ser Val Gly Pro Gly Gly
65 70 75 80
Leu Arg Ser Gly Arg Leu Pro Leu Gln Pro Arg Val Gln Leu Asp Glu
85 90 95
Arg Gly Arg Gln Arg Gly Asp Phe Ser Leu Trp Leu Arg Pro Ala Arg
100 105 110
Arg Ala Asp Ala Gly Glu Tyr Arg Ala Ala Val His Leu Arg Asp Arg
115 120 125
Ala Leu Ser Cys Arg Leu Arg Leu Arg Leu Gly Gln Ala Ser Met Thr
130 135 140
Ala Ser Pro Pro Gly Ser Leu Arg Ala Ser Asp Trp Val Ile Leu Asn
145 150 155 160
Cys Ser Phe Ser Arg Pro Asp Arg Pro Ala Ser Val His Trp Phe Arg
165 170 175
Asn Arg Gly Gln Gly Arg Val Pro Val Arg Glu Ser Pro His His His
180 185 190
Leu Ala Glu Ser Phe Leu Phe Leu Pro Gln Val Ser Pro Met Asp Ser
195 200 205
Gly Pro Trp Gly Cys Ile Leu Thr Tyr Arg Asp Gly Phe Asn Val Ser
210 215 220
Ile Met Tyr Asn Leu Thr Val Leu Gly Leu Glu Pro Pro Thr Pro Leu
225 230 235 240
Thr Val Tyr Ala Gly Ala Gly Ser Arg Val Gly Leu Pro Cys Arg Leu
245 250 255
Pro Ala Gly Val Gly Thr Arg Ser Phe Leu Thr Ala Lys Trp Thr Pro
260 265 270
Pro Gly Gly Gly Pro Asp Leu Leu Val Thr Gly Asp Asn Gly Asp Phe
275 280 285
Thr Leu Arg Leu Glu Asp Val Ser Gln Ala Gln Ala Gly Thr Tyr Thr
290 295 300
Cys His Ile His Leu Gln Glu Gln Gln Leu Asn Ala Thr Val Thr Leu
305 310 315 320
Ala Ile Ile Thr Val Thr Pro Lys Ser Phe Gly Ser Pro Gly Ser Leu
325 330 335
Gly Lys Leu Leu Cys Glu Val Thr Pro Val Ser Gly Gln Glu Arg Phe
340 345 350
Val Trp Ser Ser Leu Asp Thr Pro Ser Gln Arg Ser Phe Ser Gly Pro
355 360 365
Trp Leu Glu Ala Gln Glu Ala Gln Leu Leu Ser Gln Pro Trp Gln Cys
370 375 380
Gln Leu Tyr Gln Gly Glu Arg Leu Leu Gly Ala Ala Val Tyr Phe Thr
385 390 395 400
Glu Leu Ser Ser Pro Gly Ala Gln Arg Ser Gly Arg Ala Pro Gly Ala
405 410 415
Leu Pro Ala Gly His Leu
420
<210> 75
<211> 6
<212> Белок
<213> Homo sapiens
<400> 75
Lys Ile Glu Glu Leu Glu
1 5
<210> 76
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер rbHC.up
<400> 76
aagcttgcca ccatggagac tgggctgcgc tggcttc 37
<210> 77
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер rbHCf.do
<400> 77
ccattggtga gggtgcccga g 21
<210> 78
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> primer BcPCR_FHLC_leader.fw
<400> 78
atggacatga gggtccccgc 20
<210> 79
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер BcPCR_huCkappa.rev
<400> 79
gatttcaact gctcatcaga tggc 24
<210> 80
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, PD1-0098
<400> 80
Gly Tyr Ser Ile Thr Ser Asp Tyr
1 5
<210> 81
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, PD1-0098
<400> 81
Tyr Ser Gly
1
<210> 82
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, PD1-0098
<400> 82
His Gly Ser Ala Pro Trp Tyr Phe Asp
1 5
<210> 83
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, PD1-0098
<400> 83
Ser Gln Asn Ile Val His Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 84
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, PD1-0098
<400> 84
Lys Val Ser
1
<210> 85
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, PD1-0098
<400> 85
Gly Ser His Phe Pro Leu
1 5
<210> 86
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, PD1-0098
<400> 86
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asp Lys Leu Glu Trp
35 40 45
Leu Gly Tyr Ile Thr Tyr Ser Gly Phe Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Ala Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Trp His Gly Ser Ala Pro Trp Tyr Phe Asp Tyr Trp Gly Arg
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 87
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, PD1-0098
<400> 87
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Asn Leu Leu Ile Tyr Lys Val Ser Arg Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 88
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H1 тяжелой цепи, PD1-0069
<400> 88
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 89
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H2 тяжелой цепи, PD1-0069
<400> 89
Tyr Ser Gly
1
<210> 90
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-H3 тяжелой цепи, PD1-0069
<400> 90
Gly Ile Thr Thr Gly Phe Ala
1 5
<210> 91
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L1 легкой цепи, PD1-0069
<400> 91
Ser Lys Gly Val Ser Thr Ser Ser Tyr Ser Phe
1 5 10
<210> 92
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L2 легкой цепи, PD1-0069
<400> 92
Tyr Ala Ser
1
<210> 93
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR-L3 легкой цепи, PD1-0069
<400> 93
Ser Arg Glu Phe Pro Trp
1 5
<210> 94
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи VH, PD1-0069
<400> 94
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Lys Gln Ser His Ala Arg Thr Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asp Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ala Arg Met Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Ile Thr Thr Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 95
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельный домен легкой цепи VL, PD1-0069
<400> 95
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Ser Tyr Ser Phe Met His Trp Tyr Gln Gln Lys Pro Arg Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 96
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 1+1 PD1/LAG3 0799
<400> 96
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 97
<211> 452
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 1+1 PD1/LAG3 0799
<400> 97
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 98
<211> 227
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 1 из 1+1 PD1/LAG3 0799
<400> 98
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val
115 120 125
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
130 135 140
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
145 150 155 160
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
165 170 175
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
180 185 190
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
195 200 205
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
210 215 220
Gly Glu Cys
225
<210> 99
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 2 из 1+1 PD1/LAG3 0799
<400> 99
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Ala Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Arg Lys Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 100
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 1+1 PD1/LAG3 0927
<400> 100
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 101
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 2 из 1+1 PD1/LAG3 0927
<400> 101
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Ser Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Arg Lys Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 102
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 1+1 PD1/LAG3 0222
<400> 102
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Ser Tyr Ser Phe Met His Trp Tyr Gln Gln Lys Pro Arg Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 103
<211> 450
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 1+1 PD1/LAG3 0222
<400> 103
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 104
<211> 225
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 1 из 1+1 PD1/LAG3 0222
<400> 104
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Lys Gln Ser His Ala Arg Thr Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asp Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ala Arg Met Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Ile Thr Thr Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala Ala Ser Val Ala Ala Pro Ser Val Phe Ile
115 120 125
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
130 135 140
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
145 150 155 160
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
165 170 175
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
180 185 190
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
195 200 205
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
210 215 220
Cys
225
<210> 105
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 2 из 1+1 PD1/LAG3 0222
<400> 105
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Asn Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Arg Lys Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 106
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 1+1 PD1/LAG3 0224
<400> 106
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Asn Leu Leu Ile Tyr Lys Val Ser Arg Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 107
<211> 227
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 1 из 1+1 PD1/LAG3 0224
<400> 107
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asp Lys Leu Glu Trp
35 40 45
Leu Gly Tyr Ile Thr Tyr Ser Gly Phe Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Ala Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Trp His Gly Ser Ala Pro Trp Tyr Phe Asp Tyr Trp Gly Arg
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val
115 120 125
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
130 135 140
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
145 150 155 160
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
165 170 175
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
180 185 190
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
195 200 205
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
210 215 220
Gly Glu Cys
225
<210> 108
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь aLAG3(0156) (MDX25F7)
<400> 108
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gln Pro Lys Ala Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Cys Gly Asp Thr Pro Ser Ser Thr Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Leu Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Thr Leu Thr Asn Gly Val Arg Thr Phe Pro Ser Val
165 170 175
Arg Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Ser Val Thr
180 185 190
Ser Ser Ser Gln Pro Val Thr Cys Asn Val Ala His Pro Ala Thr Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Ala Pro Ser Thr Cys Ser Lys Pro Thr
210 215 220
Cys Pro Pro Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser Gln Asp Asp Pro Glu Val Gln Phe Thr
260 265 270
Trp Tyr Ile Asn Asn Glu Gln Val Arg Thr Ala Arg Pro Pro Leu Arg
275 280 285
Glu Gln Gln Phe Asn Ser Thr Ile Arg Val Val Ser Thr Leu Pro Ile
290 295 300
Ala His Gln Asp Trp Leu Arg Gly Lys Glu Phe Lys Cys Lys Val His
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Arg
325 330 335
Gly Gln Pro Leu Glu Pro Lys Val Tyr Thr Met Gly Pro Pro Arg Glu
340 345 350
Glu Leu Ser Ser Arg Ser Val Ser Leu Thr Cys Met Ile Asn Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Lys Asn Gly Lys Ala Glu
370 375 380
Asp Asn Tyr Lys Thr Thr Pro Ala Val Leu Asp Ser Asp Gly Ser Tyr
385 390 395 400
Phe Leu Tyr Asn Lys Leu Ser Val Pro Thr Ser Glu Trp Gln Arg Gly
405 410 415
Asp Val Phe Thr Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Ile Ser Arg Ser Pro Gly Lys
435 440
<210> 109
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь aLAG3(0156) (MDX25F7)
<400> 109
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Asn Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 110
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь aLAG3(0414)
<400> 110
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gln Pro Lys Ala Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Cys Gly Asp Thr Pro Ser Ser Thr Val
130 135 140
Thr Leu Gly Cys Leu Val Lys Gly Tyr Leu Pro Glu Pro Val Thr Val
145 150 155 160
Thr Trp Asn Ser Gly Thr Leu Thr Asn Gly Val Arg Thr Phe Pro Ser
165 170 175
Val Arg Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Ser Val
180 185 190
Thr Ser Ser Ser Gln Pro Val Thr Cys Asn Val Ala His Pro Ala Thr
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Ala Pro Ser Thr Cys Ser Lys Pro
210 215 220
Thr Cys Pro Pro Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Asp Asp Pro Glu Val Gln Phe
260 265 270
Thr Trp Tyr Ile Asn Asn Glu Gln Val Arg Thr Ala Arg Pro Pro Leu
275 280 285
Arg Glu Gln Gln Phe Asn Ser Thr Ile Arg Val Val Ser Thr Leu Pro
290 295 300
Ile Ala His Gln Asp Trp Leu Arg Gly Lys Glu Phe Lys Cys Lys Val
305 310 315 320
His Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Arg Gly Gln Pro Leu Glu Pro Lys Val Tyr Thr Met Gly Pro Pro Arg
340 345 350
Glu Glu Leu Ser Ser Arg Ser Val Ser Leu Thr Cys Met Ile Asn Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Lys Asn Gly Lys Ala
370 375 380
Glu Asp Asn Tyr Lys Thr Thr Pro Ala Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Tyr Phe Leu Tyr Asn Lys Leu Ser Val Pro Thr Ser Glu Trp Gln Arg
405 410 415
Gly Asp Val Phe Thr Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Ile Ser Arg Ser Pro Gly Lys
435 440
<210> 111
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь aLAG3(0414)
<400> 111
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Ser Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 112
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь aLAG3(0416)
<400> 112
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gln Pro Lys Ala Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Cys Gly Asp Thr Pro Ser Ser Thr
130 135 140
Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Leu Pro Glu Pro Val Thr
145 150 155 160
Val Thr Trp Asn Ser Gly Thr Leu Thr Asn Gly Val Arg Thr Phe Pro
165 170 175
Ser Val Arg Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Ser
180 185 190
Val Thr Ser Ser Ser Gln Pro Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Thr Asn Thr Lys Val Asp Lys Thr Val Ala Pro Ser Thr Cys Ser Lys
210 215 220
Pro Thr Cys Pro Pro Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Ile
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser Gln Asp Asp Pro Glu Val Gln
260 265 270
Phe Thr Trp Tyr Ile Asn Asn Glu Gln Val Arg Thr Ala Arg Pro Pro
275 280 285
Leu Arg Glu Gln Gln Phe Asn Ser Thr Ile Arg Val Val Ser Thr Leu
290 295 300
Pro Ile Ala His Gln Asp Trp Leu Arg Gly Lys Glu Phe Lys Cys Lys
305 310 315 320
Val His Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Arg Gly Gln Pro Leu Glu Pro Lys Val Tyr Thr Met Gly Pro Pro
340 345 350
Arg Glu Glu Leu Ser Ser Arg Ser Val Ser Leu Thr Cys Met Ile Asn
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Lys Asn Gly Lys
370 375 380
Ala Glu Asp Asn Tyr Lys Thr Thr Pro Ala Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Tyr Phe Leu Tyr Asn Lys Leu Ser Val Pro Thr Ser Glu Trp Gln
405 410 415
Arg Gly Asp Val Phe Thr Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Ile Ser Arg Ser Pro Gly Lys
435 440 445
<210> 113
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь aLAG3(0416)
<400> 113
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Ala Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 114
<211> 695
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь из 2+2 PD1/LAG3 8970
<400> 114
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
450 455 460
Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val
465 470 475 480
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser
485 490 495
Phe Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
500 505 510
Leu Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr
515 520 525
Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
530 535 540
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
545 550 555 560
Val Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp
565 570 575
Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala
580 585 590
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
595 600 605
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
610 615 620
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
625 630 635 640
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
645 650 655
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
660 665 670
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
675 680 685
Ser Phe Asn Arg Gly Glu Cys
690 695
<210> 115
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь 1 из 2+2 PD1/LAG3 8970
<400> 115
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys
210 215
<210> 116
<211> 696
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь из 2+2 PD1/LAG3 8984
<400> 116
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
450 455 460
Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
465 470 475 480
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
485 490 495
Ser Phe Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys
500 505 510
Gly Leu Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr
515 520 525
Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
530 535 540
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
545 550 555 560
Ala Val Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu
565 570 575
Asp Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val
580 585 590
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
595 600 605
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
610 615 620
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
625 630 635 640
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
645 650 655
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
660 665 670
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
675 680 685
Lys Ser Phe Asn Arg Gly Glu Cys
690 695
<210> 117
<211> 694
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь из 2+2 PD1/LAG3 9010
<400> 117
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
450 455 460
Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
465 470 475 480
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe
485 490 495
Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
500 505 510
Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro
515 520 525
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
530 535 540
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
545 550 555 560
Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser
565 570 575
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala Ala
580 585 590
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
595 600 605
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
610 615 620
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
625 630 635 640
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
645 650 655
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
660 665 670
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
675 680 685
Phe Asn Arg Gly Glu Cys
690
<210> 118
<211> 695
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 8310
<400> 118
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
450 455 460
Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val
465 470 475 480
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser
485 490 495
Phe Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
500 505 510
Leu Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr
515 520 525
Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
530 535 540
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
545 550 555 560
Val Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp
565 570 575
Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala
580 585 590
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
595 600 605
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
610 615 620
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
625 630 635 640
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
645 650 655
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
660 665 670
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
675 680 685
Ser Phe Asn Arg Gly Glu Cys
690 695
<210> 119
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 2+1 PD1/LAG3 8310
<400> 119
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 120
<211> 696
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 8311
<400> 120
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
450 455 460
Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
465 470 475 480
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
485 490 495
Ser Phe Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys
500 505 510
Gly Leu Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr
515 520 525
Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
530 535 540
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
545 550 555 560
Ala Val Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu
565 570 575
Asp Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val
580 585 590
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
595 600 605
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
610 615 620
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
625 630 635 640
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
645 650 655
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
660 665 670
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
675 680 685
Lys Ser Phe Asn Arg Gly Glu Cys
690 695
<210> 121
<211> 452
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 2+1 PD1/LAG3 8311
<400> 121
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 122
<211> 694
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 1252
<400> 122
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
450 455 460
Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
465 470 475 480
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe
485 490 495
Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
500 505 510
Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro
515 520 525
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
530 535 540
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
545 550 555 560
Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser
565 570 575
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala Ala
580 585 590
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
595 600 605
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
610 615 620
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
625 630 635 640
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
645 650 655
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
660 665 670
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
675 680 685
Phe Asn Arg Gly Glu Cys
690
<210> 123
<211> 941
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 8312
<400> 123
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
450 455 460
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Asp Ser
465 470 475 480
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser
485 490 495
Glu Ser Val Asp Thr Ser Asp Asn Ser Phe Ile His Trp Tyr Gln Gln
500 505 510
Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu
515 520 525
Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
530 535 540
Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr
545 550 555 560
Tyr Cys Gln Gln Asn Tyr Asp Val Pro Trp Thr Phe Gly Gln Gly Thr
565 570 575
Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
580 585 590
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
595 600 605
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
610 615 620
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
625 630 635 640
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
645 650 655
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
660 665 670
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
675 680 685
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
690 695 700
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
705 710 715 720
Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
725 730 735
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Thr Met
740 745 750
Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Thr
755 760 765
Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val Lys Gly
770 775 780
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
785 790 795 800
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Leu
805 810 815
Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln Gly Thr
820 825 830
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
835 840 845
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
850 855 860
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
865 870 875 880
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
885 890 895
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
900 905 910
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
915 920 925
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
930 935 940
<210> 124
<211> 942
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 8313
<400> 124
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asp Asn Ser Gly Tyr Tyr Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Thr Lys Thr His Ser Gly Leu Ile Val Asn Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
450 455 460
Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Asp
465 470 475 480
Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Lys Ala
485 490 495
Ser Glu Ser Val Asp Thr Ser Asp Asn Ser Phe Ile His Trp Tyr Gln
500 505 510
Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ser Ser Thr
515 520 525
Leu Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
530 535 540
Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val
545 550 555 560
Tyr Tyr Cys Gln Gln Asn Tyr Asp Val Pro Trp Thr Phe Gly Gln Gly
565 570 575
Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile
580 585 590
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
595 600 605
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
610 615 620
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
625 630 635 640
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
645 650 655
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
660 665 670
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
675 680 685
Cys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
690 695 700
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
705 710 715 720
Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
725 730 735
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Thr
740 745 750
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
755 760 765
Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val Lys
770 775 780
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
785 790 795 800
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val
805 810 815
Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln Gly
820 825 830
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
835 840 845
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
850 855 860
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
865 870 875 880
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
885 890 895
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
900 905 910
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
915 920 925
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
930 935 940
<210> 125
<211> 940
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 1088
<400> 125
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
450 455 460
Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu
465 470 475 480
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Glu
485 490 495
Ser Val Asp Thr Ser Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys
500 505 510
Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu
515 520 525
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
530 535 540
Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr
545 550 555 560
Cys Gln Gln Asn Tyr Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys
565 570 575
Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
580 585 590
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
595 600 605
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
610 615 620
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
625 630 635 640
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
645 650 655
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
660 665 670
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly
675 680 685
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
690 695 700
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln
705 710 715 720
Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
725 730 735
Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Thr Met Ser
740 745 750
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Thr Ile
755 760 765
Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val Lys Gly Arg
770 775 780
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
785 790 795 800
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Leu Leu
805 810 815
Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln Gly Thr Leu
820 825 830
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
835 840 845
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
850 855 860
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
865 870 875 880
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
885 890 895
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
900 905 910
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
915 920 925
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
930 935 940
<210> 126
<211> 589
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 1 из 2+1 PD1/LAG3 0918
<400> 126
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
450 455 460
Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
465 470 475 480
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
485 490 495
Ser Phe Ser Ser Tyr Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys
500 505 510
Gly Leu Glu Trp Val Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr
515 520 525
Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
530 535 540
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
545 550 555 560
Ala Val Tyr Tyr Cys Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu
565 570 575
Asp Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
580 585
<210> 127
<211> 580
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 2+1 PD1/LAG3 0918
<400> 127
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Asp Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Asn Gly Asn Thr Asn Ser Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Leu Ser Leu Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Gly Tyr Ser Asp Tyr Glu Tyr Asn Trp Phe Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
450 455 460
Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu
465 470 475 480
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Glu
485 490 495
Ser Val Asp Thr Ser Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys
500 505 510
Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu
515 520 525
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
530 535 540
Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr
545 550 555 560
Cys Gln Gln Asn Tyr Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys
565 570 575
Val Glu Ile Lys
580
<210> 128
<211> 288
<212> Белок
<213> Homo sapiens
<400> 128
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 129
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер G4S
<400> 129
Gly Gly Gly Gly Ser
1 5
<210> 130
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер (G4S)2
<400> 130
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 131
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер (SG4)2
<400> 131
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10
<210> 132
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер G4(SG4)2
<400> 132
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10
<210> 133
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 133
Gly Ser Pro Gly Ser Ser Ser Ser Gly Ser
1 5 10
<210> 134
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер (G4S)3
<400> 134
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 135
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер (G4S)4
<400> 135
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 136
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 136
Gly Ser Gly Ser Gly Ser Gly Ser
1 5
<210> 137
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 137
Gly Ser Gly Ser Gly Asn Gly Ser
1 5
<210> 138
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 138
Gly Gly Ser Gly Ser Gly Ser Gly
1 5
<210> 139
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 139
Gly Gly Ser Gly Ser Gly
1 5
<210> 140
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 140
Gly Gly Ser Gly
1
<210> 141
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 141
Gly Gly Ser Gly Asn Gly Ser Gly
1 5
<210> 142
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 142
Gly Gly Asn Gly Ser Gly Ser Gly
1 5
<210> 143
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 143
Gly Gly Asn Gly Ser Gly
1 5
<210> 144
<211> 461
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 1+1 PD1/LAG3 0725 (1+1 транс)
<400> 144
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln
225 230 235 240
Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
245 250 255
Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr Thr Met Asn
260 265 270
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Val Ile
275 280 285
Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val Lys Gly Arg
290 295 300
Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr Leu Gln Met
305 310 315 320
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Gly
325 330 335
Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly Gln Gly Thr
340 345 350
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
355 360 365
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
370 375 380
Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
385 390 395 400
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
405 410 415
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
420 425 430
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
435 440 445
Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
450 455 460
<210> 145
<211> 685
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь 2 из 2+1 PD1/LAG3 0750 (2+1 транс)
<400> 145
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln
450 455 460
Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
465 470 475 480
Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr Thr Met Asn
485 490 495
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Val Ile
500 505 510
Ser Trp Asp Gly Gly Gly Thr Tyr Tyr Thr Asp Ser Val Lys Gly Arg
515 520 525
Phe Thr Ile Ser Arg Asp Asp Phe Lys Asn Thr Leu Tyr Leu Gln Met
530 535 540
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Gly
545 550 555 560
Leu Thr Asp Thr Thr Leu Tyr Gly Ser Asp Tyr Trp Gly Gln Gly Thr
565 570 575
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
580 585 590
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
595 600 605
Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
610 615 620
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
625 630 635 640
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
645 650 655
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
660 665 670
Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
675 680 685
<210> 146
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь CEA (CEA TCB)
<400> 146
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Ala Ala Val Gly Thr Tyr
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Lys Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys His Gln Tyr Tyr Thr Tyr Pro Leu
85 90 95
Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 147
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь CD3 (CEA TCB)
<400> 147
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
115 120 125
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
180 185 190
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
195 200 205
Val Glu Pro Lys Ser Cys
210
<210> 148
<211> 694
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA CD3 crossfab VHck fc выступ P329GLALA (CEA TCB)
<400> 148
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Glu Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Lys Thr Gly Glu Ala Thr Tyr Val Glu Glu Phe
50 55 60
Lys Gly Arg Val Thr Phe Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Asp Phe Ala Tyr Tyr Val Glu Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser
275 280 285
Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg
290 295 300
Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met
305 310 315 320
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His
325 330 335
Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln
340 345 350
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val
355 360 365
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
370 375 380
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
385 390 395 400
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
405 410 415
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
420 425 430
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
435 440 445
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
450 455 460
Gly Glu Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
465 470 475 480
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
485 490 495
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
500 505 510
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
515 520 525
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
530 535 540
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
545 550 555 560
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly
565 570 575
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
580 585 590
Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn
595 600 605
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
610 615 620
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
625 630 635 640
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
645 650 655
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
660 665 670
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
675 680 685
Ser Leu Ser Pro Gly Lys
690
<210> 149
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA VHCH1 Fc отверстие P329GLALA (CEA TCB)
<400> 149
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Glu Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Lys Thr Gly Glu Ala Thr Tyr Val Glu Glu Phe
50 55 60
Lys Gly Arg Val Thr Phe Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Asp Phe Ala Tyr Tyr Val Glu Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 150
<211> 232
<212> Белок
<213> Искусственная последовательность
<220>
<223> CD3 VH-CL (CEACAM5 TCB)
<400> 150
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val
115 120 125
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
130 135 140
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
145 150 155 160
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
165 170 175
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
180 185 190
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
195 200 205
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
210 215 220
Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 151
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEACAM5 VH-CH1(EE)-Fc (отверстие, P329G LALA)
<400> 151
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Ser Lys Tyr Val Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Pro Phe Gly Tyr Tyr Val Ser Asp Tyr Ala Met Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro
<210> 152
<211> 674
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEACAM5 VH-CH1(EE)-CD3 VL-CH1-Fc (выступ, P329G LALA)
<400> 152
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Ser Lys Tyr Val Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Pro Phe Gly Tyr Tyr Val Ser Asp Tyr Ala Met Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Ala Val Val Thr
225 230 235 240
Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly Thr Val Thr Leu Thr
245 250 255
Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn Trp
260 265 270
Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly Leu Ile Gly Gly Thr
275 280 285
Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe Ser Gly Ser Leu Leu
290 295 300
Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala Gln Pro Glu Asp Glu
305 310 315 320
Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn Leu Trp Val Phe Gly
325 330 335
Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser Thr Lys Gly Pro
340 345 350
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
355 360 365
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
370 375 380
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
385 390 395 400
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
405 410 415
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
420 425 430
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
435 440 445
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
450 455 460
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
465 470 475 480
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
485 490 495
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
500 505 510
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
515 520 525
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
530 535 540
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
545 550 555 560
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
565 570 575
Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val
580 585 590
Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
595 600 605
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
610 615 620
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
625 630 635 640
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
645 650 655
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
660 665 670
Ser Pro
<210> 153
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEACAM5 VL-CL(RK)
<400> 153
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Gly Glu Ser Val Asp Ile Phe
20 25 30
Gly Val Gly Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Thr Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Arg Lys
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 154
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-HCDR1
<400> 154
Glu Phe Gly Met Asn
1 5
<210> 155
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-HCDR2
<400> 155
Trp Ile Asn Thr Lys Thr Gly Glu Ala Thr Tyr Val Glu Glu Phe Lys
1 5 10 15
Gly
<210> 156
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-HCDR3
<400> 156
Trp Asp Phe Ala Tyr Tyr Val Glu Ala Met Asp Tyr
1 5 10
<210> 157
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-LCDR1
<400> 157
Lys Ala Ser Ala Ala Val Gly Thr Tyr Val Ala
1 5 10
<210> 158
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-LCDR2
<400> 158
Ser Ala Ser Tyr Arg Lys Arg
1 5
<210> 159
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-LCDR3
<400> 159
His Gln Tyr Tyr Thr Tyr Pro Leu Phe Thr
1 5 10
<210> 160
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA VH
<400> 160
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Glu Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Lys Thr Gly Glu Ala Thr Tyr Val Glu Glu Phe
50 55 60
Lys Gly Arg Val Thr Phe Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Asp Phe Ala Tyr Tyr Val Glu Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 161
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA VL
<400> 161
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Ala Ala Val Gly Thr Tyr
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Lys Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys His Gln Tyr Tyr Thr Tyr Pro Leu
85 90 95
Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 162
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-HCDR1 (CEACAM5)
<400> 162
Asp Thr Tyr Met His
1 5
<210> 163
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-HCDR2 (CEACAM5)
<400> 163
Arg Ile Asp Pro Ala Asn Gly Asn Ser Lys Tyr Val Pro Lys Phe Gln
1 5 10 15
Gly
<210> 164
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-HCDR3 (CEACAM5)
<400> 164
Phe Gly Tyr Tyr Val Ser Asp Tyr Ala Met Ala Tyr
1 5 10
<210> 165
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-LCDR1 (CEACAM5)
<400> 165
Arg Ala Gly Glu Ser Val Asp Ile Phe Gly Val Gly Phe Leu His
1 5 10 15
<210> 166
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-LCDR2 (CEACAM5)
<400> 166
Arg Ala Ser Asn Arg Ala Thr
1 5
<210> 167
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA-LCDR3 (CEACAM5)
<400> 167
Gln Gln Thr Asn Glu Asp Pro Tyr Thr
1 5
<210> 168
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA VH (CEACAM5)
<400> 168
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Ser Lys Tyr Val Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Pro Phe Gly Tyr Tyr Val Ser Asp Tyr Ala Met Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 169
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> CEA VL (CEACAM5)
<400> 169
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Gly Glu Ser Val Asp Ile Phe
20 25 30
Gly Val Gly Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Thr Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<---
Реферат
Группа изобретений относится к биотехнологии. Представлены: антитело, содержащее первый антигенсвязывающий домен, который специфически связывается с PD1, и второй антигенсвязывающий домен, который специфически связывается с LAG3, полинуклеотид, кодирующий биспецифическое антитело, фармацевтические композиции для лечения рака и хронической вирусной инфекции, а также относится к способам получения этих молекул и их применению. Изобретение позволяет получить биспецифическое антитело, специфически связывающееся с белком запрограммированной гибели клеток 1 (PD1) и с геном активации лимфоцитов-3 (LAG3), применяемое для эффективного лечения рака и хронической вирусной инфекции. 9 н. и 18 з.п. ф-лы, 46 ил., 28 табл., 13 пр.
Формула
Документы, цитированные в отчёте о поиске
Антитела, сконструированные на основе цистеинов, и их конъюгаты
Патенты аналоги
Антитела, сконструированные на основе цистеинов, и их конъюгаты

Комментарии