Способы получения экспрессирующих химерный антигенный рецептор клеток - RU2751362C2
Код документа: RU2751362C2
Чертежи



















































Описание
По настоящей заявке испрашивается приоритет заявки США сериальный № 62/097375, поданной 29 декабря 2014 года, и заявки США сериальный № 62/133137, поданной 13 марта 2015 года, содержание которых включено в настоящий документ посредством ссылки во всей полноте.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Рассматриваемая заявка содержит перечень последовательностей, который был представлен в электронном виде в формате ASCII и настоящим включен посредством ссылки во всей полноте. Упомянутая копия в формате ASCII, созданная 18 декабря 2015 года, называется N2067-7067WO_SL.txt и имеет размер 246147 байт.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится в целом к способам получения иммунных эффекторных клеток (например, T-клеток, NK-клеток), сконструированных для экспрессии химерного антигенного рецептора (CAR), и содержащим их композициям.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Терапия с помощью адоптивного переноса клеток (ACT) с использованием аутологичных T-клеток, в частности T-клеток, трансдуцированных химерными антигенными рецепторами (CAR), показала себя перспективной в нескольких исследованиях гематологических раков.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее раскрытие относится к способам получения иммунных эффекторных клеток (например, T-клеток, NK-клеток), которые могут быть сконструированы для экспрессии CAR, и содержащих их композиций.
Соответственно, в одном аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток), которые могут быть сконструированы для экспрессии CAR, причем данный способ содержит предоставление популяции иммунных эффекторных клеток (например, T-клеток), удаление регуляторных T-клеток, например, CD25+ T-клеток, из популяции для обеспечения тем самым популяции истощенных по T-регуляторам клеток, например, истощенных по CD25+ клеток, которые подходят для экспрессии CAR.
В одном варианте осуществления популяция истощенных по T-регуляторам клеток содержит менее чем 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
В одном варианте осуществления популяция иммунных эффекторных клеток представляет собой клетки субъекта, имеющего рак, например, субъекта, имеющего CD25-экспрессирующий рак, такой как, например, хронический лимфоцитарный лейкоз (ХЛЛ). В одном варианте осуществления популяция истощенных по T-регуляторам клеток содержит менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток.
В одном варианте осуществления популяция иммунных эффекторных клеток является аутологичной по отношению к субъекту, которому клетки будут введены для лечения. В одном варианте осуществления популяция иммунных эффекторных клеток является аллогенной по отношению к субъекту, которому клетки будут введены для лечения.
В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с помощью анти-CD25 антитела, или его фрагмента, или CD25-связывающего лиганда, например, IL-2. В одном варианте осуществления анти-CD25 антитело, или его фрагмент, или CD25-связывающий лиганд конъюгируют с субстратом, например, гранулой, или иным образом наносят на субстрат, например, гранулу. В одном варианте осуществления анти-CD25 антитело или его фрагмент конъюгируют с субстратом, как описано здесь. В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с помощью молекулы анти-CD25 антитела или ее фрагмент.
В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с использованием реагента для истощения по CD25 от MiltenyiTM. В одном варианте осуществления отношение клеток к реагенту для истощения по CD25 составляет 1e7 клеток на 20 мкл, или 1e7 клеток на 15 мкл, или 1e7 клеток на 10 мкл, или 1e7 клеток на 5 мкл, или 1e7 клеток на 2,5 мкл, или 1e7 клеток на 1,25 мкл.
В одном варианте осуществления популяция истощенных по T-регуляторам клеток, например, истощенных по CD25+ клеток, подходит для экспрессии CAR, описанного здесь, например, CAR CD19, описанного здесь. В одном варианте осуществления популяцию иммунных эффекторных клеток получают от субъекта, имеющего гематологический рак, например, лейкоз, например, хронический лимфоцитарный лейкоз (ХЛЛ), острый лимфоцитарный лейкоз (ОЛЛ), или лимфому, например, мантийноклеточную лимфому (МКЛ) или ходжкинскую лимфому (ХЛ). В одном варианте осуществления популяция истощенных по T-регуляторам клеток содержит менее чем 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% клеток лейкоза, например, клеток ХЛЛ, клеток ОЛЛ, или клеток лимфомы, например, клеток МКЛ или клеток ХЛ. В одном варианте осуществления популяцию иммунных эффекторных клеток получают от субъекта, имеющего ХЛЛ, и популяция истощенных по T-регуляторам клеток, например, истощенных по CD25+ клеток, содержит менее чем 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% клеток лейкоза, например, клеток ХЛЛ, и подходит для экспрессии CAR CD19, описанного здесь. В одном варианте осуществления популяция истощенных по T-регуляторам клеток содержит менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления популяция истощенных по T-регуляторам клеток содержит менее чем 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ.
В одном варианте осуществления популяция иммунных эффекторных клеток представляет собой T-клетки, выделенные из лимфоцитов периферической крови. В варианте осуществления популяцию T-клеток получают посредством лизирования красных кровяных клеток и/или посредством истощения моноцитов. В варианте осуществления популяцию T-клеток выделяют из периферических лимфоцитов с использованием, например, способа, описанного здесь.
В одном варианте осуществления популяция иммунных эффекторных клеток может быть получена из образца крови от субъекта, например, получена посредством афереза. В одном варианте осуществления клетки, отобранные посредством афереза, промывают для удаления фракции плазмы, и, необязательно, клетки помещают в подходящий буфер или среду для последующих этапов обработки. В одном варианте осуществления клетки промывают буфером, таким как, например, фосфатно-солевой буфер (ФСБ). В варианте осуществления клетки промывают в растворе для промывания, в котором отсутствует один или несколько двухвалентных катионов, таких как кальций и магний, например, отсутствует как кальций, так и магний. В одном варианте осуществления клетки промывают в буфере, который по существу не содержит двухвалентных катионов.
В одном варианте осуществления способ дополнительно содержит удаление из популяции клеток, которые экспрессируют опухолевый антиген, например, опухолевый антиген, который не содержит CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, для обеспечения тем самым популяции истощенных по T-регуляторам, например, истощенных по CD25+, и истощенных по опухолевому антигену клеток, которые подходят для экспрессии CAR, например, CAR, описанного здесь. В одном варианте осуществления экспрессирующие опухолевый антиген клетки удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, анти-CD25 антитело или его фрагмент и антитело к противоопухолевому антигену или его фрагмент могут быть прикреплены к одному и тому же субстрату, например, грануле, который можно использовать для удаления клеток, или анти-CD25 антитело, или его фрагмент, или антитело к противоопухолевому антигену, или его фрагмент, могут быть прикреплены к различным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление экспрессирующих опухолевый антиген клеток происходят последовательно и могут происходить, например, в любом порядке.
В одном варианте осуществления способ дополнительно содержит удаление из популяции клеток, которые экспрессируют ингибитор контрольных точек, например, ингибитор контрольных точек, описанный здесь, например, один или несколько из (например, 2 или 3 из) PD1+ клеток, LAG3+ клеток и TIM3+ клеток, для обеспечения тем самым популяции истощенных по T-регуляторам, например, истощенных по CD25+, клеток и истощенных по ингибитору контрольных точек клеток, например, истощенных по PD1+, LAG3+ и/или TIM3+ клеток. В вариантах осуществления удаляют PD1+ клетки и LAG3+ клетки; удаляют PD1+ клетки и TIM3+ клетки; или удаляют LAG3+ и TIM3+ клетки. В одном варианте осуществления экспрессирующие ингибитор контрольных точек клетки удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, анти-CD25 антитело или его фрагмент и антитело к ингибитору контрольных точек или его фрагмент могут быть прикреплены к одной и той же грануле, которую можно использовать для удаления клеток, или анти-CD25 антитело или его фрагмент и антитело к ингибитору контрольных точек или его фрагмент могут быть прикреплены к различным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление экспрессирующих ингибитор контрольных точек клеток происходят последовательно и могут происходить, например, в любом порядке.
В одном варианте осуществления популяция клеток, подлежащая удалению, представляет собой не регуляторные T-клетки или опухолевые клетки, но клетки, которые иным образом отрицательно влияют на размножение и/или функцию CART-клеток, например, клетки, экспрессирующие CD14, CD11b, CD33, CD15 или другие маркеры, экспрессируемые потенциально иммуносупрессивными клетками. В одном варианте осуществления предусмотрено удаление таких клеток одновременно с регуляторными T-клетками и/или опухолевыми клетками, или после упомянутого истощения, или в другом порядке.
В одном варианте осуществления способ дополнительно содержит удаление из популяции клеток, которые экспрессируют CD14, для обеспечения тем самым популяции истощенных по T-регуляторам, например, истощенных по CD25+, клеток и истощенных по CD14+ клеток. В одном варианте осуществления CD14+ клетки удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, анти-CD25 антитело или его фрагмент и анти-CD14 антитело или его фрагмент могут быть прикреплены к одной и той же грануле, которую можно использовать для удаления клеток; или анти-CD25 антитело или его фрагмент и анти-CD14 антитело или его фрагмент могут быть прикреплены к различным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление CD14+ клеток происходят последовательно и могут происходить, например, в любом порядке. В одном варианте осуществления CD14+ клетки удаляют с использованием молекулы антитела к CD14 или ее фрагмента.
В одном варианте осуществления предоставляемую популяцию иммунных эффекторных клеток выбирают на основании экспрессии одного или нескольких маркеров (например, 2, 3, 4, 5, 6, 7 или более маркеров), например, CD3, CD28, CD4, CD8, CD27, CD127, CD45RA и CD45RO, например, предоставляемая популяция иммунных эффекторных клеток (например, T-клеток) представляет собой CD3+ и/или CD28+.
В одном варианте осуществления способ дополнительно содержит получение популяции иммунных эффекторных клеток, например, T-клеток, обогащенной для экспрессии одного или нескольких маркеров (например, 2, 3, 4, 5, 6, 7 или более маркеров), например, CD3, CD28, CD4, CD8, CD27, CD127, CD45RA и CD45RO. В варианте осуществления популяцию иммунных эффекторных клеток обогащают CD3+ и/или CD28+ клетками. Например, получают T-клетки, выделенные посредством инкубации с конъюгированными с анти-CD3/анти-CD28 гранулами. В одном варианте осуществления способ дополнительно содержит селекцию клеток из популяции истощенных по T-регуляторам клеток, например, истощенных по CD25+ клеток, которые экспрессируют один или несколько маркеров (например, 2, 3, 4, 5 или более маркеров), например, CD3, CD28, CD4, CD8, CD45RA и CD45RO.
В одном варианте осуществления способ дополнительно содержит активирование популяции истощенных по T-регуляторам клеток, например, истощенных по CD25+ клеток, например, с помощью способа, описанного здесь.
В одном варианте осуществления способ дополнительно содержит трансдуцирование клеток из популяции истощенных по T-регуляторам клеток, например, популяции истощенных по CD25+ клеток, вектором, содержащим нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь. В одном варианте осуществления вектор выбирают из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора. В одном варианте осуществления клетку из популяции истощенных по T-регуляторам клеток, например, популяции истощенных по CD25+ клеток, трансдуцируют вектором один раз, например, в течение одного дня после получение популяции иммунных эффекторных клеток из образца крови от субъекта, например, полученного посредством афереза.
В одном варианте осуществления способ дополнительно содержит генерирование популяции клеток с измененной РНК, временно экспрессирующих экзогенную РНК, из популяции истощенных по T-регуляторам клеток, например, популяции истощенных по CD25+ клеток. Способ содержит введение транскрибированной in vitro РНК или синтетической РНК в клетку из популяции, причем РНК содержит нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь.
В одном варианте осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, размножают, например, с помощью способа, описанного здесь. В одном варианте осуществления клетки размножают в культуре в течение периода, составляющего от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 часов) до приблизительно 14 дней (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней). В одном варианте осуществления клетки размножают в течение периода, составляющего 3-9 дней. В одном варианте осуществления клетки размножают в течение периода, составляющего 4-9 дней. В одном варианте осуществления клетки размножают в течение периода, составляющего 8 дней или менее, например, 7, 6, 5, 4 или 3 дня. В одном варианте осуществления клетки, например, клетку с CAR CD19, описанную здесь, размножают в культуре в течение 3 или 4 дней, и получаемые клетки являются более активными, чем те же клетки, размноженные в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетку с CAR CD19, описанную здесь, размножают в культуре в течение 5 дней, и получаемые клетки являются более активными, чем те же клетки, размноженные в культуре в течение 9 дней в тех же условиях культивирования. Активность может быть определена, например, по различным T-клеточным функциям, например, пролиферации, киллингу клеток-мишеней, производству цитокинов, активации, миграции или их комбинациям. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 3 или 4 дней, показывают по меньшей мере одно-, двух-, трех- или четырехкратное увеличение клеточных удвоений при антигенной стимуляции по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех- или четырехкратное увеличение клеточных удвоений при антигенной стимуляции по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR CD19, описанный здесь, размножают в культуре в течение 3 или 4 дней, и получаемые клетки проявляют более высокое производство провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR CD19, описанный здесь, размножают в культуре в течение 5 дней, и получаемые клетки проявляют более высокое производство провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 3 или 4 дней, показывают по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десятикратное или более увеличение производства провоспалительных цитокинов в пг/мл, например, уровней IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десятикратное или более увеличение производства провоспалительных цитокинов в пг/мл, например, уровней IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 3, 4 или 5 дней, показывают по меньшей мере столь же высокое производство цитокинов в пг/мл или по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десятикратное или более увеличение производства цитокинов в пг/мл, например, уровней IL2, IFN-гамма, GM-CSF, TNF-альфа, IL-1b, IL4, IL5, IL6, IL8 или IL10, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования.
В одном варианте осуществления гранулы (например, стимулирующие CD3/28 гранулы) удаляют из клеток с помощью механического разрушения. В варианте осуществления механическое разрушение содержит прохождение (например, многократное прохождение) клеток через наконечник пипетки, например, наконечник пипетки с узким отверстием. В некоторых вариантах осуществления клетки пропускают через одну или несколько (например, 2, 3, 4 или 5 или более) трубок, например, трубок с узким отверстием. В одном варианте осуществления трубки являются частью замкнутой системы культивирования клеток. В некоторых вариантах осуществления внутренний диаметр наконечника пипетки или трубок составляет менее чем приблизительно 1 мм, 0,9 мм, 0,8 мм, 0,7 мм, 0,5 мм, 0,4 мм, 0,3 мм или 0,2 мм, и, необязательно, диаметр составляет больше чем 0,1 мм, 0,2 мм, 0,3 мм или 0,4 мм.
В одном варианте осуществления клетки, например, клетки с CAR, описанные здесь, например, клетки с CAR CD19, описанные здесь, размноженные в течение 3, 4 или 5 дней, имеют повышенное содержание Tem-клеток, Tcm-клеток или как Tem, так и Tcm-клеток,по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки с CAR, описанные здесь, например, клетки с CAR CD19, описанные здесь, размноженные в течение 3, 4 или 5 дней, имеют повышенное содержание Tem-клеток, Teff-клеток или как Tem, так и Teff-клеток, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления популяция клеток, например, клеток с CD19CAR, описанных здесь, размноженных в течение 3, 4 или 5 дней, имеет процентное содержание Tnaive-подобных клеток (из Tnaive-подобных, Teff и Tcm-клеток) по меньшей мере приблизительно 20%, 25%, 30%, 35%, 40%, 45% или 50% и, необязательно, вплоть до приблизительно 40% или 50%. В одном варианте осуществления популяция клеток, например, клеток с CD19CAR, описанных здесь, размноженных в течение 3, 4 или 5 дней, имеет процентное содержание Tem-клеток (из Tnaive-подобных, Teff и Tcm-клеток) по меньшей мере приблизительно 10%, 15% или 20% и, необязательно, вплоть до приблизительно 15% или 20%. В одном варианте осуществления популяция клеток, например, клеток с CD19CAR, описанных здесь, размноженных в течение 3, 4 или 5 дней, имеет процентное содержание (Tnaive-подобных+Tem) клеток (из Tnaive-подобных, Teff и Tcm-клеток) по меньшей мере приблизительно 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65% или 70% и, необязательно, вплоть до приблизительно 50% или 70%.
В одном варианте осуществления клетки, например, клетки с CAR CD19, описанные здесь, размноженные в течение 3, 4 или 5 дней, при введении в дозе 0,5×106 клеток имеют в анализе NALM6 с фиг. 31A активность большую или равную активности дозы 1×106, 1,5×106, 2×106, 2,5×106, 3×106, 4×106 или 5×106 тех же клеток, размноженных в культуре в течение 9 дней в тех же условиях культивирования. В некоторых вариантах осуществления активность измеряют через 1, 2, 3, 4, 5 или 6 недель.
В одном варианте осуществления клетки размножают посредством культивирования клеток в присутствии средства, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и лиганда, который стимулирует костимулирующую молекулу на поверхности клеток, например, как описано здесь. В одном варианте осуществления средство представляет собой гранулу, конъюгированную с анти-CD3 антителом или его фрагментом и/или анти-CD28 антителом или его фрагментом.
В одном варианте осуществления клетки размножают в подходящей среде (например, среде, описанной здесь), которая может, необязательно, содержать один или несколько (например, 2, 3, 4 или 5 или более) факторов для пролиферации и/или жизнеспособности, включая сыворотку (например, фетальную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, IL-21, TGFβ и TNF-α или любые другие добавки для роста клеток.
В одном варианте осуществления клетки размножают в подходящей среде (например, среде, описанной здесь), которая включает в себя один или несколько (например, 2, 3, 4 или 5 или более) интерлейкинов, что приводит к по меньшей мере 200-кратному (например, 200-кратному, 250-кратному, 300-кратному, 350-кратному) увеличению количества клеток в течение 14-дневного периода размножения, например, как измерено с помощью способа, описанного здесь, такого как проточная цитометрия. В одном варианте осуществления клетки размножают в присутствии IL-15 и/или IL-7 (например, IL-15 и IL-7).
В одном варианте осуществления клетки криосохраняют после подходящего периода размножения. В одном варианте осуществления клетки криосохраняют в соответствии со способом, описанным здесь. В одном варианте осуществления размноженные клетки криосохраняют в подходящей среде, например, инфузионной среде, например, как описано здесь.
В одном варианте осуществления способ дополнительно содержит приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT. В варианте осуществления нуклеиновая кислота представляет собой ДНК или РНК.
В другом аспекте раскрытие включает в себя реакционную смесь, содержащую популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток. В одном варианте осуществления реакционная смесь содержит популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления популяция клеток содержит менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления популяция клеток содержит менее чем 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ.
В одном варианте осуществления реакционная смесь содержит популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% экспрессирующих ингибитор контрольных точек клеток, например, PD1+ клеток, LAG3+ клеток или TIM3+ клеток. Реакционная смесь может дополнительно содержать буфер или другой реагент, например, содержащий ФСБ раствор.
В одном варианте осуществления реакционная смесь содержит популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD14+ клеток. Реакционная смесь может дополнительно содержать буфер или другой реагент, например, содержащий ФСБ раствор.
В одном варианте осуществления реакционная смесь может дополнительно содержать средство, которое активирует и/или размножает клетки популяции, например, средство, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и/или лиганд, который стимулирует костимулирующую молекулу на поверхности клеток, например, как описано здесь. В одном варианте осуществления средство представляет собой гранулу, конъюгированную с анти-CD3 антителом или его фрагментом и/или анти-CD28 антителом или его фрагментом.
В одном варианте осуществления реакционная смесь дополнительно содержит один или несколько (например, 2, 3, 4 или 5) фактор для пролиферации и/или жизнеспособности, включая сыворотку (например, фетальную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, IL-21, TGFβ и TNF-α или любые другие добавки для роста клеток. В одном варианте осуществления реакционная смесь дополнительно содержит IL-15 и/или IL-7.
В одном варианте осуществления множество клеток популяции в реакционной смеси содержат молекулу нуклеиновой кислоты, например, молекулу нуклеиновой кислоты, описанную здесь, которая содержит кодирующую CAR последовательность, например, кодирующую CAR CD19 последовательность, например, как описано здесь.
В одном варианте осуществления множество клеток популяции в реакционной смеси содержат вектор, содержащий последовательность нуклеиновой кислоты, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь. В одном варианте осуществления вектор представляет собой вектор, описанный здесь, например, вектор, выбранный из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
В одном варианте осуществления реакционная смесь дополнительно содержит криопротектор или стабилизатор, такой как, например, сахарид, олигосахарид, полисахарид и полиол (например, трегалозу, маннит, сорбит, лактозу, сахарозу, глюкозу и декстран), соли и краун-эфиры. В одном варианте осуществления криопротектор представляет собой декстран.
В другом аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток), сконструированных для экспрессии CAR, причем данный способ содержит предоставление популяции иммунных эффекторных клеток (например, T-клеток), причем множество иммунных эффекторных клеток содержат нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, и размножение клеток популяции в присутствии одного или нескольких (например, 2, 3, 4 или 5) интерлейкинов, что приводит к по меньшей мере 200-кратному (например, 200-кратному, 250-кратному, 300-кратному, 350-кратному) увеличению количества клеток в течение 14-дневного периода размножения, например, как измерено с помощью способа, описанного здесь, такого как проточная цитометрия. В одном варианте осуществления клетки популяции размножают в присутствии IL-15 и/или IL-7, например, IL-15 и IL-7.
В одном варианте осуществления клетки размножают в культуре в течение периода, составляющего от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 часов) до приблизительно 14 дней (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней). В одном варианте осуществления клетки размножают в течение периода, составляющего 4-9 дней. В одном варианте осуществления клетки размножают в течение периода, составляющего менее чем 8 дней, например, 7, 6 или 5 дней. В одном варианте осуществления клетки размножают в культуре в течение 5 дней, и получаемые клетки являются более активными, чем те же клетки, размноженные в культуре в течение 9 дней в тех же условиях культивирования. Активность может быть определена, например, по различным T-клеточным функциям, например, пролиферации, киллингу клеток-мишеней, производству цитокинов, активации, миграции или их комбинациям. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех- или четырехкратное увеличение клеточных удвоений при антигенной стимуляции по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR CD19, описанный здесь, размножают в культуре в течение 5 дней, и получаемые клетки проявляют более высокое производство провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десятикратное или более увеличение производства провоспалительных цитокинов в пг/мл, например, уровней IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования.
В одном варианте осуществления клетки размножают посредством культивирования клеток в присутствии средства, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и лиганда, который стимулирует костимулирующую молекулу на поверхности клеток, например, как описано здесь. В одном варианте осуществления средство представляет собой гранулу, конъюгированную с анти-CD3 антителом или его фрагментом и/или анти-CD28 антителом или его фрагментом.
В одном варианте осуществления предоставляемая популяция иммунных эффекторных клеток представляет собой популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток. В одном варианте осуществления предоставляемая популяция иммунных эффекторных клеток представляет собой популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления предоставляемая популяция клеток содержит менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления предоставляемая популяция клеток содержит менее чем 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ.
В одном варианте осуществления предоставляемая популяция иммунных эффекторных клеток представляет собой популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% экспрессирующих ингибитор контрольных точек клеток, например, PD1+ клеток, LAG3+ клеток или TIM3+ клеток.
В одном варианте осуществления предоставляемая популяция иммунных эффекторных клеток представляет собой популяцию истощенных по T-регуляторам клеток, содержащую менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD14+ клеток.
В одном варианте осуществления способ дополнительно содержит, перед размножением, удаление регуляторных T-клеток, например, CD25+ T-клеток, из популяции для обеспечения тем самым популяции истощенных по T-регуляторам клеток, например, истощенных по CD25+ клеток, подлежащих размножению. В одном варианте осуществления регуляторные T-клетки, например, CD25+ клетки, удаляют с помощью способа, описанного здесь.
В одном варианте осуществления способ дополнительно содержит, перед размножением, удаление регуляторных T-клеток, например, CD14+ клеток, из популяции для обеспечения тем самым популяции истощенных по CD14+ клеток, подлежащих размножению. В одном варианте осуществления регуляторные T-клетки, например, CD14+ клетки, удаляют с помощью способа, описанного здесь.
В одном варианте осуществления способ дополнительно содержит приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT. В варианте осуществления нуклеиновая кислота представляет собой ДНК или РНК.
В другом аспекте раскрытие включает в себя реакционную смесь, содержащую популяцию иммунных эффекторных клеток, причем множество клеток популяции в реакционной смеси содержат молекулу нуклеиновой кислоты, например, молекулу нуклеиновой кислоты, описанную здесь, которая содержит кодирующую CAR последовательность, например, кодирующую CAR CD19 последовательность, например, как описано здесь, и IL-7 и/или IL-15.
В одном варианте осуществления множество клеток популяции в реакционной смеси содержат вектор, содержащий последовательность нуклеиновой кислоты, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь. В одном варианте осуществления вектор представляет собой вектор, описанный здесь, например, вектор, выбранный из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора.
В одном варианте осуществления реакционная смесь может дополнительно содержать средство, которое активирует и/или размножает клетки популяции, например, средство, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и/или лиганд, который стимулирует костимулирующую молекулу на поверхности клеток, например, как описано здесь. В одном варианте осуществления средство представляет собой гранулу, конъюгированную с анти-CD3 антителом или его фрагментом и/или анти-CD28 антителом или его фрагментом.
В другом аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток), сконструированных для экспрессии CAR, причем данный способ содержит предоставление популяции иммунных эффекторных клеток (например, T-клеток), причем множество иммунных эффекторных клеток содержат нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, и размножение клеток популяции в культуре в течение 5 дней, причем получаемые клетки являются более активными, как измерено по уровням клеточная пролиферация при антигенной стимуляции, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования.
В одном варианте осуществления клетки, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех- или четырехкратное увеличение клеточных удвоений при антигенной стимуляции по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR CD19, описанный здесь, размножают в культуре в течение 5 дней, и получаемые клетки проявляют более высокое производство провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десятикратное или более увеличение производства провоспалительных цитокинов в пг/мл, например, уровней IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования.
В другом аспекте раскрытие включает в себя способы, содержащие введение субъекту популяции иммунных эффекторных клеток, полученных с помощью способа, описанного здесь, и сконструированных для экспрессии CAR, например, CAR, описанного здесь, например, CAR CD19, описанного здесь.
В одном варианте осуществления способ обеспечивает противоопухолевый иммунитет у субъекта, имеющего рак, например, гематологический рак, такой как, например, ХЛЛ. В одном варианте осуществления способ представляет собой способ лечения субъекта, имеющего рак, например, гематологический рак, описанный здесь, такой как, например, лейкоз (например, ХЛЛ, ОЛЛ) или лимфома (например, МКЛ, ХЛ). В одном варианте осуществления популяция клеток является аутологичной по отношению к субъекту, которому вводят популяцию. В одном варианте осуществления популяция клеток является аллогенной по отношению к субъекту, которому вводят популяцию. В одном варианте осуществления субъект является человеком.
В одном варианте осуществления заболевание, ассоциированное с опухолевым антигеном, например, опухолевым антигеном, описанным здесь, например, CD19, выбирают из пролиферативного заболевания, такого как рак или злокачественная опухоль, или предракового состояния, такого как миелодисплазия, миелодиспластический синдром или предлейкоз, или оно представляет собой не связанный с раком симптом, ассоциированный с экспрессией опухолевого антигена, описанного здесь. В одном варианте осуществления заболевание представляет собой рак, описанный здесь, например, рак, описанный здесь как ассоциированный с мишенью, описанной здесь. В одном варианте осуществления гематологический рак представляет собой лейкоз. В одном варианте осуществления рак выбирают из группы, состоящей из одного или нескольких острых лейкозов, включая, но без ограничения, B-клеточный острый лимфоидный лейкоз ("BALL"), T-клеточный острый лимфоидный лейкоз ("TALL"), острый лимфоидный лейкоз (ОЛЛ); один или несколько хронических лейкозов включая, но без ограничения, хронический миелогенный лейкоз (ХМЛ), хронический лимфоцитарный лейкоз (ХЛЛ); дополнительные гематологические раки или гематологические состояния, включая, но без ограничения, B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную В-крупноклеточную лимфому, фолликулярную лимфому, волосистоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, мантийноклеточную лимфому, лимфому из клеток краевой зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, плазмобластную лимфому, новообразование из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", который представляет собой разнородную совокупность гематологических состояний, объединенных неэффективным производством (или дисплазией) миелоидных кровяных клеток, и заболевание, ассоциированное с экспрессией опухолевого антигена, описанного здесь, включая, но без ограничения, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, экспрессирующие опухолевый антиген, как описано здесь; и любую их комбинацию. В другом варианте осуществления заболевание, ассоциированное с опухолевым антигеном, описанным здесь, представляет собой солидную опухоль, например, солидную опухоль, описанную здесь, например, рак предстательной железы, прямой кишки, поджелудочной железы, шейки матки, желудка, яичников, головы и легкого.
В одном варианте осуществления популяцию иммунных эффекторных клеток, трансдуцированных нуклеиновой кислотой, кодирующей CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, размножают, например, с помощью способа, описанного здесь. В одном варианте осуществления клетки размножают в течение периода, составляющего 8 дней или менее, например, 7, 6, 5, 4 или 3 дня. В одном варианте осуществления клетки, например, клетку с CAR CD19, описанную здесь, размножают в культуре в течение 5 дней, и получаемые клетки являются более активными, чем те же клетки, размноженные в культуре в течение 9 дней в тех же условиях культивирования, например, как описано здесь. В одном варианте осуществления субъекту вводят от 104 до 106 иммунных эффекторных клеток на кг веса тела субъекта. В одном варианте осуществления субъект получает первоначальное введение популяции иммунных эффекторных клеток (например, первоначальное введение от 104 до 106 иммунных эффекторных клеток на кг веса тела субъекта, например, от 104 до 105 иммунных эффекторных клеток на кг веса тела субъекта), множество из которых содержат нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, и одно или несколько (например, 2, 3, 4 или 5) последующих введений популяции иммунных эффекторных клеток (например, одно или несколько последующих введений от 104 до 106 иммунных эффекторных клеток на кг веса тела субъекта, например, от 104 до 105 иммунных эффекторных клеток на кг веса тела субъекта), множество из которых содержат нуклеиновую кислоту, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь. В одном варианте осуществления одно или несколько последующих введений вводят менее чем через 15 дней, например, через 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 дня после предыдущего введения, например, менее чем через 4, 3, 2 дня после предыдущего введения. В одном варианте осуществления субъект получает всего приблизительно 106 иммунных эффекторных клеток на кг веса тела субъекта за курс из по меньшей мере трех введений популяции иммунных эффекторных клеток, например, субъект получает первоначальную дозу 1×105 иммунных эффекторных клеток, второе введение 3×105 иммунных эффекторных клеток, и третье введение 6×105 иммунных эффекторных клеток, и, например, каждое введение вводят менее чем через 4, 3, 2 дня после предыдущего введения.
В одном аспекте раскрытие включает в себя популяцию аутологичных иммунных эффекторных клеток, множество из которых трансфицированы или трансдуцированы вектором, содержащим молекулу нуклеиновой кислоты, кодирующую CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, причем популяция клеток содержит менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления популяция клеток содержит менее чем 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 15%, 10%, 5%, 4%, 3%,2%, 1%опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ. В одном варианте осуществления популяция клеток содержит менее чем 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток и менее чем 10%, 5%, 4%, 3%, 2%, 1% опухолевых клеток, например, CD25-экспрессирующих опухолевых клеток, например, клеток ХЛЛ.
В другом аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток). В варианте осуществления способ содержит: предоставление популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток) и приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR, и нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT, в условиях, которые обеспечивают экспрессию CAR и теломеразы.
В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, представляет собой РНК. В другом варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, представляет собой ДНК. В варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, содержит промотор способный управлять экспрессией субъединицы теломеразы.
В родственном аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток), причем данный способ содержит: предоставление популяции иммунных эффекторных клеток (например, T-клеток), приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR, и РНК, кодирующей субъединицу теломеразы, например, hTERT, в условиях, которые обеспечивают экспрессию CAR и теломеразы.
В варианте осуществления нуклеиновая кислота, кодирующая CAR, и РНК, кодирующая субъединицу теломеразы, являются частью одной и той же молекулы нуклеиновой кислоты. В варианте осуществления нуклеиновая кислота, кодирующая CAR, и РНК, кодирующая субъединицу теломеразы, являются частью различных молекул нуклеиновой кислоты.
В варианте осуществления способ содержит приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR, и РНК, кодирующей субъединицу теломеразы, по существу в одно и то же время. В варианте осуществления способ содержит приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR, до приведения популяции иммунных эффекторных клеток в контакт с РНК, кодирующей субъединицу теломеразы. В варианте осуществления способ содержит приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR, после приведения популяции иммунных эффекторных клеток в контакт с РНК, кодирующей субъединицу теломеразы.
В варианте осуществления РНК, кодирующая субъединицу теломеразы, представляет собой мРНК. В варианте осуществления РНК, кодирующая субъединицу теломеразы, содержит поли(A)-хвост. В варианте осуществления РНК, кодирующая субъединицу теломеразы, содержит 5ʹ-кэп-структуру.
В варианте осуществления способ содержит трансфицирование иммунных эффекторных клеток РНК, кодирующей субъединицу теломеразы. В варианте осуществления способ содержит трансдуцирование иммунных эффекторных клеток РНК, кодирующей субъединицу теломеразы. В варианте осуществления способ содержит электропорирование иммунных эффекторных клеток РНК, кодирующей субъединицу теломеразы, в условиях, которые обеспечивают экспрессию CAR и теломеразы.
В другом аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток), содержащий: предоставление популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток), которые экспрессируют CAR и/или содержат нуклеиновую кислоту, кодирующую CAR; и приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT, в условиях, которые обеспечивают экспрессию hTERT.
В другом аспекте раскрытие включает в себя способ получения популяции иммунных эффекторных клеток (например, T-клеток, NK-клеток), содержащий: предоставление популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток), которые экспрессируют нуклеиновую кислоту, кодирующую субъединицу теломеразы, например, hTERT, и приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей CAR, в условиях, которые обеспечивают экспрессию CAR.
В одном аспекте настоящее раскрытие предлагает иммунную эффекторную клетку (например, T-клетку или NK-клетку), содержащую: нуклеиновую кислоту, кодирующую CAR, например, CAR, как описано здесь; и нуклеиновую кислоту, кодирующую экзогенную субъединицу теломеразы, например, hTERT. В варианте осуществления нуклеиновая кислота, кодирующая экзогенную субъединицу теломеразы, представляет собой РНК, например, мРНК.
В одном аспекте настоящее раскрытие предлагает иммунную эффекторную клетку (например, T-клетку или NK-клетку), содержащую: CAR, например, CAR, как описано здесь; и экзогенную субъединицу теломеразы, например, hTERT. В варианте осуществления клетка не содержит ДНК, например, экзогенную ДНК, например, вектор, кодирующий экзогенную субъединицу теломеразы. Например, клетка может быть приведена в контакт с мРНК, кодирующей экзогенную субъединицу теломеразы.
Хотя при реализации на практике или тестировании настоящего изобретения можно использовать способы и материалы, аналогичные или эквивалентные описанным здесь, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки (например, ссылочные номера баз данных последовательностей), упомянутые здесь, включены посредством ссылки во всей полноте. Например, все последовательности GenBank, Unigene и Entrez, упомянутые здесь, например, в любой таблице здесь, включены посредством ссылки. Если не указано иное, номера доступа последовательностей, указанные здесь, включая любую таблицу здесь, относятся к значениям баз данных, действующим по состоянию на 29 декабря 2014 года. Если один ген или белок ссылается на множество номеров доступа последовательностей, охватываются все варианты последовательности.
Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения. Заголовки, подзаголовки или элементы, обозначенные цифрами или буквами, например, (a), (b), (i) и так далее, представлены только для удобства чтения. Использование в данном документе заголовков или элементов, обозначенных цифрами или буквами, не требует, чтобы этапы или элементы были выполнены в алфавитном порядке, или чтобы этапы или элементы были обязательно отделены друг от друга. Другие признаки, цели и преимущества настоящего изобретения будут очевидны из описания и чертежей и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
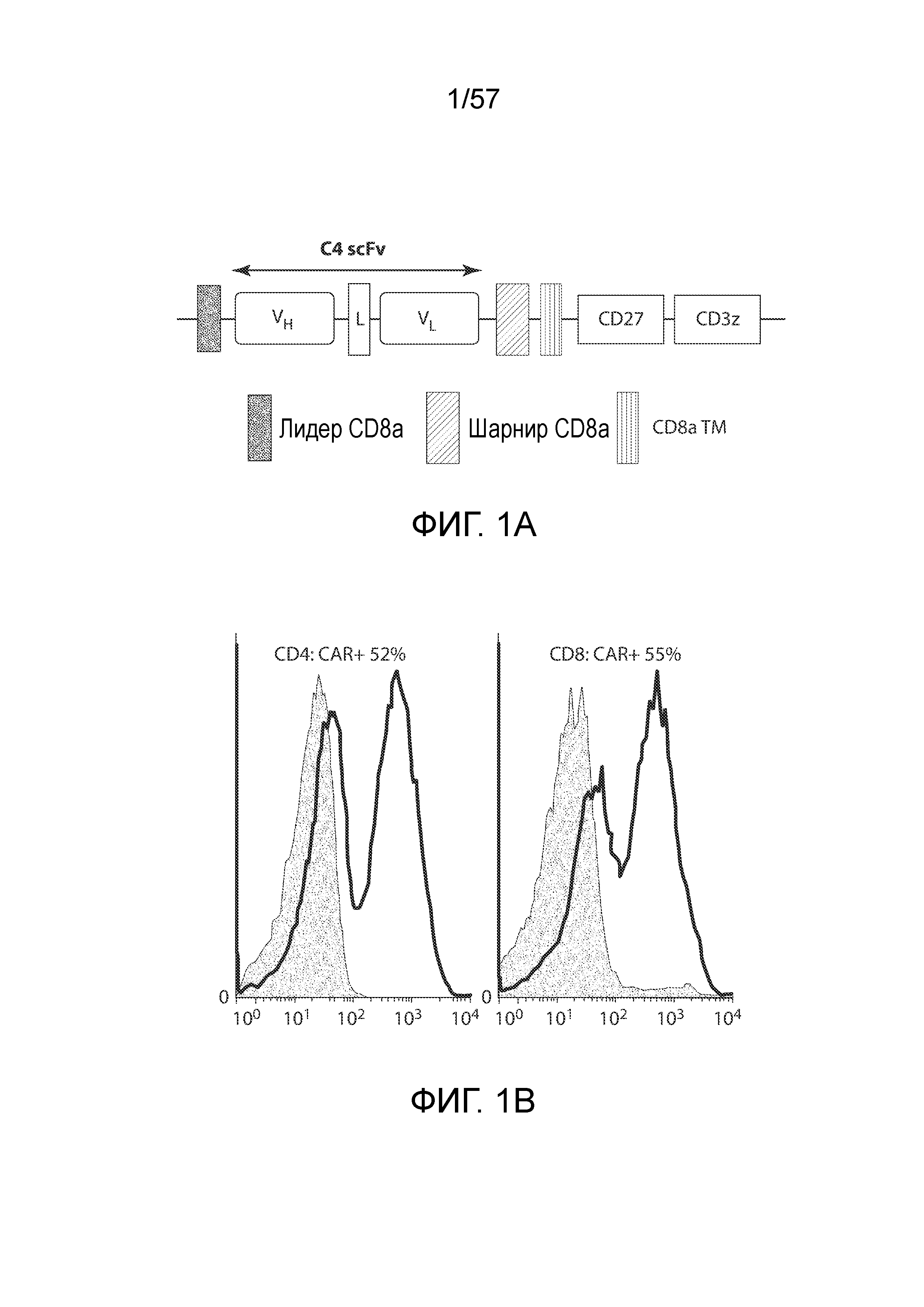
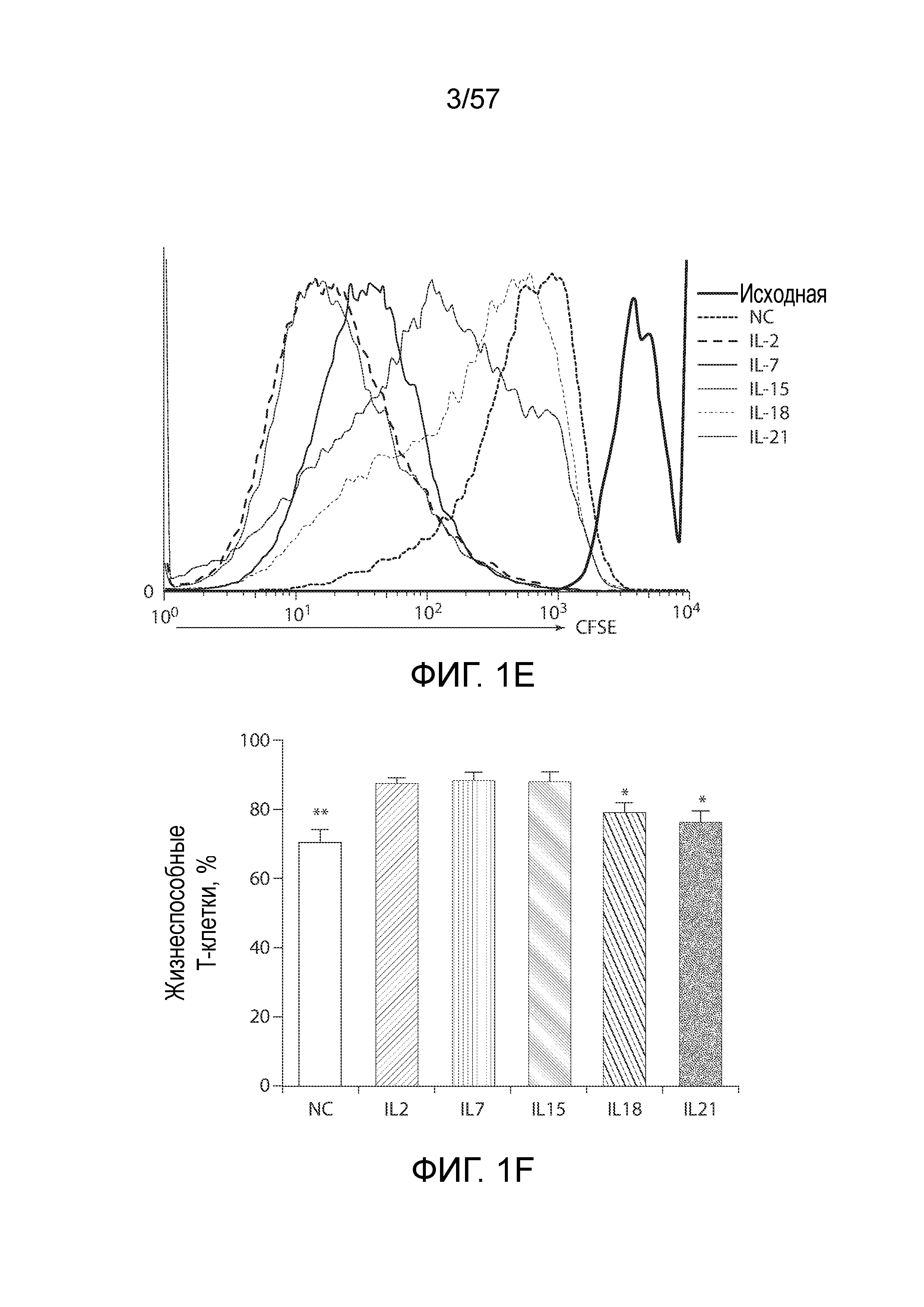
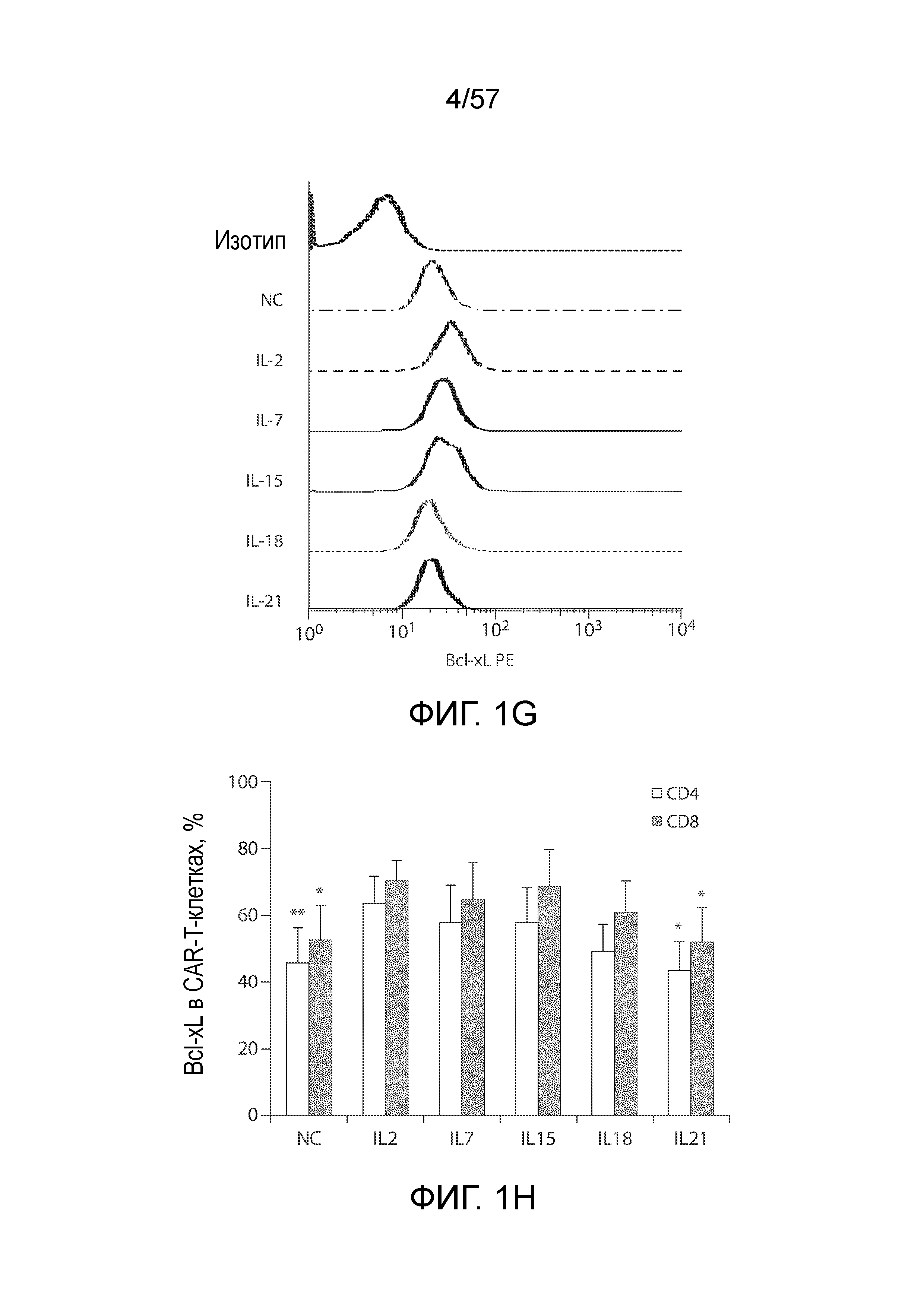
Фигуры 1A-1H показывают дифференциальные эффекты цитокинов γc и IL-18 на накопление CAR-T-клеток. Фигура 1A представляет собой схематическую диаграмму вектора C4-27z CAR. Фигура 1B представляет собой два типичных столбчатых графика FACS экспрессии CAR на CD4+ и CD8+ T-клетках через 48 часов после лентивирусной трансдукции. Фигура 1C представляет собой график, показывающий общее накопление CAR-T-клеток в ответ на воздействие различных цитокинов. T-клетки трансдуцировали и подвергали воздействию различных экзогенных цитокинов с конечными концентрациями 10 нг/мл со следующего дня (день 0). Количества CAR-T-клеток вычисляли на основании количества T-клеток и относительной экспрессии CAR. Кривые отражают 6 доноров. *P<0,05, ***P<0,001. NC, нет цитокинов. Фигура 1D представляет собой график, показывающий экспрессию CAR T-клетками через 15 дней после лентивирусной трансдукции. Столбчатый график отображает уровни экспрессии CAR (±СОС, n=6) на поверхности CD3+, CD4+ и CD8+ T-клеток, причем экспрессию CAR в группе NC нормализовали как 1. *P<0,05 по сравнению с группой IL-2; N.S., отсутствует статистическое различие. Фигура 1E представляет собой гистограмму, показывающую пролиферацию T-клеток в ответ на различные цитокины. На день 7 после лентивирусной трансдукции T-клетки в группе NC помечали CFSE (2,5 мкМ), а затем подвергали воздействию различных цитокинов. Через семь дней T-клетки анализировали на разбавление CFSE с помощью проточной цитометрии. Фигура 1F представляет собой график, показывающий жизнеспособность T-клеток через 15 дней после лентивирусной трансдукции. T-клетки из групп различных цитокинов окрашивали Annexin V и 7-AAD, а затем анализировали на относительное содержание жизнеспособных клеток (как Annexin V, так и 7-AAD-отрицательных). *P<0,05, **P<0,01 по сравнению с группой IL-2 (n=6). Фигуры 1G и 1H показывают экспрессию Bcl-xL CAR-T-клетками. На день 15 после лентивирусной трансдукции CAR-T-клетки оценивали в отношении экспрессии белка Bcl-2 с помощью проточной цитометрии. Фигура 1G представляет собой типичный столбчатый график FACS экспрессии Bcl-xL в группах различных цитокинов. Фигура 1H представляет собой график, изображающий экспрессию Bcl-xL (±СОС) в CD4+ и CD8+ CAR-T-клетках 6 доноров. *P<0,01 по сравнению с группой IL-2.
Фигуры 2A-2I показывает подгруппыT-клеток памяти CAR-T-клеток. Фигура 2Aпредставляет собой типичные графики FACS, показывающие стратегию гейтирования анализа подгрупп T-клеток. T-клетки разделяют на четыре подгруппы на основании экспрессии CD45RA и CD62L, затем также оценивают для каждой подгруппы экспрессию CCR7, CD27, CD28 и CD95. Экспрессия CD95 после лентивирусной трансдукции подвергается значительной повышающей регуляции. Фигура 2B показывает экспрессию CD95 в CD45RA+CD62L+ субпопуляции T-клеток до трансдукции и CAR-T-клетках через 15 дней после трансдукции. Фигуры 2C и 2D представляют собой графики, показывающие повышение относительного содержания стволовых T-клеток памяти (Tscm) в CD4+ (фигура 2C) и CD8+ T-клетках (фигура 2D) после лентивирусной трансдукции. Tscm определяют как подгруппы CD45RA+CD62L+CD95+CCR7+ T-клеток. Фигура 2E представляет собой график, показывающий корреляцию между количеством наивных T (Tn, определенные как CD45RA+CD62L+CD95- субпопуляция) в T-клетках перед трансдукцией и содержанием Tscm в CAR-T-клетках после трансдукции (n=6). Левые столбцы представляют процентное содержание Tn в CD4+ и CD8+ T-клетках до трансдукции, а правые столбцы представляют процентное содержание Tscm в CD4+ и CD8+ CAR-T-клетках. *P<0,05, **P<0,01. Фигуры 2F, 2G и 2H представляют собой графики, показывающие распределение подгрупп CD4+ и CD8+ CAR-T-клеток. Подгруппы T в CD4+ и CD8+ CAR-T-клетках определены на основании экспрессии CD95, CD45RA и CD62L. Относительные содержания Tscm сравнивают между группами различных цитокинов, *P<0,05, **P<0,01, по сравнению с группой IL-2 (n=6). (F) Самообновление и дифференцировка различных подгрупп CAR-T-клеток. Сортированные по FACS CAR+ Tscm, Tcm, Tem и Temra клетки культивируют при воздействии IL-2 (10 нг/мл) в течение 3 дней, затем анализируют фенотипы на основании экспрессии CD45RA и CD62L (n=3). Фигура 2I представляет собой столбчатый график, показывающий пролиферацию различных подгрупп CAR-T-клеток в ответ на IL-2. Сортированные по FACS CAR+ Tscm, Tcm, Tem и Temra клетки помечали CFSE (2,5 мкМ), а затем культивировали при воздействии IL-2 (10 нг/мл) в течение 3 дней. Через три дня T-клетки анализировали на разбавление CFSE.
Фигуры 3A-3B: показывают корреляцию между экспрессией CD45RA и интенсивностью CFSE. Фигура 3A демонстрирует, что экспрессия CD45RA обратно коррелирует с интенсивностью CFSE. Фигура 3B показывает, что для всех групп цитокинов (IL-2, IL-7, IL-15, IL-18 и IL-21) CD45RA+ T-клетки проявляли гораздо более низкие уровни CFSE, чем тусклые и отрицательные по CD45RA T-клетки, что указывает на то, что CD45RA+ T-клетки имели более сильную пролиферативную активность, чем CD45RA- T-клетки.
Фигуры 4A-4B показывают фенотипы CAR-T-клеток, получаемые в результате воздействия различных цитокинов. Фигура 4A представляет собой типичные точечные диаграммы FACS, показывающие экспрессию CD45RA, CD62L, CCR7, CD27 и CD28 на CAR- и CAR+ T-клетках, на которые воздействовали IL-2, в течение 14 дней после лентивирусной трансдукции. Фигура 4B представляет собой серию графиков, показывающих количественное определение экспрессии CD45RA, CD62L, CCR7, CD27, CD28 и IL7Rα на поверхности CAR-T-клеток в указанных группах цитокинов. Гистограммы представляют среднее значение ± СОС уровней экспрессии от 6 независимых доноров. *P<0,05, **P<0,01 по сравнению с группой IL-2.
Фигуры 5A-5I показывают функциональный анализ CAR-T-клеток, на которые воздействовали различными цитокинами. Фигура 5A представляет собой типичные графики FACS, показывающие окрашивание внутриклеточных IFN-γ, TNF-α и IL-2 в CAR-T-клетках. Фигура 5B, 5C и 5D представляют собой количественные графики, показывающие процентное содержание продуцирующих цитокины CAR-T-клеток в группах различных цитокинов (n=6) для производства IFNγ (фигура 5B), TNF-α (фигура 5C) и IL-2 (фигура 5D). Лентивирусно трансдуцированные T-клетки подвергали воздействию указанных цитокинов в течение 14 дней, а затем совместно культивировали с клетками SKOV3 в течение 5 часов до сбора для анализа с помощью проточной цитометрии. Фигура 5E представляет собой серию круговых диаграмм, изображающих содержание клеток, продуцирующих различные количества цитокинов (IFN-γ, TNF-α и IL-2) после стимуляции SKOV3. *P<0,05. Фигура 5F представляют собой типичные графики FACS, показывающие экспрессию перфорина и гранзима B (GranzB) в CAR-T-клетках. Фигуры 5G и 5H представляют собой количественные графики, показывающие относительную экспрессию перфорина (фигура 5G) и гранзима B (фигура 5H) в CAR-T-клетках в группах различных цитокинов (n=6). Лентивирусно трансдуцированные T-клетки подвергали воздействию указанных цитокинов в течение 14 дней, а затем совместно культивировали с клетками SKOV3 в течение 5 часов до сбора для анализа с помощью проточной цитометрии. Фигура 5I представляет собой график, показывающий антигенспецифическую цитотоксическую активность CAR-T-клеток. Через четырнадцать дней после воздействия указанных цитокинов CAR-T-клетки оценивали в отношении цитолитической способность посредством использования анализа на основе люциферазы после 18-часового совместного культивирования с SKOV3 при указанных отношения E/T. Нетрансдуцированные T-клетки (UNT) служили в качестве отрицательного эффекторного контроля. Показанные данные представляют собой среднее значение ± СОС шести независимых цитолитических анализов.
Фигура 6A-6C: показывает фенотип и функцию CAR-T-клеток, описанных выше на фигурах5A-5I. Фигуры 6A и 6B показывают, что CD62L+ CAR-T-клетки (Tscm и Tcm) проявляли меньшую активность производства цитокинов (фигура 6A и 6B) и более слабую цитолитическую способность (фигура 6C) по сравнению с CD62L- CAR-T-клетками (Tem и Temra).
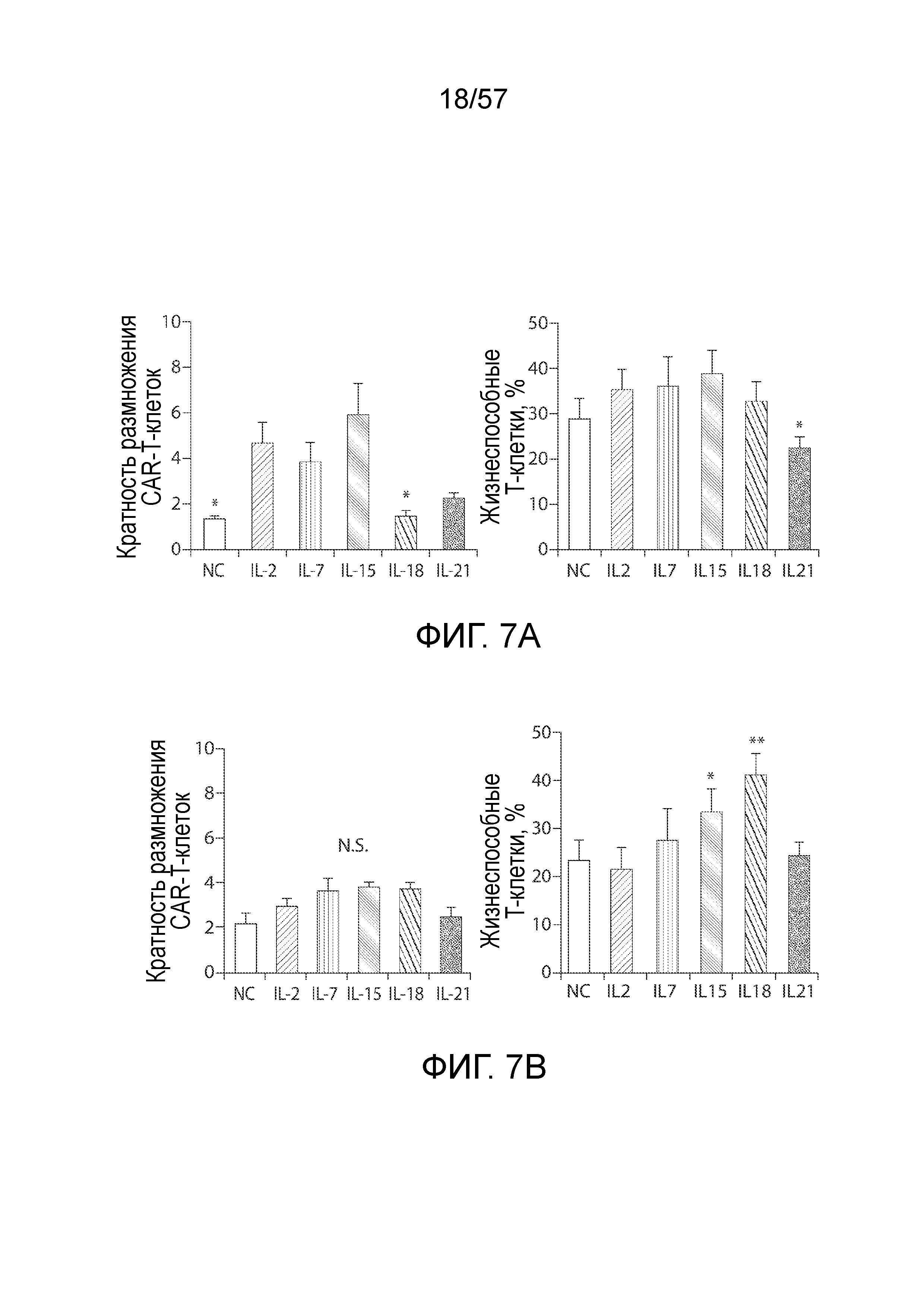
Фигуры 7A-7E показывают размножение и фенотип CAR-T-клеток, на которые воздействовали антигенной стимуляцией. Фигура 7A представляет собой два графика, показывающих общее накопление и жизнеспособность CAR-T-клеток при воздействии антигена и указанных цитокинов. T-клетки, на которые воздействовал IL-2, собирают на день 15, а затем совместно культивируют с SKOV3 при отношениях E/T 5:1 и с указанными цитокинами (10 нг/мл) в течение 7 дней с добавлением клеток SKOV3 на первый и четвертый день (тот же протокол на фигурах 7C, 7D и 7E). Кратность размножения представляет собой среднее значение ± СОС. T-клетки окрашивали Annexin V и 7-AAD, а затем анализировали на относительное содержание жизнеспособных клеток в тот же день. *P<0,05 по сравнению с группой IL-2. Фигура 7B отображает два графика, показывающих общее накопление и жизнеспособность CAR-T, на которые ранее воздействовали указанными цитокинами, при антигенной стимуляции. T-клетки, на которые воздействовали указанными цитокинами, собирают на день 15, а затем совместно культивируют с SKOV3 при отношениях E/T 5:1 в течение 7 дней. Вычисляли размножение CAR-T-клеток, и оценивали жизнеспособность T-клеток на седьмой день. Фигура 7C представляет собой график, показывающий экспрессию CAR T-клетками после 7-дневного совместного культивирования с SKOV3 и указанными цитокинами. *P<0,05 по сравнению с IL-2. Фигура 7D представляет собой два графика, показывающих количественное определение экспрессии CD27 и CD28 на CAR-T-клетках после 7-дневного совместного культивирования с SKOV3 и указанными цитокинами. *P<0,05 по сравнению с IL-2. Фигура 7E представляет собой два графика, показывающих распределение подгруппы T-клеток памяти CD4+ и CD8+ CAR-T-клеток в группах различных цитокинов. N.S., отсутствует статистическое различие.
Фигуры 8A-8G показывают противоопухолевую активность различных CAR-T-клеток при предшествующем воздействии цитокинов. Фигура 8A представляет собой схему эксперимента in vivo. Фигура 8B. Кривые роста опухоли у мышей, обработанных различными C4-27z CAR-T-клетками, на которые воздействовали цитокинами, анти-CD19-27z CAR-T-клетками и нетрансдуцированными T-клетками. Данные представлены в виде среднего значения ± СОС. Стрелка указывает момент вливания T-клеток. Фигура 8C представляет собой биолюминесцентные изображения, показывающие fLuc+ SKOV3 опухоли у мышей NSG непосредственно перед (день 38), через две недели (день 53) и пять недель (день 74) после первой внутривенной инъекции CAR-T-клеток. Фигура 8D представляет собой график, показывающий количественное определение количества циркулирующих человеческих CD4+ и CD8+ T-клеток в периферической крови мышей через 15 дней после вливания первой дозы CAR-T-клеток. Фигура 8E представляет собой график, показывающий количественное определение экспрессии CAR на циркулирующих человеческих CD4+ и CD8+ T-клетках в крови мышей. Фигура 8F представляет собой график, показывающий распределение подгрупп T-клеток циркулирующих человеческих T-клеток в крови мышей на основании окрашивания CD45RA и CD62L. Фигура 8G представляет собой график, показывающий количественное определение экспрессии CD27 и CD28 на циркулирующих человеческих CD4+ и CD8+ T-клетках в крови мышей.
Фигуры 9A и 9B показывают графики FACS. Фигура 9A представляет собой серию графиков FACS, показывающих распределение экспрессии CD45, CD3 и CD25 в клетках от афереза пациента с ХЛЛ. Фигура 9B представляет собой серию графиков FACS (сверху), показывающих популяции CD3 и CD19, и гистограммы (снизу), показывающие экспрессию CD14 у клеток от афереза, клеток, селектированных с помощью анти-CD3/CD28, клеток, истощенных по CD25, и обогащенных CD25 клеток.
Фигура 10 представляет собой два графика FACS, сравнивающих распределение популяций CD4+ и CD8+ T-клеток после селекции CD3/CD28 или истощения по CD25.
Фигуры 11A-11C показывают сравнение пролиферативной способности между селектированными по CD3/CD28 клетками и истощенными по CD25 клетки. Фигура 11A представляет собой график, показывающий общее количество клеток в указанные дни в культуре. Фигура 11B представляет собой график, показывающий количественно определенные удвоения популяции в каждый указанный день в культуре. Фигура 11C показывает процентное содержание жизнеспособных клеток в указанные дни в культуре.
Фигуры 12A и 12B показывают воздействие истощения по CD25 на лентивирусную трансдукцию CAR19. Фигура 12A представляет собой серию графиков FACS, показывающих эффективность истощения по CD25. Фигура 12B представляет собой серию графиков FACS, показывающих экспрессию CAR19 у нетрансдуцированных клеток, селектированных по CD3 клеток и истощенных по CD25 клеток.
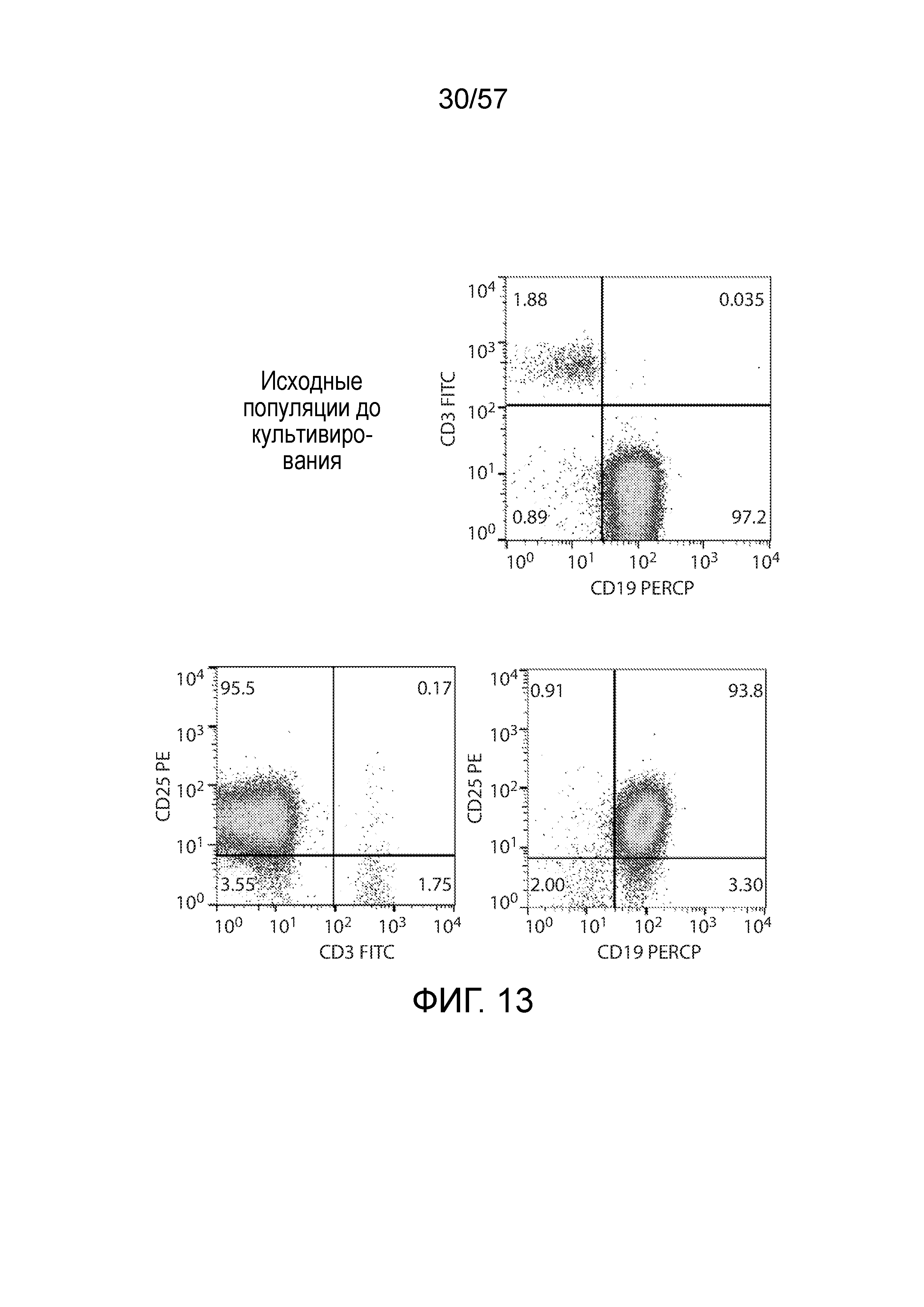
Фигура 13 представляет собой серию графиков FACS, показывающих распределение экспрессии CD3, CD19 и CD25 в клетках из PBMC от пациента до истощения по CD25 или культивирования с добавлением цитокинов.
Фигура 14 представляет собой серию графиков FACS, показывающих распределение CD3 и CD19 в необработанных PBMC и истощенных по CD25 PBMC после культивирования с добавлением указанных цитокинов IL-7, IL-15 или IL-7 и IL-15.
Фигура 15 представляет собой график, показывающий общее количество клеток после 10 дней культивирования с добавлением указанных цитокинов.
Фигура 16 представляет собой график, показывающий относительный сигнал зеленого флуоресцентного белка (GFP) как показатель уровней лентивирусной трансфекции для донорных клеток, трансфицированных дважды, в день получения (день 0) и день после получения (день 1) клеток посредством афереза (день 0+1); донорных клеток, трансфицированных один раз в день получения клеток посредством афереза (день 0); донорных клеток, трансфицированных один раз в день после получения клеток посредством афереза (день 1); донорных клеток, трансфицированных один раз через два дня после получения клеток посредством афереза (день 2); и донорных клеток, трансфицированных один раз в день после получения клеток посредством афереза (день 3).
Фигура 17 содержит графики, показывающие профиль размножения в удвоениях популяции (фигура 17A) и среднем размере (fL) (фигура 17B) PBMC, которые были стимулированы анти-CD3 и CD28 гранулами и или оставлены необработанными (UTD), или трансдуцированы CAR CD19 (CD19.BBz), очищены от гранул, а затем собраны на день 5 и день 9.
Фигура 18 содержит графики, изображающие цитотоксичность как относительный лизис экспрессирующих CD19 клеток K562, обработанных PMBC, которые были стимулированы анти-CD3 и CD28 гранулами, и или оставлены необработанными (UTD), или трансдуцированы CAR CD19 (CD19.BBz), очищены от гранул, а затем собраны на день 5 и день 9.
Фигура 19 содержит графики, изображающие пролиферациюPBMC, стимулированных анти-CD3 и CD28 гранулами (гранулами 3×28), клеток K562 дикого типа, экспрессирующих CD19 клеток K562, клеток ОЛЛ (Nalm6) или клеток ХЛЛ (PI14). PBMC были или оставлены необработанными (UTD), или трансдуцированы CAR CD19 (CART19), очищены от гранул, а затем собраны на день 5 и день 9.
Фигура 20 представляет собой схему примера схемы производства.
Фигура 21 представляет собой схему примера схемы производства.
Фигура 22 содержит графики, изображающие уровень клеточной пролиферации двух различных производственных партий донорных клеток, трансфицированных CAR CTL019, пациента 15 (левые панели) и пациента 21 (правые панели), размноженных в течение периода от 0 до 9 дней.
Фигура 23 содержит графики, показывающие производство провоспалительных цитокинов IFN-γ, GM-CSF, TNF-α и IL-4 двух различных производственных партий донорных клеток, трансфицированных или CAR CTL019, а именно клетками пациента 15, или ss1-mesoCAR, а именно клетками пациента 21, и размноженных в течение периода от 0 до 9 дней после афереза.
Фигура 24 содержит графики, изображающие уровни производстваIFN-γ, TNF-α, IL-6, IL-8, IL-2, IL-1β, GM-CSF и IL-4 в донорных клетках, стимулированных гранулами с анти-CAR19-идиотипическим антителом или контрольными гранулами, трансфицированных CAR CTL019 и размноженных в течение 5-9 дней. С контрольными гранулами детектировали отсутствие цитокинов или низкие уровни цитокинов (<200 пг/мл).
Фигура 25 представляет собой график, изображающий клеточный киллинг на основании общих лизатов, полученный с использованием люциферазного анализа клеток Nalm6 (ОЛЛ)PBMC или оставленных необработанными (UTD), или трансдуцированных CAR CD19 (CART19), очищенных от гранул, а затем собранных на день 5 и день 9. Культивировали при различных отношениях PMBC к клеткам Nalm6 (эффектор (E):мишень (T)). Как показано, клетки CART19, собранные на день 5, обладают лучшей способностью к киллингу.
Фигура 26 представляет собой график, изображающий способность к продолжительному киллингу in vivo PBMC или оставленных необработанными (UTD), или трансдуцированных CAR CD19 (CART19), очищенных от гранул, а затем собранных на день 5 и день 9. PBMC вводили нетучным мышам с диабетом/тяжелым комбинированным иммунодефицитом, инокулированных клетками Nalm6.
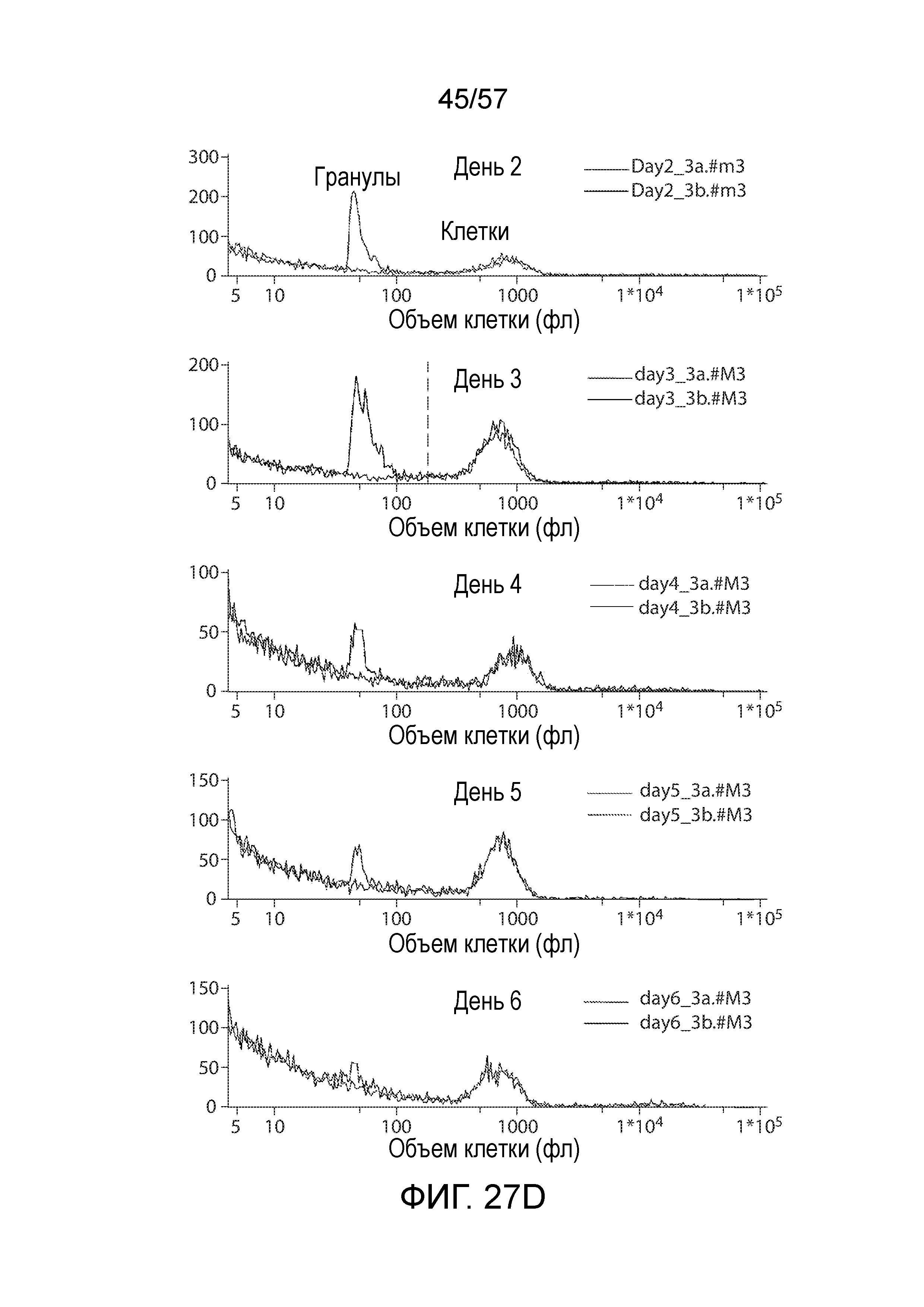
Фигуры 27A-27D показывают, что удаление гранул в ранних временных точках не вызывает потерю клеток. Фиг. 27A представляет собой анализ Коултера, иллюстрирующий средний объем T-клеток и концентрацию до и после удаления покрытых αCD3/αCD28 магнитных гранул с помощью магнита на день 3. Затем после удаления гранул клетки замораживали. Фиг. 27B показывает, что количество клеток оценивали до и после удаления магнитных гранул. Концентрация была одинаковой. Фиг. 27C представляет собой наложение, показывающее средний объем клеток одних и тех же клеток до и после оттаивания. Клетки сохраняют свой объем в процессе замораживания-оттаивания. Результаты отражают по меньшей мере 15 различных экспериментов. Фиг. 27D показывает типичный анализ Коултера T-клеточных продуктов до и после удаления покрытых αCD3/αCD28 магнитных гранул, что демонстрирует эффективность способа.
Фигуры 28A-28B показывает, что T-клетки, которые активированы, трансдуцированы CD19-специфическим CAR, несущим сигнализацию Bbz, и собраны из T-клеточных культур в ранние временные точки, такие как день 3 после активации, обладают сильной антигенспецифической цитотоксической активностью in vitro. Фигура 28A, верхняя панель, четырехчасовой анализ киллинга с использованием клеток K562-WT. Фигура 28B, нижняя панель, четырехчасовой анализ киллинга с использованием клеток K562-19. Фигура 28B, верхние панели, эффективность трансдукции при использовании IL7/IL15 (слева) или IL2 (справа). Фигура 28B, центральная панель, удвоения популяции при использовании IL7/IL15 по сравнению с IL2. Фигура 28B, нижняя панель, объем при использовании IL7/IL15 по сравнению с IL2.
Фигуры 29A-29C показывают, что 4-1BBζ CART-клетки дня 3 и дня 9 продуцируют схожие наборы цитокинов в ответ на K562-CD19. CART 19 клетки дня 3 и дня 9, ранее культивированные в среде с IL-2 или IL-7/15, инкубировали или с K562-CD19 (фиг. 29A и 29B), или только со средой в течение 24 ч (фиг. 29C). "Нет антигена" на фиг. 29A и фиг. 29B указывает на клетки, стимулированные клетками K562 дикого типа без CD19. Цитокины измеряли в культуральных супернатантах с помощью набора цитокиновых гранул (Luminex). Фигура 29C показывает типичное производство цитокинов в CART 19 T-клетках через 24 ч после оттаивания. Уровни цитокинов минимальны.
Фигуры 30A-30B показывают постепенный переход в направлении более дифференцированного фенотипа при повышении содержания o Tem и Tcm-клеток.
Фигура 31A-31D. Фиг. 31A показывает схему эксперимента для тестирования активности CART-клеток, продуцируемых в различных условиях. Фиг. 31B показывает активность обработанных IL2 CART-клеток при замедлении роста опухоли Nalm6 у мышей. D3, D5 и D9 указывают на CART-клетки, которые были собраны на день 3, день 5 или день 9. 3e6 и 0,5e6 указывают на количество введенных CAR+ клеток. Относительное содержание CAR+ клеток показано на фиг. 31C. Фиг. 31D сравнивает активность обработанных IL2 и обработанных IL7/IL15 CART-клеток при замедлении роста опухоли Nalm6 у мышей.
Фигура 32. Размножение CAR+ T-клеток in vitro в среде, содержащей IL-2 и IL-7/15, после антигенной стимуляции. Левая панель, PBMC здоровых доноров-людей стимулировали покрытыми αCD3/αCD28 гранулами Dynal на день 0, и лентивирусно трансдуцировали 19-BBζ на день 1. Эти клетки размножали в течение 9 дней в среде с добавлением или IL-2, или IL-7/15. T-клетки подсчитывали с помощью проточной цитометрии с использованием подсчета на основе гранул через день. Правая панель, наблюдали за средним объемом T-клеток (fl) во время размножения. Данные отражают по меньшей мере шесть независимых доноров.
Фигура 33. Клетки CART19 дня 3 и дня 9, культивированные в среде или с IL-2, или с IL-7/15, пролиферируют в ответ на K562-CD19, но не на K562-WT или только среду. T-клетки помечали CFSE и совместно культивировали с K562-CD19, K562 дикого типа или только средой в качестве отрицательного контроля в течение 120 часов. Количество пролиферирующих T-клеток было значительно выше в ответ на K562-CD19 по сравнению с K562 дикого типа или только со средой и было сравнимым между группами IL-7/15 и IL-2. Результаты отражают два различных донора.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не определено иное, все технические и научные термины, используемые здесь, имеют значение, обычно понимаемое средним специалистом в области техники, к которой относится настоящее изобретение.
Единственное число относится к одному или более чем одному (то есть по меньшей мере к одному) грамматическому объекту статьи. В качестве примера, "элемент" означает один элемент или более чем один элемент.
Термин "приблизительно" при ссылке на измеряемое значение, такое как количество, продолжительность времени и тому подобное, предназначен для того, чтобы охватывать изменения, составляющие ±20%, или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1%, от указанного значения, если такие изменения являются подходящими для выполнения раскрытых способов.
Термин "химерный антигенный рецептор" или, альтернативно, "CAR" относится к набору полипептидов, обычно к двум в простейших вариантах осуществления, которые при нахождении в иммунной эффекторной клетке придают клетке специфичность к клетке-мишени, обычно раковой клетке, и с возможностью генерации внутриклеточного сигнала. В некоторых вариантах осуществления CAR содержит по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый здесь как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, происходящий от стимулирующей молекулы и/или костимулирующей молекулы, как определено ниже. В некоторых вариантах осуществления полипептиды в наборе расположены в одной и той же полипептидной цепи (например, содержат химерный белок слияния). В некоторых вариантах осуществления полипептиды в наборе не соприкасаются друг с другом, например, расположены в различных полипептидных цепях. В некоторых вариантах осуществления полипептиды в наборе включают в себя переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В одном варианте осуществления стимулирующая молекула CAR представляет собой дзета-цепь, ассоциированную с T-клеточным рецепторным комплексом. В одном аспекте цитоплазматический сигнальный домен содержит первичный сигнальный домен (например, первичный сигнальный домен из CD3-дзета). В одном варианте осуществления цитоплазматический сигнальный домен дополнительно содержит один или несколько функциональных сигнальных доменов из по меньшей мере одной костимулирующей молекулы, как определено ниже. В одном варианте осуществления костимулирующая молекула представляет собой костимулирующую молекулу, описанную здесь, например, 4 1BB (то есть CD137), CD27, ICOS и/или CD28. В одном варианте осуществления CAR содержит химерный белок слияния, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен стимулирующей молекулы. В одном варианте осуществления CAR содержит химерный белок слияния, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен костимулирующей молекулы и функциональный сигнальный домен стимулирующей молекулы. В одном варианте осуществления CAR содержит химерный белок слияния, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена одной или нескольких костимулирующих молекул и функциональный сигнальный домен стимулирующей молекулы. В одном варианте осуществления CAR содержит химерный белок слияния, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена одной или нескольких костимулирующих молекул и функциональный сигнальный домен стимулирующей молекулы. В одном варианте осуществления CAR содержит необязательную лидерную последовательность на аминоконце (N-конце) белка слияния CAR. В одном варианте осуществления CAR дополнительно содержит лидерную последовательность на N-конце внеклеточного антигенсвязывающего домена, причем лидерная последовательность, необязательно, отщепляется от антигенсвязывающего домена (например, scFv) во время клеточного процессинга и локализации CAR в клеточной мембране.
CAR, который содержит антигенсвязывающий домен (например, scFv или TCR), который воздействует на специфический опухолевый антиген X, такой как описанный здесь, также обозначают XCAR. Например, CAR, который содержит антигенсвязывающий домен, который воздействует на CD19, обозначают CD19CAR.
Термин "сигнальный домен" относится к функциональной части белка, которая действует посредством передачи информация внутри клетки для регуляции клеточной активности через определенные сигнальные пути, генерируя вторичные мессенджеры или функционируя в качестве эффекторов, отвечая на такие мессенджеры.
Термин "антитело", как используется здесь, относится к белковой или полипептидной последовательности, происходящей от иммуноглобулиновой молекулы, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, много- или одноцепочечными или представлять собой интактные иммуноглобулины и могут происходить из природных источников или из рекомбинантных источников. Антитела могут представлять собой тетрамеры иммуноглобулиновых молекул.
Термин "фрагмент антитела" относится к по меньшей мере одной части антитела, которая сохраняет способность специфически взаимодействовать (например, посредством связывания, стерического несоответствия, стабилизации/дестабилизации, пространственного распределения) с эпитопом антигена. Примеры фрагментов антител включают, но без ограничения, фрагменты Fab, Fab', F(ab')2, Fv, фрагменты антител scFv, дисульфиднно связанные Fv (sdFv), фрагмент Fd, состоящий из доменов VH и CH1, линейные антитела, однодоменные антитела, такие как sdAb (или VL, или VH), верблюжьи домены VHH, мультиспецифические антитела, образованные из фрагментов антител, такие как двухвалентный фрагмент, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнирной области, и выделенные CDR или другие связывающие эпитоп фрагменты антитела. Антигенсвязывающий фрагмент может также быть введен в однодоменные антитела, макситела, минитела, нанотела, интратела, диатела, триатела, тетратела, v-NAR и бис-scFv (смотри, например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Антигенсвязывающие фрагменты можно также прививать на каркасы, основанные на полипептидах, такие как фибронектин типа III (Fn3)(смотри патент США № 6703199, который описывает минитела с фибронектиновым полипептидом).
Термин "scFv" относится к белку слияния, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, причем вариабельные области легкой и тяжелой цепи связаны рядом, например, посредством синтетического линкера, например, короткого гибкого полипептидного линкера, и способны экспрессироваться как одноцепочечный полипептид, и причем scFv сохраняет специфичность интактного антитела, от которого он происходит. Если не указано, как используется здесь, scFv может содержать вариабельные области VL и VH в любом порядке, например, по отношению к N-концевой и C-концевой областям полипептида scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
Часть CAR, содержащая антитело или его фрагмент антитела, может существовать во множестве форм, в которых антигенсвязывающий домен экспрессируется как часть непрерывной полипептидной цепи, включая, например, фрагмент однодоменного антитела (sdAb), одноцепочечное антитело (scFv) и гуманизированное антитело (Harlow et al., 1999, в Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном варианте осуществления антигенсвязывающий домен CAR содержит фрагмент антитела. В другом варианте осуществления CAR содержит фрагмент антитела, который содержит scFv.
Как используется здесь, термин "связывающий домен" или "молекула антитела" относится к белку, например, иммуноглобулиновой цепи или ее фрагменту, содержащему по меньшей мере одну последовательность иммуноглобулинового вариабельного домена. Термин "связывающий домен" или "молекула антитела" охватывает антитела и фрагменты антител. В варианте осуществления молекула антитела представляет собой мультиспецифическую молекулу антитела, например, она содержит множество последовательностей иммуноглобулиновых вариабельных доменов, причем первая последовательность иммуноглобулинового вариабельного домена из множества имеет специфичность связывания к первому эпитопу, а вторая последовательность иммуноглобулинового вариабельного домена из множества имеет специфичность связывания ко второму эпитопу. В варианте осуществления мультиспецифическая молекула антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело имеет специфичность не более чем к двум антигенам. Биспецифическая молекула антитела характеризуется первой последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания к первому эпитопу, и второй последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания ко второму эпитопу.
Часть CAR настоящего изобретения, содержащая антитело или его фрагмент антитела, может существовать во множестве форм, в которых антигенсвязывающий домен экспрессируется как часть непрерывной полипептидной цепи, включая, например, фрагмент однодоменного антитела (sdAb), одноцепочечное антитело (scFv), гуманизированное антитело или биспецифическое антитело (Harlow et al., 1999, в Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном аспекте антигенсвязывающий домен композиции CAR настоящего изобретения содержит фрагмент антитела. В другом аспекте CAR содержит фрагмент антитела, который содержит scFv.
Термин "тяжелая цепь антитела" относится к большей из полипептидных цепей двух типов, присутствующих в молекулах антител в их природных конформациях, которая обычно определяет класс, к которому принадлежит антитело.
Термин "легкая цепь антитела" относится к меньшей из полипептидных цепей двух типов, присутствующих в молекулах антител в их природных конформациях. Легкие цепи каппа (κ) и лямбда (λ) соотносятся с двумя главными изотипами легкой цепи антитела.
Термин "определяющая комплементарность область" или "CDR", как используется здесь, относится к последовательностям аминокислот в вариабельных областях антитела, которые придают антигенную специфичность и аффинность связывания. Например, в общем случае, есть три CDR в каждой вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и три CDR в каждой вариабельной области легкой цепи (LCDR1, LCDR2 и LCDR3). Точные границы аминокислотной последовательности заданной CDR могут быть определены с использованием любой из ряда хорошо известных схем, включая описанные Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации "Кэбота"), Al-Lazikani et al., (1997) JMB 273,927-948 (схема нумерации "Чотиа"), или их комбинацию. В соответствии со схемой нумерации Кэбота в некоторых вариантах осуществления аминокислотные остатки CDR в вариабельном домене (VH) тяжелой цепи нумеруют как 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в вариабельном домене (VL) легкой цепи нумеруют 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). В соответствии со схемой нумерации Чотиа в некоторых вариантах осуществления аминокислоты CDR в VH нумеруют 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в VL нумеруют 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). В объединенной схеме нумерации Кэбота и Чотиа в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам, которые являются частью CDR Кэбота, CDR Чотиа или обеих. Например, в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в VH, например, VH млекопитающего, например, человеческом VH; и аминокислотным остаткам 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в VL, например, VL млекопитающего, например, человеческом VL.
Термин "рекомбинантное антитело" относится к антителу, которое создано с использованием технологии рекомбинантной ДНК, такому как, например, антитело, экспрессируемое системой экспрессии бактериофагов или дрожжей. Данный термин также следует интерпретировать как означающий антитело, которое было создано посредством синтеза молекулы ДНК, кодирующей антитело, причем молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, определяющую антитело, причем ДНК или аминокислотная последовательность были получены с использованием технологии рекомбинантной ДНК или аминокислотной последовательности, которая доступна и хорошо известна в данной области техники.
Термин "антиген" или "Ag" относится к молекуле, которая вызывает иммунный ответ. Данный иммунный ответ может включать в себя или производство антител, или активацию специфических иммунологически компетентных клеток, или и то, и другое. Специалисту будет понятно, что любая макромолекула, включая практически все белки или пептиды, может служить антигеном. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту будет понятно, что любая ДНК, которая содержит нуклеотидные последовательности или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, тем самым кодирует "антиген", как этот термин используют здесь. Кроме того, специалисту в данной области техники будет понятно, что антиген не обязательно кодируется исключительно полноразмерной нуклеотидной последовательностью гена. Совершенно очевидно, что настоящее изобретение включает в себя, но без ограничения, использование частичных нуклеотидных последовательностей из более чем одного гена, и что эти нуклеотидные последовательности расположены в различных комбинациях для кодирования полипептидов, которые вызывают желаемый иммунный ответ. Кроме того, специалисту будет понятно, что антиген вообще не обязательно закодирован "геном". Совершенно очевидно, что антиген может быть создан синтезом или может быть получен из биологического образца, или может представлять собой макромолекулу, отличную от полипептида. Такой биологический образец может включать, но без ограничения, образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
Термин "аутологичный" относится к любому материалу, происходящему от того же индивидуума, которому он должен быть позже повторно введен.
Термин "аллогенный" относится к любому материалу, происходящему от другого животного того же вида, что и индивидуум, которому вводят данный материал. Двух или более индивидуумов называют аллогенными друг другу, когда гены в одном или нескольких локусах не идентичны. В некоторых аспектах аллогенный материал от индивидуумов того же вида может достаточно отличаться генетически для антигенного взаимодействия.
Термин "ксеногенный" относится к любому материалу, полученному от животного другого вида.
Термин "рак" относится к заболеванию, отличающемуся быстрым и неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Примеры различных раков описаны здесь и включают, но без ограничения, рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почек, рак печени, рак головного мозга, лимфому, лейкоз, рак легкого и тому подобное. Термины "опухоль" и "рак" используются здесь взаимозаменяемо, например, оба термина охватывают твердые и жидкие, например, диффузные или циркулирующие, опухоли. Как используется здесь, термин "рак" или "опухоль" включает предзлокачественные, а также злокачественные раки и опухоли.
"Происходящий от", как этот термин используют здесь, указывает на взаимосвязь между первой и второй молекулой. Он в общем относится к структурному сходству между первой молекулой и второй молекулой и не определяет или включает в себя ограничение в отношении процесса или источника для первой молекулы, которая происходит от второй молекулы. Например, в случае внутриклеточного сигнального домена, который происходит от молекулы CD3-дзета, внутриклеточный сигнальный домен сохраняет достаточную структуру CD3-дзета, так что обладает требуемой функцией, а именно способностью генерировать сигнал в соответствующих условиях. Он не определяет или не включает в себя ограничение в отношении конкретного процесса производства внутриклеточного сигнального домена, например, он не означает, что для получения внутриклеточного сигнального домена следует начинать с последовательности CD3-дзета и удалять нежелательную последовательность или вводить мутации, чтобы прийти к внутриклеточному сигнальному домену.
Фраза "заболевание, ассоциированное с экспрессией опухолевого антигена, как описано здесь" включает в себя, но без ограничения, заболевание, ассоциированное с экспрессией опухолевого антигена, как описано здесь, или состояние, ассоциированное с клетками, которые экспрессируют опухолевый антиген, как описано здесь, включая, например, пролиферативные заболевания, такие как рак или злокачественная опухоль, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанный с раком симптом, ассоциированный с клетками, которые экспрессируют опухолевый антиген, как описано здесь. В одном варианте осуществления рак, ассоциированный с экспрессией опухолевого антигена, как описано здесь, представляет собой гематологический рак. В одном варианте осуществления рак, ассоциированный с экспрессией опухолевого антигена, как описано здесь представляет собой солидный рак. Другие заболевания, ассоциированные с экспрессией опухолевого антигена, как описано здесь, включают, но без ограничения, например, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, ассоциированные с экспрессией опухолевого антигена, как описано здесь. Не связанные с раком симптомы, ассоциированные с экспрессией опухолевого антигена, как описано здесь, включают, но без ограничения, например, аутоиммунное заболевание (например, волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию. В некоторых вариантах осуществления экспрессирующие опухолевый антиген клетки экспрессируют, или в любой момент времени экспрессировали, мРНК, кодирующую опухолевый антиген. В варианте осуществления экспрессирующие опухолевый антиген клетки продуцируют белок опухолевого антигена (например, дикого типа или мутантный), и белок опухолевого антигена может присутствовать на нормальном уровне или на пониженном уровне. В варианте осуществления экспрессирующие опухолевый антиген клетки продуцировали детектируемые уровни белка опухолевого антигена в один момент, и впоследствии по существу не продуцировали детектируемый белок опухолевого антигена.
Фраза "заболевание, ассоциированное с экспрессией CD19" включает в себя, но без ограничения, заболевание, ассоциированное с экспрессией CD19, или состояние, ассоциированное с клетками, которые экспрессируют CD19, включая, например, пролиферативные заболевания, такие как рак или злокачественная опухоль, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанный с раком симптом, ассоциированный с клетками, которые экспрессируют CD19. В одном аспекте рак, ассоциированный с экспрессией CD19, представляет собой гематологический рак. В одном аспекте гематологический рак представляет собой лейкоз или лимфому. В одном аспекте рак, ассоциированный с экспрессией CD19, включает раки и злокачественные опухоли, включая, но без ограничения, например, один или несколько острых лейкозов, включая, но без ограничения, например, острый миелоидный лейкоз (ОМЛ), B-клеточный острый лимфоидный лейкоз (BALL), T-клеточный острый лимфоидный лейкоз (TALL), острый лимфоидный лейкоз (ОЛЛ); один или несколько хронических лейкозов, включая, но без ограничения, например, хронический миелогенный лейкоз (ХМЛ), хронический лимфоидный лейкоз (ХЛЛ). Дополнительные раки или гематологические состояния, ассоциированные с экспрессией CD19, содержат, но без ограничения, например, B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную В-крупноклеточную лимфому, фолликулярную лимфому, волосистоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, мантийноклеточную лимфому (МКЛ), лимфому из клеток краевой зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, ходжкинскую лимфому, плазмобластную лимфому, новообразование из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема, миелопролиферативное новообразование; гистиоцитарное заболевание (например, тучноклеточное заболевание или новообразование из бластных плазмацитоидных дендритных клеток); тучноклеточное заболевание, например, системный мастоцитоз или тучноклеточный лейкоз; B-клеточный пролимфоцитарный лейкоз, плазмоклеточную миелому и "предлейкоз", который представляет собой разнородную совокупность гематологических состояний, объединенных неэффективным производством (или дисплазией) миелоидных кровяных клеток, и тому подобное. Другие заболевания, ассоциированные с экспрессией CD19, включают, но без ограничения, например, атипичные и/или неклассические раки, злокачественные опухоли, предраковые состояния или пролиферативные заболевания, ассоциированные с экспрессией CD19. Не связанные с раком симптомы, ассоциированные с экспрессией CD19, включают, но без ограничения, например, аутоиммунное заболевание (например, волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию. В некоторых вариантах осуществления экспрессирующие опухолевый антиген клетки экспрессируют, или в любой момент времени экспрессировали, мРНК, кодирующую опухолевый антиген. В варианте осуществления экспрессирующие опухолевый антиген клетки продуцируют белок опухолевого антигена (например, дикого типа или мутантный), и белок опухолевого антигена может присутствовать на нормальном уровне или на пониженном уровне. В варианте осуществления экспрессирующие опухолевый антиген клетки продуцировали детектируемые уровни белка опухолевого антигена в один момент, и впоследствии по существу не продуцировали детектируемый белок опухолевого антигена. В других вариантах осуществления заболевание представляет собой CD19-отрицательный рак, например, CD19-отрицательный рецидивирующий рак. В некоторых вариантах осуществления экспрессирующая опухолевый антиген (например, CD19) клетка экспрессирует, или в любой момент времени экспрессировала, мРНК, кодирующую опухолевый антиген. В варианте осуществления экспрессирующая опухолевый антиген (например, CD19) клетка продуцирует белок опухолевого антигена (например, дикого типа или мутантный), и белок опухолевого антигена может присутствовать на нормальном уровне или на пониженном уровне. В варианте осуществления экспрессирующая опухолевый антиген (например, CD19) клетка продуцировала детектируемые уровни белка опухолевого антигена в один момент, и впоследствии по существу не продуцировала детектируемый белок опухолевого антигена.
Фраза "заболевание, ассоциированное с экспрессией B-клеточного антигена" включает в себя, но без ограничения, заболевание, ассоциированное с экспрессией одного или нескольких из CD19, CD20, CD22 или ROR1, или состояние, ассоциированное с клетками, которые экспрессируют, или в любой момент времени экспрессировали, один или несколько из CD19, CD20, CD22 или ROR1, включая, например, пролиферативные заболевания, такие как рак или злокачественная опухоль, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанный с раком симптом, ассоциированный с клетками которые экспрессируют один или несколько из CD19, CD20, CD22 или ROR1. Во избежание сомнений, заболевание, ассоциированное с экспрессией B-клеточного антигена, может включать в себя состояние, ассоциированное с клетками, которые в настоящий момент не экспрессируют B-клеточный антиген, например, потому что экспрессия антигена подверглась понижающей регуляции, например, вследствие лечения с помощью молекулы, воздействующей на B-клеточный антиген, например, воздействующего на B-клетки CAR, но которые в свое время экспрессировали антиген. Фраза "заболевание, ассоциированное с экспрессией B-клеточного антигена" включает в себя заболевание, ассоциированное с экспрессией CD19, как описано здесь. В вариантах осуществления экспрессирующие CAR клетки используют для лечения заболевания, ассоциированного с B-клеточным антигеном. В вариантах осуществления CAR, продуцируемый с помощью способа настоящего документа, содержит антигенсвязывающий домен, который воздействует на B-клеточный антиген.
Термин "рецидив", как используется здесь, относится к повторному появлению заболевания (например, рака) после первоначального периода реагирования, например, после предшествующего лечения с помощью терапии, например, терапии рака (например, полного ответа или частичного ответа). Первоначальный период реагирования может включать в себя падение уровня раковых клеток ниже определенного порога, например, ниже 20%, 15%, 10%, 5%, 4%, 3%, 2% или 1%. Повторное появление может включать в себя повышение уровня раковых клеток выше определенного порога, например, выше 20%, 15%, 10%, 5%, 4%, 3%, 2% или 1%. Например, в контексте B-ALL повторное появление может включать в себя, например, повторное появление бластов в крови, костном мозге (>5%) или любом экстрамедуллярном участке после полного ответа. Полный ответ в этом контексте может включать в себя <5% бластов КМ. В более общем плане, в варианте осуществления ответ (например, полный ответ или частичный ответ) может включать в себя отсутствие детектируемого MRD (минимального остаточного заболевания). В варианте осуществления первоначальный период реагирования длится по меньшей мере 1, 2, 3, 4, 5 или 6 дней; по меньшей мере 1, 2, 3 или 4 недель; по меньшей мере 1, 2, 3, 4, 6, 8, 10 или 12 месяцев; или по меньшей мере 1, 2, 3, 4 или 5 лет.
"Рефрактерный", как используется здесь, относится к заболеванию, например, раку, которое не отвечает на лечение. В вариантах осуществления рефрактерный рак может быть резистентным к лечению до или в начале лечения. В других вариантах осуществления рефрактерный рак может становиться резистентным во время лечения. Рефрактерный рак также называют резистентным раком.
Термин "консервативные модификации последовательности" относится к модификациям аминокислот, которые не воздействуют или не изменяют значительно характеристики связывания антитела или фрагмента антитела, содержащего данную аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, присоединения и делеции. Модификации могут быть введены в антитело или фрагмент антитела настоящего изобретения посредством стандартных методов, известных в данной области техники, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативными являются замены, в которых аминокислотный остаток заменяется на аминокислотный остаток, имеющий схожую боковую цепь. В данной области техники определены семейства аминокислотных остатков, имеющих схожие боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в CAR, описанном здесь, могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененный CAR может быть подвергнут тестированию с использованием функциональных анализов, описанных здесь.
Термин "стимуляция" относится к первичному ответу, индуцируемому связыванием стимулирующей молекулы (например, комплекса TCR/CD3 или CAR) с ее когнатным лигандом (или опухолевым антигеном в случае CAR), что опосредует событие трансдукции сигнала, такое как, но без ограничения, трансдукция сигнала посредством комплекса TCR/CD3 или трансдукция сигнала посредством подходящего рецептора NK или сигнальных доменов CAR. Стимуляция может опосредовать изменение экспрессии некоторых молекул.
Термин "стимулирующая молекула" относится к молекуле, экспрессируемой иммунной клеткой (например, T-клеткой, NK-клеткой, B-клеткой), которая обеспечивает цитоплазматическую сигнальную последовательность(и), которая регулирует активацию иммунной клетки стимулирующим образом для по меньшей мере некоторых аспектов сигнального пути иммунной клетки. В одном аспекте сигнал представляет собой первичный сигнал, который инициируется, например, связыванием комплекса TCR/CD3 с молекулой ГКГС, нагруженной пептидом, что ведет к опосредованию T-клеточного ответа, включая, но без ограничения, пролиферацию, активацию, дифференцировку и тому подобное. Первичная цитоплазматическая сигнальная последовательность (также называемая "первичным сигнальным доменом"), которая действует стимулирующим образом, может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащей ITAM первичной цитоплазматической сигнальной последовательности, которые особенно полезны в настоящем изобретении, включают, но без ограничения, происходящие от CD3-дзета, обычного FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12. В конкретных CAR настоящего изобретения внутриклеточный сигнальный домен в любом одном или нескольких CAR настоящего изобретения содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3-дзета. В конкретном CAR настоящего изобретения первичная сигнальная последовательность CD3-дзета представляет собой последовательность, приведенную как SEQ ID NO:9 (мутантная CD3-дзета), или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных. В конкретном CAR настоящего изобретения первичная сигнальная последовательность CD3-дзета представляет собой последовательность, приведенную в SEQ ID NO:10 (человеческая CD3-дзета дикого типа), или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных.
Термин "антигенпрезентирующая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и тому подобные), которая демонстриует чужеродный антиген в комплексе с главными комплексами гистосовместимости (ГКГС) на своей поверхности. T-клетки могут распознавать эти комплексы с использованием своих T-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их T-клеткам.
"Внутриклеточный сигнальный домен", как этот термин используют здесь, относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен может генерировать сигнал, который стимулирует иммунную эффекторную функцию содержащей CAR клетки, например, CART-клетки. Примеры иммунной эффекторной функции, например, в CART-клетке, включают цитолитическую активность и хелперную активность, включая секрецию цитокинов. В вариантах осуществления внутриклеточный сигнальный домен представляет собой часть белка, которая трансдуцирует сигнал эффекторной функции и направляет клетку к выполнению специализированной функции. Хотя может использоваться весь внутриклеточный сигнальный домен, во многих случаях нет необходимости в использовании всей цепи. Если используют усеченную часть внутриклеточного сигнального домена, такая усеченная часть может быть использована вместо интактной цепи в том случае, если она трансдуцирует сигнал эффекторной функции. Таким образом, предполагается, что термин внутриклеточный сигнальный домен включают в себя любую усеченную часть внутриклеточного сигнального домена, достаточную для трансдукции сигнала эффекторной функции.
В варианте осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Примеры первичных внутриклеточных сигнальных доменов включают происходящие от молекул, отвечающих за первичную стимуляцию или антиген-зависимую стимуляцию. В варианте осуществления внутриклеточный сигнальный домен может содержать костимулирующий внутриклеточный домен. Примеры костимулирующих внутриклеточных сигнальных доменов включают происходящие от молекул, отвечающих за костимулирующие сигналы или антиген-независимую стимуляцию. Например, в случае CART первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T-клеточного рецептора, и костимулирующий внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность от корецептора или костимулирующей молекулы.
Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащих ITAM первичных цитоплазматических сигнальных последовательностей включают, но без ограничения, происходящие от CD3-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD278 ("ICOS"), FcεRI и CD66d, CD32, DAP10 и DAP12.
Термин "дзета" или, альтернативно, "дзета-цепь", "CD3-дзета" или "TCR-дзета" определяют как белок, предлагаемый в GenBank под № доступа BAG36664.1, или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных, и "стимулирующий домен дзета" или, альтернативно, "стимулирующий домен из CD3-дзета" или "стимулирующий домен TCR-дзета" определяют как аминокислотные остатки из цитоплазматического домена дзета-цепи, которых достаточно для функциональной передачи начального сигнала, необходимого для активации T-клеток. В одном аспекте цитоплазматический домен дзета содержит остатки 52-164 в соответствии с № доступа BAG36664.1 в GenBank или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных, которые являются их функциональными ортологами. В одном аспекте "стимулирующий домен дзета" или "стимулирующий домен из CD3-дзета" представляет собой последовательность, приведенную как SEQ ID NO:9. В одном аспекте "стимулирующий домен дзета" или "стимулирующий домен из CD3-дзета" представляет собой последовательность, приведенную как SEQ ID NO:10.
Термин "костимулирующая молекула" относится к партнеру по когнатному связыванию на T-клетке, который специфически связывается с костимулирующим лигандом, тем самым опосредуя костимулирующий ответ T-клетки, такой как, но без ограничения, пролиферация. Костимулирующие молекулы являются молекулами клеточной поверхности, отличными от рецепторов антигенов или их лигандов, которые нужны для эффективного иммунного ответа. Костимулирующие молекулы включают, но без ограничения молекулу ГКГС класса I, белки-рецепторы TNF, иммуноглобулин-подобные белки, цитокиновые рецепторы, интегрины, сигнальные лимфоцит-активирующие молекулы (SLAM-белки), активирующие рецепторы NK-клеток, BTLA, рецептор толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83.
Костимулирующий внутриклеточный сигнальный домен относится к внутриклеточной части костимулирующей молекулы. Внутриклеточный сигнальный домен может содержать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, от которой он происходит, или его функциональный фрагмент.
Внутриклеточный сигнальный домен может содержать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, от которой он происходит, или его функциональный фрагмент.
Термин "4-1BB" относится к члену суперсемейства TNFR с аминокислотной последовательностью, предлагаемой под № доступа AAA62478.2 в GenBank, или эквивалентным остаткам из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных; и "костимулирующий домен из 4-1BB" определяют как аминокислотные остатки 214-255 в № доступа AAA62478.2 в GenBank или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных. В одном аспекте "костимулирующий домен из 4-1BB" представляет собой последовательность, приведенную как SEQ ID NO:7, или эквивалентные остатки из отличного от человека вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и тому подобных.
"Иммунная эффекторная клетка", как этот термин используют здесь, относится к клетке, которая участвует в иммунном ответе, например, в активации иммунного эффекторного ответа. Примеры иммунных эффекторных клеток включают в себя T-клетки, например, альфа/бета-T-клетки и гамма/дельта-T-клетки, B-клетки, клетки-естественные киллеры (NK), T-клетки-естественные киллеры (NKT), тучные клетки и фагоциты миелоидного происходения.
"Иммунная эффекторная функция или иммунный эффекторный ответ", как этот термин используют здесь, относится к функции или ответу, например, иммунной эффекторной клетки, которые усиливают или стимулируют иммунную атаку клетки-мишени. Например, иммунные эффекторные функция или ответ относятся к свойству T или NK-клеток, которое стимулирует киллинг или ингибирование роста или пролиферации клетки-мишени. В случае T-клетки первичная стимуляция и костимуляция представляют собой примеры иммунной эффекторной функции или ответа.
Термин "эффекторная функция" относится к специальной функции клетки. Эффекторная функция T-клетки, например, может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов.
Термин "кодирующий" относится к свойству, присущему специфическим последовательностям нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза в биологических процессах других полимеров и макромолекул, имеющих или определенную последовательность нуклеотидов (например, рРНК, тРНК и мРНК), или определенную последовательность аминокислот и биологические свойства, проистекающие из них. Таким образом, ген, кДНК или РНК кодируют белок, если транскрипция и трансляция мРНК, соответствующей этому гену, производит белок в клетке или другой биологической системе. Как кодирующая нить, нуклеотидная последовательность которой идентична последовательности мРНК и обычно приводится в перечнях последовательностей, так и некодирующая нить, используемая в качестве матрицы для транскрипции гена или кДНК, могут называться кодирующей белок или другой продукт этих гена или кДНК.
Если не указано иное, "нуклеотидная последовательность, кодирующая аминокислотную последовательность" включает в себя все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга, и которые кодируют одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, которая кодирует белок или РНК" может также включать в себя интроны, если нуклеотидная последовательность, кодирующая белок, может в некоторых вариантах содержать интрон(ы).
Термин "эндогенный" относится к любому материалу из организма, клетки, ткани или системы, или производимому внутри них.
Термин "экзогенный" относится к любому материалу, введенному в организм, клетку, ткань или систему, или производимому снаружи от них.
Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности, управляемой промотором.
Термин "вектор переноса"относится к композиции веществ, которая содержит выделенную нуклеиновую кислоту, и которую можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области техники известны многочисленные векторы, включая, но без ограничения, линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор переноса" включает в себя автономно реплицирующиеся плазмиду или вирус. Термин также следует интерпретировать как дополнительно включающий в себя неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосома и тому подобное. Примеры вирусных векторов переноса включают, но без ограничения, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и тому подобное.
Термин "вектор экспрессии" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий контрольные последовательности экспрессии, функционально связанные с нуклеотидной последовательностью, подлежащей экспрессии. Вектор экспрессии содержит достаточно действующих в цис-положении элементов для экспрессии; другие элементы для экспрессии могут поставляться клеткой-хозяином или в системе in vitro экспрессии. Векторы экспрессии включают в себя все известные в данной области техники, включая космиды, плазмиды (например, оголенные или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают в себя рекомбинантный полинуклеотид.
Термин "лентивирус" относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов в том, что они способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, так что они являются одним наиболее эффективных способов вектора доставки генов. ВИЧ, SIV и FIV являются примерами лентивирусов.
Термин "лентивирусный вектор" относится к вектору, происходящему по меньшей мере частично от лентивирусного генома, в частности включая самоинактивирующийся лентивирусный вектор, как предложено в документе Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). Другие примеры лентивирусных векторов, которые могут быть использованы в клинике, включают, но без ограничения, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAX™ от Lentigen и тому подобные. Неклинические типы лентивирусных векторов также доступны и должны быть известны специалисту в данной области техники.
Термин "гомологичный" или "идентичность" относятся к идентичности последовательностей субъединиц между двумя полимерными молекулами, например, между двумя молекулами нуклеиновой кислоты, такими как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Когда положение субъединицы в обеих из двух молекул занято одной и той же мономерной субъединицей; например, если положение в каждой из двух молекул ДНК занято аденином, то они гомологичны или идентичны в этом положении. Гомология между двумя последовательностями является непосредственной функцией количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях гомологичны, две последовательности гомологичны на 50%; если 90% положений (например, 9 из 10) совпадают или гомологичны, две последовательности гомологичны на 90%.
"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую от нечеловеческого иммуноглобулина. По большей части гуманизированные антитела и их фрагменты антител представляют собой человеческие иммуноглобулины (реципиентное антитело или фрагмент антитела), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены на остатки из CDR отличного от человека вида (донорное антитело), такого как мышь, крыса или кролик, имеющие желаемую специфичность, аффинность и способность. В некоторых случаях остатки каркасной области (FR) Fv человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированное антитело/фрагмент антитела может содержать остатки, которые не обнаруживаются ни в реципиентном антителе, ни в импортированной CDR или каркасных последовательностях. Эти модификации могут дополнительно уточнять и оптимизировать активность антитела или фрагмента антитела. В общем случае, гуманизированное антитело или его фрагмент антитела будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют нечеловеческому иммуноглобулину и все или значительная часть областей FR имеют последовательность от человеческого иммуноглобулина. Гуманизированное антитело или фрагмент антитела могут также содержать по меньшей мере часть иммуноглобулиновой константной области (Fc), обычно от человеческого иммуноглобулина. Для дальнейших подробностей смотри Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
"Полностью человеческий" относится к иммуноглобулину, такому как антитело или фрагмент антитела, если вся молекула имеет человеческое происхождение или состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулин.
Термин "выделенный" означает измененный или удаленный из естественного состояния. Например, нуклеиновая кислота или пептид, естественно присутствующие в живом животном, не являются "выделенными", но те же самые нуклеиновая кислота или пептид, частично или полностью отделенные от сопутствующих материалов их естественного состояния, являются "выделенными". Выделенные нуклеиновая кислота или белок могут существовать в по существу очищенной форме или могут существовать в ненативном окружении, таком как, например, клетка-хозяин.
В контексте настоящего изобретения используются следующие сокращения для часто встречающихся оснований нуклеиновой кислоты. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину, и "U" относится к уридину.
Термины "функционально связанный" или "транскрипционный контроль" относятся к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, если первая последовательность нуклеиновой кислоты помещена в функциональную взаимосвязь со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор воздействует на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут соприкасаться друг с другом и, например, если необходимо соединить две кодирующие белок области, находятся в одной и той же рамке считывания.
Термин "парентеральное" введение иммуногенной композиции включает, например, методы подкожной (п/к), внутривенной (в/в), внутримышечной (в/м) или интрастернальной инъекции, внутриопухолевого введения или инфузии.
Термины "нуклеиновая кислота" или "полинуклеотид" относится к дезоксирибонуклеиновой кислоте (ДНК), или рибонуклеиновой кислоте (РНК), или комбинации их ДНК или РНК и их полимерам или в одно-, или в двухцепочечной форме. Термин "нуклеиновая кислота" включает в себя ген, кДНК или мРНК. В одном варианте осуществления молекула нуклеиновой кислоты является синтетической (например, химически синтезированной) или рекомбинантной. Если специально не оговорено, термин охватывает нуклеиновые кислоты, содержащие аналоги или производные природных нуклеотидов, которые имеют связывающие свойства, аналогичные эталонной нуклеиновой кислоте, и метаболизируются аналогичным природным нуклеотидам образом. Если не указано иное, конкретная последовательность нуклеиновой кислоты также неявно охватывает ее консервативно модифицированные варианты (например, замены вырожденных кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также явно указанную последовательность. Если говорить конкретнее, замены вырожденных кодонов могут быть получены посредством создания последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов заменено на остатки смешанного основания и/или дезоксиинозина (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
Термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не налагается никаких ограничений на максимальное количество аминокислот, которое может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Как используется здесь, термин относится как к более коротким цепям, которые также обычно называют в данной области техники, например, пептидами, олигопептидми и олигомерами, так и к более длинным цепям, которые обычно называют в данной области техники белками, которых существует много типов. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, белки слияния и другие. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
Термин "промотор" относится к последовательности ДНК, распознаваемой аппаратом синтеза клетки или введенным аппаратом синтеза, необходимой для начала специфической транскрипции полинуклеотидной последовательности.
Термин "промотор/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая требуется для экспрессии продукта гена, функционально связанного с данными промотором/регуляторной последовательностью. В некоторых случаях данная последовательность может представлять собой последовательность корового промотора, а в других случаях данная последовательность может также включать в себя последовательность энхансера и другие регуляторные элементы, которые требуются для экспрессии продукта гена. Промотор/регуляторная последовательность может, например, представлять собой последовательность, экспрессирующую продукт гена ткань-специфическим образом.
Термин "конститутивный" промотор относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает производство продукта гена в клетке в большинстве или всех физиологических условиях клетки.
Термин "индуцируемый" промотор относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает производство продукта гена в клетке по существу только тогда, когда в клетке присутствует индуктор, который соответствует промотору.
Термин "ткань-специфический" промотор относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или определяется геном, вызывает производство продукта гена в клетке по существу только тогда, когда клетка представляет собой клетку ткани соответствующего промотору типа.
Термины "ассоциированный с раком антиген" или "опухолевый антиген" взаимозаменяемо относятся к молекуле (обычно белку, углеводу или липиду), которая преимущественно экспрессируется на поверхности раковой клетки, или полностью, или в виде фрагмента (например, ГКГС/пептида), по сравнению с нормальной клеткой, и которая полезна для преимущественного направления фармакологического средства на раковую клетку. В некоторых вариантах осуществления опухолевый антиген представляет собой маркер, экспрессируемый как нормальными клетками, так и раковыми клетками, например, маркер линии дифференцировки, например, CD19 на B-клетках. В некоторых аспектах опухолевые антигены настоящего изобретения происходят от раков, включая, но без ограничения, первичную или метастатическую меланому, тимому, лимфому, саркому, рак легкого, рак печени, неходжкинскую лимфому, ходжкинскую лимфому, лейкозы, рак матки, рак шейки матки, рак мочевого пузыря, рак почек и аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичников, рак поджелудочной железы и тому подобное. В некоторых вариантах осуществления ассоциированный с раком антиген представляет собой молекулу клеточной поверхности, которая сверхэкспрессируется в раковой клетке по сравнению с нормальной клеткой, например, 1-кратно сверхэкспрессируется, 2-кратно сверхэкспрессируется, 3-кратно или более сверхэкспрессируется по сравнению с нормальной клеткой. В некоторых вариантах осуществления ассоциированный с раком антиген представляет собой молекулу клеточной поверхности, которая неадекватно синтезируется в раковой клетке, например, молекулу, которая содержит делеции, присоединения или мутации по сравнению с молекулой, экспрессируемой на нормальной клетке. В некоторых вариантах осуществления ассоциированный с раком антиген будет экспрессироваться исключительно на клеточной поверхности раковой клетки, полностью или в виде фрагмента (например, ГКГС/пептида), и не будет синтезироваться или экспрессироваться на поверхности нормальной клетки. В некоторых вариантах осуществления CAR настоящего изобретения включают в себя CAR, содержащие антигенсвязывающий домен (например, антитело или фрагмент антитела), который связывается с презентируемым ГКГС пептидом. Обычно пептиды, происходящие от эндогенных белков, заполняют карманы молекул главного комплекса гистосовместимости (ГКГС) класса I и распознаются T-клеточными рецепторами (TCR) на CD8+T-лимфоцитах. Комплексы ГКГС класса I конститутивно экспрессируются всеми ядросодержащими клетками. При раке вирус-специфические и/или опухоль-специфические комплексы пептид/ГКГС представляют уникальный класс мишеней клеточной поверхности для иммунотерапии. Были описаны TCR-подобные антитела, воздействующие на пептиды, происходящие от вирусных или опухолевых антигенов, в контексте человеческого лейкоцитарного антигена (HLA)-A1 или HLA-A2 (смотри, например, Sastry et al., J Virol. 2011 85(5):1935-1942; Sergeeva et al., Blood, 2011 117(16):4262-4272; Verma et al., J Immunol 2010 184(4):2156-2165; Willemsen et al., Gene Ther 2001 8(21):1601-1608; Dao et al., Sci Transl Med 2013 5(176):176ra33; Tassev et al., Cancer Gene Ther 2012 19(2):84-100). Например, TCR-подобное антитело может быть идентифицировано скринингом библиотеки, такой как библиотека фагового отображения человеческого scFv.
Термин "гибкий полипептидный линкер" или "линкер", как используется в контексте scFv, относится к пептидному линкеру, который состоит из аминокислот, таких как остатки глицина и/или серина, используемые по-отдельности или в комбинации, для связывания вместе вариабельной области тяжелой цепи и вариабельной области легкой цепи. В одном варианте осуществления гибкий полипептидный линкер представляет собой линкер Gly/Ser и содержит аминокислотную последовательность (Gly-Gly-Gly-Ser)n (SEQ ID NO: 15), где n представляет собой положительное целое число, равное или большее чем 1. Например, n=1, n=2, n=3, n=4, n=5, n=6, n=7, n=8, n=9 и n=10. В одном варианте осуществления гибкие полипептидные линкеры включают, но без ограничения, (Gly4 Ser)4 (SEQ ID NO:27) или (Gly4 Ser)3 (SEQ ID NO:28). В другом варианте осуществления линкеры включают включают множественные повторы (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO:29). Также в пределы объема настоящего изобретения включены линкеры, описанные в WO2012/138475, включенной в настоящий документ посредством ссылки.
Как используется здесь, 5'-кэп (также называемый кэп РНК, 7-метилгуанозиновый кэп РНК или кэп m7G РНК) представляет собой модифицированный нуклеотид гуанин, который присоединен к "переднему" или 5'-концу эукариотической информационной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, которая связана с первым транскрибируемым нуклеотидом. Ее присутствие является критическим для распознавания рибосомой и защиты от РНКаз. Присоединение кэпа связано с транскрипцией и происходит котранскрипционно, так что они воздействуют друг на друга. Вскоре после начала транскрипции 5'-конец синтезируемой мРНК связывается синтезирующим кэп комплексом, ассоциированным с РНК-полимеразой. Этот ферментный комплекс катализирует химические реакции, которые необходимы для кэпирования мРНК. Синтез продолжается в виде многостадийной биохимической реакции. Кэпирующая группа может быть модифицирована для модулирования функциональных свойств мРНК, таких как ее стабильность или эффективность трансляции.
Как используется здесь, "транскрибируемая in vitro РНК" относится к РНК, например, мРНК, которая была синтезирована in vitro. Обычно транскрибируемая in vitro РНК генерируется из вектора in vitro транскрипции. Вектор in vitro транскрипции содержит матрицу, которая используется для генерирования транскрибируемой in vitro РНК.
Как используется здесь, "поли(A)" представляет собой ряд аденозинов, прикрепленных посредством полиаденилирования к мРНК. В некоторых вариантах осуществления конструкта для временной экспрессии поли-A составляет от 50 до 5000 (SEQ ID NO: 30), например, больше чем 64, например, больше чем 100, например, больше чем 300 или 400. Поли(A)-последовательности могут быть модифицированы химически или ферментативно для модулирования функциональных свойств мРНК, таких как локализация, стабильность или эффективность трансляции.
Как используется здесь, "полиаденилирование" относится к ковалентной связи полиаденильного участка или его модифицированного варианта с молекулой информационной РНК. В эукариотических организмах большая часть молекул информационной РНК (мРНК) полиаденилированы с 3'-конца. 3'-поли(A)-хвост представляет собой длинную последовательность адениновых нуклеотидов (часто несколько сотен), присоединенных к пре-мРНК посредством действия фермента полиаденилатполимеразы. В высших эукариотах поли(A)-хвост присоединяется к транскриптам, которые содержат специфическую последовательность, сигнал полиаденилирования. Поли(A)-хвост и белковая связь с ним помогает защитить мРНК от деградации экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре непосредственно после транскрипции ДНК в РНК, но дополнительно может также происходить позже в цитоплазме. После терминации транскрипции цепь мРНК расщепляется действием эндонуклеазного комплекса, ассоциированного с РНК-полимеразой. Сайт расщепления обычно характеризуется присутствием последовательности оснований AAUAAA около сайта расщепления. После расщепления мРНК аденозиновые остатки присоединяются к свободному 3'-концу в сайте расщепления.
Как используется здесь, "временный" относится к экспрессии неинтегрированного трансгена в течение периода, составляющего часы, дни или недели, причем период времени экспрессии меньше, чем период времени экспрессии данного гена в случае интеграции в геном или содержания в стабильном плазмидном репликоне в клетке-хозяине.
Аферез представляет собой процесс, при котором цельную кровь удаляют из индивидуума, разделяют на отдельные компоненты, и остальную часть возвращают в циркуляцию. Обычно существует два способа разделения компонентов крови, центрифужный и нецентрифужный. Лейкаферез приводит к активной селекции и удалению белых кровяных клеток пациента.
Как используется здесь, термины "лечить" и "лечение" относятся к уменьшению или ослаблению прогрессирования, тяжести и/или продолжительности пролиферативного нарушения или ослаблению одного или нескольких симптомов (например, одного или нескольких выраженных симптомов) пролиферативного нарушения, происходящих от введения одной или нескольких терапий (например, одного или нескольких терапевтических средств, таких как CAR настоящего изобретения). В конкретных вариантах осуществления термины "лечить" и "лечение" относятся к ослаблению по меньшей мере одного измеряемого физического параметра пролиферативного нарушения, такого как рост опухоли, не обязательно воспринимаемого пациентом. В других вариантах осуществления термины "лечить" и "лечение" относятся к ингибированию прогрессирования пролиферативного нарушения физически, посредством, например, стабилизации выраженного симптома, физиологически, посредством, например, стабилизации физического параметра, или и тем, и другим образом. В других вариантах осуществления термины "лечить" и "лечение" относятся к уменьшению или стабилизации размера опухоли или числа раковых клеток.
Термин "путь трансдукции сигнала" относится к биохимической взаимосвязи между множеством молекул трансдукции сигнала, которые играют роль в передаче сигнала из одной части клетки в другую часть клетки. Фраза "рецептор клеточной поверхности" включает в себя молекулы и комплексы молекул, способные к приему сигнала и передаче сигнала через мембрану клетки.
Предполагается, что термин "субъект" включает в себя живые организмы, у которых может быть вызван иммунный ответ (например, млекопитающих, людей).
Термин "по существу очищенная" клетка относится к клетке, которая по существу свободна от других типов клеток. По существу очищенная клетка также относится к клетке, которая была отделена от клеток других типов, с которыми она обычно связана в своем естественном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к однородной популяции клеток. В других случаях данный термин относится просто к клеткам, которые были отделены от клеток, с которыми они естественным образом связаны в своем естественном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
В контексте настоящего изобретения "опухолевый антиген", или "антиген гиперпролиферативного нарушения", или "антиген, ассоциированный с гиперпролиферативным нарушением" относится к антигенам, которые являются общими для конкретных гиперпролиферативных нарушений. В некоторых вариантах осуществления опухолевый антиген происходят от рака, включая, но без ограничения, первичную или метастатическую меланому, тимому, лимфому, саркому, рак легкого, рак печени, неходжкинскую лимфому, ходжкинскую лимфому, лейкозы, рак матки, рак шейки матки, рак мочевого пузыря, рак почек и аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичников, рак поджелудочной железы и тому подобное.
Термин "трансфицированный", или "трансформированный", или "трансдуцированный" относится к процессу, посредством которого экзогенную нуклеиновую кислоту переносят или вводят в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку субъекта и ее потомство.
Термин "специфически связывается" относится к антителу или лиганду, который распознает белок-когнатный партнер по связыванию, присутствующий в образце, и связывается с ним, причем эти антитело или лиганд по существу не распознают другие молекулы в образце или не связываются с ними.
Диапазоны: на протяжении настоящего раскрытия различные аспекты настоящего изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов дано только для удобства и краткости и не должно рассматриваться в качестве негибкого ограничения объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как конкретно раскрывающее все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание диапазона, такого как от 1 до 6, следует рассматривать как конкретно раскрывающее такие поддиапазоны, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и так далее, а также отдельные числовые значения в пределах этого диапазона, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера, диапазон, такой как идентичность на 95-99%, включает в себя что-либо с идентичностью на 95%, 96%, 97%, 98% или 99%, и включает в себя такие поддиапазоны как идентичность на 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99%. Это применяется независимо от ширины диапазона.
Описание
В настоящем описании предлагаются способы производства иммунных эффекторных клеток (например, T-клеток, NK-клеток), которые могут быть сконструированы с CAR, например, CAR, описанным здесь, и реакционные смеси и композиции, содержащиеы такие клетки.
В одном аспекте настоящее раскрытие включает в себя иммунную эффекторную клетку (например, T-клетку, NK-клетку), сконструированную для экспрессии CAR, причем сконструированная иммунная эффекторная клетка проявляет противоопухолевые свойства. Примером антигена является ассоциированный с раком антиген (то есть опухолевый антиген), описанный здесь. В одном аспекте клетку трансформируют с помощью CAR, и CAR экспрессируется на клеточной поверхности. В некоторых вариантах осуществления клетку (например, T-клетку, NK-клетку) трансдуцируют с помощью вирусного вектора, кодирующего CAR. В некоторых вариантах осуществления вирусный вектор представляет собой ретровирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор. В некоторых таких вариантах осуществления клетка может стабильно экспрессировать CAR. В другом варианте осуществления клетку (например, T-клетку, NK-клетку) трансфицируют нуклеиновой кислотой, например, мРНК, кДНК, ДНК, кодирующей CAR. В некоторых таких вариантах осуществления клетка может временно экспрессировать CAR.
Кроме того, настоящее изобретение предлагает композиции экспрессирующих CAR клеток, например, CART, и их применение в медикаментах или способах лечения, помимо других заболеваний, рака или любой злокачественной опухоли или аутоиммунных заболеваний с участием клеток или тканей, которые экспрессируют опухолевый антиген, как описано здесь.
В одном аспекте CAR настоящего изобретения можно использовать для эрадикации нормальных клеток, которые экспрессируют опухолевый антиген, как описано здесь, и тем самым он применим для использования в качестве клеточной кондиционирующей терапии перед клеточной трансплантацией.
Источники иммунных эффекторных клеток
В вариантах осуществления перед размножением и генетической модификацией или другой модификацией от субъекта может быть получен источник клеток, например, T-клеток или клеток-естественных киллеров (NK). Примеры субъектов включают в себя людей, обезьян, шимпанзе, собак, кошек, мышей, крыс и их трансгенные виды. T-клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из участка инфицирования, асцит, плевральный выпот, ткань селезенки и опухоли.
В некоторых аспектах настоящего раскрытия иммунные эффекторные клетки, например, T-клетки, могут быть получены из единицы крови, отобранной у субъекта с использованием любого количества способов, известных специалисту, таких как разделение с помощью Ficoll™. В одном аспекте клетки из циркулирующей крови индивидуума получают посредством афереза. Продукт афереза обычно содержит лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие белые кровяные клетки, красные кровяные клетки и тромбоциты. В одном аспекте клетки, отобранные посредством афереза, могут быть промыты для удаления фракции плазмы и, необязательно, для помещения клеток в подходящий буфер или среду для последующих этапов обработки. В одном варианте осуществления клетки промывают фосфатно-солевым буфером (ФСБ). В альтернативном варианте осуществления в растворе для промывания отсутствует кальций, и может отсутствовать магний, или могут отсутствовать многие, если не все, двухвалентные катионы.
Первоначальные этапы активации в отсутствие кальция могут приводить к увеличению активации. Как легко поймут средние специалисты в данной области техники, этап промывания может быть выполнен посредством способов, известных специалистам в данной области техники, например, посредством использования полуавтоматической "проточной" центрифуги (например, обработчика клеток Cobe 2991, Baxter CytoMate или Haemonetics Cell Saver 5) в соответствии с инструкциями изготовителя. После промывания клетки могут быть ресуспендированы во множестве биосовместимых буферов, таких как, например, свободный от Ca, свободный от Mg ФСБ, PlasmaLyte A или другой солевой раствор с буфером или без. В качестве альтернативы, нежелательные компоненты образца афереза могут быть удалены, а клетки непосредственно ресуспендированы в культуральной среде.
В одном аспекте T-клетки выделяют из лимфоцитов периферической крови посредством лизирования красных кровяных клеток и истощения моноцитов, например, посредством центрифугирования в градиенте PERCOLLTM или посредством проточного элютриационного центрифугирования.
Способы, описанные здесь могут включать в себя, например, селекцию конкретной субпопуляции иммунных эффекторных клеток, например, T-клеток, которые представляют собой истощенную по регуляторным T-клеткам популяцию, истощенные по CD25+ клетки, с использованием, например, способа отрицательной селекции, например, описанного здесь. В некоторых вариантах осуществления популяция истощенных по T-регуляторам клеток содержит меньше чем 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с помощью анти-CD25 антитела, или его фрагмента, или CD25-связывающего лиганда, например, IL-2. В одном варианте осуществления анти-CD25 антитело, или его фрагмент, или CD25-связывающий лиганд конъюгируют с субстратом, например, гранулой, или иным образом наносят на субстрат, например, гранулу. В одном варианте осуществления анти-CD25 антитело или его фрагмент конъюгируют с субстратом, как описано здесь.
В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с использованием реагента для истощения по CD25 от MiltenyiTM. В одном варианте осуществления отношение клеток к реагенту для истощения по CD25 составляет 1e7 клеток на 20 мкл, или 1e7 клеток на 15 мкл, или 1e7 клеток на 10 мкл, или 1e7 клеток на 5 мкл, или 1e7 клеток на 2,5 мкл, или 1e7 клеток на 1,25 мкл. В одном варианте осуществления, например, для истощения по регуляторным T-клеткам, например, CD25+, используют больше чем 500 миллионов клеток на мл. В другом аспекте используют концентрацию клеток 600, 700, 800 или 900 миллионов клеток на мл.
В одном варианте осуществления популяция иммунных эффекторных клеток, подлежащих истощению, включает в себя приблизительно 6×109 CD25+ T-клеток. В других аспектах популяция иммунных эффекторных клеток, подлежащих истощению, включают в себя приблизительно от 1×109 до 1×1010 CD25+ T-клеток и любое промежуточное целочисленное значение. В одном варианте осуществления получаемая популяция истощенных по T-регуляторам клеток содержит 2×109регуляторных T-клеток, например, CD25+ клеток, или меньше (например, 1×109, 5×108, 1×108, 5×107, 1×107 или меньше CD25+ клеток).
В одном варианте осуществления регуляторные T-клетки, например, CD25+ клетки, удаляют из популяции с использованием системы CliniMAC с набором магистралей для истощения, таким как, например, магистрали 162-01. В одном варианте осуществления система CliniMAC выполняется с настройками для истощения, такими как, например, DEPLETION2.1.
Без ограничения конкретной теорией, уменьшение уровня отрицательных регуляторов иммунных клеток (например, уменьшение количества нежелательных иммунных клеток, например, TREG-клеток) у субъекта перед аферезом или во время производства экспрессирующего CAR клеточного продукта значительно снижает риск рецидива у субъекта. Например, в данной области техники известны способы истощения TREG-клеток. Способы уменьшения количества TREG-клеток включают, но без ограничения, циклофосфамид, анти-GITR антитело (анти-GITR антитело, описанное здесь), истощение по CD25, ингибитор mTOR и их комбинации.
В некоторых вариантах осуществления способы производства содержат уменьшение количества (например, истощение) TREG-клеток перед производством экспрессирующей CAR клетки. Например, способы производства содержат приведение образца, например, образца афереза, в контакт с анти-GITR антителом и/или анти-CD25 антителом (или его фрагментом или CD25-связывающим лигандом), например, для истощения TREG-клеток перед производством экспрессирующего CAR клеточного (например, T-клеточного, NK-клеточного) продукта.
Без ограничения конкретной теорией, уменьшение уровня отрицательных регуляторов иммунных клеток (например, уменьшение количества нежелательных иммунных клеток, например, TREG-клеток) у субъекта перед аферезом или во время производства экспрессирующего CAR клеточного продукта может снижать риск рецидива у субъекта. В варианте осуществления субъект предварительно получает одну или несколько терапий, которые уменьшают количество TREG-клеток перед отбором клеток для производства экспрессирующего CAR клеточного продукта, что снижает риск рецидива у субъекта на лечение экспрессирующими CAR клетками. В варианте осуществления способы уменьшения количества TREG-клеток включают, но без ограничения, введение субъекту одного или нескольких из циклофосфамида, анти-GITR антитела, истощения по CD25 или их комбинации. В варианте осуществления способы уменьшения количества TREG-клеток включают, но без ограничения, введение субъекту одного или нескольких из циклофосфамида, анти-GITR антитела, истощения по CD25, ингибитора mTOR или их комбинации. Введение одного или нескольких из циклофосфамида, анти-GITR антитела, истощения по CD25 или их комбинации может осуществляться до, во время или после введения экспрессирующего CAR клеточного продукта. Введение одного или нескольких из циклофосфамида, анти-GITR антитела, истощения по CD25, ингибитора mTOR или их комбинации может осуществляться до, во время или после введения экспрессирующего CAR клеточного продукта.
В некоторых вариантах осуществления способы производства содержат уменьшение количества (например, истощение) TREG-клеток перед производством экспрессирующей CAR клетки. Например, способы производства содержат приведение образца, например, образца афереза, в контакт с анти-GITR антителом и/или анти-CD25 антителом (или его фрагментом или CD25-связывающим лигандом), например, для истощения TREG-клеток перед производством экспрессирующего CAR клеточного (например, T-клеточного, NK-клеточного) продукта.
В варианте осуществления субъект предварительно получает циклофосфамид перед отбором клеток для производства экспрессирующего CAR клеточного продукта, что снижает риск рецидива у субъекта на лечение экспрессирующими CAR клетками (например, лечение CTL019). В варианте осуществления субъект предварительно получает анти-GITR антитело перед отбором клеток для производство экспрессирующего CAR клеточного (например, T-клеточного или NK-клеточного) продукта, что снижает риск рецидива у субъекта на лечение экспрессирующими CAR клетками.
В варианте осуществления способ производства экспрессирующей CAR клетки (например, T-клетки, NK-клетки) модифицируют для истощения TREG-клеток перед производством экспрессирующего CAR клеточного (например, T-клеточного, NK-клеточного) продукта (например, продукта CTL019). В варианте осуществления истощение по CD25 используют для истощения TREG-клеток перед производством экспрессирующего CAR клеточного (например, T-клеточного, NK-клеточного) продукта (например, продукта CTL019).
В одном варианте осуществления популяция клеток, подлежащая удалению, представляет собой не регуляторные T-клетки или опухолевые клетки, но клетки, которые иным образом отрицательно влияют на размножение и/или функцию CART-клеток, например, клетки, экспрессирующие CD14, CD11b, CD33, CD15 или другие маркеры, экспрессируемые потенциально иммуносупрессивными клетками. В одном варианте осуществления предусмотрено удаление таких клеток одновременно с регуляторными T-клетками и/или опухолевыми клетками, или после упомянутого истощения, или в другом порядке.
Способы, описанные здесь, могут включать в себя более чем один этап селекции, например, более чем один этап истощения. Обогащение T-клетоной популяции посредством отрицательной селекции может быть выполнено, например, с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно селектируемых клеток. Одним способом является клеточная сортировка и/или селекция посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, которая использует коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на отрицательно селектируемых клетках. Например, для обогащения CD4+ клетками посредством отрицательной селекции коктейль моноклональных антител может включать в себя антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8.
Способы, описанные здесь, могут дополнительно включать в себя удаление из популяции клеток, которые экспрессируют опухолевый антиген, например, опухолевый антиген, который не содержит CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, для обеспечения таким образом популяции истощенных по T-регуляторам, например, истощенных по CD25+, и истощенных по опухолевому антигену клеток, которые подходят для экспрессии CAR, например, CAR, описанного здесь. В одном варианте осуществления экспрессирующие опухолевый антиген клетки удаляют одновременно с регуляторными T-клетками, например, CD25+ клетками. Например, анти-CD25 антитело или его фрагмент и антитело к противоопухолевому антигену или его фрагмент могут быть прикреплены к одному и тому же субстрату, например, грануле, который можно использовать для удаления клеток, или анти-CD25 антитело, или его фрагмент, или антитело к противоопухолевому антигену, или его фрагмент, могут быть прикреплены к отдельным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление экспрессирующих опухолевый антиген клеток происходят последовательно и могут происходить, например, в любом порядке.
Также предлагаются способы, которые включают в себя удаление из популяции клеток, которые экспрессируют ингибитор контрольных точек, например, ингибитор контрольных точек, описанный здесь, например, одних или несколько из PD1+ клеток, LAG3+ клеток и TIM3+ клеток, для обеспечения тем самым популяции истощенных по T-регуляторам, например, истощенных по CD25+, клеток и истощенных по ингибитору контрольных точек клеток, например, истощенных по PD1+, LAG3+ и/или TIM3+ клеток. Типичные ингибиторы контрольных точек включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR (например, TGFR-бета), например, как описано здесь. В одном варианте осуществления экспрессирующие ингибитор контрольных точек клетки удаляют одновременно с T-регуляторными, например, CD25+, клетками. Например, анти-CD25 антитело, или его фрагмент, и антитело к ингибитору контрольных точек, или его фрагмент, могут быть прикреплены к одной и той же грануле, которую можно использовать для удаления клеток, или анти-CD25 антитело, или его фрагмент, и антитело к ингибитору контрольных точек, или его фрагмент, могут быть прикреплены к различным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток, и удаление экспрессирующих ингибитор контрольных точек клеток происходят последовательно и могут происходить, например, в любом порядке.
Способы, описанные здесь, могут включать в себя этап положительной селекции. Например, T-клетки могут быть выделены посредством инкубации с анти-CD3/анти-CD28 (например, 3×28)-конъюгированными гранулами, такими как DYNABEADS® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительной селекции желаемых T-клеток. В одном варианте осуществления период времени составляет приблизительно 30 минут. В другом варианте осуществления период времени находится в диапазоне, включающем в себя от 30 минут до 36 часов или более и все промежуточные целочисленные значения. В другом варианте осуществления период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В еще одном варианте осуществления период времени составляет от 10 до 24 часов, например, 24 часа. Более продолжительное время инкубации можно использовать для выделения T-клеток в любой ситуации, в которой T-клеток мало по сравнению с клетками других типов, например, при выделении проникающих в опухоль лимфоцитов (TIL) из опухолевой ткани или из иммунологически скомпрометированных индивидуумов. Кроме того, использование более продолжительного времени инкубации может увеличивать эффективность захвата CD8+ T-клеток. Таким образом, посредством простого сокращения или удлинения времени, в течение которого T-клеткам позволяют связываться с CD3/CD28 гранулами, и/или посредством увеличения или уменьшения отношения гранул к T-клеткам (как описано здесь ниже), субпопуляции T-клеток могут быть преимущественно подвергнуты положительной или отрицательной селекции в начале культивирования или в других временных точках во время процесса. Кроме того, посредством увеличения или уменьшения отношения анти-CD3 и/или анти-CD28 антител на гранулах или другой поверхности субпопуляции T-клеток могут быть преимущественно подвергнуты положительной или отрицательной селекции в начале культивирования или в других желаемых временных точках.
В одном варианте осуществления быть выбрана T-клеточная популяция, которая экспрессирует один или несколько из IFN-γ, TNFα, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-10, IL-13, гранзима B и перфорина или других подходящих молекул, например, других цитокинов. Способы скрининга клеточной экспрессии могут быть определены, например, с помощью способов, описанных в публикации PCT № WO 2013/126712.
Для выделения желаемой популяции клеток посредством положительной или отрицательной селекции можно варьировать концентрацию клеток и поверхности (например, частиц, таких как гранулы). В некоторых аспектах может быть желательным значительное уменьшение объема, в котором смешаны вместе гранулы и клетки (например, увеличение концентрации клеток), для обеспечения максимального контакта клеток и гранул. Например, в одном аспекте используют концентрацию, составляющую 10 миллиардов клеток на мл, 9 миллиардов на мл, 8 миллиардов на мл, 7 миллиардов на мл, 6 миллиардов на мл или 5 миллиардов на мл. В одном аспекте используют концентрацию, составляющую 1 миллиард клеток на мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток на мл. В других аспектах можно использовать концентрации, составляющие 125 или 150 миллионов клеток на мл.
Использование высоких концентрации может приводить к увеличению выхода клеток, активации клеток и размножения клеток. Кроме того, использование высоких концентраций клеток делает возможным более эффективный захват клеток, которые могут слабо экспрессировать антигены-мишени, представляющие интерес, таких как CD28-отрицательные T-клетки, или из образцов, в которых присутствует много опухолевых клеток (например, лейкозная кровь, опухолевая ткань и так далее). Такие популяции клеток могут иметь терапевтическое значение, и их получение было бы желательным. Например, использование высокой концентрации клеток делает возможной более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
В родственном аспекте может быть желательным использование более низких концентраций клеток. Посредством значительного разбавления смеси T-клеток и поверхности (например, частиц, таких как гранулы) минимизируют взаимодействия между частицами и клетками. Так отбирают клетки, которые экспрессируют большие количества желаемых антигенов, подлежащих связыванию с частицами. Например, CD4+ T-клетки экспрессируют более высокие уровни CD28 и эффективнее захватываются, чем CD8+ T-клетки в разбавленных концентрациях. В одном аспекте используемая концентрация клеток составляет 5×106/мл. В других аспектах используемая концентрация может составлять от приблизительно 1×105/мл до 1×106/мл и любое промежуточное целочисленное значение.
В других аспектах клетки можно инкубировать на ротаторе в течение изменяющихся промежутков времени с изменяющимися скоростями или при 2-10°C, или при комнатной температуре.
В одном варианте осуществления множество иммунных эффекторных клеток популяции не экспрессируют диацилглицеринкиназу (DGK), например, являются DGK-дефицитными. В одном варианте осуществления множество иммунных эффекторных клеток популяции не экспрессируют Ikaros, например, являются Ikaros-дефицитными. В одном варианте осуществления множество иммунных эффекторных клеток популяции не экспрессируют ни DGK, ни Ikaros, например, являются как DGK, так и Ikaros-дефицитными.
T-клетки для стимуляции могут также быть заморожены после этапа промывания. Без ограничения теорией, этап замораживания и последующего оттаивания обеспечивает более однородный продукт посредством удаления гранулоцитов и до некоторой степени моноцитов из клеточной популяции. После этапа промывания, который удаляет плазму и тромбоциты, клетки могут быть суспендированы в растворе для замораживания. При том, что множество растворов для замораживания и параметров известны в данной области техники и будут подходящими в данном контексте, один способ включает в себя использование ФСБ, содержащего 20% DMSO и 8% человеческого сывороточного альбумина, или культуральной среды, содержащей 10% дестрана-40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% DMSO, или 31,25% Plasmalyte-A, 31,25% декстрозы 5%, 0,45% NaCl, 10% дестрана-40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% DMSO, или других подходящих сред для замораживания клеток, содержащих, например, геспан и PlasmaLyte A, затем клетки замораживают до -80°C со скоростью 1° в минуту и хранят в паровой фаза емкости для хранения с жидким азотом. Можно использовать другие способы контролируемого замораживания, а также неконтролируемое замораживающий непосредственно при -20°C или в жидком азоте.
В определенных аспектах криосохраненные клетки оттаивают и промывают, как описано здесь, и оставляют на один час при комнатной температуре перед активацией с использованием способов настоящего изобретения.
Также в контексте настоящего изобретения рассматривается отбор образцов крови или продукта афереза у субъекта в период времени перед тем, когда размножаемые клетки, как описано здесь, могут понадобиться. При этом источник клеток, подлежащих размножению, может быть собран в любой необходимый момент времени, и желаемые клетки, такие как T-клетки, могут быть выделены и заморожены для дальнейшего использования в терапии иммунными эффекторными клетками для любого числа заболевании или состояний, для которых может быть полезна терапия иммунными эффекторными клетками, таких как описанные здесь. В одном аспекте образец крови или аферез забирают у в целом здорового субъекта. В некоторых аспектах образец крови или аферез забирают у в целом здорового субъекта, который подвержен риску развития заболевания, но у которого заболевание еще не развилось, и клетки, представляющие интерес, выделяют и замораживают для последующего использования. В некоторых аспектах T-клетки могут быть размножены, заморожены и использованы в дальнейшем. В некоторых аспектах образцы отбирают у пациента вскоре после диагностирования конкретного заболевания, как описано здесь, но перед каким бы то ни было лечением. В другом аспекте клетки выделяют из образца крови или афереза у субъекта перед любым количеством соответствующих модальностей лечения, включая, но без ограничения, лечение с помощью таких средств, как натализумаб, эфализумаб, противовирусные средства, химиотерапия, излучение, иммуносупрессивные средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антитела или другие иммуноаблативные средства, такие как CAMPATH, анти-CD3 антитела, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и облучение.
В другом аспекте настоящего изобретения T-клетки получают у пациента непосредственно после лечения, которое оставляет у субъекта функционирующие T-клетки. В этом отношении было отмечено, что после некоторых процедур лечения рака, в частности лечения с помощью препаратов, которые повреждают иммунную систему, вскоре после лечения во время периода, когда пациенты обычно должны восстанавливаться после лечения, качество получаемых T-клеток может быть оптимальным или улучшенным в отношении их способности размножаться ex vivo. Аналогично, после манипуляций ex vivo с использованием способов, описанных здесь, эти клетки могут находиться в предпочтительном состоянии для усиления приживления и размножения in vivo. Таким образом, в контексте настоящего изобретения предполагается отбирать кровяные клетки, включая T-клетки, дендритные клетки или другие клетки гематопоэтической линии дифференцировки, во время данной фазы восстановления. Кроме того, в определенных аспектах можно использовать мобилизацию (например, мобилизацию с помощью GM-CSF) и кондиционирующие схемы для создания у субъекта состояния, в котором облегчены репопуляция, рециркуляция, регенерация и/или размножение конкретных типов клеток, особенно во время определенного окна времени после терапии. Иллюстративные клеточные типы включают T-клетки, B-клетки, дендритные клетки и другие клетки иммунной системы.
В одном варианте осуществления иммунные эффекторные клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную здесь, получают у субъекта, который получил низкую иммуностимулирующую дозу ингибитора mTOR. В варианте осуществления популяцию иммунных эффекторных клеток, например, T-клеток, которые должны быть сконструированы для экспрессии CAR, отбирают по прошествии достаточного времени или после достаточного дозирования низкой иммуностимулирующей дозы ингибитора mTOR, так что уровень PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки, у субъекта или после отбора у субъекта по меньшей мере временно повышается.
В других вариантах осуществления популяция иммунных эффекторных клеток, например, T-клеток, которые сконструированы или будут сконструированы для экспрессии CAR, может быть обработана ex vivo посредством приведения в контакт с некоторым количеством ингибитора mTOR, что увеличивает количество PD1-отрицательных иммунных эффекторных клеток, например, T-клеток, или повышает отношение PD1-отрицательные иммунные эффекторные клетки, например, T-клетки/PD1-положительные иммунные эффекторные клетки, например, T-клетки.
Считается, что способы настоящей заявки могут использовать условия культуральной среды, содержащей 5% или менее, например, 2%, человеческой сыворотки AB, и использовать известные условия и композиции культуральной среды, например, описанные в документе Smith et al., "Ex vivo expansion of human T cells for adoptive immunotherapy using the novel Xeno-free CTS Immune Cell Serum Replacement" Clinical & Translational Immunology (2015) 4, e31; doi:10,1038/cti.2014,31.
В одном варианте осуществления способы настоящей заявки могут использовать условия культуральной среды, содержащей бессывороточную среду. В одном варианте осуществления бессывороточная среда представляет собой OpTmizer CTS (LifeTech), Immunocult XF (Stemcell technologies), CellGro (CellGenix), TexMacs (Miltenyi), Stemline (Sigma), Xvivo15 (Lonza), PrimeXV (Irvine Scientific) или StemXVivo (RandD systems). Бессывороточная среда может быть дополнена заменителем сыворотки, таким как ICSR (замена сыворотки иммунных клеток) от LifeTech. Уровень заменителя сыворотки (например, ICSR) может составлять, например, вплоть до 5%, например, приблизительно 1%, 2%, 3%, 4% или 5%.
В одном варианте осуществления популяция T-клеток дефицитна по диацилглицеринкиназе (DGK). DGK-дефицитные клетки включают клетки, которые не экспрессируют РНК или белок DGK или обладают пониженной или ингибированной активностью DGK. DGK-дефицитные клетки могут быть сгенерированы с помощью генетических подходов, например, введения РНК-интерферирующих средств, например, миРНК, кшРНК, микроРНК, для снижения или предотвращения экспрессии DGK. В качестве альтернативы, DGK-дефицитные клетки могут быть сгенерированы посредством обработки ингибиторами DGK, описанными здесь.
В одном варианте осуществления популяция T-клеток дефицитна по Ikaros. Ikaros-дефицитные клетки включают клетки, которые не экспрессируют РНК или белок Ikaros или обладают пониженной или ингибированной активностью Ikaros, Ikaros-дефицитные клетки могут быть сгенерированы с помощью генетических подходов, например, введения РНК-интерферирующих средств, например, миРНК, кшРНК, микроРНК, для снижения или предотвращения экспрессии Ikaros. В качестве альтернативы, Ikaros-дефицитные клетки могут быть сгенерированы посредством обработки ингибиторами Ikaros, например, леналидомидом.
В вариантах осуществления популяция T-клеток является DGK-дефицитной и Ikaros-дефицитной, например, не экспрессирует DGK и Ikaros или обладает пониженной или ингибированной активностью DGK и Ikaros. Такие DGK- и Ikaros-дефицитные клетки могут быть сгенерированы с помощью любого из способов, описанных здесь.
В варианте осуществления NK-клетки получают у субъекта. В другом варианте осуществления NK-клетки представляют собой линию NK-клеток, например, линию клеток NK-92 (Conkwest).
Аллогенный CAR
В вариантах осуществления, описанных здесь, иммунная эффекторная клетка может представлять собой аллогенную иммунную эффекторную клетку, например, T-клетку или NK-клетку. Например, клетка может представлять собой аллогенную T-клетку, например, аллогенную T-клетку, не экспрессирующую функциональный T-клеточный рецептор (TCR) и/или человеческий лейкоцитарный антиген (HLA), например, HLA класса I и/или HLA класса II.
T-клетка без функционального TCR может быть, например, сконструирована таким образом, что она не экспрессирует никакой функциональный TCR на своей поверхности, сконструирована таким образом, что она не экспрессирует одну или несколько субъединиц, которые содержат функциональный TCR (например, сконструирована таким образом, что она не экспрессирует (или проявляет пониженную экспрессию) TCR-альфа, TCR-бета, TCR-гамма, TCR-дельта, TCR-эпсилон и/или TCR-дзета), или сконструирована таким образом, что она производит очень мало функционального TCR на своей поверхности. В качестве альтернативы, T-клетка может экспрессировать по существу поврежденный TCR, например, посредством экспрессии мутировавшей или усеченной формы одной или нескольких из субъединиц TCR. Термин "по существу поврежденный TCR" означает, что данный TCR не вызывает неблагоприятной иммунной реакции у хозяина.
T-клетка, описанная здесь может быть, например, сконструирована таким образом, что она не экспрессирует функциональный HLA на своей поверхности. Например, T-клетка, описанная здесь, может быть сконструирована таким образом, что экспрессия на клеточной поверхности HLA, например, HLA класса 1 и/или HLA класса II, подверглась понижающей регуляции. В некоторых вариантах осуществления понижающая регуляция HLA может быть выполнена посредством уменьшения или устранения экспрессии бета-2-микроглобулина (B2M).
В некоторых вариантах осуществления в T-клетке могут отсутствовать функциональный TCR и функциональный HLA, например, HLA класса I и/или HLA класса II.
Модифицированные T-клетки, у которых отсутствует экспрессия функциональных TCR и/или HLA, могут быть получены с помощью любых подходящих средств, включая нокаут или нокдаун одной или нескольких субъединиц TCR или HLA. Например, T-клетка может иметь нокдаун TCR и/или HLA благодаря использованию миРНК, кшРНК, коротких палиндромных повторов, регулярно расположенных группами (CRISPR), эффекторной нуклеазы, подобной активаторам транскрипции (TALEN), или эндонуклеазы с цинковым пальцем (ZFN).
В некоторых вариантах осуществления аллогенная клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низком уровне ингибирующую молекулу, например, с помощью любого способа, описанного здесь. Например, клетка может представлять собой клетку, которая не экспрессируют или экспрессирует на низком уровне ингибирующую молекулу, например, которая может уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR (например, TGFR-бета). Ингибирование ингибирующей молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка, может оптимизировать активность экспрессирующей CAR клетки. В вариантах осуществления можно использовать ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу с цинковым пальцем (ZFN), например, как описано здесь.
миРНК и кшРНК для ингибирования TCR или HLA
В некоторых вариантах осуществления экспрессия TCR и/или экспрессия HLA могут быть ингибированы с использованием миРНК или кшРНК, которые воздействуют на нуклеиновую кислоту, кодирующую TCR и/или HLA, и/или ингибирующую молекулу, описанную здесь (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR-бета), в клетке, например, T-клетке.
Системы экспрессии для миРНК и кшРНК и типичные кшРНК описаны, например, в абзацах 649 и 650 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена посредством ссылки во всей полноте.
CRISPR для ингибирования TCR или HLA
"CRISPR", или "CRISPR для TCR и/или HLA", или "CRISPR для ингибирования TCR и/или HLA", как используется здесь, относится к набору коротких палиндромных повторов, регулярно расположенных группами, или к системе, содержащей такой набор повторов. "Cas", как используется здесь, относится к CRISPR-ассоциированному белку. Система "CRISPR/Cas" относится к системе, происходящей от CRISPR и Cas, которую можно использовать для сайленсинга или мутации гена TCR и/или HLA и/или ингибирующей молекулы, описанной здесь (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета), в клетке, например, T-клетке.
Система CRISPR/Cas и ее применения описаны, например, в абзацах 651-658 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена посредством ссылки во всей полноте.
TALEN для ингибирования TCR и/или HLA
"TALEN", или "TALEN для HLA и/или TCR", или "TALEN для ингибирования HLA и/или TCR" относится к эффекторной нуклеазе, подобной активаторам транскрипции, искусственной нуклеазе, которую можно использовать для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описанной здесь (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета), в клетке, например, T-клетке.
TALEN и их применения описаны, например, в абзацах 659-665 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена посредством ссылки во всей полноте.
Нуклеаза с цинковым пальцем для ингибирования HLA и/или TCR
"ZFN", или "нуклеаза с цинковым пальцем", или "ZFN для HLA и/или TCR", или "ZFN для ингибирования HLA и/или TCR" относится к нуклеазе с цинковым пальцем, искусственной нуклеазе, которую можно использовать для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описанной здесь (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR-бета), в клетке, например, T-клетке.
ZFN и их применения описаны, например, в абзацах 666-671 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена посредством ссылки во всей полноте.
Экспрессия теломеразы
Теломеры играют решающую роль в жизнестойкости соматической клетки, и их длина поддерживается теломеразой (TERT). Длина теломер в клетках ХЛЛ может быть очень маленькой (Roth et al., "Significantly shorter telomeres in T-cells of patients with ZAP-70+/CD38 chronic lymphocytic leukaemia" British Journal of Haematology, 143, 383-386., 28 августа 2008 года), и может быть еще меньше в производимых экспрессирующих CAR клетках, например, клетках CART19, что ограничивает их потенциал в отношении размножения после адоптивного переноса пациенту. Экспрессия теломераз может спасать экспрессирующие CAR клетки от репликативного истощения.
Без ограничения какой-либо конкретной теорией, в некоторых вариантах осуществления терапевтическая T-клетка имеет короткую жизнестойкость в пациенте из-за укороченных теломер в данной T-клетке; соответственно, трансфекция гена теломеразы может удлинять теломеры T-клетки и улучшать жизнестойкость T-клетки в пациенте. Смотри Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117:1466-1476 (2007). Таким образом, в варианте осуществления иммунная эффекторная клетка, например, T-клетка, эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее раскрытие предлагает способ получения экспрессирующей CAR клетки, содержащий приведение клетки в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетка может быть приведена в контакт с нуклеиновой кислотой до, одновременно или после контакта с конструктом, кодирующим CAR.
Экспрессия теломераз может быть стабильной (например, нуклеиновая кислота может интегрироваться в геном клетки) или временной (например, нуклеиновая кислота не интегрируется, и экспрессия снижается через некоторое время, например, через несколько дней). Стабильная экспрессия может быть достигнута с помощью трансфицирования или трансдуцирования клетки ДНК, кодирующей субъединицу теломеразы, и селектируемым маркером и селекции стабильных интегрантов. В качестве альтернативы или в комбинация, стабильная экспрессия может быть достигнута с помощью сайт-специфической рекомбинации, например, с использованием системы Cre/Lox или FLP/FRT.
Временная экспрессия может включать в себя трансфекцию или трансдукцию нуклеиновой кислотой, например, ДНК или РНК, такой как мРНК. В некоторых вариантах осуществления временная трансфекция мРНК позволяет избежать генетической нестабильности, иногда связанной со стабильной трансфекцией TERT. Временная экспрессия активности экзогенной теломеразы описана, например, в международной заявке WO2014/130909, которая включена в настоящий документ посредством ссылки во всей полноте. В вариантах осуществления трансфекцию субъединицы теломеразы на основе мРНК осуществляют в соответствии с платформой информационной РНК Therapeutics™, выведенной на рынок Moderna Therapeutics. Например, способ может представлять собой способ, описанный в патентах США № 8710200, 8822663, 8680069, 8754062, 8664194 или 8680069.
В варианте осуществления hTERT имеет аминокислотную последовательность в соответствии с GenBank Protein ID AAC51724.1 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
MPRAPRCRAVRSLLRSHYREVLPLATFVRRLGPQGWRLVQRGDP
AAFRALVAQCLVCVPWDARPPPAAPSFRQVSCLKELVARVLQRLCERGAKNVLAFGFA
LLDGARGGPPEAFTTSVRSYLPNTVTDALRGSGAWGLLLRRVGDDVLVHLLARCALFV
LVAPSCAYQVCGPPLYQLGAATQARPPPHASGPRRRLGCERAWNHSVREAGVPLGLPA
PGARRRGGSASRSLPLPKRPRRGAAPEPERTPVGQGSWAHPGRTRGPSDRGFCVVSPA
RPAEEATSLEGALSGTRHSHPSVGRQHHAGPPSTSRPPRPWDTPCPPVYAETKHFLYS
SGDKEQLRPSFLLSSLRPSLTGARRLVETIFLGSRPWMPGTPRRLPRLPQRYWQMRPL
FLELLGNHAQCPYGVLLKTHCPLRAAVTPAAGVCAREKPQGSVAAPEEEDTDPRRLVQ
LLRQHSSPWQVYGFVRACLRRLVPPGLWGSRHNERRFLRNTKKFISLGKHAKLSLQEL
TWKMSVRGCAWLRRSPGVGCVPAAEHRLREEILAKFLHWLMSVYVVELLRSFFYVTET
TFQKNRLFFYRKSVWSKLQSIGIRQHLKRVQLRELSEAEVRQHREARPALLTSRLRFI
PKPDGLRPIVNMDYVVGARTFRREKRAERLTSRVKALFSVLNYERARRPGLLGASVLG
LDDIHRAWRTFVLRVRAQDPPPELYFVKVDVTGAYDTIPQDRLTEVIASIIKPQNTYC
VRRYAVVQKAAHGHVRKAFKSHVSTLTDLQPYMRQFVAHLQETSPLRDAVVIEQSSSL
NEASSGLFDVFLRFMCHHAVRIRGKSYVQCQGIPQGSILSTLLCSLCYGDMENKLFAG
IRRDGLLLRLVDDFLLVTPHLTHAKTFLRTLVRGVPEYGCVVNLRKTVVNFPVEDEAL
GGTAFVQMPAHGLFPWCGLLLDTRTLEVQSDYSSYARTSIRASLTFNRGFKAGRNMRR
KLFGVLRLKCHSLFLDLQVNSLQTVCTNIYKILLLQAYRFHACVLQLPFHQQVWKNPT
FFLRVISDTASLCYSILKAKNAGMSLGAKGAAGPLPSEAVQWLCHQAFLLKLTRHRVT
YVPLLGSLRTAQTQLSRKLPGTTLTALEAAANPALPSDFKTILD
(SEQ ID NO: 108)
В варианте осуществления hTERT имеет последовательность по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности в соответствии с SEQ ID NO: 108. В варианте осуществления hTERT имеет последовательность в соответствии с SEQ ID NO: 108. В варианте осуществления hTERT содержит делецию (например, не более чем 5, 10, 15, 20 или 30 аминокислот) с N-конца, C-конца или с обоих концов. В варианте осуществления hTERT содержит трансгенную аминокислотную последовательность (например, не более чем 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце или на обоих концах.
В варианте осуществления hTERT кодируется последовательностью нуклеиновой кислоты в соответствии с № доступа AF018167 в GenBank (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
1 caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc
61 cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc
121 tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg
181 gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg
241 cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg
301 cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg
361 cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct
421 acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc
481 gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg
541 tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca
601 ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg
661 cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga
721 ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg
781 ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga
841 cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag
901 ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc
961 agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc
1021 ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc
1081 ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg
1141 agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc
1201 tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc
1261 agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag
1321 cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg
1381 acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt
1441 acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc
1501 acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca
1561 agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca
1621 ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg
1681 ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt
1741 atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga
1801 gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt
1861 cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc
1921 gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag
1981 ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt
2041 tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg
2101 gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc
2161 cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc
2221 aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc
2281 gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc
2341 acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg
2401 agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca
2461 gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg
2521 gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct
2581 gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc
2641 tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa
2701 ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga
2761 agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga
2821 tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg
2881 tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc
2941 gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt
3001 gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct
3061 acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc
3121 atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc
3181 tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg
3241 ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc
3301 tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc
3361 agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg
3421 cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg
3481 agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc
3541 ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct
3601 gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc
3661 tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc
3721 agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc
3781 cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc
3841 caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt
3901 gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg
3961 ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa
4021 aaaaaaa
(SEQ ID NO: 23)
В варианте осуществления hTERT кодируется нуклеиновой кислотой, имеющей последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности в соответствии с SEQ ID NO: 23. В варианте осуществления hTERT кодируется нуклеиновой кислотой в соответствии с SEQ ID NO: 23.
Химерный антигенный рецептор (CAR)
Настоящее изобретение предлагает иммунные эффекторные клетки (например, T-клетки, NK-клетки), которые сконструированы так, чтобы они содержали один или несколько CAR, которые направляют иммунные эффекторные клетки на рак. Это достигается посредством антигенсвязывающего домена на CAR, который имеет специфичность к ассоциированному с раком антигену. Существует два класса ассоциированных с раком антигенов (опухолевых антигенов), на которые могут воздействовать CAR, описанные здесь: (1) ассоциированные с раком антигены, которые экспрессируются на поверхности раковых клеток; и (2) ассоциированные с раком антигены, которые сами являются внутриклеточными, однако фрагмент такого антигена (пептид) презентируется на поверхности раковых клеток с помощью ГКГС (главного комплекса гистосовместимости).
Соответственно, иммунная эффекторная клетка, например, полученная с помощью способа, описанного здесь, может быть сконструирована так, чтобы она содержала CAR, который воздействует на один из следующих ассоциированных с раком антигенов (опухолевых антигенов): CD19, CD123, CD22, CD30, CD171, CS-1, CLL-1, CD33, EGFRvIII, GD2, GD3, BCMA, Tn Ag, PSMA, ROR1, FLT3, FAP, TAG72, CD38, CD44v6, CEA, EPCAM, B7H3, KIT, IL-13Ra2, мезотелин, IL-11Ra, PSCA, VEGFR2, Льюис Y, CD24, PDGFR-бета, PRSS21, SSEA-4, CD20, фолатный рецептор-альфа, ERBB2 (Her2/neu), MUC1, EGFR, NCAM, простазу, PAP, ELF2M, эфрин B2, рецептор IGF-I, CAIX, LMP2, gp100, bcr-abl, тирозиназу, EphA2, фукозил GM1, sLe, GM3, TGS5, HMWMAA, O-ацетил-GD2, фолатный рецептор-бета, TEM1/CD248, TEM7R, CLDN6, TSHR, GPRC5D, CXORF61, CD97, CD179a, ALK, полисиаловую кислоту, PLAC1, GloboH, NY-BR-1, UPK2, HAVCR1, ADRB3, PANX3, GPR20, LY6K, OR51E2, TARP, WT1, NY-ESO-1, LAGE-1a, легумаин, HPV E6,E7, MAGE-A1, MAGE A1, ETV6-AML, спермальный белок 17, XAGE1, Tie 2, MAD-CT-1, MAD-CT-2, связанный с fos антиген-1, p53, мутантный p53, простеин, сурвивин и теломеразу, PCTA-1/галектин-8, MelanA/MART1, мутантный Ras, hTERT, точки разрыва характерных для саркомы транслокаций, ML-IAP, ERG (ген слияния TMPRSS2 ETS), NA17, PAX3, андрогеновый рецептор, циклин B1, MYCN, RhoC, TRP-2, CYP1B1, BORIS, SART3, PAX5, OY-TES1, LCK, AKAP-4, SSX2, RAGE-1, теломеразную обратную транскриптазу человека, RU1, RU2, кишечную карбоксилэстеразу и mut hsp70-2.
Биспецифические CAR
В варианте осуществления мультиспецифическая молекула антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело имеет специфичность к не более чем двум антигенам. Биспецифическая молекула антитела характеризуется первой последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания к первому эпитопу, и второй последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания ко второму эпитопу. В варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, на одном и том же белке (или субъединице мультимерного белка). В варианте осуществления первый и второй эпитопы перекрываются. В варианте осуществления первый и второй эпитопы не перекрываются. В варианте осуществления первый и второй эпитопы находятся на различных антигенах, например, на различных белках (или различных субъединицах мультимерного белка). В варианте осуществления биспецифическая молекула антитела содержит последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые имеют специфичность связывания к первому эпитопу, и последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые имеют специфичность связывания ко второму эпитопу. В варианте осуществления биспецифическая молекула антитела содержит полуантитело, имеющее специфичность связывания к первому эпитопу, и полуантитело, имеющее специфичность связывания ко второму эпитопу. В варианте осуществления биспецифическая молекула антитела содержит полуантитело или его фрагмент, имеющие специфичность связывания к первому эпитопу, и полуантитело или его фрагмент, имеющие специфичность связывания ко второму эпитопу. В варианте осуществления биспецифическая молекула антитела содержит scFv или его фрагмент, имеющий специфичность связывания к первому эпитопу, и scFv или его фрагмент, имеющий специфичность связывания ко второму эпитопу.
В некоторых вариантах осуществления молекула антитела представляет собой мультиспецифическую (например, биспецифическую или триспецифическую) молекулу антитела. Протоколы генерирования биспецифических или гетеродимерных молекул антител и различные конфигурации для биспецифических молекул антител описаны, например, в абзацах 455-458 WO2015/142675, поданной 13 марта 2015 года, которая включена посредством ссылки во всей полноте.
В одном аспекте биспецифическая молекула антитела характеризуется первой последовательностью иммуноглобулинового вариабельного домена, например, scFv, которая имеет специфичность связывания к CD19, например, содержит scFv, как описано здесь, или содержит CDR легкой цепи и/или CDR тяжелой цепи из scFv, описанного здесь, и второй последовательностью иммуноглобулинового вариабельного домена, которая имеет специфичность связывания ко второму эпитопу на другом антигене.
ХимерныйTCR
В одном аспекте антитела и фрагменты антител настоящего изобретения (например, антитела и фрагменты к CD19) могут быть привиты на один или несколько константных доменов цепи T-клеточного рецептора ("TCR"), например, цепи TCR-альфа или TCR-бета, для создания химерного TCR. Не связывая себя теорией, авторы полагают, что химерные TCR будут передавать сигнал через комплекс TCR при связывании антигена. Например, scFv, как раскрыто здесь, может быть привит на константный домен, например, по меньшей мере на часть внеклеточного константного домена, трансмембранного домена и цитоплазматического домена, цепи TCR, например, цепи TCR-альфа и/или цепи TCR-бета. В качестве другого примера, фрагмент антитела, например, домен VL, как описано здесь, может быть привит на константный домен цепи TCR-альфа, и фрагмент антитела, например, домен VH, как описано здесь, может быть привит на константный домен цепи TCR-бета (или альтернативно, домен VL может быть привит на константный домен цепи TCR-бета, а домен VH может быть привит на цепь TCR-альфа). В качестве другого примера, CDR антитела или фрагмента антитела могут быть привиты на цепь TCR-альфа и/или бета для создания химерного TCR. Например, LCDR, раскрытые здесь, могут быть привиты на вариабельный домен цепи TCR-альфа, а HCDR, раскрытые здесь, могут быть привиты на вариабельный домен цепи TCR-бета, или наоборот. Такие химерные TCR могут быть получены, например, с помощью способов, известных в данной области техники (например, Willemsen RA et al, Gene Therapy 2000; 7: 1369-1377; Zhang T et al, Cancer Gene Ther 2004; 11: 487-496; Aggen et al, Gene Ther. 2012 Apr;19(4):365-74).
Не являющиеся антителамикаркасы
В вариантах осуществления антигенсвязывающий домен содержит не являющийся антителом каркас, например, фибронектин, анкирин, доменное антитело, липокалин, иммунофармацевтическое средство на основе модульного белка малого размера, макситело, белок A или аффилин. Не являющийся антителом каркас обладает способностью связываться с целевым антигеном на клетке. В вариантах осуществления антигенсвязывающий домен представляет собой полипептид природного белка, экспрессируемого на клетке, или его фрагмент. В некоторых вариантах осуществления антигенсвязывающий домен содержит не являющийся антителом каркас. Можно использовать широкое множество не являющихся антителами каркасов при условии, что получаемый полипептид включает в себя по меньшей мере одну область связывания, которая специфически связывается с целевым антигеном на клетке-мишени.
Не являющиеся антителами каркасы включают: фибронектин (Novartis, MA), анкирин (Molecular Partners AG, Цюрих, Швейцария), доменные антитела (Domantis, Ltd., Cambridge, MA, и Ablynx nv, Zwijnaarde, Бельгия), липокалин (Pieris Proteolab AG, Freising, Германия), иммунофармацевтические средства на основе модульного белка малого размера (Trubion Pharmaceuticals Inc., Seattle, WA), макситела (Avidia, Inc., Mountain View, CA), белок A (Affibody AG, Швеция) и аффилин (гамма-кристаллин или убиквитин) (Scil Proteins GmbH, Halle, Германия).
В варианте осуществления антигенсвязывающий домен содержит внеклеточный домен, или его связывающий противолиганд фрагмент, молекулы, которая связывает противолиганд на поверхности клетки-мишени.
Иммунные эффекторные клетки могут содержать рекомбинантный конструкт ДНК, содержащий последовательности, кодирующие CAR, причем CAR содержит антигенсвязывающий домен (например, антитело или фрагмент антитела, TCR или фрагмент TCR), который специфически связывается с опухолевым антигеном, например, опухолевым антигеном, описанным здесь, и внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен может содержать костимулирующий сигнальный домен и/или первичный сигнальный домен, например, дзета-цепь. Как описано в другом месте, способы, описанные здесь, могут включать в себя трансдуцирование клеток, например, из популяции истощенных по T-регуляторам клеток, нуклеиновой кислотой, кодирующей CAR, например, CAR, описанный здесь.
В конкретных аспектах CAR содержит домен scFv, причем перед scFv может находиться необязательная лидерная последовательность, такая как приведенная в SEQ ID NO: 1, а после него может следовать необязательная шарнирная последовательность, такая как приведенная в SEQ ID NO:2, или SEQ ID NO:36, или SEQ ID NO:38, трансмембранная область, такая как приведенная в SEQ ID NO:6, внутриклеточный сигнальный домен, который включает в себя SEQ ID NO:7 или SEQ ID NO:16, и последовательность CD3-дзета, которая включает в себя SEQ ID NO:9 или SEQ ID NO:10, причем, например, домены соприкасаются и находятся в одной и той же рамке считывания, образуя один белок слияния.
В одном аспекте типичные конструкты CAR содержат необязательную лидерную последовательность (например, лидерную последовательность, описанную здесь), внеклеточный антигенсвязывающий домен (например, антигенсвязывающий домен, описанный здесь), шарнир (например, шарнирную область, описанную здесь), трансмембранный домен (например, трансмембранный домен, описанный здесь) и внутриклеточный стимулирующий домен (например, внутриклеточный стимулирующий домен, описанный здесь). В одном аспекте типичный конструкт CAR содержит необязательную лидерную последовательность (например, лидерную последовательность, описанную здесь), внеклеточный антигенсвязывающий домен (например, антигенсвязывающий домен, описанный здесь), шарнир (например, шарнирную область, описанную здесь), трансмембранный домен (например, трансмембранный домен, описанный здесь), внутриклеточный костимулирующий сигнальный домен (например, костимулирующий сигнальный домен, описанный здесь) и/или внутриклеточный первичный сигнальный домен (например, первичный сигнальный домен, описанный здесь).
Типичная лидерная последовательность приведена как SEQ ID NO: 1. Типичная последовательность шарнира/спейсера приведена как SEQ ID NO: 2, или SEQ ID NO:36, или SEQ ID NO:38. Типичная последовательность трансмембранного домена приведена как SEQ ID NO:6. Типичная последовательность внутриклеточного сигнального домена белка 4-1BB приведена как SEQ ID NO: 7. Типичная последовательность внутриклеточного сигнального домена из CD27 приведена как SEQ ID NO:16. Типичная последовательность домена из CD3-дзета приведена как SEQ ID NO: 9 или SEQ ID NO:10.
В одном аспекте иммунная эффекторная клетка содержит рекомбинантный нуклеиновокислотный конструкт, содержащий молекулу нуклеиновой кислоты, кодирующую CAR, причем данная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен, причем данная последовательность соприкасается и находится в одной рамке считывания с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен. Типичный внутриклеточный сигнальный домен, который можно использовать в CAR, включает, но без ограничения, один или несколько внутриклеточных сигнальных доменов из, например, CD3-дзета, CD28, CD27, 4-1BB и тому подобных. В некоторых случаях CAR может содержать любую комбинацию из CD3-дзета, CD28, 4-1BB и тому подобных.
Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы, могут быть получены с использованием рекомбинантных способов, известных в данной области техники, в том числе, например, с помощью скрининга библиотек из клеток, экспрессирующих данную молекулу нуклеиновой кислоты, с помощью получения данной молекулы нуклеиновой кислоты из вектора, о котором известно, что он включает ее в себя, или с помощью выделения непосредственно из содержащих ее клеток и тканей с использованием стандартных методов. В качестве альтернативы, представляющая интерес нуклеиновая кислота может быть произведена синтетически, а не клонирована.
Нуклеиновые кислоты, кодирующие CAR, могут быть введены в иммунные эффекторные клетки с использованием, например, ретровирусного или лентивирусного векторного конструкта.
Нуклеиновые кислоты, кодирующие CAR также могут быть введены в иммунную эффекторную клетку с использованием, например, РНК-конструкта, который может быть непосредственно трансфицирован в клетку. Способ генерирования мРНК для использования в трансфекции включает в себя in vitro транскрипцию (IVT) матрицы со специально сконструированными праймерами, после чего следует присоединение поли-A для получения конструкта, содержащего 3ʹ- и 5ʹ-нетранслируемую последовательность ("НТО") (например, 3ʹ- и/или 5ʹ-НТО, описанную здесь), 5ʹ-кэп (например, 5ʹ-кэп, описанный здесь) и/или участок внутренней посадки рибосомы (IRES) (например, IRES, описанный здесь), подлежащую экспрессии нуклеиновую кислоту и поли-A хвост, обычно длиной 50-2000 оснований (например, описанный в примерах, например, SEQ ID NO:35). Получаемая таким образом РНК может эффективно трансфицировать различные типы клеток. В одном варианте осуществления матрица включает в себя последовательности для CAR. В варианте осуществления вектор с РНК CAR трансдуцируют в клетку, например, T-клетку, посредством электропорации.
Антигенсвязывающий домен
В одном аспекте множество иммунных эффекторных клеток, например, популяция истощенных по T-регуляторам клеток, содержат нуклеиновую кислоту, кодирующую CAR, который содержит мишень-специфический связывающий элемент, иначе называемый антигенсвязывающим доменом. Выбор связывающего элемента зависит от типа и количества лигандов, которые определяют поверхность клетки-мишени. Например, антигенсвязывающий домен может быть выбран для распознавания антигена, который действует как маркер клеточной поверхности на клетках-мишенях, ассоциированный с конкретным болезненным состоянием. Таким образом, примеры маркеров клеточной поверхности, которые могут выступать в роли лигандов для антигенсвязывающего домена в CAR, описанном здесь, включают ассоциированные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и раковыми клетками.
В одном аспекте часть CAR, содержащая антигенсвязывающий домен, содержит антигенсвязывающий домен, который воздействует на опухолевый антиген, например, опухолевый антиген, описанный здесь.
Антигенсвязывающий домен может представлять собой домен, который связывается с антигеном, включая, но без ограничения, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело и их функциональный фрагмент, включая, но без ограничения, однодоменное антитело, такое как вариабельный домен (VH) тяжелой цепи, вариабельный домен (VL) легкой цепи и вариабельный домен (VHH) нанотела верблюжьего происхождения, и альтернативный каркас, о котором известно в данной области техники, что он функционирует в качестве антигенсвязывающего домена, такой как рекомбинантный фибронектиновый домен, T-клеточный рецептор (TCR) или его фрагмент, например, одноцепочечный TCR, и тому подобное. В некоторых случаях полезно, чтобы антигенсвязывающий домен происходил от того вида, в котором CAR будет в конце концов использован. Например, для использования на людях может быть полезным, чтобы антигенсвязывающий домен CAR содержал человеческие или гуманизированные остатки для антигенсвязывающего домена антитела или фрагмента антитела.
В варианте осуществления антигенсвязывающий домен содержит анти-CD19 антитело, или его фрагмент, например, scFv. Например, антигенсвязывающий домен содержит вариабельную тяжелую цепь и вариабельную легкую цепь, приведенные в таблице 1. Линкерная последовательность, соединяющая вариабельную тяжелую и вариабельную легкие цепи может представлять собой, например, любую из линкерных последовательностей, описанных здесь, или, альтернативно, может представлять собой GSTSGSGKPGSGEGSTKG (SEQ ID NO:104).
Таблица 1: Связывающие домены анти-CD19 антител
Таблица 2: Дополнительные связывающие домены анти-CD19 антител
В соответствии с настоящим раскрытием можно использовать любой CAR CD19, например, связывающий антиген CD19 домен любого известного CAR CD19. Например, LG-740; CAR CD19, описанный в патенте США № 8399645; патенте США № 7446190; Xu et al., Leuk Lymphoma. 2013 54(2):255-260(2012); Cruz et al., Blood 122(17):2965-2973 (2013); Brentjens et al., Blood, 118(18):4817-4828 (2011); Kochenderfer et al., Blood 116(20):4099-102 (2010); Kochenderfer et al., Blood 122 (25):4129-39(2013); и 16th Annu Meet Am Soc Gen Cell Ther (ASGCT) (May 15-18, Salt Lake City) 2013, Abst 10.
Типичные целевые антигены, на которые можно воздействовать с использованием экспрессирующих CAR клеток, включают, помимо прочего, но без ограничения, CD19, CD123, EGFRvIII, мезотелин, как описано, например, в WO 2014/130635, WO 2014/130657 и WO 2015/090230, которые включены в настоящий документ посредством ссылки во всей полноте.
В одном варианте осуществления CAR T-клетка, которая специфически связывается с CD19, имеет обозначение по USAN TISAGENLECLEUCEL-T. CTL019 получают с помощью генной модификации T-клеток, опосредуемой стабильной вставкой посредством трансдукции с помощью самоинактивирующегося дефицитного по репликации лентивирусного (LV) вектора, содержащего трансген CTL019, под контролем промотора EF-1-альфа. CTL019 может представлять собой смесь трансген-положительных и отрицательных T-клеток, которые доставляют субъекту исходя из процентного содержания трансген-положительных T-клеток.
В других вариантах осуществления экспрессирующие CAR клетки могут специфически связываться с человеческим CD19, например, могут включать в себя молекулу CAR или антигенсвязывающий домен (например, гуманизированный антигенсвязывающий домен) в соответствии с таблицей 3 из WO2014/153270, включенной в настоящий документ посредством ссылки.
В других вариантах осуществления экспрессирующие CAR клетки могут специфически связываться с CD123, например, могут включать в себя молекулу CAR (например, любую из CAR1-CAR8) или антигенсвязывающий домен в соответствии с таблицами 1-2 из WO 2014/130635, включенной в настоящий документ посредством ссылки.
В других вариантах осуществления экспрессирующие CAR клетки могут специфически связываться с EGFRvIII, например, могут включать в себя молекулу CAR или антигенсвязывающий домен в соответствии с таблицей 2 или SEQ ID NO:11 из WO 2014/130657, включенной в настоящий документ посредством ссылки.
В других вариантах осуществления экспрессирующие CAR клетки могут специфически связываться с мезотелином, например, могут включать в себя молекулу CAR или антигенсвязывающий домен в соответствии с таблицами 2-3 из WO 2015/090230, включенной в настоящий документ посредством ссылки.
В одном варианте осуществления антигенсвязывающий домен содержит одну, две, три (например, все три) CDR тяжелой цепи, HC CDR1, HC CDR2 и HC CDR3, из антитела, приведенного выше, и/или одну, две, три (например, все три) CDR легкой цепи, LC CDR1, LC CDR2 и LC CDR3, из антитела, приведенного выше. В одном варианте осуществления антигенсвязывающий домен содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи антитела, приведенного или описанного выше.
В некоторых вариантах осуществления опухолевый антиген представляет собой опухолевый антиген, описанный в международной заявке WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте. В некоторых вариантах осуществления опухолевый антиген выбирают из одного или нескольких из: CD19; CD123; CD22; CD30; CD171; CS-1 (также обозначаемого как подгруппа-1 CD2, CRACC, SLAMF7, CD319 и 19A24); лектиноподобной молекулы-1 C-типа (CLL-1 или CLECL1); CD33; рецептора эпидермального фактора роста, вариант III (EGFRvIII); ганглиозида G2 (GD2); ганглиозида GD3 (aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer); члена семейства рецепторов TNF B-клеточного антигена созревания (BCMA); Tn-антигена ((Tn Ag) или (GalNAcα-Ser/Thr)); простатоспецифического мембранного антигена (PSMA); подобного рецепторной тирозинкиназе орфанного рецептора-1 (ROR1); Fms-подобной тирозинкиназы-3 (FLT3); опухоль-ассоциированного гликопротеина-72 (TAG72); CD38; CD44v6; карциноэмбрионального антигена (CEA); молекулы адгезии эпителиальных клеток (EPCAM); B7H3 (CD276); KIT (CD117); субъединицы альфа-2 рецептора интерлейкина-13 (IL-13Ra2 или CD213A2); мезотелина; рецептора-альфа интерлейкина-11 (IL-11Ra); антигена стволовых клеток предстательной железы (PSCA); протеазы, серин 21 (Testisin или PRSS21); рецептора-2 фактора роста эндотелия сосудов (VEGFR2); антигена Льюис(Y); CD24; рецептора-бета фактора роста тромбоцитов (PDGFR-бета); стадиеспецифического эмбрионального антигена-4 (SSEA-4); CD20; фолатного рецептора-альфа; рецепторной тирозинпротеинкиназы ERBB2 (Her2/neu); муцина-1, связанного с клеточной поверхностью (MUC1); рецептора эпидермального фактора роста (EGFR); молекулы адгезии нервных клеток (NCAM); простазы; простатической кислой фосфатазы (PAP); мутировавшего фактора элонгации-2 (ELF2M); эфрина B2; белка активации фибробластов-альфа (FAP); рецептора инсулин-подобного фактора роста-1 (рецептора IGF-I), карбоангидразы IX (CAIX); субъединицы протеасомы (просомы, макропейна), бета-типа, 9 (LMP2); гликопротеина-100 (gp100); онкогенного белка слияния, состоящего из области кластеризации точек разрыва (BCR) и гомолога-1 вирусного онкогена мышиного лейкоза Абельсона (Abl) (bcr-abl); тирозиназы; рецептора-2 эфрина типа A (EphA2); фукозила GM1; молекулы адгезии сиалила Льюис (sLe); ганглиозида GM3 (aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer); трансглутаминазы-5 (TGS5); высокомолекулярного опухоль-ассоциированного антигена меланомы (HMWMAA); ганглиозида O-ацетил-GD2 (OAcGD2); фолатного рецептора-бета; опухолевого эндотелиального маркера-1 (TEM1/CD248); родственного опухолевому эндотелиальному маркеру-7 белка (TEM7R); клаудина-6 (CLDN6); рецептора тиреостимулирующего гормона (TSHR); члена D класса C группы 5 связанных с G-белком рецепторов (GPRC5D); белка-61 открытой рамки считывания хромосомы X (CXORF61); CD97; CD179a; киназы анапластической лимфомы (ALK); полисиаловой кислоты; плацента-специфического белка-1 (PLAC1); гексасахаридной части гликоцерамида globoH (GloboH); антигена дифференцировки молочной железы (NY-BR-1); уроплакина-2 (UPK2); клеточного рецептора-1 вируса гепатита A (HAVCR1); адренорецептора-бета 3 (ADRB3); паннексина-3 (PANX3); связанного с G-белком рецептора-20 (GPR20); комплекса лимфоцитарного антигена-6, локус K 9 (LY6K); ольфакторного рецептора 51E2 (OR51E2); белка альтернативной рамки считывания TCR-гамма (TARP); белка опухоли Вильмса (WT1); раково-тестикулярного антигена-1 (NY-ESO-1); раково-тестикулярного антигена-2 (LAGE-1a); меланома-ассоциированного антигена-1 (MAGE-A1); транслокационно-вариантного гена ETS 6, расположенного на хромосоме 12p (ETV6-AML); спермального белка-17 (SPA17); члена 1A семейства антигенов X (XAGE1); ангиопоэтин-связывающего рецептора-2 клеточной поверхности (Tie 2); меланомного раково-тестикулярного антигена-1 (MAD-CT-1); меланомного раково-тестикулярного антигена-2 (MAD-CT-2); связанного с fos антигена-1; опухолевого белка p53 (p53); мутантного p53; простеина; сурвивина; теломеразы; опухолевого антигена-1 карциномы предстательной железы (PCTA-1 или галектин-8), меланомного антигена-1, распознаваемого T-клетками (MelanA или MART1); мутанта саркомы крыс (Ras); теломеразной обратной транскриптазы человека (hTERT); точек разрыва характерных для саркомы транслокаций; меланомного ингибитора апоптоза (ML-IAP); ERG (ген слияния трансмембранной протеазы, серин 2 (TMPRSS2) ETS); N-ацетилглюкозаминилтрансферазы V (NA17); белка с парным боксом Pax-3 (PAX3); андрогенового рецептора; циклина B1; получаемого из нейробластомы гомолога вирусного онкогена миелоцитоматоза птиц v-myc (MYCN); члена C семейства гомологов Ras (RhoC); относящегося к тирозиназе белка-2 (TRP-2); цитохрома P450 1B1 (CYP1B1); подобного белкам цинковых пальцев CCCTC-связывающего фактора (BORIS или Brother of the Regulator of Imprinted Sites), антигена плоскоклеточной карциномы, распознаваемого T-клетками 3 (SART3); белка с парным боксом Pax-5 (PAX5); проакрозин-связывающего белка sp32 (OY-TES1); лимфоцит-специфической протеинтирозинкиназы (LCK); заякоревающего киназу белка-4 (AKAP-4); точки разрыва X при синовиальной саркоме 2 (SSX2); рецептора для конечных продуктов гликирования (RAGE-1); почечного убиквитарного белка-1 (RU1); почечного убиквитарного белка-2 (RU2); легумаина; вируса E6 папилломы человека (HPV E6); вируса E7 папилломы человека (HPV E7); кишечной карбоксилэстеразы; мутировавшего белка теплового шока 70-2 (mut hsp70-2); CD79a; CD79b; CD72; лейкоцит-ассоциированного иммуноглобулин-подобного рецептора-1 (LAIR1); Fc-фрагмента рецептора IgA (FCAR или CD89); члена 2 подсемейства A лейкоцитарных иммуноглобулин-подобных рецепторов (LILRA2); члена f подобного молекуле CD300 семейства (CD300LF); члена A семейства 12 лектиновых доменов C-типа (CLEC12A); антигена-2 стромальных клеток костного мозга (BST2); содержащего EGF-подобный модуль муцин-подобного подобного рецептору гормона белка-2 (EMR2); лимфоцитарного антигена-75 (LY75); глипикана-3 (GPC3); Fc-рецептор-подобного белка-5 (FCRL5); и иммуноглобулин лямбда-подобного полипептида-1 (IGLL1).
В одном варианте осуществления антигенсвязывающий домен содержит одну, две, три (например, все три) CDR тяжелой цепи, HC CDR1, HC CDR2 и HC CDR3, из антитела, приведенного выше, и/или одну, две, три (например, все три) CDR легкой цепи, LC CDR1, LC CDR2 и LC CDR3, из антитела, приведенного выше. В одном варианте осуществления антигенсвязывающий домен содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи антитела, приведенного или описанного выше.
В одном аспекте противоопухолевый антигенсвязывающий домен представляет собой фрагмент, например, одноцепочечный вариабельный фрагмент (scFv). В одном аспекте направленный на ассоциированный с раком антиген, как описано здесь, связывающий домен представляет собой Fv, Fab, (Fab')2 или бифункциональное (например, биспецифическое) гибридное антитело (например, Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)). В одном аспекте антитела и их фрагменты настоящего изобретения связывают белок ассоциированного с раком антигена, как описано здесь, с аффинностью как у дикого типа или более высокой.
В некоторых случаях scFv могут быть получены в соответствии со способом, известным в данной области техники (смотри, например, Bird et al., (1988) Science 242:423-426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Молекулы ScFv могут быть получены посредством связывания областей VH и VL вместе с использованием гибких полипептидных линкеров. Молекулы scFv содержат линкер (например, линкер Ser-Gly) с оптимизированными длиной и/или аминокислотным составом. Длиналинкера может сильно влиять на то, как вариабельные области scFv складываются и взаимодействуют. Фактически, если используется короткий полипептидный линкер (например, 5-10 аминокислот), предотвращается внутрицепочечный фолдинг. Межцепочечный фолдинг также требует соединения двух вариабельных областей вместе для образования функционального участка связывания эпитопа. Для примеров ориентаций и размеров линкеров смотри, например, Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444-6448, публикации патентных заявок США №№ 2005/0100543, 2005/0175606, 2007/0014794, и публикации PCT №№ WO2006/020258 и WO2007/024715, которые включены в настоящий документ посредством ссылки.
scFv может содержать линкер из по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков между своими областями VL и VH. Последовательность линкера может содержать любую природную аминокислоту. В некоторых вариантах осуществления последовательность линкера содержит аминокислоты глицин и серин. В другом варианте осуществления последовательность линкера содержит набор повторов глицина и серина, такой как (Gly4Ser)n, где n представляет собой положительный целое число, равное или большее 1 (SEQ ID NO: 25). В одном варианте осуществления линкер может представлять собой (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3 (SEQ ID NO: 28). Изменения длины линкера могут сохранять или увеличивать активность, что приводит к более высокой эффективности при исследованиях активности.
В другом аспекте антигенсвязывающий домен представляет собой T-клеточный рецептор ("TCR") или его фрагмент, например, одноцепочечный TCR (scTCR). Способы получения таких TCR известны в данной области техники. Смотри, например, Willemsen RA et al, Gene Therapy 7: 1369-1377 (2000); Zhang T et al, Cancer Gene Ther 11: 487-496 (2004); Aggen et al, Gene Ther. 19(4):365-74 (2012) (ссылки включены в настоящий документ во всей полноте). Например, может быть сконструирован scTCR, который содержит гены Vα и Vβ из T-клеточного клона, связанные линкером (например, гибким пептидом). Этот подход очень полезен для ассоциированной с раком мишени, которая сама является внутриклеточной, однако фрагмент такого антигена (пептид) презентируется на поверхности раковых клеток с помощью ГКГС.
Трансмембранный домен
По отношению к трансмембранному домену в различных вариантах осуществления может быть сконструирован CAR, содержащий трансмембранный домен, который прикреплен к внеклеточному домену CAR. Трансмембранный домен может включать в себя одну или несколько дополнительных аминокислот рядом с трансмембранной областью, например, одну или несколько аминокислот, ассоциированных с внеклеточной областью белка, от которого произошел трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, вплоть до 15 аминокислот внеклеточной области), и/или одну или несколько дополнительных аминокислот, ассоциированных с внутриклеточной областью белка, от которого произошел трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, вплоть до 15 аминокислот внутриклеточной области). В одном аспекте трансмембранный домен ассоциирован с одним из других доменов CAR. В некоторых случаях, трансмембранный домен может быть выбран или модифицирован посредством аминокислотной замены для предотвращения связывания таких доменов с трансмембранными доменами того же или других белков поверхности мембраны, например, для минимизации взаимодействия с другими элементами рецепторного комплекса. В одном аспекте трансмембранный домен способен к гомодимеризации с другим CAR на клеточной поверхности экспрессирующей CAR клетки. В другом аспекте аминокислотная последовательность трансмембранного домена может быть модифицирована или заменена таким образом, чтобы минимизировать взаимодействия со связывающими доменами нативного партнера по связыванию, присутствующего в той же CART.
Трансмембранный домен может происходить или из природного, или из рекомбинантного источника. Если источник является природным, домен может происходить от любого связанного с мембраной или трансмембранного белка. В одном аспекте трансмембранный домен способен сигнализировать внутриклеточному домену(ам) о том, связан ли CAR с мишенью. Трансмембранный домен, особенно полезный в настоящем изобретении, может включать в себя по меньшей мере трансмембранную область(и) из, например, альфа, бета или дзета-цепи T-клеточного рецептора, CD28, CD27, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления трансмембранный домен может включать в себя по меньшей мере трансмембранную область(и) из, например, KIR2DS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R-бета, IL2R-гамма, IL7R-α, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKG2D, NKG2C или CD19.
В некоторых случаях трансмембранный домен может быть прикреплен к внеклеточной области CAR, например, антигенсвязывающему домену CAR, посредством шарнира, например, шарнира из человеческого белка. Например, в одном варианте осуществления шарнир может представлять собой шарнир человеческого Ig (иммуноглобулина), например, шарнир IgG4, или шарнир CD8a. В одном варианте осуществления шарнир или спейсер содержит (например, состоит из нее) аминокислотную последовательность в соответствии с SEQ ID NO: 2. В одном аспекте трансмембранный домен содержит (например, состоит из него) трансмембранный домен в соответствии с SEQ ID NO: 6.
В одном аспекте шарнир или спейсер содержит шарнир IgG4. Например, в одном варианте осуществления шарнир или спейсер содержит шарнир с аминокислотной последовательностью ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM (SEQ ID NO:36). В некоторых вариантах осуществления шарнир или спейсер содержит шарнир, кодируемый нуклеотидной последовательностью GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG (SEQ ID NO:37).
В одном аспекте шарнир или спейсер содержит шарнир IgD. Например, в одном варианте осуществления шарнир или спейсер содержит шарнир с аминокислотной последовательностью RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLKDAHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH (SEQ ID NO:38). В некоторых вариантах осуществления шарнир или спейсер содержит шарнир, кодируемый нуклеотидной последовательностью AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT (SEQ ID NO:103).
В одном аспекте трансмембранный домен может быть рекомбинантным, в случае чего он будет содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В одном аспекте на каждом конце рекомбинантного трансмембранного домена может быть обнаружен триплет из фенилаланина, триптофана и валина.
Необязательно, короткий олиго- или полипептидный линкер длиной от 2 до 10 аминокислот может образовывать связь между трансмембранным доменом и цитоплазматической областью CAR. Дублет глицин-серин обеспечивает особенно подходящий линкер. Например, в одном аспекте линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 5). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 8).
В одном аспекте шарнир или спейсер содержит шарнир KIR2DS2.
Цитоплазматический домен
Цитоплазматический домен или область CAR включает в себя внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен обычно отвечает за активацию по меньшей мере одной из нормальных эффекторных функций иммунной клетки, в которую CAR был введен.
Примеры внутриклеточных сигнальных доменов для использования в CAR, описанном здесь, включают в себя цитоплазматические последовательности T-клеточного рецептора (TCR) и корецепторов, которые совместно действуют для инициирования трансдукции сигнала после взаимодействия антигена с рецептором, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, которая имеет такие же функциональные возможности.
Известно, что сигналов, генерируемых с помощью одного только TCR, недостаточно для полной активации T-клетки, и что также требуется вторичный и/или костимулирующий сигнал. Таким образом, можно сказать, что активация T-клетки является опосредованной двумя отдельными классами цитоплазматических сигнальных последовательностей: теми, которые инициируют антиген-зависимую первичную активацию посредством TCR (первичные внутриклеточные сигнальные домены), и теми, которые действуют антиген-независимым образом для обеспечения вторичного или костимулирующего сигнала (вторичный цитоплазматический домен, например, костимулирующий домен).
Первичный сигнальный домен регулирует первичную активацию комплекса TCR или стимулирующим образом, или ингибирующим образом. Первичные внутриклеточные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Примеры содержащих ITAM первичных внутриклеточных сигнальных доменов, особенно полезных в настоящем изобретении, включают домены из TCR-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI, DAP10, DAP12 и CD66d. В одном варианте осуществления CAR настоящего изобретения содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен из CD3-дзета, например, последовательность CD3-дзета, описанную здесь.
В одном варианте осуществления первичный сигнальный домен содержит модифицированный домен c ITAM, например, мутировавший домен c ITAM, который имеет измененную (например, повышенную или пониженную) активность по сравнению с нативным доменом c ITAM. В одном варианте осуществления первичный сигнальный домен содержит модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или усеченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В варианте осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотивов ITAM.
Костимулирующий сигнальный домен
Внутриклеточный сигнальный домен CAR может сам содержать сигнальный домен из CD3-дзета, или он может быть объединен с любым другим желательным внутриклеточным сигнальным доменом(ами), подходящим в контексте CAR настоящего изобретения. Например, внутриклеточный сигнальный домен CAR может содержать часть CD3-дзета-цепи и костимулирующий сигнальный домен. Костимулирующий сигнальный домен относится к части CAR, содержащей внутриклеточный домен костимулирующей молекулы. В одном варианте осуществления внутриклеточный домен сконструирован так, чтобы он содержал сигнальный домен из CD3-дзета и сигнальный домен из CD28. В одном аспекте внутриклеточный домен сконструирован так, чтобы он содержал сигнальный домен из CD3-дзета и сигнальный домен из ICOS.
Костимулирующая молекула может представлять собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая необходима для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают CD27, CD28, 4-1BB (CD137), OX40, CD30, CD40, PD-1, ICOS, лимфоцитарный функциональный антиген-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3 и лиганд, который специфически связывается с CD83, и тому подобное. Например, было продемонстрировано, что костимуляция с помощью CD27 увеличивает размножение, эффекторную функцию и выживаемость человеческих CART-клеток in vitro и увеличивает жизнестойкость и противоопухолевую активность человеческих T-клеток in vivo (Song et al. Blood 2012; 119(3):696-706). Другие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp30, NKp44, NKp46, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, NKG2D, NKG2C и PAG/Cbp.
Внутриклеточные сигнальные последовательности в цитоплазматической части CAR могут быть связаны друг с другом в случайном или определенном порядке. Необязательно, короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) может образовывать связь между внутриклеточными сигнальными последовательностями. В одном варианте осуществления в качестве подходящего линкера можно использовать дублет глицин-серин. В одном варианте осуществления в качестве подходящего линкера можно использовать одну аминокислоту, например, аланин, глицин.
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов. В варианте осуществления два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов разделены молекулой линкера, например, молекулой линкера, описанной здесь. В одном варианте осуществления внутриклеточный сигнальный домен содержит два костимулирующих сигнальных домена. В некоторых вариантах осуществления молекула линкера представляет собой остаток глицина. В некоторых вариантах осуществления линкер представляет собой остаток аланина.
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из CD28. В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из 4-1BB. В одном аспекте сигнальный домен из 4-1BB представляет собой сигнальный домен в соответствии с SEQ ID NO: 7. В одном аспекте сигнальный домен из CD3-дзета представляет собой сигнальный домен в соответствии с SEQ ID NO: 9.
В одном аспекте внутриклеточный сигнальный домен сконструирован так, что он содержит сигнальный домен из CD3-дзета и сигнальный домен из CD27. В одном аспекте сигнальный домен из CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO:16). В одном аспекте сигнальный домен из CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO:14).
В одном аспекте экспрессирующая CAR клетка, описанная здесь, может дополнительно содержать второй CAR, например, второй CAR, который включает в себя другой антигенсвязывающий домен, например, к той же самой мишени или к другой мишени (например, мишени, отличной от ассоциированного с раком антигена, описанного здесь, или к другому ассоциированному с раком антигену, описанному здесь, например, CD19, CD33, CLL-1, CD34, FLT3 или фолатному рецептору-бета). В одном варианте осуществления второй CAR включает в себя антигенсвязывающий домен к мишени, экспрессируемой на раковых клетках того же типа, что и ассоциированный с раком антиген. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который воздействует на первый антиген и включает в себя внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который воздействует на второй, отличный от него, антиген и включает в себя внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. Без ограничения теорией, помещение костимулирующего сигнального домена, например, 4-1BB, CD28, ICOS, CD27 или OX-40, на первый CAR, и первичного сигнального домена, например, CD3-дзета, на второй CAR может ограничивать активность CAR в отношении клеток, в которых экспрессируются обе мишени. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR к ассоциированному с раком антигену, который включает в себя антигенсвязывающий домен, который связывается с целевым антигеном, описанным здесь, трансмембранный домен и костимулирующий домен, и второй CAR, который воздействует на другой целевой антиген (например, антиген, экспрессируемый на раковых клетках того же типа, что и первый целевой антиген) и включает в себя антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который включает в себя антигенсвязывающий домен, который связывается с целевым антигеном, описанным здесь, трансмембранный домен и первичный сигнальный домен, и второй CAR, который воздействует на антиген, отличный от первого целевого антигена (например, антиген, экспрессируемый на раковых клетках того же типа, что и первый целевой антиген), и включает в себя антигенсвязывающий домен к антигену, трансмембранный домен и костимулирующий сигнальный домен.
В другом аспекте раскрытие включает в себя популяцию экспрессирующих CAR клеток, например, CART-клеток. В некоторых вариантах осуществления популяция экспрессирующих CAR клеток содержит смесь клеток, экспрессирующих различные CAR.
Например, в одном варианте осуществления популяция CART-клеток может включать в себя первую клетку, экспрессирующую CAR, имеющий антигенсвязывающий домен к ассоциированному с раком антигену, описанному здесь, и вторую клетку, экспрессирующую CAR, имеющий другой антигенсвязывающий домен, например, антигенсвязывающий домен к другому ассоциированному с раком антигену, описанному здесь, например, антигенсвязывающий домен к ассоциированному с раком антигену, описанному здесь, который отличается от ассоциированного с раком антигена, связываемого антигенсвязывающим доменом CAR, экспрессируемого первой клеткой.
В качестве другого примера, популяция экспрессирующих CAR клеток может включать в себя первую клетку, экспрессирующую CAR, который включает в себя антигенсвязывающий домен к ассоциированному с раком антигену, описанному здесь, и вторую клетку, экспрессирующую CAR, который включает в себя антигенсвязывающий домен к мишени, отличной от ассоциированного с раком антигена, как описано здесь. В одном варианте осуществления популяция экспрессирующих CAR клеток включает в себя, например, первую клетку, экспрессирующую CAR, который включает в себя первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, который включает в себя вторичный сигнальный домен.
В другом аспекте раскрытие включает в себя популяцию клеток, причем по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий антигенсвязывающий домен к ассоциированному с раком антигену, описанному здесь, а вторая клетка экспрессирует другое средство, например, средство, которое увеличивает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу. Ингибирующие молекулы, например, PD-1, могут в некоторых вариантах осуществления уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD-1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин и TGFR (например, TGFR-бета). В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточным сигнальным доменом, описанным здесь. В одном варианте осуществления средство содержит первый полипептид, например, полипептид ингибирующей молекулы, такой как PD-1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета или фрагмент любой из них, и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный здесь (например, содержащий костимулирующий домен (например, 41BB, CD27, OX40 или CD28, например, как описано здесь) и/или первичный сигнальный домен (например, сигнальный домен из CD3-дзета, описанный здесь)). В одном варианте осуществления средство содержит первый полипептид PD-1 или его фрагмент и второй полипептид внутриклеточного сигнального домена, описанного здесь (например, сигнального домена из CD28, описанного здесь, и/или сигнального домена из CD3-дзета, описанного здесь).
Последовательности анти-CD19 связывающих доменов приведены здесь в таблице 1. Полные конструкты CAR могут быть созданы с использованием любого из антигенсвязывающих доменов, приведенных в таблице 1, причем один или несколько дополнительных компонентов CAR приведены ниже.
- лидер (аминокислотная последовательность) (SEQ ID NO: 1)
MALPVTALLLPLALLLHAARP
- лидер (последовательность нуклеиновой кислоты) (SEQ ID NO: 12)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCC
- шарнир CD8 (аминокислотная последовательность) (SEQ ID NO: 2)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
- шарнир CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 13)
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT
- трансмембранный CD8 (аминокислотная последовательность) (SEQ ID NO: 6)
IYIWAPLAGTCGVLLLSLVITLYC
- трансмембранный (последовательность нуклеиновой кислоты) (SEQ ID NO: 17)
ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC
- внутриклеточный домен из 4-1BB (аминокислотная последовательность) (SEQ ID NO: 7)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
- внутриклеточный домен из 4-1BB (последовательность нуклеиновой кислоты) (SEQ ID NO: 18)
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
- домен из CD3-дзета (аминокислотная последовательность) (SEQ ID NO: 9)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
- CD3-дзета (последовательность нуклеиновой кислоты) (SEQ ID NO: 20)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
- домен из CD3-дзета (аминокислотная последовательность; эталонная последовательность NCBI NM_000734.3) (SEQ ID NO:10)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
- CD3-дзета (последовательность нуклеиновой кислоты; эталонная последовательность NCBI NM_000734.3); (SEQ ID NO:21)
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc
шарнир IgG4 (аминокислотная последовательность) (SEQ ID NO:36)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
шарнир IgG4 (нуклеотидная последовательность) (SEQ ID NO:37)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
промотор EF1-альфа
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACGGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGAGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGA (SEQ ID NO: 11).
Gly/Ser (SEQ ID NO:25)
GGGGS
Gly/Ser (SEQ ID NO:26): Данная последовательность может охватывать 1-6 повторяющихся единиц "Gly Gly Gly Gly Ser"
GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO:27)
GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO:28)
GGGGSGGGGS GGGGS
Gly/Ser (SEQ ID NO:29)
GGGS
поли-A (SEQ ID NO:30): A5000
поли-A (SEQ ID NO:31): A100
поли-T (SEQ ID NO:32): T5000
поли-A (SEQ ID NO:33): A5000
поли-A (SEQ ID NO:34): A400
поли-A (SEQ ID NO:35): A2000
- Gly/Ser (SEQ ID NO:15): Данная последовательность может охватывать 1-10 повторяющихся единиц "Gly Gly Gly Ser"
GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS
Типичные конструкты CAR CD19, которые можно использовать в способах, описанных здесь, приведены в таблице 3:
Таблица 3: Конструкты CAR CD19
Совместная экспрессия CAR с другими молекулами или средствами
Совместная экспрессия второго CAR
В одном аспекте экспрессирующая CAR клетка, описанная здесь, может дополнительно содержать второй CAR, например, второй CAR, который включает в себя другой антигенсвязывающий домен, например, к той же мишени (например, CD19) или к другой мишени (например, мишени, отличной от CD19, например, мишени, описанной здесь). В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который воздействует на первый антиген и включает в себя внутриклеточный сигнальный домен, имеющий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который воздействует на второй, отличающийся, антиген и включает в себя внутриклеточный сигнальный домен, имеющий первичный сигнальный домен, но не костимулирующий сигнальный домен. Помещение костимулирующего сигнального домена, например, 4-1BB, CD28, CD27, OX-40 или ICOS, на первый CAR, а первичного сигнального домена, например, CD3-дзета, на второй CAR может ограничивать активность CAR в отношении клеток, в которых экспрессируются обе мишени. В одном варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который включает в себя антигенсвязывающий домен, трансмембранный домен и костимулирующий домен, и второй CAR, который воздействует на другой антиген и включает в себя антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления экспрессирующая CAR клетка содержит первый CAR, который включает в себя антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, который воздействует на другой антиген и включает в себя антигенсвязывающий домен к антигену, трансмембранный домен и костимулирующий сигнальный домен.
В одном варианте осуществления экспрессирующая CAR клетка содержит XCAR, описанный здесь, и ингибирующий CAR. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывается с антигеном, обнаруживаемым на нормальных клетках, но не на раковых клетках, например, на нормальных клетках, которые также экспрессируют X. В одном варианте осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен из PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозина и TGFR (например, TGFR-бета).
В одном варианте осуществления, когда экспрессирующая CAR клетка содержит два или более различных CAR, антигенсвязывающие домены различных CAR могут быть такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и второй CAR, может иметь антигенсвязывающий домен первого CAR, например, в виде фрагмента, например, scFv, который не образует связь с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR представляет собой VHH.
В некоторых вариантах осуществления антигенсвязывающий домен содержит однодоменные антигенсвязывающие (SDAB) молекулы, включая молекулы, определяющие комплементарность области которых представляют собой часть однодоменного полипептида. Примеры включают, но без ограничения, вариабельные домены тяжелой цепи, связывающие молекулы, естественно лишенные легких цепей, отдельные домены, происходящие от обычных 4-цепочечных антител, сконструированные домены и однодоменные каркасы, отличные от происходящих от антител. Молекулы SDAB могут представлять собой любые из уровня техники или любые будущие однодоменные молекулы. Молекулы SDAB могут происходить из любого вида, включая, но без ограничения, мышь, человека, верблюда, ламу, миногу, рыбу, акулу, козу, кролика и быка. Данный термин также включает природные однодоменные молекулы антител из вида, отличного от верблюдовых и акул.
В одном аспекте молекула SDAB может происходить от вариабельной области иммуноглобулина, обнаруживаемого в рыбе, как например, происходящая от иммуноглобулинового изотипа, известного как новый антигенный рецептор (NAR), обнаруженного в сыворотке акулы. Способы получения однодоменных молекул, происходящих от вариабельной области NAR ("IgNAR"), описаны в WO 03/014161 и Streltsov (2005) Protein Sci. 14:2901-2909.
В соответствии с другим аспектом молекула SDAB представляет собой природную однодоменную антигенсвязывающую молекулу, известную как тяжелая цепь, лишенная легких цепей. Такие однодоменные молекулы раскрыты, например, в WO 9404678 и Hamers-Casterman, C. et al. (1993) Nature 363:446-448. Для ясности, этот вариабельный домен, происходящий от молекулы тяжелой цепи, естественно лишенной легкой цепи, именуется здесь VHH или нанотелом для его отличия от обычного VH четырехцепочечных иммуноглобулинов. Такая молекула VHH может происходить от вида верблюдовых, например, верблюда, ламы, дромадера, альпаки и гуанако. Молекулы тяжелой цепи, естественно лишенной легкой цепи, могут производить другие виды помимо верблюдовых; такие VHH находятся в пределах объема настоящего изобретения.
Молекулы SDAB могут быть рекомбинантными, CDR-привитыми, гуманизированным, камелизированными, деиммунизированными и/или созданными in vitro (например, выбранными посредством фагового отображения).
Было также обнаружено, что для клеток, содержащих множество химерных встроенных в мембрану рецепторов, содержащих антигенсвязывающий домен, взаимодействия между антигенсвязывающими доменами рецепторов могут быть нежелательными, например, потому, что они ингибируют способность одного или нескольких из антигенсвязывающих доменов связываться со своим когнатным антигеном. Соответственно, здесь раскрыты клетки, содержащие первый и второй неприродные химерные встроенные в мембрану рецепторы, содержащие антигенсвязывающие домены, которые минимизируют такие взаимодействия. Также здесь раскрыты нуклеиновые кислоты, кодирующие первый и второй неприродные химерные встроенные в мембрану рецепторы, содержащие антигенсвязывающие домены, которые минимизируют такие взаимодействия, а также способы производства и использования таких клеток и нуклеиновых кислот. В варианте осуществления антигенсвязывающий домен одного из первого и второго неприродных химерных встроенных в мембрану рецепторов содержит scFv, а другой содержит, например, одиночный домен VH верблюда, акулы или миноги или одиночный домен VH, происходящий от человеческой или мышиной последовательности.
В некоторых вариантах осуществления композиция настоящего документа содержит первый и второй CAR, причем антигенсвязывающий домен одного из первого и второго CAR не содержит вариабельный легкий домен и вариабельный тяжелый домен. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR представляет собой scFv, а другой не представляет собой scFv. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит одиночный домен VH, например, одиночный домен VH верблюда, акулы или миноги или одиночный домен VH, происходящий от человеческой или мышиной последовательности. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит верблюжий домен VHH.
В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит scFv, а другой содержит одиночный домен VH, например, одиночный домен VH верблюда, акулы или миноги или одиночный домен VH, происходящий от человеческой или мышиной последовательности. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит scFv, а другой содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из первого и второго CAR содержит scFv, а другой содержит верблюжий домен VHH.
В некоторых вариантах осуществления связывание антигенсвязывающего домена первого CAR с его когнатным антигеном по существу не уменьшается из-за присутствия второго CAR, когда они присутствуют на поверхности клетки. В некоторых вариантах осуществления связывание антигенсвязывающего домена первого CAR с его когнатным антигеном в присутствии второго CAR составляет по меньшей мере 85%, 90%, 95%, 96%, 97%, 98% или 99%, например, 85%, 90%, 95%, 96%, 97%, 98% или 99%, от связывания антигенсвязывающего домена первого CAR с его когнатным антигеном в отсутствие второго CAR.
В некоторых вариантах осуществления антигенсвязывающие домены первого и второго CAR, когда они присутствуют на поверхности клетки, связываются друг с другом меньше, чем если бы оба представляли собой антигенсвязывающие домены scFv. В некоторых вариантах осуществления антигенсвязывающий домены первого и второго CAR связываются друг с другом по меньшей мере на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньше, например, на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньше, чем если бы оба представляли собой антигенсвязывающие домены scFv.
Совместная экспрессия средства, которое увеличивает активность CAR
В другом аспекте экспрессирующая CAR клетка, описанная здесь, может дополнительно экспрессировать другое средство, например, средство, которое увеличивает активность или состояние экспрессирующей CAR клетки.
Например, в одном варианте осуществления средство может представлять собой средство, которые ингибирует молекулу, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию. В некоторых вариантах осуществления молекула, которая модулирует или регулирует T-клеточную функцию, представляет собой ингибирующую молекулу. Ингибирующие молекулы, например, PD1, могут в некоторых вариантах осуществления уменьшать способность экспрессирующей CAR клетки вызывать иммунный эффекторный ответ. Примеры ингибирующих молекул включают PD1, PD-L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин или TGFR-бета.
В вариантах осуществления средство, например, ингибирующую нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК; или, например, ингибирующий белок или систему, например, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу с цинковым пальцем (ZFN), например, как описано здесь, можно использовать для ингибирования экспрессии молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию в экспрессирующей CAR клетке. В варианте осуществления средство представляет собой кшРНК, например, кшРНК, описанную здесь. В варианте осуществления средство, которое модулирует или регулирует, например, ингибирует, T-клеточную функцию, ингибируется внутри экспрессирующей CAR клетки. Например, молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, T-клеточную функцию, связана с нуклеиновой кислотой, которая кодирует компонент, например, все компоненты, CAR.
В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибирующую молекулу, ассоциированный со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточным сигнальным доменом, описанным здесь. В одном варианте осуществления средство содержит первый полипептид, например, полипептид ингибирующей молекулы, такой как PD1, PD-L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, ГКГС класса I, ГКГС класса II, GAL9, аденозин или TGFR-бета или фрагмент любой из них (например, по меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный здесь (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано здесь) и/или первичный сигнальный домен (например, сигнальный домен из CD3-дзета, описанный здесь). В одном варианте осуществления средство содержит первый полипептид из PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена из PD1), и второй полипептид внутриклеточного сигнального домена, описанного здесь (например, сигнального домена из CD28, описанного здесь и/или сигнального домена из CD3-дзета, описанного здесь). PD1 представляет собой ингибирующий член CD28-семейства рецепторов, которое также включает в себя CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2, понижающе регулируют активацию T-клетки после связывания с PD1 (Freeman et a. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 распространен в человеческих раках (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммуносупрессия может быть обращена посредством ингибирования локального взаимодействия PD1 с PD-L1.
В одном варианте осуществления средство, содержащее внеклеточный домен (ECD) ингибирующей молекулы, например, молекулы программируемой смерти 1 (PD1), может быть слито с трансмембранным доменом и внутриклеточными сигнальными доменами, такими как из 41BB и CD3-дзета (также обозначается здесь как PD1-CAR). В одном варианте осуществления PD1-CAR при использовании в комбинации с XCAR, описанным здесь, улучшает жизнестойкость T-клетки. В одном варианте осуществления CAR представляет собой PD1-CAR, содержащий внеклеточный домен из PD1, указанный подчеркиванием в SEQ ID NO: 105. В одном варианте осуществления PD1-CAR содержит аминокислотную последовательность в соответствии с SEQ ID NO:105.
Malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO:105).
В одном варианте осуществления PD1-CAR содержит аминокислотную последовательность, приведенную ниже (SEQ ID NO:106).
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO:106).
В одном варианте осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую PD1-CAR, например, PD1-CAR, описанный здесь. В одном варианте осуществления последовательность нуклеиновой кислоты для PD1-CAR показана ниже, причем ECD PD1 ниже в SEQ ID NO: 107 подчеркнут
atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc (SEQ ID NO: 107).
В другом примере, в одном варианте осуществления средство, которое увеличивает активность экспрессирующей CAR клетки, может представлять собой костимулирующую молекулу или лиганд костимулирующей молекулы. Примеры костимулирующих молекул включают молекулу ГКГС класса I, BTLA и рецептор толл-лиганда, а также OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137). Другие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83, например, как описано здесь. Примеры лигандов костимулирующих молекул включают CD80, CD86, CD40L, ICOSL, CD70, OX40L, 4-1BBL, GITRL и LIGHT. В вариантах осуществления лиганд костимулирующей молекулы представляет собой лиганд для костимулирующей молекулы, отличающийся от домена костимулирующей молекулы в CAR. В вариантах осуществления лиганд костимулирующей молекулы представляет собой лиганд для костимулирующей молекулы, который совпадает с доменом костимулирующей молекулы в CAR. В варианте осуществления лиганд костимулирующей молекулы представляет собой 4-1BBL. В варианте осуществления костимулирующий лиганд представляет собой CD80 или CD86. В варианте осуществления лиганд костимулирующей молекулы представляет собой CD70. В вариантах осуществления экспрессирующая CAR иммунная эффекторная клетка, описанная здесь, может быть дополнительно сконструирована для экспрессии одной или нескольких дополнительных костимулирующих молекул или лигандов костимулирующих молекул.
Совместная экспрессия CAR с хемокиновым рецептором
В вариантах осуществления экспрессирующая CAR клетка, описанная здесь, например, экспрессирующая CAR CD19 клетка, дополнительно содержит молекулу хемокинового рецептора. Трансгенная экспрессия хемокиновых рецепторов CCR2b или CXCR2 в T-клетках усиливает миграцию в CCL2- или CXCL1-секретирующие солидные опухоли, включая меланому и нейробластому (Craddock et al., J Immunother. 2010 Oct; 33(8):780-8 и Kershaw et al., Hum Gene Ther. 2002 Nov 1; 13(16):1971-80). Таким образом, не желая связывать себя теорией, авторы полагают, что хемокиновые рецепторы, экспрессируемые в экспрессирующих CAR клетках, которые распознают хемокины, секретируемые опухолями, например, солидными опухолями, могут улучшать хоуминг экспрессирующей CAR клетки в опухоль, облегчать инфильтрацию экспрессирующей CAR клетки в опухоль, и увеличивают противоопухолевую эффективность экспрессирующей CAR клетки. Молекула хемокинового рецептора может содержать природный или рекомбинантный хемокиновый рецептор или его хемокин-связывающий фрагмент. Молекула хемокинового рецептора, подходящая для экспрессии в экспрессирующей CAR клетке (например, CAR-Tx), описанной здесь, включает рецептор хемокинов CXC (например, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 или CXCR7), рецептор хемокинов CC (например, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 или CCR11), рецептор хемокинов CX3C (например, CX3CR1), рецептор хемокинов XC (например, XCR1) или их хемокин-связывающие фрагменты. В одном варианте осуществления молекулу хемокинового рецептора, подлежащую экспрессии с CAR, описанным здесь, выбирают исходя из хемокина(ов), секретируемого опухолью. В одном варианте осуществления экспрессирующая CAR клетка, описанная здесь, дополнительно содержит, например, экспрессирует, рецептор CCR2b или рецептор CXCR2. В варианте осуществления CAR, описанный здесь, и молекула хемокинового рецептора расположены на одном и том же векторе или расположены на двух различных векторах. В вариантах осуществления, в которых CAR, описанный здесь, и молекула хемокинового рецептора расположены на одном и том же векторе, CAR и молекула хемокинового рецептора находятся под контролем двух различных промоторов или под контролем одного и того же промотора.
Конструкты нуклеиновой кислоты, кодирующие CAR
Настоящее изобретение предлагает также иммунную эффекторную клетку, например, получаемую с помощью способа, описанного здесь, которая включает в себя молекулы нуклеиновой кислоты, кодирующие один или несколько конструктов CAR, описанных здесь. В одном аспекте предлагается молекула нуклеиновой кислоты в виде транскрипта информационной РНК. В одном аспекте молекула предлагается нуклеиновой кислоты в виде ДНК-конструкта.
Молекулы нуклеиновой кислоты, описанные здесь, могут представлять собой молекулу ДНК, молекулу РНК или их комбинацию. В одном варианте осуществления молекула нуклеиновой кислоты представляет собой мРНК, кодирующую полипептид CAR, как описано здесь. В других вариантах осуществления молекула нуклеиновой кислоты представляет собой вектор, который включает в себя любую из вышеупомянутых молекул нуклеиновой кислоты.
В одном аспекте антигенсвязывающий домен CAR настоящего изобретения (например, scFv) кодируется молекулой нуклеиновой кислоты, последовательность которой была кодон-оптимизирована для экспрессии в клетке млекопитающего. В одном аспекте весь конструкт CAR настоящего изобретения кодируется молекулой нуклеиновой кислоты, вся последовательность которой была кодон-оптимизирована для экспрессии в клетке млекопитающего. Оптимизация кодонов относится к тому открытию, что частота встречаемости синонимичных кодонов (то есть, кодонов, которые кодируют одну и ту же аминокислоту) в кодирующей ДНК в различных видах смещена. Такое вырождение кодонов делает возможным кодирование идентичного полипептида с помощью множества нуклеотидных последовательностей. Множество способов оптимизации кодонов известны в данной области техники и включают, например, способы, раскрытые по меньшей мере в патентах США №№ 5786464 и 6114148.
Соответственно, в одном аспекте иммунная эффекторная клетка, например, получаемая с помощью способа, описанного здесь, включает в себя молекулу нуклеиновой кислоты, кодирующую химерный антигенный рецептор (CAR), причем данный CAR содержит антигенсвязывающий домен, который связывается с опухолевым антигеном, описанным здесь, трансмембранный домен (например, трансмембранный домен, описанный здесь) и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, описанный здесь), содержащий стимулирующий домен, например, костимулирующий сигнальный домен (например, костимулирующий сигнальный домен, описанный здесь), и/или первичный сигнальный домен (например, первичный сигнальный домен, описанный здесь, например, дзета-цепь, описанную здесь).
Настоящее изобретение предлагает также векторы, в которые введена молекула нуклеиновой кислоты, кодирующая CAR, например, молекула нуклеиновой кислоты, описанная здесь. Векторы, происходящие от ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долгосрочного переноса генов, поскольку они обеспечивают продолжительную стабильную интеграцию трансгена и его распространение в дочерних клетках. Лентивирусные векторы имеют дополнительное преимущество над векторами, происходящими от онкоретровирусов, таких как вирусы мышиного лейкоза, заключающееся в том, они могут трансдуцировать непролиферирующие клетки, такие как гепатоциты. Они также имеют дополнительное преимущество низкой иммуногенности. Ретровирусный вектор может также представлять собой, например, гаммаретровирусный вектор. Гаммаретровирусный вектор может включать в себя, например, промотор, сигнал упаковки (Ψ), участок связывания праймера (PBS), один или несколько (например, два) длинных концевых повторов (LTR) и представляющий интерес трансген, например, ген, кодирующий CAR. У гаммаретровирусного вектора могут отсутствовать вирусные структурные гены, такие как gag, pol и env. Типичные гаммаретровирусные векторы включают вирус мышиного лейкоза (MLV), вирус некроза селезенки (SFFV) и вирус миелопролиферативной саркомы (MPSV) и векторы, происходящие от них. Другие гаммаретровирусные векторы описаны, например, в документе Tobias Maetzig et al., "Gammaretroviral Vectors: Biology, Technology and Application", Viruses. 2011 Jun; 3(6): 677-713.
В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR, представляет собой аденовирусный вектор (A5/35). В другом варианте осуществления экспрессия нуклеиновых кислот, кодирующих CAR, может быть осуществлена с использованием транспозонов, таких как Sleeping Beauty, crisp, CAS9 и нуклеаз с цинковым пальцем. Смотри ниже документ June et al. 2009, Nature Reviews Immunology 9.10: 704-716, включенный в настоящий документ посредством ссылки.
В кратком изложении, экспрессия природных или синтетических нуклеиновых кислот, кодирующих CAR, обычно достигается посредством функционального связывания нуклеиновой кислоты, кодирующей полипептид CAR или его части, с промотором и включения конструкта в вектор экспрессии. Векторы могут подходить для репликации и интеграции в эукариотах. Типичные векторы клонирования содержат терминаторы транскрипции и трансляции, последовательности инициации и промоторы, подходящие для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Нуклеиновая кислота может быть клонирована в векторы множества типов. Например, нуклеиновая кислота может быть клонирована в вектор, включая, но без ограничения, плазмиду, фагмиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы репликации, векторы для создания зондов и векторы для секвенирования.
Затем вектор экспрессии может быть предоставлен клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна в данной области техники и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY, и в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые подходят в качестве векторов, включают, но без ограничения, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В общем случае, подходящий вектор содержит точку начала репликации, функционирующую по меньшей мере в одном организме, последовательность промотора, удобные сайты эндонуклеазной рестрикции и один или несколько селектируемых маркеров (например, WO 01/96584; WO 01/29058; и патент США № 6326193).
Был разработан ряд систем на основе вирусов для переноса генов в клетки млекопитающих. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Выбранный ген может быть введен в вектор и упакован в ретровирусные частицы с использованием способов, известных в данной области техники. Рекомбинантный вирус может быть затем выделен и доставлен в клетки субъекта или in vivo, или ex vivo. В данной области техники известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. В данной области техники известен ряд аденовирусных векторов. В одном варианте осуществления используют лентивирусные векторы.
Дополнительные элементы промоторов, например, энхансеры, регулируют частоту инициации транскрипции. Обычно они расположены в области 30-110 п.о. в обратном направлении от сайта начала, хотя было показано, что ряд промоторов также содержат функциональные элементы в прямом направлении от сайта начала. Расстояние между элементами промоторов часто является гибким, так что функция промотора сохраняется, когда элементы инвертированы или перемещены друг относительно друга. В промоторе тимидинкиназы (tk) расстояние между элементами промоторов можно увеличивать до 50 п.о. друг от друга, пока активность не начнет снижаться. Оказывается, что в зависимости от промотора отдельные элементы могут функционировать для активации транскрипции или вместе, или независимо. Типичные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK).
Примером промотора, который способен к экспрессии кодирующий CAR молекулы нуклеиновой кислоты в T-клетке млекопитающего, является промотор EF1a. Нативный промотор EF1a управляет экспрессией альфа-субъединицы комплекса фактора элонгации-1, который отвечает за ферментативную доставку аминоацилированных тРНК рибосоме. Промотор EF1a широко используется в плазмидах для экспрессии в млекопитающих, и было показано, что он эффективен при управлении экспрессией CAR из молекул нуклеиновой кислоты, клонированных в лентивирусный вектор. Смотри, например, Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). В одном аспекте промотор EF1a содержит последовательность, приведенную в примерах.
Другим примером промотора является последовательность немедленно-раннего промотора цитомегаловируса (CMV). Эта последовательность промотора представляет собой последовательность сильного конститутивного промотора, способного к управлению высокими уровнями экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Однако можно также использовать последовательности других конститутивных промоторов, включая, но без ограничения, ранний промотор вируса обезьян 40 (SV40), мышиный вирус опухоли молочной железы (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса птичьего лейкоза, немедленно-ранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы человеческих генов, такие как, но без ограничения, промотор актина, промотор миозина, промотор фактора элонгации-1α, промотор гемоглобина и промотор креатинкиназы. Кроме того, настоящее изобретение не должно быть ограничено использованием конститутивных промоторов. Индуцируемые промоторы также рассматриваются как часть настоящего изобретения. Использование индуцируемого промотора обеспечивает молекулярный переключатель, способный к включению экспрессии полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или к выключению экспрессии, когда экспрессия нежелательна. Примеры индуцируемых промоторов включают, но без ограничения, промотор металлотионеина, промотор глюкокортикоидов, промотор прогестерона и промотор тетрациклина.
Другим примером промотора является промотор фосфоглицераткиназы (PGK). В вариантах осуществления может быть желательным усеченный промотор PGK (например, промотор PGK с одной или несколькими, например, 1, 2, 5, 10, 100, 200, 300 или 400, делециями нуклеотидов по сравнению с последовательностью промотора PGK дикого типа).
Нуклеотидные последовательности типичных промоторов PGK приведены ниже.
Промотор WT PGK:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCGCGGCGACGCAAAGGGCCTTGGTGCGGGTCTCGTCGGCGCAGGGACGCGTTTGGGTCCCGACGGAACCTTTTCCGCGTTGGGGTTGGGGCACCATAAGCT (SEQ ID NO: 109)
Типичные усеченные промоторы PGK:
PGK100:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTG (SEQ ID NO: 110)
PGK200:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACG (SEQ ID NO:111)
PGK300:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCG (SEQ ID NO:112)
PGK400:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCG (SEQ ID NO:113)
Вектор может также включать в себя, например, сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (например, из гена бычьего гормона роста (BGH)), элемент, обеспечивающий эписомальную репликацию и репликацию в прокариотах (например, происходящий из SV40 и ColE1 или другие, известные в данной области техники), и/или элементы для обеспечения селекции (например, ген резистентности к ампициллину и/или маркер зеоцин).
Для того чтобы оценить экспрессию полипептида CAR или его частей, вектор экспрессии, подлежащий введению в клетку, может также содержать или ген селектируемого маркера, или репортерный ген, или и тот, и другой для облегчения идентификации и селекции экспрессирующих клеток из популяции клеток, которые пытались трансфицировать или инфицировать посредством вирусных векторов. В других аспектах селектируемый маркер может располагаться на отдельном фрагменте ДНК и использоваться в процедуре котрансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы подходящими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Подходящие селектируемые маркеры включают, например, гены резистентности к антибиотикам, такие как neo и тому подобные.
Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональных свойств регуляторных последовательностей. В общем случае, репортерный ген представляет собой ген, который не присутствует или не экспрессируется реципиентными организмом или тканью, и который кодирует полипептид, экспрессия которого проявляется в некотором легко детектируемом свойстве, например, ферментативной активности. Экспрессию репортерного гена оценивают в подходящий момент времени после того, как ДНК была введена в реципиентные клетки. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфеникол-ацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие системы экспрессии хорошо известны и могут быть приготовлены с использованием известных способов или получены коммерчески. В общем случае, в качестве промотора идентифицируют конструкт с минимальной 5'-фланкирующей областью, показывающий наивысший уровень экспрессии репортерного гена. Такие области промотора могут быть связаны с репортерным геном и могут использоваться для оценки средств в отношении способности к модулированию промотор-управляемой транскрипции.
В вариантах осуществления вектор может содержать две или более последовательности нуклеиновой кислоты, кодирующие CAR, например, CAR, описанный здесь, например, CAR CD19, и второй CAR, например, ингибирующий CAR или CAR, который специфически связывается с антигеном, отличным от CD19. В таких вариантах осуществления две или более последовательности нуклеиновой кислоты, кодирующие CAR, кодируются одной нуклеиновой молекулой в одной рамке и в виде одной полипептидной цепи. В данном аспекте два или более CAR могут, например, быть разделены одним или нескольким сайтами расщепления пептида. (Например, сайтом автоматического расщепления или субстратом для внутриклеточной протеазы). Примеры сайтов расщепления пептида включают сайты T2A, P2A, E2A или F2A.
В данной области техники известны способы введения и экспрессии генов в клетку. В контексте вектора экспрессии вектор может быть легко введен в клетку-хозяина, например, клетку млекопитающего, бактериальную, дрожжевую клетку или клетку насекомого, с помощью любого способа, например, способа, известного в данной области техники. Например, вектор экспрессии может быть перенесен в клетку-хозяина с помощью физических, химических или биологических средств.
Физические способы введения полинуклеотида в клетку-хозяина включают преципитацию фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобное. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области техники. Смотри, например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY). Подходящим способом введения полинуклеотида в клетку-хозяина является трансфекция фосфатом кальция.
Биологические способы введения полинуклеотида, представляющего интерес, в клетку-хозяина включают использование ДНК- и РНК-векторов. Вирусные векторы, и особенно ретровирусные векторы, стали наиболее широко используемым способом введения генов в клетки млекопитающего, например, человеческие. Другие вирусные векторы могут происходить от лентивируса, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и тому подобных. Смотри, например, патенты США №№ 5350674 и 5585362.
Химические средства введения полинуклеотида в клетку-хозяина включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии масло в воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для использования в качестве носителя для доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). Доступны другие способы направленной доставки нуклеиновых кислот современного уровня техники, такие как доставка полинуклеотидов с таргетными наночастицами или другая подходящая система доставки в субмикронном масштабе.
В случае, если используют невирусную систему доставки, типичным носителем для доставки является липосома. Предусмотрено использование липидных композиций для введения нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo). В другом аспекте нуклеиновая кислота может быть связана с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водном внутреннем пространстве липосомы, рассеяна в липидном бислое липосомы, прикреплена к липосоме с помощью связывающей молекулы, которая связана как с липосомой, так и с олигонуклеотидом, захвачена в липосому, связана в комплекс с липосомой, диспергирована в растворе, содержащем липид, смешана с липидом, объединена с липидом, может содержаться в виде суспензии в липиде, содержаться в мицелле или образовывать с ней комплекс или быть иначе связана с липидом. Соответствующие композиции липида, липида/ДНК или липида/вектора экспрессии не ограничены какой-либо конкретной структурой в растворе. Например, они могут присутствовать в структуре бислоя, в виде мицелл или со "схлопнувшейся" структурой. Они также могут просто быть рассеяны в растворе, возможно образуя агрегаты, которые не являются однородными по размеру и форме. Липиды представляют собой жирные вещества, которые могут представлять собой природные или синтетические липиды. Например, липиды включают жирные капли, которые естественным образом возникают в цитоплазме, а также класс соединений, которые содержат длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
Липиды, подходящие для использования, могут быть получены из коммерческих источников. Например, димиристилфосфатидилхолин ("DMPC") может быть получен от Sigma, St. Louis, MO; дицетилфосфат ("DCP") может быть получен от K & K Laboratories (Plainview, NY); холестерин ("Choi") может быть получен от Calbiochem-Behring; димиристилфосфатидилглицерин ("DMPG") и другие липиды могут быть получены от Avanti Polar Lipids, Inc. (Birmingham, AL). Маточные растворы липидов в хлороформе или смеси хлороформ/метанол можно хранить при приблизительно -20°C. Хлороформ используют в качестве единственного растворителя, так как он легче испаряется, чем метанол. "Липосома" является общим термином, охватывающим множество одно- и многослойных липидных носителей, образуемых посредством создания замкнутых липидных бислоев или агрегатов. Липосомы могут быть охарактеризованы как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Многослойные липосомы содержат множество липидных слоев, разделенных водной средой. Они образуются спонтанно при суспендировании фосфолипидов в избытке водного раствора. Липидные компоненты претерпевают само-перегруппировку до образования замкнутых структур и захватывают воду и растворенные вещества между липидными бислоями (Ghosh et al., 1991 Glycobiology 5: 505-10). При этом также охватываются композиции, которые имеют в растворе другие структуры, чем нормальная везикулярная структура. Например, липиды могут принимать мицеллярную структуру или просто существовать в виде неоднородных агрегатов липидных молекул. Также рассматриваются комплексы липофектамин-нуклеиновая кислота.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия ингибитора настоящего изобретения на клетку, для того чтобы подтвердить присутствие рекомбинантной последовательности нуклеиновой кислоты в клетке-хозяине, может быть осуществлено множество анализов. Такие анализы включают, например, "молекулярные биологические" анализы, хорошо известные специалистам в данной области техники, такие как Саузерн- и нозерн-блоттинг, ПЦР-РВ и ПЦР; "биохимические" анализы, такие как детектирование присутствия или отсутствия конкретного пептида, например, с помощью иммунологических средств (ELISA и вестерн-блоттинги) или посредством анализов, описанных здесь, для идентификации средств, попадающих в пределы объема настоящего изобретения.
CAR с рецептором клеток-естественных киллеров (NKR)
В варианте осуществления молекула CAR, описанная здесь, содержит один или несколько компонентов рецептора клеток-естественных киллеров (NKR), таким образом образуя NKR-CAR. Компонент NKR может представлять собой трансмембранный домен, шарнирный домен или цитоплазматический домен из любого из следующих рецепторов клеток-естественных киллеров: иммуноглобулин-подобного рецептора клеток-киллеров (KIR), например, KIR2DL1, KIR2DL2/L3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS4, DIR2DS5, KIR3DL1/S1, KIR3DL2, KIR3DL3, KIR2DP1 и KIR3DP1; рецептора естественной цитотоксичности (NCR), например, NKp30, NKp44, NKp46; семейства сигнальных лимфоцит-активирующих молекул (SLAM) рецепторов иммунных клеток, например, CD48, CD229, 2B4, CD84, NTB-A, CRACC, BLAME и CD2F-10; Fc-рецептоар (FcR), например, CD16 и CD64; и рецепторов Ly49, например, LY49A, LY49C. Молекулы NKR-CAR, описанные здесь, могут взаимодействовать с молекулой-адаптором или внутриклеточным сигнальным доменом, например, DAP12. Типичные конфигурации и последовательности молекул CAR, содержащих компоненты NKR, описаны в международной публикации № WO2014/145252, содержание которой настоящим включено посредством ссылки.
Расщепленный CAR
В некоторых вариантах осуществления экспрессирующая CAR клетка использует расщепленный CAR. Подход расщепленного CAR описан более подробно в публикациях WO2014/055442 и WO2014/055657. Кратко говоря, система расщепленного CAR содержит клетку, экспрессирующую первый CAR, имеющий первый антигенсвязывающий домен и костимулирующий домен (например, 41BB), и данная клетка также экспрессирует второй CAR, имеющий второй антигенсвязывающий домен и внутриклеточный сигнальный домен (например, CD3-дзета). Когда клетка встречает первый антиген, костимулирующий домен активируется, и клетка пролиферирует. Когда клетка встречает второй антиген, внутриклеточный сигнальный домен активируется, и запускается активность клеточного киллинга. Таким образом, экспрессирующая CAR клетка полностью активируется только в присутствии обоих антигенов.
Стратегии регуляции химерных антигенных рецепторов
В некоторых вариантах осуществления желателен регулируемый CAR (RCAR), в котором можно управлять активностью CAR, для оптимизации безопасности и эффективности терапии с помощью CAR. Существует много способов регуляции активности CAR. Например, в качестве выключателя безопасности при терапии с помощью CAR настоящего изобретения можно использовать индуцируемый апоптоз с помощью, например, каспазы, слитой в домен димеризации, (смотри, например, Di Stasa et al., N Engl. J. Med. 2011 Nov. 3; 365(18):1673-1683). В одном варианте осуществления клетки (например, T-клетки или NK-клетки), экспрессирующие CAR настоящего изобретения, дополнительно содержат выключатель индуцируемого апоптоза, причем человеческая каспаза (например, каспаза-9) или ее модифицированный вариант слиты с модификацией человеческого белка FKB, что обеспечивает условную димеризацию. В присутствии малой молекулы, такой как рапалог (например, AP 1903, AP20187), индуцируемая каспаза (например, каспаза-9) активируется и вызывает быстрый апоптоз и гибель клеток (например, T-клеток или NK-клеток), экспрессирующих CAR настоящего изобретения. Примеры выключателей индуцируемого апоптоза на основе каспазы (или одного или нескольких аспектов такого выключателя) были описаны, например, в US2004040047; US20110286980; US20140255360; WO1997031899; WO2014151960; WO2014164348; WO2014197638; WO2014197638; которые включены в настоящий документ посредством ссылки.
В другом примере, экспрессирующие CAR клетки могут также экспрессировать молекулу индуцируемой каспазы-9 (iCaspase-9), что после введения препарата-димеризатора (например, римидуцида (также называемого AP1903 (Bellicum Pharmaceuticals) или AP20187 (Ariad)) приводит к активации каспазы-9 и апоптозу клеток. Молекула iCaspase-9 содержит химический индуктор димеризации (CID), связывающий домен, который опосредует димеризацию в присутствии CID. Это приводит к индуцируемому и селективному истощению CAR-экспрессирующих клеток. В некоторых случаях молекула iCaspase-9 кодируется молекулой нуклеиновой кислоты, отдельной от CAR-кодирующего вектора(ов). В некоторых случаях молекула iCaspase-9 кодируется той же молекулой нуклеиновой кислоты, что и CAR-кодирующий вектор. ICaspase-9 может предоставлять выключатель безопасности для предотвращения любой токсичности CAR-экспрессирующих клеток. Смотри, например, Song et al. Cancer Gene Ther. 2008; 15(10):667-75; № идентификатора клинического исследования NCT02107963; и Di Stasi et al. N. Engl. J. Med. 2011; 365:1673-83.
Альтернативные стратегии регуляции терапии с помощью CAR настоящего изобретения включают использование небольших молекул или антител, которые деактивируют или выключают активность CAR, например, посредством удаления CAR-экспрессирующих клеток, например, посредством индуцирования антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC). Например, экспрессирующие CAR клетки, описанные здесь, могут также экспрессировать антиген, который распознается молекулами, способными индуцировать клеточную смерть, например, ADCC или индуцируемую комплементом клеточную смерть. Например, экспрессирующие CAR клетки, описанные здесь, могут также экспрессировать рецептор, допускающий воздействие на него антитела или фрагмента антитела. Примеры таких рецепторов включают EpCAM, VEGFR, интегрины (например, интегрины αVβ3, α4, αIIbβ3, α4β7, α5β1, αVβ3, αV), члены суперсемейства рецепторов TNF (например, TRAIL-R1, TRAIL-R2), рецептор PDGF, интерфероновый рецептор, фолатный рецептор, GPNMB, ICAM-1, HLA-DR, CEA, CA-125, MUC1, TAG-72, рецептор IL-6, 5T4, GD2, GD3, CD2, CD3, CD4, CD5, CD11, CD11a/LFA-1, CD15, CD18/ITGB2, CD19, CD20, CD22, CD23/рецептор IgE, CD25, CD28, CD30, CD33, CD38, CD40, CD41, CD44, CD51, CD52, CD62L, CD74, CD80, CD125, CD147/базиджин, CD152/CTLA-4, CD154/CD40L, CD195/CCR5, CD319/SLAMF7 и EGFR и их усеченные варианты (например, варианты, сохраняющие один или несколько внеклеточных эпитопов, но без одной или нескольких областей в цитоплазматическом домене).
Например, экспрессирующая CAR клетка, описанная здесь может также экспрессировать усеченный рецептор эпидермального фактора роста (EGFR), у которого отсутствует сигнальная способность, но сохранен эпитоп, который распознается молекулами, способными индуцировать ADCC, например, цетуксимабом (ERBITUX®), так что введение цетуксимаба индуцирует ADCC и последующее истощение экспрессирующих CAR клеток (смотри, например, WO2011/056894 и Jonnalagadda et al., Gene Ther. 2013; 20(8)853-860). Другая стратегия включает в себя экспрессирование высококомпактного маркера/суицидального гена, который объединяет эпитопы-мишени как из антигена CD32, так и из CD20, в экспрессирующих CAR клетках, описанных здесь, который связывает ритуксимаб, что приводит к селективному истощению CAR-экспрессирующих клеток, например, посредством ADCC (смотри, например, Philip et al., Blood. 2014; 124(8)1277-1287). Другие способы истощения экспрессирующих CAR клеток, описанных здесь, включают введение CAMPATH, моноклонального анти-CD52 антитела, которое селективно связывает и воздействует на зрелые лимфоциты, например, экспрессирующие CAR клетки, для разрушения, например, посредством индуцирования ADCC. В других вариантах осуществления на экспрессирующую CAR клетку можно селективно воздействовать с использованием лиганда CAR, например, антиидиотипического антитела. В некоторых вариантах осуществления антиидиотипическое антитело может вызывать эффекторную клеточную активность, например, активность ADCC или ADC, что уменьшает количество экспрессирующих CAR клеток. В других вариантах осуществления лиганд CAR, например, антиидиотипическое антитело, может быть связан со средством, которое индуцирует клеточный киллинг, например, токсином, что уменьшает количество экспрессирующих CAR клеток. В качестве альтернативы, сами молекулы CAR могут быть выполнены таким образом, что можно регулировать их активность, например, включать и выключать, как описано ниже.
В других вариантах осуществления экспрессирующая CAR клетка, описанная здесь, может также экспрессировать белок-мишень, распознаваемый средством для истощения T-клеток. В одном варианте осуществления белок-мишень представляет собой CD20, и средство для истощения T-клеток представляет собой анти-CD20 антитело, например, ритуксимаб. В таком варианте осуществления средство для истощения T-клеток вводят, если желательно уменьшить количество или устранить экспрессирующие CAR клетки, например, ослабить индуцируемую CAR токсичность. В других вариантах осуществления средство для истощения T-клеток представляет собой анти-CD52 антитело, например, алемтузумаб, как описано в примерах здесь.
В других вариантах осуществления RCAR содержит набор полипептидов, обычно два в простейших вариантах осуществления, в которых компоненты стандартного CAR, описанного здесь, например, антигенсвязывающий домен и внутриклеточный сигнальный домен, разделены на отдельные полипептиды или элементы. В некоторых вариантах осуществления полипептиды в наборе включают в себя переключатель димеризации, который при наличии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В одном варианте осуществления CAR настоящего изобретения использует переключатель димеризации, такой как описанный, например, в документе WO2014127261, который включен в настоящий документ посредством ссылки. Дополнительное описание и типичные конфигурации таких регулируемых CAR приведены здесь и, например, в абзацах 527-551 международной публикации № WO 2015/090229, поданной 13 марта 2015 года, которая включена посредством ссылки во всей полноте. В некоторых вариантах осуществления RCAR включает в себя домен-переключатель, например, домен-переключатель FKBP, как приведено в SEQ ID NO: 114, или содержит фрагмент FKBP, обладающий способностью связываться с FRB, например, как приведено в SEQ ID NO: 115. В некоторых вариантах осуществления RCAR включает в себя домен-переключатель, содержащий последовательность FRB, например, как приведено в SEQ ID NO: 116, или мутантную последовательность FRB, например, как приведено в любой из SEQ ID №№ 117-122.
DVPDYASLGGPSSPKKKRKVSRGVQVETISPGDGRTFPKRGQTCVVHYTGMLEDGKKFDSSRDRNKPFKFMLGKQEVIRGWEEGVAQMSVGQRAKLTISPDYAYGATGHPGIIPPHATLVFDVELLKLETSY (SEQ ID NO: 114)
VQVETISPGDGRTFPKRGQTCVVHYTGMLEDGKKFDSSRDRNKPFKFMLGKQEVIRGWEEGVAQMSVGQRAKLTISPDYAYGATGHPGIIPPHATLVFDVELLKLETS (SEQ ID NO: 115)
ILWHEMWHEGLEEASRLYFGERNVKGMFEVLEPLHAMMERGPQTLKETSFNQAYGRDLMEAQEWCRKYMKSGNVKDLTQAWDLYYHVFRRISK (SEQ ID NO: 116)
Таблица 4. Типичные мутантные FRB, обладающие повышенной аффинностью к молекуле димеризации.
РНК-трансфекция
Здесь раскрыты способы получения транскрибируемой in vitro РНК CAR. РНК CAR и способы ее использования описаны, например, в абзацах 553-570 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Иммунная эффекторная клетка может включать в себя CAR, кодируемый информационной РНК (мРНК). В одном аспекте мРНК, кодирующую CAR, описанный здесь, вводят в иммунную эффекторную клетку, например, полученную с помощью способа, описанного здесь, для получения экспрессирующей CAR клетки.
В одном варианте осуществления транскрибируемая in vitro РНК CAR может быть введена в клетку как форма временной трансфекции. РНК получают посредством in vitro транскрипции с использованием генерируемой полимеразной цепной реакцией (ПЦР) матрицы. Представляющая интерес ДНК из любого источника может быть непосредственно превращена посредством ПЦР в матрицу для in vitro синтеза мРНК с использованием подходящих праймеров и РНК-полимеразы. Источник ДНК может представлять собой, например, геномную ДНК, плазмидную ДНК, фаговую ДНК, кДНК, синтетическую последовательность ДНК или любой другой подходящий источник ДНК. Желаемой матрицей для in vitro транскрипции является CAR, описанный здесь. Например, матрица для РНК CAR содержит внеклеточную область, содержащую одноцепочечный вариабельный домен антитела к ассоциированному с опухолью антигену, описанному здесь; шарнирную область (например, шарнирную область, описанную здесь), трансмембранный домен (например, трансмембранный домен, описанный здесь, такой как трансмембранный домен из CD8a); и цитоплазматическую область, которая включает в себя внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный здесь, например, содержащий сигнальный домен из CD3-дзета и сигнальный домен из 4-1BB.
В одном варианте осуществления ДНК для использования для ПЦР содержит открытую рамку считывания. ДНК может происходить от природной последовательности ДНК из генома организма. В одном варианте осуществления нуклеиновая кислота может включать в себя некоторые или все из 5'- и/или 3'-нетранслируемых областей (НТО). Нуклеиновая кислота может включать в себя экзоны и интроны. В одном варианте осуществления ДНК для использования для ПЦР представляет собой человеческую последовательность нуклеиновой кислоты. В другом варианте осуществления ДНК для использования для ПЦР представляет собой человеческую последовательность нуклеиновой кислоты, включающую в себя 5'- и 3'-НТО. ДНК может, альтернативно, представлять собой искусственную последовательность ДНК, которая обычно не экспрессируется в природном организме. Типичной искусственной последовательностью ДНК является ДНК, содержащая части генов, которые лигированы вместе с образованием открытой рамки считывания, которая кодирует белок слияния. Части ДНК, которые лигированы вместе, могут происходить из одного организма или из более чем одного организма.
ПЦР используют для создания матрицы для in vitro транскрипции мРНК, которую используют для трансфекции. Способы осуществления ПЦР хорошо известны в данной области техники. Праймеры для использования в ПЦР конструируют так, чтобы они имели области, которые по существу комплементарны областям ДНК, подлежащей использованию в качестве матрицы для ПЦР. "По существу комплементарный", как используется здесь, относится к последовательностям нуклеотидов, в которых большинство или все из оснований в последовательности праймеров комплементарны, или одно или несколько оснований некомплементарны или не совпадают. По существу комплементарные последовательности способны к отжигу или гибридизации с предполагаемой ДНК-мишенью при условиях отжига, используемых для ПЦР. Праймеры могут быть сконструированы так, чтобы они были по существу комплементарны любой части матрицы ДНК. Например, праймеры могут быть сконструированы для амплификации части нуклеиновой кислоты, которая обычно транскрибируется в клетках (открытая рамка считывания), включая 5'- и 3'-НТО. Праймеры также могут быть сконструированы для амплификации части нуклеиновой кислоты, которая кодирует конкретный домен, представляющий интерес. В одном варианте осуществления праймеры конструируют для амплификации кодирующей области человеческой кДНК, включая все или части 5'- и 3'-НТО. Праймеры, подходящие для ПЦР, могут быть сгенерированы с помощью синтетических способов, которые хорошо известны в данной области техники. "Прямые праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны нуклеотидам на матрице ДНК, которые расположены в обратном направлении от последовательности ДНК, которая должна быть амплифицирована. "В обратном направлении" используют здесь для обозначения локализации 5' по отношению к последовательности ДНК, подлежащей амплификации, относительно кодирующей нити. "Обратные праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны двухнитевой матрице ДНК, которая расположена в прямом направлении от последовательности ДНК, которая должна быть амплифицирована. "В прямом направлении" используют здесь для обозначения локализации 3' по отношению к последовательности ДНК, подлежащей амплификации, относительно кодирующей нити.
В способах, раскрытых здесь, можно использовать любую ДНК-полимеразу, подходящую для ПЦР. Реагенты и полимераза коммерчески доступны из ряда источников.
Также можно использовать химические структуры со способностью обеспечения стабильности и/или эффективности трансляции. РНК в вариантах осуществления содержит 5'- и 3'-НТО. В одном варианте осуществления 5'-НТО имеет длину между одним и 3000 нуклеотидов. Длину последовательностей 5'- и 3'-НТО, подлежащих присоединению к кодирующей области, можно изменять различными способами, включая, но без ограничения, конструирование праймеров для ПЦР, которые отжигаются на различных областях НТО. Используя этот подход, средний специалист в данной области техники может модифицировать длины 5'- и 3'-НТО, требуемые для достижения оптимальной эффективности трансляции после трансфекции транскрибируемой РНК.
5'- и 3'-НТО могут представлять собой природные эндогенные 5'- и 3'-НТО для представляющей интерес нуклеиновой кислоты. В качестве альтернативы, последовательности НТО, которые являются не эндогенными для представляющей интерес нуклеиновой кислоты, могут быть присоединены посредством включения последовательностей НТО в прямые и обратные праймеры или посредством любых других модификаций матрицы. Использование последовательностей НТО, которые являются не эндогенными для представляющей интерес нуклеиновой кислоты, может подходить для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что богатые AU элементы в последовательностях 3'-НТО могут уменьшать стабильность мРНК. Поэтому, 3'-НТО могут быть выбраны или сконструированы для увеличения стабильности транскрибируемой РНК на основании свойств НТО, которые хорошо известны в данной области техники.
В одном варианте осуществления 5'-НТО может содержать последовательность Козак эндогенной нуклеиновой кислоты. В качестве альтернативы, когда 5'-НТО, которая является не эндогенной для представляющей интерес нуклеиновой кислоты, добавляют посредством ПЦР, как описано выше, консенсусная последовательность Козак может быть повторно сконструирована посредством присоединения последовательности 5'-НТО. Последовательности Козак могут увеличивать эффективность трансляции некоторых РНК-транскриптов, но, по-видимому, не являются необходимыми для всех РНК для обеспечения эффективной трансляции. В данной области техники известна необходимость в последовательностях Козак для многих мРНК. В других вариантах осуществления 5'-НТО может представлять собой 5ʹ-НТО РНК-вируса, РНК-геном которого стабилен в клетках. В других вариантах осуществления можно использовать различные аналоги нуклеотидов в 3'- или 5'-НТО для препятствования экзонуклеазной деградации мРНК.
Для обеспечения синтеза РНК из матрицы ДНК без необходимости в клонировании генов, к матрице ДНК в обратном направлении по отношению к подлежащей транскрипции последовательности должен быть прикреплен промотор транскрипции. Когда последовательность, которая функционирует в качестве промотора для РНК-полимеразы, присоединяют к 5'-концу прямого праймера, промотор РНК-полимеразы становится включенным в продукт ПЦР в обратном направлении от открытой рамки считывания, которая подлежит транскрипции. В одном варианте осуществления промотор представляет собой промотор полимеразы T7, как описано в другом месте здесь. Другие подходящие промоторы включают, но без ограничения, промоторы РНК-полимераз T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6 известны в данной области техники.
В варианте осуществления мРНК имеет как кэп на 5'-конце, так и 3'-поли(A)-хвост, что определяет связывание рибосомы, инициацию трансляции и стабильность мРНК в клетке. На кольцевой матрице ДНК, например, плазмидной ДНК, РНК-полимераза производит длинный конкатемерный продукт, который не подходит для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной с конца 3'-НТО, приводит к мРНК нормального размера, которая не эффективна в эукариотической трансфекции, даже если ее полиаденилировать после транскрипции.
На линейной матрице ДНК РНК-полимераза фага T7 может удлинять 3'-конец трнаскрипта за пределами последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
Обычным способом интеграции поли-A/T-удлинений в матрицу ДНК является молекулярное клонирование. Однако поли-A/T-последовательность, интегрированная в плазмидную ДНК, может вызывать нестабильность плазмиды, и поэтому плазмидные матрицы ДНК, полученные из бактериальных клеток, часто сильно загрязнены делециями и другими аберрациями. Это делает процедуры клонирования не только трудоемкими и требующими времени, но часто и не надежными. Поэтому очень желателен способ, который позволит конструировать матрицы ДНК с поли-A/T-3'-удлинением без клонирования.
Поли-A/T-сегмент транскрипционной матрицы ДНК может быть получен во время ПЦР посредством использования обратного праймера, содержащего поли-T-хвост, такой как 100T-хвост (SEQ ID NO: 31) (размер может составлять 50-5000 T (SEQ ID NO: 32)), или после ПЦР посредством любого другого способа, включая, но без ограничения, лигирование ДНК или in vitro рекомбинацию. Поли(A)-хвосты также обеспечивают стабильность РНК и уменьшают ее деградацию. Обычно длина поли(A)-хвоста положительно коррелирует со стабильностью транскрибируемой РНК. В одном варианте осуществления поли(A)-хвост составляет между 100 и 5000 аденозинов (например, SEQ ID NO: 33).
Поли(A)-хвосты РНК могут быть дополнительно удлинены после in vitro транскрипции с использованием поли(A)-полимеразы, такой как поли-A-полимераза E. coli (E-PAP). В одном варианте осуществления увеличение длины поли(A)-хвоста от 100 нуклеотидов до 300-400 нуклеотидов (SEQ ID NO: 34) приводит к приблизительно двукратному повышению эффективности трансляции РНК. Кроме того, стабильность мРНК может увеличивать присоединение различных химических групп к 3'-концу. Такое присоединение может содержать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, с использованием поли(A)-полимеразы можно вводить в поли(A)-хвост аналоги АТФ. Аналоги АТФ могут дополнительно увеличивать стабильность РНК.
5'-кэпы также придают стабильность молекулам РНК. В варианте осуществления РНК, получаемые посредством способов, раскрытых здесь, включают в себя 5'-кэп. 5'-кэп обеспечивают с использованием способов, известных в данной области техники и описанных здесь (Cougot, et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., РНК, 7:1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
РНК, получаемые посредством способов, раскрытых здесь, могут также содержать последовательность участка внутренней посадки рибосомы (IRES). Последовательность IRES может представлять собой любую вирусную, хромосомную или искусственно сконструированную последовательность, которая инициирует кэп-независимое связывание рибосомы с мРНК и облегчает инициацию трансляции. Могут быть включены любые растворенные вещества, подходящие для электропорации клеток, которые могут содержать факторы, облегчающие клеточную проницаемость и жизнеспособность, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
РНК может быть введена в клетки-мишени с использованием любого из ряда различных способов, например, коммерчески доступных способов, которые включают, но без ограничения, электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Германия)), ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Hamburg, Германия), опосредованную катионными липосомами трансфекцию с использованием липофекции, полимерную инкапсуляцию, опосредованную пептидами трансфекцию или системы биолистической доставки частиц, такие как "генные пушки" (смотри, например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
Невирусные способы доставки
В некоторых аспектах можно использовать невирусные способы для доставки нуклеиновой кислоты, кодирующей CAR, описанный здесь, в клетку, или ткань, или субъекта.
В некоторых вариантах осуществления невирусный способ включает в себя использование транспозона (также называемого подвижным элементом). В некоторых вариантах осуществления транспозон представляет собой фрагмент ДНК, который может встраиваться в некотором местоположении в геноме, например, фрагмент ДНК, который способен к саморепликации и встраиванию своей копии в геном, или фрагмент ДНК, который может быть вырезан из более длинной нуклеиновой кислоты и вставлен в геном в другом месте. Например, транспозон содержит последовательность ДНК, состоящую из инвертированных повторов, фланкирующих гены для транспозиции.
Типичные способы доставки нуклеиновой кислоты с использованием транспозона включают систему транспозона Sleeping Beauty (SBTS) и систему транспозона piggyBac (PB). Смотри, например, документы Aronovich et al. Hum. Mol. Genet. 20.R1(2011):R14-20; Singh et al. Cancer Res. 15(2008):2961-2971; Huang et al. Mol. Ther. 16(2008):580-589; Grabundzija et al. Mol. Ther. 18(2010):1200-1209; Kebriaei et al. Blood. 122.21(2013):166; Williams. Molecular Therapy 16.9(2008):1515-16; Bell et al. Nat. Protoc. 2.12(2007):3153-65; и Ding et al. Cell. 122.3(2005):473-83, которые включены в настоящий документ посредством ссылки.
SBTS включает в себя два компонента: 1) транспозон, содержащий трансген, и 2) источник фермента транспозазы. Транспозаза может перемещать транспозон из плазмиды-носителя (или другого донора ДНК) в ДНК-мишень, такую как хромосома/геном клетки-хозяина. Например, транспозаза связывается с плазмидой-носителем/донором ДНК, вырезает транспозон (включая трансген(ы)) из плазмиды и вставляет его в геном клетки-хозяина. Смотри, например, Aronovich et al. выше.
Типичные транспозоны включают транспозон на основе pT2. Смотри, например, документы Grabundzija et al. Nucleic Acids Res. 41.3(2013):1829-47; и Singh et al. Cancer Res. 68.8(2008): 2961-2971, которые включены в настоящий документ посредством ссылки. Типичные транспозазы включают транспозазу типа Tc1/mariner, например, транспозазу SB10 или транспозазу SB11 (гиперактивную транспозазу, которая может экспрессироваться, например, от промотора цитомегаловируса). Смотри, например, документы Aronovich et al.; Kebriaei et al.; и Grabundzija et al., которые включены в настоящий документ посредством ссылки.
Использование SBTS обеспечивает эффективную интеграцию и экспрессию трансгена, например, нуклеиновой кислоты, кодирующей CAR, описанный здесь. Здесь предлагаются способы генерирования клетки, например, T-клетки или NK-клетки, которая стабильно экспрессирует CAR, описанный здесь, например, с использованием системы транспозона, такой как SBTS.
В соответствии со способами, описанными здесь, в некоторых вариантах осуществления одну или несколько нуклеиновых кислот, например, плазмид, содержащих компоненты SBTS, доставляют в клетку (например, T- или NK-клетку). Например, нуклеиновую кислоту(ы) доставляют с помощью стандартных способов доставки нуклеиновых кислот (например, плазмидной ДНК), например, способов, описанных здесь, например, электропорации, трансфекции или липофекции. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген, например, нуклеиновую кислоту, кодирующую CAR, описанный здесь. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген (например, нуклеиновую кислоту, кодирующую CAR, описанный здесь), а также последовательность нуклеиновой кислоты, кодирующей фермент транспозазу. В других вариантах осуществления предлагается система с двумя нуклеиновыми кислотами, например, двухплазмидная система, например, в которой первая плазмида содержит транспозон, содержащий трансген, а вторая плазмида содержит последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Например, первую и вторую нуклеиновые кислоты совместно доставляют в клетку-хозяина.
В некоторых вариантах осуществления создают клетки, например, T- или NK-клетки, которые экспрессируют CAR, описанный здесь, посредством использования комбинации вставки гена с помощью SBTS и генетического редактирования с помощью нуклеазы (например, нуклеаз с цинковым пальцем (ZFN), эффекторных нуклеаз, подобных активаторам транскрипции (TALEN), системы CRISPR/Cas или реконструированных в сконструированные мегануклеазы хоуминг-эндонуклеаз).
В некоторых вариантах осуществления использование невирусного способа доставки позволяет перепрограммировать клетки, например, T- или NK-клетки, и направить введение клеток в субъекта. Преимущества невирусных векторов включают, но без ограничения, легкость и относительно низкую стоимость получения достаточных количеств, необходимых для удовлетворения популяции пациентов, стабильность во время хранения и отсутствие иммуногенности.
Способы производства/получения
В некоторых вариантах осуществления способы, раскрытые здесь, дополнительно включают в себя введение средства для истощения T-клеток после лечения с помощью клеток (например, иммунных эффекторных клеток, как описано здесь), что уменьшает количество (например, вызывает истощение) экспрессирующих CAR клеток (например, экспрессирующих CD19CAR клеток). Такие средства для истощения T-клеток можно использовать для эффективного истощения экспрессирующих CAR клеток (например, экспрессирующих CD19CAR клеток) для ослабления токсичности. В некоторых вариантах осуществления экспрессирующие CAR клетки производили в соответствии со способом настоящего документа, например, анализировали (например, до или после трансфекции или трансдукции) в соответствии со способом настоящего документа.
В некоторых вариантах осуществления средство для истощения T-клеток вводят через одну, две, три, четыре или пять недель после введения клеток, например, популяции иммунных эффекторных клеток, описанных здесь.
В одном варианте осуществления средство для истощения T-клеток представляет собой средство, которое истощает экспрессирующие CAR клетки, например, посредством индуцирования антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) и/или индуцируемой комплементом клеточной смерти. Например, экспрессирующие CAR клетки, описанные здесь могут также экспрессировать антиген (например, целевой антиген), который распознается молекулами, способными индуцировать клеточную смерть, например, ADCC или индуцируемую комплементом клеточную смерть. Например, экспрессирующие CAR клетки, описанные здесь, могут также экспрессировать белок-мишень (например, рецептор), допускающий воздействие на него антитела или фрагмента антитела. Примеры таких белков-мишеней включают, но без ограничения, EpCAM, VEGFR, интегрины (например, интегрины αVβ3, α4, αIIbβ3, α4β7, α5β1, αVβ3, αV), члены суперсемейства рецепторов TNF (например, TRAIL-R1, TRAIL-R2), рецептор PDGF, интерфероновый рецептор, фолатный рецептор, GPNMB, ICAM-1, HLA-DR, CEA, CA-125, MUC1, TAG-72, рецептор IL-6, 5T4, GD2, GD3, CD2, CD3, CD4, CD5, CD11, CD11a/LFA-1, CD15, CD18/ITGB2, CD19, CD20, CD22, CD23/рецептор IgE, CD25, CD28, CD30, CD33, CD38, CD40, CD41, CD44, CD51, CD52, CD62L, CD74, CD80, CD125, CD147/базиджин, CD152/CTLA-4, CD154/CD40L, CD195/CCR5, CD319/SLAMF7 и EGFR и их усеченные варианты (например, варианты, сохраняющие один или несколько внеклеточных эпитопов, но без одной или нескольких областей в цитоплазматическом домене).
В некоторых вариантах осуществления экспрессирующая CAR клетка коэкспрессирует CAR и белок-мишень, например, естественно экспрессирует белок-мишень или сконструирована для экспрессии белка-мишени. Например, клетка, например, популяция иммунных эффекторных клеток, может включать в себя нуклеиновую кислоту (например, вектор), содержащую нуклеиновую кислоту CAR (например, нуклеиновую кислоту CAR, как описано здесь) и нуклеиновую кислоту, кодирующую белок-мишень.
В одном варианте осуществления средство для истощения T-клеток представляет собой ингибитор CD52, например, молекулу анти-CD52 антитела, например, алемтузумаб.
В других вариантах осуществления клетка, например, популяция иммунных эффекторных клеток, экспрессирует молекулу CAR, как описано здесь (например, CD19CAR), и белок-мишень, распознаваемый средством для истощения T-клеток. В одном варианте осуществления белок-мишень представляет собой CD20. В вариантах осуществления, в которых белок-мишень представляет собой CD20, средство для истощения T-клеток представляет собой анти-CD20 антитело, например, ритуксимаб.
В других вариантах осуществления любого из вышеупомянутых способов способы дополнительно включают в себя трансплантацию клеток, например, гематопоэтических стволовых клеток, или костного мозга, млекопитающему.
В другом аспекте изобретение включает в себя способ кондиционирования млекопитающего перед клеточной трансплантацией. Способ включает в себя введение млекопитающему эффективного количества клеток, содержащих нуклеиновую кислоту или полипептид CAR, например, нуклеиновую кислоту или полипептид CAR CD19. В некоторых вариантах осуществления клеточная трансплантация представляет собой трансплантацию стволовых клеток, например, трансплантацию гематопоэтических стволовых клеток, или трансплантацию костного мозга. В других вариантах осуществления кондиционирование субъекта перед клеточной трансплантацией включает в себя уменьшение количества экспрессирующих мишень клеток у субъекта, например, экспрессирующих CD19 нормальных клеток или экспрессирующих CD19 раковых клеток.
Активация и размножение иммунных эффекторных клеток (например, T-клеток)
Иммунные эффекторные клетки, такие как T-клетки, могут быть активированы и размножены в основном с использованием способов, как описано, например, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041; и публикации патентной заявки США № 20060121005.
Обычно популяция иммунных эффекторных клеток, например, истощенных по регуляторным T-клеткам клеток, может быть размножена посредством контакта с поверхностью, несущей прикрепленное к ней средство, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и лигандом, который стимулирует костимулирующую молекулу на поверхности T-клеток. В частности, популяции T-клеток можно стимулировать, как описано здесь, например, посредством контакта с анти-CD3 антителом или его антигенсвязывающим фрагментом или с анти-CD2 антителом, иммобилизованным на поверхности, или посредством контакта с активатором протеинкиназы C (например, бриостатином) в сочетании с кальциевым ионофором. Для костимуляции вспомогательной молекулы на поверхности T-клеток используют лиганд, который связывает вспомогательную молекулу. Например, популяция T-клеток может быть приведена в контакт с анти-CD3 антителом и анти-CD28 антителом в условиях, подходящих для стимуляции пролиферации T-клеток. Для стимуляции пролиферации или CD4+ T-клеток, или CD8+ T-клеток можно использовать анти-CD3 антитело и анти-CD28 антитело. Можно использовать типичные анти-CD28 антитела, включая 9.3, B-T3, XR-CD28 (Diaclone, Besançon, Франция), как и другие способы, широко известные в данной области техники (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9):13191328, 1999; Garland et al., J. Immunol Meth. 227(1-2):53-63, 1999).
В некоторых аспектах первичный стимулирующий сигнал и костимулирующий сигнал для T-клетки могут быть предоставлены с помощью различных протоколов. Например, средства, обеспечивающие каждый сигнал, могут находиться в растворе или быть связаны с поверхностью. При связывании с поверхностью средства могут быть связаны с одной и той же поверхностью (то есть быть в "цис" расположении) или с различными поверхностями (то есть быть в "транс" расположении). В качестве альтернативы, одно средство может быть связано с поверхностью, а другое средство может находиться в растворе. В одном аспекте средство, обеспечивающее костимулирующий сигнал, связано с клеточной поверхностью, а средство, обеспечивающее сигнал первичной активации, находится в растворе или связано с поверхностью. В некоторых аспектах оба средства могут находиться в растворе. В одном аспекте средства могут находиться в растворимой форме, а затем быть перекрестно сшиты с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы, или антитело, или другое связывающий средство, которое будет связываться с данными средствами. В связи с этим смотри, например, публикации патентных заявок США №№ 20040101519 и 20060034810 в отношении искусственных антигенпрезентирующих клеток (aAPC), которые рассматриваются для использования при активации и размножении T-клеток в настоящем изобретении.
В одном аспекте два средства иммобилизованы на гранулах, или на одной и той же грануле, то есть "цис", или на различных гранулах, то есть "транс." В качестве примера, средство, обеспечивающее сигнал первичной активации представляет собой анти-CD3 антитело или его антигенсвязывающий фрагмент, а средство, обеспечивающее костимулирующий сигнал, представляет собой анти-CD28 антитело или его антигенсвязывающий фрагмент; и оба средства совместно иммобилизованы на одной и той же грануле в эквивалентных молекулярных количествах. В одном аспекте используют отношение 1:1 для антител, связанных с гранулами, для размножения CD4+ T-клеток и роста T-клеток. В некоторых аспектах настоящего изобретения используют такое отношение антител анти-CD3:CD28, связанных с гранулами, что наблюдается увеличение размножения T-клеток по сравнению с размножением, наблюдаемым при использовании отношения 1:1. В одном конкретном аспекте наблюдается увеличение, составляющее от приблизительно 1 до приблизительно 3-кратного по сравнению с размножением, наблюдаемым при использовании отношения 1:1. В одном аспекте отношение антител к CD3:CD28, связанных с гранулами, находится в диапазоне, включающем в себя от 100:1 до 1:100 и все промежуточные целочисленные значения. В одном аспекте с частицами связано больше анти-CD28 антитела, чем анти-CD3 антитела, то есть отношение CD3:CD28 меньше чем один. В некоторых аспектах отношение анти-CD28 антитела к анти-CD3 антителу, связанным с гранулами, больше чем 2:1. В одном конкретном аспекте используют отношение CD3:CD28 антител, связанных гранулами, равное 1:100. В одном аспекте, используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:75. В другом аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:50. В одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:30. В одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:10. В одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 1:3. В еще одном аспекте используют отношение CD3:CD28 антител, связанных с гранулами, равное 3:1.
Для стимуляции T-клеток или других клеток-мишеней можно использовать отношения частиц к клеткам, составляющее от 1:500 до 500:1 и любое промежуточное целочисленное значение. Как легко смогут понять средние специалисты в данной области техники, отношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, гранулы небольшого размера могут связываться только с несколькими клетками, тогда как гранулы большего размера могут связываться со многими клетками. В некоторых аспектах отношение клеток к частицам находится в диапазоне, включающем в себя от 1:100 до 100:1 и любое промежуточное целочисленное значение, а в других аспектах для стимуляции T-клеток также может быть использовано отношение, которое содержит от 1:9 до 9:1 и все промежуточные целочисленные значения. Отношение анти-CD3- и анти-CD28-связанных частиц к T-клеткам, которое приводит к стимуляции T-клеток, может, как отмечено выше, изменяться, однако некоторые подходящие значения включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, причем одно подходящее отношение частиц к T-клеткам составляет по меньшей мере 1:1. В одном аспекте используют отношение частиц к клеткам, составляющее 1:1 или меньше. В одном конкретном аспекте подходящее отношение частица:клетка составляет 1:5. В других аспектах отношение частиц к клеткам может изменяться в зависимости от дня стимуляции. Например, в одном аспекте отношение частиц к клеткам составляет от 1:1 до 10:1 на первый день, и каждый день или через день после этого в течение вплоть до 10 дней к клеткам добавляют дополнительные частицы при итоговых отношениях, составляющих от 1:1 до 1:10 (исходя из количества клеток на день добавления). В одном конкретном аспекте отношение частиц к клеткам составляет 1:1 на первый день стимуляции, и его доводят до 1:5 на третий и пятый дни стимуляции. В одном аспекте частицы добавляют ежедневно или через день до итогового отношения, составляющего 1:1 на первый день и 1:5 на третий и пятый дни стимуляции. В одном аспекте отношение частиц к клеткам составляет 2:1 на первый день стимуляции, и его доводят до 1:10 на третий и пятый дни стимуляции. В одном аспекте частицы добавляют ежедневно или через день до итогового отношения, составляющего 1:1 на первый день и 1:10 на третий и пятый дни стимуляции. Специалисту в данной области техники будет понятно, что для использования в настоящем изобретении подходящими могут быть различные другие отношения. В частности, отношения будут изменяться в зависимости от размера частиц и от размера и типа клеток. В одном аспекте наиболее типичные отношения для использования на первый день лежат вблизи от 1:1, 2:1 и 3:1.
В других аспектах клетки, такие как T-клетки, объединяют с покрытыми средством гранулами, затем гранулы и клетки разделяют, и затем клетки культивируют. В альтернативном аспекте перед культивированием покрытые средством гранулы и клетки не разделяют, но культивируют вместе. В другом аспекте гранулы и клетки вначале концентрируют с помощью силы, такой как магнитная сила, что приводит к увеличению лигирования маркеров клеточной поверхности, что индуцирует стимуляцию клеток.
В качестве примера, белки клеточной поверхности могут быть лигированы посредством обеспечения контакта парамагнитных гранул, к которым прикреплены анти-CD3 и анти-CD28 (гранул 3×28), с T-клетками. В одном аспекте клетки (например, от 104 до 109 T-клеток) и гранулы (например, парамагнитные гранулы DYNABEADS® M-450 CD3/CD28 T в отношении 1:1) объединяют в буфере, например, ФСБ (без двухвалентных катионов, таких как кальций и магний). При этом средним специалистам в данной области техники будет ясно, что можно использовать любую концентрацию клеток. Например, клетка-мишень может очень редко встречаться в образце и содержатся только в 0,01% образца, или весь образец (то есть, 100%) может содержать представляющую интерес клетку-мишень. Соответственно, любое количество клеток находится в контексте настоящего изобретения. В определенных аспектах может быть желательным значительно уменьшить объем, в котором частицы и клетки смешивают вместе (то есть увеличить концентрацию клеток) для обеспечения максимального контакта клеток и частиц. Например, в одном аспекте используют концентрацию, составляющую приблизительно 10 миллиардов клеток на мл, 9 миллиардов на мл, 8 миллиардов на мл, 7 миллиардов на мл, 6 миллиардов на мл, 5 миллиардов на мл или 2 миллиарда клеток на мл. В одном аспекте используют больше чем 100 миллионов клеток на мл. В другом аспекте используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток на мл. В еще одном аспекте используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток на мл. В других аспектах можно использовать концентрации, составляющие 125 или 150 миллионов клеток на мл. Использование высоких концентраций может приводить к увеличению выхода клеток, активации клеток и размножения клеток. Кроме того, использование высоких концентраций клеток делает возможным более эффективный захват клеток, которые могут слабо экспрессировать антигены-мишени, представляющие интерес, таких как CD28-отрицательные T-клетки. Такие популяции клеток могут иметь терапевтическое значение, и в некоторых аспектах их получение было бы желательныс. Например, использование высоких концентраций клеток делает возможной более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
В одном варианте осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описанный здесь, например, CAR CD19, описанный здесь, размножают, например, с помощью способа, описанного здесь. В одном варианте осуществления клетки размножают в культуре в течение периода, составляющего от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 часов) до приблизительно 14 дней (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней). В одном варианте осуществления клетки размножают в течение периода, составляющего 4-9 дней. В одном варианте осуществления клетки размножают в течение периода, составляющего 8 дней или менее, например, 7, 6 или 5 дней. В одном варианте осуществления клетки размножают в культуре в течение 5 дней, и получаемые клетки являются более активными, чем те же клетки, размноженные в культуре в течение 9 дней в тех же условиях культивирования. Активность может быть определена, например, по различным T-клеточным функциям, например, пролиферации, киллингу клеток-мишеней, производству цитокинов, активации, миграции или их комбинациям. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех- или четырехкратное увеличение клеточных удвоений при антигенной стимуляции по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR CD19, описанный здесь, размножают в культуре в течение 5 дней, и получаемые клетки проявляют более высокое производство провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетка с CAR CD19, описанная здесь, размноженные в течение 5 дней, показывают по меньшей мере одно-, двух-, трех-, четырех-, пяти-, десятикратное или более увеличение производства провоспалительных цитокинов в пг/мл, например, уровней IFN-γ и/или GM-CSF, по сравнению с теми же клетками, размноженными в культуре в течение 9 дней в тех же условиях культивирования.
Также желательным может быть проведение нескольких циклов стимуляции, так что время культивирования T-клеток может составлять 60 дней или более. Условия, подходящие для культивирования T-клеток, включают в себя соответствующие среды (например, минимальные эссенциальные среды, или RPMI Media 1640, или X-vivo 15, (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток, известные специалисту. Другие добавки для роста клеток включают, но без ограничения, поверхностно-активное вещество, плазманат и восстанавливающие средства, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer с добавлением аминокислот, пирувата натрия и витаминов, или без сыворотки, или дополненные подходящим количеством сыворотки (или плазмы), или определенным набором гормонов, и/или количеством цитокина(ов), достаточным для роста и размножения T-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения субъекту. Клетки-мишени сохраняют в условиях, необходимых для поддержания роста, например, при подходящих температуре (например, 37° C) и атмосфере (например, воздух плюс 5% CO2).
В одном варианте осуществления клетки размножают в подходящей среде (например, среде, описанной здесь), которая включает в себя один или несколько интерлейкинов, что приводит к по меньшей мере 200-кратному (например, 200-кратному, 250-кратному, 300-кратному, 350-кратному) увеличению количества клеток в течение 14-дневного периода размножения, например, как измерено с помощью способа, описанного здесь, такого как проточная цитометрия. В одном варианте осуществления клетки размножают в присутствии IL-15 и/или IL-7 (например, IL-15 и IL-7).
В вариантах осуществления способы, описанные здесь, например, способы получения экспрессирующей CAR клетки, содержат удаление регуляторных T-клеток, например, CD25+ T-клеток, из клеточной популяции, например, с использованием анти-CD25 антитела, или его фрагмента, или CD25-связывающего лиганда, IL-2. Способы удаления регуляторных T-клеток, например, CD25+ T-клеток, из клеточной популяции описаны здесь. В вариантах осуществления способы, например, способы получения, дополнительно содержат приведение клеточной популяции (например, клеточной популяции, в которой были истощены регуляторные T-клетки, такие как CD25+ T-клетки; или клеточной популяции, которая ранее контактировала с анти-CD25 антителом, его фрагментом или CD25-связывающим лигандом) в контакт с IL-15 и/или IL-7. Например, клеточную популяцию (например, которая ранее контактировала с анти-CD25 антителом, его фрагментом или CD25-связывающим лигандом) размножают в присутствии IL-15 и/или IL-7.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей полипептид интерлейкина-15 (IL-15), полипептид рецептора-альфа интерлейкина-15 (IL-15Ra) или комбинацию как полипептида IL-15, так и полипептида IL-15Ra, например, hetIL-15, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей полипептид IL-15, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей комбинацию как полипептида IL-15, так и полипептида IL-15 Ra, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей hetIL-15, во время получения экспрессирующей CAR клетки, например, ex vivo.
В одном варианте осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей hetIL-15, во время ex vivo размножения. В варианте осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей полипептид IL-15, во время ex vivo размножения. В варианте осуществления экспрессирующую CAR клетку, описанную здесь, приводят в контакт с композицией, содержащей как полипептид IL-15, так и полипептид IL-15Ra, во время ex vivo размножения. В одном варианте осуществления приведение в контакт приводит к выживаемости и пролиферации субпопуляции лимфоцитов, например, CD8+ T-клеток.
T-клетки, которые подвергались воздействию различных времен стимуляции, могут иметь различные характеристики. Например, типичные продукты крови или аферезных мононуклеарных клеток периферической крови имеют популяцию хелперных T-клеток (TH, CD4+), которая больше, чем популяция цитотоксических или супрессорных T-клеток (TC, CD8+). Ex vivo размножение T-клеток посредством стимуляции рецепторов CD3 и CD28 производит популяцию T-клеток, которая приблизительно за 8-9 дней состоит преимущественно из TH-клеток, тогда как приблизительно через 8-9 дней популяция T-клеток содержит гораздо большую популяцию TC-клеток. Соответственно, в зависимости от цели лечения может быть полезным введение субъекту популяции T-клеток, содержащей преимущественно TH-клетки. Аналогично, если была выделена антиген-специфическая подгруппа TC-клеток, полезным может быть размножение в большей степени данной подгруппы.
Кроме того, помимо маркеров CD4 и CD8, в процессе размножения клеток значительно изменяются, но по большей части воспроизводимо, другие фенотипические маркеры. Таким образом, такая воспроизводимость обеспечивает способность к адаптации активированного T-клеточного продукта к конкретным целям.
После того, как CAR, описанный здесь, сконструирован, можно использовать различные анализы для оценки активности молекулы, такой как, но без ограничения, способность к размножению T-клеток после антигенной стимуляции, поддержание T-клеточного размножения в отсутствие повторной стимуляции и противораковая активность в подходящих моделях in vitro и на животных. Анализы для оценки эффектов CAR настоящего изобретения описаны более подробно ниже.
Анализ экспрессии CAR с помощью вестерн-блоттинга в первичных T-клетках можно использовать для детектирования присутствия мономеров и димеров, например, как описано в абзаце 695 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Размножение CAR+ T-клеток in vitro после антигенной стимуляции может быть измерено с помощью проточной цитометрии. Например, смесь CD4+ и CD8+ T-клеток стимулируют aAPC αCD3/αCD28 с последующей трансдукцией лентивирусными векторами, экспрессирующими GFP, под управлением промоторов, подлежащих анализу. Типичные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают на 6 день культивирования в подгруппах CD4+ и/или CD8+ T-клеток с помощью проточной цитометрии. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В качестве альтернативы, смесь CD4+ и CD8+ T-клеток стимулируют покрытыми αCD3/αCD28 магнитными гранулами на день 0 и трансдуцируют CAR на день 1 с использованием бицистронного лентивирусного вектора, экспрессирующего CAR вместе с eGFP с использованием последовательности рибосомального скачка 2A. Культуры повторно стимулируют или положительными по ассоциированному с раком антигену, как описано здесь, K562-клетками (K562, экспрессирующими ассоциированный с раком антиген, как описано здесь), K562-клетками дикого типа (K562 дикого типа) или K562-клетками, экспрессирующими hCD32 и 4-1BBL в присутствии анти-CD3 и анти-CD28 антитела (K562-BBL-3/28), после промывания. Через день в культуры добавляют 100 МЕ/мл экзогенного IL-2. GFP+ T-клетки подсчитывают с помощью проточной цитометрии с использованием подсчета на основе гранул. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009).
Также может быть измерено установившееся размножение CAR+ T-клеток в отсутствие повторной стимуляции. Смотри, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Кратко говоря, измеряют средний объем T-клетки (fl) на 8 день культивирования с использованием счетчика частиц Coulter Multisizer III, Nexcelom Cellometer Vision или Millipore Scepter после стимуляции с помощью покрытых αCD3/αCD28 магнитных гранул на день 0 и трансдукции указанным CAR на день 1.
Также для измерения активности экспрессирующей CAR клетки можно использовать модели на животных, например, как описано в абзаце 698 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Может быть оценен дозозависимый ответ на лечение CAR, например, как описано в абзаце 699 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Оценка клеточной пролиферации и производства цитокинов была описана ранее, как описано в абзаце 700 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Цитотоксичность может быть оценена с помощью стандартного анализа высвобождения 51Cr, например, как описано в абзаце 701 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Цитотоксичность может также быть оценена с помощью измерения изменений электрического импеданса адгезивной клетки, например, с использованием клеточного анализатора xCELLigence, работающего в реальном времени, (RTCA). В некоторых вариантах осуществления цитотоксичность измеряют в нескольких временных точках.
Можно использовать технологии визуализации для оценки специфической миграции и пролиферации CAR в моделях на несущих опухоль животных, например, как описано в абзаце 702 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Можно также использовать для оценки CAR, описанных здесь, другие анализы, включая описанные в разделе примеров здесь, а также известные в данной области техники.
В качестве альтернативы, или в комбинации со способами, раскрытыми здесь, раскрыты способы и композиции для одного или нескольких из: детектирования и/или количественного описания CAR-экспрессирующих клеток (например, in vitro или in vivo (например, клинического мониторинга)); размножения и/или активации иммунных клеток; и/или CAR-специфической селекции, которая включает в себя использование лиганда CAR. В одном типичном варианте осуществления лиганд CAR представляет собой антитело, которое связывается с молекулой CAR, например, связывается с внеклеточным антигенсвязывающим доменом CAR (например, антитело, которое связывается с антигенсвязывающим доменом, например, антиидиотипическое антитело; или антитело, которое связывается с константной областью внеклеточного связывающего домена). В других вариантах осуществления лиганд CAR представляет собой молекулу антигена CAR (например, молекулу антигена CAR, как описано здесь).
В одном аспекте раскрыт способ детектирования и/или количественного описания CAR-экспрессирующих клеток. Например, можно использовать лиганд CAR для детектирования и/или количественного описания CAR-экспрессирующих клеток in vitro или in vivo (например, клинического мониторинга CAR-экспрессирующих клеток у пациента или дозирования пациенту). Способ включает в себя:
предоставление лиганда CAR (необязательно, меченого лиганда CAR, например, лиганда CAR, который включает в себя маркер, гранулу, радиоактивную или флуоресцентную метку);
получение экспрессирующей CAR клетки (например, получение образца, содержащего CAR-экспрессирующие клетки, такого как производственный образец или клинический образец);
приведение экспрессирующей CAR клетки в контакт с лигандом CAR в условиях, в которых происходит связывание, что позволяет детектировать уровень (например, количество) присутствующих CAR-экспрессирующих клеток. Связывание экспрессирующей CAR клетки с лигандом CAR может быть детектировано с использованием стандартных методов, таких как FACS, ELISA и тому подобные.
В другом аспекте раскрыт способ размножения и/или активации клеток (например, иммунных эффекторных клеток). Способ включает в себя:
предоставление экспрессирующей CAR клетки (например, первой экспрессирующей CAR клетки или временно экспрессирующей CAR клетки);
приведение упомянутой экспрессирующей CAR клетки в контакт с лигандом CAR, например, лигандом CAR, описанном здесь), в условиях, в которых происходят размножение и/или пролиферация иммунных клеток, благодаря чему получают популяцию активированных и/или размноженных клеток.
В некоторых вариантах осуществления лиганд CAR присутствует на субстрате (например, иммобилизован или прикреплен к субстрату, например, неприродному субстрату). В некоторых вариантах осуществления субстрат представляет собой неклеточный субстрат. Неклеточный субстрат может представлять собой твердую подложку, выбранную из, например, планшета (например, микротитровального планшета), мембраны (например, нитроцеллюлозной мембраны), матрицы, чипа или гранулы. В вариантах осуществления лиганд CAR присутствует в субстрате (например, на поверхности субстрата). Лиганд CAR может быть иммобилизован, прикреплен или ковалентно или нековалентно связан (например, перекрестно сшит) с субстратом. В одном варианте осуществления лиганд CAR прикреплен (например, ковалентно прикреплен) к грануле. В вышеупомянутых вариантах осуществления популяция иммунных клеток может быть размножена in vitro или ex vivo. Способ может дополнительно включать в себя культивирование популяции иммунных клеток в присутствии лиганда молекулы CAR, например, с использованием любого из способов, описанных здесь.
В других вариантах осуществления способ размножения и/или активации клеток дополнительно содержит добавление второй стимулирующей молекулы, например, CD28. Например, лиганд CAR и вторая стимулирующая молекула могут быть иммобилизованы на субстрате, например, одной или нескольких гранулах, что обеспечивает увеличение размножения и/или активации клеток.
В еще одном аспекте предлагается способ селекции или обогащения экспрессирующих CAR клеток. Способ включает в себя приведение экспрессирующей CAR клетки в контакт с лигандом CAR, как описано здесь; и селекцию клеток на сновании связывания лиганда CAR.
В других вариантах осуществления предлагается способ истощения, уменьшения количества и/или киллинга экспрессирующей CAR клетки. Способ включает в себя приведение экспрессирующей CAR клетки в контакт с лигандом CAR, как описано здесь; и воздействие на клетку на основании связывания лиганда CAR, что уменьшает количество экспрессирующих CAR клеток и/или убивает их. В одном варианте осуществления лиганд CAR связан с токсическим средством (например, токсином или клеточно-аблятивным препаратом). В другом варианте осуществления антиидиотипическое антитело может вызывать активность эффекторных клеток, например, активность ADCC или ADC.
Типичные анти-CAR антитела, которые можно использовать в способах, раскрытых здесь, описаны, например, в документах WO 2014/190273 и Jena et al., "Chimeric Antigen Receptor (CAR)-Specific Monoclonal Antibody to Detect CD19-Specific T cells in Clinical Trials", PLOS March 2013 8:3 e57838, содержание которых включено посредством ссылки.
В некоторых аспектах и вариантах осуществления композиции и способы настоящего документа оптимизированы для конкретной подгруппы T-клеток, например, как описано в заявке США сериальный № PCT/US2015/043219, поданной 31 июля 2015 года, содержание которой включено в настоящий документ посредством ссылки во всей полноте. В некоторых вариантах осуществления оптимизированные подгруппы T-клеток демонстрируют увеличенную жизнестойкость по сравнению с контрольной T-клеткой, например, T-клеткой другого типа (например, CD8+ или CD4+), экспрессирующей тот же конструкт.
В некоторых вариантах осуществления CD4+ T-клетка содержит CAR, описанный здесь, причем данный CAR содержит внутриклеточный сигнальный домен, подходящий (например, оптимизированный, например, приводящий к увеличенной жизнестойкости) для CD4+ T-клетки, например, домен из ICOS. В некоторых вариантах осуществления CD8+ T-клетка содержит CAR, описанный здесь, причем данный CAR содержит внутриклеточный сигнальный домен, подходящий (например, оптимизированный, например, приводящий к увеличенной жизнестойкости) для CD8+ T-клетки, например, домен из 4-1BB, домен из CD28 или другой костимулирующий домен, отличный от домена из ICOS. В некоторых вариантах осуществления CAR, описанный здесь, содержит антигенсвязывающий домен, описанный здесь, например, CAR содержит антигенсвязывающий домен.
В аспекте здесь описан способ лечения субъекта, например, субъекта, имеющего рак. Способ включает в себя введение упомянутому субъекту эффективного количества:
1) CD4+ T-клетки, содержащей CAR (CARCD4+), содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описанный здесь;
трансмембранный домен; и
внутриклеточный сигнальный домен, например, первый костимулирующий домен, например, домен из ICOS; и
2) CD8+ T-клетки, содержащей CAR (CARCD8+), содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описанный здесь;
трансмембранный домен; и
внутриклеточный сигнальный домен, например, второй костимулирующий домен, например, домен из 4-1BB, домен из CD28 или другой костимулирующий домен, отличный от домена из ICOS;
причем CARCD4+ и CARCD8+ отличаются друг от друга.
Необязательно, способ дополнительно включает в себя введение:
3) второй CD8+ T-клетки, содержащей CAR (второй CARCD8+), содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описанный здесь;
трансмембранный домен; и
внутриклеточный сигнальный домен, причем второй CARCD8+ содержит внутриклеточный сигнальный домен, например, костимулирующий сигнальный домен, не присутствующий на CARCD8+, и, необязательно, не содержит сигнальный домен из ICOS.
Биополимерные способы доставки
В некоторых вариантах осуществления одна или несколько CAR-экспрессирующих клеток, как раскрыто здесь, могут быть введены или доставлены субъекту с помощью биополимерного каркаса, например, биополимерного имплантата. Биополимерные каркасы могут поддерживать или улучшать доставку, размножение и/или рассеяние CAR-экспрессирующих клеток, описанных здесь. Биополимерный каркас содержит биосовместимый (например, по существу не вызывающий воспалительного или иммунного ответа) и/или биоразлагаемый полимер, который может быть природным или синтетическим.Типичные биополимеры описаны, например, в абзацах 1004-1006 международной заявки WO2015/142675, поданной 13 марта 2015 года, которая включена в настоящий документ посредством ссылки во всей полноте.
Фармацевтические композиции и виды лечения
В некоторых аспектах настоящее раскрытие предлагает способ лечения пациента, содержащий введение экспрессирующих CAR клеток, получаемых, как описано здесь, необязательно в комбинации с одной или несколькими другими терапиями. В некоторых аспектах настоящее раскрытие предлагает способ лечения пациента, содержащий введение реакционной смеси, содержащей экспрессирующие CAR клетки, как описано здесь, необязательно в комбинации с одной или несколькими другими терапиями. В некоторых аспектах настоящее раскрытие предлагает способ отправки или приема реакционной смеси, содержащей экспрессирующие CAR клетки, как описано здесь. В некоторых аспектах, настоящее раскрытие предлагает способ лечения пациента, содержащий прием экспрессирующей CAR клетки, которая была получена, как описано здесь, и дополнительно содержащий введение экспрессирующей CAR клетки пациенту, необязательно в комбинации с одной или несколькими другими терапиями. В некоторых аспектах настоящее раскрытие предлагает способ лечения пациента, содержащий получение экспрессирующей CAR клетки, как описано здесь, и дополнительно содержащий введение экспрессирующей CAR клетки пациенту, необязательно в комбинации с одной или несколькими другими терапиями. Другая терапия может представлять собой, например, терапию рака, такую как химиотерапия.
В варианте осуществления клетки, экспрессирующие CAR, описанный здесь, вводят субъекту в комбинации с молекулой, которая уменьшает популяцию Treg-клеток. Способы, которые уменьшают количество (например, истощают) Treg-клетки, известны в данной области техники, и включают, например, истощение по CD25, введение циклофосфамида, модулирование функции GITR. Не желая быть связанными теорией, авторы полагают, что уменьшение количества Treg-клеток у субъекта перед аферезом или перед введением экспрессирующей CAR клетки, описанной здесь, уменьшает количество нежелательных иммунных клеток (например, Treg) в микроокружении опухоли и уменьшает риск рецидива у субъекта.
В одном варианте осуществления терапию, описанную здесь, например, экспрессирующую CAR клетку, вводят субъекту в комбинация с молекулой, воздействующей на GITR и/или модулирующей функции GITR, такой как агонист GITR и/или антитело к GITR, которое истощает регуляторные T-клетки (Treg). В вариантах осуществления клетки, экспрессирующие CAR, описанный здесь, вводят субъекту в комбинации с циклофосфамидом. В одном варианте осуществления молекулы, связывающие GITR, и/или молекулы, модулирующие функции GITR, (например, агонист GITR и/или истощающие Treg антитела к GITR) вводят перед экспрессирующей CAR клеткой. Например, в одном варианте осуществления перед аферезом клеток может быть введен агонист GITR. В вариантах осуществления субъекту перед введением (например, вливанием или повторным вливанием) экспрессирующей CAR клетки или перед аферезом клеток вводят циклофосфамид. В вариантах осуществления субъекту перед введением (например, вливанием или повторным вливанием) экспрессирующей CAR клетки или перед аферезом клеток вводя циклофосфамид и анти-GITR антитело. В одном варианте осуществления субъект имеет рак (например, солидный рак или гематологический рак, такой как ОЛЛ или ХЛЛ). В одном варианте осуществления субъект имеет ХЛЛ. В вариантах осуществления субъект имеет ОЛЛ. В вариантах осуществления субъект имеет солидный рак, например, солидный рак, описанный здесь. Типичные агонисты GITR включают, например, белки слияния GITR и анти-GITR антитела (например, двухвалентные анти-GITR антитела), такие как, например, белок слияния GITR, описанный в патенте США № 6111090, европейском патенте № 090505B1, патенте США № 8586023, публикациях PCT №№ WO 2010/003118 и 2011/090754, или анти-GITR антитело, описанное, например, в патенте США № 7025962, европейском патенте № 1947183B1, патенте США № 7812135, патенте США № 8388967, патенте США № 8591886, европейском патенте № EP 1866339, публикации PCT № WO 2011/028683, публикации PCT № WO 2013/039954, публикации PCT № WO2005/007190, публикации PCT № WO 2007/133822, публикации PCT № WO2005/055808, публикации PCT № WO 99/40196, публикации PCT № WO 2001/03720, публикации PCT № WO99/20758, публикации PCT № WO2006/083289, публикации PCT № WO 2005/115451, патенте США № 7618632 и публикации PCT № WO 2011/051726.
В одном варианте осуществления экспрессирующую CAR клетку, описанную здесь, вводят субъекту в комбинации с агонистом GITR, например, агонистом GITR, описанным здесь. В одном варианте осуществления агонист GITR вводят перед экспрессирующей CAR клеткой. Например, в одном варианте осуществления агонист GITR может быть введен перед аферезом клеток. В одном варианте осуществления субъект имеет ХЛЛ.
Способы, описанные здесь, могут дополнительно включать в себя составление экспрессирующей CAR клетки в фармацевтическую композицию. Фармацевтические композиции могут содержать экспрессирующую CAR клетку, например, множество экспрессирующих CAR клеток, как описано здесь, в комбинации с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или вспомогательными средствами. Такие композиции могут содержать буферы, такие как нейтральный буферный раствор, фосфатный буферный раствор и тому подобные; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия); и консерванты. Композиции могут быть составлены, например, для внутривенного введения.
В одном варианте осуществления фармацевтическая композиция по существу свободна от примеси, например, отсутствуют детектируемые уровни примеси, например, выбранной из группы, состоящей из эндотоксина, микоплазмы, компетентного по репликации лентивируса (RCL), p24, нуклеиновой кислоты VSV-G, HIV gag, остатка гранул с анти-CD3/анти-CD28 покрытием, мышиных антител, смешанной человеческой сыворотки, бычьего сывороточного альбумина, бычьей сыворотки, компонентов культуральной среды, компонентов упаковывающих вектор клеток или плазмид, бактерий и грибов. В одном варианте осуществления бактерия по меньшей мере выбрана из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia и Streptococcus pyogenes группы A.
Когда указано "иммунологически эффективное количество", "эффективное противораковое количество", "эффективное ингибирующее рак количество" или "терапевтическое количество", точное количество композиций, подлежащее введению, может быть определено врачом с учетом индивидуальных различий в возрасте, весе, размере опухоли, степени инфекции или метастазирования и состояния пациента (субъекта). Как правило, можно утверждать, что фармацевтическая композиция, содержащая иммунные эффекторные клетки (например, T-клетки, NK-клетки), описанные здесь, может быть введена в дозировке, составляющей от 104 до 109 клеток на кг веса тела, в некоторых случаях от 105 до 106 клеток на кг веса тела, включая все целочисленные значения в пределах данных диапазонов. T-клеточные композиции также можно вводить в этих дозировках множество раз. Клетки могут быть введены посредством использования способов введения, которые хорошо известны в иммунотерапии (смотри, например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988).
В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108 или 5×108 клеток на кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит по меньшей мере приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108 или 5×108 клеток на кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит вплоть до приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108 или 5×108клеток на кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит приблизительно 1,1×106-1,8×107 клеток на кг. В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит по меньшей мере приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза клеток с CAR (например, клеток с CAR CD19) содержит вплоть до приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток.
В некоторых аспектах может быть желательно вводить активированные иммунные эффекторные клетки (например, T-клетки, NK-клетки) субъекту, а затем повторно отбирать кровь (или осуществлять аферез), активировать в ней иммунные эффекторные клетки (например, T-клетки, NK-клетки) и повторно вливать пациенту эти активированные и размноженные иммунные эффекторные клетки (например, T-клетки, NK-клетки). Этот процесс можно осуществлять множество раз каждые несколько недель. В некоторых аспектах можно активировать иммунные эффекторные клетки (например, T-клетки, NK-клетки) из отборов крови объемом от 10 см3 до 400 см3. В некоторых аспектах активируют иммунные эффекторные клетки (например, T-клетки, NK-клетки) из отборов крови объемом 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3.
Введение рассматриваемых композиций может быть осуществлено любым удобным способом. Композиции, описанные здесь, могут быть введены пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, внутрь узлов, внутрь костного мозга, внутримышечно, посредством внутривенной (в/в) инъекции или внутрибрюшинно, например, посредством внутрикожной или подкожной инъекции. Композиции иммунных эффекторных клеток (например, T-клеток, NK-клеток) могут быть инъецированы непосредственно в опухоль, лимфатический узел или участок инфекции.
ПРИМЕРЫ
Настоящее изобретение далее описано подробно посредством ссылки на нижеследующие экспериментальные примеры. Эти примеры приведены только с целью иллюстрации и не предназначены для ограничения, если не указано иное. Таким образом, настоящее изобретение никоим образом не должно быть истолковано как ограниченное нижеследующими примерами, а, скорее, должно быть истолковано как охватывающее любые и все вариации, которые станут очевидными благодаря идеям, предлагаемым здесь.
Пример 1: Оптимизация производства CART с помощью экзогенных цитокинов
Цитокины выполняют важные функции, связанные с размножением, дифференцировкой, выживанием и гомеостазом T-клеток. Одним из наиболее важных семейств цитокинов для клинического применения является семейство цитокинов с общей γ-цепью (γc), которое включает в себя интерлейкин (IL)-2, IL-4, IL-7, IL-9, IL-15 и IL-21 (Liao et al., 2013, Immunity, 38:13-25). IL-2 широко изучался как иммунотерапевтическое средство для лечения рака. Добавление IL-2 усиливало противоопухолевую способность анти-CAR CD19-T-клеток в клинических исследованиях (Xu et al., 2013, Lymphoma, 54:255-60). Однако введение IL-2 ограничено побочными эффектами, склонностью к размножению регуляторных T-клеток и эффектом индуцированной активацией смерти клеток (AICD) (Malek et al., 2010, Immunity, 33:153-65; и Lenardo et al., 1999, Annu Rev Immunol, 17:221-53). IL-7, IL-15 и IL-21 могут увеличивать эффективность адоптивной иммунотерапии и, по-видимому, менее токсичны по сравнению с IL-2 (Alves et al., 2007, Immunol Lett, 108:113-20). Несмотря на обширные доклинические и клинические исследования о роли вышеуказанных цитокинов, отсутствуют многопараметрические сравнительные исследования роли различных экзогенных γc-цитокинов в адоптивной терапии CAR-T-клетками.
Помимо цитокинов с γ-цепью, другим иммуностимулирующим цитокином, регулирующим иммунные ответы, является IL-18, который увеличивает производство IFN-γ T-клетками и увеличивает цитолитическую активность CTL (Srivastava et al., 2010, Curr Med Chem, 17:3353-7). Введение IL-18 безопасно и хорошо переносится, даже когда доза достигает 1000 мкг/кг (Robertson et al., 2006, Clin Cancer Res, 12:4265-73). Поэтому IL-18 может быть другим кандидатом, используемым для усиления противоопухолевого эффекта CAR-T-клеток.
В данном примере исследовали эффект от введения различных экзогенных цитокинов нв размножение, фенотип, in vitro эффекторные функции и in vivo противоопухолевую эффективность T-клеток и CART-клеток с фолатным рецептором-альфа (FRα).
В экспериментах, описанных в данном примере, использовали следующие материалы и способы.
Конструирование CAR и получение лентивируса
Вектор pELNS-C4-27z CAR был сконструирован, как описано ранее (рукопись на рассмотрении). Вкратце, pHEN2 плазмиду, содержащую анти-FRα C4/AFRA4 scFv, использовали в качестве матрицы для ПЦР-амплификации фрагмента C4 с использованием праймеров 5′-ataggatcccagctggtggagtctgggggaggc-3′ (SEQ ID NO: 19) и 5′-atagctagcacctaggacggtcagcttggtccc-3′ (SEQ ID NO: 24) (подчеркнуты BamHI и NheI). Продукт ПЦР и самоинактивирующиеся лентивирусные векторы экспрессии pELNS третьего поколения расщепляли BamHI и NheI. Расщепленные продукты ПЦР затем вставляли в вектор pELNS, содержащий T-клеточный сигнальный домен CD27-CD3z, в котором экспрессия трансгена управляется промотором фактора элонгации-1α (EF-1α).
Репликационно-дефектный лентивирус с высокими тирами был получен с помощью трансфекции клеток линии человеческих эмбриональных клеток почек 293T (293T) четырьмя плазмидами (pVSV-G, pRSV.REV, pMDLg/p.RRE и pELNS-C4-27z CAR) посредством использования Express In (Open Biosystems), как описано ранее. Супернатанты отбирали через 24 ч и 48 ч после трансфекции и концентрировали ультрацентрифугированием. Титры вируса определяли на основании эффективности трансдукции лентивируса в клетки SupT1 посредством использования способа предельного разбавления.
T-клетки и клеточные линии
Лимфоциты периферической крови были получены от здоровых доноров после информированного согласия по протоколу, утвержденному Экспертным советом Университета Пенсильвании. Первичные Т-клетки были приобретены у Human Immunology Core после очистки отрицательной селекцией. T-клетки культивировали в полной среде (RPMI 1640 с добавлением 10% ФБС, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина сульфата) и стимулировали покрытыми анти-CD3 и анти-CD28 mAb гранулами (Invitrogen) в отношении 1:1 в соответствии с инструкцией. Через двадцать четыре часа после активации клетки трансдуцировали лентивирусом при MOI 5. Указанные цитокины добавляли к трансдуцированным Т-клеткам со следующего дня с конечной концентрацией 10 нг/мл. Цитокины заменяли каждые 3 дня.
Клетки 293T, используемые для упаковки лентивируса, и клетки SupT1, используемые для лентивирусного титрования, получали от ATCC. Клеточные линии установленного рака яичников SKOV3 (FRα+) и C30 (Frα-) использовали в качестве клетки-мишени для анализа секреции и цитотоксичности цитокинов. Для биолюминесцентных анализов SKOV3 трансдуцировали лентивирусом для экспрессии люциферазы светлячка (fLuc).
Проточный цитометрический анализ и сортировка клеток
Проточную цитометрию проводили на BD FACSCanto. Античеловеческий CD45 (HI30), CD3 (HIT3a), CD8 (HIT8a), CD45RA (HI100), CD62L (DREG-56), CCR7 (G043H7), IL-7Rα (A019D5), CD27 (M-T271), CD28 (CD28,2), CD95 (DX2), TNF-α (MAb11), IFN-γ (4S.B3), IL-2 (MQ1-17H12), перфорин (B-D48), гранзим-B (GB11) получали от Biolegend. Биотин-SP-конъюгированный кроличий античеловеческий IgG (H+L) был приобретен у Jackson Immunoresearch, а конъюгированный с APC стрептавидин был приобретен у Biolegand. Античеловеческий Bcl-xl (7B2,5) был приобретен у SouhernBiotech. Набор для апоптоза и пробирки TruCount были получены от BD Bioscience. Кровь для подсчета T-клеток периферической крови получали посредством ретроорбитального кровотечения и окрашивали на присутствие человеческих CD45, CD3, CD4 и CD8 T-клеток. Гейтированные по человеческому CD45+, CD3+, CD4+ и CD8+ подгруппы количественно анализировали с помощью пробирок TruCount в соответствии с инструкциями производителя.
Исследование адоптивной клеточной терапии in vivo
Самок нетучных мышей с диабетом/тяжелым комбинированным иммунодефицитом/γ-цепь-/-(NSG) возрастом от 8 до 12 недель получали из Stem Cell and Xenograft Core в Abramson Cancer Center Университета Пенсильвании. Мышей инокулировали подкожно 3×106 fLuc+ клетками SKOV3 в боковую поверхность живота на день 0. Перед лечением мышей рандомизировали по четыре или пять на группу. Когда опухоли становились пальпируемыми, активировали и трансдуцировали человеческие первичные T-клетки, как описано ранее. T-клетки размножали в присутствии IL-2 (5 нг/мл) в течение приблизительно 2 недель. Когда опухолевая нагрузка достигала ~250-300 мм3, мышам внутривенно инъецировали 5×106 CAR-T-клеток или 100 мкл солевого раствора, а затем они ежедневно получали внутрибрюшинную инъекцию 5 мкг IL-2, IL-7, IL-15, IL-18, IL-21 или фосфатного буферного раствора (ФСБ) в течение 7 дней. Размеры опухолей измеряли с помощью штангенциркуля, и объемы опухолей вычисляли по следующей формуле: объем опухоли=(длина×ширина2)/2. Число и фенотип перенесенных Т-клеток в крови мыши-реципиента определяли с помощью проточной цитометрии после ретроорбитального кровопускания. Мышей умерщвляли, когда объемы опухолей достигали более чем 2000 мм3, и опухоли немедленно удаляли для дальнейшего анализа.
Статистический анализ
Статистический анализ проводили с помощью программного обеспечения Prism 5 (GraphPad software) и IBM SPSS Statistics 20.0. Если не указано, данные приведены как среднее±СОС. Для сравнения двух групп и повторных измерений использовали t-критерий по двум образцам или непараметрический ранговый критерий Уилкоксона. Для проверки статистической значимости различий между тремя или более группами использовали ANOVA или критерий Фридмана. Результаты считались статистически значимыми, когда P-значения составляли меньше 0,05.
РЕЗУЛЬТАТЫ
1. Конструирование и экспрессия анти-FRα C4 CAR
pELNS-C4-27z CAR состоял из анти-FRα C4 scFv, соединенного с шарниром CD8α и трансмембранной областью с последующим сигнальным фрагментом CD3ζ в тандеме с внутриклеточным сигнальным мотивом CD27 (фигура 1A). Первичные человеческие T-клетки эффективно трансдуцировали лентивирусными векторами C4 CAR с эффективностью трансдукции 43%~65% при детектировании через 48 ч после трансдукции (фигура 1B). Уровни экспрессии CAR были сравнимы между CD4+ и CD8+ T-клетками (52,6±10,2% по сравнению с 49,5±17,1%, P=0,713).
2. Влияние цитокинов на размножение трансдуцированных CAR T-клеток (CAR-T)
Исследовали размножение и накопление CAR-T-клеток в присутствии различных γc-цитокинов и IL-18. Через три недели после воздействия различных цитокинов в культуре, CAR-T-клетки, которые культивировали в присутствии IL2, IL-7 или IL-5, размножали в 1000-2000 раз. CAR-T-клетки, которые культивировали в присутствии IL-18, IL-21 или NC (контроль, нет цитокинов), продемонстрировали менее чем 200-кратное размножение (фигура 1C).
Уровни экспрессии CAR сравнивали через 15 дней после трансдукции в различных T-клеточных популяциях: CD3+, CD4+ и CD8+ T-клетках. Уровни экспрессии CAR каждой группы CAR-T-клеток, выращенных в присутствии различных цитокинов, были в популяциях CD3+, CD4+ и CD8+ T-клеток схожими. CAR-T-клетки, которые культивировали в присутствии IL-21, продемонстрировали более высокие уровни экспрессии CAR, чем CAR-T-клетки, подвергавшиеся воздействию других цитокинов (включая IL-2 и контрольные клетки, которые не выращивали в присутствии цитокинов (NC)), в популяциях CD3+ и CD4+ T-клеток (фигура 1D).
Были проанализированы причины, способствующие более высокому накоплению CAR-T-клеток, в частности были оценены пролиферация и апоптоз Т-клеток. Пролиферативный ответ измеряли путем наблюдения за клеточным делением меченных CFSE Т-клеток, культивированных в течение 7 дней. Как показано на фигуре 1E, T-клетки, культивированные с IL-2 и IL-15, продемонстрировали наивысшую пролиферативную способность, за чем следовал IL-7; тогда как IL-21 и IL-18 оказались менее активными митогенными стимуляторами. Апоптоз T-клеток, культивированных в различных цитокинах, исследовали с использованием окрашивания Annexin-V. Результаты продемонстрировали, что T-клетки, культивированные в IL-2, IL-7 и IL-15, подвергались меньшему апоптозу по сравнению с группами NC, IL-18 и IL-21 (фигура 1F). Затем экспрессию Bcl-xL, ключевого отрицательного регулятора апоптоза лимфоцитов, исследовали с помощью анализа FACS. В соответствии с результатами по апоптозу на фигуре 1F наблюдается тенденция, что воздействие IL-2, IL-7 и IL-15 приводит к повышающей регуляции экспрессии Bcl-xL как в CD4+, так и в CD8+ T-клетках, тогда как IL-21 не повышал экспрессию Bcl-xL (фигура 1G и 1H). Эти результаты показывают, что повышенное накопление T-клеток, размноженных в присутствии цитокинов, например, IL-2, IL-7 или IL-15, может быть вызвано как увеличением пролиферации, так и уменьшением апоптоза посредством активации антиапоптотического пути Bcl-xl.
3. Влияние цитокинов на фенотипы CAR-T-клеток
Затем был исследован фенотип CAR-T-клеток, размноженных в присутствии экзогенных цитокинов. Свежие Т-клетки от здоровых доноров обычно разделяли на четыре подгруппы на основании экспрессии CD45RA и CD62L: 1) наивная T-клетка (CD45RA+CD62L+, обозначается Tn), 2) центральная T-клетка памяти (CD45RA-CD62L+, обозначается Tcm), 3) эффекторная T-клетка памяти (CD45RA-CD62L-, обозначается Tem) и 4) CD45RA-положительная эффекторная T-клетка (CD45RA+CD62L-, обозначается Temra). Затем также оценивали экспрессию CCR7, CD27, CD28 и CD95 для каждой подгруппы (фигура 2A). Последние три подгруппы T-клеток оказались положительными по CD95, тогда как только малая часть Tn экспрессировала CD95 (3,6±1,4% в CD4+ и 3,7±1,3% в CD8+ T-клетках). Эта небольшая популяция также совместно экспрессировала CD27, CD28 и CCR7, и ее рассматривали как стволовые T-клетки памяти (Tscm). Однако после стимуляции анти-CD3/CD28 гранулами до и после лентивирусной трансдукции CAR, CD95 подвергался в этой популяции значительной повышающей регуляции почти до 100% (фигура 2B). Процентное содержание CD45RA+CD62L+CD95+ T-клеток значительно возрастало после стимуляция анти-CD3/CD28 гранулами как в CD4+, так и в CD8+ T и CAR-T-клетках по сравнению со свежими T-клетками (фигуры 2C и 2D). Эта популяция высоко экспрессировала одновременно CD27, CD28 и CCR7 (фигура 2A), что указывает на то, что ее можно определить как Tscm. Кроме того, CD8+ CAR-T-клетки имели более высокое процентное содержание Tscm-клеток, что может быть связано с более высоким содержанием Tn в исходных CD8+ T-клетках (фигура 2F и 2G).
Через четырнадцать дней после совместного культивирования с различными цитокинами исследовали содержание подгрупп T-клеток CAR-T-клеток посредством измерения экспрессии CD45RA, CD62L и CD95. Как показано на фигуре 2E, среди CD4+ CAR-T-клеток в группе IL-7 по сравнению с группой IL-2 существовало значительно более высокое процентное содержание Tscm-клеток, тогда как группы NC и IL-18 представляли меньшее процентное содержание Tscm, но большее процентное содержание Tcm. Распределение подгрупп T-клеток в группе IL-15 было аналогично группе IL-2, тогда как группа IL-21 представляла большее процентное содержание Tcm, тогда как процентное содержание Tscm было сравнимо с группой IL-2. CD8+ CAR-T-клетки продемонстрировали схожую тенденцию, что и CD4+ CAR-T-клетки, в отношении дифференцировки и распределения четырех подгрупп T-клеток для каждой группы введенных цитокинов, с большим относительным содержанием Tscm по сравнению с CD4+ CAR-T-клетками в соответствующей группе CD8+ CAR-T-клеток.
Были дополнительно изучены способности различных субпопуляций CAR-T-клеток к самообновлению и дифференцировке в клетки других типов. CAR-T-клетки были отсортированы на четыре подгруппы на основании экспрессии CAR, CD45RA и CD62L и культивированы по-отдельности в среде, содержащей IL-2, в течение 3 дней. Как показано на фигуре 2H, подгруппа Tscm оказалась способна к дифференцировке во все три другие подгруппы, а подгруппы Tcm и Temra оказались способны к дифференцировке в Tem. Эти результаты показывают, что CD62L+ и CD45RA+ T-клетки оказались способны к дифференцировке в CD62L- и CD45RA- T-клетки, соответственно. Пролиферативную способность этих четырех подгрупп оценивали посредством разбавления CFSE, а затем сравнивали. Результаты продемонстрировали, что Tscm представляют большую пролиферативную способность, чем другие подгруппы (фигура 2I). Кроме того, экспрессия CD45RA обратно коррелирует с интенсивностью CFSE, тогда как экспрессия CD62L и CCR7 прямо коррелирует с пролиферацией. Во всех группах цитокинов CD45RA+ T-клетки проявляли гораздо более низкие уровни CFSE, чем тусклые и отрицательные по CD45RA T-клетки (фигура 3), что указывает на то, что CD45RA+ T-клетки имели более сильную пролиферативную активность, чем CD45RA- T-клетки. Таким образом, повышенное накопление T-клеток, выращенных в присутствии IL-2, IL-7 и IL-15, может быть связано с повышенным содержанием CD45RA+ T-клеток (которые обладают повышенный пролиферативной способностью) (фигура 4B).
Что касается фенотипа CAR-T-клеток, CAR-T-клетки представляли более низкую экспрессию CD45RA, CD62L, CD27 и CD28, но более высокую экспрессию CCR7 на поверхности T-клеток (фигура 4A). Влияние цитокинов на фенотип CAR-T-клеток было дополнительно оценено на основании экспрессии следующих поверхностных маркеров: CD27, CD28, CD62L, CCR7 и IL7Rα. CAR-T-клетки, выращенные в присутствии IL-18, продемонстрировали картину экспрессии, очень похожую на клетки, выращенные без добавления цитокинов. IL-2 вызывал значительную понижающую регуляцию экспресии CD27, CD28 CD62L, CCR7 и ILR7α по сравнению с контролем NC. Среди других γc-цитокинов по сравнению с подвергавшимися воздействию IL-2 CAR-T-клетками подвергавшиеся воздействию IL-7 CAR-T-клетки представляли более высокую экспрессию CD62L, CD27 и CD28, но значительно сниженную экспрессию CCR7; CAR-T-клетки группы IL-15 представляли более высокую экспрессию CD27 и CD28; подвергавшиеся воздействию IL-21 CAR-T-клетки представляли более высокую экспрессию CD62L, CCR7, CD27 и CD28, что указывает на то, что воздействие IL-2 вызывало размножение подгруппы T-клеток с гораздо более зрелым фенотипом T-клеток, чем все другие группы (фигура 4B).
4. Влияние цитокинов на эффекторную функцию CAR-T-клеток
Для исследования влияния цитокинов на эффекторную функцию CAR-T-клеток оценивали способность CAR-T-клеток к производству цитокинов после стимуляции FRα-экспрессирующими клетками SKOV3. После 5 часов стимуляции в цитоплазме CAR-T-клеток детектировали TNF-α, IFN-γ и IL-2, причем 41,5-54,0% CAR-T-клеток продуцировали TNF-α, 12,4-15,3% CAR-T-клеток продуцировали IFNγ, и 4,3-6,5% CAR-T-клеток продуцировали IL-2 (фигура 5A и B). Воздействие IL-2, IL-7 и IL-15 во время размножения способствовало производству CAR-T-клетками TNF-α, тогда как количества продуцирующих IFN-γ и IL-2 CAR-T-клеток оказалось сравнимым по всем группам цитокинов (фигуры 5B, 5C, и 5D). Затем сравнивали фракции отвечающих CAR-T-клеток и их полифункциональность (фигура 5E). По сравнению с воздействием IL-2 во время размножения, воздействие IL-18, IL-21 или отсутствие воздействия цитокинов во время размножение вызывало меньше продуцирующих цитокины CAR-T-клеток, и меньше CAR-T-клеток обладали способностью продуцировать несколько цитокинов при стимуляции клетками-мишенями. Эти результаты соответствуют фенотипу в том, что CAR-T-клетки в группах IL-18, IL-21 и NC были менее дифференцированными, чем в группе под воздействием IL-2.
Затем определяли влияние воздействия цитокинов во время размножения на экспрессию цитолитических молекул перфорина и гранзима-B после антигенной стимуляции (фигура 5I). Аналогично производству TNF-α, CAR-T-клетки, подвергавшиеся воздействию IL-2, IL-7 и IL-15, продемонстрировали повышенную экспрессию перфорина по сравнению с CAR-T-клетками, подвергавшимися воздействию NC, IL-18 и IL-21. Однако, хотя CAR-T-клетки, подвергавшиеся воздействию IL-21, продуцировали меньше TNF-α и перфорина, они продуцировали наивысший уровень гранзима-B. Следующие по величине уровни производства гранзима-B наблюдали в CAR-T-клетках, подвергавшихся воздействию IL-2 и IL-15 во время размножения. CAR-T-клетки в группе IL-18 представляли наименьшую величину экспрессии как перфорина, так и гранзима-B после антигенной стимуляции (фигура 5G и 5H).
Наконец, активность лизиса опухоли CAR-T-клетками, подвергавшимися воздействию различных цитокинов во время воздействия, количественно определяли посредством люциферазного анализа. Как показано на фигуре 5F, CAR-T-клетки, совместно культивированные с IL-2 и IL-15, лизировали SKOV3 более эффективно, чем культивированные с NC и IL-18 (в обоих случаях P<0,05).
Была дополнительно подтверждена связь между фенотипом CAR-T-клеток и их функцией. T-клетки сортировали через 14 дней после лентивирусной трансдукции на основании экспрессии CAR и CD62L. CD62L+ CAR-T-клетки (Tscm и Tcm) проявляли меньшую активность производства цитокинов и более слабую цитолитическую способность по сравнению с CD62L- CAR-T-клетками (Tem и Temra) (фигура 6). В этой перспективе CAR-T-клетки, подвергавшиеся воздействию IL-2 и IL-15, продуцировали больше цитокинов и представляли более сильную активность лизиса опухоли, что частично можно отнести к более высокому относительному содержанию Tem и Temra в этих группах.
5. Размножение и фенотип CAR-T-клеток после антигенной стимуляции
Для изучения влияния цитокинов на размножение CAR-T-клеток при стимуляции конкретным антигеном CAR-T-клетки, подвергавшиеся воздействию IL-2 в течение двух недель, совместно культивировали с клетками SKOV3 (FRα+) или C30 (FRα-) в присутствии указанных цитокинов в течение 7 дней. Аналогично условиям отсутствия антигена, CAR-T-клетки, подвергавшиеся воздействию IL-2, IL-7 и IL-15, представляли более высокое размножение, чем CAR-T-клетки, подвергавшиеся воздействию других цитокинов. CAR-T-клетки, подвергавшиеся воздействию IL-21 во время размножения, с большей вероятностью подвергались апоптозу (фигура 7A). Однако, когда CAR-T-клетки, подвергавшиеся воздействию указанных цитокинов в течение двух недель, совместно культивировали с SKOV3 или C30 клетками без последующего добавления цитокинов в течение 7 дней, накопление CAR-T-клеток было сравнимым во всех группах, причем подвергавшиеся воздействию IL-15 и IL-18 имели наименьшую величину апоптоза (фигура 7B). T-клетками с наивысшей экспрессией CAR оказалась группа, подвергавшаяся воздействию IL-21 во время размножения (фигура 7C). Также анализировали фенотипы CAR-T-клеток. CD27 и CD28 имели высокую экспрессию в CD8+ и CD4+ CAR-T-клетках во всех группах цитокинов, соответственно. Аналогично размножению в отсутствие антигена, воздействие IL-21 повышало экспрессию CD27 и CD28 в CAR-T-клетках (фигура 7D). Что касается четырех подгрупп T-клеток памяти, результаты отличались от исследования в отсутствие антигена: Tscm были редки, а Tem составляли более чем 50% во всех группах без цитокинов, IL-18 и IL-21. Цитокины не оказывали значительного воздействия на состав подгрупп T-клеток памяти, и воздействие IL-7 не способствовало увеличению количества Tscm (фигура 7E).
6. Противоопухолевая эффективность различных цитокинов в моделях на животных
Для оценки влияния различных цитокинов во время ex vivo размножения CAR-T-клеток на эффективность CAR-T-клеток in vivo исследовали жизнестойкость CAR-T-клеток и исход посредством использования модели ксенотрансплантата рака яичников на мышах NSG. Мышам, несущим подкожные опухоли SKOV3, внутривенно инъецировали две дозы по 5×106 C4-27z CAR-T-клеток, которые ранее подвергали воздействию указанных цитокинов ex vivo в течение 2 недель (фигура 8A). Все мыши, получившие вливание C4-27z CAR-T-клеток, представляли меньшую опухолевую нагрузку по сравнению с мышами, инъецированными нетрансдуцированными T-клетками и анти-CAR CD19-T-клетками (фигуры 8B и 8C). Из групп различных цитокинов мыши, получавшие CAR-T-клетки с предшествующим воздействием IL-2, продемонстрировали наибольшую опухолевую нагрузку в соответствии наименьшим количеством циркулирующих человеческих T-клеток в этих мышах. Опухоли в группах NC, IL-7, IL-15, IL-18 и IL-21 были значительно подавлены или даже исчезли без какого-либо статистического различия по размеру опухоли. Жизнестойкость перенесенных T-клеток в периферической крови определяли через 15 и 32 дня после адоптивного переноса. По-видимому, мыши, получавшие обработанные IL-7 и IL-21 CAR-T-клетки, имели более высокое количество человеческих T-клеток, чем другие группы в периферической крови на день +15, тогда как мыши, получавшие обработанные IL-2 CAR-T-клетки, имели самое низкое количество человеческих T-клеток (фигура 8D). Что касается процентного содержания различных популяций CAR-T-клеток, подвергавшиеся воздействию NC, IL-15, IL-18 и IL-21 группы представляли больше CD4+ CAR-T-клеток по сравнению с группой IL-2, тогда как процентное содержание CD8+ CAR-T-клеток оказалось сравнимым во всех группах (фигура 8E). По фенотипам T-клеток, CD62L, CD27 и CD28 были экспрессированы только приблизительно на 5-10% T-клеток и были сравнимы по всем группам, за исключением того, что CD8+ T-клетки в группе IL-21 экспрессировали больше CD28, чем в группах IL-2 и NC (обе P<0,05) (фигуры 8F и 8G). Интересно, что NC и IL-18 имели гораздо большее количество CD45RA+CD62L+ T-клеток в крови, что было противоположно результату, полученному в эксперименте in vitro (фигуры 8F, 2E и 2F). На день +32 циркулирующие человеческие T-клетки во всех группах CAR-T-клеток значительно размножились, за исключением группы IL-2, причем среднее количество T-клеток составляло от 14907 на мкл до 19651 на мкл (и только 242 на мкл в группе IL-2). Две мыши умерли, хотя опухоли были регрессированы.
ОБСУЖДЕНИЕ
IL-2 является наиболее часто используемым цитокином для генерации лимфоцитов для адоптивной иммунотерапии. Он способствует выживанию и размножению T-клеток, увеличивает способность T-клеток к киллингу опухоли. Однако действие IL-2 ограничено, поскольку оно приводит к индуцированной активацией клеточной гибели (AICD) T-клеток и развитию регуляторных T-клеток (Malek et al., Immunity, 2010, 33:153-65; и Lenardo et al., Annu Rev Immunol, 1999, 17:221-53). В данном примере IL-2 значительно увеличивал накопление CAR-T-клеток и их цитотоксическую способность, но подвергавшиеся воздействию IL-2 CAR-T-клетки представляли наихудший противоопухолевый иммунитет in vivo после адоптивного переноса. Это открытие демонстрирует обратную зависимость между лизисом опухоли in vitro и эрадикацией опухоли in vivo. Подвергавшиеся воздействию IL-2 CAR-T-клетки продемонстрировали относительно зрелый фенотип с низкой экспрессией CD62L, CCR7, CD27 и CD28, который является менее жизнестойким in vivo (Yang et al., Cancer Immunol Immunother, 2013, 62:727-36). Недавние исследования показали, что адоптивный перенос менее дифференцированных T-клеток коррелирует с лучшей регрессией опухоли, что подтверждает вывод о том, что подвергавшиеся воздействию IL-2 CAR-T-клетки менее эффективны, чем другие группы (Gattinoni et al., Nat Med, 2011, 17:1290-7; и Markley et al., Blood, 2010, 115:3508-19).
IL-15 представлял эффективность стимулирования размножения CAR-T-клеток и функцию лизиса опухоли, сходную с IL-2, но индуцировал менее дифференцированный фенотип (более высокая экспрессия CD27 и CD28). Поэтому IL-15 поддерживает жизнестойкость CAR-T-клеток in vivo и показывает лучший противоопухолевый иммунитет в модели на животных.
По сравнению с IL-2 и IL-15, IL-7 показал схожую способность к стимуляции размножения CAR-T-клеток, но индуцировал более высокий уровень экспрессии CD62L и продемонстрировал наивысшее содержание CAR-Tscm-клеток в условиях отсутствия антигена. Поэтому по сравнению с CAR-T-клетками, подвергавшимися воздействию IL-2, ex vivo воздействие IL-7 без антигенной стимуляции увеличивало противоопухолевую эффективность CAR-T-клеток. Подвергавшиеся воздействию IL-7 CAR-T-клетки не приводили к лучшей противоопухолевой эффективности in vivo, чем IL-2, и эффективность оказалась хуже, чем у IL-15 из-за меньшего размножения CAR-T-клеток при антигенной стимуляции.
IL-21 оказывал небольшое воздействие на накопление CAR-T-клеток, поскольку он не мог увеличивать антиапоптотическую способность, например, посредством стимуляции экспрессии Bcl-xL. Однако IL-21 индуцировал размножение менее дифференцированных CAR-T-клеток с фенотипом высокой экспрессии CD62L, CCR7, CD27 и CD28 даже в условиях антигенной стимуляции. Поэтому подвергавшиеся воздействию IL-21 CAR-T-клетки продемонстрировали наилучшую жизнестойкость в модели на животных и при инъекции IL-21 in vivo, а также представляли лучшую эффективность в стимуляции эрадикации опухоли, чем другие группы цитокинов, за исключением IL-15. Эти результаты согласуются с предыдущим выводом о том, что менее дифференцированные CAR-T-клетки коррелируют с наилучшей регрессией опухоли.
IL-18 является провоспалительным цитокином, принадлежащим к семейству IL-1, который регулирует как врожденные, так и адаптивные иммунные ответы путем активации моноцитов, NK-клеток и Т-клеток и производства IFN-γ, а также других цитокинов in vivo (Srivastava et al., Curr Med Chem, 2010, 17:3353-7). Результаты, представленные здесь, показывают, что IL-18 оказывает небольшое воздействие на размножение, фенотип и функцию CAR-T-клеток в экспериментах ex vivo, поскольку большинство результатов в группах IL-18 аналогичны и сравнимы с группой NC. IL-18 способствовал небольшой пролиферации Т-клеток и поддерживал большую выживаемость Т-клеток при антигенной стимуляции по сравнению с контрольной (NC) группой. Исследования in vivo показывают, что IL-18 не оказывает существенного влияния на эффективность CAR-T-клеток по сравнению с мышами без добавления цитокинов.
Таким образом, результаты этих экспериментов показывают, что добавление IL-2 ex vivo для размножения CAR-T-клеток не является оптимальной стратегией, хотя оно широко используется. Что касается добавления IL-18, IL-21 или отсутствия цитокинов, хотя они могут индуцировать относительные эффективные CAR-T-клетки, они не достаточно эффективно стимулируют размножение CAR-T-клеток для того, чтобы достаточное количество CAR-T-клеток могло быть получено для клинического применения за ограниченное время размножения. Поэтому IL-15 и IL-7 могут представлять собой лучшие средства для размножения CAR-T-клеток. Кроме того, комбинация добавления IL-7 и IL-15 вызывает генерацию Tscm, что выгодно для производства более "молодых" CAR-T-клеток. Что касается in vivo инъекции цитокинов, добавление всех γc-цитокинов увеличивает противоопухолевую эффективность, поскольку многие из них способствуют размножению CAR-T-клеток, причем IL-15 представляет наилучший эффект. У мышей, получавших подвергавшиеся воздействию IL-15 CAR-T-клетки путем инъекции, наблюдали повышенную эффективность, частично из-за повышенной способности к размножению и повышенной жизнестойкости CAR-T-клеток во время обработки опухоли. Таким образом, результаты этих экспериментов показывают, что IL-7 и IL-15 обещают способствовать размножению CAR-T-клеток и индуцировать T-клеточные фенотипы, наиболее эффективные для терапевтического лечения.
Пример 2: Воздействие истощения по CD25 на рост клеток и эффективность трансдукции
A-цепь интерлейкина-2, также известная как CD25, экспрессируется регуляторными T-клетками (Treg), но ее также наблюдали на клетках хронического B-клеточного лейкоза (ХЛЛ) (больше чем у 85% пациентов с ХЛЛ). Treg имеют функции подавления иммунитета и могут препятствовать эффективности иммунотерапии, например, посредством ингибирования T-клеточной пролиферации. В настоящее время выделение или обогащение T-клеток пациентов с ХЛЛ посредством афереза обычно содержит значительно повышенное количество Treg, а также клеток ХЛЛ. Истощение Treg и клеток ХЛЛ в исходном материале посредством способов истощения по CD25 может значительно улучшать чистоту эффекторных T-клеток и тем самым увеличивать активность экспрессирующих CAR19 T-клеток, например, клеток CART19.
Фигура 9A показывает графики анализа с помощью проточной цитометрии клеток из афереза пациента с ХЛЛ. Клетки вначале сортировали по экспрессии CD45, и CD45-экспрессирующую (CD45+) подгруппу затем дополнительно анализировали в отношении экспрессии CD25 и CD3. Как показано в правой панели фигуры 9A, пациенты с ХЛЛ проявляют высокое процентное содержание CD25-экспрессирующих клеток.
Оптимизация истощения по CD25
Был проведен валидационный эксперимент для определения оптимальных условий для истощения по CD25 из аферезов от двух пациентов с использованием реагента для CD25 от Miltenyi в системе CliniMACS. Реагент для истощения по CD25 использовали в количестве 100%, 70% и 30% от рекомендованного производителем количества для определения того, можно ли получить такую же эффективность истощения посредством использования меньшего количества реагента. Также протестировали две различные магистрали от Miltenyi. Истощение проводили в соответствии с указаниями производителя. Результаты экспериментов показаны в таблице ниже. Для контроля провели селекцию с использованием анти-CD3/CD28 иммуномагнитных гранул.
Таблица 5. Результаты эксперимента по истощению по CD25
Ожидаемый выход CD25- (CD25-отрицательных) Т-клеток представляет рассчитанный выход CD25- T-клеток, рассчитанный в предположении 100% эффективности соответствующих манипуляций. Наблюдаемый выход CD25- T-клеток представляет количество CD25- T-клеток после соответствующих манипуляций. Как показано в таблице 5, использование меньшего количества реагента, чем рекомендовано производителем, не приводит к такой же эффективности истощения по CD25. Использование другой магистрали привело к повышению обогащения T-клеток на один порядок.
Фигура 9B показывает типичные графики анализа с помощью проточной цитометрии (верхние панели), демонстрирующие эффективность истощения по CD25 по сравнению с общим количеством клеток от афереза (верхняя левая панель фигуры 9B), контрольными селектированными по CD3/CD28 клетками (верхняя вторая слева панель фигуры 9B), истощенными по CD25 клетками (верхняя вторая справа панель фигуры 9B) и обогащенными по CD25 клетками (верхняя правая панель фигуры 9B). Гистограммы (нижние панели) показывают содержание моноцитов в клеточной популяции, определенное по экспрессии CD14 в CD3-CD19- подгруппе. Эти результаты указывают на эффективное истощение по CD25 и на то, что истощение по CD25 также приводило к значительному содержанию моноцитов (61,1% CD14-экспрессирующих клеток по сравнению с менее чем 2% во всех клетках от афереза, контрольных и обогащенных по CD25 клетках.
Воздействие истощения по CD25 на популяцию и пролиферацию T-клеток
Затем качество Т-клеточного продукта после истощения по CD25 оценивали путем определения содержания CD4+ и CD8+ T-клеток и пролиферативной способности.
Для определения содержания конкретных T-клеточных популяций клетки анализировали с помощью проточной цитометрии через девять дней после селекции с помощью анти-CD3/CD28 или истощения по CD25, как описано выше. Результаты показывают, что CD3/CD28-селектированные T-клетки имели большее содержание CD4+ T-клеток по сравнению с истощенными по CD25 клетками (84,6% по сравнению с 46,8% CD4+ T-клеток, рамки сверху слева на панелях на фигуре 10). И наоборот, истощенные по CD25 клетки имели большее содержание CD8+ T-клеток по сравнению с CD3/CD28-селектированными клетками (47,2% по сравнению с 11,5% CD8+ T-клеток; рамки снизу справа на панелях на фигуре 10). Поэтому истощение по CD25 приводит к T-клеткам с большим содержанием CD8+ эффекторных T-клеток.
Пролиферативную способность и жизнеспособность клеток также оценивали в контрольных (селектированных по CD3/CD28 клетках) и истощенных по CD25 клетках. Высевали 1,6×107клеток из контрольных и истощенных по CD25 клеток, и определяли количество клеток и жизнеспособность в течение 10-13 дней. Фигура 11A показывает общее количество клеток со временем, а фигура 11B показывает рассчитанные удвоения популяции (рассчитанные по общему количеству клеток). Результаты показывают, что истощенные по CD25 клетки продемонстрировали схожие с контрольными клетками характеристики роста. Фигура 11C показывает процентное содержание жизнеспособных клеток, и результаты показывают, что жизнеспособность также была схожей между контрольными и истощенными по CD25 клетками.
Воздействие истощения по CD25 на эффективность лентивирусной трансдукции
Воздействие истощения по CD25 на эффективность лентивирусной трансдукции оценивали посредством определения экспрессии CAR после трансдукции. Аферез пациента истощали по CD25 клеткам, как описано выше. Эффективность истощения по CD25 продемонстрирована на графиках анализа с помощью проточной цитометрии, сравнивающих CD25-экспрессирующию популяцию до (образец афереза) и после истощения по CD25 (истощенная по CD25 фракция) (фигура 12A). После истощения по CD25 истощенная по CD25 фракция содержала приблизительно 59,2% CD25-отрицательных клеток и только 10,3% CD25-положительных клеток.
Истощенную по CD25 фракцию трансдуцировали лентивирусным конструктом, кодирующим CAR19. После 11 дней культивирования оценивали экспрессию CAR с помощью проточной цитометрии. Нетрансдуцированные клетки и трансдуцированные селектированные по CD3 клетки использовали в качестве контроля. Как показано на фигуре 12B, экспрессия CAR19 была значительно выше в истощенных по CD25 клетках по сравнению с селектированными по CD3 клетками (51,4% по сравнению с 12,8%). Этот результат демонстрирует, что истощенные по CD25 клетки имеют улучшенную эффективность лентивирусной трансдукции, что может иметь важное значение для улучшения терапевтического эффекта при терапии CART.
Пример 3: Использование цитокинов с истощенными по CD25 клетками
В данном примере исследовали воздействие истощения по CD25 с добавлением цитокинов во время размножения в культуре. Мононуклеарные клетки периферической крови (PBMC) выделяли от пациента и или оставляли необработанными, или подвергали истощению CD25-экспрессирующих клеток, как описано в примере 2. Обогащение T-клетками достигалось стимуляцией анти-CD3 и CD28 покрытыми гранулами. T-клетки непосредственно культивировали в среде с добавлением 10 нг/мл IL-7, 10 нг/мл IL-15 или комбинации 10 нг/мл IL-7 и 10 нг/мл IL-15. На день 3 среду меняли с добавлением тех же цитокинов. На день 5 добавляли среду, содержащую 100 МЕ IL-2 на мл, и клетки выращивали в течение 10 дней.
Проточный цитометрический анализ показывает изменение распределения CD3 и CD19 клеток в истощенных по CD25 клетках по сравнению с необработанными PBMC (стандартная CD3/CD28 селекция) после культивирования в присутствии IL7, IL-15 или IL7 и IL15. Распределение CD3, CD19 и CD25-экспрессирующих клеток в исходной популяции (например, до истощения по CD25 и до культивирования с добавлением цитокинов) показано на фигуре 13. Исходная популяция имела высокое содержание CD3-CD19+ клеток (верхняя панель, фигура 11) и высокое содержание CD25-экспрессирующих клеток (нижние панели, фигура 13). После манипулирования (истощения по CD25) и культивирования с цитокинами распределение изменялось, как показано на фигуре 14. Истощенные по CD25 клетки в целом продемонстрировали большее уменьшение количества экспрессирующих CD19 клеток по сравнению с необработанными клетками.
Пролиферативную способность также оценивали для тех же образцов клеток посредством определения общего количества клеток в культуре на день 10 после стимуляции анти-CD3 и анти-CD28 покрытыми гранулами. Количество клеток для каждого образца клеток показано ниже и на фигуре 15.
Таблица 6. Размножение in vitro
Эти результаты показывают, что добавление IL-15 во время культивирования истощенных по CD25 T-клеток приводило к увеличению размножения по сравнению с необработанными клетками. Добавление IL-7 и IL-15 в среду во время культивирования приводило к значительному увеличению размножения по сравнению с необработанными клетками и по сравнению с добавлением цитокинов IL-7 или IL-15 независимо. Таким образом, комбинация добавления IL-7 и IL-15 приводила к T-клеткам с наиболее увеличенной пролиферативной способностью.
Пример 4: Трехдневный процесс производства
С помощью технологий переноса генов T-клетки могут быть генетически модифицированы для стабильной экспрессии связывающих антитела доменов на своей поверхности, что придает T-клеткам специфичность, которая не зависит от ограничений, налагаемых главным комплексом гистосовместимости (ГКГС). CAR-терапия может использовать синтетические белки, экспрессируемые на Т-клетках, в которых слит антиген-распознающий фрагмент антитела (scFv или одноцепочечный фрагмент вариабельной области) с внутриклеточным доменом CD3-дзета-цепи. При взаимодействии с клеткой-мишенью, экспрессирующей когнатный для scFv антиген, CAR, экспрессируемые на T-клетках, могут инициировать активацию Т-клеток, приводящую к киллингу клеток-мишеней (также называемую лизисом клеток-мишеней). В сочетании с дополнительными костимулирующими сигналами, такими как цитоплазматический домен из CD137 или CD28, эти рецепторы также могут стимулировать T-клеточную пролиферацию и увеличивать жизнестойкость CAR-модифицированных T-клеток (CART) in vivo.
Изучаются механизмы, лежащие в основе жизнестойкости CART. Сигнальные домены в CAR, по-видимому, являются важными факторами, определяющими жизнестойкость; однако ряд опубликованных исследований на мышах и отличных от человека приматах (Klebanoff, C. A., et al. (2005), "Central memory self/tumor-reactive CD8+ T cells confer superior antitumor immunity compared with effector memory T cells", Proc Natl Acad Sci USA 102(27): 9571-9576, Berger, C., et al. (2008), "Adoptive transfer of effector CD8+ T cells derived from central memory cells establishes persistent T cell memory in primates", J Clin Invest 118(1): 294-305, Hinrichs, C. S., et al. (2009), "Adoptively transferred effector cells derived from naive rather than central memory CD8+ T cells mediate superior antitumor immunity", Proc Natl Acad Sci USA 106(41): 17469-17474, Wang, X., et al. (2011), "Engraftment of human central memory-derived effector CD8+ T cells in immunodeficient mice", Blood 117(6): 1888-1898) и данные из коррелятивных клинических исследований на людях свидетельствуют о том, что фенотип T-клеток в адоптивно перенесенном продукте также является важным фактором, определяющим жизнестойкость T-клеток после адоптивного переноса (Xu, Y., et al. (2014), "Closely related T-memory stem cells correlate with in vivo expansion of CAR.CD19-T cells and are preserved by IL-7 and IL-15", Blood 123(24): 3750-3759). Без ограничения теорией, предполагается, что размножение T-клеток во время культивирования ex vivo в обычно используемой системе антител агонистов анти-CD3 и анти-CD28 в сочетании с экзогенным IL-2 изменяет размноженные T-клетки в направлении более дифференцированных клеток со сниженной жизнестойкостью. Предполагается, что замена IL-2 на IL-7 и IL-15 будет изменять культуру ex vivo с течением времени в направлении клеток с более оптимальным фенотипом Tscm/cm. Также предполагается, что продукты с меньшим культивированием ex vivo могут иметь большее содержание клеток с оптимальным фенотипом для приживления и жизнестойкости после адоптивного переноса.
Данный пример как характеризует фенотип клеток с течением времени в культуре, так и оценивает функциональность клеток в различные временные точки после активации и трансдукции.
Удаление гранул из T-клеток после активации стимулирующими CD3/28 гранулами может быть выполнено с высокой эффективностью путем механического разрушения, как показано на фигурах27A-27D. В этих предклинических исследованиях отсоединение гранул осуществляли посредством многократного прохождения (продавливания) клеточной суспензии через наконечник пипетки с узким отверстием. В замкнутой системе культивирования до удаления гранул можно осуществлять продавливание для создания мягкого сдвига с использованием замкнутой системы, которая включает набор трубок с узким отверстием в замкнутой системе.
Как показано на фигуре28, T-клетки, которые активированы, трансдуцированы CD19-специфическим CAR, несущим сигнализацию Bbz, и собраны из T-клеточных культур во временные точки уже на день 3 после активации, обладают сильной антигенспецифической цитотоксической активностью in vitro. Эти рано собранные клетки также способны продуцировать цитокины схожим по картине и количеству образом с клетками, культивированными в течение более продолжительных периодов, составляющих 5 или 9 дней, ex vivo (фигура 29A), со схожей базальной секрецией (фигура 29B).
Во время культивирования ex vivo популяция T-клеток подвергается постепенному переходу в направлении более дифференцированного фенотипа с повышенным содержанием эффекторных T-клеток памяти (Tem) и Tcm-клеток, как показано на фигуре30A. Это повышение содержания Tem и Tcm-клеток происходит из-за увеличения количества более дифференцированных подгрупп T-клеток с минимальным размножением и/или уменьшения количества подобных наивным/Tscm-клеток (фигура 30B).
Фиг. 31Aпоказывает схему эксперимента по тестированию активности CART-клеток, продуцируемых в различных условиях. Фиг. 31B показывает активность обработанных IL2 CART-клеток в замедлении роста опухоли Nalm6 у мышей. Клетки дня 3 демонстрируют повышенную активность во всех дозах. T-клетки, активированные и трансдуцированные CD19-специфическим CAR, несущим сигнальный домен 4-1BBz, показывают более сильную противолейкозную активность in vivo, когда они собраны в ранние временные точки. Эта повышенная активность продемонстрирована более низкими дозами Т-клеток, необходимыми для эрадикации лейкоза, у собранных на день 3 клеток CART19 по сравнению с собранными на день 5 или день 9 клетками. Относительное содержание CAR+ клеток показано на фиг. 31C.
Клетки, обработанные IL-2 и IL7/15, собирали в два различных дня (3, 9). Использовали относительно низкую дозу, составляющую 0,7e6 CAR+ клеток. T-клетки, активированные, трансдуцированные CD19-специфическим CAR, несущим сигнальный домен 4-1BBz, и культивированные в IL-7/IL-15, показали более сильную активность при ограниченных дозах, чем клетки, размноженные в IL-2, в ранних (день 3) и поздних (день 9) временных точках (фигура 31D). Клетки дня 3, обработанные IL7/15, продемонстрировали увеличенную активность в ранних временных точках.
ЭКВИВАЛЕНТЫ
Раскрытия всех без исключения патентов, патентных заявок и публикаций, цитируемых здесь, настоящим включены в настоящий документ посредством ссылки во всей полноте. При том, что настоящее изобретение было раскрыто со ссылкой на конкретные аспекты, очевидно, что другие аспекты и вариации настоящего изобретения могут быть разработаны другими специалистами в данной области техники без отхода от сущности и объема настоящего изобретения. Прилагаемую формулу изобретения следует интерпретировать как включающую в себя все такие аспекты и эквивалентные изменения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA
<120> СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК
<130> N2067-7067WO
<140>
<141>
<150> 62/133137
<151> 2015-03-13
<150> 62/097375
<151> 2014-12-29
<160> 122
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 1
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 2
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 2
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 3
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 3
Gln Val Gln Leu Leu Glu Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Ser Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr
115
<210> 4
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 4
Glu Leu Val Leu Thr Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Thr Tyr Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser
65 70 75 80
Lys Asp Leu Ala Asp Tyr Phe Tyr Phe Cys Gln Tyr Asn Arg Tyr Pro
85 90 95
Tyr Thr Ser Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Arg Ser
100 105 110
<210> 5
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 6
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 6
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 7
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 7
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 8
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 8
ggtggcggag gttctggagg tggaggttcc 30
<210> 9
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 9
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 10
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 10
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 11
<211> 1184
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 11
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaag gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacctggctg cagtacgtga ttcttgatcc cgagcttcgg gttggaagtg 360
ggtgggagag ttcgaggcct tgcgcttaag gagccccttc gcctcgtgct tgagttgagg 420
cctggcctgg gcgctggggc cgccgcgtgc gaatctggtg gcaccttcgc gcctgtctcg 480
ctgctttcga taagtctcta gccatttaaa atttttgatg acctgctgcg acgctttttt 540
tctggcaaga tagtcttgta aatgcgggcc aagatctgca cactggtatt tcggtttttg 600
gggccgcggg cggcgacggg gcccgtgcgt cccagcgcac atgttcggcg aggcggggcc 660
tgcgagcgcg gccaccgaga atcggacggg ggtagtctca agctggccgg cctgctctgg 720
tgcctggcct cgcgccgccg tgtatcgccc cgccctgggc ggcaaggctg gcccggtcgg 780
caccagttgc gtgagcggaa agatggccgc ttcccggccc tgctgcaggg agctcaaaat 840
ggaggacgcg gcgctcggga gagcgggcgg gtgagtcacc cacacaaagg aaaagggcct 900
ttccgtcctc agccgtcgct tcatgtgact ccacggagta ccgggcgccg tccaggcacc 960
tcgattagtt ctcgagcttt tggagtacgt cgtctttagg ttggggggag gggttttatg 1020
cgatggagtt tccccacact gagtgggtgg agactgaagt taggccagct tggcacttga 1080
tgtaattctc cttggaattt gccctttttg agtttggatc ttggttcatt ctcaagcctc 1140
agacagtggt tcaaagtttt tttcttccat ttcaggtgtc gtga 1184
<210> 12
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 12
atggccctgc ctgtgacagc cctgctgctg cctctggctc tgctgctgca tgccgctaga 60
ccc 63
<210> 13
<211> 135
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 13
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 14
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 14
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 15
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MISC_FEATURE
<222> (1)..(40)
<223> /note="Данная последовательность может включать в себя 1-10
повторяющихся единиц 'Gly Gly Gly Ser'"
<400> 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
20 25 30
Gly Gly Gly Ser Gly Gly Gly Ser
35 40
<210> 16
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 16
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 17
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 17
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 18
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 18
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 19
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
праймер"
<400> 19
ataggatccc agctggtgga gtctggggga ggc 33
<210> 20
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 20
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 21
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 21
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 22
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 22
atggccctgc ccgtcaccgc tctgctgctg ccccttgctc tgcttcttca tgcagcaagg 60
ccggacatcc agatgaccca aaccacctca tccctctctg cctctcttgg agacagggtg 120
accatttctt gtcgcgccag ccaggacatc agcaagtatc tgaactggta tcagcagaag 180
ccggacggaa ccgtgaagct cctgatctac catacctctc gcctgcatag cggcgtgccc 240
tcacgcttct ctggaagcgg atcaggaacc gattattctc tcactatttc aaatcttgag 300
caggaagata ttgccaccta tttctgccag cagggtaata ccctgcccta caccttcgga 360
ggagggacca agctcgaaat caccggtgga ggaggcagcg gcggtggagg gtctggtgga 420
ggtggttctg aggtgaagct gcaagaatca ggccctggac ttgtggcccc ttcacagtcc 480
ctgagcgtga cttgcaccgt gtccggagtc tccctgcccg actacggagt gtcatggatc 540
agacaacctc cacggaaagg actggaatgg ctcggtgtca tctggggtag cgaaactact 600
tactacaatt cagccctcaa aagcaggctg actattatca aggacaacag caagtcccaa 660
gtctttctta agatgaactc actccagact gacgacaccg caatctacta ttgtgctaag 720
cactactact acggaggatc ctacgctatg gattactggg gacaaggtac ttccgtcact 780
gtctcttcac accatcatca ccatcaccat cac 813
<210> 23
<211> 4027
<212> ДНК
<213> Homo sapiens
<400> 23
caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc 60
cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc 120
tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg 180
gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg 240
cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg 300
cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg 360
cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct 420
acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc 480
gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg 540
tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca 600
ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg 660
cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga 720
ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg 780
ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga 840
cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag 900
ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc 960
agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc 1020
ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc 1080
ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg 1140
agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc 1200
tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc 1260
agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag 1320
cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg 1380
acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt 1440
acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc 1500
acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca 1560
agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca 1620
ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg 1680
ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt 1740
atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga 1800
gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt 1860
cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc 1920
gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag 1980
ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt 2040
tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg 2100
gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc 2160
cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc 2220
aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc 2280
gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc 2340
acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg 2400
agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca 2460
gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg 2520
gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct 2580
gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc 2640
tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa 2700
ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga 2760
agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga 2820
tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg 2880
tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc 2940
gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt 3000
gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct 3060
acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc 3120
atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc 3180
tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg 3240
ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc 3300
tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc 3360
agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg 3420
cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg 3480
agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc 3540
ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct 3600
gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc 3660
tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc 3720
agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc 3780
cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc 3840
caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt 3900
gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg 3960
ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa 4020
aaaaaaa 4027
<210> 24
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
праймер"
<400> 24
atagctagca cctaggacgg tcagcttggt ccc 33
<210> 25
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 25
Gly Gly Gly Gly Ser
1 5
<210> 26
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MISC_FEATURE
<222> (1)..(30)
<223> /note="Данная последовательность может включать в себя 1-6
повторяющихся единиц 'Gly Gly Gly Gly Ser'"
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 27
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 28
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 29
Gly Gly Gly Ser
1
<210> 30
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(5000)
<223> /note="Данная последовательность может включать в себя 50-5000 нуклеотидов"
<400> 30
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 31
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 31
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt 100
<210> 32
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(5000)
<223> /note="Данная последовательность может включать в себя 50-5000 нуклеотидов"
<400> 32
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1980
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2040
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2100
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2160
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2220
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2280
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2340
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2400
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2460
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2520
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2580
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2640
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2700
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2760
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2820
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2880
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2940
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3000
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3060
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4980
tttttttttt tttttttttt 5000
<210> 33
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(5000)
<223> /note="Данная последовательность может включать в себя 100-5000 нуклеотидов"
<400> 33
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 34
<211> 400
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(400)
<223> /note="Данная последовательность может включать в себя 100-400 нуклеотидов"
<400> 34
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 400
<210> 35
<211> 2000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(2000)
<223> /note="Данная последовательность может включать в себя 50-2000 нуклеотидов"
<400> 35
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa 2000
<210> 36
<211> 230
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 36
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 37
<211> 690
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 37
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 38
<211> 282
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 38
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 39
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 39
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
225 230 235 240
Ser Ser
<210> 40
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 40
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
225 230 235 240
Ser Ser
<210> 41
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 41
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln
210 215 220
Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 42
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 42
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln
210 215 220
Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 43
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 43
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
130 135 140
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
145 150 155 160
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
165 170 175
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
180 185 190
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
195 200 205
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser
245
<210> 44
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 44
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
130 135 140
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
145 150 155 160
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
165 170 175
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
180 185 190
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
195 200 205
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser
245
<210> 45
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
130 135 140
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
180 185 190
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys
245
<210> 46
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 46
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
130 135 140
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
180 185 190
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys
245
<210> 47
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 47
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
130 135 140
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
145 150 155 160
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
165 170 175
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
180 185 190
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
195 200 205
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser
245
<210> 48
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 48
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
130 135 140
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
180 185 190
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
210 215 220
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys
245
<210> 49
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 49
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
225 230 235 240
Ser Ser
<210> 50
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 50
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln
210 215 220
Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 51
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Lys Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser Val Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu Thr Ile Ile
180 185 190
Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn Ser Leu Gln
195 200 205
Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
225 230 235 240
Ser Ser
<210> 52
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 52
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact 480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc 540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact 600
tactactctt catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag 660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag 720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc 780
gtgtccagcc accaccatca tcaccatcac cat 813
<210> 53
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 53
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact 480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc 540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact 600
tactaccaat catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag 660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag 720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc 780
gtgtccagcc accaccatca tcaccatcac cat 813
<210> 54
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 54
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
tcatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg 480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg 540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct 600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg 660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc 720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt 780
gagatcaaac atcaccacca tcatcaccat cac 813
<210> 55
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 55
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
caatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg 480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg 540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct 600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg 660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc 720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt 780
gagatcaaac atcaccacca tcatcaccat cac 813
<210> 56
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 56
atggccctcc cagtgaccgc tctgctgctg cctctcgcac ttcttctcca tgccgctcgg 60
cctgagatcg tcatgaccca aagccccgct accctgtccc tgtcacccgg cgagagggca 120
accctttcat gcagggccag ccaggacatt tctaagtacc tcaactggta tcagcagaag 180
ccagggcagg ctcctcgcct gctgatctac cacaccagcc gcctccacag cggtatcccc 240
gccagatttt ccgggagcgg gtctggaacc gactacaccc tcaccatctc ttctctgcag 300
cccgaggatt tcgccgtcta tttctgccag caggggaata ctctgccgta caccttcggt 360
caaggtacca agctggaaat caagggaggc ggaggatcag gcggtggcgg aagcggagga 420
ggtggctccg gaggaggagg ttcccaagtg cagcttcaag aatcaggacc cggacttgtg 480
aagccatcag aaaccctctc cctgacttgt accgtgtccg gtgtgagcct ccccgactac 540
ggagtctctt ggattcgcca gcctccgggg aagggtcttg aatggattgg ggtgatttgg 600
ggatcagaga ctacttacta ctcttcatca cttaagtcac gggtcaccat cagcaaagat 660
aatagcaaga accaagtgtc acttaagctg tcatctgtga ccgccgctga caccgccgtg 720
tactattgtg ccaaacatta ctattacgga gggtcttatg ctatggacta ctggggacag 780
gggaccctgg tgactgtctc tagccatcac catcaccacc atcatcac 828
<210> 57
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 57
atggccctcc cagtgaccgc tctgctgctg cctctcgcac ttcttctcca tgccgctcgg 60
cctgagatcg tcatgaccca aagccccgct accctgtccc tgtcacccgg cgagagggca 120
accctttcat gcagggccag ccaggacatt tctaagtacc tcaactggta tcagcagaag 180
ccagggcagg ctcctcgcct gctgatctac cacaccagcc gcctccacag cggtatcccc 240
gccagatttt ccgggagcgg gtctggaacc gactacaccc tcaccatctc ttctctgcag 300
cccgaggatt tcgccgtcta tttctgccag caggggaata ctctgccgta caccttcggt 360
caaggtacca agctggaaat caagggaggc ggaggatcag gcggtggcgg aagcggagga 420
ggtggctccg gaggaggagg ttcccaagtg cagcttcaag aatcaggacc cggacttgtg 480
aagccatcag aaaccctctc cctgacttgt accgtgtccg gtgtgagcct ccccgactac 540
ggagtctctt ggattcgcca gcctccgggg aagggtcttg aatggattgg ggtgatttgg 600
ggatcagaga ctacttacta ccagtcatca cttaagtcac gggtcaccat cagcaaagat 660
aatagcaaga accaagtgtc acttaagctg tcatctgtga ccgccgctga caccgccgtg 720
tactattgtg ccaaacatta ctattacgga gggtcttatg ctatggacta ctggggacag 780
gggaccctgg tgactgtctc tagccatcac catcaccacc atcatcac 828
<210> 58
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 58
atggcactgc ctgtcactgc cctcctgctg cctctggccc tccttctgca tgccgccagg 60
ccccaagtcc agctgcaaga gtcaggaccc ggactggtga agccgtctga gactctctca 120
ctgacttgta ccgtcagcgg cgtgtccctc cccgactacg gagtgtcatg gatccgccaa 180
cctcccggga aagggcttga atggattggt gtcatctggg gttctgaaac cacctactac 240
tcatcttccc tgaagtccag ggtgaccatc agcaaggata attccaagaa ccaggtcagc 300
cttaagctgt catctgtgac cgctgctgac accgccgtgt attactgcgc caagcactac 360
tattacggag gaagctacgc tatggactat tggggacagg gcactctcgt gactgtgagc 420
agcggcggtg gagggtctgg aggtggagga tccggtggtg gtgggtcagg cggaggaggg 480
agcgagattg tgatgactca gtcaccagcc accctttctc tttcacccgg cgagagagca 540
accctgagct gtagagccag ccaggacatt tctaagtacc tcaactggta tcagcaaaaa 600
ccggggcagg cccctcgcct cctgatctac catacctcac gccttcactc tggtatcccc 660
gctcggttta gcggatcagg atctggtacc gactacactc tgaccatttc cagcctgcag 720
ccagaagatt tcgcagtgta tttctgccag cagggcaata cccttcctta caccttcggt 780
cagggaacca agctcgaaat caagcaccat caccatcatc accaccat 828
<210> 59
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 59
atggcactgc ctgtcactgc cctcctgctg cctctggccc tccttctgca tgccgccagg 60
ccccaagtcc agctgcaaga gtcaggaccc ggactggtga agccgtctga gactctctca 120
ctgacttgta ccgtcagcgg cgtgtccctc cccgactacg gagtgtcatg gatccgccaa 180
cctcccggga aagggcttga atggattggt gtcatctggg gttctgaaac cacctactac 240
cagtcttccc tgaagtccag ggtgaccatc agcaaggata attccaagaa ccaggtcagc 300
cttaagctgt catctgtgac cgctgctgac accgccgtgt attactgcgc caagcactac 360
tattacggag gaagctacgc tatggactat tggggacagg gcactctcgt gactgtgagc 420
agcggcggtg gagggtctgg aggtggagga tccggtggtg gtgggtcagg cggaggaggg 480
agcgagattg tgatgactca gtcaccagcc accctttctc tttcacccgg cgagagagca 540
accctgagct gtagagccag ccaggacatt tctaagtacc tcaactggta tcagcaaaaa 600
ccggggcagg cccctcgcct cctgatctac catacctcac gccttcactc tggtatcccc 660
gctcggttta gcggatcagg atctggtacc gactacactc tgaccatttc cagcctgcag 720
ccagaagatt tcgcagtgta tttctgccag cagggcaata cccttcctta caccttcggt 780
cagggaacca agctcgaaat caagcaccat caccatcatc atcaccac 828
<210> 60
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 60
atggccctcc cagtgaccgc tctgctgctg cctctcgcac ttcttctcca tgccgctcgg 60
cctgagatcg tcatgaccca aagccccgct accctgtccc tgtcacccgg cgagagggca 120
accctttcat gcagggccag ccaggacatt tctaagtacc tcaactggta tcagcagaag 180
ccagggcagg ctcctcgcct gctgatctac cacaccagcc gcctccacag cggtatcccc 240
gccagatttt ccgggagcgg gtctggaacc gactacaccc tcaccatctc ttctctgcag 300
cccgaggatt tcgccgtcta tttctgccag caggggaata ctctgccgta caccttcggt 360
caaggtacca agctggaaat caagggaggc ggaggatcag gcggtggcgg aagcggagga 420
ggtggctccg gaggaggagg ttcccaagtg cagcttcaag aatcaggacc cggacttgtg 480
aagccatcag aaaccctctc cctgacttgt accgtgtccg gtgtgagcct ccccgactac 540
ggagtctctt ggattcgcca gcctccgggg aagggtcttg aatggattgg ggtgatttgg 600
ggatcagaga ctacttacta caattcatca cttaagtcac gggtcaccat cagcaaagat 660
aatagcaaga accaagtgtc acttaagctg tcatctgtga ccgccgctga caccgccgtg 720
tactattgtg ccaaacatta ctattacgga gggtcttatg ctatggacta ctggggacag 780
gggaccctgg tgactgtctc tagccatcac catcaccacc atcatcac 828
<210> 61
<211> 828
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 61
atggcactgc ctgtcactgc cctcctgctg cctctggccc tccttctgca tgccgccagg 60
ccccaagtcc agctgcaaga gtcaggaccc ggactggtga agccgtctga gactctctca 120
ctgacttgta ccgtcagcgg cgtgtccctc cccgactacg gagtgtcatg gatccgccaa 180
cctcccggga aagggcttga atggattggt gtcatctggg gttctgaaac cacctactac 240
aactcttccc tgaagtccag ggtgaccatc agcaaggata attccaagaa ccaggtcagc 300
cttaagctgt catctgtgac cgctgctgac accgccgtgt attactgcgc caagcactac 360
tattacggag gaagctacgc tatggactat tggggacagg gcactctcgt gactgtgagc 420
agcggcggtg gagggtctgg aggtggagga tccggtggtg gtgggtcagg cggaggaggg 480
agcgagattg tgatgactca gtcaccagcc accctttctc tttcacccgg cgagagagca 540
accctgagct gtagagccag ccaggacatt tctaagtacc tcaactggta tcagcaaaaa 600
ccggggcagg cccctcgcct cctgatctac catacctcac gccttcactc tggtatcccc 660
gctcggttta gcggatcagg atctggtacc gactacactc tgaccatttc cagcctgcag 720
ccagaagatt tcgcagtgta tttctgccag cagggcaata cccttcctta caccttcggt 780
cagggaacca agctcgaaat caagcaccat caccatcatc accaccat 828
<210> 62
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 62
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact 480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc 540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact 600
tactacaatt catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag 660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag 720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc 780
gtgtccagcc accaccatca tcaccatcac cat 813
<210> 63
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 63
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
aactcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg 480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg 540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct 600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg 660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc 720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt 780
gagatcaaac atcaccacca tcatcaccat cac 813
<210> 64
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 64
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 65
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 65
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 66
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 66
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys His His His His His His His His
260 265 270
<210> 67
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 67
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys His His His His His His His His
260 265 270
<210> 68
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 68
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser His His His His
260 265 270
His His His His
275
<210> 69
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 69
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser His His His His
260 265 270
His His His His
275
<210> 70
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 70
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys His His His His
260 265 270
His His His His
275
<210> 71
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 71
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys His His His His
260 265 270
His His His His
275
<210> 72
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 72
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser His His His His
260 265 270
His His His His
275
<210> 73
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 73
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys His His His His
260 265 270
His His His His
275
<210> 74
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 74
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 75
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 75
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys His His His His His His His His
260 265 270
<210> 76
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 76
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu
20 25 30
Ser Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr
50 55 60
Val Lys Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile
85 90 95
Ser Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
130 135 140
Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser
145 150 155 160
Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
195 200 205
Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
210 215 220
Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Ser Val Thr Val Ser Ser His His His His His His His His
260 265 270
<210> 77
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 77
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 78
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 78
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 79
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 79
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 80
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 80
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Met
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr His Thr Ser
195 200 205
Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln
245 250 255
Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 81
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 81
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Ser
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 82
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 82
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Gln
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 83
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 83
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Ser Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 84
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 84
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Gln Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 85
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 85
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 86
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 86
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val
145 150 155 160
Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser
165 170 175
Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly
180 185 190
Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn
195 200 205
Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn
210 215 220
Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp
245 250 255
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 87
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 87
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu
20 25 30
Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Val
35 40 45
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
65 70 75 80
Asn Ser Ser Leu Lys Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys
85 90 95
Asn Gln Val Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Val Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro
165 170 175
Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys
180 185 190
Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
195 200 205
Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro Ala Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
225 230 235 240
Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro
245 250 255
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 88
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 88
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
130 135 140
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
145 150 155 160
Leu Ser Leu Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ser Leu Lys Ser
195 200 205
Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu Lys
210 215 220
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 89
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 89
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu
20 25 30
Ser Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr
50 55 60
Val Lys Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile
85 90 95
Ser Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
130 135 140
Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser
145 150 155 160
Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
195 200 205
Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
210 215 220
Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Ser Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 90
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 90
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact 480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc 540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact 600
tactactctt catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag 660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag 720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc 780
gtgtccagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 91
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 91
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact 480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc 540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact 600
tactaccaat catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag 660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag 720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc 780
gtgtccagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 92
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 92
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
tcatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg 480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg 540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct 600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg 660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc 720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt 780
gagatcaaaa ccactactcc cgctccaagg ccacccaccc ctgccccgac catcgcctct 840
cagccgcttt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 93
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 93
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
caatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccga aatcgtgatg 480
acccagagcc ctgcaaccct gtccctttct cccggggaac gggctaccct ttcttgtcgg 540
gcatcacaag atatctcaaa atacctcaat tggtatcaac agaagccggg acaggcccct 600
aggcttctta tctaccacac ctctcgcctg catagcggga ttcccgcacg ctttagcggg 660
tctggaagcg ggaccgacta cactctgacc atctcatctc tccagcccga ggacttcgcc 720
gtctacttct gccagcaggg taacaccctg ccgtacacct tcggccaggg caccaagctt 780
gagatcaaaa ccactactcc cgctccaagg ccacccaccc ctgccccgac catcgcctct 840
cagccgcttt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 94
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 94
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcg gcggaggcgg gagccaggtc caactccaag aaagcggacc gggtcttgtg 480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac 540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg 600
ggctctgaga ctacttacta ctcttcatcc ctcaagtcac gcgtcaccat ctcaaaggac 660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg 720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag 780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct 840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 95
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 95
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcg gaggcggagg gagccaggtc caactccaag aaagcggacc gggtcttgtg 480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac 540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg 600
ggctctgaga ctacttacta ccaatcatcc ctcaagtcac gcgtcaccat ctcaaaggac 660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg 720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag 780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct 840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 96
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 96
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
tcatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccgg aggtggcgga 480
agcgaaatcg tgatgaccca gagccctgca accctgtccc tttctcccgg ggaacgggct 540
accctttctt gtcgggcatc acaagatatc tcaaaatacc tcaattggta tcaacagaag 600
ccgggacagg cccctaggct tcttatctac cacacctctc gcctgcatag cgggattccc 660
gcacgcttta gcgggtctgg aagcgggacc gactacactc tgaccatctc atctctccag 720
cccgaggact tcgccgtcta cttctgccag cagggtaaca ccctgccgta caccttcggc 780
cagggcacca agcttgagat caaaaccact actcccgctc caaggccacc cacccctgcc 840
ccgaccatcg cctctcagcc gctttccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 97
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 97
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
caatcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccgg aggcggtggg 480
tcagaaatcg tgatgaccca gagccctgca accctgtccc tttctcccgg ggaacgggct 540
accctttctt gtcgggcatc acaagatatc tcaaaatacc tcaattggta tcaacagaag 600
ccgggacagg cccctaggct tcttatctac cacacctctc gcctgcatag cgggattccc 660
gcacgcttta gcgggtctgg aagcgggacc gactacactc tgaccatctc atctctccag 720
cccgaggact tcgccgtcta cttctgccag cagggtaaca ccctgccgta caccttcggc 780
cagggcacca agcttgagat caaaaccact actcccgctc caaggccacc cacccctgcc 840
ccgaccatcg cctctcagcc gctttccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 98
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 98
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcg gaggcggtgg gagccaggtc caactccaag aaagcggacc gggtcttgtg 480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac 540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg 600
ggctctgaga ctacttacta caactcatcc ctcaagtcac gcgtcaccat ctcaaaggac 660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg 720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag 780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct 840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 99
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 99
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcg gaggcggtgg gagccaggtc caactccaag aaagcggacc gggtcttgtg 480
aagccatcag aaactctttc actgacttgt actgtgagcg gagtgtctct ccccgattac 540
ggggtgtctt ggatcagaca gccaccgggg aagggtctgg aatggattgg agtgatttgg 600
ggctctgaga ctacttacta caactcatcc ctcaagtcac gcgtcaccat ctcaaaggac 660
aactctaaga atcaggtgtc actgaaactg tcatctgtga ccgcagccga caccgccgtg 720
tactattgcg ctaagcatta ctattatggc gggagctacg caatggatta ctggggacag 780
ggtactctgg tcaccgtgtc cagcaccact accccagcac cgaggccacc caccccggct 840
cctaccatcg cctcccagcc tctgtccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 100
<211> 1473
<212> ДНК
<213> Homo sapiens
<400> 100
atggctctgc ccgtgaccgc actcctcctg ccactggctc tgctgcttca cgccgctcgc 60
ccacaagtcc agcttcaaga atcagggcct ggtctggtga agccatctga gactctgtcc 120
ctcacttgca ccgtgagcgg agtgtccctc ccagactacg gagtgagctg gattagacag 180
cctcccggaa agggactgga gtggatcgga gtgatttggg gtagcgaaac cacttactat 240
aactcttccc tgaagtcacg ggtcaccatt tcaaaggata actcaaagaa tcaagtgagc 300
ctcaagctct catcagtcac cgccgctgac accgccgtgt attactgtgc caagcattac 360
tactatggag ggtcctacgc catggactac tggggccagg gaactctggt cactgtgtca 420
tctggtggag gaggtagcgg aggaggcggg agcggtggag gtggctccgg aggtggcgga 480
agcgaaatcg tgatgaccca gagccctgca accctgtccc tttctcccgg ggaacgggct 540
accctttctt gtcgggcatc acaagatatc tcaaaatacc tcaattggta tcaacagaag 600
ccgggacagg cccctaggct tcttatctac cacacctctc gcctgcatag cgggattccc 660
gcacgcttta gcgggtctgg aagcgggacc gactacactc tgaccatctc atctctccag 720
cccgaggact tcgccgtcta cttctgccag cagggtaaca ccctgccgta caccttcggc 780
cagggcacca agcttgagat caaaaccact actcccgctc caaggccacc cacccctgcc 840
ccgaccatcg cctctcagcc gctttccctg cgtccggagg catgtagacc cgcagctggt 900
ggggccgtgc atacccgggg tcttgacttc gcctgcgata tctacatttg ggcccctctg 960
gctggtactt gcggggtcct gctgctttca ctcgtgatca ctctttactg taagcgcggt 1020
cggaagaagc tgctgtacat ctttaagcaa cccttcatga ggcctgtgca gactactcaa 1080
gaggaggacg gctgttcatg ccggttccca gaggaggagg aaggcggctg cgaactgcgc 1140
gtgaaattca gccgcagcgc agatgctcca gcctacaagc aggggcagaa ccagctctac 1200
aacgaactca atcttggtcg gagagaggag tacgacgtgc tggacaagcg gagaggacgg 1260
gacccagaaa tgggcgggaa gccgcgcaga aagaatcccc aagagggcct gtacaacgag 1320
ctccaaaagg ataagatggc agaagcctat agcgagattg gtatgaaagg ggaacgcaga 1380
agaggcaaag gccacgacgg actgtaccag ggactcagca ccgccaccaa ggacacctat 1440
gacgctcttc acatgcaggc cctgccgcct cgg 1473
<210> 101
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 101
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaaattg tgatgaccca gtcacccgcc actcttagcc tttcacccgg tgagcgcgca 120
accctgtctt gcagagcctc ccaagacatc tcaaaatacc ttaattggta tcaacagaag 180
cccggacagg ctcctcgcct tctgatctac cacaccagcc ggctccattc tggaatccct 240
gccaggttca gcggtagcgg atctgggacc gactacaccc tcactatcag ctcactgcag 300
ccagaggact tcgctgtcta tttctgtcag caagggaaca ccctgcccta cacctttgga 360
cagggcacca agctcgagat taaaggtgga ggtggcagcg gaggaggtgg gtccggcggt 420
ggaggaagcc aggtccaact ccaagaaagc ggaccgggtc ttgtgaagcc atcagaaact 480
ctttcactga cttgtactgt gagcggagtg tctctccccg attacggggt gtcttggatc 540
agacagccac cggggaaggg tctggaatgg attggagtga tttggggctc tgagactact 600
tactacaact catccctcaa gtcacgcgtc accatctcaa aggacaactc taagaatcag 660
gtgtcactga aactgtcatc tgtgaccgca gccgacaccg ccgtgtacta ttgcgctaag 720
cattactatt atggcgggag ctacgcaatg gattactggg gacagggtac tctggtcacc 780
gtgtccagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 102
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 102
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg 60
ccggacatcc agatgacaca gactacatcc tccctgtctg cctctctggg agacagagtc 120
accatcagtt gcagggcaag tcaggacatt agtaaatatt taaattggta tcagcagaaa 180
ccagatggaa ctgttaaact cctgatctac catacatcaa gattacactc aggagtccca 240
tcaaggttca gtggcagtgg gtctggaaca gattattctc tcaccattag caacctggag 300
caagaagata ttgccactta cttttgccaa cagggtaata cgcttccgta cacgttcgga 360
ggggggacca agctggagat cacaggtggc ggtggctcgg gcggtggtgg gtcgggtggc 420
ggcggatctg aggtgaaact gcaggagtca ggacctggcc tggtggcgcc ctcacagagc 480
ctgtccgtca catgcactgt ctcaggggtc tcattacccg actatggtgt aagctggatt 540
cgccagcctc cacgaaaggg tctggagtgg ctgggagtaa tatggggtag tgaaaccaca 600
tactataatt cagctctcaa atccagactg accatcatca aggacaactc caagagccaa 660
gttttcttaa aaatgaacag tctgcaaact gatgacacag ccatttacta ctgtgccaaa 720
cattattact acggtggtag ctatgctatg gactactggg gccaaggaac ctcagtcacc 780
gtctcctcaa ccacgacgcc agcgccgcga ccaccaacac cggcgcccac catcgcgtcg 840
cagcccctgt ccctgcgccc agaggcgtgc cggccagcgg cggggggcgc agtgcacacg 900
agggggctgg acttcgcctg tgatatctac atctgggcgc ccttggccgg gacttgtggg 960
gtccttctcc tgtcactggt tatcaccctt tactgcaaac ggggcagaaa gaaactcctg 1020
tatatattca aacaaccatt tatgagacca gtacaaacta ctcaagagga agatggctgt 1080
agctgccgat ttccagaaga agaagaagga ggatgtgaac tgagagtgaa gttcagcagg 1140
agcgcagacg cccccgcgta caagcagggc cagaaccagc tctataacga gctcaatcta 1200
ggacgaagag aggagtacga tgttttggac aagagacgtg gccgggaccc tgagatgggg 1260
ggaaagccga gaaggaagaa ccctcaggaa ggcctgtaca atgaactgca gaaagataag 1320
atggcggagg cctacagtga gattgggatg aaaggcgagc gccggagggg caaggggcac 1380
gatggccttt accagggtct cagtacagcc accaaggaca cctacgacgc ccttcacatg 1440
caggccctgc cccctcgc 1458
<210> 103
<211> 847
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 103
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca 60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc 120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc 180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag 240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag 300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg 360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga 420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca 480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat 540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc 600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc 660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt 720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc 780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact 840
gaccatt 847
<210> 104
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 104
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 105
<211> 394
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 105
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro
20 25 30
Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly
35 40 45
Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe
50 55 60
Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu
65 70 75 80
Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe
85 90 95
Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val
100 105 110
Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser
115 120 125
Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg
130 135 140
Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser
145 150 155 160
Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala
165 170 175
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
180 185 190
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
195 200 205
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
210 215 220
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
225 230 235 240
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
245 250 255
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
260 265 270
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
275 280 285
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
290 295 300
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
305 310 315 320
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
325 330 335
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
340 345 350
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
355 360 365
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
370 375 380
Ala Leu His Met Gln Ala Leu Pro Pro Arg
385 390
<210> 106
<211> 373
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 106
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
145 150 155 160
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
165 170 175
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
180 185 190
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
195 200 205
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
210 215 220
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
225 230 235 240
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
245 250 255
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 107
<211> 1182
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 107
atggccctcc ctgtcactgc cctgcttctc cccctcgcac tcctgctcca cgccgctaga 60
ccacccggat ggtttctgga ctctccggat cgcccgtgga atcccccaac cttctcaccg 120
gcactcttgg ttgtgactga gggcgataat gcgaccttca cgtgctcgtt ctccaacacc 180
tccgaatcat tcgtgctgaa ctggtaccgc atgagcccgt caaaccagac cgacaagctc 240
gccgcgtttc cggaagatcg gtcgcaaccg ggacaggatt gtcggttccg cgtgactcaa 300
ctgccgaatg gcagagactt ccacatgagc gtggtccgcg ctaggcgaaa cgactccggg 360
acctacctgt gcggagccat ctcgctggcg cctaaggccc aaatcaaaga gagcttgagg 420
gccgaactga gagtgaccga gcgcagagct gaggtgccaa ctgcacatcc atccccatcg 480
cctcggcctg cggggcagtt tcagaccctg gtcacgacca ctccggcgcc gcgcccaccg 540
actccggccc caactatcgc gagccagccc ctgtcgctga ggccggaagc atgccgccct 600
gccgccggag gtgctgtgca tacccgggga ttggacttcg catgcgacat ctacatttgg 660
gctcctctcg ccggaacttg tggcgtgctc cttctgtccc tggtcatcac cctgtactgc 720
aagcggggtc ggaaaaagct tctgtacatt ttcaagcagc ccttcatgag gcccgtgcaa 780
accacccagg aggaggacgg ttgctcctgc cggttccccg aagaggaaga aggaggttgc 840
gagctgcgcg tgaagttctc ccggagcgcc gacgcccccg cctataagca gggccagaac 900
cagctgtaca acgaactgaa cctgggacgg cgggaagagt acgatgtgct ggacaagcgg 960
cgcggccggg accccgaaat gggcgggaag cctagaagaa agaaccctca ggaaggcctg 1020
tataacgagc tgcagaagga caagatggcc gaggcctact ccgaaattgg gatgaaggga 1080
gagcggcgga ggggaaaggg gcacgacggc ctgtaccaag gactgtccac cgccaccaag 1140
gacacatacg atgccctgca catgcaggcc cttccccctc gc 1182
<210> 108
<211> 1132
<212> БЕЛОК
<213> Homo sapiens
<400> 108
Met Pro Arg Ala Pro Arg Cys Arg Ala Val Arg Ser Leu Leu Arg Ser
1 5 10 15
His Tyr Arg Glu Val Leu Pro Leu Ala Thr Phe Val Arg Arg Leu Gly
20 25 30
Pro Gln Gly Trp Arg Leu Val Gln Arg Gly Asp Pro Ala Ala Phe Arg
35 40 45
Ala Leu Val Ala Gln Cys Leu Val Cys Val Pro Trp Asp Ala Arg Pro
50 55 60
Pro Pro Ala Ala Pro Ser Phe Arg Gln Val Ser Cys Leu Lys Glu Leu
65 70 75 80
Val Ala Arg Val Leu Gln Arg Leu Cys Glu Arg Gly Ala Lys Asn Val
85 90 95
Leu Ala Phe Gly Phe Ala Leu Leu Asp Gly Ala Arg Gly Gly Pro Pro
100 105 110
Glu Ala Phe Thr Thr Ser Val Arg Ser Tyr Leu Pro Asn Thr Val Thr
115 120 125
Asp Ala Leu Arg Gly Ser Gly Ala Trp Gly Leu Leu Leu Arg Arg Val
130 135 140
Gly Asp Asp Val Leu Val His Leu Leu Ala Arg Cys Ala Leu Phe Val
145 150 155 160
Leu Val Ala Pro Ser Cys Ala Tyr Gln Val Cys Gly Pro Pro Leu Tyr
165 170 175
Gln Leu Gly Ala Ala Thr Gln Ala Arg Pro Pro Pro His Ala Ser Gly
180 185 190
Pro Arg Arg Arg Leu Gly Cys Glu Arg Ala Trp Asn His Ser Val Arg
195 200 205
Glu Ala Gly Val Pro Leu Gly Leu Pro Ala Pro Gly Ala Arg Arg Arg
210 215 220
Gly Gly Ser Ala Ser Arg Ser Leu Pro Leu Pro Lys Arg Pro Arg Arg
225 230 235 240
Gly Ala Ala Pro Glu Pro Glu Arg Thr Pro Val Gly Gln Gly Ser Trp
245 250 255
Ala His Pro Gly Arg Thr Arg Gly Pro Ser Asp Arg Gly Phe Cys Val
260 265 270
Val Ser Pro Ala Arg Pro Ala Glu Glu Ala Thr Ser Leu Glu Gly Ala
275 280 285
Leu Ser Gly Thr Arg His Ser His Pro Ser Val Gly Arg Gln His His
290 295 300
Ala Gly Pro Pro Ser Thr Ser Arg Pro Pro Arg Pro Trp Asp Thr Pro
305 310 315 320
Cys Pro Pro Val Tyr Ala Glu Thr Lys His Phe Leu Tyr Ser Ser Gly
325 330 335
Asp Lys Glu Gln Leu Arg Pro Ser Phe Leu Leu Ser Ser Leu Arg Pro
340 345 350
Ser Leu Thr Gly Ala Arg Arg Leu Val Glu Thr Ile Phe Leu Gly Ser
355 360 365
Arg Pro Trp Met Pro Gly Thr Pro Arg Arg Leu Pro Arg Leu Pro Gln
370 375 380
Arg Tyr Trp Gln Met Arg Pro Leu Phe Leu Glu Leu Leu Gly Asn His
385 390 395 400
Ala Gln Cys Pro Tyr Gly Val Leu Leu Lys Thr His Cys Pro Leu Arg
405 410 415
Ala Ala Val Thr Pro Ala Ala Gly Val Cys Ala Arg Glu Lys Pro Gln
420 425 430
Gly Ser Val Ala Ala Pro Glu Glu Glu Asp Thr Asp Pro Arg Arg Leu
435 440 445
Val Gln Leu Leu Arg Gln His Ser Ser Pro Trp Gln Val Tyr Gly Phe
450 455 460
Val Arg Ala Cys Leu Arg Arg Leu Val Pro Pro Gly Leu Trp Gly Ser
465 470 475 480
Arg His Asn Glu Arg Arg Phe Leu Arg Asn Thr Lys Lys Phe Ile Ser
485 490 495
Leu Gly Lys His Ala Lys Leu Ser Leu Gln Glu Leu Thr Trp Lys Met
500 505 510
Ser Val Arg Gly Cys Ala Trp Leu Arg Arg Ser Pro Gly Val Gly Cys
515 520 525
Val Pro Ala Ala Glu His Arg Leu Arg Glu Glu Ile Leu Ala Lys Phe
530 535 540
Leu His Trp Leu Met Ser Val Tyr Val Val Glu Leu Leu Arg Ser Phe
545 550 555 560
Phe Tyr Val Thr Glu Thr Thr Phe Gln Lys Asn Arg Leu Phe Phe Tyr
565 570 575
Arg Lys Ser Val Trp Ser Lys Leu Gln Ser Ile Gly Ile Arg Gln His
580 585 590
Leu Lys Arg Val Gln Leu Arg Glu Leu Ser Glu Ala Glu Val Arg Gln
595 600 605
His Arg Glu Ala Arg Pro Ala Leu Leu Thr Ser Arg Leu Arg Phe Ile
610 615 620
Pro Lys Pro Asp Gly Leu Arg Pro Ile Val Asn Met Asp Tyr Val Val
625 630 635 640
Gly Ala Arg Thr Phe Arg Arg Glu Lys Arg Ala Glu Arg Leu Thr Ser
645 650 655
Arg Val Lys Ala Leu Phe Ser Val Leu Asn Tyr Glu Arg Ala Arg Arg
660 665 670
Pro Gly Leu Leu Gly Ala Ser Val Leu Gly Leu Asp Asp Ile His Arg
675 680 685
Ala Trp Arg Thr Phe Val Leu Arg Val Arg Ala Gln Asp Pro Pro Pro
690 695 700
Glu Leu Tyr Phe Val Lys Val Asp Val Thr Gly Ala Tyr Asp Thr Ile
705 710 715 720
Pro Gln Asp Arg Leu Thr Glu Val Ile Ala Ser Ile Ile Lys Pro Gln
725 730 735
Asn Thr Tyr Cys Val Arg Arg Tyr Ala Val Val Gln Lys Ala Ala His
740 745 750
Gly His Val Arg Lys Ala Phe Lys Ser His Val Ser Thr Leu Thr Asp
755 760 765
Leu Gln Pro Tyr Met Arg Gln Phe Val Ala His Leu Gln Glu Thr Ser
770 775 780
Pro Leu Arg Asp Ala Val Val Ile Glu Gln Ser Ser Ser Leu Asn Glu
785 790 795 800
Ala Ser Ser Gly Leu Phe Asp Val Phe Leu Arg Phe Met Cys His His
805 810 815
Ala Val Arg Ile Arg Gly Lys Ser Tyr Val Gln Cys Gln Gly Ile Pro
820 825 830
Gln Gly Ser Ile Leu Ser Thr Leu Leu Cys Ser Leu Cys Tyr Gly Asp
835 840 845
Met Glu Asn Lys Leu Phe Ala Gly Ile Arg Arg Asp Gly Leu Leu Leu
850 855 860
Arg Leu Val Asp Asp Phe Leu Leu Val Thr Pro His Leu Thr His Ala
865 870 875 880
Lys Thr Phe Leu Arg Thr Leu Val Arg Gly Val Pro Glu Tyr Gly Cys
885 890 895
Val Val Asn Leu Arg Lys Thr Val Val Asn Phe Pro Val Glu Asp Glu
900 905 910
Ala Leu Gly Gly Thr Ala Phe Val Gln Met Pro Ala His Gly Leu Phe
915 920 925
Pro Trp Cys Gly Leu Leu Leu Asp Thr Arg Thr Leu Glu Val Gln Ser
930 935 940
Asp Tyr Ser Ser Tyr Ala Arg Thr Ser Ile Arg Ala Ser Leu Thr Phe
945 950 955 960
Asn Arg Gly Phe Lys Ala Gly Arg Asn Met Arg Arg Lys Leu Phe Gly
965 970 975
Val Leu Arg Leu Lys Cys His Ser Leu Phe Leu Asp Leu Gln Val Asn
980 985 990
Ser Leu Gln Thr Val Cys Thr Asn Ile Tyr Lys Ile Leu Leu Leu Gln
995 1000 1005
Ala Tyr Arg Phe His Ala Cys Val Leu Gln Leu Pro Phe His Gln
1010 1015 1020
Gln Val Trp Lys Asn Pro Thr Phe Phe Leu Arg Val Ile Ser Asp
1025 1030 1035
Thr Ala Ser Leu Cys Tyr Ser Ile Leu Lys Ala Lys Asn Ala Gly
1040 1045 1050
Met Ser Leu Gly Ala Lys Gly Ala Ala Gly Pro Leu Pro Ser Glu
1055 1060 1065
Ala Val Gln Trp Leu Cys His Gln Ala Phe Leu Leu Lys Leu Thr
1070 1075 1080
Arg His Arg Val Thr Tyr Val Pro Leu Leu Gly Ser Leu Arg Thr
1085 1090 1095
Ala Gln Thr Gln Leu Ser Arg Lys Leu Pro Gly Thr Thr Leu Thr
1100 1105 1110
Ala Leu Glu Ala Ala Ala Asn Pro Ala Leu Pro Ser Asp Phe Lys
1115 1120 1125
Thr Ile Leu Asp
1130
<210> 109
<211> 521
<212> ДНК
<213> Homo sapiens
<400> 109
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat 360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc 420
cgcggcgacg caaagggcct tggtgcgggt ctcgtcggcg cagggacgcg tttgggtccc 480
gacggaacct tttccgcgtt ggggttgggg caccataagc t 521
<210> 110
<211> 118
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 110
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtg 118
<210> 111
<211> 221
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 111
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac g 221
<210> 112
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 112
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccg 324
<210> 113
<211> 422
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 113
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat 360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc 420
cg 422
<210> 114
<211> 132
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 114
Asp Val Pro Asp Tyr Ala Ser Leu Gly Gly Pro Ser Ser Pro Lys Lys
1 5 10 15
Lys Arg Lys Val Ser Arg Gly Val Gln Val Glu Thr Ile Ser Pro Gly
20 25 30
Asp Gly Arg Thr Phe Pro Lys Arg Gly Gln Thr Cys Val Val His Tyr
35 40 45
Thr Gly Met Leu Glu Asp Gly Lys Lys Phe Asp Ser Ser Arg Asp Arg
50 55 60
Asn Lys Pro Phe Lys Phe Met Leu Gly Lys Gln Glu Val Ile Arg Gly
65 70 75 80
Trp Glu Glu Gly Val Ala Gln Met Ser Val Gly Gln Arg Ala Lys Leu
85 90 95
Thr Ile Ser Pro Asp Tyr Ala Tyr Gly Ala Thr Gly His Pro Gly Ile
100 105 110
Ile Pro Pro His Ala Thr Leu Val Phe Asp Val Glu Leu Leu Lys Leu
115 120 125
Glu Thr Ser Tyr
130
<210> 115
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 115
Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe Pro Lys
1 5 10 15
Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu Asp Gly
20 25 30
Lys Lys Phe Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys Phe Met
35 40 45
Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val Ala Gln
50 55 60
Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp Tyr Ala
65 70 75 80
Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala Thr Leu
85 90 95
Val Phe Asp Val Glu Leu Leu Lys Leu Glu Thr Ser
100 105
<210> 116
<211> 93
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 116
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys
85 90
<210> 117
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 117
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 118
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 118
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 119
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 119
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 120
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (78)..(78)
<223> Любая аминокислота
<400> 120
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Xaa Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Xaa Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 121
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 121
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 122
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 122
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<---
Реферат
Изобретение относится к области биотехнологии. Предложены варианты способа получения популяции иммунных эффекторных клеток, экспрессирующих химерный антигенный рецептор (CAR), связывающийся с В-клеточным антигеном. Получают популяцию иммунных эффекторных клеток из субъекта, имеющего хронический лимфоцитарный лейкоз (ХЛЛ). Затем указанную популяцию приводят в контакт с анти-CD25 антителом или CD25-связывающим лигандом для удаления регуляторных СD25+ T-клеток и CD25-экспрессирующих клеток ХЛЛ. Далее трансдуцируют клетки нуклеиновой кислотой, кодирующей CAR, получая популяцию CAR-экспрессирующих иммунных эффекторных клеток, истощенную более чем на 50% по регуляторным CD25+ T-клеткам и CD25-экспрессирующим клеткам ХЛЛ. Также изобретение относится к популяциям иммунных эффекторных клеток для лечения субъекта, имеющего гематологический рак, реакционной смеси для их получения, содержащей указанную популяцию клеток фармацевтической композиции. Изобретение обеспечивает улучшенную эффективность трансдукции в результате истощения клеток по CD25, что может быть использовано для более эффективной терапии CART. 6 н. и 30 з.п. ф-лы, 84 ил., 6 табл., 3 пр.

Комментарии