Клетки для иммунотерапии, сконструированные для нацеливания на антиген, присутствующий одновременно на иммунных клетках и на патологических клетках - RU2714258C2
Код документа: RU2714258C2
Чертежи














Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам создания генетически сконструированных предпочтительно не аллореактивных иммунных клеток для иммунотерапии, которые наделены химерными антигенными рецепторами, нацеливающимися на антигенный маркер, являющийся общим, как для патологических клеток, так и для иммунных клеток (например, CD38).
Способ по настоящему изобретению включает экспрессию химерных антигенных рецепторов (chimeric antigen receptor - CAR), направленных против указанного антигенного маркера, и инактивацию генов иммунных клеток, способствующих наличию указанного антигенного маркера на поверхности указанных иммунных клеток. Такую инактивацию обычно проводят с помощью трансгенов, кодирующих РНК-направляемые эндонуклеазы (например, Cas9/CRISPR), мегануклеазы, цинк-пальциевые нуклеазы или нуклеазы TAL. Сконструированные иммунные клетки, предпочтительно Т-клетки, направляют свою иммунную активность на злокачественные и инфицированные клетки или на дефектные иммунные клетки, при этом избегая их соответствующей деструкции, автостимуляции или агрегирования. Настоящее изобретение открывает направление по разработке стандартных и допустимых стратегий адаптивной иммунотерапии, использующих иммунные клетки для лечения рака, инфекций и аутоиммунных заболеваний.
Предшествующий уровень техники
Адаптивная иммунотерапия, которая предусматривает перенос аутологичных антигенспецифичных иммунных клеток, выработанных ex vivo, является обещающей стратегией для лечения вирусных инфекций и рака. Т-клетки, применяемые для адаптивной иммунотерапии, например, могут быть получены или размножением антигенспецифичных Т-клеток, или перенаправлением Т-клеток с помощью генетической инженерии (Park с соавт., 2011).
Новые свойства Т-клеток были успешно выработаны за счет генетического переноса трансгенных рецепторов Т-клеток или химерных антигенных рецепторов (CAR) (Jena с соавт., 2010). CAR являются синтетическими рецепторами, состоящими из нацеливающейся части, которая связана с одним или несколькими сигнальными доменами в единой гибридной молекуле. В целом, связывающая часть CAR состоит из антигенсвязывающего домена одноцепочечного антитела (single-chain antibody - scFv), включающего легкие и вариабельные фрагменты моноклонального антитела, соединенные гибким линкером. Также успешно применяют связывающие части, основанные на доменах рецептора или лиганда. Сигнальные домены первой генерации CAR производны от цитоплазматической области цепей CD3zeta или Fc рецептора гамма. Установлено, что первая генерация CAR успешно перенаправляет цитотоксичность Т-клеток, однако они не обеспечивают пролонгированное размножение и противоопухолевую активность in vivo . Сигнальные домены от ко-стимулирующих молекул, включающие CD28, ОХ-40 (CD134) и 4-1ВВ (CD137), добавляют отдельно (вторая генерация) или в комбинации (третья генерация) для повышения выживания и повышенной пролиферации CAR-модифицированных Т-клеток. CAR с успехом осуществляют перенаправление Т-клеток против антигенов, экспрессированных на поверхности раковых клеток различных злокачественных форм, включая лимфомы и солидные опухоли (Jena с соавт., 2010).
Современный протокол лечения пациентов, в котором применяют адаптивную иммунотерапию, основан на переносе аутологичных клеток. При таком подходе Т-лимфоциты выделяют от пациентов, генетически модифицируют или отбирают ex vivo, культивируют in vitro для амплификации числа клеток при необходимости и в итоге вводят пациенту инфузией. Помимо инфузии лимфоцитов организм хозяина может быть изменен другими путями, которые поддерживают приживление Т-клеток или иначе участвуют в иммунном ответе, например, предварительной обработкой (с помощью радиации или химиотерапии) и введением факторов роста лимфоцитов (например, IL-2). Каждый пациент получает индивидуально разработанное лечение, использующее собственные лимфоциты пациента (т.е. аутологичная терапия). Аутологичные терапии сталкиваются с существенными техническими и логистическими препятствиями в отношении практического применения, их разработка требует дорогостоящих специальных средств и квалифицированного персонала, их следует получать за короткое время после постановки диагноза пациенту, и во многих случаях предварительное лечение пациента приводит к понижению иммунной функции таким образом, что лимфоциты пациентов могут слабо функционировать, и они присутствуют в небольшом количестве. Несмотря на эти трудности, каждый препарат аутологичных клеток пациента является эффективным новым продуктом, который получают со значительными вариациями по эффективности и безопасности.
В идеальном варианте хотелось бы, чтобы применяли стандартизированную терапию, в которой аллогенные терапевтические клетки могли быть предварительно получены, подробно описаны и доступны для немедленного введения пациентам. Понятие «аллогенные клетки» означает, что клетки получены от индивидуумов, принадлежащих к тому же виду, но генетически отличных. Однако применение аллогенных клеток в настоящее время имеет много препятствий. В организмах иммунокомпетентных хозяев аллогенные клетки быстро отторгаются, процесс называют «организм против трансплантата» (host versus graft - HvG), и это существенно ограничивает эффективность перемещенных клеток. В организмах иммунно некомпетентных хозяев аллогенные клетки могут прижиться, но за счет специфики их эндогенных Т-клеточных рецепторов (T-cell receptor - TCR) они могут распознавать ткань хозяина в качестве чужеродной, что приводит к заболеванию «трансплантат против хозяина» (graft versus host disease - GvHD) и может привести к тяжелому повреждению ткани и смерти.
Для обеспечения аллогенными Т-клетками ранее был описан способ получения генетически сконструированных Т-клеток, в которых различные эффекторные гены, в частности те, которые кодируют рецепторы Т-клеток, инактивируют с помощью специфичных TAL-нуклеаз, больше известных под торговой маркой TALEN™ (фирма Cellectis). Доказано, что этот метод высокоэффективен в первичных клетках при использовании трансфекции РНК в качестве части платформы, обеспечивающей массовое получение аллогенных Т-клеток (WO 2013/176915).
Кластер дифференциации 38 (CD38 - cluster of differentiation 38), также называемый гидролазой циклической АДФ-рибозы, является гликопротеином, обнаруженным на поверхности многих иммунных клеток (белых кровяных клеток), в частности Т-клеток, включая CD4+, CD8+, В-лимфоцитов и природных клеток-киллеров (natural killer - NK). CD38 также участвует в клеточной адгезии, сигнальной трансдукции и кальциевой сигнализации. Информация по структуре этого белка находится в базе данных UniProtKB/Swiss-Prot под обозначением Р28907. У людей белок CD38 кодирует ген CD38, локализованный на хромосоме 4. CD38 является мультифункциональным эктоферментом, катализирующим синтез и гидролиз циклической АДФ-рибозы (цАДФр) из NAD+ в АДФ-рибозу. Продукты этой реакции считают важными для регуляции внутриклеточного Са2+. Кроме того, утрата функции CD38 связана с ухудшенными иммунными ответами и метаболическими нарушениями (Malavasi с соавт., 2008).
С другой стороны, белок CD38 является маркером ВИЧ инфекции, лейкозов, миелом, солидных опухолей, сахарного диабета второго типа и костного метаболизма, а также некоторых других генетически обусловленных состояний. В частности, его применяют в качестве прогностического маркера при лейкозе (Ibrahim с соавт., 2001).
Клетки, экспрессирующие CD38, а также многие другие опухолевые антигенные маркеры, приведенные в табл. 1, например, CD70 и CS1, можно было бы рассматривать в качестве привлекательных мишеней CAR, но тот факт, что такие антигенные маркеры также экспрессируются на поверхности большинства Т-клеток, существенно препятствуют выбору этих маркеров для осуществления иммунотерапии.
В настоящем изобретении также предусматривают стратегии иммунотерапии, включающие патологические клетки, которые экспрессируют специфические антигенные маркеры, также присутствующие на поверхности Т-клеток, например, злокачественных CD38-положительных В-клеток, вызывающих лейкоз, CD70 и CS1.
Краткое описание изобретения
Настоящее изобретение описывает способы конструирования Т-клеток, предназначенных для целевых патологических клеток, причем указанные патологические клетки экспрессируют один или несколько антигенных маркеров, которые также присутствуют на поверхности Т-клеток. Примеры таких антигенных маркеров приведены в табл. 1. Примером таких антигенных маркеров является CD38. Другими примерами являются CD70 и CS1. Понятие «антигенный маркер» означает целый белок или его иммуннореактивный фрагмент.
Согласно настоящему изобретению Т-клетки конструируют для инактивации экспрессии генов, кодирующих такие антигенные маркеры, или участвующих в презентации такого антигенного маркера на поверхности клетки.
Такую инактивацию предпочтительно осуществляют путем модификации генома, точнее через экспрессию в Т-клетках специфической редкощепящей эндонуклеазы, способной нацеливаться на генетический локус, прямо или опосредованно участвующий в выработке или презентации указанного антигенного маркера на поверхности Т-клеток. Можно применять разные типы редкощепящих эндонуклеаз, например, мегануклеазы, TAL-нуклеазы, цинк-пальциевые нуклеазы (zing-finger nucleases - ZFN) или РНК/ДНК направляемые эндонуклеазы, например, Cas9/CRISPR или Argonaute.
В предпочтительном варианте осуществления настоящего изобретения Т-клетки снабжают, по меньшей мере, одним химерным антигенным рецептором (CAR), допускающим специфическое связывание указанных клеток, несущих указанный целевой антигенный маркер.
В другом варианте осуществления настоящего изобретения Т-клетки могут быть дополнительно сконструированы для того, чтобы сделать их аллогенными, особенно путем делеции генов, участвующих в самораспознавании, например, кодирующих компоненты рецепторов Т-клеток (TCR) или комплекс HLA.
Настоящее изобретение охватывает выделенные клетки или линии клеток, которые включают генетические модификации, представленные ниже в подробном описании изобретения, примеры и фигуры, а также какие-либо белки, полипептиды или векторы, применимые для конструирования указанных Т-клеток.
В результате настоящего изобретения сконструированные Т-клетки могут применять в качестве терапевтических продуктов, в идеале в качестве имеющихся в продаже, в способах лечения или предупреждения рака, инфекций или аутоиммунных заболеваний.
Предпочтительными иммунными клетками по настоящему изобретению являются те клетки, которые выражают следующие фенотипы:
- [CAR, нацеливающийся на антигенный маркер из табл. 1]+[антигенный маркер из табл. 1]-, например, следующие:
- [CAR CD38]+[CD38]-, предпочтительно также [TCR] отрицательные,
- [CAR CD70]+[CD70]-, предпочтительно также [TCR] отрицательные,
- [CAR CS1]+[CS1]-, предпочтительно также [TCR] отрицательные,
для их применения в качестве терапевтических продуктов, предпочтительно аллогенных продуктов.
Краткое описание фигур и таблиц
Фиг. 1. Схематическое представление Т-клетки, сконструированной по настоящему изобретению, с разрушенным CD38 и снабженной химерным антигенным рецептором (представленным в виде одноцепочечного CAR), нацеливающимся на злокачественные клетки, несущие антигенный маркер CD38.
Фиг. 2. Схематическое представление мультисубъединичного химерного антигенного рецептора.
Фиг.3. Схематическое представление терапевтической стратегии по настоящему изобретению, комбинирующей Т-клетки, снабженные мультисубъединичными CAR, и циркулирующее в крови биспецифичное антитело. В этом конкретном аспекте присутствующий на внеклеточной цепи рецептор мультисубъединичного CAR включает эпитоп, который распознается биспецифическим антителом. Биспецифическое антитело предназначено для связывания и указанного эпитопа, и антигенного маркера, для облегчения связывания Т-клетки с патологической клеткой.
Фиг. 4. Схематическое представление терапевтической стратегии по настоящему изобретению, комбинирующей Т-клетки, снабженные мультисубъединичным CAR, и циркулирующее в крови моноклональное антитело. В этом конкретном аспекте присутствующий на внеклеточной цепи рецептор мультисубъединичного CAR включает, например, рецептор Fc, который предназначен для связывания моноклонального антитела, направленного против антигенного маркера. Моноклональное антитело повышает вероятность связывания Т-клеток с патологическими клетками.
Фиг. 5. Схематическое представление терапевтической стратегии по настоящему изобретению, комбинирующей Т-клетки, снабженные мультисубъединичным CAR, который включает два внеклеточных клеточных домена и одно циркулирующее в крови биспецифическое антитело. В этом конкретном аспекте внеклеточные клеточные домены локализованы на отдельных субъединицах. Эти домены соответственно состоят из эпитопа, который распознается биспецифическим антителом, и рецептора для нацеливания антигена. Рецептор направлен против первого антигенного маркера, а биспецифическое антитело предназначено для связывания эпитопа и второго антигенного маркера. Такое сочетание предназначено для селективного нацеливания на патологические клетки, несущие на своей поверхности и первый, и второй антигенные маркеры.
Фиг. 6. Данная фигура схожа с фиг. 5, но домены стимуляции и ко-стимуляции (соответственно белковые домены 4-1ВВ и CD3zeta) заменяют для корректировки интенсивности активации Т-клетки, возникающей в результате связывания химерного антигенного рецептора с патологической клеткой.
Фиг. 7. Данная фигура схожа с фиг. 5, но домены стимуляции и ко-стимуляции (соответственно домены белков 4-1ВВ и CD3zeta) были обменены, и один домен CD3zeta был добавлен для повышения интенсивности активации Т-клетки, возникающей в результате связывания химерного антигенного рецептора с патологической клеткой.
Фиг. 8. Схематическое представление терапевтической стратегии по настоящему изобретению, комбинирующей Т-клетки, снабженные мультисубъединичным CAR, который включает два внеклеточных клеточных домена и одно циркулирующее в крови моноклональное антитело. В этом конкретном аспекте внеклеточные клеточные домены локализованы на отдельных субъединицах. Эти домены соответственно состоят из антиген-связывающего домена нацеливания на антигенный маркер и рецептора Fc, предназначенного для связывания моноклонального антитела, которое направлено против второго антигенного маркера. Такое сочетание предназначено для селективного нацеливания на патологические клетки, несущие на своей поверхности и первый, и второй антигенные маркеры.
Фиг. 9. Экспрессия CD38 активированными Т-клетками. А. Экспрессия CD38 Т-клетками на 6 сутки после активации гранулами с покрытием CD3/CD28 + IL2. Б. Продольный анализ экспрессии CD38 Т-клетками на протяжении 17 суток после активирования.
Фиг. 10. Нокаут (Knock-out - КО) гена CD38: А. Положение в последовательности экзона 1 CD38 трех разных TALEN (Т2, Т4 и Т5), сконструированных для нокаута Cd38 в Т-клетке. Б. Экспрессия CD38 в Т-клетках после трансфекции TALEN CD38ex1_T2. В. Окрашивание CD38 для контроля очистки CD38 КО Т-клеток.
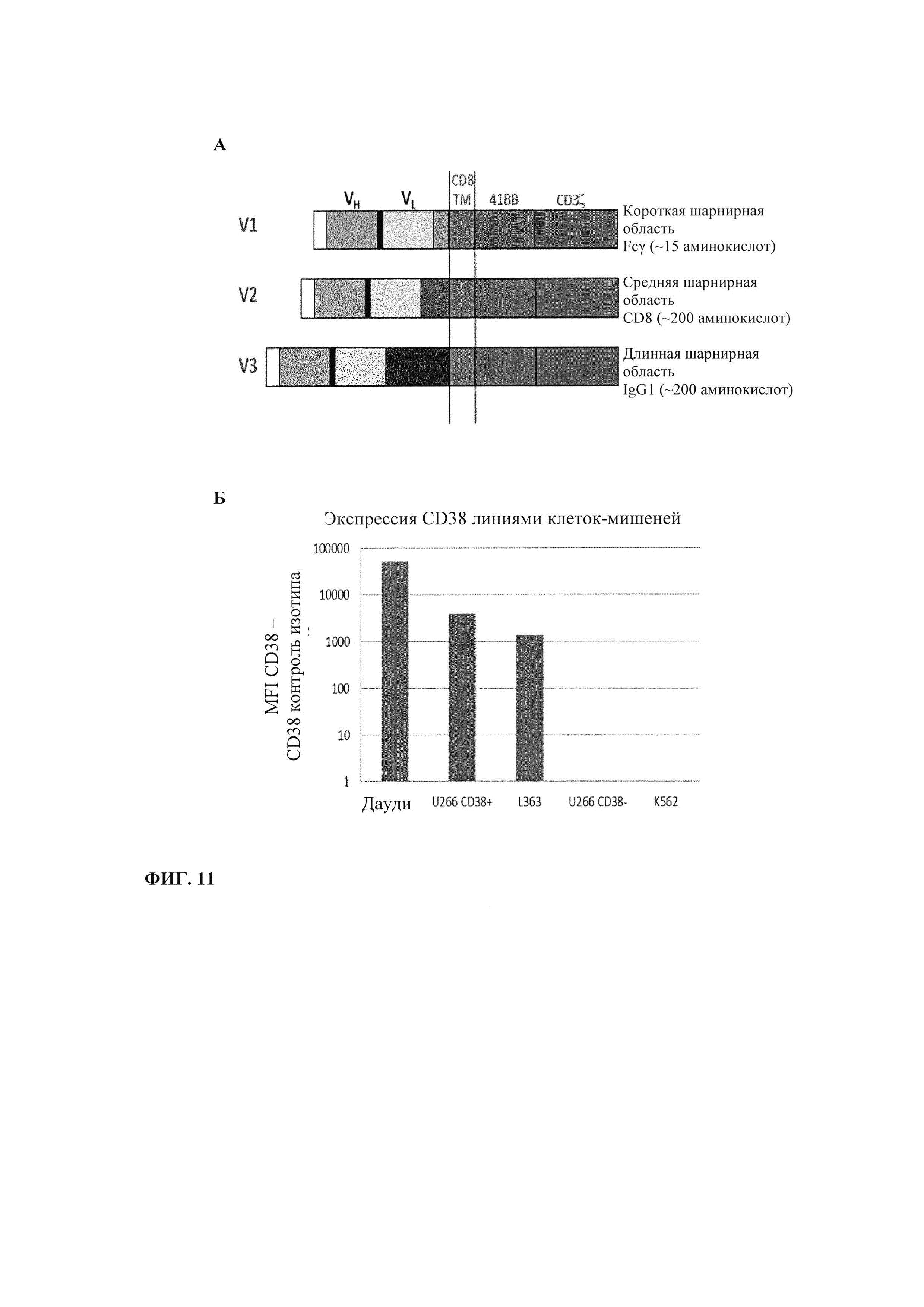
Фиг. 11. CD38 CAR: А. Представление трех версий сконструированных CAR. Б. Уровень экспрессии CD38 линиями целевых клеток.
Фиг. 12. Эксперимент зависимости от времени по конструированию CAR CS1+ и КО CS1 Т-клеток и их последующее тестирование.
Фиг. 13. Конструкции Т01, Т02 и Т03 с повторами TAL, применяемыми для нокаута гена CS1.
Фиг. 14. Направленное расположение TAL Т01, Т02 и Т03 в гене CS1 (SLAMF7). Т01 и Т02 нацелены на экзон 1 (фиг. 14А), а Т03 нацелен на экзон 2 (фиг. 14Б).
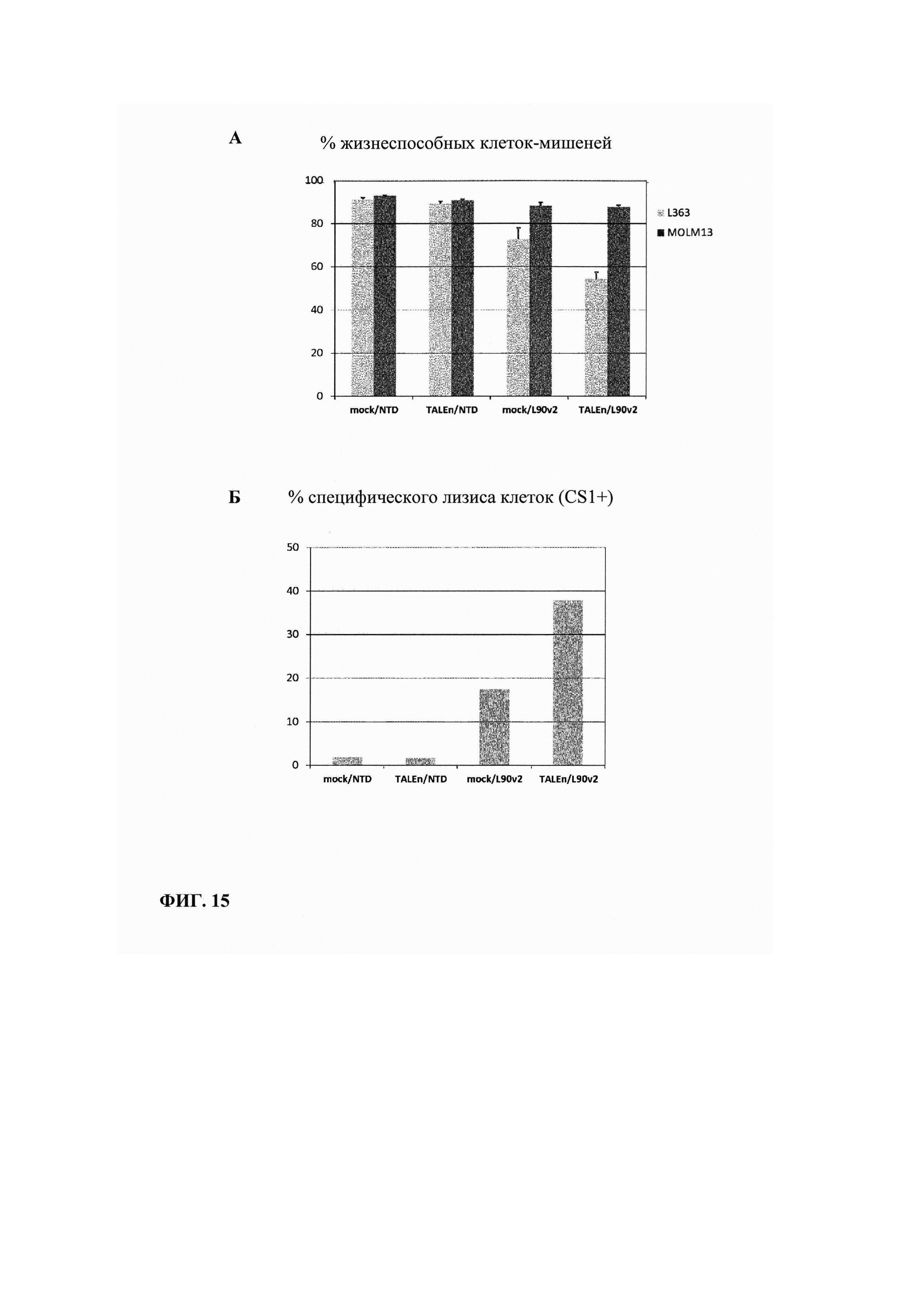
Фиг. 15А. Измерение процента жизнеспособности целевых клеток, трансфецированных или не трансфецированных TALEn, при совместном культивировании с клетками CAR+, или с нетрансдуцированными клетками: показана пониженная жизнеспособность CS1(+) клеток в условиях совместного культивирования с Т-клетками CAR+, при этом не наблюдают воздействия на выживаемость клеток CS1(-).
Фиг. 15Б. Измерение процента лизиса специфических клеток (CS1+), рассчитанного по данным жидкостной цитометрии. Показано, что лизис специфических клеток в два раза выше, если Т-клетки были трансфецированы TALEn с нацеливанием на ген CS1 перед трансдукцией CAR.
Фиг. 16. Результаты анализа FACS, полученные в экспериментах по цитотоксической активности, показывают, что эффективность трансфекции выше в ложно трансфецированных клетках по сравнению с клетками, которые были трансфецированы TALEn с нацеливанием на ген CS1 (NTD: без трансдукции).
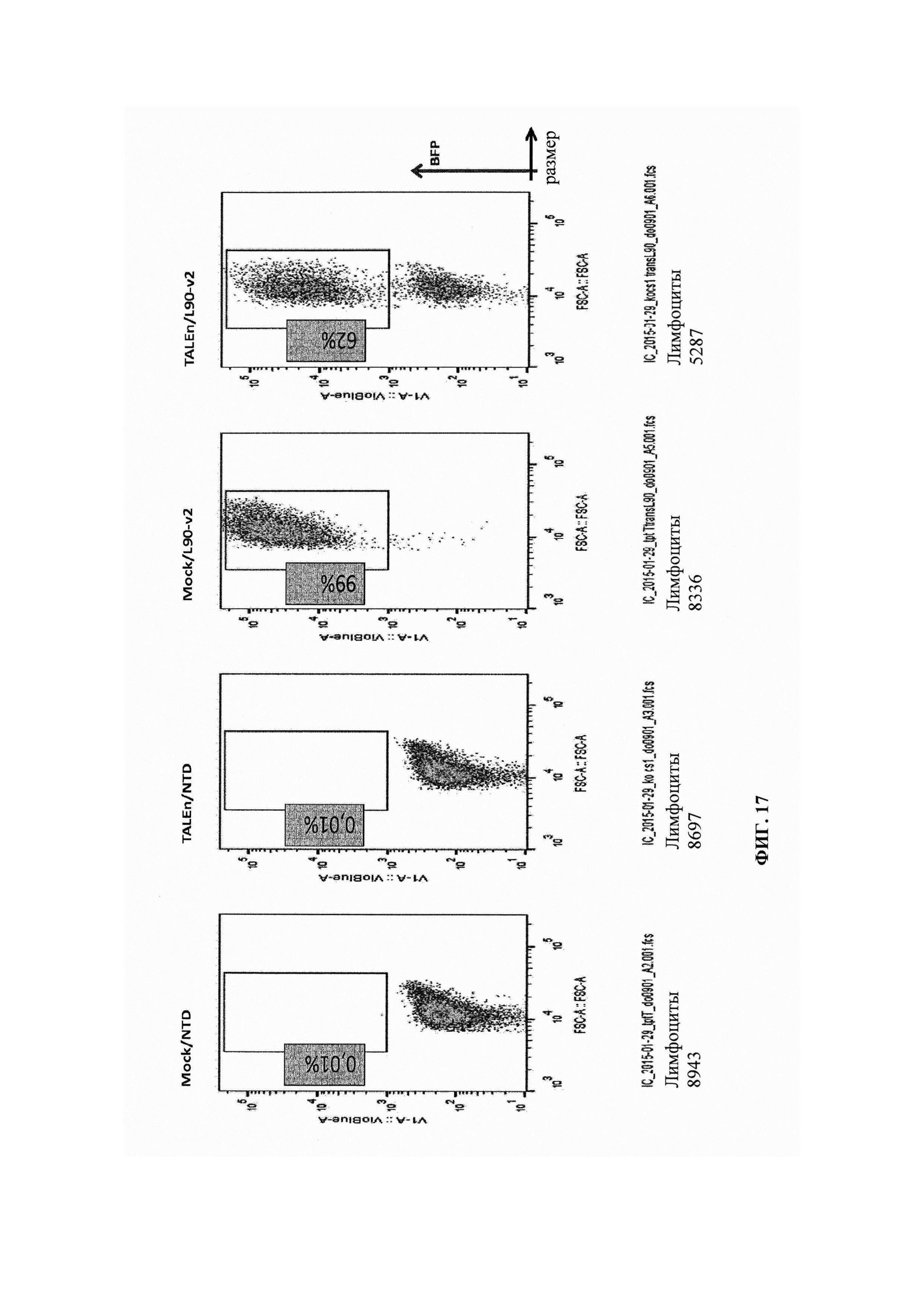
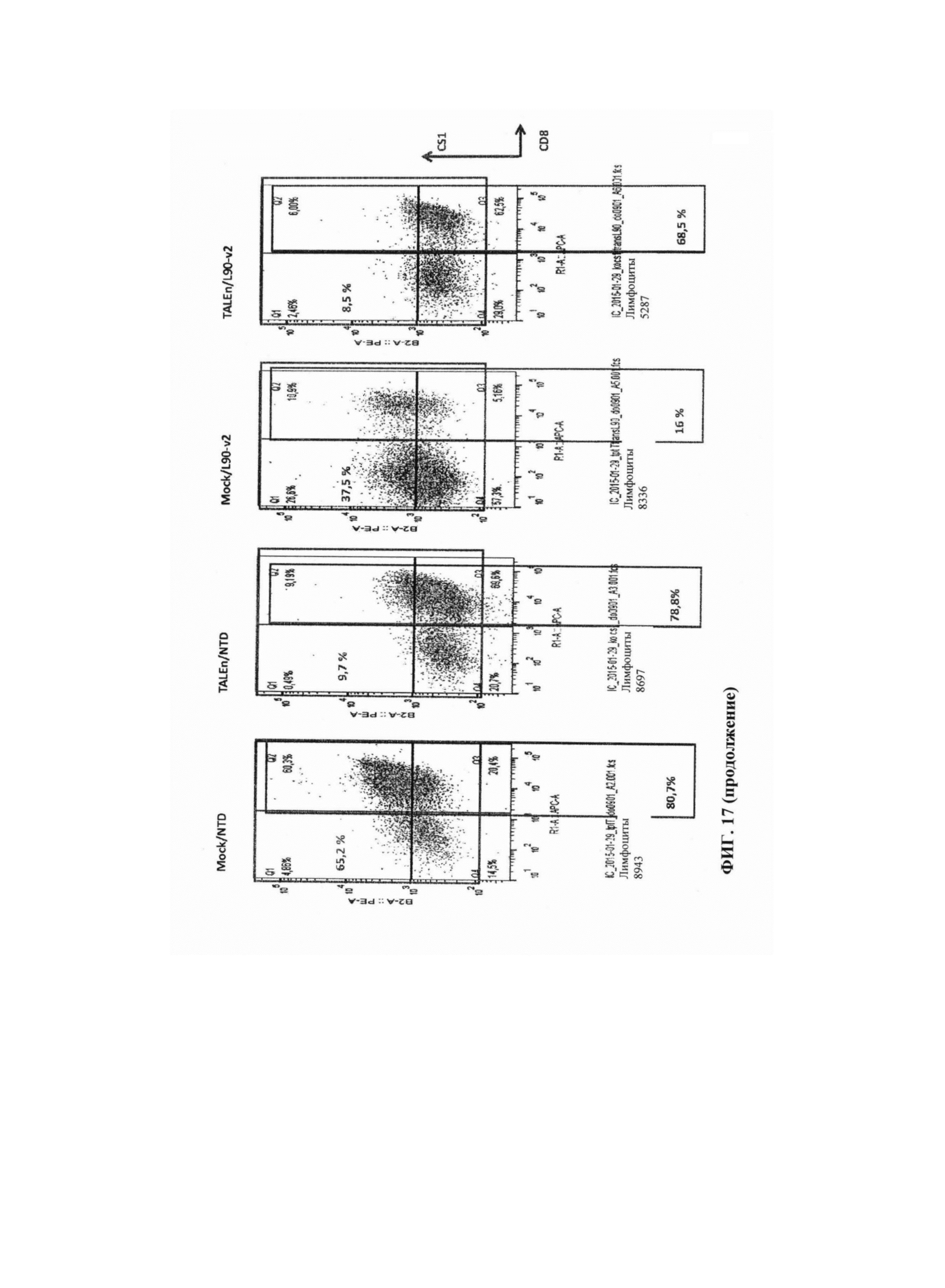
Фиг. 17. Результаты анализа методом FACS разных образцов, реактивированных гранулами CD3/CD28 на 11 сутки после трансдукции, показывают эффективность трансдукции и уровни экспрессии CD8/CS1 в каждом образце. Повышение уровней CS1 при реактивации наблюдают в ложно трансфецированных клетках, в то время как небольшое количество клеток способно экспрессировать CS1 в популяциях, трансфецированных TALEn.
Таблица 1. Различные программы Cytopulse, применяемые для электропорации Т-клеток.
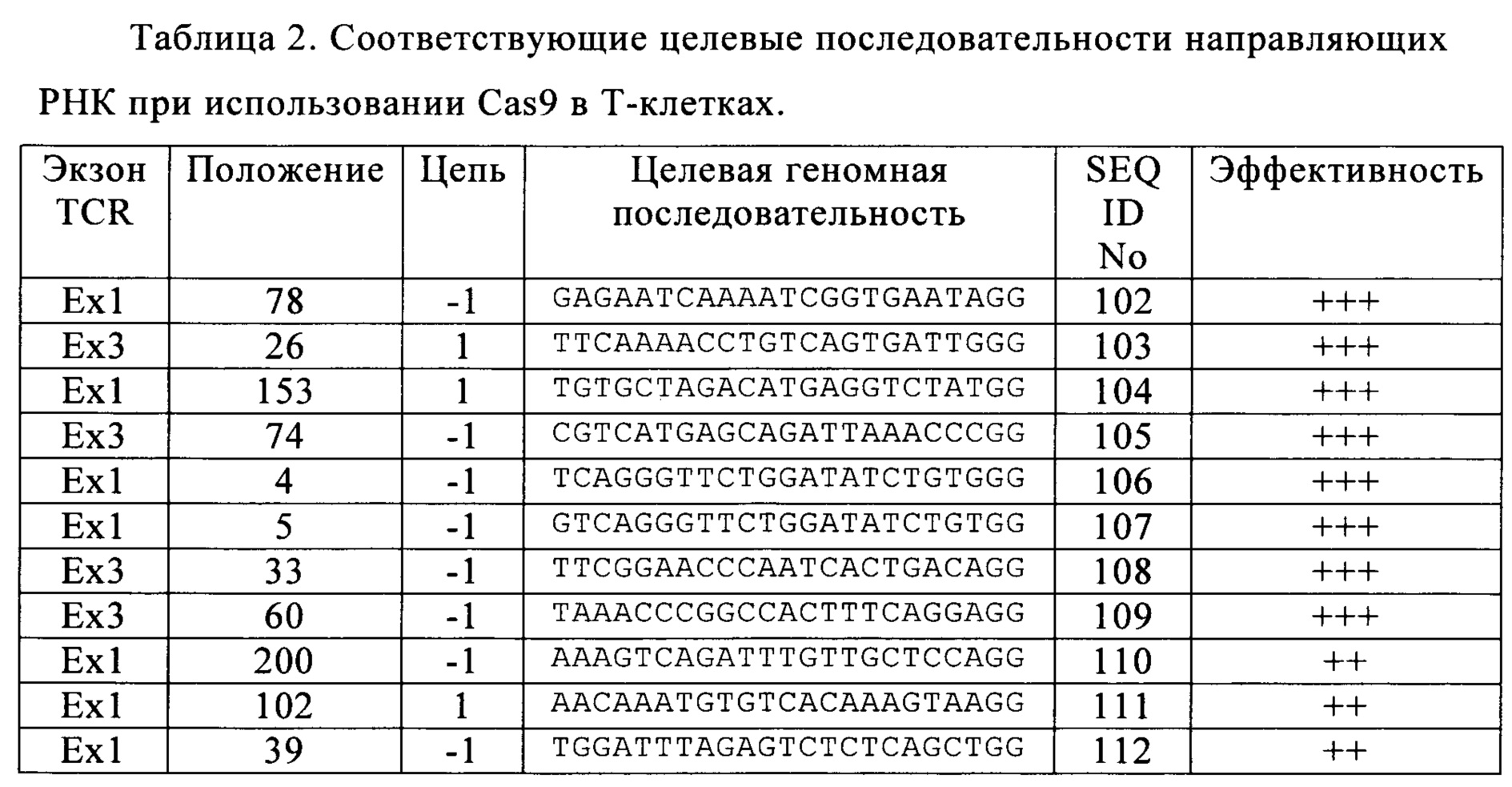
Таблица 2. Соответствующие целевые последовательности направляющих РНК при использовании Cas9 в Т-клетках.
Таблица 3. Перечень генов, кодирующих белки иммунных контрольных точек.
Таблица 4. Кластер дифференциации (Cluster of differentiation - CD) антигенных маркеров, экспрессия которых обнаружена на поверхности Т-клеток, несмотря на то, что они свойственны для разных типов опухолей.
Таблица 5-13. Основные поверхностные антигенные маркеры, экспрессированные в Т-клетках, которые сверхэкспрессируются в клетках солидных опухолей разных типов рака. Перечисленные антигенные маркеры идентифицированы в соответствии с описанием в примере 1.
Таблица 5. Клетки рака толстой кишки.
Таблица 6. Клетки рака молочной железы.
Таблица 7. Клетки рака пищеварительного тракта.
Таблица 8. Клетки рака почки.
Таблица 9. Клетки рака печени.
Таблица 10. Клетки рака легких.
Таблица 11. Клетки рака яичника.
Таблица 12. Клетки рака поджелудочной железы.
Таблица 13. Клетки рака простаты.
Таблица 14. Основные поверхностные антигенные маркеры, экспрессированные в Т-клетках, которые сверхэкспрессируются в клетках опухолей жидких тканей разных типов рака (ALL, AML, CML, MDS, CLL, CTRL). Перечисленные антигенные маркеры идентифицированы в соответствии с описанием в примере 1.
Таблица 15. Последовательности исследованной мишени CD38 и TALEN для инактивации антигена CD38.
Таблица 16. Последовательности двух других мишеней CD38 и соответствующих TALEN для их инактивации.
Таблица 17. Последовательности цепей VH и VL scFv анти-CD38 антител даратумумаба и MOR202 и специфических CDR для цепей VH и VL.
Таблица 18. Полипептидные последовательности 3 разных структур scFv даратумумаб-основанных анти-CD38 CAR и отдельных применяемых компонентов.
Таблица 19. Последовательности цепей VH и VL scFv анти-CS1 антител.
Таблица 20. Полипептидные последовательности анти-CS1 CAR, основанные на версиях V1, V2 и V3 на фиг. 11А.
Таблица 21. Последовательности мишени CS1 и TALEN для их инактивации.
Таблица 22. Последовательности мишени CD70 и TALEN для их инактивации.
Таблица 23. Полинуклеотидные последовательности и последовательности нуклеиновой кислоты цепей VH и VL scFv анти-CD70 Ab4, Ab8 и 1F6 антител.
Таблица 24. Полипептидные последовательности анти-CD70 CAR, основанные на версиях V1, V2 и V3 на фиг. 11А.
Подробное описание изобретения
Если специально в настоящем изобретении не указано иначе, все используемые методы и научные термины имеют тот же смысл, который им предают специалисты в данной области генной терапии, биохимии, генетики и молекулярной биологии.
Все методы и материалы, схожие или эквивалентные описываемым в настоящем изобретении, могут применяться в практике или для тестирования настоящего изобретения, с соответствующими методами и материалами, описанными в настоящем изобретении. Все публикации, патентные заявки, патенты и другие источники, упоминаемые в настоящем изобретении, включены в него в виде ссылок на их сущность. В случае конфликта настоящее описание, включающее определения, будет превалировать. Кроме того, материалы, методы и примеры являются только иллюстрацией и не предназначены ограничивать настоящее изобретение, если не указано иначе.
В практике настоящего изобретения могут применять, если специально не указано иначе, обычные методы биологии клеток, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинации ДНК и иммунологии, которые известны в данной области. Эти методы подробно описаны в литературе. См., например, современные протоколы в области молекулярной биологии (Frederick, 2000), молекулярного клонирования (Sambrook с соавт., 2001), синтеза олигонуклеотидов (Gait, 1984; US 4683195), гибридизации нуклеиновых кислот (Harries, Higgins, 1984), транскрипции и трансляции (Hames, Higgins, 1984), культур клеток животных (Freshney, 1987), иммобилизованных клеток и ферментов (IRL Press, 1986); в кн.: В. Perbal «А Practical Guide То Molecular Cloning», 1984; в серии книг: «Methods In ENZYMOLOGY», под ред. J. Abelson и М. Simon, Academic Press, Нью-Йорк; особенно в кн.: «Methods In ENZYMOLOGY», под ред. Wu с соавт., т.т. 154, 155 и 185 под ред. D. Goeddel; в кн. «Gene Transfer Vectors For Mammalian Cells», 1987, под ред. J.H. Miller и M.P. Calos, Cold Spring Harbor Laboratory; методы иммунохимии в кн.: immunochemical Methods In Cell And Molecular Biology», 1087, под ред. Mayer и Walker, Academic Press, London; в кн.: «Handbook Of Experimental Immunology», 1986, т. 1-IV, под ред. D.M. Weir и С.С.Blackwell; в кн.: «Manipulating the Mouse Embryo», 1986, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, Нью-Йорк.
В целом настоящее изобретение относится к способам новых стратегий адаптивной иммунотерапии для лечения заболеваний, связанных с развитием патологических клеток таких заболеваний как рак, инфекции и аутоиммунные заболевания.
Основным объектом настоящего изобретения является возможность нацеливаться на патологические клетки, которые несут специфические антигенные маркеры совместно с Т-клетками. Под патологическими клетками подразумевают любые типы клеток, имеющиеся у пациента, которые считают связанными с ухудшением здоровья.
В общем, патологические клетки являются злокачественными или инфицированными клетками, которые следует редуцировать или элиминировать для получения у пациента ремиссии.
В предпочтительном варианте осуществления настоящего изобретения способ по настоящему изобретению относится к получению соответствующих иммунных клеток, предпочтительно Т-клеток для иммунотерапии, и включает стадии:
(а) Генетической инактивации или мутирования гена в иммунной клетке, который участвует в экспрессии или презентации антигенного маркера, причем известно, что указанный антигенный маркер присутствует и на поверхности указанных Т-клеток, и на поверхности патологических клеток;
(б) Экспрессии в указанных иммунных клетках трансгена, кодирующего химерный антигенный рецептор, направленный против указанного антигенного маркера, присутствующего на поверхности указанной патологической клетки.
Иммунные клетки по настоящему изобретению снабжают химерным антигенным рецептором, направленным на маркер антигена, который обычно экспрессируется патогенными клетками и иммунными клетками, или известно, что он присутствует на поверхности указанных Т-клеток. Понятие «известно, что он присутствует» означает, что антигенный маркер обнаружен на поверхности иммунных клеток, выросших в естественных условиях in vivo , особенно в крови, и необязательно, чтобы их культивировали in vitro. Так или иначе, способ по настоящему изобретению приводит к отсутствию антигенного маркера на поверхности иммунных клеток, тем самым предупреждая химерный антигенный рецептор от взаимодействия с поверхностью сконструированных Т-клеток. В связи с этим способ может включать дополнительную стадию очистки получаемых Т-клеток путем исключения клеток, презентирующих указанный маркерный антиген на своей поверхности.
Из табл. 4 следует, что настоящее изобретение относится к существенному числу антигенных маркеров-кандидатов, о которых известно, что они экспрессируются опухолевыми клетками, а также Т-клетками. Некоторые из них, например CD38, на какое-то время применяли в качестве специфических маркеров в диагностических методах, особенно в отношении патологических клеток при лейкозе, но не в терапии. В самом деле, хотя эти маркеры были идентифицированы в данной области в качестве чрезвычайно специфичных маркеров, они не могут быть применены в качестве мишеней для иммунотерапии, поскольку антитела, направленные против этих маркеров, разрушают Т-клетки пациентов или интерферируют с ними. В настоящем изобретении установлено, что CS1 и CD70 также присутствуют на поверхности Т-клеток, и что экспрессия CAR, нацеливающихся на CS1 и CD70 в таких Т-клетках, приводит к их истощению (см. пример 2).
В предпочтительных вариантах осуществления настоящего изобретения генную мутацию или инактивацию стадии (а) указанного выше способа осуществляют, используя редкощепящую эндонуклеазу.
Предполагают, что путем инактивирования гена целевой ген не будет экспрессироваться в форму функционального белка. В некоторых вариантах осуществления настоящего изобретения генетическая модификация способа основывается на экспрессии в предусмотренных для конструирования клетках редкощепящей эндонуклеазы таким образом, что она катализирует расщепление в одном целевом гене, тем самым инактивируя указанный целевой ген. Разрывы цепи нуклеиновой кислоты, вызванные эндонуклеазой, обычно репарируются по противоположным механизмам гомологичной рекомбинации или негомологичного соединения концов (non-homologous end joining - NHEJ). Однако NHEJ является несовершенным процессом репарации, который часто приводит к изменениям в последовательности ДНК по месту расщепления. Механизмы включают воссоединение того, что осталось от двух концов ДНК, через прямое повторное лигирование (Critchlow и Jackson, 1998) или через воссоединение негомологичных концов (Microhomology-mediated end joining - MMEJ, также называемое альтернативным воссоединение негомологичных концов Alternative nonhomologous end-joining - Alt-NHEJ) (Betts с соавт. 2003; Ма с соавт. 2003). Репарация за счет соединения негомологичных концов (NHEJ) часто приводит к малым инсерциям или делениям и может быть применена для создания специфических генных нокаутов. Указанная модификация может заключаться в замещении, делеции или добавлении по меньшей мере одного нуклеотида. Клетки, в которых произошел акт мутагенеза, индуцированный расщеплением, т.е. акт мутагенеза, следующий за событием NHEJ, могут быть идентифицированы и/или выбраны методами, известными в данной области.
Понятие «редкощепящая эндонуклеаза» относится к ферменту дикого типа или к варианту фермента, способного катализировать гидролиз (расщепление) связей между нуклеиновыми кислотами в молекуле ДНК или РНК, предпочтительно в молекуле ДНК. В частности указанная нуклеаза может быть эндонуклеазой, более предпочтительно редкощепящей эндонуклеазой, которая высоко специфична, и распознает сайты-мишени в нуклеиновой кислоте в диапазоне 10-45 пар оснований (п.о.) в длину, обычно в диапазоне 10-35 п.о. в длину, чаще 12-20 п.о. Эндонуклеаза по настоящему изобретению распознает специфическую полинуклеотидную последовательность, далее обозначаемую «целевой последовательностью», и расщепляет нуклеиновую кислоту внутри таких целевых последовательностей или в примыкающих к ним последовательностях в зависимости от молекулярной структуры указанной эндонуклеазы. Редкощепящая эндонуклеаза может распознавать и производить одно- или двухцепочечный разрез в специфических полинуклеотидных последовательностях.
В одном из вариантов осуществления настоящего изобретения указанная редкощепящая эндонуклеаза по настоящему изобретению является РНК-направляемой эндонуклеазой, например, комплексом Cas9/CRISPR. РНК-направляемая эндонуклеаза является основой нового поколения инструментов геномной инженерии, связывая эндонуклеазу с молекулой РНК. В этой системе нуклеотидная последовательность молекулы РНК определяет специфичность мишени и активирует эндонуклеазу (Gasiunas с соавт. 2012; Jinek с соавт. 2012; Cong с соавт. 2013; Mali с соавт. 2013).
Cas 9
Cas9, также называемый Csn1 (COG3513), является крупным белком, участвующим и в биогенезе crRNA (крисперной РНК), и в разрушении чужеродной вторгшейся ДНК. Cas9 описан у разных видов бактерий, например, S. thermophiles, Listeria innocua (Gasiunas с соавт. 2012; Jinek с соавт. 2012) и S. pyogenes (Deltcheva с соавт., 2011). Крупный белок Cas9 (>1200 аминокислот) содержит два прогнозированных нуклеазных домена, а именно нуклеазный домен HNH (McrA-подобный), который локализован в центре белка, и расщепленный RuvC-подобный нуклеазный домен (RNaseH fold) (Makarova с соавт., 2006).
Обозначение «Cas9» означает сконструированную эндонуклеазу или гомолог Cas9, способный процессировать целевую последовательность нуклеиновой кислоты. В одном из вариантов осуществления настоящего изобретения Cas9 может индуцировать расщепление в целевой последовательности нуклеиновой кислоты, которое может соответствовать или двухцепочечному разрыву, или одноцепочечному разрыву. Вариант Cas9 может быть эндонуклеазой Cas9, которая в природе не существует, и которую получают конструированием белка или путем случайного мутагенеза. Варианты Cas9 по настоящему изобретению могут быть получены, например, мутагенезом, т.е. за счет делеций, инсерциий или замещений, по меньшей мере, одного остатка аминокислоты в аминокислотной последовательности эндонуклеазы S. pyogenes Cas9 (COG3513). В контексте настоящего изобретения такие варианты Cas9 сохраняют функциональность, т.е. они сохраняют способность процессировать целевую последовательность нуклеиновой кислоты. Вариант Cas9 также может быть гомологом S. pyogenes Cas9, который может включать делеций, инсерции или замещения, по меньшей мере, одного остатка аминокислоты в аминокислотной последовательности эндонуклеазы S. pyogenes Cas9. Какая-либо комбинация делеций, инсерции и замещения также может быть произведена для достижения итоговой конструкции, при условии, что итоговая конструкция обладает требуемой активностью, в частности способностью связывать направляющую РНК или целевую последовательность нуклеиновой кислоты.
Мотив RuvC/RNaseH включает белки, которые проявляют широкий спектр нуклеолитических функций, действуя и на РНК, и на ДНК (RNaseH, RuvC, ДНКтранспозаза и ретровирусные интегразы, домен PIWI белков Argonaut). В настоящем изобретении каталитическому домену RuvC белка Cas9 может быть свойственна последовательность мотива: D-[I/L]-G-X-X-S-X-G-W-A, в которой X представляет какую-либо одну из 20 природных аминокислот и [I/L] представляет изолейцин или лейцин. Иначе говоря, настоящее изобретение относится к варианту Cas9, который включает, по меньшей мере, последовательность D-[I/L]-G-X-X-S-X-G-W-A, в которой X представляет какую-либо одну из 20 природных аминокислот и [I/L] представляет изолейцин или лейцин.
Мотив HNH отличается от многих нуклеаз тем, что действует на двухцепочечную ДНК, в том числе на колицины, ферменты рестрикции и хоуминг-эндонуклеазы. Домен HNH (SMART ID: SM00507, номенклатура SCOP семейство HNH) ассоциирован с рядом ДНК-связывающих белков, осуществляя разнообразные связывающие и разрезающие функции. Домены с известными функциями участвуют в различных клеточных процессах, включая бактериальную токсичность, функции хоуминга в группах I и II интронов и интеинов, рекомбинацию, связанную с развитием контролируемую повторную сборку ДНК, упаковку фага и активность эндонуклеаз рестрикции (Dalgaard с соавт. 1997). Эти белки обнаружены у вирусов, архей, эубактерий и эукариотов. Интересно, что подобно мотивам LAGLI-DADG и GIY-YIG, мотив HNH часто ассоциируют с эндонуклеазными доменами таких самореплицирующихся элементов, как интеины, интроны группы I и группы II (Dalgaard с соавт. 1997). Домен HNH может быть охарактеризован по наличию консервативного остатка Asp/His, фланкированного консервативными His (амино-концевым) и His/Asp/Glu (карбокси-концевыми) остатками на некотором расстоянии. Значительное число этих белков также может иметь мотив СХ2С на любой стороне от центрального остатка Asp/His. Структурно мотив HNH представляет центральную шпильку скрученных β-цепей, которые фланкированы на каждой стороне α-спиралью (Kleanthous с соавт. 1999). Крупный домен HNH в Cas9 представлен последовательностью SEQ ID NO: 5. В настоящем изобретении мотив HNH может отличаться последовательностью мотива: Y-X-X-D-H-X-X-P-X-S-X-X-X-D-X-S, где X представляет одну из 20 природных аминокислот. Настоящее изобретение относится к варианту Cas9, который включает, по меньшей мере, последовательность Y-X-X-D-H-X-X-P-X-S-X-X-X-D-X-S, в которой X представляет одну из 20 природных аминокислот.
Настоящее изобретение может представлять особый интерес для облегчения нацеливаемых мультиплексных генных модификаций и для создания индуцибельной нуклеазной системы путем интродукции направляющей РНК в клетки Cas9. В целях настоящего изобретения было установлено, что белок Cas9 может быть поделен на два отдельных домена RuvC и HNH сплит Cas9, которые могут процессировать последовательность целевой нуклеиновой кислоты вместе или отдельно с направляющей РНК.
Также домены RuvC и HNH от разных РНК-направляемых эндонуклеаз или гомологов Cas могут быть объединены для улучшения эффективности или специфичности нуклеазы. Домены от разных видов могут быть или расщеплены на два белка, или гибридизированы друг с другом, для формирования белка варианта Cas. Сплит-систему Cas9 рассматривают особенно применимой для индуцибельного метода геномного нацеливания и чтобы избежать возможного токсического эффекта сверхэкспрессии Cas9 в клетке. В самом деле, первый сплит домен Cas9 может быть интродуцирован в клетку, предпочтительно путем стабильной трансформации указанной клетки трансгеном, кодирующим указанный сплит домен. Затем комплментарная сплит часть Cas9 может быть интродуцирована в клетку таким образом, что две сплит части заново собираются в клетке для восстановления функционального белка Cas9 в требуемый момент времени.
Уменьшение размера сплит Cas9 относительно Cas9 дикого типа упрощает векторизацию и доставку в клетку, например, за счет применения пептидов, проникающих в клетку. Повторная сборка доменов от разных белков Cas позволяет модулировать специфичность и нуклеазную активность, например, путем нацеливания мотивов РАМ, которые несколько отличаются от Cas9 S. pyogenes.
Система сплит Cas9
Ранее полученное описание доменов RuvC и HNH навело на мысль о конструировании белка Cas9 для создания белка Сплит Cas9. Неожиданно было установлено, что эти два сплит Cas9 могут процессировать вместе или отдельно мишень нуклеиновой кислоты. Это наблюдение позволяет создавать новую систему Cas9, используя белок сплит Cas9. Каждый из двух доменов Cas9 может быть получен и может применяться по отдельности. Таким образом, сплит-система демонстрирует несколько преимуществ для векторизации и высвобождения РНК-направляемых эндонуклеаз в Т-клетках, допуская доставку более короткого и/или неактивного белка, и она особенно применима для индукции конструирования генома в Т-клетках в требуемый момент времени, в результате чего ограничивается возможная токсичность интегрированной нуклеазы Cas9.
Понятие «сплит Cas9» в контексте настоящего изобретения означает редуцированную или усеченную форму белка Cas9 или варианта Cas9, который включает или домен RuvC, или HNH, но не оба эти домена. Такой белок «сплит Cas9» можно применять независимо от направляющей РНК или взаимодополняюще, например, один сплит Cas9, обеспечивающий домен RuvC, и другой, обеспечивающий домен HNH. Различные сплит РНК, направляющие эндонуклеазы, имеющие домены RuvC и/или NHN, могут применяться вместе.
Каждый Cas9 сплит-домен может происходить от одного или от разных гомологов Cas9. Многие гомологи Cas9 были идентифицированы в геномных базах данных.
Указанные Cas9 сплит домены (домены RuvC и HNH) могут быть интродуцированы в клетку одновременно или последовательно таким образом, что указанный домен (домены) Cas9 процессируют целевую последовательность нуклеиновой кислоты в клетке. Указанные Cas9 сплит домены и направляющая РНК могут быть интродуцированы в клетку путем применения проникающих в клетку пептидов или другими общеизвестными методами трансфекции.
В другом варианте осуществления настоящего изобретения только один домен сплит Cas9, названный компактным Cas9, интродуцируют в указанную клетку. Неожиданно было установлено, что домен сплит Cas9, включающий описанный выше мотив RuvC, способен расщеплять целевую последовательность нуклеиновой кислоты независимо от сплит домена, включающего мотив HNH. Таким образом, установлено, что направляющая РНК не нуждается в наличии домена HNH для связывания с целевой последовательностью нуклеиновой кислоты и в достаточной степени стабильна для связывания сплит доменом RuvC. В одном из предпочтительных вариантов осуществления настоящего изобретения один указанный домен сплит Cas9 способен к однонитевому разрыву указанной целевой последовательности нуклеиновой кислоты.
Каждый сплит домен может быть гибридизован по меньшей мере с одним активным доменом в N-концевом и/или С-концевом участке, указанный активный домен может быть выбран из группы, состоящей из: нуклеазы (например, эндонуклеазы или экзонуклеазы), полимеразы, киназы, фосфатазы, метилазы, деметилазы, ацетилазы, дезацетилазы, топоизомеразы, интегразы, транспозазы, лигазы, хеликазы, рекомбиназы, активатора транскрипции (например, VP64, VP16), ингибитора транскрипции (например, KRAB), фермента процессинга концов ДНК (например, Trex2, Tdt), репортерной молекулы (например, флуоресцирующих белков, lacZ, люциферазы).
Домен HNH ответственен за никование одной цепи целевой двухцепочечной ДНК и RuvC-подобный RNaseH fold домен участвует в никовании другой цепи (включая мотив РАМ) мишени двухцепочечной нуклеиновой кислоты (Jinek с соавт., 2012). Однако у Cas9 дикого типа эти два домена приводят к расщеплению с получением тупых концов инвазивной ДНК в одной и той же целевой последовательности (прото-спейсер) в непосредственной близости от РАМ (Jinek с соавт., 2012). Cas 9 может быть никазой и может индуцировать ник в разных целевых последовательностях.
В качестве варианта, не ограничивающего рамок охвата настоящего изобретения, Cas9 или сплит Cas9 могут включать мутацию (мутации) в каталитических остатках или HNH, или RuvC-подобных доменов, для индукции ника в разных целевых последовательностях. В качестве варианта, не ограничивающего рамок охвата настоящего изобретения, каталитическими остатками белка Cas9 являются те, которые соответствуют аминокислотным остаткам D10, D31, Н840, Н868, N882 и N891, или выравненным позициям, используя метод CLUSTALW по гомологам представителей семейства Cas. Какие-либо из этих остатков могут быть замещены какими-либо другими аминокислотами, предпочтительно остатком аланина. Мутация в каталитических остатках означает или замещение другой аминокислотой, или делецию, или вставку аминокислоты, которые индуцируют инактивацию, по меньшей мере, одного каталитического домена cas9. В одном из предпочтительных вариантов осуществления настоящего изобретения Cas9 или сплит Cas9 может включать одну или несколько из указанных выше мутаций. В другом варианте осуществления настоящего изобретения сплит Cas9 включает только один из двух каталитических доменов RuvC и HNH. В настоящем изобретении могут применять Cas9 от разных видов, гомологи Cas9, сконструированные Cas9 и их функциональные варианты. Настоящее изобретение предусматривает применение какой-либо РНК-направляемой эндонуклеазы или вариантов сплит РНК-направляемых эндонуклеаз. РНК-направляемые эндонуклеазы для осуществления расщепления нуклеиновой кислоты в генетической последовательности, представляющей интерес.
Предпочтительно варианты Cas9 по настоящему изобретению обладают аминокислотной последовательностью, которая по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90% и еще более предпочтительно на 95% идентична последовательности Cas9 S. pyogenes (COG3513).
Мегануклеазы
Редкощепящая эндонуклеаза также может быть хоуминг-эндонуклеазой, также известной под названием мегануклеазы. Такие хоуминг-эндонуклеазы известны в данной области (Stoddard, 2005). Хоуминг-эндонуклеазы высоко специфичны, распознают целевые сайты ДНК размером 12-45 пар оснований (п.о.) в длину, длина которых обычно варьирует в длину от 14 до 40 п.о. Хоуминг-эндонуклеаза по настоящему изобретению может, например, соответствовать эндонуклеазе LAGLIDADG, эндонуклеазе HNH или эндонуклеазе GIY-YIG. Предпочтительная хоуминг-эндонуклеаза по настоящему изобретению может быть вариантом I-CreI. Понятие «вариант» эндонуклеазы, т.е. не существующей в природе эндонуклеазы, а полученной путем генетической инженерии или случайным мутагенезом, может связывать последовательности ДНК, отличающиеся от последовательностей, распознаваемых эндонуклеазами дикого типа (см. WO 2006/097854).
Указанная редкощепящая эндонуклеаза также может быть модульной ДНК-связывающей нуклеазой. Понятие «модульная ДНК-связывающая нуклеаза» означает какой-либо из гибридных белков, включающих, по меньшей мере, один каталитический домен эндонуклеазы и, по меньшей мере, один ДНК-связывающий домен или белок, распознающий целевую последовательность нуклеиновой кислоты. ДНК-связывающий домен обычно является РНК- или ДНК связывающим доменом, сформированным независимо складывающимся полипептидным или белковым доменом, который содержит по меньшей мере один мотив, распознающий двух- или одно-цепочечные полинуклеотиды. Многие такие полипептиды, описанные в данной области, способны связывать специфические последовательности нуклеиновой кислоты. Такие связывающие домены часто включают домены спираль-петля-спираль, домены с лейциновыми «молниями», домены «крылатая спираль», домены HMG-box, домены иммуноглобулина, домен В3 или сконструированный цинк-пальциевый домен, но этими приведенными примерами перечень не ограничивается.
Цинк-пальциевые нуклеазы
Поскольку первоначально они были созданы для расщепления ДНК in vitro, цинк-пальциевые нуклеазы (Zinc Finger Nuclease - ZFN) являются гибридом между доменом расщепления фермента рестрикции типа IIS, FokI и ДНК-распознающим доменом, содержащим домен распознавания ДНК, включающим 3 или более цинк-пальциевых мотива С2Н2. Гетеродимеризация в определенном положении в ДНК двух отдельных ZFN в точной ориентации и в определенном пространстве приводит к двухцепочечному разрыву (double-strand break - DSB) в ДНК. Применение таких химерных эндонуклеаз подробно описано (например, Urnov с соавт., 2010).
Стандартные ZFN гибридизуют домен расщепления с С-конца каждого цинк-пальциевого домена. Для того чтобы позволить двум доменам расщепления димеризоваться и расщепить ДНК, две отдельные ZFN связывают противоположные нити ДНК с их С-концами на определенном расстоянии друг от друга. Чаще всего для применяемых линкерных последовательностей между цинк-пальциевым доменом и доменом расщепления требуется, чтобы 5' концы каждого сайта связывания были разделены 5-7 п. о.
Наиболее прямой метод получения новых цинк-пальциевых матриц заключается в объединении известных специалистам более коротких цинк-пальциевых «модулей». Самый распространенный метод сборки моделей включает комбинирование трех отдельных цинк-пальциевых доменов, каждый из которых распознает 3 пары оснований в последовательности ДНК для получения 3-пальциевой матрицы, которая может распознать целевой сайт из 9 пар оснований. Многочисленные методы отбора применяли для получения цинк-пальциевых матриц, способных нацеливаться на требуемые последовательности. При первичном отборе применяют фаговый дисплей для отбора белков, которые связывают данную мишень ДНК из большой группы частично рандомизированных цинк-пальциевых матриц. В предшествующих исследованиях применяли дрожжевые одногибридные системы, бактериальные одногибридные и двугибридные системы, а также клетки млекопитающих.
TALE-нуклеазы
Понятие «TALE-нуклеаза» или «MBBBD-нуклеаза» относится к сконструированным белкам, возникающим в результате слияния ДНК-связывающего домена, обычно производного от белков, подобных активатору транскрипции (Transcription Activator Like Effector - TALE) или модульному основание-на-основание связывающему домену (Modular Base-per-Base Binding domain - MBBBD), с каталитическим доменом, обладающим каталитической активностью. Такой каталитический домен обычно происходит от ферментов, например, I-TevI, ColE7, NucA и Fok-I. TALE-нуклеаза может быть сформирована в мономерной или димерной форме в зависимости от выбранного каталитического домена (WO 2012138927). Такие сконструированные TALE-нуклеазы коммерчески доступны под торговой маркой TALEN™ (фирма Cellectis, Париж, Франция).
В предпочтительном варианте осуществления настоящего изобретения ДНК-связывающий домен происходит от эффектора, подобного активатору транскрипции (TALE), в котором специфичность последовательности обусловлена сериями повторов из 33-35 аминокислот, происходящих от бактериальных белков Xanthomonas или Ralstonia AvrBs3, PthXol, AvrHahl, PthA, Tal1c, но этими примерами возможный перечень доменов не ограничивается.
Такие повторы существенно отличаются по положению двух аминокислот, которые обеспечивают специфичность взаимодействия с парой оснований (Boch, Scholze с соавт., 2009; Moscou, Bogdanove, 2009). Каждая пара оснований в мишени ДНК контактирует одним повтором со специфичностью, обусловленной двумя вариантами аминокислот в повторе (так называемый повторяющийся вариабельный дипептид - repeat variable dipeptide, RVD). TALE-связывающие домены могут дополнительно включать домен N-концевой транслокации, ответственный за потребность в первом основании тимина (Т0) целевой последовательности, и С-концевой домен, который содержит сигналы ядерной локализации (nuclear localization signals - NLS). Домен TALE, связывающий нуклеиновую кислоту обычно соответствует сконструированному коровому каркасу TALE, включающему множество повторяющихся последовательностей TALE, каждый повтор включает RVD, специфичный к каждому из нуклеотидных оснований в сайте распознавания TALE. В настоящем изобретении каждая последовательность повтора TALE указанного корового каркаса сконструирована из 30-42 аминокислот, более предпочтительно 33 или 34, причем две критические аминокислоты, так называемый повторяющийся вариабельный дипептид (repeat variable dipeptide - RVD), локализованные в положениях 12 и 13, опосредуют распознавание одного нуклеотида указанной последовательности в сайте связывания TALE; эквивалент двух критических аминокислот может быть локализован в положениях, отличных от 12 и 13, особенно в повторяющейся последовательности TALE, которая длиннее последовательности из 33 или 34 аминокислот. Предпочтительно RVD, связанными с распознаванием разных нуклеотидов, являются HD для распознавания С, NG для распознавания Т, NI для распознавания А, NN для распознавания G или А. В другом варианте осуществления настоящего изобретения критически важные аминокислоты 12 и 13 могут быть мутантными по отношению к другим аминокислотным остаткам для того, чтобы модулировать их специфичность по отношению к нуклеотидам А, Т, С и G и в частности для повышения их специфичности. Связывающий нуклеиновую кислоту домен TALE обычно включает от 8 до 30 повторяющихся последовательностей TALE. Более предпочтительно, указанный коровый каркас по настоящему изобретению включает 8-20 повторяющихся последовательностей TALE, еще более предпочтительно 15 повторяющихся последовательностей TALE. Он также может включать дополнительную единичную усеченную повторяющуюся последовательность TALE, построенную из 20 аминокислот, локализованных с С-конца указанного набора повторяющихся последовательностей TALE, т.е. дополнительную С-концевую полу-TALE повторяющуюся последовательность.
Другие сконструированные ДНК-связывающие домены могут применяться в качестве альтернативных последовательностей для формирования специфических связывающих доменов, так называемых модульных основание-к-основанию связывающих доменов (modular base-per-base binding domains - MBBBD), описанных в WO 2014/018601. Указанные MBBBD могут быть сконструированы, например, из вновь идентифицированных белков, а именно белков EAV36_BURRH, E5AW43_BURRH, E5AW45_BURRH и E5AW46_BURRH от ранее секвенированного генома эндосимбионтного гриба BurkholderiaRhizoxinica (Lackner с соавт.2011). Такие полипептиды, связывающие нуклеиновые кислоты, включают модули примерно из 31-33 аминокислот, которые специфичны по отношению к основаниям. Эти модули проявляют менее чем 40% идентичность с общими повторами TALE Xanthomonas и представляют более выраженную вариабельность последовательностей полипептидов. Разные домены от указанных выше белков (модули, N- и С-концы) от Burkholderia и Xanthomonas применяют для конструирования новых белков или каркасов, обладающих связывающими свойствами в отношении специфических последовательностей нуклеиновых кислот, которые можно комбинировать для формирования химерных белков TALE-MBBBD.
В качестве примера настоящее изобретение охватывает способ конструирования Т-клеток для инактивации экспрессии генов, кодирующих антигенные маркеры, например, CD38, CS1 и CD70, в котором применяют специфические TALE-нуклеазы.
Особенно применимыми в настоящем изобретении являются TALE-нуклеазы SEQ ID NO: 2-3; 5-6; 8-9, SEQ ID NO: 64-65; 67-68; 70-71 и SEQ ID NO: 73-74; 76-77; 79-80 соответственно для генов CD38, CS1 и CD70. Эти специфические TALE-нуклеазы, последовательности их мишеней и протоколы применения рассматриваются более подробно в приводимых ниже примерах 1-3.
Методы доставки
В настоящем изобретении рассматривают какие-либо известные в данной области средства для доставки внутрь клеток или в субклеточные компартменты указанных клеток полинуклеотидов, экспрессирующих эндонуклеазы, их возможные ко-эффекторы (например, направляющую РНК или ДНК, ассоциированную с нуклеазами Cas9 или Argonaute), а также химерные антигенные рецепторы. К таким средствам относятся вирусная трансдукция, электропорация, а также средства липосомальной доставки, полимерные носители, химерные носители, липоплексы, полиплексы, дендримеры, наночастицы, эмульсии, метаболические пути природного эндоцитоза или фагоцитоза, однако примерами перечисленных средств перечень не ограничивается.
В предпочтительном варианте осуществления настоящего изобретения полинуклеотиды, кодирующие эндонуклеазы по настоящему изобретению, трансфецируют в форме мРНК для того, чтобы получить транзиторную экспрессию и избежать интеграции в хромосому чужеродной ДНК, например, путем электропорации. В настоящем изобретении определены различные оптимальные условия для электропорации мРНК в Т-клетки, представленные в табл. 1. В настоящем изобретении используют технологию Cytopulse, которая позволяет с помощью пульсирующих электрических полей кратковременно делать живые клетки проницаемыми для доставки материала в клетки (US 6010613 и WO 2004/083379). Длина импульса, интенсивность, а также интервалы между импульсами могут быть модифицированы для того, чтобы достичь наилучших условий для трансфекции с высокой эффективностью при минимальной смертности. По существу первые высокие импульсы электрического поля допускают формирование пор, причем последующие пониженные импульсы электрического поля позволяют полинуклеотидам перемещаться в клетку. В одном из вариантов осуществления настоящего изобретения описывают стадии, которые ведут к достижению трансфекции мРНК в Т-клетки с эффективностью >95%, и применение протокола электропорации для кратковременного перемещения разных типов белков в Т-клетки. В частности настоящее изобретение относится к способу трансформации Т-клетки, включающему контакт указанной Т-клетки с РНК и применение по отношению к Т-клетке последовательности быстрых импульсов, состоящей из:
а. Одного электрического импульса с напряжением от 2250 до 3000 В на сантиметр, длительностью импульса 0,1 мсек и с интервалом от 0,2 до 10 мсек между электрическими импульсами стадий (а) и (б);
б. Одного электрического импульса с напряжением от 2250 до 3000 В, длительностью импульса 100 мсек и с интервалом 100 мсек между электрическими импульсами стадий (б) и первым электрическим импульсом стадии (в);
в. 4 электрических импульсов с напряжением 325 В с продолжительностью импульса 0,2 мсек и с интервалом 2 мсек между каждым из 4 электрических импульсов.
В одном из вариантов осуществления настоящего изобретения способ трансформации Т-клетки включает контакт указанной Т-клетки с РНК и применение по отношению к Т-клетке последовательности быстрых импульсов, состоящей из:
а. Одного электрического импульса с напряжением 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2400, 2450, 2500, 2600, 2700, 2800, 2900 или 3000 В на сантиметр, длительностью импульса 0,1 мсек и с интервалом 0,2, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мсек между электрическими импульсами стадий (а) и (б);
б. Одного электрического импульса с диапазоном напряжения от 2250, а именно, 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2400, 2450, 2500, 2600, 2700, 2800, 2900 или 3000 В с продолжительностью импульса 100 мсек и с интервалом 100 мсек между электрическим импульсом на стадии (б) и первым электрическим импульсом на стадии (в); и
в. 4 электрических импульсов с напряжением 325 В с продолжительностью импульса 0,2 мсек и интервалом 2 мсек между каждым из 4 электрических импульсов.
В настоящем изобретении описывают какие-либо величины, входящие в описанный выше диапазон. Средой для электропорации может быть какая-либо пригодная среда, известная в данной области. Предпочтительно среда для электропорации имеет электропроводность в диапазоне 0,01-1,0 мСм.

Вирусная трансдукция
В настоящем изобретении использование ретровирусных векторов и более предпочтительно лентивирусных векторов особенно применимо для экспрессии химерных антигенных рецепторов в Т-клетках. Методы вирусной трансдукции известны в данной области (Walther с соавт., 2000). Интегративные вирусные векторы позволяют осуществить стабильную интеграцию полинуклеотидов в геном Т-клеток и экспрессию химерных антигенных рецепторов на протяжении более длительного периода.
Т-клетки, не являющиеся аллореактивными
Хотя способ по настоящему изобретению может быть осуществлен in-vivo в качестве составляющей генной терапии, например, путем применения вирусных векторов, нацеливаемых на Т-клетки в кровяном русле, которые могут включать генетические последовательности, экспрессирующие специфическую редкощепящую эндонуклеазу наряду с другими генетическими последовательностями, экспрессирующими CAR. Способ по настоящему изобретению в большинстве случаев предназначен для применения ex-vivo в культуре Т-клеток, полученных от пациентов или доноров. Сконструированные Т-клетки ex-vivo могут быть или повторно имплантированы пациенту, от которого они изначально были получены, в качестве части аутологического лечения, или могут применяться в качестве части аллогенного лечения. В последнем случае предпочтительно дополнительно сконструировать клетки таким образом, чтобы сделать их неаллореактивными и убедиться в должной приживаемости. Соответственно, способ по настоящему изобретению может включать дополнительные стадии получения Т-клеток от донора и инактивации в этих клетках генов, участвующих в распознавании МНС, и/или являющихся мишенями иммуносупрессирующих лекарственных препаратов, что описано, например, в WO 2013/176915.
Рецепторы Т-клеток (T-cell receptor - TCR) являются рецепторами на поверхности клеток, которые участвуют в активировании Т-клеток в ответ на презентацию антигена. TCR обычно состоят из двух цепей -альфа и бета, которые соединяются для образования гетеродимера и которые связаны с CD3-трансдуцирующими субъединицами для формирования комплекса рецепторов Т-клеток, присутствующих на поверхности клеток. Каждая альфа и бета цепь TCR состоит из иммуноглобулинподобной N-концевой вариабельной (V) и константной области (С), гидрофобного трансмембранного домена и короткой цитоплазматической области. В молекулах иммуноглобулина вариабельная область альфа- и бета-цепей вырабатывается в результате V(D)J рекомбинации, создающей большое разнообразие по специфичности у антигенов в популяции Т-клеток. Однако, в противоположность иммуноглобулинам, которые распознают интактный антиген, Т-клетки активируют процессированными пептидными фрагментами в ассоциации с молекулой МНС, интродуцируя дополнительную величину для распознавания антигена Т-клетками, что называется рестрикцией по главному комплексу гистосовместимости. Распознавание несовместимости МНС между донором и реципиентом через рецептор Т-клеток приводит к пролиферации Т-клеток и к потенциальному развитию GVHD. Показано, что нормальная экспрессия TCR на поверхности зависит от скоординированного синтеза и сборки всех семи компонентов комплекса (Ashwell, Klusner, 1990). Инактивация ТСRальфа или ТСRбета может привести к элиминации TCR с поверхности Т-клеток, предупреждая распознавание аллоантигена и таким образом GVHD.
Кроме того, в настоящем изобретении приживление Т-клеток может быть улучшено путем инактивирования по меньшей мере одного гена, кодирующего компонент TCR. TCR делают нефункционирующим в клетках за счет инактивирования гена (генов) TCRaльфa и/или TCRбета.
В настоящем изобретении при применении системы Cas9/CRISPR установили соответствующие целевые последовательности в 3 экзонах, кодирующих TCR, допуская существенное снижение токсичности в живых клетках, при этом сохраняя эффективность расщепления. Предпочтительные целевые последовательности указаны в табл. 2 (+ означает пониженную долю TCR-отрицательных клеток, ++ означает среднюю долю TCR-отрицательных клеток, +++ означает повышенную долю TCR-отрицательных клеток).

МНС антигены также являются белками, которые играют важную роль в реакциях трансплантации. Отторжение опосредуют Т-клетки, реагирующие на антигены тканевой специфичности на поверхности имплантированной ткани, и наибольшая группа этих антигенов представляет антигены главного комплекса гистосовместимости (major histocompatibility antigens - МНС). Эти белки экспрессируются на поверхности клеток всех высших позвоночных и у клеток человека называются антигенами HLA (human leukocyte antigens - антигены лейкоцитов человека). Подобно TCR, белки МНС выполняют жизненно важную функцию в стимуляции Т-клеток. Презентирующие антиген клетки (часто дендритные клетки) обладают пептидами, которые являются продуктом разрушения чужеродных белков на поверхности клеток МНС. При наличии ко-стимулирующего сигнала Т-клетка становится активированной и может воздействовать на целевую клетку, которая также проявляет тот же комплекс пептид/МНС. Например, простимулированная клетка Т-хэлпера может нацеливаться на макрофаг, проявляющий антиген в сочетании с его МНС, или цитотоксическая Т-клетка (cytotoxic T-cell - CTL) может действовать на инфицированную вирусом клетку, проявляющую чужеродные вирусные пептиды.
Таким образом, для понижения аллореактивности Т-клеток способ по настоящему изобретению может дополнительно включать стадию инактивирования или мутирования одного гена HLA.
Генный кластер HLA класса I у человека включает три крупных локуса, В, С и А, а также несколько минорных локусов. Кластер HLA класса II также включает три крупных локуса, DP, DQ и DR, и оба генных кластера класса I и класса II являются полиморфными, поскольку существует несколько разных аллелей генов обоих классов, I и II, в популяции. Также имеется несколько сопутствующих белков, которые тоже участвуют в функционировании HLA. Субъединицы Tap1 и Тар2 являются частями транспортерного комплекса ТАР, который важен для нагрузки пептидных антигенов на комплексы класса I HLA, а LMP2 и LMP7 субъединицы протеосом участвуют в протеолитическом разрушении антигенов на пептиды для представления на HLA. Показано, что уменьшение LMP7 снижает количество МНС класса I на поверхности клетки, возможно за счет утраты стабильности (Fehling с соавт., 1999). Помимо ТАР и LMP имеется ген тапазина, чей продукт формирует мост между комплексом ТАР и цепями класса I HLA и повышает пептидную нагрузку. Понижение тапазина приводит в клетках с ослабленной сборкой МНС класса I к пониженной на поверхности клетки экспрессии МНС класса I и к ухудшенному иммунному ответу (Grandea с соавт., Immunity, 2000; Garbi с соавт., Nat Immunol, 2000). Какой-либо из указанных выше генов может быть инактивирован в качестве части настоящего изобретения согласно описанию, например, в WO 2012/012667.
Способ конструирования устойчивых к лекарствам Т-клеток
Для улучшения протовоопухолевой терапии и избирательной трансплантации аллогенных Т-клеток лекарственная устойчивость может быть придана сконструированным Т-клеткам для их защиты от токсических побочных эффектов вследствие химиотерапии или иммуносупрессивных агентов. В самом деле, среди исследованных в настоящем изобретении пациентов большинство лечили методом химиотерапии и агентами, истощающими иммунитет, в качестве стандартного лечения до осуществления иммунотерапии Т-клетками. Также установлено, что можно было бы получить преимущество от такого лечения, чтобы помочь выбрать сконструированные Т-клетки, либо путем добавления химиотерапевтических препаратов в культуральные среды для размножения этих клеток ex-vivo перед лечением, или путем получения избирательного размножения сконструированных Т-клеток in-vivo у пациентов при лечении методом химиотерапии или при иммуносупрессирующем лечении.
Также лекарственная устойчивость Т-клеток позволяет проводить их обогащение in или ex vivo, поскольку Т-клетки, которые экспрессируют ген лекарственной устойчивости, могут выжить и размножиться в числе относительно клеток с лекарственной чувствительностью. В частности, настоящее изобретение относится к способу конструирования аллогенных с устойчивостью к лекарственным средствам Т-клеток, устойчивых к иммунотерапии, включающему:
A. Получение Т-клеток.
Б. Выбор, по меньшей мере, одного лекарственного средства.
B. Модификацию Т-клеток для обеспечения лекарственной устойчивости к указанным Т-клеткам.
Г. Размножение указанных сконструированных Т-клеток при наличии указанного лекарственного средства, и необязательно предшествующие стадии могут быть объединены со стадиями ранее описанных методов.
Лекарственная устойчивость может быть придана Т-клеткам путем инактивирования одного или нескольких генов, ответственных за чувствительность клеток к лекарственному средству (генов лекарственной устойчивости), например, гена гипоксантин-гуанин фосфорибозилтрансферазы (hypoxanthine-guanine phosphoribosyl transferase - HPRT; Genbank: M26434.1). В частности HPRT может быть инактивирована в сконструированных Т-клетках для придания устойчивости по отношению к цитостатическому метаболиту 6-тиогуанину (6-thioguanine - 6TG), который конвертируется действием HPRT в цитотоксический тиогуаниновый нуклеотид и который в настоящее время применяют для лечения онкологических пациентов, в частности больных лейкозами (Наске с соавт., 2013). Другим примером является инактивация CD3, в норме присутствующего на поверхности Т-клеток, что может придать устойчивость к анти-CD3 антителам, например, к теплизумабу.
Лекарственная устойчивость также может быть придана Т-клеткам путем экспрессии гена лекарственной устойчивости. Указанный ген лекарственной устойчивости относится к последовательности нуклеиновой кислоты, которая кодирует «устойчивость» к агенту, например, к химиотерапевтическому агенту (например, метотрексату). Иначе говоря, экспрессия гена лекарственной устойчивости в клетке допускает пролиферацию клеток в присутствии агента в большей степени по сравнению с пролиферацией таких клеток, но без гена лекарственной устойчивости. Ген лекарственной устойчивости по настоящему изобретению может кодировать устойчивость к антиметаболиту, например, метотрексату, винбластину, цисплатину, алкилирующим агентам, антрациклинам, цитотоксическим антибиотикам, анти-иммунофилинам, их аналогам или производным, а также к другим.
Установлены варианты аллелей нескольких генов, например, дигидрофолатредуктазы (dihydrofolate reductase - DHFR), инозинмонофосфатдегидрогеназы 2 (inosine monophosphate dehydrogenase 2 - IMPDH2), кальциневрина или метилгуанинтрансферазы (methylguanine transferase - (MGMT), обусловливающих лекарственную устойчивость в клетке. Указанный ген лекарственной устойчивости может быть экспрессирован в клетках или путем интродукции трансгена, кодирующего указанный ген в клетке, или путем интеграции указанного гена лекарственной устойчивости в геноме клетки путем гомологической рекомбинации. Идентифицировали несколько других генов лекарственной устойчивости, которые в принципе могут быть применены для придания лекарственной устойчивости клеткам нацеливания (Takebe с соавт., 2001; Sugimoto с соавт., 2003; Zielske с соавт., 2003; Nivens с соавт., 2004; Bardenheuer с соавт., 2005; Kushman с соавт., 2007).
DHFR является ферментом, участвующим в регуляции количества тетрагидрофолата в клетке, который важен для синтеза ДНК. Аналоги фолата, например, метотрексат (methotrexate - МТХ), ингибируют DHFR и поэтому их используют в клинике в качестве антинеопластических агентов. Описаны различные мутантные формы DHFR, обладающие повышенной устойчивостью к подавлению антифолатами и применяемые в лечении. В одном из вариантов осуществления настоящего изобретения ген лекарственной устойчивости по настоящему изобретению может быть последовательностью нуклеиновой кислоты, кодирующей мутантную форму дикого типа DHFR человека (номер в GenBank: ААН71996.1), которая включает по меньшей мере одну мутацию, обусловливающую устойчивость к антифолатному лечению, например метотрексатом. В другом варианте осуществления настоящего изобретения мутантная форма DHFR включает, по меньшей мере, одну мутантную аминокислоту по положениям G15, L22, F31 или F34, предпочтительно по положениям L22 или F31 (Schweitzer с соавт., 1990; WO 94/24277; US 6642043).
В одном из вариантов осуществления настоящего изобретения понятие «антифолатный агент» или «аналоги фолата» относится к молекуле, направленной на интерферирование с фолатным метаболическим путем на некотором уровне. К примерам антифолатных агентов относятся, например, метотрексат (methotrexate - МТХ), аминоптерин, триметрексат (продукт Neutrexin™); эдатрексат; N10-пропаргил-5,8-дидеазафолиевая кислота (СВ3717); ZD1694 (продукт Tumodex), 5,8-дидеазатетрагидрофлиевая кислота (DDATHF); 5-деазафолиевая кислота; РТ523 (N-альфа-(4-амино-4-дезоксиптероил)-N-дельта-гемифталоил-L-орнитин); 10-этил-10-деазааминоптерин (DDATHF, ломатрексол); пиритрексим; 10-EDAM; ZD1694; GW1843; пеметрексат и PDX (10-пропаргил-10-деазааминоптерин).
Другим примером гена лекарственной устойчивости также может быть мутантная или модифицированная форма ионизин-5'-монофосфатдегидрогеназы II (inosine monophosphate dehydrogenase 2 - IMPDH2), фермент ограничения скорости синтеза de novo гуанозиновых нуклеотидов. Мутантная или модифицированная форма IMPDH2 представляет ген резистентности к ингибитору IMPDH. Ингибиторами IMPDH могут быть микофеноловая кислота (mycophenolic acid - MPA) или форма ее пролекарства микофенолята мофетила (mycophenolate mofetil - MMF). Мутантная IMPDH2 может включать, по меньшей мере, одну, предпочтительно две мутации в сайте связывания MAP дикого типа IMPDH2 человека (NP_000875.2), что приводит к существенно повышенной устойчивости к ингибитору IMPDH. Мутации локализованы предпочтительно в положениях Т333 и/или S351 (Yam с соавт., 2006; Sangiolo с соавт., 2007; Jonnalagadda с соавт., 2013). В одном из вариантов осуществления настоящего изобретения остаток треонина в положении 333 замещен остатком изолейцина, и остаток серина в положении 351 замещен остатком тирозина.
Другой ген лекарственной устойчивости является мутантной формой кальциневрина. Кальциневрин (РР2В) - это повсеместно экспрессируемая серин/треониновая протеинфосфатаза, которая участвует во многих биологических процессах и которая является важнейшей для активации Т-клеток. Кальциневрин - гетеродимер, включающий каталитическую субъединицу (CnA; три изоформы) и регуляторную субъединицу (CnB; две изоформы). После вовлечения рецептора Т-клеток, кальциневрин дефосфорилирует фактор транскрипции NFAT, допуская его транслокацию в ядро, и активный ключевой целевой ген, например, IL2. FK506 в комплексе с FKBP12 или циклоспорин A (CsA) в комплексе с СуРА блокируют доступ NFAT к активному сайту кальциневрина, предупреждая его дефосфорилирование и тем самым ингибирование активации Т-клеток (Brewin с соавт., 2009). Ген лекарственной устойчивости по настоящему изобретению может быть последовательностью нуклеиновой кислоты, кодирующей мутантную форму кальциневрина, устойчивого к ингибитору кальциневрина, например, FK506 и/или CsA. В одном из вариантов осуществления настоящего изобретения указанная мутантная форма включает, по меньшей мере, одну мутантную аминокислоту гетеродимера кальциневрина дикого типа в положениях: V314, Y341, М347, Т351, W352, L354, К360, предпочтительно двойные мутации в положениях Т351 и L354 или V314 и Y341. Соответствие положений аминокислот, описанных в настоящем изобретении, часто выражают в терминах положений аминокислот формы полипептида гетеродимера b кальциневрина дикого типа (номер в GenBank: АСХ34092.1).
В другом предпочтительном варианте осуществления настоящего изобретения указанная мутантная форма может включать, по меньшей мере, одну мутантную аминокислоту гетеродимера b кальциневрина дикого типа в положениях: V120, N123, L124 или К125, предпочтительно двойные мутации в положениях L124 и К125. Соответствие положений аминокислот, описанных в настоящем изобретении, часто выражают в терминах положений аминокислот формы полипептида гетеродимера b кальциневрина дикого типа (номер в GenBank: АСХ34095.1).
Другим геном лекарственной устойчивости является ген 0(6)-метилгуанин-метилтрансферазы (methylguanine methyltransferase - MGMT), кодирующий алкилгуанинтрансферазу человека (human alkyl guanine transferase - hAGT). Алкилгуанинтрансфераза представляет белок, репарирующий ДНК, который обусловливает устойчивость к цитотоксическим эффектам алкилирующих агентов, например, нитрозомочевины и темозоломида (temozolomide - TMZ). 6-бензилгуанин (6-benzylguanine - 6-BG) - это ингибитор AGT, который делает допустимой токсичность нитрозомочевины и который вводят вместе с TMZ для придания силы цитотоксическим эффектам этих агентов. Некоторые мутантные формы MGMT, которые кодируют варианты AGT, в высокой степени устойчивы к инактивации под действием 6-BG, но сохраняют способность репарировать повреждение ДНК (Maze с соавт. 1999). В одном из предпочтительных вариантов осуществления настоящего изобретения мутантная форма AGT может включать мутантную аминокислоту в положении Р140 AGT дикого типа (UniProtKB: Р16455).
Другим геном лекарственной устойчивости может быть ген белка 1 множественной лекарственной устойчивости (multidrug resistance protein 1 - MDR1). Этот ген кодирует мембранный гликопротеин, называемый Р-гликопротеином (Р-гликопротеин - P-GP), который участвует в транспорте побочных продуктов метаболизма через клеточную мембрану. Белок P-Gp проявляет широкую специфичность по отношению к нескольким структурно неродственным химиотерапевтическим агентам. Таким образом, лекарственная устойчивость может быть придана клеткам путем экспрессии последовательности нуклеиновой кислоты, кодирующей MDR-1 (NP_000918).
Геном лекарственной устойчивости также могут быть гены цитотоксических антибиотиков, например, ген ble или ген mcrA. Эктопическая экспрессия гена ble или mcrA в иммунной клетке обеспечивает селективное преимущество при воздействии химиотерапевтического агента, соответственно блеомицина или митомицина С.
Т-клеткам также могут придать устойчивость к иммуносупрессирующим агентам. Иммуносупрессирующим является агент, который супрессирует иммунную функцию одного или нескольких механизмов действия. Иначе говоря, иммуносупрессирующим является агент, который действует как соединение, способное уменьшить степень иммунного ответа и/или его прожорливость. Примером, не ограничивающим настоящее изобретение, является иммуносупрессирующий агент, которым может быть ингибитор кальциневрина, мишень рапамицина, блокатор α-цепи интерлейкина-2, ингибитор инозинмонофосфат дегидрогеназы, ингибитор дигидрофолат-редуктазы, кортикостероид или иммуносупрессивный антиметаболит. Классические цитотоксические иммуносупрессирующие агенты действуют путем подавления синтеза ДНК. Другие могут действовать через активирование Т-клеток или путем ингибирования активирования клеток-хелперов. Способ по настоящему изобретению придает иммуносупрессивную устойчивость Т-клеткам для иммунотерапии путем инактивирования мишени иммуносупрессивного агента в Т-клетках. В качестве примеров, не ограничивающих рамок охвата настоящего изобретения, мишенями для иммуносупрессивного агента может быть рецептор иммуносупрессивного агента, например, CD52, рецептор глюкокортикоида (glucocorticoid receptor - GR), представитель семейства генов FKBP и представитель семейства генов циклофилина.
В организмах иммунокомпетентных хозяев аллогенные клетки в норме быстро отторгаются иммунной системой. Было показано, что, аллогенные лейкоциты, присутствующие в необлученных компонентах крови, сохраняются в течение не более чем 5-6 суток. Таким образом, чтобы предотвратить отторжение аллогенных клеток иммунная система хозяина должна быть эффективно подавлена. Глюкокортикостероиды широко применяют в терапевтических целях для подавления иммунитета. Стероидные гормоны этого класса связываются с рецептором глюкокортикоидов (glucocorticoid receptor - GR), присутствующим в цитозоле Т-клеток, что приводит к их транслокации в ядро и к связыванию специфических мотивов ДНК, которые регулируют экспрессию ряда генов, участвующих в иммунологическом процессе. Обработка Т-клеток глюкокортикоидными стероидами приводит к снижению уровней выработки цитокинов, что приводит к анергии Т-клеток и препятствует активации Т-клеток. Алемтузумаб, также обозначаемый САМРАТН1-Н, представляет собой гуманизированное моноклональное антитело, нацеливающееся на CD52, гликозилфосфатидил-инозитол(glycosylphosphatidyl-inositol - CPI)-связанный гликопротеин из 12 аминокислот (Waldmann и Hale, 2005). CD52 экспрессируется на высоких уровнях на Т- и В-лимфоцитах и на пониженных уровнях на моноцитах, но отсутствует на гранулоцитах и на клетках-предшественниках костного мозга. Установлено, что лечение алемтузумабом - направленным против CD52 гуманизированным моноклональным антителом, вызывает быстрое истощение циркулирующих лимфоцитов и моноцитов. Алемтузумаб часто применяют в лечении Т-клеточной лимфомы и в некоторых случаях в качестве части режима подготовки к трансплантации. Тем не менее, в случае адоптивной иммунотерапии применение иммуносупрессивных препаратов также будет вредным по отношению к интродуцированным терапевтическим Т-клеткам. Таким образом, для эффективного применения адоптивной иммунотерапии при таких состояниях интродуцированные клетки должны быть устойчивыми к иммуносупрессивному лечению.
В предпочтительном варианте осуществления указанных выше стадий по настоящему изобретению указанным геном на стадии (б), специфичным в отношении иммуносупрессивного лечения, является CD52, и иммуносупрессивное лечение на стадии (г) включает гуманизированное антитело, нацеленное на антиген CD52. В качестве другого предпочтительного варианта осуществления настоящего изобретения указанный ген стадии (б), специфичный в отношении иммуносупрессивного лечения, является геном рецептора глюкокортикоида (GR), и иммуносупрессивное лечение на стадии (г) включает кортикостероид, например, дексаметазон. В качестве другого варианта осуществления настоящего изобретения указанный целевой ген стадии (б), специфичный для иммуносупрессивного лечения, является представителем семейства генов FKBP или его вариантом и иммуносупрессивное лечение стадии (г) включает FK506 также, называемый такролимусом или фуджимицином. В качестве другого варианта осуществления настоящего изобретения указанным представителем семейства генов FKBP является FKBP12 или его вариант. В качестве другого варианта осуществления настоящего изобретения указанным геном на стадии (б), специфичным для иммуносупрессивного лечения, является представитель семейства генов циклофилина или его вариантом, и иммуносупрессивное лечение на стадии (г) включает циклоспорин.
В одном из вариантов осуществления настоящего изобретения, стадия генетической модификации способа основывается на инактивации двух генов, выбранных из группы, состоящей из CD52 и GR, CD52 и TCR альфа, CDR52 и TCR бета, GR и TCR альфа, GR и TCR бета, TCR альфа и TCR бета. В другом варианте осуществления настоящего изобретения, стадия генетической модификации способа основывается на инактивации более двух генов. Генетическая модификация предпочтительно осуществляется ex-vivo, используя, по меньшей мере, две РНК, проводящие нацеливание на разные гены.
Предполагают, что путем инактивирования гена целевой ген не экспрессируется в форме функционального белка.
Конструирование высоко активных Т-клеток для иммунотерапии
По настоящему изобретению Т-клетки могут быть выбраны из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или Т-лимфоцитов хелперов. В другом варианте осуществления настоящего изобретения указанные клетки могут быть получены из группы, состоящей из CD4+ Т-лимфоцитов и CD8+ Т-лимфоцитов. Они могут быть извлечены из крови или получены из стволовых клеток. Стволовые клетки могут быть стволовыми клетками взрослых, эмбриональными стволовыми клетками, особенно стволовыми клетками, не являющимися клетками человека, стволовыми клетками пуповинной крови, клетками-предшественниками, стволовыми клетками костного мозга, индуцированными плюрипотентными стволовыми клетками, тотипотентными стволовыми клетками или кроветворными стволовыми клетками. Характерными клетками человека являются клетки CD34+. Перед размножением и генетической модификацией клеток по настоящему изобретению источник клеток может быть получен от субъекта с помощью различных методов. Т-клетки могут быть получены от ряда источников, перечень которых не ограничивается, в том числе мононуклеарных клеток периферической крови, костного мозга, ткани лимфатических узлов, пуповинной крови, ткани вилочковой железы, ткани от места инфекции, асцита, плеврального выпота, ткани селезенки и опухолей. В некоторых вариантах осуществления настоящего изобретения могут применять какое-либо число линий Т-клеток, доступных и известных специалистам в данной области. В другом варианте осуществления настоящего изобретения указанные клетки могут быть получены от здорового донора, от пациента с диагнозом «рак» или от пациента с диагнозом «инфекция». В другом варианте осуществления настоящего изобретения указанная клетка является частью смешанной популяции клеток, которые представляют разные фенотипические характеристики. Настоящее изобретение также относится к линии клеток, получаемой от трансформированных Т-клеток ранее описанным методом.
Кроме того, в настоящем изобретении Т-клетки по настоящему изобретению могут быть дополнительно сконструированы, предпочтительно методами генетической инженерии, для повышения их активности и/или активации, особенно путем модуляции экспрессии белков, участвующих в общей регуляции Т-клеток и называемых «белками иммунных контрольных точек».
Иммунные контрольные точки
Специалистам в данной области известно, что понятие «иммунные контрольные точки» означает группу молекул, экспрессируемых Т-клетками. Эти молекулы эффективно действуют в качестве «тормозов» для понижения или ингибирования иммунного ответа. К молекулам иммунных контрольных точек относятся, но ими перечень не ограничивается, белок запрограммированной смерти (Programmed Death 1 - PD-1, также обозначаемый PDCD1 или CD279, регистрационный номер: NM_005018), антиген 4 цитотоксических Т-лимфоцитов (Cytotoxic T-Lymphocyte Antigen 4 - CTLA-4, также обозначаемый CD152, регистрационный номер GenBank: AF414120.1), LAG3 (также обозначаемый CD223, регистрационный номер: NM_002286.5), Tim3 (также обозначаемый HAVCR2, регистрационный номер GenBank: JX049979.1), BTLA (также обозначаемый CD272, регистрационный номер: NM_181780.3), BY55 (также обозначаемый CD160, регистрационный номер GenBank: CR541888.1), TIGIT (также обозначаемый 1VSTM3, регистрационный номер: NM_173799), LAIR1 (также обозначаемый CD305, регистрационный номер GenBank: CR542051.1, {Meyaard, 1997}), SIGLEC10 (регистрационный номер GeneBank: AY358337.1), 2В4 (также обозначаемый CD244, регистрационный номер: NM_001166664.1), РРР2СА, РРР2СВ, PTPN6, PTPN22, CD96, CRTAM, SIGLEC7 {Nicoll, 1999}, SIGLEC9 {Zhang, 2000; Ikehara, 2004}, TNFRSF10B, TNFRSF10A, CASP8, CASP10, CASP3, CASP6, CASP7, FADD, FAS, TGFBRII, TGFRBRI, SMAD2, SMAD3, SMAD4, SMAD10, SKI, SKIL, TGIF1, IL10RA, IL10RB, HMOX2, IL6R, IL6ST, EIF2AK4, CSK, PAG1, SIT1, FOXP3, PRDM1, BATF {Quigley, 2010}, GUCY1A2, GUCY1A3, GUCY1B2, GUCY1B3, которые непосредственно ингибируют иммунные клетки. Например, CTLA-4 является белком на поверхности клеток, экспрессируемым на определенных CD4 и CD8 Т-клетках; при связывании своими лигандами (В7-1 и В7-2) на антиген-представляющих клеток, активация Т-клеток и эффекторная функция подавляются. Таким образом, настоящее изобретение относится к способу конструирования Т-клеток, особенно для иммунотерапии, включая генетически модифицированные Т-клетки, путем инактивирования, по меньшей мере, одного белка, вовлеченного в иммунную контрольную точку, в частности PD1 и/или CTLA-4, или каких-либо белков иммунных контрольных точек, указанных в табл. 3.

Конструирование Т-клеток, экспрессирующих химерные антигенные рецепторы против патологических клеток
Химерные антигенные рецепторы, интродуцированные в Т-клетки по настоящему изобретению, могут принимать разную конструкцию, например, одноцепочечные или многоцепочечные CAR. Такие разные конструкции позволяют осуществлять разные стратегии улучшения специфичности и связывающей эффективности по отношению к целевым патологическим клеткам. Некоторые из этих стратегий показаны на фигурах настоящей патентной заявки. Одноцепочечные CAR представляют наиболее классическую версию в данной области. Конструкции многоцепочечных CAR создают в настоящем изобретении в качестве конструкций, допускающих модуляцию активности Т-клеток в плане специфичности и интенсивности. Многочисленные субъединицы могут включать дополнительные домены костимуляции или поддерживать такие домены на расстоянии, а также другие типы рецепторов, в то время как классические одноцепочечные конструкции иногда можно рассматриваться как слишком чувствительные и менее пермиссивные по отношению к полиспецифичным взаимодействиям.
Одноцепочечные CAR
Адоптивная иммунотерапия, которая включает перенос аутологичных антигенспецифичных Т-клеток, выработанных ex vivo, является обещающей стратегией в лечении вирусных инфекций и рака. Т-клетки, применяемые в адоптивной терапии, могут быть получены или размножением антигенспецифичных Т-клеток или перенаправлением Т-клеток путем генетической инженерии (Park с соавт., 2011). Перенос специфичных по вирусному антигену Т-клеток является хорошо разработанной процедурой, применяемой для обработки ассоциированных с трансплантатом вирусных инфекций и редких связанных с вирусами злокачественных заболеваний. Сходным образом было показано, что выделение и перенос опухоль-специфичных Т-клеток успешно в лечении меланомы.
Новая специфичность Т-клеток была успешно получена путем генетического переноса трансгенных рецепторов Т-клеток или химерных антигенных рецепторов (CAR) (Jena с соавт., 2010). CAR являются синтетическими рецепторами, состоящими из нацеливающей части, которая связана с одной или несколькими сигнальными доменами в единую гибридную молекулу. В общем, связывающая часть CAR состоит из антигенсвязывающего домена одноцепочечного антитела (scFv), состоящего из легкого и вариабельного фрагментов моноклонального антитела, соединенных гибким линкером. Также успешно применяют связывающие части, основанные на доменах рецептора или лиганда. Сигнальные домены первой генерации CAR производны от цитоплазматической области цепей CD3zeta или Fc рецептора гамма. Установлено, что CAR первой генерации успешно перенаправляют цитотоксичность Т-клеток. Однако они не могут обеспечить пролонгированное распространение и противоопухолевое действие in vivo . Сигнальные домены от ко-стимулирующих молекул, включая CD28, ОХ-40 (CD134) и 4-1ВВ (CD137), добавляют отдельно (вторая генерация) или в комбинации (третья генерация) для улучшения выживания и повышения пролиферации Т-клеток с модифицированными CAR. CAR позволяют успешно перенаправить Т-клетки против антигенов, экспрессированных на поверхности опухолевых клеток разных онкологических заболеваний, включая лимфомы и солидные опухоли (Jena с соавт., 2010).
Помимо CAR, нацеливающегося на антигенный маркер и являющегося общим для патологических клеток и Т-клеток, например CD38, прогнозируют экспрессию дополнительных CAR, направленных против других антигенных маркеров, которые не обязательно экспрессируют Т-клетки, таким образом, чтобы повысить специфичность Т-клеток.
Примерами химерного антигенного рецептора, который может быть дополнительно экспрессирован Т-клетками для создания многоспецифичных клеток, являются антигенные рецепторы, направленные против антигенных маркеров множественной миеломы или лимфобластного лейкоза, например TNFRSF17 (UNIPROT Q02223), SLAMF7 (UNIPROT Q9NQ25), GPRC5D (UNIPROT Q9NZD1), FKBP11 (UNIPROT Q9NYL4), КАМР3, ITGA8 (UNIPROT Р53708) и FCRL5 (UNIPROT Q68SN8).
В качестве других примеров антиген мишени может быть из какого-либо кластера молекул дифференциации (например, CD16, CD64, CD78, CD96, CLL1, CD116, CD117, CD71, CD45, CD71, CD123 или CD138), ассоциированного с опухолью поверхностного антигена, например ErbB2 (HER2/neu), карциноэмбрионального антигена (carcinoembryonic antigen - СЕА), молекулы адгезии эпителиальных клеток человека (epithelial cell adhesion molecule - EpCAM), рецептора эпидермального фактора роста (epidermal growth factor receptor - EGFR), варианта III EGFR (EGFRvIII), CD19, CD20, CD30, CD40, дисиалоганглиозида GD2, слизи эпителия протоков, gp36, TAG-72, гликосфинголипидов, связанного с глиомой антигена, β-цепи хориального гонадотропина человека, альфафетопротеина (alphafetoprotein - AFP), лектин-реактивного альфа-фетопротеина (lectin-reactive α-fetoprotein - AFP, тироглобулина, RAGE-1, MN-CA IX, обратной транскриптазы теломеразы человека, RU1, RU2 (AS), кишечной карбоксилэстеразы, mut hsp70-2, M-CSF, простазы, специфического антигена простазы (prostase specific antigen - PSA), PAP, NY-ESO-1, LAGA-1a, p53, простеина, PSMA, выживания и теломеразы, опухолевого антигена 1 карциномы простаты (prostate-carcinoma tumor antigen-1 - РСТА-1), MAGE, ELF2M, эластазы нейтрофила, эфрина В2, CD22, инсулиноподобного фактора роста 1 (insulin growth factor - IGF1)-I, IGF-II, рецептора IGFI, мезотелина, молекулы главного комплекса гистосовместимости (major histocompatibility complex - МНС), презентирующего опухоль-специфичного пептидного эпитопа, 5Т4, ROR1, Nkp30, NKG2D, стромальных антигенов опухоли, внешнего домена A (extra domain А - EDA) и внешнего домена В (EDB) фибронектина, домена А1 тенасцина-С (Al domain of tenascin-C - TnC A1) и ассоциированного с фибробластами белка (fibroblast associated protein - fap); линиеспецифического или тканеспецифического антигена, например, CD3, CD4, CD8, CD24, CD25, CD33, CD34, CD133, CD138, CTLA-4, В7-1 (CD80), В7-2 (CD86), GM-CSF, рецепторов антигенов, эндоглина, молекулы главного комплекса гистосовместимости (major histocompatibility complex - МНС), ВСМА (CD269, TNFRSF 17) или вирус-специфичного поверхностного антигена, например, ВИЧ-специфичного антигена (например, ВИЧ gp120); EBV-специфичного антигена, CMV-специфичного антигена, HPV-специфичного антигена, специфичного антигена вируса Ласса, специфичного антигена вируса гриппа, а также какого-либо производного или варианта таких поверхностных маркеров. Антигены необязательно являются антигенными маркерами на поверхности клеток, но также могут быть эндогенными малыми антигенами, представленными HLA класса I на поверхности клеток.
В качестве примеров настоящее изобретение охватывает одноцепочечные CAR, которые специфически нацеливаются на маркер на поверхности клетки, например CD38, CS1 и/или CD70, которые описаны в примерах, вместе с инактивацией генов, кодирующих соответственно CD38, CS1 и/или CD70 в клетках, экспрессирующих указанные CAR.
Характерным примером являются цепи VH и VL scFv анти-CD38, которые составляют по меньшей мере 80%, предпочтительно 90% и более предпочтительно 95% идентичности относительно SEQ ID NO: 10 и 12, а также SEQ ID NO: 11 и 13.
Характерным примером является антитело или его эпитоп, связывающий фрагмент на антигене CD38, отличающиеся тем, что указанное антитело или его эпитоп-связывающий фрагмент включает по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, причем указанная тяжелая цепь включает три последовательные области, определяющие комплементарность, с аминокислотными последовательностями SEQ ID NOS: 14-17, а легкая цепь включает три последовательные области, определяющие комплементарность, с аминокислотными последовательностями SEQ ID NOS: 21-23.
Другим характерным примером является антитело или его эпитоп, связывающий фрагмент на антигене CD38, отличающиеся тем, что указанное антитело или его эпитоп-связывающий фрагмент включает по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, причем указанная тяжелая цепь включает три последовательные области, определяющие комплементарность, с аминокислотными последовательностями SEQ ID NOS: 18-20, а легкая цепь включает три последовательные области, определяющие комплементарность, с аминокислотными последовательностями SEQ ID NOS: 24-26.
Еще одним характерным примером являются цепи VH и VL scFv анти-CS1, которые проявляют по меньшей мере 80%, предпочтительно 90% и более предпочтительно 95% идентичности соответственно с SEQ ID NO: 38-40-42-44-46 и SEQ ID NO: 39-41-42-45-46.
Также характерным примером являются цепи VH и VL scFv анти-CD70, которые проявляют по меньшей мере 80%, предпочтительно 90% и более предпочтительно 95% идентичности на уровне полинуклеотидов или нуклеиновых кислот соответственно с SEQ ID NO: 81-82; 85-86; 89-91 и SEQ ID NO: 83-84; 87-88; 91-92.
В одном из вариантов осуществления настоящего изобретения предусматривают полинуклеотид, кодирующий одноцепочечный CAR анти-CD38, который проявляет по меньшей мере 80%, предпочтительно 90% и более предпочтительно 95% идентичности с SEQ ID NO: 35-37. В другом варианте осуществления настоящего изобретения предусматривают полинуклеотид, кодирующий одноцепочечный CAR анти-CS1, который проявляет по меньшей мере 80%, предпочтительно 90% и более предпочтительно 95% идентичности с SEQ ID NO: 48-62.
В другом варианте осуществления настоящего изобретения предусматривают полинуклеотид, кодирующий одноцепочечный CAR анти-CD70, который по меньшей мере на 80%, предпочтительно на 90% и более предпочтительно на 95% идентичен с SEQ ID NO: 93-101.
Настоящее изобретение также относится к иммунным клеткам, которые обеспечены CAR, презентирующим некоторую идентичность с теми клетками, описанными в настоящем изобретении, которые могли бы нести индуцированные редкощепящей эндонуклеазой мутации в гене, кодирующем клеточный маркер, на который нацелен указанный CAR (т.е. CAR демонстрирует сродство с продуктом указанного инактивированного гена). Понятие «идентичность» означает, по меньшей мере 70%, предпочтительно 80%, более предпочтительно 90% и даже более предпочтительно 95% идентичность полинуклеотида или полипептида, что определяют с помощью программного обеспечения, например, FASTA или BLAST, которые составляют часть пакета программ для анализа последовательностей GCG (Университет Висконсина, Мэдисон, США). Определение идентичности с помощью программы BLASTP показывает число и фракцию от общего количества остатков среди последовательностей с высоким содержанием идентичных пар. Аминокислотные последовательности, обладающие такими степенями идентичности или сходства или какой-либо промежуточной степенью идентичности или сходства с аминокислотными последовательностями, описанными в настоящем изобретении, рассматривают и включают в настоящее изобретение. Аналогичный подход применяют по отношению к полинуклеотидным последовательностям, используя программу BLASTN.
Мультисубъединичный CAR
Химерные антигенные рецепторы предшествующего уровня техники, интродуцированные в Т-клетки, были сформированы из одноцепочечных полипептидов, которые требуют последовательного пополнения сигнальных доменов. Однако смещение сигнальных доменов с их естественного околомембранного положения может нарушить их функцию. Чтобы преодолеть это препятствие, авторы настоящего изобретения ранее сконструировали многоцепочечный CAR, производный от FcεRI, чтобы допустить нормальное околомембранное положение всех значимых сигнальных доменов. При таком новом строении высокое сродство IgE связывающего домена FcεRI альфа цепи замещается внеклеточным лиганд-связывающим доменом, например scFv, чтобы перенаправить специфичность Т-клеток против клеточных мишеней, и N- и/или С-концевые хвосты FcεRI бета цепи применяют для помещения ко-стимулирующих сигналов в нормальные околомембранные положения.
Соответственно, экспрессированный сконструированными Т-клетками CAR по настоящему изобретению, может быть многоцепочечным химерным антигенным рецептором (CAR), который в высокой степени адаптирован к выработке и размножению сконструированных Т-клеток по настоящему изобретению. Такие многоцепочечные CAR включают, по меньшей мере, два из следующих компонентов:
а. один полипептид, включающий трансмембранный домен FcεRI альфа-цепи и внеклеточный лиганд-связывающий домен,
б. один полипептид, включающий часть N- и С-концевого цитоплазматического хвоста и трансмембранного домена FcεRI бета-цепи и/или
в. по меньшей мере два полипептида, каждый из которых включает часть внутрицитоплазматического хвоста и трансмембранного домена FcεRI гамма цепи, в соответствии с чем разные полипептиды спонтанно объединяются с образованием мультимеров димерных, тримерных или тетрамерных CAR.
Исходя из такой конструкции, лиганд-связывающие домены и сигнальные домены возникают на отдельных полипептидах. Разные полипептиды закреплены в мембране в тесном расположении, допускающем их взаимодействие. При такой конструкции сигнальные и костимулирующие домены могут быть в околомембранных положениях (т.е. расположены рядом с клеточной мембраной на ее внутренней стороне), что предположительно позволяет улучшить функцию костимулирующих доменов. Конструкция из многих субъединиц также обеспечивает большую гибкость и возможность проектирования CAR с повышенным контролем по активации Т-клеток. Например, можно включить несколько внеклеточных антиген-распознающих доменов, обладающих отличающейся специфичностью для получения мультиспецифичной конструкции CAR. Также можно контролировать относительное соотношение между разными субъединицами в многоцепочечный CAR. Такой тип конструкции был ранее описан заявителем в PCT/US 2013/058005 (WO 2014/039523).
Сборка разных цепей в качестве части единого многоцепочечного CAR стала возможной, например, путем использования разных альфа, бета и гамма цепей рецептора IgE (FcεRI), обладающего высоким сродством (Metzger с соавт., 1986), с которым гибридизированы передающие сигнал и костимулирующие домены. Гамма цепь включает трансмембранную область и цитоплазматический хвост, содержащий один иммунорецепторный основанный на тирозине активирующий мотив (immunoreceptor tyrosine-based activation motif - ITAM) (Cambier, 1995).
Многоцепочечные CAR могут включать несколько внеклеточных лиганд-связывающих доменов для одновременного связывания разных элементов в мишень, тем самым, повышая активацию и функцию клеток. В одном из вариантов осуществления настоящего изобретения внеклеточные лиганд-связывающие домены могут быть размещены в тандеме на одном трансмембранном полипептиде и необязательно могут быть разделены линкером. В другом варианте осуществления настоящего изобретения указанные внеклеточные лиганд-связывающие домены могут быть размещены на разных трансмембранных полипептидах, формируя многоцепочечные CAR. В другом варианте осуществления настоящее изобретение относится к популяции многоцепочечных CAR, каждый из которых включает один отличающийся внеклеточный лиганд-связывающий домен. В частности настоящее изобретение относится к способу конструирования иммунных клеток, включающему получение иммунной клетки и экспрессии на поверхности указанной клетки популяции многоцепочечных CAR, каждый из которых включает разные внеклеточные лиганд-связывающие домены. В другом предпочтительном варианте осуществления настоящее изобретение относится к способу конструирования иммунной клетки, включающему получение иммунной клетки и интродукцию в указанную клетку полинуклеотидов, кодирующих полипептиды, составляя популяцию многоцепочечных CAR, каждый из которых включает разные внеклеточные лиганд-связывающие домены. В предпочтительном варианте осуществления настоящего изобретения способ конструирования иммунной клетки включает экспрессию на поверхности клетки, по меньшей мере, части цепи FcεRI beta и/или gamma, гибридизованной с сигнал-трансдуцирующим доменом и некоторой частью цепей FcεRI alpha, гибридизованных с разными внеклеточными лиганд-связывающими доменами. В более предпочтительном варианте осуществления настоящего изобретения указанный способ включает интродукцию в указанную клетку, по меньшей мере, одного полинуклеотида, который кодирует часть цепи FcεRI beta и/или gamma, гибридизированной с сигнал-трансдуцирующим доменом и несколькими цепями FcεRI alpha, гибридизованными с разными внеклеточными лиганд-связывающими доменами. Понятие «многоцепочечные CAR» означает, по меньшей мере, два, три, четыре, пять, шесть или более многоцепочечных CAR, каждый из которых включает разные внеклеточные лиганд-связывающие домены. Разные внеклеточные лиганд-связывающие домены по настоящему изобретению могут предпочтительно одновременно связывать разные элементы мишени, тем самым, увеличивая активацию и активность иммунных клеток.
Настоящее изобретение также предусматривает выделенную иммунную клетку, которая включает популяцию многоцепочечных CAR, каждый из которых включает разные внеклеточные лиганд-связывающие домены.
Сигнал-трансдуцирующий домен или внутриклеточный сигнальный домен многоцепочечного CAR по настоящему изобретению отвечает за внутриклеточную передачу сигнала с последующим связыванием внеклеточного лиганд-связывающего домена с мишенью, что приводит к активации иммунной клетки и иммунного ответа. Иначе говоря, домен сигнальной трансдукции отвечает за активацию, по меньшей мере, одной из числа нормальных эффекторных функций иммунной клетки, в которой экспрессируется многоцепочечный CAR. Например, эффекторной функцией Т-клетки может быть цитолитическая активность или хэлперная активность, включая секрецию цитокинов.
В настоящем изобретении понятие «сигналтрансдуцирующий домен» относится к части белка, которая трансдуцирует функцию эффекторного сигнала и направляет клетку к осуществлению специализированной функции.
Предпочтительными примерами домена сигнальной трансдукции для применения в одно- или многоцепочечных CAR могут быть цитоплазматические последовательности рецептора Fc или рецептора Т-клеток и ко-рецепторы, которые действуют во взаимодействии для инициации сигнальной трансдукции, позволяя объединиться антигену и рецептору, а также какому-либо производному или варианту таких последовательностей и какой-либо синтетической последовательности, которая имеет ту же функциональную возможность. Домен сигнальной трансдукции включает два отдельных класса цитоплазматических сигнальных последовательностей таким образом, что инициируют антигензависимую первичную активацию и действуют антигензависимым образом для выработки вторичного или ко-стимулирующего сигнала. Первичная цитоплазматическая сигнальная последовательность может включать сигнальные мотивы, известные как иммунорецепторные основанные на тирозине активирующие мотивы ITAM. ITAM являются хорошо описанными сигнальными мотивами, обнаруженными во внутрицитоплазматическом хвосте различных рецепторов и являющимися связующими сайтами для тирозинкиназ класса syk/zap70. К примерам ITAM, применяемым в настоящем изобретении, но которыми перечень не ограничивается, можно отнести производные TCRzeta, FcRgamma, FcRbeta, FcRepsilon, CD3gamma, CD3delta, CD3epsilon, CD5, CD22, CD79a, CD79b и CD66d. В предпочтительном варианте осуществления настоящего изобретения домен сигнальной трансдукции многоцепочечного CAR может включать сигнальный домен CD3zeta, или внутрицитоплазматический домен FcεRI бета или гамма цепей.
В предпочтительном варианте осуществления настоящего изобретения домен сигнальной трансдукции многоцепочечного CAR по настоящему изобретению включает ко-стимулирующую сигнальную молекулу. Ко-стимулирующая молекула является молекулой на поверхности клетки, отличающейся от антигенного рецептора или его лигандов, которые требуются для эффективного иммунного ответа.
Лигандсвязывающие домены могут быть какими-либо ранее применявшимися антигенными рецепторами, и описаны в отношении одинарной цепи CAR, упомянутой в литературе, в частности scFv от моноклональных антител. Биспецифичные или мультиспецифичные CAR, описанные в WO 2014/4011988, включены в настоящее изобретение в виде ссылки.
Подобно ранее описанному, касающемуся одноцепочечных CAR, настоящее изобретение охватывает иммунные клетки, обеспеченные многоцепочечными CAR, которые нацеливаются специфически на маркеры на поверхности клетки, например, на CD38, CS1 или CD70. В предпочтительном варианте осуществления настоящего изобретения, описанные выше CAR экспрессируются в иммунных клетках, поскольку активация эндогенных генов, кодирующих указанный маркер (маркеры) на поверхности клеток, индуцируются путем экспрессии редкощепящей эндонуклеазы.
Активация и размножение Т-клеток
Способ по настоящему изобретению обычно включает дополнительную стадию активации и/или размножения Т-клеток. Она может быть произведена до или после генетической модификации Т-клеток, используя методы, например, описанные в US 6352694; US 6534055; US 6905680; US 6692964; US 5858358; US 6887466; US6905681; US 7144575; US 7067318; US 7172869; US 7232566; US 7175843; US 5883223; US 6905874; US 6797514; US 6867041; US 20060121005. Указанными методами Т-клетки по настоящему изобретению могут быть размножены путем контакта с поверхностью, к которой присоединен агент, стимулирующий сигнал, связанный с комплексом CD3 TCR, и лиганд, который стимулирует ко-стимулирующую молекулу на поверхности Т-клеток.
В частности, популяции Т-клеток могут быть простимулированы in vitro, например путем контакта с анти-CD3 антителом, или его антигенсвязывающим фрагментом, или анти-CD2 антителом, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы С (например, с бриостатином) в связке с ионофором кальция. Для ко-стимуляции сопутствующей молекулы на поверхности Т-клеток применяют лиганд, который связывает сопутствующую молекулу. Например, популяция Т-клеток может быть приведена в контакт с анти-CD3 антителом и анти-CD28 антителом в условиях, приемлемых для стимуляции пролиферации Т-клеток. Для стимуляции пролиферации или CD4+ Т-клеток, или CD8+ Т-клеток может быть контакт с анти-CD3 антителом и анти-CD28 антителом. Например, агенты, обеспечивающие каждый сигнал, могут быть в растворе или соединены с поверхностью. Специалисты в данной области могут оценить соотношение частиц и клеток в зависимости от размера частиц относительно целевых клеток. В другом варианте осуществления настоящего изобретения клетки, например Т-клетки, комбинируют с гранулами с нанесенным в виде покрытия агентом, эти гранулы и клетки затем разделяют, после чего клетки культивируют. В еще одном варианте осуществления настоящего изобретения перед культивированием гранулы с нанесенным агентом и клетки не разделяют, а культивируют вместе. Белки на поверхности клеток могут быть лигированы за счет допуска парамагнитных гранул, к которым присоединены анти-CD3 и анти-CD28 (гранулы 3×28), к контакту с Т-клетками. В одном из вариантов осуществления настоящего изобретения клетки (например, 4-10 Т-клеток) и гранулы (например, DYNABEADS® М-450 CD3/CD28 Т парамагнитные гранулы в соотношении 1:1) объединяют в буфере, предпочтительно ФСБ (без двухвалентных катионов, например, без кальция и магния). Специалисты в данной области способны определить, какую концентрацию клеток можно применить. Смесь можно культивировать в течение от нескольких часов (примерно 3 ч) до примерно 14 суток, или в течение какого-либо срока в указанном интервале. В другом варианте осуществления настоящего изобретения смесь можно культивировать в течение 21 суток. К условиям, пригодным для Т-клеток, относится соответствующая среда, например минимальная поддерживающая среда (Minimal Essential Media - MEM, или среда RPMI 1640, или среда X-vivo 5, (фирма Lonza, Швейцария)), которая может содержать факторы, требуемые для пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-g, 1L-4, 1L-7, GM-CSF, -10, - 2, 1L-15, TGFp, TNF- или какие-либо другие добавки для роста клеток, известные специалистам в данной области. К другим добавкам для роста клеток относятся, но ими перечень не ограничивается, поверхностно-активное вещество, плазмозаменитель продукт плазманат и восстанавливающие агенты, например, N-ацетил-цистеин и 2-меркаптоэтанол. К средам могут относиться PMI 1640, A1M-V, DMEM, MEM, а-МЕМ, F-12, Х-Vivo 1, Х-Vivo 20 и среда Optimizer, с добавленными аминокислотами, пируватом натрия и витаминами, или без сыворотки, или с определенным количеством сыворотки (или плазмы), или с определенным набором гормонов, и/или с количеством цитокина (цитокинов), достаточным для роста и размножения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, предназначенных для инфузии субъекту. Целевые клетки поддерживают в условиях, требуемых для роста, например при определенной температуре (например, 37°С) и атмосфере (например, дополнительно 5% СО2). Т-клетки, подвергнутые стимулирующему воздействию различное число раз, могут проявлять разные свойства.
В другом варианте осуществления настоящего изобретения указанные клетки могут быть размножены путем совместного культивирования с тканью или клетками. Указанные клетки также размножают in vivo , например, в крови субъекта после введения указанных клеток этому субъекту.
Терапевтические применения
Т-клетки, получаемые разными описанными выше методами, предназначены для применения в качестве лекарственного средства для лечения рака, инфекций или иммунных заболеваний, наряду с другими заболеваниями, у пациента, нуждающегося в таком лечении.
Указанное лечение может облегчать состояние, вылечивать или иметь профилактическое значение. Оно может быть либо частью аутологической иммунотерапии, либо частью аллогенной иммунотерапии. Понятие «аутологические» означает, что клетки, линия клеток или популяция клеток, применяемых для лечения пациентов, происходят от указанного пациента или от донора, совместимого с указанным пациентом по антигенам лейкоцитов человека (HLA). Понятие «аллогенные» означает, что клетки или популяция клеток, применяемых для лечения пациентов, происходят не от указанного пациента, а от донора.
Т-клетки, сконструированные по одному из предшествующих способов, могут быть объединены, заморожены, а также введены одному или нескольким пациентам. Если полученные Т-клетки не являются аллореактивными, они могут применяться в качестве терапевтического продукта «с полки», что означает, что они могут применяться универсально и вводиться путем инфузии пациентам, нуждающимся в этом.
Указанные способы лечения первоначально предназначались для пациентов, у которых диагностирован рак, вирусная инфекция, аутоиммунные расстройства или заболевание трансплантат-против-хозяина (Graft versus Host Disease - GvHD). Преимущественно злокачественными заболеваниями являются лейкозы и лимфомы, которые представляют поражение жидких тканей, но также могут быть солидными опухолями. К типам рака, подвергаемого лечению CAR по настоящему изобретению, относятся, но ими перечень не ограничивается, карциномы, бластомы или саркомы, а также определенные лейкозы или злокачественные лимфоидные поражения, доброкачественные и злокачественные опухоли, например, такие как саркомы, карциномы и меланомы. К ним также относятся опухоли/злокачественные заболевания взрослых и опухоли/злокачественные заболевания детей.
Настоящее изобретение предусматривает в табл. 4-14 примеры антигенных маркеров, на которые могут быть нацелены сконструированные клетки по настоящему изобретению для лечения разных типов рака.
Предпочтительными антигенными маркерами, применяемыми для иммунотерапии по настоящему изобретению, особенно являются CD38, CD319 (CS1) и CD70.
Имеющиеся Т-клетки, вооруженные определенными CAR, направленными против собственных иммунных клеток пациента, особенно Т-клеток, допускают ингибирование или регулирование указанных клеток, которые представляют ключевую стадию лечения аутоиммунного заболевания, например, ревматоидного полиартрита, системной красной волчанки, синдрома Шенгрена, склеродермы, фибромиалгии, миозита, анкилозирующего спондилита, инсулинзависимого диабета I типа, болезни Хашимото, Аддиссоновой болезни, болезни Крона, целиакии, бокового амиотрофического склероза (amyotrophic lateral sclerosis - ALS) и рассеянного клероза (multiple sclerosis - MS). Настоящее изобретение предусматривает способ лечения иммунного заболевания путем прямого конструирования ранее описанных Т-клеток против собственных Т-клеток пациента.
Описанные выше варианты лечения могут быть в комбинации с одним или несколькими способами лечения из группы, включающей лечение антителами, химиотерапию, лечение цитокинами, лечение дендритными клетками, генную терапию, гормональную терапию, лазерную терапию и радиационную терапию.
Сконструированные Т-клетки, согласно описанному ранее, после приобретения резистентности к химиотерапевтическим средствам и к иммуносупрессивным средствам, которые применяют при стандартном лечении, особенно метотрексат и комбинация флударабина и циклофосфана, особенно применимы для лечения различных форм рака. Несомненно, что настоящее изобретение предпочтительно основывается на клетках или популяции клеток, и поэтому можно ожидать, что химиотерапия и/или иммуносупрессирующее лечение могут помочь отобрать и размножить сконструированные Т-клетки in vivo .
В некоторых вариантах осуществления настоящего изобретения клетки вводят пациенту вместе (например, до, одновременно или после) с каким-либо числом значимых для лечения воздействий, включая, но ими не ограничиваясь, лечение такими агентами, как противовирусные средства цидофовир и интерлейкин-2, цитарабин (также обозначаемый ARA-C) или натализимаб для лечения пациентов с MS, или эфализтимаб для пациентов с псориазом, или другие формы лечения для пациентов с PML. В других вариантах осуществления настоящего изобретения Т-клетки по настоящему изобретению могут применять в комбинации с химиотерапией, радиацией, иммуносупрессивными агентами, например, циклоспорином, азатиоприном, метотрексатом, микофенолятом и FK506, антителами или другими иммуноабляционными агентами, например, CAMPATH, анти-CD3 антителами или другими антителами, цитоксином, флударабином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и облучением. Эти лекарственные средства ингибируют или кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506), или ингибируют киназу p70S6, важную для индуцируемой фактором роста передачи сигнала (рапамицин) (Liu с соавт., 1991; Henderson с соавт., 1991; Bierer с соавт., 1993). В другом варианте осуществления настоящего изобретения композиции клеток по настоящему изобретению вводят пациенту вместе (например, до, одновременно или после) с трансплантацией костного мозга, Т-клеточной аблятивной терапией, использованием химиотерапевтических агентов, например, флударабина, наружной дистанционной лучевой терапией (external-beam radiation therapy - XRT), циклофосфаном или антителами, например, ОКТ3 или САМРАТН. В другом варианте осуществления настоящего изобретения композицию клеток по настоящему изобретению вводят с последующей В-клеточной аблятивной терапией, например, агентами, реагирующими с CD20, например, с продуктом ритуксан. Например, в одном из вариантов осуществления настоящего изобретения субъекты могу подвергаться стандартному лечению высокими дозами химиотерапевтических средств с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления настоящего изобретения после трансплантации субъекты получают инфузию размноженных иммунных клеток по настоящему изобретению. В еще одном варианте осуществления настоящего изобретения размноженные клетки вводят до или после хирургического вмешательства. Указанные модифицированные клетки, полученные по одному из описанных в настоящем изобретении способов, особенно могут применять в настоящем изобретении для лечения пациентов, нуждающихся в этом, против отторжения хозяин-против-трансплантата (Host versus Graft - HvG) и против болезни трансплантат-против-хозяина (Graft versus Host Disease - GvHD); следовательно, в рамках охвата настоящего изобретения имеется способ лечения пациентов, нуждающихся в этом, направленный против отторжения хозяин-против-трансплантата (Host versus Graft - HvG) и против болезни трансплантат-против-хозяина (Graft versus Host Disease - GvHD), включающий лечение указанного пациента путем введения указанному пациенту эффективного количества модифицированных клеток, содержащих инактивированные гены TCR alpha и/или TCR beta.
В одном из вариантов осуществления настоящего изобретения указанные Т-клетки по настоящему изобретению могут претерпевать уверенное размножение Т-клеток in vivo при введении пациенту и могут сохраняться в жидкостях тела на протяжении длительного времени, предпочтительно в течение недели, более предпочтительно в течение 2 недель, еще более предпочтительно в течение, по меньшей мере, одного месяца. Хотя ожидают, что Т-клетки по настоящему изобретению сохраняются на протяжении указанных периодов, предполагают, что продолжительность их жизнеспособности в организме пациента не превышает года, предпочтительно 6 месяцев, более предпочтительно 2 месяцев и еще более предпочтительно одного месяца.
Введение клеток или популяции клеток по настоящему изобретению могут проводить каким-либо традиционным путем, включая аэрозольную ингаляцию, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию.
Композиции, описанные в настоящем изобретении, могут вводить пациенту подкожно, внутрикожно, внутрь опухоли, внутрь узлов, интрамедуллярно, внутримышечно, внутривенно, внутрь лимфатической системы или внутрибрюшинно. В одном из вариантов осуществления настоящего изобретения композиции клеток по настоящему изобретению предпочтительно вводят внутривенной инъекцией.
Введение клеток или популяции клеток может состоять из введения 104-109 клеток/кг массы тела, предпочтительно 105-106 клеток/кг массы тела, включая все возможные количества клеток в указанных диапазонах. Клетки или популяцию клеток могут вводить в виде одной или нескольких доз. В другом варианте осуществления настоящего изобретения указанное эффективное количество клеток вводят в виде одной дозы. В еще одном из вариантов осуществления настоящего изобретения указанное эффективное количество клеток вводят в виде нескольких доз на протяжении определенного периода времени. Определение хронометража введения проводит лечащий врач, и он и зависит от клинического состояния пациента. Клетки или популяции клеток могут быть получены из какого-либо источника, например, из банка крови или от донора. Хотя индивидуальные потребности варьируют, оптимальные диапазоны эффективных количеств клеток данного типа при определенном заболевании или состоянии может определить социалист в данной области. Эффективное количество означает такое количество, которое обеспечивает терапевтическую или профилактическую пользу. Введение дозы может зависеть от возраста, здоровья массы тела реципиента, типа сопутствующего лечения, если таковое имеется, частоты лечения и природы требуемого эффекта.
В другом варианте осуществления настоящего изобретения указанное эффективное количество клеток или композиции, включающей эти клетки, вводят парентерально. Указанное введение может быть внутривенным введением. Указанное введение может быть непосредственно осуществлено инъекцией в опухоль.
Идентификация поверхностного антигенного маркера, экспрессированного на поверхности Т-клеток, который также избыточно экспрессируется на плотных опухолях, образуемых при разных типах рака (табл. 5-13)
В настоящем изобретении используют данные микрочипа BioGPS из панели нормальных тканей (атлас генов человека U133A/GNF1H), которые также можно загрузить с BioGPS (основные опухоли человека (U95)) базы данных последовательностей белков UniProt, где содержатся сведения о субклеточной локализации.
В настоящем изобретении распределение величин, поступающих от здоровых тканей и определивших пороговое значение 5 применительно к сравнительной экспрессии.
В настоящем исследовании просматривают все гены с помощью микрочипов (44000 зондов, представляющих около 13000 генов) и контролируют их локализацию в мембране (белок, не упоминаемый в качестве мембранного белка, отбрасывают). Экспрессию в CD8+ Т-клетках сверяют с базой данных BioGPS. Гены перечисляют по типам рака, при наивысшем уровне соответствующей экспрессии (табл. 5-13).
Идентификация поверхностного антигенного маркера, экспрессированного на поверхности Т-клеток, который также избыточно экспрессируется при разных злокачественных заболеваниях крови (табл. 14)
Поскольку для данного исследования нет доступных данных по последовательностям РНК, в настоящем исследовании используют данные по микрочипам, полученные от многих исследований в рамках консорциума MILE (Microarray Innovations in Leukemia - инновации с применением микрочипов при лейкозах), включающих 11 лабораторий
http://www.ngrl.org.uk/wessex/downloads/tm08/TM08-S4-1_KenMills.pdf-Haferlach с соавт. 2010, http://www.ncbi.nlm.nih.gov/pubmed/20406941). Эти необработанные данные включают результаты по острому лимфобластному лейкозу (acute lymphoblastic leukemia - ALL), острому миелогенному лейкозу (acute myelogenous leukemia - AML), хроническому лимфобластному лейкозу (chronic lymphoblastic leukemia - CLL), хроническому миелогенному лейкозу (chronic myelogenous leukemia - CML) и миелодиспластическому синдрому (myelodysplastic syndrome - MDS). Также в настоящем изобретении используют данные базы белков UniProt по внутриклеточной локализации.
В первую очередь очерчивают общее распределение величин по всем генам во всех исследованных тканях. Затем, чтобы иметь представление о необходимом для экспрессии уровне, анализируют список генов, которые экспрессируются при некоторых злокачественных заболеваниях жидких тканей и для которых имеются терапевтические антитела (CD52, CD20, CD33, CD19, CD25, CD44, CD47, CD96, CD116, CD117, CD135, TIM-3). Для каждого гена рассматривают величину, полученную в опухоли, в которой происходит его экспрессия. На следующем этапе рассчитывают среднее значение для каждой опухоли и генной пары, для которой предполагают выработку клеточного мембранного белка (локализация клеточной мембраны + описание, по меньшей мере, одного трансмембранного домена в белке). Бракуют гены, для которых экспрессия во всех тканях ниже порогового значения 0,15. В табл. 14 перечисляют и ранжируют гены, у которых уровни относительной экспрессии в Т-клетках выше 0,2. Таким образом, в табл. 14 представлены предполагаемые кандидаты антигенных маркеров по настоящему изобретению для нацеливания на злокачественные клетки опухолей жидких тканей, в частности, для лечения ALL, AML, CLL, CML и MDS.
Пример последовательных этапов конструирования Т-клеток по настоящему изобретению, предназначенных для иммунотерапии
Для лучшего понимания настоящего изобретения предусматривают пример последовательных этапов получения Т-клеток, направленных против лейкозных клеток, положительных по CD38:
1. Получение Т-клеток из культуры клеток или из образца крови одного конкретного пациента или из банка крови и активирование указанных Т-клеток, используя анти-CD3/С28 активирующие гранулы (продукт Dynabeads®). Эти гранулы обеспечивают и первичные, и ко-стимулирующие сигналы, которые требуются для активирования и размножения Т-клеток.
2. Трансдукция указанных клеток ретровирусным вектором, включающим трансген, который кодирует рецептор химерного антигена, состоящий из гибрида домена активации CD3zeta, ко-стимулирующего домена 4-1ВВ, трансмембранного домена и шарнира от CD28, гибридизованного с последовательностью, кодирующей вариабельную цепь анти-CD38 антитела. Для безопасности и улучшения трансформированных Т-клеток может быть дополнительно интродуцирован суицидальный ген, чувствительный к ритуксимабу, согласно описанию WO 2013/153391 в лентивирусный вектор, разъединенный расщепляющими последовательностями Т2А.
3. (Необязательно) конструирование неаллореактивных и/или устойчивых Т-клеток:
а. Возможно инактивировать TCR альфа в указанных клетках для элиминации TCR с поверхности клеток и предупреждения распознавания ткани хозяина в качестве чужеродной аллогенным TCR и таким образом избежать GvHD, следуя протоколам, изложенным в WO 2013/176915.
б. Также можно инактивировать один ген, кодирующий мишень для иммуносупрессивного агента или химиотерапевтического лекарственного средства, для того, чтобы сделать указанные клетки устойчивыми к иммуносупрессивному или химиотерапевтическому воздействию для предупреждения отторжения без воздействия на трансплантированные Т-клетки. В этом примере мишенью иммуносупрессивных агентов является CD52, и иммуносупрессивный агент представляет гуманизированное моноклональное анти-CD52 антитело (например, алемтузумаб), что описано в WO 2013/176915.
4. Генную инактивацию осуществляют путем электропорации Т-клеток мРНК, кодирующей специфическую TAL-эндонуклеазу (продукт TALEN™, фирма Cellectis, Франция). Инактивированные Т-клетки сортируют, используя магнитные гранулы. Например, Т-клетки, по-прежнему экспрессирующие целевой ген (например, CD38, CD70 и CD70), могут быть удалены путем фиксации на твердой поверхности, и инактивированные клетки не испытывают стресса от пропуска через колонку. Такой мягкий метод повышает концентрацию должным образом сконструированных Т-клеток.
5. Размножение in vitro сконструированных Т-клеток перед введением пациенту или in vivo с последующим введением пациенту путем стимуляции комплекса CD3. Перед стадией введения пациенты могут быть подвергнуты иммуносупрессивной терапии, например, САМРАТН1-Н, гуманизированным моноклональным анти-CD52 антителом.
6. Необязательно подвергать указанные клетки действию биспецифических антител ex vivo перед введением пациенту или in vivo с последующим введением пациенту для привнесения сконструированных клеток в близкое расположение с целевым антигеном.
Функциональный анализ сконструированных Т-клеток, в которые электропорирована моноцистронная мРНК, кодирующая анти-CD38 одноцепочечный химерный антигенный рецептор (CAR CD38):
Чтобы убедиться, что сконструированный геном не влияет на способность сконструированных Т-клеток проявлять противоопухолевую активность, особенно при их обеспечении химерным антигенным рецептором (CAR CD38), сконструированные Т-клетки инкубируют 4 ч с клетками Дауди, экспрессирующими на поверхности CD38. Повышенную регуляцию CD107a на поверхности клеток - маркера цитотоксических гранул, высвобождаемых Т-лимфоцитами (процесс называют дегрануляцией), измеряют методом жидкостной цитометрии (Betts с соавт., 2003).
Через 24 ч после электропорации клетки окрашивают фиксирующим жизнеспособным красителем eFluor-780 и РЕ-конъюгированным козьим антителом против фрагмента IgG F(ab')2 мыши, специфичным для оценки экспрессии CAR на клеточной поверхности живых клеток. Огромное большинство живых Т-клеток, с генетически разрушенным CD38, экспрессирует на своей поверхности CAR. Т-клетки культивируют совместно с клетками Дауди (CD38+) в течение 6 ч и анализируют методом жидкостной цитометрии для обнаружения экспрессии маркера дегрануляции CD107a на их поверхности (Betts с соавт. 2003).
Результаты показывают, что Т-клетки с разрушенным CD38 сохраняют такую же способность к дегранулированию в ответ на РМА/иономицин (положительный контроль) или CD38+ клетки Дауди. Повышенная регуляция CD107 зависит от присутствия CD38+. Эти данные показывают, что конструирование генома данных Т-клеток не оказывает негативного воздействия на способность Т-клеток поддерживать контролируемый противоопухолевый ответ.


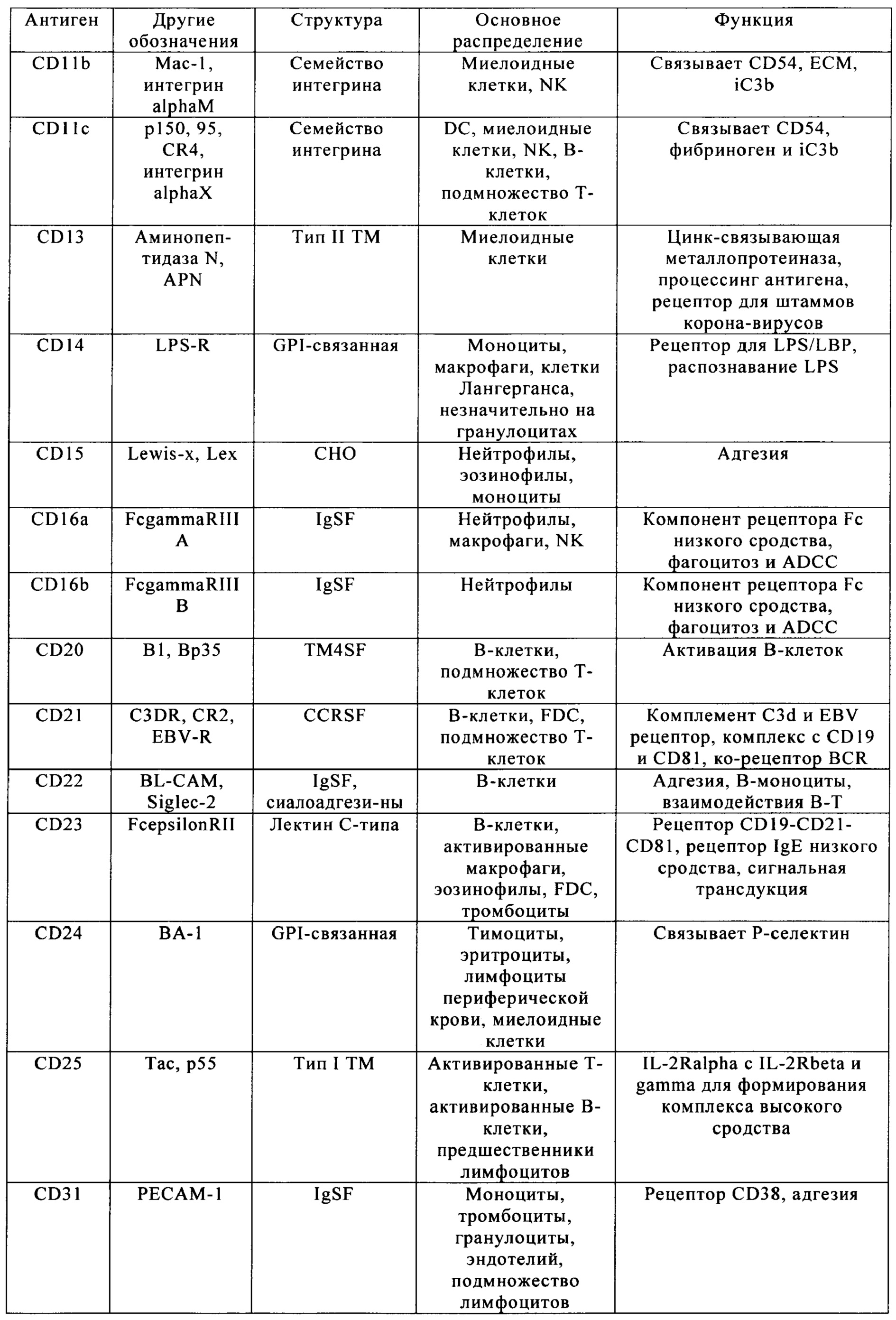





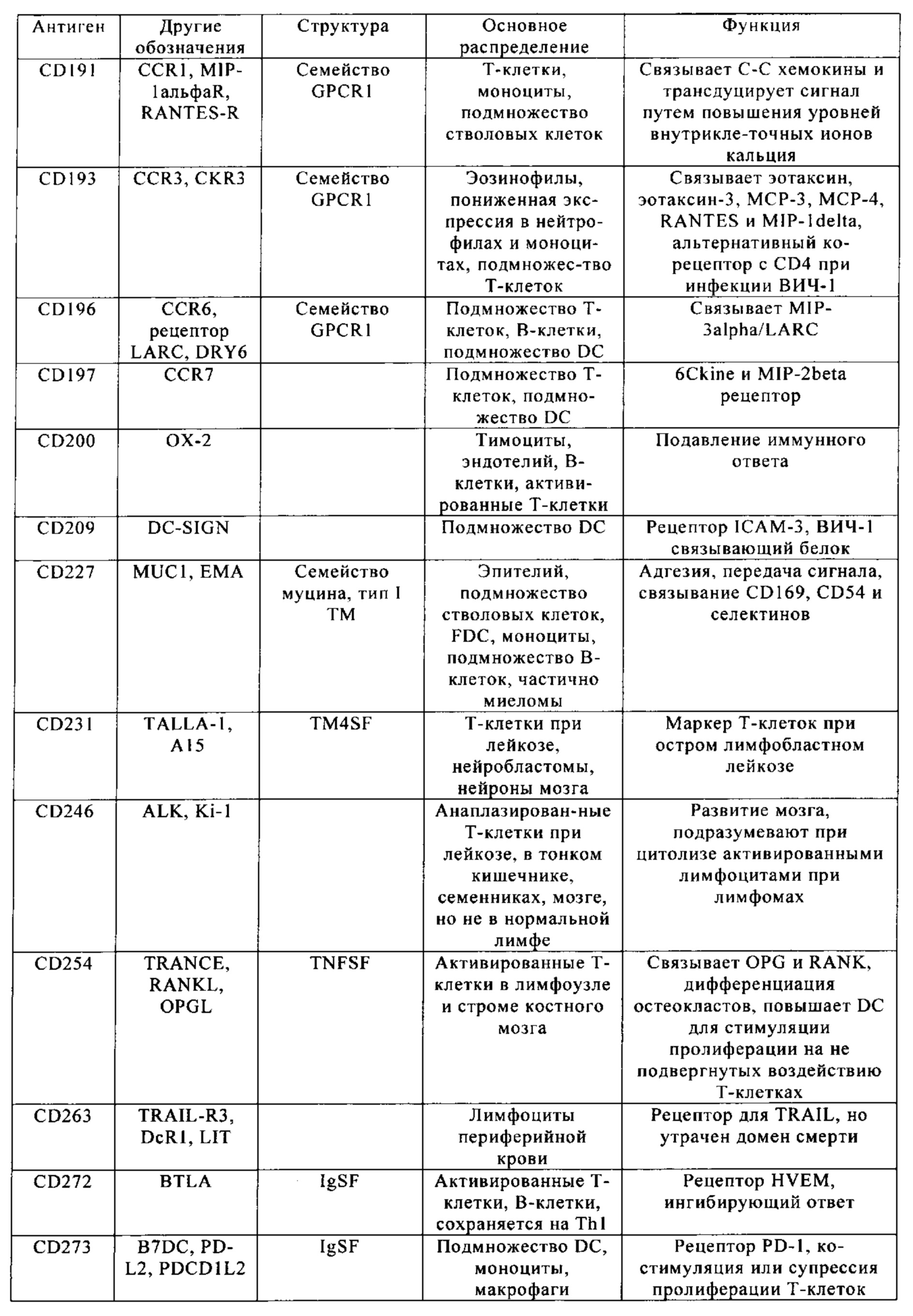



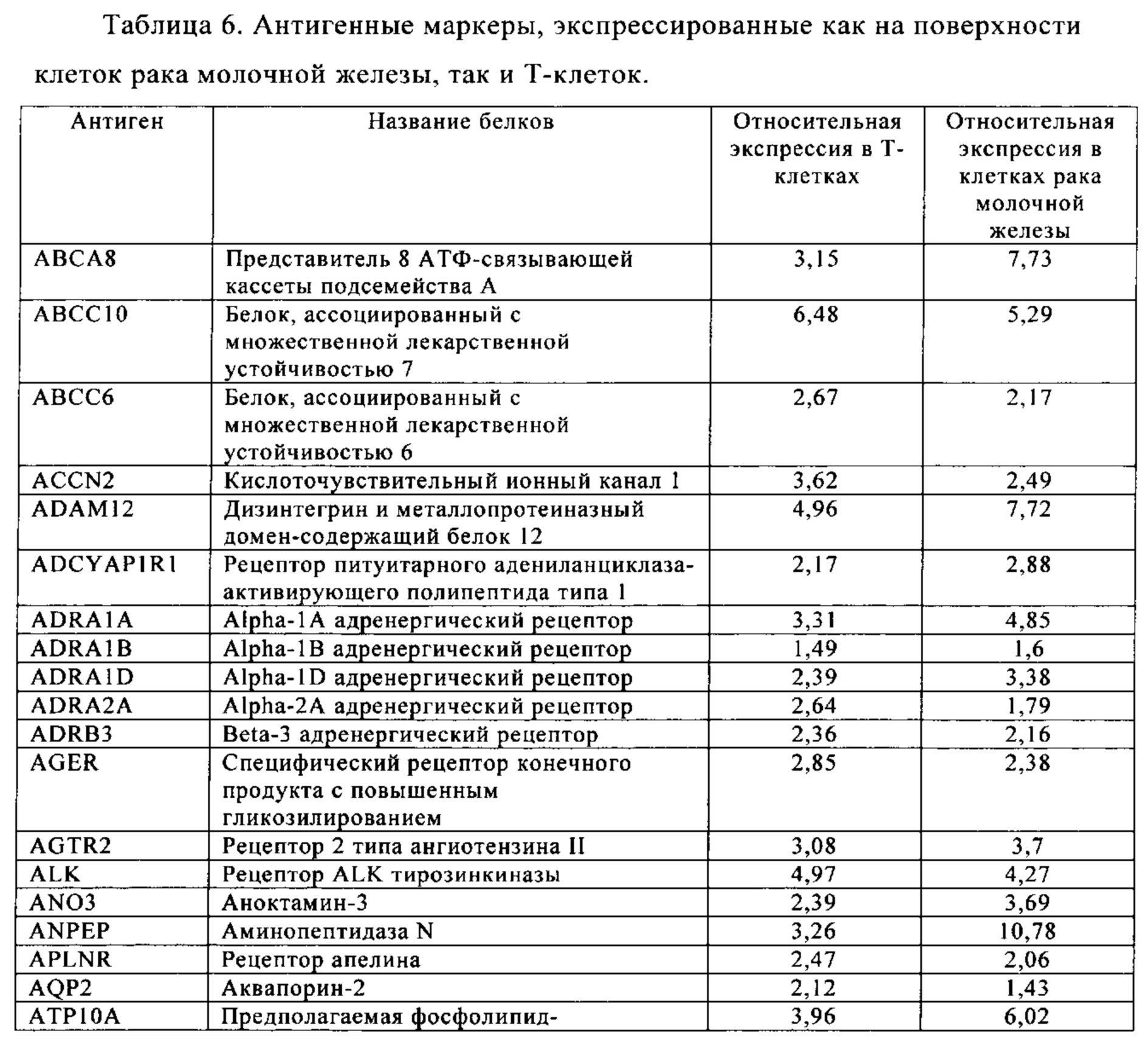


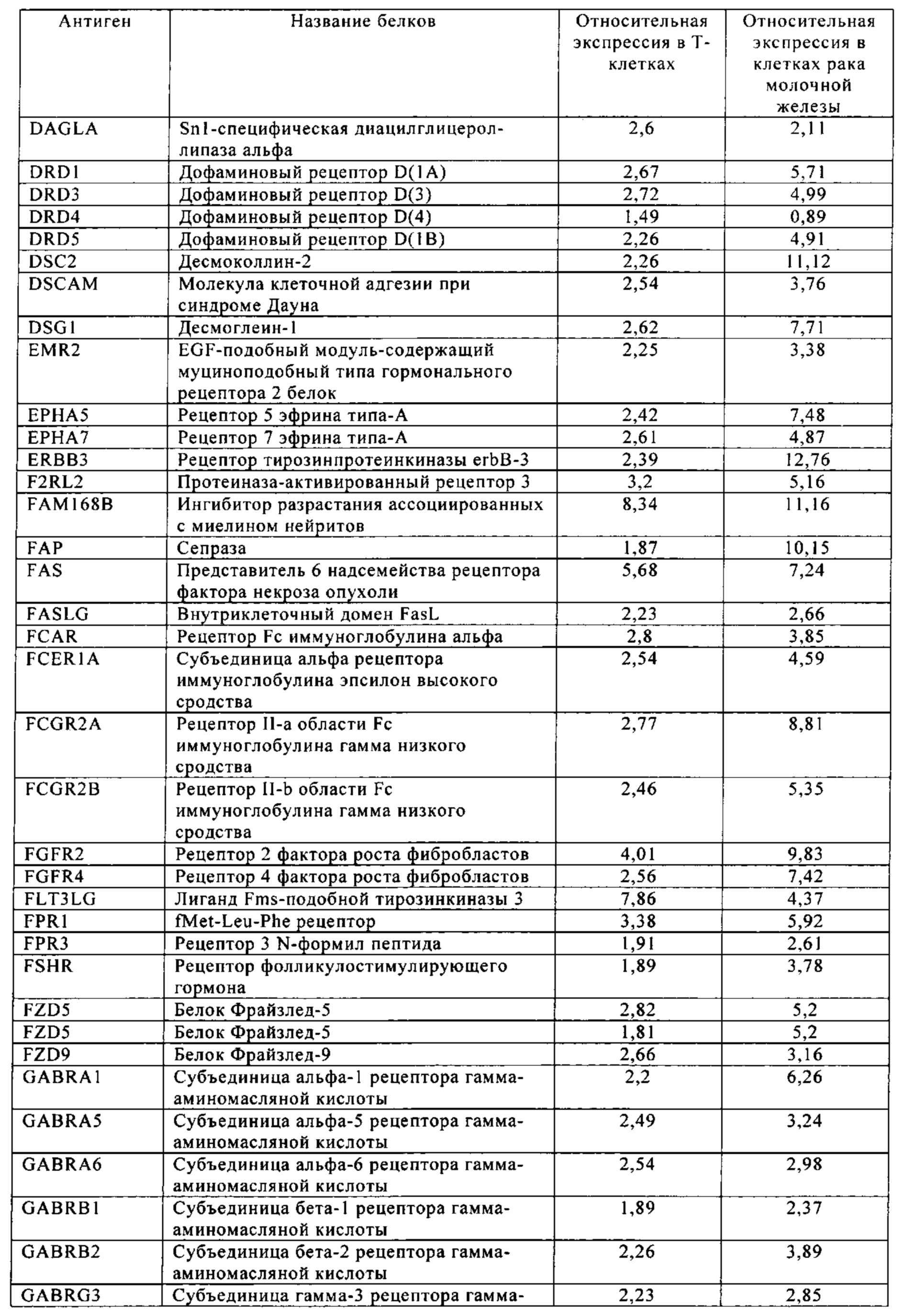

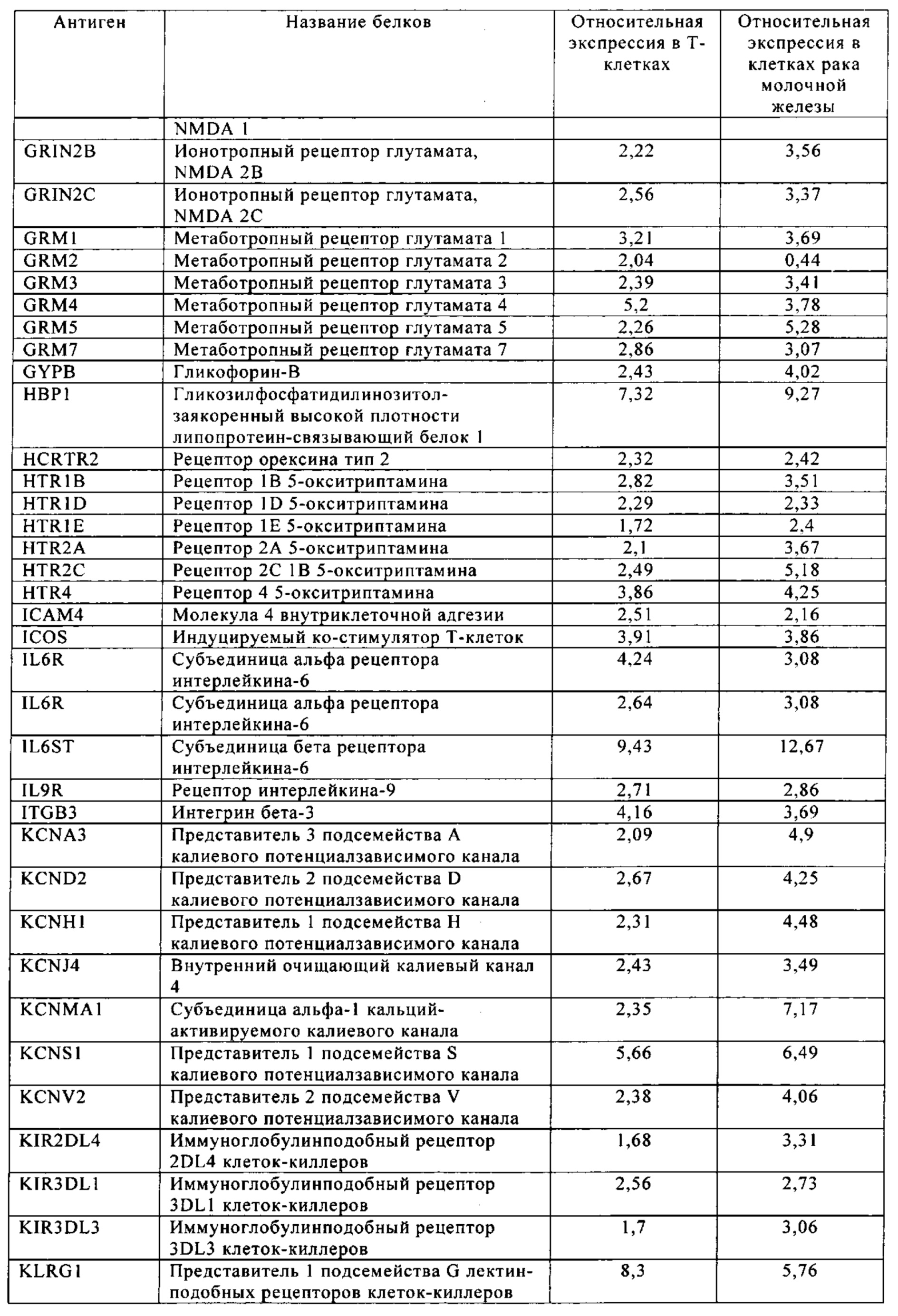

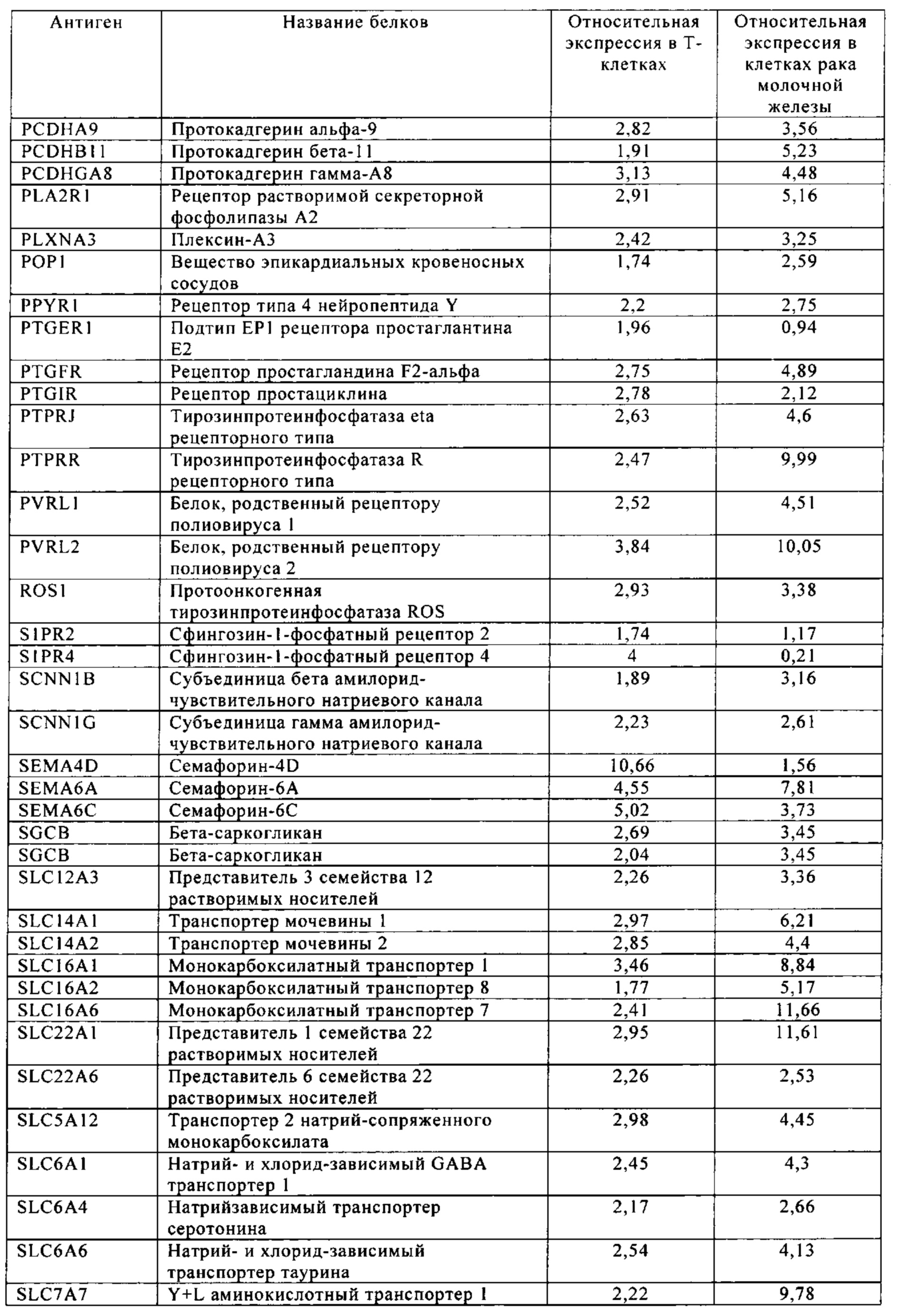
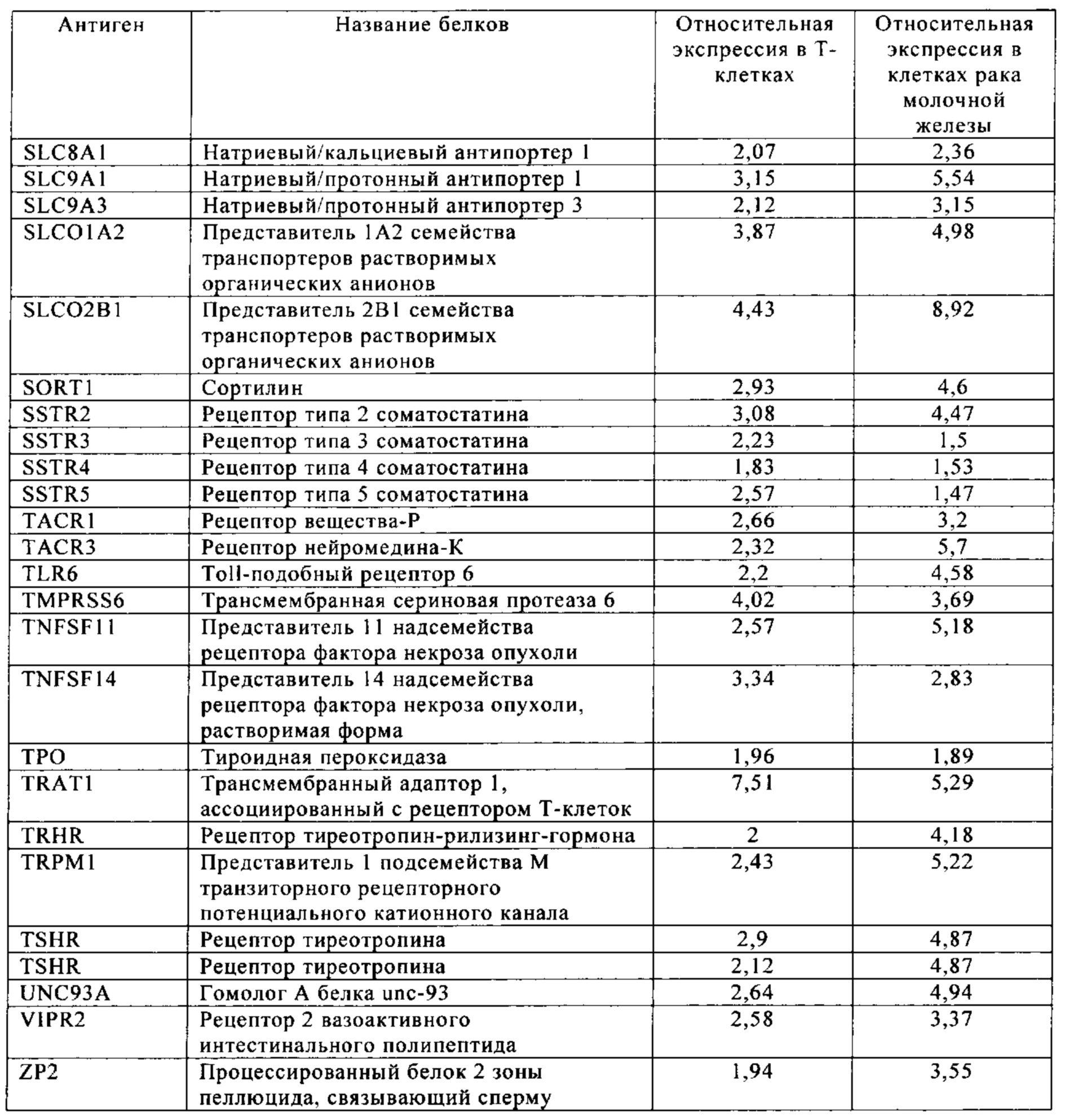


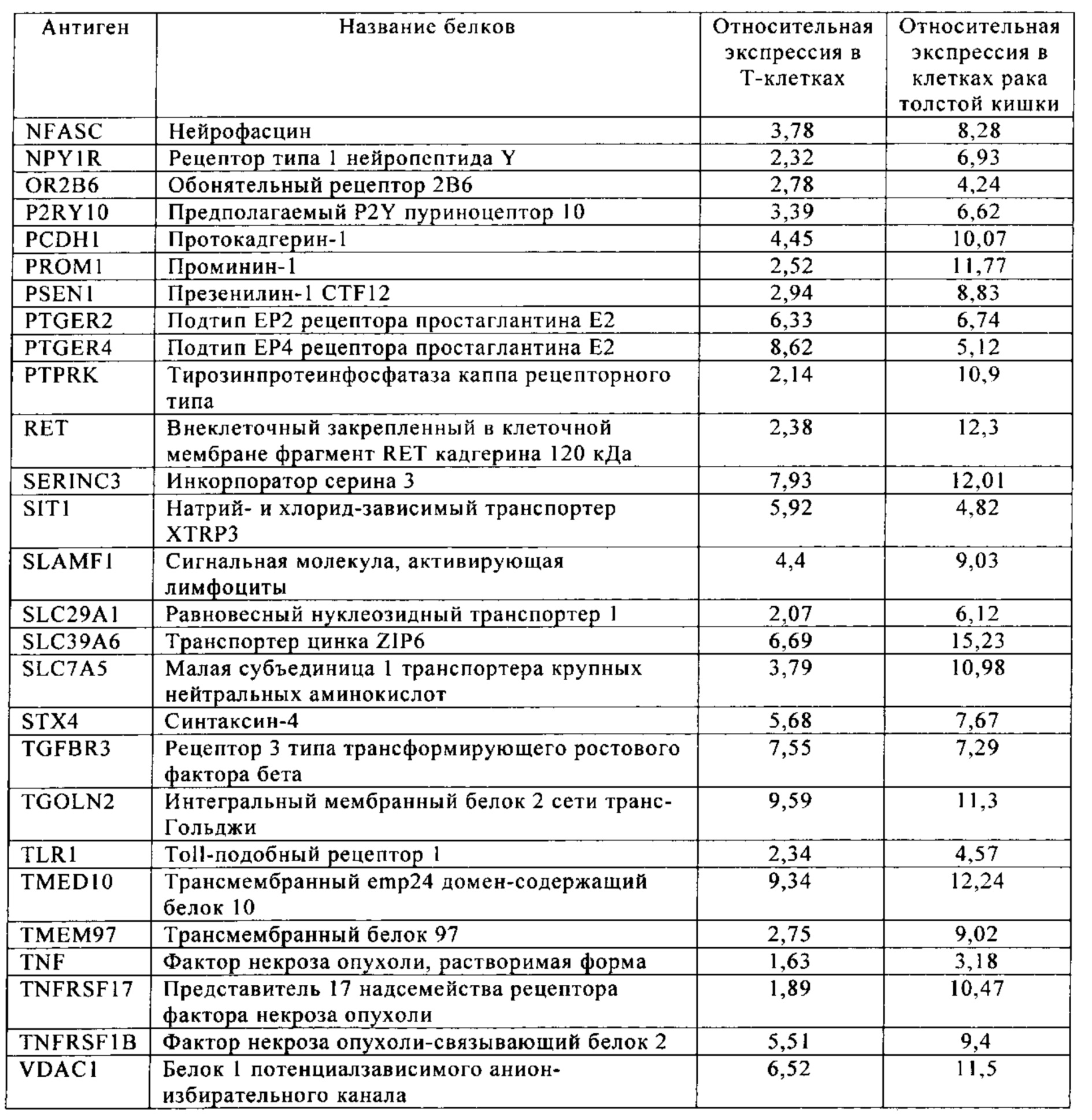




















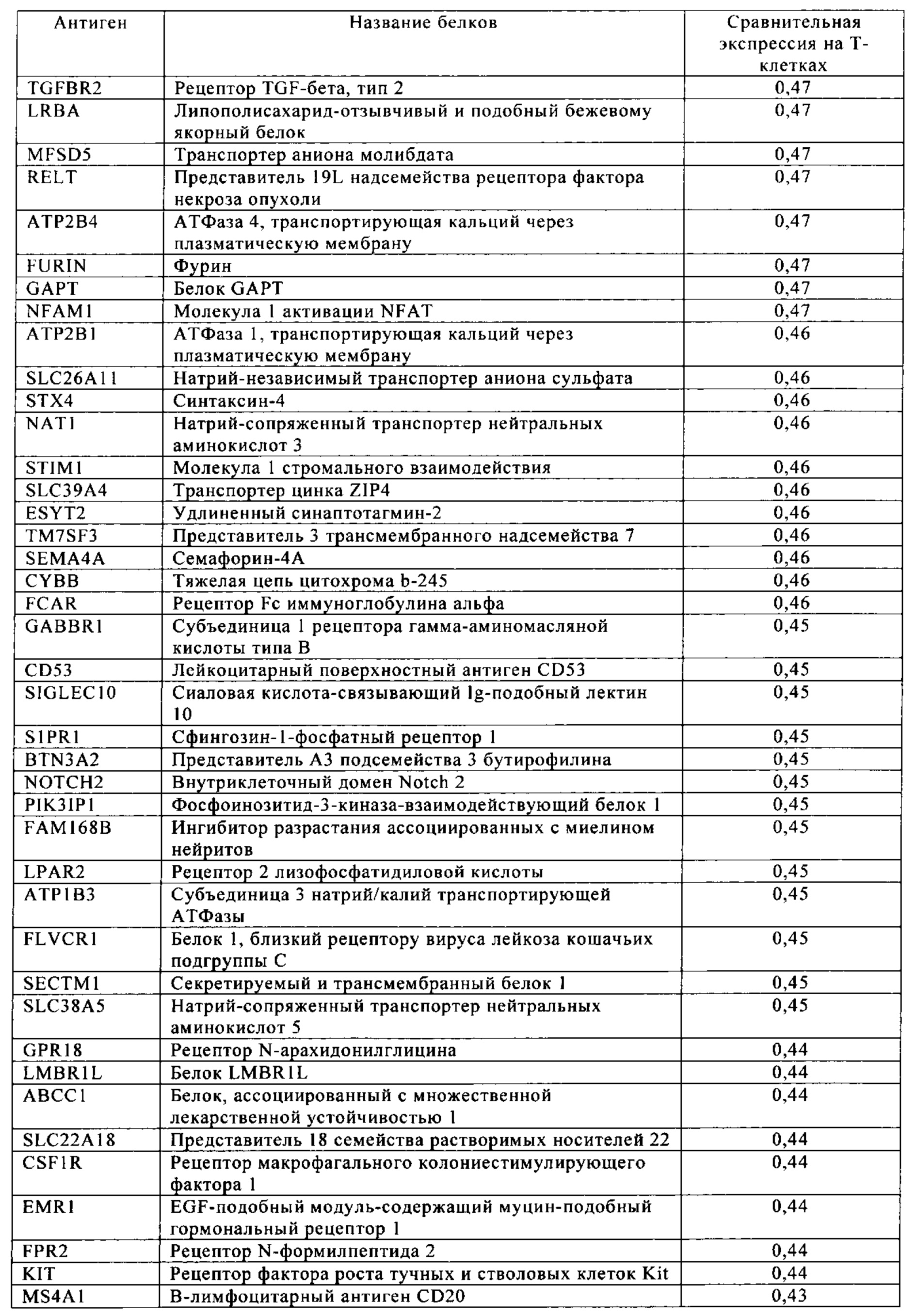






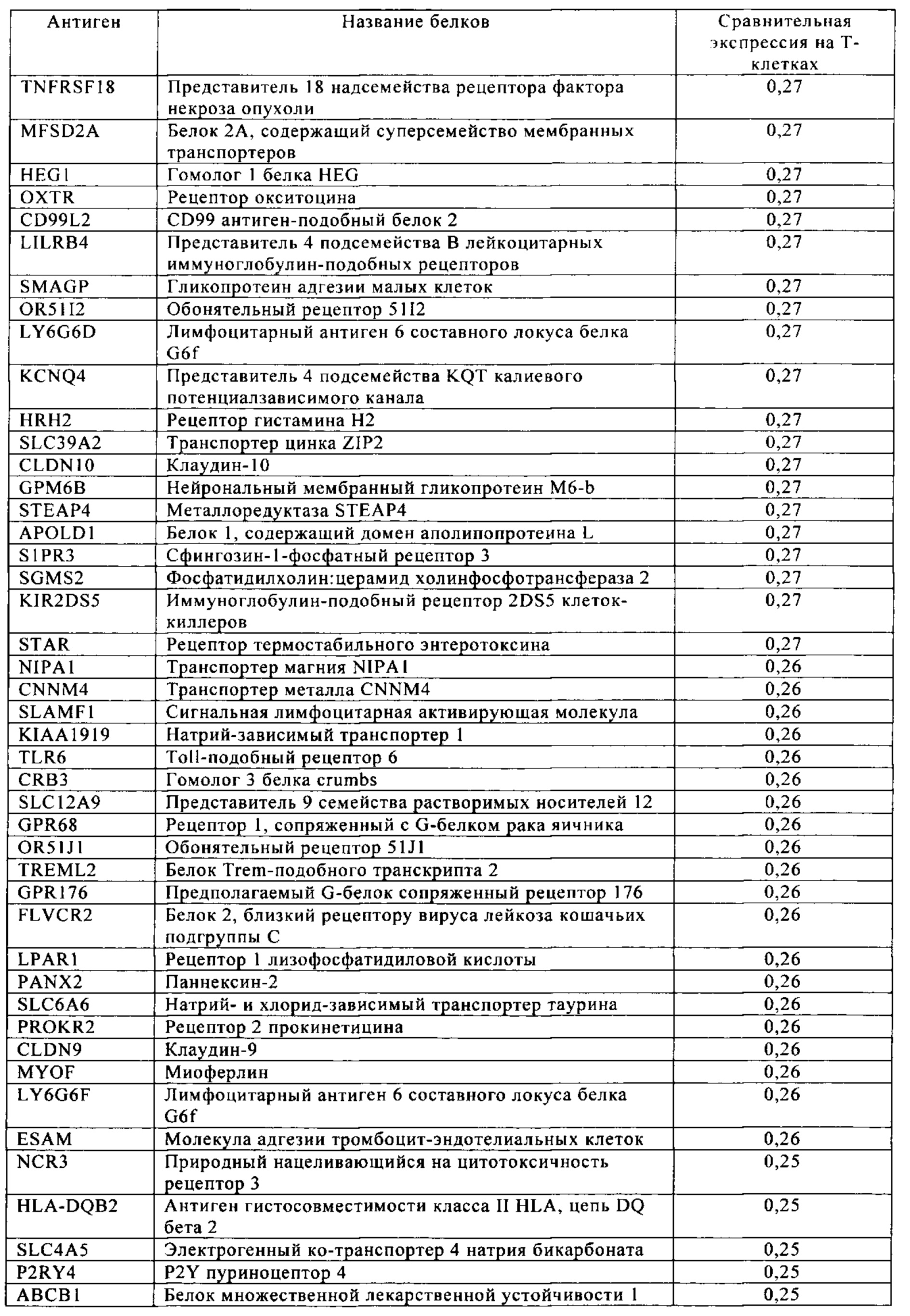




Пример 1. Нокаут (Knock out - КО) гена CD38 и экспрессия анти-CD38 CAR
Презентация мишени CD38 - гидролазы циклической АДФ-рибозы
CD38 является гликопротеином, обнаруженным на поверхности многих иммунных клеток, включая клетки множественной миеломы (multiple myeloma - ММ), которые экспрессируют на высоком уровне CD38 у значительного большинства пациентов. CD38 является обоснованной мишенью для ММ, поскольку многие исследования показывают эффективное уничтожение клеток MM CD38+ от пациентов и линий клеток MM CD38+ за счет использования анти-CD38 моноклональных антител посредством CDC и ADCC (Ellisc соавт., 1995). Даратумумаб является терапевтическим моноклональным антителом против CD38 человека, которое индуцирует уничтожение множественной миеломы и других гематологических опухолей (De Weers с соавт., 2011). В некоторых исследованиях установлено, что CD38 также экспрессируется на высоком уровне активированными Т-клетками (Sandoval-Montes с соавт., 2005).
Экспрессия CD38 Т-клетками
Экспрессию CD38 Т-клетками после гранул CD3/CD28 и стимуляции IL-2 исследуют методом FACS каждые 3-4 суток на протяжении 17 суток. Установлено, что более 90% Т-клеток осуществляют экспрессию в интервале 6-17 суток после активации (фиг. 10Б).
Таким образом, чтобы избежать уничтожения активированных Т-клеток анти-CD38 CAR+ Т-клетками следует предотвратить экспрессию на поверхности Т-клеток CD38. Этого можно достичь путем инактивации гена CD38 за счет применения TALE-нуклеаз. TALEN - торговая марка принадлежащей заявителю фирмы Cellectis (адрес: 8 rue de la Croix Jarry, 75013 PARIS), которая разрабатывает в соответствии с потребностями заказчиков формат TAL-нуклеаз.
Стратегия нокаута (knock-out КО) CD38
Была разработана и получена гетеродимерная TALE-нуклеаза, нацеленная на две последовательности длиной 17 п. о., разделенные спейсером из 13 п. о., в гене CD38. Каждая половина мишени распознается повторами половин TALE-нуклеаз, перечисленных в табл. 15 и показанных на фиг. 10А.
Повторяющейся последовательностью левой TALEN для мишени CD38ex1_T2 является NN-NI-NN-NN-NG-NN-NN-NN-NG-NG-NN-NN-HD-NN-NI-NG, а для правой TALEN - последовательность NN-NG-HD-HD-HD-HD-NN-HD-NI-NN-NG-NN-HD-HD-HD-NG.

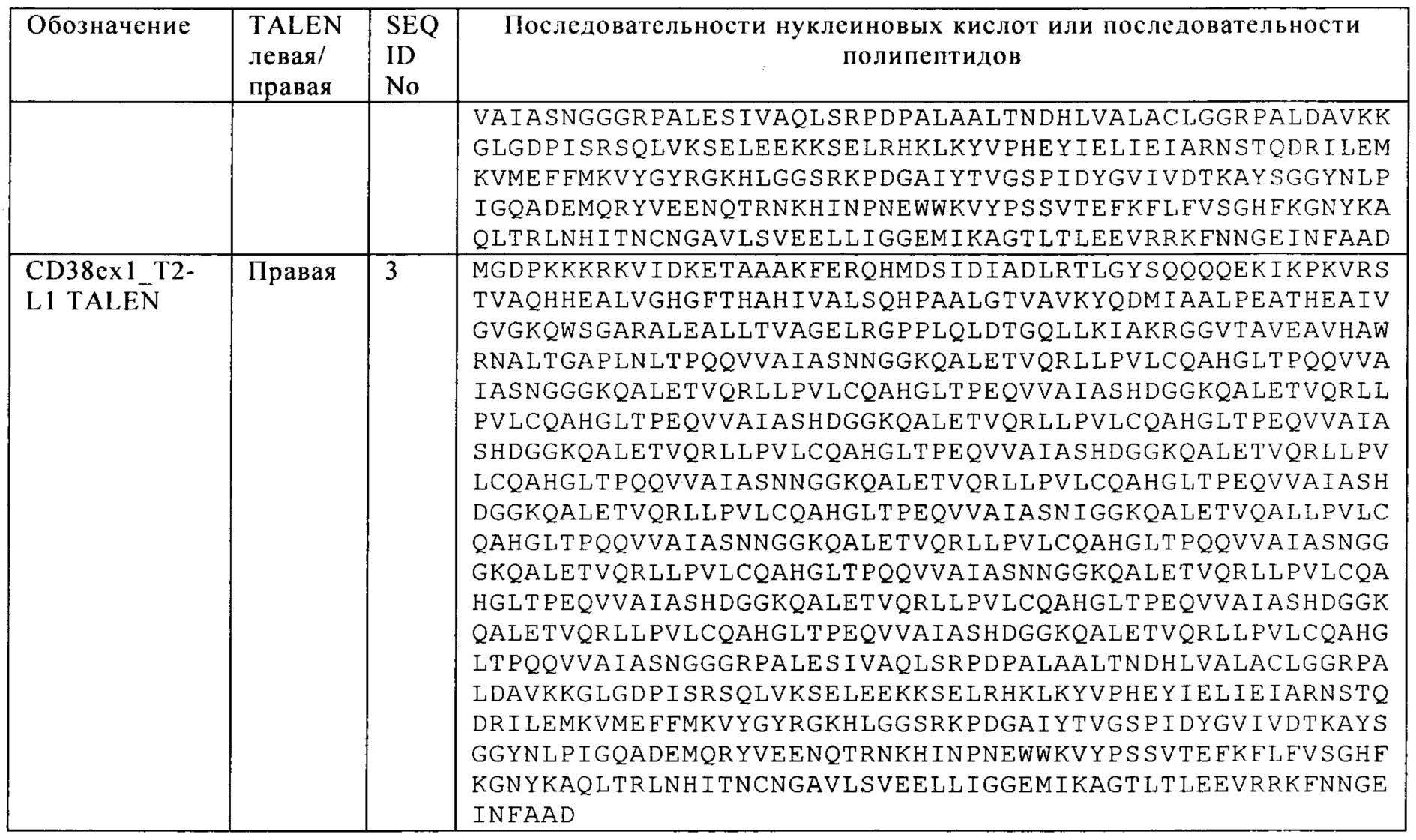
Каждую конструкцию TALE-нуклеазы субклонируют, используя расщепление ферментом рестрикции в векторе экспрессии млекопитающих под контролем промотора Т7. мРНК, кодирующую TALE-нуклеазу, расщепляющую CD38, синтезируют с плазмид, несущих кодирующую последовательность, расположенную ниже по цепи от промотора Т7.
Очищенные Т-клетки, активированные на протяжении 72 ч гранулами с покрытием CD3/CD28 и рекомбинантным IL-2, трансфецируют с помощью электропорации (Cytopulse) каждой из двух мРНК (по 10 мкг), кодирующих обе половины CD38ex1_T2 TALE-нуклеаз. Для исследования нокаута CD38, процент CD38-отрицательных Т-клеток оценивают методом жидкостной цитометрии на 3, 6, 10 и 13 сутки после трансфекции мРНК TALEN. Установлено, что 15% трансфецированных Т-клеток недостаточно по CD38 (фиг. 10В), и такая недостаточность сохраняется на протяжении 13 суток после трансфекции.
Дополнительно сконструируют две альтернативные TALE-нуклеазы, нацеливающиеся на ген CD38. Каждая половина мишени распознается повторами половинных TALE-нуклеаз, перечисленных ниже в табл. 16 и показанных на фиг. 10А. Повторяющимися последовательностями для левой TALEN для мишени CD38ex1_T4 является NG-NN-HD-NN-NI-NN-NG-NG-HD-NI-NN-HD-HD-HD-NN-NN-NG, а для правой TALEN - NG-NN-HD-NG-NN-HD-HD-NN-NN-HD-NG-HD-NG-HD-NG-NI.
Повторяющимися последовательностями для левой TALEN для мишени CD38ex1_T5 является NG-NN-NI-NG-HD-HD-NG-HD-NN-NG-HD-NN-NG-NN-NN-NG, а для правой TALEN -HD-NN-NI-NN-NN-NG-NN-NN-HD-NN-HD-HD-NI-NN-HD-NI.


Стратегия экспрессии CAR анти-CD38
Структура и состав CAR анти-CD38
В табл. 17 представлены цепи VH и VL scFv анти-CD38. SEQ ID NO: 10-11 соответствует гуманизированному анти-CD38 антителу даратумумаб (продукт Genmab), a SEQ ID NO: 12-13 соответствует MOR202 (или MOR03087) (см. US 8263746B).
SEQ ID NO: 14-20 и SEQ ID NO: 21-26 соответствуют последовательности CDR соответственно цепи VH (HCDR) и цепи VL (LCDR) (см. WO 2008/047242).


Для даратумумаба scFv были разработаны 3 разные конструкции CAR (GMB005-V1&V2&V3), например, представленные на фиг. 11А, и их последовательности показаны в приводимой ниже табл. 18. Все три конструкции состоят из одних и тех же компонентов, обозначенных сигнальным пептидом (CD8α), линкером GS (между цепями scFv VH и VL), трансмембранным доменом (ТМ), ко-стимулирующим доменом 4-1ВВ и доменом активации CD3ζ (последовательности представлены в приводимой ниже табл. 18). Их различия являются следствием выбора шарнирной области (табл. 18):
- V1: Шарнирная область FcRIIa
- V2: Шарнирная область Шарнирная область CD8a
- V3: Шарнирная область IgG1

Скрининг
CD38 TALEN могут быть трансфецированы на 4 сутки после активации. Через 3 суток недостаточные по CD38 клетки могут быть отсортированы путем отрицательного отбора и трансфецированы через 3 суток анти-CD38 CAR мРНК. Выработанные молекулы CAR затем могут быть подвержены скринингу на выявление экспрессии и активности по дегрануляции в отношении экспрессии CD38 линиями целевых клеток посредством кратковременной трансфекции мРНК CAR. Линии целевых клеток, экспрессирующих разные уровни CD38 (фиг. 11Б), могут применять для тестирования активности:
- U266 CD38+ и U266 CD38 получают магнитным разделением, используя анти-CD38 микрогранулы
- L363, линия клеток множественной миеломы, экспрессирующих промежуточные уровни CD38
- Клетки Дауди, линия клеток, производных от лимфомы Беркитта, которая экспрессирует высокие уровни CD38
- К562, линия CD38 отрицательных клеток, производных от хронического миелогенного лейкоза.
За первым скринингом следует вторая стадия скрининга, на которой может быть протестирован ряд выбранных соединений-кандидатов на способность индуцировать дегрануляцию, высвобождение IFNγ и специфическую цитотоксическую активность в отношении выбранных линий клеток-мишеней. Отбор кандидатов будет сужаться и некоторые кандидаты, отобранные для выработки на векторах лентивируса, и активность CAR будут оценивать в CD38 КО Т-клетках, стабильно экспрессирующих CAR.
Пример 2. Активация анти-CSl CAR в контексте CS1 КО
Презентация мишени CS1
Множественная миелома (ММ) является злокачественным заболеванием с поражением В-клеток, отличающимся аберрантной клональной экспансией плазматических клеток (plasma cells - PC) в костный мозг. В США в 2012 году зарегистрировано 21700 новых случаев заболевания и 10710 смертей от ММ (Siegel с соавт., 2012). В 2013 году в США ожидают 22350 вновь выявленных больных с диагнозом ММ и 10710 смертей от ММ, что составляет 20% смертей от всех злокачественных заболеваний крови. Несмотря на применение ингибиторов протеасом и иммуномодулирующих лекарственных средств, которые улучшили показатель общей выживаемости (Palumbo с соавт., 2009), ММ остается неизлечимым злокачественным заболеванием (Podar с соавт., 2009), для которого безотлагательно необходимы новые терапевтические подходы.
Гликопротеин CS1 на поверхности клетки (также обозначаемый в литературе SLAMF7, CD319 или CRACC - NCBI контрольная последовательность: NP_067004.3) экспрессируется на высоком уровне и повсеместно на поверхности клеток миеломы (Hsi с соавт., 2008). CS1 экспрессируется на очень низком уровне у большинства иммунных эффекторных клеток, включая природные клетки-киллеры (natural killer - NK), некоторые подмножества Т-клеток и нормальных В-клеток, и почти не выявляется на миелоидных клетках (Hsi с соавт., 2008). То есть, кроветворные стволовые клетки человека экспрессируют CS1 в ничтожно малом количестве (Hsi с соавт., 2008), что может быть использовано для трансплантации стволовых клеток для лечения злокачественных заболеваний крови, в том числе ММ. Функции CS1 в случае ММ по-прежнему не полностью понятны, но было подтверждено, что CS1 участвует в адгезии клеток миеломы, клональном росте и канцерогенности (Benson с соавт., 2012; Tai с соавт., 2009).
Структура CAR анти-CS1
Те же структуры, V1, V2 и V3, конструируют согласно описанному в примере 1 для анти-CD38 антигенной мишени одноцепочечного CAR, с теми же обозначениями, а именно шарнир, трансмембранный домен, ко-активация и домены трансдукции (например, представленными на фиг. 11А и последовательностями, показанными в табл. 18).
В табл. 19 представлены цепи VH и VL scFv анти-CS1. SEQ ID NO: 38-40-42-44-46 и SEQ ID NO: 39-41-43-45-47 соответствуют цепи VH и цепи VL мышиного scFv Luc63, Luc90, Luc34, LucX1 и LucX2.
В табл. 20 представлены анти-CS1 CAR с указанным выше scFv; эти CAR основаны на версиях V1, V2 и V3, показанных на фиг. 11А, в которых соответственно применяют короткую шарнирную область FcERγ, среднюю шарнирную область CD8α и длинную шарнирную область IgG1. Подчеркнутые участки соответствуют scFv VH и VL цепям, связанным линкером.

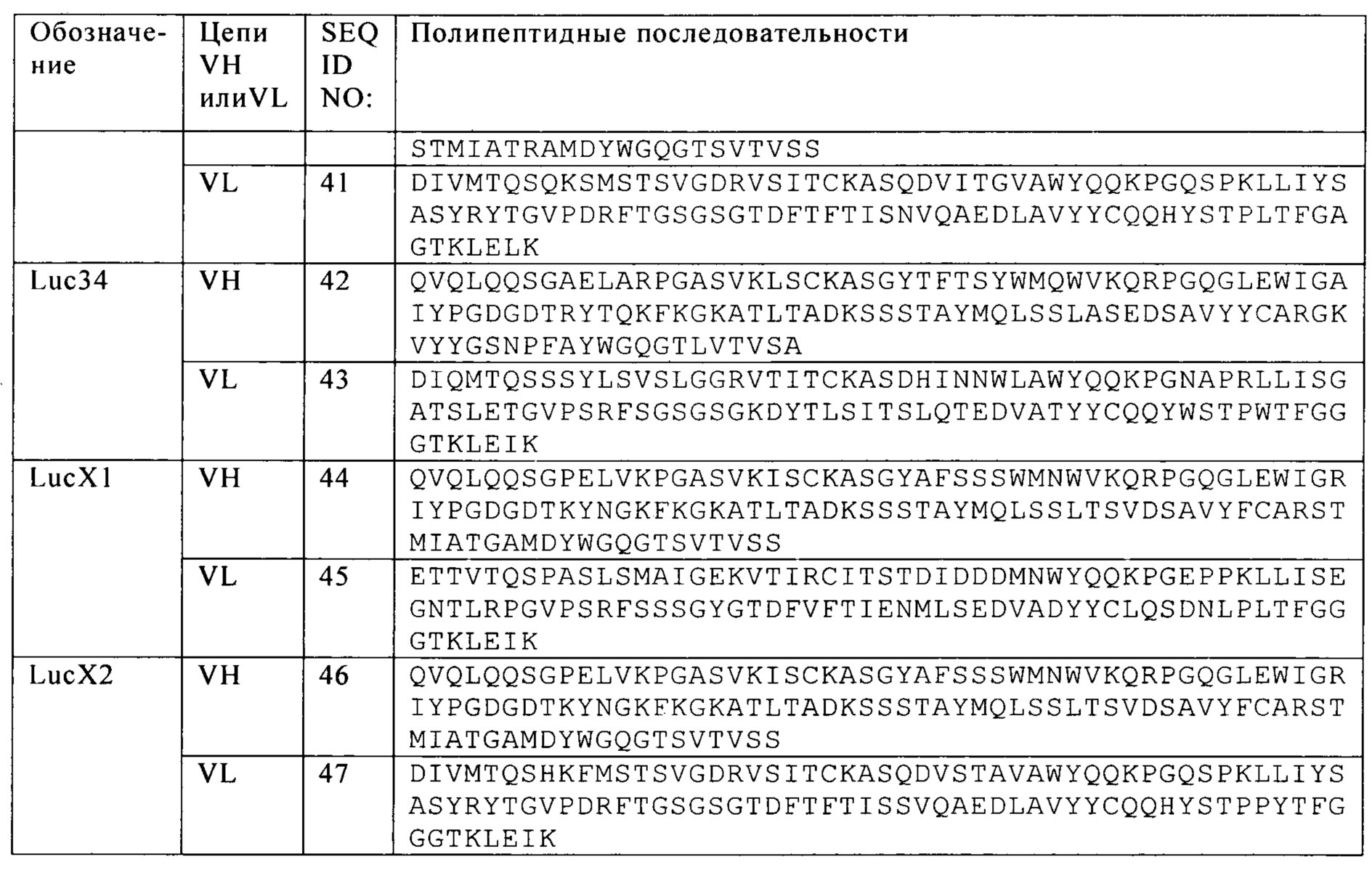



Стратегия конструирования CAR CS1+ и КО CS1
Экспрессия CS1 происходит на высоких уровнях в плазмоцитах от пациентов с множественной миеломой, что делает их интересной мишенью для развития CAR. Т-клетки, особенно подмножество CD8, экспрессируют на низких уровнях CS1, что является препятствием для развития CAR Т-клеток, поскольку они могут быть уничтожены при экспрессии анти-CS1 CAR.
В этом примере оценивают активность Luc90-v2 CAR (последовательность показана в табл. 20) в Т-клетках человека, которые были трансфецированы или ложно трансфецированы, или TALEN, нацеленной на ген CS1 (SLAMF7), чтобы выяснить, повышается ли активность CAR, если ген CS1 прерывается в Т-клетках CAR+. Схема эксперимента показана на фиг. 12.
Т-клетки очищают от образцов лейкоцитарной пленки и активируют, используя гранулы с покрытием CD3/CD28. Клетки одновременно трансфецируют через 72 ч после активирования 10 мкг мРНК, кодирующей_левый TAL и 10 мкг мРНК, кодирующей Т01_правый TAL. Последовательности TAL показаны в приводимой ниже табл. 21, а плазмидные конструкции (Т01, Т02 и Т03) с повторами TAL показаны на фиг. 13.
Фиг. 14 показывает локализацию мишени для TAL Т01, Т02 и Т03 в гене CS1 (SLAMF7): Т01 и Т02 нацеливаются на экзон 1 (фиг. 14А), а Т03 нацеливается на экзон 2 (фиг. 14Б).

Через 3 суток после трансфекции TALEn клетки трансдуцируют рекомбинантным лентивирусным вектором, запускающим экспрессию L90-v2 CAR на удалении от промотора EF1a. Вектор лентивируса сконструирован таким образом, что экспрессия CAR сопряжена с экспрессией BFP (синего флуоресцирующего белка - Blue Fluorescent Protein) через рибосомальный скип-пептид. L90-v2 CAR состоит из внутриклеточного связывающего домена, распознающего мишень CS1 (scFv L90), за которым следуют шарнирная и трансмембранная области, производные от белка hCD8α. Внутриклеточная часть молекулы содержит 41ВВ-производный ко-стимулирующий домен, за которым расположен сигнальный домен CD3γ (последовательности, представленные выше в табл. 18-20 для отдельных компонентов, последовательностей scFv и CAR, соответственно).
Эффективность трансдукции оценивают через 6 суток после трансдукции методом жидкостной цитометрии, сопровождаемой экспрессией BFP. Клетки также окрашивают анти-CDS и анти-CS1 антителами.
Результаты
Экспрессия CAR CS1+
Результаты на фиг. 16 показывают, что эффективность трансдукции выше в ложно трансфецированных клетках по сравнению с клетками, трансфецированными TALEn, нацеленную на ген CS1. Это предположительно происходит из-за специфического уничтожения нетрансдуцированных CS1-экспрессирующих Т-клеток, несмотря на то, что клетки больше не экспрессируют CS1 из-за вызванного TALEN разрушения гена.
Не наблюдают существенных отличий в уровнях CS1 во время трансфекции TALEN или ложно трансфецированных клеток (отрицательный контроль - трансфекция без плазмиды), поскольку уровни CS1 снижаются после первоначальной активации Т-клеток. С другой стороны, существенное снижение процента клеток CD8+ наблюдают в ложно трансфецированных экспрессирующих CAR клетках по сравнению с трансфецированными TALEN CAR+ клетками, указывая, что высокую долю клеток CD8+ элиминируют Т-клетками CAR+.
Оценка цитотоксической активности
Цитотоксическую активность таких клеток оценивают на 8 сутки после трансдукции CAR путем совместного культивирования такого же количества Т-клеток или с линией клеток, экспрессирующей CS1 (клетки L363), или с линией клеток отрицательного контроля, утратившей экспрессию CS1 (MOLM13). Жизнеспособность линий клеток-мишеней определяют методом жидкостной цитометрии через 4 ч после начала совместного культивирования клеток. Результаты, представленные на фиг. 15А, показывают пониженную жизнеспособность клеток CS1(+) при совместном культивировании с Т-клетками CAR+, хотя не наблюдают воздействия на жизнеспособность клеток CS1(-). Специфический лизис клеток, рассчитанный по данным жидкостной цитометрии, в 2 раза выше лизиса Т-клеток, трансфецированных TALEn, которая нацеливается на ген CS1 до трансдукции CAR (фиг. 15Б). Следует учитывать, что воздействие может быть даже выше, поскольку количество Т-клеток CAR+, присутствующих в совместных культурах, выше, когда клетки были фиктивно трансфецированы (см. данные жидкостной цитометрии на фиг. 16). Результаты эксперимента следующие:
- для образца Mock/NTD процент клеток BFP+ составляет 0,1% и количество клеток CD8+ составляет 53,9%;
- для образца TALEn/NTD процент клеток BFP+ составляет 0,2% и количество клеток CD8+ составляет 49,5%;
- для образца Mock /L90-2 процент клеток BFP+ составляет 94% и количество клеток CD8+ составляет 1,8%;
- для образца TALEn /L90-2 процент клеток BFP+составляет 61% и количество клеток CD8+ составляет 8,3%.
Эффективность трансдукции выше в ложно трансфецированных клетках, чем в клетках, трансфецированных TALEn, нацеливающихся на ген CS1 (без трансдукции - NTD: not transduced).
Реактивация после трансдукции
Для того чтобы подтвердить, что ген CS1 был разорван в клетках, трансфецированных TALEn, разные образцы были реактивированы гранулами CD3/CD28 на 11 сутки после трансдукции. Через 72 ч после реактивации клетки окрашивают анти-CD8 и анти-CS1 антителами и экспрессию исследуют с помощью жидкостной цитометрии.
На фиг. 17 показывают эффективность трансдукции и уровни экспрессии CD8/CS1 в каждом образце. На нижней панели показано, что повышение уровней CS1 при реактивации наблюдают в ложно трансфецированных клетках, хотя небольшое количество клеток способно экспрессировать CS1 в популяциях клеток, трансфецированных TALEn.
Из эксперимента получают следующие результаты:
- для образца Mock/NTD содержание клеток BFP+ составляет 0,01%, CS1 экспрессируют 65,2% клеток, количество клеток CD8+ составляет 80,7%;
- для образца TALEn/NTD содержание клеток BFP+ составляет 0,2%, CS1 экспрессируют 9,7% клеток, количество клеток CD8+ составляет 78,8%;
- для образца Mock /L90-2 содержание клеток BFP+ составляет 94%, CS1 экспрессируют 37,5% клеток, количество клеток CD8+ составляет 16%;
- для образца TALEn /L90-2 интенсивность BFP составляет 61%, экспрессия CS1 составляет 8,5% и экспрессия CD8 составляет 68,5%.
Повышение уровней CS1 при реактивации наблюдают в ложно трансфецированных клетках, хотя небольшое количество клеток способно экспрессировать CS1 в популяциях клеток, трансфецированных TALEn.
Вместе эти результаты показывают, что ген CS1 разрушен в Т-клетках, трансфецированных TALEn, и что при этом повышена цитотоксическая 1 активность анти-CS1 CAR+ клеток, преимущественно путем сохранения цитотоксических CD8+ Т-клеток.
Пример 3. Мишень CD70
Презентация мишени CD70
CD70 является цитокином, который связывается с CD27 и представляет часть семейства TNF (Goodwin с соавт., 1993). Этот белок участвует в адаптивных ответах Т-клеток, индуцирует пролиферацию Т-клеток после ко-стимуляции и повышает генерацию цитолитических Т-клеток. Его порядковый номер Р32970 (в базе Uniprot). В некоторых исследованиях (например, Schurch с соавт., 2012) установлено, что блокирование взаимодействий CD27-CD70 может помочь в лечении хронического миелогенного лейкоза (chronic myelogenous leukemia - CML).
Стратегия для CD70 КО
Стратегию КО гена CD70 осуществляют согласно описанному в примере 1 и в примере 2. Гетеродимерную TALE-нуклеазу, нацеливающуюся на две последовательности длиной 49 п. о., разделенные спейсером из 15 п. о. в гене CD70, и одну TALE-нуклеазу, нацеливающуюся на последовательность длиной 57 п. о., разделенную спейсером из 23 п. о., были разработаны и получены. Каждую половину мишени распознают повторы полу-TALE-нуклеаз, перечисленных в табл. 22.

Стратегия экспрессии анти-CD70 CAR
Для экспрессии CAR анти-CD70 могут применять ту же стратегию, что и в примерах 1 и 2.
Те же структуры, V1, V2 и V3, конструируют согласно описанному в примерах 1-2 с теми же обозначениями сигнального пептида, линкера между цепями VH и VL, трансмембранного домена, доменов ко-активации и трансдукции (общая структура показана на фиг. 11А; последовательности индивидуальных компонентов показаны в табл. 18). Три версии V1, V2 и V3 отличаются только шарнирной областью, в которых соответственно применяют короткий шарнир FcERγ, средний шарнир CD8α и длинный шарнир IgG1.
В табл. 23 представлены цепи VH и VL scFv анти-СР70. SEQ ID NO: 81-82, 85-86, 89-90 и SEQ ID NO: 83-84, 87-88, 91-92 соответствуют цепи VH и цепи VL scFv продуктов Ab4, Ab8 фирмы AMGEN и продукта 1F6 фирмы Seattle Genetics.
В табл. 24 представлены анти-CD70 CAR с указанным выше scFv; эти CAR основаны на версиях V1, V2 и V3 в соответствии с фиг. 11А, в которых применяют короткий шарнир FcEγ, средний шарнир CD8 и длинный шарнир IgG1, соответственно.






ЛИТЕРАТУРА
W. Bardenheuer и К. Lehmberg с соавт.Resistance to cytarabine and gemcitabine and in vitro selection of transduced cells after retroviral expression of cytidine deaminase in human hematopoietic progenitor cells. Leukemia, 19(12), 2005, cc. 2281-2288.
M.R. Betts и J.M. Brenchley с соавт.Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods, 281(1-2), 2003, cc. 65-78.
J. Boch и H. Scholze с соавт. Breaking the code of DNA binding specificity of TAL-type III effectors. Science, 326(5959), 2009, cc. 1509-1512.
J. Brewin и С.Mancao с соавт.Generation of EBV-specific cytotoxic T cells that are resistant to calcineurin inhibitors for the treatment of posttransplantation lymphoproliferative disease. Blood, 114(23), 2009, cc. 4792-803.
J.C. Cambier. Antigen and Fc Receptor Signaling:The Awesome Power of the lmmunoreceptor Tyrosine- I Based Activation Motif (ITAM). The Journal of Immunology, 155 (7), 1995, cc. 3281-3285.
L. Cong и F.A. Ran с соавт. Multiplex genome engineering using CRISPR/Cas systems. Science, 339(6121), 2013, cc. 819-823.
S.E. Critchlow, S.P. Jackson. DNA end-joining: from yeast to man. Trends Biochem Sci, 23(10), 1998, cc. 394-398.
J.Z. Dalgaard и A.J. Klar с соавт. Statistical modeling and analysis of the LAGLIDADG family of site-specific endonucleases and identification of an intein that encodes a site-specific endonuclease of the HNH family. Nucleic Acids Res, 25(22), 1997, cc. 4626-4638.
E. Deltcheva и К. Chylinski с соавт.CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature, 471(7340), 2011, cc. 602-607.
J.E. Garneau и M.E. Dupuis с соавт.The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature, 468(7320), 2010, cc. 67-71.
G. Gasiunas и R. Barrangou с соавт.(2012). Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proc Natl Acad Sci USA, 109(39), 2012, cc. E2579-2586.
К. Hacke и J.A. Treger с соавт. (2013). Genetic modification of mouse bone marrow by lentiviral vector-mediated delivery of hypoxanthine-Guanine phosphoribosyltransferase short hairpin RNA confers chemoprotection against 6-thioguanine cytotoxicity. Transplant Proc, 45(5), 2013, cc. 2040-2044.
B. Jena и G. Dotti с соавт.Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor. Blood, 116(7), 2010, cc. 1035-1044.
M. Jinek и К. Chylinski с соавт.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 337(6096), 2012, cc. 816-821.
M. Jonnalagadda и С.E. Brown с соавт.Engineering human T cells for resistance to methotrexate and mycophenolate mofetil as an in vivo cell selection strategy. PLoS One, 8(6), 2013, c. e65519.
M.E. Kushman и S.L. Kabler с соавт. Expression of human glutathione S-transferase P1 confers resistance to benzo[a]pyrene or benzo[a]pyrene-7,8-dihydrodiol mutagenesis, macromolecular alkylation and formation of stable N2-Gua-BPDE adducts in stably transfected V79MZ cells co-expressing hCYP1A1. Carcinogenesis, 28(1), 2007, cc. 207-214.
G. Lackner и N. Moebius с соавт. Complete genome sequence of Burkholderia rhizoxinica, an Endosymbiont of Rhizopus microsporus. J Bacteriol, 193(3), 2011, cc. 783-784.
J.L. Ma и E.M. Kim с соавт. Yeast Mrel 1 and Radl proteins define a Ku-independent mechanism to repair double-strand breaks lacking overlapping end sequences. Mol Cell Biol, 23(23), 2003, cc. 8820-8828.
A.N. Mak и P. Bradley с соавт. The crystal structure of TAL effector PthXol bound to its DNA target. Science, 335(6069), 2012, cc. 716-719.
P. Mali и L. Yang с соавт. RNA-guided human genome engineering via Cas9. Science, 339(6121), 2013, cc. 823-826.
H. Metzger с соавт. The Receptor with High Affinity for Immunoglobulin E. Annual Review of Immunology, 4, 1986, cc. 419-470.
M.J. Moscou и A.J. Bogdanove. A simple cipher governs DNA recognition by TAL effectors. Science, 326(5959), 2009, c. 1501.
M.C. Nivens и Т. Felder с соавт.Engineered resistance to camptothecin and antifolates by retroviral coexpression of tyrosyl DNA phosphodiesterase-I and thymidylate synthase. Cancer Chemother Pharmacol, 53(2), 2004, cc. 107-115.
T.S. Park и S.A. Rosenberg с соавт. Treating cancer with genetically engineered T cells. Trends Biotechnol, 29(11), 2011, cc. 550-557.
D. Sangiolo и M. Lesnikova с соавт. Lentiviral vector conferring resistance to mycophenolate mofetil and sensitivity to ganciclovir for in vivo T-cell selection. Gene Ther, 14(21), 2007, cc. 1549-1554.
В.I. Schweitzer и A.P. Dicker с соавт. Dihydrofolate reductase as a therapeutic target. Faseb J, 4(8), 1990, cc. 2441-2452.
Y. Sugimoto и S. Tsukahara с соавт. Drug-selected co-expression of P-гликопротеин and gp91 in vivo from an MDR1-bicistronic retrovirus vector Ha-MDR-IRES-gp91. J Gene Med, 5(5), 2003, cc. 366-376.
N. Takebe и S.C. Zhao с соавт. Generation of dual resistance to 4-hydroperoxycyclophosphamide and methotrexate by retroviral transfer of the human aldehyde dehydrogenase class 1 gene and a mutated dihydrofolate reductase gene. Mol Ther, 3(1), 2001, cc. 88-96.
H. Waldmann, G. Hale. CAMPATH: from concept to clinic. Phil. Trans. R. Soc., В 360, 2005, cc. 1707-1711.
P. Yam и M. Jensen с соавт. Ex vivo selection and expansion of cells based on expression of a mutated inosine monophosphate dehydrogenase 2 after HIV vector transduction: effects on lymphocytes, monocytes, and CD34+ stem cells. Mol Ther, 14(2), 2006, cc. 236-244.
S.P. Zielske и J.S. Reese с соавт. In vivo selection of MGMT(P140K) lentivirus-transduced human NOD/SCID repopulating cells without pretransplant irradiation conditioning. J Clin Invest, 112(10), 2003, cc. 1561-1570.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> СЕЛЛЕКТИС
<120> КЛЕТКИ ДЛЯ ИММУНОТЕРАПИИ, СКОНСТРУИРОВАННЫЕ ДЛЯ НАЦЕЛИВАНИЯ
НА АНТИГЕН, ПРИСУТСТВУЮЩИЙ ОДНОВРЕМЕННО НА ИММУННЫХ КЛЕТКАХ
И НА ПАТОЛОГИЧЕСКИХ КЛЕТКАХ
<130> P81400737PCT00
<150> PA201470076
<151> 2014-02-14
<160> 101
<170> PatentIn version 3.5
<210> 1
<211> 47
<212> ДНК
<213> homo sapiens
<220>
<223> CD38 мишень
<400> 1
tgaggtgggt tggcgactaa ggcgcaccgg tgggcactgc ggggaca 47
<210> 2
<211> 936
<212> БЕЛОК
<213> искусственная
<220>
<223> CD38ex1_T2-L1 TALEN
<400> 2
Met Gly Asp Pro Lys Lys Lys Arg Lys Val Ile Asp Tyr Pro Tyr Asp
1 5 10 15
Val Pro Asp Tyr Ala Ile Asp Ile Ala Asp Leu Arg Thr Leu Gly Tyr
20 25 30
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
35 40 45
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
50 55 60
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
65 70 75 80
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
85 90 95
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
100 105 110
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
115 120 125
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
130 135 140
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
145 150 155 160
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
165 170 175
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
180 185 190
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly
195 200 205
Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys
210 215 220
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
225 230 235 240
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
245 250 255
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
260 265 270
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
275 280 285
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
290 295 300
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
305 310 315 320
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
325 330 335
Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val
340 345 350
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
355 360 365
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
370 375 380
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
385 390 395 400
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
405 410 415
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
420 425 430
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
435 440 445
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
450 455 460
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
465 470 475 480
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
485 490 495
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
500 505 510
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
515 520 525
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
530 535 540
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
545 550 555 560
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
565 570 575
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
580 585 590
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
595 600 605
Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val
610 615 620
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
625 630 635 640
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
645 650 655
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
660 665 670
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
675 680 685
Leu Glu Ser Ile Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala
690 695 700
Ala Leu Thr Asn Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg
705 710 715 720
Pro Ala Leu Asp Ala Val Lys Lys Gly Leu Gly Asp Pro Ile Ser Arg
725 730 735
Ser Gln Leu Val Lys Ser Glu Leu Glu Glu Lys Lys Ser Glu Leu Arg
740 745 750
His Lys Leu Lys Tyr Val Pro His Glu Tyr Ile Glu Leu Ile Glu Ile
755 760 765
Ala Arg Asn Ser Thr Gln Asp Arg Ile Leu Glu Met Lys Val Met Glu
770 775 780
Phe Phe Met Lys Val Tyr Gly Tyr Arg Gly Lys His Leu Gly Gly Ser
785 790 795 800
Arg Lys Pro Asp Gly Ala Ile Tyr Thr Val Gly Ser Pro Ile Asp Tyr
805 810 815
Gly Val Ile Val Asp Thr Lys Ala Tyr Ser Gly Gly Tyr Asn Leu Pro
820 825 830
Ile Gly Gln Ala Asp Glu Met Gln Arg Tyr Val Glu Glu Asn Gln Thr
835 840 845
Arg Asn Lys His Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr Pro Ser
850 855 860
Ser Val Thr Glu Phe Lys Phe Leu Phe Val Ser Gly His Phe Lys Gly
865 870 875 880
Asn Tyr Lys Ala Gln Leu Thr Arg Leu Asn His Ile Thr Asn Cys Asn
885 890 895
Gly Ala Val Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu Met Ile
900 905 910
Lys Ala Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe Asn Asn
915 920 925
Gly Glu Ile Asn Phe Ala Ala Asp
930 935
<210> 3
<211> 942
<212> БЕЛОК
<213> искусственная
<220>
<223> CD38ex1_T2-R1 TALEN
<400> 3
Met Gly Asp Pro Lys Lys Lys Arg Lys Val Ile Asp Lys Glu Thr Ala
1 5 10 15
Ala Ala Lys Phe Glu Arg Gln His Met Asp Ser Ile Asp Ile Ala Asp
20 25 30
Leu Arg Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro
35 40 45
Lys Val Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His
50 55 60
Gly Phe Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala
65 70 75 80
Leu Gly Thr Val Ala Val Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro
85 90 95
Glu Ala Thr His Glu Ala Ile Val Gly Val Gly Lys Gln Trp Ser Gly
100 105 110
Ala Arg Ala Leu Glu Ala Leu Leu Thr Val Ala Gly Glu Leu Arg Gly
115 120 125
Pro Pro Leu Gln Leu Asp Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg
130 135 140
Gly Gly Val Thr Ala Val Glu Ala Val His Ala Trp Arg Asn Ala Leu
145 150 155 160
Thr Gly Ala Pro Leu Asn Leu Thr Pro Gln Gln Val Val Ala Ile Ala
165 170 175
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
180 185 190
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
195 200 205
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
210 215 220
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
225 230 235 240
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
245 250 255
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
260 265 270
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
275 280 285
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
290 295 300
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
305 310 315 320
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
325 330 335
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
340 345 350
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
355 360 365
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
370 375 380
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
385 390 395 400
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
405 410 415
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
420 425 430
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
435 440 445
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
450 455 460
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
465 470 475 480
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
485 490 495
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
500 505 510
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
515 520 525
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
530 535 540
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
545 550 555 560
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
565 570 575
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
580 585 590
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
595 600 605
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
610 615 620
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
625 630 635 640
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
645 650 655
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
660 665 670
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
675 680 685
Gly Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala Gln Leu Ser Arg
690 695 700
Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His Leu Val Ala Leu
705 710 715 720
Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val Lys Lys Gly Leu
725 730 735
Gly Asp Pro Ile Ser Arg Ser Gln Leu Val Lys Ser Glu Leu Glu Glu
740 745 750
Lys Lys Ser Glu Leu Arg His Lys Leu Lys Tyr Val Pro His Glu Tyr
755 760 765
Ile Glu Leu Ile Glu Ile Ala Arg Asn Ser Thr Gln Asp Arg Ile Leu
770 775 780
Glu Met Lys Val Met Glu Phe Phe Met Lys Val Tyr Gly Tyr Arg Gly
785 790 795 800
Lys His Leu Gly Gly Ser Arg Lys Pro Asp Gly Ala Ile Tyr Thr Val
805 810 815
Gly Ser Pro Ile Asp Tyr Gly Val Ile Val Asp Thr Lys Ala Tyr Ser
820 825 830
Gly Gly Tyr Asn Leu Pro Ile Gly Gln Ala Asp Glu Met Gln Arg Tyr
835 840 845
Val Glu Glu Asn Gln Thr Arg Asn Lys His Ile Asn Pro Asn Glu Trp
850 855 860
Trp Lys Val Tyr Pro Ser Ser Val Thr Glu Phe Lys Phe Leu Phe Val
865 870 875 880
Ser Gly His Phe Lys Gly Asn Tyr Lys Ala Gln Leu Thr Arg Leu Asn
885 890 895
His Ile Thr Asn Cys Asn Gly Ala Val Leu Ser Val Glu Glu Leu Leu
900 905 910
Ile Gly Gly Glu Met Ile Lys Ala Gly Thr Leu Thr Leu Glu Glu Val
915 920 925
Arg Arg Lys Phe Asn Asn Gly Glu Ile Asn Phe Ala Ala Asp
930 935 940
<210> 4
<211> 49
<212> БЕЛОК
<213> homo sapiens
<220>
<223> CD38ex1_T4 мишень
<400> 4
Thr Gly Cys Gly Ala Gly Thr Thr Cys Ala Gly Cys Cys Cys Gly Gly
1 5 10 15
Thr Gly Thr Cys Cys Gly Gly Gly Gly Ala Cys Ala Ala Ala Cys Cys
20 25 30
Cys Thr Gly Cys Thr Gly Cys Cys Gly Gly Cys Thr Cys Thr Cys Thr
35 40 45
Ala
<210> 5
<211> 970
<212> БЕЛОК
<213> искусственная
<220>
<223> CD38ex1_T4-L TALEN
<400> 5
Met Gly Asp Pro Lys Lys Lys Arg Lys Val Ile Asp Tyr Pro Tyr Asp
1 5 10 15
Val Pro Asp Tyr Ala Ile Asp Ile Ala Asp Leu Arg Thr Leu Gly Tyr
20 25 30
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
35 40 45
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
50 55 60
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
65 70 75 80
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
85 90 95
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
100 105 110
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
115 120 125
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
130 135 140
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
145 150 155 160
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
165 170 175
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
180 185 190
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Asn Gly
195 200 205
Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys
210 215 220
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser His
225 230 235 240
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
245 250 255
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
260 265 270
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
275 280 285
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
290 295 300
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
305 310 315 320
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
325 330 335
Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val
340 345 350
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
355 360 365
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
370 375 380
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
385 390 395 400
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
405 410 415
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
420 425 430
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
435 440 445
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
450 455 460
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Ile Gly
465 470 475 480
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
485 490 495
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
500 505 510
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
515 520 525
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
530 535 540
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
545 550 555 560
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
565 570 575
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
580 585 590
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
595 600 605
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
610 615 620
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
625 630 635 640
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
645 650 655
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
660 665 670
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
675 680 685
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
690 695 700
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg
705 710 715 720
Pro Ala Leu Glu Ser Ile Val Ala Gln Leu Ser Arg Pro Asp Pro Ala
725 730 735
Leu Ala Ala Leu Thr Asn Asp His Leu Val Ala Leu Ala Cys Leu Gly
740 745 750
Gly Arg Pro Ala Leu Asp Ala Val Lys Lys Gly Leu Gly Asp Pro Ile
755 760 765
Ser Arg Ser Gln Leu Val Lys Ser Glu Leu Glu Glu Lys Lys Ser Glu
770 775 780
Leu Arg His Lys Leu Lys Tyr Val Pro His Glu Tyr Ile Glu Leu Ile
785 790 795 800
Glu Ile Ala Arg Asn Ser Thr Gln Asp Arg Ile Leu Glu Met Lys Val
805 810 815
Met Glu Phe Phe Met Lys Val Tyr Gly Tyr Arg Gly Lys His Leu Gly
820 825 830
Gly Ser Arg Lys Pro Asp Gly Ala Ile Tyr Thr Val Gly Ser Pro Ile
835 840 845
Asp Tyr Gly Val Ile Val Asp Thr Lys Ala Tyr Ser Gly Gly Tyr Asn
850 855 860
Leu Pro Ile Gly Gln Ala Asp Glu Met Gln Arg Tyr Val Glu Glu Asn
865 870 875 880
Gln Thr Arg Asn Lys His Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr
885 890 895
Pro Ser Ser Val Thr Glu Phe Lys Phe Leu Phe Val Ser Gly His Phe
900 905 910
Lys Gly Asn Tyr Lys Ala Gln Leu Thr Arg Leu Asn His Ile Thr Asn
915 920 925
Cys Asn Gly Ala Val Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu
930 935 940
Met Ile Lys Ala Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe
945 950 955 960
Asn Asn Gly Glu Ile Asn Phe Ala Ala Asp
965 970
<210> 6
<211> 942
<212> БЕЛОК
<213> искусственная
<220>
<223> CD38ex1_T4-R TALEN
<400> 6
Met Gly Asp Pro Lys Lys Lys Arg Lys Val Ile Asp Lys Glu Thr Ala
1 5 10 15
Ala Ala Lys Phe Glu Arg Gln His Met Asp Ser Ile Asp Ile Ala Asp
20 25 30
Leu Arg Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro
35 40 45
Lys Val Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His
50 55 60
Gly Phe Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala
65 70 75 80
Leu Gly Thr Val Ala Val Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro
85 90 95
Glu Ala Thr His Glu Ala Ile Val Gly Val Gly Lys Gln Trp Ser Gly
100 105 110
Ala Arg Ala Leu Glu Ala Leu Leu Thr Val Ala Gly Glu Leu Arg Gly
115 120 125
Pro Pro Leu Gln Leu Asp Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg
130 135 140
Gly Gly Val Thr Ala Val Glu Ala Val His Ala Trp Arg Asn Ala Leu
145 150 155 160
Thr Gly Ala Pro Leu Asn Leu Thr Pro Gln Gln Val Val Ala Ile Ala
165 170 175
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
180 185 190
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
195 200 205
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
210 215 220
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
225 230 235 240
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
245 250 255
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
260 265 270
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
275 280 285
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
290 295 300
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
305 310 315 320
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
325 330 335
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
340 345 350
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
355 360 365
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser His Asp Gly
370 375 380
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
385 390 395 400
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
405 410 415
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
420 425 430
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
435 440 445
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
450 455 460
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
465 470 475 480
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
485 490 495
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
500 505 510
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
515 520 525
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
530 535 540
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
545 550 555 560
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
565 570 575
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
580 585 590
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
595 600 605
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
610 615 620
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
625 630 635 640
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Gly Gly
645 650 655
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
660 665 670
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
675 680 685
Ile Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala Gln Leu Ser Arg
690 695 700
Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His Leu Val Ala Leu
705 710 715 720
Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val Lys Lys Gly Leu
725 730 735
Gly Asp Pro Ile Ser Arg Ser Gln Leu Val Lys Ser Glu Leu Glu Glu
740 745 750
Lys Lys Ser Glu Leu Arg His Lys Leu Lys Tyr Val Pro His Glu Tyr
755 760 765
Ile Glu Leu Ile Glu Ile Ala Arg Asn Ser Thr Gln Asp Arg Ile Leu
770 775 780
Glu Met Lys Val Met Glu Phe Phe Met Lys Val Tyr Gly Tyr Arg Gly
785 790 795 800
Lys His Leu Gly Gly Ser Arg Lys Pro Asp Gly Ala Ile Tyr Thr Val
805 810 815
Gly Ser Pro Ile Asp Tyr Gly Val Ile Val Asp Thr Lys Ala Tyr Ser
820 825 830
Gly Gly Tyr Asn Leu Pro Ile Gly Gln Ala Asp Glu Met Gln Arg Tyr
835 840 845
Val Glu Glu Asn Gln Thr Arg Asn Lys His Ile Asn Pro Asn Glu Trp
850 855 860
Trp Lys Val Tyr Pro Ser Ser Val Thr Glu Phe Lys Phe Leu Phe Val
865 870 875 880
Ser Gly His Phe Lys Gly Asn Tyr Lys Ala Gln Leu Thr Arg Leu Asn
885 890 895
His Ile Thr Asn Cys Asn Gly Ala Val Leu Ser Val Glu Glu Leu Leu
900 905 910
Ile Gly Gly Glu Met Ile Lys Ala Gly Thr Leu Thr Leu Glu Glu Val
915 920 925
Arg Arg Lys Phe Asn Asn Gly Glu Ile Asn Phe Ala Ala Asp
930 935 940
<210> 7
<211> 49
<212> БЕЛОК
<213> homo sapiens
<220>
<223> CD38ex1_T5
<400> 7
Thr Gly Ala Thr Cys Cys Thr Cys Gly Thr Cys Gly Thr Gly Gly Thr
1 5 10 15
Gly Cys Thr Cys Gly Cys Gly Gly Thr Gly Gly Thr Cys Gly Thr Cys
20 25 30
Cys Cys Gly Ala Gly Gly Thr Gly Gly Cys Gly Cys Cys Ala Gly Cys
35 40 45
Ala
<210> 8
<211> 936
<212> БЕЛОК
<213> искусственная
<220>
<223> CD38ex1_T5-L TALEN
<400> 8
Met Gly Asp Pro Lys Lys Lys Arg Lys Val Ile Asp Tyr Pro Tyr Asp
1 5 10 15
Val Pro Asp Tyr Ala Ile Asp Ile Ala Asp Leu Arg Thr Leu Gly Tyr
20 25 30
Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val Arg Ser Thr Val
35 40 45
Ala Gln His His Glu Ala Leu Val Gly His Gly Phe Thr His Ala His
50 55 60
Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly Thr Val Ala Val
65 70 75 80
Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro Glu Ala Thr His Glu Ala
85 90 95
Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg Ala Leu Glu Ala
100 105 110
Leu Leu Thr Val Ala Gly Glu Leu Arg Gly Pro Pro Leu Gln Leu Asp
115 120 125
Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg Gly Gly Val Thr Ala Val
130 135 140
Glu Ala Val His Ala Trp Arg Asn Ala Leu Thr Gly Ala Pro Leu Asn
145 150 155 160
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
165 170 175
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
180 185 190
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Asn Gly
195 200 205
Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys
210 215 220
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
225 230 235 240
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
245 250 255
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
260 265 270
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
275 280 285
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
290 295 300
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
305 310 315 320
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
325 330 335
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
340 345 350
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
355 360 365
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
370 375 380
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
385 390 395 400
Pro Gln Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
405 410 415
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
420 425 430
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
435 440 445
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
450 455 460
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
465 470 475 480
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
485 490 495
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser His
500 505 510
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
515 520 525
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
530 535 540
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
545 550 555 560
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
565 570 575
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
580 585 590
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
595 600 605
Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val
610 615 620
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
625 630 635 640
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
645 650 655
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
660 665 670
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
675 680 685
Leu Glu Ser Ile Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala
690 695 700
Ala Leu Thr Asn Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg
705 710 715 720
Pro Ala Leu Asp Ala Val Lys Lys Gly Leu Gly Asp Pro Ile Ser Arg
725 730 735
Ser Gln Leu Val Lys Ser Glu Leu Glu Glu Lys Lys Ser Glu Leu Arg
740 745 750
His Lys Leu Lys Tyr Val Pro His Glu Tyr Ile Glu Leu Ile Glu Ile
755 760 765
Ala Arg Asn Ser Thr Gln Asp Arg Ile Leu Glu Met Lys Val Met Glu
770 775 780
Phe Phe Met Lys Val Tyr Gly Tyr Arg Gly Lys His Leu Gly Gly Ser
785 790 795 800
Arg Lys Pro Asp Gly Ala Ile Tyr Thr Val Gly Ser Pro Ile Asp Tyr
805 810 815
Gly Val Ile Val Asp Thr Lys Ala Tyr Ser Gly Gly Tyr Asn Leu Pro
820 825 830
Ile Gly Gln Ala Asp Glu Met Gln Arg Tyr Val Glu Glu Asn Gln Thr
835 840 845
Arg Asn Lys His Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr Pro Ser
850 855 860
Ser Val Thr Glu Phe Lys Phe Leu Phe Val Ser Gly His Phe Lys Gly
865 870 875 880
Asn Tyr Lys Ala Gln Leu Thr Arg Leu Asn His Ile Thr Asn Cys Asn
885 890 895
Gly Ala Val Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu Met Ile
900 905 910
Lys Ala Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe Asn Asn
915 920 925
Gly Glu Ile Asn Phe Ala Ala Asp
930 935
<210> 9
<211> 942
<212> БЕЛОК
<213> искусственная
<220>
<223> CD38ex1_T5-R TALEN
<400> 9
Met Gly Asp Pro Lys Lys Lys Arg Lys Val Ile Asp Lys Glu Thr Ala
1 5 10 15
Ala Ala Lys Phe Glu Arg Gln His Met Asp Ser Ile Asp Ile Ala Asp
20 25 30
Leu Arg Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro
35 40 45
Lys Val Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His
50 55 60
Gly Phe Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala
65 70 75 80
Leu Gly Thr Val Ala Val Lys Tyr Gln Asp Met Ile Ala Ala Leu Pro
85 90 95
Glu Ala Thr His Glu Ala Ile Val Gly Val Gly Lys Gln Trp Ser Gly
100 105 110
Ala Arg Ala Leu Glu Ala Leu Leu Thr Val Ala Gly Glu Leu Arg Gly
115 120 125
Pro Pro Leu Gln Leu Asp Thr Gly Gln Leu Leu Lys Ile Ala Lys Arg
130 135 140
Gly Gly Val Thr Ala Val Glu Ala Val His Ala Trp Arg Asn Ala Leu
145 150 155 160
Thr Gly Ala Pro Leu Asn Leu Thr Pro Gln Gln Val Val Ala Ile Ala
165 170 175
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
180 185 190
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
195 200 205
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
210 215 220
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
225 230 235 240
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val
245 250 255
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
260 265 270
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
275 280 285
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
290 295 300
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
305 310 315 320
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
325 330 335
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
340 345 350
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
355 360 365
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
370 375 380
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
385 390 395 400
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
405 410 415
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
420 425 430
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
435 440 445
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
450 455 460
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
465 470 475 480
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
485 490 495
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
500 505 510
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
515 520 525
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
530 535 540
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
545 550 555 560
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
565 570 575
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala
580 585 590
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
595 600 605
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
610 615 620
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
625 630 635 640
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
645 650 655
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
660 665 670
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
675 680 685
Ile Gly Gly Arg Pro Ala Leu Glu Ser Ile Val Ala Gln Leu Ser Arg
690 695 700
Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn Asp His Leu Val Ala Leu
705 710 715 720
Ala Cys Leu Gly Gly Arg Pro Ala Leu Asp Ala Val Lys Lys Gly Leu
725 730 735
Gly Asp Pro Ile Ser Arg Ser Gln Leu Val Lys Ser Glu Leu Glu Glu
740 745 750
Lys Lys Ser Glu Leu Arg His Lys Leu Lys Tyr Val Pro His Glu Tyr
755 760 765
Ile Glu Leu Ile Glu Ile Ala Arg Asn Ser Thr Gln Asp Arg Ile Leu
770 775 780
Glu Met Lys Val Met Glu Phe Phe Met Lys Val Tyr Gly Tyr Arg Gly
785 790 795 800
Lys His Leu Gly Gly Ser Arg Lys Pro Asp Gly Ala Ile Tyr Thr Val
805 810 815
Gly Ser Pro Ile Asp Tyr Gly Val Ile Val Asp Thr Lys Ala Tyr Ser
820 825 830
Gly Gly Tyr Asn Leu Pro Ile Gly Gln Ala Asp Glu Met Gln Arg Tyr
835 840 845
Val Glu Glu Asn Gln Thr Arg Asn Lys His Ile Asn Pro Asn Glu Trp
850 855 860
Trp Lys Val Tyr Pro Ser Ser Val Thr Glu Phe Lys Phe Leu Phe Val
865 870 875 880
Ser Gly His Phe Lys Gly Asn Tyr Lys Ala Gln Leu Thr Arg Leu Asn
885 890 895
His Ile Thr Asn Cys Asn Gly Ala Val Leu Ser Val Glu Glu Leu Leu
900 905 910
Ile Gly Gly Glu Met Ile Lys Ala Gly Thr Leu Thr Leu Glu Glu Val
915 920 925
Arg Arg Lys Phe Asn Asn Gly Glu Ile Asn Phe Ala Ala Asp
930 935 940
<210> 10
<211> 451
<212> БЕЛОК
<213> искусственная
<220>
<223> Даратумумаб-VH цепь
<400> 10
Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Asn Ser Phe Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
35 40 45
Ala Ile Ser Gly Ser Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys Ala
85 90 95
Lys Asp Lys Ile Leu Trp Phe Gly Glu Pro Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 11
<211> 214
<212> БЕЛОК
<213> искусственная
<220>
<223> Даратумумаб-VL цепь
<400> 11
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 12
<211> 120
<212> БЕЛОК
<213> искусственная
<220>
<223> MOR202-VH цепь
<400> 12
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Asp Pro Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Pro Leu Val Tyr Thr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 13
<211> 109
<212> БЕЛОК
<213> искусственная
<220>
<223> MOR202-VL цепь
<400> 13
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg His Tyr Tyr Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Thr Gly Gly Ala Ser Leu
85 90 95
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 14
<211> 10
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR1-1 - VH цепь
<400> 14
Gly Phe Thr Phe Ser Ser Tyr Tyr Met Asn
1 5 10
<210> 15
<211> 5
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR1-2 - VH цепь
<400> 15
Ser Tyr Tyr Met Asn
1 5
<210> 16
<211> 17
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR2 - VH цепь
<400> 16
Gly Ile Ser Gly Asp Pro Ser Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 17
<211> 11
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR3 - VH цепь
<400> 17
Asp Leu Pro Leu Val Tyr Thr Gly Phe Ala Tyr
1 5 10
<210> 18
<211> 5
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR4 - VH цепь
<400> 18
Asp Tyr Trp Met Gln
1 5
<210> 19
<211> 16
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR5 - VH цепь
<400> 19
Thr Ile Tyr Pro Gly Asp Gly Asp Thr Gly Tyr Ala Gln Lys Phe Lys
1 5 10 15
<210> 20
<211> 11
<212> БЕЛОК
<213> искусственная
<220>
<223> HCDR6 - VH цепь
<400> 20
Gly Asp Tyr Tyr Gly Ser Asn Ser Leu Asp Tyr
1 5 10
<210> 21
<211> 11
<212> БЕЛОК
<213> искусственная
<220>
<223> LCDR1 - VH цепь
<400> 21
Ser Gly Asp Asn Leu Arg His Tyr Tyr Val Tyr
1 5 10
<210> 22
<211> 7
<212> БЕЛОК
<213> искусственная
<220>
<223> LCDR2 - VH цепь
<400> 22
Gly Asp Ser Lys Arg Pro Ser
1 5
<210> 23
<211> 9
<212> БЕЛОК
<213> искусственная
<220>
<223> LCDR3 - VH цепь
<400> 23
Gln Thr Tyr Thr Gly Gly Ala Ser Leu
1 5
<210> 24
<211> 11
<212> БЕЛОК
<213> искусственная
<220>
<223> LCDR4 - VH цепь
<400> 24
Lys Ala Ser Gln Asp Val Ser Thr Val Val Ala
1 5 10
<210> 25
<211> 7
<212> БЕЛОК
<213> искусственная
<220>
<223> LCDR5 - VH цепь
<400> 25
Ser Ala Ser Tyr Arg Tyr Ile
1 5
<210> 26
<211> 8
<212> БЕЛОК
<213> искусственная
<220>
<223> LCDR6 - VH цепь
<400> 26
Gln Gln His Ser Pro Pro Tyr Thr
1 5
<210> 27
<211> 21
<212> БЕЛОК
<213> искусственная
<220>
<223> CD8α- сигнальный пептид (Signal peptide – SP)
<400> 27
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 28
<211> 15
<212> БЕЛОК
<213> искусственная
<220>
<223> GS линкер
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 16
<212> БЕЛОК
<213> homo sapiens
<220>
<223> FCRIIα шарнир
<400> 29
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
1 5 10 15
<210> 30
<211> 69
<212> БЕЛОК
<213> homo sapiens
<220>
<223> CD8α шарнир
<400> 30
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys
65
<210> 31
<211> 231
<212> БЕЛОК
<213> homo sapiens
<220>
<223> IgG1 шарнир
<400> 31
Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
20 25 30
Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val
35 40 45
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
50 55 60
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
65 70 75 80
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
85 90 95
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
100 105 110
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
115 120 125
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
130 135 140
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
145 150 155 160
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
165 170 175
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
180 185 190
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
195 200 205
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
210 215 220
Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 32
<211> 24
<212> БЕЛОК
<213> homo sapiens
<220>
<223> TM домен
<400> 32
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 33
<211> 42
<212> БЕЛОК
<213> homo sapiens
<220>
<223> 4-1 BB ко-стимулирующий домен
<400> 33
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 34
<211> 112
<212> БЕЛОК
<213> homo sapiens
<220>
<223> CD3ζ активирующий домен
<400> 34
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 35
<211> 442
<212> БЕЛОК
<213> искусственная
<220>
<223> GMB005-V1 CAR
<400> 35
Pro Leu Ala Leu Leu Leu His Ala Ala Arg Pro Glu Val Gln Leu Leu
1 5 10 15
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
20 25 30
Cys Ala Val Ser Gly Phe Thr Phe Asn Ser Phe Ala Met Ser Trp Val
35 40 45
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Ser Gly
50 55 60
Ser Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
65 70 75 80
Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser
85 90 95
Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys Ala Lys Asp Lys Ile
100 105 110
Leu Trp Phe Gly Glu Pro Val Phe Asp Tyr Trp Gly Gln Gly Thr Leu
115 120 125
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
145 150 155 160
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
165 170 175
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
180 185 190
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
195 200 205
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
210 215 220
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
225 230 235 240
Arg Ser Asn Trp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
245 250 255
Lys Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr
260 265 270
Gln Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
275 280 285
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
290 295 300
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
305 310 315 320
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
325 330 335
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
340 345 350
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
355 360 365
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
370 375 380
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
385 390 395 400
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
405 410 415
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
420 425 430
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
435 440
<210> 36
<211> 471
<212> БЕЛОК
<213> искусственная
<220>
<223> GMB005-V2 CAR
<400> 36
Pro Leu Ala Leu Leu Leu His Ala Ala Arg Pro Glu Val Gln Leu Leu
1 5 10 15
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
20 25 30
Cys Ala Val Ser Gly Phe Thr Phe Asn Ser Phe Ala Met Ser Trp Val
35 40 45
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Ser Gly
50 55 60
Ser Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
65 70 75 80
Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser
85 90 95
Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys Ala Lys Asp Lys Ile
100 105 110
Leu Trp Phe Gly Glu Pro Val Phe Asp Tyr Trp Gly Gln Gly Thr Leu
115 120 125
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
145 150 155 160
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
165 170 175
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
180 185 190
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
195 200 205
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
210 215 220
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
225 230 235 240
Arg Ser Asn Trp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
245 250 255
Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile
260 265 270
Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala
275 280 285
Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr
290 295 300
Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu
305 310 315 320
Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
325 330 335
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
340 345 350
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
355 360 365
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
370 375 380
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
385 390 395 400
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
405 410 415
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
420 425 430
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
435 440 445
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
450 455 460
Thr Lys Asp Thr Tyr Asp Ala
465 470
<210> 37
<211> 657
<212> БЕЛОК
<213> искусственная
<220>
<223> GMB005-V3 CAR
<400> 37
Pro Leu Ala Leu Leu Leu His Ala Ala Arg Pro Glu Val Gln Leu Leu
1 5 10 15
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
20 25 30
Cys Ala Val Ser Gly Phe Thr Phe Asn Ser Phe Ala Met Ser Trp Val
35 40 45
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Ser Gly
50 55 60
Ser Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
65 70 75 80
Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser
85 90 95
Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys Ala Lys Asp Lys Ile
100 105 110
Leu Trp Phe Gly Glu Pro Val Phe Asp Tyr Trp Gly Gln Gly Thr Leu
115 120 125
Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
145 150 155 160
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
165 170 175
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
180 185 190
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
195 200 205
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
210 215 220
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
225 230 235 240
Arg Ser Asn Trp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
245 250 255
Lys Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro
260 265 270
Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
275 280 285
Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val
290 295 300
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
305 310 315 320
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
325 330 335
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
340 345 350
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
355 360 365
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
370 375 380
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
385 390 395 400
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
405 410 415
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
420 425 430
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
435 440 445
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
450 455 460
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
465 470 475 480
Ser Leu Ser Leu Ser Pro Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala
485 490 495
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
500 505 510
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
515 520 525
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
530 535 540
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
545 550 555 560
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
565 570 575
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
580 585 590
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
595 600 605
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
610 615 620
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
625 630 635 640
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
645 650 655
Ala
<210> 38
<211> 119
<212> БЕЛОК
<213> mus musculus
<220>
<223> Luc63-VH цепь
<400> 38
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asp Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Pro Asp Gly Asn Tyr Trp Tyr Phe Asp Val Trp Gly Ala Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 39
<211> 107
<212> БЕЛОК
<213> mus musculus
<220>
<223> Luc63-VL цепь
<400> 39
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Ile Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 40
<211> 120
<212> БЕЛОК
<213> mus musculus
<220>
<223> Luc90-VH цепь
<400> 40
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Met Ile Ala Thr Arg Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 41
<211> 107
<212> БЕЛОК
<213> mus musculus
<220>
<223> Luc90-VL цепь
<400> 41
Asp Ile Val Met Thr Gln Ser Gln Lys Ser Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ile Thr Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Asn Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 42
<211> 121
<212> БЕЛОК
<213> mus musculus
<220>
<223> Luc34-VH цепь
<400> 42
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Lys Val Tyr Tyr Gly Ser Asn Pro Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 43
<211> 107
<212> БЕЛОК
<213> mus musculus
<220>
<223> Luc34-VL цепь
<400> 43
Asp Ile Gln Met Thr Gln Ser Ser Ser Tyr Leu Ser Val Ser Leu Gly
1 5 10 15
Gly Arg Val Thr Ile Thr Cys Lys Ala Ser Asp His Ile Asn Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Asn Ala Pro Arg Leu Leu Ile
35 40 45
Ser Gly Ala Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Lys Asp Tyr Thr Leu Ser Ile Thr Ser Leu Gln Thr
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 44
<211> 120
<212> БЕЛОК
<213> mus musculus
<220>
<223> LucX1-VH цепь
<400> 44
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 45
<211> 107
<212> БЕЛОК
<213> mus musculus
<220>
<223> LucX1-VL цепь
<400> 45
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Phe Thr Ile Glu Asn Met Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 46
<211> 120
<212> БЕЛОК
<213> mus musculus
<220>
<223> LucX2-VH цепь
<400> 46
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 47
<211> 108
<212> БЕЛОК
<213> mus musculus
<220>
<223> LucX2-VL цепь
<400> 47
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 48
<211> 432
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc63-V1 CAR
<400> 48
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Asp Phe Ser Arg Tyr Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn
65 70 75 80
Tyr Thr Pro Ser Leu Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ala Arg Pro Asp Gly Asn Tyr Trp Tyr Phe Asp
115 120 125
Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr
145 150 155 160
Gln Ser His Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile
165 170 175
Thr Cys Lys Ala Ser Gln Asp Val Gly Ile Ala Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr
195 200 205
Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr Thr Phe Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Gly Leu Ala Val Ser Thr Ile Ser Ser Phe
260 265 270
Phe Pro Pro Gly Tyr Gln Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
275 280 285
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
290 295 300
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
305 310 315 320
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
325 330 335
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
340 345 350
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
355 360 365
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
370 375 380
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
385 390 395 400
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
405 410 415
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
420 425 430
<210> 49
<211> 485
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc63-V2 CAR
<400> 49
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Asp Phe Ser Arg Tyr Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn
65 70 75 80
Tyr Thr Pro Ser Leu Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ala Arg Pro Asp Gly Asn Tyr Trp Tyr Phe Asp
115 120 125
Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr
145 150 155 160
Gln Ser His Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile
165 170 175
Thr Cys Lys Ala Ser Gln Asp Val Gly Ile Ala Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr
195 200 205
Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr Thr Phe Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
260 265 270
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
275 280 285
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
290 295 300
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
305 310 315 320
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
325 330 335
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
340 345 350
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
355 360 365
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
370 375 380
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg
485
<210> 50
<211> 647
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc63-V3 CAR
<400> 50
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Asp Phe Ser Arg Tyr Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn
65 70 75 80
Tyr Thr Pro Ser Leu Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr
100 105 110
Ala Leu Tyr Tyr Cys Ala Arg Pro Asp Gly Asn Tyr Trp Tyr Phe Asp
115 120 125
Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr
145 150 155 160
Gln Ser His Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile
165 170 175
Thr Cys Lys Ala Ser Gln Asp Val Gly Ile Ala Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr
195 200 205
Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr Thr Phe Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Glu Pro Lys Ser Pro Asp Lys Thr His Thr
260 265 270
Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu
275 280 285
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu
290 295 300
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
305 310 315 320
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
325 330 335
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
340 345 350
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
355 360 365
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
370 375 380
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
385 390 395 400
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
405 410 415
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
420 425 430
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
435 440 445
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
450 455 460
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
465 470 475 480
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Lys Arg Gly
485 490 495
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
500 505 510
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
515 520 525
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
530 535 540
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
545 550 555 560
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
565 570 575
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
580 585 590
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
595 600 605
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
610 615 620
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
625 630 635 640
Met Gln Ala Leu Pro Pro Arg
645
<210> 51
<211> 433
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc90-V1 CAR
<400> 51
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu
20 25 30
Val Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ser Phe Thr Thr Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Met Ile His Pro Ser Asp Ser Glu Thr Arg
65 70 75 80
Leu Asn Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Thr Met Ile Ala Thr Arg Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser Gln Lys Ser Met Ser Thr Ser Val Gly Asp Arg Val Ser
165 170 175
Ile Thr Cys Lys Ala Ser Gln Asp Val Ile Thr Gly Val Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Ser Ala Ser
195 200 205
Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Asn Val Gln Ala Glu Asp Leu Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Leu Thr Phe Gly Ala
245 250 255
Gly Thr Lys Leu Glu Leu Lys Gly Leu Ala Val Ser Thr Ile Ser Ser
260 265 270
Phe Phe Pro Pro Gly Tyr Gln Lys Arg Gly Arg Lys Lys Leu Leu Tyr
275 280 285
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
290 295 300
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
305 310 315 320
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
325 330 335
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
340 345 350
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
355 360 365
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
370 375 380
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
385 390 395 400
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
405 410 415
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
420 425 430
Arg
<210> 52
<211> 486
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc90-V2 CAR
<400> 52
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu
20 25 30
Val Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ser Phe Thr Thr Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Met Ile His Pro Ser Asp Ser Glu Thr Arg
65 70 75 80
Leu Asn Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Thr Met Ile Ala Thr Arg Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser Gln Lys Ser Met Ser Thr Ser Val Gly Asp Arg Val Ser
165 170 175
Ile Thr Cys Lys Ala Ser Gln Asp Val Ile Thr Gly Val Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Ser Ala Ser
195 200 205
Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Asn Val Gln Ala Glu Asp Leu Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Leu Thr Phe Gly Ala
245 250 255
Gly Thr Lys Leu Glu Leu Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 53
<211> 648
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc90-V3 CAR
<400> 53
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu
20 25 30
Val Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ser Phe Thr Thr Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Met Ile His Pro Ser Asp Ser Glu Thr Arg
65 70 75 80
Leu Asn Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Ser Thr Met Ile Ala Thr Arg Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser Gln Lys Ser Met Ser Thr Ser Val Gly Asp Arg Val Ser
165 170 175
Ile Thr Cys Lys Ala Ser Gln Asp Val Ile Thr Gly Val Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Ser Ala Ser
195 200 205
Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Asn Val Gln Ala Glu Asp Leu Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Leu Thr Phe Gly Ala
245 250 255
Gly Thr Lys Leu Glu Leu Lys Glu Pro Lys Ser Pro Asp Lys Thr His
260 265 270
Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
275 280 285
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro
290 295 300
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
305 310 315 320
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
325 330 335
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
340 345 350
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
355 360 365
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
370 375 380
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
385 390 395 400
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
405 410 415
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
420 425 430
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
435 440 445
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
450 455 460
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
465 470 475 480
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Lys Arg
485 490 495
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
500 505 510
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
515 520 525
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
530 535 540
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
545 550 555 560
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
565 570 575
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
580 585 590
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
595 600 605
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
610 615 620
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
625 630 635 640
His Met Gln Ala Leu Pro Pro Arg
645
<210> 54
<211> 434
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc34-V1 CAR
<400> 54
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu
20 25 30
Ala Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg
65 70 75 80
Tyr Thr Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Lys Val Tyr Tyr Gly Ser Asn Pro
115 120 125
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Ser Ser Tyr Leu Ser Val Ser Leu Gly Gly Arg Val
165 170 175
Thr Ile Thr Cys Lys Ala Ser Asp His Ile Asn Asn Trp Leu Ala Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Asn Ala Pro Arg Leu Leu Ile Ser Gly Ala
195 200 205
Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Lys Asp Tyr Thr Leu Ser Ile Thr Ser Leu Gln Thr Glu Asp Val
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Ser Thr Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Gly Leu Ala Val Ser Thr Ile Ser
260 265 270
Ser Phe Phe Pro Pro Gly Tyr Gln Lys Arg Gly Arg Lys Lys Leu Leu
275 280 285
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
290 295 300
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
305 310 315 320
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
325 330 335
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
340 345 350
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
355 360 365
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
370 375 380
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
385 390 395 400
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
405 410 415
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
420 425 430
Pro Arg
<210> 55
<211> 487
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc34-V2 CAR
<400> 55
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu
20 25 30
Ala Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg
65 70 75 80
Tyr Thr Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Lys Val Tyr Tyr Gly Ser Asn Pro
115 120 125
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Ser Ser Tyr Leu Ser Val Ser Leu Gly Gly Arg Val
165 170 175
Thr Ile Thr Cys Lys Ala Ser Asp His Ile Asn Asn Trp Leu Ala Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Asn Ala Pro Arg Leu Leu Ile Ser Gly Ala
195 200 205
Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Lys Asp Tyr Thr Leu Ser Ile Thr Ser Leu Gln Thr Glu Asp Val
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Ser Thr Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 56
<211> 649
<212> БЕЛОК
<213> искусственная
<220>
<223> Luc34-V3 CAR
<400> 56
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu
20 25 30
Ala Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg
65 70 75 80
Tyr Thr Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Lys Val Tyr Tyr Gly Ser Asn Pro
115 120 125
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Ser Ser Tyr Leu Ser Val Ser Leu Gly Gly Arg Val
165 170 175
Thr Ile Thr Cys Lys Ala Ser Asp His Ile Asn Asn Trp Leu Ala Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Asn Ala Pro Arg Leu Leu Ile Ser Gly Ala
195 200 205
Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Lys Asp Tyr Thr Leu Ser Ile Thr Ser Leu Gln Thr Glu Asp Val
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Ser Thr Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Glu Pro Lys Ser Pro Asp Lys Thr
260 265 270
His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
305 310 315 320
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Lys
485 490 495
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
500 505 510
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
515 520 525
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
530 535 540
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
545 550 555 560
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
565 570 575
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
580 585 590
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
595 600 605
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
610 615 620
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
625 630 635 640
Leu His Met Gln Ala Leu Pro Pro Arg
645
<210> 57
<211> 433
<212> БЕЛОК
<213> искусственная
<220>
<223> LucX1-V1 CAR
<400> 57
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ala Phe Ser Ser Ser Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys
65 70 75 80
Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Thr Thr Val
145 150 155 160
Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly Glu Lys Val Thr
165 170 175
Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile Ser Glu Gly Asn
195 200 205
Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser Ser Gly Tyr Gly
210 215 220
Thr Asp Phe Val Phe Thr Ile Glu Asn Met Leu Ser Glu Asp Val Ala
225 230 235 240
Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Leu Thr Phe Gly Gly
245 250 255
Gly Thr Lys Leu Glu Ile Lys Gly Leu Ala Val Ser Thr Ile Ser Ser
260 265 270
Phe Phe Pro Pro Gly Tyr Gln Lys Arg Gly Arg Lys Lys Leu Leu Tyr
275 280 285
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
290 295 300
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
305 310 315 320
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
325 330 335
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
340 345 350
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
355 360 365
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
370 375 380
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
385 390 395 400
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
405 410 415
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
420 425 430
Arg
<210> 58
<211> 487
<212> БЕЛОК
<213> искусственная
<220>
<223> LucX1-V2 CAR
<400> 58
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu
20 25 30
Ala Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg
65 70 75 80
Tyr Thr Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Lys Val Tyr Tyr Gly Ser Asn Pro
115 120 125
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Ser Ser Tyr Leu Ser Val Ser Leu Gly Gly Arg Val
165 170 175
Thr Ile Thr Cys Lys Ala Ser Asp His Ile Asn Asn Trp Leu Ala Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Asn Ala Pro Arg Leu Leu Ile Ser Gly Ala
195 200 205
Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Lys Asp Tyr Thr Leu Ser Ile Thr Ser Leu Gln Thr Glu Asp Val
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Ser Thr Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 59
<211> 648
<212> БЕЛОК
<213> искусственная
<220>
<223> LucX1-V3 CAR
<400> 59
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ala Phe Ser Ser Ser Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys
65 70 75 80
Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Thr Thr Val
145 150 155 160
Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly Glu Lys Val Thr
165 170 175
Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile Ser Glu Gly Asn
195 200 205
Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser Ser Gly Tyr Gly
210 215 220
Thr Asp Phe Val Phe Thr Ile Glu Asn Met Leu Ser Glu Asp Val Ala
225 230 235 240
Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Leu Thr Phe Gly Gly
245 250 255
Gly Thr Lys Leu Glu Ile Lys Glu Pro Lys Ser Pro Asp Lys Thr His
260 265 270
Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
275 280 285
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro
290 295 300
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
305 310 315 320
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
325 330 335
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
340 345 350
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
355 360 365
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
370 375 380
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
385 390 395 400
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
405 410 415
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
420 425 430
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
435 440 445
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
450 455 460
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
465 470 475 480
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Lys Arg
485 490 495
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
500 505 510
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
515 520 525
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
530 535 540
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
545 550 555 560
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
565 570 575
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
580 585 590
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
595 600 605
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
610 615 620
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
625 630 635 640
His Met Gln Ala Leu Pro Pro Arg
645
<210> 60
<211> 434
<212> БЕЛОК
<213> искусственная
<220>
<223> LucX2-V1 CAR
<400> 60
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ala Phe Ser Ser Ser Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys
65 70 75 80
Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser
165 170 175
Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Ser Ala Ser
195 200 205
Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Pro Tyr Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Gly Leu Ala Val Ser Thr Ile Ser
260 265 270
Ser Phe Phe Pro Pro Gly Tyr Gln Lys Arg Gly Arg Lys Lys Leu Leu
275 280 285
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
290 295 300
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
305 310 315 320
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
325 330 335
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
340 345 350
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
355 360 365
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
370 375 380
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
385 390 395 400
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
405 410 415
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
420 425 430
Pro Arg
<210> 61
<211> 487
<212> БЕЛОК
<213> искусственная
<220>
<223> LucX2-V2 CAR
<400> 61
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ala Phe Ser Ser Ser Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys
65 70 75 80
Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser
165 170 175
Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Ser Ala Ser
195 200 205
Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Pro Tyr Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 62
<211> 649
<212> БЕЛОК
<213> искусственная
<220>
<223> LucX2-V3 CAR
<400> 62
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ala Phe Ser Ser Ser Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Lys
65 70 75 80
Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser
100 105 110
Ala Val Tyr Phe Cys Ala Arg Ser Thr Met Ile Ala Thr Gly Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser
165 170 175
Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Ser Ala Ser
195 200 205
Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Pro Tyr Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Glu Pro Lys Ser Pro Asp Lys Thr
260 265 270
His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
305 310 315 320
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Lys
485 490 495
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
500 505 510
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
515 520 525
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
530 535 540
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
545 550 555 560
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
565 570 575
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
580 585 590
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
595 600 605
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
610 615 620
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
625 630 635 640
Leu His Met Gln Ala Leu Pro Pro Arg
645
<210> 64
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CS1 T01 left TALE
<400> 64
tgacttccag agagcaa 17
<210> 65
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CS1 T01 правая TALE
<400> 65
aacatgcctc accctca 17
<210> 66
<211> 49
<212> ДНК
<213> homo sapiens
<220>
<223> CS1 T02 мишень
<400> 66
ttccagagag caatatggct ggttccccaa catgcctcac cctcatcta 49
<210> 67
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CS1 T02 левая TALE
<400> 67
ttccagagag caatatg 17
<210> 68
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CS1 T02 правая TALE
<400> 68
tgcctcaccc tcatcta 17
<210> 69
<211> 49
<212> ДНК
<213> homo sapiens
<220>
<223> CS1 T03 мишень
<400> 69
ttgactctat tgtctggacc ttcaacacaa cccctcttgt caccataca 49
<210> 70
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CS1 T03 левая TALE
<400> 70
ttgactctat tgtctgg 17
<210> 71
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CS1 T03 правая TALE
<400> 71
cctcttgtca ccataca 17
<210> 72
<211> 49
<212> ДНК
<213> homo sapiens
<220>
<223> CD70 мишень 1
<400> 72
tggtcttttc ttccagtggg acgtagctga gctgcagctg aatcacaca 49
<210> 73
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CD70 Мишень 1-левая TALE
<400> 73
tggtcttttc ttccagt 17
<210> 74
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CD70 Мишень 1-правая TALE
<400> 74
tgcagctgaa tcacaca 17
<210> 75
<211> 49
<212> ДНК
<213> homo sapiens
<220>
<223> CD70 мишень 2
<400> 75
tggtgatctg cctcgtggtg tgcatccagc gcttcgcaca ggctcagca 49
<210> 76
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CD70 Мишень 2-левая TALE
<400> 76
tggtgatctg cctcgtg 17
<210> 77
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CD70 Мишень 2-правая TALE
<400> 77
ttcgcacagg ctcagca 17
<210> 78
<211> 57
<212> ДНК
<213> homo sapiens
<220>
<223> CD70 мишень 3
<400> 78
tgcgggctgc tttggtccca ttggtcgcgg gcttggtgat ctgcctcgtg gtgtgca 57
<210> 79
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CD70 Мишень 3-левая TALE
<400> 79
tgcgggctgc tttggtc 17
<210> 80
<211> 17
<212> ДНК
<213> искусственная
<220>
<223> CD70 Мишень 3-правая TALE
<400> 80
ctgcctcgtg gtgtgca 17
<210> 81
<211> 122
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab4-VH цепь
<400> 81
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Gly Tyr Ser Gly Tyr Asp Ser Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 82
<211> 1358
<212> ДНК
<213> искусственная
<220>
<223> анти-CD70 Ab4-VH цепь
<400> 82
aggtgcagct ggtggagtct gggggaggcg tggtccagcc tgggaggtcc ctgagactct 60
cctgtgcagc gtctggattc accttcagta actatggcat acactgggtc cgccaggctc 120
caggcaaggg gctggagtgg gtggcagtta tatggtatga tggaagtaat aaatactatg 180
cagactccgt gaagggccga ttcaccatct ccagagacaa ttccaagaac acgctgtatc 240
tgcaaatgaa cagcctgaga gccgaggaca cggctgtgta ttactgtgcg agagatggag 300
gatatagtgg ctacgattcg gggtttgact actggggcca gggaaccctg gtcaccgtct 360
cctcagctag caccaagggc ccatccgtct tccccctggc accctcctcc aagagcacct 420
ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa ccggtgacgg 480
tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct gtcctacagt 540
cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc ttgggcaccc 600
agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtggac aagaaagttg 660
agcccaaatc ttgtgacaaa actcacacat gcccaccgtg cccagcacct gaactcctgg 720
ggggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg atctcccgga 780
cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag gtcaagttca 840
actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg gaggagcagt 900
acaacagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac tggctgaatg 960
gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc gagaaaacca 1020
tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgccc ccatcccggg 1080
aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc tatcccagcg 1140
acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag accacgcctc 1200
ccgtgctgga ctccgacggc tccttcttcc tctatagcaa gctcaccgtg gacaagagca 1260
ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg cacaaccact 1320
acacgcagaa gagcctctcc ctgtctccgg gtaaatga 1358
<210> 83
<211> 112
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab4-VL цепь
<400> 83
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Phe Leu Ile Tyr Leu Gly Ser Tyr Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ile Gln Thr
85 90 95
Leu Gln Thr Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105 110
<210> 84
<211> 1476
<212> ДНК
<213> искусственная
<220>
<223> анти-CD70 Ab4-VL цепь
<400> 84
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg aatagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ttcctgatct atttgggttc ttatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgagaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgta tacaaactct acaaactcca 300
ttcactttcg gccctgggac caaagtggat atcaaacgta cggtggctgc accatctgtc 360
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 420
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 480
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctc 540
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 600
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgttag 660
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 720
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 780
gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gcccagcacc tgaactcctg 840
gggggaccgt cagtcttcct cttcccccca aaacccaagg acaccctcat gatctcccgg 900
acccctgagg tcacatgcgt ggtggtggac gtgagccacg aagaccctga ggtcaagttc 960
aactggtacg tggacggcgt ggaggtgcat aatgccaaga caaagccgcg ggaggagcag 1020
tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat 1080
ggcaaggagt acaagtgcaa ggtctccaac aaagccctcc cagcccccat cgagaaaacc 1140
atctccaaag ccaaagggca gccccgagaa ccacaggtgt acaccctgcc cccatcccgg 1200
gaggagatga ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt ctatcccagc 1260
gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct 1320
cccgtgctgg actccgacgg ctccttcttc ctctatagca agctcaccgt ggacaagagc 1380
aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac 1440
tacacgcaga agagcctctc cctgtctccg ggtaaa 1476
<210> 85
<211> 122
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab8-VH цепь
<400> 85
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asp Lys Tyr Phe Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ile Ala Gly Ala Arg Tyr Val Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 86
<211> 560
<212> ДНК
<213> искусственная
<220>
<223> анти-CD70 Ab8-VH цепь
<400> 86
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cgtctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatggtatg atggaagtga taaatacttt 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggg 300
atagcaggag ctcgctacgt ctactttgac tactggggcc agggaaccct ggtcaccgtc 360
tcctcagcta gcaccaaggg cccatccgtc ttccccctgg caccctcctc caagagcacc 420
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 480
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 540
tcctcaggac tctactccct 560
<210> 87
<211> 107
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab8-VL цепь
<400> 87
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Gly Gly Val Pro Ser Lys Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Thr Val Asp Ile Lys
100 105
<210> 88
<211> 645
<212> ДНК
<213> искусственная
<220>
<223> анти-CD70 Ab8-VL цепь
<400> 88
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca gggcattagc aattatttag cctggtttca gcagaaacca 120
gggaaagccc ctaagtccct gatctatgct gcatccagtt tgcaaggtgg ggtcccatca 180
aagttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgccaacaa tattataatt acccattcac tttcggccct 300
gggaccacag tggatatcaa acgtacggtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttag 645
<210> 89
<211> 117
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 1F6-VH цепь
<400> 89
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Ala Phe Lys
50 55 60
Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr Leu
65 70 75 80
Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys Ala
85 90 95
Arg Asp Tyr Gly Asp Tyr Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 90
<211> 411
<212> ДНК
<213> искусственная
<220>
<223> анти-CD70 1F6-VH цепь
<400> 90
atggcttggg tgtggacctt gctattcctg atggcagctg cccaaagtgc ccaagcacag 60
atccagttgg tgcagtctgg acctgaggtg aagaagcctg gagagacagt caagatctcc 120
tgcaaggctt ctgggtatac cttcacaaac tatggaatga actgggtgaa gcaggctcca 180
ggaaagggtt taaagtggat gggctggata aacacctaca ctggagagcc aacatatgct 240
gatgccttca agggacggtt tgccttctct ttggaaacct ctgccagcac tgcctatttg 300
cagatcaaca acctcaaaaa tgaggacacg gctacatatt tctgtgcaag agactacggc 360
gactatggta tggactactg gggtcaagga acctcagtca ccgtctcctc a 411
<210> 91
<211> 112
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 1F6-VL цепь
<400> 91
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Tyr Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln His Ser Arg
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 92
<211> 396
<212> ДНК
<213> искусственная
<220>
<223> анти-CD70 1F6-VL цепь
<400> 92
atggagacag acacactcct gttatgggta ctgctgctct gggttccagg ttccactggt 60
gacattgtgc tgacacagtc tcctgcttcc ttagctgtat ctctggggca gagggccacc 120
atctcatgca gggccagcaa aagtgtcagt acatctggct atagttttat gcactggtat 180
caacagaaac caggacagcc acccaaactc ctcatctatc ttgcatccaa cctagaatct 240
ggggtccctg ccaggttcag tggcagtggg tctgggacag acttcaccct caacatccat 300
cctgtggagg aggaggatgc tgcaacctat tactgtcagc acagtaggga ggttccgtgg 360
acgttcggtg gaggcaccaa gctggaaatc aaacgg 396
<210> 93
<211> 464
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab4-V1 CAR
<400> 93
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asn Tyr Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Gly Gly Tyr Ser Gly Tyr Asp Ser
115 120 125
Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro
165 170 175
Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asn Ser Asn Gly
180 185 190
Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln
195 200 205
Phe Leu Ile Tyr Leu Gly Ser Tyr Arg Ala Ser Gly Val Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile Ser Arg
225 230 235 240
Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ile Gln Thr Leu Gln
245 250 255
Thr Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Gly Leu
260 265 270
Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile Tyr
275 280 285
Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu
290 295 300
Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
305 310 315 320
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
325 330 335
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
340 345 350
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
355 360 365
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
370 375 380
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
385 390 395 400
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
405 410 415
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
420 425 430
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
435 440 445
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
450 455 460
<210> 94
<211> 493
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab4-V2 CAR
<400> 94
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asn Tyr Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Gly Gly Tyr Ser Gly Tyr Asp Ser
115 120 125
Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro
165 170 175
Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asn Ser Asn Gly
180 185 190
Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln
195 200 205
Phe Leu Ile Tyr Leu Gly Ser Tyr Arg Ala Ser Gly Val Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile Ser Arg
225 230 235 240
Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ile Gln Thr Leu Gln
245 250 255
Thr Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
370 375 380
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
385 390 395 400
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
405 410 415
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
420 425 430
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
435 440 445
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
450 455 460
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
465 470 475 480
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 95
<211> 584
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab4-V3 CAR
<400> 95
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asn Tyr Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Gly Gly Tyr Ser Gly Tyr Asp Ser
115 120 125
Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro
165 170 175
Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asn Ser Asn Gly
180 185 190
Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln
195 200 205
Phe Leu Ile Tyr Leu Gly Ser Tyr Arg Ala Ser Gly Val Pro Asp Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile Ser Arg
225 230 235 240
Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ile Gln Thr Leu Gln
245 250 255
Thr Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Glu Pro
260 265 270
Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro
275 280 285
Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
290 295 300
Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
305 310 315 320
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
325 330 335
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
340 345 350
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
355 360 365
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
370 375 380
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
385 390 395 400
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
405 410 415
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
420 425 430
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
435 440 445
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
450 455 460
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
465 470 475 480
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
485 490 495
Leu Ser Pro Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
500 505 510
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
515 520 525
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
530 535 540
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
545 550 555 560
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
565 570 575
Ala Pro Ala Tyr Gln Gln Gly Gln
580
<210> 96
<211> 459
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab8-V1 CAR
<400> 96
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asp Lys Tyr
65 70 75 80
Phe Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Gly Ile Ala Gly Ala Arg Tyr Val
115 120 125
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
165 170 175
Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr Leu Ala
180 185 190
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile Tyr Ala
195 200 205
Ala Ser Ser Leu Gln Gly Gly Val Pro Ser Lys Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
225 230 235 240
Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Tyr Pro Phe Thr Phe
245 250 255
Gly Pro Gly Thr Thr Val Asp Ile Lys Gly Leu Ala Val Ser Thr Ile
260 265 270
Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile Tyr Ile Trp Ala Pro Leu
275 280 285
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
290 295 300
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
305 310 315 320
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
325 330 335
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
340 345 350
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
355 360 365
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
370 375 380
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
385 390 395 400
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
405 410 415
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
420 425 430
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
435 440 445
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
450 455
<210> 97
<211> 488
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab8-V2 CAR
<400> 97
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asp Lys Tyr
65 70 75 80
Phe Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Gly Ile Ala Gly Ala Arg Tyr Val
115 120 125
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
165 170 175
Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr Leu Ala
180 185 190
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile Tyr Ala
195 200 205
Ala Ser Ser Leu Gln Gly Gly Val Pro Ser Lys Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
225 230 235 240
Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Tyr Pro Phe Thr Phe
245 250 255
Gly Pro Gly Thr Thr Val Asp Ile Lys Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 98
<211> 674
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 Ab8-V3 CAR
<400> 98
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val
20 25 30
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asp Lys Tyr
65 70 75 80
Phe Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Gly Ile Ala Gly Ala Arg Tyr Val
115 120 125
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile
145 150 155 160
Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
165 170 175
Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr Leu Ala
180 185 190
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile Tyr Ala
195 200 205
Ala Ser Ser Leu Gln Gly Gly Val Pro Ser Lys Phe Ser Gly Ser Gly
210 215 220
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
225 230 235 240
Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Tyr Pro Phe Thr Phe
245 250 255
Gly Pro Gly Thr Thr Val Asp Ile Lys Glu Pro Lys Ser Pro Asp Lys
260 265 270
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
305 310 315 320
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
485 490 495
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
500 505 510
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
515 520 525
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
530 535 540
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
545 550 555 560
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
565 570 575
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
580 585 590
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
595 600 605
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
610 615 620
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
625 630 635 640
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
645 650 655
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
660 665 670
Pro Arg
<210> 99
<211> 459
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 1F6-V1 CAR
<400> 99
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Val
20 25 30
Lys Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asn Tyr Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys
50 55 60
Gly Leu Lys Trp Met Gly Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr
65 70 75 80
Ala Asp Ala Phe Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
85 90 95
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala
100 105 110
Thr Tyr Phe Cys Ala Arg Asp Tyr Gly Asp Tyr Gly Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys
165 170 175
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Tyr Ser Phe Met His Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Leu Ala
195 200 205
Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala
225 230 235 240
Ala Thr Tyr Tyr Cys Gln His Ser Arg Glu Val Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Arg Gly Leu Ala Val Ser Thr Ile
260 265 270
Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile Tyr Ile Trp Ala Pro Leu
275 280 285
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
290 295 300
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
305 310 315 320
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
325 330 335
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
340 345 350
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
355 360 365
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
370 375 380
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
385 390 395 400
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
405 410 415
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
420 425 430
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
435 440 445
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
450 455
<210> 100
<211> 488
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 1F6-V2 CAR
<400> 100
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Val
20 25 30
Lys Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asn Tyr Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys
50 55 60
Gly Leu Lys Trp Met Gly Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr
65 70 75 80
Ala Asp Ala Phe Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
85 90 95
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala
100 105 110
Thr Tyr Phe Cys Ala Arg Asp Tyr Gly Asp Tyr Gly Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys
165 170 175
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Tyr Ser Phe Met His Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Leu Ala
195 200 205
Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala
225 230 235 240
Ala Thr Tyr Tyr Cys Gln His Ser Arg Glu Val Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Thr Thr Pro Ala Pro Arg
260 265 270
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
275 280 285
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
290 295 300
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
305 310 315 320
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
325 330 335
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
340 345 350
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
355 360 365
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
370 375 380
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
385 390 395 400
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
405 410 415
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
420 425 430
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
435 440 445
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
450 455 460
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
465 470 475 480
His Met Gln Ala Leu Pro Pro Arg
485
<210> 101
<211> 674
<212> БЕЛОК
<213> искусственная
<220>
<223> анти-CD70 1F6-V3 CAR
<400> 101
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Val
20 25 30
Lys Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asn Tyr Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys
50 55 60
Gly Leu Lys Trp Met Gly Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr
65 70 75 80
Ala Asp Ala Phe Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala
85 90 95
Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala
100 105 110
Thr Tyr Phe Cys Ala Arg Asp Tyr Gly Asp Tyr Gly Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser
145 150 155 160
Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys
165 170 175
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Tyr Ser Phe Met His Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Leu Ala
195 200 205
Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala
225 230 235 240
Ala Thr Tyr Tyr Cys Gln His Ser Arg Glu Val Pro Trp Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Arg Glu Pro Lys Ser Pro Asp Lys
260 265 270
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
305 310 315 320
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
485 490 495
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
500 505 510
Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu
515 520 525
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
530 535 540
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
545 550 555 560
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
565 570 575
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
580 585 590
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
595 600 605
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
610 615 620
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
625 630 635 640
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
645 650 655
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
660 665 670
Pro Arg
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к способу получения генетически сконструированных Т-клеток для иммунотерапии, и может быть использовано в медицине. Способ позволяет получить нацеленные на патологические клетки Т-клетки для иммунотерапии, которые могут быть обеспечены химерными антигенными рецепторами, нацеленными на антигенный маркер, являющийся общим и для патологических клеток, и для указанных Т-клеток, где гены, кодирующие указанные маркеры, инактивируют в указанных Т-клетках, и избежать самоэлиминации нацеленных Т-клеток в процессе иммунотерапии. 3 н. и 39 з.п. ф-лы, 17 ил., 24 табл., 3 пр.

Комментарии