Способы применения агонистов аро-2l-рецепторов и активаторов nk-клеток - RU2395294C2
Код документа: RU2395294C2
Чертежи














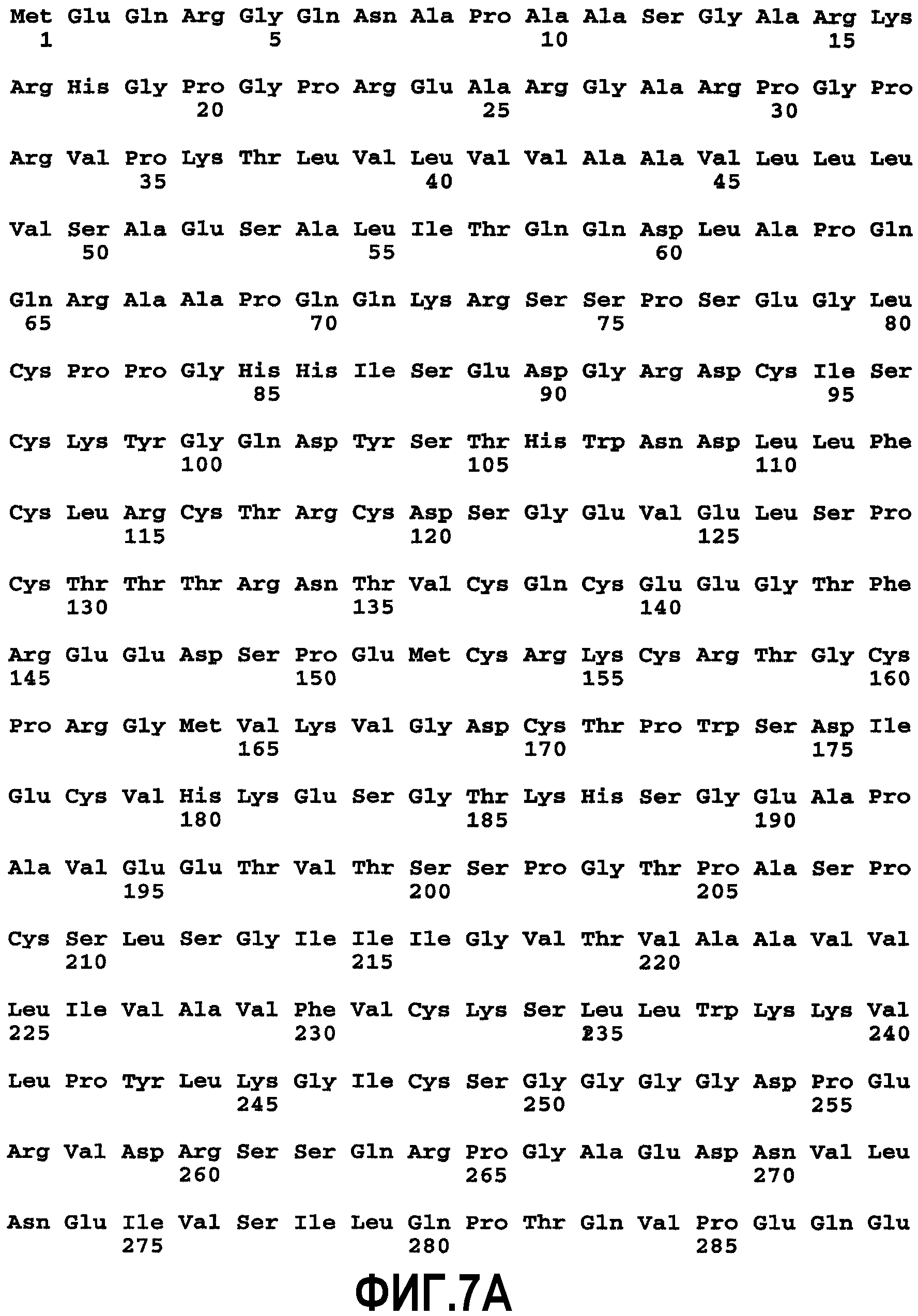


Описание
Родственные заявки
В соответствии с разделом 119(е), в этой заявке испрашивается приоритет по предварительной заявке на патент США № 60/581129, поданной 18 июня 2004 г., содержание которой включено сюда в качестве ссылки.
Область, к которой относится изобретение
Это изобретение относится в целом к способам усиления индукции апоптоза или цитолитической активности в клетках млекопитающих. В частности, оно относится к применению агонистов Apo-2L-рецепторов и NK-клеток (естественных киллерных) или активирующих их агентов для индукции апоптоза или цитолитической активности в клетках млекопитающих. Различные агонисты Apo-2L-рецепторов, предусмотренные изобретением, включают в себя лиганд, известный как Apo-2-лиганд, или TRAIL, а также агонистические антитела, направленные на один или более Apo-2L-рецепторов. Различные активирующие NK-клетки агенты, предусмотренные изобретением, включают в себя, без ограничения, агенты, активирующие Toll-рецепторы, IL-2, IL-12, IL-15, IFN-альфа, IFN-бета и агонистические антитела к активирующим рецепторам, таким как NKp30, NKp44, NKG2D.
Предпосылки изобретения
Считается, что регуляция количества клеток у млекопитающих частично определяется балансом между клеточной пролиферацией и гибелью клеток. Одна из форм гибели клеток, иногда именуемая некротической гибелью клеток, обычно характеризуется как патологическая форма гибели клеток в результате некоторой травмы или клеточного повреждения. Напротив, существует другая, «физиологическая» форма гибели клеток, которая обычно происходит упорядоченным или регулируемым образом. Эта упорядоченная или регулируемая гибель клеток часто именуется «апоптозом» [см., например, Barr et al., Bio/Technology, 12:487-493 (1994); Steller et al., Science, 267:1445-1449 (1995)]. Апоптотическая гибель клеток естественным образом происходит при многих физиологических процессах, включая эмбриональное развитие и клональный отбор в иммунной системе [Itoh et al., Cell, 66:233-243 (1991)].
Различные молекулы, такие как фактор некроза опухоли альфа («TNF-альфа»), фактор некроза опухоли бета («TNF-бета» или «лимфотоксин-альфа»), лимфотоксин-бета («LT-бета»), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, лиганд Apo-1 (также именуемый Fas-лигандом или лигандом CD95), Аро-2-лиганд (также именуемый Apo2L, или TRAIL), лиганд Apo-3 (также именуемый TWEAK), APRIL, лиганд OPG (также именуемый лиганд RANK, ODF или TRANCE) и TALL-1 (также именуемый BlyS, BAFF или THANK) были идентифицированы как члены семейства факторов некроза опухоли ("TNF") цитокинов [см., например, Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992), WO 97/01633, опубликованная 16 января 1997 г; WO 97/25428, опубликованная 17 июля 1997 г; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO 98/28426, опубликованная 2 июля 1998 г; WO 98/46751, опубликованная 22 октября 1998 г.; WO 98/18921, опубликованная 7 мая 1998 г.; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)]. Сообщалось, что среди этих молекул, TNF-альфа, TNF-бета, лиганд CD30, лиганд 4-1BB, лиганд Apo-1, Аро-2-лиганд (Apo2L/TRAIL), лиганд Apo-3 (TWEAK) участвуют в апоптотической гибели клеток.
Apo2L/TRAIL был идентифицирован несколько лет назад как член семейства цитокинов TNF [см., например, Wiley et al., Immunity, 3:673-682(1995); Pitti et al., J. Biol. Chem., 271:12697-12690 (1996); патент США № 6284236, выданный 4 сентября 2001 г.]. Нативная последовательность полной длины человеческого полипептида Apo2L/TRAIL представляет собой трансмембранный белок типа II длиной в 281 аминокислоту. Некоторые клетки могут продуцировать природную, растворимую форму этого полипептида посредством ферментативного расщепления внеклеточной области полипептида [Mariani et al., J. Cell. Biol., 137:221-229 (1997)]. Кристаллографические исследования растворимых форм Apo2L/TRAIL выявляют гомотрехмерную структуру, аналогичную структурам TNF и других родственных белков [Hymowitz et al., Molec. Cell, 4:563-571 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)]. Однако было обнаружено, что Apo2L/TRAIL, в отличие от других членов семейства TNF, имеют необычный структурный признак в том, что 3 цистеиновых остатка (в положении 230 каждой субъединицы в гомотримере) вместе координируют атом цинка и что связывание цинка важно для трехмерной устойчивости и биологической активности [Hymowitz et al., выше, Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)].
В литературе сообщалось, что Apo2L/TRAIL может играть роль в модуляции иммунной системы, включая аутоиммунные заболевания, такие как ревматоидный артрит [см., например, Thomas et al., J. Immunol., 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)].
Сообщалось также, что растворимые формы Apo2L/TRAIL вызывают апоптоз в разнообразных раковых клетках in vitro, включая опухоли толстой кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичников и мозга, а также меланому, лейкоз и множественную миелому [см., например, Wiley et al., выше; Pitti et al., выше; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)]. Исследования in vivo на мышиных моделях опухолей, кроме того, свидетельствуют о том, что Apo2L/TRAIL, отдельно или в комбинации с химиотерапией или лучевой терапией, может оказывать существенные противоопухолевые эффекты [см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999)]. В отличие от многих типов раковых клеток оказывается, что большинство нормальных типов человеческих клеток устойчивы к индукции апоптоза определенными рекомбинантными формами Apo2L/TRAIL [Ashkenazi et al., выше; Walzcak et al., выше]. Jo et al. сообщили, что меченная полигистидином растворимая форма Apo2L/TRAIL вызывала апоптоз in vitro в нормальных изолированных гепатоцитах человека в отличие от нечеловеческих гепатоцитов [Jo et al., Nature Med., 6: 564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)]. Считается, что определенные препараты рекомбинантного Apo2L/TRAIL могут варьировать с точки зрения биохимических свойств и биологической активности в отношении пораженных патологией клеток, в сравнении со здоровыми клетками, в зависимости, например, от присутствия или отсутствия молекулы метки, содержания цинка и % содержания тримера [см., Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)].
Считается, что индукция различных клеточных реакций, опосредованных цитокинами семейства TNF, инициируется их связыванием со специфическими клеточными рецепторами. Были идентифицированы 2 различных рецептора TNF приблизительно в 55 кДа (TNFR1) и 75 кДа (TNFR2) [Hohman et al., J. Biol. Chem., 264:14927-14934 (1989); Brockhaus et al., Proc. Natl. Acad. Sci., 87:3127-3131 (1990); EP 417563, опубликована 20 марта 1991 г.] и были выделены и охарактеризованы человеческие и мышиные кДНК, соответствующие обоим типам рецепторов [Loetscher et al., Cell, 61:351 (1990); Schall et al., Cell, 61:361 (1990); Smith et al., Science, 248:1019-1023 (1990); Lewis et al., Proc. Natl. Acad. Sci., 88:2830-2834 (1991); Goodwin et al., Mol. Cell. Biol., 11:3020-3026 (1991)]. Обширный полиморфизм был связан с генами обоих рецепторов TNF [см., например, Takao et al., Immunogenetics, 37:199-203 (1993)]. Оба TNFR имеют типичную структуру рецепторов клеточной поверхности, включая внеклеточную, трансмембранную и внутриклеточную области. Внеклеточные части обоих рецепторов естественно обнаруживаются, также как растворимые белки, связывающие TNF [Nophar, Y. et al., EMBO J., 9:3269 (1990); и Kohno, T. et al., Proc. Natl. Acad. Sci. USA., 87:8331 (1990)]. О клонировании рекомбинантных растворимых рецепторов TNF сообщалось ранее Hale et al. [J. Cell. Biochem. Supplement 15F, 1991, p. 113 (P424)].
Внеклеточная часть TNFR типа 1 и типа 2 (TNFR1 и TNFR2) содержит повторяющийся тип аминокислотной последовательности четырех богатых цистеином доменов (CRD), обозначенных с 1 по 4, начиная с NH2-конца. Каждый CRD имеет длину примерно в 40 аминокислот и содержит 4-6 цистеиновых остатков в положениях, которые являются весьма консервативными [Schall et al., выше; Loetscher et al., выше; Smith et al., выше; Nophar et al., выше, Kohno et al., выше]. В TNFR1 приблизительные границы четырех CRD следующие: CRD1 - аминокислоты от 14 до примерно 53; CRD2 - аминокислоты примерно от 54 до примерно 97; CRD3 - аминокислоты примерно от 98 до примерно 138; CRD4 - аминокислоты примерно от 139 до примерно 167. В TNFR2 CRD1 включает аминокислоты с 17 до примерно 54; CRD2 - аминокислоты примерно от 55 до примерно 97; CRD3 - аминокислоты примерно от 98 до примерно 140 и CRD4 - аминокислоты примерно от 141 до примерно 179 [Banner et al., Cell, 73:431-435 (1993)]. Возможная роль CRD в связывании лиганда также описана Banner et al., выше.
Аналогичный повторяющийся тип CRD существует в нескольких других белках клеточной поверхности, включая рецептор фактора роста нервов (NGFR) р.75 [Johnson et al., Cell, 47:545 (1986); Radeke et al., Nature, 325:593 (1987)], антиген CD 40 В-клеток [Stamenkovic et al., EMBO J., 8:1403 (1989)], антиген ОХ40 Т-клеток [Mallet et al., EMBO J., 9:1063 (1990)] и Fas-антиген [Yonehara et al., J. Exp. Med., 169:1747-1756 (1989) и Itoh et al., Cell, 66:233-243 (1991)]. CRD также обнаруживаются в растворимых, подобных TNFR (sTNRF) белках поксвирусов Shope и миксомы [Upton et al., Virology, 160:20-29 (1987); Smith et al., Biochem. Biophys. Res. Commun., 176:335 (1991); Upton et al., Virology, 184:370 (1991)]. Оптимальное выравнивание этих последовательностей указывает на то, что положения цистеиновых остатков весьма консервативны. Эти рецепторы иногда совместно именуются членами суперсемейства рецепторов TNF/NGF. Недавно проведенные исследования на p75NGFR показали, что делеция CRD1 [Welcher, A.A. et al., Proc. Natl. Acad. Sci. USA, 88:159-163 (1991)] или инсерция 5-аминокислоты в этот домен [Yan, H. and Chao, M.V., J. Biol. Chem., 266:12099-12104 (1991)] оказывают небольшой или не оказывают эффекта на связывание NGF [Yan, H. and Chao, M.V., см. выше]. p75 NGFR содержит богатый пролином фрагмент секвенирования примерно из 60 аминокислот, между его CRD4 и трансмембранной областью, которая не участвует в связывании NGF [Peetre, C. et al., Eur. J. Hematol., 41:414-419 (1988); Seckinger, P. et al., J. Biol. Chem., 264:11966-11973 (1989); Yan, H. and Chao, M.V., выше]. Аналогичная богатая пролином область обнаруживается в TNFR2, но не в TNFR1.
Лиганды семейства TNF, идентифицированные к настоящему времени, за исключением лимфотоксина-α, представляют собой трансмембранные белки II типа, чей С-конец является внеклеточным. Напротив, большинство рецепторов в семействе рецепторов TNF (TNFR), идентифицированных к настоящему времени, представляют собой трансмембранные белки I типа. Однако в обоих семействах лигандов и рецепторов гомология, идентифицированная между членами семейств, главным образом обнаруживалась во внеклеточном домене ("ECD"). Несколько цитокинов семейства TNF, включая TNF-α, лиганд Apo-1 и лиганд CD40, протеолитически расщепляются на клеточной поверхности; полученный белок в каждом случае обычно образует гомотримерную молекулу, которая функционирует в качестве растворимого цитокина. Белки семейства рецепторов TNF также обычно протеолитически расщепляются с высвобождением растворимых рецепторов ECD, которые могут функционировать в качестве ингибиторов родственных цитокинов.
Недавно были идентифицированы другие члены семейства TNFR. Такие вновь идентифицированные члены семейства TNFR включают CAR1, HVEM и остеопротегерин (OPG) [Brojatsch et al., Cell, 87:845-855 (1996); Montgomery et al., Cell, 87:427-436 (1996); Marsters et al., J. Biol. Chem., 272:14029-14032 (1997); Simonet et. al., Cell, 89:309-319 (1997)]. В отличие от других известных молекул, подобных TNFR, Simonet et al. (см. выше) сообщают, что OPG не содержит гидрофобной трансмембранной последовательности. Считают, что OPG действует в качестве рецептора-приманки, как описано ниже.
Pan et al. раскрыли другой член семейства рецепторов TNF, именуемого "DR4" [Pan et al., Science, 276:111-113 (1997)]. Сообщалось, что DR4 содержит домен цитоплазматической гибели, способный запускать аппарат клеточного суицида. У Pan et al. раскрыто, что CD4 считается рецептором для лиганда, известного как Аро-2-лиганд, или TRAIL.
В публикациях Sheridan et al., Science, 277:818-821 (1997) и Pan et al., Science, 277:815-818 (1997) описана другая молекула, которая, как считают, представляет собой рецептор для Apo-2L/TRAIL [см. также WO 98/51793, опубликованную 19 ноября, 1998 г.; WO 98/41629, опубликованную 24 сентября 1998 г.]. Эта молекула именуется DR5 [она также альтернативно именовалась Apo-2; TRAIL-R, TR6, Tango-63, hAPO8, TRICK2 или KILLER [Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованная 20 августа 1998 г.; ЕР 870827, опубликованная 14 октября 1998 г.; WO 98/46643, опубликованная 22 октября 1998 г.; WO 99/02653, опубликованная 21 января 1999 г.; WO 99/09165, опубликованная 25 февраля 1999 г.; WO 99/11791, опубликованная 11 марта 1999 г.]. Сообщается, что, аналогично DR4, DR5 содержит домен цитоплазматической гибели и способен передавать сигналы апоптоза. Кристаллическая структура комплекса, сформированного между Apo-2L/TRAIL и DR5, описана в публикации Hymowitz et al., Molecular Cell, 4:563-571 (1999).
Еще одна группа недавно идентифицированных членов семейства TNFR именуется «рецепторами-приманками», которые, как считается, функционируют в качестве ингибиторов, а не передатчиков сигнализации.. Эта группа включает DCR1 [также именуемые TRID, LIT или TRAIL-R3) [Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997) и Mongkolsapaya et al., J. Immunol., 160:3-6 (1998)] и DCR2 (также называемые TRUNDD или TRAIL-R4) [Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)], обе молекулы клеточной поверхности, а также OPG [Simonet et al., см. выше] и DCR3 [Pitti et al., Nature, 396:699-703 (1998)], обе из которых представляют собой секретируемые, растворимые белки. Сообщалось, что Apo-2L/TRAIL связывает те рецепторы, которые именуются DcR1, DcR2 и OPG.
Считается, что Apo-2L/TRAIL действует через «рецепторы гибели» клеточной поверхности DR4 и DR5 для активации каспаз, или ферментов, которые выносят внутриклеточную программу гибели клетки [см., например, Salvesen et al., Cell, 91:443-446 (1997)]. После связывания лиганда и DR4, и DR5 могут независимо запускать апоптоз вовлечением и активацией инициатора апоптоза, каспазы-8, посредством содержащей домен гибели адапторной молекулы, именуемой FADD/Mort1 [Kischkel et al., Immunity, 12:611-620(2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)]. В отличие от DR4 и DR5 рецепторы DcR1 и DcR2 не передают сигналы апоптоза.
Обзор семейства цитокинов TNF и их рецепторов можно найти в публикациях см., Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997); Gruss and Dower, выше, и Nagata, Cell, 88:355-365 (1997); Locksley et al., Cell, 104:487-501 (2001); Wallach, "TNF Ligand and TNF/NGF Receptor Families", Cytokine Research, Academic Press, pages 377-411 (2000).
Ряд молекул в семействе рецепторов Toll (TLR) были идентифицированы у человека, из них TLR 2, 4, 5 и 9, как считают, активируются высококонсервативными микробными продуктами, такими как соответственно липопротеины, LPS (липополисахариды), флагеллин и неметилированная ДНК CpG. TLR3 может активироваться двунитевой РНК, часто продуцируемой во время репликации вирусов, в то время как TLR7 может активироваться низкомолекулярными соединениями, такими как противовирусные имидазохинолины: имихимод и R-848. Человеческий TLR8 может также активироваться R-848, и последние сообщения демонстрируют, что однонитевая РНК представляет физиологический лиганд для TLR8.
TLR широко экспрессированы на клетках, которые важны для врожденных реакций на патогены. На представляющих антиген клетках ("APC") активация различных TLR приводит к разнообразным реакциям, включая продукцию цитокинов и ко-стимуляторные молекулы, которые инициируют и направляют адаптивную реакцию на определенные патогены. NK-клетки также экспрессируют члены семейства TLR. Очищенные NK-клетки экспрессируют TLR3, и их цитолитическая активность в отношении определенных опухолевых клеток может быть активирована под действием поли(I:C).
NK-клетки используют ряд активирующих и ингибиторных рецепторов для идентификации и устранения клеток-мишеней. Один класс активирующих рецепторов, которые запускают цитотоксичность NK, именуются NCR (рецепторами естественной цитотоксичности), которые включают в себя члены семейства иммуноглобулинов NKp46, NKp30 и NKp44 и лектин С-типа, NKG2D. Активности NCR противодействует сигнализация от ингибиторных рецепторов, специфичных для классических молекул класса I MHC (главного комплекса гистосовместимости), которые конститутивно экспрессируются нормальными клетками. Зависимый от перфорина путь экзоцитоза цитотоксических гранул представляет собой хорошо охарактеризованный механизм, посредством которого NK-клетки уничтожают клетки-мишени. Цитотоксические гранулы представляют собой специализированные секреторные лизосомы, которые содержат образующий поры белок перфорин, и семейство сериновых протеаз, известных как гранзимы, которые запускают быстрый апоптоз в клетках-мишенях. NK-клетки также используют «перфориннезависимые» механизмы клеточной поверхности для индукции цитотоксичности в клетках-мишенях.
Краткое описание сущности изобретения
Авторы изобретения обнаружили, что Аро-2-лиганд или другие агонисты рецепторов Apo-2L и NK-клетки или активирующие их агенты можно эффективно использовать в комбинации для индукции апоптоза или цитолитической активности в клетках млекопитающих, в частности, в пораженных клетках млекопитающих.
Изобретение предоставляет разнообразные способы для применения Аро-2-лиганда и NK-клеток или активирующего NK-клетки агента(ов) для усиления апоптоза или цитолитической активности в клетках млекопитающих. Например, изобретение предоставляет способы индукции апоптоза, включающие в себя приведение клетки млекопитающего, такой как раковая клетка или клетка, инфицированная вирусом или бактерией, в контакт с NK-клетками или активирующим NK-клетки агентом(ами) и одним или более агонистами рецепторов Аро-2-лиганда.
Клетки могут находиться в клеточной культуре или у млекопитающего, например, млекопитающего, страдающего раком или состоянием, при котором желательна индукция апоптоза в клетках. Таким образом, изобретение включает в себя способы лечения млекопитающего, страдающего расстройством, таким как рак или вирусная инфекция, включающие в себя введение эффективного количества Аро-2-лиганда и NK-клеток или активирующего NK-клетки агента(ов), как описано здесь.
Необязательно в способах может использоваться агонистическое антитело(антитела) против рецептора Аро-2-лиганда. Таким образом, изобретение предоставляет различные способы применения антитела(антител) против рецептора Аро-2-лиганда и NK-клеток или активирующего NK-клетки агента(агентов) для индукции апоптоза в клетках млекопитающих. В предпочтительном варианте осуществления агонистическое антитело должно включать в себя антитело против рецепторов DR4 или DR5.
В необязательных вариантах осуществления предоставляются способы усиления апоптоза в раковых клетках млекопитающих, включающие в себя приведение раковых клеток млекопитающих в контакт с эффективным количеством NK-клеток или активирующего NK-клетки агента(агентов) и агониста рецепторов Аро-2-лиганда, где указанные раковые клетки млекопитающих контактируют с NK-клетками или активирующим NK-клетки агентом(агентами) перед контактом с указанным агонистом рецепторов Аро-2-лиганда. Агонист рецепторов Аро-2-лиганда необязательно включает в себя полипептид Apo-2L или антитело против рецептора DR4 или антитело против рецептора DR5.
Изобретение также связано с композициями, которые включают в себя Аро-2-лиганд или агонистическое антитело против рецептора Apo-2L и/или NK-клетки или активирующий NK-клетки агент(агенты). Необязательно, композиции согласно изобретению включают в себя фармацевтически приемлемые носители или разбавители. Предпочтительно композиции включают в себя Аро-2-лиганд или агонистическое антитело и/или NK-клетки или активирующий NK-клетки агент(агенты) в количестве, которое эффективно для синергической индукции апоптоза в клетках млекопитающих.
Изобретение также предоставляет изготовляемые изделия и наборы, которые включают в себя Аро-2-лиганд или агонистическое антитело против рецептора Apo-2L и/или NK-клетки или активирующий NK-клетки агент(агенты).
Другие необязательные варианты осуществления иллюстрируются следующими способами:
1. Способ усиления апоптоза или цитотоксичности в клетках млекопитающих, включающий в себя приведение клеток млекопитающих в контакт с эффективным количеством агониста рецепторов Аро-2-лиганда и NK-клеток или активирующего NK-клетки агента(агентов).
2. Способ по п.1, где указанный агонист рецепторов Аро-2-лиганда включает в себя полипептид Apo-2-лиганда.
3. Способ по п.1, где указанные клетки млекопитающих представляют собой раковые клетки.
4. Способ по п.1, где указанные клетки млекопитающих представляют собой клетки, инфицированные вирусами или инфицированные бактериями.
5. Способ по п.2, где указанный полипептид Apo-2-лиганда включает в себя [последовательность] аминокислот с 39 по 281 на фиг.4 или ее биологически активный фрагмент.
6. Способ по п.5, где указанный полипептид Apo-2-лиганда включает в себя аминокислоты с 114 по 281 на фиг.4.
7. Способ по п.5, где указанный полипептид Apo-2-лиганда связан с одной или более молекулами полиэтиленгликоля (PEG).
8. Способ по п.1, где указанный агонист рецепторов Аро-2-лиганда представляет собой агонистическое антитело против рецептора Аро-2-лиганда.
9. Способ по п.8, где указанное агонистическое антитело включает в себя антитело против DR4.
10. Способ по п.8, где указанное агонистическое антитело включает в себя антитело против DR5.
11. Способ по п.9, где указанное антитело против DR4 представляет собой химерное, гуманизированное или человеческое антитело.
12. Способ по п.10, где указанное антитело против DR5 представляет собой химерное, гуманизированное или человеческое антитело.
13. Способ по п.1, где указанные NK-клетки представляют собой очищенные NK-клетки от млекопитающего донора.
14. Способ по п.1, где указанный агент, активирующий NK-клетки, выбран из группы, состоящей из агентов, активирующих Toll-рецепторы, IL-2, IL-12, IL-15, IFN-альфа и IFN-бета.
15. Способ по п.1, где указанный агент, активирующий NK-клетки, выбран из группы, состоящей из агонистических антител к активирующим рецепторам, таким как NKp30, NKp44, NKG2D.
Краткое описание чертежей
На фиг.1 показаны эффекты различных активаторов TLR на активность человеческих NK-клеток, по данным анализа высвобождения51Cr.
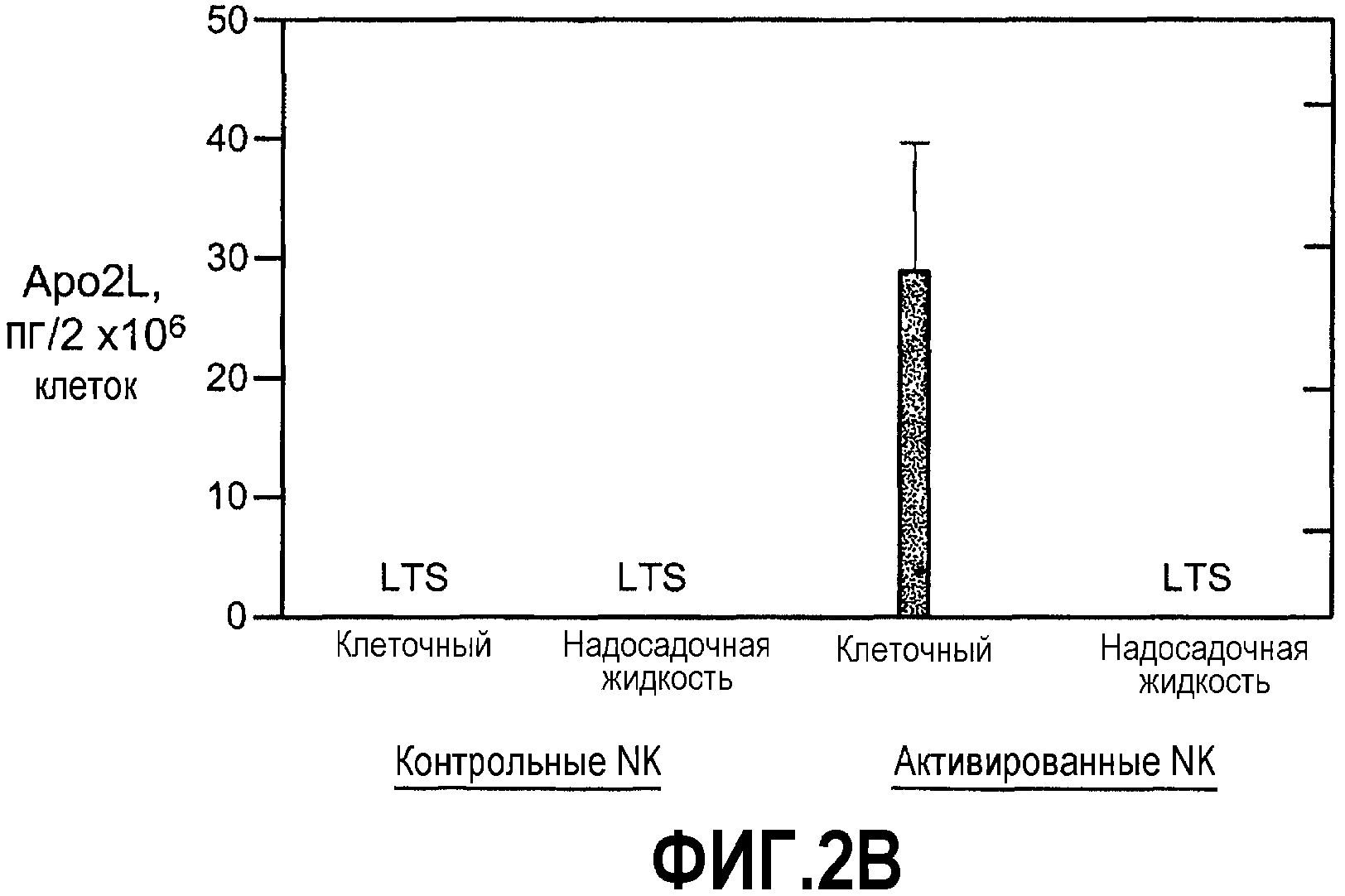
Фиг.2А-С иллюстрируют индукцию Apo2L/TRAIL на человеческих NK-клетках. (А) NK-клетки были обработаны поли(I:C), R-848 или человеческим интерфероном-альфа в присутствии или в отсутствие циклогексамида и Apo2L/TRAIL, передача сигналов измерялась в экстрагированной РНК. (В) Покоящиеся и стимулированные поли(I:C) лизаты NK-клеток или надосадочные жидкости культур оценивали для выявления присутствия белка Apo2L/TRAIL методом количественной ВЭЖХ. (С) Окрашивание для выявления Apo2L/TRAIL клеточной поверхности на очищенных NK-клетках, обработанных агентом, указанным в соответствующей панели. Жирная линия соответствует изотипическому контролю, а более тонкая линия - окрашиванию Apo2L/TRAIL. Результаты, показанные на все трех панелях, представляют собой репрезентативного донора (из трех или более доноров).
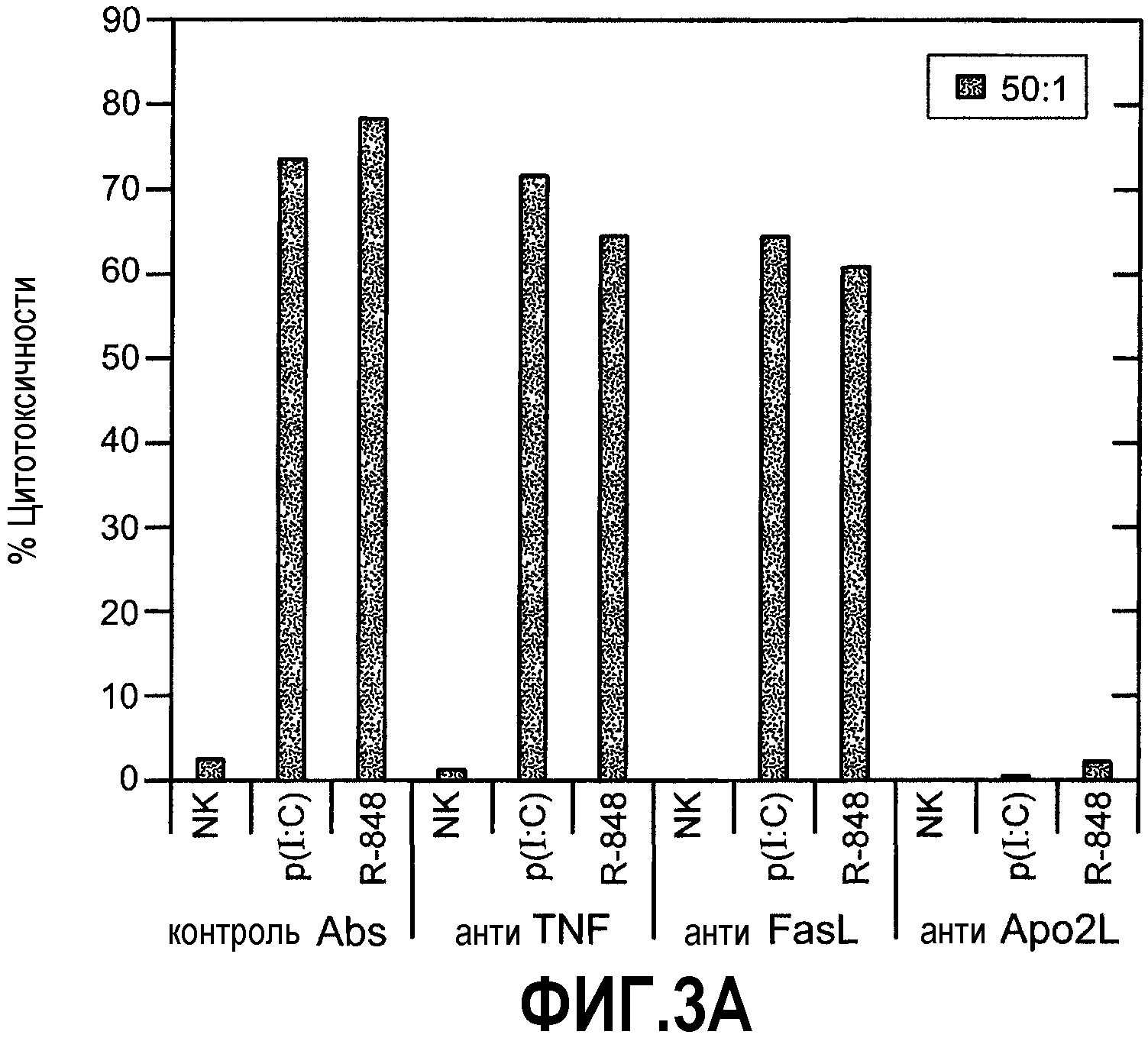
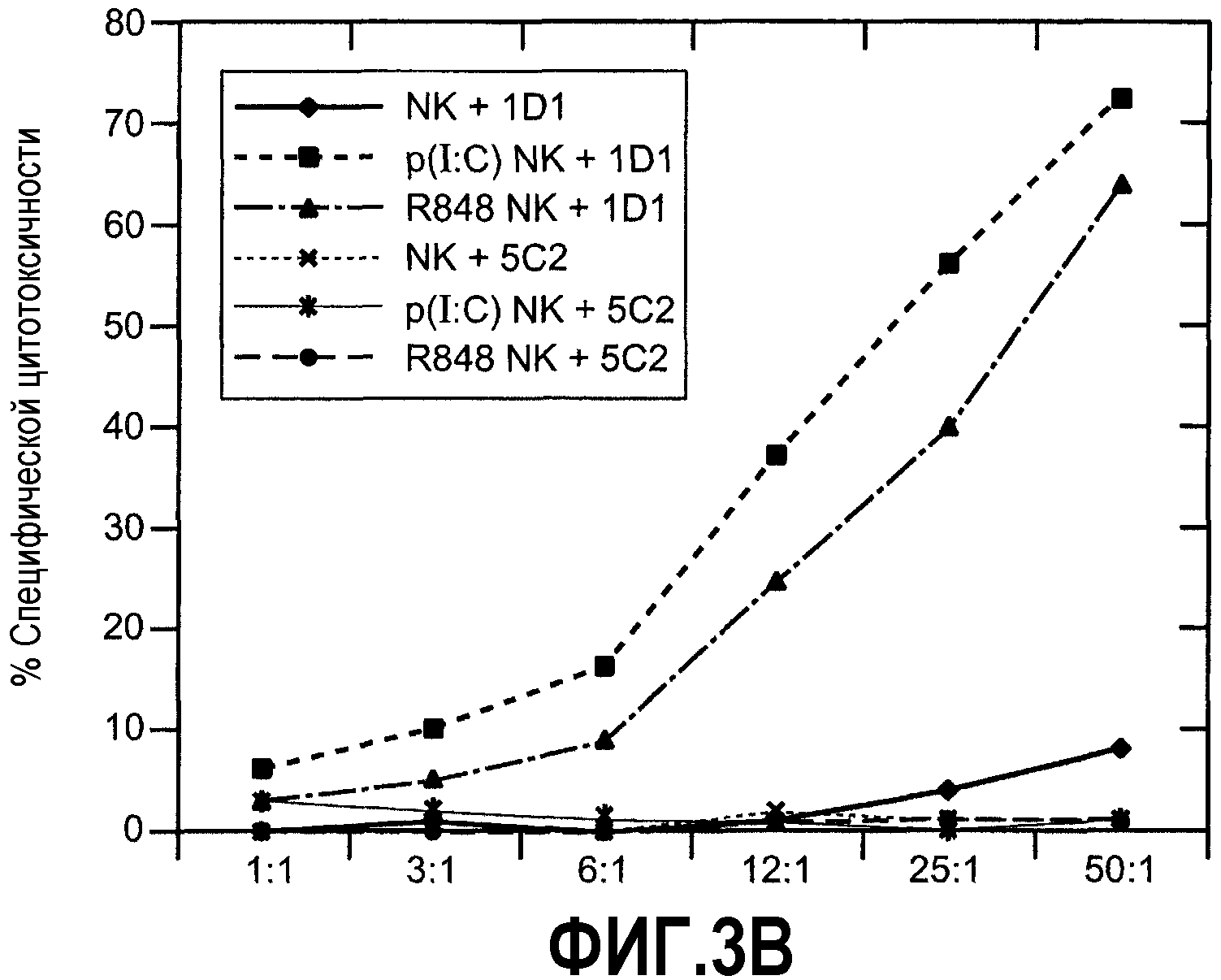
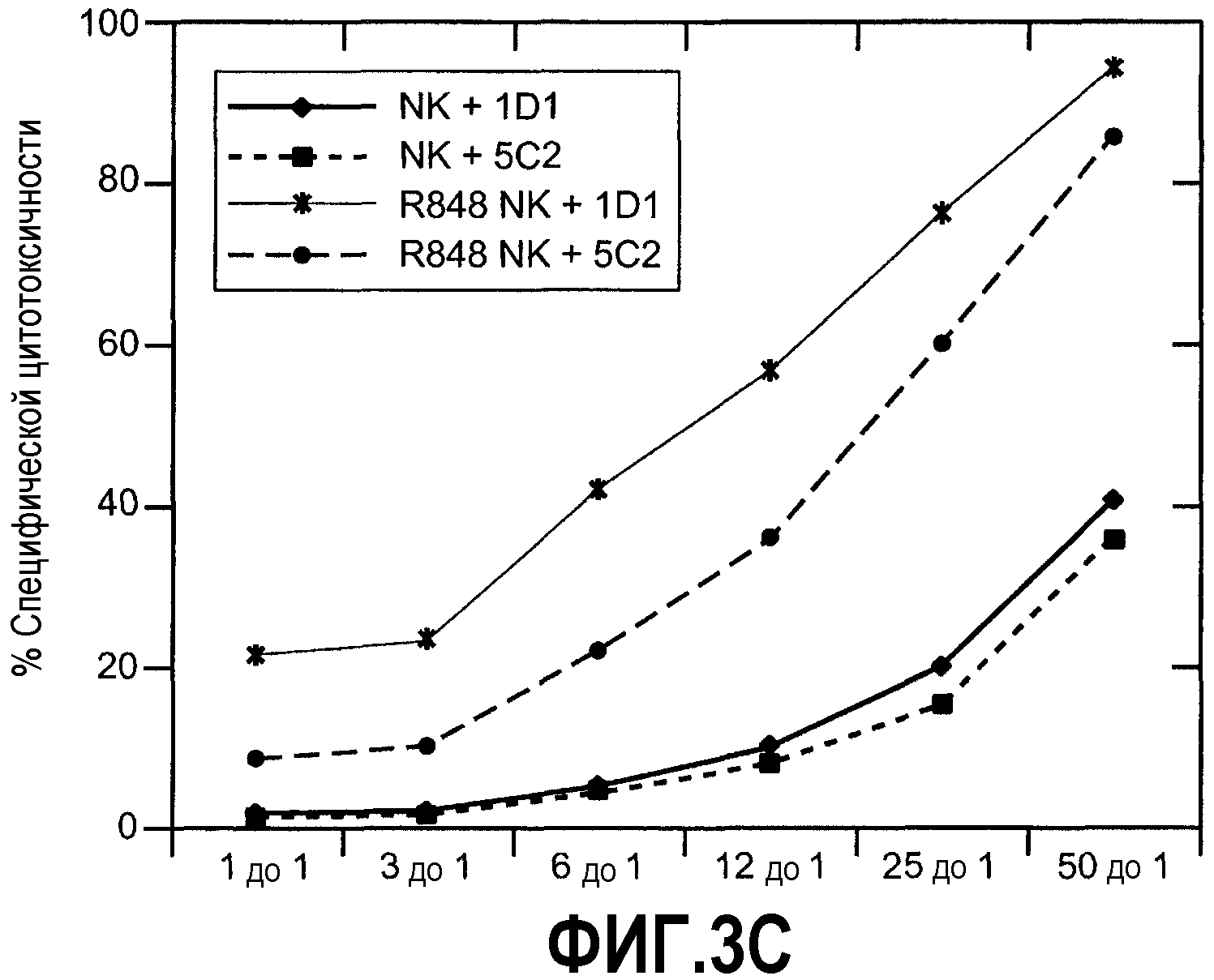
Фиг.3А-С иллюстрируют результаты анализа, показывающего роль Apo2L/TRAIL в активности активированных NK-клеток. (А) % лизиса, полученного при соотношении Е:Т 50:1. (В) Очищенные NK-клетки, обработанные поли(I:C) или R-848 и инкубированные с клетками B16BL10 в указанных соотношениях.. (С) Очищенные NK-клетки, стимулированные R-848, инкубировали с клетками-мишенями НСТ116 в указанных соотношениях. Роль Apo2L/TRAIL в анализах лизиса на панелях В и С определяли предварительной инкубацией с нейтрализующими и ненейтрализующими антителами против Apo2L/TRAIL. Данные были подтверждены NK-клетками по меньшей мере от 3 доноров, и наблюдалось SD (стандартное отклонение) менее чем 5%.
На фиг.4 показана нуклеотидная последовательность кДНК человеческого Аро-2-лиганда (SEQ ID NO:1) и происходящей из нее аминокислотной последовательности (SEQ ID NO:2). Нуклеотид "N" в положении 447 используется для указания, что нуклеотидное основание может представлять собой "T" или "G".
На фиг.5А и 5В показана нуклеотидная последовательность кДНК (SEQ ID NO:3) для человеческого DR4 полной длины и происходящей из нее аминокислотной последовательности (SEQ ID NO:4). Соответствующие нуклеотидные и аминокислотные последовательности для человеческого DR4 описаны в публикации Pan et al., Science, 276:111 (1997).
На фиг.6 показана последовательность из 411 аминокислот человеческого DR5 (SEQ ID NO:5), как опубликовано в WO 98/51793 19 ноября 1998 г.
На фиг.7 показан транскрипционный вариант сплайсинга человеческого DR5. Этот вариант сплайсинга DR5 кодирует последовательность из 440 аминокислот человеческого DR5 (SEQ ID NO:6), как опубликовано в WO 98/35986 20 августа 1998 г.
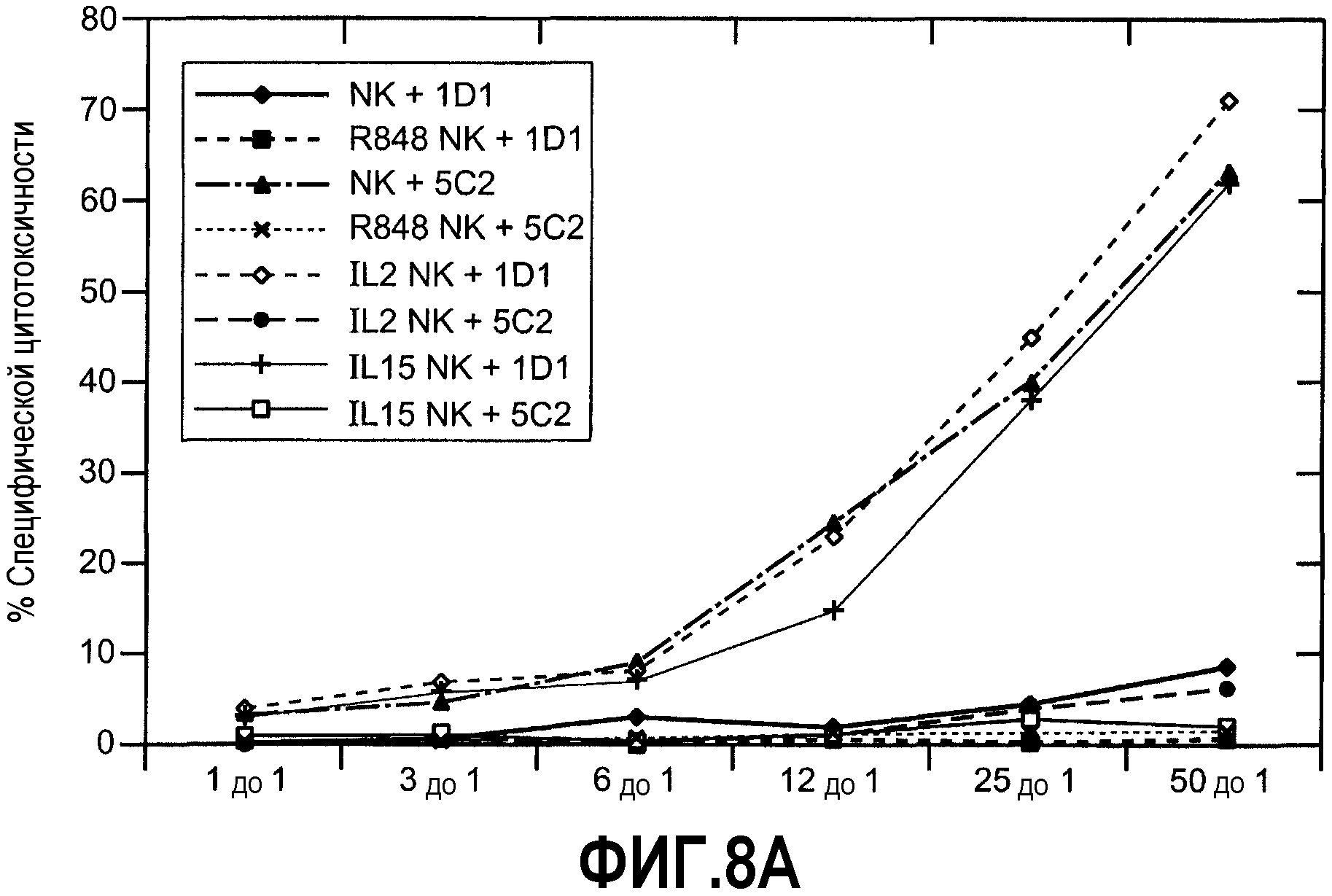
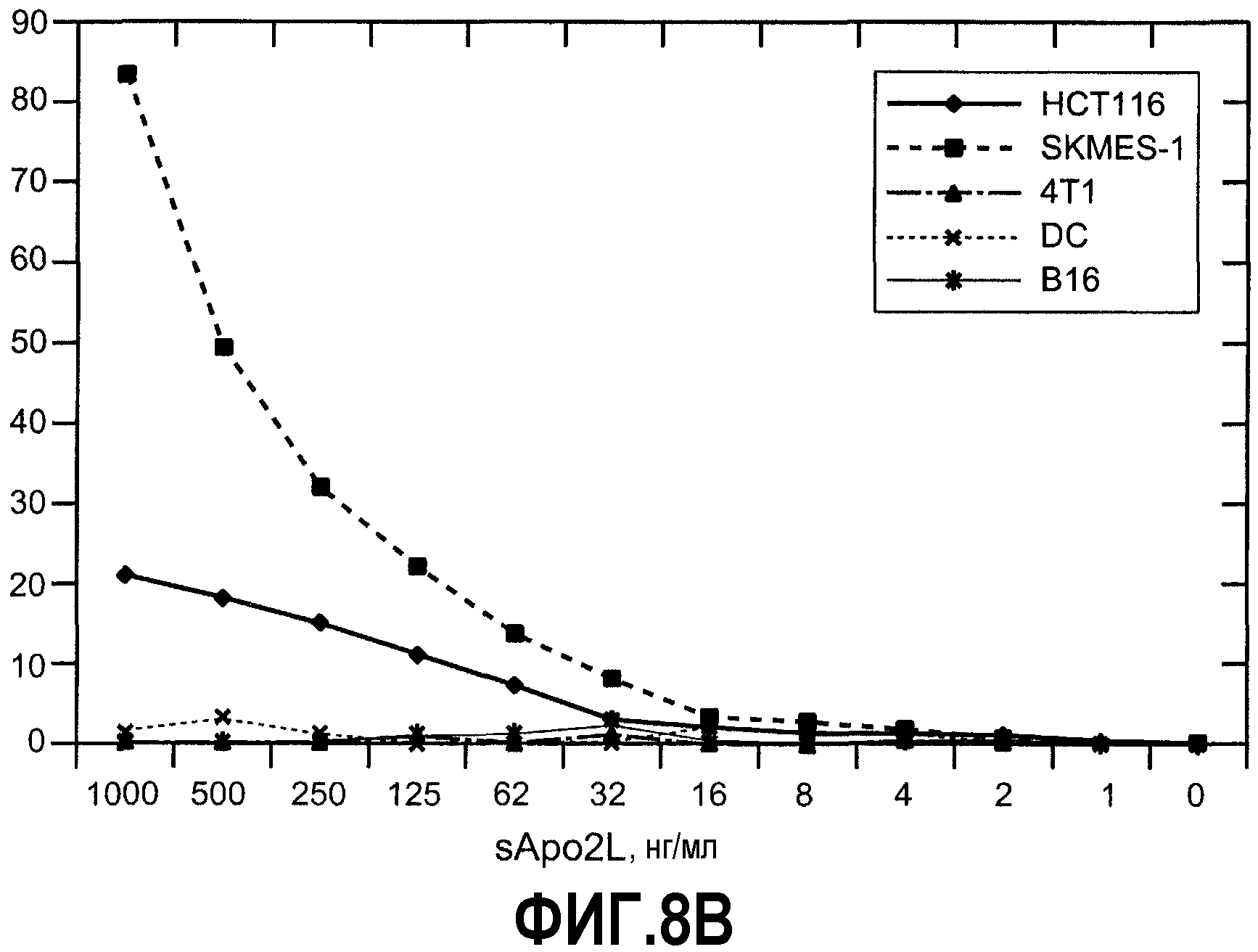
Фиг.8А иллюстрирует эффекты указанных агентов на клетки меланомы В16 и свидетельствует о том, что клетки были лизированы активированными NK-клетками зависимым от Apo2L/TRAIL образом. На фиг.8В показаны результаты анализа, где клетки В16 метили51Cr и культивировали с очищенными покоящимися или стимулированными NK-клетками в указанных соотношениях. Роль Apo2L/TRAIL оценивали, предварительно инкубируя NK-клетки или с нейтрализующим (5C2), или с не нейтрализующим (1D1) mAb. % Лизиса наносили на график, и результаты являются репрезентативными для 3 экспериментов (SD составляет менее 5%). Как показано на фиг.8В, указанные линии клеток и дендритные клетки (DC), полученные из первичных моноцитов, меченных51Cr и инкубированных с варьируемыми концентрациями растворенного белка Apo2L/TRAIL (указанными как "sApo2L") в течение 4 ч. Затем надосадочные жидкости оценивали на предмет высвобождения Cr. Аналогичные результаты цитолиза были получены по меньшей мере в 3 экспериментах.
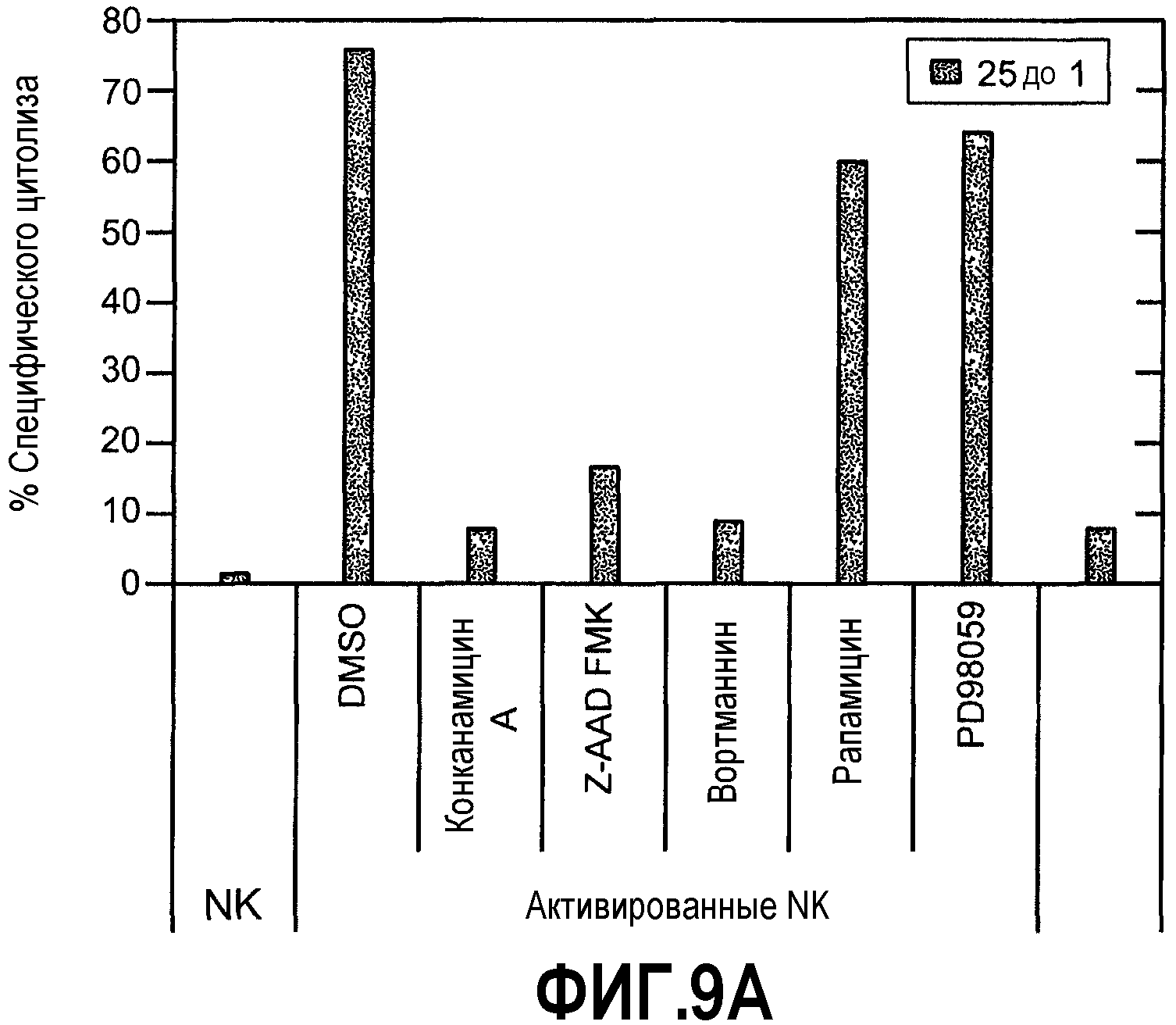
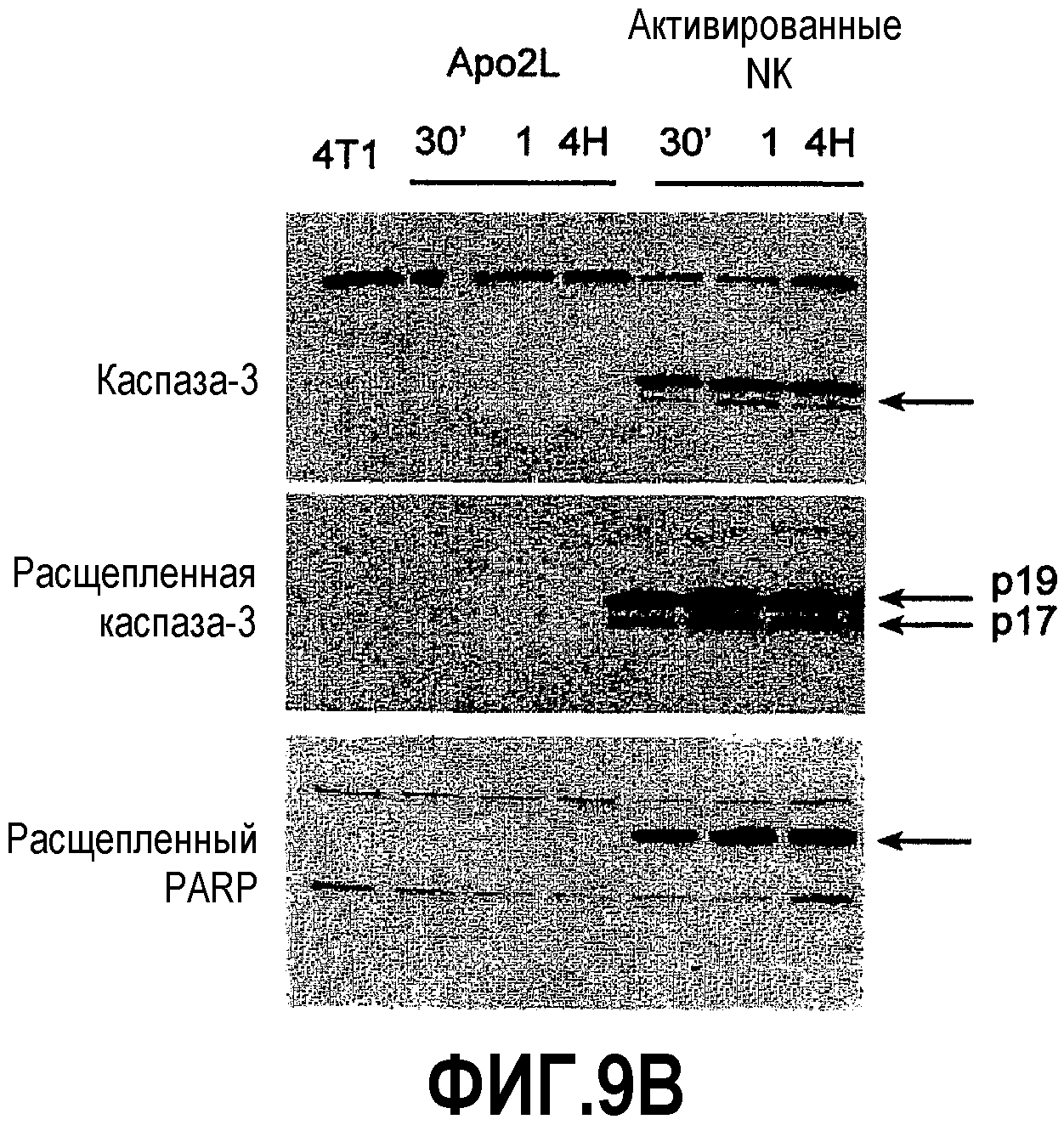
Фиг.9А представляет собой диаграмму по результатам количественного анализа, свидетельствующую о том, что цитотоксические гранулы активированных NK-клеток могут быть существенными для лизиса 4Т1-клеток. Цитолитическую активность покоящихся и активированных NK-клеток оценивали против клеток-мишеней 4Т1. Активированные NK-клетки обрабатывали ингибиторами созревания перфорина (конканамицином А), GraB (Z-AAD-FMK), PI3K (вортманнин), киназой МЕК1 (PD98059), киназой S6 (рапамицином) и JNK (SP) для оценки роли цитотоксических гранул. Отношение E/T составило 25 к 1, и показанные результаты получены от одного репрезентативного донора (из трех доноров). Фиг.9В иллюстрирует результаты количественного анализа, свидетельствующие о том, что активированные NK-клетки способны индуцировать активацию каспазы-3 в клетках 4Т1. Клетки-мишени 4Т1 обрабатывали белком Apo2L/TRAIL (100 нг/мл) или активированными NK-клетками ("Act NK") в течение 30 мин, 1 ч или 4 ч. Отношение E/T составило 10:1. Экстракты клеток 4Т1 анализировали SDS-PAGE (электрофорезом на полиакриламидном геле с додецилсульфатом натрия) и анализом иммуноблоттинга для выявления про-каспазы-3, расщепленной каспазы-3 и расщепленной PARP (полимеразы поли(АДФ-рибозы)).
На фиг.10 показаны результаты количественного анализа расщепления PARP. Клетки 4Т1 обрабатывали Apo2L/TRAIL, покоящимися NK-клетками ("NK") или активированными NK-клетками ("Act NK"), отдельно или в комбинации. Лизаты анализировали для выявления расщепления PARP, показатель активации каспазы-3. Использовали NK-клетки от множественных доноров, и показаны результаты от одного репрезентативного донора.
Подробное описание изобретения
I. Определения
Термины «апоптоз» и «апоптотическая активность» используются в широком смысле и относятся к упорядоченной или регулируемой форме гибели клеток у млекопитающих, которая обычно сопровождается одним или более характерными изменениями клеток, включая конденсацию цитоплазмы, потерю микроворсинок плазматической мембраны, сегментацию ядра, расщепление хромосомной ДНК или потерю функции митохондрий. Эту активность можно определить и измерить, используя методики, известные в данной области, например, анализами жизнеспособности клеток, FACS-анализом (с использованием сортера клеток по интенсивности флюоресценции) или электрофорезом ДНК, а конкретнее связыванием аннексина V, фрагментацией ДНК, расщеплением PARP, сморщиванием клеток, расширением эндоплазматической сети, фрагментацией клеток и/или формированием мембранных пузырьков (называемых апоптотическими телами). Эти методики и количественные анализы описаны в данной области, например, в WO 97/25428 и WO 97/01633.
Используемый здесь термин «синергия», или «синергизм», или «синергически» относится к взаимодействию двух или более агентов, при котором их комбинированный эффект больше, чем сумма эффектов, которые возникают в результате такой же обработки с использованием соответствующих агентов раздельно.
Термины «Apo-2-лиганд», «Apo-2L» или "TRAIL" используются здесь для обозначения полипептида, который включает в себя аминокислотные остатки 95-281 включительно, 114-281 включительно, остатки 91-281 включительно, остатки 92-281 включительно, остатки 41-281 включительно, остатки 15-281 включительно, или остатки 1-281 включительно, аминокислотной последовательности, показанной на фиг.1А публикации Pitti et al., J. Biol. Chem., 271:12687-12690 (1996) (представленной здесь на фиг.4), а также биологически активные (например, имеющие апоптотическую активность) фрагменты, делеционные, инсерционные или заместительные варианты указанных выше последовательностей. В одном варианте осуществления полипептидная последовательность включает в себя остатки 114-281 на фиг.4. Необязательно полипептидная последовательность имеет по меньшей мере остатки 91-281 или остатки 92-281. В другом предпочтительном варианте осуществления биологически активные фрагменты или варианты имеют степень идентичности аминокислотных последовательностей, составляющую по меньшей мере примерно 80%, предпочтительнее, по меньшей мере 90%, а еще предпочтительнее, по меньшей мере 95%, 96%, 97%, 98% или 99%, с одной из последовательностей, представленных выше. Это определение охватывает заместительные варианты Аро-2-лиганда, включающие в себя аминокислоты 91-281 на фиг.1А в публикации Pitti et al., J. Biol. Chem., 271:12687-12690 (1996) (представленной здесь на фиг.4), в которой по меньшей мере одна из аминокислот в положениях 203, 218 или 269 (пользуясь нумерацией последовательности, представленной на фиг.4) замещены аланиновым остатком. Это определение охватывает Аро-2-лиганд, выделенный из источника Аро-2-лиганда, такого как из типов тканей человека, или из другого источника, или полученный рекомбинантными или синтетическими способами. Аро-2-лиганд может, например, представлять собой растворимый полипептид или быть экспрессирован на клеточной поверхности клеток млекопитающих. Термин Аро-2-лиганд также относится к полипептидам, описанным в приведенных выше документах WO 97/25428 и WO 97/01633. Предусматривается, что полипептид Аро-2-лиганда может быть связан с одной или более молекул полимера, такого как полиэтиленгликоль.
«Степень (%) идентичности аминокислотной последовательности» в отношении идентифицированной здесь полипептидной последовательностей Apo-2L определяется как процентная доля аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в последовательности Apo-2L после выравнивания последовательностей и, при необходимости, введения гэпов для достижения максимальной процентной идентичности, при этом не рассматривая любые консервативные замены как часть идентичности последовательностей. Выравнивание в целях определения степени идентичности аминокислотной последовательности можно достичь различными путями, которые входят в объем навыков в данной области, например, общедоступное компьютерное программное обеспечение, такое как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Необязательно, величины % идентичности аминокислотных последовательностей получают с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2 была утверждена Genentech, Inc., и код источника был подан с документацией пользователя в US Copyright Office, Washington, D.C., 20559) Агентство США по Авторским Правам, где он зарегистрирован под № US Copyright Registration No TXU510087 (регистрационным номером авторского права). Программа ALIGN-2 общедоступна через компанию Genentech, Inc., South San Francisco, California. Программу ALIGN-2 следует составить для использования на операционной системе UNIX, предпочтительной, цифровой UNIX V4.OD. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются. Однако % идентичность аминокислотных последовательностей можно также определить, используя программу сравнения последовательностей NCBI-BLAST2 (Altschul et al., Nucleic Acids Res. 25:3389-3402 (1997)). Программу сравнения последовательностей NCBI-BLAST2 можно загрузить с сайта Интернета http://www.ncbi.nlm.nih.gov. В NCBI-BLAST2 используются несколько параметров поиска, где все из этих параметров поиска установлены на величины по умолчанию, включая, например, раскрыть = да, нити = все, ожидаемые частоты встречаемости = 10, минимальная длина низкой сложности = 15/5, е - величина множественного прохождения = 0,01, константа множественного прохождения = 25, выпадение для конечного выравнивания с гэпами = 25 и матрица балльной оценки = BLOSUM62.
Термин «антитело» при использовании в отношении «агонистического антитела против рецептора Apo-2-лиганда» используется в самом широком смысле и конкретно охватывает интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител, пока они связывают один или более рецепторов Apo-2-лиганда и/или способны активировать путь передачи сигналов апоптоза клетки млекопитающего, экспрессирующие один или более рецепторов Apo-2-лиганда или имитировать (например, иметь сравнимую или по меньшей мере равную) апоптотическую активность Apo-2-лиганда или иметь большую апоптотическую активность, чем активность Apo-2-лиганда.
«Рецептор Apo-2-лиганда» включает в себя рецепторы, именуемые в данной области "DR4" "и DR5". Pan et al. описали член семейства рецепторов TNF, именуемый "DR4" [Pan et al., Science, 276:111-113 (1997); см. также документ WO 98/32856, опубликованный 30 июля 1998 г]. Сообщалось, что рецептор DR4 содержит домен цитоплазматической гибели, способный приводить в действие аппарат клеточного суицида. Pan et al. раскрывают, что DR4 считают рецептором для лиганда, известного как Apo2L/TRAIL. Аминокислотная последовательность рецептора DR4 полной длины представлена здесь в виде фиг.5. Sheridan et al., Science, 277:818-821 (1997) и Pan et al., Science, 277:815-818 (1997) описали другой рецептор для Apo2L/TRAIL [см. также WO 98/51793, опубликованный 19 ноября 1998 г.; WO 98/41629, опубликованный 24 сентября 1998 г.]. Этот рецептор именуется DR5 (этот рецептор также альтернативно именовался Apo-2; TRAIL-R, TR6, Tango-63, hAPO8, TRICK2 или KILLER; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа 1998 г. (соответствующий выданному патенту США № 6072047); ЕР 870827, опубликованный 14 октября 1998 г.; WO 98/46643, опубликованный 22 октября 1998 г.; WO 99/02653, опубликованный 21 января 1999 г.; WO 99/09165, опубликованный 25 февраля 1999 г.; WO 99/11791, опубликованный 11 марта 1999 г.]. Сообщается, что DR5, как и DR4, содержит домен цитоплазматической гибели и способен передавать сигналы апоптоза. В WO 98/35986 (соответствующем патенту США № 6072047) сообщается, что последовательность полной длины рецептора DR5 представляет собой полипептид из 440 аминокислот и что эта аминокислотная последовательность представлена на фиг.7. В WO 98/51793 сообщается, что последовательность полной длины рецептора DR5 представляет собой полипептид из 411 аминокислот и что эта аминокислотная последовательность представлена на фиг.6. Как описано выше, другие рецепторы для Apo-2L включают в себя DcR1, DcR2 и OPG [см. Sheridan et al., выше Marsters et al., выше; и Simonet et al., выше]. При использовании здесь термин «рецептор Apo-2L» охватывает рецептор нативной последовательности и варианты рецептора. Эти термины охватывают рецептор Apo-2L, экспрессированный у разнообразных млекопитающих, включая людей. Рецептор Apo-2L может быть эндогенно экспрессирован, как естественно происходит в разнообразных линиях дифференцировки человеческих тканей, или может быть экспрессирован рекомбинантными или синтетическими способами. «Рецептор Apo-2L с нативной последовательностью» включает в себя полипептид, имеющий такую же аминокислотную последовательность, как и природный рецептор Apo-2L. Таким образом, рецептор Apo-2L с нативной последовательностью может иметь аминокислотную последовательность природно встречающегося рецептора Apo-2L из любого животного. Такой рецептор Apo-2L с нативной последовательностью можно выделить в природе или получить рекомбинантными или синтетическими средствами. Термин «рецептор Apo-2L с нативной последовательностью» конкретно охватывает природно встречающиеся усеченные или секретируемые формы рецептора (например, растворимую форму, содержащую, например, последовательность внеклеточного домена), природно встречающиеся вариантные формы (например, альтернативно подвергнутые сплайсингу формы) и природно встречающиеся аллельные варианты. Варианты рецепторов могут включать фрагменты или делеционные мутанты рецептора Apo-2L с нативной последовательностью.
Используемый здесь термин «моноклональное антитело» относится к антителу, полученному из популяции по существу однородных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных природно встречающихся мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифическими, направленными против одной области детерминанты. Кроме того, в отличие от обычных препаратов (поликлонального) антитела, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. В дополнение к их специфичности моноклональные антитела имеют преимущества в том, что они синтезируются культурой гибридомы, не загрязненной другими иммуноглобулинами. Определитель «моноклональное» указывает на характер антитела как полученного по существу из однородной популяции антител, и его не следует рассматривать как требующий продукции антитела любым конкретным способом. Например, моноклональные антитела, подлежащие использованию в соответствии с настоящим изобретением, можно получить способом гибридомы, впервые описанным Kohler et al., Nature, 256:495 (1975), или можно получить способом рекомбинантной ДНК (см., например, патент США № 4816567). «Моноклональные антитела» можно также выделить из библиотек антител фага, используя методики, описанные, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991).
Моноклональные антитела конкретно включают здесь «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенного вида или относящихся к определенному классу или подклассу антител, тогда как остальная цепь (цепи) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, пока они проявляют желательную биологическую активность (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)).
«Гуманизированные» формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или связывающие антиген субпоследовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Главным образом, гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из определяющей комплементарность области (CDR) реципиента замещены остатками из CDR нечеловеческого вида (антитело-донор), такого как мышь, крыса или кролик, имеющего желательную специфичность, аффинность и активность. В некоторых случаях остатки каркасной области (FR) Fv человеческого иммуноглобулина замещаются соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаруживаются ни в теле реципиента, ни в импортированной CDR или каркасной последовательности. Эти модификации произведены для дальнейшего уточнения и максимализации функции антитела. В целом гуманизированное антитело включает в себя по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют таковым нечеловеческого иммуноглобулина, и все или по существу все из областей FR представляют собой таковые последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также включает в себя по меньшей мере часть константной области иммуноглобулина (Fc), обычно таковую человеческого иммуноглобулина. Дополнительные детали можно найти в публикациях см. Jones et al., Nature, 321:522-525 (1986); Reichmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992). Гуманизированное антитело включает антитело PRIMATIZEDTM, в котором связывающая антиген область антитела получена из антитела, продуцированного иммунизацией макак интересующим антигеном.
Антитела представляют собой типично белки или полипептиды, которые проявляют специфичность связывания с определенным антигеном. Нативные антитела представляют собой обычно гетеродимерные гликопротеиды, составленные из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Типично, каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, хотя количество дисульфидных связей варьируется между тяжелыми цепями различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также имеет равномерно расположенные с промежутками межцепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на ее другом конце, константный домен легкой цепи выровнен в соответствии с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выровнен в соответствии с вариабельным доменом тяжелой цепи. Считают, что определенные аминокислотные остатки формируют поверхность раздела между вариабельными доменами легкой и тяжелой цепи [Chothia et al., J. Mol. Biol., 186:651-663 (1985); Novotny and Haber, Proc. Natl. Acad. Sci. USA, 82:4592-4596 (1985)]. Легкие цепи антител из любого вида позвоночных могут быть отнесены к одному из двух четко отличающихся типов, называемых каппа и лямбда, на основании аминокислотной последовательности их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей иммуноглобулины можно отнести к различным классам. Существуют 5 основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько из них можно дополнительно разделить на подклассы (изотипы), например, IgG-1, IgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются соответственно альфа, дельта, эпсилон, гамма и мю.
«Фрагменты антитела» включают часть интактного антитела, в целом, связывающую антиген или вариабельную область интактного антитела. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2 и Fv, диатела, одноцепочечные молекулы антитела и мультиспецифические антитела, сформированные из фрагментов антитела.
Термин «вариабельная» используется здесь для описания определенных частей вариабельных доменов, которые отличаются последовательностью среди антител и используются при связывании и специфичности каждого конкретного антитела с его определенным антигеном. Однако вариабельность обычно неравномерно распределена по вариабельным доменам антител. Она типично концентрируется в трех сегментах, называемых области, определяющие комплементарность (CDR), или гипервариабельные области в вариабельных доменах и легкой цепи, и тяжелой цепи. Более высоко сохранные части вариабельных доменов называются каркасом (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей включают 4 области FR, главным образом принимающие конфигурацию β-листка, соединенного тремя CDR, которые образуют петли, соединяющие и в некоторых случаях формирующие часть структуры β-листка. CDR в каждой цепи удерживаются вместе в тесной близости областями FR и с CDR из другой цепи, участвуют в формировании области антител, связывающих антигенную детерминанту [см. Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, MD (1987)]. Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности.
Используемые в настоящем изобретении моноклональные антитела включают химерные, гибридные и рекомбинантные антитела, продуцируемые сплайсингом вариабельного (включая гипервариабельный) домена антитела против Apo-2L константным доменом (например, «гуманизированные» антитела), или легкой цепи тяжелой цепью, или цепи от одного вида цепью от другого вида, или слияниями с гетерологичными белками, независимо от вида происхождения или класса иммуноглобулина или обозначения подкласса, а также фрагменты антитела (например, Fab, F(ab')2 и Fv), пока они проявляют желательную биологическую активность или свойства (см., например, патент США № 4816567 и Mage et al., in Monoclonal Antibody Production Techniques and Applications, pp.79-97 (Marcel Dekker, Inc.: New York, 1987).
«Человеческое антитело» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует таковой антитела, продуцируемого человеком, и/или было получено с использованием любой из методик получения человеческих антител, как раскрыто здесь. Это определение человеческого антитела конкретно исключает гуманизированное антитело, включающее остатки, связывающие нечеловеческий антиген. Человеческие антитела можно получить, используя различные методики, известные в данной области. В одном варианте осуществления человеческое антитело выбрано из библиотеки фага, где эта библиотека фага экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology, 14:309-314 (1996): Sheets et al. PNAS, (USA) 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Человеческие антитела можно также получить внесением локусов человеческого иммуноглобулина в [организм] трансгенных животных, например, мышей, у которых гены эндогенного иммуноглобулина были частично или полностью инактивированы. После антигенной стимуляции наблюдается продукция человеческого антитела, которое во всех отношениях имитирует антитело, наблюдаемое у человека, включая перестройку, сборку гена и репертуар антител. Этот подход описан, например, в патентах № 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology, 10:779-783 (1992); Lonberg et al., Nature, 368:856-859 (1994); Morrison, Nature, 368:812-13 (1994); Fishwild et al., Nature Biotechnology, 14:845-51 (1996); Neuberger, Nature Biotechnology, 14:826 (1996); Lonberg and Huszar, Intern. Rev. Immunol., 13:65-93 (1995). Альтернативно, человеческое антитело можно получить посредством иммортализации человеческих В лимфоцитов, продуцирующих антитело, направленное против антигена-мишени (такие В-лимфоциты можно извлечь у индивидуума или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147 (1):86-95 (1991); и патент США № 5750373.
Термин «область Fc» используется для определения С-концевой области тяжелой цепи иммуноглобулина, которую можно генерировать перевариванием папаином интактного антитела. Область Fc может представлять собой область Fc нативной последовательности или вариантную область Fc. Хотя границы области Fc тяжелой цепи иммуноглобулина могут варьироваться, область Fc тяжелой цепи человеческого IgG обычно определяется простирающейся от аминокислотного остатка примерно в положении Cys226, или примерно от положения Pro230 до карбоксильного конца области Fc (используя здесь систему нумерации в соответствии с Kabat et al., выше). Область Fc иммуноглобулина в целом включает 2 константных домена, домен СН2 и домен СН3, и, необязательно, включает домен СН4.
Под «цепью области Fc» здесь подразумевается одна из двух полипептидных цепей области Fc.
«Домен СН2» области Fc человеческого IgG (также именуемый доменом "Cγ2") обычно простирается от аминокислотного остатка примерно в положении 231 до аминокислотного остатка примерно в положении 340. Домен СН2 необычен в том, что он не тесно спарен с другим доменом. Скорее, N-связанные разветвленные углеводородные цепи вставлены между двух доменов СН2 молекулы интактного нативного IgG. Предполагалось, что углеводород может обеспечить замещение для спаривания между доменами и способствовать стабилизации домена СН2 (Burton, Molec. Immunol.22:161-206 (1985). Домен СН2 здесь может представлять собой домен СН2 нативной последовательности или вариантный домен СН2.
«Домен СН3» включает в себя фрагмент секвенирования остатков, С-концевых относительно домена СН2 в области Fc (т.е. от аминокислотного остатка примерно в положении 341 до аминокислотного остатка примерно в положении 447 IgG). Область СН3 здесь может представлять собой домен СН3 нативной последовательности или вариантный домен СН3 (например, домен СН3 с внесенным «выступом» в одной его цепи и соответствующей внесенной «полостью» в другой его цепи (см. патент США № 5821333).
«Шарнирная область» в целом определяется как фрагмент секвенирования примерно от Glu216 или примерно Cys226 до примерно Pro230 человеческого IgG1 (Burton, Molec. Immunol.22:161-206 (1985)). Шарнирные области других изотипов IgG могут быть совмещены с последовательностью IgG1 сплайсингом первого и последнего цистеиновых остатков, формирующим связи S-S между тяжелыми цепями в одним и тех же положениях. Шарнирная область в настоящем изобретении может представлять собой шарнирную область нативной последовательности или вариантную шарнирную область. Эти две полипептидные цепи вариантной шарнирной области в целом сохраняют по меньшей мере один цистеиновый остаток на полипептидную цепь, так что две полипептидные цепи вариантной шарнирной области могут формировать дисульфидную связь между двумя цепями. Предпочтительная шарнирная область в настоящем изобретении представляет собой человеческую шарнирную область нативной последовательности, например, шарнирную область нативной последовательности человеческого IgG1.
«Функциональная область Fc» обладает по меньшей мере одной «эффекторной функцией» области Fc нативной последовательности. Иллюстративные «эффекторные функции» включают связывание C1q; комплемент-зависимую цитотоксичность (CDC); связывание рецептора Fc; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз; подавляющую регуляцию рецепторов клеточной поверхности (например, В клеточных рецепторов; BCR) и т.д. Такие эффекторные функции в целом требуют комбинации области Fc с доменом связывания (например, вариабельным доменом антитела), и их можно оценить, используя различные количественные анализы оценки таких эффекторных функций антител, известные в данной области.
«Область Fc нативной последовательности» включает аминокислотную последовательность, идентичную аминокислотной последовательности области Fc, обнаруживаемую в природе. «Вариантная область Fc» включает аминокислотную последовательность, которая отличается от таковой области Fc нативной последовательности посредством модификации по меньшей мере одной аминокислоты. Предпочтительно, вариантная область Fc имеет по меньшей мере одно аминокислотное замещение по сравнению с областью Fc нативной последовательности или с областью Fc материнского полипептида, например, примерно от 1 до примерно 10 аминокислотных замещений, а предпочтительно примерно от 1 до примерно 5 аминокислотных замещений в области Fc нативной последовательности или в области Fc материнского полипептида. Вариантная область Fc в настоящем изобретении предпочтительно обладает идентичностью последовательностей по меньшей мере 80% с областью Fc нативной последовательности и/или с областью Fc материнского полипептида, а наиболее предпочтительно идентичностью последовательностей с ней по меньшей мере примерно 90%, предпочтительнее идентичностью последовательностей с ней, по меньшей мере, примерно 95%.
Термины «рецептор Fc» и "FcR" используются для описания рецептора, который связывается с областью FcR антитела. Предпочтительный FcR представляет собой человеческий FcR нативной последовательности. Более того, предпочтительный FcR представляет собой рецептор, который связывает IgG антитело (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включающие в себя аллельные варианты и, альтернативно, подвергнутые сплайсингу формы этих рецепторов. Рецепторы FcγRII включают в себя FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют одинаковые аминокислотные последовательности, которые отличаются, главным образом, их цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный мотив активации на основе тирозина (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный мотив ингибирования на основе тирозина (ITIM) в его цитоплазматическом домене (обзор см. Daëron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR рассматриваются в Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Другие FcR, включая те, которые предстоит идентифицировать в будущем, охватываются здесь термином «FcR». Этот термин также включает неонатальный рецептор, FcRn, который ответствен за перенос материнских IgG к плоду (Guyer et al., J. Immunol., 117:587 (1976); и Kim et al., J. Immunol., 24:249 (1994)).
«Созревшее для аффинности» антитело представляет собой антитело с одним или более изменениями его одной или более CDR, что приводит к улучшению аффинности антитела к антигену, по сравнению с материнским антителом, которое не обладает этим изменением (изменениями). Предпочтительные созревшие для аффинности антитела имеют наномолярные или даже пикомолярные аффинности к антигену-мишени. Созревшие для аффинности антитела продуцируются процедурами, известными в данной области. Marks et al. Bio/Technology, 10:779-783 (1992) описывают созревание для аффинности путем обмена местами доменов VH и VL. Случайный мутагенез CDR и/или остатков каркаса описан: Barbas et al. Proc. Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene, 169:147-155 (1995); Yelton et al. J. Immunol., 155:1994-2004 (1995); Jackson et al., J. Immunol., 154(7):3310-9 (1995); и Hawkins et al, J. Mol. Biol., 226:889-896 (1992).
Термины «агонист» и «агонистическая» при использовании в настоящем описании относятся или описывают молекулу, которая способна прямо или косвенно по существу индуцировать, способствовать или усиливать биологическую активность или активацию рецептора к лиганду Аро-2. Необязательно, «антитело-агонист рецептора Аро-2L» представляет собой антитело, которое имеет активность, имитирующую или сравнимую с лигандом Аро-2. Предпочтительно, агонист представляет собой молекулу, которая способна индуцировать апоптоз в клетке млекопитающего, предпочтительно, в раковой клетке млекопитающего. Еще предпочтительнее, агонист представляет собой антитело, направленное на рецептор Аро-2L, и указанное антитело имеет апоптотическую активность, которая равна или больше, чем у полипептида Аро-2L. Необязательно, агонистическую активность такой молекулы можно определить количественным анализом молекулы при анализе для исследования апоптоза одной или более раковых клеток. Предусматривается, что агонист может быть связан с одной или более молекул полимера, такого как полиэтиленгликоль.
Термин «изолированные» при использовании для описания различных раскрытых здесь белков означает белок, который был идентифицирован, и/или выделен, и/или извлечен из компонента его природной среды. Загрязняющие компоненты его природной среды представляют собой материалы, которые обычно бы препятствовали диагностическим или терапевтическим способам применения для белка, и могут включать ферменты, гормоны и другие белковые и небелковые растворенные вещества. В предпочтительных вариантах осуществления белок должен быть очищен (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности использованием секвенатора с вращающейся воронкой или (2) до однородности SDS-PAGE при невосстанавливающих или восстанавливающих условиях с использованием Кумасси синего или, предпочтительно, серебряной краски. Изолированный белок включает белок in situ внутри рекомбинантных клеток, поскольку по меньшей мере один компонент природной среды белка будет отсутствовать. Однако обычно изолированный белок получают по меньшей мере одной стадией очистки.
«Биологически активный» или «биологическая активность» в целях настоящего изобретения означает (а) имеющий способность индуцировать или стимулировать апоптоз по меньшей мере в одном типе клетки млекопитающего, такой как раковая клетка или клетка, инфицированная вирусами, или клетка, инфицированная бактериями, in vivo или ex vivo; (b) способный вызвать выработку антитела, т.е. иммуногенный; или (с) сохраняющий активность нативного или природно встречающегося полипептида-лиганда Аро-2.
Используемый здесь термин «NK-клетки» относится к лимфоцитам, которые обычно имеют молекулы CD16, и/или NCAM, и/или CD56, экспрессируемые в качестве маркеров клеточной поверхности, но которые не экспрессируют CD3. NK-клетки относятся к клеткам, присутствующим in vivo у млекопитающего или in vitro в форме очищенной популяции клеток.
Используемый здесь термин «агент, активирующий NK-клетки», относится к агентам, которые способны усилить или увеличить цитолитическую активность покоящихся (или необработанных) NK-клеток в раковых клетках млекопитающих или клетках, инфицированных вирусами. Такие агенты включают, без ограничения, агенты, которые активируют один или более рецепторов Toll, таких как гранзим А или гранзим В, различные интелейкины, такие как IL-2, IL-12, IL-15, и интерфероны, такие как IFN-альфа, IFN-бета, и агонистические антитела к активирующим рецепторам, такие как NKp30, NKp44, NKG2D.
Термин «агент, ингибирующий рост» при использовании в настоящем описании относится к соединению или композиции, которая ингибирует рост клетки in vitro и/или in vivo. Таким образом, агент, ингибирующий рост, может представлять собой агент, который значительно снижает процентную долю клеток в фазе S. Примеры агентов, ингибирующих рост, включают агенты, которые блокируют прогрессирование клеточного цикла (в месте, отличном от фазы S), такие как агенты, которые индуцируют остановку G1 и остановку М-фазы. Классические блокаторы М-фазы включают винки (винкристин и винбластин), TAXOL® и ингибиторы топо II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те агенты, которые останавливают G1, также вызывают остановку в S-фазе, например, агенты, алкилирующие ДНК, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ара-С. Дополнительную информацию можно найти в документе The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, озаглавленная "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), в частности, стр.13.
Термин «пролекарство», используемый в настоящей заявке, относится к предшественнику или производной форме фармацевтически активного вещества, которое менее цитотоксично для раковых клеток, по сравнению с материнским препаратом, и способно быть ферментативно активированным или превращаемым в более активную материнскую форму (см., например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985)). Пролекарства согласно настоящему изобретению включают, без ограничения, пролекарства, содержащие фосфаты, пролекарства, содержащие тиофосфаты, пролекарства, содержащие сульфаты, пролекарства, содержащие пептиды, пролекарства с модифицированной D-аминокислотой, гликозилированные пролекарства, пролекарства, содержащие бета-лактам, пролекарства, содержащие необязательно замещенный феноксиацетамид, или пролекарства, содержащие необязательно замещенный фенилацетамид, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активный цитотоксический свободный препарат. Примеры цитотоксических препаратов, которые можно дериватизировать в пролекарственную форму для применения в настоящем изобретении, включают, без ограничения, теми химиотерапевтическими средствами, которые описаны ниже.
Используемый здесь термин «цитотоксическое средство» относится к веществу, которое ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. Этот термин предназначен для включения радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты.
«Химиотерапевтическое средство» представляет собой химическое соединение, которое можно применять при лечении состояний, подобных раку. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохон, метуредопа и уредопа; этиленимины и метиламеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфаорамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его адоцелезиновые, карзелесиновые и бизелесиновые аналоги); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CBI-TMI); элейтеробин; панкратистатин; сакродиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, оксигидрохлорид мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилиприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин (1I и калихеамицин 2I1, см.. например, Agnew Chem Intl. Ed. Engl., 33:183-186 (1994); динемицин, включая динемицин А; эсперамицин, а также неокарциностатиновый хромофор и родственные хромопротеиновые энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и деоксидоксорубицин), эпирубицин, эсорубицин, идарубицин, марцелломицин, митомицины, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флюдарабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; анти-адреналиновые средства, такие как аминоглутетимид, митотан, трилостан; вещество, пополняющее запас фолиевой кислоты, такое как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элфорнитин; эллиптиний ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; мейтансиноиды, такие как мейтансин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазихон; 2,2',2"-трихлортриэтиламин; трихотецены (в частности, Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ) и доксетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомера RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше соединений. Также включены в это определение анти-гормональные средства, которые действуют для регулирования или ингибирования действия гормонов на опухоли, такие как анти-эстрогены, включая в себя, например тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); и анти-андрогены, такие как как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше соединений.
Термин «цитокин» представляет собой родовой термин для белков, высвобождаемых одной клеточной популяцией, которые действуют на другие клетки как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В цитокины включены гормоны роста, такие как человеческие гормоны роста, N-метиониловые человеческие гормоны роста, и коровьи гормоны роста; паращитовидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеидные гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреостимулирующий гормон (ТСГ) и лютеинизирующий гормон (ЛГ); печеночный фактор роста; фибробластный фактор роста; пролактин; плацентарный лактоген; фактор некроза опухоли альфа и бета; вещество, ингибрующее муллериан; пептид, связанный с мышиным гонадотропином; ингибин; активин; сосудистый эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); нервные факторы роста, такие как NGF-альфа; тромбоцитарный фактор роста; трансформирующие фактор роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста -I и -II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма колониестимулирующие факторы (CSF), такие как макрофаги-CSF (M-CSF); колониестимулирующий фактор роста гранулоцитов-макрофагов (GM-CSF); и гранулоциты-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1альфа, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухоли, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганды набора (KL). Используемый здесь термин «цитокин» включает в себя белки из природных источников или из рекомбинантной клеточной культуры и биологически активных эквивалентов цитокинов нативной последовательности.
Термины «лечение» или «терапия» относятся и к терапевтическому лечению, и к профилактическим или превентивным мерам.
Термин «эффективное количество» относится к количеству препарата, эффективному для лечения заболевания или расстройства у млекопитающего. В случае рака терапевтически эффективное количество препарата может уменьшить количество раковых клеток; уменьшить размер опухоли; ингибировать (т.е. в некоторой степени замедлить и предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. в некоторой степени замедлить и предпочтительно остановить) метастаз опухоли; в некоторой степени ингибировать рост опухоли; и/или в некоторой степени облегчить один или более из симптомов, связанных с расстройством. В той степени, в которой препарат может предотвратить рост и/или уничтожить существующие раковые клетки, он может быть цитостатическим и/или цитотоксическим. Для лечения рака эффективность in vivo можно, например, измерить оценкой опухолевого груза или объема, времени до прогрессирования заболевания (ТТР) и/или определением частот реакции (RR).
«Млекопитающее» в целях лечения или терапии относится к любому животному, классифицированному как млекопитающее, включая людей, домашних и сельскохозяйственных животных, и животных, содержащихся в зоопарках, спортивных животных или таких домашних животных, как собаки, лошади, кошки, коровы и т.д. Предпочтительно, млекопитающее представляет собой человека.
Термины «рак», «раковый» или «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым клеточным ростом. Примеры рака включают, без ограничения, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких видов злокачествнных опухолей включают рак толстой кишки, рак ободочной и прямой кишки, рак прямой кишки, плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, ходжкинскую и неходжкинскую лимфому, рак семенников, миелому, рак пищевода, желудочно-кишечный рак, почечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, глиому, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, карциному эндометрия, карциному слюнных желез, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, печеночную карциному и различные типы рака головы и шеи.
II. Методы и материалы
А. МЕТОДЫ
В целом, способы согласно изобретению для индукции апоптоза или цитотоксичности в клетках млекопитающих включают в себя контакт клеток с лигандом Аро-2 или агонистическим антителом рецептора Apo-2L и NK-клетками или агентом (агентами), активирующим NK-клетки. Иллюстративные состояния или расстройства, подлежащие лечению лигандом или агонистическим антителом Аро-2 и NK-клетками или агентом, активирующим NK-клетки, включают доброкачественную или злокачественную опухоль, а также вирусные инфекции.
Способы обработки клеток млекопитающих NK-клетками или агентом, активирующим NK-клетки, в комбинации с их обработкой агонистом (агонистами) рецептора Apo-2L, могут иметь ряд преимуществ перед введением этих средств в виде одиночного средства для терапии. В частности, как отмечено выше, эти способы могут способствовать проводимым схемам лечения идентификацией оптимальных условий для комбинированного введения этих средств. Следовательно, путем идентификации способов оптимизации апоптотической реакции практикующий врач может вводить эти средства в более удобном и приемлемым для пациента формате. В частности, используя способы, которые оптимизируют апоптотическую реакцию, практикующий врач может ввести эти средства одним болюсом, а не множественными инъекциями, ввести более низкие концентрации этих средств или ввести эти средства в течение более коротких периодов времени.
В соответствии с одним вариантом осуществления изобретения предоставляется способ индукции апоптоза в клетках млекопитающего, включающий контакт клеток с эффективным количеством агониста рецептора Apo-2L и NK-клетками или агентом, активирующим NK-клетки. В этих способах агонист рецептора Apo-2L Apo2L/TRAIL или антитело против рецептора DR4 или DR5. Дополнительные варианты осуществления изобретения включают вариации этих способов, таких как те, в которых используются дополнительные терапевтические методы, такие как контакт раковых клеток с одним или более средств, ингибирующих рост, или радиацией.
В. МАТЕРИАЛЫ
Apo-2L, который можно использовать в способах, включает в себя полипептиды Apo-2L, описанные выше в документах Pitti et al., WO 97/25428 и WO 97/01633 (полипептиды имеются TRAIL). Предусматривается, что можно использовать различные формы Apo-2L, такие как полипептид полной длины, а также в виде растворимых форм Apo-2L, которые включают в себя последовательность внеклеточного домена (ECD). Примеры таких растворимых последовательностей ECD включают в себя полипептиды, содержащие аминокислоты 114-281, 95-281, 91-281 или 92-281 последовательности Apo-2L, показанной на фиг.1А документа Pitti et al., J. Biol. Chem., 271:12687-12690 (1996) и на фиг.4 в настоящем описании. В настоящее время считается, что полипептид, включающий аминокислоты 92-281, представляет собой природно расщепленную форму Apo-2L. Авторы изобретения экспрессировали человеческий Apo-2L в клетках СНО и обнаружили, что полипептид 92-281 представляет собой экспрессированную форму Apo-2L. Включены модифицированные формы Apo-2L, такие как ковалентно модифицированные формы, описанные в WO 97/25428. В частности, Apo-2L, связанный с небелковым полимером, таким как полиэтиленгликоль, включен для использования в настоящих способах. Полипептид Apo-2L можно получить в соответствии с любым из способов, описанных в WO 97/25428.
Варианты лиганда Apo-2L, имеющие апоптотическую активность, которые можно использовать в способах, включают в себя, например, варианты, идентифицированные методиками сканирования аланина. Определенные заместительные варианты включают в себя аминокислоты 91-281 на фиг.1А документа Pitti et al., J. Biol. Chem., 271:12687-12690 (1996), на которой по меньшей мере одна из аминокислот в положениях 203, 218 или 269 замещены аланиновым остатком. Необязательно, варианты лиганда Apo-2 могут включать одно или более из этих трех различных замещений участка.
Предусматривается, что в раскрытых в настоящее время способах альтернативно может использоваться молекула, которая имитирует апоптотическую активность Apo-2L. Примеры таких молекул включают в себя агонистические антитела, которые могут индуцировать апоптоз по типу, по меньшей мере сравнимому или похожему Apo-2L. В частности, эти агонистические антитела должны содержать антитела, которые связывают один или более из рецепторов для Apo-2L. Предпочтительно, агонистическое антитело направлено на рецептор Apo-2L, который включает домен цитоплазматической гибели, такой как DR4 или DR5. Еще предпочтительнее, агонистическое антитело связывается с таким рецептором и связывание можно определить, например, используя FACS-анализ или ELISA (иммуноферментного анализа). Агонистические антитела, направленные на рецептор, называемый DR5 (или Аро-2), были получены с использованием методик слияния, таких как описанные ниже. Одно из агонистических антител рецептора DR5 или Аро-2 именуется 3F11.39.7 и было депонировано в АТСС в виде депозита № НВ-12456 13 января 1998 г. Другие антитела рецептора DR5 включают в себя 3Н3.14.5, депонированный в АТСС. Агонистическую активность антител рецептора Apo-2L можно определить, используя различные способы количественного анализа апоптотической активности, и, необязательно, апоптотическую активность такого антитела можно определить количественным анализом антитела отдельно или в поперечно-сшитой форме, используя иммуноглобулин Fc или комплемент в анализе, для исследования апоптоза клеток, экспрессирующих рецептор Apo-2L, такой как DR4 или DR5.
Кроме того, были также получены агонистические антитела, направленные на другой рецептор Apo-2L, называемый DR4. Одно из агонистических антител DR4 именуется 4Н6.17.8 и было депонировано в АТСС в виде депозита № НВ-12455 13 января 1998 г. Еще одни агонистические антитела DR4 включают в себя антитела 4Е7.24.3, 1Н5.25.9, 4G7.18.8 и 5G11.17.1, которые были депонированы в АТСС. Агонистическую активность антител рецептора Apo-2L можно определить, используя различные способы количественного анализа апоптотической активности, и, необязательно, апоптотическую активность такого антитела можно определить количественным анализом антитела отдельно или в поперечно-сшитой форме с использованием иммуноглобулина Fc или комплемента.
Агонистические антитела, предусмотренные изобретением, включают в себя антитела, которые связывают одиночный рецептор Apo-2L или более одного рецептора Apo-2L. Антитело, которое связывает более чем один рецептор Apo-2L, можно характеризовать как антитело, которое «перекрестно взаимодействует» с двумя или более различными антигенами и способно связываться с каждым из различных антигенов, например, по данным определения ELISA или FACS. Необязательно, антитело, которое «перекрестно взаимодействует» с двумя или более различными антигенами, представляет собой антитело, которое связывается с первым антигеном, и, кроме того, связывается со вторым другим антигеном, где способность связывания антитела для второго антигена при концентрации антитела примерно 10 г/мл составляет примерно от 50% до примерно 100% (предпочтительно, примерно от 75% до примерно 100%) способности связывания первого антигена, по данным определения при ELISA захвата. Например, антитело может специфически связываться с DR5 («первым антигеном») и специфически перекрестно взаимодействовать с другим рецептором Apo-2L, таким как DR4 («вторым антигеном»), где степень связывания примерно 10 г/мл антитела к DR4 составляет примерно от 50% до примерно 100% способности связывания антитела к DR5 при ELISA захвата. Различные перекрестно взаимодействующие антитела к рецепторам Apo-2L подробнее описаны в Международной патентной заявке PCT/US 99/13197.
Как описано ниже, иллюстративные формы таких антител включают в себя поликлональные, моноклональные, гуманизированные, биспецифические и гетероконъюгатные антитела.
1. Поликлональные антитела
Антитела согласно изобретению могут включать поликлональные антитела. Способы получения поликлональных антител известны специалисту в данной области. Выработку поликлональных антител можно вызвать у млекопитающего, например, одной или более инъекций иммунизирующего агента и, при желании, адъюванта. Обычно иммунизирующий агент и/или адъювант инъецируется млекопитающему множественными подкожными или внутрибрюшинными инъекциями. Иммунизирующий агент может включать в себя полипептид DR4 или DR5 (или DR4 или DR5 ECD) или их гибридный белок. Может быть полезным конъюгировать иммунизирующий агент с белком, который, как известно, является иммуногенным у иммунизированного млекопитающего. Примеры таких иммуногенных белков включают, без ограничения, гемоцианин блюдечка (простейшего в форме скважины), сывороточный альбумин, бычий тиреоглобулин и ингибитор трипсина соевых бобов. Примеры адъювантов, которые можно использовать, включают в себя полный адъювант Фрейнда и адъювант MPL-TDM (липид А монофосфорила, синтетический дикориномиколат трегалозы). Протокол иммунизации может выбрать специалист в данной области без ненужного экспериментирования. Затем млекопитающему можно произвести кровопускание и провести анализ сыворотки на титр антител. При желании млекопитающее можно подвергать повторной иммунизации до тех пор, пока титр антител не увеличится или не выйдет на плато.
2. Моноклональные антитела
Антитела согласно изобретению могут альтернативно представлять собой моноклональные антитела. Моноклональные антитела можно получить, используя способы гибридомы, такие как способы, описанные Kohler and Milstein, Nature, 256:495 (1975). В способе гибридомы мышь, хомяка или другое животное-хозяина обычно иммунизируют иммунизирующим агентом для того, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые специфически связываются с иммунизирующим агентом. Альтернативно, лимфоциты можно иммунизировать in vitro.
Иммунизирующий агент обычно включает в себя полипептид DR4 или DR5 или их гибридный белок, такой как гибридный белок ECD-IgG DR4 или DR5.
В целом, используются любые лимфоциты периферической крови ("PBL"), если желательны клетки человеческого происхождения, или используются клетки селезенки или клетки лимфатических узлов, если желательны источники млекопитающих, кроме человека. Затем лимфоциты сливаются с линией иммортализованных клеток с использованием подходящего агента слияния, такого как полиэтиленгликоль, для формирования клетки гибридомы [Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, (1986) pp. 59-103]. Линии иммортализованных клеток представляют собой обычно трансформированные клетки млекопитающих, в частности, клетки миеломы, происходящие от грызунов, коров и человека. Обычно используются линии клеток миеломы крыс или мышей. Можно культивировать клетки гибридомы в подходящей культуральной среде, которая предпочтительно содержит одно или более веществ, которые ингибируют рост или выживание неслившихся, иммортализованных клеток. Например, если материнские клетки лишены фермента гипоксантин-гуанин-фосфорибозил трансферазы (HGPRT или HPRT), то культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин («среда НАТ»), причем эти вещества предотвращают рост клеток с дефицитом HGPRT.
Предпочтительными линиями иммортализованных клеток являются те, которые эффективно сливаются, поддерживают стабильный высокий уровень экспрессии антитела выбранными клетками, продуцирующими антитело, и чувствительны к среде, такой как среда НАТ. Более предпочтительные линии иммортализованных клеток представляют собой линии мышиной миеломы, которые можно получить, например, из распределительного центра Salk Institute Cell Distribution Center, San Diego, California и Американской коллекции типовых культур (АТСС), Manassas, Virginia. Примером такой линии клеток мышиной миеломы является P3X63AgU.1. Линии клеток человеческой миеломы и мышиной-человеческой гетеромиеломы также были описаны для продукции человеческих моноклональных антител [Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York, (1987) pp.. 51-63].
Культуральная среда, в которой культивируются клетки гибридомы, можно затем анализировать на присутствие моноклональных антител, направленных против рецептора Apo-2L. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяется иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализ (RIA) или ферментный иммуносорбентный анализ (ELISA). Такие методики и анализы известны в данной области. Аффинность связывания моноклональных антител можно, например, определить анализом Scatchard из документа Munson and Pollard, Anal. Biochem., 107:220 (1980).
После идентификации желательных клеток гибридомы клоны можно субклонировать процедурами ограничивающего разбавления и выращивать стандартными способами [Goding, см. выше]. Подходящие культуральные среды для этой цели включают в себя, например, модифицированную Дульбекко среду Игла (DMEM) или среду RPMI-1640. Альтернативно, клетки гибридомы можно выращивать in vivo в виде асцита у млекопитающего.
Моноклональные антитела, секретируемые субклонами, можно изолировать или очистить из культуральной среды или асцитической жидкости обычными процедурами очистки иммуноглобулина, такими как, например, белок А-сефароза, хроматография на гидроксиапатите, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела можно также получить способами рекомбинантной ДНК, такими как способы, описанные в патенте США № 4816567. ДНК, кодирующую моноклональные антитела согласно изобретению, можно легко выделить и определить их последовательность, используя обычные процедуры (например, использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител). Клетки гибридомы согласно изобретению служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно поместить в векторы экспрессии, которые затем трансфектируются в клетки-хозяева, такие как обезьяньи клетки COS, клетки яичников китайского хомячка (СНО) или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также можно модифицировать, например, замещением кодирующей последовательности для константных доменов тяжелой и легкой цепи человека вместо гомологичных мышиных последовательностей [патент США № 4816567; Morrison et al., см. выше] или ковалентным связыванием с последовательностью, кодирующей иммуноглобулин, полной или частичной кодирующей последовательности для неиммуноглобулинового полипептида. Такой неиммуноглобулиновый полипептид может быть замещен на константные домены антитела согласно изобретению или может быть замещен на вариабельные домены одного комбинирующего антигены сайта антитела согласно изобретению для создания химерного бивалентного антитела.
Антитела согласно изобретению включают в себя «перекрестно сшитые» антитела. Используемый здесь термин «перекрестно сшитые» относится к связыванию по меньшей мере двух молекул IgG вместе для формирования одной (или единственной) молекулы. Антитела рецептора Apo-2L могут быть поперечно-сшиты с использованием различных линкерных молекул, необязательно, антитела DR4 поперечно-сшиваются, используя молекулу анти-IgG, комплемент, химическую модификацию или молекулярную инженерию. Специалистам в данной области понятно, что комплемент имеет относительно высокую аффинность к молекулам антитела после связывания антител с мембраной клеточной поверхности. Соответственно, считается, что комплемент можно использовать в качестве поперечно-сшивающей молекулы для соединения двух или более антител, связанных с мембраной клеточной поверхности. Среди различных изотипов мышиного IgG известно, что IgM, IgG2a и IgG2b фиксируют комплемент.
Антитела согласно изобретению могут необязательно включать димерные антитела, а также мультивалентные формы антител. Специалисты в данной области могут сконструировать такие димерные или мультивалентные формы методиками, известными в данной области, с использованием описанных здесь антител против рецептора Apo-2L.
Антитела согласно изобретению могут также включать в себя моновалентные антитела. Способы получения моновалентных антител хорошо известны в данной области. Например, один способ включает в себя рекомбинантную экспрессию легкой цепи иммуноглобулина и модифицированной тяжелой цепи. Тяжелая цепь усечена в целом в любой точке в области Fc с тем, чтобы предотвратить поперечную сшивку тяжелой цепи. Альтернативно, релевантные цистеиновые остатки замещаются другим аминокислотным остатком или подвергаются делеции с тем, чтобы предотвратить поперечную сшивку.
Способы in vitro также подходят для получения моновалентных антител. Переваривание антител для получения его фрагментов, в частности, фрагментов Fab, можно осуществить, используя обычные методики, известные в данной области. Например, переваривание можно выполнить, используя папаин. Примеры переваривания папаином описаны в WO 94/29348, опубликованной 22 декабря 1994 г., и в патенте США № 4342566. Переваривание антител папаином обычно продуцирует два идентичных фрагмента, связывающих антиген, называемых фрагментами Fab, каждый с одним сайтом связывания антигена, и остаточный фрагмент Fc. Обработка пепсином дает фрагмент F(ab')2, который имеет два сайта, комбинирующих антиген, и все же способен поперечно-сшивать антиген.
Фрагменты Fab, продуцируемые при переваривании антител, также содержат константные домены легкой цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбокси конце домена тяжелой цепи СН1, включающего один или более цистеинов из шарнирной области антитела. Fab'-SH представляет собой обозначение в настоящем описании Fab', в котором остаток (остатки) цистеина константного домена несут свободную тиоловую группу. Фрагменты антитела F(ab')2 первоначально были получены в виде пар фрагментов Fab', которые имеют между ними шарнирные цистеины. Известны также другие химически связанные фрагменты антител.
Можно также получить одноцепочечные фрагменты Fv, такие как описанные в документе Iliades et al., FEBS Letters, 409:437-441 (1997). Соединение таких одноцепочечных фрагментов с использованием различных линкеров описано в документе Kortt et al., Protein Engineering, 10:423-433 (1997).
В дополнение к антителам, описанным выше, предусматривается, что можно получить in vitro химерные или гибридные антитела, используя известные способы в синтетической химии белков, включая способы с применением поперечно-сшивающих агентов. Например, иммунотоксины можно сконструировать с использованием реакции обмена дисульфидов или формированием тиоэфирной цепи. Примеры подходящих реагентов для этой цели включают в себя иминотиолат и метил-4-меркаптобутиримидат.
Антитела рецептора Apo-2L согласно изобретению могут, кроме того, включать гуманизированные антитела или человеческие антитела. Гуманизированные формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие связывающие антиген последовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Гуманизированные антитела включают в себя человеческие иммуноглобулины (антитело-реципиент), в которых остатки из определяющей комплементарность области (CDR) реципиента замещены остатками из CDR нечеловеческого вида (антитело-донор), такого как мышь, крыса или кролик, имеющий желательную специфичность, аффинность и активность. В некоторых случаях остатки каркаса Fv человеческого иммуноглобулина замещаются соответствующими нечеловеческими остатками. Гуманизированные антитела могут также включать в себя остатки, которые не обнаруживаются ни в антителе-реципиенте, ни в импортированной CDR или каркасных последовательностях. В целом, гуманизированное антитело включает по существу все из по меньшей мере одного, а типично двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют таковым нечеловеческого иммуноглобулина и все или по существу все из областей FR представляют собой таковые консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также включает в себя по меньшей мере часть константной области иммуноглобулина (Fc), обычно таковую человеческого иммуноглобулина [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992)].
Способы гуманизации нечеловеческих антител хорошо известны в данной области. В целом, гуманизированное антитело имеет одну или более аминокислотных последовательностей, введенных в него, из нечеловеческого организма. Такие остатки часто именуются «импортные» остатки, которые обычно взяты из «импортного» вариабельного домена. Гуманизацию можно по существу выполнить, следуя способу Winter и сотрудников [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)], замещением CDR грызунов или последовательностей CDR на соответствующие последовательности человеческого антитела. Соответственно, такие «гуманизированные» антитела представляют собой химерные антитела (патент США № 4816567), где по существу менее чем интактный человеческий вариабельный домен был замещен соответствующей последовательностью из нечеловеческого вида. На практике, гуманизированные антитела представляют собой обычно человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещены остатками из аналогичных участков в антителах грызунов. Источники таких импортных остатков или импортных вариабельных доменов (или CDR) включают осажденные антитела против рецептора Apo-2L 4H6.17.8, 3F11.39.7, 4E7.24.3, 1H5.25.9, 4G7.18.8, 5G11.17.1 и 3Н3.14.5.
Выбор человеческих вариабельных доменов, и легкого, и тяжелого, которые предстоит использовать при получении гуманизированных антител, очень важен для уменьшения антигенности. В соответствии с «самым подходящим» способом проводится скрининг последовательности вариабельного домена антитела грызунов по всей библиотеке известных последовательностей человеческого вариабельного домена. Затем человеческую последовательность, которая наиболее близка к последовательности грызуна, принимается в качестве человеческого каркаса (FR) для гуманизированного антитела [Sims et al., J. Immunol., 151:2296-2308 (1993); Chothia and Lesk, J. Mol. Biol., 196:901-917 (1987)]. В другом способе используется определенный каркас, полученный из консенсусной последовательности всех человеческих антител определенной подгруппы легкой и тяжелой цепей. Один и тот же каркас можно использовать для нескольких различных гуманизированных антител [Carter et al., Proc. Natl. Acad. Sci. USA, 82:4285-4289 (1992); Presta et al., J. Immunol., 151:2623-2632 (1993)].
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других благоприятных биологических свойств. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают способом анализа материнских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей материнской и гуманизированной последовательностей. Трехмерные модели иммуноглобулина общедоступны и знакомы специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и представляют на дисплее возможные трехмерные конформационные структуры выбранных иммуноглобулиновых последовательностей-кандидатов. Осмотр этих представлений позволяет анализировать вероятную роль остатков в функционировании иммуноглобулиновой последовательности-кандидата, т.е. анализировать остатки, которые влияют на способность перспективного иммуноглобулина связывать его антиген. Таким образом, остатки FR можно выбрать и комбинировать из консенсусной и импортной последовательности с тем, чтобы была достигнута желательная характеристика антитела, такая как увеличенная аффинность к антигену (антигенам)-мишени. В целом, остатки CDR непосредственно и наиболее существенно вовлечены во влияние на связывание антигена [см. документ WO 94/04679, опубликованный 3 марта 1994 г.].
Человеческие моноклональные антитела можно получить посредством адаптации способа гибридомы, впервые описанного Kohler и Milstein, использованием человеческих В лимфоцитов в качестве партнера слияния. Человеческие В лимфоциты, продуцирующие интересующее антитело, можно, например, изолировать у человека после получения информированного согласия. Например, индивидуум может продуцировать антитела против аутоантигена, как происходит при определенных расстройствах, таких как системная красная волчанка (Shoenfeld et al. J. Clin. Invest. 70:205 (1982)), иммунно-опосредованная тромбоцитопеническая пурпура (ITP) (Nugent et al., Blood, 70(1): 16-22 (1987)) или злокачественная опухоль. Альтернативно, или дополнительно, лимфоциты можно иммунизировать in vitro. Например, можно подвергнуть изолированные лимфоциты периферической крови человека in vitro воздействию лизомотрофического агента (например, сложного L-лейцин-О-метилового эфира, сложного диметилового эфира L-глутаминовой кислоты или сложного L-лейцил-L-лейцин-О-метилового эфира) (патент США № 5567610, Borrebaeck et al.); и/или лимфоциты периферической крови человека с истощенным запасом Т-клеток можно обработать in vitro адъювантами, такими как 8-меркаптогуанозин и цитокинина (патент США № 5229275, Goroff et al.).
В лимфоциты, извлеченные у субъекта или иммунизированные in vitro, затем в целом иммортализуются для генерирования человеческого моноклонального антитела. Методики иммортализации В-лимфоцитов включают, без ограничения: (а) слияние человеческого В-лимфоцита с клетками человеческих, мышиных миелом или мышино-человеческой гетеромиеломы; (b) вирусную трансформацию (например, вирусом Эпштейна-Барра; см., например, приведенный выше документ Nugent et al.); (с) слияние с линией лимфобластоидных клеток; или (d) слияние с клетками лимфомы.
Лимфоциты могут быть слиты с клетками миеломы с использованием подходящего агента слияния, такого как полиэтиленгликоль, для образования клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Полученные таким образом клетки гибридомы высеваются и выращиваются в подходящей культуральной среде, которая предпочтительно содержит одно или более веществ, которые ингибируют рост или выживание неслившихся, материнских клеток миеломы. Например, если в материнских клетках миеломы отсутствует фермент гипоксантин-гуанин-фосфорибозил трансфераза (HGPRT или HPRT), то культуральная среда для гибридом обычно включает гидроксантин, аминоптерин и тимидин (среда НАТ), причем эти вещества предотвращают рост клеток с дефицитом HGPRT. Были описаны подходящие линии клеток человеческой миеломы и мышиной-человеческой гетеромиеломы (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)). Культуральная среда, в которой растут клетки гибридомы, анализируют для выявления продукции моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяется иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализом (RIA) или ферментным иммуносорбентным анализом (ELISA).
После идентификации клеток гибридомы, которые продуцируют антитела желательной специфичности, аффинности и/или активности, клоны можно субклонировать процедурами ограничивающего разбавления и выращивать стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие культуральные среды для этой цели включают в себя, например, среду D-MEM или RPMI-1640. Моноклональные антитела, секретируемые субклонами, подходящим образом отделяются от культуральной среды, асцитической жидкости или сыворотки обычными процедурами очистки иммуноглобулина, такими как, например, хроматография белка А, гель-электрофорез, диализ или аффинная хроматография.
Человеческие антитела можно также генерировать с использованием нечеловеческого хозяина, такого как мышь, который способен продуцировать человеческие антитела. Как отмечено выше, в настоящее время имеются трансгенные мыши, которые способны, после иммунизации, продуцировать полный репертуар человеческих антител в отсутствие продукции эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена соединительной области (JH) у химерных и мутантных по зародышевой лини мышей приводит к полному ингибированию продукции эндогенных антител. Перенос серии генов иммуноглобулина человеческой зародышевой линии у таких мутантных по зародышевой линии мышей приведет к продукции человеческих антител после антигенной стимуляции (см. например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); патент США № 5591669; патент США № 5589369 и патент США № 5545807). Человеческие антитела можно также получить, используя мышей SCID-hu (Duchosal et al., Nature 355:258-262 (1992)).
В другом варианте осуществления человеческое антитело можно выбрать из библиотеки представления фага человеческого антитела. Получение библиотек антител или их фрагментов хорошо известно в данной области, можно использовать любые известные способы для конструкции семейства трансформационных векторов, которые могут быть введены в клетки-хозяева. Библиотеки легкой и тяжелой цепей антитела в фаге (Huse et al., Science, 246:1275 (1989)) или гибридных белков в фаге или фагемиде можно получить в соответствии с известными процедурами (см., например, Vaughan et al., Nature Biotechnology 14:309-314 (1996); Barbas et al., Proc. Natl. Acad. Sci., USA, 88:7978-7982 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Hoogenboom and Winter, J. Mol. Biol., 227:381-388 (1992); Barbas et al., Proc. Natl. Acad. Sci., USA, 89:4457-4461 (1992); Griffiths et al., EMBO Journal, 13:3245-3260 (1994); de Kruif et al., J. Mol. Biol., 248:97-105 (1995); WO 98/05344; WO 98/15833; WO 97/47314; WO 97/44491; WO 97/35196; WO 95/34648; патент США № 5712089; патент США № 5702892; патент США № 5427908; патент США № 5403484; патент США № 5432018; патент США № 5270170; WO 92/06176; WO 99/06587; патент США № 5514548; WO 97/08320 и патент США № 5702892). Интересующий антиген выделяют методом пэннинга из библиотеки фага, используя процедуры, известные в области отбора фага-антител, которые связываются с антигеном-мишенью.
Описанные здесь антитела рецептора Apo-2L необязательно обладают одним или более видами желательной биологической активности или свойств. Такие антитела могут включать в себя, без ограничения, химерные, гуманизированные, человеческие и созревшие для аффинности антитела. Как описано выше, антитела можно сконструировать или получить методами инженерии, используя различные методики, для достижения этих желательных видов активности или свойств. В одном варианте осуществления антитело к рецептору Apo-2L будет иметь аффинность связывания рецепторов DR4 или DR5 по меньшей мере 105 М-1, предпочтительно по меньшей мере в диапазоне от 106 М-1 до 107 М-1, предпочтительнее по меньшей мере в диапазоне от 108 М-1 до 1012 М-1, а еще предпочтительнее по меньшей мере в диапазоне от 109 М-1 до 1012М-1. Аффинность связывания антитела можно определить без ненужного экспериментирования тестированием антитела в соответствии с методиками, известными в данной области, включая анализ Scatchard (см. приведенный выше документ Munson et al.).
В другом варианте осуществления антитело к рецептору Apo-2L согласно изобретению может связывать один и тот же эпитоп на DR4 или DR5, с которым связывается Apo-2L или связывается с эпитопом на DR4 или DR5, который совпадает или перекрывается соответственно с эпитопом на DR4 или DR5, с которым связывается Apo-2L. Антитело может также взаимодействовать таким образом, чтобы создать стерическую конформацию, которая предотвращает связывание лиганда Аро-2 с DR4 или DR5. Свойство связывания эпитопа антитела согласно настоящему изобретению можно определить, используя методики, известные в данной области. Например, антитело можно тестировать в анализе in vitro, таком как анализ конкурентного ингибирования, для определения способности антитела блокировать или ингибировать связывание Apo-2L с DR4 или DR5. Необязательно, антитело можно тестировать в анализе конкурентного ингибирования для определения способности, например, антитела DR4 ингибировать связывание полипептида Apo-2L с конструктом DR4-IgG или с клеткой, экспрессирующей DR4. Необязательно, антитело будет способно блокировать или ингибировать связывание Apo-2L с рецептором по меньшей мере на 50%, предпочтительно по меньшей мере на 75%, а еще предпочтительнее по меньшей мере на 90%, что можно определить, в качестве примера, в анализе конкурентного ингибирования in vitro, используя растворимую форму лиганда Аро-2 (TRAIL) и DR4 ECD-IgG.
В предпочтительном варианте осуществления антитело включает агонистическое антитело, имеющее активность, которая имитирует активность лиганда Аро-2 (TRAIL) или сравнима с ним. Предпочтительно, такое агонистическое DR4 или DR5 антитело вызовет апоптоз по меньшей мере в одном типе линии раковых или опухолевых клеток или первичной опухоли. Апоптотическую активность агонистического DR4 или DR5 антитела можно определить, используя известные анализы in vitro или in vivo. In vitro апоптотическую активность можно определить, используя известные методики, такие как связывание аннексина V. In vivo апоптотическую активность можно определить, например, измерением уменьшения опухолевого груза или объема.
3. Биспецифические антитела
Биспецифические антитела представляют собой моноклональные, предпочтительно человеческие или гуманизированные антитела, которые имеют специфичность связывания в отношении по меньшей мере двух различных антигенов. В настоящем случае одна из специфичностей связывания относится к рецептору Apo-2L, другая относится к любому другому антигену, а предпочтительно к белку клеточной поверхности, или рецептору, или субъединице рецептора.
Способы получения биспецифичных антител известны в данной области. Традиционно рекомбинантная продукция биспецифических антител основывается на совместной экспрессии двух пар тяжелой цепи/легкой цепи иммуноглобулина, где эти 2 тяжелых цепи имеют различные специфичности [Milstein and Cuello, Nature, 305:537-539 (1983)]. Ввиду случайного ассортимента тяжелой и легкой цепей иммуноглобулина эти гибридомы (квадромы) продуцируют потенциальную смесь 10 различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы обычно осуществляется стадиями аффинной хроматографии. Аналогичные процедуры раскрыты в документе WO 93/08829, опубликованном 13 мая 1993 г, и в публикации Traunecker et al., EMBO J., 10:3655-3659 (1991).
Вариабельные домены антитела с желательными специфичностями связывания (участки комбинирования антитела-антигена) могут быть слиты в последовательности константного домена иммуноглобулина. Слияние предпочтительно происходит с последовательностями константного домена тяжелой цепи иммуноглобулина, включающего по меньшей мере часть шарнирной, СН2 и СН3 областей. Предпочтительно иметь первую константную область тяжелой цепи (СН1), содержащую участок, необходимый для связывания легкой цепи, присутствующего по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, при желании, легкой цепи иммуноглобулина, вставляются в отдельные векторы экспрессии и совместно трансфектируются в организм подходящего хозяина. Дополнительные детали генерирования биспецифических антител можно найти, например, в документе Suresh et al., Methods in Enzymology, 121:210 (1986).
4. Гетероконъюгатные антитела
Гетероконъюгатные антитела также находятся в пределах объема настоящего изобретения. Гетероконъюгатные антитела составлены из двух ковалентно соединенных антител. Такие антитела были, например, предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения ВИЧ инфекции [WO 91/00360; WO 92/200373; EP 03089]. Предусматривается, что антитела можно получить in vitro, используя способы, известные в химии синтеза белков, включая способы, связанные с использованием перекрестно-сшивающих агентов. Например, иммунотоксины можно сконструировать, используя реакцию обмен дисульфидов или формированием тиоэфирной связи. Примеры подходящих реагентов для этой цели включают в себя иминотиолат и метил-4-меркаптобутирамидат и реагенты, раскрытые, например, в патенте США № 4676980.
5. Триатела
Триатела также находятся в пределах объема изобретения. Такие антитела описаны, например, в приведенных выше документах Iliades et al. и Kortt et al.
6. Другие модификации
В настоящем изобретении предусмотрены другие модификации антител рецептора Apo-2L. Антитела согласно настоящему изобретению можно модифицировать конъюгированием антитела с цитотоксическим агентом (подобным молекуле токсина) или активирующего пролекарство фермента, который превращает пролекарство (например, пептидильным химиотерапевтическим средством, см. WO 81/01145) с активным противораковым препаратом (см., например, WO 88/07378 и патент США № 4975278). Эта технология также именуется «Антитело-зависимой ферментно-опосредованной пролекарственной терапией» (ADEPT).
Ферментный компонент иммуноконъюгата, который можно применять для ADEPT, включает в себя любой фермент, способный действовать на пролекарство таким образом, чтобы превратить его в его более активную, цитотоксическую форму. Ферменты, которые можно применять в способе согласно изобретению, включают, без ограничения, щелочную фосфатазу, которую можно использовать для превращения содержащих фосфаты пролекарства в свободные препараты; арилсульфатазу, которую можно использовать для превращения сульфат-содержащего пролекарства в свободные препараты; цитозин-дезаминазу, которую можно использовать для превращения нетоксичного 5-фторцитозина в противораковый препарат, 5-фторурацил; протеазы, такие как протеаза serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины B и L), которые можно использовать для превращения содержащих пептиды пролекарств в свободные препараты; каспазы, такие как каспаза-3; D-аланилкарбоксипептидазы, которые можно использовать для превращения пролекарств, которые содержат заместители D-аминокислот; ферменты, расщепляющие углеводороды, такие как бета-галактозидаза и нейраминидаза, которые можно использовать для превращения гликолизированных пролекарств в свободные препараты; бета-лактамаза, которую можно использовать для превращения препаратов, дериватизированных бета-лактамами, в свободные препараты; и амидазы пенициллина, такие как V амидаза пенициллина или G амидаза пенициллина, которые можно использовать для превращения препаратов, дериватизированных у их аминовых азотов соответственно феноксиацетильной или фенилацетильной группами, в свободные препараты. Альтернативно, антитела с ферментной активностью, также известные в данной области как «абзимы», можно использовать для превращения пролекарств согласно изобретению в свободные активные препараты (см., например, Massey, Nature 328: 457-459(1987)). Конъюгаты антитела-абзима можно получить, как описано здесь, для доставки абзима к популяции опухолевых клеток.
Ферменты могут быть ковалентно связаны с антителами методиками, хорошо известными в данной области, такими как использование гетеробифункциональных поперечно-сшивающих реагентов. Альтернативно, гибридные белки, включающие по меньшей мере связывающую антиген область антитела согласно изобретению, соединенную по меньшей мере с функционально активной частью фермента согласно изобретению, можно сконструировать, используя методики рекомбинантной ДНК, хорошо известные в данной области (см., например, Neuberger et al., Nature, 312: 604-608 (1984)).
Предусмотрены другие модификации антител. Например, антитело может быть соединено с одним из разнообразных небелковых полимеров, например, полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Антитело также может быть заключено в микрокапсулы, полученные, например, методиками коацервации или межповерхностной полимеризацией (например, соответственно гидроксиметилцеллюлозы или желатиновых микрокапсул и микрокапсул поли(метилметацилата)), в системах доставки коллоидного препарата (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A., Ed., (1980). Для увеличения периода полувыведения антитела из сыворотки, в антитело можно включить обеспечивающий защиту, связывающий рецептор эпитоп (в частности, фрагмент антитела), как описано, например, в патенте США № 5739277. Используемый здесь термин «обеспечивающий защиту, связывающий рецептор эпитоп» относится к эпитопу области Fc молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), которая ответственна за увеличение in vivo сывороточного периода полувыведения молекулы IgG.
7. Рекомбинантные способы
Изобретение также предоставляет изолированные нуклеиновые кислоты, кодирующие антитела, как раскрыто здесь, векторы и клетки-хозяева, включающие нуклеиновую кислоту, и рекомбинантные методики продукции антитела.
Для рекомбинантной продукции антитела нуклеиновая кислота, кодирующая его, изолируется и вставляется в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующее антитело, легко выделяется и секвенируется с использованием обычных процедур (например, использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими антитело). Имеется много векторов. Компоненты векторов в целом включают в себя, без ограничения, один или более из следующих: сигнальную последовательность, происхождение репликации, один или более маркерных генов, усилительный элемент, промотор и последовательность терминации транскрипции.
Способы в настоящем изобретении включают способы получения химерных или рекомбинантных антител против рецептора Apo-2L, которые содержат стадии предоставления вектора, содержащего последовательность ДНК, кодирующую легкую цепь или тяжелую цепь антитела против рецептора Apo-2L (или и легкую цепь, и тяжелую цепь), трансфекции или трансформации клетки-хозяина вектором и культивирования клетки (клеток)-хозяина в условиях, достаточных для продукции продукта рекомбинантного антитела против рецептора Apo-2L.
(i) Компонент сигнальной последовательности
Антитело против рецептора Apo-2L согласно настоящему изобретению можно получить рекомбинантно не только непосредственно, но также в виде гибридного полипептида с гетерологичным полипептидом, который представляет собой предпочтительно сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность представляет собой последовательность, которая распознается и перерабатывается (т.е. расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и перерабатывают сигнальную последовательность нативного антитела, сигнальная последовательность замещается выбранной прокариотической сигнальной последовательностью, например, из группы щелочной фосфатазы, пенициллиназы, lpp, или термоустойчивые лидерные последовательности энтеротоксина II. Для дрожжевой секреции нативную сигнальную последовательность можно заместить, например, лидерной последовательностью дрожжевой инвертазы, лидерной последовательностью α-фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluyveromyces) или лидерной последовательностью кислой фосфатазы, лидерной последовательностью глюкоамилазы C. albicans или сигнальной последовательностью, описанной в WO 90/13646. При экспрессии клеток млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнальная последовательность gD простого герпеса. ДНК для такой области-предшественника лигируется в рамке считывания в ДНК, кодирующую антитело.
(ii) Происхождение репликационного компонента
И вектор экспрессии, и вектор клонирования содержат последовательность нуклеиновых кислот, которая дает возможность вектору реплицироваться в одном или более выбранных клетках-хозяевах. В целом, в векторах клонирования эта последовательность представляет собой последовательность, которая дает возможность вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает происхождения репликационных или автономно реплицирующихся последовательностей. Такие последовательности хорошо известны для разнообразных бактерий, дрожжей и вирусов. Происхождение репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, происхождение из плазмиды 2μ подходит для дрожжей, и различные вирусные происхождения (SV40, полиомы, аденовирусы, VSV (вируса везикулярного стоматита) или BPV (вируса папилломы крупного рогатого скота)) можно использовать для клонирования векторов в клетках млекопитающих. В целом, происхождение репликационного компонента не требуется для векторов экспрессии млекопитающих (происхождение из SV40 можно типично использовать только потому, что он содержит ранний промотор).
(iii) Компонент селекционного гена
Векторы экспрессии и клонирования могут содержать селекционный ген, также именуемый селектируемым маркером. Типичные селекционные гены кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофные недостаточности или (с) поставляют имеющие решающее значение питательные вещества, недоступные из сложных сред, например, гена, кодирующего рацемазу D-аланина для Bacilli.
Один пример селекционной схемы использует препарат для остановки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий устойчивость препарату и, таким образом, устойчивость к селекционному режиму. В примерах такой доминантной селекции используются препараты неомицин, микофенольная кислота и гидромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются те, которые обеспечивают возможность идентификации клеток, компетентных в захвате нуклеиновой кислоты антитела, такие как DHFR (дигидрофолат-редуктаза), тимидин-киназа, металлотионеин-I и -II, предпочтительно, гены металлотионеина приматов, аденозин-дезаминаза, орнитин-декарбоксилаза и т.д.
Например, клетки, трансформированные селекционным геном DHFR, сначала идентифицируются культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Соответствующая клетка-хозяин при использовании DHFR дикого типа представляет собой линию клеток яичника китайского хомячка (СНО) с недостаточной активностью DHFR.
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или совместно трансформированные с последовательностями ДНК, кодирующими антитело против рецептора Apo-2L, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно селектировать клеточным ростом в среде, содержащей селекционный агент для селектируемого маркера, такого как аминогликозидный антибиотик, например, канамицин, неомицин или G418 (см. патент США № 4965199).
Подходящий селекционный ген для использования в дрожжах представляет собой ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 обеспечивает селекционный маркер для мутантного штамма дрожжей, лишенных способности расти в триптофане, например, АТСС № 44076 или РЕР4-1 (Jones, Genetics, 85:12 (1977)). Затем присутствие повреждения trp1 в геноме дрожжевой клетке-хозяине обеспечивает эффективную среду для выявления трансформации ростом отсутствие триптофана. Аналогично, штамм дрожжей с дефицитом Leu2 (АТСС 20,622 или 38,626) дополняются известными плазмидами, несущими ген Leu2.
Кроме того, векторы, полученные из кольцевой плазмиды pKD1 1,6 мкм можно использовать для трансформации дрожжей Kluyveromyces. Альтернативно, сообщалось об экспрессионной системе для крупномасштабной продукции рекомбинантного телячьего химозина для K. lactis (Van den Berg, Bio/Technology, 8:135 (1990)). Также были раскрыты множественные копии устойчивых векторов экспрессии для секреции зрелого рекомбинантного человеческого сывороточного альбумина промышленными штаммами Kluyveromyces (Fleer et al., Bio/Technology, 9:968-975 (1991)).
(iv) Промоторный компонент
Векторы экспрессии и клонирования обычно содержат промотор, который распознается организмом хозяина и функционально связан с нуклеиновой кислотой антитела. Промоторы, подходящие для использования с прокариотическими хозяевами, включают в себя промотор phoA, β-лактамазные и лактозные промоторные системы, щелочную фосфатазу, триптофановую (trp) промоторную систему и гибридные промоторы, такие как промотор tac. Однако подходят другие известные бактериальные промоторы. Промоторы для использования в бактериальных системах также содержат последовательность Shine-Dalgarno (S.D.), функционально связанную с ДНК, кодирующей антитело против рецептора Apo-2L.
Известны промоторные последовательности для эукариотов. В сущности, все эукариотические гены имеют область, богатую АТ, расположенную приблизительно от 25 до 30 оснований выше сайта, где инициируется транскрипция. Другая последовательность, обнаруживаемая от 70 до 80 оснований выше начала транскрипции многих генов, представляет собой область CNCAAT, где N может представлять собой любой нуклеотид. На 3'-конце большинства эукариотических генов находится последовательность ААТААА, которая может представлять собой сигнал для добавления поли А хвоста к 3'-концу кодирующей последовательности. Все эти последовательности могут быть вставлены в эукариотические векторы экспрессии.
Примеры подходящих промотирующих последовательностей для использования с дрожжами-хозяевами включают в себя промоторы для 3-фосфоглицерат-киназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфат-дегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триосефосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другими дрожжевыми промоторами, которые представляют собой индуцируемые промоторы, имеющие дополнительное преимущество транскрипции, регулируемой условиями роста, являются области промотора для алкоголь-дегидрогеназы 2, изоцитохрома с, кислой фосфатазы, расщепляющие ферменты, связанные с азотным метаболизмом, металлотионеин, глицеральдегид-3-фосфатдегидрогеназа и ферменты, ответственные за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для использования в дрожжевой экспрессии, кроме того, описаны в ЕР 73657. Дрожжевые усилители также преимущественно используются с дрожжевыми промоторами.
Транскрипция антитела против рецептора Apo-2L из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы, аденовирус (такой как аденовирус 2), вирус коровьей папилломы, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита В и наиболее предпочтительно обезьяний вирус 40 (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, из промоторов теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина.
Ранние и поздние промоторы вируса SV40 можно получить в виде рестрикционного фрагмента SV40, который также содержит вирусный источник репликации SV40. Непосредственный ранний промотор человеческого цитомегаловируса можно получить в виде рестрикционного фрагмента HindIII E. Система для экспрессии ДНК в млекопитающих хозяевах с использованием вируса коровьей папилломы в качестве вектора раскрыт в патенте США № 4419446. Модификация этой системы описана в патенте США № 4601978 (см. также документ Reyes et al., Nature 297:598-601 (1982)) по экспрессии кДНК человеческого β-интерферона в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно, длинный концевой повтор вируса саркомы Рауса можно использовать в качестве промотора.
(v) Компонент элемента усилителя
Транскрипция ДНК, кодирующей антитело против рецептора Apo-2L согласно данному изобретению высшими эукариотами, часто увеличивается инсерцией последовательности усилителя в вектор. Многие усилительные последовательности неизвестны из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Обычно, однако, используется усилитель из эукариотического клеточного вируса. Примеры включают усилитель SV40 на поздней стороне источника репликации (bp 100-270), усилитель раннего промотора цитомегаловируса, усилитель полиомы на поздней стороне источника репликации и усилители аденовируса (см. также Yaniv, Nature 297:17-18 (1982) по усилению элементов для активации эукариотических промоторов. Усилитель может быть подвергнут сплайсингу в вектор в положении 5' или 3' в последовательность, кодирующую антитело, но предпочтительно расположен в сайте 5' из промотора.
(vi) Компонент терминации транскрипции
Векторы экспрессии, используемые в эукариотических клетках-хозяевах (дрожжевые, грибковые, насекомые, растительные, животные, человеческие или содержащие ядра клетки из других многоклеточных организмов), должны также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности общедоступны из 5' и, изредка, 3', нетранслированных областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные фрагменты, транскрибированные в качестве полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей многовалентное антитело. Один полезный компонент терминации транскрипции представляет собой область полиаденилирования коровьего гормона роста (см. WO 94/11026 и раскрытый здесь вектор экспрессии).
(vii) Селекция и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в описанных здесь векторах представляют собой описанные выше прокариот, дрожжи или высшие эукариотные клетки. Подходящие прокариоты для этой цели включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, раскрытые в DD 266710, опубликованном 12 апреля 1989 г.), Pseudomonas, такие как P. aeruginosa и Streptomyces. Один необязательный хозяин, клонирующий E. coli, представляет собой E.coli 294 (ATCC 31446), хотя подходят другие штаммы, такие как E. coli В, E. coli X1776 (АТСС 31537) и E. coli W3110 (АТСС 27325). Эти примеры являются иллюстративными без ограничения.
В дополнение к прокариотам, эукариотические микрозонды, такие как нитевидные грибы или дрожжи, представляют собой подходящие хозяева клонирования или экспрессии для векторов, кодирующих антитело рецептора Apo-2L. Saccharomyces cerevisiae, или обычные пекарные дрожжи, представляет собой самый широко используемый среди эукариотических микроорганизмов-хозяев. Однако в настоящем изобретении общедоступен и может применяться ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12,424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATGC 24,178), K. waltii (ATCC 56,500), K. drosophilarum (ATCC 36,906), K. thermotolerans и K. marxianus; yarrowia (EP 402,226); Pichia pastoris (EP 183,070); Candida; Trichoderma reesia (EP 244,234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, такие как, например, Neurospora, Penicillium, хозяева Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела получены из многоклеточных организмов. Примеры клеток беспозвоночных включают в себя клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие клетки-хозяева пермиссивных насекомых от таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (дрозофила) и Bombyx mori. Общедоступны разнообразные вирусные штаммы для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать здесь в качестве вируса в настоящем изобретении, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток хлопка, кукурузы, картофеля, соевых бобов, петунии, томатов и табака можно также использовать в качестве хозяев.
Однако самый большой интерес представляли клетки позвоночных, и размножение клеток позвоночных в культуре (культуре ткани) стало обычной процедурой. Примерами полезных клеток-хозяев млекопитающих являются линия клеток CV1 почек обезьян, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток человеческой эмбриональной почки (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); почечные клетки детеныша хомяка (BHK, ATCC CCL 10); клетки яичников китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); обезьяньи почечные клетки (CV1 ATCC CCL 70); почечные клетки африканских зеленых мартышек (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); почечные клетки собаки (MDCK, ATCC CCL 34); печеночные клетки клетки-буйвола (BRL 3A, ATCC CRL 1442); легочные клетки человека (W138, ATCC CCL 75); печеночные клетки человека (Hep G2, HB 8065); мышиная опухоль молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; линия гепатомы человека (Hep G2); и клетки миеломы или лимфомы (например, клетки YO, J558L, P3 и NS0) (см. патент США № 5807715).
Клетки-хозяева трансформируются описанными выше векторами экспрессии или клонирования для продукции антител и культивируются в обычных питательных средах, модифицированных соответствующим образом, для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желательные последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела согласно настоящему изобретению, можно культивировать в разнообразных средах. Имеющиеся в продаже среды, такие как среда Ham F10 (Sigma), минимальная эссенциальная среда (МЕМ), (Sigma), RPMI-1640 (Sigma) и Модифицированная Дульбекко среда Игла (DMEM), (Sigma) подходят для культивирования клеток-хозяев. Кроме того, любая из сред, описанных в документах Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патенты США № 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195 или в заявке на патент США 30985 можно использовать в качестве культуральных сред для клеток-хозяев. Любая из этих сред может дополняться по необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальные факторы роста), соли (такие как хлорид и фосфат натрия, кальция и магния), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как препарат GENTAMYCINTM), микроэлементы (определяемые как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкоза или эквивалентный источник энергии. Можно также включить любые другие необходимые добавки в соответствующих концентрациях, которые должны быть известны специалистам в данной области. Условия культивирования, такие как температура, рН и им подобные, представляют собой условия, ранее используемые с клетками-хозяевами, выбранными для экспрессии, и они очевидны для среднего специалиста в данной области.
(ix) Очистка
При использовании рекомбинантных методик антитело можно получить внутриклеточно, в периплазматическом пространстве, или оно может непосредственно секретироваться в среду. Если антитело продуцируется внутриклеточно, то в качестве первой стадии удаляются клеточные фрагменты в виде частиц, или фрагменты клеток-хозяев, или лизированные фрагменты, например, центрифугированием или ультрафильтрацией. Carter et al., Bio/Technology 10:163-167 (1992) описывают процедуру для выделения антител, которые секретируются в периплазматическое пространство E. Coli. Вкратце, клеточная паста оттаивается в присутствии ацетата натрия (рН 3,5), EDTA (этилендиаминтетрауксусной кислоты) и фенилметилсульфонилфторида (PMSF) в течение примерно 30 мин. Клеточный дебрис можно удалить центрифугированием. Когда антитело секретируется в среду, надосадочные жидкости из таких систем экспрессии в целом сначала концентрируются, используя имеющийся в продаже концентрирующий белок фильтр, например, установку для ультрафильтрации Amicon или Millipore Pellicon. Ингибитор протеазы, такой как PMSF, можно включить в любую из указанных выше стадий для ингибирования протеолиза и можно включить антибиотики для предотвращения роста адвентиционных загрязняющих элементов.
Композицию антитела, полученную из клеток, можно очистить, используя, например, гидроксилапатитную хроматографию, гель-электрофорез, диализ и аффинную хроматографию, причем аффинная хроматография является предпочтительной методикой очистки. Пригодность белка А в качестве лиганда аффинности зависит от вида и изотипа любой области Fc иммуноглобулина, которая присутствует в антителе. Белок А можно использовать для очистки антител, которые основаны на тяжелых цепях человека γ1, γ2 или γ4 (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для человеческого γ3 (Guss et al., EMBO J. 5:15671575 (1986)). Матрица, к которой присоединен лиганд аффинности, чаще всего представляет собой агарозу, но имеются другие матрицы. Механически устойчивые матрицы, такие как стекло или поли(стиролдивинил)бензол с регулируемыми порами, обеспечивают возможность более быстрых скоростей потока и более короткие периоды времени переработки, чем которые можно достичь агарозой. Когда антитело включает домен СН3, для очистки можно использовать смолу Bakerbond ABXTM (J. T. Baker, Phillipsburg, NJ). В зависимости от антитела, которое предстоит извлечь, также имеются другие методики для очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ в обращенной фазе, хроматография на диоксиде кремния, хроматография на гепарине SEPHAROSETM, хроматография на анионно- или катионнообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и преципитация сульфатом аммония.
NK-клетки можно получить у млекопитающего, используя методики, известные в данной области. Необязательно, NK-клетки представляют собой человеческие клетки, полученные и очищенные от человека-донора. NK-клетки можно очистить, используя материалы, которые общедоступны и имеются в продаже, включая, без ограничения, те, которые описаны ниже в примерах.
Агенты, активирующие NK-клетки, включают различные мелкие молекулы, цитокины и антитела, такие как агенты, активирующие рецепторы Toll, IL-2, IL-12, IL-15, IFN-альфа, IFN-бета, и агонистические антитела к активирующим рецепторам, таким как NKp30, NKp44, NFG2D. Такие агенты общедоступны и имеются в продаже.
С. ПРЕПАРАТИВНЫЕ ФОРМЫ
Лиганд Аро-2 или агонистическое антитело против рецептора Apo-2L и NK-клетки или агент, активирующий NK-клетки, предпочтительно вводятся в носителе. Молекулы можно вводить в одном носителе, или, альтернативно, они могут быть включены в отдельные носители. Подходящие носители и их составы описаны (Remington's Pharmaceutical Sciences, 16th ed., 1980, Mack Publishing Co., Osol et al.). Обычно соответствующее количество фармацевтически приемлемой соли используется в носителе для придания композиции изотоничности. Примеры носителя включают солевой раствор, раствор Рингера и раствор декстрозы. рН раствора составляет предпочтительно примерно от 5 до примерно 8, а предпочтительнее примерно от 7,4 до примерно 7,8. Для специалистов в данной области должно быть очевидно, что определенные носители могут быть более предпочтительны, в зависимости от, например, пути введения и концентрации вводимого агента. Носитель может быть в форме лиофилизированной композиции или водного раствора.
Приемлемые носители, эксципиенты или стабилизаторы являются предпочтительно нетоксичными для клеток и/или реципиентов в используемых дозировках и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалоконийхлорид, бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); полипептиды низкой молекулярной массы (менее чем примерно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводороды, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соль противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (PEG).
Препаративные формы могут также содержать более одного активного соединения, как необходимо для определенного подвергаемого лечению показания, предпочтительно активные соединения с дополнительными видами активности, которые не оказывают неблагоприятного эффекта друг на друга. Альтернативно, или в дополнение, композиция может включать цитотоксический агент, цитокин или агент, ингибирующий рост. Такие молекулы могут присутствовать в комбинации в количествах, которые эффективны для предполагаемой цели.
Антитело против Apo-2L или агонистическое антитело NK-клетки или агент, активирующий NK-клетки, могут также быть включены в полученные микрокапсулы, например, методиками коацервации или межповерхностной полимеризацией, например, гидроксиметилцеллюлозу или соответственно желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в руководстве Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Препаративные формы, подлежащие применению для введения in vivo, должны быть стерильными. Это легко достигается фильтрацией через мембраны для стерилизационной фильтрации.
Можно получить препараты длительного высвобождения. Подходящие примеры препаратов длительного высвобождения включают в себя полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, причем указанные матрицы представлены в форме профилированных изделий, например, пленок или микрокапсул. Примеры матриц длительного высвобождения включают в себя полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и (этил-L-глутамат, нерасщепляемый этиленвинилацетат, расщепляемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, составленные из сополимера молочной кислоты-гликолевой кислоты и лейпролидацетата) и поли-D-(-)-3-гидроксимасляной кислоты. Хотя полимеры, такие как этиленвинилацетат и молочная кислота-гликолевая кислота, обеспечивают возможность высвобождения молекул в течение периода более 100 дней, определенные гидрогели высвобождают белки в течение более коротких периодов времени.
D. ПУТИ ВВЕДЕНИЯ
Apo-2L или агонистическое антитело против Apo-2L и NK-клетки или агент, активирующий NK-клетки, можно вводить в соответствии с известными способами, такими как внутривенное введение в виде болюса или непрерывным вливанием в течение периода времени, внутримышечным, внутрибрюшинным, в спинномозговую жидкость, подкожным, внутрисуставным, внутрисиновиальным, подоболочечным, пероральным, местным или ингаляционным путями. Необязательно, введение можно выполнить посредством вливания мини-насосом, используя различные имеющиеся в продаже устройства.
Эффективные дозировки для введения лиганда Apo-2 или агонистического антитела против Apo-2L и NK-клетки или агента, активирующего NK-клетки, можно определить эмпирически, и проведение таких определений входит в компетенцию специалистов в данной области. В настоящее время считают, что эффективная дозировка или количество лиганда Apo-2, используемого отдельно, может находиться в диапазоне примерно от 1 мкг/кг до примерно 100 мг/кг массы тела или более в день. Эффективная дозировка или количество NK-клеток или агента, активирующего NK-клетки, используемых отдельно, может находиться в диапазоне примерно от 1 мг/м2 до примерно 150 мг/м2. Межвидовое масштабирование дозировок можно выполнить известным в данной области образом, например, как раскрыто в документе Mordenti et al., Pharmaceut. Res., 8:1351 (1991). Специалистам в данной области будет понятно, что дозировка лиганда Apo-2 или агонистического антитела и NK-клеток или агента, активирующего NK-клетки, которую необходимо ввести, будет варьироваться, в зависимости, например, от млекопитающего, которое будет получать лиганд Apo-2 или агонистическое антитело и NK-клетки или агент, активирующий NK-клетки, пути введения и других препаратов или лечебных средств, вводимых млекопитающему.
В зависимости от типа клеток и/или тяжести заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-20 мг/кг) агонистического антитела представляет собой планируемую первоначальную дозировку для введения, или, например, одним или более отдельными введениями, или непрерывным вливанием. Типичная суточная дозировка может находиться в диапазоне примерно от 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. Для повторных введений в течение нескольких дней или больше, в зависимости от состояния, лечение продолжается до тех пор, пока не произойдет желательное подавление симптомов заболевания. Однако можно использовать другие схемы дозировки.
Предусмотрено, что в способах можно использовать один или более агонистов рецептора Apo-2L. Например, опытный специалист может использовать лиганд Apo-2, агонистическое антитело DR4, агонистическое антитело DR5 или их комбинацию. Необязательно, агонистическое антитело против рецептора Apo-2L включает в себя перекрестно-реактивное антитело, которое связывается и с DR4, и с DR5.
Предусматривается, что в способах можно использовать еще дополнительные лечебные средства. Одно или более других терапевтических средств могут включать в себя, без ограничения, другие виды химиотерапии (или химиотерапевтические средства) и/или лучевую терапию, иммуноадъюванты, средства, ингибирующие рост, цитокины, и другие методы лечения, не основанные на Her-2 антителе. Примеры включают в себя интерлейкины (например, IL-1, IL-2, IL-3, IL-6), фактор, ингибирующий лейкоз, интерфероны, TGF-бета, эритропоэтин, тромбопоэтин и антитело против VEGF. Можно также использовать другие средства, которые, как известно, вызывают апоптоз в клетках млекопитающих, и такие агенты включают TNF-α, TNF-β (лимфотоксин-α), лиганд CD30, лиганд 4-1ВВ и лиганд Apo-1.
Дополнительные химиотерапевтические средства, предусмотренные изобретением, включают в себя химические вещества или препараты, которые известны в данной области, и имеются в продаже, такие как адриамицин, доксорубицин, 5-фторурацил, цитозинарабинозид ("Ara-C"), циклофосфамид, лейковорин, тиотепа, бусульфан, цитоксин, таксол, токсотер, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопозид, ифосфамид, митомицин С, митоксантрон, винкристин, винорелбин, карбоплатин, тенипозид, дауномицин, каминомицин, аминоптерин, дактиномицин, митомицины, эспарамицины (см. патент США № 4675187), мелфалан и другие родственные азотистые иприты. Также включены средства, которые действуют для регуляции или ингибирования действия гормонов на опухоли, такие как тамоксифен и онапристон.
Получение и схемы дозировки таких химиотерапевтических средств можно использовать в соответствии с инструкциями изготовителей или в соответствии с эмпирическим определением опытным практикующим врачом. Получение и схемы дозировки таких химиотерапевтических средств также описаны в документе Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992). Введение химиотерапевтического средства может предшествовать или следовать за введением Apo-2L или агонистического антитела и/или NK-клеток или агента, активирующего NK-клетки, или его можно вводить одновременно с ними.
Химиотерапевтическое средство предпочтительно вводится в носителе, таком как носители, описанные выше. Путь введения химиотерапевтического средства может быть таким же, как используемый для лиганда или агонистического антитела Apo-2 и/или NK-клеток или агента, активирующего NK-клетки, или его можно вводить другим способом.
Лучевую терапию можно проводить в соответствии с протоколами, обычно используемыми в данной области и известными опытному специалисту. Такая терапия может включать облучение цезием, иридием, йодом или кобальтом. Лучевая терапия может представлять собой облучение всего тела или может быть направлена локально на определенный участок или ткань в теле или на нем. Обычно лучевую терапию проводят импульсами в течение периода времени примерно от 1 до примерно 2 недель. Однако лучевую терапию можно проводить в течение более длительных периодов времени. Необязательно, лучевую терапию можно проводить в виде одиночной дозы или в виде множественных, последовательных доз.
После введения лиганда или агонистического антитела Apo-2 и NK-клеток или агента, активирующего NK-клетки, обработанные клетки in vitro можно анализировать. В случаях, когда было проведено лечение in vivo, получавшее лечение млекопитающее можно подвергать мониторингу различными путями, известными опытному практикующему специалисту. Например, массу опухоли можно наблюдать физически, путем биопсии или стандартными методиками рентгеновской визуализации.
III. Изготавливаемые изделия
В другом варианте осуществления изобретения предоставляется изготавливаемое изделие, содержащее материалы, используемые для лечения расстройств, описанных выше. Изготовленное изделие включает в себя контейнер и этикетку. Подходящие контейнеры включают, например, бутыли, флакончики, шприцы и пробирки. Контейнеры могут быть изготовлены из разнообразных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая эффективна для лечения состояния и может иметь стерильный канал доступа (например, контейнер может представлять собой мешочек или флакончик с раствором для внутривенного введения, имеющий пробку, прокалываемую иглой для подкожных инъекций). Активные средства в композиции представляют собой лиганд или агонистическое антитело Apo-2L и NK-клетки или агент, активирующий NK-клетки. Этикетка на контейнере или в сочетании с ним указывает на то, что композиция используется для лечения выбранного состояния. Изготавливаемое изделие может, кроме того, включать второй контейнер, включающий фармацевтически приемлемый буфер, такой как солевой раствор с фосфатным буфером, раствор Рингера и раствор декстрозы. Он может, кроме того, включать другие материалы, желательные с коммерческой точки зрения и с точки зрения пользователя, включая в себя другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши упаковки с инструкциями по применению.
Следующие примеры представлены в качестве иллюстрации, а не в качестве ограничения. Содержание всех ссылок, приведенных в описании, специально включено сюда в качестве ссылки.
ПРИМЕРЫ
Пример 1
Воздействие активаторов рецепторов Toll и NK-клеток на клетки 4Т1
Клетки 4Т1 (линия клеток метастатической карциномы молочной железы, полученная у мышей BALB/C, полученных из Fred Miller, Karmanos Cancer Institute) анализировали в анализе цитотоксичности in vitro для исследования эффектов уничтожения опухолевых клеток различными активаторами рецептора Toll ("TLR") и NK-клеток. Клетки-мишени 4Т1 культивировали в среде IDMEM с добавлением 10% FCS (фетальной телячьей сыворотки), глутамина и пенициллина/стрептомицина, меченного 100 мКи51Cr в течение 1 ч при 37°С, и затем промывали 3 раза культуральной средой.
Для получения очищенных эффекторных NK-клеток для анализа PBMC (мононуклеарные клетки периферической крови) от здоровых людей-доноров изолировали стандартным центрифугированием в градиенте плотности через Ficoll-Paque Plus (Pharmacia). Сначала вызывали истощение запаса CD3 положительных клеток, используя микрошарики против CD3 (полученные от Miltenyi), и затем NK-клетки очищали, используя микрошарики против CD56 (Miltenyi). Чистота препарата NK-клеток составила 95% или выше, по данным определения окрашиванием конъюгатами мышиного античеловеческого CD56 PE и мышиного античеловеческого CD14 PE (BD Biosciences). Изолированные клетки культивировали в среде RPMI 1640 с добавлением инактивированной нагреванием 10% FCS, пенициллина, стрептомицина, 10 мМ пирувата натрия, 2 мМ L-глутамина и 10 мМ HEPES.
104 меченых 4Т1-клеток добавляли к варьирующимся количествам очищенных NK-клеток (или необработанных контрольных NK-клеток, или NK-клеток, обработанных определенным агентом) в соотношениях соответственно 1:1, 3:1, 6:1, 12:1, 25:1 и 50:1. NK-клетки обрабатывали в течение 18 ч одним из следующих агентов, активирующих TLR: sBLP (1 мкг/мл, Bachem); поли(I:C) (50 мкг/мл, Pharmacia); E. Coli 055:B5 LPS (липополисахарид, экстрагированный фенолом, 1 мкг/мл, Sigma); флагеллин (1 мкг/мл, A. Gewirtz, Emory University); R-848 (5 мкг/мл, Invivogen); CpG олигонуклеотиды (2006 и 2216, 5 мкМ, Invivogen). Анализы цитотоксичности выполняли в 96-луночных планшетах с круглым дном и образцы инкубировали в двойных лунках в течение 4 ч при 37°С, 5% СО2. Во время инкубации использовали среду RPMI 1640 с добавлением инактивированной нагреванием 10% FCS, пенициллина, стрептомицина, 10 мМ пирувата натрия, 2 мМ L-глутамина и 10 мМ HEPES.
После 4-часовой инкубации надосадочные жидкости аспирировали из лунок и исследовали на высвобождение51Cr, используя гамма-счетчик. Процент специфического лизиса рассчитывали в виде 100 × (экспериментальное cpm (количество имп/мин) - спонтанное cpm)/(общее cpm - спонтанное cpm). Данные являются репрезентативными по меньшей мере трех экспериментов, и наблюдалось SD (стандартное отклонение) <5%.
Результаты показаны на фиг.1. Небольшой или отсутствующий лизис 4Т1-клеток наблюдали при обработке контрольными (покоящимися) NK-клетками, даже при высоком отношении эффектора к мишени (Е:Т), тогда как клетки эффективно лизировались NK-клетками, активированными поли(I:C). Кроме того, NK-клетки, обработанные активатором TLR7 и TLR8 R-848, также эффективно уничтожали 4Т1-клетки-мишени. В определенных условиях анализа ни BLP, LPS, флагеллин, ни CpG олигонуклеотид не вызывали цитотоксическую активность очищенных NK-клеток в отношении 4Т1-мишеней.
Пример 2
Индукция Apo2L/TRAIL NK-клетками
Анализ экспрессии гена на основе микромассы с использованием масс олигонуклеотида высокой плотности (GeneChip, Affymetrix) выполняли, используя РНК из покоящихся и обработанных поли(I:C) NK-клеток (NK-клетки получали и очищали от 4 здоровых доноров, используя методику, описанную в примере 1 выше). NK-клетки обрабатывали поли(I:C) (50 мкг/мл, Pharmacia) в течение ночи в среде RPMI 1640 с добавлением инактивированной нагреванием 10% FCS, пенициллина, стрептомицина, 10 мМ пирувата натрия, 2 мМ L-глутамина и 10 мМ HEPES. РНК выделяли, используя набор RNeasy (Qiagen) и обрабатывали лишенной РНазы ДНазой-I (Ambion) для обеспечения удаления загрязняющей ДНК. NK-клетки лизировали в лизисном буфере (50 мМ HEPES рН 7,5, 150 мМ NaCl, 1,5 мМ MgCl2, 1 мМ EGTA (этиленгликольтетрауксусной кислоты), 10% глицерина и 1% Triton X-100, дополненном коктейлем полного ингибитора протеазы (Roche).
Наборы зондов Affymetrix U133A и B GeneChip использовали для идентификации дифференциально экспрессированных транскриптов. Первоначально гены ранжировали в соответствии с согласованностью при попарном сравнении и использовали тест попарного сравнения Mann-Whitney для расчета значимости. Гены, для которых согласованность составила 100%, были выбраны для дальнейшего анализа. Этот подход был ранее обоснован для идентификации дифференциально экспрессированных генов подтверждением RT-PCR (полимеразной реакцией синтеза цепи) в реальном масштабе времени. Для определения доверительных интервалов, показанных в таблице 1, средний log10-сигнал рассчитывали для каждого набора зондов интересующих генов или групп лечения и контроля. Показатель log10 изменения складки определяли как разность между этими средними величинами. Объединенный показатель стандартного отклонения средних величин этих двух групп (рассчитанных отдельно для каждого набора зондов) использовали для расчета 95% доверительного интервала для log10 изменения складки. Показатель log10 изменения складки и 2 итога его 95% доверительного интервала экспонировали обратно на первоначальную сигнальную шкалу, предоставляя показатель изменения складки и соответствующий 95% доверительный интервал. Дополнительную информацию о наборах зондов U133 можно получить у изготовителя, Affymetrix.
Индукция IL-6, IL-8 и IFN-гамма, наблюдавшаяся в этом анализе, подтверждает ранее полученные результаты, о которых сообщили Schmidt et al., J. Immunol., 172:138-143 (2004) и обосновывает этот подход для анализа других генов, контролируемых активацией TLR (таблица 1).
Величины изменения складки и ассоциированные 95% доверительные интервалы (степень свободы = 6) определяли для интересующих генов после обработки поли(I:C) относительно необработанных NK-клеток. Показаны данные по каждому набору зондов, присутствующему на серии чипов Affymetrix U133, соответствующему интересующим генам.
В случае таких генов, как TNF-альфа, FasL, IL-8 и CCL20, нижний предел доверительного интервала для изменения складки был ниже 2,0. Это можно было отнести на счет вариабельности доноров, главным образом, ввиду большей вариабельности донора #1. Внимание было сосредоточено на генах, считавшихся потенциально важными эффекторами функции NK-клеток, таких как NCR, лиганды рецепторов гибели и гены, участвующие в цитотоксичности, зависимой от перфорина (таблица 1). Обработка NK-клеток поли(I:C) значимо не изменяла экспрессию мРНК, кодирующих нарушающих равновесие мембраны белков перфорина и гранулизина, гранзимов А, В, М или активирующих рецепторов клеточной поверхности NKG2D и NKp44. Экспрессия гранзима Н и NKp30 была снижена в 3-5 раз. Авторам изобретения в настоящее время неизвестны какие-либо сообщения о том, что гранзим Н вызывает гибель клеток, и его физиологическая роль остается не полностью понятной [Edwards et al., J. Biol. Chem., 274:30468-30473 (1999)]. Напротив, обработка поли(I:C) увеличила экспрессию Apo2L/TRAIL почти в 10 раз. Меньшее, но воспроизводимое увеличение экспрессии мРНК для FasL и TNF-альфа также наблюдалось после активации TLR3 на NK-клетках.
В другом эксперименте очищенные NK-клетки обрабатывали в течение 18 ч в среде RPMI 1640 с добавлением инактивированной нагреванием 10% FCS, пенициллина, стрептомицина, 10 мМ пирувата натрия, 2 мМ L-глутамина и 10 мМ HEPES поли(I:C) (50 мкг/мл), R-848 (5 мкг/мл) или hIFN-альфа (1000 ЕД/мл, Sigma) в присутствии или в отсутствие 10 мкг/мл циклогексамида и измеряли содержание Apo2L/TRAIL в экстрагированных РНК. Выполняли RT-PCR и количество кДНК определяли анализом RT-QPCR (количественной полимеразно-цепьевой реакции в реальном масштабе времени), нормализованным к RPL19, и индукция складки в сравнении с контролем показана на фиг.2А. Затравки обозначались в соответствии с инструкциями (Primer Express) и последовательности представляют собой: hRPL19-зонд: AGGTCTAAGACCAAGGAAGCACGCAA (SEQ ID NO:7); hRPL19-For: ATGTATCACAGCCTGTACCTG (SEQ ID NO:8); hRPL19-Rev: TTCTTGGTCTCTTCCTCCTTG (SEQ ID NO:9); hApo2L-зонд: CCCAATGACGAAGAGAGTATGAACAGCCC (SEQ ID NO:10); hApo2L-For: TCCAAAAGTGGCATTGCTTG (SEQ ID NO:11); hApo2L-Rev: CTGACGGAGTTGCCACTTGA (SEQ ID NO:12). кДНК анализировали для выявления экспрессии RPL19 и Apo2L/TRAIL RT-QPCR (Applied Biosystems), как описано в документе Zarember et al., J. Immunol., 168(2):554-61 (2002). Величины увеличения складки выражены в произвольных единицах относительно калибровочного гена RPL19.
Вероятно, что увеличенная экспрессия Apo2L/TRAIL является важной, потому что Apo2L/TRAI может вызвать апоптоз в разнообразных линиях раковых клеток, а клетки 4Т1 экспрессируют рецептор DR4 (данные не показаны). Количественный анализ RT-PCR показал, что обработка поли(I:C) и R-848 увеличивала мРНК Apo2L/TRAIL соответственно в 26 и 25 раз (см. фиг.2А). Кроме того, аналогичное увеличение мРНК Apo2L/TRAIL наблюдалось в NK-клетках, обработанных IFN-альфа, подтверждая предыдущие результаты, представленные в документе Biron et al., Semin. Immunol., 10:383-390 (1998). Индукция сигналов Apo2L/TRAIL в этих стимулированных клетках не блокировалась ингибитором синтеза белка циклогексимидом, указывающим на то, что увеличение сигналов Apo2L/TRAIL представляет собой первичный эффект стимуляции TLR на NK-клетки.
Лизаты покоившихся и стимулированных поли(I:C) NK-клеток или надосадочные жидкости их культур оценивали на присутствие белка Apo2L/TRAIL количественной ELISA (набор, BD Biosciences). Для подтверждения того, что экспрессия белка Apo2L/TRAIL была увеличена после активации NK-клеток поли(I:C) или R848, выполняли ELISA. Хотя белок Apo2L/TRAIL не выявлялся в необработанных клетках или их надосадочной жидкости, белок Apo2L/TRAIL присутствовал в ассоциированной с клетками форме в клетках, стимулированных поли(I:C) (фиг.2В). Не было обнаружено высвобождение значимых уровней Apo2L/TRAIL в надосадочные жидкости из стимулированных клеток.
Apo2L/TRAIL клеточной поверхности на очищенных NK-клетках, обработанных поли(I:C), R848 или hIL-2 (30 нг/мл, BD Biosciences) также анализировали цитометрией. Изотипический контроль (IgG2a, Sigma) и антитело против Apo2L/TRAIL (5С2) метили Alexa 488 (Molecular Probes). 5×105 клеток инкубировали с 2 мкг человеческого IgG для блокировки FcRs и 1 мкг непосредственно меченых mAbs при 4°С в течение 45 мин с последующими 2 промываниями. Окрашенные клетки анализировали, используя цитометр FACS (Becton Dickenson) и программное обеспечение Cellquest.
Результаты представлены на фиг.2С. Жирная линия соответствует изотипическому контролю, а более тонкая линия - окрашиванию Apo2L/TRAIL. Показанные результаты представляют собой репрезентативного донора (из трех или более доноров) во всех трех панелях. Обработка клеток R848 или поли(I:C) привела к возросшим уровням белка Apo2L/TRAIL, связанного с мембраной при использовании проточной цитометрии (фиг.2С). Хотя Apo2L/TRAIL не был выявлен на поверхности необработанных NK-клеток, обработка поли(I:C) или R848 привела к выявляемой экспрессии Apo2L/TRAIL на клеточной поверхности. В качестве положительного контроля обработка NK-клеток IL-2 также увеличивает экспрессию Apo2L/TRAIL на клеточной поверхности [Zamai et al., J. Exp. Med., 188:2375-2380 (1998)].
Пример 3
Эффекты анти-Apo2L Abs при блокировке цитолитической активности NK-клеток
Проводили эксперименты, которые продемонстрировали, что Apo2L/TRAIL ответствен за усиленную активность NK-клеток, обработанных агонистами TLR. Анализ цитотоксичности выполняли, как описано в примере 1, за исключением следующих модификаций. Очищенные NK-клетки обрабатывали поли(I:C) или R848 в течение ночи и инкубировали с клетками 4Т1. Роль TNF-альфа, FasL и Apo2L/TRAIL оценивали предварительной инкубацией NK-клеток с нейтрализующими антителами к соответствующим лигандам. Следующие нейтрализующие антитела добавляли в конечной концентрации 2 мкг/мл: анти-Fas-L (mIgG2b, R&D Systems), анти-TNF-альфа (mIgG1, Genetech) и анти-Apo2L/TRAIL (5С2, mIgG2a, ATCC HB-12258 и 1D1, mIgG2b; ATCC HB-12257). Изотипические контрольные антитела получали от BD Biosciences. Подобранные к изотипу mAbs использовали в качестве контролей; эти антитела не изменяли литическую активность покоящихся или активированных NK-клеток.
При использовании нейтрализующего антитела к Apo2L/TRAIL устранялась цитотоксическая активность NK-клеток, активированных или R-848, или поли(I:C), тогда как антитела или к TNF-альфа, или к FasL не оказывали эффекта (фиг.3А). Цитотоксическая активность NK-клеток, стимулированных TLR, в отношении клеток 4Т1 также блокировалась использованием гибридного белка DR5-Fc, рекомбинантной формы внеклеточного домена DR5, которая связывает Apo2L/TRAIL и, посредством этого, нейтрализует его функцию (данные не показаны).
Очищенные NK-клетки обрабатывали поли(I:C) или R-848 и инкубировали с клетками меланомы B16BL10 (ATCC) в указанных соотношениях. Очищенные NK-клетки, стимулированные R-848, инкубировали клетками-мишенями НСТ116 (АТСС) в указанных соотношениях. Роль Apo2L/TRAIL в анализах лизиса в панелях В и С определяли предварительной инкубацией с нейтрализующими (5С2) и не нейтрализующими (1D1) mAbs против Apo2L/TRAIL. Данные были подтверждены NK-клетками по меньшей мере от 3 доноров, и наблюдалось 5% SD.
Нестимулированные NK-клетки не были цитотоксичными в отношении клеток B16BL6 и проявляли ограниченную активность в отношении клеток НСТ116 при высоких соотношениях E/T (фиг.3В, С). Напротив, поли(I:C) или NK-клетки, стимулированные R-848, эффективно уничтожали клетки B16BL6, и нейтрализация Apo2L/TRAIL полностью блокировала эту активность (фиг.3В). Интересно, что хотя NK-клетки, стимулированные поли(I:C) (данные не показаны) или R-848, также проявляли повышенную цитотоксичность в отношении клеток НСТ116, эта активность лишь частично блокировалась нейтрализацией активности Apo2L/TRAIL. Это свидетельствует о том, что активация NK-клеток TLR также ведет к индукции независимых от Apo2L/TRAIL цитотоксических путей, которые могут быть зависимыми от клетки-мишени. Эти данные демонстрируют, что индукция Apo2L/TRAIL представляет собой важную стадию в опосредованной TLR стимуляции цитотоксической активность NK-клеток против опухолевых клеток.
Индукция Apo2L/TRAIL вслед за активацией TLR ранее наблюдалась в других природных иммунных клетках, таких как моноциты и DC (донорские клетки). Однако в этих случаях усиленная экспрессия Apo2L/TRAIL представляла собой вторичный эффект. В частности, стимуляция очищенных DC поли(I:C) преднамеренно вела к секреции IFN-бета, которая затем вызывала экспрессию Apo2L/TRAIL [Vidalain et al., J. Immunol., 167:3765-37752(2001)]. Аналогичные вторичные эффекты наблюдались после обработки РВМС олигодеоксинуклеотидом CpG, где IFN-альфа, секретируемый плазмацитоидными DC, вела к усиленной экспрессии Apo2L/TRAIL моноцитами [Kemp et al., J. Immunol., 171:212-218 (2003)]. Согласованно с этим понятием исследования, включающие использование мышей с дефицитом Apo2L/TRAIL или нейтрализацией активности Apo2L/TRAIL, выявили роль NK-клеток, экспрессирующих Apo2L/TRAIL, в борьбе с метастазами опухолей [Cretney et al., J. Immunol., 168:1356-1361 (2002); Takeda et al., J. Exp. Med., 195:161-169 (2002)].
Пример 4
Воздействия объединения Apo2L/TRAIL и активированных NK-клеток на опухолевые клетки
Используя анализ цитотоксичности, как описано в примере 1, рекомбинантный Apo2L/TRAIL (аминокислоты 114-281, полученные, как описано в документе Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999), добавляли в отобранные ячейки в концентрации 200 нг/мл. Для оценки устойчивости опухолевых клеток использовали также концентрации Apo2L/TRAIL до 2 мкг/мл. Клетки 4Т1 обрабатывали диапазоном концентраций белка Apo2L/TRAIL, но они были устойчивы к лизису.
Проводили также эксперименты для определения того, можно ли покоящиеся NK-клетки активировать добавлением белка Apo2L/TRAIL. Покоящиеся NK-клетки (очищенные, как описано в примере 1) инкубировали с клетками-мишенями 4Т1 и увеличивающимися концентрациями белка Apo2L/TRAIL. Наблюдали зависимый от дозы лизис клеток 4Т1, указывающий на то, что Apo2L/TRAIL может действовать совместно с покоящимися NK-клетками. Некоторое увеличение наблюдалось в случае активированных NK-клеток после добавления Apo2L/TRAIL, возможно, ввиду достаточного количества Apo2L/TRAIL, уже экспрессированного активированными NK-клетками.
Эти результаты также наблюдались в линиях опухолевых клеток мышей, эпителиальных клеток молочной железы C57MG и клеток B16BL10, происходящих из меланомы, где добавление Apo2L/TRAIL к покоящимся NK-клеткам увеличивало наблюдавшийся лизис (значимое увеличение не наблюдалось в случае активированных NK-клеток). Аналогичные результаты также наблюдались, когда клетки НСТ116 обрабатывали 5 нг/мл Apo2L/TRAIL или покоящимися NK-клетками и комбинацией обоих. Концентрация 5 нг/мл Apo2L/TRAIL была выбрана, поскольку при этой концентрации не наблюдался лизис клеток НСТ116. Добавление Apo2L/TRAIL к ограничивающим соотношениям покоящихся NK-клеток приводит к усиленному цитотоксическому эффекту. Поэтому комбинированная обработка Apo2L/TRAIL и покоящимися NK-клетками может привести к лизису раковых одним Apo2L/TRAIL отдельно, или, альтернативно, можно увеличить чувствительность раковых клеток к Apo2L/TRAIL.
Пример 5
Воздействия комбинации Apo2L/TRAIL и NK-клеток на опухолевые клетки
Дополнительные количественные анализы проводили для демонстрации или подтверждения воздействий белка Apo-2L и NK-клеток на раковые клетки.
Методики и материалы
NK-клетки изолировали из периферической крови здоровых доноров и NK-клетки очищали, как описано выше. NK-клетки культивировали в среде RPMI 1640 с добавлением инактивированной нагреванием FCS, стрептомицина, пенициллина, 10 мМ пирувата натрия, 2 мМ L-глутамина и 10 мМ HEPES, рН 7,4. Активированные NK-клетки получали обработкой в течение 16 ч 5 мкг/мл R848 (Invivogen, растворенным в концентрации 1 мг/мл в воде; активаторе TLR7 и TLR8), IL-2, IL-12 и IL-15. Клетки 4Т1 (карциномы молочной железы, полученной у мышей BALB/C; полученные из Fred Miller, Karmanos Cancer Institute), и клетки меланомы В16 (АТСС) сохраняли соответственно в средах IDMEM и DMEM, с добавлением 10% FCS, глутамина, стрептомицина и пенициллина. Р19 субклонировали в сайты pRKN-Flag, Cla и AscI, что привело к меченой на С-конце форме Р19. Устойчивые линии клеток 4Т1 или В16 получали после трансфекции pRKN-PI9 Flag или пустого вектора, используя Polyfect. Клоны отбирали в среде, дополненной генетицином (Gibco) (в концентрации 1 и 2 мг/мл соответственно для клеток 4Т1 и В16). Экспрессию РI9 выявляли анти-Flag антителом (клон М2, Sigma).
Для анализов цитотоксичности клетки-мишени метили 100 мКи51Cr в течение 1 ч при 37°С и затем промывали 3 раза перед использованием. 104 Клеток-мишеней добавляли к варьирующимся количествам эффекторных клеток в указанных соотношениях и инкубировали в спаренных лунках в течение 4 ч при 37°С, 5% СО2 и надосадочные жидкости использовали для определения высвобожденного51Cr, используя гамма-счетчик. Количественные анализы цитотоксичности выполняли в 96-луночных планшетах с круглым дном и процент специфического лизиса рассчитывали в виде 100 × (имп/мин в эксперименте - спонтанные имп/мин)/(общее количество имп/мин - спонтанные имп/мин). Роль Apo2L/TRAIL, экспрессированных NK-клетками, при лизисе клеток-мишеней оценивали, используя mAbs против Apo2L/TRAIL (5С2 и 1D1, Genetech, Inc.). Изотипические контрольные антитела получали от BD Biosciences. Эти контрольные антитела не изменяли литическую активность NK-клеток.
При количественных анализах белка использовали кроличьи антитела против mPARP (Asp-214), каспазы 3 (8G10) и расщепленной активной каспазы-3 (Asp-175 5A1), как рекомендуется изготовителем (Cell Signaling Technology) для анализа иммуноблоттинга. Антитело к Flag эпитопу (M2, Sigma) использовали для выявления РI9, меченного Flag эпитопом. Все клеточные экстракты получали из 4Т1-клеток, используя лизисный буфер (0,1 М Tris рН 8,0, 500 мМ NaCl, 2мМ EDTA, 1% Triton X-100, 10% глицерин с добавлением полного коктейля ингибитора протеазы, Roche) и лизаты просветляли центрифугированием при 16000 об/мин в течение 10 мин при 4°С. Лизаты фракционировали SDS-PAGE и переносили на нитроцеллюлозные мембраны. Мембраны инкубировали с указанными антителами с последующей инкубацией со вторичными антителами, конъюгированными HRP (пероксидазой хрена) (козье анти-кроличье антитело, Cell Signaling Technology; и козье анти-мышиное антитело, Jackson Immunoresearch). Иммунные комплексы выявляли, используя усиленную хемилюминесценцию (Amersham).
Результаты анализов
Результаты анализов показаны на фиг.8-10.
Линии 4Т1- и В16-клеток лизировали активированными NK-клетками зависимым от Apo2L/TRAIL путем, в то время как обработка этих клеток диапазоном концентраций белка Apo2L/TRAIL выявила определенную устойчивость к его апоптотическим эффектам. Аналогичные концентрации Apo2L/TRAIL эффективно опосредовали высвобождение51Cr клетками НСТ-116 или SKMES-1, как сообщалось ранее.
Поскольку NK-клетки обладают цитотоксическими гранулами, которые содержат зависимый от перфорина механизм уничтожения клеток-мишеней, то исследовали роль перфорина и содержимого других цитотоксических гранул в лизисе 4Т1-клеток. Обработка активированных NK-клеток проникающим в клетки ингибитором гранзима В ("GraB") в виде пептидного субстрата привела к лизису 4Т1-клеток. Напротив, обработка пептидом, общим ингибитором каспазы (данные не показаны), не блокировала высвобождение Cr, указывая на специфичность ингибитора GraB и на то, что пермеабилизация мембран представляет собой явление, предшествующее активации каспаз. Конканамицин А, который блокирует созревание перфорина, также блокировал цитотоксическую активность NK-клеток. Доставка цитотоксических гранул в направлении к зоне контакта с клетками-мишенями опосредуется подачей сигналов PI3K, и ингибирование PI3K приводит к отсутствию движения цитотоксических гранул. Обработка активированных NK-клеток вортманнином, ингибитором PI3K, также блокировала литическую активность, в то время как добавление других ингибиторов киназы не воздействовала на активность NK-клеток. Эти результаты совместно демонстрируют роль зависимых от перфорина путей при лизисе 4Т1-клеток активированными NK-клетками.
4Т1-клетки обрабатывали Apo2L/TRAIL или активированными NK-клетками и оценивали на наличие активации каспазы-3 и продукции расщепленного фермента репарации ДНК, поли(АДФ-рибозил) полимеразы ("PARP"), субстрата каспазы-3. Обработка Apo2L/TRAIL не приводила к расщеплению про-каспазы-3 и PARP, но активировали NK-клетки, обладали мощной способностью активации каспазы-3 и способностью расщепления PARP в 4Т1-клетках. Соответственно, обработка опухолевых клеток активированными NK-клетками привела к продукции активных форм каспазы-3 и PARP, явлениям, которые представляют собой критерии апоптотической гибели клеток.
Поскольку и Apo2L/TRAIL, и гранулы перфорина клеточной поверхности существенны для лизиса 4Т1-клеток, то проводили количественные анализы для исследования того, могут ли NK-клетки быть «вооружены» добавлением растворимого белка Apo2L/TRAIL. Существует прецедент проявления связанной с мембраной и растворимой формами членов семейства TNF различного поведения после нанесения на клетку-мишень. С целью подтверждения результатов количественных анализов высвобождения51Cr, клоногенный потенциал 4Т1-клеток оценивали обработкой растворимым Apo2L/TRAIL и покоящимся NK-клетками. Как видно в исследованиях высвобождения Cr, 4Т1-клетки, обработанные индивидуально растворимым Apo2L/TRAIL или покоящимся NK-клетками при отношении 25 к 1, не подвергались воздействию с точки зрения клоногенной способности, однако одновременная обработка растворимым Apo2L/TRAIL и покоящимся NK-клетками привела в резком уменьшении клонов 4Т1-клеток, наблюдавшемся через 5 дней. Аналогичное уменьшение количества клонов наблюдалось в случае 4Т1-клеток, инкубированных активированными NK-клетками. В случае активированных NK-клеток лизис 4Т1-клеток снова строго зависел от активности Apo2L/TRAIL, поскольку добавление 5С2 нейтрализующего антитела привело к защите жизнеспособности 4Т1-клеток.
В количественных анализах, исследующих эффекты на клетки НСТ116, обработка растворимым Apo2L/TRAIL и ограничивающими отношениями покоящихся NK-клеток привела к усиленному цитотоксическому эффекту. Поэтому считается, что добавление Apo2L/TRAIL и покоящихся NK-клеток может привести к лизису линий опухолевых клеток, которые иначе устойчивы к гибели, вызванной одним Apo2L/TRAIL, или что чувствительность опухолевых клеток к Apo2L/TRAIL можно увеличить, как наблюдалось в случае клеток НСТ116.
Обработка 4Т1-клеток активированными NK-клетками привела к активации каспазы-3 и PARP. 4Т1-клетки также обрабатывали покоящимися NK-клетками или растворимым Apo2L/TRAIL или их комбинацией. Обработка 4Т1-клеток покоящимися NK-клетками не привела к расщеплению PARP, однако комбинированная обработка покоящимися NK-клетками наряду с растворимым Apo2L/TRAIL привела к продукции расщепленной PARP, демонстрируя, что комбинированные эффекты покоящихся NK-клеток и растворимого Apo2L/TRAIL не привели к апоптозу (что согласуется с наблюдениями в описанных выше клоногенных анализах и анализах высвобождения хрома). Считается, Granzyme B может представлять собой важный комонент NK-клеток в этом синергическом или совместном эффекте.
Депозит материала
Следующие материалы были депонированы в Американской Типовой Коллекции Культур, 10801 University Blvd., Manassas, VA 20110-2209, USA (ATCC):
Это депонирование было произведено согласно положениям Будапештского договора по Международному признанию депозитов микроорганизмов с целью патентной процедуры и по Инструкциям в соответствии с этим договором (Будапештским договором). Это обеспечивает поддержание жизнеспособной культуры депозита в течение 30 лет от даты депонирования. В соответствии с условиями Будапештского договора доступ к депозиту должен быть предоставлен АТСС и подлежит соглашению между Genentech Inc. и ATCC, которое гарантирует постоянную и неограниченную доступность потомства культуры депозита для общественности после выдачи соответствующего патента США или открытия для общественности любой заявки на патент США или другого государства, в зависимости от того, что поступит первым, и гарантирует доступность потомства лицу, определенному Уполномоченным по патентам и торговым маркам, имеющим на это право, в соответствии с разделом 122 35 Кодекса Законов США и определяемыми им инструкциями для Уполномоченного (включая раздел '1.14 37 Свода Федеральных Инструкций с особой ссылкой на параграф 886 OG 638).
С правопреемником настоящей заявки согласовано, что если культура материалов в депозите погибнет или будет потеряна или разрушена при культивировании в подходящих условиях, то после уведомления материалы будут сразу замещены другими или такими же. Доступность депонированного материала не следует рассматривать как разрешение на осуществление изобретения в нарушение прав, которые даны полномочиями любого правительства в соответствии с патентным законодательством данной страны.
Предшествующее письменное описание считается достаточным для обеспечения возможности осуществления изобретения специалистом в данной области. Настоящее изобретение не должно ограничиваться объемом представленных здесь примеров. Действительно, различные модификации изобретения, в дополнение к тем, которые показаны и описаны здесь, станут очевидными для специалистов в данной области из предшествующего описания, и они укладываются в объем прилагаемой формулы изобретения.
Реферат
Группа изобретений относится к экспериментальной медицине и может быть использовано для усиления апоптоза или цитолитической активности в клетках млекопитающих. Способ и применение по изобретению включают приведение клеток млекопитающих в контакт с эффективным количеством агониста рецепторов Аро-2-лиганда и покоящихся или необработанных NK-клеток, при этом указанный агонист выбирают из полипептида Аро-2-лиганда, агонистического анти-DR5 антитела и агонистического анти-DR4 антитела. Использование изобретений позволяет усилить индукцию апоптоза и цитолиза в опухолевых клетках за счет активирования агонистом рецепторов Аро-2-лиганда покоящихся NK-клеток. 2 н.и 24 з.п. ф-лы, 1 табл., 10 ил.

Комментарии