Вектор экспрессии car и car-экспрессирующие т-клетки - RU2670147C1
Код документа: RU2670147C1
Чертежи













Описание
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к вектору экспрессии CAR, CAR-экспрессирующей Т-клетке, вводимой с вектором экспрессии CAR, и противораковому средству, содержащего Т-клетку, экспрессирующую CAR.
Предшествующий уровень техники
[0002] Химерный антигенный рецептор (в дальнейшем называемый также «CAR») представляет собой искусственный составной белок, в котором одноцепочечное антитело, которое распознает антиген клеточной поверхности на раковой клетке, сливается с областью трансдукции сигнала, которая индуцирует активацию Т-клетки. Как показано на фиг. 1, перенос гена, кодирующего CAR, в невосприимчивую к опухоли нормальную Т-клетку периферической крови (Т-лимфоцит периферической крови) дает возможность широкомасштабного приготовления CAR-экспрессирующей Т-клетки (в дальнейшем также именуется просто «CAR-T-клеткой»), которая способна экспрессировать CAR. CAR-T-клетка реагирует на опухоли и может вызвать повреждение раковой клетки вне зависимости от взаимодействия с главным комплексом гистосовместимости (МНС).
[0003] Иммунотерапия рака путем введения CAR-T-клеток, более конкретно, терапия, которая включает в себя сбор Т-клеток от пациента, передачу гена, кодирующего CAR, в Т-клетки и передачу Т-клеток снова пациенту (см. непатентный документ 1), в настоящее время проходит клинические испытания во всем мире и дает результаты, которые показывают эффективность, например, для злокачественной опухоли в кроветворном органе, например, лейкемии или лимфомы.
[0004] В последние годы были проведены исследования на различных CAR-T клетках. Предложена, например, фармацевтическая композиция, содержащая модифицированные собственные Т-клетки человека, содержащие нуклеиновую кислоту, кодирующую CAR, состоящую из CD19-антиген-связывающей области, трансмембранной области, области костимулирующего сигнала 4-1 ВВ и области сигнала CD3ζ (см. патентный документ 1), одну или более терапевтически эффективную популяцию Т-клеток, экспрессирующих химерный антигенный рецептор анти-меток (AT-CAR), которые вводят субъекту одновременно или отдельно от препарата одного или нескольких меченых белков, связывающихся с раковыми клетками, где популяции Т-клеток, экспрессирующие AT-CAR, связываются с мечеными белками и вызывают гибель раковых клеток (см. патентный документ 2), клетки, содержащие нуклеиновую кислоту, кодирующую химерный антигенный рецептор, содержащий антигенсвязывающий домен человеческого антитела 139, внеклеточный шарнирный домен, трансмембранный домен и внутриклеточный домен трансдукции сигнала Т-клеток (см. патентный документ 3), клетки, содержащие последовательность нуклеиновой кислоты, кодирующей химерный антигенный рецептор, при этом химерный антигенный рецептор содержит домен трансдукции сигнала CD3ζ, содержащий антигенсвязывающий домен, трансмембранный домен, область трансдукции костимулирующего сигнала и аминокислотную последовательность SEQ ID NO: 24 (см. патентный документ 4), генетически сконструированные CD19-специфичные Т-клетки, которые экспрессируют и удерживают CD19-специфичный химерный рецептор на их мембранах их клеточной поверхности, причем химерный рецептор состоит из внутриклеточного сигнального домена для эффекторных функций иммуноцитов, по меньшей мере, одного трансмембранного домена и, по меньшей мере, одного внеклеточного домена, и внеклеточный домен содержит CD19-специфичный рецептор (см. патентный документ 5), а также клетки, экспрессирующие химерный антигенный рецептор, скрывающие нуклеиновую кислоту, кодирующую химерный антигенный рецептор, содержащий в качестве внутриклеточного домена внутриклеточный домен индуцированного глюкокортикоидами фактор некроза опухоли (GITR) (см. патентный документ 6).
[0005] Однако ни в одном из предыдущих способов не была решена проблема низкой выживаемости CAR-T-клеток in vivo или недостаточная активация эндогенных Т-клеток, индуцированных CAR-T-клетками, или недостаточное локальное накопление их в опухоли или проблемы иммунодепрессирующих сигналов, опосредованных на пути PD-L1/PD-1, который является механизмом ускользания от иммунологического надзора опухоли из раковых клеток, а также ингибирования активности CAR-T-клеток с помощью иммунодепрессирующих факторов, таких, как TGF-β или IL-10, секретируемых в раковой микросреде. Таким образом, существуют типы рака или случаи, в которых не подтверждается достаточный терапевтический эффект. Таким образом, было желательно получить более эффективные CAR-T-клетки и вектор экспрессии для получения CAR-T-клеток.
Документы предшествующего уровня техники
Патентные документы
[0006] Патентный документ 1: Публикация патентной заявки США No. 2014/0106449
Патентный документ 2: Публикация нерассмотренной японской патентной заявки (Перевод заявки РСТ) No. 2014-504294
Патентный документ 3: Публикация нерассмотренной японской патентной заявки (Перевод заявки РСТ) No. 2014-516510
Патентный документ 4: Публикация нерассмотренной японской патентной заявки (Перевод заявки РСТ) No. 2014-507118
Патентный документ 5: Публикация нерассмотренной японской патентной заявки No. 2011-004749
Патентный документ 6: Международная публикация No. WO 2013/051718
Непатентные документы
[0007] Непатентный документ 1: Yozo Nakazawa, The Shinshu Medical Journal (Медицинский журнал Shinshu), 61 (4): 197-203 (2013)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задача, решаемая изобретением
[0008] Традиционные CAR-T-клетки были разработаны для усиления способности активации Т-клетки путем содержания CD28, 4-1 ВВ, CD3ζ или т.п. в области трансдукции сигнала CAR. Однако обычные CAR-T-клетки недостаточно стимулируют индуцирующее иммунитет действие CAR-T-клеток на эндогенные Т-клетки или резистентность к иммунодепрессирующему механизму микроокружения опухоли. Такие CAR-T-клетки еще не достигли терапевтического эффекта при солидном раке. Соответственно, объектом настоящего изобретения является создание CAR-T-клеток, которые совместно экспрессируют CAR и иммуномодулирующий фактор Т-клетки и обладают высоким усиливающим иммунитет эффектом и противораковой активностью, а также создание вектора экспрессии CAR для получения CAR-T клеток.
Средство решения задачи
[0009] Авторы изобретения попытались усовершенствовать CAR-T-клетки с целью достижения лучшего индуцирующего иммунитет эффекта или противораковой активности при противораковой иммунотерапии с использованием CAR-T-клеток. В ходе этого процесса авторы изобретения сосредоточились на цитокинах, хемокинах и сигнальных регуляторных белках, которые являются факторами, усиливающими иммунные функции Т-клеток, и сконструировали вектор для коэкспрессии CAR и факторов, усиливающих иммунные функции Т-клеток. В результате переноса этого вектора экспрессии в Т-клетки авторами изобретения обнаружено, что могут быть получены CAR-T-клетки, индуцирующий иммунитет эффект и противораковая активность которых превосходит эти показатели обычных CAR-T-клеток, и это сделано в настоящем изобретении
[0010] В частности, настоящее изобретение описано ниже.
(1) Вектор экспрессии CAR, содержащий нуклеиновую кислоту, кодирующую химерный антигенный рецептор (CAR), и нуклеиновую кислоту, кодирующую иммуномодулирующий фактор Т-клетки, причем нуклеиновая кислота, кодирующая иммуномодулирующий фактор, представляет собой нуклеиновую кислоту, кодирующую интерлейкин-7, и нуклеиновую кислоту, кодирующую CCL19, нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-1, или нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-2.
(2) Вектор экспрессии CAR согласно (1), в котором нуклеиновая кислота, кодирующая иммуномодулирующий фактор, представляет собой нуклеиновую кислоту, кодирующую интерлейкин-7, и нуклеиновую кислоту, кодирующую CCL19.
(3) Вектор экспрессии CAR согласно (2), в котором нуклеиновая кислота, кодирующая CAR, и нуклеиновая кислота, кодирующая иммуномодулирующий фактор Т-клетки, связаны с использованием последовательности, кодирующей саморасщепляющийся пептид.
(4) Вектор экспрессии CAR согласно (2) или (3), в котором нуклеиновая кислота, кодирующая интерлейкин-7, и нуклеиновая кислота, кодирующая CCL19, связаны с использованием последовательности, кодирующей саморасщепляющийся пептид.
(5) Вектор экспрессии CAR согласно любому из (1)-(4), в котором нуклеиновая кислота, кодирующая CAR, содержит нуклеиновую кислоту, кодирующую полипептид одноцепочечного антитела, который распознает FITC или CD20.
(6) Вектор экспрессии CAR согласно любому из (1)-(5), в котором нуклеиновая кислота, кодирующая CAR, содержит нуклеиновую кислоту, кодирующую полипептид трансмембранной области CD8.
(7) Вектор экспрессии CAR согласно любому из (1)-(6), в котором нуклеиновая кислота, кодирующая CAR, содержит нуклеиновые кислоты, кодирующие полипептиды внутриклеточной области CD28, внутриклеточной области 4-1 ВВ и внутриклеточной области CD3ζ.
(8) CAR-экспрессирующая Т-клетка, вводимая со следующим вектором (а) или (b):
(а) вектор экспрессии CAR в соответствии с любым одним из (1)-(7);
(b) вектор экспрессии CAR, содержащий нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую интерлейкин-7, и вектор экспрессии CAR, содержащий нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую CCL19.
(9) Противораковое средство, содержащее CAR-экспрессирующую Т-клетку согласно (8) и фармацевтически приемлемую добавку.
Технический результат изобретения
[0011] Использование вектора экспрессии CAR настоящего изобретения позволяет получить CAR-T-клетку, обладающую всей жизнеспособностью, способностью накапливать лимфоциты и цитотоксической активностью против опухолевых клеток, и CAR-T-клетка обладает резистентностью к иммунодепрессии в раковой микросреде. Ожидается, что иммунотерапия для онкологических больных с использованием CAR-T-клетки окажет сильное терапевтическое воздействие на рак и может служить в качестве иммунотерапии рака, эффективной даже для трудноизлечимого или прогрессирующего рака.
Краткое описание чертежей
[0012] Фиг. 1 представляет собой диаграмму, показывающую структуру CAR и основную систему противораковой иммунотерапии с использованием CAR-T клеток.
Фиг. 2 представляет собой диаграмму, показывающую вектор экспрессии из CAR, интерлейкин-7 (IL-7) и CCL19.
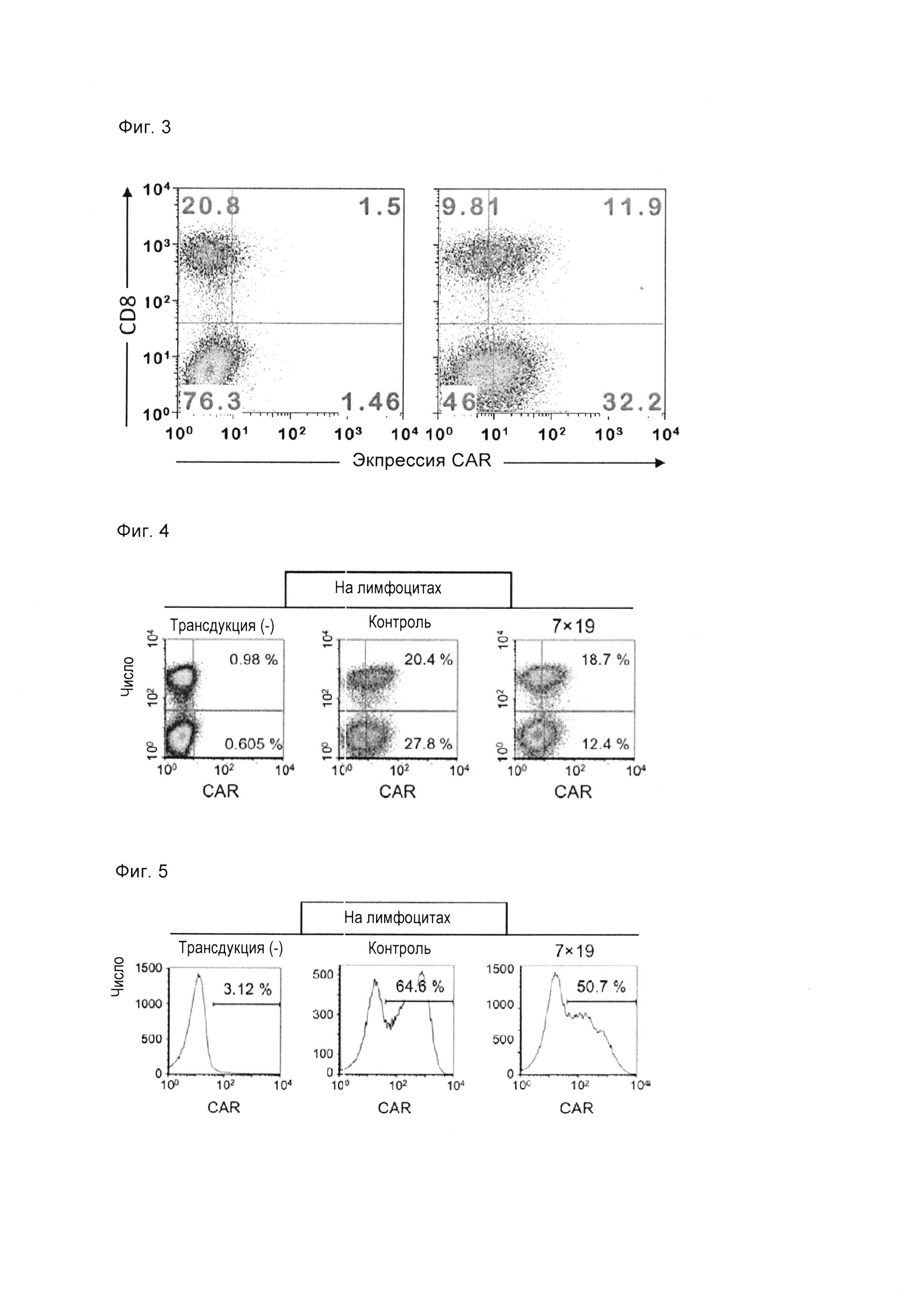
Фиг. 3 представляет собой диаграмму, показывающую результаты 1 подтверждения уровня экспрессии CAR в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19, с использованием проточной цитометрии. На левом графике изображен неокрашенный образец CAR, а на правом графике - окрашенный образец CAR.
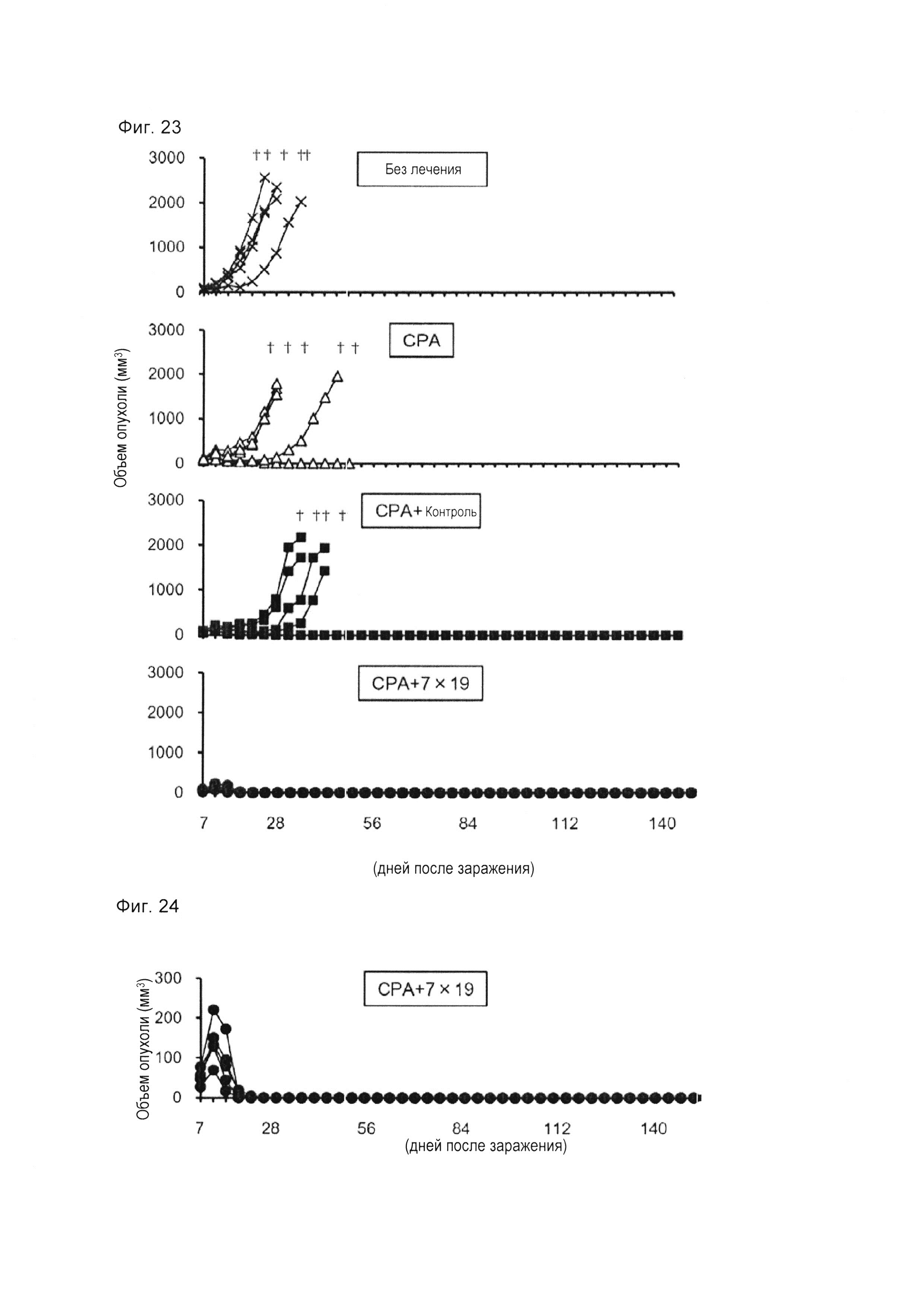
Фиг. 4 представляет собой диаграмму, показывающую результаты 2 подтверждения уровня экспрессии CAR в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19, с использованием проточной цитометрии.
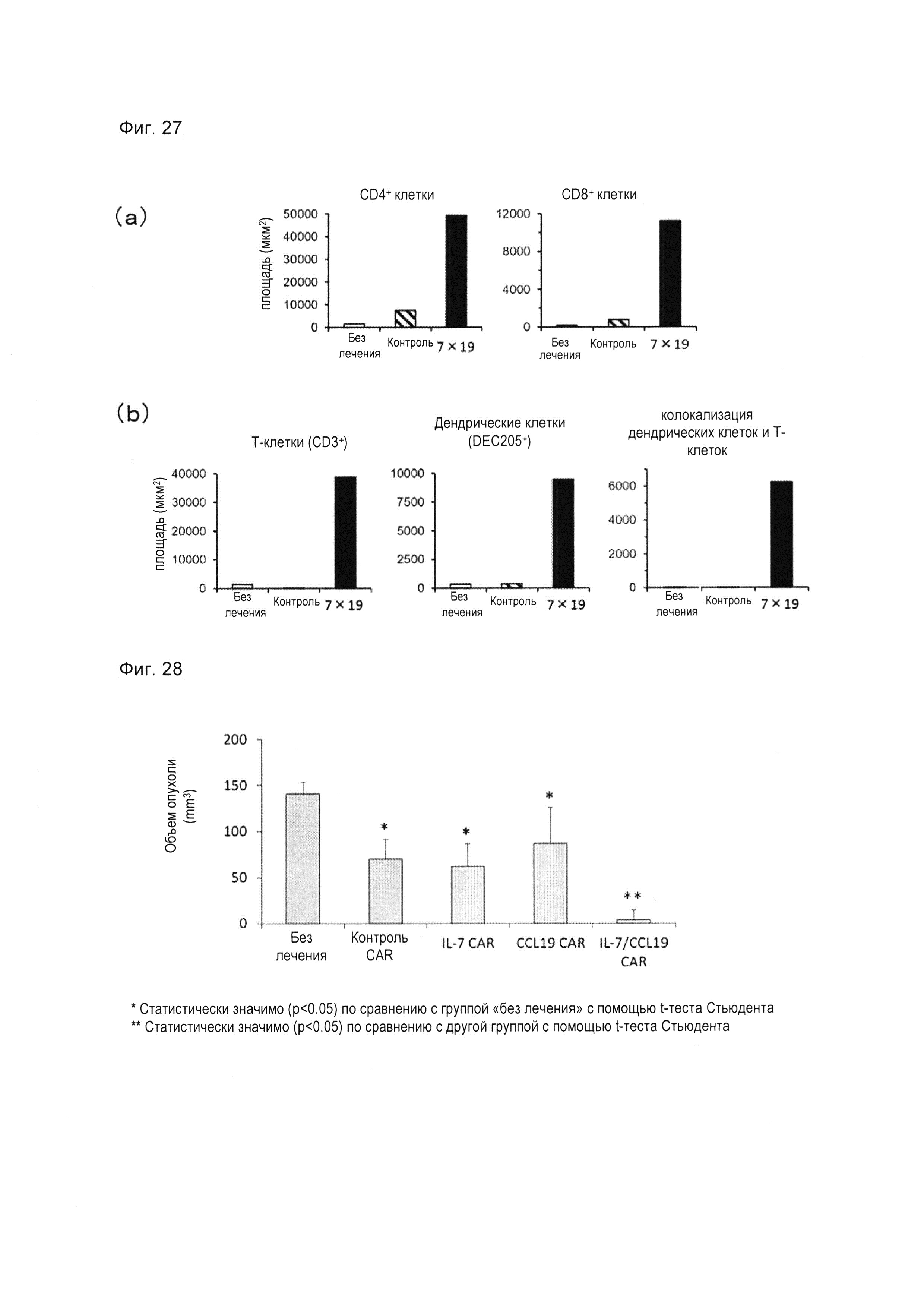
Фиг. 5 представляет собой диаграмму, показывающую результаты подтверждения уровня экспрессии CAR в Т-клетках, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека, с использованием проточной цитометрии.
Фиг. 6 представляет собой диаграмму, показывающую результаты 1 измерения концентрации IL-7 и CCL19 в клеточном супернатанте Т клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, с использованием ELISA.
Фиг. 7 представляет собой диаграмму, показывающую результаты 2 измерения концентрации IL-7 и CCL19 в клеточном супернатанте Т клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, с использованием ELISA.
Фиг. 8 представляет собой диаграмму, показывающую результаты измерения концентраций IL-7 и CCL19 в клеточном супернатанте Т клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека, с использованием ELISA.
Фиг. 9 представляет собой диаграмму, показывающую количество Т клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, стимулированных и культивированных в течение 3 дней, 5 дней или 7 дней.
Фиг. 10 представляет собой диаграмму, показывающую выживаемость Т клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, стимулированных и культивированных в течение 3 дней, 5 дней или 7 дней.
Фиг. 11 представляет собой диаграмму, показывающую количество Т клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека, стимулированных и культивированных в течение 5 дней.
Фиг. 12 представляет собой диаграмму, показывающую результаты 1 теста на миграцию Т-клеток с использованием Т клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19.
Фиг. 13 представляет собой диаграмму, показывающую результаты 2 теста на миграцию Т-клеток с использованием Т клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19.
Фиг. 14 представляет собой диаграмму, показывающую результаты теста миграции дендритных клеток с использованием Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19.
Фиг. 15 представляет собой диаграмму, показывающую результаты теста на миграцию Т-клеток с использованием Т-клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека.
Фиг. 16 представляет собой диаграмму, показывающую результаты исследования пролиферативного потенциала Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19 (на 5й день после стимуляции).
Фиг. 17 представляет собой диаграмму, показывающую результаты исследования пролиферативного потенциала Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19 (на 3й и 7й дни после стимуляции).
Фиг. 18 представляет собой диаграмму, показывающую результаты исследования экспрессии CD127 в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19.
Фиг. 19 представляет собой диаграмму, показывающую результаты исследования экспрессии CCR7 в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19.
Фиг. 20 представляет собой диаграмму, показывающую результаты исследования изменения объема опухоли, когда Т-клетки, экспрессирующие анти- CD20 CAR-IL-7 / CCL19 человека, вводили мышам, несущим рак.
Фиг. 21 представляет собой диаграмму, показывающую результаты исследования выживаемости мыши, когда мышам, несущим рак, вводили Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека.
Фиг. 22 представляет собой диаграмму, показывающую результаты исследования выживаемости мыши, когда Т-клетки, экспрессирующие анти-CD20 CAR-IL-7/CCL19 человека, вводили мышам после подкожного заражения P815-hCD20 и последующего введения циклофосфамида.
Фиг. 23 представляет собой диаграмму, показывающую результаты исследования объема опухоли мыши, когда Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, вводили мышам после подкожного заражения P815-hCD20 и последующего введения циклофосфамида.
Фиг. 24 представляет собой диаграмму, показывающую по оси ординат 1/10 числовых значений графика CPA + 7×19 на фиг. 23.
Фиг. 25 представляет собой диаграмму, показывающую результаты наблюдения опухолевых тканей на окрашивание гемаксилином и эозином (Н и Е), когда Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, вводили мышам после подкожного заражения P815-hCD20.
На фигуре 26 представлена диаграмма, показывающая результаты иммуногистохимического анализа опухолевых тканей, когда Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, вводили мышам после подкожного заражения P815-hCD20.
Фиг. 27 представляет собой диаграмму, показывающую результаты количественного определения положительной области, помеченной флуоресцентным красителем на фиг. 26.
Фиг. 28 представляет собой диаграмму, показывающую результаты исследования объема опухоли, когда Т-клетки, экспрессирующие анти-CD20 CAR-IL-7 человека, или Т-клетки, экспрессирующие анти- CD20 CAR-CCL19 человека, либо Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19, вводили мышам после подкожного заражения P815-hCD20.
Фиг. 29(а) представляет собой диаграмму, показывающую вектор экспрессии CAR и доминантного отрицательного мутанта SHP1 (фосфатаза-1, содержащая область 2 Src гомологии). Фиг. 29(b) представляет собой диаграмму, показывающую вектор экспрессии CAR и доминантного отрицательного мутанта SHP2 (фосфатаза-2, содержащая область 2 Src гомологии).
Фиг. 30(а) представляет собой диаграмму, показывающую результаты теста цитотоксической активности с использованием Т-клеток, экспрессирующих анти- CD20 CAR-SHP1DN человека. Фиг. 30(b) представляет собой диаграмму, показывающую тест на цитотоксическую активность с использованием Т-клеток, экспрессирующих анти- CD20 CAR-SHP2DN человека.
Фигура 31 представляет собой диаграмму, показывающую результаты изучения цитотоксической активности против опухолевых клеток путем смешивания P815-hCD20 в присутствии Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, и связанного с FITC ритуксимаба.
Фиг. 32 представляет собой диаграмму, показывающую результаты исследования цитотоксической активности против опухолевых клеток путем смешивания P815-hCD20 с Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека.
Фиг. 33 представляет собой диаграмму, показывающая результаты анализа CD4, CD8, CD44 и CD62L для поверхностных фенотипов лейкоцитов с использованием проточной цитометрии, когда Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, вводили мышам после подкожного заражения P815-hCD20.
Фиг. 34 представляет собой диаграмму, показывающую результаты исследования пролиферации Т-клеток способом проточной цитометрии, когда лейкоциты селезенки стимулировались культурой в течение 4 дней с P815-hCD20, обработанным митомицином С.
Способ осуществления изобретения
[0013] Вектор экспрессии CAR настоящего изобретения особо не ограничивается, при условии, что вектор экспрессии CAR содержит нуклеиновую кислоту, кодирующую химерный антигенный рецептор (CAR), и нуклеиновую кислоту, кодирующую иммуномодулирующий фактор Т-клетки, где нуклеиновая кислота, кодирующая иммуномодулирующий фактор, представляет собой нуклеиновую кислоту, кодирующую интерлейкин-7, и нуклеиновую кислоту, кодирующую CCL19, нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-1, или нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-2. Химерный антигенный рецептор означает искусственный химерный белок, в котором одноцепочечное антитело, которое распознает антиген клеточной поверхности на раковой клетке, сливается с областью трансдукции сигнала, которая индуцирует активацию Т-клетки через трансмембранную область.
[0014] В настоящем изобретении нуклеиновая кислота, кодирующая CAR, особо не ограничена, при условии, что нуклеиновая кислота кодирует полипептид, составляющий CAR. Нуклеиновая кислота, кодирующая CAR, содержит нуклеиновые кислоты, кодирующие полипептиды одноцепочечного антитела, которое распознает антиген клеточной поверхности на раковой клетке, трансмембранную область, и область трансдукции сигнала, которая индуцирует активацию Т-клетки.
[0015] Одноцепочечное антитело в CAR состоит из вариабельной области легкой цепи и вариабельной области тяжелой цепи (scFv), происходящей из антигенсвязывающего участка моноклонального антитела. Их примеры могут включать олигопептид или полипептид, в котором линкерный пептид расположен между вариабельной областью легкой цепи и вариабельной областью тяжелой цепи 1.
[0016] Клеточный поверхностный антиген на раковой клетке, который распознается одноцепочечным антителом, может представлять собой биологическую молекулу, специфически экспрессируемую на раковой клетке и ее клетке-предшественнице, биологическую молекулу, которая оказалась вновь экспрессированной вследствие злокачественной трансформации клетки, или биологическую молекулу, уровень экспрессии которой повышается в раковой клетке по сравнению с нормальной клеткой. Их примеры могут включать варианты CD20, EGFR, FITC, CD19, CD22, CD33, PSMA, GD2, EGFR, а также ROR1, c-Met, HER2, СЕА, мезотелин, GM2, CD7, CD10, CD30, CD34, CD38, CD41, CD44, CD74, CD123 CD133, CD171, MUC16, MUC1, CS1 (CD319), IL-13Ra2, ВСМА, Lewis Y, каппа-цепь IgG, фолатный рецептор-альфа, PSCA и ЕрСАМ.
[0017] Область трансдукции сигнала активации Т-клеток представляет собой область, которая способна к внутриклеточно-трансдуцирующим сигналам, когда одноцепочечное антитело распознает антиген клеточной поверхности на раковой клетке. Область трансдукции сигнала активации Т-клеток предпочтительно содержит, по меньшей мере, один или несколько полипептидов, выбранных из полипептидов внутриклеточных областей γ-цепи, связанных с рецепторами CD28, 4-1 ВВ (CD137), GITR, CD27, ОХ40, HVEM, CD3ζ и Fc, и, более предпочтительно, содержит полипептиды трех внутриклеточных областей CD28, 4-1 ВВ и CD3ζ.
[0018] Эти полипептиды внутриклеточных областей могут быть связаны посредством олигопептидного линкера или полипептидного линкера, состоящего из 2-10 аминокислот. Примеры такой линкерной последовательности могут включать в себя жесткие последовательности глицин-серин.
[0019] Примеры трансмембранного участка в соответствии с настоящим изобретением могут включать в себя полипептиды трансмембранных областей, полученных из CD8, рецепторов α и β-цепей Т-клетки, CD28, CD3ε, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154 и GITR и могут предпочтительно включать в себя полипептид трансмембранной области CD8 человека. CAR прикрепляется к клеточным мембранам Т-клетки этой трансмембранной областью.
[0020] Трансмембранная область может содержать шарнирную область, которая состоит из произвольного олигопептида или полипептида и имеет длину от 1 до 100 аминокислот, предпочтительно от 10 до 70 аминокислот. Примеры шарнирной области могут включать в себя шарнирную область CD8 человека.
[0021] Область спейсера, состоящая из произвольного олигопептида или полипептида, может быть расположена между одноцепочечным антителом, которое распознает антиген клеточной поверхности на раковой клетке, и трансмембранной областью, или между трансмембранной областью и областью трансдукции сигнала активации Т-клетки. Примеры длины области спейсера могут включать от 1 до 100 аминокислот, предпочтительно от 10 до 50 аминокислот. Примеры такой области спейсера могут включать в себя жесткие последовательности глицин-серин.
[0022] В настоящем изобретении нуклеиновая кислота, кодирующая иммуномодулирующий фактор Т-клетки, не имеет особых ограничений, при условии, что нуклеиновая кислота представляет собой нуклеиновую кислоту, кодирующую IL-7, и нуклеиновую кислоту, кодирующую CCL19 (в дальнейшем также совместно именуемые «присутствующей нуклеиновой кислотой 1»), нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-1 (в дальнейшем называемую также «присутствующей нуклеиновой кислотой 2»), или нуклеиновую кислоту, кодирующую доминантный отрицательный мутант SHP-2 (в дальнейшем также именуемой «присутствующей нуклеиновой кислотой 3»). Нуклеиновая кислота может содержать множество нуклеиновых кислот, выбранных из присутствующих нуклеиновых кислот 1-3, и может конкретно содержать присутствующую нуклеиновую кислоту 1 и присутствующую нуклеиновую кислоту 2, присутствующую нуклеиновую кислоту 1 и присутствующую нуклеиновую кислоту 3, присутствующую нуклеиновую кислоту 2 и присутствующую нуклеиновую кислоту 3, присутствующую нуклеиновую кислоту 1 и присутствующую нуклеиновую кислоту 2 и присутствующую нуклеиновую кислоту 3.
[0023] Нуклеиновая кислота, кодирующая IL-7, и нуклеиновая кислота, кодирующая CCL19, в присутствующей нуклеиновой кислоте 1 могут содержать нуклеиновую кислоту, кодирующую IL-7, и нуклеиновую кислоту, кодирующую CCL19, а нуклеиновая кислота, кодирующая CCL19, может быть расположена против хода или по ходу транскрипции от нуклеиновой кислоты, кодирующей IL-7.
[0024] Нуклеиновая кислота, кодирующая доминантный отрицательный мутант SHP1, особо не ограничивается, при условии, что нуклеиновая кислота кодирует SHP1-мутант, который работает преимущественно над SHP1 и может ингибировать действие SHP1. Ее примеры могут включать в себя нуклеиновую кислоту, кодирующую мутант, который состоит из аминокислотной последовательности, полученной из аминокислотной последовательности SHP1, путем замещения, по меньшей мере, одной аминокислоты другой аминокислотой и может ингибировать действие SHP1. Нуклеиновая кислота, кодирующая доминантно-негативный мутант SHP2, особо не ограничивается, при условии, что нуклеиновая кислота кодирует SHP2 мутант, который работает преимущественно над SHP2 и может ингибировать действие SHP2. Ее примеры могут включать в себя нуклеиновую кислоту, кодирующую мутант, который состоит из аминокислотной последовательности, полученной из аминокислотной последовательности SHP2, путем замещения, по меньшей мере, одной аминокислоты другой аминокислотой и может ингибировать действие SHP2.
[0025] Вектор экспрессии CAR настоящего изобретения может содержать произвольную нуклеиновую кислоту между нуклеиновой кислотой, кодирующей химерный антигенный рецептор, и нуклеиновую кислоту, кодирующую иммуномодулирующий фактор Т-клетки, между множеством нуклеиновых кислот, выбранных из присутствующей нуклеиновой кислоты 1, присутствующей нуклеиновой кислоты 2 и присутствующей нуклеиновой кислоты 3, или между нуклеиновой кислотой, кодирующей IL-7, и нуклеиновой кислотой, кодирующей CCL19, в присутствующей нуклеиновой кислоте 1 при том условии, что каждая нуклеиновая кислота может быть экспрессирована. Эти нуклеиновые кислоты предпочтительно связаны через последовательность, кодирующую саморасщепляющийся пептид (2А пептид) или IRES (внутренний участок введения рибозима), предпочтительно последовательность, кодирующую 2А пептид. Сцепление с использованием этой последовательности позволяет эффективно экспрессировать каждую нуклеиновую кислоту.
[0026] Пептид 2А является полученным из вируса саморасщепляющимся пептидом и характеризуется тем, что G-P (положение 1 остатка от С-конца) в аминокислотной последовательности, представленной SEQ ID NO: 1, отщепляется в эндоплазматическом ретикулуме (Szymczak et al., Expert Opinion Biol. Ther., 5 (5): 627-638 (2005)). Поэтому нуклеиновые кислоты, включенные для примыкания к 2А-пептиду, внутриклеточно экспрессируются независимо друг от друга.
[0027] Пептид 2А предпочтительно представляет собой пептид 2А, полученный из вируса пикорнавируса, ротавируса, вируса насекомых, вируса Aphthovirus или вируса трипаносомы, более предпочтительно пептида 2А, полученного из пикорнавируса (F2A), показанного в SEQ ID NO: 2.
[0028] Нуклеиновая кислота, кодирующая химерный антигенный рецептор, может быть получена с помощью известного в данной области техники способа, такого как способ химического синтеза или способ амплификации ПЦР, на основе нуклеотидных последовательностей, кодирующих полипептиды одноцепочечного антитела против антигена клеточной поверхности на раковой клетке, трансмембранной области и области трансдукции сигнала активации Т-клеток. Выбранные кодоны для кодирования аминокислот могут быть модифицированы для оптимизации экспрессии нуклеиновых кислот в представляющей интерес клетке-хозяине.
[0029] Информация о нуклеотидных последовательностях, кодирующих полипептиды одноцепочечного антитела против антигена клеточной поверхности на раковой клетке, трансмембранной области и области трансдукции сигнала активации Т-клеток, может быть соответственно получена из документов, известных в данной области, или путем поиска в базе данных NCBI (http://www.ncbi.nlm.nih.gov/guide/) или тому подобное.
[0030] Например, информация о нуклеотидных последовательностях, кодирующих полипептиды CD28, 4-1 ВВ и CD3ζ трансмембранных областей в области трансдукции сигнала активации Т-клетки, может быть получена соответствующим образом путем поиска в базе данных NCBI или т.п. Их примеры могут включать в себя последовательности, зарегистрированные в GenBank No: NM_006139.2 (дата обновления: 10 мая 2014 г.) для CD28 человека, GenBank No: NM_001561.5 (дата обновления: 16 марта 2014 г.) для 4-1 ВВ человека и GenBank No: NM_000734.3 (дата обновления: 12 августа 2014 г.) для CD3ζ человека.
[0031] Информация о нуклеотидной последовательности, кодирующей полипептид трансмембранной области CD8 человека, может быть получена соответствующим образом путем поиска в базе данных NCBI и пр. Их примеры могут включать последовательность, зарегистрированную под номером GenBank: NM_001768.6 (дата обновления: 10 мая 2014 г.).
[0032] Информация о нуклеотидной последовательности, кодирующей полипептид одноцепочечного антитела, также может быть получена путем получения моноклонального антитела, которое распознает целевой антиген поверхности клетки, определяя аминокислотную последовательность моноклонального антитела с помощью известного в данной области способа, такого как способ Эдмана и получение информации на основе аминокислотной последовательности. Примеры способа получения моноклонального антитела могут включать в себя способ получения с использованием гибрида, способ получения, который включает в себя трансформацию хозяина с экспрессирующим вектором, содержащим ген антитела, с помощью генно-инженерного подхода, и способ получения, который включает в себя иммунизацию трансгенного животного с желаемым антигеном.
[0033] Нуклеиновая кислота, кодирующая иммуномодулирующий фактор Т-клетки, то есть нуклеиновая кислота, кодирующая IL-7, и нуклеиновая кислота, кодирующая CCL19, нуклеиновая кислота, кодирующая доминантно-негативный мутант SHP-1, или нуклеиновая кислота, кодирующая доминантно-негативный мутант SHP-2, могут быть получены способом, известным в данной области, таким как способ химического синтеза или способ амплификации ПЦР, на основе их соответствующих нуклеотидных последовательностей. Выбранные кодоны для кодирования аминокислот могут быть модифицированы для оптимизации экспрессии нуклеиновых кислот в представляющей интерес клетке-хозяине.
[0034] Информацию о нуклеиновой кислоте, кодирующей IL-7, и нуклеиновой кислоте, кодирующей CCL19, нуклеиновой кислоте, кодирующей доминантно-негативный мутант SHP-1, или нуклеиновой кислоте, кодирующей доминантно-негативный мутант SHP-2, можно соответствующим образом получить из документов предшествующего уровня техники, или путем поиска в базе данных NCBI (http://www.ncbi.nlm.nih.gov/guide/) или тому подобного.
[0035] Нуклеиновую кислоту, кодирующую IL-7, можно соответствующим образом подбирать в соответствии с типом клетки, на которую переносится вектор экспрессии CAR. Ее примеры могут включать в себя нуклеиновую кислоту, кодирующую аминокислотную последовательность (SEQ ID NO: 3) IL-7 человека. Может быть использована нуклеотидная последовательность, имеющая 80% или более, предпочтительно 85% или выше, более предпочтительно 90% или выше, более предпочтительно 95% или выше, наиболее предпочтительно 98% или выше идентичности нуклеотидной последовательности, показанной в SEQ ID NO: 3 могут быть использованы, при том условии, что будет обеспечен эффект IL-7, усиливающий пролиферацию клеток.
[0036] Нуклеиновую кислоту, кодирующую CCL19, можно соответствующим образом подобрать в соответствии с типом клетки, в которую переносится вектор экспрессии CAR. Ее примеры могут включать в себя нуклеиновую кислоту, кодирующую аминокислотную последовательность (SEQ ID NO: 4) CCL19 человека. Может быть использована нуклеотидная последовательность, имеющая 80% или выше, предпочтительно 85% или выше, более предпочтительно 90% или выше, более предпочтительно 95% или выше, наиболее предпочтительно 98% или выше идентичности нуклеотидной последовательности, показанной в SEQ ID NO: 4, при условии, что будет обеспечен благоприятный химиотерапевтический эффект CCL19 на Т-клетке.
[0037] Нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-1, можно соответствующим образом подбирать в соответствии с типом клетки, в которую переносится вектор экспрессии CAR. Ее примеры могут включать нуклеиновую кислоту, кодирующую аминокислотную последовательность (SEQ ID NO: 5) доминантно-негативного мутанта SHP-1 человека. Может быть использована нуклеотидная последовательность, имеющая 80% или выше, предпочтительно 85% или выше, более предпочтительно 90% или выше, более предпочтительно 95% или выше, наиболее предпочтительно 98% или выше идентичности с нуклеотидной последовательностью, показанной в SEQ ID NO: 5, при условии, что доминантно-негативный мутант SHP-1 может ингибировать действие SHP-1. В SEQ ID NO: 5 серии в положении 453 является мутированным участком.
[0038] Нуклеиновую кислоту, кодирующую доминантно-негативный мутант SHP-2, можно соответствующим образом подобрать в соответствии с типом клетки, в которую переносится вектор экспрессии CAR. Их примеры могут включать нуклеиновую кислоту, кодирующую аминокислотную последовательность (SEQ ID NO: 6) доминантно-негативного мутанта SHP-2 человека. Может быть использована нуклеотидная последовательность, имеющая 80% или выше, предпочтительно 85% или выше, более предпочтительно 90% или выше, более предпочтительно 95% или выше, наиболее предпочтительно 98% или выше идентичности с нуклеотидной последовательностью, показанной в SEQ ID NO: 6 могут быть использованы, при условии, что доминантно-негативный мутант SHP-2 может ингибировать действие SHP-2. В SEQ ID NO: 6 серии в положении 459 является мутированным участком.
[0039] Вектор экспрессии CAR настоящего изобретения может быть линейным или круговым и может быть невирусным вектором, таким как плазмида, вирусным вектором или вектором, основанный на транспозонах. Такой вектор может содержать контрольные последовательности, такие как промотор и терминатор, и последовательность селективного маркера, например, ген устойчивости к лекарственному средству или репортерный ген. Нуклеиновая кислота, кодирующая CAR или нуклеиновая кислота, кодирующая иммуномодулирующий фактор Т-клетки, функционально расположена по ходу транскипции промоторной последовательности, так что каждая нуклеиновая кислота может быть эффективно транскрибирована. Кроме того, экспрессия нуклеиновой кислоты, кодирующей химерный антигенный рецептор, может быть легко подтверждена благодаря содержащемуся в ней маркерному гену.
[0040] Вектор экспрессии CAR настоящего изобретения может содержать нуклеиновую кислоту, кодирующую саморазрушающийся ген. Положение саморазрушающегося гена особо не ограничивается, и саморазрушающийся ген может быть расположен через последовательность, кодирующую 2А-пептид или IRES, по ходу транскипции промотора для экспрессии нуклеиновой кислоты, кодирующей IL-7, нуклеиновой кислоты, кодирующей CCL19, нуклеиновой кислоты, кодирующей доминантно-негативный мутант SHP-1, или нуклеиновой кислоты, кодирующей доминантно-отрицательный мутант SHP-2 и против хода транскрипции или по ходу транскрипции по отношению к каждой из этих нуклеиновых кислот, или могут быть расположены ниже по потоку от дополнительного промотора. Вектор экспрессии CAR настоящего изобретения, содержащий нуклеиновую кислоту, кодирующую саморазрушающийся ген, позволяет контролировать количество CAR-экспрессирующей Т-клетки in vivo путем введения лекарственного средства, активирующего функции саморазрушающегося гена, в соответствии с течением лечения рака, например, когда опухоль исчезла.
[0041] Примеры саморазрушающегося гена могут включать в себя тимидинкиназу вируса простого герпеса (HSV-TK) и индуцибельные гены каспазы 9, описанные в документах, приведенных ниже. Примеры лекарственных средств, активирующих функции этих генов, могут включать в себя ганцикловир для первого, и соединение CID (химическая индукция димеризации) АР1903 для последнего (Cooper LJ., Et al., Cytotherapy, 2006; 8 (2): 105- 17, Jensen MC et al., Biol Blood Marrow Transplant, 2010, сентябрь, 16 (9): 1245-56, Jones BS, Front Pharmacol., 2014, Nov 27, 5:25, Minagawa K., Pharmaceuticals (Basel). 8; 8 (2): 230-49 и Bole-Richard Э., Front Pharmacol., 2015 Aug 25, 6: 174).
[0042] Примеры вирусного вектора могут включать в себя ретровирусные векторы, лентивирусные векторы, аденовирусные векторы и аденоассоциированные вирусные векторы и могут предпочтительно включать в себя ретровирусные векторы, более предпочтительно вектор pMSGV (Tamada k et al., Clin Cancer Res 18: 6436-6445 (2002)) и вектор pMSCV (производства Takara Bio Inc.). При использовании ретровирусного вектора трансген интегрируется в геномы клетки-хозяина и поэтому может стабильно экспрессироваться в течение длительного периода.
[0043] CAR-экспрессирующая Т-клетка настоящего изобретения особо не ограничена, при условии, что CAR-экспрессирующая Т-клетка представляет собой Т-клетку, полученную путем переноса (а) вектора экспрессии CAR настоящего изобретения или Т-клетку, полученную путем переноса (b), по меньшей мере, двух векторов: вектора экспрессии CAR, содержащего нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую интерлейкин-7 (вектор экспрессии CAR-IL-7), а также вектора экспрессии CAR, содержащего нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую CCL19 (вектор экспрессии CAR-CCL19). Примеры способа переноса вектора экспрессии CAR настоящего изобретения или вектора экспрессии CAR-IL-7 и вектора экспрессии CAR-CCL19 в Т-клетку могут включать в себя, но не ограничиваются этим, способы переноса способами, известными в данной области, такими, как способ вирусной инфекции, способ фосфата кальция, липофекцией, микроинъекцией и электропорацией, и могут предпочтительно включать в себя способ вирусной инфекции. Вектор экспрессии CAR-IL-7 может содержать нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую интерлейкин-7. Вектор экспрессии CAR-CCL19 может содержать нуклеиновую кислоту, кодирующую CAR и нуклеиновую кислоту, кодирующую CCL19. Как и в случае вектора экспрессии CAR настоящего изобретения, эти векторы экспрессии могут каждый содержать дополнительную нуклеиновую кислоту, такую как нуклеиновую кислоту, кодирующую 2А пептид, IRES, или саморазрушающийся ген, если только каждая нуклеиновая кислота может экспрессироваться.
[0044] Примеры способа вирусной инфекции могут включать в себя способ, который включает трансфектирование упаковывающей клетки, например, клетки GP2-293 (производства Takara Bio Inc.), клетки Plat-GP (производства Cosmo Bio Co., Ltd.), клетки PG13 (ATCC CRL-10686) или клетки РА317 (ATCC CRL-9078) с вектором экспрессии CAR настоящего изобретения и упаковывающей плазмидой для получения рекомбинантных вирусов и инфицирования Т-клетки рекомбинантными вирусами. Способ вирусной инфекции может быть осуществлен с использованием коммерчески доступного набора, такого как Retrovirus packaging Kit Eco (производства Takara Bio Inc.).
[0045] Перенос вектора экспрессии CAR в соответствии с настоящим изобретенем в Т-клетку может быть подтвержден путем изучения экспрессии CAR путем проточной цитометрии, Нозерн-блоттинга, Саузерн-блоттинга, ПЦР такого как RT-PCR, ELISA или вестерн-блоттинга, или изучения экспрессии маркерного гена, вставленного в вектор.
[0046] Примеры Т-клетки могут включать в себя Т-клетку, полученную от человека, и Т-клетку, полученную от млекопитающего, отличного от человека (например, собаки, кошки, свиньи или мыши). В качестве альтернаты Т-клетка может быть получена путем выделения и очистки из организма жидкости, такой как кровь или жидкость из костного мозга, ткани селезенки, тимуса, лимфатических узлов и т.п. или иммуноцитов, проникающих в раковые ткани первичной опухоли, метастатических опухолей, раковых асцитов и тому подобного. Примеры такой Т-клетки могут включать в себя αβТ клетку, γδТ-клетку, CD8 + Т-клетку, CD4 + Т-клетку, инфильтрирующую опухоль Т-клетку, Т-клетку памяти, первичную Т-клетку и NKT-клетку.
[0047] Одноцепочечное антитело, экспрессируемое CAR-экспрессирующей Т-клеткой настоящего изобретения, находится вне клетки. CAR-экспрессирующая Т-клетка, имеющая это одноцепочечное антитело, способна распознавать связанный с опухолью антиген (ТАА), экспрессированный на поверхности раковой клетки.
[0048] CAR-экспрессирующие Т-клетки настоящего изобретения могут содержать вектор, содержащий нуклеиновую кислоту, кодирующую саморазрушающийся ген, в дополнение к вектору экспрессии CAR настоящего изобретения.
[0049] Противораковое средство настоящего изобретения особо не ограничено, поскольку противораковое средство содержит CAR-экспрессирующую Т-клетку настоящего изобретения и фармацевтически приемлемую добавку. Примерами добавки могут быть физиологический раствор, забуференный солевой раствор, среда для культивирования клеток, декстроза, вода для инъекций, глицерин, этанол и их комбинации, стабилизаторы, солюбилизаторы и поверхностно-активные средства, буферы и антисептики, агенты тоничности, наполнители и смазывающие средства.
[0050] Противораковое средство настоящего изобретения можно вводить испытуемому субъекту, нуждающемуся в лечении рака, с использованием способа, известного специалистам в данной области. Примеры способа введения могут включать внутривенную, внутриопухолевую, внутрикожную, подкожную, внутримышечную, внутрибрюшинную, внутриартериальную, интрамедуллярную, внутрисердечную, внутрисуставную, интрасиновиальную, внутричерепную, интратекальную и субарахноидальную (в спинномозговую жидкость) инъекцию.
[0051] Количество CAR-экспрессирующих Т-клеток по настоящему изобретению, содержащихся в противораковом средстве, подлежащем введению, может быть соответствующим образом скорректировано в соответствии с типом, положением и степенью злокачественной опухоли, возрастом, массой тела и состоянием испытуемого, подлежащего лечению, и т.д. Их примеры могут предпочтительно включать от 1×104 до 1×1010клеток, предпочтительно от 1×105 до 1×109 клеток, более предпочтительно от 5×106 до 5×108 клеток, в однократной дозе.
[0052] Противораковое средство, подлежащее введению, можно независимо вводить 4 раза, 3 раза, 2 раза или 1 раз в день с интервалом в 1 день, 2 дня, 3 дня, 4 дня или 5 дней, один раз в неделю, с интервалом в 7 дней, 8 дней или 9 дней, два раза в неделю, один раз в месяц или два раза в месяц.
[0053] Примеры рака для противоракового средства по настоящему изобретению или способа лечения рака, упомянутого ниже, могут включать в себя: рак, такой как аденокарцинома, плоско клеточный рак, аденоскамный рак, недифференцированный рак, крупноклеточный рак, мелкоклеточный рак, рак кожи, рак молочной железы, рак предстательной железы, рак мочевого пузыря, рак влагалища, рак шейки матки, рак матки, рак печени, рак почки, рак поджелудочной железы, рак селезенки, рак легкого, рак трахеи, рак бронхов, рак толстой кишки, рак тонкого кишечника, рак желудка, рак пищевода, рак желчного пузыря, рак яичка и рак яичников; рак костных тканей, хрящевых тканей, жировых тканей, мышечных тканей, сосудистых тканей и кроветворных тканей; саркомы, такие как хондросаркома, саркома Юинга, злокачественная гемангиоэндотелиома, злокачественная шванна, остеосаркома и саркома мягких тканей; бластомы, такие как гепатобластома, медуллобластома, нефробластома, нейробластома, панкреатобластома, плевролегочная бластома и ретинобластома; опухоль эмбриональных клеток; лимфому и лейкемию.
[0054] Противораковое средство настоящего изобретения может использоваться в комбинации с дополнительным противораковым средством. Примеры дополнительного противоракового средства могут включать алкилирующие средства, такие как циклофосфамид, бендамустин, ифосфамид и дакарбазин; антиметаболиты, такие как пентостатин, флударабин, кладрибин, метотрексат, 5-фторурацил, 6-меркаптопурин и эноцитабин; препараты молекулярного нацеливания, такие как ритуксимаб, цетуксимаб и трастузумаб; ингибиторы киназы, такие как иматиниб, гефитиниб, эрлотиниб, афатиниб, дазатиниб, сунитиниб и траметиниб; ингибиторы протеасомы, такие как бортезомиб; ингибиторы кальцинеурина, такие как циклоспорин и такролимус; противораковые антибиотики, такие как идарубицин, доксорубицин митомицин С; растительные алкалоиды, такие как иринотекан и этопозид; платиносодержащие лекарственные средства, такие как цисплатин, оксалиплатин и карбоплатин; гормональные средства, такие как тамоксифен и бикалютамид; и иммунорегуляторные лекарственные средства, такие как интерферон, ниволумаб и пембролизумаб, и могут предпочтительно включать алкилирующие средства и антиметаболиты, более предпочтительно циклофосфамид.
[0055] Способ «использования противоракового средства по настоящему изобретению в сочетании с дополнительным противораковым средством» может включать способ, использующий при лечении дополнительное противораковое средство с последующим использованием противоракового средства по настоящему изобретению, способ, совместно использующий противораковое средство по настоящему изобретению и дополнительное противораковое средство, и способ, использующий при лечении противораковое средство по настоящему изобретению с последующим использованием дополнительного противоракового средства, и может предпочтительно включать способ с использованием при лечении дополнительного противоракового средства с последующим применением противоракового средства по настоящему изобретению. Комбинированное использование противоракового средства по настоящему изобретению и дополнительного противоракового средства дополнительно улучшает терапевтическое воздействие на рак и также может уменьшать неблагоприятные эффекты каждого противоракового средства за счет уменьшения частоты введения или дозы противоракового средства. Кроме того, дополнительное противораковое средство может содержаться в противораковом средстве по настоящему изобретению.
[0056] Примеры 1 приведены для следующих альтернативных объектов настоящего изобретения: 1) способ лечения рака, включающий введение CAR-экспрессирующей Т-клетки по настоящему изобретению пациенту, нуждающемуся в лечении рака, 2) CAR-экспрессирующую Т-клетку по настоящему изобретению для использования в качестве противоракового средства и 3) использование CAR-экспрессирующей Т-клетки по настоящему изобретению для получения противоракового средства.
[0057] Примеры 2 приведены для следующего альтернативного объекта 2 настоящего изобретения: набор для получения CAR-экспрессирующей Т-клетки, содержащий вектор экспрессии CAR по настоящему изобретению. Набор не имеет особого ограничения при условии, что в наборе содержится вектор экспрессии CAR по настоящему изобретению. Набор может содержать инструкцию для получения CAR-экспрессирующих Т-клеток и реагент для использования в передаче вектора экспрессии CAR по настоящему изобретению в Т-клетки.
Пример 1
[0058] Получение Т-клеток, экспрессирующих IL-7 и CCL19
Выбор иммуномодулирующего фактора Т-клетки
По меньшей мере, несколько сотен различных типов молекул, которые могут контролировать функции Т-клеток, присутствуют in vivo. Авторы изобретения сначала выбрали IL-7 и CCL19 из огромного числа комбинаций на основе предыдущих результатов или экспериментов в качестве контрольных молекул для дальнейшего усиления противоракового эффекта CAR-T-клеток, а также выбрали комбинацию этих двух молекул, то есть, комбинацию IL-7 и CCL19, а не каждую в отдельности. Авторы изобретения подготовили вектор для коэкспрессии этих иммуномодулирующий факторов Т-клеток и CAR.
[0059] IL-7 является цитокином, необходимым для выживания Т-клеток, и продуцируется негемопоэтическими клетками, такими как стромальные клетки костного мозга, тимуса и лимфатических органов или тканей. С другой стороны, сами Т-клетки вряд ли могут обладать способностью продуцировать IL-7.
[0060] CCL19 главным образом производится из дендритных клеток или макрофагов лимфатических узлов и имеет функцию вызывания миграции Т-клеток, В-клеток или созревших дендритных клеток через его рецептор CCR7.
[0061] Получение вектора экспрессии анти-FITC CAR для экспрессии IL-7 и CCL19
Фрагмент ДНК анти-FITC CAR (SEQ ID NO: 7), кодирующий анти-FITC CAR, состоящий из scFv анти-FITC, трансмембранной области мышиного CD8 и мышиных CD28-4-1BB-CD3Z внутриклеточных сигнальных мотивов, фрагмент ДНК F2A-MCS (SEQ ID NO: 8), кодирующий пептид 2A (F2A), показанный в SEQ ID NO: 1, и участок мультиклонирования (MCS), следующий за пептидом, и фрагмент ДНК IL-7-F2A-CCL19 (SEQ ID NO: 9), кодирующий мышиный IL-7 (без стоп-кодона) и F2A, а также мышиный CCL19 после мышиного IL-7, были искусственно синтезированы. В SEQ ID NO: 7 положения от 1 до 819 представляют собой последовательность, кодирующую полипептид scFv анти-FITC, положения 829-1074 представляют собой последовательность, кодирующую полипептид трансмембранной области CD8 мыши, положения 1075-1197 представляют собой последовательность, кодирующую полипептид внутриклеточной области CD28 мыши, положения 1198-1332 представляют собой последовательность, кодирующую полипептид внутриклеточной области 4-1 ВВ, а положения 1333-1674 представляют собой последовательность, кодирующую полипептид внутриклеточной области CD3ζ. В SEQ ID NO: 9 положения от 1 до 462 представляют собой последовательность, кодирующую IL-7, положения 463-573 представляют собой последовательность, кодирующую F2A, а положения 538-864 представляют собой последовательность, кодирующую CCL19.
[0062] Для получения CAR-вектора для экспрессии CAR, IL-7 и CCL19, фрагмент ДНК анти-FITC CAR и фрагмент ДНК F2A-MCS связывали с получением конструкции анти-FITC CAR-F2A-MCS. Затем полученную конструкцию клонировали в вектор экспрессии ретровируса pMSGV (Tamada k et al., Clin Cancer Res 18: 6436-6445 (2002)) для получения вектора pMSGV, содержащего анти-FITC CAR-F2A-MCS. Фрагмент ДНК IL-7-F2A-CCL19 был встроен в MCS вектора pMSGV путем обработки и лигирования рестрикционного фермента (Nsil и Sail) для получения вектора pMSGV, содержащего анти-FITC CAR-F2A-IL-7-F2A-CCL19 (вектор экспрессии IL-7/CCL19-анти-FITC CAR). Карта полученного вектора показана на фиг. 2. Кроме того, фрагмент ДНК анти-FITC CAR был клонирован в вектор экспрессии ретровируса pMSGV для получения вектора pMSGV, содержащего анти-FITC CAR в качестве контроля (контроль вектора анти-FITC CAR).
[0063] Получение ретровируса, содержащего вектор экспрессии IL-7/CCL19-анти-FITC CAR
Для трансдукции Т-клеток мыши был получен ретровирус. Пакующую клеточную линию GP2-293 (производства Takara Bio Inc.) трансфектировали вышеуказанным вектором экспрессии IL-7/CCL19 анти-FITC CAR или контрольным вектором анти-FITC CAR и плазмидой pCL-Есо (производства Imgenex Corp.) с использованием Lipofectamine 2000 или 3000 (производства Life Technologies Corp.) для получения ретровируса, содержащего вектор экспрессии IL-7/CCL19 анти-FITC CAR или контрольный вектор анти-FITC CAR. По прошествии 48 часов после трансфекции был получен супернатант, содержащий ретровирус.
[0064] DMEM, дополненную 10% FCS, 100 ед/мл пенициллина и 100 мг/мл стрептомицина, использовали в качестве культуральной среды для клеток GP2-293. RPMI-1640, дополненную 10% FCS, 100 ед/мл пенициллина, 100 мг/мл стрептомицина, 50 ммоль 2-меркаптоэтанола и 2 ммоль L-глутамина, использовали в качестве культуральной среды для Т-клеток, используемых в примерах, упомянутых ниже.
[0065] Трансдукция мышиных Т-клеток
Для трансдукции мышиных Т-клеток 3×106 очищенных мышиных Т-клеток, полученных из селезенки и лимфатических узлов, активировали в течение 48 часов с иммобилизованным моноклональным антителом анти-CD3 (3 мкг/мл), моноклональным антителом анти-CD28 (1 мкг/мл) и IL-2 (100 ME/мл). Затем супернатант, содержащий полученный таким образом ретровирус, содержащий вектор, экспрессии IL-7/CCL19 анти-FITC CAR или контрольный вектор анти-FITC CAR, смешали с активированными мышиными Т-клетками (1×106 клеток/мл) на пластине, покрытой 25 мкг/мл RetroNectin (R) (производства Takara Bio Inc.). После центрифугирования при 1500 об/мин в течение 2 часов клетки культивировали в течение 6 часов в присутствии IL-2 (100 МЕ/мл). Для удаления ретровируса из культуральной среды мышиные Т-клетки были выделены, перенесены в свежую культуральную питательную среду (RPMI), содержащую IL-2 (100 МЕ/мл), и далее культивированы в течение 42 часов для получения мышиных Т-клеток, содержащих вектор экспрессии IL-7 / CCL19 анти-FITC CAR (Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19) или мышиных Т-клеток, несущих контрольный вектор анти-FITC CAR (Т-клеток, экспрессирующих анти-FITC CAR).
[0066] Получение вектора экспрессии анти-CD20 CAR для экспрессии IL-7 и CCL19
Вектор pMSGV, содержащий анти- CD20 CAR-F2A-IL-7-F2A-CCL19 человека (вектор экспрессии CAR IL-7/CCL19-анти- CD20 человека) получали таким же образом, что и при получении описанного выше вектора, экспрессирующего анти-FITC CAR IL-7/CCL19, за исключением того, что последовательность области scFv анти-FITC, содержащаяся в последовательности, представленной SEQ ID NO: 7, была заменена последовательностью анти-CD20 scFv человека (SEQ ID NO: 10) синтезированного Life Technologies Corp.на основе последовательности ритуксимаба. Аналогичным образом, вектор pMSGV, содержащий анти-CD20 CAR человека (контрольный вектор анти-CD20 человека), получили таким же образом, что и при получении контрольного вектора анти-FITC CAR, описанного выше, за исключением того, что область последовательности анти-FITC scFv, содержащаяся в последовательности, представленной SEQ ID NO: 7, была заменена последовательностью scFv анти-CD20 человека (SEQ ID NO: 10). Вектор экспрессии CAR IL-7/CCL19 анти-CD20 человека или контрольный вектор CAR анти-CD20 человека перенесли в мышиные Т-клетки таким же образом, как описано выше, для получения Т-клеток экспрессии анти-CD20 CAR-IL-7/CCL19 человека или Т-клеток, экспрессирующих CAR анти-CD20 человека.
Пример 2
[0067] Анализ экспрессии CAR способом проточной цитометрии
Анализ проточной цитометрии Уровень экспрессии CAR, распознающего FITC в качестве модельного антигена, анализировали с помощью двухцветной проточной цитометрии. Полученные Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, культивировали в присутствии FITC-связанного декстрана и (АРС)-связанного анти-CD8 моноклонального антитела аллофикоцианина (53-6,7 производства Affymetrix, Inc.). ЕС800 (производства Sony Corp.) использовали в проточной цитометрии, и данные анализировали с использованием программного обеспечения FlowJo (производства Tree Star, Inc.).
[0068] Уровень экспрессии CAR, распознающего CD20 человека, также анализировали с использованием двухцветной проточной цитометрии. Полученные Т-клетки, экспрессирующие CAR-IL-7/CCL19, экспрессирующие CD20 человека, анализировали, используя биотинилированный белок L и АРС-связанный стрептавидин.
[0069] Результаты
Результаты показаны на фиг. 3-5. На фиг. 3 на левом графике показаны результаты для неокрашенного образца CAR (не был добавлен FITC-связанный декстран) Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, а на правом графике показаны результаты для окрашенного образца CAR (добавлен FITC-связанный декстран) Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19. На фиг. 4 «трансдукция (-)» показывает результаты для нетрансдуцированных Т-клеток, «Контроль» показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR, а «7×19» показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19,. На фиг. 5 «трансдукция (-)» показывает результаты для нетрансдуцированных Т-клеток, «Контроль» показывает результаты для Т-клеток, экспрессирующих CAR античеловеческого CD20, а «7×19» показывает результаты относительно Т-клеток, экспрессирующих анти-CD20 CAR-IL-7 / CCL19 человека. Численные значения на этих фигурах представляют собой процент от каждой популяции. Как показано на фиг. 3-5, экспрессия CAR была подтверждена в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19, и в Т-клетках, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека.
Пример 3
[0070] Секреция IL-7 и CCL19
Измерение 1 концентраций IL-7 и CCL19 в культуральном супернатанте Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19
Полученные Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, или Т-клетки, экспрессирующие анти-FITC CAR, стимулировали 1 мг/мл иммобилизованным FITC-связанным трастузумабом и культивировали в течение 3 дней. Супернатант был извлечен, а концентрации IL-7 и CCL19 были измерены с использованием коммерчески доступного набора ELISA (изготовленного R&D systems, Inc.). Результаты показаны на фиг. 6.
[0071] Результаты
Как показано на фиг. 6, в культуральном супернатанте IL-7 был обнаружен при 300 пг/мл или более, и CCL19 детектирован при 75 пг/мл или более. Таким образом, было подтверждено, что: Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, экспрессируют IL-7 и CCL19; и экспрессированные IL-7 и CCL19 секретируются вне клеток. IL-7 и CCL19 из контрольных Т-клеток, экспрессирующих анти-FITC CAR, в обоих случаях падали ниже предела обнаружения (не были обнаружены).
[0072] Измерение 2 концентраций IL-7 и CCL19 в культуральном супернатанте Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19
Концентрации IL-7 и CCL-19 после культивирования в течение 3, 5 или 7 дней со стимуляцией или без стимуляции иммобилизованным FITC-связанным трастузумабом или моноклональным антителом анти-CD3 измеряли с использованием набора ELISA. Результаты показаны на фиг. 7. На фиг. 7 светлый столбец показывает результаты, полученные без стимуляции, серый столбец показывает результаты, полученные при стимуляции с использованием FITC-связанного трастузумаба, а темный столбец показывает результаты, полученные при стимуляции моноклональным антителом анти-CD3. «Контроль» показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR, и «7×19» показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19.
[0073] Результаты
Как видно из фиг. 7, было показано, что Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, секретируют IL-7 и CCL-19 вне клеток при культивировании не только в течение 3 дней, но и в течение 5 дней или 7 дней.
[0074] Измерение концентраций IL-7 и CCL19 в культуральном супернатанте Т-клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека
Для приготовленных Т-клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека, или Т-клеток, экспрессирующих анти-CD20 CAR человека, концентрации IL-7 и CCL-19 после культивирования в течение 3 дней или 5 дней с или без стимуляции мастоцитомой Р815, обработанной митомицином С, причем мастоцитома Р815 генетически рекомбинирована для экспрессии человеческого CD20 (P815-hCD20), или иммобилизованного моноклонального антитела анти-CD3 аналогичным образом выполняли измерения с использованием набора ELISA. Результаты показаны на фиг. 8. На фиг. 8 светлый столбец показывает результаты, полученные без стимуляции, в диагонально заштрихованном столбце показаны результаты, полученные при стимуляции Р815, обработанной митомицином С, темный столбец показывает результаты, полученные при стимуляции P815-hCD20, а в сером столбце показаны результаты, полученные при стимуляции иммобилизованным моноклональным антителом анти-CD3. «Контроль» демонстрирует результаты для Т-клеток, экспрессирующих анти-CD20 CAR человека, и «7×19» показывает результаты для Т-клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека.
[0075] Результаты
Как видно из фиг. 8, также показано, что Т-клетки, экспрессирующие анти-CD20 CAR-IL-7/CCL19 человека, секретируют IL-7 и CCL-19 вне клеток.
Пример 4
[0076] Число клеток и уровень выживаемости CAR экспрессирующих Т-клеток,
Количество клеток и уровень выживаемости Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19
Было проведено исследование того, будет ли IL-7 или CCL19, продуцируемый Т-клетками, экспрессирующими анти-FITC CAR-IL-7//CCL19, выполнять биологические функции и проявлять стимулирующий иммунитет эффект. Приготовленные Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, или Т-клетки, экспрессирующие анти-FITC CAR, стимулировали иммобилизованным FITC-связанным трастузумабом с концентрацией 1 мкг/мл и культивировали в течение 3 дней, 5 дней или 7 дней, и клетки и супернатант были извлечены. Число клеток и уровень выживаемости анализировали окрашиванием трипановым синим. Результаты показаны на фиг. 9 и 10. На фиг. 9 и 10 темный столбец показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, светлый столбец показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR, а абсцисса показывает количество дней культуры. Статистически значимое различие изучали с помощью t-критерия Стьюдента (* р < 0,05, ** р < 0,01, *** р < 0,005,

[0077] Результаты
Как показано на фиг. 9 и 10, как клеточная пролиферация, так и уровень выживаемости Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, возросли, что свидетельствует о том, что IL-7 и CCL19, продуцируемые Т-клетками, экспрессирующими анти-FITC CAR-IL-7/CCL19, выполняют биологические функции.
[0078] Число клеток Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека
Образец, содержащий Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека (4×105 клеток), был костимулирован с митомицином С и P815-hCD20 в присутствии контроля крысиного IgG2a изотипа, моноклонального нейтрализующего антитела анти-CD127 или моноклонального нейтрализующего антитела анти-CCR7. Клетки культивировали в течение 5 дней, и абсолютное число живых клеток исследовали с использованием трипанового синего. CD127 является рецептором IL-7, a CCR7 представляет собой CCL19-рецептор. Результаты показаны на фиг. 11. На фиг. 11 «Iso.Cntrl» демонстрирует результаты, полученные при стимуляции с P815-hCD20 в присутствии контроля крысиного IgG2a изотипа, «анти-CD127» показывает результаты, полученные при стимуляции с P815-hCD20 в присутствии моноклонального нейтрализующего антитела анти-СБ127, и «анти-CCR7» показывает результаты, полученные при стимуляции с P815-hCD20 в присутствии моноклонального нейтрализующего антитела анти-CCR7. На фиг. 11 темный столбец показывает результаты для Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека, а светлый столбец показывает результаты для Т-клеток, экспрессирующих анти- CD20 CAR человека. Каждые данные были обозначены средним ± стандартным отклонением от 3 лунок. *: Р < 0,05,
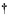
[0079] Результаты
Как показано на фиг. 11, число Т-клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека, также возросло, и их скорость пролиферации клеток повысилась, в то время как клеточная пролиферация ингибировалась анти-CD127, что демонстрирует, что повышение скорости пролиферации клеток работает через рецептор IL-7 CD127.
Пример 5
[0080] Тест миграции Т-клеток
Тест миграции Т-клеток с использованием Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19
Хемоатрактивный эффект CCL19 изучался с помощью теста миграции клеток при использовании Transwell. Миграционные свойства Т-клеток-ответчиков измеряли миграцией через поликарбонатный фильтр, имеющий размер пор 5 мкм, используя 96-луночные камеры Transwell (R) (Costar, производства Corning, Inc.). В частности, Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, или Т-клетки, экспрессирующие анти-FITC CAR, стимулировали в течение 3 дней с 1 мкг/мл иммобилизованным FITC-связанным трастузумабом в нижней камере. Т-клетки-ответчики получали из селезенки или лимфатических узлов путем отрицательной селекции с использованием MACS (R) (производства Miltenyi Biotec GmbH). Т-клетки-ответчики метили синим CytoTell (производство ААТ Bioquest, Inc.) и культивировали в течение 3 часов в верхнем слое. Перенос из верхней камеры в нижнюю камеру проводился способом проточной цитометрии. Результаты показаны на фиг. 12. На фиг. 12 темный столбец отображает результаты для Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, светлый столбец показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR, а ордината показывает абсолютное число Т-клеток-ответчиков, которые мигрировали в нижнюю камеру (то же самое справедливо и для фиг. 13 и 14 ниже). Статистически значимое различие изучали с помощью t-критерия Стьюдента (* р < 0,05).
[0081] Результаты
Как показано на фиг. 12, Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, позволили мигрировать большему числу Т-клеток в нижнюю камеру по сравнению с Т-клетками, экспрессирующими анти-FITC CAR. В терапии переноса лимфоцитов (например, Т-клетками, экспрессирующими CAR) повреждение раковых клеток вводимыми Т-клетками является важным, и, кроме того, важно активировать эндогенные Т-клетки (= иммуноциты хозяина), изначально присутствующие в больном раком, и тем самым вербовать эти клетки в качестве клеток, атакующих раковые клетки. Для этой цели предпочтительно не только переносить лимфоциты, обладающие противораковой активностью, но и вызывать активное взаимодействие между переданными Т-клетками и эндогенными Т-клетками с помощью определенного подхода, так чтобы эндогенные Т-клетки накапливались локально в месте раковой опухоли, с точки зрения усиления иммунотерапевтических эффектов. Как видно из результатов на фиг. 12, Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, обладают способностью накапливать собственные Т-клетки, демонстрируя, что активное взаимодействие между переданными Т-клетками и эндогенными Т-клетками может быть индуцированным.
[0082] Тест миграции Т-клеток или дендритных клеток с использованием Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19
Образец, содержащий Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, или Т-клетки, экспрессирующие анти-FITC CAR (5×105клеток), стимулировали иммобилизованным FITC-связанным трастузумабом или моноклональным антителом анти-CD3 в нижней камере Transwell. На 3-й день 4×105 Т-клеток, окрашенных CytoTell Blue, помещали в верхнюю камеру и инкубировали в течение 3 часов или 5 часов. Аналогичным образом, каждый образец стимулировался иммобилизованным FITC-связанным трастузумабом. На третий день 4×105 дендритных клеток, окрашенных CytoTell Blue, помещали в верхнюю камеру и инкубировали в течение 3 часов. Клетки-ответчики каждого типа, мигрировавшие из верхней камеры в нижнюю камеру, анализировали проточной цитометрией. Результаты показаны на фиг. 13 и фиг. 14. На фиг. 13 и 14 темный столбец показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, и в светлом столбце показаны результаты для Т-клеток, экспрессирующих анти-FITC CAR. На фигурах 13 и 14 и фиг. 15, упомянутых ниже, каждая отметка была обозначена средним стандартным отклонением от 3 лунок. *: Р < 0,05, **: Р < 0,01,
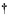
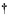
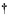

[0083] Результаты
Результаты на фиг. 13 и фиг. 14 продемонстрировали, что Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, обладают высокой способностью к накоплению собственных Т-клеток и дендритных клеток.
[0084] Тест миграции Т-клеток с использованием Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека
Образец, содержащий Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека (1×105 клеток), культивировали с P815-hCD20, обработанным митомицином С в нижней камере Transwell. На 3-й день 4×105 Т-клеток, окрашенных CytoTell Blue, помещали в верхнюю камеру и инкубировали в течение 3 часов в присутствии контроля крысиного IgG2a изотипа, или моноклонального антитела анти-CD127 или моноклонального антитела анти-CCR7. Т-клетки-ответчики, мигрировавшие из верхней камеры в нижнюю камеру, анализировали проточной цитометрией. Результаты показаны на фиг. 15. На фиг. 15 «Iso.Cntrl» показывает результаты, полученные при стимуляции с P815-hCD20 в присутствии контроля крысиного IgG2a изотипа, «анти-CD127» показывает результаты, полученные при стимуляции с P815-hCD20 в присутствии моноклонального нейтрализующего антитела анти-СБ127 и «анти-CCR7» показывает результаты, полученные при стимуляции с P815-hCD20 в присутствии моноклонального нейтрализующего антитела анти-CCR7. На фиг. 15 темный столбец показывает результаты для Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека, а светлый столбец показывает результаты для Т-клеток, экспрессирующих анти- CD20 CAR человека.
[0085] Результаты
Как видно из результатов, приведенных на фиг. 15, Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, также обладают высокой способностью накапливать собственные Т-клетки, и накопление собственных Т-клеток ингибируется анти-CCR7, что демонстрирует, что накопление собственных Т-клеток работает через CCR19 рецептор CCR7.
[0086] Результаты, представленные на фиг. 9-15, демонстрируют, что Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, и Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, обладают важными эффектами, необходимыми для индукции иммунитета, эффективной пролиферации IL-7, обладающего высокой выживаемостью, и локального накопления Т-клеток или дендритных клеток к раку через CCL19 и обладают превосходным эффектом повышения иммунитета. Вкратце, было показано, что экспрессия двух контрольных молекул, т.е. «IL-7» и «CCL19», в CAR-экспрессирующих Т-клетках позволяет улучшить пролиферативный потенциал, выживаемость и иммуномодулирующий эффект Т-клеток.
Пример 6
[0087] Пролиферативный потенциал Т-клеток
Образец, содержащий Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19 или контрольные Т-клетки, экспрессирующие анти-FITC CAR (5×105 клеток), окрашивали CytoTell синий (производство ААТ Bioquest, Inc.), стимулировали иммобилизованным FITC-связанным трастузумабом, а затем анализировали с использованием проточной цитометрии. Результаты на 5-й день после начала стимуляции показаны на фиг. 16, а результаты на 3-е и 7-е дни после начала стимуляции показаны на фиг. 17. На фиг. 16 численные значения на гистограммах представляют собой число деления клеток. На фигурах 16 и 17 численные значения на круговых диаграммах представляют отношение каждой ограниченной фракции (0, 1, 2, 3 или 4 > числа делений клеток) к популяции лейкоцитов.
[0088] Результаты
Результаты, представленные на фиг. 16 и фиг. 17, продемонстрировали, что пролиферативный потенциал Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19, увеличивается по сравнению с Т-клетками, экспрессирующими анти-FITC CAR.
Пример 7
[0089] Экспрессия CD127 или CCR7 в Т-клетках, дендритных клетках и CAR-экспрессирующих Т-клетках
Нестимулированные Т-клетки селезенки (необработанные Т-клетки), Т-клетки селезенки, стимулированные культивированием в течение 2 дней с моноклональным антителом анти-CD3, моноклональным антителом анти-CD28 и IL-2 (активированные Т-клетки), нестимулированные дендритные клетки селезенки (дендритные клетки) и Т-клетки, экспрессирующие анти-FITC CAR (Контроль), а также Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19 (7×19), полученные активацией таким же образом, что и в «Трансдукции мышиных Т-клеток» примера 1, анализировали с использованием проточной цитометрии и исследовали на экспрессию CD127 или CDR7. Т-клетки представляли собой популяцию CD3+CD19-, Т-клетки, экспрессирующие анти-FITC CAR, и Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, были положительными по отношению к FITC-связанным гранулам декстрана, а дендритные клетки представляли собой популяцию CD11c+. Результаты исследования экспрессии CD127 показаны на фиг. 18, а результаты исследования экспрессии CCR7 показаны на фиг. 19. На этих фигурах численные значения представляют % положительных клеток, «Контроль» показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR, и «7×19» показывает результаты для Т-клеток, экспрессирующих анти-FITC CAR-IL-7/CCL19.
[0090] Результаты
Как показано на фиг. 18, экспрессия CD127, очевидно, была снижена в активированных Т-клетках по сравнению с необработанными Т-клетками, но было показано, что она была больше в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19, чем в активированных Т-клетках, и для восстановления покрывают необработанные Т-клетки. Как показано на фиг. 19, экспрессия CCR7 была снижена активацией в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19, но было показано, что она поддерживается на уровне приблизительно 67% экспрессии в необработанных Т-клетках. До сих пор было известно, что экспрессия CD127 или CCR7 снижается примерно до 1/2 к 1/3 активацией Т-клеток. Таким образом, даже если получают CAR-экспрессирующие Т-клетки, которые экспрессируют IL-7 или CCL19, считается, что эффекты IL-7 и CCL19 снижаются посредством активации CAR экспрессирующих Т-клеток. Таким образом, как правило, нельзя ожидать, что экспрессия IL-7 и CCL19 в CAR экспрессирующих Т-клетках усиливает иммуномодулирующий эффект или противораковую активность CAR экспрессирующих Т-клеток. В этом тесте также было подтверждено, что экспрессия CD127 или CCR7 временно снижалась на 2-й день после активации селезеночных Т-клеток. Тем не менее, было показано, что экспрессия CD127 или CCR7 восстанавливается на 4-й день в Т-клетках, экспрессирующих анти-FITC CAR-IL-7/CCL19. Это указывает на то, что экспрессия IL-7 и CCL19 в CAR-экспрессирующих Т-клетках полезна для повышения их иммуномодулирующего эффекта или противораковой активности.
Пример 8
[0091] Терапевтический эффект в мышиных моделях опухолей
Введение мышам Т-клеток, экспрессирующих античеловеческий CD20 CAR-IL-7/CCL19
5×105 клеток мастоцитомы Р815, генетически рекомбинированных для экспрессии CD20 (P815-hCD20) человека, подкожно ввели для заражения каждой мыши, несущей рак (мышь DBA/2). Спустя 3 дня мышам внутривенно вводили 3×106 Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека, или Т-клетки, экспрессирующие анти- CD-20 CAR человека. Была установлена группа без лечения в качестве контроля путем заражения мастоцитомой Р815 каждой мыши и без проведения последующего лечения (без введения CAR-экспрессирующих Т-клеток). Объем опухоли и уровень выживаемости мыши измеряли дважды в неделю. В анализе объема опухоли стандартное отклонение рассчитывали для каждой экспериментальной группы. Статистически значимое различие среди 3 групп исследовали с помощью t-критерия Стьюдента для объемного анализа опухоли и логарифмического рангового теста для исследования уровня выживаемости (* Р < 0,05, ** Р < 0,01).
[0092] Результаты исследования изменения объемов опухоли у мышей показаны на фиг. 20, а результаты исследования уровня выживаемости мышей показаны на фиг. 21. На фигурах 20 и фиг. 21 светлый круг обозначает результаты, полученные введением Т-клеток, экспрессирующих анти- CD20 CAR человека, темный кружок отображает результаты, полученные при введении Т-клеток, экспрессирующих анти-CD20 CAR-IL-7/CCL19 человека, и светлый ромб показывает результаты, полученные без введения CAR экспрессирующих Т-клеток в группе без лечения. На фиг. 20 абсцисса показывает дни после внутривенного введения клеток мышам, а ордината показывает объем опухоли (мм3). На фиг. 21 абсцисса показывает недели после внутривенного введения клеток мышам, а по оси ординат - уровень выживаемости (%).
[0093] Результаты
Как показано на фиг. 20 и фиг. 21, при введении Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека, было подтверждено, что они проявляют эффект уменьшения объема опухоли и возрастания уровня выживаемости (эффект продления периода выживания). По сравнению с введением Т-клеток, экспрессирующих анти- CD20 CAR человека, или без введения Т-клеток, экспрессирующих CAR. Таким образом, было продемонстрировано, что Т-клетки, экспрессирующие анти-CD20 CAR-IL-7/CCL19 человека, обладают превосходной противораковой активностью.
[0094] Введение мышам противоракового средства и Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека
5×105 клеток P815-hCD20 были подкожно введены для заражения каждой мыши. На 10-й день после заражения внутрибрюшинно вводили противораковый препарат циклофосфамид (CPA, 100 мг / кг) и на 14-й день вводили внутривенно 1×106 Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека, или Т-клеток, экспрессирующих анти CD20 CAR человека. Результаты исследования уровня выживаемости мышей показаны на фиг. 22, а результаты исследования их объемов опухоли показаны на фигурах 23 и 24. На фигурах 22-24 абсцисса показывает дни после подкожного заражения P815-hCD20 (день подкожного заражения Р815-hCD20 мышей определялся как день 0), а по оси ординат - уровень выживаемости (рис.22) или объем опухоли (большая ось опухоли × (малая ось опухоли)2 /2 (мм3)) (фиг. 23 и фиг. 24). «Без лечения» отображает результаты, полученные в необработанной группе, «СРА» отображает результаты, полученные в группе, получавшей только CPA, «СРА + Контроль» показывает результаты, полученные в группе с учетом Т-клеток, экспрессирующих анти- CD20 CAR человека, после введения CPA, «СРА + 7×19» показывает результаты, полученные в данной группе, с учетом Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека после введения CPA, и

[0095] Результаты
Как показано на фиг. 22, комбинированное применение Т-клеток, экспрессирующих анти- CD20 CAR-IL-7 / CCL19 человека, по настоящему изобретению и противоракового средства продемонстрировало очень высокий уровень выживаемости. Как показано на фиг. 23 и 24, комбинированное применение Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека, по настоящему изобретению и противоракового средства показало полное исчезновение опухоли. Как показано на фиг. 24, объем опухоли был самым большим на 10-й день после подкожного заражения P815-hCD20. В этом отношении малая ось составляла от 4,86 мм до 7,25 мм, главная ось была от 5,92 до 8,38 мм, а объем опухоли составлял от 69,91 мм3 до 220,50 мм3, в среднем 140,02 мм3. Результаты, описанные выше, также показали, что опухоль, которая пролиферировала, временно исчезла при обработке Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека. В случае использования CAR-экспрессирующих Т-клеток по настоящему изобретению в комбинации с дополнительным противораковым средством для дальнейшего повышения противораковой активности CAR экспрессирующих Т-клеток настоящего изобретения, с тем, чтобы вначале уменьшить число клеток лимфоцитов при использовании дополнительного противоракового средства, а затем вводить Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, как в способе, описанном выше. Такой способ может усиливать in vivo гомеостаз CAR-экспрессирующих Т-клеток.
Пример 9
[0096] Эффект проникновения в опухолевые ткани
5×105 клеток P815-hCD20 подкожно введены для заражения каждой мыши. На 3-й день после их заражения вводили 1×106 Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека. На 21 день после заражения ткани опухоли были разрезаны. Ткань каждой мыши была разделена на две части. Одну из этих двух порций окрашивали гематоксилин-эозином (Н&Е), а другую часть использовали для иммуногистохимического анализа. Иммуногистохимический анализ проводили с использованием комбинации моноклональных антител анти-CD4 и анти-CD8 или комбинации моноклональных антител анти-CD3 и анти-ОЕС205 в качестве первичных антител. В качестве вторичных антител использовали Alexa Fluor (R) 488-связанный анти- IgG2a крысы (зеленый) и Alexa Fluor (R), содержащий 647 анти- IgG2b крысы (красный). Ядра клеток окрашивали DAPI (синий). Н&Е-окрашенные образцы и иммуномеченые фрагменты под микроскопом наблюдали при увеличении × 100 или × 200. CD4 и CD8 являются маркерами для Т-клеток, a DEC205 является маркером дендритных клеток. Результаты Н&Е окрашивания показаны на фиг. 25, а результаты иммуногистохимического анализа показаны на фиг. 26(a) и 26(b). Результаты количественного определения положительной области, помеченной каждым флуоресцентным окрашиванием (окрашивание CD4 (красный), окрашивание CD8 (зеленый), окрашивание CD3 (красный), окрашивание DEC205 (зеленый) и сосуществование CD3 и DEC205 (желтый)) в данных на фигурах 26(а) и 26(b) с использованием программы подсчета гибридных ячеек (производства Keyence Corp.) показаны на фиг. 27(a) и 27(b) соответственно. На фигурах 25-27 «без лечения» показаны результаты, полученные в группе без лечения, в «Контроль» изображены результаты, полученные в группе, обработанной Т-клетками, экспрессирующими анти- CD20 CAR человека, и в 7×19 изображена группа, обработанная Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека.
[0097] Результаты
Из результатов на фиг. 25 наблюдали обработку ускоренного некроза Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека (участки, обозначенные стрелками), и наблюдали области, где исчезли зародыши. Результаты на фиг. 26(а) и фиг. 27(а) показывают, что Т-клетки проникают в раковые ткани при обработке Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека. Результаты на фиг. 26(b) и фиг. 27(b) продемонстрировали, что дендритные клетки вместе с Т-клетками проникают в раковые ткани при обработке Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека.
Пример 10
[0098] Терапевтический эффект, вызванный комбинацией IL-7 и CCL19 на опухоли
5×105 клеток P815-hCD20 подкожно ввели для заражения каждой мыши DBA/2. На 3-й день после заражения вводили внутривенно 1×106 Т-клеток, экспрессирующих анти- CD20 CAR человека, Т-клетки, экспрессирующие анти- CD20 CAR-IL-7 человека, которые экспрессировали только IL-7 в качестве иммуномодулирующего фактора (не экспрессируя CCL19), Т-клетки, экспрессирующие анти-CD20 CAR-CCL19 человека, которые экспрессировали только CCL19 в качестве иммуномодулирующего фактора (не экспрессируя IL-7), или Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, которые экспрессировали IL-7 и CCL19. Группа контрольных мышей была установлена без введения CAR экспрессирующих Т-клеток, которые экспрессировали либо IL-7, либо CCL19. На 10-е сутки после введения измеряли большую ось и малую ось опухоли, а объем опухоли (мм3) рассчитывали таким же образом, как указано выше. Результаты показаны на фиг. 28. На фиг. 28, «Без лечения» показывает результаты, полученные без введения Т-клеток, экспрессирующих CAR, «Control CAR» показывает результаты, полученные при введении Т-клеток, экспрессирующих анти- CD20 CAR человека, «IL-7 CAR» показывает результаты, полученные при введении Т-клеток, экспрессирующих анти-CD20 CAR-IL-7 человека, «CCL19 CAR» показывает результаты, полученные при введении Т-клеток, экспрессирующих анти- CD20 CAR-CCL19 человека, и «IL-7 / CCL19 CAR» показывает результаты, полученные при введении Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека.
[0099] Т-клетки, экспрессирующие анти- CD20 CAR-IL-7, получали путем получения вектора pMSGV, содержащего анти- CD20 CAR-F2A-IL-7 человека (вектор экспрессии IL-7 анти- CD20 CAR человека) и перенос этого вектора к мышиным Т-клеткам таким же образом, как и в «Трансдукции мышиных Т-клеток» примера 1. Аналогичным образом, Т-клетки, экспрессирующие анти- CD20 CAR-CCL19 человека, получали путем получения вектора pMSGV, содержащего анти- CD20 CAR-F2A-CCL19 человека (вектор экспрессии анти- CCL19 CD20 CAR человека) и перенос этого вектора в мышиные Т-клетки таким же образом, что и в «Трансдукции мышиных Т-клеток» примера 1. Получение каждого вектора осуществляли в соответствии со способом «Получение вектора экспрессии анти-FITC CAR для экспрессии IL-7 и CCL19» или «Получение вектора экспрессии анти-CD20 CAR для экспрессии IL-7 и CCL19» примера 1. Последовательность положений от 1 до 462 и стоп-кодон, следующий за этими положениями в SEQ ID NO: 9, были использованы в качестве последовательности, кодирующей IL-7. Последовательность положений с 538 по 864 в SEQ ID NO: 9 использовали в качестве последовательности, кодирующей CCL19. Результаты показаны на фиг. 28.
[0100] Результаты
Как показано на фиг. 28, введение Т-клеток, экспрессирующих анти-CD20 CAR-IL-7 человека, или Т-клеток, экспрессирующих анти- CD20 CAR-CCL19 человека, наглядно демонстрирует эффект ингибирования роста опухоли, эквивалентный или несколько меньший, чем путь введения контрольных Т-клеток, экспрессирующих анти- CD20 CAR человека, в то время как опухоль почти исчезает при введении Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека. Таким образом, несмотря на то, что только IL-7 или CCL19 сам по себе вряд ли обладает ингибирующим рост опухолей эффектом, было показано, что комбинация IL-7 и CCL19 дает очень высокий ингибиторный эффект роста опухоли.
Пример 11
[0101] Цитотоксическая активность 1 против опухолевых клеток при исследовании высвобождения51Cr -
Выбор иммуномодулирующего фактора Т-клеток
В микроокружении раковых тканей ингибирующие сигналы трансдуцируются в иммуноциты, так что противораковый иммунный ответ подавляется, таким образом, ослабляя эффект иммунотерапии. Ингибирующие сигналы к иммуноцитам трансдуцируются SHP-1 или SHP-2. Таким образом, при Т-клеточной терапии рака противораковый эффект можно повысить, позволяя самим Т-клеткам продуцировать доминантно-негативный мутант, который ингибирует действие SHP-1 или SHP-2. Соответственно, был получен вектор для коэкспрессии доминантно-негативного мутанта, ингибирующего действие SHP-1 или SHP-2 и CAR, и была исследована цитотоксическая активность против опухолевых клеток.
[0102] Получение вектора экспрессии CAR для экспрессии доминантно-негативного мутанта для SHP1 или SHP2
Фрагмент ДНК, кодирующий доминантно-негативный мутант мышиного SHP1 (SHP1DN), содержащий мутацию каталитического цистеинового остатка в положении 453 до серина (C453S), был получен с помощью мутагенеза, направленного на участок опосредованной полимеразной цепной реакции (ПЦР). Фрагмент ДНК, кодирующий доминантно-негативный мутант мышиного SHP2 (SHP2DN), содержащий мутацию каталитического цистеинового остатка в положении 459 до серина (C459S), был синтезирован Life Technologies Corp. и использован. Нуклеотидная последовательность, кодирующая SHP1DN мыши, показана в SEQ ID NO: 11, а нуклеотидная последовательность, кодирующая SHP2DN мыши, показана в SEQ ID NO: 12. Три основания в положениях с 1357 по 1359 в SEQ ID NO: 11 и в положениях с 1375 по 1377 в SEQ ID NO: 12 являются мутантными участками. Фрагмент ДНК, кодирующий SHP1DN или SHP2DN, был вставлен в MCS вектора pMSGV, содержащего анти-CD20 scFv CAR-F2A-MCS человека, в ходе получения вектора экспрессии анти- CD20 IL-7/CCL19 CAR человека в примере 2 для получения SHP1DN вектора экспрессии анти- CD20 CAR человека и SHP2DN вектора экспрессии анти- CD20 CAR человека, соответственно. Карты полученных векторов показаны на фиг. 29.
[0103] Трансдукция мышиных Т-клеток
SHP1DN вектора экспрессии анти- CD20 CAR человека или SHP2DN вектора экспрессии анти- CD20 CAR человека был перенесен на мышиные Т-клетки таким же образом, что и в примере 1, для получения Т-клеток, экспрессирующих анти- CD20 CAR-SHP1DN человека, и Т-клеток, экспрессирующих анти- CD20 CAR-SHP2DN человека, соответственно. Т-клетки, экспрессирующие анти- CD20 CAR человека, полученные в примере 1, использовали в качестве контроля.
[0104] Цитотоксическая активность против опухолевых клеток при анализе высвобождения51Cr
Цитотоксическую активность CAR-экспрессирующих Т-клеток против опухоли измеряли стандартным 4-часовым анализом высвобождения51Cr. В качестве опухолевых клеток-мишеней использовали Р815, экспрессирующий CD20 человека (P815-hCD20). Опухолевые клетки собирали, культивировали при 37°С в течение 1 часа в присутствии 100 мкКи Na251CrO4 и затем промывали три раза. Затем опухолевые клетки культивировали с Т-клетками, экспрессирующими анти- CD20 CAR человека, Т-клетками, экспрессирующими анти- CD20 CAR-SHP1DN человека, или Т-клетками, экспрессирующими анти- CD20 CAR-SHP2DN человека, в качестве эффекторных Т-клеток. Соотношение эффектор/мишень устанавливали равным 0,6, 1,25, 2,5, 5 или 10. Максимальное выделение и спонтанное выделение клеток-мишеней определяли путем культивирования клеток в культуральной среде, содержащей 10% тритона-Х (изготовленного Sigma- Aldrich Co. LLC.) или только в культуральной среде. Высвобождение51Cr из супернатанта измеряли с использованием сцинтилляционного счетчика TopCount (производства PerkinElmer, Inc.). Процент специфической цитотоксичности рассчитывали в соответствии с уравнением:

Результаты показаны на фиг. 30. На фиг. 30(a) светлые кружки показывают результаты для Т-клеток, экспрессирующих анти- CD20 CAR человека, а темные кружки отображают результаты для Т-клеток, экспрессирующих анти- CD20 CAR-SHP1DN человека. На фигуре 30(b) светлые кружки показывают результаты для Т-клеток, экспрессирующих анти- CD20 CAR человека, а темные кружки отображают результаты для Т-клеток, экспрессирующих анти- CD20 CAR-SHP2DN человека. По оси абсцисс отложено отношение Е/Т между эффектором (Т-клетки) и мишенью (опухолевые клетки), а по оси ординат - удельная цитотоксичность (%). Статистически значимое различие изучали с помощью t-критерия Стьюдента (* р < 0,05).
[0105] Как показано на фиг. 30, было продемонстрировано, что Т-клетки, экспрессирующие анти- CD20 CAR-SHP1DN человека, и Т-клетки, экспрессирующие анти- CD20 CAR-SHP2DN человека, обладают значительно более высокой цитотоксической активностью в отношении опухолевых клеток, чем Т-клетки, экспрессирующие анти- CD20 CAR человека.
Пример 12
[0106] Цитотоксическая активность 2 против опухолевых клеток при анализе высвобождения51Cr
P815-hCD20 (1×104 клеток/лунку) были смешаны с Т-клетками, экспрессирующими анти-FITC CAR (Контроль, кружки) или Т-клетками, экспрессирующими анти-FITC CAR-IL-7/CCL19 (7×19, квадраты) при соотношениях эффектор/мишень (Е/Т) 0,15525, 0,3125, 0,625, 2,5, 5 или 10 в присутствии немеченого (Ab, светлые фигуры) или FITC-связанного (FITC-Ab, темные фигуры) ритуксимаба. Таким же образом, как описано выше, измеряли высвобождение51Cr из супернатанта и вычисляли процент цитотоксической активности. Результаты показаны на фиг. 31. На фиг. 31 «темные кружки» изображают результаты, полученные при смешивании с Т-клетками, экспрессирующими анти-FITC CAR, в присутствии FITC-связанного ритуксимаба, «светлые кружки» изображают результаты, полученные при смешивании с Т-клетками, экспрессирующими анти-FITC CAR, в присутствии немеченого ритуксимаба, «темные квадраты» показывают результаты, полученные при смешивании с Т-клетками, экспрессирующими анти-FITC CAR-IL-7/CCL19, в присутствии FITC-связанного ритуксимаба, и «светлые квадраты» показывают результаты, полученные при смешивании с Т-клетками, экспрессирующими анти-FITC CAR-IL-7/CCL19, в присутствии немеченого ритуксимаба.
[0107] 815-hCD20 (1×104 клеток / лунку) смешивали с Т-клетками, экспрессирующими анти- CD20 CAR человека, или с Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека, при отношении эффектор/мишень (Е/Т) 0,3125, 0,625, 2,5, 5, 10 или 20. Таким же образом, как описано выше, измеряли высвобождение51Cr из супернатанта и вычисляли процент цитотоксической активности. Результаты показаны на фиг. 32. На фиг. 32 «темные кружки» изображают результаты, полученные при смешивании с Т-клетками, экспрессирующими анти- CD20 CAR-IL-7/CCL19 человека, а «светлые кружки» изображают результаты, полученные при смешивании с Т-клетками, экспрессирующими анти- CD20 CAR человека.
[0108] Результаты
Как показано на фиг. 31 и 32, было продемонстрировано, что Т-клетки, экспрессирующие анти-FITC CAR-IL-7/CCL19, поддерживают цитотоксическую активность (в расчете на клетку) против опухолевых клеток на том же уровне, что и Т-клетки, экспрессирующие анти-FITC CAR. Показано также, что Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, сохраняют цитотоксическую активность (в расчете на клетку) в отношении опухолевых клеток на том же уровне, что и Т-клетки, экспрессирующие анти- CD20 CAR человека.
Пример 13
[0109] Выживаемость CAR-экспрессирующих Т-клеток in vivo и дифференциация в Т-клетках памяти Анализ проточной цитометрии
5×105 клеток P815-hCD20 были введены для заражения подкожно каждой мыши DBA/2. На 10-й день после заражения вводили внутрибрюшинно противораковый препарат циклофосфамид (CPA, 100 мг/кг) и на 14-й день в количестве 1×106 вводили внутривенно Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19, или Т-клетки, экспрессирующие анти- CD20 CAR человека. На 21-й день после введения Т-клеток, экспрессирующих CAR, лейкоциты были выделены из селезенки или региональных лимфатических узлов опухоли (подчелюстной области, плеча и паха). Результаты анализа CD4, CD8, CD44 и CD62L для поверхностных фенотипов лейкоцитов способом проточной цитометрии показаны на фиг. 33. Лейкоциты селезенки стимулировали культивированием в течение 4 дней с P815-hCD20, обработанным митомицином С. Результаты исследования пролиферации Т-клеток способом проточной цитометрии показаны на фиг. 34. Экспрессия CAR была подтверждена с использованием биотинилированного белка L и АРС-связанного стрептавидина. На фигуре 33 цифры представляют собой соотношения соответствующих областей, регулируемых на CD4+ Т-клетках и CD8+ Т-клетках (CD62L+CD44-: необработанные Т-клетки, CD62L+CD44+: центральные Т-клетки памяти, CD62L-CD44+: эффекторные Т-клетки памяти). На фигуре 34 цифры представляют собой отношение L-положительных Т-клеток белка. На фигурах 33 и 34 «Контроль» показывает результаты для Т-клеток, экспрессирующих анти- CD20 CAR человека, и «7×19» показывает результаты для Т-клеток, экспрессирующих анти- CD20 CAR-IL-7/CCL19 человека.
[0110] Результаты
Результаты, показанные на фиг. 33 и 34, продемонстрировали, что Т-клетки памяти увеличены в селезенке и лимфатических узлах мышей, которым вводили Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, и Т-клетки, экспрессирующие анти- CD20 CAR-IL-7/CCL19 человека, которые выжили у мышей, и интенсивно размножаются путем кокультуры с опухолевыми клетками, экспрессирующими человеческий CD20. Вместе с результатами уровня выживаемости на фигурах 21 и 22, эти результаты показывают, что CAR-экспрессирующие Т-клетки настоящего изобретения эффективно выживают in vivo у реципиента, а также обладают способностью гасить раковые клетки и повышать уровень выживаемости, становясь Т-клетками памяти, а также показывают, что CAR-экспрессирующие Т-клетки настоящего изобретения также эффективны для предотвращения рецидива рака.
Промышленная применимость
[0111] Использование вектора экспрессии CAR настоящего изобретения позволяет получать CAR-T-клетки, имеющие как жизнеспособность, так и способность накапливать лимфоциты, и CAR-T-клетки, имеющие устойчивость к иммуносупрессии в раковом микроокружении. Таким образом, вектор экспрессии CAR настоящего изобретения применим в области иммунотерапии рака.
Реферат
Изобретение относится к биотехнологии. Описан вектор экспрессии CAR, содержащий нуклеиновую кислоту, кодирующую химерный антигенный рецептор (CAR), и нуклеиновую кислоту, кодирующую иммуномодулирующий фактор Т-клетки, при этом нуклеиновая кислота, кодирующая иммуномодулирующий фактор Т-клетки, представляет собой нуклеиновую кислоту, кодирующую интерлейкин-7, и нуклеиновую кислоту, кодирующую CCL19. Также описана CAR-экспрессирующая Т-клетка, полученная путем переноса следующего указанного вектора или вектора экспрессии CAR, содержащего нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую интерлейкин-7, а также вектора экспрессии CAR, содержащего нуклеиновую кислоту, кодирующую CAR, и нуклеиновую кислоту, кодирующую CCL19. Изобретение обладает выраженным усиливающим иммунитет эффектом и противораковой активностью. 6 н. и 5 з.п. ф-лы, 34 ил., 13 пр.

Комментарии