Новая субпопуляция cd8+cd45rclow клеток treg и ее применения - RU2766691C2
Код документа: RU2766691C2
Чертежи








Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области клеточной терапии с выявлением субпопуляции CD8+CD45RClow клеток Treg человека с высокой супрессорной активностью.
УРОВЕНЬ ТЕХНИКИ
Иммуносупрессорные протоколы остаются значительным препятствием для длительной выживаемости трансплантата и благополучия прошедших трансплантацию пациентов, и за последние годы улучшение выживаемости аллотрансплантата затормозилось, главным образом, вследствие вторичных эффектов и неспецифического подавления иммунитета (Feng 2008). Выявление у человека регуляторных популяций с лучшей супрессорной активностью и специфичностью к антигенам донора представляет большой интерес при трансплантации человеку и при множестве заболеваний с нарушенной регуляцией регуляторных Т-клеток (Treg)/ эффекторных Т-клеток (Teff).
Действительно, регуляторные Т-клетки, или "Treg", которые включают клетки Foxp3+ Treg и CD45RClow Treg, являются основными клетками, контролирующими различные иммунные ответы, поскольку клетки Treg могут быстро подавлять активность других иммунных клеток. В частности, клетки Treg крайне необходимы для поддержания иммунологической толерантности путем понижающей регуляции нежелательных иммунных ответов на ауто- и неаутоантигены. Например, недостаточность Treg была обнаружена у пациентов с множественным склерозом (МС), диабетом I типа (СДI), псориазом, тяжелой миастенией (ТМ) и другими аутоиммунными заболеваниями. Сходные связи также могут существовать для атопии и аллергических заболеваний. Для всех данных заболеваний существуют свидетельства, указывающие на пониженную иммуносупрессию in vitro клеток Treg пациента. Это привело к возрастающему интересу к возможности применения клеток Treg в иммунотерапии для лечения или предотвращения аутоиммунных заболеваний, аллергий, иммунных ответов против терапевтического белка (т.е. фактора VIII) и связанных с трансплантацией осложнений.
Следовательно, существует особая потребность в получении субпопуляций клеток Treg с высоко супрессорными свойствами, которые практически не содержат CD4+ и CD8+ эффекторных Т-клеток, для получения выделенной популяции клеток Treg. Действительно, выделенные клетки Treg с высокой супрессорной активностью затем могут быть размножены и стимулированы интересующими антигенами или генетически модифицированы (например, для экспрессии данного химерного рецептора антитела, также обозначаемого CAR, или для экспрессии химерного Т-клеточного рецептора (TCR) или другого типа химерных рецепторов антигенов), чтобы эффективно вызвать антиген-специфическую иммунологическую толерантность. Такие размноженные популяции клеток Treg представляют особый интерес в областях хронического воспаления, аутоиммунитета, аллергии, трансплантации, лечения терапевтическим белком и генотерапии, для предотвращения разрушения собственных или терапевтических молекул/тканей иммунной системой.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте настоящего изобретения предложена выделенная популяция CD8+CD45RClow регуляторных Т-клеток (Treg) человека, секретирующих IFNγ+IL-10+IL-34+.
Во втором аспекте настоящего изобретения предложен способ детектирования и/или выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, включающий следующие этапы: (а) осуществление контакта указанной популяции клеток МКПК или лимфоцитов человека со средствами, подходящими для выделения популяции CD8+CD45RClow клеток Treg человека; (b) осуществление контакта указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
В третьем аспекте настоящего изобретения предложен способ размножения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, включающий этап осуществления контакта выделенной популяции CD8+CD45RClowклеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, с культуральной средой, подходящей для размножения клеток Treg. В настоящем изобретении также предложен способ получения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, включающий (i) выделение CD8+CD45RClow клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, необязательно выделение CD8+CD45RClowGITR+клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, (ii) необязательно замораживание и последующее размораживание выделенных клеток Treg и (iii) размножение указанных клеток в культуре.
В четвертом аспекте настоящего изобретения предложена выделенная популяция размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
В пятом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая выделенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+ (размноженных или нет), согласно настоящему изобретению.
В шестом аспекте настоящего изобретения предложена выделенная популяция CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+ человека (размноженных или нет), согласно настоящему изобретению для применения в качестве лекарственного средства.
В седьмом аспекте настоящего изобретения предложена выделенная популяция CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+ человека (размноженных или нет), согласно настоящему изобретению для применения в способе предотвращения или лечения отторжения трансплантата, РТПХ (реакции «трансплантат против хозяина»), хронических воспалительных заболеваний, аутоиммунных заболеваний, нежелательного иммунного ответа против терапевтических белков или аллергий у нуждающегося в этом пациента.
В последнем аспекте настоящего изобретения предложен способ in vitro определения того, есть ли у пациента риск отторжения трансплантата, РТПХ, хронических воспалительных заболеваний, аутоиммунных заболеваний, нежелательного иммунного ответа против терапевтических белков или аллергии, включающий этап определения присутствия CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в биологическом образце, полученном из указанного пациента, с помощью способа согласно настоящему изобретению, в котором присутствие CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, указывает на пониженный риск отторжения трансплантата, РТПХ, хронических воспалительных заболеваний, аутоиммунных заболеваний, нежелательного иммунного ответа против терапевтических белков или аллергий.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
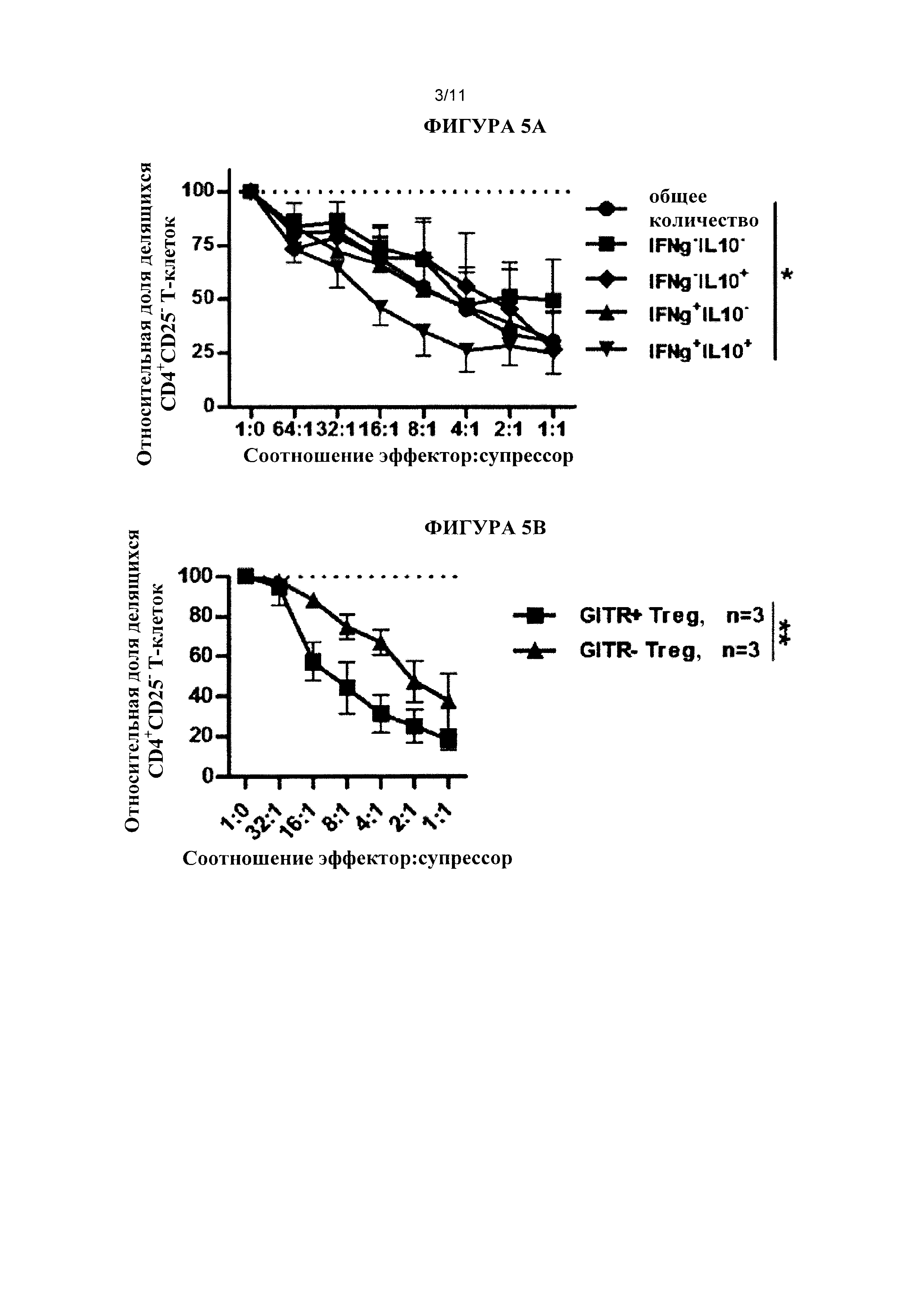
Настоящее изобретение является результатом выявления субпопуляций CD8+ клеток Treg с высокой супрессорной активностью. В частности, авторы настоящего изобретения обнаружили субпопуляцию CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, с высокой супрессорной активностью. Авторы настоящего изобретения продемонстрировали лучший потенциал данных клеток по сравнению с классическими CD4+CD25highCD127low клетками Treg в отношении ответа против донора CD4+CD25- эффекторных Т-клеток и роль IFNγ, IL-10 и IL-34 в их супрессорной активности. Кроме того, авторы настоящего изобретения описали специфическое размножение CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, и их потенциал в качестве клеточной терапии при трансплантации для ингибирования отторжения трансплантата кожи человека и РТПХ, используя гуманизированных мышей.
Популяция клеток Treg согласно настоящему изобретению
В первом аспекте настоящего изобретения предложены выделенные популяции CD8+ клеток Treg и, в особенности, выделенная популяция CD8+CD45RClow регуляторных Т-клеток (Treg) человека, секретирующих IFNγ+IL-10+IL-34+. В настоящем изобретении также предложена выделенная популяция CD8+CD45RClow регуляторных Т-клеток (Treg) человека, секретирующих IFNγ+IL-10+IL-34+, в которой указанные клетки Treg являются GITR+ и/или Foxp3+.
В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+CD45RClow клеток Treg. В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+GITR+ клеток Treg. В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+Foxp3+ клеток Treg. В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+CD45RClowGITR+ клеток Treg. В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+CD45RClowFoxp3+ клеток Treg. В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+GITR+Foxp3+ клеток Treg. В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+CD45RClowGITR+Foxp3+ клеток Treg.
В одном варианте реализации выделенные популяции CD8+ клеток Treg согласно настоящему изобретению секретируют по меньшей мере один цитокин из IFNγ, IL-10 и IL-34. Таким образом, в одном варианте реализации выделенные популяции CD8+ клеток Treg согласно настоящему изобретению секретируют IFNγ, или IL-10, или IL-34.
В другом варианте реализации выделенные популяции CD8+ клеток Treg согласно настоящему изобретению секретируют по меньшей мере два цитокина из IFNγ, IL-10 и IL-34. Таким образом, в одном варианте реализации выделенные популяции CD8+ клеток Treg согласно настоящему изобретению секретируют IFNγ и IL-10, или IFNγ и IL-34, или IL-10 и IL-34.
В еще одном варианте реализации выделенные популяции CD8+ клеток Treg согласно настоящему изобретению секретируют IFNγ, IL-10 и IL-34.
В одном варианте реализации выделенные популяции CD8+ клеток Treg, описанные выше в данной заявке, дополнительно секретируют IL-2 и/или TGFβ-1.
В частности, среди CD8+CD45RClow регуляторных Т-клеток человека авторы настоящего изобретения обнаружили субпопуляцию CD8+CD45RClow регуляторных Т-клеток, секретирующих IFNγ, и IL-10 и IL-34. Таким образом, в одном варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10 и IL-34.
В одном варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10 и IL-34 и экспрессируют GITR. В одном варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10 и IL-34 и экспрессируют Foxp3. В одном варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10, IL-34 и TGFβ-1.
В другом варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10 и IL-34 и экспрессируют Foxp3 и GITR. В одном варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10, IL-34 и TGFβ-1 и экспрессируют Foxp3. В другом варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10, IL-34 и TGFβ-1 и экспрессируют GITR.
В еще одном варианте реализации CD8+CD45RClow клетки Treg человека согласно настоящему изобретению секретируют IFNγ, IL-10, IL-34 и TGFβ-1 и экспрессируют Foxp3 и GITR.
В одном варианте реализации CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, описанные выше в данной заявке, секретируют IL-2.
В одном варианте реализации настоящего изобретения выделенную популяцию CD8+ клеток Treg, описанных выше в данной заявке, можно заморозить для хранения. В некотором варианте реализации настоящего изобретения выделенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанную выше в данной заявке, можно заморозить для хранения. В одном варианте реализации выделенную популяцию CD8+ клеток Treg человека, описанную выше в данной заявке, замораживают и размораживают. В некотором варианте реализации выделенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанную выше в данной заявке, замораживают и размораживают.
В данной заявке термин "регуляторные Т-клетки" или "клетки Treg", ранее известные как супрессорные Т-клетки, относится к субпопуляции Т-клеток, которая модулирует иммунную систему, поддерживает иммунологическую толерантность к аутоантигенам и подавляет аутоиммунные заболевания. Данные клетки, как правило, подавляют или понижающе регулируют индукцию и пролиферацию эффекторных Т-клеток.
В данной заявке термин "популяция" относится к популяции клеток, в которой большая часть (например, по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 60%, более предпочтительно по меньшей мере приблизительно 70%, и еще более предпочтительно по меньшей мере приблизительно 80%) общего количества клеток обладают определенными свойствами интересующих клеток и экспрессируют интересующие маркеры (например, популяция CD8+CD45RClow клеток Treg человека содержит по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 60%, более предпочтительно по меньшей мере приблизительно 70%, и еще более предпочтительно по меньшей мере приблизительно 80% клеток, которые проявляют высоко супрессорные функции и которые экспрессируют конкретные интересующие маркеры, такие как IFNγ, IL-10, IL-34, Foxp3, GITR или TGFβ-1+). В данной заявке термин "приблизительно", предшествующий цифре, означает плюс или минус 10% от значения указанной цифры.
В данной заявке "выделенный" относится к клетке или популяции клеток, которую удалили из естественного окружения (такого как периферическая кровь) и которую выделили, очистили или отделили, и которая по меньшей мере приблизительно на 75% не содержит, на 80% не содержит, на 85% не содержит и предпочтительно приблизительно на 90%, 95%, 96%, 97%, 98%, 99% не содержит других клеток, вместе с которыми она находится в природе, но у которых отсутствуют маркеры клеточной поверхности, на основе которых указанные клетки были выделены.
В данной заявке термин "маркер" относится к белку, гликопротеину или любой другой молекуле, экспрессированной на поверхности клетки, или в клетке, или секретируемой клеткой, которую можно применять, чтобы помочь определить клетку. Маркер в большинстве случаев можно обнаружить с помощью обычных способов. Конкретные лишь некоторые из примеров способов, которые можно применять для детектирования маркера клеточной поверхности, представляют собой иммуноцитохимию, сортировку клеток с возбуждением флуоресценции (FACS) и ферментативный анализ, но также ОТ-ПЦР и методы молекулярной биологии для детектирования мРНК белка.
В данной заявке термин "CD8" (кластер дифференцировки 8), хорошо известный в данной области, относится к трансмембранному гликопротеину, который служит корецептором для Т-клеточного рецептора (TCR). Для функционирования CD8 образует димер, состоящий из пары цепей CD8. Наиболее распространенная форма CD8 состоит из цепей CD8-α и CD8-β. Последовательность аминокислот встречающегося в природе белка CD8-α человека представлена в базе данных UniProt под номером доступа Р01732. Последовательность аминокислот встречающегося в природе белка CD8-β человека представлена в базе данных UniProt под номером доступа Р10966.
В данной заявке термин "CD45" (также известный как LCA или PTPRC) относится к трансмембранному гликопротеину, существующему в различных изоформах, ранее описанному в Streuli и др., 1996. Данные различные изоформы CD45 отличаются по структурам внеклеточного домена, которые возникают в результате альтернативного сплайсинга 3 вариабельных экзонов, кодирующих часть внеклеточной области CD45. Указанные различные изоформы CD45 содержат различные внеклеточные домены, но содержат одинаковые трансмембранные и цитоплазматические фрагменты, содержащие два гомологичных высоко консервативных фосфатазных домена приблизительно из 300 аминокислотных остатков. Последовательность аминокислот встречающегося в природе белка CD45 человека представлена в базе данных UniProt под номером доступа Р08575. В данной заявке термин "CD45RC" относится к варианту сплайсинга экзона 6 (экзону С) тирозинфосфатазы CD45. Изоформа CD45RC экспрессируется на В-клетках и на субпопуляциях CD4+ и CD8+ Т-клеток.
В данной заявке термины "интерферон гамма", или "IFNγ", или "IFNg", или "интерферон II типа" хорошо известны в данной области и относятся к цитокину, который крайне необходим для врожденного и приобретенного иммунитета. Последовательность аминокислот встречающегося в природе белка IFNγ человека состоит из 146 аминокислот, представленных в базе данных UniProt под номером доступа Р01579.
Согласно настоящему изобретению секретирующие IFNγ CD8+ клетки Treg согласно настоящему изобретению секретируют по меньшей мере приблизительно 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 11000, 12000, 13000, 14000, 15000, 16000,17000, 18000, 19000 или 20000 пг/мл IFNγ.
В данной заявке термины "интерлейкин-10" или "IL-10" хорошо известны в данной области и относятся к противовоспалительному цитокину. Последовательность аминокислот встречающегося в природе белка IL-10 человека состоит из 178 аминокислот, представленных в базе данных под номером доступа Р22301.
Согласно настоящему изобретению секретирующие IL-10 CD8+ клетки Treg согласно настоящему изобретению секретируют по меньшей мере приблизительно 0,1, 0,5, 1, 10, 25, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900 или 2000 пг/мл IL-10.
В данной заявке термины "интерлейкин-34" или "IL-34" хорошо известны в данной области и относятся к цитокину, который вызывает пролиферацию, выживаемость и дифференцировку моноцитов и макрофагов. Последовательность аминокислот встречающегося в природе белка IL-34 человека состоит из 242 аминокислот, представленных в базе данных под номером доступа Q6ZMJ4.
Согласно настоящему изобретению секретирующие IL-34 CD8+ клетки Treg согласно настоящему изобретению секретируют по меньшей мере приблизительно 0,1, 0,5, 1, 10, 25, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900 или 2000 пг/мл IL-34.
В данной заявке термины "белок семейства TNFR, индуцированный глюкокортикоидами", или "GITR", или "представитель 18 надсемейства рецепторов фактора некроза опухоли", или "TNFRSF18" хорошо известны в данной области и относятся к молекуле рецептора на поверхности клетки из надсемейства рецепторов TNF. Последовательность аминокислот встречающегося в природе белка GITR человека состоит из 241 аминокислот, представленных в базе данных под номером доступа Q9Y5U5.
В данной заявке термины "белок Р3 семейства Forkhead" или "Foxp3" хорошо известны в данной области и относятся к ядерному белку, который считают действующим как фактор транскрипции, маркер регуляторных Т-клеток. Последовательность аминокислот встречающегося в природе белка Foxp3 человека состоит из 431 аминокислот, представленных в базе данных под номером доступа Q9BZS1.
В данной заявке термины "трансформирующий фактор роста бета 1", или "TGFβ-1", или "TGFb1" хорошо известны в данной области и относятся к цитокину, который играет важную роль в контролировании иммунной системы. Последовательность аминокислот встречающегося в природе белка TGFβ-1 человека состоит из 390 аминокислот, представленных в базе данных под номером доступа Р01137.
Согласно настоящему изобретению секретирующие TGFβ-1 CD8+ клетки Treg согласно настоящему изобретению секретируют по меньшей мере приблизительно 0,1, 0,5, 1, 10, 25, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900 или 2000 пг/мл TGFβ-1.
В данной заявке термины "интерлейкин-2" или "IL-2" хорошо известны в данной области и относятся к цитокину, который играет крайне важную роль в регуляции как активации иммунной системы, так и гомеостаза. Последовательность аминокислот встречающегося в природе белка IL-2 человека состоит из 153 аминокислот, представленных в базе данных под номером доступа Р60568.
Согласно настоящему изобретению секретирующие IL-2 CD8+ клетки Treg, описанные выше в данной заявке, секретируют по меньшей мере приблизительно 0,1, 0,5, 1, 10, 25, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, или 2000 пг/мл IL-2.
Согласно настоящему изобретению секрецию цитокинов обычно оценивают в культурах клеток после активации по меньшей мере одним стимулирующим агентом. Примеры стимулирующих агентов включают, но не ограничены перечисленными: антигены, клетки, полимеры ГКГС, антитела и лектины. В одном варианте реализации указанный по меньшей мере один стимулирующий агент выбирают из группы, включающей аллогенные антигенпредставляющие клетки, антитела к CD3 и/или антитела к CD8, IL-2, РМА+ иономицин.
В одном варианте реализации секрецию цитокинов обычно оценивают после 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 дней культивирования, предпочтительно после 12, 13, 14, 15, 16 или 17 дней культивирования и более предпочтительно после 14 дней культивирования. В другом варианте реализации секрецию цитокинов обычно оценивают в культуре, которую начали приблизительно с 2×105, 3×105 или 4×105 клеток/мл, предпочтительно приблизительно с 2,5×105, 3×105 или 3,5×105 клеток/мл, более предпочтительно приблизительно с 3×105 клеток/мл. В одном варианте реализации секрецию цитокинов оценивают после 14 дней культивирования в культуре, которую начали с приблизительно 3,5×105 клеток/мл.
В одном варианте реализации настоящего изобретения CD8+ клетки Treg человека согласно настоящему изобретению и, в особенности, CD8+CD45RClow регуляторные Т-клетки (Treg) человека, секретирующие IFNγ+IL-10+IL-34+, описанные выше в данной заявке, можно генетически модифицировать, чтобы они кодировали желательные продукты экспрессии, что будет дополнительно описано ниже.
Термин "генетически модифицированный" указывает на то, что клетки содержат молекулу нуклеиновой кислоты, не присутствующую в природе в немодифицированных CD8+ клетках Treg человека согласно настоящему изобретению, в частности, в CD8+CD45RClow клетках Treg человека, секретирующих IFNγ+IL-10+IL-34+, или молекулу нуклеиновой кислоты, присутствующую в неестественном состоянии в указанных CD8+ клетках Treg человека согласно настоящему изобретению, в частности, в CD8+CD45RClow клетках Treg человека, секретирующих IFNγ+IL-10+IL-34+ (например, амплифицированную). Указанную молекулу нуклеиновой кислоты можно внедрить в указанные клетки или в их предшественники.
Можно использовать множество подходов, чтобы генетически модифицировать CD8+ клетки Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, таких как опосредованная вирусом доставка генов, не опосредованная вирусом доставка генов, голая ДРЕК, физические обработки и т.д. С этой целью нуклеиновую кислоту обычно включают в состав вектора, такого как рекомбинантный вирус, плазмида, фаг, эписома, искусственная хромосома и т.д. Примеры способов, с помощью которых нуклеиновую кислоту, несущую ген, можно внедрить в клетки, включают, но не ограничены перечисленными: микроинъекцию, электропорацию, трансдукцию или трансфекцию с применением DEAE-декстрана, липофекцию, фосфат кальция или другие процедуры, известные специалисту в данной области.
В некотором варианте реализации настоящего изобретения CD8+ клетки Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, генетически модифицируют, применяя векторную частицу, такую как вирусный вектор (или рекомбинантный вирус) или подобную вирусу частицу (ПВЧ). В данном варианте реализации гетерологичную нуклеиновую кислоту, например, внедряют в рекомбинантный вирус, который затем используют для инфицирования CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. Можно применять различные типы рекомбинантных вирусов, в частности, рекомбинантные ретровирусы. Ретровирусы представляют собой предпочтительные векторы, поскольку ретровирусная инфекция приводит к стабильному встраиванию в геном клеток. Это свойство важно, так как для размножения лимфоцитов, либо in vitro, либо in vivo после инъекции субъекту требуется, чтобы трансген поддерживался на стабильном уровне во время сегрегации для того, чтобы он передавался при каждом делении клетки. Примерами типов ретровирусов, которые можно применять, являются ретровирусы из семейства онковируса, лентивируса или спумавируса. Конкретными примерами семейства онковирусов являются медленный онковирус, неонкогенные носители, такие как вирус лейкоза Молони мыши (ВЛМ), вирус лейкоза птиц (ВЛП), вирус лейкоза крупного рогатого скота (ВЛКРС) или вирус опухоли молочной железы мышей (ВОМЖ), и быстрые онковирусы, такие как респираторно-синцитиальный вирус (РСВ). Примерами из семейств лентивируса являются вирус иммунодефицита человека (ВИЧ), вирус иммунодефицита обезьян (ВИО), вирус иммунодефицита кошек (ВИК) или вирус артрита-энцефалита коз (ВАЭК).
Методики конструирования дефектных рекомбинантных ретровирусов были широко описаны в литературе (WO 89/07150, WO 90/02806 и WO 94/19478). Данные методики обычно включают внедрение ретровирусного вектора, содержащего трансген, в подходящую линию пакующих клеток, а затем выделение полученных вирусов, указанные вирусы содержат трансген в своем геноме. CD8+ клетки Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, можно инфицировать рекомбинантными вирусами, применяя различные протоколы, например, путем инкубации с супернатантом вируса, с очищенными вирусами, путем совместного культивирования указанных клеток Treg с пакующими вирус клетками, с помощью методик Transwell и т.д.
В данной заявке термин "подобная вирусу частица" (ПВЧ) относится к структуре, похожей на вирусную частицу. Подобная вирусу частица в соответствии с настоящим изобретением нерепликативна, поскольку в ней отсутствует весь или часть генома вируса, обычно и предпочтительно отсутствуют все или часть репликативных и инфекционных компонентов генома вируса. Термин "нерепликативная" в данной заявке относится к неспособности реплицировать геном, содержащийся или не содержащийся в ПВЧ. ПВЧ можно получить согласно методикам, известным в данной области, и, например, описанным в международной заявке на патент, опубликованной под номером WO 02/34893.
Указанная нуклеиновая кислота, применяемая для генетического модифицирования CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, может кодировать различные биологически активные продукты, включая полипептиды (например, белки, пептиды и т.д.), молекулы РНК и т.д. В некотором варианте реализации нуклеиновая кислота кодирует полипептид, обладающий иммуносупрессорной активностью. В другом варианте реализации нуклеиновая кислота кодирует полипептид, который токсичен или при определенных условиях токсичен для клеток. Предпочтительные примеры включают тимидинкиназу (которая приводит к токсичности в присутствии аналогов нуклеозида), такую как HSV-1 ТК, цитозиндезаминазу и т.д.
Другой предпочтительной категорией нуклеиновых кислот являются такие нуклеиновые кислоты, которые кодируют Т-клеточный рецептор или его субъединицу или функциональный эквивалент, такой как химерный рецептор антигена (CAR), специфичный к интересующему антигену, или химерный рецептор аутоантител (CAAR), содержащий аутоантиген. Например, экспрессия рекомбинантных TCR или CAR, специфичных к антигену, приводит к продукции CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, которые могут действовать более специфично и эффективно на эффекторные Т-клетки, чтобы ингибировать иммунные ответы у нуждающегося в этом пациента. Основные принципы разработки химерного рецептора антигена (CAR) были широко описаны (например, Sadelain и др., 2013).
Рецепторы CAR содержат внеклеточный антигенраспознающий фрагмент, как правило, связанный посредством спейсера/шарнира и трансмембранного домена с внутриклеточным сигнальным доменом. Внутриклеточный сигнальный домен CAR "первого поколения" содержит лишь активирующий Т-клетки фрагмент. Внутриклеточный домен CAR "второго поколения" содержит костимулирующий фрагмент вместе с активирующим фрагментом, например, CD3ζ. Примеры костимулирующих доменов включают, но не ограничены перечисленными: ICOS, ОХ40 (CD134), CD28, 4-1ВВ (CD137), CD27 и DAP10. Внутриклеточный домен CAR "третьего поколения" содержит два костимулирующих домена вместе с активирующим фрагментом, например, комбинацию CD28, рецептора фактора некроза опухоли (TNFr), например, ОХ40 или 4-1ВВ, и CD3ζ.
Рецепторы CAR, как правило, получают путем слияния внеклеточного антиген-связывающего домена с внутриклеточными сигнальными доменами, полученными из CD3-ζ, цепи Т-клеточного рецептора, вместе с костимулирующими эндодоменами для поддержания сигналов выживаемости и пролиферации. Так как модифицированные CAR Т-клетки функционируют независимо от ГКГС пациента, и их можно легко получить для клинического применения, то нацеливание на патогенные антигены, описанное ниже, с помощью подхода на основе CAR оказывается эффективным.
Рецепторы CAAR содержат внеклеточный аутоантиген, такой как аутоантиген, вовлеченный в аутоиммунное заболевание, слитый с внутриклеточными сигнальными доменами. Примеры внутриклеточных сигнальных доменов CAAR включают, без ограничения перечисленными, сигнальные домены Т- или NK-рецептора, такие как сигнальный домен CD137CD3ζ.
В одном варианте реализации CD8+ клетки Treg согласно настоящему изобретению генетически модифицированы и экспрессируют по меньшей мере один CAR, один CAAR и/или один нативный рецептор, связанный с внутриклеточными сигнальными молекулами. Примеры CAR включают, без ограничения перечисленными, CAR первого поколения, CAR второго поколения, CAR третьего поколения, CAR, содержащие более трех сигнальных доменов (костимулирующие домены и активирующий домен), и ингибиторные CAR (iCAR).
Таким образом, в одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, выделенная популяция CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в которой указанные клетки Treg являются генетически модифицированными клетками Treg, содержащими химерный рецептор антигена.
Согласно настоящему изобретению внеклеточный домен CAR, распознающий интересующий антиген, может включать рецептор или фрагмент рецептора, который связывается с указанным антигеном, таким как антитело или его антигенсвязывающий фрагмент. Согласно настоящему изобретению внеклеточный домен CAR может включать антитело человека или антитело, происходящее из любого другого вида.
В данной заявке термин "фрагмент антитела" относится к по меньшей мере одной части антитела, которая сохраняет способность специфично взаимодействовать с эпитопом антигена. Примеры фрагментов антител включают, без ограничения перечисленными: фрагменты Fab, Fab', F(ab')2, Fv, фрагменты антител scFv, связанные дисульфидными связями Fv (sdFv), фрагмент Fd, состоящий из доменов VH и CHI, линейные антитела, однодоменные антитела, такие как sdAb (либо VL, либо VH), домены VHH верблюдовых, мультиспецифические антитела, образованные из фрагментов антител, такие как бивалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области, и выделенную определяющую комплементарность область (CDR) или другой эпитоп, связывающий фрагменты антитела.
В другом варианте реализации CD8+ клетки Treg согласно настоящему изобретению генетически модифицированы, и в них отсутствует экспрессия функционального Т-клеточного рецептора (TCR) и/или антигена лейкоцитов человека (HLA), например, HLA класса I и/или HLA класса II. В одном варианте реализации указанные генетически модифицированные CD8+ клетки Treg согласно настоящему изобретению, в которых нет функционального TCR и/или HLA, представляют собой аллогенные клетки Treg.
Способы захвата клеток Treg согласно настоящему изобретению
Субпопуляцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, субпопуляцию CD8+CD45RClow клеток Treg, описанных выше в данной заявке, можно в рабочем порядке описать по маркерам клеточной поверхности и их способности продуцировать IFNγ, IL-10 и IL-34.
Во втором аспекте настоящего изобретения, следовательно, предложен способ детектирования и/или выделения субпопуляции CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+EL-10+IL-34+, описанных выше в данной заявке, из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, включающий следующие этапы: (а) осуществление контакта указанной популяции клеток МКПК или лимфоцитов человека со средствами, подходящими для выделения популяции CD8+CD45RClow клеток Treg человека; (b) осуществление контакта указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
В настоящем изобретении также предложен способ детектирования и/или выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, в котором указанные клетки Treg необязательно представляют собой клетки GITR+ и/или Foxp3+, включающий следующие этапы: (а) приведение указанной популяции клеток МКПК или лимфоцитов человека в контакт со средствами, подходящими для выделения популяции CD8+CD45RClow клеток Treg человека, необязательно со средствами, подходящими для выделения популяции GITR+ и/или Foxp3+ CD8+CD45RClow клеток Treg; (b) приведение указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), в контакт со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
В одном варианте реализации этап (b) способа согласно настоящему изобретению включает приведение указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), в контакт со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, которые также экспрессируют по меньшей мере один из GITR, Foxp3 и TGFβ-1.
В другом варианте реализации этап (b) способа согласно настоящему изобретению включает приведение указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), в контакт со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, которые также экспрессируют Foxp3 и GITR, или Foxp3 и TGFβ-1, или GITR и TGFβ-1.
В еще одном варианте реализации этап (b) способа согласно настоящему изобретению включает приведение указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), в контакт со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, которые также экспрессируют GITR, и Foxp3 и TGFβ-1.
Согласно одному варианту реализации выделение популяции CD8+CD45RClow клеток Treg человека на этапе (а) способа согласно настоящему изобретению не требует активации CD8+ клеток Treg согласно настоящему изобретению. Согласно одному варианту реализации выделение CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению на этапе (b) способа согласно настоящему изобретению осуществляют после стимуляции выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), по меньшей мере одним стимулирующим агентом. Примеры стимулирующих агентов описаны выше в данной заявке.
В данной заявке термин "биологический образец" относится к любой биологической жидкости или ткани, которая содержит мононуклеарные клетки периферической крови "МКПК" или лимфоциты. В рамках контекста настоящего изобретения "жидкость, содержащая МКПК или лимфоциты" включает кровь (образец цельной крови, образец сыворотки или образец плазмы) и синовиальную жидкость. "Содержащая лимфоциты ткань" включает селезенку, тимус, лимфатические узлы, костный мозг, пейеровы бляшки и миндалины.
В одном варианте реализации способ согласно настоящему изобретению предназначен для получения и/или выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, из культуры индуцированных плюрипотентных стволовых клеток (иПСК) или полученных из иПСК CD34+ клеток. В рамках контекста настоящего изобретения культуру иПСК или полученных из иПСК CD34+ клеток можно получить, например, из биологического образца, содержащего мононуклеарные клетки периферической крови человека (МКПК).
На этапах (а) и (b) выделение популяции интересующих клеток человека можно осуществить с помощью различных способов детектирования определенной популяции иммунных клеток, доступных для квалифицированного специалиста, включая методики иммуноселекции, такие как высокопроизводительная сортировка клеток с применением способов проточной цитометрии, аффинные способы с антителами, мечеными магнитными гранулами, биоразлагаемыми гранулами, небиоразлагаемыми гранулами, и комбинации таких способов.
В данной заявке термин "способы проточной цитометрии" относится к методике подсчета интересующих клеток путем их суспендирования в потоке жидкости и пропускания через электронное детектирующее устройство. Способы проточной цитометрии позволяют одновременный многопараметрический анализ физических и/или химических параметров вплоть до тысячи частиц в секунду, таких как флуоресцентные параметры. В современных устройствах для проточной цитометрии обычно присутствует множество лазеров и детекторов флуоресценции. Широко распространенным вариантом методик проточной цитометрии является физическая сортировка частиц на основании их свойств, чтобы очистить или обнаружить интересующие популяции, применяя "сортировку клеток с возбуждением флуоресценции".
В данной заявке "сортировка клеток с возбуждением флуоресценции" (FACS) относится к способу проточной цитометрии для сортировки гетерогенной смеси клеток из биологического образца в два или более контейнеров, одну клетку в один момент времени, на основании определенных свойства рассеяния света и флуоресценции каждой клетки. FACS позволяет быструю, объективную и количественную регистрацию флуоресцентных сигналов отдельных клеток, а также физическое отделение представляющих особый интерес клеток. Соответственно, FACS можно применять в комбинации со способами, описанными в данной заявке, чтобы выделить, например, CD8+ клетки Treg человека.
В качестве альтернативы выделение CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg согласно настоящему изобретению можно осуществить, применяя способы сортировки с использованием гранул, таких как магнитные гранулы.
Применяя такие способы, клетки можно отделить и изолировать на основании присутствия или отсутствия на их поверхности конкретных маркеров. В данной заявке установлено, что "положительная селекция" относится к методикам, которые приводят к выделению и детектированию клеток, экспрессирующих определенные маркеры на своей поверхности, тогда как "отрицательная селекция" относится к методикам, которые приводят к выделению и детектированию клеток, не экспрессирующих определенные маркеры на своей поверхности. В некоторых вариантах реализации квалифицированный специалист может покрыть гранулы антителами, применяя стандартные методики, известные в данной области, такие как доступные для приобретения наборы для конъюгирования гранул. В некоторых вариантах реализации проводят этап отрицательной селекции для удаления клеток, экспрессирующих один или более маркеров линии дифференцировки, с последующей сортировкой клеток с возбуждением флуоресценции, чтобы осуществить положительную селекцию интересующих клеток Treg человека (т.е. CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке).
Таким образом, в одном варианте реализации способ согласно настоящему изобретению включает: (а) приведение популяции клеток МКПК или лимфоцитов человека в контакт со средствами, подходящими для обеднения не относящимися к CD8+CD45RClow клетками Treg; (b) приведение указанной выделенной популяции CD8+CD45RClow клеток Treg человека, полученной на этапе (а), в контакт со средствами, подходящими для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
Обычно средства, подходящие для выделения популяции клеток, такой как популяция CD8+CD45RClow клеток Treg человека, представляют собой партнеры по связыванию (такие как антитела) с подходящими молекулами или маркерами на поверхности клетки.
Партнеры по специфическому связыванию включают захватывающие молекулы и метящие молекулы. Захватывающие молекулы представляют собой такие молекулы, которые присоединяются как к клетке, либо напрямую, либо опосредованно, так и к продукту. Метящие молекулы представляют собой такие молекулы, которые присоединяются к продукту и могут быть напрямую или опосредованно помечены. Партнеры по специфическому связыванию включают любую молекулу, для которой наблюдается относительно высокая аффинность и специфичность между продуктом и его партнером по связыванию и для которой диссоциация комплекса продукт : партнер относительно медленная, чтобы комплекс продукт : партнер можно было обнаружить в процессе мечения или методики разделения клеток.
Захватывающую молекулу можно соединить со средствами заякоривания ("молекулой якоря"), необязательно через связывающую молекулу, и они также могут содержать связывающую молекулу, которая увеличивает количество доступных захватывающих молекул и, следовательно, потенциал для захвата продукта, такую как разветвленные полимеры, включая, например, модифицированные молекулы декстрана, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт и поливинилпирролидон.
Метящие молекулы, которые можно конъюгировать с захватывающей молекулой, такой как антитело, хорошо известны специалисту в данной области. Например, радиоактивные изотопы, например,32Р,3SS или3Н; флуоресцентные или люминесцентные маркеры, например, флуоресцеин (FITC), родамин, техасский красный, фикоэритрин (РЕ), аллофикоцианин, комплекс перидинин-хлорофилл протеина (PerCP), 6-карбоксифлуоресцеин (6-FAM), 2', 7'-диметокси-4', 5'-дихлор-6-карбоксифлуоресцеин (JOE), 6-карбокси-Х-родамин(6-ROX), 6-карбокси-2',4',7',4,7-гексахлорфлуоресцеин (HEX), 5-карбоксифлуоресцеин (5-FAM) или N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA); антитела или фрагменты антител, например, фрагмент F(ab)2; аффинные метки, например, биотин, авидин, агароза, костный морфогенетический белок (BMP), связанный с матриксом, гаптены; и ферменты или субстраты ферментов, например, щелочная фосфатаза (АР) и пероксидаза хрена (HRP).
Подходящие молекулы на клетках включают, но не ограничены перечисленными: маркеры клеточной поверхности CD8+CD45RClow клеток Treg человека, такие как CD3 (Т-клетки (активация)), CD8 и CD45RC, а также другие маркеры CD или молекулы адгезии клетки, характерные для данных CD8+ Т-клеток.
В одном варианте реализации настоящего изобретения на этапе (а) средства, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, представляют собой антитела, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека.
В одном варианте реализации настоящего изобретения на этапе (а) средства, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, представляют собой комбинацию по меньшей мере трех антител, состоящую из моноклонального антитела к CD3 человека, моноклонального антитела к CD8 человека и моноклонального антитела к CD45RC человека, необязательно дополнительно включающую антитело к GITR человека (предпочтительно моноклональное антитело к GITR человека).
В одном варианте реализации настоящего изобретения на этапе (а) средства, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, представляют собой комбинацию по меньшей мере трех антител, состоящую из моноклонального антитела к CD3 человека, моноклонального антитела к CD8 человека и моноклонального антитела к CD45RC человека, необязательно дополнительно включающую антитело к GITR человека (предпочтительно моноклональное антитело к GITR человека) и/или антитело к Foxp3 человека (предпочтительно моноклональное антитело к Foxp3 человека).
В данной заявке термин "антитело" относится к молекулам иммуноглобулинов и к иммунологически активным частям молекул иммуноглобулинов, т.е., к молекулам, которые содержат участок связывания антигена, который иммуноспецифически связывает антиген. "Антитело против X " или "антитело к X" согласно настоящему изобретению представляет собой антитело, которое может специфично связываться с X.
В некотором варианте реализации настоящего изобретения антитела, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, представляют собой антитело к CD3 человека, антитело к CD8 человека и антитело к CD45RC человека, предпочтительно моноклональное антитело к CD3 человека, моноклональное антитело к CD8 человека и моноклональное антитело к CD45RC человека. Примеры антител, которые связываются с антигеном CD3 человека, которые предложены в настоящем изобретении, включают моноклональные антитела OKT3, UCHT1, HIT3a, S4.1 и SK7. Примеры антител, которые связывают антиген CD8 человека, которые предложены в настоящем изобретении, включают моноклональные антитела С8/144 В, SK1, 3В5, OKT8, BW135/80 и RPA-T8. Примеры антител, которые связываются с антигеном CD45RC человека, которые предложены в настоящем изобретении, включают моноклональные антитела МТ2 и RP1/12.
В одном варианте реализации настоящего изобретения на этапе (b) средства, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, представляют собой антитела, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
В частности, антитела, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, представляют собой биспецифические антитела, которые связываются с одним из цитокинов, секретируемых CD8+CD45RClow клетками Treg человека согласно настоящему изобретению (т.е. IFNγ, IL-10 и IL-34), и с молекулой на поверхности клетки, специфичной для Т-клеток, предпочтительно для CD8+ Т-клеток (например, CD3, CD8, CD45). Примеры биспецифических антител, которые предложены в настоящем изобретении, включают биспецифическое антитело, которое связывается с IFNγ человека и CD45 человека, биспецифическое антитело, которое связывается с EFNγ человека и CD3 человека, биспецифическое антитело, которое связывается с IFNγ человека и CD8 человека, биспецифическое антитело, которое связывается с IL-10 человека и CD45 человека, биспецифическое антитело, которое связывается с IL-10 человека и CD3 человека, биспецифическое антитело, которое связывается с IL-10 человека и CD8 человека, биспецифическое антитело, которое связывается с IL-34 человека и CD45 человека, биспецифическое антитело, которое связывается с EL-34 человека и CD3 человека, биспецифическое антитело, которое связывается с IL-34 человека и CD8 человека. Например, наборы для детектирования, используемые в анализе секреции IFNγ или IL-10, доступны для приобретения (Miltenyi biotec).
В одном варианте реализации для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, этап (b) способа согласно настоящему изобретению включает комбинацию по меньшей мере двух биспецифических антител, выбранных из группы, состоящей из биспецифического антитела, которое связывается с IFNγ и с молекулой на поверхности клетки, специфичной для Т-клеток, предпочтительно для CD8+ Т-клеток (например, CD3, CD8, CD45), биспецифического антитела, которое связывается с IL-10 и с молекулой на поверхности клетки, специфичной для Т-клеток, предпочтительно для CD8+ Т-клеток (например, CD3, CD8, CD45), и биспецифического антитела, которое связывается с IL-34 и с молекулой на поверхности клетки, специфичной для Т-клеток, предпочтительно для CD8+ Т-клеток (например, CD3, CD8, CD45).
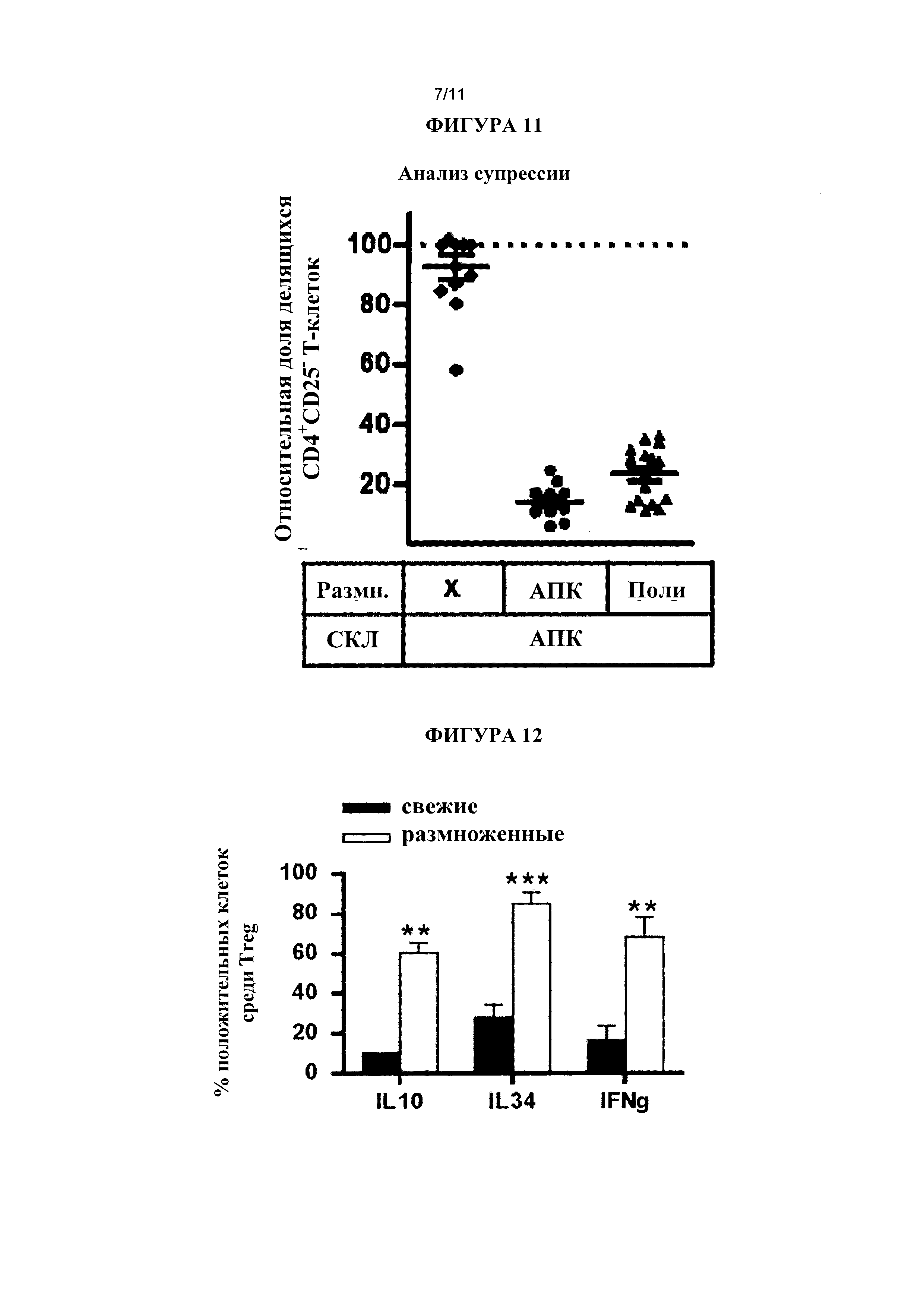
Среди секретирующих IFNγ+CD8+CD45RClow клеток Treg человека лишь 10% или 20% являются IL-10+. Согласно результатам, полученным заявителем, IL-10 и IL-34, как правило, совместно экспрессируются CD8+CD45RClow клетками Treg человека. Следовательно, в одном варианте реализации комбинация биспецифических антител для выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, от CD8+CD45RClow клеток Treg, выделенных на этапе (а), включает по меньшей мере биспецифическое антитело, которое связывается с IFNγ и с молекулой на поверхности клетки, специфичной для Т-клеток, и либо биспецифическое антитело, которое связывается с IL-10 и с молекулой на поверхности клетки, специфичной для Т-клеток, либо биспецифическое антитело, которое связывается с IL-34 и с молекулой на поверхности клетки, специфичной для Т-клеток.
В некотором варианте реализации биспецифическое антитело, которое связывается с IFNγ и с молекулой на поверхности клетки, специфичной для Т-клеток, биспецифическое антитело, которое связывается с IL-10 и с молекулой на поверхности клетки, специфичной для Т-клеток, и биспецифическое антитело, которое связывается с IL-34 и с молекулой на поверхности клетки, специфичной для Т-клеток, используют для того, чтобы выделить интересующую популяцию.
Биспецифические антитела, также известные как бифункциональные антитела, содержат по меньшей мере один участок распознавания первого антигена и по меньшей мере один участок распознавания второго антигена. Такие антитела можно получить с помощью способов рекомбинантной ДНК или с помощью химических способов, известных в данной области. Созданные химическими способами биспецифические антитела включают, но не ограничены перечисленными: антитела, которые были восстановлены и преобразованы таким образом, чтобы они сохранили бивалентные свойства, и антитела, которые были химически соединены таким образом, чтобы они содержали по меньшей мере два участка распознавания каждого антигена. Биспецифические антитела включают все антитела или конъюгаты антител, или полимерные формы антител, которые способны распознавать два различных антигена. Антитела можно иммобилизовать на полимере или частице.
Методики получения таких биспецифических антител были широко описаны в международной заявке на патент WO 94/09117.
В одном варианте реализации для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, этап (b) способа согласно настоящему изобретению включает применение триспецифического антитела, которое связывается с IFNγ, с IL-10 и с молекулой на поверхности клетки, специфичной для Т-клеток.
Триспецифические антитела, которые соединяют три антигена, были описаны в WO 2016105450.
В одном варианте реализации настоящего изобретения на этапе (b) средства, подходящие для выделения популяции GITR+CD8+CD45RClow клеток человека, секретирующих IFNγ+IL-10+IL-34+Treg, представляют собой антитела, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и антитела подходящие для детектирования GITR, и/или Foxp3 и/или TGFβ-1.
В частности, антитела, подходящие для детектирования GITR, представляют собой антитела человека к GITR. Примеры антител, которые связывают антиген GITR человека, включают, без ограничения перечисленными, моноклональные антитела МАВ689-100, 621, eBioAITR, 110416.
В частности, антитела, подходящие для детектирования Foxp3, представляют собой антитела человека к Foxp3. Примеры антител, которые связывают антиген Foxp3 человека, включают, без ограничения перечисленными, моноклональные антитела РСН101, 259D, 206D и 236А/Е7.
В частности, антитела, подходящие для детектирования TGFβ-1, представляют собой антитела человека к TGFβ-1. Примеры антител, которые связывают антиген TGFβ-1 человека, включают, без ограничения перечисленными, моноклональные антитела МАВ2463, TW4-6H10, 19D8 и eBio16TFB.
В одном варианте реализации настоящего изобретения на этапе (b) средства, подходящие для выделения популяции GITR+CD8+CD45RClow клеток человека, секретирующих IFNγ+IL-10+IL-34+Treg, представляют собой антитела, подходящие для выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и антитела подходящие для детектирования IL-2.
В частности, антитела, подходящие для детектирования IL-2, представляют собой антитела человека к IL-2. Примеры антител, которые связывают антиген IL-2 человека, включают, без ограничения перечисленными, моноклональные антитела MQ1-17H12 и 5344.111.
В одном варианте реализации этап (а) и этап (b) способа согласно настоящему изобретению осуществляют одновременно. Другими словами, в одном варианте реализации способ согласно настоящему изобретению для детектирования и/или выделения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, включает приведение указанной популяции клеток МКПК или лимфоцитов человека в контакт со средствами, подходящими для выделения популяции CD8+CD45RClow Treg человека, секретирующих IFNγ+IL-10+IL-34+ человека. Примеры подходящих средств описаны выше в данной заявке.
В настоящем изобретении также предложен способ in vitro или ex vivo получения популяции CD8+CD45RClow клеток Treg согласно настоящему изобретению, включающий этап культивирования популяции CD8+ Т-клеток в культуральной среде, содержащей выделенный пептид, полученный из молекулы ГКГС II класса, или его функциональный фрагмент, в присутствии популяции дендритных клеток, предпочтительно плазмацитоидных дендритных клеток (пДК).
В одном варианте реализации длина выделенного пептида, полученного из молекулы ГКГС II класса, находится в диапазоне от 5 до 40 аминокислот, и он содержит по меньшей мере 5 последовательных аминокислот из последовательности аминокислот REEYARFDSDVGEYR (SEQ ID NO: 1) или ее функционально консервативного варианта. Предпочтительно, длина выделенного пептида, полученного из молекулы ГКГС II класса, находится в диапазоне от 15 до 40 аминокислот, и он содержит последовательность аминокислот REEYARFDSDVGEYR (SEQ ID NO: 1) или ее функционально консервативный вариант.
В другом варианте реализации длина выделенного пептида, полученного из молекулы ГКГС II класса, находится в диапазоне от 11 и 16 аминокислот, и он содержит последовательность аминокислот SDVGEYR (SEQ ID NO: 18) или ее функционально консервативный вариант.
Согласно настоящему изобретению термин "функционально консервативный вариант" относится к пептидам, которые идентичны по меньшей мере приблизительно на 70% эталонному пептиду (такой как SEQ ГО NO: 1 или SEQ ID NO: 18), еще более предпочтительно по меньшей мере приблизительно на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9%, и которые остаются функциональными, т.е., все еще способными вызывать образование популяции CD8+CD45RClow клеток Treg по существу таким же образом, как и эталонный пептид (такой как SEQ ID NO: 1 или SEQ ID NO: 12).
Предпочтительно указанный пептид, полученный из молекулы ГКГС II класса, выбран из группы, состоящей из:
REEYARFDSDVGEYR (SEQ ГО NO: 1);
NREEYARFDSDVGEYR (SEQ ID NO: 2);
REEYARFDSDVGEFR (SEQ ID NO: 3);
REEYVRFDSDVGEYR (SEQ ID NO: 4);
QEEYARFDSDVGEYR (SEQ ID NO: 5);
REEYARFDSDVGVYR (SEQ ID NO: 6);
NREEYARFDSDVGEFR (SEQ ID NO: 7);
NREEYVRFDSDVGEYR (SEQ ID NO: 8);
NQEEYARFDSDVGEYR (SEQ ID NO: 9);
NREEYARFDSDVGVYR (SEQ ID NO: 10);
RLLARLIYNREEYARFDSDVGEYRAVTELGRPSAEYRNKQ (SEQ ID NO: 11);
YLRYDSDVGEYRAVTE (SEQ ID NO: 12);
DSDVGEYRAVTELGRP (SEQ ID NO: 13);
YLRYDSDVGEYR (SEQ ID NO: 14);
YLRYDSDVGEYRAV (SEQ ID NO: 15);
SDVGEYRAVTELGR (SEQ ID NO: 16);
LRYDSDVGEYRAVTE (SEQ ID NO: 17).
В одном варианте реализации указанный способ включает этап культивирования популяции CD8+ Т-клеток в культуральной среде, содержащей мультимер ГКГС/пептид, содержащий пептид, полученный из молекулы ГКГС II класса, описанной выше.
Согласно настоящему изобретению термин "мультимер ГКГС/пептид" относится к стабильному мультимерному комплексу, состоящему из белковых субъединиц главного комплекса гистосовместимости (ГКГС), нагруженных пептидом, полученным из молекулы ГКГС II класса, описанной выше. Указанные мультимеры ГКГС/пептид (также называемые в данной заявке комплексом ГКГС/пептид) включают, но не ограничены перечисленными: димер, тример, тетрамер или пентамер ГКГС/пептид. Предпочтительно указанные мультимеры ГКГС/пептид представляют собой тетрамеры.
Пептиды, полученные из описанных молекул ГКГС II класса, и мультимеры ГКГС/пептид описаны в WO 2015150491 и в WO 2015150492, которые настоящим включены посредством ссылки.
Способ обогащения/способ обеднения/набор
В настоящем изобретении также предложен способ обогащения популяции клеток CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, описанными выше в данной заявке, включающий:
- детектирование CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, в биологическом образце, содержащем мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, как описано выше в данной заявке,
- селекцию указанных клеток,
что позволяет получить популяцию клеток, обогащенную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+.
Таким образом, в одном варианте реализации способ обогащения популяции CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, описанными выше в данной заявке, включает:
- приведение биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, в контакт со средствами, подходящими для выделения популяции CD8+CD45RClow клеток Treg человека,
- детектирование и отделение CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+EL-10+IL-34+, от CD8+CD45RClow клеток Treg,
что позволяет получить популяцию клеток, обогащенную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+.
Способы детектирования и/или селекции CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, описаны выше в данной заявке. Например, способы отделения, выделения или селекции клеток включают, но не ограничены перечисленными: магнитное разделение с применением покрытых антителом магнитных гранул (Schwartz, и др., патент США номер 5759793) и аффинную хроматографию или просеивание ("пэннинг") с применением антитела, присоединенного к твердой матрице (например, планшету). Дополнительные методики, позволяющие осуществить точное разделение, включают устройства для сортировки клеток с возбуждением флуоресценции (FACS), у которых могут быть различные степени сложности, например, множество каналов цветового сигнала, каналы детектирования рассеяния света под острым и тупым углом или каналы сопротивления. Погибшие клетки можно устранить путем селекции с помощью красителей, связывающихся с погибшими клетками (например, йодида пропидия, LDS). Красные кровяные клетки можно удалить, например, путем элютриации, гемолиза или с помощью градиентов Ficoll-Paque. Можно применять любую методику, хорошо известную в данной области, которая не оказывает пагубное влияние на жизнеспособность выбираемых клеток.
Согласно настоящему изобретению способ обогащения популяции CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, может включать:
- приведение биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, в контакт с по меньшей мере одним реагентом, который связывается с маркером не относящихся к CD8+ клеток, тем самым обедняя не относящимися к CD8+ клетками,
- детектирование CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и их селекцию,
что позволяет получить популяцию клеток, обогащенную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+.
В одном варианте реализации способ обогащения популяции CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, включает:
- приведение биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, в контакт с по меньшей мере одним реагентом, который связывается с маркером не относящихся к CD8+ клеток, тем самым обедняя не относящимися к CD8+ клетками,
- детектирование и выделение CD8+CD45RClow клеток Treg, описанных выше в данной заявке, и
- детектирование и отделение CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+EL-10+IL-34+, описанных выше в данной заявке, от CD8+CD45RClow клеток Treg,
что позволяет получить популяцию клеток, обогащенную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+.
Примеры маркеров, которые связываются с не относящимися к CD8+ клетками, включают, но не ограничены перечисленными: CD4, CD14, CD16, CD19.
Предпочтительные реагенты, которые связываются с указанными маркерами, представляют собой антитела. В одном варианте реализации указанные антитела конъюгированы с флуорохромом или магнитной частицей. В другом варианте реализации селекцию клеток осуществляют с помощью проточной цитометрии, сортировки клеток с возбуждением флуоресценции, магнитной селекции, аффинной хроматографии или пэннинга, или комбинации перечисленных методов.
В другом аспекте настоящего изобретения предложена обогащенная популяция CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. Указанную обогащенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, можно получить с помощью способа обогащения популяции CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, описанного выше в данной заявке.
В данной заявке обогащенная популяция CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, представляет собой такую популяцию, в которой процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, выше, чем процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в исходно полученной популяции клеток. Хотя возможно, что обогащенная популяция CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, не обязательно должна содержать гомогенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В конкретных вариантах реализации по меньшей мере приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 98% или приблизительно 99% указанных клеток композиции представляют собой CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+. В другом варианте реализации процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в обогащенной популяции по меньшей мере в два раза, в 5 раз, в 10 раз, в 20 раз, в 30 раз, в 40 раз, в 50 раз, в 60 раз, в 70 раз, в 80 раз, в 90 раз, в 100 раз больше, чем процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, до обогащения.
Способы обогащения изменяются на основании уровня обогащения, связанного с каждым этапом процесса обогащения. Уровень обогащения и процент чистоты CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, будет зависеть от множества факторов, включая, но не ограничиваясь перечисленными: конкретный донор, исходная клетка/ткань и течение заболевания донора. В некотором варианте реализации CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, обогащены по меньшей мере приблизительно в 2 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 15 раз, приблизительно в 20 раз, приблизительно в 25 раз, приблизительно в 30 раз, приблизительно в 35 раз, приблизительно в 40 раз, приблизительно в 50 раз, приблизительно в 55 раз, приблизительно в 60 раз, приблизительно в 65 раз, приблизительно в 70 раз, приблизительно в 75 раз, приблизительно в 80 раз, приблизительно в 85 раз, приблизительно в 90 раз, приблизительно в 95 раз, приблизительно в 100 раз, приблизительно в 105 раз, приблизительно в 110 раз, приблизительно в 115 раз, приблизительно в 120 раз, приблизительно в 130 раз, приблизительно в 140 раз, приблизительно в 150 раз или приблизительно в 200 раз.
В настоящем изобретении также предложен способ обеднения популяции клеток CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, включающий:
- детектирование CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, в биологическом образце, содержащем мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, как описано выше в данной заявке,
- обеднение указанными клетками,
- что позволяет получить популяцию клеток, обедненную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+.
Способы детектирования и/или селекции CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, описаны выше в данной заявке.
В другом аспекте настоящего изобретения предложена популяция, обедненная CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+. Указанную популяцию, обедненную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, можно получить в соответствии со способом обеднения популяции клеток CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, описанным выше в данной заявке.
В данной заявке, популяция, обедненная CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, представляет собой такую популяцию, в которой процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, ниже, чем процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в исходно полученной популяции клеток.
В одном варианте реализации процент CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в обедненной популяции составляет не более 0,5, 0,4, 0,3, 0,25, 0,2, 0,15, 0,1 от процента CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, перед обеднением.
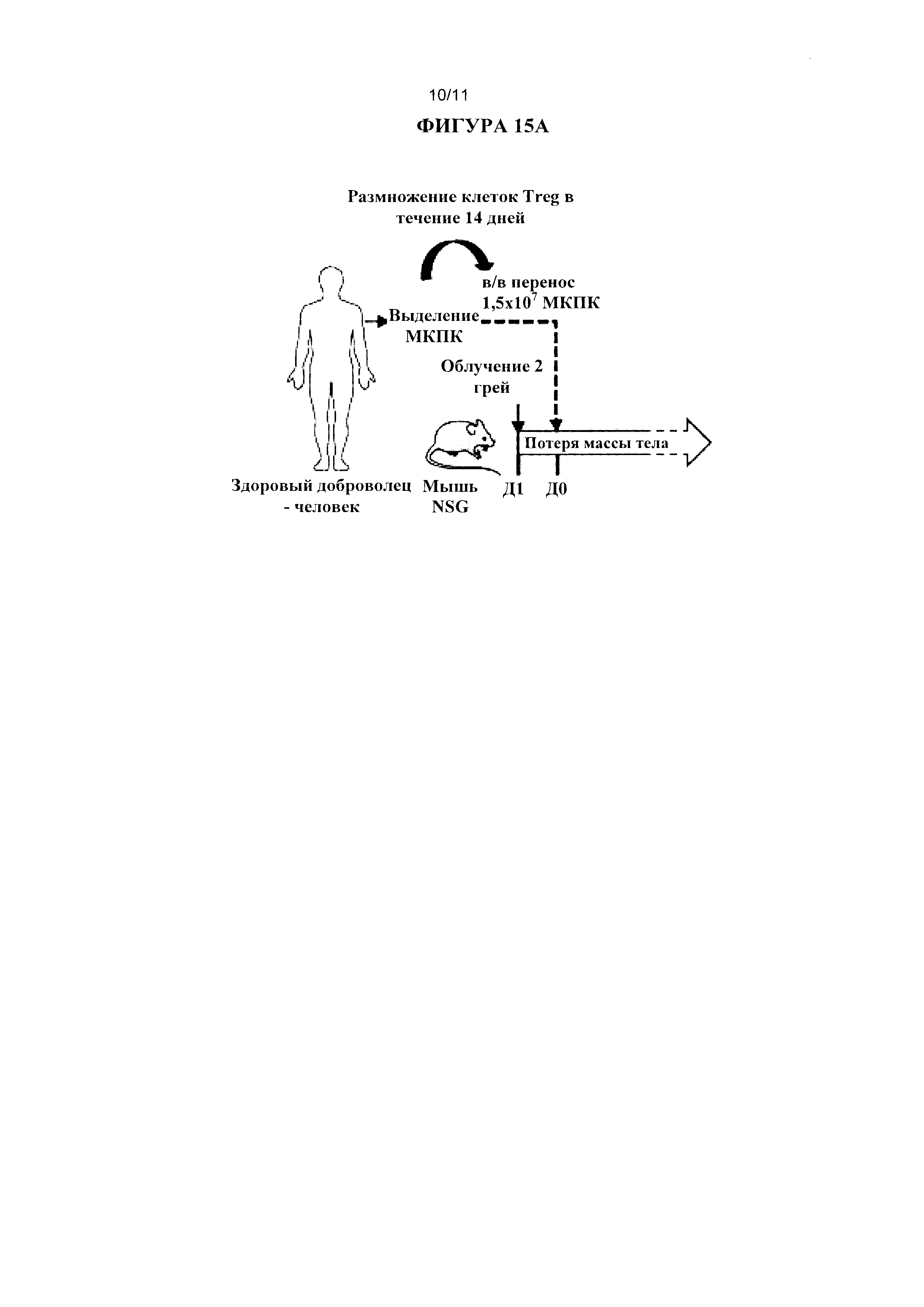
Было показано, что обеднение регуляторными Т-клетками повышает опосредованный вакциной иммунитет у страдающих раком пациентов (Dannull и др., 2005, 115(12):3623-3633). Таким образом, в другом варианте реализации настоящего изобретения предложили, что обеднение CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, согласно настоящему изобретению можно применять в клеточной терапии для лечения рака или инфекционного заболевания, при этом указанные клетки Treg могут быть вредны или пагубны для лечения. Например, при лечении рака, временное обеднение CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, может представлять интерес перед осуществлением протокола вакцинации/иммунотерапии, указанное временное обеднение осуществляют путем обеднения крови пациента ex vivo посредством устройства, описанного в способе обеднения согласно настоящему изобретению, и ее незамедлительного введения обратно пациенту путем инъекции. Таким образом, в указанном варианте реализации обеднение CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, крови пациента осуществляют ex vivo посредством некоторого устройства.
В настоящем изобретении также предложен набор для идентификации или выделения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, или обогащения или обеднения популяции клеток CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+, указанный набор содержит реагенты для детектирования экспрессии на поверхности клетки CD3, CD8, CD45RC и средства для детектирования секреции IFNγ и IL-10 и/или IL-34.
Предпочтительно указанные реагенты представляют собой антитела. Более предпочтительно данные антитела конъюгированы с флуорохромом или магнитной частицей.
В одном конкретном варианте реализации указанные реагенты представляют собой антитела, конъюгированные с цитотоксическим лекарственным средством, таким как ингибиторы образования микротрубочек, алкилирующие агенты и агенты, связывающиеся с малой бороздкой ДНК. Примеры цитотоксических лекарственных средств включают, без ограничения перечисленными: митомицин, ауристатины и производные майтансина.
В другом варианте реализации указанные реагенты представляют собой конъюгаты антител с антибиотиками. Примеры антибиотиков включают, без ограничения перечисленными: хлорамфеникол, эритромицин, линкомицин, фусидовую кислоту, стрептомицин, антибиотик класса аминогликозидов, тетрациклин, полимиксин, фосфомицин, ванкомицин, ристоцетин, бацитрацин, грамицидин, пенициллин и цефалоспорин.
В одном варианте реализации указанный набор дополнительно содержит реагенты для детектирования экспрессия Foxp3, и/или экспрессии GITR, и/или экспрессии TGFβ-1, и/или экспрессии IL-2. Предпочтительно указанные реагенты представляют собой антитела. Более предпочтительно указанные антитела конъюгированы с флуорохромом.
Способы размножения клеток Treg согласно настоящему изобретению
В третьем аспекте настоящего изобретения предложен способ размножения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, включающий этап культивирования выделенной популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, предпочтительно этап приведения выделенной популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в контакт с культуральной средой, подходящей для размножения клеток Treg.
В одном варианте реализации настоящего изобретения предложен способ размножения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, указанные клетки Treg необязательно являются GITR+ и/или Foxp3+, включающий этап приведения выделенной популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в контакт с культуральной средой, подходящей для размножения клеток Treg.
В одном варианте реализации настоящего изобретения предложен способ размножения CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, экспрессирующих по меньшей мере один из GITR, Foxp3 и TGFβ-1, включающий этап приведения выделенной популяции GITR+CD8+CD45RClow клеток человека, секретирующих IFNγ+IL-10+IL-34+ Treg, в контакт с культуральной средой, подходящей для размножения клеток Treg.
В одном варианте реализации указанную выделенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению замораживают и впоследствии размораживают перед приведением в контакт с культуральной средой, подходящей для размножения клеток Treg. Авторы настоящего изобретения продемонстрировали, что CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, согласно настоящему изобретению можно эффективно размножить, даже еще более эффективно, после размораживания. Действительно, авторы настоящего изобретения наблюдали, что CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+EL-34+, согласно настоящему изобретению пролиферировали более эффективно после размораживания, чем когда их сортировали свежими.
В данной заявке термин "размножение" относится к процессу преобразования и/или увеличения данной популяции клеток (например, иммунных клеток, таких как Т-клетки). Размножение Т-клеток предпочтительно осуществляют путем культивирования популяции клеток, содержащей Т-клетки, в присутствии антиген-специфического стимулирующего агента, такого как антигены, клетки (такие как клетки донора в контексте трансплантации аллографта), полимеры ГКГС, антитела (такие как антитела к CD3 и/или антитела к CD28), лектины (такие как РНА) и т.д. Для размножения также может потребоваться культивирование Т-клеток в присутствии цитокина (такого как IL-15, IL-12, IL-4, IL-7, IL-2, IFNγ, IL-34 и провоспалительные цитокины (такие как, например, IL-1 (в частности IL-1β), IL-6 и TNFα)).
В данной заявке термин "культуральная среда" относится к среде для поддержания популяции клеток или культивирования популяции клеток, содержащей питательные вещества, которые сохраняют жизнеспособность клеток и поддерживают пролиферацию. Культуральная среда может содержать любой из следующих компонентов в подходящей комбинации: соль(-и), буфер(ы), аминокислоты, глюкозу или другой(-ие) сахар(а), антибиотики, сыворотку или заменитель сыворотки и другие компоненты, такие как факторы роста, цитокины и т.д. Культуральные среды, обычно применяемые для конкретных типов клеток, известны специалистам в данной области. Культуральную среду согласно настоящему изобретению можно получить на основе доступной для приобретения среды, такой как RPMI 1640 от Invitrogen.
В одном варианте реализации среда, подходящая для размножения CD8+CD45RClow клеток Treg человека согласно настоящему изобретению, содержит по меньшей мере один стимулирующий агент. В одном варианте реализации указанный по меньшей мере один стимулирующий агент выбирают из группы, включающей антигены, клетки, полимеры ГКГС, антитела и лектины. В одном варианте реализации указанный по меньшей мере один стимулирующий агент антиген-специфичен, и его выбирают из группы, состоящей из антигенов, клеток, полимеров ГКГС и антител. В одном варианте реализации указанный по меньшей мере один стимулирующий агент выбирают из группы, включающей аллогенные антигенпредставляющие клетки, антитела к CD3 и/или антитела к CD8, РМА+ иономицин.
В одном варианте реализации среда, подходящая для размножения CD8+CD45RClow клеток Treg человека согласно настоящему изобретению, содержит некоторое количество по меньшей мере одного цитокина. Примеры цитокинов, которые могут присутствовать в среде, подходящей для размножения Treg, включают, но не ограничены перечисленными: EL-15, IL-12, IL-4, IL-7, IL-2, IFNγ, IL-34 и провоспалительные цитокины (такие как, например, IL-1 (в частности, IL-1β), IL-6 и TNFα).
В одном варианте реализации культуральная среда, подходящая для размножения клеток Treg, содержит некоторое количество интерлейкина-2 (IL-2) и/или некоторое количество интерлейкина-15 (IL-15).
В некотором варианте реализации IL-2 представляет собой интерлейкин-2 (hIL-2) человека, предпочтительно рекомбинантный интерлейкин-2 (rhIL-2) человека. Дополнительно следует отметить, что rhIL-2 доступен для приобретения для применения в фармацевтике. Подходящие доступные для приобретения формы включают, например, Пролейкин® - композицию рекомбинантного IL-2 человека.
В некотором варианте реализации IL-15 представляет собой интерлейкин-15 (hIL-15) человека, предпочтительно рекомбинантный интерлейкин-15 (rhIL-15) человека.
Обычно IL-2 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 100 до 10000 ед/мл, предпочтительно от 500 до 5000 ед/мл, более предпочтительно при концентрации 1000 ед/мл.
Обычно IL-15 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 1 до 100 нг/мл, предпочтительно от 2,5 до 50 нг/мл, более предпочтительно при концентрации 10 нг/мл.
Обычно IL-12 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 1 до 50 нг/мл, более предпочтительно при концентрации 5 нг/мл.
Обычно IL-4 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 1 до 20 нг/мл, более предпочтительно при концентрации 5 нг/мл.
Обычно IL-7 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 2,5 до 50 нг/мл, более предпочтительно при концентрации 10 нг/мл.
Обычно IFNγ добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 5 до 100 нг/мл, более предпочтительно при концентрации 20 нг/мл.
Обычно IL-34 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 10 до 100 нг/мл, более предпочтительно при концентрации 50 нг/мл.
Обычно IL-1 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 2,5 до 50 нг/мл, более предпочтительно при концентрации 10 нг/мл.
Обычно IL-6 добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 5 до 100 нг/мл, более предпочтительно при концентрации 20 нг/мл.
Обычно TNF добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 5 до 100 нг/мл, более предпочтительно при концентрации 20 нг/мл.
Обычно TGF-бета добавляют в культуральную среду согласно настоящему изобретению при концентрации в диапазоне от 0,01 до 500 нг/мл, предпочтительно от 0,1 до 10 нг/мл, более предпочтительно при концентрации 1 нг/мл.
Обычно культивирование CD8+CD45RClow клеток Treg человека согласно настоящему изобретению в интересующей культуральной среде следует осуществлять в течение по меньшей мере 6 дней, например, от по меньшей мере 6 дней до не более 15 дней, или от по меньшей мере 6 дней до не более 20 дней, или от по меньшей мере 6 дней до не более 6-8 недель, предпочтительно 14 дней. В одном варианте реализации культивирование CD8+CD45RClow клеток Treg человека согласно настоящему изобретению в интересующей культуральной среде осуществляют в течение 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или 31 дня. В одном варианте реализации культивирование CD8+CD45RClow клеток Treg человека согласно настоящему изобретению в интересующей культуральной среде осуществляют в течение 1 недели, 2 недель, 3, 4, 5, 6, 7, 8, 9 или 10 недель или более.
В одном варианте реализации цитокины, предпочтительно IL-2 и/или IL-15, добавляют в культуральную среду в день 0 культивирования CD8+CD45RClow клеток Treg человека согласно настоящему изобретению. В другом варианте реализации цитокины, предпочтительно IL-2 и/или IL-15, дополнительно добавляют в культуральную среду один раз, два раза, или три раза, или четыре раза, или более раз, например, в день 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 и/или 20. В одном варианте реализации цитокины, предпочтительно IL-2 и/или IL-15, добавляют в культуральную среду в день 0 и в день 5, 6, 7, 8 или 9 культивирования CD8+CD45RClow клеток Treg человека согласно настоящему изобретению, предпочтительно в дни 0 и 7. В другом варианте реализации цитокины, предпочтительно IL-2 и/или IL-15, добавляют в культуральную среду три раза, предпочтительно в день 0 и два дополнительных раза. В другом варианте реализации цитокины, предпочтительно IL-2 и/или IL-15, добавляют в культуральную среду четыре раза, предпочтительно в день 0 и три дополнительных раза. В другом варианте реализации цитокины, предпочтительно IL-2 и/или EL-15, добавляют в культуральную среду 5 раз, предпочтительно в день 0 и 4 дополнительных раза, например, в дни 0, 6, 13, 16 и 18. В одном варианте реализации цитокины, предпочтительно IL-2 и/или IL-15, добавляют в день 0 и каждые 2, 3 или 4 дня до окончания культивирования.
В одном варианте реализации культуральная среда, подходящая для размножения клеток Treg, содержит некоторое количество по меньшей мере одного интересующего антигена. Обычно, данный антиген добавляют в культуральную среду согласно настоящему изобретению в концентрации 1 мкг/мл.
В некотором варианте реализации размножение представляет собой поликлональное размножение. Поликлональное размножение можно получить, применяя AT к CD3 и AT к CD28 и/или аллогенные антигенпредставляющие клетки (АПК).
В одном варианте реализации в культуральную среду добавляют от 0,1 до 10 мкг/мл, предпочтительно от 0,25 до 4 мкг/мл, более предпочтительно 1 мкг/мл антитела к CD3 и/или от 0,1 до 10 мкг/мл, предпочтительно от 0,25 до 4 мкг/мл, более предпочтительно 1 мкг/мл антитела к CD28.
В одном варианте реализации в культуральную среду добавляют аллогенные антигенпредставляющие клетки (АПК) при соотношении клетки Treg : АПК в диапазоне от 1:1 до 1:10, предпочтительно от 1:2 до 1:6, и более предпочтительно составляющем 1:4.
В рамках контекста настоящего изобретения выделенную популяцию CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, размноженных или нет, можно затем стимулировать интересующим антигеном, чтобы получить популяцию антиген-специфических CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, указанный антиген предоставляют в количестве, эффективном для "примирования" выделенной популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению, и, следовательно, получения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, специфичных к указанному антигену. Действительно, такие размноженные антиген-специфические CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, являются подходящими для предотвращения или лечения нежелательных иммунных ответов, например, вовлеченных в аутоиммунные расстройства, иммунные реакции на терапевтические белки и/или аллергии.
Соответствующим образом следует получить популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, специфичных к антигену, связанному с заболеванием, от которого лечат (патогенному антигену). Следовательно, интересующий антиген выбирают из группы, состоящей из аутоантигенов, аллоантигенов, пищевых антигенов из обычного рациона человека, воспалительных антигенов и аллергенов.
Термин "аутоантиген" относится к иммуногенному пептиду, полученному из белка индивида. Он может, в качестве примера, представлять собой аутоантиген из следующего неограничивающего перечня аутоантигенов: рецептор ацетилхолина, актин, адениннуклеотидтранслоказа, адренорецептор, декарбоксилазу ароматических L-аминокислот, асиалогликопротеиновый рецептор, бактерицидный/повышающий проницаемость белок (BPi), кальций-чувствительный рецептор, фермент, расщепляющий боковую цепь холестерина, цепь коллагена IV типа, цитохром Р450 2D6, десмин, десмоглеин-1, десмоглеин-3, F-актин, ганглиозиды GM, глутаматдекарбоксилазу, рецептор глутамата, Н/К АТФазу, 17-α-гидроксилазу, 21-гидроксилазу, IA-2 (ICAS12), инсулин, рецептор инсулина, внутренний фактор типа 1, антиген 1 функции лейкоцитов, связанный с миелином гликопротеин, основный белок миелина, белок миелина олигодендроцитов, миозин, Р80-коилин, пируватдегидрогеназный комплекс Е2 (ПДК-Е2), натрий-йодный симпортер, SOX-10, общий белок щитовидной железы и глазной мышцы, тиреоглобулин, тиреоидную пероксидазу, рецептор тиреотропин, а тканевую трансглутаминазу, коактиватор транскрипции р75, триптофангидроксилазу, тирозиназу, тирозингидроксилазу, АСТН, гистидил-аминоацил-тРНК-синтетазу, кардиолипин, карбоангидразу II, ассоциированные с центромерой белки, ДНК-зависимую стимулируемую нуклеосомой АТФазу, фибрилларин, фибронектин, глюкоза-6-фосфат-изомеразу, бета 2-гликопротеин I, голгин (95, 97, 160, 180), белки теплового шока, гемидесмосомальный белок 180, гистон Н2А, Н2 В, кератин, рецептор IgE, Ku-ДНК протеинкиназу, Ku-нуклеопротеин, фосфобелок La, миелопероксидазу, протеиназу 3, РНК-полимеразу I-III, сигналузнающий белок, топоизомеразу I, тубулин, виментин, ассоциированный с миелином основный белок олигодендроцитов (МОВР), протеолипидный белок, специфичный для олигодендроцитов белок (OSP/клаудин 11), 3-фосфодиэстеразу 2',3'-циклических нуклеотидов (ЦНФаза), BP антиген 1 (BPAG 1-е), трансальдолазу (TAL), митохондриальные аутоантигены человека ПДК-Е2 (Novo 1 и 2), OGDC-E2 (Novo 3) и BCOADC-E2 (Novo 4), буллезный пемфигоид (BP) 180, ламинин 5 (LN5), DEAD-box белок 48 (DDX48) или ассоциированный с инсулиномой антиген-2.
Термин "пищевой антиген из обычного рациона человека" относится к иммуногенному пептиду, который поступает с продуктами питания, обычными для людей, такому как пищевые антигены из следующего неограничивающего перечня антигенов: бычьи антигены, такие как липокалин, Са-связывающий S100, альфа-лактальбумин, лактоглобулины, такие как бета-лактоглобулин, бычий сывороточный альбумин, казенны. Пищевые антигены также могут представлять собой антигены семги, такие как парвальбумин, антигены цыпленка, такие как овомукоид, овальбумин, Ag22, кональбумин, лизоцим или сывороточный альбумин цыпленка, арахис, антигены креветки, такие как тропомиозин, антигены пшеницы, такие как агглютинин или глиадин, антигены сельдерея, такие как профилин сельдерея, антигены моркови, такие как профилин моркови, антигены яблока, такие как тауматин, белок переноса липидов яблока, профилин яблока, антигены груши, такие как профилин груши, изофлавон-редуктаза, антигены авокадо, такие как эндохитиназа, антигены абрикоса, такие как белок переноса липидов абрикоса, антигены персика, такие как белок переноса липидов персика или профилин персика, антигены сои, такие как HPS, профилин сои или белок (SAM22) PR-10.
Термин "воспалительный антиген" относится к основному белку миелина (МВР), связанному с миелином гликопротеину (MAG), гликопротеину миелина олигодендроцитов (MOG), протеолипидному белку (PLP), олигопротеину миелина олигодендроцитов (OMGP), ассоциированному с миелином основному белку олигодендроцитов (МОВР), специфичному для олигодендроцитов белку (OSP/клаудин 1), белкам теплового шока, специфичным для олигодендроцитов белкам (OSP), NOGO А, гликопротеину Ро, периферическому белку миелина 22 (РМР22), 3-фосфодиэстеразе 2',3'-циклических нуклеотидов (ЦНФазе), цитруллин-замещенным циклическим и линейным пептидам филаггрина, пептидам коллагена II типа, пептидам гликопротеина 39 хряща человека (HCgp39), HSP, пептидам гетерогенного ядерного рибонуклеопротеина (гяРНП) А2, В1 гяРНП, D гяРНП, Ro60/52, HSP60, 65, 70 и 90, BiP, кератину, виментину, фибриногену, пептидам коллагена типа I, III, IV и V, аннексину V, глюкоза-6-фосфат-изомеразе (GPI), ацетил-кальпастатину, пируватдегидрогеназе (ПДГ), альдолазе, топоизомеразе I, мяРНП, PARP, Scl-70, Scl-100, фосфолипидному антигену, включая анионный кардиолипин и фосфатидилсерин, нейтрально заряженному фосфатидилэтаноламину и фосфатидилхолину, матриксной металлопротеиназе, фибриллину, аггрекану.
Термин "аллерген" относится к ингалируемому аллергену, проглатываемому аллергену или контактному аллергену. Примеры аллергенов включают, но не ограничены ингалируемыми аллергенами из пыльцы (Cup, Jun), клещей домашней пыли (Der, Gly, Tyr, Lep), собаки, кошки и грызунов (Can, Fel, Mus, Rat). Примеры контактных аллергенов включают, но не ограничены перечисленными: тяжелые металлы (такие как никель, хром, золото), латекс, гаптены, такие как галотан, гидралазин.
Таким образом, в одном варианте реализации, когда аутоиммунное заболевание представляет собой множественный склероз, аутоантиген выбирают из группы, состоящей из родственных миелину антигенов (например, основного белка миелина (МВР) (например, пептида МВР83-102), гликопротеина миелина олигодендроцитов (MOG) (например, пептида MOG35-55) и протеолипидного белка (PLP) (например, пептида PLP139-151). Когда аутоиммунное заболевание представляет собой диабет I типа (СД1), аутоантиген выбирают из группы, состоящей из инсулина, предшественника инсулина - проинсулина (ProIns), декарбоксилазы 65 глутаминовой кислоты (GAD65), глиального фибриллярного кислого белка (GFAP), специфического для островков белка, родственного каталитической субъединице глюкозо-6-фосфатазы (IGRP), ассоциированного с инсулиномой антигена-2 (IA-2) и транспортера цинка 8 (ZnT8). Когда аутоиммунное заболевание представляет собой ревматоидный артрит, аутоантиген представляет собой коллаген II типа (CTII).
Также предполагается, что аллоантигены включают, но не ограничены перечисленными: антигены, экспрессируемые аллотрансплантатом, белки, экспрессируемые в ходе генотерапии (а также вирусные антигены, выходящие из используемого вирусного вектора), а также терапевтические белки. Аллоантиген выбирают из группы, состоящей из HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G, HLA-DM, HLA-DO, HLA-DP, HLA-DQ, HLA-DR, минорных антигенов, таких как НА-1, НА-2, НА-3, НА-8, НВ-1, UGT2B17, BCL2A1, HY В7, HY А2, HY A1, HY В60, HY В8, HY DQ5, HY DRB3 и антигенов группы крови А и В.
Таким образом "аллотрансплантат" представляет собой трансплантат между двумя индивидами одного вида с двумя генетически различными гаплотипами ГКГС, но также минорными антигенами гистосовместимости и группами крови. Таким образом, для предотвращения или лечения отторжения аллотрансплантата CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, обычно выделяют из организма пациента (или реципиента) и размножают, используя клетки из донора. В качестве альтернативы CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, можно размножить, применяя смесь антигенов, полученных из донора.
Термин "терапевтические белки" относится к белкам или пептидам и их введению при терапии любого из данных состояний или заболеваний. Терапевтические белки относятся к любому белку или пептиду, такому как терапевтические антитела, цитокины, ферменты или любые другие белки, которые вводят пациенту. Примеры белковой терапии включают лечение гемофилии путем введения концентратов полученного из плазмы или рекомбинантного фактора свертывания крови (например, фактора VIII и фактора IX), лечение рака или сердечно-сосудистых заболеваний с применением моноклональных антител или лечение метаболических или лизосомальных заболеваний путем заместительной терапии ферментами.
В некотором варианте реализации культуральная среда, подходящая для размножения клеток Treg, содержит некоторое количество интерлейкина-2 (IL-2) и/или некоторое количество интерлейкина-15 (IL-15) и некоторое количество по меньшей мере одного интересующего антигена.
В другом аспекте настоящего изобретения предложена выделенная популяция размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В одном варианте реализации настоящего изобретения предложена выделенная популяция размноженных GITR+CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В одном варианте реализации настоящего изобретения предложена выделенная популяция размноженных Foxp3+CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В одном варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+CD45RClow клеток Treg человека, секретирующих TGFβ-1+IFNγ+IL-10+IL-34+. В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, в которой указанные клетки Treg являются GITR+ и/или Foxp3+. В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных Foxp3+GITR+CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных Foxp3+CD8+CD45RClow клеток Treg человека, секретирующих TGFβ-1+IFNγ+IL-10+IL-34+. В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных GITR+CD8+CD45RClow клеток Treg человека, секретирующих TGFβ-1+IFNγ+IL-10+IL-34+. В еще одном варианте реализации настоящего изобретения предложена выделенная популяция размноженных Foxp3+GITR+CD8+CD45RClow клеток Treg человека, секретирующих TGFβ-l+IFNγ+IL-10+IL-34+.
Указанные выделенные популяции размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше, можно получить с помощью способа размножения клеток Treg согласно настоящему изобретению, описанного выше. В некотором варианте реализации указанные CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, антиген-специфичны.
В настоящем изобретении также предложен способ получения популяции CD8+ клеток Treg согласно настоящему изобретению, включающий:
- выделение CD8+GITR+клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, необязательно выделение CD8+CD45RClowGITR+ клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека,
- необязательно замораживание и последующее размораживание выделенных клеток Treg, и
- размножение указанных клеток в культуре.
В одном варианте реализации указанный способ включает:
- выделение CD8+GITR+клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, где указанные выделенные CD8+GITR+клетки Treg представляют собой CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+,
- необязательно замораживание и последующее размораживание выделенных клеток Treg, и
- размножение указанных клеток в культуре.
Действительно, авторы настоящего изобретения продемонстрировали, что субпопуляция GITR+CD8+CD45RClow клеток Treg проявляет высокую супрессорную активность.
В одном варианте реализации настоящего изобретения предложен способ получения популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγIL-10+IL-34+, включающий:
- выделение CD8+GITR+клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, необязательно выделение CD8+CD45RClowGITR+ клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека,
- необязательно замораживание и последующее размораживание выделенных клеток Treg, и
- размножение указанных клеток в культуре.
В одном варианте реализации указанный способ включает:
- выделение CD8+GITR+клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека,
необязательно замораживание и последующее размораживание выделенных клеток Treg, и
- размножение указанных клеток в культуре.
В другом варианте реализации указанный способ включает:
- выделение CD8+CD45RClowGITR+клеток Treg из биологического образца, содержащего мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека,
- необязательно замораживание и последующее размораживание выделенных клеток Treg, и
- размножение указанных клеток в культуре.
Способы выделения CD8+ клеток Treg человека и размножения клеток Treg описаны выше в данной заявке.
В одном варианте реализации CD8+GITR+ клетки Treg можно изолировать с помощью антител, подходящих для детектирования GITR. Примеры антител, которые связывают антиген GITR человека, включают, без ограничения перечисленными: моноклональные антитела МАВ689-100, 621, eBioAITR, 110416.
В другом варианте реализации CD8+CD45RClowGITR+ клетки Treg можно изолировать с помощью антител, подходящих для детектирования GITR, и антител, подходящих для детектирования CD45RC. Примеры антител, которые связывают антиген GITR человека включают, без ограничения перечисленными, моноклональные антитела МАВ689-100, 621, eBioAITR, 110416. Примеры антител, которые связывают антиген CD45RC человека, включают моноклональные антитела МТ2 и RP1/12.
В одном варианте реализации CD8+GITR+ клетки Treg или CD8+CD45RClowGITR+ клетки Treg выделяют в соотвутствии со способом согласно настоящему изобретению после активации МКПК или лимфоцитов по меньшей мере одним стимулирующим агентом. Примеры стимулирующих агентов описаны выше в данной заявке.
В одном варианте реализации CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, описанные выше в данной заявке, получают и выделяют из культуры индуцированных плюрипотентных стволовых клеток (иПСК) или полученных из иПСК CD34+ клеток. В рамках контекста настоящего изобретения культуру иПСК или полученных из иПСК CD34+ клеток можно получить, например, из биологического образца, содержащего мононуклеарные клетки периферической крови человека (МКПК).
В настоящем изобретении также предложен способ обеднения популяции CD8+ клеток Treg согласно настоящему изобретению, включающий:
- детектирование CD8+GITR+клеток Treg в биологическом образце, содержащем мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, необязательно детектирование CD8+CD45RClowGITR+ клеток Treg в биологическом образце, содержащем мононуклеарные клетки периферической крови (МКПК) или лимфоциты человека, и
- обеднение указанными клетками,
- что позволяет получить популяцию клеток, обедненную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+EL-10+IL-34+.
Фармацевтические композиции согласно настоящему изобретению.
Согласно настоящему изобретению также предложена композиция, содержащая популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению, предпочтительно выделенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В одном варианте реализации композиция согласно настоящему изобретению содержит обогащенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В одном варианте реализации композиция согласно настоящему изобретению содержит популяцию клеток, обедненную CD8+ клетками человека согласно настоящему изобретению, в частности, популяцию, обедненную CD8+CD45RClow клетками Treg человека, секретирующими IFNγ+IL-10+IL-34+. В другом варианте реализации композиция согласно настоящему изобретению содержит популяцию генетически модифицированных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, популяцию генетически модифицированных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
В другом варианте реализации композиция согласно настоящему изобретению содержит размноженную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+. В другом варианте реализации композиция согласно настоящему изобретению содержит размноженную популяцию антиген-специфических CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженную популяцию антиген-специфических CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+.
Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению.
В одном варианте реализации указанная фармацевтическая композиция содержит популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и фармацевтически приемлемый носитель. В одном варианте реализации фармацевтическая композиция содержит выделенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и фармацевтически приемлемый носитель. В одном варианте реализации фармацевтическая композиция содержит обогащенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и фармацевтически приемлемый носитель. В одном варианте реализации фармацевтическая композиция содержит популяцию генетически модифицированных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, генетически модифицированных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и фармацевтически приемлемый носитель.
В другом варианте реализации фармацевтическая композиция содержит популяцию размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и фармацевтически приемлемый носитель. В некотором варианте реализации фармацевтическая композиция содержит популяцию размноженных антиген-специфических CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных антиген-специфических CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, и фармацевтически приемлемый носитель.
Указанная фармацевтическая композиция, как правило, может содержать одно или более фармацевтически приемлемых и/или одобренных вспомогательных веществ, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такие вспомогательные вещества могут представлять собой воду, солевой раствор, глицерин, этанол, смачивающие или эмульгирующие агенты, рН-буферные вещества или тому подобные вспомогательные вещества. Подходящие носители обычно представляют собой большие, медленно метаболизируемые молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, агрегаты липидов или тому подобные носители. Данная фармацевтическая композиция может содержать дополнительные вспомогательные вещества, такие как маннит, декстран, сахар, глицин, лактоза или поливинилпирролидон, или другие вспомогательные вещества, такие как антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, сывороточный альбумин человека), подходящие для введения in vivo.
В данной заявке термин "фармацевтически приемлемый" относится к химическим соединениям и композициям, которые не вызывают нежелательную, аллергическую или другую неблагоприятную реакцию при введении млекопитающему, особенно человеку, в соответствующих случаях. Фармацевтически приемлемый носитель или вспомогательное вещество относится к нетоксичному твердому, полутвердому или жидкому наполнителю, разбавителю, инкапсулирующему материалу или любому типу вспомогательного вещества для композиции.
Согласно настоящему изобретению также предложено лекарственное средство, содержащее популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению. В одном варианте реализации указанное лекарственное средство согласно настоящему изобретению содержит выделенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению. В одном варианте реализации лекарственное средство согласно настоящему изобретению содержит обогащенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению. В одном варианте реализации лекарственное средство согласно настоящему изобретению содержит популяцию генетически модифицированных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, генетически модифицированных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению.
В одном варианте реализации лекарственное средство согласно настоящему изобретению содержит размноженную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению. В одном варианте реализации лекарственное средство согласно настоящему изобретению содержит размноженную популяцию антиген-специфических CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженную популяцию антиген-специфических CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению.
Терапевтические способы и применения клеток Tree согласно настоящему изобретению.
Как описано выше, выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению представляет интерес в областях аутоиммунитета, хронического воспаления, аллергии, трансплантации (либо для предотвращения, либо для лечения отторжения трансплантата или РТПХ), генотерапии и лечения терапевтическим белком, чтобы избежать разрушения собственных тканей или терапевтических белков иммунной системой. Выделенная популяция CD8+CD45RClow клеток Treg человека согласно настоящему изобретению действительно проявляет способность вызывать иммунологическую толерантность и/или подавлять и/или ингибировать иммунные ответы, предпочтительно антиген-специфический(-е) иммунный(-е) ответ(ы), направленный(-е) против антигена(-ов), вовлеченного(-ых) в заболевание, от которого лечат, и/или нежелательные приобретенные иммунные ответы, опосредованные CD4+ Т-клетками, CD8+ Т-клетками, предпочтительно иммунологическую толерантность Т-клеток или пониженную активацию Т-клеток. Предпочтительно выделенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению, выделяют из организма пациента, которого лечат (и будут вводить обратно пациенту после размножения ex vivo).
В некотором аспекте настоящего изобретения, таким образом, предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в качестве лекарственного средства. В другом аспекте настоящего изобретения предложена выделенная популяция размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению, предпочтительно антиген-специфических, для применения в качестве лекарственного средства.
Выделенную популяцию CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению (предпочтительно размноженную антиген-специфическую популяцию) можно ввести обратно пациенту с помощью множества подходов. Предпочтительно ее вводят путем внутривенной инъекции. В одном варианте реализации от приблизительно 1×104 до приблизительно 1×108 клеток вводят обратно пациенту. В другом варианте реализации от приблизительно 1×106 до приблизительно 10×106 клеток/кг массы тела пациента вводят обратно пациенту.
Термины "предотвратить", "предупредить" и "предотвращение" в данной заявке относятся к ингибированию развития или начала расстройства или к предотвращению рецидива, начала или развития одного или более симптомов расстройства у субъекта, происходящему в результате введения CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению.
В данной заявке термин "лечение" относится к терапевтическому лечению и профилактическим и предупредительным мерам, при этом целью является предотвращение или замедление (уменьшение, ослабление) являющегося мишенью патологического расстройства или состояния. Нуждающиеся в лечении субъекты включают субъектов, у которых уже есть расстройство, а также субъектов, склонных к развитию расстройства. Пациента успешно "лечат" от нежелательного иммунного ответа, если после получения терапевтического количества CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению, у указанного пациента выявляют заметное и/или измеримое уменьшение или отсутствие одного или более из следующих проявлений: уменьшение количества патогенных клеток; уменьшение процента общего количества патогенных клеток; и/или облегчение до некоторой степени одного или более симптомов, связанных с конкретным заболеванием или состоянием; уменьшение заболеваемости и смертности и улучшение качества жизни. Описанные выше параметры оценки успешного лечения и улучшения при заболевании можно легко измерить с помощью обычных процедур, известных врачу.
В данной заявке термин "пациент" относится к человеку, который ждет или получает медицинскую помощь или был/является/будет субъектом медицинской процедуры, или у которого отслеживают развитие или прогрессирование заболевания. В одном варианте реализации пациент является взрослым (например, пациент старше 18 лет). В другом варианте реализации пациент является ребенком (например, пациент младше 18 лет). В одном варианте реализации пациент представляет собой мужчину. В другом варианте реализации пациент представляет собой женщину.
В данной заявке термин "терапевтически эффективное количество" относится к количеству CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, которое, не вызывая значительных отрицательных или нежелательных побочных действий на мишень, направлено на: (1) отсрочивание или предотвращение начала нежелательного иммунного ответа; (2) замедление или остановку прогрессирования, обострения или ухудшения одного или более симптомов нежелательного иммунного ответа; (3) обеспечение снижения выраженности симптомов нежелательного иммунного ответа; (4) уменьшение тяжести или частоты нежелательного иммунного ответа; или (5) излечение от нежелательного иммунного ответа. Терапевтически эффективное количество можно вводить перед началом нежелательного иммунного ответа для профилактического или предупредительного действия. В качестве дополнения или альтернативы, терапевтически эффективное количество можно вводить после начала нежелательного иммунного ответа для терапевтического действия. Эффективное количество будет изменяться в зависимости от возраста, пола, расы, общего состояния пациента и т.д., тяжести состояния, которое лечат, продолжительности лечения, природы любого сопутствующего лечения, используемого фармацевтически приемлемого носителя и тому подобных факторов в рамках знаний и компетенции специалистов в данной области. В соответствующих случаях "эффективное количество" в каждом отдельном случае может определить средний специалист в данной области, обратившись к соответствующим источникам и литературе и/или путем проведения обычного исследования (например, см. Gennaro и др., ред. Remington's The Science and Practice of Pharmacy, 20oe издание, (2000), Lippincott Williams and Wilkins, Балтимор, Мэриленд; Braunwald и др., ред. Harrison's Principles of Internal Medicine, 15oe издание, (2001), McGraw Hill, NY; Berkow и др., ред. The Merck Manual of Diagnostics and Therapy, (1992), Merck Research Laboratories, Рауэй, Нью-Джерси).
В одном варианте реализации настоящего изобретения предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения аутоиммунного заболевания.
В одном варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения аутоиммунного заболевания.
В настоящем изобретении также предложен способ предотвращения или лечения аутоиммунного заболевания, включающий этап введения фармацевтически эффективного количества популяции CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+ CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению нуждающемуся в этом пациенту.
В данной заявке термин "аутоиммунное заболевание" относится к заболеванию, при котором иммунная система вырабатывает иммунный ответ (например, В-клеточный или Т-клеточный ответ) против антигена, который является частью нормального хозяина (то есть, представляет собой аутоантиген), с последующим повреждением тканей. При аутоиммунном заболевании иммунная система хозяина не может распознать определенный антиген как "собственный", и возникает иммунная реакция против тканей хозяина, экспрессирующих указанный антиген.
Примеры аутоиммунных заболеваний, поражающих людей, включают ревматоидный артрит, ювенильный олигоартрит, вызванный коллагеном артрит, вызванный адъювантом артрит, увеит, синдром Шегрена, множественный склероз, экспериментальный аутоиммунный энцефаломиелит, воспалительное заболевание кишечника (например, болезнь Крона и язвенный колит), аутоиммунную атрофию желудка, обыкновенную пузырчатку, псориаз, витилиго, диабет 1 типа, диабет без ожирения, тяжелую миастению, болезнь Грейвса, тиреоидит Хашимото, склерозирующий холангит, склерозирующий сиаладенит, системную красную волчанку, аутоиммунную тромбоцитопеническую пурпуру, синдром Гудпасчера, болезнь Аддисона, системный склероз, полимиозит, дерматомиозит, приобретенную гемофилию, тромбическую тромбоцитопеническую пурпуру и тому подобные заболевания.
В другом варианте реализации настоящего изобретения предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения хронических воспалительных заболеваний.
В одном варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения хронических воспалительных заболеваний.
Примеры хронических воспалительных заболеваний, поражающих людей, включают, без ограничения перечисленными: неаутоиммунное воспалительное заболевание кишечника, послеоперационные спайки, ишемическую болезнь сердца, фиброз печени, синдром острой дыхательной недостаточности, острый воспалительный панкреатит, вызванный эндоскопической ретроградной холангиопанкреатографией панкреатит, ожоги, атерогенез коронарных, церебральных и периферических артерий, аппендицит, холецистит, дивертикулит, висцеральные фиброзные расстройства, заживление ран, образование шрамов на коже (келоиды, гнойный гидраденит), гранулематозные расстройства (саркоидоз, первичный билиарный цирроз), астму, гангренозную пиодермию, синдром Свита, болезнь Бехчета, первичный склерозирующий холангит и абсцесс.
В другом варианте реализации настоящего изобретения предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения отторжения трансплантата (или индуцирования иммунологической толерантности к трансплантату) или предотвращения или лечения РТПХ.
В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения отторжения трансплантата (или индуцирования иммунологической толерантности к трансплантату) или предотвращения или лечения РТПХ.
В настоящем изобретении также предложен способ предотвращения или лечения реакции «трансплантат против хозяина» (РТПХ) или отторжения трансплантата (или индуцирования иммунологической толерантности к трансплантату), включающий этап введения фармацевтически эффективного количества популяции CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению нуждающемуся в этом пациенту.
В данной заявке в объем термина "отторжение трансплантата" входит как острое, так и хроническое отторжение трансплантата. "Острое отторжение" представляет собой отторжение иммунной системой реципиента ткани трансплантата, когда трансплантированная ткань иммунологически чужеродна. Острое отторжение характеризуется инфильтрацией ткани трансплантата иммунными клетками реципиента, которые осуществляют эффекторную функцию и разрушают ткань трансплантата. Начало острого отторжения быстрое и, как правило, происходит у людей в течение нескольких недель после операции трансплантации. Как правило, острое отторжение можно ингибировать или подавить иммуносупрессорными лекарственными средствами, такими как рапамицин, циклоспорин, моноклональное антитело к CD40L и тому подобные лекарственные средства. "Хроническое отторжение трансплантата", как правило, происходит у людей в течение от нескольких месяцев до нескольких лет после приживления трансплантата, даже при успешном подавлении острого отторжения. Фиброз является общим фактором хронического отторжения всех типов трансплантатов органов.
Термин "трансплантация" и его варианты относится к помещению трансплантата (также называемого имплантатом) в реципиента, при этом трансплантация либо сингенная (когда донор и реципиент являются генетически идентичными), либо аллогенная (когда донор и реципиент различного генетического происхождения, но одного вида), либо ксеногенная (когда донор и реципиент принадлежат к различным видам). Таким образом, в обычной ситуации хозяин представляет собой человека и трансплантат представляет собой изотрансплантат, полученный из человека того же или отличного генетического происхождения. При другом сценарии трансплантат получают из вида, отличного от вида, в который его трансплантируют, включая животных из филогенетически отдаленного вида, например, сердце павиана трансплантируют хозяину-человеку.
В одном варианте реализации донор трансплантата представляет собой человека. Донор трансплантата может представлять собой живого донора или мертвого донора, то есть, донора-трупа.
В одном варианте реализации трансплантат представляет собой орган, ткань или клетки.
В данной заявке термин "орган" относится к твердому васкуляризованному органу, который выполняет определенную функцию или группу функций в организме. Термин "орган" включает, но не ограничен перечисленными органами: сердце, легкое, почку, печень, поджелудочную железу, кожу, матку, кость, хрящ, тонкий или толстый кишечник, мочевой пузырь, головной мозг, грудь, кровеносные сосуды, пищевод, фаллопиеву трубу, желчный пузырь, яичники, поджелудочную железу, предстательную железу, плаценту, спинной мозг, конечность, включая верхнюю и нижнюю конечности, селезенку, желудок, яички, тимус, щитовидную железу, трахею, мочеточник, уретру. В данной заявке термин "ткань" относится к любому типу ткани у человека или животных и включает, но не ограничен перечисленными тканями: ткань сосуда, ткань кожи, ткань печени, ткань поджелудочной железы, нервную ткань, ткань мочеполовой системы, ткань желудочно-кишечного тракта, ткань скелета, включая кость и хрящ, жировую ткань, соединительную ткань, включая сухожилия и связки, амниотическую ткань, хорионическую ткань, ткань твердой мозговой оболочки, ткань перикарда, мышечную ткань, железистую ткань, ткань лицевой области, ткань глаза.
В данной заявке термин "клетки" относится к композиции, обогащенной интересующими клетками, предпочтительно к композиции, содержащей по меньшей мере приблизительно 20%, приблизительно 30%, приблизительно 40%, предпочтительно по меньшей мере приблизительно 50%, приблизительно 60%, еще более предпочтительно по меньшей мере приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80% указанных клеток.
В некоторых вариантах реализации клетки выбраны из группы, состоящей из мультипотентных гематопоэтических стволовых клеток, полученных из костного мозга, периферической крови или пуповинной крови; или плюрипотентных (т.е. эмбриональных стволовых клеток (ЭСК), или индуцированных плюрипотентных стволовых клеток (ИПСК)), или дифференцированных клеток, полученных из мультипотентных стволовых клеток, из различных линий дифференцировки, например, кардиомиоцитов, бета-клеток поджелудочной железы, гепатоцитов, нейронов и т.д.
В одном варианте реализации композицию клеток применяют для аллогенной трансплантации гематопоэтических стволовых клеток (ТГСК), и, следовательно, она содержит мультипотентные гематопоэтические стволовые клетки, обычно полученные из костного мозга, периферической крови или пуповинной крови.
ТГСК может вылечить пациентов с лейкозом и лимфомами. Тем не менее, значительным ограничением аллогенной НСТ является развитие реакции «трансплантат против хозяина» (РТПХ), которая встречается в тяжелой форме приблизительно у 30-50% людей, которые получают данную терапию.
В другом варианте реализации настоящего изобретения предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения любой нежелательной иммунной реакции против терапевтического белка.
В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, размноженных CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения в способе предотвращения или лечения любой нежелательной иммунной реакции против терапевтического белка.
В настоящем изобретении также предложен способ предотвращения или лечения любой нежелательной иммунной реакции против терапевтического белка, включающий этап введения фармацевтически эффективного количества популяции CD8+ клеток Treg человека согласно настоящему изобретению, в частности, популяции CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению нуждающемуся в этом пациенту.
В данной заявке термин "нежелательный иммунный ответ против терапевтического белка" относится к любой нежелательной иммунной реакции, направленной на белки, экспрессируемые в ходе генотерапии, и/или на терапевтические белки, такие как фактор VIII (гемофилия А) и другие факторы свертывания крови, на заместительную ферментную терапию, моноклональные антитела (например, натализумаб, ритуксимаб, инфликсимаб), поликлональные антитела, ферменты или цитокины (например, IFNβ).
В другом варианте реализации настоящего изобретения предложена выделенная популяция CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения для предотвращения или лечения аллергий.
В другом варианте реализации настоящего изобретения предложена выделенная популяция размноженных CD8+ клеток Treg человека согласно настоящему изобретению, в частности, выделенная популяция размноженных CD8+CD45RClowклеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению для применения для предотвращения или лечения аллергий.
В настоящем изобретении также предложен способ предотвращения или лечения аллергии, включающий этап введения фармацевтически эффективного количества популяции CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, согласно настоящему изобретению нуждающемуся в этом пациенту.
В данной заявке термин "аллергия" или "аллергии" относится к расстройству (или ненадлежащей реакции) иммунной системы. Аллергические реакции возникают на обычно безвредные вещества окружающей среды, известные как аллергены; данные реакции приобретенные, предсказуемые и быстрые. Строго говоря, аллергия представляет собой одну из четырех форм гиперчувствительности и называется гиперчувствительностью I типа (или незамедлительной). Она характеризуется избыточной активацией определенных белых кровяных клеток, называемых тучными клетками и базофилами по типу антитела, известного как IgE, приводящей к очень сильному воспалительному ответу. Обычные аллергические реакции включают экзему, крапивницу, сенную лихорадку, астму, пищевые аллергии и реакции на яд жалящих насекомых, таких как осы и пчелы.
В одном варианте реализации субъект представляет собой пациента.
В одном варианте реализации субъект страдает от хронического воспалительного заболевания (предпочтительно, ему поставлен данный диагноз).
В одном варианте реализации субъект страдает от аутоиммунного заболевания (предпочтительно, ему поставлен данный диагноз).
В одном варианте реализации субъекта ранее подвергали трансплантации или будут подвергать трансплантации.
В одном варианте реализации субъект ранее получал терапевтический белок или будет получать терапевтический белок.
В одном варианте реализации субъект страдает от аллергии (предпочтительно, ему поставлен данный диагноз).
В одном варианте реализации субъекта лечат иммуносупрессорным лекарственным средством, таким как, например, рапамицин, циклоспорин А, мофетил микофенолата, метилпреднизолон, такролимус, или комбинациями перечисленных лекарственных средств. В другом варианте реализации субъекта не лечат иммуносупрессорным лекарственным средством, таким как, например, рапамицин, циклоспорин А, мофетил микофенолата, метилпреднизолон, такролимус, или комбинациями перечисленных лекарственных средств.
Прогностические способы настоящего изобретения.
В другом аспекте настоящего изобретения предложен способ in vitro определения того, есть ли у пациента риск отторжения трансплантата, РТПХ, хронических воспалительных заболеваний, аутоиммунных заболеваний, нежелательного иммунного ответа против терапевтических белков или аллергий (как описано выше), включающий этап определения присутствия CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, в биологическом образце, полученном из указанного пациента, с помощью способа согласно настоящему изобретению, при этом присутствие CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, указывает на пониженный риск отторжения трансплантата, РТПХ, хронических воспалительных заболеваний, аутоиммунных заболеваний, нежелательного иммунного ответа против терапевтических белков или аллергий.
В данной заявке термин "риск" относится к вероятности того, что через некоторый период времени будет происходить некоторое событие, такое как начало отторжения трансплантата, и может означать "абсолютный" риск или "относительный" риск для субъекта. Абсолютный риск можно измерить либо на основании фактического наблюдения после измерения для соответствующей временной группы, либо на основании заданных значений, определенных для статистически обоснованных ретроспективных групп, которые наблюдали в течение соответствующего периода времени. Относительный риск относится к отношению абсолютных рисков для некоторого пациента по сравнению либо с абсолютными рисками групп с низким риском, либо со средним популяционным риском, который может изменяться в зависимости от того, как оценивают клинические факторы риска. Также широко используют отношения шансов, отношение положительных событий к отрицательным событиям для данного результата анализа (шансы оценивают согласно формуле р/(1-р), где р представляет собой вероятность события и (1-р) представляет собой вероятность отсутствия события).
В объем термина "определение риска" в контексте настоящего изобретения входит предсказание правдоподобия, шансов или вероятности того, что может произойти некоторое событие. Определение риска также может включать предсказание клинических параметров в будущем, обычных значений лабораторных факторов риска, таких как возраст, несовпадение пола, HLA-тестирование и т.д.; либо в абсолютных, либо в относительных величинах по сравнению с ранее измеренной популяцией. Способы согласно настоящему изобретению можно применять для получения категориальных показателей риска отторжения трансплантата, таким образом, определяя спектр риска для категории подвергнутого трансплантации пациента, у которого определили наличие риска отторжения трансплантата.
В данной заявке термин "определение присутствия" включает качественное и/или количественное детектирование (т.е. детектирование и/или измерение присутствия) со сравнением или без сравнения с контролем или с заранее определенным значением. В данной заявке "детектирование" означает определение того, присутствуют в биологическом образце или нет CD8+ клетки Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клетки Treg человека, секретирующие IFNγ+IL-10+IL-34+, описанные выше в данной заявке, и "измерение" означает определение в биологическом образце количества CD8+ клеток Treg человека согласно настоящему изобретению, в частности, количество CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке.
В данной заявке термин "биологический образец" имеет обычное в данной области значение и относится к любому образцу, который можно получить из организма пациента с целью оценки in vitro. Предпочтительный биологический образец представляет собой образец крови (например, образец цельной крови, образец сыворотки или образец плазмы), в частности, образец крови, полученный из подвергнутого трансплантации пациента или пациента, страдающего от аутоиммунного заболевания или аллергии.
В еще одном аспекте настоящего изобретения предложен способ in vitro определения толерантности подвергнутого трансплантации пациента (реципиента), включающий этап определения присутствия CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, в биологическом образце, полученном из указанного подвергнутого трансплантации пациента с помощью способа согласно настоящему изобретению, при этом присутствие CD8+ клеток Treg человека согласно настоящему изобретению, в частности, CD8+CD45RClowклеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, описанных выше в данной заявке, указывает на иммунологическую толерантность.
В данной заявке термин "толерантность" или "иммунологическая толерантность" относится к состоянию отсутствия ответа иммунной системы на вещества или ткани, которые обладают способностью вызывать иммунный ответ. В данной заявке термин "иммунный ответ" включает опосредованные Т-клетками и/или опосредованные В-клетками иммунные ответы. Примеры иммунных ответов включают ответы Т-клеток, например, продукцию цитокинов и клеточную цитотоксичность, кроме того, термин "иммунный ответ" включает иммунные ответы, на которые опосредованно воздействует активация Т-клеток, например, продукцию антител (гуморальные ответы) и активацию реагирующих на цитокины клеток, например, макрофагов. Иммунные клетки, вовлеченные в иммунный ответ, включают лимфоциты, такие как В-клетки и Т-клетки (CD4+, CD8+, Th1- и Th2-клетки); антигенпредставляющие клетки (например, профессиональные антигенпредставляющие клетки, такие как дендритные клетки); клетки-естественные киллеры; миелоидные клетки, такие как макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты.
Настоящее изобретение будет дополнительно проиллюстрировано следующими фигурами и примерами. Тем не менее, данные примеры и фигуры не должны истолковываться как каким-либо образом ограничивающие объем настоящего изобретения.
ФИГУРЫ
Фигура 1. CD8+CD45RClow клетки Treg человека более эффективно подавляют иммунные ответы против донора, чем CD4+CD25+CD127- клетки Treg человека. CD8+CD45RClow Т-клетки сравнивали с классическими CD4+CD25+CD127- клетками Treg по супрессорному действию на пролиферацию сингенных эффекторных CD4+CD25- Т-клеток, стимулированных аллогенными Т-обедненными МКПК, в диапазоне соотношений эффектор хупрессор от 16:1 до 1:4. Двухфакторный дисперсионный анализ с повторными измерениями (RM ANOVA). Пролиферацию нормировали на пролиферацию в отсутствие клеток Treg. *, р<0,05.
Фигура 2. Супрессорная активность CD8+CD45RClow клеток Treg человека предпочтительно повышалась при взаимодействии с пДК. Сортированные CD8+ клетки Treg стимулировали в течение 12 ч МАТ к CD3 и CD28 и анализировали их супрессорное действие на пролиферацию сингенных эффекторных CD4+CD25- Т-клеток, стимулированных аллогенными Т-обедненными МКПК (АПК), классическими ДК (кДК) или пДК, в диапазоне соотношений эффекторхупрессор от 8:1 до 1:1. Двухфакторный дисперсионный анализ с повторными измерениями. Пролиферацию нормировали на пролиферацию в отсутствие клеток Treg. *р<0,05, **, р<0,01.
Фигура 3. Субпопуляция CD8+CD45RClow клеток Treg человека экспрессирует GITR. Экспрессию рецептора поверхности клеток GITR анализировали с помощью проточной цитометрии на выделенных CD8+CD45RClow клетках Treg и выделенных CD8+CD45RChigh клетках Treg. Результаты выражены в виде среднего процента клеток (+/- стандартная ошибка среднего), экспрессирующих GITR.
Фигура 4. Экспрессия TGFβ-1, IL34, IFNγ и GITR повышена в Foxp3+CD8+ клетках Treg человека. МКПК выделяли из крови здоровых добровольцев с помощью градиента фиколла и стимулировали в течение 4 часов 50 нг/мл РМА и 1 мкг/мл иономицина в присутствии 10 мкг/мл брефельдина А. Выделенные популяции CD8+ клеток анализировали с помощью сортировки клеток с возбуждением флуоресценции (FACS) окрашенных на экспрессию Foxp3, IL-34, IFNγ, TGFβ-1 и GITR клеток после установки окон дискриминации (гейтов) для жизнеспособных клеток. Один типичный эксперимент. А. Экспрессию Foxp3 и CD45RC анализировали в CD8+ клетках Treg. В. Экспрессию IL-34, IFNγ, GITR и TGFβ-1 определяли в Foxp3+CD45RClow, Foxp3- CD45RClow и CD45RChigh CD8+ клетках.
Фигура 5. Определенные субпопуляции CD8+CD45RClow клеток Treg человека демонстрируют высокую супрессорную способность in vitro. А. Сортированные CD8+ клетки Treg стимулировали в течение 24 ч МАТ к CD3 и к CD28, сортировали по секреции IFNγ и/или IL-10 и исследовали на супрессорную активность в диапазоне соотношений эффекторхупрессор в анализе реакции смешанной культуры лимфоцитов (реакции СКЛ), в котором сингенные CD4+CD25- Т-клетки, меченые CFSE, стимулировали аллогенными Т-обедненными МКПК. Сортированные CD8+ клетки Treg сравнивали с совокупностью CD8+ клеток Treg, стимулированных МАТ к CD3 + к CD28. Двухфакторный дисперсионный анализ с повторными измерениями. Пролиферацию нормировали на пролиферацию в отсутствие клеток Treg. **, р<0,01. В. Сортированные CD8+CD45RClow клетки Treg стимулировали в течение 12 ч 1 мкг/мл МАТ к CD3 и к CD28 и заново сортировали по экспрессии GITR с помощью FACS Aria. Анализировали супрессорное действие GITR+CD8+CD45RClow клеток Treg и GITR- CD8+CD45RClow клеток Treg на пролиферацию сингенных эффекторных CD4+CD25- Т-клеток, стимулированных аллогенными Т-обедненными МКПК, в диапазоне соотношений эффекторхупрессор от 32:1 до 1:1. Двухфакторный дисперсионный анализ с повторными измерениями. Пролиферацию нормировали на пролиферацию в отсутствие клеток Treg. **, р<0,01
Фигура 6. IFNγ, IL-10 и IL-34 представляют собой ключевые медиаторы супрессии CD8+CD45RClow клеток Treg. 50 мкг/мл очищенных блокирующих AT против цитокинов IL-34 (α-IL-34), IL-10 (α-IL-10) или IFNγ (α-IFNγ) или против их рецепторов IL-10R (α-IL-10R) или IFNγR (α-IFNγR) добавляли в день 0 анализа совместного культивирования, применяя сортированные CD8+CD45RClow Т-клетки и сингенные меченые CFSE эффекторные CD4+CD25- Т-клетки, стимулированные аллогенными Т-обедненными МКПК. Пролиферацию в присутствии клеток Treg нормировали на пролиферацию в отсутствие клеток Treg. Супрессию в присутствии блокирующих AT нормировали на супрессию в присутствии AT изотипического контроля.
Фигура 7. Супрессорная активность CD8+CD45RClow клеток Treg человека зависит от контактов. Эксперименты Transwell проводили, как описано далее: Сортированные CD8+ клетки Treg стимулировали в течение 12 ч МАТ к CD3 и к CD28 и анализировали их супрессорное действие на пролиферацию сингенных эффекторных CD4+CD25- Т-клеток, стимулированных аллогенными Т-обедненными МКПК, после 5 дней культивирования в присутствии IL-2. Аллогенные Т-обедненные МКПК добавляли как в верхнюю, так и в нижнюю лунку. Клетки Treg добавляли в верхнюю лунку, a CD4+CD25- Т-клетки - в нижнюю лунку в диапазоне соотношений эффекторхупрессор от 1:1 до 1:4. Двухфакторный дисперсионный анализ с повторными измерениями. Пролиферацию нормировали на пролиферацию в отсутствие клеток Treg. *, р<0,05.
Фигура 8. Значительное размножение как свежесортированных, так и размороженных CD8+CD45RClow клеток Treg после 14 дней стимуляции. А. Сортированные CD8+ клетки Treg стимулировали в день 0 аллогенными АПК (АПК), необязательно МАТ к CD3 и к CD28 (поли), и снова стимулировали или не стимулировали (обозначено X) такими же АПК (АПК) или АПК и МАТ к CD3 + к CD28 (поли). На диаграмме представлена кратность размножения клеток, полученных в 14-дневной культуре. В. Свежесортированные (свежие) или размороженные CD8+CD45RClow клетки высевали при концентрации 3,3×105 клеток/мл в полной среде с аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК и 1 мкг/мл AT к CD3 и к CD28 в день 0. В день 7 клетки Treg снова стимулировали 1 мкг/мл AT к CD3 и к CD28. В дни 0, 7, 10 и 12 культуральную среду дополняли 1000 ед/мл IL-2 человека и 10 нг/мл IL-15 человека. В день 14 анализировали производительность размножения клеток Treg. На диаграмме представлена кратность размножения клеток, полученных в 14-дневной культуре. Для размороженных клеток выявили значительно большее размножение. Т-критерий Манна-Уитни ***, р<0,001.
Фигура 9. Размноженные CD8+ клетки Treg выживают в присутствии иммуносупрессорных лекарственных средств. Сортированные CD8+ клетки Treg стимулировали в день 0 аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК и 1 мкг/мл AT к CD3 и к CD28. В день 7 клетки Treg снова стимулировали 1 мкг/мл AT к CD3 и к CD28. В дни 0, 7, 10 и 12 культуральную среду дополняли IL-2 человека (1000 ед/мл) и IL-15 человека (10 нг/мл). В день 14 клетки Treg снова стимулировали аллогенными АПК в присутствии или в отсутствие (не лечили - НЛ) иммуносупрессорных лекарственных средств (ИС): циклоспорина А (ЦсА), мофетила микофенолата (МФА), метилпреднизолона (МПр), рапамицина (Рапа) или такролимуса (Такро), - и в присутствии или в отсутствие IL-2/IL-15. Выживаемость Treg анализировали через 6 дней. На диаграмме представлен процент выживаемости клеток, полученных после последних 6 дней культивирования. Процент выживаемости нормировали на пролиферацию в день 14 перед добавлением иммуносупрессорных лекарственных средств (ИС).
Фигура 10. CD8+ клетки Treg пролиферируют более эффективно, чем CD4+ клетки Treg при таких же условиях культивирования. Сортированные CD8+CD45RClow (CD8+) и CD4+CD25highCD127low (CD4+) клетки Treg стимулировали аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК и 1 мкг/мл AT к CD3 и к CD28 в день 0. В дни 7 и 14 клетки Treg снова стимулировали 1 мкг/мл AT к CD3 и к CD28. В дни 0, 7, 10, 12, 14, 17 и 19 культуральную среду дополняли 1000 ед/мл IL-2 человека и 10 нг/мл IL-15 человека. Количество размноженных Treg анализировали каждые 7 дней. Двухфакторный апостериорный критерий Бонферрони с повторными измерениями *, р<0,05
Фигура 11. Размноженные CD8+CD45RClow клетки Treg значительно более эффективно подавляют ответы аллогенных CD4+CD25- эффекторных Т-клеток. Исследовали супрессорную активность клеток Treg, размноженных в течение 7 дней в присутствии АПК или МАТ к CD3+МАТ к CD28+АПК, на сингенные CD4+CD25- Т-клетки (сортированные из клеток Treg донора), стимулированные аллогенными АПК, которые использовали для размножения. По размороженным, сортированным и неразмноженным клеткам Treg (обозначенным X) из того же донора определяли исходную супрессорную активность. Пролиферацию нормировали на пролиферацию в отсутствие клеток Treg.
Фигура 12. Размноженные CD8+CD45RClow клетки Treg обогащали секретирующими IFNγ, IL-10 и IL-34 клетками Treg. Экспрессию цитокинов (IL-10, IL-34 и IFNγ) размноженными в течение 14 дней CD8+CD45RClow клетками Treg ("размноженные") анализировали и сравнивали с таковой для CD8+CD45RClow клеток Treg до размножения ("свежие"). **р<0,01, ***р<0,001.
Фигура 13. В супернатанте CD8+CD45RClow клеток Treg можно обнаружить повышенную секрецию IFNγ. CD8+CD45RClow клетки стимулировали 1 мкг/мл AT к CD3 и к CD28 в течение ночи и либо добавляли в анализ реакции СКЛ, в котором сингенные CD4+CD25- эффекторные Т-клетки стимулировали аллогенными Т-обедненными МКПК при соотношении 1:1 эффекторхупрессор, либо высевали при плотности 3,3×105 клеток/мл в полной среде с аллогенными Т-обедненными МКПК при соотношении 1:4 Treg: АПК и с 1 мкг/мл AT к CD3 и к CD28 для размножения в течение 14 дней. В день 7 клетки Treg снова стимулировали 1 мкг/мл AT к CD3 и к CD28 и сменяли культуральную среду. В дни 0, 7, 10 и 12 культуральную среду дополняли 1000 ед/мл IL-2 человека и 10 нг/мл IL-15 человека. IFNγ измеряли в культуральных супернатантах с помощью твердофазного иммуноферментного анализа (ELISA) в день 14.
Фигура 14. Размноженные CD8+CD45RClow клетки Treg эффективно подавляли отторжение аллогенной кожи человека. А. Кожу человека трансплантировали мышам NSG и оставляли на 15 дней для приживления. 5×106 МКПК, аллогенных для трансплантата, затем переносили в брюшную полость с добавлением или без сингенных размноженных в течение 15 дней клеток Treg (eTreg). В. Оценивали отторжение трансплантата и присваивали баллы. С. Оценивали процент выживаемости мышей.
Фигура 15. Размноженные CD8+CD45RClow клетки Treg эффективно подавляли РТПХ у гуманизированных мышей. А. Для экспериментов с ксеногенной РТПХ 1,5×107 сингенных МКПК переносили внутривенно с добавлением или без поликлонально размноженных клеток Treg (eTreg) при соотношении 1:1 и 1:2 МКПК : размноженные клетки Treg облученным за 12 ч до этого мышам NSG. В. Контролировали приживление клеток МКПК человека в крови, и развитие ТПХ оценивали по потере массы тела. С. Оценивали процент выживаемости мышей. *р<0,05, **р<0,01.
ПРИМЕР. Новая популяция CD8+CD45RClow клеток Treg человека, секретирующих IFNγ+IL-10+IL-34+, эффективно подавляет отторжение трансплантата.
Материалы и методы.
Сбор крови от здоровых добровольцев и разделение МКПК.
Кровь собирали от здоровых доноров в Etablissement Francais du Sang (Нант, Франция). Одобрение данного исследования получали в экспертных советах организации. Подписанное информированное согласие было предоставлено в соответствии с руководствами экспертного совета. Кровь разбавляли ФБР в 2 раза перед выделением МКПК путем центрифугирования в градиенте плотности фиколла (Ficoll-Paque) (Eurobio, Куртабеф, Франция) при 2000 об/мин в течение 20 мин при комнатной температуре без торможения. Собранные МКПК промывали 50 мл ФБР при 1800 об/мин в течение 10 мин и оставшиеся эритроциты и тромбоциты удаляли после инкубации в течение 5 мин в гипотоническом растворе и центрифугирования при 1000 об/мин в течение 10 мин. Когда это было необходимо, МКПК замораживали в ДМСО : SVF 1:9 и дважды промывали в среде с 10% SVF для размораживания.
Выделение клеток.
Т-клетки получали из МКПК путем отрицательной селекции с помощью элютриации (DTC Plateforme, Нант) и обеднения с использованием магнитных гранул (Dynabeads, Invitrogen) В-клетками (CD19+ клетками) и оставшимися моноцитами (CD14+ и CD16+ клетками) перед сортировкой CD3+CD4+CD25- клеток в качестве иммунореактивных клеток, CD3+CD4-CD45RClow в качестве CD8+ клеток Treg и CD3+CD4+CD25-CD127low клеток в качестве CD4+ клеток Treg. Клетки Treg, сортированные из размороженных МКПК, стимулировали в течение 24 ч МАТ к CD3 и к CD28 в присутствии 250 ед/мл IL-2 перед посевом. Секретирующие IFNγ и/или IL-10 клетки сортировали после 24 ч поликлональной стимуляции клеток Treg, применяя наборы для детектирования в анализе секреции от Miltenyi. Для сортировки клеток использовали FACS ARIA I (BD Biosciences, Маунтин-Вью, Калифорния).
АПК, используемые в качестве стимулирующих клеток, получали путем магнитного обеднения CD3+ клетками и облучения 35 грей. Клетки пДК и кДК получали путем обеднения CD3-, CD14- и CD16-положительными клетками и сортировки Nrp1+ или CD1c+ клеток, соответственно.
Моноклональные антитела и проточная цитометрии.
Для анализа интерлейкинов IFNγ и Foxp3, МКПК стимулировали РМА (50 нг/мл) и иономицином (1 мкг/мл) в течение 7 ч в присутствии брефельдина А (10 мкг/мл) в течение последних 4 ч.
Флуоресценцию измеряли с помощью цитометра LSR II или Canto II (BD Biosciences, Маунтин-Вью, Калифорния) для определения фенотипа и функционального анализа, соответственно, и применяли программное обеспечение FLOWJO (Tree Star, Inc. США) для анализа результатов. Сначала клетки отбирали (с помощью гейта) по их морфологии, исключая погибшие клетки путем выбора жизнеспособных клеток.
Реакция смешанной культуры лимфоцитов.
Супрессорную активность Treg оценивали на сингенных эффекторных CD4+CD25- Т-клетках (полученных из донора клеток Treg), стимулированных аллогенными АПК. Исследовали диапазон отношений стимулятор : эффектор, чтобы добиться значительной пролиферации иммунореактивных клеток при стимуляции ДК, другие эксперименты осуществляли при соотношении 1:1 АПК : реактивная клетка. Блокирующие МАТ или МАТ изотипического контроля добавляли при концентрации 50 мкг/мл в день 0 совместного культивирования. Мембрану Transwell (диаметр пор 0,4 мкм) применяли, чтобы отделить клетки Treg от иммунореактивных клеток, обе популяции клеток находились в контакте со стимулирующими клетками. Добавляли 1000 ед/мл IL-2 (Miltenyi), чтобы оценить устранение цитокинов клетками Treg. Супрессорную активность размноженных клеток Treg из размороженных МКПК оценивали на сингенных эффекторных клетках, стимулированных аллогенными АПК из того же донора, которого использовали для размножения, и сравнивали с нестимулированными клетками Treg, сортированными из того же донора, из которого были получены размороженные МКПК. Пролиферацию меченых CFSE иммунореактивных клеток анализировали с помощью проточной цитометрии после 4,5 дней совместного культивирования в среде с 5% сывороткой АВ путем установки окон дискриминации для CD3+CD4+ живых клеток (отрицательных по окрашиванию DAPI) и исключения меченых CPD-V450 CD4+Treg, когда их добавляли.
Размножение клеток Treg.
Treg высевали при концентрации приблизительно 3×105/мл в среде с 5% сывороткой АВ, дополненной IL-2 (1000 ед/мл) и IL-15 (10 нг/мл), и стимулировали использованными в качестве покрытия МАТ к CD3 (1 мкг/мл), растворимыми МАТ к CD28 (1 мкг/мл) и/или аллогенными АПК при соотношении 1:4 Treg : АПК. В день 7 размноженные клетки разбавляли до концентрации 1×105/мл и снова стимулировали или не стимулировали. Снова добавляли цитокины IL-2 и IL-15 в дни 0, 7, 10 и 12. В день 14 размноженные клетки Treg промывали ФБР перед применением.
Модели гуманизированных мышей.
Мышей NOD/SCID/IL-2Rγ-/- (NSG) в возрасте 8-12 недель разводили в собственных вивариях в условиях, не содержащих специфической патогенной микрофлоры (SPF). Данное исследование осуществляли в строгом соответствии с протоколом, одобренным Комитетом по этике исследований на животных Pays de la Loire (номер разрешения СЕЕА.2012.155).
Для экспериментов с ксеногенной РТПХ переносили внутривенно 1,5×107 сингенных МКПК, с добавлением или без поликлонально размноженных клеток Treg при соотношении 1:1 и 1:2 МКПК : размноженные клетки Treg, облученным за 12 ч до этого мышам NSG. Контролировали приживление в крови клеток МКПК человека, и развитие ТПХ оценивали по потере массы тела и гистопатологическому анализу легкого, печени, кишечника, селезенки, почек.
Для модели трансплантации из CHU, Нант, предоставили кожу человека от здоровых добровольцев, и трансплантат приживался за 15 дней у мышей NSG. 5×106 МКПК, аллогенных для трансплантата, переносили интраперитонеально с добавлением или без сингенных размноженных в течение 15 дней клеток Treg. Оценивали балл отторжения трансплантата.
Результаты.
CD8+CD45RClow клетки Treg человека оказались более эффективными супрессорами иммунных ответов против донора, чем CD4+CD25+CD127- клетки Treg человека.
В предыдущих исследованиях описали участие CD8+CD45RClow регуляторных Т-клеток в приживлении трансплантата, вызванном обработкой CD40Ig, в модели аллотрансплантата сердца с несовпадением ГКГС у крыс (Guillonneau и др., 2007; Li и др., 2010). В обоих исследованиях подчеркнули ключевую роль IFNγ в вызванном CD40Ig приживлении аллотрансплантата.
Фенотипический анализ маркера CD45RC у здоровых индивидов показал, что маркер CD45RC дифференциально представлен у здоровых индивидов, что выявили путем наложения результатов для нескольких индивидов. Данная дифференциальная экспрессия не была связана с возрастом или полом.
Сначала супрессорную активность всей субпопуляции CD8+CD45RClow Т-клеток оценивали и сравнивали с супрессорной активностью хорошо известных CD4+CD25+CD127- клеток Treg, когда их добавляли в различных соотношениях в анализе реакции СКЛ, где меченые CFSE CD4+CD25- Т-клетки стимулировали аллогенными Т-обедненными МКПК (фигура 1). Интересно, что CD8+CD45RClow клетки Treg человека проявили значительно лучшую способность подавлять пролиферацию направленных против донора CD4+CD25- эффекторных Т-клеток по сравнению с CD4+CD25+CD127- клетками Treg, при всех соотношениях.
У крысы обнаружили предпочтительное взаимодействие CD8+CD45RClow клеток Treg с пДК для проявления CD8+CD45RClow клетками Treg оптимальной супрессорной активности. Таким образом, супрессорный потенциал CD8+CD45RClow клеток человека исследовали в присутствии различных соотношений кДК (CD3-CD19-CD1c+Nrp-1-), пДК (CD3+CD19-CD1c-Nrp-1+) по сравнению с Т-обедненными МКПК в качестве стимуляторов (фигура 2). Интересно, что в присутствии кДК наблюдали меньшую супрессорную активность CD8+CD45RClow клеток Treg по сравнению с присутствием пДК и Т-обедненными МКПК, позволяя предположить, что у человека, как и в случае крысы, пДК необходимы для опосредования супрессорной активности CD8+CD45RClow клеток Treg на CD4+ эффекторные Т-клетки.
В заключение, CD8+CD45RClow клетки Treg человека в присутствии пДК более эффективно подавляли ответы CD4+CD25+ эффекторных Т-клеток на донора, чем CD4+CD25+CD127- клетки Treg.
Субпопуляция CD8+CD45RClow клеток Treg экспрессирует IFNγ, IL-34 и IL-10.
Для того чтобы охарактеризовать CD8+CD45RClow Treg человека, проводили глубокий фенотипический анализ, применяя 13-цветную проточную цитометрию. Анализировали несколько маркеров, чтобы оценить существование субпопуляций внутри общей субпопуляции CD8+CD45RClow Treg: маркеры, ранее описанные на клетках Treg, такие как CD103, CTLA-4, GITR, или цитокины, такие как IFNγ, IL-34 или IL-10, а также известный маркер CD8+ клеток Treg человека, т.е., CD28 и CD122.
Скрининг маркеров выявил существено повышенную экспрессию CD69, CD71, CD103, Foxp3, Tbet, HLA-DR, CD154, IFNγ, IL-2 и IL-34 и пониженную экспрессию CD38 среди CD8+CD45RClow клеток Treg по сравнению с CD8+CD45RChigh Т-клетками, что в целом дает представление о профиле активированных протолерогенных клеток.
Анализ коэкспрессии CD45RC, CD28 и CD122 выявил, что у каждой субпопуляции был маркер CD45RC, но что не все CD8+CD28- клетки Treg и CD8+CD122+ клетки Treg содержали маркер CD45RClow, позволяя предположить, что каждый из данных маркеров позволяет идентифицировать различные субпопуляции клеток Treg.
Особенно интересно отметить, что наблюдали значительный уровень экспрессии IFNγ и IL-34 среди CD8+CD45RClow клеток Treg (приблизительно 60% и 20%, соответственно), при этом IL-34 по большей части коэкспрессировался секретирующими IL-10 клетками.
Экспрессию рецептора поверхности клеток GITR оценивали в CD8+CD45RClow клетках Treg и CD8+CD45RChigh клетках Treg (фигура 3). Анализ проточной цитометрии показал, что GITR на значительно более высоком уровне экспрессировался в популяции CD8+CD45RClow клеток Treg (приблизительно 15% клеток экспрессировали GITR), чем в популяции CD8+CD45RChigh клеток Treg (приблизительно 5% клеток экспрессировали GITR). Следовательно, среди CD8+CD45RClow клеток Treg присутствует субпопуляция GITR+CD8+CD45RClow клеток Treg.
Наконец, CD3+CD8+CD45RClow клетки Treg анализировали с помощью FACS путем окрашивания на экспрессию Foxp3, IL-34, IFNγ, TGFβ-1 и GITR после установки окон дискриминации для жизнеспособных клеток (фигура 4). CD3+CD8+CD45RClow клетки Treg получали из МКПК, стимулированных в течение 4 часов 50 нг/мл РМА и 1 мкг/мл иономицина в присутствии 10 мкг/мл брефельдина А. Только Foxp3+CD8+CD45RClow клетки Treg экспрессировали GITR, TGFb1 и IL-34. Foxp3+CD8+CD45RClow клетки Treg также экспрессировали более высокие уровни IFNγ, чем Foxp3-CD8+CD45RClow клетки Treg.
В заключение, экспрессия IL-34, TGFb1 и GITR сильно коррелировала с экспрессией Foxp3 в CD8+CD45RClow клетках Treg.
Субпопуляция CD8+CD45RClow клеток Treg, секретирующих IL-10+IL-34+IFNγ+, проявляет высокую супрессорную способность in vitro.
Оценивали супрессорную способность субпопуляции CD8+CD45RClow клеток Treg человека, экспрессирующих IFNγ и IL-34. Сначала субпопуляции CD8+CD45RClow клеток Treg сортировали на основании экспрессии IFNγ и IL-10, применяя набор для анализа детектирования секреции IFNγ или IL-10, позволяя сортировку живых клеток. Из наблюдения того, что IL-34 в большинстве случаев коэкспрессируется секретирующими IL-10 клетками, было выдвинуто предположение, что IL-10+ клетки также являлись IL-34+ клетками. Таким образом, отсортировали четыре субпопуляции CD8+CD45RClow клеток Treg: IL-10-(IL-34-)IFNγ-, IL-10-(IL-34-)IFNγ+, IL-10+(IL-34+)IFNγ- и IL-10+(IL-34+)IFNγ+ CD8+CD45RC1ow клетки Treg. Такие сортированные клетки затем добавляли в анализ реакции СКЛ, описанный выше (фигура 5А). Важно отметить, что IL-10+(IL-34+)IFNγ+CD8+CD45RClow клетки Treg проявляли значительно большую супрессорную активность, чем IL-10-(IL-34-)IFNγ+ CD8+CD45RClow клетки Treg, позволяя предположить ключевую роль IL-10 и IL-34.
В заключение, субпопуляция CD8+CD45RClow клеток Treg, секретирующих IL-10+IL-34+IFNγ+, проявляет высокую супрессорную способность in vitro.
GITR+ сортированные CD8+CD45RClow клетки Treg являются более эффективными супрессорами, чем GITR- CD8+CD45RClow Treg.
Аналогичные анализы проводли, подразделяя общую популяцию CD8+CD45RClow Treg по маркерам на поверхности клеток: GITR, CD38, HLA-DR, CD45RA, CD127, CD197, CD27, CD28, CD25. Хотя можно было наблюдать небольшую потерю супрессорной активности с некоторыми другими маркерами, такими как CD45RA и CD28, не было обнаружено значительных различий. За одним исключением, не наблюдали повышения супрессорной активности, позволяя предположить, что данные маркеры не могут быть использованы для дополнительного различения CD8+CD45RClow клеток Treg по супрессорной активности.
Тем не менее, наибольший интерес представлял тот факт, что GITR+CD3+CD8+CD45RClow клетки Treg более эффективно подавляли иммунные ответы против донора, чем GITR-CD3+CD8+CD45RClow клетки Treg (фигура 5В). В заключение, экспрессия GITR позволяет идентифицировать субпопуляцию CD8+ клеток Treg с более высокой супрессорной способностью по отношению к пролиферации аллогенных CD4+CD25- эффекторных Т-клеток.
Опосредованная CD8+CD45RClow Treg супрессорная активность зависит от секреции IL-34, IL-10 и IFNγ.
Затем были рассмотрены различные механизмы действия, которые могли лежать в основе супрессорной активности CD8+CD45RClow клеток Treg. Такие механизмы действия включали секрецию цитокинов, зависимую от контактов активность, лишение или уничтожение IL-2 для подавления пролиферации эффекторных Т-клеток.
Сначала, поскольку IFNγ, IL-34 и IL-10 позволяют отличить субпопуляцию CD8+CD45RClow Treg с наилучшей регуляторной активностью, исследовали продукцию цитокинов в супернатанте СКЛ. Анализ продукции цитокинов в супернатанте СКЛ к 5 дню продемонстрировал значительную продукцию IFNγ в присутствии CD8+CD45RClow Treg по сравнению с отсутствием клеток Treg и с CD8+CD45RChigh Т-клетками (фигура 13).
Для того чтобы дополнительно оценить роль IFNγ, IL-34 и IL-10 в опосредованной CD8+CD45RClow Treg супрессии, следующие блокирующие антитела добавляли в анализ супрессии СКЛ в присутствии CD8+CD45RClow клеток Treg: антитела к IL-34, к IL-10, к IL-10R, к IFNγ и к IFNγR (фигура 6). Интересно, что блокирование IL-34, IL-10 и IL-10R, IFNγ и IFNγR приводило к аналогичной утрате супрессорной активности CD8+CD45RClow клеток Treg по отношению к иммунному ответу CD4+CD25- Т-клеток против донора.
Опосредованная CD8+CD45RClow Treg супрессорная активность также зависит от контакта.
Для того чтобы определить важность контакта для опосредованной CD8+CD45RClow клетками Treg супрессии, проводили эксперименты Transwell (фигура 7). Пролиферацию меченых CFSE CD4+CD25- Т-клеток, стимулированных аллогенными Т-обедненными МКПК, в нижней камере оценивали в присутствии или в отсутствие CD8+CD45RClow клеток Treg в нижней или верхней камере. Полную утрату супрессорной активности наблюдали, когда CD8+CD45RClow клетки Treg добавляли отдельно в верхнюю камеру, что продемонстрировало необходимость контакта.
Так как это позволяет предположить супрессорные механизмы через уничтожение, далее исследовали опосредованную возрастающими соотношениями CD8+CD45RClow клеток Treg цитотоксичность по отношению к сингенным CD4+CD25- эффекторным Т-клеткам или аллогенным обедненным Т-клетками МКПК после 15 ч инкубации. Не наблюдали индукции некроза или позднего апоптоза по отношению к сингенным или аллогенным мишеням, тем не менее, наблюдали небольшую индукцию раннего апоптоза по отношению к обеим мишеням при высоких соотношениях мишень : эффектор (результаты не представлены). Отсутствие индукции конечной стадии апоптоза позволяет предположить, что цитотоксические механизмы играют небольшую роль в супрессорной активности, опосредованной CD8+CD45RClow клетками Treg.
CD8+CD45RClow клетки Treg можно эффективно размножить даже после размораживания.
Так как клеточная терапия с применением CD4+ клеток Treg является перспективным подходом, предотвращающим отторжение аллотрансплантата, и так как CD8+CD45RClow клетки Treg более эффективно, чем CD4+CD25highCD127- клетки Treg, ингибируют иммунный ответ против донора ex vivo (фигура 1), был создан протокол размножения CD8+CD45RClow клеток Treg.
Сначала определили наиболее эффективные условия размножения общей популяции CD8+CD45RClow клеток Treg, применяя различные соотношения АПК (соотношения от 1:1 до 1:16 Treg : АПК), различные источники сыворотки (сыворотка АВ, аутологическая плазма, Тех Mecs или 2% альбумин) и различные стимуляторы (поликлональные антитела к CD3 + к CD28 по сравнению с объединенными аллогенными Т-обедненными АПК).
Таким образом, обнаружили, что соотношение 1:4 Treg : АПК было необходимо и достаточно для эффективного 7-дневного размножения клеток Treg и что применение сыворотки АВ в культуральных средах приводило к эффективному размножению CD8+CD45RClow клеток Treg при таком соотношении. Далее наблюдали, что CD8+CD45RClow клетки Treg можно эффективно размножить до 1000 раз в течение 14 дней, даже после размораживания, при стимуляции не важно чем: аллогенными Т-обедненными АПК с добавлением или без поликлональных МАТ к CD3 + МАТ к CD28 начиная с дня 0 до дня 7 культивирования, в присутствии высокой дозы IL-2 и IL-15, и повторной стимуляции или начиная с дня 7 до дня 14 (фигура 8А).
Сравнивали размножение свежесортированных CD8+CD45RClow клеток Treg и размороженных CD8+CD45RClow клеток Treg после 14 дней культивирования (фигура 8В). В день 0 клетки стимулировали аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК и поликлональными AT к CD3 + к CD28. В день 7 клетки снова стимулировали AT к CD3 + к CD28. В дни 0, 7, 10 и 12 культуральную среду дополняли IL-2 и IL-15. После 14 дней свежесортированные CD8+CD45RClow клетки Treg размножились в 135 раз и размороженные CD8+CD45RClow клетки Treg размножились в 612 раз. Таким образом, размороженные CD8+CD45RClow клетки Treg пролиферировали более эффективно, чем свежесортированные CD8+CD45RClow клетки Treg.
В заключение, CD8+CD45RClow клетки Treg можно эффективно размножить, даже лучше - после размораживания.
Кроме того, оценивали выживаемость размноженных CD8+CD45RClow клеток Treg в присутствии иммуносупрессорных лекарственных средств (фигура 9). В день 0 клетки стимулировали аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК и поликлональными МАТ к CD3 + МАТ к CD28. В день 7 клетки снова стимулировали МАТ к CD3 + МАТ к CD28. В дни 0, 7, 10 и 12 культуральную среду дополняли IL-2 и IL-15. В день 14 клетки Treg снова стимулировали аллогенными АПК в присутствии или без иммуносупрессорных лекарственных средств (циклоспорина А, мофетила микофенолата, метилпреднизолона, рапамицина или такролимуса) и в присутствии или без IL-2/IL-15. В день 20 анализировали выживаемость клеток Treg. Выживаемость CD8+CD45RClow клеток Treg не изменялась в присутствии иммуносупрессорных лекарственных средств. Кроме того, CD8+CD45RClow клетки Treg пролиферировали в присутствии исследуемых иммуносупрессорных лекарственных средств, за исключением мофетила микофенолата. Пролиферация была более эффективной при добавлении IL-2/IL-15, позволяя предположить, что оба данных цитокина можно добавить in vivo в качестве добавки к CD8+ клеткам Treg для поддержания их пролиферации.
Наконец, пролиферацию CD8+CD45RClow клеток Treg и CD4+CD25highCD127low клеток Treg сравнивали при одинаковых условиях культивирования (фигура 10). В день 0 обе субпопуляции клеток Treg стимулировали в течение 21 дня аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК и поликлональными МАТ к CD3 + МАТ к CD28. В дни 7 и 14 клетки Treg снова стимулировали МАТ к CD3 + МАТ к CD28. В дни 0, 7, 10, 12, 14 и 19 культуральную среду дополняли IL-2 и IL-15. CD8+CD45RClow клетки Treg размножились в 354 раза, тогда как CD4+CD25high клетки Treg размножились лишь в 11 раз в ответ на поликлональную стимуляцию. Более того, эффективная и экспоненциальная пролиферация CD8+CD45RClow Treg сохранялась по меньшей мере до дня 21, в противоположность пролиферации CD4+CD25hlgh Treg, которая досигала плато в день 14.
Размноженные в течение 14 дней CD8+CD45RClow клетки Treg повышают продукцию IFNγ, IL-10 и IL-34 для ингибирования иммунного отторжения.
Важно отметить, что как аллогенные, так и поликлонально размноженные CD8+CD45RClow клетки Treg значительно более эффективно подавляли ответы аллогенных CD4+CD25- эффекторных Т-клеток, чем размороженные, сортированные и неразмноженные CD8+CD45RClow клетки Treg (фигура 11).
Кроме того, такие размноженные в течение 14 дней CD8+CD45RClow клетки Treg проявляли цитотоксическую активность, сравнимую с таковой для неразмноженных или размноженных в течение 7 дней CD8+CD45RClow клеток Treg, демонстрируя, что лучшая супрессорная способность, приобретаемая при размножении, не являлась следствием повышенной активности уничтожения у CD8+CD45RClow клеток Treg.
Наиболее важно отметить, что такой протокол размножения приводил к значительному обогащению CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-34+IL-10 (фигура 12).
IFNγ, вероятно, играет крайне важную роль в функционировании CD8+CD45RClow Treg.
Оценивали наличие IFNγ в супернатанте различных культур CD8+CD45RClow Treg (фигура 13). Выделенные CD8+CD45RClow клетки Treg стимулировали поликлональными AT к CD3 и к CD28 в течение ночи и либо добавляли в анализ реакции СКЛ, в котором сингенные CD4+CD25- эффекторные Т-клетки стимулировали аллогенными Т-обедненными МКПК при соотношении 1:1 эффекторхупрессор, либо стимулировали аллогенными Т-обедненными МКПК при соотношении 1:4 Treg : АПК в день 0 и поликлональными AT к CD3 и к CD28 в течение 14 дней размножения. В день 7 клетки снова стимулировали AT к CD3 и к CD28. В дни 0, 7, 10 и 12 культуральную среду дополняли IL-2 и IL-15. IFNγ измеряли в культуральном супернатанте с помощью ELISA в день 14. Секрецию IFNγ можно было обнаружить в присутствии эффекторных CD4+CD25- Т-клеток и АПК (в среднем, 2,5 нг/мл), но она повышалась после 6 дней инкубации с CD8+ клетками Treg (в среднем, 3,9 нг/мл) или в течение 14 дней размножения CD8+ клеток Treg (в среднем, 8,7 нг/мл) с МАТ к CD3 и CD28.
В заключение, высокие уровни IFNγ обнаружили в супернатантах культуры CD8+CD45RClow Treg, позволяя предположить крайне важную роль данного цитокина в функционировании CD8+CD45RClow Treg.
Размноженные CD8+CD45RClow клетки Treg, секретирующие IFNγ+IL-10+IL-34+, проявляют терапевтический эффект in vivo.
Наконец, супрессорную способность таких размноженных CD8+CD45RClow клеток Treg оценивали, применяя две различные модели трансплантации с использованием мышей NSG: модель отторжения аллотрансплантата кожи человека после инъекции аллогенных МКПК (фигура 14) и модель ксеногенной РТПХ после инъекции клеток МКПК человека (фигура 15).
В данных моделях сингенные размноженные CD8+CD45RClow клетки Treg вводили путем инъекции в то же время, что и МКПК, чтобы оценить их способность ингибировать иммунные ответы против донора путем измерения процента выживаемости, гистологии кожи и потери массы тела.
Интересно, что в обоих случаях совместный перенос размноженных CD8+CD45RClow клеток Treg значительно ингибировал отторжение трансплантата, демонстрируя потенциал CD8+CD45RClow клеток Treg в качестве клеточной терапии.
По всему тексту настоящей заявки различные источники описывают существующий уровень техники в области, к которой относится настоящее изобретение. Описания данных истояников настоящим включены в данное описание посредством ссылки.
Источники информации
Feng S. 2008 Long-term management of immunosuppression after pediatric liver transplantation: is minimization or withdrawal desirable or possible or both? Curr Opin Organ Transplant. Oct; 13(5):506-12.
Guillonneau, C., Hill, M., Hubert, F.X., Chiffoleau, E., Herve, C., Li, X.L., Heslan, M., Usal, C., Tesson, L., Menoret, S., et al. 2007. CD40Ig treatment results in allograft acceptance mediated by CD8CD45RC T cells, IFN-gamma, and indoleamine 2,3-dioxygenase. J Clin Invest 117:1096-1106.
Li, X.L., Menoret, S., Bezie, S., Caron, L., Chabannes, D., Hill, M., Halary, F., Angin, M., Heslan, M., Usal, C., et al. 2010. Mechanism and localization of CD8 regulatory T cells in a heart transplant model of tolerance. J Immunol 185:823-833.
Picarda, E., Bezie, S., Venturi, V., Echasserieau, K., Merieau, E., Delhumeau, A., Renaudin, K., Brouard, S., Bernardeau, K., Anegon, I., et al. 2014. МНС-derived allopeptide activates TCR-biased CD8+ Tregs and suppresses organ rejection. J Clin Invest 124:2497-2512.
Sadelain M, Brentjens R,

Streuli, M., Hall, L.R., Saga, Y., Schlossman, S.F., and Saito, H. 1987. Differential usage of three exons generates at least five different mRNAs encoding human leukocyte common antigens. J Exp Med 166:1548-1566.
--->
Перечень последовательностей
<110> INSERM (Institut National de la Sante et de la Recherche Medicale)
<120> Новая субпопуляция CD8+CD45RClow клеток Treg и ее применения
<130>CV - 833/PCT
<160> 18
<170> BiSSAP 1.3.6
<210> 1
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 1
Arg Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10 15
<210> 2
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 2
Asn Arg Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10 15
<210> 3
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 3
Arg Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
1 5 10 15
<210> 4
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 4
Arg Glu Glu Tyr Val Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10 15
<210> 5
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 5
Gln Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10 15
<210> 6
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 6
Arg Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Val Tyr Arg
1 5 10 15
<210> 7
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 7
Asn Arg Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Glu Phe Arg
1 5 10 15
<210> 8
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 8
Asn Arg Glu Glu Tyr Val Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10 15
<210> 9
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 9
Asn Gln Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10 15
<210> 10
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 10
Asn Arg Glu Glu Tyr Ala Arg Phe Asp Ser Asp Val Gly Val Tyr Arg
1 5 10 15
<210> 11
<211> 40
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 11
Arg Leu Leu Ala Arg Leu Ile Tyr Asn Arg Glu Glu Tyr Ala Arg Phe
1 5 10 15
Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu Leu Gly Arg Pro
20 30
Ser Ala Glu Tyr Arg Asn Lys Gln
35 40
<210> 12
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 12
Tyr Leu Arg Tyr Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
1 5 10 15
<210> 13
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 13
Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu Leu Gly Arg Pro
1 5 10 15
<210> 14
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 14
Tyr Leu Arg Tyr Asp Ser Asp Val Gly Glu Tyr Arg
1 5 10
<210> 15
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 15
Tyr Leu Arg Tyr Asp Ser Asp Val Gly Glu Tyr Arg Ala Val
1 5 10
<210> 16
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 16
Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu Leu Gly Arg
1 5 10
<210> 17
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 17
Leu Arg Tyr Asp Ser Asp Val Gly Glu Tyr Arg Ala Val Thr Glu
1 5 10 15
<210> 18
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Пептид, полученный из молекулы MHC II класса
<400> 18
Ser Asp Val Gly Glu Tyr Arg
1 5
<---
Реферат
Настоящее изобретение относится к клеточной биологии, в частности к выделенной популяции CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, фармацевтической композиции для предотвращения или лечения отторжения трансплантата, РТПХ, хронических воспалительных заболеваний, аутоиммунных заболеваний, нежелательного иммунного ответа против терапевтических белков или аллергий, а также способам детектирования, выделения и размножения CD8+CD45RClow клеток Treg, секретирующих IFNγ+IL-10+IL-34+, применению указанной популяции для предотвращения или лечения и способу определения риска указанных заболеваний. Настоящее изобретение раскрывает новую субпопуляцию CD8+CD45RClow клеток Treg. 7 н. и 6 з.п. ф-лы, 15 ил., 1 пр.

Комментарии