Антиген-связывающий белок, распознающий происходящий из mage-a4 пептид - RU2777074C2
Код документа: RU2777074C2
Чертежи










Описание
[Область техники]
[0001]
В настоящем изобретении предложен антиген-связывающий белок, распознающий происходящий из MAGE-A4 пептид и т.п.
[Уровень техники]
[0002]
В настоящее время злокачественные опухоли приводят более чем к 30% смертей и являются основной причиной смертности в развитых странах. Некоторые типы рака можно вылечить с помощью передовых методов в области медицины, однако другие плохо поддаются лечению. Разработка новых способов лечения рака является неотложной задачей. Тремя основными видами терапии для лечения рака являются хирургическое лечение, химиотерапия и лучевая терапия. Для лечения рака используют комбинацию указанных трех видов терапии.
Недавно начал развиваться четвертый тип терапии рака, называемый иммунотерапией - основное внимание уделяется неинвазивности и высокий эффективности иммунотерапии. Иммунотерапию в целом разделяют на три типа, а именно: вакцинацию, терапию на основе антител и трансфузионную клеточную терапию. Известны два типа трансфузионной клеточной терапии. Один из них представляет собой трансфузионную терапию с использованием лимфоцитов, трансфицированных геном T-клеточного рецептора, при которой в лимфоцитах пациента обеспечивают индукцию in vitro указанного гена T-клеточного рецептора (T-cell receptor, TCR), который специфично реагирует с раковыми клетками, и проводят трансфузию указанных лимфоцитов пациенту. Другой тип представляет собой трансфузионную терапию на основе специфичных T-клеток, при которой в лимфоциты пациента вводят химерный антигенный рецептор (chimeric antigen receptor, CAR), содержащий scFv-фрагмент в качестве сайта распознавания антигена и CD3ζ в качестве молекулы внутриклеточной передачи сигнала, и инфузионно обеспечивают пациенту введение полученных лимфоцитов. Поскольку в указанных способах лечения большое количество лимфоцитов, специфичных в отношении ракового антигена, получают за короткое время путем генного переноса, терапевтические средства на основе специфичных T-клеток можно применять для лечения различных видов рака у пациентов.
[0003]
Инфузионная терапия на основе гена TCR, при которой T-клетки распознают комплекс пептид-MHC (главный комплекс гистосовместимости, major histocompatibility complex) (pMHC) и происходит уничтожение раковых клеток, является безопасной и эффективной и развивается во всем мире. Однако существует проблема, связанная с тем, что клоны клеток T-киллеров клеток крайне сложно выделить.
С другой стороны, существуют три преимущества инфузионной терапии на основе CAR: (1) терапию могут получать различные пациенты, поскольку T-клетки, трансфицированные CAR, содержащим одноцепочечный фрагмент антитела (scFv) и T-клеточный рецептор (TCR) и домен сигнализации костимулирующих молекул, могут независимо распознавать комплекс раковый антиген-MHC и атаковать раковые клетки, отличные от исходных T-клеток, (2) могут привлекаться CD4-положительные T-клетки, а также CD8-положительные T-клетки и клетки, не являющиеся T-клетками, (3) сохраняется более высокая аффинность по сравнению с TCR, так как рецептор приобретает реакционную активность антитела. В самом деле, была показана высокая клиническая эффективность CAR-терапии с применением антител против CD19 у пациентов, страдающих лейкозом и лимфомой (непатентный документ 1, документы кратко описаны в конце описания). Молекула CD19 также экспрессируется в B-клетках, исчезновение B-клеток может компенсироваться путем добавления иммуноглобулина. В целом, идеально было бы использовать антигены, которые экспрессируются только в раковых клетках. Однако проблема заключается в том, что в настоящее время такие антигены клеточной поверхности не были обнаружены.
[0004]
С другой стороны, сообщалось об онкоспецифичных антигенах во внутриклеточных молекулах, включая раково-тестикулярный антиген и неоантиген. Однако не было описано инфузионной терапии на основе CAR для онкоспецифичных внутриклеточных антигенов.
Принимая во внимание указанные обстоятельства, авторы настоящего изобретения выделили антитела, которые распознают комплекс MHC с внутриклеточными пептидами, происходящими из антигенных молекул, и разработали способ иммунотерапии на основе CAR с использованием указанных антител. Сообщалось только о нескольких антителах, которые специфично распознают комплекс пептид/MHC (непатентный документ 2). Получение антитела, специфично распознающего комплекс пептид/MHC, и CAR-T-клеток, специфично убивающих раковые клетки, могло бы обеспечить инновационный способ терапии. CAR, распознающий комплекс пептид/MHC, можно использовать для инфузии CAR-T-клеток, а при одновременной инфузии пептида, который специфично распознается CAR-T-клетками, можно ожидать пролиферацию CAR-T-клеток в результате презентации антигена.
[КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ]
[Проблемы, решаемые с помощью настоящего изобретения]
[0005]
Настоящее изобретение было создано с учетом проблем, описанных выше, и его целью является получение антиген-связывающего белка, специфично распознающего комплекс происходящий из MAGE-A4 пептид/HLA-A2.
[Способы решения указанных проблем]
[0006]
В качестве антигена, который презентируется MHC, использовали молекулу MAGE-A4. MAGE-A4 экспрессируется в солидных опухолях, включая злокачественные меланомы (непатентный документ 3), и представляет собой раково-тестикулярный антиген (cancer testis antigen, CTA) типа NY-ESO-1. Указанные молекулы экспрессируются только в семенниках и плаценте и не наблюдаются в других нормальных тканях. После экспрессии MAGA-A4 в клетках происходит его деградация в протеасомах. Деградация приводит к образованию пептидов MAGE-A4, содержащих 10 аминокислот, которые связываются с HLA-A*0201, бета-2 микроглобулином в эндоплазматическом ретикулуме и презентируются на клеточной поверхности в качестве онкоспецифичного антигена. В качестве пептида, который презентируется HLA-A*0201, был выбран p230-239 (GVYDGREHTV: SEQ ID NO:1) (непатентный документ 4).
Были разработаны способы получения CAR-T-клеток, проявляющих специфичный ответ на раковые клетки-мишени в результате трансфекции человеческих лимфоцитов CAR-рецептором, который специфично распознает A2-MAGE-A4, и применения клеточной инфузионной терапии у человека. (1) Выделяли антитела, распознающие с высокой аффинностью комплекс происходящий из MAGE-A4 пептид/HLA-A2, (2) проверяли специфичность указанных антител, (3) проводили скрининг антител, обладающих высокой специфичностью, (4) с использованием указанных антител получали CAR-T-клетки, которые специфично активировались в ответ на раковые клетки-мишени, и подтверждали вызванную цитотоксичность. На модели терапии рака с использованием человеческой опухоли, трансплантированной мышам, которым проводили инфузию CAR-T-клеток in vivo, наблюдали специфичную пролиферацию CAR-T-клеток в теле мыши и инфильтрацию опухоли. Таким образом, настоящее изобретение было по сути выполнено.
[0007]
Антиген-связывающий белок согласно настоящему изобретению характеризуется тем, что содержит указанные далее полипептиды (A) или (B) и распознает комплекс HLA-A2/MAGE-A4: (A) полипептид, содержащий аминокислотную последовательность VH (вариабельного участка тяжелой цепи) SEQ ID NO: 36 и аминокислотную последовательность VL (вариабельного участка легкой цепи) SEQ ID NO: 38; (B) полипептид, содержащий аминокислотную последовательность, гомологичную по меньшей мере на 90% последовательности VH (вариабельного участка тяжелой цепи) SEQ ID NO: 36, и аминокислотную последовательность, гомологичную по меньшей мере на 90% последовательности VL (вариабельного участка легкой цепи) SEQ ID NO: 38. В то же время антиген-связывающий белок предпочтительно содержит следующий далее полипептид (C) или (D) между участками VH и VL: (C) полипептид, содержащий аминокислотную последовательность sc-фрагмента (одноцепочечного фрамента) SEQ ID NO: 37; (D) полипептид, содержащий аминокислотную последовательность, содержащую по меньшей мере 90% последовательности sc-фрагмента (одноцепочечного фрагмента) SEQ ID NO: 37. Кроме того, антиген-связывающий белок предпочтительно содержит полипептид, содержащий аминокислотную последовательность SEQ ID NO: 32, или полипептид, гомологичный по меньшей мере на 90% последовательности SEQ ID NO: 32. Антиген-связывающий белок предпочтительно представляет собой Fab, Fab', F(ab')2, Fv или одноцепочечный Fv-фрагмент (scFv). В настоящей заявке антиген-связывающий белок содержит антитело или производное антитела.
[0008]
Согласно настоящему изобретению, гомология означает отношение между двумя (или тремя или более) аминокислотными последовательностями или нуклеотидными последовательностями, определенное путем их сравнения. Гомология означает степень корреляции между аминокислотными последовательностями или нуклеотидными последовательностями или между группой частей последовательностей при их выравнивании. В частности, гомология определяется по идентичности и сохранению свойств последовательности (замена для поддержания физико-химических свойств конкретной аминокислоты или последовательности аминокислот в аминокислотной последовательности). Способ определения гомологии предпочтительно представляет собой способ, при котором сопоставляется самый длинный участок выравнивания между последовательностями. Для определения гомологии используют доступные в интернете программы, например, BLAST (основное средство поиска локального выравнивания, Basic Local Alignment Search Tool)
Согласно другому варианту реализации настоящего изобретения, нуклеиновая кислота кодирует антиген-связывающий белок в соответствии с первым вариантом реализации настоящего изобретения.
Согласно другому варианту реализации настоящего изобретения, вектор содержит нуклеиновую кислоту, где указанная нуклеиновая кислота включает ДНК или РНК. Нуклеиновая кислота может быть одноцепочечной или двуцепочечной. Векторы включают плазмидный вектор и вирусный вектор и т.п.
Согласно другому варианту реализации настоящего изобретения, химерный антигенный рецептор содержит антиген-связывающий белок и внеклеточный домен белка передачи сигнала, при этом белок передачи сигнала предпочтительно представляет собой любую из цепей CD3-зета (CD3ζ) и костимулирующих молекул CD (GITR). Предпочтительным является включение любого из внутриклеточного домена CD28 и GITR.
Согласно другому варианту реализации настоящего изобретения, нуклеиновая кислота кодирует химерный антигенный рецептор. Согласно другому варианту реализации настоящего изобретения, вектор содержит нуклеиновую кислоту.
Согласно другому варианту реализации настоящего изобретения, клетка экспрессирует химерный антигенный рецептор. Согласно другому варианту реализации настоящего изобретения, фармацевтическая композиция содержит указанную клетку в качестве активного ингредиента.
[Эффекты согласно настоящему изобретению]
[0009]
Согласно настоящему изобретению, предложен антиген-связывающий белок, специфично распознающий комплекс происходящий из MAGE-A4 пептид/HLA-A2, нуклеиновые кислоты, кодирующие указанный антиген-связывающий белок, векторы, содержащие указанные нуклеиновые кислоты, химерные антигенные рецепторы, связывающие антиген-связывающий белок, нуклеиновые кислоты, кодирующие указанный химерный антигенный рецептор, векторы, содержащие указанные нуклеиновые кислоты, клетки, экспрессирующие указанный химерный антигенный рецептор, и фармацевтические композиции, содержащие указанные клетки. Антиген-связывающий белок, специфично распознающий комплекс происходящий из MAGE-A4 пептид/HLA-A2, можно использовать в клеточной терапии и в области генной терапии. Указанный белок крайне полезен для выявления опухолевых клеток, экспрессирующих комплекс происходящий из MAGE-A4 пептид/HLA-A2, для лечения опухолей, проведения исследований и тестирования опухолей. Более того, CAR-T-клетки согласно настоящему изобретению можно использовать для эффективной терапии рака, поскольку их побочные эффекты являются небольшими.
[КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ]
[0010]
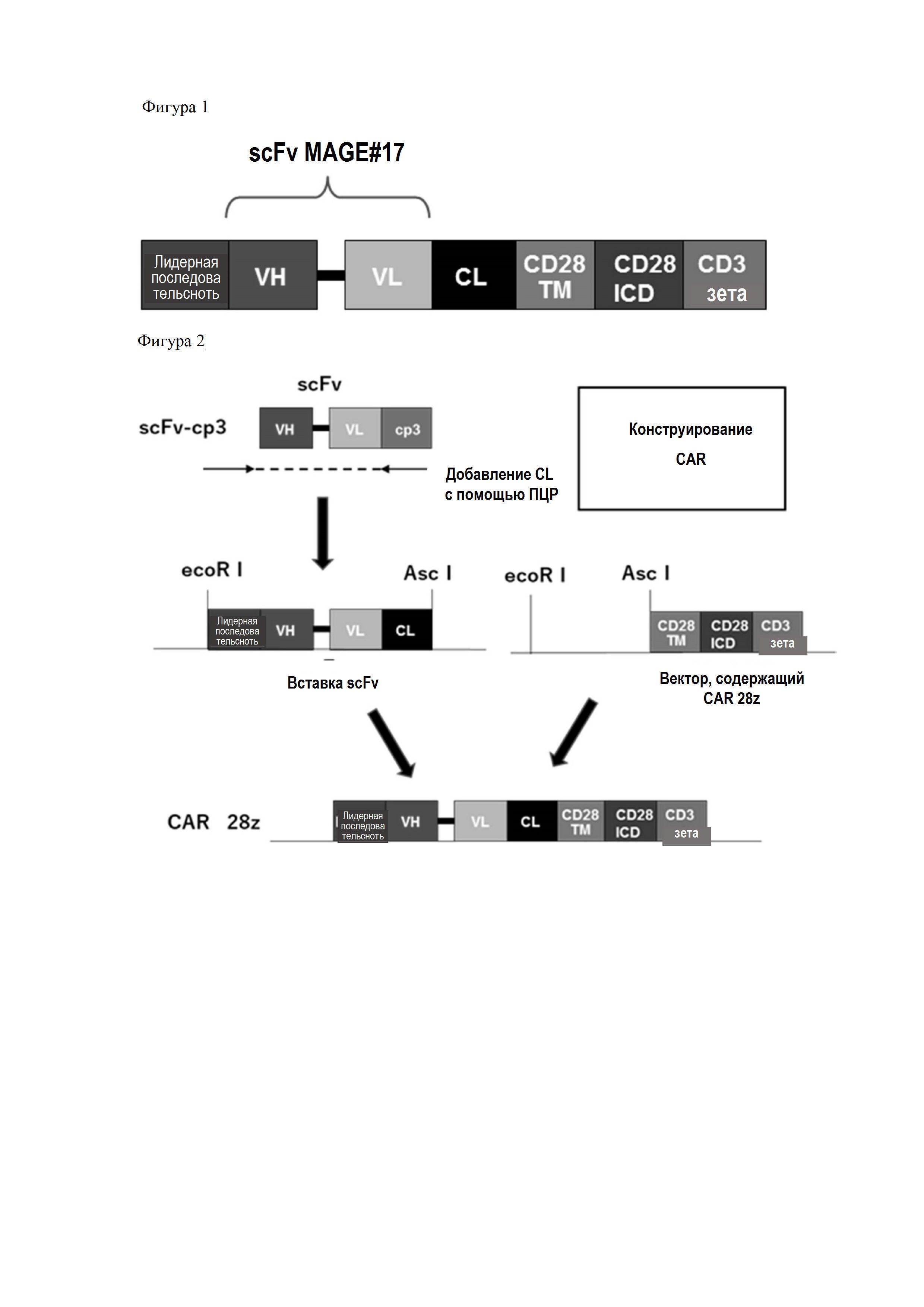
На Фигуре 1 показана схема последовательности scFV MAGE#17.
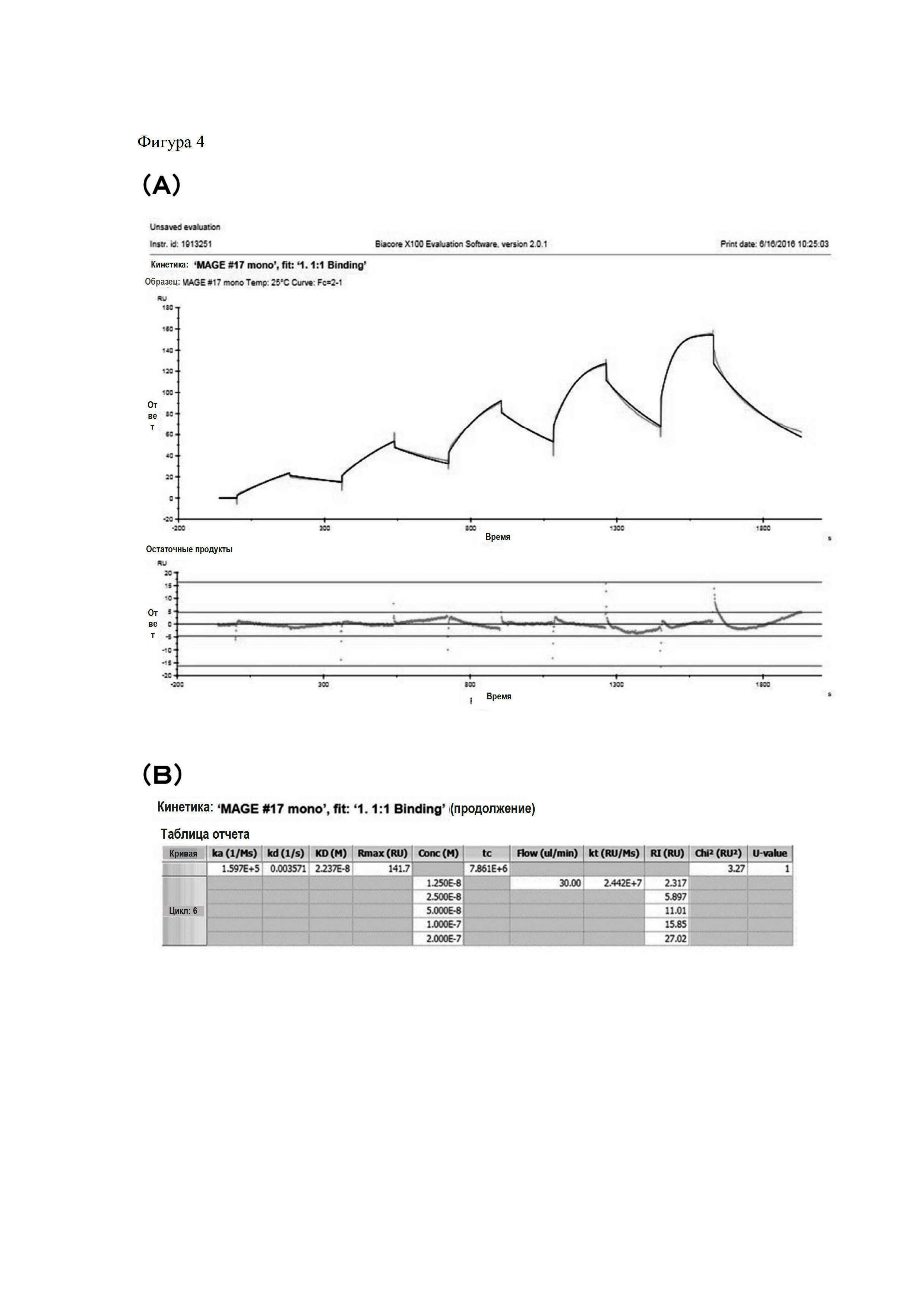
На Фигуре 2 показана схема последовательности генов для объяснения способа конструирования CAR.
На Фигуре 3 ((A) и (B)) показаны гистограммы, иллюстрирующие результаты определения с помощью ИФА реакционной активности отобранных клонов в отношении множества антигенов.
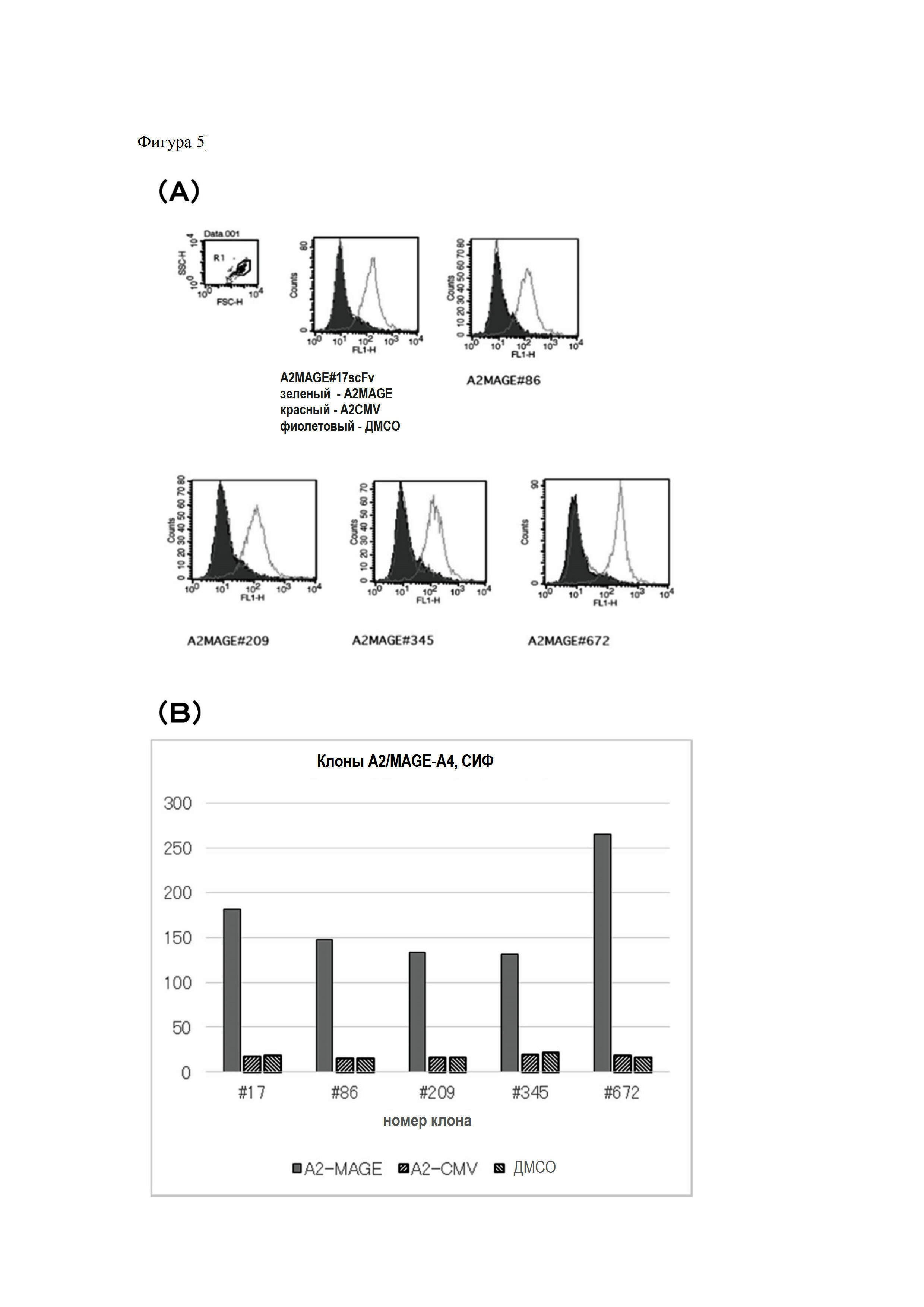
На Фигуре 4 показан график измерения значений KD для MAGE#17. (A) - показан график динамических изменений чувствительности выявления с течением времени, (B) - показана таблица с результатами расчета значений KD на основе данных, полученных из графика, соответственно.
На Фигуре 5(A) показан график результатов оценки величины сдвига, полученных при взаимодействии антител MAGE#17, #86, #209, #345 и #672 с T2-клетками, в которые вводили MAGE-A4p230, CMV и ДМСО, (B) - показана гистограмма результатов.
На Фигуре 6 показан график результатов оценки количества HLA с помощью метода FACS на поверхности T2-клеток, в которые вводили аланин-замещенные пептиды.
На Фигуре 7 показан график результатов оценки аминокислот, связанных с распознаванием антитела, при взаимодействии MAGE#17 с T2-клетками, в которые вводили аланин-замещенные пептиды.
На Фигуре 8 показан график результатов оценки количества HLA с помощью метода FACS на поверхности T2-клеток, в которые вводили пептиды-имитаторы.
На Фигуре 9 показан график результатов оценки реакционной активности с пептидами-имитаторами при взаимодействии MAGE#17 с T2-клетками, в которые вводили указанные пептиды-имитаторы.
На Фигуре 10 показаны результаты оценки с помощью окраски тетрамером экспрессии CAR (мРНК), введенного в мононуклеарные клетки периферической крови (МКПК).
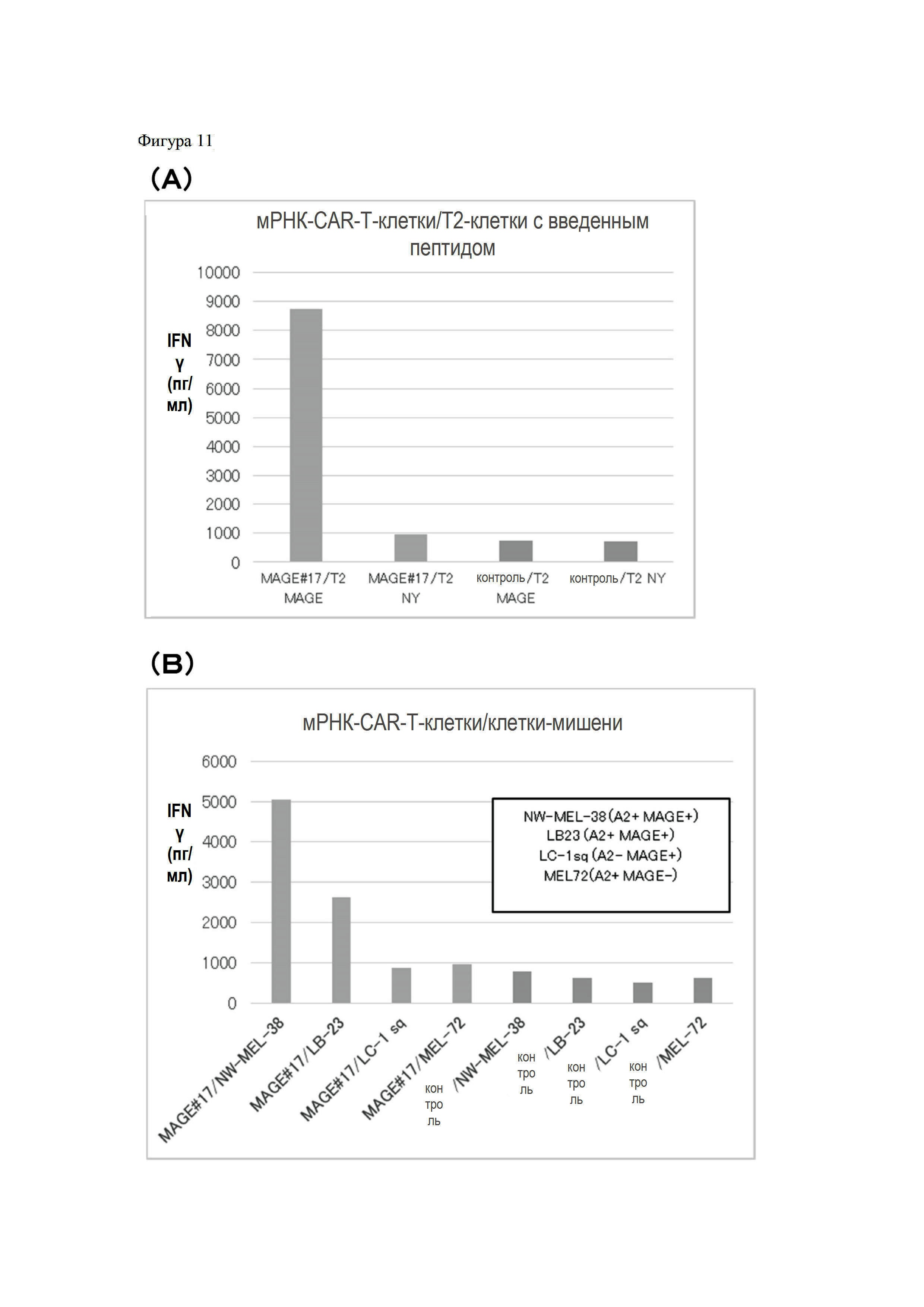
На Фигуре 11 показаны графики результатов, показывающих, что CAR-T-клетки, трансфицированные мРНК, специфично распознают клетки-мишени и повышают продукцию IFNγ.
На Фигуре 12 показаны результаты оценки с помощью окраски тетрамером экспрессии гена CAR, введенного с помощью ретровируса в мононуклеарные клетки периферической крови (МКПК).
На Фигуре 13 представлены графики, показывающие, что CAR-T-клетки, трансфицированные ретровирусом, специфично распознают клетки-мишени и повышают продукцию IFNγ.
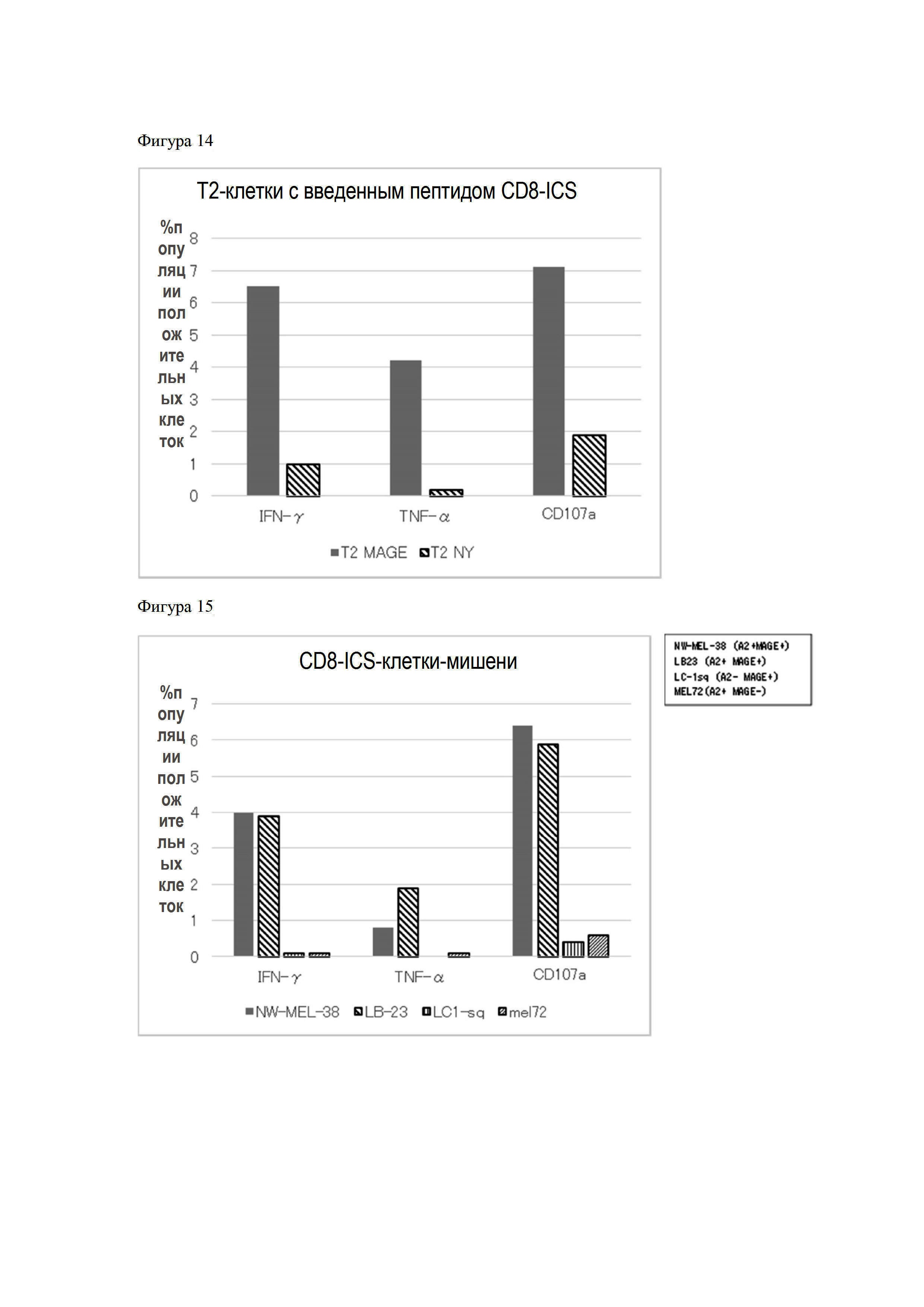
Фигура 14 представляет собой график, показывающий активацию T-клеток, трансфицированных MAGE#17-CAR, при их сокультивировании с T2-клетками, в которые вводили пептид MAGE-A4.
Фигура 15 представляет собой график, показывающий активацию T-клеток, трансфицированных MAGE#17-CAR, при их сокультивировании с A2-положительными MAGE-A4-положительными клетками.
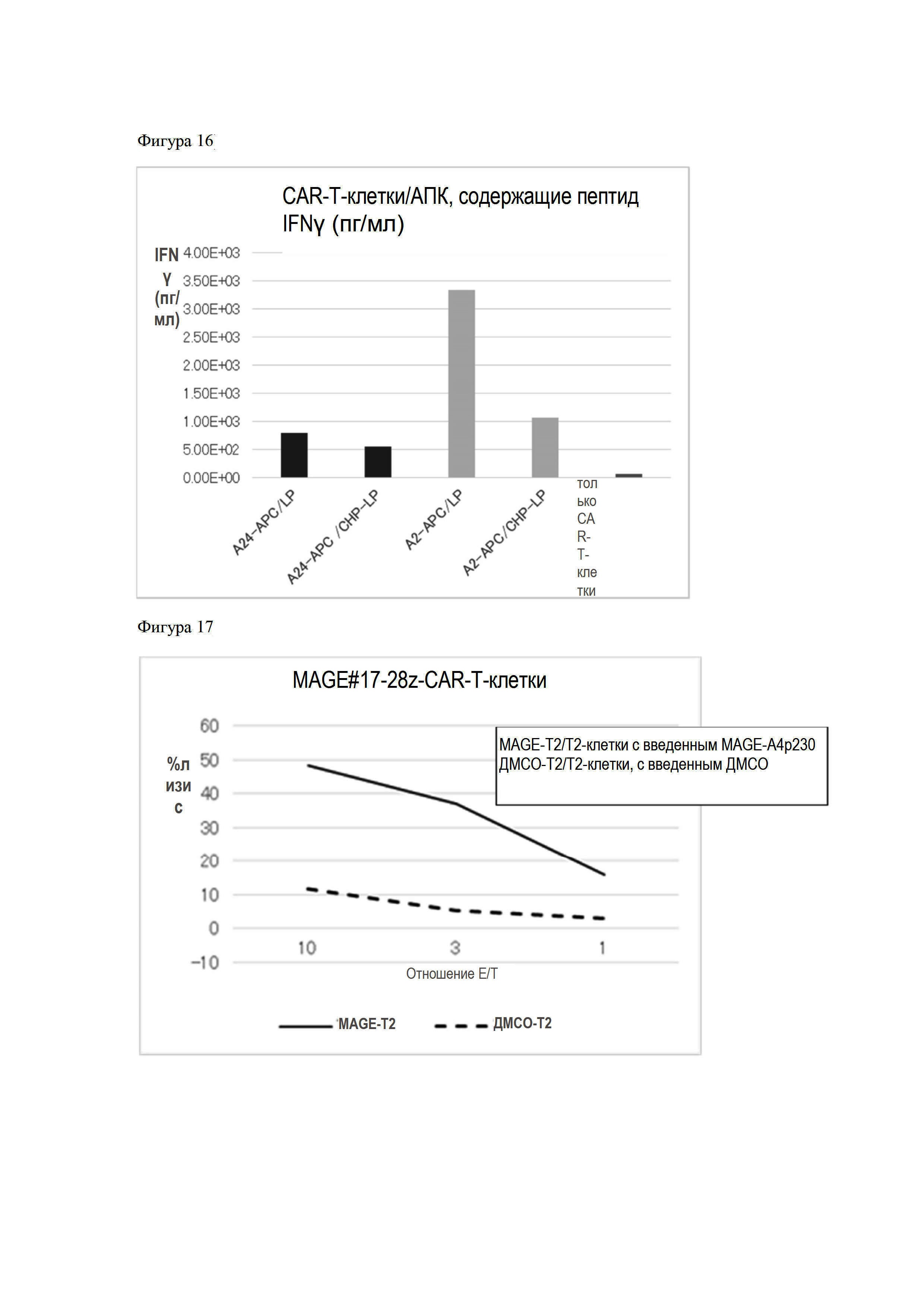
На Фигуре 16 представлен график результатов, показывающих повышение продукции интерферона в CAR-T-клетках при их сокультивировании с антиген-презентирующими клетками, содержащими длинные пептиды MAGE-A4.
Фигура 17 представляет собой график, показывающий, что T2-клетки, в которые вводили пептид MAGE-A4, обладают специфичной в отношении MAGE-A4 цитотоксической активностью.
Фигура 18 представляет собой график, показывающий, что клетки-мишени обладают специфичной цитотоксической активностью в отношении A2-положительных MAGE-положительных клеток.
На Фигуре 19 показаны результаты оценки коэффициента позитивности CAR с помощью окраски тетрамером для инфузируемых CAR-T-клеток.
Фигура 20 (A) представляет собой график, показывающий результаты эффекта CAR-T-клеток в отношении A2-положительной MAGE-A4-положительной опухоли (NW-MEL-38), и (B) представляет собой график, показывающий результаты эффекта CAR-T-клеток в отношении A2-положительной MAGE-A4-отрицательной опухоли (HCT116).
На Фигуре 21 показана схема последовательности генов CAR zG.
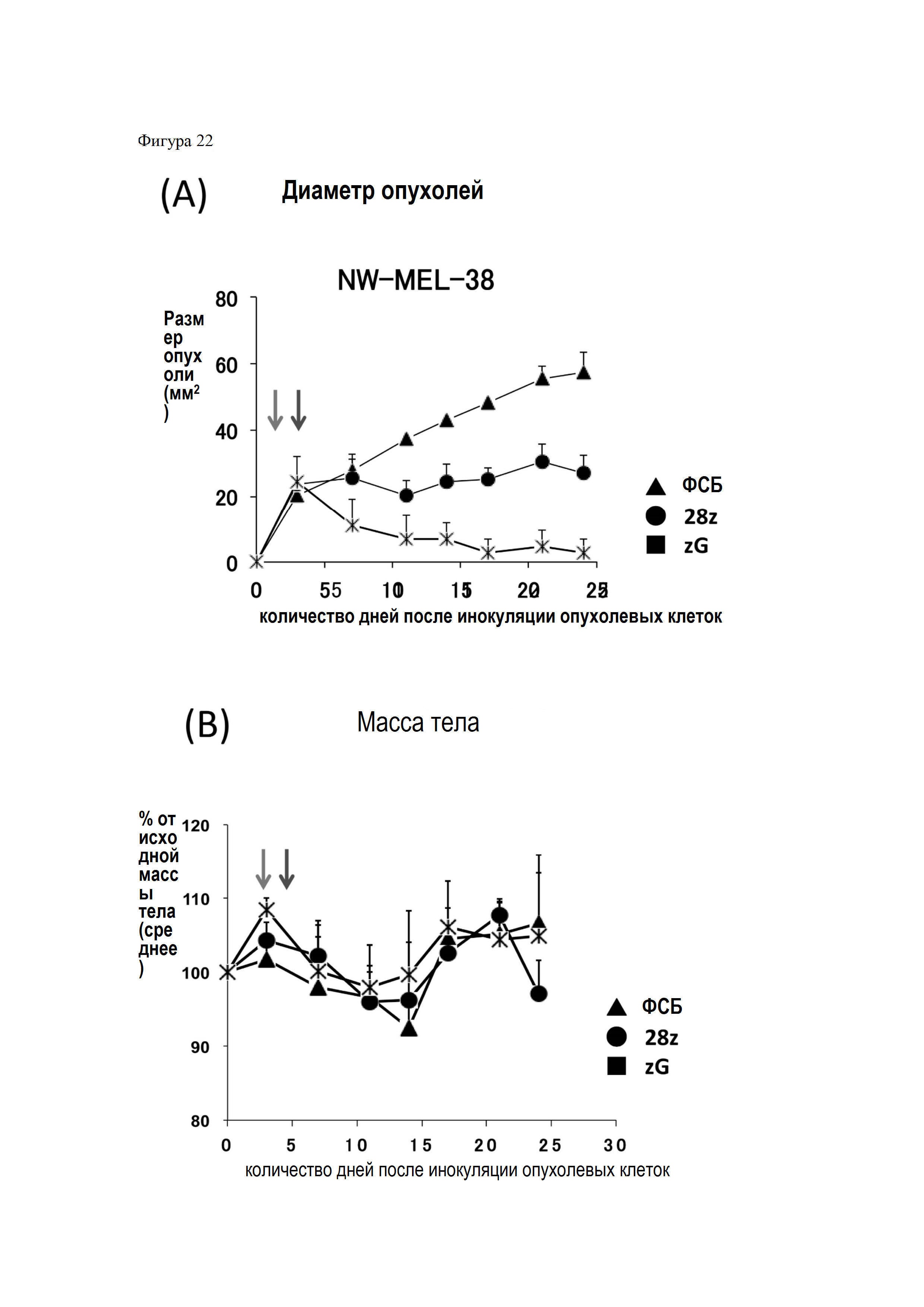
На Фигуре 22 представлены графики, показывающие результаты эффекта CAR-T-клеток, содержащих различные внутриклеточные домены (intracellular domain, ICD), в отношении A2-положительных MAGE-A4-положительных опухолей (NW-MEL-38). (A) - показан размер опухоли, (B) - показана масса тела животных соответственно. Стрелки слева на графиках показывают день проведения тотального облучения тела (ТОТ) (3 день), стрелки справа показывают день введения лимфоцитов (4 день) соответственно.
На Фигуре 23 представлены изображения, показывающие результаты оценки по окраске тетрамером коэффициента позитивности CAR для CD8-положительных T-клеток, в которые не вводили CAR (NGMC: контроль), CD8-положительных T-клеток, в которые вводили CAR типа zG (zG), и CD8-положительных T-клеток, в которые вводили CAR типа 28z (28z).
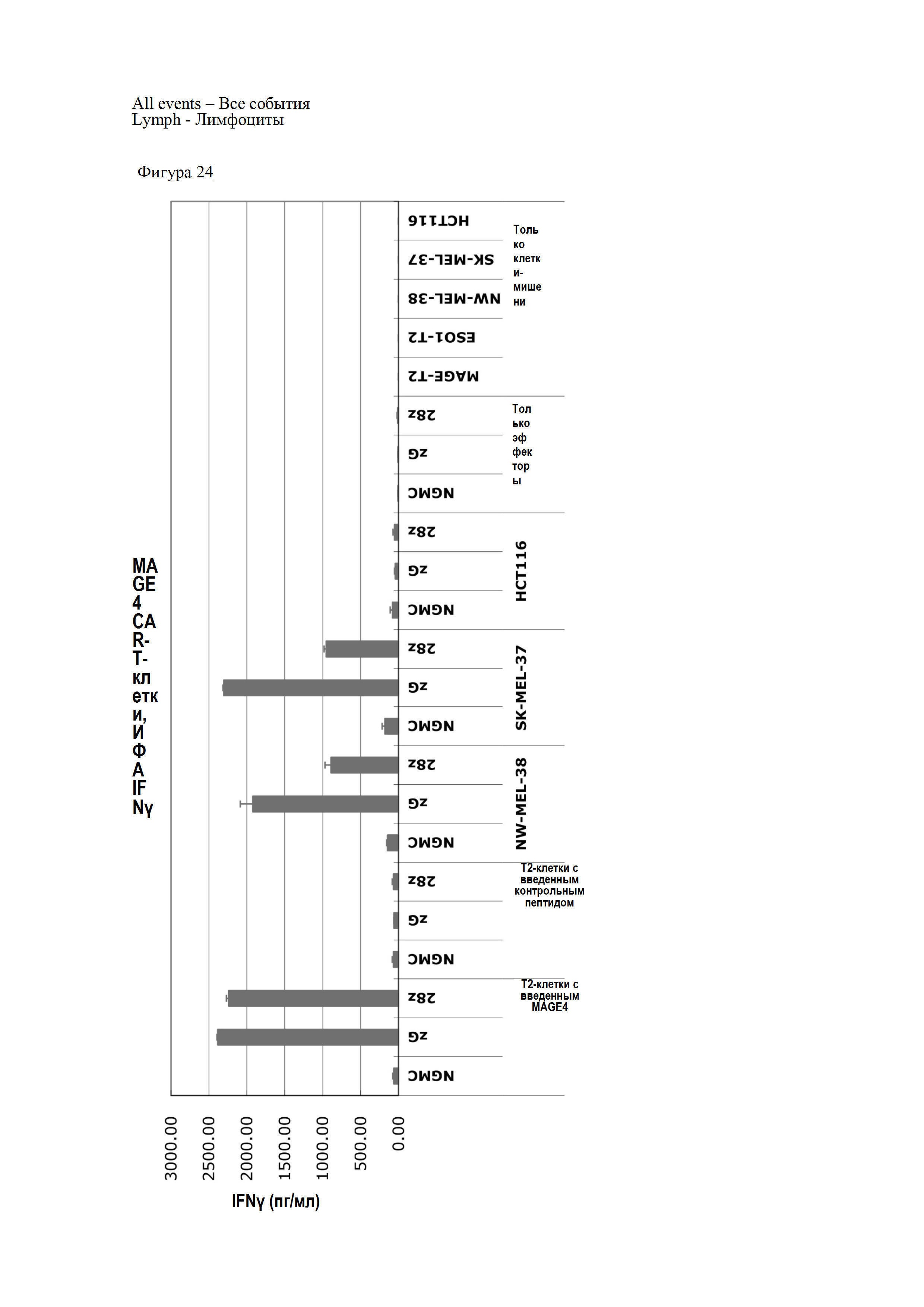
Фигура 24 представляет собой график, показывающий результаты оценки специфичного распознавания клеток-мишеней CAR-T-клетками и повышения продукции IFNγ.
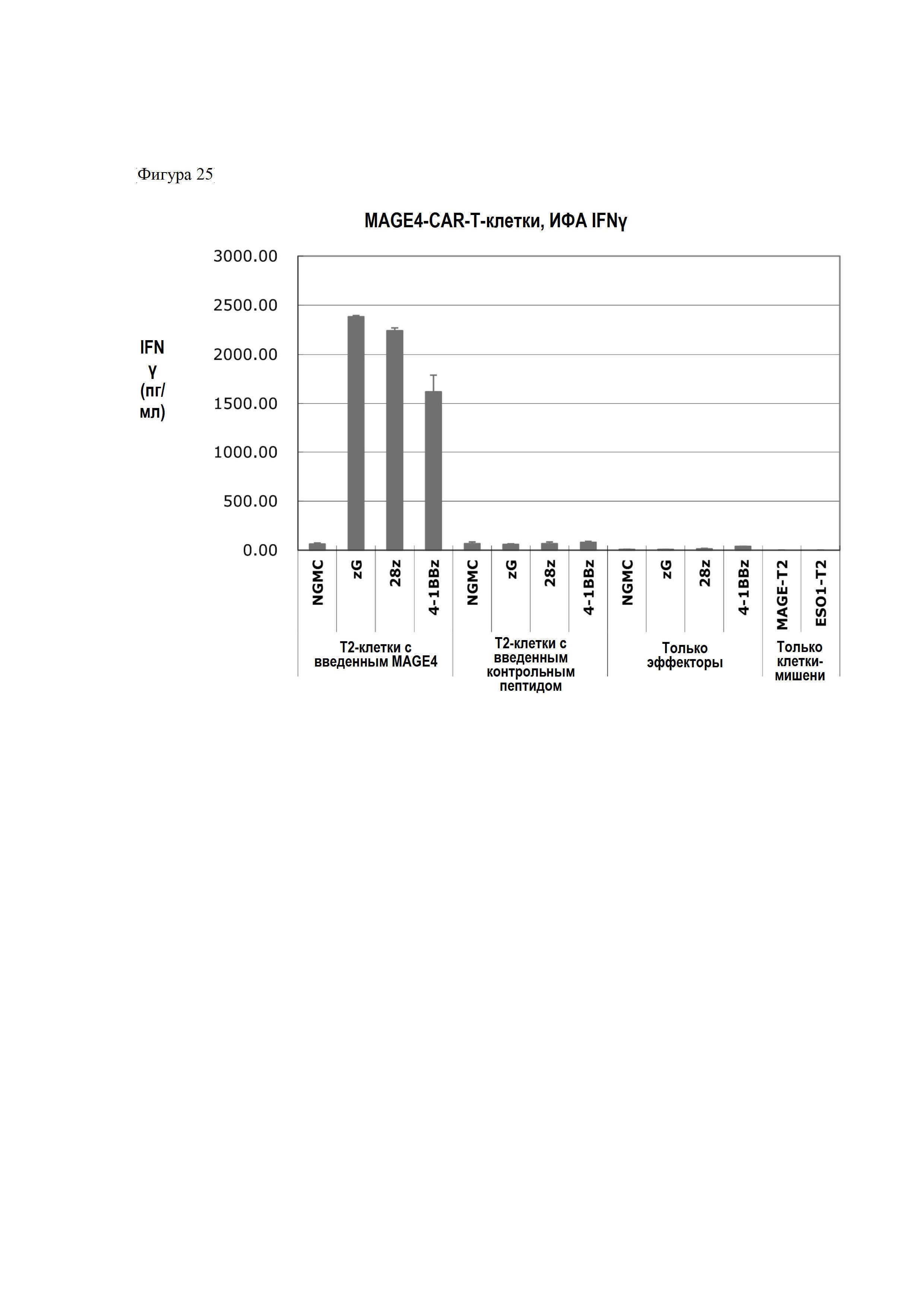
Фигура 25 представляет собой график, показывающий результаты оценки специфичного распознавания клеток-мишеней CAR-T-клетками и повышения продукции IFNγ.
[ОПИСАНИЕ ИЗОБРЕТЕНИЯ]
[0011]
Далее следует описание вариантов реализации настоящего изобретения со ссылкой на фигуры и таблицы. Технический объем изобретения не ограничивается указанными вариантами реализации, и настоящее изобретение может быть осуществлено в различных формах без изменения сущности настоящего изобретения.
В настоящей заявке термины «антитело» и «антиген-связывающий фрагмент» относятся к антиген-связывающему белку в иммунной системе. Антитело, содержащее антиген-связывающий участок, представляет собой гликопротеин, содержащий две тяжелые цепи (H-цепи) и две легкие цепи (L-цепи), связанные друг с другом с помощью дисульфидных связей. Каждая тяжелая цепь содержит вариабельный участок тяжелой цепи (VH) и константный участок тяжелой цепи (CH). Константный участок тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельный участок легкой цепи (VL) и константный участок легкой цепи (CL). VL состоит из CL домена. VH и VL-участки можно дополнительно разделить на определяющие комплементарность участки (CDR) с гипервариабельными и каркасными областями (FR), содержащими в некоторой степени консервативную последовательность. В участках VH и VL участки FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4, т.е. три CDR и четыре FR, расположены в направлении от аминоконца к карбокси-концу соответственно. Известно, что для связывания с антигеном важны CDR3. Как VH, так и VL содержат связывающие домены, которые взаимодействуют с антигеном.
[0012]
В настоящей заявке термин «HLA» означает антиген лейкоцитов человека (человеческий лейкоцитарный антиген, human leucocyte antigen, HLA) и относится к молекулам главного комплекса гистосовместимости (major histocompatibility complex, MHC) человека и комплексу генов, кодирующих молекулы клеточной поверхности, которые необходимы для презентации антигена клеткам иммунной системы. HLA можно разделить на молекулы класса I и класса II. HLA I класса состоит из α-цепи и β2-микроглобулина. HLA I класса экспрессируется практически во всех ядерных клетках и функционирует путем презентации антигена CD8-положительным T-клеткам. HLA I класса можно разделить на HLA-A, HLA-B и HLA-C.
В настоящей заявке термин «химерный антигенный рецептор (chimeric antigen receptor, CAR)» означает белок слияния (гибридный белок), содержащий внеклеточный домен, который связывается с антигеном, трансмембранный домен, отличный от внеклеточного домена, и по меньшей мере один из внеклеточных доменов. CAR может называться «химерным рецептором», «T-телом» или «химерным иммунным рецептором (chimeric immune receptor, CIR)». «Внеклеточный домен, который связывается с антигеном», означает любой олигопептид или полипептид, который связывается с антигеном, «внутриклеточный домен» означает любой олигопептид или полипептид, который, как известно, функционирует в качестве домена для передачи сигнала, активирующего или подавляющего биологический процесс в клетке.
В настоящей заявке «антиген-связывающий белок» означает часть антитела, которая связывается с антигеном, или фрагмент антитела, который придает антителу специфичность в отношении антигена.
[0013]
Далее следует подробное описание настоящего изобретения.
(1) Антиген-связывающий фрагмент и кодирующая его нуклеиновая кислота согласно настоящему изобретению
Антитело против комплекса происходящий из MAGE-A4 пептид/HLA-A2 (HLA-A2-MAGE-A4) представляет собой антитело, которое специфично распознает и связывается с комплексом HLA-A2 и P230-239 (SEQ ID NO: 1), который представляет собой пептид, происходящий из рестриктированного HLA-A2 антигена MAGE-A4. Антитело согласно настоящему изобретению является высокоспецифичным, не связывается с комплексом HLA-A2 и пептида, отличного от P230-239, и с комплексом пептида P230-239 и HLA, отличного от HLA-A2 (или связывается с очень низкой активностью). Таким образом, антиген-связывающий фрагмент согласно настоящему изобретению может специфично выявлять или быть направленным на комплекс HLA-A2-MAGE-A4.
Антиген-связывающий фрагмент согласно настоящему изобретению содержит (A) полипептид, имеющий аминокислотную последовательность VH (вариабельного участка тяжелой цепи) SEQ ID NO: 36 и аминокислотную последовательность VL (вариабельного участка легкой цепи) SEQ ID NO: 38, или (B) полипептид, имеющий аминокислотную последовательность VH (вариабельного участка тяжелой цепи), гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 36, и аминокислотную последовательность VL (вариабельного участка легкой цепи), гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 38. Антиген-связывающий фрагмент согласно настоящему изобретению может содержать (C) полипептид, имеющий аминокислотную последовательность sc-фрагмента (одноцепочечного фрагмента) SEQ ID NO: 37, или (D) полипептид, имеющий аминокислотную последовательность sc-фрагмента (одноцепочечного фрагмента), гомологичную на 90% или более последовательности SEQ ID NO: 37, между участками VH и VL.
[0014]
Антиген-связывающий фрагмент содержит один или более фрагментов, которые специфично связываются с антигеном. Фрагмент антитела, содержащий антиген-связывающий участок антитела, специфично распознает антиген подобно полноразмерному антителу. Примерами антиген-связывающих фрагментов являются антитела и их фрагменты, содержащие Fab, Fab', F(ab')2, Fv и одноцепочечный Fv-фрагмент (scFv). Fab представляет собой фрагмент моновалентного антитела, состоящий из доменов VL, VH, CL и CH1. Fab' представляет собой фрагмент моновалентного антитела, состоящий из доменов VL, VH, CL, CH1 и шарнирного участка. F(ab')2 представляет собой фрагмент дивалентного антитела, содержащий два Fab-фрагмента, связанных дисульфидными связями шарнирного участка. Fv представляет собой фрагмент моновалентного антитела, состоящий из доменов VL и VH. Домены VL и VH Fv-фрагмента кодируются отдельными генами, scFv, который представляет собой одноцепочечный белок, можно получать с помощью методов рекомбинации генов путем объединения двух генов с помощью линкера. scFv содержит линкер (одноцепочечный) между VH и VL. sc связывает домены VH и VL и представляет собой пептид, который обычно используется в данной области техники для стабилизации антиген-связывающей способности антитела scFv (см., например, Huston et al, Methods in Enzymology , 203: 46-88 (1991), Whitlow et al, Protein Eng., 6: 989 (1993)). sc в целом содержит глицин и серин, его длина составляет от 15 до 18 аминокислот.
[0015]
Один аспект настоящего изобретения включает комбинированный антиген-связывающий фрагмент. Примерами таких молекул являются Fab3, диатело, триатело, тетратело, минитело, Bis-scFv, (scFv)2-Fc, интактный IgG (Holliger et al., Nature Biotechnology, 23(9), p,1126-36 (2005)).
Одна или несколько аминокислот антиген-связывающих фрагментов могут быть модифицированы, при условии что такая модификация по существу не влияет на свойства указанных антиген-связывающих фрагментов. Например, одна или несколько аминокислот в константном участке или FR-участке могут быть заменены, удалены, добавлены или встроены. Модификацию можно легко осуществлять путем комбинирования известных методов, включая сайт-направленный мутагенез (введение точечной мутации и кассетный мутагенез и т.д.), метод гомологичной рекомбинации генов, метод удлинения праймера и метод ПЦР.
Настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген-связывающий фрагмент. Дополнительно, нуклеиновая кислота согласно настоящему изобретению содержит нуклеотидную последовательность, показанную в SEQ ID NO: 31 и 33 - 35 в перечне последовательностей. Нуклеиновая кислота может быть модифицирована по кодонам (кодон-оптимизация) с получением кодонов, подходящего для клетки-хозяина, без изменения аминокислотной последовательности, закодированной указанной нуклеиновой кислотой. Эффективность экспрессии полипептида в клетке хозяина можно улучшить путем модифицирования с кодон-оптимизацией.
Антиген-связывающий фрагмент согласно настоящему изобретению может быть получен с помощью известных методов генной инженерии или методов химического синтеза. Согласно методу генной инженерии в результате получения клонирующего вектора или вектора экспрессии, содержащего нуклеиновую кислоту согласно настоящему изобретению, введения указанного вектора в клетку-хозяина, культивирования указанной клетки-хозяина, экспрессирующей нуклеиновую кислоту, и восстановление полипептида путем очистки может быть получен полипептид. При включении нескольких нуклеиновых кислот согласно настоящему изобретению в клетку-хозяина можно вводить комбинацию нескольких векторов, каждый из которых содержит молекулу нуклеиновой кислоты, или один вектор, содержащий несколько нуклеиновых кислот. Если с полипептидом при его получении связывают пептидную метку, то указанный полипептид может быть восстановлен и очищен с помощью указанной пептидной метки.
[0016]
Вектор согласно настоящему изобретению функционально связан с подходящими контрольными последовательностями для экспрессии нуклеиновых кислот в подходящем хозяине. Такие контрольные последовательности содержат промотор для транскрипции нуклеиновых кислот, последовательность оператора для контроля транскрипции, последовательность, кодирующую сайт связывания рибосом, энхансер, последовательность полиаденилирования и последовательность для контроля терминации транскрипции и трансляции и т.д. Различные известные последовательности (например, сайт расщепления рестрикционным ферментом, маркерный ген, такой как ген лекарственной устойчивости (селекционной ген), сигнальная последовательность, лидерная последовательность, и т.д.) можно использовать в векторе. Различные последовательности могут быть выбраны и использоваться подходящим образом в соответствии с типом экспрессируемого полипептида, клетки-хозяина, условий среды и т.д.
Согласно настоящему изобретению, можно применять вектор, встраиваемый или не встраиваемый в геном хозяина, и эписомальный цитоплазматический вектор с автономной репликацией и т.д. Примером вектора служит ретровирусный вектор (включая онкоретровирусные векторы, лентивирусные векторы, псевдотипированый вектор), аденовирусный вектор, аденоассоциированный вирусный (ААВ) вектор, вектор на основе вируса обезьян, вектор на основе вируса коровьей оспы, вектор на основе вируса Сендай, вектор на основе вируса Эпштейна-Барра (ВЭБ), вектор на основе ВПГ и т.д. В качестве вирусного вектора предпочтительно может использоваться вирус, у которого отсутствует способность к репликации в инфицированных клетках. Кроме того, также может применяться невирусный вектор в результате его комбинации с липосомой и конденсирующим агентом, таким как катионные липиды. Более того, нуклеиновую кислоту можно вводить в клетки путем трансфекции с использованием фосфата кальция, DEAE-дектрана, электропорации, бомбардироваки частицами и т.д.
[0017]
В качестве клетки-хозяина можно использовать известные клетки. Так, в качестве примера можно привести клетки прокариот, такие как клетки E. coli, клетки млекопитающих, такие как клетки яичника китайского хомячка (клетки CHO), клетки человека и эукариотические клетки, такие как клетки дрожжей и насекомых и т.д.
Антиген-связывающий фрагмент согласно настоящему изобретению, который экспрессируется в клетке-хозяине, можно очистить из среды, полученной от клетки-хозяина, экстрактов и/или лизата клети-хозяина. Способ очистки можно осуществлять путем комбинирования подходящих известных методов. Например, подходящим образом можно использовать центрифугирование, хроматографию на гидроксиапатите, электрофорез в геле, диализ, фракционирование на ионообменной колонке, этанольную преципитацию, обращенно-фазовую ВЭЖХ, хроматографию на силикагеле, хроматографию на гепарин-сефарозе, хроматографию на анионной или катионной смоле (колонка с полиаспарагиновой кислотой и т.д.), хроматофокусирование, ДСН-ПААГ-электрофорез, преципитацию с сульфатом аммония и аффинную хроматографию.
[0018]
(2) Композиция согласно настоящему изобретению
Согласно настоящему изобретению, предложена композиция, содержащая антитело или антиген-связывающий фрагмент согласно настоящему изобретению, описанный в разделе (1), а также композиция, содержащая нуклеиновую кислоту, кодирующую указанное антитело или антиген-связывающий фрагмент.
Антитело или антиген-связывающий фрагмент согласно настоящему изобретению можно применять в качестве маркера комплекса происходящий из MAGE-A4 пептид/HLA-A2. MAGE-A4, как известно, экспрессируется в раковых клетках и презентируется с HLA. T-клетки атакуют раковые клетки в результате распознавания антигена. Таким образом, антиген-связывающий фрагмент согласно настоящему изобретению можно использовать в качестве маркера раковых клеток, т.е. композиции для выявления или диагностики.
Примерами таких способов выявления могут служить известные методы выявления, например, ИФА, флуоресцентный анализ антител, радиоиммуноанализ, радиоиммунопреципитация, анализ с помощью дот-блоттинга, анализ ингибирования или конкурентный анализ, «сэндвич»-анализ и анализ агглютинации латексных гранул.
Образцы для диагностики и выявления включают биологические образцы (например, ткани из области поражения, клетки, жидкость организма, содержащая кровь, сыворотку, плазму, лимфу и мочу). В указанных образцах после предварительной очистки, гомогенизации, центрифугирования или разведения в подходящем буфере (при необходимости), взаимодействия с антиген-связывающим фрагментом согласно настоящему изобретению выявляют комплекс антиген-антитело. В некоторых случаях антиген-связывающий фрагмент согласно настоящему изобретению может быть меченным, или может использоваться меченное вторичное антитело. В качестве метки можно использовать фермент (такой как пероксидаза хрена, щелочная фосфатаза и т.д.), радиоактивные изотопы (например,32P,35S,3H,125I и т.д.), флуоресцентное вещество (например, родамин, флуоресцамин, дансилхлорид и их производные и т.д.) и пептидную метку и т.д.
[0019]
Антиген-связывающий фрагмент согласно настоящему изобретению можно использовать для доставки фармацевтической композиции к мишени. Антитело или антиген-связывающий фрагмент согласно настоящему изобретению, связанный с фармацевтическим агентом, специфично распознает комплекс пептида WT1 и HLA-A24. Примерами фармацевтической композиции для доставки к мишени служат цитокины (IL2, TNF, IFN-γ и т.д.), их рецепторные белки, цитотоксин (рицин, дифтерийный токсин, гелонин и т.д.), радиоактивные изотопы (90Y,131I,225Ac,213Bi,223Ra и227Th и т.д.), клетки (T-клетки, NK-клетки и т.д.) или низкомолекулярные соединения (калихимицин, доксорубицин и т.д.).
Эффективное количество активных ингредиентов фармацевтической композиции согласно настоящему изобретению определяется подходящим образом в зависимости от цели лечения, типа опухоли, медицинского состояния, например, области поражения и размера поражения у пациента, и способа введения и т.д. При использовании в качестве фармацевтической композиции помимо активного ингредиента можно добавлять различные компоненты, которые могут являться фармацевтически приемлемыми (например, носитель, вспомогательное вещество, буфер, стабилизатор, и т.д.). Фармацевтическая композиция в зависимости от состояния может быть представлена в виде таблетки, жидкого вещества, порошка, геля, спрея, микрокапсулы, коллоидной системы распределения (липосом, микроэмульсий и т.д.) и макроэмульсии и т.д. Примером способа введения служит введение в виде фармацевтической композиции, внутривенная, внутрибрюшинная, внутримозговая, интратекальная, внутримышечная, внутриглазничная, внутриартериальная, внутриочаговая инъекция и инъекция через желчный проток, инфузия, использование лекарственных форм в виде систем с замедленным высвобождением и т.д. Фармацевтическую композицию можно вводить путем непрерывной инфузии или инъекции.
Фармацевтическую композицию согласно настоящему изобретению можно использовать для лечения гемопоэтических опухолей, таких как хронический миелоидный лейкоз, острый лимфоцитарный лейкоз (ОЛЛ) и острый миелоидный лейкоз (ОМЛ), и солидных опухолей, таких как рак желудка, рак толстой кишки, рак легких, рак молочной железы, герминогенный рак, рак печени, рак кожи, рак мочевого пузыря, рак предстательной железы, рак матки, рак шейки матки, рак яичников, мезотелиома и т.д., а также для диагностики и выявления опухолей и солидных опухолей. В частности, указанная фармацевтическая композиция применима для лечения, диагностики и выявления MAGE-A4-положительной или HLA-A2-положителной гемопоэтической опухоли и солидной опухоли.
[0020]
(3) Химерный антигенный рецептор согласно настоящему изобретению
Настоящее изобретение включает химерный антигенный рецептор (CAR), содержащий антиген-связывающий фрагмент из раздела (1) и внутриклеточный домен белка сигнального пути. CAR специфично распознает комплекс HLA-A2/происходящий из MAGE-A4 пептид и связывается с ним, может передавать сигнал клеткам, экспрессирующим CAR. CAR содержит внеклеточный домен, трансмембранный домен и внеклеточный домен. Во внеклеточном домене содержится антиген-связывающий фрагмент согласно настоящему изобретению. Когда внеклеточный домен специфично связывается с комплексом HLA-A2/MAGE-A4, сигнал передается в клетку через внутриклеточный домен CAR и стимулирует клетки, экспрессирующие CAR. Стимулированные клетки продуцируют цитокины и т.д., проявляют цитотоксичность в отношении клеток-мишеней, экспрессирующих комплекс, или индуцируют цитотоксичность других клеток иммунной системы.
В качестве внеклеточного домена CAR можно использовать домен, который может передавать сигнал в клетку, когда внеклеточный домен молекулы CAR взаимодействует (связывается) с комплексом происходящий из MAGE-A4 пептид/HLA-A2. Примерами таких белков сигнальных путей служат мембранные белки, сигнальные рецепторы и рецепторы цитокинов. Примерами внутриклеточного домена CAR являются внутриклеточные домены, содержащие последовательность передачи первичного цитоплазматического сигнала, происходящую из CD3-зета (CD3ζ), FCRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD5, CD22, CD79a и CD66d. Дополнительно, примерами служат внутриклеточные домены, содержащие последовательность передачи вторичного цитоплазматического сигнала (костимулирующего сигнала), происходящую из CD2, CD4, CD5, CD8α, CD8β, CD28, CD137 (также известного как «4-1BB»), CD134, ICOS, GITR и CD154. Более того, примерами являются внутриклеточные домены, содержащие последовательность передачи третичного цитоплазматического сигнала, происходящую из рецептора IL-2 и рецептора IL-21.
[0021]
Можно использовать трансмембранный домен CAR, альфа-цепь или бета-цепь T-клеточного рецептора, трансмембранный домен зета цепи CD3, CD28, CD3ε, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 (также известного как «4-1BB»), ICOS, CD154 и GITR и т.д. Можно использовать искусственно сконструированную последовательность.
Настоящее изобретение включает нуклеиновую кислоту, кодирующую CAR. Нуклеиновая кислота, кодирующая CAR, может быть связана с другой нуклеиновой кислотой, экспрессируемой под контролем подходящего промотора. Можно использовать промотор, который экспрессируется конститутивно или экспрессия которого индуцируется лекарственным средством (например, тетрациклином или доксорубицином). Например, можно применять промотор, происходящий из млекопитающего, включая промотор фосфоглицераткиназы (ФГК), промотор Xist, промотор бета-актина и промотор РНК-полимеразы II, происходящий из вируса промотор, включая ранний промотор вируса SV40, промотор цитомегаловируса, тимидинкиназный промотор вируса простого герпеса, промотор LTR различных ретровирусов и т.д. Для достижения эффективной транскрипции нуклеиновой кислоты с указанной нуклеиновой кислотой может быть связан другой регуляторный элемент, который взаимодействует с промотором или сайтом инициации транскрипции (например, последовательность энхансера или последовательность терминатора). Более того, можно встраивать маркерный ген, который может применяться для подтверждения экспрессии нуклеиновой кислоты (например, ген лекарственной устойчивости, ген, кодирующий репортерный фермент, или ген, кодирующий флуоресцентный белок и т.д.).
[0022]
Нуклеиновую кислоту, кодирующую CAR, можно вводить в клетки с помощью вектора. Более того, нуклеиновую кислоту, кодирующую CAR, можно применять в качестве активного ингредиента фармацевтической композиции. Фармацевтическую композицию, содержащую нуклеиновую кислоту, кодирующую CAR, можно получать и применять в соответствии с описанием в разделе (2).
Согласно другому аспекту, настоящее изобретение включает клетку, которая экспрессирует CAR. Указанные клетки могут быть получены с помощью процесса введения CAR в клетку согласно настоящему изобретению. Когда клетки, экспрессирующие CAR, связываются с комплексом HLA-A2/MAGE-A4 через указанный CAR, сигнал передается в клетку, и клетка активируется. Активацию клеток можно подтверждать по высвобождению цитокинов, повышенной скорости пролиферации, изменению молекул клеточной поверхности и т.д., в зависимости от типа клетки-хозяина и внутриклеточного домена. Например, высвобождение цитотоксических цитокинов (фактора некроза опухоли, лимфотоксина и т.д.) из активированных клеток приводит к разрушению опухолевых клеток, экспрессирующих комплекс. Дополнительно, высвобождение цитокинов и изменение молекул клеточной поверхности стимулирует другие клетки иммунной системы, например, B-клетки, дендритные клетки, NK-клетки, макрофаги и т.д. Таким образом, экспрессирующие CAR клетки применимы для адоптивной иммунотерапии, особенно направленной на MAGE-A4-положительные HLA-A2-положительные опухоли или рак.
[0023]
Процесс введения в клетки нуклеиновой кислоты, кодирующей CAR, осуществляется in vitro (ex vivo) или in vivo. В качестве клеток, в которые вводят нуклеиновую кислоту, можно использовать клетки млекопитающих, такие как клетки человеческого происхождения и клетки, происходящие из млекопитающих, не представляющих собой человека, включая обезьяну, мышь, крысу, свинью, корову и собаку и т.д. Типы клеток, которые можно использовать, представляют собой, например, клетки жидкостей организма, таких как кровь (периферическая кровь, пуповинная кровь и т.д.), клетки костного мозга, клетки ткани или органа, собранные, выделенные, очищенные и индуцированные. Можно использовать МКПК, клетки иммунной системы (дендритные клетки, B-клетки, гемопоэтические стволовые клетки, макрофаги, моноциты или NK-клетки), клетки крови (нейтрофилы, базофилы, моноциты), гемопоэтические стволовые клетки, мононуклеарные клетки пуповинной крови, фибробласты, преадипоциты, гепатоциты, клетки крови, кожные кератиноциты, мезенхимные стволовые клетки, гемопоэтические стволовые клетки, жировые стволовые клетки, плюрипотентные стволовые клетки, различные лини раковых клеток или нейральные стволовые клетки. Согласно настоящему изобретению, предпочтительно применяются, в частности, T-клетки, T-клеточные предшественники (гемопоэтические стволовые клетки, лимфоидные клетки-предшественники и т.д.), плюрипотентные стволовые клетки или содержащие их клеточные популяции. T-клетки включают CD8-положительные T-клетки, CD4-положительные T-клетки, регуляторные T-клетки, цитотоксические T-клетки, инфильтрирующие опухоль лимфоциты. Клеточная популяция, содержащая T-клетки и предшественники T-клеток, включает мононуклеарные клетки периферической крови (МКПК). Клетки, применимые согласно настоящему изобретению, могут представлять собой любые из клеток, отобранных из живого организма, размноженных путем культивирования, и клеточных линий. Когда предполагается трансплантация в живой организм клеток, трансфицированных нуклеиновой кислотой, или дифференцированных из них клеток, предпочтительно трансплантируют клетки, полученные из указанные живого организма или живого организма того же типа.
[0024]
Клетки, экспрессирующие CAR согласно настоящему изобретению, можно культивировать и/или стимулировать подходящей культуральной средой и/или стимулирующими молекулами до введения субъекту. Стимулирующие молекулы включают цитокины, подходящие белки и другие компоненты. Примерами цитокинов служат, например, IL-2, IL-7, IL-12, IL-15 и IFN-γ и т.д., предпочтительно, примером является IL-2. Концентрация IL-2 в среде составляет, например, 0,01 - 1×105 Ед./мл, предпочтительно, 1 - 1×104 Ед./мл, но не ограничивается конкретными значениями. Кроме того, примерами подходящих белков служат лиганд CD3, лиганд CD28 и антитело против IL-4. Кроме того, можно добавлять стимулятор лимфоцитов, такой как лектины. Кроме того, к культуральной среде можно добавлять сыворотку или плазму. Количество добавок к среде составляет, например, 0 - 20% по объему, но не ограничивается конкретными значениями, количество сыворотки или плазмы можно изменять в соответствии со стадией культивирования. Концентрацию сыворотки или плазмы можно снижать поэтапно. Сыворотка или плазма может быть собственной (иметь одинаковое с культивируемыми клетками происхождение) или не собственной (иметь происхождение, отличное от культивируемых клеток). Предпочтительно используются собственные компоненты для безопасности.
Оборудование, которое можно использовать для культивирования клеток, представляет собой, например, чашку Петри, флакон, пакет, большую культуральную баню, биореактор и т.д., но не ограничивается конкретными вариантами. В качестве пакета можно применять CO2-газопроницаемый пакет для клеточных культур. При промышленном производстве клеточных популяций в большом количестве можно использовать большую культуральную баню. Кроме того, культивирование можно проводить в открытой системе или закрытой системе, предпочтительно используется закрытая система для безопасности полученной в результате клеточной популяции.
[0025]
Настоящее изобретение включает фармацевтическую композицию, содержащую клетки, экспрессирующие CAR в качестве активного ингредиента. Фармацевтическую композицию согласно настоящему изобретению вводят парентерально. В качестве парентерального введения включено внутривенное, внутриартериальное, внутримышечное, внутрибрюшинное и подкожное введение и т.д. Для повышения противоопухолевого эффекта можно использовать введение в менингиому или близкорасположенную ткань, например, подкожное введение. Вводимая доза выбирается подходящим образом в зависимости от состояния, массы тела, возраста субъекта и т.д. Как правило, клетки вводят в количестве, составляющем 107 - 109 клеток на 60 кг массы тела на введение, предпочтительно, примерно 5×107 - 5×108 клеток. Фармацевтическую композицию можно вводить один или более раз. Фармацевтическая композиция может быть представлена в форме, подходящей для парентерального введения, например, инъекции или инфузии. Фармацевтическая композиция может необязательно содержать фармацевтической приемлемое вспомогательное вещество. Фармацевтическая композиция может содержать солевой раствор, фосфатно-солевой буфер (ФСБ), среды и т.д. для стабильного поддержания клеток. В целом среды не ограничиваются конкретными примерами и включают такие среды, как RPMI, AIM-V, X-Vivo 10 и т.д.
[0026]
<Способ тестирования>
1. Скрининг антител с помощью фаговой библиотеки антител человека
(1) Получение связанных с комплексом п-MHC гранул
20 мкг комплекса A2/MAGE-A4 в качестве п-MHC и 200 мг магнитных гранул, связанных со стрептавидином, смешивали и повергали взаимодействию при 4°C в 0,05% растворе Твин/ФСБ(-). 3 мкл 2 мМ биотина/ФСБ(-) добавляли и подвергали взаимодействию в течение 1 часа. Раствор промывали два раза с помощью 0,05% раствора Твин/ФСБ(-) и суспендировали в 400 мкл 0,05% раствора Твин/ФСБ(-). Суспензию использовали в качестве содержащих антиген гранул.
(2) Библиотека человеческих антител
VH и VL амплифицировали с помощью ПЦР из ткани миндалин, пуповинной крови, периферической крови и костного мозга от десятков здоровых субъектов. Продукты ПЦР встраивали путем рекомбинации в фагмидный вектор pUC119 для создания scFv с репертуаром 3,4×1012. scFv был представлен на cp3 фага M13. Продукт использовали в качестве библиотеки человеческих антител.
[0027]
(3) Скрининг с применением библиотеки человеческих антител, выделение антитела, получение супернатанта cp3-содержащей культуры
Готовили реакционную смесь, содержащую раствор, включающий 3,4×1012 КОЕ библиотеки человеческих антител, 100 мкг стрептавидина (Pierce), 30 мкг тетрамера A2-CMV, 30 мкг тетрамера A2-Foxp69, 30 мкг тетрамера A2-IDOp41, 30 мкг тетрамера A2-IDOp195, 20 мкг реагента Gamma guard, 100 мкл 2% раствора БСА, 65 мкл 10% раствора Тритон X100, 1000 мкл 1% раствора Тритон X100/ФСБ, и смешивали и откручивали в течение 1 часа при комнатной температуре и добавляли 100 мкл раствора магнитных гранул, связанных с тетрамером A2/MAGE-A4, и смешивали и откручивали в течение 1 часа. Затем магнитные гранулы улавливали с помощью магнитной ловушки (Toyobo) с пятикратной промывкой 1% раствором Тритон X100/ФСБ. Магнитные гранулы добавляли к культивируемым клеткам XL1-blue, инфицировали в течение 1 часа при 37°C, центрифугировали и суспендировали в 600 мкл 2×среды YTAG (200 мкг/мл ампииллина, 1% глюкоза/2×YT). Суспензию помещали на планшет с агаром YTAG (200 мкг/мл ампициллина, 2% глюкоза/питательный агар (Nissui)), и культивировали в течение 15 часов при 37°C. Колонии собирали с помощью 30 мл 2×среды YTAG, 200 мкл собранного раствора добавляли к 20 мл 2×среды YTAG и добавляли 30 мкл хелперного фага VCSM. Смесь инкубировали в течение 30 минут при 37°C для инфицирования и инкубировали в течение 90 минут при 37°C. К культивируемой смеси добавляли 80 мл 2×среды YTAG, 60 мкл канамицина в концентрации 50 мкг/мл и 50 мкл 1M IPTG и инкубировали в течение 20 часов при 28°C. После центрифугирования инкубированной смеси супернатант смешивали с 25 мл раствора ПЭГ (20% ПЭГ#600, 2,5M NaCl). Осадок собирали посредством центрифугирования, суспендировали в 1 мл ФСБ и стерилизовали с помощью фильтра. Операцию повторяли два раза. Восстановленные E. coli помещали на агаровую среду YTAG. Затем инкубировали при 30°C, колонии собирали и культивировали в среде LB при 30°C в течение ночи. ДНК экстрагировали с помощью набора Miniprep DNA (QIAGEN) с использованием части культуральной среды LB и секвенировали. 50 мкл культуры смешивали с 1,5 мл 2×YTAI (2×среда YT, содержащая 0,5 мМ IPTG) и культивировали при 30°C в течение ночи. Супернатант разделяли посредством центрифугирования. Супернатант использовали в качестве cp3-содержащего супернатанта. Проводили ИФА путем использования cp3-содержащего супернатанта.
[0028]
2. Иммуноферментный анализ (ИФА)
(1) Комплекс MHC-пептид (мономер)
Комплекс, полученный в результате связывания HLA-A*0201 с MAGE-A4p230, MAGE-A4 P286, MAGE-A3 P195, CMV, MelanA, GP3, HTLV-1, NY-ESO-1 p157, NY-ESO-1 p159, Foxp3 p69, Foxp3 p127, Foxp3 p390, IDO p41, IDO p41, IDO p195 и IDO p199, использовали в качестве комплекса MHC-пептид.
(2) Иммобилизация п-MHC
500 нг нейтравидина (PIERCE Co.) в 50 мкл ФСБ суспендировали в планшете Maxisorp loose (Nunc) и встряхивали при 4°C в течение ночи. После удаления раствора добавляли 200 мкл 2% раствора БСА/ФСБ, раствор оставляли для блокировки в течение ночи. После удаления раствора добавляли 300 нг мономера HLA-A2/MAGE-A4 в 50 мкл ФСБ и встряхивали при 4°C в течение ночи. Раствор промывали ФСБ.
Иммобилизирование HLA-A2/CMV в качестве отрицательного контроля проводили таким же образом.
(3) Измерение ИФА-реакции
100 мкл супернатанта cp3-содержащей культуры выливали в лунку планшета с иммобилизированным антигеном, после встряхивания в течение 1 часа при комнатной температуре лунку планшета промывали ФСБ, выливали в лунку 100 мкл кроличьих антител против cp3, разведенных в 2000 раз 0,05% раствором Твин 20/ФСБ, и планшет встряхивали в течение 1 часа при комнатной температуре. Затем лунку промывали ФСБ, наливали в лунку 100 мкл меченных пероксидазой хрена (horseradish peroxidase, HRP) антител против IgG кролика (MBL Co., Ltd.) в 4000-кратном разведении в 0,05% растворе Твин 20/ФСБ и планшет встряхивали в течение 1 часа при комнатной температуре. Затем лунку промывали ФСБ, OPD (WAKO Co., Ltd.) суспендировали в растворе, содержавшем 0,01% H2O2, 0,1М Na2PO4, 0,1М лимонную кислоту (pH5,1), выливали и подвергали реакции, после подтверждения появления цвета добавляли 2н H2SO4 для остановки реакции. Поглощение измеряли при длине волны 490 нм на ридере SpectraMaxM2 (Molecular Devices).
[0029]
3. Очистка антитела
(1) Перенос (трансфекция) в вектор для очистки
Ген антитела переносили в вектор экспрессии, содержащий His/FLAG-метку для получения указанного гена в форме scFv-FLAG/His. FLAG-метку использовали для выявления с помощью метода сортировки клеток с активированной флуоресценцией (Fluorescence-Activated Cell Sorting, FACS), His-метку использовали для очистки с помощью колонки соответственно.
(2) Трансфицирование
После того, как клонированную ДНК выделенного антитела обрабатывали SalI (Takara Bio Inc.), фрагмент ДНК подвергали взаимодействию с вектором с помощью ДНК-лигазы T4. Компетентные клетки DH5α (TOYOBO Co. Ltd.) трансфицировали ДНК и помещали на планшет LBGA. После инкубирования при 30°C в течение ночи колонии культивировали в 2×среде YTAG и часть раствора культуры культивировали в 2×среде YTAI, супернатант получали посредством центрифугирования.
(3) Подтверждение экспрессии scFv-FLAG/His
После того как 100 мкл супернатанта культуры выливали в лунку планшета с антигеном, планшет встряхивали в течение 1 часа при комнатной температуре и лунку промывали ФСБ. Для подтверждения экспрессии His-метки наливали меченные пероксидазой хрена (horseradish peroxidase, HRP) антитела против His (MBL Co., Ltd.) в 4000-кратном разведении в 0,05% растворе Твин 20/ФСБ и встряхивали в течение 1 часа при комнатной температуре. Для подтверждения экспрессии FLAG-метки проводили по очереди реакцию с антителами против FLAG(DDDK) и меченными HRP антителами.
После промывки ФСБ планшета, связанного с антигеном, наливали OPD (WAKO Co., Ltd.), суспендированный в растворе, содержавшем 0,01% H2O2, 0,1M Na2PO4, 0,1M лимонную кислоту (pH 5,1), и подвергали взаимодействию. После подтверждения появления цвета добавляли 2н H2SO4 для остановки реакции. Поглощение измеряли при длине волны 490 нм на ридере SpectraMaxM2 (Molecular Devices).
[0030]
(4) Грубая очистка антитела
2 мл бактериального раствора после предварительного культивирования помещали в 100 мл 2×YTAI и культивировали при 30°C в течение ночи. Раствор центрифугировали (8000 об./мин, 10 мин, 4°C), супернатант собирали, добавляли к указанному супернатанту 100 мл насыщенной серной кислоты и перемешивали. Раствор центрифугировали (8000 об./мин, 20 мин, 4°C) и суспендировали в 10,5 мл раствора ФСБ. После центрифугирования раствора ФСБ (12000 об./мин, 1 ч, 4°C), к супернатанту добавляли 1 мл никель-сефарозной среды (Ni Sepharose excel, GE Healthcare), уравновешенной с помощью ФСБ, и инкубировали при 4°C в течение ночи. Колонку заполняли образцом, промывали 0,5 М NaCl-ФСБ, содержащим 0,5М NaCl-ФСБ и 20 мМ имидазол, и элюировали 0,5M NaCl-ФСБ, содержащим 250 мМ имидазол. Элюент диализовали против ФСБ, после диализа концентрировали с помощью концентратора Amicon Ultra 10K (Millipore). Часть образца подвергали ДСН-ПААГ-электрофорезу для подтверждения наличия банда с помощью окраски Кумасси бриллиантовым синим (Coomassie Brilliant Blue, CBB) и для определения концентрации белка для антитела, прошедшего грубую очистку.
(5) Очистка белка с His-меткой с применением системы AKTA Prime plus
Антитело после грубой очистки дополнительно очищали с помощью хроматографической системы AKTA Prime plus (GE Healthcare) с использованием колонки HisTRAP. Процедуру осуществляли в соответствии с протоколом очистки с использованием присоединенной His-метки. Восстановленные пиковые фракции выявляли с помощью ДСН-ПААГ-электрофореза.
[0031]
4. Измерение константы диссоциации (значения KD)
Значения KD очищенных антител измеряли с помощью системы BiacoreX100 (GE Healthcare). Лиганды иммобилизировали с помощью набора для захвата Biotion (GE Healthcare).
(1) Иммобилизация лиганда
HLA-A2/MAGE-A4p230 иммобилизировали на сенсорном CAP-чипе. Концентрацию доводили до 200 нМ с помощью HBS-буфера и лиганд иммобилизировали как подходящую РЕ (резонансную единицу).
(2) Получение анализируемого раствора (раствора аналита)
Концентрацию очищенного антитела доводили до 12,5 нМ, 25 нМ, 50 нМ, 100 нМ и 200 нМ с помощью HBS EP + буфера.
(3) Измерение значений KD
Реакцию связывания измеряли в течение 180 секунд по мере прохождения анализируемого раствора через проточную кювету сенсорного чипа. После измерения анализируемый раствор заменяли на HBS-буфер и реакцию диссоциации измеряли в течение 300 секунд. Измерение осуществляли с помощью однотактного метода программы для непрерывного потока анализируемого раствора от низкой концентрации к высокой концентрации.
После окончания реакций со всеми концентрациями рассчитывали константу связывания с использованием программы аппроксимации кривой по точкам.
[0032]
5. Анализ с помощью проточной цитометрии (FACS)
(1) Оборудование
Систему FACS Calibur/FACS Cant/FACS CantII (BD) использовали для проточного цитометрического измерения.
(2) Флуоресцентно меченное антитело
Использовали флуоресцентно меченные антитела, как описано в таблице 1.
[0033]
[Таблица 1]

(3) ФЭ-тетрамер
ФЭ-тетрамер означает стрептавидин-фикоэритрин (ФЭ), к которому присоединены четыре биотинилированных мономера. ФЭ-тетрамер использовали для выявления антиген-специфичных T-клеток. Тетрамеры, используемые в заявке, представляли собой тетрамер A2/MAGE-A4p230 и тетрамер A2/NY-ESO-1 p157.
[0034]
6. Анализ стабильности HLA и анализ связывания scFv
(1) T2-клетки (гибридная лимфобластная человеческая клеточная линия HLA-A*02+BT)
T2-клетки представляют собой вид клеточной линии, у которой отсутствует транспортер, связанный с процессингом антигена (Transporter Associated with Antigen Processing, TAP), ее особенность заключается в отсутствии презентации внутриклеточного белка с HLA.
(2) Введение пептида в T2-клетки
Пептид добавляли к T2-клеткам с достижением конечной концентрации 10 мкМ в среде RPMI1640 для клеток человека, оставляли на 15 минут при комнатной температуре, добавляли RPMI1640 для клеток человека, содержавшую 20% ЭБС с достижением конечной концентрации ЭБС, составляющей 10%. Клетки инкубировали в CO2-инкубаторе в течение 45 мин при 37°C. После двух промывок клетки использовали для анализа.
(3) Анализ стабильности HLA
Связанные с красителем Alexa Fluor 488 антитела против HLA-A2 подвергали реакции в течение 1 часа с T2-клетками, в которые вводили пептид. Количество HLA, стабилизированного на поверхности T-клеток, определяли путем выявления с помощью метода сортировки клеток с активированной флуоресценцией (FACS).
[0035]
(4) Анализ связывания scFv
T2-клетки, в которые вводили пептид, подвергали реакции с полученными антителами в течение 1 часа, с антителом против FLAG в течение 1 часа, с FITC-конъюгированным антителом против IgG мыши в течение 1 часа и выявляли с помощью метода FACS.
(5) Пептиды с одной аминокислотной заменой и пептиды-имитаторы
Как показано в Таблице 2, синтезировали пептиды с одной аминокислотной заменой, где одна из 10 аминокислот MAGE-A4p230-239 была заменена на аланин (A), метионин (M), фенилаланин (F) и триптофан (W), и оценивали значение концентрации полумаксимального ингибирования (half maximal inhibitory concentration, IC50) для каждого полученного пептида. Концентрацию каждого пептида доводили до конечной концентрации 10 мМ в ДМСО.
IC50 для MHC представляет собой теоретическое значение, рассчитанное с использованием базы данных иммунных эпитопов (Immune Epitope Database, IEDB, http://tools.immuneepitope.org/processing/). Чем ниже указанное значение, тем сильнее связь между HLA-A*0201 и пептидом.
В Таблице 2 показана аминокислотная последовательность пептидов с одной аминокислотной заменой и значения IC50.
[0036]
[Таблица 2]

В Таблице 3 показаны аминокислотные последовательности и значения IC50 для пептидов-имитаторов, которые выбирали с помощью поиска BLAST из пептидов семейства MAGE и аминокислот, распознающих антитело MAGE#17.
[0037]
[Таблица 3]

[0038]
7. Создание конструкта CAR и вектора
(1) MAGE#17-28z CAR
На Фигуре 1 представлено изображение последовательности CAR-конструкта. Конструкт содержит лидерную последовательность, VH, VL, CL, CD28TM, CD28ICD (внутриклеточный домен CD28) и CD3-зета (CD3ζ) цепи с 5'-конца. VH и VL представляют собой scFv-фрагмент MAGE#17 в указанных цепях.
(2) Конструирование CAR
На Фигуре 2 схематично показаны этапы конструирования CAR. Для пояснения, каждый этап являлся таким, как следует далее.
Сначала проводили реакцию ПЦР с использованием scFv-cp3 в качестве матрицы, при этом добавляли лидерную последовательность с сайтом распознавания EcoRI на 5'-конец VH-VL и CL с сайтом распознавания AscI на 3'-конец соответственно. Затем фрагмент продукта ПЦР, обработанный EcoRI и AscI, и фрагмент CAR 28z-вектора, обработанный EcoRI и AscI, подвергали взаимодействию с помощью лигазы для получения CAR 28z.
[0039]
8. Получение человеческих лимфоцитов
Человеческие лимфоциты получали из крови здорового донора с применением раствора Ficoll-PaqueTM PLUS (17-1440-03, GE Healthcare). Указанные лимфоциты получали путем отделения мононуклеарных клеток периферической крови (МКПК). Сбор образцов, содержащих используемую в исследовании периферическую кровь человека, и анализ проводили в соответствии с Хельсинской декларацией и в соответствии с протоколом, одобренным Этическим комитетом факультета медицинских исследований Университета Миэ (Mie University) с письменного согласия субъектов.
Собранные образцы хранили в морозильной камере или сосуде с жидким азотом в зашифрованном виде для невозможности идентификации субъектов и в качестве меры защиты от кражи данных. Личная информация субъектов была анонимной, особое внимание уделяли приватности персональных данных и предотвращению утечки данных результатов анализа генов.
[0040]
9. Введение мРНК в клетки путем электропорации
(1) Получение мРНК
ДНК CAR разрезали с образованием одноцепочечных молекул для получения линейной ДНК-матрицы. ДНК очищали с использованием системы для очистки ДНК из гелей Wizard SV и системы для очистки ДНК после ПЦР PCR Clean-UP (Promega). мРНК получали из очищенной ДНК с применением набора mMESSAGEmMACHINE T7 Ultra (Life Technologies).
(2) Проверка с помощью системы Bioanalyzer
Добавление полиA к мРНК подтверждали с помощью системы Bioanalyzer (Agilent Technologies).
(3) Получение культуры МКПК в планшете
Антитела против CD3 (OKT-3, eBioscience) разводили раствором антикоагулянта ACD-A (TERUMO) с достижением конечной концентрации 5 мкг/мл, реагент RetroNectin (Takara Bio) разводили раствором ACD-A с достижением конечной концентрации 25 мкг/мл, по 400 мкл обоих растворов выливали в каждую лунку 12-луночного планшета (Nunc) и инкубировали в течение 5-10 часов при 37°C в CO2-инкубаторе.
[0041]
(4) Получение КС (культуральной среды)
Получали культуру МКПК, содержащую 50 мл среды для лимфоцитов GT-T503, 50 мкл IL-2 человека (600 IU), 400 мкл раствора Albuminar (25% человеческий сывороточный альбумин, ЧБС) и 300 мкл лимфоцитов плазмы донора.
(5) Выделение и культивирование МКПК
Мононуклеарные клетки периферической крови (МКПК) выделяли из крови здорового человека с помощью раствора Ficoll и суспендировали в КС в концентрации 2×105 клеток/мл, 2,5 мл суспензии выливали в планшет и культивировали в течение 4 дней при 37°C в CO2-инкубаторе.
(6) Электропорация
Полученную мРНК вводили в МКПК путем электропорации через 10 дней после выделения клеток. МКПК с введенной мРНК использовали для анализа в пределах 24 часов.
[0042]
10. Перенос генов в клетки с помощью ретровируса (эксперимент по инфицированию)
(1) Получение ретровируса с помощью пакующих клеток Plat-A
Ген CAR вводили в пакующие клетки plat-A с применением реагента FuGENE (Promega). После инкубирования в течение двух дней супернатант восстанавливали и использовали в качестве вирусного раствора.
(2) Выделение и культивирование МКПК
Выделение и культивирование МКПК осуществляли в соответствии с приведенным выше способом в разделе 9, (3)-(5).
(3) Получение планшета для ретровирусной инфекции
Реагент RetroNectin разбавляли раствором ACD-A в конечной концентрации 20 мкг/мл. 500 мкл раствора выливали в каждую лунку 24-луночного планшета и хранили при 4°C в течение ночи. Перед заливкой вирусного раствора планшет дважды промывали ACD-A.
[0043]
(4) Получение планшета, содержащего ретровирус для инфекции, инфицирование клеток
Вирусный раствор, полученный выше (10.(1)), выливали в планшет для ретровирусной инфекции в объеме 1 мл, планшет центрифугировали при 2000×g в течение 2 часов при 32°C для покрытия планшета вирусом. Планшет промывали два раза 1,5% раствором Alubuminar/ФСБ.
(5) Инфицирование ретровирусом МКПК, получение CAR-T-клеток
Культивированные МКПК (10.(2), выше) восстанавливали. После разведения культуральной средой до концентрации 4×105 в планшет высевали 950 мкл суспензии для инфицирования ретровирусом, затем планшет центрифугировали при 1000×g в течение 10 минут при 32°C и инкубировали при 37°C в CO2-инкубаторе.
Полученные CAR-T-клетки использовали для анализа через 12-14 дней после выделения МКПК.
(6) Получение контрольных клеток
Часть культивированных клеток (10.(2), выше) использовали в качестве контрольных клеток (без проведения процедур по переносу генов).
[0044]
11. Характеристики опухолевых клеточных линий, используемых в экспериментах in vitro
Характеристики клеточных линий, используемых в экспериментах in vitro, показаны в Таблице 4.
[Таблица 4]

[0045]
12. Анализ высвобождения IF-γ
Концентрацию IF-γ в культуре определяли с помощью ИФА с применением набора eBioscience.
10× буфер для иммобилизации разводили в 10 раз очищенной водой с получением 1× буфера для иммобилизации. 48 мкл первичных антител добавляли к 12 мл буфера для иммобилизации. Буфер добавляли в 96-луночный планшет с плоским дном в объеме 100 мкл на лунку. После поддержания планшета при температуре 4°C в течение ночи проводили его пятикратную промывку 0,05% раствором ФСБ-T. 5× раствор аналитических разбавителей разводили в 5 раз очищенной водой для получения 1× раствора аналитических разбавителей. Аналитические разбавители добавляли в концентрации 200 мкл на лунку. Через 1 час инкубирования планшета при комнатной температуре для блокировки планшет промывали 5 раз 0,05% раствором ФСБ-T. IFN-γ готовили в максимальной концентрации 1000 пг/мл и проводили 7-стадийное двукратное разведение для приготовления стандартов. Образцы и стандарты добавляли в планшет, позволяли реагировать в течение 2 часов при комнатной температуре и планшет промывали 5 раз 0,05% раствором ФСБ-T. 48 мкл вторичных антител добавляли к 12 мл аналитических разбавителей, полученные разбавители добавляли в объеме 100 мкл на лунку. После инкубирования планшета в течение 1 часа при комнатной температуре осуществляли пятикратную промывку 0,05% раствором ФСБ-T. К 12 мл аналитических разбавителей добавляли 48 мкл конъюгированного с пероксидазой хрена (HRP) стрептавидина, полученный раствор добавляли в объеме 100 мкл на лунку. Планшет оставляли реагировать в темноте в течение 30 минут при комнатной температуре и промывали семь раз 0,05% раствором ФСБ-T. Раствор тетраметилбензидинового (tetramethylbenzidine, TMB) субстрата добавляли в объеме 100 мкл, позволяли реагировать в темноте в течение 15 минут при комнатной температуре и добавляли 50 мкл 0,18М H2SO4 для остановки реакции. Планшет сразу анализировали при длине волны 450 нм с помощью планшетного ридера (Model 680, Bio-Rad).
[0046]
13. Внутриклеточное окрашивание цитокинов (ВОЦ)
Клетки-мишени доводили до концентрации 1×105 клеток/мл, эффекторные клетки доводили до концентрации 1×105 клеток/мл. Добавляли 0,5 мкл раствора направленных на CD107a человека антиген-презентирующих клеток (АПК) на образец, клетки-мишени и эффекторные клетки добавляли в отношении 1:1 в 96-луночный планшет (с U-образным дном), проводили сокультивирование в течение 1 часа при 37°C. Затем в каждую лунку добавляли 0,7 мкл реагента Golgistop (ингибитора белкового транспорта) и инкубировали в течение 4 часов при 37°C. Клетки из каждой лунки переносили в 96-луночный планшет с V-образным дном, центрифугировали при скорости 1200 об./мин в течение 5 минут при 4°C и затем промывали два раза 0,5% раствором бычьего сывороточного альбумина (БСА) на ФСБ. 0,5 мкл раствора направленных на CD4 человека АПК-cy7 и 0,5 мкл конъюгированных с флуоресцеинизотиоцианатом (fluorescein isothyocyanate, FITC) антител против CD8 человека добавляли в каждую лунку и помещали на лед на 20 минут в темноте и планшет промывали два раза 0,5% раствором БСА/ФСБ. Добавляли 100 мкл фиксирующего раствора для клеток (Cytofix/Cytoperm: BD), помещали на лед на 20 минут в темноте, добавляли 100 мкл пермеабилизирующего/промывочного буфера Perm/Wash (BD) и центрифугировали. Затем планшет промывали два раза пермеабилизирующим/промывочным буфером Perm/Wash. В каждую лунку добавляли 0,5 мкл IFN-γ V450 и 0,5 мкл TNF-α PE-Cy7. Планшет помещали на лед в темноте на 30 минут, промывали два раза 0,5% раствором БСА/ФСБ. После этого планшет анализировали с помощью проточного цитометра FACSCanto II (BD) и анализ данные проводили с помощью программы FACS Diva (BD).
[0047]
14. Захват АПК длинного пептида, перекрестная презентация
(1) Длинный пептид MAGE-A4
Аминокислотная последовательность длинного пептида MAGE-A4 представляла собой NYKRCFPVIF GKASEGVYDG REHTVYGEPR KAETSYVKVL EHVVRVNARV RI (SEQ ID NO: 28), молекулярная масса пептида составляла 6006,811. Длинный пептид был создан путем соединения эпитопа MAGE-A4 A24 (143-151) (NYKRCFPVI: SEQ ID NO: 29), эпитопа MAGE-A4 A2 (230-239) (GVYDGREHTV: SEQ ID NO: 1) и хелперного эпитопа (AETSYVKVLE HVVRVNARVR I: SEQ ID NO: 30).
(2) CHP-длинные пептиды
CHP-длинный пептид относится к объекту, в котором длинный пептид MAGE-A4 упакован в наногель на основе содержащего холестерильную группу пуллулана (cholesteryl group-bearing pullulan, CHP) в качестве системы доставки лекарственного средства. Ожидается, что использование указанного объекта может вызывать индукцию клеточного иммунитета (непатентный документ 5).
(3) Селекция CD3-отрицательных гранул
1×107 лимфоцитов человека суспендировали в 80 мкл 2% раствора ЭБС/ФСБ. К суспензии добавляли 20 мкл связанных с CD3 микрогранул (Miltenyi Biotec) и тщательно перемешивали. После инкубирования в течение 15 минут при 4°C при экранировании света суспензию промывали 10 объемами 2% раствора ЭБС/ФСБ. Клетки суспендировали в 3 мл 2% раствора ЭБС/ФСБ для использования в качестве клеточной суспензии. Клеточную суспензию наносили на сепаратор MACS, снабженный колонкой MACS. Фракции, которые проходили через колонку, представляли собой CD3-отрицательные фракции, используемые в качестве АПК.
[0048]
15. Анализ цитотоксичности
(1) Анализ высвобождения Cr
После того как клетки-мишени были собраны посредством центрифугирования, их суспендировали в 100% ЭБС в конечной концентрации 1×106 клеток/50 мкл. К клеткам добавляли 50мкКи (3,7×106 Бк)51Cr и инкубировали в течение 1 часа при 37°C в CO2-инкубаторе. Концентрацию эффекторных клеток подводили с помощью среды RPMI1640, содержащей 10% ЭБС, в соответствии с отношением E/T и клетки высевали в 96-луночный планшет с U-образным дном. После культивирования клетки промывали три раза средой RPMI1640, содержащей 10% ЭБС. Клетки суспендировали в среде RPMI1640, содержащей 10% ЭБС, в конечной концентрации 1×105 клеток/мл, высевали в концентрации 1×104 клеток/100 мкл/лунку в 96-луночный планшет с U-образным дном и культивировали в течение 8 часов в CO2-инкубаторе при 37°C. После культивирования планшет центрифугировали при 1200 об./мин в течение 5 минут при 4°C, 30 мкл супернатанта переносили в планшет для считывания и высушивали на воздухе в течение ночи. Количество51Cr определяли с помощью сцинтилляционного счетчика MicroBeta2 (Perkin Elmer). Расчет цитотоксической активности определяли в соответствии со следующим далее уравнением. Максимальное значение высвобождения представляло собой значение, измеренное при добавлении 100 мкл 1% NP-40.
Цитотоксическая активность (%) = 100 × (измеренное значение (cpm) - значение спонтанного высвобождения (cpm)) / (значение максимального высвобождения (cpm) - значение спонтанного высвобождения (cpm))
[0049]
16. Эксперимент на in vivo модели лечения рака с использованием мышей NOG
(1) Используемые мыши
Мышей NOG (NOD/Shi-scid, IL-2RγKO Jic) получали из компании CLEA Japan, Inc. В эксперименте использовали самок мышей возрастом 7-8 недель. Проведение инфузионной T-клеточной терапии на лабораторных животных и исследование на основе генной иммунотерапии были одобрены Комитетом по экспериментам с рекомбинантной ДНК Университета Миэ (Mie University), Этическим комитетом факультета медицинских исследований Университета Миэ и Комитетом по исследованиям на животных. Мышей размножали в Центре наук о жизни для исследований и поддержки отдела исследований на животных Университета Миэ (Mie University).
(2) Имплантация опухоли человека и тотальное облучение тела (ТОТ)
В качестве предварительного лечения мышам NOG проводили тотальное облучение тела (ТОТ, 2,5 Гр) за день до инфузии клеток. С помощью предварительного лечения снижали количество лимфоцитов у реципиента для облегчения приживления переносимых лимфоцитов донора. Концентрация CAR-T-клеток и лимфоцитов человека для инфузии составляла 1×107 клеток/животное. Трансфузию клеток проводили через хвостовую вену мышей NOG. Массу тела измеряли каждые 2-3 дня.
Трансплантацию опухоли мышам NOG проводили за 7 дней до инфузии CAR-T-клеток. Клетки NW-MEL-38 (A2-положительные MAGE-A4-положительные) инъецировали мышам в правый бок в концентрации 2,5×106 клеток/мышь, клетки HCT116 (A2-положительные MAGE-A4-отрицательные) инъецировали мышам подкожно в левый бок в концентрации 2,5×106 клеток/мышь. Диаметр опухоли измеряли каждые 2-3 дня.
[0050]
(3) Получение клеток для инфузии
CAR-T-клетки для инфузии готовили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса».
(4) Выделение мононуклеарных клеток периферической крови (МКПК) из периферической крови мыши путем забора крои из глазницы
Периферическую кровь собирали из глазницы мыши, мононуклеарные клетки периферической крови (МКПК) отделяли с помощью реагента Ficoll. Клетки окрашивали тетрамером A2/MAGE-A4 и флуоресцентно меченными антителами против CD4CD8 человека и инфузию клеток подтверждали с помощью метода FACS.
(5) Подтверждение ИОЛ (инфильтрирующих опухоль лимфоцитов)
Опухоль, извлеченную из мыши, разминали, окрашивали тетрамером A2-MAGE-A4 и флуоресцентно меченными антителами против CD4CD8 человека и трансфузию клеток подтверждали с помощью метода FACS.
(6) Иммуноокрашивание
Опухоли, извлеченные из мыши, замораживали в жидком азоте, срезы замороженной ткани готовили на криостате. Указанные срезы окрашивали с помощью DAPI, FITC-конъюгированных антител против CD4 человека и FITC-конъюгированных антител против CD8 человека и наблюдали с помощью флуоресцентного микроскопа.
[0051]
17. In vitro эксперименты на CD8-положительных T-клетках, в которые вводили CAR типа zG, и CD8-положительных T-клетках, в которые вводили CAR типа 4-1BBz
Подтверждали эффекты CAR-T-клеток, связанные с различиями в ICD-участке (внутриклеточном домене). В частности, CAR типа GITR (zG) и типа CD137 (4-1BBz) получали из CAR типа CD28 (28z), их эффекты подтверждали. Как показано на Фигуре 21, индуцируемый глюкокортикоидами рецептор фактора некроза опухоли (glucocorticoid-induced tumor necrosis factor receptor, GITR) использовали вместо CD28 в качестве ICD в CAR типа zG. Сходным образом, CD137 (4-1BBz) использовали вместо CD28.
В качестве контроля использовали CD8-положительные T-клетки, которые не трансфицировали CAR (NGMC).
[0052]
<Результаты>
1. Выделение и оценка антитела, распознающего HLA-A2/MAGE-A4
MAGE-A4 (HLA-A2-MAGE-A4), как известно, экспрессируется на высоком уровне в меланомах. Таким образом, было выделено множество антител, распознающих MAGE-A4, путем скрининга с использованием библиотек человеческих антител. Для выделения антител использовали метод фагового дисплея. Согласно методу, scFv был представлен как часть белка оболочки фага cp3. Клоны, которые связываются с антигеном с высокой аффинностью, могут быть выбраны с помощью ИФА. После сбора примерно 1500 клонов проводили ИФА для выявления клонов в форме scFv-CP3. Были выбраны клоны, отвечающие на комплекс HLA-A2/MAGE-A4, который использовали в качестве положительной мишени, и не отвечающие на комплекс A2/CMV, который использовали в качестве отрицательной мишени. Для оценки специфичности связывания выбранных антител проводили ИФА с применением комплексов нескольких пептидов с MHC (п-MHC). Каждый мономер п-MHC, содержащий HLA-A2/MAGE-A4p230, MAGE-A4 p286, MAGE-A3 p195, CMV, MelanA, GP3, HTLV-1 p11, NY-ESO-1 p157, NY-ESO-1 p159, Foxp3 p69, Foxp3 p127, Foxp3 p390, IDO p41, IDO p41, IDO p195 и IDO p199 иммобилизировали и проводили ИФА с применением выбранных антител. Некоторые результаты ИФА показаны на Фигуре 3.
[0053]
Было получено пятнадцать клонов, для которых наблюдали специфичную реакцию с HLA-A2/MAGE-A4, после сравнения последовательностей клонов, для которых наблюдали сильное связывание с HLA-A2/MAGE-A4. Из них 5 клонов, для которых наблюдали сильное связывание, а именно: MAGE#17, #86, #209, #345 и #672, были выбраны в качестве клонов-кандидатов и их подвергали аналитическим методам.
Затем значение KD для антитела MAGE#17 измеряли с помощью прибора BiacoreX100. Значения KD определяли с помощью Biacore путем измерения динамических изменений в чувствительности выявления (резонанс, отражающий изменение массы на матрице) с течением времени. Константу скорости диссоциации (Kd) и константу скорости связывания (Ka) определяли с помощью кривой динамики изменения, константу связывания определяли из отношения двух констант. По результатам измерения константа связывания MAGE#17 составляла 22 нМ (Фигура 4).
[0054]
2. Исследование специфичности распознавания комплекса A2/MAGE-A4 и антигена-имитатора полученными антителами
В T2-клетках отсутствует связанный с процессингом антигена транспортер (TAP) и не происходит презентация внутриклеточного белка с HLA. Поскольку HLA стабилизирован на T2-клетках, и уровень его экспрессии был подтвержден с помощью флуоресцентных антител против HLA, при введении пептида в T2-клетки можно определить степень связывания указанного пептида с HLA.
Выбранные антитела, т.е. антитела MAGE#17, #86, #209, #345 и #672, подвергали реакции с T2-клетками, в которые вводили MAGE-A4p230, CMV и ДМСО, величину сдвига определяли с помощью метода сортировки клеток с активированной флуоресценцией (FACS). Только в T2-клетках, в которые вводили MAGE-A4p230, для выбранных клонов антител MAGE #17, #86, #209, #345 и #672 наблюдали изменение величины сдвига (Фигура 5).
После этого для поиска аминокислот, связанных с распознаванием антитела, получали пептиды с заменой одной аминокислоты на другую аминокислоту (главным образом, аланин) в MAGE-A4p230 (GVYDGREHTV: SEQ ID NO: 1), силу связывания между HLA-A*0201 и пептидом оценивали с использованием базы данных иммунных эпитопов (immune epitope database, IEDB) и определяли IC50 для MHC (Таблица 2). IC50 для MHC представляет собой теоретическое значение, рассчитанное с использованием IEDB, чем ниже указанное значение, тем сильнее связь между HLA-A*0201 и пептидом. Пептиды с заменой аминокислоты на аланин вводили в T2-клетку, количество HLA на поверхности указанной T2-клетки определяли с помощью метода FACS (Фигура 6). Чем сильнее пептид связывался с HLA, тем более стабильной была структура пептид-HLA, поскольку величина сдвига в методе FACS увеличивалась. Значение средней интенсивности флуоресценции (СИФ) являлось показателем силы связывания пептида и HLA. За исключением некоторых пептидов, значение СИФ и значение IC50 для MHC соответствовали друг другу.
[0055]
Затем пептид с заменой аминокислоты на аланин вводили в T2-клетку и подвергали взаимодействию с MAGE#17 и проводили оценку аминокислот, вовлеченных в распознавание антитела (Фигура 7). Поскольку значение СИФ снижалось при замене 1A, 2A, 3A, 4A, 5A, 6A и 8A, было определено, что семь аминокислот вовлечено в распознавание. Аминокислотная последовательность GVYDGRxHxx была выведена с помощью поиска BLAST и был выбран пептид-имитатор (Таблица 3). После введения в T2-клетки стимулирующего пептида определяли количество HLA на поверхности T2-клеток с помощью метода FACS. Подобно результатам, показанным на Фигуре 6, значение СИФ и значение IC50 для MHC соответствовали друг другу (Фигура 8).
Затем в T2-клетки вводили пептид-имитатор, подвергали взаимодействию с MAGE#17 и подтверждали, что T2-клетка не распознает указанный пептид-имитатор (Фигура 9). Сходные анализы осуществляли на практике с применением других клонов #86, #209, #345, и #672, результаты показали, что клон #17 содержал наибольше количество аминокислот, вовлеченных в распознавание антигена. По этой причине антитело MAGE#17 была выбран в качестве окончательного кандидата.
[0056]
Была показана нуклеотидная последовательность (SEQ ID NO: 31) и аминокислотная последовательность (SEQ ID NO: 32) MAGE#17.
Нуклеотидная последовательность MAG#17 (SEQ ID NO: 31): CAGGTCCAGC TGGTACAGTC TGGGGCTGAG GTGAAGAAGC CTGGGTCCTC GGTGAAGGTC TCCTGCAAGG CTTCTGGAGG CACCTTCAGC AGCTATGCTA TCAGCTGGGT GCGACAGGCC CCTGGACAAG GGCTTGAGTG GATGGGAGGG ATCATCCCTA TCTTTGGTAC AGCAAACTAC GCACAGAAGT TCCAGGGCAG AGTCACGATT ACCGCGGACA AATCCACGAG CACAGCCTAC ATGGAGCTGA GCAGCCTGAG ATCTGAGGAC ACGGCCGTGT ATTACTGTGC GAGATCCCCC CGGCGGGCAT ATCATGATGC TTTTGATATC TGGGGCCAAG GGACAATGGT CACCGTCTCT TCAGGTGGAG GCGGTTCAGG CGGAGGTGGC AGCGGCGGTG GCGGGAGTTC CTATGAGCTG ACTCAGCCAC CCTCGATGTC AGTGGCCCCA GGAAAGACGG CCAGCATTAC CTGTGGCGGA GACCATATTG GAAGTAAAAG TGTTCACTGG TACCAGCAGA AGCCAGGCCA GGCCCCTGTA CTGGTCGTCT ATGATGATAG CGACCGGCCC TCAGGGATCC CTGAGCGATT CTCTGGCTCC AACTCTGGGA ACACAGCCAC TCTGACCATC AGCGGGACCC AGGCTATGGA TGAGGCTGAC TATTACTGTC TGGCGTGGGA CAGCAGCACT GCGATCTTCG GCGGAGGGAC CAAGCTGACC GTCCTC.
[0057]
Аминокислотная последовательность MAGE#17 (SEQ ID NO: 32): QVQLVQSGAE VKKPGSSVKV SCKASGGTFS SYAISWVRQA PGQGLEWMGG IIPIFGTANY AQKFQGRVTI TADKSTSTAY MELSSLRSED TAVYYCARSP RRAYHDAFDI WGQGTMVTVS SGGGGSGGGG SGGGGSSYEL TQPPSMSVAP GKTASITCGG DHIGSKSVHW YQQKPGQAPV LVVYDDSDRP SGIPERFSGS NSGNTATLTI SGTQAMDEAD YYCLAWDSST AIFGGGTKLT VL.
Указанные выше последовательности показывают, что нуклеотидная последовательность содержит VH-участок (SEQ ID NO: 33), sc-участок (SEQ ID NO: 34) и VL-участок (SEQ ID NO: 35), и аминокислотная последовательность содержит VH-участок (SEQ ID NO: 36), sc-участок (SEQ ID NO: 37) и VL-участок (SEQ ID NO: 38), как показано далее.
Нуклеотидная последовательность VH-участка (SEQ ID NO 33): CAGGTCCAGC TGGTACAGTC TGGGGCTGAG GTGAAGAAGC CTGGGTCCTC GGTGAAGGTC TCCTGCAAGG CTTCTGGAGG CACCTTCAGC AGCTATGCTA TCAGCTGGGT GCGACAGGCC CCTGGACAAG GGCTTGAGTG GATGGGAGGG ATCATCCCTA TCTTTGGTAC AGCAAACTAC GCACAGAAGT TCCAGGGCAG AGTCACGATT ACCGCGGACA AATCCACGAG CACAGCCTAC ATGGAGCTGA GCAGCCTGAG ATCTGAGGAC ACGGCCGTGT ATTACTGTGC GAGATCCCCC CGGCGGGCAT ATCATGATGC TTTTGATATC TGGGGCCAAG GGACAATGGT CACCGTCTCT TCA.
[0058]
Нуклеотидная последовательность sc-участка (SEQ ID NO 34): GGTGGAGGCG GTTCAGGCGG AGGTGGCAGC GGCGGTGGCG GGAGTTCCTA T.
Нуклеотидная последовательность VL-участка (SEQ ID NO 35): GAGCTGACTC AGCCACCCTC GATGTCAGTG GCCCCAGGAA AGACGGCCAG CATTACCTGT GGCGGAGACC ATATTGGAAG TAAAAGTGTT CACTGGTACC AGCAGAAGCC AGGCCAGGCC CCTGTACTGG TCGTCTATGA TGATAGCGAC CGGCCCTCAG GGATCCCTGA GCGATTCTCT GGCTCCAACT CTGGGAACAC AGCCACTCTG ACCATCAGCG GGACCCAGGC TATGGATGAG GCTGACTATT ACTGTCTGGC GTGGGACAGC AGCACTGCGA TCTTCGGCGG AGGGACCAAG CTGACCGTCC TC.
Аминокислотная последовательность VH-участка (SEQ ID NO 36): QVQLVQSGAE VKKPGSSVKV SCKASGGTFS SYAISWVRQA PGQGLEWMGG IIPIFGTANY AQKFQGRVTI TADKSTSTAY MELSSLRSED TAVYYCARSP RRAYHDAFDI WGQGTMVTVS S.
Аминокислотная последовательность sc-участка (SEQ ID NO: 37): GGGGSGGGGS GGGGSSY.
Аминокислотная последовательность VL-участка (SEQ ID NO: 38): ELTQPPSMSV APGKTASITC GGDHIGSKSV HWYQQKPGQA PVLVVYDDSD RPSGIPERFS GSNSGNTATL TISGTQAMDE ADYYCLAWDS STAIFGGGTK LTVL.
[0059]
3. MAGE#17-CAR специфично распознает раковые клетки-мишени и повышает продукцию IFN-γ
Поскольку была подтверждена специфичность клона антитела MAGE#17, MAGE#17 перемещали в вектор CAR. Затем после получения мРНК его включение подтверждали с помощью системы Bioanalyzer, ген CAR вводили в человеческие лимфоциты периферической крови (МКПК) с помощью метода электропорации. Нормальную экспрессию введенного CAR подтверждали с помощью окраски тетрамером. В результате коэффициент позитивности CAR для CAR-T-клеток составлял 98,8% (CD8) и 98,5% (CD4) (Фигура 10). CAR-T-клетки и T2-клетки с введенным пептидом сокультивировали в течение 24 часов и измеряли уровень IFN-γ в супернатанте культуры. Наблюдали специфичное повышение продукции IFN-γ в T2-клетках, в которые вводили MAGE-A4. Сходный анализ проводили с использованием контрольных клеток (клетки, не подверженные переносу генов). Кроме того, опухоль-специфичную продукцию IFN-γ наблюдали в клетках-мишенях - A2-положительных MAGE-A4-положительных клетках линий NW-MEL-38 и LB-23 - по сравнению с клетками линий LC-1/sq и MEL72, не являющимися мишенями (Фигура 11).
[0060]
Поскольку экспрессия CAR по результатам оценки мРНК была временной, проводили генную трансфекцию с помощью ретровируса для постоянной экспрессии CAR. После того, как был сконструирован ретровирусный вектор для введения CAR, ретровирус получали с использованием пакующих клеток plat-A, CAR-T-клетки были получены путем инфицирования ретровирусом мононуклеарных клеток периферической крови (МКПК). Перенос генов проводили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса». Экспрессию CAR подтверждали по окраске тетрамером. В результате коэффициент позитивности CAR для CAR-T-клеток составлял 59,3% (CD8) и 49,5% (CD4) (Фигура 12).
CAR-T-клетки, подвергнутые ретровирусному генному переносу, и T2-клетки, в которые вводили пептид, сокультивировали в течение 24 часов, измеряли уровень IFN-γ в супенатанте культуры. Наблюдали специфичное повышение продукции IFN-γ в T2-клетках, в которые вводили MAGE-A4. Сходный анализ проводили с использованием контрольных клеток (клетки, не подвергавшиеся генному переносу). Кроме того, опухоль-специфичную продукцию IFN-γ наблюдали в клетках-мишенях - A2-положительных MAGE-A4-положительных клетках линий NW-MEL-38 и LB-23 - по сравнению с клетками LC-1/sq и MEL72, не являющимися мишенями (Фигура 13). Подтверждали экспрессию CAR в результате введения мРНК и введения гена CAR с помощью ретровирусных векторов, клетки специфично распознавали опухоль и продуцировали IFN-γ.
[0061]
4. CAR-T-клетки, в которые вводили ген MAGE#17-CAR, специфично распознавали раковые клетки-мишени и проявляли цитотоксическую активность
Ожидалось, что CAR-T-клетки будут распознавать A2/MAGE-A4, экспрессируемый в качестве антигена на раковых клетках, активироваться и проявлять цитотоксическую активность. Известно, что IFN-γ, TNF-α и CD107a являются индикаторами активации T-клеток, их экспрессия повышается по мере активации T-клеток. Таким образом, проводили внутриклеточную окраску цитокинов (ВОЦ) в T2-клетках, в которые вводили пептид, и MAGE#17-CAR-T-клетках, которые сокультивировали с клетками-мишенями.
В результате процент CAR-T-клеток, в которых окрашивался IFN-γ, TNF-α и CD107a, повышался при сокультивировании с T2-клетками, в которые вводили MAGE-A4p230 (Фигура 14). Боле того, процент CAR-T-клеток, в которых окрашивался IFN-γ, TNF-α и CD107a, повышался при их сокультивировании с клетками-мишенями - A2-положительными MAGE-A4-положительными клетками NW-MEL-38 и LB-23 (Фигура 15).
[0062]
5. Продукция IFN-γ в CAR-T-клетках повышалась в результате презентации антигена антиген-презентирующими клетками (АПК), которые захватывали длинный пептидный антиген MAGE-A4.
Мононуклеарные клетки периферической крови (МКПК) отделяли из периферической крови здорового человека, проводили негативную селекцию с помощью связанных с CD3 магнитных шариков, CD3-отрицательные фракции использовали в качестве антиген-презентирующих клеток (АПК). A2-АПК использовали в качестве АПК с презентацией MAGE-A4p230, и A24-АПК использовали в качестве АПК для отрицательного контроля. Добавляли длинный пептид MAGE-A4 и CHP-длинный пептид MAGE-A4 с достижением конечной концентрации 10 мкМ, клетки культивировали в течение ночи и проводили сокультивирование с CAR-T-клетками в течение 24 часов. Перенос генов в CAR-T-клетки проводили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса». В результате концентрация IFN-γ в супернатанте культуры повышалась при сокультивировании с A2-АПК, в которые вводили длинный пептид MAGE-A4 (Фигура 16).
Длинные пептиды MAGE-A4 встраивали в АПК, MAGE-A4p230 презентировался с молекулами MHC I класса, продукция IFN-γ CAR-T-клетками, которые распознавали комплекс MAGE-A4p230/MHC I класса, специфично повышалась. С другой стороны, специфичную продукцию IFN-γ не наблюдали в случае CHP-длинных пептидов MAGE-A4, упакованных в CHP-наногель, используемый в качестве системы доставки лекарственного средства.
[0063]
6. CAR-T-клетки, в которые переносили ген MAGE#17-CAR, специфично лизировали раковые клетки-мишени
Наличие специфичной цитотоксической активности содержащих MAGE#17-CAR клеток подтверждали по анализу высвобождения51Cr. Когда отношение CAR-T-клеток и раковых клеток-мишеней представляло собой отношение E/T (отношение эффектор/мишень), раковые клетки, захватывающие Cr, и CAR-T-клетки сокультивировали в течение 8 часов при отношении E/T 10:1, 3:1, 1:1, уровень цитотоксичности (% лизиса) определяли на основе радиоактивности51Cr в супернатанте. Генный перенос в CAR-T-клетках проводили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса».
В результате специфичную в отношении MAGE-A4 цитотоксичность наблюдали в T2-клетках, в которые вводили пептид MAGE-A4p230 (Фигура 17). Кроме того, специфичную цитотоксичность в отношении клеток-мишеней подтверждали на клетках NW-MEL-38, которые представляли собой A2-положительные MAGE-A4-положительные клетки (Фигура 18).
[0064]
7. Мышиная модель терапии рака
(1) Модель с применением клеток NW-MEL-38 и HCT116
Поскольку у мыши NOG отсутствует рецептор, содержащий общую γ-цепь, у этих мышей нет NK-клеток. Таким образом, приживление человеческих клеток и человеческой ткани происходит значительно лучше у мышей NOG по сравнению с мышами NOD-SCID, человеческие опухоли и человеческие ткани могут легко приживляться у мышей NOG. Кроме того, поскольку после трансплантации гемопоэтических стволовых клеток человека наблюдается дифференцировка человеческих T-клеток, ожидалось использование мышиной модели NOG в качестве модели иммунной системы человека. Мыши NOG имеют особенности, включающие отсутствие T-клеток и B-клеток, отсутствие природных клеток-киллеров (NK-клеток), снижение функции дендритных клеток, снижение функции макрофагов, потерю активности комплемента, отсутствие связанного со старением просачивания B-клеток и T-клеток (проницаемости).
Мышам NOG инъецировали в правый бок клетки NW-MEL-38 (A2-положительные MAGE-A4-положительные) в концентрации 2,5×106 клеток/мышь и подкожно инъецировали в левый бок клетки HCT116 (A2-положительные MAGE-A4-отрицательные) в концентрации 2,5×106 клеток/мышь. В качестве предварительного лечения мышам NOG проводили тотальное облучение тела (ТОТ, 2,5 Гр) через 6 дней после трансплантации опухоли. Поскольку ТОТ вызывает снижение лимфоцитов у реципиента, трансплантированные лимфоциты донора должны легко приживаться. На 7 день проводили инфузию содержащих MAGE#17-CAR T-клеток и лимфоцитов человека через хвостовую вену в концентрации 1×107 клеток/животное. Перенос генов в CAR-T-клетки проводили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса». Коэффициент позитивности CAR составлял 36,3% (CD8) и 38,5% (CD4) (Фигура 19).
Проводили эксперименты на животных, включающих группу животных, которым проводили инфузию CAR-T-клеток (n=2), группу животных, которым проводили инфузию лимфоцитов человека (без трансфекции CAR, n=2), и группу животных, которым проводили трансфузию ФСБ (n=2), размер опухолей и массу тела измеряли каждые 2-3 дня. Измерения проводили до 42-го дня после имплантации опухоли.
В результате в группе животных, которым проводили инфузию CAR-T-клеток, у мыши #1 и мыши #2 наблюдали подавление роста клеток NW-MEL-38 (A2-положительных MAGE-A4-положительных). С другой стороны, не наблюдали подавление роста клеток HCT116 (A2-положительных MAGE-A4-отрицательных). Мышь #1 умерла через 34 дня после трансплантации опухоли. Причиной смерти являлась не опухоль, а, вероятно, инфекция (Фигура 20).
[0065]
(2) Эксперименты по изучению эффектов различий во внутриклеточных доменах (ICD)
Затем подтверждали эффекты CAR-T-клеток, связанные с различиями в ICD-участке. На Фигуре 21 показано изображение последовательности генов CAR zG. В CAR zG ICD GITR использовали вместо ICD CD28. GITR представляет собой индуцируемый глюкокортикоидами рецептор фактора некроза опухоли. Известно, что использование CAR с ICR повышает уровень экспрессии цитокинов по сравнению с CAR (WO2013051718). В CAR zG внутриклеточный домен CD28 рецептора CAR 28z (Фигура 2) был заменен на ICD GITR, и был изменен порядок доменов CD3ζ и ICD рецептора CAR 28z. Последовательности других используемых частей были идентичны последовательностям CAR 28z.
Клетки NW-MEL-38 (A2-положительные MAGE-A4-положительные) в концентрации 2,5×106 клеток/мышь инъецировали подкожно мышам NOG. Через три дня после имплантации опухоли проводили тотальное облучение тела (ТОТ, 2,0 Гр) в качестве предварительного лечения. На 4 день проводили инфузию через хвостовую вену клеток или ФСБ и человеческих лимфоцитов в концентрации 4×106 клеток/мышь в каждой группе A - C (n=4), как показано далее. Генный перенос в CAR-T-клетки проводили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса». Проводили инфузию ФСБ в группе A, MAGE#17-CAR-T-клетки в группе B (28z) и CAR-T-клеток (zG) в группе C.
Диаметр опухолей и массу тела измеряли каждые 2-3 дня для групп A - C. Измерения осуществляли до 24 дня после имплантации опухоли.
В результате наблюдали подавление роста клеток NW-MEL-38 (A2-положительных MAGE-A4-положительных) при инфузии CAR-T-клеток, содержащих 28z ICT или zG ICT (Фигура 22). Согласно варианту реализации настоящего изобретения, было обнаружено, что при изменении внутриклеточного домена достигался такой же эффект.
[0066]
8. Эксперименты по оценке эффектов CD8-положительных T-клеток с введенным CAR типа zG и CD8-положительных T-клеток c введенным CAR типа 4-1BBz.
(1) С помощью сконструированного ретровирусного вектора вводили CAR типа zG и CAR типа 28z. После получения ретровируса с использованием пакующих клеток plat-A получали CAR-T-клетки путем инфицирования указанным ретровирусом мононуклеарных клеток периферической крови (МКПК). Генный перенос проводили в соответствии со способом из приведенного выше раздела «10. Перенос генов в клетки с помощью ретровируса». Экспрессию CAR подтверждали по окраске тетрамером. В результате коэффициент позитивности CAR для CAR-T-клеток типа zG составлял 99,1% (CD8), и для CAR-T-клеток типа 28z - 99,8% (CD8) (Фигура 23).
(2) Подвергнутые ретровирусному генному переносу CAR-T-клетки (4×104 клеток) и T2-клетки, в которые вводили пептид, клетки NW-MEL-38, SK-MEL-37 и HCT116 соответственно (2×105 клеток) сокультивировали в течение 18 часов, измеряли уровень INF-γ в супернатанте культуре. Как показано на Фигуре 24, продукция IFN-γ специфично повышалась в CAR-T-клетках, трансфицированных CAR типа zG и CAR типа 28z, в T2-клетках, в которые вводили MAGE-A4, и клетках NW-MEL-38 и SK-MEL-37.
Сходные анализы проводили с применением контрольных клеток (клетки без генного переноса). Продукцию IFN-γ не наблюдали в A2-положительных MAGE-A4-содержащих клетках HCT116, используемых в качестве клеток-мишеней. Продукцию IFN-γ не наблюдали в клетках, содержащих только клетки-эффекторы (только эффекторы), и клетках, содержащих только клетки-мишени (только мишень).
Таким образом, CD8-положительные T-клетки, в которые вводили CAR типа zG, вызывали продукцию INF-γ in vitro. Полученные данные могут успешно объяснить результаты, полученные in vivo.
(3) Затем проводили анализы, сходные с анализами в пункте (1) и (2), с применением CD8-положительных T-клеток, в которые вводили CAR типа 4-1BBz, для характеристики клеток. Как показано на Фигуре 25, в CAR-T-клетках, трансфицированных CAR типа 4-1BBz, наблюдали повышение продукции IFN-γ, специфичное в отношении T2-клеток, в которые вводили MAGE-A4.
В T2-клетках, в которые вводили контрольный пептид, не наблюдали продукцию IFN-γ. В клетках, содержащих только эффекторные клетки (только эффекторы), и клетках, содержащих только клетки-мишени (только мишень), продукцию IFN-γ не наблюдали.
Таким образом, даже когда ICD был заменен на домен типа 4-1BBz, наблюдали такой же эффект. Данные in vitro могут легко объяснить результаты, полученные in vivo.
Таким образом, даже когда ICD был изменен, наблюдали такой же эффект, как для домена типа zG.
[0067]
Таким образом, в соответствии с указанными вариантами реализации настоящего изобретения был предложен антиген-связывающий белок, специфично распознающий комплекс происходящий из MAGE-A4 пептид/HLA-A2, нуклеиновые кислоты, кодирующие указанный антиген-связывающий белок, вектор, содержащий указанные нуклеиновые кислоты, химерный антигенный рецептор, содержащий указанный антиген-связывающий белок, нуклеиновые кислоты, кодирующие указанный химерный антигенный рецептор, вектор, содержащий указанные нуклеиновые кислоты, клетка, экспрессирующая указанный химерный антигенный рецептор, и фармацевтическая композиция, содержащая указанные клетки.
Антиген-связывающий белок, специфично распознающий комплекс происходящий из MAGE-A4 пептид/HLA-A2, можно использовать в клеточной терапии и в области генной терапии. Настоящее изобретение особо полезно для выявления опухолевых клеток, экспрессирующих комплекс происходящий из MAGE-A4 пептид/HLA-A2, лечения и проведения исследований и экспериментов на опухолях. Клетки CAR-T согласно настоящему изобретению могут обеспечить высокоэффективную терапию рака, поскольку они вызывают очень небольшие побочные эффекты.
[Предшествующий уровень техники]
[Непатентные документы]
[0068]
Непатентный документ 1: Brentjens RJ, et al: Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B- leukemias. Blood 2011,118:4817-4828.
Непатентный документ 2: Dao T, Yan S, Veomett N, Pankov D, Zhou L, Korontsvit T, et al: Targeting the intracellular WT1 oncogene product with a therapeutic human antibody. Sci Transl Med 2013; 5 : 176ra133.
Непатентный документ 3: Van Der Bruggen P, Zhang Y, Chaux P, Stroobant V, Panichelli C, Schultz ES, Chapiro J, Van Den Eynde BJ, Brasseur F, Boon T. Tumor-specific shared antigenic peptides recognized by human T cells. Immunological Reviews 2002. Vol. 188: 51-64.
Непатентный документ 4: Duffour MT, Chaux P, Lurquin C, Cornelis G, Boon T, van der Bruggen P. A MAGE-A4 peptide presented by HLA-A2 is recognized by cytolytic T Lymphocytes. Eur. J. Immunol 1999. 29: 3329-3337.
Непатентный документ 5: Muraoka D, Harada N,Hayashi T, Tahara Y, Momose F, Sawada S, Mukai SA, Akiyoshi K, Shiku H. Nanogel-based immunologically stealth vaccine targets macrophages in the medulla of lymph node and induces potent antitumor immunity. ACS Nano.Sep 23,2014;8(9):9209-18.
Непатентный документ 6: Hillig RC, Coulie PG, Stroobant V, Saenger W, Ziegler A, Huelsmeyer M. High-resolution Structure of HLA-A*0201 in Complex with a Tumour-specific Antigenic Peptide Encoded by the MAGE-A4 Gene. J. Mol. Biol. 2001,310,1167-1176.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Университет Миэ
<120> АНТИГЕН-СВЯЗЫВАЮЩИЙ БЕЛОК, РАСПОЗНАЮЩИЙ ПРОИСХОДЯЩИЙ ИЗ
MAGE-A4 ПЕПТИД
<130> JP2018001MIU
<150> JP2017-111157
<151> 2017-06-05
<160> 38
<170> PatentIn версия 3.5
<210> 1
<211> 10
<212> Белок
<213> Homo sapiens
<400> 1
Gly Val Tyr Asp Gly Arg Glu His Thr Val
1 5 10
<210> 2
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 1A
<400> 2
Ala Val Tyr Asp Gly Arg Glu His Thr Val
1 5 10
<210> 3
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 2A
<400> 3
Gly Ala Tyr Asp Gly Arg Glu His Thr Val
1 5 10
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 3A
<400> 4
Gly Val Ala Asp Gly Arg Glu His Thr Val
1 5 10
<210> 5
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4A
<400> 5
Gly Val Tyr Ala Gly Arg Glu His Thr Val
1 5 10
<210> 6
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 5A
<400> 6
Gly Val Tyr Asp Ala Arg Glu His Thr Val
1 5 10
<210> 7
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 6A
<400> 7
Gly Val Tyr Asp Gly Ala Glu His Thr Val
1 5 10
<210> 8
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7A
<400> 8
Gly Val Tyr Asp Gly Arg Ala His Thr Val
1 5 10
<210> 9
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 8A
<400> 9
Gly Val Tyr Asp Gly Arg Glu Ala Thr Val
1 5 10
<210> 10
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 9A
<400> 10
Gly Val Tyr Asp Gly Arg Glu His Ala Val
1 5 10
<210> 11
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10A
<400> 11
Gly Val Tyr Asp Gly Arg Glu His Thr Ala
1 5 10
<210> 12
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 2.10A
<400> 12
Gly Ala Tyr Asp Gly Arg Glu His Thr Ala
1 5 10
<210> 13
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 3M
<400> 13
Gly Val Met Asp Gly Arg Glu His Thr Val
1 5 10
<210> 14
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 3F
<400> 14
Gly Val Phe Asp Gly Arg Glu His Thr Val
1 5 10
<210> 15
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 5F
<400> 15
Gly Val Tyr Asp Phe Arg Glu His Thr Val
1 5 10
<210> 16
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 5W
<400> 16
Gly Val Tyr Asp Trp Arg Glu His Thr Val
1 5 10
<210> 17
<211> 10
<212> Белок
<213> Homo sapiens
<400> 17
Glu Val Tyr Asp Gly Arg Glu His Ser Ala
1 5 10
<210> 18
<211> 10
<212> Белок
<213> Homo sapiens
<400> 18
Gly Leu Tyr Asp Gly Arg Glu His Ser Val
1 5 10
<210> 19
<211> 10
<212> Белок
<213> Homo sapiens
<400> 19
Gly Val Tyr Val Gly Lys Glu His Met Phe
1 5 10
<210> 20
<211> 10
<212> Белок
<213> Homo sapiens
<400> 20
Gly Leu Tyr Asp Gly Arg Glu His Leu Ile
1 5 10
<210> 21
<211> 10
<212> Белок
<213> Homo sapiens
<400> 21
Gly Val Tyr Ala Gly Arg Glu His Phe Leu
1 5 10
<210> 22
<211> 10
<212> Белок
<213> Homo sapiens
<400> 22
Gly Val Tyr Asp Gly Glu Glu His Ser Val
1 5 10
<210> 23
<211> 10
<212> Белок
<213> Homo sapiens
<400> 23
Gly Leu Tyr Asp Gly Ile Glu His Phe Met
1 5 10
<210> 24
<211> 10
<212> Белок
<213> Homo sapiens
<400> 24
Gly Val Tyr Ala Gly Arg Glu His Phe Val
1 5 10
<210> 25
<211> 10
<212> Белок
<213> Homo sapiens
<400> 25
His Val Tyr Asn Gly Arg Thr His Gln Trp
1 5 10
<210> 26
<211> 10
<212> Белок
<213> Homo sapiens
<400> 26
Arg Val Tyr Asp Gly Arg Glu Ile Leu Thr
1 5 10
<210> 27
<211> 10
<212> Белок
<213> Homo sapiens
<400> 27
Gly Val Tyr Ser Gly Arg Ala His Pro Lys
1 5 10
<210> 28
<211> 52
<212> Белок
<213> Искусственная последовательность
<220>
<223> Длинный пептид MAGE-A4
<400> 28
Asn Tyr Lys Arg Cys Phe Pro Val Ile Phe Gly Lys Ala Ser Glu Gly
1 5 10 15
Val Tyr Asp Gly Arg Glu His Thr Val Tyr Gly Glu Pro Arg Lys Ala
20 25 30
Glu Thr Ser Tyr Val Lys Val Leu Glu His Val Val Arg Val Asn Ala
35 40 45
Arg Val Arg Ile
50
<210> 29
<211> 9
<212> Белок
<213> Homo sapiens
<400> 29
Asn Tyr Lys Arg Cys Phe Pro Val Ile
1 5
<210> 30
<211> 21
<212> Белок
<213> Homo sapiens
<400> 30
Ala Glu Thr Ser Tyr Val Lys Val Leu Glu His Val Val Arg Val Asn
1 5 10 15
Ala Arg Val Arg Ile
20
<210> 31
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> MAGE#17
<400> 31
caggtccagc tggtacagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cttctggagg caccttcagc agctatgcta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaggg atcatcccta tctttggtac agcaaactac 180
gcacagaagt tccagggcag agtcacgatt accgcggaca aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gagatccccc 300
cggcgggcat atcatgatgc ttttgatatc tggggccaag ggacaatggt caccgtctct 360
tcaggtggag gcggttcagg cggaggtggc agcggcggtg gcgggagttc ctatgagctg 420
actcagccac cctcgatgtc agtggcccca ggaaagacgg ccagcattac ctgtggcgga 480
gaccatattg gaagtaaaag tgttcactgg taccagcaga agccaggcca ggcccctgta 540
ctggtcgtct atgatgatag cgaccggccc tcagggatcc ctgagcgatt ctctggctcc 600
aactctggga acacagccac tctgaccatc agcgggaccc aggctatgga tgaggctgac 660
tattactgtc tggcgtggga cagcagcact gcgatcttcg gcggagggac caagctgacc 720
gtcctc 726
<210> 32
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<223> MAGE#17
<400> 32
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Arg Arg Ala Tyr His Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Ser Tyr Glu Leu Thr Gln Pro Pro
130 135 140
Ser Met Ser Val Ala Pro Gly Lys Thr Ala Ser Ile Thr Cys Gly Gly
145 150 155 160
Asp His Ile Gly Ser Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Val Leu Val Val Tyr Asp Asp Ser Asp Arg Pro Ser Gly
180 185 190
Ile Pro Glu Arg Phe Ser Gly Ser Asn Ser Gly Asn Thr Ala Thr Leu
195 200 205
Thr Ile Ser Gly Thr Gln Ala Met Asp Glu Ala Asp Tyr Tyr Cys Leu
210 215 220
Ala Trp Asp Ser Ser Thr Ala Ile Phe Gly Gly Gly Thr Lys Leu Thr
225 230 235 240
Val Leu
<210> 33
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> VH-участок MAGE#17
<400> 33
caggtccagc tggtacagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cttctggagg caccttcagc agctatgcta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaggg atcatcccta tctttggtac agcaaactac 180
gcacagaagt tccagggcag agtcacgatt accgcggaca aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gagatccccc 300
cggcgggcat atcatgatgc ttttgatatc tggggccaag ggacaatggt caccgtctct 360
tca 363
<210> 34
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> sc-участок MAGE#17
<400> 34
ggtggaggcg gttcaggcgg aggtggcagc ggcggtggcg ggagttccta t 51
<210> 35
<211> 312
<212> ДНК
<213> Искусственная последовательность
<220>
<223> VL-участок MAGE#17
<400> 35
gagctgactc agccaccctc gatgtcagtg gccccaggaa agacggccag cattacctgt 60
ggcggagacc atattggaag taaaagtgtt cactggtacc agcagaagcc aggccaggcc 120
cctgtactgg tcgtctatga tgatagcgac cggccctcag ggatccctga gcgattctct 180
ggctccaact ctgggaacac agccactctg accatcagcg ggacccaggc tatggatgag 240
gctgactatt actgtctggc gtgggacagc agcactgcga tcttcggcgg agggaccaag 300
ctgaccgtcc tc 312
<210> 36
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH-участок MAGE#17
<400> 36
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Arg Arg Ala Tyr His Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 37
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> sc-участок MAGE#17
<400> 37
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
1 5 10 15
Tyr
<210> 38
<211> 104
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL-участок MAGE#17
<400> 38
Glu Leu Thr Gln Pro Pro Ser Met Ser Val Ala Pro Gly Lys Thr Ala
1 5 10 15
Ser Ile Thr Cys Gly Gly Asp His Ile Gly Ser Lys Ser Val His Trp
20 25 30
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr Asp Asp
35 40 45
Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser Asn Ser
50 55 60
Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met Asp Glu
65 70 75 80
Ala Asp Tyr Tyr Cys Leu Ala Trp Asp Ser Ser Thr Ala Ile Phe Gly
85 90 95
Gly Gly Thr Lys Leu Thr Val Leu
100
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к конструированию химерных антигенных рецепторов (CAR) и получению CAR-T-клеток, которые можно применять в CAR-инфузионной терапии с использованием онкоспецифичного внутриклеточного антигена. Предложен антиген-связывающий белок, представляющий собой антитело или его антиген-связывающий фрагмент, способный распознавать пептид GVYDGREHTV в комплексе HLA-A2-MAGE-A4 и содержащий полипептид вариабельной области тяжелой цепи (VH) с SEQ ID NO: 36 и полипептид вариабельной области легкой цепи (VL) с SEQ ID NO: 38. Также сконструирован CAR, в котором указанный антиген-связывающий белок расположен в N-концевом положении белка и находится снаружи клетки, а внутриклеточный домен расположен в С-концевом положении белка и находится внутри клетки. Изобретение обеспечивает получение специфичных scFv к пептиду GVYDGREHTV из MAGE-A4, распознающих комплекс MAGE-A4 пептид/HLA-A2, и их использование для получения цитотоксических CAR-T-клеток, которые специфично активировались на раковые клетки-мишени, экспрессирующие HLA-A2/MAGE-A4. 9 н. и 6 з.п. ф-лы, 25 ил., 4 табл.


Комментарии