Сконструированные универсальные иммунные клетки с анти-cd22 химерным антигенным рецептором - RU2775453C2
Код документа: RU2775453C2
Чертежи





























Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к области иммунотерапии и более конкретно к универсальным Т-клеткам с химерным антигенным рецептором, специфическим в отношении CD22 (UCART 22), которые представляют собой сконструированные человеческие первичные иммунные клетки, которые содержат по меньшей мере один отредактированный ген, предпочтительно ген, кодирующий TCR-субъединицу, или ген CD52, и химерные антигенные рецепторы (CAR), специфические в отношении кластера дифференцировки 22 (CD22), (CAR CD22), и к способам конструирования указанных клеток. Изобретение относится также к UCART 22, предназначенной для применения на пациентах, которые могут являться или могут не являться первичными донорами клеток («аллогенные» или «аутологичные» несущие CD22 CAR сконструированные первичные человеческие иммунные клетки), в качестве средства лечения рецидивирующих рефрактерных гематологических видов рака. Клетки, экспрессирующие CD22, предлагаемые в изобретении, являются прежде всего эффективными и безопасными для иммунотерапии, в частности, в отношении агрессивного или рецидивирующего рака.
Предпосылки создания изобретения
В 2000 г. в Соединенных Штатах ожидалось 45000 смертей от гематологического рака (неходжкинская лимфома, лейкоз) (Greenlee и др., СА Cancer J. Clin., 50, 2000, сс.7-33). Количество смертей, данные о которых опубликованы в 2014 г., оказалось сходным, несмотря на успехи, достигнутые в средствах лечения, таких как химиотерапия, и прогноз относительно таких раков остается в целом без изменений (Е. К. Mai, U. Bertsch, J. Dtirig, С.Kunz, M. Haenel, I. W. Blau, M. Munder, A. Jauch, B. Schurich, T. Hielscher, M. Merz, B. Huegle-Doerr, A. Seckinger, D. Hose, J. Hillengass, M. S. Raab, K. Neben, H.-W. Lindemann, M. Zeis, C. Gerecke, I. G. H. Schmidt-Wolf, K. Weisel, C. Scheid, H. Salwender и H. Goldschmidt. Phase III trial of bortezomib, cyclophosphamide and dexamethasone (VCD) versus bortezomib, doxorubicin and dexamethasone (PAd) in newly diagnosed myeloma. Leukemia, 19 марта 2015 г., doi: 10.1038/leu.2015.80.
Уникальной среди новых изученных путей лечения указанных гематологических раков является генетическая модификация клеток с цитолитической способностью, таких как Т-клетки, посредством переноса гена химерного антигенного рецептора (CAR) (Jena, Dotti и др., 2010).
CAR представляют собой синтетические рецепторы, состоящие из таргетирующего («нацеливающего») фрагмента, ассоциированного с одним или несколькими сигнальными внутриклеточными доменами в одной молекуле или в нескольких трансмембранных доменах, образующих мультимер. В конкретном CAR связывающий фрагмент состоит из антигенсвязывающего домена из одноцепочечного антитела (scFv), который содержит вариабельные фрагменты моноклонального антитела, соединенные линкером. Для получения CAR успешно применяли также связывающие фрагменты, основой которых являлись домены рецепторов или лигандов.
Сигнальные домены из костимуляторных молекул Т-клеточного рецептора (TCR), а также конкретные трансмембранные и шарнирные домены добавляли для получения CAR второго и третьего поколений, которые успешно прошли испытания на людях в качестве терапевтических средств. В этих исследованиях Т-клетки из пациента, страдающего гематологическим («жидким») раком, перенаправляли против злокачественных клеток, экспрессирующих, например, CD19 или CD22 (June и др., 2011, Haso и др., 2013), и повторно инъецировали этому же пациенту (Haso W., Lee D.W., Shah N.N., Stetler-Stevenson M., Yuan СМ., Pastan I.H., Dimitrov D.S., Morgan R.A, FitzGerald D.J., Barrett D.M., Wayne A.S., Mackall C.L., Orentas R.J. Anti-CD22-chimeric antigen receptors targeting B-cell precursor acute lymphoblastic leukemia. Blood. 121(7), 14 февраля 2013 г., cc. 1165-1174. doi: 10.1182/blood-2012-06-438002. Epub 14 декабря 2112 г).
Методы, обеспечивающие возможность осуществлять повторную инъекцию предварительно сконструированных иммунных клеток из одного индивидуума этому же индивидууму, который, как правило, страдает раком, не адаптированы в достаточной степени к агрессивным формам раков, которые могут быстро протекать. Кроме того, указанный метод может оказаться проблематичным или непредсказуемым в случае пациентов с измененной иммунной системой.
Для решения этой проблемы в настоящее время реализована иммунотерапия, в которой применяют экспрессирующие CAR так называемые «аллогенные» Т-клетки (которые называют универсальными или «имеющимися в готовом виде, не требующими доработки» Т-клетками), и у двух первых пациентов, которых лечили с помощью указанных клеток, еще сохраняется ремиссия в течение двух лет после лечения.
Однако у указанной терапии все еще имеются аспекты, подлежащие улучшению, такие как эффективность в присутствии лекарственных средств против Т-клеток, эффективность против ускользающих от иммунного надзора раковых клеток, персистетность, средства контроля и т.д. Так, вероятно, раковые клетки - благодаря понижающей регуляции экспрессии поверхностного антигена, распознаваемого CAR, могут ускользать от лечения и выживать, несмотря на персистентность перенаправленного иммунитета у обработанных пациентов. Кроме того, одним из основных и иногда летальных побочных действий, обнаруженных у пациентов, которых лечили либо аутологичными, либо аллогенными Т-клетками, является синдром выброса цитокинов.
Таким образом, все еще существует необходимость в разработке эффективных и безопасных вариантов лечения указанных патологий, прежде всего агрессивных или рефрактерных/рецидивирующих форм гематологических раков.
Краткое изложение сущности изобретения
При создании изобретения разработано новое эффективное лечение («UCART 22»), включающее применение сконструированной первичной человеческой Т-клетки по меньшей мере с одной делецией в гене TRAC, наделенной химерным антигенным рецептором, таргетирующим CD22, и маркером безопасности, позволяющим контролировать количество указанных клеток in vivo и, следовательно, активность указанных клеток.
В новом эффективном лечении («UCART 22»), включающем применение сконструированной первичной человеческой Т-клетки по меньше мере с делецией в гене TRAC, предусматривается наличие по меньшей мере одной дополнительной делеции в генах CD52, dCK, бета-2-микроглобулина.
Указанные новые UCART 22 являются наиболее эффективными для адоптивного переноса пациенту, страдающему опосредуемой CD22 патологией, вне зависимости от того, является или не является указанный пациент первичным донором иммунных клеток, и от того, уже подвергается или еще не подвергается указанный пациент терапии, влияющей иммунитет.
Клетки UCART 22, предлагаемые в изобретении, являются устойчивыми по меньшей мере к одному химическому лекарственному средству или лекарственному средству на основе антитела, применяемому для лечения CD22-опосредумой патологии, такому как Campath (кэмпас) и/или аналоги пуриновых нуклеотидов (PNA). Клетки UCART 22, предлагаемые в изобретении, могут выживать и обладать активностью в присутствии указанного лекарства, применяемого в дозе, уничтожающей более 80% клеток.
Обнаружены выраженные и неожиданные клинические преимущества сконструированных выделенных первичных иммунных клеток UCART 22, включая низкий уровень выброса цитокинов, отсутствие реакции «трансплантат-против-хозяина» или очень слабая указанная реакция, а также выраженная активность против клеток рефрактерных рецидивирующих форм гематологического рака.
В настоящем описании будут указаны другие преимущества.
В настоящем изобретении предложены:
1. Сконструированная клетка с «выключенным» (нокаут) человеческим Т-клеточным рецептором (TCR-KO), наделенная химерным антигенным рецептором (CAR), специфическим в отношении CD22 (UCART 22), защитным переключателем (включения-выключения), предпочтительно экспрессируемым на клеточной поверхности, где указанный анти-CD22 CAR (CD22 CAR) содержит:
I) по меньшей мере один внеклеточный домен, содержащий:
- шарнирный домен из СD8альфа,
- антигенсвязывающий домен, специфический в отношении CD22, необязательно лидерную последовательность,
II) трансмембранный домен из СЭ8альфа и
III) внутриклеточный сигнальный домен указанного CD22 CAR, имеющий полипептидную последовательность, идентичную по меньшей мере на 80% SEQ ID NO: 15,
указанный защитный переключатель содержит:
- RQR8 (ген суицида), временно связанный с CD22 CAR с помощью пептида 2А, или
по меньшей мере два специфических для МАт ритуксимаба эпитопа, предпочтительно локализованных между VH и шарнирным доменом, или 3 специфических для МАт ритуксимаба эпитопа, или 3 специфических для МАт ритуксимаба эпитопа и специфические для МАт QBEND-10 эпитопы, связанные с CD22 CAR.
2. UCART 22 по варианту осуществления изобретения 1, в которой полинуклеотидная последовательность, идентичная по меньшей мере на 80% SEQ ID NO: 11, встроена в геном, и дополнительно содержащая инактивированный ген TRAC с инсерцией, делецией или мутацией в SEQ ID NO 18, с
не поддающимся обнаружению уровнем Т-клеточного рецептора (TCR) на клеточной поверхности по данным, полученным с помощью проточной цитометрии, и не поддающимся обнаружению уровнем имеющих место вне целевого сайта событий по данным, полученным с помощью технологии на основе гидовой последовательности.
UCART 22 по п. 2, в которой указанный анти-CD22 CAR встроен предпочтительно в ген TRAC, предпочтительно имеющий SEQ ID NO: 18.
3. UCART 22 по одному из вариантов осуществления изобретения 1-2, содержащая другой инактивированный ген, выбранный из гена dCK, гена В2М, гена CD52, предпочтительно гена CD52.
4. UCART 22 по одному из вариантов осуществления изобретения 1-3, в которой инактивирован по меньшей мере один дополнительный ген, где указанный ген выбран из гена, кодирующего арилуглеводородный рецептор (рецептор ароматических углеводородов) (AHR), рецептор трансформирующего ростового фактора (рецептор TGF бета), рецептор интерлейкина 10 (IL-10 R), белок 1 запрограммированной гибели клеток, их комбинацию.
5. UCART 22 по одному из вариантов осуществления изобретения 1-4, в которой инактивирован ген, кодирующий бета-2-микроглобулин (В2М).
6. UCART 22 по одному из вариантов осуществления изобретения 1-5, в которой инактивирован ген, кодирующий арилуглеводородный рецептор (AHR).
7. UCART 22 по одному из вариантов осуществления изобретения 1-6, в которой инактивирован ген, кодирующий рецептор трансформирующего ростового фактора бета (рецептор TGF бета).
8. UCART 22 по одному из вариантов осуществления изобретения 1-7, в которой инактивирован ген, кодирующий рецептор интерлейкина 10 (IL-10 R).
9. UCART 22 по одному из вариантов осуществления изобретения 1-8, в которой инактивирован ген, кодирующий белок 1 запрограммированной гибели клеток (PD1).
5. UCART 22 по одному из вариантов осуществления изобретения 1-4, содержащая дополнительный scfv, специфический для одного из следующих ассоциированных с опухолью поверхностный антигенов, которые выбраны из CD19, CD20, CD30, молекулы главного комплекса гистосовместимости (ГКГС), иммуноглобулина (Ig), CD3, CD5, CD34, CD79, предпочтительно CD79b, CD 138, В7-1 (CD80), ВСМА (CD269, TNFRSF 17), FLT-3 или РАХ5, предпочтительно CD19.
6. UCART 22 по одному из вариантов осуществления изобретения 1-5, в которой указанный CD22 CAR дополнительно содержит антигенсвязывающий домен, специфический в отношении CD19, или указанная UCART 22 дополнительно содержит CD19 CAR, предпочтительно CD19 CAR, идентичный по меньшей мере на 80% SEQ ID NO: 25 или SEQ ID NO: 26.
7. UCART 22 по одному из вариантов осуществления изобретения 1-5, в которой анти-CD22 CAR представляет собой одноцепочечный CAR или многоцепочечный CAR.
8. UCART 22 по одному из вариантов осуществления изобретения 5 или 6, в которой анти-CD19 CAR представляет собой одноцепочечный CAR или многоцепочечный CAR.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD19.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD20.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD30.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении молекулы главного комплекса гистосовместимости (ГКГС).
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении иммуноглобулина (Ig).
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD3.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD5.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD34.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD79, предпочтительно CD79b.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD138.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD80.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении ВСМА (CD269).
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении TNFRSF 17.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении FLT-3.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD19.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD79 или CD79b.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD20.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD30.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении молекулы главного комплекса гистосовместимости (ГКГС).
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении иммуноглобулина (Ig).
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD3.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD5.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD34.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD138.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD80.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении ВСМА (CD269).
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении TNFRSF 17.
UCART 22 по одному из указанных выше пунктов, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении FLT-3.
9. Популяция UCART-клеток, содержащая UCART 22 по одному из вариантов осуществления изобретения 1-8.
10. Популяция UCART-клеток по варианту осуществления изобретения 9, содержащая UCART 19, предпочтительно UCART 19, которая экспрессирует на клеточной поверхности анти-CD19 CAR, содержащий SEQ ID NO: 25 или SEQ ID NO: 26.
11. Набор, содержащий UCART 22 и UCART 19 для последовательного (по меньшей мере один раз) или одновременного, или последовательного (по меньшей мере один раз), а затем одновременного введения пациенту, который нуждается в этом.
12. Набор по варианту осуществления изобретения 11, при использовании которого UCART 19 применяют первой по меньшей мере один, два, три, четыре или большее количество раз, а затем применяют UCART 22 индивидуально или совместно с UCART 19.
13. Набор по вариантам осуществления изобретения 11 или 12, при использовании которого UCART 19 применяют первой по меньшей мере один, два, три, четыре или большее количество раз, а затем применяют UCART 19 индивидуально или совместно с UCART 22.
14. Набор по вариантам осуществления изобретения 11-13, дополнительно включающий агент для лимфодеплеции, который применяют до UCART.
15. Набор по вариантам осуществления изобретения 11-14, при использовании которого лимфодеплеция достигается с помощью флударабина и циклофосфамида, предпочтительно флударабина в дозе 25 мг/м2 i.v. × 5 доз в дни от -6 до -2 и циклофосфамида в дозе 60 мг/кг i.v. в виде 1 дозы в день -5.
16. Набор по вариантам осуществления изобретения 11-15, содержащий по меньшей мере одну другую UCART-клетку, направленную против ракового антигена, выбранного из CD79a, CD79b, CD20, CD30, CD52, CD40, CD80, CD86, CD74, VEGF.
17. Фармацевтическая композиция, содержащая UCART 22 по одному из вариантов осуществления изобретения 1-8 или популяцию клеток, содержащую указанную UCART 22, по варианту осуществления изобретения 9 или 10 и фармацевтически приемлемый эксципиент.
18. Фармацевтическая композиция по варианту осуществления изобретения 17, дополнительно содержащая бриостатин, предпочтительно бриостатин-1.
19. Фармацевтическая композиция по варианту осуществления изобретения 17 или 18 или набор по одному из вариантов осуществления изобретения 11-16 для применения в качестве лекарственного средства для предупреждения или лечения пациента, страдающего CD22+-опосредуемым раком или CD22+-опосредуемым воспалительным заболеванием.
20. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения в качестве лекарственного средства для предупреждения или лечения пациента, страдающего CD19+-опосредуемым раком или CD19+-опосредуемым воспалительным заболеванием.
21. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения в качестве лекарственного средства для предупреждения или лечения пациента, страдающего CD19 CD22 -опосредуемым раком или CD19+CD22+-опосредуемым воспалительным заболеванием.
22. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения по одному из вариантов осуществления изобретения 19 или 21, где лечение пациента включает стадию введения фармацевтической композиции по меньшей мере два раза (редозирование, повторяющееся дозирование) во избежание развития рецидивирующего/рефрактерного рака.
23. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения по одному из вариантов осуществления изобретения 19 или 21 для лечения CD22-опосредуемого гематологического рака, выбранного из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, предпочтительно экспрессирующего CD22 гематологического рака, выбранного из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, более предпочтительно рецидивирующего рефрактерного экспрессирующего CD22 гематологического рака, еще более предпочтительно агрессивной формы указанного связанного с CD22 гематологического рака.
24. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения по одному из вариантов осуществления изобретения 19 или 21 для лечения СВ19-опосредуемого гематологического рака, выбранного из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, предпочтительно экспрессирующего CD19 гематологического рака, гематологического рака, выбранного из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, более предпочтительно рецидивирующего рефрактерного экспрессирующего CD19 гематологического рака, еще более предпочтительно агрессивной формы указанного связанного с CD19 гематологического рака.
25. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения по одному из вариантов осуществления изобретения 19-22 для лечения рецидивирующего или рефрактерного, экспрессирующего В-клетки ALL, предпочтительно в педиатрии.
26. Фармацевтическая композиция по варианту осуществления изобретения 17-18 или набор по одному из вариантов осуществления изобретения 11-16 для применения по одному из вариантов осуществления изобретения 19-25, где лечение пациента включает введение по меньшей мере одного моноклонального антитела (МАт), предпочтительно QBEND-10 и/или ритуксимаба, пациенту в дозе, обеспечивающий контактирование указанной UCART 22 по меньшей мере с одним специфическим МАт.
Варианты CD22 CAR
В изобретении предложен анти-CD22 CAR, содержащий шарнирный домен, выбранный из FcRIIIα, СD8альфа, IgG1, IgG4 и PD1, предпочтительно из СD8альфа или IgG4.
Выше описан анти-CD22 CAR, в котором scfv, специфический в отношении CD22, содержит VH и VL, связанные друг с другом с помощью линкера L1, предпочтительно линкера, который содержит 1-3 «GGGGS»-мотива, более предпочтительно один «GGGGS»-мотив.
В одном из указанных выше вариантов в анти-CD22 CAR указанный scfv, специфический в отношении CD22, связан с трансмембранным доменом с помощью шарнира, выбранного из шарнира из FcRIIIα, СD8альфа, IgG1, предпочтительно из СD8альфа.
В одном из указанных выше вариантов анти-CD22 CAR содержит внутриклеточный домен, где указанный внутриклеточный домен содержит сигнальный домен CD3дзета и сигнальный домен 4-1ВВ.
В одном из указанных выше вариантов анти-CD22 CAR представляет собой анти-CD22 CAR, который содержит по меньшей мере один, предпочтительно два, три иди четыре специфических для моноклонального антитела (МАт) эпитопа, предпочтительно два эпитопа, встроенных в линкер L scfv-фрагмента, специфического для CD22, и/или в шарнир.
В одном из указанных выше вариантов анти-CD22 CAR МАт-специфический эпитоп представляет собой полипептид, выбранный из:

В изобретении предложен полинуклеотид, кодирующий анти-CD22 CAR, указанный в одном из представленных выше вариантов, или полинуклеотид, идентичный по меньшей мере на 80% полинуклеотиду, который кодирует анти-CD22 CAR, вектор, содержащий полинуклеотид, соответствующий одному из описанных выше полинуклеотидов.
Как будет описано ниже, в указанной UCART 22 отредактированы другие гены, прежде всего ген dCK, ген В2М, ген CD52.
Предложенная UCART
Предложена указанная выше UCART 22, в которой по меньшей мере один дополнительный ген является отредактированным или сконструированным, указанный ген выбран из гена, кодирующего арилуглеводородный рецептор (AHR), рецептор трансформирующего ростового фактора (рецептор TGF бета), рецептор интерлейкина 10 (IL-10 R), белок 1 запрограммированной гибели клеток, их комбинацию.
Предложена UCART 22, указанная выше, в которой по меньшей мере один дополнительный ген содержит мутацию, делецию или инсерцию, инактивирующую активность и/или экспрессию указанного гена, выбранного из гена, кодирующего арилуглеводородный рецептор (AHR), рецептор трансформирующего ростового фактора (рецептор TGF бета), рецептор интерлейкина 10 (IL-10 R), белок 1 запрограммированной гибели клеток, их комбинацию.
Предложена UCART 22, указанная выше, в которой по меньшей мере один дополнительный ген содержит мутацию, делецию или инсерцию, инактивирующую активность и/или экспрессию указанного гена, выбранного из гена, кодирующего арилуглеводородный рецептор (AHR), рецептор трансформирующего ростового фактора (рецептор TGF бета), рецептор интерлейкина 10 (IL-10 R), их комбинацию.
Предложена UCART 22, указанная выше, в которой по меньшей мере один дополнительный ген содержит мутацию, делецию или инсерцию, инактивирующую активность и/или экспрессию указанного гена, выбранного из гена, кодирующего рецептор трансформирующего ростового фактора (рецептор TGF бета), рецептор интерлейкина 10 (IL-10 R), белок 1 запрограммированной гибели клеток, их комбинацию.
Предложена UCART 22, указанная выше, в которой по меньшей мере один дополнительный ген содержит мутацию, делецию или инсерцию, инактивирующую активность и/или экспрессию указанного гена, выбранного из гена, кодирующего арилуглеводородный рецептор (AHR), рецептор интерлейкина 10 (IL-10 R), белок запрограммированной гибели клеток 1, их комбинацию.
Предложена UCART 22, указанная выше, в которой по меньшей мере один дополнительный ген содержит мутацию, делецию или инсерцию, инактивирующую активность и/или экспрессию указанного гена, выбранного из гена, кодирующего арилуглеводородный рецептор (AHR), рецептор трансформирующего ростового фактора (рецептор TGF бета), белок запрограммированной гибели клеток 1, их комбинацию.
Гены, в которые указанный CAR можно встраивать, описаны ниже в таблице 9.
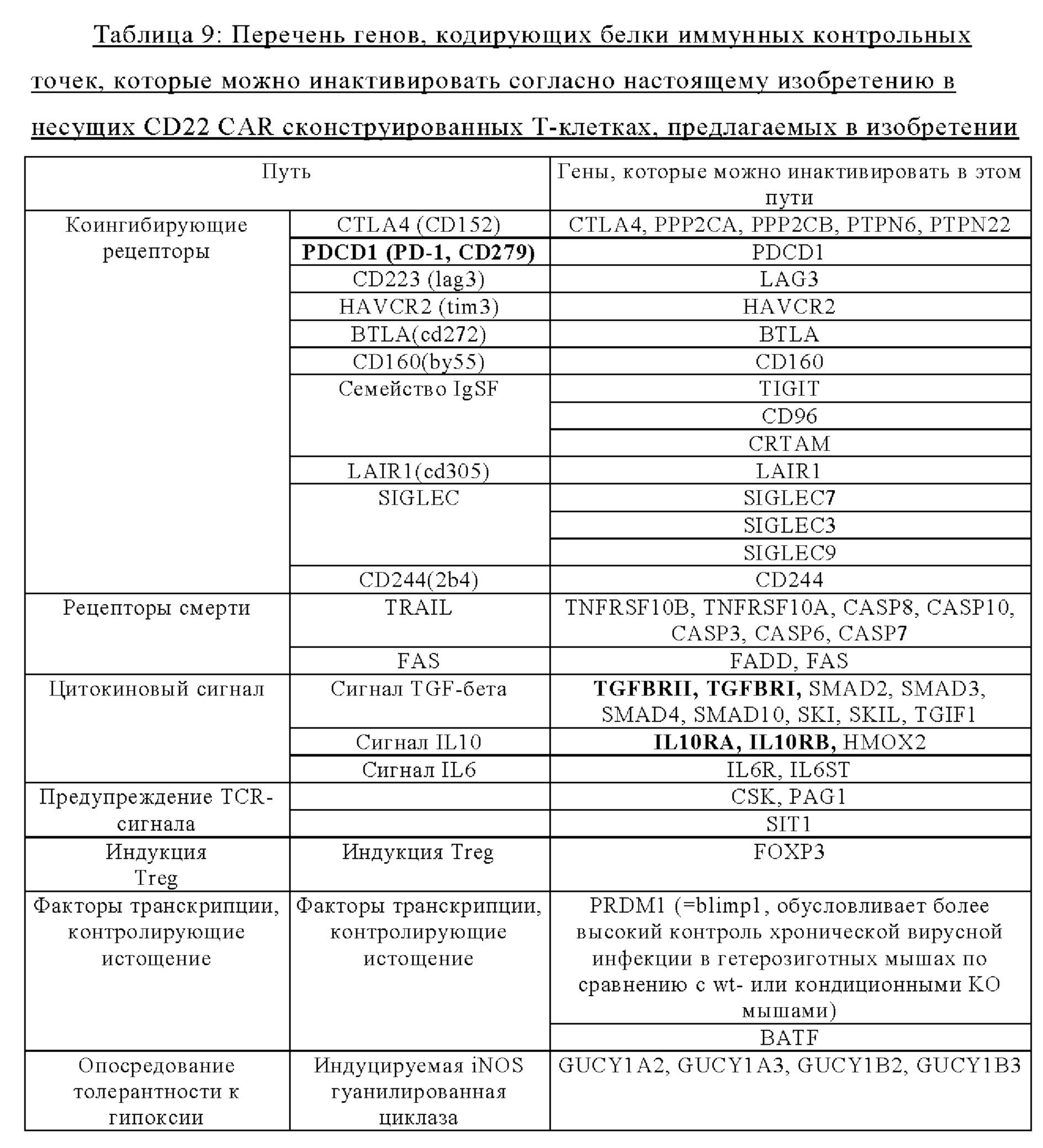
Жирным шрифтом обозначены предпочтительные гены, инактивированные в UCART, предлагаемой в изобретении
Указанная выше UCART 22 содержит анти-CD22 CAR (UCART 22), предлагаемый в одном из указанных выше вариантов, и встроенный в геном полинуклеотид, кодирующий указанный анти-CD22 CAR (UCART 22), в гене CD25.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR или многоцепочечный CAR.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении одного из следующих ассоциированных с опухолью поверхностных антигенов, которые выбраны из CD19, CD20, CD30, молекулы главного комплекса гистосовместимости (ГКГС), иммуноглобулина (Ig), CD3, CD5, CD34, CD79, предпочтительно CD79b, CD138, В7-1 (CD80), ВСМА (CD269, TNFRSF 17), FLT-3 или РАХ5, предпочтительно CD19.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD19.
В одном из указанных выше вариантов представлена UCART 22, которая экспрессирует анти-CD22 CAR и анти-CD19 CAR, предпочтительно SEQ ID NO: 94 или SEQ ID NO: 95.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD20.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD30.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении молекулы главного комплекса гистосовместимости (ГКГС).
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении иммуноглобулина (Ig).
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD3.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD5.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD34.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD79, предпочтительно CD79b.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD138.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD80.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении ВСМА (CD269).
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении TNFRSF 17.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой одноцепочечный CAR, содержащий дополнительный scfv, специфический в отношении FLT-3.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD19.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD79 или CD79b.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный (mc) CAR, содержащий дополнительный scfv, специфический в отношении CD19.
В одном из указанных выше вариантов представлена UCART 22, которая экспрессирует анти-CD22 mcCAR и анти-CD19CAR, предпочтительно SEQ ID NO: 94 или SEQ ID NO: 95.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD20.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD30.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении молекулы главного комплекса гистосовместимости (ГКГС).
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении иммуноглобулина (Ig).
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD3.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD5.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD34.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD138.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении CD80.
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении ВСМА (CD269).
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении TNFRSF 17,
В одном из указанных выше вариантов представлена UCART 22, в которой анти-CD22 CAR представляет собой многоцепочечный CAR, содержащий дополнительный scfv, специфический в отношении FLT-3.
Предложена популяция клеток, содержащая UCART 22, представленную в одном из указанных выше вариантов.
Предложена популяция клеток, содержащая UCART 22, представленную в одном из указанных выше вариантов, и в которой клетки, экспрессирующие указанный анти-CD22 CAR, экспрессируют также анти-CD19 CAR, предпочтительно указанный анти-CD19 CAR содержит на клеточной поверхности последовательность SEQ ID NO: 25 или SEQ ID NO: 26.
CD22 CAR Т-клетка (UCART 22), необязательно объединенная с ингибитором протеинкиназы С, таким как бриостатин 1, в качестве фармацевтической композиции, предлагаемой в изобретении, является особенно ценной для лечения CLL, ALL, множественной миеломы (ММ), бластоидной плазмацитоидной дендритоклеточной неоплазии (BPDCN), прежде всего рефрактерного/рецидивирующего ALL, рефрактерного/рецидивирующего CLL и/или агрессивных форм указанных заболеваний, более предпочтительно рефрактерного или рецидивирующего B-ALL.
CD22 CAR Т-клетка (UCART 22), полученная из антитела m971, необязательно объединенная с ингибитором протеинкиназы С, таким как бриостатин 1, в качестве фармацевтической композиции, предлагаемой в изобретении, является особенно ценной для лечения CLL, ALL, множественной миеломы (ММ), бластоидной плазмацитоидной дендритоклеточной неоплазии (BPDCN), прежде всего рефрактерного/рецидивирующего ALL, рефрактерного/рецидивирующего CLL и/или агрессивных форм указанных заболеваний, более предпочтительно рефрактерного или рецидивирующего В-ALL.
Сконструированные иммунные клетки, предлагаемые в настоящем изобретении, не только характеризуются высоким уровнем активности in vivo в отношении злокачественных клеток, низким выбросом цитокинов, а также тем, что их количество и активность поддаются контролю, что обеспечивает безопасность и эффективность при применении в иммунотерапии.
В настоящем изобретении предложена сконструированная человеческая Т-клетка с «выключенным» (нокаут) рецептором (TCR-KO), наделенная химерным антигенным рецептором, специфическим в отношении CD22 (CD22 CAR) (UCART 22), предпочтительно экспрессируемым на клеточной поверхности, где указанный CD22 CAR содержит:
I) по меньшей мере один внеклеточный домен, содержащий:
- а шарнирный домен из СD8альфа,
- антигенсвязывающий домен, специфический в отношении CD22, необязательно лидерную последовательность,
II) трансмембранный домен из СD8альфа и
III) внутриклеточный сигнальный домен.
Указанная UCART 22 содержит по меньший мере один дополнительный отредактированный ген, предпочтительно делецию в гене CD52.
В настоящем изобретении предложена также описанная выше UCART CD22, в которой антигенсвязывающий домен содержит scfv, специфический в отношении CD22, полученный из антитела m971 (m971), предпочтительно указанный scfv содержит последовательность, выбранную из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15, более предпочтительно последовательность SEQ ID NO: 15.
Одним из вариантов осуществления настоящего изобретения является также сконструированная человеческая Т-клетка с «выключенным» (нокаут) рецептором (TCR-KO), наделенная химерным антигенным рецептором, специфическим в отношении CD22 (CD22 CAR) (UCART 22), предпочтительно экспрессируемым на клеточной поверхности,
где указанный CD22 CAR содержит:
I) по меньшей мере один внеклеточный домен, содержащий:
- а шарнирный домен из СD8альфа,
- антигенсвязывающий домен, специфический в отношении CD22, необязательно лидерную последовательность,
II) трансмембранный домен из СD8альфа и
III) внутриклеточный сигнальный домен,
указанная UCART 22 содержит по меньший мере один дополнительный отредактированный ген, предпочтительно делецию в гене CD52, и в которой антигенсвязывающий домен содержит scfv, специфический в отношении дистальной части CD22, указанный CAR имеет SEQ ID NO: 20.
Указанная выше UCART CD22 содержит следующие последовательности:
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSNSAAWNWIRQSPSRGLEWLGRTY
YRSKWYNDYAVSVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCAREVTGDLE
DAFDIWGQGTMVTVSS и
DIQMTQSPSSLSASVGDRVTITCRASQTIWSYLNWYQQRPGKAPNLLIYAASSLQ
SGVPSRFSGRGSGTDFTLTISSLQAEDFATYYCQQSYSIPQTFGQGTKLEIK или последовательности, гомологичные на 80-99% каждой из указанных последовательностей.
В настоящем изобретении предложена также указанная выше UCART 22, содержащая полипептид, имеющий SEQ ID NO: 15, и защитный переключатель, который содержит:
- RQR8, временно связанный с CD22 CAR с помощью пептида 2А, или по меньшей мере два специфических для МАт ритуксимаба эпитопа,
предпочтительно три специфических для МАт ритуксимаба эпитопа и более предпочтительно три специфических для МАт ритуксимаба эпитопа и специфические для МАт QBEND-10 эпитопы, связанные с CD22 CAR [что позволяет осуществлять сортинг и/или истощение иммунных клеток, наделенных указанным CD22 CAR].
В настоящем изобретении предложена также указанная выше UCART 22, содержащая по меньшей мере один дополнительный отредактированный ген, предпочтительно делецию в гене CD52 или в гене dCK, или делецию в гене бета-2-микроглобулина или в гене CTIIA, еще более предпочтительно делецию в гене CD52 и/или инсерцию в гене HIF-1альфа, придающую устойчивость к гипоксии.
В настоящем изобретении предложена также указанная выше UCART 22, содержащая делецию в гене CD52, применяемая в комбинации с алемтузумабом.
В настоящем изобретении предложена также указанная выше UCART 22, в которой указанный CD22 CAR экспрессируется в условиях гипоксии (нижняя концентрация О2 составляет менее 5%, предпочтительно менее 1% О2).
В настоящем изобретении предложена также указанная выше UCART 22, содержащая полинуклеотид, который кодирует полипептид, содержащий CD22 CAR и защитный переключатель. В предпочтительном варианте осуществления настоящего изобретения предложена указанная выше UCART 22, которая содержит полинуклеотид, имеющий SEQ ID NO: 22 и SEQ ID NO: 18 в одном и том же гене, предпочтительно в гене TRAC.
В настоящем изобретении предложена также указанная выше UCART 22, содержащая полинуклеотид, который кодирует полипептид, содержащий CD22 CAR и защитный переключатель. В предпочтительном варианте осуществления настоящего изобретения предложена указанная выше UCART 22, которая содержит полинуклеотид, имеющий SEQ ID NO: 20 и SEQ ID NO: 18 в одном и том же гене, предпочтительно в гене TRAC.
В настоящем изобретении предложена популяция клеток, содержащая указанную выше UCART 22.
В настоящем изобретении предложена фармацевтическая композиция, которая содержит либо UCART 22, указанную выше, либо популяцию клеток, содержащую любую из указанных выше UCART 22, и фармацевтически приемлемый эксципиент.
В конкретных вариантах осуществления изобретения предложена фармацевтическая композиция, которая содержит UCART 22, предлагаемую в изобретении, или популяцию клеток, содержащую указанную UCART 22 в комбинации с UCART CD 19, и фармацевтически приемлемый эксципиент. UCART 19 и UCART 22 можно применять в одно и то же время, одновременно или последовательно, начиная с UCART 19 или с UCART 22, в зависимости от уровня экспрессии CD19 и CD22 в раковых клетках пациентов.
В конкретных вариантах осуществления изобретения предложена фармацевтическая композиция, которая содержит UCART 22/19 или UCART 19/22 (биспецифический одноцепочечный CAR или многоцепочечный CAR или клетки, которые экспрессируют как CD 19 CAR, так и CD22 CAR) и фармацевтически приемлемый эксципиент. В настоящем изобретении предложена указанная выше фармацевтическая композиция, дополнительно содержащая соединение из семейства бриостатина, предпочтительно бриостатин 1.
В настоящем изобретении предложено терапевтически эффективное количество указанной выше UCART 22 или фармацевтической композиции, содержащей указанную выше UCART 22, для применения в качестве лекарственного средства для лечения пациента.
В настоящем изобретении предложено терапевтически эффективное количество указанной выше UCART 22 или фармацевтической композиции, указанной выше, для применения в качестве лекарственного средства для лечения пациента, где лечение пациента включает введение по меньшей мере два раза (повторяющееся дозирование) указанного терапевтически эффективного количества UCART CD22 или указанной фармацевтической композиции во избежание рецидива.
В конкретном варианте осуществления настоящего изобретения предложена UCART CD22, представленная в одном из указанных выше пунктов, или фармацевтическая композиция, представленная в одном из указанных выше пунктов, для применения в качестве лекарственного средства для лечения пациента, где лечение пациента включает введение указанной выше UCART 22 или указанной выше фармацевтической композиции по меньшей мере два раза во избежание рецидива.
В настоящем изобретении предложено терапевтически эффективное количество указанной выше UCART 22 или фармацевтической композиции, указанной выше, для применения в качестве лекарственного средства для лечения пациента, указанного выше, в случае связанной в CD22 патологии, предпочтительно связанной с CD22 В-клеточного злокачественной патологии (например, связанного с CD22 гематологического рака).
В конкретном варианте осуществления настоящего изобретения предложено:
терапевтически эффективное количество указанной выше UCART 22 или фармацевтической композиции, указанной выше, для применения в качестве лекарственного средства для лечения гематологического рака, выбранного из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, предпочтительно экспрессирующего CD22 гематологического рака, более предпочтительно рецидивирующего рефрактерного экспрессирующего CD22 гематологического рака, еще более предпочтительно агрессивной формы указанного связанного с CD22 гематологического рака.
Предпочтительно UCART 22 применяют для лечения пациентов с рецидивирующим рефрактерным В-клеточным ALL.
В настоящем изобретении предложено терапевтически эффективное количество указанной выше UCART 22 или фармацевтической композиции, указанной выше, для применения в качестве лекарственного средства для лечения пациента, где указанный пациент страдает раком, выбранным из альвеолярной рабдомиосаркомы, рака мочевого пузыря (например, карциномы мочевого пузыря), рака кости, рака головного мозга (например, медуллобластомы), рака молочной железы, рака ануса, анального канала или аноректума, рака глаза, рака внутрипеченочного желчного протока, рака сустава, рака шеи, рака желчного пузыря, рака плевры, рака носа, рака носовой полости, рака среднего уха, рака ротовой полости, рака вульвы, хронического лимфоцитарного лейкоза, хронического миелоидного рака, рака ободочной кишки, рака пищевода, рака шейки матки, фибросаркомы, карциноидной опухоли желудочно-кишечного тракта, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи), рака гипофаринкса, рака почки, рака гортани, рака печени, рака легкого (например, немелкоклеточной карциномы легкого), злокачественной мезотелиомы, мастоцитомы, меланомы, рака носоглотки, рака яичника, рака поджелудочной железы, рака брюшины, рака сальника, рака брыжейки, рака глотки, рака предстательной железы, ректального рака, ренального рака, рака кожи, рака тонкого кишечника, рака мягких тканей, солидных опухолей, рака желудка, рака яичек, рака щитовидной железы, рака мочеточника.
В настоящем изобретении предложена:
1. Сконструированная человеческая Т-клетка с «выключенным» (нокаут) рецептором (TCR-KO), наделенная химерным антигенным рецептором (CAR), специфическим в отношении CD22 (CD22 CAR) (UCART 22), предпочтительно экспрессируемым на клеточной поверхности,
где указанный CD22 CAR содержит:
I) по меньшей мере один внеклеточный домен, содержащий:
- шарнирный домен из СD8альфа,
- антигенсвязывающий домен, специфический в отношении CD22, необязательно лидерную последовательность,
II) трансмембранный домен из СD8альфа и
III) внутриклеточный сигнальный домен,
указанная UCART 22 содержит по меньший мере один дополнительный отредактированный ген, предпочтительно инактивированный ген CD52, инактивированный ген dCK, инактивированный ген бета-2-микроглобулина или встроенный ген HIF-1альфа.
2. UCART CD22 по п. 1, в которой антигенсвязывающий домен содержит scfv, специфический в отношении CD22, где указанный scfv получен из антитела m971 (m971), предпочтительно указанный scfv содержит последовательность, выбранную из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, предпочтительно последовательность из SEQ ID NO: 15.
3. UCART 22 по одному из п.п. 1-2, содержащая полипептид, имеющий SEQ ID NO: 15 и защитный переключатель, где указанный защитный переключатель содержит:
- RQR8, временно связанный с CD22 CAR с помощью пептида 2А, или
по меньшей мере два специфических для МАт ритуксимаба эпитопа, предпочтительно три специфических для МАт ритуксимаба эпитопа и более предпочтительно три специфических для МАт ритуксимаба эпитопа и специфические для МАт QBEND-10 эпитопы, связанные с CD22 CAR [что позволяет осуществлять сортинг и/или истощение иммунных клеток, наделенных указанным CD22 CAR].
4. UCART 22 по одному из п.п. 1-3, содержащая инактивированный ген CD52, еще более предпочтительно инактивированный ген CD52 и встроенный ген HIF-1 альфа, что придает устойчивость к алемтузумабу и гипоксии.
5. UCART 22 по одному из п.п. 1-4, где указанный анти-CD22 CAR экспрессируется на клеточной поверхности при низкой концентрации О2 (<5% 02).
6. UCART 22 по одному из п.п. 1-5, содержащая полинуклеотид, который кодирует полипептид, содержащий анти-CD22 CAR по п.п. 1-5.
UCART 22 по одному из указанных выше пунктов, содержащая анти-CD22 CAR на клеточной поверхности, полинуклеотид, кодирующий указанный анти-CD22 CAR, встроенный в ген TRAC, и экзогенную полинуклеотидную последовательность, которая кодирует IL-12, встроенную в геномную последовательность CD25, геномную последовательность В2М или в геномную последовательность PD1.
UCART 22 по одному из указанных выше пунктов, содержащая анти-CD22 CAR на клеточной поверхности, полинуклеотид, кодирующий указанный анти-CD22 CAR, встроенный в ген TRAC, и экзогенную полинуклеотидную последовательность, которая кодирует IL-12, встроенную в геномную последовательность CD25 или в геномную последовательность PD1, и дополнительно содержащая геномный «выключенный» (KO) ген, выбранный из гена рецептора IL-10, рецептора TGFбета, TIM-3, LAG-3 (см. выше таблицу 9).
7. UCART 22 по одному из п.п. 1-6, дополнительно содержащая полинуклеотид, имеющий SEQ ID NO: 22, предпочтительно содержащая последовательности SEQ ID NO: 18 и 22 в том же гене TRAC.
8. Популяция клеток, содержащая указанную UCART 22 по одному из п.п. 1-7.
9. Фармацевтическая композиция, содержащая UCART 22 по одному из п.п. 1-7 или популяцию клеток, содержащую указанную UCART 22 по п. 8, и фармацевтически приемлемый эксципиент.
10. Фармацевтическая композиция по п. 9, дополнительно содержащая бриостатин, предпочтительно бриостатин-1.
11. Терапевтически эффективное количество UCART 22 по одному из п.п. 1-7 или фармацевтической композиции по п. 9 или п. 10 для применения в качестве лекарственного средства для лечения пациента.
12. Терапевтически эффективное количество UCART 22 по одному из п.п. 1-7 или фармацевтической композиции по п. 9 или п. 10 для применения в качестве лекарственного средства для лечения пациента по п. 11, где лечение пациента включает введение по меньшей мере два раза (повторяющееся дозирование) в указанном терапевтически эффективном количестве UCART CD22 или указанную фармацевтическую композицию во избежание рецидива.
13. Терапевтически эффективное количество UCART 22 по одному из п.п. 1-7 или фармацевтической композиции по п. 9 или п. 10 для применения в качестве лекарственного средства для лечения пациента по п. 11 или п. 12, для лечения связанной с CD22 патологии, предпочтительно связанного с CD22 В-клеточного злокачественного заболевания.
14. Терапевтически эффективное количество UCART 22 по одному из п.п. 1-7 или фармацевтической композиции по п. 9 или п. 10 для применения в качестве лекарственного средства для лечения пациента по одному из п.п. 11-13, для применения для лечения гематологического рака, выбранного из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, предпочтительно экспрессирующего CD22 гематологического рака, более предпочтительно рецидивирующего рефрактерного экспрессирующего CD22 гематологического рака, еще более предпочтительно агрессивной формы указанного связанного с CD22 гематологического рака.
15. Терапевтически эффективное количество UCART 22 по одному из п.п. 1-7 или фармацевтической композиции по п. 9 или п. 10 для применения в качестве лекарственного средства для лечения пациента по одному из п.п. 11-13, для применения для лечения рецидивирующего и/или рефрактерного CD22-позитивного В-ALL.
16. Терапевтически эффективное количество UCART 22 по одному из п.п. 1-7 или фармацевтической композиции по п. 9 или п. 10 для применения в качестве лекарственного средства для лечения пациента по одному из п.п. 11-13, где указанный пациент страдает раком, предпочтительно опосредуемым CD22+-клетками, выбранным из альвеолярной рабдомиосаркомы, рака мочевого пузыря (например, карциномы мочевого пузыря), рака кости, рака головного мозга (например, медуллобластомы), рака молочной железы, рака ануса, анального канала или аноректума, рака глаза, рака внутрипеченочного желчного протока, рака сустава, рака шеи, рака желчного пузыря, рака плевры, рака носа, рака носовой полости, рака среднего уха, рака ротовой полости, рака вульвы, хронического лимфоцитарного лейкоза, хронического миелоидного рака, рака ободочной кишки, рака пищевода, рака шейки матки, фибросаркомы, карциноидной опухоли желудочно-кишечного тракта, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи), рака гипофаринкса, рака почки, рака гортани, рака печени, рака легкого (например, немелкоклеточной карциномы легкого), злокачественной мезотелиомы, мастоцитомы, меланомы, рака носоглотки, рака яичника, рака поджелудочной железы, рака брюшины, рака сальника, рака брыжейки, рака глотки, рака предстательной железы, ректального рака, ренального рака, рака кожи, рака тонкого кишечника, рака мягких тканей, солидных опухолей, рака желудка, рака яичек, рака щитовидной железы, рака мочеточника, предпочтительно рака печени и рака легкого.
Краткое описание чертежей
На чертежах показано:
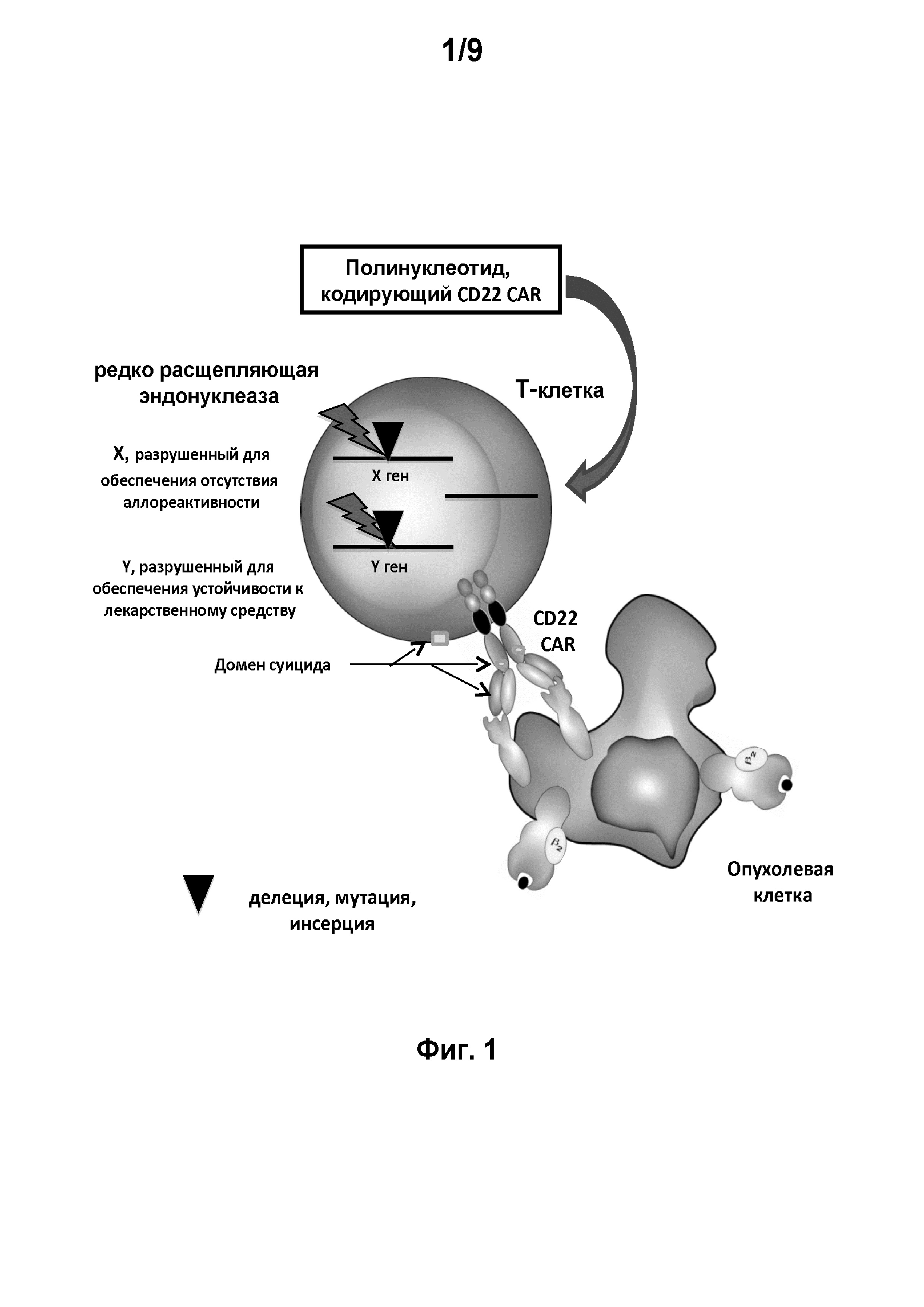
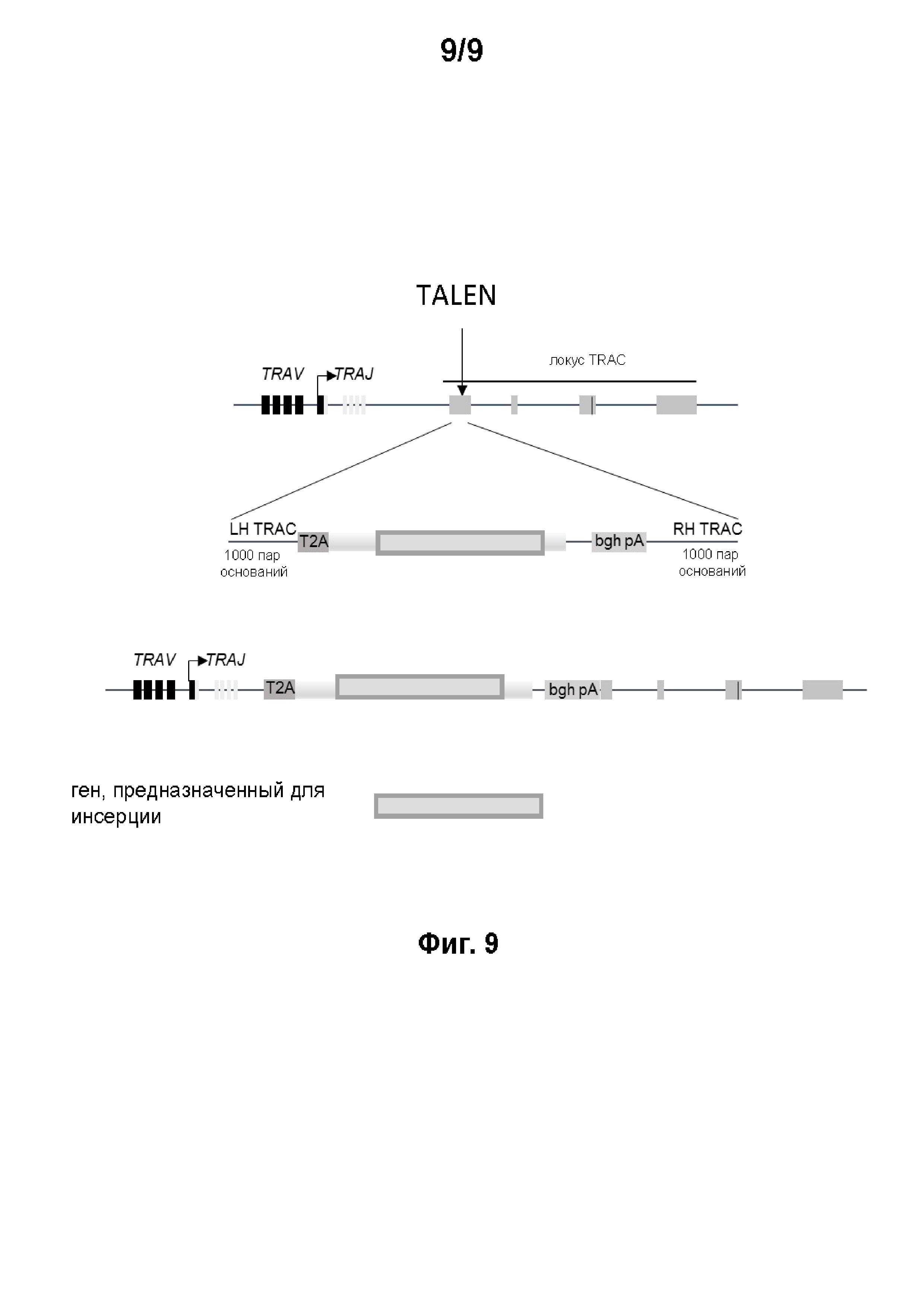
на фиг. 1 - схематическое изображение сконструированной иммунной клетки, предлагаемой в изобретении.
Сконструированная иммунная клетка, представленная на фиг. 1, может представлять собой Т-клетку, наделенную полинуклеотидом, который кодирует CAR, предлагаемый в изобретении. Указанная Т-клетка сконструирована также для того, чтобы обеспечивать лучшее и безопасное приживление трансплантата у пациента. X или Y обозначает отредактированный ген, который может быть изменен в результате мутации, удален в результате делеции и/или иметь инсерцию. Например, ген, экспрессирующий компонент Т-клеточного рецептора (TCR), например, TCRaльфa или TCRбета, может быть удален в результате делеции или может содержать инсерцию, Y может обозначать ген, участвующий в придании Т-клеткам чувствительности к иммуносупрессивным лекарственным средствам типа dCK (касательно устойчивости к аналогам пуриновых нуклеотидов) или CD52 (касательно препарата кэмпас), или HPRT (касательно 6-тиогуанина);
на фиг. 2 - изображение одноцепочечного и многоцепочечного CD22 CAR.
На фиг. 2 проиллюстрированы примеры CD22 CAR, предлагаемых в изобретении, которые содержат scfv, специфический в отношении CD22, необязательно содержат защитный переключатель, шарнир и трансмембранный домен из СD8альфа, внутриклеточные домены из 4-1ВВ и CD3дзета, необязательно домен, придающий устойчивость к гипоксии;
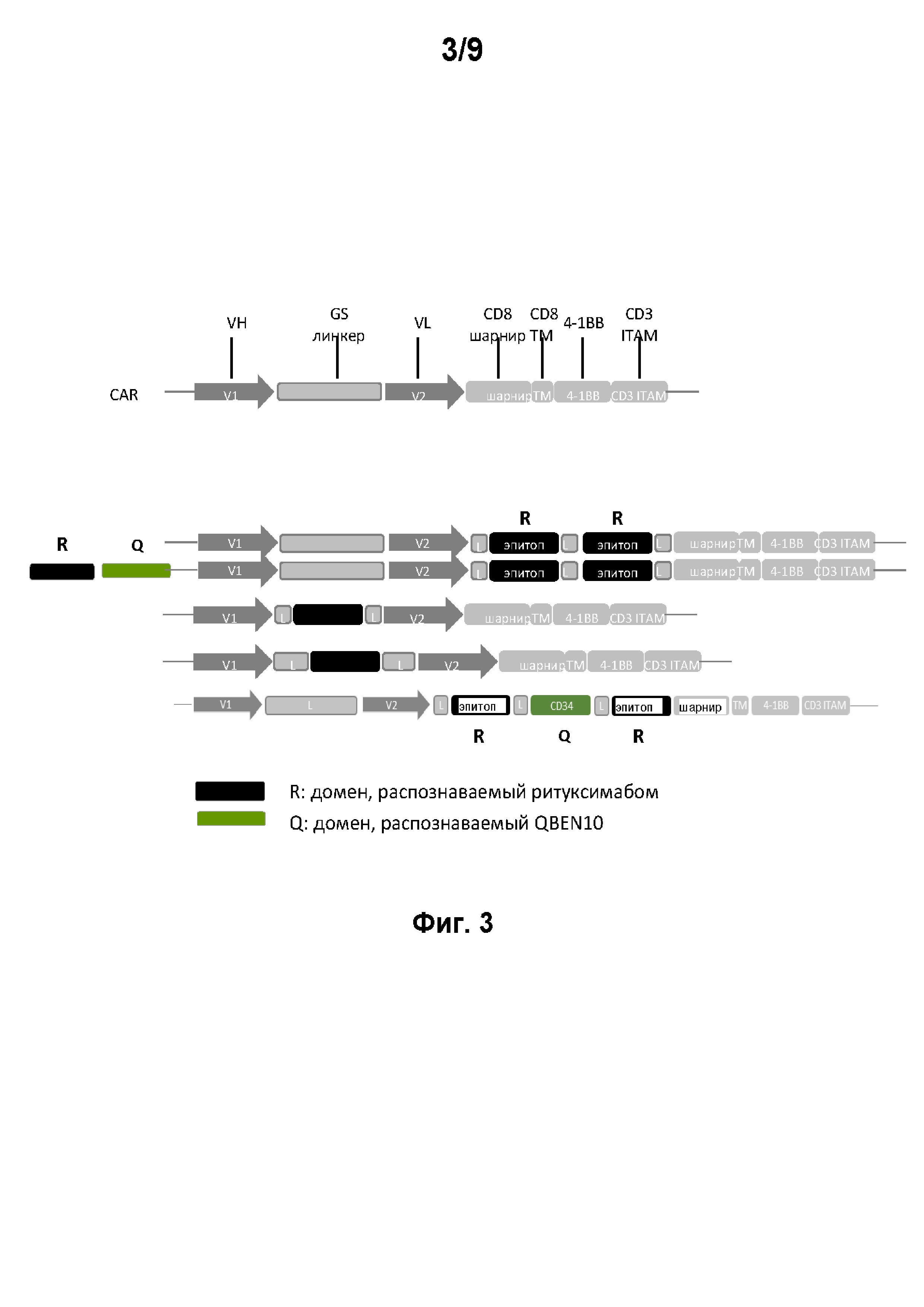
на фиг. 3 примеры конструкций CD22 CAR, предлагаемых в изобретении, которые содержат защитный переключатель.
По меньшей мере специфические для МАт ритуксимаба (R) эпитопы (черные прямоугольники), предпочтительно 3 специфических для МАт ритуксимаба эпитопа и более предпочтительно 3 специфических для МАт ритуксимаба эпитопа и специфические для МАт QBEND-10 (Q) эпитопа (серый прямоугольник) встроены в CD22 CAR.
R может быть встроен в scfv, между VH- и VL-доменом (или VL- и VH-доменом) и/или в шарнир;
на фиг. 4 пример полипептида, кодируемого полинуклеотидом.
На фиг. 4 представлен один пример полипептида, который может расщепляться таким образом, чтобы защитный переключатель (RQR8) и CD22 CAR могли экспрессироваться на клеточной поверхности.
R обозначает мимеотоп CD20 (связывающийся ритуксимабом), Q обозначает эпитоп CD34 (связывающийся QBEND-10);
на фиг. 5 - данные о дегранулирующей активности UCART 22.
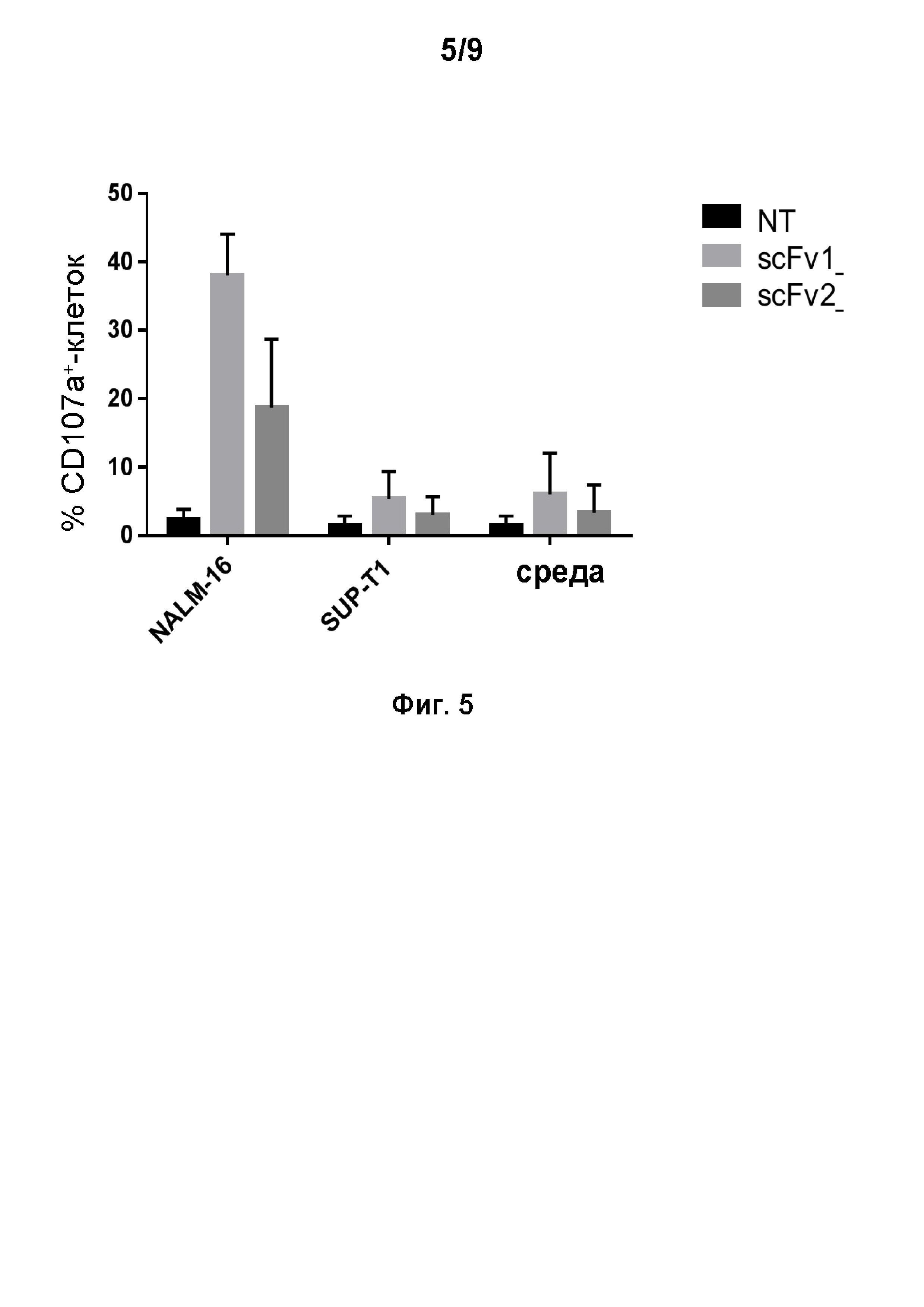
Дегранулирующую активность UCART 22 (scfv-V1 против проксимального домена CD22) сравнивали с дегранулирующей активностью нетрансдуцированных (NT) Т-клеток или Т-клеток, трансдуцированных CAR, мишенью которого является дистальная область CD22 (scfv-V2), в присутствии СВ22-позитивных клеток NALM-16 в сравнении с CD22-негативными клетками SUP-T1;
на фиг. 6 - данные о цитотоксической активности UCART 22.
Цитотоксическую активность UCART 22 (scfv-V1 против проксимального домена CD22) сравнивали с цитотоксической активностью нетрансдуцированных (NT) Т-клеток или Т-клеток, трансдуцированных CAR, мишенью которого является дистальная часть CD22 (scfv-V2), в присутствии CD22-позитивных клеток NALM-16 в сравнении с CD22-негативными клетками SUP-T1;
на фиг. 7 - данные о производстве интерферона гамма клетками UCART 22;
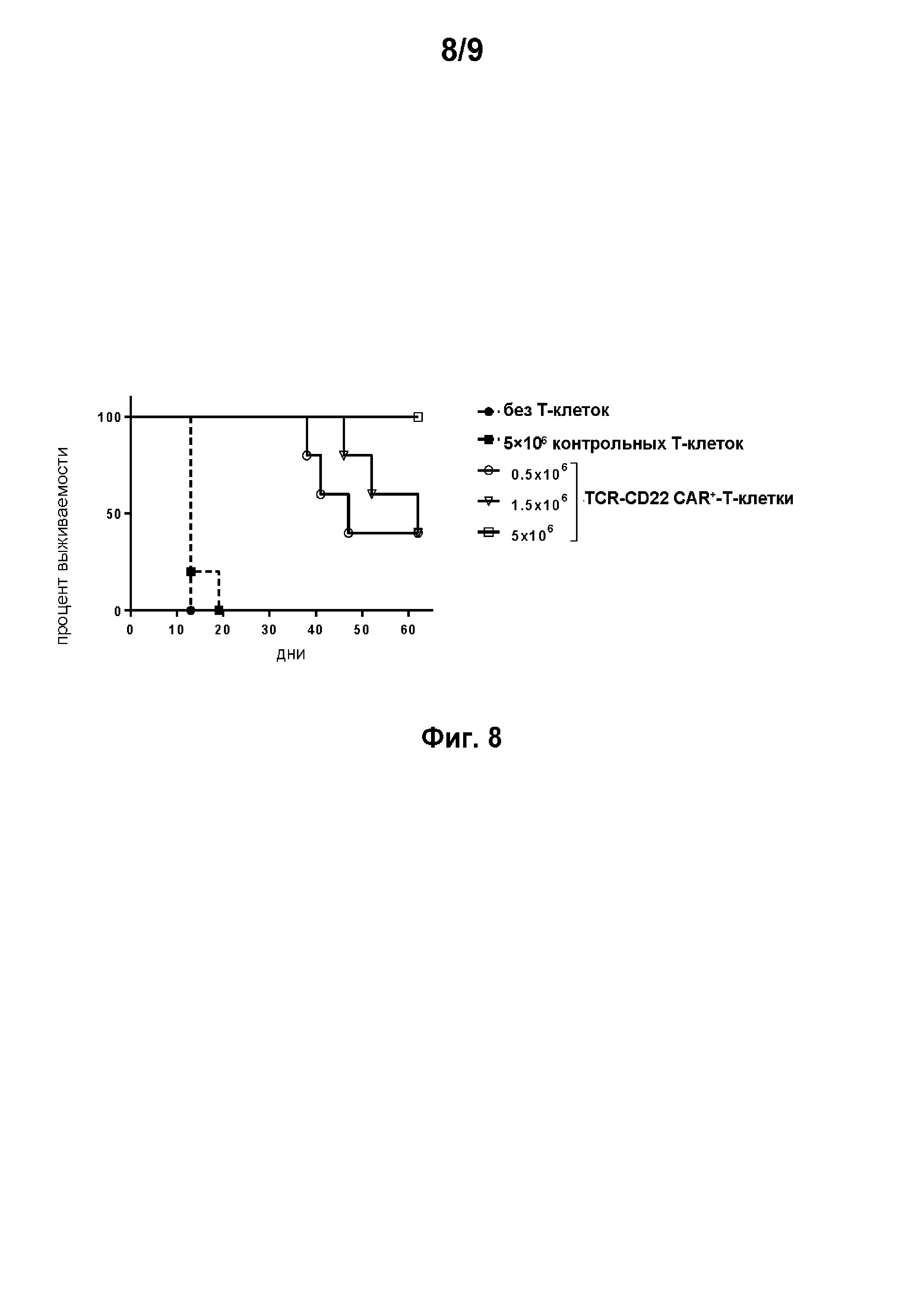
на фиг. 8 - данные о выживании мышей в присутствии контрольных клеток, UCART 22 (scfv-V1 против проксимального домена CD22) или CART 22 (без делеции в TRAC);
на фиг. 9 общая стратегия встраивания гена в ген TRAC с использованием TALEN.
Подробное описание изобретения
Если специально не указано иное, то все технические и научные понятия, использованные в настоящем описании, имеют значение, которое является общепринятым для специалистов в области генной терапии, биохимии, генетики и молекулярной биологии.
Для осуществления на практике или тестирования настоящего изобретения можно применять все методы и материалы, сходные или эквивалентные тем, которые указаны в настоящем описании, при этом в настоящей заявке описаны приемлемые методы и материалы. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в настоящем описании, полностью включены в настоящее описание в качестве ссылки. В случае разночтения следует руководствоваться настоящим описанием, включая определения. Кроме того, материалы, методы и примеры представлены только для иллюстрации и не направлены на ограничение объема изобретения, если не указано иное.
При осуществлении на практике настоящего изобретения следует применять, если не указано иное, общепринятые методы клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, известные специалисту в данной области. Такие методы подробно описаны в литературе, см., например, Current Protocols in Molecular Biology (Frederick M. AUSUBEL, изд-во Wiley and son Inc, Library of Congress, USA, 2000); Molecular Cloning: A Laboratory Manual, 3-е изд. (Sambrook и др., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 2001); Oligonucleotide Synthesis, под ред. M.J. Gait, 1984; Mullis и др., US №4683195; Nucleic Acid Hybridization (под ред. В.D. Harries и S.J. Higgins, 1984); Transcription And Translation (под ред. В.D. Hames и S.J. Higgins, 1984); Culture Of Animal Cells (R.I. Freshney, изд-во Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (изд-во IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning, 1984; серия: Methods In ENZYMOLOGY (под. ред. J. Abelson и M. Simon, изд-во Academic Press, Inc., New York), прежде всего том 154 и том 155 (под ред. Wu и др.) и том 185, «Gene Expression Technology)) (под ред. D. Goeddel); Gene Transfer Vectors For Mammalian Cells (под ред. J.H. Miller и M.P. Calos, 1987, изд-во Cold Spring Harbor Laboratory); Immunochemical Methods In Cell And Molecular Biology (под ред. Mayer и Walker, изд-во Academic Press, London, 1987); Handbook Of Experimental Immunology, тома I-IV (под ред. D.M. Weir и С.С. Blackwell, 1986); и Manipulating the Mouse Embryo, (изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986)
CD22-специфические химерные антигенные рецепторы
Настоящее изобретение относится к вновь созданным анти-CD22 химерным антигенным рецепторам (CAR или CD22 CAR, или анти-CD22 CAR), которые представляют собой химерные антигенные рецепторы, обладающие способностью специфически связываться с CD22, прежде всего с проксимальным доменом CD22.
CD22-специфические химерные антигенные рецепторы, предлагаемые в изобретении, содержат внеклеточный домен, который содержит внеклеточный лигандсвязывающий домен и шарнир, необязательно домен суицида, трансмембранный домен и внутриклеточный домен, содержащий домен трансдукции сигнала.
CD22 CAR, предлагаемый в настоящем изобретении, который экспрессируется на клеточной поверхности, содержит внеклеточный домен, который содержит внеклеточный лигандсвязывающий домен.
Понятие «внеклеточный лигандсвязывающий домен» в контексте настоящего описания обозначает олиго- или полипептид, обладающий способностью связываться по меньшей мере с одним эпитопом CD22. Предпочтительно внеклеточный лигандсвязывающий домен должен обладать способностью взаимодействовать по меньшей мере частично с молекулой клеточной поверхности, которая взаимодействует с CD22, и с другим антигеном, расположенным на клеточной поверхности, или другим связанным с мембраной антигеном, или взаимодействовать непосредственно с CD22 или взаимодействовать с человеческим CD22, более конкретно взаимодействовать непосредственно с проксимальной областью человеческого CD22 (от аминокислоты 243 до аминокислоты 687).
В одном из вариантов осуществления изобретения CD22 CAR, предлагаемый в настоящем изобретении, содержит внеклеточный домен, который содержит внеклеточный лигандсвязывающий домен, обладающий способностью взаимодействовать с проксимальной областью CD22 (от аминокислоты 243 до аминокислоты 687) и с дистальной частью CD22 (от ак 20 до ак 425).
Согласно настоящему изобретению полноразмерный внеклеточный домен CD22 простирается от аминокислоты (ак) 20 до ак 687, мембранный проксимальный домен CD22 простирается от ак 243 до ак 687, мембранный дистальный домен CD22 простирается от ак 20 до ак 425.
В одном из вариантов осуществления изобретения можно выбирать внеклеточный лигандсвязывающий домен, позволяющий распознавать конкретную форму (гликозированную) CD22, которая функционирует в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием.
В предпочтительном варианте осуществления изобретения указанный внеклеточный лигандсвязывающий домен содержит по меньшей мере один одноцепочечный фрагмент антитела (scFv), содержащий вариабельный фрагмент легкой (VL) и тяжелой (VH) цепи специфического в отношении антигена-мишени моноклонального антитела к CD22, соединенные линкером, прежде всего гибким линкером. Указанные VL и VH предпочтительно получают из антитела m971, представленного ниже в таблице 2. Они предпочтительно связаны гибким линкером, который содержит, например, последовательность SEQ ID NO: 10.
Для целей настоящего изобретения конкретные участки полноразмерного человеческого антитела к CD22, т.е. антитела m971 (m971), которое было идентифицировано ранее с использованием методологии фагового дисплея и охарактеризовано (Xiao X., Но М., Zhu Z., Pastan I., Dimitrov D.S. Identification and characterization of fully human anti-CD22 monoclonal antibodies. mAbs, 1(3), 2009, cc. 297-303), объединяли с конкретными последовательностями с получением новых CD22 CAR, предлагаемых в изобретении (см. также WO 2014065961, которая включена в настоящее описание в качестве ссылки).
Предпочтительным вариантом осуществления изобретения являются CAR, которые содержат антигенсвязывающий домен, содержащий, состоящий или практически состоящий из одноцепочечного вариабельного фрагмента (scFv) антигенсвязывающего домена m971 со следующими представленными в таблице 1 фрагментами.




В предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении, содержит последовательность SEQ ID NO: 15.
В предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении, содержит последовательность SEQ ID NO: 23.
Последовательности CD22 CAR, предлагаемых в изобретении, содержат пептидный сигнал, ТМ-домен из СD8альфа и линкер между VH- и VL-доменами из m971.
SCFV
Согласно настоящему изобретению scfv представляет собой слитый белок вариабельной области тяжелой (VH-домен) и легкой цепи (VL-домен) иммуноглобулина или области иммуноглобулина, специфической в отношении CD22, которые связаны с помощью короткого линкерного пептида, состоящего из 10-25 аминокислот, предпочтительно имеющего SEQ ID NO: 10.
В предпочтительном варианте осуществления изобретения указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 12.
В предпочтительном варианте осуществления изобретения указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 13.
В предпочтительном варианте осуществления изобретения указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 12, и полипептидную последовательность, идентичную по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 13.
Шарнир
Внеклеточный домен может содержать также шарнирную область между указанным внеклеточным лигандсвязывающим доменом и указанным трансмембранным доменом. В контексте настоящего описания понятие «шарнирная область», как правило, обозначает любой олиго- или полипептид, функция которого заключается в сцеплении трансмембранного домена с внеклеточным лигандсвязывающим доменом. В частности, шарнирную область используют для обеспечения большей гибкости и доступности внеклеточного лигандсвязывающего домена. Шарнирная область может содержать вплоть до 300 аминокислот, предпочтительно от 10 до 100 аминокислот, и наиболее предпочтительно от 10 до 50 аминокислот. Шарнирную область можно получать из полных встречающихся в естественных условиях молекул, или их частей, таких как полная внеклеточная область CD8 или CD4 или ее часть, или из полной константной области антитела или ее части. Альтернативно этому, шарнирная область может представлять собой синтетическую последовательность, которая соответствует встречающейся в естественных условиях шарнирной последовательности, или может представлять собой полностью синтетическую шарнирную последовательность. В предпочтительном варианте осуществления изобретения указанный шарнирный домен содержит часть альфа-цепи человеческого CD8, FcyRIIIα-рецептора или IgG1 соответственно, которые обозначены в настоящем описании как SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, или в более предпочтительном варианте осуществления изобретения представляет собой шарнирные полипептиды, последовательности которых идентичны предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% последовательности SEQ ID NO: 4, еще более предпочтительно идентичны на 100% последовательности SEQ ID NO: 4.
Шарнир из IgG4 или из PD1 является частью настоящего изобретения, и они описаны в WO 2016/120216 и их можно использовать в конструкции CD22 CAR, предлагаемой в изобретении.
CD22 CAR, предлагаемый в настоящем изобретении, закреплен в мембране клетки. Таким образом, CD22 CAR дополнительно содержит трансмембранный домен. Отличительными особенностями соответствующих транс мембранных доменов являются способность экспрессироваться на поверхности клетки, согласно настоящему изобретению предпочтительно на поверхности иммунной клетки, прежде всего лимфоцитов или естественных клеток-киллеров (NK), и способность взаимодействовать друг с другом, направляя клеточный ответ иммунной клетки на заранее определенную клетку-мишень. Трансмембранный домен можно получать как из встречающегося в естественных условиях, так и из синтетического источника. Трансмембранный домен можно получать из любого связанного с мембраной или трансмембранного белка. Примерами трансмембранных полипептидов могут служить (но, не ограничиваясь только ими) субъединица Т-клеточного рецептора, такая как α-, β-, γ- или δ-субъединица, полипептид, образующий комплекс с CD3, р55 (α-цепь), р75 (β-цепь) или γ-цепь рецептора IL2, цепь субъединицы Fc-рецепторов, в частности, Fcγ-рецептора III, или CD-белки. Альтернативно этому, трансмембранный домен может быть синтетическим, и он может содержать преимущественно гидрофобные остатки, такие как лейцин и валин.
В предпочтительном варианте осуществления изобретения указанный трансмембранный домен получают из альфа-цепи человеческого CD8 (например, NP 001139345.1).
CD22 CAR, предлагаемый в изобретении, как правило, дополнительно содержит трансмембранный домен (ТМ), более конкретно из CD8α, который идентичен полипептидам, имеющим SEQ ID NO: 6 или SEQ ID NO: 7. Предпочтительно CAR, предлагаемый в изобретении, содержит ТМ, идентичный по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% полипептидной последовательности SEQ ID NO: 6.
CD22 CAR, предлагаемый в изобретении, как правило, дополнительно содержит трансмембранный домен (ТМ) из CD8α, идентичный на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% полипептидам, имеющим SEQ ID NO: 6. Предпочтительно CAR, предлагаемый в изобретении, содержит ТМ, идентичный по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% полипептидной последовательности SEQ ID NO: 6.
CD22 CAR, предлагаемый в настоящем изобретении, содержит внутриклеточный домен, который содержит домен трансдукции сигнала или внутриклеточный сигнальный домен.
Домен трансдукции сигнала или внутриклеточный сигнальный домен CD22 CAR, предлагаемого в настоящем изобретении, ответствен за внутриклеточную передачу сигнала после связывания внеклеточного лигандсвязывающего домена с мишенью, приводя к активации иммунной клетки и иммунному ответу (цитолитическая активность в отношении клетки-мишени). Другими словами, домен трансдукции сигнала ответствен за активацию по меньшей мере одной из обычных эффекторных функций иммунной клетки, в которой экспрессируется CAR. Например, эффекторная функция Т-клетки может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов. Таким образом, понятие «домен трансдукции сигнала» относится к участку белка, который трансдуцирует сигнал эффекторной сигнальной функции и побуждает клетку осуществлять специализированную функцию.
Предпочтительными примерами домена трансдукции сигнала в CD22 CAR, предлагаемом в изобретении, могут являться цитоплазматические последовательности Т-клеточного рецептора и корецепторов, совместное действие которых состоит в инициации трансдукции сигнала после контакта с рецептором антигена, а также любое производное или любой вариант указанных последовательностей и любая синтетическая последовательность, которая имеет такую же функциональную способность. Домен трансдукции сигнала содержит два различных класса цитоплазматических сигнальных последовательностей, те, которые инициируют антигензависимую первичную активацию, и те, которые действуют независимым от антигена образом, обеспечивая вторичный или костимуляторный сигнал. Первичная цито плазматическая сигнальная последовательность может содержать сигнальные мотивы, известные как мотивы активации иммунных рецепторов на основе тирозина, ITAM. ITAM представляют собой хорошо известные сигнальные мотивы, присутствующие во внутрицитоплазматическом «хвосте» различных рецепторов, которые служат в качестве сайтов связывания для класса syk/zap70 тирозинкиназ. Примерами ITAM, применяемых согласно изобретению, могут служить (но, не ограничиваясь только указанными примерами) ITAM, происходящие из TCRдзета, FcRгамма, FcRбета, FcRэпcилoн, СВ3 гамма, СВ3дельта, СВ3эпсилон, CD5, CD22, CD79a, CD79b и CD66d. В предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR может содержать сигнальный домен CD3дзета, который имеет аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 9. Необязательно указанный сигнальный домен CD3дзета содержит полипептидную последовательность, идентичную по меньшей мере на 90%, 91%, 92% 93% 94%, 95%, 96%, 97%, 98%, 99% или 100% SEQ ID NO: 9.
В более предпочтительном варианте осуществления изобретения домен трансдукции сигнала CD22 CAR состоит из сигнального домена СD3дзета, имеющего SEQ ID NO: 9, и в нем исключено присутствие какой-либо последовательности из сигнального домена человеческого CD28. В конкретном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит костимуляторную сигнальную молекулу. Костимуляторная молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая требуется для эффективного иммунного ответа. Понятие «костимуляторный лиганд» относится к молекуле на антигенпрезентирующей клетке, которая специфически связывается с когнатной костимуляторной молекулой на Т-клетке, создавая тем самым сигнал, который, в дополнение к первичному сигналу, создаваемому, например, при связывании комплекса TCR/CD3 с молекулой ГКГС, загруженной пептидом, опосредует Т-клеточный ответ, включая (но, не ограничиваясь только ими) активацию пролиферации, дифференцировку и т.п. Костимуляторный лиганд может включать (но, не ограничиваясь только ими) CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимуляторный лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM), CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, рецептор лимфотоксина бета, 3/TR6, ILT3, ILT4, агонист или антитело, который/которое связывается с лигандом Толл-рецептора, и лиганд, который специфически связывается с В7-Н3. Под понятие «костимуляторный лиганд» подпадает, среди прочего, антитело, которое специфически связывается с костимуляторной молекулой, присутствующей на Т-клетке, такой как (но, не ограничиваясь только ими) CD27, 4-1ВВ, ОХ40, CD30, CD40, PD-1, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LTGHT, NKG2C, В7-Н3, лиганд, специфически связывающийся с CD83.
Понятие «костимуляторная молекула» относится к когнатному связывающему партнеру, присутствующему на Т-клетке, который специфически связывается с костимуляторным лигандом, опосредуя тем самым костимуляторный ответ клетки, такой как (но, не ограничиваясь только им) пролиферация. Костимуляторные молекулы включают (но, не ограничиваясь только ими) молекулу ГКГС класса I, BTLA и лиганд Толл-рецептора. Примерами костимуляторных молекул являются CD27, CD8, 4-1ВВ (CD 137), ОХ40, CD30, CD40, PD-1, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3 и лиганд, специфически связывающийся с CD83, и т.п.
В предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит часть костимуляторной сигнальной молекулы, состоящей из фрагмента 4-1ВВ (GenBank: ААА53133). В частности, домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 8.
В более предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, не содержит последовательность из CD28 (NP 006130.1).
В еще более предпочтительном варианте осуществления изобретения во всех вариантах осуществления настоящего изобретения отсутствует последовательность из CD28 (NP 006130.1).
В еще более предпочтительном варианте осуществления изобретения домен трансдукции сигнала CD22 CAR, предлагаемого в настоящем изобретении, содержит часть костимуляторной сигнальной молекулы 4-1ВВ (GenBank: ААА53133) и не содержит последовательность из CD28 (NP 006130.1).
В настоящем изобретении предложен CD22-специфический химерный антигенный рецептор (CD22 CAR), содержащий:
внеклеточный домен, который содержит:
- связывающий домен, специфический в отношении CD22, предпочтительно связывающий домен, специфический в отношении человеческого CD22, более предпочтительно указанный связывающий домен, специфический в отношении человеческого CD22, который представляет собой одноцепочечный вариабельный фрагмент (scFv),
- шарнир, предпочтительно из СD8альфа,
- трансмембранный домен, предпочтительно из СD8альфа,
- внутриклеточный домен, содержащий:
костимуляторную сигнальную молекулу из человеческого 4-1ВВ, и внутриклеточный сигнальный домен, который содержит сигнальный домен человеческого СD3дзета.
В предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении, не имеет последовательности из CD28.
В предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении, не содержит никакой последовательности из CD28 и содержит последовательность лидера, ТМ-домен и шарнир из CD8a, предпочтительно не содержит никакой последовательности из CD28 и содержит последовательность лидера SEQ ID NO: 1, ТМ-домен, имеющий SEQ ID NO: 6, и шарнир, имеющий SEQ ID NO: 4, из CD8α.
В одном из вариантов осуществления изобретения CD22 CAR, предлагаемый в изобретении, содержит лидерную последовательность из человеческого CD8α (SEQ ID NO: 1) или лидерную последовательность, идентичную по меньшей мере на 95% SEQ ID NO: 1.
В другом варианте осуществления изобретения, CD22 CAR, предлагаемый в изобретении, содержит лидерную последовательность SEQ ID NO: 2 или лидерную последовательность, идентичную по меньшей мере на 95% SEQ ID NO: 2.
В одном из вариантов осуществления настоящего изобретения предложен CD22-специфический химерный антигенный рецептор (CD22 CAR), содержащий:
- связывающий домен, специфический в отношении CD22, предпочтительно связывающий домен, специфический в отношении человеческого CD22, более предпочтительно указанный связывающий домен, специфический в отношении человеческого CD22, который представляет собой одноцепочечный вариабельный фрагмент (scFv), еще более предпочтительно содержащий VH и VL из m971,
- шарнир из человеческого СD8альфа (из CD8α),
- трансмембранный домен из человеческого СD8альфа (α),
- костимуляторную сигнальную молекулу из человеческого 4-1ВВ,
- внутриклеточный сигнальный домен, содержащий сигнальный домен человеческого СD3дзета.
В одном из вариантов осуществления настоящего изобретения предложен CD22-специфический химерный антигенный рецептор (CD22 CAR), содержащий:
- связывающий домен, специфический в отношении CD22, предпочтительно связывающий домен, специфический в отношении человеческого CD22, более предпочтительно указанный связывающий домен, специфический в отношении человеческого CD22, который представляет собой одноцепочечный вариабельный фрагмент (scFv), еще более предпочтительно содержащий VH и VL из m971,
- шарнир из человеческого FcRIIIα,
- трансмембранный домен из человеческого СD8альфа (α),
- костимуляторную сигнальную молекулу из человеческого 4-1ВВ,
- внутриклеточный сигнальный домен, содержащий сигнальный домен человеческого СD3дзета.
В настоящем изобретении предложен также CD22-специфический химерный антигенный рецептор (CD22 CAR), содержащий:
- связывающий домен, специфический в отношении CD22, предпочтительно связывающий домен, специфический в отношении человеческого CD22, более предпочтительно указанный связывающий домен, специфический в отношении человеческого CD22, который представляет собой одноцепочечный вариабельный фрагмент (scFv), еще более предпочтительно содержащий VH и VL из m971,
- шарнир из человеческого IgG1,
- трансмембранный домен из человеческого СD8альфа (α),
- костимуляторную сигнальную молекулу из человеческого 4-1ВВ,
- внутриклеточный сигнальный домен, содержащий сигнальный домен человеческого СD3дзета.
Указанные три последних варианта осуществления изобретения включают CD22 CAR с сигнальным пептидом, имеющим SEQ ID NO: 1 или SEQ ID NO: 2, предпочтительно SEQ ID NO: 1.
Более предпочтительно указанный CD22 CAR не имеет никакой последовательности из CD28.
Scfv, предлагаемый в изобретении, получают из антитела, специфического в отношении CD22, он содержит VH-домен, отделенный от VL-домена линкером, указанный(ые) VH- и/или VL-домены участвуют в связывании с CD22.
В предпочтительном варианте осуществления изобретения UCART 22, предлагаемая в изобретении, содержит scfv из антитела m971 с одним GS4-линкером между VH и VL и 2R между VL и шарниром из СD8альфа.
Согласно настоящему изобретению scfv представляет собой слитый белок вариабельных областей тяжелой (VH-домен) (SEQ ID NO: 12) и легкой (VL-домен) (SEQ ID NO: 13) цепей иммуноглобулина, специфического в отношении CD22, m971, которые соединены линкерным пептидом, предпочтительно линкером, имеющим SEQ ID NO: 10.
В одном из вариантов осуществления изобретения указанный scfv, предлагаемый в изобретении, дополнительно содержит лидерную последовательность (или сигнальный пептид), предпочтительно указанная лидерная последовательность соединена с VH-доменом.
Вариант осуществления изобретения, в котором указанная лидерная последовательность соединена с VL-доменом, является частью настоящего изобретения.
В одном из вариантов осуществления изобретения VH-домен соединен с шарниром, в другом варианте осуществления изобретения VL-домен соединен с указанным шарниром.
В настоящем изобретении предложен scfv, связанный с шарниром, имеющим различную длину, предпочтительно шарниром из CD8α, IgG1 или FcRIIIα (см. фиг. 2), более предпочтительно из CD8α.
Предпочтительно в настоящем изобретении предложен CD22 CAR, содержащий:
- сигнальный пептид, например, сигнальный пептид, имеющий SEQ ID NO 2, или из СD8альфа, имеющий SEQ ID NO: 1,
- (scFv), содержащий VH-домен, отделенный от VL-домена линкером, где указанные VH и VL и линкер участвуют в связывании с CD22,
- шарнир из альфа-цепи человеческого CD8 или шарнир из человеческого IgG1, или шарнир из FcRIIIα, предпочтительно из СD8альфа,
- трансмембранный домен (ТМ) из СD8альфа(α),
- костимуляторную сигнальную молекулу из человеческого 4-1ВВ,
- внутриклеточный сигнальный домен, содержащий сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемый в изобретении, состоит из:
- лидерной последовательности (например, лидерной последовательности CD8α или сигнального пептида CD8α),
- анти-CD22 scfv, который содержит VH, линкер и VL или VL, линкер и VH, где указанные VH и VL получены из m971,
• шарнира CD8α,
• ТМ CD8α,
• костимуляторной сигнальной молекулы из 4-1ВВ,
• внутриклеточного сигнального домена СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- эпитоп, распознаваемый QBEND-10, и эпитоп, распознаваемый ритуксимабом,
- анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971, два последовательных эпитопа, распознаваемых ритуксимабом,
• шарнир CD8α,
• ТМ CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- эпитоп, распознаваемый QBEND-10, и эпитоп, распознаваемый ритуксимабом,
- анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971, два последовательных эпитопа, распознаваемых ритуксимабом,
• TM CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971,
два последовательных эпитопа, распознаваемых ритуксимабом,
• шарнир CD8α,
• TM CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971,
два последовательных эпитопа, распознаваемых ритуксимабом,
• TM CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971, анти-CD 19 scfv,
два последовательных эпитопа, распознаваемых ритуксимабом,
• шарнир CD8α,
• ТМ CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971, анти-CD 19 scfv,
два последовательных эпитопа, распознаваемых ритуксимабом,
• ТМ CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- анти-CD19 scfv и анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971,
два последовательных эпитопа, распознаваемых ритуксимабом,
• шарнир CD8α,
• ТМ CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Один из CD22 CAR, предлагаемых в изобретении, содержит последовательно расположенные:
- сигнальный пептид CD8α, который может удаляться после экспрессии на клеточной поверхности,
- анти-CD19 scfv и анти-CD22 scfv, который содержит VH, линкер и VL, где указанные VH и VL получены из m971,
два последовательных эпитопа, распознаваемых ритуксимабом,
• TM CD8α,
• костимуляторную сигнальную молекулу из 4-1ВВ,
• внутриклеточный сигнальный домен СD3дзета.
Линкер-SCFV
Линкер, предлагаемый в изобретении, может представлять собой, например, мультимер пентапептида (GGGGS)n или (G4S)n, или (Gly4Ser)n, где n имеет значение от 1 до 4, предпочтительно n равно 3, 18-мерный линкер GGSSRSSSSGGGGSGGGG (Andris-Widhopf и др., 2011) и 20-мерный линкер (648)4 (Schaefer и др., 2010). Линкер, предлагаемый в изобретении, может включать последовательности с добавленными функциональностями, например, эпитопную метку (Sblattero и Bradbury, Nature Biotechnology 18, 2000, сс. 75-80), по меньшей мере последовательность SEQ ID NO: 20, предпочтительно две, разделенные линкером, последовательности, улучшающие свойства scFv, предлагаемого в настоящем изобретении, часто в контексте конкретных последовательностей антител.
Среди других линкеров, приемлемых согласно настоящему изобретению, следует упомянуть 15-мерный пептидный линкер (RGRGRGRGRSRGGGS) (Zhihong Shen, Heping Yan, Ying Zhang, Raymond L. Mernaugh и Xiangqun Zeng Anal Chem. 80(6), 2008, cc. 1910-1917).
В предпочтительном варианте осуществления изобретения линкер, который связывает последовательность VH с VL в m971 (или последовательность VL с VH), представляет собой линкер формулы (G4S)n, в которой n имеет значение от 1 до 3; предпочтительно n равно 3 в последовательности (G4S)3 (SEQ ID NO: 10).
Одним из вариантов осуществления изобретения настоящего изобретения является:
CD22 CAR, содержащий
- лидерную последовательность человеческого CD8α (лидер CD8α или сигнальный пептид CD8α) SEQ ID NO: 1,
- анти-CD22 scfv, который содержит VH, имеющий SEQ ID NO: 12, линкер, имеющий SEQ ID NO: 10, и VL, имеющий SEQ ID NO: 13,
шарнир человеческого CD8α, имеющий SEQ ID NO: 4,
• TM человеческого CD8α, имеющий SEQ ID NO: 6,
• костимуляторную сигнальную молекулу из 4-1ВВ, имеющую SEQ ID NO: 8,
• внутриклеточный сигнальный домен СD3дзета, имеющий SEQ ID NO: 9.
Одним из вариантов осуществления изобретения настоящего изобретения является также:
CD22 CAR, содержащий
- лидерную последовательность человеческого CD8α (лидер CD8α или сигнальный пептид CD8α) SEQ ID NO: 1,
- анти-CD22 scfv, который содержит VH, имеющий SEQ ID NO: 12, линкер, имеющий SEQ ID NO: 10, и VL, имеющий SEQ ID NO: 13,
шарнир человеческого FcγRIIIα, имеющий SEQ ID NO: 3,
• TM человеческого CD8α, имеющий SEQ ID NO: 6,
• костимуляторную сигнальную молекулу из 4-1ВВ, имеющую SEQ ID NO: 8,
• внутриклеточный сигнальный домен СD3дзета, имеющий SEQ ID NO: 9.
Одним из вариантов осуществления изобретения настоящего изобретения является:
CD22 CAR, содержащий
- лидерную последовательность человеческого CD8α (лидер CD8α или сигнальный пептид CD8α) SEQ ID NO: 1,
- анти-CD22 scfv, который содержит VL, имеющий SEQ ID NO: 13, линкер, имеющий SEQ ID NO: 10, и VH, имеющий SEQ ID NO: 12,
шарнир человеческого FcyRIIIα, имеющий SEQ ID NO: 3,
• TM человеческого CD8α, имеющий SEQ ID NO: 6,
• костимуляторную сигнальную молекулу из 4-1ВВ, имеющую SEQ ID NO: 8,
• внутриклеточный сигнальный домен СD3дзета, имеющий SEQ ID NO: 9.
Одним из вариантов осуществления изобретения настоящего изобретения является:
CD22 CAR, содержащий
- лидерную последовательность человеческого CD8α (лидер CD8α или сигнальный пептид CD8α) SEQ ID NO: 1,
- анти-CD22 scfv, который содержит VL, имеющий SEQ ID NO: 13, линкер, имеющий SEQ ID NO: 10, и VH, имеющий SEQ ID NO: 12,
шарнир человеческого CD8альфа, имеющий SEQ ID NO: 4,
• TM человеческого CD8α, имеющий SEQ ID NO: 6,
• костимуляторную сигнальную молекулу из 4-1ВВ, имеющую SEQ ID NO: 8,
• внутриклеточный сигнальный домен CD3дзета, имеющий SEQ ID NO: 9.
В одном из вариантов осуществления настоящего изобретения предложен CD22-специфический химерный антигенный рецептор (CD22 CAR), содержащий:
- сигнальный пептид, который имеет аминокислотную последовательность, идентичную по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95% 97%, 99% или 100% полипептидной последовательности SEQ ID NO: 1 или 2; предпочтительно сигнальный пептид имеет аминокислотную последовательность, идентичную по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% полипептидной последовательности SEQ ID NO: 1,
- VH-домен, отделенный от VL-домена линкером, где указанные VH и VL участвуют в связывании с CD22; указанный линкер имеет последовательность, идентичную по меньшей мере на 90%, 95%, 97%, 99% или 100% полипептидной последовательности SEQ ID NO: 10;
указанный VH-домен имеет последовательность, идентичную по меньшей мере на 90%, 95%, 97%, 99% или 100% полипептидной последовательности SEQ ID NO: 12,
указанный VL-домен имеет последовательность, идентичную по меньшей мере на 90%, 95%, 97%, 99% или 100% полипептидной последовательности SEQ ID NO: 13,
- шарнир, полученный из альфа-цепи человеческого CD8, который имеет аминокислотную последовательность, идентичную по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% полипептидной последовательности SEQ ID NO: 4,
- трансмембранный домен, полученный из CD8альфа(α), который имеет аминокислотную последовательность, идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% полипептидной последовательности SEQ ID NO: 6,
- костимуляторную сигнальную молекулу, полученную из человеческого 4-1ВВ (или внутриклеточного домена 4-1ВВ), имеющую аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% аминокислотной последовательности, выбранной из группы включающей SEQ ID NO: 8,
- внутриклеточный сигнальный домен, который содержит сигнальный домен CD3дзета, имеющий аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%, 99% или 100% аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 9.
В предпочтительном варианте осуществления изобретения CD22-специфический химерный антигенный рецептор (CD22 CAR), предлагаемый в настоящем изобретении, не содержит никакой последовательности из человеческого CD28, прежде всего из внутриклеточного сигнального домена человеческого CD28. В более предпочтительном варианте осуществления изобретения CD22-специфический химерный антигенный рецептор (CD22 CAR), предлагаемый в настоящем изобретении, не содержит никакой последовательности из человеческого CD28, прежде всего из внутриклеточного сигнального домена человеческого CD28, и дополнительно содержит сигнальный пептид из CD8α, предпочтительно слитый с VH-доменом scfv, специфического в отношении CD22.
В одном из вариантов осуществления настоящего изобретения предложен CD22 CAR, имеющий SEQ ID NO: 15.
В одном из вариантов осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность, идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% полипептидной последовательности SEQ ID NO: 15.
В одном из вариантов осуществления настоящего изобретения предложен CD22 CAR, имеющий последовательность, идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% полинуклеотидной последовательности SEQ ID NO: 22.
CD22 CAR, предлагаемый в изобретении, содержит следующие последовательности:
v1-m971 (FcγRIIIα-CD8αTM-4-1BB.IC-CD3ζ.IC)

V3-m971 (CD8α-CD8αTM-4-1BB.IC-CD3ζ.IC)

В предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении, содержит следующую последовательность:

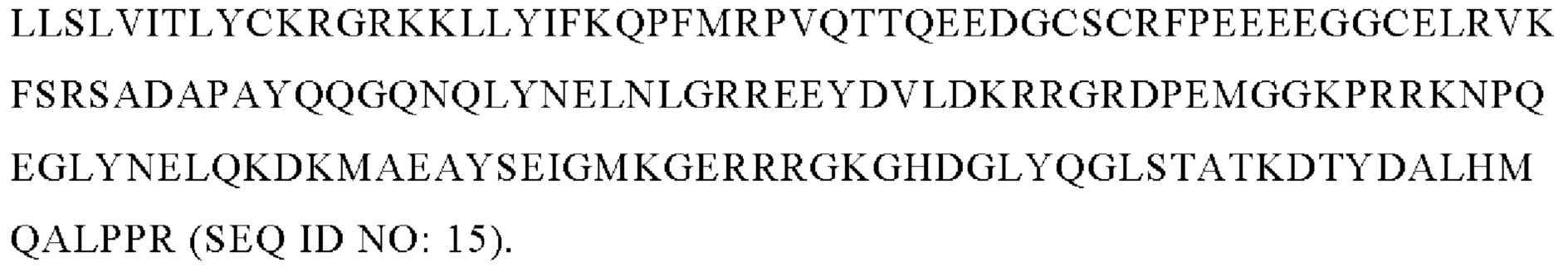
Ниже представлены последовательности CD22 CAR с пептидным сигналом из SEQ ID NO: 2, ТМ-доменом из CD8α и линкером между VH- и VL-доменом:

М971 V1


М971 V3

Одним из вариантов осуществления настоящего изобретения являются следующие последовательности:

В одном из вариантов осуществления изобретения UCART 22, предлагаемая в настоящем изобретении, содержит последовательность SEQ ID NO: 20

В одном из вариантов осуществления изобретения UCART 22, предлагаемая в настоящем изобретении, содержит последовательность SEQ ID NO: 22.
В предпочтительном варианте осуществления изобретения UCART 22, предлагаемая в настоящем изобретении, содержит последовательность SEQ ID NO: 22, встроенную в человеческий ген TRAC (например, в человеческий ген TRAC на хромосоме 14 - NC_000014.9), и экспрессирует на клеточной поверхности анти-CD22 CAR, специфический в отношении проксимальной области CD22.
В более предпочтительном варианте осуществления изобретения UCART 22, предлагаемая в настоящем изобретении, содержит последовательность SEQ ID NO: 20, встроенную в человеческий ген TRAC (например, в человеческий ген TRAC на хромосоме 14 - NC_000014.9), и экспрессирует на клеточной поверхности анти-CD22 CAR, специфический в отношении дистальной области CD22.
В одном из объектов изобретения анти-CD22-связывающий домен CD22 CAR, предлагаемого в изобретении, представляет собой анти-CD22-связывающий домен, специфический в отношении дистальной области CD22.
HA22-CAR
В настоящем изобретении предложен CD22 CAR, имеющий следующую последовательность:


Предпочтительно UCART 22, предлагаемая в настоящем изобретении, содержит последовательность:

Анти-CD22-связывающий домен, специфический в отношении дистальной области CD22, может экспрессироваться индивидуально или в сочетании с анти-CD22-связывающим доменом, специфическим в отношении проксимальной области CD22, в UCART 22, предлагаемой в изобретении.
В одном из объектов изобретения анти-CD22-связывающий домен CD22 CAR, предлагаемого в изобретении, представляет собой оптимизированный анти-CD22-связывающий домен.
В контексте настоящего описания понятие «оптимизированное» антитело (или scfv) относится к формам антител (или scfv), которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальные последовательности, полученные из иммуноглобулина. Предпочтительно антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из гипервариабельных участков (CDR) заменены на остатки из CDR для достижения требуемой специфичности, аффинности и требуемого потенциала.
В донорском CDR можно осуществлять несколько аминокислотных замен, которые могут оказывать существенное влияние или изменять характеристики связывания CD22 CAR, предлагаемого в изобретении. Так, одним из вариантов осуществления изобретения, представленных в настоящем описании, является CD22 CAR, связывание которого с экспрессирующей CD22 клеткой (и цитолитическая активность) сохраняют, но аффинность модифицируют для снижения интенсивности ответа (выброс цитокинов).
Аминокислотные модификации, как правило, представляют собой консервативные модификации, включающие аминокислотные замены, добавления и делеции в указанном фрагменте антитела в указанном CAR и/или других участках указанной молекулы CAR. Модификации можно интродуцировать в антитело, во фрагмент антитела или в любые из других участков молекулы CAR, предлагаемой в изобретении, с использованием стандартных методик, известных в данной области, таких как сайтнаправленный мутагенез, ПЦР-опосредуемый мутагенез, или путем применения оптимизированных зародышевых последовательностей.
Как правило, оптимизированный CAR должен содержать практически все по меньшей мере из одного, и, как правило, двух вариабельных доменов, в которых все или практически все CDR-участки соответствуют исходному человеческому иммуноглобулину.
Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток заменяют на аминокислотный остаток, который имеет сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, известны в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фениланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в CAR, предлагаемом в изобретении, можно заменять на другие аминокислотные остатки из того же семейства боковых цепей и измененный CAR можно тестировать, используя функциональные анализы, представленные в настоящем описании.
В предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий консервативные модификации последовательности (или изменение аминокислотной последовательности) по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15.
В предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность с 2 аминокислотными изменениями по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15.
В предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность с 3 аминокислотными изменениями по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15.
В предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность с 4 аминокислотными изменениями по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15.
В предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность с 5 аминокислотными изменениями по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15, необязательно содержащий по меньшей мере одну последовательность SEQ ID NO: 20.
В более предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность с 5 аминокислотными изменениями по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15, и при этом по меньшей мере один CDR в SEQ ID NO: 15 является консервативным.
В более предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность с 1-15 аминокислотными изменениями по сравнению с аминокислотной последовательностью полипептида SEQ ID NO: 15, и при этом по меньшей мере один CDR в SEQ ID NO: 15 является консервативным.
В предпочтительном варианте осуществления изобретения последовательность CD22 CAR, предлагаемую в изобретении, модифицируют путем изменения 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот по сравнению с wt CD22 CAR для снижения НАМА (ответ в виде человеческого антимышиного антитела), без воздействия на связывающую способность указанного CAR с его мишенью (CD22).
В предпочтительном варианте осуществления настоящего изобретения предложен CD22 CAR, имеющий аминокислотную последовательность по меньшей мере с 1 аминокислотным изменением по сравнению с аминокислотной последовательностью wt (wt представляет собой последовательность m971), указанное по меньшей мере 1 аминокислотное изменение не влияет или улучшает связывание и/или активность указанного CD22 CAR в первичных Т-клетках.
Характеристики ввязывания можно модифицировать с использованием адаптированной методики, впервые описанной у Mitchell Но, Satoshi Nagata и Ira Pastan. Isolation of anti-CD22 Fv with high affinity by Fv display on human cells, PNAS 103 (25), 2006, cc. 9637-9642; предварительная публикация 8 июня 2006 г., doi: 10.1073/pnas.0603653103, которая включена в настоящее описание в качестве ссылки.
Указанные оптимизированные scfv несут также по меньшей мере одну из мутаций, эквивалентных мутациям Pro-91-Thr-92 (РТ), Gly-91-Ala-92 и Val-91-Phe-92.
В одном из вариантов осуществления настоящего изобретения предложен анти-CD22 CAR, который содержит:
- внеклеточный домен, содержащий сигнальный пептид,
лигандсвязывающий домен, необязательно оптимизированный, который содержит VH-домен и VL-домен из моноклонального антитела к CD22, имеющего одну из следующих мутаций Pro-91-Thr-92 (РТ), Gly-91-Ala-92, Val-91-Phe-92 или ее эквивалент,
шарнир, содержащий шарнир CD8альфа (α),
- трансмембранный домен CD8альфа и
- цитоплазматический домен, содержащий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ.
В предпочтительном варианте осуществления настоящего изобретения предложен указанный выше CD22 CAR, в котором указанное моноклональное антитело к CD22 получают из антитела m971 с «горячими точками» в CDR. Предпочтительно оно имеет одну из следующих мутаций Pro-91-Thr-92 (РТ), Gly-91-Ala-92, Val-91-Phe-92.
В более предпочтительном варианте осуществления настоящего изобретения предложена выделенная сконструированная (TCR- и dCK-KO) иммунная Т-клетка, содержащая анти-CD22 CAR, который содержит
• внеклеточный домен, содержащий
сигнальный пептид, лигандсвязывающий домен, который содержит VH-домен и VL-домен из моноклонального антитела к CD22, имеющего по меньшей мере одну из следующих мутаций: мутацию Pro-91-Thr-92, Gly-91-Ala-92; мутацию Val-91-Phe-92,
шарнир, содержащий шарнир CD8альфа (α),
- трансмембранный домен CD8альфа и
- цитоплазматический домен, содержащий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ.
В более предпочтительном варианте осуществления настоящего изобретения предложена выделенная сконструированная (TCR- и CD52-KO) иммунная Т-клетка, содержащая анти-CD22 CAR, который содержит
• внеклеточный домен, содержащий
сигнальный пептид, лигандсвязывающий домен, который содержит VH-домен и VL-домен из моноклонального антитела к CD22, имеющего по меньшей мере одну из следующих мутаций: мутацию Pro-91-Thr-92, Gly-91-Ala-92; мутацию Val-91-Phe-92,
шарнир, содержащий шарнир CD8альфа (α),
- трансмембранный домен CD8альфа и
- цитоплазматический домен, содержащий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ.
В более предпочтительном варианте осуществления настоящего изобретения предложена выделенная сконструированная (TCR-, CD52- и dCK-KO) иммунная Т-клетка, содержащая анти-CD22 CAR, который содержит
• внеклеточный домен, содержащий
сигнальный пептид, лигандсвязывающий домен, который содержит VH-домен и VL-домен из моноклонального антитела к CD22, имеющего по меньшей мере одну из следующих мутаций: мутацию Pro-91-Thr-92, Gly-91-Ala-92; мутацию Val-91-Phe-92,
шарнир, содержащий шарнир CD8альфа (α),
- трансмембранный домен CD8альфа и
- цитоплазматический домен, содержащий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ.
В одном из объектов изобретения CAR 22 может экспрессироваться на клеточной поверхности совместно по меньшей мере с одним, предпочтительно двумя, более предпочтительно тремя специфическими для моноклонального антитела (МАт) эпитопами, указанные МАт-специфические эпитопы могут быть слиты с транс мембранным доменом CD8. В одном из вариантов осуществления изобретения указанный МАт-специфический эпитоп представляет собой эпитоп, распознаваемый ритуксимабом и/или QBEND-10, и пептид, совместно экспрессируемый с CD22 CAR, представляет собой RQR8.
В другом варианте осуществления изобретения по меньшей мере один, предпочтительно два, более предпочтительно три, специфических для моноклонального антитела (МАт) эпитопа, можно встраивать в линкер L scfv-фрагмента (связывающий VH с VL), специфического в отношении CD22, и/или в шарнир CD22 CAR.
Специфический для моноклонального антитела (МАт) эпитоп может представлять собой один из следующих МАт-специфических эпитопов, которые специфически распознаются моноклональным антителом, выбранным из ибритумомаба, тиуксетана, муромонаба-CD3, тозитумомаба, абсиксимаба, базиликсимаба, брентуксимаба ведотина, цетуксимаба, инфликсимаба, ритуксимаба, алемтузумаба, бевацизумаба, цертолизумаба пэгола, даклизумаба, экулизумаба, эфализумаба, гемтузумаба, натализумаба, омализумаба, паливизумаба, ранибизумаба, тоцилизумаба, трастузумаба, ведолизумаба, адалимумаба, белимумаба, канакинумаба, деносумаба, голимумаба, ипилимумаба, офатумумаба, панитумумаба, QBEND-10 и устекинумаба, предпочтительно из ритуксимаба (R) и/или из QBEND-10 (Q).
Эпитопспецифический МАт можно применять для сортинга клеток in vitro и/или для клеточного истощения in vivo иммунных клеток, экспрессирующих CD22.
В конкретных вариантах осуществления изобретения внеклеточный связывающий домен CD22 CAR, предлагаемого в изобретении, может содержать одну из следующих последовательностей:
V1-L1-V2-(L)x-эпитоп1-(L)x-;
V1-L1-V2-(L)х-эпитоп1-(L)х-эпитоп2-(L)х-;
V1-L1-V2-(L)х-эпитоп1-(L)х-эпитоп2-(L)х-эпитоп3-(L)х-;
(L)x-эпитоп1-(L)x-V1-L1-V2;
(L)х-эпитоп1-(L)х-эпитоп2-(L)х-V1-L1-V2;
эпитоп 1-(L)х-эпитоп2-(L)х-эпитоп3-(L)х-V1-L1-V2;
(L)х-эпитоп1-(L)х-V1-L1-V2-(L)х-эпитоп2-(L)х;
(L)х-эпитоп1-(L)х-V1-L1-V2-(L)х-эпитоп2-(L)х-эпитоп3-(L)х-;
(L)х-эпитоп1-(L)х-V1-L1-V2-(L)х-эпитоп2-(L)х-эпитоп3-(L)х-эпитоп4-(L)х-;
(L)х-эпитоп1-(L)х-эпитоп2-(L)х-V1-L1-V2-(L)х-эпитоп3-(L)х-;
(L)х-эпитоп1-(L)х-эпитоп2-(L)х-V1-L1-V2-(L)х-эпитоп3-(L)х-эпитоп4-(L)х-;
V1-(L)х-эпитоп1-(L)х-V2;
V1-(L)х-эпитоп1-(L)х-V2-(L)х-эпитоп2-(L)х;
V1-(L)х-эпитоп1-(L)х-V2-(L)х-эпитоп2-(L)х-эпитоп3-(L)х;
V1-(L)х-эпитоп1-(L)х-V2-(L)х-эпитоп2-(L)х-эпитоп3-(L)х-эпитоп4-(L)х;
(L)х-эпитоп1-(L)х-V1-(L)х-эпитоп2-(L)х-V2; or,
(L)х-эпитоп1-(L)х-V1-(L)х-эпитоп2-(L)х-V2-(L)х-эпитоп3-(L)х;
где
V1 обозначает VL, предпочтительно SEQ ID NO: 12, и V2 обозначает VH, предпочтительно SEQ ID NO: 13, или V1 обозначает VH и V2 обозначает VL;
L1 обозначает линкер, который можно применять для связывания VH-цепи с VL-цепью; предпочтительно имеющий SEQ ID NO: 10;
L обозначает линкер, содержащий остатки глицина и серина, и каждый из L, встречающийся во внеклеточном связывающем домене, может быть идентичным или отличаться от другого L, встречающегося в этом же внеклеточном связывающем домене, и
х обозначает 0 или 1 и каждый из встречающихся х выбирают независимо друг от друга; и
эпитоп 1, эпитоп 2 и эпитоп 3 представляют собой МАт-специфические эпитопы и могут быть идентичными или различными.
В одном из вариантов осуществления изобретения внеклеточный связывающий домен содержит следующие последовательности V1-L1-V2-L-эпитоп1; V1-L1-V2-L-эпитоп1-L; V1-L1-V2-L-эпитоп1-L-эпитоп2; V1-L1-V2-L-эпитоп1-L-эпитоп2-L; V1-L1-V2-L-эпитоп1-L-эпитоп2-L-эпитоп3; V1-L1-V2-L-эпитоп1-L-эпитоп2-L-эпитоп3-L; V1-L1-V2-эпитоп1; V1-L1-V2-эпитоп1-L; V1-L1-V2-эпитоп1-L-эпитоп2; V1-L1-V2-эпитоп1-L-эпитоп2-L; V1-L1-V2-эпитоп1-L-эпитоп2-L-эпитоп3; V1-L1-V2-эпитоп1-L-эпитоп2-L-эпитоп3-L; эпитоп1-V1-L1-V2; эпитоп1-L-V1-L1-V2; L-эпитоп1-V1-L1-V2; L-эпитоп1-L-V1-L1-V2; эпитоп1-L-эпитоп2-V1-L1-V2; эпитоп1-L-эпитоп2-L-V1-L1-V2; L-эпитоп1-L-эпитоп2-V1-L1-V2; L-эпитоп1-L-эпитоп2-L-V1-L1-V2; эпитоп 1-L-эпитоп2-L-эпитоп3-V1-L1-V2; эпитоп 1-L-эпитоп2-L-эпитоп3-L-V1-L1-V2; L-эпитоп1-L-эпитоп2-L-эпитоп3-V1-L1-V2; L-эпитоп1-L-эпитоп2-L-эпитоп3-L-V1-L1-V2; V1-L-эпитоп1-L-V2; L-эпитоп1-L-V1-L-эпитоп2-L-V2; V1-L-эпитоп1-L-V2-L-эпитоп2-L; V1-L-эпитоп1-L-V2-L-эпитоп2-L-эпитоп3; V1-L-эпитоп1-L-V2-L-эпитоп2-эпитоп3; V1-L-эпитоп1-L-V2-L-эпитоп2-L-эпитоп3-эпитоп4; L-эпитоп1-L-V1-L-эпитоп2-L-V2-L-эпитоп3-L; эпитоп 1-L-V1-L-эпитоп2-L-V2-L-эпитоп3-L; L-эпитоп1-L-V1-L-эпитоп2-L-V2-L-эпитоп3; L-эпитоп1-L-V1-L1-V2-L-эпитоп2-L; L-эпитоп1-L-V1-L1-V2-L-эпитоп2-L-эпитоп3; L-эпитоп1-L-V1-L1-V2-L-эпитоп2-эпитоп3 или эпитоп1-L-V1-L1-V2-L-эпитоп2-L-эпитоп3-эпитоп4, где
V1 обозначает VL и V2 обозначает VH или V1 обозначает VH и V2 обозначает VL; и VH, и VL представляют собой оптимизированные VH и VL из m971.
L1 обозначает любой линкер, который можно применять для связывания VH-цепи с VL-цепью;
L обозначает линкер, содержащий остатки глицина и серина, и каждый из L, встречающийся во внеклеточном связывающем домене, может быть идентичным или отличаться от другого L, встречающегося в этом же внеклеточном связывающем домене, и
эпитоп 1, эпитоп 2 и эпитоп 3 представляют собой МАт-специфические эпитопы и могут быть идентичными или различными.
L1 обозначает линкер, содержащий глицин и/или серии, предпочтительно, L1 обозначает линкер, содержащий аминокислотную последовательность (Gly-Gly-Gly-Ser)n или (Gly-Gly-Gly-Gly-Ser)n, где n обозначает 1, 2, 3, 4 или 5, или линкер содержащий аминокислотную последовательность (Gly4Ser)4 или (Gly4Ser)3.
Аналогично этому, L обозначает линкер, содержащий глицин и/или серии, предпочтительно L обозначает линкер, который имеет аминокислотную последовательность, выбранную из
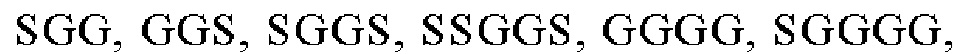

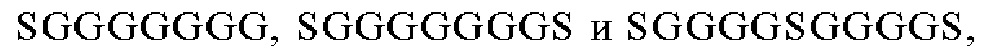

В предпочтительном варианте осуществления изобретения эпитоп 1, эпитоп 2, эпитоп 3 и эпитоп 4 независимо выбирают из МАт-специфических эпитопов, которые специфически распознаются ибритумомабом, тиуксетаном, муромонабом-CD3, тозитумомабом, абсиксимабом, базиликсимабом, брентуксимаба ведотином, цетуксимабом, инфликсимабом, ритуксимабом, алемтузумабом, бевацизумабом, цертолизумаба пэголом, даклизумабом, экулизумабом, эфализумабом, гемтузумабом, натализумабом, омализумабом, паливизумабом, ранибизумабом, тоцилизумабом, трастузумабом, ведолизумабом, адалимумабом, белимумабом, канакинумабом, деносумабом, голимумабом, ипилимумабом, офатумумабом, панитумумабом, QBEND-10 и устекинумабом, предпочтительно эпитоп 1, эпитоп 2, эпитоп 3 и эпитоп 4 распознаются ритуксимабом или QBEND-10.
Эпитоп 1, эпитоп 2, эпитоп 3 и эпитоп 4 представляют собой МАт-специфические эпитопы, которые специфически распознаются:
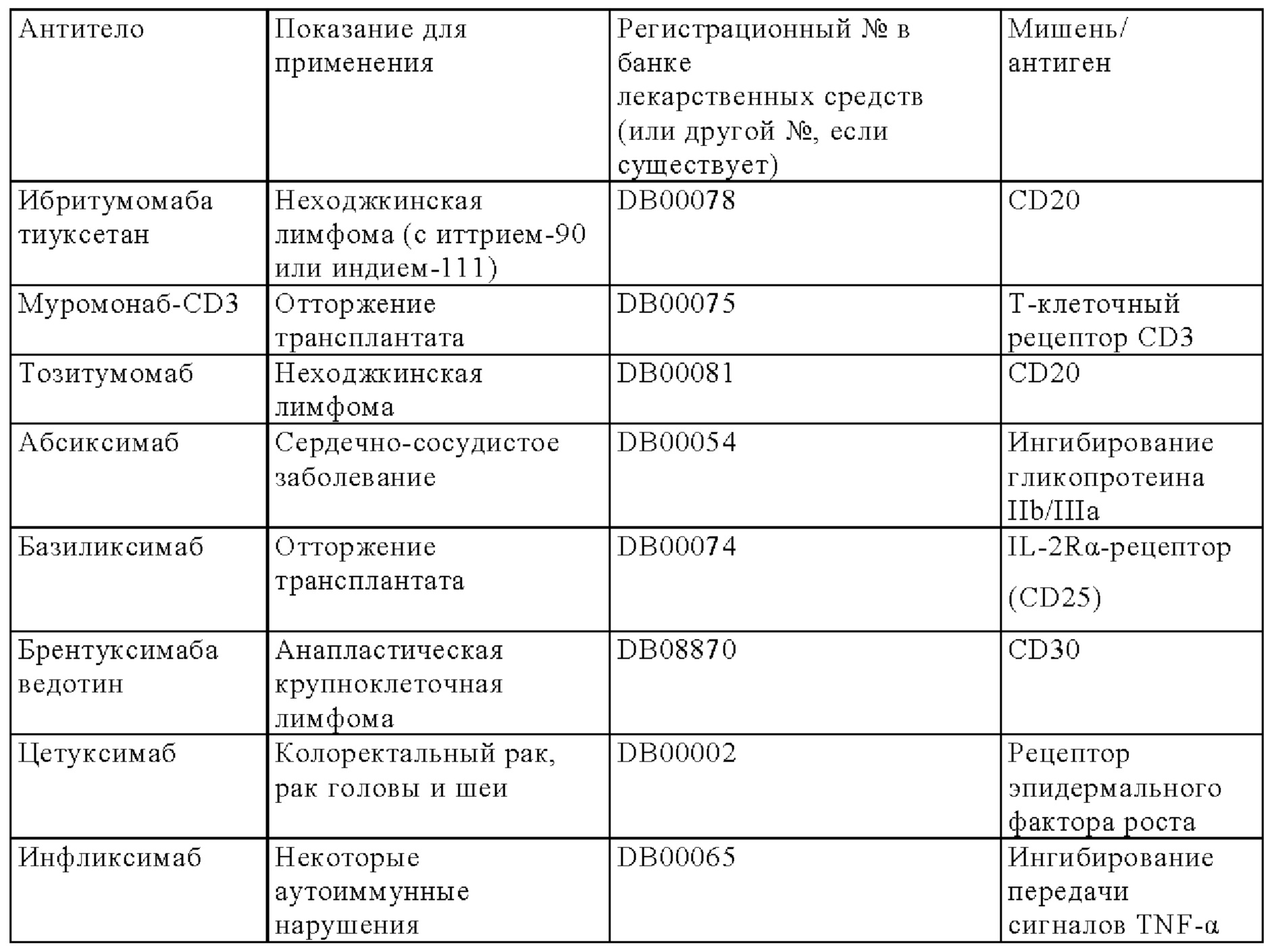
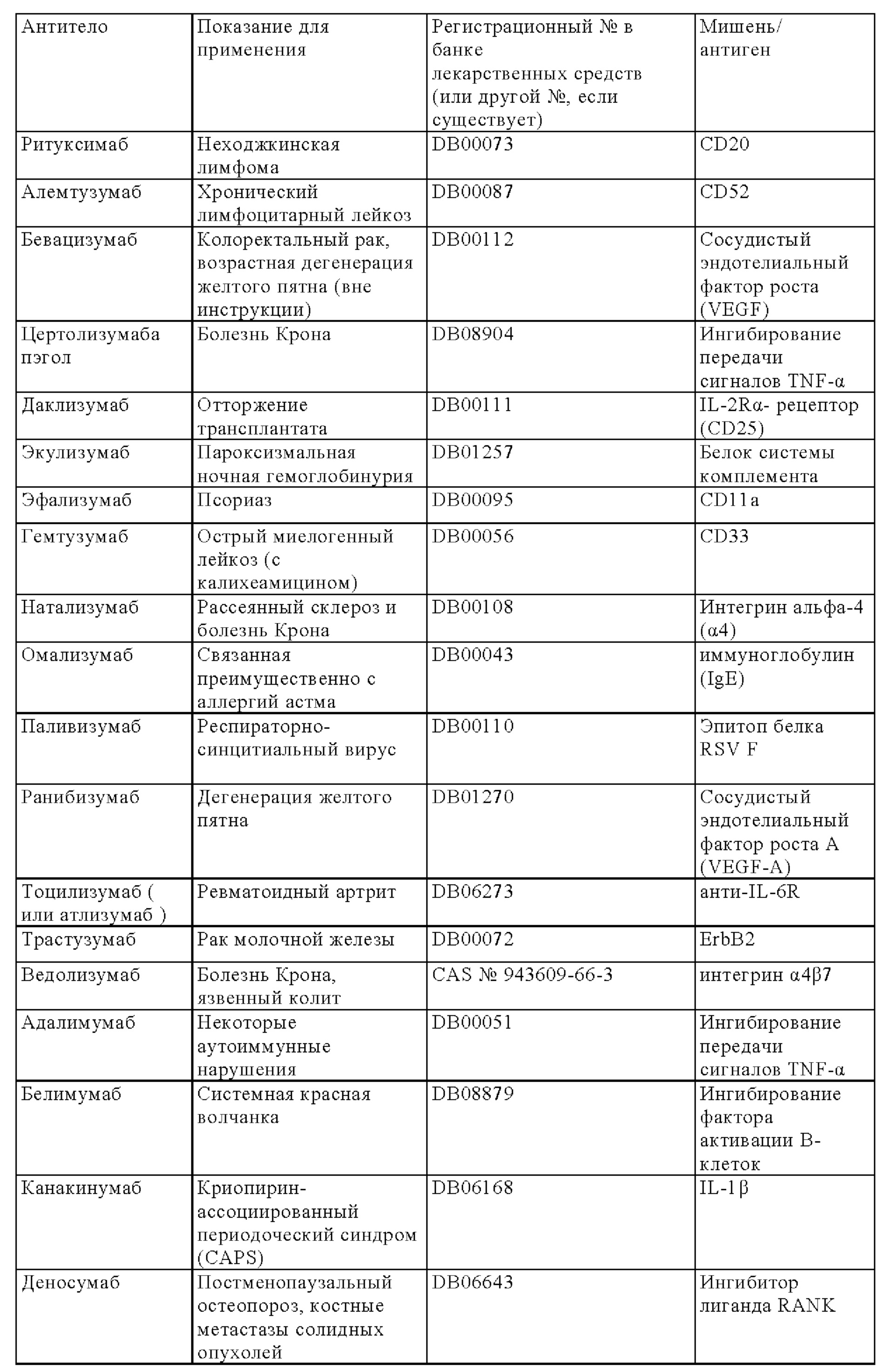

Таким образом, МАт-специфический эпитоп может содержать один из полипептидов, выбранных из:

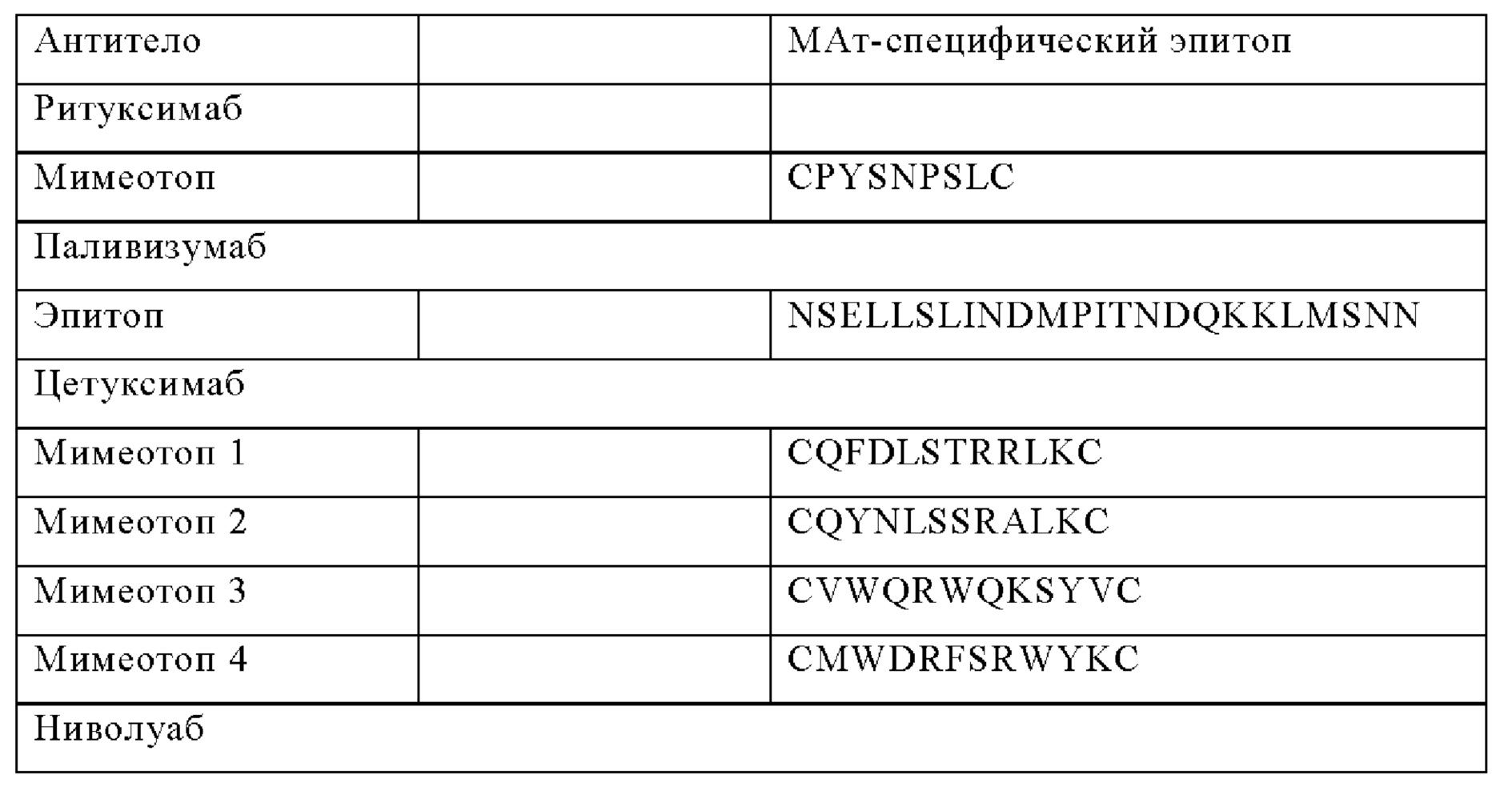
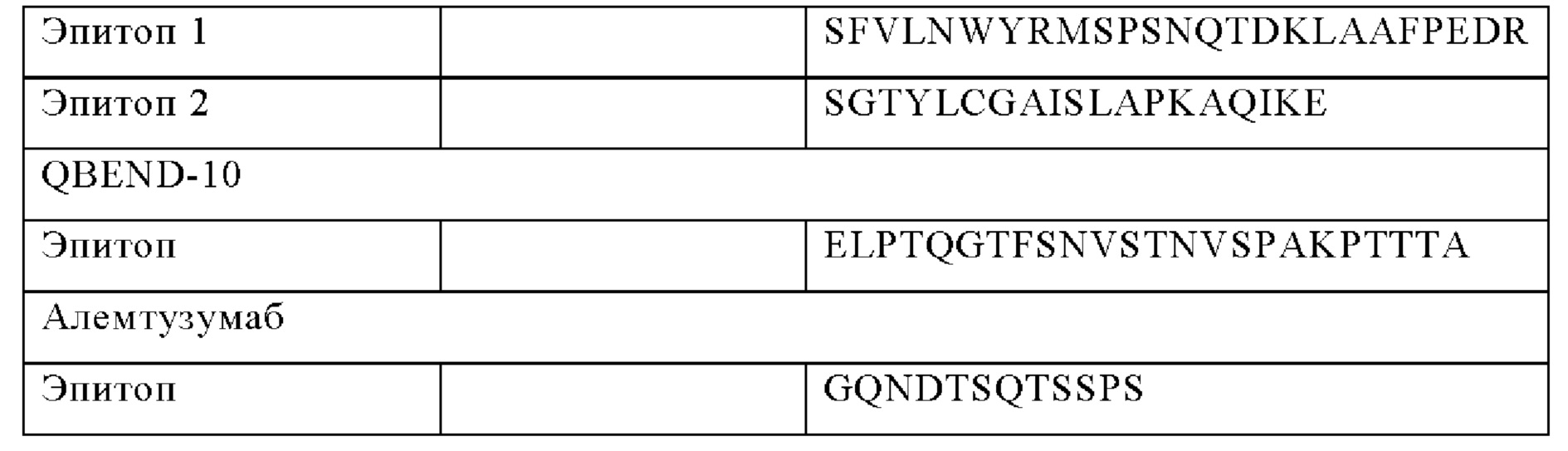
В предпочтительном варианте осуществления изобретения МАт-специфический эпитоп представляет собой МАт-специфический эпитоп, который имеет аминокислотную последовательность ELPTQGTFSNVSTNVSPAKPTTTA и/или CPYSNPSLC (SEQ ID NO: 19).
В более предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении, содержит 3 МАт-специфических эпитопа, которые имеют аминокислотную последовательность CPYSNPSLC (R), и один, который имеет аминокислотную последовательность ELPTQGTFSNVSTNVSPAKPTTTA (Q).
В еще более предпочтительном варианте осуществления изобретения CD22 CAR, предлагаемый в изобретении содержит два МАт-специфических эпитопа, имеющих аминокислотную последовательность CPYSNPSLC (R), которые локализованы в NT-части шарнира, непосредственно за VL.
В одном из объектов изобретения по меньшей мере одну последовательность, с помощью которой ритуксимаб связывается с (R), и/или последовательность, с помощью которой QBEND-10 связывается с (Q), можно встраивать в линкер GGGGSGGGGSGGGGS и/или в шарнир, что описано ранее в WO 2016/120216.
В конкретном варианте осуществления изобретения CD22 CAR, предлагаемый в настоящем изобретении, представляет собой одноцепочечный CAR (scCAR).
В конкретных вариантах осуществления изобретения одноцепочечный анти-CD22 CAR, предлагаемый в изобретении, содержит scfv из m971 и по меньшей мере один другой связывающий домен, предпочтительно специфический в отношении дистальной области CD22, альтернативно этому, специфический в отношении другого В-клеточного антигена, прежде всего, если он экспрессируется злокачественными В-клетками, такого как CD34, CD10, CD79a, CD20, IgD, CD5, CD23, CD19, STAT5, CD3, CD30, ВСМА. В конкретном варианте осуществления изобретения CD22 CAR, предлагаемый в настоящем изобретении, представляет собой многоцепочечный CAR (mcCAR). Многоцепочечные CD22 CAR являются частью настоящего изобретения и их можно получать согласно методу, подробно описанному в WO 2014/039523, которая включена в настоящее описание в качестве ссылки. В конкретном варианте осуществления изобретения VH-домен и VL-домен иммуноглобулина или область иммуноглобулина, специфическая в отношении CD22, могут находиться на двух различных и отделенных (не связанным ковалентно) цепях многоцепочечного CAR.
В многоцепочечной версии CD22 CAR, предлагаемый в изобретении, содержит два, предпочтительно три трансмембранных домена (которые не связанные ковалентно друг с другом), при этом по меньшей мере один трансмембранный домен содержит предлагаемый в изобретении scfv, специфический в отношении CD22.
В конкретном варианте осуществления изобретения VH-домен и VL-домен иммуноглобулина, специфического в отношении CD22, предпочтительно из m971, могут присутствовать на одной цепи многоцепочечного CAR.
Пример scCD22 CAR и mcCD22 CAR, предлагаемых в изобретении, представлен на фиг. 2.
В конкретном варианте осуществления изобретения VH-домен и VL-домен иммуноглобулина, специфического в отношении CD22, предпочтительно из m971, могут находиться на одной цепи многоцепочечного CAR, а VH-домен и VL-домен другого иммуноглобулина, специфического в отношении CD22, могут находиться на другой цепи mcCAR.
Понижающая регуляции или мутация антигенов-мишеней часто встречается в раковых клетках, что приводит к созданию вариантов без антигенов, которые обладают способностью ускользать от иммунологического надзора. Таким образом, для нейтрализации ускользания опухолей от иммунологического надзора и для придания иммунной клетке более высокой специфичности в отношении мишени СВ22-специфический CAR, предлагаемый в изобретении, может содержать другой внеклеточный лигандсвязывающий домен для одновременного связывания с другими элементами в мишени, повышая тем самым активацию и функцию иммунных клеток. В одном из вариантов осуществления изобретения внеклеточные лигандсвязывающие домены можно помещать в виде тандема на один и тот же трансмембранный полипептид и необязательно можно разделять линкером.
В другом варианте осуществления изобретения указанные различные внеклеточные лигандсвязывающие домены можно помещать на различные трансмембранные полипептиды, образующие многоцепочечный CAR. Другим вариантом осуществления настоящего изобретения является популяция CAR, которые содержат различные внеклеточные лигандсвязывающие домены, один из которых является специфическим в отношении CD22.
В одном из вариантов осуществления изобретения внеклеточный связывающий домен, специфический в отношении CD22, и второй внеклеточный связывающий домен содержатся в одном и том же sCAR.
В другом варианте осуществления изобретения внеклеточный связывающий домен, специфический в отношении CD22, и второй внеклеточный связывающий домен содержатся в одном и том же mcCAR и принадлежат к одному и тому же или к двум различным и не связанным ковалентно трансмембранным доменам указанного mcCAR.
В качестве второго внеклеточного связывающего домена можно использовать любой внеклеточный связывающий домен, который специфически связывается с антигеном, ассоциированным (совместно экспрессируемым - даже временно) с CD22 на патологических клетках, таким как CD34, CD10, CD79a, CD20, IgD, CD5, CD23, CD19, STAT5, CD3, CD30, ВСМА, РАХ5, CD19, CD20, CD30, гликосфинголипиды, молекула главного комплекса гистосовместимости (ГКГС), Ig, CD3, CD34, CD79, предпочтительно CD79a, CD 138, В7-1 (CD80), В7-2 (CD86), молекула главного комплекса гистосовместимости (ГКГС), ВСМА (CD269, TNFRSF 17) или FLT-3, Рах5.
Изобретение относится также к имеющим отношение к CD22 CAR нуклеиновым кислотам, рекомбинантным экспрессионным векторам для CD22 CAR, сконструированным клеткам TCR-KO, предпочтительно Т-клеткам, которые содержат по меньшей мере другой отредактированный ген, которые наделены CD22 CAR, популяциям указанных клеток TCR-KO, наделенных CD22 CAR, и фармацевтическим композициям, содержащим CD22 CAR, белок, экспрессионный вектор, сконструированные клетки TCR-KO, CD52-KO, экспрессирующим указанный CD22 CAR, предлагаемый в изобретении.
Объектами изобретения являются: имеющие отношение к CD22 CAR нуклеиновые кислоты, рекомбинантные экспрессионные векторы, сконструированные клетки TCR-KO, содержащие по меньшей мере другой отредактированный ген, выбранный из гена, обусловливающего устойчивость к гипоксии, гена, обусловливающего устойчивость к алемтузумабу, к ингибитору протеаз, такому как бортезомиб, гена, обусловливающего устойчивость к PNA (dCK), и наделенные CD22 CAR, и соответствующая нуклеиновая кислота, популяции сконструированных клеток TCR-KO, которые содержат по меньшей мере другой отредактированный ген, указанный ниже, которые наделены указанным CD22 CAR, и фармацевтические композиции, содержащие указанные объекты изобретения, в качестве лекарственного средства.
Полинуклеотиды. векторы:
Настоящее изобретение относится к полинуклеотидам, векторам, которые кодируют описанный выше CD22 CAR, предлагаемый в изобретении.
Полинуклеотид может содержаться в кассете экспрессии или экспрессионном векторе (например, в плазмиде, предназначенной для интродукции в бактериальную клетку-хозяина, или вирусном векторе, таком как бакуловирусный вектор, предназначенный для трансфекции клетки насекомого-хозяина, или плазмидном или вирусном векторе, таком как лентивирус или аденоассоциированный вирус, предназначенном для интродукции в клетку-хозяина млекопитающего, предпочтительно человеческую клетку.
В конкретном варианте осуществления изобретения можно включать различные нуклеотидные последовательности в один полинуклеотид или вектор, который содержит нуклеотидную последовательность, кодирующую рибосомальную skip-последовательность, такую как последовательность, кодирующую пептид 2А. Пептиды 2А, которые были идентифицированы в подгруппе афтовирусов группы пикорнавирусов, приводят к рибосомальному «перескоку» (skip) от одного кодона к следующему без образования пептидной связи между двумя аминокислотами, кодируемыми кодонами (см. Donnelly и Elliott 2001; Atkins, Wills и др. 2007; Doronina, Wu и др. 2008).
Таким образом, в настоящем изобретении предложен вектор, представленный на фиг. 4, который кодирует RQR8 и анти-CD22CAR, сцепленные с пептидом 2А.
Под «кодоном» понимают три нуклеотида на мРНК (или на смысловой цепи молекулы ДНК), которые транслируются рибосомой в один аминокислотный остаток. Таким образом, можно синтезировать два полипептида из одной непрерывной открытой рамки считывания в мРНК, если полипептиды разделены последовательностью олигопептида 2А, присутствующей в рамке считывания. Такие рибосомальные skip-механизмы хорошо известны в данной области и известно их применение в нескольких векторах для экспрессии нескольких белков, кодируемых одной матричной РНК.
Вектор, обеспечивающий экспрессию CD22 CAR, предлагаемого в изобретении, в клетке является другим объектом настоящего изобретения. В предпочтительном варианте осуществления изобретения указанный вектор обеспечивает кратковременную экспрессию CD22 CAR, предлагаемого в изобретении. В более предпочтительном варианте осуществления изобретения указанный вектор обеспечивает конститутивную и стабильную экспрессию CD22 CAR, предлагаемого в изобретении, путем инсерции последовательности, которая кодирует указанный CD22 CAR, в геном клетки.
Экспрессию CD22 CAR, предлагаемого в изобретении, и/или выживание клетки, экспрессирующей CD22 CAR, предлагаемый в изобретении, можно контролировать с использованием гена, находящегося под контролем индуцибельного промотора, что описано у R. Kuhn, F. Schwenk, М. Aguet, K. Rajewsky. Inducible gene targeting in mice. Science, т. 269, №5229, 8 сентября 1995 г., cc. 1427-1429 DOI: 10.1126/science.7660125, и в процитированных в указанной публикации ссылках.
В одном из вариантов осуществления изобретения предложен CD22 CAR, в котором внеклеточный домен содержит по меньшей мере два CD20-мимеотопа, имеющих SEQ ID NO: 19 (CPYSNPSLC), локализованных между доменами m971 scfv и шарниром из человеческого CD8альфа. В патентном документе WO 2016/120216А1 описан метод получения указанных конструкций, и он включен в настоящее описание в качестве ссылки.
В одном из вариантов осуществления настоящего изобретения предложен вектор, содержащий последовательность, которая кодирует CD22 CAR, выбранную из SEQ ID NO: 22.
Для направления трансмембранного полипептида в секреторный путь клетки-хозяина, в последовательность полинуклеотида или в последовательность вектора помещают секреторную сигнальную последовательность (известную также как лидерная последовательность, пре-про-последовательность или пре-последовательность). Секреторную сигнальную последовательность функционально связывают с трансмембранной нуклеотидной последовательностью, т.е. две последовательности соединяют в правильной рамке считывания и размещают так, чтобы направлять вновь синтезированный полипептид в секреторный путь клетки-хозяина. Секреторные сигнальные последовательности, как правило, размещают в 5'-направлении относительно нуклеотидной последовательности, кодирующей представляющий интерес полипептид, хотя некоторые секреторные сигнальные последовательности можно размещать и в другом месте представляющей интерес нуклеотидной последовательности (см., например, Welch и др., US №5037743; Holland и др., US №5143830). В предпочтительном варианте осуществления изобретения сигнальный пептид содержит аминокислотные последовательности SEQ ID NO: 1 и 2.
В более предпочтительном варианте осуществления изобретения сигнальный пептид CAR, предлагаемого в изобретении, содержит аминокислотную последовательность SEQ ID NO: 1 из человеческого С08альфа.
Специалистам в данной области должно быть очевидно, что с учетом вырожденности генетического кода могут иметь место значительные вариации последовательности указанных полинуклеотидных молекул. Предпочтительно нуклеотидные последовательности, предлагаемые в настоящем изобретении, имеют оптимизированные кодоны для экспрессии в клетках млекопитающих, предпочтительно для экспрессии в человеческих клетках. Оптимизация кодонов относится к замене в представляющей интерес последовательности кодонов, встречающихся относительно редко в генах с высоким уровнем экспрессии в указанных видах, на кодоны, которые, как правило, часто встречаются в генах с высоким уровнем экспрессии в указанных видах, такие кодоны кодируют те же аминокислоты, что и подлежащие замене кодоны.
Способы конструирования иммунных клеток, наделенных CD22 CAR:
В настоящем изобретении предложен способ получения иммунных клеток для иммунотерапии, включающий интродукцию ex vivo в указанные иммунные клетки полинуклеотида или вектора, кодирующего один из ранее описанных CD22 CAR, предлагаемых в изобретении, предпочтительно SEQ ID NO: 15.
В предпочтительном варианте осуществления изобретения указанные полинуклеотиды включают в вектор, с учетом того, что он стабильно экспрессируется в иммунных клетках.
В других вариантах осуществления изобретения указанный способ дополнительно включает стадию, на которой генетически модифицируют указанную клетку, делая ее пригодной для адоптивного переноса и/или для применения в сочетании с лекарственным средством, влияющим на выживаемость указанной иммунной клетки, прежде всего для трансплантации (также обозначаемой как аллотрансплантация или гомотрансплантация), индивидуально или в комбинации с лекарственным средством, к которому иммунная клетка приобретает устойчивость.
В последнем случае сконструированные клетки можно сначала выделять из донора и применять для повторной инъекции в этого же донора в комбинации с лекарственным средством, к которому она приобретает устойчивость.
Для редактирования гена, что в контексте настоящего описания означает модификацию гена или инактивацию гена, например, мутацию гена, делецию гена, инсерцию последовательности в ген, модификацию метилирования указанного гена (включая промотор гена) и т.д., применяют методы, описанные в документе РА201670503, включенном в настоящее описание в качестве ссылки, и проиллюстрированные ниже в примерах.
Методы, описанные в публикации MacLeod и др., Integration of a CD19 CAR into the TCR Alpha Chain Locus Streamlines Production of Allogeneic Gene-Edited CAR T Cells, Molecular Therapy, 2017, http://dx.doi.Org/10.1016/j.ymthe.2017.02.005, которая включена в настоящее описание в качестве ссылки, могут также представлять собой возможные альтернативы метода, применяемого в настоящем изобретении, для получения TCR-KO CD22 CAR или клеток, наделенных CD22 CAR, устойчивых к гипоксии в результате сверхэкспрессии HIF-1a.
Способ, предлагаемый в настоящем изобретении, базируется на клеточных механизмах направляемой гомологией репарации (HDR) для «включения» («нокин») CD22 CAR в ген TRAC (кодирующий альфа-субъединицу TCR), что позволяет получать более эффективный продукт.
Механизм HDR с экзогенной последовательностью ДНК описан ранее для Т-клеток с использованием коротких олигонуклеотидов, спаренных с CRISPR/Cas9. В других исследования продемонстрировано, что векторы на основе аденоассоциированного вируса (AAV) можно применять в качестве матрицы в сочетании с сайтспецифической нуклеазой Crispr/Cas9 или MegaTAL, для достижения генной инсерции посредством HDR. В настоящем изобретении предложен новый способ объединения векторов на основе аденоассоциированного вируса (AAV) и TALEN для инсерции CAR в ген TCR.
При создании UCART 22 ААУ6-вектор можно применять после генетического редактирования с использованием TALEN, специфической для гена, такого как ген TRAC (ген, кодирующий альфа-субъединицу, или TCR), или любого гена, описанного в РСТ/ЕР2017/076798.
Поскольку TALEN является специфической в отношении последовательности ДНК и обеспечивает интеграцию последовательности в ген, предпочтительно в ген TRAC, то в настоящем изобретении предложены также сконструированные иммунные клетки, которые содержат последовательность, кодирующую CAR, предпочтительно описанный выше CD22 CAR, локализованную строго в области гена TRAC, определяемой применяемой TALEN. Последовательность в гене TRAC указанной сконструированной иммунной клетки является уникальной в результате специфичности TALEN.
Согласно настоящему изобретению предложена сконструированная иммунная клетка, содержащая следующую последовательность:
(YYY)n-ZZZ-(XXX)m,
которой n имеет значение от 1 до по меньшей мере 10
и m имеет значение от 1 до 100, предпочтительно m>100, и обозначает количество пар оснований последовательности, подлежащей интеграции,
где ZZZ кодирует саморасщепляющийся пептид, такой как 2А-пептид, в рамке считывания с кодирующей TRAC последовательностью,
Y обозначает А или Т, или G, или С и фланкирует или содержит последовательность гена TRAC, таргетируемую TALEN, которая содержит по меньшей мере ttgtcccacagATATC, предпочтительно ttgtcccacagATATCCAG, а (ХХХ)n обозначает А или Т, или G, или С и часть экзогенной последовательности, подлежащей инсерции в ген TRAC, предпочтительно последовательности, которая кодирует CAR, более предпочтительно последовательности, которая кодирует CD22 CAR.
В одном из вариантов осуществления изобретения ген TRAC удален в результате делеции, и встроенный ген экспрессируется под контролем промотора TRAC.
Дополнительные или альтернативные последовательности, такие как IRES (участок внутренней посадки рибосомы); можно «вклинивать» между мишенью TALEN и XXX.
В настоящем изобретении мишенью TALEN является SEQ ID NO: 21 и CAR CD22 имеет SEQ ID NO: 22.
В одном из вариантов осуществления изобретения последовательность, расщепляемая указанной TALEN, представляет собой AGAACCCTGACCCTG.
Последовательность AGAACCCTGACCCTG может быть консервативной по меньшей мере частично (см. фиг. 9) в сконструированной клетке, предлагаемой в изобретении, в зависимости от последовательности-вставки.
В настоящем изобретении предложена сконструированная иммунная клетка, содержащая ген TRAC, содержащий SEQ ID NO: 22.
В настоящем изобретении предложена сконструированная иммунная клетка, которая содержит последовательность, кодирующую CAR, специфический в отношении CD19, или последовательность, кодирующую CAR, специфический в отношении CD22, встроенную в ген TRAC, предпочтительно в любом месте в локусе: AGAACCCTGACCCTG.
Таким образом, согласно конкретным вариантам осуществления изобретения сконструированная иммунная клетка, предлагаемая в изобретении, содержит две различные последовательности, кодирующие CAR, и экспрессирует два указанных различных CAR. На клеточной поверхности уровень TCR не поддается обнаружению.
Таким образом, согласно конкретным вариантам осуществления изобретения сконструированная иммунная клетка, предлагаемая в изобретении, содержит две различные последовательности, кодирующие CAR, и экспрессирует два указанных различных CAR. На клеточной поверхности уровни TCR и молекулы ГКГС класса I не поддаются обнаружению.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD19.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD34.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD79a.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD79b.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD10.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении IgD.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD5.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD23.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD30.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении ВСМА.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении FLT3.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD138.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD80.
Сконструированная иммунная клетка, предлагаемая в изобретении, содержит в геноме гена TRAC последовательность, кодирующую CD22, предпочтительно SEQ ID NO: 22, и другую геномную последовательность, в которую встроен другой экзогенный ген, кодирующий CAR, специфический в отношении CD86.
Другая геномная последовательность, в которую встроен другой экзогенный ген, кодирующий второй CAR, может представлять собой любой из генов, описанных в РСТ/ЕР2017/076798 или в WO 2017/069958А2.
Другой экзогенный ген, кодирующий CAR, может быть встроен в ген TRAC в рамке считывания с саморасщепляющимся пептидом и с последовательностью CD22 CAR, предпочтительно SEQ ID NO:, или в другой ген, кодирующий белок, такой как представленный в РСТ/ЕР2017/076798 или выбранный из PD1 (Uniprot Q15116), CTLA4 (Uniprot Р16410), РРР2СА (Uniprot Р67775), РРР2СВ (Uniprot P62714), PTPN6 (Uniprot P29350), PTPN22 (Uniprot Q9Y2R2), LAG3 (Uniprot P18627), HAVCR2 (Uniprot Q8TDQ0), BTLA (Uniprot Q7Z6A9), CD160 (Uniprot 095971), TIGIT (Uniprot Q495A1), CD96 (Uniprot P40200), CRTAM (Uniprot 095727), LAIR1 (Uniprot Q6GTX8), SIGLEC7 (Uniprot Q9Y286), SIGLEC9 (Uniprot Q9Y336), CD244 (Uniprot Q9BZW8), TNFRSF10B (Uniprot 014763), TNFRSF10A (Uniprot 000220), CASP8 (Uniprot Q14790), CASP10 (Uniprot Q92851), CASP3 (Uniprot P42574), CASP6 (Uniprot P55212), CASP7 (Uniprot P55210), FADD (Uniprot Q13158), FAS (Uniprot P25445), TGFBRII (Uniprot P37173), TGFRBRI (Uniprot Q15582), SMAD2 (Uniprot Q15796), SMAD3 (Uniprot P84022), SMAD4 (Uniprot Q13485), SMAD10 (Uniprot B7ZSB5), SKI (Uniprot P12755), SKIL (Uniprot P12757), TGIF1 (Uniprot Q15583), IL10RA (Uniprot Q13651), IL10RB (Uniprot Q08334), HMOX2 (Uniprot P30519), IL6R (Uniprot P08887), IL6ST (Uniprot P40189), EIF2AK4 (Uniprot Q9P2K8), CSK (Uniprot Р41240), PAG1 (Uniprot Q9NWQ8), SIT1 (Uniprot Q9Y3P8), FOXP3 (Uniprot Q9BZS1), PRDM1 (Uniprot Q60636), BATF (Uniprot Q16520), GUCY1A2 (Uniprot P33402), GUCY1 A3 (Uniprot Q02108), GUCY1B2 (Uniprot Q8BXH3) и GUCY1B3 (Uniprot Q02153).
Предпочтительно отредактированные (KO) гены в UCART 22 представляют собой TNFRSF10B (Uniprot 014763), TNFRSF10A (Uniprot 000220), IL10RA (Uniprot Q13651), IL10RB (Uniprot Q08334, TGFBRII (Uniprot P37173), TGFRBRI (Uniprot Q15582), PD1 (Uniprot Q15116), CTLA4 (Uniprot PI6410), LAG3 (Uniprot P18627), HAVCR2 (Uniprot Q8TDQ0), TIGIT (Uniprot Q495A1).
Предпочтительно ген, в который встроен второй CAR, представляет собой геномный ген, активный во время Т-клеточной активации, выбранный из одного из указанных в таблице А:
или из указанных в «безопасной гавани локусов», которые описаны в РСТ/ЕР2017/076798 или в таблице АА.

Другой ген, в который можно встраивать второй CAR, может представлять собой ген, кодирующий один из белков, представленных в таблице Б, выбранный из следующих генов…





UCART 22 можно получать с использованием AAV-вектора, предпочтительно AAV6-вектора и еще более предпочтительно AAV6/2-вектора для инсерции CD22 CAR или другого гена, указанного в настоящем описании. AAV-вектор(ы) можно применять после генетического редактирования гена, такого как ген TRAC (ген, кодирующий альфа-субъединицу, или TCR), или любого гена, описанного в РСТ/ЕР 2017/076798, с применением специфической эндонуклеазы.
Адоптивный клеточный перенос представляет собой перенос клеток в организм пациента. Клетки могут иметь происхождение из организма самого пациента и затем изменены перед переносом обратно (сингенный перенос) или их можно получать из другого индивидуума. Клетки наиболее часто получают из иммунной системы для переноса улучшенной иммунной функциональности и характеристик при возвращении клеток обратно в организм пациента. Перенос аутологичных клеток или клеток из пациента минимизирует реакцию трансплантат-против-хозяина (GVHD) или отторжение ткани или органа. Аналогично этому, перенос Т-клеток с TCR-дефицитом, экспрессирующих CD22 CAR, минимизирует GVHD. Перенос Т-клеток с дефицитом TCR, с дефицитом ГКГС, экспрессирующих CD22 CAR, минимизирует GVHD и HVGD.
В одном из вариантов осуществления изобретения стадию генетической модификации (конструирования, инженеринга) указанной иммунной клетки осуществляют перед стадией интродукции полинуклеотидов или векторов, кодирующих один из CD22 CAR, предлагаемых в изобретении, в указанные клетки. Согласно первому объекту изобретения иммунную клетку можно делать менее аллогенной, например, путем инактивации по меньшей мере одного гена, экспрессирующего один или несколько компонентов Т-клеточного рецептора (TCR), указанного в WO 2013/176915, что можно объединять с инактивацией гена, который кодирует или регулирует экспрессию HLA, такого как гена β2m, что описано в WO 2008/102199 или в WO 2015/136001, или в WO 2016/201047, которые все включены в настоящее описание в качестве ссылки. Таким образом, риск синдрома «трансплантат-против-хозяина» и риск отторжения трансплантата значительно снижаются.
Таким образом, согласно другому объекту изобретения иммунные клетки, предлагаемые в изобретении, можно дополнительно генетически конструировать для повышения устойчивости сконструированных иммунных клеток к иммуносупрессивному лекарственному средству или химиотерапевтическому лечению, которые применяют в качестве стандартной помощи при лечении CD22-позитивных злокачественных клеток согласно подходу, описанному в WO 2015/75195, которая включена в настоящее описание в качестве ссылки.
Устойчивость к препарату кэмпас (алемтузумаб)
Согласно одному из предпочтительных вариантов осуществления изобретения гены, которые можно инактивировать для придания устойчивости Т-клеткам к лекарственным средствам, представляют собой гены глюкокортикоидного рецептора (GR) и CD52. Гены инактивируют для придания клеткам устойчивости к указанным обработкам и придания им конкурентного преимущества по сравнению с собственными Т-клетками пациента, которые не наделены специфическими CD22 CAR.
Инактивацию генов CD52 и TRAC в сконструированной иммунной клетке, предлагаемой в изобретении, осуществляют с использованием TALE-нуклеазы или системы CRISPR CAS9.
Согласно одному из более предпочтительных вариантов осуществления изобретения ген, который можно инактивировать для придания устойчивости Т-клеткам к лекарственным средствам, представляет собой CD52 в TCR-KO в иммунных Т-клетках, которые наделены CD22 CAR.
Согласно одному из предпочтительных вариантов осуществления изобретения ген, который можно инактивировать для придания устойчивости Т-клеткам к лекарственным средствам, представляет собой ген глюкокортикоидного рецептора (GR).
Экспрессию гена CD3 можно также подавлять или понижать для придания устойчивости к теплизумабу, который представляет собой другое иммунносупрессивное лекарственное средство. Экспрессию HPRT можно также подавлять или понижать, согласно изобретению для придания устойчивости к 6-тиогуанину, цитостатическому агенту, широко применяемому в химиотерапии, прежде всего для лечения острого лимфобластного лейкоза.
Устойчивость к аналогам пуриновых нуклеотидов путем делеции гена человеческой дезоксицитидинкиназы (dCK)
Согласно одному из предпочтительных вариантов осуществления изобретения ген, который можно инактивировать для придания Т-клеткам устойчивости к лекарственным средствам, представляет собой ген дезоксицитидинкиназы (dCK). Этот фермент требуется для фосфорилирования дезоксирибонуклеозидов дезоксицитидина (dC), дезоксигуанозина (dG) и дезоксиаденозина (dA). Пуриновые нуклеотидные аналоги (PNA) метаболизируются dCK с образованием моно-, ди- и трифосфата PNA. Указанные трифосфатные формы, и прежде всего клофарабина трифосфат, конкурируют с АТФ при синтезе ДНК, действуют в качестве проапоптозного агента и являются потеницильными ингибиторами рибонуклеотидредуктазы (RNR), которая участвует в производстве тринуклеотидов.
Инактивация гена dCK в сконструированной иммунной клетке, предлагаемой в изобретении, опосредуется TALE-нуклеазой или системой CRISPR CAS9. Для достижения указанной цели разработано несколько пар TALE-нуклеаз для dCK, собраны на полинуклеотидном уровне и их правильность подтверждена секвенированием. Примеры пар TALE-нуклеаз, которые можно применять согласно изобретению, описаны в РСТ/ЕР 2014/075317.
Указанная инактивация dCK в сконструированных иммунных клетках, предлагаемых в изобретении, обусловливает устойчивость к аналогам пуриновых нуклеозидов (PNA), таким как клофарабин и флударабин.
В другом предпочтительном варианте осуществления изобретения инактивацию dCK в сконструированных иммунных клетках, предлагаемых в изобретении, объединяют с инактивацией генов TRAC, получая указанные клетки с двойным «выключением» (KO) (TCR- или TRAC-KO и dCK-KO), которые обладают устойчивостью к лекарственному средству, такому как клофарабин, и являются менее аллогенными.
В другом предпочтительном варианте осуществления изобретения инактивацию CD52 в сконструированных иммунных клетках, предлагаемых в изобретении, объединяют с инактивацией гена TRAC, получая указанные клетки с двойным «выключением» (KO) (TCR- или TRAC-KO и CD52-KO), которые обладают устойчивостью к лекарственному средству, такому как кэмпас (алемтузумаб), и являются менее аллогенными.
Указанные двойные свойства являются наиболее ценными для терапевтичесих целей, позволяя применять «имеющиеся в готовом виде» алллогенные клетки (UCART 22) для иммунотерапии в сочетании с химиотерапией для лечения страдающих раком пациентов, которые нуждаются в этом. Указанную двойную KO-инактивацию dCK/TRAC или CD52/TRAC можно осуществлять одновременно или последовательно. Один из примеров пары TALE-нуклеаза dCK/TRAC, которая обеспечивает успех согласно изобретению, описан в РСТ/ЕР 2014/075317, при этом, в частности, последовательности-мишени находятся в 2 локусах (dCK и TRAC). Документ РСТ/ЕР 2014/075317 полностью включен в настоящее описание в качестве ссылки.
В настоящем изобретении предложены первичные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены CD52 и TRAC инактивированы путем делеции для их применения для лечения CLL, ALL, предпочтительно их агрессивных рецидивирующих рефрактерных форм, необязательно у пациентов с лимфоидным истощением, более предпочтительно рецидивирующих рефрактерных форм B-ALL.
Согласно другому объекту изобретения иммунные клетки можно подвергать дополнительным манипуляциям для придания им большей активности или для ограничения их истощения путем инактивации генов, которые кодируют белки, действующие в качестве «иммунных контрольных точек», которые являются регуляторами активации Т-клеток, такие как PDCD1 или CTLA-4. Примеры генов, экспрессию которых можно понижать или подавлять, представлены в таблице 9.
В настоящем изобретении предложены также первичные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены CD52, TRAC и dCK удалены в результате делеции.
Другим вариантом осуществления настоящего изобретения являются также первичные Т-клетки, которые экспрессируют CD22 CAR, которым придана устойчивость к гипоксии.
В настоящем изобретении предложены также первичные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены CD52, TRAC и dCK удалены в результате делеции и последовательности HIF-1a встроены для придания клеткам устойчивости к гипоксии.
Сконструированные клетки, устойчивые к гипоксии
В конкретных вариантах осуществления изобретения экспрессию и цитолитическую активность CD22 CAR Т-клетки, предлагаемой в изобретении, сохраняют или экспрессию CD22 CAR Т-клетки индуцируют и активность сохраняют в условиях низкого содержания кислорода (гипоксия), (нормальный уровень кислорода 20% О2 в сравнении с уровнем 1-5% О2), и указанная клетка все еще таргетирует и разрушает опухолевые клетки при попадании в ткани.
Примеры индуцируемого гипоксией CAR в Т-клетках описаны (в WO 2013/123061 или у Juillerat А. и др. An oxygen sensitive self-decision making engineered CAR T-cell, Sci. Rep. 7, 39833; doi: 10.1038/srep39833, 2017, оба документа включены в настоящее описание в качестве ссылки): был создан синтетический промотор, специфический в отношении OxiTF, контролирующий экспрессию CD22 CAR. OxiTF создавали для активации синтетического генетического элемента, кодирующего CD22 CAR. После контакта с опухолью (создание гипоксии) сконструированные Т-клетки могут «обнаруживать» снижение уровня кислорода (по сравнению со средним уровнем О2 в крови) и запускать экспрессию CD22 CAR. Экспонируемый на клеточной поверхности CD22 CAR может распознавать опухолевый антиген в условиях гипоксии, что в конце концов запускает активацию и пролиферацию Т-клеток посредством доменов активации и костимуляторных доменов, присутствующих в указанном CD22 CAR. В результате экспрессирующие опухолевый антиген клетки лизируются UCART 22, предлагаемой в изобретении.
Согласно настоящему изобретению иммунные клетки можно конструировать также для сохранения эффективности в условиях низких уровней О2 (низкая концентрация кислорода составляет 1-5%) путем сверхэкспрессии по меньшей мере одного, предпочтительно всех из перечисленных ниже факторов: Oct3, Oct4, Sox2, Klf4 и с-Мус, или путем редактирования фактора HIF-1a.
При создании настоящего изобретения была создана сконструированная клетка, экспрессирующая чувствительный к кислороду одноцепочечный CD22 CAR, и сконструированная клетка, экспрессирующая устойчивый к гипоксии CD22 CAR, и они успешно прошли испытания.
Поскольку CD22 экспрессируется главным образом при экспрессирующих CD22 В-клеточных злокачественных заболеваниях, которые представляют собой «жидкие опухоли», и поэтому, как предполагается, не создает гипоксию в отличие от солидных опухолей, то не ожидается, что экспрессирующие CD22 CAR сконструированные иммунные клетки, устойчивые к гипоксии, будут более эффективными, чем экспрессирующие CD22 CAR сконструированные иммунные клетки, которые не являются устойчивыми к гипоксии, в отношении В-ALL из организма пациента. Фактически UCART 22, предлагаемые в изобретении, достигая гнездовых раковых клеток, образующих кластеры, или попадая в результате «самонавадения» в ткани, могут лизировать эти клетки.
Другие гены, которые можно редактировать в UCART 22, предлагаемой в настоящем изобретении, представляет собой представленные ниже в таблице 5:


В настоящем изобретении предложены выделенные сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены dCK и/или CD52 и TRAC отредактированы, т.е. инактивированы путем делеции, предназначенные для применения для лечения CLL, ALL, предпочтительно их агрессивных рецидивирующих рефрактерных форм, у пациентов с лимфоидным истощением.
В настоящем изобретении предложены выделенные сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены b2m и TRAC отредактированы, т.е. инактивированы путем делеции, предназначенные для применения для лечения CLL, ALL, предпочтительно их агрессивных рецидивирующих рефрактерных форм, у пациентов с лимфоидным истощением.
В настоящем изобретении предложены выделенные сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены TRAC и IL-10R отредактированы, т.е. инактивированы путем делеции, предназначенные для применения для лечения CLL, ALL, предпочтительно их агрессивных рецидивирующих рефрактерных форм, у пациентов с лимфоидным истощением.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR (UCART 22), с дефицитом гена TCR альфа (в результате экспрессия TCR на клеточной поверхности нарушена), с дефицитом гена В2М (в результате экспрессия молекул ГКГС класса I на клеточной поверхности нарушена), и в дополнение к этому с КО-геном рецептора TGFбета.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR (UCART 22), с дефицитом гена TCR альфа (в результате экспрессия TCR на клеточной поверхности нарушена), с дефицитом гена В2М (в результате экспрессия молекул ГКГС класса I на клеточной поверхности нарушена), и в дополнение к этому с КО-геном рецептора IL-10.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR (UCART 22), с дефицитом гена TCR альфа (в результате экспрессия TCR на клеточной поверхности нарушена), с дефицитом гена В2М (в результате экспрессия молекул ГКГС класса I на клеточной поверхности нарушена), и в дополнение к этому с КО-геном AHR.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR (UCART 22), с дефицитом гена TCR альфа (в результате экспрессия TCR на клеточной поверхности нарушена), с дефицитом гена В2М (в результате экспрессия молекул ГКГС класса I на клеточной поверхности нарушена), и в дополнение к этому с КО-геном PD1.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR (UCART 22), с дефицитом гена TCR альфа (в результате экспрессия TCR на клеточной поверхности нарушена), с дефицитом гена В2М (в результате экспрессия молекул ГКГС класса I на клеточной поверхности нарушена), и в дополнение к этому с КО-геном LAG-3.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR (UCART 22), с дефицитом гена TCR альфа (в результате экспрессия TCR на клеточной поверхности нарушена), с дефицитом гена В2М (в результате экспрессия молекул ГКТС класса I на клеточной поверхности нарушена), и в дополнение к этому с КО-геном TIM-3.
В настоящем изобретении предложены сконструированные иммунные Т-клетки, экспрессирующие CD22 CAR, имеющий SEQ ID NO: 15, в которых гены CD52 и TRAC инактивированы путем делеции, предназначенные для применения для лечения рецидивирующих рефрактерных форм В-ALL у пациентов с лимфоидным истощением.
В предпочтительном варианте осуществления изобретения способ создания иммунных клеток включает интродукцию в указанные Т-клетки полинуклеотидов, прежде всего мРНК, кодирующих специфическую редко расщепляющую эндонуклеазу, обладающую способностью осуществлять избирательную инактивацию указанных выше генов путем расщепления ДНК.
В более предпочтительном варианте осуществления изобретения указанные редко расщепляющие эндонуклеазы представляют собой TALE-нуклеазы или эндонуклеазу Cas9. К настоящему времени доказано, что TAL-нуклеазы обладают более высокой специфичностью и эффективностью расщепления по сравнению с другими типами редко расщепляющих эндонуклеаз, поэтому их выбирают в качестве эндонуклеаз для получения сконструированных иммунных клеток при крупномасштабном производстве с постоянным циклом.
Методы доставки
Различные методы, описанные выше, включают интродукцию CD22 CAR, предлагаемого в изобретении, в клетку. В качестве не ограничивающих изобретение примеров указанный CD22 CAR можно интродуцировать в виде трансгена, кодируемого одним плазмидным вектором, предлагаемым в изобретении. Указанный плазмидный вектор, кодирующий CD22 CAR, предлагаемый в изобретении, может содержать также маркер для селекции, обеспечивающий идентификацию и/или селекцию клеток, в которые доставляется указанный вектор.
Метод, обеспечивающий интродукцию CD22 CAR, предлагаемого в изобретении, и последующую экспрессию в выделенной иммунной клетке, является известным, например, описан в WO 2013/126720 или в WO 2015/121454, которые полностью включены в настоящее описание в качестве ссылки.
Полипептиды, соответствующие CD22 CAR, предлагаемому в изобретении, могут синтезироваться in situ в клетке в результате интродукции полинуклеотидов, кодирующих указанные полипептиды, в клетку. Альтернативно этому, указанные полипептиды можно получать вне клетки и затем интродуцировать в нее. Методы интродукции полинуклеотидной конструкции в клетки известны в данной области и их примерами являются (но, не ограничиваясь только ими) методы стабильной трансформации, в которых полинуклеотидную конструкцию интегрируют в геном клетки, методы кратковременной трансформации, в которых полинуклеотидную конструкцию не интегрируют в геном клетки, и методы, основанные на использовании вирусов. Указанные полинуклеотиды можно интродуцировать в клетку, например, с использованием рекомбинантных вирусных векторов (например, ретровирусов, таких как лентивирусы, аденовирусов, аденоассоциированного вируса), липосом и т.п. Например, методы кратковременной трансформации включают микроинъекцию, электропорацию или бомбардировку частицами. Указанные полинуклеотиды можно включать в векторы, более конкретно, в плазмиды или вирусы, с целью экспрессии в клетках.
В предпочтительном варианте осуществления изобретения указанный полинуклеотид, кодирующий CD22 CAR, встраивают в вектор на основе AAV6 и интродуцируют в конкретный ген. Методы получения вектора, обеспечивающего интродукцию CD22 CAR, предлагаемого в изобретении, и последующую экспрессию в выделенной Т-клетке, известны и описаны, например, в WO 2013/126720, которая включена в настоящее описание в качестве ссылки.
Сконструированные иммунные клетки (UCART)
Сконструированная иммунная клетка, наделенная CD22 CAR (UCART 22), является другим объектом настоящего изобретения.
Предпочтительно указанная иммунная клетка представляет собой выделенную иммунную клетку, более предпочтительно выделенную иммунную Т-клетку, более предпочтительно выделенную первичную иммунную Т-клетку.
UCART 22 предложена в качестве лекарственного средства, так, в качестве лекарственного средства предложена UCART 22 в терапевтически эффективном количестве.
«Первичная иммунная клетка» согласно изобретению означает клетку, происходящую из ткани, такой как образец крови, или из мононуклеарных клеток периферической крови (РВМС), и которую можно культивировать с использованием нескольких пассажей, замораживания в конце перед применением, указанная первичная иммунная клетка имеет ограниченную способность к делению (Raulf-Heimsoth М. Т cell - primary culture from peripheral blood. Methods Mol Med. 138, 2008, cc. 17-30. doi: 10.1007/978-1-59745-366-0) no сравнению с трансформированной или раковой клеткой.
Иммунная клетка, предлагаемая в изобретении, предпочтительно представляет собой иммунную Т- или NK-клетку. Так, сконструированная иммунная клетка, предлагаемая в изобретении, выделенная из образца крови, представляет собой первичную клетку и имеет происхождение из иммунной Т-клетки, выбранной из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хелперных Т-лимфоцитов, естественных клеток-киллеров из группы Т-клеток, предпочтительно из цитотоксических Т-лимфоцитов, дополнительно сконструированную.
Конструирование подразумевает такую модификацию первичных иммунных клеток, чтобы они содержали CD22 CAR и по меньшей мере один отредактированный ген, предпочтительно указанные клетки модифицируют так, чтобы они содержали CD22 CAR и при этом не экспрессировали ни TCR, ни погибали в присутствии аналогов пуриновых нуклеотидов.
Другими словами, сконструированные иммунные клетки представляют собой экспрессирующие CD22 CAR выделенные TCR-KO иммунные Т-клетки, содержащие по меньшей мере один другой отредактированный ген.
В конкретном варианте осуществления изобретения конструирование подразумевает такую модификацию первичных иммунных клеток, чтобы они содержали CD22 CAR, предпочтительно указанные клетки модифицируют так, чтобы они содержали CD22 CAR и не погибали в присутствии аналогов пуриновых нуклеотидов (1-5 мкмолей/л) или в присутствии алемтузумаба (50 мкг/мл) (Valton и др., Molecular Therapy т.23, №. 9, сентябрь 2015 г., сс. 1507-1518).
Предпочтительно указанную Т-клетку наделяют CD22 CAR, имеющим SEQ ID NO: 15.
Более предпочтительно указанную Т-клетку наделяют CD22 CAR, имеющим SEQ ID NO: 15, и она содержит по меньшей мере одну последовательность SEQ ID NO: 22.
Более предпочтительно указанную Т-клетку наделяют CD22 CAR, имеющим SEQ ID NO: 15, и она содержит по меньшей мере одну последовательность SEQ ID NO: 22 и по меньшей мере часть последовательности.
Более предпочтительно указанную Т-клетку наделяют CD22 CAR, имеющим SEQ ID NO: 18, которая включает по меньшей мере одну последовательность SEQ ID NO: 20.
В настоящем изобретении предложена первичная иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении, и обладающая CTL и/или дегранулирующей активностью в отношении экспрессирующей CD22 клетки.
В настоящем изобретении предложена также первичная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении, предназначенная для лизиса экспрессирующей CD22 клетки, прежде всего экспрессирующей CD22 раковой клетки.
Предпочтительно клетки, таргетируемые Т-клеткой, которая наделена CD22 CAR, имеющим SEQ ID NO: 16, предлагаемым в изобретении, обладают эффективностью при лечении рецидивирующего/рефрактерного/агрессивного ALL или CLL предпочтительно.
Настоящее изобретение относится также к выделенным клеткам или клеточным линиям, которые можно получать указанным способом конструирования клеток. В частности, указанная выделенная клетка содержит по меньшей мере один предлагаемый в изобретении CD22 CAR, указанный выше. В другом варианте осуществления изобретения указанная выделенная клетка содержит популяцию CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены. В частности, указанная выделенная клетка содержит экзогенную полинуклеотидую последовательность, кодирующую CAR. Генетически модифицированные иммунные клетки, предлагаемые в настоящем изобретении, являются активными и могут пролиферировать вне зависимости от антигенсвязывающих механизмов.
Под объем настоящего изобретения подпадает также выделенная иммунная клетка, предпочтительно выделенная иммунная Т-клетка (Т-клетка), более предпочтительно сконструированная выделенная иммунная Т-клетка, полученная с помощью одного из ранее описанных способов. Указанная иммунная клетка представляет собой клетку, происходящую из гематопоэтической клетки, функционально участвующую в инициации и/или реализации врожденного или адаптивного иммунного ответа. Указанную иммунную клетку, предлагаемую в настоящем изобретении, можно получать из стволовой клетки. Стволовые клетки могут представлять собой зрелые стволовые клетки, нечеловеческие эмбриональные стволовые клетки, более предпочтительно нечеловеческие стволовые клетки, стволовые клетки из пуповинной крови, клетки-предшественники, стволовые клетки костного мозга, индуцированные плюропотентные стволовые клетки, тотипотентные стволовые клетки или гематопоэтические стволовые клетки. Репрезентативными человеческими клетками являются CD34+-клетки. Указанная выделенная клетка может представлять собой также дендритную клетку, дендритную киллерную клетку, тучную клетку, NK-клетку, В-клетку или Т-клетку, выбранную из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хелперных Т-лимфоцитов. В другом варианте осуществления изобретения указанная клетка может иметь происхождение из группы, состоящей из CD4+-Т-лимфоцитов и CD8+-T-лимфоцитов.
Перед осуществлением размножения и генетической модификации клеток, предлагаемых в изобретении, из организма индивидуума можно получать источник клеток с помощью различных методов, не ограничивающих объем изобретения. Клетки можно получать из многочисленных источников, включая (но, не ограничиваясь только ими) мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из инфицированной области, асциты, плевральный выпот, ткань селезенки и опухоли. В некоторых вариантах осуществления настоящего изобретения можно применять любое количество Т-клеточных линий, доступных и известных специалистам в данной области. В другом варианте осуществления изобретения указанную клетку предпочтительно получают из организма здорового донора, пациента с диагностированным раком или пациента с диагностированной инфекцией. В другом варианте осуществления изобретения указанная клетка представляет собой часть смешанной популяции клеток, обладающих различными фенотипическими характеристиками. Под объем настоящего изобретения подпадает также клеточная линия, полученная из сконструированной с помощью описанного способа Т-клетки. Под объем настоящего изобретения подпадают модифицированные клетки, устойчивые к иммуносупрессивному лечению, и которые можно получать с помощью описанного выше способа.
В качестве предпочтительного варианта осуществления изобретения в настоящем изобретении предложены Т-клетки или популяция Т-клеток, наделенных описанным выше CD22 CAR, предлагаемым в изобретении, которые не экспрессируют функциональный TCR и которые обладают реактивностью в отношении CD22-позитивных клеток, предназначенные для адоптивного переноса в организм пациентов.
В качестве предпочтительного варианта осуществления изобретения в настоящем изобретении предложены Т-клетки или популяция Т-клеток, наделенных описанным выше CD22 CAR, предлагаемым в изобретении, которые не экспрессируют функциональный TCR и которым придана устойчивость к химиотерапии, прежде всего к аналогам пуриновых нуклеотидов (PNA).
Согласно предпочтительному варианту осуществления изобретения иммунные клетки, наделенные CD22 CAR, конструируют так, чтобы они приобретали устойчивость к химиотерапевтическим лекарственным средствам, прежде всего к аналогам пуриновых нуклеотидов (PNA), что позволяет применять их для лечения рака в сочетании с адоптивной иммунотерапией и химиотерапией.
Аналоги пуриновых нуклеотидов входят в химиотерапевтические композиции, предназначенные для многих путей лечения рака. Их применяют в качестве стандарта медицинской помощи при лейкозе или лимфоме. Наиболее широко применяемыми PNA являются клофарабин, флударабин и цитарабин индивидуально или в комбинации. PNA метаболизируются с помощью ферментов, обладающих дезоксицитидинкиназной (dCK) активностью [ЕС 2.7.1.74], в моно-, ди- и трифосфат PNA. Их трифосфтаные формы и прежде всего клофарабина трифосфат, конкурируют с АТФ за синтез ДНК, действуют в качестве проапоптозного агента и являются сильными ингибиторами рибонуклеотидредуктазы (RNR), которая участвует в образовании тринуклеотидов.
Таким образом, настоящее изобретение включает способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, которые не экспрессируют TCR, являются устойчивыми к лекарственному средству, представляющему собой аналог пурина, и которые могут таргетировать CD22-позитивные злокачественные клетки.
Способ получения UCART 22, предлагаемой в изобретении, может представлять собой также способ, описанный в WO 2013/176915 или WO 2014/191128, которые полностью включены в настоящее описание в качестве ссылки.
Способ получения UCART 22 включает следующие стадии:
(а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки или выделенной популяции Т-клеток,
(б) интродукцию в указанную иммунную клетку (предпочтительно путем трансфекции или трансдукции) нуклеотидной последовательности, кодирующей редко расщепляющую эндонуклеазу, специфически таргетирующую
- ген, который экспрессирует фермент, обладающий дезоксицитидинкиназной активностью (dcK - ЕС 2.7.1.74), прежде всего человеческий ген дезоксицитидинкиназы (NCBI Gene ID: 1633), и/или
- ген, который кодирует одну из TCR-субъединиц альфа и/или бета, предпочтительно альфа, и/или
- ген, который кодирует человеческий CD52,
(в) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инактивации указанного(ых) гена(ов);
(г) размножение сконструированных иммунных клеток, полученных на стадии в), необязательно в присутствии лекарственного средства, представляющего собой аналог пурина;
(д) интродукцию в указанную иммунную клетку CD22 CAR, предлагаемого в изобретении, предпочтительно, имеющего SEQ ID NO: 15.
Способ получения UCART 22 включает следующие стадии:
(а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки или выделенной популяции Т-клеток,
(б) интродукцию в указанную иммунную клетку (предпочтительно путем трансфекции или трансдукции) нуклеотидной последовательности, кодирующей редко расщепляющую эндонуклеазу, специфически таргетирующую
- ген, который экспрессирует фермент, обладающий дезоксицитидинкиназной активностью (dcK - ЕС 2.7.1.74), прежде всего человеческий ген дезоксицитидинкиназы (NCBI Gene ID: 1633), и/или
- ген, который кодирует одну из TCR-субъединиц альфа и/или бета, предпочтительно альфа, и/или
- ген, который кодирует человеческий бета-2-микроглобулин (В2М),
(в) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инактивации указанного(ых) гена(ов);
(г) размножение сконструированных иммунных клеток, полученных на стадии в), необязательно в присутствии лекарственного средства, представляющего собой аналог пурина;
(д) интродукцию в указанную иммунную клетку CAR, предлагаемого в изобретении, предпочтительно CD22 CAR, индивидуально или в комбинации с CD19 CAR, еще более предпочтительно CD22 CAR, который имеет SEQ ID NO: 15, индивидуально или в комбинации с CD19 CAR.
В предпочтительном варианте осуществления изобретения настоящее изобретение включает способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, которые не экспрессируют TCR, являются устойчивыми к лекарственному средству, представляющему собой аналог пурина, и которые могут таргетировать CD22-позитивные злокачественные клетки.
Указанный способ включает следующие стадии:
• (а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки (или выделенной популяции Т-клеток),
• (б) интродукцию в указанную иммунную клетку CD22 CAR, предлагаемого в изобретении, предпочтительно, имеющего SEQ ID, выбранную из SEQ ID NO: 15,
• (в) размножение сконструированных иммунных клеток, полученных на стадии б),
(г) интродукцию в указанную иммунную клетку (путем трансфекции или трансдукции) нуклеотидной последовательности, которая кодирует редко расщепляющую эндонуклеазу, специфически таргетирующую
ген, который экспрессирует фермент, обладающий дезоксицитидинкиназной активностью (dcK ЕС 2.7.1.74), прежде всего человеческий ген дезоксицитидинкиназы (NCBI Gene ID: 1633), и/или ген, который кодирует одну из TCR-субъединиц альфа и/или бета,
(д) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инактивации указанного(ых) гена(ов);
(е) размножение сконструированных иммунных клеток, полученных на стадии д), необязательно в присутствии лекарственного средства, представляющего собой аналог пурина.
Способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, которые не экспрессируют TCR, являются устойчивыми к лекарственному средству, представляющему собой аналог пурина, и которые могут таргетировать CD22-позитивные злокачественные клетки, необязательно включает другую стадию интродукции в указанную иммунную клетку (путем трансфекции или трансдукции) нуклеотидной последовательности, которая кодирует редко расщепляющую эндонуклеазу, специфически таргетирующую один из генов, указанных в таблице 9, предпочтительно PD-1, CD279 и более предпочтительно PDCD1 (PD-1, CD279) или CTLA4 (CD152).
При создании настоящего изобретения достигнуты успехи в создании экспрессирующих CD22 CAR первичных Т-клеток, устойчивых к аналогам пуриновых нуклеотидов (dCK-KO), более предпочтительно к клофарабину и/или флударабину, опосредуя инактивацию (делеция) экспрессии гена dcK в указанных клетках, в частности с использованием нуклеаз, прежде всего TAL-нуклеаз.
Трансфекция Т-клеток с использованием мРНК, которая кодирует специфическую TAL-нуклеазу, направленную против генов dCK, предпочтительно с помощью электропорации, описанной в WO 2013/176915, индуцировала выраженную устойчивость к лекарственным средствам с сохранением цитотоксической активности Т-клеток в отношении несущих CD22 клеток.
В настоящей заявке описаны также TCR-KO, CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия дезоксицитидинкиназы подавлена или инактивирована (dCK-KO), предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме, более предпочтительно В-ALL.
Согласно предпочтительному варианту осуществления изобретения иммунные клетки, наделенные CD22 CAR, конструируют так, чтобы они обладали устойчивостью к химиотерапевтическим лекарственным средствам, в частности к алемтузумабу (кэмпас), что позволяет применять их для лечения рака в сочетании с адоптивной иммунотерапией и химиотерапией.
Алемтузумаб применяют во многих вариантах лечения рака. Его применяют в качестве стандарта медицинской помощи при лейкозе или лимфоме, прежде всего для лечения хронического лимфоцитарного лейкоза (CLL), кожной Т-клеточной лимфомы (CTCL) и Т-клеточной лимфомы. Он известен под торговыми знаками Campath (кэмпас), MabCampath и Campath-1H. Его применяют в некоторых кондиционирующих режимах при трансплантации костного мозга, трансплантации почки и трансплантации островковых клеток.
Он представляет собой моноклональное антитело, которое связывается с CD52, белком, который присутствует на поверхности зрелых лимфоцитов, но не на стволовых клетках, из которых образуются лимфоциты. После лечения алемтузумабом указанные несущие CD52 лимфоциты становятся мишенями для деструкции.
Алемтузумаб применяют также в качестве терапии второй линии при CLL. Он разрешен для применения Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (US Food and Drug Administration) для страдающих CLL пациентов, которых лечили алкилирующими агентами и которые оказались нечувствительными к терапии флударабином.
Таким образом, настоящее изобретение включает способ получения ex vivo UCART 22, не экспрессирующих, как указано выше, TCR, которые являются устойчивыми к алемтузумабу.
Способ получения UCART 22 CD52-KO включает следующие стадии:
(а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки или выделенной популяции Т-клеток,
(б) интродукцию в указанную иммунную клетку (предпочтительно путем трансфекции или трансдукции) нуклеотидной последовательности, кодирующей редко расщепляющую эндонуклеазу, специфически таргетирующую
- ген, который кодирует одну из TCR-субъединиц альфа и/или бета, предпочтительно альфа, и/или
- ген, который кодирует CD52,
(в) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инактивации указанного(ых) гена(ов);
(г) размножение сконструированных иммунных клеток, полученных на стадии в), необязательно в присутствии алемтузумаба;
(д) интродукцию в указанную иммунную клетку CD22 CAR, предлагаемого в изобретении, предпочтительно имеющего SEQ ID NO: 15.
В предпочтительном варианте осуществления изобретения настоящее изобретение включает способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, не экспрессирующих TCR, которые являются устойчивыми к алемтузумабу и которые могут таргетировать CD22-позитивные злокачественные клетки. Указанный способ включает следующие стадии:
• (а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки (или выделенной популяции Т-клеток),
• (б) интродукцию в указанную иммунную клетку CD22 CAR, предлагаемого в изобретении, предпочтительно, имеющего SEQ ID NO: 15,
• (в) размножение сконструированных иммунных клеток, полученных на стадии б),
(г) интродукцию в указанную иммунную клетку (путем трансфекции или трансдукции) нуклеотидной последовательности, которая кодирует редко расщепляющую эндонуклеазу, специфически таргетирующую
ген, который экспрессирует CD52, и ген, который кодирует одну из TCR-субъединиц альфа или бета,
(д) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инактивации указанного(ых) гена(ов);
(е) размножение сконструированных иммунных клеток, полученных на стадии д), необязательно в присутствии лекарственного средства, представляющего собой аналог пурина.
В одном из вариантов осуществления изобретения способ получения UCART 22 включает следующие стадии:
(а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки или выделенной популяции Т-клеток,
(б) интродукцию в указанную иммунную клетку (предпочтительно путем трансфекции или трансдукции)
-нуклеотидной последовательности, кодирующей редко расщепляющую эндонуклеазу, специфически таргетирующую ген, который кодирует одну из TCR-субъединиц альфа и/или бета, предпочтительно альфа, и
- нуклеиновой кислоты, кодирующей последовательность, предназначенную для встраивания, предпочтительно кодирующей HIF-1альфа,
(в) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инсерции указанной последовательности, предназначенной для встраивания,
(г) размножение сконструированных иммунных клеток, полученных на стадии в), необязательно в присутствии низкой концентрации О2 (5% О2, предпочтительно 1% О2);
(д) интродукцию в указанную иммунную клетку CD22 CAR, предлагаемого в изобретении, предпочтительно имеющего SEQ ID NO: 15.
В предпочтительном варианте осуществления изобретения настоящее изобретение включает способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, не экспрессирующих TCR, которые являются устойчивыми к гипоксии и которые могут таргетировать CD22-позитивные злокачественные клетки. Указанный способ включает следующие стадии:
• (а) получение иммунной клетки из донора, предпочтительно выделенной Т-клетки (или выделенной популяции Т-клеток),
• (б) интродукцию в указанную иммунную клетку CD22 CAR, предлагаемого в изобретении, предпочтительно, имеющего SEQ ID NO: 15,
• (в) размножение сконструированных иммунных клеток, полученных на стадии б),
(г) интродукцию в указанную иммунную клетку (путем трансфекции или трансдукции)
- нуклеотидной последовательности, которая кодирует редко расщепляющую эндонуклеазу, специфически таргетирующую ген, который кодирует одну из TCR-субъединиц альфа и/или бета, предпочтительно альфа, и
- нуклеиновую кислоту, кодирующую последовательность, предназначенную для встраивания, которая кодирует HIF-1 альфа,
(д) экспрессию указанной эндонуклеазы в указанных иммунных клетках с получением таргетированной инсерции указанного(ых) гена(ов);
(е) размножение сконструированных иммунных клеток, полученных на стадии д), необязательно в присутствии низкой концентрации О2 (5% О2, предпочтительно 1% О2).
Способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, которые не экспрессируют TCR, являются устойчивыми либо к лекарственному средству, представляющему собой аналог пурина, либо к алемтузумабу, либо к гипоксии, и которые могут таргетировать CD22-позитивные злокачественные клетки, необязательно включает другую стадию интродукции в указанную иммунную клетку (путем трансфекции или трансдукции) нуклеотидной последовательности, которая кодирует редко расщепляющую эндонуклеазу, специфически таргетирующую один из генов, указанных в таблице 9, предпочтительно PD-1, CD279 и более предпочтительно PDCD1 (PD-1, CD279) и CTLA4 (CD 152).
При создании настоящего изобретения достигнуты успехи в создании экспрессирующих CD22 CAR первичных Т-клеток, устойчивых к аналогам пуриновых нуклеотидов (dCK-KO), более предпочтительно к клофарабину и/или флударабину, опосредуя инактивацию (делеция) экспрессии гена dcK в указанных клетках, в частности с использованием нуклеаз, прежде всего TAL-нуклеаз.
Трансфекция Т-клеток с использованием мРНК, которая кодирует специфическую TAL-нуклеазу, направленную против генов dCK, предпочтительно с помощью электропорации, описанной в WO 2013/176915, индуцировала выраженную устойчивость к лекарственным средствам с сохранением цитотоксической активности Т-клеток в отношении несущих CD22 клеток.
Такой же способ применяли для делеции человеческого CD52 с помощью специфической TALEN, что описано в настоящем изобретении.
В настоящей заявке предложены также TCR-KO, наделенные CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия дезоксицитидинкиназы подавлена или инактивирована (dCK-KO), предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме, более предпочтительно В-ALL.
Такие клетки представляют собой «универсальные» Т-клетки (или UCART).
Одним из вариантов осуществления изобретения, представленного в настоящем описании, являются экспрессирующие CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия дезоксицитидинкиназы подавлена или инактивирована (dCK-KO), предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме; более предпочтительно рецидивирующего B-ALL после аутологичного переноса.
Одним из вариантов осуществления изобретения, представленного в настоящем описании, являются экспрессирующие CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия CD52 подавлена или инактивирована (CD52-KO), предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме; более предпочтительно рецидивирующего B-ALL после аутологичного переноса.
Одним из вариантов осуществления изобретения, представленного в настоящем описании, являются экспрессирующие CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия HIF-1альфа повышена в результате инсерции кодирующей последовательности в TRAC-последовательность без «выключения» TCR, предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме; более предпочтительно рецидивирующего B-ALL после аутологичного переноса.
Одним из вариантов осуществления изобретения, представленного в настоящем описании, являются экспрессирующие CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия дезоксицитидинкиназы и CD52 подавлена или инактивирована (dCK- и CD52-KO), предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме; более предпочтительно рецидивирующего B-ALL после аутологичного переноса.
Одним из вариантов осуществления изобретения, представленного в настоящем описании, являются экспрессирующие CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, в которых экспрессия дезоксицитидинкиназы и CD52 подавлена или инактивирована (dCK- и CD52-KO) и экспрессия HIF-1альфа повышена в результате инсерции кодирующей последовательности в TRAC- последовательность без «выключения» TCR, предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме; более предпочтительно рецидивирующего B-ALL после аутологичного переноса.
Способ получения ex vivo иммунных клеток, предпочтительно первичных Т-клеток, которые не экспрессируют TCR, являются устойчивыми к лекарственному средству, представляющему собой аналог пурина, и/или к алемтузумабу, и/или к гипоксии, которые могут таргетировать CD22-позитивные злокачественные клетки, необязательно включает другую стадию интродукции в указанную иммунную клетку (путем трансфекции или трансдукции) нуклеотидной последовательности, которая кодирует редко расщепляющую эндонуклеазу, специфически таргетирующую один из генов, указанных в таблице 9, предпочтительно PD-1, CD279 и более предпочтительно PDCD1 (PD-1, CD279) или CTLA4 (CD152).
При создании настоящего изобретения достигнуты успехи в создании экспрессирующих CD22 CAR первичных Т-клеток, устойчивых к аналогам пуриновых нуклеотидов (dCK-KO), более предпочтительно к клофарабину и/или флударабину, опосредуя инактивацию (делеция) экспрессии гена dcK в указанных клетках, в частности с использованием нуклеаз, прежде всего TAL-нуклеаз.
При создании настоящего изобретения достигнуты успехи в создании экспрессирующих CD22 CAR первичных Т-клеток, устойчивых к гипоксии, путем таргетированной инсерции гена HIF-1 альфа в указанные клетки, в частности с использованием нуклеаз, прежде всего TAL-нуклеаз.
Трансфекция Т-клеток с использованием мРНК, которая кодирует специфическую TAL-нуклеазу, направленную против генов dCK, предпочтительно с помощью электропорации, описанной в WO 2013/176915, индуцировала выраженную устойчивость к лекарственным средствам с сохранением цитотоксической активности Т-клеток в отношении несущих CD22 клеток.
В настоящей заявке предложены также TCR-KO, наделенные CD22 CAR (предпочтительно SEQ ID NO: 15) первичные Т-клетки, устойчивые к гипоксии, предназначенные для лечения лейкоза или лимфомы, предпочтительно в их агрессивной устойчивой рецидивирующей форме, более предпочтительно В-ALL.
Активация и размножение Т-клеток
Как до, так и после осуществления генетической модификации Т-клеток, даже в том случае, если активация и пролиферация генетически модифицированных иммунных клеток, предлагаемых в настоящем изобретении, не зависит от механизмов связывания с антигеном, иммунные клетки, прежде всего Т-клетки, предлагаемые в настоящем изобретении, можно подвергать дополнительной активации и размножать с помощью методов, описанных в целом, например, в US №№6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации заявки на патент США №2006/0121005. Т-клетки можно размножать in vitro или in vivo.
Как правило, Т-клетки, предлагаемые в изобретении, размножают путем приведения в контакт с агентом, который стимулирует комплекс CD3 TCR, и костимуляторной молекулой на поверхности Т-клеток с целью создания сигнала активации для Т-клетки. Например, для создания сигнала активации для Т-клетки можно применять химические соединения, такие как ионофор кальция А23187, форбол-12-миристат-13-ацетат (ФМА) или митогенные лектины, такие как фитогемагглютинин (ФГА).
Например (но, не ограничиваясь только этим), популяции Т-клеток можно стимулировать in vitro путем приведения в контакт с антителом к CD3 или его антигенсвязывающим фрагментом, или антителом к CD2, иммобилизованным на поверхности, или путем приведения в контакт с активатором протеинкиназы С (например, бриостатином) в сочетании с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности Т-клеток используют лиганд, который связывается с вспомогательной молекулой. Например, популяцию Т-клеток можно приводить в контакт с антителом к CD3 и антителом к CD28 в условиях, обеспечивающих стимуляцию пролиферации Т-клеток. Условия, пригодные для культивирования Т-клеток, включают соответствующие среды (например, минимальную поддерживающую среду или среду RPMI 1640, или X-vivo 5, (фирма Lonza)), которые могут содержать факторы, необходимые для обеспечения пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью сыворотку или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-g, 1L-4, 1L-7, GM-CSF, -10, -2, 1L-15, TGFp и TNF, или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают (но, не ограничиваясь только ими) сурфактант, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут представлять собой RPMI 1640, A1M-V, DMEM, MEM, а-МЕМ, F-12, Х-Vivo 1 и Х-Vivo 20, Optimizer, содержащие в качестве добавок аминокислоты, пируват натрия и витамины, они могут быть бессывороточными или могут содержать в качестве добавок в определенном количестве сыворотку (или плазму) или определенный набор гормонов, и/или цитокин(ы) в количестве, достаточном для роста и размножения Т-клеток.
Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения путем инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, при 37°С) и атмосфере (например, в воздухе плюс 5% СО2). Клетки, которые подвергали стимуляции в течение различных промежутков времени, могут обладать различными характеристиками.
В другом конкретном варианте осуществления изобретения указанные клетки можно размножать путем совместного культивирования с тканью или клетками. Указанные клетки можно размножать также in vivo, например, в крови индивидуума после введения указанной клетки индивидууму.
Фармацевтическая композиция
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая сконструированную (TCR- и dCK-KO) или (TRAC- и CD52-KO) иммунную Т-клетку, которая экспрессирует CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15), и фармацевтически приемлемый наполнитель.
Другим вариантом осуществления настоящего изобретения является композиция, которая содержит UCART 22, предлагаемую в настоящем изобретении (указанную в любом из представленных выше вариантов осуществления изобретения), в сочетании с соединением из семейства бриостатинов, предпочтительно с бриостатином-1.
Бриостатины представляют собой группу макролидных лактонов из мшанок Bugula neritina. Структура бриостатина 1 установлена в 1980-ые годы. К настоящему времени выделено 20 различных бриостатинов; а также некоторые аналоги бриостатина, обозначенные как «бриологи». Бриостатины являются сильными модуляторами протеинкиназы С (Wender, Paul A., Jeremy L. Baryza, Chad E. Bennett,F. Christopher Bi, Stacey E. Brenner, Michael O. Clarke, Joshua C. Horan,Cindy Kan, Emmanuel Lacote, Blaise Lippa, Peter G. Nell и d Tim M. Turner. The Practical Synthesis of a Novel and Highly Potent Analogue of Bryostatin. Journal of the American Chemical Society 124 (46), 2002, cc. 13648-13649 DOI: 10.1021/ja027509+).
Примеры бриостатинов, пригодных для объединения с UCART 22, предлагаемой в изобретении, и способы получения этих соединений описаны в WO 2001/040214А1 или ЕР 2737904А2, WO 1997/034598, которые включены в настоящее описание в качестве ссылки.
Пример дозы бриостатина-1, которую можно применять в сочетании с UCART 22, предлагаемой в настоящем изобретении, ранее описан у Varterasian M.L. 1, Mohammad R.M., Shurafa M.S., Hulburd K., Pemberton P.A., Rodriguez D.H., Spadoni V., Eilender D.S., Murgo A., Wall N., Dan M., Al-Katib A.M. Phase II trial of bryostatin 1 in patients with relapsed low-grade non-Hodgkin's lymphoma and chronic lymphocytic leukemia. Clin Cancer Res., 6(3), март 2006, cc. 825-828.
Предложена сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], или фармацевтическая композиция, содержащая указанную UCART 22, в качестве лекарственного средства.
Другим объектом изобретения является сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], предназначенная для применения для лечения рака или уменьшения воспаления.
Другим объектом изобретения является сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], предназначенная для применения лечения ALL, CLL, рецидивирующих рефрактерных агрессивных форм CLL или ALL.
Предложена сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], предназначенная для лечения экспрессирующего CD19 рецидивирующего рака, предпочтительно экспрессирующего CD19 B-ALL.
Другим вариантом осуществления изобретения является устойчивая к гипоксии сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], или фармацевтическая композиция, содержащая указанную UCART 22, в качестве лекарственного средства.
Другим вариантом осуществления следующего объекта настоящего изобретения является устойчивая к гипоксии сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], предназначенная для применения для лечения рака или уменьшения воспаления.
Другим вариантом осуществления следующего объекта настоящего изобретения является устойчивая к гипоксии сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], предназначенная для применения для лечения ALL, CLL, рецидивирующих рефрактерных агрессивных форм CLL или ALL.
Другим вариантом осуществления изобретения является устойчивая к гипоксии сконструированная (TRAC- и dCK-KO или TRAC- и CD52-KO) иммунная Т-клетка, экспрессирующая CD22 CAR, предлагаемый в изобретении (предпочтительно SEQ ID NO: 15) [UCART 22], предназначенная для применения для лечения экспрессирующего CD19 рецидивирующего рака, предпочтительно экспрессирующего CD19 рецидивирующего В-ALL.
Согласно другому варианту осуществления изобретения выделенную клетку, полученную различными способами, предлагаемыми в настоящем изобретении, или клеточную линию, полученную из указанной выделенной клетки, можно применять в качестве лекарственного средства. Согласно другому варианту осуществления изобретения указанное лекарственное средство можно применять для лечения рака, прежде всего для лечения В-клеточных лимфом и лейкоза у пациента, который нуждается в этом. Согласно другому варианту осуществления изобретения указанную выделенную клетку, предлагаемую в изобретении, или клеточную линию, полученную из указанной выделенной клетки, можно применять для приготовления лекарственного средства, предназначенного для лечения рака у пациента, который нуждается в этом.
Настоящее изобретение включает аутологичный перенос сконструированных клеток. В этом случае клетки выделяют из одного донора человека, конструируют и затем переносят в исходного донора, который нуждается в этом.
В указанном конкретном варианте осуществления изобретения клетки можно конструировать, например, так, чтобы они обладали устойчивостью к лекарственному средству, такому как алемтузумаб (кэмпас) и/или pna (аналог пуринового нуклеотида), и необязательно обладали устойчивостью к гипоксии.
Терапевтические применения
Понятие «рак» относится к заболеванию, характеризующемуся неконтролируемым ростом одного или нескольких типов клеток.
Примеры раков представлены в настоящем описании, и включают (но, не ограничиваясь только ими) жидкие опухоли или гематологический рак.
Гематологический рак согласно настоящему изобретению можно выбирать из лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лейкоза, множественной миеломы, В-клеточного хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфоцитарного лейкоза (ALL) и лимфомы Беркитта, острого лимфоцитарного рака, острого миелоидного лейкоза, предпочтительно экспрессирующего CD22 гематологического рака, более предпочтительно рецидивирующего рефрактерного экспрессирующего CD22 гематологического рака, еще более предпочтительно агрессивной формы указанного связанного с CD22 гематологического рака.
В предпочтительном варианте осуществления изобретения рецидивирующий или рефрактерный экспрессирующий CD22 гематологический рак представляет собой рецидивирующий и/или рефрактерный экспрессирующий CD22 или позитивный по CD22 В-ALL.
Таким образом, предложено применение в терапевтически эффективном количестве UCART 22, предлагаемой в одном из указанных выше вариантов осуществления изобретения, или в терапевтически эффективном количестве фармацевтической композиции, указанной выше, в качестве лекарственного средства для лечения пациента, страдающего рецидивирующим и/или рефрактерным экспрессирующим CD22 или позитивным по CD22 В-ALL.
Согласно другому варианту осуществления изобретения предложено применение в терапевтически эффективном количестве UCART 22, предлагаемой в одном из указанных выше вариантов осуществления изобретения, или в терапевтически эффективном количестве фармацевтической композиции, указанной выше, в качестве лекарственного средства для лечения пациента, страдающего CD22-позитивным гематологическим раком, выбранным из лейкоза и лимфомы, волосатоклеточного лейкоза, любого острого лимфоцитарного рака, острого лимфоцитарного лейкоза (ALL), острого миелоидного лейкоза, хронического лимфоцитарного лейкоза, В-клеточного хронического лимфоцитарного лейкоза, хронического миелоидного рака, лимфомы Ходжкина, неходжкинской лимфомы и лимфомы Беркитта, множественной миеломы.
Согласно другому варианту осуществления изобретения предложено применение в терапевтически эффективном количестве UCART 22, предлагаемой в одном из указанных выше вариантов осуществления изобретения, или в терапевтически эффективном количестве фармацевтической композиции, указанной выше, в качестве лекарственного средства для лечения пациента, страдающего CD22-позитивным раком, выбранным из альвеолярной рабдомиосаркомы, рака мочевого пузыря (например, карциномы мочевого пузыря), рака кости, рака головного мозга (например, медуллобластомы), рака молочной железы, рака ануса, анального канала или аноректума, рака глаза, рака внутрипеченочного желчного протока, рака сустава, рака шеи, рака желчного пузыря, рака плевры, рака носа, рака носовой полости, рака среднего уха, рака ротовой полости, рака вульвы, хронического лимфоцитарного лейкоза, хронического миелоидного рака, рака ободочной кишки, рака пищевода, рака шейки матки, фибросаркомы, карциноидной опухоли желудочно-кишечного тракта, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи), рака гипофаринкса, рака почки, рака гортани, рака печени, рака легкого (например, немелкоклеточной карциномы легкого), злокачественной мезотелиомы, мастоцитомы, меланомы, рака носоглотки, рака яичника, рака поджелудочной железы, рака брюшины, рака сальника, рака брыжейки, рака глотки, рака предстательной железы, ректального рака, ренального рака, рака кожи, рака тонкого кишечника, рака мягких тканей, солидных опухолей, рака желудка, рака яичек, рака щитовидной железы, рака мочеточника.
Другие примеры опосредуемых CD22 раков представлены в настоящем описании и включают (но, не ограничиваясь только ими) рак печени, рак легкого (например, немелкоклеточная карцинома легкого), рак яичника, рак поджелудочной железы и уротелиальный рак.
Конкретным вариантом осуществления объекта настоящего изобретения является лечение агрессивных форм указанных раков, которые растут по меньшей мере в 2 раза быстрее по сравнению с обычным средним ростом указанных раков в популяция.
Одним из вариантов осуществления объектов настоящего изобретения является лечение лейкоза в процессе лечения фазы акселерации.
Конкретным вариантом осуществления объекта настоящего изобретения является лечение рефрактерной/рецидивирующей диффузной крупноклеточной В-клеточной неходжкинской лимфомы - метастазов рака молочной железы в легкое - тройного рака, состоящего из хронического лимфоцитарного лейкоза в сочетании с карциномой мочевого пузыря и предстательной железы.
Предпочтительно рак представляет собой гематологическое злокачественное заболевание (например, лейкоз или лимфому, включая (но, не ограничиваясь только ими) лимфому Ходжкина, неходжкинскую лимфому, хронический лимфоцитарный лейкоз, острый лимфоцитарный рак, острый миелоидный лейкоз, В-клеточный хронический лимфоцитарный лейкоз, волосатоклеточный лейкоз, острый лимфоцитарный лейкоз (ALL) и лимофому Беркитта).
Более предпочтительно рак характеризуется экспрессией CD22, более предпочтительно рак характеризуется экспрессией CD22 раковыми клетками, еще более предпочтительно сверхэкспрессией CD22 раковыми клетками.
В одном из вариантов осуществления изобретения указанные раковые клетки представляют собой рецидивирующие рефракторные CD19-негативные раковые клетки.
В одном из вариантов осуществления изобретения указанные раковые клетки представляют собой рецидивирующие рефракторные экспрессирующие CD22 раковые клетки.
В предпочтительном варианте осуществления изобретения указанные раковые клетки представляют собой рецидивирующие рефракторные CD19-негативные, позитивные по экспрессии CD22 В-клетки ALL.
В-клетки ALL содержат:
• ранние предшественники В (ранние пре-В) клетки ALL (называемые также про-В ALL),
• обычные клетки ALL,
• пре-В ALL,
• зрелые В-клетки ALL, который называют также лейкозом Беркитта или неходжкинской лимфомой у детей.
Понятие «заболевание, ассоциированное с экспрессией CD22» в контексте настоящего описание включает (но, не ограничиваясь только ими) заболевание, ассоциированное с экспрессией CD22, или состояние, связанное с активностью клеток, которые экспрессируют CD22, включая опухолевые клетки различных раков, таких, например, как экспрессирующий CD22 B-ALL.
Деструкция клеток путем лизиса представляет собой один из механизмов, посредством которого CD22 CAR Т-клетки, предлагаемые в изобретении, действуют против экспрессирующих CD22 клеток, уменьшая или устраняя опухоли, облегчая инфильтрацию иммунных клеток хозяев к месту опухоли и/или повышая/удлиняя противоопухолевые ответы.
Другим объектом настоящего изобретения являются способы лечения пациентов, которые нуждаются в этом, где указанный способ включает по меньшей мере одну из следующих стадий:
• получение UCART 22, предлагаемой в изобретении,
• введение указанных трансформированных иммунных клеток указанному пациенту.
В одном из вариантов осуществления изобретения указанные UCART 22-клетки, предлагаемые в изобретении, могут подвергаться усиленному Т-клеточному размножению in vivo и могут сохраняться в течение более длительного времени в хозяине.
Другим объектом настоящего изобретения являются способы лечения пациентов, которые нуждаются в этом, где указанный способ включает по меньшей мере одну из следующих стадий:
• кондиционирование пациента, страдающего раком,
• получение UCART 22, предлагаемой в изобретении,
• введение указанных трансформированных иммунных клеток указанному пациенту.
Кондиционирование включает лимфодеплецию или любое приемлемое кондиционирование, известное специалисту в данной области, предпочтительно также лечащему врачу, которому известно, как определять необходимую медицинскую помощь указанному пациенту.
В предпочтительном варианте осуществления изобретения указанный способ дополнительно включает стадию трансплантации костного мозга.
В одном из вариантов осуществления изобретения указанные UCART 22-клетки, предлагаемые в изобретении, могут подвергаться усиленному Т-клеточному размножению in vivo и могут сохраняться в течение более длительного времени в хозяине.
Указанное лечение может быть облегчающим, исцеляющим или профилактическим. Оно может либо являться, либо частью аутологичной иммунотерапии, либо частью аллогенной иммунотерапии. Под аутологичным лечением подразумевается, что клетки, клеточную линию или популяцию клеток, которые применяют для лечения пациентов, получают из указанного пациента или из совместимого по человеческому лейкоцитарному антигену (HLA) донора. Под аллогенным лечением подразумевается, что клетки или популяцию клеток, которые применяют для лечения пациентов, не получают из указанного пациента, а получают из донора.
В одном из вариантов осуществления изобретения выживание указанных Т-клеток, предлагаемых в изобретении, в хозяине контролируют с помощью обработки антителом к CD20 (ритуксимаб) и/или QBEND-10.
Индивидуум (субъект)
Композиции и способы, предлагаемые в настоящем изобретении, можно применять для лечения индивидуума, для которого установлено присутствие патологических клеток или тканей, экспрессирующих CD22, или у которого ожидается присутствие патологических клеток или тканей, экспрессирующих CD22. Например, пациенты, на которых может оказывать благоприятное действие лечение, предлагаемое в изобретении, включают пациентов с B-ALL или CLL, рефракторным B-ALL, рецидивирующим B-ALL.
В предпочтительном варианте осуществления изобретения пациенты представляют собой детей, страдающих B-ALL, рецидивирующим B-ALL, рефракторным B-ALL (педиатрическое показание).
Лечение с помощью сконструированных иммунных клеток, предлагаемых в изобретении, можно осуществлять в сочетании с применением одного или нескольких типов противораковой терапии, выбранных из группы, включающей терапию на основе антител, химиотерапию, цитокиновую терапию, терапию с использованием дендритных клеток, генную терапию, гормональную терапию, свето-лазерную терапию и лучевую терапию.
Таким образом, в настоящем изобретении предложена фармацевтическая композиция, содержащая в терапевтически эффективном количестве UCART 22, предназначенная для лечения детей, страдающих В-ALL, рецидивирующим В-ALL, рефракторным B-ALL.
В настоящем изобретении предложена фармацевтическая композиция, содержащая UCART 22 и фармацевтически приемлемый эксципиент, предназначенная для лечения детей, страдающих B-ALL, рецидивирующим В-ALL, рефракторным B-ALL.
В предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит UCART 22, предлагаемую в изобретении, и соединение из семейства бриостатинов, предпочтительно бриостатин-1, фармацевтически приемлемый эксципиент, предназначенная для лечения детей, страдающих B-ALL, рецидивирующим B-ALL, рефракторным В-ALL.
Согласно предпочтительному варианту осуществления изобретения указанное лечение можно применять для пациентов, подвергающихся иммуносупрессивному лечению (кондиционированное лечение), более предпочтительно лимфодеплеции. Таким образом, настоящее изобретение предпочтительно относится к клеткам или популяции клеток, которым придана устойчивость по меньшей мере к одному иммуносупрессивному агенту путем инактивации гена, кодирующего рецептор для указанного иммуносупрессивного агента. В этом аспекте иммуносупрессивное лечение или лимфодеплеция должно способствовать селекции и размножению Т-клеток, предлагаемых в изобретении, в организме пациента и деструкции экспрессирующих CD22 раковых клеток.
Введение клеток или популяции клеток, предлагаемых в настоящем изобретении, можно осуществлять любым пригодным методом, включая ингаляцию аэрозоля, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. Композиции, представленные в настоящем описании, можно вводить пациенту подкожно, внутрикожно, внутрь опухоли, интранодально, интрамедуллярно, внутримышечно, путем внутривенной или внутрилимфатической инъекции или внутрибрюшинно. В одном из вариантов осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, предпочтительно вводят путем внутривенной инъекции.
Введение клеток или популяции клеток может заключаться во введении 104-109 клеток/кг веса тела, предпочтительно от 105 до 106 клеток/кг веса тела, включая все целочисленные количества клеток в указанных диапазонах. Клетки или популяцию клеток можно вводить в виде одной или нескольких доз предпочтительно нескольких последующих доз (повторяющееся дозирование) во избежание ускользания (от иммунологического надзора) (рецидивирующие клетки). В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде однократной дозы или доз. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде более чем одной дозы в течение некоторого периода времени.
График введения находится в компетенции лечащего врача и зависит от клинического состояния пациента.
Клетки или популяцию клеток можно получать из любого источника, такого как банк крови или донор. Поскольку индивидуальные потребности варьируются, определение оптимальных диапазонов эффективных количеств рассматриваемого типа клеток для конкретного заболевания или конкретных состояний, находится в компетенции специалиста в данной области. Эффективное количество представляет собой количество, которое обеспечивает терапевтическое или профилактическое полезное действие. Вводимая доза должна зависеть от возраста, состояния здоровья и веса реципиента, вида одновременно применяемого лечения, если это имеет место, частоты обработки и природы требуемого действия.
Предлагаемую в настоящем изобретении UCART 22 создают так, чтобы она была эффективной, но не активировала и ограничивала цитокиновый шторм. В случае сверхчувствительных пациентов настоящее изобретение можно объединять с соответствующим медицинским лечением для предупреждения или блокады цитокинового шторма, таким как применение лекарственных средств против IL-6.
В другом варианте осуществления изобретения клетки или композицию, содержащую эти клетки, вводят в указанном эффективном количестве парентерально. Указанное введение может представлять собой внутривенное введение. Указанное введение можно осуществлять непосредственно путем инъекции в опухоль.
В некоторых вариантах осуществления настоящего изобретения клетки вводят пациенту в сочетании с осуществлением (например, до, одновременно или после) любого количества соответствующих вариантов лечения, включая (но не ограничиваясь только ими) лечение с помощью средств противовирусной терапии, таких как цидофовир и интерлейкин-2, цитарабин (известный также под названием ARA-C), или лечение натализумабом пациентов с MS (рассеянный склероз), или лечение эфализумабом пациентов с псориазом, или другие виды лечения пациентов с PML (прогрессирующая многоочаговая лейкоэнцефалопатия). В других вариантах осуществления изобретения Т-клетки, предлагаемые в изобретении, можно применять в сочетании с химиотерапией, лучевой терапией, иммуносупрессивными агентами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммунодеструктивными агентами, такими как кэмпас, алемтузумаб, антитела к CD3, или с другими видами терапии на основе антител, цитоксином, флударибином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и облучением. Эти лекарственные средства ингибируют или кальций-зависимую фосфатазу, кальцинеурин (циклоспорин и FK506), или ингибируют киназу p70S6, которая важна для индуцируемой фактором роста передачи сигнала (рапамицин) (Henderson, Naya и др., 1991; Liu, Albers и др., 1992; Bierer, Hollander и др., 1993).
В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят пациенту в сочетании с (например, до, одновременно или после) трансплантацией костного мозга, Т-клеточной абляционной терапией с использованием либо химиотерапевтических средств, таких как флударабин, либо внешней лучевой терапии (XRT), циклофосфамида, либо антител, таких как ОКТ3 или Кэмпас. В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят после осуществления В-клеточной абляционной терапии с использованием агентов, которые взаимодействуют с CD20, таких, например, как ритуксан или QBEND-10. Например, в одном из вариантов осуществления изобретения индивидуумов можно подвергать стандартной обработке химиотерапевтическими средствами в высокой дозе с последующей трансплантацией клеток периферической крови. В некоторых вариантах осуществления изобретения после трансплантации индивидуумам вводят путем инфузии размноженные иммунные клетки, предлагаемые в настоящем изобретении. В еще одном варианте осуществления изобретения размноженные клетки вводят до или после хирургического вмешательства.
В другом варианте осуществления после трансплантации индивидууму вводят агент, который взаимодействует с CD20, например, ритуксан или ритиксимаб, предпочтительно в сочетании с агентом, который взаимодействует с CD22 и CD20.
Другие определения
- Аминокислотные остатки в полипептидной последовательности обозначают в настоящем описании с помощью однобуквенного кода, согласно которому, например, Q обозначает Gln или остаток глутамина, R обозначает Arg или остаток аргинина и D обозначает Asp или остаток аспарагиновой кислоты.
- Аминокислотная замена обозначает замену одного аминокислотного остатка на другой, например, замена остатка аргинина на остаток глутамина в пептидной последовательности представляет собой аминокислотную замену.
- Нуклеотиды обозначают следующим образом: однобуквенный код используют для обозначения основания нуклеозида: а обозначает аденин, t обозначает тимин, с обозначает цитозин и g обозначает гуанин. Для вырожденных нуклеотидов r обозначает g или а (пуриновые нуклеотиды), k обозначает g или t, s обозначает g или с, w обозначает а или t, m обозначает а или с, у обозначает t или с (пиримидиновые нуклеотиды), d обозначает g, а или t, v обозначает g, а или с, b обозначает g, t или с, h обозначает а, t или сип обозначает g, a, t или с.
- В контексте настоящего описания понятия «нуклеиновая кислота» или «полинуклеотиды» относятся к нуклеотидам и/или полинуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), олигонуклеотидам, фрагментам, созданным с помощью полимеразной цепной реакции (ПЦР), и фрагментам, созданным путем лигирования, расщепления, обработки эндонукле азами и обработки экзонуклеазами. Молекулы нуклеиновой кислоты могут состоять из мономеров, которые являются встречающимися в естественных условиях нуклеотидами (такими как ДНК или РНК) или аналогами встречающихся в естественных условиях нуклеотидов (например, энантиомерными формами встречающихся в естественных условиях нуклеотидов), или представляют собой их комбинацию. Модифицированные нуклеотиды могут иметь изменения в сахарных фрагментах и/или во фрагментах, содержащих пиримидиновые или пуриновые основания. Модификации Сахаров включают, например, замену одной или нескольких гидроксильных групп на галогены, алкильные группы, амины и азидогруппы, или сахара могут быть функционализированы до простых или сложных эфиров. Кроме того, весь сахарный фрагмент может быть заменен стерически и электронно сходными структурами, такими как аза-сахара и карбоциклические аналоги Сахаров. Примерами модификаций во фрагменте, представляющем собой основание, могут служить алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие хорошо известные гетероциклические заместители. Мономеры нуклеиновой кислоты могут быть сшиты фосфодиэфирными связями или аналогами таких связей. Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными.
- Под химерным антигенным рецептором (CAR) подразумевают молекулы, в которых объединен связывающий домен, направленный против компонента, присутствующего на клетке-мишени, например, присущую антителу специфичность в отношении требуемого антигена (например, опухолевого антигена), с активирующим Т-клеточный рецептор внутриклеточным доменом, в результате чего образуется химерный белок, обладающий специфической клеточной иммунной активностью в отношении мишени. Как правило, CAR состоит из внеклеточного одноцепочечного антитела (scFvFc), слитого с внутриклеточным сигнальным доменом дзета-цепи комплекса Т-клеточный антиген-рецептор (scFvFc:ζ), и при экспрессии в Т-клетках он обладает способностью перенаправлять распознавание антигена благодаря специфичности моноклонального антитела. Одним из примеров CAR, применяемого в настоящем изобретении, является CAR, направленный против антигена CD22, и он может, например, содержать (но не ограничиваясь только ими) аминокислотные последовательности: SEQ ID NO: 15-18, предпочтительно SEQ ID NO: 16 или 18, более предпочтительно SEQ ID NO: 16.
- Понятие «эндонуклеаза» относится к ферменту дикого типа или его варианту, обладающему способностью катализировать гидролиз (расщепление) связей между нуклеиновыми кислотами в молекуле ДНК или РНК, предпочтительно в молекуле ДНК. Эндонуклеазы не расщепляют молекулу ДНК или РНК независимо от ее последовательности, но они распознают и расщепляют молекулу ДНК или РНК в специфических полинуклеотидных последовательностях, в дальнейшем обозначенных как «последовательности-мишени» или «сайты-мишени». Эндонуклеазы можно классифицировать как редко расщепляющие Эндонуклеазы, для которых, как правило, полинуклеотидный сайт распознавания имеет длину более 12 пар оснований (bp), более предпочтительно 14-55 пар оснований. Редко расщепляющие Эндонуклеазы значительно повышают гомологичную рекомбинацию (HR), индуцируя двухцепочечные разрывы ДНК (DSB) в определенном локусе (Perrin, Buckle и др., 1993; Rouet, Smih и др., 1994; Choulika, Perrin и др., 1995; Pingoud и Silva, 2007). Редко расщепляющие Эндонуклеазы могут представлять собой, например, хоминг-эндонуклеазу (Paques и Duchateau, 2007), химерную нуклеазу с цинковыми пальцами (ZFN), образованную слиянием сконструированных доменов «цинковых пальцев» с каталитическим доменом рестриктазы, такой как FokI (Porteus и Carroll, 2005), эндонуклеазу Cas9 из системы CRISPR (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012; Cong, Ran и др., 2013; Mali, Yang и др., 2013) или химическую эндонуклеазу (Eisenschmidt, Lanio и др., 2005; Arimondo, Thomas и др., 2006). В химических эндонуклеазах химический или пептидный расщепляющий компонент конъюгируют либо с полимером нуклеиновой кислоты, либо с другой ДНК, распознающей специфическую последовательность-мишень, тем самым обеспечивая направление расщепляющей активности на специфическую последовательность. Химические Эндонуклеазы включают также синтетические нуклеазы типа конъюгатов ортофенантролина, ДНК-расщепляющей молекулы и триплекс-образующих олигонуклеотидов (TFO), которые, как известно, связываются со специфическими последовательностями ДНК (Kalish и Glazer, 2005). Такие химические эндонуклеазы подпадают под понятие «эндонуклеаза» в контексте настоящего изобретения.
- Под «TALE-нуклеазой» (TALEN) понимают слитый белок, который состоит из связывающего нуклеиновую кислоту домена, как правило, происходящего из подобного активатору транскрипции эффектора (TALE), и одного нуклеазного каталитического домена для расщепления последовательности нуклеиновой кислоты-мишени. Каталитический домен предпочтительно представляет собой нуклеазный домен и более предпочтительно домен, обладающий эндонуклеазной активностью, например, типа I-TevI, ColE7, NucA и Fok-I. В конкретном варианте осуществления изобретения домен TALE может быть слит с мегануклеазой, например, типа I-CreI и I-OnuI, или ее функциональным вариантом. В более предпочтительном варианте осуществления изобретения указанная нуклеаза представляет собой мономерную TALE-нуклеазу. Мономерная TALE-нуклеаза представляет собой TALE-нуклеазу, которая не требует димеризации для специфического распознавания и расщепления, например, в виде слияний сконструированных повторов TAL с каталитическим доменом I-TevI, описанным в WO 2012/138927. Подобные активатору транскрипции эффекторы (TALE) представляют собой белки из видов бактерий рода Xanthomonas, содержащие несколько повторяющихся последовательностей, где каждый повтор содержит di-остатки (двойные остатки) в положениях 12 и 13 (RVD), обладающие специфичностью в отношении каждого нуклеотидного основания последовательности нуклеиновой кислоты-мишени. Связывающие домены, обладающие сходными модульными свойствами связывания нуклеиновых кислот по типу основание-с основанием («base-per-base») (MBBBD) могут быть получены также из новых модульных белков, недавно обнаруженных заявителями в различных видах бактерий. Преимущество новых модульных белков заключается в том, что они характеризуются большей вариабельностью последовательности, чем TAL-повторы. Предпочтительно RVD, ассоциированные с распознаванием различных нуклеотидов, представляют собой HD для распознавания С, NG для распознавания Т, NI для распознавания А, NN для распознавания G или A, NS для распознавания А, С, G или Т, HG для распознавания Т, IG для распознавания Т, NK для распознавания G, НА для распознавания С, ND для распознавания С, HI для распознавания С, HN для распознавания G, NA для распознавания G, SN для распознавания G или А и YG для распознавания Т, TL для распознавания А, VT для распознавания А или G и SW для распознавания А. В другом варианте осуществления изобретения имеющие решающее значение аминокислоты 12 и 13 можно изменять путем мутации на другие аминокислотные остатки для модуляции их специфичности в отношении нуклеотидов А, Т, С и G и, прежде всего, для повышения их специфичности. Ранее уже была описана TALE-нуклеаза, и ее применяют для стимуляции генного нацеливания и генных модификаций (Boch, Schoize и др., 2009; Moscou и Bogdanove, 2009; Christian, Cermak и др., 2010; Li, Huang и др., 2011). Сконструированные TAL-нуклеазы поступают в продажу под товарным знаком TALEN (фирма Cellectis, 8 rue de la Croix Jarry, 75013, Париж, Франция).
Редко расщепляющая эндонуклеаза, предлагаемая в настоящем изобретении, может представлять собой также эндонуклеазу Cas9, эндонуклеазу с «цинковыми пальцами», эндонуклеазу MegaTAL. В последние годы был разработан новый инструмент для генетической инженерии на основе РНК-направляемой нуклеазы Cas9 (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012; Cong, Ran и др., 2013; Mali, Yang и др., 2013) из адаптивной иммунной системы CRISPR (короткие палиндромные повторы, регулярно расположенные группами (Clustered Regularly Interspaced Short palindromic Repeats)) типа II прокариот (см. обзор Sorek, Lawrence и др., 2013). CRISPR-ассоциированная (Cas) система впервые была обнаружена в бактериях, и ее функция состоит в защите от чужой вирусной или плазмидной ДНК. При осуществлении опосредуемой CRISPR генетической инженерии сначала проводят отбор последовательности-мишени, часто фланкированной короткой последовательностью мотива, который обозначают как примыкающий к протоспейсеру мотив (РАМ). После отбора последовательности-мишени конструируют специфическую crPHK (CRISPR-РНК), комплементарную указанной последовательности-мишени. Для систем CRISPR типа II требуется транс активирующая crРНК (tracrРНК), спаренная с crRNA и связанная с внесенным белком Cas9. Cas9 функционирует в качестве молекулярного якоря, облегчающего спаривание оснований tracРНК с сРНК (Deltcheva, Chylinski и др., 2011). В этом тройном комплексе двойная структура tracrРНК:crРНК функционирует в качестве гидовой РНК, которая направляет эндонуклеазу Cas9 к когнатной последовательности-мишени. Распознавание мишени комплексом Cas9-tracrРНК:crРНК инициируется путем сканирования последовательности-мишени для обнаружения гомологии между последовательностью-мишенью и crРНК. Помимо комплементарности последовательности-мишени и crРНК, таргетирование ДНК требует присутствия короткого мотива; примыкающего к протоспейсеру (примыкающий к протоспейсеру мотив - РАМ). После спаривания двойной РНК и последовательности-мишени Cas9 интродуцирует «тупой» двухцепочечный разрыв на расстоянии 3 пар оснований в обратном направлении относительно мотива РАМ (Garneau, Dupuis и др., 2010).
Редко расщепляющая эндонуклеаза может представлять собой хоминг-эндонуклеазу, также известную под названием мегануклеаза. Такие хоминг-эндонуклеазы хорошо известны в данной области (Stoddard, 2005). Хоминг-эндонуклеазы распознают последовательность ДНК-мишени и создают одноцепочечный или двухцепочечный разрыв. Хоминг-эндонуклеазы обладают высокой специфичностью, распознавая сайты ДНК-мишени длиной от 12 до 45 пар оснований (bp), как правило, длиной от 14 до 40 пар оснований. Хоминг-эндонуклеаза, предлагаемая в изобретении, может соответствовать, например, эндонуклеазе LAGLIDADG, эндонуклеазе HNH или эндонуклеазе GIY-YIG. Предпочтительно хоминг-эндонуклеаза, предлагаемая в настоящем изобретении, может представлять собой вариант I-CreI.
- Под «вектором для доставки» или «векторами для доставки» понимают любой обеспечивающий доставку вектор, который можно применять согласно настоящему изобретению для приведения в контакт с клеткой (т.е. для «контактирования») или доставки внутрь клетки или в субклеточные компартменты (т.е. для «интродукции») агентов/химических веществ и молекул (белков или нуклеиновых кислот), требующихся для осуществления настоящего изобретения. К ним относятся (но не ограничиваясь только ими) липосомальные векторы для доставки, вирусные векторы для доставки, векторы для доставки лекарственного средства, химические носители, полимерные носители, липоплексы, полиплексы, дендримеры, микропузырьки (ультразвуковые контрастные агенты), наночастицы, эмульсии или другие пригодные векторы для переноса. Такие векторы для доставки позволяют доставлять молекулы, химические вещества, макромолекулы (гены, белки) или другие векторы, такие как плазмиды, пептиды, разработанные фирмой Diatos. В этих случаях векторы для доставки представляют собой молекулы-носители. Под «вектором для доставки» или «векторами для доставки» понимают также методы доставки, предназначенные для осуществления трансфекции.
- Понятия «вектор» или «векторы» относятся к молекуле нуклеиновой кислоты, обладающей способностью транспортировать другую нуклеиновую кислоту, с которой она сцеплена. К «векторам», применяемым согласно настоящему изобретению, относятся (но не ограничиваясь только ими) вирусный вектор, плазмида, РНКовый вектор или молекула линейной или кольцевой ДНК или РНК, которые могут состоять из хромосомальных, нехромосомальных, полусинтетических или синтетических нуклеиновых кислот. Предпочтительными векторами являются векторы, которые способны автономно реплицировать (эписомальный вектор) и/или экспрессировать нуклеиновые кислоты, с которыми они сцеплены (экспрессионные векторы). Специалистам в данной области известно большое количество пригодных векторов, которые поступают в продажу.
К вирусным векторам относятся ретровирус, аденовирус, парвовирус (например, аденоассоциированный вирус, прежде всего aav6), коронавирус, РНК-вирусы с негативной цепью, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства и вирус везикулярного стоматита), парамиксовирус (например, вирус кори и вирус Сендай), РНК-вирусы с позитивной цепью, такие как пикорнавирус и альфавирус, и вирусы с двухцепочечной ДНК, включая аденовирус, вирус герпеса (например, вирус герпеса простого типов 1 и 2, вирус Эпштейна-Барра, цитомегаловирус) и вирус оспы (например, вирус коровьей оспы, вирус оспы птиц и вирус оспы канарейки). Другие вирусы включают, например, вирус Норвалк, тогавирус, флавивирус, реовирусы, паповирус, гепаднавирус и вирус гепатита. Примерами ретровирусов являются: вирус птичьего лейкоза-саркомы, вирусы млекопитающих С-типа, В-типа, вирусы D-типа, группа HTLV-BLV, лентивирус, спумавирус (Coffin J. M., Retroviridae: The viruses and their replication, в: Fundamental Virology, 3-е изд., под ред. В. N. Fields и др., изд-во Lippmcott-Raven Publishers, Philadelphia, 1996).
- Под «лентивирусным вектором» подразумевают лентивирусные векторы на основе ВИЧ, которые являются очень перспективными с точки зрения доставки гена благодаря их относительно большой способности к упаковке, пониженной иммуногенности и их способности стабильно трансдуцировать с высокой эффективностью большой спектр различных типов клеток. Лентивирусные векторы, как правило, создают посредством кратковременной трансфекции клеток-продуцентов тремя (упаковывающая плазмида, оболочечная плазмида и плазмида для переноса) или большим количеством плазмид. Подобно ВИЧ, лентивирусные векторы проникают в клетку-мишень посредством взаимодействия гликопротеинов вирусной поверхности с рецепторами на клеточной поверхности. После проникновения вирусная РНК подвергается обратной транскрипции, опосредуемой комплексом вирусной обратной транскриптазы. Продуктом обратной транскрипции является двухцепочечная линейная вирусная ДНК, которая служит субстратом для вирусной интеграции в ДНК инфицированных клеток. Понятие «интегрирующие лентивирусные векторы (или LV)» обозначает, например (но не ограничиваясь только ими), такие векторы, которые способны интегрироваться в геном клетки-мишени. В противоположность этому, понятие «неинтегрирующие лентивирусные векторы (или NILV)» обозначает эффективные векторы для доставки генов, которые не интегрируются в геном клетки-мишени под действием вирусной интегразы.
- Векторы для доставки и векторы можно объединять или комбинировать с любыми методами клеточной пермеабилизации, такими как сонопорация или электропорация, или вариантами этих методов.
- Под клеткой или клетками подразумевают любые эукариотические живые клетки, первичные клетки и клеточные линии, происходящие из указанных организмов для получения культур in vitro.
- Под «первичной клеткой» или «первичными клетками» подразумевают клетки, взятые непосредственно из живой ткани (т.е. материал, полученный путем биопсии) и подготовленные для выращивания in vitro, в популяции которых имело место лишь небольшое количество удвоений, и следовательно они являются более репрезентативными с точки зрения основных функциональных компонентов и характеристик тканей, из которых они происходят, по сравнению с непрерывно поддерживаемыми или искусственно иммортализованными онкогенными клеточными линиями.
Примерами таких клеточных линий могут являться (но не ограничиваясь только ими) клеточные линии, выбранные из группы, состоящей из клеток СНО-K1; клеток HEK293; клеток Сасо2; клеток U2-OS; клеток NIH 3Т3; клеток NSO;
клеток SP2; клеток CHO-S; клеток DG44; клеток K-562; клеток U-937; клеток MRC5; клеток IMR90; клеток Jurkat; клеток HepG2; клеток HeLa; клеток НТ-1080; клеток НСТ-116; клеток Hu-h7; клеток Huvec; клеток Molt 4.
Все эти клеточные линии можно модифицировать с помощью способа, предлагаемого в настоящем изобретении, создавая модели клеточных линий для получения, экспрессии, количественной оценки, обнаружения, изучения представляющего интерес гена или белка; эти модели можно применять также для скрининга представляющих интерес биологически активных молекул для исследовательских и промышленных целей в различных областях, например, таких как (но не ограничиваясь только ими) химия, биотопливо, терапевтические средства и агрономия.
- Под «мутацией» подразумевают замену, делецию или инсерцию одного/одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, двадцати, двадцати пяти, тридцати, сорока, пятидесяти или большего количества нуклеотидов/аминокислот в полинуклеотидной (кДНК, ген) или полипептидной последовательности. Мутация может влиять на кодирующую последовательность гена или его регуляторную последовательность. Она может влиять также на структуру геномной последовательности или структуру/стабильность кодируемой мРНК.
- Под «вариантом(ами)» подразумевают вариант повтора, вариант, ДНК-связывающий вариант, вариант TALE-нуклеазы, вариант полипептида, полученный в результате мутации или замены по меньшей мере одного остатка в аминокислотной последовательности родительской молекулы.
- Под «функциональным вариантом» подразумевают обладающий каталитической активностью мутант белка или домена белка; такой мутант может обладать такой же активностью, что и родительский белок или домен белка, или дополнительными свойствами, или более высокой или более низкой активностью.
- Понятие «идентичность» относится к идентичности последовательностей двух молекул нуклеиновых кислот или полипептидов. Идентичность можно оценивать путем сравнения положений в каждой из последовательностей, которые можно выравнивать для целей сравнения. Если положение в сравниваемой последовательности занято тем же самым основанием, то молекулы являются идентичными в этом положении. Степень сходства или идентичности между двумя нуклеотидными или аминокислотными последовательностями является функцией количества идентичных или совпадающих нуклеотидов в положениях нуклеотидных последовательностей. Для расчета идентичности двух последовательностей можно использовать различные алгоритмы и/или программы сравнительного анализа первичной структуры последовательностей, включая FASTA или BLAST, которые доступны в виде компонента пакета программ анализа последовательностей GCG (Университет Висконсина, Мэдисон, шт. Висконсин), и их можно применять, например, с использованием задаваемых по умолчанию параметров. Например, можно рассматривать полипептиды, обладающие идентичностью, составляющей по меньшей мере 70%, 85%, 90%, 95%, 98% или 99%, с конкретными полипептидами, представленными в настоящем описании, и предпочтительно обладающие практически такими же функциями, а также полинуклеотиды, кодирующие такие полипептиды. Если специально не указано иное, то указанные в описании баллы сходства получены с использованием BLOSUM62. При использовании BLASTP процент сходства основан на рассчитанном программой BLASTP балле положительных оценок, а процент идентичности последовательностей основан на рассчитанном BLASTP балле идентичности. Рассчитанные с помощью BLASTP «идентичности» представляют собой количество и пропорцию идентичных остатков относительно общего количества остатков в парах последовательностей с высокими баллами; а рассчитанные с помощью BLASTP «положительные оценки» представляют собой количество и пропорцию остатков, для которых полученные при сравнительном анализе первичной структуры последовательностей баллы, являются положительными, и которые сходны друг с другом. В настоящей заявке предложены и подпадают под объем изобретения аминокислотные последовательности, имеющие указанные степени идентичности или сходства, или любую промежуточную степень идентичности или сходства с представленными в настоящем описании аминокислотными последовательностями. Полинуклеотидные последовательности сходных полипептидов выводят с использованием генетического кода и их можно получать с помощью общепринятых методов, в частности, путем обратной трансляции его аминокислотной последовательности с использованием генетического кода.
- Понятия «домен трансдукции сигнала» или «костимуляторный лиганд» относятся к молекуле на антигенпрезентирующей клетке, которая специфически связывается с когнатной костимуляторной молекулой на Т-клетке, обеспечивая тем самым сигнал, который в дополнение к первичному сигналу, обеспечиваемому, например, связыванием комплекса TCR/CD3 с молекулой ГКГС, загруженной пептидом, опосредует Т-клеточный ответ, включая (но не ограничиваясь только ими) активацию пролиферации, дифференцировку и т.п. Костимуляторным лигандом может служить (но не ограничиваясь только ими) CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимуляторный лиганд (ICOS-L), молекула межклеточной адгезии (ICAM, CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, рецептор лимфотоксина бета, 3/TR6, ILT3, ILT4, агонист или антитело, который/которое связывается с лигандом Толл-рецептора, и лиганд, который специфически связывается с В7-Н3). Из указанного перечня исключен CD28. Костимуляторный лиганд включает также, среди прочего, антитело, которое специфически связывается с костимуляторной молекулой, присутствующей на Т-клетке, такой как (но не ограничиваясь только ими) CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, PD-1, ICOS, ассоциированный с функцией лимфоцитов антиген-1 (LFA-1), CD2, CD7, LTGHT, NKG2C, В7-Н3, лиганд, который специфически связывается с CD83.
Понятие «костимуляторная молекула» относится к когнатному связывающему партнеру на Т-клетке, который специфически связывается с костимуляторным лигандом, опосредуя тем самым костимуляторный ответ клетки, такой как (но не ограничиваясь только им) пролиферация. Костимуляторные молекулы включают (но не ограничиваясь только ими) молекулу ГКГС класса I, BTLA и лиганд Толл-рецептора.
В контексте настоящего описания понятие «костимуляторный сигнал» относится к сигналу, который в сочетании с первичным сигналом, таким как сигнал, обусловленный сцеплением TCR/CD3, приводит к пролиферации Т-клеток и/или повышающей или понижающей регуляции имеющих решающее значение молекул.
- В контексте настоящего описания понятие «внеклеточный лигандсвязывающий домен» обозначает олиго- или полипептид, который обладает способностью связываться с лигандом. Предпочтительно домен должен обладать способностью взаимодействовать с молекулой клеточной поверхности. Например, можно выбирать внеклеточный лигандсвязывающий домен для распознавания лиганда, который функционирует в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием. Так, примерами маркеров клеточной поверхности, которые могут функционировать в качестве лигандов, являются маркеры, ассоциированные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и раковыми клетками.
В контексте настоящего описания понятие «индивидуум» или «пациент» включает всех представителей царства животных, в том числе приматов кроме человека и человека. В одном из вариантов осуществления изобретения пациенты представляют собой пациентов с агрессивным или рефрактерным или рецидивирующим ALL, или агрессивным рефрактерным рецидивирующим CLL.
Млекопитающее представляет собой любое теплокровное позвоночное животное из класса млекопитающих, предпочтительно человека.
«Домен суицида или переключатели» или «защитные переключатели включения и выключения» относится к домену, как правило, домену клеточной поверхности, распознаваемому молекулой, белком, химическим соединением, антителом для иммуноселекции экспрессии клеток и в итоге контроля их функционирования и выживаемости.
В представленном выше описании изобретения изложены подход и способ его осуществления и применения, так что любой специалист в данной области способен осуществлять и применять его, эта возможность относится, прежде всего, к сущности изобретения, изложенной в прилагаемой формуле изобретения, которая представляет собой составную часть исходного описания.
Если в настоящем описании указаны численные пределы или численный диапазон, то они включают их границы. Кроме того, считается, что включены все значения и поддиапазоны, находящиеся в указанных пределах или указанном численном диапазоне, как если бы они были специально указаны.
Приведенное выше описание представлено для того, чтобы дать возможность специалисту в данной области осуществлять и применять изобретение, и оно изложено в контексте конкретного применения и требуемых для этого условий. Специалистам в данной области должны быть очевидны различные модификации предпочтительных вариантов осуществления изобретения, и общие принципы, указанные в нем могут быть применены для других вариантов осуществления изобретения и применений без отклонения от сущности и объема изобретения. Таким образом, не следует считать, что настоящее изобретение ограничено представленными вариантами осуществления изобретения, напротив, оно соответствует наиболее широкому объему, согласующемуся с принципами и отличительными признаками, указанными в настоящем описании.
Общие методы
Скрининг и селекция CAR
Культуры первичных Т-клеток
Т-клетки очищают из образцов лейкоцитарных пленок, полученных на фирме EFS (Etablissement
Трансфекция мРНК CAR
Трансфекции мРНК CAR, кодирующими каждую из конструкций CAR, осуществляют в день 4 или день 11 после очистки и активации Т-клеток. Клетки немедленно разводят в среде X-Vivo™-15 (фирма Lonza) и инкубируют при 37°С в атмосфере с 5% СО2. IL-2 добавляют через 2 ч после электропорации в концентрации 20 нг/мл.
Трансдукция Т-клеток
Векторы, кодирующие CD22 CAR, интродуцируют в Т-клетки согласно описанному ранее методу.
Обнаружение CAR на поверхности Т-клеток осуществляют, используя рекомбинантный белок, который состоит из белка внеклеточного домена человеческого белка CD22 (цельный белок, дистальная область CD22 или проксимальная область CD22), слитого с Fc-фрагментом мышиного IgG1. Связывание указанного белка с молекулой CAR определяют с помощью конъюгированного с РЕ вторичного антитела (фирма Jackson Immunoresearch), таргетирующего мышиный Fc-фрагмент белка, и анализируют с помощью проточной цитометрии.
Инактивация специфического(их) гена(ов) в первичных Т-клетках
Инактивацию специфического(их) гена(ов) в первичных Т-клетках можно осуществлять до, но предпочтительно после интродукции CD22 CAR в клетки, используя эндонуклеазы, такие как TAL-эндонуклеаза, необязательно Crispr Cas 9 эндонуклеазы, созданные соответствующим образом. По меньшей мере инактивируют один ген, один, два или три гена можно инактивировать на одной стадии или на нескольких последовательных стадиях. В предпочтительном варианте осуществления изобретения инактивируют два гена, предпочтительно ген ТСRальфа и ген, делеция которого придает устойчивость к лекарственному средству, выбранному из аналогов пуриновых нуклеотидов, алемтузумаба, препаратов платины (цисплатин или карбоплатин), антитела к топоизомеразе I (иринотекан), антитела к топоизомеразе II (этопозид), метотрексату (аналоги фолиевой кислоты), предпочтительно аналогов пуриновых нуклеотидов, алемтузумаба.
В целом, создают и получают гетеродимерную нуклеазу, в частности TALE-нуклеазу, таргетирующую в гене-мишени две длинные последовательности (называемые полумишениями), разделенные спейсером.
Каждую конструкцию TALE-нуклеазы можно клонировать в соответствующем экспрессионном векторе для клеток млекопитающих. мРНК, кодирующую TALE-нуклеазу, которая расщепляет таргетированную геномую последовательность, можно синтезировать из плазмиды, несущей кодирующую последовательность в прямом направлении относительно промотора. Применяют очищенные Т-клетки, предварительно активированные покрытыми анти-CD3/CD28 гранулами, и трасфектированные каждой из двух мРНК, кодирующих обе половины TALE-нуклеаз. Клетки можно реактивировать растворимым антителом к CD28 для оценки пролиферации клеток в различные моменты времени и определять маркер активации CD25 для оценки статуса активации клеток.
• Анализ дегрануляции (мобилизация CD107a)
Клетки инкубируют в 96-луночных планшетах вместе с равным количеством клеток, экспрессирующих различные уровни таргетируемого белка (CD22). Совместные культуры поддерживают в течение 6 ч при 37°С в атмосфере с 5% СО2. Окрашивание CD107a осуществляют в процессе стимуляции клеток, добавляя флуоресцентное антитело к CD107a в начале совместного культивирования, вместе с антителом к CD49d, антителом к CD28 и 1-кратным раствором монензина в качестве контроля. После периода инкубации, составляющего 6 ч, клетки окрашивают фиксирующим витальным красителем и конъюгированным с флуорохромом антителом к CD8 и анализируют с помощью проточной цитометрии. Дегранулирующую активность определяют в виде % CD8+/CD107a+-клеток и на основе определения средней интенсивности сигнала флуоресцении (MFI) при окрашивании CD107a в популяции CD8+-клеток. Анализы дегрануляции осуществляют через 24 ч после трансфекции мРНК.
• Анализ высвобождения IFN гамма
Через 24 ч после трансфекция мРНК экспрессирующие CD22 CAR Т-клетки инкубируют вместе с клеточными линиями, которые экспрессируют различные уровни таргетируемого белка, в течение 24 ч при 37°С. Супернатанты выделяют и осуществляют определение IFN гамма в супернатантах клеточных культур с помощью ELISA-анализа.
• Анализ цитотоксичности
Клетки инкубируют вместе с клетками-мишенями (экспрессирующими различные уровни CD22) или с клетками (представляющими собой отрицательный контроль). Клетки-мишени и контрольные клетки метят флуоресцентными внутриклеточными красителями (CFSE или Cell Trace Violet) перед их совместным культивированием с CAR+-T-клетками. Совместные культуры инкубируют в течение 4 ч при 37°С. После указанного периода инкубации клетки метят фиксирующим витальным красителем и анализируют с помощью проточной цитометрии. Определяют жизнеспособность каждой клеточной популяции (клетки-мишени или клетки, применяемые в качестве отрицательного контроля) и рассчитывают % специфического (удельного) клеточного лизиса. Анализы цитотоксичности осуществляют через 48 ч после трансфекции мРНК.
• Мышиная модель для оценки противоопухолевого действия Мышам с иммунодефицитом имплантируют опухолевые клетки (CD22 В-ALL из пациентов) или клетки, экспрессирующие комплекс таргетируемый белок-люцифераза, в боковую область. Затем клетки имплантируют в головной мозг мышей. Серийная трансплантация в последующие поколения мышей продолжают поддерживать клеточные линии, трансплантированные in vivo Необязательно мышей подвергают противораковой обработке до/или одновременно с инъекцией CAR+ Т-клеток (алемтузумаб и/или flu). Затем мышам инъецируют iv (либо через 2, либо через 7 дней после инъекции линии опухолевых клеток) в различных дозах подлежащие тестированию CAR+ Т-клетки или Т-клетки, которые не экспрессируют CD22 CAR. Биолюминесцентые сигналы определяют в день инъекции Т-клеток (D0), в D7, 14, 21, 28 и 40 после инъекции Т-клеток, для отслеживания развития опухолей у различных животных.
Фаза I исследования с эскалацией доз для оценки безопасности, размножения и персистентности аллогенных CD22 CART (UCART 22) у пациентов с рецидивирующим или рефрактерным или MRD+ CD22+ В-клеточным острым лимфобластным лейкозом (В-ALL)
Предпосылки и логическое обоснование
При применении современных химиотерапевтических режимов с использованием нескольких лекарств длительная продолжительность выживания обнаружена у >80% детей, страдающих острым лимфобластным лейкозом (ALL) и примерно у 40% взрослых с ALL (1). Не доказана эффективность дополнительной интенсификации химиотерапии (2). В последние несколько лет достигнуты значительные успехи в понимании биологии ALL, которые привели к возможности применения «таргетной терапии» (3, 4).
Рецидивирующий/рефрактерный ALL остается проблемным заболеванием. Терапии после рецидивов могут приводить к вторичному CR (полный ответ) (CR2) у 30-40% пациентов с достижением 5-летней OS (общей выживаемости) лишь 10%. В сообщении о самом масштабном к настоящему времени исследовании взрослых пациентов с рецидивирующим ALL Fielding с коллегами проанализировали конечные результаты (исходы) для взрослых пациентов с рецидивирующим ALL, которых лечения в соответствии с исследованием MRC UKALLXII/ECOG Е2993 (5). Из 1508 исследуемых пациентов у 1372 (91%) был достигнут CR1, из которых у 609 (44% из дающих CR1-ответ пациентов) медиана рецидива составляла 11 месяцев. 5-летня OS достигалась только у 7% пациентов с рецидивом болезни. Медианная OS для пациентов с рецидивом болезни составляла 5,5 месяца. Tavernier с коллегами описали конечные результаты для 421 страдающего ALL пациента, на которых впервые изучено лечение рецидива в исследовании French LALA-94 (6). CR2 был достигнут у 44% пациентов, при этом медианная DFS (безрецидивная выживаемость) составляла 5,2 месяца и медианная OS составляла 6,3 месяца. Oriol с коллегами описали конечные результаты для 263 страдающих ALL пациентов, на которых впервые изучено лечение рецидива, полученные в 4 последовательных исследованиях РЕТНЕМА (7), CR2 был достигнут у 45% пациентов, уровень, аналогичный полученному в исследованиях French LALA. Медианная OS после рецидива составляла 4,5 месяца, 5-летняя OS достигалась у 10%.
Экспрессия CD22 обнаружена у >90% пациентов с ALL, и он является ценной терапевтической мишенью. Клеточные терапии, такие как терапии с использованием экспрессирующих химерный антигенный рецептор (CAR) Т-клеток, все шире используются для лечения пациентов с гематологическими злокачественными заболеваниями (8-16). У пациентов с рецидивирующим острым лимфобластным лейкозом (ALL) описан очень высокий уровень полного ответа (80-90%) при применении аутологичных CD19-CART-клеток (12). Аналогично этому уровень ответа, составляющий 40-50%, обнаружен у пациентов с рецидивирующим хроническим лимфоцитарным лейкозом (CLL), которых подвергали терапиям на основе аутологичных CD19 CART (9).
В настоящем опыте исследовали аллогенные CART-клетки, мишенью которых является CD22, для пациентов с рецидивирующим и/или рефрактерным CD22 B-ALL.
Задачи
Первичные задачи
Оценка безопасности и переносимости аллогенных CD22 CART и определение максимальной переносимой дозы (MTD).
Вторичные задачи
Определение эффективности аллогенных CD22 CART. Определение частоты встречаемости GVHD.
Исследовательские задачи
Определение способности к размножению, фенотипа, транспортировки и персистентности введенных путем инфузии CART-клеток.
Критерии включения
1. Рецидивирующий или рефрактерный CD22-позитивный ALL (для расширения фазы: допустимо включение пациентов с MRD+ -заболеванием).
2. Пациенты возрастом ≥2 лет.
3. Оценка общего состояния пациента с использованием шкалы ECOG ≤2.
4. Нормальная функция органов, включая билирубин ≤2 мг/дл, ALT/AST ≤3×ULN и креатинин ≤2 мг/дл.
5. Фракция выброса левого желудочка (LVEF)≥40%.
Критерии исключения
1. Пациентка является беременной или кормящей грудью.
2. Пациенты с неконтролируемыми активными инфекциями.
3. Изолированный экстрамедуллярный рецидив (т.е. яички, ЦНС).
4. Известно наличие активного лейкоза ЦНС.
Примечание: Пациентов с заболеванием ЦНС в анамнезе, лечение которых было эффективным, можно включать в опыт при условии, что у них ремиссия ЦНС наблюдается в течение >4 недель перед включением
5. Активный гепатит В или активный гепатит С.
6. ВИЧ-инфекция.
7. Активная реакция GVHD, требующая системной стероидной терапии. Стероидная терапия для физиологического замещения является приемлемой.
8. Получающие DLI (аллогенная родственная инфузия) в течение 4 недель инфузии CD22 CART.
9. Алло-SCT (трансплантация аллогенных гематопоэтических стволовых клеток) в течение 60 дней инфузии CD22 CART.
Описание опыта
Опыт относится к фазе I исследования. Осуществляли 2 фазы этого исследования. Осуществляли эскалацию доз и расширение числа пациентов.
Пациенты получали аллогенные CD22 CART после лимфодеплеционной химиотерапии.
Эскалация доз: четыре уровня доз изучали согласно стандартной схеме 3×3. В целом, включено 9-18 пациентов.

После того, как идентифицирован уровень R2PD, начинали опыт с расширением числа пациентов.
Затем в опыт включали в целом 20 пациентов (10 R/R ALL; 10 MRD+ пост-SCT).
Общий размер выборки: 29-38 пациентов.

Второй опыт включал аллогенные CART-клетки, мишенью которых является CD22, и аллогенные CART-клетки, мишенями которых являются CD22 и CD19 (2 формы), проведенный на пациентах с CD19+ CD22+ В-ALL.
Задачи
Первичные задачи
Оценка безопасности и переносимости аллогенных CD19+ CD22 CART и определение максимальной переносимой дозы (MTD).
Вторичные задачи
Определение эффективности аллогенных CD22 CART. Определение частоты встречаемости GVHD.
Исследовательские задачи
Определение способности к размножению, фенотипа, транспортировки и персистентности введенных путем инфузии CART-клеток.
Критерии включения
1. Рецидивирующий или рефрактерный CD22-позитивный ALL (для расширения фазы: допустимо включение пациентов с MRD+ -заболеванием).
2. Пациенты возрастом ≥2 лет.
3. Оценка общего состояния пациента с использованием шкалы ECOG ≤2.
4. Нормальная функция органов, включая билирубин ≤2 мг/дл, ALT/AST <3×ULN и креатинин ≤2 мг/дл.
5. Фракция выброса левого желудочка (LVEF)≥40%.
Критерии исключения
1. Пациентка является беременной или кормящей грудью.
2. Пациенты с неконтролируемыми активными инфекциями.
3. Изолированный экстрамедуллярный рецидив (т.е. яички, ЦНС).
4. Известно наличие активного лейкоза ЦНС.
Примечание: Пациентов с заболеванием ЦНС в анамнезе, лечение которых было эффективным, можно включать в опыт при условии, что у них ремиссия ЦНС наблюдается в течение>4 недель перед включением
5. Активный гепатит В или активный гепатит С.
6. ВИЧ-инфекция.
7. Активная реакция GVHD, требующая системной стероидной терапии. Стероидная терапия для физиологического замещения является приемлемой.
8. Получающие DLI в течение 4 недель инфузии CD22 CART.
9. Алло-SCT в течение 60 дней инфузии CD22 CART.
Описание опыта
Опыт относится к фазе I исследования. Осуществляли 2 фазы этого исследования. Осуществляли эскалацию доз и расширение числа пациентов.
Пациенты получали аллогенные CD22 CART после лимфодеплеционной химиотерапии.
Эскалация доз: четыре уровня доз изучали согласно стандартной схеме 3×3. В целом, включено 9-18 пациентов.

После того, как идентифицирован уровень R2PD, начинали опыт с расширением числа пациентов.
Затем в опыт включали в целом 20 пациента (10 R/R ALL; 10 MRD+ пост-SCT).
Общий размер выборки: 29-38 пациентов.

Ссылки
1. Inaba Н., Greaves М., Mullighan C.G., Acute lymphoblastic leukaemia. Lancet. 381(9881), 2013, cc. 1943-1955.
2. Faderl S., Thomas D.A., O'Brien S., Ravandi F., Garcia-Manero G., Borthakur G. и др., Augmented hyper-CVAD based on dose-intensified vincristine, dexamethasone, and asparaginase in adult acute lymphoblastic leukemia salvage therapy. Clin Lymphoma Myeloma Leuk. 11(1), 2011, cc. 54-59.
3. Mullighan C.G., Genome sequencing of lymphoid malignancies. Blood. 122(24), 2013, cc. 3899-3907.
4. Mullighan C.G., Genomic characterization of childhood acute lymphoblastic leukemia. Semin Hematol. 50(4), 2013, cc. 314-324.
5. Fielding A.K., Richards S.M., Chopra R., Lazarus H.M., Litzow M.R., Buck G., и др., Outcome of 609 adults after relapse of acute lymphoblastic leukemia (ALL); an MRC UKALL12/ECOG 2993 study. Blood. 109(3), 2007, cc. 944-950.
6. Tavernier E., Boiron J.M., Huguet F., Bradstock K., Vey N., Kovacsovics Т. и др., Outcome of treatment after first relapse in adults with acute lymphoblastic leukemia initially treated by the LALA-94 trial. Leukemia: official journal of the Leukemia Society of America, Leukemia Research Fund, U.K. 21(9), 2007, cc. 1907-1914.
7. Oriol A., Vives S., Hernandez-Rivas J.M., Tormo M., Heras I., Rivas С.и др., Outcome after relapse of acute lymphoblastic leukemia in adult patients included in four consecutive risk-adapted trials by the PETHEMA Study Group.Haematologica. 95(4), 2010, cc. 589-596.
8. Kochenderfer J.N., Wilson W.H., Janik J.E., Dudley M.E., Stetler-Stevenson M., Feldman S.A. и др., Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood. 116(20), 2010, cc. 4099-4102.
9. Porter D.L., Levine B.L., Kalos M., Bagg A., June C.H., Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med. 365(8), 2011, cc. 725-733.
10. Brentjens R.J., Davila M.L., Riviere I., Park J., Wang X., Cowell L.G. и др., CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci Transl Med. 5(177), 2013, 177ra38.
11. Grupp S.A., Kalos M., Barrett D., Aplenc R., Porter D.L., Rheingold S.R. и др., Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med. 368(16), 2013, cc. 509-518.
12. Maude S.L., Teachey D.T., Porter D.L., Grupp S.A., CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Blood. 125(26), 2015, cc. 4017-4023.
13. Park J.H., Geyer M.B., Brentjens R.J., CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date. Blood. 127(26), 2016, cc. 3312-3320.
14. Lee D.W., Kochenderfer J.N., Stetler-Stevenson M., Cui Y.K., Delbrook C, Feldman S.A. и др., T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet. 385(9967), 2015, cc. 517-528.
15. Kochenderfer J.N., Dudley M.E., Kassim S.H., Somerville R.P., Carpenter R.O., Stetler-Stevenson M. и др., Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor. J Clin Oncol. 33(6), 2015, cc. 540-549.
16. Kebriaei P., Singh H., Huls M.H., Figliola M. J., Bassett R., Olivares S. и др., Phase I trials using Sleeping Beauty to generate CD19-specific CAR T cells. J Clin Invest. 126(9), 2017, cc. 3363-3376.
Примеры
Пример 1: Пролиферация клеток с инактивированным TCRальфа, экспрессирующих CD22-CAR
Конструировали и получали гетеродимерную TALE-нуклеазу, таргетирующую две последовательности длиной 17 пар оснований (которые обозначали как полумишени), разделенные состоящим из 15 пар оснований спейсером в гене константной области альфа-цепи Т-клеточного рецептора (TRAC). Каждая из полумишеней распознавалась повторами половин TALE-нуклеаз, представленными в таблице 6.
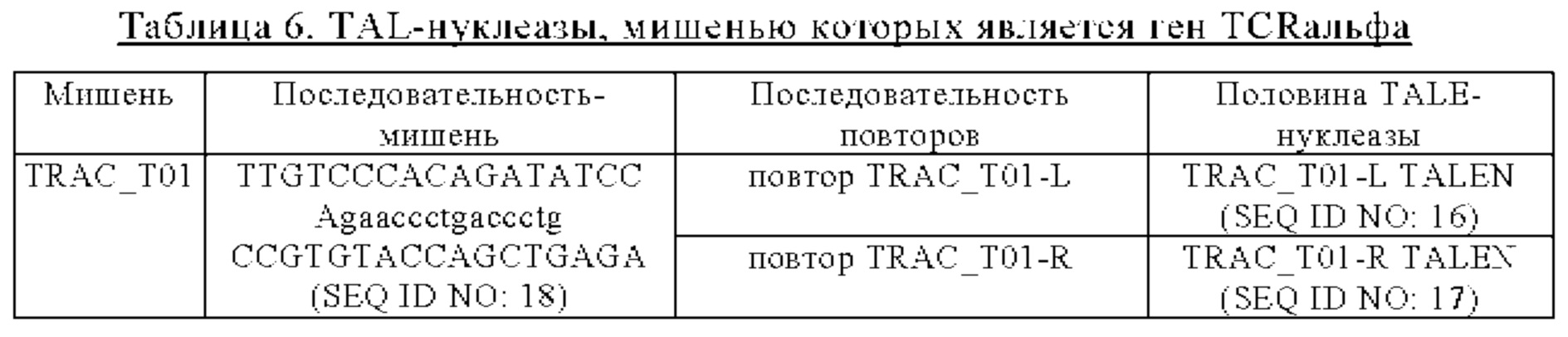
Каждую конструкцию TALE-нуклеазы субклонировали с использованием расщепления рестриктазами в экспрессионном векторе для клеток млекопитающих под контролем промотора Т7. мРНК, кодирующую TALE-нуклеазу, расщепляющую геномную последовательность TRAC, синтезировали с использованием плазмиды, несущей кодирующую последовательность, расположенную в прямом направлении относительно промотора Т7.
Очищенные Т-клетки, предварительно активированные в течение 72 ч покрытыми антителами к CD3/CD28 гранулами, трансфектировали каждой из 2 мРНК, кодирующих обе половины TRAC_T01 TALE-нуклеаз. Через 48 ч после трансфекции различные группы Т-клеток из одного и того же донора соответственно трансдуцировали вектором, кодирующим один из ранее описанных CD22 CAR, предлагаемых в изобретении. Через 2 для после трансдукции CD3-NEG-клетки очищали с использованием покрытых антителом к CD3 магнитных гранул и через 5 дней после трансдукции клетки реактивировали растворимым антителом к CD28 (5 мкг/мл).
Мониторинг клеточной пролиферации осуществляли в течение периода времени вплоть до 30 дней после реактивации, подсчитывая количество клеток 2 раза в неделю. Пролиферация клеток с инактивированным TCR альфа, экспрессирующих CD22 CAR, оказалась сопоставимой с пролиферацией неактивированных клеток и существенно возрастала в том случае, когда их реактивировали антителом к CD28.
Множественная трансфекция мРНК TALEN
мРНК, кодирующими TRAC TALEN (левую и правую), и мРНК, кодирующими пару TALEN, специфическими в отношении гена В2М, трансфектировали активированные Т-клетки и затем трансдуцировали экзогенными полинуклеотидами, кодирующими CAR, специфический в отношении CD22, или CAR, специфический в отношении CD19, или в отношении их обоих.
Клетки с двойной KO-инактивацией TRAC и гена В2М или CD56 экспрессировали не поддающийся обнаружению уровень TCR и молекул ГКГСI или TCR и CD56. После очистки клетки трансдуцировали вновь.
Пример 2: CD22 CAR-T
• Создание сконструированных CAR Т-клеток, таргетирующих CD22, для лечения рефрактерного рецидивирующего или агрессивного ALL или CLL
• CD22 CAR: (фиг. 2)
• Конструкция в виде m971 и вариантов m971 с пониженной аффинностью к CD22 и высокой селективностью
CD22 CAR создавали и получали с использованием различных scfv. m971 scfv получали из антитела 971 (Haso W.1, Lee D.W., Shah N.N., Stetler-Stevenson M., Yuan С.М., Pastan I.H., Dimitrov D.S., Morgan R.A., FitzGerald D.J., Barrett D.M., Wayne A.S., Mackall C.L., Orentas R.J., Anti-CD22-chimeric antigen receptors targeting B-cell precursor acute lymphoblastic leukemia. Blood. 121(7), 14 февраля 2013 г., 1165-74. doi: 10.1182/blood-2012-06-438002. Epub 14 декабря 2012 г.)
Создавали архитектуру CAR (фиг. 2) с использованием костимуляторного домена 4-1ВВ, домена активации CD3ξ, трансмембранного домена и шарнира CD8α, шарнира CD8α (SEQ ID NO: 15). Конструкция содержала FcγRIIIα-шарнир, соответствующий SEQ ID NO: 14.
Конструкции встраивали в вектор для стабильной экспрессии и созданные CAR подвергали скринингу.
CD22 CAR представляли собой m971-V3 CAR (SEQ ID NO: 22) и SEQ ID NO: 24.
Последовательности можно также оптимизировать в отношении связывания CD22 и лечения ALL и CLL, предпочтительно их рефрактерных рецидивирующих и агрессивных форм.
• Экспрессия CAR
CD22 CAR интродуцировали в первичные KO-TCR Т-клетки через 5 дней после активации с помощью покрытых антителами к CD3/CD28 гранулами и IL-2. Экспрессию CAR оценивали с помощью проточной цитометрии. Все CAR экспрессировались на клеточной поверхности. Определяли активность в отношении CD22+ трансформированных клеточных линий и в отношении клеток пациентов с рефрактерным или рецидивирующим CD22+ B-ALL.
Для оценки функциональности анти-CD22 CAR В-клетки, экспрессирующие CD22 (применяли ALL-линии REH, SEM, NALM6-GL, KOPN8, Daudi, Raji и K562, см. у Haso и др., Blood: 121 (7), 2013, сс. 1165-1174 детали эксперимента). Получали клетки из пациентов с рефрактерным или рецидивирующим CD22+ B-ALL.
Как и ожидалось все клетки, экспрессирующие CD22, окрашивались позитивно и таргетировались CD22 CAR из m971, предлагаемым в изобретении, а также CD22 CAR (scfv2 из НА22).
• Анализ дегрануляции
Для валидации конструкций CD22 CAR осуществляли анализ дегрануляции в клетках-мишенях с использованием Т-клеток, экспрессирующих CD22 CAR, предлагаемый в изобретение. Дегранулирующую способность CART оценивали с помощью проточной цитометрии. Получали данные об экспрессии CD107a на плазматической мембране Т-клетки после инкубации в течение 5 ч с клетками-мишенями. Результаты продемонстрировали, что дегрануляция оказалась более выраженной при использовании CARm971- (scfv-1) по сравнению с CD22 CAR Т-клетками против дистальной области CD22 (SEQ ID NO: 20) scfv-2 (фиг. 5).
• Анализ цитотоксичности
Анализ цитотоксичности осуществляли с использованием тех же клеток-мишеней и Т-клеток, экспресирующих CD22 CAR, предлагаемые в изобретении. Для CD22 CAR обнаружен сильный специфический лизис CD22-клеток с помощью UCART 22, предлагаемой в изобретении, по сравнению с клетками, экспрессирующими scfv против дистальной области CD22 (scfv2) (фиг. 6).
Анализ интерферона гамма
Производство интерферона гамма UCART 22 (scfv-V1 против проксимального домена CD22) сравнивали с производством нетрансдуцированными (NT) клетками или Т-клетками, трансдуцированными CAR, который таргетирует дистальную область CD22 (scfv-V2), в присутствии CD22-позитивных клеток NALM-16 по сравнению с CD22-негативными клетками SUP-T1 (фиг. 7).
Выживание мышей
Выживание мышей повышалось в присутствии UCART 22 (scfv-V1 против проксимального домена CD22) или CART22 (без инактивации TRAC) по сравнению с контрольными клетками (фиг. 8).
Устойчивость к гипоксии и/или лекарственным средствам
Сконструированные клетки UCART 22, предлагаемые в изобретении, не существенно подвергались воздействию (выживаемость и CTL-активность) алемтузумаба (50 мкг/мл) или PNA (flu) по сравнению с несконструированными клетками, которые погибали в течение 48 ч после добавления лекарственного средства в клеточную культуру или после культивирования в условиях гипоксии (менее 5%, предпочтительно менее 1% О2).
В опытах, которые осуществляли в условиях низкого уровня О2 (<5% или <1%), получены сходные результаты, и это подтвердило, что UCART 22 с повышенным уровнем экспрессии HIF-1a обладали способностью выживать, экспрессируя при этом CD22 CAR, и обладали активность в условиях гипоксии.
Аналогичные результаты (выживаемость, CTL-активность) получали на мышах, которых обрабатывали препаратом кэмпас (50 мкг/мл), что подтверждало устойчивость UCART 22 к лекарственным средствам. Предполагается возможность клеток UCART 22, предлагаемых в изобретении, достигать раковых клеток, гнездившихся в ткани, или достигать раковых клеток, образующих кластеры in vivo, поскольку количество раковых клеток «восстановившихся» после обработки или «избежавших» обработку UCART 22 оказалось существенно ниже (снижение примерно на 15%), по сравнению с мышами, которых обрабатывали UCART 22, не обладающей устойчивостью к О2. Отсюда следует, что локальная гипоксия, создаваемая жидкими опухолями, может препятствовать иммунным клеткам бороться с ними.
Осуществляли эксперименты для решения вопроса о том, могут ли клетки UCART 22 быть элиминированы, если это требуется и когда это требуется (фиг. 3 и 4). У мышей ритуксимаб индуцировал существенное снижение UCART, о чем свидетельствовала повышенная интенсивность флуоресцении опухолевых клеток у мышей, которых обрабатывали ритуксимабом и UCART, по сравнению с обработкой только клетками.
Впервые полученные результаты клинических испытаний продемонстрировали, что UCAR Т-клетки оказывали существенное благоприятное воздействие на рецидивирующий и рефрактерный ALL in vivo и in vitro, при этом реакция GVHD отсутствовала или была очень слабой (1 степень), и цитокиновый шторм был слабым или не поддавался обнаружению.
Указанное лечение может быть менее «токсичным» по сравнению с лечением аутологичными CD22 CART и может контролироваться у пациентов с использованием ритуксимаба и/или QBEND-10.
Клетки сохранялись в организме человека достаточно долгое для проявления активности время (более месяца) и их можно истощать с помощью QBEND-10.
Примеры полученных полипептидных последовательностей CD22 CAR Обрамленные последовательности соответствуют предпочтительным последовательностям VH и VL. VH и VL могут быть обменены (модификация в «горячей точке») для повышения эффективности CAR, что описано выше.
• v1-m972 (FcγRIIIα-CD8αTM-4-1BB.IC-CD3ζ.IC) (контрольная конструкция, не являющаяся частью изобретения)

• V3-m972 (CD8α-CD8αTM-4-1ВВ.IC-CD3ζ.IC) (контрольная конструкция, не являющаяся частью изобретения)


• v1-m971 (FcγRIIIα-CD8αTM-4-1BB.IC-CD3ζ.IC)

• v3-m971 (CD8α-CD8αTM-4-1BB.IC-CD3ζ.IC)

Результаты
Конструкция CAR, отобранная для получения UCART 22, содержит scFv к человеческому CD22 m971 (описанный у Haso и др., 2013), шарнир CD8α (необязательно) и трансмембранный домен, а также цитоплазматический хвост, состоящий из костимуляторного домена 4-1ВВ и сигнального домена CD3ζ (фиг. 3).
Другая конструкция CAR содержит последовательно расположенные последовательность scFv к человеческому CD22 m971, два связывающих домена для ритуксимаба (CD20), шарнир CD8α и трансмембранный домен, а также цитоплазматический хвост, состоящий из костимуляторного домена 4-1ВВ и сигнального домена CD3ζ (фиг. 3).
Альтернативная конструкция CAR содержит последовательно расположенные связывающий домен для ритуксимаба (CD20), связывающий домен для Q-BEN10 (CD34), scFv к человеческому CD22 m971, два связывающих домена для ритуксимаба (CD20), шарнир CD8α и трансмембранный домен, а также цито плазматический хвост, состоящий из костимуляторного домена 4-1ВВ и сигнального домена CD3ζ (фиг. 3).
Для UCART 22 применяли рекомбинантный третьего поколения самоинактивирующийся (SIN) лентивирусный вектор (rLV) для создания Т-клеток, экспрессирующих анти-CD22 CAR и связанный с RQR8 механизм истощения под контролем человеческого промотора EF1α (фиг. 4). Рекомбинантные лентивирусные векторы, происходящие из вируса HIV, являются генетически стабильными и для них к настоящему времени отсутствуют данные о патологических свойствах, приписываемых векторам (Chang и Sadelain, 2007; Wang и др., 2009). Кроме того, условия для трансдукции Т-клеток с помощью rLV известны и пригодны для сохранения функциональных свойств Т-клеток.
Для UCART 22 AAV6-вектор можно применять после генетического редактирования гена, такого как ген TRAC (ген, кодирующий альфа-субъединицу или TCR) или любого гена, описанного в РСТ/ЕР2017/076798 (фиг. 9).
Получали также варианты конструкций анти-CD22 CAR, предлагаемых в изобретении, содержащие дополнительный CD19 scfv (расположенный до или после CD22 scfv), а также создавали конструкции, содержащие многоцепочечный CD22 CAR, многоцепочечный CD22, CD19 CAR (фиг. 2), и встраивали в лентивирусный вектор аденоассоциированного вируса 6 (AAV6), что обеспечивало возможность встраивания конструкций CD22 CAR или конструкции CD19 CAR, описанных ниже, в ген TRAC или в ген CD25, или в ген бета-2-микроглобулина (CAR-последовательность фланкировали на 5'- и 3'- концах последовательностей для обеспечения гомологичной рекомбинации с геном TRAC, геном CD25 или геном бета-2-микроглобулина после специфического расщепления указанного гена с использованием специфической TAL-белок-Fok-1 (TALEN).
Создавали UCART 22, которая содержала дополнительно KO-ген рецептора TGFбета, KO-ген рецептора IL-10, KO-ген AHR, KO-ген PD1, KO-ген LAG-3, KO-ген TIM-3 или их комбинацию.
Создавали приведенные в качестве примера каждую из UCART 22, содержащих дополнительно KO-ген рецептора TGFбета или KO-ген рецептора IL-10, или KO-ген арилуглеводородного рецептор (AHR), или KO-ген PD1, или KO-ген LAG-3, или KO-ген TIM-3.
Для оценки действия в отношении истощения CD19+ CD22+ раковых клеток получали также конструкцию анти-CD19, ранее описанную у: «Waseem Qasim и др., Molecular remission of infant B-ALL after infusion of universal TALEN gene-edited CAR T cells». Science Translational Medicine, 25 января 2017), и дополнительно содержащую ген суицида, отличный от того, который присутствует в CD22 CAR (описанный в WO 2016/120216 А1). В настоящем исследовании измеряли цитолитическую активность:
1) комбинации UCART 19 + UCART 22 (два одноцепочечных CAR) в сравнении только с индивидуальными клетками (во всех случаях 5×106 клеток),
2) TCR-негативных клеток, экспрессирующих биспецифический анти-CD22-анти-CD19 CAR (биспецифический одноцепочечный CAR), в сравнении только с индивидуальными клетками (во всех случаях 5×106 клеток),
3) многоцепочечного CAR, содержащего оба scfv CD22 и CD19 или scfv CD19 CD22, в сравнении только с индивидуальными клетками (во всех случаях 5×106 клеток).
Экспрессия RQR8, R2CD22CAR или OR3CD22CAR для придания чувствительности к ритуксимабу / ритуксимабу и QBEND-10
Создавали кассету лентивирусного вектора, в которой запускается экспрессия CD22 CAR, для совместной экспрессии RQR8 (через пептидный линкер 2А). RQR8 является лигандом рецептора истощения, который может активироваться в случае неконтролируемых нежелательных явлений, связанных с введением UCART 22. RQR8 представляет собой состоящий из 136 аминокислот искусственный белок клеточной поверхности, в котором объединены связывающиеся антителом эпитопы из человеческого CD34, распознаваемые антителом QBEND-10, и человеческого CD20 (Philip и др., 2014). Эпитопы CD20, присутствующие в конструкции, распознаются ритуксимабом, что делает возможным делецию экспрессирующих RQR8 клеток с помощью опосредуемого комплементом цитолиза клеток (CDC) и антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) в присутствии ритуксимаба и/или QBEND-10.
В других экспериментах получали конструкции, соответствующие анти-CD22 CAR, которые содержали 2 эпитопа, распознаваемых ритуксимабом (R) (R2 CD22 CAR: два эпитопа, распознаваемых ритуксимабом, встраивали непосредственно за scfv и непосредственно перед шарниром или вместо шарнира для укорочения внеклеточного домена по сравнению с полной конструкцией с шарниром), или «QR3» QR3 CD22 CAR (Q: эпитоп, распознаваемый QBEND-10, Q-R -на N-конце перед VH-линкер-VL RR шарнир ТМ-4-1ВВ-СD3дзета), и тестировали в отношении клеток, экспрессирующих различные уровни CD22.
Нокаут «выключение» гена TRAC для ограничения аллореактивности UCART 22
Возможное ограничение подходов аллогенной адоптивной иммунотерапии состоит в том, что распознавание антигенов ГКГС является несовпадающим между донором и реципиентом из-за комплекса TCRαβ клеток донора, что может приводить к активации/пролиферации Т-клеток донора и развитию реакции трансплантат-против-хозяина (GvHD). TCRαβ состоит из α- и β-субъединиц, при этом TCRα кодируется одним геном, a TCRβ двумя гомологичными генами.
Клетки UCART 22 генетически модифицировали для специфического разрушения гена альф α-константы Т-клеточного рецептора (TRAC). Инактивация гена TRAC препятствовала экспрессии на клеточной поверхности комплекса TCRαβ, элиминируя опосредуемое TCR распознавание антигеном гистосовместимости, которое могло приводить к GvHD. В конце процесса получения UCART 22 оставшиеся TCRαβ+ истощали, гарантируя остаточной уровень ≤3,0% TCRαβ+ клеток в конечном продукте, согласно условиям (критериям) выпуска.
Нокаут гена CD52 для придания устойчивости к алемтузумабу
UCART 22 конструировали так, чтобы они представляли собой смесь CD52- и CD52+ клеток, что обеспечивало возможность применения алемтузумаба в режиме лимфодеплеции перед введением UCART 22. Алемтузумаб представляет собой моноклональное антитело, которое связывается с человеческим CD52. Таким образом, фракция CD52- UCART 22 является устойчивой к алемтузумабу.
Применяли технологию TALEN® для разрушения обоих генов TRAC и CD52. В процессе получения UCART 22 TRAC- и CD52-TALEN® интродуцировали в клетки в виде матричной рибонуклеиновой кислоты (мРНК), применяя систему для электропорации. Указанная кратковременная экспрессия позволяет TALEN® осуществлять эффективный таргетный нокаут гена до расщепления клетками. Указанный подход предупреждает потенциальные риски, ассоциированные с длительной экспрессией нуклеаз в клетках, инъцированных в организм пациентов.
Нокаут гена В2М для ограничения аллореактивность UCART 22
Применяли технологию TALEN® для разрушения обоих генов TRAC и В2М. В процессе получения UCART 22 TRAC- и B2M-TALEN® интродуцировали в клетки в виде матричной рибонуклеиновой кислоты (мРНК), применяя систему для электропорации. Указанная кратковременная экспрессия позволяет TALEN® осуществлять эффективный таргетный нокаут гена до расщепления клетками.
Примеры
Источники Т-клеток, применяемых в доклинических исследованиях (фармакология и токсикология)
Описание клеточных продуктов, применяемых в доклинических исследованиях, обобщено в таблице В.


Выводы
Активация UCART 22 запускается в результате контакта между анти-CD22 химерным антигенным рецептором (CD22 CAR) и антигеном CD22, что приводит к деструкции клеток CD22+ В-ALL с помощью опосредуемой Т-клетками цитотоксичности и возможно производства провоспалительных цитокинов.
Правильность концепции подтверждена в осуществляемых опытах по разработке других UCART-продуктов (UCART 19 и UCART 123), в которых продемонстрировано, что клетки UCART (CAR Т-клетки с дефицитом TCRαβ) обладают такой же активностью, что и CAR Т-клетки, которые не подвергали редактированию генов (TCRαβ-позитивные CAR Т-клетки), in vitro и in vivo на моделях ксенотрансплантатов опухолей на NSG-мышах (Poirot и др., 2015). Это подтверждено для CD22 CAR Т-клеток с дефицитом TCRαβ и CAR Т-клеток с дефицитом TCRαβ, дефицитом ГКГС I по сравнению с TCRαβ-позитивными CD22 CAR Т-клетками.
Данные фармакологических исследований in vitro, проведенных в процессе доклинического испытания UCART 22, обобщены в таблице. В опытах продемонстрировано:
- Противоопухолевая активность UCART 22 посредством зависимой от антигена CD22 цитотоксичности и секреции цитокинов, установленная с помощью анализов. Анализы активности осуществляли с использованием клеточных линий В-ALL и первичных образцов В-ALL.
- Эффективная опосредуемая TALEN® инактивация генов TRAC и CD52.
- Эффективная опосредуемая TALEN® инактивация генов TRAC и бета-2-микроглобулина.
- Устойчивость CD52- -Т-клеток к алемтузумабу.
- Эффективная элиминация RQR8+ клеток или R2 CD22 CAR+ клеток с помощью ритуксимаба.
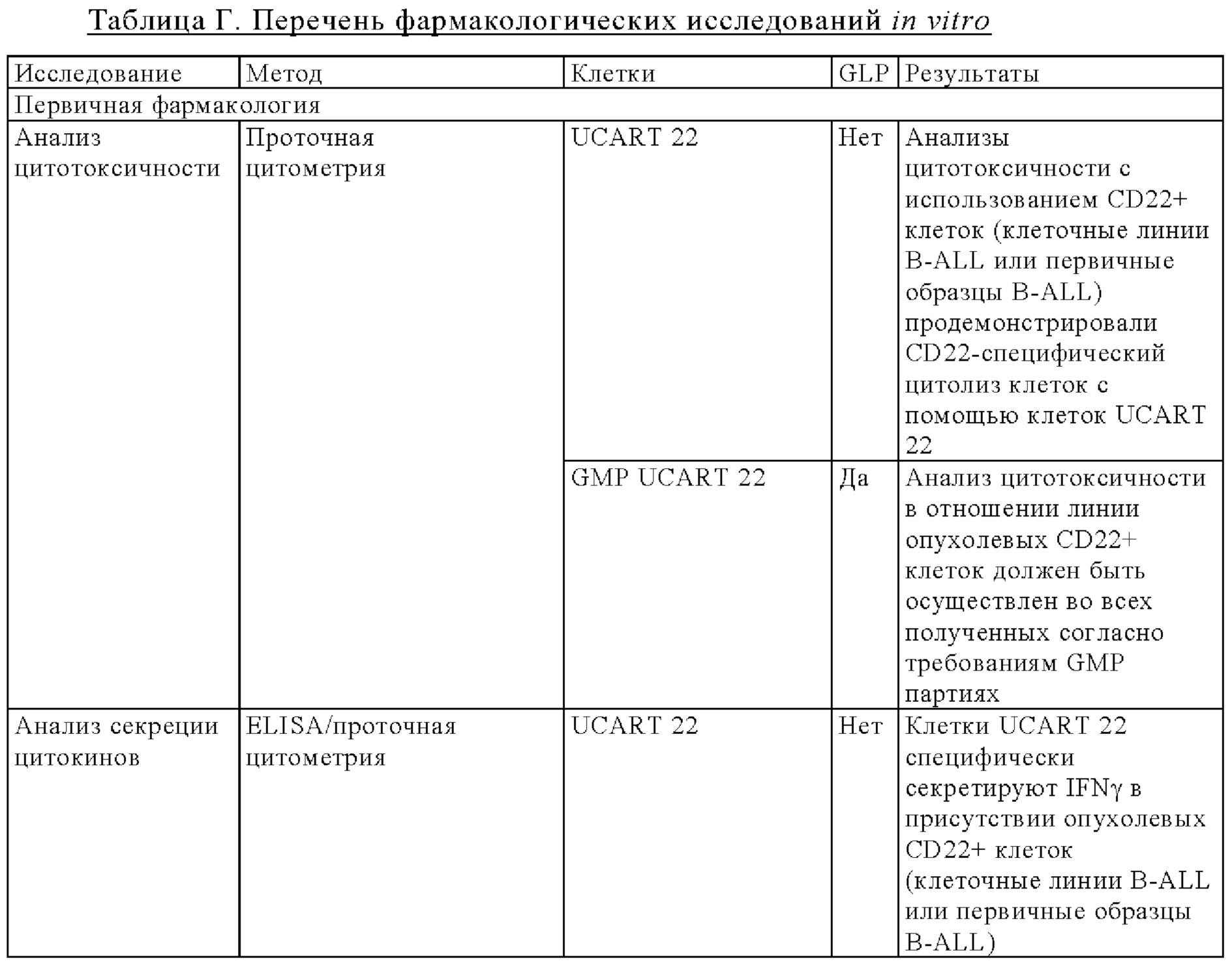
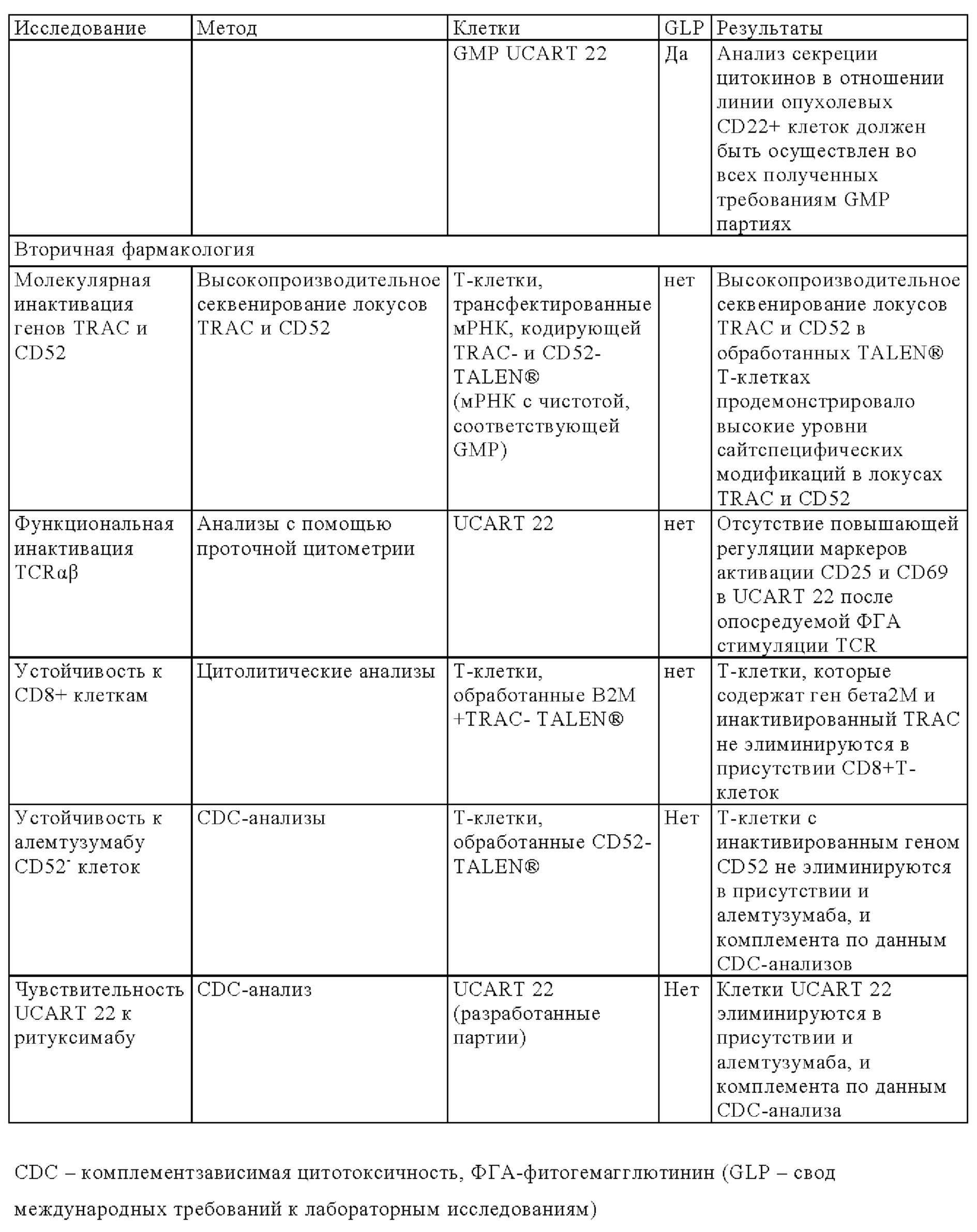
В фармакологических исследованиях in vivo (результаты обобщены в таблице Д) продемонстрированы:
- Противоопухолевая активность UCART 22 in vivo в отношении несущих полученные с использованием клеточной линии B-ALL трансплантаты опухолей мышей с иммунодефицитом. Активность in vivo UCART 22, полученных в соответствии с требованиями GMP, подтверждена в отношении клеточной линии В-ALL.
- Повышенная противоопухолевая активность UCART 22/19 in vivo в отношении несущих полученные с использованием клеточной линии B-ALL трансплантаты опухолей мышей с иммунодефицитом. Активность in vivo UCART 22/19 и 19/22, полученных в соответствии с требованиями GMP, подтверждена в отношении клеточной линии В-ALL.
- Способность ритуксимаба элиминировать RQR8+ клетки на модели, созданной с использованием иммунокомпетентных мышей.
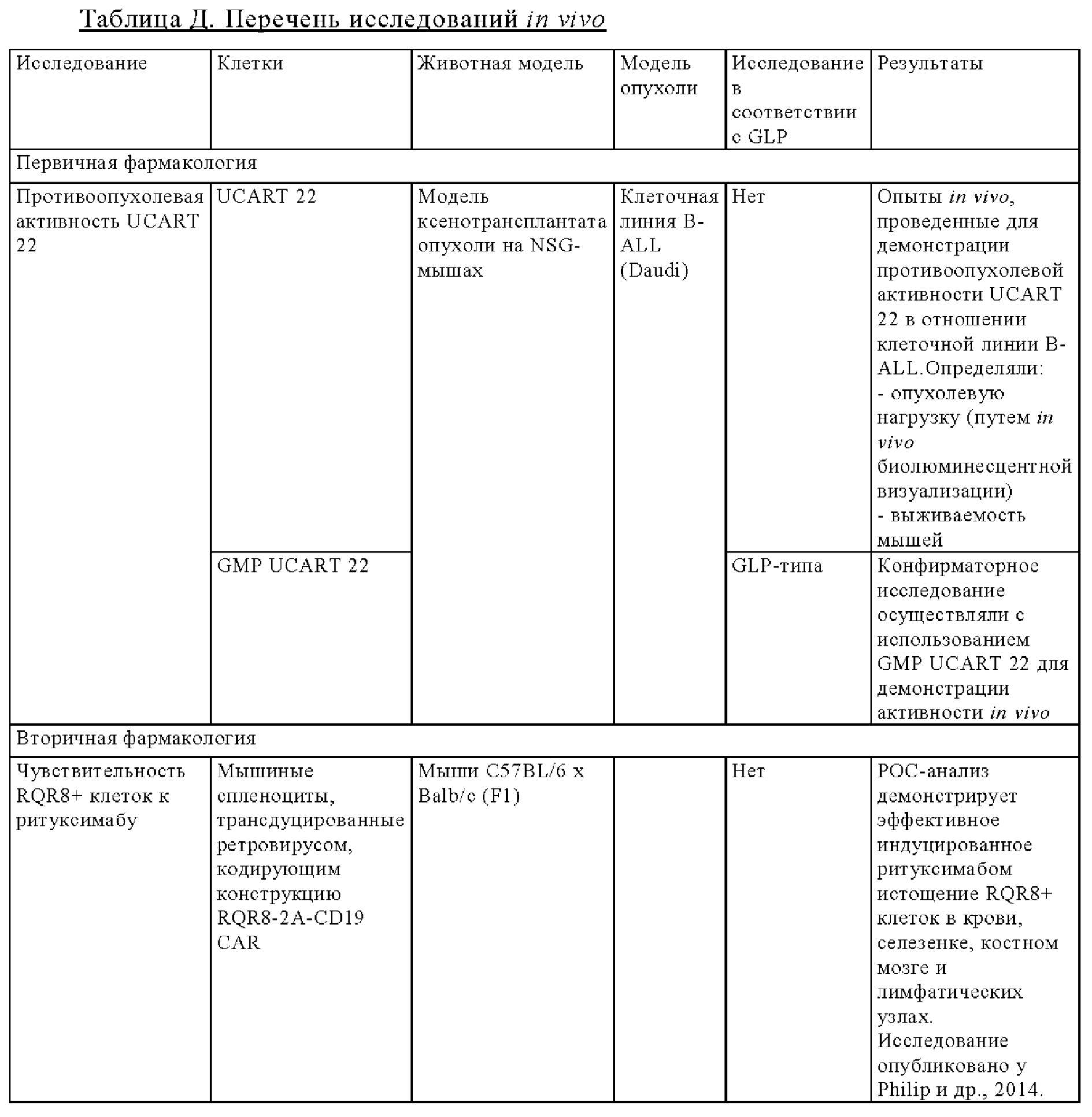
Для демонстрации активности клеток UCART 22 осуществляли анализ запускаемой CAR цитотоксичности и секреции цитокинов в отношении линий опухолевых клеток и первичных клеток В-ALL.
Оценка активности UCART 22 с помощью анализов цитотоксичности Цитотоксическая активность в отношении клеточных линий В-ALL Потенциальную цитотоксичность UCART 22 оценивали в отношении нескольких линий опухолевых клеток, полученных из страдающих В-ALL детей и взрослых пациентов (таблица Е). Результаты продемонстрировали, что все линии MHH-CALL-4, MUTZ-5, SEMK2, PALL-2, LAX2, B-ALL-1, NALM-6 и RS4; 11 представляют собой CD22+ клеточные линии, экспрессирующие различные уровни CD22. Две клеточные линии острого миелоидного лейкоза (AML) (OCI-AML2 и MOLM13), у которых отсутствует экспрессия CD22, применяли в качестве отрицательных контролей.

Специфическую цитотоксичность UCART 22 в отношении CD22+ клеток оценивали, измеряя жизнеспособность CD22+ клеток-мишеней после совместного культивирования с клетками UCART 22. Нетрансдуцированные (CAR-) Т-клетки с двойным КО TRAC и CD52 применяли в качестве контроля для расчета процента специфического клеточного лизиса CD22+ B-ALL-клеток-мишеней с помощью UCART 22. Результаты продемонстрировали цитотоксическую активность клеток UCART 22 в отношении панели линий опухолевых клеток CD22+ В-ALL. Даже при применении в самых низких концентрациях для UCART 22 установлена специфическая лизирующая клетки активность в отношении всех клеточных линий, экспрессирующих CD22.
Цитотоксическая активность в отношении первичных образцов В-ALL
Цитотоксическую активность UCART 22 подтверждали в отношении нескольких первичных образцов В-ALL. Характеристики первичных образцов представлены в таблице Ж. Только полученные из организма пациентов образцы, в которых присутствовало более 50% бластов, применяли в опытах по совместной инкубации, в которые было включено 14 из 19 образцов.
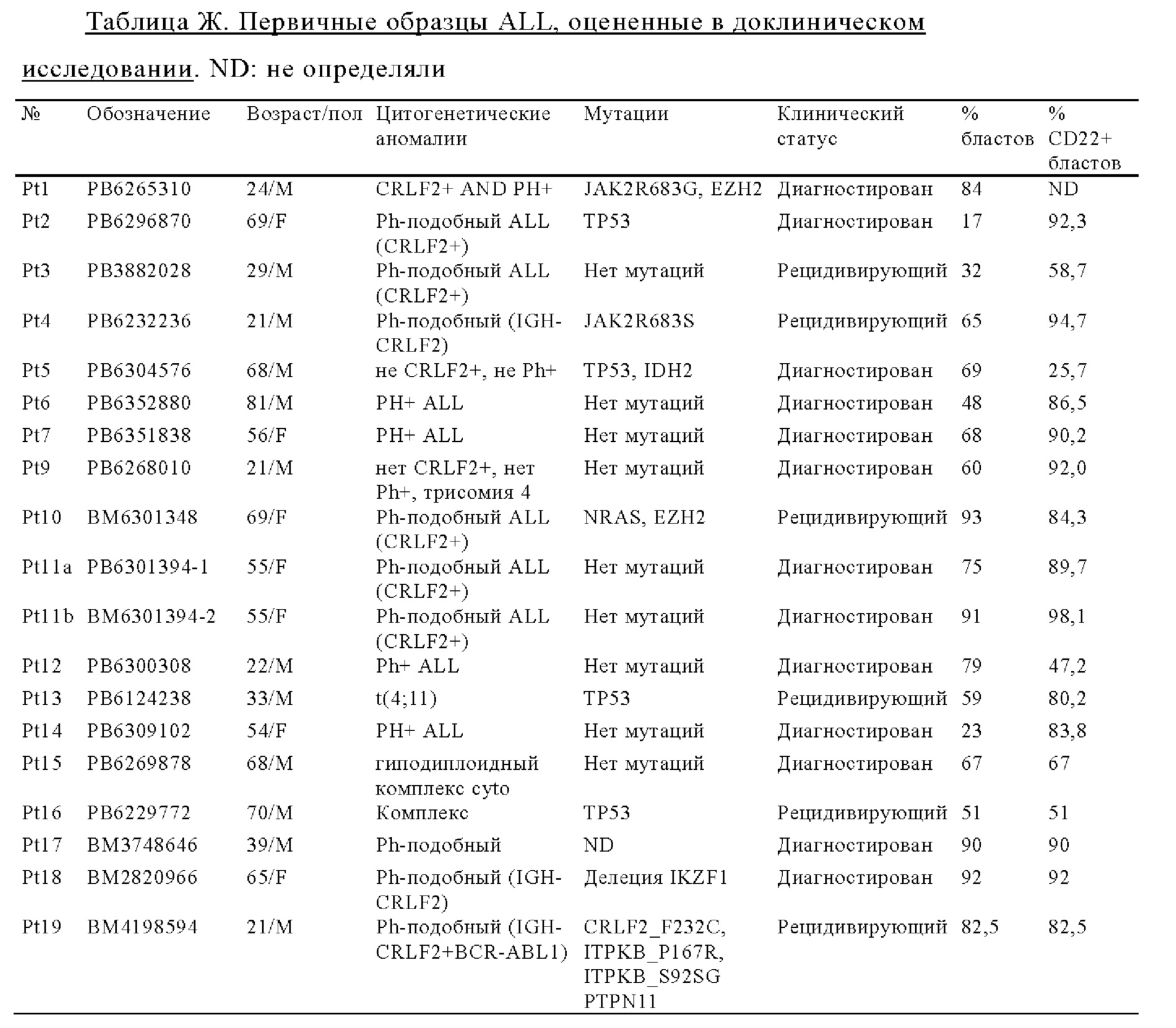
Оценивали также уровень экспрессии CD22 и CD19 во всех первичных образцах B-ALL за исключением Pt1. В 11 образцах уровень экспрессии CD22 на поверхности превышал уровень в CD22- -контролях и в 4 образцах, полученных из страдающих В-ALL пациентов, обнаружен уровень экспрессии CD22 на поверхности в диапазоне, характерном для клеточных линий B-ALL (>1000 молекул CD22 /клетку). В образцах с высоким уровнем экспрессии CD22 (>60%) обнаружена также экспрессия CD19 за исключением двух образцов рецидивирующего рака.
С использованием такого же подхода, который применяли для клеточных линий, подтверждена CTL-активность для 8 образцов пациентов с B-ALL (специфический клеточный лизис более 10%).
Анализ секреции цитокинов в присутствии клеточных линий B-ALL и первичных образцов В-ALL
Высвобождение интерферона-гамма (IFNγ) и других цитокинов клетками UCART 22, которые инкубировали совместно с несколькими клеточными линиями или образцами из организма страдающих B-ALL пациентов, оценивали с использованием анализа цитокинов фирма BioLegend Legend PLEX 13. Установлено, что концентрация IFNγ является самой высокой из всех обнаруженных цитокинов (IL-2, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, IL-17A, IL-17F, IL-21, IL-22 и фактор некроза опухоли альфа (TNF-α)), секретируемых в среду после 25-часовой совместной инкубации клеток B-ALL либо с клетками UCART 22, либо с контрольными Т-клетками (NTD DKO).
Высокий уровень секреции IFNγ обнаружен, когда UCART 22 совместно инкубировали как с клеточными линиями B-ALL, так и с первичными образцами В-ALL.
Вторичные исследования in vitro
Индуцируемая TALEN® инактивация генов TRAC, В2М и CD52 Возможность применения UCART 22 для аллогенной трансплантации зависит от способности предупреждать экспрессию на клеточной поверхности TCRαβ, молекул ГКГС I, элиминировать опосредуемое TCR распознавание антигенов гистосовместимости, что может приводить к GvHD и атаке на CD8+ клетки хозяина. Для эффективной элиминации TCRαβ и молекул ГКГСI с клеточной поверхности применяли опосредуемое TALEN® редактирование генов для инактивации гена TRAC и гена бета-2-микроглобулина (В2М). Кроме того, другую TALEN® применяли в процессе получения UCART 22 для инактивации гена CD52, что позволяет применять алемтузумаб в режиме кондиционирования, включающем лимфодеплецию. В конкретных вариантах TALEN® применяли в процессе получения UCART 22 для инактивации гена бета-2-микроглобулина (В2М), для изменения экспрессии молекул главного комплекса гистосовместимости класса I (ГКГС класса I) и для предупреждения отторжения Т-клетками хозяина.
Молекулярный анализ разрушения генов TRAC, CD52, В2М
Для демонстрации целевых модификаций генов TRAC и CD52 на молекулярном уровне геномную дезоксирибонуклеиновую кислоту (ДНК) выделяли из Т-клеток, подвергнутых электропорации, с использованием имеющих чистоту, соответствующую требованиям GMP, мРНК TRAC- и CD52-TALEN® или мРНК TRAC- и В2М TALEN® и очищали с получением TCRαβ-клеток ГКГСI-области вокруг сайтов расщепления TRAC-, В2М- и CD52-TALEN® амплифицировали с использованием полимерназной цепной реакции (ПЦР) и анализировали с помощью секвенирования следующего поколения (NGS, фирма Illumina). В контрольных образцах осуществляли такой же анализ с использованием клеток, удаленных перед электропорацией мРНК TALEN® (в день 6). Этот анализ продемонстрировал, что в то время как в контрольных клетках в день 6 не обнаружено никаких модификаций в локусах TRAC и CD52, в обработанных TALEN® Т-клетках обнаружены встречающиеся с высокой частотой модификации (таблица 6).
Таблица З. Процент соединения негомологичных концов (NHEJ) после расщепления TALEN® в локусах TRAC и CD52, и В2М
Проценты определяли с помощью NGS для обработанных TALEN® Т-клеток из 3 различных партий. Образцы контрольных клеток отбирали до электропорации мРНК TALEN® из всех партий.

Дополнительный анализ последовательностей продемонстрировал, что индуцированные TALEN® модификации локализованы в небольшой области, окружающей сайт-мишень, причем, 93-97% указанных модификаций представляли собой делеции. Эти делеции, как правило, являются небольшими, в среднем 97% из них имели размер меньше 150 bp, а 81% меньше 50 bp.
Функциональный анализ, демонстрирующий разрушение гена TRAC в UCART 22
Для демонстрации функциональной инактивации TCRαβ анализировали способность клеток UCART 22 экпрессировать маркеры активации, такие как CD25 и CD69, после опосредуемой фитогемагглютинином (ФГА) стимуляции TCR. UCART 22 получали с использованием всех полученных согласно требованиям GMP исходных продуктов, Т-клетки выделяли либо до (TRAC), либо после (UCART 22) истощения TCRαβ+ клеток. Клетки реактивировали с помощью 0,5 мкг/мл ФГА в течение 24 ч. Экспрессию маркеров активации (CD25 и CD69) измеряли проточной цитометрией. В то время как в контрольных TRAC-клетках (65,2% TCRαβ-) обнаружена повышающая регуляция CD25 и CD69, никакой повышающей регуляции не обнаружено на клетках UCART 22 (98,9% TCRαβ-), что подтверждает отсутствие TCRαβ-рецептора в UCART 22.
Устойчивость к алемтузумабу клеток CD52- UCART 22
Возможность применения алемтузумаба, моноклонального антитела к CD52, в режиме лимфодеплеции зависит от эффективной элиминации гликопротеина CD52 с клеточной поверхности клеток UCART 22 для предупреждения их элиминации алемтузумабом. Сконструированные таким образом UCART 22 с использованием CD52-TALEN® представляли собой смесь CD52+ и CD52- клеток. Осуществленный анализ методом проточной цитометрии созданных партий UCART 22 в конце процесса получения продемонстрировал, что в среднем 72% Т-клеток (CD45+/CD4+ или CD8+ клетки) представляли собой CD52--клетки (диапазон 62,3-76,5%, N=6).
Для демонстрации того, что CD52--клетки являются устойчивыми к алемтузумабу осуществляли анализ комплементзависимой цитотоксичности (CDC). Человеческие Т-клетки с опосредуемой TALEN® инактивацией гена CD52 обрабатывали крысиным антителом к CD52 в концентрации 50 мкг/мл, из которого получено терапевтическое антитело алемтузумаб, или крысиным иммуноглобулином G (IgG) в качестве контроля с добавление кроличьего комплемента или без него в течение 2 ч при 37°С, после чего анализировали с помощью проточной цитометрии в отношении жизнеспособности и экспрессии CD52.
Результаты продемонстрировали, что клетки без инактиации гена CD52 специфически элиминировались посредством комплементзависимой цитотоксичности в присутствии алемтузумаба.
Устойчивость к хозяйским CD8+ Т-клеткам
Клетки UCART 22 с дефицитом ГКГС класса I обладали устойчивостью к опосредуемому CD8+ Т-клетками разрушению. Обработка интерфероном-γ (IFN-γ) существенно индуцировала экспрессию β2-микроглобулина, усиливая опосредуемый CD8+ Т-клетками цитолиз контрольных UCART 22.
Демонстрация эффективного истощения UCART 22 после обработки ритуксимабом (RTX)
UCART 22 представляют собой аллогенные Т-клетки и поэтому должны элиминироваться после обнаружения иммунной системой пациента. Кроме того, UCART 22 конструировали так, чтобы они совместно экспрессировали CD22 CAR и RQR8, короткий мембранный белок, имеющий два эпитопа, которые связываются ритуксимабом (RTX), терапевтическим моноклональным антителом, специфическим в отношении человеческого CD20. Таким образом, RQR8 обеспечивал возможность истощения UCART 22 при обработке ритуксимабом.
Изучали возможность элиминации клеток UCART 22 посредством комплементзависимой цитотоксичности (CDC) после обработки RTX. Замороженные UCART 22 (из 5 различных разработанных партий) подвергали оттаиванию и совместно культивировали с CD22+ клетками Raji (клетки Раджи) в соотношении 1:0,25 в течение 3 дней. После указанного периода реактивации осуществляли анализ CDC (клетки инкубировали с RTX (100 мкг/мл) в течение 2 ч в присутствии комплемента детеныша кролика (BRC) или без него). Результаты продемонстрировали, что ~85% CAR+ клеток эффективно элиминировались in vitro в присутствии и RTX, и комплемента.
Другим механизмом действия RTX, с помощью которого может достигаться истощение RQR8+ клеток, является антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Seidel и др., 2013). В этом случае эффекторные клетки иммунной системы (главным образом естественные клетки-киллеры (NK-клетки)) могут активно лизировать клетки-мишени, у которых расположенные на поверхности мембраны антигены, специфически связаны антителом.
Дополнительные эксперименты опубликованы Martin Pule в UCL (Philip и др., 2014), они демонстрируют эффективность in vitro опосредуемой элиминации RQR8+ Т-клеток с помощью CDC и ADCC (первичные человеческие Т-клетки, трансдуцированные бицисторонным ретровирусным вектором (SFG.RQR8.IRES.eGFP), который кодирует RQR8 и GFP, и отобранные с использованием гранул Miltenyi QBEND-10). Изучение динамики и титрования доз RTX продемонстрировали, что CDC является высоко эффективной при концентрациях RTX 25 мкг/мл и выше, при этом цитолиз происходит в течение 30 мин. Аналогично этому, чувствительность к опосредуемой ADCC продемонстрирована для RQR8+ Т-клеток.
Исследования in vivo
Логическое обоснование выбора вида животного/модели
Поскольку UCART 22 являются специфическими для человека, то исследования на стандартных иммунокомпетентных животных моделях являются неприемлемыми из-за быстрого таргетинга и элиминации человеческих клеток UCART 22 в результате иммунных реакций на ксеногенные антигены.
Таким образом, можно рассматривать два подхода к моделированию in vivo активности UCART 22: сингенные животные модели и модели ксенотрансплантатов человеческих опухолей, созданные на животных с иммунодефицитом.
Подход, основанный на применении сингенных животных моделей, должен включать повторное создание/повторную разработку видоспецифической для модельного организма версии UCART 22 с последующей оценкой функциональных свойств указанного видоспецифического продукта-аналога UCART 22 при трансплантации сингенному хозяину. Указанный подход не рассматривается в качестве релевантного из-за того, что свойства индивидуальных CAR существенно варьируются, и поскольку видоспецифические различия в иммунной функции, физиологии и генетике существенно снижают возможность экстраполяции данных об активности UCART 22 при применении на человеке.
Была выбрана модель трансплантации, созданная на мышах с иммунодефицитом, поскольку она позволяет приживлять как UCART 22, так и человеческие опухолевые CD22+ клетки (клеточные линии B-ALL или первичные образцы). Указанную животную модель широко применяли для оценки in vivo активности терапий на основе CAR Т-клеток. Поскольку на указанные модели накладываются такие же ограничения, что и на указанные выше модели, созданные на иммунокомпетентных животных, в отношении нацеленной/но не направленной на опухоль цитотоксичности и нецелевой цитотоксичности, и полного устранения какой-либо роли несовпадения по ГКГС, они, вероятно, являются очень ценными для изучения in vivo противоопухолевой эффективности CAR Т-клеток. Они выступают в качестве де-факто стандарта для оценки in vivo активности продуктов в виде CAR Т-клеток (см., например, у Carpenito и др., 2009; Gade и др., 2005; Gill и др., 2014; Hudecek и др., 2010; Kenderian и др., 2015; Mardiros и др., 2013; Zhou и др., 2013 среди многих опубликованных статей). В них доказана способность различать противоопухолевую активность различных CAR, устанавливать их способность к захвату и полуколичественно определять ценные для применения на человеке in vivo Т-клеточные функции (см., например, Milone и др., 2009). Так, человеческие опухолевые CD22+ клетки трансплантировали мышам с иммунодефицитом (NSG-мыши) с последующим введением UCART 22, осуществляя серийную оценку опухолевой нагрузки и продолжительности жизни в качестве показателя противоопухолевой активности.
Выбранные модели опухолей
При использовании ксенотрансплантов опухолей активность UCART 22 in vivo оценивали в отношении клеток Daudi (Дауди), клеточной линии CD22+ В-ALL (CCL-213, АТСС). Клеточную линию модифицировали для экспрессии люцеферазы светлячка (и GFP) путем трансдукции лентивирусным вектором (amsbio LVP438-PBS) для отслеживания опухолевой нагрузки путем визуализации in vivo (клетки Daudi-Luc-GFP).
Выбранные линии мышей
Для проведения доклинических испытаний in vivo применяли следующие линии мышей:
1) NSG-мыши с высокой степенью иммунодефицита (NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ; штамм фирмы Jackson Laboratory №5557), лишенные зрелых Т-клеток, В-клеток и функциональных NK-клеток, для демонстрации противоопухолевой активности.
2) Иммунокомпетентная мышиная модель (мыши C57BL/6 х Balb/c (F1)) для демонстрации эффективности механизма истощения RQR8 или R2 CD22 CAR.
Методы анализа
Активность UCART 22 in vivo оценивали с помощью:
- измерения биолюминесценции обработанных мышей относительно контрольной группы (для модели ксенотрансплантата, полученной с использованием клеточных линий, экспрессирующих люциферазу),
- клинических признаков,
- общей выживаемости мышей.
Путь введения
Путь введения UCART 22 в животных представлял собой внутривенную инъекцию (однократная неразделенная доза). Людям UCART 19 и UCART 22 инъецировали также внутривенно (неразделенная доза), один, два или три, или четыре раза индивидуально или друг за другом в соответствии со следующей последовательностью 19. 22 19 22 19 или 22 19 22 19, или 19/22 19/22.
Демонстрация противоопухолевой активности UCART 22 in vivo
Активность UCART 22 продемонстрирована на мышах с иммунодефицитом, которым трансплантировали человеческие опухолевые клетки Daudi-Luc-GFP в сочетании с несколькими созданными партиями UCART 22. Пример опыта представлен на фиг. 8. Кроме того, продолжали подтверждающее исследование для оценки активности in vivo созданной согласно требованиям GMP партии UCART 22.
В целом, метод состоял в следующем: NSG-мышам инъецировали внутривенно 0,5×106 клеток Daudi-Luc-GFP в день день -7 и обрабатывали в день 0 UCART 22 (внутривенная инъекция, 2 дозы: 3×106 и 10×106 клеток UCART 22/мышь, 5 мышей /группу) или оставляли без обработки (инъекция наполнителя). Нетрансдуцированные Т-клетки с двойным KO TRAC и CD52 (NTD DKO) инъецировали в качестве контроля. Вводимые дозы UCART 22 определяли в соответствии с дозами CAR+ Т-клеток, применение которых известно из литературы для демонстрации противоопухолевой активности in vivo других CD22 CAR Т-клеток (Haso и др., 2013). Обработка UCART 22 приводила к элиминации опухолевых клеток, что продемонстрировано с помощью визуализации in vivo и по удлиненной продолжительности жизни, при этом все обработанные мыши были живыми в конце опыта (80 дней после обработки UCART 22). Указанные результаты свидетельствуют о противоопухолевой активности UCART 22.
CD52-клетки являются устойчивыми к алемтузумабу in vivo и CD52- CAR+ Т-клетки обладают активностью in vivo в присутствии алемтузумаба
Опыты, проведенные при разработке UCART 19, другого продукта в виде UCART, содержащего такой же двойной нокаут TRAC/CD52, продемонстировали, что CD52--Т-клетки являются устойчивыми к алемтузумабу in vivo (Poirot и др., 2015).
Кроме того, активность клеток UCART 19 в присутствии алемтузумаба продемонстрирована на модели ксенотрансплантата опухоли, созданной на NSG-мышах. У всех мышей, которых обрабатывали опухолевыми клетками, но не обрабатывали клетками UCART 19, обнаружено прогрессирование опухолей, приводящее к необходимости их умерщвления через 13 дней после инъекции. У 5 из 7 мышей, которым приживляли опухоли и обрабатывали клетками UCART 19, опухоли полностью контролировались ко дню 13, а у двух оставшихся мышей обнаружены частичные ответы. В противоположность этому, установлено, что обработка алемтузумабом лишь замедляла прогрессирование опухолей в отсутствии инфузии клеток UCART 19 (6/6 мышей). У мышей, обработанных алемтузумабом в сочетании с клетками UCART 19, опухолевые клетки элиминировались из костного мозга, что установлено с помощью люминометрии или проточной цитометрии клеточных суспензий, полученных из костного мозга, выделенного через 13 дней после инъекции.
В заключение следует отметить, что у мышей, подвергающихся терапии на основе алемтузумаба за 2 дня до инфузии клеток UCART 19, обнаружена противоопухолевая эффективность клеток UCART 19 в присутствии алемтузумаба in vivo. Кроме того, данные, полученные для трансплантатов селезенки в день 13, продемонстрировали, что CD52--Т-клетки являются устойчивыми к алемтузумабу in vivo.
Демонстрация эффективности индуцированного ритуксимабом истощения RQR8+ клеток in vivo
Чувствительность RQR8+ UCART 22 к вызываемому RTX истощению ранее продемонстрирована in vitro. Кроме того, исследователи из группы Martin Pule установили, что RTX обладал способностью элиминировать RQRS+ клетки на модели иммунокомпетентных мышей с использованием реконструированного для получения мышиного IgG2a RTX, функционального эквивалента человеческого IgGI (mRtx-IgG2a) (Philip и др., 2014). Указанное антитело адаптировано для применения в мышиных системах путем переноса связывающих участков RTX на мышиный Fc-домен, что обеспечивает связывание с мышиными Fc-рецепторами приблизительно с такой же аффинностью, с которой RTX связывается с человеческими Fc-рецепторами. Исследование осуществляли с применением иммунокомпетентной гаплоидентичной модели адоптивного переноса с использованием трансдуцированных RQR8 спленоцитов мышей C57BL/6, перенесенных в реципиентов, которые представляли собой облученные нелетальной дозой C57BL/6 х Balb/c кроссы (F1). Эта модель позволяла получать высокие уровни приживления во всей лимфоидной ткани, поддерживаемой аллогенной стимуляцией, но также с сохранением эндогенных лимфоцитов.
В день 1 1,5×106 RQR8+ донорских спленоцитов из мышей C57BL/6 (спленоциты, трансдуцированные с помощью ретровируса, кодирующего конструкцию RQR8-2A-GD2CAR, и очищенные с использованием гранул Miltenyi CD34) внутривенно инъецировали F1-мышам (C57BL/6 х Balb/c) через 4 ч после предварительного кондиционирования путем рентгеновского облучения дозой 5 Гр. В день 7 приживление донорских клеток подтверждали проточной цитометрией в периферической крови. Мышей обрабатывали три раза «муринизированным» RTX (ritux-mIgG2a 150 мкг, внутривенная инъекция в хвостовую вену в день 7, день 10 и день 12) или ЗФР (необработанные мыши). Каждая группа состояла из 5 мышей. Животных умерщвляли в день 14 для анализа с помощью проточной цитометрии селезенки, костного мозга, крови и лимфатических узлов. У обработанных RTX мышей обнаружено 50, 60 и 70%-ное истощение RQR8+ клеток в селезенке, костном мозге и крови соответственно в течение 6 ч после введения мышам ritux-mIgG2a.
Аналогичное исследование проводили также с использованием анти-CD19 CAR, который применяли в виде продукта UCART 19. UCART 19 представляет собой также продукт в виде аллогенных сконструированных CAR Т-клеток, содержащих такую же конструкцию RQR8, что и UCART 22.
Повторяющееся дозирование (редозирование)
В этом опыте исследовали противоопухолевую активность однократной инъекции или нескольких инъекций UCART 22. Применяли линию опухолевых клеток B-ALL, экспрессирующую CD22 (клетки Daudi, экспрессирующие высокий уровень CD22). Клетки трансдуцировали лентивирусным вектором для экспрессии GFP и люциферазы светлячка.
Опухолевые клетки (0,5×106 Daudi-Luc-GFP) внутривенно инъецировали в день -7 NSG-мышам (NOD.Cg-Prkdcscid I12rgtm1Wjl/SzJ, линия 005557, фирма The Jackson Laboratory) через хвостовую вену. В день 0 мышей произвольно разделяли на 11 групп по 6 мышей в зависимости от биолюминесцентного сигнала, измеренного в день -1 и веса тела.
Мышей обрабатывали 1, 2 или 3 раза UCART 22 (используя 1 или 3 млн CAR+ клеток/мышь). UCART 22 внутривенно инъецировали мышам в день 0 +/- день 10 +/- день 20.
Противоопухолевую активность UCART 22 оценивали по опухолевой нагрузке, установленной путем биолюминесцентной визуализации в день -1, день 7, день 14, день 21, день 28 и день 35, с помощью обследования клинических признаков и выживаемости мышей.
Модель Daudi. обработка 1×106 клеток UCART 22/мышь
У мышей, которых обрабатывали 2 или 3 раза 1×106 UCART 22, обнаружено лучший контроль прогрессирования опухолей и более длительная продолжительность жизни по сравнению с мышами, которых обрабатывали однократно 1×106 UCART 22 (выживаемость 80% в день 60 при использовании 3 доз по сравнению с 0% при использовании 1 дозы).
В одном эксперименте UCART 19 внутривенно инъецировали мышам в день 30. В этом случае мыши оставались живыми, а уровень раковых клеток был ниже, установленного в день 90.
Выводы
Активность UCART 22 продемонстрирована in vitro и in vivo в отношении клеточных линий B-ALL и in vitro в отношении первичных образцов B-ALL.
UCART 22 представляют собой аллогенные Т-клетки и поэтому должны элиминироваться после восстановления иммунной системы пациента. Кроме того, UCART 22 конструировали так, чтобы они совместно экспрессировали RQR8, короткий мембранный белок, имеющий два эпитопа, которые связываются моноклональным антителом ритуксимабом. Таким образом, RQR8 обеспечивает возможность истощения RQR8+ UCART 22 при обработке ритуксимабом в случае неуправляемой связанной с UCART 22 токсичности, такой как синдром выброса цитокинов (CRS) или GvHD до алло-HSCT (трансплантация аллогенных гематопоэтических стволовых клеток). Эффективность ритуксимаба в отношении элиминации RQR8+ клеток in vitro продемонстрирована с помощью анализов CDC и ADCC. Кроме того, эффективность индуцированного ритуксимабом истощения RQR8+ клеток продемонстрирована in vivo в крови, селезенке, костном мозге и лимфатических узлах на модели иммунокомпетентных мышей и с использованием «муринизированной» версии ритуксимаба.
Аналогичные результаты получали с использованием анти-CD22 CAR R2 ил QR3, экспрессируемого в Т-клетках с дефицитом TCR, дефицитом ГКГС класса I.
Устойчивость к алемтузумабу CD52--клеток продемонстрирована in vitro и in vivo, что позволяет потенциально применять алемтузумаб в режиме лимфодеплеции.
И, наконец, устойчивость к опосредуемой CD8+ Т-клетками деструкции обнаружена при применении R2 - анти-CD22 CAR, экспрессируемого в Т-клетках с дефицитом TCR, дефицитом ГКГС класса I.
Дополнительные исследования, которые осуществляли для оценки различных рисков, обобщены таблице И и таблице К и подробно описаны в разделе ниже.
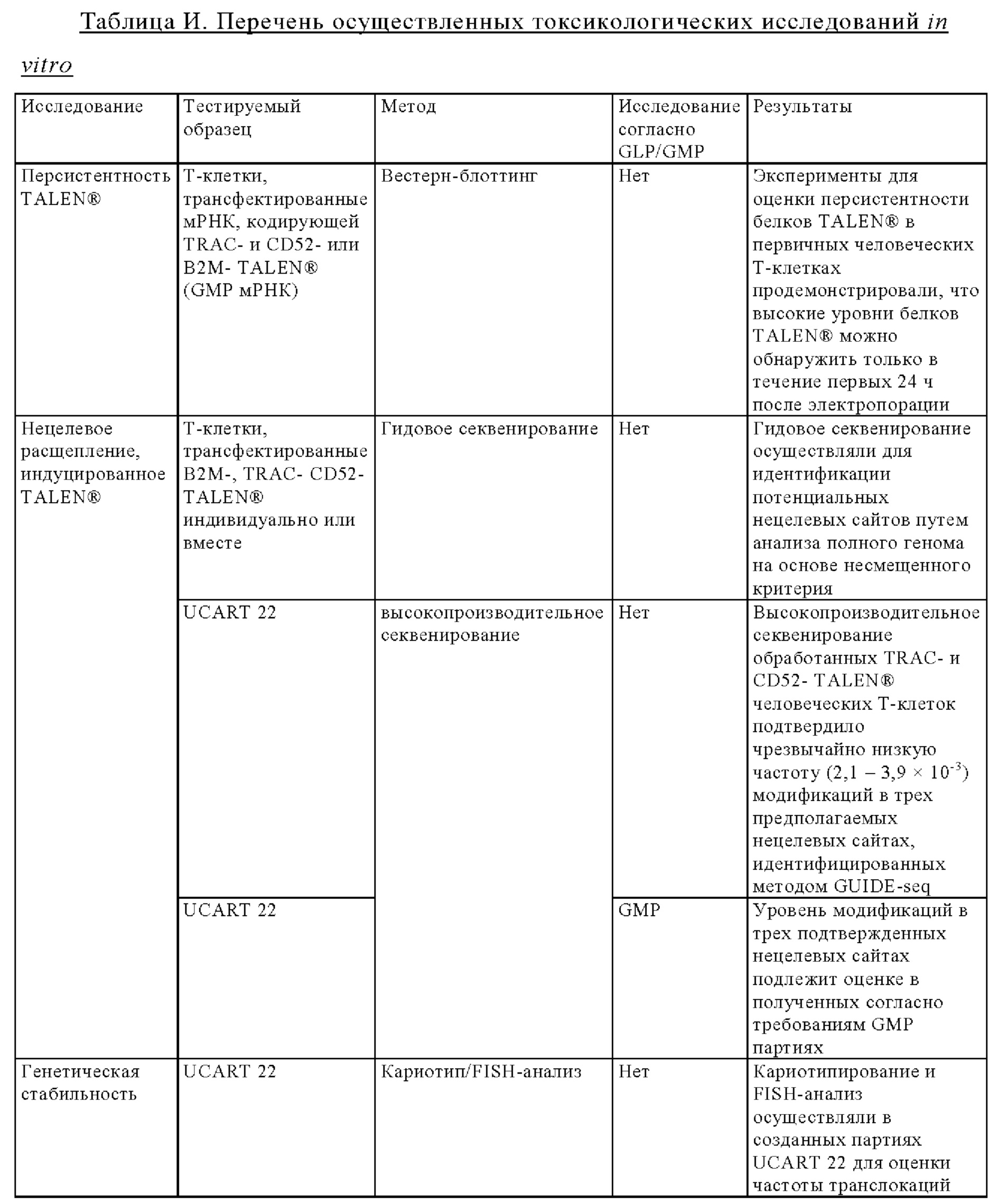
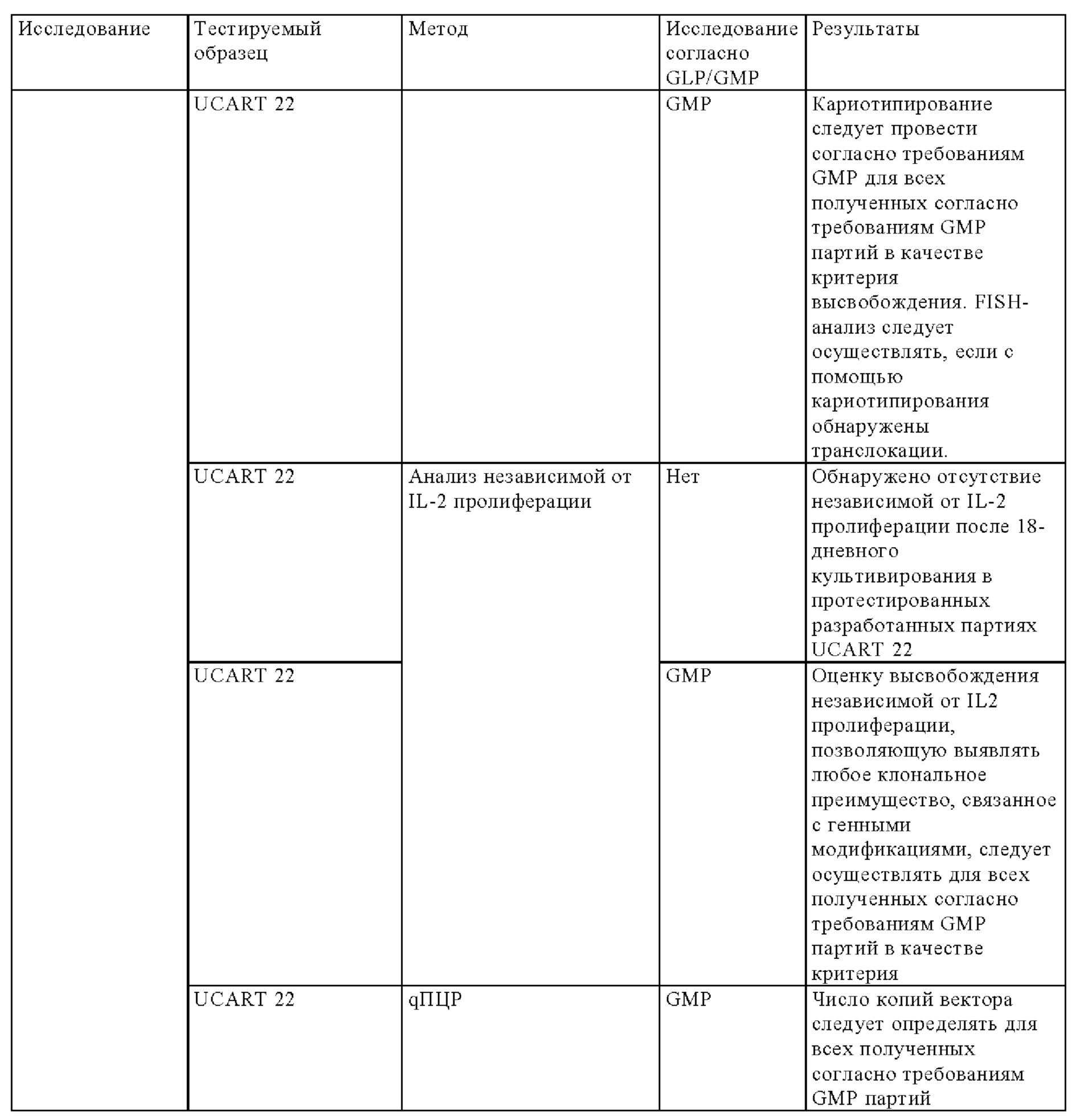

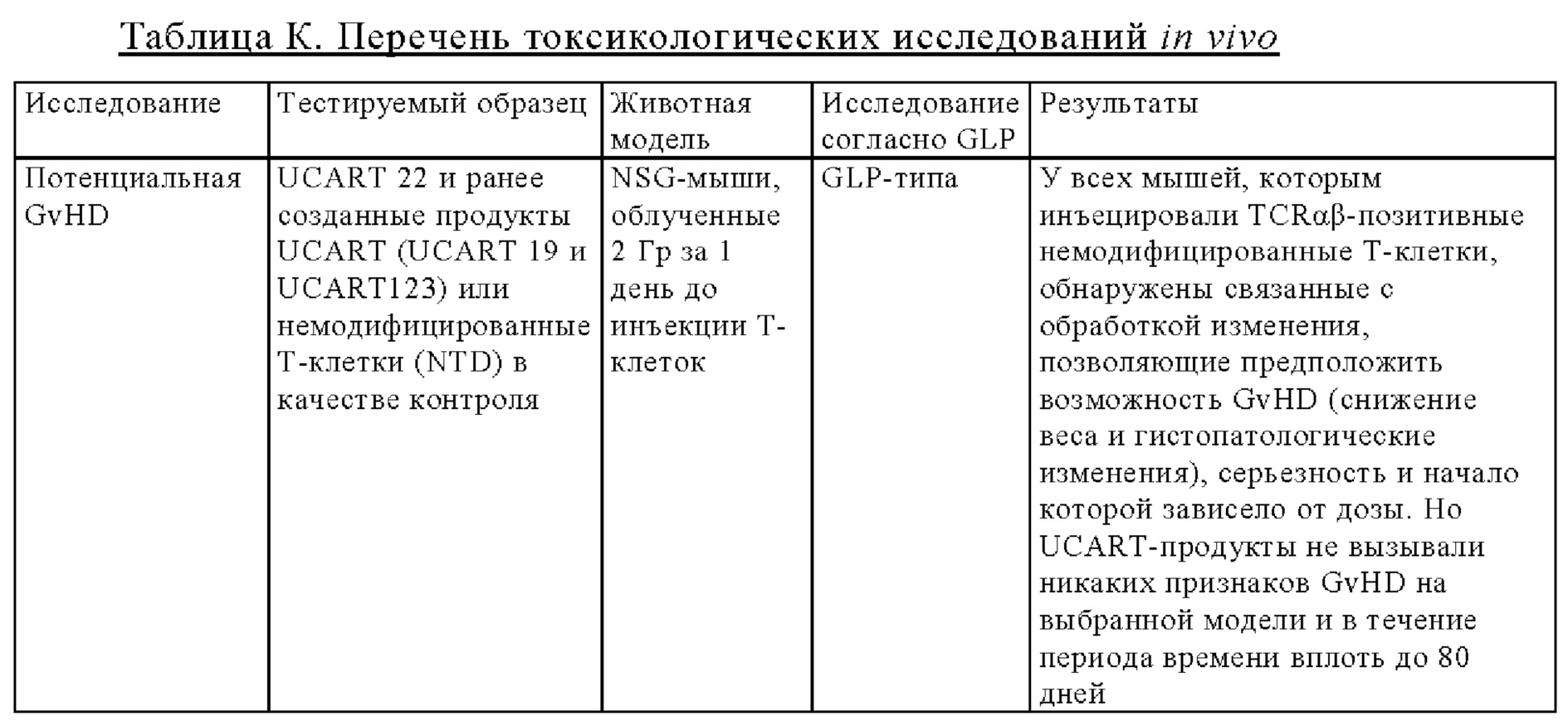
Потенциальный риск GvHD оценивали на мышах с иммунодефицитом ранее в процессе разработки UCART-продуктов. Применение указанной животной модели позволяло эффективно осуществлять приживление человеческих Т-клеток и, как продемонстрировано ранее, у этой модели стабильно происходило развитие ксеногенной GvHD после инъекции человеческих РВМС или Т-клеток (Ali и др., 2012; Schroeder и DiPersio, 2011).
Нецелевая активность CD22 CAR
CD22-специфичность CD22 CAR оценивали, используя соответствующее своду международных требований к лабораторным исследованиям (GLP) изучение тканевой кросс-реактивности, в котором продемонстрировано отсутствие неожиданного нецелевого связывания scFv-компонента CD22 CAR с человеческими тканям, и в настоящее время продолжается скрининг с использованием технологии Retrogenix. Кроме того, в опубликованных данных клинического исследования на пациенте, которого лечили с помощью экспрессирующих полученный из m971 CAR Т-клеток, описано отсутствие нецелевой токсичности (Fry и др., 2017).
Поскольку CD22 экспрессируется на здоровых В-клетках, риск В-клеточной аплазии, являющейся результатом нацеленной/но не направленной на опухоль активности UCART 22, является возможным при длительном присутствии UCART 22.
GVHD, связанная UCART 22 CAR
Основной риск безопасности UCART 22-продукта, связанная с потенциальной способностью UCART 22 опосредовать GvH-реакцию, элиминирована путем разрушения гена TRAC и очистки TCRap-клеток. Указанный риск оценивали ранее в процессе разработки UCART-продуктов (UCART 19 и UCART 123) в доклинических испытаниях in vivo. Признаки GvHD обнаружены у всех NSG-мышей, которым инъецировали немодифицированные Т-клетки, при этом более серьезные симптомы обнаружены при применении наиболее высокой дозы, но никаких связанных с обработкой изменений не обнаружено у мышей, которым инъецировали UCART. К настоящему времени в условиях клинического испытания из 14 пациентов, которых лечили UCART 19, у 4 развилась кожная GvHD от слабой до умеренной (у трех балла 1 и у одного балл 2) (Qasim и др., 2017), и эти данные представлены на съезде ASH (американское гематологическое общество) в 2017 г. R. Benjamin и W. Qasim), и она не требовала системного лечения.
CRS
Были идентифицированы другие потенциальные риски безопасности, связанные с введением иммунотерапевтических продуктов и заболеванием, для лечения которых их применяют: реакция, связанная с инфузией, синдром выброса цитокинов (CRS), синдром лизиса опухоли, инфекции и нейротоксичность. CRS является частым нежелательным явлением при иммунотерапии и особенно при применении CAR Т-клеток. В клинических испытаниях аутологичных анти-CD19 CAR Т-клеток обнаружено, что интенсивность выброса цитокинов зависит от комбинации нескольких параметров, таких как доза инъецированных CAR Т-клеток, сигнальные домены CAR (4-1BB/CD28), уровень пролиферации CAR Т-клеток и опухолевая нагрузка пациента в день обработки. Указанные риски оценивали in vivo на модели, соответствующей недавно описанной (Taraseviciute A., Kean L. и Jensen M.С. Creation of the First Non-Human Primate Model That Faithfully Recapitulates Chimeric Antigen Receptor (CAR) Т Cell-Mediated Cytokine Release Syndrome (CRS) and Neurologic Toxicity Following В Cell-Directed CAR-T Cell Therapy. Blood, 128(22), 2016, с. 651. Доступна 28 марта 2018 г. Получена из http://www.bloodjournal.org/content/128/22/651).
Рекомендация по исходной дозе для FIH-исследований
Стандартные методы определения приемлемых для клинических исследований доз не пригодны для иммунотерапии на основе CAR Т клеток, из-за ограниченной релевантности животной(ых) модели(ей), биодинамической природы продукта и иммунноадоптивного механизма действия.
Поэтому выбор исходной клинической дозы главным образом базируется на (I) существующем опыте, накопленном при применении CAR Т-клеток на людях (литература об аутологичных CAR Т-клетках); (II) случаях, в которых требуется помощь, и данных, полученных для пациентов, которые включены в текущие клинические исследования UCART 19 в University College London (UCL) и King's College London (KCL) (ссылка на (Qasim и др., 2017), и на презентациях R. Benjamin и W. Qasim на съезде ASH 2017 г.) и (III) дозах, которые в настоящее время изучены или одобрены в исследованиях других аутологичных CAR для лечения B-ALL. Указанный подход описан в разделе, касающемся клинических испытаний.
Первые результаты клинических испытаний продемонстрировали сильное уменьшение опухолевой массы при осуществлении обоих анализов (>80%) у пациентов, обработанных UCART 22. Кроме того, данные продемонстрировали, что даже короткое, но эффективное лечение (двумя дозами) может прерывать развитие связанного со злокачественными В-клетками заболевания и освобождаться от него (73% случаев ремиссии через 150 дней), прежде всего, после повторяющегося дозирования и/или применения UCART 22 и 19.
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая сконструированную клетку с «выключенным» (нокаут) человеческим Т-клеточным рецептором (TCR-KO), экспрессирующую на своей поверхности химерный антигенный рецептор (CAR), специфический в отношении кластера дифференциации 22 (CD22) (UCART 22), и защитный переключатель, для предотвращения или лечения пациента, страдающего от опосредованного CD22+ рака или опосредованного CD22+ воспалительного заболевания, популяцию клеток и фармацевтическую композицию. В одном из вариантов реализации клетка UCART 22 экспрессирует анти-CD22 CAR, содержащий внеклеточный домен, трансмембранный домен из СD8альфа и внутриклеточный сигнальный домен, и причем указанный анти-CD22 CAR имеет полипептидную последовательность, идентичную по меньшей мере на 80% SEQ ID NO: 15. Изобретение расширяет арсенал средств для предотвращения или лечения пациента, страдающего от опосредованного CD22+ рака или опосредованного CD22+ воспалительного заболевания. 3 н. и 11 з.п. ф-лы, 9 ил., 24 табл., 1 пр.
Формула
Документы, цитированные в отчёте о поиске
Плазмида без устойчивости к антибиотику

Комментарии