Фармацевтическая композиция, содержащая c-kit-лиганд и гемопоэтический фактор, способ повышения уровней стволовых клеток в периферической крови, антагонист c-kit-лиганда, антисмысловая молекула нуклеиновой кислоты, способ увеличения уровней клеток перифе - RU2180850C2
Код документа: RU2180850C2
Чертежи






































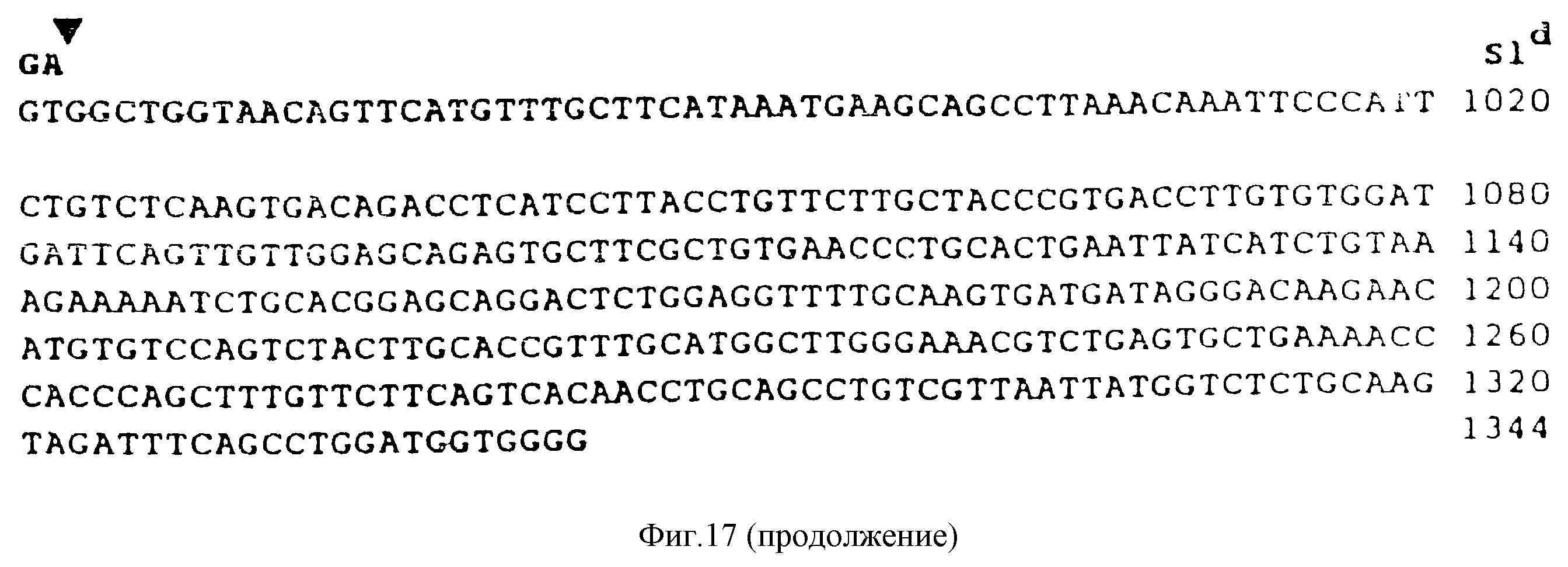














Описание
Изобретение является частичным продолжением заявки США 07/873962, поданной 23 апреля 1992, содержание которой вводится в настоящую заявку в качестве ссылки.
Работа над настоящим изобретением проводилась в соответствии с договором о субсидии ROI-CA 32926 и ACS MV 246D от национального института здравоохранения и Американского противоракового общества соответственно. Правительство США имеет определенные права на это изобретение.
Известный уровень техники
Различные публикации, на которые имеются ссылки в настоящей заявке, обозначены арабскими цифрами в скобках. Полная
библиография приводится в конце описания. Для более полного описания уровня техники, предшествующего настоящему изобретению, раскрытие указанных публикаций во всей своей полноте вводится в настоящую
заявку посредством ссылки.
Протоонкоген c-kit кодирует трансмембранный рецептор тирозин-киназы для неидентифицированного лиганда и является членом подсемейства kit-рецепторов, рецептора колониестимулирующего фактора - I(CSF-I) - фактора роста, происходящего от тромбоцитов (PDGF) [7, 41, 57, 3]. Недавно было показано, что с-kit является аллельным по локусу белой пятнистости (W) (White - spotting) мыши [9, 17, 35]. Мутации в W-локусе влияют на пролиферацию и/или миграцию и дифференциацию зародышевых клеток, пигментных клеток и различных популяций клеток гематопоэтической системы в процессе развития организма и в течение его взрослой жизни [47, 51]. Влияние на гемопоэз заключается в воздействии на линии дифференцировки эритроидных и тучных клеток, а также стволовых клеток, что приводит к макроцитарной анемии, которая является летальной для гомозигот по большинству сильных W-аллелей [46], и к полному отсутствию тучных клеток в соединительной ткани и слизистой оболочке [72]. W-мутации действуют в клетке автономным образом [28, 46], и в соответствии с этим свойством W-мутации было показано, что мРНК с-kit экспрессируется в мишенях для W-мутаций [35] . Высокий уровень c-kit-мРНК был обнаружен в зародышевых тучных клетках, происходящих из костного мозга, и линиях тучных клеток. Несколько меньшие уровни обнаруживаются в меланоцитах и эритроидных клеточных линиях.
Идентификация лиганда для c-kit представляет большой интерес для специалиста, поскольку он может оказывать плейотропное действие на различные типы клеток, которые экспрессируют c-kit и которые подвержены влиянию W-мутаций in vivo. На основании знаний о функции c-kit/W могут быть получены важные сведения о типах клеток, которые могут продуцировать c-kit-лиганд. Отсутствие тучных клеток как в соединительной ткани, так и в слизистой желудочно-кишечного тракта W/Wv-мышей свидетельствует о роли c-kit в развитии тучных клеток. Тучными клетками, происходящими из костного мозга (ВММС), являются интерлейкин-3 (IL-3)-зависимыми; причем аналогичные тучные клетки обнаруживаются в слизистой оболочке желудочно-кишечного тракта (ММС) [92, 93]. Тучные клетки соединительной ткани, происходящие из брюшной полости (СТМС), in vitro необходимы для пролиферации IL-4 и IL-4 [79, 75]. Интерлейкины IL-3 и IL-4 характеризуются как гемопоэтические факторы роста, которые продуцируются активированными Т-клетками и активированными тучными клетками [92, 94, 95, 96, 97]. Было высказано предположение, что существует, кроме того, фактор роста тучных клеток, который продуцируется фибробластами [47]. При отсутствии IL-3 BMMC и СТМС, полученные из брюшной полости, могут поддерживаться совместным культивированием с 3Т3-фибробластами [98]. Однако BMMC, происходящие от W/Wv-мышей, a также от мышей, гомозиготных по ряду других W-аллелей, оказались неспособны к пролиферации в системах совместного культивирования с фибробластами в отсутствие IL-3 [99, 100, 38]. Это позволило сделать предположения относительно определенной функции рецептора c-kit в зрелых тучных клетках и придти к заключению, что лиганд c-kit-рецептора продуцируется фибробластами. Недавно Huff и его коллегами было сделано сообщение о стимуляции колоний тучных клеток, происходящих из лимфоузлов мыши, инфицированной нематодой Nippostronglyus brasiliensis с использованием концентрированной кондиционированной среды для фибробластов NIH-3T3 [84]. Был разработан короткий тест на пролиферацию тучных клеток, заключающийся в выделении фибробласт-ассоциированной активности (обозначенной KL), которая в отсутствие IL-3 способствует пролиферации W/Wv BMMC. Кроме того, было показано, что KL способствует образованию очага дифференцировки ранних клеток-предшественников эритроидного ряда (бурст-очаг) (BFU-E). Биологические свойства KL соответствуют предполагаемым свойствам c-kit-лиганда в отношении биологии тучных клеток и эритропоэза. Дефектные W-мутации являются клеточно-автономными, и в соответствии с этим свойством была проиллюстрирована экспрессия c-kit-PHK в клетках-мишенях W-мутаций [35, 39]. Проведенная недавно характеризация молекулярных повреждений нескольких мутантных аллелей показала, что они являются мутациями с потерей функции, что приводит к нарушению нормальной активности или экспрессии c-kit-рецептора [35, 100, 101, 36].
Мутации в steel-локусе (SI) мышиной хромосомы 10 приводят к появлению фенотипических признаков, которые очень похожи на признаки, наблюдаемые у мышей, несущих W-мутации, т.е. они влияют на гемопоэз, гаматогенез и меланогенез [5, 47, 51]. Многие аллели в SI-локусе являются известными (они являются полудоминантными мутациями), и различные аллели сильно варьируются как по своему влиянию на линии дифференцировки различных клеток, так и по степени своей доминантности [47, 51]. Исходный SI-аллель представляет собой сильную мутацию. SII SI-гомозиготы редко встречаются среди зародышевых клеток, лишены покровного пигмента, и погибают перинатально от пакроцитарной анемии [5, 50]. Мыши, гомозиготные по SI-аллелю, хотя и являются жизнеспособными, однако у них наблюдается тяжелая форма макроцитарной анемии, отсутствие пигмента в шкуре и стерильность. Гетерозиготы по SII+ и SId/+ - аллелям имеют бледную окраску шкурки и умеренную макроцитарную анемию, однако при этом они способны производить потомство, но их гонады уменьшены в размерах. В противоположность W-мутациям SI-мутации не имеют клеточной автономии, и, по-видимому, обусловлены дефектом в микроокружении мишеней для указанных мутаций [28, 30, 12]. На основании параллельных и дополнительных характеристик мышей, несущих SI и W-мутации, авторы настоящей заявки и др. высказали предварительную гипотезу, что генный продукт является лигандом c-kit-рецептора [51, 9].
Протоонкоген c-kit является нормальным клеточным эквивалентом онкогена v-kit HZ4-вируса сакромы кошек [7]. c-kit кодирует трансмембранный рецептор тирозин-киназы, который является членом подсемейства рецепторов для фактора роста, происходящего от тромбоцитов, и представляет собой генный продукт локуса белой пятнистости [9, 17, 23, 35, 41, 57]. Идентичность c-kit с W-локусом свидетельствует о том, что система c-kit-рецепторов играет определенную роль в различных аспектах меланогенеза, гаметогенеза, и гемопоэза в процессе развития зародыша и у зрелого животного [47, 51]. Подтверждением вышеуказанной гипотезы относительно функций c-kit-рецептора является тот факт, что c-kit-мРНК экспрессируется в клетках-мишенях для W-мутаций [3, 24, 25, 35, 39].
На основании известных данных о функции c-kit/W в тучных клетках недавно был идентифицирован и охарактеризован лиганд c-kit-рецептора (KL) [2, 14, 37, 38, 56, 58, 59]. В соответствии с предсказанными функциями c-kit-рецепторов в гепопоэзе KL стимулирует пролиферацию тучных клеток, происходящих из костного мозга и соединительной ткани; а в эритропоэзе KL в сочетании с эритропоэтином стимулирует образование очагов дифференцировки ранних клеток-предшественников эритроидного ряда (7-14-дневные BFU-Е). Кроме того, недавно проведенные in vitro-эксперименты с KL проиллюстрировали усиление пролиферации и дифференцировки эритроидных, миелоидных и лимфоидных предшественников в случае, когда KL использовали в сочетании с эритропоэтином, GM-CSF, G-CSF и IL-7 соответственно, что позволяет предположить, что система c-kit-рецепторов играет определенную роль в образовании предшественников нескольких гемопоэтических клеточных линий дифференцировки [27, 37].
Мутации в steel-локусе мышиной хромосомы 10 приводят к фенотипическим признакам, которые очень похожи на признаки, наблюдаемые у мышей, несущих W-мутации, т. е. они влияют на гемопоэз, гаметогенез и меланогенез [5, 47, 51]. Недавно было показано, что лиганд c-kit-рецептора KL является аллельным с мышиным steel-локусом, о чем свидетельствовал установленный из наблюдений факт делегации в SI-последовательностях у нескольких сильных SI-аллелях [11, 38, 59] . Согласно лиганд-рецепторному соотношению между KL и c-kit SI-мутации воздействуют на те же клеточные мишени, что и W-мутации, однако в противоположность W-мутациям SI-мутации не являются клеточно-автономными и оказывают влияние на микроокружение c-kit-рецептора [12, 28, 30]. Мутации в steel-локусе являются полудоминантными мутациями, и различные аллели широко варьируются как по своему влиянию на линии дифференцировки различных клеток, так и по степени своей доминантности [47, 51]. Исходный аллель SI является примером сильной SI-мутации. SI/SI-гомозиготы имеют дефицит зародышевых клеток, лишены окраски шерсти и уже внутриутробно погибают от макроцитарной анемии [5, 50] . Мыши, гомозиготные по SId-аллелю, хотя и являются жизнеспособными, однако у них наблюдается тяжелая макроцитарная анемия, отсутствие окраски шерсти и стерильность [6]. Гетерозиготы по SI/+ и SI/d/+ - аллелям имеют более светлую окраску шерсти и умеренную макроцитарную анемию; однако при этом они способны производить потомство, хотя их нонады уменьшены в размерах. Саузерн-блот-анализ Sid/+ - ДHК, проводимый с использованием KL-ДНК в качестве зонда, засвидетельствовал EcoRI-полиморфизм, что дает основание предположить, что указанная мутация приводит к делеции, точечной мутации или ДНК-реаранжировке KL-гена (II).
Краткое описание изобретения
Была изготовлена фармацевтическая композиция, которая включает в себя c-kit-лиганд (KL), очищенный авторами настоящей заявки или продуцированный рекомбинантными методами, разработанными заявителями, в
сочетании с другими гемопоэтическими факторами, и фармацевтически приемлемый носитель. Были также разработаны методы лечения пациентов, заключающиеся во введении этим пациентам фармацевтической
композиции настоящего изобретения. Настоящее изобретение относится к комплексному лечению с использованием c-kit-лиганда (KL) и очищенного полипептида c-kit-лиганда (KL) или его растворимого фрагмента,
и других гемопоэтических факторов. Настоящее изобретение также относится к методам и композициям для ex-vivo-использования KL как отдельно, так и в комплексной терапии. В настоящей заявке, кроме того,
описан мутированный антагонист KL. Этот антагонист может также представлять собой небольшую молекулу. Помимо этого описываются антисмысловые нуклеиновые кислоты для KL, используемые в качестве
терапевтических средств. И наконец, в настоящей заявке показано, что KL играет важную роль в зародышевых клетках, тучных клетках и меланоцитах.
Настоящее изобретение относится к нуклеиновой кислоте.
Настоящее изобретение относится к нуклеиновой кислоте, которая кодирует аминокислотную последовательность, соответствующую c-kit-лиганду (KL) и очищенному полипептиду c-kit-лиганда (KL).
Краткое описание чертежей
Фиг. 1. Пролиферативный ответ +/+ и W/W-BMCC на кондиционированную фибробластами среду и II -3. Тучные клетки,
происходящие от +/+ или W/Wv-костного мозга культивировали в присутствии 1% зсм, 10% FCM (20•концентрированные), или в одной лишь среде. Включение3H-тимидина оценивали
после 24-30-часового культивирования.
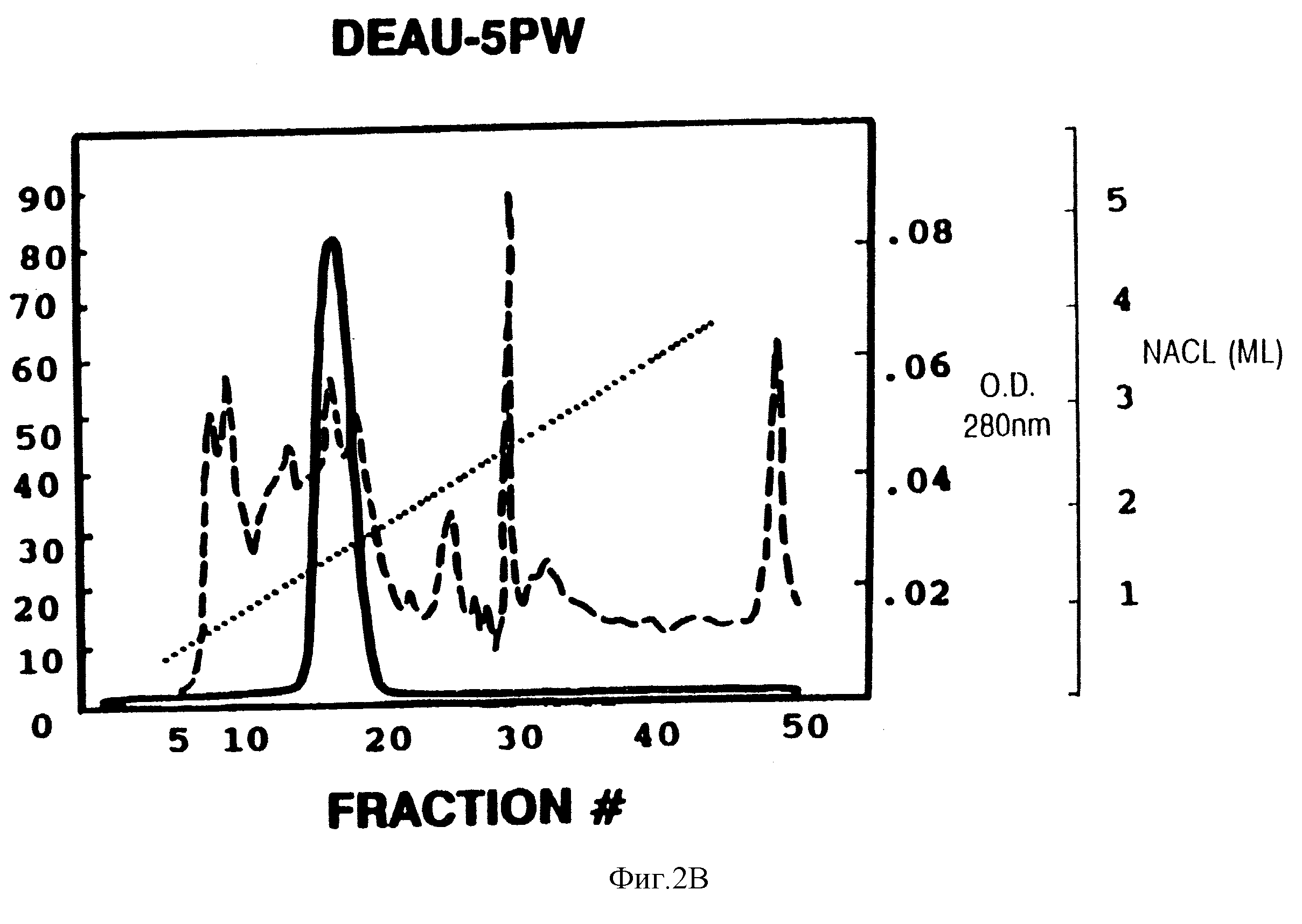
Фиг.2. Хроматографические профили очистки KL.
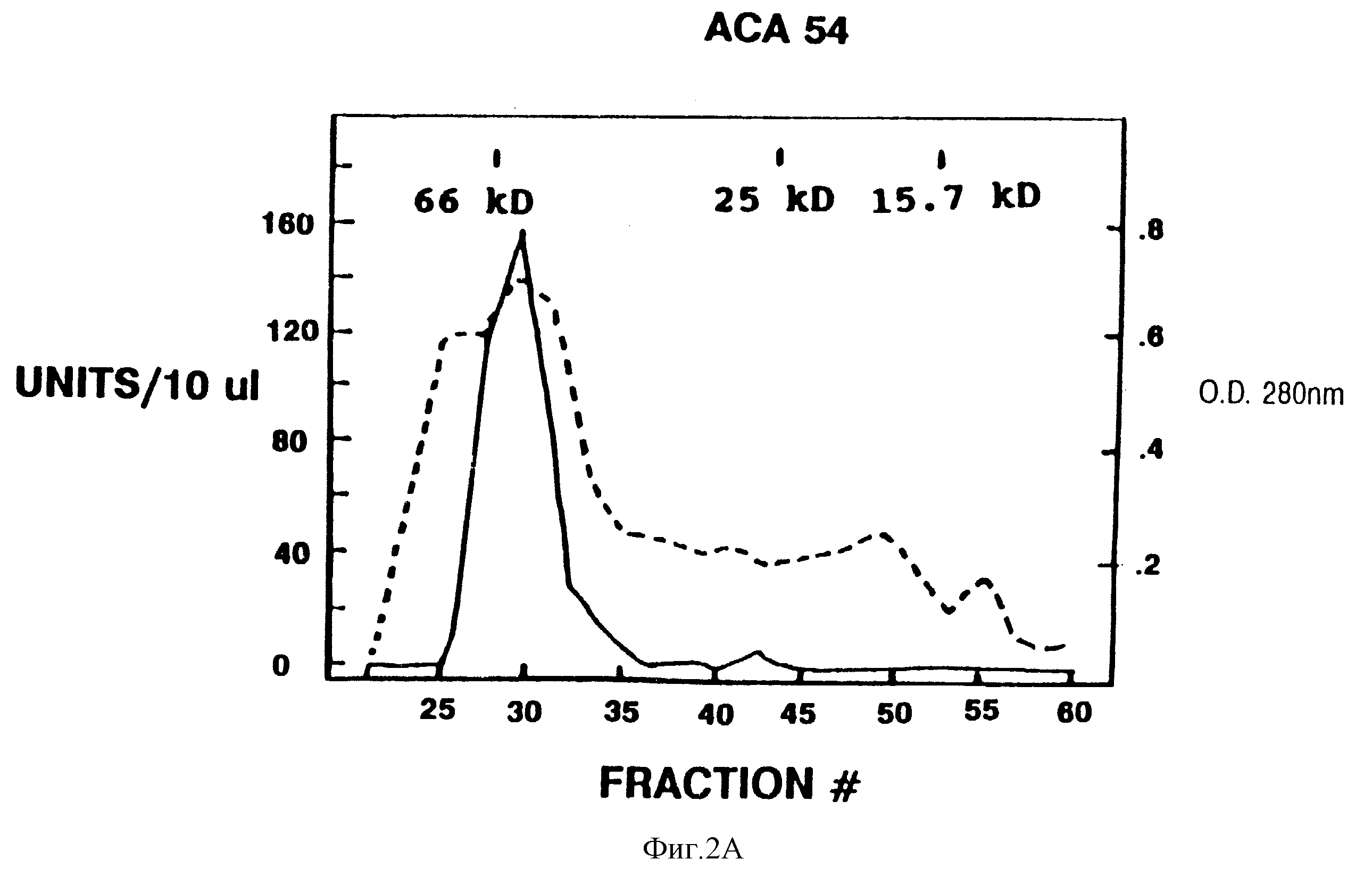
А. Гель-хроматографии на Ultrogel АСА 54. Оптическая плостность при 280 нм показана пунктирной линией, а биоактивность показана сплошной линией. Положения при элюировании метчиков размера белка показаны в кД.
В. Анионообменная FPLC (жидкостная экспресс-хроматография) на колонке DEAE-5PW. NaCl-градиент показан пунктирной линией.
С. Разделение на полупрепаративной С18-колонке. Градиент I-пропанола показан пунктирной линией.
1. Разделение на аналитической С 18-колонке.
Фиг.3. Электрофоретический анализ KL. Материал от отдельных фракций разделяли с помощью ДСН/ПААГ (12%)-электрофореза и окрашивали серебром. Положение KL (28-30 кД) показано стрелкой. KL-активность соответствующих фракций показана ниже.
А. Анализ 0,5 мл фракций из аналитической С18-колонки, элюированной аммонийацетатным буфером и градиентом 1 -пропанола.
В. Анализ 0,5 мл фракций из аналитической С4-колонки, элюированной водной 0,1% TFA и при отсутствии 2-меркапто-этанола.
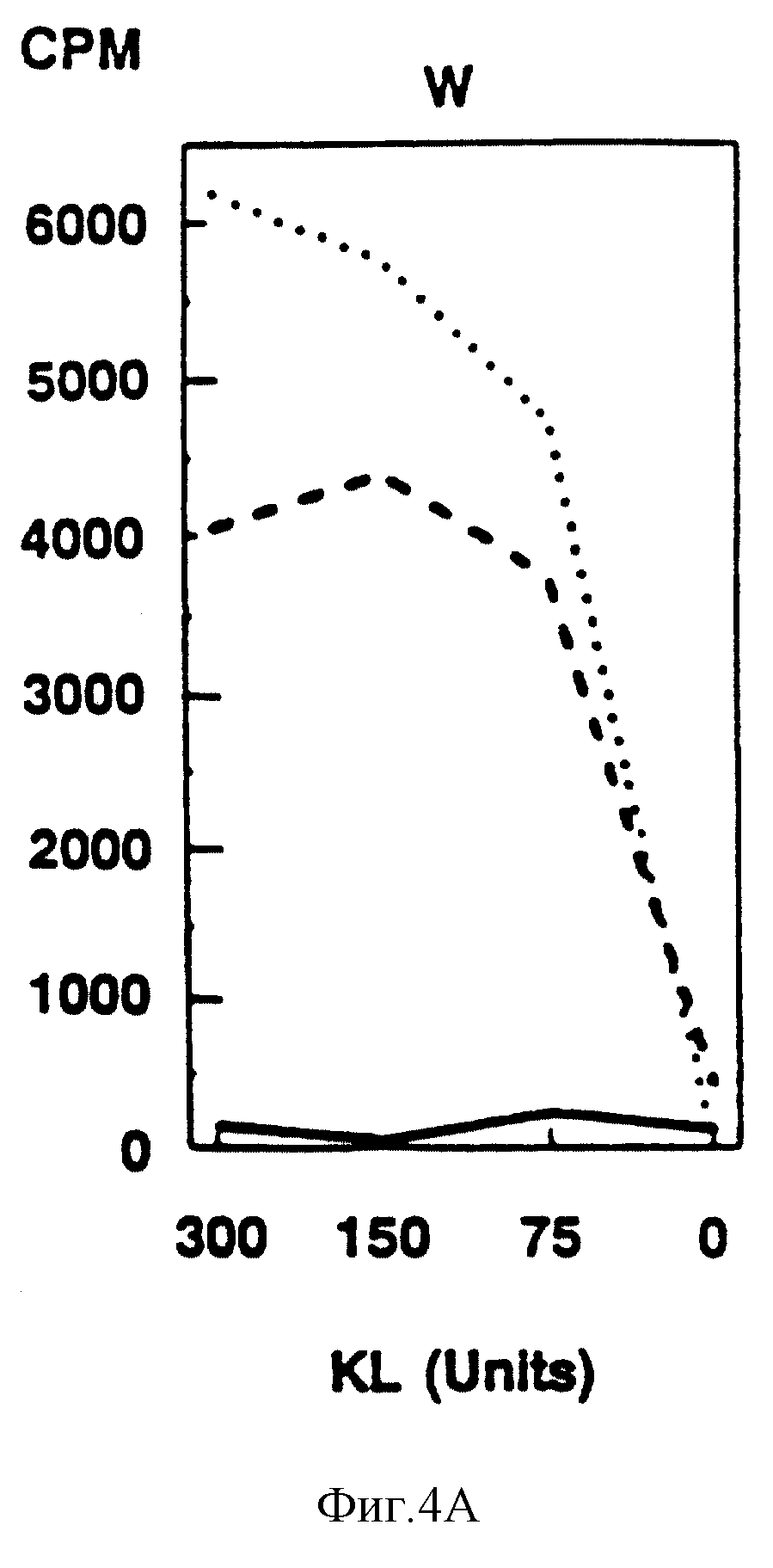
Фиг. 4. Пролиферация Wv-мутантных тучных клеток в ответ на KI. Тучные клетки были получены из печени эмбриона, взятой от W/+ХW/+гибрида, либо из костного мозга дикого типа, W и W41 -гeтepoзигoт и гомозигот. Степень пролиферации мутантных тучных клеток оценивали путем повышения концентраций KI в анализе на пролиферацию. Гомозиготные мутантные тучные клетки показаны сплошной линией, гетерозиготные мутантные тучные клетки - пунктирной линией, а тучные клетки дикого типа - точечным пунктиром за исключением W, где нормальные эмбрионы могут быть либо +/+, либо W/+.
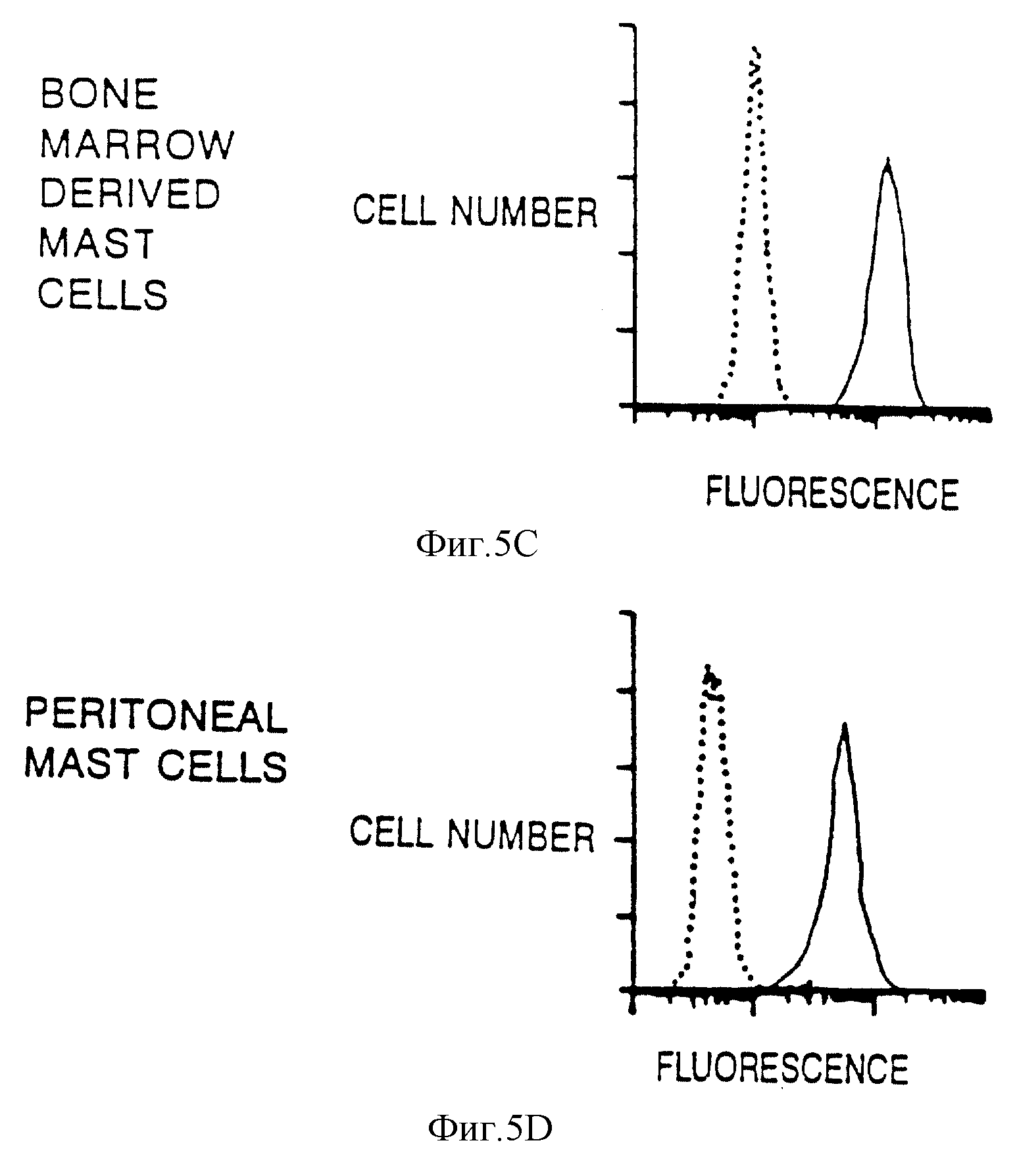
Фиг. 5. Сравнение c-kit-экспрессии и чувствительности к фактору роста в ВММС и перитональных тучных клетках (СТМС/РМС).
А. Флуоресцентное окрашивание гепарин-гликопротеида в очищенных РМС и ВММС с использованием берберинсульфата.
В. Оценка экспрессии c-kit на клеточной поверхности РМС и ВММС при помощи FACS (флуоресцентного метода разделения клеток) с использованием антител к c-kit. Сыворотка против c-kit показана сплошной линией, а неимунная контрольная сыворотка показана пунктирной линией.
С. Оценка пролиферативного потенциала РМС в присутствии KL. 5000 клеток засевали в 0,5 мл RPMI-C-среды в присутствии 100 ед./мл KL, 10% Wehi-3СМ или одной среды и через две недели определяли число жизнеспособных клеток.
Фиг. 6. Оценка "бурст" - стимулирующей активности KL. Клетки костного мозга и селезенки культивировали в присутствии эритропоэтина (2 ед./мл) и с добавлением чистого KL в указанной концентрации. На 7 день культивирования определяли число BFU-E. Полученные данные выражали как средние значения из двух отдельных экспериментов, каждый из которых проводили в двух дубликатах каждой концентрации KL.
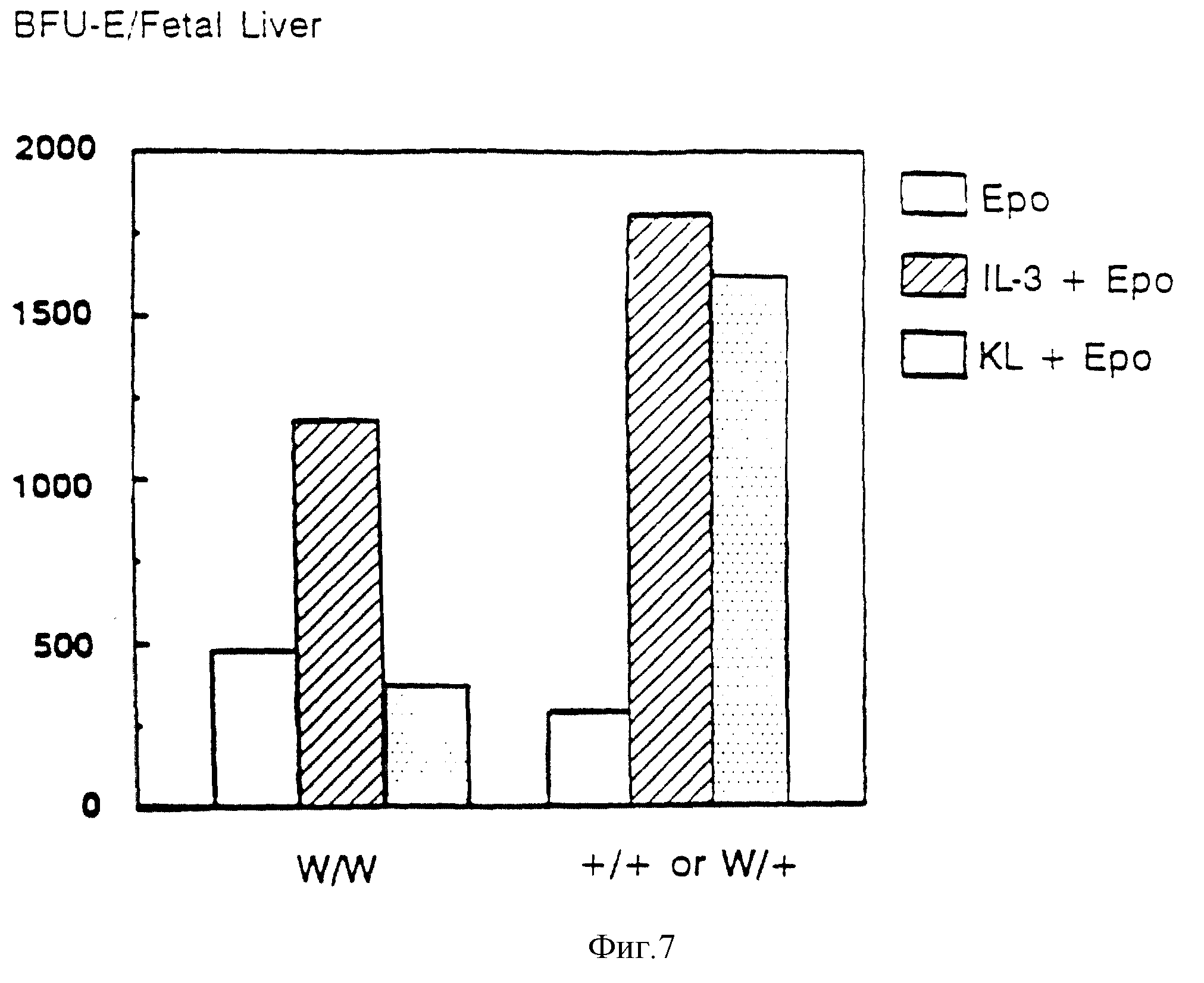
Фиг. 7. Оценка KL-зависимого образования BFU-E из печени W/W-эмбриона. Эмбрионы от скрещенных W/+ - животных собирали на 16,5 день беременности. При этом один плод из четырех был W/W-гомозиготным. Клетки печени засевали с плотностью 105 кл/пл в среду, содержащую IL-3 (50 ед./мл) или KL (2,5 мг/мл), либо в контрольную среду. Все культуры содержали эритропоэтин (2 ед. /мл). Полученные данные были выражены как число BFU-E/печень и представляли собой средние значения по двум дубликатным чашкам. Данные для +/+ или W/+ эмбрионов выражали как среднее значение от трех нормальных эмбрионов, у которых брали печень.
Фиг. 8. N-концевая аминокислотная последовательность KL и вывод соответствующей нуклеиновокислотной последовательности с помощью PCR. Верхняя строка: N-концевая аминокислотная последовательность (остатка 10-36) KL. Средняя строка: нуклеотидные последовательности трех кДНК, полученных путем клонирования 101 п.о. PCR-продукта (см. фиг.10) в М13 и последующего определения последовательности. Нижняя линия: последовательности вырожденного и антисмыслового праймеров, используемых для синтеза первой нити кДНК и для PCR. Эта аминокислотная последовательность представлена как SEQ ID 2.
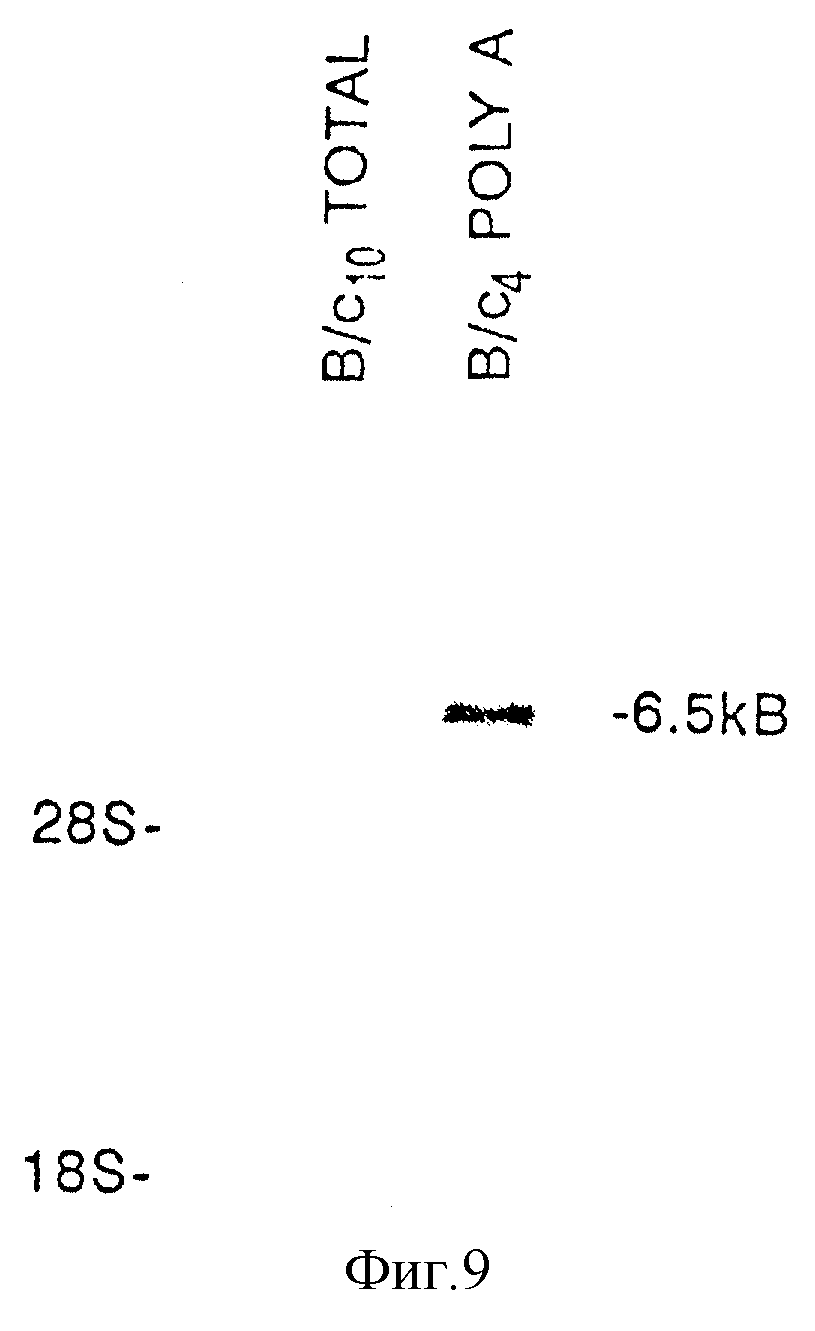
Фиг. 9. Нозерн-блот-анализ с использованием PCR-генерированных олигонуклеотидных зондов, соответствующих выделенному полипептиду c-kit-лиганда. С использованием меченых зондов были выделены 6,5 ко мРНК.
Фиг. 10. Полученные кДНК, соответствующей N-концевым аминокислотам 10-26 KL с помощью RT-PCR. Один микрограмм ро1у(А)-+РНК из Balb/с-3Т3-клеток использовали в качестве матрицы для синтеза кДНК и последующей PCR-амплификацией в комбинации с двумя вырожденными олигонуклеотидными праймерами. На фиг.10 показан электрофоретический анализ 101 п.о. PCR-продукта в агарозе.
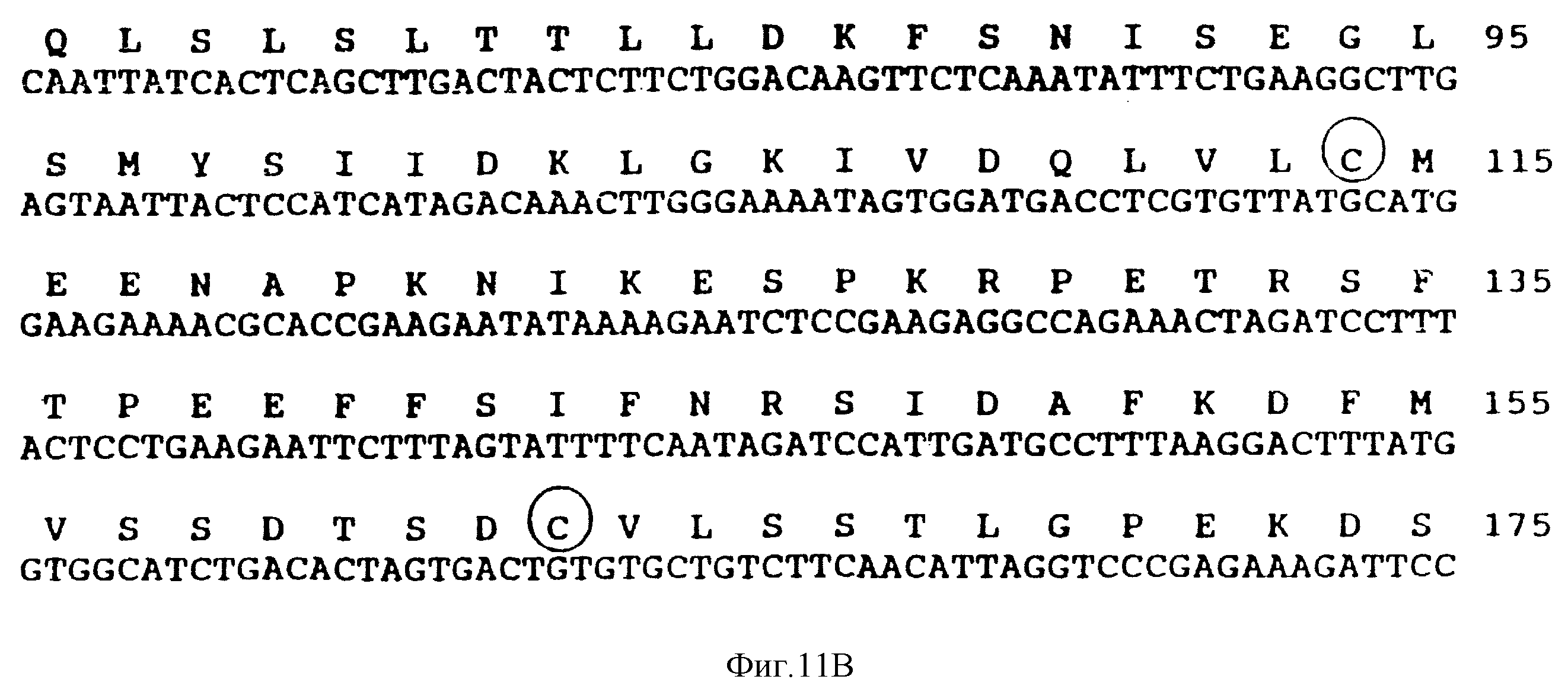
Фиг. 11. Нуклеотидная последовательность и предсказанная аминокислотная последовательность 1,4 kb к ДНК клона KL. Предсказанная аминокислотная последовательность длинной открытой рамки считывания (вверху) и нуклеотидной последовательности показана с использованием однобуквенного кода для аминокислот. Числа справа относятся к аминокислотам, при этом метионин нуклеотиды 16-18) имеет 1. Потенциальная N-концевая сигнальная последовательность (SP) и трансмембранный домен (TMS) показаны сверху пунктирными линиями, а цистеиновые остатки во внеклеточном домене обведены кружочками. Структура предсказанных белковых схематически показана ниже. Там же указываются сайты для N-гликозилирования и расположение N-концевой пептидной последовательности (Pep. Seg). Нуклеиновокислотная последовательность представлена как SEQ ID 1.
Фиг. 12. Идентификация KL-специфических мРНК в РНК клеток Balb/c-3Т3 с помощью Нозерн-блот-анализа. Роly(А)+-PHK (4 мкг) выделяли из Balb/c-3Т3-клеток путем электрофореза, затем переносили на нитроцеллюлозу, и гибридизировали с32Р-меченной кДНК (1,4 kb) KL. На фиг. 12 показана мигнация 18S- и 28S-рибосомных РНК.
Фиг.13. ДСН-ПААГ-анализ KL.
А. Окрашивание KL серебром.
В. Авторадиография125I-KL.
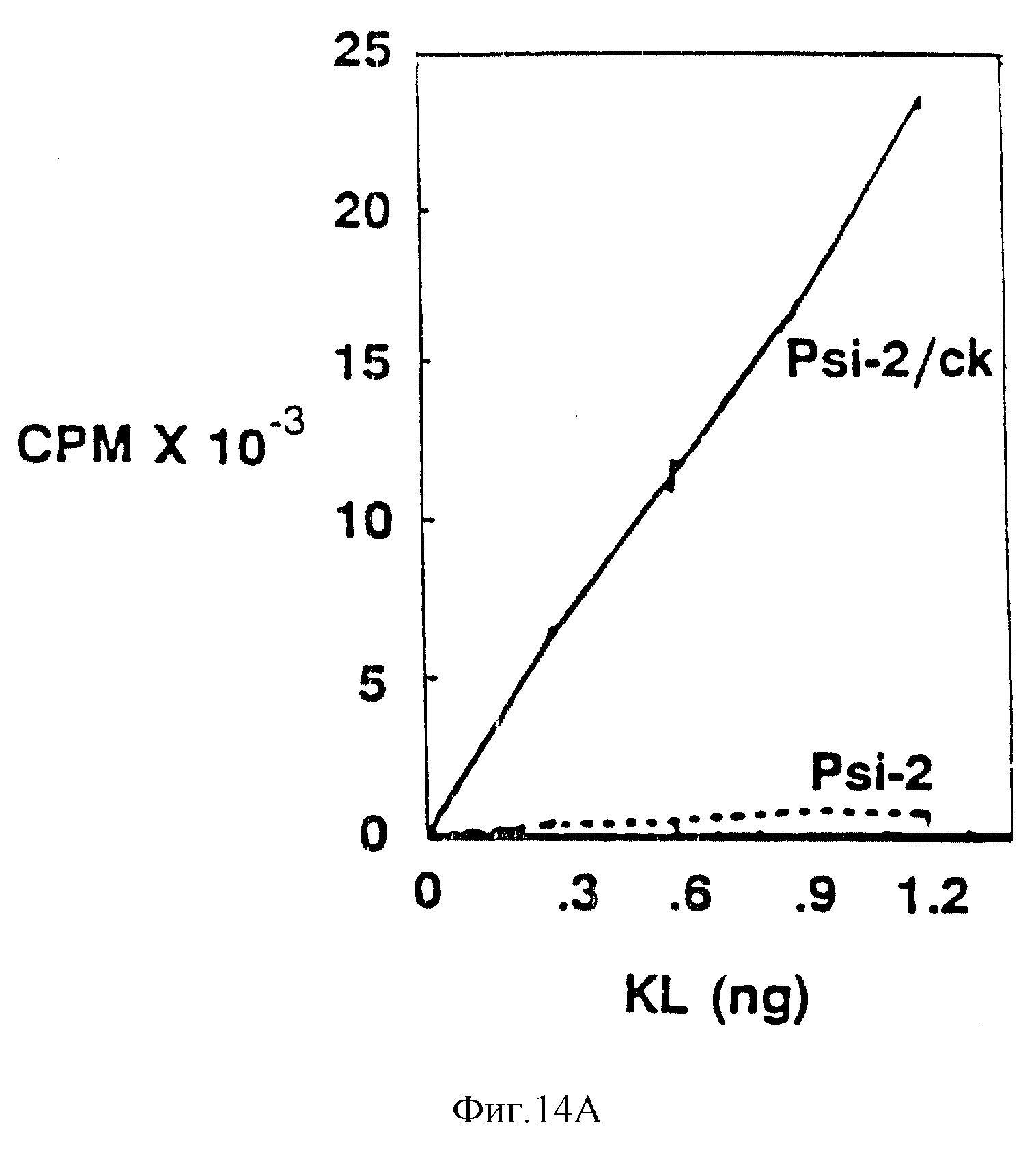
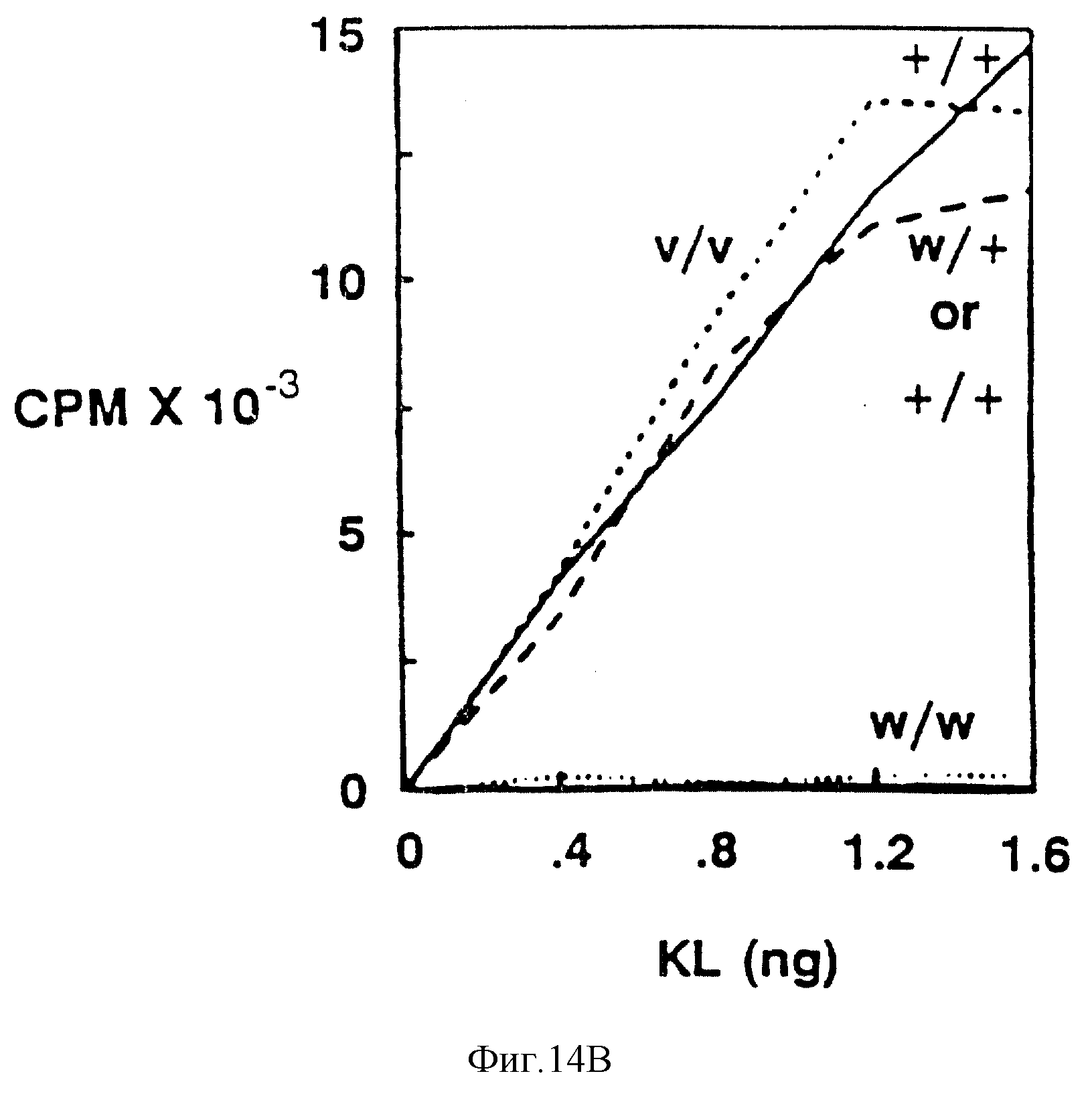
Фиг. 14. Связывание125I-K с тучными клетками и c-kit экспрессирующими 2-клетками.
A. IY 2/ c-kit-клетки, содержащие вектор (pLJ) экспрессии c-kit, и экспрессирующие высокий уровень c-kit-белка.
В. Тучные клетки, происходящие из костного мозга взрослых +/+ -или W/Wv-мышей, или клетки печени эмбриона от W/W, или нормальный контроль от детенышей одного помета (W/+ или +/+).
Фиг. 15. Совместное осаждение и перекрестное связывание125I-KI c-kit-рецептором на тучных клетках.
А. Совместное осаждение KL с нормальной кроличьей сывороткой (NRS) или двумя кроличьими антисыворотками против c-kit (α -c-kit).
В. Перекрестное связывание KL для c-kit с дисукцинимидиловым субстратом. ДСН-ПААГ-анализ проводили либо на 12%, либо на 7,5% полиакриламидном геле. Перекрестно-сшитые образцы помечали "KL+cK".
Фиг. 16. RFL Р-анализ TagI- переваренной ДНК от SI/+ и II I-мышей. SI-аллель от мышей С3НеВ/Fej а/а CaJ I Hm вводили в С57ВL/6J-фон и оценивали потомство, полученное
от скрещивания C57BL/6J SIC3H • SIC3H
А. Гибридизация KL-кДНК-зонда (1,4 кb) с ДНК от двух неанемичных мышей (дорожки SII+) и двух анемичных мышей (дорожки
SIISI). Было зарегистрировано отсутствие гибридизации с ДНК от SII SI-мышей.
В. Гибридизация того же самого блота с TIS Dra/Sal зондом, который тесно связан с SI (см. ниже подробное описание изобретения). Этот зонд идентифицирует С3НеВ/FeJ - аллель (4 кb) и С57В1/6J-аллель (2 кb) и SIc3H+SIc3H гoмoзигoтax.
Фиг. 17. Нуклеотидная и предсказанная аминокислотная последовательность кДНК KL-2 и KL-SId. Показана нуклеотидная последовательность KL-кДНК, полученная из библиотеки плазмидных кДНК клеток Ваlb/3Т3. RT-PCT-продукты от различных тканей, а также SId/+ - полную РНК, KL-I, KL-2 и KL-SFd субклонировали и подвергали секвенированию. Незаштрихованные треугольники обозначают 5'- и 3'-границы экзона, сплайсированного в KL-2; а заштрихованные треугольники указывают на точки делеции в SId-кДHK. Последовательность-вставка SIdкДНК из 67 нуклеотидов представляет собой показанную выше KL-кДНК-последовательность. Стрелками показаны предполагаемые протеолитические сайты рестрикции во внеклеточной области KL-1. Сигнальный пептид (SP) и трансмембранный сегмент (TMS) показаны линиями сверху.
Фиг. 18. Панели А и В. Идентификация посредством RT-PCR клонирования KL-кДНК из нормальных тканей и SId-мутантных фибробластов. Полную РНК получали из различных тканей C57B16/J -мышей и из SId/+ фибробластов. RT-PCR-реакции с РНК (10 мкг) от нормальный тканей и Balb/3T3-клеток осуществляли с использованием праймеров 1 и 2, а реакции с РНК от +/+ и SId/+ фибробластов осуществляли с использованием комбинаций праймеров 1 + 2, 1 + 3, и 1 + 4. Реакционные продукты анализировали с помощью электрофореза в 1% агарозном геле Nusieve в присутствии 0,25 мкг/мл этидийбромида. Показана мигнация # Х174-Нае III-ДНК-маркеров.
Фиг.19. Топология различных KL-концевых сигнальных пептидов, зачерченные сплошь области обозначают трансмембранные домены, а значки Y обозначают сайты N-гликозилирования. Пунктирными линиями показаны границы альтернативно сплайсированного экзона и указаны соответствующие номера аминокислот. Стрелками показаны предполагаемые сайты протеолитического расщепления. Заштрихованная область у С-конца KL-SId обозначает аминокислоты, которые не кодируются KL. KL-S обозначает растворимую форму KL, продуцируемую посредством протеолитического расщепления либо посредством мутации KL путем С-концевого усечения.
Фиг. 20. Идентификация KL-1 и KL-2-транскриптов в различных тканях с помощью анализа защиты от РНКазы32Р-меченный антисмысловой рибозонд (625 нукл. ) гибридизировали с 200 мкг полной РНК от тканей и фибробластов (за исключением легких и сердца, где использовали 10 мкг). После переваривания РНКазой реакционную смесь анализировали с помощью электрофореза в 4% полиакриламидном/мочевинном геле. Были получены защищенные фрагменты из 575 нукл. и 449 нукл. для КL-1 и KL-2 соответственно. Авторадиографическое экспонирование продолжалось в течение 48 или 72 часов, за исключением РНК фибробластов 3Т3, где время экспонирования составляло 6 часов.
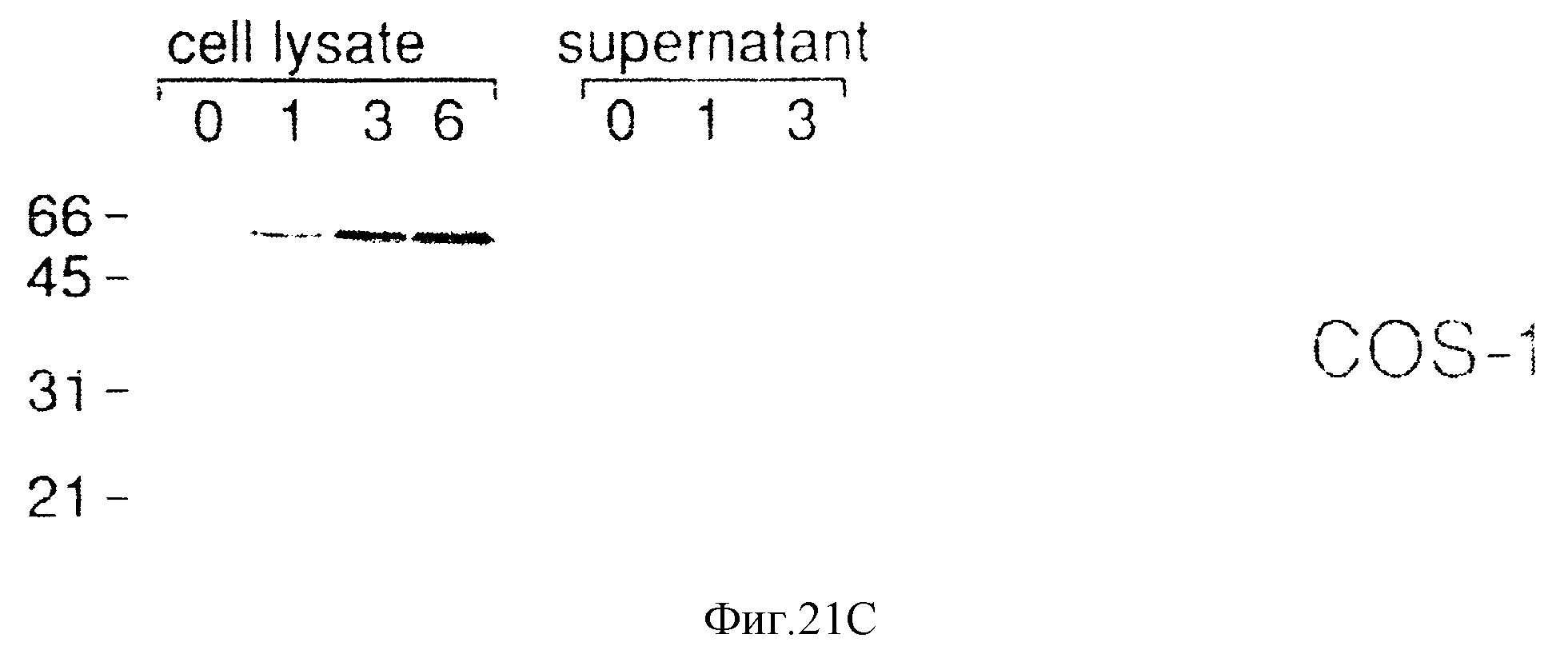
Фиг.21. Панели А-С. Характеристики биосинтеза KL-1- и KL-2-белковых продуктов в COS-клетках. СОS-1-клетки трансфицировали 5 микрограммами KL-1 и KL-2-экспрессирующих плазмид с использованием DEAE-декстрана. Через 72 часа клетки метили35S-метионином в течение 30 минут, после чего среду для мечения заменяли полной средой. Иммунопреципитаты анализировали с помощью ДСН-электрофореза в ПААГ (12%). Мигнация маркеров молекулярной массы показана в килодальтонах (кД).
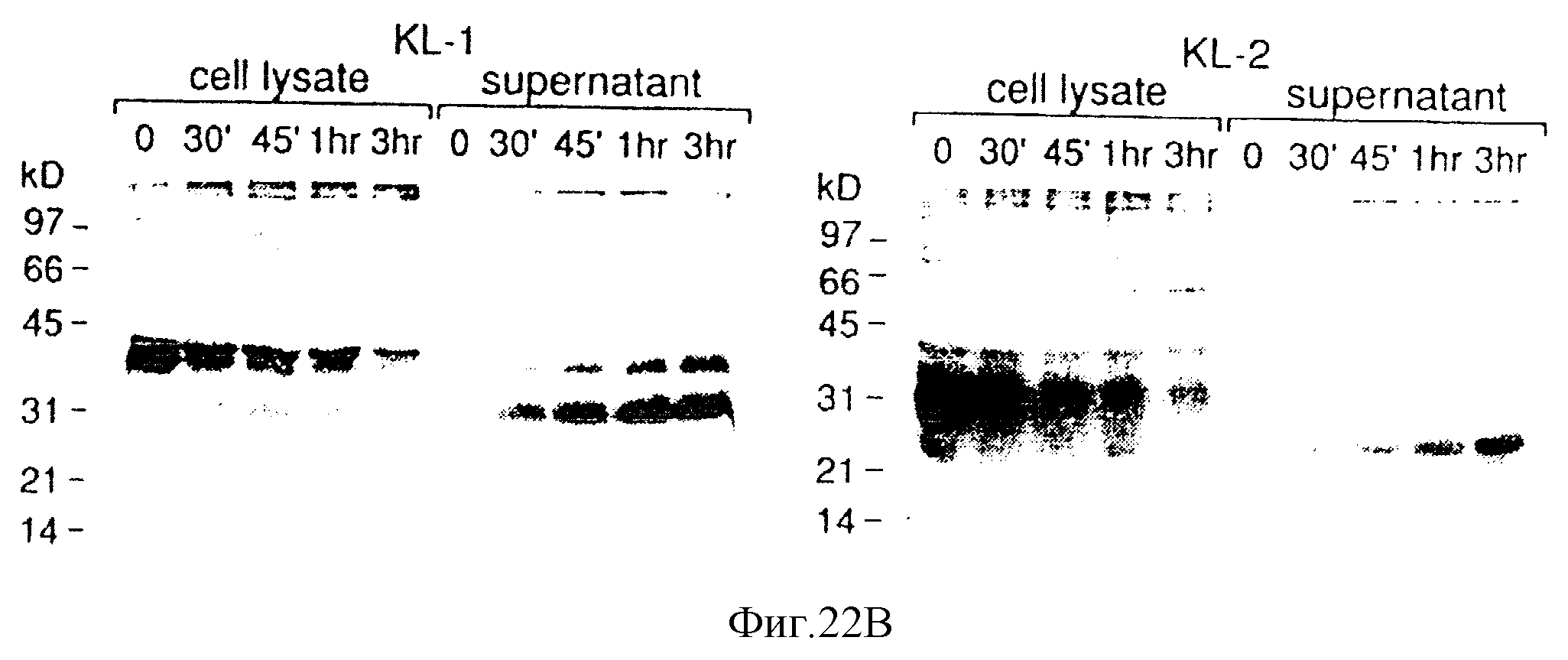
Фиг. 22. Панели А-С. РМА-индуцированное расщепление KL-1 и KL-2-белковых продуктов. COS-1-клетки трансфицировали 5 микрограммами KL-1 и KL-2-экспрессирующих плазмид, и через 72 часа, клетки метили35S-Met в течение 30 минут, а затем среду для мечения заменяли средой: (а) не содержащей сыворотки; (b) содержащей сложный форболовый эфир РМА (1 мкМ); (с) содержащей кальций-ионофор А23187 (1 мкМ). Супернатанты и клеточные лизаты подвергали иммунопреципитации с кроличьей сывороткой против KL. Иммунопреципитаты анализировали с помощью ДСН-электрофореза в ПААГ (12%). Миграция маркеров молекулярной массы показана в килодальтонах (кД).
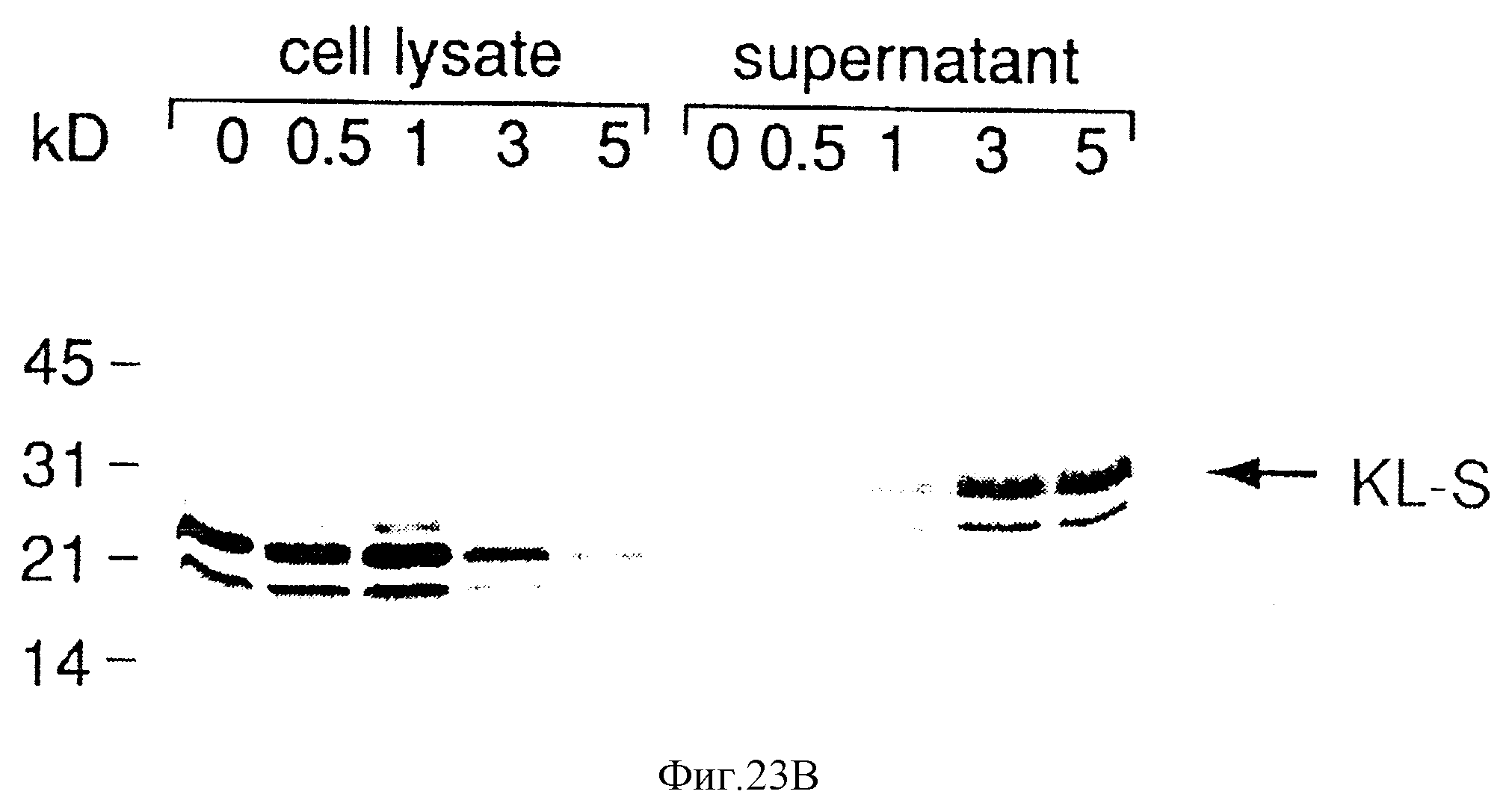
Фиг. 23. Панели А и В. Характеристики биосинтеза KL-SId и KL-S-белковых продуктов в СОS-клетках.
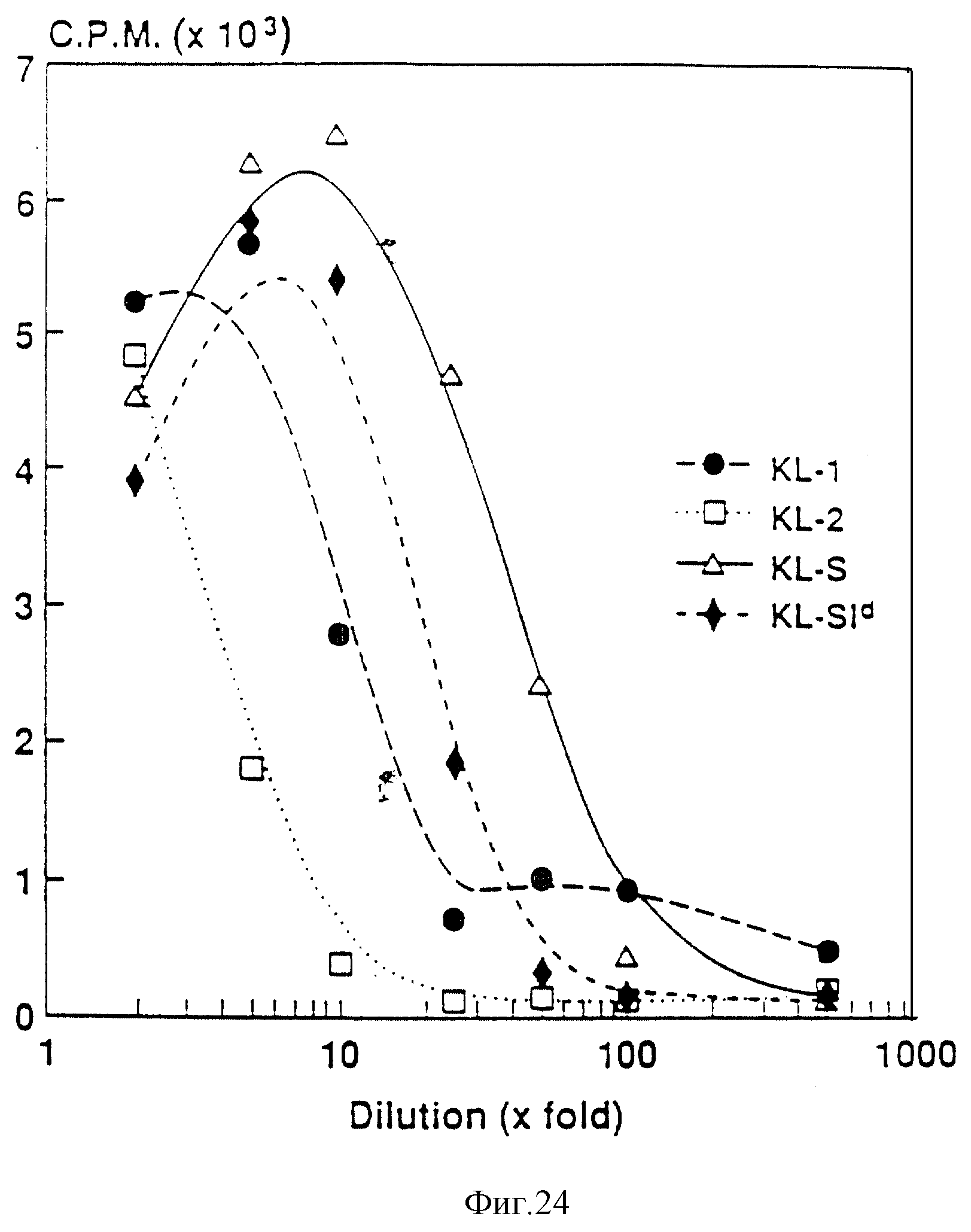
Фиг. 24. Определение биологической активности в СОS-клеточных супернатантах. Супернатанты от COS-клеток, трансфицированных KL-1-KL-2-, KL-SId- и KL-S-экспрессирующими плазмидами, анализировали на активность в анализе на пролиферацию тучных клеток. Серийные разведения супернатантов инкубировали с ВММС, и после 24-30-часового культивирования определяли включение3H-тимидина.
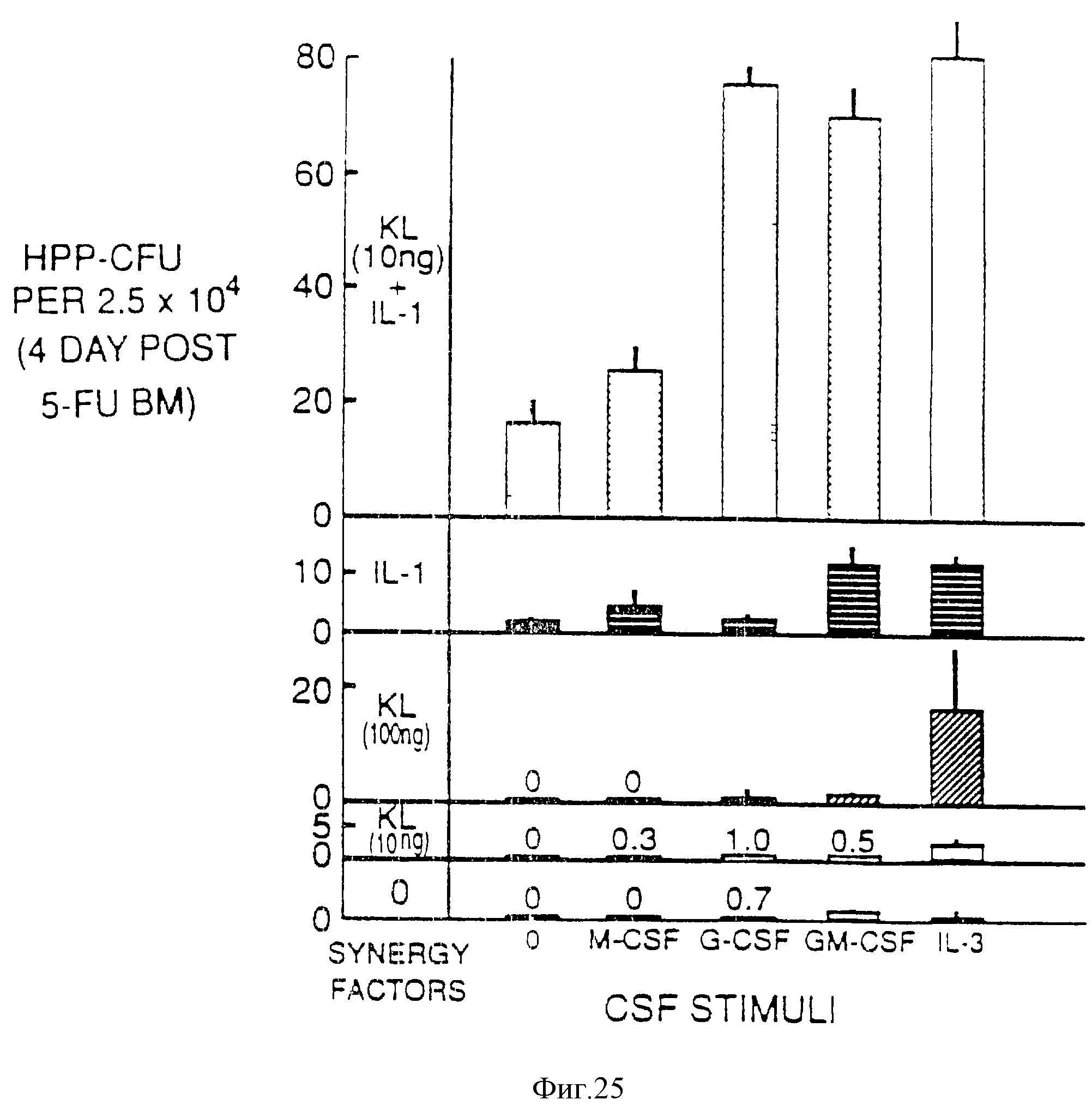
Фиг. 25. Анализ HPP-CFU на синергизм между рекомбинантными человеческими (rh) IL-Iβ (100 ед./мл), рек. мыш. (rm) (10-100 нг/мл), и rhM-CSF, rhG-CSF, и rm IL-3 (все при 100 ед./мл). Костный мозг, полученный через 4 дня от мыши, обработанной 5-FU, культивировали в 60-мм чашках Петри с 2 мл 0,5%-агарозного нижнего слоя, содержащего цитокины и покрытого верхним слоем в 1 мл из 0,36% агарозы, содержащей 2,5•104 клеток костного мозга. После 12-дневного инкубирования в условиях пониженного содержания кислорода культуры оценивали на колонии, диаметр которых превышал более 0,5 мм.
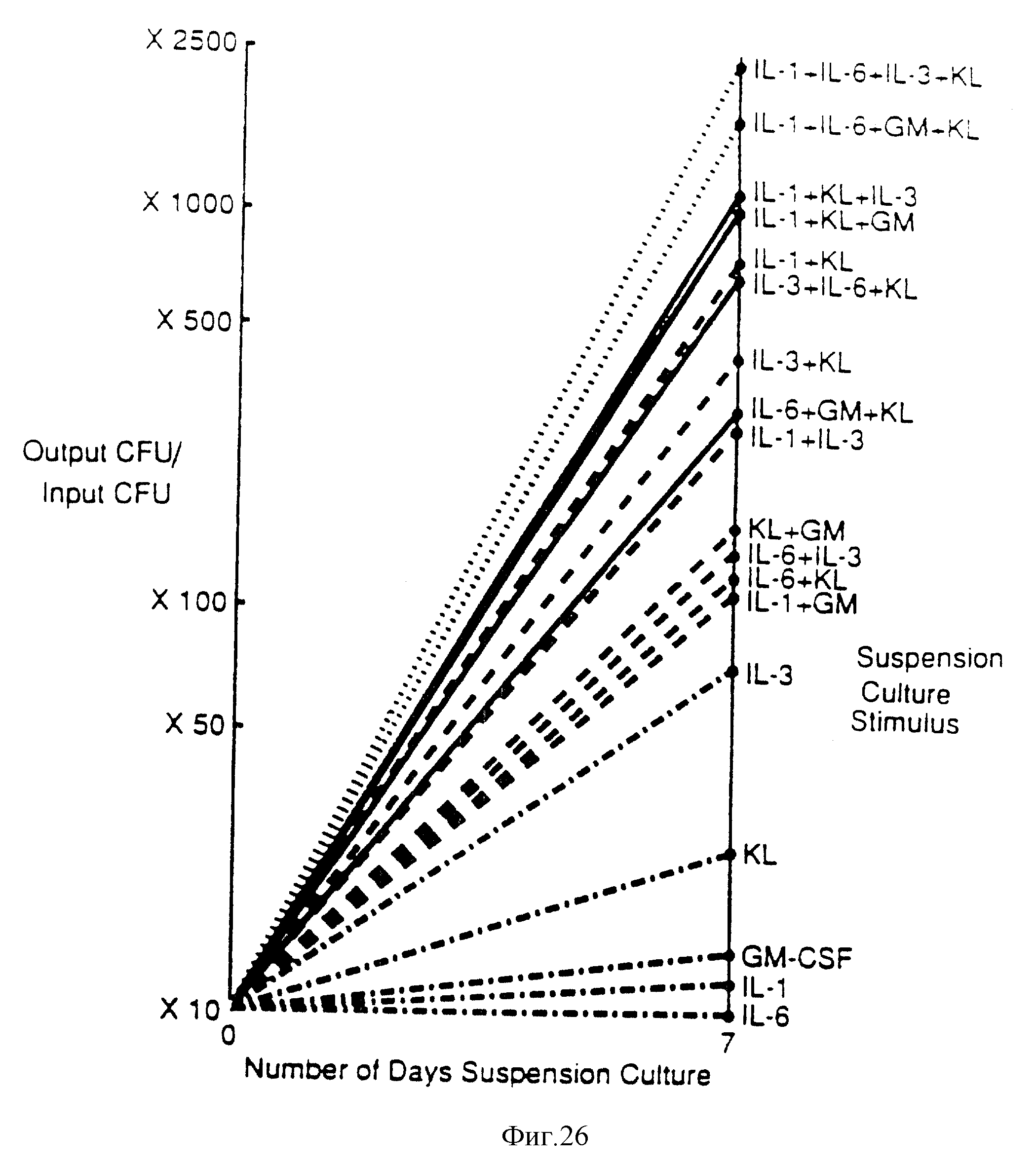
Фиг. 26. Анализ вторичных CFU-GM или дельта-культур, иллюстрирующий ступень увеличения GM-CSF-восприимчивых CFU-GM в 7-дневной суспензионной культуре костного мозга, полученного через 24 часа после обработки мыши 5-FU. Клетка костного мозга (2/5•105 мл) культивировали в течение 7 дней с указанными комбинациями цитокина и выделенные клетки снова клонировали в анализе на GM-CSF-стимулированные колонии. Указанную степень увеличения определяли как отношение числа CFU-GM, выделенных во вторичном клоногенном анализе, к исходному числу CFU-GM, определенному в первичном клоногенном анализе с GM-CSF; при этом rmKL использовали в количестве 20 нг/мл, rhII - 6 в количестве 50 нг/мл, rmIL1β в количестве 100 ед./мл, a rhM-CSF или rmlL-3 в количестве 1000 ед./мл.
Фиг.27. Стимуляция гемопоэза в культурах костного мозга, полученного через 24 часа после 5-FU-обработки и культивированного в течение 7 дней в суспензии в присутствии IL-1 + IL-3 + KL. Клетки, 104, (после вычитания гранулоцитов, лимфоцитов) и содержащие 2,5% НРР-CFU, восприимчивые к IL-1 + IL-3 + KL в первичном клоногенном анализе, инкубировали в суспензии; через 7 дней во вторичном клоногенном анализе определяли полное число клеток и HPP-CFU, чувствительных к IL-1 + IL-3 + KL, или CFU-GM, чувствительных к rm GM-CSF. Результаты вычисляли как отношение "выходных" клеток к "входным" HPP-CFU.
Фиг. 28. Воздействие IL-6, IL-1 и KL как отдельно, так и в комбинации на рост колоний от нормального мышиного костного мозга. Контрольные культуры выращивали в отсутствие каких-либо факторов роста. Было использовано семь комбинаций либо IL-6, IL-1 и KL были испытаны отдельно или в комбинации с CSF, G CSF, M-CSF, GN-CSF и IL-3. Данные выражали как средние значения ± ср. кв. отклонение по тройным дубликатам.
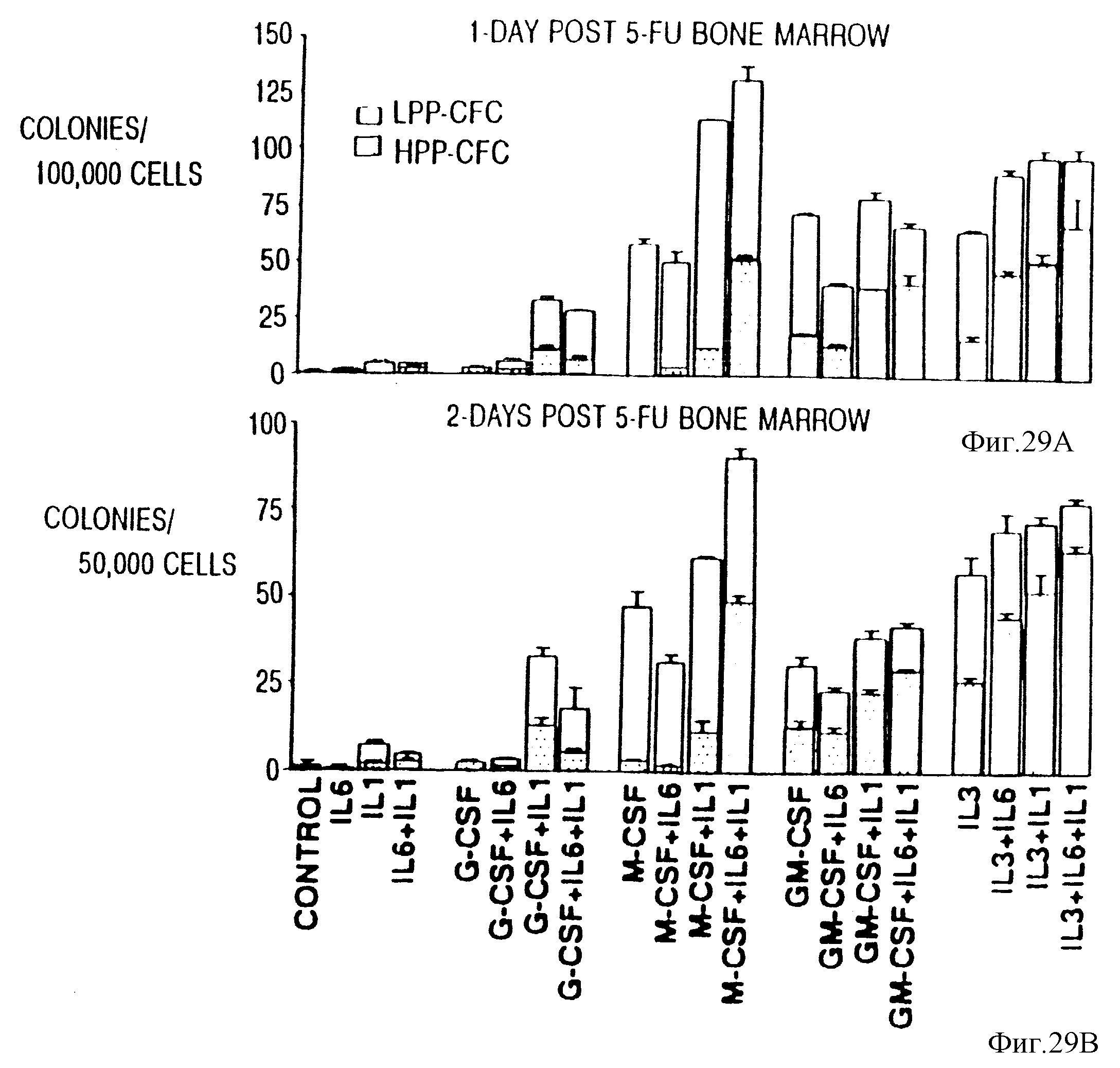
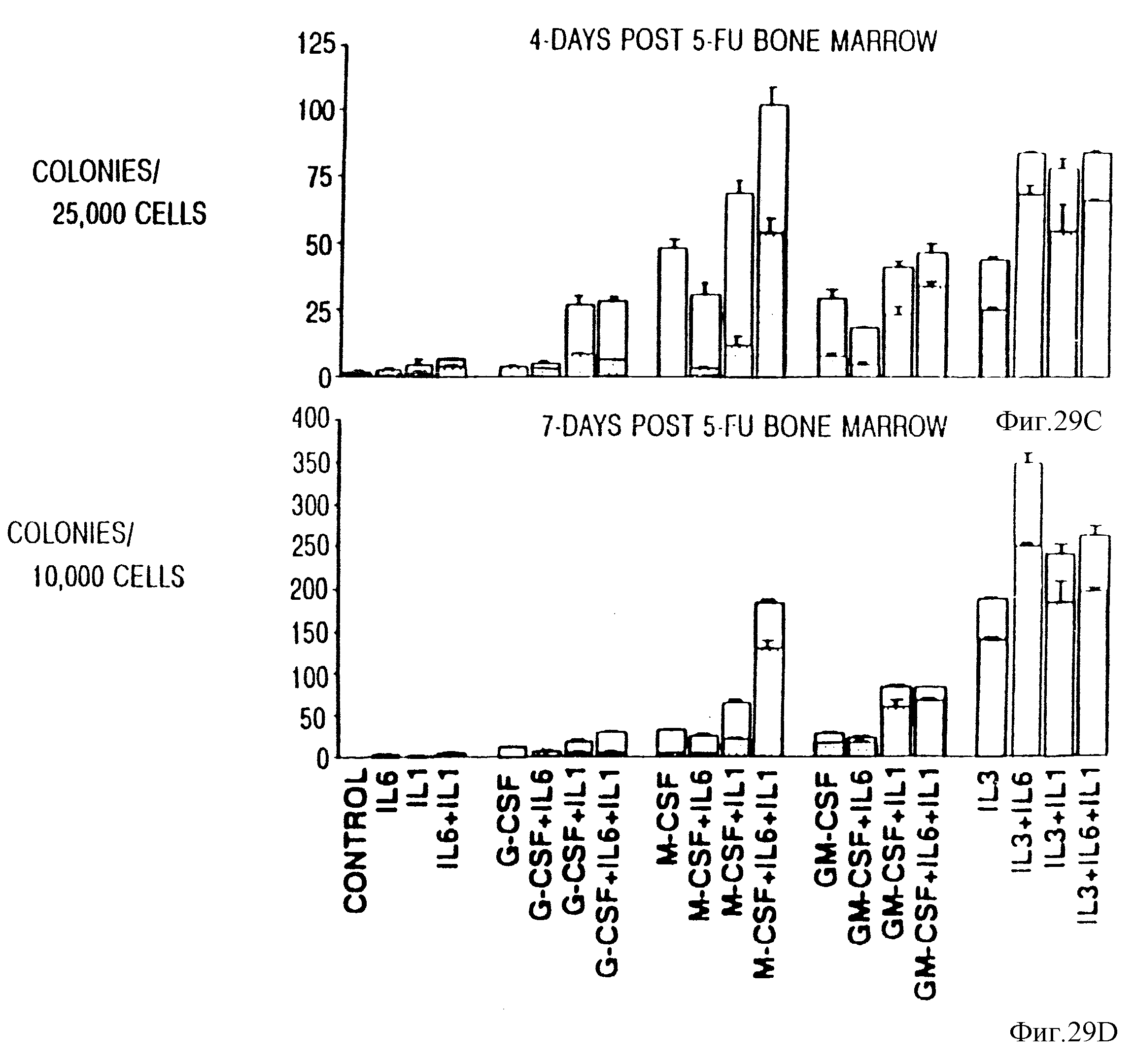
Фиг. 29. Синергическое действие IL-6, IL-1 и CSF при стимуляции HPP-CFC, происходящих от 5-FU-десенсибилизированного костного мозга. Костный мозг брали на 1-7 день после введения 5-FU (сверху вниз) и культивировали в присутствии G-CSF, M-CSF, и IL-3 + IL-6, IL-1 или IL-6 + IL-1. Данные представляли как полное число CFU-C (HPP-CFC + LРР -CFC) на 1•105 - 1•104 (d15) FU (d7) 5-FU клеток костного мозга. Результаты представляли собой средние значения ± ср. кв. отклонение по трем дубликатам культур.
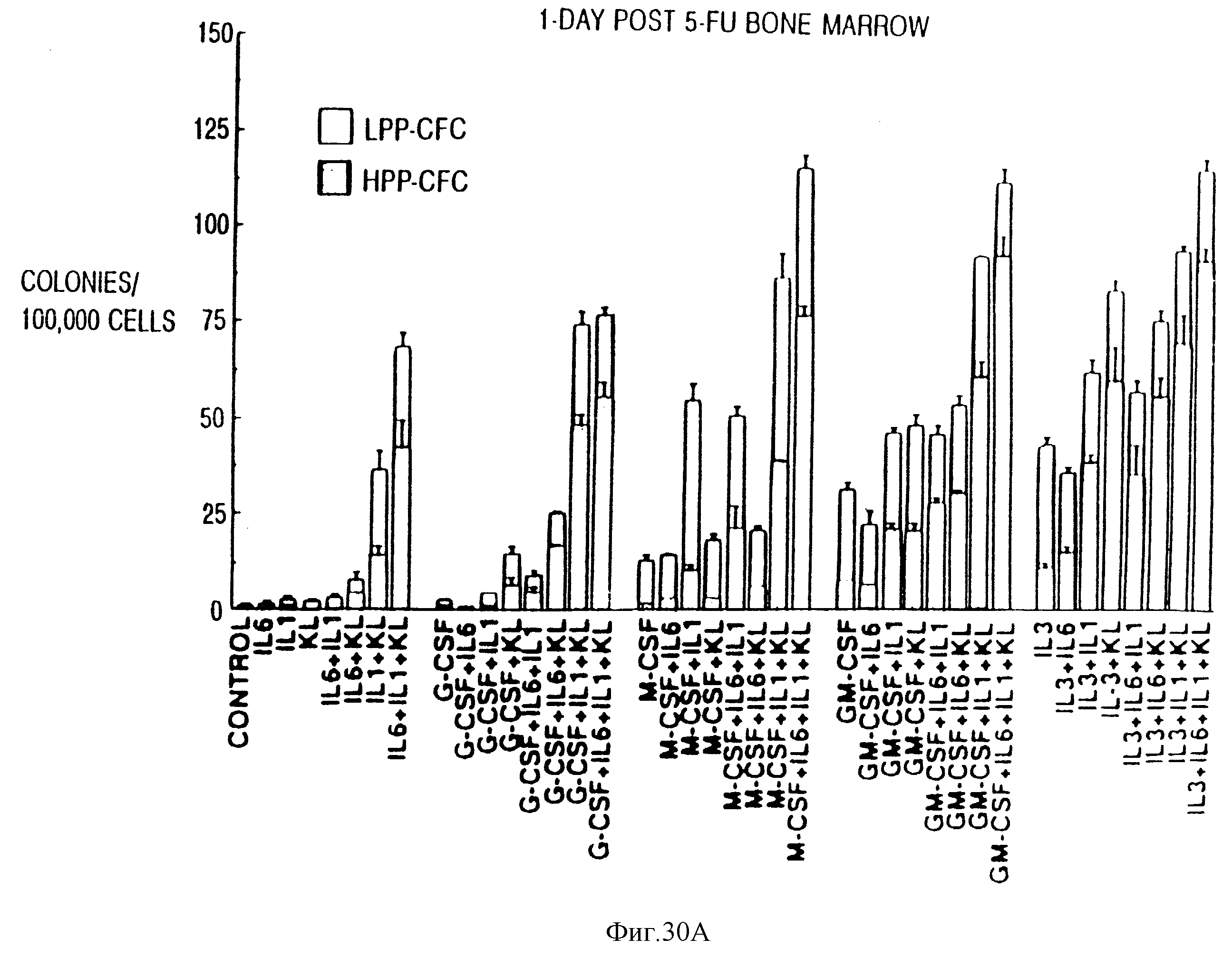
Фиг.30. KL синергически стимулирует HPP-CFC в сочетании с другими цитокинами. Как и на фиг. 28, 40 комбинаций цитокинов было проанализировано на их способность к стимуляции CFU-C (HPP-CFC + LPP-CFC), происходящих от ВМ, взятого после 5-FU-инъекции. Число колоний представляло собой среднее значение ± ср. кв. отклонение, вычисленное по тройным дубликатам культур 1•105 (d1) 5-FU BM или 1•104 (d7) 5-FU ВМ-клеток.
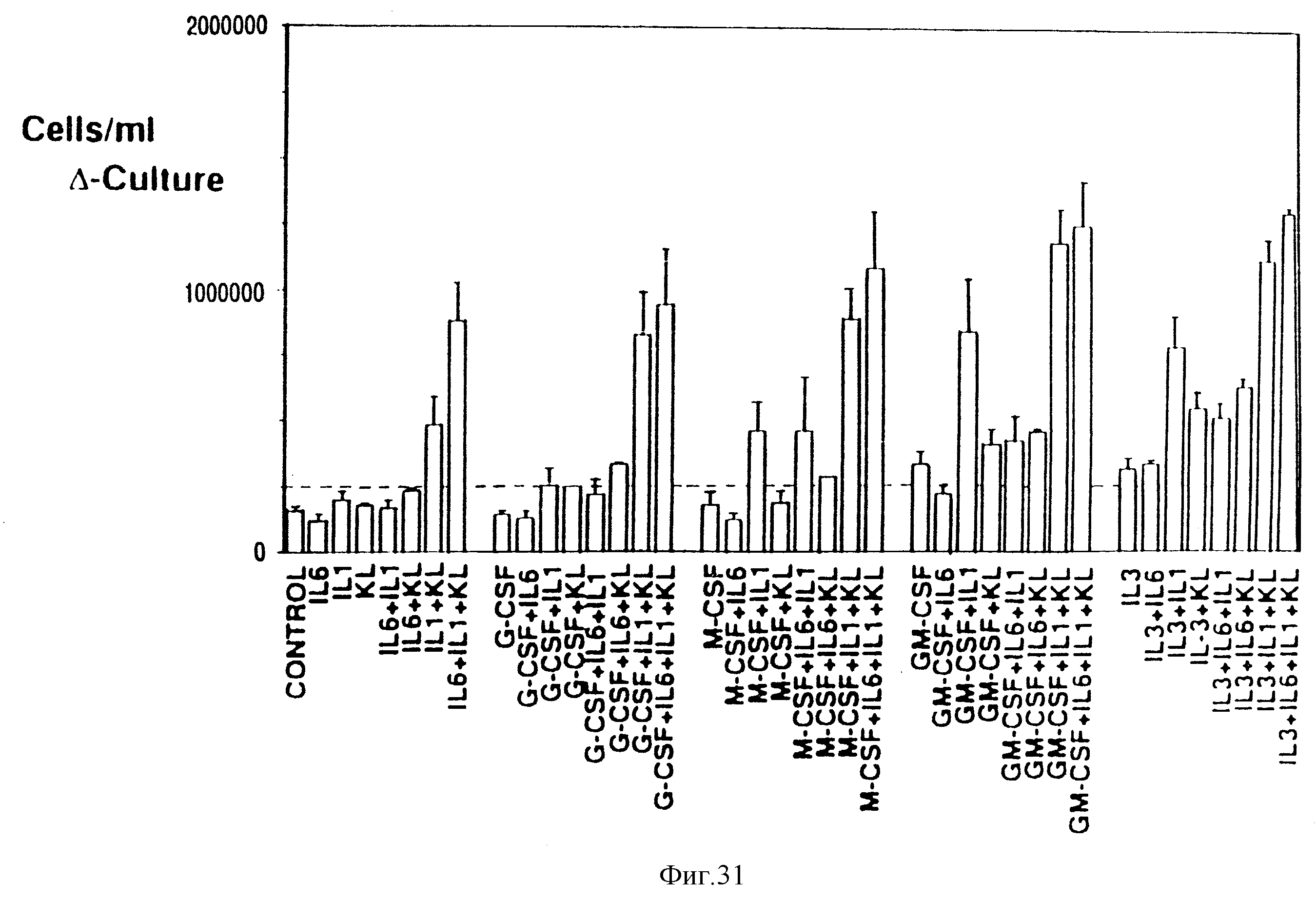
Фиг.31. Увеличение полного числа клеток в Δ-культурах требует стимуляции комбинаций нескольких факторов роста. Как описано в материалах и методах, определяли число неприлипающих клеток, присутствующих в Δ-культурах после 7-дневного культивирования. Пунктирной линией обозначены 1,5•105 (d1) 5-FU-ВМ-клетки, используемые для инокуляции культур. Морфология выделенных клеток обсуждается в тексте. Данные представляют собой средние значения ± ср.кв. отклонение по 2-16 экспериментам.
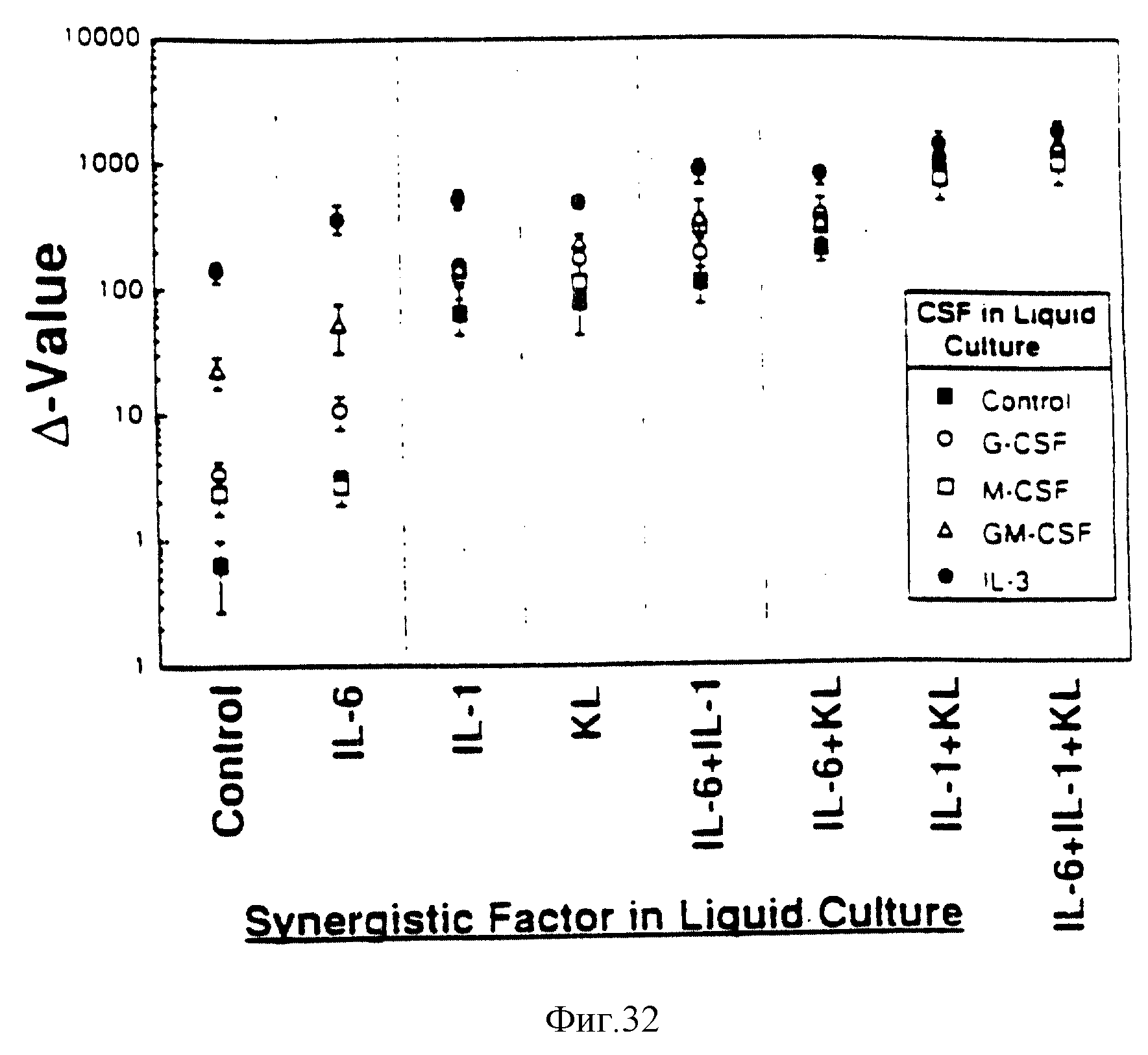
Фиг. 32. IL-6, IL-2 и KL как отдельно, так и в комбинации оказывают синергеическое действие вместе с СSF при размножении LPP-CFC в Δ-культурах. Как описано в материалах и методах, вычисляли данные для L PP-CFC, культивированных в присутствии G-CSF, M-SF, GM-CSF, IL-3 или IL-1 + IL-3. Δ -Величины были вычислены как среднее из трех дубликатов отсчетов первичных и вторичных колоний. Результаты представлены как средние значения ± ср. кв. отклонение по 6-11 Δ-значениям, полученным из двух или трех экспериментов. Следует отметить, что Δ-величины для LPP-CFC даны в логарифмической шкале.
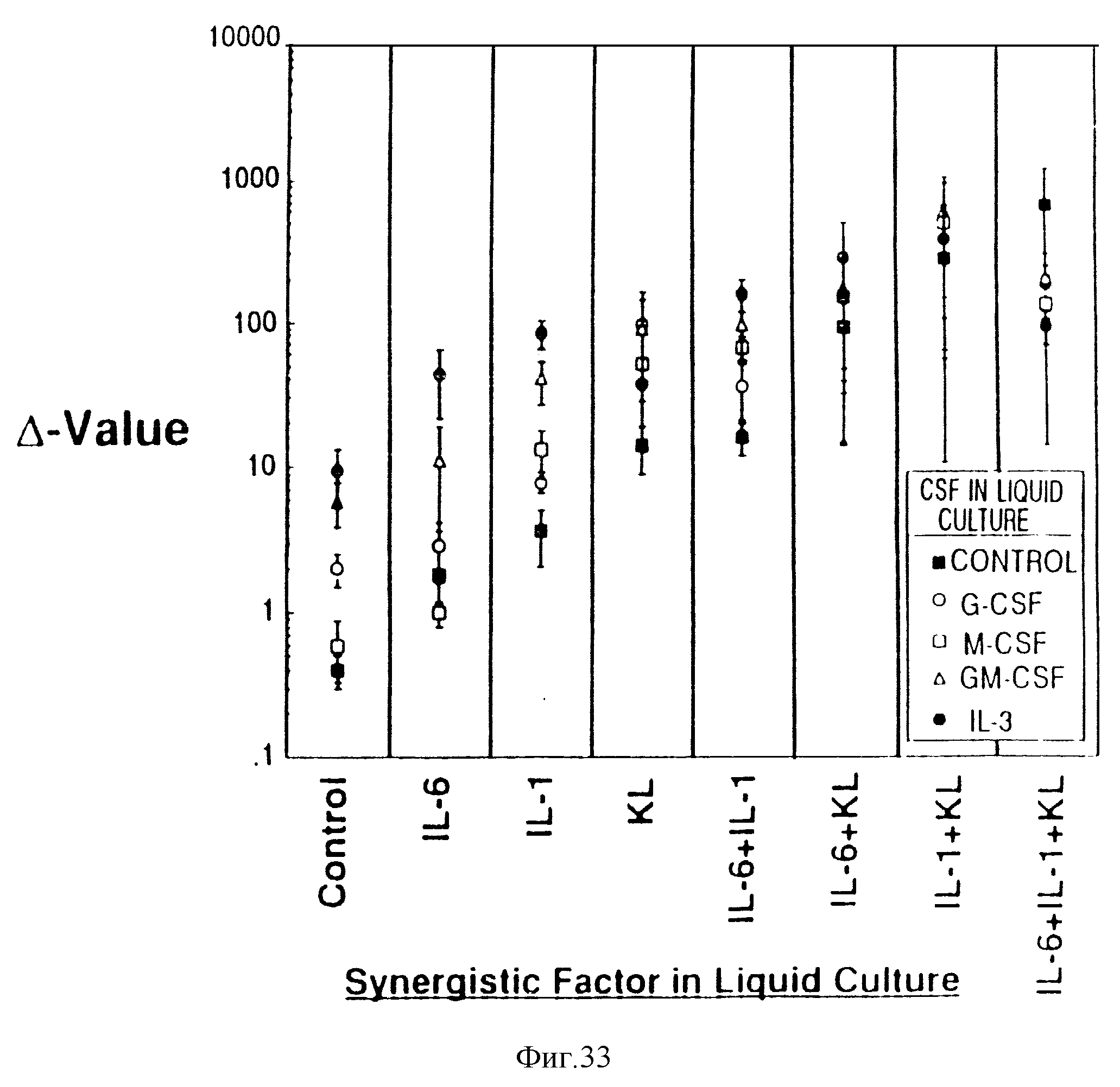
Фиг. 33. IL-6, IL-1 и KL, взятые отдельно или в комбинации, вместе с С F стимулируют размножения HPP-CFC в Δ-культурах. Все HPP-CFC культивировали в присутствии II-I + IL-37. Δ-Величины вычисляли как среднее по тройным дубликатам отсчетов первичных и вторичных колоний. Результаты представлены как средние значения ± ср. кв. отклонение по 2-11 экспериментам. Следует отметить, что Δ-величины для HPP-CFC даны в логарифмической шкале.
Фиг. 34. Клетки-предшественники, восприимчивые к IL-1 + KL не размножаются в Δ-культурах. IL-1 + IL-3 сравнивали с IL-1 + KL в отношении их эффективности в стимулировании первичных и вторичных HPP-CFC и LPP-CFC в Δ-анализе. Δ-Величины вычисляли исходя из средних значений, полученных по трем дубликатам в CF -С-анализе. Эти данные представляют результаты одного эксперимента. Следует отметить, что Δ-величины даны в логарифмической шкале.
Фиг. 35. Число CFU-S увеличивалось в Δ-культурах. Сравнивали Δ-величины, характеризующие увеличение HPP-CFC, LPP-CFC, и CFU-S, которое имело место в in vitro Δ-анализе или в in vivo-анализе после введения 5-FU. Δ-величины для in vivo-увеличения клеток-предшественников измеряли как отношение числа клеток-предшественников, наблюдаемых через 8 дней после введения 5-FU, к числу клеток, наблюдаемых через 1 день после введения 5-FU. Полученные данные представляют собой средние значения ± ср.кв. отклонение по 1-3 экспериментам.
Подробное описание изобретения
В настоящей работе была установлена
взаимосвязь между KL и c-kit-рецептором и на основании экспериментов по связыванию и перекрестному сшиванию было показано, что KL являются лигандом c-kit. Для получения KL-специфических кДНК-клонов
использовали N-концевую белковую последовательность KL. Эти кДНК-клоны использовали для исследования взаимоотношения KL-гена с SI-локусом, в результате чего было продемонстрировано, что KL кодируется
SI-локусом.
Недавно из среды, кондиционированной фиброобластами Balb/c-3Т3, был выделен гемопоэтический фактор KL, имеющий биологические свойства, которыми, как предполагается, обладает c-kit-лиганд [37]. Очистку KL проводили исходя из его способности стимулировать пролиферацию ВММС от нормальных мышей, но не от W-мутантных мышей в отсутствие IL-3. Очищенный фактор стимулирует пролиферацию ВММС и СТМС в отсутствие IL-3, а это свидетельствует о том, что он играет, по-видимому, важную роль в созревании тучных клеток. Что касается предсказываемой функции c-kit в эритропоэзе, то было показано, что KL стимулирует образование области дифференцировки ранних клеток-предшественников эритроидного ряда (7-14-дневные BFU-E) в сочетании с эритропоэтином. Растворимая форма KL, которая была выделена из среды, кондиционированной Balb/3Т3-клетками, имеет молекулярную массу 3 кД и рI 3,8; но при этом она не является дисульфид-связанным димером, хотя характеристики KL после гель-фильтрации указывали на образование нековалентно связанных димеров в физиологических условиях.
Предсказанная аминокислотная последовательность KL, выведенная из нуклеиновокислотной последовательности кДНК, свидетельствует о том, что KL синтезируется как трансмембранный белок, а не как секретируемый белок. Растворимая форма KL может быть затем получена путем протеолитического расщепления мембрано-ассоциированной формы KL. Лиганд СSF-1-рецептора, который является наиболее близким родственником с-kit, имеет общие с KL топологические характеристики, и, как было показано, он может быть протеолитически расщеплен с образованием растворимого фактора роста [44, 45]. Проведенный недавно анализ структурных особенностей KI указывал на родство между KL и CSF-1 (о чем свидетельствовали аминокислотная гомология, вторичная структура и локализация экзонов) и проиллюстрировал эволюционную взаимосвязь этих двух факторов, подтверждая тем самым ранее высказанную гипотезу о эволюционном родстве двух указанных рецепторных систем.
Альтернативно, были описаны сплайсированные KL-мРНК, которые кодируют две различные формы KL-белка, т.е. KL-1 и KL-2 [15]. Кодированные KI-белковые продукты были идентифицированы, охарактеризованы в COS-клетках, трансфецированных KL-кДНК, и исследованы несколькими способами Flanagan и др. Как указывалось выше, KL синтезировался как трансмембранный белок, который протеолитически расщеплялся с образованием растворимой формы KL. Было показано, что белковый продукт альтернативно сплайсированного транскрипта KL, KL-2, в котором отсутствует экзон, кодирующий предполагаемый сайт протеолитического расщепления, обнаруживает как бы "перевернутые" характеристики по сравнению с характеристиками KL-1. Кроме того, протеолитическое расщепление как KL-1, так и KL-2 может регулироваться такими агентами, как РМА и калий-ионофор А23187. Относительное содержание KL-1 и KL-2 было определено в различных мышиных тканях широкого спектра. Полученные результаты показали, что экспрессия KL-1 и KL-2 осуществляется под тканеспецифическим контролем.
Кроме того, были определены генные продуты SId [15]. SId является следствием делеции в KL-последовательности, которая включает в себя последовательности, кодирующие трансмембранный и цитоплазметический домены белка, что приводит к образованию биологически активного секретируемого мутантного KL-белка. В свете полученных результатов обсуждалась относительная роль растворимой и клеточно-ассоциированной форм KL в пролиферативной и трансфортной функциях c-kit.
Настоящее изобретение относится к очищенному белку млекопитающих, соответствующему лиганду для c-kit. который включает в себя гомодимер из двух полипептидов, каждый из которых имеет молекулярную массу около 30 кД и изоэлектрическую точку около 3,8. Используемый в настоящем описании термин "c-kit-лиганд" означает полипетид или белок, который был также определен как фактор стволовых клеток, фактор тучных клеток и steel-фактор. Настоящее изобретение включает в себя как натуральные, так и рекомбинантные формы полипептида и белка лиганда c-kit, причем рекомбинантные формы представляют собой формы белка и полипептида, не встречающиеся в природе, но являющиеся достаточно идентичными натуральным формам c-kit и обладающие аналогичной биологической активностью. Примерами таких полипептидов являются полипептиды, обозначенные KL-1.4 и S-KL, однако эти примеры не ограничиваются указанными полипептидами. Примерами указанных белков и полипептидов могут также служить и производные и аналоги. В одном из вариантов осуществления настоящего изобретения очищенным белком млекопитающего является мышиный белок. В другом варианте осуществления настоящего изобретения очищенным белком млекопитающего является человеческий белок.
В настоящей заявке также рассматривается очищенный белок млекопитающего, соответствующий c-kit-лиганду и представляющий собой очищенный гликозилированный белок. Однако настоящее изобретение также относится и к негликозилированным формам белка. Кроме того, настоящее изобретение включает в себя очищенные белки млекопитающих, уровень гликозилирования которых в достаточной степени аналогичен уровню гликозилирования натурального очищенного белка млекопитающего, соответствующего c-kit-лиганду. Этот белок может быть продуцирован путем введения цистеиновой перекрестной сшивки между двумя гомодимерными полипептидами, описанными выше, с использованием стандантной техники, хорошо известной специалистам.
Настоящее изобретение также относится к фармацевтической композиции, которая содержит эффективное количество очищенного белка млекопитающего, соответствующего c-kit-лиганду и описанного выше, и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к фармацевтической композиции для лечения лейкопении у млекопитающих, которая содержит определенное количество гемопоэтического фактора, эффективного для лечения лейкопении у млекопитающих; причем указанный гемопоэтический фактор выбирают из G-CSF, GM-CSF, и IL-3.
Настоящее изобретение также относится к фармацевтической композиции для лечения анемии у млекопитающих, которая содержит эффективное количество фармацевтической композиции, описанной выше, и эффективное количество ЕРО (эритропоэтин) или IL-3. Примерами анемии могут служить, но не ограничиваются ими, анемия Даймонда-Блекфена и гипопластическая анемия. Однако указанную фармацевтическую композицию, содержащую эффективное количество вышеописанной композиции и эффективное количество G-CSF и GM-CSF, предпочтительно использовать для лечения анемии Блекфена и гипопластической анемии. Кроме этого, настоящее изобретение относится к способу лечения анемии у млекопитающих путем введения этим млекопитающим композиции, описанной выше. В настоящем изобретении также раскрывается фармацевтическая композиция, эффективная для усиления приживаемости костного мозга у млекопитающих во время трансплантации и содержащая эффективное количество фармацевтической композиции, описанной выше, и эффективное количество IL-1, или IL-6, необходимое для усиления приживаемости костного мозга у млекопитающего во время трансплантации. Авторами настоящего изобретения также разработана фармацевтическая композиция для ускорения восстановления костного мозга у млекопитающих при лечении лучевого, химического или хемиотерапевтического поражения костного мозга, аплазии или миелосуппрессии, содержащая эффективное количество фармацевтической композиции, описанной выше, и эффективное количество IL-1. Настоящее изобретение также относится к фармацевтической композиции для лечения синдрома приобретенного иммунодефицита (СПИД) у пациента, которая содержит эффективное количество фармацевтической композиции, описанной выше, и эффективное количество AZT или G-CSF, необходимое для лечения СПИДа.
В настоящем изобретении также раскрывается композиция для лечения нервных расстройств, которая содержит эффективное количество вышеописанной фармацевтической композиции, необходимое для лечения нервных расстройств у млекопитающих.
Кроме того, настоящее изобретение относится к композиции для лечения детей с симптомами порока развития легких, которая содержит терапевтически эффективное количество очищенного белка млекопитающего и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к композиции для предупреждения выпадения волос у индивидуума, которая содержит профилактически эффективное количество очищенного белка млекопитающего, соответствующего c-kit-лиганду, и фармацевтически приемлемый носитель. Кроме того, настоящее изобретение относится к фармацевтической композиции для ингибирования обесцвечивания волос индивидуума, которая содержит эффективное для такого ингибирования количество очищенного белка млекопитающего, соответствующего c-kit-лиганду, и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к способам лечения вышеуказанных расстройств путем введения эффективной композиции в количестве, необходимом для лечения данного заболевания.
Используемый в настоящем описании термин "индивидуум" означает, но и не ограничивается ими, млекопитающее, животное, человек, мышь или крыса. "Млекопитающее" означает, но не ограничивается ими, мышь или человек.
Настоящее изобретение относится к выделенной нуклеиново-кислотной молекуле, кодирующей аминокислотную последовательность, соответствующую c-kit-лиганду (КL). Примерами указанных нуклеиновых кислот могут служить, но не ограничиваются ими, нуклеиновые кислоты, обозначенные KL 1,4, KL-1, KL-2 или S-K1. Настоящее изобретение также включает в себя нуклеиновые кислоты, которые отличаются от нуклеиновой кислоты, кодирующей вышеуказанный аминокислотные последовательности, но которые при этом продуцируют тот же самый фенотипический эффект. Эти изменения, но фенотипически эквивалентные нуклеиновокислотные молекулы далее будут именоваться "эквивалентные нуклеиновые кислоты". Кроме того, настоящее изобретение также относится к нуклеиновокислотным молекулам, отличающимся от вышеописанной нуклеиновокислотной молекулы тем, что у них имеются изменения в некодирующих областях, но при этом фенотип полипептида, продуцируемого ими, остается без изменений. Настоящее изобретение также относится к нуклеиновокислотным молекулам, которые гибридиризуются с нуклеиновокислотной молекулой настоящего изобретения, описанной выше. Используемый в настоящем описании термин "нуклеиновая кислота" означает РНК, а также одноцепочечные и двухцепочечные ДНК и кДНК. Кроме того, используемый в настоящем описании термин "полипептид" означает любой его аллельный вариант, встречающийся в природе, а также его синтетические рекомбинантные формы.
В целях настоящего изобретения в качестве c-kit-лиганда (KL) используют c-kit-лиганд (КI) человека и мышиный c-kit-лиганд (KL).
Настоящее изобретение также относится к вектору, включающему в себя нуклеиновокислотную молекулу, которая кодирует аминокислотную последовательность, соответствующую c-kit-лиганду (KL). Таким вектором может быть плазмидный, вирусный, космидный или какой-либо другой вектор.
Настоящее изобретение также относится к выделенной нуклеиновокислотной молекуле, определенной выше, которая является правильно соединенной с промотором РНК-транскрипции, а также с другими регуляторными последовательностями. Используемый в настоящем описании термин "правильно соединенный" означает расположенный таким образом, чтобы инициация транскрипции РНК осуществлялась под контролем данного промотора. Примерами такого промотора являются SP6, Т4 и Т4. Векторы, содержащие промотор и сайт клонирования, в который вставляют фрагмент ДНК, правильно соединенный с указанным промотором, хорошо известны специалистам. Предпочтительно, чтобы эти векторы были способны к РНК-транскрипции in vitro. Примерами таких векторов являются зGЕМ-серии (Promega Biotec, Madison Wl).
Кроме того, настоящее изобретение относится к системе "хозяин-вектор", предназначенной для продуцирования полипептида c-kit-лиганд (KL) и содержащей один из вышеуказанных векторов в соответствующем хозяине. Подходящими хозяевами, которые могут быть использованы в целях настоящего изобретения, являются (но не ограничиваются ими): клетки млекопитающего или клетки насекомого для экспрессии бакуловируса. Подходящими хозяевами могут быть также бактериальные клетки, например Е. cоli, или дрожжевые клетки.
Для выделения белка, экспрессируемого в E.coli, клетки Е.соli трансфецируют нуклеиновой кислотой настоящего изобретения, кодирующей белок лиганда c-kit. Затем клетки E.coli культивируют в одном литре культуры в двух различных средах, LB или ТВ, а затем центрифугируют. Бактериальный дебрис гомогенизируют путем двукратного пропускания через ячейку френца под давлением 200000 фунт/кв. дюйм в 10 мл лизирующего буфера (см. ниже). После центрифугирования на высокой скорости (120 об./мин•20 мин), супернатанты переносят во вторую пробирку c-kit-белок или полипептид локализован в твердой фракции. Он может быть солюбилизирован с использованием 6 М гуанидиний-НС1 или 8 М мочевины с последующим диализом или разведением.
Буфер для лизиса: 50 мМ Hepes, pH 8,0; 20% глицерин, 150 мM NaCl; 1 мМ MgО4; 2 мМ DTT; 5 cC EGTA; 20 мкг/мл ДНКазы 1.
В настоящей заявке также рассматривается очищенный растворимый полипептид c-kit-лиганда (KL) и фрагмент очищенного растворимого полипептида c-kit-лиганда (KL).
В одном из вариантов осуществления настоящее изобретение относится к полипептиду c-kit-лиганда, соответствующему аминокислотам 1-164. В другом варианте настоящее изобретение относится к полипептиду лиганда c-kit, соответствующему аминокислотам от 1 и примерно до 148, или к гибридным полипептидам, соответствующим аминокислотам от 1 и примерно до 148, дотированным с аминокислотами приблизительно от 165 до 202 или 205, а также к гибридному полипептиду, соответствующему аминокислотам от 1 и примерно до 164, дотированным с аминокислотами от 177 и примерно до 202 или 205.
В следующем варианте осуществления настоящего изобретения полипептидом c-kit-лиганда может быть полипептид, соответствующий аминокислотам от 1 до примерно 164, соединенным с биологически активным сайтом связывания. Примерами таких биологически активных сайтов связывания являются (но не ограничиваются ими) аминокислоты, соответствующие сайту связывания для стромальных клеток, внеклеточный матрикс, область связывания с гепарином, сайт связывания с гемонектином или сайт активации клеток. См., например, патенты США 4578079, 4614517 и 4792525, выданные 25 марта 1986, 30 сентября 1986 и 20 декабря 1988, соответственно.
В одном из вариантов осуществления настоящего изобретения растворимый полипептид c-kit-лиганда (KL) подвергают конъюгированию с визуализирующим агентом. Визуализирующие агенты хорошо известны специалистам, и примерами таких агентов могут служить радиоактивные изотопы, красители, или ферменты, такие как пероксидаза или щелочная фосфатаза. Подходящими радиоизотопами являются125I,32P,35S и др.
Указанные конъюгированные полипептиды могут быть использованы для обнаружения клеток (in vitro или in vivo), которые экспрессируют c-kit-рецепторный белок. При обнаружении in vitro образец испытуемых клеток или ткани подвергают контакту с конъюгированным полипептидом в соответствующих условиях, способствующих связыванию этого конъюгированного полипептида с c-kit-рецептором, присутствующим на поверхности клетки или ткани, после чего несвязанный конъюгированный полипептид удаляют и фиксируют присутствие связанного конъюегированного полипептида, обнаруживая тем самым клетки и ткани, которые экспрессируют c-kit-рецепторный белок.
Альтернативно, конъюгированный полипептид может быть введен пациенту, например, путем внутривенного введения. При этом должно быть введено достаточное количество конъюгированного полипептида, которое может варьироваться в широком диапазоне в зависимости от размеров, массы и других характеристик пациента. Однако это количество может быть легко определено любым специалистом.
После введения конъюгированный полипептид, который связывается с любым c-kit-рецептором, присутствующим на поверхности клеток или ткани, обнаруживают путем внутриклеточной визуализации.
В способе настоящего изобретения внутриклеточная визуализация может быть осуществлена любым из существующих многочисленных методов визуализации, например путем обнаружения и визуализации излучения радиоактивного изотопа. Например, если радиоактивным изотопом является йод, а именно125I, то обнаружение и визуализация излучения этого изотопа может быть осуществлена при помощи гамма-камеры для обнаружения излучения радиоактивного йода.
Кроме того, фрагмент растворимого полипептида c-kit может быть конъюгирован с терапевтическим агентом, таким как токсины, химиотерапевтические агенты или радиоактивные изотопы. Таким образом, конъюгированная молекула, введенная пациенту в эффективном количестве, действует как тканеспецифическая система доставки терапевтического агента в клетку, экспрессирующую c-kit-рецептор.
В настоящем изобретении также рассматривается способ продуцирования полипептида c-kit-лиганда (KL), предусматривающий культивирование системы "вектор-хозяин", описанный выше, в соответствующих условиях, обеспечивающих продуцирование и выделение полипептида c-kit-лиганда (KL).
Кроме того, настоящее изобретение относится к полипептиду c-kit-лиганда (KL), продуцированному указанным способом.
Настоящее изобретение также относится к антагонистам c-kit-лиганда. Указанными антагонистами могут быть небольшие молекулы, обнаруживаемые путем теста-скрининга на присутствие c-kit-рецептора. Альтернативно, они могут быть антисмысловыми нуклеиновыми кислотами, ДНК, РНК на основе рибозы или другого сахаридного остова с тиофосфатными, метилфосфатными, метилфосфонатными связями между сахарами. Антисмысловые молекулы блокируют трансляцию c-kit-лиганда in vivo.
В настоящее изобретение также входит растворимый мутированный антагонист c-kit-лиганда (KL), причем этот мутированный полипептид сохраняет свою способность к связыванию c-kit-рецептором, но при этом он блокирует биологический ответ, который опосредуется связыванием функционального лиганда, с рецептором. Таким образом, указанные мутированные полипептизы c-kit-лиганда (KL) действуют как антагонисты по отношению к биологической функции, опосредуемой лигандом к c-kit-рецептору, путем блокирования связывания нормально функционирующих лигандов с c-kit-рецептором. KL-антагонисты могут быть получены путем неспецифического мутагенеза. В качестве эффективного антагониста может быть использована мутированная или дифицированная KL-молекула, которая не обладает способностью к димеризации. KL обнаруживают высокую степень гомологии с M-CSF, содержащего несколько α-спиралей, которые, очевидно, играют важную роль для димеризации [102]. Сайт-направленный мутагенез, проведенный в этих спиральных областях, дает возможность блокировать способность к димеризации. Альтернативно, мутированный KL может образовывать гетеродимер с нормальным функционирующим KL, однако этот гетеродимер не способе активировать c-kit-рецептор. Поскольку c-kit-рецептор сам по себе требует димеризации для образования активной киназы, то эффективным антагонистом может быть растворимый мутированный KL, который, связываясь с c-kit-рецептором, уже блокирует димеризацию рецептора.
Настоящее изобретение также относится к фармацевтической композиции, содержащей c-kit-лиганд (KL), очищенный авторами настоящего изобретения или
продуцированный рекомбинантными методами, и фармацевтически приемлемый носитель. Указанным c-kit-лигандом может быть выделенный растворимый c-kit-лиганд настоящего изобретения, его фрагмент или
растворимый мутированный полипептид c-kit-лиганда (KL), описанный выше. Используемый в настоящем
описании термин "фармацевтически приемлемый носитель" означает любой стандартный
фармацевтический носитель, такой как фосфатно-буферный раствор, вода, и эмульсии, такие как эмульсия "масло/вода" или "вода/масло", а также различные типы смачиваемых агентов. В указанные
фармацевтические носители могут быть также включены аэрозольобразующие вещества.
KL-антагонисты, описанные выше, могут быть использованы для лечения ряда заболеваний, включая такие заболевания, как астма, аллергия, анафилаксия, аллергическая астма, артриты, например ревматоидный артрит, папиллярный конъюнктивит, лейкоз, меланома, кожно-аллергические реакции, склеродермия.
Настоящее изобретение также относится к субстанции, способной к специфическому образованию комплекса с белком c-kit-лиганда (KL) или с его фрагментом, описанным выше. Настоящее изобретение, кроме того, относится к субстанции, способной к специфическому образованию комплекса с рецептором белком c-kit-лиганда (KL). В одном из вариантов осуществления настоящего изобретения указанной субстанцией является моноклональное антитело, например моноклональное антитело человека.
Кроме того, настоящее изобретение относится к способу модификации биологической функции, ассоциируемой с c-kit-клеточной активностью. Этот способ предусматривает взаимодействие образца клеток, функции которых должны быть модифицированы с эффективным количеством вышеописанной фармацевтической композиции, необходимым для модификации биологической функции клетки. Примерами биологических функций, которые могут быть модифицированы, являются (но не ограничиваются ими) такие функции, как межклеточные взаимодействия, размножения клеток, экспрессирующих c-kit, и in vitro-фертилизация. Этот способ может быть осуществлен in vitro или in vivo. При in vivo осуществлении данного способа пациенту вводят эффективное количество вышеописанной фармацевтической композиции, необходимое для модификации биологической функции, ассоциированной с c-kit-функцией.
Другой вариант настоящего изобретения относится к ex vivo-способам и композициям, содержащим KL в соответствующем носителе, пригодным для ех vivo-использования.
Такими способами являются:
1. способ усиления трансфекции ранних гемопоэтических клеток-предшественников посредством гена, заключающийся в том, что сначала ранние гомеопоэтические клетки подвергают контакту с композицией,
содержащей KL и гемопоэтический фактор, а затем клетки, культивированные в стадии (а), трансфецируют геном;
2. способ передачи гена млекопитающему, заключающийся в том, что (а) ранние
гемопоэтические клетки-предшественники подвергают взаимодействию с композицией, содержащей KL; (b) клетки из (а) трансфицируют геном; (с) клетки, трансфицированные в (b), вводят млекопитающему. В
описанных способах в качестве гена может быть использована антисмысловая ДНК или РНК.
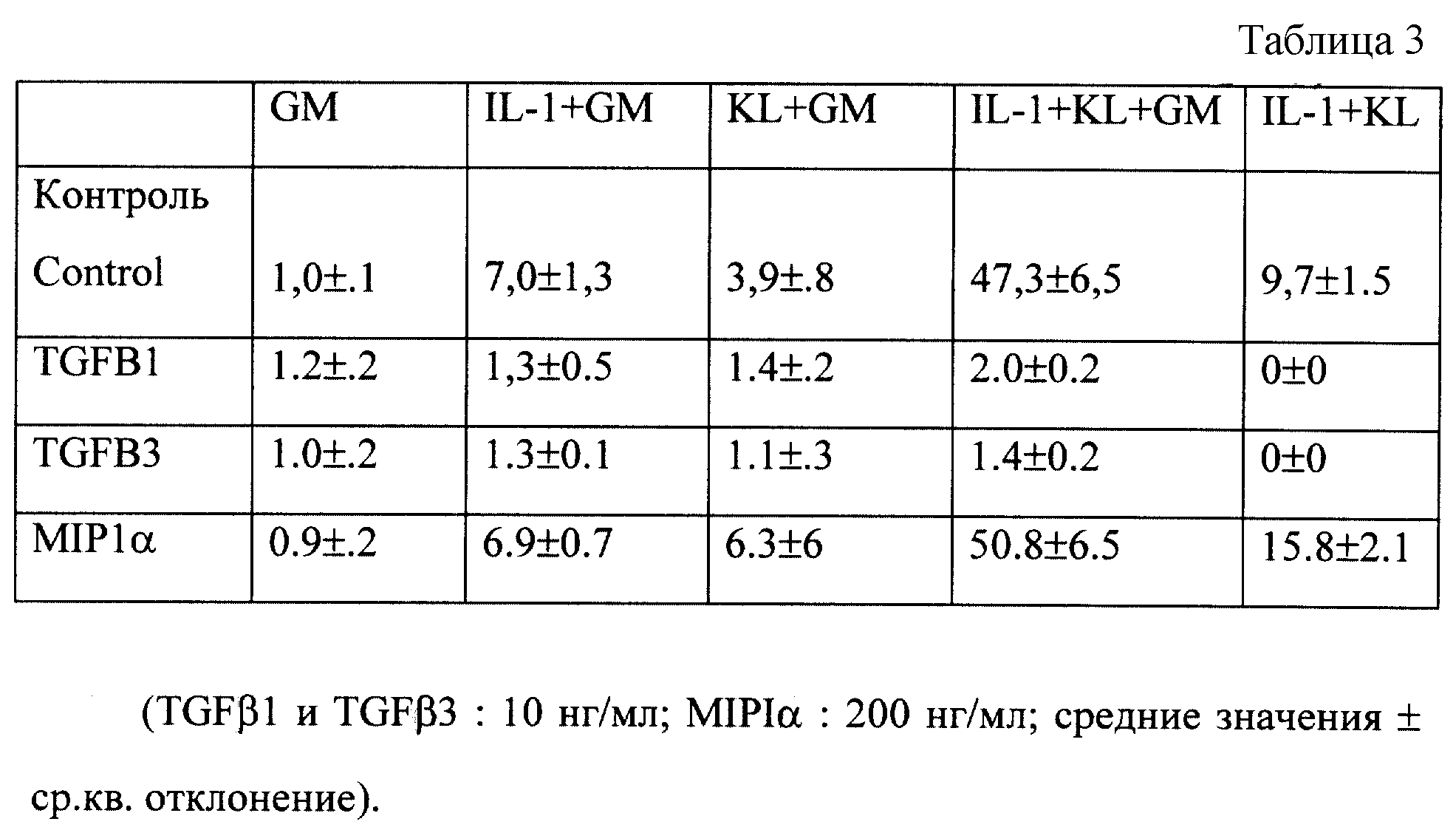
Композиция, содержащая KL, может быть использована для увеличения ex-vivo-уровней периферической крови и эффективного количества гематопоэтического фактора (или факторов) роста. В этих целях особенно предпочтительными являются гемопоэтический фактор роста IL-1, IL-3, IL-6, G-CSF, GM-CSF или их комбинации (см. фиг. 26). В настоящей заявке также рассматривается способ увеличения уровня периферической крови.
Кроме того, в настоящей заявке рассматриваются способы и KL-содержащие композиции для повышения уровней тромбоцитов или клеток других типов (IL-6 являются особенно предпочтительными).
Настоящее изобретение также относится к способу модификации биологической функции, ассоциированной с c-kit-клеточной активностью, путем взаимодействия клеток с KL. Такой клеткой может быть клетка, экспрессирующая c-kit, или гемопоэтическая клетка, или клетка, участвующая в in vitro-фертилизации.
Настоящее изобретение также относится к способу стимулирования пролиферации тучных клеток у пациента, заключающемуся в том, что этому пациенту вводят вышеописанную фармацевтическую композицию в количестве, эффективном для пролиферации тучных клеток у пациента. Методы введения композиций хорошо известны каждому специалисту, например, такие как пероральный, внутривенный или парентеральный, и другие методы введения. Доза вводимой композиции должна быть такой, чтобы она стимулирована полиферацию тучных клеток. При этом введение может быть осуществлено непрерывно или периодически так, чтобы количество композиции, вводимой пациенту, было эффективным для стимулирования пролиферации тучных клеток.
Кроме того, настоящее изобретение относится к способу индуцирования дифференцировки тучных клеток или клеток-предшественников эритроидного ряда у пациента, заключающемуся в том, что этому пациенту вводят вышеописанную фармацевтическую композицию в количестве, эффективном для индуцирования дифференцировки тучных клеток или эритроидных клеток-предшественников. Методы введения композиций хорошо известны каждому специалисту, и примерами таким методов являются пероральное, внутривенное или парентеральное введение. Доза вводимой композиции должна быть такой, чтобы она способствовала дифференцировке тучных клеток или эритроидных клеток-предшественников. При этом введение может быть осуществлено непрерывно или периодически так, чтобы количество композиции, вводимой пациенту, было эффективным для индуцирования дифференцировки тучных клеток или эритроидных клеток-предшественников.
Настоящее изобретение также относится к способу стимуляции или повышения уровней клеток-предшественников с использованием c-kit-лиганда, отдельно или в комбинации. Особенно эффективными являются комбинации c-kit-лиганда с G-CSF, GM-CSF, IL-1, IL-3, IL-6, IL-7 и MIPIα. Наиболее эффективной является комбинация KL + IL-1, IL-3 и IL-6. Однако IL-1, IL-3, IL-6 и GM-CSF, взятые отдельно, имеют умеренную эффективность. Это, в частности, проиллюстрировано в анализе на рост колониеобразующей клетки с высоким пролиферативным потенциалом, который был проведен с использованием костной ткани, обработанной 5-фторурацилом
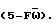
Кроме того, настоящее изобретение относится к способу облегчения трансплантации костного мозга или лечений лейкоза у пациентов, заключающемуся в том, что этому пациенту вводят вышеописанную фармацевтическую композицию в количестве, эффективном для облегчения трансплантации костного мозга или для лечения лейкоза. Методы введения композиций хорошо известны каждому специалисту, и примерами таким методов является пероральное, внутривенное, или парентеральное введение. Доза вводимой композиции должна быть такой, чтобы она способствовала облегчению трансплантации костного мозга или лечению лейкоза. При этом введение может быть осуществлено непрерывно или периодически так, чтобы количество композиции, вводимой пациенту, было эффективным. Этот способ является особенно эффективным для лечения хронического миелоидного лейкоза, c-kit-лиганд способствует повышению скорости роста лейкоцитов, увеличивая тем самым их восприимчивость к химиотерации.
Настоящее изобретение также относится к способу лечения меланомы у пациента, заключающемся в том, что этому пациенту вводят эффективное количество вышеописанной фармацевтической композиции, необходимое для лечения меланомы. Указанная композиция может быть введена стандартным методами, такими как пероральный, внутривенный, парентеральный, или другой метод введения. Доза вводимой композиции должна быть достаточно эффективной для лечения меланомы. При этом введение композиции может быть осуществлено непрерывно или периодически так, чтобы количество вводимой пациенту композиции было эффективным.
Растворимый полипептид c-kit-лиганда может быть также мутирован так, чтобы блокировалась биологическая активность c-kit при сохранении его способности связываться с c-kit. Таким образом, настоящее изобретение относится к способу лечения аллергии у пациента, заключающемуся в том, что этому пациенту вводят эффективное количество растворимого мутированного c-kit-лиганда, описанного выше, и фармацевтически приемлемый носитель. Указанная композиция может быть изготовлена в аэрозольной форме, которая вводится путем распыления водной формы мутированного антагониста c-kit-лиганда. К1-антагонист, описанный выше, также является эффективным против аллергий, и также в аэрозольной форме.
Фармацевтическая композиция для наружного применения, содержащая антагонист c-kit-лиганда, является эффективным средством для использования против артритов, ревматоидного артрита, склеродермии, острых кожно-аллергических реакций. Указанный антагонист c-kit-лиганда может быть также эффективным против аллергического конъюнктивита, посталлергического поражения ткани, либо он может быть использован как профилактическое средство против анафилактического шока. Поскольку тучные клетки опосредуют гистаминовый ответ, то антагонист c-kit или антисмысловая молекула, комплементарная c-kit-лиганду, должны быть эффективными для блокирования гистамин-опосредованных ответов, включая аллергии и секрецию желудочного сока.
Антагонист c-kit должен быть эффективным для лечения меланомы, поскольку меланоциты в своем развитии в значительной степени зависят от KL. Аналогичным образом, KL-антагонисты могут быть использованы для лечения лейкозов.
Как известно каждому специалисту, количество композиции, которое является эффективным для лечения аллергии, может варьироваться для каждого конкретного пациента и для конкретного типа аллергии. При этом введение композиции может быть осуществлено непрерывно или периодически так, чтобы количество композиции, вводимой пациенту, было эффективным.
Кроме того, настоящее изобретение относится к способу определения биологической активности полипептида c-kit-лиганда (KL), заключающемуся в том, что нормальные тучные клетки костного мозга инкубируют с образцом полипептида c-kit-лиганда (KL) в условиях, подходящих для индуцирования пролиферации нормальных тучных клеток костного мозга; дважды мутированные тучные клетки костного мозга инкубируют с образцом полипептида c-kit-лиганда (KL) в подходящих условиях; каждый из полученных продуктов инкубируют с3Н-тимидином; определяют количество тимидина, включенного в ДНК нормальных тучных клеток костного мозга и сравнивают количество тимидина, включенного в нормальные тучные клетки костного мозга, с количеством тимидина, включенного в дважды мутированные тучные клетки костного мозга, в результате чего оценивают биологическую активность полипептида c-kit-лиганда (KL).
В описании настоящей заявки при ссылках на конкретные нуклеотиды в ДНК молекулах имеются в виду нуклеотиды, присутствующие на кодирующей нити ДНК. При этом для обозначения конкретных нуклеотидов использовались следующие стандартные обозначения: С - цитозин; А - аденозин; Т - тимидин; G - гуанозин; U-урацил.
Эксперимент 1. Очистка c-kit-лиганда
Экспериментальные материалы
Мыши и эмбрионы
Мыши W BB6
+/+ и W/Wv. C57B16W/+ и WB W/+ были получены из лаборатории Джексона (Jackson Labkratory, Bar Harbor ME). Гетерозиготные W41/+ мыши были любезно предоставлены Or. J.Barker
(Jackson Laboratory) и поддерживались в колонии, полученной заявителями путем спаривания сибсов. Из эмбрионов на 14-15 день беременности, полученных в результате скрещивания W/+ животных, удаляли
печень. W/W-эмбрионы идентифицировали благодаря их бледной окраске и небольшому размеру печени по сравнению с другими эмбрионами (W/+ и +/+) в помете. Идентификация этих эмбрионов была подтверждена
анализом c-kit-белка в тучных клетках, происходящих от каждого эмбриона [38].
Культуры тучных клеток, получение перитонеальных тучных клеток и проточная цитометрия
Тучные
клетки, происходящие от костного мозга взрослой мыши, и клетки печени эмбриона на 14-15 день беременности культивировали в среде RPMI-1640, дополненной 10% плодной сывороткой теленка (FCS); средой,
кондиционированной ЕH1-3В-клетками; аминокислотами, не являющимися незаменимыми; пируватом натрия и 2-меркапто-этанолом (RPMI-среда полного состава (С)) [60]. Неслипшиеся клетки собирали, еженедельно
подпитывали и поддерживали при плотности клеток менее чем 7•105 кл./мл. Соединение тучных клеток в культурах определяли еженедельно путем окрашивания цитопсиновых препаратов 1%
толуидиновым синим в метаноле. Через 4 часа культуры содержали обычно более чем 95% тучных клеток, и эти культуры использовали для анализа на пролиферацию. Перитональные тучные клетки были получены от
С57ВL/б-мышей путем промывания брюшинной полости 7-10 миллилитрами RPMI-C. Тучные клетки очищали путем центрифугирования в градиенте плотности на 22% Metrizamide (Nycomed, Осло, Норвегия) в PBS, не
содержащем Са++ и Mg++, в основном, как описано ранее [61] . Тучные клетки окрашивали 1% толуидиновым синим в метаноле в течение 5 минут, в течение 5 минут промывали в воде, и в
сульфате берберина с помощью стандартных процедур, [62]. Тучные клетки подвергали мечению с использованием c-kit-специфической кроличьей антисыворокти, распознающей внеклеточные детерминатны с-kit, и
анализировали на FACSCAN (Becton Dickinson) [38].
Анализ на пролиферацию тучных клеток
Тучные клетки три раза промывали в RPMI для удаления IL-3, и культивировали при
концентрации 5•10 кл./мл в RPMI-C в объеме 0,2 мл в 96-луночных планшетах с двукратными серийными разведениями испытуемых образцов. Планшеты инкубировали при 37oС в течение 24 часов,
а затем в каждую лунку добавляли 2,5 мкКи3Н-TdR и инкубирование продолжали еще 6 часов. Клетки собирали на стекловолоконных фильтрах, после чего определяли уровень включения тимидина в
ДНК.
Получение среды, кондиционированной фибробластами
Balb/3Т3-клетки [1] культивировали до состояния сплошности в модифицированной по способу Дульбекко среде Игла (D MEM),
дополненной 10% телячьей сывороткой (CS), пенициллином и стрептомицином, во вращающихся флаконах (роллер-флаконах). Затем среду удаляли, а клетки два раза промывали форфатно-буферным раствором (PBS).
Затем добавляли MEM, не содержащую CS, и через три дня собирали кондиционированную среду. После этого клетки подпитывали средой, содержащей сыворотку, в течение 1-2 дней, затем промывали
бессывороточной средой, снова подпитывали, но уже бессывороточной средой, и через 3 дня собирали вторую партию кондиционированной среды. Кондиционированную среду (СМ) центрифугировали при 2500 об./мин
в течение 15 минут для удаления клеток, затем фильтровали через 0,45 мкм фильтр, и замораживали при 4oС. После этого кондиционированную среду концентрировали до 100-200-кратного снижения
объема с использованием устройства Pellicon для ультрафильтрации, а затем устройство для размешивания Amicon, при этом мембраны имели отсечку 10000 кДа.
Колоночная хроматография
Хроматографию на голубой агарозе (BRL, Gaithersburg, MD) осуществляли с использованием колонки с объемом слоя 100 мл уравновешенную PBS. 50-80 мл FCM-концентрат загружали в колонку и после
уравновешивания в течение 1 часа поток, содержащий активный материал, собирали и концентрировали до объема 15-20 мл в трубке для диализа с ПЭГ 8000.
Гель-хроматографию осуществляли на колонке (2,6•90 см) АСА54 Ultrogel (LKB, Rockiand, MD), которую уравновешивали PBS и калибровали метчиками молекулярной массы, альбумином бычьей сыворотки (Mr 68000), химотрипсином (Mr 25700) и рибонуклеазой А (Mr 14300) (все эти белки были получены от Pharmacia, Piscataway, NJ). Концентрат из колонки с голубой агарозой загружали в колонку для гель-фильтрации, скорость потока доводили до 37, 5 мл/ч, и 7,5 мл/фракции собирали.
Анионообменная и обращенно-фазовая высокоразрешающая жидкостная хроматография (ВРЖХ)
Высокоразрешающую жидкостную хроматографию
осуществляли с использованием системы Waters HPLC (регулятор W 600E Powerline, многоволновый детектор с программным управлением 490Е, автоматизированная рабочая станция 810, Baselime, Bedford MA).
Активные фракции от гель-фильтрации диализовали в 0,05 М Трис-HCl рН 7,8 и загружали в ВРЖХ-колонку Protein-Pak DEAE-5PW (7,5 мм•7,5, см. Waters), уравновешенную 0,05 М Трис-HCl, рН 7,8.
Связанные белки элюировали линейным градиентом (0-->0,05 М) Трис-HCl, рН 7,8. Связанные белки элюировали линейным градиентом NaCl (О-->0,4 М) в 0,02 М Трис-HCl, рН 7,8. Скорость потока
составляла 1 мл/мин, 2 мл фракции собирали.
Обращенно-фазовую ВРЖХ осуществляли с использованием полупрепаративной и аналитической C18-колонки от Vydac. В колонках использовали два буфера: буфер А-100 мМ ацетата аммония (рН 6,0), и буфер В - 1-пропанол. Биологически активные фракции из анионообменной колонки объединяли и загружали в полупрепаративную С18 колонку. Связанные белки элюировали крутым градиентом (0 - 23%) 1-пропанола в течение первых 10 минут, и 23-33% - градиентом 1-пропанола в течение 70 минут. Скорость потока доводили до 2 мл/мин, и 2 мл фракции собирали. Биологически активные фракции объединяли и разводили (1:1) буфером А, а затем загружали в аналитическую обращенно-фазовую C18-колонку. белки элюировали крутым градиентом (0-26%) 1-пропанола в течение 10 минут, а затем в течение 70 минут элюировали пологим градиентом (26-33%) 1-пропанола. При этом скорость потока составляла 1 мл/мин. Фракция 1 мл собирали, разделение на аналитической обращенно-фазовой С4-колонке осуществляли с использованием линейного градиента ацетонитрила (0-80%) в водном 0,1%TFA.
Изоэлектрическое
фокусирование
К 1 мл частично очищенного KL добавляли 20% глицерин (по объему) и 2% амфолин (по объему) при рН 3,5-10 (LKB, Gaithersburg, MD), Глицерин с градиентом плотности 5-60%,
содержащий 2% амфолин (рН 3,5-10) загружали в IEF-колонку (KB 8100). Образец наносили на область одинаковой плотности градиента и подвергали изоэлектрическому фокусированию (ИЭФ) (2000 В, 24 ч, 4oС). Затем 5 мл фракции собирали и в каждой фракции определяли рН. Эти фракции диализовали против RPMI-C, а затем анализировали на биологическую активность.
Анализ эритроидных
предшественников
Клетки от зрелого костного мозга, селезенки и от печени 14-дневного эмбриона засевали при плотности 105, 106 и 107 кл./мл соответственно в
среду Дульбекко, модифицированную по способу Исков и содержащую 1,2% метилцеллюлозу, 30% FCS, 100 мкМ 2-меркаптоэтанола, рекомбинантного эритропоэтина человека (2 ед./мл, Amgen, Thousand Oaks, CA)
(Iscove, 1978; Nocka and Pelus, 1987). Культуры инкубировали в течение 7 дней при 37oС и гемоглобулинизированные в бурстколонии анализировали на инвертационном микроскопе. Для оптимизации
условий роста к культурам клеток костного мозга добавляли 0,1 мМ гемина (Кооак). Очищенный KL, IL-3 (либо в виде WEHI-3 СМ (10%, об./об.) либо рекомбинантный мышиный IL-3 (50 мк/мл, Genzyme, Cambride)
добавляли, как было указано.
Экспериментальные методы
Короткий анализ на пролиферацию тучных клеток для обнаружения фибробластного фактора роста
Для идентификации и
измерения активности бифробластного фактора роста, которая способствует пролиферации нормальных (а не W/Wv) тучных клеток, ВММС промывали средой, не содержащей IL-3; инкубировали со средой,
содержащей 20-кратно концентрированную среду, кондиционированную фибробластами (FCM) или WEHI-СМ (IL-3) и после 24 часового инкубирования определяли уровень включения Н-тимидина. Ответы ВМСС,
полученные от нормальных (+/+) и мутантных

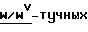


Очистка KL, стимулирующего тучные клетки
Для очистки KL 5 литров бессывороточной среды, кондиционированной фибробластами Вalb/3Т3, концентрировали путем ультрафильтрации (50-кратное
концентрирование). Полученный концентрат пропускали через колонку с голубой агарозой, уравновешенную PBS, и поток, содержащий стимулирующую тучные клетки активность, собирали и концентрировали с
полиэтиленгликолем. Помимо определения биологической активности с использованием тучных клеток все пиковые фракции также анализировали с использованием W/Wv-тучных клеток, где наблюдается
незначительная активность. Материал из колонки с голубой агарозой фракционировали посредством гель-фильтрации с использованием колонки АСА 54 (фиг. 2А). Биологическую активность элюировали как
мажорный и минорный пики, соответствующие 55-70 кДа и 30 кДа соответственно. Фракции главного пика объединяли, лиализовали и фракционировали с помощью FP1 С-хроматографии (жидкостная
экспресс-хроматография белков) на колонке DEAE-PW с градиентом NaCl (фиг. 2В). Активность элюировали при 0,11 М NaCl с FPLC-колонки. Пиковые фракции объединяли и подвергали ВРЖХ-хроматографии с
использованием полупрепаративной C18-колонки и градиента ацетата аммония /н-пропанола (фиг. 2С). Активный материал, элюированный 30% н-пропанолом из полупрепаративной С18-колонки, разводили буфером
А(1:1) и снова хроматографировали на аналитической С18-колонке (фиг. 21). Затем одиночный пик активности, который соответствовал мажорному пику (О,П. 280 нм) в профиле элюции, снова элюировали 30%
н-пропанолом. Аналогичные результаты были получены с использованием С4-колонки и Н2О и ацетонитрилом, содержащим 0,1% TFA, в качестве растворителей (фиг. 3В). ДСН-электрофорез в ПААГ
активных фракций, полученных в результате разделения с использованием обоих систем растворителей, и окрашивание серебром обнаружили одну полосу с подвижностью, соответствующей молекулярной массе 28-30
кД. Присутствие и интенсивность этой полосы непосредственно коррелируют с пиком биологической активности (фиг. 3). При этом какого-либо значительного различия в миграции указанной полосы в
восстановительных и невосстановительных условиях не наблюдалось, что свидетельствует о том, что KL не является димером с дисульфидной связью (3С). Три дискретных образца анализировали с помощью
восстановительного и невосстановительного ДСH-электрофореза в ПААГ, в результате чего было обнаружено, что очищенный материал является неоднородным по своим размерам. Полное количество белка,
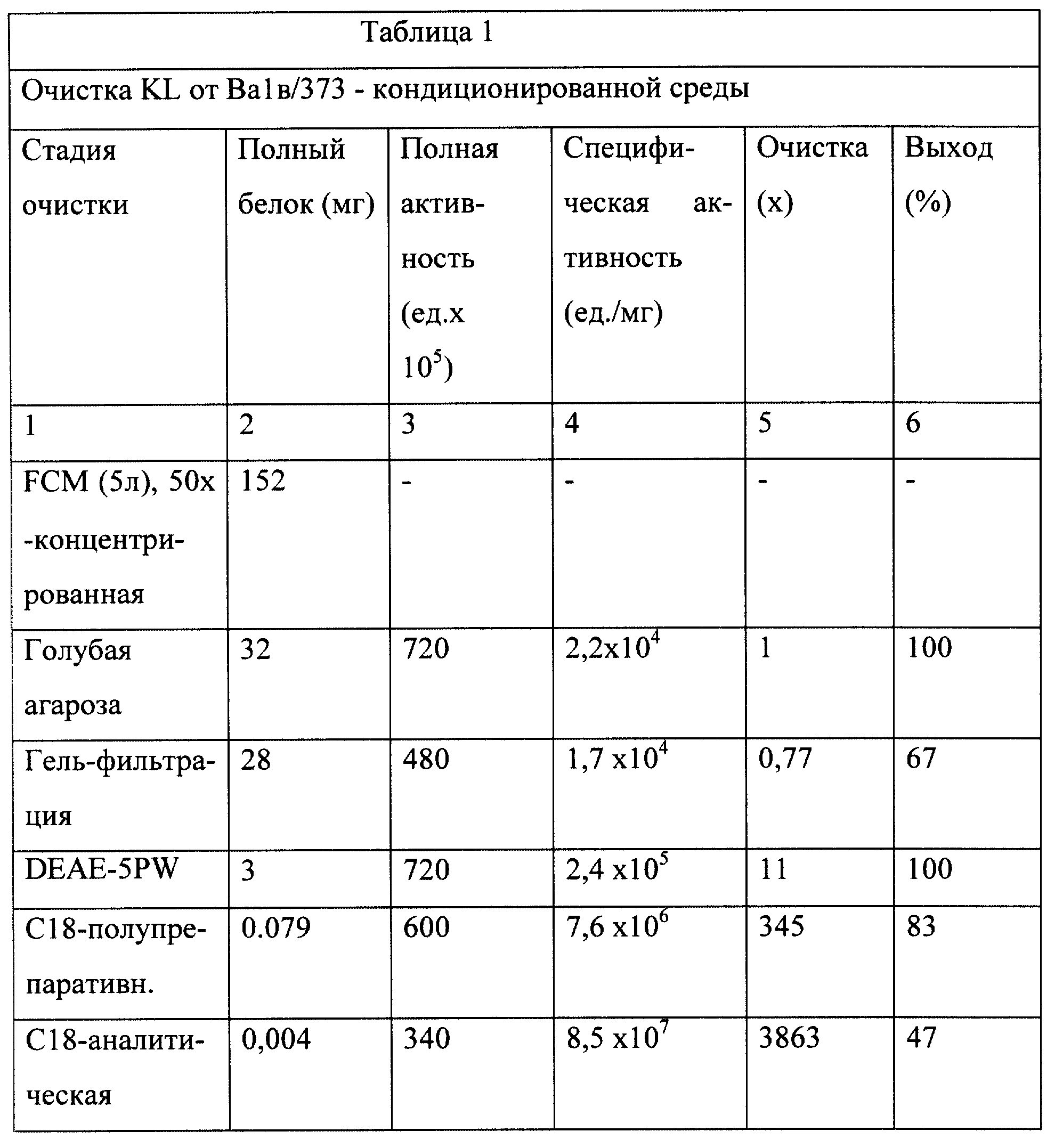
определенное по оптической плотности при 280 нм, соответствует количеству белка, определенному путем окрашивания серебром по отношению к BSA, используемому в качестве стандарта. Как показано в Таблице
1, очистка К1 из кондиционированной среды Вalb/3Т3 - клеток составляла более, чем 3000х, а восстановление начальной полной активности составляло 47%. В анализе, проведенном заявителем в объеме 0,2 мл,
половина максимальной пролиферации +/+ - тучных клеток была определена как 50 ед. активности и соответствовала 0,5 нг белка. Изоэлектрическое фокусирование частично очищенного материала (после
ионообменной хроматографии) обнаружило мажорный пик активности в диапазоне рН 3,7-3,9, что указывает на то, что изоэлектрическая точка для KL составляет 3,7-3,9.
Полиферативный ответ
на KL тучных клеток с различными с-kit/ W-мутациями
Очищенные KL испытывали на их способность стимулировать пролиферацию тучных клеток, полученных от животных дикого типа, а также от
гомозиготных и гетерозиготных по аллелям W, Wv и W41. Исходный W-аллель определяет нефункциональный c-kit-рецептор, и животные, гомозиготные по W-аллелю, погибают внутриутробно
или имеют тяжелую степень анемии; а тучные клетки, происходящие от W/W-эмбрионов не способны к пролиферации при совместном культивировании с Вalb/3Т3-фибробластами [63, 38]. Оба Wv- и W41-аллеля определяют частично дефектный c-kit-рецептор, и гомозиготные мутантные животные являются жизнеспособными [64, 65, 38]. Wv-гомозиготные животные имеют тяжелую форму
макроцитарной анемии, а тучные клетки этих животных обнаруживают незначительный ответ в анализе с совместным культивированием. Животные, гомозиготные по менее сильному W41-аллелю, имеют
умеренную форму анамии, а тучные клетки этих животных показывают промежуточный ответ в анализе с совместным культивированием. Гомозиготные и гетерозиготные мутанты и +/+ - тучные клетки, происходящие
из костного мозга W и W41-аллельных животных и из печени 14-дневного эмбриона W-аллельного животного, были описаны ранее [38]. W/W-тучные клетки, происходящие от эмбриональной печени, не
обнаруживали пролиферации в ответ на KL, тогда как гетерозиготные (W/+) и нормальные (+/+) тучные клетки обнаруживали аналогичный пролиферативный ответ на KL (фиг. 4). Тучные клетки, происходящие из
костного мозга Wv/Wv-мышей, давали очень незначительный ответ на KL, хотя некоторая степень пролиферации (10% от +/+- значений) наблюдалась при 100 ед./мл (фиг. 4). В
противоположность гетерозиготным W/+ - тучным клеткам W3+ - тучные клетки показывали промежуточный ответ (40%), что согласуется с доминантными признаками этой мутации. W41/W41- и
W41/+ - тучные клетки имели также недостаточную способность к пролиферации с KL, хотя и менее выраженную, чем тучные клетки, несущие W- и Wv-аллели, что соответствует in
vivo-фенотипу этой мутации (фиг. 4). Полученные результаты проиллюстрировали зависимость восприимчивость тучных клеток, несущих W, Wv и W41-аллели, к К1 от силы и in
vivo-признаков этих мутаций. В противоположность этому пролиферативный ответ мутантных тучных клеток на WEHI-3CM (11-3) не подвержен влиянию различных W-мутаций.
KL стимулирует
пролиферацию перитонеальных тучных клеток
Тучные клетки брюшной полости (РМС) были тщательно исследованы и в противоположность ВММС представляют собой тучные клетки, подобные тучным клеткам
соединительной ткани [66]. РМС не способны к пролиферации только в ответ на IL-3, однако их зрелый фенотип и жизнеспособность могут поддерживаться путем совместного культивирования с
NlH/3Т3-фибробластами [67]. Поэтому было интересно установить, будут ли К1 стимулировать пролиферацию РМС. Сначала проводили эксперимент для того, чтобы определить, будет ли с-kit экспрессироваться в
РМС. Для этого перитонеальные тучные клетки очищали путем осаждения в градиенте метризамида, а затем посредством иммунофлуоресценции с использованием сыворотки против с-kit- или нормальной кроличьей
сыворотки проводили анализ на экспрессию с-kit на клеточной поверхности. Чистота РМС-препаратов составляла 90-98%, что было установлено по окраске толуидиновым синим и сульфатом берберина. Сульфат
берберина окрашивают протеогликаны, например гепарин, в гранулах тучных клеток соединительной ткани, кроме того, как известно, он окрашивает также ДНК (фиг. 5) [62]. ВММС и тучные клетки слизистых
оболочек содержат в основном хондроитинсульфат (di-B/E -протеогликан), а не гепариновый протеогликан [67], а поэтому сульфат берберина не окрашивает гранулы в ВММС (фиг. 5А). Анализ экспрессии c-kit
путем проточной цитометрии показал, что фактически все РМС экспрессируют с-kit на уровнях, аналогичных уровням, наблюдаемым в ВММС (фиг. 5В). Затем проводили исследование для того, чтобы определить,
влияет ли KL на выживание РМС или способен ли KL стимулировать пролиферацию РМС (фиг.5С). Культивирование РМС лишь в оной среде или при добавлении WEHI-3СМ в концентрации, оптимальной для ВММС,
приводит к потере жизнеспособности РМС в течение 3-4 дней, хотя несколько клеток выживали в WENI-3CM в течение более длительного периода. Культивирование РМС в присутствии KL способствовало сохранению
их жизнеспособности и через две недели число клеток возросло от 5000 до 60000. Аналогичное возрастание количества ВМСС наблюдалось в ответ на KL. В отличие от РМС, которые не обнаруживали
пролиферативного ответа на WEHI-3CM, у ВММС, как и ожидалось, пролиферативный ответ наблюдался. После недельного и двухнедельного культивирования клетки окрашивали толуидиновым синим и сульфатом
берберина. Зрелый фенотип РМС поддерживали в культуре со 100% клетками, окрашивающимися обоими красителями, хотя их окрашивание сульфатом серберина было несколько менее интенсивным по сравнению со
свежевыделенными РМС.
К 1 стимулирует образование ранних клеток-предшественников эритроидного ряда, образующих "взрывообразные" колонии (бурст-колонии) (BFU-E)
Важная
особенность W-мутаций заключается в их воздействии на линию дифференцировки эритроидных клеток. In vivo-последствия этой мутации выражаются в макроцитарной анемии, которая является летальной для
гомозиготов по большинству сильных аллелей [47, 65]. Анализ популяций эритроидных клеток предшественников в костном мозге W/Wv-мышей показал небольшое уменьшение BFU-E и CFU-E [68, 69] . В
печени W/W-эмбрионов число BFU-Е оставалось неизменным, однако значительное увеличение числа BFU-E позволяет предположить, что с-kit играет определенную роль на отдельных стадиях созревания
эритроидных клеток, очевидно, перед CFU-E стадией [35]. Для оценки роли KL∞ в эритропоэзе и для последующего определения его взаимосвязи с c-kit-рецептором исследовали влияние KL на образование
BFU-E. Клетки костного мозга, селезенки и печени эмбриона засевали, используя стандартные условия культивирования, в присутствии (или в отсутствие) KL, эритропоэтина, и WENI-3CM. На 7 день
культивирования, BFU-E анализировали. В отсутствие эритропоэтина, но в присутствие WEHI-3СМ или KL роста эритроидных клеток не наблюдалось. В присутствии эритропоэтина BFU-E селезенки стимулировались
KL дозозависимым образом, т.е. от 12 BF-E/106 клеток в присутствии одного эритропоэтина и до 50 BF-E/106 клеток с максимальной стимуляцией при 2,5 нг KL/мл (фиг. 6). Помимо
воздействия на число BFU-E было также зарегистрировано резкое увеличение среднего BFU-E, обусловленное KL. Число BFU-E, продуцированное с использованием клеток селезенки вместе с К1+ эритропоэтином,
было аналогично числу BFU-E, полученному с использованием (WEHI-3 CM+эритропоэтин). В противоположность этому KL-эритропоэтин не стимулировали пролиферацию BFU-E от клеток костного мозга, тогда как
WEHI+ эритропоэтин индуцировали образование BFU-E от 103 клеток костного мозга. Была также проведена оценка влияния KL на клетки печени 14-дневного плода, и полученные результаты были
аналогичны результатам, полученным для клеток селезенки. При использовании одного лишь эритропоэтина наблюдалось значительное число BFU-E от клеток печени плода, однако это число возрастало от
6±2 до 20 ±5 с использованием 2,5 нг/мл KL. В присутствии WEHI-3CM и эритропоэтина наблюдалось 18±3 BFU-E для клеток печени плода.
Для последующей оценки взаимосвязи KL с c-kit в отношении дифференцировки эритроидных клеток были проведены исследования, чтобы выяснить, способствуют ли KL образованию эритроидных бурстообразующих ранних клеток - предшественников (BFU-E) от клеток эмбриональной печени W/W-мышей. W/W и Е/+ или +/+ - клетки печени были получены из эмбрионов от гибридной (W/+) мыши на 16,5 дне беременности. Полное число ядерных клеток в печени от W/W-мутантного эмбриона было в 8 раз меньше по сравнению с нормальными эмбрионами. Число BFU-E от W/W и Е/+ или +/+ - эмбриональной печени было одинаковым при культивировании с IL-3 + эритропоэтином, и более низким при культивировании лишь с одним эритропоэтином (фиг. 7). Для W/W - эмбриональных клеток печени KL не стимулировал BFU-E выше тех уровней, которые наблюдались при культивировании лишь с одним эритропоэтином, тогда как число KL-зависимых BFU-E от W/+ или +/+ -клеток печени было таким же, как и число, полученное при культивировании с эритропоэтином + 1L-3. Эти результаты позволяют предположить, что чувствительность эритроидных предшественников к KL зависит от функции c-kit.
Исследование связывания с очищенным KL
Очищенные KL
подвергали мечению125I с использованием хлораминового метода иодирования, в результате чего получали высокоспецифическую активность, т.е. до 2,8•105 имп./мин/нг.
С помощью меченых KL было установлено, что KL специфически связываются с тучными клетками. Но при этом не было зафиксировано связывание с W/W-тучными клетками, однако наблюдалось хорошее связывание с тучными клетками от одного помета. После связывания с тучными клетками KL подвергали совместному осаждению с антисывороткой против c-kit. Кроме того, связывание KL с W-мутантными тучными клетками коррелирует с экспрессией с-kit на клеточной поверхности, V, 37 (+) в зависимости от W(-).
Определение пептидной последовательности с-kit-лиганда
Белок
с-kit-рецептора выделяли, как описано выше, и последовательность этого белка определяли стандартными способами.
Ниже показана N-концевая аминокислотная последовательность белка (с
использованием однобуквенных аббревиатур):
KEIXGNPVTDNVKDITKLVANLPNDNYMITLNYVAGMXVLP,
где К= лизин, Е=глутаминовая кислота I=изолейцин, Х= неизвестная аминокислота, G=глицин,
N=аспаргин, Р=пролин, V= валин, Т=треонин, D=аспаргиновая кислота, К=лецин, А=аланин, Y=тирозин и М=метионин.
Обсуждение экспериментов
Обнаружение того факта, что W-локус и
протоонкоген c-kit являются аллельными, явилось важной информацией относительно функции c-kit в процессе развития организма животного, а также у взрослого животного. Сведения о функции c-kit, в свою
очередь, дают важный ключ к разгадке, какие именно типы тканей и клеток продуцируют лиганд c-kit-рецептора. Для идентификации c-kit-лиганда фактор роста, обозначенный KL, очищали из кондиционированной
среды фибробластов Вalb/3Т3, т. е. клеток, "подозреваемых" в продуцировании c-kit-лиганда и имеющих биологические свойства, которые, как ожидается, должен иметь c-kit-лиганд в отношении биологии
клеток из ритропоэза. Молекулярная масса KL составляет 30 кДа, а изоэлектрическая точка - 3,8. KL не является димером с дисульфидной связью в противоположность CSG-1, PDCF-B, которые обладают этим
свойством [70,71] (хотя гель-фильтрация KL в PBS и указывала на размеры 55-70 кДа, что свидетельствует о присутствии нековалентно связанных димеров в физиологических условиях.) KL отличается от других
гемопоэтических факторов роста своим действием на тучные клетки, например от IL-3 и IL-4 (благодаря своей способности стимулировать пролиферацию ВММС и очищенных перитонеальных тучных клеток (СТМС),
кроме ВММС от W-мутантных мышей). Источниками для гемопоэтических факторов роста G-CSF, GM-CSF, CSG-1, L1F и IL-6 являются фибробласты Вalb/3Т3, однако ни один из них не обладает активностью KL. Кроме
того, предварительные результаты, полученные при определении белковой последовательности KL, показали, что KL отличается от известных белковых последовательностей.
На основании того факта, что у W-мышей отсутствуют тучные клетки [72,73] , был сделан вывод о важной роли, которую играют с-kit и его лиганд в пролиферации, дифференцировке и/или выживания тучных клеток in vivo. Однако пока не известно, на какой именно стадии (или стадиях) дифференцировки тучных клеток требуется участие с-kit. Тучные клетки, полученные in vitro от костного мозга, печени эмбриона или селезенки с IL-3, похожи на тучные клетки слизистых оболочек (ММС), хотя они могут быть предшественниками тучных клеток обоих типов (ММС и СТМС) на терминальной стадии диффенецировки [66] . Вероятно, присутствие c-kit не требуется для продуцирования ВММС из гемопоэтических клеток-предшественников, поскольку IL-3- зависимые тучные клетки могут быть генерированы с такой же эффективностью из костного мозга или печени эмбриона как нормальных, так и W-мутантных мышей [60]. Иллюстрация факта экспрессии c-kit в ВММС и СТМС/РМС и соответствующей чувствительности ВММС и зрелых СТМС/РМС и KL позволяет предположить, что c-kit играет определенную роль на различных стадиях дифференцирования тучных клеток. Было также показано, что помимо фибробластов комбинации IL-3 и IL-4; IL-3 и РМА или перекрестное связывание IgE-рецепторов могут стимулировать in vitro-пролиферацию СТМС [74, 75, 76, 77, 78]. В отличие от указанных модуляторов биологического ответа, которые являются медиаторами аллергических и воспалительных реакций, KL сам по себе в присутствии FC способен стимулировать пролиферацию СТМС. Поэтому KL может обладать способностью к пролиферации и дифференцировке тучных клеток, которая не зависит от указанных иммунных ответов на его продуцирование и воздействие на клетки -мишени.
Влияние W-мутаций на эритропоэз свидетельствует о важной роли c-kit в созревании эритроидных клеток [80, 68, 69]. Сравнительный анализ эритроидных клеток-предшественников в печени W/W-эмбрионов и в нормальных пометах дает основание предположить, что в отсутствие с-kit-функции созревание протекает нормально лишь до BFU-E-стадии, а до CGU-E-стадии это развитие подавляется [35] . In vitro это явление может быть устранено путем введения в культуральную среду IL-3, который вместе с эритропоэтином стимулирует созревание BFU-E от W/W и +/+ - костного мозга [78]. Роль IL-3 в этом процессе in vivo пока неизвестна, а поэтому c-kit может играть решающую роль на этой стадии дифференцировки эритроидных клеток. С этой ролью с-kit на указанной стадии дифференцировки эритроидных клеток согласуется также и способность KL стимулировать образование ранних бурстообразующих эритроидных клеток-предшественников, происходящих от клеток селезенки и эмбриональной печени в присутствии эритропоэтина. Кроме того, способность KL стимулировать W/W- BFU-E позволяет предположить, что функция с-kit необходима для KL-опосредованного образования BFU-E, а это означает, что c-kit-функция необходима для KL-опосредованной пролиферации тучных клеток. Буртостимулирующее действие Balb/3T3-клеток на дифференцировку BFU-E от клеток эмбриональной печени было описано ранее [79]. По всей вероятности, KL является чувствительным к бурстостимулирующей активности Balb/3Т3-клеток. Интересным аспектом описываемых исследований является обнаружение того факта, что KL неспособен стимулировать 7-дневные BFU-E от клеток костного мозга. Этот результат позволяет предположить, что BFU-E в печени эмбриона, селезенке и костном мозге зрелого организма отличаются по условиям своего роста. Недавно проведенные эксперименты показали, что KL могут стимулировать образование раннего эритроид-мультипотенциального предшественника в костном мозге, который появляется в культуре в более позднее время (на 14-20 день). Для иллюстрации непосредственно влияния KL на образование BFU-E и для исключения возможного участия А-клеток или других эндогенных факторов роста необходимо было провести эксперименты с использованием очищенных популяций клеток-предшественников.
W-мутации помимо недостаточности эритропоэза и развития тучных клеток, очевидно, влияют на компартментализацию стволовых клеток в гемопоэтической системе. Такими подверженными влиянию популяциями могут быть колониеобразующие единицы (клетки) селезенки (CFU-S), которые продуцируют миелоидные колонии в селезенке мышей, облучаемых летальными дозами, а также долгоживущая репопуляция, необходимая для дифференцировки различных клеток [81, 46, 47, 81, 82]. Кроме того, было бы интересно узнать, является ли действие KL самоподдерживающимся либо дифференцировка популяций гомопоэтических стволовых клеток возможна лишь в комбинации с другими гемопоэтическими факторами роста. Такие сведение помогли бы точно определить стадию (или стадии) в компартментации стволовых клеток, в которой (или в которых) участвует c-kit/W-генный продукт.
Мутации в steel-локусе (SI) мыши способствуют продуцированию плейотропных фенотипов в гепомоэзе, меланогенезе и гаматогенезе, которые аналогичны фенотипам мыши, несущей W мутации [47, 51]. Однако в отличие от W-мутаций, SI-мутации воздействуют на микроокружение клеточной мишени для мутации, и не являются клеточно-автономными [46]. Исходя из параллельных и взаимодополняющих эффектов W- и SI-мутаций было сделано предположение, что SI-ген кодирует лиганд c-kit-рецептора или генного продукта, непосредственно связанного с продуцированием и/или функцией этого лиганда [9]. Согласно этому предположению фибробласты SI/SId-эмбриона или кондиционированная среда от SI/SId-фибробластов не способны поддерживать пролиферацию ВММС и предшественников тучных клеток соответственно и, по всей вероятности, не будет продуцировать функциональный KL [16, 84]. Если KL является лигандом с-kit-рецептора, то молекулярный анализ позволит точно установить идентичность KL с генным продуктом SI-локуса и, кроме того, позволит убедиться в том, что введение KL мыши, несущей SI-мутации. приведет к устранению по крайней мере некоторых симптомов этой мутации.
Для скрининга библиотеки фибробластов человека или плаценты человека, проводимого описанными выше методами, использовали 1,4 кв-кДНК-клон. После выделения гена, кодирующего с-kit-лиганд человека, этот ген может быть охарактеризован в соответствии с вышеописанными методами.
Эксперимент 2. Выделение
нуклеиновокислотной последовательности
Экспериментальные материалы
Мыши и тканевые
культуры
Мыши WBB6+/+, C57BL/7J, C57BL/67 Wv/+, WB6W/+, С3НеВ/FeJ а/а GaJ SI
Hm, и М. spretus) поставлялись из Лаборатории Джексона (The Jackson Laboratory, Bar Harbor, Me). Для межвидового скрещивания, спаривали самок С57ВL/6J и самцов M. spretus. Потомство от этого
скрещивания затем оценивали на наследование аллелей С57ВL/6J или М. spretus (см. ниже). Самок (C57BL/6J•M.spretus) F1-потомства подвергали обратному скрещиванию с С 57BL/6J-самцами.
Тучные клетки из костного мозга взрослой +/+б Wv/Wv и W/+ -мыши и печени 15-14-дневного W/W-эмбриона культивировали в среде RPMI 1640, дополненной 10% плодной сывороткой теленка (FCS), средой, кондиционированной WEHI-3B-клетками, аминокислотами, не являющимися незаменимыми, пируватом натрия и 2-меркаптоэтанолом (RPMI-Complete) [36, 60]. Клетки Balb/c 3T3 [1] получали от Paul О'Donnell (Sloan-Kettiring Institute Нью-Йорк), и культивировали в минимальной поддерживающей среде (MEM), модифицированной по способу Дульбекко и дополненной 10% телячьей сывороткой, пенициллином и стрептомицином.
Очистка и определение аминокислотной последовательности KL
KL выделяли из среды, кондиционированной Balb/c 3T3-клетками, с
проведением анализа на пролиферацию тучных клеток, как описано в литературе [37]. Затем кондиционированную среду концентрировали до 100-200-кратного снижения объема с помощью устройства для
ультрафильтрации Pellicon и ячейки с мешалкой Amicon. После этого концентрат хроматографировали на голубой агарозе (Bethesda Reseath Laboratories, Gainhersburg, MD) и поток, содержащий активный
материал, концентрировали в трубке для диализа с полиэтиленгликолем 8000, а затем фракционировали с помощью гель-хроматографии на колонке с гелем АСА54 Ultrogel (LKB, Rockland, MD). Биологически
активный материал элюировали как мажорный и минорный пики, соответствующие 55-70 кД и 30 кД соотвественно. Фракции главного пика объединяли, диализовали и фракционировали с помощью жидкостной
экспресс-хроматографии белков (FKLC) на LEAE/5PW-колонке с использованием градиента NaCl. Активный материал элюировали при 0,11 M NaCl с FRLC-колонки. Пиковые фракции объединяли и подвергали ВРЖХ с
использованием полупрепаративной С18-колонки и градиента ацетата аммония-н-пропанола. После элюирования 30% пропанолом с полупрепаративной С18-колонки активный материал разводили (1:1) и снова
хроматографировали с использованием аналитической С18-колонки. Одиночный пик активности, который снова элюировали 30% н-пропанолом, соответствовал мажорному пику О.П. при 280 нм в профиле элюции.
Аналогичные результаты были получены с помощью С4-колонки с использованием Н2О и ацетонитрила, содержащего 0,1% TFA в качестве растворителей, П-концевую аминокислотную последовательность
определяли на аминокислотном анализаторе РТН, работающем в оперативном режиме Applied Biosistev 477 (Hewick и др. , 1961) и модифицированного метода Stanley и Giklert (1981). Вкратце, реакцию мечения
проводили с использованием 200 нм KL, 2 нМ хлорамина Т, 10% диметилсульфоксилила, и 0,02% полиэтиленгликоля (полный объем 25 мкл) в 0,25 М фосфатного буфера (рН 6,5). Реакцию осуществляли в течение 2
минут при 4oС и прекращали путем добавления 2 нМ цистеина и 4 мкМ KL. Затем KL выделяли из среды, не содержащей Nal, путем гель-фильтрации на ko-PD10-колонке (Pharmacia). Иодированный KL
хранили вплоть до 2 недель при 4oС.
Анализ на связывание
Буфер для связывания содержал среду RPM1 1640, 5% BSA (Sigma), 20 мМ НЕРЕ (рН 7,5) и NaNO3.
Эксперименты на связывание с неприкрепленными клетками осуществляли в 96-лучночных планшетах для культивирования с плотностью 2•105 клеток на лунку в объеме 100 мкл. Эксперименты на
связывание с ψ2-клетками осуществляли в 24 луночных планшетах в объеме 300 мкл. Перед добавлением конкурента или меченого KL клетки уравновешивали в буфере для связывания в течение 15 минут.
Для неспецифического связывания перед добавлением125I-KL в течение 30 минут в 10-кратном избытке добавляли немеченый KL или кроличью сыворотку против c-kit. Клетки инкубировали с125I-KL в течение 90 минут и неприкрепленные клетки осаждали с использованием 150 мкл FCS. Клеточный дебрис замораживали и подсчитывали.
Иммунопреципитация и перекрестное
смешивание
ВММС инкубировали с125I-KL в стандартный условиях связывания и промывали в FCS, а затем в PBS при 4oС. Клетки лизировали, как было описано ранее [35] в 1%
Тритоне Х-100, 20 мм Трис (рН 7,4), 150= мМ NaCl, 20 мМ EDTA, 10% глицерина и ингибиторов протеазы фенилметилсульфонилфторида (1 мМ) и лейпептина (20 мкг/мл). Лизаты подвергали иммунопреципитации с
нормальной кроличьей сывороткой или с c-kit-специфической сывороткой, продуцированной путем иммунизации кроликов фрагментом домена тирозин-киназы v-kit ]23]; или с мышиным c-kit, экспрессированным из
кДНК в рекомбинантном вирусе коровьей оспы [36]. Для экспериментов по совместному осаждению иммунопреципитаты три раза промывали промывкой А (0,1% Тритон Х-100, 20 мМ Трис (рН 7,4), 150 мМ NaCl, 10%
глицерин), солюбизировали в буфере для ДСН-образца и анализировали с помощью ДСН-электрофореза в ПААГ и авторадиографии. Для экспериментов по перекрестному сшиванию клетки инкубировали с
дисукцинимидиловым субстратом (0,25 мг/мл) в PBS в течение 30 минут при 4oС, промывали в PBS и лизировали, как описано выше. После осаждения осуществляли промывание в следующих условиях:
один раз в промывке В (50 мМ Триас, 500 мМ NaCI, 5 мМ EDTA, 0,2% Тритон Х-100); три раза в промывке С (50 мМ Трис, 150 мМ NaCI, 0,1% Тритон Х-100, 0,1% ДСНб 5мМ EDTA); и один раз в промывке D (10 мМ
Трис, 0,1% Тритон Х-100).
Синтез кДНК, RCP-амплификация (RT2PCR), и определение последовательности
RT-PCR-амплификацию осуществляли в основном методом, описанным в [53]. Для
кДНК-синтеза 1 мкг ро1у(А)-РНК от слившихся Balb/c 3Т3-клеток в 25 мкл 0,05 М Трис-НСl (рН 8,3), 0,075 М КС1, 3 мМ MgCl2, 10 мМ дитиотреитола, 200 мкМ dNTP и 25 ед. араназина
(Promega) инкубировали с 50 пМ антисмыслового праймера и 50 ед. обратной транскриптазы вируса мышиного лейкоза Молони при 40oС в течение 30 минут. Затем добавляли еще 50 ед. обратной
транскриптазы и продолжали инкубировать еще 30 минут, кДНК амплифицировали сначала путем доведения реакционного объема до 50 мкл с помощью 25 мкл 50 мМ KC1, 10 мМ Трис-HCl (рН 8,3), 1,5 мМ MgCl2 0,01% (мас./об.) желатина, и 200 мкМ dNTP, а затем путем добавления 50 пМ смыслового праймера и 2,5 ед. ДНК-полимеразы Tag с последующим амплифицированием в течение 25-30 циклов в
автоматической термоячейке (Perkin-Elmer Cetus). Амплифицированные фрагменты очищали путем электрофореза на агарозном геле, переваривали соответствующими рестриктирующими ферментами и субклонировали в
М13mр18 и М13 mр19 для анализа последовательности [49].
Выделение кДНК и секвенирование
В настоящей работе использовали λ-о11-с ДНК-библиотеку фибробластов 3Т3 мыши,
полученную от Clontech. Скрининг осуществляли в дубликате и использованием Yscherichia coli
У 1090 в качестве бактериального хозяина [48], и меченного по 5'-концу олигонуклеотида в качестве
зонда. Гибридизацию проводили в 6хSSC при 63oС, а конечную промывку фильтров проводили в 2•SSC, 0,2% ДСН при 63oС. Рекомбинантный фаг переваривали CoRI-ферментом и вставки
субклонировали в М13 для анализа последовательности. Нуклеотидную последовательность этих кДНК на обеих нитях и с перекрыванием определяли методом дидезокси-терминации Сенгера [49] с использованием в
качестве праймеров синтетических олигонуклеотидов (17-меры).
ДНК и РНК-анализ
Из концевых фрагментов получали геномную ДНК, которую затем переваривали рестриктирующими
ферментами, фракционировали с помощью электрофореза и переносили на нейлоновые мембраны. В качестве зондов для гибридизации использовали 1,4 кв кДНК KL и TIS-Dra/Sal (зонд, полученный из трансгенного
инсерционного сайта в трансгенной линии TG. ЕВ [85]).
Клетки Вalb/с 3Т3 гомогенизировали в изотиоцианате гуанидиния и в соответствии с методом Chirgwin и др. [10] выделяли РНК. Полную клеточную РНК (10 мкг) и poly(А)+РНК фракционировали в 1% агарозно-формальдегидном геле и переносили на найлоновые мембраны (Nytran, Schlelcher α Schuell), a затем осуществляли предгибридизацию и гибридизацию в соответствии с известными процедурами [86, 35]. В качестве зонда для гибридизации использовали 1,4 ко кДНК KL, меченную32Р фосфатом.
Получение моноклональных тел протеины c-kit-лиганда
Для выделения моноклональных антител мышам Вalb/с в возрасте 8 недель внутрибрюшинно инъецировали 50 микрограммов очищенного растворимого
полипептида c-kit-лиганда (KL) настоящего изобретения или его фрагмента (полученного, как описано выше) в полном адъюванте Фрейнда (1:1 по объему). Затем с интервалом в 1 месяц мышам вводили
бустер-инъекцию (вторичную инъекцию) растворимого полипептида лиганда или его растворимого фрагмента, смешанного с неполным адъювантом Фрейнда, после чего у мышей брали кровь через хвостовую вену. На
4, 3 и 2 день до осуществления слияния клеток мышам внутривенно вводили бустер-инъекцию 50 мкг полипептида или его фрагмента в физиологическом растворе. Затем осуществляли слияния спленоцитов с
несекреторными клетками миеломы в соответствии с стандартным процедурами. Через две недели гибридомные супернатанты скринировали на связывающую активность против c-kit-рецепторного белка, как описано
выше. Положительные клоны затем выделяли и размножали.
Альтернативно, для продуцирования моноклональных антител против c-kit-рецептора использовали метод, описанный выше, за исключением того, что мышам вводили инъекцию и бустер-инъекцию с-kit-рецепторного белка.
Альтернативно, для выделения мышиных моноклоналных антител крысам Sprague-Dawley или Louis инъекцировали мышиный полипептид и полученные сплетоциды гибридизировали путем слияния с клетками миеломы крысы (y3-Ag 1.2.3).
Результаты экспериментов
Выделение и
характеризации мышиных кДНК, кодирующих гемопоэтический фактор роста KL
KL-белок очищали из серы, кондиционированной клетками Balb/c 3Т3, с помощью серии хроматографических стадий, включая
аминообменную и обращенно-фазовую хроматографию высокого разрешения, как описано выше [37]. Как указывалось ранее, определяли N-концевую последовательностть (40 аминокислот) KL, которая представляла
собой:
KEIXGNPVTDNVKDITKLVANPLBDYMITLNYVAGMXVLP
Для получения невырожденного гомологичного зонда для гибридизации синтезировали (как показано на фиг. 8) полностью вырожденные
олигонуклеотидные праймеры, соответствующие аминокислотам 10-16 (смысловой праймер) и аминокислотам 31-36 (антисмысловой праймер) и имеющие в своих 5'-концах сайты распознавания эндонуклеазы, кДНК,
соответствующую KL-мРНК-последовательностям, кодирующим аминокислоты 10-36 KL, получали путем модифицированной полимеразно-цепной реакции с использованием обратной транскриптазы (RT-PCR). В
кДНК-синтезе и PCR-амплификации в качестве матрицы использовали poly(A)+-РНК из Balb/c 3T3-клеток в комбинации с вырожденными олигонуклеотидными праймерами.
Амплифицированный ДНК-фрагмент субклонировали в М13 и определяли последовательности для трех вставок. Было установлено, что последовательности между праймерами являются уникальными и кодируют нужную аминокислотную последовательно (фиг.8) Олигонуклеотид (49 нуклеотидов), соответствующий уникальной последовательности PCR-продуктов, был затем использован для скрининга библиотеки λ gtlll-фибробластов мыши. Был получен 1,4 kb, который, в своей 3'-половине, кодирует открытую рамку считывания, простирающуюся вплоть до 3'-конца клона, и 270 аминокислот (фиг. 11). Первые 25 аминокислот KL-последовательности имели характеристики сигнальной последовательности. Из очищенного белка (аминокислоты 26-65, следующие до сигнальной последовательностью) получали N-концевую пептидную последовательность. Гидрофобная последовательность из 21 аминокислоты (остатки 217-237), за которой у ее карбоксильного конца следуют положительно заряженные аминокислоты, имеет признаки трансмембранного сегмента, В последовательности, расположенной между сигнальным пептидом и трансмембранным доменом, находились четыре потенциальных сайта N-гликозилирования и 4 нерегулярно расположенных цистеиновых спейсеров. За трансмембранным сегментом, не доходя до сигнала терминации (конец клона), следует С-концевой сегмент из 33 аминокислот. Поэтому аминокислотная последовательность KL имеют признаки трансмембранного белка: N-концевой сигнальный пептид, внеклеточный домен и С-концевой внутриклеточный сегмент.
Для идентификации KL-специфических мРНК в Balb/c 3Т3-клетках проводили блот-анализ РHК. (фиг.12). С использованием 1,4-кв-KI-кДНК в качестве зонда на блотах, содержащих poly (A)+ РНК, идентифицировали мажорный транскрипт из 6,5 кв и два минорных транскрипта из 4,65 кв и 3,5 кв. С использованием меченного по концу олигонуклеотида, полученного из N-концевой белковой последовательности, были обнаружены идентичные транскрипты. Как затем было выяснено, этот результат указывает на то, что KL кодируется крупной мРНК, которая в больших количествах экспрессируется в клетках Balb/c 3T3.
Растворимая
форма KL представляет собой лиганд c-kit-рецептора
Было показано, что гемопоэтический фактор роста KL, происходящий из фибробластов, стимулирует пролиферацию первичных точных клеток костного
мозга и перитонеальных тучных клеток и способствует образованию бурст - очагов дифференцицировки ранних эритроидных предшественников. Чтобы определить, является ли KL лигандом c-kit-рецептора, сначала
было решено продемонстрировать специфическое связывание KL с клетками, экспрессирующими высокие уровни c-kit-белка, а именно, тучными клетками (ВММС) и NIH ψ2-клетками, экспрессирующими
с-kit-кДНК. С помощью модифицированного хлораминового метода [88] осуществляли125I-мечение КI для получения высокой специфической активности. Анализ, проведенный путем ДСН-электрофореза в
РAAГ, выявил одну полосу (28-30 кД) (фиг. 13); а анализ на пролиферацию тучных клеток показал, что меченый материал сохранил свою биологическую активность. Затем оценивали связывание повышенных
концентраций125I-KL с N1Hψ-2 клетками, экспрессирующими с-kit-кДНК, с N1H ψ2-контрольными клетками, с нормальными ВММС, и с W/W-6 W/+, и Wv
/Wv- ВММС (при 4oС). Результаты, проиллюстрированные на фиг. 14, показали, что меченый KL связывается с N1H 2-клетками, экспрессирующими с с-kit-кДНК и с (+/+)-6 (W/+)- и (Wv/Wv) тучными клетками, но не связывается контрольными N1H ψ2-клетками или тучными (w/W)-клетками. Wv -Мутация является результатом миссенсмутации в домене киназы
с-kit, что снижает in vitro-активность киназы, но не оказывает влияния на экспрессию с-kit-белка на клеточной поверхности [36]. В противоположность этому W-мутация возникает в результате делекции,
обусловленной нарушением сплайсинга, что приводит к удалению трансмембранного домена c-kit-белка, а поэтому экспрессии белка на клеточной поверхности не происходит [36]. Кроме того, связывание125I-KL может быть завершено с немечеными KL и с двумя различными антисыворотками против c-kit. Полученные результаты проиллюстрировали связывание125I-меченных KL с клетками,
экспрессирующими с-kit на своей поверхности.
Для получения прямого доказательства того, что KL является лигандом с-kit-рецептора, был проведен эксперимент, чтобы определить, могут ли быть очищены комплексы "рецептор-лиганд" путем иммунопреципитации с сывороткой против с-kit. Для осуществления этого эксперимента необходимо, чтобы комплекс "KL-с-kit" был стабильным и не был подвержен воздействию детергентов, используемых для солюбилизации с-kit-рецептора. Подходящими для этой цели являются рецептор-лигандные комплексы, происходящие от близкородственного рецептора фактора активации колонии макрофагов (CSF-1) и системы PDCF-рецепторов [89] . При инкубировании при 4oС125I-KL путем промывания клетки солюбилизировали путем лизиса с использованием Тритона Х-100 и осаждали с помощью кроличьих сывороток против v-kit и против с-kit, конъюгированных с белком А-Сефарозой.125I-KL сохранялся в иммунопреципитетах, полученных путем инкубирования с анти-kit сывороткой, но не с неименным контролем, о чем свидетельствовал анализ иммунного комплекса, проведенный с помощью ДСН-электрофореза в ПААГ, где было продемонстрировано выделение целого125I-KL из образцов, содержащих иммунные комплексы, полученные с анти-kit сывороткой.
Для дальнейшей характеризации комплексов "с-kit-KL-рецептор-лиганд", был проведен эксперимент, чтобы определить, может ли KL перекрестно связываться с c-kit. Для этого ВММС инкубировали с125I-KL, промывали и обрабатывали перекрестно сшитым дисукцинимидиловым субстратом. Затем клеточные лигазы подвергали иммунопреципитации с антисывороткой против v-kit и анализировали с помощью ДСН-электрофореза в ПААГ. Авторадиография выявила три структуры; одна из них (приблизительно 30 кД) представляла собой KL, совместно осажденный при отсутствии перекрестного связывания с c-kit; другая (180-190 кД) соответствовала ковалентно связанному c-kit-KL-мономерномерному комплексу; третья - высокомолекулярная структура, которая находилась на границе раздела между разделяющим и концентрирующим гелями (фиг. 15В). Молекулярные структуры с аналогичными размерами наблюдались при выделении непосредственно на ДСН-ПААГ без предварительной иммунопреципитации. После осаждения с неиммунной сывороткой125I-меченных молекул не наблюдалось. Образование высокомолекулярных структур зависит от инкубировали KL с тучными клетками и не наблюдается при перекрестном связывании KL с самим собой. Суммируя полученные результаты, можно со всей очевидностью утверждать, что KL специфически связывается с с-kit-рецептором и является лигандом с-kit.
Картирование KL по отношению к SI-локусу
Для того чтобы
установить, кодируется ли KL в SI-локусе, проводили рекомбинационный анализ в целях определения положения KL на карте по отношению к локусу, который непосредственно связан с 1. Этот локус представляет
собой сайт трансгенной инсерции в трансгенной линии TGEB [85]. Было установлено, что геномные последовательности, клонированные из сайта инсерции, соответствуют на карте расстоянию 0,9±0,8 см
от SI-локуса. Поэтому этот сайт представляет собой наиболее известный маркер для SI.
Для картирования KL по отношению к сайту трансгенной инсерции проводили анализ путем межвидового картирования, где использовали скрещивание мышей C57B1L/6J с мышами вида Mus spretus. Этот метод позволил установить, что полиморфизм рестрикционных фрагментов (PFLPS) для клонированной ДНК наблюдается гораздо чаще среди мышей различных видов, чем среди мышей различных лабораторных инбредных штаммов [90]. Связь между 1,4 kb-KL-кДНК-зондом и TIS Dra/Sal (зондом от сайта трансгенной инсекреции) анализировали путем оценки на степень совпадения наследования их соответствующих аллелей (C57BL/6J или М.spertus). Это может быть легко установлено путем анализа полиформизма рестрикционных фрагментов, выявляемого с помощью Taol - рестрикционного переваривания. Результаты такого анализа связи показаны в Таблице 2. Лишь один рекомбинант был обнаружен у 53 потомства. Это соответствует проценту рекомбинации 1,9±1,9. Поскольку эта величина очень близка к значению генетического расстояния, измеренного между сайтом трансгенной инсерции и SI, то полученный результат подтверждает высказанное мнение, что карте, KL соответствует локусу S1.
Степень совпадения наследования С57В1/6 (В6)-или M.spretus (Sp)-аллелей у потомства, полученного путем межвидового скрещивания (см. экспериментальные процедуры), определяли путем оценки KL-кДНК (12,4 кb)-зонда и Ti Dra/Sal (полученного из сайта трансгенной инсерции, который непосредственно связан с S1, см. результаты). Процент рекомбинации вычисляли по методу Грина (1981).
Локус, идентифицируемый с помощью KL, также исследовали у мышей, несущих исходную SI-мутацию [50]. Для этой цели за основу были взяты наблюдения полиморфным у инбредных штаммов, и эти наблюдения использовали для определения генотипа в SI в процессе развития эмбриона. С57B1/6J-мышей, несущих SI-мутацию, сохраненную в штамме С3НеВ/FeJ, получали путем скрещивания, и FI-потомство, несущее SI-аллель, подвергали интеркроссу, т.е. скрещиванию непосредственных особей (С57В1J /6 SI3CH ± SI3ch/+). Гомозиготное SIISI-потомство, полученное от этого скрещивания, было анемичным и гомозиготным в отношении С3НеВ/FeJ - происходящего RFLP в сайте трансгенной интеграции (фиг. 16). Неанемичные мыши были либо гетерозиготными SII+ - мышами, либо мышами дикого типа, и при этом они были гетерозиготными по С3НеВ/FeJ- и C57BL/6J-происходящему полиморфизму или гомозиготными по C57BL/6J-полиморфизму соответственно. При анализе геномной ДНК от SII+ и SIISI-мышей с использованием 1,4 kb-KL-кДНК-зонда никакой гибридизации с ДНК гомозиготных SIISI-мышей на наблюдалось (фиг. 16). Отсюда можно сделать вывод, что локус, кодирующий KL-белок, делетирован в SI-мутации. Этот факт еще раз подтверждает мнение, что KL является продуктом SI-гена.
Обсуждение
экспериментов
Обнаружение аллелизма между протоонкогенном с-kit- и мышиным W-локусом выявило плейотропные функции с-kit-рецептора при эмбриональном развитии и у взрослого животного. Кроме
того, он определяет первичную генетическую систему трансмембранного рецептора тирозин-киназы у млекопитающего. Мутации в SI-локусе и в с-kit/W-локусе воздействуют на те же самые клетки-мишени. Исходя
из взаимодополняющих и параллельных свойств указанных мутаций было высказано предположение, что с-kit-рецептор кодируется SI-локусом.
Проведенные эксперименты показали, что SI-ген кодирует лиганд для с-kit рецептора. Этот вывод может быть проиллюстрирован следующим образом. Исходя из имеющихся сведений о функции с-kit-рецептора идентифицировали и очищали предполагаемый лиганд с-kit-рецептора, обозначенный KL [37]. Было также проиллюстрировано специфическое связывание KL с с-kit-рецептором, о чем свидетельствовало связывание KL c клетками, экспрессирующими функциональные с-kit-рецептор, и образование стабильного комплекса между KL и с-kit-белком. Были получены KL-специфические кДНК-клоны, и было показано, что KL занимает определенное положение на карте по отношению к SI-локусу на мышиной хромосоме 10. Кроме того, было также продемонстрировано, что KL-последовательности делегированы в геноме SI-мыши. Суммируя полученные результаты, можно утверждать, что KL кодируется SI-локусом и является лигандом для с-kit-рецептора, а этот вывод в свою очередь дает молекулярное обоснование SI-дефекта.
Аминокислотная последовательность, выведенная исходя из нуклеотидной последовательности KL-кДНК-клона, позволяет предположить, что KL синтезируется как интегральный трансмембранный белок. Структурные особенности первичного продукта трансляции KL являются поэтому очень схожими со структурными особенностями CSF-1. CSF-1 синтезируется как трансмембранная молекула, которая процессируется путем протеолитического расщепления с образованием растворимого секретируемого продукта [91, 44]. Отсюда можно предположить, что подобно CSF-1 KL также синтезируется как белок клеточной поверхности, который может быть процессирован с образованием растворимого белка. Белок, выделенный из среды, кондиционированной клетками Balb/c 3T3, может быть затем получен в растворимой форме KL путем высвобождения из мембранной формы посредством протеолитического высвобождения. Хотя пространсляционный процессинг и экспрессия KL-белка пока еще не были точно охарактеризованы, однако KL-форма, связанная с клеточной поверхностью, может опосредовать межклеточные взаимодействия, как это свойственно для предполагаемых пролиферативной и транспортной функций с-kit/W-рецепторной системы. В соответствии с высказанным утверждением относительно мембраны - ассоциированной формы KL было показано, что гибридный белок, полученный путем слияния растворимого с-kit рецептора и щелочной фосфатазы, связывается с клеточной поверхностью Balb/c 3T3-клеток, но не с вибробластами, происходящими от SIISI-мышей.
Наиболее значительным аспектом идентификации лиганда с-kit-рецептора является тот факт, что благодаря такой идентификации облегчается исследование плейотропных функций с-kit. Был также сделан вывод, что в гемопоэтической системе с-kit-мутации воздействуют на линию дифференцировки эритроидных и тучных клеток, и, кроме того, они оказывают влияние на компартментацию стволовых клеток, с-kit/KL играют важную роль в созревании эритроидных клеток, о чем свидетельствует анемия, наблюдаемая у мутантных животных. Кроме того, было зарегистрировано снижение числа CFU-E в эмбриональной печени от W/W- и SIISId-животных, но число BFU-E оставалось при этом нормальным, в результате чего можно сделать вывод, что с-kit/KL способствует продвижению дифференцировки от стадии BFU-E до стадии CFU-E [90, 35]. В соответствии с этим было показано, что KL стимулирует пролиферацию и дифференцировку BFU-E (на 7 день), а также способствует образованию в костном мозге ранних эритроидных мультипотентных предшественников, которые появляются в культуре в более позднее время (на 14-20) [37].
Исходя из того факта, что у W- и SI-мутантных мышей отсутствуют тучные клетки, был сделан вывод, что с-kit/KL играют главную роль в пролиферации, дифференцировке и/или выживании тучных клеток in vivo [72, 73]. Однако на какой именно стадии дифференцировки тучных клеток требуется участие с-kit/KL, пока еще точно не известно. In vitro-образование ВММС из костного мозга или эмбриональной печени не требует присутствия с-kit/KL, поскольку ВММС могут быть с той же эффективностью продуцированы как от нормальных, так и от W-мутантных мышей [60]. Авторами настоящей заявки была продемонстрирована пролиферация ВММС и тучных клеток, подобных тучным клеткам соединительной ткани, в ответ на KL, что указывало на определенную роль с-kit/KL в различных стадиях пролиферации и дифференцировке тучных клеток независимо от присутствия или отсутствия IL3 и IL-4, которые считаются медиаторами аллергических и воспалительных реакций [66]. В компартментации стволовых клеток восприимчивыми популяциями, очевидно, являются колониеобразующие единицы селезенки (CFU-S), которые продуцируют миелоидные колонии в селезенке мышей, облученных летальной дозой, а также клетки с долгоживущей репопуляцией, подходящей для дифференцировки различных клеток [80, 81, 82, 83]. При этом было бы интересно установить, влияет ли KL на способность к самообновлению или дифференцировке гемопоэтических популяций стволовых клеток in vitro, возможно в сочетании с другими гемопоэтическими факторами роста. Такие сведения помогли бы точно определить стадию компартментации стволовых клеток, в которой необходимо участие с-kit/KL. Другой возможной функцией с-kit является, очевидно, способность облегчать переход клеток из фазы покоя в циклирующую фазу [31] . Повышенная чувствительность к облучению у SIISId- и W/Wv-мышей может свидетельствовать о такой функции в динамике стволовых клеток; и, кроме того, известно, что родственный PDCF-рецептор стимулирует вхождение в клеточный цикл.
В гаметогенезе W- и SI-мутации воздействуют на пролиферацию и выживание зародышевых клеток и их миграцию из спланхплевры желточного мешка в генитальные гребни в процессе раннего развития. При постнатальном гаметогенезе с-kit-экспрессию наблюдали в незрелых и зрелых ооцитах и в сперматогониях А и В, а также в интерстициальной ткани [39]. При меланогенезе с-kit/KL, очевидно, играет определенную роль в пролиферации и миграции меланобластов из нервного гребешка в периферические области в процессе раннего развития, а также в зрелых меланоцитах. Использование вышеуказанных сведений относительно KL может значительно облегчить in vitro-исследования функции с-kit-рецептора в упомянутых клеточных системах.
Областью, в которой функции с-kit-экспрессирующих клеток нарушены, а в частности в SI-мутантных мышах, является область, где продуцируется с-kit-лиганд. Вследствие чужеродной природы мутации точное определение типов клеток, продуцирующих KL in vivo, пока не сделано. Однако in vitro-системы, которые продуцируют генетический дефект W- и SI- мутаций, проливают некоторый свет на этот вопрос. В долгоживущих системах культур костного мозга, прилипающие SIISId-клетки являются дефектными, тогда как неприлипающие гемопоэтические клетки не являются дефектными; а в системах совместных культур тучных клеток и фибробластов, SIISId - фибробласты являются дефектными, тогда, как тучные клетки не являются дефектными [12, 16]. В результате исследования in vitro этих двух систем было высказано предположение, что гемопоэтические стромальные клетки, а также эмбриональные фибробласты и фибробласты соединительной ткани продуцируют KL. Клеточная линия Balb/с 3Т3, которая имеет эмбриональное происхождение, экспрессируют значительные уровни KL, которые были использованы в качестве источника для его очистки. Сведения, полученные о типах KL-экспрессирующих клеток, могут помочь в оценке функции с-kit в пищеварительном тракте, в нервной системе, в плаценте и в некоторых черепно-лицевых областях, т. е. в областях, где была документально зарегистрирована с-kit-экспрессия [35, 39]. При этом известно, что ни SI-, ни W-фенотипы не ассоциируются с этими клеточными системами.
Для установления тесной связи между KL-геном, SI-локусом и локусом трансгенной инсерции Tg. ЕВ на мышиной хромосоме 10 использовали межвидовое обратное скрещивание. Этот метод был использован ранее для картирования Tg. ЕВ-локуса вблизи SI. Обнаружение этого факта, что KL-кодирующие последовательности являются делегированными в исходном 1-аллеле, лишний раз подтверждает идентичность SI-локуса с KL-геном. Размер делеций в SI-аллеле в настоящее время пока не установлен. При этом было бы важно установить, оказывает ли это влияние на соседние гены.
Отсутствие KL-кодирующих последовательностей в SI-аллеле свидетельствует о том, что этот аллель представляет собой нуль-мутацию KL. Большинство гомозиготных по SI-аллелю мышей погибают уже в эмбриональном периоде от макроцитарной анемии, а у редких выживших особей отсутствует пигментация шкурки и отсутствуют зародышевые клетки [3]. Этот фенотип почти аналогичен фенотипу сильной мутации с потерей функции с-kit/W, что свидетельствует о лиганд-рецепторном взаимодействии KL и с-kit. Хотя между SIISI- и W/W-гомозиготами существуют различия, например, в развитии зародышевых клеток, однако SI может обладать более выраженным действием, и в гемопоэзе SI может вызывать более тяжелую анемию; но при этом неизвестно, являются ли указанные различия результатом разных генетических фонов штаммов, либо они являются, возможно, последствием влияния SI-делеции на соседние гены [5].
Первоначальная W-мутацию является примером с-kit-нуль-мутации (36). (Wl+)-мыши, гетерозиготные по нормальному аллелю, имеет пятна на брюшине, но не имеют размытой окраски, и нормальный гемопоэз и гаметогенез. Слабый фенотип гетерозиготных W1+-мышей представляет собой противоположность фенотипу гетерозиготных SII+-мышей, которые имеют умеренную макроцитарную анепию, размытую окраску шкурки (помимо брюшинного пятна) и уменьшенные в размере гонады. Таким образом, 50%-ная доза гена KL является предельной, но не достаточной для нормальной функции с-kit-рецептора, хотя в большинстве случаев, 50% доза с-kit-рецептора не является, по-видимому, предельной.
Система с-kit-рецепторов играет определенную роль в популяциях незрелых клето-предшественников, а также в более зрелых клетках при гемопоэзе, гаметогенезе и меланогенезе. Сильные SI- или W-мутации могут блокировать процесс дифференцировки этих клеток, а поэтому роль с-kit-рецептора в популяциях более зрелых клеток остается невыясненной. SI- и W-мутации, в которых с-kit/KL-функция является лишь частично нарушенной, часто обнаруживают свое действие в более зрелых популяциях клеток. Известно множество слабых WI-аллелей. Их фенотипы, например в гаметогенезе и меланогенезе, могут иметь большое значение в выявлении плейотропных функций с-kit-рецепторной системы.
Эксперимент 3. KL-1 и KL-2
Экспериментальные материалы
Мыши и тканевые культуры
Мышиw BB6+/+, C57B1/6J и 129/Sv-SId/+ были получены из лаборатории Джексона (Jackson Laboratory, Bar
Harbon, ME) [52], 129/Sv-SId/+ самцов и самок скрещивали и полученные затем 14-дневные эмбрионы использовали для продуцирования эмбрионных фибробластов по методу Todaro и Green [54]. Тучные
клетки, полученные от костного мозга взрослой +/+ - мыши, культивировали в среде RPMI-1640, дополненной 10% плодной телячьей сывороткой (FCS); средой, кондиционированной ЕР1-3 В-клетками; заменимыми
аминокислотами: пируватом натрия и 2-меркаптоэтанолом (полная RPMI (С) [36]. Клетки Balb/3Т3 [1] культивировали в минимальной поддерживающей среде (MEM), модифицированной по способу Дульбекко (DME) и
дополненной 10% телячьей сывороткой (CS), пенициллином и стрептомицином, COS-1 клетки [18] получали от Dr. Jerrard Huewitz (SKI) и культивировали в DME, дополненной 10% плодной бычьей сывороткой,
глутамином, пенициллином и стрептомицином.
Продуцирование антител против KL
Мышиные KL выделяли из среды, кондиционированной клетками Вalb 3T3, используя анализ на
пролиферацию тучных клеток, как описано в литературе [37]. Для получения антител против KL одного кролика иммунизировали путем подкожного введения 1 мкг KL в полном адъюванте Фрейнда. Через три недели
кролику чрескожно вводили бустер-инъекцию 1 мкг в неполном адъюванте Фрейнда. Сыворотку собирали через неделю, а затем раз в две недели. Используемый в этих целях125I-меченный KL
иодинировали хлораминовым методом Stanley α Gilbetr, модифицированным, как описано выше [38].
Скрининг кДНК-библиотеки
Ро1у(А)РНК получают из полной РНК фибробластов
из Balb/c 3Т3-клеток с помощью хроматографии на олиго(dT) целлюлозе. Затем подготавливали изготовленную обычным способом плазмидную кДНК (Invitrogen Inc). В основном двухцепочечную кДНК синтезировали
путем олиго dT-праймирования и рандомизированного праймирования. Непалиндромные BstXI-линкеры сшивали с затупленной по концам кДНК и после переваривания BstXI ферментом кДНК субклонировали в
экспрессирующую плазмиду рс DNA1 (Invitrigen). Реакционную смесь для лигирования затем использовали для трансформации bС1061/Р3 путем электропорации, в результате чего генерировали плазмидную
библиотеку. Первоначальный размер библиотеки составлял приблизительно 107 независимых колоний. Для скрининга этой плазмидной библиотеки использовали меченный по концу олигонуклеотидный зонд,
описанный ранее [38]. Гидридизацию проводили в 6•SSC при 63oС, а конечную промывку фильтров осуществляли в 2•SSC и 0,2% ДСН при 63oС. Вставки рекомбинантных
плазмид выделяли путем переваривания HindIII- и Хва1-ферментами, а затем субклонировали в фаговую плазмиду М13mр18 для последующего анализа.
РСR-амплификация (RТ-РСR) и определение
последовательности
Из тканей и клеточных линий получали полную РНК методом центрифугирования в изоцианате гуанидиния /CSCI (Chirgwin) [10]. RT-PCR- амплификацию осуществляли в основном, как
описано ранее [38]. При этом использовали следующие праймеры:
Праймер 1: 5'-CCCCAGCTTCGGTGCCTTTCCTTATG-3' (нукл. 94-107);
Праймер 2: 5'-AGTATCTTAGAATTTCACCTCGAAATTCTC-3'
(нукл.907-929);
Праймер 3: 5'-CATTTATCTAGAAAACATGAACTGTTACCAGCC-3' (нукл. 963-978)
Праймер 4: 5'-ACCCTCGAGGGTGAAATCTAAAYCTACTTG-3' (нукл. 1317-1333)
Для синтеза кДНК 10 мкг
полной РНК, полученной из клеточных линий или тканей, в 50 мкл 0,05 мМ Трис-HCl (рН 8,3), 0,75 KСl, 3мМ MgCl2, 10 мМ ДТТ, 200 мкМ dNTP и 25 ед. РНКазина (BPL) инкубировали с 50 ПМ
антисмыслового праймера и 400 ед. обратной транскриптазы вируса мышиного лейкоза Молони (BE) в течение 1 часа при 37oС. кДНК осаждали путем добавления 1/10 объема 3 М NaOH (рН 7,0) и 2,5
объема абсолютного этанола и ресуспендировали в 50 мл ddH2O. PCR осуществляли в 30 циклов в 100 мкл 10 мМ Трис-НСl (рН 8,3), 50 мМ KCl, 1,5 мМ MgCl2, 0,01% (мас./об.) желатина,
200 мкм dNTP, 500 пМ обоих смыслового и антисмыслового праймеров, и 2,5 ед. Таополимеразы (Perkin-Elmer-Cetus) и Hind III-сайты и Xbal-сайты находились внутри смыслового и антисмыслового праймеров
соответственно. Амплифицированные ДНК-фрагменты очищали путем электрофореза на агарозном геле, переваривали соответствующими рестриктирующими ферментами и субклонирования в М13 mp18 и М13mр19 для
последующего анализа последовательностей [49]. PCR-продукты KL-1, KL-2, KL-S и KL-SId переваривали Hind III и Abal-ферментами и субклонировали в экспрессирующие плазмиды pCDM8 или pcDNAI
(Invitrogen). Минипрепарат плазмидной ДНК получали методом щелочного лизиса [48] с последующей экстракцией фенолом-хлороформом, и с последующим осаждением этанолом. Максипрепарат плазмидной ДНК,
используемой для трансфекции COS-1-клеток, получали с помощью "Oiagen" - хроматографии на колонках.
Анализ на защиту от РНКазы
Рибозонд для анализа защиты от РНКазы получали
путем линеаризации KL-1-содержащей плазмиды рс DNAI с помощью Spel. Затем синтезировали антисмысловой рибозонд с использованием SP6-полимеразы в соответствии с инструкцией к набору Promega Gemini,
Рибозонд, меченный для получения высокоспецифической активности, затем гибридизировали с 10 мкг или 20 мкг полной РНК в присутствии 80% формамида в течение ночи при 45oС. Гибридизационную
смесь переваривали РНКазой и TI (Boehinger-Mannheium) и обрабатывали протеиназой К [48], после чего защищенные меченые РНК-фрагменты анализировали с использованием 4% мочевины /полиакриламидного геля.
Авторадиограммы анализировали путем денситометрии и части пленок восстанавливали на анализаторе Phospholmage (Molecular Dynamics для лучшего разрешения.
Кратковременная экспрессия
"KL"-кДНК в COS-1-клетках
Для кратковременной экспрессии KL-кДНК COS-1-клетки трансфицировали DEAE-декстрановым методом, описанным ранее [20], с небольшими модификациями. Вкратце,
COS-1-клетки культивировали до субконфлюэентного состояния за один день до использования, трипсинизировали и снова засевали на чашки Петри при плотности 6•106 клеток на чашку. Через
24 часа клетки достигали 70% сплошности, после чего их трансфицировали 5 микрограммами плазмидной ДНК в присутствии 10% DEAE -декстрана (Sigma) в течение 6-12 часов. Среду, содержащую плазмидную ДНК,
удаляли, а клетки подвергали химическому шоку с помощью 10% ДМСО/PBS++ строго в течение 1 минуты. Остаток ДМСО удаляли путем промывания (2х) клеток фосфатно-буферным физиологическим
раствором. Транс фицированные клетки COS-1 культивировали в DME, дополненной 10% плодной телячьей сывороткой, 100 мг/мл, 100 мг/мл L-глутамина и антибиотиками.
Пульс-чейз- и
иммунопреципитационный анализ "КЕ"-белков
Через 72 часа после трансфекции трансфицированные СОS-1-клетки использовали для пульс-чейз-экспериментов. Эти клетки в течение 30 минут инкубировали
с DME, содержащей диализированную 10% плодную телячью сыворотку и не содержащей метионин; а затем метили35S-метионином (NEN) при 0,5 мкМ/мл. В конце процедуры мечения среду для мечения
заменяли средой, содержащей избыточное количество метионина. Для оценки влияния форбол-12-миристат-13-ацетата (РМА) и А23187 на протеолитическое расщепление KL после замены среды для мечения обычной
средой (в конце процедуры мечения) к трансфицированным клеткам добавляли 1 мкМ РМА или 1 мкМ А 23187. Через определенные промежутки времени клетки и супернатанты собирали отдельно для
иммунопреципитационного анализа. Клеточные лизаты получали, как описано ранее [35] в среде, содержащей: 1% Тритон-100, 20 мМ Трис (рН 7,5), 150 мМ NaCl, 20 мМ EDTA, 10% глицерин, 1 мМ ингибиторов
протеазы (фенилметилсульфонилхлорид), и 20 мкг/мл лейпетин. Для иммунопреципитационного анализа KL-белковых продуктов использовали кроличью антисыворотку против мышиного KL. Эту сыворотку против KL
конъюгировали с белком А сефарозой (Pharmacia) и промывали три раза Промывкой А (0,1% Тритон -Х-100, 20 мМ трис (рН 7,5), 150 мМ NaCl, 10% глицерин). Конъюгат "анти-КL-сыворотка-белок А-сефароза"
инкубировали с супернатантом и клеточным лизатом в течение по крайней мере 2 часов при 4oС. Затем иммунопреципитаты один раз промывали в Промывке В (50 мМ Трис, 500 мМ NaCl, 5 мМ Е ТА, 0,2
Тритон-Х-100), три раза в Промывке С (50 мМ Трис, 500 мМ NaCl, 0,1% Тритон Х-100, 0,1% ДСH, 5 мМ EDTA), и один раз в Промывке 1 (10 мМ Трис, 0,1% Тритон Х-100). Для гель-анализа иммунопреципитаты
солюбилизировали в ДСП-буфере для образца путем кипячения в течение 5 минут и анализировали с помощью ДСП-электрофореза в ПААГ (12%), после чего проводили авторадиографию.
Оценка биологической активности растворимого KL.
Тучные клетки, полученные от костного мозга взрослой WBB6 +/+ мыши, культивировали в среде RPM1-1640, дополненной 10% плодной телячьей сывороткой, кондиционированной средой от WEH1-3В-клеток, заменимыми аминокислотами, пирусатом натрия, и 2-меркаптоэтанолом (RPM1-полная среда), как описано ранее [37]. Неприлипающие клетки собирали путем центрифугирования, еженедельно подпитывали и поддерживали при плотности <7•105 кл/мл. Содержание тучных клеток в культуре определяли каждую неделю путем окрашивания препаратом цитопсина, содержащими 1% толуидинового синего в метаноле. Через 4 недели культуры, обычно содержащие 95% тучных клеток, использовали для анализа на пролиферацию. Супернатанты от трансфицированных COS-1-клеток собирали через 48-72 часа после трансфекции. Биологическую активность растворимого KL в супернатантах оценивали путем культивирования ВММС с различными разведениями COS-1 клеточных супернатантов при отсутствии IL-3. ВММС три раза промывали полной ССМ1-средой и культивировали с 0,1% IL-3. На следующий день клетки собирали и суспендировали в полной RPM1 (не содержащей IL-3)-cpeдe и в 96-луночную планшету высевали 104 ВММС в 100 мкл/лунку. Затем к каждой лунке добавляли равные объемы разведенного супернатанта и культуры инкубировали в течение 24 часов при 37oС, после чего добавляли [3Н]-тимидина в каждую лунку (2,5 мкКи), и продолжали инкубировать еще 6 часов. После этого клетки собирали на стекловолоконные фильтры (GF/C, Whatman) и с помощью сцинтилляционного счетчика определяли включение тимидина. Анализ проводили с тройными дубликатами и результаты выражали как средние значения. Стандартные отклонения обычно не превышали 10% от средних значений.
Результаты экспериментов
Альтернативно сплайсированная KL-мРНК кодирует усеченную трансмембранную формулу KL-белка.
Ниже описан кДНК-клон, который был выделен из библиотеки 3Т3-мышиных фибробластов и содержал большую часть KL-клодирующих последовательностей (267 аминокислот). При попытке получить полные кДНК-последовательности, соответствующие, 65 ко-KL-мДНК, конструировали библиотеку плазмидных кДНК с использованием polyA+РНК от Balb/с 3Т3-фибробластов. В этих целях использовали плазмидный вектор рс DNA1, представляющий собой экспрессирующий вектор млекопитающего, в котором кДНК-вставки экспрессируются под контролем CMV-промотора и который содержит сайт инициации репликации SV40 для кратковременной экспрессии в COS-клетках (Invitrogen). Библиотеку скринировали с использованием олигонуклеотидных зондов, соответствующих концевой и С-концевой KL-кодирующим последовательностям, как описано в данном описании. Был получен кДНК-клон, который содержит полные KL-кодирующие последовательности, а также 5'- и 3'-нетранслируемые последовательности. Нуклеотидная последовательность этого клона (фиг.17) соответствует ранее опубликованным последовательностям за исключением изменения в одном основании в положении 644, которое привело к замещению серина 206 на аланин [2, 38].
Анализ мышиных KL-кДНК-клонов, проведенный Андерсоном и коллегами и обнаруживший сплайсированную кДНК с делецией внутри рамки считывания из 48 нуклеотидов, позволяет предположить наличие альтернативно сплайсированных KL-транскриптов в KL-экспрессирующих клетках [2]. Для идентификации альтернативно сплайсированных KL-транскриптов в РНК от тканей и клеточных линий использовали RT-PCR. В этой реакции использовали праймеры, соответствующие 5' и 3'-нетранслируемым областям KL-кДНК и модифицированные так, чтобы они содержали уникальные рестрикционные сайты. Анализ продуктов RT-PCR-реакции, проведенный с помощью электрофореза и показанный на фиг. 18, выявил один фрагмент (приблизительно 870 п.о.) в образцах от Вalb 3Т3-клеток и головного мозга, а в образцах от селезенки, яичек и легких обнаруживалось два фрагмента размером приблизительно 870 и 750 п.о. Для последующего анализа два продукта PCR-реакции субклонировали в экспрессирующий вектор млекопитающего pCDM8. Анализ первой ДНК-последовательности показал, что более крупный PCR-продукт соответствует известной KL-кДНК-последовательности, обозначенной затем KL-1. Однако в более мелком PCR-продукте отсутствовал сегмент из 84 нуклеотидов KL-кодирующих последовательностей, в результате чего образовалась делеция внутри рамки считывания. Концевые точки делеции соответствовали границам экзона в крысином и человеческом KL-генах, и по всей вероятности эти границы сохраняются также и в мышином гене [27]. Поэтому более мелкий PCR-продукт, очевидно, соответствует альтернативно сплайсированному KL-PHK-транскрипту, обозначенному KL-2. Отсутствующий экзон в КL-2 предшествует трансмембранному домену: он содержит один из четырех сайтов N-гликозилирования и является С-концом (А1а-166 и А1а-167) растворимой формы KL [58]. Поэтому было предположено, что KL-2 кодирует усеченный вариант KL-1, который, по всей вероятности, синтезируется как трансмембранный протеин (фиг. 17 и 19).
KL-2 экспрессируется по тканеспецифическому типу экспрессии, альтернативно сплайсированный транскрипт KL-2 был обнаружен в РНК селезенки, яичек и легких, но не был обнаружен в РНК головного мозга и фибробластов, что свидетельствует о том, что экспрессия KL-2 может регулироваться тканеспецифическим образом. Для более детального исследования данного факта определяли стабильные уровни KL-1 и KL-2-РНК-транскриптов в РНК из тканей широкого диапазона с использованием метода защиты от РНКазы.
Плазмиду рс DNA1, содержащую Kl-1-кДНК, линеаризовали с помощью Spel-фермента в целях получения РНК-гибридизационного зонда из 625 нуклеотидов с использованием SP6-PHK-полимеразы. Полученный зонд гибридизировали с 20 мкг полной РНК от Вalb/с 3Т3-фибробластов головного мозга, селезенки и яичек мыши в возрасте 40 дней, а также головного мозга, костного мозга, мозжечка, сердца, легких, печени, селезенки и почек взрослой мыши и плаценты (14 дней р. с. ). Затем образцы переваривали РНКазой и реакционные продукты анализировали с помощью электрофореза в 4% мочевине/полиакриламидном геле. В этих экспериментах KL-1-мРНК-защищенным был один фрагмент из 575 оснований, а KL-2-мРНК-защищенными фрагментами были фрагменты, состоящие из 449 и 42 нуклеотидов. Как показано на фиг.20, в Вalb/с3Т3-фибробластах, KL-1 был преобрадающим транскриптом, тогда как KL-2 был едва обнаружим. В головном мозге и тимусе KL-1 был преобладающим транскриптом, а в селезенке, яичках, плаценте, сердце и мозжечке KL-1 и KL-2-транскрипты наблюдались в различных соотношениях. Отношения KL-1 и KL-2 в тканях, определенные путем денситометрии, представляли собой следующие значения: в головном мозге - 26,1; в костном мозге - 3:1, в селезенке 1,5:1 и в яичках (40 дней р.п.) 1:2,6. Полученные результаты дают основание предположить, что экспрессия KL и KL-2 в тканях протекает под тканеспецифическим контролем.
Характеристики биосинтеза KL-белковых продуктов в COS-клетках.
Хотя KL был очищен из кондиционированной среды Вalb/с3Т3 клеток и представлял собой растворимый белок, однако выведенные аминокислотные последовательности для KL-1 и KL-2 позволяют предположить, что эти белки являются мембрано-ассоциированными. Для установления взаимосвязи KL-S с KL-1 и KL-2-белковыми продуктами определяли их биосинтетические характеристики, KL-1 и KL-2-к ДНК, полученные с помощью RT-PCR, субклонировали в Hind III- и Xoal-сайты экспрессирующих векторов рс DNA1 или ос DM8 для кратковременной экспрессии с COS-клетках. Для облегчения кратковременной экспрессии KL-1 и KL-2-белковых продуктов COS-1-клетки трансфицировали KL-1 и KL-2-плазмидами с использованием DAEA-декстран/ДМСО-схемы, описано в настоящей заявке. В результате было обнаружено, что максимальный синтез KL-белка с COS-1-клетками наблюдается через 72-96 часов после трансфекции. Для определения биосинтетических характеристик KL-1 и KL-2-белков проводили пульс-чейз-эксперименты. Через 72 часа после трансфекции культуры метили35S-метионином (0,5 мКи/мл) в течение 30 минут, а затем среду для мечения заменяли нормальной средой. Затем клеточный лизат и супернатанты собирали в установленное время и обрабатывали сывороткой против KL (для проведения иммунопреципитации), полученной путем иммунизации кроликов очищенным мышиным KL, после чего осуществляли анализ с помощью ДСН-электрофореза в ПААГ (12%). В конце периода мечения в клетках, трансфицированных KL-1-плазмидой, были обнаружены KL-специфические белковые продукты размером 24, 35, 40 и 45 кД (фиг.21). Эти белки, по-видимому, представляют собой первичный продукт трансляции и процессированные KI-белковые продукты, которые были постепенно модифицированы путем гликозилирования. Все более продолжительные чейз-периоды выявили 45 кД-форму в виде зрелого KL-белкового продукта, что дает основание предположить, что этот белок представляет собой мембранную форму KL. Через 30 минут в супернатантах наблюдался 28 кД-белковый продукт, количество которого возрастало со временем. По истечении более продолжительного времени были обнаружены два минорных продукта размером 38 и 24 кД. Эти результаты подтверждают высказанное ранее мнение, что синтезированный сначала KL-1 является мембрано-ассоциированным белком, который затем высвобождается в среду, вероятно, благодаря протеолитическому расщеплению.
Пульс-чейз-эксперимент с использованием COS-1-клеток, трансфицированных KL-2-плазмидой, проиллюстрирован на фиг. 20. KL-2-белковые продукты были эффективно процессированы с образованием продуктов в 32 кД и 28 кД, которые, очевидно, являются мембранной формой KL-2. Указанная клеточно-мембранная форма KL-2 является более стабильной, чем соответствующий KL-1-белок, время полужизни которого составляет более 5 часов. Через 3 часа в клеточном супернатанте наблюдалась растворимая форма KL-2 приблизительно в 20 кД. Появление и аккумуляция растворимой формы KL-2 в клеточном супернатанте происходит в более позднее время, чем KL-1, что свидетельствует о менее эффективном процессинге KL-2-белкового продукта. В KL-2 в результате альтернативного сплайсинга последовательности, имеющие известный С-конец растворимой формы KL, не содержат предполагаемого сайта рестрикции KL-1. Поэтому, очевидно, протеолитическое расщепление KL-2 происходит благодаря второму сайту расщепления, который присутствует в КI-1 и KI-2 на N-концевой или С-концевой стороне последовательностей, кодируемых делегированным экзоном. 38 кД-KL-1-белковый продукт, наблюдаемый в супернатанте, может представлять собой продукт расщепления, обусловленного рестрикционным сайтом, расположенным в виде трансмембранного домена (фиг. 19).
Протеолитический процессинг KL-1 и KL-2 в COS-клетках модулируется РМА и кальций-ионоформ А23187.
Известно, что РМА, индуцирующий протеин-киназу С, стимулирует протеолитическое расщепление мембранных белков, в результате которого продуцируются растворимые формы внеклеточного домена указанных белков, как показано на примерах с CSF-I-рецептором, c-kit-рецептором и TCF-α [13, 4]. Определяли воздействие РМА-обработки на биосинтетические характеристики KL-1 и KL-2 в COS-1-клетках. Пульс-чейз-эксперименты, проиллюстрированные на фиг. 22В, показали, что РМА индуцирует быстрое расщепление как KL-1, так и KL-2 с одинаковой кинетикой и что высвобожденные KL-1 и KL-2- белковые продукты практически неотличимы от тех продуктов, которые были получены в отсутствие индуктора. Эти результаты дают основание предположить, что протеолитическое расщепление как KL-1, так и KL-2 активируется РМА аналогичным образом. С другой стороны/ этот факт может означать, что РМА активирует две различные протеазы, специфичные для KL-1 и KL-2 соответственно; либо альтернативно, РМА активирует лишь одну протеазу, но на очень высоком уровне, которая расщепляет оба KL-1 и KL-2, но с различной скоростью. Манорный сайт рестрикции в KL-1 содержит, как предполагается исходя из известной С-концевой аминокислотной последовательности крысиного KL-аминокислоты PPVA ASSL (186-193) и может требовать фермент, подобный эластазе [22, 34]. На основе аргументов, высказанных ранее, последовательность сайта распознавания в KL находится, предположительно, с С-конца от делетированного экзона, а поэтому может содержать аминокислоты РКААКА (202-207), требующие фермента, который по свой специфичности аналогичен KL-1-протеазе, или альтернативно, который может быть трипсин-подобной протеазой. Кроме того, определяли воздействие кальций-ионофора А23187 на расщепление KL. Тот факт, что с использованием этого реагента наблюдалось ускорение расщепления KL-1 и KL-2, свидетельствует о том, что протеолитическое расщепление KL-1 и KL-2 может быть опосредовано механизмом, не требующим активации протеин-киназы С (фиг. 22С).
Биологическая активность высвобожденных KL-белковых продуктов.
Для определения биологической активности высвобожденных KL-белковых продуктов супернатанты трансфицированных СОS-1-клеток собирали через 72 часа после трансфекции и анализировали на активность в тесте на пролиферацию тучных клеток. Тучные клетки, происходящие от костного мозга (ВММС), инкубировали в течение 24 часов с различными разведениями собранных супернатантов, а анализировали на включение3Р-тимидина, как описано ранее (фиг. 23). Супернатанты, продуцированные от KL-1-трансфектантов, обнаруживали в 3-5 раз большую активность, чем активность от KL-2-трансфектантов, что соответствует вышеуказанным различиям в высвобождении растворимого KL из KL-1 и KL-2. При этом важно отметить, что белки, высвобождающиеся от KL-1 и KL-2-трансфектантов, обнаруживали одинаковую специфическую активность в анализе на пролиферацию тучных клеток.
Steel dickie-аллель, полученный в результате делеции С-концевых KL-кодирующих последовательностей, включающих трансмембранный и цитоплазматический домены.
Мыши, гомозиготные по SId-аллелю, являются жизнеспособными в противоположность мышам по SI-аллелю, но при этом у них отсутствует окраска шерстного покрова, они являются стерильными и имеют макроцитарную анемию. Поэтому у этих мышей c-kit-рецепторная система, очевидно, обладает некоторой остаточной активностью. Поскольку SId мутация влияет на три линии дифференцировки клеток аналогичным образом, то можно предположить, что эта мутация воздействует на генетические свойства KL. Поэтому для исследования SId на молекулярном уровне KL-кодирующие последовательности характеристики проводят сначала в этом аллеле, используя для этого технологию PCR-клонирования. С помощью стандартных процедур получали первичные фибробласты от SId/+ - эмбрионов. Затем с использованием РНК, полученной от SId/+ эмбриональных фибробластов и различных праймеров, амплифицировали KL-кодирующую область SId, учитывая при этом возможность того, что SId может быть делеционной мутацией. Путем RT-PCR-амплификации с использованием полной SId/+ - РНК и праймеров 1 и 2, продуцировали ДНК-фрагмент, который мигрировал с подвижностью, идентичный подвижности продукта, полученного от РНК фибробластов +/+; и после определения последовательности этого фрагмента оказалось, что он не отличается от известной KI-последовательности. Поэтому был сделан вывод, что этот фрагмент представляет собой нормальный аллель. При использовании праймеров 1 и 3 или 1 и 4 был амплифицирован более быстро мигрирующий ДНК-фрагмент (фиг. 18). Оба фрагмента ДНК (850 и 1070 п.о.), полученные с праймерами 1+3 и 1+4, субклонировали в рС М8, а затем секвенировали. В KL-SId-кДНК, был делетирован сегмент из нуклеотидов 660-902 последовательности дикого типа, а вместо этого была обнаружена вставка в виде последовательности из 67 п.о. (фиг. 17). В результате указанных мутаций в направлении к 5' от точки делеции были введены три аминокислоты кодона терминации. Предсказанная исходя из KL-SId -кДНК аминокислотная последовательность состояла из аминокислот 1-205 известной KL-последовательности + трех дополнительных аминокислот (фиг. 17 и 19). KL-SId-aминoкиcлoтнaя последовательность содержит все 4 сайта N-гликозилирования и все последовательности, содержащиеся в растворимой форме KL, но при этом трансмембранный и цитоплазматический домены KL-1 дикого типа являются делетированными. Отсюда можно сделать вывод, что KL-SId-белковый продукт является секретируемым белком, обладающим биологической активностью.
Биосинтетические характеристики и биологическая активность KL-SId- и KL-S-белковых продуктов.
Для сравнения с KL-SId-белковым продуктом был сконструирован усеченный вариант KJL-1,
обозначенный KL-S, в который был введен терминирующий кодон в положение 191, являющееся предположительно С-концом растворимого KL-белка, COS-1-клетки трансфицировали KL-SId- и
KL-содержащими плазмидами, и проводили пульс-чейз-эксперименты в целях определения биосинтетических характеристик этих двух белковых продуктов. KL-SId -белковый продукт быстро
процессировался, вероятно, благодаря гликозилированию и выделялся в среду, где уже через 30 минут чейз-периода обнаруживались мажорные 30 кД-виды и со временем их количество возрастало (фиг. 24).
Биосинтетические характеристики KL-S-белковых продуктов были очень
схожи с характеристиками KL/SId (фиг. 24). И в данном случае с временем количество секретируемого в среду
материала возрастало в отличие от клеточно-ассоциированного KL-S-белкового продукта, количество которого убывало со временем.
Для оценки биологической активности секретируемых KL-SId-и KL-S-белковых продуктов осуществляли анализ на пролиферацию тучных клеток. Среду от трансфицированных COS-1-клеток собирали через 72 часа после трансфекции, а затем различные разведения были использованы для анализа пролиферативной активности в отношении ВММС в отсутствие IL-3. Оба образца обнаруживали значительную биологическую активность, которая до некоторой степени превышала активность KL-I (фиг. 23). Полученные результаты убедительно продемонстрировали, что KL-SId-белковые продукты являются секретируемыми и биологически активными белками.
Обсуждение экспериментов.
Демонстрация аллелизма между c-kit и мышиным w-локусом проливает свет на плеотропные функции c-kit-рецептора при развитии организма животного и при функционировании взрослого организма, а также облегчает идентификацию лиганда для этого рецептора (KL). Кроме того, недавно обнаруженный аллелизм между KL и мышиным Steel-локусом дает молекулярное обоснование взаимосвязи между w- и SI-мутациями, о которой ранее предполагали специалисты по мышиной генетике исходя из схожести и взаимодополняемости фенотипов этих мутаций. Предсказанная трансмембранная структура KL позволяет сделать вывод о том, что обе формы, как мембранная так и растворимая, KL играют важную роль в функционировании c-kit. В настоящей заявке это предположение подтверждается экспериментально.
Во-первых, было показано, что растворимая форма KL продуцируется путем эффективного протеолитического расщепления из трансмембранного предшественника KL-1. Во-вторых, было показано, что альтернативно сплайсированный вариант KL-1, KL-2, в котором главный сайт протеолитического расщепления удален посредством сплайсинга, также продуцирует растворимую биологически активную форму KL, хотя и с несколько меньшей эффективностью. В-третьих, было показано, что процесс расщепления KL-1 и KL-2 в COS-1-клетках может быть модулирован. В четвертых, было проиллюстрировано, что экспрессия KL-1 и KL-2 в клетках является тканеспецифической. Было также показано, что жизнеспособная SId-мутация является результатом делеции, которая включает в себя С-конец KL-кодирующей последовательности, включая трансмембранный домен, генерирующий биологически активную секретируемую форму KL. Кроме того, фенотип мышей, несущих SId-аллель, подтверждает высказанное выше предположение о роли секретируемой и мембранной форм KL в c-kit-функции.
На основании тесной эволюционной взаимосвязи между c-kit и CSF-IR можно предположить, что определенная взаимосвязь между соответствующими факторами роста, KL и CSF-1 существует и в отношении их структуры и топологии. Известно, что альтернативно сплайсированные формы CSF-1-мРРК кодируют белковые продукты, которые отличаются последовательностями N-конца трансмембранного домена, спейсерного сегмента из 298 аминокислот, расположенных между лигандой частью и трансмембранным доменом белка [43]. Кроме того, альтернативно сплайсированные CSF-1-РНК-транскрипты отличаются по своим 3'-нетранслируемым областям [21] . Анализ KL-PHK-транскриптов в нескольких тканях идентифицировал альтернативно сплайсированную KL-РHК, в которой так же, как и в случае CSF-I, был делегирован сплейсер между предполагаемой лигандной частью и трансмебранным доменом. Интересно отметить, что экспрессия этого альтернативно сплайсированного РНК-продукта протекает по тканеспецифическому типу. Недавно проведенный сравнительный анализ лигандых частей KL и CSF-I выявил структурную гомологию между двумя белками исходя из ограниченной аминокислотной гомологии и сравнения соответствующих экзонов и правильности спаривания оснований в "экзон-кодированнй вторичной структуре" [4]. Кроме того, верхнее положение 4 α-спиральных доменов и цистеиновых остатков, которые образуют межмолекулярные дисульфидные связи, подразумевает присутствие родственных третичных структур доменов лигандов KL и CSF-1; а гомология, наблюдаемая в N-концевых сигнальных пептидах, трансмембранных доменах и внутриклеточных доменах этих двух пептидов, может указывать на то, что эти домены выполняют схожие функции в этих двух белках. Полученные результаты подтверждают высказанные ранее предположения о эволюционной связи и структурной гомологии между KL и CSF-I.
Отличительной особенностью KL является его ранее предсказанная тройственная структура как трансмембранного белка. Обе формы KL, KL-1 и KL-2 синтезируются в виде трансмембранных белков, которые процессируются путем протеолитического расщепления с высвобождением растворимой биологически активной формы КL, хотя, как это было установлено, в COS-клеточной системе стадии прессинга в этих двух формах отличаются по своей кинетике. В отличие от KL-1-белка, где протеолитическое расщепление протекает весьма эффективно, KL-2-белок является более стабильным или резистентным к протеолитическому расщеплению. Последовательности, кодированные делегированным экзоном (аминокислоты 174-201), включают в себя С-конец растворимого KL-белка и предполагаемый сайт протеолитического расщепления [27]. Поэтому по всей вероятности, для генерирования растворимого KL-2-белка используется второй или альтернативный сайт протеолитического расщепления, причем в этом расщеплении может участвовать другая протеаза. Индуцирование протеолитического расщепления KL-1 и KL-2 в COS-1-клетках активатором протеин-киназы С (РМА) и кальций-ионофором А23187 дает основание предположить, что в различных типах клеток этот процесс может протекать по различным типам регулирования. Интересно отметить, что растворимый KL-2-белок обладает нормальной биологической активностью, что указывает на то, что последовательности, кодированные делегированным экзоном, не имеют большого значения для этой активности.
С одной стороны, в своих мембрано-ассоциированных вариантах KL-1 и KL-2 могут действовать как медиаторы сигнала при межклеточном взаимодействии; либо, альтернативно, они могут действовать как молекулы для прилипания к клеткам [19, 26]. С другой стороны, растворимые формы KL являются диффундируемыми факторами, которые могут достигать клетки-мишени и ее рецептора на относительно коротких или более длинных расстояниях. Однако растворимые формы KL могут также считаться ассоциированными с внеклеточным матрикосом, либо они могут быть секвенированными в этом внеклеточном матриксе аналогично FCF, LIF или int-1 и, таким образом, функционировать на коротком расстоянии подобно мембрано-ассоциированным формам [8, 33, 42]. В своей клеточно-мембранной форме KL могут быть способными обеспечить или поддерживать высокие концентрации локализованного сигнала для взаимодействия с рецептор-несущими клетками-мишенями. В свою очередь растворимая форма KL может индуцировать сигнал при более низких и изменяемых концентрациях. Очевидно, что c-kit способствует пролиферации клеток, миграции клеток, выживанию клеток и стимулирует постмитотические функции в различных системах клеток. Аналогично CSF-1-рецпеторным системам функция выживания клеток и миграции клеток может требовать более низкие концентрации фактора, чем функция пролиферации клеток [55]. Мембрано-ассоциированная и растворимая форма KL могут служить различными вариантами c-kit-функции. Рецептор CSF-1 и c-kit могут регулироваться по типу обратной связи посредством протеолитического высвобождения соответствующих внеклеточных доменов, опосредственного протеин-киназой С [13]. Функционально значение этого процесса пока неизвестно, однако было высказано предположение, что высвобождаемый внеклеточный домен этих рецепторов может нейтрализовать CSF-1 и KL соответственно в целях модуляции этих сигналов. В некоторых случаях протеолитическое расщепление приводит к негативной модуляции c-kit-функции, а поэтому эти процессы могут рассматриваться как взаимодополняющие или аналогичные. Резюмируя вышесказанное, можно утверждать, что синтез вариантных мембрано-ассоциированных KL-молекул и их протеолитическое расщепление с продуцированием растворимых форм KL имеет важное значение для регулирования или модуляции c-kit-функции в клетках различных типов в процессе развития организма животного или при функционировании организма взрослого животного.
Характеризация SId-мутации на молекулярном уровне представляет уникальную возможность для оценки роли растворимой формы KL в процессе развития и у взрослых животных. SId-аллель кодирует секретируемый вариант KL-белка (но не мембранную его форму) вследствие делеции, которая включает в себя трансмембранный домен и С-конец KL. Поэтому биологические характеристики SId /SId и SI/ SId-мышей должны дать ключ к выявлению роли растворимой и мембранной форм KL. SI/SId-мыши продуцируют лишь SId-белок, поскольку SI-аллель является нуль мутацией KL [11, 38]. Эти мыши являются жизнеспособными, но характеризуются тяжелой макроцитарной анемией, отсутствием тучных клеток в ткани, отсутствием пигментации шерстяного покрова и бесплодностью. В большинстве вариантов этого мутантного фенотипа указанные мыши похожи на w/wv видимые различия. Анемия у SI/SId-мышей является, очевидно, более восприимчивой к гипоксии, чем w/wv-мыши [46,47]. Что касается гаметогенеза, то у w/wv-мышей отсутствует пролиферация первичных зародышевых клеток и их миграция замедлена [32] . У SI/SId-эмбрионов, так же, как и у" w/wv-эмбрионов, отсутствует пролиферация первичных зародышевых клеток, однако оставшиеся клетки сохраняют способность к надлежащей миграции, и, очевидно, они достигают гонадных гребешков в соответствующий период развития [29, 51]. На основании этих экспериментов, можно сделать вывод, что SId-КL-белковый продукт способен к поддержанию клеточной миграции (но не к пролиферации клеток), а затем к образованию мембранной формы KL, а следовательно, он может играть решающую роль в пролиферативном ответе c-kit. Кроме того, SI/SId -фибpoблacты неспособны к пролиферации и поддержанию тучных клеток костного мозга в отсутствие IL-3 в отличие от нормальных эмбриональных фибробластов, которые обладают этим свойством [16] . При условии, если SI/SId-фибробласт действительно синтезируют SId-белковые продукты, то неспособность SI/SId-фибробластов к поддержанию пролиферации тучных клеток, с одной стороны, может означать, что количество растворимого KL-SId-белка, высвобождаемого этими клетками, является недостаточным для стимуляции пролиферации; но с другой стороны, это явление может указывать на критическую роль клеточно-мембранной формы KL в данном процессе.
KL в комбинации с IL-1, IL-3, G-CSF, GM-CSF
В нормальных мышиных культурах костного мозга мы
использовали мышиный KL (рекомбинатный мышиный c-kit-лиганд), и наблюдали лишь очень небольшое число миелоидных колоний, стимулированных одним KL, однако число и размер колоний значительно
увеличивался с использованием комбинаций KL и G-CSF, GM-CSF, и IL-3, но не с M-CSF [103] . В HPP-CFC-анализе с использованием костного мозга, полученного через 24 часа после обработки мыши 5-FU,
наблюдалось увеличение колоний в комбинациях с цитокинами. Комбинации KL с G-CSF, GM-CSF, IL-3, IL-7 или IL-6 являются эффективными, а комбинации из трех или четырех факторов еще более эффективными в
стимулировании HPP-CFC, причем максимально эффективными оказались CSF или IL-3 в сочетании с IL-1, IL-6 и KL. На фиг. 25 показаны HPP-CFC, стимулированные комбинациями с цитокином в культурах клеток
костного мозга, полученного через 4 дня после обработки мыши 5-FU. При двойных комбинациях цитокина, таких как IL-1 + GM-CSF или IL-3 IL-1, стимулировалось примерно такое же число HPP-CFC, как и при
комбинациях KL + IL-1 или KL + IL-3, но особенно эффективной оказалась комбинация из трех факторов IL-1 + KL и либо G-CSF, либо IL-3.
Дельта-, или вторичный CFU-анализ на ранние гемопоэтические клетки. Исследования на мышах.
Дельта-анализ представляет собой вторичный клоногенный анализ, в котором короткоживующую (7 дней) суспензионную культуру костного мозга, лишенную коммутированных предшественников и обогащенную ранними стволовыми клетками в присутствии различных цитокинов, исследуют на стимулирование выживаемости, рекрутинг, дифференцировку и увеличение стволовых клеток и клеток-предшественников. 5-FU-резистентные стволовые клетки анализировали в первичном HPP-CFC-анализе с множественной цитокиновой стимуляцией, а также в стандартном CFU-GM-анализе со стимуляцией лишь одним CSF. Во вторичном HPP-CFC и CFU-GM-анализах использовали суспензионную культуру. Обычно определяли три параметра. Первым параметром являлась амплификация линиеспецифически рестриктированных предшественников, определяемая величиной, представляющей собой отношение полного числа CFU-GM, восприимчивых к одному виду CSF (например, G CSF) в первичной культуре (вход), к полному числу вторичных CFU-GM, восприимчивых к тем же самым видам CSF во вторичной культуре (выход). Вторым параметром является отношение HPP-CFC-"вход" к полному числу CFU-GM-предшественников во вторичном анализе. Поскольку CFU-GM, как предполагается, происходят от ранних предшественников, т.е. HPP-CFC, то это отношение может служить указанием на дифференцировку стволовых клеток в клетки-предшественники. И наконец, третьим параметром является отношение НРР-CFC-входа к полному числу вторичных НРР-CFC. Этот параметр является наилучшим показателем самообновления стволовых клеток, особенно если HPP-CFC-стимуляция в первичных и вторичных культурах обусловлена комбинацией IL-1, IL-3, и KL.
На ранних этапах исследований (перед использованием KL) различные уровни увеличения числа CFC-GM, восприимчивых к одному виду CSF, и в НРР-CFC-1 и 2 наблюдались в случае, если IL-1 комбинировали с М-CSF (20-30-кратное увеличение), с G-CSF (50-100-кратное увеличение), с... (200-кратное увеличение), при этом IL-3 и GM-CSF продуцировали ограниченную степень увеличения клеток-предшественников, тогда как M-CSF и GM-CSF вообще не продуцировали такого увеличения. IL-6 обнаруживал меньшую эффективность, чем IL-1 при синергическом действии с M-CSF, GM-CSF или G-CSF, но при комбинации IL-3 он показал такую же эффективность, как и IL-1. Комбинация IL-1 и IL-6 обнаруживала аддитивное и супераддитивное взаимодействия с тремя CSF-видами и IL-3. Присутствие лишь одного KL (полученного, как описано в настоящей заявке, или альтернативно, полученного, как описано в Международной публикации РСТ WO 92/00376 под названием "Mast Cell Growth Factor" (Фактор роста тучных клеток), опубликованной 9 января 1992 г. и переданной Immunex Corporation, или, альтернативно, полученного, как описано в Европейской патентной заявке 423980 под заглавием "Stem Cell Factor" (Фактор стволовых клеток), опубликованной 24 апреля 1992 и переданной A mgen Inc.) в фазе суспензионной культуры вызывало небольшое увеличение продуцирования клеток-предшественников (фиг. 26), но при комбинации KL с GM-CSF, IL-3 или IL-1 наблюдалось 200-800-кратное увеличение. Более эффективное увеличение клеток-предшественников дает комбинация IL-1, KL и либо GM-CSF, либо IL-3, а при комбинации четырех факторов, таких как IL-1 + KL + IL-6 либо IL-3, либо GM-CSF, наблюдалось вплоть до 2500-кратного увеличения клеток-предшественников. Подсчет генераций клеток-предшественников проводили исходя из выхода CFU-GM. HPP-CFC-"вход" показал, что комбинация из трех факторов (IL-1 + KL + IL-3 или CSF) давала отношения 6000-10000, а комбинация из четырех факторов (включая IL-6) давала отношения 8000-15000. По мере самообновления генерация вторичных HPP-CF-"входу" при комбинации из двух факторов (KL с IL-1, IL-3 или с CFU) достигала значений 50-700, а при комбинации из трех факторов (KL + IL-1 с IL-6, IL-3 или CSF) эта величина достигала значений 700-1300.
Эксперимент с полностью дифференцированными клетками, продуцированными в 7-дневной культуре, обогащенной HPP-CFC в комбинации с IL-1 + IL-3 + KL (фиг. 27), проиллюстрировал резкое увеличение пролиферации. В этом эксперименте измеряли степень самообновления (с помощью вторичной HPP-CFC-генерации) продуцирование клеток-предшественников (при низкопролиферативном потенциале CFU-GM) и морфологически идентифицируемую дифференцировку миелоидных клеток. Время удвоения клеточной популяции, необходимое для генерации этих клеток из одного предшественника, достигало пределов, установленных для скорости пролиферации клеток млекопитающих. Если эти пролиферация поддерживается более ранними и даже более редко встречающимися клетками, чем HPP-CFC-клетка, то может потребоваться даже более короткое время удвоения популяции. Размножение HPP-CFC в этой короткоживующей культуре вряд ли даст ясное представление о сравнительном увеличении долгоживущих восстановляющихся клеток, и большинство генерированных HPP-CFC, скорее всего, представляют более поздние стадии в иерархии стволовых клеток. Анализ D12-CFU-S также показал абсолютное увеличение числа клеток в 7-дневной суспензионной культуре с IL-1 + IL-3 или KL. Другими исследователями было показано, что в аналогичных суспензионных культурах предшественники CFU-GEMM (вероятно, долгоживующие восстанавливающиеся стволовые клетки) также размножаются в присутствии (IL-1 + IL-3)- комбинации, но не в присутствии комбинаций IL-6 + IL-3 или GM-CSF.
Дельта-, или вторичный CFU-анализ на ранние гемопоэтические клетки. Исследования с использованием человеческого материала.
Было показано, что 4-НС-обработка костного мозга человека приводит к элиминации большинства клеток-предшественников, способных к реагированию непосредственно на GM-CSF путем образования колоний in vitro, но при этом сохраняются стволовые клетки, способные к гемопоэтическому восстановлению в связи с трансплантацией костного мозга. В предварительных исследованиях по трансплантации выбор CD34+ также способствовал увеличению числа клеток костного мозга, способных к длительному восстановлению. После комбинированной 4-НС-обработки и выбора С 34+-клeтoк путем иммуноцитоадгезии образование первичных колоний в ответ на G-CSF или GM-CSF было ничтожно мало. Однако с использованием 7-дневной суспензионной культуры и последующего вторичного переклонирования в GM-CSF было показано, что воздействие на обработанные клетки костного мозга 7-дневной суспензией в комбинации с IL-1 и IL-3 приводит к постоянному генерированию наиболее высоких уровней вторичных CFU-GM. IL-3 и IL-6 были не менее эффективными, чем один IL-3, тогда как другие комбинации цитокинов были в значительной степени менее эффективными. В этом анализе максимальное стимулирование образования колоний было получено с использованием комбинаций IL-1 и KL; KL и IL-3; а комбинации из трех цитокинов был наиболее эффективными для стимулирования генерации клеток-предшественников.
Взаимодействие между c-kit-лигандом (KL) и IL-1, IL-6 и другими гемопоэтическими факторами.
In vivo-десенсибилизация трансплантируемого костного мозга посредством 5-FU является простым способом для увеличения популяции гемопоэтических покоящихся клеток-предшественников. Лишь одна доза 5-FU может уже через 24 часа снизить число рано появляющихся CFU-S и более зрелых CFU-C -популяций на более чем 99%, обогащая при этом костный мозг более примитивными предшественниками. Более поздние CFU-S также являются чувствительными к 5-FU-десенсибилизации костного мозга (ВМ), что дает основание предположить, что эти клетки не являются такими же, как стволовые клетки, ответственные за восстановление костного мозга (ВМ). Напротив, было показано, что ВМ-восстанавливающие стволовые клетки являются невосприимчивыми к цитотоксическому действию 5-FU [105] . Brad ley и Hodgson, используя 5-FU-десенсибилизированный костный мозг, идентифицировали компартментализацию клеток-предшественников HPP-CFC, которые способны к образованию очень больших колоний в агаровых культурах.
Авторы настоящей заявки исследовали взаимодействие IL-1, IL-6 и KL исходя из компартментации примитивных мышиных клеток-предшественников [104]. Используя клональные культуры, авторы настоящей заявки продемонстрировали синергическое или аддитивное действие этих факторов, взятых как отдельно, так и в комбинации с CSF. Полученные результаты дают основание предположить, что IL-1, IL-6 и KL в своей стимуляции раннего гемопоэза действуют уникальным образом. Этот эксперимент с использованием клональных культур был затем подкреплен последующим проведением анализа с использованием короткоживущей жидкой культуры, т.е. Δ-анализа, который был описан выше. Была продемонстрирована способность IL-1, IL-6, и KL регулировать.
Материалы и
методы
Мыши. Самцы и самки (С 57 BL/6XDBA/2)F, (B6D2F 1)-мышей поставлялись из Лаборатории Джексона (Jackson Laboratory, Bar Harbor, ME). Этих мышей выдерживали в привычных условиях, давая
подкисленную и/или автоклавированную воду для питья. Особей-часовых, помещенных вместе с колонией, наблюдали на специфические патогены. Все мыши имели возраст по крайней мере 8 недель.
Препараты костного мозга и условия культивирования тканей.
Костный мозг (ВМ) от нормальных (NBM) или 5-FU-обработанных мышей получали из бедра, а иногда из большой берцовой кости от по крайней мере 3 мышей на один эксперимент. Мышей обрабатывали путем внутривенного введения 150 мг/кг 5-FU мг/кг в объеме 150-250 мл. Перед культивированием ВМ два раза промывали путем центрифугирования. Если это не оговорено особо, все обработки и культивирования ВМ осуществляли в культуральной среде, содержащей IMDM (Gibco, Grand Island, NY) и дополненной 20% FCS (Hyclone Laboratories Inc, Logan UT) и 0,05% мг/гл гентамицина (Gibco). Подсчет клеток костного мозга (ВМ) проводили с использованием счетчика Coulter модели ZBI. (Coulter Electronics, Hialeah, FL). Вся используемая пластиковая посуда имела качество, пригодное для культивирования тканей.
Цитокины и антитела.
Очищенные rhIL-Iβ, sp act=1,32•107 ед./мг (Syntex Laboratories, Inc: Palo Alto, CA) использовали при 100 ед./мл. Частично очищенные и очищенные IL-6 были любезно предоставлены Steven Cillis (Immunex Corporation Seattle, WA); частично очищенные IL-6 использовали при 300 CESS ед./мл, и очищенные IL-6 использовали при 50 нг/мл. Очищенные KI получали, как описано в настоящей заявке. Очищенные rhG-CSF (Amgen Biological, Thousand Oaks, CA). Использовали при 100 ед./мл (sp act=1Х108 ед./мг). Очищенные rhM-CSF использовали при 1000 ед./мл (Immunex). Кондиционированную среду, содержащую rmIL-3, получали из кратковременно трансфицированных COS-1-клеток и подобно другим факторам роста использовали в концентрации, необходимой для максимальной CFU-C-стимуляции. Крысиные моноклональные антитела против мышиного IL-6 поставлялись от Genzyme (Cambridge MA).
CFU-C-анализ.
LPP-CFC анализировали в 35 мм чашках Петри, содержащих 1 мл 5•104 NBM, суспендированных в культуральной среде, содержащей цитокины и 0,36% агарозе (SeaPlague; FMC, Rocland, ME). Эти культуры инкубировали в течение 7 дней при 37oС в 5% СО2-атмосфере с абсолютной влажностью. HOO-CFC анализировали с использованием агарозной системы с двойным слоем, описанной ранее. 60 мм чашки Петри, содержащие нижний 2 мл слой, состоящий из культуральной среды, цитокинов и 0, 5% агарозы, покрывали верхним 1 мм слоем 5-FU за 1-8 дней до (dl - d8) 5-FU BM) анализа на HPP-CFC при концентрации клеток 1•103 - 1•105 кл./культура. Двухслойные культуры культивировали в течение 12 дней при 37oС в 5% СО2- и 7% О2-атмосфере при абсолютной влажности. Чашки оценивали на низко пролиферативные колонии, содержащие, по крайней мере, 50 клеток (LPP-CFC) и на высокопролиферативные колонии с диаметрами, составляющими по крайней мере 0,5 мм (HPP-CFC). Все CFU-C подсчитывали в культурах по трем дубликатам.
CFU-S-анализ.
Мышей облучали 1250 Гр из гамма-источника137Cs при дозе приблизительно 90 Грей в минуту (Гр/мин). Облучение (1250 Гр) проводили раздельными дозами в 800 Гр и 450 Гр с интервалом в 3 часа. Через 3-2 часа после последнего облучения мышам внутривенно инъецировали ВМ-клетки. Через 12 дней после трансплантации ВМ подсчитывали поздние CFU-S на селезенке, фиксированной в растворе Bouin.
Дельта--(Δ)-анализ.
Суспензионные культуры получали, как описано выше, 1 мл Δ-культуры (в 4 дубликатах), состоящих из 2,5•105 (dl) 5-FU-ВМ кл./мл помещали в 24-луночные планшеты, и инкубировали 7 дней при 37oС в присутствии факторов роста в 5% СО2-атмосфере при абсолютной влажности. После энергетичного пипетирования собирали неприлепающие клетки от слабых старых культур. Ресуспендированные ВМ-клетки из 4 дупликатных Δ-культур собирали и 1 мл культуры использовали для определения насыщенности клетками. Остальные 3 мл клеток промывали путем центрифугирования. Промытые клетки анализировали на вторичные LPP-CFC, HPP-CFC и CFU-S. Вторичные РР-CFC, чувствительные к G-CSF, GM-CSF и IL-3 измеряли в 7-дневных CFU-С-культурах. Вторичные HPP-CFC и LPP-CFC, восприимчивые к IL-1 и IL-3, оценивали через 12 дней в условиях, аналогичных условиям, описанным для культивирования HPP-CFC. Клетки из Δ-культур разводили до 20-200-кратного объема и определяли число вторичных CFU-C. Число CFU-S, присутствующих в Δ-культурах после недельного культивирования, определяли путем трансплантации мышам 2-200-кратных разведении промытых клеток.
Кратность увеличения популяций клеток-предшественников костного мозга в Δ-культуре выражали в Δ-величинах. Число первичных LPP-CFC, HPP-CFC и CFU-S, присутствующих в исходных (dl) 5-FU-BM-популяциях, измеряли в параллельных суспензионных культурах. Дельта-величины определяли как отношение полного "выхода" вторичных LPP-CFC, HPP-CFC, и CFU-3 к исходным первичным LKPP-CFC, HPP-CF и CFU-S соответственно.
Δ-Анализ на
истощение прилипающих клеток
Дельта культуры по (12,5 мл 2,5•105 (dl) 5-FU-BM кл./мл) помещали в 25 см2 колбы для тканевых культур. Перед началом культивирования
ВМ освобождали от популяций прилипающих клеток путем 4-часового инкубирования в культуральной среде при 30oС. Неприлипающие клетки переносили во вторую 25-см2 колбу и обе
популяции клеток поддерживали в условиях, описанных выше для Δ-культур.
Анализ на активность цитокинов.
Супернатанты от А-культур, выращенных в 25 см2 колбах для тканевых культур, собирали путем центрифугирования. Супернатаны собирали от культур с (dl) 5-FU-BM (ВМ-культур, лишенных прилипающих клеток, и ВМ-культур с прилипающими клеткам). IL-6-активность измеряли с помощью анализа на пролиферацию клеток с использованием мышиной гибридомы В9. Активность цитокинов также измеряли с использованием фактор-зависимой гемопоэтической клеточной линии NFS-60. Пролиферацию NFS-, % клеток в ответ на активность фактора роста измеряли, как было описано ранее.
Статистический анализ.
Значимость полученных данных определяли с использованием двустороннего т-критерия Стъюдента.
Результаты
Активность IL-6, IL-1 и KL в отношении NBM.
Влияние G-CSF, M-CSF, GC-CSF и IL-3 в сочетании с IL-1, IL-6 и KL на образование колоний от NBM показано на фиг. 1. Образование колоний в ответ на IL-1, IL-6, KL и IL-1 + IL-6 было минимальным. Комбинация IL-1 с M-CSF, GM-CSF или IL-4 стимулировала более высокую активность в образовании колоний, чем CSF, взятые отдельно; причем наиболее высокий аддитивный эффект достигался с использованием комбинации IL-1 и M-CSF, что подтвердили повторные эксперименты. Добавление IL-6 к CSF-содержащим культурам способствовало повышению образования колоний аддитивным образом. Комбинация IL-1 + IL-6, взятая отдельно или в сочетании с CSF, не давала значительного отличия в стимулировании роста колоний, т.е. отличия, превышающего аддитивный эффект. Добавление KL к культурам, содержащим IL-1, IL-6, G-CSF, GM-CSF или IL-3, оказывало синергическое действие в стимулировании CFU-C. KL в сочетании с М-CSF не давал синергического эффекта. Добавление CSF к IL-1 + KL или IL-6 + KL-стимулированным культурам давало аддитивный эффект или менее.
Действие IL-1, IL-6 и KL на 5-FU-BM.
Выделение HPP-CFC и LPP-CFC от мыши (через 1-7 дней после того, как ей вводили 5-FU) показано на фиг. 1 и 3. Наблюдался небольшой рост колоний в ответ на IL-1 и/или IL-6-стимуляцию, хотя при этом постоянно наблюдалось лишь несколько HPP-CFC и LPP-CFC. Линиеспецифические CSF, G-CSF и M-CSF имели низкую способность к стимулированию, тогда как GM-CSF и IL-3 обнаруживали способность к стимулированию как HPP-CFC, так и LPP-CFC. Для наибольшего стимулирования HPP-CFC требовались комбинации нескольких факторов.
Kit-лиганд почти не обнаруживал заметной колониестимулирующей активности, при этом в среднем обнаруживалось лишь 1,3 HPP-CFC и 2,7 LPP-CFC, стимулированных от 1•104 d7 5-FU-BM-клеток (фиг. 30). Наибольшая концентрация KL, используемая в этом исследовании, составляла 230 нг/мл и эта концентрация KL стимулирует образование высокопролиферативных колоний в присутствии IL-1 и IL-6. При концентрации 1 нм/мл KL наблюдалось в среднем 6,7 колоний, а при концентрациях KL от 10 до 100 нг/мл, число колоний достигало плато в диапазоне 120-147 HPP-CFC на 2,5•104 (d4) 5-FU-ВМ-клеток (данные не приводятся). Добавление KL к G-CSF-содержащим культурам приводило к увеличению числа HPP-CFC в (d1) 5-FU-BM, а также к увеличению числа LPP-CFC в обеих (dl d7) 5-FU-BM популяциях. Синергичное действие KL и G-CSF в стимулировании HPP-CFC было особенно выражено в культурах (d4) 5-FU-BM (данные не приводятся). Комбинации KL+M+CSF не давала какой-либо супераддитивный эффект в образовании колоний. Однако KL оказывал сильное синергичное действие в присутствии GM-CSF и IL-3 при стимулировании HPP-CFC, IL-3 + KL-комбинация была более эффективна в образовании больших колоний, чем IL-1 + IL-3 в обеих (d1 и d7) 5-FU-ВМ-популяциях. Добавление KL к IL-3-содержащим культурам способствовало 6-35-кратному увеличению числа HPP-CFC в (dl и d7) 5-FU-BM соответственно.
Хотя IL-1, IL-6 или KL не имеют заметной CSF-активности, добавление KL к IL-1, IL-6 или IL-1 + IL-6-содержащим культурам приводило к резкому синергичному действию этих факторов в стимулировании рост HPP-CFC (фиг. 30). Объединение KL с IL-6 или IL-1 приводило к образованию в среднем 4,9 и 13,7 высокопролиферативных колоний от 1•105 (d1) 5-FU-BM-клеток соответственно. Кроме того, в ответ на все три цитокина наблюдалось образование в среднем 42,0 HPP-CFC на 1•105 клеток. Эти результаты ясно продемонстрировали существование субпопуляций HPP-CFC, которая для образования большой колонии требует стимуляции IL-1, IL-6 + KL. Ответ (d7) 5-FU-ВМ на эти комбинации факторов роста был аналогичным ответу (d1) 5-FU-ВМ. Однако число HPP-CFC, стимулированных комбинацией IL-1, IL-6 + KL в (d7) 5-FU-BM, был в десять раз меньше, чем максимальное число HPP-CFC, которое может быть стимулировано путем последующего добавления GM-CSF к этим трем факторам. Число колоний HPP-CFC, стимулированных (d7) 5-FU-BM популяциях четырьмя цитокинами, лишь немного отличается (чуть более чем в два раза) от числа колоний, стимулированных IL-1, IL-6 + KL.
Добавление IL-6 к культурам, содержащим KL и CSF, не дало значительного увеличения образования колоний свыше обычного аддитивного эффекта, которого можно было ожидать от комбинации двух факторов IL+6, KL с CSF (фиг. 30). Например, комбинация на IL-6, KL + GM-CSF приводит к образованию приблизительно 30 высокопролиферативных колоний на 1• 105 (d1) 5-FU-ВМ-клеток. Объем этих 30 HPP-CFC может быть обусловлен объединенным числом колоний, наблюдаемых в культурах, стимулированных IL-6 + KL + GM-CSF (4 и 20 HPP-CFC соответственно), что дает основание предположить, что объединение этих факторов не даст какую-либо дополнительную пролиферацию HPP-CFC.
В противоположность описанным выше результатам, полученным с использованием IL-6, добавление IL-1 к культурам, содержащим KL и CSF, не давало синергизма (фиг. 30). Этот синергизм был наиболее ярко выражен в культурах (d7) 5-FU-BM, культивированных с комбинациями IL-1, KL + G-CSF. Комбинация любых двух факторов из трех цитокинов стимулировала образование 5 или менее НРР-CFC, тогда как комбинация из IL-1, KL + G-CSF стимулирует в среднем 100 HPP-CFC на 1•104 BМ-клеток. Синергичное действие, хотя и не столь выраженное, наблюдалось также при использовании IL-1, KL + GM-CSF или IL-1 в стимулировании (d7) 5-FU-BM. Такое же супераддитивное действие, кроме того, наблюдалось в (dl) 5-FU-BM-популяциях в присутствии комбинаций IL-1, KL + G-CSF или M-CSF. Образование большого числа HPP-CFC в (d1) 5-FU-BM было стимулировано комбинациями IL-1, KL + GM-CSF или IL-3, однако этот эффект обусловлен аддитивным действием этих факторов роста на различные популяции HPP-CFC.
Как указывалось выше, наибольшее число HPP-CFC было стимулировано комбинацией из четырех факторов роста, при этом оптимальное число колоний давали комбинации IL-1, IL-6, KL + GM-CSF-CSF или IL-3. Комбинация IL-1, IL-6, KL + GM-CSF способствовала стимуляции свыше 3% от (d7) 5-FU-BM-клеток с образованием высокопролиферативных колоний. Только с использованием смеси IL-1, IL-6, KL + M-CSF наблюдалось увеличение HPP-CFC, обусловленное, очевидно, синергизмом всех четырех факторов при стимулировании дополнительного роста крупных колоний, которого не наблюдалось с комбинациями меньшего числа цитокинов. Добавление IL-6 к комбинации цитокинов IL-1, KL + G-CSF, GM-CSF или IL-3 не дало супераддитивного эффекта. В большинстве случаев число высокопролиферативных колоний, стимулированных IL-1, IL-6, KL + G-CSF, GM-CSF или IL-3, существенно не превышало число HPP-CFC, стимулированных комбинациями IL-1, KL + G-CSF, GM-CSF или IL-3.
Увеличение 5-FU-BM в Δ-культурах.
Число неприлипающих клеток, выделенных после 7-дневного культивирования в Δ-культурах, характеризует тип ответа, наблюдаемого в клональных культурах 5-FU-BM с различными комбинациями цитокинов (фиг. 31). Контрольные культуры (dl) 5-FU-BM, полученные без стимуляции цитокинами, обнаруживали в среднем 39%-ное снижение насыщенности клетками с преимущественным выживанием клеточных популяций моноцитов/макрофагов. Добавление IL-1, IL-6 или KL отдельно не давало увеличения количества клеток выше его исходного уровня. За исключением небольшого увеличения ответа на стимуляцию GM-CSF и IL-3 эти культуры стимулировались лишь с использованием нескольких цитокинов, в результате чего число их клеток увеличивалось. Набольшую пролиферацию наблюдали от культур, стимулированных комбинациями UL-1, KL + GM-CSF или IL-3; причем последующее добавление IL-6 к этим культурам не давало значительного увеличения числа клеток. Появление незрелых миелоидных клеток коррелировало с наблюдаемой пролиферацией Δ-культур. В одном эксперименте IL-3 стимулировал культуры, содержащие около 50% зрелых сегментированных нейтрофильных гранулоцитов и магрофагов, 25% метамиелоцитов, 20% миелоцитов и 3% бластных клеток. Процент бластных клеток возрастал с добавлением IL-1 (22%), IL-6 (18%), KL (24%), IL-1 + IL-6 (12%), IL-1 + KL (51%), IL-6 + KL (43%) и IL-1, IL-6+KL (46%) к IL-3-содержащим культурам, наибольшее полное число бластных клеток (6,1•105) получали от культур, стимулированных IL-1, KL, и IL-3, что составляет примерно 200-кратное увеличение по сравнению с исходной (dl) 5-FU-BM-популяцией.
Контрольные культуры, выращенные без добавления цитокинов, не обнаруживали увеличения клеток-предшественников LPP-CFC-популяций по сравнению с исходными величинами (фиг. 32). Добавление колониестимулирующих факторов G-CSF, M-CSF, GM-CSF и IL-3 дало явное увеличение клеток (средние Δ-величины составляли 3,4; 2,4; 23 и 140 соответственно). Один IL-1 стимулировал более чем 60-кратное увеличение LPP-CFC, а объединение IL-1 с CSF приводило к синергичной экспансии LPP-CFC. Например, IL-1 + IL-3 давали средние значения 520 (для сравнения; предполагаемое аддитивное Δ-значение составляет 140(IL-3) + 63(IL-1)=203). IL-6 стимулировал небольшое, но значимое увеличение LPP-CFC (Δ-величина=3,4; р < 0,01). Более чем аддитивный эффект наблюдался с использованием комбинации IL-6 + G-CSF и IL-6 + IL-3, KL не давал значительного увеличения LPP-CFC из Δ-культур (р=0,08). Комбинации KL и CSF давали, однако, более чем аддитивный эффект во всех случаях. Комбинация KL + IL-3 имела такую же эффективность, как и IL-1 + IL-3 в стимулировании роста LPP-CFC (среднее Δ-значение = 485 и 520 соответственно; р=0,21). Дельта-культуры, стимулированные IL-1 + IL-6 в комбинации с CSF, имели более высокое Δ-значение во всех случаях, чем культуры, стимулированные IL-1 или IL-6. Повышенную экспансию LPP-CFC с аддитивным эффектом стимулировали все комбинации IL-1, IL-6 + CSF за исключением комбинации IL-1, IL-6 + M-CSF (Δ-значение= 300, а для IL-1 + M-CSF это Δ-значение составляло 140, и для IL-6 + M-CSF Δ-значение=2,8). Комбинация IL-6 + KL давала синергичный эффект в стимулировании LPP-CFC (в более чем 200 раз), однако добавление этих двух цитокинов к CSF-coдepжaщим культурам приводило лишь к аддитивному увеличению клеток-предшественников. Комбинация IL-1 и KL синергически стимулировала более чем 1000-кратное увеличение LPP-CFC. Добавление G-CSF, GM-CSF или IL-3 к IL-1 + KL-содержащим культурам еще более увеличивало число LPP-CFC (средние Δ-значения 1100, 1200 и 1400 соответственно). Наибольшее увеличение достигалось с использованием комбинаций IL-1, IL-6, KL + CSF. В дельта-культурах, стимулированных комбинаций IL-1, IL-6, KL + IL-3, наблюдалось 1800-кратное увеличение LPP-CFC несмотря на указанное увеличение этих Δ -значение, добавление IL-6 к IL-1 + KL-содержащим Δ-культурам не вносило существенного вклада в наблюдаемое увеличение клеток-предшественников (Р > 0,05).
Увеличение HPP-CFC в дельта-культурах.
Были проведены эксперименты для оценки способности к стимулированию HPP-CFC различных комбинаций цитокинов (фиг. 33). Как и в случае с увеличением LPP-CFC, наибольшее увеличение HPP-CFC было достигнуто в Δ-культурах, стимулированных комбинациями IL-1, KL + CSF, CSF, взятый отдельно, стимулировал лишь очень скромное увеличение HPP-CFC. IL-6 стимулировал увеличение НРР-СFС, а IL-6 вместе с IL-3 был более эффективен в увеличении HPP-CFC, чем один IL-3. В отличие от IL-6 IL-1 продемонстрировал синергизм в комбинации со времени четырьмя CSF. KL в комбинации со всеми четырьями CFC также обнаруживал более чем аддитивный эффект в увеличении HPP-CFC. Комбинация IL-1 + IL-6 без CSF или вместе с СSF была более эффективной, чем IL-1 или IL-6, взятые отдельно. Особенно яркий синергизм наблюдался при использовании IL-1 + IL-6 в сочетании с М-CSF (средние Δ-значения составляли: с IL-6 + M-CSF = 1,0; IL-1 + M-CSF = 13,2; и с IL-1 + IL-6 + CSF = 65,7). Добавление IL-1 или IL-6 к Δ-культурам, содержащим KL один или в комбинации с CSF, приводило к более чем аддитивному увеличению HPP-CFC. Несмотря на увеличение Δ-величин в каждом случае добавление CSF к культурам, содержащим KL либо вместе с IL-2 либо вместе с IL-6, не давало значительного увеличения HPP-CFC. Наибольшее увеличение HPP-CFC наблюдалось в культурах, стимулированных комбинацией IL-1, IL-6 + KL (Δ-значение=705).
Продуцирование вторичных HPP-CFC в Δ-культурах оценивали с помощью клонального анализа при стимулировании IL-1 + IL-3 (фиг.33). Были также исследованы и другие комбинации цитокинов, такие как IL-1 + GM-CSF или IL-1 + М-CSF на их способность к стимулированию вторичных HPP-CFC. Определение числа вторичных HPP-CFC, культивированных в присутствии IL-1 + M-CSF или GM-CSF, было достаточно затруднительным из-за слишком большого количества вторичных LPP-CFC по отношению к числу HPP-CFC, стимулированных этими комбинациями цитокинов. Оценивали также эффективность IL-1 и KL как стимулирующих факторов роста вторичных HPP-CFC (фиг. 34). В отличие от любых других комбинаций исследуемых цитокинов, резкого увеличения (IL-1 + KL)- чувствительных клеток-предшественников в Δ-культуре не наблюдалось, как это было зафиксировано в случае увеличения (IL-1 + IL-3) - чувствительных HPP-CFC и LPP-CFC.
Увеличение CFU-S в Δ-культурах.
Для последующей характеризации популяций ВМ-клеток, появляющихся в Δ-культурах, было исследовано увеличение СFC в ответ на стимуляцию цитокина в Δ-культурах (фиг. 35). Культуры, выращенные в присутствии IL-1, IL-3, IL-1 + IL-3 или IL-1 + KL, обнаруживали увеличение в HPP-CFC и LPP-CFC, что соответствовало результатам, представленным на фиг.32 и 33. В этих культурах также наблюдалось увеличение CFU-S, которое превышало увеличение HPP-CFC. При стимулировании комбинациями IL-1 + IL-3 и IL-1 + KL, количество поздних CFU-S возрастало более чем в 100 раз. Эти результаты сравнивали с увеличением HPP-CFC и CFU-, которое, как известно, имело место у мышей, излечиваемых в результате 5-FU-обработки; in vivo-увеличение (Δ-in vivo) измеряли как отношение полного числа бедренных HPP-CFC, LPP-CFC и CFU-S в (d8) 5-FU-BM к полному числу колоний, наблюдаемых на 1 день (1d) после 5-FU-BM к полному числу колоний, наблюдаемых в 1 день (1d) после 5-FU-обработки. In vivo-увеличение клеток-предшественников было аналогично увеличению в in vitro-культурах, за исключением того, что увеличение LPP-CFC in vivo было меньше, чем увеличение, наблюдаемое in vitro.
Обсуждение.
Эти исследования проиллюстрировали роль IL-1, IL-6 и KL как регуляторов пролиферации гемопоэтических примитивных клеток. Эти цитокины, взятые отдельно, имеют ограниченную способность к стимулированию пролиферации гемопоэтических клеток-предшественников в клональном анализе культур, описанном в настоящей заявке (фиг. 20-30). Но IL-1, IL-6 и KL, взятые вместе, обнаруживают синергичное действие в стимуляции роста колоний. Путем систематического анализа комбинаций IL-1, IL-6, KL и колониестимулирующих факторов авторы настоящей заявки смогли различить популяции HPP-CFC и LPP-CFC, присутствующие в 5-FU-десенсибилизированном костном мозге (ВМ). Способность IL-1, IL-6 и/или KL к регулированию колониеобразования примитивными гемопоэтическими клетками была также подтверждена экспериментами с использованием короткоживущих культур (dl) 5-FU-BM. Δ-Анализ, позволяющий измерить приток популяций ранних предшественников в ответ на стимуляцию цитокинами, продемонстрировал, что наибольшее увеличение LPP-CFC и HPP-CFC зависит от синергичного воздействия IL-1, IL-6, KL и CSF на ранние гемопоэтические клетки-предшественники (фиг. 32-35).
Важная роль IL-1 как регулятора раннего гемопоэза известна со времени его идентификации как фактора (Гемопоэтин-1), обладающего синергичной активностью и присутствующего в кондиционированной среде клеточной линии карциномы мочевого пузыря 5637. В соответствии с полученными ранее результатами авторы настоящей заявки показали, что IL-1 обладают синергичным действием совместно с G-CSF, M-CSF, IL-1 или KL при стимуляции HPP-CFC (фиг. 29 и 30). Способность IL-I стимулировать пролиферацию примитивных гемопоэтических клеток наблюдалась также в Δ-анализе (фиг. 31-33). Синергичная активность IL-2 в комбинации с G-CSF, M-CSF, GM-CSF, IL-3 или KL была продемонстрирована его способностью стимулировать увеличение полного числа миелоидных бластных клеток, числа LPP-CFC и числа HPP-CFC в жидкой культуре. Несколько проведенных исследований дали основание предположить, что комбинация цитокинов IL-1 + IL-3, G-CSF, M-CSF, GM-CSF. В Δ-культурах, комбинация IL-1 + IL-3 может стимулировать увеличение LPP-CFC и HPP-CFC в 520 и 83 раза соответственно. Это увеличение популяций клеток-предшественников превышало увеличение стимулированное комбинаций IL-1 + G-CSF, М-CSF или GM-CSF. Однако синергизм, наблюдаемый между IL-1 и KL, оказывает более эффективное стимулирующее действие на (dl) 5-FU-BM, чем IL-1 + IL-3.
Число LPP-CFC в дельта-культурах, стимулированных IL-1 + KL, возрастало более чем в 1000 раз, а число HPP-CFC - в 280 раз.
Было установлено, что гемопоэтическая активность IL-6 отличается от активности IL-1. Было установлено, что комбинация IL-6 + IL-3 или KL обладает синергичным действием при стимуляции HPP-CFC от (dl-d7) 5-FU-BM (фиг. 30). IL-6 и KL также действуют синергически при стимулировании CFU-C от NBM (фиг. 28). В Δ-анализе был проиллюстрирован синергизм между IL-6 и либо IL-3 или KL и увеличение LPP-CFC и HPP-CFC (фиг. 5 и 6). В стимулировании HPP-CFC, IL-6 + IL-3 являются не так эффективными, как IL-1 + IL-3 (Δ-величины 40 и 83, соответственно). Было установлено, что комбинация из трех факторов IL-1, IL-6 и M-CSF обладают синергичным стимулирующим действием на HPP-CFC от (dl-d7) 5-FU-BM. Кроме того, Δ-анализ также показал синергизм IL-1, IL-6 и M-CSF в увеличении LPP-CFC- и HPP-CFC-популяций. Комбинация цитокинов IL-6, IL-1 + KL оказывала синергичное стимулирующее действие на рост HPP-CFC от (d1-d7) 5-FU-BM. Наибольший рост HPP-CFC (Δ-значение = 705) в Δ-культурах наблюдался при добавлении IL-1, IL-6 + KL к указанным культурам. Описанная картина синергичного взаимодействия IL-1, IL-6 и KL в регулировании плюрипотентных гемопоэтических клеток-предшественников.
Стимулирующее действие KL на ранние гемопоэтические клетки-предшественники, проиллюстрированное в этих исследованиях, соответствует активности, способствующей росту стволовых клеток, которая играет важную роль в клонировании RL-гена. Ответ NBM-предшественников на стимулирующее действие IL-1, IL-6, G-CSF или IL-1 проиллюстрировал синергизм в комбинации с KL (фиг. 28). Как сообщалось ранее, KL не стимулирует колониеобразование в ответ на М-CSF от NBM. Аналогичная картина ответа наблюдалась с использованием 5-FU-BM; KL обнаруживал синергизм в сочетании с IL-1, IL-6, G-CSF, GM-CSF или IL-3, но не с M-CSF (фиг. 30). Резкий синергизм при стимуляции HPP-CFC, наблюдаемый с использованием комбинации IL-1 + KL, может быть усилен еще более путем добавления CSF. Наиболее яркий синергизм наблюдался с IL-1, KL и G-CSF в культурах от (d1 и d7) 5-FU-ВМ. Оптимальный гемопоэтический ответ наблюдался с использованием комбинации из четырех цитокинов IL-1, IL-6, KL и CSF. Но лишь комбинация IL-1, IL-6, KL и M-CSF, оказывала синергичное стимулирующее действие на HPP-CFC. Комбинация IL-1, IL-6, KL и GM-CSF или IL-3 стимуровала наибольшее число HPP-CFC, наибольшую степень пролиферации клеток в Δ -культурах, и наибольшее увеличение LPP-CFC в Δ-культурах (фиг. 31-33). Описанные результаты иллюстрируют важную роль KL в регулировании пролиферации ранних гемопоэтическиех клеток.
HPP-CFC занимают определенное место в иерархии клеток, которые могут быть идентифицированы исходя из их потребности определенного фактора роста и/или техники их физического разделения. Идентификация двух ранних гемопоэтических клеток HPP-CFC-1 и HPP-CFC-2 коррелирует с разделением клеток-предшественников на основе их удерживания митохондриального красителя родамина-123. Слабо окрашивающиеся родамином-123 клетки представляют более примитивную фазу (HPP-CFC-1)клеток, которые для своей пролиферации требуют синергичного воздействия IL-1, IL-3 и M-CSF, в то время как фаза HPP-CFC-2 клеток не требует стимуляции фактором IL-1. Более примитивная природа IL-1 + CSF-стимулированных ранних предшественников подтверждается наблюдаемым синергичным воздействием IL-1 + CSF в увеличении LPP-CFC и HPP-CFC при Δ-анализе (фиг. 32 и 33). Кроме того, регулирование примитивных гемопоэтических клеток осуществляется также факторами роста IL-6 и KL. Способность IL-6 и KL к стимулированию роста HPP-CFC в Δ-культуре, очевидно, может свидетельствовать о их роли в стимуляции ранних предшественников HPP-CFC-1. Эти данные подтверждают предположение, что покоящиеся стволовые клетки, обогащение которыми проводили путем 5-FU-десенсибилизации ВМ, требуют стимуляции для их пролиферации несколькими факторами роста. Созревание этих ранних клеток-предшественников из Hpp-CFC-1 в HPP-CFC-1 влечет за собой ограничение в требовании стимуляции несколькими цитокинами для их пролиферации. Вывод относительно иерархии HPP-CFC подтверждает наблюдение того факта, что в ответ на стимуляцию комбинаций IL-1, IL-6, KL + GM + CSF свыше 3% (d7) 5-FU-ВМ-клеток способны образовывать HPP-CFC (фиг. 30), что намного превышает ожидаемую частоту встречаемости мультипотентных стволовых клеток в костном мозге (ВМ).
Увеличение HPP-CFC в Δ-культурах, очевидно, свидетельствует о экспансии мультипотентных гемопоэтических предшественников. Однако место этих пост-HPP-CFC Δ-культуры в иерархии HPP-CFC пока не выяснено. Наблюдаемое увеличение поздно появляющихся CFU-S в Δ-культурах подтверждает имеющееся мнение, что число мультипотентных гемопоэтических клеток-предшественников, увеличивается в условиях
(IL-1 и KL)-индуцированная пролиферация и влияние
TGFβ и MIPIα.
Как сообщалось ранее, TGFβ и MIPIα (воспалительный белок-Iα макрофагов) способны ингибировать рост клеток-предшественников.
Было высказано предположение, что любой из этих цитокинов может действовать как негативный регулятор пролиферации гемопоэтических стволовых клеток, хотя оба эти фактора ранее непосредственно не сравнивались в анализе на распознавание стволовых клеток. В анализе мышиных НРР-колоний оценивали свойства стволовых клеток путем элиминации поздних клеток-предшественников с использованием 5-фторурацила, и рассматривали лишь колонии с высокопролиферативным потенциалом (размером ≥ 0,5 мм). IL-1 и KL стимулируют преимущественно ранние гемопоэтические клетки-предшественники. Поэтому авторами настоящей заявки была проведена оценка воздействия TGFβ и MIPIα на пролиферацию НРР, индуцированную IL-1 и KL. Данные, полученные в результате двух отдельных экспериментов (каждый осуществляли в тройном дублировании), выражали как число НРР-колоний, индуцированных комбинациями факторов роста по отношению к числу колоний, индуцированных лишь одним GM-CSF (GSМ) (см. табл. 3).
Эти результаты показали, что TGFβ "отменяет" синергичную пролиферацию НРР-колоний, стимулированную IL-1 и/или KL с GM-CSF, тогда как VIPIα таким действием не обладает. Кроме того, TNF/HPP-колонии, индуцированные IL-1 + KL, в то время, как MIPIα фактически стимулирует образование колоний НРР в этих условиях. Поэтому авторами настоящей заявки был сделан вывод, что TGFβ, но не MIPIα, действует как негативный регулятор исследованных в настоящей работе популяций гемопоэтических клеток-предшественников. Это очень важное заключение может быть учтено при разработке схемы защитной химиотерапии.
Исследование действия KL в комбинации с IL-3, ЕРО или GM-CSF у человека
11 пациентов с анемией Даймонда-Блекфена
(все эти пациенты обладали резистентностью к преднизону или требовали высоких доз) имели пониженные значения частоты встречаемости BFU-E при rhHPO- и rhIL-3-стимуляции. За исключением одного
восприимчивого к преднизону пациента, эти значения были ниже на 95% доверительного предела, полученного исходя из костного мозга 4 нормальных взрослых людей. При добавлении или введении вместо rhII-3
рекомбинантного мышиного c-kit-лиганда (rmKL) все пациенты обнаруживали значительное увеличение размера BFU-E и гемоглобинизацию. Кроме того, комбинация rhEPO, rhIL-3 и rmKL по крайней мере вдвое
увеличивала среднее значение частоты BFU-E у 8 из 11 пациентов (диапазон: 2-16-кратное увеличение). У 5 из 11 пациентов наблюдалось также снижение (до 95%) доверительного предела rhIL-3-индуцированных
миелоидных колоний. У 6 пациентов добавление KL способствовало увеличению среднего значения частоты миелоидных колоний в 2 раза или более.
BFU-E, стимулированные комбинацией rhEPO+rmIL-3 и/или rhKL, не были обнаружены у 6 пациентов с синдромом Фанкони с различной степенью недостаточности костного мозга. Миелоидные колонии также не наблюдались у 4 пациентов и были значительно снижены у 2 пациентов при стимуляции либо rhIL-3, либо rhGM-CSF. Этим 2 пациентам вводили дополнительно rmKL или rhIL-3, в результате чего среднее значение частоты повышалось. У третьего пациента с DC rhIL-3 + rmKL индуцировали миелоидные колонии, у одного пациента с более тяжелой дисплазией не обнаруживалось эритроидных или миелоидных колоний при стимулировании одним rhIL-3 или rhGM-CSF или вместо rhEPO и rhIL-3 (13% нормального контроля). У последнего пациента наблюдалось увеличение размеров и числа BFU-E, а также повышенная гемоглобинизация при добавлении rmKL, rhIL-3 или rhGM-CSF-стимулированные миелоидные колонии были слегка снижены, a KL индуцировал соответствующее увеличение частоты колоний.
Взаимодействие между с-kit-лигандом (KL), GM-CSF и фактором некроза опухолевых клеток и влияние этих взаимодействий на развитие пре-дендритных и дендритных клеток у человека.
Дендритные клетки являются наиболее потентными антигенпрезентирующими клетками, индуцирующими образование первичных специфических Т-клеток в ответ на воздействие антигена как in vivo, так и in vitro. Дендритные клетки, генерированные in vitro, могут быть использованы после воздействия антигеном для вторичной иммунизации в целях вакцинотерапии против ВИЧ и опухолей. Авторами настоящей заявки были разработаны in vitro-системы для генерирования чел. дендритных клеток из CD34+-пoпyляций костного мозга, периферической и центральной крови человека. При этом, было установлено, что присутствие GM-CSF и TNFα является необходимым для дифференцировки дендритных клеток в суспензионной культуре и колоногенном анализе; а с-kit-лиганд синергически повышает число дендритных клеток/колоний дендритных клеток. В Таблице 3а показано, что в клоногенном анализе с использованием CD34+-клеток костного мозга взрослого человека для развития дендритных клеточных колоний совершенно необходима синергичная стимуляция KL в комбинации с GM-СSF и TNF. В CD34+-популяциях крови GM-CSF + один TNFα индуцируют и образование колоний дендритных клеток, однако при добавлении KL частота образования колоний увеличивается (Таблица 1b). Сравнение нескольких цитокинов показало, что максимальное образование колоний дендритных клеток стимулировалось комбинаций KL, GC-CSF и TNFα (Таблица 1с). В системах суспензионных культур, комбинация IL-1 + KL + IK-3 способствовала 100-кратному увеличению предендритных клеток на 14 день культивирования; а добавление GM-CSF + KL + TNF способствовало дифференцировке этих клеток в дендритные антигенпроезентирующие клетки в связи с аллогенной реакцией смешанных лимфоцитов и митогенезом CD3-Т-лимфоцитов. KL оказывает уникальное стимулирующее действие на генерирование предендритных и дендритных клеток для примитивных клеток-предшественников костного мозга/стволовых клеток.
CD34+-клетки выделяли из моноядерных клеточных фракций нормального костного мозга путем иммуномагнитной сепарации с использованием микросфер для фракционирования. IL-1, KL, IL-3 и GM-CSF использовали при концентрации 10 нг/мл. Клетки засевали с плотностью 2•103 кл./мл и через 14 дней проводили оценку колоний дендритных клеток.
CD34+-клетки выделяли путем иммуномагнитной сепарации, и культивировали при плотности 103 кл./мл в 10 DM-среде, дополненной 20% плодной сывороткой теленка и 0,36% агарозой, в течение 14 дней. Через 14 дней колонии дендритных клеток идентифицировали путем морфологического анализа, rhKL, IL-3, и rhGM-CSF использовали при 10 нг/мг.
CD34+-клетки выделяли путем иммуномагнитной сепарации и культивировали при плотности 103 кл//мл, rhKL, rhIL-3, rhGM-CSF, rhG-CSF, rhM-CSF и rhPIXY использовали при плотности 10 нг/мл. Через 14 дней после культивирования дендритные клетки идентифицировали путем морфологического анализа.
Реферат
Изобретение относится к области медицины и касается фармацевтической композиции, содержащей c-kit-лиганд и гемопоэтический фактор, способа повышения уровней стволовых клеток в периферической крови, антагониста c-kit лиганда, антисмысловой молекулы нуклеиновой кислоты, способа увеличения уровней клеток периферической крови ex-vivo. Сущность изобретения включает фармацевтическую композицию на основе c-kit-лиганда, представляющего собой полипептид, кодируемый нуклеиновой кислотой SEQ ID NО:l, или природно встречающийся гемопоэтический вариант полипептида, а также эффективное количество гемопоэтического фактора, способ повышения уровня стволовых клеток в периферической крови млекопитающего с применением указанной композиции. Кроме того, раскрывается антисмысловые нуклеиновые кислоты для использования в качестве терапевтических средств, а также способ увеличения уровней клеток периферической крови ex-vivo, включающий обработку клеток периферической крови ex-vivo указанной композицией. Преимущество изобретения заключается в создании нового гемопоэтического средства. 4 с. и 10 з.п.ф-лы, 35 ил., 3 табл.
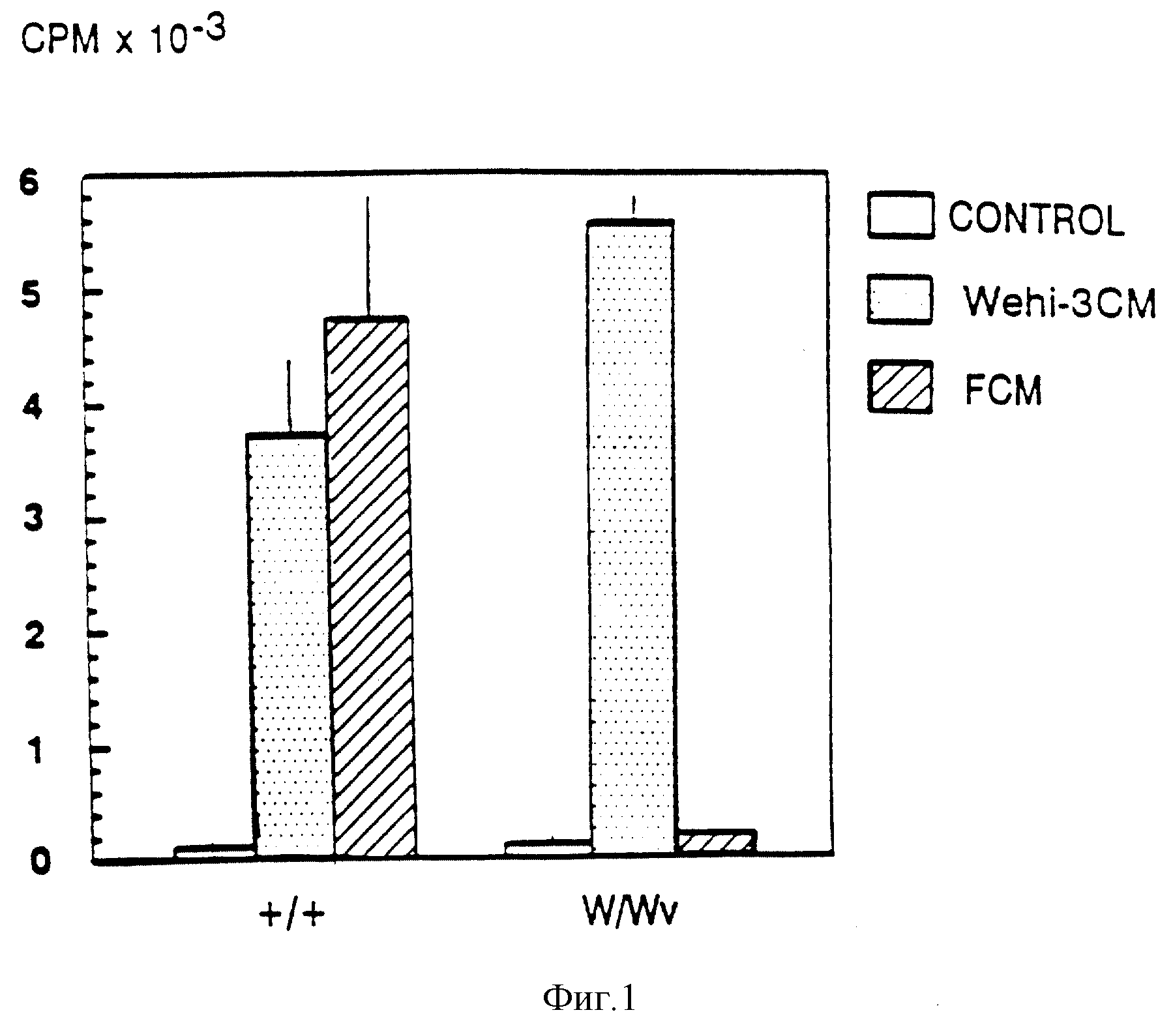

Комментарии