Новый вариант альфа-1-антитрипсина, способ его получения и применения - RU2567007C1
Код документа: RU2567007C1
Чертежи






Описание
Область техники
Настоящее изобретение имеет отношение к новому варианту альфа-1-антитрипсина, способу его получения и его применению.
Предшествующий уровень техники
Альфа-1-антитрипсин представляет собой белок, состоящий из 394 аминокислотных остатков, имеющий молекулярную массу приблизительно 50,000 дальтон (Da) и присутствующий в крови млекопитающих. Альфа-1-антитрипсин является одним из основных белков крови, концентрация которого в крови составляет приблизительно 2 мг/мл (Robin W.C. et. al., Nature, 298, 329-334, 1982), при этом он также известен под названием альфа-1-ингибитор протеаз. Альфа-1-антитрипсин имеет, по меньшей мере, около 100 природных аллелей, и его фенотипы классифицируются по категориям от A до Z в соответствии с профилями изоэлектрического фокусирования (IEF). Известно, что наиболее распространенный аллель M-типа присутствует в крови большинства людей, имеет, по меньшей мере, приблизительно 75 различных изоформ (Brantley, M. et. al., Am. J. Med., 84 (suppl. 6A), 13-31, 1988) и сохраняет основную функцию ингибитора протеаз.
В общем, известно, что приблизительно 90% изоформ альфа-1-антитрипсина присутствуют в виде пяти PiM подтипов, таких как M1, M2, M3, M4 и M5. Из их числа M1, M2 и M3 составляют приблизительно 67%, 16% и 11%, соответственно (Jan-Olof Jeppson and Carl-Bertil Laurell, FEBS Lett., 231, 327-330, 1986). Известно, что M2 и M3 подтипы имеют гистидин (His) и аргинин (Arg) в 101ом положении от N-конца, соответственно, а также известно, что отличие по этой аминокислоте не оказывает влияния на природную активность альфа-1-антитрипсина.
Альфа-1-антитрипсин представляет собой гликопротеин, который гликозилируется по 3 сайтам (Mega, Т. et. al., J. Biol. Chem., 255, 4057-4061, 1980). Рентгеновская кристаллическая структура показывает, что он состоит из 3-х бета листов и 8-ми альфа-спиралей подобно другим ингибиторам протеазы (серпинам), присутствующим в крови (Elliot P.R., et. al., JMB, 275, 419-425, 1998). Функция альфа-1-антитрипсина заключается в ингибировании различных видов протеаз в организме, а его главной функцией in vivo, связанной с известными в настоящее время болезнями, является ингибирование активности эластазы нейтрофилов (Beatty et. al., J. Biol. Chem., 255, 3931~3934, 1980). Недостаток альфа-1-антитрипсина вызывает такие тяжелые болезни, как эмфизема легких, при которых функция легких нарушается вследствие разрушения эластина. Кроме того, имеются клинические отчеты, показывающие, что модифицированные белки альфа-1-антитрипсина в норме не секретируются печенью, но накапливаются в печени, что приводит к началу цирроза печени.
В последние годы некоторые продукты, полученные из крови человека, были одобрены Управлением США по контролю за продуктами питания и медицинскими изделиями (FDA) и имеются в продаже в качестве терапевтических средств для лечения дефицита альфа-1-антитрипсина. Характерные примеры таких продуктов включают Prolastin (коммерчески доступный от Talecris Plasma Resources Inc), Aralast (коммерчески доступный от Baxter Inc) и Zemaira (коммерчески доступную от CSL Behring Inc), которые в большинстве случаев вводятся в организм человека в дозе 60 мг/кг с помощью внутривенной инъекции с интервалами в одну неделю. Следовательно, белок должен вводиться взрослому пациенту в большой дозе от 4 до 5 г в течение длительного периода времени.
Согласно анализу мониторинга данных (DMHC2364) в США и Европе насчитывается около 200,000 пациентов, имеющих генетические проблемы, связанные с альфа-1-антитрипсином, однако только часть этих пациентов получает лечение, в силу того, что остальным не поставлен правильный диагноз. Все созданные до настоящего времени продукты медицинского назначения представляют собой альфа-1-антитрипсин, полученный из крови человека. Извлеченный из крови человека альфа-1-антитрипсин может содержать вирусы из организма человека, которые могут вызывать фатальные для людей болезни, такие как вирус иммунодефицита человека (HIV), вирус гепатита B или вирус гепатита C, даже если он полностью исключен в ходе процесса изготовления. Даже в том случае, когда при получении альфа-1-антитрипсина проводятся скрининговый анализ крови с целью обнаружения некоторых патогенов и процедура инактивации вирусов, невозможно устранить редкие патогены, которые до сих пор неизвестны. Следовательно, всегда существует риск инфицирования организма человека неизвестными патогенами при использовании выделенного из крови альфа-1-антитрипсина. Кроме того, стабильная поставка незараженной крови, используемой для производства коммерчески необходимого количества альфа-1-антитрипсина, является проблематичной.
В качестве альтернативы для решения упомянутых выше проблем может быть использован метод рекомбинантных ДНК для создания альфа-1-антитрипсина, в качестве терапевтического средства. Поэтому метод рекомбинантных ДНК постоянно разрабатывается, однако до сих пор отсутствует коммерчески доступный рекомбинантный альфа-1-антитрипсин вследствие различных ограничивающих факторов.
Известно, что человеческий альфа-1-антитрипсин имеет 3 N-гликановых фрагмента, так как он гликозилируется по 3 сайтам (аспарагин в 46ом положении, аспарагин в 83ем положении и аспарагин в 247ом положении). Поскольку альфа-1-антитрипсин, полученный методом рекомбинантных ДНК с использованием микроорганизмов, таких как Е. coli, не гликозилируется, известно, что при введении в организм он имеет короткий период полужизни in vivo (Karnaukhova et. al., Amino Acids, 30, 317-332, 2006, Garver Jr. et. al., Proc. Natl. Acad. Sci. USA., 84, 1050-1054, 1987). Для решения этой проблемы, а также эффективного производства большого количества альфа-1-антитрипсина, было проведено исследование экспрессии альфа-1-антитрипсина у растений. Однако было обнаружено, что хотя у рекомбинантного альфа-1-антитрипсин, экспрессированного в растениях, наблюдалось характерное для растений гликозилирование, он имел еще более короткий период полужизни в организме, чем человеческий альфа-1-антитрипсин (Huang et. al., Biotechnol. Prog., 17, 126-133, 2001).
С целью увеличения периода полужизни альфа-1-антитрипсина в организме Cantin et. al. предложили гибридный белок, полученный путем конъюгации полиэтиленгликоля с остатком цистеина альфа-1-антитрипсина, экспрессированного в микроорганизмах (Cantin et. al., Am. J. Respir. Cell. Mol. Biol., 27, 659-665, 2002). В статье сообщается, что в том случае, когда полиэтиленгликоль, имеющий молекулярную массу от 20 до 40 кДа, был соединен с остатком цистеина альфа-1-антитрипсина, экспрессированного в микроорганизме, конъюгированный альфа-1-антитрипсин имел увеличенный период полужизни в организме по сравнению с альфа-1-антитрипсином, экспрессированным в микроорганизме, что приводит по существу к такому же периоду полужизни, как у человеческого альфа-1-антитрипсина. Однако при соединении полиэтиленгликоля с белком могут образовываться различные гетерогенные продукты реакции из-за побочных химических реакций. В связи с этим, требуются дополнительные стадии для удаления гетерогенных продуктов реакции. Кроме того, поскольку не существует N-гликановых фрагментов в альфа-1-антитрипсине, конъюгированном с PEG, это может быть причиной возникновения проблем с иммуногенностью при лечении людей, вызванных экспонированными аминокислотными последовательностями.
Известно, что альфа-1-антитрипсин, полученный из клеток животных, имеет в основном тот же самый период полужизни в организме как человеческий альфа-1-антитрипсин (Garver Jr. et. al., Proc. Natl. Acad. Sci. USA., 84, 1050-1054, 1987). Поэтому для получения альфа-1-антитрипсина имеющего структуру, сходную с человеческим альфа-1-антитрипсином, может быть предпочтительным получение в животных клетках. Несмотря на преимущество альфа-1-антитрипсина, происходящего из животных клеток, производство альфа-1-антитрипсина с использованием животных клеток связано с проблемой, поскольку этот способ является в целом более дорогим, чем способ получения альфа-1-антитрипсина в микроорганизмах.
В то же время, была предложена технология добавления сайта гликозилирования в участок петли альфа-1-антитрипсина с целью увеличения периода полужизни in vivo альфа-1-антитрипсина. В общем, можно предположить, что когда белок, экспрессируемый в животных клетках, является гликозилированным, можно считать, что белок имеет увеличенный период полужизни в организме вследствие увеличенного гидродинамического объема гликозилированного белка при введении в организм человека по сравнению с негликозилированными белками. Однако, как можно видеть на примере эритропоэтинов, изменение или добавление сайта гликозилирования к физиологически активному белку оказывает большое влияние на период полужизни белка in vivo в зависимости от положений сайтов гликозилирования (Eliott et. al., Nat. Biotechnol., 21, 414-421, 2003). Следовательно, когда сайт гликозилирования добавляется к альфа-1-антитрипсину с целью увеличения периода полужизни in vivo и физиологической стабильности, необходимо тщательно контролировать к какому положению(ям) альфа-1-антитрипсина добавляется сайт гликозилирования.
В заключение, предпринималось множество попыток создать методику, получения альфа-1-антитрипсина с использованием методов рекомбинантных ДНК, который бы имел увеличенную устойчивость in vivo. Однако такие существующие методы не пригодны для получения альфа-1-антитрипсина в качестве медикамента вследствие различных проблем, описанных выше. Следовательно, существует острая необходимость в новом способе получения рекомбинантного альфа-1-антитрипсина, обладающего хорошей устойчивостью в организме.
Техническая проблема
С целью получения рекомбинантного альфа-1-антитрипсина, обладающего практической ценностью для клиники, настоящие изобретатели получили варианты альфа-1-антитрипсина путем добавления сайтов гликозилирования к альфа-1-антитрипсину в различных конкретных положениях и обнаружили, что вариант альфа-1-антитрипсина обладает превосходной устойчивостью в организме и сохраняет ингибирующее действие на эластазу, причем значительно увеличивается период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства в крови от времени (AUC). Следовательно, настоящее изобретение выполнено с учетом этих фактов.
Техническое решение
Согласно одному аспекту настоящего изобретения предоставляется вариант альфа-1-антитрипсина, полученный путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно одному типичному варианту осуществления настоящего изобретения вариант альфа-1-антитрипсина может иметь от 1 до 3 дополнительных центров гликозилирования.
Согласно другому типичному варианту осуществления настоящего изобретения определенный сайт может находиться между 3им и 13ым положениями N-конца.
Согласно другому типичному варианту осуществления настоящего изобретения определенный сайт может находиться в 9ом или 12ом положении N-конца.
Согласно еще одному типичному варианту осуществления настоящего изобретения определенный сайт может находиться в 4ом или 9ом положениях, 4ом или 12ом положениях или 9ом и 12ом положениях.
Согласно другому аспекту настоящего изобретения предоставляется способ получения варианта альфа-1-антитрипсина, включающий замену аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования, культивирование клеток трансформированных вектором экспрессии альфа-1-антитрипсина, обладающим добавленным к нему сайтом гликозилирования, в культуральной среде, экспрессирование варианта белка альфа-1-антитрипсина из клеток и очистку и извлечение экспрессированного варианта белка альфа-1-антитрипсина.
Согласно еще одному аспекту настоящего изобретения предоставляется композиция, предназначенная для предотвращения или лечения дефицита альфа-1-антитрипсина, включающая вариант альфа-1-антитрипсина в качестве активного ингредиента, при этом вариант альфа-1-антитрипсина получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно одному типичному варианту осуществления настоящего изобретения дефицит альфа-1-антитрипсина может являться хронической обструктивной болезнью легких или циррозом печени.
Согласно следующему аспекту настоящего изобретения предоставляется способ предотвращения или лечения дефицита альфа-1-антитрипсина, включающий введение терапевтически эффективного количества варианта альфа-1-антитрипсина пациенту, при этом вариант альфа-1-антитрипсина получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно еще одному аспекту настоящего изобретения предоставляется вариант гибридного белка альфа-1-антитрипсина, обладающий увеличенным периодом полужизни в организме, при этом гибридный белок получают путем связывания двух вариантов альфа-1-антитрипсина, каждый из которых получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью введения дополнительного сайта гликозилирования.
Согласно следующему аспекту настоящего изобретения предоставляется вариант гибридного белка альфа-1-антитрипсина, включающий гетерогенный белок, обладающий повышенным периодом полужизни в организме, при этом гибридный белок получают путем связывания варианта альфа-1-антитрипсина с гетерогенным белком, а вариант альфа-1-антитрипсина получают путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью добавления сайта гликозилирования.
Согласно одному типичному варианту осуществления настоящего изобретения вариант альфа-1-антитрипсина может иметь дополнительную замену аминокислоты пролина в 357ом положении, которое является Р2 положением, на аспарагин.
Полезные эффекты
Вариант альфа-1-антитрипсина согласно настоящему изобретению обладает превосходной устойчивостью в организме и сохраняет ингибирующее действие на активность эластазы, в силу того, что период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства в крови от времени (AUC) значительно увеличиваются при добавлении сайта N-гликозилирования в результате мутации аминокислоты между 1ым и 25ым положениями N-конца альфа-1-антитрипсина. Следовательно, вариант альфа-1-антитрипсина согласно настоящему изобретению можно использовать при предотвращении или лечении дефицита альфа-1-антитрипсина. Кроме того, вариант альфа-1-антитрипсина согласно настоящему изобретению можно использовать при лечении дефицита альфа-1-антитрипсина и можно использовать для увеличения периода полужизни гетерогенного белка в организме, когда гетерогенный белок связан с вариантом альфа-1-антитрипсина.
Описание чертежей
Эти и другие признаки, аспекты и преимущества предпочтительных вариантов осуществления настоящего изобретения будут более подробно описаны в последующем описании изобретения и прилагаемых чертежах.
Фиг. 1 - схематическое изображение вектора альфа-1-антитрипсина (рТ003) согласно настоящему изобретению;
Фиг. 2 - диаграмма, показывающая последовательности и положения вариантов альфа-1-антитрипсина согласно настоящему изобретению;
Фиг. 3 - диаграмма, показывающая результаты SDS-PAGE очищенного альфа-1-антитрипсин и его вариантов согласно настоящему изобретению;
Фиг. 4 - фармакокинетическая кривая выделенного из плазмы альфа-1-антитрипсина и рекомбинантного альфа-1-антитрипсина, экспрессированного в животных клетках, после подкожного введения согласно настоящему изобретению;
Фиг. 5 - фармакокинетическая кривая альфа-1-антитрипсина и его вариантов после подкожного введения согласно настоящему изобретению;
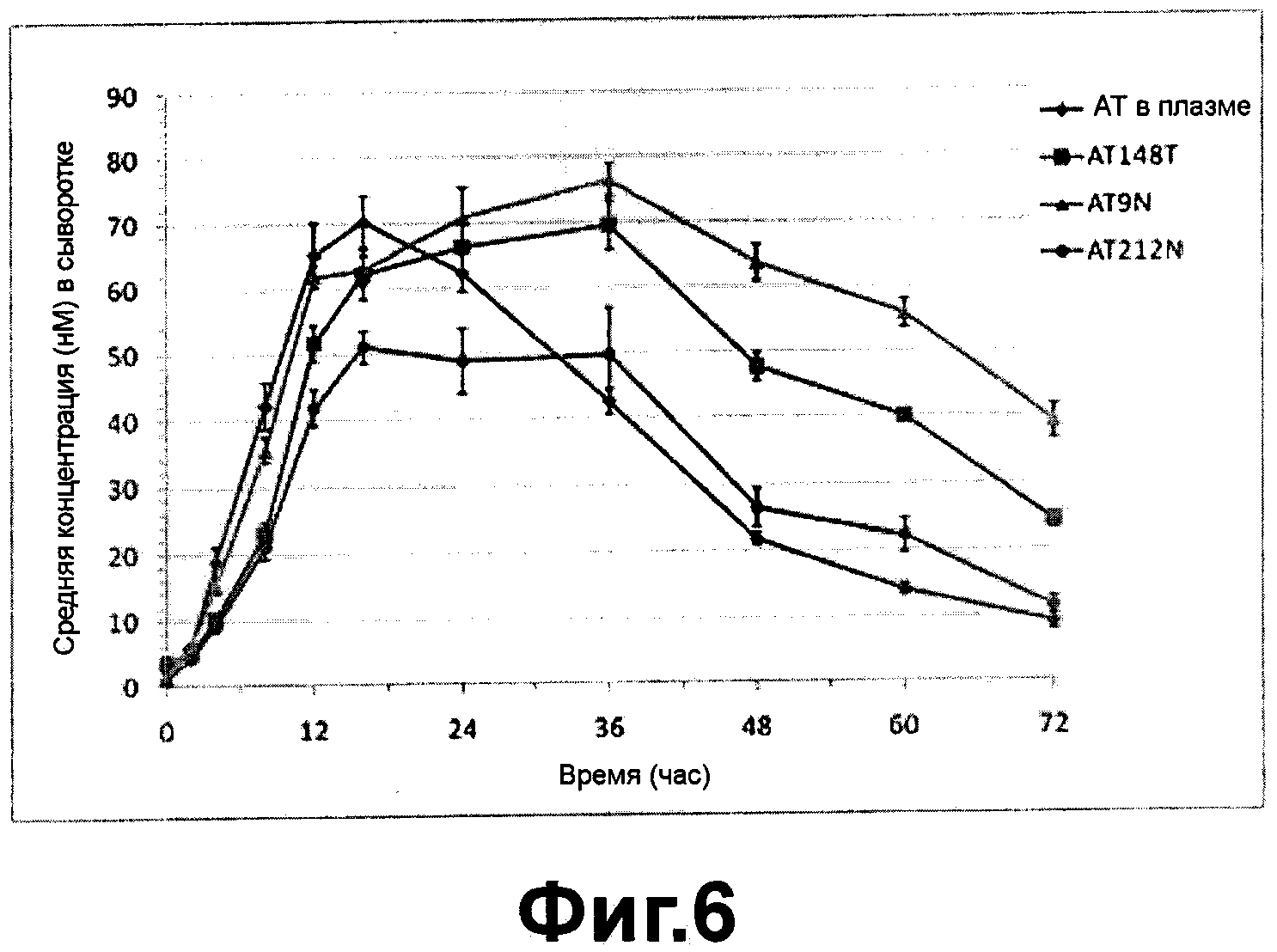
Фиг. 6 - фармакокинетическая кривая полученного из плазмы альфа-1-антитрипсин и рекомбинантных вариантов альфа-1-антитрипсина после подкожного введения согласно настоящему изобретению;
Фиг. 7 - фармакокинетическая кривая вариантов альфа-1-антитрипсина после подкожного и внутривенного введения согласно настоящему изобретению;
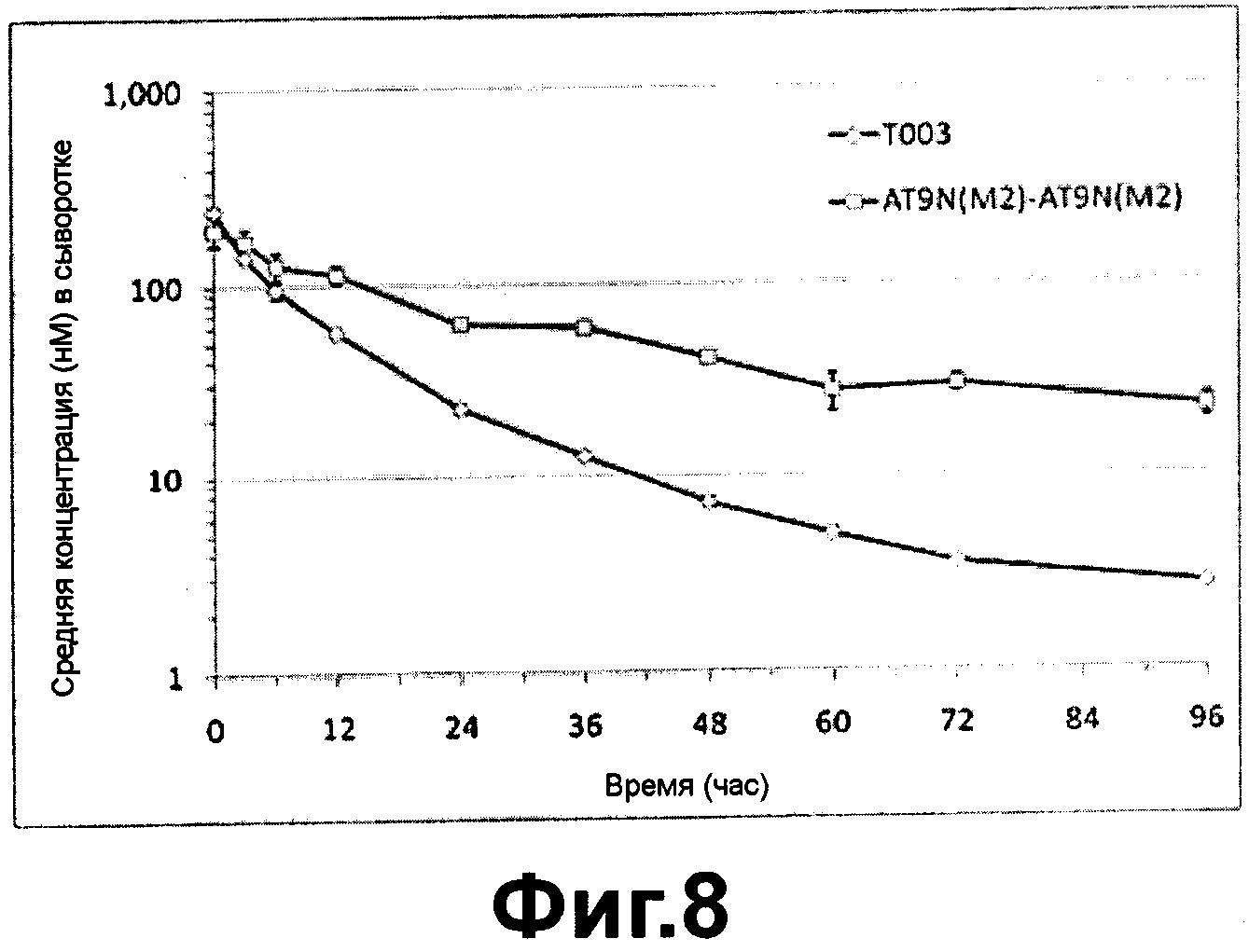
Фиг. 8 - фармакокинетическая кривая альфа-1-антитрипсина и его димера после внутривенного введения согласно настоящему изобретению;
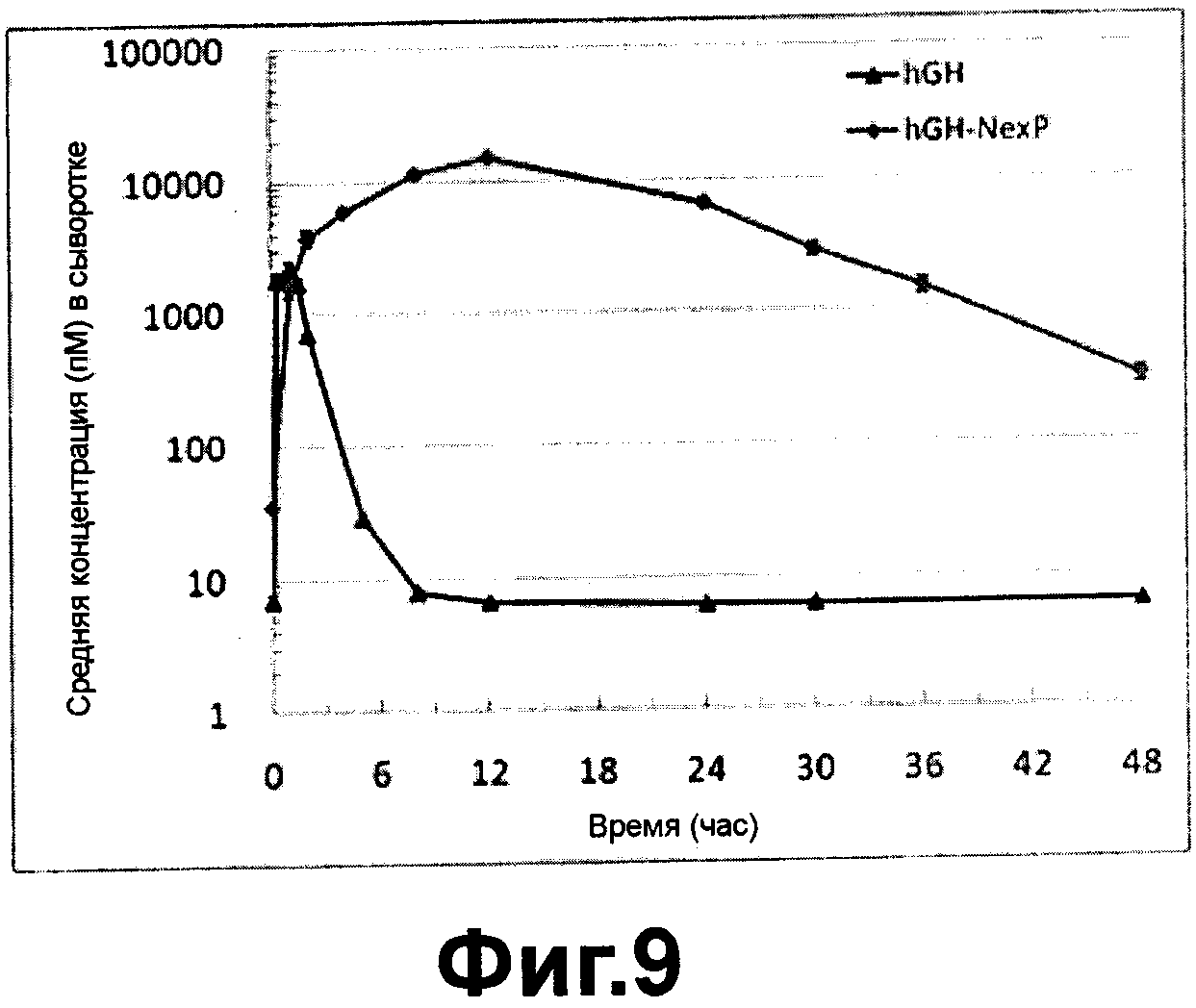
Фиг. 9 - фармакокинетическая кривая человеческого гормона роста/варианта гибридного альфа-1-антитрипсина после подкожного введения согласно настоящему изобретению; и
Фиг. 10 - фармакокинетическая кривая гранулоцитарного колониестимулирующего фактора/варианта гибридного альфа-1-антитрипсина после подкожного введения согласно настоящему изобретению.
Способы осуществления изобретения
Настоящее изобретение относится к варианту альфа-1-антитрипсина, полученному путем замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью добавления сайта гликозилирования.
Вариант альфа-1-антитрипсина согласно настоящему изобретению отличается тем, что в дополнение к трем сайтам гликозилирования (аспарагин в 46ом положении, аспарагин в 83ем положении и аспарагин в 247ом положении) альфа-1-антитрипсина, аминокислота в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина заменяется с целью добавления сайта N-гликозилирования. Количество добавляемых сайтов гликозилирования не ограничивается. Например, количество сайтов гликозилирования может находиться в пределах от 1 до 3.
Добавление сайта N-гликозилирования к определенному сайту на N-конце человеческого альфа-1-антитрипсина может осуществляться с целью образования последовательности Asn-X-Thr/Ser, являющейся последовательностью, кодирующей сайт присоединения N-гликана между 1ым и 25ым положениями N-конца. Предпочтительно, глутамин, аминокислота, присутствующая между 3ьим и 13ым положениями N-конца человеческого альфа-1-антитрипсина и предпочтительно присутствующая в 9ом или 12ом положении N-конца, заменяется аспарагином для добавления сайта гликозилирования. Варианты, образованные добавлением сайта гликозилирования, могут иметь структуру, в которой сахара добавляются в 4ом и 90ом положениях, 4ом и 12ом положениях или 9ом и 12ом положениях. В дополнение к описанным здесь специфическим сайтам варианты альфа-1-антитрипсина могут гликозилироваться в другом сайте в 25ом положении N-конца.
Кроме того, настоящее изобретение имеет отношение к способу получения варианта альфа-1-антитрипсина, включающему замену аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца альфа-1-антитрипсина с целью добавления сайта гликозилирования, культивирование клеток, трансформированных вектором экспрессии альфа-1-антитрипсина, имеющим добавленный к нему сайт гликозилирования, в культуральной среде, выделение варианта альфа-1-антитрипсина из культуральной среды, очистку и восстановление экспрессированного варианта белка альфа-1-антитрипсина.
В качестве упомянутой выше технологии добавления сайта N-гликозилирования может использоваться метод рекомбинантных ДНК, причем аминокислота может быть замещена, вставлена и удалена с помощью генной инженерии с целью добавления сайта N-гликозилирования. Приблизительно 20 аминокислот N-конца человеческого альфа-1-антитрипсина составляют участок, который был с трудом обнаружен в рентгеновской кристаллической структуре альфа-1-антитрипсина (PDB код: 1QLP, 2QUG, 3CWL, 1PSI, 7API, 1KCT (www.pdb.org)). В этом случае N-концевой участок альфа-1-антитрипсина имел трехмерную структуру, которая была очень гибкой и неорганизованной.
Вариант альфа-1-антитрипсина согласно настоящему изобретению может быть получен путем мутации, по меньшей мере, одной аминокислоты с использованием метода сайт-направленного мутагенеза. Например, когда глутамин в 9ом положении человеческого альфа-1-антитрипсина заменяется аспарагином, или глицин в 148ом положении заменяется аспарагином, при этом модифицированный человеческий альфа-1-антитрипсин экспрессируется в животных клетках, сайт гликозилирования образуется на остатке аспарагина используемого вместо глутамина (9ое) или глицина (148ое). Так же, когда глицин в 148ом положении заменяется треонином, новый сайт гликозилирования формируется на аспарагине в 146ом положении. В этом случае сайт гликозилирования может быть добавлен в различных положениях альфа-1-антитрипсина.
В настоящем изобретении вариант альфа-1-антитрипсина получают путем добавления сайта N-гликозилирования в результате замены аминокислоты в определенном сайте между 1ым и 25ым положениями N-конца человеческого альфа-1-антитрипсина, который был неорганизованным в рентгеновской кристаллической структуре альфа-1-антитрипсина (А1АТ), в дополнение к трем сайтам гликозилирования (аспарагин в 46ом положении, аспарагин в 83ем положении и аспарагин в 247ом положении) человеческого альфа-1-антитрипсина. Затем вариант альфа-1-антитрипсина экспрессируется в клетках яичника китайского хомячка и очищается до высокой степени очистки с использованием хроматографии.
Очищенный вариант альфа-1-антитрипсина, имеющий добавленный к нему сайт N-гликозилирования, при окрашивании наблюдается в виде полосы, которая располагается в относительно более высоком положении, чем альфа-1-антитрипсин дикого типа в SDS-PAGE-анализе. Это показывает, что молекулярная масса варианта альфа-1-антитрипсина увеличивается при гликозилировании.
Кроме того, очищенный вариант альфа-1-антитрипсина обладает превосходной устойчивостью в организме, что видно по заметному увеличению площади под кривой зависимости концентрации лекарственного средства от времени (AUC) и периода полужизни in vivo (t1/2). Однако в случае варианта (I26T), в котором аминокислота в 26ом положении альфа-1-антитрипсина заменяется треонином, устойчивость in vivo не улучшалась даже при добавлении сайта N-гликозилирования. Кроме того, добавление сайта гликозилирования к участку петли (петля A, петля B, петля C, петля D, или петля E), как описано в WO 2008/151845, или поблизости от участка петли не оказывает существенного влияния на улучшение устойчивости in vivo вариантов альфа-1-антитрипсина. Кроме того, поскольку гликозилирование участка петли может оказывать влияние на активность альфа-1-антитрипсина, который в основном функционирует как ингибитор протеаз, очень важно выбрать положение гликозилирования, не оказывающее влияния на активность альфа-1-антитрипсина.
Также было подтверждено, что очищенный вариант альфа-1-антитрипсина сохранял ингибирующее действие на эластазу. Кроме того, известно, что константа скорости ассоциации человеческого альфа-1-антитрипсина находилась в основном в пределах от 1.0±0.2×105 (Boudier С., 1994) до 1.67×106 M-1сек-1 (Terashima M, et. al., Appl. Microbiol. Biotechnol., 52(4), 516-523, 1999). Человеческий альфа-1-антитрипсин дикого типа и его варианты согласно настоящему изобретению имеют константы скорости ассоциации и константы равновесия, сходные с константами человеческого альфа-1-антитрипсина. Следовательно, можно видеть, что гликозилирование N-конца альфа-1-антитрипсина не влияло на ингибирование активности эластазы.
Кроме того, настоящее изобретение имеет отношение к варианту гибридного белка альфа-1-антитрипсина, имеющему увеличенное время полужизни в организме. При этом гибридный белок получают путем соединения двух вариантов альфа-1-антитрипсина друг с другом.
Настоящие изобретатели получили двойной вариант альфа-1-антитрипсина, в котором аминокислота пролин в 357ом положении, которое было P2 положением варианта альфа-1-антитрипсина, была дополнительно заменена аспарагином; получили гибридный белок, в котором гранулоцитарный колониестимулирующий фактор был связан с двойным вариантом альфа-1-антитрипсина; провели фармакокинетическое исследование и подтвердили, что гибридный белок обладал повышенной устойчивостью в организме (смотри Экспериментальный Пример 5). Из этих результатов видно, что период полужизни in vivo гетерогенного белка, например физиологически активного белка, увеличивалось, когда физиологически активный белок был связан с двойным вариантом альфа-1-антитрипсина.
Следовательно, настоящее изобретение имеет отношение к варианту гибридного белка альфа-1-антитрипсина, при этом время полужизни in vivo другого гетерогенного белка увеличивается путем связывания гетерогенного белка с вариантом альфа-1-антитрипсина. Тип гетерогенного белка не ограничивается, тем не менее, он может быть физиологически активным пептидом или физиологически активным белком.
Вариант гибридного белка альфа-1-антитрипсина, имеющий увеличенный период полужизни, можно получить путем связывания двух или более очищенных вариантов альфа-1-антитрипсина. В результате предыдущих исследований Sytkowski, A.J. et. al. было сделано сообщение, что когда эритропоэтин (ЕРО) был связан с использованием подходящего линкера с целью получения гибридного белка ЕРО-ЕРО, гибридный белок обладал значительно повышенной активностью и более длительным периодом полужизни в организме, чем мономер ЕРО (Sytkowski, A.J., et. al., J. Biol. Chem., 274, 24773-24778, 1999). Следовательно, когда два или более вариантов альфа-1-антитрипсина настоящего изобретения связаны друг с другом, ожидается, что период полужизни гибридного белка будет увеличен по сравнению с мономером варианта альфа-1-антитрипсина. Кроме того, когда физиологически активный пептид или иммунорегуляторный фактор или цитокин или тому подобное с коротким периодом полужизни в организме связывается с вариантом альфа-1-антитрипсина согласно настоящему изобретению, ожидается, что период полужизни in vivo будет существенно увеличиваться, тем самым демонстрируя достаточно устойчивое действие.
Кроме того, настоящее изобретение имеет отношение к композиции, предназначенной для предотвращения или лечения дефицита альфа-1-антитрипсина, включающей вариант альфа-1-антитрипсина в качестве активного ингредиента.
В дополнение к этому, настоящее изобретение имеет отношение к способу предотвращения или лечения дефицита альфа-1-антитрипсина, который включает введение терапевтически эффективного количества варианта альфа-1-антитрипсина пациенту.
Как описано выше, вариант альфа-1-антитрипсина согласно настоящему изобретению обладает превосходной устойчивостью в организме и сохраняет ингибирующее действие в отношении эластазы, в силу того, что период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства от времени (AUC) существенно увеличиваются при добавлении сайта N-гликозилирования в результате мутации аминокислоты между 1ым и 25ым положениями N-конца альфа-1-антитрипсина. Следовательно, вариант альфа-1-антитрипсина согласно настоящему изобретению может использоваться для предотвращения или лечения дефицита альфа-1-антитрипсина. Дефицит альфа-1-антитрипсина включает хроническую обструктивную болезнь легких (COPD) или цирроз печени, предпочтительно эмфизему легких, однако настоящее изобретение не ограничивается этим.
В дополнение к варианту альфа-1-антитрипсина композиция согласно настоящему изобретению может включать, по меньшей мере, один известный активный ингредиент, способный предотвращать или лечить дефицит альфа-1-антитрипсина.
Композиция согласно настоящему изобретению дополнительно может включать, по меньшей мере, один фармацевтически приемлемый носитель в дополнение к активному ингредиенту, как описано выше, для целей введения. Фармацевтически пригодный носитель может использоваться в комбинации, по меньшей мере, с одним средством, выбранным из группы, состоящей из физиологического раствора, стерильной воды, раствора Рингера, забуференного солевого раствора, раствора декстрозы, раствора мальтодекстрина, глицерина, этанола и их смеси. При необходимости может быть добавлена другая типичная добавка, такая как антиоксидант, буфер и бактериостатическое средство. Кроме того, разбавитель, диспергирующее вещество, поверхностно-активное вещество, связующее вещество и смазывающее вещество дополнительно добавляют в композицию, которая затем может быть заключена в состав для инъекции или в состав пилюли, капсулы, гранулы или таблетки. Кроме того, композиция может быть создана в соответствии с болезнями или ингредиентами с использованием надлежащего способа, известного в соответствующем уровне техники, или метода, раскрытого в последней редакции Фармации Ремингтона (Remington′s Pharmaceutical Science, Mack Publishing Company, Easton PA).
Композиция согласно настоящему изобретению может быть введена перорально или парентерально (например, с помощью внутривенной, подкожной или внутрибрюшинной инъекции, ингаляции или местного применения) в соответствии с желательным методом, и может использоваться для генной терапии с использованием варианта альфа-1-антитрипсина согласно настоящему изобретению. Доза композиции может варьировать в зависимости от веса, возраста, пола и состояния здоровья пациента, диеты, времени введения, способа введения, скорости высвобождения медикамента и тяжести болезни. Доза варианта альфа-1-антитрипсина, которая вводится один раз в неделю, - это доза менее чем 60 мг/кг (это доза альфа-1-антитрипсина), однако композиция в этой дозе показывает фактически такую же клиническую эффективность. Кроме того, когда вариант альфа-1-антитрипсина вводится в той же самой дозе как альфа-1-антитрипсин дикого типа, ожидается, что композиция будет демонстрировать ту же самую клиническую эффективность, даже когда продолжительность введения увеличивается.
Композиция настоящего изобретения может использоваться отдельно или в комбинации с хирургическим лечением, гормональной терапией, лекарственной терапией и с методами, использующими модификатор биологического ответа.
Далее для лучшего понимания настоящего изобретения предоставляются предпочтительные Примеры и Экспериментальные Примеры. Однако следует понимать, что предоставленное здесь подробное описание предназначается только для лучшего понимания настоящего изобретения и не предназначается для ограничения объема настоящего изобретения.
Пример 1: Получение альфа-1-антитрипсина, его варианта и димера
1-1. Создание вектора экспрессии pAV1
Вектор pAV1, созданный с помощью соответствующей модификации исходного вектора pSGHVO (GenBank, учетный № AF 285183) с целью производственного применения, использовали в качестве вектора экспрессии для клонирования в настоящем изобретении. Исходным вектором был лабораторный вектор, созданный для того, чтобы легко очищать белок, обладающий физиологической активностью, в том случае, когда белок человеческого происхождения сверхэкспрессировался в высокой концентрации и высвобождался из животных клеток, но не проявлял активность, когда белок экспрессировался в бактерии, такой как Е. coli. Однако, так как исходный вектор имел различные ограничения по использованию в производстве, исходный вектор был модифицирован, чтобы использоваться в производстве с высоким уровнем экспрессии белка, что является самым большим преимуществом вектора pSGHV0.
1-2. Создание вектора альфа-1-антитрипсина (подтип M3) (рТ003)
Вектор альфа-1-антитрипсина (рТ003) был сконструирован клонированием гена альфа-1-антитрипсина (M3) в вектор pAV1, с использованием hMU001448 (KRIBB) в качестве матрицы. Подробнее, hMU001448 (KRIBB) матрица была амплифицирована с помощью полимеразной цепной реакции (ПЦР) с использованием двух праймеров: XhoAT прямой праймер (5′-CCCTCCTCGAGAATGCCGTCTTCTGTCTCG-3′, SEQ ID NO: 1) и ATNot обратный праймер (5′-GGGCCCGCGGCCGCAGTTATTTTTGGGTGG G-3′, SEQ ID NO: 2). Оба конца амплифицированного нуклеотида были расщеплялены двумя рестрикционными ферментами XhoI и NotI и соединены с вектором экспрессии pAV1, имеющим сайт рестрикции XhoI/NotI, давая в результате конструкцию вектора альфа-1-антитрипсина (рТ003, SEQ ID NO: 39). Этот вектор альфа-антитрипсина (рТ003) схематически показан на ФИГ. 1.
1-3. Получение варианта альфа-1-антитрипсина (M3)
Для получения множества вариантов альфа-1-антитрипсина, имеющих дополнительный сайт гликозилирования, вектор альфа-1-антитрипсина (рТ003), полученный в Примере 1-2, использовали в качестве матрицы. Для получения вариантов альфа-1-антитрипсина использовали пары прямых и обратных праймеров, перечисленные в следующей Таблице 1, и набор для мутагенеза (Enzynomix, EZchangeTM Site-Directed Mutagenesis Kit). Последовательности и положения вариантов альфа-1-антитрипсина показаны на ФИГ. 2.
Так как целью мутаций всех вариантов альфа-1-антитрипсина было добавление сайта N-гликозилирования, первоначальная аминокислота заменялась, как правило, аспарагином с образованием последовательности Asn-X-Thr, которая, как известно, является сайтом N-гликозилирования в животных клетках. В некоторых случаях, однако, соседняя с остатком аспарагина аминокислота была заменена треонином, для того чтобы использовать остаток аспарагина, присутствующий в первоначальной последовательности ДНК.

1-4. Создание вектора альфа-1-антитрипсина (подтип M2) (рТ006)
Вектор альфа-1-антитрипсина (рТ006) был сконструирован клонированием гена альфа-1-антитрипсина в pAV1 вектор, с использованием рЕАТ8 (кодирующий a1-AT (M2) cDNA) в качестве матрицы. Подробнее, рЕАТ8 (кодирующий a1-AT(M2) cDNA) матрица была амплифицирована с помощью ПЦР с использованием двух праймеров: XhoAT прямой праймер (5′-CCCTCCTCGAGAATGCCGTCTTCTGTCTCG-3′, SEQ ID NO: 1) и ATNot обратный праймер (5′-GGGCCCGCGGCCGCAGTTATTTTTGGGTGGG-3′, SEQ ID NO: 2). Оба конца амплифицированного нуклеотида были расщеплены двумя рестрикционными ферментами XhoI и NotI и соединены с вектором экспрессии pAV1, имеющим сайт рестрикции XhoI/NotI, давая в результате конструкцию вектора альфа-1-антитрипсина (рТ006, SEQ ID NO: 40).
1-5. Получение варианта альфа-1-антитрипсина (M2)
Для получения варианта альфа-1-антитрипсина (M2) с дополнительным сайтом гликозилирования вектор альфа-1-антитрипсина (рТ006), полученный в Примерах 1-4, использовали в качестве матрицы. Для получения вектора варианта (M2) альфа-1-антитрипсина (AT9N (M2)) использовали пару из двух праймеров (т.е., прямой праймер (SEQ ID NO: 5) и обратный праймер (SEQ ID NO: 6)) и набор для мутагенеза (Enzynomix, EZchangeTM Site-Directed Mutagenesis Kit). Аминокислотная последовательность полученного в результате варианта альфа-1-антитрипсина приведена в SEQ ID NO: 42.
1-6. Получение димеров альфа-1-антитрипсинов и их вариантов
Для получения димера варианта альфа-1-антитрипсина был использован pAT9N (подтип M2) в качестве варианта альфа-1-антитрипсина. Для создания вектора димера использованный в качестве матрицы pAT9N (M2) был амплифицирован с помощью ПЦР с использованием двух праймеров: XhoAT прямой праймер 2 (5′-GGGCCCCTCGAGGCCACCATGCCGTCTTCTGTCTCGTGGGGCATCCTCCTGCTGGCAGGCC
TGTGCTGCCTGGTCCCTGTCTCCCTGGCTGAAGATCCCCAGGGA-3′, SEQ ID NO: 31) и ATBam обратный праймер 2 (5′-GGGGGGATCCTCTTTTTGGGTGGGATTCAC-3′, SEQ ID NO: 32). Оба конца амплифицированного нуклеотида были расщеплены двумя рестрикционными ферментами XhoI и BamHI и соединены с вектором экспрессии pAT9N (M2), имеющим сайт рестрикции XhoI/BamHI, давая в результате конструкцию вектора димера альфа-1-антитрипсина (pAT9N (M2)-AT9N (M2)).
1-7. Экспрессия димеров альфа-1-антитрипсинов и их вариантов
Для экспрессии белков альфа-1-антитрипсина (Т003, Т006), его вариантов и димера, полученных в Примерах 1-2, 3, 4, 5 и 6, использовали клетки яичника китайского хомячка (СНО-K1). СНО-K1 инкубировали в среде Игла, модифицированной по Дульбекко (DMEM), с добавлением 10% эмбриональной телячьей сыворотки (FBS) и антибиотика, в условиях 5% СО2 и 37°C. За день до введения векторов экспрессии, содержащих альфа-1-антитрипсин и его вариант, клетки высевали при плотности 5×106 клеток в 100 мм чашку для культивирования и культивировали. Затем смешивали 800 мкл DMEM без FBS, антибиотик и 10 мкг каждого из векторов экспрессии, содержащих альфа-1-антитрипсин, его вариант и димер, и выдержали при комнатной температуре в течение одной минуты. Затем полученную смесь смешивали с 20 мкг полиэтиленимина (PEI, linear, Polysciences Inc. (кат. номер 23966, MB: около 25,000)) и выдержали при комнатной температуре приблизительно в течение от 10 до 15 минут. В этом случае культивированные клетки днем раньше промыли PBS и добавили 6 мл свежей среды DMEM. Через 10-15 минут каждый из векторов экспрессии, содержащий альфа-1-антитрипсин, его вариант и димер, который выдерживали при комнатной температуре, добавили в чашку для культивирования. На следующий день клетки промыли PBS и поместили в среду Дульбекко, модифицированную по Исков, (IMDM, кат. №12200-028, Gibco) без FBS и подтвердили экспрессию белка.
1-8. Очистка альфа-1-антитрипсина, его варианта и димера
Альфа-1-антитрипсин, его вариант и димер, экспрессированные в Примерах 1-7, были очищены, как описано далее. Конкретнее, с целью очистки альфа-1-антитрипсина, его варианта и димера, секретируемого в культуральную жидкость, культуральную жидкость центрифугировали для удаления клеток, клеточный супернатант собрали и разбавили уравновешивающим буфером (20 мМ фосфат натрия, pH 8.0). После этого клеточный супернатант, разбавленный уравновешивающим буфером, поместили в колонку Q-Sepharose (GE Healthcare, США), уравновешенную с помощью уравновешивающего буфера, и тщательно промыли уравновешивающим буфером. Затем белок элюировали при увеличивающейся концентрации (от 0 до 400 мМ NaCl, 20 мМ фосфат натрия, pH 8.0) хлорида натрия. Элюированный белок поместили в колонку Альфа-1-Антитрипсин Select (GE Healthcare, США), уравновешенную с помощью уравновешивающего буфера (50 мМ Tris, 0.15 М хлорида натрия, pH 7.5), а затем тщательно промыли уравновешивающим буфером. Затем белок элюировали при увеличивающейся концентрации MgCl2. Полученный раствор подвергли диализу в фосфатно-буферном солевом растворе, а затем концентрировали с использованием Vivaspin20 (GE Healthcare, США), чтобы получить очищенный белок с высокой степенью очистки. Результаты SDS-PAGE-анализа очищенного альфа-1-антитрипсина, его варианта и димера показаны на ФИГ. 3.
Как можно видеть на ФИГ. 3, было подтверждено, что варианты альфа-1-антитрипсина, имеющие дополнительные сайты N-гликозилирования, наблюдались в относительно более высоком положении, чем альфа-1-антитрипсин дикого типа (Т003 или Т006), что указывает, что молекулярная масса варианта альфа-1-антитрипсина увеличивался в результате гликозилирования. Кроме того, было показано, что димер наблюдался в положении, которое соответствует молекулярной массе димера, при этом имелось небольшое различие в положении молекулярной массы соответственно уровню гликозилирования.
Пример 2: Получение гибридного белка гормона роста человека / варианта альфа-1-антитрипсина
Для получения гибридного белка гормона роста человека / варианта альфа-1-антитрипсина (AT9N) в качестве варианта альфа-1-антитрипсина использовали pAT9N (подтип M2). Для создания гибридного вектора ген гормона роста человека (IOH45734, Invitrogen), использованный в качестве матрицы, был амплифицирован с помощью ПЦР с использованием двух праймеров: XhoGH прямой праймер (5′-GGGCCCCTCGAGGCCACCATGGCTACAGGCTCCCGG-3′, SEQ ID NO: 33) и GHBam обратный праймер (5′-GGGGGGATCCTCGAAGCCACAGCTGCCCTC-3′, SEQ ID NO: 34). Оба конца амплифицированного нуклеотида были расщеплены двумя рестрикционными ферментами XhoI и BamHI, а затем соединены с вектором экспрессии pAT9N (M2), имеющим сайт рестрикции XhoI/BamHI, давая в результате конструкцию гибридного вектора гормона роста человека/варианта альфа-1-антитрипсина (phGH-AT9N (M2), SEQ ID NO: 43).
Пример 3: Получение гибридного белка гранулоцитарного колониестимулирующего фактора / двойного варианта альфа-1-антитрипсина
3-1. Получение двойного варианта альфа-1-антитрипсина
В качестве матрицы использовали вектор варианта альфа-1-антитрипсина (AT9N), созданный таким же образом, как в Примерах 1-5, а следующие два праймера, прямой праймер (5′-CCATGTTTTTAGAGGCCATAAACATGTCTATCCCCCCC-3′, SEQ ID NO: 35) и обратный праймер (5′-GGGGGGGATAGACATGTTTATGGCCTCTAAAAACATGG-3′, SEQ ID NO: 36), а также набор для мутагенеза (Enzynomix, EZchangeTM Site-Directed Mutagenesis Kit) использовали для создания вектора pT004N (Q9N, P357N), содержащего двойной вариант альфа-1-антитрипсина, в котором глутамин в 9ом положении N-конца альфа-1-антитрипсина был заменен аспарагином, а пролин в 357ом положении также был заменен аспарагином. Аминокислотная последовательность полученного двойного варианта альфа-1-антитрипсина представлена в SEQ ID NO: 44.
3-2. Получение гибридного белка гранулоцитарного колониестимулирующего фактора / двойного варианта альфа-1-антитрипсина
Для получения гибридного белка гранулоцитарного колониестимулирующего фактора в / двойного варианта альфа-1-антитрипсина, использовали pT004N (Q9N, P357N) содержащий двойной вариант альфа-1-антитрипсина и полученный методом в Примере 3-1. Для создания гибридного вектора гранулоцитарный колониестимулирующий фактор (IHS1380-97652343, Open Biosystems), использованный в качестве матрицы, был амплифицирован с помощью ПЦР с использованием двух праймеров: XhoCSF прямой праймер (5′-GGGCCCCTCGAGATGGCTGGACCTGCCACC-3′, SEQ ID NO: 37) и CSFBam обратный праймер (5′-GGGGGGATCCTCGGGCTGGGCAAGGTGGCG-3′, SEQ ID NO: 38). Оба конца амплифицированного нуклеотида были расщеплены двумя рестрикционными ферментами XhoI и BamHI, а затем соединены с вектором экспрессии pT004N, имеющим сайт рестрикции XhoI/BamHI, давая в результате конструкцию гибридного вектора гранулоцитарного колониестимулирующего фактора/двойного варианта альфа-1-антитрипсина (pT603N, SEQ ID NO: 45). Далее, гибридный белок гранулоцитарного колониестимулирующего фактора/двойного варианта альфа-1-антитрипсина был экспрессирован и выделен из полученного гибридного вектора (pT603N) таким же образом, как в Примерах 1-7 и 1-8.
Экспериментальный Пример 1: Фармакокинетика выделенного из плазмы альфа-1-антитрипсина, альфа-1-антитрипсина, полученного в клетках яичника китайского хомячка, и их вариантов
Для определения фармакокинетики выделенного из плазмы альфа-1-антитрипсина и альфа-1-антитрипсина, полученного в клетках яичника китайского хомячка, согласно настоящему изобретению, были проведены эксперименты, как описано далее.
В качестве лабораторных животных использовали самцов крыс Sprague-Dawley, которых разделили на несколько экспериментальных групп (N = от 3 до 5). Выделенный из плазмы человека альфа-1-антитрипсин (Calbiochem, США), рекомбинантный альфа-1-антитрипсин и его варианты подкожно или внутривенно вводили каждой группе крыс Sprague-Dawley в дозе 445 мкг на крысу, причем фосфатно-солевой буферный раствор использовали в качестве раствора для разведения. Кровь отбирали после каждого введения, а затем центрифугировали для получения сыворотки. Сыворотку от каждого введения хранили в морозильной камере до проведения анализов, концентрации в крови альфа-1-антитрипсина и его варианта измеряли с использованием твердофазного иммуноферментного анализа (ELISA). ELISA осуществляли с использованием двух методов. Один метод был осуществлен, как описано далее. Чашку (Nunc, Denmark) покрывали моноклональными антителами (Medix Biochemica, Финляндия) против человеческого альфа-1-антитрипсина, обрабатывали фосфатно-солевым буферным раствором, в котором был растворен 1% бычьего сывороточного альбумина. Образец разбавляли фосфатно-солевым буферным раствором, в котором был растворен 1% бычьего сывороточного альбумина, и использовали. Для обнаружения альфа-1-антитрипсина использовали моноклональные антитела к анти-альфа-1-антитрипсину, конъюгированные с биотином и полученные с использованием сульфо-NHS-биотина (Pierce biotechnology, США), и стрептавидин-HRP. Колориметрическую реакцию проводили с использованием 3,3′,5,5′-тетраметилбензидина (ТМВ) и колориметрического раствора перекиси водорода. Затем добавили серную кислоту к каждой лунке, чтобы остановить реакцию, и измеряли оптическую плотность в реакционном растворе при 450 нм, используя ридер для микропланшетов (Molecular Device, США). Другой метод осуществляли, как описано далее. Планшет (Nunc, Дания) покрывали моноклональными антителами (Medix Biochemica, Финляндия) к человеческому альфа-1-антитрипсину и обрабатывали фосфатно-солевым буферным раствором, в котором был растворен 1% бычьего сывороточного альбумина. Образец разбавляли фосфатно-солевым буферным раствором, в котором был растворен 1% бычьего сывороточного альбумина, и использовали. Конъюгат поликлональных антител к анти-альфа-1-антитрипсину с биотином (Abeam, United Kingdom) и стрептавидин-HRP использовали для обнаружения альфа-1-антитрипсина. Колориметрическую реакцию проводили с использованием 3,3′,5,5′-тетраметилбензидина (ТМВ) и колориметрического раствора перекиси водорода. Затем добавили серную кислоту к каждой лунке, чтобы остановить реакцию, и измеряли оптическую плотность в реакционном растворе при 450 нм, используя ридер для микропланшетов (Molecular Device, США). На каждой стадии планшет промывали раствором для промывки (0.05% Твин 20, фосфатно-солевой буферный раствор). Количественное значение каждого образца вычисляли методом регрессионного анализа после нанесения на график стандартной кривой для стандартного эталонного материала.
Фармакокинетические кривые полученного из плазмы альфа-1-антитрипсина, альфа-1-антитрипсина, полученного из клеток яичника китайского хомячка, и их вариантов после подкожного и внутривенно введения представлены на ФИГ. 4-7.
Как показано на ФИГ. 4 и 5, фармакокинетика полученного из плазмы альфа-1-антитрипсина, рекомбинантного альфа-1-антитрипсина и его вариантов после подкожного введения была изучена в различных аспектах. Как показано на ФИГ. 4, было показано, что полученный из плазмы альфа-1-антитрипсин имел период полужизни (t1/2) в организме приблизительно 15,2 час, Tmax - 16,8 часов и значение AUC (час*мкг/мл) - 113.1, а рекомбинантный альфа-1-антитрипсин (Т003) имел период полужизни (t1/2) в организме приблизительно 16.5 часов, Tmax - 20.8 часов и значение AUC (час*мкг/мл) - 156.6 часов. Следовательно, альфа-1-антитрипсин, полученный в клетках яичника китайского хомячка, показал сходные фармакокинетические профили с профилями, полученного из плазмы альфа-1-антитрипсина. Период полужизни (t1/2) и Tmax рекомбинантного альфа-1-антитрипсина было немного увеличено, а также значение AUC (час*мкг/мл) было увеличено приблизительно на 40%, по сравнению с полученным из плазмы альфа-1-антитрипсином. Кроме того, было показано, что изоформы альфа-1-антитрипсина M2 типа (His101) и M3 типа (Arg101) продемонстрировали сходные профили в пределах экспериментальной ошибки в фармакокинетическом исследовании на животных.
С другой стороны, фармакокинетика вариантов альфа-1-антитрипсина, полученных в клетках яичника китайского хомячка, продемонстрировала различные профили в зависимости от того, какие сайты гликозилирования были добавлены.
Как показано на ФИГ. 5, было обнаружено, что AUCINF_obs (час*мкг/мл) AT70N, AT178N, AT201N и AT212N были ниже приблизительно на 50-70%, чем у альфа-1-антитрипсина (Т003), полученного в клетках яичника китайского хомячка. Однако было показано, что период полужизни вариантов в организме было увеличено приблизительно на 15-90% по сравнению с временем полужизни альфа-1-антитрипсина дикого типа, полученных в клетках яичника китайского хомячка, показывая, что добавление сайта гликозилирования оказывает влияние на период полужизни в организме. С другой стороны, AUC (час*мкг/мл) АТ148Т было сходно с временем полужизни альфа-1-антитрипсина, полученного в клетках яичника китайского хомячка, однако период полужизни in vivo составляло 24.6 часов, т.е. было увеличено приблизительно на 50% по сравнению с рекомбинантным альфа-1-антитрипсином. Это показывает, что фармакокинетика АТ148Т улучшалась вследствие добавления сайта гликозилирования.
Как показано на ФИГ. 5, было обнаружено, что период полужизни in vivo АТ26Т было немного увеличено по сравнению с временем полужизни альфа-1-антитрипсина (Т003), полученного в клетках яичника китайского хомячка, однако AUC (час*мкг/мл) АТ26Т составляло только около 17% от альфа-1-антитрипсина (Т003), полученного в клетках яичника китайского хомячка, а скорость выведения in vivo (CL/F; мл/час/кг) АТ26Т была приблизительно в 6 раз выше, чем скорость выведения альфа-1-антитрипсина (Т003), показывая, что добавление сайта гликозилирования в 26ом положении оказывает самое плохое влияние на фармакокинетику.
ФИГ. 6 - фармакокинетическая кривая полученного из плазмы альфа-1-антитрипсина и рекомбинантных вариантов альфа-1-антитрипсина после подкожного введения. Как было показано на ФИГ. 6, полученный из плазмы альфа-1-антитрипсин имел период полужизни in vivo (t1/2) приблизительно 15.2 часов, а среди вариантов альфа-1-антитрипсина АТ148Т имел in vivo период полужизни 24.6 часов, AT9N имел in vivo период полужизни 37.7 часов и AT212N имел in vivo период полужизни 19.1 часов, указывая, что фармакокинетика вариантов альфа-1-антитрипсина демонстрирует разные профили в зависимости от дополнительных сайтов гликозилирования.
Вышеупомянутые результаты подтверждают, что период полужизни вариантов альфа-1-антитрипсина (АТ26Т, АТ148Т, AT178N, AT201N и AT212N), которые были подвергнуты дополнительному гликозилированию путем мутации участка петли альфа-1-антитрипсина, было немного увеличено по сравнению с рекомбинантным альфа-1-антитрипсином, который не был подвергнут дополнительному гликозилированию, однако другие фармакокинетические профили были намного хуже, чем у рекомбинантного альфа-1-антитрипсина дикого типа (Т003). Соответственно, можно сделать заключение, что эти гликозилированные в участке петли варианты были клинически не лучше, чем альфа-1-антитрипсин дикого типа.
Тем не менее, можно сделать вывод, что из числа вариантов, полученных путем дополнительного гликозилирования рекомбинантного альфа-1-антитрипсина, вариант, в котором сайт гликозилирования был добавлен в 9ом положении N-конца, обладал существенно улучшенной устойчивостью в организме по сравнению с вариантами, в которых сайт гликозилирования был добавлен в других положениях, и имел весьма низкий уровень выведения из организма. Следовательно, изменения фармакокинетических параметров свидетельствуют о добавлении сайта гликозилирования в нижележащем положении от 25ого остатка аминокислоты в структуре N-концевого пептида альфа-1-антитрипсина.
ФИГ. 7 показывает результаты фармакокинетических исследований вариантов, которые были получены добавлением сайтов гликозилирования в 4ом, 9ом и 12ом положениях N-конца альфа-1-антитрипсина. На ФИГ. 7 было показано, что когда сайты гликозилирования были добавлены в 9ом или 12ом положениях, вариант имел превосходное период полужизни in vivo или площадь под кривой (AUC) по сравнению с вариантом, в котором сайт гликозилирования был добавлен в 4ом положении. N-концевой участок альфа-1-антитрипсина не был виден в рентгеновской кристаллической структуре, следовательно имел аморфную структуру в растворе и двигался свободно. Можно сделать заключение о том, что когда N-концевой участок был гликозилирован, увеличение гидродинамического объема вызывало увеличение периода полужизни in vivo альфа-1-антитрипсина, и кроме того, эти варианты обладали повышенной биологической доступностью в организме после инъекции.
Экспериментальный Пример 2: Фармакокинетика полученного из плазмы альфа-1-антитрипсина, альфа-1-антитрипсина, полученного в клетках яичника китайского хомячка, и их димеров
Для определения фармакокинетики димера альфа-1-антитрипсина, полученного в клетках яичника китайского хомячка, согласно настоящему изобретению были проведены эксперименты, как описано далее. Последовательности, кодирующие белки, в которые был добавлен сайт гликозилирования в 9ом положении альфа-1-антитрипсина, были соединены параллельно и клонированы. После этого димер AT9N (M2)-AT9N (M2) и мономер Т003, экспрессированный в СНО клетках, очистили и провели фармакокинетические исследования.
На ФИГ. 8 было показано, что период полужизни in vivo AT9N (M2)-AT9N (M2) димера составляло 32,8 часов, т.е. в два раза больше, чем in vivo период полужизни (16,5 часов) Т003, и значение AUC димера AT9N (M2)-AT9N (M2) также было увеличено в два раза. Также было показано, что величина выведения димера AT9N (M2)-AT9N (M2) была существенно снижена. Эти результаты подтверждают, что мономер варианта альфа-1-антитрипсина, а также димер варианта альфа-1-антитрипсина, имеющие повышенную устойчивость in vivo, могут использоваться в качестве лекарственного средства.
Экспериментальный Пример 3: Ингибирующее действие альфа-1-антитрипсина и его вариантов на активность эластазы
Для определения ингибирующего действия альфа-1-антитрипсина и его вариантов согласно настоящему изобретению на активность эластазы были проведены описанные далее эксперименты.
Эластазу поджелудочной железы свиньи (Calbiochem, Cat. 324682) и AAA-pNA (N-Succinyl-Ala-Ala-Ala-p-nitroanilide, Sigma, S4760) использовали в качестве фермента и субстрата, соответственно, для измерения констант скорости реакции альфа-1-антитрипсина и его вариантов. Конкретнее, эластазу поджелудочной железы свиньи и альфа-1-антитрипсин и его варианты смешали в том же самом молярном соотношении, обеспечивая прохождение реакции при 25°C в течение 120 секунд, 300 секунд и 600 секунд. После этого к полученной реакционной смеси добавили AAA-pNA и измеряли кинетику в течение 5 минут с интервалами в одну минуту. В окончательной реакционной смеси концентрации эластазы поджелудочной железы свиньи и альфа-1-антитрипсина и его вариантов составляли 20 нМ, а концентрация AAA-pNA была 1 мМ.
Так как реакция эластазы поджелудочной железы свиньи с альфа-1-антитрипсином и его вариантами была необратимой вторичной реакцией (Levenspiel О. Chemical reaction engineering, 2nd edition. 1972, Wiley, New York), константу скорости вычисляли с помощью уравнения: 1/R=kaCE0t+1 [R = остаточная РРЕ активность, ka = константа скорости реакции (М-1сек-1), CE0 = исходная концентрация ААТ (M) и t = период реакции (секунды)]. Константу скорости ассоциации (ka) вычисляли, используя остаточные значения активности эластазы поджелудочной железы свиньи в каждый момент времени прохождения реакции. Результаты приведены в Таблице 2.
Кроме того, константу равновесия альфа-1-антитрипсина и его вариантов вычисляли, используя следующее уравнение. Результаты приведены в Таблице 3.
Ka(М-1)=[EI]/[E]f/[I]f×109
[Е]Т = Исходная концентрация фермента
[I]Т = Исходная концентрация ингибитора
[E]f=[Е]Т×(Аопыт/Аконтроль)
[EI]=[E]T-[E]f=[Е]Т×(1-Аопыт/Аконтроль)
[I]f=[I]T-[EI]
А = Наклон t (время измерения) против оптической плотности


Как видно из Таблиц 2 и 3, было обнаружено, что константы скорости ассоциации и константы равновесия альфа-1-антитрипсина дикого типа (Т003) и варианта альфа-1-антитрипсина AT9N были в основном сходны с константами полученного из плазмы человеческого альфа-1-антитрипсина. Следовательно, было показано, что N-концевое гликозилирование альфа-1-антитрипсина не оказывало влияния на активность ингибитора эластазы альфа-1-антитрипсина. Однако при сравнении ингибирующих эффектов АТ148Т и полученного из плазмы альфа-1-антитрипсина в отношении эластазы было обнаружено, что, АТ148Т имел аффинность связывания равную половине аффинности связывания альфа-1-антитрипсина дикого типа. Следовательно, можно видеть, что даже если АТ148Т оказывал влияние на период полужизни в организме вследствие добавления сайта гликозилирования, тем не менее гликозилирование в 148ом положении альфа-1-антитрипсина имело отрицательное действие на связывание альфа-1-антитрипсина с протеолитическим ферментом (т.е., протеазой).
Такие варианты, как AT70N и AT178N, обладали существенно уменьшенной аффинностью связывания с эластазой по сравнению с полученным из плазмы альфа-1-антитрипсином дикого типа. Из этих фактов можно сделать вывод, что когда сайт гликозилирования был добавлен в определенном положении альфа-1-антитрипсина, было важно выбрать положение(я) гликозилирования, которое не влияло на активность альфа-1-антитрипсина, несмотря на то, что гликозилирование способно влиять на фармакокинетику в организме.
Экспериментальный Пример 4: Исследование фармакокинетики гибрида гормона роста человека / варианта альфа-1-антитрипсина
Для определения фармакокинетики гибридного белка гормона роста человека / варианта альфа-1-антитрипсина согласно настоящему изобретению были выполнены эксперименты, описанные далее. В качестве лабораторных животных использовали крыс Sprague-Dawley, которых разделили на группы с введением гормона роста человека (N=3) и с введением гибрида (N=5). Гибридный белок гормон роста человека / альфа-1-антитрипсин, полученный в Примере 2, подкожно вводили крысам Sprague-Dawley в дозе 720 мкг на крысу, фосфатно-буферный солевой раствор использовали в качестве раствора для разведения. Кровь отбирали во временные точки 0, 1, 2, 4, 8, 12, 16, 24, 30 и 48 часов, затем центрифугировали для получения сыворотки. Гормон роста человека, Scitropin (SciGen, Singapore), подкожно вводили в качестве контроля в дозе 200 мкг на крысу, а фосфатно-солевой буферный раствор использовали в качестве раствора для разведения. Кровь отбирали в моменты времени 0, 0.33, 1, 2, 5, 8, 12, 18, 24, 30 и 48 часов и центрифугировали с целью получения сыворотки. Каждый образец исследовали с помощью ELISA, как будет описано ниже. Моноклональные антитела (Medix Biochemica, Финляндия) против гормона роста человека разводили фосфатно-солевым буферным раствором при концентрации от 1 до 5 мкг/мл и добавили в каждую лунку 96-луночного планшета (Nunc, Denmark) в количестве 100 мкл. После этого полученный раствор держали при комнатной температуре в течение от 15 до 18 часов. Антитела, не прикрепленные к лункам, удалили и добавили 250 мкл фосфатно-буферного солевого раствора, в котором был растворен 1% бычьего сывороточного альбумина, выдержали при комнатной температуре в течение 2 часов, а затем промыли 3 раза раствором для промывки (0.05% Твин 20, фосфатно-буферный солевой раствор), чтобы удалить раствор. Образец разбавили фосфатно-буферным солевым раствором, в котором был растворен 1% бычий сывороточный альбумин, добавили к 96-луночному планшету и давали возможность прореагировать при комнатной температуре в течение 2 часов. 96-луночный планшет промыли 5 раз раствором для промывки, а конъюгат моноклональных антител против гормона роста человека с биотином, конъюгированный с использованием сульфо-NHS-биотина (Pierce biotechnology, США), разбавили промывочным раствором и добавили в каждую лунку 96-луночного планшета в количестве 100 мкл. Потом 96-луночный планшет оставляли для прохождения реакции при комнатной температуре в течение 2 часов и промыли 5 раз промывочным раствором. Затем добавили раствор стрептавидин-HRP к 96-луночному планшету и оставили для прохождения реакции при комнатной температуре в течение 30 минут. 96-луночный планшет промыли 5 раз раствором для промывки, в каждую лунку поместили 100 мкл колориметрического раствора 3,3′,5,5′-тетраметилбензидина (ТМВ) и перекиси водорода и оставили для прохождения реакции в течение 30 минут в темном месте. 100 мкл 1 М серной кислоты добавили в каждую лунку, чтобы остановить реакцию, а затем измеряли оптическую плотность при 450 нм, используя микропланшетный ридер VersaMax (Molecular Device, США). Количественное значение каждого образца вычисляли методом регрессионного анализа после нанесения на график стандартной кривой для стандартного эталонного материала.
График фармакокинетики гибридного белка гормона роста человека/варианта альфа-1-антитрипсина согласно настоящему изобретению показан на ФИГ. 9.
Как видно на ФИГ. 9, период полужизни в крови (t1/2) гибридного белка гормона роста человека / варианта альфа-1-антитрипсин согласно настоящему изобретению составляло приблизительно 6 часов, что было в 4 раза больше, чем у гормона роста человека, указывая, что вариант гибридного белка имел существенно повышенную устойчивость в организме.
Экспериментальный Пример 5: Исследование фармакокинетики гибрида гранулоцитарного колониестимулирующего фактора / двойного варианта альфа-1-антитрипсина
Для определения фармакокинетики гибридного белка гранулоцитарного колониестимулирующего фактора / двойного варианта альфа-1-антитрипсина согласно настоящему изобретению эксперименты были выполнены, как указано далее. В качестве лабораторных животных использовали крыс Sprague-Dawley, которых разделили на группы с введением гранулоцитарного колониестимулирующего фактора (N=5) и с введением гибридного белка (N=3). Гибридный белок гранулоцитарного колониестимулирующего фактора/двойного варианта альфа-1-антитрипсина (pT603N), полученный в Примере 3, подкожно вводили крысам Sprague-Dawley в дозе 340 мкг на крысу, а фосфатно-солевой буферный раствор использовали в качестве раствора для разведения. Кровь отбирали во временные точки 0, 1, 2, 4, 8, 12, 16, 24, 36, 48, 60 и 72 часа после подкожной инъекции, затем центрифугировали для получения сыворотки. Гранулоцитарный колониестимулирующий фактор Grasin (Filgrastim), разводили фосфатно-солевым буферным раствором и подкожно вводили в качестве контроля в дозе 100 мкг на крысу. Кровь отбирали во временные точки 0, 0.5, 1, 2, 4, 8, 12, 16, 24, 36 и 48 часов, затем центрифугировали для получения сыворотки. Каждый образец исследовали с помощью ELISA, как будет описано ниже. Моноклональные антитела (R&D Systems) против гранулоцитарного колониестимулирующего фактора развели фосфатно-солевым буферным раствором при концентрации от 1 до 10 мкг/мл и добавили в каждую лунку 96-луночного планшета (Nunc, Дания) в количестве 100 мкл. После этого полученный раствор держали при комнатной температуре в течение от 15 до 18 часов. Удалили неприкрепленные к лункам антитела и добавили 250 мкл фосфатно-буферного солевого раствора, в котором был растворен 1% бычий сывороточный альбумин, выдержали при комнатной температуре в течение 2 часов, а затем промыли 3 раза раствором для промывки (0.05% Твин 20, фосфатно-буферный солевой раствор), чтобы удалить раствор. Образец разбавили фосфатно-буферным солевым раствором, в котором был растворен 1% бычий сывороточный альбумин, добавили к 96-лункам планшета и дали возможность прореагировать при комнатной температуре в течение 2 часов. 96-луночный планшет промыли 5 раз раствором для промывки, конъюгат поликлональных антител к гранулоцитарному колониестимулирующему фактору с биотином (R&D Systems) разбавили промывочным раствором и добавили в каждую лунку 96-луночного планшета в количестве 100 мкл. Потом 96-луночный планшет оставили для прохождения реакции при комнатной температуре в течение 2 часов и промыли 5 раз промывочным раствором. Затем раствор стрептавидин-HRP добавили к 96-луночному планшету и оставили для прохождения реакции при комнатной температуре в течение 30 минут. 96-луночный планшет промыли 5 раз промывочным раствором, в каждую лунку поместили 100 мкл колориметрического раствора 3,3′,5,5′-тетраметилбензидина (ТМВ) и перекиси водорода и оставили для прохождения реакции в течение 30 минут в темном месте. Чтобы остановить реакцию в каждую лунку добавили 100 мкл 1 М серной кислоты, а затем измеряли оптическую плотность при 450 нм, используя микропланшетный ридер VersaMax (Molecular Device, США). Количественное значение каждого образца вычисляли методом регрессионного анализа после нанесения на график стандартной кривой для стандартного эталонного материала. График фармакокинетики гибридного белка гранулоцитарного колониестимулирующего фактора / варианта альфа-1-антитрипсина согласно настоящему изобретению показан на ФИГ. 10.
Как видно на ФИГ. 10, было подтверждено, что гибридный белок гранулоцитарного колониестимулирующего фактора/двойного варианта альфа-1-антитрипсина согласно настоящему изобретению показал период полужизни (t1/2) приблизительно 7.3 час, что было приблизительно в 3 раза больше, чем период полужизни в крови (2.7 часов) гранулоцитарного колониестимулирующего фактора, а значение AUC было увеличено в 3 раза или больше, чем у гранулоцитарного колониестимулирующего фактора. Исходя из этих результатов, можно сделать заключение, что когда гетерогенный белок, такой как физиологически активный белок, был связан с двойным вариантом альфа-1-антитрипсина, период полужизни гетерогенного белка увеличивалось.
Промышленная применимость
Когда вариант альфа-1-антитрипсина, имеющий сайт N-гликозилирования, добавленный к нему посредством мутации аминокислоты между 1ым и 25ым положениями N-конца, согласно настоящему изобретению используется для предотвращения или лечения дефицита альфа-1-антитрипсина, период полужизни в крови (t1/2) и площадь под кривой зависимости концентрации лекарственного средства в крови от времени (AUC) могут быть существенно увеличены для того, что указывает на отличную устойчивость в организме и сохранение ингибирующего действия на активность эластазы. Следовательно, вариант альфа-1-антитрипсина согласно настоящему изобретению может использоваться для лечения дефицита альфа-1-антитрипсина и может использоваться для увеличения периода полужизни гетерогенного белка в организме, когда гетерогенный белок связывается с вариантом альфа-1-антитрипсина. Соответственно, варианты альфа-1-антитрипсина согласно настоящему изобретению могут использоваться для предотвращения и лечения дефицита альфа-1-антитрипсина.
Настоящее изобретение подробно описано. Однако следует понимать, что подробное описание и конкретные примеры, при том, что они раскрывают предпочтительные варианты осуществления изобретения, даны только для наглядности, и различные изменения и модификации в пределах сущности и объема изобретения станут очевидны специалистам в данной области техники из этого подробного описания.
<110> ALTEOGEN, INC
<120> New alpha-1 antitrypsin variant, method for producing the same
and use thereof
<130> PCT01523
<150> KR 10-2011-0092819
<151> 2011-09-15
<150> KR 10-2012-0058998
<151> 2012-06-01
<160> 45
<170> KopatentIn 2.0
<210> 1
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> A1AT forward primer 1
<400> 1
ccctcctcga gaatgccgtc ttctgtctcg 30
<210> 2
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> A1AT reverse primer 1
<400> 2
gggcccgcgg ccgcagttat ttttgggtgg g 31
<210> 3
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Q4N forward primer
<400> 3
aacggaactg ctgcccagaa gacagataca 30
<210> 4
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Q4N reverse primer
<400> 4
gggatcctca gccagggaga c 21
<210> 5
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Q9N forward primer
<400> 5
aacaagacag atacatccca c 21
<210> 6
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Q9N reverse primer
<400> 6
ggcagcatct ccctggggat c 21
<210> 7
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> D12N forward primer
<400> 7
aatacaaccc accatgatca ggatcac 27
<210> 8
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> D12N reverse primer
<400> 8
tgtcttctgg gcagcatctc c 21
<210> 9
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> I26T forward primer
<400> 9
actaccccca acctggctg 19
<210> 10
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> I26T reverse primer
<400> 10
cttgttgaag gttgggtgat cc 22
<210> 11
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> A31T forward primer
<400> 11
actgagttcg ccttcagcct atac 24
<210> 12
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> A31T reverse primer
<400> 12
caggttgggg gtgatcttgt tg 22
<210> 13
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> L66N forward primer
<400> 13
aacgggacca aggctgacac 20
<210> 14
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> L66N reverse primer
<400> 14
ggagagcatt gcaaaggctg ta 22
<210> 15
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> A70N forward primer
<400> 15
aacgacactc acgatgaaat cctg 24
<210> 16
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> A70N reverse primer
<400> 16
cttggtcccc agggagag 18
<210> 17
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> G148N forward primer
<400> 17
aacgacaccg aagaggccaa g 21
<210> 18
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> G148N reverse primer
<400> 18
gaagttgaca gtgaaggctt ctg 23
<210> 19
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> G148T forward primer
<400> 19
actgacaccg aagaggccaa g 21
<210> 20
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> G148T reverse primer
<400> 20
gaagttgaca gtgaaggctt ctg 23
<210> 21
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> R178N forward primer
<400> 21
aacgacacag tttttgctct ggtg 24
<210> 22
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> R178N reverse primer
<400> 22
gtcaagctcc ttgaccaaat cca 23
<210> 23
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> K201N forward primer
<400> 23
aacgacaccg aggaagagga c 21
<210> 24
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> K201N reverse primer
<400> 24
gacttcaaag ggtctctccc att 23
<210> 25
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Q212N forward primer
<400> 25
aacgtgacca ccgtgaaggt g 21
<210> 26
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Q212N reverse primer
<400> 26
gtccacgtgg aagtcctctt c 21
<210> 27
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> E266N forward primer
<400> 27
aacctcaccc acgatatcat cac 23
<210> 28
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> E266N reverse primer
<400> 28
attttccagg tgctgtagtt tccc 24
<210> 29
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> K343N forward primer
<400> 29
aacgggactg aagctg 16
<210> 30
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> K343N reverse primer
<400> 30
ctcgtcgatg gtcagc 16
<210> 31
<211> 105
<212> DNA
<213> Artificial Sequence
<220>
<223> A1AT forward primer 2
<400> 31
gggcccctcg aggccaccat gccgtcttct gtctcgtggg gcatcctcct gctggcaggc 60
ctgtgctgcc tggtccctgt ctccctggct gaagatcccc aggga 105
<210> 32
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> A1AT reverse primer 2
<400> 32
ggggggatcc tctttttggg tgggattcac 30
<210> 33
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> hGH forward primer
<400> 33
gggcccctcg aggccaccat ggctacaggc tcccgg 36
<210> 34
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> hGH reverse primer
<400> 34
ggggggatcc tcgaagccac agctgccctc 30
<210> 35
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> P357N forward primer
<400> 35
ccatgttttt agaggccata aacatgtcta tccccccc 38
<210> 36
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> P357N reverse primer
<400> 36
gggggggata gacatgttta tggcctctaa aaacatgg 38
<210> 37
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> XhoCSF forward primer
<400> 37
gggcccctcg agatggctgg acctgccacc 30
<210> 38
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> CSFBam reverse primer
<400> 38
ggggggatcc tcgggctggg caaggtggcg 30
<210> 39
<211> 1182
<212> DNA
<213> Artificial Sequence
<220>
<223> pT003
<400> 39
gaggatcccc agggagatgc tgcccagaag acagatacat cccaccatga tcaggatcac 60
ccaaccttca acaagatcac ccccaacctg gctgagttcg ccttcagcct ataccgccag 120
ctggcacacc agtccaacag caccaatatc ttcttctccc cagtgagcat cgctacagcc 180
tttgcaatgc tctccctggg gaccaaggct gacactcacg atgaaatcct ggagggcctg 240
aatttcaacc tcacggagat tccggaggct cagatccatg aaggcttcca ggaactcctc 300
cgtaccctca accagccaga cagccagctc cagctgacca ccggcaatgg cttgttcctc 360
agcgagggcc tgaagctagt ggataagttt ttggaggatg ttaaaaagtt gtaccactca 420
gaagccttca ctgtcaactt cggggacacc gaagaggcca agaaacagat caacgattac 480
gtggagaagg gtactcaagg gaaaattgtg gatttggtca aggagcttga cagagacaca 540
gtttttgctc tggtgaatta catcttcttt aaaggcaaat gggagagacc ctttgaagtc 600
aaggacaccg aggaagagga cttccacgtg gaccaggtga ccaccgtgaa ggtgcctatg 660
atgaagcgtt taggcatgtt taacatccag cactgtaaga agctgtccag ctgggtgctg 720
ctgatgaaat acctgggcaa tgccaccgcc atcttcttcc tgcctgatga ggggaaacta 780
cagcacctgg aaaatgaact cacccacgat atcatcacca agttcctgga aaatgaagac 840
agaaggtctg ccagcttaca tttacccaaa ctgtccatta ctggaaccta tgatctgaag 900
agcgtcctgg gtcaactggg catcactaag gtcttcagca atggggctga cctctccggg 960
gtcacagagg aggcacccct gaagctctcc aaggccgtgc ataaggctgt gctgaccatc 1020
gacgagaaag ggactgaagc tgctggggcc atgtttttag aggccatacc catgtctatc 1080
ccccccgagg tcaagttcaa caaacccttt gtcttcttaa tgattgacca aaataccaag 1140
tctcccctct tcatgggaaa agtggtgaat cccacccaaa aa 1182
<210> 40
<211> 1182
<212> DNA
<213> Artificial Sequence
<220>
<223> pT006
<400> 40
gaggatcccc agggagatgc tgcccagaag acagatacat cccaccatga tcaggatcac 60
ccaaccttca acaagatcac ccccaacctg gctgagttcg ccttcagcct ataccgccag 120
ctggcacacc agtccaacag caccaatatc ttcttctccc cagtgagcat cgctacagcc 180
tttgcaatgc tctccctggg gaccaaggct gacactcacg atgaaatcct ggagggcctg 240
aatttcaacc tcacggagat tccggaggct cagatccatg aaggcttcca ggaactcctc 300
cataccctca accagccaga cagccagctc cagctgacca ccggcaatgg cctgttcctc 360
agcgagggcc tgaagctagt ggataagttt ttggaggatg ttaaaaagtt gtaccactca 420
gaagccttca ctgtcaactt cggggacacc gaagaggcca agaaacagat caacgattac 480
gtggagaagg gtactcaagg gaaaattgtg gatttggtca aggagcttga cagagacaca 540
gtttttgctc tggtgaatta catcttcttt aaaggcaaat gggagagacc ctttgaagtc 600
aaggacaccg aggaagagga cttccacgtg gaccaggtga ccaccgtgaa ggtgcctatg 660
atgaagcgtt taggcatgtt taacatccag cactgtaaga agctgtccag ctgggtgctg 720
ctgatgaaat acctgggcaa tgccaccgcc atcttcttcc tgcctgatga ggggaaacta 780
cagcacctgg aaaatgaact cacccacgat atcatcacca agttcctgga aaatgaagac 840
agaaggtctg ccagcttaca tttacccaaa ctgtccatta ctggaaccta tgatctgaag 900
agcgtcctgg gtcaactggg catcactaag gtcttcagca atggggctga cctctccggg 960
gtcacagagg aggcacccct gaagctctcc aaggccgtgc ataaggctgt gctgaccatc 1020
gacgagaaag ggactgaagc tgctggggcc atgtttttag aggccatacc catgtctatc 1080
ccccccgagg tcaagttcaa caaacccttt gtcttcttaa tgattgacca aaataccaag 1140
tctcccctct tcatgggaaa agtggtgaat cccacccaaa aa 1182
<210> 41
<211> 394
<212> PRT
<213> Artificial Sequence
<220>
<223> Alpha-1 antitrypsine
<400> 41
Glu Asp Pro Gln Gly Asp Ala Ala Gln Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Asp Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys
385 390
<210> 42
<211> 394
<212> PRT
<213> Artificial Sequence
<220>
<223> Alpha-1 antitrypsine variant
<400> 42
Glu Asp Pro Gln Gly Asp Ala Ala Asn Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Pro Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Asp Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys
385 390
<210> 43
<211> 1755
<212> DNA
<213> Artificial Sequence
<220>
<223> phGH-AT9N DNA
<400> 43
ttcccaacca ttcccttatc caggcttttt gacaacgcta tgctccgcgc ccatcgtctg 60
caccagctgg cctttgacac ctaccaggag tttgaagaag cctatatccc aaaggaacag 120
aagtattcat tcctgcagaa cccccagacc tccctctgtt tctcagagtc tattccgaca 180
ccctccaaca gggaggaaac acaacagaaa tccaacctag agctgctccg catctccctg 240
ctgctcatcc agtcgtggct ggagcccgtg cagttcctca ggagtgtctt cgccaacagc 300
ctggtgtacg gcgcctctga cagcaacgtc tatgacctcc taaaggacct agaggaaggc 360
atccaaacgc tgatggggag gctggaagat ggcagccccc ggactgggca gatcttcaag 420
cagacctaca gcaagttcga cacaaactca cacaacgatg acgcactact caagaactac 480
gggctgctct actgcttcag gaaggacatg gacaaggtcg agacattcct gcgcatcgtg 540
cagtgccgct ctgtggaggg cagctgtggc ttcgaggatc cccagggaga tgctgccaac 600
aagacagata catcccacca tgatcaggat cacccaacct tcaacaagat cacccccaac 660
ctggctgagt tcgccttcag cctataccgc cagctggcac accagtccaa cagcaccaat 720
atcttcttct ccccagtgag catcgctaca gcctttgcaa tgctctccct ggggaccaag 780
gctgacactc acgatgaaat cctggagggc ctgaatttca acctcacgga gattccggag 840
gctcagatcc atgaaggctt ccaggaactc ctccataccc tcaaccagcc agacagccag 900
ctccagctga ccaccggcaa tggcctgttc ctcagcgagg gcctgaagct agtggataag 960
tttttggagg atgttaaaaa gttgtaccac tcagaagcct tcactgtcaa cttcggggac 1020
accgaagagg ccaagaaaca gatcaacgat tacgtggaga agggtactca agggaaaatt 1080
gtggatttgg tcaaggagct tgacagagac acagtttttg ctctggtgaa ttacatcttc 1140
tttaaaggca aatgggagag accctttgaa gtcaaggaca ccgaggaaga ggacttccac 1200
gtggaccagg tgaccaccgt gaaggtgcct atgatgaagc gtttaggcat gtttaacatc 1260
cagcactgta agaagctgtc cagctgggtg ctgctgatga aatacctggg caatgccacc 1320
gccatcttct tcctgcctga tgaggggaaa ctacagcacc tggaaaatga actcacccac 1380
gatatcatca ccaagttcct ggaaaatgaa gacagaaggt ctgccagctt acatttaccc 1440
aaactgtcca ttactggaac ctatgatctg aagagcgtcc tgggtcaact gggcatcact 1500
aaggtcttca gcaatggggc tgacctctcc ggggtcacag aggaggcacc cctgaagctc 1560
tccaaggccg tgcataaggc tgtgctgacc atcgacgaga aagggactga agctgctggg 1620
gccatgtttt tagaggccat acccatgtct atcccccccg aggtcaagtt caacaaaccc 1680
tttgtcttct taatgattga ccaaaatacc aagtctcccc tcttcatggg aaaagtggtg 1740
aatcccaccc aaaaa 1755
<210> 44
<211> 394
<212> PRT
<213> Artificial Sequence
<220>
<223> Alpha-1 antitrypsine divariant
<400> 44
Glu Asp Pro Gln Gly Asp Ala Ala Asn Lys Thr Asp Thr Ser His His
1 5 10 15
Asp Gln Asp His Pro Thr Phe Asn Lys Ile Thr Pro Asn Leu Ala Glu
20 25 30
Phe Ala Phe Ser Leu Tyr Arg Gln Leu Ala His Gln Ser Asn Ser Thr
35 40 45
Asn Ile Phe Phe Ser Pro Val Ser Ile Ala Thr Ala Phe Ala Met Leu
50 55 60
Ser Leu Gly Thr Lys Ala Asp Thr His Asp Glu Ile Leu Glu Gly Leu
65 70 75 80
Asn Phe Asn Leu Thr Glu Ile Pro Glu Ala Gln Ile His Glu Gly Phe
85 90 95
Gln Glu Leu Leu Arg Thr Leu Asn Gln Pro Asp Ser Gln Leu Gln Leu
100 105 110
Thr Thr Gly Asn Gly Leu Phe Leu Ser Glu Gly Leu Lys Leu Val Asp
115 120 125
Lys Phe Leu Glu Asp Val Lys Lys Leu Tyr His Ser Glu Ala Phe Thr
130 135 140
Val Asn Phe Gly Asp Thr Glu Glu Ala Lys Lys Gln Ile Asn Asp Tyr
145 150 155 160
Val Glu Lys Gly Thr Gln Gly Lys Ile Val Asp Leu Val Lys Glu Leu
165 170 175
Asp Arg Asp Thr Val Phe Ala Leu Val Asn Tyr Ile Phe Phe Lys Gly
180 185 190
Lys Trp Glu Arg Pro Phe Glu Val Lys Asp Thr Glu Glu Glu Asp Phe
195 200 205
His Val Asp Gln Val Thr Thr Val Lys Val Pro Met Met Lys Arg Leu
210 215 220
Gly Met Phe Asn Ile Gln His Cys Lys Lys Leu Ser Ser Trp Val Leu
225 230 235 240
Leu Met Lys Tyr Leu Gly Asn Ala Thr Ala Ile Phe Phe Leu Pro Asp
245 250 255
Glu Gly Lys Leu Gln His Leu Glu Asn Glu Leu Thr His Asp Ile Ile
260 265 270
Thr Lys Phe Leu Glu Asn Glu Asp Arg Arg Ser Ala Ser Leu His Leu
275 280 285
Pro Lys Leu Ser Ile Thr Gly Thr Tyr Asp Leu Lys Ser Val Leu Gly
290 295 300
Gln Leu Gly Ile Thr Lys Val Phe Ser Asn Gly Ala Asp Leu Ser Gly
305 310 315 320
Val Thr Glu Glu Ala Pro Leu Lys Leu Ser Lys Ala Val His Lys Ala
325 330 335
Val Leu Thr Ile Asp Glu Lys Gly Thr Glu Ala Ala Gly Ala Met Phe
340 345 350
Leu Glu Ala Ile Asn Met Ser Ile Pro Pro Glu Val Lys Phe Asn Lys
355 360 365
Pro Phe Val Phe Leu Met Ile Asp Gln Asn Thr Lys Ser Pro Leu Phe
370 375 380
Met Gly Lys Val Val Asn Pro Thr Gln Lys
385 390
<210> 45
<211> 1706
<212> DNA
<213> Artificial Sequence
<220>
<223> pT603N
<400> 45
ccacccccct gggccctgcc agctccctgc cccagagctt cctgctcaag tgcttagagc 60
aagtgaggaa gatccagggc gatggcgcag cgctccagga gaagctgtgt gccacctaca 120
agctgtgcca ccccgaggag ctggtgctgc tcggacactc tctgggcatc ccctgggctc 180
ccctgagcag ctgccccagc caggccctgc agctggcagg ctgcttgagc caactccata 240
gcggcctttt cctctaccag gggctcctgc aggccctgga agggatctcc cccgagttgg 300
gtcccacctt ggacacactg cagctggacg tcgccgactt tgccaccacc atctggcagc 360
agatggaaga actgggaatg gcccctgccc tgcagcccac ccagggtgcc atgccggcct 420
tcgcctctgc tttccagcgc cgggcaggag gggtcctggt tgcctcccat ctgcagagct 480
tcctggaggt gtcgtaccgc gttctacgcc accttgccca gcccgaggat ccccagggag 540
atgctgccaa caagacagat acatcccacc atgatcagga tcacccaacc ttcaacaaga 600
tcacccccaa cctggctgag ttcgccttca gcctataccg ccagctggca caccagtcca 660
acagcaccaa tatcttcttc tccccagtga gcatcgctac agcctttgca atgctctccc 720
tggggaccaa ggctgacact cacgatgaaa tcctggaggg cctgaatttc aacctcacgg 780
agattccgga ggctcagatc catgaaggct tccaggaact cctccatacc ctcaaccagc 840
cagacagcca gctccagctg accaccggca atggcctgtt cctcagcgag ggcctgaagc 900
tagtggataa gtttttggag gatgttaaaa agttgtacca ctcagaagcc ttcactgtca 960
acttcgggga caccgaagag gccaagaaac agatcaacga ttacgtggag aagggtactc 1020
aagggaaaat tgtggatttg gtcaaggagc ttgacagaga cacagttttt gctctggtga 1080
attacatctt ctttaaaggc aaatgggaga gaccctttga agtcaaggac accgaggaag 1140
aggacttcca cgtggaccag gtgaccaccg tgaaggtgcc tatgatgaag cgtttaggca 1200
tgtttaacat ccagcactgt aagaagctgt ccagctgggt gctgctgatg aaatacctgg 1260
gcaatgccac cgccatcttc ttcctgcctg atgaggggaa actacagcac ctggaaaatg 1320
aactcaccca cgatatcatc accaagttcc tggaaaatga agacagaagg tctgccagct 1380
tacatttacc caaactgtcc attactggaa cctatgatct gaagagcgtc ctgggtcaac 1440
tgggcatcac taaggtcttc agcaatgggg ctgacctctc cggggtcaca gaggaggcac 1500
ccctgaagct ctccaaggcc gtgcataagg ctgtgctgac catcgacgag aaagggactg 1560
aagctgctgg ggccatgttt ttagaggcca taaacatgtc tatccccccc gaggtcaagt 1620
tcaacaaacc ctttgtcttc ttaatgattg accaaaatac caagtctccc ctcttcatgg 1680
gaaaagtggt gaatcccacc caaaaa 1706
Реферат
Изобретение относится к области биотехнологии, конкретно к получению варианта альфа-1-антитрипсина, и может быть использовано в медицине для предотвращения или лечения дефицита альфа-1-антитрипсина. Получают вариант альфа-1-антитрипсина путем замены аминокислоты в 4, 9 или 12 положении N-конца альфа-1-антитрипсина на аспарагин с целью добавления сайта гликозилирования. Изобретение позволяет увеличить период полужизни альфа-1-антитрипсина в организме. 7 н. и 1 з.п.ф-лы, 10 ил., 3 табл., 5 пр.
Формула
a) замену аминокислоты в 4, 9 или 12 положении N-конца альфа-1-антитрипсина на аспарагин с целью добавления сайта гликозилирования;
b) культивирование клеток животных, трансформированных вектором экспрессии альфа-1-антитрипсина с добавленным к нему сайтом гликозилирования, в культуральной среде;
c) экспрессирование варианта белка альфа-1-антитрипсина из клеток; и
d) очистку и восстановление экспрессированного варианта белка альфа-1-антитрипсина.
введение терапевтически эффективного количества варианта альфа-1-антитрипсина по п. 1 пациенту.

Комментарии