Способ и композиция для получения усиленных противовоспалительных/антикатаболических и регенеративных средств из аутологичной физиологической жидкости - RU2708242C2
Код документа: RU2708242C2
Чертежи















Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка, в целом, относится к области медицины и, более конкретно, к способам и композициям, применимым, в частности, в лечении поврежденных и/или травмированных соединительных тканей, включая хронический тендиноз, хронические разрывы мышц (тендинит), разрывы хряща, хронические дегенеративные нарушения суставов, такие как остеоартрит, а также хронические воспалительные заболевания кожи, включая атопический дерматит и хронические раны.
УРОВЕНЬ ТЕХНИКИ
Остеоартрит ("OA") является дегенеративным заболеванием суставов, отличающимся повреждением хряща и воспалением синовиальной оболочки. Полученные ранее данные относятся к изменениям молекулярного воспалительного каскада, приводящего к деструкции макромолекул хряща и необратимым морфологическим изменениям1. Есть существенные доказательства того, что ИЛ-1, фактор некроза опухоли, ИЛ-6, ИЛ-8 и металлопротеиназы являются преобладающими катаболическими и провоспалительными молекулами, играющими значительную роль в патогенезе остеоартрита1. Эти цитокины продуцируются активированными синовицитами, мононуклеарными клетками или самим суставным хрящом, и их катаболический эффект можно успешно блокировать ингибиторными цитокинами, такими как ИЛ-4, ИЛ-10, ИЛ-13 и ИЛ-1ra1.
Схожие воспалительные и катаболические пути вовлечены в патогенез хронического тендинита2и незаживления хронических разрывов мышц3. Клетки сухожилия подвергаются непрерывному повреждению посредством продукции повышенных уровней ИЛ-1, ИЛ-6, металлопротеиназ (MMP) и других катаболических молекул2. Провоспалительные цитокины ИЛ-1 и ФНО также участвуют в патогенезе хронического миозита3. Атопический дерматит (атопическую экзему) считают наиболее распространенным рецидивирующим воспалительным состоянием кожи. Хроническая рана (включая диабетическую рану) является раной, не заживающей в течение трех месяцев по причине плохой циркуляции, невропатии, иммунных нарушений и осложнений системных заболеваний, возраста и повторной травмы. Все указанные состояния отличаются нарушением передачи сигнала в клетке посредством цитокинов и утратой внеклеточного матрикса (ECM), образующего крупнейший компонент дермального слоя кожи. Направленное воздействие на конкретные воспалительные и катаболические молекулярные пути может иметь благоприятный терапевтический эффект в случае воспалительных патологий. Этого эффекта можно достигать с использованием терапевтически активных белков. В настоящее время, в фармацевтической промышленности используют дорогостоящие молекулярно-генетические технологии для получения рекомбинантных белков, таких как инсулин, интерфероны, факторы свертывания крови и т.д. Однако эти способы получения рекомбинантного белка включают экспрессию генов человека в бактериальной клетке. Профиль посттрансляционных модификаций белков, включая гликозилирование, может отличаться от природного профиля у людей. Это может приводить к нестабильности продукта в организме человека, снижению биологической функции или индуцированию иммунного ответа. Кроме того, стоимость конечного рекомбинантного продукта является крайне высокой.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к биоактивной композиции, применимой для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц и/или хронических дегенеративных нарушений суставов, таких как остеоартрит, и воспалительных нарушений кожи. Настоящее изобретение также относится к способу получения композиций. Композиция включает противовоспалительный компонент/антикатаболический компонент. Противовоспалительный компонент также является антикатаболическим компонентом. В рамках изобретения, термины "противовоспалительный компонент" и "антикатаболический компонент" можно использовать взаимозаменяемо. Композиция также может включать регенеративный компонент, включающий аутологичную богатую тромбоцитами плазму (PRP). Хотя большинство способов получения PRP включают стадию активации, приводящей к немедленному высвобождению факторов роста и цитокинов из тромбоцитов, настоящее изобретение относится к применению неактивированного PRP компонента для последующей медленной активации инъецируемой композиции окружающей тканью.
Противовоспалительный/антикатаболический компонент, предпочтительно, содержит аутологичную сыворотку, содержащую ИЛ-1ra, антагонист рецептора ИЛ-1. Кроме того, противовоспалительный/антикатаболический компонент, предпочтительно, содержит повышенный уровень тканевых ингибиторов металлопротеиназ (TIMP).
По одному из аспектов настоящее изобретение относится к способу получения аутологичной композиции для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, включающему следующие стадии:
A) получение противовоспалительного/антикатаболического компонента аутологичной композиции, содержащего TIMP и ИЛ-1ra, включающее следующие стадии: i) сбор аутологичной физиологической жидкости, предпочтительно крови, из млекопитающего; ii) помещение крови в пробирку; iii) инкубацию крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов; iv) центрифугирование крови для разделения крови на супернатантный компонент и клеточную фракцию и v) сбор супернатантного компонента;
B) получение регенеративного компонента аутологичной композиции, включающее следующие стадии: i) сбор крови из млекопитающего; ii) помещение крови в пробирку в присутствие приблизительно 4% цитрата натрия; iv) центрифугирование цельной крови для отделения богатого тромбоцитами плазматического компонента и v) сбор богатого тромбоцитами плазматического компонента; и
C) смешивание супернатантного компонента противовоспалительного/антикатаболического компонента с богатым тромбоцитами плазматическим компонентом для получения аутологичной композиции.
В рамках изобретения, термины "цитрат натрия" и "лимонная кислота" можно использовать взаимозаменяемо.
По другому аспекту настоящее изобретение относится к способу получения аутологичной композиции для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, включающему следующие стадии:
A) получение противовоспалительного/антикатаболического компонента аутологичной композиции, содержащего TIMP и ИЛ-1ra, включающее следующие стадии: i) сбор крови из млекопитающего; ii) помещение крови в пробирку, включающую цитрат натрия; iii) инкубацию крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов; iv) центрифугирование крови для разделения крови на супернатантный компонент и клеточную фракцию и v) сбор супернатантного компонента;
B) получение регенеративного компонента аутологичной композиции, включающее следующие стадии: i) сбор крови из млекопитающего; ii) помещение крови в пробирку в присутствие приблизительно 4% цитрата натрия; iv) центрифугирование цельной крови для отделения богатого тромбоцитами плазматического компонента и v) сбор богатого тромбоцитами плазматического компонента; и
C) смешивание супернатантного компонента противовоспалительного/антикатаболического компонента с богатым тромбоцитами плазматическим компонентом для получения аутологичной композиции.
По другому аспекту настоящее изобретение относится к способу получения аутологичной композиции для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, включающему следующие стадии:
i) сбор крови из млекопитающего; ii) добавление цитрата натрия в пробирку; iii) помещение крови в пробирку; iv) инкубацию крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов; v) центрифугирование крови для разделения крови на супернатантный компонент и клеточную фракцию и vi) сбор супернатантного компонента.
По другому аспекту настоящее изобретение относится к аутологичной композиции для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, полученной способом по настоящему изобретению.
По другому аспекту настоящее изобретение относится к аутологичной композиции для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, содержащей противовоспалительный/антикатаболический компонент, предпочтительно, включающий цитрат натрия, противовоспалительному/антикатаболическому компоненту, содержащему TIMP и ИЛ-1ra. Композиция дополнительно содержит регенеративный компонент, содержащий богатую тромбоцитами плазму.
По другому аспекту настоящее изобретение относится к аутологичной композиции для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, содержащей противовоспалительный/антикатаболический компонент, содержащий супернатантный компонент, полученный из аутологичной крови млекопитающего, указанному противовоспалительному/антикатаболическому компоненту, включающему ИЛ-1ra и TIMP, композиции, дополнительно содержащей регенеративный компонент, содержащий богатую тромбоцитами плазму, полученную из млекопитающего. Противовоспалительный/антикатаболический компонент, предпочтительно, включает цитрат натрия. Наиболее предпочтительно, цитрат натрия является 4%-ным раствором цитрата натрия.
По другому аспекту настоящее изобретение относится к применению аутологичной композиции по настоящему изобретению для лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего.
По другому аспекту настоящее изобретение относится к способу лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, включающему следующие стадии:
сбор крови из млекопитающего;
помещение крови в пробирку;
инкубацию крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов;
центрифугирование крови для разделения крови на супернатантный компонент и клеточную фракцию; и
сбор супернатантного компонента; и
получение регенеративного компонента аутологичной композиции, включающее следующие стадии:
сбор крови из млекопитающего;
помещение крови в пробирку в присутствие приблизительно 4% лимонной кислоты;
центрифугирование крови для отделения богатого тромбоцитами плазматического компонента от цельной крови;
сбор богатого тромбоцитами плазматического компонента; и
смешивание супернатантного компонента с богатым тромбоцитами плазматическим компонентом для получения аутологичной композиции; и
введение аутологичной композиции млекопитающему.
По другому аспекту настоящее изобретение относится к способу лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, включающему следующие стадии:
сбор крови из млекопитающего;
добавление цитрата натрия в пробирку;
помещение крови в пробирку;
инкубацию крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов;
центрифугирование крови для разделения крови на супернатантный компонент и клеточную фракцию;
сбор супернатантного компонента;
получение регенеративного компонента аутологичной композиции, включающее следующие стадии:
сбор крови из млекопитающего;
помещение крови в пробирку в присутствие лимонной кислоты;
центрифугирование крови для отделения богатого тромбоцитами плазматического компонента от цельной крови;
сбор богатого тромбоцитами плазматического компонента;
смешивание супернатантного компонента с богатым тромбоцитами плазматическим компонентом для получения аутологичной композиции; и
введение аутологичной композиции млекопитающему.
По другому аспекту настоящее изобретение относится к способу лечения поврежденных и/или травмированных соединительных тканей, хронического тендиноза, хронических разрывов мышц, и/или хронических дегенеративных нарушений суставов, и воспалительных нарушений кожи у млекопитающего, включающему следующие стадии:
сбор крови из млекопитающего;
помещение крови в пробирку в присутствие приблизительно 4% цитрата натрия;
инкубацию крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов;
центрифугирование крови для разделения крови на супернатантный компонент и клеточную фракцию;
сбор супернатантного компонента; и
введение супернатантного компонента млекопитающему.
Композиции и способы, представленные в настоящем описании, подходят для применения на людях. Они также подходят для широкого спектра ветеринарного применения, включая лечение лошадей, собак и верблюдов.
Настоящее изобретение относится к альтернативному продукту для лечения дегенеративного заболевания суставов у людей и для ветеринарного применения, включая применение у лошадей, собак и верблюдов, являющемуся относительно безопасным, эффективным, стабильным, регенеративным и рентабельным.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
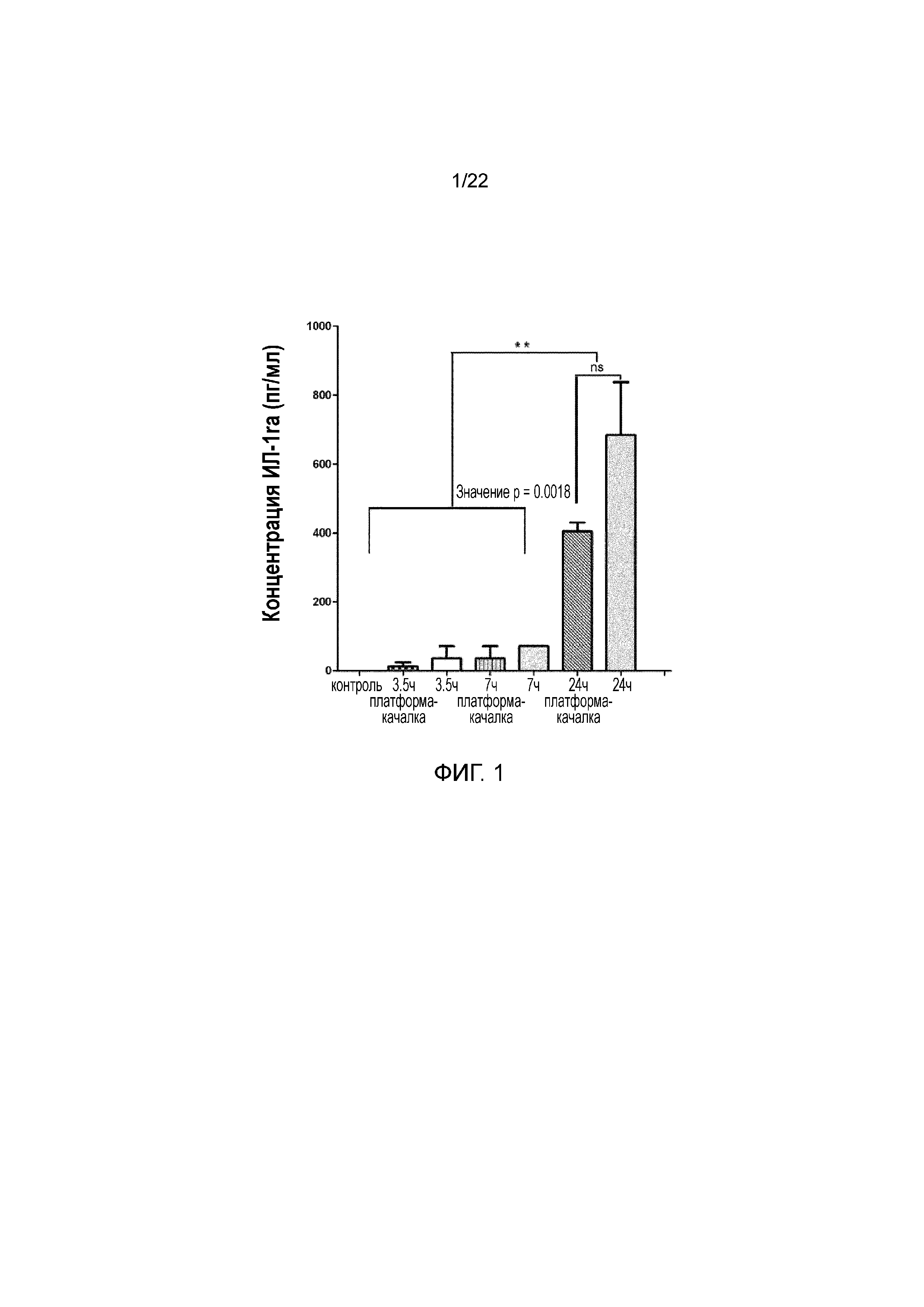
Фигура 1 является графиком концентрации ИЛ-1ra в пг/мл относительно времени, на котором показано сравнение уровня белка антагониста ИЛ-1ra в образцах сыворотки человека при различных условиях инкубации, включая стационарную инкубацию и встряхивание в различные моменты времени.
Фигура 2 является графиком концентрация ИЛ-1ra в пг/мл относительно времени, на котором показано сравнение уровня белка антагониста ИЛ-1ra в образцах сыворотки человека в различные моменты времени в присутствие воздуха, Ca++ (в фосфатно-солевом буфере, PBS) и различных концентраций сыворотки.
Фигуры 3a и 3b являются допплеросонограммами правой околопозвоночной области пациента до лечения (3a) и в нормальном состоянии после лечения (3b).
Фигуры 4a и 4b являютсядопплеросонограммами, на которых показан хронический тендиноз ахиллова сухожилия, отличающийся избыточной гиперемией (a, состояние до лечения), разрешающейся в результате лечения аутологичной композицией (b, изображение после лечения).
Фигура 5 является графиком, на котором показан средний уровень концентрации TIMP 1, TIMP 2 и TIMP 4 до и после инкубации в течение 24 ч.
Фигура 6 является графиком, на котором показан средний исходный уровень боли в коленном суставе в соответствии с визуальной аналоговой шкалой ("VAS") у восьми пациентов до и после инъекций.
Фигура 7 является графиком, на котором показаны значения точек в соответствии с индексом WOMAC для средних уровней боли в колене, тугоподвижности и способности к повседневной деятельности у восьми пациентов.
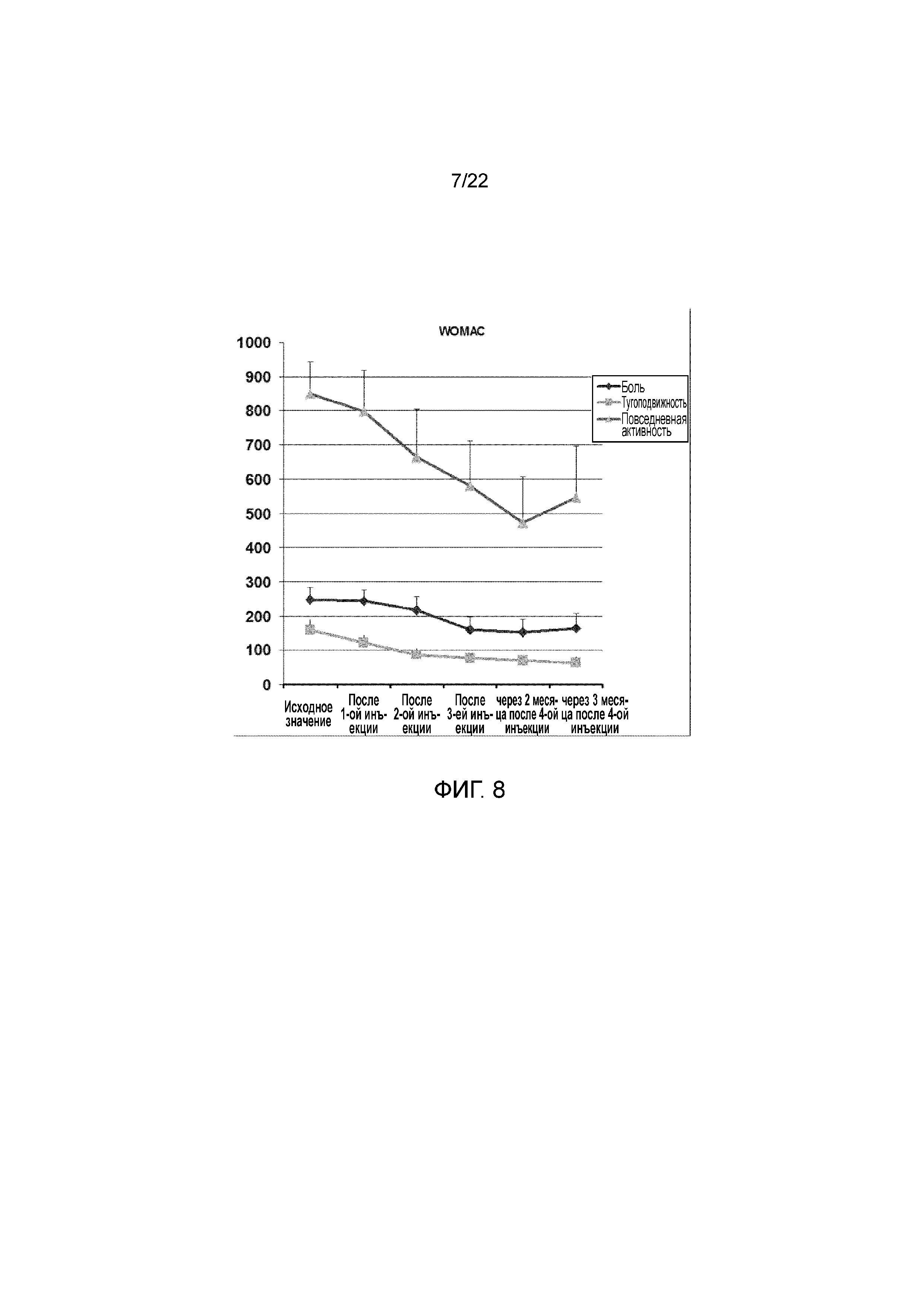
На фигуре 8 результаты показаны в форме графика, на котором показано снижение средних результатов после первой, второй и третей инъекций и на последующих осмотрах через два и три месяца.
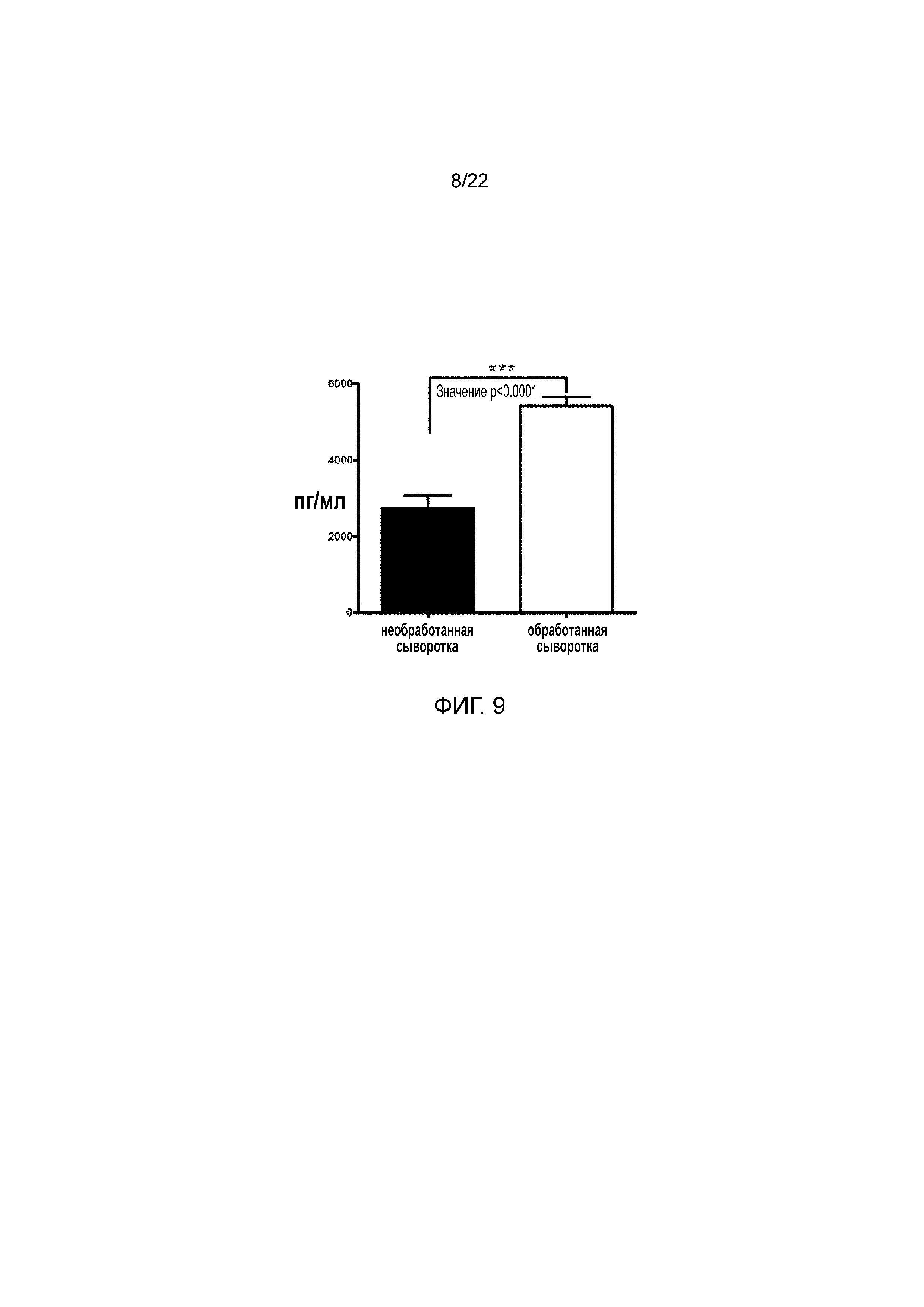
Фигура 9 является графиком, на котором показано сравнение среднего уровня концентрации PGDF в образцах сыворотки человека до и после инкубации в течение 24 ч.
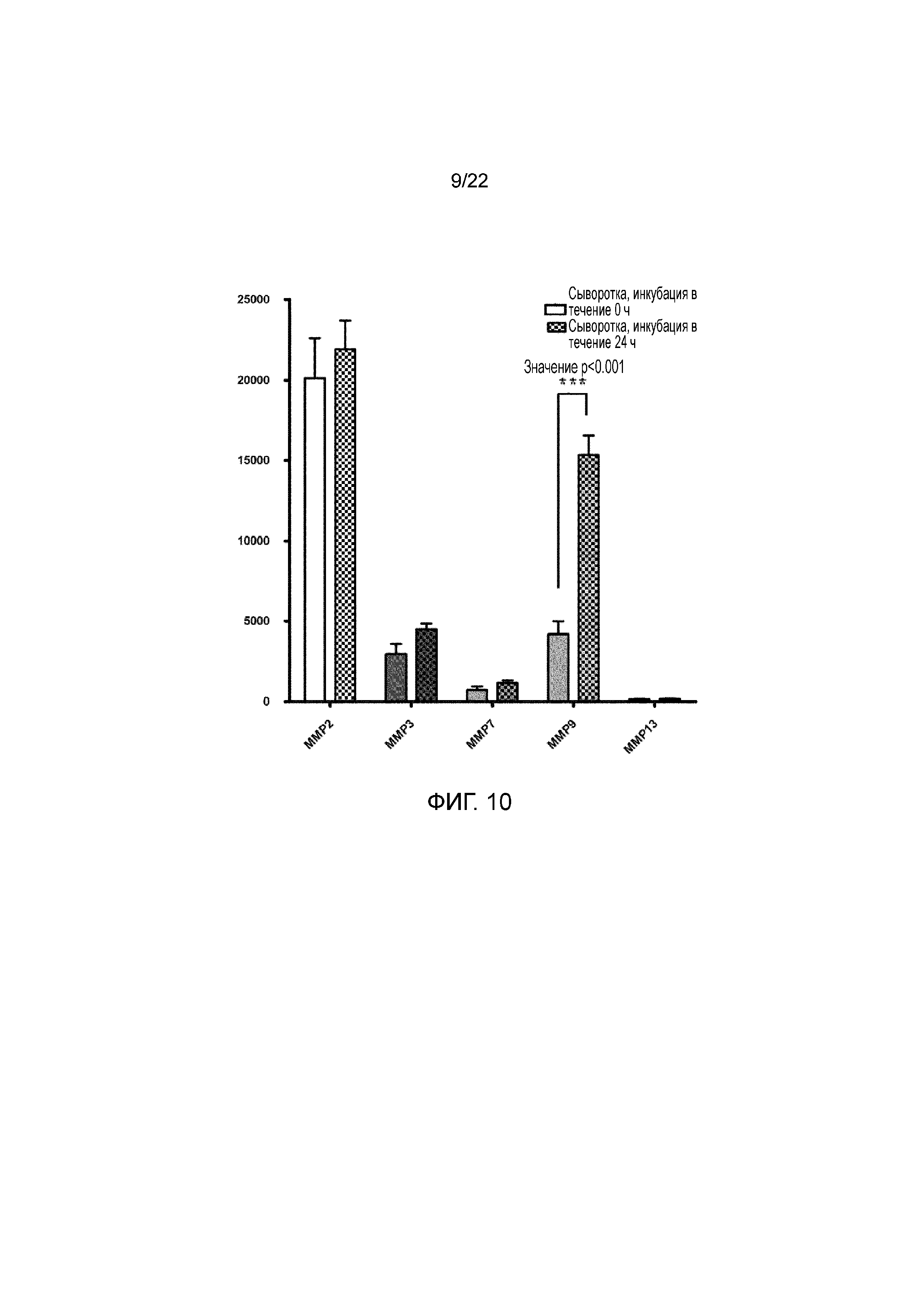
Фигура 10 является графиком, на котором показано сравнение уровня белков MMP2, MMP3, MMP7, MMP9 и MMP13 в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч.
Фигура 11 является графиком, на котором показано сравнение уровня белков MMP2, MMP3, MMP7, MMP9 и MMP13 в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч. в присутствие цитрата натрия.
Фигура 12 является графиком, на котором показаны данные о MMP9 с фигуры 11.
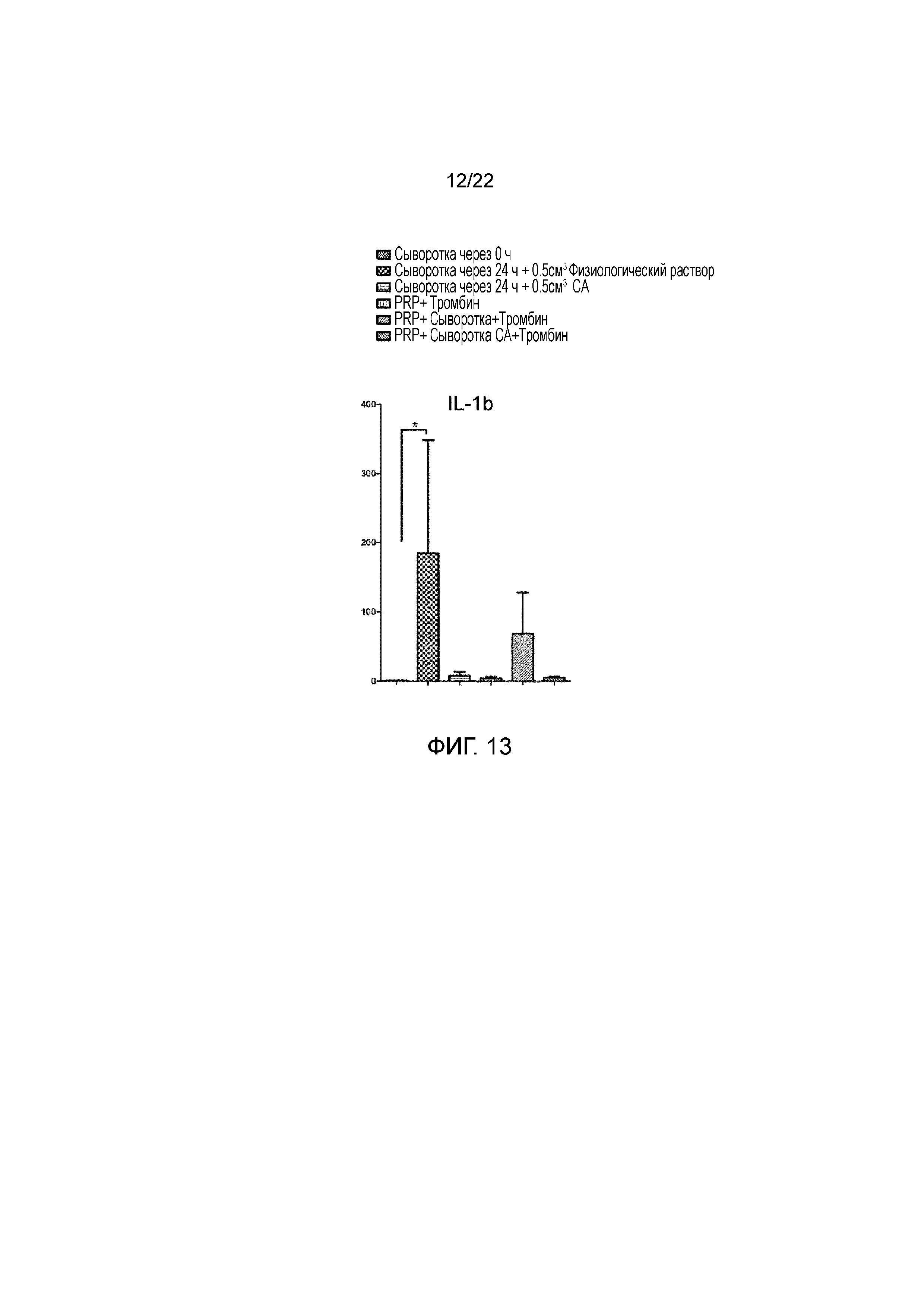
Фигура 13 является графиком, на котором показано сравнение уровня ИЛ-1β в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч., активированной PRP и в конечной композиции.
Фигура 14 является графиком, на котором показано сравнение уровня ФНО в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч., активированной PRP и в конечной композиции.
Фигура 15 является графиком, на котором показано сравнение уровня TIMP2 в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч., активированной PRP и в конечной композиции.
Фигура 16 является графиком, на котором показано сравнение уровня ИЛ-1ra в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч., активированной PRP и в конечном продукте.
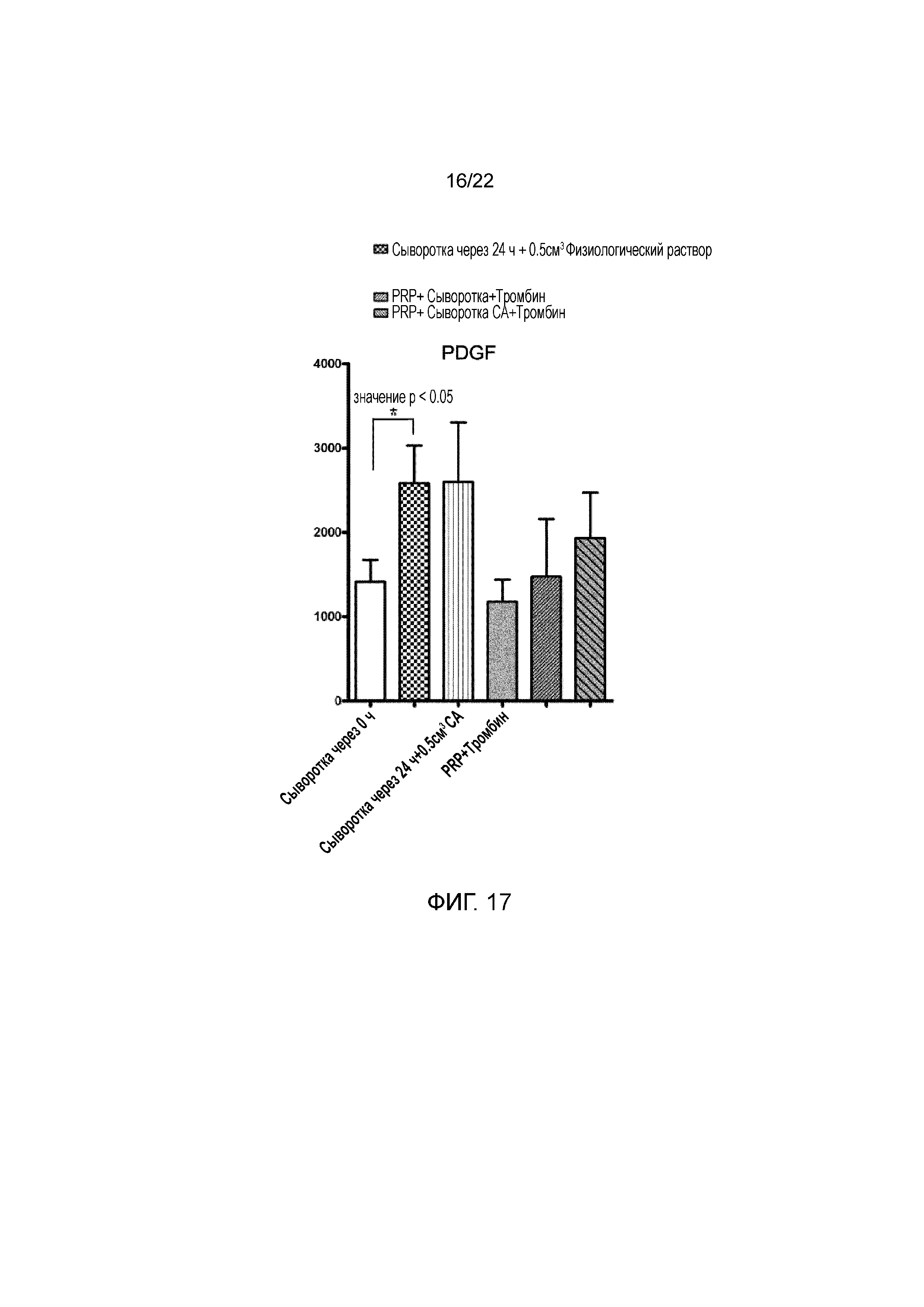
Фигура 17 является графиком, на котором показано сравнение уровня PDGF в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч, активированной PRP и в конечной композиции.
Фигура 18a является графиком, на котором показаны значения точек в соответствии с индексом WOMAC для средних уровней боли у семнадцати тестируемых пациентов. Представлены значения для исходного уровня и через 1 месяц после инъекций в группах CA- и CA+.
Фигура 18b является графиком, на котором показаны значения точек в соответствии с индексом WOMAC для средних уровней тугоподвижности у семнадцати тестируемых пациентов. Представлены значения для исходного уровня и через 1 месяц после инъекций в группах CA- и CA+.
Фигура 18c является графиком, на котором показаны значения точек в соответствии с индексом WOMAC для средних уровней способности к повседневной деятельности у семнадцати тестируемых пациентов. Представлены значения для исходного уровня и через 1 месяц после инъекций в группах CA- и CA+.
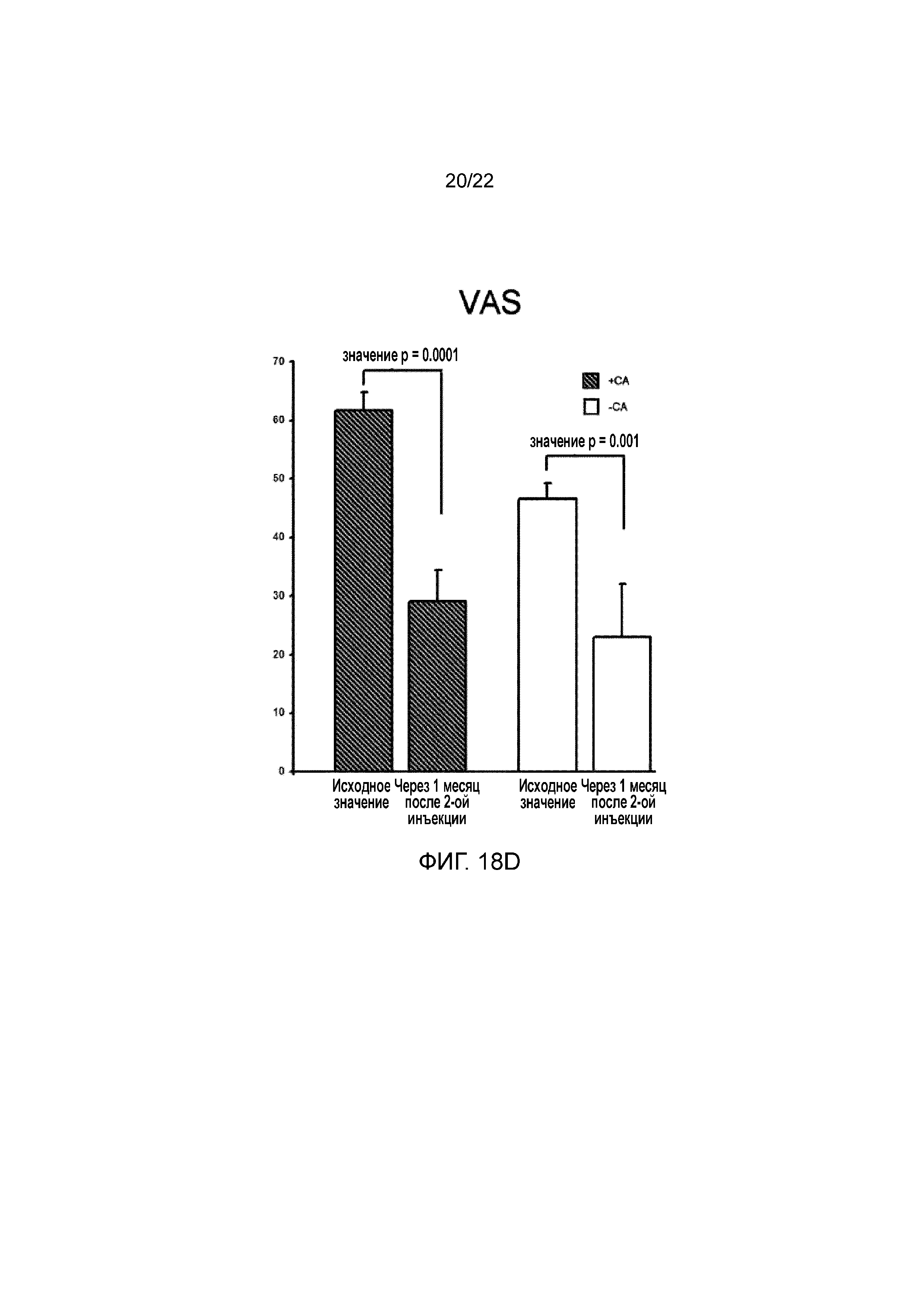
Фигура 18d является графиком, на котором показан статистический анализ визуальной аналоговой шкалы боли (VAS) у семнадцати тестируемых пациентов. Представлены значения для исходного уровня и через 1 месяц после инъекций в группах CA- и CA+.
Фигура 19a является фотографией кожи предплечья пациента, страдающего псориазом, перед лечением способом по настоящему изобретению.
Фигура 19b является фотографией кожи предплечья пациента, страдающего псориазом, через три месяца после лечения способом по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к композиции, содержащей аутологичный противовоспалительный/антикатаболический компонент и, предпочтительно, аутологичный богатый тромбоцитами плазматический компонент с сывороткой, обогащенной биологически активными белками, имеющими синергические противовоспалительные/антикатаболические, пролиферативные, ремоделирующие ткань и регенеративные эффекты.
Такая композиция, как правило, включает следующие терапевтически активные белки: ИЛ-1ra6, ИЛ-47, ИЛ-108,9, ИЛ-1310, PDGF11, TGF-β10,11 и VEGF12,13,14,16.
ИЛ-1ra секретируется моноцитами, адипоцитами и эпителиальными клетками. Терапевтически эффективных концентраций этого белка достигают посредством инкубации моноцитов человека при приблизительно 37°C в течение приблизительно 24 ч17. ИЛ-4, ИЛ-10, ИЛ-13, PDGF, TGF-β являются содержимым тромбоцитов и гранул, и они попадают в PRP-компонент. ИЛ-4, ИЛ-10, ИЛ-13 попадают из лейкоцитов. PDGF продуцируются тромбоцитами, и TGF-B высвобождается тромбоцитами и некоторыми T-клетками. Использование синергического эффекта указанных белков приводит к получению мощного биоактивного аутологичного продукта. Таким образом, комбинация свежеприготовленной PRP в качестве источника регенеративных биологических факторов и противовоспалительных цитокинов и факторов роста и противовоспалительного компонента, содержащего инкубируемую аутологичную сыворотку в качестве источника ингибитора ИЛ-1, представляет собой эффективное и рентабельное аутологичное терапевтическое средство для лечения дегенеративных состояний, подобных остеоартриту, хроническому тендинозу и хроническим разрывам мышц, а также воспалительным нарушениям кожи.
В рамках изобретения, термин "лечение" включает паллиативное лечение, посредством которого снижают боль и/или воспаление у индивидуума.
Способ получения противовоспалительного/антикатаболического компонента по изобретению неожиданно приводит к продукции повышенного уровня тканевых ингибиторов металлопротеиназ (TIMP) в дополнение к продукции ИЛ-1ra. Считают, что матричные металлопротеиназы MMP вызывают деструкцию сустава, когда они находятся в активном состоянии. TIMP нейтрализуют активные MMP, таким образом, обеспечивая дополнительный антикатаболический благоприятный эффект, являющийся синергическим по отношению к ИЛ-1ra.
Также неожиданно, что получение противовоспалительного/антикатаболического компонента по изобретению, добавление цитрата натрия перед инкубацией крови пациента при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов предотвращает образование повышенного уровня патологических молекулярных веществ, имеющих катаболический эффект в отношении суставов, таких как MMP9, ИЛ-1β и ФНО, но не приводит к значительно сниженному уровню антикатаболических и регенеративных средств, таких как TIMP, ИЛ-1ra и PDGF.
Описываемый способ получения аутологичной композиции для лечения остеоартрита, хронического тендиноза и хронических разрывов мышц, а также воспалительных нарушений кожи, предпочтительно, включает стадию сбора аутологичной физиологической жидкости млекопитающего, предпочтительно крови, асептическим способом. Предпочтительно, млекопитающее является человеком. Однако композиции и способы по изобретению также подходят для широкого спектра ветеринарного применения, например, для лечения лошадей, собак и верблюдов.
Участок венепункции и поверхность пробирок для сбора образцов можно очищать 2-процентной настойкой йода. Перед началом какой-либо очистки участка, пациента можно спросить о какой-либо аллергии на йод. Крышки пробирок очищают 70%-ным раствором спирта также во избежание возможной контаминации перед сбором крови.
Композицию, предпочтительно, получают посредством культивирования аутологичной физиологической жидкости, предпочтительно крови, при температуре, предпочтительно, от приблизительно 37°C до приблизительно 39°C. Однако специалисту в этой области будет понятно, что кровь можно инкубировать при температурах вне этого диапазона, например, приблизительно от 37°C до приблизительно 40°C, с приемлемыми результатами. Наиболее предпочтительно, температура составляет от 37°C до 38°C. Кровь инкубируют, предпочтительно, в течение приблизительно 24 часов для обогащения внеклеточного ИЛ-1ra и, предпочтительно, для получения TIMP. Предпочтительно, цитрат натрия, предпочтительно, в концентрации 4% добавляют в стерильную стеклянную пробирку или полистироловую пробирку, в которую собирают кровь перед инкубацией. В особенно предпочтительном варианте осуществления инкубацию можно осуществлять в стерильных стеклянных пробирках (Coviden) или полистироловых (BD) вакуумных пробирках без добавок. Вариант осуществления дополнительно относится к инкубации аутологичной физиологической жидкости, предпочтительно крови, на платформе-качалке (24 об/мин) или в статических условиях. Предпочтительно, инкубацию осуществляют в статических условиях, как показано на фигуре 1.
Предпочтительно, инкубацию крови осуществляют в присутствие 0,64-0,72 мМ Ca++ для облегчения продукции ИЛ-1ra15. В особенно предпочтительном варианте осуществления можно и предпочтительно разводить инкубируемую кровь стерильным раствором хлорида кальция, содержащим 0,64-0,72 мМ Ca++, в соотношении 9:1 посредством добавления раствора с использованием стерильного шприца и иглы непосредственно в пробирку с кровью перед инкубацией (1 см3 раствора хлорида кальция на 9 см3 цельной крови) (фигура 2). Равную часть стерильного воздуха можно добавлять в стерильные пробирки, содержащие кровь для подвергания крови воздействию атмосферного воздуха для повышения продукции ИЛ-1ra (фигура 2). В особенно предпочтительном варианте осуществления воздух будут пропускать через фильтр 0,22 мкм MillexGP с использованием стерильного шприца и иглы непосредственно в пробирку с кровью перед инкубацией.
Предпочтительно, цитрат натрия добавляют в кровь перед инкубацией в соотношении 9,5 частей цельной крови (9,5 см3): 0,5 (0,5 см3), предпочтительно, 4% цитрата натрия. 4% цитрат, предпочтительно, является 4%-ным раствором цитрата натрия. Четырехпроцентные растворы цитрата натрия являются коммерчески доступными.
Затем инкубируемую кровь подвергают центрифугированию для разделения супернатантного компонента и клеточной фракции. Центрифугирование осуществляют в течение приблизительно 10-20 минут при приблизительно 4000-10000 об/мин. Предпочтительно, центрифугирование осуществляют в течение 10 минут при 4000 об/мин.
Следующая стадия включает аспирацию супернатанта и разделение его на аликвоты для дальнейшей обработки стерильным способом. Способ осуществляют в стерильной среде (ламинарный шкаф с фильтрами HEPA). Три см3 слоя супернатанта, содержащего биологически активные средства, осторожно отбирали стерильным шприцом и иглой. Длительное хранение продукта, содержащего ИЛ-1ra, осуществляют посредством замораживания аликвот при приблизительно -20°C и их хранения в течение до 6 месяцев или до одного года при приблизительно -70°C.
Затем получение регенеративного компонента, содержащего PRP, включает забор крови в вакуумные пробирки. Предпочтительно, это осуществляют в присутствие 4% лимонной кислоты. Предпочтительно, в соотношении 9,5 частей цельной крови (9,5 см3):0,5 (0,5см3) 4% лимонной кислоты. Затем кровь подвергают центрифугированию предпочтительно в течение приблизительно 30 сек при приблизительно 7500 об/мин для выделения фракции PRP. Параметры центрифугирования используют в предпочтительных вариантах осуществления для получения PRP как части конечного продукта для лечения остеоартрита, хронического тендиноза и нарушений кожи. Фракцию PRP отбирают стерильным шприцом и иглой в стерильных условиях. В особенно предпочтительном варианте осуществления для лечения хронических разрывов фракцию лейкоцитарной пленки добавляют к PRP в качестве дополнительного источника VEGF для стимуляции развития новых кровеносных сосудов в пораженной области. Слой лейкоцитарной пленки и плазму собирают вручную стерильным шприцом и иглой после центрифугирования цельной крови, как указано выше или с использованием коммерчески доступной системы Harvest SmartPrep system. Регенеративный компонент, содержащий PRP, не подвергают замораживанию или другому хранению. Аутологичная композиция подлежит введению пациенту незамедлительно после смешивания регенеративного компонента с противовоспалительным/антикатаболическим компонентом.
Противовоспалительный/антикатаболический компонент, содержащий ИЛ-1ra, и, предпочтительно, кровь, содержащую TIMP, смешивают с регенеративным компонентом, содержащим фракцию PRP, предпочтительно, в соотношении 1:1 для получения конечного продукта.
Продукт инъецируют для дальнейшей медленной активации коллагеном сухожилия18и тканевым тромбином.
Далее изобретение описывают с помощью следующих иллюстративных примеров.
Примеры
Пример 1 - Сравнение продукции внеклеточного ИЛ-1ra после разных условий культивирования.
Как графически показано на фигуре 1, осуществляли сравнение уровня белка антагониста ИЛ-1ra в образцах сыворотки человека, подвергнутых воздействию условий инкубации в различные моменты времени, включая сравнение стационарной инкубации с инкубацией при встряхивании. ИЛ-1ra секретируется активированными моноцитами, макрофагами крови. Такой активации достигают посредством приведения клеток крови в контакт с внутренними поверхностями пробирок для сбора образцов посредством встряхивания. Повышая площадь внутренней поверхности, подвергаемой воздействию клеточного компонента, можно максимизировать активацию клеток и секрецию биоактивных молекул.
Периферическую кровь 10 здоровых добровольных доноров мужского и женского пола (возрастом от 21 до 60 лет) собирали посредством венепункции в стерильных условиях в стерильные стеклянные пробирки емкостью 10 мл. Одну пробирку обрабатывали стандартным способом без стадии инкубации (контрольный образец). Образцы инкубировали в течение 3,5 ч., 7 ч. и 24 ч. при 37°C со встряхиванием на платформе-качалке (24 об/мин) и без него. Инкубированные образцы центрифугировали в течение 10 минут при 4000 об/мин, а затем фильтровали, и конечные концентрации ИЛ-1ra сравнивали с концентрациями в необработанных контрольных образцах (0 ч.) по инструкциям производителя (доступным в сети интернет на bio-rad.com/webroot/web/pdf/lsr/literature/10014905.pdf). С использованием одностороннего теста ANOVA выявляли значительное повышение концентрации ИЛ-1ra в сыворотке только через 24 ч. инкубации; не наблюдали значимой концентрации ИЛ-1ra в образцах, инкубированных в течение 3,5 ч. и 7 ч. Кроме того, не наблюдали значимых различий между инкубацией в стационарных условиях и при встряхивании. Концентрацию ИЛ-1ra оценивали с использованием технологии MAGPIX LuminexTM.
На фигуре 2 показано сравнение уровня белка антагониста ИЛ-1ra в образцах сыворотки человека, подвергнутых следующим условиям инкубации: инкубация в течение 24 ч. в присутствие воздуха, Ca++ (в фосфатно-солевом буфере, PBS) и различных концентраций сыворотки. С использованием одностороннего теста ANOVA выявляли значительное повышение продукции в сыворотке через 24 ч. инкубации во всех указанных условиях, за исключением культивирования в 50% разведенной крови.
Пример 2 - Клинические случаи пациентов с диагнозом остеоартрит и хронический тендиноз, которых лечили аутологичной композицией.
Способы и материалы:
Для каждого пациента в настоящем описании противовоспалительный/антикатаболический компонент аутологичной композиции, содержащий ИЛ-1ra и TIMP, получали посредством: сбора крови пациента; помещения крови в пробирку; инкубации крови при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов; центрифугирования крови для разделения крови на супернатантный компонент и клеточную фракцию и сбора супернатантного компонента противовоспалительного компонента. Аналогично, регенеративный компонент аутологичной композиции получали посредством: сбора крови пациента; помещения крови в пробирку в присутствие приблизительно 4% лимонной кислоты; центрифугирования крови для отделения богатого тромбоцитами плазматического компонента от цельной крови компонент; сбора богатого тромбоцитами плазматического компонента и смешивания супернатантного компонента противовоспалительного/антикатаболического компонента с богатым тромбоцитами плазматическим компонентом для получения аутологичной композиции. Затем аутологичную композицию вводили пациенту.
Случай 1: S, 61 лет.
Диагноз: Пациент сообщал о билатеральной боли в колене с внезапным началом, начавшейся несколькими годами ранее и усилившейся в течение последних 6 месяцев. При МРТ коленных суставов выявляли тяжелый OA коленных суставов: тяжелый хондроз медиального компартмента с повышенной степенью утраты полной толщины хряща, затрагивающей правый мыщелок и мыщелок бедренной кости в правом коленном суставе, и утрату полной толщины хряща, включающую заднюю часть медиального блока бедренной кости, с нижележащим отеком в правом коленном суставе. Одним годом ранее пациенту делали инъекцию кортизона IA, приведшую к облегчению на один месяц. Физикальный осмотр: гибкость в коленном суставе (ROM) была полной, все связки были нормальными, небольшой билатеральный суставной выпот, нейроваскулярное обследование являлось нормальным. VAS составлял 60.
Лечение: Билатеральные инъекции местной аутологичной для пациента композиции в коленные суставы пациента три раза с недельным интервалом.
Результаты: После первой билатеральной инъекции местной аутологичной для пациента композиции у пациента наблюдали значительное улучшение, VAS составлял 3. Во время 3-ейинъекции ROM была полной, все связки были нормальными, отсутствие боли по линии сустава и отсутствие суставного выпота. Пациент сообщал о сильном снижении боли, VAS составлял 10, пациент вернулся к физической активности. Тремя месяцами позже последующий осмотр показал отсутствие боли у пациента.
Случай 2: E, 64 лет.
Диагноз: Активный мужчина с VAS 60 в левом тазобедренном суставе. Боль при повседневной деятельности и значительное ухудшение при ходьбе на большие расстояния. При МРТ выявляли слабый OA в обоих тазобедренных суставах: билатеральную дегенерацию тазобедренного сустава и дегенеративные разрывы вертлужной губы. Физиотерапевтическое лечение имело ограниченный успех в терминах облегчения боли.
Лечение: Инъекция местной аутологичной композиции, полученной для пациента, под контролем ультразвука в левый тазобедренный сустав 2 раза с недельным интервалом.
Результаты: после 1-ой инъекции местной аутологичной композиции пациент сообщал о 85% улучшении боли (личная оценка пациентом). После второй инъекции местной аутологичной композиции VAS составлял 10. Пятью месяцами позже VAS также составлял 10.
Случай 3: A, 70 лет.
Диагноз: Пациентка с хронической болью (VAS составлял 6), болезненностью и отеком левого коленного сустава. Она имела значительные затруднения при ходьбе, в стоячем положении и подъеме по лестнице. Она безрезультатно посещала физиотерапевта (6 посещений), мануального терапевта (6 посещений) для облегчения боли в колене. При МРТ наблюдали тяжелый OA в левом коленном суставе, с сужением медиального компартмента по причине утраты полной толщины хряща в части, несущей весовую нагрузку, медиального мыщелка бедренной кости и медиального плато большеберцовой кости.
Лечение: Получали местную аутологичную композицию и осуществляли инъекции в левый коленный сустав три раза с недельным интервалом.
Результаты: Последующее посещение через пять месяцев после лечения местной аутологичной композицией: пациент сообщал о приблизительно 80% улучшении симптомов, отсутствии отеков; VAS составляет 20.
Случай 4: J, 26 лет, профессиональный пловец.
Диагноз: Состояние после травмы околопозвоночных мышц, хронический околопозвоночный тендинит. Пациент жаловался на боль в околопозвоночной мышце. Длительная физиотерапия не имела результата. ROM спины является полной, нейроваскулярное обследование являлось нормальным. Площадь правой околопозвоночной гиперемии идентифицировали с помощью цветной допплерографии (фигура 3a), VAS составлял 80.
Лечение: Воспаленную область отмечали с использованием ультразвука, аутологичную композицию инъецировали внутримышечно 4 раза с недельным интервалом.
Фигуры 3a и 3b являются допплеросонограммами, на которых показана гиперемия правой околопозвоночной области до лечения (фигура 3a) и нормальное состояние после лечения (фигура 3b).
Результаты: При допплерографии не наблюдали воспаление (фигура 3 b), VAS составлял 10 через четыре месяца после терапии.
Случай 5: S, 18 лет.
Диагноз: Состояние после разрыва правого ахиллова сухожилия. Пациент жаловался на боль в месте прикрепления ахиллова сухожилия: хронический тендинит ахиллова сухожилия и тендосиновит. При допплерографии наблюдали тяжелую гиперемию внутри сухожилия в области (фигура 4a). VAS составлял 60.
Лечение: Длительная физиотерапия и лечение у мануального терапевта не приводили к какому-либо положительному результату. Аутологичную композицию получали и инъецировали в сухожилие три раза с недельным интервалом под контролем ультразвука.
Фигуры 4a и 4b являются допплеросонограммами, на которых показан хронический тендиноз ахиллова сухожилия, отличающийся избыточной гиперемией (фигура 4a, состояние до лечения), разрешающейся в результате лечения аутологичной композицией (фигура 4b, визуализация после лечения).
Результаты: при допплерографии не наблюдали гиперемию (фигура 4b), VAS составлял 0 при последующем осмотре через пять месяцев после инъекций.
Пример 3 - Исследования in vitro
Периферическую кровь здоровых добровольных доноров мужского и женского пола (от 21 до 60 лет) собирали посредством венепункции в стерильных условиях в стерильные стеклянные пробирки емкостью 10 мл. Одну пробирку обрабатывали стандартным способом без стадии инкубации (контрольный образец). Образцы подвергали воздействию различных условий инкубации и для анализа использовали 500 мкл сыворотки из каждого образца. Перед анализом образцы центрифугировали при 10000×g в течение 10 мин при 4°C для удаления клеточного дебриса и агрегатов. Анализ с использованием BioPlex ProTM Human Cytokine 27-plex Panel, Human TIMP Magnetic LuminexTM Performance Assay 4-plex PanelTM (Bio-Rad Laboratories, Canada, LTD) с частицами MagPlexTM осуществляли в плоскодонном планшете для микротитрования по инструкциям производителя (доступным в сети интернет на bio-rad.com/webroot/web/pdf/lsr/literature/10014905.pdf).
В кратком изложении, образцы разводили 1:4 в дилюенте для образцов. Стандарт восстанавливали и разводили в серии четырехкратных разведений. Получали соединенные с антителом иммобилизованные частицы и помещали их на планшет. Перед добавлением в каждую лунку раствор частиц перемешивали на центрифуге типа вортекс. Планшет промывали, все стадии промывки осуществляли вручную. Сначала на планшет добавляли промывочный раствор, затем закрывали его упаковочной лентой. Планшет инкубировали на шейкере в течение 30 сек при 1100 об/мин, а затем в течение 1,5 мин при 300 об/мин. Планшет снимали с шейкера и инкубировали на магните в течение 1 мин перед удалением супернатанта. После промывки разбавленные образцы и стандарты добавляли к частицам в лунки в двух параллелях. Планшет инкубировали на шейкере в течение 30 минут и после инкубации и промывки добавляли детекторные антитела на 30 минут в каждую лунку. Планшет снова инкубировали на шейкере и после еще одной стадии промывки в лунки добавляли раствор стрептавидина на 10 минут. После последней стадии инкубации частицы ресуспендировали в буфере для анализа и планшет считывали с помощью MagPixTM (Luminex Corporation) с использованием программного обеспечения xPONENTTM (Luminex Corporation, Austin, TX, USA). Результаты анализировали с использованием программного обеспечения xPONENTTM. Абсолютные концентрации образцов определяли посредством построения стандартной кривой для каждого аналита.
Статистический анализ: Все статистические тесты осуществляли с использованием GraphPad PrismTM версии 5.01. Статистические анализы осуществляли с использованием дисперсионного анализа (ANOVA) с апостериорными тестами Бонферрони для сравнения групп. Количество анализируемых экспериментов составляло ≥3, и данные представлены в виде среднего ± SEM, p<0,05.
Фигура 5 является графиком, на котором показано сравнение уровня белков TIMP 1, TIMP 2 и TIMP 4 (антагонистов MMP) в образцах сыворотки человека до (исходный уровень) и после инкубации при 37°C в течение 24 ч. При двухстороннем тесте ANOVA выявляли статистически значимое повышение уровней TIMP 1 и TIMP 2 через 24 часа после инкубации.
Фигура 9 является графиком, на котором показано сравнение среднего уровня концентрации PGDF в необработанных образцах сыворотки человека и среднего уровня PGDF в инкубированных в течение 24 ч. образцах. При анализе данных тестирования наблюдали статистически значимое повышение концентрации белка PGDF в обработанных образцах. Концентрацию PDGF оценивали с использованием технологии MAGPIX LuminexTM.
Пример 4 - Результаты пациентов, которых лечили от боли при остеоартрите коленного сустава
Восьмерых пациентов лечили от симптомов боли при остеоартрите коленного сустава. Пациентам проводили четыре инъекции местной аутологичной композиции способом, описанным в примере 2, с недельным интервалом.
Пациентов оценивали после проведения инъекций с помощью визуальной аналоговой шкалы боли (VAS) и опросника Western Ontario and McMaster Universities Arthritis Index (WOMAC) для оценки боли, тугоподвижности и функционального статуса у пациентов с остеоартритом тазобедренного и/или коленного сустава. При анализе данных опросника WOMAC выявляли статистически значимое улучшение повседневной деятельности пациентов и статистически незначимую, но положительную динамику улучшения параметров боли и тугоподвижности в течение длительного периода времени (до 3 месяцев), как показано на фигуре 7. При статистическом анализе визуальной аналоговой шкалы боли выявляли значимое снижение боли после третьей инъекции, как показано на фигуре 6.
Фигура 6 является гистограммой, на которой показано сравнение среднего исходного значения и значения боли в суставах после инъекций по шкале VAS у восьми пациентов. Результаты свидетельствуют о статистически значимом среднем снижении боли со стабильным эффектом в течение до 3 месяцев.
Фигура 7 является графиком, на котором показаны значения точек в соответствии с индексом WOMAC для средних уровней боли, тугоподвижности и способности к повседневной деятельности у восьми пациентов. Представлены исходные значения, значения после инъекций, через два месяца и три месяца после инъекций.
На фигуре 8 показаны результаты в форме графика для восьми пациентов, на котором показано снижение средних результатов после первой, второй и третей инъекций, через два месяца и три месяца после четвертой инъекции.
Результаты, представленные на фигурах 6-8, являются средними результатами для восьми тестируемых пациентов.
Пример 5 - Эффект добавления цитрата натрия (CA) перед инкубацией при получении противовоспалительного/антикатаболического компонента
Пятнадцать пациентов тестировали для определения эффекта добавления цитрата натрия (CA) к крови пациентов перед инкубацией крови в течение приблизительно 24 часов в отношении уровней MMP, включая MMP9, ИЛ-1β, ФНО, TIMP2, ИЛ-1ra и PDGF в противовоспалительном компоненте и в конечном продукте, являющемся комбинацией противовоспалительного компонента и регенеративного или PRP-компонента.
В следующем описании термины "кровь" и "сыворотка" используют взаимозаменяемо.
Способы и материалы:
Для каждого пациента в настоящем описании противовоспалительный/антикатаболический компонент получали следующим образом. Собирали приблизительно 9,5 см3 крови пациента. Затем приблизительно 9,5 см3 крови помещали в первую пробирку, содержащую приблизительно 0,5 см3 физиологического раствора. Физиологический раствор содержал приблизительно 0,9% NaCl. Собирали другие приблизительно 9,5 см3 крови пациента и помещали во вторую пробирку, содержащую приблизительно 0,5 см3 4% цитрата натрия. После сбора крови первую и вторую пробирки инкубировали при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов. Затем первую и вторую пробирки центрифугировали для разделения крови в каждой пробирке на супернатантный компонент и клеточную фракцию. Супернатантные компоненты первой и второй пробирок собирали раздельно для получения первого противовоспалительного/антикатаболического компонента, получаемого из первой пробирки, содержащей физиологический раствор, и второго противовоспалительного/антикатаболического компонента, получаемого из второй пробирки, содержащей цитрат натрия. Для каждого пациента регенеративный компонент получали посредством: сбора крови пациента; помещения крови в пробирку в присутствие приблизительно 4% лимонной кислоты и центрифугирования крови для отделения богатого тромбоцитами плазматического компонента от цельной крови. Для каждого пациента богатый тромбоцитами плазматический компонент собирали и смешивали с супернатантным компонентом из первой и второй пробирок, соответственно, для получения первого конечного продукта, получаемого из первой пробирки, содержащей физиологический раствор, и второго конечного продукта, получаемого из второй пробирки, содержащей цитрат натрия.
Для каждого пациента исходный уровень MMP2, MMP3, MMP7, MMP9, MMP13, ИЛ-1β, ФНО, TIMP2, ИЛ-1ra и PDGF измеряли непосредственно после забора крови. Для каждого из пятнадцати пациентов уровень MMP9, ИЛ-1β, ФНО, TIMP2, ИЛ-1ra и PDGF измеряли в первой пробирке, содержащей физиологический раствор и кровь пациента, приблизительно через 24 часа после инкубации. Аналогично, для каждого из пятнадцати пациентов уровень MMP9, ИЛ-1β, ФНО, TIMP2, ИЛ-1ra и PDGF измеряли во второй пробирке, содержащей цитрат натрия и кровь пациента, приблизительно через 24 часа после инкубации. Для каждого пациента богатый тромбоцитами плазматический компонент смешивали с тромбином, а затем измеряли уровни MMP9, ИЛ-1β, ФНО, TIMP2, ИЛ-1ra и PDGF. Для каждого пациента уровень MMP9, ИЛ-1β, ФНО, TIMP2, ИЛ-1ra и PDGF измеряли в каждом из первого и второго конечных продуктов. Измерения, графически показанные на фигурах 10-17, представляют собой средние значения для пятнадцати тестируемых пациентов.
У пятнадцати тестируемых пациентов средний уровень ИЛ-1ra в нативной сыворотке (крови) в 0 часов инкубации составлял 9±4 пг/мл. В конечном продукте, получаемом при комбинировании противовоспалительного/антикатаболического компонента с регенеративным или PRP-компонентом, среднее измерение ИЛ-1ra в нативной сыворотке (крови) составляло 920±80 пг/мл. Это наблюдали и в случае добавления цитрата натрия к противовоспалительному/антикатаболическому компоненту, и без него.
У пятнадцати тестируемых пациентов средний уровень PDGF в нативной сыворотке (крови) в 0 часов инкубации составлял 1100 ±300 пг/мл. В конечном продукте, получаемом при комбинировании противовоспалительного/антикатаболического компонента с регенеративным или PRP-компонентом, среднее измерение PDGF в нативной сыворотке (крови) составляло 1920±380 пг/мл. Это наблюдали и в случае добавления цитрата натрия к противовоспалительному/антикатаболическому компоненту, и без него.
У пятнадцати тестируемых пациентов средний уровень TIMP2 в нативной сыворотке (крови) в 0 часов инкубации составлял 1800 ±150 пг/мл. В конечном продукте, получаемом при комбинировании противовоспалительного/антикатаболического компонента с регенеративным или PRP-компонентом, среднее измерение TIMP2 в нативной сыворотке (крови) составляло 5500±360 пг/мл. Это наблюдали и в случае добавления цитрата натрия к противовоспалительному/антикатаболическому компоненту, и без него.
На этих фигурах "сыворотка через 0 ч." является исходным измерением уровня аналита в крови пациентов, измеряемым непосредственно после сбора. "Сыворотка через 24 ч.+0,5 см3 физиологического раствора" представляет собой уровень аналита в крови пациентов, смешанной с физиологическим раствором через 24 часа инкубации. "Сыворотка через 24 ч.+0,5 см3 CA" представляет собой уровень аналита в крови пациентов, смешанной с 4%-ным раствором цитрата натрия, через 24 часа инкубации. "PRP+тромбин" представляет собой уровень аналита в PRP-компоненте, комбинированном с тромбином в качестве свертывающего средства. Это измерение представляет собой исходный уровень аналита в PRP-компоненте. "PRP+сыворотка+тромбин" или "PRP+сыворотка через 24 ч.+тромбин" представляет собой уровень аналита в конечном продукте, получаемом при комбинировании противовоспалительного/антикатаболического компонента с регенеративным или PRP-компонентом, где противовоспалительный/антикатаболический компонент получали только с физиологическим раствором и без цитрата натрия. "PRP+сыворотка+CA+тромбин" или "PRP+сыворотка через 24 ч.+CA+тромбин" представляет собой уровень аналита в конечном продукте, получаемом при комбинировании противовоспалительного/антикатаболического компонента с регенеративным или PRP компонентом, где противовоспалительный/антикатаболический компонент получали с использованием цитрата натрия.
При получении противовоспалительного/антикатаболического компонента, как описано в примере 2, наблюдали, что получение этого компонента приводит к повышенному уровню ИЛ-1ra (противовоспалительного средства), TIMP (антикатаболических средств) и PDGF (регенеративного средства) после стадии инкубации. Способ получения аутологичной биоактивной композиции основан на способности активированных мононуклеарных клеток крови секретировать положительные биоактивные молекулы. Однако определяли, что те же иммунные клетки неселективно продуцируют патологические молекулярные вещества и их ингибиторы после их активации. Таким образом, аутологичная биоактивная композиция также содержит повышенную концентрацию катаболических молекул, таких как MMP9. Это подтверждали посредством количественного анализа четырех типов MMP в антикатаболическом компоненте, полученном после инкубации крови пациентов в присутствие физиологического раствора при температуре от приблизительно 37°C до приблизительно 39°C в течение приблизительно 24 часов, как показано на фигуре 10. Хотя концентрации MMP2, MMP3, MMP7, MMP13 значимо не изменялись после инкубации, концентрация MMP9, наиболее важной для патогенеза остеоартрита, значимо повышалась, как показано на фигуре 10. При одностороннем тесте ANOVA выявляли статистически значимое повышение уровней MMP9 через 24 часа после инкубации.
Наличие повышенной концентрации MMP9 в аутологичной биоактивной композиции может приводить к проявлению неблагоприятного эффекта при лечении пациента. Таким образом, желательной является селективная элиминация этого отрицательного компонента. Наличие антикоагулянта цитрата натрия значимо отрицательно регулирует высвобождение MMP9 лейкоцитами крови человека19. Кровь человека в присутствие цитрата натрия (CA) в соотношении 9,5 см3 крови:0,5 см3 цитрата натрия инкубировали при температуре от приблизительно 37°C до приблизительно 39°C в течение 24 часов и обнаруживали сильные динамические изменения, особенно в секреции MMP9, как показано на фигурах 11 и 12. В частности, добавление цитрата натрия при получении противовоспалительного/антикатаболического компонента значимо снижало концентрацию MMP9 в конечном продукте комбинации противовоспалительного/антикатаболического компонента и регенеративного компонента (тромбин-активированная PRP+сыворотка через 24 ч.). Уровень MMP9 после инкубации в течение 24 ч. не изменялся по сравнению с исходным уровнем (0 ч.), если при получении противовоспалительного/антикатаболического компонента добавляли цитрат натрия. Измерение уровня MMP9 в PRP-компоненте с тромбином осуществляли для демонстрации исходного уровня MMP9 в PRP-компоненте. Это измерение свидетельствует о том, что при получении PRP-компонента не продуцируется значимое количество MMP9.
Учитывая, что инкубация крови приводит к повышению прокатаболической молекулы MMP9, тестировали концентрации других патологических молекулярных веществ, а именно ИЛ-1β и ФНО, в инкубированной сыворотке и в конечном продукте комбинации противовоспалительного/антикатаболического компонента и регенеративного компонента (тромбин-активированная PRP+сыворотка крови, инкубированная в течение 24 ч). Тестировали эффект цитрата натрия в отношении этих молекул, высвобождаемых активированными лейкоцитами при инкубации. Обнаруживали, что, хотя концентрации ИЛ-1β и ФНО значимо повышались после инкубации. Этот эффект можно эффективно блокировать посредством добавления цитрата натрия при получении противовоспалительного/антикатаболического компонента, как показано на фигурах 13 и 14.
Со ссылкой на фигуру 13, с помощью двухстороннего теста ANOVA выявляли статистически значимое снижение концентрации ИЛ-1β в сыворотке крови, инкубированной в течение 24 часов при температуре от приблизительно 37°C до приблизительно 39°C в присутствие цитрата натрия, а также в конечном продукте (PRP+сыворотка через 24 ч.+цитрат натрия (CA)+тромбин) по сравнению с описанным ранее способом получения продукта (PRP+сыворотка через 24 ч.+физиологический раствор). Как указано на всем протяжении настоящего описания, конечный продукт (PRP+сыворотка через 24 ч.+CA+тромбин) является комбинацией противовоспалительного/антикатаболического компонента и регенеративного компонента.
Со ссылкой на фигуру 14, с помощью двухстороннего теста ANOVA выявляли статистически значимое снижение концентрации ФНО в сыворотке крови, инкубированной в течение 24 часов при температуре от приблизительно 37°C до приблизительно 39°C в присутствие цитрата натрия, а также в конечном продукте (PRP+сыворотка чрез 24 ч.+CA+тромбин) по сравнению с описанным ранее способом получения продукта (PRP+сыворотка через 24 ч.+физиологический раствор).
Для оценки того, влияет ли добавление цитрата натрия к противовоспалительному/антикатаболическому компоненту на ингибиторы патологических молекулярных веществ при получении биоактивной композиции, концентрации TIMP, ИЛ-1ra и PDGF тестировали в схожих условиях. Как показано на фигурах 15, 16 и 17, не наблюдали отрицательных эффектов цитрата натрия в отношении продукции TIMP, ИЛ-1ra и PDGF.
Со ссылкой на фигуру 15,сравнение уровня TIMP2 в образцах сыворотки человека осуществляли до (исходный уровень), после инкубации при 37°C в течение 24 ч, в активированном PRP и в конечном продукте. С помощью двухстороннего теста ANOVA выявляли, что цитрат натрия не снижает концентрацию TIMP в сыворотке, инкубированной в течение 24 часов в присутствие цитрата натрия, а также в конечном продукте (PRP+сыворотка через 24 ч.+CA+тромбин) по сравнению с описанным ранее способом получения продукта (PRP+сыворотка через 24 ч.+физиологический раствор).
Со ссылкой на фигуру 16, с помощью двухстороннего теста ANOVA выявляли, что цитрат натрия не снижает концентрацию ИЛ-1ra в сыворотке, инкубированной в течение 24 часов в присутствие цитрата натрия, а также в конечном продукте (PRP+сыворотка через 24 ч.+CA+тромбин) по сравнению с описанным ранее способом получения продукта (PRP+сыворотка через 24 ч.+физиологический раствор).
Со ссылкой на фигуру 17, с помощью двухстороннего теста ANOVA выявляли, что цитрат натрия не снижает концентрацию PDGF в сыворотке, инкубированной в течение 24 часов, а также в конечном продукте (PRP+сыворотка 24 ч.+CA+тромбин) по сравнению с описанным ранее способом получения продукта (PRP+сыворотка через 24 ч.+физиологический раствор).
Пример 6 - Лечение пациентов с симптомами боли при остеоартрите коленного сустава
Семнадцать пациентов лечили от симптомов боли при остеоартрите коленного сустава способом, представленным в настоящем описании, как описано в примере 2. Двум группам пациентов осуществляли две инъекции с недельным интервалом. Первой группе из семи пациентов вводили продукт, включающий противовоспалительный/антикатаболический компонент, полученный без цитрата натрия (CA-). Второй группе из десяти пациентов вводили продукт, включающий противовоспалительный/антикатаболический компонент, полученный с использованием цитрата натрия (CA+). Оба способа лечения не приводили к каким-либо побочным эффектам, и обнаруживали, что они являются безопасными и эффективными.
Пациентов оценивали с использованием опросника Western Ontario and McMaster Universities Arthritis Index (WOMAC) для оценки боли, тугоподвижности и физической функции у пациентов с остеоартритом тазобедренного и/или коленного сустава. При предварительном анализе данных из опросника WOMAC через месяц после инъекции наблюдали статистически значимое улучшение боли, тугоподвижности и повседневной активности у пациентов, которых лечили с использованием противовоспалительного/антикатаболического компонента, содержащего цитрат (CA+), как показано на фигурах 18a, 18b и 18c, соответственно. В группе пациентов, которых лечили с использованием противовоспалительного/антикатаболического компонента, не содержащего цитрат (CA-), наблюдали статистически незначимую, но положительную динамику улучшения указанных параметров, как показано на фигурах 18a, 18b и 18c, соответственно. При статистическом анализе визуальной аналоговой шкалы боли (VAS) выявляли значимое снижение боли в обеих группах, как показано на фигуре 18d.
Пример 7 - Хронические воспалительные заболевания кожи
Способ по примеру 2 осуществляли в отношении пациентки возрастом 59 лет, страдающей тяжелым псориазом, в течение четырех недель. Аутологичную композицию, получаемую посредством комбинирования противовоспалительного/антикатаболического компонента с богатым тромбоцитами плазматическим компонентом, вводили пациентке посредством четырех отдельных инъекций аутологичной композиции с недельным интервалом. Лечение включало внутрикожную инъекцию по всему участку повреждения. Через четыре недели после лечения наблюдали значительные видимые изменения. Результат являлся стабильным через три месяца после инъекции с устранением эффектов псориаза. Фигура 19 является фотографией пораженной области предплечья пациентки перед лечением. Фигура 19b является фотографией пораженной области предплечья пациентки через три месяца после четвертой инъекции.
Способы по примеру 2 с добавлением цитрата натрия при получении противовоспалительного/антикатаболического компонента и без него осуществляют в отношении индивидуумов, страдающих хроническими воспалительными заболеваниями кожи, такими как атопический дерматит и хронические раны. Снижалась тяжесть хронических воспалительных заболеваний кожи.
Пример 8 - Лошади, собаки и верблюды
Способы по примеру 2 с добавлением цитрата натрия при получении противовоспалительного/антикатаболического компонента и без него осуществляют в отношении лошадей, собак и верблюдов, страдающих повреждениями и/или травмами соединительных тканей. Снижалась тяжесть боли, ассоциированной с поврежденными и/или травмированными соединительными тканями.
Хотя настоящее изобретение описано со ссылкой на иллюстративные варианты осуществления, следует понимать, что изобретение не ограничено этими конкретными вариантами осуществления. Можно осуществлять многочисленные модификации, варианты и адаптации конкретных вариантов осуществления изобретения, описываемых выше, без отклонения от объема изобретения. Объем формулы изобретения не должен быть ограничен предпочтительными вариантами осуществления, приведенными в примерах, а должен иметь широчайшую интерпретацию, соответствующую описанию в целом.
Ссылки
1. Fernandes JC, Martel-Pelletier J, Pelletier JP. The role of cytokines in osteoarthritis pathophysiology. Biorheology. 2002;39(1-2):237-46.
2. Fredberg U, Stengaard-Pedersen K. Chronic tendinopathy tissue pathology, pain mechanisms, and etiology with a special focus on inflammation. Scand J Med Sci Sports. 2008 Feb;18(1):3-15.
3. Loell I, Lundberg IE. Can muscle regeneration fail in chronic inflammation: a weakness in inflammatory myopathies? J Intern Med. 2011 Mar;269(3):243-57.
4. Rita E, Mirza, Milie M. Fang,1 William J, Timothy J. Koh. Blocking Interleukin-1β Induces a Healing-Associated Wound Macrophage Phenotype and Improves Healing in Type 2 Diabetes. Diabetes. 2013 Jul; 62(7): 2579-2587.
5. Eming SA, Krieg T, Davidson JM. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol. 2007;127:514.
6. Dinarello CA. Interleukin-1, interleukin-1 receptors and interleukin-1 receptor antagonist. Int Rev Immunol. 1998;16(5-6):457-99.
7. Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol. 1986 Apr 1;136(7):2348-57.
8. Brandtzaeg P1, Osnes L, Ovstebø R, Joø GB, Westvik AB, Kierulf P. Net inflammatory capacity of human septic shock plasma evaluated by a monocyte-based target cell assay: identification of interleukin-10 as a major functional deactivator of human monocytes. J Exp Med. 1996 Jul 1;184(1):51-60.
9. Clarke CJ1, Hales A, Hunt A, Foxwell BM. IL-10-mediated suppression of TNF-alpha production is independent of its ability to inhibit NF kappa B activity. Eur J Immunol. 1998 May;28(5):1719-26.
10. de Waal Malefyt R, Figdor CG, Huijbens R, Mohan-Peterson S, Bennett B, Culpepper J, Dang W, Zurawski G, de Vries JE. Effects of IL-13 on phenotype, cytokine production, and cytotoxic function of human monocytes. Comparison with IL-4 and modulation by IFN-gamma or IL-10. J Immunol. 1993 Dec 1;151(11):6370-81.
11. Alvarez RH1, Kantarjian HM, Cortes JE. Biology of platelet-derived growth factor and its involvement in disease. Mayo Clin Proc. 2006 Sep;81(9):1241-57.
12. Roberts AB, Flanders KC, Kondaiah P, Thompson NL, Van Obberghen-Schilling E, Wakefield L, Rossi P, De Crom-Brugghe B, Heine UI, Sporn MB: Transforming growth factor beta: biochemistry and roles in embryogenesis, tissue repair and remodeling, and carcinogenesis. Rec Prog Horm Res 44:157-197, 1988
13. Roberts AB, Heine UI, Flanders KC, Sporn MB: TGF-beta: Major role in regulation of extracellular matrix. Ann NY Acad Sci. "Structure, Molecular Biology and Pathology of Collagen". 580:225-232, 1990.
14. Gospodarowicz, D., Abraham, J. A., and Schilling, J. Isolation and characterization of a vascular endothelial cell mitogen produced by pituitary-derived folliculo stellate cells. Proc. Natl. Acad. Sci. USA 86, 7311-7315, 1989.
15. Hirata H, Nagakura T, Tsujii M, Morita A, Fujisawa K, Uchida A.The relationship of VEGF and PGE2 expression to extracellular matrix remodelling of the tenosynovium in the carpal tunnel syndrome.J Pathol. 2004 Dec;204(5):605-12.
16. Peng H, Usas A, Olshanski A, Ho AM, Gearhart B, Cooper GM, Huard J.VEGF improves, whereas sFlt1 inhibits, BMP2-induced bone formation and bone healing through modulation of angiogenesis.J Bone Miner Res. 2005 Nov;20(11):2017-27.
17. Poutsiaka DD, Clark BD, Vannier E, Dinarello CA. Production of interleukin-1 receptor antagonist and interleukin-1 beta by peripheral blood mononuclear cells is differentially regulated. Blood. 1991 Sep 1;78(5):1275-81.
18. Fufa D, Shealy B, Jacobson M, et al. Activation of platelet-rich plasma using soluble Type I collagen. J Oral Maxillofac Surg 2008;66:684-90
19. Mannello F. Serum or plasma samples? The "Cinderella" role of blood collection procedures: preanalytical methodological issues influence the release and activity of circulating matrix metalloproteinases and their tissue inhibitors, hampering diagnostic trueness and leading to misinterpretation. Arterioscler Thromb Vasc Biol. 2008 Apr;28(4):611-4.
Таким образом, содержание этих ссылок включено в настоящее описание в качестве ссылок.
Реферат
Группа изобретений относится к медицине и касается способа получения аутологичной композиции, применимой в лечении млекопитающего, страдающего от заболевания соединительных тканей, выбранного из повреждения и/или травмы соединительных тканей, хронического тендиноза, хронических разрывов мышц и хронических дегенеративных нарушений суставов, и/или от заболевания кожи, представляющего собой воспалительное нарушение кожи, включающего стадии получения противовоспалительного/антикатаболического компонента аутологичной композиции, содержащего ИЛ-1ra и TIMP; получения регенеративного компонента аутологичной композиции; и смешивания супернатантного компонента противовоспалительного/антикатаболического компонента с богатым тромбоцитами плазматическим компонентом для получения аутологичной композиции. Группа изобретений также касается применения аутологичной композиции для лечения заболевания соединительных тканей, и/или заболевания кожи у млекопитающего; способа получения указанной аутологичной композиции. Группа изобретений обеспечивает снижение отрицательных катаболических факторов. 7 н. и 17 з.п. ф-лы, 19 ил., 8 пр.

Комментарии