Партеногенетическая активация человеческих ооцитов для получения человеческих эмбриональных стволовых клеток - RU2469085C2
Код документа: RU2469085C2
Чертежи

















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к эмбриональным стволовым клеткам, конкретнее, к способу получения человеческих эмбриональных стволовых клеток с использованием партеногенетически активированных ооцитов.
Уровень техники
Человеческие эмбриональные стволовые клетки (ES) являются плюрипотентными клетками, которые могут дифференцироваться в обширный ряд различных типов клеток. При введении мышам с иммунодефицитом эмбриональные стволовые клетки образуют дифференцированные опухоли (тератомы). Однако эмбриональные стволовые клетки, которые индуцируются в условиях in vitro с формированием зародышевых телец (EB), обеспечивают источник линий эмбриональных стволовых клеток, которые поддаются дифференцировке в многочисленные типы клеток, характерные для нескольких тканей, при некоторых условиях культивирования. Например, ES-клетки начинают дифференцироваться в нейроны в присутствии фактора роста нервов и ретиноевой кислоты.
Человеческие ES-клетки и их дифференцированное потомство являются важным источником нормальных человеческих клеток для терапевтической трансплантации и для тестирования и разработки лекарственных средств. Для обеих целей необходимо обеспечение достаточного количества клеток, которые подвергаются дифференцировке в типы тканей, подходящие для нужд пациентов или постановки соответствующего фармакологического теста. С этим связана потребность в эффективном и надежном способе получения дифференцированных клеток из эмбриональных стволовых клеток.
В настоящее время человеческие эмбриональные стволовые клетки (hES) получают из трех источников: бластоцист, остающихся после лечения бесплодия и предоставленных для исследований, бластоцист, полученных из донорных гамет, (ооцитов и спермы) и продуктов переноса ядра (NT). Трупная плодная ткань является единственным источником человеческих эмбриональных зародышевых клеток (hEG). hES- и hEG-клетки предоставляют замечательные научные и терапевтические возможности, включая потенциальную возможность получения более специализированных клеток или тканей. Однако этические вопросы, касающиеся источников hES- и hEG-клеток, и опасения по поводу использования NT для исследований, которые могут привести к применению NT для создания человека, способствовали возникновению дискуссий и дебатов в обществе.
Партеногенетическую активацию ооцитов млекопитающих можно использовать в качестве альтернативы для оплодотворения спермой/NT для приготовления ооцитов с целью получения эмбриональных стволовых клеток. Партеногенетическая активация представляет собой получение эмбриональных клеток, с развитием в конечном итоге во взрослую особь или без него, из женской гаметы без какого-либо участия мужской гаметы.
Партеногенетическую активацию ооцитов млекопитающих можно индуцировать с помощью ряда путей. Применение электрического раздражителя для индукции активации представляет особый интерес, поскольку электрослияние является частью существующего в настоящее время метода переноса ядра. Сообщалось о партеногенетической активации в условиях in vitro посредством электрической стимуляции с использованием устройства для электрослияния, используемого для слияния эмбриональная клетка-мембрана ооцита.
Мышиные ооциты активировали под действием не содержащей Ca+2-Mg+2 среды, среды, содержащей гиалуронидазу, под действием этанола, Ca+2-ионофоров или комплексообразователей, ингибиторов синтеза белка и посредством электрической стимуляции. Указанные способы приводили к партеногенетической активации и развитию мышиных ооцитов с высокой интенсивностью, но не приводили ни к активации, ни к замедлению развития ранних ооцитов крупного рогатого скота. Кроме того, оплодотворение и партеногенетическая активация мышиных ооцитов также зависит от их старения после овуляции.
Сообщалось об активации ооцитов крупного рогатого скота под действием этанола, электрической стимуляции, воздействия комнатной температуры и сочетания электрической стимуляции и ингибирования синтеза белка циклогексимидом. Несмотря на то что, как полагают, указанные процессы приводят к повышению внутриклеточной концентрации ионов Ca+2, они наиболее результативны, когда ооциты созревают в течение более 28 ч.
Сущность изобретения
Настоящее изобретение основано на первоначальном открытии того, что некоторые условия являются оптимальными для партеногенетической активации человеческих ооцитов.
В одном варианте осуществления обеспечивается способ получения человеческих стволовых клеток, включающий партеногенетическую активацию ооцита, в котором активация включает в себя контактирование ооцита с ионофором при высоком давлении кислорода (О2) и контактирование ооцита с ингибитором серин-треониновой киназы при низком давлении О2, культивирование активированного ооцита при низком давлении О2 до формирования бластоцисты, перенос бластоцисты на слой питающих клеток и культивирование перенесенной бластоцисты в условиях высокого давления О2, механическое отделение клеточной массы внутренней области (ICM) от трофэктодермы бластоцисты и культивирование клеток ICM на слое питающих клеток, где культивирование клеток ICM проводят при высоком давлении О2. Предпочтительно ооцит является человеческим.
В связанном аспекте низкое давление О2поддерживают путем инкубации в среде газовой смеси, имеющей концентрацию О2 примерно от 2% О2до примерно 5% О2, где среда газовой смеси дополнительно содержит примерно 5% СО2 и примерно от 90% азота (N2) до 93% N2.
В другом варианте осуществления обеспечивается способ активации человеческих ооцитов, находящихся на стадии метафазы II, включающий в себя инкубацию человеческих ооцитов на стадии метафазы II в среде для оплодотворения в условиях in vitro (IVF) при высоком давлении О2, активацию путем инкубирования клеток в среде (IVF), содержащей ионофор, при высоком давлении О2 и затем инкубацию клеток в среде (IVF), содержащей ингибитор серин-треониновой киназы (STKI) при низком давлении О2, и инкубацию обработанных STKI клеток до формирования бластоцисты при низком давление О2, где клеточные массы внутренней области (ICM), полученные из бластоцисты, продуцируют культивируемые стволовые клетки. Высокое давление О2можно поддерживать путем инкубации в среде газовой смеси, содержащей примерно 5% СО2, примерно 20% О2 и примерно 75% N2.
В связанном аспекте давление О2 для стадий инкубации после активации поддерживают путем инкубации клеток в среде газовой смеси, имеющей концентрацию О2 примерно от 2% О2 до примерно 5% О2, где среда газовой смеси дополнительно содержит примерно 5% СО2 и примерно от 90% N2до примерно 93% N2.
В другом связанном аспекте среда ICM, по существу, не содержит продуктов, отличных от человеческих.
В дополнительном связанном аспекте обеспечиваются выделенные ооциты, полученные способами согласно изобретению, содержащие выделенные клеточные массы внутренней области (ICM), полученные из таких ооцитов, и соответствующие стволовые клетки, выделенные из них.
В другом варианте осуществления обеспечивается человеческая партеногенетическая активация ооцитов млекопитающих, приводящая к получению эмбриональных стволовых клеток и их дифференцированного потомства. Такие клетки и потомство, по существу, являются изогенными по отношению к донору ооцитов, что позволяет проводить аутологичную трансплантацию клеток относительно донора ооцитов, и, как правило, без отторжения иммунной системой ооцитов донора.
В связанном аспекте обеспечивается клеточный банк линий hES-клеток, полученных из партеногенетически активированных ооцитов.
В одном варианте осуществления обеспечивается способ получения человеческих стволовых клеток из криоконсервированного ооцита или партенота, включающий в себя микроинъецирование в цитоплазму ооцита или партенота криоконсервирующего агента, замораживание ооцита или партенота до криогенной температуры для вхождения в состояние покоя, хранение ооцита или партенота в состоянии покоя, размораживание ооцита или партенота, партеногенетическую активацию ооцита, где активация включает в себя контактирование ооцита с ионофором при высоком давлении кислорода (О2) и контактирование ооцита с ингибитором серин-треониновой киназы при низком давлении О2, культивирование партенота или активированного ооцита при низком давлении О2 до формирования бластоцисты, выделение внутренней области клеточной массы (ICM) из трофобласта (т.е. трофэктодермы) бластоцисты и культивирование клеток ICM на слое питающих клеток, где культивирование проводят при высоком давлении О2.
В другом варианте осуществления получают аутологичные стволовые клетки, полученные из партеногенетически активированных ооцитов от человека-донора. В одном аспекте стволовые клетки имеют гаплотип, в основном идентичный донорной клетке. В связанном аспекте стволовые клетки в основном генетически идентичны донорной клетке.
В одном аспекте стволовую клетку идентифицируют как полного «двойника» донора, согласно маркерам однонуклеотидного полиморфизма (SNP). В другом аспекте стволовую клетку подвергают геномному импринтингу соответственно природе донорной клетки.
В одном варианте осуществления раскрыта дифференцированная клетка, происходящая из стволовой клетки, полученной из партеногенетически активированного ооцита от человека-донора. В связанном аспекте дифференцированная клетка включает в себя, но не ограничивается этим, нейрон, кардиоцит, клетку гладкой мускулатуры, клетку поперечно-полосатой мускулатуры, эндотелиальную клетку, остеобласт, олигодендроцит, гематопоэтическую клетку, жировую клетку, стромальную клетку, хондроцит, астроцит, дендритную клетку, кератиноцит, клетку островков поджелудочной железы, клетку-предшественник лимфоидной ткани, тучную клетку, мезодермальную клетку и эндодермальную клетку. В дополнительном связанном аспекте дифференцированная клетка экспрессирует один или более маркеров, включая, но не ограничиваясь этим, нейрофилимент 68, бета-III-тубулин, GFAP, альфа-актинин, десмин, PECAM-1, VE-кадгерин, альфа-фетопротеин или их комбинации.
В другом варианте осуществления раскрыта клеточная линия, содержащая аутологичные стволовые клетки, где стволовые клетки получены из партеногенетически активированных ооцитов от человека-донора. В одном аспекте клетки не экспрессируют SSEA-1. В еще одном аспекте клетки клеточной линии дают начало эктодермальным, мезодермальным и эндодермальным зародышевым линиям.
В одном варианте осуществления раскрыт банк клеток, содержащий криоконсервированные партеноты, где партеноты получены из партеногенетически активированных ооцитов от одного или более людей-доноров. В связанном аспекте партеноты культивируют при низком давлении О2 до формирования бластоцисты.
В одном варианте осуществления раскрыт банк клеток, содержащий криоконсервированные аутологичные стволовые клетки, где стволовые клетки получены из партеногенетически активированных ооцитов от одного или более людей-доноров.
В другом варианте осуществления раскрыт способ лечения нуждающегося в этом субъекта, включающий в себя введение клеточной композиции, содержащей дифференцированные клетки, где дифференцированные клетки происходят из стволовой клетки, полученной из партеногенетически активированного ооцита от человека-донора. В одном аспекте дифференцированная клетка выбрана из группы, состоящей из нейрона, кардиоцита, клетки гладкой мускулатуры, клетки поперечно-полосатой мускулатуры, эндотелиальной клетки, остеобласта, олигодендроцита, гематопоэтической клетки, жировой клетки, стромальной клетки, хондроцита, астроцита, дендритной клетки, кератиноцита, клетки островков поджелудочной железы, клетки-предшественника лимфоидной ткани, тучной клетки, мезодермальной клетки и эндодермальной клетки.
В связанном аспекте у субъекта имеется заболевание, выбранное из группы, состоящей из болезни Паркинсона, болезни Гентингтона, болезни Альцгеймера, бокового амиотрофического склероза, дефектов или повреждений спинного мозга, рассеянного склероза, мышечной дистрофии, кистозного фиброза, заболевания печени, диабета, заболевания сердца, заболевания сетчатки (такого как дегенерация желтого пятна и пигментный ретинит), дефектов или повреждений хрящей, ожогов, язв на конечностях, сосудистого заболевания, заболевания органов мочевой системы, СПИДа и злокачественного заболевания.
В одном варианте осуществления раскрыт способ получения клонированных человеческих эмбриональных стволовых клеток, включающий в себя удаление первого пронуклеуса из предварительно оплодотворенного человеческого ооцита, перенос второго пронуклеуса в энуклеированный ооцит, где второй пронуклеус получен из ооцита донора или ооцита от матери донора, или партеногенетически активированного ооцита, где пронуклеус ооцита замещен на ядро соматической клетки донора перед активацией, и культивирование полученного ооцита до формирования бластоцисты, где клеточная масса внутренней области бластоцисты содержит эмбриональные стволовые клетки.
Приведенные в качестве примера способы и композиции согласно изобретению более подробно описаны ниже.
Краткое описание фигур
На фиг.1А приведена микрофотография экспрессии поверхностного маркера, щелочной фосфатазы, на партеногенетически полученных hES-клетках.
На фиг.1В приведена микрофотография экспрессии поверхностного маркера Oct4.
На фиг.1С приведена микрофотография экспрессии поверхностного маркера SSEA-1.
На фиг.1D приведена микрофотография экспрессии поверхностного маркера SSEA-3.
На фиг.1E приведена микрофотография экспрессии поверхностного маркера SSEA-4.
На фиг.1F приведена микрофотография экспрессии поверхностного маркера TRA-1-60.
На фиг.1G приведена микрофотография экспрессии поверхностного маркера TRA-1-81.
На фиг.2 представлены результаты анализа активности теломеразы в партеногенетически полученных hES-клетках. Для постановки анализа использовали 500, 1000 и 10000 (единиц) экстракта. Δ-Н обработанный теплом опытный экстракт (отрицательный контроль); положительный контроль - позитивные в отношении теломеразы клетки; лизирующий CHAPS-буфер; TSR8 - контрольная матрица.
На фиг.2В приведена микрофоторография образования зародышевого тела из партеногенетически полученных hES-клеток, 9 сутки культивирования.
На фиг.2С приведена микрофоторография образования зародышевого тела из партеногенетически полученных hES-клеток, 10 сутки культивирования.
На фиг.2D представлен кариотип партеногенетически полученных hES-клеток.
На фиг.2Е приведены результаты анализа ДНК-фингерпринта партеногенетически полученных hES-клеток. 1 - ДНК из крови донора ооцита; 2 - ДНК из партеногенетических hES-клеток, полученных от того же донора; 3 - ДНК из человеческих питающих фибробластов.
На фиг.3 приведены результаты нозерн-блоттинга, характеризующие экспрессию генов, ассоциированных с геномным импринтингом. ДНК-зонды: SNRPN, Peg1_2, Peg1_A, H19 и GAPDH (в качестве внутреннего контроля). NSF, неонатальные фибробласты кожи; hES, человеческие эмбриональные стволовые линии клеток, полученные из оплодотворенных ооцитов; 1, phESC-3; 2, phESC-3, 3, phESC-4; 4, phESC-5; 5, phESC-6; 6, phESC-7. NSF RT-, hES RT-, 1RT - отрицательные контроли.
На фиг.4 показана дифференцировка phESC в производные всех трех зародышевых слоев. Дифференцировка в эктодерму представлена позитивным иммуноцитохимическим окрашиванием на специфические маркеры нейронов нейрофилиментов 68 (А), NCAM (B), бета-III-тубулин (С) и глиальный клеточный маркер GFAP (D, M). Дифференцированные клетки были позитивны в отношении мезодермальных маркеров: мышечный специфический альфа-актин (G) и десмин (J), эндотелиальные маркеры РЕСАМ-1 (E) и VE-кадгерин (F). Дифференцировка в эндодерму показана позитивным окрашиванием на альфа-фетопротеин (H, L). phESC образуют пигментированные эпителиоподобные клетки (I, K). Увеличение (I)×100; (А-Н, J-M)×400.
На фиг.5 приведены полученные свойства линий phESC в отношении специфических маркеров. Недифференцированные колонии phESC на слое человеческих питающих клеток (A-F), негативное окрашивание на SSEA-1 (G-L), экспрессия клеточных поверхностных маркеров SSEA-3 (M-R), SSEA-4 (S-X). Увеличение (А)-(В) × 100; (F) × 200; (G)-(X) × 400. Позитивное окрашивание на щелочную фосфатазу колоний phESC на питающих клетках (A-F), OCT-4(G-L), TRA-1-60 (K-R) и TRA-1-81 (S-X). Увеличение (A, B, O, R) × 100; (C-F, M, S, X) × 200; (G-L, N, P, Q, T-W) × 400.
На фиг.6 показано, что клетки phESC обладают высокой активностью теломеразы при сравнении с позитивными контрольными клетками: «+» - экстракт из 500 клеток; «-» - экстракт обработанных теплом клеток с инактивированной теломеразой; «контроль +» - экстракт позитивных в отношении теломеразы клеток (имеющихся в наборе ТRAPEZE); «В» - лизирующий CHAPS-буфер, контроль на загрязнение праймер-димер/ПЦР; количественная контрольная матрица TSR8-теломеразы (0,1 и 0,2 моль/мкл); «М» - маркер, лэддер ДНК.
На фиг.7 показаны результаты кариотипирования линий phESC с использованием G-бэндинга. Линии phESC-1 (А), phESC-3 (В), phESC-4 (С), phESC-5 (D) и phESC-6 (Е) имеют нормальный кариотип 46, ХХ. Линия phESC-7 имеет кариотип 47, ХХХ (F).
Подробное описание изобретения
Перед описанием настоящих композиций, способов и методов культивирования следует понимать, что данное изобретение не сводится к описанным конкретным композициям, способам и экспериментальным условиям, поскольку такие композиции, способы и условия могут варьировать. Также, очевидно, понятно, что используемая в данном документе терминология предназначена для целей описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения.
В описании и в прилагаемой формуле изобретения единственное число предполагает также и множественное число, если не указано иначе. Так, например, выражение «способ» относится к одному или более способам и/или одной или более стадиям, описанным в данном документе, что станет очевидно специалистам в данной области при ознакомлении с настоящим описанием и так далее.
«Дифференцировка» относится к изменению, которое происходит в клетках с появлением у этих клеток определенных специализированных функций и с потерей способности к превращению в определенные другие специализированные функциональные единицы. Клетки, способные к дифференцировке, могут быть любыми тотипотентными, плюрипотентными или мультипотентными клетками. Зрелые клетки взрослого организма могут быть дифференцированы полностью иди частично.
Гиногенез относится к развитию эмбриона, содержащего различимый трофобласт и клеточную массу внутренней области, которая возникает при активации клетки, такой как ооцит, или эмбриональной клетки другого типа, содержащего ДНК млекопитающих полностью женского происхождения, предпочтительно человеческого женского происхождения, например ДНК ооцита человека или отличного от человека примата. Такую женскую ДНК млекопитающих можно генетически модифицировать, например, посредством вставки, делеции или замены по меньшей мере одной последовательности ДНК или можно не подвергать модификации. Например, ДНК можно модифицировать вставкой или делецией желаемых кодирующих последовательностей или последовательностей, которые способствуют эмбриогенезу или подавляют его. Как правило, такой эмбрион получают при активации в условиях in vitro ооцита, который содержит ДНК полностью женского происхождения. Гиногенез включает в себя партеногенез, определение которого приводится ниже. Он также включает в себя способы активации, в которых ДНК сперматозиодов не вносит свой вклад в ДНК активированного ооцита.
В связанном аспекте ооциты получают от субъектов с суперовуляцией, подготовленных к IVF. Способы «суперовуляции», такие как лечение женщин гормонами, используемые при IVF, предназначены для стимуляции яичников в целях получения нескольких яйцеклеток (ооцитов), а не единичной яйцеклетки, как это имеет место в природном цикле.
Препараты, необходимые для повышенного получения яйцеклеток, могут включать, но не ограничиваются этим, следующие: люпрон (агонист высвобождающего гонадотропин гормона), оргалютран, антагон или цетротид (антагонист высвобождающего гонадотропин гормона), фоллистим, бравелле или гонал-F (FSH, фолликулостимулирующий гормон), репронекс (комбинация FSH и LH (лютеинизирующий гормон)) и прегнил или новарел (hCG, человеческий хорионический гонадотропин).
В связанном аспекте получение яйцеклеток можно проводить под трансвагинальным ультразвуковым контролем. Для осуществления этого вводят иглу (например, при внутривенной анестезии) через стенку влагалища в яичники под ультразвуковым контролем для определения локализации каждого фолликула. Фолликулярную жидкость откачивают в пробирку для получения яйцеклеток.
«Партеногенез» («партеногенически активированный» или «партеногенетически активированный» используются взаимозаменяемо), процесс, с помощью которого происходит активация ооцита при отсутствии проникновения спермы, и он относится к развитию эмбриона на ранних стадиях, содержащего трофобласт и клеточную массу внутренней области, который получен при активации ооцита или эмбриональной клетки, например бластомера, содержащего ДНК полностью женского происхождения. В связанном аспекте «партенот» относится к продуцированной клетке, полученной с помощью такой активации. В другом связанном аспекте «бластоциста» относится к стадии отделения оплодотворенного или активированного ооцита, содержащего полое тело из внешних клеток трофобласта (т.е. трофэктодермы) и клеточную массу внутренней области (ICM). В дополнительном связанном аспекте «формирование бластоцисты» относится к процессу после оплодотворения или активации, где ооцит затем культивируют в среде в течение периода, достаточного для превращения в полое тело из внешних клеток трофобласта и ICM (например, 5-6 суток).
В одном варианте осуществления раскрыт способ получения линии клонированных человеческих эмбриональных стволовых клеток из активированных ооцитов. Несмотря на то что партеногенез не является необычной формой репродукции в природе, отсутствуют данные о том, что млекопитающие способны к данной форме размножения. Однако у ооцитов от самок инбредного штамма мышей LT/Sv можно обнаружить спонтанный партеногенез на уровне 10% (Ozil and Huneau, Development (2001) 128:917-928; Vrana et al., Proc. Natl. Acad. Sci. USA (2003) 100 (Suppl 1):11911-11916; Berkowitz and Goldstein, New Eng. J. Med. (1996) 335(23):1740-1748). Ооциты от плацентарных млекопитающих можно стимулировать для прохождения партеногенеза в условиях in vitro; однако эмбриональное развитие не завершается.
После партеногенетической активации ооцитов млекопитающих и переноса активированного ооцита в организм суррогатной матери наблюдается ограниченная выживаемость эмбрионов: 10 суток у мышей; 21 сутки у овец; 29 суток у свиней и 11,5% суток у кроликов (Kure-bayashi et al., Theriogenology (2000) 53:1105-1119; Hagemann et al., Mol. Reprod. Dev. (1998) 50:154-162; Surani and Barton, Science (1983) 222:1034-1036). Причиной такой остановки развития является генетический импринтинг. Было показано, что материнский и отцовский геномы эпигенетически являются различными и что для успешного развития эмбриона необходимы оба геномных набора (Surani, Cell (1998) 93:309-312; Sasaki et al. (1992) 6:1843-1856). В партенотах весь генетический материал должен быть материнского происхождения, следовательно, будет отсутствовать отцовский импринтинг. Полагают, что отцовский импринтинг ответственен за развитие внезародышевой ткани и, таким образом, за развитие трофобласта после оплодотворения энуклеированного ооцита (Stevens, Nature (1978) 276:266-267). Следовательно, у животных энуклеированные зиготы могут быть пригодны для переноса ядра с последующей партеногенетической активацией.
Партеноты млекопитающих подвергаются только ограниченному развитию с гибелью эмбриона в конечном итоге. У макак Macac fascicularis только 14% ооцитов на стадии метафазы II после партеногенетической активации в условиях in vitro развивались до стадии бластоцисты после 8 суток культивирования (Monk, Genes Dev. (1988) 2:921-925). Аналогично 12% человеческих ооцитов, которые партеногенетически активировали в условиях in vitro, после переноса ядра развились до стадии бластоцисты (Monk, 1988). В обоих случаях была создана одна линия стволовых клеток.
Эмбрионы, развившиеся из спонтанно активированных партенот, у виргильных самок инбредного штамма мышей LT/Sv, погибали в течение нескольких суток. В том случае, когда проводят перенос ядра из клеток, содержащих клеточную массу внутренней области (ICM) данных эмбрионов, в оплодотворенные энуклеированные ооциты мышей C57BL/6j, то получают клонированных мышей с геномом LT/Sv (Kaufman et al., Nature (1977) 265:53-55). Таким образом, использование оплодотворенных ооцитов позволяет получить полное развитие партенота. В одном аспекте оплодотворенный энуклеированный человеческий ооцит можно использовать для поддержания развития партеногенетического эмбриона, содержащего донорное ядро, до стадии бластоцисты.
В одном варианте осуществления пронуклеус ооцита донора или ооцита матери донора после партеногенетической активации можно перенести в оплодотворенный человеческий ооцит, из которого выделены мужской и женский пронуклеусы.
В другом варианте осуществления раскрыт двухстадийный способ получения человеческих стволовых клеток, включающий в себя перенос ядра соматической клетки донора в ооцит донора, где ооцит затем активируют партеногенезом, и перенос пронуклеуса активированного ооцита в оплодотворенный ооцит, откуда были выделены мужской и женский пронуклеусы.
В другом варианте осуществления ядро соматической клетки донора можно перенести в оплодотворенный энуклеированный человеческий ооцит с последующей партеногенетической активацией. Три варианта осуществления, указанные выше, иллюстрируются следующими схемами:
Вариант 1
Женщина-пациентка → извлечение ооцита → партеногенетическая активация → удаление пронуклеуса → добавление пронуклеуса к энуклеированному оплодотворенному ооциту.
Мужчина-пациент → получение ооцита от матери пациента → партеногенетическая активация → удаление пронуклеуса → добавление пронуклеуса к энуклеированному оплодотворенному ооциту.
Вариант 2
Получение пронуклеуса ооцита донора → извлечение ооцита → добавление ядра соматической клетки пациента с использованием переноса ядра → партеногенетическая активация → извлечение → добавление пронуклеуса к энуклеированному оплодотворенному ооциту.
Вариант 3
Получение ооцита донора → оплодотворение → удаление ядра → добавление ядра соматической клетки пациента → партеногенетическая активация.
Термин «плюрипотентная клетка» относится к клетке, полученной из эмбриона, развившегося при активации клетки, содержащей ДНК полностью женского или мужского происхождения, которую можно поддерживать в условиях in vitro в течение длительного, теоретически неограниченного периода в недифференцированном состоянии, которая может давать начало дифференцированным тканям различных типов, т.е. эктодерме, мезодерме и эндодерме. Предпочтительно плюрипотентное состояние клеток поддерживается при культивировании клеточной массы внутренней области или клеток, полученных из клеточной массы внутренней области эмбриона, в свою очередь, полученного андрогенетическим или гиногенетическим методами в соответствующих условиях, например при культивировании на питающем слое из фибробластов или другом питающем слое, или культуре, которая содержит лейкемический ингибирующий фактор (LIF). Плюрипотентное состояние таких культивируемых клеток можно подтвердить с использованием различных методов, например, (i) установлением экспрессии маркеров, специфичных для плюрипотентных клеток; (ii) получением химерных животных, которые содержат клетки, экспрессирующие генотип плюрипотентных клеток; (iii) введением клеток животным, например, мышам SCID, с получением дифференцированных клеток различных типов в условиях in vivo; и (iv) установлением наличия дифференцировки клеток (например, при культивировании при отсутствии питающего слоя или LIF) в зародышевые тельца и дифференцированные клетки других типов.
«Диплоидная клетка» относится к клетке, например ооциту или бластомеру, имеющей диплоидный набор ДНК полностью мужского или женского происхождения.
«Гаплоидная клетка» относится к клетке, например ооциту или бластомеру, имеющей гаплоидный набор ДНК полностью мужского или женского происхождения.
Активация относится к способу, при котором оплодотворенный или неоплодотворенный ооцит, например, но не ограничиваясь этим, находящийся в метафазе II мейоза, подвергается процессу, как правило, включающему разделение пар хроматид, выталкивание второго полярного тельца, что приводит к получению ооцита, имеющего гаплоидный набор хромосом, каждая из одной хроматиды. Активация включает способы, посредством которых клетка, содержащая ДНК полностью мужского или женского происхождения, стимулируется с развитием в эмбрион, который имеет различимую клеточную массу внутренней области и трофэктодерму, эмбрион пригоден для превращения в плюрипотентные клетки, но который, вероятно, сам по себе не способен к развитию в жизнеспособное потомство. Активацию можно проводить, например, при наличии одного из следующих условий: (i) условий, которые не приводят к выталкиванию второго полярного тельца; (ii) условий, которые приводят к выталкиванию полярного тельца, но где выталкивание полярного тельца ингибируется; или (iii) условий, при которых ингибируется первое клеточное деление гаплоидного ооцита.
«Метафаза II» относится к стадии развития клетки, на которой состав ДНК клетки состоит из гаплоидного набора хромосом, где каждая хромосома состоит из двух хроматид.
В одном варианте осуществления ооциты в метафазе II активируют инкубацией ооцитов в газовых средах с различным давлением О2. В связанном аспекте низкое давление О2 в газовой среде создают применением газовой смеси с концентрацией О2 на уровне примерно 2%, 3%, 4% или 5%. В дополнительном связанном аспекте газовая смесь содержит примерно 5% СО2. Кроме того, газовая смесь содержит примерно 90% N2, 91% N2 или 93% N2. Указанная газовая смесь отличается от содержания 5% СО2 в воздухе, который состоит примерно из 5% СО2, 20% О2 и 75% N2.
«Давление О2» относится к парциальному давлению (давлению, создаваемому одним компонентом газовой смеси) кислорода в потоке (например, жидкости или газа). Низкое давление означает, что парциальное давление кислорода (рО2) является низким, и высокое давление - что рО2 является высоким.
«Условия с определенной средой» относятся к средам, предназначенным для культивирования клеток, в которых детально определена концентрация компонентов, необходимых для оптимального роста. Например, в зависимости от применения клеток (например, для терапевтических применений), важно выделение клеток из условий, в которых имеются ксеногенные белки; т.е. в условиях культивирования не используются белки животного происхождения или белки животных, отличных от человека. В связанном аспекте «среда для оплодотворения в условиях in vitro (IVF)» относится к питательной системе, которая содержит химически определенные вещества, на которой или в которой могут расти оплодотворенные ооциты.
«Субстраты внеклеточного матрикса (ЕСМ)» относятся к поверхности под клетками, которая поддерживает их оптимальный рост. Например, такие субстраты ЕСМ включают, но не ограничиваются этим, матригель, ламинин, желатин и фибронектин. В связанном аспекте такие субстраты могут включать коллаген IV, энтактин, гепарин сульфат протеогликан, с включением различных факторов роста (например, bFGF, эпидермального фактора роста, инсулиноподобного фактора роста 1, тромбоцитарного фактора роста, фактора роста нервов и TGF-β-1).
«Эмбрион» относится к эмбриону, который развивается в результате активации клетки, например ооцита или других эмбриональных клеток, содержащих ДНК полностью мужского или женского происхождения, которая необязательно может быть модифицирована, который содержит различимые трофэктодерму или клеточную массу внутренней области, который не может произвести жизнеспособное потомство и в котором ДНК имеет полностью мужское или женское происхождение. Клеточная масса внутренней области или клетки, содержащиеся в ней, являются пригодными для получения плюрипотентных клеток, имеющих значение определенное выше.
«Клеточная масса внутренней области (ICM)» относится к внутренней части эмбриона, из которой образуются ткани плода. В данном документе эти клетки используют в качестве постоянного источника плюрипотентных клеток в условиях in vitro. Кроме того, ICM относится к внутренней области эмбриона, полученного в результате андрогенеза или гиногенеза, т.е. эмбрионов, которые развиваются при активации клеток, содержащих ДНК полностью мужского или женского происхождения. Такая ДНК, например, будет представлять собой человеческую ДНК, например ДНК человеческого ооцита или сперматозоида, которая может быть или может быть не подвергнута генетической модификации.
«Трофобласт или трофэктодерма» относится к другой части эмбриона на ранних стадиях развития, которая дает начало развитию тканей плаценты, содержащей такую ткань эмбриона, которая развивается в результате андрогенеза или гиногенеза, т.е. эмбрионов, которые развиваются при активации клеток, содержащих ДНК полностью мужского или женского происхождения, например яйцеклетки или сперматозоида человека.
«Дифференцированная клетка» относится к клетке, отличной от эмбриональной, которая имеет конкретное дифференцированное, т.е. не эмбриональное, состояние. Тремя наиболее ранними типами дифференцированных клеток являются эндодерма, мезодерма и эктодерма.
Термин «по существу идентичный» относится к степени аналогии в отношении конкретного свойства, которое является настолько близким, что оно оценивается как по существу одинаковое ввиду отсутствия возможности определить различие (например, при HLA-типировании, анализе SNP и пр.).
«Гистосовместимый» относится к той способности, с которой организм будет переносить пересадку чужой ткани.
«Геномный импринтинг» относится к механизму, посредством которого гены в геноме экспрессируются моноаллельно в соответствии с их родительской природой.
«Гомоплазмия», включая грамматические варианты данного термина, относится к наличию одного и того же типа митохондриальной ДНК (мДНК) в клетке или у индивидуума.
«Гетероплазмия», включая грамматические варианты данного термина, относится к наличию смеси более чем одного типа митохондриальной ДНК (мДНК) в клетке или у индивидуума.
Термин «униродительский» относится к одной или более клеткам или индивидуумам, которые дают начало последующим [поколениям] или по отношению к которым они остаются дочерними.
«Механическое выделение» относится к способу разделения клеточных агрегатов под действием физических сил. Например, такой способ будет включать применение ферментов (или других продуктов для разделения клеток), который может содержать вещества, отличные от человеческих.
В естественной среде незрелые ооциты (яйцеклетки) из яичника подвергаются процессу созревания, который проходит через мейоз к метафазе II мейоза. Затем развитие ооцитов останавливается на стадии метафазы II. В метафазе II состав ДНК клетки представляет гаплоидный набор хромосом, каждая из которых состоит из двух хроматид.
Такие ооциты можно неограниченно поддерживать при криоконсервации, например, посредством, но не ограничиваясь этим, микроинъекции сахара.
В одном варианте осуществления обеспечивается способ получения человеческих стволовых клеток из криоконсервированного ооцита или партенота, включающий в себя микроинъецирование в цитоплазму ооцита или партенота криоконсервирующего агента, замораживание ооцита или партенота до криогенной температуры для их вхождения в состояние покоя, хранение ооцита или партенота в состоянии покоя, размораживание ооцита или партенота, партеногенетическое активирование ооцита при высоком давлении О2 в присутствии ионофора с последующим контактированием ооцита с ингибитором серин-треониновой киназы при низком давлении О2, культивирование активированного ооцита или партенота до формирования бластоцисты, выделение клеточной массы внутренней области (ICM) из бластоцисты и культивирование клеток ICM на слое человеческих питающих клеток, где культивирование ICM проводят при высоком давлении О2.
В одном аспекте ооциты, полученные как описано выше, переносят на модифицированную, изотоническую среду IVF, покрытую тестированным на эмбрионах минеральным маслом (Sigma), или другую подходящую среду. Если это желательно, то ооциты можно инкубировать с внеклеточным сахаром, находящимся в той же концентрации, которую планируют для применения при микроинъекции. Например, для введения 0,1 М сахара ооциты можно уравновесить в среде DMEM/F-12 с 0,1 М сахара. В одном аспекте криоконсервирующий агент содержит более низкую концентрацию ионов Na+ по сравнению со стандартной средой DMEM (т.е. среда с низким содержанием Na+). В связанном аспекте криоконсервирующий агент содержит более высокую концентрацию К+ по сравнению со стандартной средой DMEM (т.е. среда с высоким содержанием ионов К+). В дополнительном связанном аспекте криоконсервирующий агент содержит более низкую концентрацию ионов Na+ и более высокую концентрацию ионов К+ по сравнению со стандартной средой DMEM (т.е. среда с низким содержанием Na+/высоким содержанием К+). В одном аспекте криоконсервирующий агент содержит органический буфер, включая, но не ограничиваясь этим, HEPES буфер. В еще одном аспекте криоконсервирующий агент содержит соединения, которые ингибируют апоптозный белок (например, капазы).
Альтернативно ооциты можно необязательно уравновесить с помощью любого другого в основном непроникающего растворенного вещества, такого как NaCl, для уменьшения их клеточного объема перед проведением микроинъекции. Данное первоначальное снижение клеточного объема может привести к меньшему конечному объему подвергнутых микроинъекции ооцитов по сравнению с ооцитами, которые не инкубировали в гипертонической среде, перед микроинъекцией. Указанный меньший конечный объем может свести до минимума проявление любого потенциального отрицательного эффекта в результате набухания ооцитов. Указанный общий способ подготовки клеток к проведению микроинъекции можно также использовать для клеток других типов (например, активированных ооцитов, hES-клеток и пр.).
Затем в ооциты можно микроинъецировать криоконсервирующий агент. В данной области хорошо известно оборудование и методы проведения микроинъекций, и в изобретении можно использовать оборудование, известное для применения в целях введения небольших молекул в клетки. На приведенной в качестве примера стадии микроинъецирования введение в ооциты можно провести под давлением 10 фунт/дюйм2 в течение 30 миллисекунд. Другим примером стандартного метода микроинъекции является метод, описанный Nakayama и Yanagimachi (Nature Biotech. 16:639-642, 1998).
Криоконсервирующий агент, пригодный в данном способе, включает в себя любое химическое соединение, обладающее криопротективными свойствами и которое обычно является непроникающим. В частности, криоконсервирующий агент может включать сахара, отдельно или в смеси с другими обычно используемыми криоконсервирующими агентами. Углеводы-сахара, такие как трегалоза, сахароза, фруктоза и раффиноза, можно микроинъецировать в концентрациях ниже или равных примерно 1,0 М и более предпочтительно ниже или равных примерно 0,4 М. В одном аспекте концентрация находится в пределах от 0,05 до 0,20 М включительно. Дополнительно внеклеточный сахар или криоконсервирующий агент можно добавить перед хранением. Если клетки инкубировали в гипертоническом растворе до проведения микроинъекции, то по существу непроникающее растворенное вещество можно оставить в среде после проведения микроинъекции или можно удалить из среды промыванием клеток средой, содержащей данное растворенное вещество в более низкой концентрации или вовсе не содержащей его.
Некоторые сахара или полисахариды, которые обычно не проникают через клеточные мембраны за счет того, что они являются слишком крупными для прохождения через мембрану, обладают преимущественными физико-химическими и биологическими свойствами для применения в целях криоконсервации. Несмотря на то что данные сахара, как правило, сами не проникают через клеточные мембраны при использовании описанного способа, данные, как правило, не проникающие сахара можно микроинъецировать внутриклеточно с получением положительного эффекта.
Не проникающие сахара, оказывающие стабилизирующее или консервирующее действие на клетки, которые являются особенно пригодными в качестве криоконсервирующих агентов в настоящем способе, включают сахарозу, трегалозу, фруктозу, декстран и раффиозу. Было показано, что среди данных сахаров трегалоза, нередуцирующий дисахарид глюкозы, является особенно эффективной для стабилизации клеточных структур в низких концентрациях. Добавление внеклеточных гликолипидов или гликопротеинов также может стабилизировать клеточную мембрану.
После микроинъекции криоконсервирующего агента клетки готовят для хранения. Можно использовать различные методы замораживания/высушивания для подготовки клеток к хранению. В частности, в данном случае желательны три подхода: вакуумное или воздушное высушивание, высушивание вымораживанием или замораживание-оттаивание. Способы высушивания имеют преимущество, заключающееся в том, что стабилизированный биологический материал можно транспортировать и хранить при комнатной температуре.
Как правило, ооциты, содержащие 1-2 М ДМСО, охлаждают с очень медленной скоростью охлаждения (0,3-0,5°С/мин) до промежуточной температуры (от -60 до -80°С) перед погружением в жидкий азот для хранения. Затем пробу можно хранить при данной температуре.
Затем суспендированный материал можно хранить при температуре криоконсервации, например, оставляя флаконы в жидком азоте (LN2) на желаемый период времени.
В данной области хорошо известны протоколы вакуумной или воздушной сушки и высушивания вымораживанием для белков (Franks et al., «Materials Science and the Production of Shelf-Stable Biologicals», BioPharm, October 1991, p. 39; Shalaev et al., «Changes in the Physical State of Model Mixtures during Freezing and Drying: Impact on Product Quality», Cryobiol. 33, 14-26 (1996) и такие протоколы можно использовать для приготовления клеточных суспензий для хранения с применением описанного способа. В дополнении к воздушному высушиванию другие методы конвекционной сушки, которые можно использовать для удаления воды из клеточных суспензий, включают конвекционный поток азота или других газов.
Приведенный в качестве примера метод высушивания выпариванием в вакууме, пригодный для применения со способом согласно изобретению, может включать помещение 20 мкл каждого образца в лунки 12-луночного планшета и проведение вакуумной сушки в течение 2 ч при комнатной температуре. Конечно, можно использовать другие методы высушивания, включая высушивание клеток в ампулах. Клетки, подготовленные таким образом, можно хранить сухими и регидратировать разведением в среде DMEM или любой другой подходящей среде.
Способ согласно изобретению с использованием высушивания вымораживанием для подготовки клеток к хранению начинается с замораживания клеточной суспензии. Несмотря на то что можно использовать методы замораживания, известные в данной области, также возможно применять простой способ замораживания погружением, описанный в данном документе, для метода замораживание-оттаивание на стадии замораживания в протоколе сушки вымораживанием.
После замораживания можно использовать двухстадийный способ высушивания. На первой стадии используют энергию сублимации для испарения замороженной воды. Второе высушивание проводят после сублимации чистого кристаллического льда в пробе. Высушенные вымораживанием клетки можно хранить и гидратировать таким же образом, как описано выше для вакуумного высушивания. Затем можно выделить жизнеспособные клетки.
После выведения клеток из замороженного или высушенного состояния можно необязательно удалить из культуральной среды любой внешний криоконсервирующий агент. Например, среду можно развести добавлением соответствующей среды с низкой концентрацией криоконсервирующего агента. Например, выделенные клетки можно инкубировать в течение примерно 5 мин в среде, содержащей сахар в более низкой концентрации по сравнению с той, которая применялась для хранения клеток. При данной инкубации среда может содержать тот же сахар, который использовали в качестве криоконсервирующего агента; другой криоконсервирующий агент, такой как галактоза, или любое другое по существу не проникающее растворенное вещество. Для сведения до минимума возможности осмотического шока, возникающего в результате снижения осмомолярности среды, концентрацию внеклеточного криоконсервирующего агента можно медленно снизить при проведении данной стадии при многократном разведении, каждый раз получая более низкую концентрацию криоконсервирующего агента. Данные стадии разведения можно повторять до тех пор, пока не будет отсутствовать внеклеточный криоконсервирующий агент, или до тех пор, пока концентрация криоконсервирующего агента или осмомолярность среды не уменьшится до желаемого уровня.
Партеногенетически активированные ооциты, бластоцисты, ICM и аутологичные стволовые клетки можно хранить или «поддерживать в банке» таким образом, чтобы клетки «ожили», когда это будет необходимо в будущем. Аликвотную порцию партеногенетически активированных ооцитов и аутологичных стволовых клеток можно выделить в любое время, вырастить в культуры многих недифференцированных клеток, и затем подвергнуть дифференцировке в клетки или ткани определенного типа, и затем можно использовать для лечения заболеваний или замещения нарушенных тканей у субъекта. Поскольку клетки получены от донора партеногенетически, то клетки можно хранить так, чтобы индивидуум или близкий родственник мог иметь доступ к клеткам в течение продолжительного периода времени.
В одном варианте осуществления обеспечивается банк клеток для хранения образцов партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток. В другом варианте осуществления обеспечиваются способы введения такого банка клеток. В опубликованной заявке на патент США № 20030215942, которая включена в полном объеме в данном документе для сведения, приводится пример банка стволовых клеток.
При использовании способов, раскрытых в данном документе, выделение и размножение в условиях in vitro образцов партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток и их криоконсервация способствуют получению «банка» трансплантируемых человеческих стволовых клеток. Поскольку является возможным хранить небольшие аликвотные порции клеток, то для метода «поддержания в банке» может потребоваться относительное небольшое пространство. Следовательно, клетки многих индивидуумов можно хранить или «поддерживать в банке» на краткосрочной или долгосрочной основе при относительно небольших затратах.
В одном варианте осуществления часть образца делают доступной для тестирования до или после обработки и хранения.
Данное изобретение также относится к способам регистрации или индексирования образцов партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток таким образом, чтобы, когда потребуется определить нахождение образцов, это было бы легко сделать. Для осуществления этой цели можно использовать любую систему индексирования или поиска. Можно использовать любую подходящую систему хранения таким образом, чтобы можно было хранить образцы партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток. Образцы можно подготовить для хранения в виде индивидуальных проб или можно подготовить для хранения сотен, тысяч и даже миллионов различных клеточных образцов.
Хранящиеся образцы партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток можно индексировать для надежного и точного поиска. Например, каждый образец можно промаркировать кодами в алфавитном порядке, штрихкодами или с помощью любого другого метода или их комбинациями. Также может иметь место доступный и читаемый перечень информации по идентификации каждого образца партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток и его нахождению в банке и идентификации источника и/или типа клеточного образца, находящегося вне банка. Данной системой индексирования можно управлять любым образом, известным в данной области, например, вручную или не вручную, например, с помощью компьютера и обычного программного обеспечения.
В одном варианте осуществления клеточные образцы организуют с использованием системы индексирования таким образом, чтобы образец был доступен для использования донором, когда бы это ни потребовалось. В других вариантах осуществления клеточные образцы могут использоваться индивидуумами, связанными с исходным донором. После регистрации в системе индексирования клеточный образец можно сделать доступным для анализа пробы на совместимость, например, с помощью программы по определению совместимости будет найден совместимый индивидуум, который будет, следовательно, иметь возможность получить совместимый образец.
Накопительная система хранения может включать систему для хранения множества протоколов, связанных с множеством индивидуумов и множеством клеточных образцов. Каждый протокол может содержать информацию о типе, информацию о генотипе или информацию о фенотипе клеточных образцов или конкретных индивидуумах. В одном варианте осуществления система будет включать таблицу по перекрестной совместимости, в которой проводится оценка совместимости типов образцов с типами индивидуумов, желающих получить образец.
В одном варианте осуществления в базе данных хранится информация по каждому образцу партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток, находящихся в банке. Определенная информация хранится в ассоциации с каждым образцом. Информация может быть ассоциирована с конкретным донором, например, по идентификации донора и медицинской карте донора. Например, каждый образец может быть HLA-типирован, и информация о HLA-типе может храниться в ассоциации с каждым образцом. Хранящаяся информация может представлять собой информацию по доступности. Хранящаяся с каждым образцом информация является находимой, и она идентифицирует образец таким образом, чтобы можно было установить его нахождение и немедленно доставить клиенту.
Следовательно, в вариантах осуществления изобретения применяются компьютерные системы, которые содержат информацию, такую как о сведения доноре, дате предоставления клеток, типе предоставленных клеток, типах присутствующих клеточных поверхностных маркеров, генетическую информацию о доноре, или другую важную информацию и подробности по хранению, такие как содержание протоколов и нахождение хранящихся образцов, и другую полезную информацию.
Термин «компьютерная система» относится к жесткому диску, программному обеспечению и любой базе данных, используемой для хранения, поиска и восстановления информации о находящихся на хранении клетках. Предпочтительно компьютерная система содержит оперативную память, описанную выше, и процессор для доступа к данным и манипуляций с ними. Жесткий диск компьютерных систем по данному варианту осуществления включает центральный процессор (CPU) и базу данных. Специалист в данной области может легко понять, что подходящими является любая из имеющихся в настоящее время компьютерных систем.
В одном варианте осуществления компьютерная система включает процессор, соединенный с шиной, которая связана с оперативной памятью (предпочтительно в виде RAM) и множеством вспомогательных запоминающих устройств, таких как жесткий диск и запоминающее устройство со съемным носителем. Запоминающее устройство со съемным носителем может представлять, например, привод гибкого диска, привод для DVD дисков, привод для оптических дисков, привод для компакт-дисков, привод для магнитных дисков и т.д. Съемный носитель, такой как дискета, компактный диск, магнитный диск и т.д., содержащий управляющую логику и/или данные, записанные на него, может быть вставлен в запоминающее устройство со съемным носителем. Компьютерная система включает соответствующее программное обеспечение для чтения управляющей логики и/или данных со съемного носителя после установки в запоминающее устройство со съемным носителем. Информацию о партеногенетически активированном ооците, бластоцисте, ICM и/или аутологичной стволовой клетке можно хранить известным образом в оперативной памяти, любом вспомогательном запоминающем устройстве и/или съемном носителе данных. Программное обеспечение для доступа и обработки этих данных (такое как средства поиска, средства сравнения и т.д.) остается во время выполнения в оперативной памяти.
В том смысле, в котором в данном документе используется термин «база данных» относится к памяти, в которой можно хранить любую полезную информацию, касающуюся коллекций партеногенетически активированных ооцитов и/или аутологичных стволовых клеток и доноров.
Данные, касающиеся хранящихся образцов партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток, можно хранить и манипулировать ими с помощью различных процессорных программ различных форматов. Например, данные можно хранить в виде текста в текстовом файле, таком как Microsoft WORD или WORDPERFECT, файле ASCII, файле html или файле pdf в разнообразных программах базы данных, которые известны специалистам в данной области, такие как DB2, SYBASE или ORACLE.
«Программа поиска» относится к одной или более программам, которые имеются в компьютерной системе, для поиска деталей или сравнения информации, относящейся к криоконсервированным образцам в базе данных. «Программа извлечения» относится к одной или более программам, которые имеются в компьютерной системе, для идентификации интересующих параметров в базе данных. Например, программу извлечения можно использовать для поиска образцов, имеющих конкретный профиль, образцов со специфическими маркерами или последовательностью ДНК, или поиска нахождения образцов, соответствующих конкретным индивидуумам.
Верхний предел в отношении количества клеточных образцов, которые можно хранить в одном банке клеток, отсутствует. В одном варианте осуществления в одном банке или устройстве для хранения будут храниться сотни продуктов от различных индивидуумов. В другом варианте осуществления в одном устройстве для хранения можно хранить до миллионов продуктов. Можно использовать одно устройство хранения образцов партеногенетически активированных ооцитов и/или аутологичных стволовых клеток, или можно использовать несколько устройств для хранения.
В некоторых вариантах осуществления настоящего изобретения устройство хранения может иметь средства для любого способа организации и индексирования хранящихся образцов клеток, например, такие как автоматизированные механизмы для восстановления и механизмы для манипуляций с клеточными образцами. Устройство может включать микропроцессорные механизмы для обработки клеточных образцов. Можно использовать известные обычно использумые технологии для эффективного хранения и восстановления клеточных образцов. Приведенные в качестве примера технологии включают, но не ограничиваются этим, Machine Vision, Robotics, Automated Guided Vehicle System, Automated Storage and Retrieval Systems, Computer Integrated Manufacturing, Computer Aided Process Planning, Statistical Process Control и тому подобное.
Типовую информацию или другую информацию, касающуюся индивидуума, нуждающегося в образце, можно зарегистрировать в системе, которую можно использовать для идентификации соответствующего совместимого продукта, такой, например, как база данных, система индексации и пр. После регистрации в системе можно провести оценку совместимости между типом индивидуума и донором клеточного образца. В предпочтительных вариантах осуществления донорный образец получают от того же индивидуума, который нуждается в клеточном образце. Однако можно также использовать аналогичные, но не идентичные сопоставления донор/реципиент. Совместимый образец доступен для любого индивидуума, прошедшего тестирование идентификатором совместимости. В одном варианте осуществления настоящего изобретения информация по идентификации индивидуума хранится в ассоциации с клеточным образцом. В некоторых вариантах осуществления способ определения совместимости осуществляют во время получения образца, или же его можно осуществить в любое другое время во время обработки, хранения, или по мере возникновения необходимости. Следовательно, в некоторых вариантах осуществления изобретения способ оценки совместимости имеет место перед тем, как индивидууму будет необходим клеточный образец.
Когда у индивидуума возникает необходимость в образце партеногенетически активированных ооцитов, бластоцист, ICM и/или аутологичных стволовых клеток, то, если желательно, его можно восстановить и сделать доступным для исследования, трансплантации или других целей в течение времени, исчисляемого минутами. Также образец можно дополнительно обработать для его подготовки к трансплантации или других нужд.
Обычно ооцит подвергается овуляции на данной стадии и оплодотворяется сперматозоидом. Сперматозоид инициирует завершение мейоза в процессе, называемом активацией. Во время активации пары хроматид расходятся, второе полярное тельце выталкивается и ооцит сохраняет гаплоидный набор хромосом, каждая из одной хроматиды. Сперматозоид привносит другой гаплоидный комплементарный набор хромосом с образованием полной диплоидной клетки с одними хроматидами. Затем хромосомы проходят через синтез ДНК во время первого клеточного цикла. Затем данные клетки развиваются в эмбрионы.
В противоположность, эмбрионы, описанные в данном документе, развиваются в результате искусственной активации клеток, как правило, ооцитов или бластомеров млекопитающих, содержащих ДНК мужского или женского происхождения. Как уже обсуждалось в разделе «Уровень техники», в литературе сообщалось о многих способах искусственной активации неоплодотворенных ооцитов. Такие способы включают физические способы, например механические способы, такие как обкалывание, манипуляции с ооцитами в культуре, термические способы, такие как охлаждение и нагревание, повторяющиеся электрические импульсы, обработку ферментами, такими как трипсин, проназа, гиалуронидаза, осмотическую обработку, обработку ионами, такими как двухвалентные катионы, и кальциевыми ионофорами, такими как иономицин и А23187, применение анестетиков, таких как простой эфир, этанол, тетракаин, лигнокаин, прокаин, фенотиазин, транквилизаторов, таких как тиоридазин, трифторперазин, флуфеназин, хлорпромазин, применение ингибиторов синтеза белка, таких как циклогексимид, пуромицин, применение ингибиторов фосфорилирования, например ингибиторов протеинкиназ, таких как стауроспорин, 2-аминопурин, сфингозин и DMAP, их комбинаций, а также другие способы.
Такие способы активации являются хорошо известными в данной области и описаны в патенте США № 5945577, включенном в данный документ для сведения.
В одном варианте осуществления человеческая клетка в метафазе II, как правило, ооцит или бластомер, содержащий ДНК полностью мужского или женского происхождения, искусственно активируют для проведения искусственной активации ооцитов.
В связанном аспекте активированной клетке, например, ооциту, которая является диплоидной, дают возможность развиться в эмбрион, содержащий трофэктодерму и клеточную массу внутренней области. Это можно осуществить с использованием известных способов и культуральных сред, которые способствуют развитию бластоцисты.
После культивирования гиногенетических эмбрионов с получением различимого трофобласта и клеточной массы внутренней области клетки клеточной массы внутренней области затем используют для получения желаемых линий плюрипотентных клеточных линий. Это можно осуществить переносом клеток, полученных из клеточной массы внутренней области, или цельной клеточной массы внутренней области на культуру, которая подавляет дифференцировку. Это можно провести переносом клеток клеточной массы внутренней области на питающий слой, который подавляет дифференцировку, например на фибробласты или эпителиальные клетки, такие как фибробласты, полученные из постнатальных тканей человека и т.д., или другие клетки, продуцирующие LIF. Можно использовать другие факторы/компоненты для обеспечения соответствующих культуральных условий для поддержания клеток в недифференцированном состоянии, включая, но не ограничиваясь этим, добавление кондиционированной среды (Amit et al., Developmental Biol. (2000) 227:271-278), bFGF и TGF-β1 (с или без LIF) (Amit et al., Biol. Reprod. (2004) 70:837-845), факторы, которые активируют путь gp130/STAT3 (Hoffman and Carpenter, Nature Biotech. (2005) 23(6):699-708), факторы, которые активируют путь PI3K/Akt, PKB (Kim et al., FEBS Lett. (2005) 579:534-540), факторы, которые являются членами надсемейства морфогенетических белков костной ткани (BMP) (Hoffman and Carpenter, (2005), см. выше), и факторы, которые активируют канонический/β-катениновый Wnt сигнальный путь (например, специфический ингибитор GSK-3; Sato et al., Nat. Med. (2004) 10:55-63). В связанном аспекте такие факторы могут входить в культуральные условия, которые включают питающие клетки и/или субстраты ЕСМ (Hoffman and Carpenter, (2005), см. выше).
В одном аспекте клетки клеточной массы внутренней области культивируют на человеческих постнатальных фибробластах крайней плоти или кожи или других клетках, продуцирующих лейкемический ингибирующий фактор, или в присутствии лейкемического ингибирующего фактора. В связанном аспекте питающие клетки подвергают инактивации перед посевом ICM. Например, питающие клетки можно инактивировать митотически с использованием антибиотика. В связанном аспекте антибиотик может представлять собой, не ограничиваясь этим, митомицин С.
Культивирование можно проводить в условиях, которые поддерживают клетки в недифференцированном, плюрипотентном состоянии в течение продолжительного периода времени, теоретически бесконечно. В одном варианте осуществления ооциты партеногенетически активируют кальциевыми ионофорами при высоком давлении О2 с последующим контактированием ооцитов с ингибитором серин-треониновой киназы при высоком давлении О2. Полученную из партеногенетически активированных ооцитов ICM культивируют при высоком давлении О2, когда клетки, например, поддерживают с использованием газовой смеси, содержащей 20% О2. В одном аспекте термин «культивируемый» относится к способности или возможности подвергаться культивированию. В связанном аспекте выделение ICM проводят механически после культивирования бластоцисты в течение 4 суток, когда культивирование проводят на питающих клетках. Такое культивирование, например, устраняет необходимость в использовании веществ, полученных из источников животного происхождения, как в случае для «иммунохирургии».
В связанном аспекте в культуральную среду для ICM добавляют сыворотку не от животных, а включая, но не ограничиваясь этим, сыворотку крови из пупочного канатика человека, где сыворотка находится в определенной среде (например, IVF производства MediCult A/S, Дания; Vitrolife, Швеция, или Zander IVF, Inc., Vero Beach, FL). В еще одном аспекте в средах не содержатся и в способах не используются продукты животного происхождения. В связанном аспекте продукты животного представляют такие продукты, как сыворотка, интерфероны, хемокины, цитокины, гормоны и факторы роста, которые не имеют человеческого происхождения.
Плюрипотентное состояние клеток, полученных по настоящему изобретению, можно подтвердить различными методами. Например, клетки можно тестировать на присутствие или отсутствие характерных для ES-клеток маркеров. В случае человеческих ES-клеток примеры таких маркеров приведены выше, и они включают SSEA-4, SSEA-3, TRA-1-60, TRA-1-81 и ОСТ 4, и они известны в данной области.
Также наличие плюрипотентности можно подтвердить введением клеток подходящему животному, например мышам SCID, и наблюдением за образованием дифференцированных клеток и тканей. Еще одним методом подтверждения плюрипотентности является использование данных плюрипотентных клеток для получения химерных животных и оценка вклада введенных клеток в различные типы клеток. Способы получения химерных животных являются хорошо известными в данной области, и они раскрыты в патенте США № 6642433, включенном в данный документ для сведения.
Еще один метод подтверждения плюрипотентности заключается в оценке дифференцировки ES-клеток в зародышевые тельца и другие типы дифференцированных клеток при культивировании в условиях, способствующих дифференцировке (например, при удалении питающего слоя из фибробластов). Указанный метод использовали, и было подтверждено, что указанные плюрипотентные клетки развиваются в зародышевые тельца и различные типы дифференцированных клеток в культуре ткани.
Полученные плюрипотентные клетки и клеточные линии, предпочтительно человеческие плюрипотентные клетки и клеточные линии, происходящие из ДНК полностью женского происхождения, имеют многочисленные терапевтические и диагностические применения. Такие плюрипотентные клетки можно использовать для трансплантации клеток или генной терапии (если они генетически модифицированы) для лечения многочисленных заболеваний.
В этом отношении известно, что мышиные эмбриональные стволовые (ES)-клетки способны подвергаться дифференцировке практически в любой тип клеток. Следовательно, человеческие плюрипотентные (ES)-клетки, полученные согласно изобретению, должны обладать аналогичной способностью к дифференцировке. Плюрипотентные клетки согласно изобретению можно стимулировать к дифференцировке с получением желаемого типа клеток известными способами. Например, человеческие (ES)-клетки, полученные согласно изобретению, можно стимулировать к дифференцировке в различные гематопоэтические стволовые клетки, мышечные клетки, клетки сердечной мышцы, клетки печени, клетки сетчатки, хрящевые клетки, эпителиальные клетки, клетки мочевых путей и т.д., культивированием таких клеток в среде для дифференцировки и в условиях, способствующих дифференцировке клеток. В данной области известны среды и способы, которые приводят к дифференцировке (ES)-клеток, в качестве подходящих условий культивирования.
Например, Palacios et al., Proc. Natl. Acad. Sci. USA, 92:7530-7537 (1995) сообщают о получении гематопоэтических стволовых клеток из линии эмбриональных клеток индукцией стволовых клеток, включающей первоначально культивирование агрегатов таких клеток в суспензионной культуральной среде, не содержащей ретиноевую кислоту, с последующим культивированием в той же среде, но уже содержащей ретиноевую кислоту, с последующим переносом клеточных агрегатов на субстрат, обеспечивающий прикрепление клеток.
Кроме того, Pedersеn, J. Reprod. Fertil. Dev., 6:543-552 (1994) представил обзор, в котором приводятся многочисленные статьи, раскрывающие способы, обеспечивающие дифференцировку эмбриональных стволовых клеток в условиях in vitro, с получением различных типов дифференцированных клеток, включая, среди прочего, гематопоэтические клетки, мышечные клетки, клетки сердца, нервные клетки.
Кроме того, Bain et al., Dev. Biol., 168:342-357 (1995) сообщают о дифференцировке эмбриональных стволовых клеток в условиях in vitro с получением нейрональных клеток, обладающих свойствами нейронов. Данные источники приведены в качестве примера описанных в литературе способов получения дифференцированных клеток из эмбриональных или стволовых клеток. Эти источники, и в частности, раскрытие которых относится к способам дифференцировки эмбриональных стволовых клеток, включены в данный документ в полном объеме для сведения. Таким образом, с использованием известных способов и культуральной среды специалист в данной области может культивировать ES-клетки согласно изобретению, включая генно-инженерные или трансгенные ES-клетки, с получением желаемых типов дифференцированных клеток, например нейрональных клеток, мышечных клеток, гематопоэтических клеток и т.д. Плюрипотентные клетки, полученные способами, описанными в данном документе, можно использовать для получения любого желаемого типа дифференцированных клеток. Терапевтические применения дифференцированных человеческих стволовых клеток не имеют себе равных. Например, человеческие гематопоэтические стволовые клетки можно использовать при лечении, требующем пересадки костного мозга. Такие способы применяют для лечения многих заболеваний, например, злокачественных заболеваний на поздних стадиях, таких как рак яичников и лейкемия, а также заболеваний, нарушающих функцию иммунной системы, таких как СПИД. Гематопоэтические стволовые клетки можно получить, например, включением мужской или женской ДНК, полученной от пациента или пациентки со злокачественным заболеванием или СПИДом, в энуклеированный ооцит, получением плюрипотентных клеток, как описано выше, и культивированием таких клеток в условиях, способствующих дифференцировке, до получения гематопоэтических стволовых клеток. Такие гематопоэтические клетки можно использовать для лечения заболеваний, включая рак и СПИД.
Альтернативно плюрипотентные клетки согласно изобретению можно использовать для лечения пациента с неврологическим расстройством при культивировании таких клеток в условиях, способствующих дифференцировке, с получением линий нейрональных клеток. Конкретные заболевания, поддающиеся лечению трансплантацией таких человеческих нейрональных клеток, включают, среди прочего, в качестве примера, болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз и церебральный паралич. В конкретном случае болезни Паркинсона было показано, что транплантированные фетальные нейрональные клетки мозга образуют правильные соединения с окружающими клетками и продуцируют дофамин. Это может привести к долгосрочной ремиссии симптомов болезни Паркинсона. В связанном аспекте предшественники нервной ткани можно использовать для соединения пострадавших/поврежденных нервных волокон в целях восстановления двигательной активности после травм рук, ног и спинного мозга.
Одной целью настоящего изобретения является обеспечение по существу неограниченного источника плюрипотентных человеческих стволовых клеток, которые можно использовать для получения дифференцированных клеток, подходящих для аутологичной трансплантации для донора ооцитов. Человеческие эмбриональные стволовые клетки и их дифференцированное потомство, полученное из бластоцист, оставшихся после лечения бесплодия или полученное с использованием NT, вероятно, будет отторгаться под действием иммунной системой реципиента при использовании при аллогенной трансплантации клеток. Полученные партеногенетически стволовые клетки будут превращаться в дифференцированные клетки, которые могут снижать существенную проблему, характерную для имеющихся в настоящее время методов трансплантации, т.е. отторжение трансплантированной ткани, которое может иметь место в результате синдрома хозяин-против-трансплантата или трансплантат-против-хозяина относительно донора ооцитов. Как правило, отторжение предупреждается или ослабляется при введении лекарственных средств против отторжения, таких как циклоспорин. Однако такие лекарственные средства обладают существенными побочными эффектами, например иммуносупрессией, канцерогенными свойствами, а также они являются очень дорогостоящими. Клетки, полученные раскрытыми способами, будут устранять или, по меньшей мере, существенно снижать потребность в применении лекарственных средств против отторжения по отношению к донору ооцитов.
Другой целью настоящего изобретения является обеспечение по существу неограниченного источника плюрипотентных человеческих стволовых клеток, которые можно использовать для получения дифференцированных клеток, подходящих для аллогенной трансплантации членам семьи донора ооцитов (например, родным братьям или сестрам). В иммунологическом и генетическом отношении клетки будут аналогичны таковым у прямых членов семьи донора ооцитов и, таким образом, в меньшей степени будут отторгаться у членов семьи донора.
Другой целью данного способа является то, чтобы партеногенетическая активация ооцитов была относительно простым способом по сравнению с SСNT и приводила к получению стволовых клеток при меньших манипуляциях с клетками.
Было показано, что партеногенетическая активация ооцитов млекопитающих является более эффективной для получения стволовых клеток по сравнению с методами, требующими механических манипуляций с ооцитами (например, SСNT).
Одним недостатком SСNT является то, что субъекты с недостаточной активностью митохондриальной дыхательной цепи представляют фенотипы с высокой аналогией к аномалиям, часто встречающимся у плодов и потомства при постановке SСNT (Hiendleder et al., Repro. Fertil. Dev. (2005), 17(1-2):69-83). В норме клетки содержат только один тип митохондриальной ДНК (мтДНК), что называется гомоплазмией, однако существует гетероплазмия, как правило, в виде комбинации мутантной молекулы мтДНК и молекулы мтДНК дикого типа или в виде комбинации вариантов дикого типа (Spikings et al., Hum. Repro. Update (2006) 12(4):401-415). Поскольку гетероплазмия может привести к нарушениям митохондрий, то существуют различные механизмы для гарантии только материнской передачи. Однако с увеличением применения протоколов, при которых обходятся нормальные механизмы поддержания гомоплазмии (например, цитоплазматический перенос (СТ) и SСNT), нарушение функции митохондрий может стать характерным для стволовых клеток, полученных из данных источников.
В одном аспекте, ввиду того, что партеноты являются униродительскими, то возможность гетероплазмии сводится до минимума.
Другие заболевания и состояния, поддающиеся лечению клеточной терапией, включают, в качестве примера, травмы спинного мозга, рассеянный склероз, мышечную дистрофию, диабет, заболевания печени, включая острые заболевания (вирусный гепатит, передозировка лекарственных препаратов (ацетаминофен) и другие), хронические заболевания (хронический гепатит и другие (обычно приводящие к циррозу), наследственные аномалии печени (гемофилию В, недостаточность фактора IX, аномалии обмена билирубина, аномалии обмена мочевины, лизосомальную болезнь накопления, недостаток al-антитрипсина и другие), заболевания сердца, замещение хрящей, ожоги, язвы на конечностях, заболевания желудочно-кишечного тракта, сосудистые заболевания, заболевания почек, заболевания сетчатки, заболевания мочевых путей и заболевания и состояния, связанные со старением.
Данную методологию можно использовать для замены дефектных генов, например дефектных генов иммунной системы, генов кистозного фиброза, или введения генов, приводящих к экспрессии терапевтически полезных белков, таких как факторы роста, лимфокины, цитокины, ферменты и пр.
Например, ген, кодирующий фактор роста из ткани мозга, можно ввести в человеческие плюрипотентные клетки, полученные согласно изобретению, клетки, подвергающиеся дифференцировке в нейрональные клетки, и клетки, трасплатируемые пациенту с болезнью Паркинсона, для замедления потери нейронов при этом заболевании.
Кроме того, плюрипотентные человеческие ES-клетки по настоящему изобретению можно использовать в качестве модели дифференцировки в условиях in vitro, в частности, для исследования генов, принимающих участие в регуляции развития на ранних стадиях. Также ткани и органы из дифференцированных клеток, полученные с использованием настоящих ES-клеток, можно использовать для изучения лекарственных средств.
Кроме того, ES-клетки по настоящему изобретению или дифференцированные клетки, полученные из них, можно применять в качестве доноров ядра для получения других ES-клеток и клеточных колоний.
Также плюрипотентные клетки, полученные по настоящему изобретению, можно использовать для идентификации белков и генов, участвующих в эмбриогенезе. Это можно осуществлять, например, посредством дифференциальной экспрессии, т.е. сравнением мРНК, которые экспрессируются в плюрипотентных клетках, полученных согласно изобретению, с мРНК, которые экспрессируются клетками, подвергающимися дифференцировке в другие типы клеток, например нейрональные клетки, миокардиоциты, другие мышечные клетки, клетки кожи и т.д. Тем самым, возможно установить, какие гены участвуют в дифференцировке конкретных клеточных типов.
Кроме того, ES-клетки и/или их дифференцированное потомство, которое имеет определенные генетические дефекты, такие как генетический дефект, приводящий к развитию мышечной дистрофии Дюшена, можно использовать в качестве моделей для исследования конкретного заболевания, связанного с генетическим дефектом.
Также другой целью настоящего изобретения является воздействие на линии плюрипотентных клеток, полученных описанными способами, смесей различных факторов роста, с различной концентрацией и в различных условиях культивирования клеток, таких как культивирование на различных клеточных субстратах и при различном парциальном давлении газов, в целях установления условий, индуцирующих продукцию и пролиферацию желаемых типов дифференцированных клеток.
Последующие примеры предназначены для иллюстрации, но не ограничения изобретения.
Пример 1
Получение человеческих партеногенетических эмбриональных стволовых клеток
Материалы и методы
Добровольные доноры ооцитов, кумулюсных клеток и крови (для анализа ДНК) не требовали ни какого денежного вознаграждения. Всесторонне информированные доноры подписали документы на согласие и были проинформированы о том, что все донорные материалы будут использованы для исследований, а не для репродуктивных целей. Перед стимуляцией яичников доноры ооцитов были подвергнуты медицинскому осмотру в целях оценки их соответствия требованиям FDA для доноров человеческих клеток, тканей и продуктов на основе тканей (Управление по санитарному надзору за пищевыми продуктами и медикаментами. (Проект) Guidance for Industry: Eligibility Determination for Donors of Human Cells, Tissues and Cellular and Tissue Based Products (HCT/Ps) от мая 2004) и приказ № 67 (02.26.03) Министерства здравоохранения России. Обследование включало рентгенографическое исследование, анализ крови и мочи, постановку теста на оценку функционального состояния печени. Доноров также проверяли на наличие сифилиса, ВИЧ, гепатита В и гепатита C.
Ооциты получали с использованием обычной гормональной стимуляции для получения суперовуляции у донора. Каждый донор яйцеклеток подвергся стимуляции яичника с помощью FSH с 3 по 13 дни менструального цикла. В общей сложности было введено 1500 МЕ FSН. Начиная с 10 по 14 дни менструального цикла донору вводили антагонист гонадолиберина оргалутран (Organon, Голландия) в дозе 0,25 мг/день. Начиная с 12 по 14 дни менструального цикла донору ежедневно вводили 75 МЕ FSH + 75 МЕ LH (Menopur, Ferring GmbH, Германия). При обнаружении при ультразвуковом обследовании фолликулов с диаметром 18-20 мм вводили одну дозу 8000 МЕ hGC (Choragon, Ferring GmbH, Германия) на 14 день менструального цикла донора. Трансвагинальную пункцию осуществляли через 35 ч после введения hGC примерно на 16 сутки. Собирали фолликулярную жидкость из антральных фолликулов доноров при анестезии под ультразвуковым контролем иглой для аспирации в стерильные пробирки.
Кумулюсные комплексы ооцитов (СОС) извлекали из фолликулярной жидкости, промывали средой Flushing Medium (MediCult) и затем инкубировали в универсальной среде IVF (MediCult, см. таблицу 1) со слоем жидкого вазелина (MediCult) в течение 2 ч во влажной атмосфере 20% О2, 5% СО2 при 37°С.
Перед активацией комплексы кумулюсные клетки-ооциты (СОС) обрабатывали гиадазой SynVitro (MediCult, A/S, Дания) для удаления кумулюсных клеток с последующей инкубацией в универсальной среде IVF со слоем вазелина в течение 30 мин.
Начиная с этой точки, далее культивирование ооцитов и эмбрионов проводили во влажной атмосфере при 37°С с использованием газовой смеси с низким уровнем О2 (90% N2 + 5% O2 + 5% CO2), за исключением обработки иономицином. Ооциты активировали инкубацией с 5 мкМ иономицина в течение 5 мин в СО2-инкубаторе при 37°С в атмосфере газовой смеси с содержанием 20% O2, 5% CO2 с последующим культивированием с 1 мМ 6-диметиламинопурина (DMAP) в течение 4 ч в среде IVF, со слоем вазелина, в газовой смеси 90% N2, 5% O2 и 5% CO2 при 37°С. Затем ооциты промывали 3 раза средой IVF. Активацию и культивирование проводили в 4-луночных планшетах (Nunclon, A/S, Дания) в 500 мкл среды со слоем жидкого вазелинового масла (MediCult, A/S, Дания).
Активированные ооциты культивировали в среде IVF в атмосфере газовой смеси, содержащей 5% O2, 5% CO2и 90% N2, и эмбрионы, полученные из активированных ооцитов, культивировали в той же газовой смеси.
Активированные ооциты инкубировали в среде IVF в описанных выше условиях (т.е. низкое давление O2) до полного формирования бластоцист, содержащих клеточную массу внутренней области (ICM), по оценочной системе модификации бластоцист 1АА или 2АА (Shady Grove Fertility Center, Rockville, MD и Georgia Reproductive Specialists, Atlanta, GA).
Прозрачную зону удаляли обработкой 0,5% проназой (Sigma, St. Louis). ICM из бластоцист удаляли «иммунохирургическим» способом, при котором бластоцисты инкубировали с лошадиной антисывороткой против человеческих спленоцитов с последующим воздействием комплемента морской свинки. Клетки трофобласта удаляли из ICM мягким пипетированием полученных бластоцист.
Для отделения ICM от цельных бластоцист последние помещали на питающий слой в среде для культивирования phESC (т.е. среде VitroHESTM) (например, среде DMEM с высоким содержанием глюкозы, VitroLife, Швеция) c добавлением 10% сыворотки крови из пупочного канатика человека, 5 нг/мл человеческого рекомбинантного LIF (Chemicon Int'l, Inc., Temecula, CA), 4 нг/мл рекомбинантного человеческого FGF (Chemicon Int'l, Inc., Temecula, CA) и смеси пенициллин-стрептомицин (100 Е/100 мкг)). После прикрепления бластоцист и распластывания клеток трофобласта ICM становилась видимой. Через 3-4 суток дополнительного культивирования ICM выделяли механически отделением ICM с пророста трофобласта с использованием тонкой стеклянной пипетки. Затем клетки ICM культивировали на слое питающих клеток из митотически инактивированных постнатальных человеческих фибробластов кожи в среде VirtroHESTM (состав приведен выше) в 96-луночном планшете в атмосфере 5% CO2 и 20% O2 при 37°С. Данную газовую смесь использовали для культивирования стволовых клеток. Культуры человеческих фибробластов готовили с использованием веществ, не имеющих животного происхождения. Инактивацию фибробластов проводили с использованием 10 мкг/мл митомицина С (Sigma, St. Louis, MO) в течение 3 ч.
В отдельном способе проводили «иммунохирургию» при инкубации бластоцист с лошадиной антисывороткой против человеческих спленоцитов с последующим воздействием кроличьего комплемента. Клетки трофобласта отделяли от ICM мягким пипетированием обработанных бластоцист. Дальнейшее культивирование выделенной ICM проводили на питающем слое из человеческих фибробластов кожи новорожденного (HSF), полученных от генетически неродственного индивидуума (с разрешения родителей) с использованием среды, содержащей сыворотку крови из пупочного канатика человека. Питающий слой из HSF митотически инактивировали с использованием митомицина С.
Среда для культивирования HSF состояла на 90% из DMEM (с высоким содержанием глюкозы, с L-глутамином (Invitrogen), 10% сыворотки крови из пупочного канатика человека и смеси пенициллин-стрептомицин (100 Е/100 мг) Invitrogen).
Для культивирования ICM и phESC использовали среду VitroHESTM (Vitrolife) с добавлением 4 нг/мл hrbFGF, 5 нг/мл hrLIF и 10% сыворотки крови из пупочного канатика человека. ICM механически высевали на свежий питающий слой и культивировали в течение 3-4 суток. Первую колонию механически вырезали и высевали повторно после первых пяти суток культивирования. Все последующие пассажи проводили через 5-6 суток культивирования. При ранних пассажах колонии механически разделяли на группы и высевали повторно. Дальнейшее пассажирование phESC проводили при обработке коллагеназой IV и механическом разделении. Размножение phESC осуществляли при 37°С во влажной атмосфере с 5% СО2.
Активация ооцитов
Четыре ооцита от первоначального донора активировали и активированные ооциты культивировали в среде IVF в атмосфере газовой смеси из 5% О2, 5% СО2 и 90% N2 в течение пяти (5) суток. В таблице 2 приведены данные по динамике созревания активированных ооцитов. Каждый ооцит находился в отдельном 4-луночном планшете
Внутренние клеточные массы выделяли из N4 и переносили на питающий слой из человеческих фибробластов, как описано выше. N1 и N2 дегенерировали на 6 сутки. Затем на 6 сутки N3 полностью превращался в бластоцисты с ICM 2АВ. Затем N3 переносили на питающий слой из человеческих фибробластов на 6 сутки. ICM из N4 не изменялись. N3 использовали для выделения стволовых клеток.
Клетки ICM культивировали в среде VitroHESTM в атмосфере газовой смеси, содержащей 5% СО2 и 95% N2, в течение сорока пяти (45) суток. В таблице 2а приведены данные по динамике культивирования клеток N3-ICM.
Выделение стволовых клеток
Культивирование ооцитов от 5 доноров с использованием среды MediCult с последующим культивированием в атмосфере с пониженным содержанием кислорода давало 23 бластоцисты на 5-6 сутки культивирования. 11 бластоцист имело видимые ICM (таблица 3).
Данные результаты указывают, что примерно в 57,5% случаев имело место формирование бластоцист из партеногенетически активированных ооцитов.
Иммуногистохимическое окрашивание
Для иммунного окрашивания колонии hES-клеток и phESC-клеток на питающих слоях высевали на покровные микростекла, дважды промывали PBS и фиксировали 100% метанолом в течение 5 мин при -20°С. Клетки дважды промывали смесью PBS + 0,05% Твин-20 и делали проницаемыми при обработке PBS + 0,1% Тритон Х-100 в течение 10 мин при комнатной температуре. После отмывки клеток неспецифическое связывание блокировали инкубацией с блокирующим раствором (PBS + 0,05% Твин-20 + 4% козьей сыворотки + 3% сыворотки крови из пупочного канатика человека) в течение 30 мин при комнатной температуре (RT). Моноклональные антитела разводили в блокирующем растворе и использовали в течение 1 ч при комнатной температуре: SSEA-1 (MAB301) (1:30), SSEA-3 (MAB4303) (1:10), SSEA-4 (MAB4304) (1:50), OCT-4 (MAB4305) (1:30), TRA-1-60 (MAB4360) (1:50) и TRA-1-81 (MAB4381) (1:50) производства Chemicon. После отмывки клеток вторичные антитела Alexa Fluor 546 (оранжевый флуоресцентный) и 488 (зеленый флуоресцентный) (Molecular Probes, Invitrogen) разводили 1:1000 в PBS + 0,05% Твин-20 и использовали в течение 1 ч при комнатной температуре. Клетки промывали и ядра окрашивали DAPI (Sigma) 0,1 мкг/мл в PBS + 0,05% Твин-20 в течение 10 мин при комнатной температуре. Клетки отмывали и готовили микропрепараты с использованием Mowiol (Calbiochem). Флуоресцирующие препараты исследовали под флуоресцентным микроскопом.
Для детектирования мезодермальных маркеров в трехнедельных зародышевых тельцах или в сокращающихся зародышевых тельцах использовали моноклональные мышиные анти-десминовые антитела против человеческого альфа-актининового антитела (Chemicon) в качестве мышечных специфических маркеров и антитела против человеческого CD31/PECAM-1 (R&D Systems), антитела против человеческого VE-кадгерина (DC144) (R&D Systems) в качестве эндотелиальных маркеров.
Для детектирования эндодермальных маркеров в зародышевых тельцах использовали моноклональные мышиные антитела против человеческого альфа-фетопротеина (R&D Systems).
Активность щелочной фосфатазы и теломеразы
Активность фосфатазы и теломеразы определяли согласно инструкциям изготовителя к набору АР и набору TRAPEZETM (Chemicon).
Кариотипирование
Для анализа кариотипа hES-клетки обрабатывали 10 мкг/мл демеколцина (Sigma) в течение 2 ч, собирали с использованием смеси 0,05% трипсин/ЭДТА (Invitrogen) и центрифугировали при 700×об/мин в течение 3 мин. Осадок после центрифугирования ресуспендировали в 5 мл 0,56% KCl и инкубировали в течение 15 мин при комнатной температуре. После повторного центрифугирования супернатант удаляли, клетки ресуспендировали и фиксировали в 5 мл охлажденной на льду смеси метанол/уксусная кислота (3:1) в течение 5 мин при +4°С. Фиксацию клеток повторяли дважды, после чего из клеточной суспензии готовили микроскопические препараты и их окрашивали модифицированной краской Гимза (Sigma). Метафазы клеток, приготовленных таким образом, анализировали обычно используемым методом G-бэндинга. Исследовали метафазные пластинки 5/1000 и анализировали 63 метафазы.
Формирование зародышевых телец
Колонии hES- и phESC-клеток механически разделяли на группы и помещали в лунки 24-луночного планшета, заранее покрытого 1,5% агарозой (Sigma), в среду, содержащую 85% Knockout DMEM, 15% сыворотки крови из пупочного канатика человека, 1×МЕМ NEAA, 1 мМ глутамакса, 0,055 мМ β-меркаптоэтанола, смесь пенициллин-стрептомицин (50 Е/50 мг), 4 нг/мл hrbFGF (все реактивы производства Invitrogen, за исключением сыворотки крови). Человеческие EB-клетки культивировали в течение 14 суток в суспензионной культуре и помещали на культуральные чашки для роста или культивировали в суспензии еще в течение недели.
Дифференцировку в нейроны стимулировали культивированием зародышевых телец двухнедельного возраста, прикрепленных к поверхности культуральной чашки, в течение недели в среде для дифференцировки: DMEM/F12, В27, 2 мМ глутамакса, смесь пенициллин-стрептомицин (100 Е/100 мкг) и 20 нг/мл hrbFGF (все реактивы производства Invitrogen). Некоторые зародышевые тельца превращались в дифференцированные клетки с морфологией нейронов, другие препарировали и культивировали дополнительно с получением нейросфер.
Ритмично пульсирующие зародышевые тельца появлялись спонтанно через 5 суток культивирования после посева на адгезивную поверхность в той же среде, которую использовали для получения зародышевых телец.
HLA-типирование
Геномную ДНК экстрагировали из крови донора, hES-, phESC-клеток и человеческих фибробластов кожи новорожденных (NSF) с использованием шариков Dynabeads DNA Direct Blood производства Dynal (Invtrogen). HLA-типирование проводили ПЦР с использованием аллель-специфических секвенирующих праймеров (PCR-SSP, Protrans) согласно инструкциям изготовителя. Гены HLA класса I (HLA A*, B*, CW*) типировали с использованием PROTRANS HLA A*, B*, CW* для идентификации областей A*01-A*80, B*07-B*83, Cw*01-Cw*18. Гены HLA класса II (HLA DRB1*, DRB3*, DRB4*, DRB5*, DQA1*, DQB1*) анализировали с использованием PROTRANS HLA DRB1* для идентификации областей DRB1*-DRB16* (DR1-DR18), DRB3*, DRB4*, DRB5* и PROTRANS HLA DQB1* DQA1* для идентификации областей DQB1*02-DQB1*06 (DQ2-DQ9), DQA1*-DQA101-DQA1*0601. Амплификацию ПЦР проводили: при 94°С в течение 2 мин; 10 циклов при 94°С в течение 10 сек; 65°С в течение 1 мин; 20 циклов при 94°С в течение 10 сек; 61°С в течение 50 сек; 72°С в течение 30 сек. Амплифицированные продукты детектировали в 2% агарозном геле.
Анализ Affimetrix SNP microarray
Геномную ДНК выделяли из крови, кумулюсных клеток, phESC и NSF экстракцией фенолом/хлороформом. Данные образцы ДНК, полученные от четырех субъектов кавказской национальности, подвергали генотипированию с помощью Affimetrix Mapping 50K Hind 240 Array (часть набора Affimetrix GeneChip Mapping 100K). Первоначально база данных содержала 57244 бинарных маркера SNP. Поскольку число маркеров превышало необходимое для идентификации эквивалентности геномных проб и исследования гетерозиготности, выбирали 15 (хромосомы 1-15) из 22 аутосомальных хромосом. Удаляли более короткие 7 хромосом для снижения вероятности отсутствия маркера или наличия только одного маркера для данной хромосомы во время произвольного тестирования. Анализировали 1459 маркеров с помощью Relcheck (версия 0.67, Copyright© 2000) Karl W. Broman, Johns Hopkins University, лицензирована по версии 2 GNU General Public License (июнь 1991)).
Геномный импринтинг
Общую нуклеиновокислотную фракцию готовили, как описано Li et al. (J. Biol Chem. (2002) 277(16):13518-13527). РНК и ДНК экстрагировали из клеток с использованием Tri-реагента (Sigma) или набора для получения РНК производства Qiagen (Valencia, CA).
Нозерн-блоты, содержащие РНК из различных проб (см. фиг.3), подвергали переносу на фильтры с использованием стандартных методов (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 1989, 2nd ed., Cold Spring Harbor Press). Нозерн-фильтр гибридизовали с одноцепочечными олигонуклеотидными зондами, которые специфически гидридизовались с мРНК. Олигонуклеотидные зонды метили на концах [γ32P]АТФ (Amersham Biosciences). Затем фильтры последовательно промывали три раза в течение 10 мин каждый раз 0,2×SSC (1×SSC = 0,15 M NaCl и 0,015 М цитрата натрия), содержащим 0,1% SDS при 60°С и анализировали PhosphorImager (Molecular Dynamics). Последовательности олигонуклеотидных зондов получали из последовательностей, основанных на следующих номерах для доступа: NP002393 (Peg1_2 и Peg1_А; для данных генов, человеческий PEG1 транскрибировали от двух альтернативных промоторов с получением транскрипции двух изоформ, из которых только одна (изоформа 1_2) подвергалась импринтингу. Экспрессия родительской изоформы 1 имела место в сочетании с неметилированным участком CpG в экзоне 1 родительской аллели, в то время как соответствующий участок CpG в материнском гене (изоформа 1_А) был полностью метилирован. См., например, Li et al. (2002), выше); CAG29346 (SNRPN); AF087017(H19); NR_001564 (неактивный Х специфический транскрипт XIST) и PO4406 (GAPDH).
Фингерпринт ДНК
Геномную ДНК выделяли из крови, hES-клеток и NSF экстракцией фенолом/хлороформом, расщепляли рестриктазой HinfI (Fermentas) и наносили на 0,8% агарозный гель. После проведения электрофореза денатурированную ДНК переносили на нейлоновую мембрану (Hybond N, Amersham) саузерн-блоттингом и гибридизовали с32Р-меченным олигонуклеотидным зондом (САС) 5. мДанные анализировали после экспозиции рентгеновской пленки с мембраной (Kodak XAR) с использованием интенсифицирующих сит Cronex.
Монолокусное ПЦР-генотипирование
Для определения аллельной идентичности минисателлитных локусов между ДНК крови донора и ДНК стволовых клеток 11 полиморфных сайтов ((1) гипервариабельный минисателлитный локус 3' аполипопротеина В (3' Аро В); (2) гипервариабельный минисателлитный локус (D1S80) (PMCT118) D1S80; (3) D6S366; (4) D16S359; (5) D7S820; (6) гипервариабельный минисателлитный локус II гена человеческого фактора фон Виллебрандта (vWFII); (7) D13S317; (8) гипервариабельный минисателлитный локус гена человеческого фактора фон Виллебрандта (vWА); (9) человеческий протоонкоген c-fms для минисателлитного локуса гена рецептора CFS-1 (CSF1PO); (10) минисателлитный локус гена человеческой пероксидазы щитовидной железы (TROX); и (11) минисателлитный локус гена человеческой тирозингидроксилазы (ТН01)) анализировали ПЦР-генотипированием. Сравнивали аллельные частоты для известных популяций людей (т.е. русских и белокожих американцев) для указанных выше полиморфных сайтов с аллельными частотами данных сайтов в тестируемых образцах (т.е. ДНК hES, NSF и крови донора). Ниже приведены данные по локализации в хромосоме, локус в Genbank, данные последовательности повтора, диапазон изменений размера аллельного лэддера, разброс в размерах лэддера VNTR, другие известные аллели, размеры аллелей, протоколы ПЦР и частота аллелей для 11 минисателлитных локусов в указанных популяциях.
1) Гипервариабельный минисателлитный локус 3' аполипопротеина В (3' Аро В VNTR).
Локализация в хромосоме: 2р23-р23.
Локус в Genbank и определение локуса: АРОВ, нетранслируемая область аполипопротеина В (включая антиген Ag(x)).
Последовательность повтора 5'-3': (TATAATTAAATATTTTATAATTAAAATATT)n (SEQ ID NO:1).
Диапазон изменений размера аллельного лэддера (нуклеотиды): 450 + 10 + 2 праймера + связи.
Разброс в размерах лэддера VNTR: (# повторов по Ludwig et al., 1989): 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52.
Другие известные аллели (# повторов): 25, 27, 28, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 54, 55.
Promega K562 DNA® Allele sizes (# повторов): 36/36.
Протокол ПЦР:
Анализ проводили, как описано Verbenko et al. (Apolipoprotein B 3'-VNTR polymorphism in Eastern European populations. Eur. J. Hum. Gen. (2003) 11(1):444-451). См. таблицу 4.
2) Гипервариабельный минисателлитный локус (D1S80 VNTR) D1S80 (pMCT118)
Локализация в хромосоме: lр35-36
Локус в Genbank и определение локуса: человеческий D1S80 и ген МСТ118
Последовательность повтора 5'-3': (GAAGACAGACCACAG)n (SEQ ID NO:2)
Диапазон изменений размера аллельного лэддера (нуклеотиды): 387-762
Разброс в размерах лэддера VNTR (# повторов): 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 34, 35, 36, 37, 40, 41.
Другие известные аллели (# повторов): 13, 14, 15, 38, 39, >41.
Promega K562 DNA® Allele sizes (# повторов): 18/29
Протокол ПЦР:
Анализ проводили, как описано Verbenko et al. (Allele frequencies for D1S80 (pMCT118) locus in some Eastern European populations. J. Forensic Sci. (2003) 48(1):207-208). См. таблицу 5.
3) D6S366
Локализация в хромосоме: 6q21-qter
Локус в Genbank и определение локуса: NA (не обнаружено)
Диапазон изменений размера аллельного лэддера (нуклеотиды): 150-162
Разброс в размерах лэддера STR: (# повторов): 12, 13, 15
Другие известные аллели (# повторов): 10, 11, 14, 16, 17
Promega K562 DNA® Allele sizes (# повторов): 13/14
Протокол ПЦР:
Анализ проводили, как описано Efremov et al. (An expert evaluation of molecular genetic individualizing systems based on the HUMvWFII and D6S366 tetranuclеotide tandem repeats. Sud. Med. Ekspert (1998) 41(2):33-36). См. таблицу 6.
4) D16S539
Локализация в хромосоме: 16q24-qter
Локус в Genbank и определение локуса: NA (не обнаружено)
Последовательность повтора 5'-3': (AGAT)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 264-304
Разброс в размерах лэддера STR: (# повторов): 5, 8, 9, 10, 11, 12, 13, 14, 15
Promega K562 DNA® Allele sizes (# повторов): 11/12
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 7.
5) D7S820
Локализация в хромосоме: 7q11.21-22
Локус в Genbank и определение локуса: NA (не обнаружено)
Последовательность повтора 5'-3': (AGAT)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 215-247
Разброс в размерах лэддера VNTR (# повторов): 6, 7, 8, 9, 10, 11, 12, 13, 14
Promega K562 DNA® Allele sizes (# повторов): 9/11
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 8.
6) Гипервариабельный микросателлитный локус II гена человеческого фактора фон Виллебрандта
Локализация в хромосоме: 12p13.3-12p13.2
Локус в Genbank и определение локуса: ген человеческого фактора фон Виллебрандта, HUMvWFII
Последовательность повтора 5'-3': (ATCT)n/(AGAT)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 154-178
Разброс в размерах лэддера STR (# повторов): 9, 11, 12, 13
Другие известные аллели (# повторов): 8, 10, 14, 15
Promega K562 DNA® Allele sizes (# повторов): 13/13
Протокол ПЦР:
Анализ проводили, как описано Efremov et al. (An expert evaluation of molecular genetic individualizing systems based on the HUMvWFII and D6S366 tetranuclеotide tandem repeats. Sud. Med. Eksperts (1998) 41(2):33-36). См. таблицу 9.
7) D13S317
Локализация в хромосоме: 13q22-q31
Локус в Genbank и определение локуса: NA (не обнаружено)
Последовательность повтора 5'-3': (AGAT)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 165-197
Разброс в размерах лэддера STR (# повторов): 8, 9, 10, 11, 12, 13, 14, 15
Другие известные аллели (# повторов): 7
Promega K562 DNA® Allele sizes (# повторов): 8/8
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 10.
8) Гипервариабельный микросателлитный локус гена человеческого фактора фон Виллебрандта (vWA)
Локализация в хромосоме: 12p12pter
Локус в Genbank и определение локуса: ген человеческого фактора фон Виллебрандта, HUMVWFA31
Последовательность повтора 5'-3': (AGAT)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 139-167
Разброс в размерах лэддера STR (# повторов): 14, 16, 17, 18
Другие известные аллели (# повторов): 11, 12, 13, 15, 19, 20, 21
Promega K562 DNA® Allele sizes (# повторов): 16/16
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 11.
9) Человеческий протоонкоген c-fms для микросателлитного локуса гена рецептора CSF-1 (CSF1 PO)
Локализация в хромосоме: 5q33.3-34
Локус в Genbank и определение локуса: HUMCSF1PO, человеческий протоонкоген c-fms
Последовательность повтора 5'-3': (AGAT)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 295-327
Разброс в размерах лэддера STR (# повторов): 7, 8, 9, 10, 11, 12, 13, 14, 15
Другие известные аллели (# повторов): 6
Promega K562 DNA® Allele sizes (# повторов): 9/10
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 12.
10) Микросателлитный локус гена человеческой пероксидазы щитовидной железы (ТРОХ)
Локализация в хромосоме: 2p25.1-pter
Локус в Genbank и определение локуса: HUMTPOX, ген человеческой пероксидазы щитовидной железы
Последовательность повтора 5'-3': (AATG)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 224-252
Разброс в размерах лэддера STR (# повторов): 6, 7, 8, 9, 10, 11, 12, 13
Другие известные аллели (# повторов): отсутствуют
Promega K562 DNA® Allele sizes (# повторов): 8/9
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 13.
11) Микросателлитный локус гена человеческой тирозингидроксилазы (ТН01)
Локализация в хромосоме: 5q33.3-34
Локус в Genbank и определение локуса: HUMTHO1, ген человеческой тирозингидроксилазы
Последовательность повтора 5'-3': (AATG)n
Диапазон изменений размера аллельного лэддера (нуклеотиды): 179-203
Разброс в размерах лэддера STR (# повторов): 5, 6, 7, 8, 9, 10, 11
Другие известные аллели (# повторов): 9.3
Promega K562 DNA® Allele sizes (# повторов): 9.3/9.3
Протокол ПЦР:
Анализ проводили, как описано GenePrint® STR Systems (Silver Stain Detection) Technical Manual No. D004. Promega Corporation, Madison, WI USA: 1993-2001. См. таблицу 14.
Результаты
hES-клетки, полученные данным способом, обладают многими признаками, типичными для эмбриональных стволовых клеток: наличие цитоплазматических липидных телец, небольшое соотношение цитоплазмы/ядра и четко различимые нуклеоли. Колонии hES-клеток имеют морфологию, аналогичную той, о которой сообщалось ранее для человеческих эмбриональных стволовых клеток, полученных после оплодотворения в условиях in vitro. Клетки проявляли позитивную иммунореактивность на щелочную фосфатазу (фиг.1А), октамер-связывающий транскрипционный фактор 4 мРНК (Oct-4) (фиг.1В), специфический для стадии развития эмбриональный антиген 1 (SSEA-1) (фиг.1С), специфический для стадии развития эмбриональный антиген 3 (SSEA-3) (фиг.1D), специфический для стадии развития эмбриональный антиген 4 (SSEA-4) (фиг.1E), антиген отторжения опухолей 1-60 (TRA-1-60) (фиг.1F), антиген отторжения опухолей 1-81 (TRA-1-81) (фиг.1G) и негативную иммунореактивность на специфический для стадии развития эмбриональный антиген 1 (SSEA-1) (фиг.1С), (на который позитивны мышиные эмбриональные стволовые клетки, но не человеческие). Активность теломеразы часто коррелирует с репликационной иммортальностью и, обычно экспрессируется в зародышевых клетках, злокачественных клетках и различных стволовых клетках, включая стволовые клетки, но отсутствует в большинстве типов соматических клеток. Клетки, полученные данным способом, спустя три месяца после пролиферации в условиях in vitro сохраняли свою недифференцированную морфологию и обладали высокой активностью теломеразы (фиг.2А). Плюрипотентность клеток исследовали в условиях in vitro по формированию зародышевых телец (фиг.2В, 2С), и в результате кариотипирования с использованием G-бэндинга было показано, что клетки имеют нормальный человеческий кариотип 46, ХХ (фиг.2D).
ДНК-фингерпринт проводили с кровью донора ооцитов, ES-клетками и питающими HNSF-клетками с использованием саузерн-блоттинга и гибридизации с32Р-меченным (САС) олигонуклеотидным зондом (фиг.2Е) и монолокусной полимеразной цепной реакции (ПЦР) по различным локусам.
В результате генотипирования монолокусной ПЦР были выявлены идентичные аллели для всех локусов (кроме одного D7S820) между ДНК крови (донора) и ДНК OL1. См. таблицу 15.
Гетерозиготность (гетерозигоз) всех гетерозиготных локусов донора (кроме одного, D7S820) не подвергалась изменению в локусах hES-клеток. Гомозиготность (гомозигоз) локуса D7S820 в ДНК hES-клеток является результатом мутации (вставки одного мономера AGAT в микросателлитном повторе) за счет нарушения комплементарности в результате сдвига цепей во время репликации и репарации ДНК.
Данные результаты согласуются с полученными при мультилокусном ДНК-фингерпринте (когда был установлен по существу идентичный характер фингерпринта для ДНК донора и ДНК hES-клеток).
На фиг.2Е приведены данные по гетерозиготности hES-клеток и их идентичности в этом отношении крови донора ооцитов и данные по отсутствию аналогии между hES-клетками и питающими клетками. ДНК-профиль линии hES-клеток подтверждали основанным на ПЦР анализом гаплотипа с использованием полиморфных генов МНС класса I и класса II. Общую геномную ДНК из клеток крови донора ооцитов, hES-клеток и питающих HNSF-клеток генотипировали и сравнивали. Данные показали, что hES-клетки и клетки из крови донора не различались между собой и, следовательно, их следует рассматривать в качестве аутологичных, и оба вида клеток отличались от питающих клеток (таблица 16).
Результаты ДНК-фингерпринта и HLA-типирования подтвердили, что hES-клетки являются гетерозиготными и содержат полный генетический материал донора. Данные результаты согласуются с данными, полученными на линиях партеногенетических обезьяньих стволовых клеток (Vrana et al., Proc. Natl. Acad. Sci. USA (2003) 100 (Suppl. 1):11911-11916), и не согласуются с данными опытов с линиями партеногенетических мышиных стволовых клеток (Lin et al., Stem Cells (2003) 21:153-161), которые содержат половину генетического материала донора.
Линии phES-клеток имеют морфологию, предполагаемую для hES-клеток, они образуют колонии плотно упакованных клеток, имеют выступающие нуклеоли и небольшое соотношение цитоплазмы к ядру (фиг.4). Указанные клетки экспрессируют традиционные маркеры для hES-клеток SSEA-3, SSEA-4, TRA-1-60, TRA-1-81 и ОСТ-4 и не экспрессируют SSEA-1, позитивный маркер для недифференцированных мышиных эмбриональных стволовых клеток (фиг.4). Было показано, что все линии клеток имеют высокую активность щелочной фосфатазы и теломеразы (фиг.5 и фиг.6). Результаты кариотипирования с G-бэндингом показали, что линии phESС-клеток имеют нормальный человеческий кариотип 46, ХХ, за исключением клеточной линии phESС-7 (фиг.7). Примерно 91% клеток линии phESС-7 имеют кариотип 47, ХХХ, и 9% клеток имеют кариотип 48, ХХХ+6. В линиях наблюдали различную степень гетероморфизма Х хромосомы; соответственно примерно 12% линий phESС-1 и phESС-6; 42% линии phESС-5; и 70, 80 и 86% клеточных линий phESС-7, phESС-3 и phESС-4 (фиг.7).
Проводили сравнительное определение ДНК-профиля для всех линий phESС у соматических клеток донора и питающих клеток. В данных опытах использовали microarray Affimetrix SNP (Mapping 50K Hind 240 Arrays) для исследования изменений хромосом и подтверждения генетического сходства клеток phESС с соматическими клетками доноров. Все парные генотипические связи между линиями phESС и связанными с ними соматическими клетками донора идентифицировали как «полных двойников», и все другие комбинации пар идентифицировали как «неродственные». Внутренние контроли идентифицировали парную взаимосвязь генотипа между расщепленными культурами, полученными из одних линий phESС, в виде «монозиготных близнецов» (таблица 17, база данных S1).
В результате сравнительного анализа 1459 маркеров SNP было установлена гетерозиготность phESС, и было показано, что имели место изменения в генотипе клеток phESС по сравнению с генотипом соматических клеток донора. Некоторые сегменты генома соматических клеток, которые ранее были гетерозиготными, становились гомозиготными в геноме линий phESС. Данный переход гетерозиготных клеток в гомозиготные имел место в 11-15% линий phESС-1, phESС-3, phESС-4, phESС-5 и phESС-6, в 19% линии phESС-7 (база данных S2). Кроме того, генетические различия наблюдали между линиями phESС и phESС-5, которые были получены от того же донора ооцитов (таблица 18, база данных S2).
В предыдущем исследовании партеногенетическая активация мышиных ооцитов приводила к получению линий гомозиготных эмбриональных стволовых клеток (Lin et al., Stem Cells (2003) 21:152). У человеческих ооцитов подавление второго мейотического деления после партеногенетической активации и генерации диплоидных эмбрионов не приводит к отклонению полностью гомозиготных hES-клеток.
Основываясь на результатах HLA-типирования, можно сделать вывод, что дифференцированные клетки, полученные из всех линий phESС, будут полностью гистосовместимыми с донорами ооцитов, что делает данный способ пригодным для создания клеток с терапевтической применимостью (таблица 19).
Анализ ДНК-профиля генетического материала, полученного из человеческих фибробластов, использованных в качестве питающих клеток, не выявил загрязнения клеточных линий phESС материалом из человеческих фибробластов (таблица 19).
Линия phESС-1 оставалась недифференцированной в течение 10 месяцев культивирования во время проведения 35 пассажей. Другие клеточные линии успешно культивировали в течение, по меньшей мере, 21 пассажа. Клетки из всех линий phESС образовывали пузырные зародышевые тельца в суспензионной культуре, и из них развивались производные всех трех зародышевых слоев: эктодермы, мезодермы и эндодермы после дифференцировки в условиях in vitro (фиг.4). Примерно 5% зародышевых телец из линии phESС-1 в течение 5 суток после посева превращалось в пульсирующие клетки. Линия phESС-6 продуцировала пигментированные эпителиоподобные клетки (фиг.4I, K). О дифференцировке в эктодерму судили по позитивному иммуноцитохимическому окрашиванию на специфические для нейронов маркеры нейрофилиментов 68 (фиг.4А), NCAM (фиг.4В), бета-III-тубулин (фиг.4С) и глиальный клеточный маркер GFAP (фиг.4D, M). Дифференцированные клетки были позитивными на маркеры мезодермы, включая альфа-актинин (фиг.4G) и десмин (фиг.4J), которые являются специфическими маркерами для мышечной ткани, и эндотелиальные маркеры PECAM-1 (фиг.4Е) и VE-кадгерин (фиг.4F). О дифференцировке в эндодерму судили по позитивному окрашиванию дифференцированных производных на альфа-фетопротеин. Эти данные показывают, что phESС могут подвергаться дифференцировке в три зародышевых слоя, которые приводят к формированию всех типов клеток человеческого организма.
Измененный кариотип phESС-7 может быть причиной отказа от клинического применения этих клеток. Изменения в геномном импринтинге человеческих эмбрионов могут стать причиной возникновения нарушений, связанных с материнскими или отцовскими экспрессированными генами (Gabriel et al., Proc. Natl. Acad. Sci. USA (1998) 95:14857). Для исследования других характеристик линий phESС и определения их пригодности для применения в клеточной терапии проводили импринтинг.
Ставили нозерн-блоттинг и проводили скрининг с использованием ДНК-зондов SNRPN, Peg1_2, Peg1_А, Н19 и GAPDH (в качестве внутреннего контроля), как описано выше. Подвергшиеся блоттингу нуклеиновые кислоты получали из NSF, неонатальных фибробластов кожи; hES, человеческих эмбриональных стволовых клеток, полученных из оплодотворенных ооцитов; 1, phESС-1; 2, phESС-3; 3, phESС-4; 4, phESС-5; 5, phESС-6; 6, phESС-7. Отрицательными контролями были NSF RT-, hES RT-, 1 RT. На фиг.3 приведены результаты импринтинга.
При импринтинге материнского гена Peg1_А показал сильное связывание для всех тестированных клеточных линий. Более слабое (по сравнению с Peg1_А), но устойчивое связывание наблюдали для всех клеточных линий при импринтинге материнского гена Н19. SNRPN показывал преимущественное связывание для NSF, hES, phESC-4 и phESC-6. Peg1_2 показывал преимущественное связывание для NSF, hES, phESC-1 (сигнал был слабее), phESC-3, phESC-5 и phESC-6. Связывание GAPDH подтверждало аналогичную нагрузку РНК во всех полосах.
Несмотря на то что изобретение описано при обращении к приведенным выше примерам, будет очевидно, что модификации и вариации входят в сущность и объем изобретения. Следовательно, изобретение ограничивается только последующей формулой изобретения.
Источники информации

Реферат
Изобретение относится к области биотехнологии, клеточных технологий и медицины. Раскрыты способы получения человеческих стволовых клеток при партеногенетической активации человеческих ооцитов. Способы предусматривают манипулирование давлением O, включая манипулирование концентрацией ионов Сапри высоком давлении O, и контактирование ооцитов с ингибитором серин-треониновой киназы при низком давлении O. Далее проводят выделение клеточной массы внутренней области (ICM) из активированных ооцитов и культивирование клеток выделенной ICM при высоком давлении O. Предложенные способы позволяют получать человеческие стволовые клетки, которые в дальнейшем могут быть использованы в исследовательских целях или медицине. 5 н. и 11 з.п. ф-лы, 18 ил., 20 табл.
Формула
a) партеногенетическую активацию человеческого ооцита, где активация включает i) контактирование ооцита с ионофором при высоком давлении кислорода (О2) и ii) контактирование ооцита с ингибитором серин-треониновой киназы при низком давлении O2;
b) культивирование активированного ооцита со стадии (а) при низком давлении О2 до формирования бластоцисты;
c) перенос бластоцисты на слой питающих клеток и культивирование перенесенной бластоцисты при высоком давлении O2;
d) механическое отделение клеточной массы внутренней области (ICM) от трофэктодермы бластоцисты со стадии (с); и
e) культивирование клеток ICM со стадии (d) на слое питающих клеток при высоком давлении O2,
где низкое давление O2 поддерживается путем инкубации в среде газовой смеси, содержащей O2 в концентрации, составляющей от примерно 2% O2 до примерно 5% O2, а высокое давление O2 поддерживают путем инкубации в среде газовой смеси, содержащей примерно 5% СO2 и примерно 20% O2.
(a) инкубацию человеческого ооцита на стадии метафазы II в среде для оплодотворения в условиях in vitro (IVF);
(b) инкубацию клетки со стадии (а) в среде (IVF), содержащей ионофор; и
(c) инкубацию клетки со стадии (b) в среде (IVF), содержащей ингибитор серин-треониновой киназы;
где стадии инкубации (а) и (b) проводят при высоком давлении O2, и где высокое давление O2 поддерживается путем инкубации в среде газовой смеси, содержащей примерно 5% СO2 и примерно 20% O2.
a) микроинъецирование в цитоплазму ооцита криоконсервирующего агента;
b) замораживание ооцита до криогенной температуры для индукции вхождения ооцита в состояние покоя;
c) хранение ооцита в состоянии покоя;
d) размораживание ооцита;
e) партеногенетическую активацию ооцита со стадии (d), включающую (i) контактирование ооцита с ионофором при высоком давлении O2 и ii) приведение ооцита в контакт с ингибитором серин-треониновой киназы при низком давлении O2;
f) культивирование ооцита со стадии (е) при низком давлении O2 до формирования бластоцисты;
g) отделение клеточной массы внутренней области (ICM) от трофэктодермы бластоцисты, где условия культивирования осуществляют при высоком давлении O2; и
h) культивирование клеток ICM со стадии (g) на слое питающих клеток или субстрате внеклеточного матрикса (ЕСМ),
где низкое давление O2 поддерживают путем инкубации в среде газовой смеси, содержащей O2 в концентрации, составляющей от примерно 2% O2 до примерно 5% O2, а высокое давление O2 поддерживают путем инкубации в среде газовой смеси, содержащей примерно 5% СO2 и примерно 20% O2.
а) микроинъецирование в цитоплазму партенота криоконсервирующего агента;
b) замораживание партенота до криогенной температуры для индукции вхождения партенота в состояние покоя;
c) хранение партенота в состоянии покоя;
d) размораживание партенота;
e) культивирование партенота со стадии (d) при низком давлении O2 до формирования бластоцисты;
f) отделение клеточной массы внутренней области (ICM) от трофэктодермы бластоцисты, где условия культивирования осуществляют при высоком давлении O2; и
g) культивирование клеток ICM со стадии (f) на слое питающих клеток или субстрате внеклеточного матрикса (ЕСМ),
где низкое давление O2 поддерживают путем инкубации в среде газовой смеси, содержащей O2 в концентрации, составляющей от примерно 2% O2 до примерно 5% O2, а высокое давление O2 поддерживают путем инкубации в среде газовой смеси, содержащей примерно 5% СO2 и примерно 20% O2.









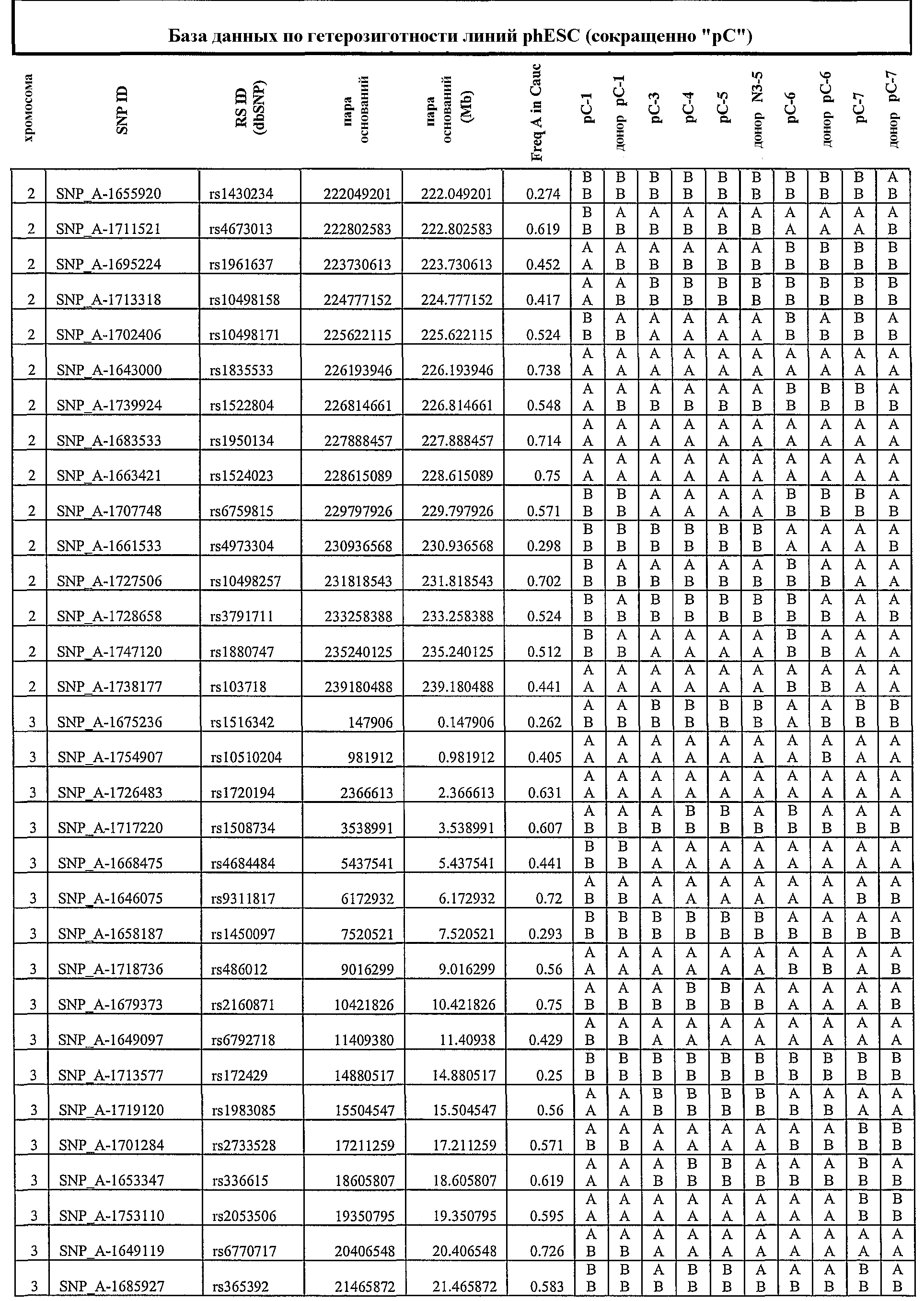


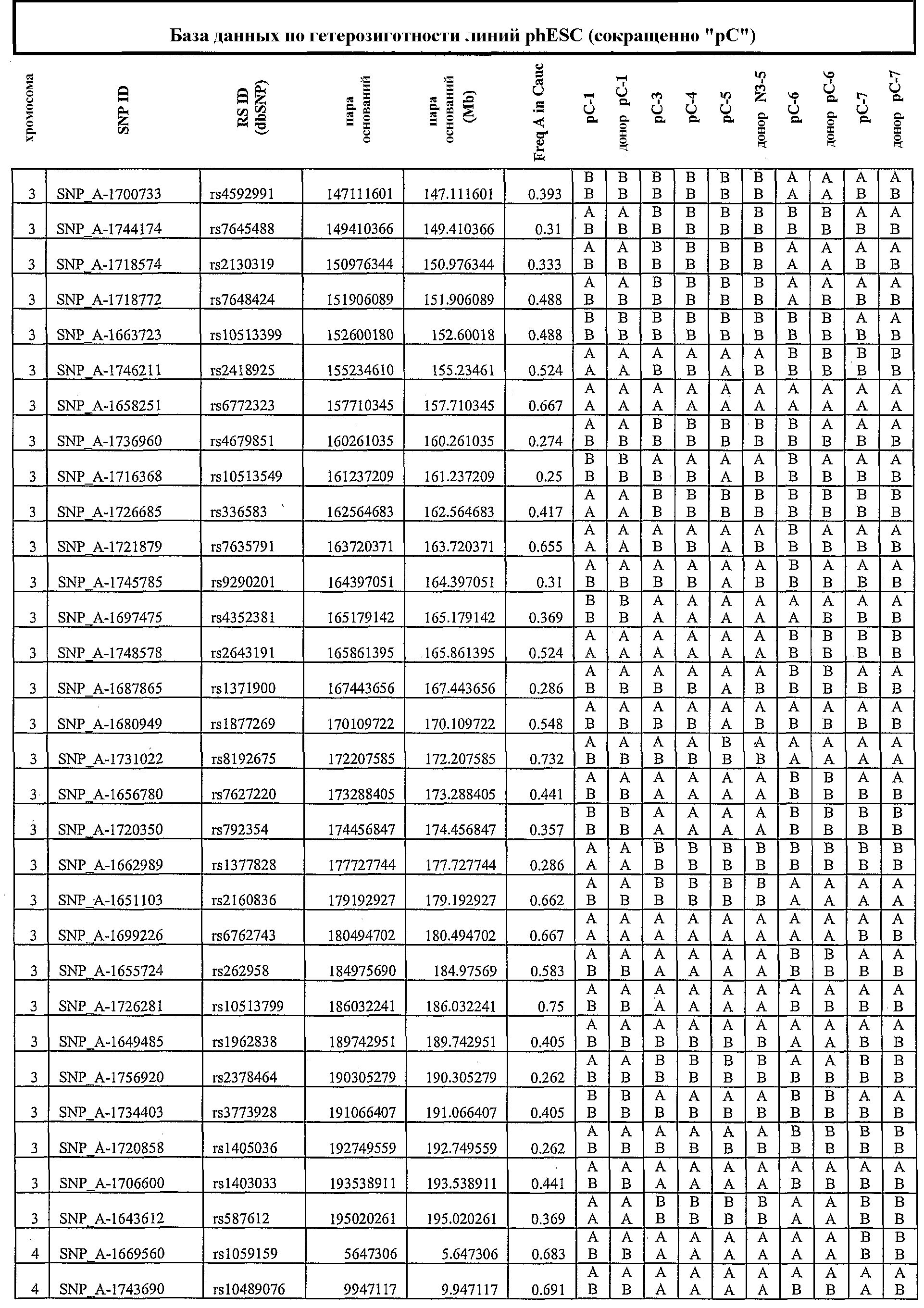

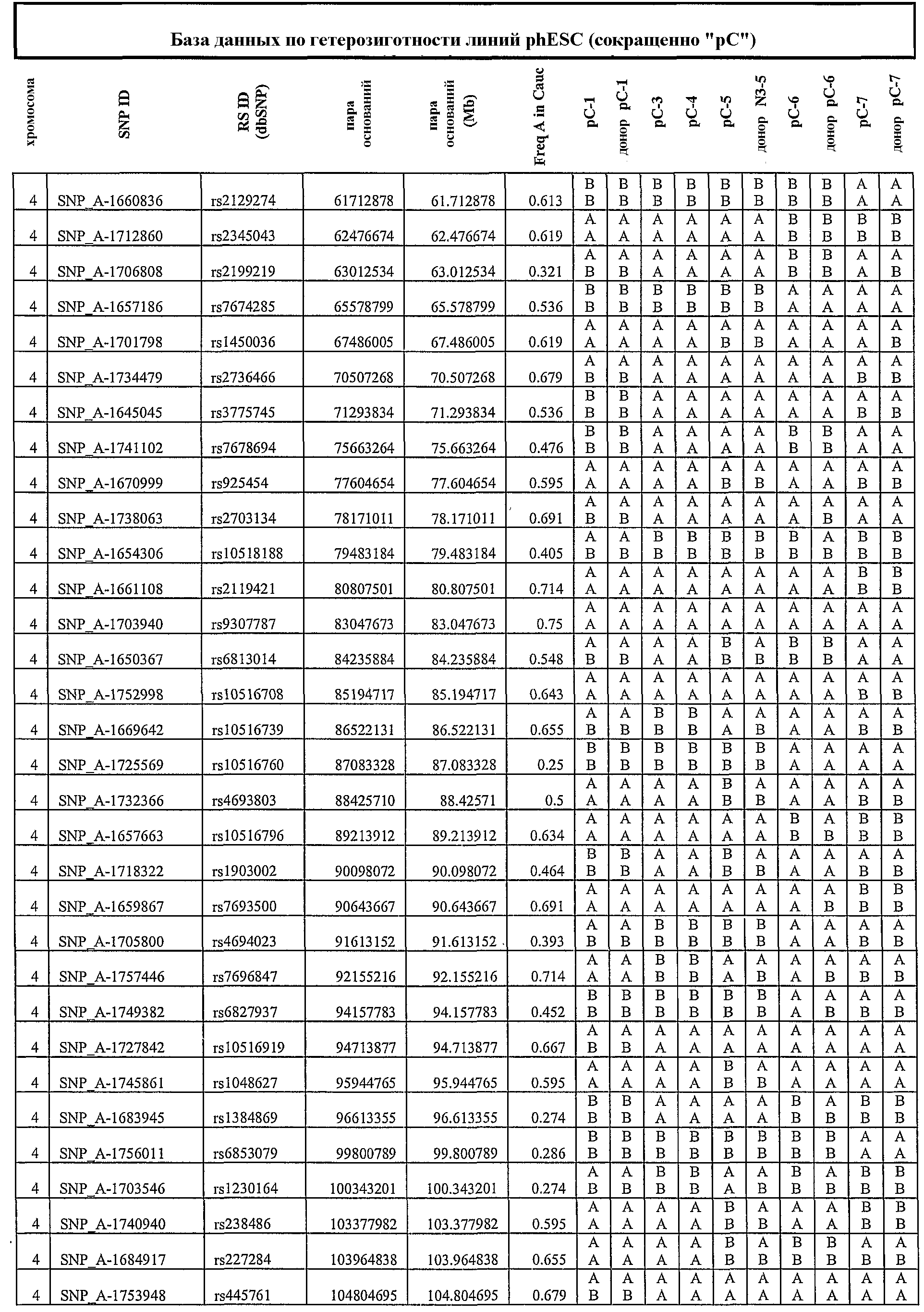

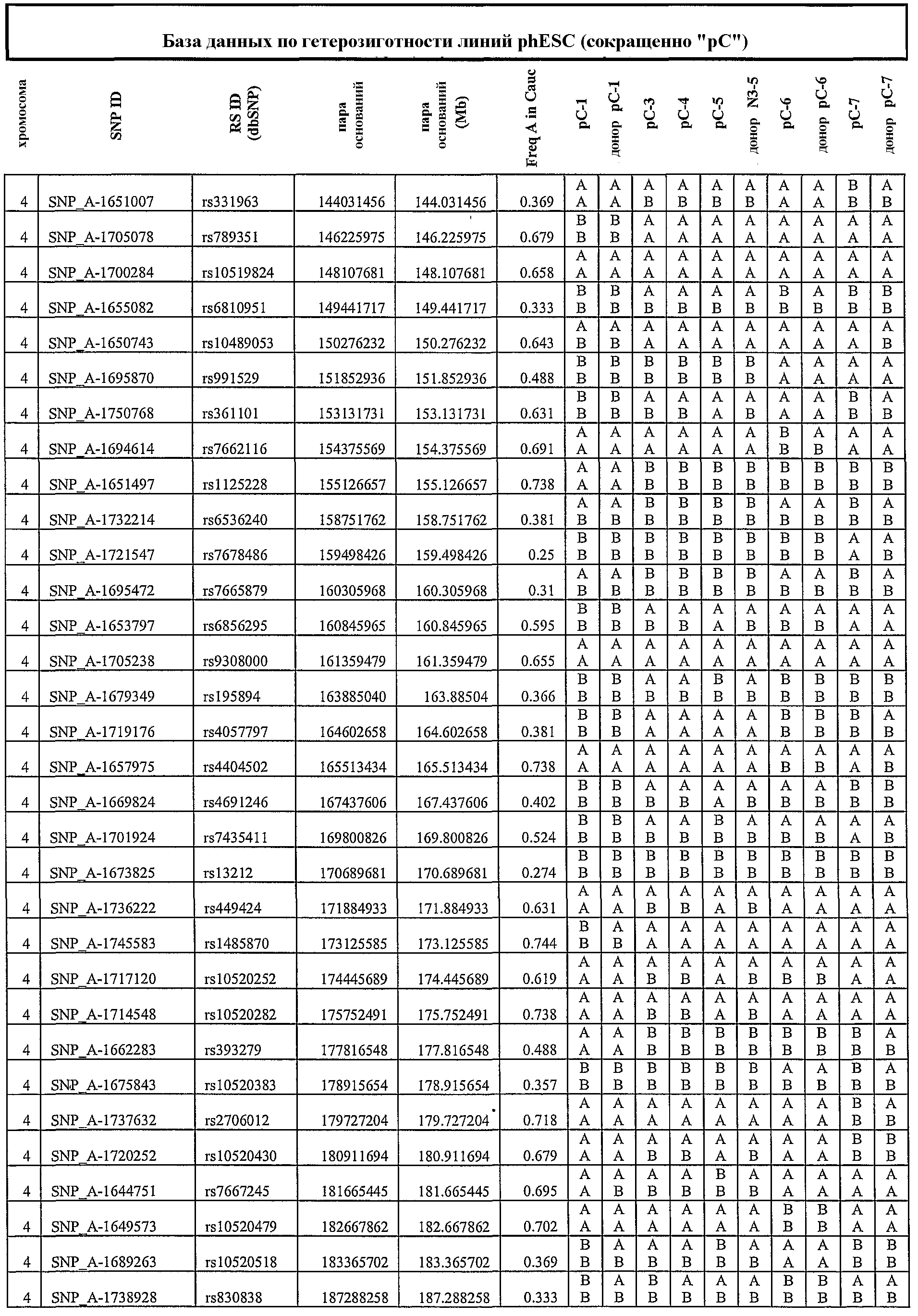


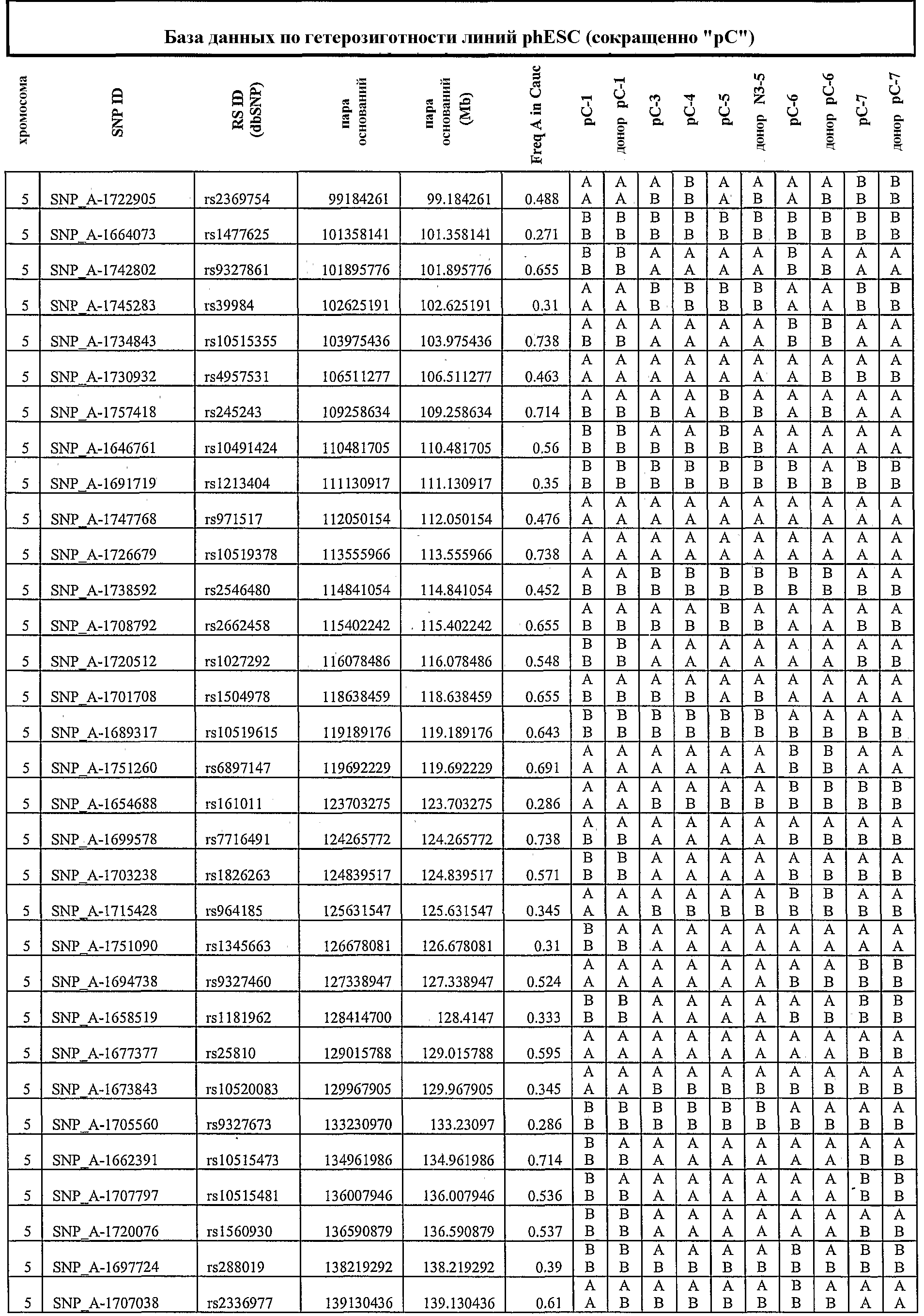

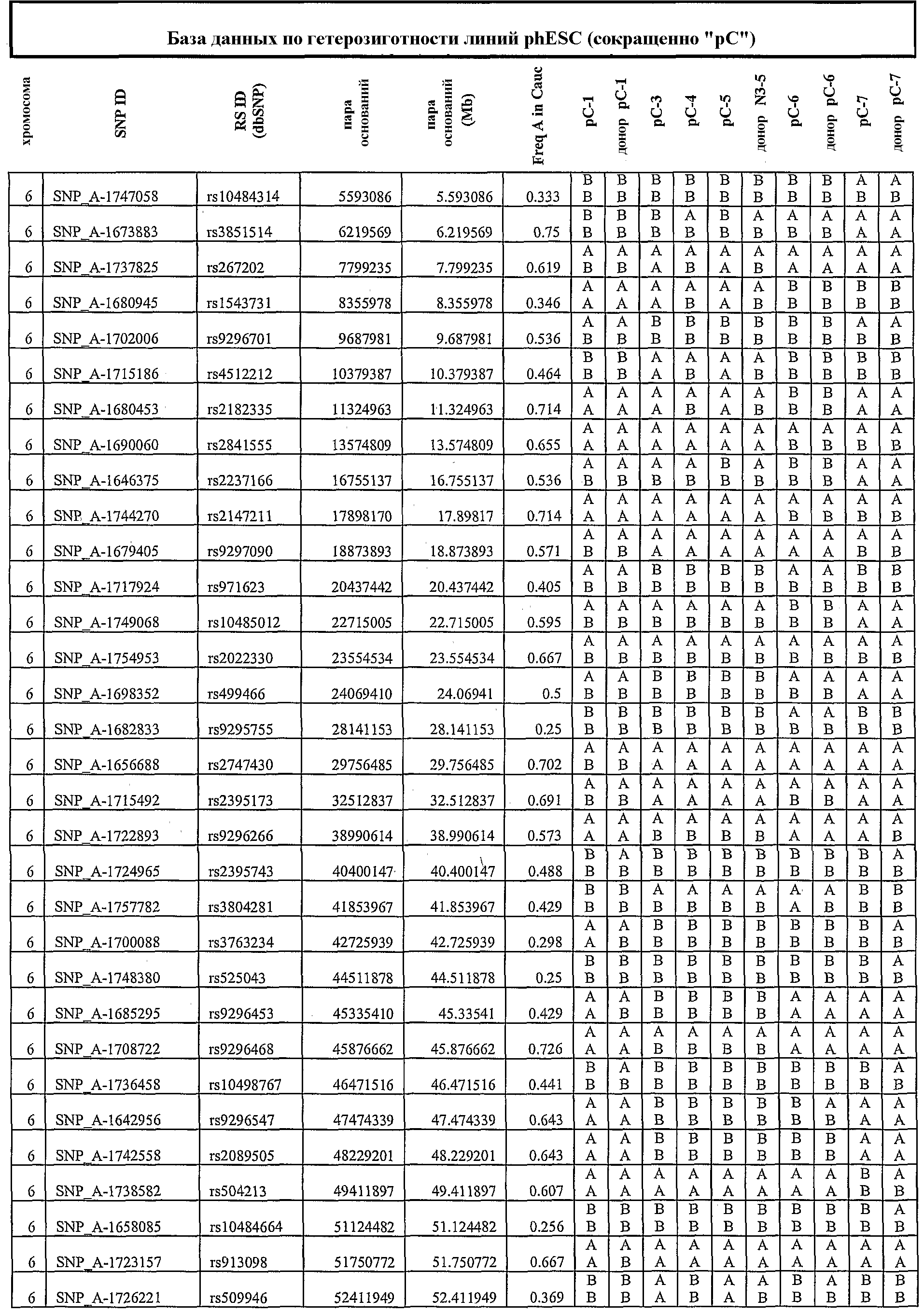
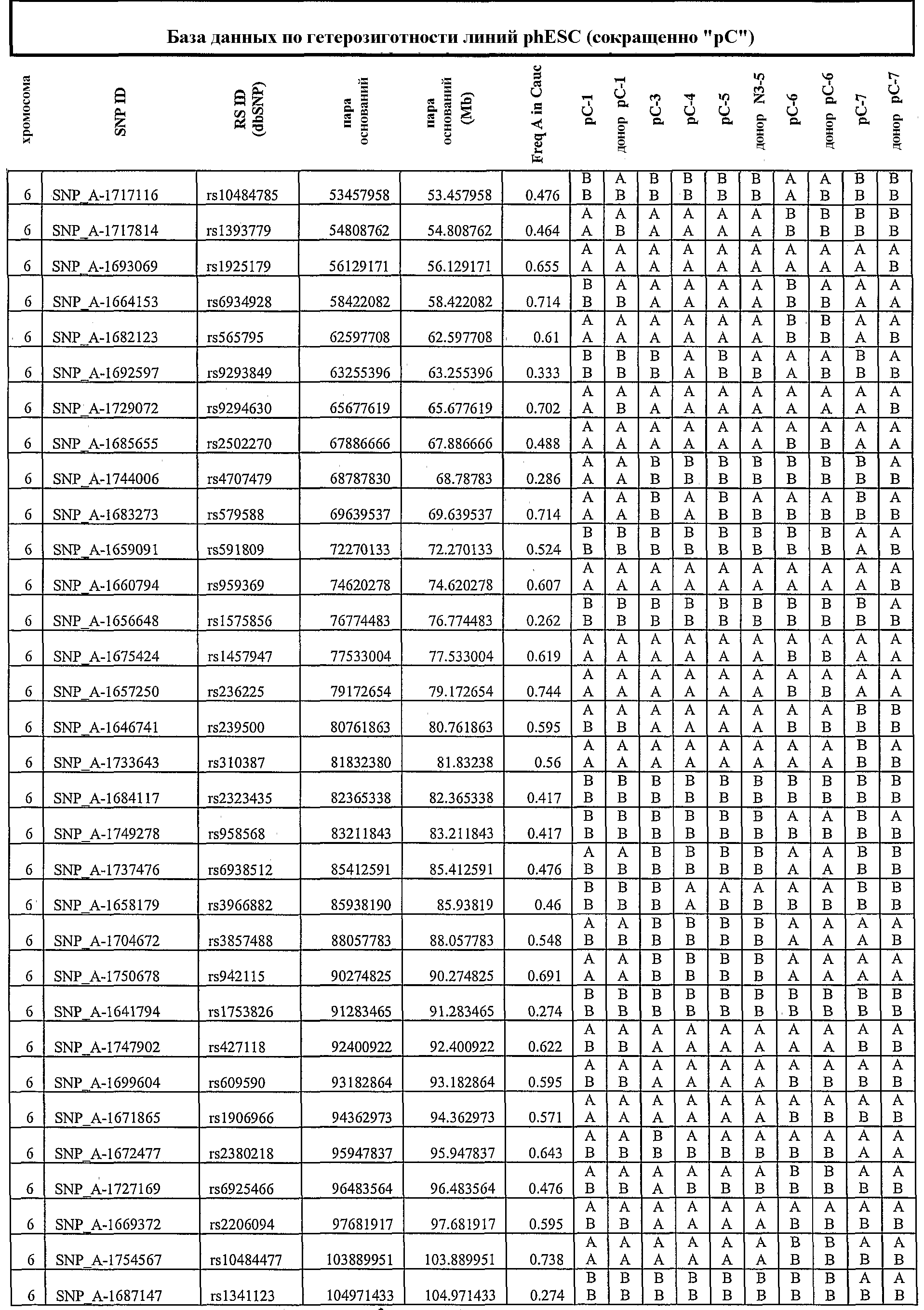

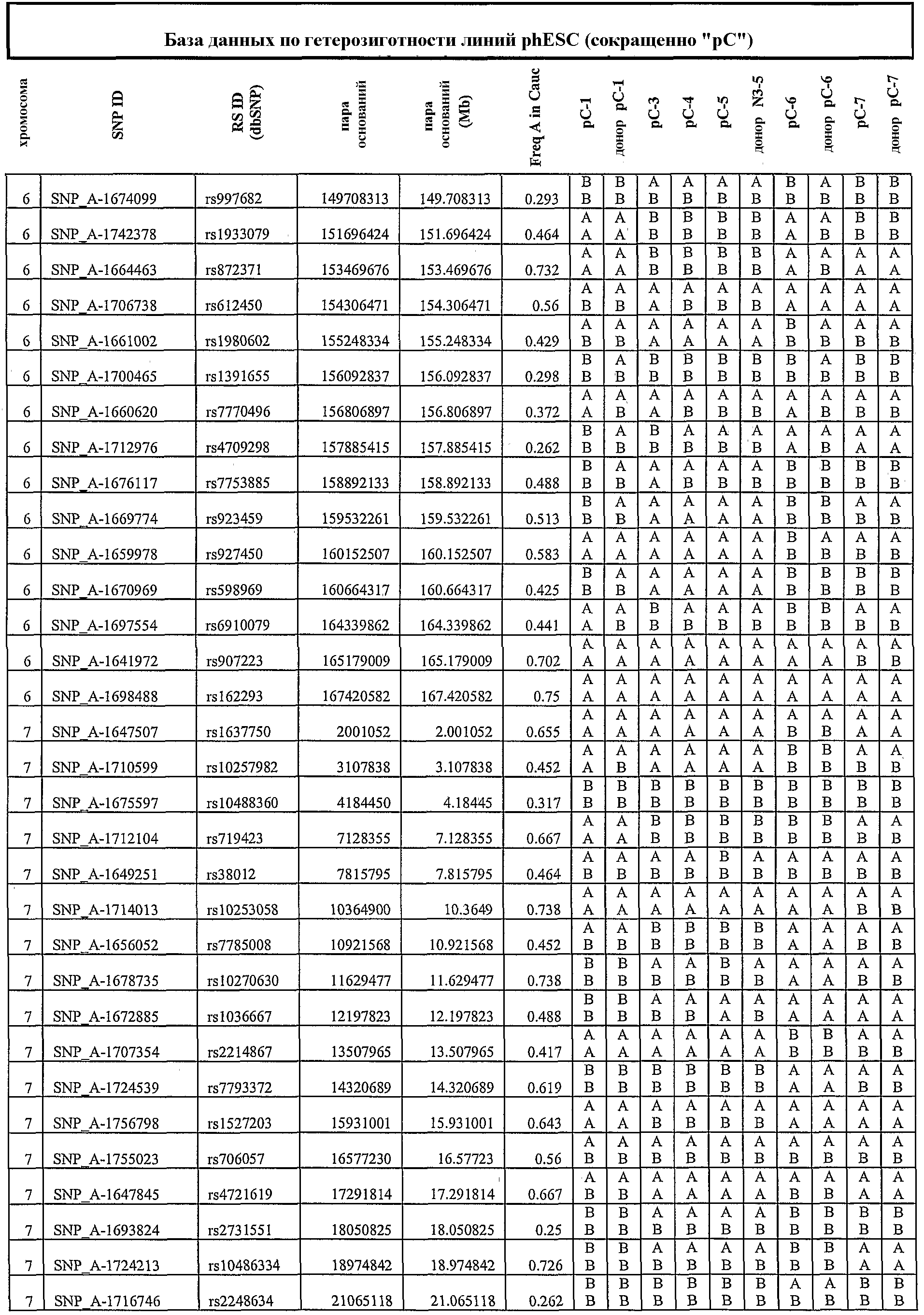
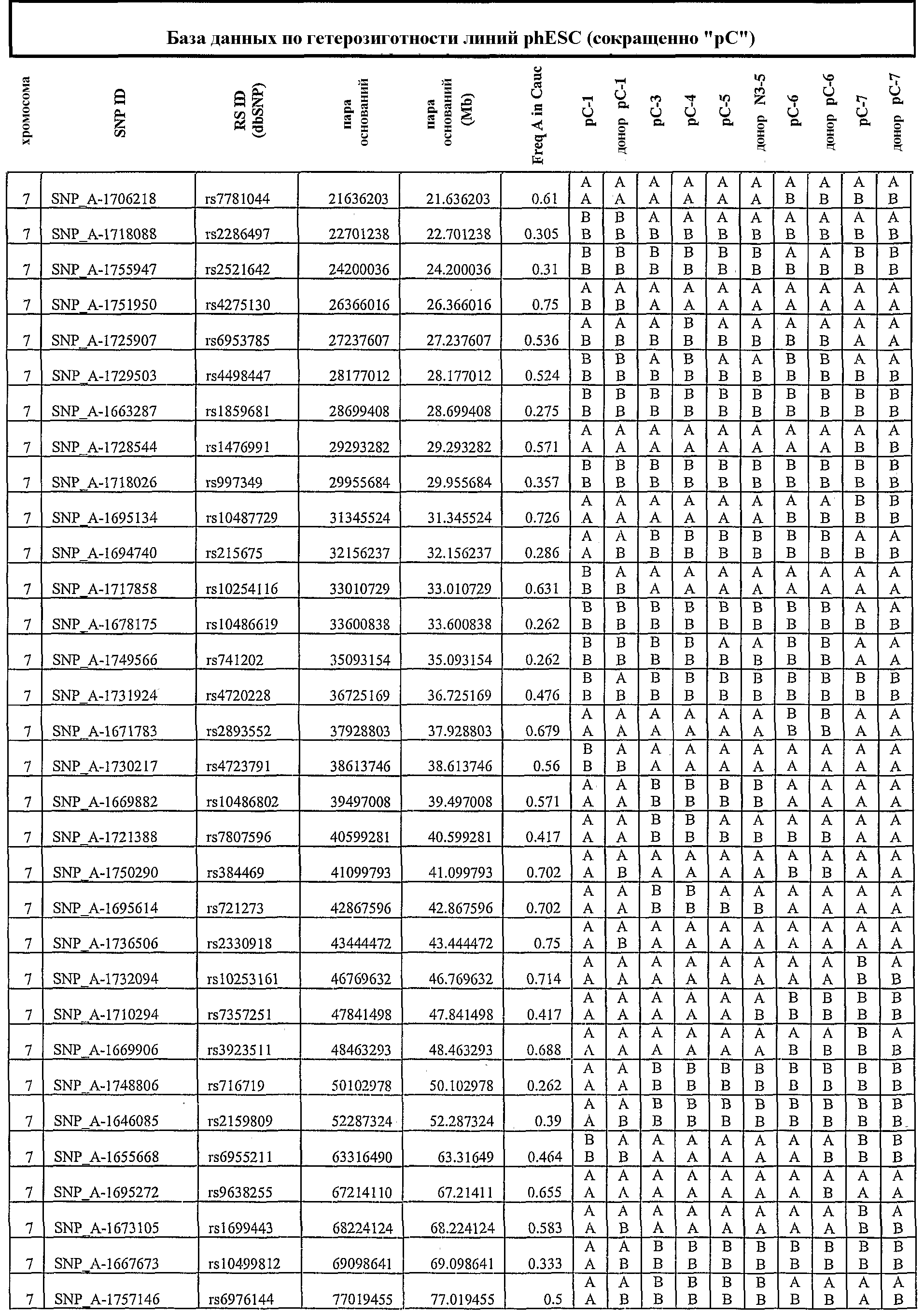

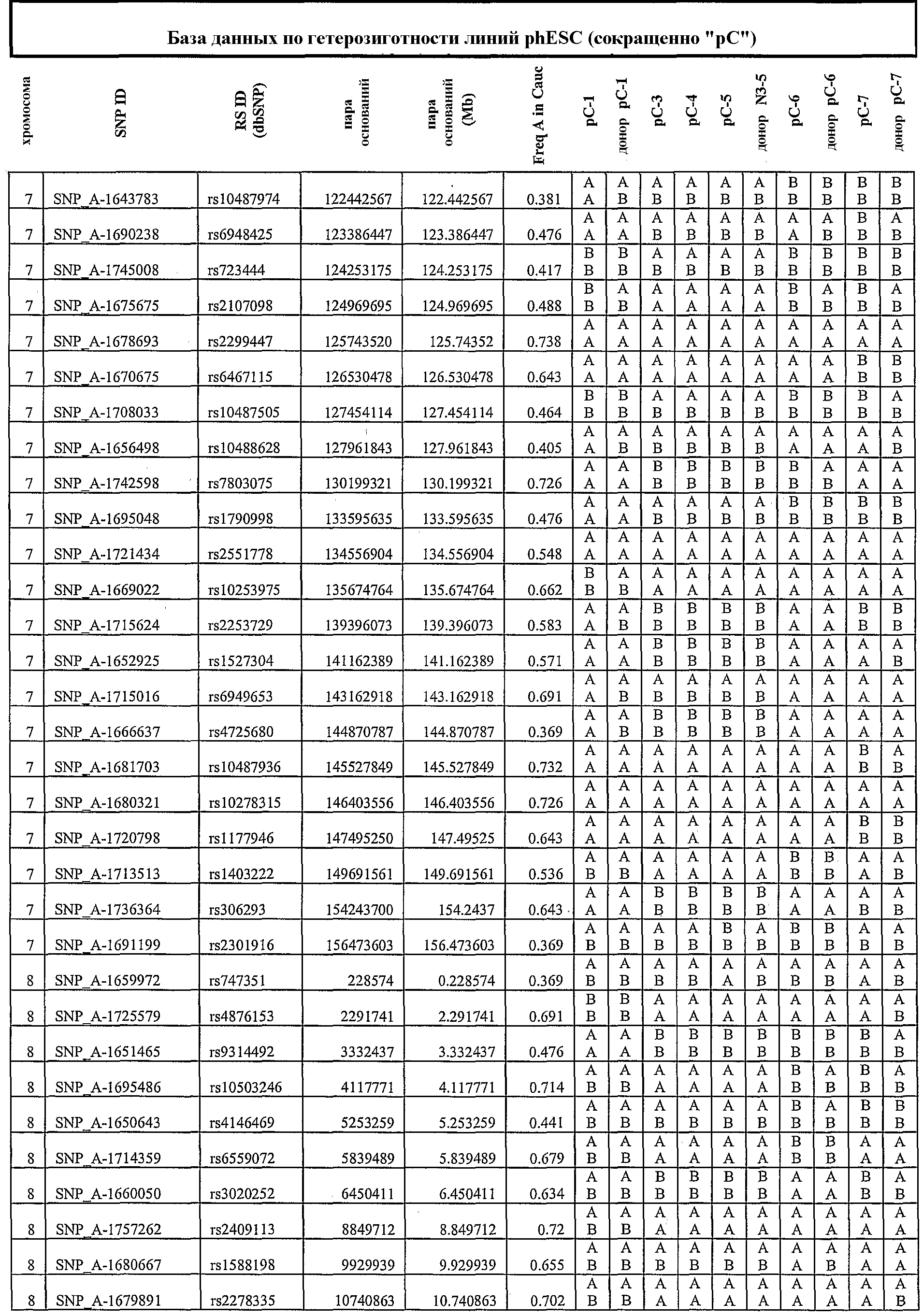



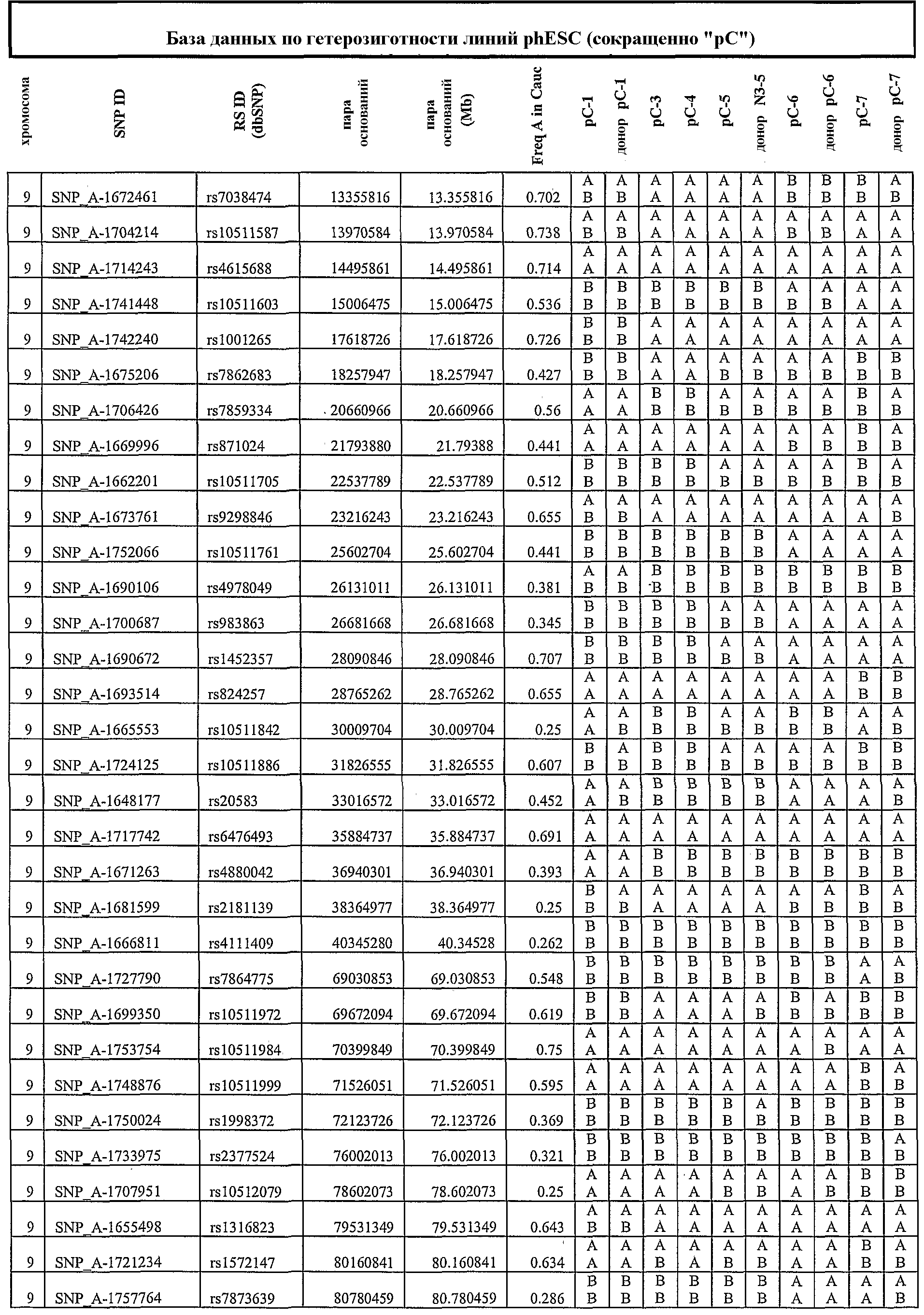
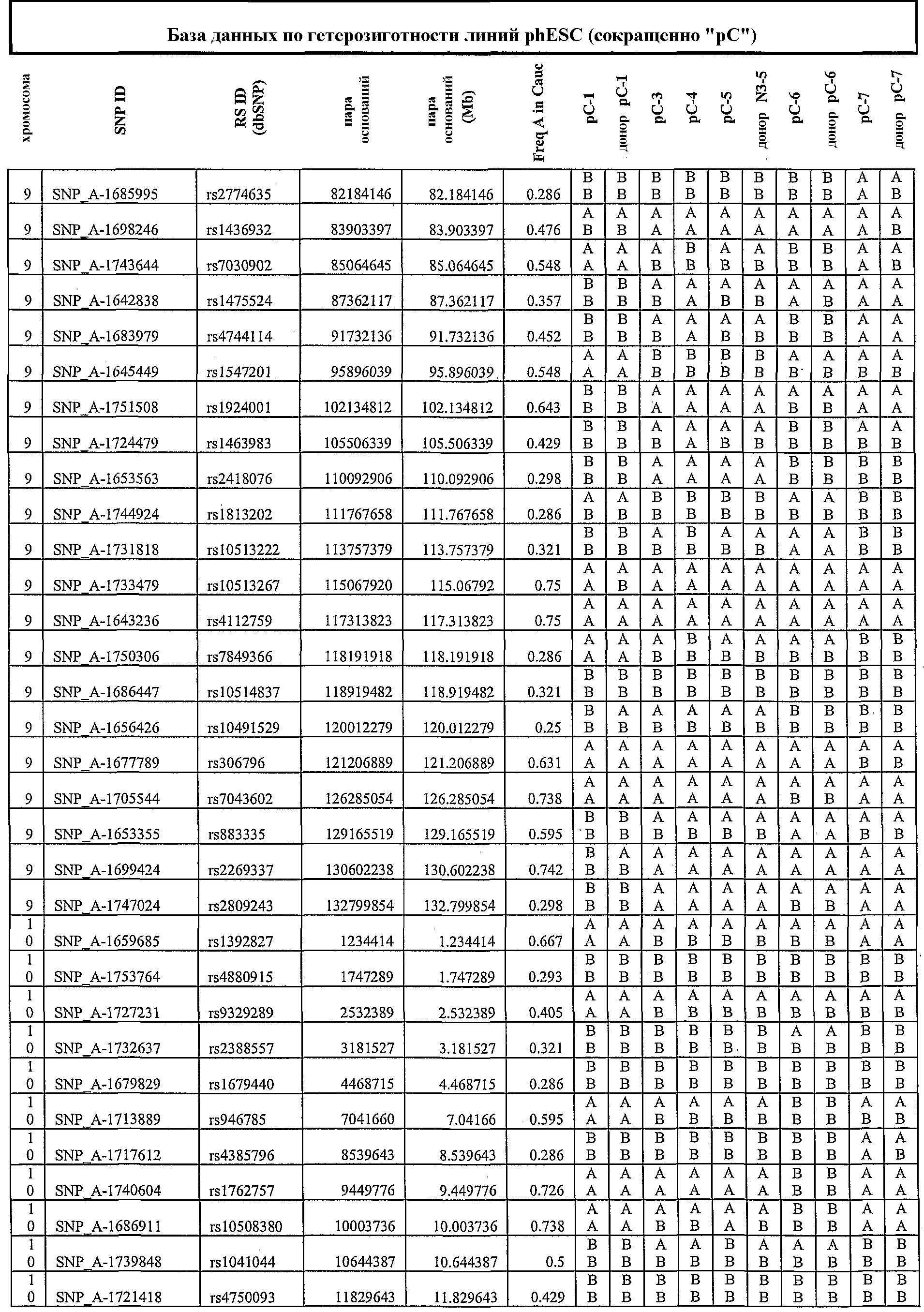
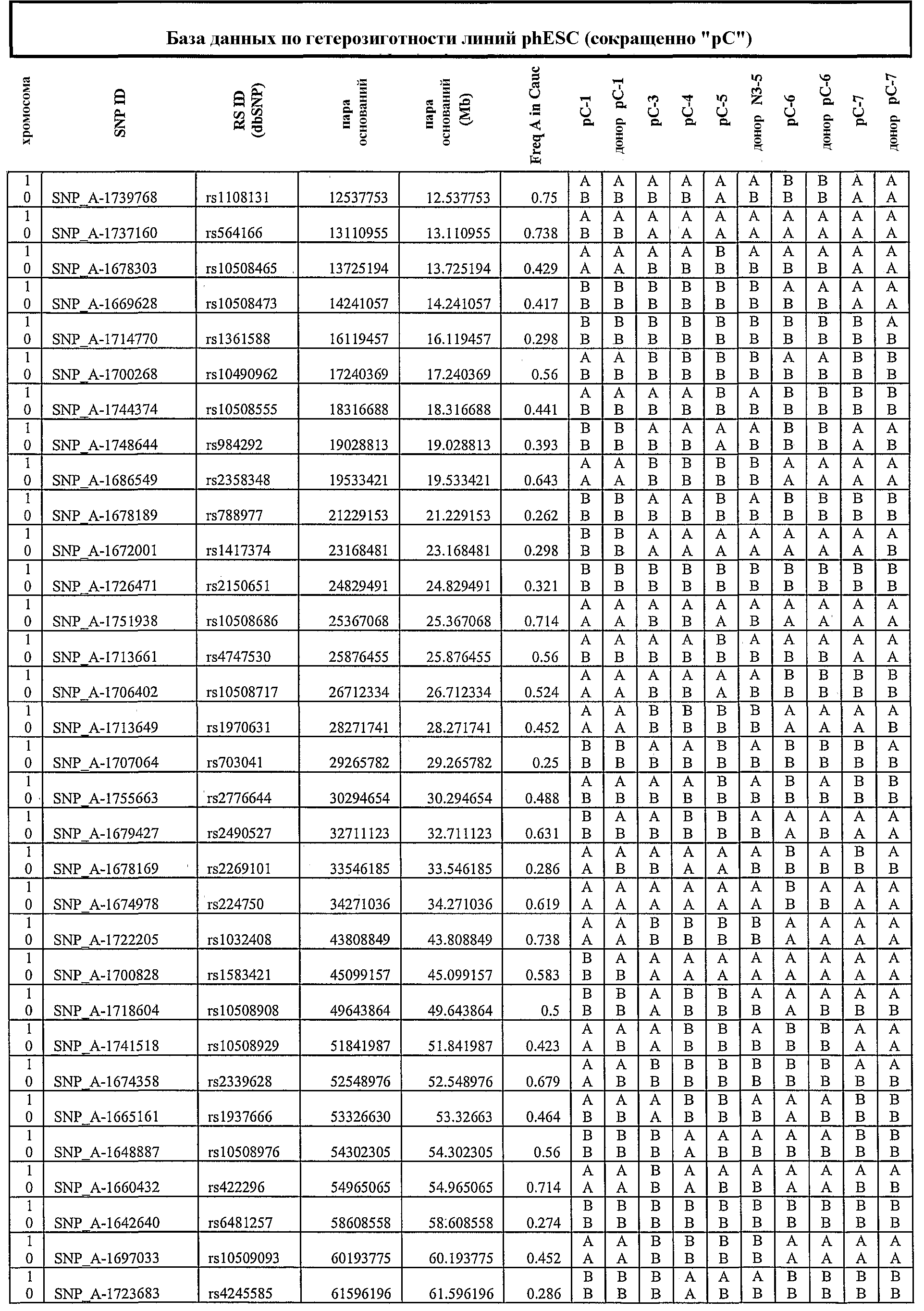

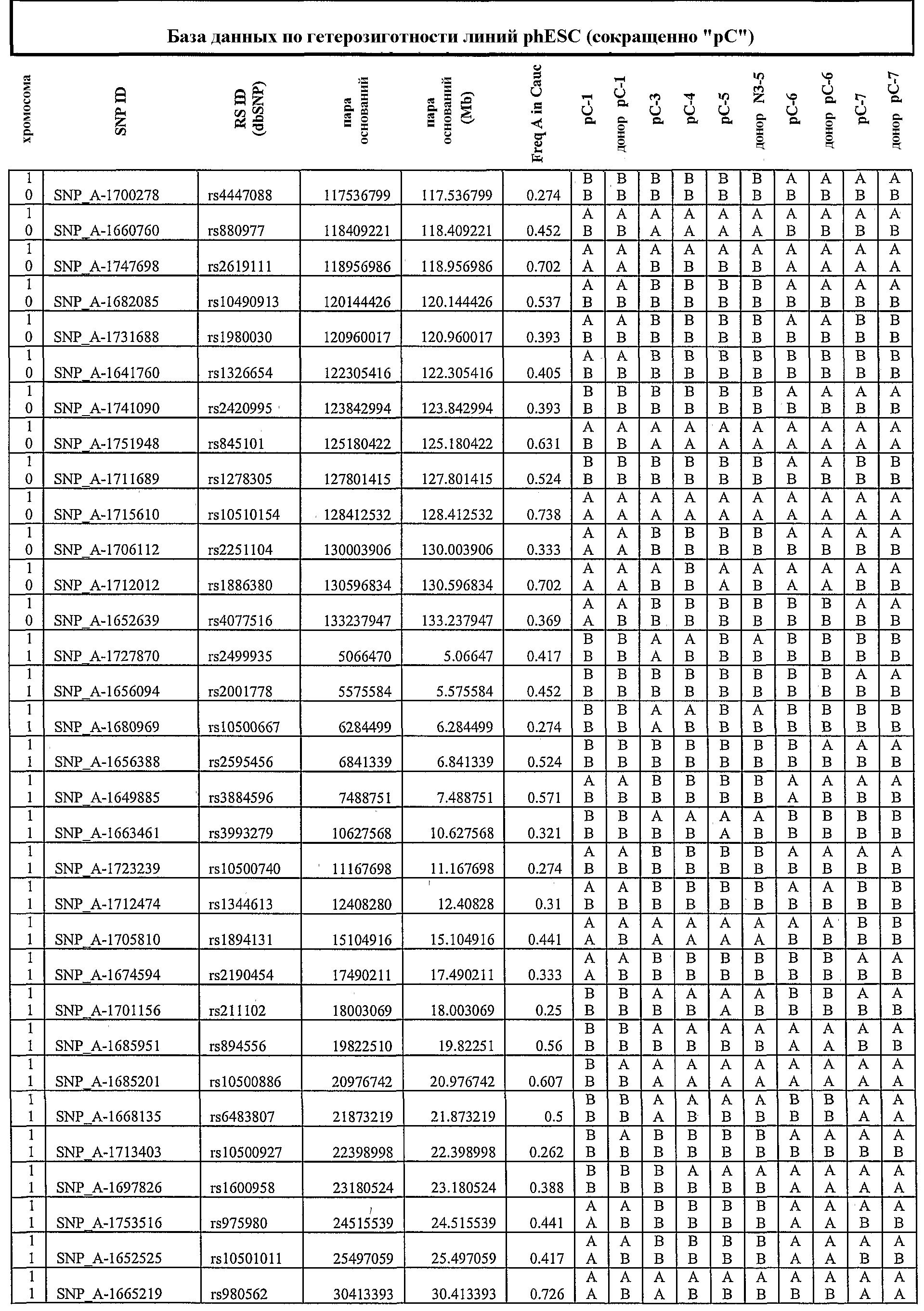
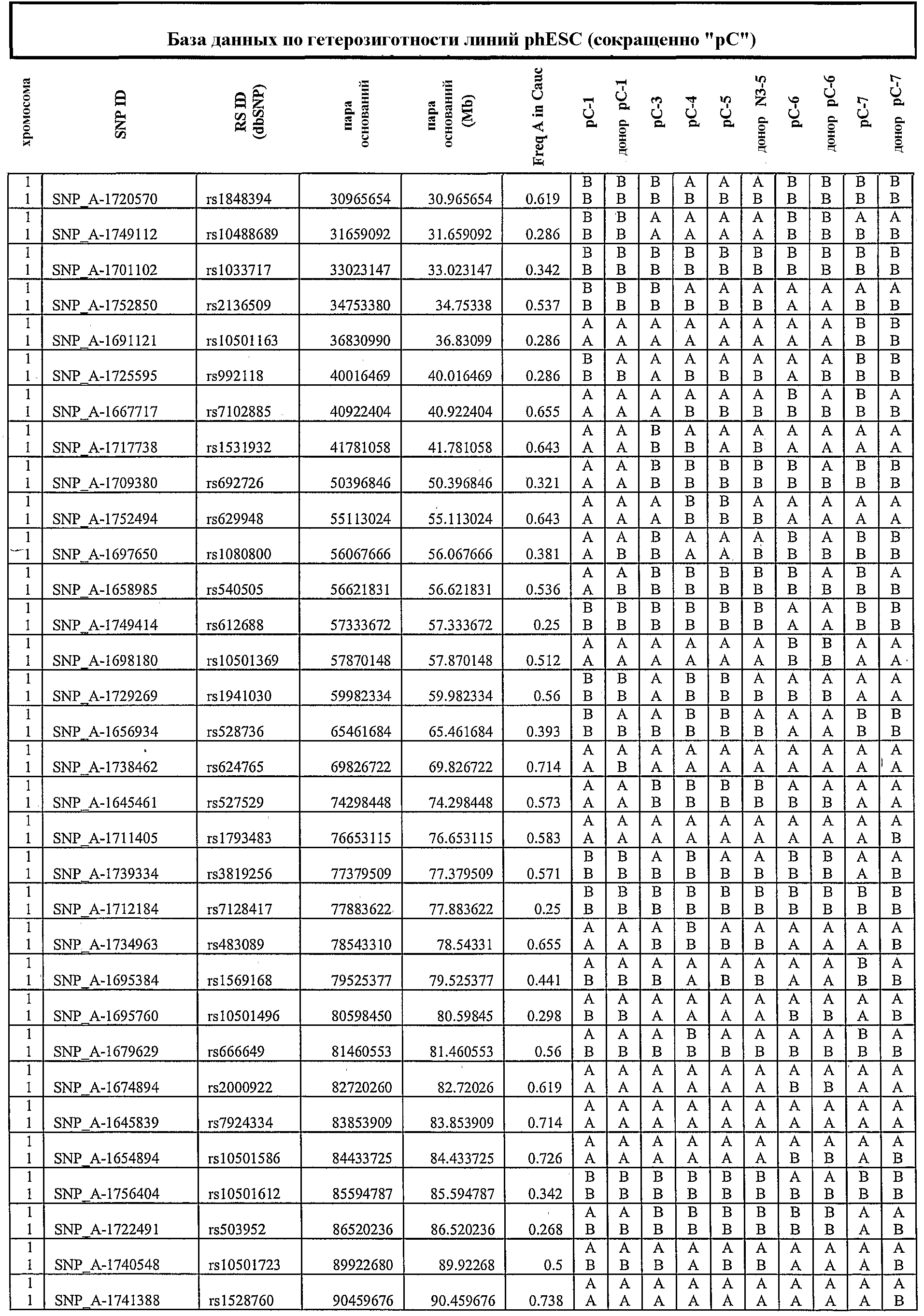
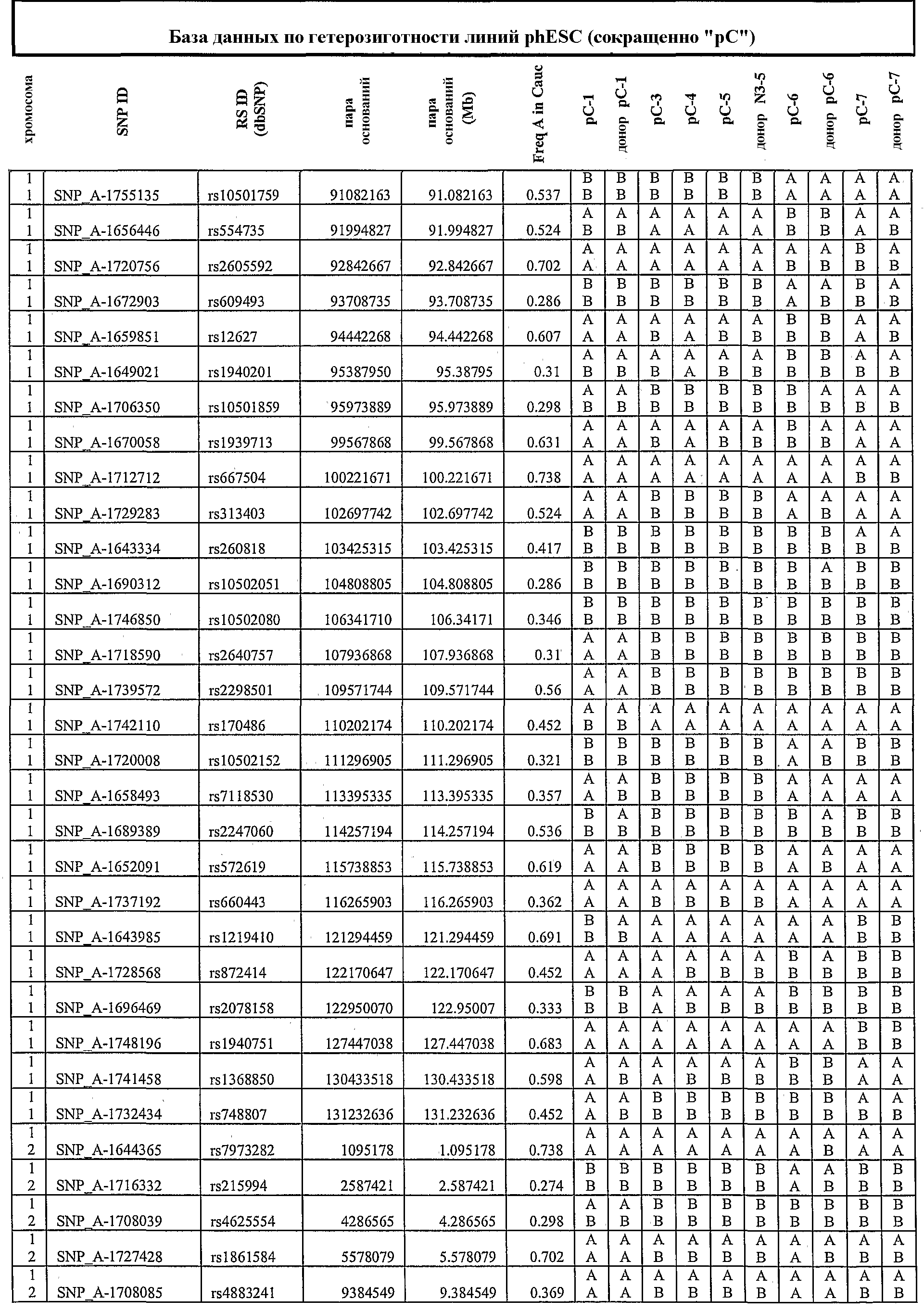
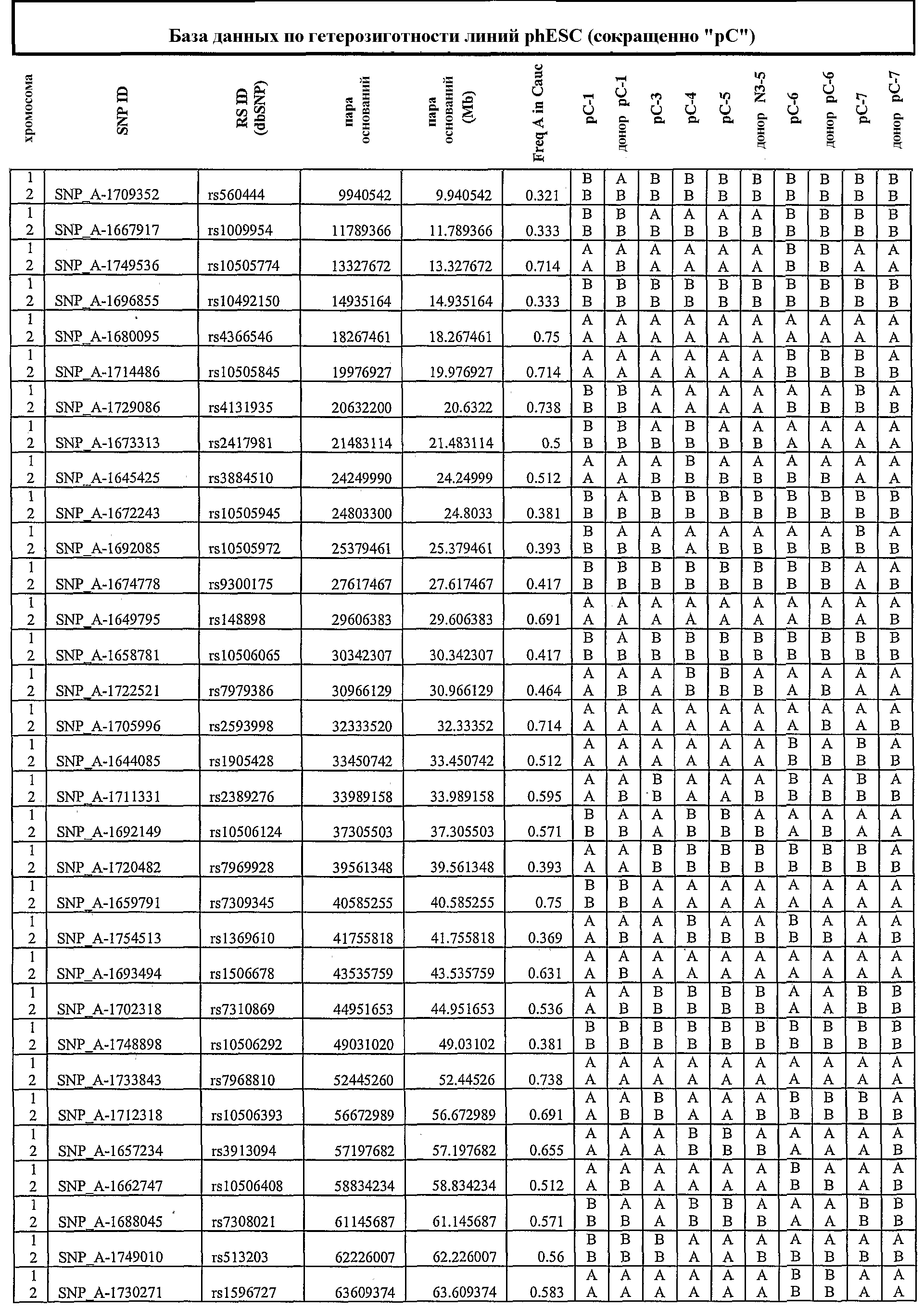

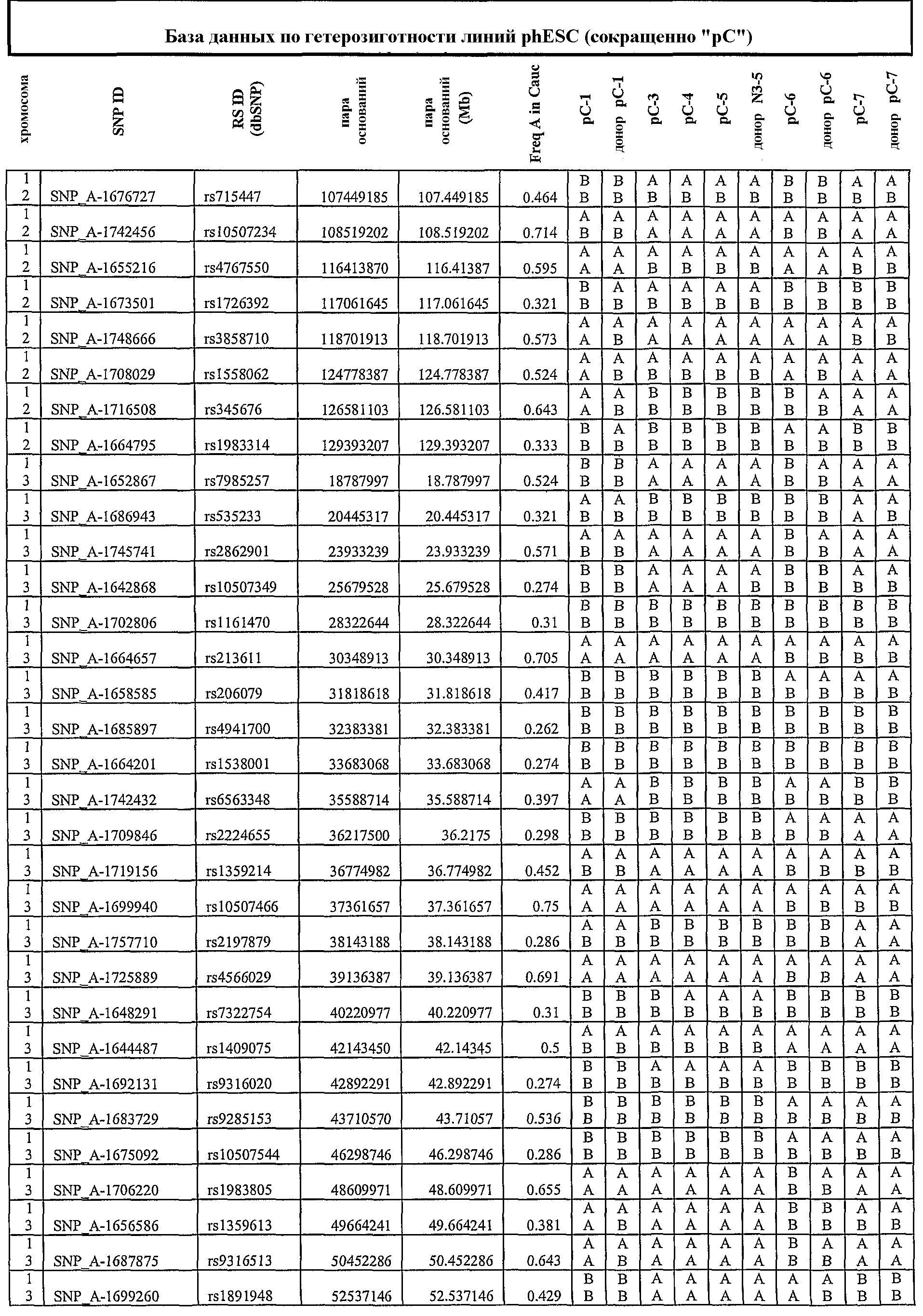
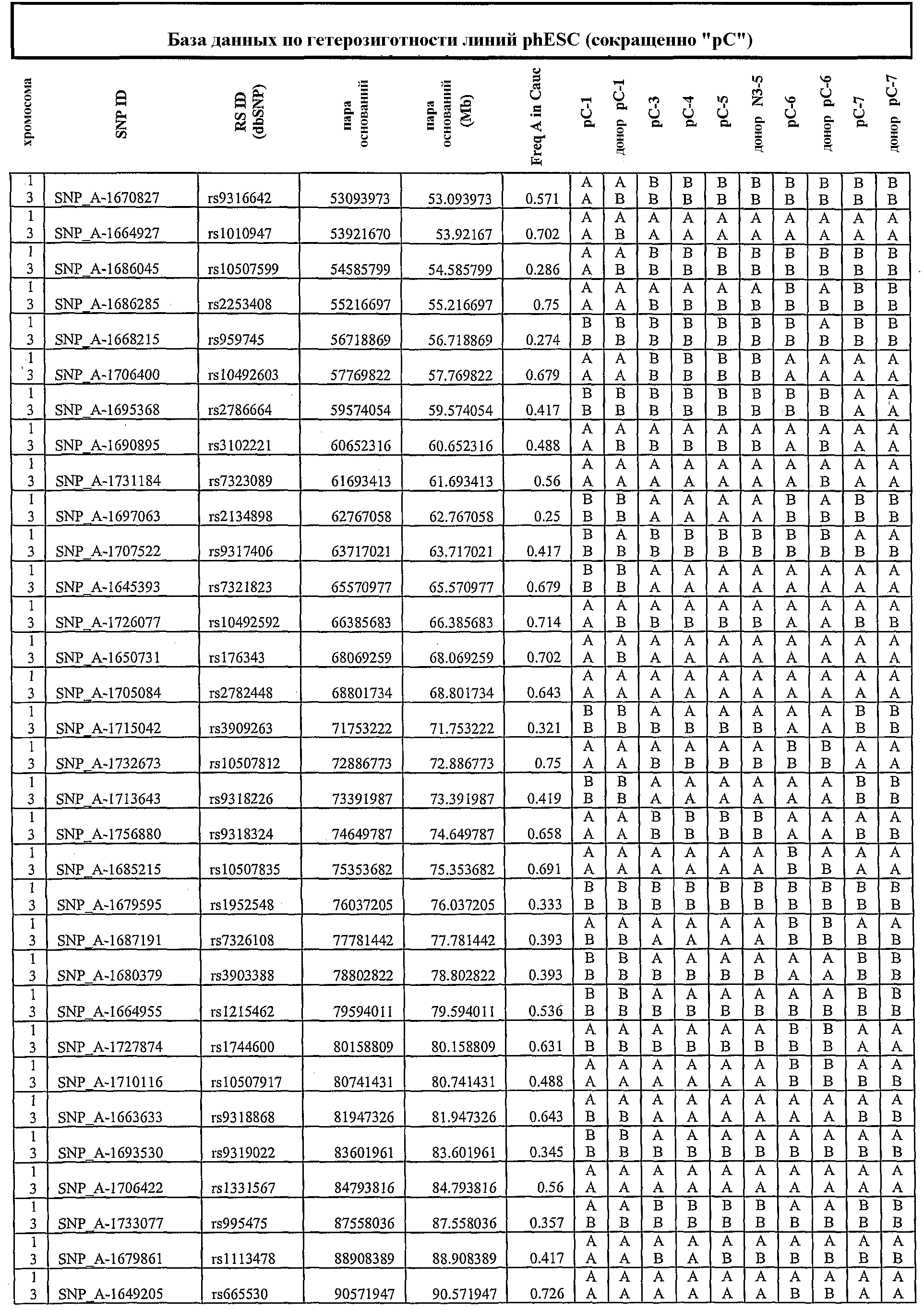

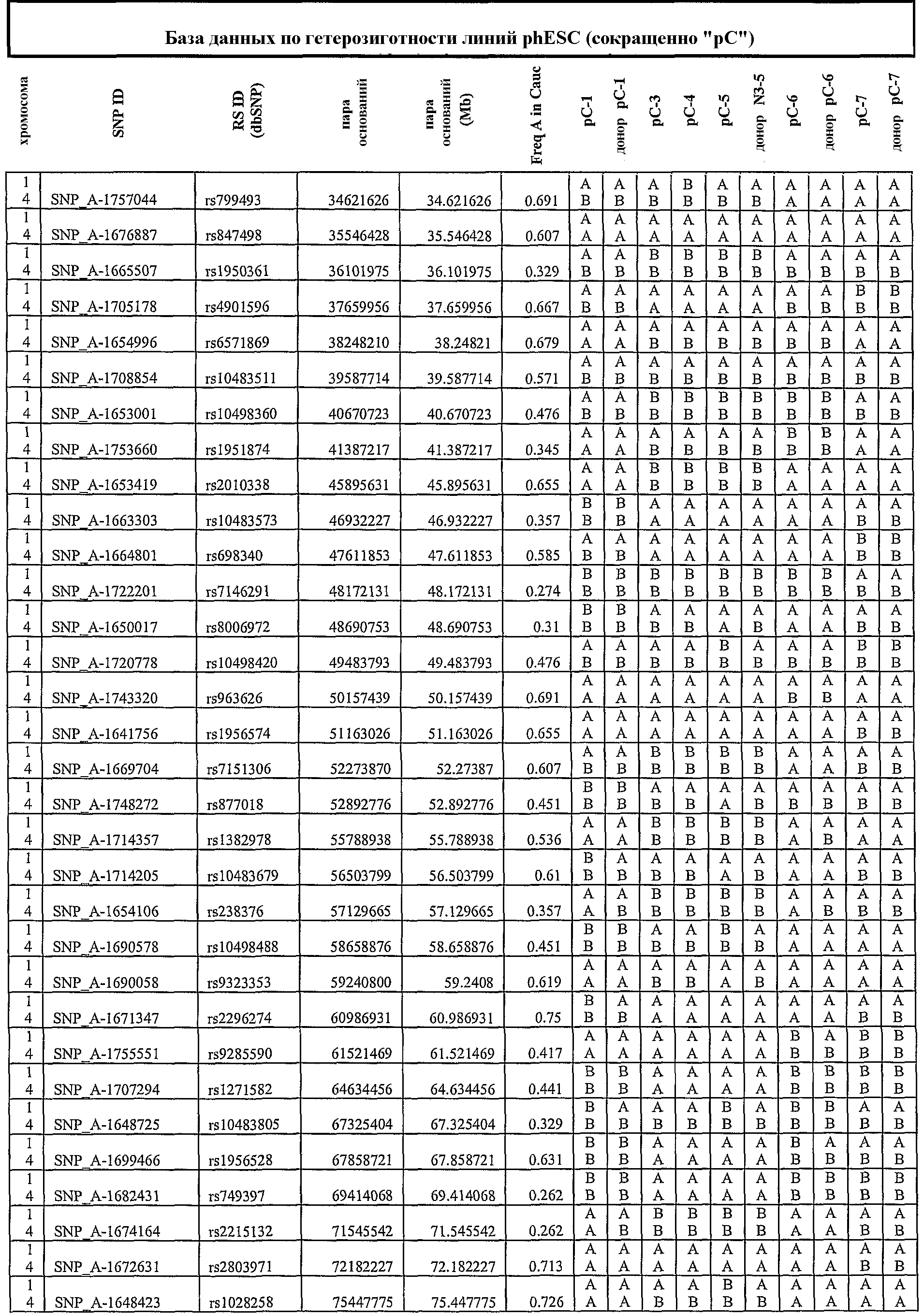


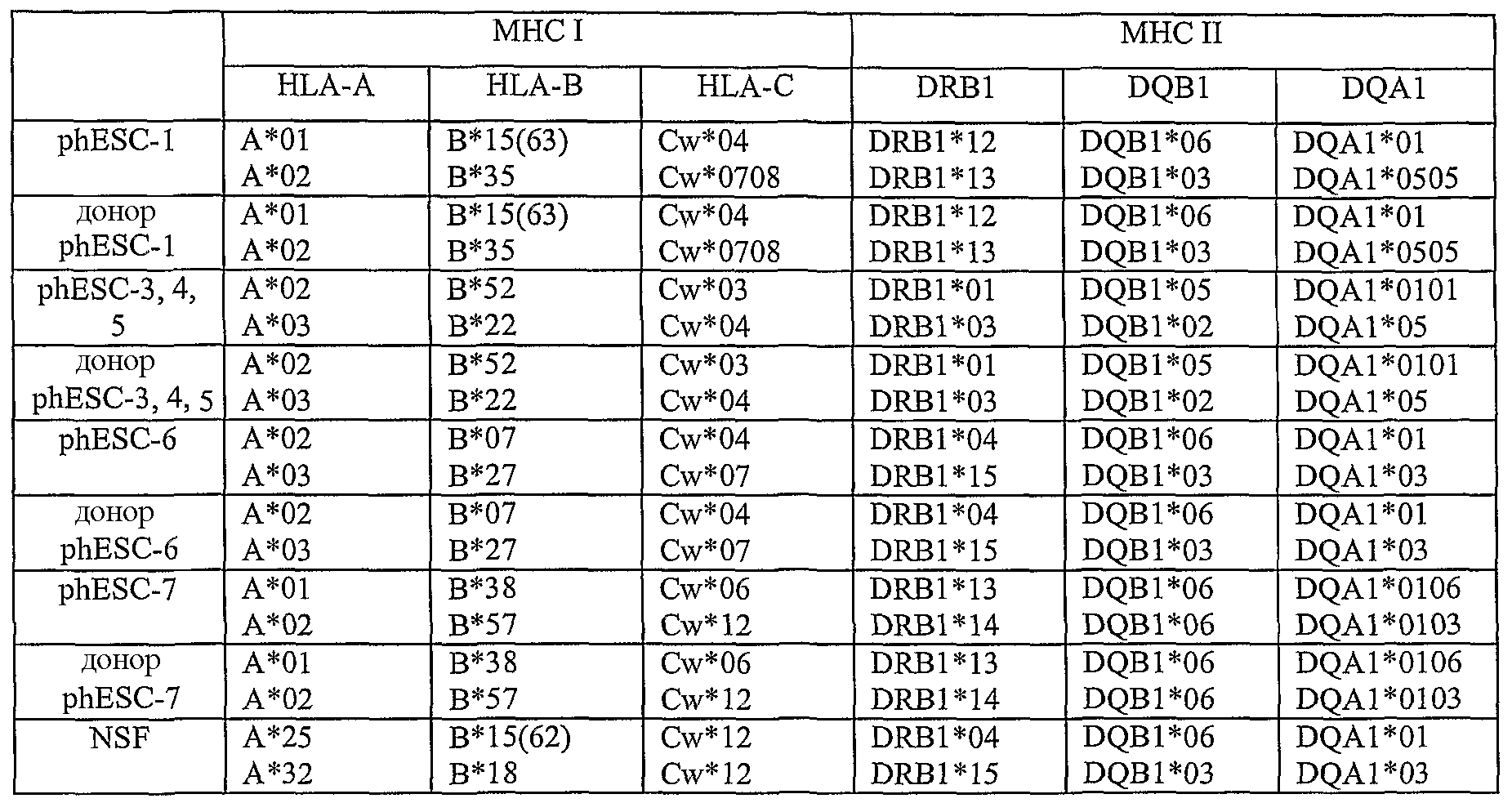

Комментарии