Пептид, полученный из mphosph1, и включающая его вакцина - RU2731099C2
Код документа: RU2731099C2
Чертежи






Описание
[Область техники]
Настоящее изобретение относится к области биологической науки, более конкретно, к области терапии злокачественных опухолей. В частности, настоящее изобретение относится к новым пептидам, которые эффективны в качестве противоопухолевых вакцин, к способам для лечения и/или профилактики опухолей с использованием пептида/пептидов, и фармацевтическим композициям, содержащим пептид(-ы).
[Предшествующий уровень техники]
Известно, что CD8-положительные цитотоксические T-лимфоциты (ЦТЛ) распознают эпитопные пептиды, полученные из опухолеассоциированных антигенов (TAA) и презентированные на молекуле главного комплекса гистосовместимости (MHC) класса I, которая экспрессируется на клеточной поверхности, а затем убивают опухолевые клетки. С момента открытия семейства антигенов меланомы (MAGE) с использованием иммунологических подходов было обнаружено много других TAA (NPL1: Boon T, Int J Cancer 1993, 54(2): 177-80; NPL2: Boon T & van der Bruggen P, J Exp Med 1996, 183(3): 725-9). Некоторые из этих TAA в настоящее время проходят клиническую разработку в качестве мишеней для иммунотерапии.
В некоторых из многочисленных TAA были выявлены эпитопные пептиды, которые могут распознаваться ЦТЛ, и планируется их применение в иммунотерапии для различных типов злокачественных опухолей (NPL3: Harris CC, J Natl Cancer Inst 1996, 88(20): 1442-55; NPL4: Butterfield LH et al., Cancer Res 1999, 59(13): 3134-42; NPL5: Vissers JL et al., Cancer Res 1999, 59(21): 5554-9; NPL6: van der Burg SH et al., J Immunol 1996, 156(9) 3308-14; NPL7: Tanaka F et al., Cancer Res 1997, 57(20): 4465-8; NPL8: Fujie T et al., Int J Cancer 1999, 80(2): 169-72; NPL9: Kikuchi M et al., Int J Cancer 1999, 81(3): 459-66; NPL10: Oiso M et al., Int J Cancer 1999, 81(3): 387-94). До настоящего времени, было зарегистрировано несколько клинических испытаний с использованием этих эпитопных пептидов, полученных из TAA. Однако, к сожалению, многие из этих клинических испытаний показали низкую частоту объективных ответов (NPL11: Belli F et al., J Clin Oncol 2002, 20(20): 4169-80; NPL12: Coulie PG et al., Immunol Rev 2002, 188: 33-42; NPL13: Rosenberg SA et al., Nat Med 2004, 10(9): 909-15). Таким образом, все еще существует потребность в выявлении новых эпитопных пептидов для ЦТЛ, которые можно использовать в иммунотерапии злокачественных опухолей.
MPHOSPH1 (фосфопротеин 1 M-фазы); референсная последовательность: номер доступа GenBank NM_016195 (SEQ ID NO: 185) или NM_001284259 (SEQ ID NO: 187 был идентифицирован как белок, который специфически фосфорилируется в переходной фазе G2/M и который характеризуется как белок-активатор клеточного цикла, родственный кинезину. В частности, MPHOSPH1 был описан как молекулярный мотор с эффектом стимуляции деления, который играет важную роль во время деления цитоплазмы (NPL14: Abaza A et al., J Biol Chem 2003, 278:27844-52). С другой стороны, MPHOSPH1 был идентифицирован с использованием профилей экспрессии генов в полногеномном анализе кДНК, включающем 27648 генов, в качестве новой молекулы, экспрессия которой повышена при раке мочевого пузыря (NPL15: Kanehira M et al., Cancer Res 2007, 67(7):3276-85). В дополнение, в анализе путем нозерн-блоттинга, продукт гена MPHOSPH1 не экспрессировался в важных здоровых органах, за исключением яичка. Дополнительно, снижение экспрессии MPHOSPH1 при помощи миРНК вызвало подавление пролиферации клеток в клеточных линиях рака мочевого пузыря (PTL1: WO2006/085684; PTL2: WO2008/023842).
Недавно были идентифицированы эпитопные пептиды для ЦТЛ, полученные из MPHOSPH1 и рестриктированные по HLA-A02 (PTL3: WO2013/024582; PTL4: WO2008/047473) и HLA-A24 (PTL4: WO2008/047473). Можно ожидать терапевтического эффекта от этих пептидов у пациентов со злокачественными опухолями, имеющих тип HLA-A02 или HLA-A24, но не у других раковых пациентов.
[Список цитирования]
[Патентная литература]
[PTL 1] WO2006/085684
[PTL 2] WO2008/023842
[PTL 3] WO2013/024582
[PTL 4] WO2008/047473
[Непатентная литература]
[NPL 1] Boon T, Int J Cancer 1993, 54(2): 177-80
[NPL 2] Boon T & van der Bruggen P, J Exp Med 1996, 183(3): 725-9
[NPL 3] Harris CC, J Natl Cancer Inst 1996, 88(20): 1442-55
[NPL 4] Butterfield LH et al., Cancer Res 1999, 59(13): 3134-42
[NPL 5] Vissers JL et al., Cancer Res 1999, 59(21): 5554-9
[NPL 6] van der Burg SH et al., J Immunol 1996, 156(9): 3308-14
[NPL 7] Tanaka F et al., Cancer Res 1997, 57(20): 4465-8
[NPL 8] Fujie T et al., Int J Cancer 1999, 80(2): 169-72
[NPL 9] Kikuchi M et al., Int J Cancer 1999, 81(3): 459-66
[NPL 10] Oiso M et al., Int J Cancer 1999, 81(3): 387-94
[NPL 11] Belli F et al., J Clin Oncol 2002, 20(20): 4169-80
[NPL 12] Coulie PG et al., Immunol Rev 2002, 188: 33-42
[NPL 13] Rosenberg SA et al., Nat Med 2004, 10(9): 909-15
[NPL 14] Abaza A et al., J Biol Chem 2003,278:27844-52
[NPL 15] Kanehira M et al., Cancer Res 2007,67(7):3276-85
Сущность изобретения
Настоящее изобретение относится к пептидам, которые могут индуцировать ЦТЛ, которые специфически реагируют на клетки, экспрессирующие MPHOSPH1. Когда эти пептиды образуют комплекс с человеческим лейкоцитарным антигеном (HLA) и презентируются CD8-положительным T-клеткам при помощи антигенпрезентирующих клеток (APC), которые презентируют на своей поверхности этот комплекс, индуцируются ЦТЛ, которые демонстрируют пептид-специфическую цитотоксическую активность. Пептиды, полученные из MPHOSPH1, которые были идентифицированы к настоящему времени, как имеющие способность индуцировать ЦТЛ (индуцибельность ЦТЛ), являются или HLA-A02-рестриктированными или HLA-A24-рестриктированными пептидами, и не могут индуцировать ЦТЛ против клеток, которые не экспрессируют эти HLA. Таким образом, известные пептиды не подходят для проведения иммунотерапии у индивидуумов, у которых нет этих HLA. HLA-A11 и HLA-A33 представляют собой аллели, которые часто встречаются у азиатов (Cao et al., Hum Immunol 2001; 62(9): 1009-30), и желательно вводить HLA-A11-рестриктированные пептиды HLA-A11-положительным индивидуумам, и HLA-A33-рестриктированные пептиды HLA-A33-положительным индивидуумам. Таким образом, настоящее изобретение относится к пептидам, полученным из MPHOSPH1 и способным индуцировать ЦТЛ, и которые являются рестриктированными по HLA-A11 или HLA-A33. На основании результатов, описываемых в настоящем документе, было доказано, что пептиды по настоящему изобретению являются эпитопными пептидами, которые могут индуцировать мощный и специфический иммунный ответ против клеток, экспрессирующих MPHOSPH1 и HLA-A11 или HLA-A33.
Таким образом, одной из задач по настоящему изобретению является создание пептидов, полученных из MPHOSPH1, которые могут индуцировать ЦТЛ ограничительно по HLA-A11 или HLA-A33. Эти пептиды можно использовать для индуцирования ЦТЛ in vitro, ex vivo или in vivo, или можно использовать для введения индивидуумам с целью индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных клеток. Предпочтительными пептидами являются пептиды, содержащие аминокислотную последовательность, выбранную из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170; более предпочтительными пептидами являются нонапептиды или декапептиды; и еще более предпочтительными пептидами являются пептиды, состоящие из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170.
Пептиды по настоящему изобретению включают пептиды, в которых одна, две или более аминокислот замещены, удалены, вставлены и/или добавлены, при условии, что полученные модифицированные пептиды сохраняют способность исходного пептида индуцировать ЦТЛ.
Настоящее изобретение дополнительно относится к изолированным полинуклеотидам, кодирующим любой один из пептидов по настоящему изобретению. Аналогично пептидам по настоящему изобретению, эти полинуклеотиды можно использовать для индуцирования АПК со способностью индуцировать ЦТЛ, и можно вводить индивидуумам для индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных клеток.
Настоящее изобретение также относится к композициям, содержащим один или несколько типов пептидов по настоящему изобретению, один или несколько типов полинуклеотидов, кодирующих один или несколько типов пептидов по настоящему изобретению, АПК по настоящему изобретению, экзосомы, презентирующие пептиды по настоящему изобретению, и/или ЦТЛ по настоящему изобретению. Композиции по настоящему изобретению предпочтительно являются фармацевтическими композициями. Фармацевтические композиции по настоящему изобретению можно использовать для лечения и/или профилактики злокачественной опухоли, а также для профилактики послеоперационных рецидивов злокачественной опухоли. Их также можно использовать для индуцирования иммунного ответа против злокачественной опухоли. При введении индивидууму, пептид по настоящему изобретению презентируется на поверхности АПК, и в результате индуцируются ЦТЛ, нацеленные на пептид. Таким образом, другой задачей по настоящему изобретению является создание композиций для индуцирования ЦТЛ, где композиции содержат один или несколько типов пептидов по настоящему изобретению, один или несколько типов полинуклеотидов, кодирующих один или несколько типов пептидов по настоящему изобретению, АПК по настоящему изобретению и/или экзосомы, презентирующие пептиды по настоящему изобретению.
Следующей задачей по настоящему изобретению является создание способов индуцирования АПК, имеющих способность индуцировать ЦТЛ, где способы включают этап контакта одного или нескольких типов пептидов по настоящему изобретению с АПК, или этап введения полинуклеотида, кодирующего любой один пептид по настоящему изобретению, в АПК.
Настоящее изобретение дополнительно относится к способу индуцирования ЦТЛ, включающему этап совместного культивирования CD8-положительной T-клетки с АПК, которая презентирует на поверхности комплекс антигена HLA и пептида по настоящему изобретению, этап совместного культивирования CD8-положительной T-клетки с экзосомой, которая презентирует на поверхности комплекс антигена HLA и пептида по настоящему изобретению, или этап введения в CD8-положительную T-клетку вектора, содержащего полинуклеотид, кодирующий каждую субъединицу T-клеточного рецептора (TCR), способного связываться с пептидом по настоящему изобретению, который презентируется посредством антигена HLA на клеточной поверхности. Предпочтительным антигеном HLA в настоящем изобретении является HLA-A11 или HLA-A33.
Следующей задачей по настоящему изобретению является получение изолированных АПК, которые презентируют на поверхности комплекс антигена HLA и пептида по настоящему изобретению. Настоящее изобретение дополнительно относится к изолированным ЦТЛ, нацеленным на пептид по настоящему изобретению. Эти АПК и ЦТЛ можно использовать в иммунотерапии для MPHOSPH1-экспрессирующих злокачественных опухолей. В настоящем изобретении, злокачественная опухоль, которую лечат иммунотерапией, является, например, злокачественной опухолью у пациентом, гомозиготных или гетерозиготных по HLA-A11 или HLA-A33. Следовательно, АПК или ЦТЛ также представляют собой клетки с гетерозиготой или гомозиготой по HLA-A11 или HLA-A33. Таким образом, настоящее изобретение относится к иммунотерапии для злокачественных опухолей, экспрессирующих MPHOSPH1 и, по меньшей мере, один антиген HLA, выбранный из HLA-A11 и HLA-A33.
Другой задачей по настоящему изобретению является создание способов индуцирования иммунного ответа против злокачественной опухоли у индивидуума, где способы включают этап введения индивидууму композиции, содержащей пептид (-ы) по настоящему изобретению или полинуклеотид (-ы), кодирующие пептид(-ы), АПК по настоящему изобретению, экзосомы/экзосом, презентирующих пептид(-ы) по настоящему изобретению, и/или ЦТЛ по настоящему изобретению. Другой задачей по настоящему изобретению является создание способов для лечения и/или профилактики злокачественной опухоли, а также для профилактики послеоперационных рецидивов злокачественной опухоли у индивидуума, где способы включают этап введения индивидууму пептида/пептидов по настоящему изобретению, полинуклеотида/полинуклеотидов, кодирующих пептид(-ы), АПК по настоящему изобретению, экзосомы/экзосом, презентирующих пептид(-ы) по настоящему изобретению, и/или ЦТЛ по настоящему изобретению.
В дополнение к вышеизложенному, другие задачи и признаки настоящего изобретения станут более очевидными после прочтения последующего подробного описания в сочетании с сопутствующими фигурами и примерами. Однако следует понимать, что как указанная выше сущность по настоящему изобретению, так и последующее подробное описание являются примерами вариантов осуществления, и не ограничивают настоящее изобретение или другие альтернативные варианты осуществления настоящего изобретения. В частности, хотя настоящее изобретение описано в настоящем документе со ссылкой на ряд конкретных вариантов осуществления, следует понимать, что описание является иллюстративным по отношению к настоящему изобретению и не ограничивает настоящее изобретение. Специалисту в данной области могут прийти на ум различные модификации и применения, в пределах сущности и объема по настоящему изобретению, описанных в прилагаемой формуле изобретения. Кроме того, другие цели, особенности, выгоды и преимущества настоящего изобретения будут очевидны из сущности и определенных вариантов осуществления, описанных ниже, и будут легко понятны специалистам в данной области. Такие цели, особенности, выгоды и преимущества будут понятны из вышеизложенного в сочетании с сопутствующими примерами, данными, фигурами и всеми разумными выводами, вытекающими из них, по отдельности или с учетом ссылок, включенных в настоящий документ.
Краткое описание чертежей
Фиг. 1 состоит из фотографий от (a) до (f), показывающих результаты анализа способом иммуноферментных пятен (ELISPOT) с интерфероном (IFN)-гамма, который проводили с использованием клеток, индуцированных при помощи пептидов, полученных из MPHOSPH1. На фигуре, «+» показывает выработку IFN-гамма против клеток-мишеней, активированных интересующим пептидом; и «-» показывает выработку IFN-гамма против клеток-мишеней, которые не были активированы ни одним из пептидов (отрицательные контроли). При сравнении с отрицательными контролями можно видеть, что пептид-специфическую выработку IFN-гамма наблюдали в
Лунке #3 с MPHOSPH1-A11-9-762 (SEQ ID NO: 5) (a),
Лунке #2 с MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (b),
Лунке #5 с MPHOSPH1-A11-9-96 (SEQ ID NO: 27) (c),
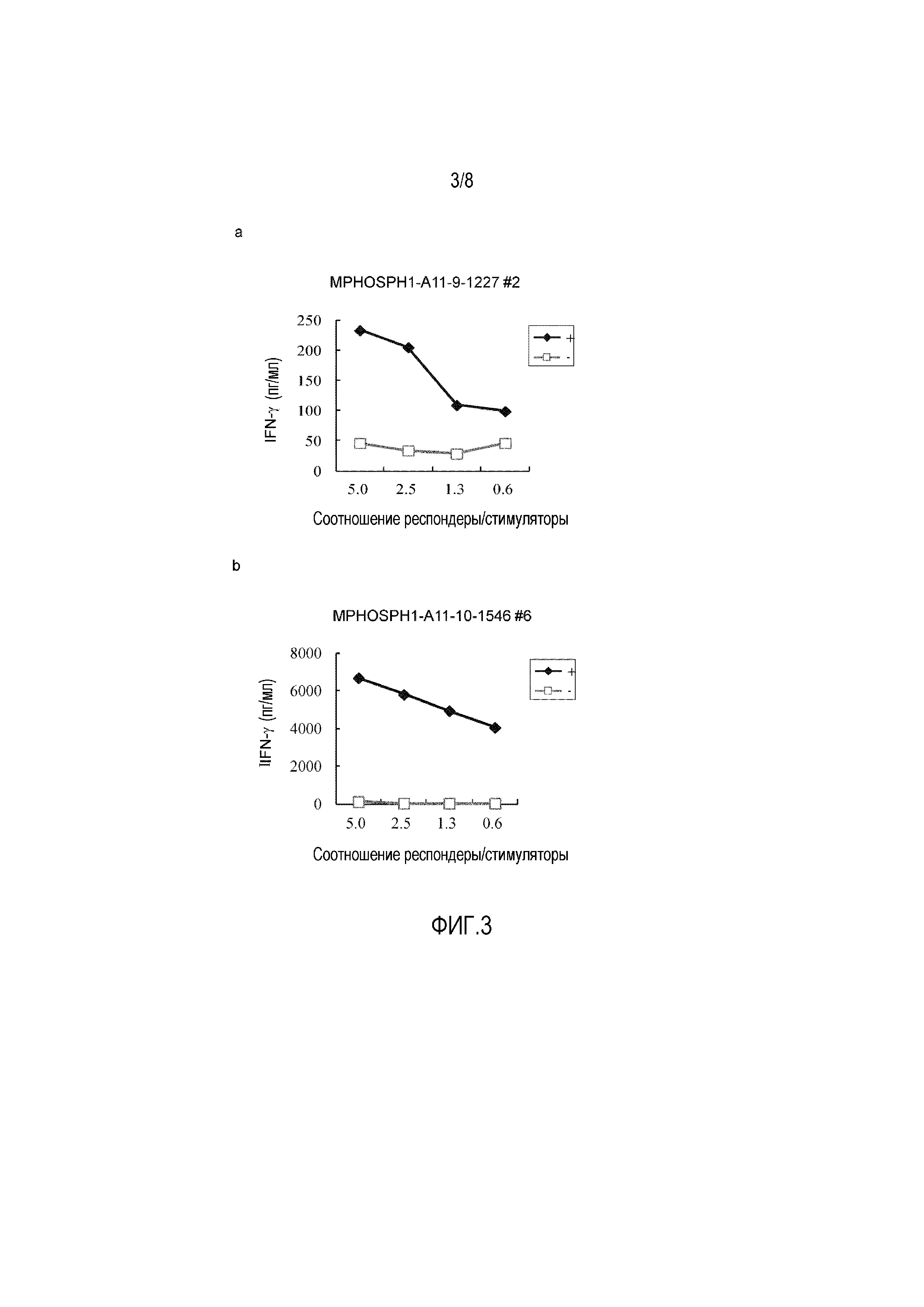
Лунке #6 с MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (d), и
Лунке #5 с MPHOSPH1-A11-10-1675 (SEQ ID NO: 53) (e). Клетки, которые продемонстрировали реакцию и выделены квадратом на фотографиях, размножали для получения линии ЦТЛ. При этом, MPHOSPH1-A11-9-739 (SEQ ID NO: 4) (f) показан как пример типичных отрицательных данных, при котором не наблюдали пептид-специфической выработки IFN-гамма.
Фиг. 2 состоит из линейных графиков от (a) до (b), показывающих результаты измерений твердофазного иммуноферментного анализа (ELISA) для IFN-гамма, произведенного линией ЦТЛ, которая была стимулирована MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (a) или MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (b). Эти результаты показывают, что линии ЦТЛ, которые вырабатывают IFN-гамма пептид-специфическим образом, были получены после индуцирования каждым из пептидов. На фигуре, «+» показывает выработку IFN-гамма линией ЦТЛ против клеток-мишеней, активированных интересующим пептидом; и «-» показывает выработку IFN-гамма линией ЦТЛ против клеток-мишеней, которые не были активированы ни одним из пептидов. Соотношение R/S указывает на соотношение числа клеток линии ЦТЛ (клетки-респондеры) и числа клеток-мишеней, которые их стимулируют (клетки-стимуляторы).
Фиг. 3 состоит из линейных графиков от (a) до (b), показывающих выработку IFN-гамма в клоне ЦТЛ, полученном способом серийных разведений после MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (a) или MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (b). Эти результаты показывают пептид-специфическую выработку IFN-гамма клонами ЦТЛ. На фигуре, «+» показывает выработку IFN-гамма клонами ЦТЛ против клеток-мишеней, активированных интересующим пептидом; и «-» показывает выработку IFN-гамма клонами ЦТЛ против клеток-мишеней, которые не были активированы ни одним из пептидов. Соотношение R/S указывает на соотношение числа клеток клона ЦТЛ (клетки-респондеры) и числа клеток-мишеней, которые их стимулируют (клетки-стимуляторы).
Фиг. 4 представляет собой линейный график, показывающий выработку IFN-гамма клонами ЦТЛ против клеток-мишеней, экспрессирующих и MPHOSPH1, и HLA-A*11:01. Клетки-мишени, в которые был вставлен или HLA-A*11:01, или полноразмерный ген MPHOSPH1, использовали в качестве отрицательного контроля. Клон CTL, полученный при индуцировании с использованием MPHOSPH1-A11-10-1546 (SEQ ID NO: 52), показал выработку IFN-гамма против клеток COS7, в которые были вставлены гены и MPHOSPH1, и HLA-A*11:01 (черный ромб). С другой стороны, не было выявлено значительной выработки IFN-гамма против клеток COS7, в которые был вставлен один из HLA-A*11:01 (треугольник) и MPHOSPH1 (белый круг).
Фиг. 5 состоит из фотографий от (a) до (d), показывающих результаты анализа ELISPOT с IFN-гамма, который проводили с использованием клеток, индуцированных пептидами, полученными из MPHOSPH1. На фигуре, «+» показывает выработку IFN-гамма против клеток-мишеней, активированных интересующим пептидом; и «-» показывает выработку IFN-гамма против клеток-мишеней, которые не были активированы ни одним из пептидов (негативные контроли).
При сравнении с негативными контролями можно видеть, что пептид-специфическую выработку IFN-гамма наблюдали в
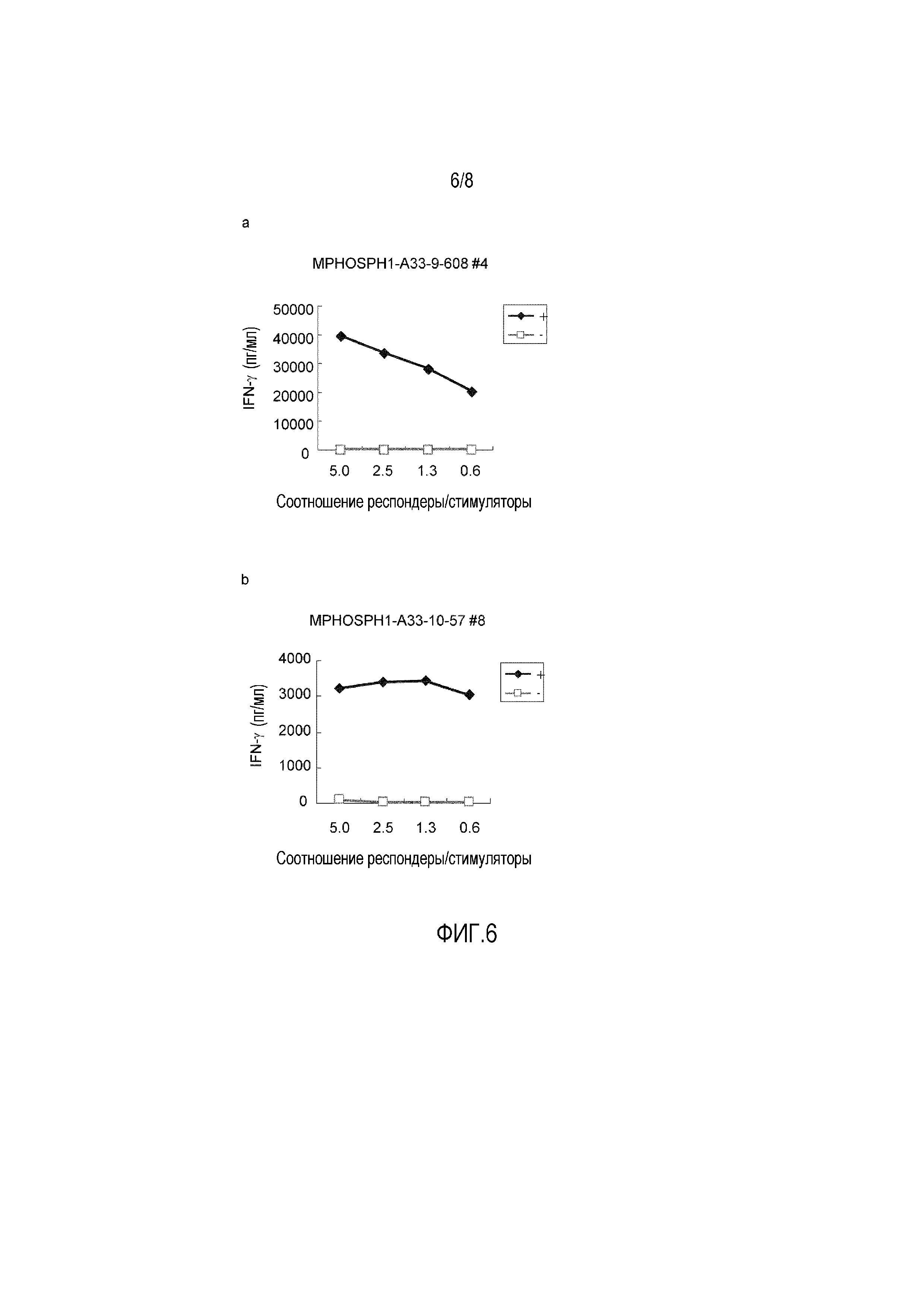
Лунке #4 с MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a),
Лунке #6 с MPHOSPH1-A33-9-1474 (SEQ ID NO: 119) (b), и
Лунке #8 с MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (c).
Клетки, которые продемонстрировали реакцию и выделены квадратом на фотографиях, размножали для получения линии ЦТЛ. При этом, MPHOSPH1-A33-9-1663 (SEQ ID NO: 48) (d) показан как пример типичных отрицательных данных, при котором не наблюдали пептид-специфической выработки IFN-гамма.
Фиг. 6 состоит из линейных графиков от (a) до (b), показывающих результаты измерения путем ELISA IFN-гамма, выработанного линией ЦТЛ, которая была стимулирована MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a) или MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (b). Эти результаты показывают, что линии ЦТЛ, которые вырабатывают IFN-гамма пептид-специфическим образом, были получены после индуцирования каждым из пептидов. На фигуре, «+» показывает выработку IFN-гамма линией ЦТЛ против клеток-мишеней, активированных интересующим пептидом; и «-» показывает выработку IFN-гамма линией ЦТЛ против клеток-мишеней, которые не были активированы ни одним из пептидов. Соотношение R/S указывает на соотношение числа клеток линии ЦТЛ (клетки-респондеры) и числа клеток-мишеней, которые их стимулируют (клетки-стимуляторы).
Фиг. 7 состоит из серий линейных графиков от (a) до (b) показывающих выработку IFN-гамма в клоне ЦТЛ, полученном способом серийных разведений после индуцирования MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a) или MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (b). Эти результаты показывают пептид-специфическую выработку IFN-гамма клонами ЦТЛ. На фигуре, «+» показывает выработку IFN-гамма клонами ЦТЛ против клеток-мишеней, активированных интересующим пептидом; и «-» показывает выработку IFN-гамма клонами ЦТЛ против клеток-мишеней, которые не были активированы ни одним из пептидов. Соотношение R/S указывает на соотношение числа клеток клона ЦТЛ (клетки-респондеры) и числа клеток-мишеней, которые их стимулируют (клетки-стимуляторы).
Фиг. 8 представляет собой линейный график, показывающий выработку IFN-гамма клонами ЦТЛ против клеток-мишеней, экспрессирующих и MPHOSPH1, и HLA-A*33:03. Клетки-мишени, в которые был вставлен или HLA-A*33:03, или полноразмерный ген MPHOSPH1, использовали в качестве отрицательного контроля. Клон CTL, полученный при индуцировании с использованием MPHOSPH1-A33-9-608 (SEQ ID NO: 118), показал выработку IFN-гамма против клеток COS7, в которые были вставлены гены и MPHOSPH1, и HLA HLA-A*33:03 (черный ромб). С другой стороны, не было выявлено значительной выработки IFN-гамма против клеток COS7, в которые был вставлен один из HLA-A*33:03 (треугольник) и MPHOSPH1 (белый круг).
[Способ осуществления изобретения]
Описание вариантов осуществления
Хотя в практическом осуществлении или тестировании вариантов осуществления настоящего изобретения можно использовать любые способы и материалы, аналогичные или эквивалентные тем, что описаны в настоящем документе, предпочтительные способы, устройства и материалы описаны в настоящем документе. Однако перед тем как будут описаны материалы и способы по настоящему изобретению, следует понимать, что настоящее изобретение не ограничено конкретными размерами, формами, измерениями, материалами, способами, протоколами, и т.д., описываемыми в настоящем документе, поскольку они могут варьировать в соответствии с рутинной экспериментальной деятельностью и оптимизацией. Также следует понимать, что терминология, применяемая в описании, предназначена только для описания конкретных версий или вариантов осуществления, и не предназначена для ограничения объема по настоящему изобретению, который ограничен только прилагаемой формулой изобретения.
I. Определения
Определители единственного числа, используемые в настоящем документе, означают «по меньшей мере, один», если конкретно не указано иное.
Термины «изолированный» и «очищенный», применяемые по отношению к веществу (например, пептиду, антителу, полинуклеотиду или т.п.), указывают на то, что вещество по существу не содержит, по меньшей мере, ни одно вещество, которое также может входить в натуральный источник. Таким образом, изолированный или очищенный пептид относится к пептиду, который по существу не содержит другой клеточный материал, например, углевод, липид и другие загрязняющие белки из источника клеток или ткани, из которого получают пептид. Если пептид синтезируют химическим путем, изолированный или очищенный пептид относится к пептиду, который по существу не содержит вещество-предшественник или другое химическое вещество. Фраза «по существу не содержит клеточный материал» включает получение пептида, при котором пептид отделяют от клеточных компонентов из клеток, из которых пептид выделен или где он был рекомбинантно произведен. Таким образом, пептид, который по существу не содержит клеточный материал, включает пептидные препараты, которые содержат менее чем приблизительно 30%, 20%, 10%, или 5%, 3%, 2% или 1% (на основании сухой массы) других клеточных материалов.
Если пептид производят рекомбинантным способом, изолированный или очищенный пептид, который по существу не содержит среду для культивирования, и пептид, который по существу не содержит среду для культивирования, включает пептидные препараты, которые содержат среду для культивирования, менее чем приблизительно 20%, 10% или 5%, 3%, 2% или 1% (на основании сухой массы) от объема пептидного препарата.
Альтернативно, если пептид синтезируют химическим путем, изолированный или очищенный пептид по существу не содержит вещество-предшественник или другое химическое вещество, и пептид, который по существу не содержит вещество-предшественник или другое химическое вещество, включает пептидные препараты, которые содержат вещество-предшественник или другие химические вещества, менее чем приблизительно 30%, 20%, 10%, 5%, 3%, 2% или 1% (на основании сухой массы) от объема пептидного препарата. То, что конкретный пептидный препарат является изолированным или очищенным можно подтверждать, например, при появлении одиночной полосы при электрофорезе с додецилсульфатом натрия (SDS) в полиакриламидном геле и окраске Кумасси бриллиантовым голубым или на подобном геле. В предпочтительном варианте осуществления пептиды и полинуклеотиды по настоящему изобретению являются изолированными или очищенными.
Термины «полипептид», «пептид» и «белок» в настоящем документе используются взаимозаменяемо, и относятся к полимерам из аминокислотных остатков. Эти термины также применяют к неприродным аминокислотным полимерам, содержащим один или несколько неприродных аминокислотных остатков, в дополнение к природным аминокислотным полимерам. Неприродные аминокислоты включают аналоги аминокислот, миметики аминокислот, и т.п.
Термин «аминокислота», применяемый в настоящем документе, относится к природным аминокислотам, а также аналогам аминокислот и миметикам аминокислот, которые функционируют аналогично природным аминокислотам. Природными аминокислотами являются аминокислоты, которые кодируются генетическим кодом, а также аминокислоты, модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутаминат, и O-фосфосерин, и т.д.). Фраза «аналог аминокислоты» относится к соединениям, которые имеют такую же основную химическую структуру (альфа углерод, связанный с водородом, карбоксигруппу, аминогруппу, и группу R), как и природная аминокислота, но имеют модифицированную R-группу или модифицированные остовы (например, гомосерин, норлейцин, метионин сульфоксид, метионин метил сульфоний, и т.п.). Фраза «миметик аминокислоты» относится к соединениям, которые имеют различные структуры с основными аминокислотами, но аналогичные функции с аминокислотами. Аминокислоты могут быть или L-аминокислотами или D-аминокислотами, и пептиды по настоящему изобретению предпочтительно являются L-аминокислотными полимерами.
Термины «полинуклеотид», «олигонуклеотид» и «нуклеиновая кислота» используются взаимозаменяемо в настоящем документе, и относятся к полимеру из нуклеотидов.
Термин «композиция», применяемый в настоящем описании, предназначен для включения продуктов, которые содержат конкретно оговоренные ингредиенты в конкретно оговоренных количествах, и любых продуктов, полученных прямо или косвенно из комбинации конкретно оговоренных ингредиентов в конкретно оговоренных количествах. Если композиция представляет собой фармацевтическую композицию, термин «композиция» предназначен для включения продуктов, содержащих активный ингредиент/ингредиенты и инертный ингредиент/ингредиенты, а также любых продуктов, полученных прямо или косвенно из комбинации, комплексообразования или агрегации любых двух или более ингредиентов, из диссоциации одного или нескольких ингредиентов, или из реакций другого типа или взаимодействий одного или нескольких ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению включают в себя любые композиции, полученные путем смешивания соединений или клеток по настоящему изобретению с фармацевтически или физиологически приемлемым носителем. Не являясь ограничивающими, термины «фармацевтически приемлемый носитель» или «физиологически приемлемый носитель», применяемые в настоящем описании, включают жидкие или твердые наполнители, разбавители, эксципиенты, растворители, и инкапсулирующие материалы; и означают фармацевтически или физиологически приемлемые материалы, композиции, вещества или среды.
Если не указано иначе, термин «злокачественная опухоль» относится к злокачественной опухоли, которая гиперэкспрессирует ген MPHOSPH1; и примеры таких опухолей представляют собой рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, хронический миелолейкоз (ХМЛ), рак толстого кишечника, рак желудка, рак легких, лимфому, остеосаркому, рак предстательной железы, рак почки, опухоль мягких тканей и т.п., но не ограничиваются вышеуказанными. В иллюстративном варианте осуществления «злокачественная опухоль» представляет собой злокачественную опухоль, которая экспрессирует MPHOSPH1 и HLA-A11 и/или HLA-A33.
Если не указано иначе, термины «цитотоксический T-лимфоцит» и «цитотоксическая T-клетка» и «ЦТЛ» используют взаимозаменяемо в настоящем документе. Если конкретно не указано иное, они относятся к подгруппе T-лимфоцитов, которая может распознавать «чужие» клетки (например, опухолевые/злокачественные клетки, вирус-инфицированные клетки) и индуцировать гибель таких клеток.
Если не указано иначе, термин «HLA-A11» относится к типу HLA-A11, который включает подтипы, такие как HLA-A*11:01, HLA-A*11:02, HLA-A*11:03, и HLA-A*11:04.
Если не указано иначе, термин «HLA-A33» относится к типу HLA-A33, который включает подтипы, такие как HLA-A*33:03, HLA-A*33:01 и HLA-A*33:04.
В отношении индивидуума или пациента, фраза «антиген HLA индивидуума (или пациента) представляет собой HLA-A11», применяемая в настоящем документе, указывает, что индивидуум или пациент имеет ген антигена HLA-A11 в гомозиготном или гетерозиготном состоянии как молекулу MHC (Главного комплекса гистосовместимости) класса I, и что антиген HLA-A11 экспрессируется в клетках индивидуума или пациента в виде антигена HLA. Аналогично, фраза «антиген HLA индивидуума (или пациента) представляет собой HLA-A33», применяемая в настоящем документе, указывает, что индивидуум или пациент имеет ген HLA-A33 в гомозиготном или гетерозиготном состоянии как молекулу MHC (Главного комплекса гистосовместимости) класса I, и что антиген HLA-A33 экспрессируется в клетках индивидуума или пациента в виде антигена HLA.
При условии, что способы и композиции по настоящему изобретению пригодны в отношении «лечения» злокачественной опухоли, лечение считается «эффективным», если оно достигает клинических преимуществ, например, уменьшение размера, распространения или метастатических свойств злокачественной опухоли, замедление прогрессирования злокачественной опухоли, ослабление клинических симптомов злокачественной опухоли, продление периода выживания, подавление послеоперационных рецидивов у индивидуума. Если лечение применяется профилактически, «эффективность» означает, что лечение замедляет или предотвращает образование злокачественной опухоли, или предупреждает или ослабляет клинические симптомы злокачественной опухоли. Эффективность определяют по отношению к любым общеизвестным способам для диагностики или лечения конкретного типа опухоли.
При условии, что способы и композиции по настоящему изобретению пригодны в отношении «предупреждения (профилактики)» злокачественной опухоли, термин «предупреждение (профилактика)» в настоящем документе включает любую работу, которая облегчает бремя смертности или заболеваемости, ассоциированных заболеванием. Предупреждение (профилактику) можно проводить на «первичном, вторичном и третичном профилактических уровнях». В то время как первичное предупреждение (профилактика) помогает избежать развития заболевания, вторичное и третичное предупреждение (профилактика) включает в себя предупреждение (профилактику) прогрессирования заболевания и появления симптомов, а также деятельность, предназначенную для снижения неблагоприятных воздействий существующего заболевания путем восстановления функций и уменьшения осложнений, ассоциированных с заболеванием. С другой стороны, предупреждение (профилактика) может включать в себя ослабление тяжести конкретного нарушения, например, обширную профилактическую терапию, предназначенную для уменьшения роста опухоли и метастазирования.
В контексте настоящего изобретения, лечение и/или предупреждение (профилактика) злокачественной опухоли и/или предупреждение (профилактика) ее послеоперационного рецидива включают в себя любое из событий, таких как ингибирование пролиферации злокачественных клеток, инволюцию или регрессию опухоли, инициацию ремиссии и подавление развития злокачественной опухоли, регрессию опухоли, а также уменьшение или ингибирование метастазирования, подавление послеоперационных рецидивов злокачественной опухоли, и продление периода выживания. Эффективное лечение и/или предупреждение (профилактика) злокачественной опухоли снижает смертность, улучшает прогноз индивидуума со злокачественной опухолью, снижает уровень опухолевых маркеров в крови, и облегчает выявляемые симптомы, ассоциированные со злокачественной опухолью. Например, облегчение или улучшение симптомов составляет эффективное лечение и/или предупреждение (профилактику), и включает состояние, при котором симптомы стабильны или улучшены на 10%, 20%, 30% или больше.
В контексте настоящего изобретения, термин «антитело» относится к иммуноглобулинам и их фрагментам, которые специфически реакционноспособны по отношению к обозначенному белку или его пептиду. Антитело может включать антитела человека, приматизированные антитела, химерные антитела, биспецифические антитела, гуманизированные антитела, антитела, слитые с другими белками или радиоактивными метками, и фрагменты антител. Кроме того, «антитело» в настоящем документе используется в самом широком смысле и конкретно включает интактные моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные из двух или более интактных антител, и фрагменты антител при условии, что они проявляют желательную биологическую активность. «Антитело» может быть антителами всех классов (например, IgA, IgD, IgE, IgG и IgM).
Если не указано иначе, все технические термины и научные термины, применяемые в настоящем документе, имеют то же самое значение, в каком их обычно понимает специалист в области, к которой относится настоящее изобретение.
II. Пептиды
HLA-A11 и HLA-A33 представляют собой аллели, которые часто встречаются у азиатов (Cao et al., Hum Immunol 2001; 62(9): 1009-30). Таким образом, предлагается эффективный способ лечения MPHOSPH1-экспрессирующих злокачественных опухолей для большой популяции азиатов путем создания пептидов, полученных из MPHOSPH1, которые способны к индуцированию ЦТЛ и рестриктированы по HLA-A11 или HLA-A33. Таким образом, настоящее изобретение относится к пептидам, полученным из MPHOSPH1, которые способны индуцировать ЦТЛ ограничительно по HLA-A11 или HLA-A33.
Пептиды по настоящему изобретению представляют собой пептиды, полученные из MPHOSPH1, которые способны индуцировать ЦТЛ ограничительно по HLA-A11 или HLA-A33. Пептиды, способные индуцировать ЦТЛ ограничительно по HLA-A11, включают пептиды с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53. Пептиды, способные индуцировать ЦТЛ ограничительно по HLA-A33, включают пептиды с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170.
ЦТЛ с цитотоксической активностью, специфичные по отношению к этим пептидам, можно создавать при стимуляции Т-клеток in vitro дендритными клетками (DC), активированными этими пептидами. Полученные ЦТЛ демонстрируют специфическую цитотоксическую активность против клеток-мишеней, активированных каждым из пептидов.
Ген MPHOSPH1 сверхэкспрессирован в злокачественных клетках, таких как злокачественные клетки, например, при раке мочевого пузыря, раке молочной железы, раке шейки матки, холангиоцеллюлярном раке, хроническом миелолейкозе (ХМЛ), раке толстого кишечника, раке желудка, раке легких, лимфоме, остеосаркоме, раке предстательной железы, раке почки, опухоли мягких тканей и т.п., но не экспрессируется в большинстве здоровых органов. Следовательно, он представляет собой превосходную мишень для иммунотерапии. Таким образом, пептиды по настоящему изобретению могут быть подходящим образом использованы для иммунотерапии злокачественной опухоли. Предпочтительным пептидом является нонапептид (пептид, состоящий из 9 аминокислотных остатков) или декапептид (пептид, состоящий из 10 аминокислотных остатков), и более предпочтительным является пептид, состоящий из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170. Например, пептид с аминокислотной последовательностью из SEQ ID NO: 52 подходит для индуцирования ЦТЛ, демонстрирующих цитотоксическую активность против клеток, экспрессирующих HLA-A11 и MPHOSPH1, и может быть подходящим образом использован для иммунотерапии злокачественной опухоли у HLA-A11-положительных пациентов. Дополнительно, например, пептид с аминокислотной последовательностью SEQ ID NO: 118 подходит для индуцирования ЦТЛ, демонстрирующих цитотоксическую активность против клеток, экспрессирующих HLA-A33 и MPHOSPH1, и может быть подходящим образом использован для иммунотерапии злокачественной опухоли у HLA-A33-положительных пациентов. В более предпочтительном варианте осуществления пептид по настоящему изобретению представляет собой пептид, состоящий из аминокислотной последовательности, выбранной из числа SEQ ID NO: 52 и 118.
Для пептидов по настоящему изобретению, дополнительный аминокислотный остаток/остатки могут быть присоединены к аминокислотной последовательности пептида по настоящему изобретению, при условии, что полученные пептиды сохраняют способность исходного пептида индуцировать ЦТЛ. Дополнительный аминокислотный остаток/остатки могут состоять из любых типов аминокислот, при условии, что они не снижают способность исходного пептида индуцировать ЦТЛ. Таким образом, пептиды по настоящему изобретению включают пептиды, способные индуцировать ЦТЛ, состоящие из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170. Такие пептиды состоят, например, менее чем из приблизительно 40 аминокислот, во многих случаях менее чем из приблизительно 20 аминокислот, и, как правило, менее чем из приблизительно 15 аминокислот. Таким образом, если исходный пептид представляет собой нонапептид, пептид по настоящему изобретению относится к пептидам, которые имеют 10 аминокислот в длину или 11-40 аминокислот в длину, которые получены добавлением дополнительной аминокислоты/аминокислот к пептиду. Более того, если исходный пептид представляет собой декапептид, пептид по настоящему изобретению относится к пептидам, которые имеют 11-40 аминокислот в длину. Такой пептид может быть, например, пептидом, который имеет 11-20 аминокислот в длину, или пептидом, который имеет 11-15 аминокислот в длину. Предпочтительным примером дополнительного аминокислотного остатка/остатков является аминокислотный остаток/остатки, примыкающие к аминокислотной последовательности пептида по настоящему изобретению в полноразмерной аминокислотной последовательности MPHOSPH1 (например,, SEQ ID NO: 186 или 188). Таким образом, пептиды по настоящему изобретению включают пептиды, содержащие аминокислотную последовательность, выбранную из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170, и где пептиды представляют собой пептидные фрагменты MPHOSPH1 и имеют способность индуцировать ЦТЛ.
Как правило, модификации одной, двух или более аминокислот в определенном пептиде не влияют на функции пептида, или в некоторых случаях даже усиливают желаемые функции исходного пептида. Фактически, известно, что модифицированные пептиды (т.е., пептиды, состоящие из аминокислотной последовательности, в которой один, два или несколько аминокислотных остатков являются модифицированными (т.е., замещены, удалены, вставлены, и/или добавлены) по сравнению с исходной референсной последовательностью) сохраняют биологическую активность исходного пептида (Mark et al., Proc Natl Acad Sci USA 1984, 81: 5662-6; Zoller and Smith, Nucleic Acids Res 1982, 10: 6487-500; Dalbadie-McFarland et al., Proc Natl Acad Sci USA 1982, 79: 6409-13). Таким образом, в одном из вариантов осуществления пептиды по настоящему изобретению могут быть пептидами, содержащими аминокислотную последовательность, в которой одна, две или несколько аминокислот замещены, удалены, вставлены, и/или добавлены к аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170, и имеющими способность индуцировать ЦТЛ.
Специалисту в данной области ясно, что отдельные замены в аминокислотной последовательности, которые изменяют единичную аминокислоту или небольшое процентное содержание аминокислот, как правило, приводят к сохранению свойств исходной боковой цепи/цепей аминокислоты. Таким образом, на них часто ссылаются как на «консервативные замены» или «консервативные модификации»; и модификация белка «консервативной заменой» или «консервативной модификацией» может приводить к модифицированному белку, который имеет функции, аналогичные функциям исходного белка. Таблицы консервативных замен, представляющие функционально сходные аминокислоты, хорошо известны в данной области. Примеры характеристик боковых цепей аминокислот, которые функционально похожи, включают, например, гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T), и боковые цепи со следующими общими функциональными группами или характеристиками: алифатические боковые цепи (G, A, V, L, I, P); боковые цепи, содержащие гидроксильную группу (S, T, Y); боковые цепи, содержащие атом серы (C, M); боковые цепи, содержащие карбоновую кислоту и амид (D, N, E, Q); боковые цепи, содержащие основание (R, K, H); и ароматические боковые цепи (H, F, Y, W). Кроме того, следующие восемь групп содержат аминокислоты, которые принимаются в данной области в качестве консервативных замен друг для друга:
1) Аланин (A), Глицин (G);
2) Аспарагиновая кислота (D), Глутаминовая кислота (E);
3) Аспарагин (N), Глутамин (Q);
4) Аргинин (R), Лизин (K);
5) изолейцин (I), Лейцин (L), Метионин (M), Валин (V);
6) Фенилаланин (F), Тирозин (Y), Триптофан (W);
7) Серин (S), Треонин (T); и
8) Цистеин (C), Метионин (M) (см., например, Creighton, Proteins 1984).
Такие консервативно модифицированные пептиды также включены в пептиды по настоящему изобретению. Однако пептиды по настоящему изобретению не ограничены ими и могут включать неконсервативные модификации, при условии, что модифицированный пептид сохраняет способность исходного пептида индуцировать ЦТЛ. Кроме того, модифицированные пептиды не исключают пептиды, способные индуцировать ЦТЛ, которые получены из полиморфных вариантов, межвидовых гомологов, и аллелей MPHOSPH1.
При условии, что пептид сохраняет способность исходного пептида индуцировать ЦТЛ, можно модифицировать (т.е., замещать, удалять, вставлять и/или добавлять) небольшое число (например, 1, 2 или несколько) или небольшое процентное содержание аминокислот. В настоящем документе, термин «несколько» означает 5 или менее аминокислот, например, 4 или 3, или менее. Процентное содержание аминокислот, которые будут модифицированы, предпочтительно составляет 20% или менее, более предпочтительно, 15% или менее, даже более предпочтительно, 10% или менее, или от 1 до 5%.
При использовании для иммунотерапии, пептиды по настоящему изобретению должны презентироваться на поверхности клетки или экзосомы, предпочтительно в виде комплекса с антигеном HLA. Таким образом, предпочтительно, что пептиды по настоящему изобретению обладают высокой аффинностью связывания с антигеном HLA. С этой целью, пептиды можно модифицировать при помощи замены, делеции, вставки, и/или добавления аминокислотных остатков для получения модифицированного пептида с улучшенной аффинностью связывания. Поскольку закономерность последовательностей пептидов, показанная путем связывания с антигенами HLA, уже известна (Falk, et al., Immunogenetics 1994 40 232-41; Chujoh, et al., Tissue Antigens 1998: 52: 501-9; Takiguchi, et al., Tissue Antigens 2000: 55: 296-302.), модификации на основании такой закономерности можно вводить в пептиды по настоящему изобретению.
Например, в пептидах с аффинностью связывания для HLA класса I, вторая аминокислота с N-конца и C-концевая аминокислота, как правило, представляют собой якорные остатки, участвующие в связывании с HLA класса I (Rammensee HG, et al., Immunogenetics. 1995; 41(4): 178-228.). Например, для HLA-A11, треонин, валин, изолейцин, лейцин, фенилаланин, и тирозин в качестве второй аминокислоты с N-конца, и лизин и аргинин в качестве C-концевой аминокислоты известны как якорные остатки с высокой аффинностью связывания для HLA-A11 (Falk, et al., Immunogenetics 1994, 40: 232-41; Chujoh, et al., Tissue Antigens 1998: 52: 501-9).
Дополнительно, для HLA-A11, существуют вспомогательные якорные остатки в положениях 3 и 7 от N-конца; и известно, что лейцин, фенилаланин, тирозин, изолейцин, и аланин являются предпочтительными в качестве третьей аминокислоты от N-конца, и что лейцин, изолейцин, тирозин, валин и фенилаланин являются предпочтительными в качестве седьмой аминокислоты с N-конца (Falk, et al., Immunogenetics 1994, 40: 232-41; Chujoh, et al., Tissue Antigens 1998: 52: 501-9). Таким образом, для повышения аффинности связывания с HLA-A11, существует вероятность того, что желательно заменить вторую аминокислоту с N-конца треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином, и/или заменить C-концевую аминокислоту лизином или аргинином. Дополнительно, существует вероятность того, что также желательно заменить третью аминокислоту с N-конца лейцином, фенилаланином, тирозином, изолейцином, или аланином, и/или заменить седьмую аминокислоту с N-конца лейцином, изолейцином, тирозином, валином или фенилаланином.
Таким образом, пептиды со способностью индуцировать ЦТЛ, содержащие аминокислотную последовательность, в которой, в аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином; третья аминокислота с N-конца замещена лейцином, фенилаланином, тирозином, изолейцином, или аланином; седьмая аминокислота с N-конца замещена лейцином, изолейцином, тирозином, валином или фенилаланином; и/или C-концевая аминокислота замещена аргинином, охватываются пептидами по настоящему изобретению.
В предпочтительном варианте осуществления пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности, в которой, в аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином; третья аминокислота с N-конца замещена лейцином, фенилаланином, тирозином, изолейцином, или аланином; седьмая аминокислота с N-конца замещена лейцином, изолейцином, тирозином, валином или фенилаланином; и/или C-концевая аминокислота замещена аргинином.
То есть, пептиды по настоящему изобретению включают в себя пептиды со способностью индуцировать ЦТЛ, которые содержат аминокислотную последовательность с одной или несколькими заменами, которые выбраны из нижеизложенных от (a) до (d), введенных в аминокислотную последовательность, выбранную из числа SEQ ID NO: 5, 12, 27, 52 и 53:
(a) вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином;
(b) третья аминокислота с N-конца замещена лейцином, фенилаланином, тирозином, изолейцином, или аланином;
(c) седьмая аминокислота с N-конца замещена лейцином, изолейцином, тирозином, валином или фенилаланином; и
(d) C-концевая аминокислота замещена аргинином.
В предпочтительном варианте осуществления пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности с одной или несколькими заменами, которые выбраны из вышеизложенных от (a) до (d), введенных в аминокислотную последовательность, выбранную из числа SEQ ID NO: 5, 12, 27, 52 и 53. В настоящем изобретении, предпочтительное число замен составляет 1, 2, 3 или 4 замены, выбранные из вышеизложенных от (a) до (d).
Пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который содержит аминокислотную последовательность, в которой, в аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином, и/или C-концевая аминокислота замещена лизином или аргинином. Предпочтительно, пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности, в которой, в аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином, и/или C-концевая аминокислота замещена аргинином. То есть, пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который содержит аминокислотную последовательность, в которой одна или несколько замен выбраны из нижеизложенных от (a) до (b) в аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53:
(a) вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином, фенилаланином, или тирозином; и
(b) C-концевая аминокислота замещена аргинином.
В предпочтительном варианте осуществления пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности, включающей одну или несколько замен, выбранных из вышеизложенных от (a) до (b), введенных в аминокислотную последовательность, выбранную из числа SEQ ID NO: 5, 12, 27, 52 и 53. В более предпочтительном варианте осуществления вторая аминокислота с N-конца замещена треонином, валином, изолейцином, лейцином.
В HLA-A33 фенилаланин, тирозин, аланин, изолейцин, лейцин и валин в качестве второй аминокислоты с N-конца, и лизин и аргинин в качестве C-концевой аминокислоты известны как якорные остатки с высокой аффинностью связывания для HLA-A33 (Falk, et al., Immunogenetics 1994, 40: 232-41; Takiguchi, et al., Tissue Antigens 2000, 55: 296-302). Дополнительно, в HLA-A33, также известно, что первый аминокислотный остаток с N-конца функционирует как якорный остаток, и известно, что аспарагиновая кислота и глутаминовая кислота являются предпочтительными в качестве первой аминокислоты с N-конца (Falk, et al., Immunogenetics 1994, 40: 232-41; Takiguchi, et al., Tissue Antigens 2000: 55: 296-302).
Таким образом, для того чтобы сохранить или усилить аффинность связывания с HLA-A33, существует вероятность того, что желательно заменить первую аминокислоту с N-конца аспарагиновой кислотой или глутаминовой кислотой, вторую аминокислоту с N-конца - фенилаланином, тирозином, аланином, изолейцином, лейцином или валином, и/или С-концевую аминокислоту - лизином. Следовательно, пептиды по настоящему изобретению включают в себя пептиды со способностью индуцировать ЦТЛ, содержащие аминокислотную последовательность, в которой в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170, первая аминокислота с N-конца замещена аспарагиновой кислотой или глутаминовой кислотой, вторая аминокислота с N-конца замещена фенилаланином, тирозином, аланином, изолейцином, лейцином или валином, и/или С-концевая аминокислота замещена лизином.
В предпочтительном варианте осуществления, пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности, в которой в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170, первая аминокислота с N-конца замещена аспарагиновой кислотой или глутаминовой кислотой, вторая аминокислота с N-конца замещена фенилаланином, тирозином, аланином, изолейцином, лейцином или валином, и/или С-концевая аминокислота замещена замещена лизином.
То есть, пептиды по настоящему изобретению включают в себя пептид со способностью индуцировать ЦТЛ, который содержит аминокислотную последовательность с одной или несколькими заменами, которые выбраны из нижеизложенных от (a) до (c), в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170:
(a) первая аминокислота с N-конца замещена аспарагиновой кислотой или глутаминовой кислотой;
(b) вторая аминокислота с N-конца замещена фенилаланином, тирозином, аланином, изолейцином, лейцином или валином; и
(c) С-концевая аминокислота замещена лизином.
В предпочтительном варианте осуществления пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности с одной или несколькими заменами, которые выбраны из вышеизложенных от (a) to (c) в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170. В настоящем изобретении, предпочтительное число замен составляет 1, 2 или 3 замены, выбранные из вышеизложенных от (a) до (c).
Кроме того, пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который содержит аминокислотную последовательность, в которой в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170, вторая аминокислота с N-конца замещена фенилаланином, тирозином, аланином, изолейцином, лейцином или валином, и/или С-концевая аминокислота замещена лизином. Предпочтительно, пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности, в которой, в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170, вторая аминокислота с N-конца замещена фенилаланином, тирозином, аланином, изолейцином, лейцином или валином, и/или С-концевая аминокислота замещена лизином. То есть, пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который содержит аминокислотную последовательность, в которой одна или несколько замен выбраны из нижеизложенных (a) и (b) в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170:
(a) вторая аминокислота с N-конца замещена фенилаланином, тирозином, аланином, изолейцином, лейцином или валином; и
(b) С-концевая аминокислота замещена лизином.
В предпочтительном варианте осуществления пептид по настоящему изобретению может быть пептидом со способностью индуцировать ЦТЛ, который состоит из аминокислотной последовательности с одной или несколькими заменами, выбранными из вышеизложенных от (a) до (b) в аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170. В более предпочтительном варианте осуществления вторая аминокислота с N-конца замещена фенилаланином или тирозином.
Замену/замены можно вводить в аминокислоту/аминокислоты пептидов не только в якорном участке/участках, но также в положении/положениях потенциальных участков распознавания T-клеточного рецептора (TCR) пептидов. Несколько исследовательских работ продемонстрировали, что пептид, который имеет замены аминокислот, такие как CAP1, p53(264-272), Her-2/neu(369-377) или gp100(209-217), может иметь равную или лучшую активность по сравнению с исходным пептидом (Zaremba et al. Cancer Res. 1997, 57, 4570-7; T. K. Hoffmann et al. J Immunol. 2002, 168(3): 1338-47.; S. O. Dionne et al. Cancer Immunol immunother. 2003, 52: 199-206; and S. O. Dionne et al. Cancer Immunology, Immunotherapy 2004, 53, 307-14).
Настоящее изобретение также предполагает, что одну, две или несколько аминокислот можно добавлять с N-конца и/или C-конца пептидов по настоящему изобретению (например, пептидов, состоящих из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170). Более конкретно, настоящее изобретение относится к пептидам, состоящим из аминокислотных последовательностей, в которых одна, две или несколько аминокислот добавлены или к одному, или к обоим из N-конца и C-конца аминокислотных последовательностей, на которые ссылается каждая из SEQ ID NO. Такие модифицированные пептиды, которые сохраняют способность индуцировать ЦТЛ, также включены в настоящее изобретение. Например, если пептид, в котором одна, две или несколько аминокислот добавлены с N-конца и/или C-конца пептида, состоящего из аминокислотной последовательности SEQ ID NO: 52 или 118, контактирует с АПК, он захватывается в АПК и процессируется до пептида, состоящего из аминокислотной последовательности SEQ ID NO: 52 или 118. Он может затем индуцировать ЦТЛ путем презентирования на клеточной поверхности АПК с помощью пути презентации антигена. Более конкретно, пептиды по настоящему изобретению могут быть пептидами, в которых одну, две или несколько аминокислот добавляют к любому из N-конца и C-конца, или к обоим.
Дополнительно, в другом варианте осуществления настоящего изобретения, предлагаются пептиды, состоящие из аминокислотных последовательностей, содержащих одну, две или несколько замен аминокислот в аминокислотных последовательностях, на которые ссылается каждая из SEQ ID NO, и в которых одна, две или несколько аминокислот добавлены или к одному, или к обоим из N-конца и C-конца этих замещенных аминокислотных последовательностей.
Если пептиды по настоящему изобретению содержат замену аминокислоты/аминокислот, желаемые положения для замены могут быть, например, одним, двумя, тремя или четырьмя положениями, выбранными из второго положения с N-конца, третьего положения с N-конца, седьмого положения с N-конца, и C-конца в аминокислотных последовательностях, на которые ссылаются SEQ ID NO: 5, 12, 27, 52 и 53, содержащиеся в пептидах по настоящему изобретению. Альтернативно, они могут быть одним, двумя или тремя положениями, выбранными из первого положения с N-конца, второго положения с N-конца, и C-конца в аминокислотных последовательностях, на которые ссылаются SEQ ID NO: 5, 12, 27, 52 и 53.
Однако если аминокислотная последовательность пептида идентична части аминокислотной последовательности эндогенного или экзогенного белка с отличающейся функцией, могут быть индуцированы побочные эффекты, такие как аутоиммунные нарушения и/или аллергические симптомы против конкретных веществ. Таким образом, предпочтительно проводить поиски с использованием доступных баз данных, для того чтобы избежать ситуаций, в которых аминокислотная последовательность пептида соответствует аминокислотной последовательности другого белка. Если из поисков гомологии становится ясно, что не существует пептида всего лишь с одной или двумя различающимися аминокислотами по сравнению с указанным пептидом, указанный пептид можно модифицировать для того чтобы повысить его аффинность связывания с антигенами HLA, и/или увеличить его способность индуцировать ЦТЛ без опасности таких побочных эффектов.
Пептиды, в которых модифицированы одна, две или несколько аминокислот из пептида по настоящему изобретению, теоретически спрогнозированы для сохранения способности исходного пептида индуцировать ЦТЛ; однако предпочтительно проверить способность модифицированных пептидов индуцировать ЦТЛ. В настоящем документе, «пептид со способностью индуцировать ЦТЛ (индуцибельность ЦТЛ)» относится к пептиду, который индуцирует ЦТЛ при помощи АПК, стимулированных пептидом. «Индуцирование ЦТЛ» включает индуцирование дифференцировки в ЦТЛ, индуцирование активации ЦТЛ, индуцирование пролиферации ЦТЛ, индуцирование цитотоксической активности ЦТЛ, индуцирование опосредованного ЦТЛ разрушения клеток-мишеней, и индуцирование повышенной выработки IFN-гамма ЦТЛ.
Способность индуцировать ЦТЛ можно подтверждать путем стимулирования АПК, которые экспрессируют интересующий антиген HLA (например, B-лимфоциты, макрофаги или дендритные клетки), с пептидом, и смешивания с CD8-положительными Т-клетками; и затем с помощью измерения IFN-гамма, высвобожденного ЦТЛ против клеток-мишеней. В качестве АПК можно предпочтительно использовать дендритные клетки, полученные из мононуклеарных клеток периферической крови человека. В качестве реакционной системы можно использовать трансгенных животных, созданных для экспрессии антигена HLA. Альтернативно, клетки-мишени могут быть радиоактивно-меченными с помощью51Cr и так далее, и цитотоксическая активность пептид-индуцированных ЦТЛ может быть рассчитана на основании радиоактивности, испускаемой клетками-мишенями. Альтернативно, способность индуцировать ЦТЛ можно оценивать путем измерения IFN-гамма, выработанного и высвобожденного ЦТЛ в присутствии пептид-стимулированных АПК, и путем визуализации области ингибирования на среде с использованием моноклональных антител к IFN-гамма.
В дополнение к вышеизложенным модификациям, пептиды по настоящему изобретению могут быть связаны с другими пептидами при условии, что полученный связанный пептид сохраняет способность индуцировать ЦТЛ. Пример подходящего пептида для связывания с пептидами по настоящему изобретению включает пептид, индуцирующий ЦТЛ и полученный из других TAA. Дополнительно, пептиды по настоящему изобретению могут также быть связаны друг с другом. Подходящие линкеры для применения для связывания пептидов известны в данной области, и, например, можно использовать линкеры, такие как AAY (P. M. Daftarian et al., J Trans Med 2007, 5:26), AAA, NKRK (SEQ ID NO: 189) (R. P. M. Sutmuller et al., J Immunol. 2000, 165: 7308-15), или K (S. Ota et al., Can Res. 62, 1471-6, K. S. Kawamura et al., J Immunol. 2002, 168: 5709-15). Пептиды можно связывать в различных расположениях (например, мелкими цепочками, повторами, и т.д.), и можно также связывать три или более пептидов.
Пептиды по настоящему изобретению могут также быть связааны с другими веществами при условии, что полученный связанный пептид сохраняет способность индуцировать ЦТЛ. Примеры подходящего вещества для связывания с пептидом по настоящему изобретению включают, например, пептид, липид, сахар или цепь сахаров, ацетильную группу, и природный или синтетический полимер. Пептиды по настоящему изобретению можно модифицировать путем гликозилирования, окисления боковых цепей, фосфорилирования или т.п., при условии, что их способность индуцировать ЦТЛ не будет нарушена. Можно также проводить такие типы модификаций для придания дополнительных функций (например, нацеливающей функции и функции доставки) или для стабилизации пептида.
Например, для повышения стабильности пептида in vivo в данной области известно введение D-аминокислот, миметиков аминокислот или неприродных аминокислот, и эта концепция также может быть применима к пептидам по настоящему изобретению. Стабильность пептидов можно оценивать несколькими способами. Например, стабильность можно тестировать с использованием пептидазы, а также различных биологических сред, таких как плазма и сыворотка человека (см., например, Verhoef et al., Eur J Drug Metab Pharmacokin 1986, 11: 291-302).
Дополнительно, как указано выше, среди модифицированных пептидов, в которых один, два, или несколько аминокислотных остатков были замещены, удалены, вставлены и/или добавлены, можно проводить скрининг или отбор по тем пептидам, которые имеют такую же или более высокую активность, как и исходные пептиды. Таким образом, настоящее изобретение также относится к способам скрининга или отбора модифицированных пептидов, которые имеют такую же или более высокую активность, как и исходный пептид. Конкретно, настоящее изобретение относится к способу скрининга на пептид со способностью индуцировать ЦТЛ, где способ включает этапы:
(a) создания кандидатных последовательностей, состоящих из аминокислотной последовательности, в которой один, два, или несколько аминокислотных остатков замещены, удалены, вставлены и/или добавлены по сравнению с исходной аминокислотной последовательностью, состоящей из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170;
(b) отбора в кандидатных последовательностях, полученных в (a), кандидатной последовательности, которая не имеет значительной гомологии (идентичности последовательности) с любым известным продуктом гена человека, за исключением MPHOSPH1;
(c) контакта пептида, состоящего из кандидатной последовательности, выбранной в (b), с АПК;
(d) контакта АПК из (c) с CD8-положительными T-клетками; и
(e) отбора пептида, который имеет равную или более высокую способность индуцировать ЦТЛ, чем пептид, состоящий из исходной аминокислотной последовательности.
В настоящем документе, пептид по настоящему изобретению также описан как «пептид(-ы) MPHOSPH1».
III. Получение пептидов по настоящему изобретению
Для получения пептидов по настоящему изобретению можно использовать хорошо известные способы. Например, для получения пептидов по настоящему изобретению можно использовать технологию рекомбинантных ДНК или химический синтез. Пептиды по настоящему изобретению можно синтезировать по отдельности, или в виде более длинных полипептидов, включающих два или более пептида. Пептиды по настоящему изобретению можно выделять из клеток-хозяев или продуктов реакции синтеза, после того как они были произведены в клетках-хозяевах при помощи технологии рекомбинантных ДНК или после того как они были синтезированы химическим путем. То есть, пептиды по настоящему изобретению можно очищать или изолировать таким образом, что они по существу не содержат других белков и их фрагментов из клетки-хозяина, или любых других химических веществ.
Пептиды по настоящему изобретению могут содержать модификации, такие как гликозилирование, окисление боковых цепей, фосфорилирование при условии, что такие модификации не разрушают биологическую активность исходного пептида. Другие иллюстративные модификации включают введение D-аминокислот или других миметиков аминокислот, которые можно использовать, например, для увеличения времени полувыведения пептидов из сыворотки.
Пептид по настоящему изобретению можно получать путем химического синтеза на основании выбранной аминокислотной последовательности. Примеры общепринятых способов пептидного синтеза, которые можно адаптировать для синтеза, включают способы, описанные в документах ниже:
(i) Peptide Synthesis, Interscience, New York, 1966;
(ii) The Proteins, Vol. 2, Academic Press, New York, 1976;
(iii) ʺPeptide Synthesisʺ (in Japanese), Maruzen Co., 1975;
(iv) ʺBasics and Experiment of Peptide Synthesisʺ (in Japanese), Maruzen Co., 1985;
(v) ʺDevelopment of Pharmaceuticalsʺ (in Japanese), Continued Vol. 14 (peptide synthesis), Hirokawa, 1991;
(vi) WO99/67288; и
(vii) Barany G. & Merrifield R.B., Peptides Vol. 2, Solid Phase Peptide Synthesis, Academic Press, New York, 1980, 100-118.
Альтернативно, пептиды по настоящему изобретению можно получать, адаптируя любые известные способы генетической инженерии для выработки пептидов (например, Morrison J, J Bacteriology 1977, 132: 349-51; Clark-Curtiss & Curtiss, Methods in Enzymology (Wu et al.) 1983, 101: 347-62). Например, сначала получают подходящий вектор, несущий полинуклеотид, который кодирует пептид по настоящему изобретению, в экспресирующейся форме (например, после регуляторной последовательности, соответствующей промоторной последовательности), и транформируют подходящую клетку-хозяина. Клетку-хозяина затем культивируют для получения пептида по настоящему изобретению. Пептид по настоящему изобретению также можно получать in vitro с использованием системы для трансляции in vitro.
IV. Полинуклеотиды
Настоящее изобретение также относится к полинуклеотиду, который кодирует любой из пептидов по настоящему изобретению. Он включает полинуклеотиды, полученные из природного гена MPHOSPH1 (например, номер доступа GenBank NM_016195 (SEQ ID NO: 185) или номер доступа GenBank NM_001284259 (SEQ ID NO: 187)) а также полинуклеотиды с консервативно модифицированной нуклеотидной последовательностью. В настоящем документе, фраза «консервативно модифицированная нуклеотидная последовательность» относится к последовательностям, которые кодируют идентичные или по существу идентичные аминокислотные последовательности. Из-за вырожденности генетического кода, большое количество функционально идентичных нуклеиновых кислот кодирует любой указанный белок. Например, все кодоны GCA, GCC, GCG, и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, где кодоном определен аланин, кодон можно изменять на любой из соответствующих вышеописанных кодонов без изменения кодируемого полипептида. Такие вариации нуклеиновых кислот представляют собой «молчащие вариации», которые являются одним из видов консервативно модифицированных вариаций. Каждая последовательность нуклеиновой кислоты в настоящем документе, которая кодирует пептид, также описывает любую возможную молчащую вариацию нуклеиновой кислоты. Специалисту в данной области будет понятно, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который, как правило, является единственным кодоном для метионина, и TGG, который, как правило, является единственным кодоном для триптофана) можно модифицировать для получения функционально идентичной молекулы. Таким образом, каждая молчащая вариация нуклеиновой кислоты, кодирующей пептид, неявно описана в каждой раскрытой последовательности.
Полинуклеотид по настоящему изобретению может состоять из ДНК, РНК, и их производных. ДНК соответствующим образом состоит из оснований, таких как A, T, C, и G, и T заменена на U в РНК.
Полинуклеотид по настоящему изобретению может кодировать несколько пептидов по настоящему изобретению с наличием или отсутствием между ними промежуточных аминокислотных последовательностей. Например, промежуточная аминокислотная последовательность может обеспечивать участок расщепления (например, последовательность распознавания фермента) полинуклеотида или транслированных пептидов. Кроме того, полинуклеотид может включать любые дополнительные последовательности в кодирующую последовательность, которая кодирует пептид по настоящему изобретению. Например, полинуклеотид может быть рекомбинантным полинуклеотидом, который включает регуляторные последовательности, необходимые для экспрессии пептида или может быть экспрессирующим вектором (например, плазмидой) с маркерными генами и т.п. Как правило, такие рекомбинантные полинуклеотиды можно получать путем манипуляций с полинуклеотидами путем общепринятых рекомбинантных способов при помощи, например, полимераз и эндонуклеаз.
Для получения полинуклеотидов по настоящему изобретению можно использовать и рекомбинантные способы, и способы химического синтеза. Например, полинуклеотид можно получать путем вставки в соответствующий вектор, который можно экпрессировать после трансфекции в компетентных клетках. Альтернативно, полинуклеотид можно амплифицировать при помощи способов ПЦР или экспрессии в подходящих хозяевах (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1989). Альтернативно, полинуклеотид можно синтезировать с ипользованием твердофазных способов, как описано в Beaucage SL & Iyer RP, Tetrahedron 1992, 48: 2223-311; Matthes et al., EMBO J 1984, 3: 801-5. Продукты связывания из нескольких пептидов, которые можно получать таким образом, можно очищать по мере необходимости и вводить в таком связанном состоянии. В этом случае, из связанных пептидов путем процессинга можно получать антигенпрезентирующие пептиды и выявлять ЦТЛ-индуцирующую активность каждого из пептидов. Таким образом, присвязывании пептидов предпочтительно комбинировать пептиды с одинаковым ограничением по HLA. Альтернативно, пептиды можно вводить в виде смеси отдельных пептидов, расщепляя связанную часть.
V. Экзосомы
Настоящее изобретение дополнительно относится к внутриклеточным пузырькам, обозначаемым как экзосомы, которые презентируют на своей поверхности комплексы, образованные между пептидами по настоящему изобретению и антигенами HLA. Экзосомы можно получать, например, при помощи способов, подробно описанных в JPH11-510507 и WO99/03499, и можно получать с использованием АПК, полученных от пациентов, которые являются объектами для лечения и/или предупреждения заболевания (профилактики). Экзосомы по настоящему изобретению можно прививать как вакцины, аналогичным образом, как и пептиды по настоящему изобретению.
Тип антигенов HLA, включенных в описанные выше комплексы, должен совпадать с типом у индивидуума, которому необходимо лечение и/или предупреждение заболевания (профилактика). Например, HLA-A11 (например, HLA-A*11:01) и HLA-A33 (например, HLA-A*33:03) представляют собой аллели широко и повсеместно наблюдаемые в азиатских популяциях, и этот тип антигенов HLA считается подходящим для лечения азиатских пациентов. Как правило, в клинической практике, за счет предварительного исследования типа антигена HLA у пациента, нуждающегося в лечении, возможно выбрать подходящий пептид, который имеет высокий уровень аффинности связывания с конкретным антигеном HLA, или который имеет способность индуцировать ЦТЛ за счет презентации антигена, опосредованной конкретным антигеном HLA.
Экзосомы по настоящему изобретению презентируют на своей поверхности комплекс пептида по настоящему изобретению и HLA-A11 или HLA-A33. Если HLA, который образует комплекс с пептидом по настоящему изобретению, представляет собой HLA-A11, пептид по настоящему изобретению предпочтительно является пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 15, 12, 27, 52 и 53, или его модифицированным пептидом, и, более предпочтительно, пептидом, состоящим из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, или его модифицированным пептидом. Дополнительно, если HLA, который образует комплекс с пептидом по настоящему изобретению, представляет собой HLA-A33, пептид по настоящему изобретению предпочтительно является пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170, или его модифицированным пептидом, и, более предпочтительно, пептидом, состоящим из аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170, или его модифицированным пептидом.
VI. Антигенпрезентирующие клетки (АПК)
Настоящее изобретение дополнительно относится к АПК, которые презентируют на своей поверхности комплексы, образованные между антигенами HLA и пептидами по настоящему изобретению. Альтернативно, настоящее изобретение относится к АПК, имеющим на своей клеточной поверхности комплексы, образованные между антигенами HLA и пептидами по настоящему изобретению. АПК по настоящему изобретению могут быть изолированными АПК. При применении в отношении клетки (АПК, ЦТЛ, и т.д.), термин «изолированный» означает, что клетки отделены от другого типа клеток. АПК по настоящему изобретению могут быть АПК, индуцированными из АПК, полученных от пациента, которого собираются подвергать лечению и/или предупреждению (профилактике), и их можно вводить в виде вакцины сами по себе или в комбинации с другими лекарственными средствами, включая пептид(-ы), экзосому/экзосомы или ЦТЛ по настоящему изобретению.
АПК по настоящему изобретению не ограничиваются конкретным типом клеток, и могут быть клетками, о которых известно, что они презентируют белковые антигены на своей клеточной поверхности таким образом, что они распознаются лимфоцитами, например, дендритные клетки (DC), клетки Лангерганса, макрофаги, B-клетки, и активированные T-клетки. Поскольку DC является типичной АПК, которая имеет самую сильную способность индуцировать ЦТЛ среди АПК, DC могут быть предпочтительно использованы в качестве АПК по настоящему изобретению. В настоящем изобретении, предпочтительная DC является изолированной DC, полученной от человека. Дополнительно, АПК по настоящему изобретению могут также представлять собой смеси нескольких типов клеток с антиген-презентирующей функцией и могут быть смесями АПК, каждая из которых презентирует различные типы пептидов по настоящему изобретению.
Например, АПК по настоящему изобретению можно получать, выделяя DC из мононуклеарных клеток периферической крови, а затем стимулируя их in vitro, ex vivo или in vivo пептидами по настоящему изобретению. Когда пептид по настоящему изобретению вводят индивидууму, АПК, презентирующие пептид по настоящему изобретению, индуцируются в организме индивидуума. Таким образом, после того как пептиды по настоящему изобретению вводят индивидууму, можно получать АПК по настоящему изобретению путем забора АПК от индивидуума. Альтернативно, АПК по настоящему изобретению можно получать путем контакта АПК, собранных у индивидуума, с пептидом по настоящему изобретению.
Для того чтобы индуцировать иммунный ответ против MPHOSPH1-экспрессирующих злокачественных клеток у индивидуума, АПК по настоящему изобретению можно вводить индивидууму сами по себе или в комбинации с другими лекарственными средствами, включая пептид(-ы), экзосому/экзосомы или ЦТЛ по настоящему изобретению. Например, введение ex vivo может включать следующие этапы:
(a) забор АПК у первого индивидуума;
(b) контакт АПК из этапа (a) с пептидом; и
(c) введение АПК из этапа (b) второму индивидууму.
Первый индивидуум и второй индивидуум могут быть одним и тем же индивидуумом, или могут быть разными индивидуумами. Когда первый индивидуум и второй индивидуум являются разными индивидуумами, предпочтительно, что HLA первого индивидуума и второго индивидуума представляют собой HLA одного типа. АПК, полученные на вышеописанном этапе (b), могут быть вакциной для лечения злокачественной опухоли и/или предупреждения заболевания (профилактики).
АПК по настоящему изобретению, полученные вышеописанным способом, имеют способность индуцировать ЦТЛ. Термин «способность индуцировать ЦТЛ (индуцибельность ЦТЛ)», применяемый в отношении АПК, относится к способности АПК индуцировать ЦТЛ при контакте с CD8-положительной T-клеткой/клетками. Дополнительно, «способность индуцировать ЦТЛ (индуцибельность ЦТЛ)» включает способность АПК индуцировать активацию ЦТЛ, способность АПК индуцировать пролиферацию ЦТЛ, способность АПК способствовать опосредованному ЦТЛ разрушению клеток-мишеней, и способность АПК повышать опосредованную ЦТЛ выработку IFN-гамма. ЦТЛ, индуцированная АПК по настоящему изобретению, представляет собой ЦТЛ, специфичную к MPHOSPH1, и демонстрирует специфическую цитотоксическую активность против MPHOSPH1-экспрессирующих клеток.
В дополнение к вышеописанным способам, АПК по настоящему изобретению можно получать путем введения полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК in vitro. Вводимый полинуклеотид может быть в форме ДНК или РНК. Способ введения конкретно не ограничен, и его примеры включают различные способы, применяемые обычно в данной области, такие как липофекция, электропорация и способ с фосфатом кальция. Более конкретно, можно использовать способы, описанные в Cancer Res 1996, 56: 5672-7; J Immunol 1998, 161: 5607-13; J Exp Med 1996, 184: 465-72 и JP2000-509281. За счет введения полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК, полинуклеотид транскрибируется и транслируется в клетке, а затем произведенный пептид процессируется MHC класса I и проходит через путь презентации пептида по настоящему изобретению на клеточной поверхности АПК.
В предпочтительном варианте осуществления АПК по настоящему изобретению презентирует на своей клеточной поверхности комплекс, образованный между пептидом по настоящему изобретению и HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03). Если HLA, который образует комплекс с пептидом по настоящему изобретению, представляет собой HLA-A11, пептид по настоящему изобретению предпочтительно является пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, или его модифицированным пептидом, и, более предпочтительно, пептидом, состоящим из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53. Если HLA, который образует комплекс с пептидом по настоящему изобретению, представляет собой HLA-A33, пептид по настоящему изобретению предпочтительно является пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170, или его модифицированным пептидом, и, более предпочтительно, пептидом, состоящим из аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170.
АПК по настоящему изобретению предпочтительно представляет собой АПК, индуцированную способом, включающим этап, описанный (a) или (b) ниже:
(a) контакт АПК, экспрессирующей, по меньшей мере, один HLA, выбранный из HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03) с пептидом по настоящему изобретению; или
(b) введение полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК, экспрессирующую, по меньшей мере, один HLA, выбранный HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03).
Пептид по настоящему изобретению, который контактирует с HLA-A11-экспрессирующей/экспрессирующими АПК, предпочтительно представляет собой пептид, имеющий аминокислотную последовательность, выбранную из числа SEQ ID NO: 5, 12, 27, 52 и 53, или его модифицированный пептид, и более предпочтительно пептид, состоящий из аминокислотной последовательности, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53.
Пептид по настоящему изобретению, который контактирует с HLA-A33-экспрессирующей/экспрессирующими АПК, предпочтительно представляет собой пептид, имеющий аминокислотную последовательность, выбранную из числа SEQ ID NO: 118, 119 и 170, или его модифицированный пептид, и более предпочтительно пептид, состоящий из аминокислотной последовательности, выбранной из числа SEQ ID NO: 118, 119 и 170.
Настоящее изобретение относится к применению пептида по настоящему изобретению для получения фармацевтической композиции, которая индуцирует АПК со способностью индуцировать ЦТЛ. Кроме того, настоящее изобретение относится к способу или процессу производства фармацевтической композиции, которая индуцирует АПК со способностью индуцировать ЦТЛ. Дополнительно, настоящее изобретение относится к пептиду по настоящему изобретению для индуцирования АПК со способностью индуцировать ЦТЛ.
VII. Цитотоксические T-лимфоциты (ЦТЛ)
ЦТЛ, индуцированные пептидом по настоящему изобретению можно использовать в качестве вакцины аналогичным образом, как и пептид по настоящему изобретению, для усиления in vivo иммунного ответа, нацеленного на MPHOSPH1-экспрессирующую раковую клетку. Таким образом, настоящее изобретение относится к ЦТЛ, которые индуцируются или активируются пептидом по настоящему изобретению. ЦТЛ по настоящему изобретению представляют собой ЦТЛ, которые нацелены на пептид по настоящему изобретению, и способны к связыванию с комплексом пептида по настоящему изобретению и антигена HLA. Связывание ЦТЛ с комплексом опосредуется через T-клеточный рецептор (TCR), присутствующий на клеточной поверхности ЦТЛ. ЦТЛ по настоящему изобретению могут быть изолированными ЦТЛ. Предпочтительные ЦТЛ представляют собой изолированные ЦТЛ человеческого происхождения. ЦТЛ по настоящему изобретению могут также представлять собой смеси ЦТЛ, каждая из которых нацелена на различные типы пептидов по настоящему изобретению.
ЦТЛ по настоящему изобретению можно получать путем (1) введения пептидов по настоящему изобретению индивидууму, (2) стимулирования АПК и CD8-положительных T-клеток, или мононуклеарных клеток периферической крови (PBMC),полученных от индивидуума, пептидом по настоящему изобретению in vitro, (3) контактаCD8-положительных T-клетокили PBMC с АПК или экзосомами, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению, in vitro, или (4) введения в CD8-положительные T-клетки вектора, содержащего полинуклеотид, кодирующий каждую субъединицу T-клеточного рецептора (TCR), способного связываться с пептидом по настоящему изобретению, презентированным на клеточной поверхности посредством антигена HLA. Экзосомы и АПК, применяемые в способе (2) или (3) выше, можно получать путем способов, описанных в разделах «V. Экзосомы» и «VI. Антигенпрезентирующие клетки (АПК)», соответственно, а подробности способа (4) выше будут описаны в разделе «VIII. T-клеточный рецептор (TCR)».
ЦТЛ по настоящему изобретению можно вводить сами по себе пациентам, которые подвергаются лечению и/или предупреждению (профилактике), или в комбинации с другими лекарственными средствами, включая пептид(-ы), АПК или экзосому/экзосомы по настоящему изобретению с целью регулирования воздействий. Дополнительно, ЦТЛ по настоящему изобретению могут быть ЦТЛ, индуцированными из CD8-положительных T-клеток, полученных от пациентов, которым предполагается вводить ЦТЛ. ЦТЛ по настоящему изобретению действуют специфически на клетки-мишени, которые презентируют пептиды по настоящему изобретению, например, те же самые пептиды, которые использовали для индуцирования ЦТЛ по настоящему изобретению. Клетки-мишени могут быть клетками, которые эндогенно экспрессируют MPHOSPH1, такими как злокачественные клетки, или клетки, трансфецированные геном MPHOSPH1. Клетки, которые презентируют пептид по настоящему изобретению на своей клеточной поверхности из-за стимулирования пептидом, могут становиться мишенью для атаки ЦТЛ по настоящему изобретению. Клетки, являющиеся мишенями для ЦТЛ по настоящему изобретению, предпочтительно являются клетками, которые положительны, по меньшей мере, по одному из HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03).
В предпочтительном варианте осуществления ЦТЛ по настоящему изобретению специфически нацелены на клетки, которые экспрессируют и MPHOSPH1, и, по меньшей мере, один HLA, выбранный из HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03). В настоящем изобретении, клетки, являющиеся мишенями для ЦТЛ, могут быть клетками, которые имеют любые из аллелей HLA-A11 и HLA-A33 в гомозиготном или гетерозиготном состоянии.
В настоящем документе, то, что ЦТЛ «нацелен на» клетки, относится к распознаванию ЦТЛ клеток, которые презентируют на своей клеточной поверхности комплекс HLA и пептида по настоящему изобретению, и демонстрации цитотоксической активности против клеток. Дополнительно, «специфически нацелен на» относится к тому, что ЦТЛ демонстрирует цитотоксическую активность против таких клеток, но не демонстрирует повреждающей активности по отношению к другим клеткам. Выражение «распознавать клетки», применяемое в отношении ЦТЛ, относится к связыванию с комплексом HLA и пептида по настоящему изобретению, презентированным на клеточной поверхности, через TCR, и к демонстрации цитотоксической активности против клеток. Таким образом, ЦТЛ по настоящему изобретению предпочтительно является ЦТЛ, который может связываться через TCR с комплексом, образованным между пептидом по настоящему изобретению и HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03), презентированным на клеточной поверхности.
Кроме того, ЦТЛ по настоящему изобретению предпочтительно являются ЦТЛ, индуцированными способом, включающим этап, описанный в (a) или (b) ниже:
(a) контакт in vitro CD8-положительных T-клеток с АПК или экзосомами, которые презентируют на своей поверхности комплекс пептида по настоящему изобретению и HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03); или
(b) введение в CD8-положительные T-клетки полинуклеотида, кодирующего каждую субъединицу TCR, способного связываться с пептидом по настоящему изобретению, презентированным на клеточной поверхности посредством HLA-A11 (более предпочтительно HLA-A*11:01) или HLA-A33 (более предпочтительно HLA-A*33:03). ЦТЛ, индуцированные таким способом, представляют собой клетки с TCR, которые специфически распознают комплекс пептида и антигена HLA, использованный для индукции. Таким образом, они представляют собой клетки со структурным отличием от других ЦТЛ, которые имеют отличающуюся специфичность реакции из-за различий в структуре TCR.
VIII. T-клеточные рецепторы (TCR)
Настоящее изобретение также относится к композициям, содержащим полинуклеотид, кодирующий каждую субъединицу TCR, способного связываться с пептидом по настоящему изобретению, который презентирован на клеточной поверхности при помощи антигена HLA, и к способам применения таких композиций. Полинуклеотид наделяет CD8-положительные T-клетки специфичностью против MPHOSPH1-экспрессирующих злокачественных клеток за счет экспрессии TCR на поверхности CD8-положительных T-клеток, способного связываться с пептидом по настоящему изобретению, который презентирован на поверхности клетки-мишени при помощи антигена HLA. Полинуклеотиды, кодирующие альфа цепь/цепи и бета цепь/цепи, можно идентифицировать как субъединицу TCR ЦТЛ, индуцированных пептидом по настоящему изобретению, с применением способов, известных в данной области (WO2007/032255 и Morgan et al., J Immunol, 171, 3288 (2003)). Например, для анализа TCR предпочтительными являются способы ПЦР. Не ограничиваясь нижеописанными, праймеры для ПЦР для анализа могут быть, например, набором/наборами праймеров для амплификации путем комбинирования 5'-концевого праймера и 3'-концевого праймера/праймеров ниже:
5'-концевой праймер:
5'-R праймер (5'-gtctaccaggcattcgcttcat-3') (SEQ ID NO: 181)
3'-концевой праймер:
Специфичный к области С альфа-цепи TCR
3-TRa-C праймер (5'-tcagctggaccacagccgcagcgt-3') (SEQ ID NO: 182)
Специфичный к области С1 бета-цепи TCR
3-TRb-C1 праймер (5'-tcagaaatcctttctcttgac-3') (SEQ ID NO: 183) или
Специфичный к области С2 бета-цепи TCR
3-TR-бета-C2 праймер (5'-ctagcctctggaatcctttctctt-3') (SEQ ID NO: 184)
TCR, образованные за счет введения идентифицированных полинуклеотидов в CD8-положительные T-клетки, могут связываться с высокой аффинностью связывания с клетками-мишенями, которые презентируют пептид по настоящему изобретению, и опосредовать эффективный лизис клеток-мишеней, презентирующих пептид по настоящему изобретению, in vivo и in vitro.
Полинуклеотид, кодирующий каждую субъединицу TCR, можно вставлять в подходящий вектор, например, ретровирусный вектор. Эти векторы хорошо известны в данной области. Полинуклеотид или вектор, содержащий его в экспрессируемой форме, можно вводить в CD8-положительную T-клетку, например, CD8-положительную T-клетку, полученную от пациента. Настоящее изобретение относится к готовым композициям, которые позволяют легко и быстро получить модифицированные T-клетки, имеющие превосходные свойства лизиса злокачественных клеток, за счет быстрой модификации собственных Т-клеток пациента (или T-клеток, полученных от другого индивидуума).
В настоящем документе, специфический TCR представляет собой TCR, который может придавать специфическую цитотоксическую активность против клеток-мишеней за счет специфического распознавания комплекса пептида по настоящему изобретению и антигена HLA, презентированного на поверхности клеток-мишеней, при этом TCR присутствует на поверхности CD8-положительной T-клетки. Специфическое распознавание вышеописанного комплекса можно подтверждать любым известным способом, и предпочтительные примеры способов включают анализ окрашивания мультимеров HLA с использованием молекул HLA и пептидов по настоящему изобретению, и способы анализа иммуноферментных пятен (ELISPOT). Специфическое, опосредованное TCR, распознавание клетки-мишени Т-клеткой, в которую был введен вышеописанный полинуклеотид, и передачу сигнала в клетке можно подтверждать, проводя анализ ELISPOT. Когда вышеописанный TCR присутствует на поверхности CD8-положительной T-клетки, может ли он наделять CD8-положительную T-клетку специфической цитотоксической активностью против клетки-мишени можно также подтверждать известными способами. Предпочтительные способы включают, например, измерение цитотоксической активности против клеток-мишеней при помощи анализа высвобождения хрома или т.п.
Настоящее изобретение в отношении HLA-A11 относится к ЦТЛ, полученным путем трансформации CD8-положительных T-клеток полинуклеотидом, кодирующим каждую субъединицу TCR, которая связывается, например, с комплексом, образованным пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, и антигеном HLA-A11.
Настоящее изобретение в отношении HLA-A33 относится к ЦТЛ, полученным путем трансформации CD8-положительных T-клеток полинуклеотидом, кодирующим каждую субъединицу TCR, которая связывается, например, с комплексом, образованным пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118,119 и 170, и антигеном HLA-A33.
Трансформированные ЦТЛ способны к хоумингу (перемещению лимфоцитов из крови в лимфатические ткани) in vivo и могут быть выращены при помощи хорошо известного способа культивирования in vitro (например, Kawakami et al., J Immunol., 1989, 142: 3252-61). ЦТЛ по настоящему изобретению можно использовать для получения иммуногенной композиции, подходящей для лечения заболевания или предупреждения заболевания (профилактики) у пациента, нуждающегося в лечении или предупреждении заболевания (профилактике) (содержание включено в настоящий документ в виде ссылки WO2006/031221).
IX. Фармацевтические композиции
Настоящее изобретение дополнительно относится к композициям или фармацевтическим композициям, содержащим, по меньшей мере, один активный ингредиент, выбранный из нижеизложенных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК по настоящему изобретению;
(d) экзосома по настоящему изобретению; и
(e) ЦТЛ по настоящему изобретению.
Фармацевтические композиции по настоящему изобретению могут содержать по мере необходимости носитель/носители, эксципиент (-ы) или т.п., широко используемые в фармацевтических препаратах без конкретных ограничений, в дополнение к вышеописанному активному ингредиенту/ингредиентам. Примеры носителя, который можно использовать в фармацевтической композиции по настоящему изобретению, относятся к стерилизованной воде, физиологическому раствору, фосфатному буферу, культуральной жидкости и т.п. Таким образом, настоящее изобретение также относится к фармацевтическим композициям, содержащим, по меньшей мере, один активный ингредиент, выбранный из нижеизложенных от (a) до (e), и фармацевтически приемлемый носитель:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК по настоящему изобретению;
(d) экзосома по настоящему изобретению; и
(e) ЦТЛ по настоящему изобретению.
Дополнительно, фармацевтические композиции по настоящему изобретению могут содержать, по мере необходимости, стабилизаторы, суспензии, консерванты, поверхностно-активные вещества, солюбилизаторы, регуляторы pH, ингибиторы агрегации и т.п.
Экспрессия MPHOSPH1 значительно повышена в злокачественных клетках по сравнению с нормальными тканями. Таким образом, пептид по настоящему изобретению или полинуклеотид, кодирующий пептид, можно использовать для лечения и/или профилактики злокачественной опухоли, и/или профилактики ее послеоперационного рецидива. Таким образом, настоящее изобретение относится к фармацевтическим композициям для лечения и/или профилактики злокачественной опухоли, и/или профилактики ее послеоперационного рецидива, содержащим один или несколько типов пептидов или полинуклеотидов по настоящему изобретению в качестве активного ингредиента. Альтернативно, пептиды по настоящему изобретению можно производить для презентирования на поверхности экзосом или АПК для применения в качестве фармацевтических композиций. Кроме того, ЦТЛ по настоящему изобретению, нацеленный на любой один из пептидов по настоящему изобретению, также можно использовать в качестве активного ингредиента фармацевтических композиций по настоящему изобретению. Фармацевтические композиции по настоящему изобретению могут содержать терапевтически эффективное количество или фармацевтически эффективное количество вышеописанного активного ингредиента.
Фармацевтические композиции по настоящему изобретению также можно использовать в качестве вакцины. В контексте настоящего изобретения, термин «вакцина» (также называемая «иммуногенная композиция») относится к композициям, которые имеют функцию индуцирования иммунного ответа, приводящего к противоопухолевому действию при введении животному. Таким образом, фармацевтическую композицию по настоящему изобретению можно использовать для индуцирования иммунного ответа, приводящего к противоопухолевому действию у индивидуума. Иммунный ответ, индуцируемый пептидом, полинуклеотидом, АПК, ЦТЛ и фармацевтической композицией по настоящему изобретению, конкретно не ограничен при условии, что он является иммунным ответом, который приводит к противоопухолевому действию, и примеры включают индуцирование ЦТЛ, специфичных к злокачественным клеткам, и индуцирование специфической цитотоксической активности против злокачественных клеток.
Фармацевтические композиции по настоящему изобретению можно использовать для лечения и/или профилактики злокачественной опухоли, и/или профилактики ее послеоперационного рецидива у человеческих индивидуумов или пациентов. Фармацевтические композиции по настоящему изобретению можно использовать предпочтительно индивидууму, положительному, по меньшей мере, по одному HLA, выбранному из HLA-A11 и HLA-A33. Дополнительно, фармацевтические композиции по настоящему изобретению можно использовать предпочтительно для лечения и/или профилактики злокачественных опухолей, экспрессирующих MPHOSPH1 и, по меньшей мере, один HLA, выбранный из HLA-A11 и HLA-A33, и/или для профилактики их послеоперационного рецидива.
В другом варианте осуществления настоящее изобретение относится к применению активного ингредиента, выбранного из нижеуказанных, в производстве фармацевтической композиции для лечения или профилактики злокачественной опухоли:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Альтернативно, настоящее изобретение дополнительно относится к активному ингредиенту, выбранному из нижеуказанных, для применения в лечении или профилактике злокачественной опухоли:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Альтернативно, настоящее изобретение дополнительно относится к способу или процессу для производства фармацевтической композиции для лечения или профилактики злокачественной опухоли, где способ или процесс включает этап формулирования, по меньшей мере, одного активного ингредиента, выбранного из нижеуказанных, с фармацевтически или физиологически приемлемым носителем:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
В другом варианте осуществления настоящее изобретение дополнительно относится к способу или процессу для производства фармацевтической композиции для лечения или профилактики злокачественной опухоли, где способ или процесс включает этап смешивания активного ингредиента, выбранного из нижеуказанных, с фармацевтически или физиологически приемлемым носителем:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
В другом варианте осуществления настоящее изобретение дополнительно относится к способу лечения или профилактики злокачественной опухоли, который включает этап введения индивидууму, по меньшей мере, одного активного ингредиента, выбранного из нижеуказанных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
В настоящем изобретении, пептид с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, идентифицирован как эпитопный пептид, рестриктированный по HLA-A11, который может индуцировать мощный и специфический иммунный ответ. Таким образом, фармацевтические композиции по настоящему изобретению, содержащие, по меньшей мере, один из пептидов с аминокислотной последовательностью, выбранной из SEQ ID NO: 5, 12, 27, 52 и 53 являются подходящими, в частности для введения индивидууму с HLA-A11 (например, HLA-A*11:01) в качестве антигена HLA. То же самое относится и к фармацевтическим композициям, содержащим полинуклеотид, кодирующий любые из этих пептидов (т.е., полинуклеотиды по настоящему изобретению), АПК или экзосому, которые презентируют эти пептиды (т.е., АПК или экзосомы по настоящему изобретению), или ЦТЛ, нацеленный на эти пептиды (т.е., ЦТЛ по настоящему изобретению). То есть, фармацевтические композиции, содержащие активный ингредиент в сочетании с пептидом с аминокислотной последовательностью, выбранной из SEQ ID NO: 5, 12, 27, 52 и 53 являются подходящими для введения индивидуумам с HLA-A11 (т.е., HLA-A11-положительным индивидуумам). В более предпочтительном варианте осуществления фармацевтическая композиция по настоящему изобретению представляет собой фармацевтическую композицию, которая содержит пептид с аминокислотной последовательностью из SEQ ID NO: 52.
Аналогично, в настоящем изобретении, пептиды с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170, идентифицированы как эпитопные пептиды, рестриктированные по HLA-A33, которые могут индуцировать мощный и специфический иммунный ответ. Таким образом, фармацевтические композиции по настоящему изобретению, содержащие, по меньшей мере, один из пептидов с аминокислотной последовательностью, выбранной из числа SEQ ID NOs: 118, 119 и 170, являются подходящими, в частности для введения индивидууму с HLA-A33 (например, HLA-A*33:03) в качестве антигена HLA. То же самое относится и к фармацевтическим композициям, содержащим полинуклеотид, кодирующий любые из этих пептидов (т.е., полинуклеотиды по настоящему изобретению), АПК или экзосому, которые презентируют эти пептиды (т.е., АПК или экзосомы по настоящему изобретению), или a ЦТЛ, нацеленный на эти пептиды (т.е., ЦТЛ по настоящему изобретению). То есть, фармацевтические композиции, содержащие активный ингредиент в сочетании с пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170, являются подходящими для введения индивидуумам с HLA-A33 (т.е., HLA-A33-положительным индивидуумам). В более предпочтительном варианте осуществления фармацевтическая композиция по настоящему изобретению представляет собой фармацевтическую композицию, которая содержит пептид с аминокислотной последовательностью из SEQ ID NO: 118.
Злокачественные опухоли для лечения и/или профилактики при помощи фармацевтических композиций по настоящему изобретению конкретно не ограничены при условии, что они являются злокачественными опухолями, экспрессирующими MPHOSPH1, и включают различные злокачественные опухоли, например, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, хронический миелолейкоз (ХМЛ), рак толстого кишечника, рак желудка, рак легких, лимфому, остеосаркому, рак предстательной железы, рак почки, опухоль мягких тканей и т.п. Помимо этого, фармацевстические композиции по настоящему изобретению могут быть предпочтительно использованы для индивидуумов, которые имеют аллель HLA в гомозиготном или гетерозиготном состоянии, выбранный из числа HLA-A11 и HLA-A33.
В дополнение к активным ингредиентам, описанным выше, фармацевтические композиции по настоящему изобретению могут содержать другие пептиды, которые имеют способность индуцировать ЦТЛ против злокачественных клеток (например, другие полученные из TAA индуцирующие ЦТЛ пептиды), другие полинуклеотиды, кодирующие другие пептиды, другие клетки, которые презентируют другие пептиды, или т.п.
Фармацевтические композиции по настоящему изобретению могут также необязательно содержать другие терапевтические вещества в качестве активного ингредиента, при условии, что они не ингибируют противоопухолевые воздействия вышеписанных активных ингредиентов, таких как пептиды по настоящему изобретению. Например, фармацевтические композиции по настоящему изобретению необязательно могут содержать противовоспалительные композиции, анальгетики, химиотерапевтические препараты и т.п. В дополнение к включению других терапевтических веществ в фармацевтическую композицию по настоящему изобретению, можно также вводить фармацевтическую композицию по настоящему изобретению последовательно или одновременно с одной или несколькими другими фармацевтическими композициями. Доза фармацевтической композиции по настоящему изобретению и других фармацевтических композиций зависит, например, от типа применяемой фармацевтической композиции и заболевания, которое лечат, а также от режима и путей введения.
Следует понимать, что с учетом типа состава, фармацевтическая композиция по настоящему изобретению может включать другие компоненты, общепринятые в данной области, в дополнение к ингредиентам, конкретно упомянутым в настоящем документе.
Настоящее изобретение также относится к промышленным изделиям или наборам, которые содержат фармацевтическую композицию по настоящему изобретению. Промышленные изделия или наборы по настоящему изобретению могут включать контейнер, который содержит фармацевтическую композицию по настоящему изобретению. Пример подходящего контейнера включает бутылку, флакон или пробирку, но не ограничивается ими. Контейнер может быть сделан из различных материалов, таких как стекло или пластик. К контейнеру может быть присоединена этикетка, и на этикетке может быть описано заболевание или состояние болезни, для которого должна быть использована фармацевтическая композиция по настоящему изобретению. Этикетка может также содержать указания для введения и т.п.
Промышленные изделия или наборы по настоящему изобретению могут дополнительно включать второй контейнер, который содержит фармацевтически приемлемые разбавители, необязательно, в дополнение к контейнеру, который содержит фармацевтическую композицию по настоящему изобретению. Промышленные изделия или наборы по настоящему изобретению могут дополнительно содержать другие материалы, необходимые с коммерческой точки зрения и с точки зрения пользователя, такие как другие буферы, разбавители, фильтры, иглы для инъекций, шприцы и вкладыши в упаковку с инструкциями по применению.
По мере необходимости, фармацевтическую композицию по настоящему изобретению можно предоставлять в упаковке или в дозаторном устройстве, которые могут содержать одну или несколько единиц лекарственных форм, содержащих активные ингредиенты. Упаковка может включать, например, металлическую пленку или полимерную пленку, такую как блистерная упаковка. Инструкции для введения могут быть прикреплены к упаковке или к дозаторному устройству.
(1) Фармацевтические композиции, содержащие пептид(-ы) в качестве активного ингредиента
Фармацевтическую композицию, содержащую пептид по настоящему изобретению можно формулировать путем общепринятых способов рецептуры по мере необходимости. Фармацевтические композиции по настоящему изобретению могут включать по мере необходимости в дополнение к пептиду по настоящему изобретению, носители, эксципиенты и т.п., широко используемые в фармацевтических препаратах без конкретных ограничений. Примеры носителей, которые можно использовать в фармацевтических композициях по настоящему изобретению включают стерилизованную воду (например, воду для инъекций), физиологический раствор, фосфатный буфер, фосфатно-солевой буфер, физиологический раствор, забуференный Трисом, 0,3% глицин, культуральную жижкость, и т.п. Дополнительно, фармацевтические композиции по настоящему изобретению могут содержать по мере необходимости стабилизаторы, суспензии, консерванты, поверхностно-активные вещества, солюбилизаторы, регуляторы pH, ингибиторы агрегации, и т.п. Фармацевтические композиции по настоящему изобретению могут индуцировать специфический иммунитет против MPHOSPH1-экспрессирующих злокачественных клеток, и, таким образом, их можно применять с целью лечения злокачественных опухолей или предупреждения (профилактики) злокачественных опухолей.
Например, фармацевтические композиции по настоящему изобретению можно получать путем растворения в фармацевтически или физиологически приемлемых водорастворимых носителях, таких как стерилизованная вода (например, вода для инъекций), физиологический раствор, фосфатный буфер, фосфатно-солевой буфер, физиологический раствор, забуференный Трисом, и добавления, по мере необходимости, стабилизаторов, суспензий, консервантов, поверхностно-активных веществ, солюбилизаторов, регуляторов pH, ингибиторов агрегации, и т.п., а затем стерилизации раствора пептида. Способ стерилизации раствора пептида конкретно не ограничен, и предпочтительно проводится путем стерилизации фильтрацией. Стерилизацию фильтрацией можно проводить при помощи, например, фильтра для стерилизации фильтрацией 0,22 мкм или менее по диаметру пор. Раствор пептида, стерилизованный фильтрацией, можно вводить индивидууму, например, в виде инъекции, не ограничиваясь ею.
Фармацевтические композиции по настоящему изобретению можно получать в виде лиофилизированного состава путем лиофильного высушивания вышеописанного раствора пептида. Лиофилизированный состав можно получать путем заполнения раствором пептида, приготовленным, как описано выше, подходящего контейнера, такого как ампула, флакон или пластиковый контейнер, с последующей лиофильной сушкой и инкапсуляцией в контейнер с промытой стерилизованной резиновой пробкой или т.п. после восстановления давления. Лиофилизированный состав можно вводить индивидууму после повторного растворения в фармацевтически или физиологически приемлемых водорастворимых носителях, таких как стерилизованная вода (например, вода для инъекций), физиологический раствор, фосфатный буфер, фосфатно-солевой буфер, физиологический раствор, забуференный Трисом, и т.п., перед введением. Предпочтительные примеры фармацевтических композиций по настоящему изобретению включают инъекции такого стерилизованного фильтрацией раствора пептида, и лиофилизированные составы, которые получают из лиофилизированного раствора пептида. Настоящее изобретение дополнительно включает наборы, содержащие такой лиофилизированный состав и раствор для повторного растворения. Настоящее изобретение также включает наборы, содержащие контейнер, который содержит лиофилизированный состав, который представляет собой фармацевтическую композицию по настоящему изобретению, и контейнер, который содержит раствор для его повторного растворения.
Фармацевтические композиции по настоящему изобретению могут включать комбинацию двух или более типов пептидов по настоящему изобретению. Комбинация пептидов может быть в форме коктейля из смешанных пептидов, или они могут быть конъюгированы друг с другом стандартными способами. Например, пептиды могут быть химически связаны или могут экспрессироваться в виде последовательностей одиночного слитого полипептида. За счет введения пептида по настоящему изобретению, пептид с высокой плотностью презентируется на АПК при помощи антигена HLA, а затем ЦТЛ, которые специфически реагируют с комплексом, образованным между презентируемым пептидом и антигеном HLA, индуцируются. Альтернативно, АПК (например, DC) забирают у индивидуума, и затем стимулируют пептидами по настоящему изобретению для получения АПК, которые презентируют любой из пептидов по настоящему изобретению на своей клеточной поверхности. Эти АПК повторно вводят индивидууму для индуцирования ЦТЛ у индивидуума, и в результате, повышается их агрессивность по отношению к MPHOSPH1-экспрессирующим злокачественным клеткам.
Фармацевтические композиции по настоящему изобретению могут также содержать адъювант, известный эффективным формированием клеточного иммунитета. Адъювант относится к соединению, которое усиливает иммунный ответ против антигена и которое имеет иммунологическую активность при введении вместе (или последовательно) с антигеном. Можно использовать известные адъюванты, описанные в литературе, например, Clin Microbiol Rev 1994, 7: 277-89. Примеры подходящего адъюванта включают соли алюминия (фосфат алюминия, гидроксид алюминия, алюминий оксигидроксид и т.п.), квасцы, холерный токсин, токсин сальмонеллы, неполный адъювант Фрейнда (IFA), полный адъювант Фрейнда (CFA), ISCOMatrix, GM-CSF и другие иммуностимулирующие цитокины, олигодезоксинуклеотид, содержащий мотив CpG (CpG7909 и т.п.), эмульсии «масло-в-воде», сапонин или его производные (QS21 и т.п.), липополисахарид, такой как липид A или его производные (MPL, RC529, GLA, E6020 и т.п.), липопептиды, лактоферрин, флагеллин, двухцепочечную РНК или ее производные (poly I:C и т.п.), бактериальную ДНК, имидазохинолины (имиквимод, R848 и т.п.), лиганд лектина С-типа (трегалоза-6,6'-дибегенат (TDB) и т.п.), лиганд CD1d (альфа-галактозилцерамид и т.п.), скваленовые эмульсии (MF59, AS03, AF03 и т.п.), PLGA, и т.п., не ограничиваясь указанными. Адъювант может находиться в другом контейнере отдельно от фармацевтической композиции, содержащей пептид по настоящему изобретению, в наборах, содержащих фармацевтическую композицию по настоящему изобретению. В этом случае, адъювант и фармацевтическую композицию можно вводить индивидууму последовательно, или смешивать друг с другом непосредственно перед введением индивидууму. Такие наборы, содержащие фармацевтическую композицию, включающую пептид по настоящему изобретению и адъювант, также предусмотрены настоящим изобретением. Когда фармацевтическая композиция по настоящему изобретению представляет собой лиофилизированный состав, набор может дополнительно содержать раствор для повторного растворения. Дополнительно, настоящее изобретение относится к наборам, содержащим контейнер, который содержит фармацевтическую композицию по настоящему изобретению и контейнер, который содержит адъювант. Набор может дополнительно содержать по мере необходимости контейнер, который содержит раствор для повторного растворения.
Когда в качестве адъюванта используют масляный адъювант, фармацевтическую композицию по настоящему изобретению можно получать в виде эмульсии. Эмульсии можно получать, например, путем смешивания и перемешивания раствора пептида, приготовленного, как описано выше, и масляного адъюванта. Раствор пептида может быть раствором, который был восстановлен после лиофилизации. Эмульсия может быть или типа «вода в масле», или типа «масло в воде», и эмульсия типа «вода в масле» является предпочтительной для получения высокоэффективного усиленного иммунного ответа. В качестве масляного адъюванта может быть предпочтительно использован IFA, без ограничений упомянутым. Получение эмульсии можно проводить непосредственно перед введением индивидууму, и в этом случае, фармацевтическая композиция по настоящему изобретению может быть предоставлена в виде набора, содержащего раствор пептида по настоящему изобретению и масляный адъювант. Когда фармацевтическая композиция по настоящему изобретению представляет собой лиофилизированный состав, набор может дополнительно содержать раствор для повторного растворения.
Дополнительно, фармацевтическая композиция по настоящему изобретению может быть составом с липосомами, в которые инкапсулирован пептид по настоящему изобретению, гранулярным составом, в котором пептид связан с гранулами несколько микрометров в диаметре, или составом, в котором липид связан с пептидом.
В другом варианте осуществления настоящего изобретения пептид по настоящему изобретению также можно вводить в форме фармацевтически приемлемой соли. Предпочтительные примеры солей включают соли со щелочными металлами (литием, калием, натрием и т.п.), соли со щелочноземельными металлами (кальцием, магнием и т.п.), соли с другими металлами (медью, железом, цинком, марганцем и т.п.), соли с органическими основаниями, соли с аминами, соли с органическими кислотами (уксусной кислотой, муравьиной кислотой, пропионовой кислотой, фумаровой кислотой, малеиновой кислотой, янтарной кислотой, винной кислотой, лимонной кислотой, яблочной кислотой, щавелевой кислотой, бензойной кислотой, метансульфоновой кислотой и т.п.), и соли с неорганическими кислотами (соляной кислотой, фосфорной кислотой, бромистоводородной кислотой, серной кислотой, азотной кислотой и т.п.). Фраза «фармацевтически приемлемая соль», применяемая в настоящем документе, относится к соли, которая сохраняет фармакологическую и фармацевтическую эффективность и свойства соединений. Таким образом, фармацевтические композиции, содержащие фармацевтически приемлемую соль пептида по настоящему изобретению, также охватываются настоящим изобретением. Дополнительно, «пептид по настоящему изобретению» также включает, в дополнение к свободному пептиду, его фармацевтически приемлемые соли.
В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению могут дополнительно включать компонент, который примирует ЦТЛ. Липиды были идентифицированы как вещества, способные примировать ЦТЛ in vivo против вирусных антигенов. Например, остатки пальмитиновой кислоты можно присоединять к эпсилон- и альфа-аминогруппам остатка лизина, а затем связывать с пептидом по настоящему изобретению. Липидированный пептид затем можно вводить или напрямую в мицеллу или частицу, включенную в липосому, или эмульгировать в адъюванте. В качестве другого примера липида, примирующего ответы ЦТЛ, можно использовать липопротеины E. coli, такие как трипальмитоил-S-глицерилцистенил-серил-серин (P3CSS), для примирования ЦТЛ при ковалентном присоединении к соответствующему пептиду (см., например, Deres et al., Nature 1989, 342: 561-4).
Примеры подходящих способов для введения пептидов или фармацевтических композиций по настоящему изобретению включают пероральные, эпидермальные, подкожные, внутримышечные, внутрикостные, внутрибрюшинные, и внутривенные инъекции, а также системное введение или местное введение в непосредственной близости от участков-мишеней, но не ограничиваются перечисленными. Предпочтительный способ введения включает подкожную инъекцию в непосредственной близости от лимфоузлов, таких как подмышечный или паховый. Более конкретно, например, подкожное введение является предпочтительным, если фармацевтическая композиция по настоящему изобретению в качестве активного ингредиента содержит пептид или экзосому. Альтернативно, композиции с APC или ЦТЛ в качестве активного ингредиента можно вводить путем внутривенной инъекции или т.п. Введение можно проводить путем одиночного введения или разделенным на несколько введений.
Пептиды по настоящему изобретению можно вводить индивидууму в терапевтически или фармацевтически эффективном количестве для лечения злокачественной опухоли или в терапевтически или фармацевтически эффективном количестве для индуцирования иммунитета (более конкретно, ЦТЛ) против MPHOSPH1-экспрессирующих злокачественных клеток. Доза пептидов по настоящему изобретению может быть соответствующим образом скорректирована в соответствии с заболеванием, подлежащим лечению, возрастом и массой пациента, способом введения и т.п. Для каждого из пептидов по настоящему изобретению, доза составляет, как правило, 0,001 мг - 1000 мг, например, 0,01 мг - 100 мг, например, 0,1 мг - 30 мг, например, 0,1 мг - 10 мг, например, 0,5 мг - 5 мг. Интервал между дозами может составлять от одного раза каждые несколько суток до нескольких месяцев, и например, дозировку можно производить с интервалом раз в неделю. Специалист в данной области может соответствующим образом выбрать подходящую дозу (дозирование).
В предпочтительном варианте осуществления фармацевтические композиции по настоящему изобретению содержат терапевтически эффективное количество пептида по настоящему изобретению и фармацевтически или физиологически приемлемый носитель. В другом варианте осуществления фармацевтические композиции по настоящему изобретению содержат терапевтически эффективное количество пептида по настоящему изобретению, фармацевтически или физиологически приемлемый носитель и адъювант. Фармацевтические композиции по настоящему изобретению могут содержать 0,001 мг - 1000 мг, предпочтительно 0,01 мг - 100 мг, более предпочтительно 0,1 мг - 30 мг, даже более предпочтительно 0,1 мг - 10 мг, например, 0,5 мг - 5 мг пептида по настоящему изобретению. Когда фармацевтическая композиция по настоящему изобретению представляет собой инъекцию, она может содержать пептид по настоящему изобретению в концентрации 0,001 мг/мл - 1000 мг/мл, предпочтительно 0,01 мг/мл - 100 мг/мл, более предпочтительно 0,1 мг/мл - 30 мг/мл, даже более предпочтительно 0,1 мг/мл - 10 мг/мл, например, 0,5 мг/мл - 5 мг/мл. В этом случае, например, можно вводить индивидууму путем инъекции от 0,1 до 5 мл, предпочтительно, от 0,5 мл до 2 мл фармацевтической композиции по настоящему изобретению.
Дополнительно, настоящее изобретение относится к способам лечения и/или профилактики злокачественной опухоли и/или профилактики ее послеоперационного рецидива, которые включают введение индивидууму терапевтически эффективного количества пептида по настоящему изобретению или фармацевтической композиции по настоящему изобретению. Как описано выше, пептиды по настоящему изобретению можно вводить индивидууму в однократной дозе, как правило, 0,001 мг - 1000 мг, например, 0,01 мг - 100 мг, например, 0,1 мг - 30 мг, например, 0,1 мг - 10 мг, или например, 0,5 мг - 5 мг. В предпочтительном варианте осуществления пептиды по настоящему изобретению вводят индивидууму вместе с адъювантом. Дополнительно, интервал между дозами может составлять от одного раза каждые несколько суток до нескольких месяцев, предпочтительно от одного раза каждые несколько суток до раза в месяц, например, от одного раза в неделю или одного раза в две недели.
(2) Фармацевтические композиции, содержащие полинуклеотиды в качестве активного ингредиента
Фармацевтические композиции по настоящему изобретению могут также содержать полинуклеотиды, кодирующие пептиды по настоящему изобретению, в экспрессируемой форме. В настоящем документе, фраза «в экспрессируемой форме» означает, что полинуклеотид, при введении в клетку, будет экспрессироваться как пептид по настоящему изобретению. В примере варианта осуществления, последовательность полинуклеотида по настоящему изобретению относится к регуляторным элементам, необходимым для экспрессии пептида по настоящему изобретению. Полинуклеотид(-ы) по настоящему изобретению могут быть дополнены последовательностью, необходимой для достижения стабильной вставки в геном клеток-мишеней (см., например, Thomas KR & Capecchi MR, Cell 1987, 51: 503-12 для описания кассетных векторов для гомологичной рекомбинации). См., например, Wolff et al., Science 1990, 247: 1465-8; патенты США №№ 5580859, 5589466, 5804566, 5739118, 5736524, 5679647; и WO98/04720. Примеры технологий доставки на основе ДНК включают «голую ДНК», облегченную доставку (бупивакаин, полимеры, опосредованную пептидами), комплексы катионных липидов, и доставку, опосредованную частицами («генная пушка») или давлением (см., например, патент США № 5922687).
Пептиды по настоящему изобретению можно также экспрессировать при помощи вирусных или бактериальных векторов. Примеры экспрессирующих векторов включают аттенуированные вирусы-хозяева, такие как вирус осповакцины или вирус оспы кур. Например, можно использовать вирус осповакцины в качестве вектора для экспрессии пептида по настоящему изобретению. После введения в хозяина, рекомбинантный вирус осповакцины экспрессирует иммуногенный пептид, и, таким образом, вызывает иммунный ответ. Векторы на основе вируса осповакцины и способы, подходящие для протоколов иммунизации, описаны, например, в патенте США № 4722848. Другим вектором является БЦЖ (бацилла Кальмета-Герена). Векторы на основе БЦЖ описаны у Stover et al., Nature 1991, 351: 456-60. Будет очевиден широкий спектр других векторов, подходящих для терапевтического введения или иммунизации, например, аденовирусные и аденоассоциированные вирусные векторы, ретровирусные векторы, векторы на основе Salmonella typhi, векторы на основе обезвреженного токсина сибирской язвы и т.п. См., например, Shata et al., Mol Med Today 2000, 6: 66-71; Shedlock et al., J Leukoc Biol 2000, 68: 793-806; Hipp et al., In Vivo 2000, 14: 571-85.
Доставка полинуклеотида по настоящему изобретению пациенту может быть или прямой, при этом пациент может напрямую получать вектор, несущий полинуклеотид по настоящему изобретению, или опосредованной, при этом, сначала клетки трансформируются вектором, несущим полинуклеотид по настоящему изобретению in vitro, затем клетки пересаживают пациенту. Эти два подхода известны, соответственно, как генная терапия in vivo и ex vivo.
Для общих обзоров способов генотерапии, см. Goldspiel et al., Clinical Pharmacy 1993, 12: 488-505; Wu и Wu, Biotherapy 1991, 3: 87-95; Tolstoshev, Ann Rev Pharmacol Toxicol 1993, 33: 573-96; Mulligan, Science 1993, 260: 926-32; Morgan & Anderson, Ann Rev Biochem 1993, 62: 191-217; Trends in Biotechnology 1993, 11(5): 155-215. Способы, общеизвестные в области технологии рекомбинантных ДНК, которые также можно использовать для настоящего изобретения, описаны в Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, NY, 1993; и Krieger, Gene Transfer и Expression, A Laboratory Manual, Stockton Press, NY, 1990.
Аналогично введению пептидов, введение полинуклеотидов можно проводить путем пероральной, интрадермальной, подкожной, внутривенной, внутримышечной, внутрикостной и/или внутрибрюшинной инъекции, и т.п. Введение полинуклеотидов может быть системным введением или местным введением в непосредственной близости от участков-мишеней. Введение можно проводить путем одиночного введения или разделенным на несколько введений. Полинуклеотиды по настоящему изобретению можно вводить индивидууму в терапевтически или фармацевтически эффективном количестве для лечения злокачественной опухоли или в терапевтически или фармацевтически эффективном количестве для индуцирования иммунитета (более конкретно, ЦТЛ) против MPHOSPH1-экспрессирующих злокачественных клеток. Доза полинуклеотида в подходящем носителе или доза полинуклеотида в клетках, трансформированных полинуклеотидом, кодирующим пептид по настоящему изобретению, может быть соответствующим образом скорректирована в соответствии с заболеванием, подлежащим лечению, возрастом и массой пациента, способом введения и т.п., и она может составлять, как правило, 0,001 мг - 1000 мг, например, 0,01 мг - 100 мг, например, 0,1 мг - 30 мг, например, 0,1 мг - 10 мг, или например, 0,5 мг - 5 мг. Интервал между дозами может составлять от одного раза каждые несколько суток до нескольких месяцев, и например, дозировку можно производить с интервалом раз в неделю. Специалист в данной области может соответствующим образом выбрать подходящую дозу (дозирование).
X. Способы применения пептидов, экзосом, АПК и ЦТЛ
Пептиды и полинуклеотиды по настоящему изобретению можно использовать для индуцирования АПК и ЦТЛ. ЦТЛ можно также индуцировать при помощи экзосом и АПК по настоящему изобретению. Пептиды, полинуклеотиды, экзосомы и АПК по настоящему изобретению можно использовать в комбинации с любым другим соединением/соединениями при условии, что не будет ингибирована их способность индуцировать ЦТЛ. Таким образом, ЦТЛ по настоящему изобретению можно индуцировать при помощи фармацевтической композиции, содержащей любой из пептидов, полинуклеотиды, АПК и экзосомы по настоящему изобретению. Дополнительно, АПК по настоящему изобретению можно индуцировать при помощи фармацевтической композиции, содержащей пептид или полинуклеотид по настоящему изобретению.
(1) Способы индуцирования АПК
Настоящее изобретение относится к способам индуцирования АПК со способностью индуцировать ЦТЛ, при помощи пептида/пептидов или полинуклеотида/полинуклеотидов по настоящему изобретению.
Способы по настоящему изобретению включают этап контакта АПК с пептидом по настоящему изобретению in vitro, ex vivo, или in vivo. Например, способ контакта АПК с пептидом ex vivo может включать нижеизложенные этапы:
(a) забор АПК у индивидуума; и
(b) контакт АПК из этапа (a) с пептидом по настоящему изобретению.
Вышеописанные АПК не ограничиваются конкретным типом клеток, и можно использовать DC, клетки Лангерганса, макрофаги, B-клетки, и активированные T-клетки, о которых известно, что они презентируют белковые антигены на своей клеточной поверхности, таким образом, что они распознаются лимфоцитами. Среди АПК, DC имеют наиболее мощную способность индуцировать ЦТЛ, и, таким образом, предпочтительно использовать DC. Любые пептиды по настоящему изобретению можно использовать сами по себе или в комбинации с другими пептидами по настоящему изобретению. Дополнительно, пептиды по настоящему изобретению можно использовать в комбинации с другими пептидами, индуцирующими ЦТЛ (например, другими полученными из TAA индуцирующими ЦТЛ пептидами).
Помимо этого, когда пептид по настоящему изобретению вводят индивидууму, АПК контактируют с пептидом in vivo, и в результате АПК, имеющие высокую способность индуцировать ЦТЛ, индуцируются в организме индивидуума. Таким образом, способы по настоящему изобретению могут включать этап введения пептида по настоящему изобретению индивидууму. Аналогично, когда полинуклеотид по настоящему изобретению вводят индивидууму в экспрессируемой форме, пептид по настоящему изобретению экспрессируется in vivo, экспрессировавшийся пептид контактирует с АПК in vivo, и в результате АПК, имеющие высокую способность индуцировать ЦТЛ, индуцируются в организме индивидуума. Таким образом, настоящее изобретение может также включать этап введения полинуклеотида по настоящему изобретению индивидууму.
Для того чтобы индуцировать АПК со способностью индуцировать ЦТЛ, настоящее изобретение может включать этап введения полинуклеотида по настоящему изобретению в АПК. Например, способ может включать нижеизложенные этапы:
(a) забор АПК у индивидуума; и
(b) введение полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК из этапа (a).
Этап (b) можно проводить, как описано выше в разделе «VI. Антигенпрезентирующие клетки (АПК)».
Таким образом, в одном из вариантов осуществления настоящее изобретение относится к способу индуцирования АПК со способностью индуцировать ЦТЛ, включающему нижеизложенные этапы (a) или (b):
(a) контакт АПК с пептидом по настоящему изобретению; или
(b) введение полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК.
Кроме того, настоящее изобретение относится к способу получения АПК со способностью индуцировать ЦТЛ, включающему нижеизложенные этапы (a) или (b):
(a) контакт АПК с пептидом по настоящему изобретению; или
(b) введение полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК.
Вышеописанные способы можно проводить in vitro, ex vivo, или in vivo, и предпочтительно проводить их in vitro или ex vivo. АПК, применяемые в вышеописанных способах, можно получать от индивидуума, которому планируется вводить индуцированные АПК, или их можно получать от другого индивидуума. Когда используют АПК, полученные от индивидуума (донора), отличного от индивидуума, для которого запланировано введение, индивидуум для введения и донор должны иметь идентичный тип HLA.
В способах по настоящему изобретению, когда пептид с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, или его модифицированный пептид используют в качестве пептида по настоящему изобретению, HLA предпочтительно представляет собой HLA-A11 (более предпочтительно HLA-A*11:01) как у индивидуума для введения, так и у донора. Альтернативно, АПК, применяемые в вышеописанных способах, предпочтительно представляют собой АПК, которые экспрессируют HLA-A11 (более предпочтительно HLA-A*11:01).
Аналогично, когда пептид с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170, или его модифицированный пептид используют в качестве пептида по настоящему изобретению, HLA предпочтительно представляет собой HLA-A33 (более предпочтительно HLA-A*33:03), как у индивидуума для введения, так и у донора. Альтернативно, АПК, применяемые в вышеописанных способах, предпочтительно представляют собой АПК, которые экспрессируют HLA-A33 (более предпочтительно HLA-A*33:03). АПК можно получать с применением известных способов из PBMC, после того как PBMC выделены из крови, полученной от донора, путем способа центрифугирования с удельной плотностью или т.п.
В другом варианте осуществления настоящее изобретение также относится к фармацевтическим композициям, которые содержат пептид по настоящему изобретению или полинуклеотид, кодирующий пептид, для индуцирования АПК со способностью индуцировать ЦТЛ.
Альтернативно, настоящее изобретение дополнительно относится к применению пептида по настоящему изобретению или полинуклеотида, кодирующего пептид, в производстве фармацевтической композиции для индуцирования АПК со способностью индуцировать ЦТЛ.
Альтернативно, настоящее изобретение дополнительно относится к пептидам по настоящему изобретению или полинуклеотидам, кодирующим пептиды, для применения для индуцирования АПК со способностью индуцировать ЦТЛ.
Альтернативно, настоящее изобретение дополнительно относится к способам или процессам производства фармацевтической композиции для индуцирования АПК, где способ или процесс включают этап формулирования пептида по настоящему изобретению или полинуклеотида, кодирующего пептид, с фармацевтически или физиологически приемлемым носителем.
В другом варианте осуществления настоящее изобретение дополнительно относится к способам или процессам производства фармацевтической композиции для индуцирования АПК со способностью индуцировать ЦТЛ, где способ или процесс включают этап смешивания пептида по настоящему изобретению или полинуклеотида, кодирующего пептид, с фармацевтически или физиологически приемлемым носителем.
АПК, индуцированные способами по настоящему изобретению, могут индуцировать ЦТЛ, специфичные к MPHOSPH1 (т.е., ЦТЛ по настоящему изобретению).
(2) Способы индуцирования ЦТЛ
Настоящее изобретение также относится к способам индуцирования ЦТЛ с использованием пептидов, полинуклеотидов, экзосом или АПК по настоящему изобретению. Настоящее изобретение дополнительно относится к способам индуцирования ЦТЛ с использованием одного или нескольких полинуклеотидов, кодирующих полипептид(-ы), которые могут формировать T-клеточный рецептор (TCR) (т.е., субъединицу TCR), способный распознавать комплекс пептида по настоящему изобретению и антигена HLA. Предпочтительно, способы индуцирования ЦТЛ включают, по меньшей мере, один этап, выбранный из нижеизложенных:
(a) контакт CD8-положительных T-клеток с антигенпрезентирующими клетками, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению;
(b) контакт CD8-положительных T-клеток с экзосомами, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению; и
(c) введение в CD8-положительные T-клетки одного или нескольких полинуклеотидов, кодирующих полипептид(-ы), которые могут формировать TCR, способный распознавать комплекс пептида по настоящему изобретению и антигена HLA.
Когда пептид(-ы), полинуклеотид(-ы), экзосому/экзосомы или АПК по настоящему изобретению вводят индивидууму, ЦТЛ индуцируются в организме индивидуума, и сила иммунного ответа, нацеленного на MPHOSPH1-экспрессирующие злокачественные клетки, возрастает. Таким образом, способы по настоящему изобретению могут включать этап введения индивидууму пептида/пептидов, полинуклеотида/полинуклеотидов, АПК или экзосомы/экзосом по настоящему изобретению.
Альтернативно, ЦТЛ можно индуцировать при использовании их in vitro или ex vivo. Например, способы по настоящему изобретению могут включать следующие этапы:
(a) забор АПК у индивидуума;
(b) контакт АПК из этапа (а) с пептидом по настоящему изобретению; и
(c) совместное культивирование АПК из этапа (b) с CD8-положительными T-клетками.
Индуцированные ЦТЛ впоследствии можно возвращать индивидууму.
АПК для совместного культивирования с CD8-положительными T-клетками из этапа (c) выше также можно получать путем введения в АПК полинуклеотида, кодирующего пептид по настоящему изобретению, как описано выше в разделе «VI. Антигенпрезентирующие клетки (АПК)». Однако АПК для применения в способах по настоящему изобретению не ограничиваются вышеуказанными, и можно использовать любые АПК, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению.
В способах по настоящему изобретению, вместо таких АПК, также можно использовать экзосомы, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению. То есть, способы по настоящему изобретению могут включать этап совместного культивирования с экзосомами, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению. Такие экзосомы можно получать способами, описанными выше в разделе «V. Экзосомы».
Дополнительно, ЦТЛ также можно индуцировать путем введения в CD8-положительную T-клетку вектора, содержащего полинуклеотид, кодирующий каждую субъединицу TCR, способного связываться с пептидом по настоящему изобретению, презентированным при помощи антигена HLA на клеточной поверхности. Такую трансформацию можно проводить, как описано выше в разделе «VIII. T-клеточные рецепторы (TCR)».
Таким образом, в одном из вариантов осуществления настоящее изобретение относится к способам индуцирования ЦТЛ, включающим этап, выбранный из нижеизложенных:
(a) совместное культивирование CD8-положительных T-клеток с АПК, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению;
(b) совместное культивирование CD8-положительных T-клеток с экзосомами, которые презентируют на своей поверхности комплекс антигена HLA и пептида по настоящему изобретению; и
(c) введение в CD8-положительные T-клетки вектора, содержащего полинуклеотид, кодирующий каждую субъединицу TCR, способного связываться с пептидом по настоящему изобретению, презентированным при помощи антигена HLA на клеточной поверхности.
Вышеописанные способы можно проводить in vitro, ex vivo, или in vivo, и предпочтительно проводить их in vitro или ex vivo. АПК, или экзосомы, и CD8-положительные T-клетки, применяемые в вышеописанных способах, можно получать от индивидуума, которому планируется вводить индуцированные АПК, или их можно получать от другого индивидуума. Когда используют АПК, или экзосомы, и CD8-положительные T-клетки, полученные от индивидуума (донора), отличного от индивидуума, для которого запланировано введение, индивидуум для введения и донор должны иметь идентичный тип HLA. Например, когда пептид с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, или его модифицированный пептид используют в качестве пептидов по настоящему изобретению, HLA и у индивидуума, которому проводят введение, и у донора предпочтительно представляет собой HLA-A11 (более предпочтительно HLA-A*11:01). Альтернативно, АПК или экзосомы, используемые в вышеописанных способах, предпочтительно являются АПК или экзосомами, которые презентируют на своей поверхности комплекс HLA-A11 (более предпочтительно HLA-A*11:01) и пептида по настоящему изобретению (пептида с аминокислотной последовательностью, выбранной из SEQ ID NO: 5, 12, 27, 52 и 53, или его модифицированного пептида). В этом случае, индуцированные ЦТЛ показывают специфическую цитотоксическую активность против клеток, которые презентируют комплекс HLA-A11 и пептид по настоящему изобретению (например, MPHOSPH1-экспрессирующие HLA-A11-положительные клетки).
Альтернативно, например, когда пептид с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118,119 и 170, или его модифицированный пептид используют в качестве пептидов по настоящему изобретению, HLA и у индивидуума, которому проводят введение, и у донора предпочтительно представляет собой HLA-A33 (более предпочтительно HLA-A*33:03). Альтернативно, АПК или экзосомы, используемые в вышеописанных способах, предпочтительно являются АПК или экзосомами, которые презентируют на своей поверхности комплекс HLA-A33 (более предпочтительно HLA-A*33:03) и пептида по настоящему изобретению (пептида с аминокислотной последовательностью, выбранной из SEQ ID NO: 118,119 и 170 или его модифицированного пептида). В этом случае, индуцированные ЦТЛ показывают специфическую цитотоксическую активность против клеток, которые презентируют комплекс HLA-A33 и пептид по настоящему изобретению (например, MPHOSPH1-экспрессирующие HLA-A33-положительные клетки).
В другом варианте осуществления настоящее изобретение также относится к композициям или фармацевтическим композициям для индуцирования ЦТЛ, содержащим по меньшей мере один активный ингредиент, выбранный из нижеизложенных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности.
В другом варианте осуществления настоящее изобретение также относится к применению активного ингредиента, выбранного из нижеизложенных, в производстве композиций или фармацевтических композиций для индуцирования ЦТЛ:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности.
Альтернативно, настоящее изобретение дополнительно относится к активному ингредиенту, выбранному из нижеизложенных, для применения в индуцировании ЦТЛ:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности.
Альтернативно, настоящее изобретение дополнительно относится к способу или процессу для производства композиции или фармацевтической композиции для индуцирования ЦТЛ, где способ или процесс включает этап формулирования активного ингредиента, выбранного из нижеизложенных, с фармацевтически или физиологически приемлемым носителем:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности.
В другом варианте осуществления настоящее изобретение дополнительно относится к способу или процессу для производства композиции или фармацевтической композиции для индуцирования ЦТЛ, где способ или процесс включает этап смешивания активного ингредиента, выбранного из нижеизложенных, с фармацевтически или физиологически приемлемым носителем:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности.
XI. Способы индуцирования иммунного ответа
Настоящее изобретение дополнительно относится к способам индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных опухолей. Подходящие злокачественные опухоли включают рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, хронический миелолейкоз (ХМЛ), рак толстого кишечника, рак желудка, рак легких, лимфому, остеосаркому, рак предстательной железы, рак почки, опухоль мягких тканей и т.п., но не ограничиваются вышеуказанными. Предпочтительно, чтобы злокачественная опухоль экспрессировала, по меньшей мере, один HLA, выбранный из HLA-A11 и HLA-A33.
Настоящее изобретение дополнительно относится к способам индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных клеток. Признано, что MPHOSPH1 сверхэкспрессирован в различных типах злокачественных опухолей, описанных выше. Таким образом, когда индуцируется иммунный ответ против MPHOSPH1-экспрессирующих злокачественных клеток, в результате ингибируется пролиферация злокачественных клеток. Таким образом, настоящее изобретение дополнительно относится к способам ингибирования пролиферации MPHOSPH1-экспрессирующих злокачественных клеток. Способы по настоящему изобретению подходят, в частности, для ингибирования пролиферации злокачественных клеток, экспрессирующих MPHOSPH1 и, по меньшей мере, один HLA, выбранный из HLA-A11 и HLA-A33.
Способы по настоящему изобретению могут включать этап введения композиции, содержащей любой из пептидов по настоящему изобретению или полинуклеотида/полинуклеотидов, кодирующих пептид(-ы). Способы по настоящему изобретению также включают введение АПК или экзосом, презентирующих любой из пептидов по настоящему изобретению. За деталями можно обращаться в раздел «IX. Фармацевтические композиции», в частности, к частям, описывающим применение фармацевтических композиций по настоящему изобретению в качестве вакцин. Кроме того, экзосомы и АПК, которые можно использовать в способах по настоящему изобретению для индуцирования иммунного ответа, описаны подробно в «V. Экзосомы», «VI. Антигенпрезентирующие клетки (АПК)» и в пунктах (1) и (2) из «X. Способы применения пептидов, экзосом, АПК и ЦТЛ», описанных выше.
В другом варианте осуществления настоящее изобретение относится к фармацевтическим композициям или вакцинам для индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных опухолей, где фармацевтическая композиция или вакцина содержит активный ингредиент, выбранный из нижеизложенных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Альтернативно, настоящее изобретение также относится к фармацевтическим композициям или вакцинам для индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных клеток, где фармацевтическая композиция или вакцина содержит активный ингредиент, выбранный из нижеизложенных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Альтернативно, настоящее изобретение дополнительно относится к фармацевтическим композициям или вакцинам для ингибирования пролиферации MPHOSPH1-экспрессирующих злокачественных клеток, где фармацевтическая композиция или вакцина содержит активный ингредиент, выбранный из нижеизложенных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
В другом варианте осуществления настоящее изобретение относится к применению активного ингредиента, выбранного из нижеизложенных, в производстве фармацевтических композиций или вакцин для индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных опухолей:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Альтернативно, настоящее изобретение относится к применению активного ингредиента, выбранного из нижеизложенных, в производстве фармацевтических композиций или вакцин для индуцирования иммунного ответа против MPHOSPH1-экспрессирующих злокачественных клеток:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Альтернативно, настоящее изобретение относится к применению активного ингредиента, выбранного из нижеизложенных, в производстве фармацевтических композиций или вакцин для ингибирования пролиферации MPHOSPH1-экспрессирующих злокачественных клеток:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
Настоящее изобретение дополнительно относится к способам или процессам для производства фармацевтических композиций, которые индуцируют иммунный ответ против MPHOSPH1-экспрессирующих злокачественных опухолей, при этом способ может включать этап смешивания или формулирования пептида или полинуклеотида по настоящему изобретению с фармацевтически приемлемым носителем.
Альтернативно, настоящее изобретение относится к способам для ингибирования пролиферации MPHOSPH1-экспрессирующих злокачественных клеток или к способам индуцирования иммунного ответа против злокачественных опухолей, которые включают этап введения индивидууму вакцин или фармацевтических композиций, содержащих активный ингредиент, выбранный из нижеизложенных:
(a) пептид по настоящему изобретению;
(b) полинуклеотид, кодирующий пептид по настоящему изобретению в экспрессируемой форме;
(c) АПК, которая презентирует пептид по настоящему изобретению на своей поверхности;
(d) экзосома, которая презентирует пептид по настоящему изобретению на своей поверхности; и
(e) ЦТЛ по настоящему изобретению.
В контексте настоящего изобретения,, MPHOSPH1-экспрессирующие злокачественные опухоли можно лечить путем введения пептида, полинуклеотида, АПК, экзосомы и/или ЦТЛ по настоящему изобретению. Альтернативно, иммунный ответ против MPHOSPH1-экспрессирующих злокачественных опухолей можно индуцировать путем введения пептида, полинуклеотида, АПК, экзосомы и/или ЦТЛ по настоящему изобретению. Примеры таких злокачественных опухолей включают рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, хронический миелолейкоз (ХМЛ), рак толстого кишечника, рак желудка, рак легких, лимфому, остеосаркому, рак предстательной железы, рак почки, опухоль мягких тканей и т.п., но не ограничиваются вышеуказанными. Дополнительно, иммунный ответ против MPHOSPH1-экспрессирующих злокачественных клеток можно индуцировать путем введения пептида, полинуклеотида, АПК, экзосомы и/или ЦТЛ по настоящему изобретению. Таким образом, перед введением вакцины или фармацевтической композиции, содержащей вышеописанный активный ингредиент, предпочтительно подтвердить, увеличен ли уровень экспрессии MPHOSPH1 в больном участке у индивидуума, подлежащего лечению, или нет.
Таким образом, в одном из вариантов осуществления настоящее изобретение относится к лечению MPHOSPH1-экспрессирующей злокачественной опухоли у пациента, нуждающегося в лечении злокачественных опухолей, где способ включает нижеизложенные этапы:
(i) измерение уровня экспрессии MPHOSPH1 в биологическом образце, полученном из больного участка индивидуума со злокачественной опухолью;
(ii) выявление индивидуума с MPHOSPH1-экспрессирующей злокачественной опухолью на основании уровня экспрессии MPHOSPH1, измеренного в (i); и
(iii) введение индивидууму с опухолью со сверхэкспрессией MPHOSPH1 по сравнению со здоровым контролем, по меньшей мере, одного ингредиента, выбранного из группы, состоящей из вышеописанных от (a) до (e).
Альтернативно, настоящее изобретение дополнительно относится к вакцинам и фармацевтическим композициям, содержащим, по меньшей мере, один активный ингредиент, выбранный из группы, состоящей из вышеописанных от (a) до (e), для введения индивидууму с MPHOSPH1-экспрессирующей злокачественной опухолью. Настоящее изобретение дополнительно относится к способу выявления или отбора индивидуума, подлежащего лечению, по меньшей мере, одним активным ингредиентом, выбранным из группы, состоящей из вышеописанных от (a) до (e), где способ включает нижеизложенные этапы:
(i) измерение уровня экспрессии MPHOSPH1 в биологическом образце, полученном из больного участка индивидуума со злокачественной опухолью;
(ii) выявление индивидуума с MPHOSPH1-экспрессирующей злокачественной опухолью на основании уровня экспрессии MPHOSPH1, измеренного в (i); и
(iii) идентификация или отбор индивидуума, выявленного в (ii) как индивидуума, которого можно лечить, по меньшей мере, одним активным ингредиентом, выбранным из группы, состоящей из вышеописанных от (a) до (e).
Биологические образцы, собранные у индивидуума для измерения уровня экспрессии MPHOSPH1 в вышеописанных способах конкретно не ограничены, и например, можно предпочтительно использовать образцы ткани, полученные путем биопсии и т.п и содержащие злокачественные клетки. Уровень экспрессии MPHOSPH1 в биологическом образце можно измерять известными способами, и например, можно использовать способы, которые детектируют продукты транскрипции гена MPHOSPH1 при помощи зондов, или способы ПЦР (например, способ микропанелей с кДНК, способ Нозерн-блоттинга, способ ОТ-ПЦР или т.п.), способы, которые детектируют продукты трансляции гена MPHOSPH1 при помощи антител или т.п. (например, способ Вестерн-блоттинга, способ иммуноокрашивания или т.п.), и т.п. Дополнительно, биологические образцы могут быть образцами крови, и в этом случае, измеряют уровень антител против MPHOSPH1 в крови, и можно оценивать уровень экспрессии MPHOSPH1 в месте заболевания на основании уровня в крови. Уровень антитела против MPHOSPH1 или его фрагментов в крови можно измерять с применением известных способов, и, например, можно использовать иммуноферментный анализ (EIA), твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (РИА) и т.п., с использованием белка MPHOSPH1 или пептида по настоящему изобретению в качестве антигена.
Как правило, в тканях и клетках, которые не экспрессируют MPHOSPH1, практически не выявляются продукты транскрипции и трансляции MPHOSPH1. Таким образом, когда продукт транскрипции или трансляции MPHOSPH1 детектируется в полученных от индивидуума злокачественных клетках или образце ткани, содержащем злокачественные клетки, можно определить, что злокачественная опухоль индивидуума экспрессирует MPHOSPH1. В образцах крови индивидуума, у которого нет MPHOSPH1-экспрессирующей злокачественной опухоли, практически не выявляются антитела против MPHOSPH1 или их фрагменты. Таким образом, когда антитела против MPHOSPH1 или их фрагменты детектируются в образце крови, полученном от индивидуума, можно определить, что злокачественная опухоль индивидуума экспрессирует MPHOSPH1.
Экспрессирует ли злокачественная опухоль индивидуума MPHOSPH1 или нет, также можно определить при сравнении результатов измерений в биологическом материале того же типа, полученном из неопухолевого участка индивидуума или в биологическом материале того же типа, полученном от индивидуума без злокачественной опухоли (образец здорового контроля). То есть, при сравнении с уровнем мишени измерения в образце здорового контроля (уровень у здорового контроля), если уровень в биологическом образце исследуемого индивидуума повышен, злокачественную опухоль индивидуума оценивают как экспрессирующую MPHOSPH1. Например, когда количество выявленной мишени измерения повышено, по меньшей мере, на 10% или более по сравнению уровнем у здорового контроля, злокачественную опухоль индивидуума можно оценивать как экспрессирующую MPHOSPH1. Желательно, чтобы количество выявленной мишени измерения было повышено предпочтительно на 25% или более, и более предпочтительно, на 50% или более, чем уровень у здорового контроля. Дополнительно, количество выявленного продукта транскрипции или трансляции MPHOSPH1 можно оценивать при нормализации его против выявленного количества известного гена «домашнего хозяйства», такого как бета-актин, глицеральдегид-3-фосфат дегидрогеназа, или рибосомальный белок P1.
В предпочтительном варианте осуществления, предпочтительно подтверждать тип HLA у индивидуума перед введением, по меньшей мере, одного активного ингредиента, выбранного из группы, состоящей из вышеизложенных от (a) to (e). Например, для индивидуумов, которым вводят активный ингредиент, связанный с пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 5, 12, 27, 52 и 53, предпочтительно выбирать HLA-A11-положительных индивидуумов. Для индивидуумов, которым вводят активный ингредиент, связанный с пептидом с аминокислотной последовательностью, выбранной из числа SEQ ID NO: 118, 119 и 170, предпочтительно выбирать HLA-A33-положительных индивидуумов.
Настоящее изобретение дополнительно относится к комплексам пептида по настоящему изобретению и HLA. Вышеописанные комплексы по настоящему изобретению могут быть мономерами или мультимерами. Когда комплекс по настоящему изобретению является мультимером, число полимеров конкретно не ограничено, и он может быть мультимером с любым числом полимеров. Примеры включают тетрамер, пентамер, гексамер и т.п., но не ограничиваются перечисленными. Мультимеры по настоящему изобретению также включают декстрамеры (WO2002/072631) и стрептамеры (Knabel M et al., Nat Med. 2002 Jun; 8(6): 631-7.). Комплексы пептида по настоящему изобретению и HLA можно получать в соответствии с известными способами (например, Altman JD et al., Science.1996, 274(5284): 94-6; WO2002/072631; WO2009/003492; Knabel M et al., Nat Med. 2002 Jun; 8(6): 631-7, и т.д.).
Комплексы по настоящему изобретению, например, можно использовать в количественной оценке ЦТЛ, специфичных к пептиду по настоящему изобретению. Например, образец крови получают у индивидуума, которому вводили фармацевтическую композицию по настоящему изобретению, и после отделения PBMC получают CD4-негативные клетки и приводят их в контакт с комплексом по настоящему изобретению, который конъюгирован с флуоресцентным красителем. Затем, можно измерять процентное содержание ЦТЛ, специфичных к пептиду по настоящему изобретению, путем анализа проточной цитометрией. Например, воздействия фармацевтической композиции по настоящему изобретению на индуцирование иммунного ответа можно контролировать, измеряя специфические ЦТЛ против пептида по настоящему изобретению до, во время и/или после введения фармацевтической композиции по настоящему изобретению.
XII. Антитела
Настоящее изобретение дополнительно относится к антителам, которые связываются с пептидом по настоящему изобретению. Предпочтительные антитела специфически связываются с пептидом по настоящему изобретению, но не связываются (или слабо связываются) с пептидом, который не является пептидом по настоящему изобретению. В другом варианте осуществления такое антитело может включать антитело, которое распознает пептид относительно молекул HLA, т.е., антитело, которое связывается с комплексом пептид-MHC. Специфичность связывания антитела можно подтверждать анализом ингибирования. То есть, если связывание между анализируемым антителом и полноразмерным полипептидом MPHOSPH1 ингибируется в присутствии пептида по настоящему изобретению, такое антитело демонстрирует специфическое связывание с пептидом по настоящему изобретению. Антитела против пептидов по настоящему изобретению можно использовать в анализах для диагностики и прогнозирования заболевания, а также отбора индивидуума для введения фармацевтических композиций по настоящему изобретению и мониторинга фармацевтических композиций по настоящему изобретению.
Настоящее изобретение также относится к различным иммунологическим анализам для детекции и/или количественного определения пептидов по настоящему изобретению или их фрагментов. Такие иммунологические анализы включают радиоиммунологический анализ, имунохроматографию, твердофазный иммуноферментный анализ (ELISA), иммуноферментный флуоресцентный анализ (ELIFA) и т.п., не ограничиваясь перечисленными, и их проводят в рамках различных форматов иммунологических анализов, хорошо известных в данной области.
Антитела по настоящему изобретению можно использовать в способах иммунологической визуализации, которые могут выявлять MPHOSPH1-экспрессирующие заболевания, и их примеры включают радиоактивную сцинтиграфию с использованием меченого антитела по настоящему изобретению, не ограничиваясь указанным. Такие способы анализа используют в клинике для детекции, мониторинга, и прогнозирования MPHOSPH1-экспрессирующих злокачественных опухолей; и примеры таких злокачественных опухолей включают острый миелоидный лейкоз, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, хронический миелолейкоз (ХМЛ), рак толстого кишечника, рак пищевода, рак желудка, диффузный рак желудка, немелкоклеточный рак легких (NSCLC), лимфому, остеосаркому, рак яичников, рак поджелудочной железы, рак предстательной железы, рак почки, мелкоклеточный рак легких (SCLC), опухоль мягких тканей, рак яичка и т.п., но не ограничиваются указанными.
Антитела по настоящему изобретению можно использовать в любой произвольной форме, такой как моноклональные антитела или поликлональные антитела, и они могут дополнительно включать антитела, полученные при иммунизации животного, такого как кролик, пептидом по настоящему изобретению, все классы поликлональных антител и моноклональных антител, антитела человека, а также химерные антитела и гуманизированные антитела, полученные путем генетической рекомбинации.
Пептид по настоящему изобретению или его фрагмент, применяемый в качестве антигена для получения антител, можно получать путем химического синтеза или способов генетической инженерии, на основании аминокислотных последовательностей, описываемых в настоящем документе.
Пептид, применяемый в качестве иммунизирующего антигена, может быть пептидом по настоящему изобретению или фрагментом пептида по настоящему изобретению. Дополнительно, пептид может быть связан или конъюгирован с носителем для повышения иммуногенности. Гемоцианин морского блюдца (KLH) является хорошо известным носителем. Способы для связывания KLH с пептидом также хорошо известны в данной области.
Любое млекопитающее можно иммунизировать вышеописанным антигеном, и предпочтительно рассматривать совместимость сродительской клеткой, применяемой в слиянии клеток, при получении моноклонального антитела. Как правило, можно использовать животных отряда Грызуны (Rodentia), Зайцеобразные (Lagomorpha) или Приматы (Primate). Животные отряда Грызунов включают, например, мышей, крыс и хомяков. Животные отряда Зайцеобразных включают, например, кроликов. Животные отряда Приматов включают, например, обезьян катарринов (обезьян старого света), таких как яванский макак (Macaca fascicularis), макаки-резусы, гамадрилы, и шимпанзе.
Способы иммунизации животных антигеном известны в данной области. Интраперитонеальная и подкожная инъекции антигена являются стандартными способами для иммунизации млекопитающих. Более конкретно, антиген разбавляют и суспендируют в соответствующем количестве фосфатно-солевого буфера (PBS), физиологического раствора, или т.п. По мере необходимости, раствор суспензии антигена можно вводить млекопитающим после смешивания с соответствующим количеством стандартного адъюванта, такого как полный адъювант Фрейнда, и эмульсификации. Затем предпочтительно вводить антиген, смешанный с соответствующим количеством неполного адъюванта Фрейнда несколько раз в интервале от 4 до 21 суток. Для иимунизации можно использовать подходящий носитель. После вышеуказанной иммунизации, сыворотку можно тестировать стандартным способом на увеличение количества желаемого антитела.
Поликлональные антитела против пептида по настоящему изобретению можно получать, забирая кровь у млекопитающих, у которых было подтверждено увеличение уровня желаемого антитела в сыворотке после иммунизации, и отделяя сыворотку от крови любым общепринятым способом. Поликлональное антитело может быть сывороткой, содержащей поликлональное антитело, или из сывороткии можно выделять фракцию, содержащую поликлональное антитело. Иммуноглобулин G или M можно получать из фракций, которые распознают только пептид по настоящему изобретению, например, с использованием аффинной колонки, конъюгированной с пептидом по настоящему изобретению, а затем дополнительной очистки фракций с использованием колонки с белком A или белком G.
Для того чтобы приготовить моноклональные антитела, после подтверждения увеличения уровня желаемого антитела в сыворотке после иммунизации, у млекопитающих забирают иммунные клетки и проводят клеточное слияние. Иммунные клетки, используемые для слияния клеток, предпочтительно можно получать из селезенки. Для других родительских клеток, которые сливают с вышеуказанными иммунными клетками, можно использовать, например, миеломную клетку млекопитающих, и более предпочтительно, миеломную клетку, которая приобрела свойство селекции по лекарственному средству клеток для слияния.
Вышеуказанные иммунные клетки можно сливать с миеломными клетками следующими известными способами, например, способом из Milstein et al. (Galfre и Milstein, Methods Enzymol, 1981, 73: 3-46).
Гибридомы, полученные путем слияния клеток, можно отбирать, культивируя их в стандартной селективной среде, такой как среда HAT (среда, содержащая гипоксантин, аминоптерин и тимидин). Культивирование клеток обычно продолжают в среде HAT в течение достаточного периода времени (например, от нескольких суток до нескольких недель), чтобы погибли все остальные клетки (не слитые клетки), кроме желаемых гибридом. Затем, гибридомные клетки, вырабатывающие желаемое антитело можно отбирать и клонировать, проводя стандартные лимитирующие разведения.
В дополнение к вышеописанным способам иммунизации не являющегося человеком животного при помощи антигена для получения гибридомы, можно иммунизировать лимфоциты человека, такие как лимфоциты, инфицированные вирусом Эпштейна-Барр, in vitro пептидом, клетками, экспрессирующими пептид, или их лизатами. Затем иммунизированные лимфоциты можно сливать с иммортализованными миеломными клетками, полученными от человека, такими как U266, для получения гибридом, производящих желаемое антитело человека, способное связываться с пептидом (JPS63-17688).
Затем, полученную гибридому пересаживают в брюшную полость мыши, и забирают асцитную жидкость. Полученное моноклональное антитело можно очищать, например, путем осаждения сульфатом аммония, на колонках с белком A или белком G, ионообменной хроматографией с DEAE, или на аффинной колонке, конъюгированной с пептидом по настоящему изобретению.
Альтернативно, антителопродуцирующие иммунные клетки, такие как иммунизированные лимфоциты, можно иммортализовать при помощи гена злокачественной опухоли ген и использовать для получения моноклональных антител.
Моноклональные антитела, полученные таким образом, также можно получать путем рекомбинации с использованием способов генетической инженерии (см., например, Borrebaeck и Larrick, Therapeutic Monoclonal Antibodies, опубликованную в Великобритании у MacMillan Publishers LTD (1990)). Например, ДНК, кодирующую антитело, можно клонировать в иммунные клетки, такие как клетки антителопродуцирующей гибридомы или иммунизированные лимфоциты, и вставить в подходящий вектор, а затем ввести в клетки-хозяева для получения рекомбинантного антитела. Настоящее изобретение также относится к рекомбинантным антителам, полученным, как описано выше.
Дополнительно, антитела по настоящему изобретению могут быть фрагментами антител или модифицированными антителами, при условии, что они связываются с пептидами по настоящему изобретению. Например, желательно, чтобы фрагмент антитела содержал антигенсвязывающий участок/участки антител. Конкретно, фрагменты антител могут быть Fab, F(ab')2, Fv, или одноцепочечным Fv(scFv), в котором фрагменты Fv, полученные из тяжелой и легкой цепей связаны подходящим линкером (Huston et al., Proc Natl Acad Sci USA, 1988, 85: 5879-83). Более конкретно, фрагменты антител можно получать при обработке антитела ферментом, таким как папаин или пепсин. Альтернативно, можно сконструировать ген, кодирующий фрагмент антитела, вставить в экспрессирующий вектор, и экспрессировать в подходящей клетке-хозяине (см., например, Co et al., J Immunol, 1994, 152: 2968-76; Better и Horwitz, Methods Enzymol, 1989, 178: 476-96; Pluckthun и Skerra, Methods Enzymol, 1989, 178: 497-515; Lamoyi, Methods Enzymol, 1986, 121: 652-63; Rousseaux et al., Methods Enzymol, 1986, 121: 663-9; Bird и Walker, Trends Biotechnol, 1991, 9: 132-7).
Антитела можно модифицировать путем конъюгации с различными молекулами, такими как полиэтиленгликоль (ПЭГ). Настоящее изобретение относится к таким модифицированным антителам. Модифицированные антитела можно получать путем химической модификации антител. Эти способы модификации являются общепринятыми в данной области.
Альтернативно, антитела по настоящему изобретению можно получать в виде химерных антител из вариабельной области антитела, не принадлежащего человеку, и константной области антитела человека, или в виде гуманизированных антител, которые содержат определяющую комплементарность область (CDR) из антитела, не принадлежащего человеку, и каркасную область, и константную область (FR) из антитела человека. Такие антитела можно получать в соответствии с известными способами. Гуманизацию можно проводить, замещая последовательность/последовательности антитела человека соответствующей последовательностью/последовательностями CDR из антитела, не принадлежащего человеку (см., например, Verhoeyen et al., Science, 1988, 239: 1534-6). Таким образом, такие гуманизированные антитела представляют собой химерные антитела, в которых по существу менее чем интактный вариабельный домен человека замещен соответствующей последовательностью от видов, не являющихся человеком.
Также можно использовать интактные антитела человека, содержащие вариабельную область человека в дополнение к каркасу и константным областям человека. Такие антитела можно получать при помощи различных способов, известных в данной области. Например, способы in vitro включают использование рекомбинантных библиотек из фрагментов антител человека, презентированных на бактериофагах (например, Hoogenboom & Winter, J. Mol. Biol., 1991, 227: 381). Аналогично, антитела человека можно также получать, вводя локусы гена иммуноглобулина человека трансгенным животным, например, мышам, у которых гены эндогенных иммуноглобулинов были частично или полностью инактивированы. Этот подход описан, например, в патентах США №№ 6150584, 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016.
Антитела, полученные, как описано выше, можно очищать для гомогенности. Например, выделение и очистку антител можно проводить в соответствии со способами выделения и способами очистки, применяемыми для распространенных белков. Например, антитело можно отделять и изолировать при помощи соответствующим образом выбранного и скомбинированного применения хроматографии на колонках, такой как аффинная хроматография, фильтрации, ультрафильтрации, высаливания, диализа, SDS-электрофореза в полиакриламидном геле и электрофореза с изоэлектрофокусированием (Antibodies: A Laboratory Manual. Ed Harlow и David Lane, Cold Spring Harbor Laboratory (1988)), но не ограничиваясь перечисленными. Колонку с белком A и колонку с белком G можно использовать в качестве аффинной колонки. Примеры колонок с белком A, которые можно использовать, включают, например, Hyper D, POROS и Sepharose F.F. (Pharmacia).
Кроме аффинной хроматографии, примеры хроматографии включают, например, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию с обратной фазой, адсорбционную хроматографию и т.п. (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press (1996)). Хроматографию можно проводить путем хроматографии в жидкой фазе, такой как ВЭЖХ и FPLC.
Активность связывания антигена для антитела по настоящему изобретению можно измерять, например, при помощи измерения оптической плотности, твердофазного иммуноферментного анализа (ELISA), иммуноферментного анализа (EIA), радиоиммунологического анализа (РИА), и/или иммунофлуоресценции (IF). В случае ELISA, антитело по настоящему изобретению иммобилизуют на планшете, пептид по настоящему изобретению наносят на планшет, а затем наносят образец, содержащий желаемое антитело, такой как культуральный супернатант антителопродуцирующих клеток или очищенные антитела. Затем наносят вторичное антитело, которое распознает первичное антитело и помечено ферментом, таким как щелочная фосфатаза, и инкубируют планшет. Затем после отмывания на планшет наносят субстрат для фермента, такой как п-нитрофенилфосфат, и оценивают активность связывания антигена для образца по измерению оптической плотности. Для оценки активности связывания антитела, в качестве антигена можно использовать пептидные фрагменты, такие как C-концевые или N-концевые фрагменты. Для оценки активности антитела по настоящему изобретению можно использовать BIAcore (Pharmacia).
Возможно выявлять или измерять пептид по настоящему изобретению при помощи вышеописанных способов, добавляя антитело по настоящему изобретению к образцу, предположительно содержащему пептид по настоящему изобретению, и выявляя или измеряя иммунный комплекс, образовавшийся между антителом и пептидом.
Например, антитело по настоящему изобретению можно использовать для выявления пептида по настоящему изобретению, присутствующего в образце крови (например, образце сыворотки) индивидуума. Альтернативно, антитело по настоящему изобретению, присутствующее в образце крови (например, образце сыворотки) индивидуума, также можно выявлять при помощи пептида по настоящему изобретению. Результат измерения пептида по настоящему изобретению или антитела по настоящему изобретению в образце крови индивидуума можно использовать для отбора индивидуума для введения фармацевтических композиций по настоящему изобретению или мониторинга эффективности фармацевтических композиций по настоящему изобретению. Кроме того, опубликовано, что пациенты, у которых есть антитело против пептида, вводимого в качестве вакцины, могут иметь высокую восприимчивость к вакцине. Таким образом, пептид по настоящему изобретению можно использовать в качестве антигена для иммунологического анализа с использованием антитела к пептиду как индикатора для отбора из числа раковых пациентов пациента с ожидаемой высокой восприимчивостью к вакцине, содержащей пептид.
XIII. Векторы и клетки-хозяева
Настоящее изобретение относится к векторам, содержащим полинуклеотид, кодирующий пептид по настоящему изобретению, и клетки-хозяева, в которые введены векторы. Вектор по настоящему изобретению можно использовать для хранения полинуклеотида по настоящему изобретению в клетке-хозяине, для экспрессии пептида по настоящему изобретению в клетке-хозяине, или для введения полинуклеотида по настоящему изобретению для генотерапии.
Когда E. coli является клеткой-хозяином и вектор амплифицируют в большом количестве в E. coli (например, JM109, DH5-альфа, HB101 или XL1-Blue), вектор должен иметь «точку начала репликации» для амплификации в E. coli и маркерный ген для селекции трансформированных E. coli (например, ген резистентности к лекарственному средству, отбирающий по лекарственному средству, такому как ампициллин, тетрациклин, канамицин, хлорамфеникол). Например, можно использовать векторы серии M13, векторы серии pUC, pBR322, pBluescript, pCR-Script и т.п. Кроме того, для клонирования можно использовать pGEM-T, pDIRECT и pT7, а также вышеуказанные векторы. Когда вектор используют для продукции пептида по настоящему изобретению, можно использовать экспрессирующий вектор. Например, экспрессирующий вектор для экспрессии в E. coli должен иметь вышеуказанные характеристики для амплификации в E. coli. Когда E. coli, такие как JM109, DH5-альфа, HB101 или XL1-Blue используют в качестве клетки-хозяина, вектор должен иметь промотор, например, промотор lacZ (Ward et al., Nature, 1989, 341: 544-6; FASEB J, 1989, 6: 2422-7), промотор araB (Better et al., Science, 1988, 240: 1041-3), промотор T7 или т.п., который может эффективно экспрессировать желаемый ген в E. coli. В этом отношении вместо вышеуказанных векторов можно использовать, например, pGEX-5X-1 (Pharmacia), "QIAexpress system" (Qiagen), pEGFP и pET (в этом случае, хозяином предпочтительно являются BL21, которые экспрессируют РНК-полимеразу T7). Дополнительно, вектор может содержать сигнальную последовательность для секреции пептида. Иллюстративной сигнальной последовательностью, которая направляет пептид для секреции в периплазматическое пространство E. Coli, является сигнальная последовательность pelB (Lei et al., J Bacteriol, 1987, 169: 4379). Способы для введения векторов в целевые клетки-хозяева включают, например, способ с хлоридом кальция и способ электропорации.
В дополнение к E. coli, для получения полипептида по настоящему изобретению можно использовать, например, экспрессирующие векторы, полученные от млекопитающих (например, pcDNA3 (Invitrogen) и pEGF-BOS (Nucleic Acids Res, 1990, 18(17): 5322), pEF, pCDM8), экспрессирующие векторы, полученные из клеток насекомых (например, "экспрессирующая бакуловирусная система Bac-to-BAC" (GIBCO BRL), pBacPAK8), экспрессирующие векторы, полученные из растений (например, pMH1, pMH2), экспрессирующие векторы, полученные из вирусов животных (например, pHSV, pMV, pAdexLcw), экспрессирующие векторы, полученные из ретровирусов (например, pZIpneo), экспрессирующие векторы, полученные из дрожжей (например, "Pichia Expression Kit" (Invitrogen), pNV11, SP-Q01) и экспрессирующие векторы, полученные из Bacillus subtilis (например, pPL608, pKTH50).
Для того чтобы экспрессировать вектор в клетках животных, таких как клетки CHO, COS или NIH3T3, вектор должен нести промотор, необходимый для экспрессии в таких клетках, например, промотор SV40 (Mulligan et al., Nature, 1979, 277: 108)), промотор MMLV-LTR, промотор EF1-альфа (Mizushima et al., Nucleic Acids Res, 1990, 18: 5322), промотор CMV и т.п., и предпочтительно маркерный ген для селекции трансформантов (например, ген резистентности к лекарственному средству, отбирающий по лекарственному средству (например, неомицину, G418)). Примеры известных векторов с этими характеристиками включают, например, pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Варианты осуществления настоящего изобретения проиллюстрированы ниже на основании вышеизложенного объяснения, однако настоящее изобретение не ограничено этими вариантами осуществления.
[1] Пептид менее чем из 15 аминокислот со способностью индуцировать цитотоксическую T-клетку (ЦТЛ), который содержит аминокислотную последовательность, выбранную из группы, состоящей из:
(a) аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170; и
(b) аминокислотной последовательности, в которой одна, две или несколько аминокислот замещены, удалены, вставлены и/или добавлены к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170.
[2] Пептид из [1], который выбран из группы, состоящей из нижеизложенных от (i) до (ii):
(i) пептид, содержащий аминокислотную последовательность, включающую одну или несколько замен, выбранных из группы, состоящей из нижеизложенных от (a) до (d), в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 12, 27, 52 и 53:
(a) вторая аминокислота с N-конца замещена аминокислотой, выбранной из группы, состоящей из треонина, валина, изолейцина, лейцина, фенилаланина и тирозина;
(b) третья аминокислота с N-конца замещена аминокислотой, выбранной из группы, состоящей из лейцина, фенилаланина, тирозина, изолейцина и аланина;
(c) седьмая аминокислота с N-конца замещена аминокислотой, выбранной из группы, состоящей из лейцина, изолейцина, тирозина, валина и фенилаланина; и
(d) C-концевая аминокислота замещена аргинином; и
(ii) пептид, содержащий аминокислотную последовательность, в которой одна или несколько замен, выбранных из группы, состоящей из нижеизложенных от (a) до (c), введены в аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 118,119 и 170:
(a) первая аминокислота с N-конца замещена аминокислотой, выбранной из группы, состоящей из аспарагиновой кислоты и глутаминовой кислоты;
(b) вторая аминокислота с N-конца замещена аминокислотой, выбранной из группы, состоящей из фенилаланина, тирозина, аланина, изолейцина, лейцина и валина; и
(c) C-концевая аминокислота замещена лизином.
[3] Пептид из [1], который состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170.
[4] Полинуклеотид, который кодирует пептид по любому из пп. с [1] до [3].
[5] Композиция, содержащая фармацевтически приемлемый носитель и, по меньшей мере, один ингредиент, выбранный из группы, состоящей из нижеизложенных от (a) до (e):
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[6] Композиция по п. [5], которая является композицией для индуцирования ЦТЛ, где ингредиент представляет собой, по меньшей мере, один ингредиент, выбранный из группы, состоящей из из нижеизложенных от (a) до (d):
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA.
[7] Композиция по п. [5], которая является фармацевтической композицией.
[8] Композиция по п. [7], которая является фармацевтической композицией для одного или нескольких применений, выбранных из группы, состоящей из (i) лечения злокачественных опухолей, (ii) предупреждения (профилактики) злокачественной опухоли и (iii) предупреждения (профилактики) послеоперационного рецидива злокачественной опухоли.
[9] Композиция по п. [7], которая предназначена для индуцирования иммунного ответа против злокачественной опухоли.
[10] Композиция по п. [8] или [9], где злокачественная опухоль выбрана из группы, включающей рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, хронический миелолейкоз (ХМЛ), рак толстого кишечника, рак желудка, рак легких, лимфому, остеосаркому, рак предстательной железы, рак почки и опухоль мягких тканей.
[11] Композиция по любому из пп. с [5] до [10], которую формулируют для введения индивидууму, положительному, по меньшей мере, по одному HLA, выбранному из группы, состоящей из HLA-A11 и HLA-A33.
[12] Способ индуцирования АПК со способностью индуцировать ЦТЛ, который включает этап, выбранный из группы, состоящей из следующих:
(a) контакта АПК с пептидом по любому из пп. с [1] до [3] in vitro, ex vivo или in vivo; и
(b) введения полинуклеотида, кодирующего пептид по любому из пп. с [1] до [3], в АПК.
[13] Способ индуцирования ЦТЛ, который включает этап, выбранный из группы, состоящей из нижеизложенных от (a) до (c):
(a) совместное культивирование CD8-положительной T-клетки/клеток с АПК, которые презентируют на своей поверхности комплекс из антигена HLA и пептида по любому из пп. с [1] до [3];
(b) совместное культивирование CD8-положительной T-клетки/клеток с экзосомой/экзосомами, которые презентируют на своей поверхности комплекс из антигена HLA и пептида по любому из пп. с [1] до [3]; и
(c) введение в CD8-положительную T-клетку/клетки полинуклеотида, кодирующего каждую субъединицу T-клеточного рецептора (TCR), способного связываться с пептидом по любому из пп. с [1] до [3], презентированным при помощи антигена HLA на клеточной поверхности.
[14] АПК, которая презентирует на своей поверхности комплекс из антигена HLA и пептида по любому из пп. с [1] до [3].
[15] АПК по п. [14], которая индуцирована при помощи способа из п. [12].
[16] ЦТЛ, которая нацелена на пептид по любому из пп. с [1] до [3].
[17] ЦТЛ из п. [16], которая индуцирована при помощи способа из п. [13].
[18] Способ индуцирования иммунного ответа против злокачественной опухоли, который включает введение индивидууму, по меньшей мере, одного ингредиента, выбранного из группы, состоящей из нижеизложенных с (a) по (e):
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[19] Способ лечения и/или профилактики злокачественной опухоли, и/или профилактики ее послеоперационного рецидива, который включает введение индивидууму, по меньшей мере, одного ингредиента, выбранного из группы, состоящей из нижеизложенных пп. с (a) по (e):
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[20] Антитело, которое связывается с пептидом по любому из пп. с [1] до [3].
[21] Способ скрининга на пептид со способностью индуцировать ЦТЛ, который включает этапы:
(a) создания кандидатных последовательностей, состоящих из аминокислотной последовательности, в которой один, два, или несколько аминокислотных остатков замещены, удалены, вставлены и/или добавлены по сравнению с исходной аминокислотной последовательностью, состоящей из аминокислотной последовательности, выбранной из SEQ ID NO: 5, 12, 27, 52, 53, 118, 119 и 170;
(b) отбора в кандидатных последовательностях, полученных в (a), кандидатной последовательности, которая не имеет значительной гомологии (идентичности последовательности) с любым известным продуктом гена человека, за исключением MPHOSPH1;
(c) контакта пептида, состоящего из кандидатной последовательности, выбранной в (b), с АПК;
(d) контакта АПК из (c) с CD8-положительной T-клеткой/клетками; и
(e) отбора пептида, который имеет равную или более высокую способность индуцировать ЦТЛ, по сравнению с пептидом, состоящим из исходной аминокислотной последовательности.
[22] Применение, по меньшей мере, одного активного ингредиента выбранного из группы, состоящей из нижеизложенных пп. с (a) по (e), в производстве композиции для индуцирования иммунного ответа против злокачественной опухоли:
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[23] Применение, по меньшей мере, одного ингредиента выбранного из группы, состоящей из нижеизложенных пп. с (a) по (e), в производстве фармацевтической композиции для лечения и/или профилактики злокачественной опухоли, и/или профилактики ее послеоперационного рецидива:
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[24] Применение, по меньшей мере, одного ингредиента выбранного из группы, состоящей из нижеизложенных пп. с (a) по (e), для индуцирования иммунного ответа против злокачественной опухоли:
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[25] Применение, по меньшей мере, одного ингредиента выбранного из группы, состоящей из нижеизложенных пп. с (a) по (e), для лечения и/или профилактики злокачественной опухоли, и/или профилактики ее послеоперационного рецидива:
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[26] Способ индуцирования цитотоксической активности против MPHOSPH1-экспрессирующей клетки/клеток, который включает этап введения индивидууму, по меньшей мере, одного ингредиента, выбранного из группы, состоящей из нижеизложенных пп. с (a) по (e):
(a) один или несколько типов пептидов по любому из пп. с [1] до [3];
(b) один или несколько типов полинуклеотидов, кодирующих пептид(-ы) по любому из пп. с [1] до [3] в экспрессируемой форме;
(c) антигенпрезентирующая клетка (АПК), которая презентирует на своей клеточной поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA;
(d) экзосома, которая презентирует на своей поверхности комплекс из пептида по любому из пп. с [1] до [3] и антигена HLA; и
(e) ЦТЛ, который нацелен на пептид по любому из пп. с [1] до [3].
[27] Лиофилизированный состав, содержащий один или несколько типов пептидов по любому из пп. с [1] до [3].
[28] Фармацевтическая композиция, которую получают способом, включающим растворение одного или нескольких типов пептидов по любому из пп. с [1] до [3] в водорастворимом носителе, и проведение стерилизации фильтрованием.
[29] Водный раствор, стерилизованный фильтрованием, который представляет собой водный раствор, содержащий один или несколько типов пептидов по любому из пп. с [1] до [3] и водорастворимый носитель.
[30] Эмульсия, содержащая один или несколько типов пептидов по любому из пп. с [1] до [3], водорастворимый носитель и масляный адъювант.
[31] Набор, включающий контейнер, который содержит композицию по любому из пп. с [5] по [11], и контейнер, который содержит адъювант.
[32] Набор, включающий контейнер, в котором находится лиофилизированный состав, содержащий пептид по любому из пп. с [1] до [3], контейнер, в котором находится адъювант, и контейнер, в котором находится раствор для повторного растворения лиофилизированного состава.
Настоящее изобретение поясняется в настоящем документе подробно со ссылкой на его конкретные варианты осуществления. Однако следует понимать, что вышеизложенное объяснение по факту является иллюстративным и пояснительным, и предназначено для объяснения настоящего изобретения и его предпочтительных вариантов осуществления. Путем общепринятого экспериментирования, специалист в данной области легко поймет, что можно производить различные изменения и модификации в пределах сущности и объема настоящего изобретения. Таким образом, настоящее изобретение не ограничивается вышеизложенным разъяснением, а определяется прилагаемой формулой изобретения и ее эквивалентами.
Здесь и далее, настоящее изобретение более подробно описано со ссылкой на примеры. Однако, хотя последующие материалы, способ и примеры могут помочь специалисту в производстве и использовании определенных вариантов настоящего изобретения, они существуют только для иллюстрации аспектов настоящего изобретения, и, таким образом, никоим образом не ограничивают объем настоящего изобретения. Специалист в данной области может использовать способы и материалы, аналогичные или эквивалентные тем, что описаны в настоящем документе, в практическом осуществлении или испытаниях по настоящему изобретению.
Все документы по известному уровню техники, процитированные в настоящем документе, включены посредством ссылки в настоящее описание.
Примеры
[Пример 1]
Материалы и способы
Линии клеток
Клетки C1R, HLA-A- и HLA-B-негативную В-лимфобластную линию клеток человека, и клетки COS7, линию клеток почки африканской зеленой мартышки, приобретали у ATCC.
Создание клеток-мишеней со стабильной экспрессией HLA-A*11:01
Клетки C1R (C1R-A11), которые стабильно экспрессируют HLA-A*11:01, использовали в качестве клеток-стимуляторов ЦТЛ. Амплифицировали путем ПЦР кДНК, кодирующую ген HLA-A*11:01, и клонировали в экспрессирующий вектор. Клетки C1R, в которые был введен экспрессирующий вектор с геном HLA-A*11:01, культивировали с отбором по чувствительности к лекарственному препарату в течение двух недель в среде, содержащей G418 (Invitrogen). Суспензию G418-устойчивых клеток C1R разводили, высевали в 96-луночный планшет и дополнительно селективно культивировали в течение 30 суток в среде для культивирования с G418. Экспрессию HLA-A*11:01 в клетках C1R подтверждали анализом проточной цитометрии.
Селекция пептидов, полученных из MPHOSPH1
Девяти- и десятимерные пептиды, полученные из MPHOSPH1, которые, как ожидают, будут связываться с молекулой HLA-A*11:01, определяли при помощи сервера для предсказания связывания «NetMHC 3.2» (www.cbs.dtu.dk/services/NetMHC-3.2/) (Buus et al., Tissue Antigens. 2003, 62(5): 378-84; Nielsen et al., Protein Sci. 2003, 12(5): 1007-17; Bioinformatics. 2004, 20(9): 1388-97).
Пептидный синтез
Пептиды синтезировали в American Пептид Company (Sunnyvale, CA) в соответствии со стандартным способом синтеза на твердой фазе, и очищали при помощи обратно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ). Качество пептидов (чистота от 90% или выше) было гарантировано путем ВЭЖХ и масс-спектрометрии. Пептиды растворяли в диметилсульфоксиде (конечная концентрация: 20 мг/мл) и хранили при -80°C.
Индукция ЦТЛ in vitro
Дендритные клетки (DC) моноцитарного происхождения использовали в качестве антигенпрезентирующей клетки для того чтобы индуцировать специфический ответ цитотоксического T-лимфоцита (ЦТЛ) против пептидов, презентированных на лейкоцитарных антигенах человека (HLA). Как уже описано в литературе, DC получали in vitro (Nakahara S et al., Cancer Res 2003, 63(14): 4112-8). Конкретно, мононуклеарные клетки периферической крови (PBMC), выделенные у здоровых добровольцев (HLA-A*11:01-положительных) при помощи раствора Фиколл-Пак плюс (Pharmacia) высевали на пластиковые чашки для тканевой культуры (Corning), чтобы позволить PBMC прикрепиться к чашкам. Их культивировали в присутствии 1000 МЕ/мл гранулоцитарно-макрофагального колониестимулирующего фактора (R&D System) и 1000 МЕ/мл интерлейкина(IL)-4 (R&D System) в течение семи суток. В качестве среды использовали среду AIM-V (Invitrogen), содержащую 2% инактивированной сыворотки АВ-типа (AВS). DC, которые были активированы цитокинами для того чтобы отличить их от моноцитов, были активированы 20 мкг/мл каждого из синтезированных пептидов (37 градусов C, три часа). Активацию пептидами проводили в среде AIM-V, содержащей 3 мкг/мл бета 2-микроглобулина. Эти активированные пептидами DC были инактивированы рентгеновским облучением (20 Гр), смешаны в соотношении 1:20 с аутологичными CD8+ T-клетками, полученными путем положительной селекции при помощи CD8 Positive Isolation Kit (Invitrogen) (1,5×104 DC и 3×105 CD8+-положительных T-клеток) и их культивировали в 48-луночном планшете (Corning). Каждая лунка содержала 0,5 мл среды 5% ABS/AIM-V, и в каждую лунку был добавлен IL-7 (R&D System) (конечная концентрация: 10 нг/мл). Через два дня после начала культивирования добавляли IL-2 (конечная концентрация 20 МЕ/мл). На сутки 7 и сутки 14 культивирования, CD8+-положительные T-клетки дополнительно стимулировали DC, активированными пептидами. DC готовили ко времени использования тем же способом, что и вышеописанный. После суток 21 (после трех стимуляций DC) подтверждали выработку IFN-гамма против активированных пептидами C1R-A11 с использованием метода иммуноферментных пятен(ELISPOT) для человеческого интерферона(IFN)-гамма (Tanaka H et al., Br J Cancer 2001, 84(1): 94-9; Umano Y et al., Br J Cancer 2001, 84(8): 1052-7; Uchida N et al., Clin Cancer Res 2004, 10(24): 8577-86; Suda T et al., Cancer Sci 2006, 97(5): 411-9; Watanabe T et al., Cancer Sci 2005, 96(8): 498-506).
Способ наращивания ЦТЛ
ЦТЛ наращивали при помощи способов, аналогичных, описанным у Riddell et al. (Walter EA et al., N Engl J Med 1995, 333(16): 1038-44; Riddell SR et al., Nat Med 1996, 2(2): 216-23). ЦТЛ культивировали в 25 мл среды 5% ABS/AIM-V вместе с двумя типами В-лимфобластных клеточных линий человека, обработанных митомицином C (5×106 клеток/25мл среды каждая) и антитела к CD3 (конечная концентрация: 40 нг/мл). Через сутки после начала культивирования к культуре добавляли IL-2 (конечная концентрация: 120 МЕ/мл). На сутки 5, 8 и 11 среду меняли на среду 5% ABS/AIM-V, содержащую IL-2 (конечная концентрация: 30 МЕ/мл) (Tanaka H et al., Br J Cancer 2001, 84(1): 94-9; Umano Y et al., Br J Cancer 2001, 84(8): 1052-7; Uchida N et al., Clin Cancer Res 2004, 10(24): 8577-86; Suda T et al., Cancer Sci 2006, 97(5): 411-9; Watanabe T et al., Cancer Sci 2005, 96(8): 498-506)
Создание клонов ЦТЛ
После индукции ЦТЛ in vitro, ЦТЛ высаживали на 96-луночные круглодонные планшеты для микротитрования (Nalge Nunc International) в концентрации 1 клетка/на лунку или 10 клеток/на лунку. ЦТЛ культивировали с двумя типами В-лимфобластных клеточных линий человека, обработанных митомицином C (1×104 клеток/лунку каждая) в общем объеме 150 мкл/лунку среды 5% ABS/AIM-V с антителом к CD3 (конечная концентрация: 30 нг/мл) и IL-2 (конечная концентрация: 125 МЕ/мл). Через десять суток к среде добавляли 500 МЕ/мл IL-2 в 50 мкл среды 5% ABS/AIM-V. На сутки 14 или позже, ЦТЛ, которые продемонстрировали пептид-специфическую выработку IFN-гамма в анализе ELISPOT, наращивали с использованием способа, аналогичного описанному выше (Uchida N et al., Clin Cancer Res 2004, 10(24): 8577-86; Suda T et al., Cancer Sci 2006, 97(5): 411-9; Watanabe T et al., Cancer Sci 2005, 96(8): 498-506).
Подтверждение выработки IFN-гамма
Для подтверждения пептид-специфической выработки IFN-гамма ЦТЛ, индуцированных пептидом, проводили анализы ELISPOT и ELISA для IFN-гамма. Активированные пептидами C1R-A11 (1×104 клеток/лунку) готовили в качестве клеток-мишеней. Анализы ELISPOT и ELISA для IFN-гамма проводили в соответствии с руководством производителя к набору для анализа.
Получение клеток-мишеней, принудительно экспрессирующих MPHOSPH1 и HLA-A*11:01
кДНК, кодирующую ген MPHOSPH1 или HLA-A*33:03, амплифицировали при помощи ПЦР. Амплифицированный продукт клонировали в экспрессирующий вектор. Вектор, экспрессирующий MPHOSPH1 и вектор, экспрессирующий HLA-A*11:01, вместе или по отдельности были трансфецированы в клетки COS7, которые представляют собой линию клеток, отрицательную по HLA, с использованием липофектамина 2000 (Invitrogen). Через день после трансфекции, клетки COS7 отделяли и собирали с использованием версена (Invitrogen) и использовали в качестве клеток-мишеней для подтверждения выработки IFN-гамма (5×104 клетки/лунку).
Результаты
Предсказание пептидов, полученных из MPHOSPH1 и связывающихся с HLA-A*11:01
Таблицы 1a и 1b показывают девятимерные и десятимерные пептиды, полученные из MPHOSPH1, которые были теоретически рассчитаны как связывающиеся с HLA-A*11:01 при помощи «NetMHC 3.2», в порядке уменьшения аффинности связывания. Всего в качестве эпитопных кандидатных пептидов были использованы 117 пептидов, которые потенциально обладают свойством связываться с HLA-A*11:01.
[Таблица 1a-1]

[Таблица 1a-2]
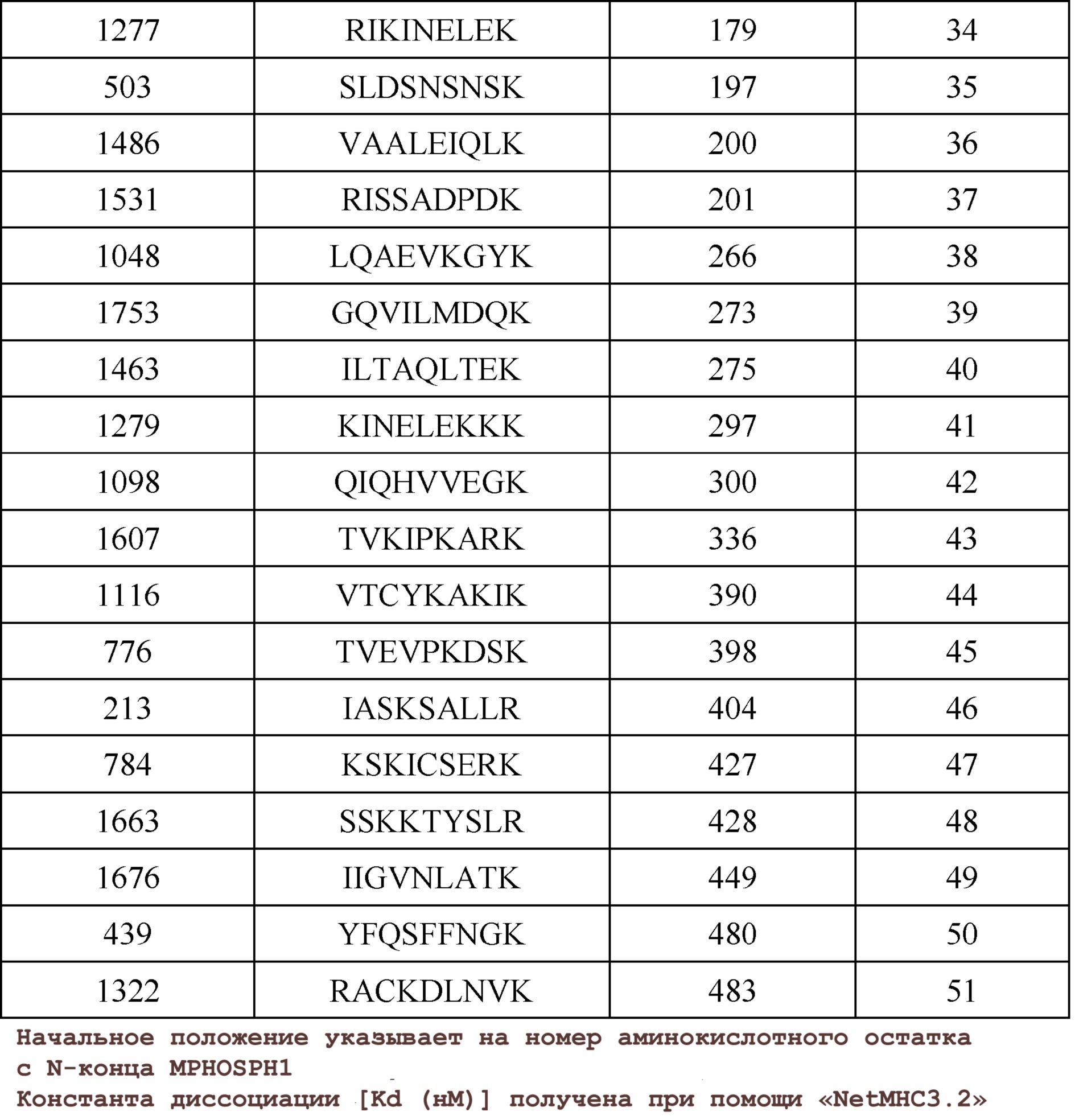
[Таблица 1b-1]

[Таблица 1b-2]

Индуцирование ЦТЛ теоретически рассчитанными пептидами, полученными из MPHOSPH1 и рестриктированными по HLA-A*11:01
ЦТЛ, специфические к пептидам, полученным из MPHOSPH1, индуцировали в соответствии с протоколом, описанным в «Материалах и способах». Пептид-специфическую выработку IFN-гамма подтверждали путем анализа ELISPOT (фиг. 1). Пептид-специфическую выработку IFN-гамма наблюдали в Лунке #3 с MPHOSPH1-A11-9-762 (SEQ ID NO: 5) (a),
Лунке #2 с MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (b),
Лунке #5 с MPHOSPH1-A11-9-96 (SEQ ID NO: 27) (c),
Лунке #6 с MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (d), и
Лунке #5 с MPHOSPH1-A11-10-1675 (SEQ ID NO: 53) (e). Кроме этого, не наблюдали специфической выработки IFN-гамма против других пептидов, показанных в таблицах 1a и 1b. Например, не наблюдали специфической выработки IFN-гамма против MPHOSPH1-A11-9-739 (SEQ ID NO: 4) (f). В результате, хотя все пептиды имели потенциал связывания с HLA-A*11:01, отобрали пять пептидов в качестве пептидов со способностью индуцировать ЦТЛ.
Получение линий и клонов ЦТЛ, специфичных к пептидам, полученным из MPHOSPH1 и рестриктированным по HLA-A*11:01
Линии ЦТЛ получали, наращивая клетки в Лунке #2 с MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (a) и Лунке #6 с MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (b) из анализа ELISPOT для IFN-гамма. В результате измерения IFN-гамма путем ELISA, наблюдали выработку IFN-гамма ЦТЛ против клеток-мишеней (C1R-A11), активированных при помощи MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (a) или MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (Фиг. 2). Дополнительно, клоны ЦТЛ получали способом серийных разведений, как описано в разделе «Материалы и способы» выше. В результате измерения IFN-гамма путем ELISA, клоны ЦТЛ, стимулированные MPHOSPH1-A11-9-1227 (SEQ ID NO: 12) (a) или MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) (b) показали пептид-специфическую выработку IFN-гамма (Фиг. 3).
Выработка IFN-гамма против клеток-мишеней, экспрессирующих MPHOSPH1 и HLA-A*11:01
Исследовали выработку IFN-гамма клоном ЦТЛ, специфическим по MPHOSPH1-A11-10-1546 (SEQ ID NO: 52), против клеток-мишеней, экспрессирующих MPHOSPH1 и HLA-A*11:01. Клетки COS7, трансфецированные и MPHOSPH1, и HLA-A*11:01, получали в качестве клеток-мишеней. Клетки COS7, транфецированные или MPHOSPH1, или HLA-A*11:01, получали в качестве отрицательного клеточного контроля. Клон ЦТЛ, специфический по MPHOSPH1-A11-10-1546 (SEQ ID NO: 52), показал выработку IFN-гамма против клеток COS7, экспрессирующих и MPHOSPH1, и HLA-A*11:01 (фиг. 4). С другой стороны, не было выявлено значительной выработки IFN-гамма против отрицательных клеточных контролей. Это ясно доказывает, что MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) представляет собой пептид, полученный в результате антигенного процессинга, и он презентируется на клетках-мишенях при помощи молекулы HLA-A*11:01 и распознается ЦТЛ. Этот результат подтверждает, что MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) может быть полезен в качестве противораковой вакцины для пациентов с повышенной экспрессией MPHOSPH1 в злокачественных клетках.
Анализ гомологии антигенных пептидов
Было подтверждено, что MPHOSPH1-A11-9-762 (SEQ ID NO: 5), MPHOSPH1-A11-9-1227 (SEQ ID NO: 12), MPHOSPH1-A11-9-96 (SEQ ID NO: 27), MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) и MPHOSPH1-A11-10-1675 (SEQ ID NO: 53) могут индуцировать CTL, показывающие пептид-специфическую выработку IFN-гамма. Таким образом, для того чтобы подтвердить, что последовательности MPHOSPH1-A11-9-762 (SEQ ID NO: 5), MPHOSPH1-A11-9-1227 (SEQ ID NO: 12), MPHOSPH1-A11-9-96 (SEQ ID NO: 27), MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) и MPHOSPH1-A11-10-1675 (SEQ ID NO: 53) получены только из MPHOSPH1, проводили анализ гомологии пептидных последовательностей с использованием алгоритма BLAST (blast.ncbi.nlm.nih.gov/Blast.cgi). В результате, последовательности MPHOSPH1-A11-9-762 (SEQ ID NO: 5), MPHOSPH1-A11-9-1227 (SEQ ID NO: 12), MPHOSPH1-A11-9-96 (SEQ ID NO: 27), MPHOSPH1-A11-10-1546 (SEQ ID NO: 52) и MPHOSPH1-A11-10-1675 (SEQ ID NO: 53) обнаружены только в MPHOSPH1. Таким образом, как известно авторам настоящего изобретения, эти пептиды специфичны для MPHOSPH1, так что практически не существует возможности того, что эти пептиды могли бы вызвать непреднамеренную иммунную реакцию против молекул, иных чем MPHOSPH1 и уже известных тем, что они сенсибилизируют иммунную систему человека. Подводя итоги, были идентифицированы новые эпитопные пептиды, полученные из MPHOSPH1 и рестриктированные по HLA-A*11:01. Было продемонстрировано, что эпитопные пептиды, полученные из MPHOSPH1, применимы для иммунотерапии злокачественных опухолей.
[Пример 2]
Материалы и способы
Линии клеток
Клетки C1R, HLA-A- и HLA-B-негативную В-лимфобластную линию клеток человека, и клетки COS7, линию клеток почки африканской зеленой мартышки, приобретали у ATCC.
Создание клеток-мишеней со стабильной экспрессией HLA-A*33:03
Клетки C1R (C1R-A33), которые стабильно экспрессируют HLA-A*33:03, использовали в качестве клеток-стимуляторов ЦТЛ. Амплифицировали путем ПЦР кДНК, кодирующую ген HLA-A*33:03, и клонировали в экспрессирующий вектор. Клетки C1R, в которые был введен экспрессирующий вектор с геном HLA-A*33:03, культивировали с отбором по чувствительности к лекарственному препарату в течение двух недель в среде, содержащей G418 (Invitrogen). Суспензию G418-устойчивых клеток C1R разводили, высевали в 96-луночный планшет и дополнительно селективно культивировали в течение 30 суток в среде для культивирования с G418. Экспрессию HLA-A*33:03 в клетках C1R подтверждали анализом проточной цитометрии.
Селекция пептидов, полученных из MPHOSPH1
Девяти- и десятимерные пептиды, полученные из MPHOSPH1, которые, как ожидают, будут связываться с молекулой HLA-A*33:03, определяли при помощи сервера для предсказания связывания «NetMHC pan2.4» (www.cbs.dtu.dk/services/NetMHCpan-2.4/) (Nielsen et al., PLoS One. 2007; 29; 2(8): e796; Hoof et al., Immunogenetics. 2009; 61(1): 1-13).
Пептидный синтез
Пептиды синтезировали в American Пептид Company (Sunnyvale, CA) в соответствии со стандартным способом синтеза на твердой фазе, и очищали при помощи обратно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ). Качество пептидов (чистота от 90% или выше) было гарантировано путем ВЭЖХ и масс-спектрометрии. Пептиды растворяли в диметилсульфоксиде (конечная концентрация: 20 мг/мл) и хранили при -80°C.
Индукция ЦТЛ in vitro
Дендритные клетки (DC) моноцитарного происхождения использовали в качестве антигенпрезентирующей клетки для того чтобы индуцировать специфический ответ цитотоксического T-лимфоцита (ЦТЛ) против пептидов, презентированных на лейкоцитарных антигенах человека (HLA). Как уже описано в литературе, DC получали in vitro (Nakahara S et al., Cancer Res 2003, 63(14): 4112-8). Конкретно, мононуклеарные клетки периферической крови (PBMC), выделенные у здоровых добровольцев (HLA-A*33:03-положительных) при помощи раствора Фиколл-Пак плюс (Pharmacia) высевали на пластиковые чашки для тканевой культуры (Corning), чтобы позволить PBMC прикрепиться к чашкам. Их культивировали в присутствии 1000 МЕ/мл гранулоцитарно-макрофагального колониестимулирующего фактора (R&D System) и 1000 МЕ/мл интерлейкина(IL)-4 (R&D System) в течение семи суток. В качестве среды использовали среду AIM-V (Invitrogen), содержащую 2% инактивированной сыворотки АВ-типа (AВS). DC, которые были активированы цитокинами для того чтобы отличить их от моноцитов, были активированы 20 мкг/мл каждого из синтезированных пептидов (37 градусов C, три часа). Активацию пептидами проводили в среде AIM-V, содержащей 3 мкг/мл бета 2-микроглобулина. Эти активированные пептидами DC были инактивированы рентгеновским облучением (20 Гр), смешаны в соотношении 1:20 с аутологичными CD8+ T-клетками, полученными путем положительной селекции при помощи CD8 Positive Isolation Kit (Invitrogen) (1,5×104 DC и 3×105 CD8+-положительных T-клеток)и культивировали в 48-луночном планшете (Corning). Каждая лунка содержала 0,5 мл среды 5% ABS/AIM-V, и в каждую лунку был добавлен IL-7 (R&D System) (конечная концентрация: 10 нг/мл). Через два дня после начала культивирования добавляли IL-2 (конечная концентрация 20 МЕ/мл). На сутки 7 и сутки 14 культивирования, CD8+-положительные T-клетки дополнительно стимулировали DC, активированными пептидами. DC готовили ко времени использования тем же способом, что и вышеописанный. После суток 21 (после трех стимуляций DC) подтверждали выработку IFN-гамма против активированных пептидами C1R-A33 с использованием метода иммуноферментных пятен (ELISPOT) (Tanaka H et al., Br J Cancer 2001, 84(1): 94-9; Umano Y et al., Br J Cancer 2001, 84(8): 1052-7; Uchida N et al., Clin Cancer Res 2004, 10(24): 8577-86; Suda T et al., Cancer Sci 2006, 97(5): 411-9; Watanabe T et al., Cancer Sci 2005, 96(8): 498-506).
Способ наращивания ЦТЛ
ЦТЛ наращивали при помощи способов, аналогичных, описанным у Riddell et al. (Walter EA et al., N Engl J Med 1995, 333(16): 1038-44; Riddell SR et al., Nat Med 1996, 2(2): 216-23). ЦТЛ культивировали в 25 мл среды 5% ABS/AIM-V вместе с двумя типами В-лимфобластных клеточных линий человека, обработанных митомицином C (5×106 клеток/25мл среды каждая) и антитела к CD3 (конечная концентрация: 40 нг/мл). Через сутки после начала культивирования к культуре добавляли IL-2 (конечная концентрация: 120 МЕ/мл). На сутки 5, 8 и 11 среду меняли на среду 5% ABS/AIM-V, содержащую IL-2 (конечная концентрация: 30 МЕ/мл) (Tanaka H et al., Br J Cancer 2001, 84(1): 94-9; Umano Y et al., Br J Cancer 2001, 84(8): 1052-7; Uchida N et al., Clin Cancer Res 2004, 10(24): 8577-86; Suda T et al., Cancer Sci 2006, 97(5): 411-9; Watanabe T et al., Cancer Sci 2005, 96(8): 498-506)
Создание клонов ЦТЛ
После индукции ЦТЛ in vitro, ЦТЛ высаживали на 96-луночные круглодонные планшеты для микротитрования (Nalge Nunc International) в концентрации 1 клетка/на лунку или 10 клеток/на лунку. ЦТЛ культивировали с двумя типами В-лимфобластных клеточных линий человека, обработанных митомицином C (1×104 клеток/лунку каждая) в общем объеме 150 мкл/лунку среды 5% ABS/AIM-V с антителом к CD3 (конечная концентрация: 30 нг/мл) и IL-2 (конечная концентрация: 125 МЕ/мл). Через десять суток к среде добавляли 500 МЕ/мл IL-2 в 50 мкл среды 5% ABS/AIM-V. На сутки 14 или позже, ЦТЛ, которые продемонстрировали пептид-специфическую выработку IFN-гамма в анализе ELISPOT, наращивали с использованием способа, аналогичного описанному выше (Uchida N et al., Clin Cancer Res 2004, 10(24): 8577-86; Suda T et al., Cancer Sci 2006, 97(5): 411-9; Watanabe T et al., Cancer Sci 2005, 96(8): 498-506).
Подтверждение выработки IFN-гамма
Для подтверждения пептид-специфической выработки IFN-гамма ЦТЛ, индуцированных пептидом, проводили анализы ELISPOT и ELISA для IFN-гамма. Активированные пептидами C1R-A33 (1×104 клеток/лунку) готовили в качестве клеток-мишеней. Анализы ELISPOT и ELISA для IFN-гамма проводили в соответствии с руководством производителя к набору для анализа.
Получение клеток-мишеней, принудительно экспрессирующих MPHOSPH1 и HLA-A*33:03
кДНК, кодирующую ген MPHOSPH1 или HLA-A*33:03, амплифицировали при помощи ПЦР. Амплифицированный продукт клонировали в экспрессирующий вектор. Вектор, экспрессирующий MPHOSPH1 и вектор, экспрессирующий HLA-A*33:03, вместе или по отдельности были трансфецированы в клетки COS7, которые представляют собой линию клеток, отрицательную по HLA, с использованием липофектамина 2000 (Invitrogen). Через день после трансфекции, клетки COS7 отделяли и собирали с использованием версена (Invitrogen) и использовали в качестве клеток-мишеней для подтверждения выработки IFN-гамма (5×104 клетки/лунку).
Результаты
Отбор пептидов, полученных из MPHOSPH1 и связывающихся с HLA-A*33:03
Таблицы 2a и 2b показывают девятимерные и десятимерные пептиды, полученные из MPHOSPH1, которые были теоретически рассчитаны как связывающиеся с HLA-A*33:03 при помощи «NetMHC pan2.4», в порядке уменьшения аффинности связывания. Всего в качестве эпитопных кандидатных пептидов были использованы 78 пептидов, которые потенциально обладают свойством связываться с HLA-A*33:03.
[Таблица 2a-1]

[Таблица 2a-2]

[Таблица 2b-1]

[Таблица 2b-2]

Индуцирование ЦТЛ теоретически рассчитанными пептидами, полученными из MPHOSPH1 и рестриктированными по HLA-A*33:03
ЦТЛ, специфические к пептидам, полученным из MPHOSPH1, индуцировали в соответствии с протоколом, описанным в «Материалах и способах». Пептид-специфическую выработку IFN-гамма подтверждали путем анализа ELISPOT (фиг. 5). Пептид-специфическую выработку IFN-гамма наблюдали в Лунке #4 с MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a),
Лунке #6 с MPHOSPH1-A33-9-1474 (SEQ ID NO: 119) (b), и
Лунке #8 с MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (c). Кроме этого, не наблюдали специфической выработки IFN-гамма против других пептидов, показанных в таблицах 2a и 2b. Например, не наблюдали специфической выработки IFN-гамма против MPHOSPH1-A33-9-1663 (SEQ ID NO: 48) (d). В результате, хотя все пептиды имели потенциал связывания с HLA-A*33:03, отобрали три пептида в качестве пептидов со способностью индуцировать ЦТЛ.
Получение линий и клонов ЦТЛ, специфичных к пептидам, полученным из MPHOSPH1 и рестриктированным по HLA-A*33:03
Линии ЦТЛ получали, наращивая клетки в Лунке #4 с MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a) и Лунке #8 с MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (b) в анализе ELISPOT для IFN-гамма. В результате измерения IFN-гамма путем ELISA, наблюдали выработку IFN-гамма линиями ЦТЛ против клеток-мишеней (C1R-A33), активированных MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a) или MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (b) (Фиг. 6). Дополнительно, клоны ЦТЛ получали способом серийных разведений. В результате измерения IFN-гамма путем ELISA, каждый из клонов ЦТЛ, стимулированных MPHOSPH1-A33-9-608 (SEQ ID NO: 118) (a) или MPHOSPH1-A33-10-57 (SEQ ID NO: 170) (b) показал пептид-специфическую выработку IFN-гамма (Фиг. 7).
Выработка IFN-гамма против клеток-мишеней, экспрессирующих MPHOSPH1 и HLA-A*33:03
Исследовали выработку IFN-гамма клоном ЦТЛ, специфическим по MPHOSPH1-A33-9-608 (SEQ ID NO: 118), против клеток-мишеней, экспрессирующих MPHOSPH1 и HLA-A*33:03. Клетки COS7, трансфецированные и MPHOSPH1, и HLA-A*33:03, получали в качестве клеток-мишеней. Клетки COS7, транфецированные или MPHOSPH1, или HLA-A*33:03, получали в качестве отрицательного клеточного контроля. Клон ЦТЛ, специфический по MPHOSPH1-A33-9-608 (SEQ ID NO: 118), показал выработку IFN-гамма против клеток COS7, экспрессирующих и MPHOSPH1, и HLA-A*33:03 (фиг. 4). С другой стороны, не было выявлено значительной выработки IFN-гамма против отрицательных клеточных контролей. Это ясно доказывает, что MPHOSPH1-A33-9-608 (SEQ ID NO: 118) представляет собой пептид, полученный в результате антигенного процессинга, и он презентируется на клетках-мишенях при помощи молекулы HLA-A*33:03 и распознается ЦТЛ. Этот результат подтверждает, что MPHOSPH1-A33-9-608 (SEQ ID NO: 118) может быть полезен в качестве противораковой вакцины для пациентов с повышенной экспрессией MPHOSPH1 в злокачественных клетках.
Анализ гомологии антигенных пептидов
Было подтверждено, что MPHOSPH1-A33-9-608 (SEQ ID NO: 118), MPHOSPH1-A33-9-1474 (SEQ ID NO: 119) и MPHOSPH1-A33-10-57 (SEQ ID NO: 170) могут индуцировать CTL, показывающие пептид-специфическую выработку IFN-гамма. Таким образом, для того чтобы подтвердить, что последовательности MPHOSPH1-A33-9-608 (SEQ ID NO: 118), MPHOSPH1-A33-9-1474 (SEQ ID NO: 119) и MPHOSPH1-A33-10-57 (SEQ ID NO: 170) получены только из MPHOSPH1, проводили анализ гомологии пептидных последовательностей с использованием алгоритма BLAST (blast.ncbi.nlm.nih.gov/Blast.cgi). В результате, последовательности MPHOSPH1-A33-9-608 (SEQ ID NO: 118), MPHOSPH1-A33-9-1474 (SEQ ID NO: 119) и MPHOSPH1-A33-10-57 (SEQ ID NO: 170) обнаружены только в MPHOSPH1. Таким образом, как известно авторам настоящего изобретения, эти пептиды специфичны для MPHOSPH1, так что практически не существует возможности того, что эти пептиды могли бы вызвать непреднамеренную иммунную реакцию против молекул, иных чем MPHOSPH1 и уже известных тем, что они сенсибилизируют иммунную систему человека. Подводя итоги, были идентифицированы новые эпитопные пептиды, полученные из MPHOSPH1 и рестриктированные по HLA-A*33:03. Было продемонстрировано, что эпитопные пептиды, полученные из MPHOSPH1, применимы для иммунотерапии злокачественных опухолей.
[Пример 3]
Получение составов эмульсий
Пептид растворяли в растворителе для инъекций или стерильном физиологическом растворе до получения концентрации от 1,0 мг/мл до 10,0 мг/мл, и набирали в шприц. Его соединяли через коннектор со шприцем, наполненным неполным адъювантом Фрейнда (IFA), в количестве, эквивалентном количеству растворителя для инъекций или стерильного физиологического раствора, и перемешивали, поочередно нажимая на поршни двух соединенных шприцев. После нескольких минут перемешивания, готовность эмульсии оценивали путем капельной пробы. Капельную пробу можно проводить, капая одну каплю смешанного образца на воду. Эмульсию оценивают как готовую, когда образец, капнутый на воду, не сразу диффундирует в воде; и эмульсию оценивают, как не готовую, когда образец, капнутый на воду, сразу растворяется в воде. Когда эмульсию оценивают как не готовую, дополнительно проводят перемешивание до готовности эмульсии. Готовую эмульсию можно вводить пациенту со злокачественной опухолью путем подкожной инъекции. Пациента со злокачественной опухолью, подходящего для введения, можно выбирать из пациентов, страдающих от рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярного рака, хронического миелолейкоза (ХМЛ), рака толстого кишечника, рака желудка, рака легких, лимфомы, остеосаркомы, рака предстательной железы, рака почки, опухоли мягких тканей и т.п.
Получение лиофилизированных составов
Пептид растворяли в растворителе для инъекций растворе до получения концентрации от 1,0 мг/мл до 10,0 мг/мл, и стерилизовали фильтрованием. Раствором заполняли стерилизованный флакон, и наполовину закрывали стерилизованной резиновой пробкой. После лиофилизации флакона, его полностью закрывали и запаивали алюминиевой крышкой для получения лиофилизированного состава. При использовании, растворитель для инъекций или стерильный физиологический раствор инъецировали во флакон для повторного растворения лиофилизированного порошка. Повторно растворенный раствор во флаконе собирали в шприц, и шприц соединяли через коннектор со шприцем, наполненным IFA, в количестве, эквивалентном собранному повторно растворенному раствору. Повторно растворенный раствор и IFA смешивали, поочередно нажимая на поршни двух соединенных шприцев. После нескольких минут перемешивания, готовность эмульсии оценивали путем капельной пробы. Готовую эмульсию можно вводить пациенту со злокачественной опухолью путем подкожной инъекции. Пациента со злокачественной опухолью, подходящего для введения, можно выбирать из пациентов, страдающих от рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярного рака, хронического миелолейкоза (ХМЛ), рака толстого кишечника, рака желудка, рака легких, лимфомы, остеосаркомы, рака предстательной железы, рака почки, опухоли мягких тканей и т.п
Промышленная применимость
Настоящее изобретение относится к новым эпитопным пептидам, полученным из MPHOSPH1 и рестриктированным по HLA-A11 и HLA-A33, которые могут индуцировать мощный и специфический противоопухолевый иммунный ответ, и, таким образом, иметь применимость для широкого спектра типов злокачественных опухолей. Пептиды, композиции, АПК, и ЦТЛ по настоящему изобретению можно использовать в качестве пептидной вакцины для злокачественной опухоли, экспрессирующей MPHOSPH1, например, рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярного рака, хронического миелолейкоза (ХМЛ), рака толстого кишечника, рака желудка, рака легких, лимфомы, остеосаркомы, рака предстательной железы, рака почки и опухоли мягких тканей.
Хотя настоящее изобретение в настоящем документе описано подробно и относительно его конкретных вариантов осуществления, следует понимать, что вышеуказанное описание является по своему характеру иллюстративным и пояснительным и предназначено для иллюстрации настоящего изобретения и его предпочтительных вариантов осуществления. Путем рутинных экспериментов, специалист в данной области легко поймет, что в изобретении можно производить различные изменения и модификации в пределах сущности и объема настоящего изобретения, пределы которых определены прилагаемой формулой изобретения.
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ONCOTHERAPY SCIENCE,INC.
<120> ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ MPHOSPH1, И ВКЛЮЧАЮЩАЯ ЕГО ВАКЦИНА
<130> ONC-A1603P
<150> JP 2015-200220
<151> 2015-10-08
<160> 189
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 1
Met Ala Gln Lys Phe Ser Phe Ser Lys
1 5
<210> 2
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 2
Leu Thr Gln Gly Val Thr Cys Tyr Lys
1 5
<210> 3
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 3
Lys Met Met Leu Ile Thr Gln Ala Lys
1 5
<210> 4
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 4
Thr Ile Asn Glu Phe Gln Asn Leu Lys
1 5
<210> 5
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 5
Thr Ser Ser Leu Ile Ile Asn Asn Lys
1 5
<210> 6
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 6
Arg Leu Tyr Thr Lys Met Asn Leu Lys
1 5
<210> 7
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 7
Thr Ser Phe Glu Ile Ser Arg Asn Lys
1 5
<210> 8
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 8
Arg Ser His Ser Ile Phe Thr Val Lys
1 5
<210> 9
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 9
Lys Ser Ser Gly Gln Met Ala Gln Lys
1 5
<210> 10
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 10
Ser Gln Ile Lys Leu Met His Thr Lys
1 5
<210> 11
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 11
Ala Ile Ala Glu Leu His Val Gln Lys
1 5
<210> 12
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 12
Ser Ser Ala Arg Thr Gln Asn Leu Lys
1 5
<210> 13
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 13
Lys Ser His Met Glu Asn Thr Phe Lys
1 5
<210> 14
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 14
Ser Leu Gln Glu Arg Leu Tyr Thr Lys
1 5
<210> 15
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 15
Ala Leu Ile Ser Ser Asn Val Gln Lys
1 5
<210> 16
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 16
Ala Ile Phe Lys Asp Leu Val Gly Lys
1 5
<210> 17
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 17
Ile Thr Asn Asn Val Ser Gln Ile Lys
1 5
<210> 18
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 18
Asn Thr Ser Leu Leu Thr Leu Gly Lys
1 5
<210> 19
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 19
Ser Ile Leu Gln Ser Lys Ala Lys Lys
1 5
<210> 20
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 20
Lys Ala Phe Ile Ser His Glu Glu Lys
1 5
<210> 21
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 21
Lys Val Ala Ile Arg Pro Ser Ser Lys
1 5
<210> 22
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 22
Leu Thr Asn Asn Leu Gln Asp Met Lys
1 5
<210> 23
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 23
Gly Val Asn Leu Ala Thr Lys Lys Lys
1 5
<210> 24
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 24
Lys Leu Ser Asn Val Glu Ala Ser Lys
1 5
<210> 25
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 25
Ser Ser Ala Ile Thr Glu Asp Gln Lys
1 5
<210> 26
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 26
Lys Val Glu Cys Ser His Ser Ala Lys
1 5
<210> 27
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 27
Cys Ile Leu Gly Arg Leu Ser Glu Lys
1 5
<210> 28
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 28
Val Ala Ile Arg Pro Ser Ser Lys Lys
1 5
<210> 29
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 29
Lys Ser Ala Leu Leu Arg Gln Ile Lys
1 5
<210> 30
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 30
Val Ser Ser Lys Phe Gln Lys Arg Lys
1 5
<210> 31
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 31
Thr Gln Ile Met Asp Ile Lys Pro Lys
1 5
<210> 32
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 32
Ile Ile Glu Thr Met Ser Ser Ser Lys
1 5
<210> 33
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 33
Gln Ser Phe Phe Asn Gly Lys Gly Lys
1 5
<210> 34
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 34
Arg Ile Lys Ile Asn Glu Leu Glu Lys
1 5
<210> 35
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 35
Ser Leu Asp Ser Asn Ser Asn Ser Lys
1 5
<210> 36
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 36
Val Ala Ala Leu Glu Ile Gln Leu Lys
1 5
<210> 37
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 37
Arg Ile Ser Ser Ala Asp Pro Asp Lys
1 5
<210> 38
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 38
Leu Gln Ala Glu Val Lys Gly Tyr Lys
1 5
<210> 39
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 39
Gly Gln Val Ile Leu Met Asp Gln Lys
1 5
<210> 40
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 40
Ile Leu Thr Ala Gln Leu Thr Glu Lys
1 5
<210> 41
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 41
Lys Ile Asn Glu Leu Glu Lys Lys Lys
1 5
<210> 42
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 42
Gln Ile Gln His Val Val Glu Gly Lys
1 5
<210> 43
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 43
Thr Val Lys Ile Pro Lys Ala Arg Lys
1 5
<210> 44
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 44
Val Thr Cys Tyr Lys Ala Lys Ile Lys
1 5
<210> 45
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 45
Thr Val Glu Val Pro Lys Asp Ser Lys
1 5
<210> 46
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 46
Ile Ala Ser Lys Ser Ala Leu Leu Arg
1 5
<210> 47
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 47
Lys Ser Lys Ile Cys Ser Glu Arg Lys
1 5
<210> 48
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 48
Ser Ser Lys Lys Thr Tyr Ser Leu Arg
1 5
<210> 49
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 49
Ile Ile Gly Val Asn Leu Ala Thr Lys
1 5
<210> 50
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 50
Tyr Phe Gln Ser Phe Phe Asn Gly Lys
1 5
<210> 51
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 51
Arg Ala Cys Lys Asp Leu Asn Val Lys
1 5
<210> 52
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 52
Ser Thr Ser Phe Glu Ile Ser Arg Asn Lys
1 5 10
<210> 53
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 53
Ser Ile Ile Gly Val Asn Leu Ala Thr Lys
1 5 10
<210> 54
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 54
Ala Ser Ser Ala Arg Thr Gln Asn Leu Lys
1 5 10
<210> 55
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 55
Thr Thr Pro Val Thr Val Lys Ile Pro Lys
1 5 10
<210> 56
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 56
Ser Ile Thr Asn Asn Val Ser Gln Ile Lys
1 5 10
<210> 57
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 57
Phe Thr Tyr Gly Leu Thr Asn Ser Gly Lys
1 5 10
<210> 58
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 58
Lys Ile Ile Glu Thr Met Ser Ser Ser Lys
1 5 10
<210> 59
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 59
Lys Val Phe Gly Pro Ala Thr Thr Gln Lys
1 5 10
<210> 60
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 60
Gln Met Ala Gln Lys Phe Ser Phe Ser Lys
1 5 10
<210> 61
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 61
Val Ser Leu Asp Ser Asn Ser Asn Ser Lys
1 5 10
<210> 62
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 62
Ala Ser Lys Glu Asn Val Ser Gln Pro Lys
1 5 10
<210> 63
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 63
Lys Ala Leu Ile Ser Ser Asn Val Gln Lys
1 5 10
<210> 64
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 64
Lys Val Ala Ile Arg Pro Ser Ser Lys Lys
1 5 10
<210> 65
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 65
Val Ser Ser Ala Ile Thr Glu Asp Gln Lys
1 5 10
<210> 66
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 66
Ile Met Gln Pro Val Lys Asp Leu Leu Lys
1 5 10
<210> 67
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 67
Asp Thr Ser Ser Leu Ile Ile Asn Asn Lys
1 5 10
<210> 68
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 68
Asp Ser Leu Gln Glu Arg Leu Tyr Thr Lys
1 5 10
<210> 69
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 69
Ser Ser Ala Ile Thr Glu Asp Gln Lys Lys
1 5 10
<210> 70
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 70
Leu Val Ala Ala Leu Glu Ile Gln Leu Lys
1 5 10
<210> 71
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 71
Phe Val Pro Val Ser Ser Lys Phe Gln Lys
1 5 10
<210> 72
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 72
Val Ser Gln Ile Lys Leu Met His Thr Lys
1 5 10
<210> 73
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 73
Leu Ala Ile Phe Lys Asp Leu Val Gly Lys
1 5 10
<210> 74
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 74
Ile Ala Ile Ala Glu Leu His Val Gln Lys
1 5 10
<210> 75
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 75
Arg Ile Arg Pro Phe Thr Gln Ser Glu Lys
1 5 10
<210> 76
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 76
Asn Thr Glu Ala Asn Ser Phe Glu Ser Lys
1 5 10
<210> 77
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 77
Asp Thr Ile Asn Glu Phe Gln Asn Leu Lys
1 5 10
<210> 78
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 78
Gln Val Ile Leu Met Asp Gln Lys Met Lys
1 5 10
<210> 79
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 79
Asn Ser Asn Ser Lys Ile Leu Asn Val Lys
1 5 10
<210> 80
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 80
Ile Leu Asp Ser Gln Thr Val Val Leu Lys
1 5 10
<210> 81
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 81
Gln Ile Ile Lys Arg Arg Leu Arg Thr Lys
1 5 10
<210> 82
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 82
Glu Leu Thr Gln Gly Val Thr Cys Tyr Lys
1 5 10
<210> 83
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 83
Glu Ile Leu Thr Ala Gln Leu Thr Glu Lys
1 5 10
<210> 84
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 84
Ile Ser Asp Asp Arg Asn Ser Ser Val Lys
1 5 10
<210> 85
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 85
Ile Gln Phe Thr Pro Leu Gln Pro Asn Lys
1 5 10
<210> 86
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 86
Tyr Ala Glu Asp Arg Glu Arg Phe Phe Lys
1 5 10
<210> 87
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 87
Phe Leu Leu Thr Ile Glu Asn Glu Leu Lys
1 5 10
<210> 88
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 88
Leu Leu Gly Asn Asp Tyr Leu Val Ser Lys
1 5 10
<210> 89
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 89
Thr Leu Gly Lys Cys Ile Asn Val Leu Lys
1 5 10
<210> 90
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 90
Asn Ile Ser Glu Phe Glu Glu Ser Ile Lys
1 5 10
<210> 91
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 91
Val Gln Ile Gln His Val Val Glu Gly Lys
1 5 10
<210> 92
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 92
Lys Leu Leu Asp Leu Ile Glu Asp Leu Lys
1 5 10
<210> 93
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 93
Leu Thr Glu Lys Asp Ser Asp Leu Gln Lys
1 5 10
<210> 94
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 94
Leu Ile Gln Glu Leu Glu Thr Ser Asn Lys
1 5 10
<210> 95
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 95
Ile Ile Leu Lys Leu Glu Arg Asn Leu Lys
1 5 10
<210> 96
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 96
Arg Ile Lys Ile Asn Glu Leu Glu Lys Lys
1 5 10
<210> 97
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 97
Cys Ile Asn Val Leu Lys Asn Ser Glu Lys
1 5 10
<210> 98
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 98
Tyr Val Phe Ser Ala Asp Pro Ile Ala Arg
1 5 10
<210> 99
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 99
Ala Thr Glu Leu Glu Lys Trp Lys Glu Lys
1 5 10
<210> 100
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 100
Ala Ile Gln Gln Tyr Glu Arg Ala Cys Lys
1 5 10
<210> 101
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 101
Phe Gln Ser Phe Phe Asn Gly Lys Gly Lys
1 5 10
<210> 102
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 102
Lys Thr Lys Gly Glu Leu Ile Lys Thr Lys
1 5 10
<210> 103
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 103
Gly Val Thr Cys Tyr Lys Ala Lys Ile Lys
1 5 10
<210> 104
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 104
Ser Leu Cys Asp Leu Ala Gly Ser Glu Arg
1 5 10
<210> 105
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 105
Leu Leu Asp Leu Ile Glu Asp Leu Lys Lys
1 5 10
<210> 106
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 106
Lys Ile Ile Thr Gln Asn Gln Arg Ile Lys
1 5 10
<210> 107
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 107
Asn Val Leu Phe Asp Ser Leu Gln Glu Arg
1 5 10
<210> 108
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 108
Val Thr Val Lys Ile Pro Lys Ala Arg Lys
1 5 10
<210> 109
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 109
Val Ser Phe Phe Glu Ile Tyr Asn Glu Tyr
1 5 10
<210> 110
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 110
Lys Met Leu Arg Leu Ser Gln Asp Val Lys
1 5 10
<210> 111
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 111
Asp Ser Lys Glu Ala Tyr Arg Leu Leu Lys
1 5 10
<210> 112
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 112
Lys Leu Gln Ala Glu Val Lys Gly Tyr Lys
1 5 10
<210> 113
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 113
Phe Gln Gln Glu Leu Ser Leu Ser Glu Lys
1 5 10
<210> 114
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 114
Lys Leu Thr Asp Ala Lys Lys Gln Ile Lys
1 5 10
<210> 115
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 115
Ile Ile Gly Val Asn Leu Ala Thr Lys Lys
1 5 10
<210> 116
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 116
Gln Leu Thr Asn Asn Leu Gln Asp Met Lys
1 5 10
<210> 117
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 117
Val Leu Lys Phe Ser Ala Ile Ala Gln Lys
1 5 10
<210> 118
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 118
Glu Phe Thr Gln Tyr Trp Ala Gln Arg
1 5
<210> 119
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 119
Asp Leu Gln Lys Trp Arg Glu Glu Arg
1 5
<210> 120
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 120
Gln Ile Met Asp Ile Lys Pro Lys Arg
1 5
<210> 121
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 121
Asn Ser Lys Ile Leu Asn Val Lys Arg
1 5
<210> 122
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 122
His Gln Ile Ile Lys Arg Arg Leu Arg
1 5
<210> 123
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 123
Glu Ile Leu Glu Glu Asn Ala Glu Arg
1 5
<210> 124
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 124
Val Thr Val Lys Ile Pro Lys Ala Arg
1 5
<210> 125
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 125
Lys Phe Gln Lys Arg Lys Met Leu Arg
1 5
<210> 126
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 126
Glu Ser Ile Ile Leu Lys Leu Glu Arg
1 5
<210> 127
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 127
Lys Phe Gln Gln His Val Pro Phe Arg
1 5
<210> 128
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 128
Asn Phe Asn Gln Glu Gly Val Pro Arg
1 5
<210> 129
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 129
Asp Val Lys Gly Tyr Ser Phe Ile Lys
1 5
<210> 130
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 130
Asp Met Lys His Leu Leu Gln Leu Lys
1 5
<210> 131
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 131
Ser Asn Ile Asp Leu Leu Asn Leu Arg
1 5
<210> 132
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 132
Val Phe Ser Ala Asp Pro Ile Ala Arg
1 5
<210> 133
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 133
Glu Met Lys Lys Tyr Ala Glu Asp Arg
1 5
<210> 134
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 134
Val Ser Gln Pro Lys Arg Ala Lys Arg
1 5
<210> 135
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 135
Glu Tyr Arg Ile Gln Glu Pro Asn Arg
1 5
<210> 136
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 136
Val Ser Lys Gln Val Lys Glu Tyr Arg
1 5
<210> 137
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 137
Val Leu Phe Asp Ser Leu Gln Glu Arg
1 5
<210> 138
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 138
Asn Ile Ala Glu Ile Glu Asp Ile Arg
1 5
<210> 139
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 139
Leu Ser Thr Ser Phe Glu Ile Ser Arg
1 5
<210> 140
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 140
Met Asn Leu Lys Pro His Arg Ser Arg
1 5
<210> 141
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 141
Val Gln Lys Glu Val Ser Val Met Arg
1 5
<210> 142
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 142
Asp Leu Phe Val Pro Val Ser Ser Lys
1 5
<210> 143
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 143
Glu Ala Lys Leu Glu Glu Val Glu Arg
1 5
<210> 144
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 144
Tyr Ile Tyr Asp Leu Phe Val Pro Val
1 5
<210> 145
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 145
Asp Leu Glu Thr Lys Asn Asn Gln Arg
1 5
<210> 146
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 146
Ala Phe Ile Ser His Glu Glu Lys Arg
1 5
<210> 147
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 147
Ser Phe Phe Glu Ile Tyr Asn Glu Tyr
1 5
<210> 148
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 148
Pro Val Ser Ser Lys Phe Gln Lys Arg
1 5
<210> 149
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 149
Asn Ala Thr Pro Arg Thr Asn Leu Lys
1 5
<210> 150
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 150
Asp Leu Val Gly Lys Cys Asp Thr Arg
1 5
<210> 151
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 151
Glu Asn Lys Lys Asn Ala Thr Pro Arg
1 5
<210> 152
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 152
Asp Ser Glu Met Ser Arg Val Ile Arg
1 5
<210> 153
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 153
Asp Phe Lys Glu Thr Leu Leu Gln Glu Arg
1 5 10
<210> 154
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 154
Phe Thr Lys Leu Asn Asn Ala Ser Ser Arg
1 5 10
<210> 155
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 155
Asp Ser Lys Ser Lys Ile Cys Ser Glu Arg
1 5 10
<210> 156
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 156
Tyr Thr Lys Met Asn Leu Lys Pro His Arg
1 5 10
<210> 157
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 157
Glu Ile Ala Ser Lys Ser Ala Leu Leu Arg
1 5 10
<210> 158
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 158
His Tyr Phe Gln Ser Phe Phe Asn Gly Lys
1 5 10
<210> 159
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 159
Gln Val Ser Asp Ser Lys Glu Ala Tyr Arg
1 5 10
<210> 160
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 160
Asn Val Ser Gln Pro Lys Arg Ala Lys Arg
1 5 10
<210> 161
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 161
Leu Met His Thr Lys Ile Asp Glu Leu Arg
1 5 10
<210> 162
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 162
Thr Val Lys Ile Pro Lys Ala Arg Lys Arg
1 5 10
<210> 163
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 163
Leu Val Ser Lys Gln Val Lys Glu Tyr Arg
1 5 10
<210> 164
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 164
Thr Met Lys Thr Gln Asn Glu Gly Glu Arg
1 5 10
<210> 165
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 165
Leu Ser Asn Glu Ile Glu Thr Ala Thr Arg
1 5 10
<210> 166
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 166
Asn Leu Lys Phe Pro Ile Ser Asp Asp Arg
1 5 10
<210> 167
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 167
Glu Ile Leu Glu Glu Asn Ala Glu Arg Arg
1 5 10
<210> 168
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 168
Lys Met Asn Leu Lys Pro His Arg Ser Arg
1 5 10
<210> 169
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 169
Gln Val Gln Lys Glu Val Ser Val Met Arg
1 5 10
<210> 170
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 170
Asp Tyr Leu Gln Val Cys Leu Arg Ile Arg
1 5 10
<210> 171
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 171
Gln Ile Gln His Val Val Glu Gly Lys Arg
1 5 10
<210> 172
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 172
Asp Leu Lys Lys Lys Leu Ile Asn Glu Lys
1 5 10
<210> 173
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 173
Ile Ser Asn Ile Asp Leu Leu Asn Leu Arg
1 5 10
<210> 174
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 174
Ser Asn Ser Lys Ile Leu Asn Val Lys Arg
1 5 10
<210> 175
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 175
Ser Asn Phe Asn Gln Glu Gly Val Pro Arg
1 5 10
<210> 176
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 176
Lys Pro His Arg Ser Arg Glu Tyr Leu Arg
1 5 10
<210> 177
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 177
Val Met Arg Asp Glu Asp Lys Leu Leu Arg
1 5 10
<210> 178
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 178
Thr Gln Ile Met Asp Ile Lys Pro Lys Arg
1 5 10
<210> 179
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 179
Gln Glu Phe Thr Gln Tyr Trp Ala Gln Arg
1 5 10
<210> 180
<211> 10
<212> Белок
<213> искусственная последовательность
<220>
<223> пептид, полученный из MPHOSPH1
<400> 180
Lys Ala Phe Ile Ser His Glu Glu Lys Arg
1 5 10
<210> 181
<211> 22
<212> ДНК
<213> искусственная последовательность
<220>
<223> ПЦР-праймер для анализа TCR
<400> 181
gtctaccagg cattcgcttc at 22
<210> 182
<211> 24
<212> ДНК
<213> искусственная последовательность
<220>
<223> ПЦР-праймер для анализа TCR
<400> 182
tcagctggac cacagccgca gcgt 24
<210> 183
<211> 21
<212> ДНК
<213> искусственная последовательность
<220>
<223> ПЦР-праймер для анализа TCR
<400> 183
tcagaaatcc tttctcttga c 21
<210> 184
<211> 24
<212> ДНК
<213> искусственная последовательность
<220>
<223> ПЦР-праймер для анализа TCR
<400> 184
ctagcctctg gaatcctttc tctt 24
<210> 185
<211> 6339
<212> ДНК
<213> Homo sapiens
<220>
<221> кодирующая последовательнсоть
<222> (93)..(5435)
<400> 185
agtgcggtgc cctggccgcc attgtttgaa tttgaaaacg gtaacatcgc agtgctgctc 60
gcgggtctgg ctagtcaggc gaagtttgca ga atg gaa tct aat ttt aat caa 113
Met Glu Ser Asn Phe Asn Gln
1 5
gag gga gta cct cga cca tct tat gtt ttt agt gct gac cca att gca 161
Glu Gly Val Pro Arg Pro Ser Tyr Val Phe Ser Ala Asp Pro Ile Ala
10 15 20
agg cct tca gaa ata aat ttc gat ggc att aag ctt gat ctg tct cat 209
Arg Pro Ser Glu Ile Asn Phe Asp Gly Ile Lys Leu Asp Leu Ser His
25 30 35
gaa ttt tcc tta gtt gct cca aat act gag gca aac agt ttc gaa tct 257
Glu Phe Ser Leu Val Ala Pro Asn Thr Glu Ala Asn Ser Phe Glu Ser
40 45 50 55
aaa gat tat ctc cag gtt tgt ctt cga ata aga cca ttt aca cag tca 305
Lys Asp Tyr Leu Gln Val Cys Leu Arg Ile Arg Pro Phe Thr Gln Ser
60 65 70
gaa aaa gaa ctt gag tct gag ggc tgt gtg cat att ctg gat tca cag 353
Glu Lys Glu Leu Glu Ser Glu Gly Cys Val His Ile Leu Asp Ser Gln
75 80 85
act gtt gtg ctg aaa gag cct caa tgc atc ctt ggt cgg tta agt gaa 401
Thr Val Val Leu Lys Glu Pro Gln Cys Ile Leu Gly Arg Leu Ser Glu
90 95 100
aaa agc tca ggg cag atg gca cag aaa ttc agt ttt tcc aag gtt ttt 449
Lys Ser Ser Gly Gln Met Ala Gln Lys Phe Ser Phe Ser Lys Val Phe
105 110 115
ggc cca gca act aca cag aag gaa ttc ttt cag ggt tgc att atg caa 497
Gly Pro Ala Thr Thr Gln Lys Glu Phe Phe Gln Gly Cys Ile Met Gln
120 125 130 135
cca gta aaa gac ctc ttg aaa gga cag agt cgt ctg att ttt act tac 545
Pro Val Lys Asp Leu Leu Lys Gly Gln Ser Arg Leu Ile Phe Thr Tyr
140 145 150
ggg cta acc aat tca gga aaa aca tat aca ttt caa ggg aca gaa gaa 593
Gly Leu Thr Asn Ser Gly Lys Thr Tyr Thr Phe Gln Gly Thr Glu Glu
155 160 165
aat att ggc att ctg cct cga act ttg aat gta tta ttt gat agt ctt 641
Asn Ile Gly Ile Leu Pro Arg Thr Leu Asn Val Leu Phe Asp Ser Leu
170 175 180
caa gaa aga ctg tat aca aag atg aac ctt aaa cca cat aga tcc aga 689
Gln Glu Arg Leu Tyr Thr Lys Met Asn Leu Lys Pro His Arg Ser Arg
185 190 195
gaa tac tta agg tta tca tca gaa caa gag aaa gaa gaa att gct agc 737
Glu Tyr Leu Arg Leu Ser Ser Glu Gln Glu Lys Glu Glu Ile Ala Ser
200 205 210 215
aaa agt gca ttg ctt cgg caa att aaa gag gtt act gtg cat aat gat 785
Lys Ser Ala Leu Leu Arg Gln Ile Lys Glu Val Thr Val His Asn Asp
220 225 230
agt gat gat act ctt tat gga agt tta act aac tct ttg aat atc tca 833
Ser Asp Asp Thr Leu Tyr Gly Ser Leu Thr Asn Ser Leu Asn Ile Ser
235 240 245
gag ttt gaa gaa tcc ata aaa gat tat gaa caa gcc aac ttg aat atg 881
Glu Phe Glu Glu Ser Ile Lys Asp Tyr Glu Gln Ala Asn Leu Asn Met
250 255 260
gct aat agt ata aaa ttt tct gtg tgg gtt tct ttc ttt gaa att tac 929
Ala Asn Ser Ile Lys Phe Ser Val Trp Val Ser Phe Phe Glu Ile Tyr
265 270 275
aat gaa tat att tat gac tta ttt gtt cct gta tca tct aaa ttc caa 977
Asn Glu Tyr Ile Tyr Asp Leu Phe Val Pro Val Ser Ser Lys Phe Gln
280 285 290 295
aag aga aag atg ctg cgc ctt tcc caa gac gta aag ggc tat tct ttt 1025
Lys Arg Lys Met Leu Arg Leu Ser Gln Asp Val Lys Gly Tyr Ser Phe
300 305 310
ata aaa gat cta caa tgg att caa gta tct gat tcc aaa gaa gcc tat 1073
Ile Lys Asp Leu Gln Trp Ile Gln Val Ser Asp Ser Lys Glu Ala Tyr
315 320 325
aga ctt tta aaa cta gga ata aag cac cag agt gtt gcc ttc aca aaa 1121
Arg Leu Leu Lys Leu Gly Ile Lys His Gln Ser Val Ala Phe Thr Lys
330 335 340
ttg aat aat gct tcc agt aga agt cac agc ata ttc act gtt aaa ata 1169
Leu Asn Asn Ala Ser Ser Arg Ser His Ser Ile Phe Thr Val Lys Ile
345 350 355
tta cag att gaa gat tct gaa atg tct cgt gta att cga gtc agt gaa 1217
Leu Gln Ile Glu Asp Ser Glu Met Ser Arg Val Ile Arg Val Ser Glu
360 365 370 375
tta tct tta tgt gat ctt gct ggt tca gaa cga act atg aag aca cag 1265
Leu Ser Leu Cys Asp Leu Ala Gly Ser Glu Arg Thr Met Lys Thr Gln
380 385 390
aat gaa ggt gaa agg tta aga gag act ggg aat atc aac act tct tta 1313
Asn Glu Gly Glu Arg Leu Arg Glu Thr Gly Asn Ile Asn Thr Ser Leu
395 400 405
ttg act ctg gga aag tgt att aac gtc ttg aag aat agt gaa aag tca 1361
Leu Thr Leu Gly Lys Cys Ile Asn Val Leu Lys Asn Ser Glu Lys Ser
410 415 420
aag ttt caa cag cat gtg cct ttc cgg gaa agt aaa ctg act cac tat 1409
Lys Phe Gln Gln His Val Pro Phe Arg Glu Ser Lys Leu Thr His Tyr
425 430 435
ttt caa agt ttt ttt aat ggt aaa ggg aaa att tgt atg att gtc aat 1457
Phe Gln Ser Phe Phe Asn Gly Lys Gly Lys Ile Cys Met Ile Val Asn
440 445 450 455
atc agc caa tgt tat tta gcc tat gat gaa aca ctc aat gta ttg aag 1505
Ile Ser Gln Cys Tyr Leu Ala Tyr Asp Glu Thr Leu Asn Val Leu Lys
460 465 470
ttc tcc gcc att gca caa aaa gtt tgt gtc cca gac act tta aat tcc 1553
Phe Ser Ala Ile Ala Gln Lys Val Cys Val Pro Asp Thr Leu Asn Ser
475 480 485
tct caa gag aaa tta ttt gga cct gtc aaa tct tct caa gat gta tca 1601
Ser Gln Glu Lys Leu Phe Gly Pro Val Lys Ser Ser Gln Asp Val Ser
490 495 500
cta gac agt aat tca aac agt aaa ata tta aat gta aaa aga gcc acc 1649
Leu Asp Ser Asn Ser Asn Ser Lys Ile Leu Asn Val Lys Arg Ala Thr
505 510 515
att tca tgg gaa aat agt cta gaa gat ttg atg gaa gac gag gat ttg 1697
Ile Ser Trp Glu Asn Ser Leu Glu Asp Leu Met Glu Asp Glu Asp Leu
520 525 530 535
gtt gag gag cta gaa aac gct gaa gaa act caa aat gtg gaa act aaa 1745
Val Glu Glu Leu Glu Asn Ala Glu Glu Thr Gln Asn Val Glu Thr Lys
540 545 550
ctt ctt gat gaa gat cta gat aaa aca tta gag gaa aat aag gct ttc 1793
Leu Leu Asp Glu Asp Leu Asp Lys Thr Leu Glu Glu Asn Lys Ala Phe
555 560 565
att agc cac gag gag aaa aga aaa ctg ttg gac tta ata gaa gac ttg 1841
Ile Ser His Glu Glu Lys Arg Lys Leu Leu Asp Leu Ile Glu Asp Leu
570 575 580
aaa aaa aaa ctg ata aat gaa aaa aag gaa aaa tta acc ttg gaa ttt 1889
Lys Lys Lys Leu Ile Asn Glu Lys Lys Glu Lys Leu Thr Leu Glu Phe
585 590 595
aaa att cga gaa gaa gtt aca cag gag ttt act cag tat tgg gct caa 1937
Lys Ile Arg Glu Glu Val Thr Gln Glu Phe Thr Gln Tyr Trp Ala Gln
600 605 610 615
cgg gaa gct gac ttt aag gag act ctg ctt caa gaa cga gag ata tta 1985
Arg Glu Ala Asp Phe Lys Glu Thr Leu Leu Gln Glu Arg Glu Ile Leu
620 625 630
gaa gaa aat gct gaa cgt cgt ttg gct atc ttc aag gat ttg gtt ggt 2033
Glu Glu Asn Ala Glu Arg Arg Leu Ala Ile Phe Lys Asp Leu Val Gly
635 640 645
aaa tgt gac act cga gaa gaa gca gcg aaa gac att tgt gcc aca aaa 2081
Lys Cys Asp Thr Arg Glu Glu Ala Ala Lys Asp Ile Cys Ala Thr Lys
650 655 660
gtt gaa act gaa gaa gct act gct tgt tta gaa cta aag ttt aat caa 2129
Val Glu Thr Glu Glu Ala Thr Ala Cys Leu Glu Leu Lys Phe Asn Gln
665 670 675
att aaa gct gaa tta gct aaa acc aaa gga gaa tta atc aaa acc aaa 2177
Ile Lys Ala Glu Leu Ala Lys Thr Lys Gly Glu Leu Ile Lys Thr Lys
680 685 690 695
gaa gag tta aaa aag aga gaa aat gaa tca gat tca ttg att caa gag 2225
Glu Glu Leu Lys Lys Arg Glu Asn Glu Ser Asp Ser Leu Ile Gln Glu
700 705 710
ctt gag aca tct aat aag aaa ata att aca cag aat caa aga att aaa 2273
Leu Glu Thr Ser Asn Lys Lys Ile Ile Thr Gln Asn Gln Arg Ile Lys
715 720 725
gaa ttg ata aat ata att gat caa aaa gaa gat act atc aac gaa ttt 2321
Glu Leu Ile Asn Ile Ile Asp Gln Lys Glu Asp Thr Ile Asn Glu Phe
730 735 740
cag aac cta aag tct cat atg gaa aac aca ttt aaa tgc aat gac aag 2369
Gln Asn Leu Lys Ser His Met Glu Asn Thr Phe Lys Cys Asn Asp Lys
745 750 755
gct gat aca tct tct tta ata ata aac aat aaa ttg att tgt aat gaa 2417
Ala Asp Thr Ser Ser Leu Ile Ile Asn Asn Lys Leu Ile Cys Asn Glu
760 765 770 775
aca gtt gaa gta cct aag gac agc aaa tct aaa atc tgt tca gaa aga 2465
Thr Val Glu Val Pro Lys Asp Ser Lys Ser Lys Ile Cys Ser Glu Arg
780 785 790
aaa aga gta aat gaa aat gaa ctt cag caa gat gaa cca cca gca aag 2513
Lys Arg Val Asn Glu Asn Glu Leu Gln Gln Asp Glu Pro Pro Ala Lys
795 800 805
aaa ggg tct atc cat gtt agt tca gct atc act gaa gac caa aag aaa 2561
Lys Gly Ser Ile His Val Ser Ser Ala Ile Thr Glu Asp Gln Lys Lys
810 815 820
agt gaa gaa gtg cga ccg aac att gca gaa att gaa gac atc aga gtt 2609
Ser Glu Glu Val Arg Pro Asn Ile Ala Glu Ile Glu Asp Ile Arg Val
825 830 835
tta caa gaa aat aat gaa gga ctg aga gca ttt tta ctc act att gag 2657
Leu Gln Glu Asn Asn Glu Gly Leu Arg Ala Phe Leu Leu Thr Ile Glu
840 845 850 855
aat gaa ctt aaa aat gaa aag gaa gaa aaa gca gaa tta aat aaa cag 2705
Asn Glu Leu Lys Asn Glu Lys Glu Glu Lys Ala Glu Leu Asn Lys Gln
860 865 870
att gtt cat ttt cag cag gaa ctt tct ctt tct gaa aaa aag aat tta 2753
Ile Val His Phe Gln Gln Glu Leu Ser Leu Ser Glu Lys Lys Asn Leu
875 880 885
act tta agt aaa gag gtc caa caa att cag tca aat tat gat att gca 2801
Thr Leu Ser Lys Glu Val Gln Gln Ile Gln Ser Asn Tyr Asp Ile Ala
890 895 900
att gct gaa tta cat gtg cag aaa agt aaa aat caa gaa cag gag gaa 2849
Ile Ala Glu Leu His Val Gln Lys Ser Lys Asn Gln Glu Gln Glu Glu
905 910 915
aag atc atg aaa ttg tca aat gag ata gaa act gct aca aga agc att 2897
Lys Ile Met Lys Leu Ser Asn Glu Ile Glu Thr Ala Thr Arg Ser Ile
920 925 930 935
aca aat aat gtt tca caa ata aaa tta atg cac acg aaa ata gac gaa 2945
Thr Asn Asn Val Ser Gln Ile Lys Leu Met His Thr Lys Ile Asp Glu
940 945 950
cta cgt act ctt gat tca gtt tct cag att tca aac ata gat ttg ctc 2993
Leu Arg Thr Leu Asp Ser Val Ser Gln Ile Ser Asn Ile Asp Leu Leu
955 960 965
aat ctc agg gat ctg tca aat ggt tct gag gag gat aat ttg cca aat 3041
Asn Leu Arg Asp Leu Ser Asn Gly Ser Glu Glu Asp Asn Leu Pro Asn
970 975 980
aca cag tta gac ctt tta ggt aat gat tat ttg gta agt aag caa gtt 3089
Thr Gln Leu Asp Leu Leu Gly Asn Asp Tyr Leu Val Ser Lys Gln Val
985 990 995
aaa gaa tat cga att caa gaa ccc aat agg gaa aat tct ttc cac 3134
Lys Glu Tyr Arg Ile Gln Glu Pro Asn Arg Glu Asn Ser Phe His
1000 1005 1010
tct agt att gaa gct att tgg gaa gaa tgt aaa gag att gtg aag 3179
Ser Ser Ile Glu Ala Ile Trp Glu Glu Cys Lys Glu Ile Val Lys
1015 1020 1025
gcc tct tcc aaa aaa agt cat cag att gag gaa ctg gaa caa caa 3224
Ala Ser Ser Lys Lys Ser His Gln Ile Glu Glu Leu Glu Gln Gln
1030 1035 1040
att gaa aaa ttg cag gca gaa gta aaa ggc tat aag gat gaa aac 3269
Ile Glu Lys Leu Gln Ala Glu Val Lys Gly Tyr Lys Asp Glu Asn
1045 1050 1055
aat aga cta aag gag aag gag cat aaa aac caa gat gac cta cta 3314
Asn Arg Leu Lys Glu Lys Glu His Lys Asn Gln Asp Asp Leu Leu
1060 1065 1070
aaa gaa aaa gaa act ctt ata cag cag ctg aaa gaa gaa ttg caa 3359
Lys Glu Lys Glu Thr Leu Ile Gln Gln Leu Lys Glu Glu Leu Gln
1075 1080 1085
gaa aaa aat gtt act ctt gat gtt caa ata cag cat gta gtt gaa 3404
Glu Lys Asn Val Thr Leu Asp Val Gln Ile Gln His Val Val Glu
1090 1095 1100
gga aag aga gcg ctt tca gaa ctt aca caa ggt gtt act tgc tat 3449
Gly Lys Arg Ala Leu Ser Glu Leu Thr Gln Gly Val Thr Cys Tyr
1105 1110 1115
aag gca aaa ata aag gaa ctt gaa aca att tta gag act cag aaa 3494
Lys Ala Lys Ile Lys Glu Leu Glu Thr Ile Leu Glu Thr Gln Lys
1120 1125 1130
gtt gaa tgt agt cat tca gcc aag tta gaa caa gac att ttg gaa 3539
Val Glu Cys Ser His Ser Ala Lys Leu Glu Gln Asp Ile Leu Glu
1135 1140 1145
aag gaa tct atc atc tta aag cta gaa aga aat ttg aag gaa ttt 3584
Lys Glu Ser Ile Ile Leu Lys Leu Glu Arg Asn Leu Lys Glu Phe
1150 1155 1160
caa gaa cat ctt cag gat tct gtc aaa aac acc aaa gat tta aat 3629
Gln Glu His Leu Gln Asp Ser Val Lys Asn Thr Lys Asp Leu Asn
1165 1170 1175
gta aag gaa ctc aag ctg aaa gaa gaa atc aca cag tta aca aat 3674
Val Lys Glu Leu Lys Leu Lys Glu Glu Ile Thr Gln Leu Thr Asn
1180 1185 1190
aat ttg caa gat atg aaa cat tta ctt caa tta aaa gaa gaa gaa 3719
Asn Leu Gln Asp Met Lys His Leu Leu Gln Leu Lys Glu Glu Glu
1195 1200 1205
gaa gaa acc aac agg caa gaa aca gaa aaa ttg aaa gag gaa ctc 3764
Glu Glu Thr Asn Arg Gln Glu Thr Glu Lys Leu Lys Glu Glu Leu
1210 1215 1220
tct gca agc tct gct cgt acc cag aat ctg aaa gca gat ctt cag 3809
Ser Ala Ser Ser Ala Arg Thr Gln Asn Leu Lys Ala Asp Leu Gln
1225 1230 1235
agg aag gaa gaa gat tat gct gac ctg aaa gag aaa ctg act gat 3854
Arg Lys Glu Glu Asp Tyr Ala Asp Leu Lys Glu Lys Leu Thr Asp
1240 1245 1250
gcc aaa aag cag att aag caa gta cag aaa gag gta tct gta atg 3899
Ala Lys Lys Gln Ile Lys Gln Val Gln Lys Glu Val Ser Val Met
1255 1260 1265
cgt gat gag gat aaa tta ctg agg att aaa att aat gaa ctg gag 3944
Arg Asp Glu Asp Lys Leu Leu Arg Ile Lys Ile Asn Glu Leu Glu
1270 1275 1280
aaa aag aaa aac cag tgt tct cag gaa tta gat atg aaa cag cga 3989
Lys Lys Lys Asn Gln Cys Ser Gln Glu Leu Asp Met Lys Gln Arg
1285 1290 1295
acc att cag caa ctc aag gag cag tta aat aat cag aaa gtg gaa 4034
Thr Ile Gln Gln Leu Lys Glu Gln Leu Asn Asn Gln Lys Val Glu
1300 1305 1310
gaa gct ata caa cag tat gag aga gca tgc aaa gat cta aat gtt 4079
Glu Ala Ile Gln Gln Tyr Glu Arg Ala Cys Lys Asp Leu Asn Val
1315 1320 1325
aaa gag aaa ata att gaa gac atg cga atg aca cta gaa gaa cag 4124
Lys Glu Lys Ile Ile Glu Asp Met Arg Met Thr Leu Glu Glu Gln
1330 1335 1340
gaa caa act cag gta gaa cag gat caa gtg ctt gag gct aaa tta 4169
Glu Gln Thr Gln Val Glu Gln Asp Gln Val Leu Glu Ala Lys Leu
1345 1350 1355
gag gaa gtt gaa agg ctg gcc aca gaa ttg gaa aaa tgg aag gaa 4214
Glu Glu Val Glu Arg Leu Ala Thr Glu Leu Glu Lys Trp Lys Glu
1360 1365 1370
aaa tgc aat gat ttg gaa acc aaa aac aat caa agg tca aat aaa 4259
Lys Cys Asn Asp Leu Glu Thr Lys Asn Asn Gln Arg Ser Asn Lys
1375 1380 1385
gaa cat gag aac aac aca gat gtg ctt gga aag ctc act aat ctt 4304
Glu His Glu Asn Asn Thr Asp Val Leu Gly Lys Leu Thr Asn Leu
1390 1395 1400
caa gat gag tta cag gag tct gaa cag aaa tat aat gct gat aga 4349
Gln Asp Glu Leu Gln Glu Ser Glu Gln Lys Tyr Asn Ala Asp Arg
1405 1410 1415
aag aaa tgg tta gaa gaa aaa atg atg ctt atc act caa gcg aaa 4394
Lys Lys Trp Leu Glu Glu Lys Met Met Leu Ile Thr Gln Ala Lys
1420 1425 1430
gaa gca gag aat ata cga aat aaa gag atg aaa aaa tat gct gag 4439
Glu Ala Glu Asn Ile Arg Asn Lys Glu Met Lys Lys Tyr Ala Glu
1435 1440 1445
gac agg gag cgt ttt ttt aag caa cag aat gaa atg gaa ata ctg 4484
Asp Arg Glu Arg Phe Phe Lys Gln Gln Asn Glu Met Glu Ile Leu
1450 1455 1460
aca gcc cag ctg aca gag aaa gat agt gac ctt caa aag tgg cga 4529
Thr Ala Gln Leu Thr Glu Lys Asp Ser Asp Leu Gln Lys Trp Arg
1465 1470 1475
gaa gaa cga gat caa ctg gtt gca gct tta gaa ata cag cta aaa 4574
Glu Glu Arg Asp Gln Leu Val Ala Ala Leu Glu Ile Gln Leu Lys
1480 1485 1490
gca ctg ata tcc agt aat gta cag aaa gat aat gaa att gaa caa 4619
Ala Leu Ile Ser Ser Asn Val Gln Lys Asp Asn Glu Ile Glu Gln
1495 1500 1505
cta aaa agg atc ata tca gag act tct aaa ata gaa aca caa atc 4664
Leu Lys Arg Ile Ile Ser Glu Thr Ser Lys Ile Glu Thr Gln Ile
1510 1515 1520
atg gat atc aag ccc aaa cgt att agt tca gca gat cct gac aaa 4709
Met Asp Ile Lys Pro Lys Arg Ile Ser Ser Ala Asp Pro Asp Lys
1525 1530 1535
ctt caa act gaa cct cta tcg aca agt ttt gaa att tcc aga aat 4754
Leu Gln Thr Glu Pro Leu Ser Thr Ser Phe Glu Ile Ser Arg Asn
1540 1545 1550
aaa ata gag gat gga tct gta gtc ctt gac tct tgt gaa gtg tca 4799
Lys Ile Glu Asp Gly Ser Val Val Leu Asp Ser Cys Glu Val Ser
1555 1560 1565
aca gaa aat gat caa agc act cga ttt cca aaa cct gag tta gag 4844
Thr Glu Asn Asp Gln Ser Thr Arg Phe Pro Lys Pro Glu Leu Glu
1570 1575 1580
att caa ttt aca cct tta cag cca aac aaa atg gca gtg aaa cac 4889
Ile Gln Phe Thr Pro Leu Gln Pro Asn Lys Met Ala Val Lys His
1585 1590 1595
cct ggt tgt acc aca cca gtg aca gtt aag att ccc aag gct cgg 4934
Pro Gly Cys Thr Thr Pro Val Thr Val Lys Ile Pro Lys Ala Arg
1600 1605 1610
aag agg aag agt aat gaa atg gag gag gac ttg gtg aaa tgt gaa 4979
Lys Arg Lys Ser Asn Glu Met Glu Glu Asp Leu Val Lys Cys Glu
1615 1620 1625
aat aag aag aat gct aca ccc aga act aat ttg aaa ttt cct att 5024
Asn Lys Lys Asn Ala Thr Pro Arg Thr Asn Leu Lys Phe Pro Ile
1630 1635 1640
tca gat gat aga aat tct tct gtc aaa aag gaa caa aag gtt gcc 5069
Ser Asp Asp Arg Asn Ser Ser Val Lys Lys Glu Gln Lys Val Ala
1645 1650 1655
ata cgt cca tca tct aag aaa aca tat tct tta cgg agt cag gca 5114
Ile Arg Pro Ser Ser Lys Lys Thr Tyr Ser Leu Arg Ser Gln Ala
1660 1665 1670
tcc ata att ggt gta aac ctg gcc act aag aaa aaa gaa gga aca 5159
Ser Ile Ile Gly Val Asn Leu Ala Thr Lys Lys Lys Glu Gly Thr
1675 1680 1685
cta cag aaa ttt gga gac ttc tta caa cat tct ccc tca att ctt 5204
Leu Gln Lys Phe Gly Asp Phe Leu Gln His Ser Pro Ser Ile Leu
1690 1695 1700
caa tca aaa gca aag aag ata att gaa aca atg agc tct tca aag 5249
Gln Ser Lys Ala Lys Lys Ile Ile Glu Thr Met Ser Ser Ser Lys
1705 1710 1715
ctc tca aat gta gaa gca agt aaa gaa aat gtg tct caa cca aaa 5294
Leu Ser Asn Val Glu Ala Ser Lys Glu Asn Val Ser Gln Pro Lys
1720 1725 1730
cga gcc aaa cgg aaa tta tac aca agt gaa att tca tct cct att 5339
Arg Ala Lys Arg Lys Leu Tyr Thr Ser Glu Ile Ser Ser Pro Ile
1735 1740 1745
gat ata tca ggc caa gtg att tta atg gac cag aaa atg aag gag 5384
Asp Ile Ser Gly Gln Val Ile Leu Met Asp Gln Lys Met Lys Glu
1750 1755 1760
agt gat cac cag att atc aaa cga cga ctt cga aca aaa aca gcc 5429
Ser Asp His Gln Ile Ile Lys Arg Arg Leu Arg Thr Lys Thr Ala
1765 1770 1775
aaa taa atcacttatg gaaatgttta atataaattt tatagtcata gtcattggaa 5485
Lys
1780
cttgcatcct gtattgtaaa tataaatgta tatattatgc attaaatcac tctgcatata 5545
gattgctgtt ttatacatag tataatttta attcaataaa tgagtcaaaa tttgtatatt 5605
tttataaggc ttttttataa tagcttcttt caaactgtat ttccctatta tctcagacat 5665
tggatcagtg aagatcctag gaaagaggct gttattctca tttattttgc tatacaggat 5725
gtaataggtc aggtatttgg tttacttata tttaacaatg tcttatgaat tttttttact 5785
ttatctgtta tacaactgat tttacatatc tgtttggatt atagctagga tttggagaat 5845
aagtgtgtac agatcacaaa acatgtatat acattattta gaaaagatct caagtcttta 5905
attagaatgt ctcacttatt ttgtaaacat tttgtgggta catagtacat gtatatattt 5965
acggggtatg tgagatgttt tgacacaggc atgcaatgtg aaatacgtgt atcatggaga 6025
atgaggtatc catcccctca agcatttttc ctttgaatta cagataatcc aattacattc 6085
tttagatcat ttaaaaatat acaagtaagt tattattgat tatagtcact ctattgtgct 6145
atcagatagt agatcattct ttttatctta tttgtttttg tacccattaa ccatccccac 6205
ctccccctgc aaccgtcagt acccttacca gccactggta accattcttc tactctgtat 6265
gcccatgagg tcaattgatt ttatttttag atcccataaa taaatgagaa catgcagtct 6325
ttgtcaaaaa aaaa 6339
<210> 186
<211> 1780
<212> Белок
<213> Homo sapiens
<400> 186
Met Glu Ser Asn Phe Asn Gln Glu Gly Val Pro Arg Pro Ser Tyr Val
1 5 10 15
Phe Ser Ala Asp Pro Ile Ala Arg Pro Ser Glu Ile Asn Phe Asp Gly
20 25 30
Ile Lys Leu Asp Leu Ser His Glu Phe Ser Leu Val Ala Pro Asn Thr
35 40 45
Glu Ala Asn Ser Phe Glu Ser Lys Asp Tyr Leu Gln Val Cys Leu Arg
50 55 60
Ile Arg Pro Phe Thr Gln Ser Glu Lys Glu Leu Glu Ser Glu Gly Cys
65 70 75 80
Val His Ile Leu Asp Ser Gln Thr Val Val Leu Lys Glu Pro Gln Cys
85 90 95
Ile Leu Gly Arg Leu Ser Glu Lys Ser Ser Gly Gln Met Ala Gln Lys
100 105 110
Phe Ser Phe Ser Lys Val Phe Gly Pro Ala Thr Thr Gln Lys Glu Phe
115 120 125
Phe Gln Gly Cys Ile Met Gln Pro Val Lys Asp Leu Leu Lys Gly Gln
130 135 140
Ser Arg Leu Ile Phe Thr Tyr Gly Leu Thr Asn Ser Gly Lys Thr Tyr
145 150 155 160
Thr Phe Gln Gly Thr Glu Glu Asn Ile Gly Ile Leu Pro Arg Thr Leu
165 170 175
Asn Val Leu Phe Asp Ser Leu Gln Glu Arg Leu Tyr Thr Lys Met Asn
180 185 190
Leu Lys Pro His Arg Ser Arg Glu Tyr Leu Arg Leu Ser Ser Glu Gln
195 200 205
Glu Lys Glu Glu Ile Ala Ser Lys Ser Ala Leu Leu Arg Gln Ile Lys
210 215 220
Glu Val Thr Val His Asn Asp Ser Asp Asp Thr Leu Tyr Gly Ser Leu
225 230 235 240
Thr Asn Ser Leu Asn Ile Ser Glu Phe Glu Glu Ser Ile Lys Asp Tyr
245 250 255
Glu Gln Ala Asn Leu Asn Met Ala Asn Ser Ile Lys Phe Ser Val Trp
260 265 270
Val Ser Phe Phe Glu Ile Tyr Asn Glu Tyr Ile Tyr Asp Leu Phe Val
275 280 285
Pro Val Ser Ser Lys Phe Gln Lys Arg Lys Met Leu Arg Leu Ser Gln
290 295 300
Asp Val Lys Gly Tyr Ser Phe Ile Lys Asp Leu Gln Trp Ile Gln Val
305 310 315 320
Ser Asp Ser Lys Glu Ala Tyr Arg Leu Leu Lys Leu Gly Ile Lys His
325 330 335
Gln Ser Val Ala Phe Thr Lys Leu Asn Asn Ala Ser Ser Arg Ser His
340 345 350
Ser Ile Phe Thr Val Lys Ile Leu Gln Ile Glu Asp Ser Glu Met Ser
355 360 365
Arg Val Ile Arg Val Ser Glu Leu Ser Leu Cys Asp Leu Ala Gly Ser
370 375 380
Glu Arg Thr Met Lys Thr Gln Asn Glu Gly Glu Arg Leu Arg Glu Thr
385 390 395 400
Gly Asn Ile Asn Thr Ser Leu Leu Thr Leu Gly Lys Cys Ile Asn Val
405 410 415
Leu Lys Asn Ser Glu Lys Ser Lys Phe Gln Gln His Val Pro Phe Arg
420 425 430
Glu Ser Lys Leu Thr His Tyr Phe Gln Ser Phe Phe Asn Gly Lys Gly
435 440 445
Lys Ile Cys Met Ile Val Asn Ile Ser Gln Cys Tyr Leu Ala Tyr Asp
450 455 460
Glu Thr Leu Asn Val Leu Lys Phe Ser Ala Ile Ala Gln Lys Val Cys
465 470 475 480
Val Pro Asp Thr Leu Asn Ser Ser Gln Glu Lys Leu Phe Gly Pro Val
485 490 495
Lys Ser Ser Gln Asp Val Ser Leu Asp Ser Asn Ser Asn Ser Lys Ile
500 505 510
Leu Asn Val Lys Arg Ala Thr Ile Ser Trp Glu Asn Ser Leu Glu Asp
515 520 525
Leu Met Glu Asp Glu Asp Leu Val Glu Glu Leu Glu Asn Ala Glu Glu
530 535 540
Thr Gln Asn Val Glu Thr Lys Leu Leu Asp Glu Asp Leu Asp Lys Thr
545 550 555 560
Leu Glu Glu Asn Lys Ala Phe Ile Ser His Glu Glu Lys Arg Lys Leu
565 570 575
Leu Asp Leu Ile Glu Asp Leu Lys Lys Lys Leu Ile Asn Glu Lys Lys
580 585 590
Glu Lys Leu Thr Leu Glu Phe Lys Ile Arg Glu Glu Val Thr Gln Glu
595 600 605
Phe Thr Gln Tyr Trp Ala Gln Arg Glu Ala Asp Phe Lys Glu Thr Leu
610 615 620
Leu Gln Glu Arg Glu Ile Leu Glu Glu Asn Ala Glu Arg Arg Leu Ala
625 630 635 640
Ile Phe Lys Asp Leu Val Gly Lys Cys Asp Thr Arg Glu Glu Ala Ala
645 650 655
Lys Asp Ile Cys Ala Thr Lys Val Glu Thr Glu Glu Ala Thr Ala Cys
660 665 670
Leu Glu Leu Lys Phe Asn Gln Ile Lys Ala Glu Leu Ala Lys Thr Lys
675 680 685
Gly Glu Leu Ile Lys Thr Lys Glu Glu Leu Lys Lys Arg Glu Asn Glu
690 695 700
Ser Asp Ser Leu Ile Gln Glu Leu Glu Thr Ser Asn Lys Lys Ile Ile
705 710 715 720
Thr Gln Asn Gln Arg Ile Lys Glu Leu Ile Asn Ile Ile Asp Gln Lys
725 730 735
Glu Asp Thr Ile Asn Glu Phe Gln Asn Leu Lys Ser His Met Glu Asn
740 745 750
Thr Phe Lys Cys Asn Asp Lys Ala Asp Thr Ser Ser Leu Ile Ile Asn
755 760 765
Asn Lys Leu Ile Cys Asn Glu Thr Val Glu Val Pro Lys Asp Ser Lys
770 775 780
Ser Lys Ile Cys Ser Glu Arg Lys Arg Val Asn Glu Asn Glu Leu Gln
785 790 795 800
Gln Asp Glu Pro Pro Ala Lys Lys Gly Ser Ile His Val Ser Ser Ala
805 810 815
Ile Thr Glu Asp Gln Lys Lys Ser Glu Glu Val Arg Pro Asn Ile Ala
820 825 830
Glu Ile Glu Asp Ile Arg Val Leu Gln Glu Asn Asn Glu Gly Leu Arg
835 840 845
Ala Phe Leu Leu Thr Ile Glu Asn Glu Leu Lys Asn Glu Lys Glu Glu
850 855 860
Lys Ala Glu Leu Asn Lys Gln Ile Val His Phe Gln Gln Glu Leu Ser
865 870 875 880
Leu Ser Glu Lys Lys Asn Leu Thr Leu Ser Lys Glu Val Gln Gln Ile
885 890 895
Gln Ser Asn Tyr Asp Ile Ala Ile Ala Glu Leu His Val Gln Lys Ser
900 905 910
Lys Asn Gln Glu Gln Glu Glu Lys Ile Met Lys Leu Ser Asn Glu Ile
915 920 925
Glu Thr Ala Thr Arg Ser Ile Thr Asn Asn Val Ser Gln Ile Lys Leu
930 935 940
Met His Thr Lys Ile Asp Glu Leu Arg Thr Leu Asp Ser Val Ser Gln
945 950 955 960
Ile Ser Asn Ile Asp Leu Leu Asn Leu Arg Asp Leu Ser Asn Gly Ser
965 970 975
Glu Glu Asp Asn Leu Pro Asn Thr Gln Leu Asp Leu Leu Gly Asn Asp
980 985 990
Tyr Leu Val Ser Lys Gln Val Lys Glu Tyr Arg Ile Gln Glu Pro Asn
995 1000 1005
Arg Glu Asn Ser Phe His Ser Ser Ile Glu Ala Ile Trp Glu Glu
1010 1015 1020
Cys Lys Glu Ile Val Lys Ala Ser Ser Lys Lys Ser His Gln Ile
1025 1030 1035
Glu Glu Leu Glu Gln Gln Ile Glu Lys Leu Gln Ala Glu Val Lys
1040 1045 1050
Gly Tyr Lys Asp Glu Asn Asn Arg Leu Lys Glu Lys Glu His Lys
1055 1060 1065
Asn Gln Asp Asp Leu Leu Lys Glu Lys Glu Thr Leu Ile Gln Gln
1070 1075 1080
Leu Lys Glu Glu Leu Gln Glu Lys Asn Val Thr Leu Asp Val Gln
1085 1090 1095
Ile Gln His Val Val Glu Gly Lys Arg Ala Leu Ser Glu Leu Thr
1100 1105 1110
Gln Gly Val Thr Cys Tyr Lys Ala Lys Ile Lys Glu Leu Glu Thr
1115 1120 1125
Ile Leu Glu Thr Gln Lys Val Glu Cys Ser His Ser Ala Lys Leu
1130 1135 1140
Glu Gln Asp Ile Leu Glu Lys Glu Ser Ile Ile Leu Lys Leu Glu
1145 1150 1155
Arg Asn Leu Lys Glu Phe Gln Glu His Leu Gln Asp Ser Val Lys
1160 1165 1170
Asn Thr Lys Asp Leu Asn Val Lys Glu Leu Lys Leu Lys Glu Glu
1175 1180 1185
Ile Thr Gln Leu Thr Asn Asn Leu Gln Asp Met Lys His Leu Leu
1190 1195 1200
Gln Leu Lys Glu Glu Glu Glu Glu Thr Asn Arg Gln Glu Thr Glu
1205 1210 1215
Lys Leu Lys Glu Glu Leu Ser Ala Ser Ser Ala Arg Thr Gln Asn
1220 1225 1230
Leu Lys Ala Asp Leu Gln Arg Lys Glu Glu Asp Tyr Ala Asp Leu
1235 1240 1245
Lys Glu Lys Leu Thr Asp Ala Lys Lys Gln Ile Lys Gln Val Gln
1250 1255 1260
Lys Glu Val Ser Val Met Arg Asp Glu Asp Lys Leu Leu Arg Ile
1265 1270 1275
Lys Ile Asn Glu Leu Glu Lys Lys Lys Asn Gln Cys Ser Gln Glu
1280 1285 1290
Leu Asp Met Lys Gln Arg Thr Ile Gln Gln Leu Lys Glu Gln Leu
1295 1300 1305
Asn Asn Gln Lys Val Glu Glu Ala Ile Gln Gln Tyr Glu Arg Ala
1310 1315 1320
Cys Lys Asp Leu Asn Val Lys Glu Lys Ile Ile Glu Asp Met Arg
1325 1330 1335
Met Thr Leu Glu Glu Gln Glu Gln Thr Gln Val Glu Gln Asp Gln
1340 1345 1350
Val Leu Glu Ala Lys Leu Glu Glu Val Glu Arg Leu Ala Thr Glu
1355 1360 1365
Leu Glu Lys Trp Lys Glu Lys Cys Asn Asp Leu Glu Thr Lys Asn
1370 1375 1380
Asn Gln Arg Ser Asn Lys Glu His Glu Asn Asn Thr Asp Val Leu
1385 1390 1395
Gly Lys Leu Thr Asn Leu Gln Asp Glu Leu Gln Glu Ser Glu Gln
1400 1405 1410
Lys Tyr Asn Ala Asp Arg Lys Lys Trp Leu Glu Glu Lys Met Met
1415 1420 1425
Leu Ile Thr Gln Ala Lys Glu Ala Glu Asn Ile Arg Asn Lys Glu
1430 1435 1440
Met Lys Lys Tyr Ala Glu Asp Arg Glu Arg Phe Phe Lys Gln Gln
1445 1450 1455
Asn Glu Met Glu Ile Leu Thr Ala Gln Leu Thr Glu Lys Asp Ser
1460 1465 1470
Asp Leu Gln Lys Trp Arg Glu Glu Arg Asp Gln Leu Val Ala Ala
1475 1480 1485
Leu Glu Ile Gln Leu Lys Ala Leu Ile Ser Ser Asn Val Gln Lys
1490 1495 1500
Asp Asn Glu Ile Glu Gln Leu Lys Arg Ile Ile Ser Glu Thr Ser
1505 1510 1515
Lys Ile Glu Thr Gln Ile Met Asp Ile Lys Pro Lys Arg Ile Ser
1520 1525 1530
Ser Ala Asp Pro Asp Lys Leu Gln Thr Glu Pro Leu Ser Thr Ser
1535 1540 1545
Phe Glu Ile Ser Arg Asn Lys Ile Glu Asp Gly Ser Val Val Leu
1550 1555 1560
Asp Ser Cys Glu Val Ser Thr Glu Asn Asp Gln Ser Thr Arg Phe
1565 1570 1575
Pro Lys Pro Glu Leu Glu Ile Gln Phe Thr Pro Leu Gln Pro Asn
1580 1585 1590
Lys Met Ala Val Lys His Pro Gly Cys Thr Thr Pro Val Thr Val
1595 1600 1605
Lys Ile Pro Lys Ala Arg Lys Arg Lys Ser Asn Glu Met Glu Glu
1610 1615 1620
Asp Leu Val Lys Cys Glu Asn Lys Lys Asn Ala Thr Pro Arg Thr
1625 1630 1635
Asn Leu Lys Phe Pro Ile Ser Asp Asp Arg Asn Ser Ser Val Lys
1640 1645 1650
Lys Glu Gln Lys Val Ala Ile Arg Pro Ser Ser Lys Lys Thr Tyr
1655 1660 1665
Ser Leu Arg Ser Gln Ala Ser Ile Ile Gly Val Asn Leu Ala Thr
1670 1675 1680
Lys Lys Lys Glu Gly Thr Leu Gln Lys Phe Gly Asp Phe Leu Gln
1685 1690 1695
His Ser Pro Ser Ile Leu Gln Ser Lys Ala Lys Lys Ile Ile Glu
1700 1705 1710
Thr Met Ser Ser Ser Lys Leu Ser Asn Val Glu Ala Ser Lys Glu
1715 1720 1725
Asn Val Ser Gln Pro Lys Arg Ala Lys Arg Lys Leu Tyr Thr Ser
1730 1735 1740
Glu Ile Ser Ser Pro Ile Asp Ile Ser Gly Gln Val Ile Leu Met
1745 1750 1755
Asp Gln Lys Met Lys Glu Ser Asp His Gln Ile Ile Lys Arg Arg
1760 1765 1770
Leu Arg Thr Lys Thr Ala Lys
1775 1780
<210> 187
<211> 6459
<212> ДНК
<213> Homo sapiens
<220>
<221> кодирующая последовательнсоть
<222> (93)..(5555)
<400> 187
agtgcggtgc cctggccgcc attgtttgaa tttgaaaacg gtaacatcgc agtgctgctc 60
gcgggtctgg ctagtcaggc gaagtttgca ga atg gaa tct aat ttt aat caa 113
Met Glu Ser Asn Phe Asn Gln
1 5
gag gga gta cct cga cca tct tat gtt ttt agt gct gac cca att gca 161
Glu Gly Val Pro Arg Pro Ser Tyr Val Phe Ser Ala Asp Pro Ile Ala
10 15 20
agg cct tca gaa ata aat ttc gat ggc att aag ctt gat ctg tct cat 209
Arg Pro Ser Glu Ile Asn Phe Asp Gly Ile Lys Leu Asp Leu Ser His
25 30 35
gaa ttt tcc tta gtt gct cca aat act gag gca aac agt ttc gaa tct 257
Glu Phe Ser Leu Val Ala Pro Asn Thr Glu Ala Asn Ser Phe Glu Ser
40 45 50 55
aaa gat tat ctc cag gtt tgt ctt cga ata aga cca ttt aca cag tca 305
Lys Asp Tyr Leu Gln Val Cys Leu Arg Ile Arg Pro Phe Thr Gln Ser
60 65 70
gaa aaa gaa ctt gag tct gag ggc tgt gtg cat att ctg gat tca cag 353
Glu Lys Glu Leu Glu Ser Glu Gly Cys Val His Ile Leu Asp Ser Gln
75 80 85
act gtt gtg ctg aaa gag cct caa tgc atc ctt ggt cgg tta agt gaa 401
Thr Val Val Leu Lys Glu Pro Gln Cys Ile Leu Gly Arg Leu Ser Glu
90 95 100
aaa agc tca ggg cag atg gca cag aaa ttc agt ttt tcc aag gtt ttt 449
Lys Ser Ser Gly Gln Met Ala Gln Lys Phe Ser Phe Ser Lys Val Phe
105 110 115
ggc cca gca act aca cag aag gaa ttc ttt cag ggt tgc att atg caa 497
Gly Pro Ala Thr Thr Gln Lys Glu Phe Phe Gln Gly Cys Ile Met Gln
120 125 130 135
cca gta aaa gac ctc ttg aaa gga cag agt cgt ctg att ttt act tac 545
Pro Val Lys Asp Leu Leu Lys Gly Gln Ser Arg Leu Ile Phe Thr Tyr
140 145 150
ggg cta acc aat tca gga aaa aca tat aca ttt caa ggg aca gaa gaa 593
Gly Leu Thr Asn Ser Gly Lys Thr Tyr Thr Phe Gln Gly Thr Glu Glu
155 160 165
aat att ggc att ctg cct cga act ttg aat gta tta ttt gat agt ctt 641
Asn Ile Gly Ile Leu Pro Arg Thr Leu Asn Val Leu Phe Asp Ser Leu
170 175 180
caa gaa aga ctg tat aca aag atg aac ctt aaa cca cat aga tcc aga 689
Gln Glu Arg Leu Tyr Thr Lys Met Asn Leu Lys Pro His Arg Ser Arg
185 190 195
gaa tac tta agg tta tca tca gaa caa gag aaa gaa gaa att gct agc 737
Glu Tyr Leu Arg Leu Ser Ser Glu Gln Glu Lys Glu Glu Ile Ala Ser
200 205 210 215
aaa agt gca ttg ctt cgg caa att aaa gag gtt act gtg cat aat gat 785
Lys Ser Ala Leu Leu Arg Gln Ile Lys Glu Val Thr Val His Asn Asp
220 225 230
agt gat gat act ctt tat gga agt tta act aac tct ttg aat atc tca 833
Ser Asp Asp Thr Leu Tyr Gly Ser Leu Thr Asn Ser Leu Asn Ile Ser
235 240 245
gag ttt gaa gaa tcc ata aaa gat tat gaa caa gcc aac ttg aat atg 881
Glu Phe Glu Glu Ser Ile Lys Asp Tyr Glu Gln Ala Asn Leu Asn Met
250 255 260
gct aat agt ata aaa ttt tct gtg tgg gtt tct ttc ttt gaa att tac 929
Ala Asn Ser Ile Lys Phe Ser Val Trp Val Ser Phe Phe Glu Ile Tyr
265 270 275
aat gaa tat att tat gac tta ttt gtt cct gta tca tct aaa ttc caa 977
Asn Glu Tyr Ile Tyr Asp Leu Phe Val Pro Val Ser Ser Lys Phe Gln
280 285 290 295
aag aga aag atg ctg cgc ctt tcc caa gac gta aag ggc tat tct ttt 1025
Lys Arg Lys Met Leu Arg Leu Ser Gln Asp Val Lys Gly Tyr Ser Phe
300 305 310
ata aaa gat cta caa tgg att caa gta tct gat tcc aaa gaa gcc tat 1073
Ile Lys Asp Leu Gln Trp Ile Gln Val Ser Asp Ser Lys Glu Ala Tyr
315 320 325
aga ctt tta aaa cta gga ata aag cac cag agt gtt gcc ttc aca aaa 1121
Arg Leu Leu Lys Leu Gly Ile Lys His Gln Ser Val Ala Phe Thr Lys
330 335 340
ttg aat aat gct tcc agt aga agt cac agc ata ttc act gtt aaa ata 1169
Leu Asn Asn Ala Ser Ser Arg Ser His Ser Ile Phe Thr Val Lys Ile
345 350 355
tta cag att gaa gat tct gaa atg tct cgt gta att cga gtc agt gaa 1217
Leu Gln Ile Glu Asp Ser Glu Met Ser Arg Val Ile Arg Val Ser Glu
360 365 370 375
tta tct tta tgt gat ctt gct ggt tca gaa cga act atg aag aca cag 1265
Leu Ser Leu Cys Asp Leu Ala Gly Ser Glu Arg Thr Met Lys Thr Gln
380 385 390
aat gaa ggt gaa agg tta aga gag act ggg aat atc aac act tct tta 1313
Asn Glu Gly Glu Arg Leu Arg Glu Thr Gly Asn Ile Asn Thr Ser Leu
395 400 405
ttg act ctg gga aag tgt att aac gtc ttg aag aat agt gaa aag tca 1361
Leu Thr Leu Gly Lys Cys Ile Asn Val Leu Lys Asn Ser Glu Lys Ser
410 415 420
aag ttt caa cag cat gtg cct ttc cgg gaa agt aaa ctg act cac tat 1409
Lys Phe Gln Gln His Val Pro Phe Arg Glu Ser Lys Leu Thr His Tyr
425 430 435
ttt caa agt ttt ttt aat ggt aaa ggg aaa att tgt atg att gtc aat 1457
Phe Gln Ser Phe Phe Asn Gly Lys Gly Lys Ile Cys Met Ile Val Asn
440 445 450 455
atc agc caa tgt tat tta gcc tat gat gaa aca ctc aat gta ttg aag 1505
Ile Ser Gln Cys Tyr Leu Ala Tyr Asp Glu Thr Leu Asn Val Leu Lys
460 465 470
ttc tcc gcc att gca caa aaa gtt tgt gtc cca gac act tta aat tcc 1553
Phe Ser Ala Ile Ala Gln Lys Val Cys Val Pro Asp Thr Leu Asn Ser
475 480 485
tct caa gag aaa tta ttt gga cct gtc aaa tct tct caa gat gta tca 1601
Ser Gln Glu Lys Leu Phe Gly Pro Val Lys Ser Ser Gln Asp Val Ser
490 495 500
cta gac agt aat tca aac agt aaa ata tta aat gta aaa aga gcc acc 1649
Leu Asp Ser Asn Ser Asn Ser Lys Ile Leu Asn Val Lys Arg Ala Thr
505 510 515
att tca tgg gaa aat agt cta gaa gat ttg atg gaa gac gag gat ttg 1697
Ile Ser Trp Glu Asn Ser Leu Glu Asp Leu Met Glu Asp Glu Asp Leu
520 525 530 535
gtt gag gag cta gaa aac gct gaa gaa act caa aat gtg gaa act aaa 1745
Val Glu Glu Leu Glu Asn Ala Glu Glu Thr Gln Asn Val Glu Thr Lys
540 545 550
ctt ctt gat gaa gat cta gat aaa aca tta gag gaa aat aag gct ttc 1793
Leu Leu Asp Glu Asp Leu Asp Lys Thr Leu Glu Glu Asn Lys Ala Phe
555 560 565
att agc cac gag gag aaa aga aaa ctg ttg gac tta ata gaa gac ttg 1841
Ile Ser His Glu Glu Lys Arg Lys Leu Leu Asp Leu Ile Glu Asp Leu
570 575 580
aaa aaa aaa ctg ata aat gaa aaa aag gaa aaa tta acc ttg gaa ttt 1889
Lys Lys Lys Leu Ile Asn Glu Lys Lys Glu Lys Leu Thr Leu Glu Phe
585 590 595
aaa att cga gaa gaa gtt aca cag gag ttt act cag tat tgg gct caa 1937
Lys Ile Arg Glu Glu Val Thr Gln Glu Phe Thr Gln Tyr Trp Ala Gln
600 605 610 615
cgg gaa gct gac ttt aag gag act ctg ctt caa gaa cga gag ata tta 1985
Arg Glu Ala Asp Phe Lys Glu Thr Leu Leu Gln Glu Arg Glu Ile Leu
620 625 630
gaa gaa aat gct gaa cgt cgt ttg gct atc ttc aag gat ttg gtt ggt 2033
Glu Glu Asn Ala Glu Arg Arg Leu Ala Ile Phe Lys Asp Leu Val Gly
635 640 645
aaa tgt gac act cga gaa gaa gca gcg aaa gac att tgt gcc aca aaa 2081
Lys Cys Asp Thr Arg Glu Glu Ala Ala Lys Asp Ile Cys Ala Thr Lys
650 655 660
gtt gaa act gaa gaa aca cat aat tat gta gga ttt gaa gat att att 2129
Val Glu Thr Glu Glu Thr His Asn Tyr Val Gly Phe Glu Asp Ile Ile
665 670 675
gat tct ctt caa gat aat gtt gct gat att aag aaa cag gct gaa att 2177
Asp Ser Leu Gln Asp Asn Val Ala Asp Ile Lys Lys Gln Ala Glu Ile
680 685 690 695
gct cac tta tat att gca tct ctt cct gac ccc cag gaa gct act gct 2225
Ala His Leu Tyr Ile Ala Ser Leu Pro Asp Pro Gln Glu Ala Thr Ala
700 705 710
tgt tta gaa cta aag ttt aat caa att aaa gct gaa tta gct aaa acc 2273
Cys Leu Glu Leu Lys Phe Asn Gln Ile Lys Ala Glu Leu Ala Lys Thr
715 720 725
aaa gga gaa tta atc aaa acc aaa gaa gag tta aaa aag aga gaa aat 2321
Lys Gly Glu Leu Ile Lys Thr Lys Glu Glu Leu Lys Lys Arg Glu Asn
730 735 740
gaa tca gat tca ttg att caa gag ctt gag aca tct aat aag aaa ata 2369
Glu Ser Asp Ser Leu Ile Gln Glu Leu Glu Thr Ser Asn Lys Lys Ile
745 750 755
att aca cag aat caa aga att aaa gaa ttg ata aat ata att gat caa 2417
Ile Thr Gln Asn Gln Arg Ile Lys Glu Leu Ile Asn Ile Ile Asp Gln
760 765 770 775
aaa gaa gat act atc aac gaa ttt cag aac cta aag tct cat atg gaa 2465
Lys Glu Asp Thr Ile Asn Glu Phe Gln Asn Leu Lys Ser His Met Glu
780 785 790
aac aca ttt aaa tgc aat gac aag gct gat aca tct tct tta ata ata 2513
Asn Thr Phe Lys Cys Asn Asp Lys Ala Asp Thr Ser Ser Leu Ile Ile
795 800 805
aac aat aaa ttg att tgt aat gaa aca gtt gaa gta cct aag gac agc 2561
Asn Asn Lys Leu Ile Cys Asn Glu Thr Val Glu Val Pro Lys Asp Ser
810 815 820
aaa tct aaa atc tgt tca gaa aga aaa aga gta aat gaa aat gaa ctt 2609
Lys Ser Lys Ile Cys Ser Glu Arg Lys Arg Val Asn Glu Asn Glu Leu
825 830 835
cag caa gat gaa cca cca gca aag aaa ggg tct atc cat gtt agt tca 2657
Gln Gln Asp Glu Pro Pro Ala Lys Lys Gly Ser Ile His Val Ser Ser
840 845 850 855
gct atc act gaa gac caa aag aaa agt gaa gaa gtg cga ccg aac att 2705
Ala Ile Thr Glu Asp Gln Lys Lys Ser Glu Glu Val Arg Pro Asn Ile
860 865 870
gca gaa att gaa gac atc aga gtt tta caa gaa aat aat gaa gga ctg 2753
Ala Glu Ile Glu Asp Ile Arg Val Leu Gln Glu Asn Asn Glu Gly Leu
875 880 885
aga gca ttt tta ctc act att gag aat gaa ctt aaa aat gaa aag gaa 2801
Arg Ala Phe Leu Leu Thr Ile Glu Asn Glu Leu Lys Asn Glu Lys Glu
890 895 900
gaa aaa gca gaa tta aat aaa cag att gtt cat ttt cag cag gaa ctt 2849
Glu Lys Ala Glu Leu Asn Lys Gln Ile Val His Phe Gln Gln Glu Leu
905 910 915
tct ctt tct gaa aaa aag aat tta act tta agt aaa gag gtc caa caa 2897
Ser Leu Ser Glu Lys Lys Asn Leu Thr Leu Ser Lys Glu Val Gln Gln
920 925 930 935
att cag tca aat tat gat att gca att gct gaa tta cat gtg cag aaa 2945
Ile Gln Ser Asn Tyr Asp Ile Ala Ile Ala Glu Leu His Val Gln Lys
940 945 950
agt aaa aat caa gaa cag gag gaa aag atc atg aaa ttg tca aat gag 2993
Ser Lys Asn Gln Glu Gln Glu Glu Lys Ile Met Lys Leu Ser Asn Glu
955 960 965
ata gaa act gct aca aga agc att aca aat aat gtt tca caa ata aaa 3041
Ile Glu Thr Ala Thr Arg Ser Ile Thr Asn Asn Val Ser Gln Ile Lys
970 975 980
tta atg cac acg aaa ata gac gaa cta cgt act ctt gat tca gtt tct 3089
Leu Met His Thr Lys Ile Asp Glu Leu Arg Thr Leu Asp Ser Val Ser
985 990 995
cag att tca aac ata gat ttg ctc aat ctc agg gat ctg tca aat 3134
Gln Ile Ser Asn Ile Asp Leu Leu Asn Leu Arg Asp Leu Ser Asn
1000 1005 1010
ggt tct gag gag gat aat ttg cca aat aca cag tta gac ctt tta 3179
Gly Ser Glu Glu Asp Asn Leu Pro Asn Thr Gln Leu Asp Leu Leu
1015 1020 1025
ggt aat gat tat ttg gta agt aag caa gtt aaa gaa tat cga att 3224
Gly Asn Asp Tyr Leu Val Ser Lys Gln Val Lys Glu Tyr Arg Ile
1030 1035 1040
caa gaa ccc aat agg gaa aat tct ttc cac tct agt att gaa gct 3269
Gln Glu Pro Asn Arg Glu Asn Ser Phe His Ser Ser Ile Glu Ala
1045 1050 1055
att tgg gaa gaa tgt aaa gag att gtg aag gcc tct tcc aaa aaa 3314
Ile Trp Glu Glu Cys Lys Glu Ile Val Lys Ala Ser Ser Lys Lys
1060 1065 1070
agt cat cag att gag gaa ctg gaa caa caa att gaa aaa ttg cag 3359
Ser His Gln Ile Glu Glu Leu Glu Gln Gln Ile Glu Lys Leu Gln
1075 1080 1085
gca gaa gta aaa ggc tat aag gat gaa aac aat aga cta aag gag 3404
Ala Glu Val Lys Gly Tyr Lys Asp Glu Asn Asn Arg Leu Lys Glu
1090 1095 1100
aag gag cat aaa aac caa gat gac cta cta aaa gaa aaa gaa act 3449
Lys Glu His Lys Asn Gln Asp Asp Leu Leu Lys Glu Lys Glu Thr
1105 1110 1115
ctt ata cag cag ctg aaa gaa gaa ttg caa gaa aaa aat gtt act 3494
Leu Ile Gln Gln Leu Lys Glu Glu Leu Gln Glu Lys Asn Val Thr
1120 1125 1130
ctt gat gtt caa ata cag cat gta gtt gaa gga aag aga gcg ctt 3539
Leu Asp Val Gln Ile Gln His Val Val Glu Gly Lys Arg Ala Leu
1135 1140 1145
tca gaa ctt aca caa ggt gtt act tgc tat aag gca aaa ata aag 3584
Ser Glu Leu Thr Gln Gly Val Thr Cys Tyr Lys Ala Lys Ile Lys
1150 1155 1160
gaa ctt gaa aca att tta gag act cag aaa gtt gaa tgt agt cat 3629
Glu Leu Glu Thr Ile Leu Glu Thr Gln Lys Val Glu Cys Ser His
1165 1170 1175
tca gcc aag tta gaa caa gac att ttg gaa aag gaa tct atc atc 3674
Ser Ala Lys Leu Glu Gln Asp Ile Leu Glu Lys Glu Ser Ile Ile
1180 1185 1190
tta aag cta gaa aga aat ttg aag gaa ttt caa gaa cat ctt cag 3719
Leu Lys Leu Glu Arg Asn Leu Lys Glu Phe Gln Glu His Leu Gln
1195 1200 1205
gat tct gtc aaa aac acc aaa gat tta aat gta aag gaa ctc aag 3764
Asp Ser Val Lys Asn Thr Lys Asp Leu Asn Val Lys Glu Leu Lys
1210 1215 1220
ctg aaa gaa gaa atc aca cag tta aca aat aat ttg caa gat atg 3809
Leu Lys Glu Glu Ile Thr Gln Leu Thr Asn Asn Leu Gln Asp Met
1225 1230 1235
aaa cat tta ctt caa tta aaa gaa gaa gaa gaa gaa acc aac agg 3854
Lys His Leu Leu Gln Leu Lys Glu Glu Glu Glu Glu Thr Asn Arg
1240 1245 1250
caa gaa aca gaa aaa ttg aaa gag gaa ctc tct gca agc tct gct 3899
Gln Glu Thr Glu Lys Leu Lys Glu Glu Leu Ser Ala Ser Ser Ala
1255 1260 1265
cgt acc cag aat ctg aaa gca gat ctt cag agg aag gaa gaa gat 3944
Arg Thr Gln Asn Leu Lys Ala Asp Leu Gln Arg Lys Glu Glu Asp
1270 1275 1280
tat gct gac ctg aaa gag aaa ctg act gat gcc aaa aag cag att 3989
Tyr Ala Asp Leu Lys Glu Lys Leu Thr Asp Ala Lys Lys Gln Ile
1285 1290 1295
aag caa gta cag aaa gag gta tct gta atg cgt gat gag gat aaa 4034
Lys Gln Val Gln Lys Glu Val Ser Val Met Arg Asp Glu Asp Lys
1300 1305 1310
tta ctg agg att aaa att aat gaa ctg gag aaa aag aaa aac cag 4079
Leu Leu Arg Ile Lys Ile Asn Glu Leu Glu Lys Lys Lys Asn Gln
1315 1320 1325
tgt tct cag gaa tta gat atg aaa cag cga acc att cag caa ctc 4124
Cys Ser Gln Glu Leu Asp Met Lys Gln Arg Thr Ile Gln Gln Leu
1330 1335 1340
aag gag cag tta aat aat cag aaa gtg gaa gaa gct ata caa cag 4169
Lys Glu Gln Leu Asn Asn Gln Lys Val Glu Glu Ala Ile Gln Gln
1345 1350 1355
tat gag aga gca tgc aaa gat cta aat gtt aaa gag aaa ata att 4214
Tyr Glu Arg Ala Cys Lys Asp Leu Asn Val Lys Glu Lys Ile Ile
1360 1365 1370
gaa gac atg cga atg aca cta gaa gaa cag gaa caa act cag gta 4259
Glu Asp Met Arg Met Thr Leu Glu Glu Gln Glu Gln Thr Gln Val
1375 1380 1385
gaa cag gat caa gtg ctt gag gct aaa tta gag gaa gtt gaa agg 4304
Glu Gln Asp Gln Val Leu Glu Ala Lys Leu Glu Glu Val Glu Arg
1390 1395 1400
ctg gcc aca gaa ttg gaa aaa tgg aag gaa aaa tgc aat gat ttg 4349
Leu Ala Thr Glu Leu Glu Lys Trp Lys Glu Lys Cys Asn Asp Leu
1405 1410 1415
gaa acc aaa aac aat caa agg tca aat aaa gaa cat gag aac aac 4394
Glu Thr Lys Asn Asn Gln Arg Ser Asn Lys Glu His Glu Asn Asn
1420 1425 1430
aca gat gtg ctt gga aag ctc act aat ctt caa gat gag tta cag 4439
Thr Asp Val Leu Gly Lys Leu Thr Asn Leu Gln Asp Glu Leu Gln
1435 1440 1445
gag tct gaa cag aaa tat aat gct gat aga aag aaa tgg tta gaa 4484
Glu Ser Glu Gln Lys Tyr Asn Ala Asp Arg Lys Lys Trp Leu Glu
1450 1455 1460
gaa aaa atg atg ctt atc act caa gcg aaa gaa gca gag aat ata 4529
Glu Lys Met Met Leu Ile Thr Gln Ala Lys Glu Ala Glu Asn Ile
1465 1470 1475
cga aat aaa gag atg aaa aaa tat gct gag gac agg gag cgt ttt 4574
Arg Asn Lys Glu Met Lys Lys Tyr Ala Glu Asp Arg Glu Arg Phe
1480 1485 1490
ttt aag caa cag aat gaa atg gaa ata ctg aca gcc cag ctg aca 4619
Phe Lys Gln Gln Asn Glu Met Glu Ile Leu Thr Ala Gln Leu Thr
1495 1500 1505
gag aaa gat agt gac ctt caa aag tgg cga gaa gaa cga gat caa 4664
Glu Lys Asp Ser Asp Leu Gln Lys Trp Arg Glu Glu Arg Asp Gln
1510 1515 1520
ctg gtt gca gct tta gaa ata cag cta aaa gca ctg ata tcc agt 4709
Leu Val Ala Ala Leu Glu Ile Gln Leu Lys Ala Leu Ile Ser Ser
1525 1530 1535
aat gta cag aaa gat aat gaa att gaa caa cta aaa agg atc ata 4754
Asn Val Gln Lys Asp Asn Glu Ile Glu Gln Leu Lys Arg Ile Ile
1540 1545 1550
tca gag act tct aaa ata gaa aca caa atc atg gat atc aag ccc 4799
Ser Glu Thr Ser Lys Ile Glu Thr Gln Ile Met Asp Ile Lys Pro
1555 1560 1565
aaa cgt att agt tca gca gat cct gac aaa ctt caa act gaa cct 4844
Lys Arg Ile Ser Ser Ala Asp Pro Asp Lys Leu Gln Thr Glu Pro
1570 1575 1580
cta tcg aca agt ttt gaa att tcc aga aat aaa ata gag gat gga 4889
Leu Ser Thr Ser Phe Glu Ile Ser Arg Asn Lys Ile Glu Asp Gly
1585 1590 1595
tct gta gtc ctt gac tct tgt gaa gtg tca aca gaa aat gat caa 4934
Ser Val Val Leu Asp Ser Cys Glu Val Ser Thr Glu Asn Asp Gln
1600 1605 1610
agc act cga ttt cca aaa cct gag tta gag att caa ttt aca cct 4979
Ser Thr Arg Phe Pro Lys Pro Glu Leu Glu Ile Gln Phe Thr Pro
1615 1620 1625
tta cag cca aac aaa atg gca gtg aaa cac cct ggt tgt acc aca 5024
Leu Gln Pro Asn Lys Met Ala Val Lys His Pro Gly Cys Thr Thr
1630 1635 1640
cca gtg aca gtt aag att ccc aag gct cgg aag agg aag agt aat 5069
Pro Val Thr Val Lys Ile Pro Lys Ala Arg Lys Arg Lys Ser Asn
1645 1650 1655
gaa atg gag gag gac ttg gtg aaa tgt gaa aat aag aag aat gct 5114
Glu Met Glu Glu Asp Leu Val Lys Cys Glu Asn Lys Lys Asn Ala
1660 1665 1670
aca ccc aga act aat ttg aaa ttt cct att tca gat gat aga aat 5159
Thr Pro Arg Thr Asn Leu Lys Phe Pro Ile Ser Asp Asp Arg Asn
1675 1680 1685
tct tct gtc aaa aag gaa caa aag gtt gcc ata cgt cca tca tct 5204
Ser Ser Val Lys Lys Glu Gln Lys Val Ala Ile Arg Pro Ser Ser
1690 1695 1700
aag aaa aca tat tct tta cgg agt cag gca tcc ata att ggt gta 5249
Lys Lys Thr Tyr Ser Leu Arg Ser Gln Ala Ser Ile Ile Gly Val
1705 1710 1715
aac ctg gcc act aag aaa aaa gaa gga aca cta cag aaa ttt gga 5294
Asn Leu Ala Thr Lys Lys Lys Glu Gly Thr Leu Gln Lys Phe Gly
1720 1725 1730
gac ttc tta caa cat tct ccc tca att ctt caa tca aaa gca aag 5339
Asp Phe Leu Gln His Ser Pro Ser Ile Leu Gln Ser Lys Ala Lys
1735 1740 1745
aag ata att gaa aca atg agc tct tca aag ctc tca aat gta gaa 5384
Lys Ile Ile Glu Thr Met Ser Ser Ser Lys Leu Ser Asn Val Glu
1750 1755 1760
gca agt aaa gaa aat gtg tct caa cca aaa cga gcc aaa cgg aaa 5429
Ala Ser Lys Glu Asn Val Ser Gln Pro Lys Arg Ala Lys Arg Lys
1765 1770 1775
tta tac aca agt gaa att tca tct cct att gat ata tca ggc caa 5474
Leu Tyr Thr Ser Glu Ile Ser Ser Pro Ile Asp Ile Ser Gly Gln
1780 1785 1790
gtg att tta atg gac cag aaa atg aag gag agt gat cac cag att 5519
Val Ile Leu Met Asp Gln Lys Met Lys Glu Ser Asp His Gln Ile
1795 1800 1805
atc aaa cga cga ctt cga aca aaa aca gcc aaa taa atcacttatg 5565
Ile Lys Arg Arg Leu Arg Thr Lys Thr Ala Lys
1810 1815 1820
gaaatgttta atataaattt tatagtcata gtcattggaa cttgcatcct gtattgtaaa 5625
tataaatgta tatattatgc attaaatcac tctgcatata gattgctgtt ttatacatag 5685
tataatttta attcaataaa tgagtcaaaa tttgtatatt tttataaggc ttttttataa 5745
tagcttcttt caaactgtat ttccctatta tctcagacat tggatcagtg aagatcctag 5805
gaaagaggct gttattctca tttattttgc tatacaggat gtaataggtc aggtatttgg 5865
tttacttata tttaacaatg tcttatgaat tttttttact ttatctgtta tacaactgat 5925
tttacatatc tgtttggatt atagctagga tttggagaat aagtgtgtac agatcacaaa 5985
acatgtatat acattattta gaaaagatct caagtcttta attagaatgt ctcacttatt 6045
ttgtaaacat tttgtgggta catagtacat gtatatattt acggggtatg tgagatgttt 6105
tgacacaggc atgcaatgtg aaatacgtgt atcatggaga atgaggtatc catcccctca 6165
agcatttttc ctttgaatta cagataatcc aattacattc tttagatcat ttaaaaatat 6225
acaagtaagt tattattgat tatagtcact ctattgtgct atcagatagt agatcattct 6285
ttttatctta tttgtttttg tacccattaa ccatccccac ctccccctgc aaccgtcagt 6345
acccttacca gccactggta accattcttc tactctgtat gcccatgagg tcaattgatt 6405
ttatttttag atcccataaa taaatgagaa catgcagtct ttgtcaaaaa aaaa 6459
<210> 188
<211> 1820
<212> Белок
<213> Homo sapiens
<400> 188
Met Glu Ser Asn Phe Asn Gln Glu Gly Val Pro Arg Pro Ser Tyr Val
1 5 10 15
Phe Ser Ala Asp Pro Ile Ala Arg Pro Ser Glu Ile Asn Phe Asp Gly
20 25 30
Ile Lys Leu Asp Leu Ser His Glu Phe Ser Leu Val Ala Pro Asn Thr
35 40 45
Glu Ala Asn Ser Phe Glu Ser Lys Asp Tyr Leu Gln Val Cys Leu Arg
50 55 60
Ile Arg Pro Phe Thr Gln Ser Glu Lys Glu Leu Glu Ser Glu Gly Cys
65 70 75 80
Val His Ile Leu Asp Ser Gln Thr Val Val Leu Lys Glu Pro Gln Cys
85 90 95
Ile Leu Gly Arg Leu Ser Glu Lys Ser Ser Gly Gln Met Ala Gln Lys
100 105 110
Phe Ser Phe Ser Lys Val Phe Gly Pro Ala Thr Thr Gln Lys Glu Phe
115 120 125
Phe Gln Gly Cys Ile Met Gln Pro Val Lys Asp Leu Leu Lys Gly Gln
130 135 140
Ser Arg Leu Ile Phe Thr Tyr Gly Leu Thr Asn Ser Gly Lys Thr Tyr
145 150 155 160
Thr Phe Gln Gly Thr Glu Glu Asn Ile Gly Ile Leu Pro Arg Thr Leu
165 170 175
Asn Val Leu Phe Asp Ser Leu Gln Glu Arg Leu Tyr Thr Lys Met Asn
180 185 190
Leu Lys Pro His Arg Ser Arg Glu Tyr Leu Arg Leu Ser Ser Glu Gln
195 200 205
Glu Lys Glu Glu Ile Ala Ser Lys Ser Ala Leu Leu Arg Gln Ile Lys
210 215 220
Glu Val Thr Val His Asn Asp Ser Asp Asp Thr Leu Tyr Gly Ser Leu
225 230 235 240
Thr Asn Ser Leu Asn Ile Ser Glu Phe Glu Glu Ser Ile Lys Asp Tyr
245 250 255
Glu Gln Ala Asn Leu Asn Met Ala Asn Ser Ile Lys Phe Ser Val Trp
260 265 270
Val Ser Phe Phe Glu Ile Tyr Asn Glu Tyr Ile Tyr Asp Leu Phe Val
275 280 285
Pro Val Ser Ser Lys Phe Gln Lys Arg Lys Met Leu Arg Leu Ser Gln
290 295 300
Asp Val Lys Gly Tyr Ser Phe Ile Lys Asp Leu Gln Trp Ile Gln Val
305 310 315 320
Ser Asp Ser Lys Glu Ala Tyr Arg Leu Leu Lys Leu Gly Ile Lys His
325 330 335
Gln Ser Val Ala Phe Thr Lys Leu Asn Asn Ala Ser Ser Arg Ser His
340 345 350
Ser Ile Phe Thr Val Lys Ile Leu Gln Ile Glu Asp Ser Glu Met Ser
355 360 365
Arg Val Ile Arg Val Ser Glu Leu Ser Leu Cys Asp Leu Ala Gly Ser
370 375 380
Glu Arg Thr Met Lys Thr Gln Asn Glu Gly Glu Arg Leu Arg Glu Thr
385 390 395 400
Gly Asn Ile Asn Thr Ser Leu Leu Thr Leu Gly Lys Cys Ile Asn Val
405 410 415
Leu Lys Asn Ser Glu Lys Ser Lys Phe Gln Gln His Val Pro Phe Arg
420 425 430
Glu Ser Lys Leu Thr His Tyr Phe Gln Ser Phe Phe Asn Gly Lys Gly
435 440 445
Lys Ile Cys Met Ile Val Asn Ile Ser Gln Cys Tyr Leu Ala Tyr Asp
450 455 460
Glu Thr Leu Asn Val Leu Lys Phe Ser Ala Ile Ala Gln Lys Val Cys
465 470 475 480
Val Pro Asp Thr Leu Asn Ser Ser Gln Glu Lys Leu Phe Gly Pro Val
485 490 495
Lys Ser Ser Gln Asp Val Ser Leu Asp Ser Asn Ser Asn Ser Lys Ile
500 505 510
Leu Asn Val Lys Arg Ala Thr Ile Ser Trp Glu Asn Ser Leu Glu Asp
515 520 525
Leu Met Glu Asp Glu Asp Leu Val Glu Glu Leu Glu Asn Ala Glu Glu
530 535 540
Thr Gln Asn Val Glu Thr Lys Leu Leu Asp Glu Asp Leu Asp Lys Thr
545 550 555 560
Leu Glu Glu Asn Lys Ala Phe Ile Ser His Glu Glu Lys Arg Lys Leu
565 570 575
Leu Asp Leu Ile Glu Asp Leu Lys Lys Lys Leu Ile Asn Glu Lys Lys
580 585 590
Glu Lys Leu Thr Leu Glu Phe Lys Ile Arg Glu Glu Val Thr Gln Glu
595 600 605
Phe Thr Gln Tyr Trp Ala Gln Arg Glu Ala Asp Phe Lys Glu Thr Leu
610 615 620
Leu Gln Glu Arg Glu Ile Leu Glu Glu Asn Ala Glu Arg Arg Leu Ala
625 630 635 640
Ile Phe Lys Asp Leu Val Gly Lys Cys Asp Thr Arg Glu Glu Ala Ala
645 650 655
Lys Asp Ile Cys Ala Thr Lys Val Glu Thr Glu Glu Thr His Asn Tyr
660 665 670
Val Gly Phe Glu Asp Ile Ile Asp Ser Leu Gln Asp Asn Val Ala Asp
675 680 685
Ile Lys Lys Gln Ala Glu Ile Ala His Leu Tyr Ile Ala Ser Leu Pro
690 695 700
Asp Pro Gln Glu Ala Thr Ala Cys Leu Glu Leu Lys Phe Asn Gln Ile
705 710 715 720
Lys Ala Glu Leu Ala Lys Thr Lys Gly Glu Leu Ile Lys Thr Lys Glu
725 730 735
Glu Leu Lys Lys Arg Glu Asn Glu Ser Asp Ser Leu Ile Gln Glu Leu
740 745 750
Glu Thr Ser Asn Lys Lys Ile Ile Thr Gln Asn Gln Arg Ile Lys Glu
755 760 765
Leu Ile Asn Ile Ile Asp Gln Lys Glu Asp Thr Ile Asn Glu Phe Gln
770 775 780
Asn Leu Lys Ser His Met Glu Asn Thr Phe Lys Cys Asn Asp Lys Ala
785 790 795 800
Asp Thr Ser Ser Leu Ile Ile Asn Asn Lys Leu Ile Cys Asn Glu Thr
805 810 815
Val Glu Val Pro Lys Asp Ser Lys Ser Lys Ile Cys Ser Glu Arg Lys
820 825 830
Arg Val Asn Glu Asn Glu Leu Gln Gln Asp Glu Pro Pro Ala Lys Lys
835 840 845
Gly Ser Ile His Val Ser Ser Ala Ile Thr Glu Asp Gln Lys Lys Ser
850 855 860
Glu Glu Val Arg Pro Asn Ile Ala Glu Ile Glu Asp Ile Arg Val Leu
865 870 875 880
Gln Glu Asn Asn Glu Gly Leu Arg Ala Phe Leu Leu Thr Ile Glu Asn
885 890 895
Glu Leu Lys Asn Glu Lys Glu Glu Lys Ala Glu Leu Asn Lys Gln Ile
900 905 910
Val His Phe Gln Gln Glu Leu Ser Leu Ser Glu Lys Lys Asn Leu Thr
915 920 925
Leu Ser Lys Glu Val Gln Gln Ile Gln Ser Asn Tyr Asp Ile Ala Ile
930 935 940
Ala Glu Leu His Val Gln Lys Ser Lys Asn Gln Glu Gln Glu Glu Lys
945 950 955 960
Ile Met Lys Leu Ser Asn Glu Ile Glu Thr Ala Thr Arg Ser Ile Thr
965 970 975
Asn Asn Val Ser Gln Ile Lys Leu Met His Thr Lys Ile Asp Glu Leu
980 985 990
Arg Thr Leu Asp Ser Val Ser Gln Ile Ser Asn Ile Asp Leu Leu Asn
995 1000 1005
Leu Arg Asp Leu Ser Asn Gly Ser Glu Glu Asp Asn Leu Pro Asn
1010 1015 1020
Thr Gln Leu Asp Leu Leu Gly Asn Asp Tyr Leu Val Ser Lys Gln
1025 1030 1035
Val Lys Glu Tyr Arg Ile Gln Glu Pro Asn Arg Glu Asn Ser Phe
1040 1045 1050
His Ser Ser Ile Glu Ala Ile Trp Glu Glu Cys Lys Glu Ile Val
1055 1060 1065
Lys Ala Ser Ser Lys Lys Ser His Gln Ile Glu Glu Leu Glu Gln
1070 1075 1080
Gln Ile Glu Lys Leu Gln Ala Glu Val Lys Gly Tyr Lys Asp Glu
1085 1090 1095
Asn Asn Arg Leu Lys Glu Lys Glu His Lys Asn Gln Asp Asp Leu
1100 1105 1110
Leu Lys Glu Lys Glu Thr Leu Ile Gln Gln Leu Lys Glu Glu Leu
1115 1120 1125
Gln Glu Lys Asn Val Thr Leu Asp Val Gln Ile Gln His Val Val
1130 1135 1140
Glu Gly Lys Arg Ala Leu Ser Glu Leu Thr Gln Gly Val Thr Cys
1145 1150 1155
Tyr Lys Ala Lys Ile Lys Glu Leu Glu Thr Ile Leu Glu Thr Gln
1160 1165 1170
Lys Val Glu Cys Ser His Ser Ala Lys Leu Glu Gln Asp Ile Leu
1175 1180 1185
Glu Lys Glu Ser Ile Ile Leu Lys Leu Glu Arg Asn Leu Lys Glu
1190 1195 1200
Phe Gln Glu His Leu Gln Asp Ser Val Lys Asn Thr Lys Asp Leu
1205 1210 1215
Asn Val Lys Glu Leu Lys Leu Lys Glu Glu Ile Thr Gln Leu Thr
1220 1225 1230
Asn Asn Leu Gln Asp Met Lys His Leu Leu Gln Leu Lys Glu Glu
1235 1240 1245
Glu Glu Glu Thr Asn Arg Gln Glu Thr Glu Lys Leu Lys Glu Glu
1250 1255 1260
Leu Ser Ala Ser Ser Ala Arg Thr Gln Asn Leu Lys Ala Asp Leu
1265 1270 1275
Gln Arg Lys Glu Glu Asp Tyr Ala Asp Leu Lys Glu Lys Leu Thr
1280 1285 1290
Asp Ala Lys Lys Gln Ile Lys Gln Val Gln Lys Glu Val Ser Val
1295 1300 1305
Met Arg Asp Glu Asp Lys Leu Leu Arg Ile Lys Ile Asn Glu Leu
1310 1315 1320
Glu Lys Lys Lys Asn Gln Cys Ser Gln Glu Leu Asp Met Lys Gln
1325 1330 1335
Arg Thr Ile Gln Gln Leu Lys Glu Gln Leu Asn Asn Gln Lys Val
1340 1345 1350
Glu Glu Ala Ile Gln Gln Tyr Glu Arg Ala Cys Lys Asp Leu Asn
1355 1360 1365
Val Lys Glu Lys Ile Ile Glu Asp Met Arg Met Thr Leu Glu Glu
1370 1375 1380
Gln Glu Gln Thr Gln Val Glu Gln Asp Gln Val Leu Glu Ala Lys
1385 1390 1395
Leu Glu Glu Val Glu Arg Leu Ala Thr Glu Leu Glu Lys Trp Lys
1400 1405 1410
Glu Lys Cys Asn Asp Leu Glu Thr Lys Asn Asn Gln Arg Ser Asn
1415 1420 1425
Lys Glu His Glu Asn Asn Thr Asp Val Leu Gly Lys Leu Thr Asn
1430 1435 1440
Leu Gln Asp Glu Leu Gln Glu Ser Glu Gln Lys Tyr Asn Ala Asp
1445 1450 1455
Arg Lys Lys Trp Leu Glu Glu Lys Met Met Leu Ile Thr Gln Ala
1460 1465 1470
Lys Glu Ala Glu Asn Ile Arg Asn Lys Glu Met Lys Lys Tyr Ala
1475 1480 1485
Glu Asp Arg Glu Arg Phe Phe Lys Gln Gln Asn Glu Met Glu Ile
1490 1495 1500
Leu Thr Ala Gln Leu Thr Glu Lys Asp Ser Asp Leu Gln Lys Trp
1505 1510 1515
Arg Glu Glu Arg Asp Gln Leu Val Ala Ala Leu Glu Ile Gln Leu
1520 1525 1530
Lys Ala Leu Ile Ser Ser Asn Val Gln Lys Asp Asn Glu Ile Glu
1535 1540 1545
Gln Leu Lys Arg Ile Ile Ser Glu Thr Ser Lys Ile Glu Thr Gln
1550 1555 1560
Ile Met Asp Ile Lys Pro Lys Arg Ile Ser Ser Ala Asp Pro Asp
1565 1570 1575
Lys Leu Gln Thr Glu Pro Leu Ser Thr Ser Phe Glu Ile Ser Arg
1580 1585 1590
Asn Lys Ile Glu Asp Gly Ser Val Val Leu Asp Ser Cys Glu Val
1595 1600 1605
Ser Thr Glu Asn Asp Gln Ser Thr Arg Phe Pro Lys Pro Glu Leu
1610 1615 1620
Glu Ile Gln Phe Thr Pro Leu Gln Pro Asn Lys Met Ala Val Lys
1625 1630 1635
His Pro Gly Cys Thr Thr Pro Val Thr Val Lys Ile Pro Lys Ala
1640 1645 1650
Arg Lys Arg Lys Ser Asn Glu Met Glu Glu Asp Leu Val Lys Cys
1655 1660 1665
Glu Asn Lys Lys Asn Ala Thr Pro Arg Thr Asn Leu Lys Phe Pro
1670 1675 1680
Ile Ser Asp Asp Arg Asn Ser Ser Val Lys Lys Glu Gln Lys Val
1685 1690 1695
Ala Ile Arg Pro Ser Ser Lys Lys Thr Tyr Ser Leu Arg Ser Gln
1700 1705 1710
Ala Ser Ile Ile Gly Val Asn Leu Ala Thr Lys Lys Lys Glu Gly
1715 1720 1725
Thr Leu Gln Lys Phe Gly Asp Phe Leu Gln His Ser Pro Ser Ile
1730 1735 1740
Leu Gln Ser Lys Ala Lys Lys Ile Ile Glu Thr Met Ser Ser Ser
1745 1750 1755
Lys Leu Ser Asn Val Glu Ala Ser Lys Glu Asn Val Ser Gln Pro
1760 1765 1770
Lys Arg Ala Lys Arg Lys Leu Tyr Thr Ser Glu Ile Ser Ser Pro
1775 1780 1785
Ile Asp Ile Ser Gly Gln Val Ile Leu Met Asp Gln Lys Met Lys
1790 1795 1800
Glu Ser Asp His Gln Ile Ile Lys Arg Arg Leu Arg Thr Lys Thr
1805 1810 1815
Ala Lys
1820
<210> 189
<211> 4
<212> Белок
<213> искусственная последовательность
<220>
<223> линкерный пептид
<400> 189
Asn Lys Arg Lys
1
<---
Реферат
Изобретение относится к эпитопным пептидам, полученным из MPHOSPH1, со способностью индуцировать цитотоксические T-клетки, к полинуклеотидам, кодирующим такие пептиды, антигенпрезентирующим клеткам, презентирующим пептиды, и цитотоксическим T-клеткам, нацеленным на пептиды, а также к способам индуцирования антигенпрезентирующих клеток или ЦТЛ. Также предложен способ индуцирования иммунного ответа против злокачественной опухоли и способ лечения и/или профилактики злокачественной опухоли, экспрессирующей MPHOSPH1, и/или профилактики ее послеоперационного рецидива, с использованием пептидов, полинуклеотидов, антигенпрезентирующих клеток, цитотоксических T-клеток или композиций по настоящему изобретению. 12 н. и 5 з.п. ф-лы, 8 ил., 2 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Пептиды mphosph1 и вакцины, включающие их

Комментарии