Композиции и способы для бустинга эффективности адоптивной клеточной иммунотерапии - RU2716716C2
Код документа: RU2716716C2
Чертежи











Описание
Настоящая заявка испрашивает приоритет в соответствии с параграфом 119(e) раздела 35 Свода законов США на основании предварительной заявки на патент США №62/069168, поданной 27 октября 2014, указанная заявка полностью включена в настоящую заявку посредством ссылки.
ЗАЯВЛЕНИЕ О ГОСУДАРСТВЕННОМ ИНТЕРЕСЕ
Настоящее изобретение было создано с помощью государственной поддержки в соответствии с грантами №№СА114536, AI053193 и P51-OD010425, присужденных Государственными институтами здоровья. Государство заявляет определенные права на настоящее изобретение.
УРОВЕНЬ ТЕХНИКИ
Область техники
Настоящее изобретение относится главным образом к композициям и способам усиления или бустинга эффективности иммунотерапии. Конкретнее, настоящее изобретение относится к применению Т-клеток, экспрессирующих антигенсвязывающий белок (например, химерный антигенный рецептор), в сочетании с клетками (такими как гемопоэтические клетки-предшественники, модифицированные клетки иммунной системы человека или их комбинация), модифицированными для экспрессии антигена, специфично связываемого антигенсвязывающим белком модифицированных Т-клеток, с целью бустинга адоптивной клеточной иммунотерапии для лечения заболеваний или нарушений, связанных с экспрессией целевого антигена, такого как рак.
Описание предшествующего уровня техники
Введение направленных против опухоли рецепторов в Т-клетки с помощью переноса генов позволяет осуществлять быстрое получение опухолеспецифических Т-клеток от любого ракового больного для адоптивной Т-клеточной терапии. Перспективная стратегия включает конструирование Т-клеток с синтетическими химерными антигенными рецепторами (CAR), состоящих из одноцепочечного антитела или другого связывающего домена, который является специфичным к молекуле клеточной поверхности опухоли, и связан с одной или более Т-клеточной сигнальными молекулами (Turtle et al., Curr. Opin. Immunol. 24:633, 2012; Barrett et al., Annu. Rev. Med. 65:10.1, 2014; Sadelain et al., Cancer Discovery 5:388, 2013). Недавние эксперименты с использованием CAR-модифицированных Т-клеток (CAR-T-клеток), специфичных к молекуле CD 19 на В-клеточных злокачественных опухолях, показали заметную регрессию опухоли у подгруппы пациентов с заболеванием на поздних стадиях (Barrett et al., 2014; Sadelain et al., 2013; Kalos et al., Sci. Transl. Med. 3:95ra73, 2011; Kochenderfer and Rosenberg, Nat. Rev. Clin. Oncol. 10:267, 2013). Перенос данной терапии на обычные эпителиальные раковые заболевания вызывает некоторые трудности, включая идентификацию молекул, экспрессируемых на опухолевых клетках, которые могут безопасно являться мишенями для Т-клеток. Это подчеркивается серьезными и даже фатальными токсическими эффектами, которые наблюдали в связи с направленными на мишень и ненаправленными на опухоль воздействиями CAR-терапии на нормальные клетки, которые экспрессируют целевую молекулу (Lamers et al., Mol. Ther. 21:904, 2013; Morgan et al., Mol. Ther. 18:843, 2010). Помимо этого, важными областями исследований остается возможность идентификации свойств Т-клеток, которые определяют их способность выживать и функционировать in vivo.
Очевидно, что существует потребность в альтернативных композициях и способах усиления или бустинга адоптивных клеточных иммунотерапий, направленных против различных раковых заболеваний, таких как лейкозы и опухоли. Раскрытые в настоящей заявке варианты реализации удовлетворяют эту потребность, а также обеспечивают другие связанные с этим преимущества.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигурах 1A-1D показаны функция и характеризация ROR1 (трансмембранного рецептора протеинтирозинкиназы 1) макака-резуса. (А) функция Т-клеток макака-резуса, модифицированных для экспрессии R12-ROR1 CAR с доменами 4-1 ВВ и CD3ζ человека или макака. (В) анализ проточной цитометрией чистоты и фенотипа ROR1 CAR-модифицированных CD4+ и CD8+ Т-клеток с использованием маркера tCD19. Данные показывают фенотип нетрансдуцированных Т-клеток (модель), трансдуцированных Т-клеток перед и после селекции по tCD19 и после селекции по CD4 (верхние области) или CD8 (нижние области). Все образцы перенесены на CD3+ -клетки. (С) цитолитическая активность CD4+ и CD8+ ROR1 CAR-T-клеток в отношении51Cr-меченых клеток K562/ROR1 или K562 в ходе 4-часового цитотоксического анализа. (D) цитокиновый анализ на приборе Luminex супернатантов, полученных спустя 24 часа от трех повторностей сокультур 5×104 ROR1 CAR-T-клеток с клетками K562/ROR1 или форболмиристатацетатом (ФМА)/иономицином или только от культуральной среды, как описано в разделе «Способы». Цитокиновые уровни в контрольных образцах культуральной среды были ниже предела обнаружения. На фиг. B-D показаны данные от макака А13002, которые являются типичными для независимых экспериментов на 3 животных.
На фигурах 2А-2Е показан мониторинг токсичности и персистенции in vivo ROR1 CAR-T-клеток. (А) масса тела и биохимический анализ крови до и в указанные дни после инфузии Т-клеток. Серая закрашенная область обозначает специфичный для макак-резуса нормальный диапазон для каждого параметра. (В) уровни цитокинов в плазме измеряли перед и после инфузии с использованием специфичного для макак-резуса мультиплексного цитокинового анализа. (С) получали мононуклеарные клетки периферической крови (МКПК) до и в указанные дни после инфузии ROR1 CAR-T-клеток и контрольных EGFRt+ Т-клеток. Частоту перенесенных Т-клеток (%) в пределах субпопуляции CD3+CD4+ клеток и субпопуляции CD3+CD8+ клеток определяли с помощью проточной цитометрии после окрашивания моноклональными антителами (МАТ), специфичными к CD3, CD4, CD8 и CD19 или к EGFRt. (D) абсолютное количество R12-ROR1 CAR+ Т-клеток и EGFRt+ Т-клеток в периферической крови, измеренное с помощью проточной цитометрии и рассчитанное на основе результатов общего анализа крови в указанные дни в аккредитованной клинической лаборатории. (Е) выделяли ДНК из образцов МКПК, полученных в указанные дни, и анализировали с помощью количественной ПЦР в реальном времени (TaqMan) на наличие специфичных для трансгенного вектора последовательней.
На фигурах 3А-3D показана миграция in vivo и функция R12-ROR1 CAR-T-клеток. (А) образцы костного мозга (КМ) и лимфатических узлов (ЛУ), полученные до и на 5 день после инфузии Т-клеток, окрашивали МАТ, специфичными к CD3, CD4, CD8 и CD 19 или к EGFRt, и анализировали с помощью проточной цитометрии после гейтирования по CD3+ CD4+ или CD3+ CD8+ Т-клеткам. (В) обнаружение ROR1+ В-клеток-предшественников в костном мозге. Образцы костного мозга получали до и на 5 день после инфузии и анализировали с помощью проточной цитометрии на наличие субпопуляций ROR1-экспрессирующих CD19+СD45промежуточный В-клеток. (С) абсолютное количество CD19+ В-клеток в образцах периферической крови, полученных до и после инфузии Т-клеток, определенное окрашиванием МАТ, специфичными к CD19, CD3, CD4 и CD8, и проточной цитометрией для обнаружения CD19+ CD3- В-клеток. Абсолютное количество клеток определяли на основе числа лимфоцитов согласно общему анализу крови, полученному в то же время и определенному в аккредитованной клинической лаборатории. (D) анализ дегрануляции CD107A. МКПК получали до и на 7 день после инфузии, стимулировали ex vivo клеткам K562/ROR1, культуральной средой или ФМА и иономицином и анализировали с помощью проточной цитометрии на экспрессию CD107A, как описано в разделе «Методы». Культивируемые ROR1 CAR-T-клетки служили в качестве положительного контроля.
На фигурах 4А-4Е показана персистенция, миграция и безопасность ROR1 CAR-T-клеток, вводимых при высокой дозе клеток. (А) общая схема инфузий Т-клеток. Аутологические ROR1 CAR-T-клетки адоптивно переносили в общей дозе 5×108/кг. Контрольные Т-клетки с геном-меткой tCD34 вводили в эквивалентной дозе. Образцы костного мозга и лимфатических узлов получали до и на 3 день после инфузии Т-клеток. (В) анализ проточной цитометрией МКПК, полученных от макак А13011 и А13002 до и на 1 день после инфузии Т-клеток. (С) частоту перенесенных Т-клеток (%) в пределах субпопуляции CD3+CD4+ клеток и субпопуляции CD3+CD8+ клеток определяли после окрашивания МАТ, специфичными к CD3, CD4, CD8 и CD19 или к tCD34. Образцы МКПК, костного мозга и лимфатических узлов получали от обеих макак на 3 день после инфузии Т-клеток, окрашивали МАТ, специфичными к CD3, CD4, CD8 и CD19 или к tCD34, и анализировали с помощью проточной цитометрии после гейтирования по CD3+CD4+ или CD3+CD8+ клеткам. Частоту ROR1 CAR Т-клеток и контрольных Т-клеток, меченных tCD34, в каждой субпопуляции показана в виде гистограммы для каждого животного. (D) Частота ROR1+ В-клеток-предшественников в костном мозге до и после инфузии ROR1 CAR-T-клеток. Образцы костного мозга, полученные до и спустя 3 дня после переноса ROR1 CAR-T-клеток, анализировали с помощью проточной цитометрии на наличие ROR1-экспрессирующих CD19+СD45промежуточный В-клеток. Показаны типичные окрашивания образцов, полученных от макака А13011, гейтированные по CD19+ клеткам. (Е) частота ROR1+ В-клеток в лимфатических узлах. Образцы лимфатических узлов получали до и спустя 3 дня после инфузии Т-клеток, окрашивали МАТ, специфичными к CD 19, CD45 и ROR1 или изотипу, и анализировали с помощью проточной цитометрии на наличие ROR1+ CD45+ клеток в субпопуляции CD19+ клеток. Показаны данные от макака А13011.
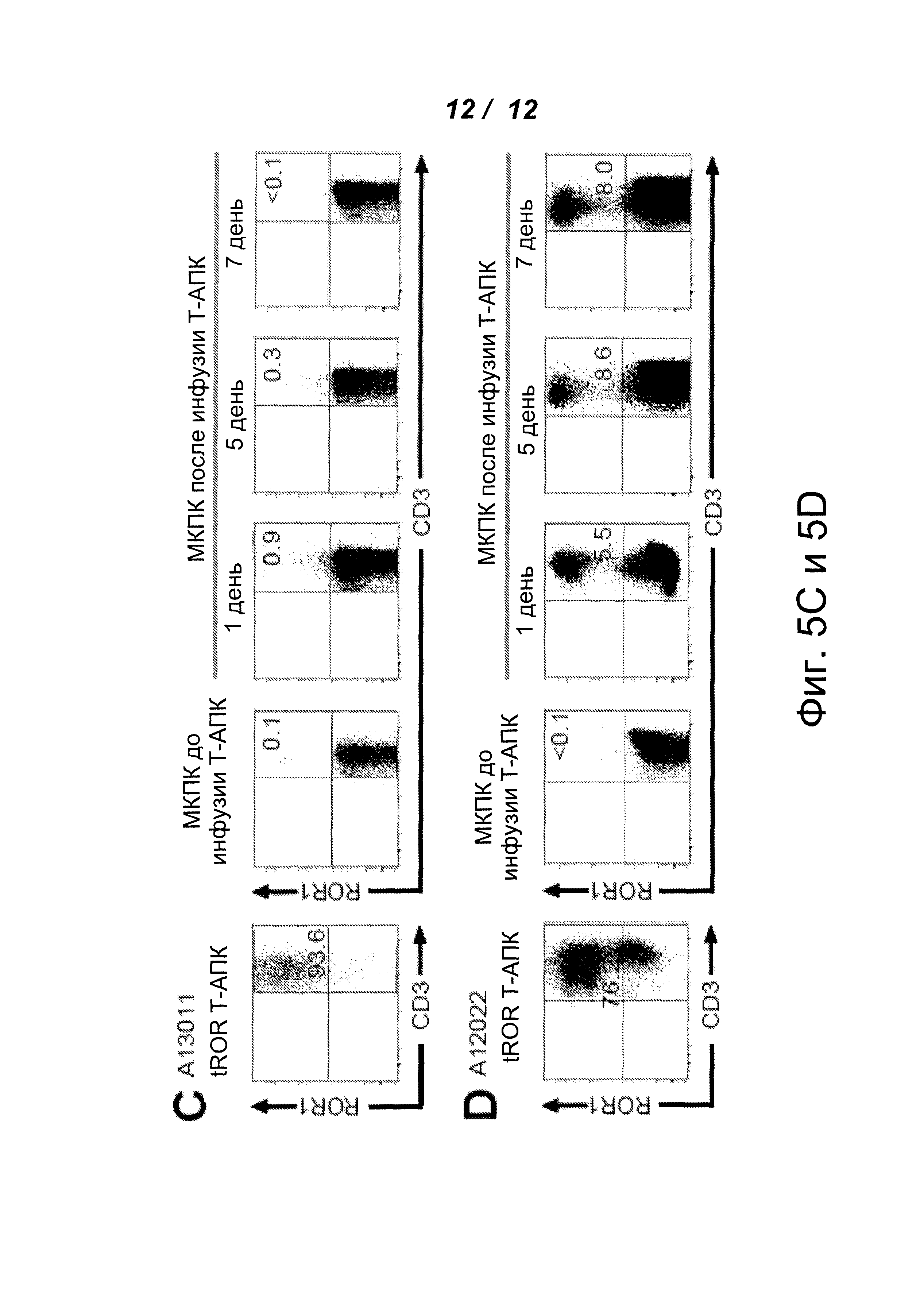
На фигурах 5А-5D показано действие стимуляции ROR1+Т-клетками (Т-антигенпрезентирующими клетками (Т-АПК)) на перенесенные ROR1 CAR-T-клетки in vivo. (А) образцы МКПК получали от макак А13011 и А13002 в указанные дни и анализировали с помощью проточной цитометрии после окрашивания МАТ, специфичными к CD3, CD4, CD8 и CD19 или к CD34. Общий анализ крови проводили в аккредитованной клинической лаборатории. Показаны абсолютное количество ROR1 CAR+ Т-клеток и tCD34+ Т-клеток в периферической крови в субпопуляции CD3+CD4+ и CD3+CD8+ клеток. (В) кратное изменение абсолютного количества ROR1 CAR-T-клеток в крови после стимуляции Т-АПК. Количество CD3+CD8+ Т-клеток и CD19+CD8+ Т-клеток/мкл крови измеряли с помощью проточной цитометрии до и в указанные дни после введения Т-АПК. Данные показывают кратное увеличение выше исходного уровня абсолютного количества эндогенных немеченых CD4+ и CD8+ Т-клеток, R12 ROR1 CAR CD4+ и CD8+ Т-клеток и CD4+ и CD8+ Т-клеток, меченных tCD34, после введения Т-АПК. (С) наличие tROR1+ Т-клеток до и после инфузии Т-АПК в образцах МКПК, полученных на 1, 5 и 7 день от животного (А13011) с персистирующими ROR1 CAR-T-клетками. МКПК окрашивали МАТ против CD3 и против ROR1. (D) наличие tROR1+ Т-клеток до и после инфузии Т-АПК в образцах МКПК, полученных на 1, 5 и 7 день от животного (А12022) без ROR1 CAR-T-клеток.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте согласно настоящему изобретению предложены композиции и способы бустинга, увеличение или усиления эффективности адоптивной клеточной иммунотерапии или лечения гиперпролиферативного заболевания путем введения человеку эффективного количества композиции, содержащей популяцию модифицированных Т-клеток человека, содержащих молекулу нуклеиновой кислоты, которая кодирует антигенсвязывающий белок (например, химерный антигенный рецептор (CAR), при этом антигенсвязывающий белок содержит гидрофобную часть, расположенную между внеклеточным связывающим компонентом и внутриклеточным эффекторным компонентом; и популяцию модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или их комбинацию, содержащую молекулу нуклеиновой кислоты, которая кодирует антиген, специфично распознаваемый внеклеточным связывающим компонентом антигенсвязывающего белка.
Перед представлением настоящего описания более подробно, может быть полезным для его понимания предоставить определения конкретных терминов, используемых в настоящей заявке. Дополнительные определения указаны по тексту настоящего описания.
В настоящем описании любой конкретный диапазон, диапазон процентов, диапазон соотношений или диапазон целых чисел следует понимать как включающий значения любого целого числа в пределах изложенного диапазона и, если допустимо, его частей (таких как одна десятая и одна сотая от целого), если не указано иначе. Также любые диапазоны чисел, изложенные в настоящей заявке, относящиеся к любому физическому признаку, такому как субъединицы полимера, размер или толщина, следует понимать как включающие любое целое число в пределах описанного диапазона, если не указано иное. Используемый в настоящей заявке термин «приблизительно» означает ±20% от указанного диапазона, значения или структуры, если не указано иное. Следует понимать, что термины в единственном числе, используемые в настоящей заявке, обозначают «один или более» из перечисленных компонентов. Использование альтернативы (например, «или») следует понимать как означающее один, оба, или любую комбинацию из альтернатив. Используемые в настоящей заявке термины «включает», «имеет» и «содержит» используются как синонимы, чьи термины и варианты следует толковать как нелимитирующие.
Помимо этого, следует понимать, что индивидуальные соединения или группы соединений, полученные от различных комбинаций структур и заместителей, описанных в настоящей заявке, раскрыты посредством настоящей заявке в той же степени, как если бы каждое соединение или группа соединений были указаны по отдельности. Таким образом, выбор конкретных структур или конкретных заместителей находится в пределах объема настоящего изобретения.
Термин «состоящий по существу из» ограничивает объем пункта формулы изобретения до конкретных материалов или этапов или до тех, которые существенно не влияют на основные характеристики заявляемого изобретения. Например, белковый домен, область или модуль (например, связывающий домен, шарнирная область, линкерный модуль) или белок (который может иметь один или более доменов, областей или модулей) «по существу состоит из» конкретной аминокислотной последовательности, где аминокислотная последовательность домена, области, модуля или белка включает удлинения, делеции, мутации или их комбинацию (например, аминокислоты на амино-или карбоксиконце или между доменами), которые в комбинации составляют по большей мере 20% (например, по большей мере 15%, 10%, 8%, 6%, 5%, 4%, 3%, 2% или 1%) от длины домена, области, модуля или белка и по существу не влияют (то есть снижают активность не более чем на 50%, например, не более чем на 40%, 30%, 25%, 20%, 15%, 10%, 5% или 1%) на активность домена(доменов), области(областей), модуля(модулей) или белка (например, аффинность связывания мишени связывающего белка).
Используемая в настоящей заявке «гемопоэтическая клетка-предшественник» представляет собой клетку, которая может быть выделена из гемопоэтических стволовых клеток или эмбриональной ткани, и способна дифференцироваться в дальнейшем в зрелые типы клеток (например, клетки иммунной системы). Примеры гемопоэтических клеток-предшественников включают клетки с фенотипом CD24Lo Lin- CD117+ или клетки, обнаруживаемые в тимусе (обозначаемые как клетки-предшественники тимоцитов).
«Гемопоэтические стволовые клетки» относятся к недифференцированным гемопоэтическим клеткам, которые способны самообновляться и in vivo, по существу неограниченно размножаться in vitro и способны дифференцироваться в другие типы клеток, включая клетки Т-клеточной линии дифференцировки. Гемопоэтические стволовые клетки можно выделить, например, из эмбриональной печени, костного мозга, пуповинной крови.
«Эмбриональные стволовые клетки» или «ЭС клетки» или «ЭСК» относятся к недифференцированным эмбриональным стволовым клеткам, которые способны интегрироваться и становиться частью зародышевой линии развивающегося эмбриона. Эмбриональные стволовые клетки способны дифференцироваться в гемопоэтические клетки-предшественники и любую ткань или орган. Эмбриональные стволовые клетки, которые подходят для применения согласно настоящей заявке, включают клетки из линии ЭС клеток J1, линии ЭС клеток 129J, линии стволовых клеток мыши D3 (American Туре Culture Collection (Американская коллекция типовых культур)), линии клеток R1 или Е14K, полученные от мышей линии 129/Sv, линии клеток, полученные от мышей линий Balb/c и С57Вl/6, и эмбриональные стволовые клетки человека (например, от Научно-исследовательского института WiCell, Висконсин; или ES cell International, Мельбурн, Австралия).
Используемая в настоящей заявке «клетка иммунной системы» означает любую клетку иммунной системы, происходящую от гемопоэтической стволовой клетки в костном мозге, которая дает начало двум основным линиям дифференцировки, миелоидная клетка-предшественник (которая дает начало миелоидным клеткам, таким как моноциты, макрофаги, дендритные клетки, мегакариоциты и гранулоциты) и лимфоидная клетка-предшественник (которая дает начало лимфоидным клеткам, таким как Т-клетки, В-клетки и клетки-естественные киллеры (NK-клетки)). Примеры клеток иммунной системы включают CD4+ Т-клетки, CD8+ Т-клетки, CD4- CD8- двойные негативные Т-клетки, γδ Т-клетки, регуляторные Т-клетки, клетки-естественные киллеры и дендритные клетки. Макрофаги и дендритные клетки могут также называться «антигенпрезентирующими клетками» или «АПК», которые представляют собой специализированные клетки, которые могут активировать Т-клетки, когда рецептор главного комплекса гистосовместимости (МНС) на поверхности АПК взаимодействует с Т-клеточным рецептором (TCR) на поверхности Т-клетки. Альтернативно, любая гемопоэтическая стволовая клетка или клетка иммунной системы может быть преобразована в АПК путем введения молекулы нуклеиновой кислоты, которая экспрессирует антиген, распознаваемый TCR или любым другим антигенсвязывающим белком (например, CAR).
Используемый в настоящей заявке термин «хозяин» относится к клетке (например, Т-клетке, гемопоэтической клетке-предшественнику) или микроорганизму, являющемуся мишенью для генетической модификации гетерологичной или экзогенной молекулой нуклеиновой кислоты с получением интересующего полипептида (например, специфичного к опухолевому антигену CAR). В определенных вариантах реализации клетка-хозяин необязательно может уже содержать или быть модифицированной для включения других генетических модификаций, которые придают требуемые свойства, связанные или несвязанные с биосинтезом гетерологичного или экзогенного белка (например, включение детектируемой метки; удаление, изменение или усечение CD34; повышенная экспрессия костимулирующего фактора). В определенных вариантах реализации клетка-хозяин представляет собой гемопоэтическую клетку-предшественника человека, трансдуцированную гетерологичной или экзогенной молекулой нуклеиновой кислоты, кодирующей антиген, связанный с заболеванием и специфично связываемый антигенсвязывающим белком (например, CAR).
«Т-клетка» представляет собой клетку иммунной системы, которая созревает в тимусе и вырабатывает Т-клеточные рецепторы (TCR). Т-клетки могут представлять собой наивные клетки (не контактировавшие с антигеном; повышенная экспрессия CD62L, CCR7, CD28, CD3, CD127 и CD45RA и сниженная экспрессия CD45RO по сравнению с ТСМ), Т-клетки памяти (ТМ) (контактировавшие с антигеном и долгоживущие) и эффекторные клетки (контактировавшие с антигеном, цитотоксические). ТМ можно дальше подразделить на субпопуляции Т-клеток центральной памяти (ТСМ, повышенная экспрессия CD62L, CCR7, CD28, CD127, CD45RO и CD95 и пониженная экспрессия CD54RA по сравнению с наивными Т-клетками) и Т-клетки эффекторной памяти (ТЕМ, сниженная экспрессия CD62L, CCR7, CD28, CD45RA и повышенная экспрессия CD127 по сравнению с наивными Т-клетками или ТСМ). Эффекторные Т-клетки (ТЕ) относятся к контактировавшим с антигеном CD8+ цитотоксическим Т-лимфоцитам, которые имеют пониженную экспрессию CD62L, CCR7, CD28 и являются положительными по гранзиму и перфорину по сравнению с ТСМ.
«Связывающий компонент» (также называемый «связывающая область» или «связывающий фрагмент»), используемый в настоящей заявке, относится к пептиду, олигопептиду, полипептиду или белку, который обладает способностью специфично и нековалентно ассоциировать, объединяться или комбинироваться с целевой молекулой (например, CD19, CD20, EGFRvIII, GD2, MUC16, ROR1, мезотелином, PD-L1, PD-L2, простатическим специфическим мембранным антигеном (PSMA), связанным с раком неоантигеном). Связывающий домен включает любого встречающегося в природе, синтетического, полусинтетического или полученного рекомбинантным путем связывающего партнера для биологической молекулы, молекулярного комплекса (то есть комплекса, содержащего две или более биологические молекулы) или для другой мишени, представляющей интерес. Примеры связывающих доменов включают одноцепочечные иммуноглобулиновые вариабельные области (например, одноцепочечный TCR (scTCR), одноцепочечный Fv-фрагмент (scFv)), эктодомены рецепторов, лиганды (например, цитокины, хемокины) или синтетические полипептиды, выбранные за специфическую способность связываться с биологической молекулой, молекулярным комплексом или другой мишенью, представляющей интерес.
Используемый в настоящей заявке термин «специфично связывает» или «специфичный к» относится к ассоциации или объединению связывающего белка (например, CAR или TCR) или связывающего компонента (или его слитого белка) с целевой молекулой с аффинностью или Ka (то есть константой равновесия ассоциации конкретного связывающего взаимодействия с единицей измерения 1/М), равной или выше 105 М-1 (что равно отношению скорости ассоциации [kon] к скорости диссоциации [koff] для данной реакции ассоциации), вместе с тем по существу не ассоциируя или не объединяясь с любыми другими молекулами или компонентами в образце. Связывающие белки или связывающие домены (или их слитые белки) можно классифицировать как «высокоаффинные» связывающие белки или связывающие домены (или их слитые белки) или как «низкоаффинные» связывающие белки или связывающие домены (или их слитые белки). «Высокоаффинными» связывающими белками или связывающими доменами называются те связывающие белки или связывающие домены, имеющие Ka, равную по меньшей мере 107 М-1, по меньшей мере 108 М-1, по меньшей мере 109 М-1, по меньшей мере 1010 М-1, по меньшей мере 1011 М-1, по меньшей мере 1012 М-1, или по меньшей мере 1013 М-1. «Низкоаффинными» связывающими белками или связывающими доменами называются те связывающие белки или связывающие домены, имеющие Ka не более 107 М-1, не более 106 М-1, не более 105 М-1. Альтернативно, аффинность может быть определена как равновесная константа диссоциации (Kd) конкретного связывающего взаимодействия с единицей измерения М (например, 10-5 М до 10-13 М).
Известно множество различных анализов для идентификации связывающих доменов согласно настоящему изобретению, которые специфично связывают конкретную мишень, а также определения аффинностей связывающего домена или слитого белка, таких как вестерн-блотинг, твердофазный иммуноферментный анализ (ELISA), аналитическое ультрацентрифугирование, спектроскопия и анализ поверхностного плазмонного резонанса (Biacore®) (см., например, Scatchard et al., Ann. N.Y. Acad. Sci. 51:660, 1949; Wilson, Science 295:2103, 2002; Wolff et al., Cancer Res. 53:2560, 1993; и патенты США №№5283173, 5468614 или эквивалент).
Используемый в настоящей заявке термин «шарнирная область» или «шарнир» относится к (а) иммуноглобулиновой шарнирной последовательности (состоящей, например, из верхней и коровой областей) или ее функциональному варианту, (b) междоменной области («стеблю») лектина С-типа II группы или ее функциональному варианту или к (с) области «стебля» молекулы кластера дифференцировки (CD) или ее функциональному варианту. Используемый в настоящей заявке термин «иммуноглобулиновая шарнирная область дикого типа» относится к встречающимся в природе верхней и средней шарнирным аминокислотным последовательностям, расположенным между и соединяющим домены СН1 и СН2 (для IgG, IgA и IgD) или расположенные между и соединяющие домены СН1 и СН3 (для IgE и IgM), обнаруживаемые в тяжелой цепи антитела. В определенных вариантах реализации шарнирная область принадлежит человеку, а в конкретных вариантах реализации включает шарнирную область IgG человека.
Термин «гидрофобная часть», используемый в настоящей заявке, означает любую аминокислотную последовательность, имеющую трехмерную структуру, которая является термодинамически стабильной в клеточной мембране, и в общем случае ее длина находится в диапазоне от приблизительно 15 аминокислот до приблизительно 30 аминокислот. Структура гидрофобного домена может содержать альфа-спираль, бета-бочку, бета-лист, бета-спираль или любую их комбинацию.
Используемый в настоящей заявке «эффекторный компонент» или «эффекторный домен» представляет собой внутриклеточную часть слитого белка или рецептора, которая может напрямую или косвенно стимулировать биологический или физиологический ответ в клетке при получении подходящего сигнала. В определенных вариантах реализации эффекторный компонент представляет собой часть белка, слитого белка или белкового комплекса, который получает сигнал при связывании или он напрямую связывается с целевой молекулой, что запускает сигнал от эффекторного домена. Эффекторный домен может напрямую стимулировать клеточный ответ, когда он содержит один или более сигнальных доменов или мотивов, таких как иммунорецепторный тирозиновый активирующий мотив (ITAM). В других вариантах реализации эффекторный компонент будет косвенно стимулировать клеточный ответ путем ассоциации с одним или более другими белками, которые напрямую стимулируют клеточный ответ.
Термин «линкер» относится к аминокислотной последовательности, которая соединяет два белка, полипептида, пептида, домена, области или мотива и может обеспечивать спейсерную функцию, совместимую с взаимодействием двух суб-связывающих доменов, так что конечный полипептид сохраняет специфическую связывающую аффинность (например, scTCR) по отношению к целевой молекуле или сохраняет сигнальную активность (например, комплекс TCR). В определенных вариантах реализации линкер состоит из приблизительно двух до приблизительно 35 аминокислот, например, или из приблизительно четырех до приблизительно 20 аминокислот, или из приблизительно восьми до приблизительно 15 аминокислот, или из приблизительно 15 до приблизительно 25 аминокислот. В дополнительных вариантах реализации линкер представляет собой линкер вариабельной области, который соединяет иммуноглобулиновую вариабельную область тяжелой цепи с иммуноглобулиновой вариабельной областью легкой цепи, или связывает цепи Vα/β и Сα/β Т-клеточного рецептора (например, Vα-Cα, Vβ-Cβ, Vα-Vβ) или связывает каждую пару Vα-Cα, Vβ-Cβ, Vα-Vβ с шарниром или гидрофобным доменом.
Термин «аминокислоты области стыка» или «аминокислотные остатки области стыка» относится к одной или более (например, приблизительно 2-10) аминокислотным остаткам между двумя соседними мотивами, областями или доменами полипептида, например, между связывающим доменом и соседним константным доменом или между цепью TCR и соседним саморасщепляющимся пептидом. Аминокислоты области стыка могут быть обусловлены дизайном конструкции слитого белка (например, аминокислотные остатки являющиеся результатом использования сайта рестриктазы в ходе конструирования молекулы нуклеиновой кислоты, кодирующей слитый белок).
Термин «измененный компонент», или «измененный домен», или «измененный белок» относится к мотиву, области, домену, пептиду, полипептиду или белку с последовательностью, идентичной мотиву, области, домену, пептиду, полипептиду или белку дикого типа (например, внутриклеточным доменам CD3ζ, CD134, CD137 дикого типа) по меньшей мере на 85% (например, на 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%).
Используемый в настоящей заявке «антиген», кодируемый молекулой нуклеиновой кислоты, содержащейся в модифицированных гемопоэтических клетках-предшественниках человека, модифицированных клетках иммунной системы человека или их комбинации, относится к любой биологической молекуле (например, белку, углеводу), который связан с заболеванием или нарушением (например, раком) и является мишенью для иммунотерапии. В определенных вариантах реализации антиген может представлять собой антиидиотипическое антитело или его связывающий фрагмент антиидиотипического антитела или антитело или его связывающий фрагмент антитела, специфичный к антигенсвязывающему белку (например, CAR), экспрессируемому модифицированной Т-клеткой. Примеры антигенов включают α-фетопротеин (AFP), В7Н4, BTLA, CD3, CD19, CD20, CD25, CD22, CD28, CD30, CD40, CD44v6, CD52, CD56, CD79b, CD80, CD81, CD86, CD134 (ОХ40), CD137 (4-1ВВ), CD151, CD276, СА125, СЕА, СЕАСАМ6, c-Met, СТ-7, CTLA-4, EGFR, EGFRvIII, ErbB2, ErbB3, ErbB4, EphA2, FLT1, FLT4, Frizzled, O-ацетил-GD2, GD2, GHRHR, GHR, GITR, gp130, HVEM, IGF1R, IL6R, KDR, L1CAM, Lewis A, Lewis Y, LTβR, LIFRβ, LRP5, MAGE, мезотелин, MUC1, NY-ESO-1, специфический для рака неоантиген, OSMRβ, PD1, PD-L1, PD-L2, PSMA, PTCH1, RANK, Robo1, ROR1, TERT, TGFBR2, TGFBR1, TLR7, TLR9, TNFRSF4, TNFR1, TNFR2, тирозиназу, TWEAK-R или WT-1.
Термин «Т-клеточный рецептор» (TCR) относится к члену суперсемейства иммуноглобулинов (имея вариабельный связывающий домен, константный домен, трансмембранную область и короткий цитоплазматический хвост; см., например, Janeway et al, Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997), способному специфично связываться с антигенным пептидом, который связан с рецептором МНС. TCR может встречаться на поверхности клетки или в растворимой форме, и он в общем случае состоит из гетеродимера, имеющего цепи α и β (также известные как TCRα и TCRβ соответственно) или цепи γ и δ (также известные как TCRγ и TCRδ соответственно). Подобно иммуноглобулинам внеклеточная часть цепей TCR (например, α-цепи, β-цепи) содержит два иммуноглобулиновых домена, вариабельный домен (например, вариабельный домен α-цепи или Vα вариабельный домен β-цепи или Vβ; как правило, это аминокислоты 1-116 согласно нумерации Кабата, Kabat et al., "Sequences of Proteins of Immunological Interest, US Dept. Health and Human Services, Public Health Service National Institutes of Health, 1991, 5th ed.) на N-конце и один константный домен (например, константный домен α-цепи или Сα, как правило, это аминокислоты 117-259 согласно нумерации Кабата, константный домен β-цепи или Сβ, как правило, это аминокислоты 117-295 согласно нумерации Кабата), примыкающий к клеточной мембране. Также подобно иммуноглобулинам вариабельные домены содержат определяющие комплементарность участки (CDR), разделенные каркасными участками (FR) (см., например, Jores et al., Proc. Nat'l Acad. Sci. U.S.A. 87:9138, 1990; Chothia et al., EMBO J. 7:3745, 1988; см. также Lefranc et al., Dev. Comp. Immunol. 27:55, 2003). В определенных вариантах реализации TCR встречается на поверхности Т-клеток (или Т-лимфоцитов), и рецептор ассоциирован с комплексом CD3. Источником TCR, используемого в настоящем изобретении, может быть любой вид животных, например, человек, мышь, крыса, кролик или другое млекопитающее.
«CD3» известен в данной области техники как мультибелковый комплекс из шести цепей (см. Abbas and Lichtman, 2003; Janeway et al., p172 and 178, 1999). У млекопитающих комплекс содержит CD3γ-цепь, CD3δ-цепь, две CD3ε-цепи и гомодимер CD3ζ-цепи. Цепи CD3γ, CD3δ и CD3ε являются белками клеточной поверхности с высокой степенью родства, относящиеся к суперсемейству иммуноглобулинов, содержащие один иммуноглобулиновый домен. Трансмембранные области цепей CD3γ, CD3δ и CD3ε отрицательно заряжены, свойство, которое позволяет этим цепям ассоциировать с положительно заряженными цепями Т-клеточного рецептора. Внутриклеточные хвосты каждой из цепей CD3γ, CD3δ и CD3ε содержат один консервативный мотив, известный как иммунорецепторный тирозиновый активирующий мотив или ITAM, тогда как каждая CD3ζ-цепь содержит три мотива. Не желая ограничиваться теорией, полагают, что мотивы ITAM являются важными для сигнальной пропускной способности комплекса TCR. CD3, используемый в настоящем изобретении, может быть от различных видов животных, включая человека, мышь, крысу или других млекопитающих.
Используемый в настоящей заявке термин «комплекс TCR» относится к комплексу, образованному ассоциацией CD3 с TCR. Например, комплекс TCR может состоять из CD3γ-цепи, CD3δ-цепи, двух CD3ε-цепей, гомодимера CD3ζ-цепей, TCRα-цепи и TCRβ-цепи. Альтернативно, комплекс TCR может состоять из CD3γ-цепи, CD3δ-цепи, двух CD3ε-цепей, гомодимера CD3ζ-цепей, TCRγ-цепи и TCRδ-цепи.
Термин «компонент комплекса TCR», используемый в настоящей заявке, относится к цепи TCR (то есть цепи TCRα, TCRβ, TCRγ или TCRδ), цепи CD3 (то есть цепи CD3γ, CD3δ, CD3ε или CD3ζ) или к комплексу, образованному двумя или более цепями TCR или цепями CD3 (например, комплексу из цепей TCRα и TCRβ, комплексу из цепей TCRγ и TCRδ, комплексу из цепей CD3ε и CD3δ, комплексу из цепей CD3γ и CD3ε или субкомплексу TCR из цепей TCRα, TCRβ, CD3γ, CD3δ и двух CD3ε-цепей).
Используемый в настоящей заявке термин «нуклеиновая кислота» или «молекула нуклеиновой кислоты» относится к любой дезоксирибонуклеиновой кислоте (ДНК), рибонуклеиновой кислоте (РНК), олигонуклеотидам, фрагментам, полученным, например, путем полимеразной цепной реакции (ПЦР) или путем трансляции in vitro, и фрагментам, полученным посредством любого из следующих процессов: лигирования, разрезания, действия эндонуклеазы или действия экзонуклеазы. В определенных вариантах реализации нуклеиновые кислоты согласно настоящему изобретению получают посредством ПЦР. Нуклеиновые кислоты могут состоять из мономеров, которые представляют собой встречающиеся в природе нуклеотиды (такие как дезоксирибонуклеотиды и рибонуклеотиды), аналоги встречающихся в природе нуклеотидов (например, α-энантиомерные формы встречающихся в природе нуклеотидов) или их комбинацию. Модифицированные нуклеотиды могут иметь модификации в или содержать замену остатков сахаров или остатков пиримидинового или пуринового основания. Мономеры нуклеиновой кислоты могут быть связаны фосфодиэфирными связями или аналогами подобных связей. Аналоги фосфодиэфирных связей включают тиофосфатные, дитиофосфатные, фосфорселеноатные, фосфордиселеноатные, фосфоранилотиоатные, фосфоранилидатные, фосфорамидатные и подобные связи. Молекулы нуклеиновой кислоты могут быть как одноцепочечными, так и двухцепочечными.
Термин «выделенный» означает, что материал удален из своего первоначального окружения (например, природного окружения, если это встречающийся в природе материал). Например, встречающаяся в природе нуклеиновая кислота или полипептид, присутствующий у живого животного не является выделенным, но та же самая нуклеиновая кислота или полипептид, отделенный от нескольких или всех существующих совместно с ним материалов в природной системе, является выделенным. Такая нуклеиновая кислота может быть частью вектора и/или такая нуклеиновая кислота или полипептид может быть частью композиции (например, клеточного лизата) и все также являться выделенным, в том отношении, что такой вектор или композиция не являются частью природного окружения для этой нуклеиновой кислоты или полипептида. Термин «ген» означает сегмент ДНК, участвующий в получении полипептидной цепи; он включает области, расположенные перед и после кодирующей области, «лидерную и хвостовую», а также вставочные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
Используемый в настоящей заявке термин «рекомбинантный» относится к клетке, микроорганизму, молекуле нуклеиновой кислоты или вектору, который был модифицирован путем введения молекулы экзогенной нуклеиновой кислоты, или относится к клетке или микроорганизму, который был изменен, так что экспрессия молекулы эндогенной нуклеиновой кислоты или гена является контролируемой, дерегулируемой или конститутивной, где подобные изменения или модификации можно ввести с помощью генной инженерии. Генетические изменения могут включать, например, модификации, вводящие молекулы нуклеиновой кислоты (которые могут включать элемент контроля экспрессии, такой как промотор), кодирующие один или более белков или ферментов, или другие добавления, делеции, замены в молекуле нуклеиновой кислоты, или другие функциональные нарушения или добавления к генетическому материалу клетки. Примеры модификаций включают модификации в кодирующих областях или их функциональных фрагментах гетерологичных или гомологичных полипептидов от референтной или первоначальной молекулы.
Используемый в настоящей заявке термин «мутация» относится к изменению в последовательности молекулы нуклеиновой кислоты или молекулы полипептида по сравнению с референтной молекулой нуклеиновой кислоты или молекулой полипептида дикого типа соответственно. Мутация может приводить к нескольким различным типам изменений в последовательности, включая замену, вставку или делецию нуклеотида(нуклеотидов) или аминокислоты(аминокислот). В определенных вариантах реализации мутация представляет собой замену одного или трех кодонов или аминокислот, делецию одного до приблизительно 5 кодонов или аминокислот или комбинацию перечисленного.
«Консервативная замена» понимается в данной области техники как замена одной аминокислоты на другую аминокислоту, которая имеет схожие свойства. Примеры консервативных замен хорошо известны в данной области техники (см., например, WO 97/09433 на стр. 10; Lehninger, Biochemistry, 2nd Edition; Worth Publishers, Inc. NY, NY, pp. 71-77, 1975; Lewin, Genes IV, Oxford University Press, NY and Cell Press, Cambridge, MA, p. 8, 1990).
Термин «конструкция» относится к любому полинуклеотиду, который содержит рекомбинантную нуклеиновую кислоту. Конструкция может присутствовать в векторе (например, бактериальном векторе, вирусном векторе) или может быть встроена в геном. «Вектор» представляет собой молекулу нуклеиновой кислоты, которая способна переносить другую нуклеиновую кислоту. Векторы могут представлять собой, например, плазмиды, космиды, вирусы, РНК-вектор или молекулу линейной или кольцевой ДНК или РНК, которая может включать хромосомные, нехромосомные, полусинтетические или синтетические нуклеиновые кислоты. Примеры векторов представляют собой векторы, способные к автономной репликации (эписомальный вектор) или экспрессии нуклеиновых кислот, с которыми они связаны (экспрессионные векторы).
Вирусные векторы включают ретровирус, аденовирус, парвовирус (например, аденоассоциированные вирусы), коронавирус, вирусы с отрицательной цепью РНК, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства или вирус везикулярного стоматита), парамиксовирус (например, корь и вирус Сендай), вирусы с положительной цепью РНК, такие как пикорнавирус и альфавирус, и вирусы с двухцепочечной ДНК, включая аденовирус, вирус герпеса (например, вирус простого герпеса типа 1 и 2, вирус Эпштейна-Барра, цитомегаловирус) и поксвирус (например, осповакцина, оспа домашней птицы и канарипокс). Другие вирусы включают, например, норовирус, тогавирус, флавивирус, реовирусы, паповавирус, гепаднавирус и вирус гепатита. Примеры ретровирусов включают вирус лейкоза-саркомы птиц, вирусы млекопитающих С-типа, В-типа, D-типа, группу HTLV-BLV (вирус Т-клеточного лейкоза человека/вирус коровьего лейкоза), лентивирус, спумавирус (Coffin, J.М., Retroviridae: The viruses and their replication, In Fundamental Virology, Third Edition, B.N. Fields et al., Eds., Lippincott-Raven Publishers, Philadelphia, 1996).
Термин «лентивирусный вектор», используемый в настоящей заявке, означает лентивирусные векторы на основе вируса иммунодефицита человека (ВИЧ) для доставки генов, которые могут быть интегративными или неинтегративными, иметь относительно большую емкость для упаковки и могут трансдуцировать ряд различных типов клеток. Лентивирусные векторы, как правило, получают после транзиентной трансфекции трех (отвечающих за упаковку, оболочку и перенос) или более плазмид в клетки-продуценты. Подобно ВИЧ лентивирусные векторы попадают в клетку-мишень посредством взаимодействия гликопротеинов вирусной поверхности с рецепторами на поверхности клетки. При входе вирусная РНК подвергается обратной транскрипции, которая опосредуется комплексом обратной транскриптазы вируса. Продукт обратной транскрипции представляет собой двухцепочечную линейную вирусную ДНК, которая является субстратом для вирусной интеграции в ДНК инфицированных клеток.
Термин «функционально связанный» относится к ассоциации двух или более молекул нуклеиновой кислоты на одном фрагменте нуклеиновой кислоты, так что функция одной молекулы находится под влиянием другой. Например, промотор функционально связан с кодирующей последовательностью, когда он способен влиять на экспрессию этой кодирующей последовательности (то есть кодирующая последовательность находиться под транскрипционным контролем промотора). «Несвязанный» означает, что ассоциированные генетические элементы не ассоциируют тесно друг с другом и функция одного не влияет на другого.
Используемый в настоящей заявке термин «экспрессионный вектор» относится к ДНК-конструкции, содержащей молекулу нуклеиновой кислоты, которая функционально связана с подходящей контрольной последовательностью, способной воздействовать на экспрессию молекулы нуклеиновой кислоты у подходящего хозяина. Такие контрольные последовательности включают промотор для воздействия на транскрипцию, необязательную операторную последовательность для контроля такой транскрипции, последовательность, кодирующую подходящие сайты связывания рибосомы с мРНК, и последовательности, которые контролируют терминацию транскрипции и трансляцию. Вектор может представлять собой плазмиду, фаговую частицу, вирус или просто потенциальную геномную вставку. После переноса внутрь подходящего хозяина вектор может реплицировать и функционировать независимо от генома хозяина или может в некоторых случаях сам интегрироваться в геном. В настоящем описании «плазмида», «экспрессионная плазмида», «вирус» и «вектор» часто используются взаимозаменяемо.
Термин «экспрессия», используемый в настоящей заявке, относится к процессу, посредством которого получается полипептид на основе последовательности нуклеиновой кислоты гена. Процесс включает как транскрипцию, так и трансляцию.
Термин «введенный» в контексте вставки последовательности нуклеиновой кислоты в клетку означает «трансфекцию», или «трансформацию», или «трансдукцию» и включает ссылку на включение последовательности нуклеиновой кислоты в эукариотическую или прокариотическую клетку, при этом молекула нуклеиновой кислоты может быть включена в геном клетки (например, хромосому, плазмиду, пластиду или митохондриальную ДНК), превращена в автономный репликон или транзиентно экспрессирована (например, трансфицированная РНК).
Используемая в настоящей заявке «гетерологичная» или «экзогенная» молекула нуклеиновой кислоты, конструкция или последовательность относится к молекуле нуклеиновой кислоты или части молекулы нуклеиновой кислоты, которая не является нативной для клетки-хозяина, но может быть гомологична молекуле нуклеиновой кислоты или части молекулы нуклеиновой кислоты из клетки-хозяина. Источник гетерологичной или экзогенной молекулы нуклеиновой кислоты, конструкции или последовательности может быть из различных родов или видов. В определенных вариантах реализации гетерологичную или экзогенную молекулу нуклеиновой кислоты добавляют (то есть не являющуюся эндогенной или нативной) к клетке-хозяину или геному хозяина с помощью, например, конъюгации, трансформации, трансфекции, электропорации или тому подобного, при этом добавленная молекула может интегрироваться в геном хозяина или существовать в виде внехромосомного генетического материала (например, в виде плазмиды или другой формы самореплицирующегося вектора) и может быть представлена множеством копий. Дополнительно, «гетерологичный» относится к ненативному ферменту, белку или другой активности, кодируемой экзогенной молекулой нуклеиновой кислоты, введенной в клетку-хозяина, даже если клетка-хозяин кодирует гомологичный белок или активность.
Как описано в настоящей заявке, в клетку-хозяина можно ввести более одной гетерологичной или экзогенной молекулы нуклеиновой кислоты в виде отдельных молекул нуклеиновых кислот, в виде множества индивидуально контролируемых генов, в виде полицистронной молекулы нуклеиновой кислоты, в виде отдельной молекулы нуклеиновой кислоты, кодирующей слитый белок, или в виде любой комбинации перечисленного. Например, как описано в настоящей заявке, клетку-хозяина можно модифицировать для экспрессии двух или более гетерологичных или экзогенных молекул нуклеиновых кислот, кодирующих требуемые антигенспецифичные связывающие белки (например, CAR, TCRα и TCRβ). Когда две или более экзогенных молекул нуклеиновых кислот вводят в клетку-хозяина, понятно, что две или более экзогенные молекулы нуклеиновых кислот можно ввести в виде одной молекулы нуклеиновой кислоты (например, в составе одного вектора), в составе разных векторов, встраиваемых в хромосому хозяина на одном сайте или на множестве сайтов. Количество указанных гетерологичных молекул нуклеиновых кислот или белковых активностей отражает количество кодирующих молекул нуклеиновых кислот или количество белковых активностей, но не количество отдельных молекул нуклеиновых кислот, введенных в клетку-хозяина.
Используемый в настоящей заявке термин «эндогенный» или «нативный» относится к гену, белку или активности, которая в норме присутствует в клетке-хозяине. Кроме того, ген, белок или активность, которая является мутировавшей, сверхэкспрессируемой, «перетасованной», дуплицированной или измененной иным способом по сравнению с первичным геном, белком или активностью, все также считается эндогенной или нативной для этой конкретной клетки-хозяина. Например, эндогенную контрольную последовательность от первого гена (например, промотор, последовательности аттенуации трансляции) можно использовать для изменения или регулирования экспрессии второго нативного гена или молекулы нуклеиновой кислоты, при этом экспрессия или регуляция второго нативного гена или молекулы нуклеиновой кислоты отличается от нормальной экспрессии или регуляции в первичной клетке.
Термин «гомологичный» или «гомолог» относится к молекуле или активности, обнаруживаемой в или происходящей из клетки, вида или штамма хозяина. Например, гетерологичная или экзогенная молекула нуклеиновой кислоты может быть гомологичной нативному гену клетки-хозяина и необязательно может иметь измененный уровень экспрессии, другую последовательность, измененную активность или любую комбинацию перечисленного.
Термин «идентичность последовательностей», используемый в настоящей заявке, относится к проценту аминокислотных остатков в одной последовательности, которые являются идентичными аминокислотным остаткам в другой референтной полипептидной последовательности после выравнивания последовательностей и введения гэпов при необходимости для достижения максимального процента идентичности последовательностей, и не рассматривая никакие консервативные замены как часть идентичности последовательности. Значения идентичности последовательностей в процентах можно получить с использованием программного обеспечения BLAST2.0 Национального центра биотехнологической информации (NCBI), как описано Altschul et al. (1997) "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25:3389-3402, с установленными по умолчанию параметрами.
Используемый в настоящей заявке термин «гиперпролиферативное заболевание» относится к чрезмерному росту или пролиферации по сравнению с нормальной или небольной клеткой. Примеры гиперпролиферативных нарушений включают опухоли, раковые заболевания, неопластическую ткань, карциному, предраковые клетки, а также неопухолевые или доброкачественные гиперпролиферативные заболевания (например, аденома, фиброма, липома, лейомиома, гемангиома, рестеноз, а также аутоиммунные заболевания, такие как ревматоидный артрит, остеоартрит, псориаз, воспалительное заболевание кишечника или тому подобное).
Модифицированные клетки, экспрессирующие антигенсвязывающий белок или антиген
В определенных аспектах согласно настоящему изобретению предложена композиция адоптивной клеточной иммунотерапии, содержащая популяцию модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или их комбинацию, где первая популяция модифицированных клеток представляет собой Т-клетки, содержащие молекулу нуклеиновой кислоты, которая кодирует антигенсвязывающий белок (например, CAR), а вторая популяция представляет собой модифицированные клетки, содержащие молекулу нуклеиновой кислоты, которая кодирует антиген (например, специфический для рака антиген, антиидиотипическое антитело или его связывающий фрагмент). В этих вариантах реализации антигенсвязывающий белок содержит гидрофобную часть, расположенную между внеклеточным связывающим компонентом и внутриклеточным эффекторным компонентом, и внеклеточный связывающий компонент является специфичным к антигену, кодируемому второй популяцией модифицированных клеток. Например, антигенсвязывающий белок может представлять собой Т-клеточный рецептор (TCR) или химерный антигенный рецептор.
Преимущество данных композиций состоит в том, что, например, пациенту можно вводить меньшую дозу антигенспецифичных CAR Т-клеток, а затем введение (например, одновременное или последовательное) второй популяции клеток, экспрессирующих антиген, распознаваемый CAR, будет приводить к бустингу действия адоптивной иммунотерапии. Другое преимущество состоит в том, что эффект бустинга может также улучшить хоуминг, так что клетки мигрируют к ткани, представляющей интерес. Еще одно преимущество комбинации CAR-экспрессирующих Т-клетки и искусственных АПК состоит в том, чтобы систематически осуществлять бустинг действия адоптивной иммунотерапии для получения большего количества активных клеток на месте опухоли.
В других определенных аспектах модифицированную гемопоэтическую клетку-предшественника, содержащую молекулу нуклеиновой кислоты, которая кодирует антиген, вводят субъекту, при этом кодируемый антиген находится под контролем регулируемого промотора. Модифицированная гемопоэтическая клетка-предшественник будет локализоваться в интересующей ткани и реплицироваться (например, в костном мозге или лимфатических узлах). После этого экспрессию антигена в размножившихся модифицированных гемопоэтических клетках-предшественниках можно индуцировать одновременно с помощью или сразу после того, как субъекту введут первую популяцию модифицированных Т-клеток, содержащих молекулу нуклеиновой кислоты, которая кодирует антигенсвязывающий белок (например, CAR), при этом количество введенных «АПК» значительно выше, чем было бы доступно посредством размножения ex vivo и введения. В определенных вариантах реализации вводимая вторая популяция клеток является облученной перед введением.
В любом из упомянутых выше вариантов реализации антигенсвязывающий белок содержит связывающий компонент, гидрофобную часть и внутриклеточный эффекторный компонент. Например, связывающий компонент может представлять собой вариабельный фрагмент антитела (Fv), вариабельный домен TCR, эктодомен рецептора или лиганд. В дополнительных вариантах реализации связывающий компонент представляет собой scFv или scTCR, содержащий линкер вариабельной области, например, линкер содержит (GlyxSery)n, где х и у независимо представляют собой целые числа от 1 до 5, и n - целое число от 1 до 10. В дополнительных вариантах реализации связывающий компонент является специфичным к α-фетопротеину (AFP), В7Н4, BTLA, CD3, CD19, CD20, CD25, CD22, CD28, CD30, CD40, CD44v6, CD52, CD56, CD79b, CD80, CD81, CD86, CD134 (OX40), CD137 (4-1BB), CD151, CD276, CA125, CEA, CEACAM6, c-Met, CT-7, CTLA-4, EGFR, EGFRvIII, ErbB2, ErbB3, ErbB4, EphA2, FLT1, FLT4, Frizzled, O-ацетил-GD2, GD2, GHRHR, GHR, GITR, gp130, HVEM, IGF1R, IL6R, KDR, L1CAM, Lewis A, Lewis Y, LTβR, LIFRβ, LRP5, MAGE, мезотелину, MUC1, NY-ESO-1, специфическому для рака неоантигену, OSMRβ, PD1, PD-L1, PD-L2, PSMA, PTCH1, RANK, Robo1, ROR1, TERT, TGFBR2, TGFBR1, TLR7, TLR9, TNFRSF4, TNFR1, TNFR2, тирозиназе, TWEAK-R или WT-1.
В еще одних дополнительных вариантах реализации гидрофобная часть представляет собой трансмембранный домен, такой как трансмембранный домен CD4, CD8, CD28 или CD27.
В определенных вариантах реализации внутриклеточный эффекторный компонент содержит внутриклеточную область CD3ε, CD3δ, CD3ζ, CD25, CD27, CD28, CD79A, CD79B, CD134, CD137, CARD11, DAP10, FcRα, FcRβ, FcRγ, Fyn, HVEM, ICOS, Lck, LAG3, LAT, LRP, NKG2D, NOTCH1, NOTCH2, NOTCH3, NOTCH4, ROR2, Ryk, SLAMF1, Slp76, pTα, TCRα, TCRβ, TRIM, Zap70, PTCH2 или любую их комбинацию. В конкретных вариантах реализации внутриклеточный эффекторный компонент содержит CD3ζ и один или более из CD27, CD28, CD134 и CD137, или внутриклеточный эффекторный компонент содержит LRP, NOTCH1, NOTCH2, NOTCH3, NOTCH4, ROR2 или Ryk.
В любом из упомянутых выше вариантов реализации модифицированная клетка представляет собой клетку иммунной системы, такую как CD4+ Т-клетку, CD8+ Т-клетку, CD4- CD8-двойную негативную Т-клетку, γδ Т-клетку, регуляторную Т-клетку, клетку-естественного киллера, дендритную клетку или любую их комбинацию. В определенных вариантах реализации Т-клетка представляет собой наивную Т-клетку, Т-клетку центральной памяти, Т-клетку эффекторной памяти или любую их комбинацию. Например, первая популяция модифицированных Т-клеток может состоять по существу из CD4+ Т-клеток, CD8+ Т-клеток или из CD4+ и CD8+ Т-клеток, а вторая популяция модифицированных клеток содержит модифицированные гемопоэтические клетки-предшественники человека. В других примерах, первая популяция Т-клеток может состоять по существу из CD4+ Т-клеток, CD8+ Т-клеток или из CD4+ и CD8+ Т-клеток, а вторая популяция модифицированных клеток содержит модифицированные клетки иммунной системы человека, такие как клетки, состоящие по существу из CD4+ Т-клеток, CD8+ Т-клеток или из CD4+ и CD8+ Т-клеток.
В любом из упомянутых выше вариантах реализации популяции модифицированных клеток являются рекомбинантно модифицированными ex vivo с использованием, например, вирусного вектора, такого как лентивирусный вектор или γ-ретровирусного вектора. В дополнительных вариантах реализации модифицируемые популяции клеток представляют собой изогенные, аллогенные или аутологические клетки. В любом из упомянутых выше вариантов реализации популяции модифицированных клеток дополнительно находятся в составе с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом, как описано в настоящей заявке.
Множество различных критериев, известных специалистам в данной области техники, указывает на то, является ли аминокислота, замененная в конкретном положении в пептиде или полипептиде, консервативной (или аналогичной). Например, аналогичная аминокислотная или консервативная аминокислотная замена представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим аналогичную боковую цепь. Аналогичные аминокислоты можно разделить на следующие категории: аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин); аминокислоты с кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота); аминокислоты с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, гистидин); аминокислоты с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан); аминокислоты с бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и аминокислоты с ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан). Пролин, который считается более сложным для классификации, имеет общие свойства с аминокислотами, которые имеют алифатические боковые цепи (например, лейцин, валин, изолейцин и аланин). В определенных условиях замещение глутамина на глутаминовую кислоту или аспарагин на аспарагиновую кислоту можно считать аналогичной заменой в том смысле, что глутамин и аспарагин являются амидными производными соответственно глутаминовой кислоты и аспарагиновой кислоты. Как считается в данной области техники, «схожесть» между двумя полипептидами определяют путем сравнения аминокислотной последовательности полипептида и консервативных аминокислотных замен в ней с последовательностью второго полипептида (например, с использованием алгоритма GENEWORKS, Align, BLAST или других алгоритмов, описанных в настоящей заявке и применяемых на практике в данной области).
В определенных вариантах реализации антигенспецифический связывающий белок содержит связывающий компонент, который по меньшей мере приблизительно на 90% или по меньшей мере приблизительно на 95% идентичен аминокислотной последовательности исходной последовательности дикого типа при условии, что (а) по меньшей мере три или четыре CDR не содержат мутаций, и (b) CDR, у которых нет мутаций, содержат только не более двух или трех аминокислотных замен, делецию из не более пяти последовательных аминокислот или комбинацию перечисленного.
В определенных вариантах реализации молекулы нуклеиновых кислот, кодирующие антигенсвязывающий белок или антиген, используют для трансфекции/трансдукции клетки-хозяина (например, гемопоэтических стволовых клеток, Т-клеток) для применения при терапии путем адоптивного переноса. Были описаны недавние достижения в способах трансфицирования/трансдуцирования Т-клеток требуемыми нуклеиновыми кислотами (например, патент США №2004/0087025), как и процедуры адоптивного переноса с использованием Т-клеток требуемой антигенной специфичности (например, Schmitt et al., Hum. Gen. 20:1240, 2009; Dossett et al., Mol. Ther. 17:742, 2009; Till et al., Blood 112:2261, 2008; Wang et al, Hum. Gene Ther. 18:712, 2007; Kuball et al., Blood 109:2331, 2007; патент США №2011/0243972; патент США №2011/0189141; Leen et al., Ann. Rev. Immunol. 25:243, 2007), так что подразумевается адаптация этих методологий к раскрытым в настоящей заявке вариантам реализации, опираясь на принципы настоящего изобретения.
Антигенсвязывающие белки или компоненты, как описано в настоящей заявке, можно функционально охарактеризовать в соответствии с любой из широкого ряда принятых в данной области техники методологий для анализа Т-клеточной активности, включая определение связывания, активации или индукции Т-клеток, а также включая определение ответов Т-клеток, которые являются антигенспецифичными. Примеры включают определение пролиферации Т-клеток, Т-клеточного высвобождения цитокинов, антигенспецифичной стимуляции Т-клеток, ограниченной по МНС стимуляции Т-клеток, активности цитотоксических Т-лимфоцитов (CTL) (например, путем определения высвобождения51Cr из предварительно нагруженных клеток-мишеней), изменения в экспрессии фенотипических маркеров Т-клеток и другие параметры оценки функций Т-клеток. Процедуры выполнения этих и похожих анализов можно найти, например, у Lefkovits (Immunology Methods Manual: The Comprehensive Sourcebook of Techniques, 1998). См. также Current Protocols in Immunology; Weir, Handbook of Experimental Immunology, Blackwell Scientific, Boston, MA (1986); Mishell and Shigii (eds.) Selected Methods in Cellular Immunology, Freeman Publishing, San Francisco, CA (1979); Green and Reed, Science 281:1309 (1998) и источники, цитируемые в них).
Уровни цитокинов можно определить в соответствии со способами, описанными в настоящей заявке и применяемыми на практике в данной области техники, включая, например, ELISA, метод иммуноферментных пятен (ELISPOT), внутриклеточное окрашивание цитокинов и проточную цитометрию и их комбинации (например, внутриклеточное окрашивание цитокинов и проточная цитометрия). Пролиферацию иммунных клеток и клональное размножения в результате антигенспецифического вызова или стимулирования иммунного ответа можно определить путем выделения лимфоцитов, таких как циркулирующие лимфоциты, в образцах клеток периферической крови или клеток из лимфатических узлов, стимулирования клеток антигеном и измерения выработки цитокинов, клеточной пролиферации и/или жизнеспособности клеток, например, путем анализа включения меченного тритием тимидина или путем нерадиоактивных анализов, таких как МТТ-тесты (анализы на основе 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиумбромида) и тому подобное. Действие иммуногена, описанного в настоящей заявке, на баланс между иммунным ответом, опосредуемым Т-хелперами 1 (Th1), и иммунным ответом, опосредуемым Т-хелперами 2 (Th2), можно проанализировать, например, посредством определения уровней цитокинов Th1, таких как интерферон гамма (ИФН-γ), ИЛ-12, ИЛ-2 и фактор некроза опухоли бета (ФНО-β, TNF-β), и цитокинов 2 типа, таких как ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-10 и ИЛ-13.
Полинуклеотиды. кодирующие антигенсвязываюшие белки или антигены
Выделенные или рекомбинантные молекулы нуклеиновой кислоты, кодирующие антигенсвязывающий белок, такой как CAR, высокоаффинный рекомбинантный TCR, специфичный к антигену, или антиген или антиидиотипическое антитело против антигенспецифического связывающего компонента, как описано в настоящей заявке, можно получить и приготовить в соответствии с различными способами и техниками молекулярной биологии или областями техники, касающимися очистки полипептидов. Конструирование экспрессионного вектора, который используют для рекомбинантного получения антигенсвязывающего белка, такого как CAR, высокоаффинного рекомбинантного TCR, специфичного к антигену, или антигена или антиидиотипического антитела против интересующего антигенспецифического связывающего компонента, можно выполнить с использованием любых способов генной инженерии молекулярной биологии, известных в данной области техники, включая применение расщепления эндонуклеазами рестрикции, лигирование, трансформацию, очистку плазмид и секвенирование ДНК, например, как описано у Sambrook et al. (издания 1989 и 2001; Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY) и Ausubel et al., (Current Protocols in Molecular Biology (2003)). Для получения эффективной транскрипции и трансляции полинуклеотид в каждой рекомбинантной экспрессионной конструкции включает по меньшей мере одну подходящую последовательность контроля экспрессии (также называемую регуляторной последовательностью), такую как лидерная последовательность и особенно промотор, функционально (то есть оперативно) связанный с нуклеотидной последовательностью, кодирующей иммуноген. В определенных вариантах реализации полинуклеотид представляет собой кодон, оптимизированный для эффективной экспрессии в целевой клетке-хозяине.
Определенные варианты реализации относятся к нуклеиновым кислотам, которые кодируют полипептиды, предполагаемые в настоящей заявке, например, химерные антигенные рецепторы, высокоаффинные рекомбинантные TCR, антиген, представляющий интерес, и антиидиотипические антитела, специфичные к антигенсвязывающим белкам. Специалист в данной области технике поймет, что нуклеиновая кислота может относиться к одноцепочечной или двухцепочечной ДНК, кДНК или РНК в любой форме и может включать положительную и отрицательную цепь нуклеиновой кислоты, которые комплементарны друг другу, включая антисмысловые ДНК, кДНК и РНК. Также включаются короткие интерферирующие РНК (киРНК), микроРНК, гибриды РНК-ДНК, рибозимы и другие различные встречающиеся в природе или синтетические формы ДНК или РНК.
Можно использовать стандартные способы для синтеза рекомбинантных ДНК, пептидов и олигонуклеотидов, иммуноанализов и культивирования тканей и трансформации (например, электропорацию, липофекцию). Ферментативные реакции и способы очистки можно осуществлять в соответствии со спецификациями производителя, или как они обычно выполняются в данной области техники, или как описано в настоящей заявке. Эти и родственные способы и процедуры в общем случае выполняют в соответствии с традиционными способами, хорошо известными в данной области техники, и как описано в различных общих и более узких источниках по способам микробиологии, молекулярной биологии, биохимии, молекулярной генетики, клеточной биологии, вирусологии и иммунологии, которые цитируются и обсуждаются в ходе настоящего описания. См., например, Sambrook, et al., Molecular Cloning: A Laboratory Manual, 3d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (John Wiley and Sons, updated July 2008); Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Glover, DNA Cloning: A Practical Approach, vol. I & II (IRL Press, Oxford Univ. Press USA, 1985); Current Protocols in Immunology (Edited by: John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober 2001 John Wiley & Sons, NY, NY); Real-Time PCR: Current Technology and Applications, Edited by Julie Logan, Kirstin Edwards and Nick Saunders, 2009, Caister Academic Press, Norfolk, UK; Anand, Techniques for the Analysis of Complex Genomes, (Academic Press, New York, 1992); Guthrie and Fink, Guide to Yeast Genetics and Molecular Biology (Academic Press, New York, 1991); Oligonucleotide Synthesis (N. Gait, Ed., 1984); Nucleic Acid Hybridization (B. Hames & S. Higgins, Eds., 1985); Transcription and Translation (B. Hames & S. Higgins, Eds., 1984); Animal Cell Culture (R. Freshney, Ed., 1986); Perbal, A Practical Guide to Molecular Cloning (1984); Next-Generation Genome Sequencing (Janitz, 2008 Wiley-VCH); PCR Protocols (Methods in Molecular Biology) (Park, Ed., 3rd Edition, 2010 Humana Press); Immobilized Cells And Enzymes (IRL Press, 1986); научные труды, Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J.H. Miller and M.P. Calos eds., 1987, Cold Spring Harbor Laboratory); Harlow and Lane, Antibodies, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1998); Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D.M. Weir and CC Blackwell, eds., 1986); Roitt, Essential Immunology, 6th Edition, (Blackwell Scientific Publications, Oxford, 1988); Embryonic Stem Cells: Methods and Protocols (Methods in Molecular Biology) (Kurstad Turksen, Ed., 2002); Embryonic Stem Cell Protocols: Volume I: Isolation and Characterization (Methods in Molecular Biology) (Kurstad Turksen, Ed., 2006); Embryonic Stem Cell Protocols: Volume II: Differentiation Models (Methods in Molecular Biology) (Kurstad Turksen, Ed., 2006); Human Embryonic Stem Cell Protocols (Methods in Molecular Biology) (Kursad Turksen Ed., 2006); Mesenchymal Stem Cells: Methods and Protocols (Methods in Molecular Biology) (Darwin J. Prockop, Donald G. Phinney, and Bruce A. Bunnell Eds., 2008); Hematopoietic Stem Cell Protocols (Methods in Molecular Medicine) (Christopher A. Klug, and Craig T. Jordan Eds., 2001); Hematopoietic Stem Cell Protocols (Methods in Molecular Biology) (Kevin D. Bunting Ed., 2008) Neural Stem Cells: Methods and Protocols (Methods in Molecular Biology) (Leslie P. Weiner Ed., 2008).
Определенные варианты реализации включают нуклеиновые кислоты, заключенные в вектор. Специалист в данной области может быстро установить подходящие вектора для применения с определенными вариантами реализации, раскрытыми в настоящей заявке. Типичный вектор может содержать молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту, с которой она была связана, или которая способна осуществлять репликацию в организме-хозяине. Некоторые примеры векторов включают плазмиды, вирусные векторы, космиды и другие.
Некоторые вектора могут быть способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальную точку начала репликации и эписомные векторы млекопитающих), тогда как другие векторы могут быть интегрированы в геном клетки-хозяина после того, как введены в клетку-хозяина, и тем самым реплицироваться вместе с геномом хозяина. Дополнительно, некоторые вектора способны направлять экспрессию генов, с которыми они функционально связаны (эти векторы можно назвать «экспрессионными векторами»). Согласно родственными вариантам реализации также понятно, что если одно или более средство (например, полинуклеотиды, кодирующие антигенсвязывающий белок, как CAR, высокоаффинный рекомбинантный TCR, специфичный к антигену, или антиген или антиидиотипическое антитело против антигенспецифичного связывающего компонента, как описано в настоящей заявке) вводят совместно субъекту, то каждое средство может находиться в отдельных или в одних и тех же векторах, и множество векторов (каждый содержащий различное средство или одно и то же) можно ввести в клетку или клеточную популяцию или ввести субъекту.
В определенных вариантах реализации нуклеиновая кислота, кодирующая антигенсвязывающие белки или антигены согласно настоящему описанию, может быть функционально связана с определенными элементами вектора. Например, полинуклеотидные последовательности, которые необходимы для воздействия на экспрессию и процессинг кодирующих последовательностей, с которыми они лигированы, могут быть функционально связаны. Последовательности контроля экспрессии могут включать подходящие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые увеличивают эффективность трансляции (то есть консенсусные последовательности Козак); последовательности, которые увеличивают стабильность белка; и возможно последовательности, которые усиливают секрецию белка. Последовательности контроля экспрессии могут быть функционально связаны, если они являются смежными с интересующим геном и последовательностями контроля экспрессии, которые действуют посредством трансрегуляции или на расстоянии для контроля интересующего гена.
В конкретных вариантах реализации рекомбинантный экспрессионный вектор доставляют к подходящей клетке, например, гемопоэтической стволовой клетке, Т-клетке, антигенпрезентирующей клетке (например, дендритной клетке) или подобной. Следовательно, рекомбинантные экспрессионные вектора могут также включать, например, специфичные для лимфоидной ткани транскрипционные регуляторные элементы (ТРЭ), такие как транскрипционные регуляторные элементы, специфичные для В-лимфоцитов, Т-лимфоцитов или дендритных клеток. Специфичные для лимфоидной ткани транскрипционные регуляторные элементы известны в данной области техники (см., например, Thompson et al, Mol. Cell. Biol. 12:1043, 1992); Todd et al., J. Exp. Med. 177:1663, 1993); Penix et al., J. Exp. Med. 178:1483, 1993).
В дополнении к векторам определенные варианты реализации имеют отношение к клеткам-хозяевам, которые содержат векторы, раскрытые в настоящей заявке. Специалист в данной области техники сразу понимает, что доступно множество подходящих клеток-хозяев в данной области техники. Клетка-хозяин может включать любую отдельную клетку или культуру клеток, которая может принимать вектор или в которую можно встроить нуклеиновые кислоты и/или белки, а также любые клетки-предшественники. Термин также охватывает потомство клетки-хозяина, генетически или фенотипически такое же или отличающееся. Пригодность клеток-хозяев может зависеть от вектора, и клетки-хозяева могут включать клетки млекопитающих, клетки животных, клетки человека, клетки обезьян, клетки насекомых, клетки дрожжей и бактериальные клетки. Эти клетки могут быть индуцированы для включения вектора или другого материала посредством применения вирусного вектора, трансформации путем преципитации фосфатом кальция, диэтиламиноэтилдекстрана (ДЭАЭ-декстрана), электропорации, микроинъекции или других способов. Например, см. Sambrook et al., Molecular Cloning: A Laboratory Manual 2d ed. (Cold Spring Harbor Laboratory, 1989).
Способы лечения
В определенных аспектах настоящее изобретение направлено на способы лечения гиперпролиферативных заболеваний или состояний (например, характеризуемых сверхэкспрессией антигена) путем введения человеку эффективного количества композиции, содержащей популяцию модифицированных Т-клеток человека, содержащих молекулу нуклеиновой кислоты, которая кодирует антигенсвязывающий белок, при этом антигенсвязывающий белок содержит гидрофобную часть, расположенную между внеклеточным связывающим компонентом и внутриклеточным эффекторным компонентом; и популяцию модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или их комбинацию, содержащую молекулу нуклеиновой кислоты, которая кодирует антиген, специфично распознаваемый внеклеточным связывающим компонентом антигенсвязывающего белка. В определенных вариантах реализации этапы введения можно повторять многократно и в течение периодов времени, составляющих несколько недель, несколько месяцев или до двух лет или более.
В определенных вариантах реализации гиперпролиферативное заболевание представляет собой гематологическую злокачественную опухоль или солидный рак. Примеры гематологических злокачественных опухолей включают острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), хронический миелоидный лейкоз (ХМЛ), хронический эозинофильный лейкоз (ХЭЛ), миелодиспластический синдром (МДС), неходжкинскую лимфому (НХЛ) или множественную миелому (ММ). Примеры солидных раков включают рак желчного пузыря, рак мочевого пузыря, карциному костей и мягких тканей, опухоль головного мозга, рак молочной железы, рак шейки матки, рак толстой кишки, колоректальную аденокарциному, колоректальный рак, десмоидную опухоль, эмбриональный рак, рак эндометрия, рак пищевода, рак желудка, аденокарциному желудка, мультиформную глиобластому, гинекологическую опухоль, плоскоклеточную карциному головы и шеи, рак печени, рак легких, злокачественную меланому, остеосаркому, рак яичников, рак поджелудочной железы, аденокарциному протоков поджелудочной железы, первичную астроцитарную опухоль, первичный рак щитовидной железы, рак предстательной железы, рак почек, почечно-клеточный рак, рабдомиосаркому, рак кожи, саркому мягких тканей, опухоль половых клеток яичка, уротелиальный рак, саркому матки или рак матки.
В дополнительных аспектах настоящее изобретение направлено на лечение заболевания у субъекта путем (а) введения субъекту эффективного количества популяции модифицированных Т-клеток человека, содержащих молекулу нуклеиновой кислоты, которая кодирует антигенсвязывающий белок, при этом антигенсвязывающий белок содержит гидрофобную часть, расположенную между внеклеточным связывающим компонентом и внутриклеточным эффекторным компонентом; (b) введения субъекту эффективного количества популяции модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или их комбинации, содержащих молекулу нуклеиновой кислоты, которая кодирует антиген, при этом внеклеточный связывающий компонент антигенсвязывающего белка из модифицированных Т-клеток человека этапа (а) является специфичным к антигену, кодируемому популяцией модифицированных клеток данного этапа (b); и (с) необязательно повторение этапа (а), этапа (b) или обоих этапов (а) и (b); таким образом, проводя лечение заболевания с помощью адоптивной клеточной иммунотерапии.
В еще одних дополнительных аспектах настоящее изобретение направлено на способ улучшения адоптивной клеточной иммунотерапии путем (а) введения субъекту эффективного количества популяции модифицированных Т-клеток человека, содержащих молекулу нуклеиновой кислоты, которая кодирует антигенсвязывающий белок, при этом антигенсвязывающий белок содержит гидрофобную часть, расположенную между внеклеточным связывающим компонентом и внутриклеточным эффекторным компонентом; и (b) введения субъекту эффективного количества популяции модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или их комбинации, содержащих молекулу нуклеиновой кислоты, которая кодирует антиген, при этом внеклеточный связывающий компонент антигенсвязывающего белка из модифицированных Т-клеток человека этапа (а) является специфичным к антигену, кодируемому популяцией модифицированных клеток данного этапа (b). Данные введения, которые можно повторять, как описано в настоящей заявке, тем самым осуществляют бустинг, увеличение или усиления эффективности адоптивной клеточной иммунотерапии.
В любом из упомянутых выше вариантов реализации способы применяют для лечения вирусного заболевания, бактериального заболевания, рака, воспалительного заболевания, иммунопатологического заболевания или возрастного заболевания.
В любом из упомянутых выше вариантов реализации способы применяют с использованием клеток, кодирующих антигенсвязывающий белок, содержащий связывающий компонент, гидрофобную часть и внутриклеточный эффекторный компонент. Например, связывающий компонент может представлять собой вариабельный фрагмент антитела (Fv), вариабельный домен TCR, эктодомен рецептора или лиганд. В дополнительных вариантах реализации связьшающий компонент представляет собой scFv или scTCR, содержащий линкер вариабельной области, например, линкер содержит (GlyxSery)n, где х и у независимо представляют собой целые числа от 1 до 5, и n - целое число от 1 до 10. В дополнительных вариантах реализации связывающий компонент является специфичным к α-фетопротеину (AFP), В7Н4, BTLA, CD3, CD19, CD20, CD25, CD22, CD28, CD30, CD40, CD44v6, CD52, CD56, CD79b, CD80, CD81, CD86, CD134 (ОХ40), CD137 (4-1ВВ), CD151, CD276, CA125, CEA, CEACAM6, c-Met, CT-7, CTLA-4, EGFR, EGFRvIII, ErbB2, ErbB3 , ErbB4, EphA2, FLT1, FLT4, Frizzled, O-ацетил-GD2, GD2, GHRHR, GHR, GITR, gp130, HVEM, IGF1R, IL6R, KDR, L1CAM, Lewis A, Lewis Y, LTβR, LIFRβ, LRP5, MAGE, мезотелину, MUC1, NY-ESO-1, специфическому для рака неоантигену, OSMRβ, PD1, PD-L1, PD-L2, PSMA, PTCH1, RANK, Robo1, ROR1, TERT, TGFBR2, TGFBR1, TLR7, TLR9, TNFRSF4, TNFR1, TNFR2, тирозиназе, TWEAK-R или WT-1. В любом из этих вариантов реализации внеклеточный связывающий компонент антигенсвязывающего белка из модифицированных Т-клеток человека направлен против больной клетки, сверхэкспрессирующей антиген.
В еще одних дополнительных вариантах реализации гидрофобная часть представляет собой трансмембранный домен, такой как трансмембранный домен CD4, CD8, CD28 или CD27.
В определенных вариантах реализации внутриклеточный эффекторный компонент содержит внутриклеточную область CD3ε, CD3δ, CD3ζ, CD25, CD27, CD28, CD79A, CD79B, CD134, CD137, CARD11, DAP10, FcRα, FcRβ, FcRγ, Fyn, HVEM, ICOS, Lck, LAG3, LAT, LRP, NKG2D, NOTCH1, NOTCH2, NOTCH3, NOTCH4, ROR2, Ryk, SLAMF1, Slp76, pTα, TCRα, TCRβ, TRIM, Zap70, PTCH2 или любую их комбинацию. В конкретных вариантах реализации внутриклеточный эффекторный компонент содержит CD3ζ и один или более из CD27, CD28, CD134 и CD 137, или внутриклеточный эффекторный компонент содержит LRP, NOTCH1, NOTCH2, NOTCH3, NOTCH4, ROR2 или Ryk.
В любом из упомянутых выше вариантов реализации способы предусматривают применение модифицированной клетки иммунной системы, такой как CD4+ Т-клетки, CD8+ Т-клетки, CD4- CD8-двойной негативной Т-клетки, γδ Т-клетки, регуляторной Т-клетки, клетки-естественного киллера, дендритной клетки или любой их комбинации. В определенных вариантах реализации Т-клетка представляет собой наивную Т-клетку, Т-клетку центральной памяти, Т-клетку эффекторной памяти или любую их комбинацию. Например, первая популяция модифицированных Т-клеток может состоять по существу из CD4+ Т-клеток, CD8+ Т-клеток или из CD4+ и CD8+ Т-клеток, а вторая популяция модифицированных клеток содержит модифицированные гемопоэтические клетки-предшественники человека. В других примерах, первая популяция Т-клеток может состоять по существу из CD4+ Т-клеток, CD8+ Т-клеток или из CD4+ и CD8+ Т-клеток, а вторая популяция модифицированных клеток содержит модифицированные клетки иммунной системы человека, такие как клетки, состоящие по существу из CD4+ Т-клеток, CD8+ Т-клеток или из CD4+ и CD8+ Т-клеток.
В любом из упомянутых выше вариантов реализации способы предусматривают применение популяций модифицированных клеток, которые рекомбинантно модифицированы ex vivo посредством, например, вирусного вектора, такого как лентивирусный вектор или γ-ретровирусного вектора. В дополнительных вариантах реализации модифицируемые популяции клеток представляют собой изогенные, аллогенные или аутологические клетки. В любом из упомянутых выше вариантов реализации популяции модифицированных клеток дополнительно находятся в составе с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом, как описано в настоящей заявке.
В любом из упомянутых выше вариантов реализации способы включают введение популяций модифицированных клеток внутривенно.
В любом из упомянутых выше вариантов реализации способы включают введение субъекту множества доз модифицированных Т-клеток из этапа (а), множества доз модифицированных клеток из этапа (b) или их комбинацию. Например, множество доз модифицированных Т-клеток из этапа (а) вводят в интервалах между введениями, составляющими приблизительно одну неделю до приблизительно четырех недель. В определенных вариантах реализации модифицированные Т-клетки из этапа (а) вводят параллельно или последовательно с модифицированными клетками из этапа (b). В дополнительных вариантах реализации начальную дозу модифицированных клеток из этапа (b) вводят спустя приблизительно 1 день до приблизительно 28 дней после введения модифицированных Т-клеток из этапа (а).
В любом из упомянутых выше вариантов реализации способы включают введение модифицированных клеток из этапа (b) последовательно в течение приблизительно 24 часов от введения модифицированных Т-клеток из этапа (а) или введение модифицированных Т-клеток из этапа (а) последовательно в течение приблизительно 24 часов от введения модифицированных клеток из этапа (b). В конкретном варианте реализации первоначальное введение включает введение композиции, содержащей смесь модифицированных Т-клеток из этапа (а) и модифицированных клеток из этапа (b) при условии, что клетки из этапа (b) не активируют клетки из этапа (а), пока смесь вводят субъекту. В дополнительных вариантах реализации модифицированные клетки из этапа (b) дополнительно вводят в одной или более дозах в течение одного или более интервалов, составляющих до приблизительно 365 дней после введения модифицированных Т-клеток из этапа (а). В любом из упомянутых выше вариантов реализации модифицированные клетки из этапа (b) содержат или состоят по существу из модифицированных гемопоэтических клеток-предшественников или содержат или состоят по существу из Т-клеток.
В любом из упомянутых выше вариантов реализации модифицированные Т-клетки из этапа (а) вводят субъекту в дозе приблизительно 106 клеток/м2 до приблизительно 1011 клеток/м2 и модифицированные Т-клетки из этапа (b) вводят субъекту в дозе приблизительно 106 клеток/м2 до приблизительно 1011 клеток/м2, при этом дозы для любой из или обеих популяций модифицированных клеток могут быть повторены, как описано в настоящей заявке.
Наличие гиперпролиферативного заболевания или злокачественного заболевания у субъекта относится к наличию диспластических, раковых и/или трансформированных клеток у субъекта, включая, например, неопластические, опухолевые, не обладающие контактным торможением или онкогенно трансформированные клетки или тому подобное (например, солидные раки; гематологические раковые заболевания, включая лимфомы и лейкозы, такие как острый миелоидный лейкоз, хронический миелоидный лейкоз и т.д.), которые известны в данной области техники и для которых установлены критерии для диагностики и классификации (например, Hanahan and Weinberg, 2011 Cell 144:646; Hanahan and Weinberg 2000 Cell 100:57; Cavallo et al., 2011 Cane. Immunol. Immunother. 60:319; Kyrigideis et al., 2010 J. Carcinog. 9:3). В определенных вариантах реализации подобные раковые клетки могут представлять собой клетки острого миелоидного лейкоза, В-клеточного лимфобластного лейкоза, Т-клеточного лимфобластного лейкоза или миеломы, включая раковые стволовые клетки, которые способны инициировать и периодически трансплантировать данные типы рака (см., например, Park et al., Molec. Therap.17:219, 2009).
В другом аспекте согласно настоящему изобретению предложен способ ингибирования роста, метастазирования и метастатического роста злокачественной опухоли (например, солидной злокачественной опухоли или гематологической злокачественной опухоли), включающий введение нуждающемуся субъекту эффективного количества клетки, кодирующей полипептидный комплекс, предложенный в настоящей заявке, или его композицию.
Целый ряд разнообразных раковых заболеваний, включая солидную злокачественную опухоль и гематологическую злокачественную опухоль, восприимчивы к композициям и способам, раскрытым в настоящей заявке. Типы рака, которые можно лечить, включают аденокарциному молочных желез, предстательной железы, поджелудочной железы, толстого кишечника и прямого кишечника; все формы бронхогенной карциномы легких (включая плоскоклеточную карциному, аденокарциному, мелкоклеточный рак легкого и немелкоклеточный рак легкого) миелоидный рак; меланому; гепатому; нейробластому; папиллому; апудому; хористому; бранхиому; карциноидный синдром; карциноидную болезнь сердца; и карциному (например, карциному Уокера, базальноклеточную карциному, базальную плоскоклеточную карциному, карциному Брауна-Пирса, протоковую карциному, опухоль Эрлиха, карциному Кребса-2, карциному из клеток Меркеля, слизистный рак, немелкоклеточный рак легких, овсяноклеточную карциному, папиллярную карциному, фиброзную карциному, бронхиолярную карциному, бронхогенную карциному, плоскоклеточный карционму и переходно-клеточную карциному). Дополнительные типы раковых заболеваний, которые можно лечить, включают: гистиоцитарные расстройства; лейкоз; злокачественный гистиоцитоз; болезнь Ходжкина; неходжкинскую лимфому; плазмоцитому; ретикулоэндотелиоз; меланому; почечно-клеточную карциному; хондробластому; хондрому; хондросаркому; фиброму; фибросаркому; гигантоклеточные опухоли; гистиоцитому; липому; липосаркому; мезотелиому; миксому; миксосаркому; остеому; остеосаркому; хордому; краниофарингиому; дисгерминому; гамартому; мезенхимому; мезонефрому; миосаркому; амелобластому; цементому; одонтому; тератому; тимому; трофобластическую опухоль.
Дополнительно, следующие типы раковых заболевания также предполагаются восприимчивыми к лечению: аденома; холангиома; холестеатома; цилиндрома; цистаденокарцинома; цистоаденома; фолликулярная аденома яичника; гинандробластома; гепатома; гидраденома; аденома островковой ткани; опухоль из клеток Лейдига; папиллома; опухоль из клеток Сертоли; текаклеточная опухоль; лейомиома; лейомиосаркома; миобластома; миома; миосаркома; рабдомиома; рабдомиосаркома; эпендимома; ганглионеврома; глиома; медуллобластома; менингиома; невринома; нейробластома; эпендимома; нейрофиброма; неврома; параганглиома; нехромафинная параганглиома; и мультиформная глиобластома. Типы раковых заболеваний, которые можно лечить, также включают ангиокератому; ангиолимфоидную гиперплазию с эозинофилией; склерозирующую ангиому; ангиоматоз; гломангиому; гемангиоэндотелиому; гемангиому; гемангиоперицитому; гемангиосаркому; лимфангиому; лимфангиомиому; лимфангиосаркому; пинеалому; карциносаркому; хондросаркому; филлоидную цистосаркому; фибросаркому; гемангиосаркому; лейомиосаркому; лейкосаркому; липосаркому; лимфангиосаркому; миосаркому; миксосаркому; карциному яичника; рабдомиосаркому; саркому; новообразования; нейрофиброматоз; и дисплазию шейки матки.
Дополнительные приводимые в качестве примера раковые заболевания, которые также восприимчивы к композициям и способам, описанным в настоящей заявке, представляют собой В-клеточные раковые заболевания, включая В-клеточные лимфомы [такие как различные формы болезни Ходжкина, неходжкинская лимфома (НХЛ) или лимфомы центральной нервной системы], лейкозы [такие как острый лимфобластный лейкоз (ОЛЛ), хроническая лимфоцитарная лейкемия (ХЛЛ), волосатоклеточный лейкоз и хронический миобластный лейкоз] и миеломы (такие как множественная миелома). Дополнительные В-клеточные раковые заболевания включают мелкоклеточную лимфоцитарную лимфому, В-клеточный пролимомфоцитарный лейкоз, лимфоплазмоцитарную лимфому, лимфому маргинальной зоны селезенки, плазмоклеточную миелому, изолированную плазмоцитому кости, экстраоссальную плазмоцитому, экстранодальную В-клеточную лимфому маргинальной зоны лимфоидной ткани слизистой оболочки (MALT), нодальную В-клеточную лимфому маргинальной зоны, фолликулярную лимфому, лимфому из клеток мантийной зоны, диффузную крупноклеточную В-клеточную лимфому, медиастинальную (тимическую) крупноклеточную В-клеточную лимфому, внутрисосудистую крупноклеточную В-клеточную лимфому, первичную эффузионную лимфому, лимфому Беркитта/лейкоз, пролиферации В-клеток неопределенного злокачественного потенциала, лимфогранулематоз и посттрансплантационное лимфопролиферативное расстройство.
В определенных вариантах реализации клетки, кодирующие антигенсвязывающие белки, пригодные для ингибирования роста солидных злокачественных опухолей или метастазирования или метастатического роста солидной злокачественной опухоли или гематологической злокачественной опухоли, включают клетки, которые специфично связываются с опухолевым или раковым антигеном и со вторым целевым антигеном на раковой клетке.
Как понятно специалисту в области медицины, термины «лечить» и «лечение» относятся к медицинскому управлению течением заболевания, нарушения или состояния субъекта (то есть пациента, хозяина, который может быть человеком или другим животным) (см., например, Медицинский словарь Стедмана). В целом, подходящая доза и схема лечения предусматривают один или более антигенсвязывающих белков (например, CAR) или высокоаффинный TCR, специфичный к целевому антигену человека, Т-клетку хозяина, экспрессирующую тот же самый антиген, и необязательно дополнительную терапию (например, цитокин, такой как ИЛ-2, ИЛ-15, ИЛ-21 или любая их комбинация) в количестве, достаточном для обеспечения терапевтического или профилактического эффекта. Терапевтический или профилактический эффект в результате терапевтического лечения или профилактических способов включает, например, улучшение клинического исхода, при этом целью является профилактика или замедление или иное снижение (например, уменьшение статистически значимым образом по отношению к не получающему лечение контролю) нежелательного физиологического изменения или нарушения, или профилактика, замедление или иное уменьшение распространения или тяжести подобного заболевания или нарушения. Благоприятные или желаемые клинические результаты лечения субъекта включают снижение выраженности, уменьшение или облегчение симптомов, являющихся результатом или связанных с лечимым заболеванием или нарушением; сниженную частоту симптомов; улучшение качества жизни; более длительный безрецидивный статус (то есть уменьшение вероятности или предрасположенности, что у субъекта проявятся симптомы, на основе которых был сделан диагноз о заболевании); уменьшение степени заболевания; стабилизированное (то есть не ухудшающееся) состояние болезни; задержка или замедление прогрессирования болезни; уменьшение интенсивности или временное облегчение болезненного состояния; и ремиссию (частичную или полную), определяемую или неопределяемую; или общую выживаемость.
«Лечение» также может означать увеличение выживаемости при сравнении с ожидаемой выживаемостью, если субъект не получал лечение. Субъекты, которым необходимы способы и композиции, описанные в настоящей заявке, включают тех, у кого уже есть заболевание или нарушение, а также субъектов, предрасположенных или имеющих риск развития заболевания или нарушения. Субъекты, которым необходимо профилактическое лечение, включают субъекты, у которых необходимо провести профилактику заболевания, состояния или нарушения (то есть снизить вероятность появления или повторного появления заболевания или нарушения). Клинический эффект, обеспечиваемый композициями (и препаратами, содержащими композиции) и способами, описанными в настоящей заявке, можно оценить с помощью разработки и выполнения анализов in vitro, доклинических исследований и клинических исследований у субъектов, введение которым композиций предполагается, что принесет пользу, как описано в примерах.
Клетки, экспрессирующие антигенсвязывающий белок или высокоаффинный рекомбинантный TCR, специфичный к связанному с заболеванием человека антигену, вместе с клетками, экспрессирующими целевой антиген, как описано в настоящей заявке, можно вводить субъекту в фармацевтически или физиологически приемлемом или подходящем вспомогательном веществе или носителе. Фармацевтически приемлемые вспомогательные вещества представляют собой биологически совместимые носители, например, физиологический раствор, которые более подробно описаны в настоящей заявке, которые подходят для введения человеку или другому животному.
Терапевтически эффективная доза представляет собой количество Т-клеток хозяина (экспрессирующих антигенсвязывающий белок или высокоаффинный рекомбинантный TCR, специфичный к связанному с заболеванием человека антигену) и клеток, экспрессирующих целевой антиген, используемый в адоптивном переносе, которое способно вызывать клинически требуемый результат (то есть достаточное количество для индуцирования или усиления специфического Т-клеточного иммунного ответа против клеток, сверхэкспрессирующих антиген, (например, цитотоксический Т-клеточный ответ) статистически значимым образом) у проходящего лечение человека или другого животного. Как хорошо известно в медицинской области, дозировка для любого пациента зависит от множества факторов, включая размер пациента, массу, площадь поверхности тела, возраст, конкретно применяемое лечение, пол, время и способ введения, общее состояние здоровья и вводимые параллельно другие лекарственные средства. Дозы могут варьироваться, но предпочтительная доза для введения клетки-хозяина, содержащей рекомбинантный экспрессионный вектор, как описано в настоящей заявке, составляет приблизительно 106 клеток/м2, приблизительно 5×106 клеток/м2, приблизительно 107 клеток/м2, приблизительно 5×107 клеток/м2, приблизительно 108 клеток/м2, приблизительно 5×108 клеток/м2, приблизительно 109 клеток/м2, приблизительно 5×109 клеток/м2, приблизительно 1010 клеток/м2, приблизительно 5×1010 клеток/м2 или приблизительно 1011 клеток/м2.
Фармацевтические композиции можно вводить способом, подходящим для того заболевания или состояния, которое лечат (или проводят профилактику), определяемым специалистами в области медицины. Подходящая доза и подходящая длительность и частота введения композиций будет определяться такими факторами, как состояние здоровья пациента, размер пациента (то есть масса или площадь тела), тип и тяжесть заболевания пациента, конкретная форма активного вещества и способ введения. В целом, подходящая доза и схема лечения предусматривают композицию(и) в количестве, достаточном для обеспечения терапевтического и/или профилактического эффекта (такого, как описан в настоящей заявке, включая улучшенный клинический исход, например, более частые полные или частичные ремиссии, или увеличенная по времени безрецидивная и/или общая выживаемость, или уменьшение тяжести симптомов). С целью профилактического применения доза должна быть достаточной для профилактики, задержки дебюта или снижения тяжести заболевания, связанной с болезнью или нарушением. Профилактический эффект иммуногенных композиций, вводимых согласно способам, описанным в настоящей заявке, можно определить путем проведения доклинических (включая исследования на животных in vitro и in vivo) и клинических исследований и анализа данных, полученных из них, с помощью подходящих статистических, биологических и клинических способов и техник, все из которых может легко применять на практике специалист в данной области техники.
Состояние, связанное со сверхэкспрессией антигена, включает любое нарушение или состояние, при котором присутствует недостаточная активность, сверхактивность или ненадлежащая активность связанного с антигеном клеточного или молекулярного явления, и, как правило, является результатом необычно высоких (статистически значимых) уровней экспрессии антигена в пораженных клетках (например, лейкозных клетках) по сравнению с нормальными клетками. Субъект, имеющий подобное заболевание или состояние, получить пользу от лечения композицией или способом согласно раскрытым в настоящей заявке вариантам реализации. Таким образом, некоторые состояния, связанные со сверхэкспрессией антигена, могут включать острые, а также хронические нарушения или заболевания, такие как те патологические состояния, которые провоцируют у субъекта развитие конкретного нарушения.
Некоторые примеры состояний, связанных со сверхэкспрессией антигена, включают гиперпролиферативные заболевания, которые относятся к состоянию активированных и/или пролиферирующих клеток (которые также могут быть транскрипционно сверхактивны) у субъекта, включая опухоли, новообразования, рак, злокачественные опухоли и т.д. Кроме активированных или пролиферирующих клеток гиперпролиферативное заболевание может также включать отклонение или дисрегуляцию процессов клеточной смерти, будь то некроз или апоптоз. Подобные отклонения процессов клеточной смерти могут быть связаны с различными состояниями, включая рак (включая первичные, вторичные злокачественные опухоли, а также метастазирование) или другие состояния.
Согласно определенным вариантам реализации практически любой тип рака, который характеризуется экспрессией или сверхэкспрессией антигена, можно лечить посредством применения композиций и способов, описанных в настоящей заявке, включая гематологические раковые заболевания (например, лейкоз, включая острый миелоидный лейкоз (ОМЛ), Т- или В-клеточные лимфомы, миеломы и другие). Кроме того, термин «рак» может относиться к любой ускоренной пролиферации клеток, включая солидные опухоли, асцитные опухоли, гематологические или лимфоидные или другие злокачественные заболевания; злокачественные опухоли соединительной ткани; метастазирование; минимальное остаточное заболевание после трансплантации органов или стволовых клеток; раковые заболевания с множественной лекарственной устойчивостью, первичные и вторичные злокачественные опухоли, ангиогенез, связанный со злокачественной опухолью или другие формы рака. Также подразумевается в рамках раскрытых в настоящей заявке вариантов реализации специфические варианты реализации, где включен только один из упомянутых выше типов заболеваний или где определенные состояния могут быть исключены в независимости от того, характеризуются ли они сверхэкспрессией целевого антигена.
Определенные способы лечения или профилактики, рассматриваемые в настоящей заявке, включают введение клетки-хозяина (которая может быть аутологической, аллогенной или изогенной), содержащей требуемую молекулу нуклеиновой кислоты, как описано в настоящей заявке, которая стабильно интегрирована в хромосому клетки. Например, такую клеточную композицию можно получить ex vivo с использованием аутологических, аллогенных или изогенных клеток иммунной системы (например, Т-клеток, антигенпрезентирующих клеток, клеток-естественных киллеров), чтобы ввести требуемую направленную против антигена Т-клеточную композицию субъекту вместе с экспрессирующей антиген клеточной композицией в качестве адоптивной иммунотерапии.
Используемое в настоящей заявке введение композиции или проведение терапии относится к доставке вышеуказанной композиции субъекту в независимости от пути или способа доставки. Введение можно осуществлять непрерывно или с периодичностью и парентерально. Введение можно осуществлять для лечения субъекта, у которого уже подтверждено распознаваемое состояние, заболевание или болезненное состояние, или для лечения субъекта, предрасположенного или имеющего риск развития подобного состояния, заболевания или болезненного состояния. Совместное введение с дополнительной терапией может включать одновременную и/или последовательную доставку множества средств в любом порядке и при любой схеме приема (например, антигенспецифичные рекомбинантные Т-клетки хозяина и экспрессирующие антиген клетки с одним или более цитокинами; иммуносупрессивная терапия, например, ингибиторами кальциневрина, кортикостероидами, ингибиторами микротрубочек, низкой дозой пролекарства микофеноловой кислоты или любой их комбинацией).
В определенных вариантах реализации субъекту вводят множество доз рекомбинантных Т-клеток хозяина, как описано в настоящей заявке, которые могут быть введены в интервалах между введениями, составляющими от приблизительно две недели до приблизительно четырех недель, и субъекту может быть необязательно введена экспрессирующая антиген клетка, как описано в настоящей заявке, одновременно, параллельно или последовательно с введениями рекомбинантных (модифицированных) Т-клеток. В дополнительных вариантах реализации цитокин вводят последовательно при условии, что субъекту вводили рекомбинантную Т-клетку хозяина по меньшей мере три или четыре раза перед введением цитокина. В определенных вариантах реализации цитокин вводят подкожно (например, ИЛ-2, ИЛ-15, ИЛ-21). В еще одних дополнительных вариантах реализации субъект, проходящий лечения, дополнительно получает иммуносупрессивную терапию, например, ингибиторами кальциневрина, кортикостероидами, ингибиторами микротрубочек, низкой дозой пролекарства микофеноловой кислоты или любой их комбинацией. В еще одних дополнительных вариантах реализации субъект, проходящий лечение, получил немиелоаблативный или миелоаблативный трансплантат гемопоэтических стволовых клеток (например, аутологический, аллогенный), при этом терапия может быть проведена спустя по меньшей мере два месяца до по меньшей мере трех месяцев после миелоаблативного или немиелоаблативного трансплантата гемопоэтических стволовых клеток.
Эффективное количество терапевтической или фармацевтической композиции относится к количеству, достаточному в дозах и в течение необходимых периодов времени для достижения требуемых клинических результатов или эффективного лечения, как описано в настоящей заявке. Эффективное количество может быть доставлено в результате одного или более введений. В случае введения субъекту, у которого уже известно или подтверждено заболевание или болезненное состояние, термин «терапевтическое количество» может быть использован в отношении лечения, тогда как термин «профилактически эффективное количество» может быть использован для описания введения эффективного количества субъекту, который предрасположен или имеет риск развития заболевания или болезненного состояния (например, повторного проявления), в качестве профилактического курса.
Уровень иммунного ответа цитотоксических Т-лимфоцитов, содержащих CAR, (CAR-CTL) можно определить с помощью любого из множества иммунологических способов, описанных в настоящей заявке, и обычно применяемых на практике в данной области техники. Уровень иммунного ответа CAR-CTL можно определить перед и после введения любой из описанных в настоящей заявке модифицированных гемопоэтических стволовых клеток, клеток иммунной системы (например, Т-клеток) или любой их комбинации. Анализы цитотоксичности для определения активности CTL можно провести с использованием любой из нескольких техник и способов, обычно применяемых на практике в данной области техники (см., например, Henkart et al., "Cytotoxic T-Lymphocytes" in Fundamental Immunology, Paul (ed.) (2003 Lippincott Williams & Wilkins, Philadelphia, PA), pages 1127-50, и источники, цитируемые в них).
Антигенспецифичные Т-клеточные ответы, как правило, определяют путем сравнения наблюдаемых Т-клеточных ответов по любому из описанных в настоящей заявке функциональных параметров Т-клеток (например, пролиферации, высвобождению цитокинов, активности CTL, измененному фенотипу маркеров клеточной поверхности и т.д.), которое может быть проведено между Т-клетками, которые контактировали с распознаваемым антигеном в подходящем контексте (например, антиген или антиген-АПК, используемая для праймирования или активирования модифицированных Т-клеток), и Т-клетками из той же исходной популяции, которые вместо этого контактируют с отличным по структуре или нерелевантным контрольным антигеном. Ответ на распознаваемый антиген, который сильнее со статистической значимостью, чем ответ на контрольный антиген, указывает на наличие антигенспецифичности.
Биологический образец может быть получен от субъекта для определения наличия и уровня иммунного ответа, как описано в настоящей заявке. Термин «биологический образец», используемый в настоящей заявке, может представлять собой образец крови (из которого может быть получена сыворотка или плазма), биоптат, биологическую жидкость (например, лаваж легкого, асцит, смывы со слизистых оболочек, синовиальная жидкость), костный мозг, лимфатические узлы, эксплантат ткани, органную культуру или любой другой препарат ткани или клеток от субъекта или из биологического источника. Биологические образцы можно также получить от субъекта перед получением любой иммуногенной композиции, такой биологический образец является пригодным для применения в качестве контроля для установления исходных (то есть до иммунотерапии) данных.
Фармацевтические композиции, описанные в настоящей заявке, могут быть представлены в однодозовых или многодозовых контейнерах, таких как запаянные ампулы или флаконы. Такие контейнеры могут быть заморожены для сохранения стабильности состава до срока. В определенных вариантах реализации одна доза содержит рекомбинантные клетки-хозяева, как описано в настоящей заявке, в дозе приблизительно 106 клеток/м2 до приблизительно 1011 клеток/м2. Разработка подходящих схем приема и лечения для применения конкретных композиций описано в настоящей заявке во множестве различных схем лечения, включая, например, парентеральное или внутривенное введение или состав.
Если субъекту вводят композицию парентерально, композиция также может включать стерильный раствор или суспензию на основе воды или масла. Подходящие нетоксичные приемлемые для парентерального введения разбавители или растворители включают воду, раствор Рингера, изотонический физиологический раствор, 1,3-бутандиол, этанол, пропиленгликоль или полиэтиленгликоли в смесях с водой. Водные растворы или суспензии могут дополнительно содержать одно или более буферных веществ, таких как ацетат натрия, цитрат натрия, тетраборат натрия или виннокислый натрий. Конечно, любой материал, используемый для приготовления любой единицы дозирования препарата, должен быть фармацевтически чистым и по существу нетоксичным в используемых количествах. Кроме того, активные соединения могут быть включены в препарат или составы с замедленным высвобождением. Термин «форма единицы дозы», используемый в настоящем изобретении, относится к физически отдельным единицам, подходящих в качестве однократных доз для субъекта, проходящего лечение; каждая единица может содержать заранее определенное количество рекомбинантных клеток или активного соединения, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с подходящим фармацевтическим переносчиком.
В целом, подходящая схема приема и лечения предусматривает активные молекулы или клетки в количестве, достаточном для обеспечения терапевтического или профилактического эффекта. Мониторинг подобного ответа можно осуществлять путем определения наличия улучшенного клинического исхода (например, более частых ремиссий, частичных или полных, или увеличения по времени безрецидивной выживаемости) у субъектов, проходящих лечение, по сравнению с субъектами, не проходящими его. Повышение в уровнях показателей предсуществующих иммунных ответов на опухолевый белок в целом коррелирует с улучшенным клиническим исходом. Подобные иммунные ответы можно в целом оценить с использованием стандартных анализов пролиферации, цитотоксичности или высвобождения цитокинов, которые являются рутинными в данной области техники и могут быть выполнены с использованием образцов, полученных от субъекта до и после лечения.
ПРИМЕРЫ
ПРИМЕР 1
Характеризация ROR1 CAR-T-клеток для иммунотерапии адоптивного переноса
Сигнальные молекулы 4-1ВВ и CD3ζ, человека и макаки высококонсервативны (95%), и иммунорецепторный тирозиновый активирующий мотив CD3ζ идентичен на 100%. С целью обеспечения функциональности ROR1 CAR (химерных антигенных рецепторов для трансмембранного рецептора протеинтирозинкиназы 1) в Т-клетках макак, Т-клетки трансдуцировали ROR1 CAR, кодирующими сигнальные домены 4-1ВВ и CD3ζ, человека и макаки, и оценивали распознавание ROR1+ клеток-мишеней. С целью обеспечить селективный маркер для очистки трансдуцированных Т-клеток включали последовательность, кодирующую tCD19 макака-резуса, в вектор справа от элемента Т2А, опосредующего рибосомальный пропуск (Berger et al., J. Med. Primatol. 40:88, 2011). Распознавание K562/ROR1 опухолевых клеток Т-клетками макака, трансдуцированными ROR1 CAR, содержащим 4-1ВВ / CD3ζ человека, или ROR1 CAR, содержащим 4-1ВВ / CD3ζ макака, было эквивалентным (Фиг. 1А). Соответственно, исследования безопасности in vivo с использованием конструкции, содержащей сигнальные домены человека, использовали для анализа потенциальной клинической трансляции этого вектора.
Для опытов по адаптивному переносу получали образцы периферической крови от трех взрослых макак-резусов и стимулировали МКПК от каждого животного с помощью МАТ против CD3/CD28, а затем Т-клетки трансдуцировали ретровирусным вектором с ROR1 CAR. Средняя эффективность трансдукции CD4+ и CD8+ Т-клеток, измеренная по коэкспрессии tCD19, составила 28,2% (6,6-58,1%), и трансдуцированные клетки обогащали до чистоты более 90% с помощью иммуномагнитного разделения спустя 4-5 дней после трансдукции (Фиг. 1В). После экспансии проводили второе иммуномагнитное разделение для очистки CD4+ и CD8+ CAR-T-клеток и размножение каждой субпопуляции осуществляли раздельно, чтобы была возможность образования смеси 1:1. Это гарантировало однообразную композицию ROR1 CAR-T-клеток в каждом опыте по адоптивному переносу. Дополнительно получали аутологические CD4+ и CD8+ Т-клетки, которые были модифицированы для экспрессии EGFRt или tCD34, и готовили контрольные трансдуцированные CD4+ и CD8+ Т-клетки в виде смеси 1:1 для коинфузии с ROR1 CAR-T-клетками.
Подтверждали функцию ROR1 CAR в CD4+ и CD8+ Т-клетках с помощью анализов цитотоксичности, пролиферации и высвобождения цитокинов после совместного культивирования с клетками K562/ROR1. CD8+ ROR1 CAR-T-клетки лизировали клетки-мишени K562/ROR1 более эффективно, чем CD4+ ROR1 CAR-T-клетки (Фиг. 1С), и обе субпопуляции пролиферировали и специфично вырабатывали цитокины в ответ на клетки K562/ROR1 (Фиг. 1D).
ПРИМЕР 2
ROR1 CAR-T-клетки являются функциональными in vivo
С целью определения, могут ли быть аутологические ROR1 CAR-T-клетки безопасно перенесены, и для анализа их персистенции и миграции in vivo, вводили дозу 1×108 ROR1 CAR-T-клеток/кг (отношение CD4:CD8 1:1) одному макаку. Эта доза клеток меньше, чем доза специфичных к цитомегаловирусу (ЦМВ) Т-клеток, безопасно вводимой макакам, но равна или превышает дозу, применяемую в клинических исследованиях CAR-Т-клеточной терапии CD19+ В-клеточных злокачественных опухолей (Maus et al., Blood 123:2625, 2014). Параллельно вводили такую же дозу EGFRt+ Т-клеток для контроля персистенции и миграции клеток. Осуществляли мониторинг животного после инфузий Т-клеток на наличие лихорадки, респираторного дистресса, аппетита, диарею и потерю веса и анализировали образцы крови до и после инфузии по показателям общего анализа крови, биохимическим показателям сыворотки и уровню цитокинов. При данной дозе клеток не было отмечено никаких мгновенных или отсроченных клинических нарушений. Масса тела, общий анализ крови и биохимические показатели сыворотки крови остались в нормальных пределах за исключением транзиторного повышения креатинфосфокиназы (КФК) из мышц, наблюдаемого у макак после внутримышечных (в/м) инъекций кетамина для седации животного перед инфузиями Т-клеток (Фиг. 2А). Уровни ИФН-γ и ИЛ-6 в плазме были повышенными в 1 день после инфузии ROR1 CAR-T-клеток, но вернулись в норму на 3 день (Фиг. 2В). Не наблюдалось повышения в уровнях ИФН-γ и ИЛ-6 после переноса в 5 раз более высокой дозы аутологических Т-клеток, трансдуцированных только маркерным геном, отдельному животному (данные не показаны), что указывает на то, что увеличенные уровни цитокинов после инфузии ROR1 CAR-T-клеток отражают транзиторную активацию CAR-T-клеток in vivo.
Анализ частоты ROR1 CAR-T-клеток и контрольных Т-клеток в крови показал различие, начинающееся в самые ранние моменты времени после инфузии. Определяли ROR1 CAR-T-клетки в крови спустя 1 день после инфузии с частотой 0,3% CD4+ и 0,8% CD8+ Т-клеток (7 клеток/мкл и 6 клеток/мкл), и их персистенция была на уровнях 4-11 клеток/мкл в течение следующих 2 недель. Значения частоты контрольных CD4+ и CD8+ EGFRf+ Т-клеток были выше в 1 день (6,2% CD4+ и 4,6% CD8+ Т-клеток, соответствующие 137 клеткам/мкл и 36 клеткам/мкл). Количество EGFRt+ Т-клеток постепенно снижалось до стабильных уровней в 6-13 клеток/мкл в течение последующих 4 недель (Фиг. 2C-D). Количественный ПЦР-анализ на трансген-специфичные последовательности подтвердил различную картину персистенции in vivo (Фиг. 2Е).
Данные о персистенции указывали, что ROR1 CAR-T-клетки могут мигрировать из крови, возможно, в ткани, где может экспрессироваться ROR1. Ранее было показано, что субпопуляция незрелых В-клеток в костном мозге (КМ) экспрессирует ROR1 и адоптивно перенесенные Т-клетки макаки мигрируют в костный мозг и лимфатические узлы (ЛУ) (Hudecek et al., Blood 116:4532, 2010). Таким образом, аликвоты образцов костного мозга и лимфатических узлов, полученные до и на 5 день после инфузии, анализировали на наличие как ROR1+ В-клеток, так и перенесенных Т-клеток. EGFRt+ и ROR1 CAR-T-клетки присутствовали на 5 день после инфузии в образцах костного мозга и лимфатических узлов, но ROR1 CAR-T-клетки были представлены с частотой в 1,1-2,3 раза выше, чем контрольные EGFRt+ Т-клетки (Фиг. 3А). Применяли стратегию гейтирования для обнаружения субпопуляции CD19+CD45промежуточный В-клеток в отношении суспензии клеток костного мозга, которые содержат В-клетки на стадии пре-BII-крупных клеток, экспрессирующих ROR1 у человека (данные не показаны). Обнаруживали экспрессию ROR1 на субпопуляции CD19+CD45промежуточный В-клеток (8.3%) в костном мозге, полученном перед инфузией Т-клеток, и эта популяция была элиминирована в образце костного мозга, полученном на 5 день после переноса ROR1 CAR-T cells (Фиг. 3В). Подсчет CD19+ В-клеток периферической крови, которые являются ROR1-, показал, что ROR1 CAR-T-клетки не оказывают влияния на пул зрелых CD19+ В-клеток в течение 28 дней исследования (Фиг. 3С). Эти результаты показывают, что перенесенные ROR1 CAR-T-клетки мигрировали в костный мозг и распознали и элиминировали ROR1+ В-клетки-предшественники, но не вызвали органной токсичности или истощения зрелых В-клеток.
С целью подтверждения, что ROR1 CAR-T-клетки остаются функциональными in vivo, МКПК, полученные спустя одну неделю после инфузии, стимулировали клетками K562/ROR1, форболмиристатацетатом (ФМА)/иономицином или только культуральной средой. МКПК, полученные до инфузии, и ROR1 CAR-T-клетки служили контролем. После 4 часов стимуляции клетки анализировали на экспрессию CD107A, который является маркером дегрануляции после распознавания антигена CD8+ Т-клетками (Chan and Kaur, J. Immunol. Methods 325:20, 2007). Было обнаружено повышение экспрессии CD107A в субпопуляции CD8+ROR1 CAR-T-клеток, персистирующих in vivo после стимуляции, и это повышение было на уровне подобном тому, что наблюдался у ROR1 CAR-T-клеток перед инфузией (Фиг. 3D). Таким образом, перенесенные ROR1 CAR-T-клетки, которые персистировали в крови in vivo, остались функциональными, демонстрируя отсутствие наблюдаемой органной токсичности за исключением элиминации предшественников В-клеток, которая не была вызвана нарушением функции ROR1 CAR-T-клеток.
ПРИМЕР 3
ROR1 CAR-T-клетки реагируют на антиген in vivo
Инфузия более высоких доз CAR-T-клеток может быть необходима для лечения экспрессирующих ROR1 злокачественных опухолей и может выявить токсичность в отношении нормальных тканей, особенно если CAR-T-клетки были активированы in vivo путем распознавания опухолевых клеток, экспрессирующих высокие уровни ROR1. В ходе анализа экспрессии ROR1 на В-клетках у макак, было отмечено, что в отличие от человека, некоторые животные имели высокую частоту зрелых В-клеток в лимфатических узлах, экспрессирующих ROR1 (данные не показаны). Отобрали двух животных с высокими уровнями ROR1+ В-клеток в лимфатических узлах для анализа безопасности более высокой дозы (5×108/кг) ROR1 CAR-T-клеток, так как по опыту работы с первым животным предположили, что снижение ROR1+ В-клеток предоставляло суррогат функционирования CAR-T-клеток in vivo. tCD34 использовали в качестве маркерного гена в контрольных Т-клетках у этих животных, так как обогащение CD34 было более эффективным, чем отбор по EGFRt, что облегчало получение более высокой дозы Т-клеток, необходимой для данного эксперимента. С целью получения максимальной вероятности того, что активация ROR1 CAR-T-клеток in vivo может выявить токсичность, применяли инфузию аутологических Т-клеток, трансфицированных для экспрессии tROR1 на клеточной поверхности, спустя пять дней после введения CAR-T-клеток, если ранее не наблюдалась токсичность (Фиг. 4А).
Более высокая доза ROR1 CAR-T-клеток хорошо переносилась, и хотя CD4+ и CD8+ ROR1 CAR-T-клетки легко определялись у обоих животных, снова наблюдали сниженную частоту ROR1 CAR-T-клеток по сравнению с контрольными tCD34 Т-клетками в крови спустя один день после адоптивного переноса (Фиг. 4В). Различия в пиковой частоте не отражали уникальные свойства маркерных генов, которые могли повлиять на миграцию, поскольку коинфузия Т-клеток, меченных только tCD19 или tCD34, контрольному животному, обеспечивала эквивалентно высокие уровни обеих популяций in in vivo (данные не показаны).
Клеточные суспензии из МКПК, костного мозга и лимфатических узлов, полученные от каждого животного на 3 день после инфузии, окрашивали для определения наличия перенесенных Т-клеток. ROR1 CAR-T-клетки, но не контрольные tCD34+ Т-клетки, присутствовали с большей частотой в костном мозге, чем в МКПК у обоих животных, и частота ROR1 CAR-T-клеток в лимфатических узлах превысила частоту контрольных tCD34+ Т-клеток (Фиг. 4С). Аккумуляция ROR1 CAR-T-клеток в костном мозге и лимфатических узлах на 3 день после адоптивного переноса совпала с более 65%-80% снижением количества ROR1+ В-клеток по сравнению с образцами костного мозга и лимфатических узлов до лечения (см. Фиг. 4D и 4Е). Эти данные согласуются с теми, что наблюдали у первого животного, проходившего лечение более низкой дозой ROR1 CAR-T-клеток, и показывает, что перенесенные ROR1 CAR-T-клетки мигрируют из крови и аккумулируются в местах, где располагаются ROR1+ В-клетки.
С целью определения, может ли выявить систематическое активирование ROR1 CAR-T-клеток in vivo токсичность, проводили инфузию каждому животному аутологических Т-клеток, которые были трансдуцированы для экспрессии tROR1, (tROR+ Т-клеток). tROR1-модифицированные Т-клетки распознавались in vitro аутологическими ROR1 CAR-T-клетками также эффективно, как клетки K562/ROR1 (данные не показаны).
Инфузия tROR+ Т-клеток не вызывала острых побочных эффектов ни у одного из животных, и было отмечено повышение количества CD4+ и CD8+ ROR1 CAR-T-клеток до 30 клеток/мкл и 52 клеток/мкл (А13011), и до 22 клеток/мкл и 34 клеток/мкл (А13002) соответственно за 5-7 дней (Фиг. 5А). Это отражало повышение до 7,7 раз (А13011) и 4,3 раз (А13002) количества ROR1 CAR-T-клеток без существенных изменений в количестве эндогенных или CD4+ and CD8+ Т-клеток с маркером tCD34 (Фиг. 5А-В). С целью определения, элиминировали ли ROR1 CAR-T-клетки tROR+ Т-клетки in vivo, образцы МКПК, полученные на 1, 5 и 7 день после стимуляции с помощью Т-АПК, анализировали на наличие циркулирующих tROR+ Т-клеток. У А13011 tROR+ Т-клетки присутствовали с частотой 1,0% от CD8+ Т-клеток спустя один день после переноса, и большинство этих клеток демонстрировали только низкие уровни экспрессии ROR1 по сравнению с вводимьми tROR1+ Т-клетками (Фиг. 5С). Важно, что количество ROR1низкий Т-клеток снижалось дополнительно до частоты 0,3% и менее 0,1% от CD8+ Т-клеток на 5 и 7 день соответственно (Фиг. 5С). Схожую картина персистенции tROR+ Т-клеток наблюдали у А13002 с только редкими ROR1низкий Т-клетками, персистирующими in vivo (данные не показаны). Напротив, значения частоты tROR1+ Т-клеток в крови на 1, 5 и 7 дни составляли 5,5%, 8,6% и 8,0% после инфузии этих Т-клеток животному без обнаруживаемых ROR1 CAR-T-клеток (Фиг. 5С и 5D).
В итоге, это показывает, что рекомбинантно созданные «антигенпрезентирующие клетки» (в данном случае Т-клетки, вырабатывающие антиген, но можно применять в качестве АПК другие клетки иммунной системы и даже гемопоэтические стволовые клетки), экспрессирующие тот же антиген, распознаваемый CAR-модифицированными Т-клетками, могут осуществлять бустинг или усиление эффективности иммунотерапии путем адоптивного переноса.
Различные варианты реализации, описанные выше, могут быть скомбинированы для обеспечения дополнительных вариантов реализации. Все патенты США, публикации заявок на патенты США, заявки на патенты США, иностранные патенты, иностранные заявки на патенты и непатентные публикации, на которые есть ссылка в настоящем описании и/или перечисленные в информационном листке заявки включены полностью в настоящую заявку посредством ссылки. Аспекты вариантов реализации могут быть модифицированы при необходимости применить идеи различных патентов, заявок и публикаций для обеспечения других дополнительных вариантов реализации.
Эти и другие изменения могут быть внесены в варианты реализации в свете упомянутого выше описания. В целом, в последующей формуле изобретения используемые термины не должны толковаться как ограничивающие формулу изобретения конкретными вариантами реализации, раскрытыми в описании и в формуле изобретения, но должны толковаться как включающие все возможные варианты реализации вместе с полным объемом эквивалентов, на которые имеет право данная формула изобретения. Соответственно, формула изобретения не ограничена настоящим описанием.
Реферат
Группа изобретений относится к медицине и касается способа улучшения адоптивной клеточной иммунотерапии, включающего (a) введение субъекту эффективного количества популяции модифицированных Т-клеток человека, содержащих молекулу нуклеиновой кислоты, которая кодирует экзогенный антигенсвязывающий белок, при этом указанный антигенсвязывающий белок содержит гидрофобную часть, расположенную между внеклеточным связывающим компонентом и внутриклеточным эффекторным компонентом; и (b) введение субъекту эффективного количества популяции модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или их комбинации, содержащих молекулу нуклеиновой кислоты, которая кодирует указанный антиген. Группа изобретений также касается способа лечения заболевания, ассоциированного с экспрессией антигена у субъекта, включающего стадии обеспечения улучшенной адоптивной клеточной иммунотерапии; композиции адоптивной клеточной иммунотерапии, содержащей (i) популяцию модифицированных Т-клеток человека и (ii) популяцию модифицированных гемопоэтических клеток-предшественников человека, модифицированных клеток иммунной системы человека или комбинацию указанных клеток. Группа изобретений обеспечивает увеличение эффективности адоптивной клеточной иммунотерапии. 5 н. и 69 з.п. ф-лы, 3 пр., 5 ил.

Комментарии