Терапевтическая вакцина против рака на основе стрессовых белков в качестве иммуногенов - RU2694761C9
Код документа: RU2694761C9
Чертежи



Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается нового терапевтического подхода к лечению рака на основе белков стресса - "белковых шаперонов", включая белки типа HSP и/или GRP или другие белки, участвующие в механизмах устойчивости (LRPs, CTL4, PD-L1 и т.п.). В частности, оно касается способа получения фармацевтических композиций или терапевтических вакцин, самих таких фармацевтических композиций или терапевтических вакцин и способа лечения для терапевтического лечения рака.
Уровень техники
Иммунная система основывается на двух защитных механизмах, а именно: врожденном иммунитете, который является быстрым, но неспецифическим; и приобретенном иммунитете, который медленнее, но специфичен и обладает памятью. Эти два дополняющих друг друга механизма обеспечивают способность к отражению внутренней "агрессии" путем мобилизации клеток, либо непосредственно при опосредованном клетками иммунном ответе, либо через секрецию активных молекул (типа иммуноглобулинов, цитокинов и др.) при гуморальном иммунном ответе.
Иммунитет активно участвует в возникновении и развитии рака. Согласно теории трех фаз (3Es), процесс канцерогенеза основывается на двойственной функции иммунитета: защитном процессе иммунного надзора, направленном на уничтожение опухолевых клеток, и "отборе" устойчивых раковых клеток в ответ на механизм элиминации. Теория трех фаз включает в себя первую фазу, которая именуется фазой элиминации, при которой иммунная система борется с пролиферацией опухоли, что влечет за собой изменения связанных с опухолью тканей и ее окружения (мобилизацию неспецифических клеток - макрофагов, NKs, DC), секрецию антипролиферативных, апоптотических, ангиостатических молекул, выработку цитокинов, мобилизацию и активацию CD4 и CD8. Во время второй фазы, которая именуется фазой равновесия под действием иммунной системы, устраняются "чувствительные" клетки опухоли и начинается иммунный отбор наиболее устойчивых клеток. При этом приводятся в действие такие механизмы устойчивости, как устойчивость к апоптозу, секреция ингибирующих цитокинов (TGF-β, IL-10, PGE2, IDO), изменение презентации антигенов (частичная или полная потеря экспрессии главного комплекса гистосовместимости (МНС) класса I), секреция нейтрализующих молекул и экспрессия MICA и MICB, "контрнаступление" опосредованного клетками иммунитета путем экспрессии FAS-L, PD-L1, приводящее к гибели Т-лимфоцитов. Во время этой фазы количество разрушаемых клеток опухоли находится в равновесии с количеством устойчивых клеток. Эта фаза равновесия соответствует фазе ремиссии, наблюдаемой во время лечения, а также это фаза селекции для отбора наиболее вирулентных клонов по их способности к противостоянию системе иммунной защиты или терапии. Во время третьей фазы, которая именуется фазой избежания, устойчивые к различным защитным механизмам иммунной системы клетки, выработавшие одно или несколько средств избежания, пролиферируют в отсутствие какого-либо контроля. Затем раковые клетки наращивают опухолевую массу, что является клиническим проявлением физиологического явления избежания. Аналогичный феномен избежания также наблюдается на развитых и метастатических стадиях раковых заболеваний при явлениях устойчивости к терапии.
Противораковая терапия включает хирургию, целью которой является прежде всего удаление или уменьшение опухоли, но такое "механическое" воздействие не оказывает никакого реального ингибирующего влияния на процесс канцерогенеза и обычно дополняется различными другими способами лечения, направленными на "устранение" причины рака. Лучевая терапия имеет целью вызвать изменения в ДНК быстро пролиферирующих клеток, как в случае с опухолевыми клетками. Побочные эффекты лучевой терапии двойственные: облучаются даже и здоровые клетки, что вызывает их разрушение или генетические изменения, которые могут привести к их "канцеризации", а опухолевые клетки вырабатывают устойчивость к индуцированному радиацией апоптозу посредством выработки специальных белков-шаперонов (HSP, GRP и др.), что приводит к феномену избежания. Химиотерапия имеет целью устранение опухолевых клеток, действуя либо на сами клетки, либо ингибируя определенные метаболические пути путем прямого взаимодействия с ДНК (электрофильные средства, интеркалирующие средства, расщепляющие вещества), косвенного взаимодействия с ДНК (ингибиторы синтеза ДНК, как-то антиметаболиты, ингибиторы топоизомераз, ингибиторы образования веретена), ингибиторы неоваскуляризации, ингибиторы протеасом. При этом опять же опухолевые клетки вырабатывают механизмы устойчивости, и, несмотря на реализацию стратегии полихимиотерапии, наблюдаются явления рецидива с массированной пролиферацией опухоли, свидетельствующей о приспособляемости и селекции клеток, что можно рассматривать аналогично природным феноменам избежания, как описано в теории 3Es с участием иммунной системы.
Иммунотерапия включает пассивную иммунотерапию, которая заключается в обеспечении значительного количества эффекторов, и активную иммунотерапию, целью которой является запуск специфического иммунного ответа. Пассивная иммунотерапия основывается на введении антител с тем, чтобы блокировать рецептор, вызвать лизис клеток, стимулировать цитотоксичность, снять ингибирование апоптоза (цетуксимаб-Erbitux®, бевацизумаб-Avastin®, ритуксимаб-Mabthera® и др.). Другая стратегия стимуляции защитных иммунных реакций против опухоли - применение цитокинов (IL2, Infy и др.). Целью активной иммунотерапии или иммунизации посредством вакцинации является иммунизация пациентов против рака в соответствии с различными стратегиями: активация иммунной системы посредством активации дендритных клеток, агонистов TLR, лизатов опухолевых клеток, непролиферирующих опухолевых клеток, либо модифицированных, либо не модифицированных. Эти подходы составляют новые лекарственные препараты продвинутой терапии (ATMPs). Они являются перспективными и дают хорошие результаты, особенно в сочетании с другими методами лечения. Первым средством активной иммунотерапии, которое было одобрено Управлением по контролю за продуктами и лекарствами (FDA), был Sipuleucel-T Provenge® на основе активации Т-лимфоцитов (TLs) пациента при культивировании в присутствии определенных опухолевых антигенов. Однако и с этими средствами наблюдаются явления избежания, сходные с естественным феноменом избежания, как описано в теории 3Es с участием иммунной системы.
Таким образом, все еще существует потребность в разработке новых стратегий терапии для лечения рака, которые могут обеспечить конкретную собственную эффективность и/или способствовать стратегии политерапии.
Разнообразные противоопухолевые механизмы, как бы их ни было много, все опираются на основополагающую стратегию прямой или косвенной атаки опухолевых клеток, причем последней стадией является лизис клеток или их апоптоз. Таким образом, ключевым феноменом, как представляется, является фактор устойчивости к апоптозу, так как он вызывает прямое избежание (ингибирование индуцированного апоптоза) или косвенное избежание путем защиты опухолевых клеток от промежуточных механизмов разрушения.
В ряде исследований были получены средства для лучшего понимания явлений устойчивости, в частности, роли "белковых шаперонов" или белков стресса в устойчивости к апоптозу. В частности, уже известен защитный эффект белков теплового шока (HSP110, HSP90, HSP70, HSP60, HSP20, убиквитина) и GRP (регулируемых глюкозой белков) GRP94, GRP78 (BiP) и GRP58, локализованных в основном в эндоплазматическом ретикулуме (они также причисляются к семейству белков стресса). Также делается упор на факторах устойчивости, привязанных более конкретно к различным видам лечения (множественная лекарственная устойчивость), включая сюда и белки множественной устойчивости (MRP), такие как GP170, VMP1 и LRP.
Механизм устойчивости к стрессу, в частности, к тепловому шоку, оказался универсальным и имеется у всех живых организмов (бактерий, растений, животных). Функция HSPs характеризуется защитной и репарационной активностью определенных белков и ферментов путем образования молекулярных комплексов, ингибирующих денатурацию и образование "неправильных связей" вследствие "метаболических атак" (гипоксия, низкая концентрация углеводов и т.п.), агрессивных физических воздействий (тепловое, радиация) или химических/лекарственных воздействий.
В настоящее время существуют новые стратегии, в которых в качестве терапевтической мишени применяются HSPs. В частности, были разработаны некоторые молекулы для того, чтобы заингибировать HSP90, но с неоднозначными результатами и высоким уровнем токсичности. Одним из наиболее передовых способов лечения является применение небольшой молекулы 17-AAG (танеспимицин или 17-аллиламино-17-десметоксигелданамицин; Len Neckers, Heat shock protein 90: the cancer chaperone. J Biosci 32(3) April 2007, 517-530, Indian Academy of Sciences), которая ингибирует функцию шаперона у HSP90 и проявляет перспективную клиническую активность, хотя и с рядом побочных эффектов. Точно так же небольшая молекула Ganetespib (STA-9090), ингибитор АТР-сайта у HSP90, сейчас тестируется на меланоме, равно как и другие молекулы, которые действуют на функции или на сайты HSP90 (Novobiocin, Shepherdine, ингибиторы изоформ и др.). /Другая мишень, которая рассматривается для исследования, это снятие ингибирования апоптоза путем воздействия на HSP70. Рассматриваются такие препараты, как ADD70 (молекулы аминокислот), PES (2-фенилэтиленсульфонамид), VER-155 008 (производное аденозина), МКТ077 (небольшая молекула). Наконец, предметом нескольких клинических исследований было применение "антисмыслового OGX-427", направленного против HSP27 и клустерина.
Кроме того, упоминалось и аутологическое применение HSP70 или его производных в качестве фактора иммунизации против опухолевых клеток у мышей. В работе A Menoret and J Le pendu (Proteines de choc thermique et antigenes tumoraux/Heat Shock Proteins and Tumour Antigens, Medecine/Sciences 1994; 10: 665-71) описана иммунизация мышей препаратами очищенного HSP70, которые оказались иммуногенными при условии их связи с опухолевыми пептидами. В работе Wirth D et al. (Arm. Med Vet. 2002, 146, 201-216) приведены исследования, показавшие, что вакцинация мышей препаратом HSP или перенос полученных из опухоли генов HSP70 вызывает иммунизацию их против введения аутологичных опухолевых клеток и вызывает регрессию уже возникших опухолей.
Тем не менее, в настоящее время представляется, что эти подходы имеют конкретную мишень с упором на тот или иной из стрессовых белков, но не предусматривают комбинированной стратегии, сосредоточенной на ингибировании "всего комплекта" защитных механизмов, вырабатываемых опухолевыми клетками. Так, уже отмечалось, что ингибирование HSP90 тоже должно вызывать защитный сигнал путем стимулирования секреции других HSPs (реакции теплового шока), таких как HSP27 и HSP70, тем самым повышая устойчивость к апоптозу и индуцируя химические средства защиты (A Menoret and J Hangman 1994, см. выше).
Целью настоящего изобретения является обеспечение всеобъемлющего общего подхода, то есть такого, который дает возможность воздействовать одновременно на несколько механизмов устойчивости, предпочтительно всей совокупности этих механизмов, которые вырабатываются опухолевыми клетками.
Целью изобретения также является получение возможности адаптировать такой подход к тому стрессу или стрессам, которым подвергаются опухолевые клетки in vivo, в частности, в ходе того лечения, которое применяется к пациентам.
Целью изобретения также является предложение такого подхода, в котором предусматривается стандартизация в связи с использованием клеточных линий.
Целью изобретения также является обеспечение того, чтобы в этом подходе учитывался тип и/или стадия опухолевых клеток, в частности, у подлежащего лечению пациента.
Целью изобретения также является предложение такого подхода, который сам по себе может составлять методику лечения или будет вспомогательной методикой другого терапевтического протокола.
Дальнейшей целью изобретения также является предложение такого подхода, который специфичен к пациентам.
Сущность изобретения
Целью настоящего изобретения является стимулирование иммунной системы с помощью белков стресса, ставших иммуногенными, в частности, посредством гаптенилирования, с тем, чтобы добиться устранения клеток, экспрессирующих данные факторы устойчивость (белки стресса). Такая иммунологическая обработка направлена на устранение или контролирование тех клеток, которые могут экспрессировать эти факторы устойчивости. Предлагаемый терапевтический подход предназначается, в частности, для применения против рака на основе следующих пунктов:
- опухолевые клетки вырабатывают механизмы устойчивости или избежания, когда они подвергаются "стрессу" естественным образом (иммунная система) или при терапевтическом воздействии (радиация, химиотерапия, иммунотерапия и т.п.);
- механизмы устойчивости влекут за собой вовлечение стрессовых белков типа HSP, GRP и других белков/гликопротеинов;
- белки стресса сами по себе не иммуногенны в естественных условиях, хотя при определенных условиях они могут обеспечивать "иммунную защиту" при вакцинации;
- определенные подходы против HSP (или против факторов устойчивости), видимо, также подвержены феномену избежания;
- окружение белка (кофакторы, субстраты и т.п.), по-видимому, является тем элементом, который следует принимать во внимание при запуске противоопухолевого защитного эффекта путем вакцинации.
Таким образом, изобретение касается, в частности, способа получения композиций, содержащих белки стресса, индуцируемые при воздействии стресса in vitro на культуры опухолевых клеток. Более конкретно, данным способом такие белки стресса получаются в иммуногенном виде, то есть они могут распознаваться иммунной системой пациента и вызывать у него иммунный ответ против этих белков и опухолевых клеток, содержащих такие белки. Способ предпочтительно включает в себя стадию инактивации опухолевых клеток с тем, чтобы сделать их непролиферирующими. Изобретение также касается композиций, в частности, фармацевтических композиций или терапевтических вакцин, содержащих такие белки. Изобретение также касается способов лечения рака посредством введения таких композиций, в качестве основной терапевтической стратегии или в сочетании (в частности, как вспомогательное средство) с другим протоколом лечения.
Изобретение касается, а способ дает возможность получать фармацевтические композиции, которые содержат несколько или все или же большинство белков стресса, экспрессируемых опухолевыми клетками в условиях воздействия на них стресса. Это составляет преимущество получаемого при этом препарата, который, будучи представителем нескольких белков стресса, позволяет фармацевтической композиции включать в себя целый ряд белков стресса, ставших иммуногенными, которые составляют дополнительные иммуногенные элементы, на которые сможет реагировать иммунная система пациента, а затем воздействовать на целый комплект опухолевых клеток и противодействовать механизмам устойчивости, которые различным образом выработались у этих опухолевых клеток под давлением со стороны иммунной системы и/или применяемого лечения.
Как правило, эти белки стресса находятся в композициях по изобретению в одной или нескольких из следующих форм: в свободном состоянии, в связанном с мембраной опухолевых клеток (в том числе внутри самой мембраны) состоянии, выставленными на поверхности опухолевых клеток, присутствующими внутри опухолевых клеток, связанными с фрагментами опухолевых клеток или с опухолевыми пептидами.
Следовательно, композиция по изобретению предпочтительно будет включать в себя один или несколько идентифицированных белков стресса, установленных к настоящему времени и на данный момент времени. В следующем разделе представлено несколько их семейств, известных специалистам в данной области.
Белки HSP подразделяются на шесть семейств в соответствии с молекулярной массой, но их конформации и характеристики в пределах одного и того же семейства могут варьироваться в зависимости от происхождения. Так, у белков HSP70 (которые включают HSP72 и 73, среди прочего) можно провести различие между теми, которые реагируют на тепловой шок (HSP70), и теми, на которых тепловой шок очень слабо влияет (HSP70).
HSP25/HSP27, которые слабо экспрессируются в нормальных клетках, подвергаются гиперэкспрессии в опухолевых клетках и должны играть роль в устойчивости к определенным процедурам и способствовать росту и развитию пролиферативных опухолевых клеток. /Другие роли - ингибирование апоптоза при взаимодействии с путями с участием каспазы-3, регуляция продукции TNF-α и пр.
Семейство HSP47 идентифицировано совсем недавно и его роль пока еще плохо установлена. В основном они участвуют в развитии соединительной ткани, в частности, при выработке коллагена. Поскольку они входят в число "белков теплового шока", то вероятно их участие в устойчивости опухолевых клеток, в частности, их участие в процессах неоваскуляризации опухолей. HSP40 также может играть роль "совместного шаперона" в сочетании с HSP70.
HSP60 (шаперонин) был идентифицирован в клетках бактерий (GroEL, то есть крупный белок роста Е. coli) и встречается у растений. Эти белки-шапероны принимают участие в третичной конформации структуры белков. Это семейство HSP может играть роль в иммунитете, в частности, при аутоиммунных заболеваниях.
Семейство HSP70 является одним из наиболее изученных, а вместе с HSP90 они являются наиболее распространенными. Существует несколько подклассов, которые либо экспрессируются клетками в "нормальном" состоянии, либо индуцируются сразу после стресса. Отличительные признаки этих HSPs включают способность взаимодействовать с другими белками во время трансляции (укладки), участие в мембранном транспорте, ингибирование апоптоза в качестве белка-шаперона. Активность HSP70 в качестве шаперона является сложной и влечет за собой участие нескольких факторов, таких как HSP40, Hip (белок, взаимодействующий с Hsc), Нор (белок, организующий Hsc-HSP90), которые обеспечивают АТФазную активность, необходимую для образования комплексов "шаперон-субстрат". Антиапоптозное действие HSP70, видимо, многогранно и включает в себя многочисленные механизмы ингибирования/активации на путях прокаспаз-9, -8, -3 (ингибирование), взаимодействия с путем р53 (стабилизация белка анти-Р53), ингибирования проапоптотических факторов (Вах), регуляции цитохрома С и др.
Белки HSP90 чаще всего экспрессируются конститутивно и присутствуют у всех эукариот. Они также подвергаются гиперэкспрессии при явлениях стресса и нацелены на стабилизацию и ренатурацию белков. Установлено несколько изоформ в соответствии с их расположением, происхождение и функциональными возможностями. После димеризации HSP90s приобретают способность к взаимодействию со своими шаперонами и при этом образуют белковые комплексы, которые способствуют мутации и защите молекул, участвующих в раковой трансформации клеток (стабилизации определенных белков): Р90 участвует в регуляции апоптоза (ингибирование Bcl-2 и Apaf-1), принимает участие в пролиферации клеток и метастазировании (hTERT, ММР2), ингибирует р53, участвует в мутациях путем изменения, а затем стабилизации белков.
Белки HSP110 (или 105) в основном индуцируются в результате воздействия стресса. Они могут участвовать в защите рибосом, которые особенно чувствительны при тепловом шоке. Их защитное действие в основном заключается в диссоциации белковых агрегатов и их повторной солюбилизации, что способствует реактивации этих белков. Белки HSP110 могут составлять подгруппу белков HSP70 с одинаковыми связывающими доменами, поэтому они обладают некоторыми близкими свойствами.
Другую большую группу белков стресса составляют GRPs (белки, регулируемые глюкозой). Как правило, они связаны с HSPs, а их главная роль в механизмах устойчивости связана с защитой структуры белков. Так, GRP78 (BiP) может выполнять роль шаперона с дефектными белками, подлежащими разрушению в норме, что объясняет устойчивость раковых клеток. GRP75, известный под названием "морталин", обладает антипролиферативным действием в нормальных клетках, которые после их дерегуляции могли бы участвовать в раковом перерождении, и в то же время дает обратный эффект путем инактивации р53, участвующего в регуляции апоптоза. GRP94 также участвует в защите неполностью собранных белков, у которых нарушена трехмерная конформация. Как и HSP70, он принимает участие в устойчивости к некоторым противораковым средствам.
Другие белковые факторы устойчивости, описанной как "множественная лекарственная устойчивость", как-то GP170, MRPs (семь различных белков), LRPs и описанный совсем недавно VMP1, принимают участие в терапевтическом избежании.
Раскрытие сущности изобретения 1. Способ получения
Итак, предметом изобретения является способ получения композиций, содержащих белки стресса опухолевых клеток, который включает следующие стадии:
i) получение опухолевых клеток в культуральной среде;
ii) подвергание опухолевых клеток из стадии i) стрессу и обеспечение того, чтобы эти клетки вырабатывали белки стресса в ответ на стресс;
iii) получение или извлечение подвергнутых стрессу опухолевых клеток и/или белков стресса;
iv) обработка подвергнутых стрессу опухолевых клеток и/или белков стресса, полученных на стадии iii), молекулой или способом, способным сделать белки стресса иммуногенными, предпочтительно методом гаптенилирования.
Культуральной средой может быть среда, дающая возможность поддерживать жизнеспособность клеток и/или их рост или размножение. Можно использовать любые среды, хорошо известные специалистам в данной области. Эти среды обычно включают основу культуральной среды типа "минимальной поддерживающей среды", которая позволяет выживание клеток, при этом можно добавить один или несколько митогенных факторов с сывороткой или используя определенные факторы роста ("синтетическая бессывороточная" среда). Для примера можно привести следующие стандартные среды: DMEM, ЕМЕМ, HBSS, EBSS, PBS, RPMI, а также другие среды, используемые для культивирования клеток без сыворотки - PANSEPJN, EX-CELL® и др., с добавлением или без добавления глютамина, инсулина, питательных веществ Хэма и т.п., в которые при необходимости можно добавлять сыворотку и/или факторы роста.
Стадия ii) предпочтительно выполняется в культуральной среде, содержащей опухолевые клетки в фазе роста или в фазе плато. Специалисты в данной области смогут легко определить, что клетки находятся в одной из этих фаз. Во-первых, можно заранее определить условия культивирования, позволяющие достичь этих фаз после определенного периода времени. Также можно определить, что эти фазы достигнуты, с помощью следующих методов: по кривой роста клеток, жизнеспособности, времени удваивания, анализу метаболитов или потреблению питательных веществ и пр.
Стресс применяется in vitro. Он может быть любого типа в смысле химической или физической природы, а продолжительность применения стресса может варьироваться в зависимости от типа применяемого стресса, природы и продолжительности применения, которые выбираются таким образом, чтобы гарантировать, что опухолевые клетки будут вырабатывать белки стресса на таком уровне, который подходит для изобретения, к примеру, с учетом противораковой терапии применительно к пациенту. Можно использовать следующие методы:
- облучение, в частности, облучение от 0,25 до 25 Гр, предпочтительно низкой дозы, то есть от 1 до 5 Гр, к примеру, около 2 Гр; продолжительность облучения может составлять от 1 до 20 мин, предпочтительно от 1 до 5 мин;
- тепловой шок, например, прогрессирующее постепенное или внезапное повышение температуры выше 37°С и достаточное для того, чтобы вызвать стресс, который служит для получения белков теплового шока; эта температура может составлять от 38°С до 45°С, предпочтительно от 40°С до 43°С; время содержания при этой температуре может составлять от 20 до 100 минут, предпочтительно от 30 до 60 минут; повышение температуры может продолжаться от 1 до 5 минут, к примеру, около 3 минут;
- химический шок с помощью вещества, которое применяется для индукции стресса, который служит для получения белков химического стресса; среди используемых веществ можно отметить такие спирты, как этанол (обычно используется в концентрации от 10% до 50% об/об); противоопухолевые вещества, используемые в химиотерапии, в частности, такого типа, как алкилирующие средства, интеркалирующие средства, к примеру, циклофосфамид, доксорубицин, вещества, вызывающие разрывы в ДНК, к примеру, цисплатин; в одном воплощении используется одно или несколько или же все лекарственные вещества, используемые при стандартном протоколе химиотерапии для рассматриваемого типа рака или применительно к пациенту; продолжительность контакта может составлять от 1 до 48 часов, предпочтительно от 20 часов до 26 часов; также можно применять по меньшей мере два из этих химических стрессов;
- метаболический стресс типа гипоксии, рН (в частности, путем подкисления ниже рН 6,5), дефицита вещества, применимого для роста или выживаемости опухолевых клеток, к примеру, глюкоза, дефицита вещества, необходимого для роста или выживания опухолевых клеток, к примеру, электролитов (баланс натрия, калия, кальция и т.п.); также можно применять по меньшей мере два из этих метаболических стрессов;
- комбинации по меньшей мере двух из этих типов стресса.
Условия для каждого типа стресса можно легко определить, имея в виду стресс этих живых клеток для того, чтобы вырабатывались белки стресса, но без апоптоза или гибели опухолевых клеток или слишком многих из них, как уже было сказано выше. Например, методы вестерн-блота и FACS-цитометрии дают возможность отслеживать продукцию конкретных белков стресса, к примеру, HSP, с помощью антител, направленных против этих белков. Такие антитела можно получить, как будет дополнительно изложено ниже в отношении некоторых примеров HSP. Кроме того, можно проверить с помощью рутинных тестов in vitro (к примеру, тестов доза-эффект), не будут ли условия стресса слишком резкими, что приведет к гибели опухолевых клеток.
В соответствии с одним отличительным признаком, при применении более 1 стресса предпочтительно они применяются последовательно. Предпочтительно после применения первого стресса соблюдается лаг-период перед применением следующего стресса и так далее в зависимости от количества стрессов. Предпочтительно после первого стресса проводится центрифугирование, а затем промывка и центрифугирование, после чего следует добавление свежей среды, лаг-период, а затем следующий стресс и т.д.
В соответствии с одним отличительным признаком способа по изобретению можно проверить экспрессию или продукцию факторов устойчивости или белков стресса и даже количественно их оценить. Специалисты в этой области имеют в своем распоряжении средства, позволяющие это, как-то анализ методом проточной цитометрии, к примеру, FACS, ELISA, вестерн-блот и т.п. Они могут подтвердить экспрессию или продукцию данного типа белков стресса, их принадлежность к определенному семейству и даже идентифицировать и количественно определить данный тип.
В соответствии с одним отличительным признаком способа по изобретению, за стадией iii) может следовать стадия iii-i), на которой полученное на предыдущей стадии подвергается обработке в соответствии с одним или несколькими из следующих методов: концентрирование твердых и белковых материалов, включая белки стресса и опухолевые клетки и их фрагменты, разделение или очистка белков стресса или опухолевых клеток, разделение или очистка опухолевых клеток или белков стресса, экстрагирование белков стресса.
В соответствии с изобретением, белки стресса подразделяются на внутриклеточные, внеклеточные свободные, внутримембранные (клеток или фрагментов клеток), на поверхности клеток или фрагментов клеток. В общем, подвернутые стрессу раковые клетки содержат внутриклеточные белки стресса и поверхностные белки стресса.
В соответствии с важным отличительным признаком способа, на стадии iv) проводится процесс обработки, который дает возможность сделать белки стресса иммуногенными или иммунокомпетентными, то есть способными вызывать in vivo иммунный ответ против них.
Промежуток времени между окончанием стадии применения стресса и началом следующей стадии будет достаточным для того, чтобы опухолевые клетки выработали белки стресса. Этот промежуток можно определить путем варьирования данного промежутка времени и определения или измерения изменения в экспрессии белков стресса. Например, можно использовать методы вестерн-блота и проточной цитометрии, напр., FACS, используя специфические антитела для отслеживаемых белков (см ниже). Этот промежуток предпочтительно составляет несколько часов, в частности, он может составлять от 5 ч до 24 ч. Этот промежуток может составлять менее 5 часов, его можно определить путем отслеживания продукции белков стресса, используя описанные выше методы вестерн-блота и FACS-цитометрии. Он также может составлять и более 24 ч, но такой длительный период может и не потребоваться, что также легко определяется с помощью вышеупомянутых методов измерения.
В соответствии с изобретением, молекула, которая служит средством для придания иммуногенности белкам стресса, вводится в продукт, полученный на стадии iii) или iii-i). Эта стадия iv) in vitro дает возможность, к примеру, соединить данную молекулу химической связью с присутствующими белками, будь то свободными или находящимися на поверхности или внутри клеточной мембраны или клеточной структуры, к примеру, опухолевой клетки или фрагмента опухолевой клетки. Как правило, молекула, к примеру, гаптен для гаптенилирования, не встречается естественным образом в опухолевых клетках или их окружении ("не встречающаяся в природе молекула").
Специалистам в данной области известны процедуры, которые дают возможность сделать белки иммуногенными (в частности, гаптенилирование), поэтому они могут реализовать эту стадию без труда. Это значит, что гаптены становятся иммуногенными при соединении иммуногенной молекулы ("носителя") и гаптена (в данном случае белков стресса) ковалентной связью с этой молекулой.
Можно использовать любые молекулы носителей или смеси известных молекул носителей. В качестве примера можно отметить: динитрофенил, 2,4-динитрофторбензол (DNFB), сульфаниловая кислота, N-йодацетил-N'-(5-сульфонил-нафтил)этилендиамин (EDA), анилин, n-аминобензойная кислота и их смеси. Специалисты в данной области могут обратиться к работам К. Landsteiner (Specificity of Serological Reactions, 1945, Chap. V, Harvard University Press). Молекулы "носителя" способны проникать через мембрану клетки и достигать цитозоля. В изобретении подвергаются гаптенилированию свободные белки стресса, внутриклеточные белки стресса и связанные с клеточными мембранами.
Стадия гаптенилирования включает инкубацию in vitro подвергнутых стрессу клеток и молекул носителя. Как правило, инкубация составляет от 15 мин до 1 часа, в особенности от 20 мин до 40 мин.
Эта стадия предпочтительно проводится при легком перемешивании, что дает возможность поддерживать клетки в суспензии или при определенных условиях перемешивания.
В соответствии с одним отличительным признаком способа по изобретению, за стадией iv), которая используется для того, чтобы сделать белки иммуногенными (к примеру, гаптенилирования), может следовать стадия iv-i), на которой полученное на предыдущей стадии подвергается обработке в соответствии с одним или несколькими из следующих методов: концентрирование твердых и белковых материалов, включая белки стресса и опухолевые клетки и их фрагменты, разделение или очистка белков стресса или опухолевых клеток, разделение или очистка опухолевых клеток и белков стресса, экстрагирование белков стресса.
В зависимости от характера стресса и его интенсивности, опухолевые клетки могут быть более или менее деградированными или фрагментированными. Основная цель изобретения состоит не в деградации или фрагментации этих клеток, а в том, чтобы они экспрессировали целый арсенал белков стресса. Это значит, что определенная часть опухолевых клеток должна оставаться жизнеспособной.
Именно поэтому, в соответствии с другим отличительным признаком изобретения, может предусматриваться стадия, которая служит цели инактивации жизнеспособных клеток. Эта стадия именуется стадией инактивации и осуществляется после применения стресса и после периода времени, достаточного для того, чтобы клетки экспрессировали белки стресса.
В соответствии с первым воплощением продукт, полученный на стадии, которая используется для того, чтобы сделать белки иммуногенными, то есть на стадии iv) или стадии iv-i), может подвергаться обработке, в частности, инактивации (стадия v), с тем, чтобы сделать опухолевые клетки, которые могут присутствовать, непролиферирующими.
В соответствии со вторым воплощением, именно продукт, полученный на стадии стресса, может подвергаться обработке, в частности, инактивации (стадия v), с тем, чтобы сделать опухолевые клетки, которые могут присутствовать, непролиферирующими. В этом случае инактивацию помещают между стадиями ii) и iv).
Для инактивации можно использовать любые обработки, известные специалистам в данной области, при условии, что они обеспечивают средства, заставляющие опухолевые клетки терять способность к пролиферации in vivo, при введении композиции пациентам. Такая инактивация может осуществляться, в частности, при помощи процесса химической обработки (фиксация этанолом) или процесса физической обработки, к примеру, высокой дозы облучения (например, около 25 Гр). Можно определить правильные условия для инактивации путем испытания на клеточной культуре, с тем, чтобы определить условия, приводящие к полной потере жизнеспособности. Также можно использовать йодид пропидия, который дает возможность отличить живые клетки от мертвых клеток, как это известно специалистам. Также можно использовать, к примеру, тест с йодидом пропидия, а затем с культивированием, как описано ниже.
В соответствии с другим отличительным признаком изобретения, продукт, полученный на стадии iv) или на стадии v), формулируется путем смешивания ставшего иммуногенным продукта (гаптенилированного белкового материала и/или гаптенилированных клеток и/или гаптенилированных фрагментов клеток) с фармацевтически приемлемым носителем или наполнителем и, по возможности, вспомогательным веществом. Предпочтительно эта стадия включает смешивание с фармацевтически приемлемым носителем или наполнителем и вспомогательным веществом.
Способ дает возможность получать фармацевтические композиции, содержащие несколько или все или большинство белков стресса, экспрессируемых опухолевыми клетками в условиях примененного к ним стресса. Это составляет первое преимущество полученного при этом продукта, который, будучи представителем нескольких белков стресса, позволяет включать в фармацевтические композиции целый ряд ставших иммуногенными белков стресса, против которых сможет реагировать иммунная система пациента, а затем воздействовать на целый комплект опухолевых клеток и противодействовать механизмам устойчивости, которые различным образом выработались у этих опухолевых клеток под давлением со стороны иммунной системы и/или применяемого лечения.
Для того, чтобы обеспечить реакцию на самые разнообразные стрессы и сохранить белковое окружение, подвергаемый стрессу продукт предпочтительно состоит из целых опухолевых клеток. Опухолевые клетки, используемые на стадии i), могут представлять собой клетки пациента, полученные при биопсии, по возможности культивируемые или хранящиеся живыми, или же сборные, полученные от нескольких разных пациентов, в частности, аллогенные клетки (клетки одного типа); клетки от пациента (аутогенные клетки); аллогенные клетки из заранее установленных линий или полученные из клеток пациента либо смеси таких клеток; смеси этих различных типов клеток.
В одном особенно предпочтительном воплощении эти целые клетки предпочтительно получены из клеточных линий, в частности, из линий того же типа, что и опухоли подлежащего лечению пациента (аллогенные клетки). Эти клетки "стимулируют" одним из факторов стресса, что способствует гиперэкспрессии факторов устойчивости. Например, линия может быть подвергнута тепловому шоку, химическому воздействию, облучению, метаболическому стрессу или нескольким из этих стрессов во время их культивирования. Затем "стимулированную" линию либо сырой необработанный или обработанный продукт, полученный по методике стресса, делают иммуногенным с тем, чтобы обеспечить распознавание белков стресса иммунной системой. Для того, чтобы получить оптимальную репрезентативность факторов устойчивости, можно использовать несколько линий, в особенности аллогенных.
В одном воплощении, воздействию разных типов стресса подвергаются группы клеток из одной и той же популяции опухолевых клеток. Например, можно подвергнуть первую порцию клеток одному типу стресса, выбранному из числа описанных выше, а затем подвергнуть вторую порцию клеток одному из других типов стресса (природа стресса может быть различной или же такой же характер стресса, но при других условиях) и т.д. Затем их можно использовать в виде набора из отдельных частей для введения, которое может быть одновременным, по отдельности или поочередно по времени. Их также можно смешивать. Станут доступными фармацевтические композиции, содержащие белки стресса, потенциально специфичные для каждого из механизмов устойчивости в зависимости от типа и/или применяемых условий стресса (к примеру, облучения, теплового, химического, метаболического и т.п.).
В одном воплощении способ применяется к смеси аллогенных опухолевых клеток, то есть из одного типа опухоли, или же в качестве варианта способ применяется отдельно по меньшей мере к двум популяциям аллогенных опухолевых клеток, а затем полученные продукты, ставшие иммуногенными, смешиваются для составления фармацевтической композиции. Таким образом, изобретение дает возможность обеспечить такое решение, которое способствует целевому подходу на основе типа опухолевых клеток, то есть использованию различных типов клеток, но происходящих из одного и того же типа рака, с тем, чтобы усилить общие иммунные реакции против факторов устойчивости, экспрессируемых всеми этими клетками из одного и того же типа опухоли (аллогенными клетками) или экспрессируемых специфически определенными опухолевыми клетками.
В другом воплощении для того, чтобы сохранить специфическое белковое окружение опухоли пациента, клетки, полученные из этой опухоли (аутологичные клетки) содержатся в среде, которая обеспечивает их жизнеспособность и/или рост, а затем подвергаются одному (или нескольким) из указанных типов стресса. Аутологичные клетки, стимулированные таким образом, экспрессируют белки стресса, которые затем становятся иммунокомпетентными, к примеру, при последующем гаптенилировании.
В этом воплощении способ применяется к смеси аутологичных опухолевых клеток, то есть к опухолевым клеткам, происходящим от пациента, подлежащего лечению, или же в качестве варианта способ применяется отдельно по меньшей мере к двум популяциям аутологичных опухолевых клеток. Затем их можно использовать в виде набора из отдельных частей для введения, которое может быть одновременным, по отдельности или поочередно по времени. Их также можно смешивать. Таким образом, изобретение дает возможность обеспечить персонализированный терапевтический подход, специфичный для того индивида, у которого возникла опухоль, с тем, чтобы сохранились факторы устойчивости и белковое окружение, специфичное для опухоли пациента, путем использовании аутологичных клеток.
В другом воплощении предыдущие решения объединяются, с наборами из отдельных частей или смесями аутологичных клеток и аллогенных клеток, причем аутологичные и аллогенные клетки предпочтительно являются аллогенными друг другу, либо со смесью их продуктов, ставших иммуногенными в соответствии со способом по изобретению.
При работе с опухолевыми клетками пациента предпочтительно начинать с клеток, выделенных при биопсии или резекции.
Предпочтительно композиции, содержащие иммуногенные белки стресса и/или, а предпочтительно и инактивированные опухолевые клетки, замораживают или лиофилизируют.
2. Композиции по изобретению
Итак, предметом настоящего изобретения также являются композиции, которые могут быть получены или полученные способом по изобретению.
Композиции по изобретению характеризуются тем, что они включают в себя белки стресса, ставшие иммуногенными в соответствии с изобретением, в частности, гаптенилированные. Эти композиции также могут характеризоваться тем, что они включают в себя опухолевые клетки, а именно такие, которые выработали белки стресса в ответ на стресс согласно стадии ii), в частности, опухолевые клетки и/или их остатки или фрагменты таких клеток, которые были получены данным способом. Эти композиции могут содержать такие иммуногенные белки стресса, в частности, гаптенилированные, которые являются свободными, и/или такие иммуногенные белки стресса, в частности, гаптенилированные, которые находятся на поверхности или внутри опухолевых клеток либо их фрагментов. Предпочтительно композиции по изобретению включают в себя инактивированные опухолевые клетки и такие иммуногенные белки стресса, которые, в частности, гаптенилированы.
Эти композиции включают в себя несколько или все или же большинство белков стресса, экспрессируемых опухолевыми клетками in vitro после воздействия примененного к ним стресса, причем они находятся в иммуногенном виде, в частности, гаптенилированные. В частности, когда идет речь о "белках стресса", то это означает по меньшей мере два различных белка стресса, предпочтительно 2, 3, 4, 5, 6, 7, 8, 9 или 10 и даже больше белков стресса, причем это варьируется в зависимости от типа клеток и от стресса и от примененного к ним in vitro стресса.
В различных воплощениях композиции содержат один или несколько белков теплового шока, в частности, выбранных из числа описанных выше, к примеру, HSP27, HSP70 или HSP90; HSP27, HSP70 и HSP90; HSP27 и HSP70; HSP90 и HSP27; HSP90 и HSP70. В этих композициях данные HSPs уже являются иммуногенными, в частности, гаптенилированными.
В других воплощениях композиции содержат один или несколько белков со множественной устойчивостью к лекарственным препаратам, в частности, белки с устойчивостью к химиотерапии (MRP, то есть белки, связанные со множественной лекарственной устойчивостью), к примеру, GP170, MRPs (семь различных белков), LRPs и/или VMP1.
В других воплощениях композиции содержат белки с устойчивостью к радиации или даже белки с устойчивостью к метаболическому стрессу.
В других воплощениях композиции содержат такие GRPs, как GRP78 (BiP), GRP75 и/или GRP94.
В соответствии с замыслом изобретения, композиция может включать в себя белки стресса нескольких из этих категорий.
Изобретение более конкретно касается фармацевтических композиций или терапевтических вакцин или иммуногенных композиций, содержащих белки стресса, ставшие иммуногенными, предпочтительно гаптенилированные.
Эти белки стресса могут быть в свободном состоянии, в связанном с мембраной опухолевых клеток (в том числе внутри самой мембраны) состоянии, выставленными на поверхности опухолевых клеток, присутствующими внутри опухолевых клеток и/или связанными с фрагментами опухолевых клеток или с опухолевыми пептидами.
В соответствии с одним отличительным признаком, композиции содержат белки стресса, ставшие иммуногенными, предпочтительно гаптенилированные.
В соответствии с другим отличительным признаком, композиции содержат опухолевые клетки, а именно те, у которых выработались белки стресса в ответ на стресс в соответствии со стадией ii), в том числе инактивированные опухолевых клеток. Эти клетки могут включать в себя и предпочтительно они включают внутриклеточные белки стресса, которые гаптенилированы или иным образом стали иммуногенными в соответствии с изобретением. In vivo эти внутриклеточные иммуногенные белки стресса будут, в частности, представлены иммунной системы антиген-презентирующими клетками.
Более предпочтительно, композиции содержат опухолевые клетки и/или фрагменты этих клеток, содержащие и/или несущие иммуногенные белки стресса, которые предпочтительно гаптенилированы.
В соответствии с одним отличительным признаком, композиции содержат как иммуногенные белки стресса, которые являются свободными и предпочтительно гаптенилированы, так и опухолевые клетки и/или фрагменты этих клеток, содержащие и/или несущие иммуногенные белки стресса, которые предпочтительно гаптенилированы.
Для применения в качестве продукта, который можно вводить пациентам, эти клетки делают неспособными к пролиферации, что именуется инактивацией.
Эти композиции также могут включать в себя фармацевтически приемлемые носители или наполнители.
В одном воплощении композиция содержит популяцию иммуногенных белков стресса, которые предпочтительно гаптенилированы, и/или клеток, содержащих такие белки, которые были подвергнуты первой процедуре стресса, и по меньшей мере еще одну другую популяцию иммуногенных белков стресса, которые предпочтительно гаптенилированы, и/или клеток, содержащих такие белки, которые были подвергнуты другой процедуре стресса.
В одном воплощении композиция содержит популяцию иммуногенных белков стресса, которые предпочтительно гаптенилированы, и/или клеток, содержащих такие белки, и по меньшей мере еще одну другую популяцию иммуногенных белков стресса, которые предпочтительно гаптенилированы, и/или клеток, содержащих такие белки, причем эти популяции происходят из исходных аллогенных опухолевых клеток и эти клетки подвергались воздействию стресса в виде смеси или по отдельности.
В одном воплощении композиция содержит иммуногенные белки стресса, которые предпочтительно гаптенилированы, и/или клетки, содержащие такие белки, которые происходят из исходных аутологичных опухолевых клеток.
В одном воплощении композиция содержит иммуногенные белки стресса, которые предпочтительно гаптенилированы, и/или клетки, содержащие такие белки, которые являются аллогенными и аутологичными.
В одном воплощении композиция содержит иммуногенные белки стресса, которые предпочтительно гаптенилированы, и/или клетки, содержащие такие белки, которые являются аллогенными и аутологичными, для одновременного, раздельного или поочередного по времени введения. Композиция может состоять из нескольких доз белков стресса, ставших иммуногенными, и/или клеток, содержащих аллогенные белки стресса, ставшие иммуногенными, в частности, происходящих из разных линий (1, 2, 3, … линий), и нескольких доз белков стресса, ставших иммуногенными, и/или клеток, содержащих аутологичные белки стресса, ставшие иммуногенными.
Композиции по изобретению применимы в качестве противораковых препаратов.
В соответствии с одним отличительным признаком, они применимы в качестве противораковых препаратов для введения пациентам, подвергавшимся противораковой терапии. Как изложено выше, такая терапия должна привести к стрессу, а тем самым и к продукции белков стресса. Таким образом, пациент будет нести опухолевые клетки, экспрессирующие белки стресса.
В соответствии с другим отличительным признаком, композиции применимы в качестве противораковых препаратов для введения пациентам, которые подвергаются или будут подвергаться противораковой терапии. Как изложено выше, такая терапия может привести к стрессу, а тем самым и к продукции белков стресса. У пациентов, проходящих лечение, либо уже есть, либо предположительно есть опухолевые клетки, экспрессирующие белки стресса.
В соответствии с одним отличительным признаком, композиции дополнительно содержат адъюванты.
Адъювант представляет собой вещество, которое действует путем повышения эффективности вакцины. Такое вещество может действовать путем ускорения, увеличения продолжительности и/или усиления иммунного ответа, специфичного к иммуногену, если это вещество используется в сочетании с данным конкретным иммуногеном. Специалист в данной области может обратиться, в частности, к Recent Advances in Vaccine Adjuvants, Singh M & O'Hagan DT, Pharmaceutical Research 2002, Volume 19, issue 6, pp 715-728. Среди адъювантов, которые можно использовать, следует отметить цитокины и другие иммуномодулирующие молекулы (а именно, хемокины и костимулирующие факторы), вещества-адъюванты, происходящие из микроорганизмов и растений, или химически синтезированные адъюванты. В зависимости от их природы, адъюванты могут действовать не только в качестве иммуностимулирующих адъювантов, но и в качестве системы доставки вакцин. Такими системами доставки, как правило, являются твердые частицы, и можно отметить, в частности, эмульсии, микрочастицы (к примеру, на основе полилактид-гликолида PLG), ISCOMs, липосомы, которые служат в основном для ориентировки и направления иммуногенов на антиген-презентирующие клетки. Что касается иммуностимулирующих адъювантов, то это в основном молекулы микробиологического происхождения, например, липополисахариды, монофосфориллипид А, CpG-ДНК, которые активируют иммунную систему. Адъюванты также могут использоваться для доставки через слизистые, например, бактериальные энтеротоксины, в частности, происходящие из Е. coli, термолабильные энтеротоксины, лишенные токсичности мутанты, такие как К63 или R72.
В качестве репрезентативных применимых адъювантов можно отметить, среди прочего: гидроксид алюминия, сапонины (например, сапонин Quillaja или Quil А; см. Vaccine Design, The Subunit and Adjuvant Approach, 1995, edited by Michael F. Powell and Mark J Newman, Plenum Press, NY and London, p. 210), Avridine® (Vaccine Design, p.148), DDA (диметил-диоктадециламмония бромид, Vaccine Design, p. 157), полифосфазен (Vaccine Design, p. 204), эмульсии типа масло-в-воде, в частности те, что содержат минеральное масло, сквалан (к примеру, эмульсии SPT, Vaccine Design, p. 147) или сквален (к примеру, MF59, Vaccine Design, p. 183), эмульсии типа вода-в-масле, в частности те, что содержат метаболизируемое масло (в частности, см. WO 9420071), эмульсии в соответствии с US 5,422,109 или тройные эмульсии, к примеру, эмульсии типа вода-в-масле-в-воде.
Термин "фармацевтически приемлемый" служит для обозначения таких носителей или наполнителей, которые могут применяться для введения иммуногена пациенту без риска аллергических или иных неблагоприятных реакций при сохранении отличительных признаков продукта при его хранении. К ним относятся, к примеру, одни или в смеси, вода, солевые растворы, фосфатные буферы, белковые соединения, декстроза, сахароза, глицерин, DMSO, этанол и др. Можно отметить, к примеру, солевой раствор с 0,9% NaCl, фосфатный буфер, смеси на основе растворов коммерчески доступных консервантов.
В одном воплощении композиции по изобретению должны быть заморожены, в частности, между -20°С и -80°С. При этом в композицию добавляют по меньшей мере один криопротектор и/или же композицию готовят обычным способом так, чтобы она переносила замораживание без ущерба для ее компонентов, в частности, опухолевых клеток.
В другом воплощении композиции по изобретению должны быть лиофилизованы (замораживание-высушивание). При этом, если нужно, добавляют по меньшей мере один обычный наполнитель для лиофилизации.
Состав носителей или адъювантов и/или выбор адъюванта может варьироваться в зависимости от способа введения, как это известно специалистам.
3. Применение и способ лечения
Продукт, разработанный по изобретению, может иметь переменный состав, однако он имеет отличительные признаки, которые должны сохраняться, а именно то, что он включает в себя белки стресса, которые были индуцированы in vitro путем воздействия на живые опухолевые клетки одного или нескольких контролируемых стрессов, причем эти белки стресса обнаруживаются при высоких уровнях концентрации вследствие их гиперэкспрессии этими опухолевыми клетками в ответ на стресс, при этом обычно есть несколько типов этих белков стресса, причем эти белки стресса в конечном продукте, который может вводиться пациентам, являются гаптенилированными или иным образом обработаны с тем, чтобы сделать их иммунокомпетентными (иммуногенными).
Принцип, лежащий в основе изобретения, основывается на способности и возможности иммунной системы вырабатывать специфические реакции против факторов устойчивости опухолевых клеток (белков стресса) после их стимуляции присутствием белков стресса, ставших иммунокомпетентными (иммуногенными), к примеру, гаптенилированными. Эта иммунная реакция устраняет опухолевые клетки, завершает действия, инициированные при предыдущих обработках (адъювантное действие композиции по изобретению), или включает активацию иммунного ответа в качестве основной терапии.
Предметом изобретения также является способ терапевтического лечения. Этот способ включает введение эффективного количества композиции по изобретению с тем, чтобы вызвать иммунный ответ.
Вводимая доза может составлять, к примеру, от 105 до 107, в частности, по меньшей мере 106±0,5 клеток на дозу. Это количество клеток может быть выражено в виде общего количества опухолевых клеток, общего органического углерода (ТОС) опухолевых клеток или в виде количественного содержания белка.
Схема дозировки может включать в себя введение одной или нескольких доз, разделенных по времени. Например, схема может предусматривать 2, 3, 4, 5, 6, 7, 8, 9 или 10 введений, разнесенных с интервалом от 1 до 10 дней между каждым введением.
Можно использовать любой способ введения. Так, можно отметить способы, которые включают пероральное, интраназальное, ректальное и парентеральное введение. Предпочтителен парентеральный способ, в частности, посредством внутримышечной, внутривенной, внутрибрюшинной, подкожной или внутрикожной инъекции. Особенно предпочтительно внутрикожное введение.
Лечение может дополняться введением иммуностимуляторов любого типа, что обеспечит его усиление (цитокины, факторы роста, иммуномодуляторы, адъюванты и т.д.), независимо от того, содержит терапевтическая композиция адъюванты или нет.
Способ лечения может включать в себя комбинирование лечения по изобретению со стандартным протоколом лечения рака: хирургией, лучевой терапией, химиотерапией и/или иммунотерапией. Композиции по изобретению вводятся пациентам до, во время или после одной или нескольких из этих процедур. В отношении индукции иммунного ответа, однако, предпочтительно композиции по изобретению вводятся до или во время стандартной процедуры, предпочтительно до этого.
Особенно целесообразно лечение пациентов с помощью аллогенных линий, уже экспрессирующих белки стресса, в связи с будущим стандартным лечением так, чтобы стимулировать иммунную систему заранее с тем, чтобы получить реакцию против белков стресса, которые могут экспрессироваться in vivo, и подавить устойчивость к обычному лечению. Например, введение композиции по изобретению, содержащей индуцированные облучением белки стресса и/или клетки, экспрессирующие индуцированные облучением белки стресса, перед проведением лучевой терапии, и/или введение композиции по изобретению, содержащей химически индуцированные белки стресса и/или клетки, экспрессирующие химически индуцированные белки стресса, предпочтительно используя в качестве инициатора стресса противораковую терапевтическую молекулу, перед проведением химиотерапии с помощью этой молекулы.
Далее настоящее изобретение будет описано более подробно с помощью примеров, приведенных в качестве неограничительных примеров, и с привлечением чертежей.
Краткое описание фигур
На фиг. 1 представлен вестерн-блот, показывающий индукцию экспрессии HSP70 при тепловом шоке. Для удобства при чтении, "основные калибровочные пятна и пятна HSP70 обведены кружками, причем последний идентифицирован под номером 1.
На фиг. 2 представлен вестерн-блот, показывающий индукцию HSP70 посредством теплового шока и гаптенилирования HSP70, параллельно с контрольным вестерн-блотом на β-актин. Д ля удобства при чтении основные пятна обведены кружками. Идентификация цифровых обозначений: HSP70 (2); гаптенилированный HSP70 (3); β-актин (4); гаптенилированный β-актин (5); маркеры молекулярного веса (6); клетки CT26WT, обработанные 1 час при 37°С (7); клетки CT26WT, обработанные 1 час при 42°С (8); доза вакцины после стресса, гаптенилирования и облучения (9); маркеры молекулярного веса (10); клетки CT26WT, обработанные 1 час при 37°С + 14 часов при 37°С (11); клетки CT26WT, обработанные 1 час при 42°С + 14 часов при 37°С (12); доза вакцины после стресса, гаптенилирования и облучения (13).
На фиг. 3 и 4 представлены графики, на которых приведены развивающиеся по времени изменения объема опухолей, индуцированных у мышей, между контрольными мышами, получавшими наполнитель ("Veh" означает "носитель"), и мышами, получавшими вакцины по изобретению ("The" - "терапевтическое средство").
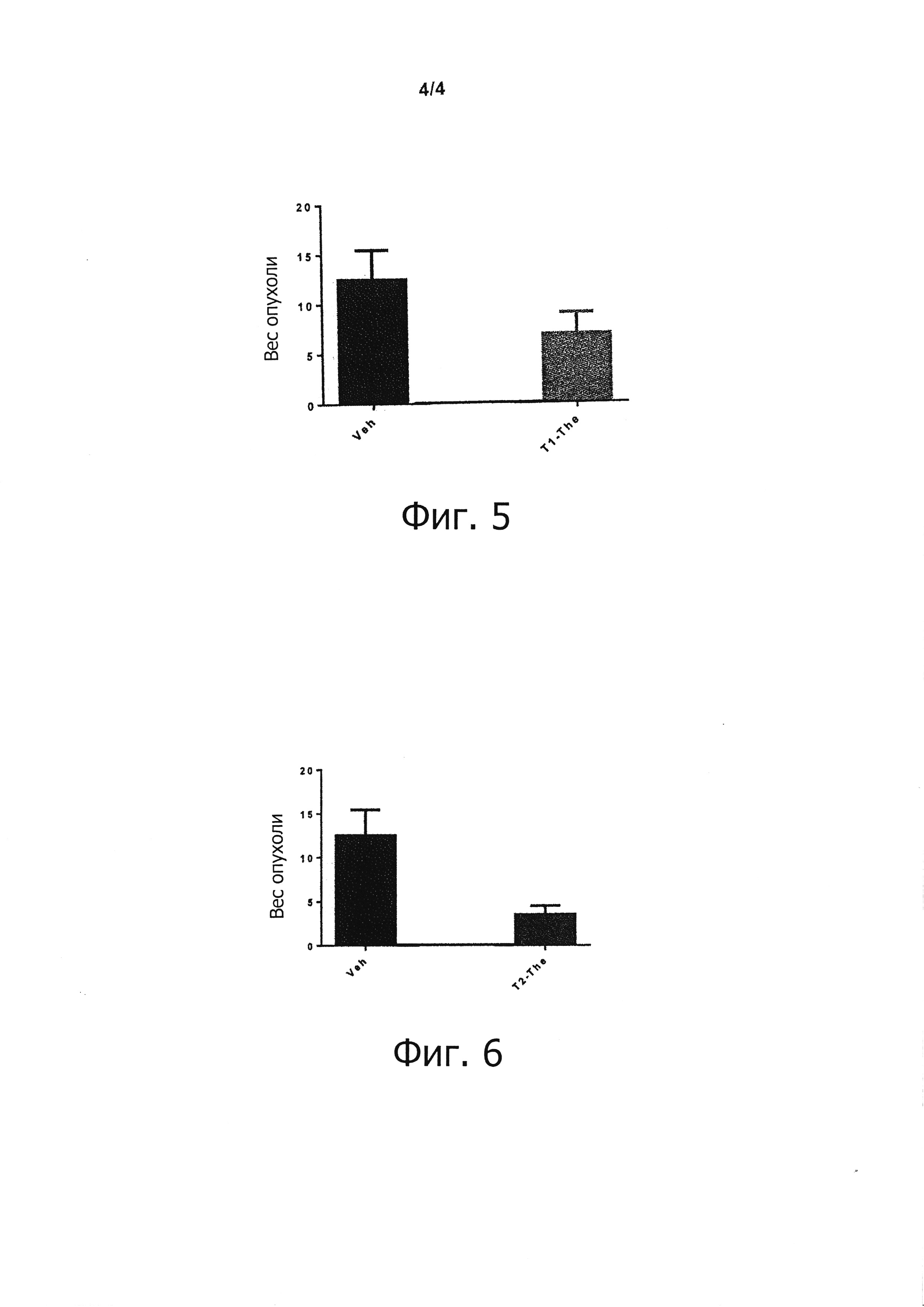
На фиг. 5 и 6 представлены графики, на которых приведены, для тех же групп, которые представлены на фиг. 1 и 2, веса опухолей в граммах, индуцированных у мышей во время резекции ("Veh" означает "носитель" или "наполнитель"; "The" -"терапевтическое средство").
ПРИМЕРЫ
Пример 1. Способ получения аллогенных доз
Клеточные линии
Клеточные линии происходят из коммерчески доступных заранее установленных линий (типа АТСС) или получены путем составления линий, полученных из образцов от пациентов, изучения их и тестирования. В качестве примера, используемые линии включают клетки CaOV, OVCAR-3, ES-2 и OV-3, в качестве терапевтической мишени для рака яичников. Их культивировали по отдельности в рекомендуемых условиях.
Клетки пациентов
Клетки пациентов выделяли у пациентов и культивировали в среде при соответствующих условиях.
Клетки из клеточных линий и пациентов подвергали стрессу во время их фазы роста или фазы плато с тем, чтобы обеспечить гиперэкспрессию факторов устойчивости (белков стресса).
Применявшиеся типы стресса:
- облучение 2 Гр;
- тепловой шок: повышение температуры до 40°С-43°С и на плато в течение 30-60 минут;
- химический шок с помощью этанола, циклофосфамида, доксорубицина и цисплатина.
Экспрессию одного или нескольких факторов устойчивости проверяли методом проточной цитометрии, ELISA или вестерн-блот. В частности, методом цитометрии с помощью антител против HSP (против HSP27 человека с FITC, против HSP60 человека с РЕ, против HSP72 человека с FITC, против HSP90 человека с РЕ).
Факторы устойчивости (белки стресса), экспрессируемые аллогенными клетками, метили химической меткой или динитрофенилом. В качестве варианта можно использовать сульфаниловую кислоту, N-йодацетил-N'-(5-сульфонил-нафтил)этилендиамин (EDA), анилин или n-аминобензойную кислоту.
Затем аллогенные клетки, содержащие гаптенилированные белки стресса, делали непролиферирующими при помощи высокой дозы облучения (25 Гр). В качестве варианта можно использовать фиксацию этанолом между 10% и 50% об/об или любой другой метод, который обеспечивает ингибирование пролиферации клеток, сохраняя структуру клеток неизменной.
Гаптенилированные клеточные белки стресса аллогенного происхождения распределяли в виде суспензии клеток в рецептурной среде, пригодной для терапевтического применения и позволяющей хранить их при низкой температуре (-20°С, -80°С), а затем распределяли на дозы, содержащие от 1 до 5×106 инактивированных и гаптенилированных клеток на дозу, соответствующую терапевтической дозе, выраженной по количеству "HSP-положительного" белка и/или по содержанию органических веществ. Может присутствовать иммунизирующий адъювант, к примеру, BCG, GM-CSF, IL-2.
Пример 2. Способ получения аутологичных доз
Клетки получали из опухолей пациентов после резекции. Биологический материал транспортировали в специальном наборе, который дает возможность их сохранения и обеспечивает оптимальную жизнеспособность клеток.
Клетки из биопсии диссоциировали подходящим механическим способом, а затем переводили в суспензию в питательной среде, обеспечивающей их рост или только жизнеспособность.
Опухолевые клетки использовали как они есть или после отбора посредством сортировки клеток.
Опухолевые клетки в фазе экспансии или в стационарной фазе подвергали стрессу, как изложено при получении аллогенных клеток.
Экспрессию одного или нескольких факторов устойчивости проверяли соответствующим методом анализа, как описано в примере 1.
Факторы устойчивости (белки стресса), экспрессируемые аутологичными клетками, метили химическим способом, аналогично способу, описанному для аллогенных клеток в примере 1.
Аутологичные клетки, содержащие гаптенилированные белки стресса, делали непролиферирующими тем же методом, который использовался для аллогенных клеток в примере 1.
Гаптенилированные белки стресса, встроенные в аутологичные клетки, распределяли в виде суспензии клеток в рецептурной среде, пригодной для терапевтического применения и обеспечивающей их сохранность, а затем распределяли на терапевтические дозы.
Пример 3. Способ лечения
Терапевтический режим лечения включает в себя введение:
- одной или нескольких аллогенных или аутологичных доз; либо
- одной или нескольких аллогенных и аутологичных доз, которые вводятся вместе или в последовательном порядке.
Введение продукта осуществляется посредством внутрикожной инъекции. Также можно использовать и другие способы введения, в частности, per os.
Продукт вводится по отдельности или в сочетании с любой другой терапией, что позволяет усиливать лечение.
Пример 4. Получение HSPs
Линия CT26-WT представляет собой линию клеток карциномы толстой кишки мыши, которая доступна под номером АТСС® CRL-2638™. Клетки растут легко и быстро (время удвоения 22 часа).
Линия HL60 представляет собой линию клеток промиелоцитарной лейкемии человека (европеоида), которая доступна от Sigma-Aldrich®. После экспандирования клетки замораживали.
Исходные клетки были получены в замороженном виде. Клетки оттаивали, после чего их культивировали в колбах, в соответствующей культуральной среде. В день D +1 меняли культуральную среду. После экспандирования проводили подсчет живых клеток, а затем доводили концентрацию до около 2×106 живых клеток/мл культуральной среды. Извлекали пул в 200×106 клеток, а затем промывали после подтверждения того, что клетки достигали 50%-й конфлюэнтности. Затем суспензию разливали в пробирки на 50 мл по 25 мл на пробирку. Затем пробирки погружали в водяную баню, нагретую до 42°С. Пробирки оставляли в водяной бане на 1 час. Затем переносили клетки в колбы порциями по 2×106 клеток. После этого клетки инкубировали 14 часов при 37°С. Затем доводили концентрацию клеток до 5×106 живых клеток/мл.
Клетки затем подвергали гаптенилированию с помощью 0,07% раствора 2,4-динитрофторбензола (DNFB). Гаптенилирование проявляли по метке методом FACS. В качестве аналитического метода была выбрана проточная FACS-цитометрия, которая дает возможность получать процент гаптенилированных клеток относительно общего числа клеток.
Суспензию клеток доводили до концентрации 2-5×106 клеток/мл среды для замораживания и хранили в морозилке при -80°С±3°С как минимум 24 часа перед тестированием.
Затем замороженные клетки подвергали рентгеновскому облучению при 25 Гр, чтобы инактивировать опухолевые клетки.
Для выявления экспрессии HSPs или гаптенилированных HSPs использовали два стандартных метода; эти же методы могут применяться для выявления любых белков стресса с помощью антител, специфичных к детектируемому белку:
- вестерн-блот с помощью антител, специфичных к детектируемому HSP;
- проточная цитометрия (FACS, активируемая флуоресценцией сортировка клеток) после мечения внутриклеточных HSPs, с использованием специфических антител.
В качестве специфических антител использовали коммерчески доступные антитела против HSP27, антитела против HSP70, антитела против HSP90α/β. В соответствии с применявшейся методикой, также использовали, как это известно per se, дополнительные антитела: IgG1 мыши, конъюгированное с FITC овечье антитело против IgG мыши, контрольное антитело (против KLH-FITC), антитело против TNP-FITC, специфичное к DNFB. Имеющиеся в продаже антитела, которые можно использовать, доступны от Santa Cruz Biotechnology Inc. и BD Biosciences.
Для цитометрии гаптенилированные клетки оттаивали, после чего их промывали и доводили концентрацию до 1-2×106 клеток/мл. В лунки с V-образным дном 96-луночного планшета вносили следующее:
- 5 мкл контрольного антитела (против KLH-FITC) - в две лунки,
- 5 мкл антитела против TNP-FITC - в две лунки.
После этого в каждую лунку добавляли 100 мкл суспензии гаптенилированных клеток и инкубировали планшет 15 минут при +5°С±3°С. После этого клетки отмывали и переносили клеточные суспензии в пробирки для пропускания через "FACS Calibur". Пробирки "DNP-FITC" пропускали через него в соответствии с фиксированными заранее параметрами вместе с контролем.
Результаты
1. Линия CT26-WT
По сравнению с клетками той же линии, содержавшимися при 37°С в течение 1 часа, на вестерн-блоте отмечается полоса около 70 кДа (фиг. 1), которая соответствует HSP70 у клеток, подвергнутых стрессу при 42°С по приведенному выше протоколу.
2. Линия HL60
Проводили анализ контрольных клеток (1 час при 37°С + 14 ч восстановительного периода при 37°С) и подвергнутых стрессу клеток (1 час при 42°С + 14 ч восстановительного периода при 37°С) методом проточной цитометрии после внутриклеточного мечения HSP27, 70 и 90, используя приведенные выше специфические антитела.
Результаты

Отмечается гиперэкспрессия HSPs и более конкретно HSP27 и HSP70 у подвергнутых стрессу клеток.
Пример 5. Тестирование на животных
Получение опухолевых доз заключалось в экспандировании клеток CT26-WT, после чего следовало замораживание в культуральной среде с добавлением 5% DMSO порциями по 6,25×104 клеток в конечном объеме 250 мкл.
Получение вакцинных доз заключалось в экспандировании клеток CT26-WT, а затем после 2 пассажей клетки подвергали тепловому стрессу в течение 1 часа при +42°С с последующим восстановительным периодом в 14 ч при 37°С. Затем клетки подвергали гаптенилированию (с помощью DNFB, динитрофторбензола), а затем замораживали при -80°С, исходя из 6,25×105 клеток в конечном объеме 250 мкл, и наконец вакцинные дозы подвергали облучению (25 Гр).
Ставили контроли для опухолевых и вакцинных доз.
Опухолевые дозы (получение опухолей у животных):
- стерильность по гемокультурам: → гемокультуры отрицательны;
- контроль на эндотоксины: → эндотоксины ≤ 200 МЕ/мл;
- контроль на число клеток и жизнеспособность опухолевых доз: → количество составляет от 5,5 до 6,95×105 клеток, жизнеспособность ≥ 95%.
Вакцинные дозы:
- стерильность по гемокультурам: → гемокультуры отрицательны;
- контроль на эндотоксины: → эндотоксины ≤ 200 МЕ/мл;
- контроль на гаптенилирование по метке методом FACS с помощью антитела против KLH-TNP: → степень гаптенилирования ≥ 96%;
- контроль на количество клеток в вакцинных дозах: → количество составляет от 5,96 до 6,10×105 клеток;
- контроль на экспрессию HSPs методом цитометрии с помощью специфических антител, приведенных выше: → отмечается экспрессия HSP27, 70 и 90;
- контроль на выявление HSPs методом вестерн-блот с помощью специфических антител, приведенных выше: → на фиг. 2 отмечено пятно HSP70 после теплового стресса и пятно гаптенилированного HSP70;
- тест на жизнеспособность для проверки того, что клетки вакцинной композиции не являются пролиферирующими: добавление пропидия йодида + культивирование; подтвердилось отсутствие пролиферативной способности у клеток, входящих в состав вакцинных доз.
Пример 6. Исследования in vivo на мышах
Использовали самцов и самок мышей BALB/c в возрасте от 6 до 8 недель, полученных от Charles River. По 5 мышей помещали в клетки 16×19×35 см при контролируемой температуре (22±2°С), в условиях чередующегося освещения (циклы по 12 ч света и 12 ч темноты), и давали им воду и корм ad libitum. Мышей акклиматизировали в течение по меньшей мере 1 недели перед началом экспериментов.
Модель опухоли - подкожная карцинома СТ26 (CT26WT, АТСС® CRL-2638™), то есть сингенная модель опухоли, которая обычно используется для исследования терапевтических применений против рака на животных, в частности, для тестирования протоколов иммунотерапии и изучения иммунного ответа.
50 самок мышей разбивали на 5 групп по 10 мышей. В день 0 (D 0) каждой мыши вводили подкожно (п/к) 5×104 опухолевых клеток CT26WT. Использовали следующий протокол обработки:
- группа 1: наполнитель;
- группа 2: терапевтическая обработка 1;
- группа 3: терапевтическая обработка 2.
В день D +2 группам 2 и 3 вводили циклофосфамид путем инъекции в дозе 15 мг/кг внутрибрюшинно (в/б).
Обработка Т1 (BCG/IL-2/вакцина) для группы 2:
- BCG: 2×106 к.о.е (колониеобразующих единиц) на 1 п/к инъекцию;
- рекомбинантный IL-2 мыши: 4000 ME на 1 п/к инъекцию;
- вакцина: 5×105 клеток CT26WT (облученных и гаптенилированных) посредством п/к инъекции.
Обработка Т2 (BCG/GM-CSF/вакцина) для группы 3:
- BCG: 2×106 к.о.е посредством п/к инъекции;
- рекомбинантньгй GM-CSF мыши: 25000 ME (международных единиц) п/к;
- вакцина: 5×105 клеток CT26WT (облученных и гаптенилированных) посредством п/к инъекции.
Протоколы

Параметры, измеряемые в ходе исследования, и другие характеристики:
- ежедневное наблюдение за поведением мышей;
- мониторинг массы тела и объема опухолей по 3 раза в неделю. Объем опухолей в мм3 рассчитывали по следующей формуле: объем = [(ширина)2 × длина]/2. Размеры измеряли с помощью штангенциркуля;
- при появлении признаков неожиданного бедствия мышей забивали;
- мышей забивали, когда опухоль достигала 1000 мм3, но в любом случае не позднее, чем через 40 дней после имплантации опухоли. Опухоли извлекали и измеряли.
Результаты измерения объема опухолей в мм3 по времени свидетельствуют о благоприятном воздействии обеих терапевтических вакцин Т1 и Т2 по сравнению с контрольными мышами: см. фиг. 3 и 4.
Результаты измерения веса опухолей после резекции также свидетельствуют о благоприятном воздействии вакцин Т1 и Т2 по сравнению с контрольными мышами: см. фиг. 5 и 6.
Реферат
В изобретении описан способ получения композиций, содержащих белки стресса опухолевых клеток, который включает следующие стадии: получение опухолевых клеток в культуральной среде; воздействие на опухолевые клетки из стадии 1) стрессом с тем, чтобы эти клетки вырабатывали белки стресса в ответ на стресс; получение или извлечение подвергнутых стрессу опухолевых клеток и/или белков стресса; обработка подвергнутых стрессу опухолевых клеток и/или полученных белков стресса молекулой или способом, способным сделать белки стресса иммуногенными, предпочтительно гаптеном или методом гаптенилирования. В изобретении также описаны фармацевтические композиции, включающие белки стресса опухолевых клеток и/или опухолевые клетки, содержащие белки стресса, которые стали иммуногенными, в частности гаптенилированные, а также фармацевтически приемлемый наполнитель. 5 н. и 22 з.п. ф-лы, 6 ил., 6 пр.
Формула
Документы, цитированные в отчёте о поиске
Применение белков теплового шока для улучшения терапевтического эффекта невакцинного лечебного воздействия

Комментарии