Композиции подвергнутых рестрикции клеток, способных к быстрому росту, которые продуцируют вещества, подавляющие пролиферацию клеток, и их применение - RU2236855C2
Код документа: RU2236855C2
Описание
Настоящее изобретение относится к ограничению пролиферации клеток, находящихся на логарифмической фазе роста, или их способности к быстрому росту в логарифмической фазе, которые при физическом ограничении их размножения биосовместимым полупроницаемым материалом, продуцируют в норме неэкспрессируемые или повышенные количества обычно экспрессируемого фактора или факторов, способных ингибировать рост других быстро пролиферирующих клеток того же самого или другого типов и/или происхождения. Эти подвергнувшиеся рестрикции клетки здесь называются пролиферативными клетками. Нелимитирующий перечень пролиферативных клеток, принадлежащих к указанной категории, включает опухолевые клетки, раковые клетки и незлокачественные клетки, в том числе (но без ограничения ими) клетки эмбриона, стволовые клетки и клетки в фазе восстановления после повреждения ткани, включая гепатоциты, фибробласты и эпителиальные клетки. Структуры, которые являются одним из признаков данного изобретения, могут использоваться сами по себе или для получения некоего материала, например, концентратов с приблизительно установленным молекулярным весом, которые также обладают антипролиферативным действием на быстро размножающиеся клетки, связанные с заболеваниями или соответствующими состояниями, например, раком, или для контроля за ростом клеток с целью предотвращения некоторых медицинских проблем, которые могут возникать при неконтролируемом росте клеток, например, при образовании послеоперационных рубцов.
Предпосылки создания изобретения и предшествующий уровень техники
Инкапсулирование различных биологически активных веществ в биологически совместимые материалы, которое достаточно полно описано в литературе, является методикой, которая использовалась в течение некоторого периода времени, хотя и с ограниченным успехом. Примерами из данной области могут служить US патенты 5227298 (Weber et al.); 5053332 (Cook et al.); 4997443 (Walthall et al.); 4971833 (Larsson et al.); 4902295 (Walthall et al.); 4798786 (Tice et al.); 4673566 (Goosen et al.); 4647536 (Mosbach et al.); 4409331 (Lim); 4392909 (Lm); 4352883 (Lm) и 4663286 (Tsang et al.). Также следует отметить US патент 5643569, выданный Jain et al. Jain et al., довольно подробно обсуждают инкапсулирование островков в различные биосовместимые материалы. Островки вырабатывают инсулин, и потому там раскрыто применение описанных Jain et al. продуктов при лечении диабета. В US патенте 5888497, выданном Jain et al., описываются агарозные шарики, покрытые слоем пригодной для имплантации агарозы, содержащие раковые клетки, подвергнутые рестрикции, которые продуцируют больше вещества, подавляющего рост не подвергаемых рестрикции раковых клеток, по сравнению с тем же количеством тех же самых (ранее упомянутых), но не подвергнутых рестрикции раковых клеток.
В патентах Jain et al. довольно подробно обсуждаются методики, используемые ранее в трансплантационной практике. Кроме того, они там обобщены.
Известны пять главных подходов к защите трансплантированной ткани от иммунной реакции хозяина. Все они основаны на стремлении изолировать трансплантированную ткань от иммунной системы хозяина. Методы по иммуноизолированию на сегодняшний день обычно включают: внесосудистые диффузионные камеры, внутрисосудистые диффузионные камеры, внутрисосудистые ультрафильтрационные камеры, микроинкапсулирование и макроинкапсулирование. Существует множество проблем, связанных с ранее используемыми методами, включающих фиброзную реакцию хозяина на имплантируемый материал, нестабильность имплантируемого материала, ограниченную диффузию питательных веществ через полупроницаемые мембраны, проницаемость стимулятора секреции и продукта и лаг-фазу диффузии через полупроницаемые мембранные фильтры.
Например, метод микроинкапсулирования для заключения жизнеспособных клеток, тканей и других лабильных мембран внутрь оболочки, представляющей собой полупроницаемую мембрану, был разработан Lim в 1978 г. (Lim, Research report to Damon Corporotion (1978)). Lim использовал микрокапсулы из альгината и поли L-лизина для инкапсулирования островков Лангерганса (называемых здесь "островками"). В 1980 г. было сообщено о первом успешном применении in vivo этой новой методики при исследовании диабета (Lim, et al., Science 210:908 (1980)). Имплантация этих микроинкапсулированных островков поддержала эугликемическое состояние у животных с диабетом. Однако, при повторении этих опытов другие исследователи обнаружили, что альгинат вызывает тканевую реакцию, и не смогли воспроизвести результаты Lim, et al. (Lamberti, et al. Applied Biochemistry and Biotechology 10:101 (1984); Dupuy, et al., J. Biomed. Material and Res. 22:1061 (1988); Weber, et al., Transplantation 49:396 (1990); Doon-shiong, et al., Transplantation Proceedings 22:754 (1990)). В настоящее время полагают, что растворимость этих полимеров в воде обусловлена ограниченной стабильностью и биосовместимостью этих микрокапсул in vivo (Dupuy, et al., см. выше; Weber et al., см. выше; Doon-shiong, et al., см. выше; Smidsrod, Faraday Discussion of Chemical Society 57:263 (1974)).
Iwata et al., (Iwata, et al., Jour. Biomedical Material and Res. 26:967 (1992)) использовал агарозу для микроинкапсулирования аллогенных панкреатических островков и обнаружил, что она может использоваться как материал для изготовления микрогранул. В этом исследовании 1500-2000 островков были микроинкапсулированы каждый по отдельности в 5% агарозу и имплантированы мышам со стрептозотоцин - индуцируемым диабетом. Трансплантат сохранялся живым в течение длительного периода времени и у реципиентов неограниченно долго сохранялась нормогликемия.
Однако, этот метод обладает рядом недостатков. Он трудоемок и неточен. Например, много гранул остаются не полностью покрытыми, а несколько сотен гранул остаются в форме свободной агарозы. Таким образом, требуется дополнительное время, чтобы отделить микроинкапсулированные островки от "незанятых" (пустых) гранул. Кроме того, большая часть имплантированных микрокапсул скапливается в тазовой полости и для того, чтобы достичь нормогликемии, требуется большое количество отдельных гранул, абсолютно полностью покрытых островками. К тому же трансплантируемые гранулы не подлежат восстановлению и извлечению, довольно хрупки и при малейшем повреждении островки легко отсоединяются.
Способ макроинкапсулирования также исследовался. Для иммуновыделения островков были изготовлены макрокапсулы из самых различных материалов, например, поли-2-гидроксиэтил-метакрилата, поливинилхлорид - с - акриловой кислоты и ацетата целлюлозы (См. Altman, et al., Diabetes 35:625 (1986); Altman, et al., Transplantation: American Society of Artificial Internal Organs 30:382 (1984); Ronel, et al., Jour. Biomedical Material Research 17:855 (1983); Klomp, et al., Jour. Biomedical Material Research 17:865-871 (1983)). Во всех этих опытах достигалось только скоропреходящая нормализация гликемии.
Archer, et al., Journal of Surgical Research 28:77 (1980), использовали полые волокна из акрилового сополимера для того, чтобы на время предотвратить отторжение островковых ксенотрансплантатов. Они сообщили об удлинении продолжительности жизни включенных в полые волокна неонатальных мышиных панкреатических трансплантатов, которые были трансплантированы хомякам с диабетом. Недавно Lacy, et al., Science 254:1782-1784 (1991) подтвердили эти результаты, но было обнаружено, что эугликемическое состояние является временным. Авторы работы установили, что когда островки вводятся внутрь волокна, они агрегируют внутри пустого канала волокна, что приводит к некрозу в сердцевинной части островковых масс. Этот некроз в центре препятствует пролонгированию жизни трансплантата. Для решения этой проблемы используют альгинат для диспергирования островков в волокне.
Однако, этот эксперимент не был воспроизведен многократно. Поэтому роль мембраны как средства для трансплантации островков у человека сомнительна.
В патенте Jain et al., упомянутом выше, сообщается, что микроинкапсулирование секреторных клеток в проницаемый гидрофильный гель приводит к получению функционально полезного неиммуногенного материала, который может быть имплантирован животным, может храниться в течение продолжительного времени и является полезным в терапевтическом плане in vivo. Макроинкапсулирование секреторных клеток предусматривало более эффективную и усовершенствованную методику для трансплантации этих секреторных клеток.
В патенте, во всем его тексте, не обсуждается включение клеток, способных к быстрой пролиферации.
Обзор литературы по инкапсулированию клеток свидетельствует о том, что вследствие инкапсулирования клетки почти всегда продуцируют меньше веществ, чем они продуцируют без инкапсулирования. См. Lloyd - George, et al., Biomat.Art. Cell & Immob. Biotech. 21(3): 323-333 (1993); Schinstine, et al., Cell Transplant 4 (I): 93-102 (1995); Chicheportiche, etal., Diabetologica 31:54-57 (1988); Jaeger, et al., Progress In Brain Research 82:41-46 (1990); Zekorn, et al., Diabetologica 29:99-106 (1992); Zhou, et al., Am. J. Physiol. 274: C.1356-1362 (1998); Darquy, et al., Diabetologica 28:776-780 (1985); Tse, et al., Biotech. & Bioeng. 51:271-280 (1996); Jaeger, et al., Neurol. 21:469-480 (1992); Hortelano, et al., Blood 87(12): 5095-5103 (1996); Gardiner, et al., Transp. Proc. 29:2019-2020 (1997). Ни в одной из этих ссылок не упоминается о включении клеток, способных к быстрой пролиферации, внутрь структуры, которая поглощает их и в то же время ограничивает их рост, но тем не менее обеспечивает диффузию веществ внутрь этой структуры и наружу из нее.
Некая теория, рассматривающая канцероподобные образования, уподобляет такого рода образования, например, опухоли нормальным органам. Здоровые органы, например, печень, растут до определенного размера и далее рост прекращается, однако, если часть печени удалить, она до определенной степени восстановится. Такое же явление наблюдается и в отношении опухолей. В заключение следует отметить, что если часть опухоли удалить, клетки в оставшейся части опухоли начнут размножаться очень быстро, пока получившаяся опухоль не достигнет своего определенного размера, после чего размножение идет на спад и прекращается. Это дает возможность предположить, что существует некий внутренний механизм регулирования роста раковых клеток.
Сущность изобретения
Изобретение, сущность которого раскрыта в данном описании, показывает, что когда клетки, способные быстро размножаться, физически ограничены, например, путем включения в какую-либо структуру, скорость их размножения заметно падает и они продуцируют неожиданно большие количества вещества, которое, будучи применено по отношению к клеткам, не подвергнутым ограничению и быстро размножающимся, ингибирует размножение этих не подвергнутых ограничению клеток. Возможность торможения пролиферации раковых клеток является изначальной целью онкологии. Следовательно, будет понятной терапевтическая полезность данного изобретения в отношении лечения рака и других заболеваний и состояний, вызванных быстрой пролиферацией клеток, и это далее будет подробно разъяснено. По-видимому, продуцируемое вещество не ограничено ни типом быстро размножающихся используемых клеток, ни видом животного, от которого получены быстро размножающиеся клетки. Далее, этот эффект, по-видимому, не является видоспецифичным, так как подвергнутые рестрикции клетки первого вида продуцируют вещество, ингибирующее размножение не подвергнутых рестрикции клеток второго вида. Далее, что касается рака, по всей видимости, данный эффект не зависит от типа рака, так как подвергнутые рестрикции клетки одного типа рака продуцируют вещество, которое ингибирует размножение не подвергнутых рестрикции клеток другого типа рака.
Данный эффект не требует также, по-видимому, и иммунного ответа. Антипролиферативный эффект просматривается в системах in vitro, где используются неиммунные клетки. Отсюда ясно, что антипролиферативный эффект не может быть отнесен к классическим иммунологическим реакциям.
Таким образом, предпочтительный вариант изобретения относится к композиции вещества, имеющего биосовместимую, ограничивающую размножение, избирательно проницаемую структуру. Эта структура ограничивает быстро размножающиеся клетки, которые в результате продуцируют больше вещества, подавляющего быструю клеточную пролиферацию, по сравнению с равным количеством таких же быстро размножающихся клеток, но не подвергнувшихся рестрикции.
Другой предпочтительный вариант настоящего изобретения относится к способу создания биосовместимой, ограничивающей размножение избирательно проницаемой структуры путем формирования этой структуры взаимодействием быстро размножающихся клеток с биосовместимым ограничивающим размножение веществом с получением вышеуказанной структуры и культивирование этих структур в течение продолжительного периода времени для того, чтобы ограничить быстро размножающиеся клетки с тем, чтобы они продуцировали вещество, подавляющее пролиферацию быстро размножающихся клеток, которую следует подавить, по сравнению с равным количеством не подвергнувшихся рестрикции быстро размножающихся клеток того же типа.
Еще один предпочтительный вариант изобретения относится к способу увеличения продуцирования вещества, которое подавляет клеточный рост быстро размножающихся клеток, включающему ограничение быстро размножающихся клеток в биосовместимой, избирательно проницаемой структуре и культивирование быстро размножающихся клеток таким образом, чтобы они продуцировали вышеуказанное вещество. При помещении указанных структур в культуральную среду упомянутое вещество покидает эти структуры и переходит в культуральную среду. Получившаяся культуральная среда также является признаком данного изобретения.
Кроме того, установлено, что сильный антипролиферативный эффект может быть достигнут в результате фильтрации кондиционированной среды, полученной при культивировании структур данного изобретения в культуральной среде. Полученные концентраты обладают исключительно сильными антипролиферативными свойствами.
Упомянутое вещество, кондиционированная среда и/или концентраты, полученные из нее, также могут оказаться полезными для индуцирования выработки указанного антипролиферативного вещества не подвергнутыми рестрикции быстро размножающимися клетками.
В предпочтительных вариантах подвергнутые рестрикции клетки являются раковыми клетками, но преимущества использования клеток, отличных от раковых, для лечения рака и других состояний обеспечивает дополнительную выгоду, что очевидно специалисту в данной области.
Эти и другие признаки изобретения будут поняты из нижеследующего описания.
Подробное описание предпочтительных вариантов
Пример 1
В этом примере и следующих за ним используют RENCA клетки. Это клетки спонтанной аденокарциномы почки от BALB/C мышей, которые широко доступны, сохраняемые как в культурах in vitro, так и in vivo. См. Franco, et al., Cytokine Induced Tumor Immunoqenecity, 181-193 (1994).
Образцам замороженных RENCA клеток дали оттаять при 37°С и затем перенесли в колбы с модифицированной средой Dulbecco (D-MEM), в которую было добавлено 10% бычьей сыворотки, пенициллин (100 ед/мл) и стрептомицин (50 мкг/мл) с получением среды, которая далее будет называться "полная среда".
Клетки выращивали до слияния, затем обрабатывали их трипсином с последующим промыванием сбалансированным солевым раствором Хэнкса, а затем средой, названной выше "полной средой".
Для того чтобы определить, насколько эффективно продуцируют опухоли RENCA клетки, двум BALB/C мышам внутрибрюшинно вводили эти клетки в количестве 106. За животными наблюдали в течение периода 3-4 недель. В первые две недели по клиническим признакам они выглядели здоровыми и проявляли обычную активность. Затем клинические проявления рака стали очевидными. Одна мышь умерла через 23 дня, а вторая - через 25 дней. После смерти мышей обследовали и были обнаружены многочисленные опухоли разных размеров. Кроме того, некоторые из опухолей были кровоточащими.
Пробу из одной опухоли, взятой от одной из мышей, зафиксировали в 10% формалине для дальнейшей гистологической проверки.
Пример 2
После того, как было показано, что RENCA клетки растут in vivo, приступили к исследованию с целью определить, растут ли эти клетки, когда они ограничены в структуре согласно изобретению.
RENCA клетки выращивали до слияния, как было описано выше, обрабатывали трипсином и промывали так, как описано выше. Затем приготовили пробы с содержанием от 60000 до 90000 клеток. Клетки затем центрифугировали при 750 об/мин и жидкость удаляли. Клетки затем суспендировали в растворах 1% ателоколлагена, в фосфатно-солевом буферном растворе при рН 6,5.
Готовили 1% раствор агарозы с низкой вязкостью на минимальной необходимой среде (MEM), сохраняли при 60°С и затем 100 мкл этого раствора добавляли к суспензии RENCA клеток и ателоколлагена, описанной выше. Затем эту смесь немедленно перенесли в виде одной большой капли в стерильное минеральное масло с комнатной температурой. Эта смесь образовала одну единственную ровную полутвердую гранулу. Эту процедуру повторяли, чтобы получить несколько гранул.
Спустя минуту гранулы перенесли в полную среду, которая описана выше, при температуре 37°С. Гранулы затем были трижды промыты в минимальной необходимой среде (MEM), содержащей антибиотики, перечисленные выше. Гранулы затем выдерживали в течение ночи при 37°С в увлажненной атмосфере воздуха, содержащего 5% СО2. После инкубации гранулы, теперь уже ставшие твердыми, были перенесены в стерильную ложку, которая содержала 1 мл 5% агарозы в MEM. Гранулы прокатывали 2-3 раза в растворе, чтобы достигнуть единообразного нанесения на них агарозы. Прежде чем агароза затвердеет, гранулы переносили в минеральное масло, чтобы получить гладкую внешнюю поверхность. Через 60 с гранулы пять раз промывали полной средой при 37°С, чтобы удалить масло. После этого осуществляли выдержку в течение ночи при 37°С в увлажненном воздухе с 5% СO2.
Полученные RENCA содержащие гранулы использовали в дальнейших экспериментах.
Пример 3
Прежде, чем осуществлять исследования in vivo, необходимо было определить, будут ли RENCA клетки расти внутри гранул, приготовленных как описано выше.
Для этого гранулы, полученные как объяснено в примере 2, инкубировали в среде, описанной в примере 2, в течение трех недель при описанных выше условиях. Три гранулы были разрезаны на маленькие кусочки и их культивировали в стандартных культуральных колбах, допуская прямой контакт как с колбой, так и культуральной средой.
Наблюдение за этими культурами показало, что клетки растут и образуют стандартные RENCA колонии. Это доказывает, что клетки в гранулах остались жизнеспособными.
Пример 4
Затем были приведены опыты in vivo. В этих экспериментах гранулы инкубировали в течение 7 дней при 37°С. Опытным животным ввели гранулы. Для этого каждой из четырех мышей сделали срединный надрез, выполненный внутрибрюшинно. Три гранулы, каждая из которых содержала 60000 RENCA клеток, были трансплантированы. Надрезы были затем сшиты (двуслойное смыкание) с помощью рассасывающейся нити. Четверо мышей (BALB/C) были нормальными (мыши - самцы, весом 24-26 г) и казались здоровыми. Были сделаны 2 серии контролей. В первой серии двум мышам вводили 3 гранулы без RENCA клеток, двух мышей не обрабатывали ничем.
Спустя 3 недели после имплантации все мыши получили внутрибрюшинные инъекции 106 RENCA клеток. Спустя 18 дней одна контрольная мышь умерла. Все оставшиеся мыши были затем умерщвлены и исследованы на предмет наличия или отсутствия опухоли.
У контрольных мышей были многочисленные опухоли, в то время как у мышей, получивших имплантаты инкапсулированных в гранулы клеток, обнаружились только отдельные маленькие узелки по всей полости.
Эти обнадеживающие результаты легли в основу плана экспериментов, описанных в следующем примере.
Пример 5
В этих опытах моделировали заранее определенные типы рака путем введения RENCA клеток под одну почечную капсулу каждой из шести BALB/C мышей. Через 15 дней мышей разделили на две группы. Трем мышам в первой группе ввели по три гранулы, как описано в примере 4, выше. Второй группе (контрольной) ввели гранулы, не содержащие RENCA клеток.
В первые 4-5 дней мыши, которые получили имплантаты, содержащие RENCA клетки, выглядели вялыми, апатичными, шерсть у них топорщилась.
После они вернулись к нормальному состоянию. Животные контрольной группы оставались полными сил, их шерсть не претерпела изменений.
Спустя 10 дней после имплантации (25 дней после введения RENCA клеток), однако, мыши из контрольной группы стали медлительными, брюшная полость вздулась. Одна из трех контрольных мышей умерла на 14-й день после трансплантации гранул. Затем мыши были умерщвлены.
В полости тела у контрольных мышей обнаружили профузное кровотечение с многочисленными опухолями по всему пищеварительному тракту, печени, желудку и легким.
Все органы брюшной полости стали неузнаваемыми вследствие поражения быстро растущей опухолью. У мышей, которым ввели гранулы с инкапсулированными RENCA клетками, не наблюдалось, однако, кровотечения, а только несколько узелков в пищеварительном тракте. Кроме того, сравнение опытной и контрольной групп показало, что в опытной группе узелки не увеличивались по сравнению с их первоначальным ростом под почечной капсулой и до имплантации макрогранул.
Пример 6
In vitro рост свободно инокулируемых RENCA клеток ингибируется, когда такие клетки инкубируют наряду с инкапсулированными в макрогранулы RENCA клетками.
Следующая серия экспериментов выполнялась для того, чтобы определить, наблюдается ли данный эффект для других клеток.
Линия клеток аденокарциномы, т.е. ММТ (опухоль молочной железы мыши) была получена из Американской коллекции типовых культур. Как описано выше, готовили инкапсулированные ММТ клетки на основе ММТ клеток, получали гранулы, содержащие от 120000 до 240000 клеток на гранулу. После получения гранул их использовали для определения, будут ли они ингибировать пролиферацию RENCA клеток in vitro. В частности, подготовили две 6-луночные чашки Петри и инокулировали по 1х104 RENCA клеток в 4 мл среды в лунку. В каждой чашке три лунки служили контролем, а три были опытными. В одну из трех контрольных лунок в каждой чашке помещали одну пустую гранулу. В каждую из остальных лунок помещали или 2, или 3 пустых гранул. Вторая серия лунок обрабатывалась аналогично с введением в лунки по 1, 2 и 3 гранулы, содержащие 120000 - 240000 ММТ клеток. Чашки инкубировали при 37°С в течение одной недели, после чего RENCA клетки обрабатывали трипсином, промывали и обсчитывали с помощью гемоцитометра.
Результаты показаны в таблице 1.

Пример 7
После получения результатов примера 6 такие же опыты проделали с использованием в качестве инокулята 1×104 ММТ клеток (т.е. свободных клеток) вместо RENCA клеток. Эксперимент проводили точно так же, как в примере 6.
Результаты приведены в таблице 2.

Эти результаты подтвердили in vivo эксперимент. Эти данные представлены в примере 8.
Пример 8
Использовали клеточную линию опухоли молочной железы мыши (ММТ), описанную выше. С помощью вышеизложенных методик приготовили имплантаты, содержащие 120000 клеток на гранулу и 240000 клеток на гранулу.
Используемой экспериментальной моделью были мыши. 22 мыши были разделены на группы, состоящие из 4 (контроль), 9 и 9 особей. Первая группа (т.е. контрольная) была еще разделена на три группы: две получали имплантат из одной свободной гранулы, одна получала 2 свободные гранулы и одна получала 3 свободные гранулы.
В рамках экспериментальной группы А (9 животных) гранулы содержали 120000 клеток, тогда как в экспериментальной группе В гранулы содержали 240000 клеток. Внутри групп А и В были три подгруппы, в каждой из которых было по 3 мыши. В подгруппах мыши получали одну, две или три гранулы, содержащие ММТ клетки.
В течение нескольких первых дней мыши в группах А и В были вялыми со взъерошенной шерстью. Это продолжалось около пяти дней, после чего наблюдали нормальное поведение мышей. Спустя 21 день после имплантации всем животным ввели 40000 RENCA клеток.
Спустя еще 20 дней у контрольной мыши увеличилась брюшная полость и сильно взъерошилась шерсть. Одна контрольная мышь умерла через 25 дней после инъекции, в то время как остальные контрольные мыши оказались уже мертвы. Все мыши были вскрыты для наблюдения за развившейся опухолью. Эти наблюдения приведены в таблице 3.

Эти результаты показывают, что из 18 обработанных мышей 13 не заболели. Что же касается мышей в группе А, у одной мыши было несколько маленьких узелков (+), а у другой мыши - несколько опухолей (++).
В рамках группы В одна мышь, которая получила одну гранулу, и одна мышь, которая получила 2 гранулы, имели несколько опухолей в кишечнике. У одной из мышей, которая получила 3 гранулы, развилась большая твердая опухоль, и она была явно очень больной (+++). Все контрольные мыши имели многочисленные опухоли (++++).
Результаты показали, что инкапсулированные клетки мышиной опухоли молочной железы ингибируют образование опухолей.
Согласно высказанному выше предположению, реализация данного изобретения приводит к получению вещества, ингибирующего и/или предотвращающего размножение опухолевых клеток. Это изучалось далее в результате эксперимента, который описан выше.
Согласно описанию выше в примере 2, дополнительно приготовили гранулы, но без включения в них ателоколлагена. Следовательно, эти гранулы имели строение агароза - агароза. RENCA клетки, как описано выше, были включены внутрь этих гранул, опять же соответственно вышеданному описанию.
Две серии из трех 6-луночных пластин использовались как контрольная и опытная группы. В контрольной группе в лунки вносили по 4 мл RPMI полной среды (10% эмбриональной телячьей сыворотки и 10 мл/л пенициллина). Каждую ячейку контрольной группы затем инокулировали 10000 RENCA клеток.
В опытной группе RPMI полная среда была кондиционирована путем добавления вещества, полученного в результате инкубирования десяти RENCA содержащих гранул (120000 клеток на 1 гранулу) в чашке Петри размером 35×100 мм, содержащей 50 мл RPMI полной среды. После пяти дней инкубации среда с этих чашек собиралась и 4 мл ее помещали в каждую опытную лунку. Эти лунки затем инкубировали, внеся 10000 RENCA клеток в каждую.
Обе пластины (и контрольная, и опытная) инкубировались при 37°С в течение пяти дней. По окончании инкубирования клетки обрабатывали трипсином, промывали, собирали и подсчитывали с помощью гемоцитометра.
Результаты показаны в таблице 4.

Эти результаты показывают, что клетки, при ограничении их включением, например, в гранулы согласно примерам, продуцируют некое вещество, которое приводит к подавлению размножения клеток опухоли.
Пример 10
Эксперимент, описание которого изложено выше, показал, что рост RENCA клеток в кондиционированной среде примерно в два раза меньше роста клеток в контрольной среде. С помощью описываемых здесь опытов проверили, будет ли продолжаться подавление размножения, если кондиционированная среда заморожена.
RENCA кондиционированная среда была приготовлена путем инкубирования десяти RENCA содержащих гранул в течение 5 дней. Инкубирование проводили в 35×100 мм чашках Петри с 50 мл RPMI полной средой при 37°С. После инкубации среду собирали и хранили при -20°С. Кондиционированная среда была приготовлена инкубированием гранул, содержащих клетки ММТ (опухоль молочной железы мыши). Гранулы содержали по 240000 клеток каждая; в других отношениях все условия опыта были такими же.
Замороженной среде дали оттаять при 37°С и затем использовали в следующих опытах. Три 6-луночные пластины использовались для каждого вида обработки, т.е. (1) RPMI контрольная среда, (2) RENCA замороженная кондиционированная среда, (3) ММТ замороженная кондиционированная среда. В целом, по 4 мл среды было внесено в каждую ячейку. Все ячейки инокулировали 10000 RENCA клеток и инкубировали при 37°С в течение 5 дней. После инкубации отбирали пробы из каждой ячейки двух пластин, обрабатывали трипсином, промывали, собирали и подсчитывали с помощью гемоцитометра. После восьми дней содержимое каждой ячейки трех оставшихся пластин исследовалось таким же образом.
Результаты даны в табл.5.

Если сравнить эти результаты с аналогичными в примере 6, выше, станет ясно, что, несмотря на то, что замороженная и оттаявшая RENCA кондиционированная среда и не подавляет пролиферации в такой же степени, что и замороженная и оттаявшая ММТ кондиционированная среда (сравните примеры 6 и 7), она, тем не менее, подавляет пролиферацию.
Пример 11
Эксперименты, описанные выше, показали, что замороженная кондиционированная среда на основе и RENCA-, и ММТ-содержащих гранул, ингибирует пролиферацию RENCA-клеток in vitro. В экспериментах, описываемых теперь, проверяли, будет ли ингибировать размножение RENCA клеток in vivo среда, кондиционированная RENCA- или ММТ-макрогранулами. Эффекты кондиционированной макрогранулами среды сравнивали с эффектами среды, кондиционированной в присутствии не подвергнутых рестрикции RENCA и ММТ клеток, растущих в монослойных культурах, для того, чтобы определить, будут ли не подвергнутые рестрикции опухолевые клетки, выросшие до слияния, тоже вырабатывать вещество, регулирующее пролиферацию.
Для этих экспериментов 10 макрогранул, каждая из которых содержала 120000 RENCA или ММТ клеток (т.е. 1,2×106 клеток всего), использовали для кондиционирования среды (полной RPMI) в течение 5-дневного периода. Параллельно 1,2×106 RENCA или ММТ клеток, т.е. такое же количество клеток, были внесены в культуральную чашку и они затем размножались в виде монослоя в полной RPMI среде в течение 4-дневного периода времени. Среду потом заменили другой и эту среду собрали спустя 24 ч. Причина разной продолжительности выдерживания гранул и не подвергнутых рестрикции клеток состояла в различии между количествами клеток в монослоях по сравнению с гранулами (3-5-кратное превышение числа клеток в монослоях) в конце 5-дневного периода. Другими словами, не подвергнутые рестрикциии клетки росли гораздо быстрее, чем инкапсулированные клетки, так что их было в 3-5 раз больше.
Для получения концентратов кондиционированной среды, которые предположительно должны были содержать активное вещество с исключением токсичных метаболитов и/или отходов жизнедеятельности клеток как сопутствующих факторов эксперимента, использовали фильтры с размером пор 30 килодальтон и 50 килодальтон. Контаминирующие вещества, которые хорошо известны, слишком малого размера, чтобы удерживаться в 30 кД фильтре. Фильтраты также исследовали, но какая-либо интерпретация результатов с этим материалом осложнена присутствием отходов клеточного метаболизма. Бессывороточная среда (AIM V) также использовалась в некоторых опытах для того, чтобы убедиться, что любые эффекты, обусловленные присутствием сыворотки, сами по себе могут контролироваться.
В основном, кондиционированную среду собирали либо 3-5 дней спустя после того, как макрогранулы были добавлены к ней, или спустя 24 ч после добавления свежей среды к клеткам, не подвергнутым рестрикции. Среду затем помещали в фильтр для опытов в виде пробирки с соответствующим фильтром (или на 30 кД, или на 50 кД), и центрифугировали 90 мин. Массу, которая осталась на фильтре, назвали "концентратом", тогда как то, что прошло через фильтр и собралось на дне пробирки, было фильтратом.
Результаты суммированы в таблицах 6, 7 и 8; они показывают, что когда использовали кондиционированную среду, полученную от RENCA клеток, подвергнутых рестрикции в макрогранулах, это ингибировало пролиферацию RENCA клеток в двух отдельных экспериментах примерно на 52%. Концентрат 50 кД ингибировал пролиферацию примерно на 99% в обоих случаях, в то время как концентрат 30 кД ингибировал пролиферацию примерно на 97%.



Важным моментом в данном эксперименте является тот факт, что и ММТ клетки и RENCA клетки, будучи включенными в макрогранулы и подвергнутыми в результате этого рестрикции, подавляют размножение RENCA клеток, демонстрируя, что ограничивающий размножение эффект не обладает специфичностью к типу опухоли. Эти опыты подтверждают опыты примера 8, в которых ММТ-содержащие макрогранулы подавляли пролиферацию RENCA клеток in vivo. Кроме того, они расширили полученные данные и показали, что вещество, выделившееся из макрогранул в среду, состоит из молекул с массой, по меньшей мере, 30 кД, которые в какой-то мере являются ответственными за ограничивающий пролиферацию эффект. Наконец, эти эксперименты показывают, что ограниченные включением в макрогранулы RENCA и ММТ клетки продуцируют значительно больше подавляющего пролиферацию вещества, чем те же самые клетки, выросшие до состояния монослоя.
Пример 12
Описываемые выше эксперименты показывают, что кондиционированная как ММТ-, так и RENCA - клетками среда содержит вещество, выделившееся из клеток, включенных в макрогранулу и подвергнувшихся в результате этого ограничению в размножении. Это вещество может ингибировать размножение RENCA клеток in vivo и in vitro. Важно, что эксперименты показывают, что эффект ингибирования размножения не специфичен по отношению к типу опухоли. Описываемые здесь эксперименты выявляют, является ли этот эффект независимым от вида животного, у которого естественным путем возникла опухоль.
В этом эксперименте проверяли, оказывает ли клеточная линия рака груди человека подавляющий пролиферацию эффект in vitro на RENCA-клетки (при использовании макрогранул и кондиционированной макрогранулами среды) и ММТ-клетки (при использовании только кондиционированной макрогранулами среды).
Методологически эти in vitro исследования аналогичны опытам, описанным в вышеприведенных примерах. 1000000 MCF-7 клеток (клетки рака груди человека) инкапсулировали в макрогранулы, а получившиеся MCF - 7 макрогранулы инкубировали с RENCA клетками (10000 на ячейку) в течение 5 дней для того, чтобы оценить ингибирующее пролиферацию действие макрогранул. Кроме того, в течение 5 дней инкубирования была приготовлена среда, кондиционированная MCF - 7 макрогранулами; она была испытана и на RENCA, и на ММТ клетках. Клеточную пролиферацию определяли спустя 5 дней.
Полученные результаты приведены в табл.9-11.



Эти результаты показывают, что клетки MCF-7, принадлежащие линии аденокарциномы груди человека, будучи включенными в макрогранулы и ограниченные в отношении размножения, продуцируют вещество, которое ингибирует размножение клеток почечной аденокарциномы мыши и клеток опухоли молочной железы мыши в значительной степени (30-70%), что было продемонстрировано как с помощью самих макрогранул, так и кондиционированной ими среды. Это показывает, что эффект ингибирования размножения, проявляемый ограниченными в росте раковыми клетками, не зависит ни от типа опухоли, ни от вида животного, у которого развилась опухоль, т.е. мыши и человека.
Пример 13
Эксперименты, описанные выше, демонстрируют, что линия клеток, выделенных из аденокарциномы груди человека (MCF-7), будучи ограниченной в росте при включении в макрогранулы, обеспечивает ингибирование размножения клеток почечной аденокарциномы мыши и аденокарциномы молочной железы мыши in vitro. Описываемые здесь эксперименты ставят своей целью проверить, существует ли in vivo параллельный эффект MCF-7 содержащих макрогранул на рост опухоли RENCA клеток.
Восемнадцати Balb/c мышам внутрибрюшинно ввели 200000 RENCA клеток. Спустя 3 дня мышей разделили на две группы. В группе 1 было шесть мышей, а в группе 2 - остальные 12 мышей. Мышам из группы 1, контрольным, были трансплантированы каждой - по три пустые макрогранулы. Каждой мыши из группы 2 трансплантировали по три MCF - 7 - содержащие гранулы (100000 клеток на гранулу). Спустя 25 дней две мыши из группы 1 и три мыши из группы 2 были умерщвлены. Такое же количество мышей было умерщвлено на двадцать шестой день и оставшиеся мыши умерщвлены на двадцать седьмой день.
При некроскопии контрольных мышей наблюдалось абсолютная заполненность опухолями брюшной полости, и обычные органы стали неузнаваемыми. Такая опухолевая насыщенность классифицировалась как +++++ (100%). У мышей, подвергнутых обработке, опухолевая насыщенность была + (10-20%).
Эти результаты показывают, что макрогранулы, содержащие клетки аденокарциномы груди человека, способны ингибировать рост клеток аденокарциномной опухоли у мышей, вновь подтверждая, что эффект ингибирования роста опухоли/размножения раковых клеток не является зависящим ни от типа опухоли, ни от видовой принадлежности источника ее происхождения.
Пример 14
Описанные выше эксперименты демонстрируют, что эффект ингибирования клеточной пролиферации/роста под действием опухолей, рост которых ограничен макрогранулами, не зависит ни от типа опухоли, ни от видовой принадлежности источника ее происхождения. Описываемые здесь эксперименты ставят своей целью проверить, могут ли клетки аденокарциномы молочной железы мыши, ограниченные в размножении включением в макрогранулы, ингибировать рост спонтанных опухолей молочной железы, и опухолей, возникших в результате инъекции ММТ клеток.
У СЗН мышей имеется очень высокая вероятность развития рака молочной железы на протяжении всей жизни. У семи мышей с риском развития таких опухолей эти опухоли появились на шестнадцатом месяце жизни. В это время пяти из этих семи мышей имплантировали по 4 ММТ макрогранулы, содержащих 100000 клеток каждая. Остальные две контрольные мыши получили по 4 пустых макрогранулы каждая. У двух контрольных мышей развились большие опухоли и они умерли в течение трех месяцев после имплантации гранул. Мыши, подвергшиеся обработке, были умерщвлены 11 месяцев спустя после имплантации ММТ макрогранул. Извлеченные макрогранулы, органы и опухоли были исследованы макроскопически и гистологически. Окрашивание ММТ макрогранул гернотоксилином и эозином выявило жизнеспособные клетки. Существующие до этого опухоли не увеличивались в размерах и было очевидно отсутствие развития каких-либо новых опухолей.
Были проведены также опыты по подкожному введению ММТ опухолевых клеток в грудную зону. Четырнадцать СЗН мышей разделили на 2 группы. Пяти мышам из контрольной группы имплантировали по 3 пустые макрогранулы каждой. Девять подвергнутых обработке мышей получили по три ММТ - содержащих макрогранулы (240000 клеток) каждая. Спустя 3 недели после имплантации всем четырнадцати мышам подкожно ввели в зону молочной железы по 200000 ММТ клеток каждой.
Между 25-м и 30-м днем пятеро контрольных мышей заболели с очевидным образованием опухоли, и все они умерли к 35-му дню после инъекции. Девять подвергнувшихся обработке мышей, наблюдаемых еженедельно, в течение этого периода были живы без какого-либо очевидного признака образования опухоли или без потери здоровья. Спустя 10-12 месяцев после инъекции опухоли у четырех из девяти обработанных мышей появились узелки и в этих "очажках" вылезла шерсть. Оставшимся пяти мышам снова имплантировали по три ММТ макрогранулы 13 месяцев спустя после первой инъекции опухоли. Одна мышь умерла через 3 дня после этой операции, но при вскрытии никакой опухоли не обнаружилось. Четыре выжившие мыши были умерщвлены через 8 месяцев после второй имплантации макрогранул. Вскрытие показало минимальное или полное отсутствие роста опухоли.
Дополнительным наблюдением данных экспериментов было то, что гранулы, извлеченные после первой имплантации, содержали жизнеспособные опухолевые клетки, что основывается на данных гистологии и их способности возобновлять агрессивно растущие опухолевые структуры в культурах ткани после извлечения из гранулы.
Результаты этих экспериментов показывают, что эффекты ограниченных гранулой раковых клеток по ингибированию клеточной пролиферации/роста опухоли применительно к клеткам аденокарциномы молочной железы мыши могут влиять на развитие и рост как спонтанно возникших опухолей, так и экспериментально вызванных опухолей, возникших от инъекции опухолевых клеток в грудную зону.
Пример 15
Описанные выше эксперименты демонстрируют ингибирующий эффект включенных в макрогранулы и ограниченных в размножении раковых клеток в отношении клеточной пролиферации/роста опухоли, который проявляется независимо от типов опухоли и независимо от видовой принадлежности источников указанных клеток, а также в отношении как спонтанно возникших, так и искусственно индуцированных опухолей. Описываемые здесь эксперименты призваны расширить полученные результаты с целью исследования влияния включенных в макрогранулы и ограниченных в размножении клеток аденокарциномы простаты человека (ARCap 10), клеток почечной аденокарциномы (RENCA клетки) мыши (Balb/c) и клеток аденокарциномы грудной железы (ММТ) мыши (СЗН) на пролиферацию ARCaP10 опухолевых клеток и рост опухоли ARCaP10 у голых мышей (Nu/Nu).
В первой серии экспериментов пятнадцати Nu/Nu мышам было введено подкожно в бок 2,5×106 ARCaP10 клеток. На двадцатый день после инъекции, когда средний размер максимальной опухоли достиг 0,5 см, мышей разделили на 2 группы. Девяти мышам имплантировали по 4 ARCaP10 макрогранулы (1,0×105 клеток на макрогранулу), а шесть контрольных мышей получили по 4 пустые макрогранулы.
Спустя 10 недель после имплантации у пяти контрольных мышей были обнаружены очень крупные васкуляризованные опухоли (в среднем 2,5 см в диаметре) и у одной мыши была опухоль, меньшая по размеру (менее чем 0,5 см). В группе подвергнутых обработке мышей у пяти мышей наблюдали полную регрессию первоначальных опухолей, а все остальные оказались без опухолей вплоть до умерщвления на восьмом месяце. У двух мышей выявлено отсутствие роста опухоли, т.е. их опухоли были того же самого максимального диаметра, который они имели во время имплантации макрогранул, а две мыши имели опухоли, которые увеличились с момента имплантации макрогранул.
Эти результаты [объем и размер опухоли (дл. х шир. х выс.)] эксперимента, в котором RENCA - содержащие макрогранулы (1,2×105) были имплантированы 4 Nu/Nu мышам спустя 18 дней после подкожной инъекции каждому животному в бок по 3,0×106 ARCaP10 опухолевых клеток, показаны в табл.12, 13.

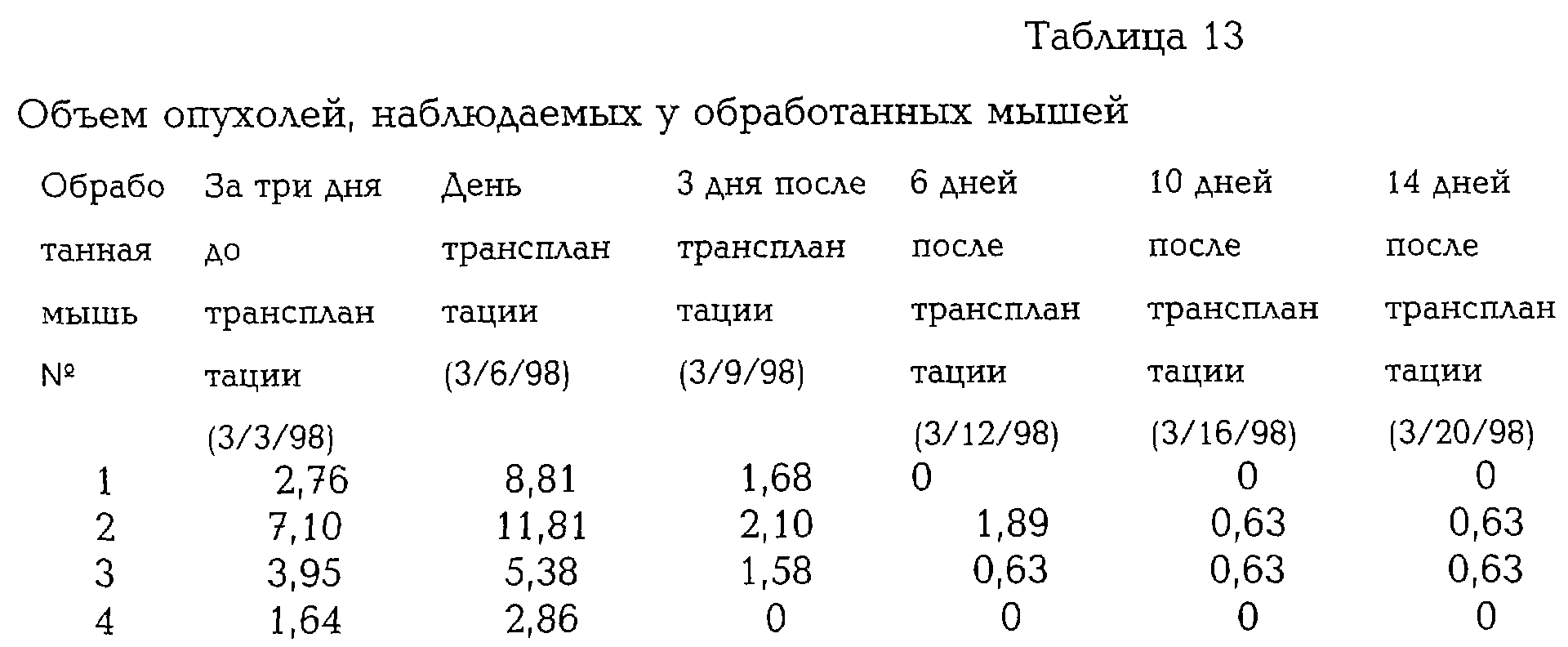
В другом эксперименте 10 Nu/Nu мышам вводили по 2,5×106 АРСаР10 клеток, причем у шести из них было отмечено развитие опухоли спустя 64 дня после инъекции. Трем из этих мышей были введены по 4 ММТ макрогранулы (2,4×105 клеток), а трем - пустые макрогранулы. Результаты приведены в табл.14, 15.


Результаты этих экспериментов еще раз подтверждают не зависящий от видовой принадлежности источника клеток и природы опухоли подавляющий рост опухоли эффект ограничения размножения, оказываемый на опухоли различных типов. Кроме того, эти эксперименты демонстрируют способность ограниченных в отношении размножения раковых клеток не только подавлять рост опухоли и предотвращать ее образование, но также и вызывать эффективную регрессию опухолей in vivo.
Пример 16
Эксперименты, описанные выше, показали, что раковые клетки, размножение которых ограничено, полученные из разных типов опухолей от разных видов животных, могут ингибировать пролиферацию раковых клеток того же самого или других типов рака in vitro и предотвращать образование как спонтанных, так и индуцированных опухолей, а также предотвращать рост опухолей и вызывать регрессию опухолей in vivo, причем независимо от видовой принадлежности источника таких клеток или типа рака. Описываемый здесь эксперимент касается распространения этих выводов применительно к другим видам животных (кролик) и опухолям кроликов, вызываемых, как известно, вирусами (VX2).
В этом эксперименте белому новозеландскому кролику (2,5 фунта) внутримышечно ввели в одно бедро (в разные точки) по 0,5 мл в каждую точку VX2 опухолевой суспензии (которую можно охарактеризовать тем, что она обладала способностью проходить через иглу 26-го калибра). Через 3,5 недели на дорсальной части бедра была обнаружена опухоль размером 5 × 2,5 см (длина х ширина), а на вентральной части бедра две опухоли диаметром 3 см. В это время внутрибрюшинно было имплантировано 211 макрогранул (108 гранул с RENCA клетками, 63 гранулы с ММТ клетками и 40 гранул, содержащих MCF-7 клетки рака груди человека). Спустя 2 дня опухоль на дорсальной части бедра сократилась примерно на 50%; тем не менее две вентральные опухоли не уменьшились. Животное умертвили спустя 10 дней после имплантации макрогранул. При вскрытии стала ясной разница между дорсальной и вентральными опухолями, заключающаяся в том, что первая была гораздо меньше, чем она была во время имплантации макрогранул, в то время как две вентральные опухоли были и кровоточащими, и некротическими.
Этот эксперимент распространяет выводы относительно эффективности ограничения размножения разных типов раковых клеток в отношении предотвращения, приостановки и даже регрессии роста опухолей на другие виды животных, в частности, кролика. Кроме того, он дополняет перечень типов опухолей, в отношении которых показан такой ответ, опухолью вирусного происхождения, и, наконец, подтверждает перекрестный в отношении опухоли и видовой принадлежности источника происхождения опухолевых клеток характер ингибирующего рост раковых клеток эффекта, так как использовались макрогранулы с клетками рака почки мыши, рака молочной железы мыши и рака груди человека. Кроме того, в указанном эксперименте использована модель, разработанная на более крупном животном, что является очень важным для демонстрации in vivo эффективности использования раковых клеток с ограничением размножения при лечении рака.
Пример 17
Вышеописанный эксперимент показывает, что ограничение размножения опухолевых клеток различных типов приводит к их способности ингибировать рост клеток того же или разных типов in vitro и предотвращать образование, подавлять рост или вызывать регрессию различных типов опухолей in vivo и что обнаруженные эффекты не зависят от типа опухоли или происхождения раковых клеток. В экспериментах, излагаемых теперь, оценивалась долговременная жизнеспособность ограниченных в плане размножения RENCA раковых клеток, находящихся внутри агароза/агарозных макрогранул, сохраняемых в культуре в течение 1 месяца, 6 месяцев, 2 лет и 3 лет с использованием гистологических, культуралъных и in vivo методов. ММТ - содержащие макрогранулы сохранялись в культуре вплоть до 6 месяцев. Кроме того, RENCA- и ММТ-содержащие макрогранулы, извлеченные из Balb/c и СЗН мышей соответственно после периода продолжительностью от 2 до 8 месяцев после имплантации, проверялись на наличие жизнеспособности раковых клеток как гистологическим, так и культуральным методами.
Для этих экспериментов готовили агароза/агарозные макрогранулы либо с 1,2х105 RENCA клетками, либо с 2,4×105 ММТ клетками. Они проверялись гистологически (герматоксилин + эозиновое окрашивание) и культуральным методом на жизнеспособность клеток и опухолевые характеристики в указанных выше интервалах времени. Что касается RENCA макрогранул, количество клеток увеличилось приблизительно в 3 - 5 раза к первому месяцу с последующим дополнительным удвоением в 6 месяцев. После 1 года происходило непрерывное увеличение клеточной массы, но скорость клеточной пролиферации была пониженной. Спустя 2 года аморфный материал начал скапливаться в центре гранулы и, по-видимому, клеточная масса/число клеток не увеличивалось, хотя признаки митоза были еще очевидными. Спустя три года в центре гранулы по всей видимости был еще какой-то более аморфный материал, но масса клеток/число клеток было стабильно. За ММТ макрогранулами следили только 6 месяцев, но ранний характер клеточной пролиферации и внешний вид гранул были такими, как для RENCA клеток.
Для оценки жизнеспособности и биологических свойств RENCA и ММТ клеток в интервалах, указанных выше, раздробили 10 гранул и высевали их в 2 или более 25 см2 колбы для тканевых культур в полную RPMI среду. Затем наблюдали за ростом клеток в колбах. По прошествии времени от 1 до 6 месяцев число жизнеспособных клеток, выделенных из гранул, увеличилось. К году количество RENCA клеток, выросших из раздробленных гранул, было таким же, как к 6-му месяцу. Ко второму и третьему году соотношение между жизнеспособными клетками, было немного меньше, падая приблизительно на 20% от максимального количества, полученного в грануле (т.е. в состоянии ограничения роста) после трех лет культивирования.
Для оценки извлеченных RENCA и ММТ макрогранул (периоды 1-4 года для RENCA макрогранул и до 8 месяцев для ММТ макрогранул) до сих пор использовались гистологические методы. Характер клеточной пролиферации и массы клеток весьма схож с таковыми в гранулах, сохраняемых в культуре в течение соответствующих периодов времени, т.е. клетки увеличиваются в количестве, по меньшей мере, до 4 месяцев для RENCA и 8 месяцев для ММТ.
Для других используемых линий раковых клеток, таких как MCF-7 и ARCaP10, гранульные образцы по жизнеспособности аналогичны таковым для RENCA и ММТ.
Эти эксперименты показывают, что раковые клетки могут сохраняться in vitro в течение периодов времени вплоть до 3 лет и in vivo в течение, по меньшей мере, 8 месяцев в окружении, ограничивающем размножение, и что они сохраняют свою жизнеспособность в течение этих периодов времени, четко демонстрируя увеличивающееся число клеток вплоть, по меньшей мере, до одного года. Это важно не только для того, чтобы суметь создать и хранить средства для лечения рака, но также и для способности клеток с ограничением размножения вырабатывать в теплокровных животных непрерывно и в течение продолжительного времени вещества, подавляющие рост опухоли, что, вероятно, будет необходимым для успешного лечения экспериментального или естественно возникшего рака.
Пример 18
Вышеописанные эксперименты показывают, что раковые клетки различных типов могут поддерживаться и сохраняться в условиях, ограничивающих размножение, в течение длительного времени (до 3-х лет) с сохранением их способности размножаться, образовывать опухоли и выделять ингибирующее размножение клеток и предотвращающие рост опухоли, подавляющие и разрушающие ее вещества. Описываемый теперь эксперимент касается оценки возможной токсичности долговременных (одногодичных) имплантированных Balb/c мышам агароза/агарозных микрогранул, содержащих раковые клетки.
Семи Balb/c мышам имплантировали по 3 RENCA макрогранул каждой (1,2×105 клеток на гранулу). Сразу же после операции мыши стали казаться больными (торчащая шерсть и апатия) в течение нескольких дней, но потом они снова выглядели здоровыми. Все мыши выжили при хорошем состоянии здоровья в течение периода времени, по меньшей мере, 1 год, причем одна мышь умерла уже будучи старой, а другая умерла по другим причинам. Все мыши были умерщвлены. При вскрытии не наблюдалось никаких аномалий, таких как фиброз, перитонит или растущая опухоль. Все органы выглядели вполне нормальными, хотя наблюдалось некоторое прилипание гранул к серозным поверхностям кишечника, особенно где были кишечные петли. Никакой помехи нормальной функции или структуре кишечника не наблюдалось.
Эти результаты показывают, что агароза/агарозные макрогранулы, содержащие раковые клетки, хорошо переносятся животными в эксперименте в течение периода времени свыше 1 года. Эти выводы показывают, что гранулы с раковыми клетками с ограничением размножения могут использоваться in vivo для предотвращения, подавления и регрессии клеточного размножения, включая in vivo опухоли различных типов.
Следующие примеры предоставляют дополнительные данные, подтверждающие, что, в связи с настоящим изобретением, иммобилизованные стволовые клетки эффективно ингибируют рост стволовых клеток (даже стволовых клеток других линий), и что иммобилизованные раковые клетки ингибируют рост стволовых клеток.
Пример 19
Две различные мышиные зародышевые стволовые (ES) клеточные линии (т.е. ES-D3 и SCC-PSA1, являющиеся общедоступными) получают из Американской коллекции типовых культур ("АТСС").
Обе линии выращивают в стандартных культуральных условиях, которые включают выращивание в виде атонических "STO" эмбриональных фибробластных питающих клеток монослоя. Эти клетки также получают из АТСС. Стволовые клетки культивируют в среде DMEM, дополненной 100% ES-установленной фетальной бычьей сывороткой, фактором, ингибирующим лейкоз (LIF), и (β -меркаптоэтанолом (общее название среды "Среда А"). Клетки, которые после получения хранят на холоду (криоконсервируют), размораживают и определяют в качестве культур, по меньшей мере, после 3 пассажей, прежде чем культивировать, как описано выше.
Через три дня культура ES-клеток на 70-80% является монослойной, ее обрабатывают трипсином, а затем иммобилизуют на гранулах агарозы. Используют агарозу Sigma XII, с начальной концентрацией около 1,0%. Аликвоту 100:1 этого агарозного раствора добавляют к 34:1 клеточной суспензии. Полученные в результате гранулы содержат 2, 0×105±1,5×104 мышиных эмбриональных стволовых клеток. Гранулы покрывают вторым слоем агарозы с концентрацией около 5%. Гранулы культивируют в вышеописанной среде, за исключением того, что отсутствуют LIF или жизнеспособные STO питательные клетки ("Среда В").
Жизнеспособность клеток в гранулах во времени оценивают обычными гистохимическими исследованиями и исследованиями под микроскопом, а также стандартными анализами МТТ, используя клетки, выделенные из гранул или сохраняющиеся в гранулах, в различные моменты времени.
Наблюдается, что иммобилизованные стволовые клетки повышают свою метаболическую активность при первом покрытии. За этим следует понижение активности, по мере того, как клетки погибают вследствие апоптоза, достигая самой низкой точки метаболической активности, примерно, на 21 день. Однако, после этой низкой точки выжившие клетки медленно пролиферируют, и наблюдается постепенное повышение общей метаболической активности на 35 день после иммобилизации и далее. Эти результаты соответствуют наблюдениям на иммобилизованных раковых клетках.
Морфологически существует заметное различие между колониями, образуемыми во внутреннем слое агарозы гранулы раковыми клетками, и колониями, образуемыми стволовыми клетками. Хотя оба типа колоний имеют яйцевидные очертания, колонии, образованные раковыми клетками, характеризуются внешней зоной жизнеспособных клеток (как правило, толщиной в две или три клетки) с центральной зоной эозинофильного клеточного дебриса. С другой стороны, колонии, образуемые стволовыми клетками, полностью заняты жизнеспособными клетками, и центральная зона клеточного дебриса отсутствует.
Пример 20
В данном эксперименте проверяют ингибирующее действие стволовых клеток на пролиферацию других стволовых клеток.
Жизнеспособность десятидневных стволовых клеток, содержащихся в агароза/агарозных гранулах (клетки SCC-PSA), проверяют методом МТТ, рассмотренных выше, и культивируют их в Среде В, см. пример 1, в течение 6 дней. Через 6 дней среду кондиционируют с помощью иммобилизованных стволовых клеток. В дальнейшем ее называют "Среда, кондиционированная стволовыми клетками" (SCM).
Через 6 дней SCM переносят в 6-луночные планшеты, содержащие свежие клетки SCC-PSA 1. Каждый из этих планшетов содержит 9х105 STO питательных клеток, покрытых 1,5х104 SCC-PSA1 клеток. Клетки STO обрабатывают митомицином С с целью предотвратить пролиферацию. Имеются три контрольные лунки, т.е. лунки, которые содержат Среду В (некондиционированная среда), и три лунки, которые содержат SCM.
Через 3 дня содержимое всех лунок обрабатывают трипсином и считают общее число клеток, применяя стандартные методы. Результаты корректируют в расчете на 9×10 питательных клеток. Результаты приведены в табл.16.

В аналогичном эксперименте получены следующие результаты (см. табл.17).

Далее, эффект не является специфическим в отношении клеточной линии, как показывают результаты, полученные при добавлении в среду клеток ES-D3 (см. табл.18).

Пример 21
В Примере 20 показано, что ингибирующее действие стволовых клеток на пролиферацию не является специфическим в отношении клеточной линии. В описанных ниже экспериментах проверяют способность иммобилизованных стволовых клеток ингибировать пролиферацию раковых клеток.
В этих экспериментах используют опухолевые клетки RENCA. В каждую лунку засевают 15000 опухолевых клеток. Используют SCM (кондиционированная либо SCC-PSA 1, либо ES-D3), как описано выше, в качестве контрольной используют Среду В, так же как описано выше.
Что касается SCM, кондиционирование осуществляют в течение 5 дней. Анализ проводят в течение 32 недель. Ингибирование клеток RENCA определяют, фиксируя клетки 100%-ным метанолом с последующим окрашиванием нейтральным красным, лизисом с помощью SDS и сканированием при использовании спектрофотометра с целью определения количества нейтрального красного в клеточном лизате, которое пропорционально числу клеток на лунку.
Результаты объединяют в таблицах, 19, 20, в которых показано действие ES-D3 и SCC-PSA 1 стволовых клеток, соответственно. Результаты для недель 1-3 коррелируют с результатами, обсуждаемыми в Примере 1, т.е. гибель иммобилизованных стволовых клеток достигает самой низкой точки на 21 день с последующей регенерацией.


Пример 22
В предыдущих экспериментах проверяется и подтверждается способность иммобилизованных стволовых клеток ингибировать пролиферацию стволовых клеток и раковых клеток. Нижеследующие эксперименты проводят с целью определить, могут ли иммобилизованные раковые клетки ингибировать пролиферацию стволовых клеток.
Стволовые клетки помещают в планшеты и культивируют, как описано выше. Гранулы, содержащие клетки RENCA, полученные, как описано в патентах США 6303151; 6224912 и 5888497, культивируют в Среде В с целью ее кондиционирования в течение 5 дней. Затем эту кондиционированную с помощью RENCA среду (RCM) добавляют к находящимся в планшетах стволовым клеткам и через 3 дня стволовые клетки считают. Результаты, представленные выше, представляют данные для клеток ES-D3, а затем для клеток SCC-PSA1 (см. табл.21, 22).


Эти результаты указывают, что иммобилизованные раковые клетки ингибируют пролиферацию стволовых клеток.
Вышеприведенные примеры описывают изобретение, которое включает, помимо прочего, композиции, которые могут использоваться для получения вещества, которое подавляет или регулирует пролиферацию быстро размножающихся клеток, в особенности, обеспечивает супрессию раковых клеток. Эти композиции содержат клетки в логарифмической фазе роста (фаза быстрого размножения), включенные в избирательно проницаемый материал, образующий структуру, которая ограничивает размножение включенных клеток. В результате клетки, претерпевающие такое ограничение, продуцируют неожиданно высокие количества вещества, которое подавляет размножение в высокой степени пролиферирующих клеток, таких как раковые клетки. Клетки, подвергнувшиеся рестрикции (ограничению), продуцируют больше этого вещества по сравнению с сопоставимыми количествами клеток, не подвергнутых рестрикции.
Материал, используемый для образования структур данного изобретения, представляет собой любой биосовместимый материал, который ограничивает рост быстро размножающихся клеток, стимулируя их тем самым вырабатывать большие количества вещества, подавляющего рост и размножение клеток. Эта структура имеет подходящий размер пор, так что вышеупомянутое супрессивное вещество может диффундировать наружу, во внешнюю среду, и предохраняет выработанные вещества и клетки от действия иммунной системы хозяина, от попадания внутрь этой структуры каких-либо продуктов и клеток и индукции отторжения нужных раковых клеток или, другими словами, от ослабления их способности к выживанию и продолжению вырабатывать желаемое вещество. Материал, используемый для создания такой структуры, также должен обеспечивать сохранение жизнеспособности (ограниченных в размножении, но выживающих) клеток как in vitro, так и in vivo, предпочтительно в течение периодов времени до нескольких лет, поддерживая поступление соответствующих питательных элементов, удаление продуктов клеточного метаболизма и совместимые физико-химические условия внутри структуры. Материал, используемый для получения этой структуры, предпочтительно, является хорошо совместимым материалом для имплантации in vivo и - самое предпочтительное - хорошо переносится хозяином в течение всего имплантационного периода.
Нелимитирующий перечень материалов и комбинаций материалов, которые могут быть использованы, включает альгинат-поли-(L-лизин); альгинат-поли-(L-лизин)-альгинат; альгинат-поли-(L-лизин)-полиэтиленимин; хитозан-альгинат; полигидроксиэтил-метакрилат-метил метакрилат; карбонилметилцеллюлозу; К-каррагенан; хитозан; агароза-полиэфирсульфон-гексади-метирин-бромид (Polybrene); этилцеллюлозу; силикагели и их сочетания.
Структуры, которые содержат композиции веществ, могут иметь разные формы, например, гранулы (зерна), сферы, цилиндры, капсулы, пластины или любую иную форму, которая пригодна для имплантации индивидууму и/или в культуральную среду in vitro. Размеры структуры могут варьировать в зависимости от ее возможного использования, что должно быть понятно квалифицированному специалисту.
Структуры данного изобретения обладают избирательной проницаемостью, так что питательные элементы могут проникать в структуру, а ингибирующее пролиферацию вещество, так же как клеточные отходы, могут покидать структуру. Для in vivo использования предпочтительно, чтобы эти структуры охраняли "вход" продуктов или клеток иммунной системы хозяина, что должно было бы вызывать отторжение подвергнутых рестрикции клеток или, другими словами, ухудшать способность клеток продуцировать подавляющее размножение вещество.
Другой аспект изобретения включает композиции, которые можно применять для подавления пролиферации раковых клеток. Эти композиции готовят путем культивирования подвергнутых рестрикции клеток, как описано выше, в соответствующей культуральной среде с последующим выделением получившейся кондиционированной среды. Из кондиционированной среды могут быть потом получены концентраты, например, отделением фракций, имеющих молекулярные массы более чем 30 кД или более чем 50 кД, которые оказывают сильные антипролиферативные воздействия на раковые клетки.
Изобретение не ограничивается каким-либо особым типом пролиферативной клетки. Любая быстро размножающаяся клетка, в соответствии с определенным выше, может быть использована согласно изобретению, включая (но без ограничения) опухолевые клетки, клетки эмбриона, стволовые клетки, клетки в фазе восстановления, например, после повреждения или травмы, в частности, гепатоциты, фибробласты и эпителиальные клетки. Раковые клетки являются предпочтительным типом клеток и примерные типы раковых клеток, которые могут использоваться, включают раковые клетки почки, клетки рака молочной железы, клетки рака простаты, клетки хориокарциномы и так далее. Раковые клетки могут быть эпителиальными, мезотелиальными, эндотелиальными или клетками зародышевого происхождения и включают раковые клетки, которые вообще не образуют плотных опухолей, например, клетки лейкемии.
Как должно быть понятно из этого описания, еще одним аспектом изобретения являются терапевтические способы для лечения лиц, страдающих от гиперпролиферативных заболеваний, таких как рак, воспаление, фиброз и трофобластоз. Предметом изобретения является также и контроль роста клеток в пролиферативной фазе с тем, чтобы они репродуцировались контролируемым путем. Это особенно целесообразно, например, при контролировании образования келоидов или рубцовой ткани, предотвращая адгезию после абдоминальной хирургии, или возможно - при гиперпролиферативных заболеваниях кожи, например, при псориазе. При использовании в терапевтических целях, как будет обосновано ниже, тип клеток, ограниченных в росте включением в указанную структуру, не обязательно может быть типом клеток, обусловливающим (или который может обусловливать) страдания пациента, хотя может быть и таким. Один из способов включает введение, по крайней мере, одной из описываемых структур согласно изобретению индивидууму в количестве, достаточном, чтобы вызвать подавление клеточной пролиферации. Предпочтительно, такой метод применим для лечения рака, а индивидуумом является человек, хотя он применим и к животным, таким как домашние животные, сельскохозяйственные животные или любой другой вид животных, которые больны раком.
Композиция настоящего изобретения может использоваться как для первичной терапии гиперпролиферативных заболеваний, так и в качестве дополнительной лечебной процедуры в комбинации с другими видами терапии. Например, пациентов можно лечить с помощью композиций и способов, описываемых здесь, в дополнение к хорошо известным видам терапии, например, облучению, химиотерапии, генной терапии, лечению другими биологическими активными веществами, такими как цитокины, вещества, притупляющие чувствительность (содержащие наркотики), стероидные гормоны и т.п. Композиции и способы данного изобретения могут также использоваться дополнительно к хирургическим процедурам лечения рака, например, для имплантации макрогранул после иссечения опухоли для предотвращения ее повторного роста и метастазирования. Рак в неоперабельном состоянии может быть превращен в операбельный, если использовать для лечения антипролиферативные композиции данного изобретения.
Композиции изобретения могут использоваться профилактически в индивидуальных случаях при риске развития рака, например, при наличии индивидуальных факторов риска, в основном, при наследственных факторах риска вообще, при наследственном факторе риска заболевания раком определенного типа (например, раком груди), при подвергании воздействию профессиональных или других канцерогенов и средств, вызывающих рак. При профилактике рака профилактически эффективное количество структур изобретения вводится лицу при установлении одного или нескольких факторов риска.
Как показано в примерах выше, антипролиферативный эффект не определяется ни типом используемых пролиферирующих клеток, ни видом животного, от которого получены пролиферирующие клетки. Однако можно ввести структуры, которые содержат, например, раковые клетки первого типа, индивидууму с другим, отличным от первого, типом рака. Далее, пролиферирующие клетки видов животных, отличных от видов, которые подвергают лечению, могут использоваться в вводимых структурах. Например, клетки рака мыши могут быть включены в структуры в соответствии с изобретением и ограничены в размножении и затем введены человеку. Конечно, структуры могут содержать раковые клетки тех же самых видов животных, что и животные, подвергаемые лечению. Более того, пролиферирующие клетки могут быть получены от индивидуума, который подвергается лечению, включены в структуру, ограничены в размножении и затем введены тому же самому индивидууму. Другими словами, собственные раковые клетки пациента могу быть подвергнуты ограничению в размножении и использоваться для подавления того же самого типа рака.
Еще один аспект изобретения отражает использование концентратов, которые здесь описаны, в качестве терапевтических средств. Эти концентраты могут быть приготовлены, как описано выше, затем быть введены субъекту с гиперпролиферативным заболеванием, таким как рак, или пациенту, который нуждается в контролировании скорости размножения клеток, например, послеоперационный больной, у которого шовная рана находится в таком месте, где избыточная рубцовая ткань будет приносить вред или просто нежелательна. Все варианты, описанные выше, могут использоваться для приготовления концентратов. Например, после in vitro культивирования структур, содержащих клетки рака мыши, могут быть приготовлены концентраты и введены людям. Аналогично структуры могут содержать клетки человека и даже клетки, полученные от одного и того же лица. Кроме того, как обсуждалось выше, тип раковых клеток, используемых для получения концентрата, может быть, но не обязательно, тем же самым типом рака, от которого страдает больной. Однако клетки рака молочной железы мыши могут использоваться, например, для получения концентрата, который будет применен для лечения людей с меланомой, или у индивидуума с раком простаты может быть удалена часть клеток опухоли простаты, включена в структуру согласно изобретению, подвергнута культивированию в соответствующей среде и затем путем фильтрования полученной в результате кондиционированной среды выделен концентрат. Следует иметь в виду, что кондиционированная среда, полученная при культивировании in vitro структур данного изобретения, также является предметом изобретения.
Способы получения структур данного изобретения, так же, как и указанные концентраты, являются предметом данного изобретения. Что касается концентратов, можно просто культивировать структуры, полученные в соответствии с изобретением, в течение периода времени, достаточного для наработки необходимого количества антипролиферативного вещества, и затем отделить желаемые части от полученной кондиционированной среды, например, фильтрацией через фильтр с соответствующим пределом отсечения, например, 30 килодальтон или 50 килодальтон.
Другие аспекты изобретения будут ясны квалифицированному специалисту и не излагаются здесь.
Термины и выражения, которые были применены, используются для описания изобретения и применение этих терминов и выражений не ограничивает и не ставит целью исключение любых эквивалентов раскрытых и описанных признаков или их частей, при этом подразумевается, что в объеме изобретения возможны различные модификации.
Реферат
Изобретение относится к медицине. Заявлены композиции, которые содержат ограниченные в размножении пролиферирующие клетки. При таком ограничении клетки продуцируют неожиданно высокое количество вещества, которое подавляет пролиферацию клеток и имеет молекулярную массу около 30 кД. Это явление не зависит ни от типа клеток, ни от их видовой принадлежности. Раскрыты также способы получения таких композиций и их применение. Изобретение обеспечивает возможность использования клеток, отличных от раковых, для лечения рака и других состояний. 16 н. и 94 з.п.ф-лы, 22 табл.

Комментарии