Вакцины и компоненты вакцин для подавления микробных клеток - RU2528854C2
Код документа: RU2528854C2
Чертежи




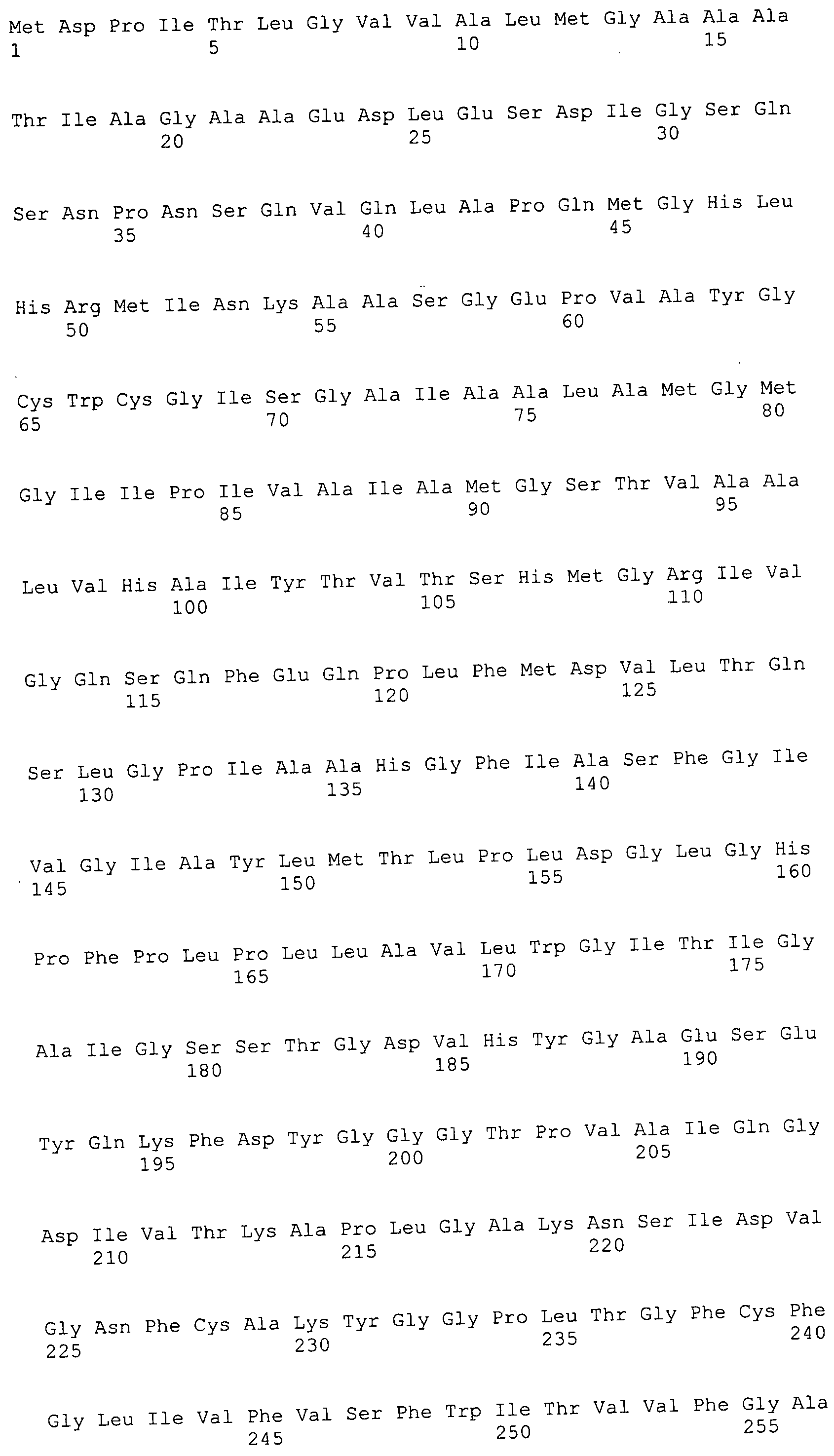
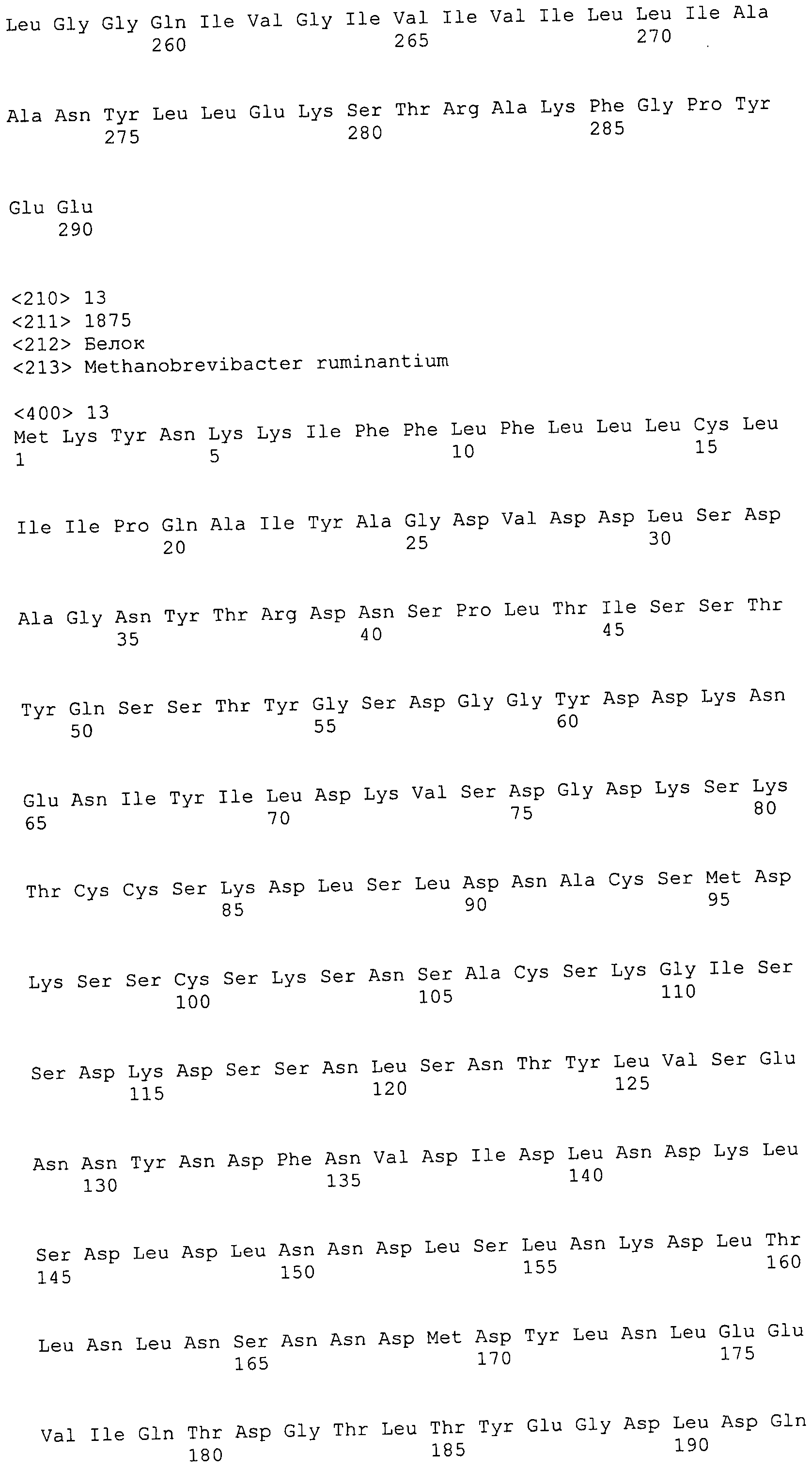
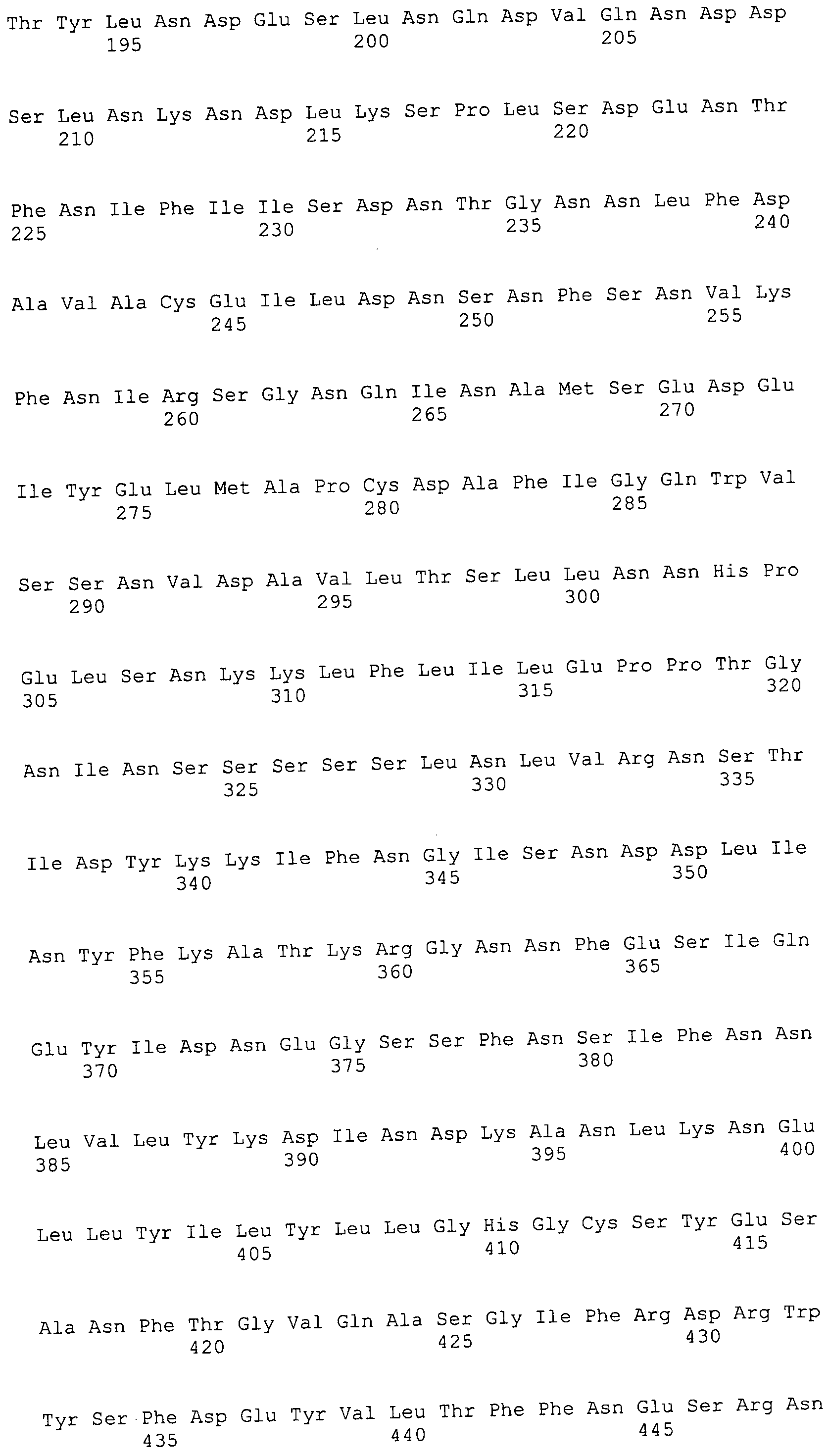
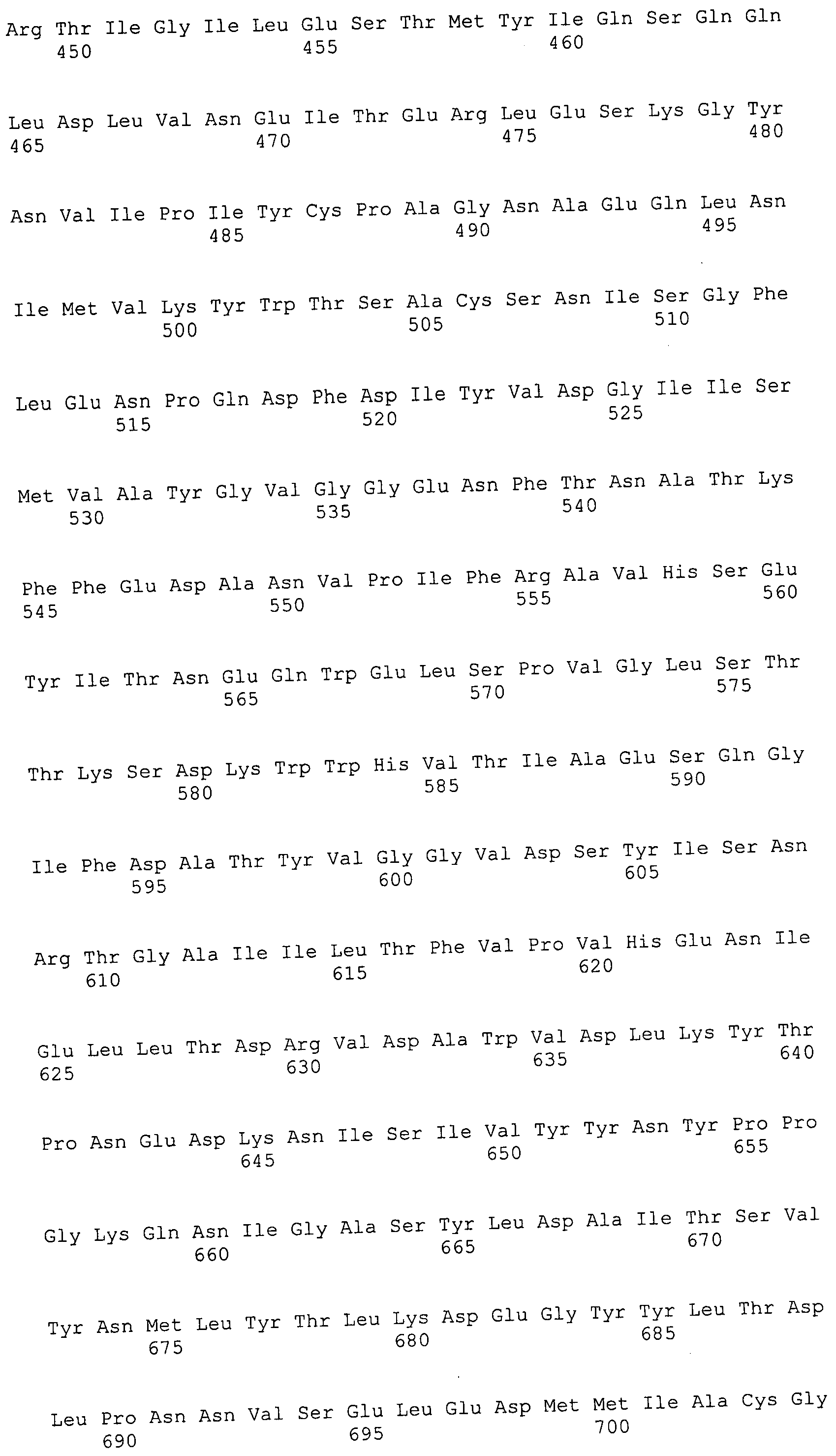





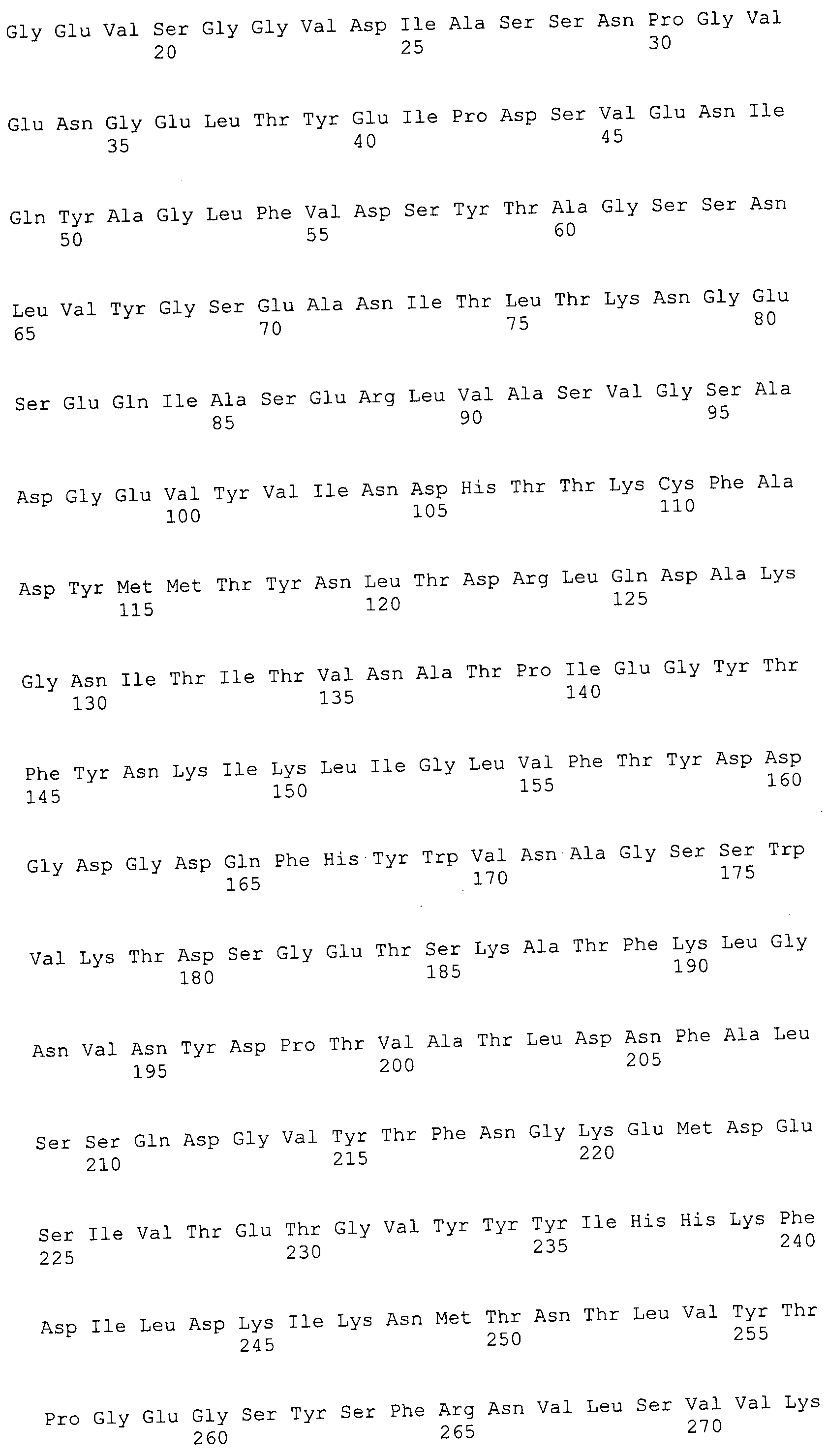
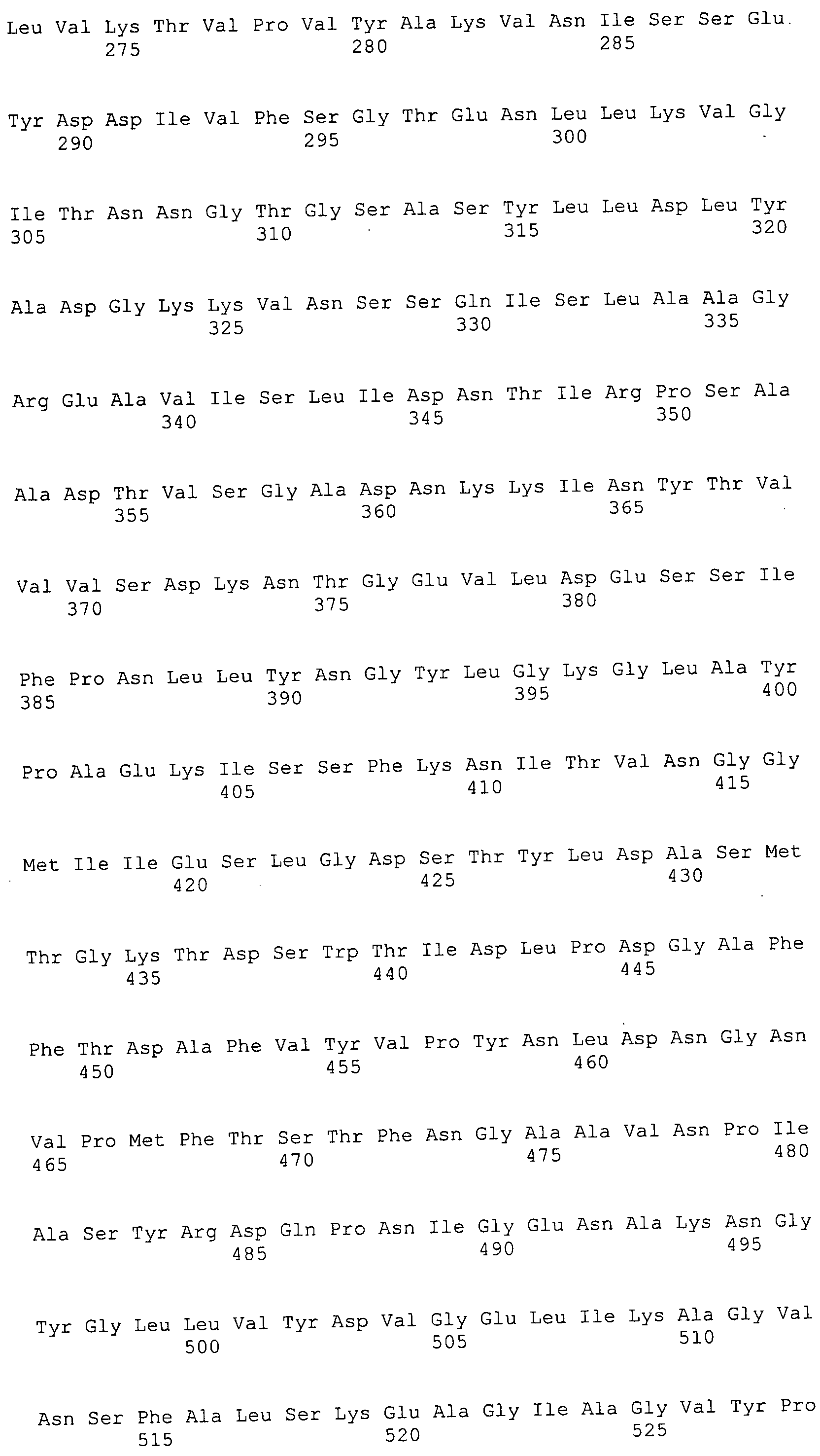





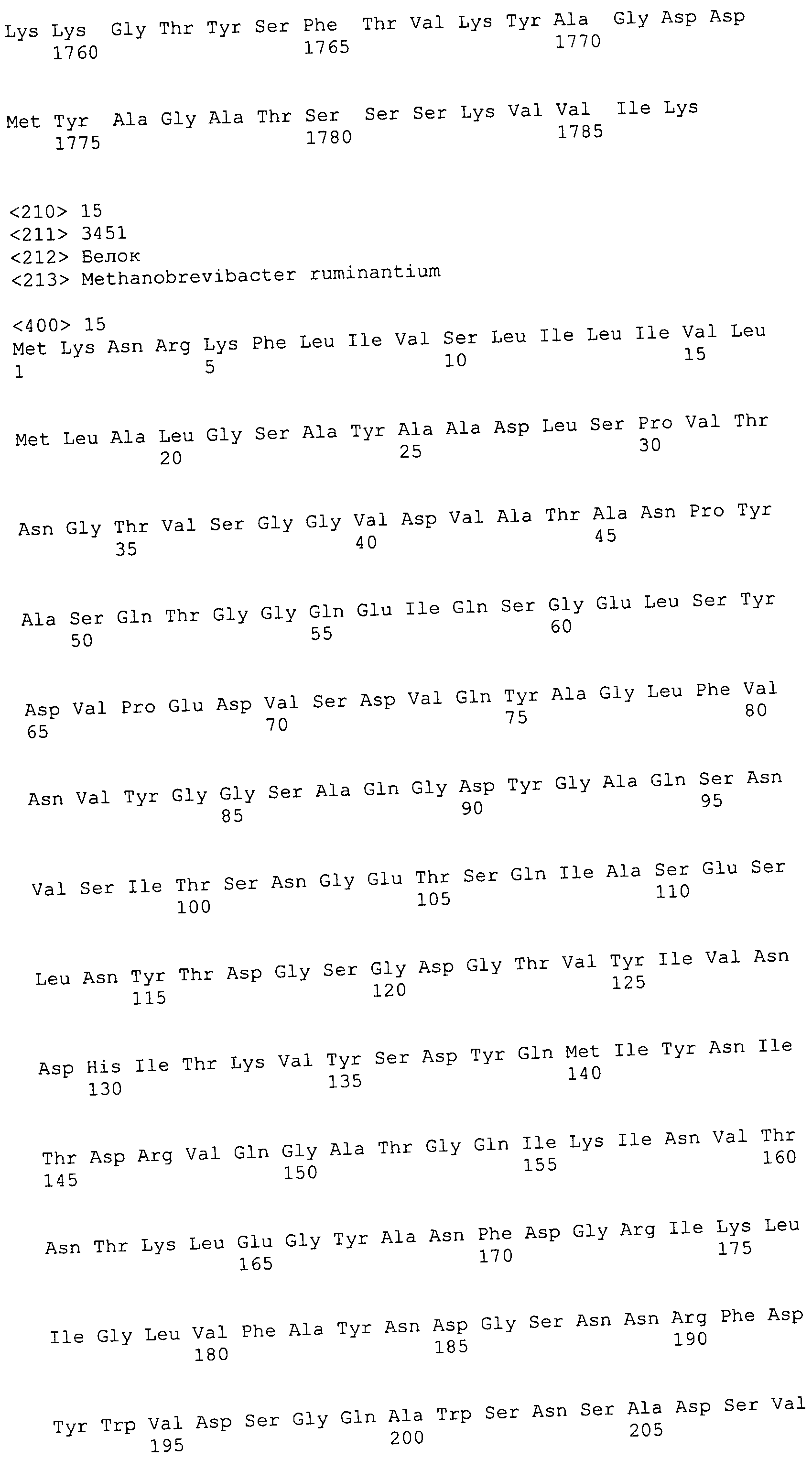
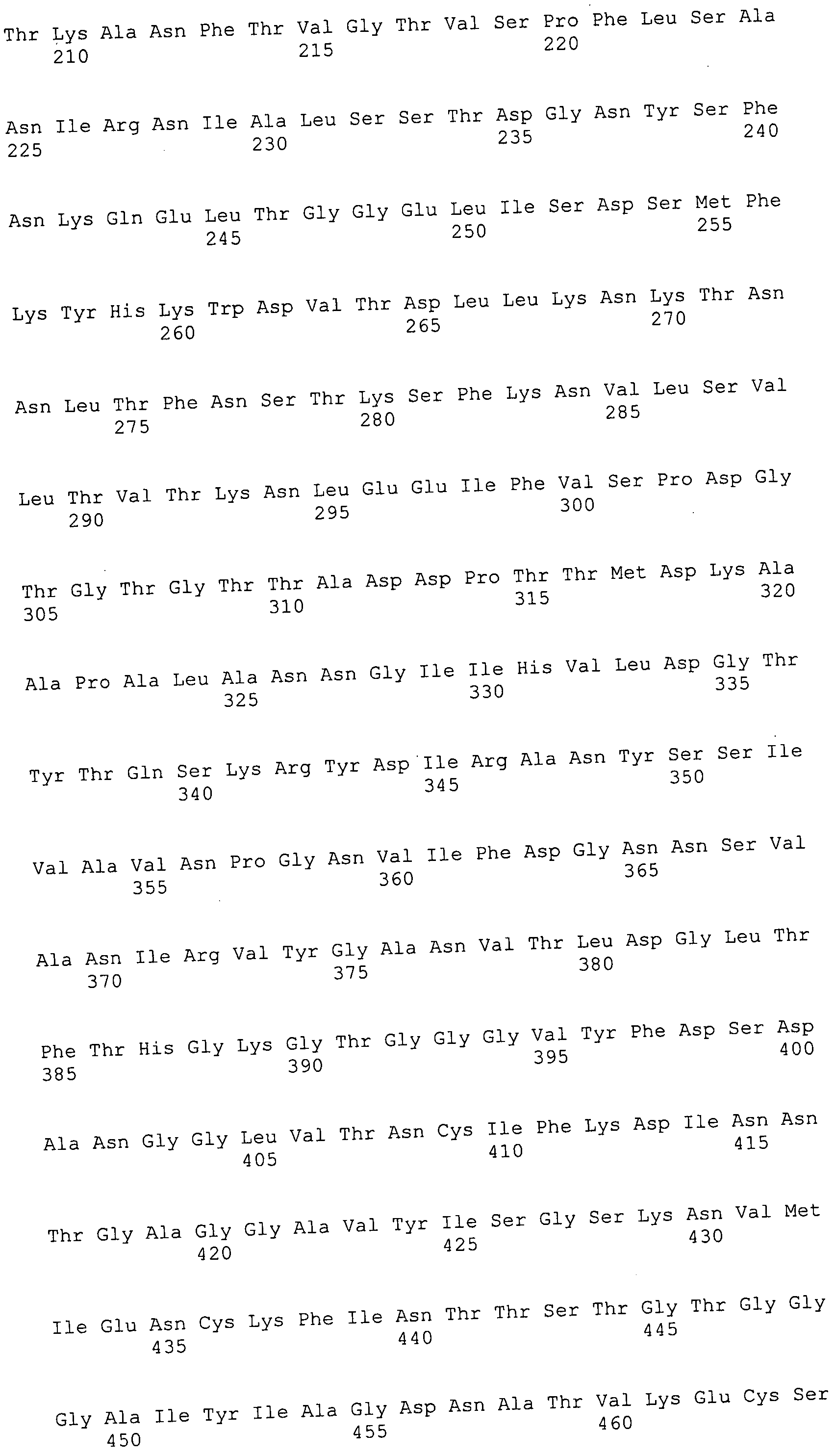





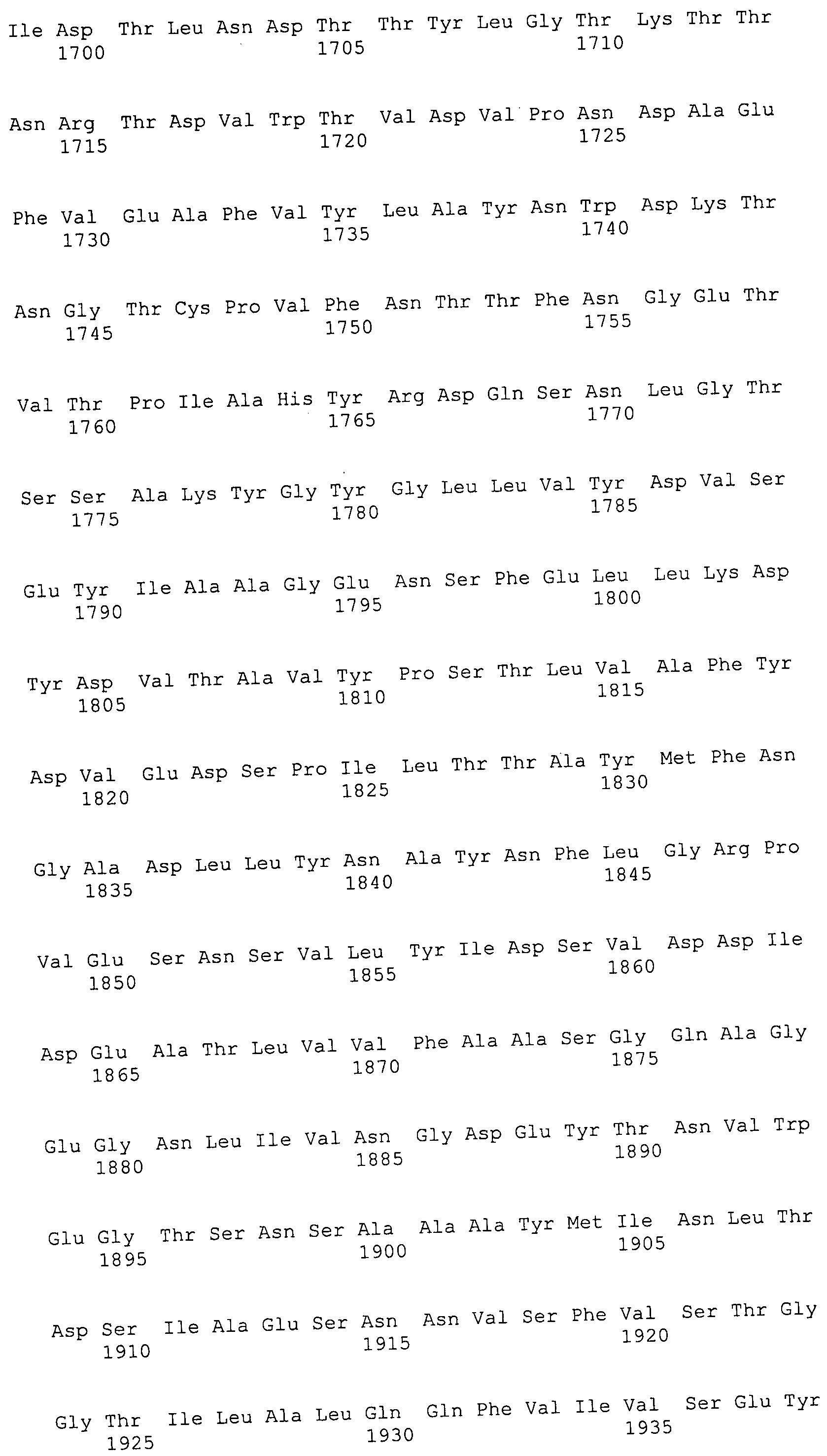



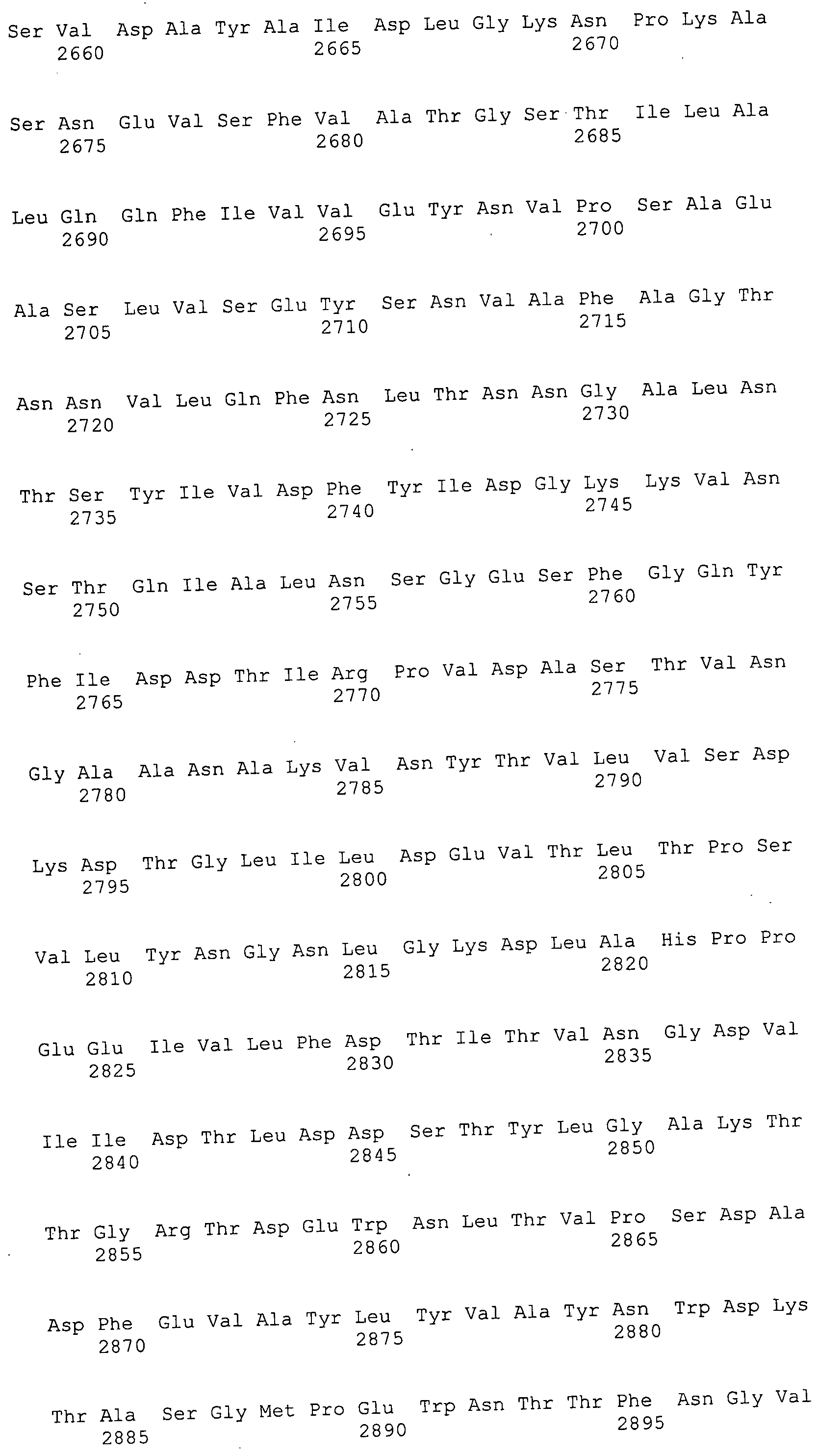
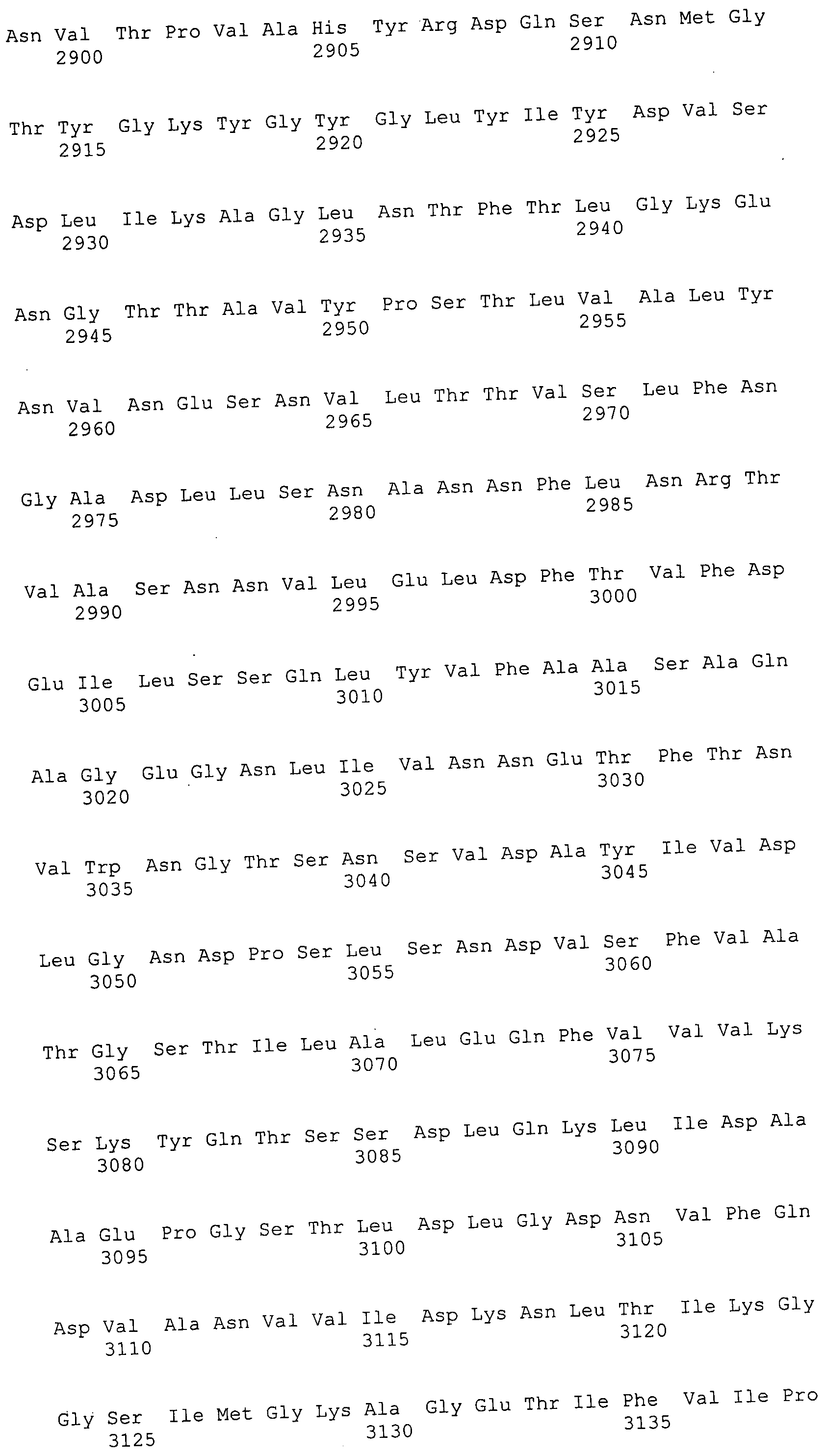


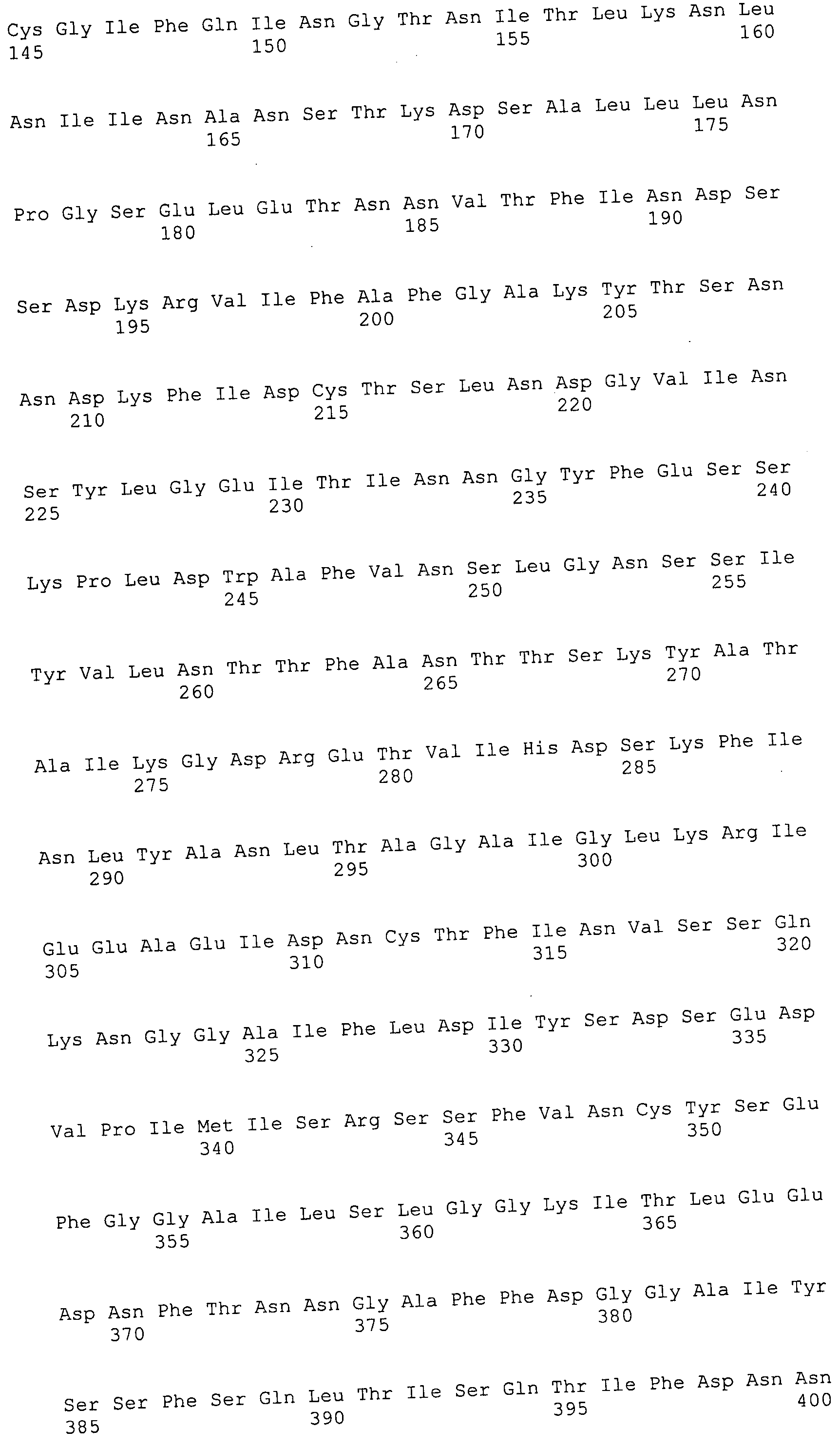




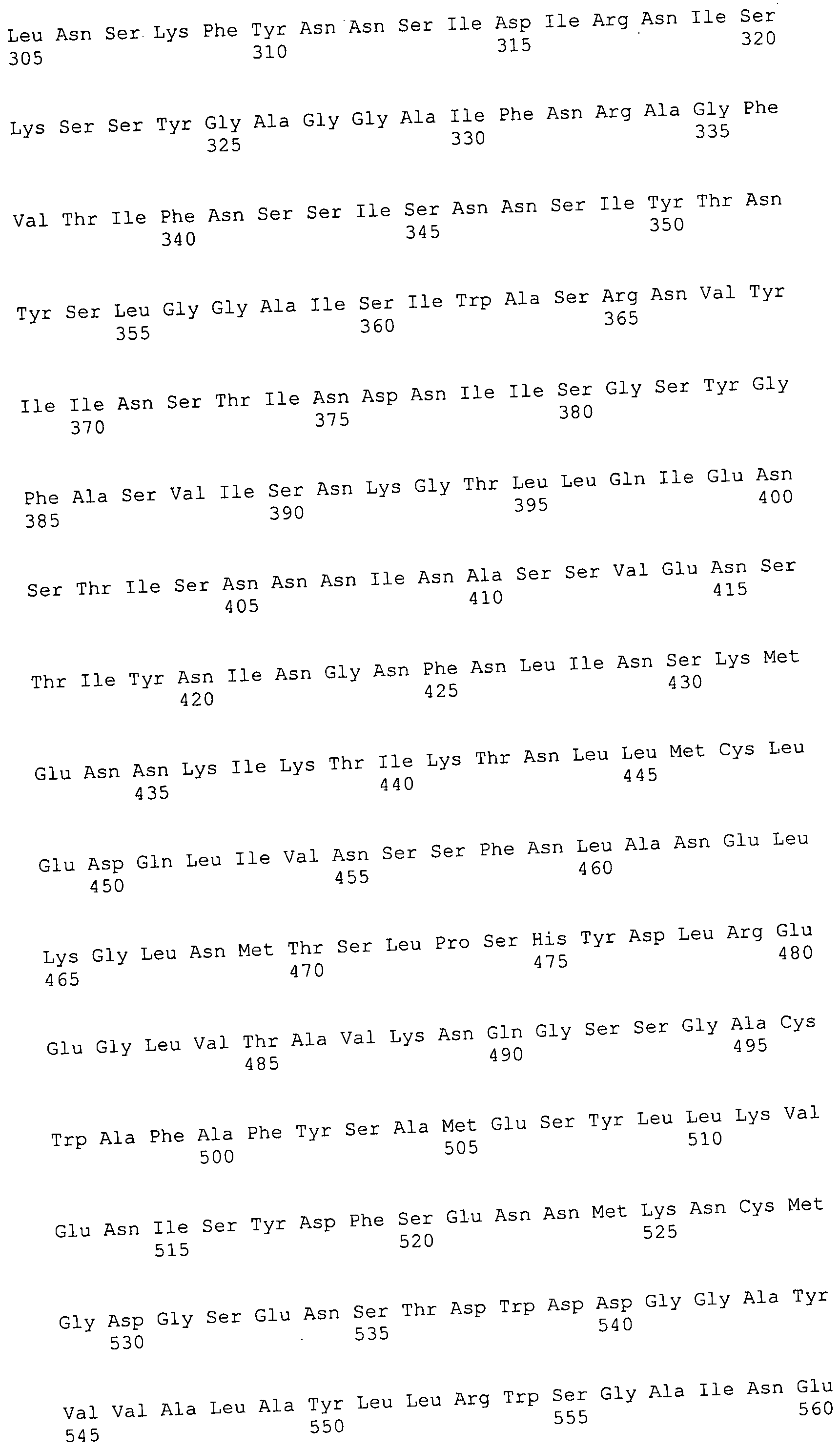


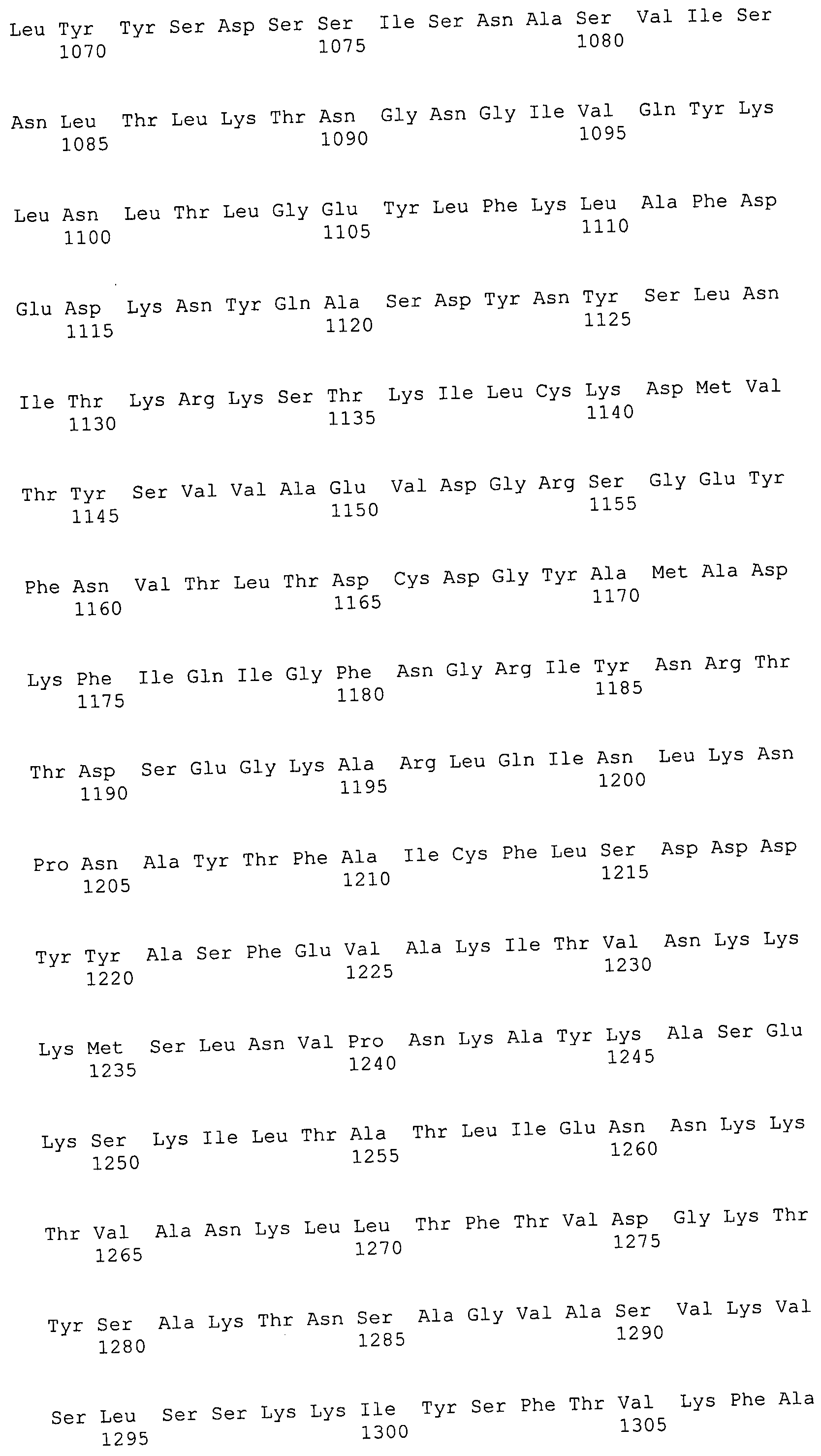




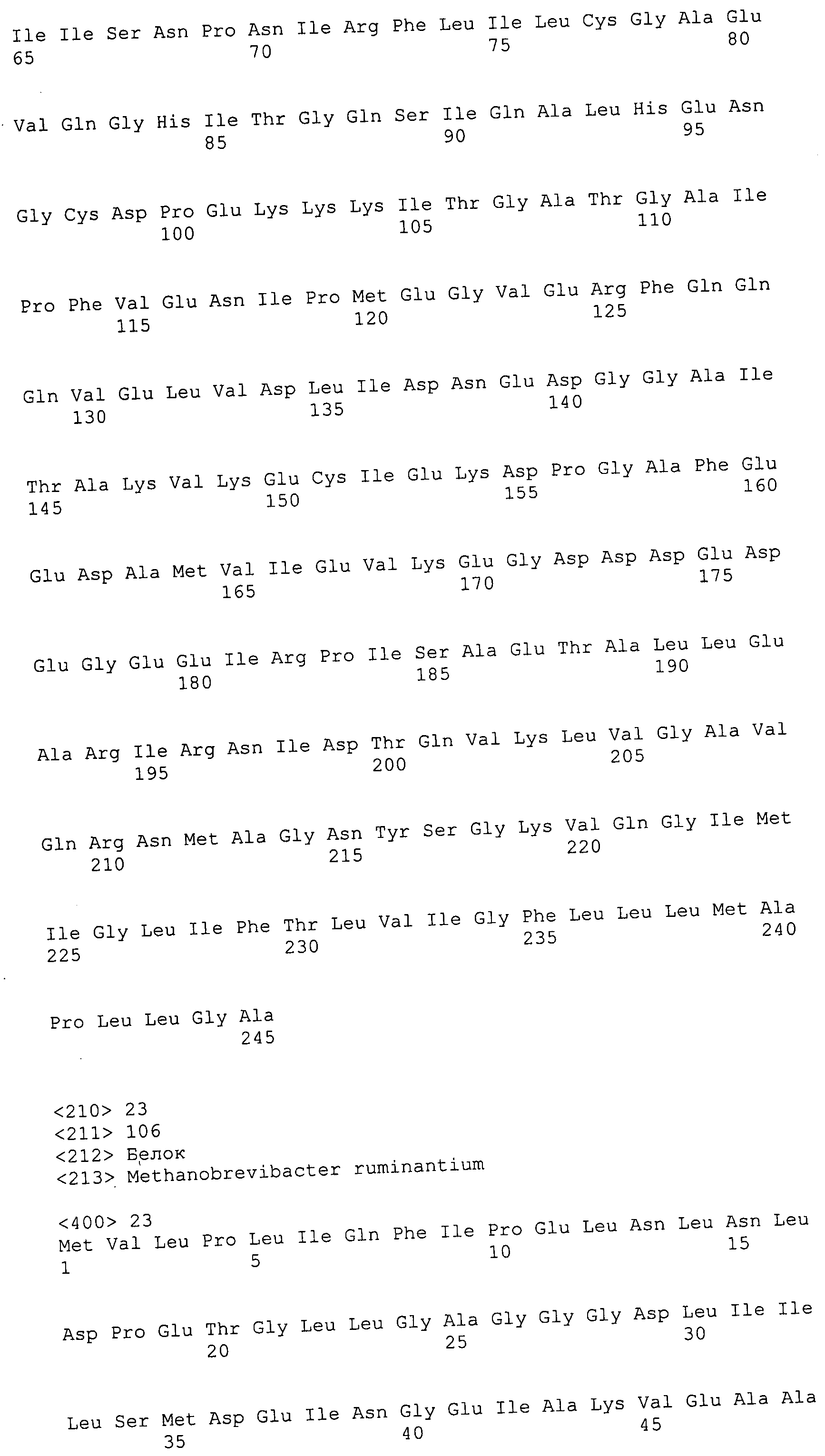





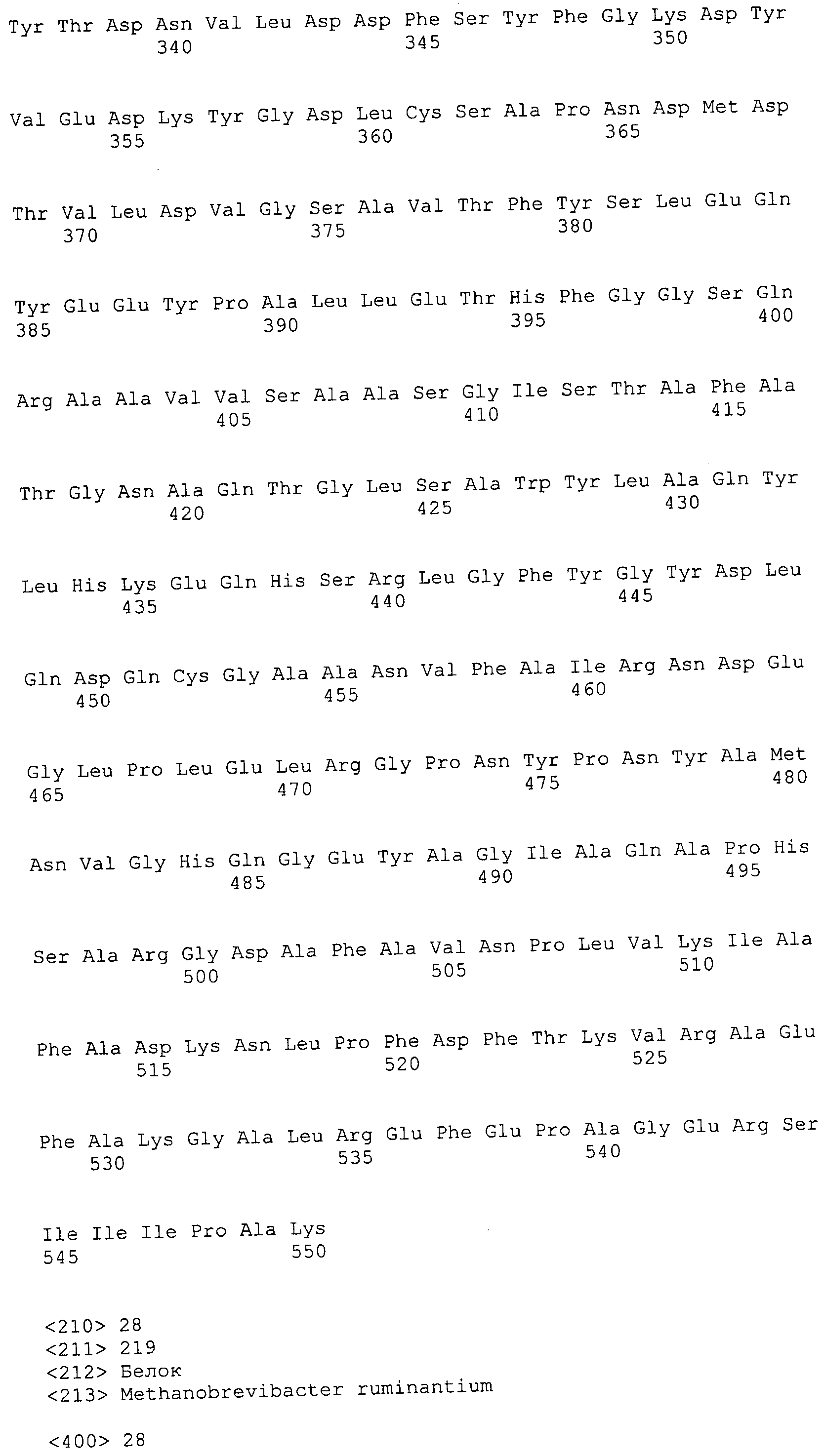

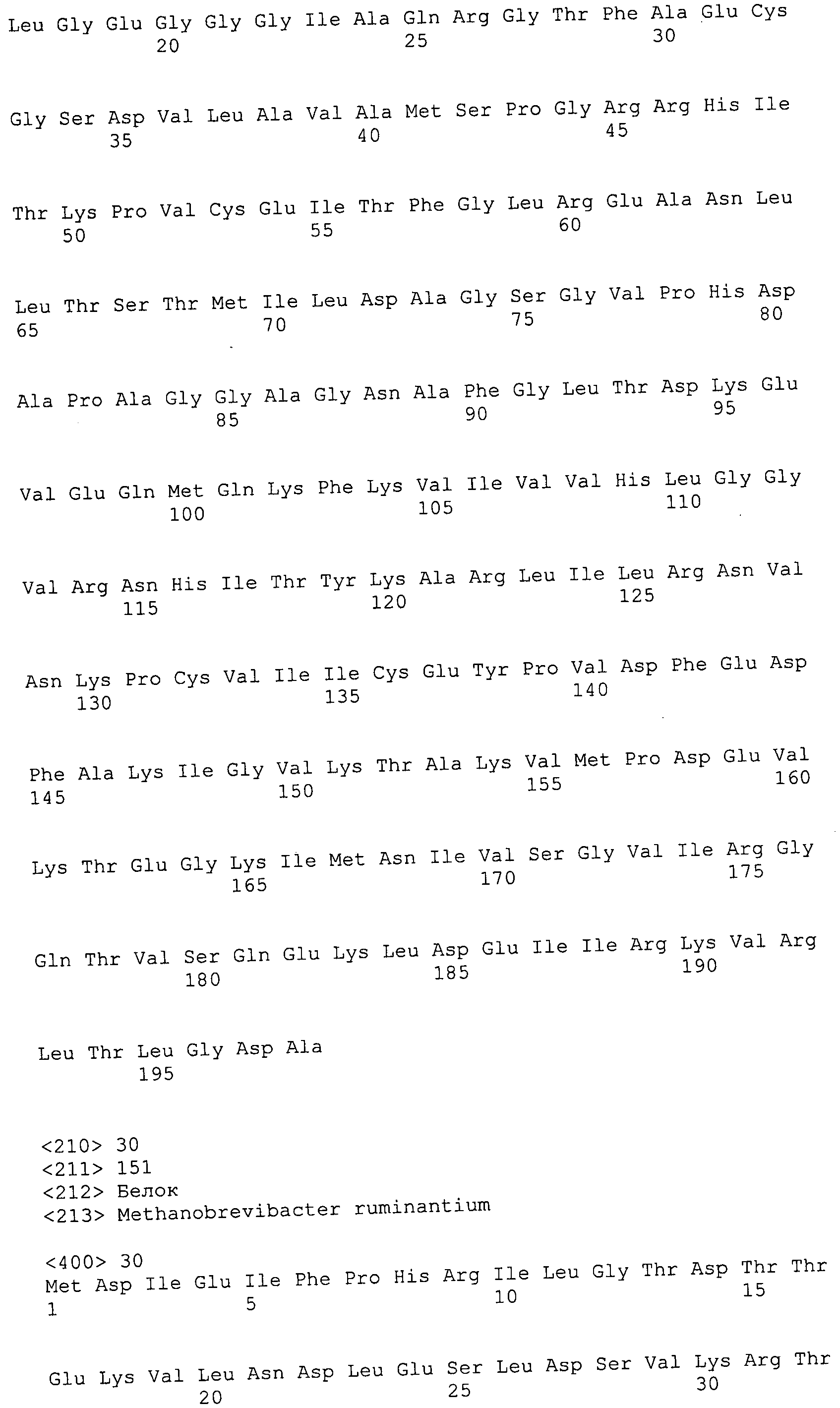

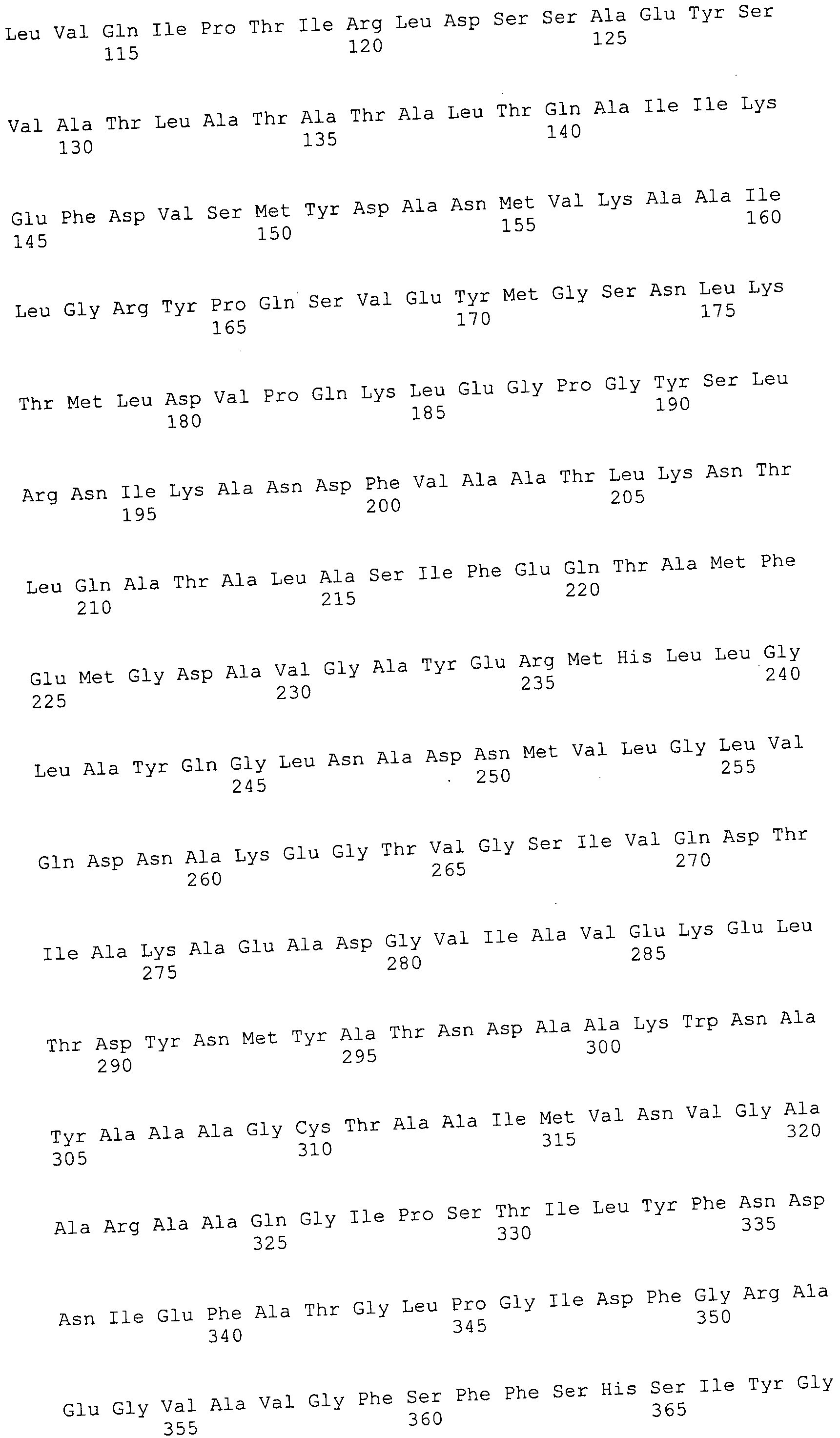




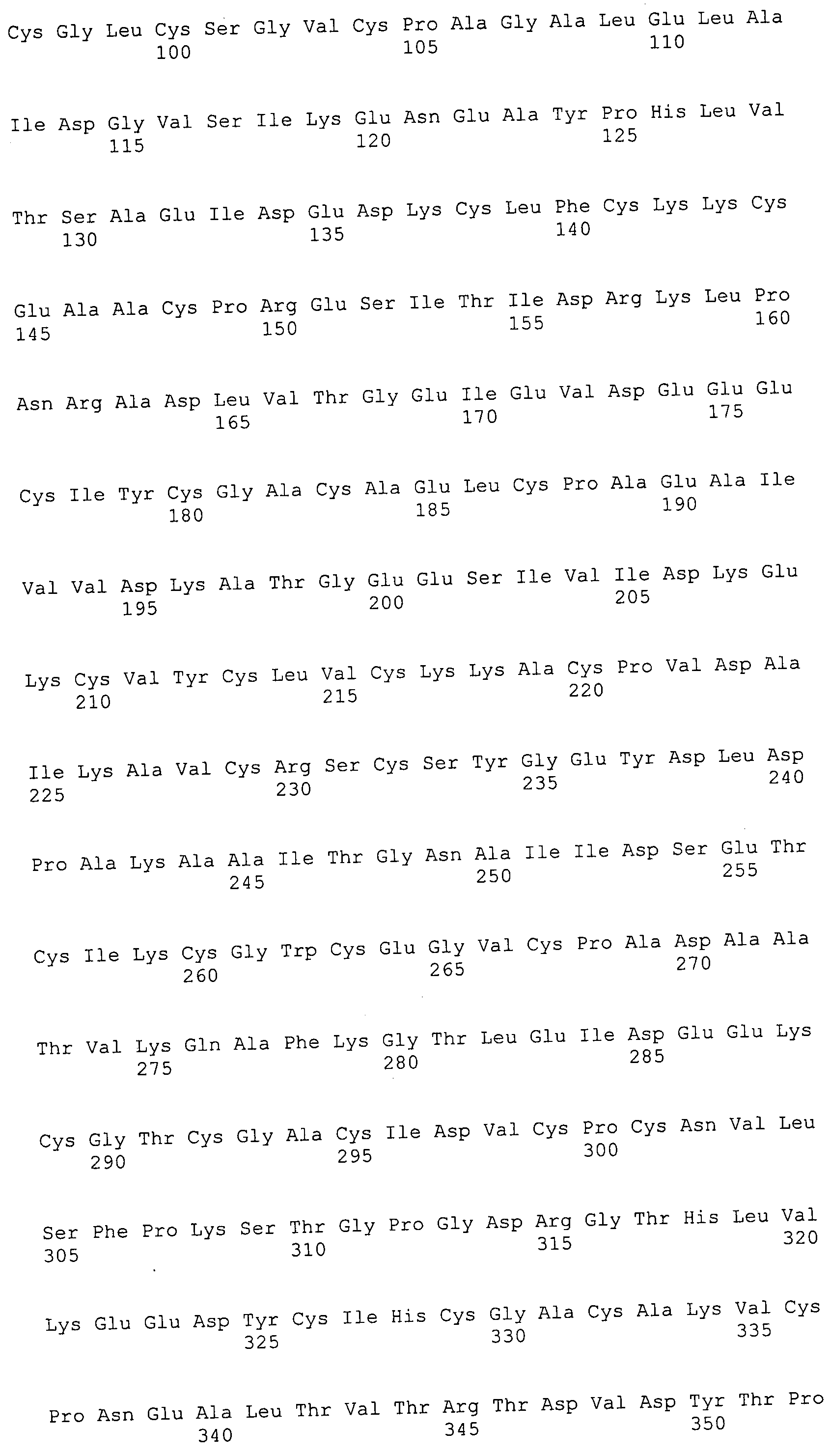


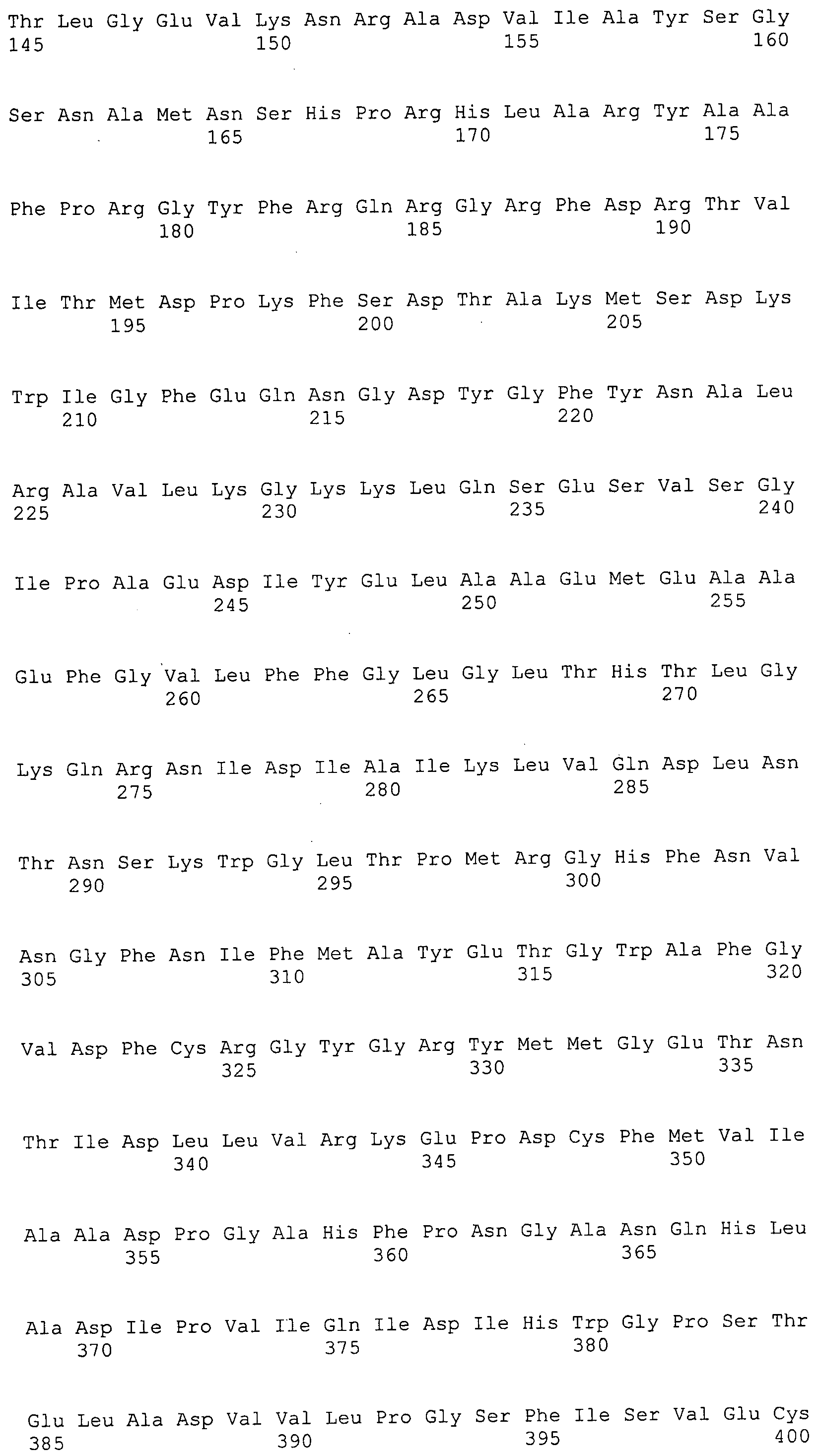















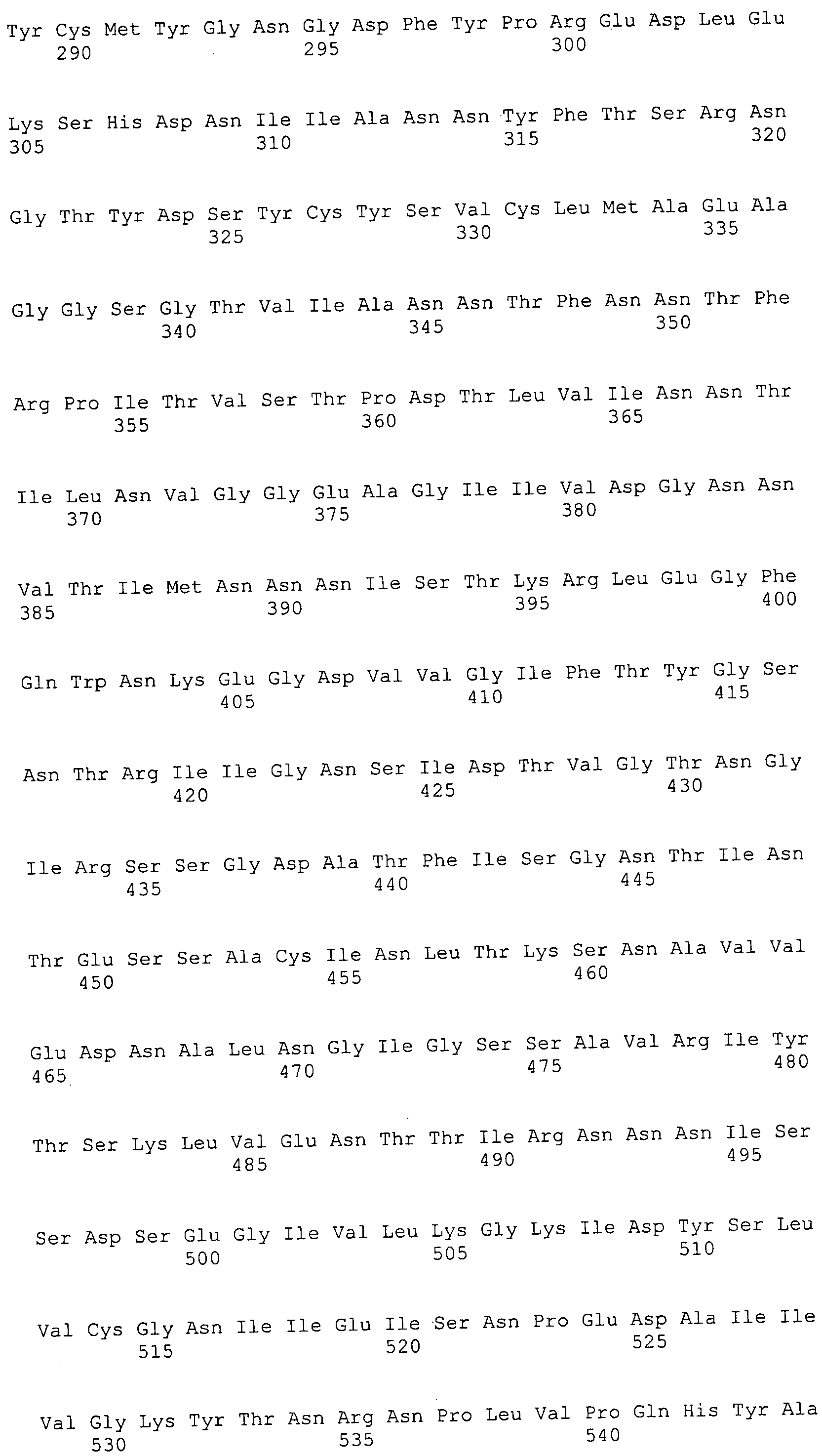
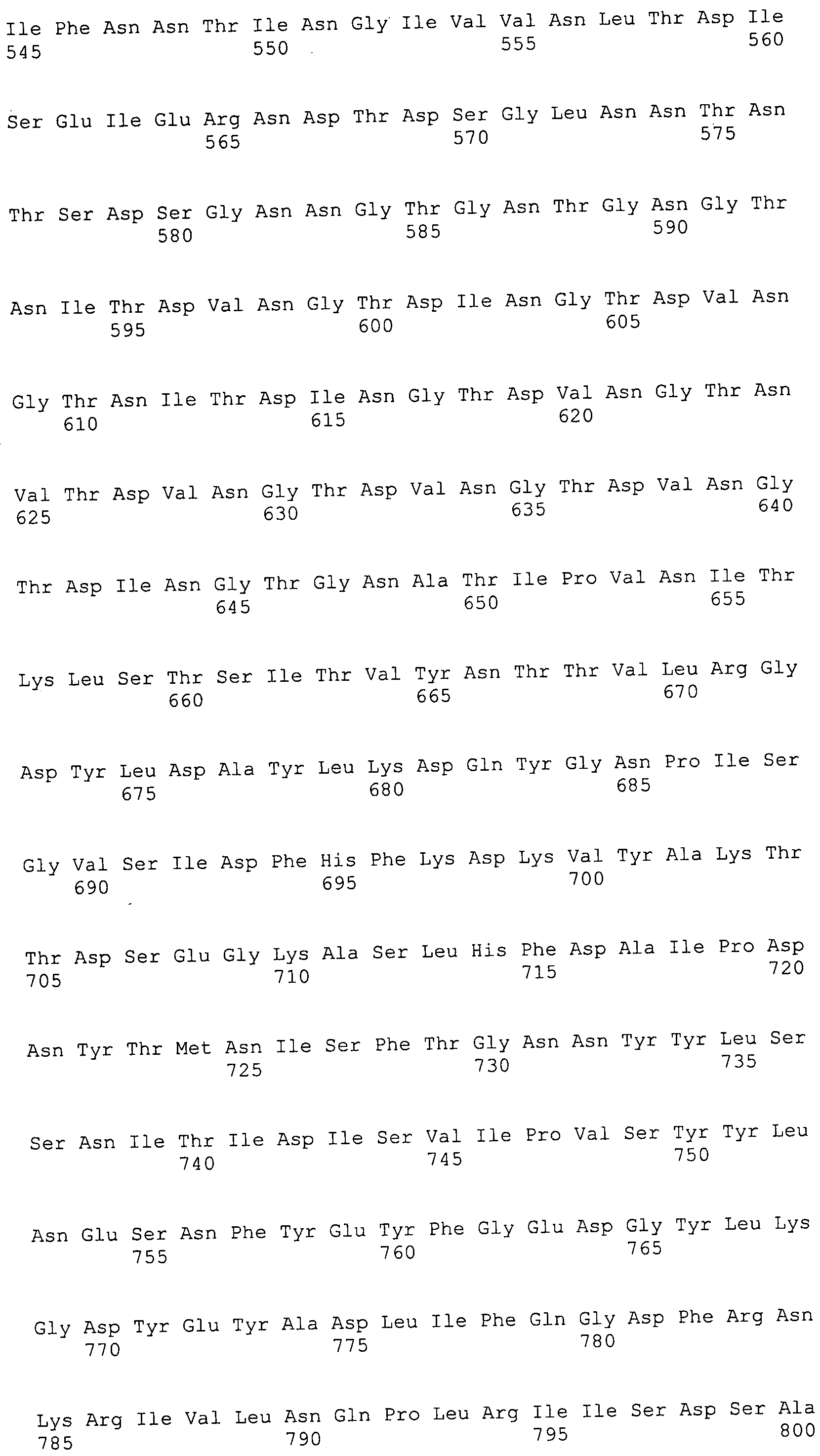

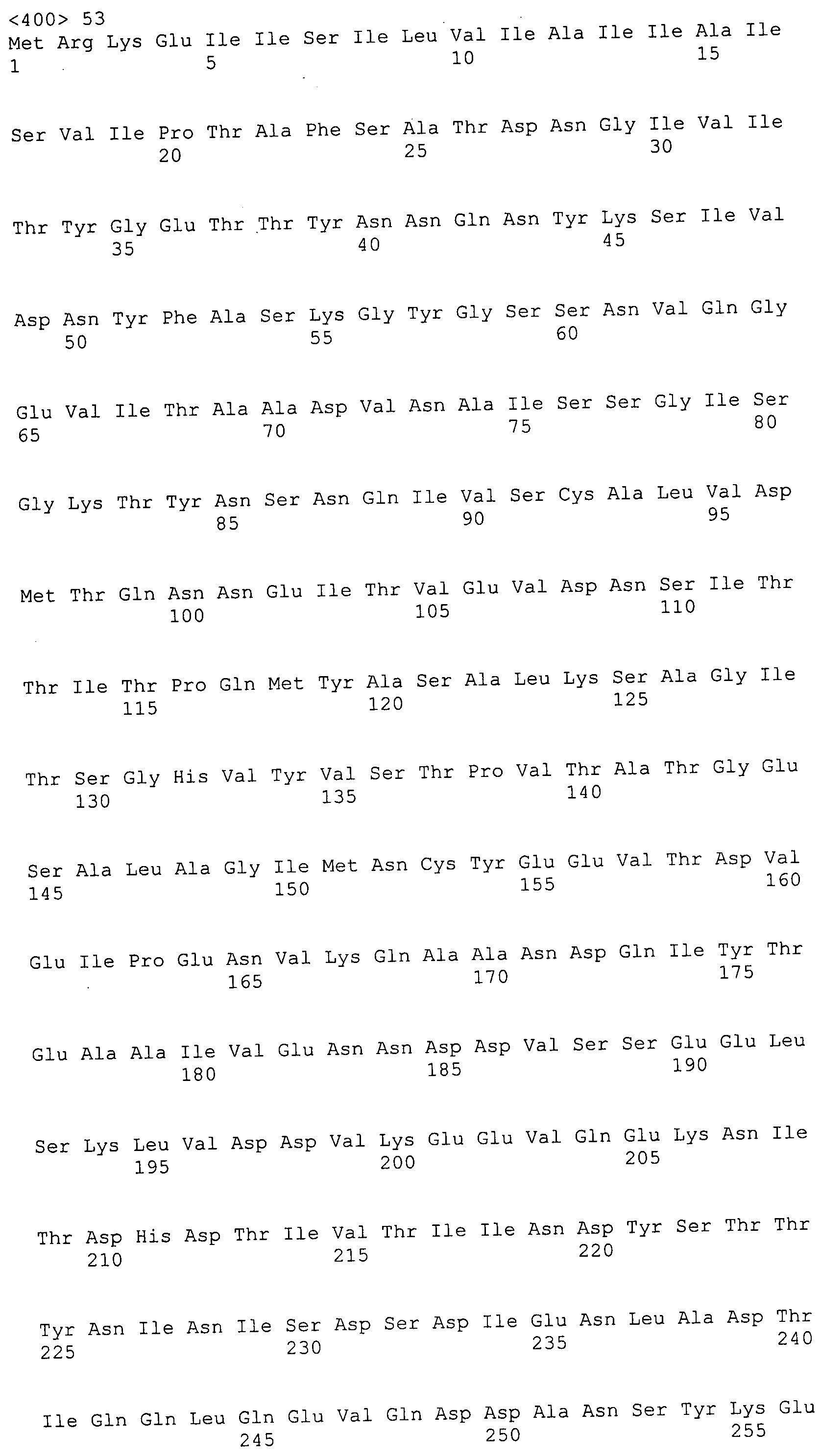
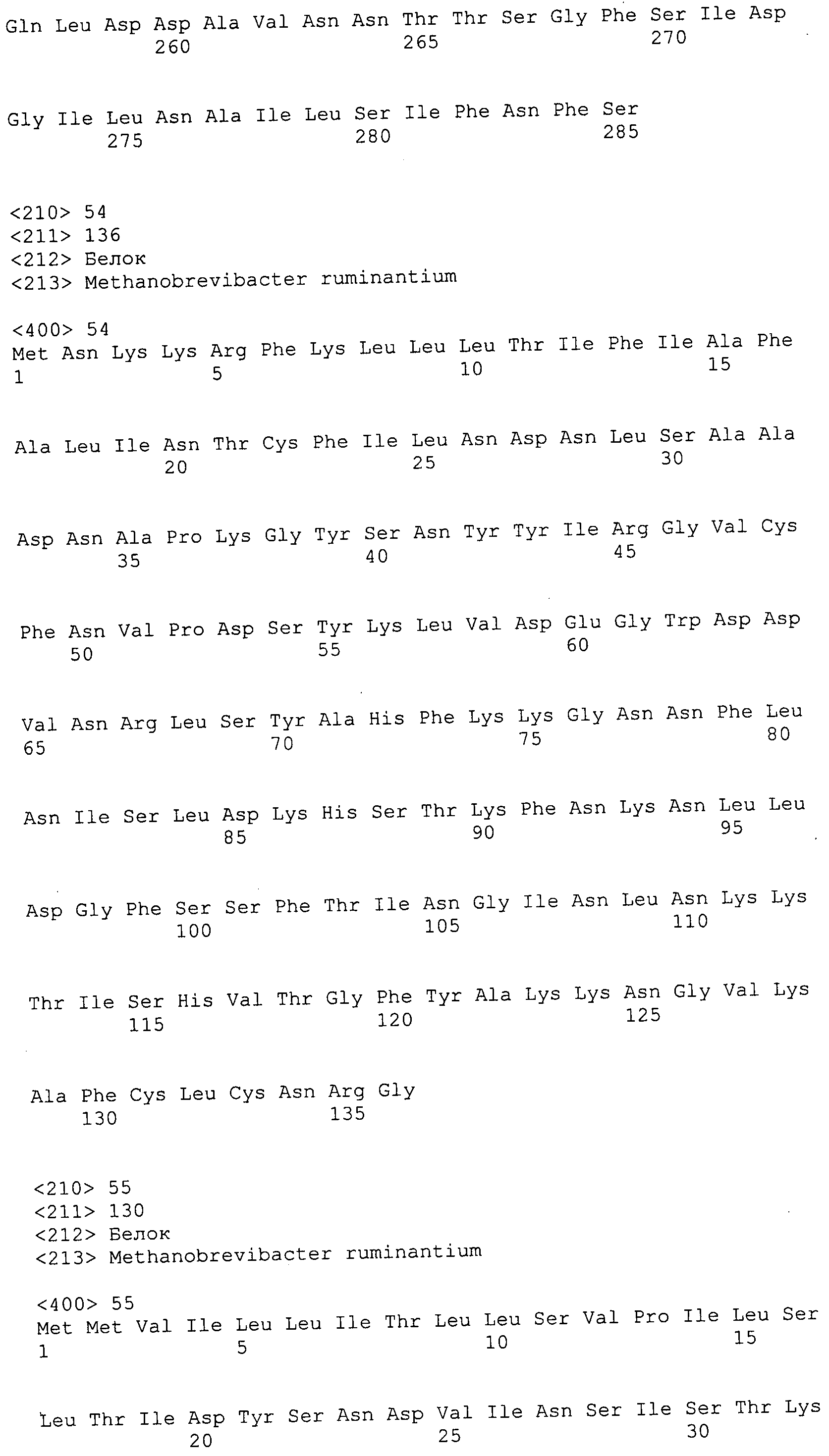


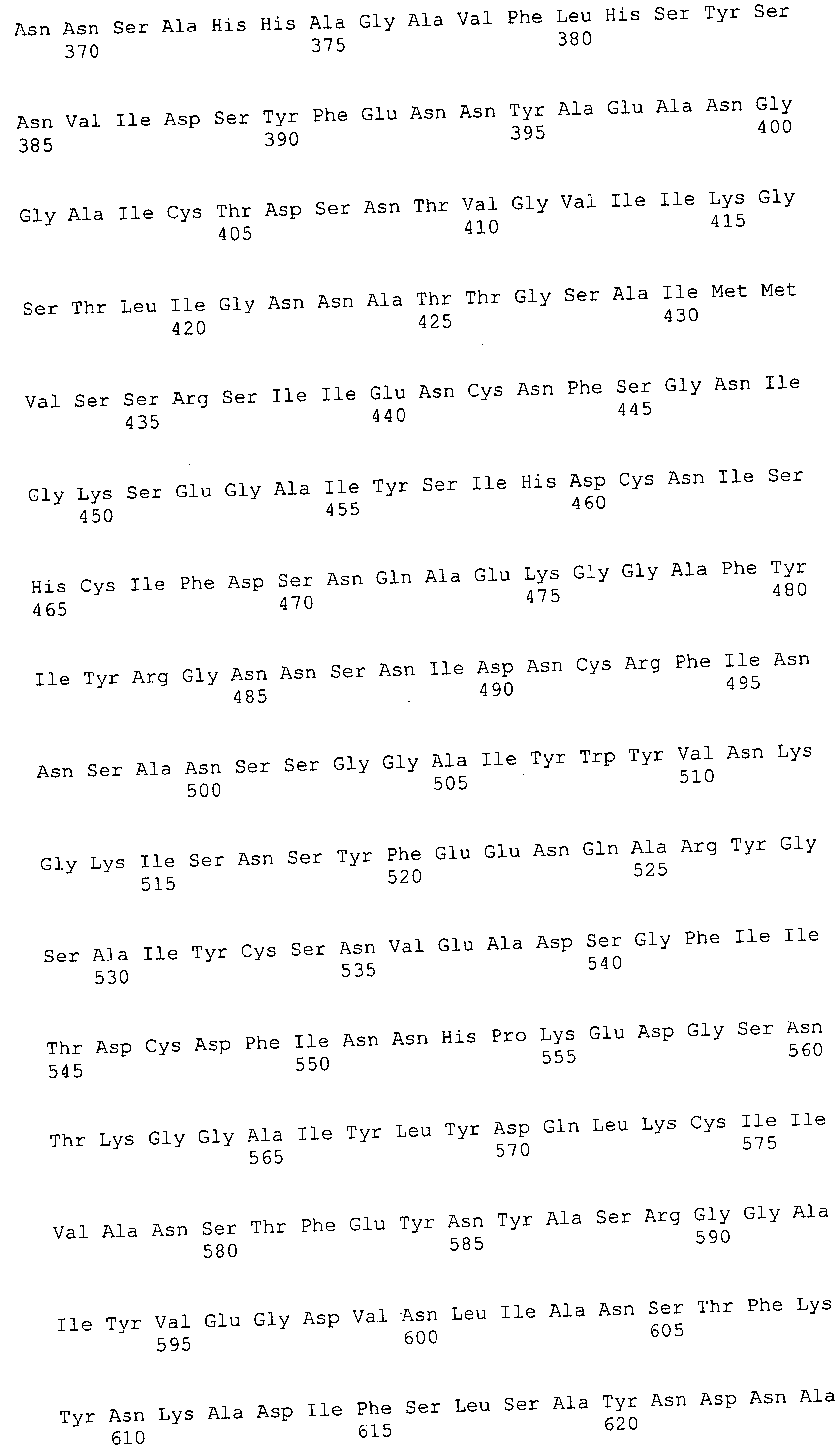



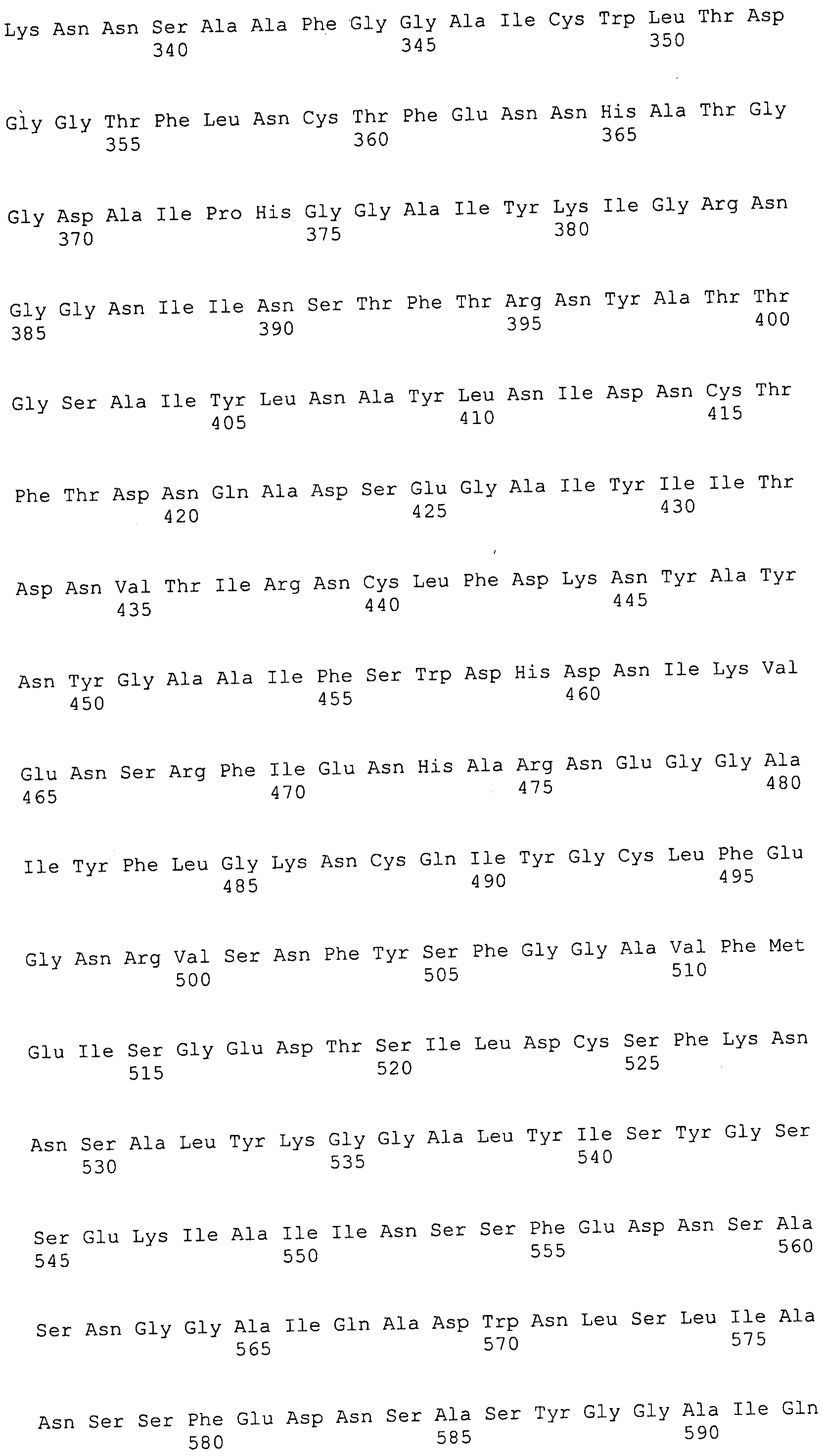



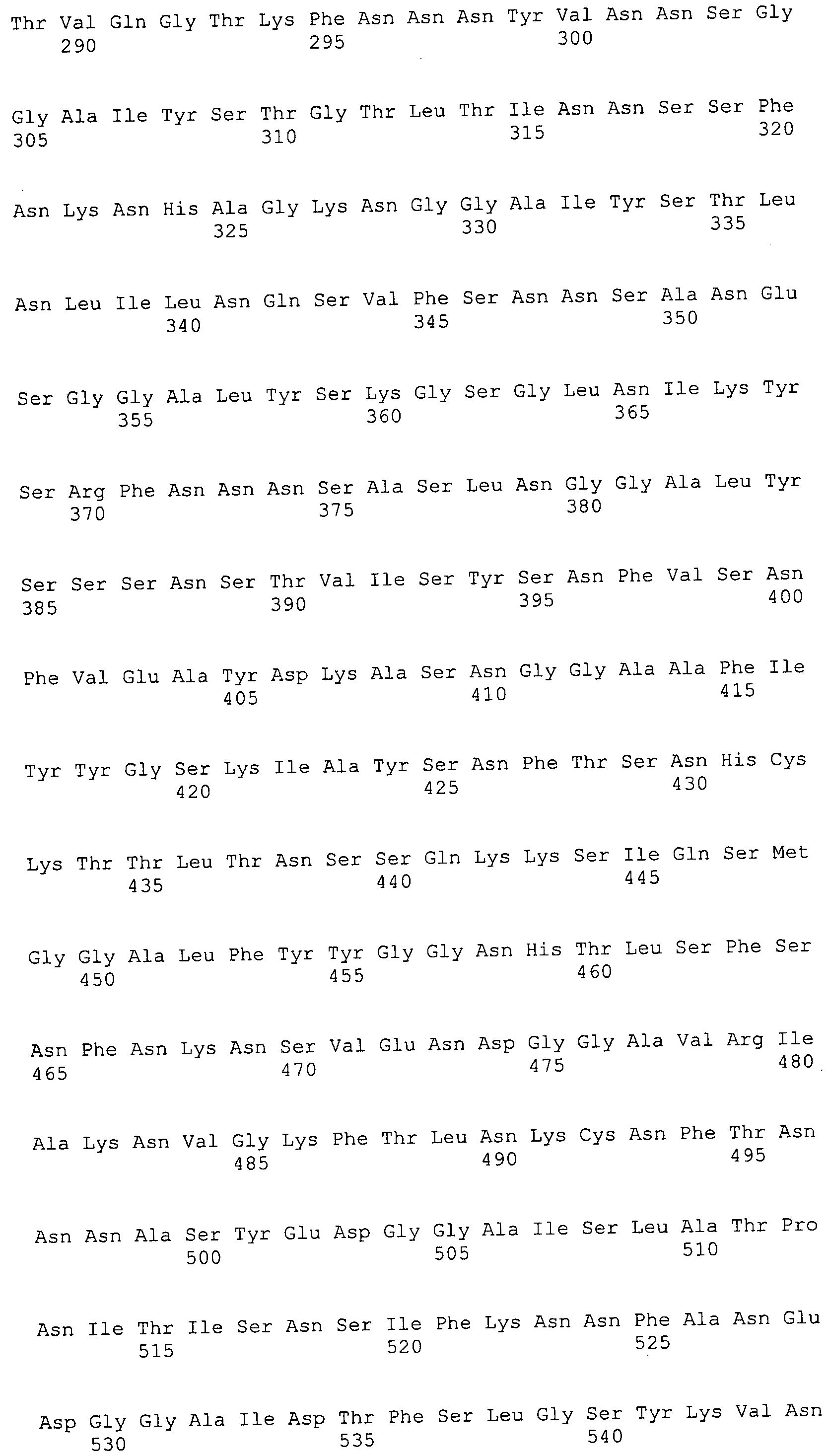





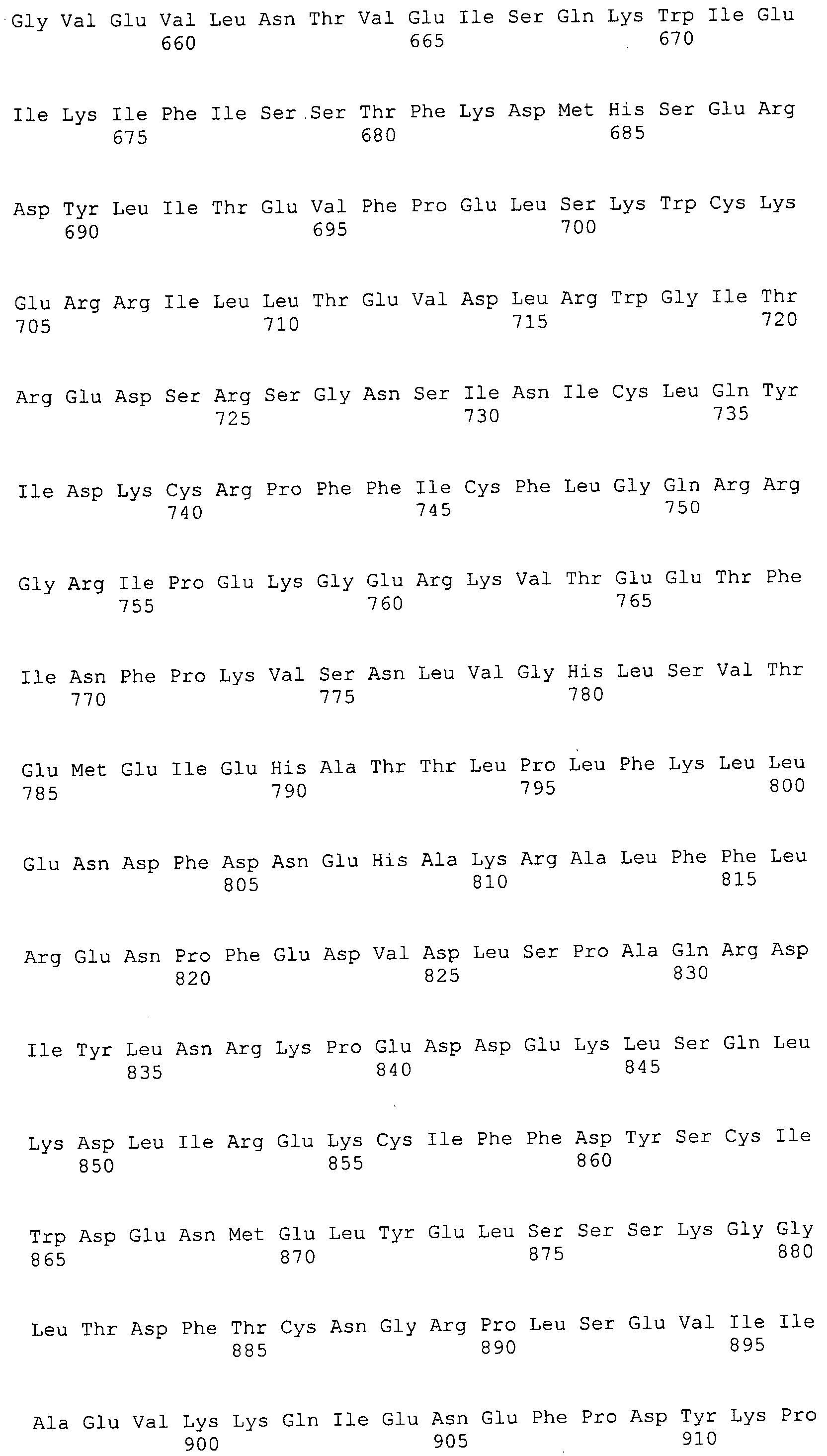




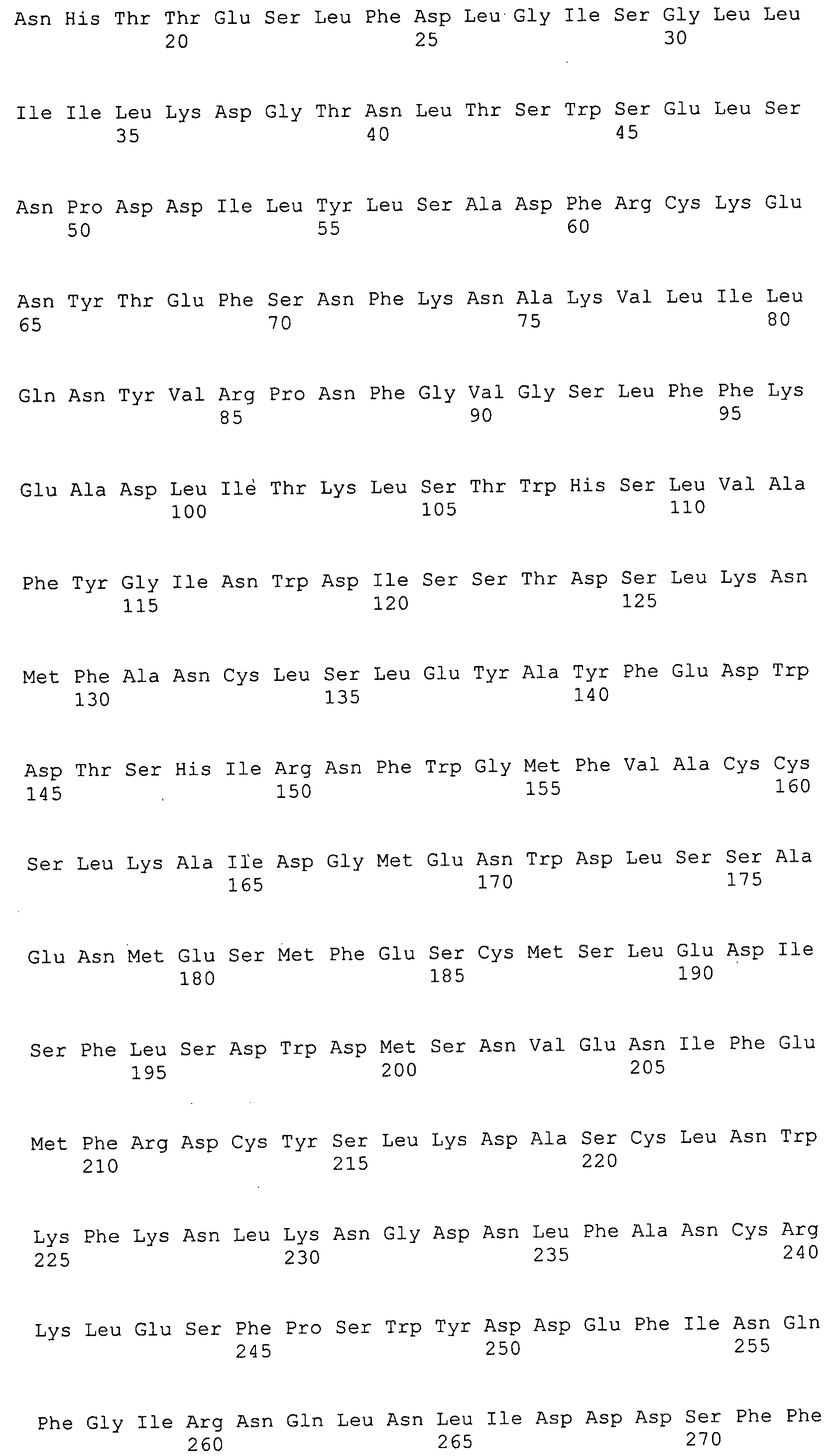








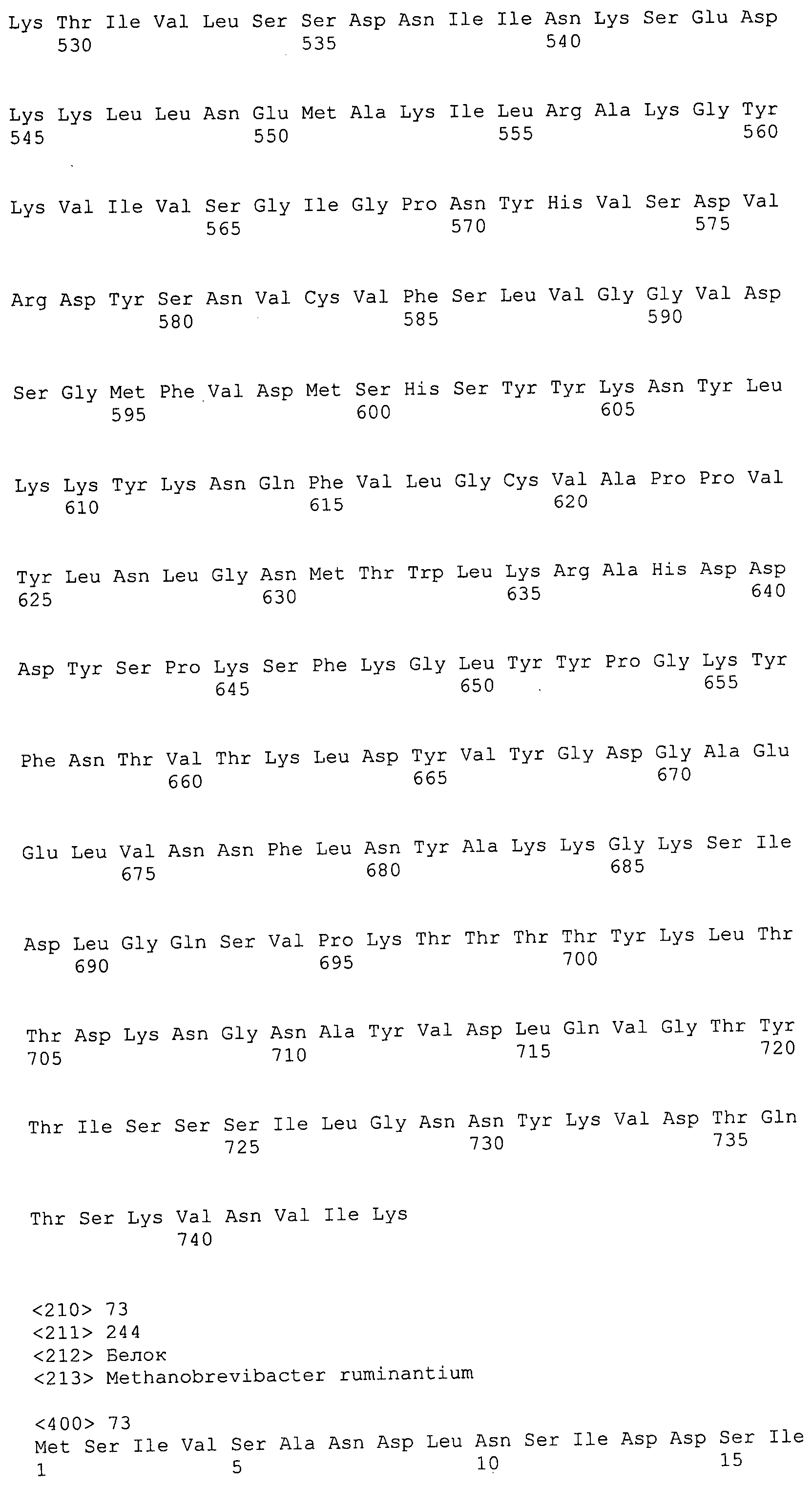

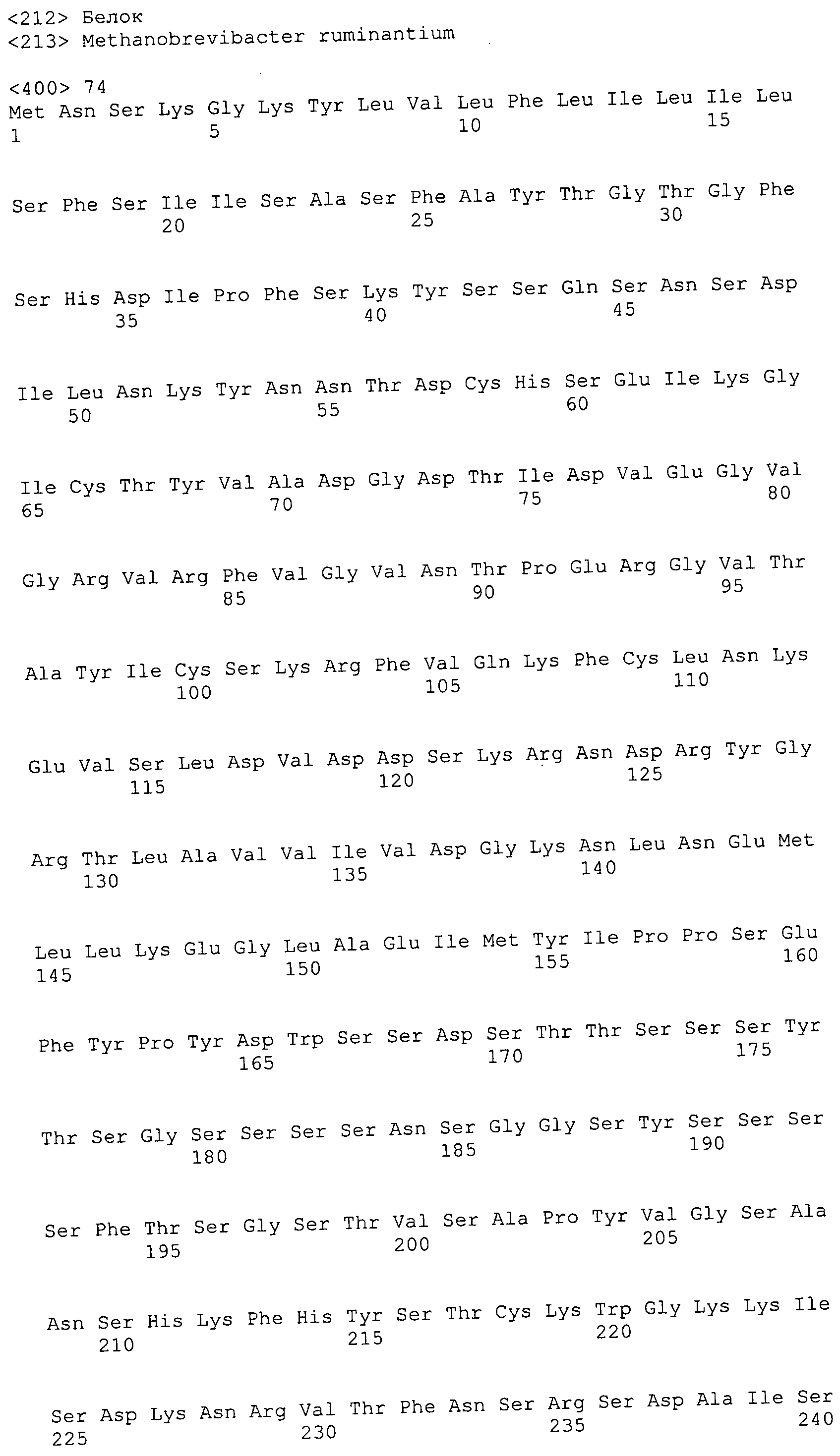
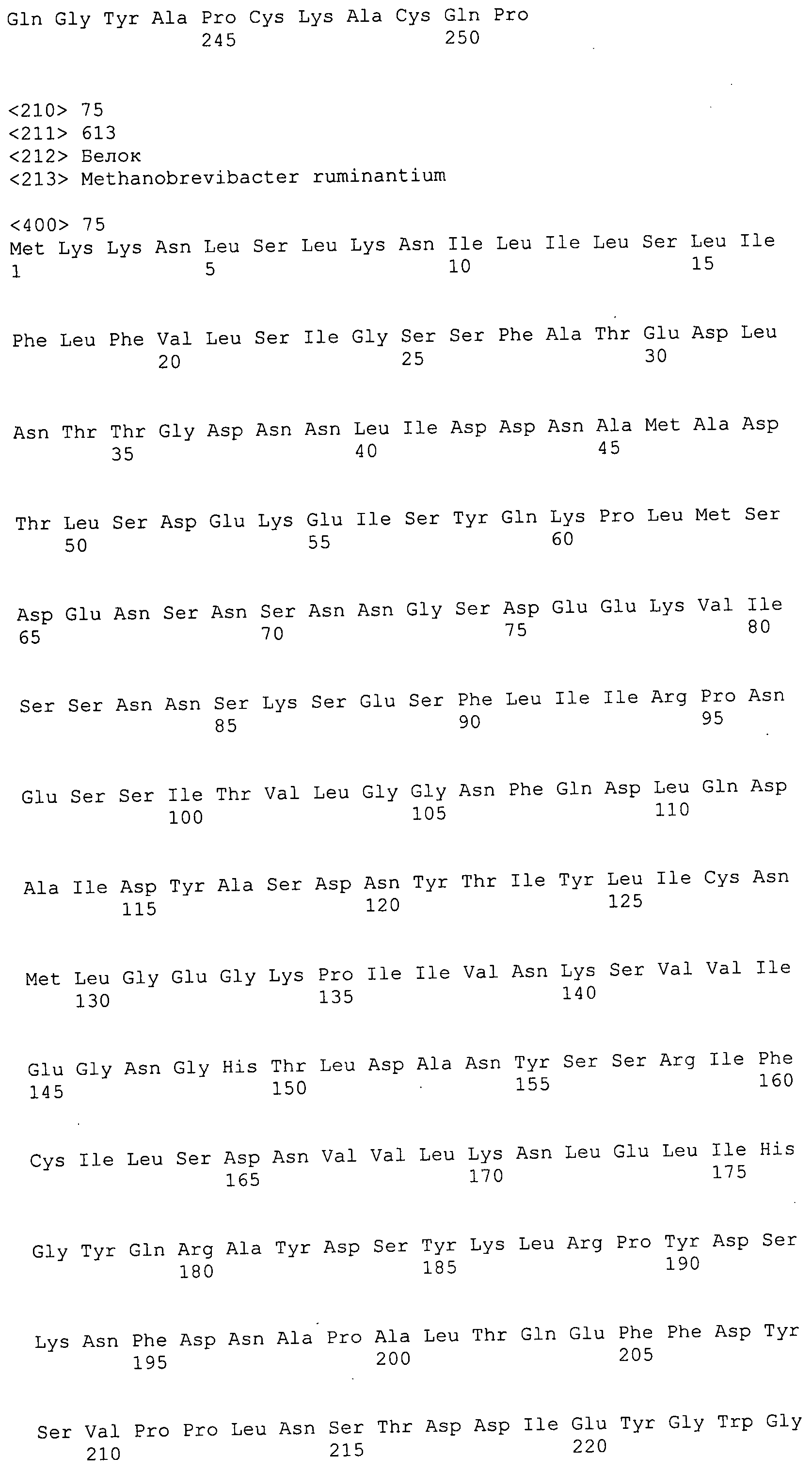









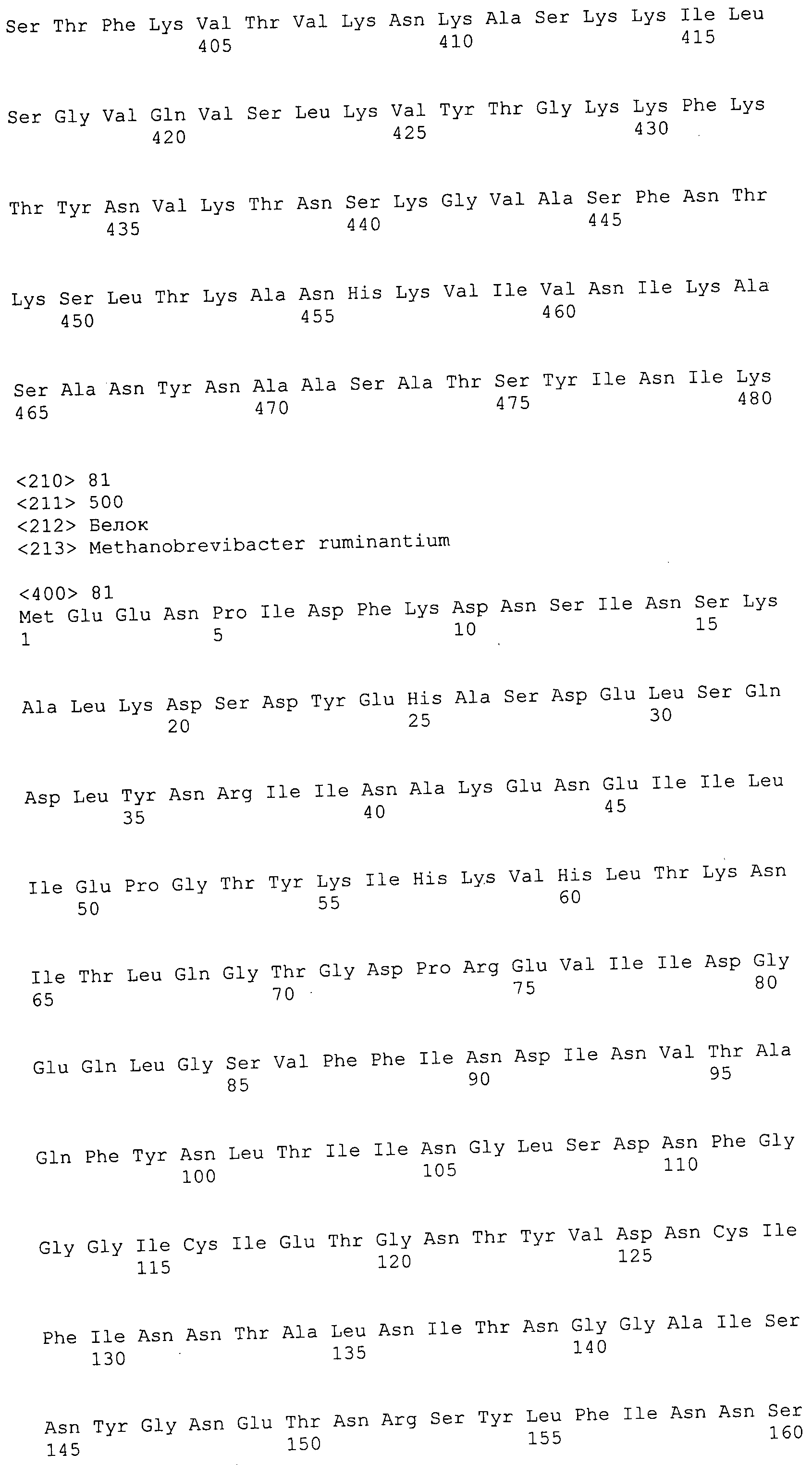
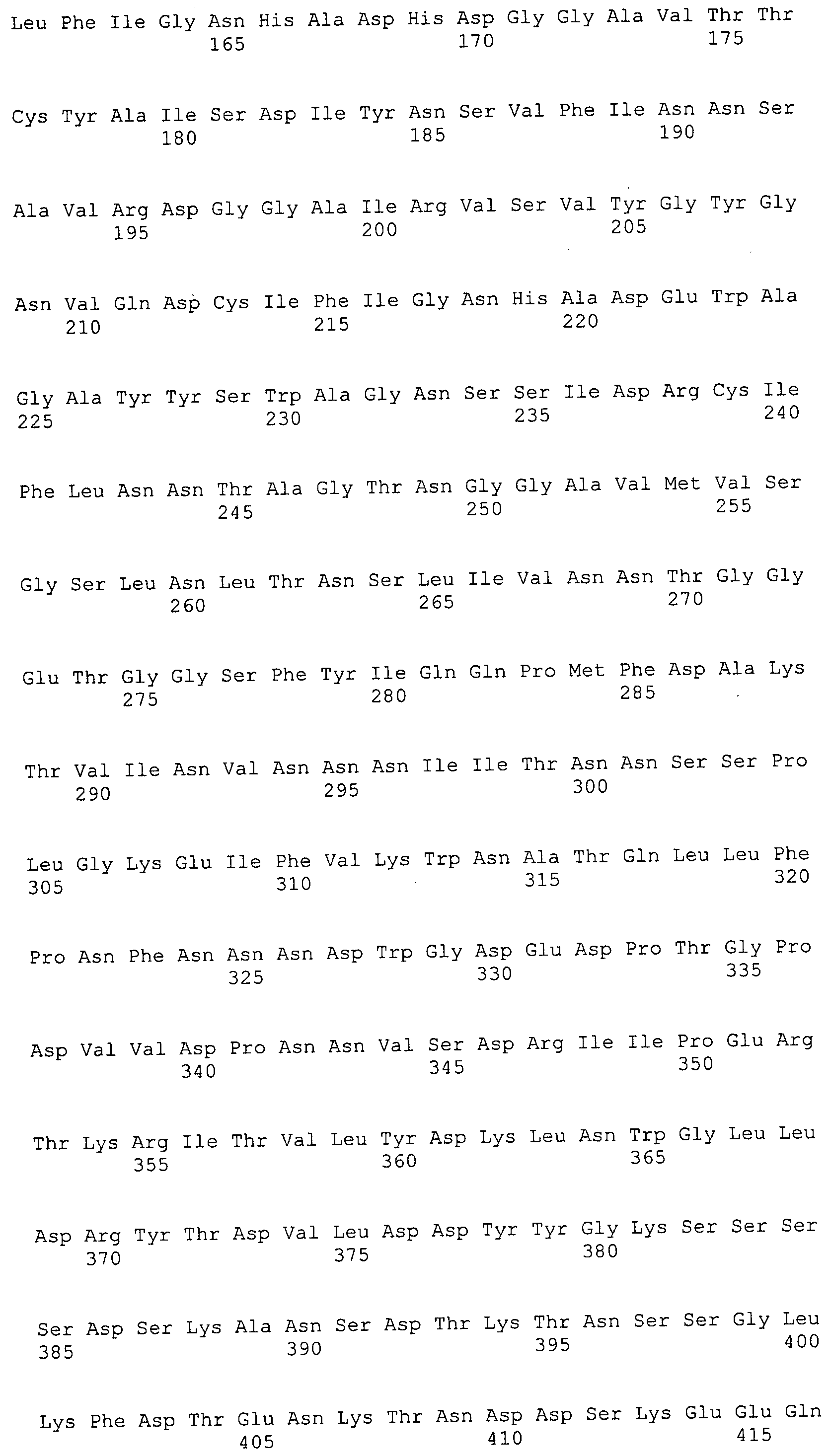

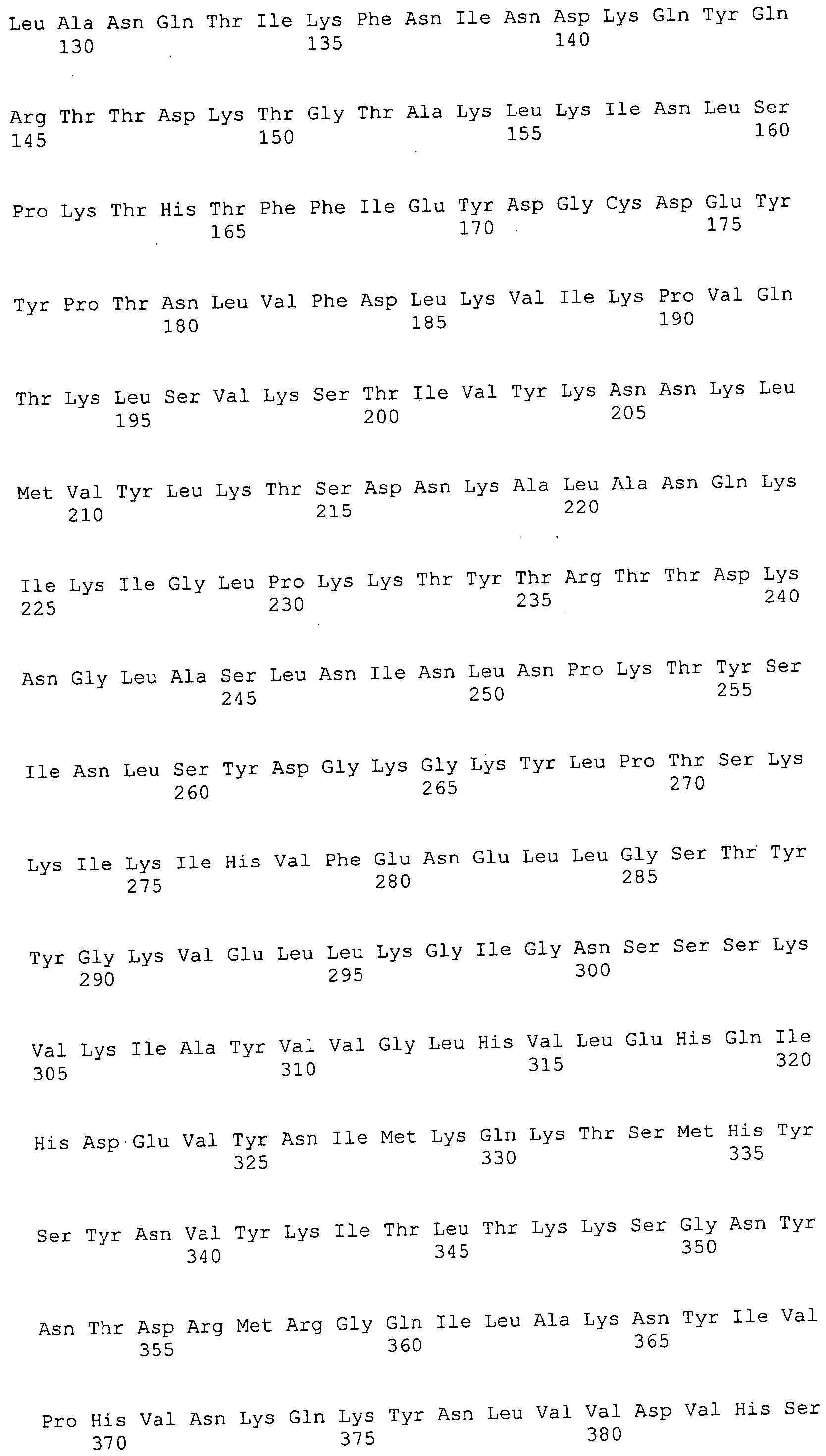


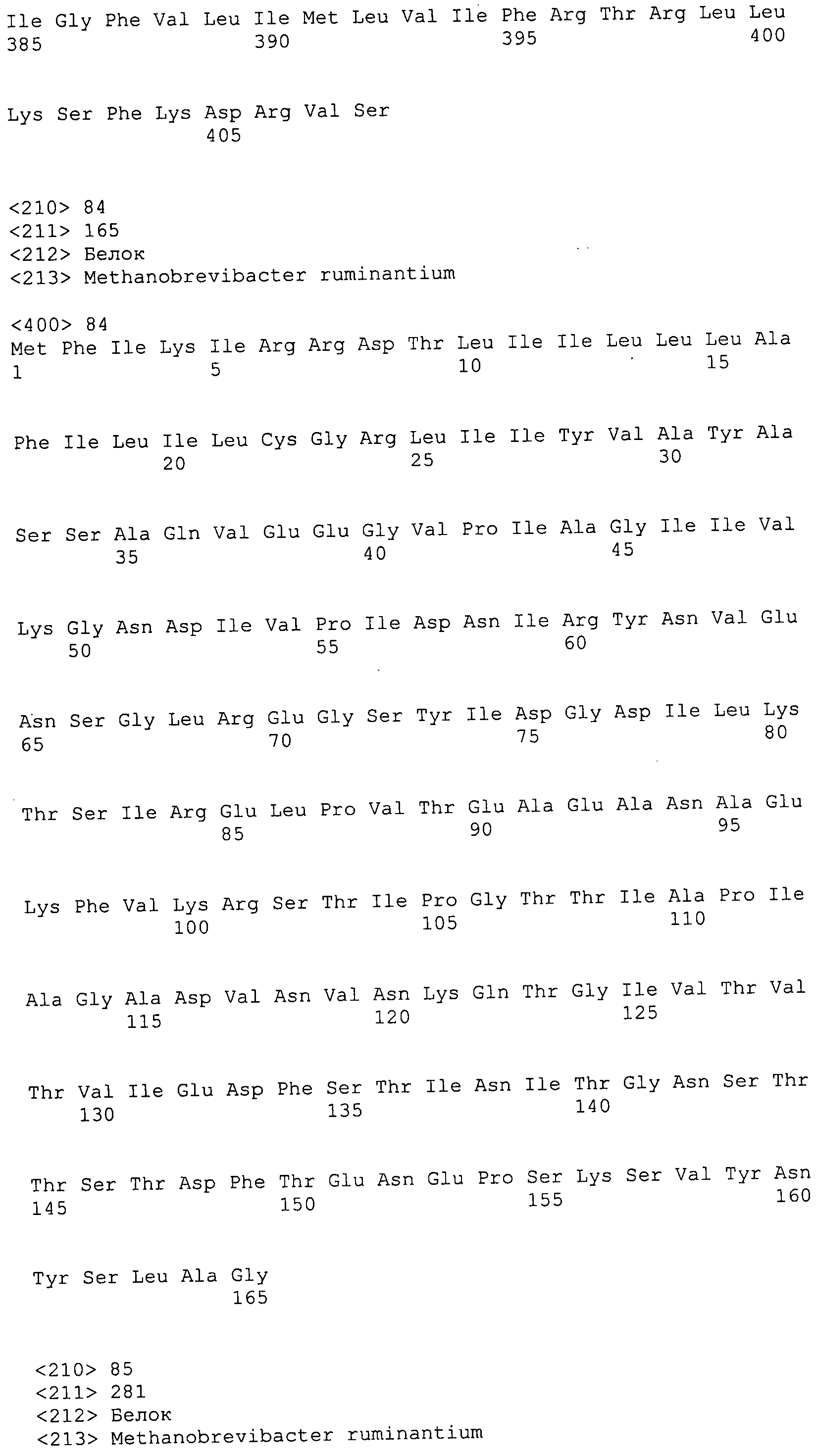


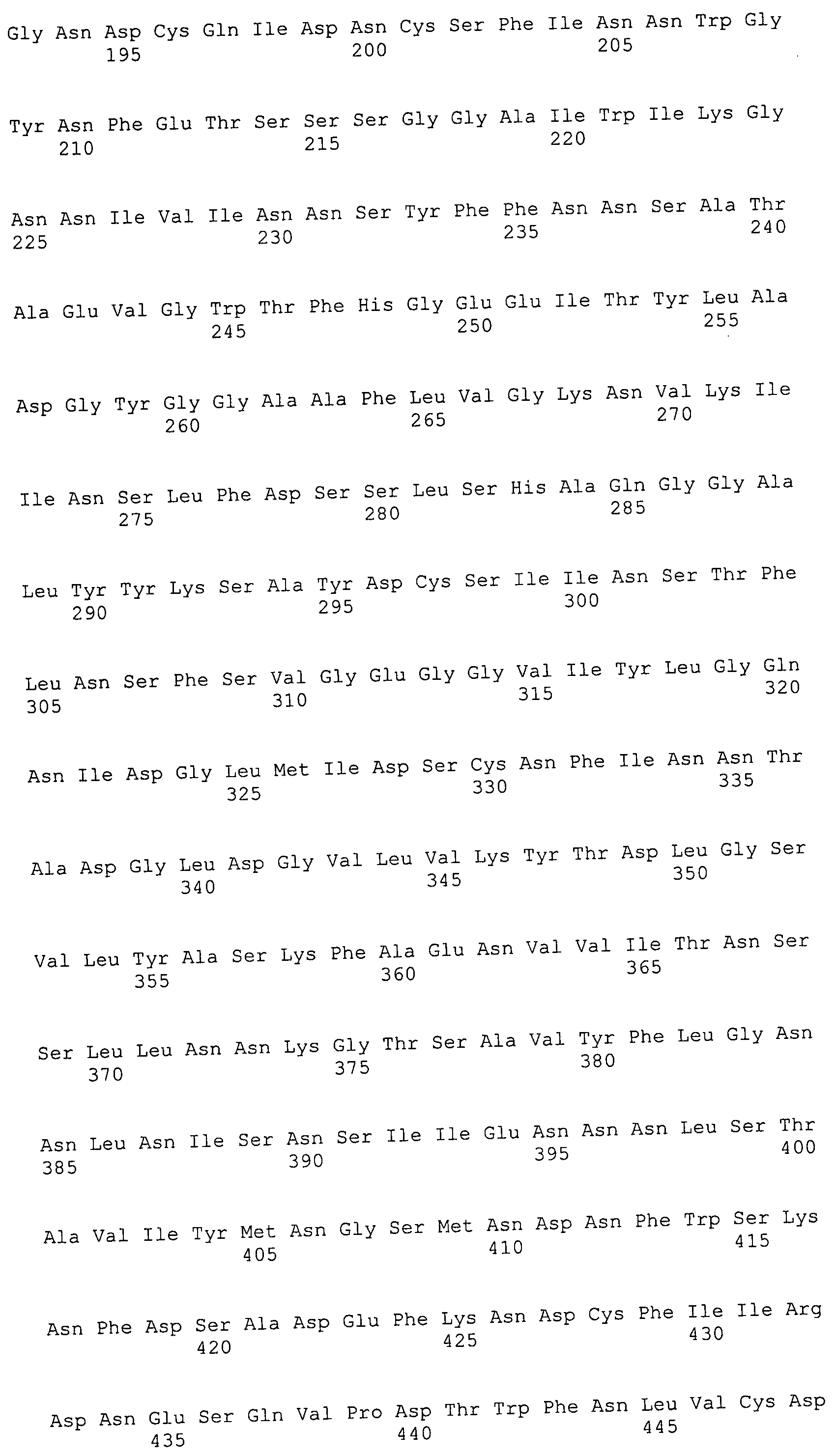






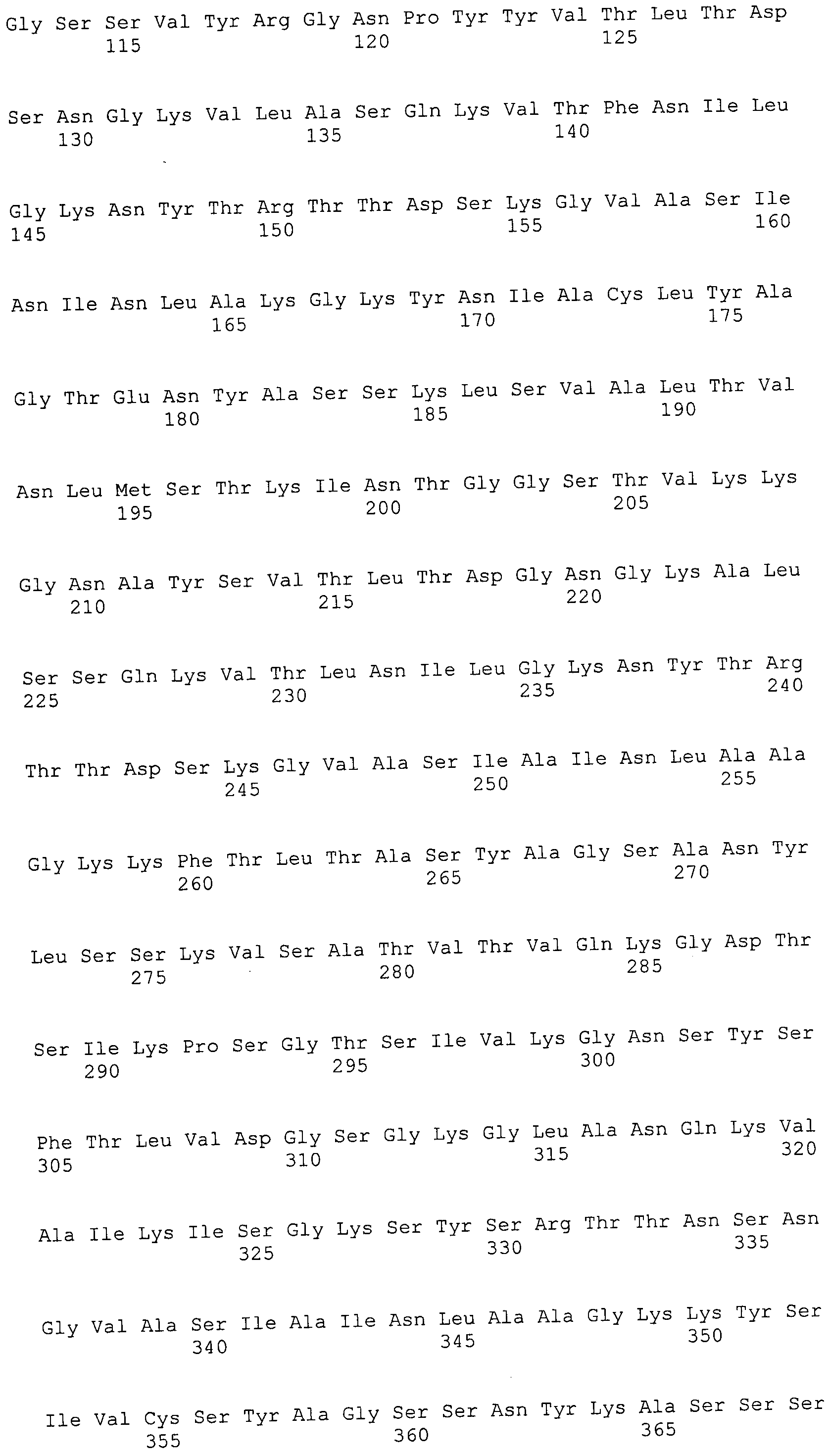

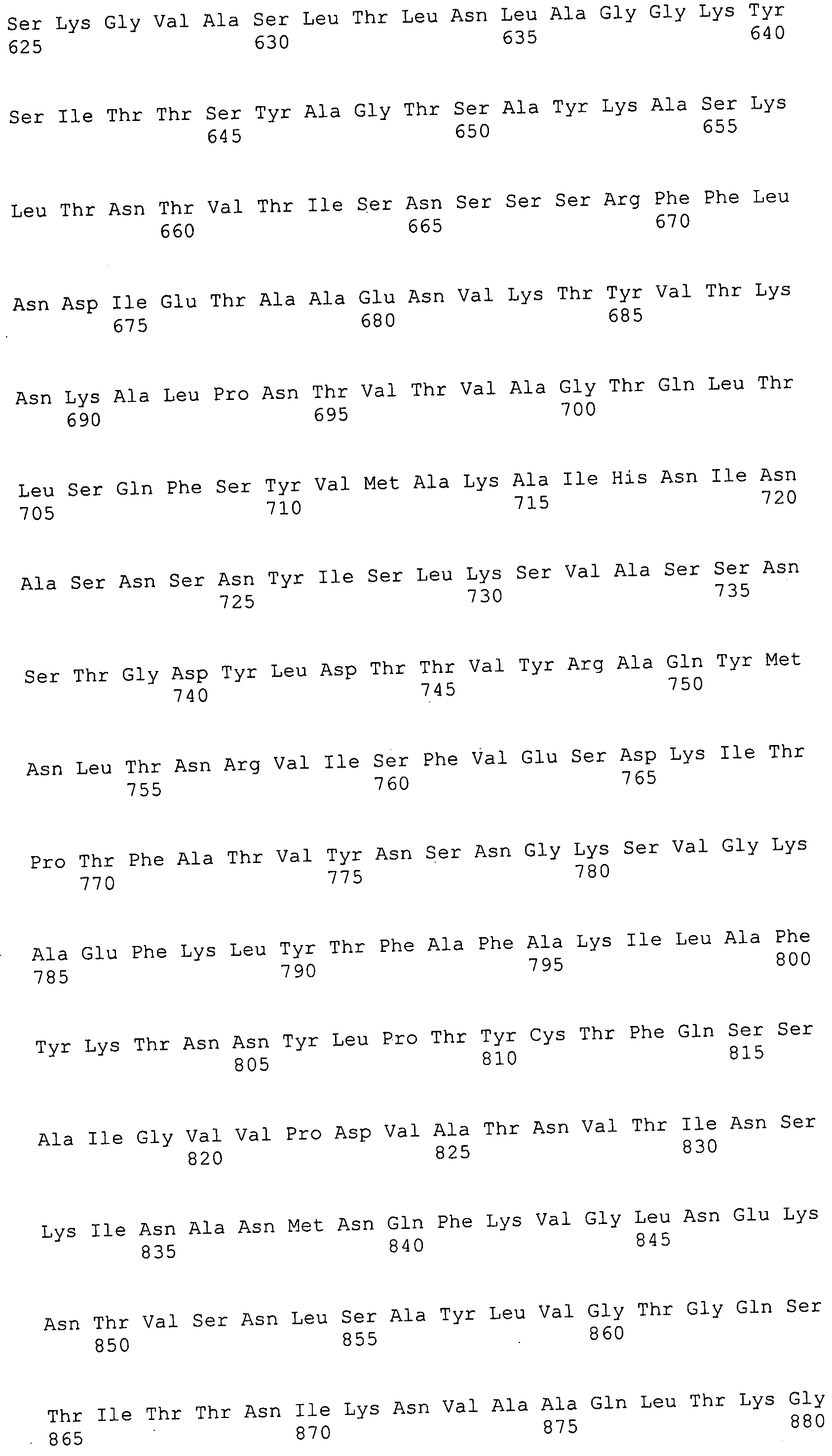


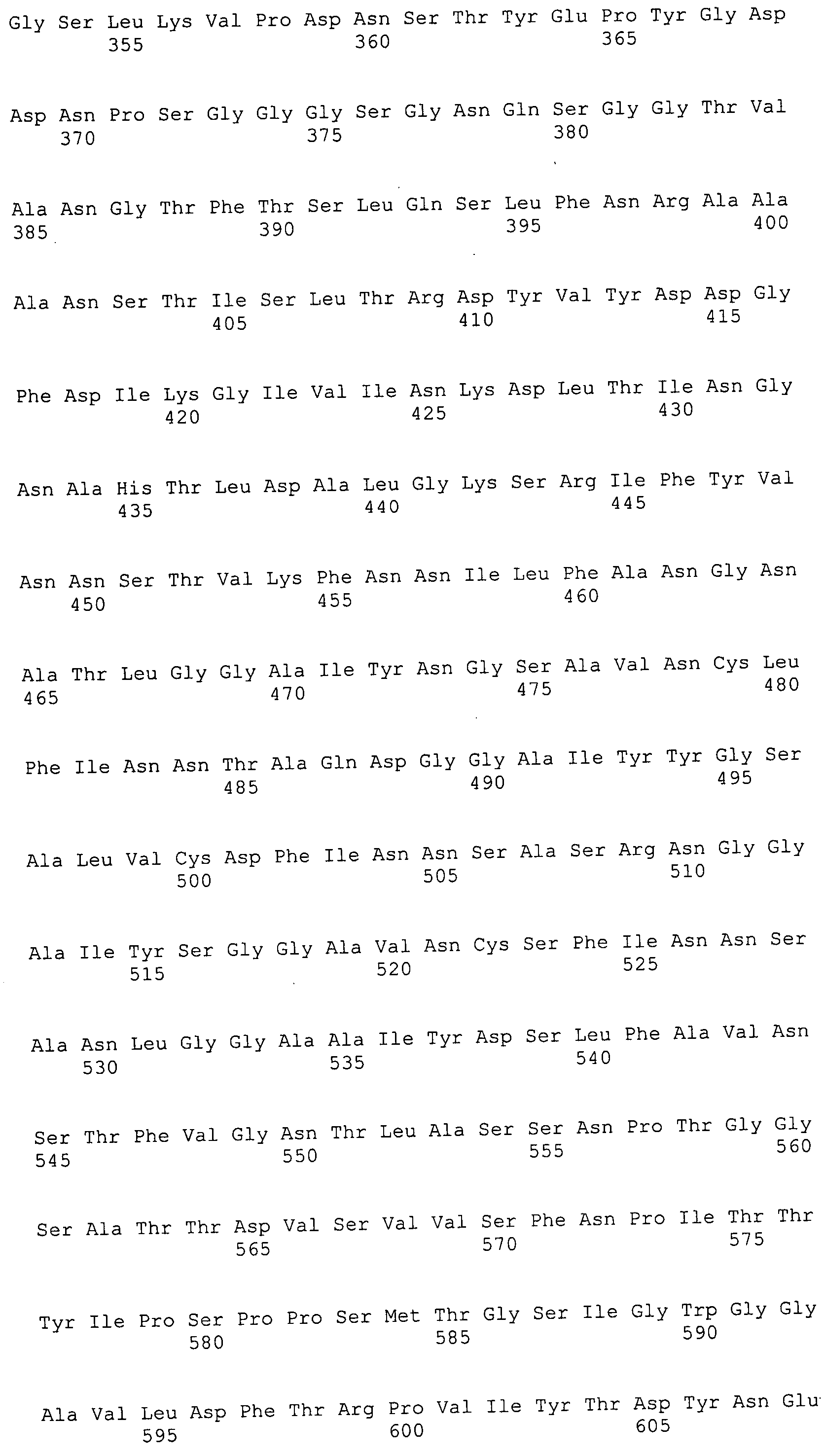





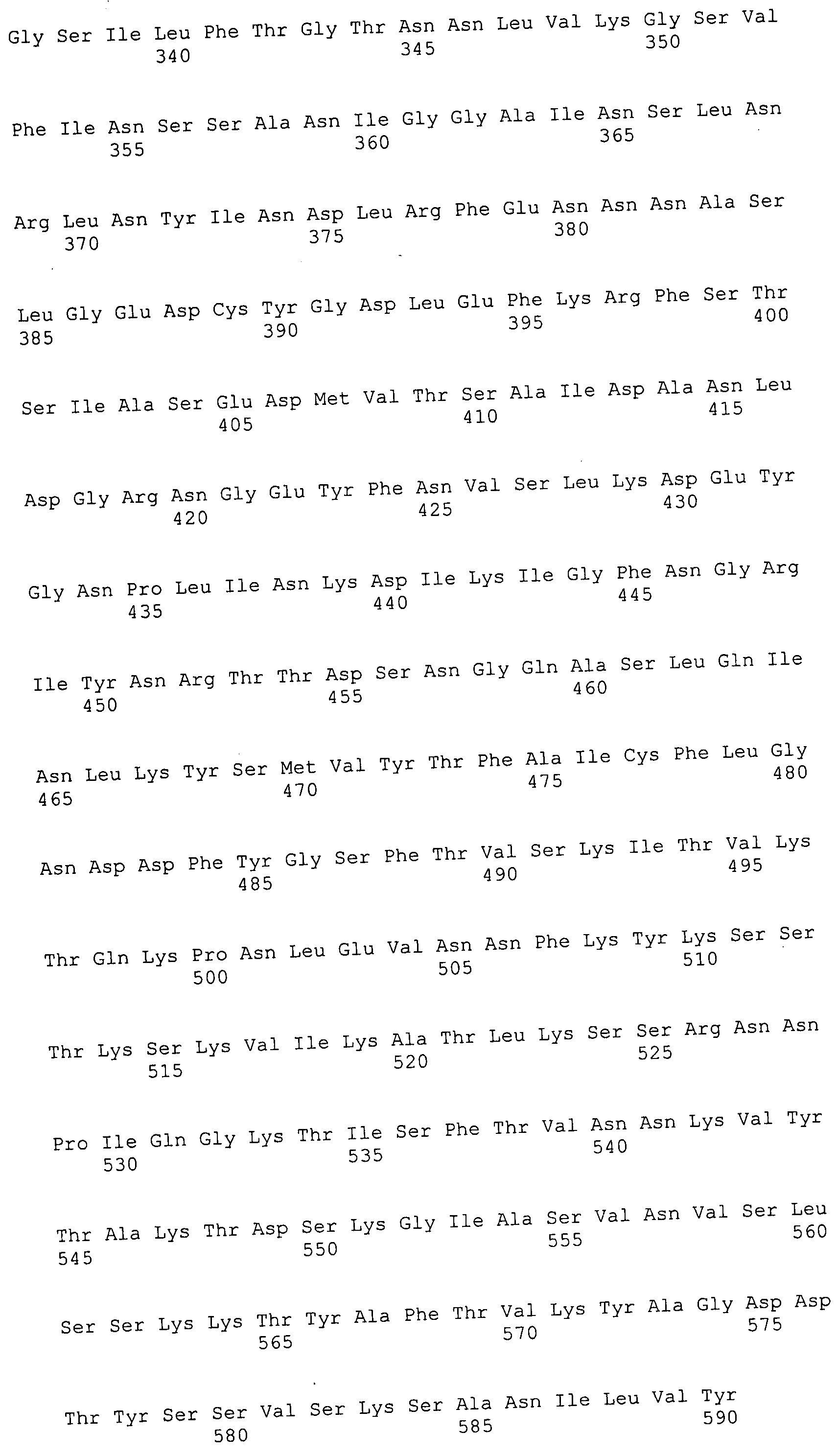

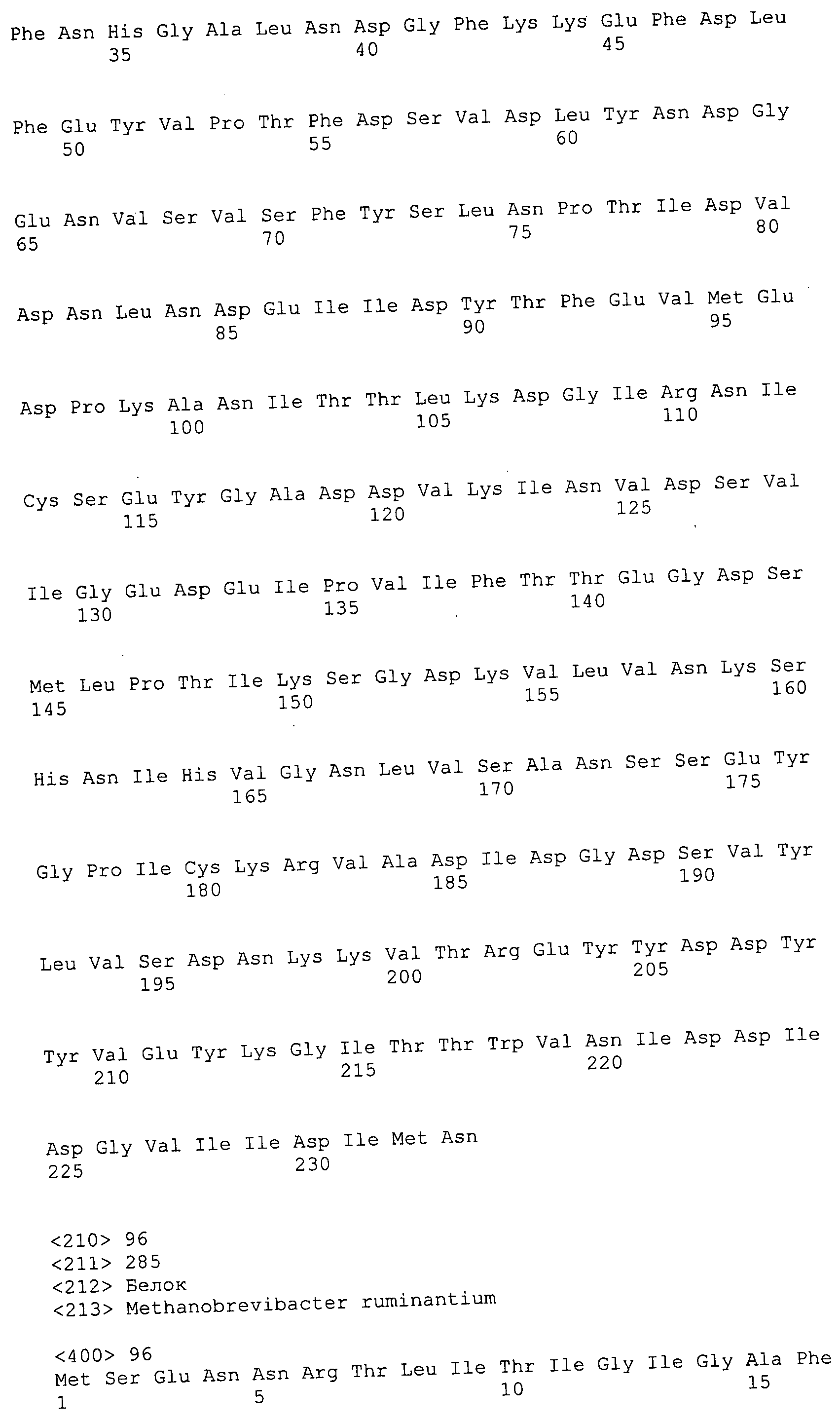



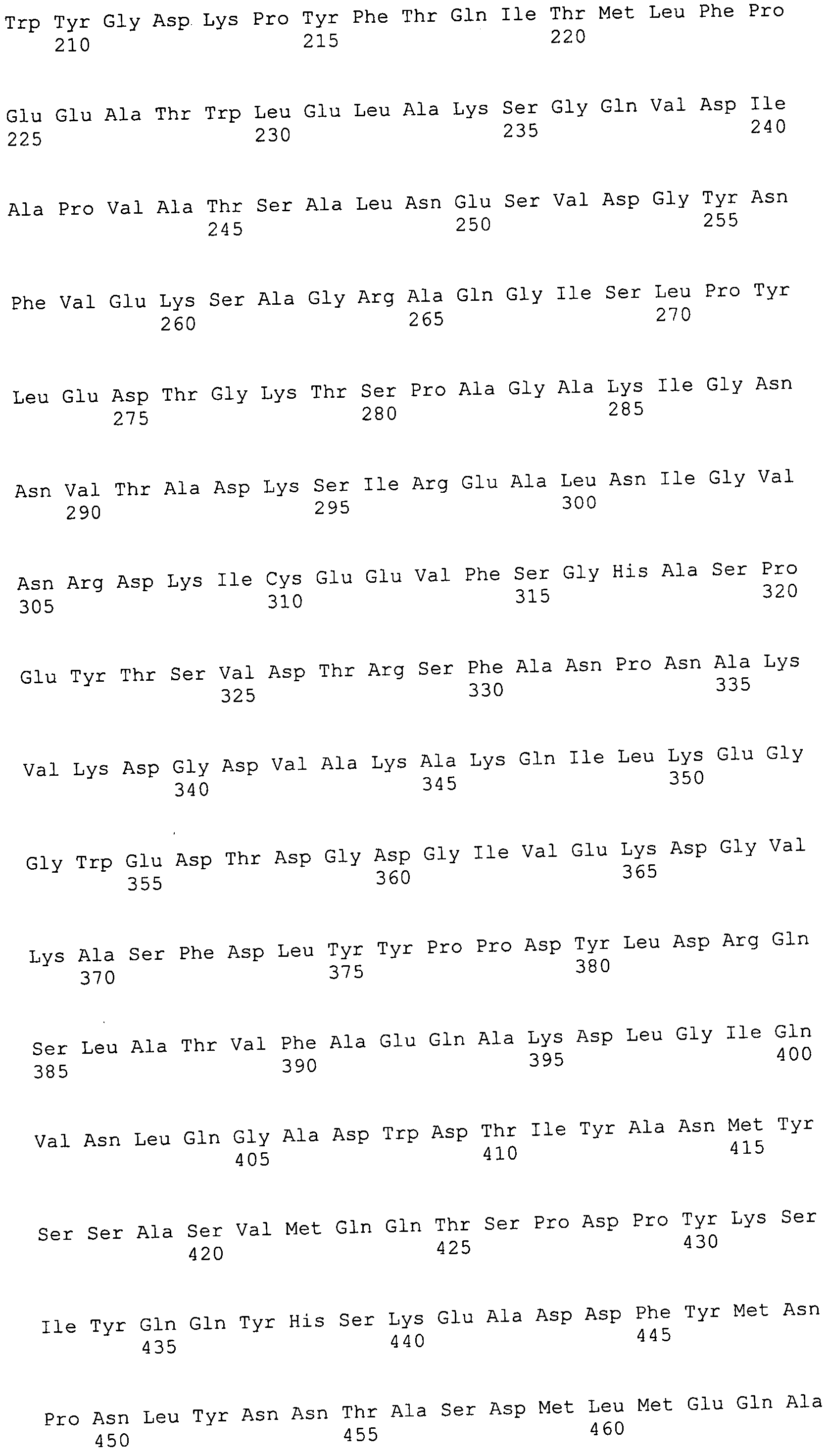





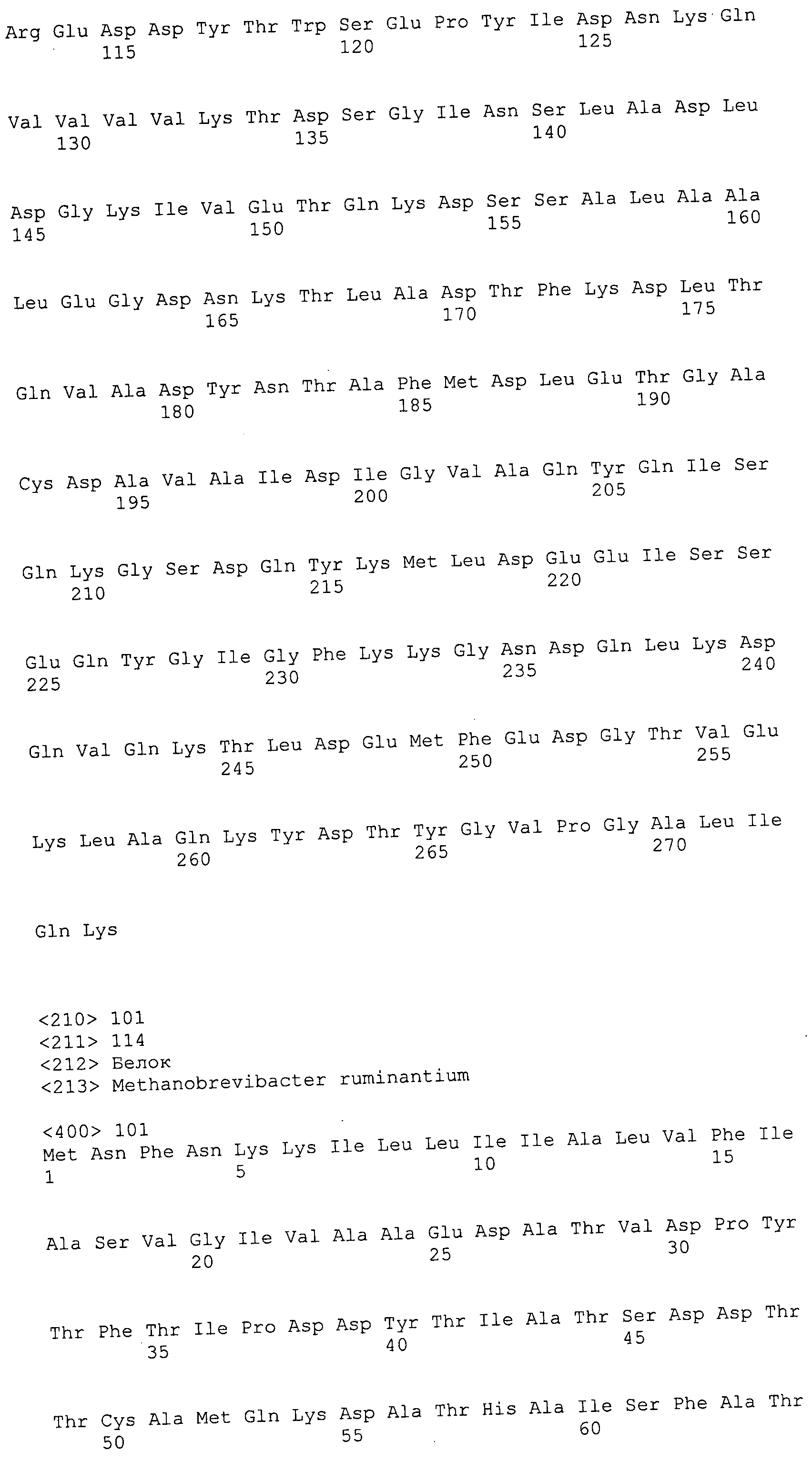


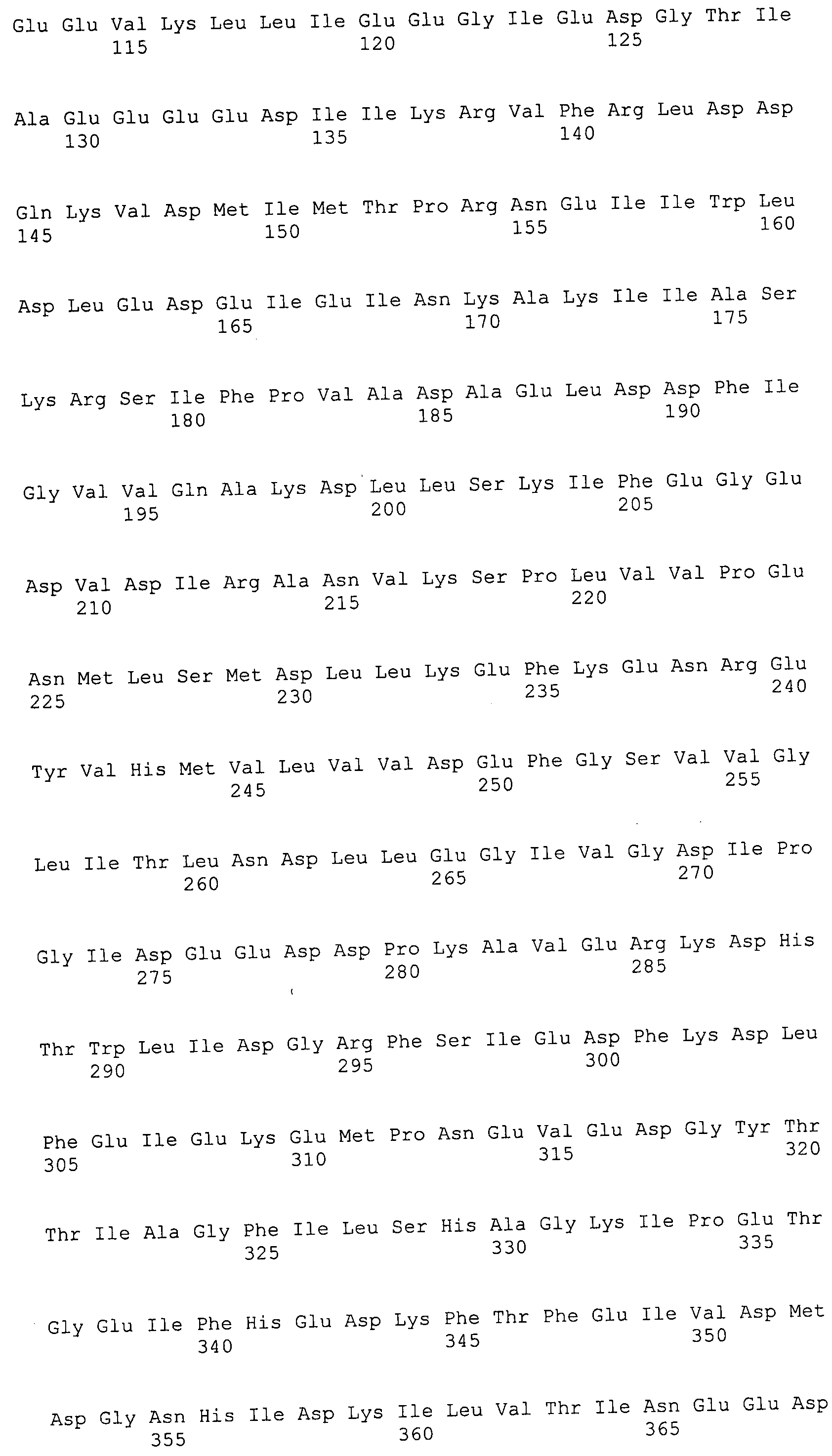
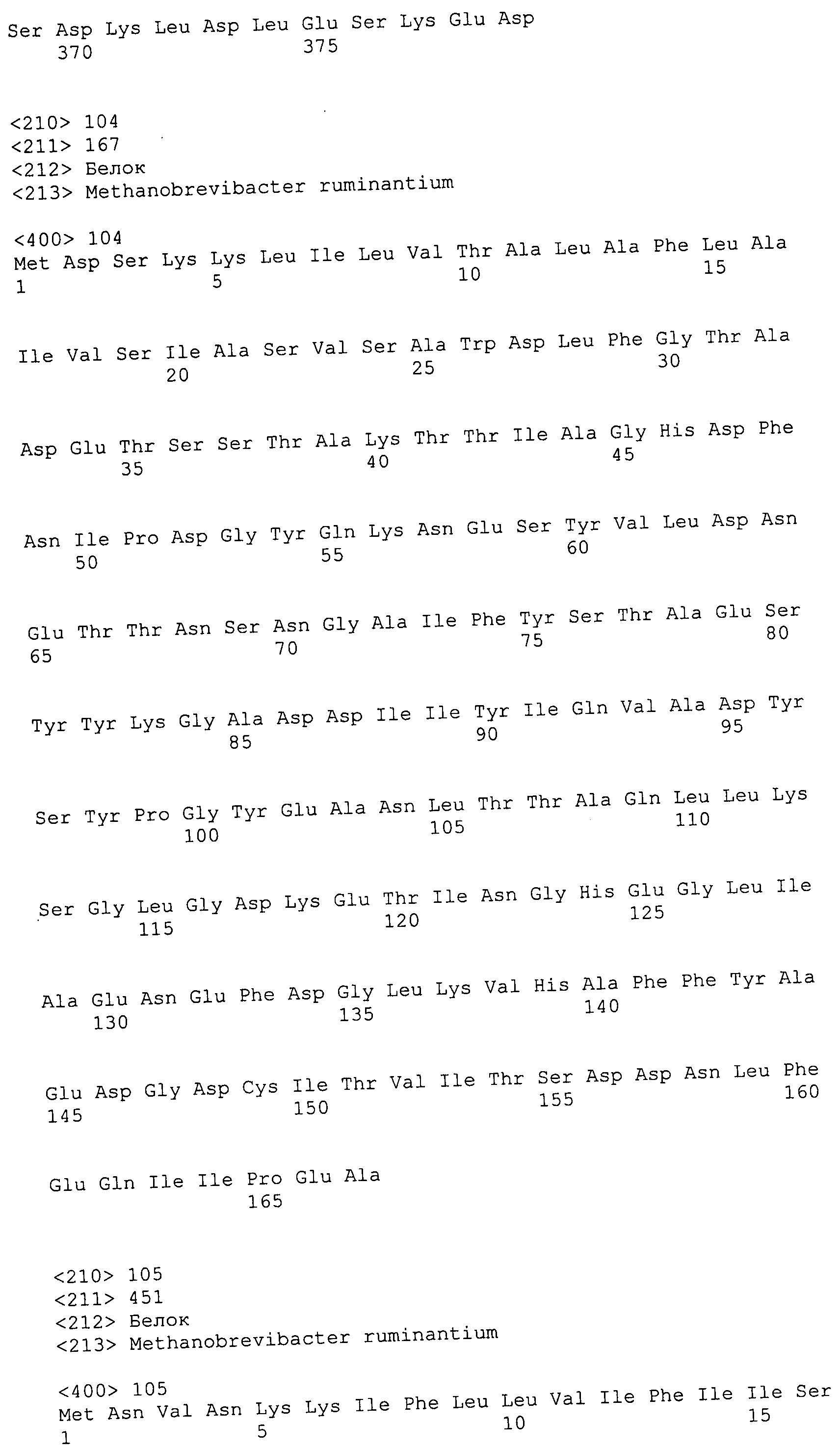



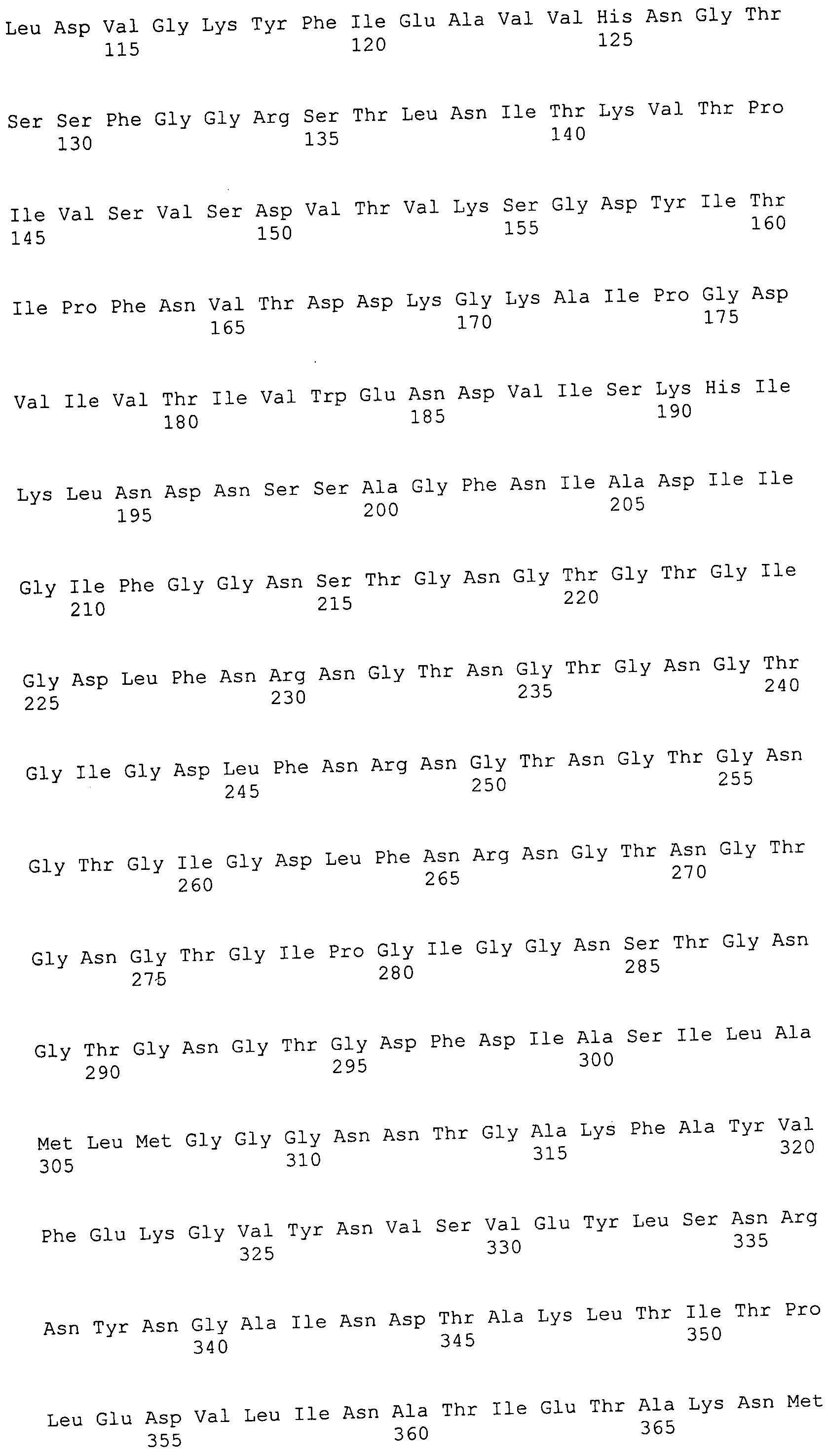
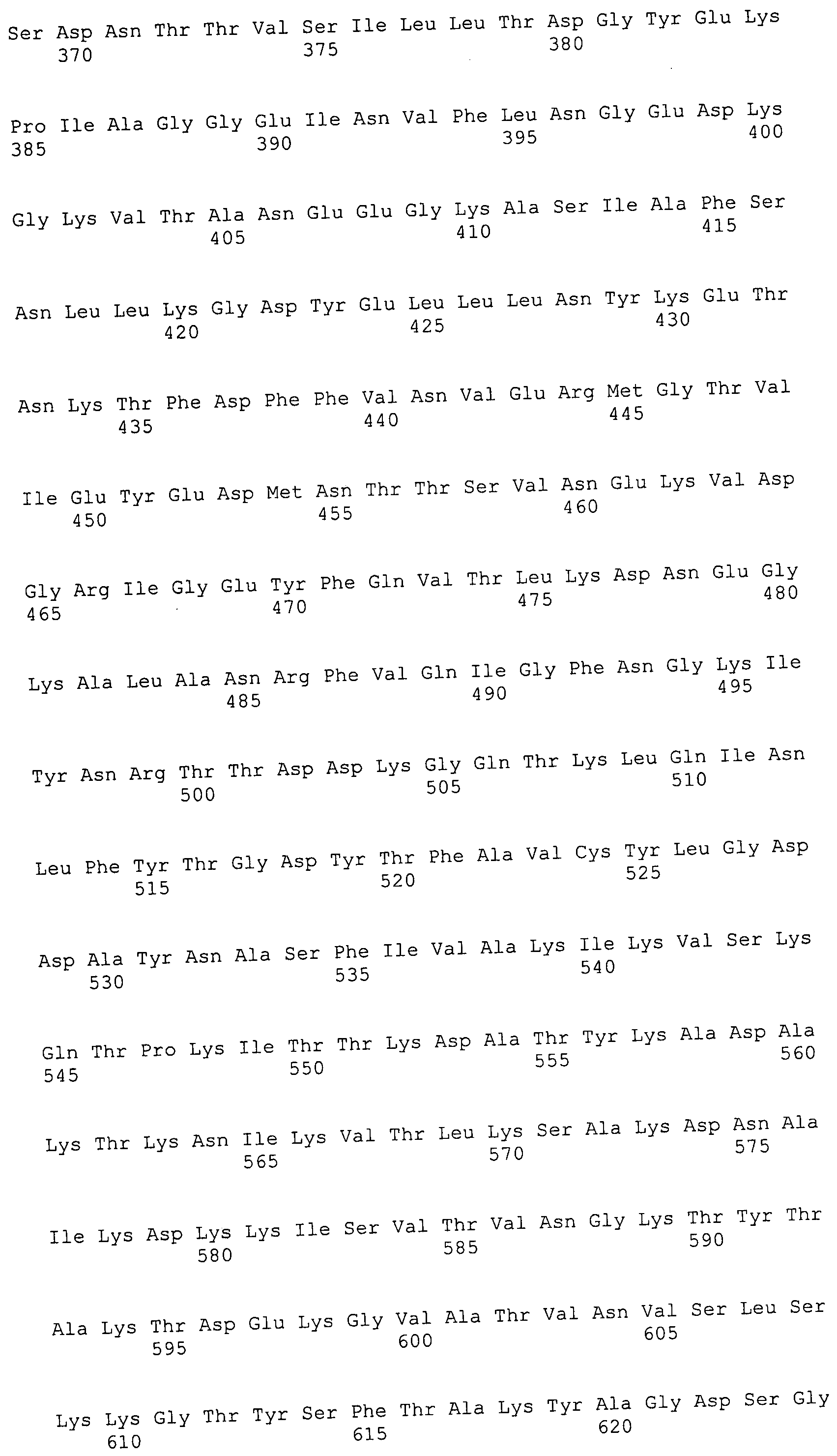




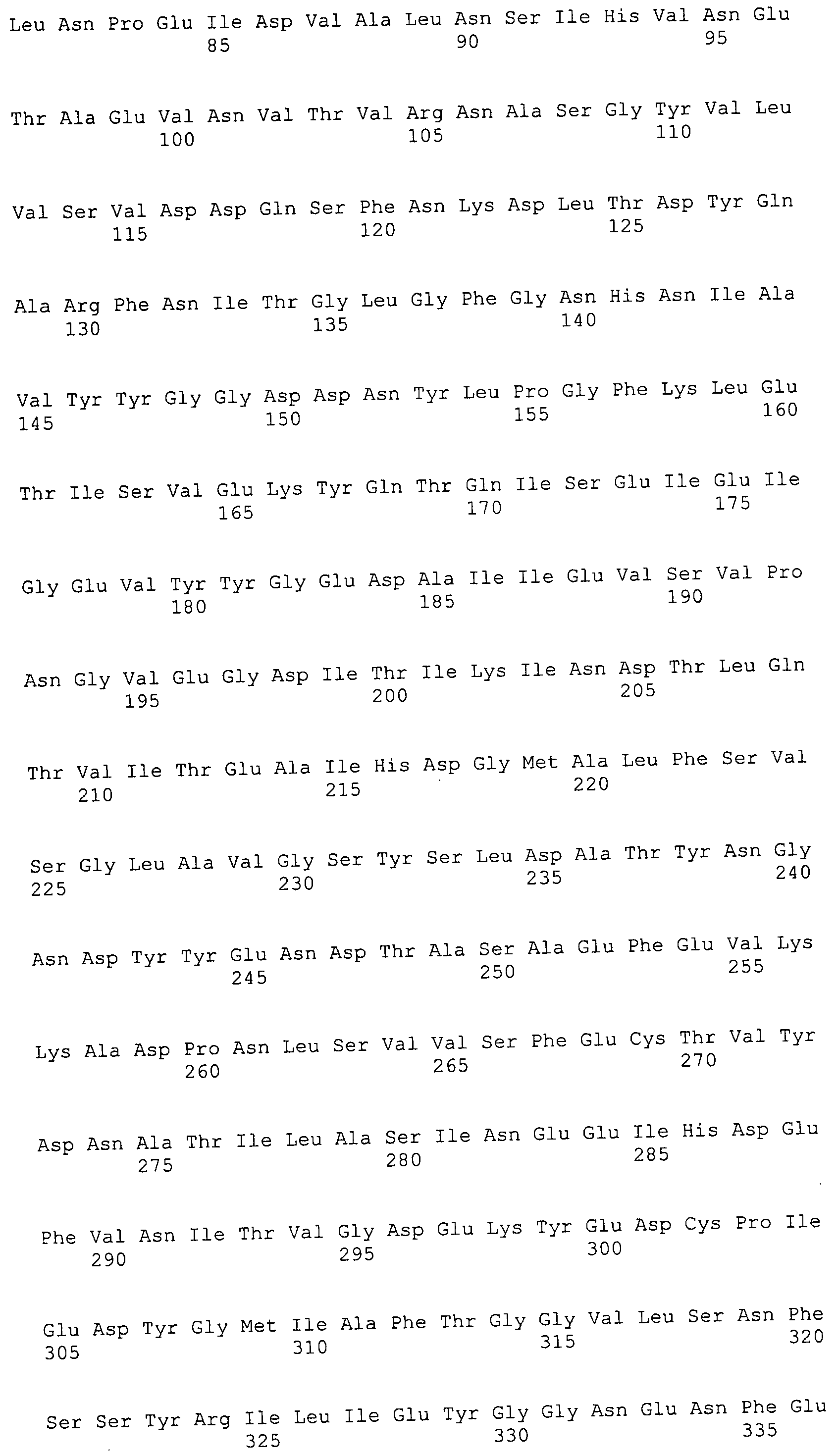


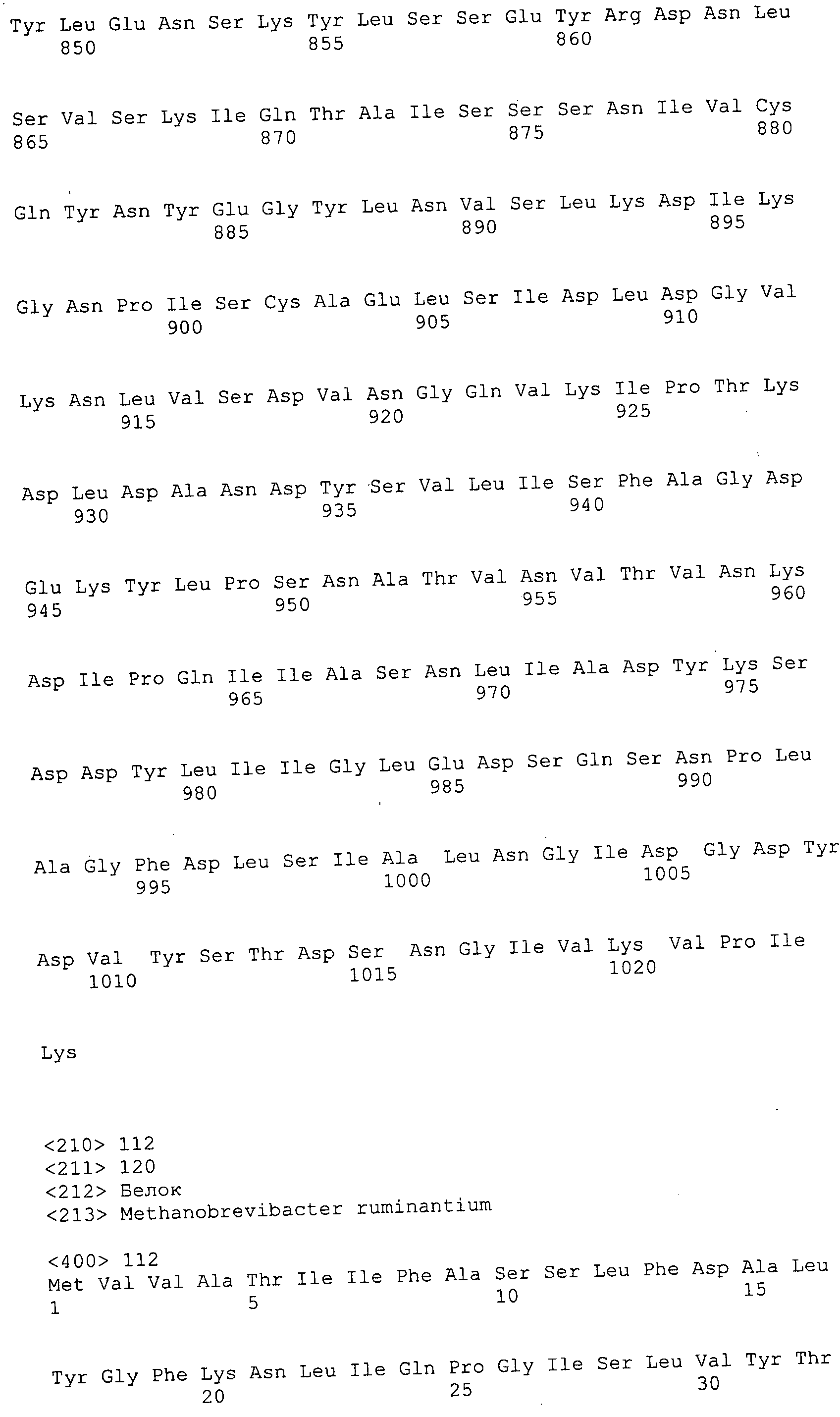

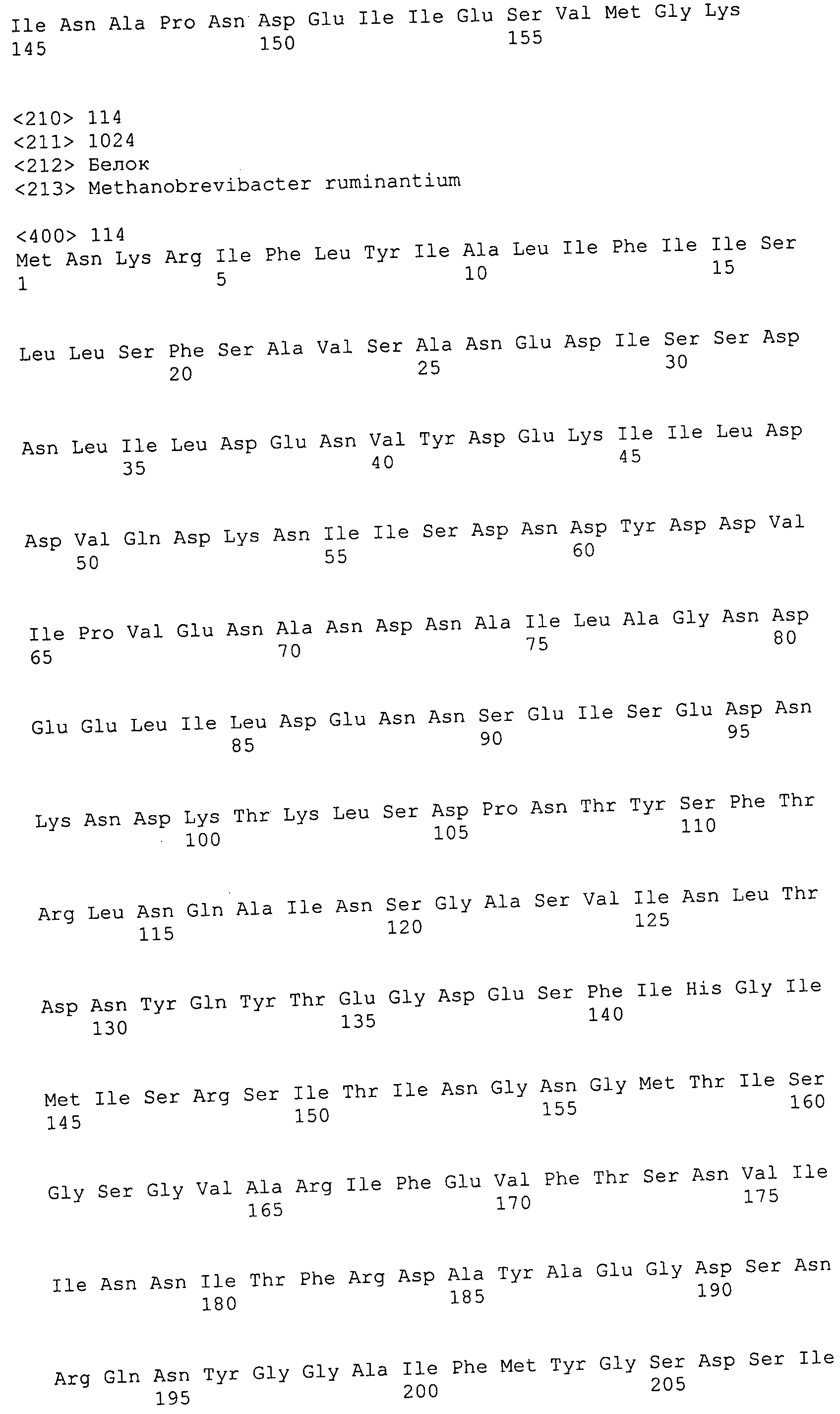


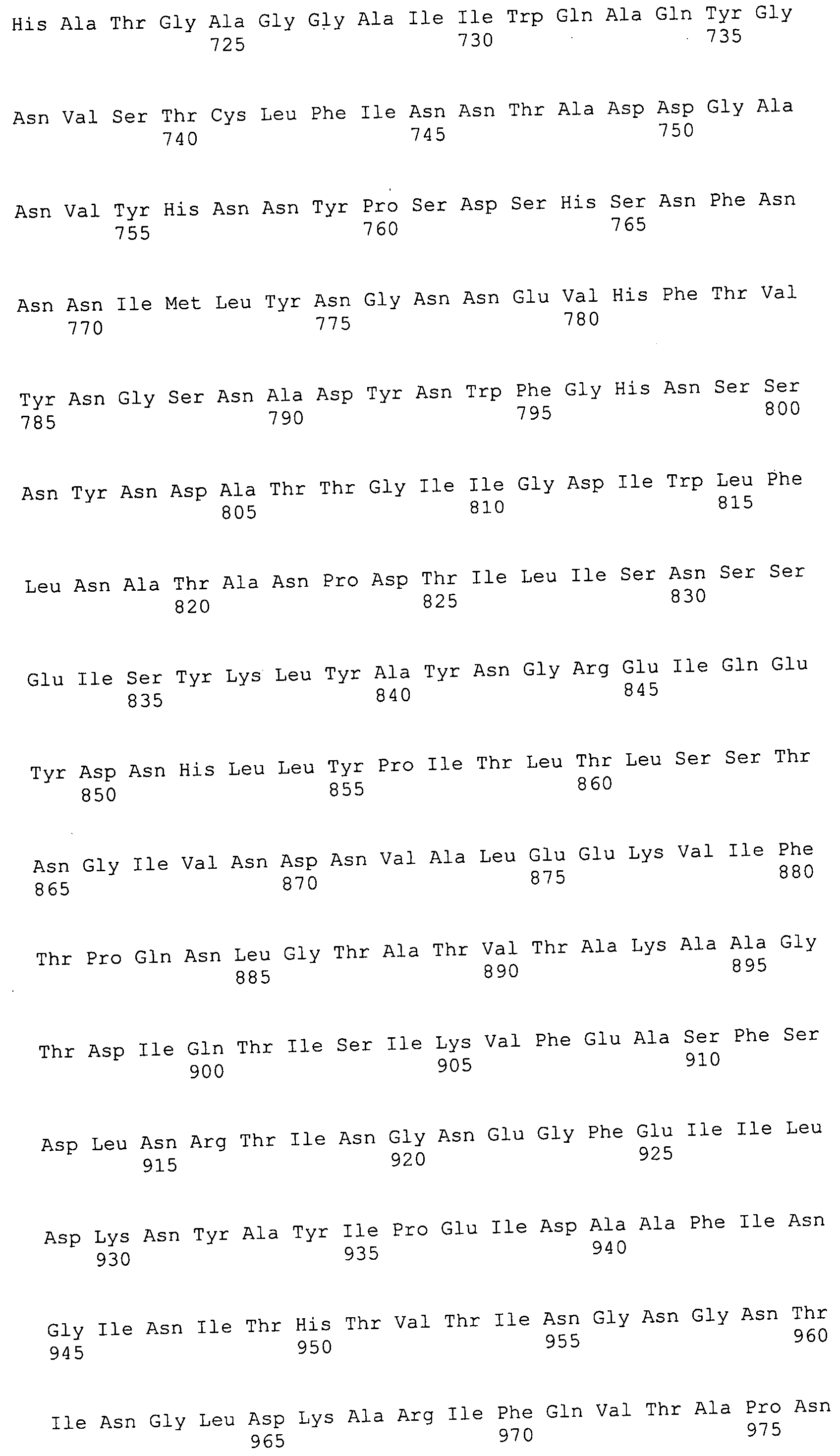



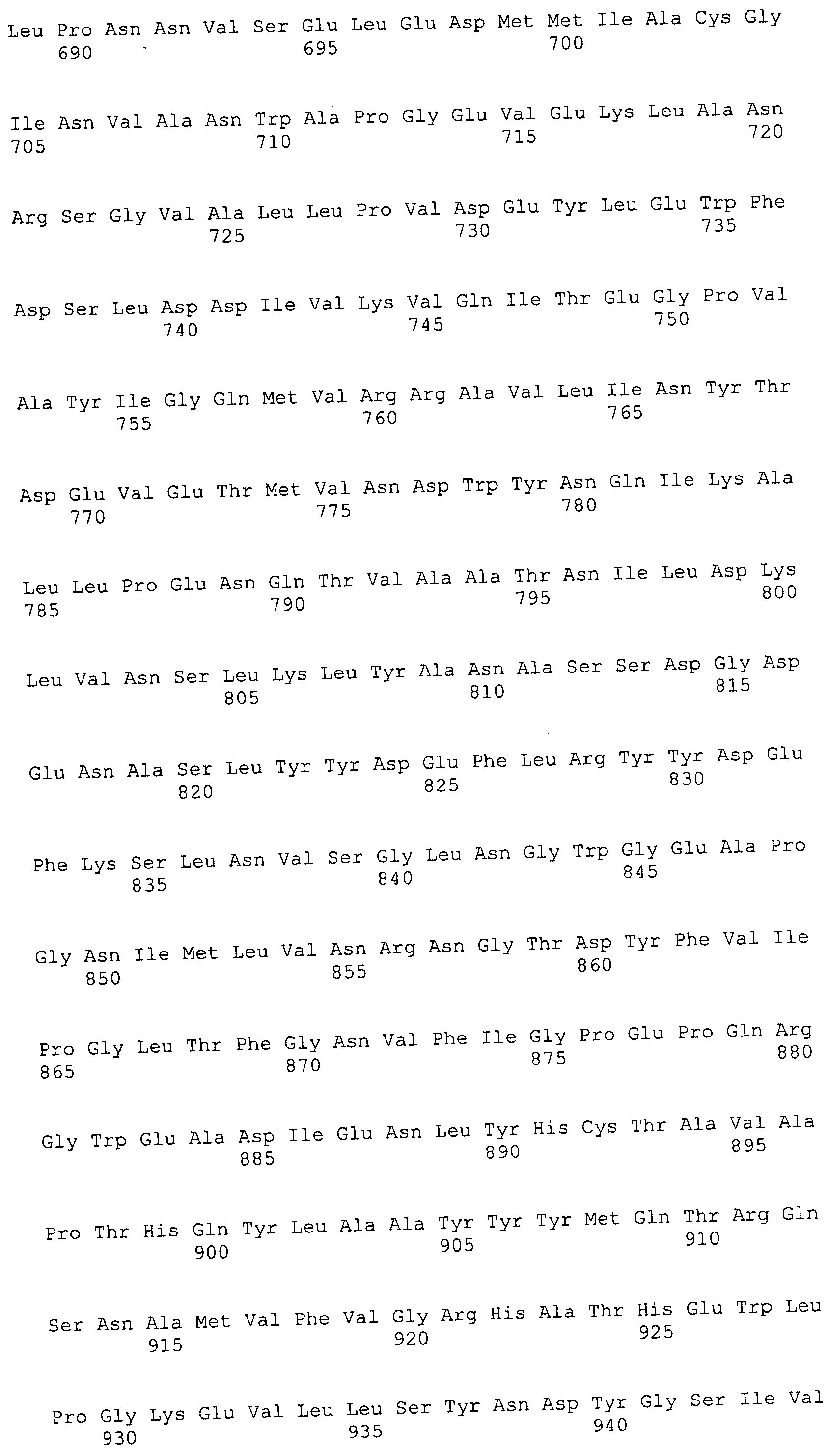


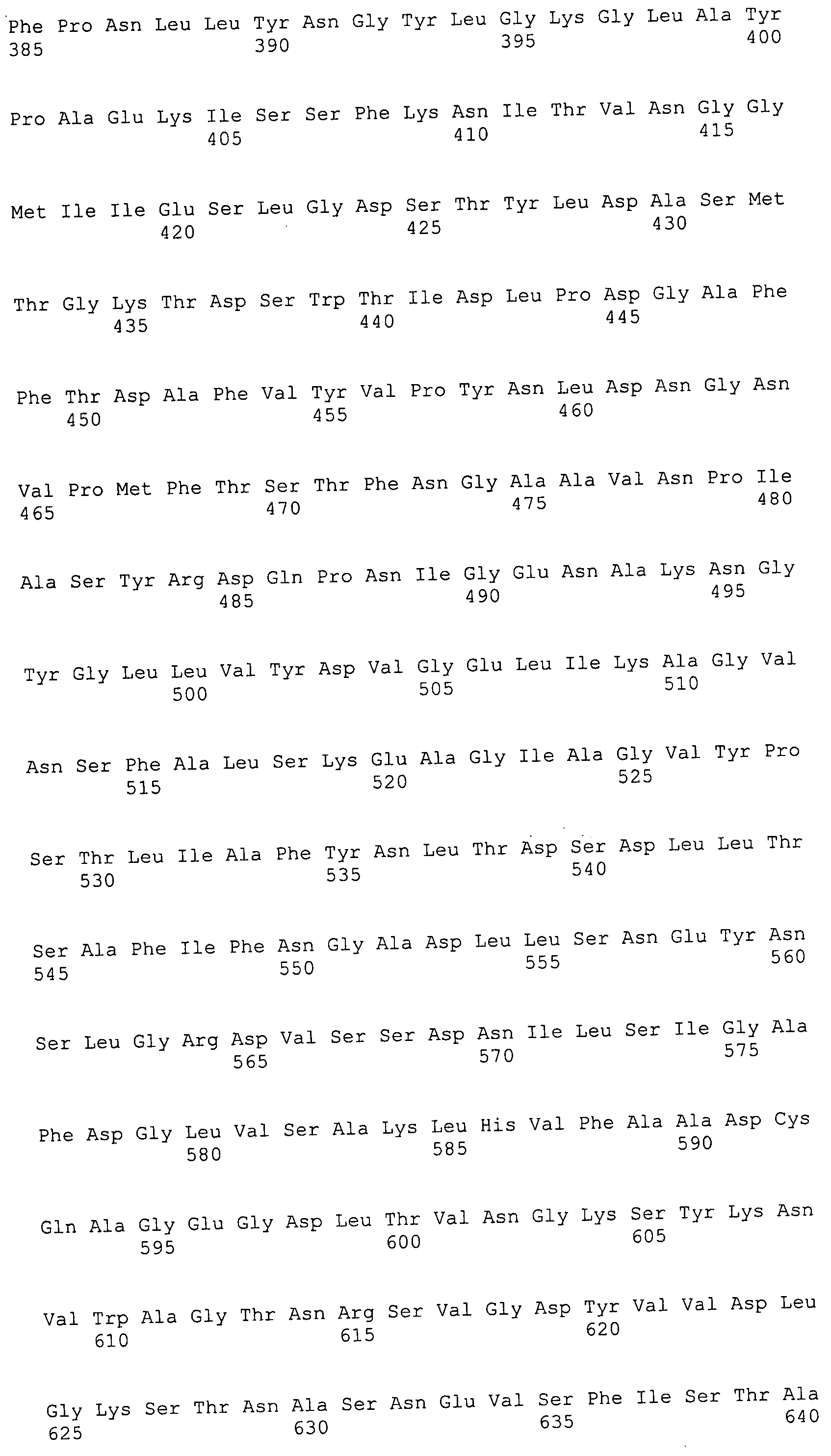

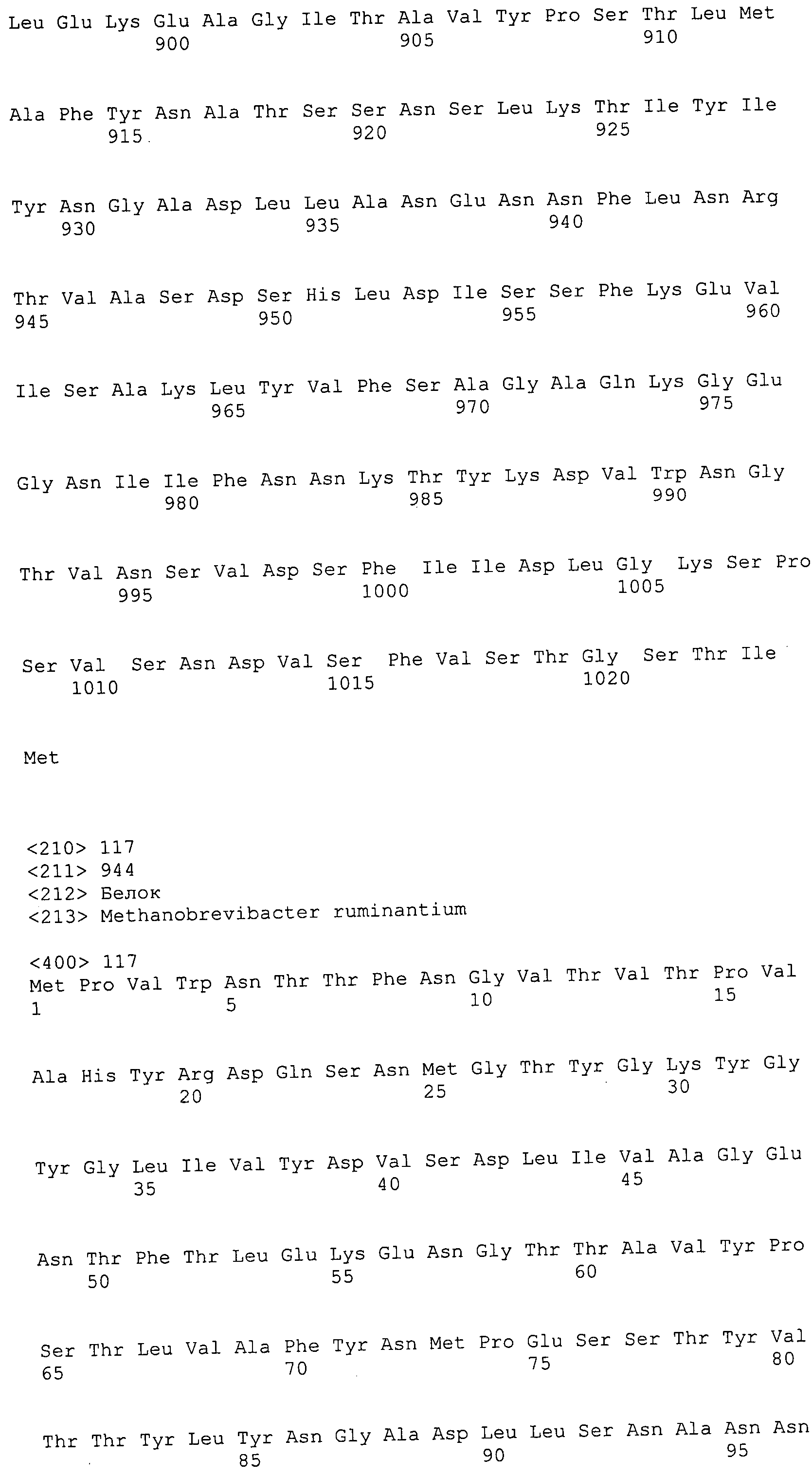
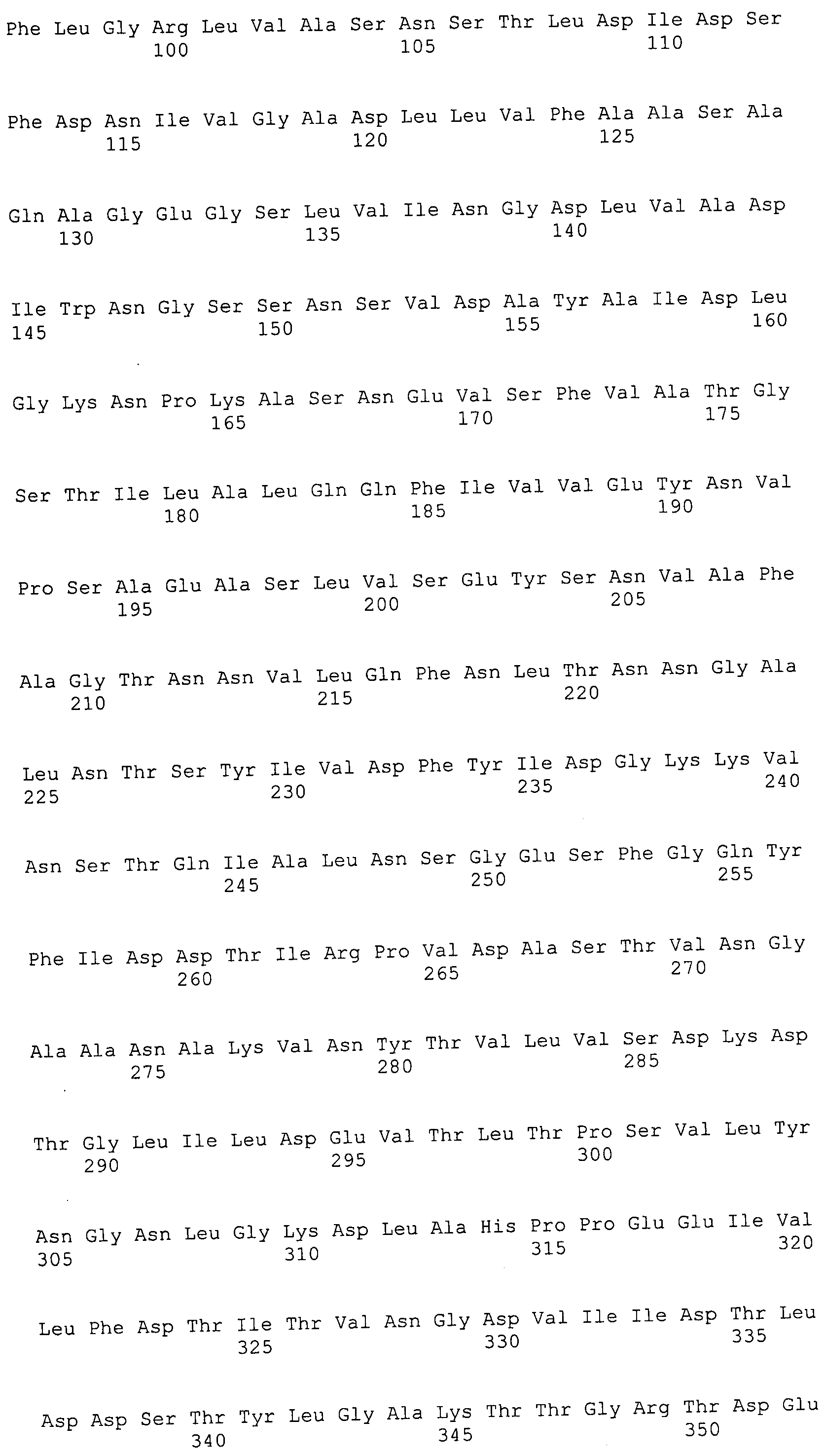



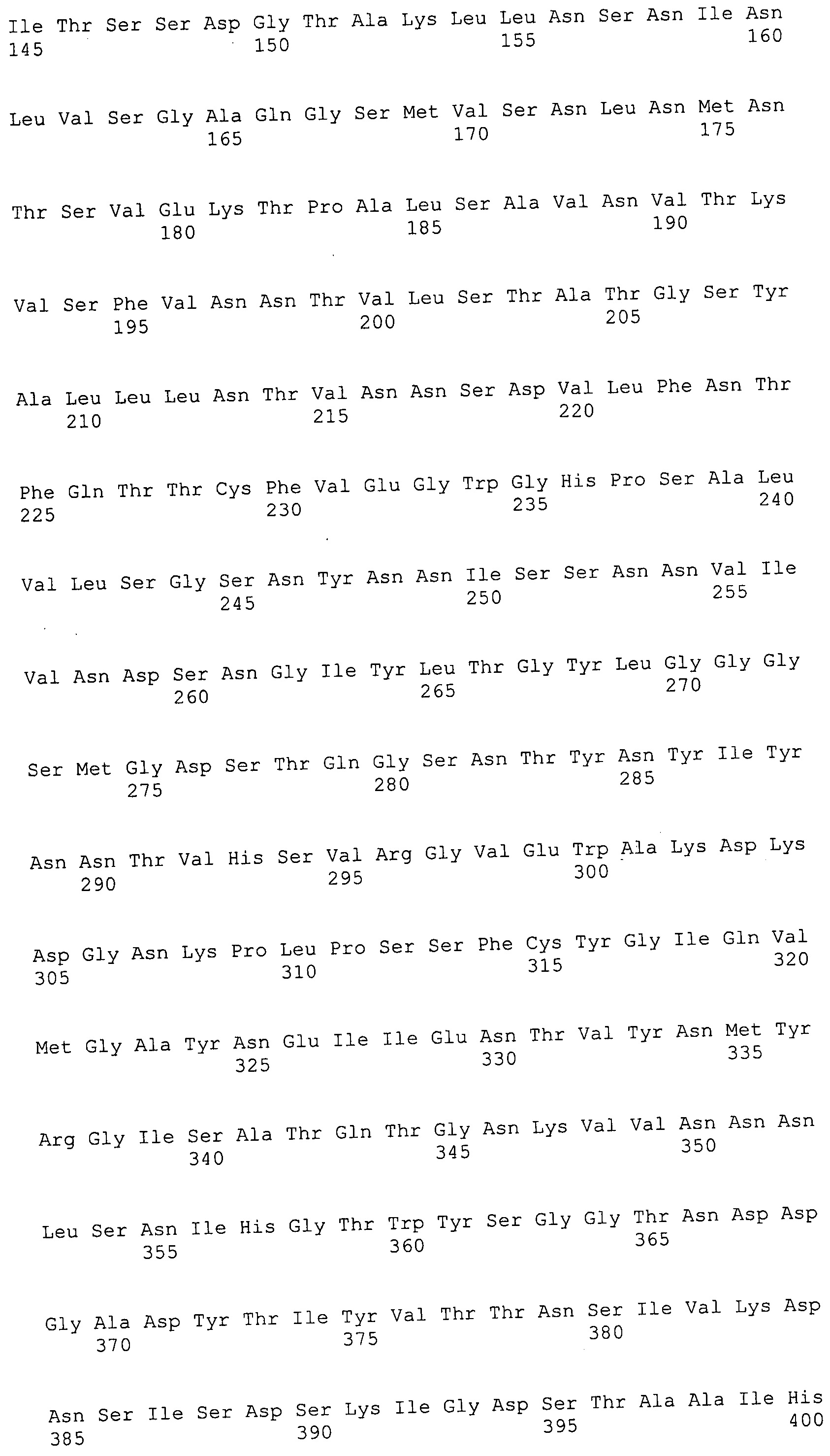
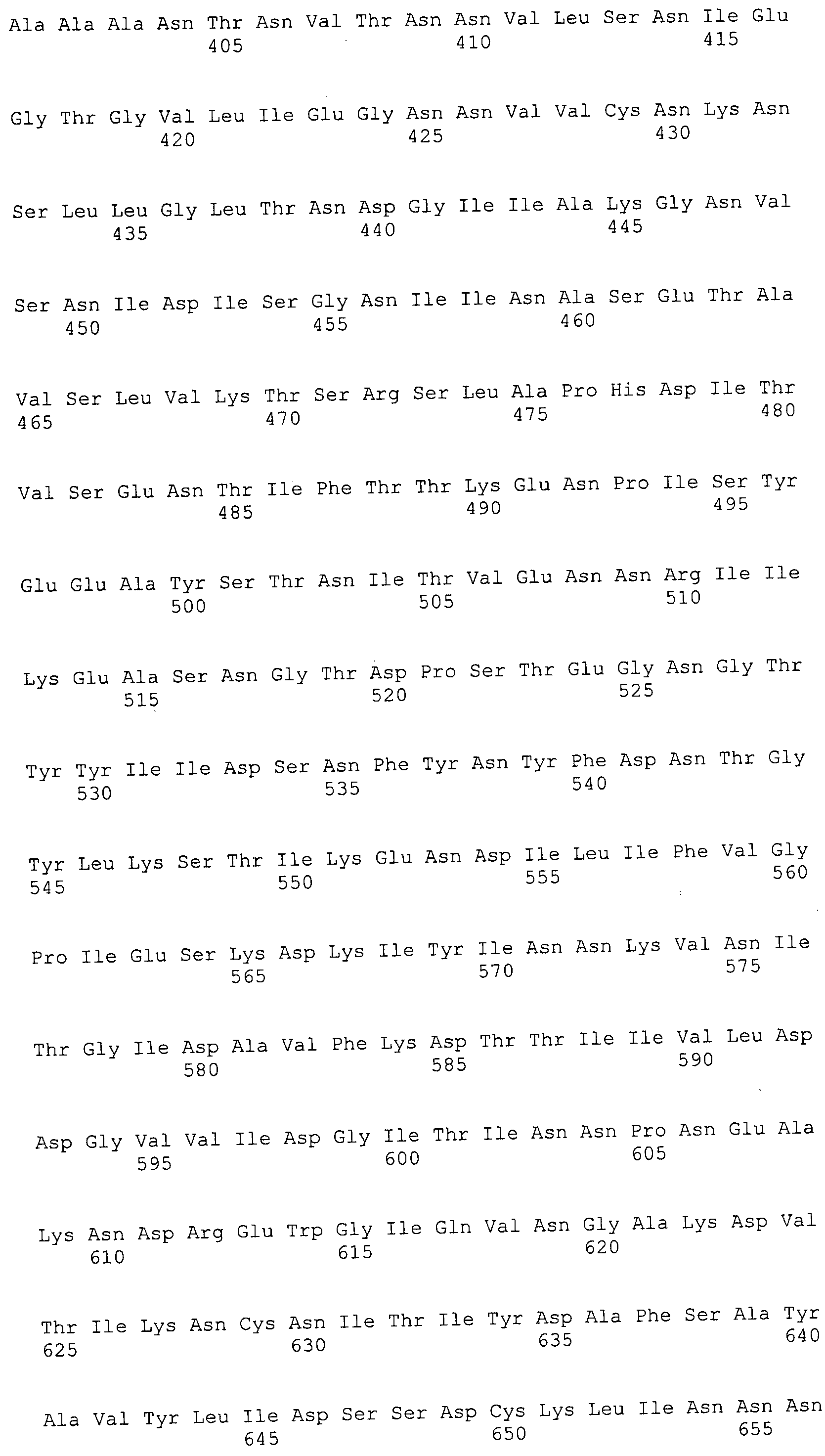


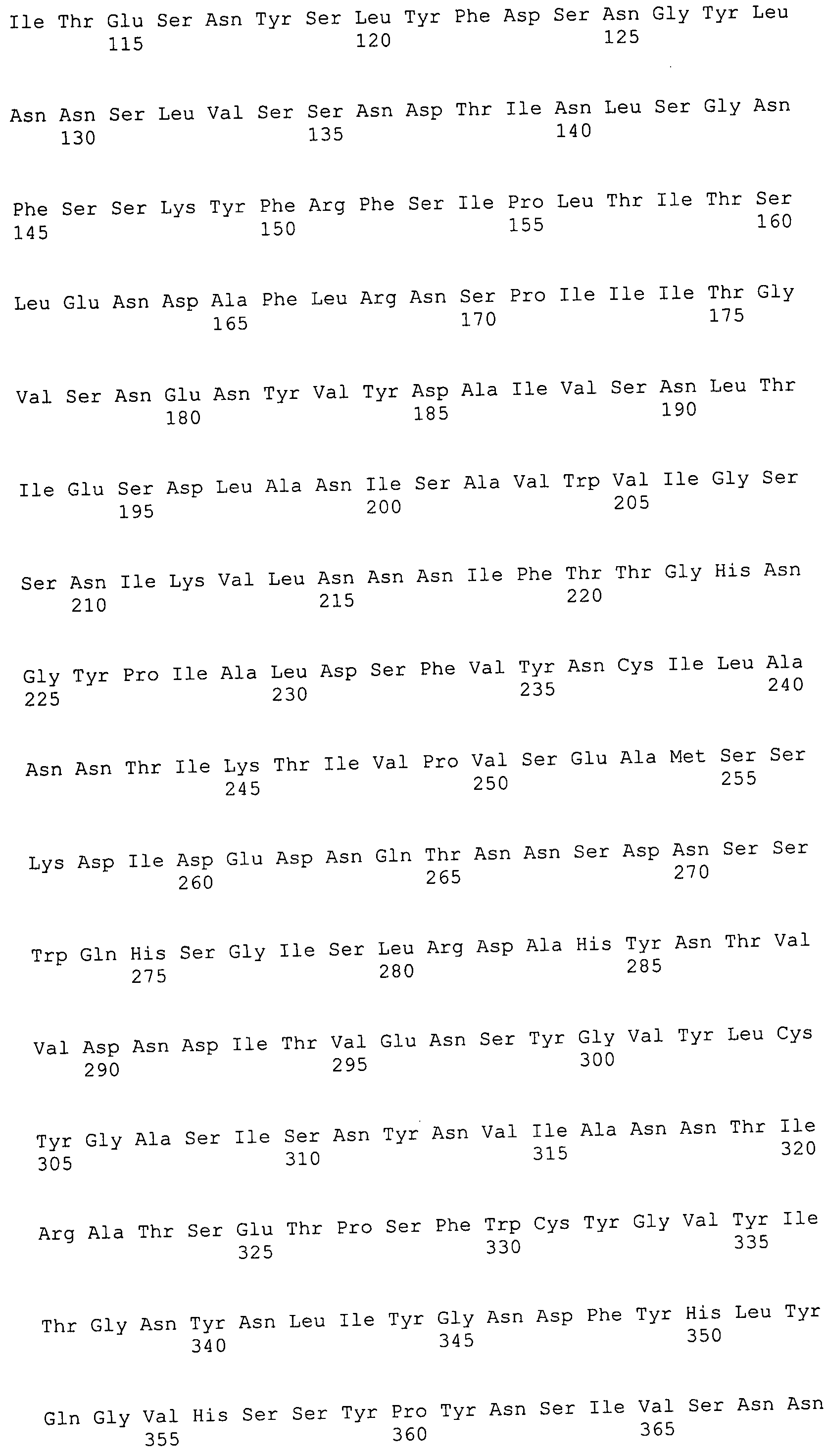
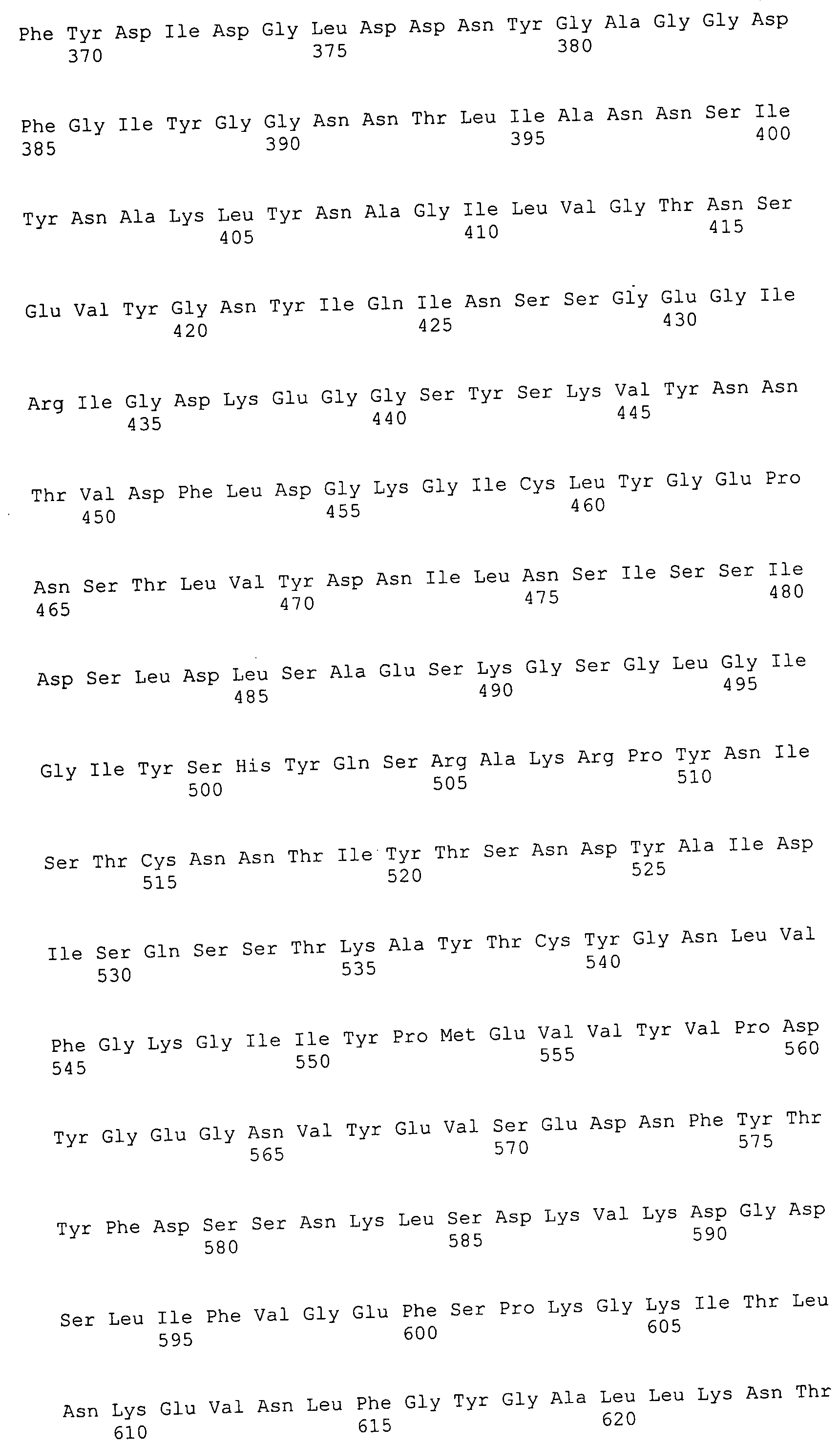












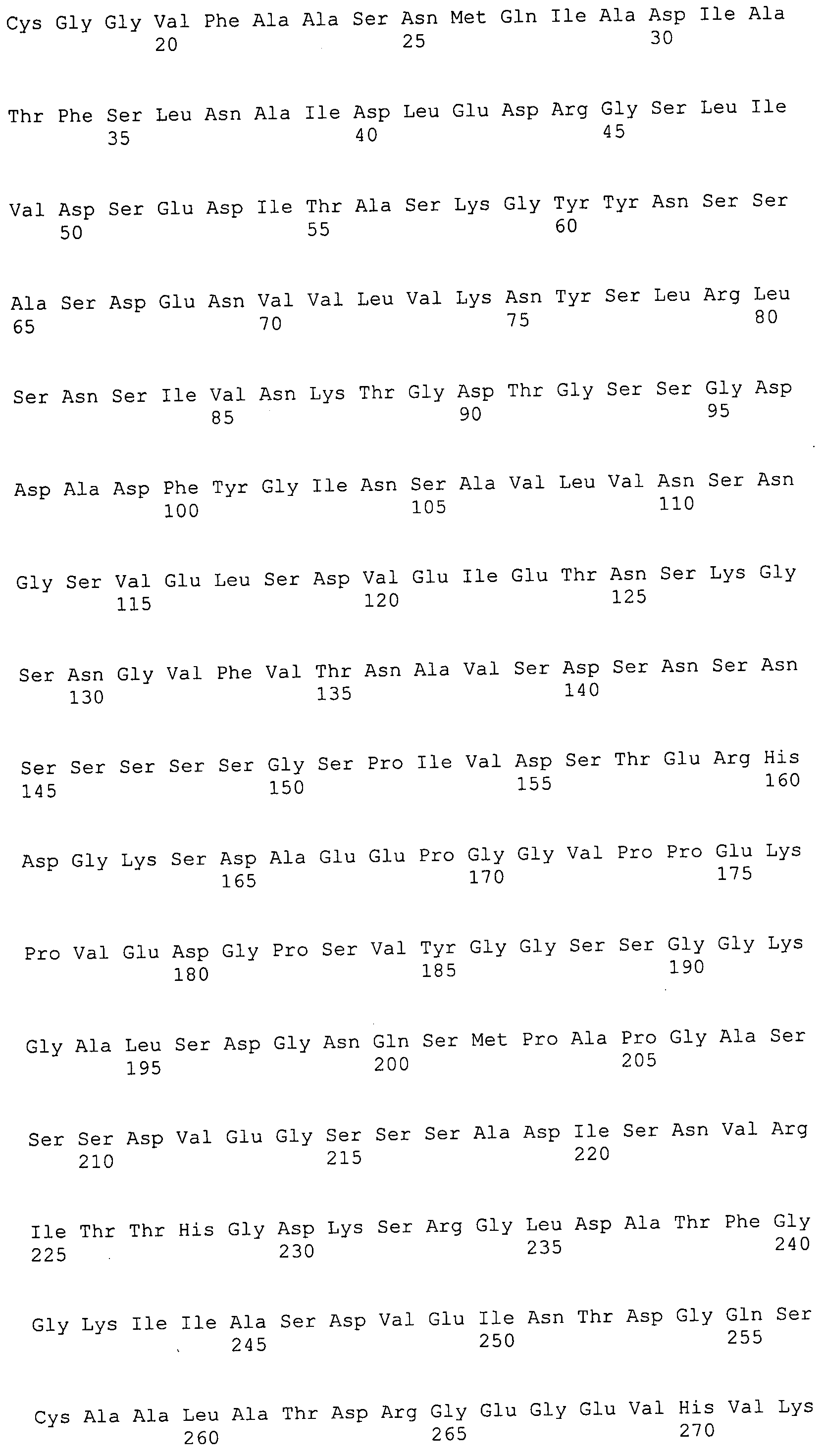

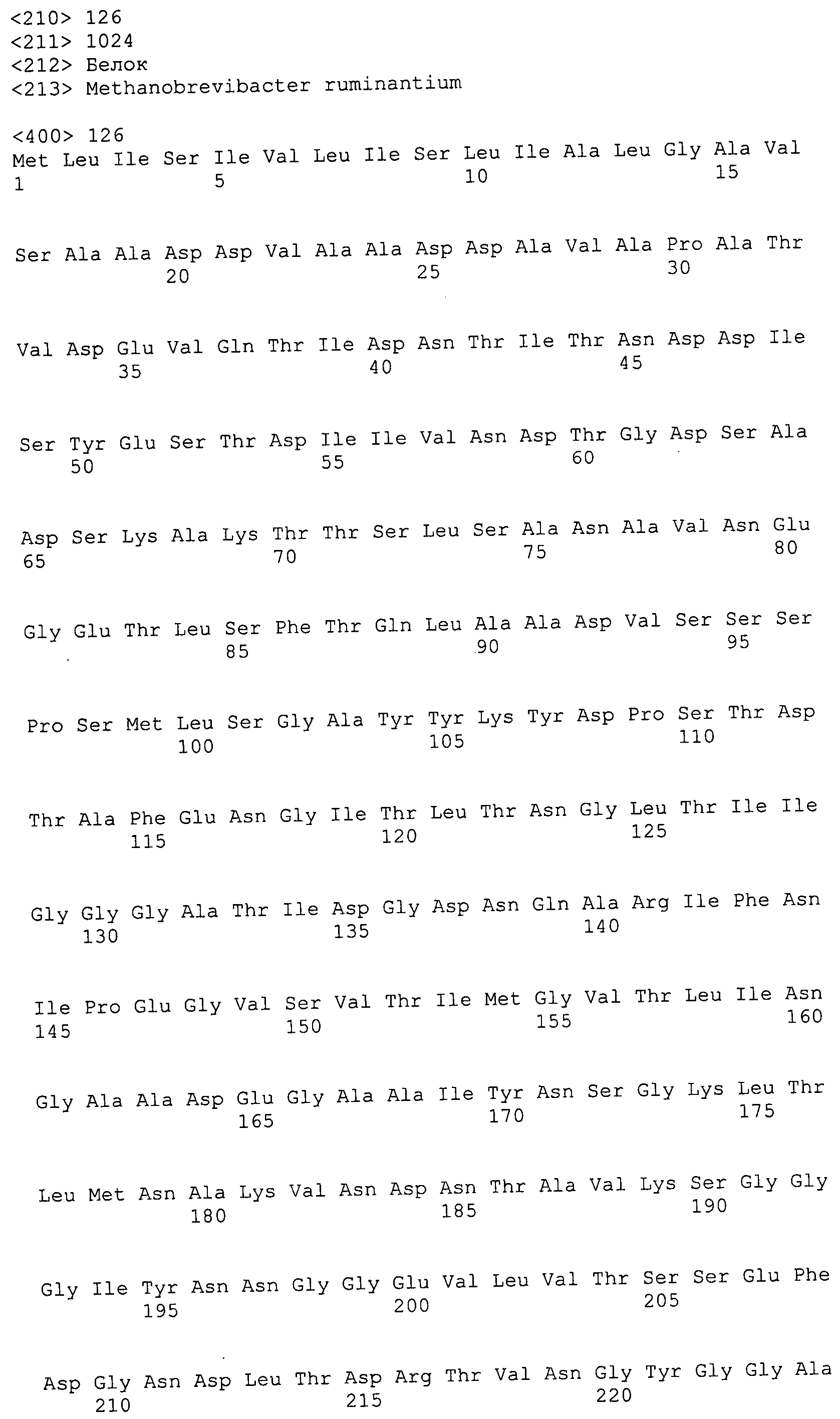







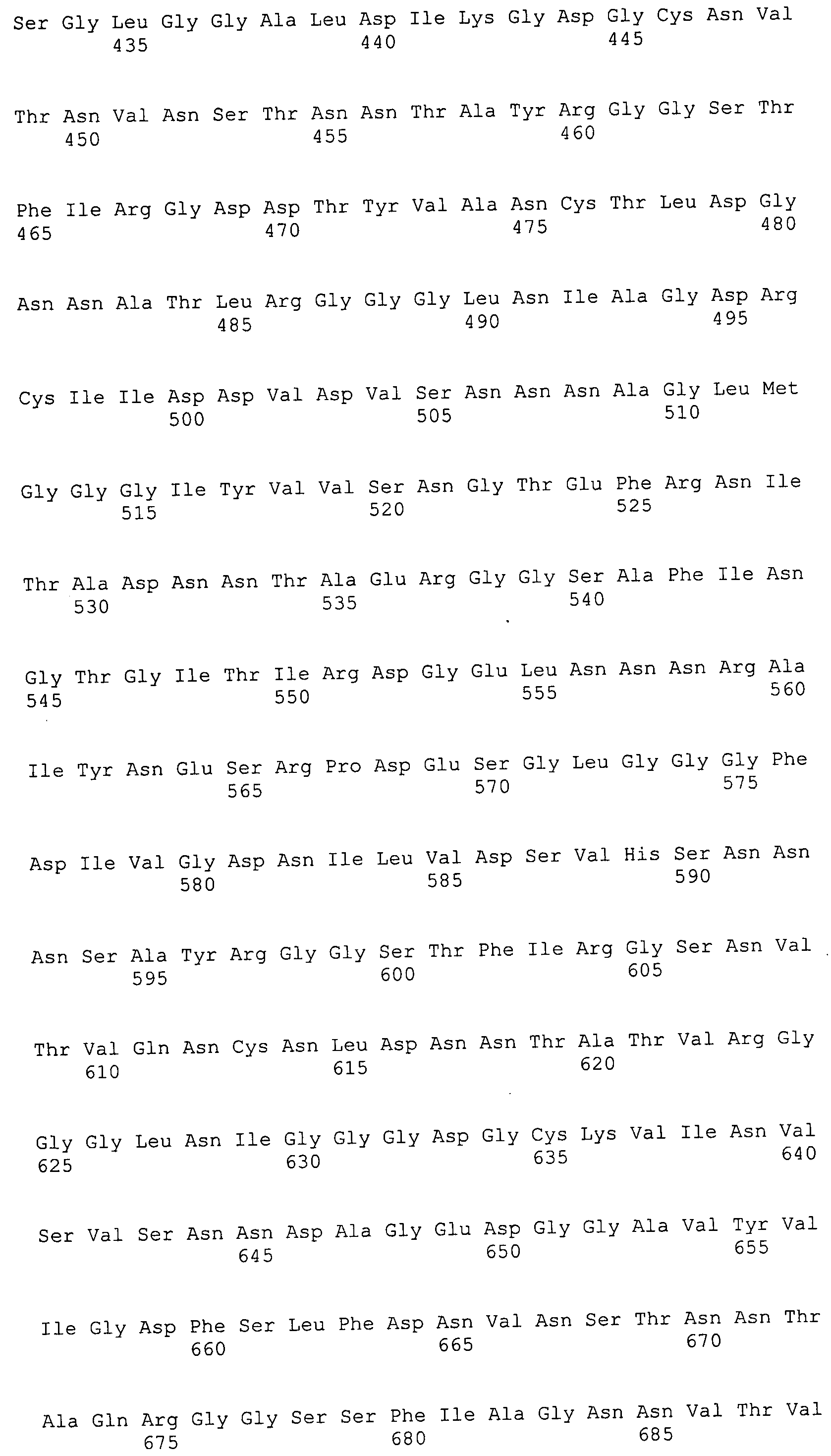
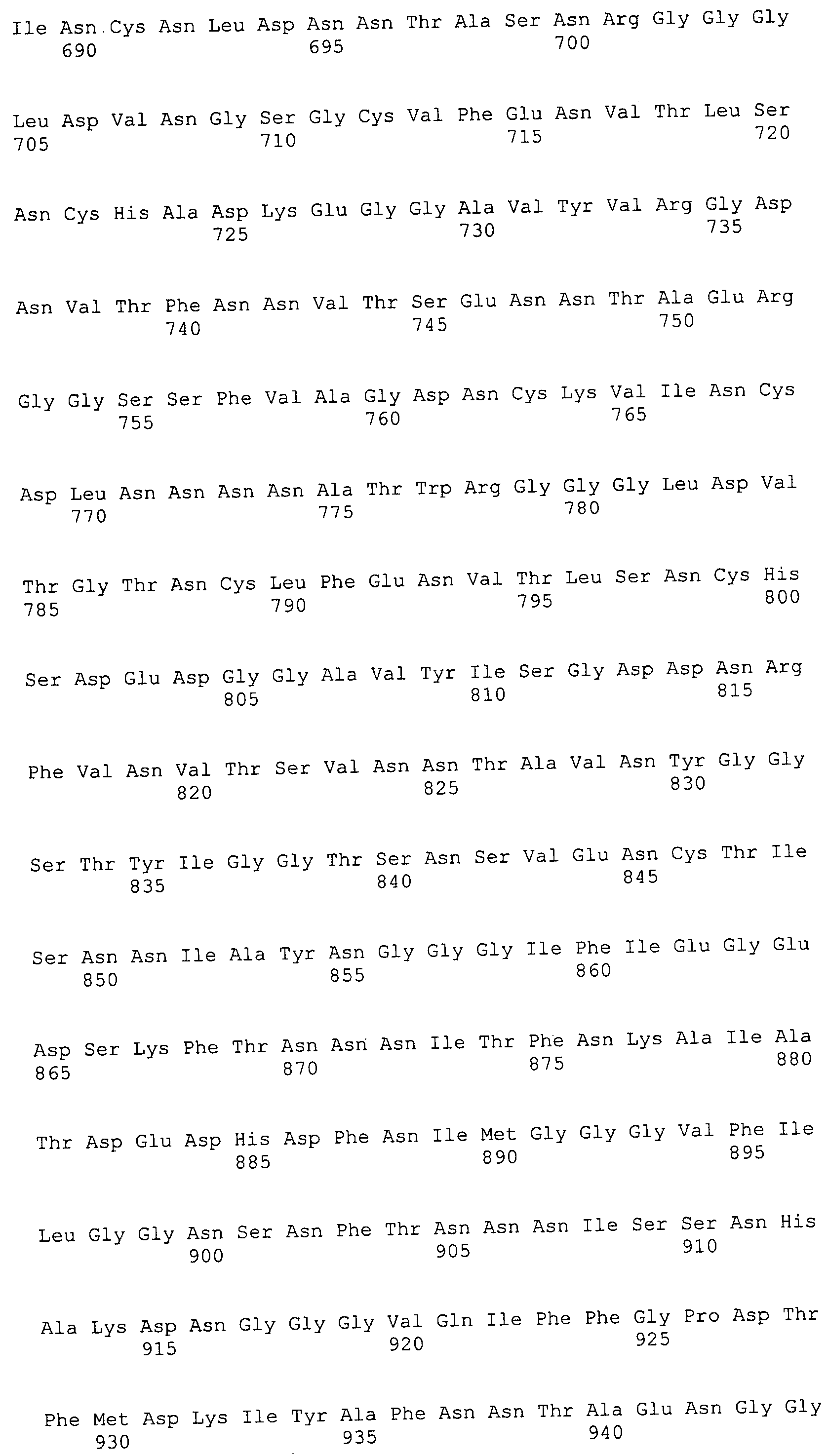





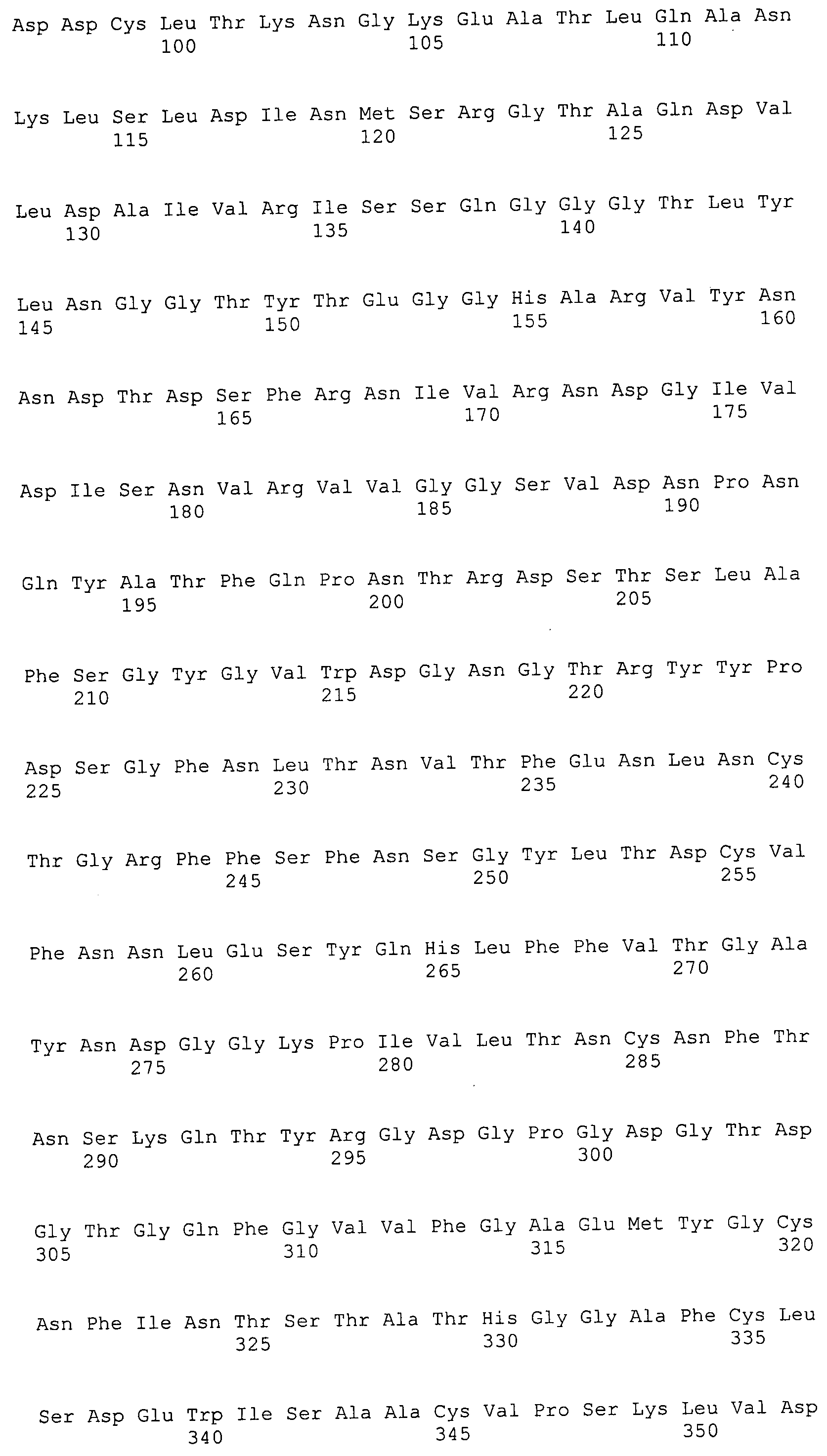



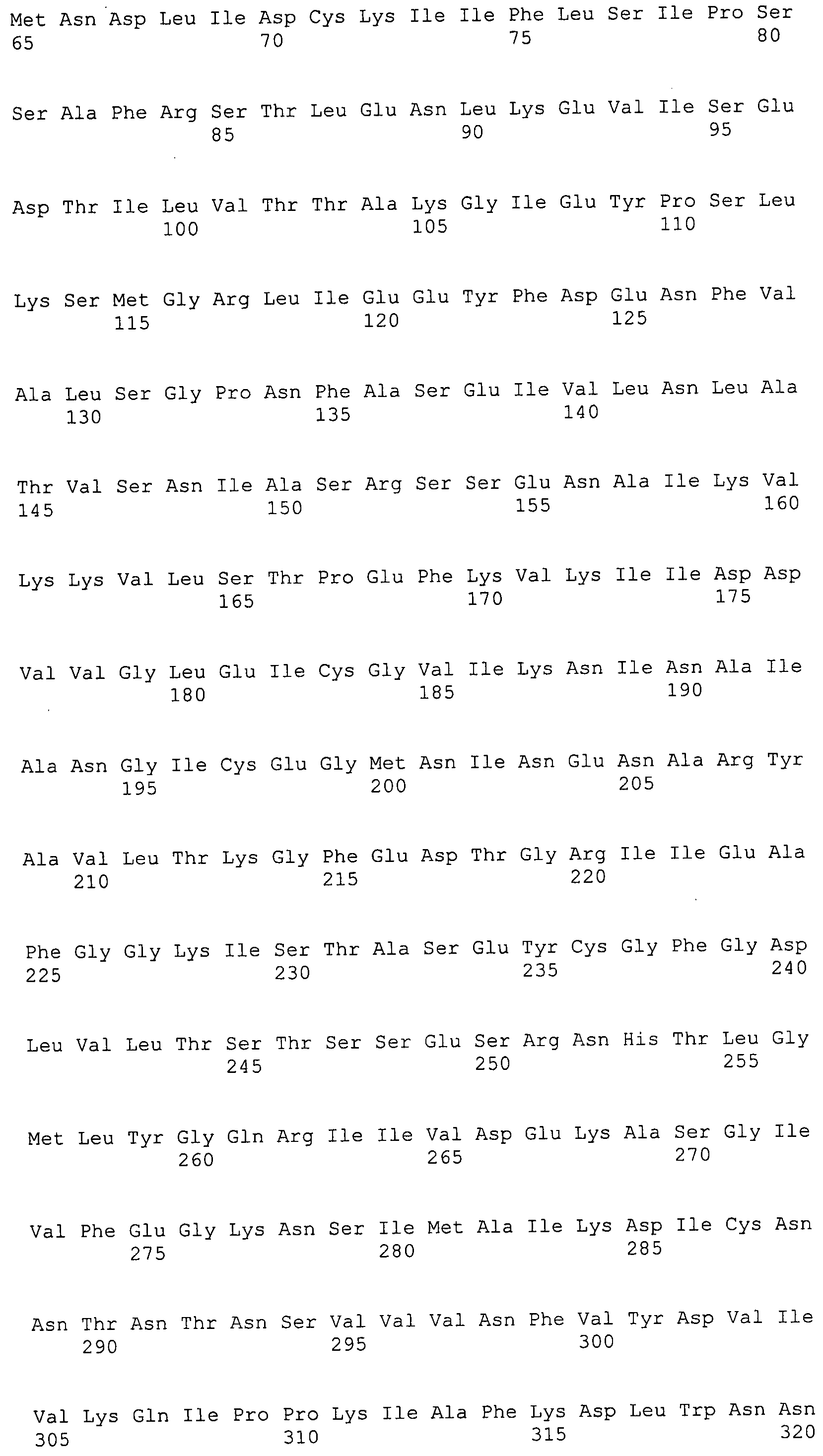

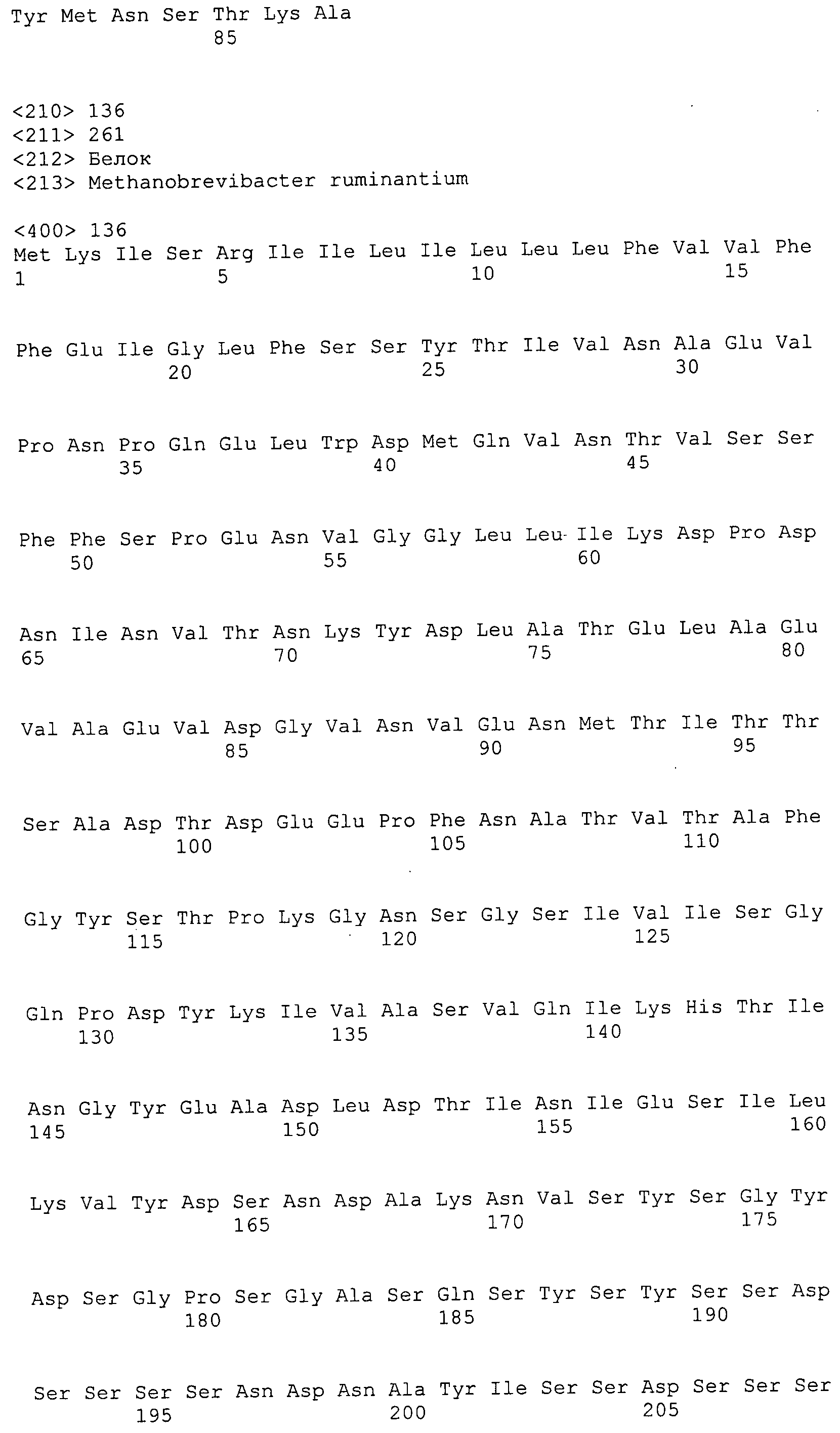









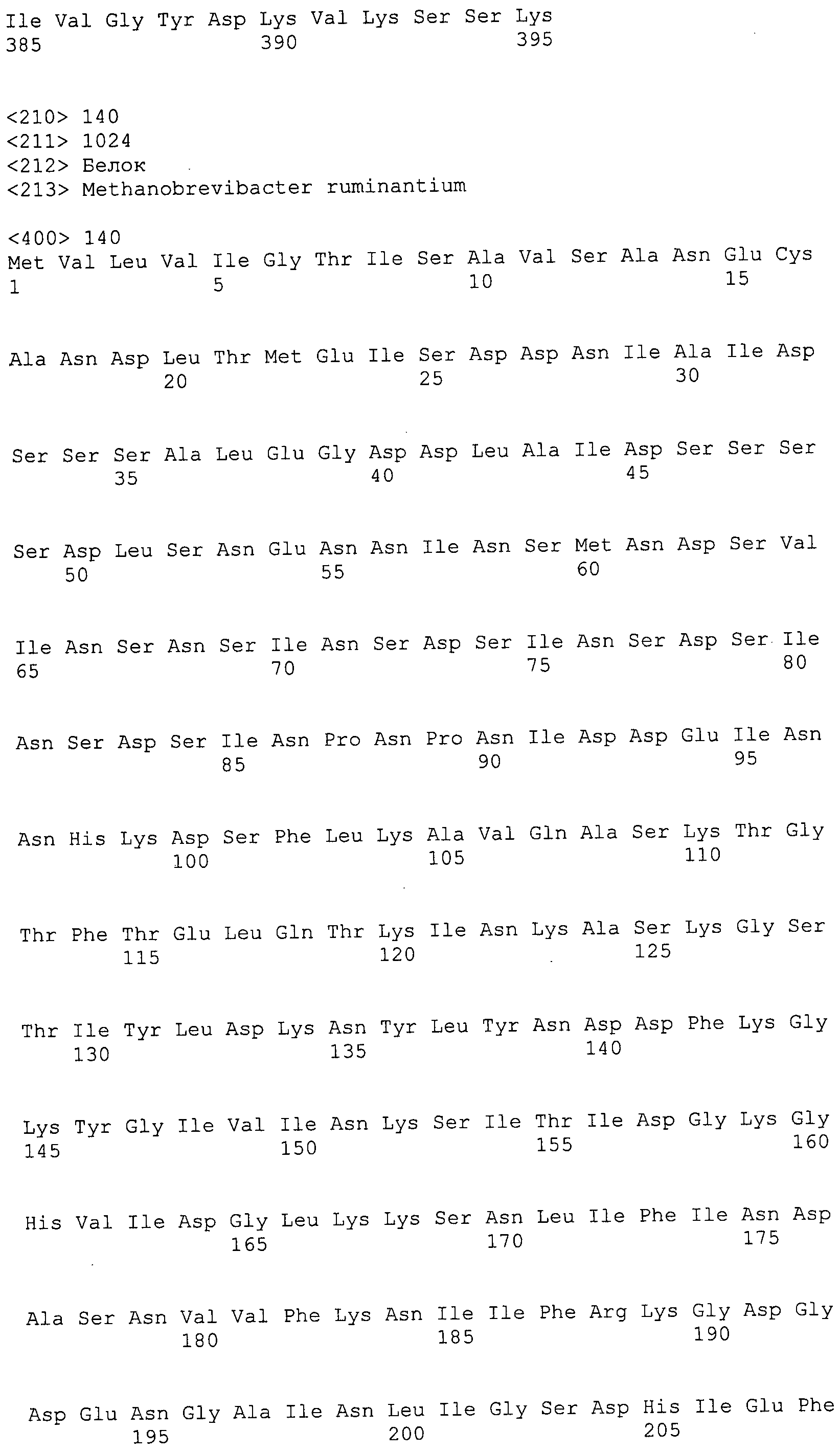

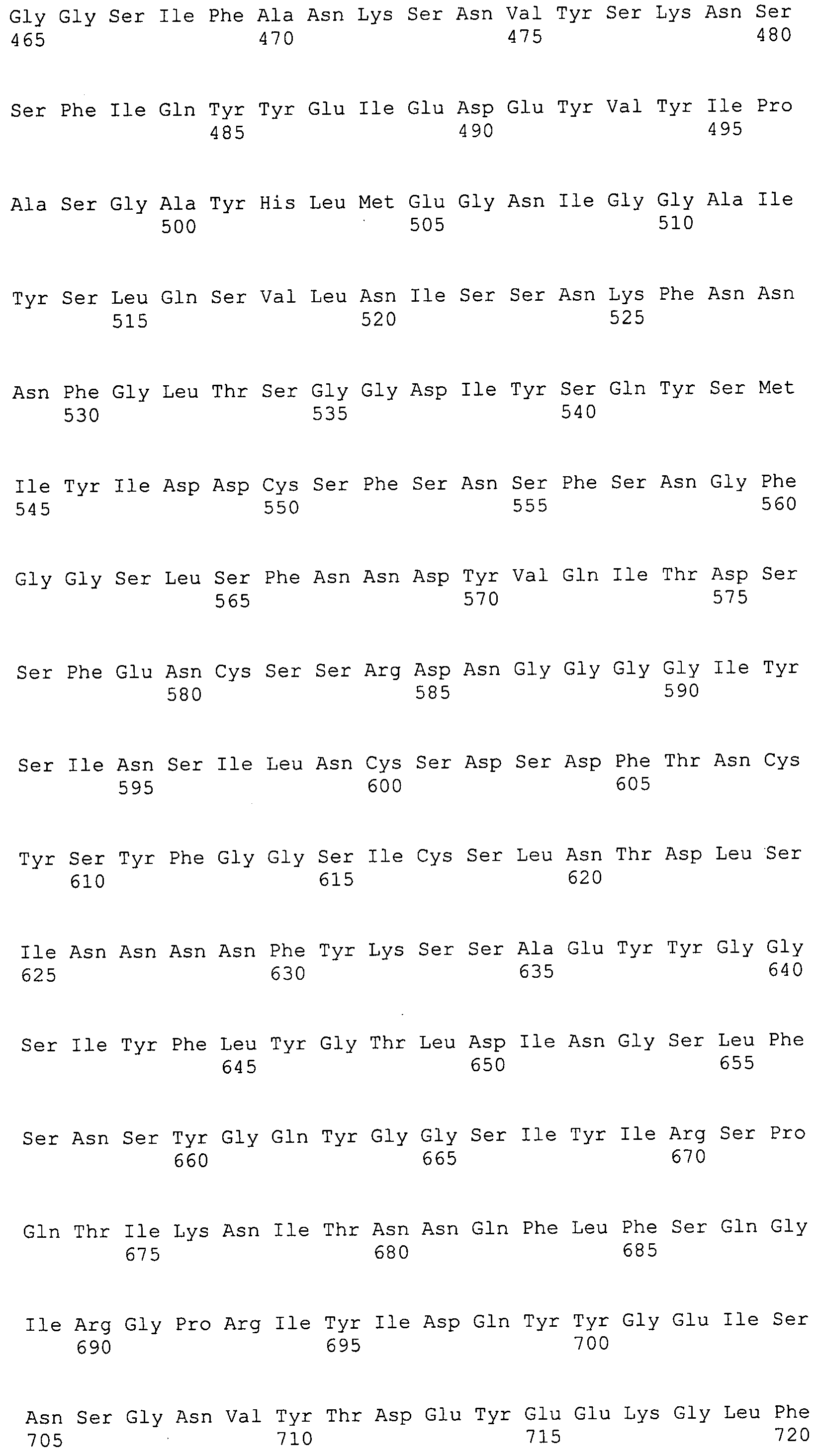




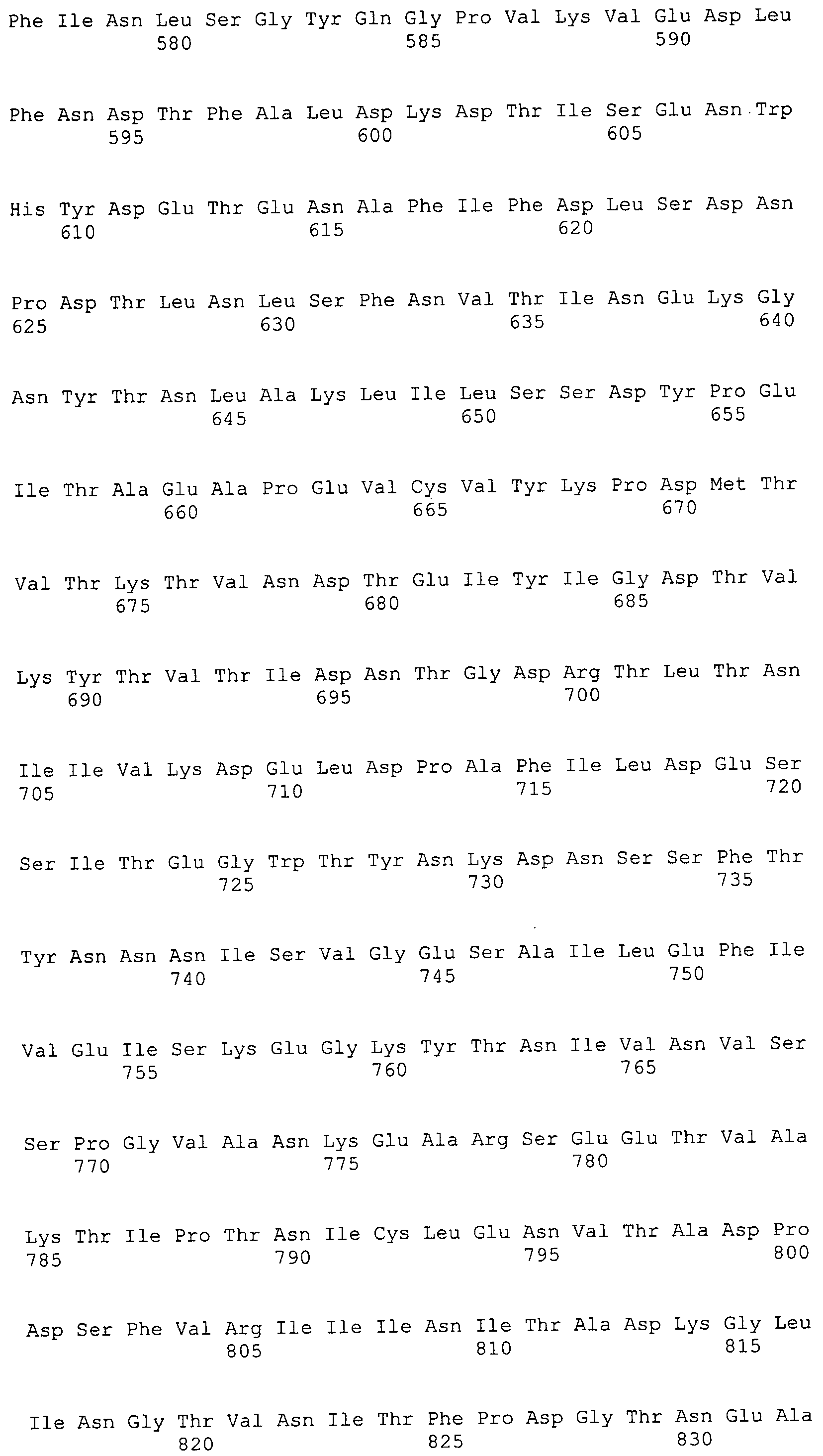




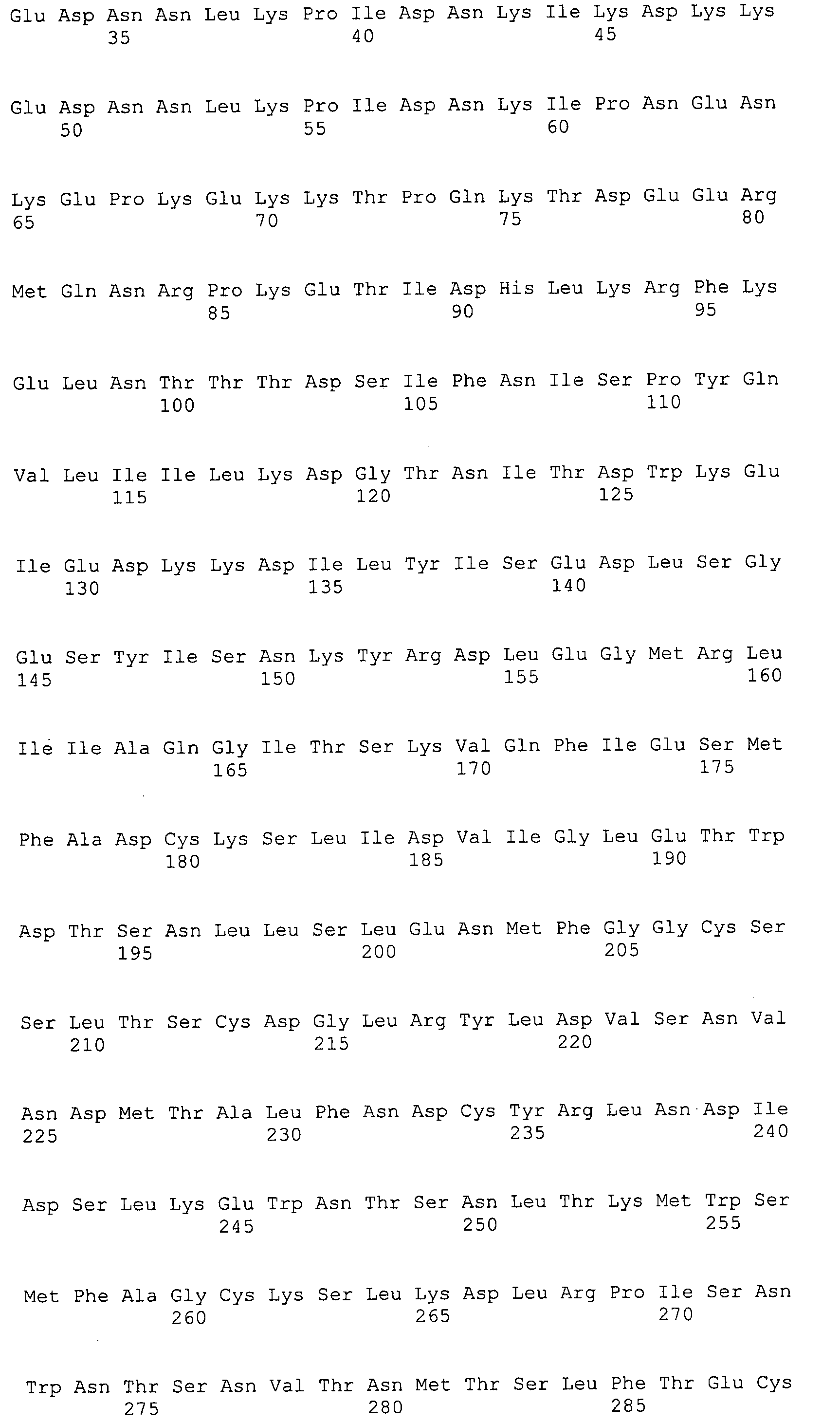







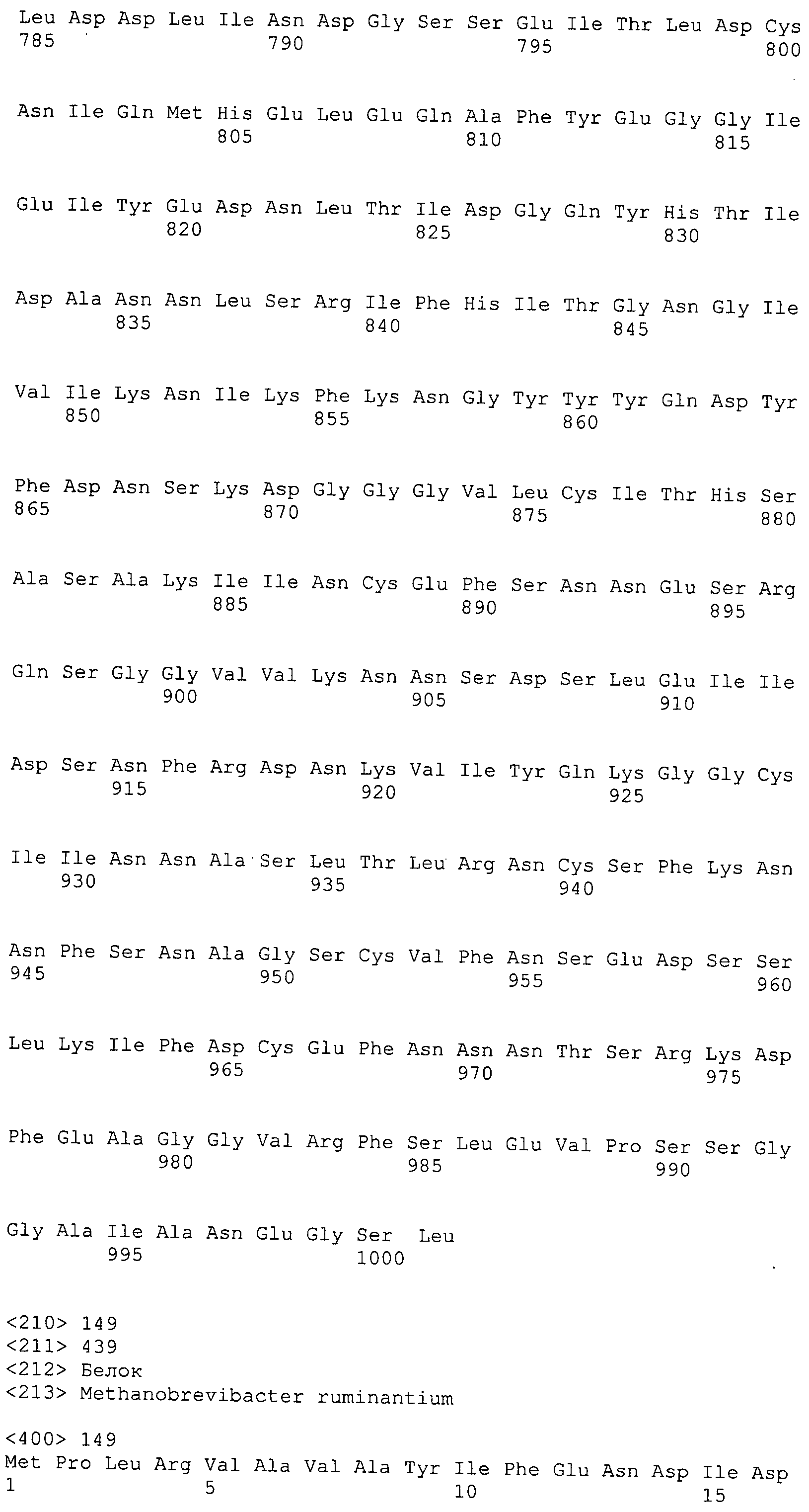




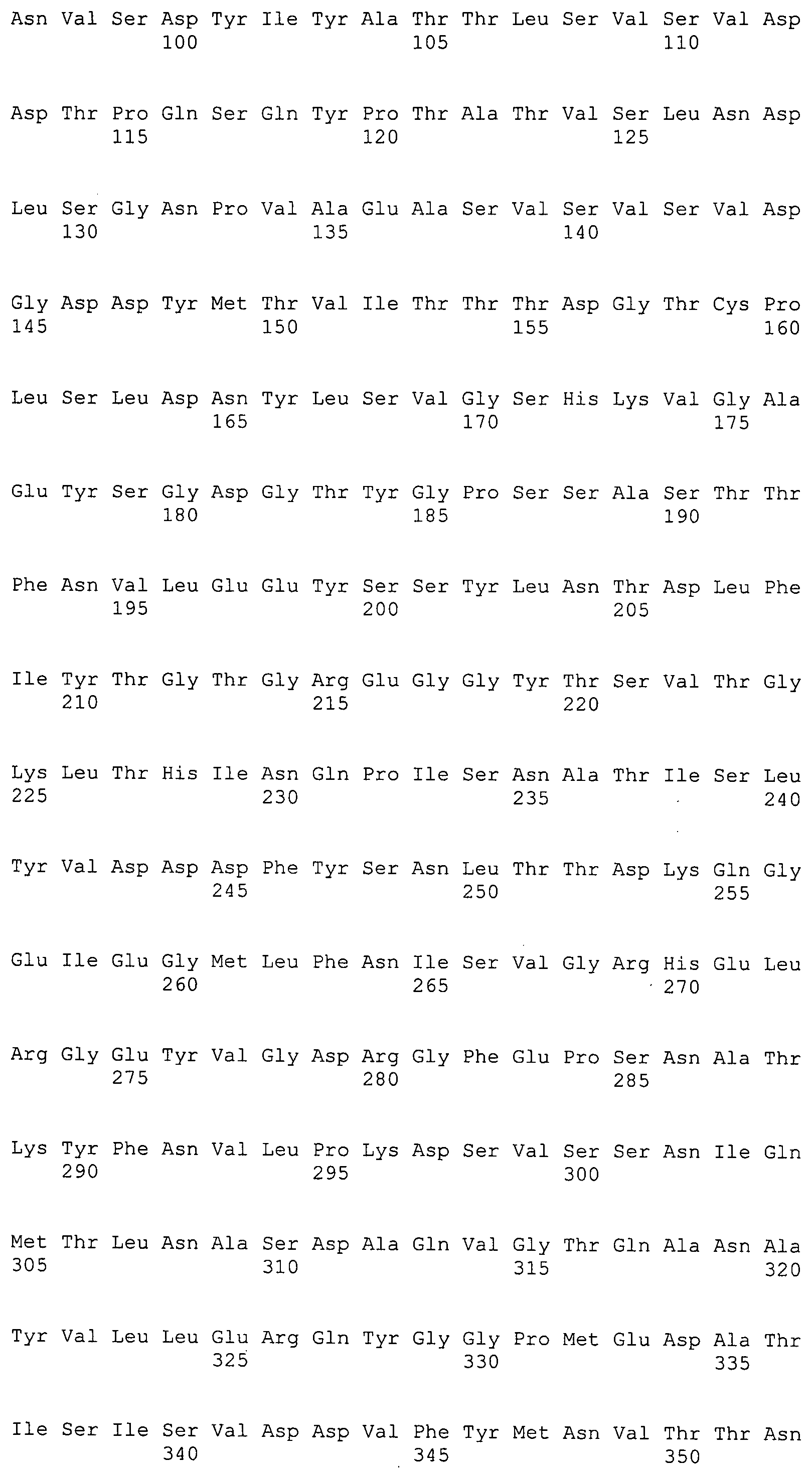

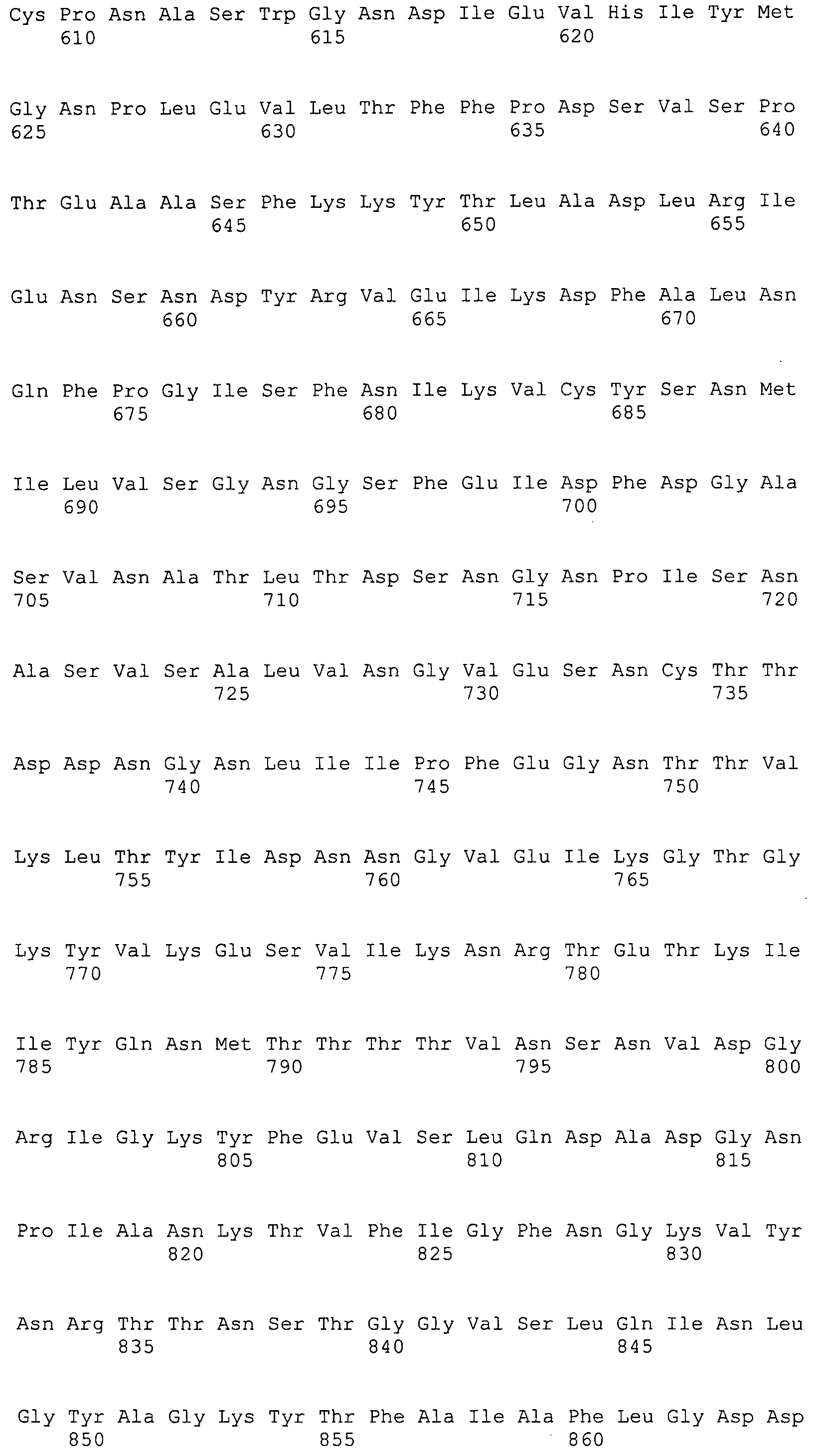

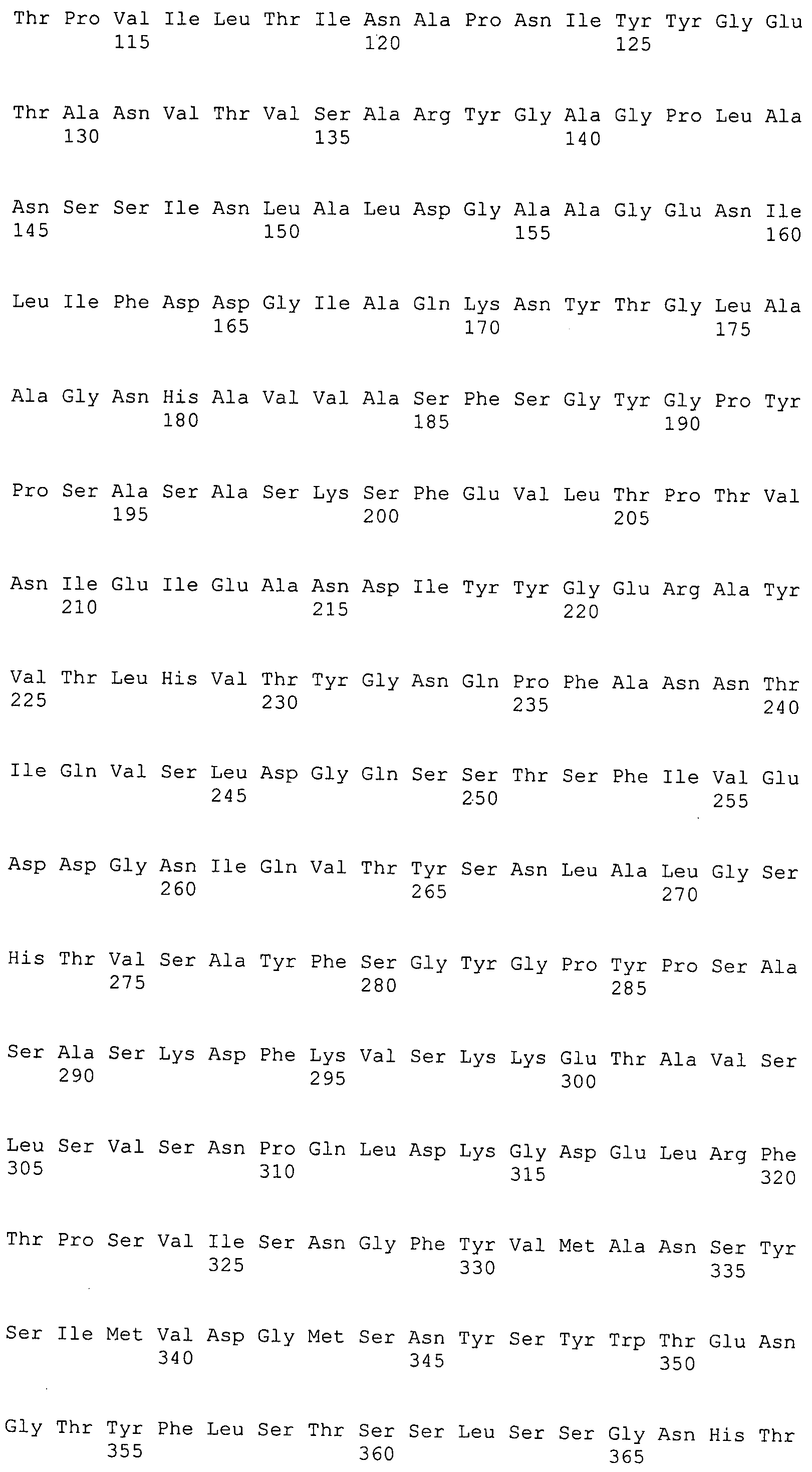




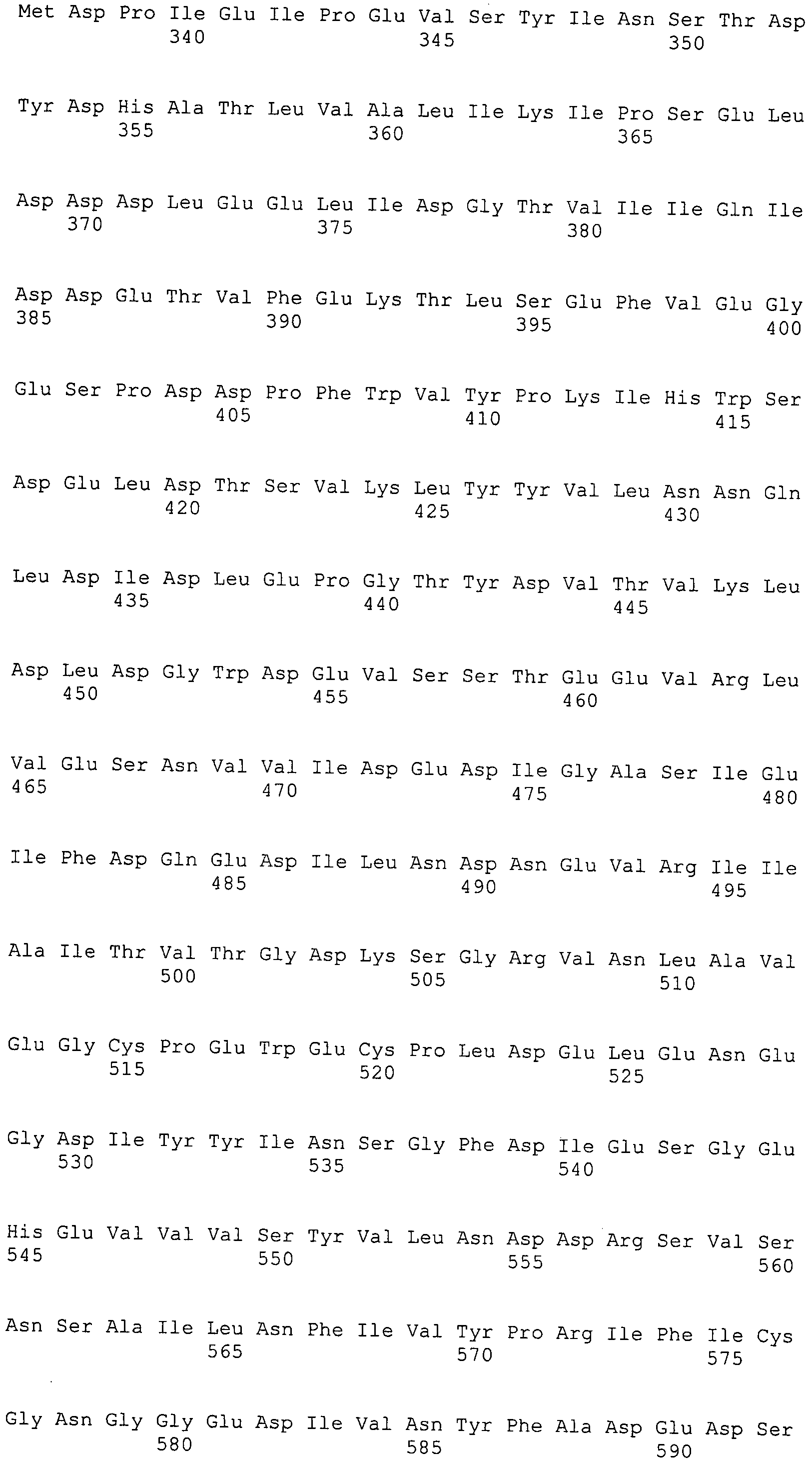
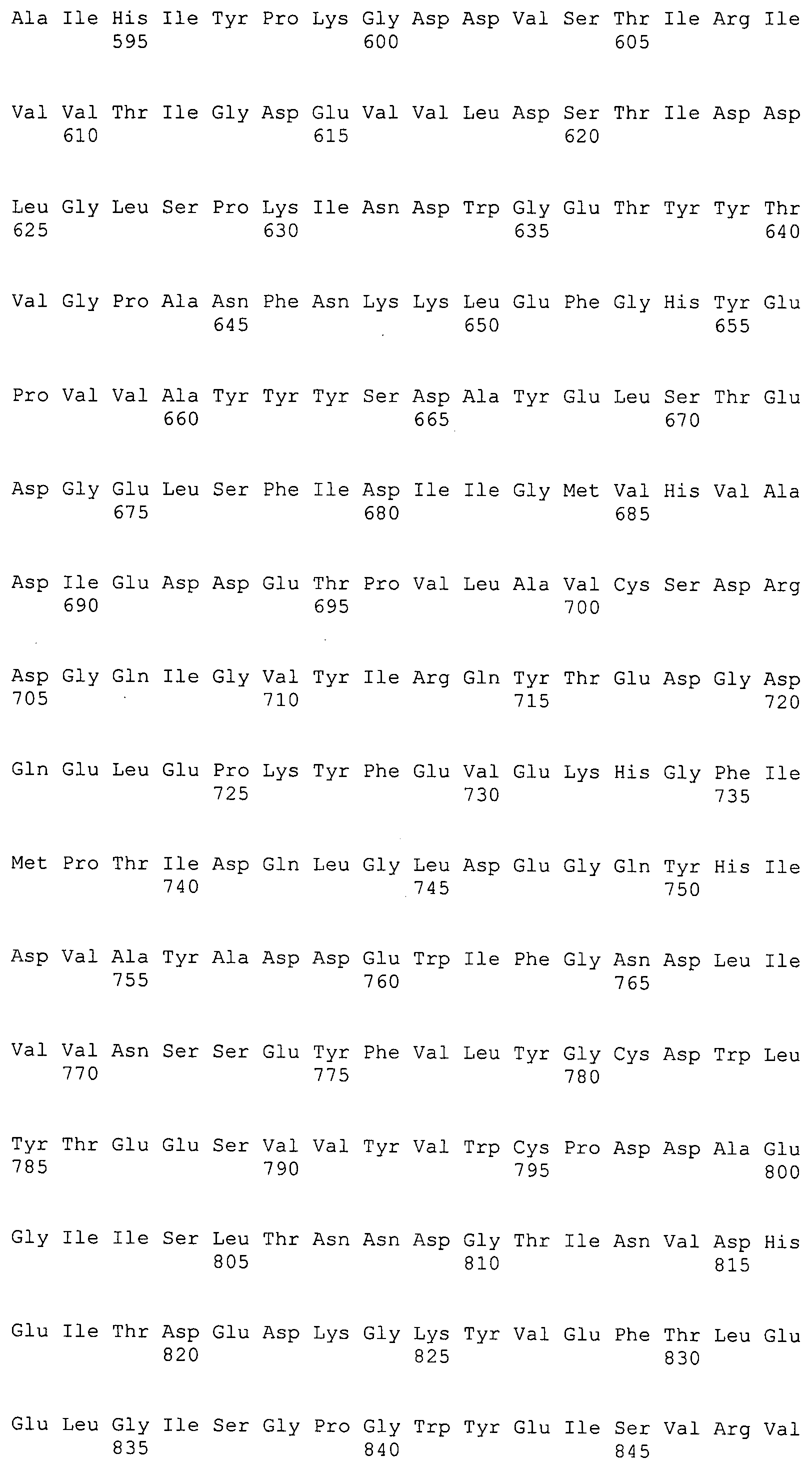

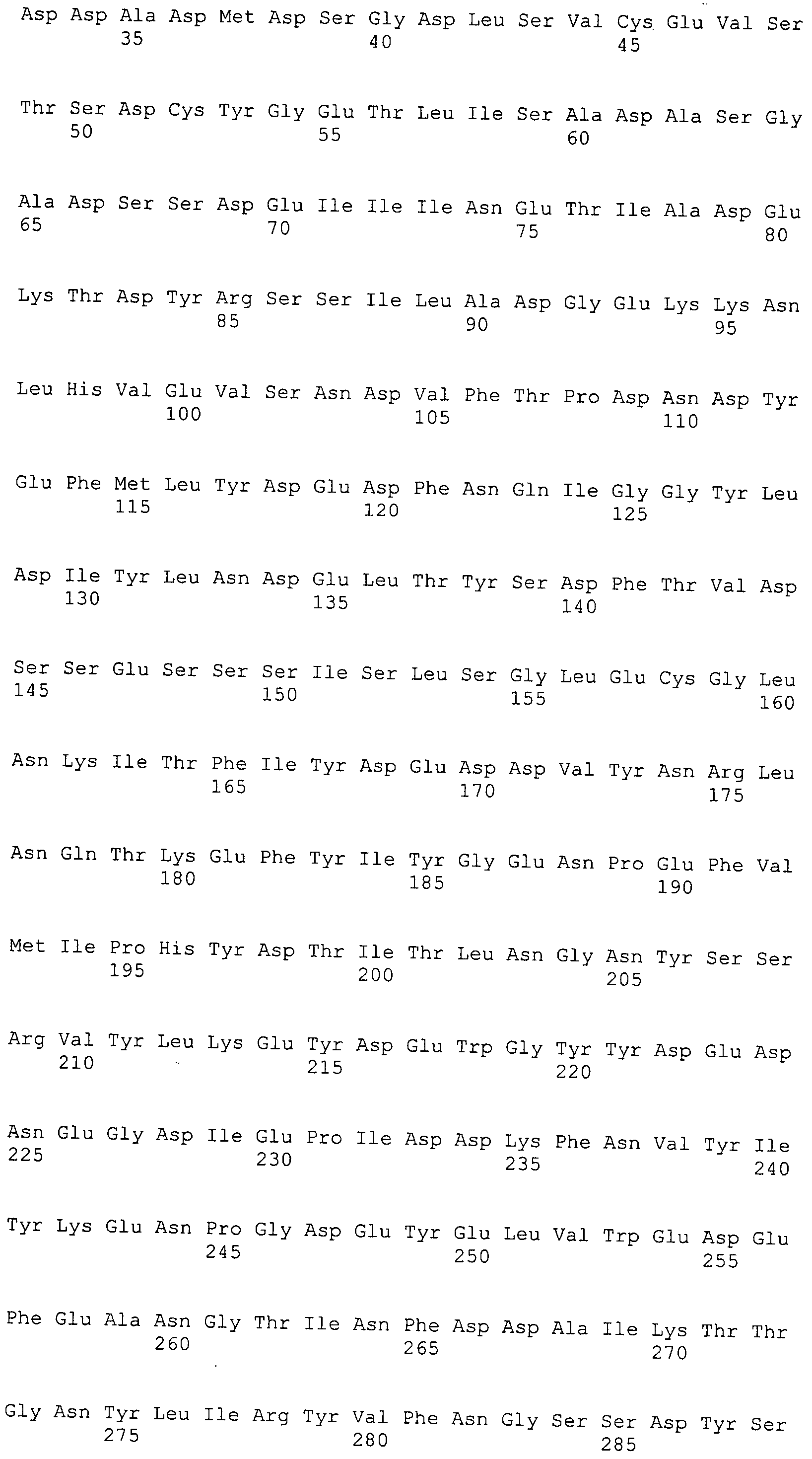




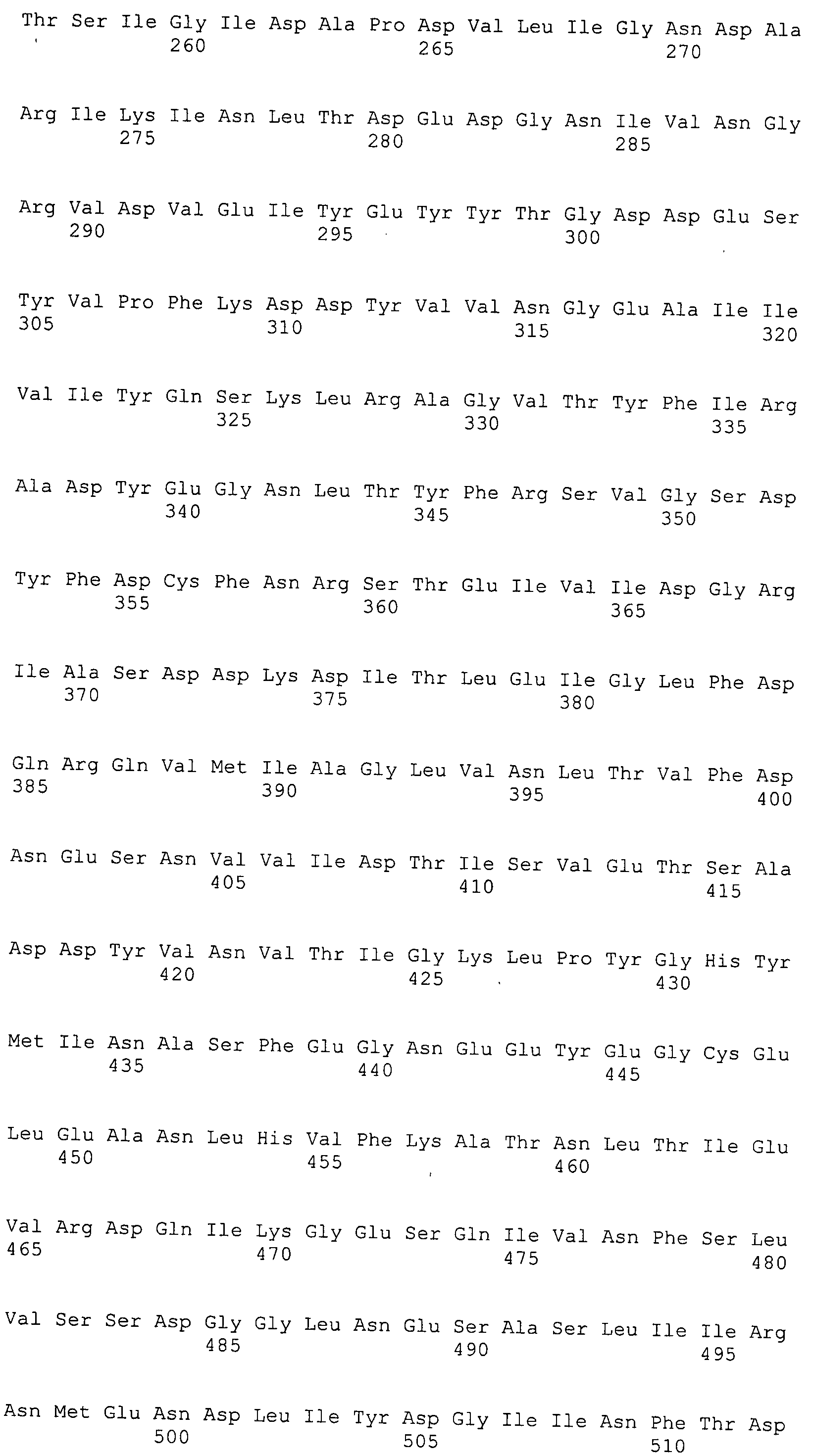




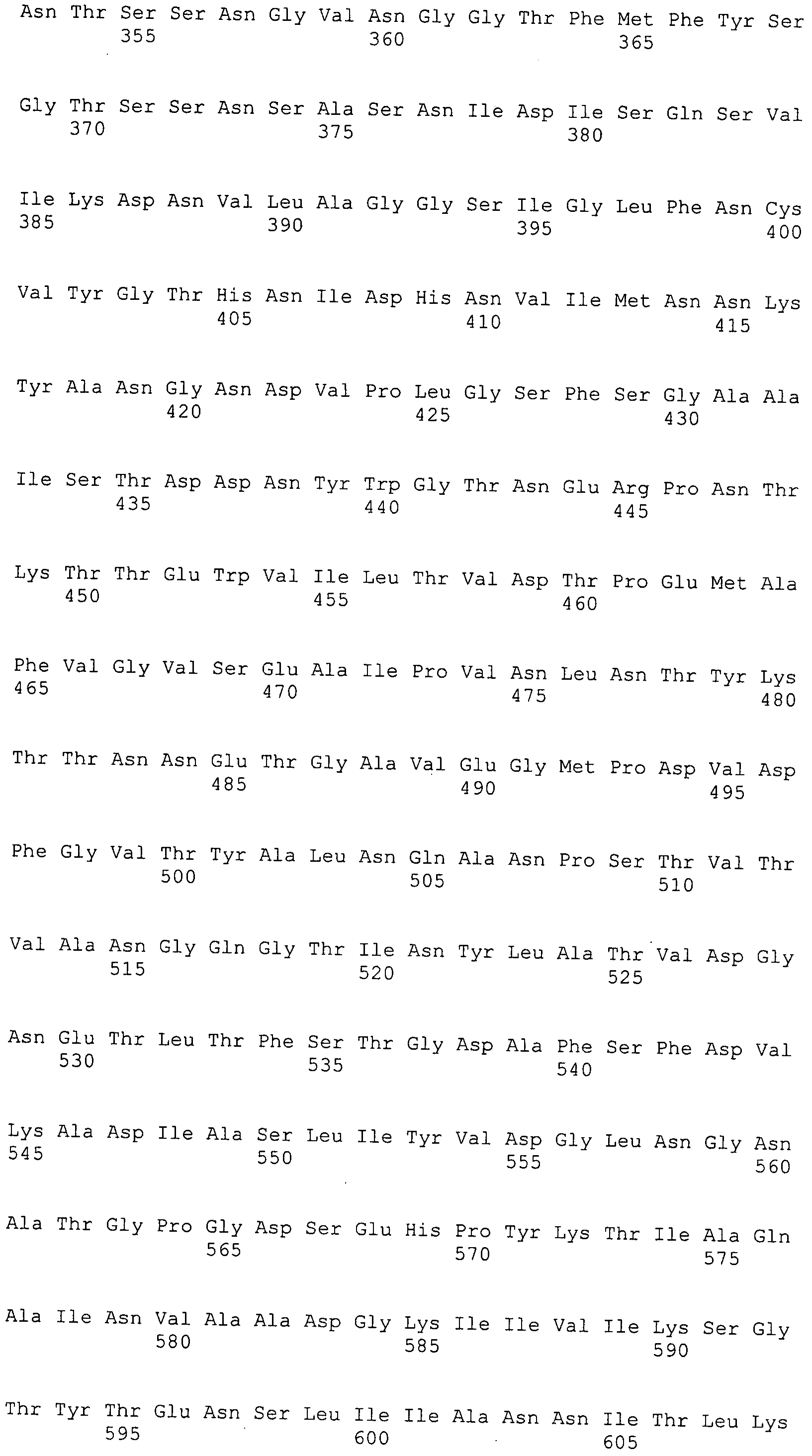




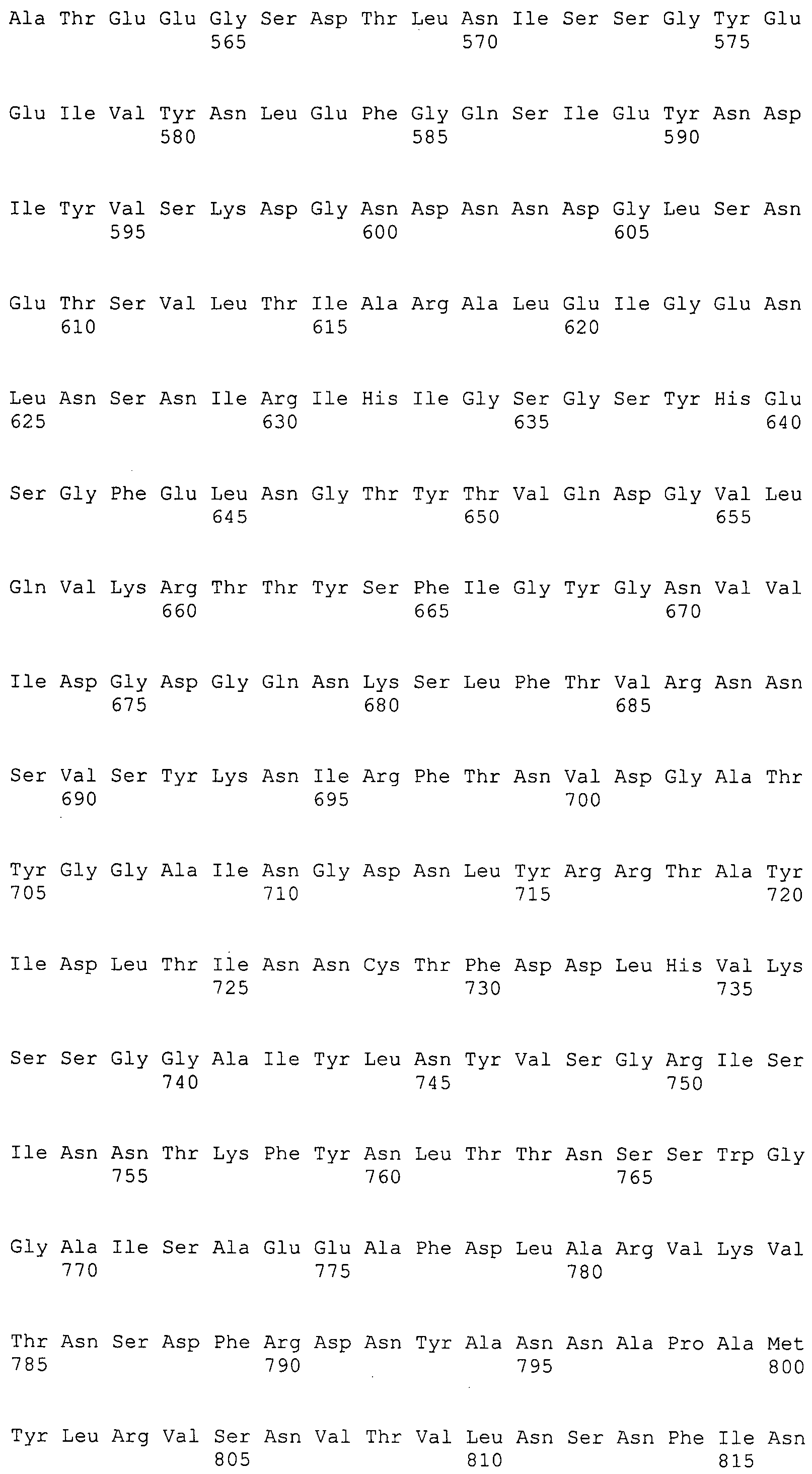
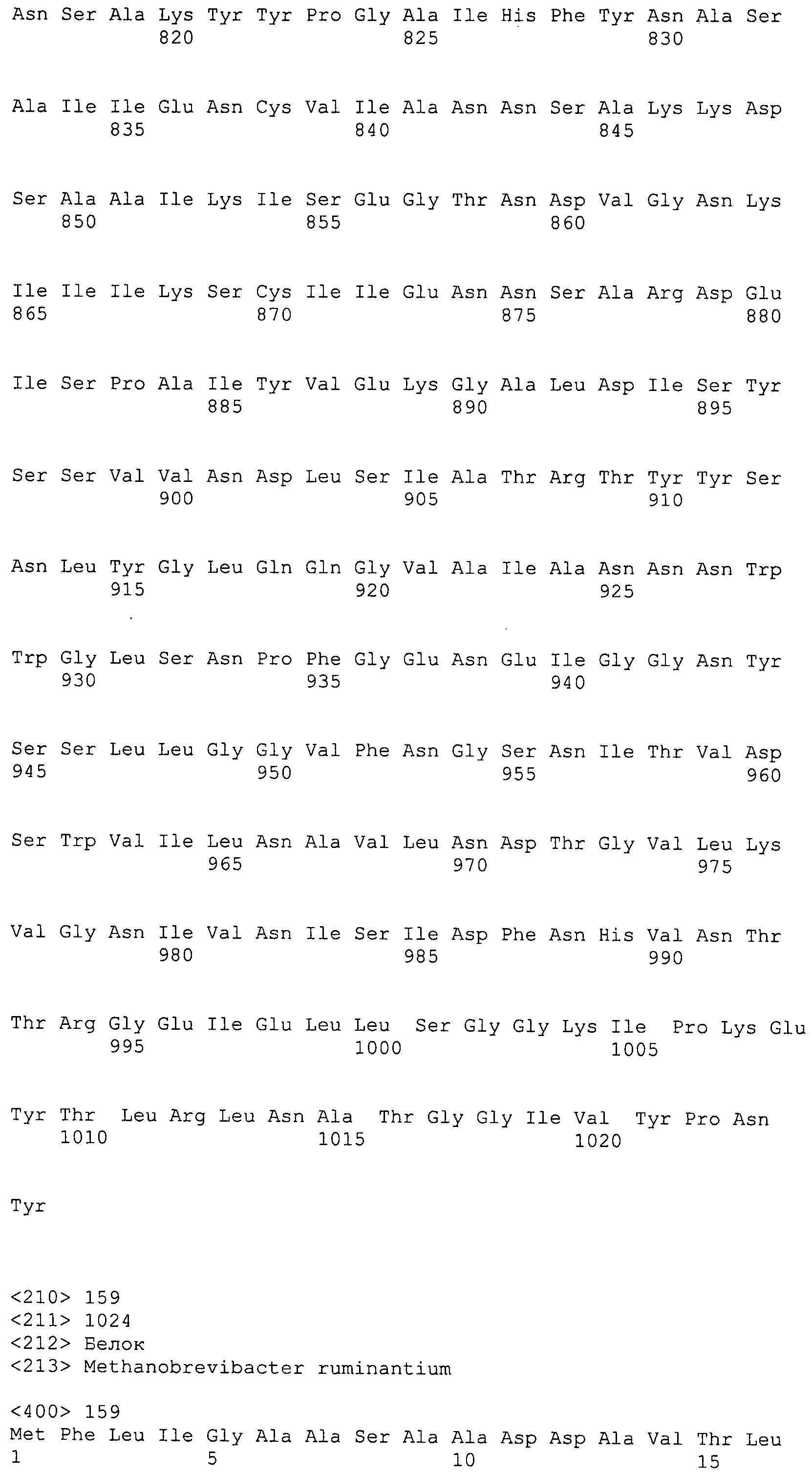




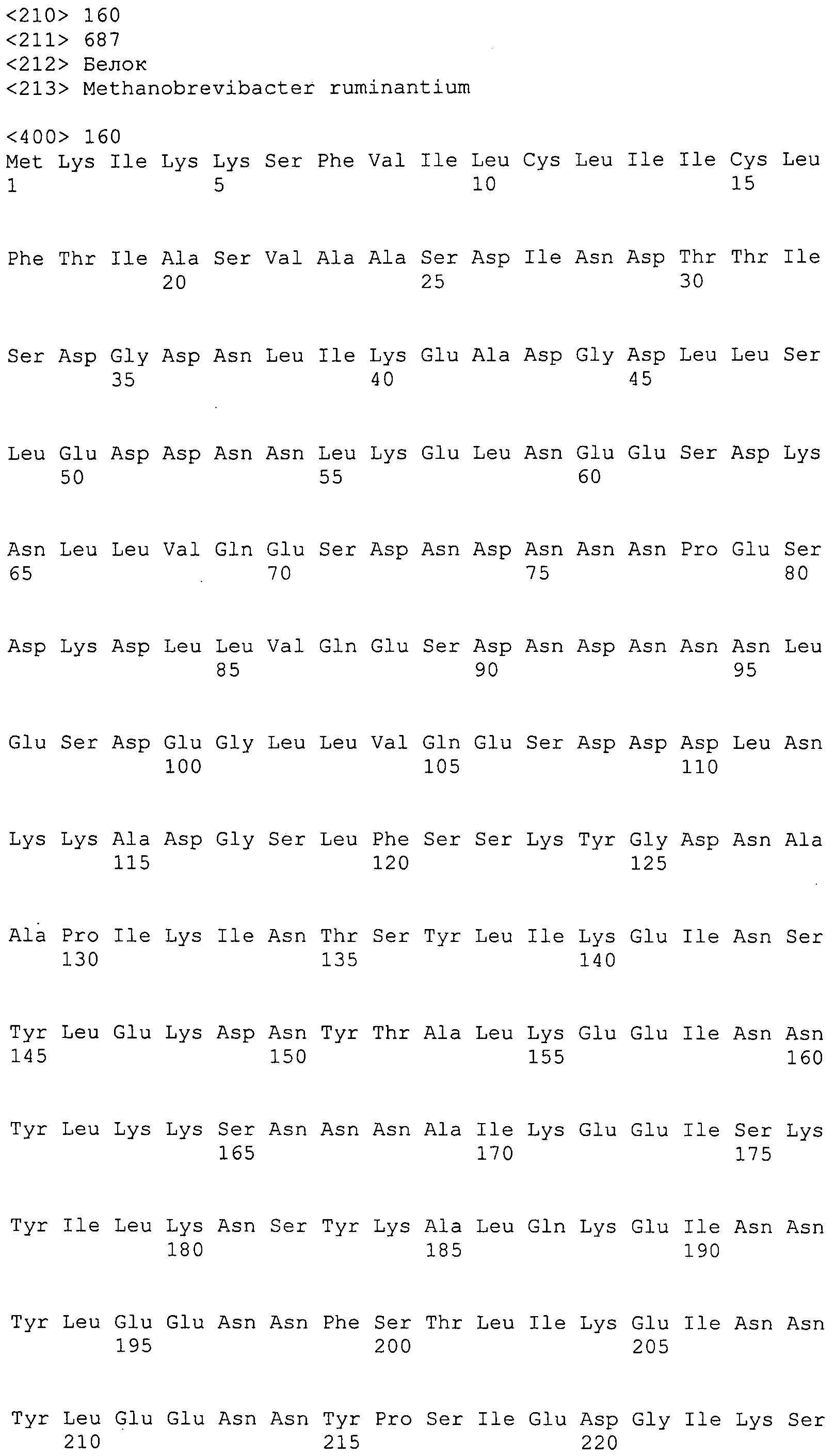


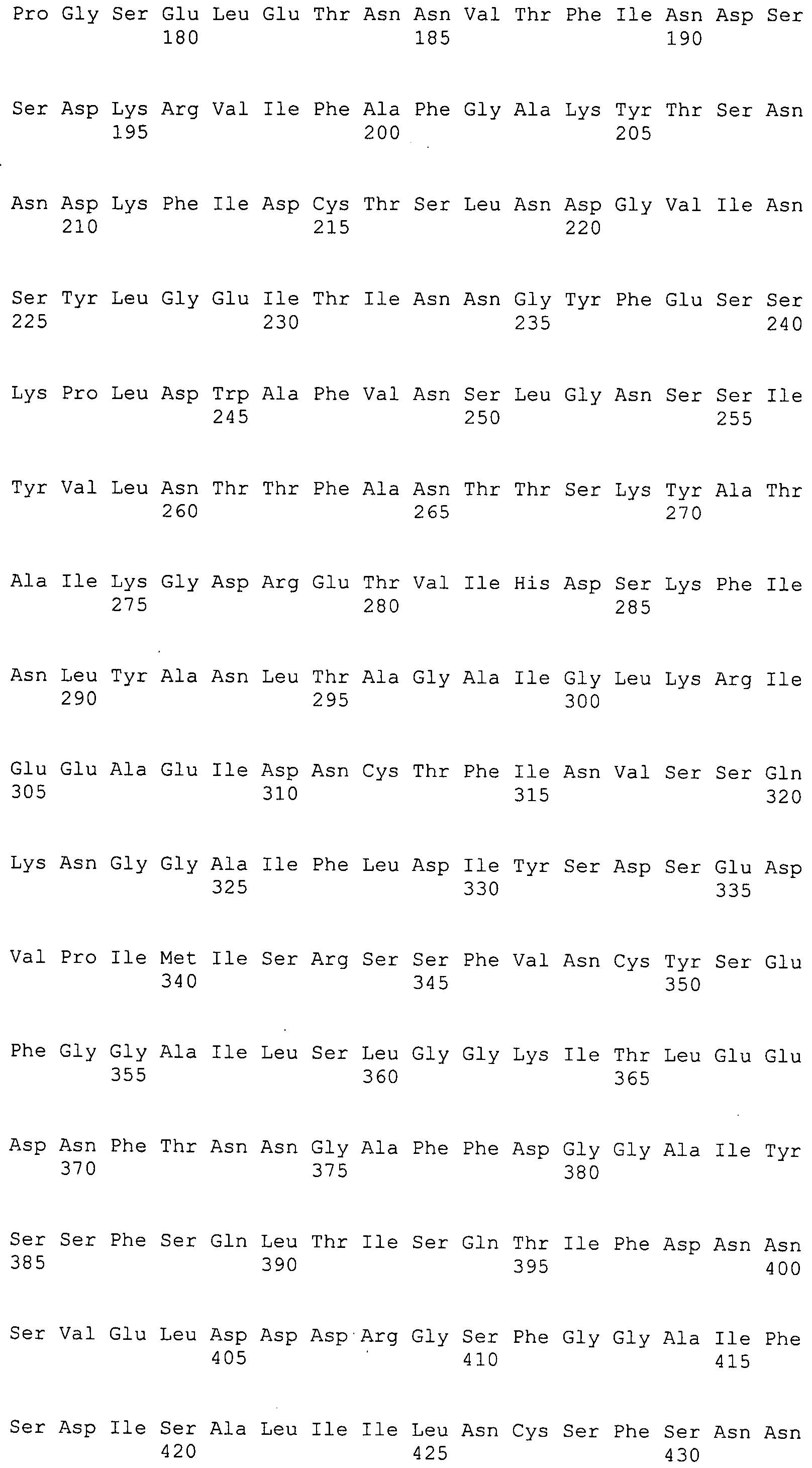










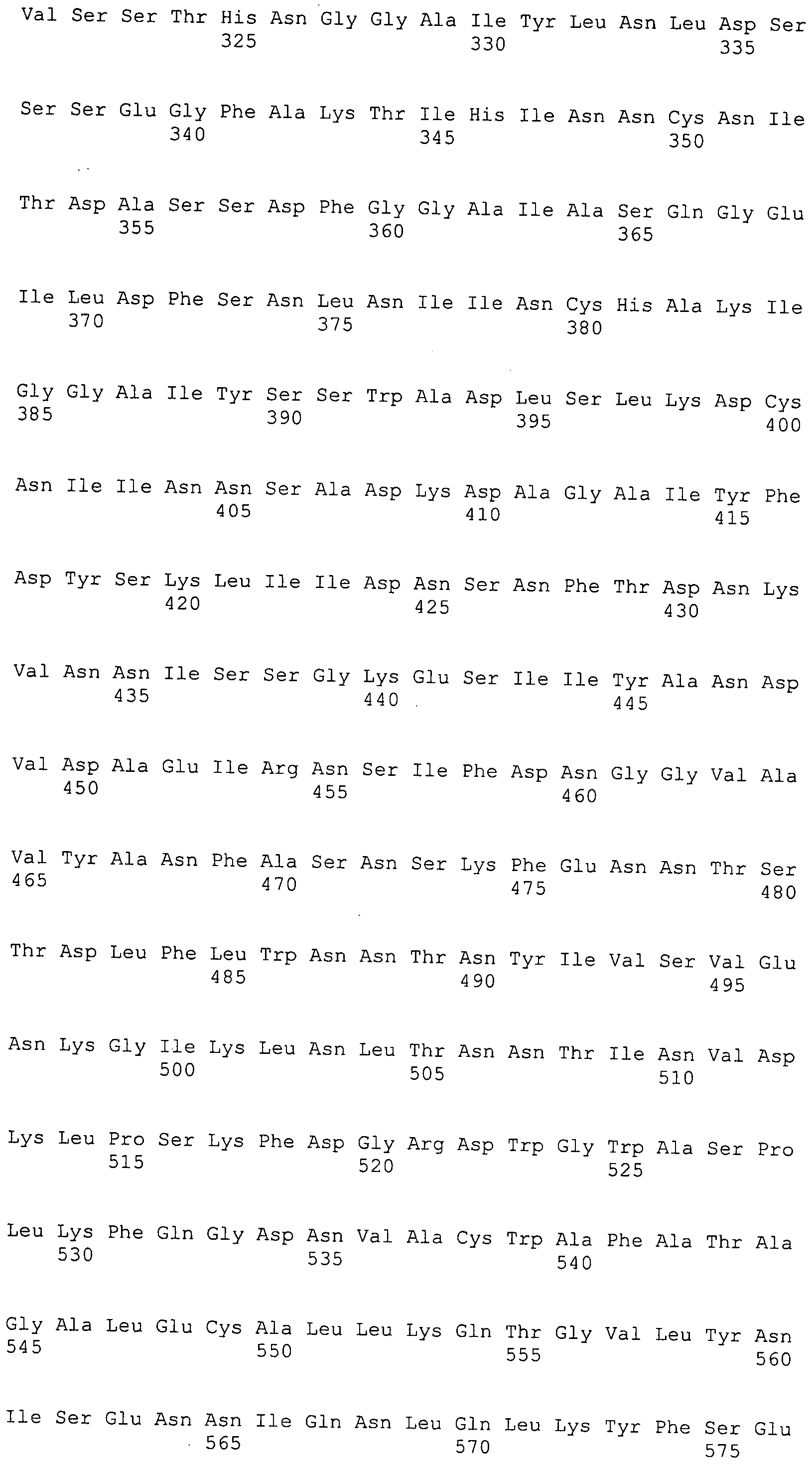

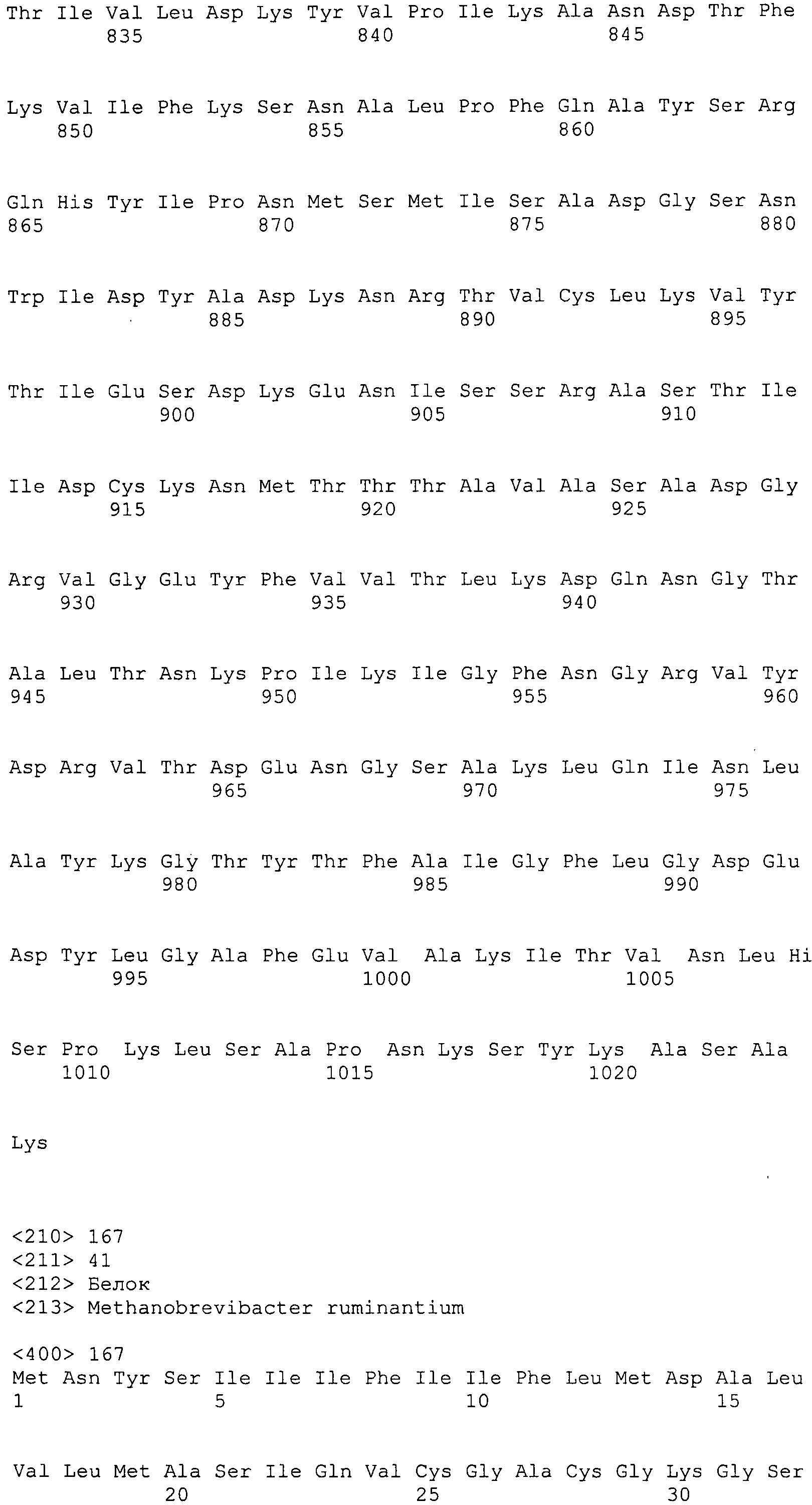
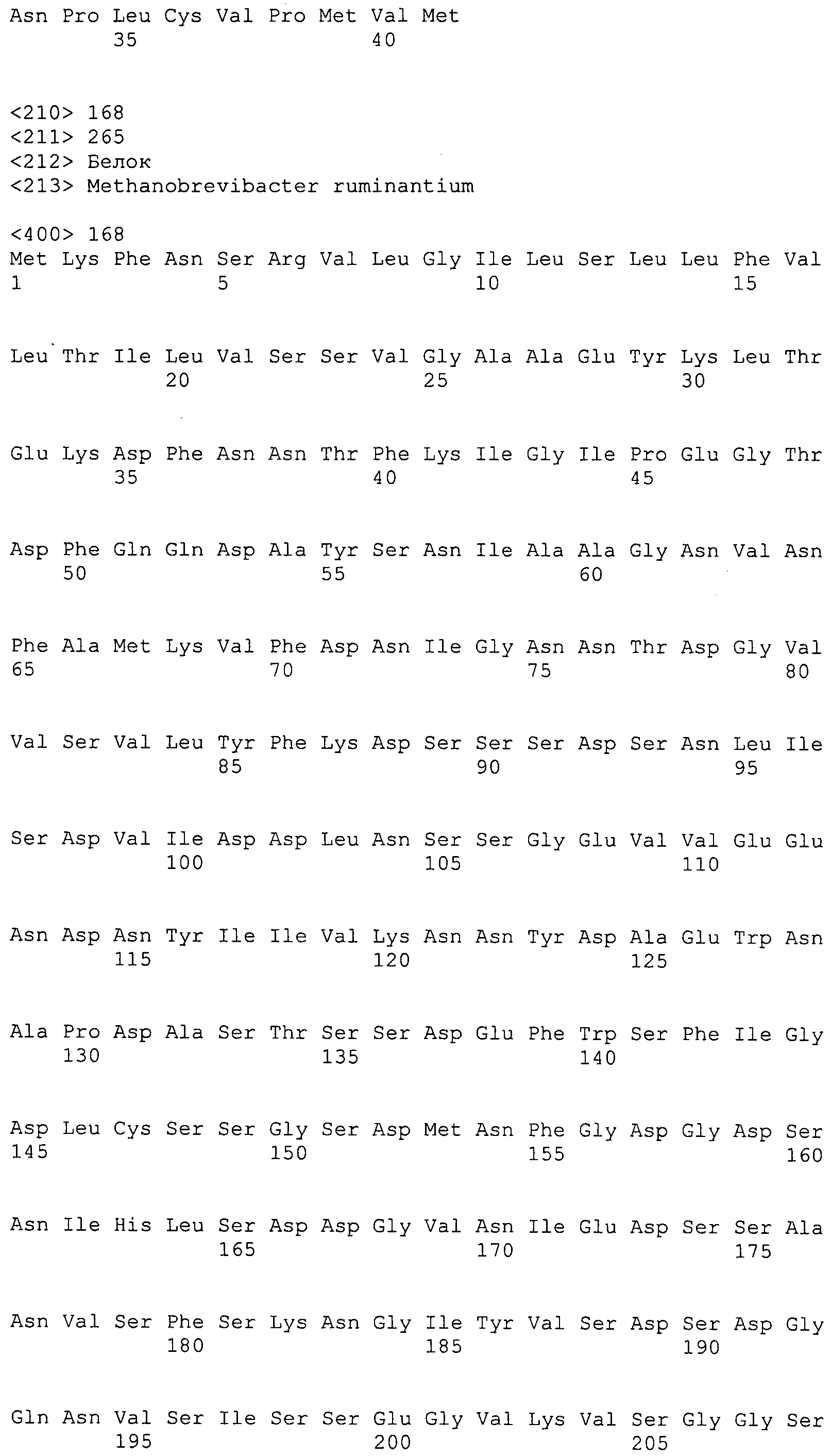

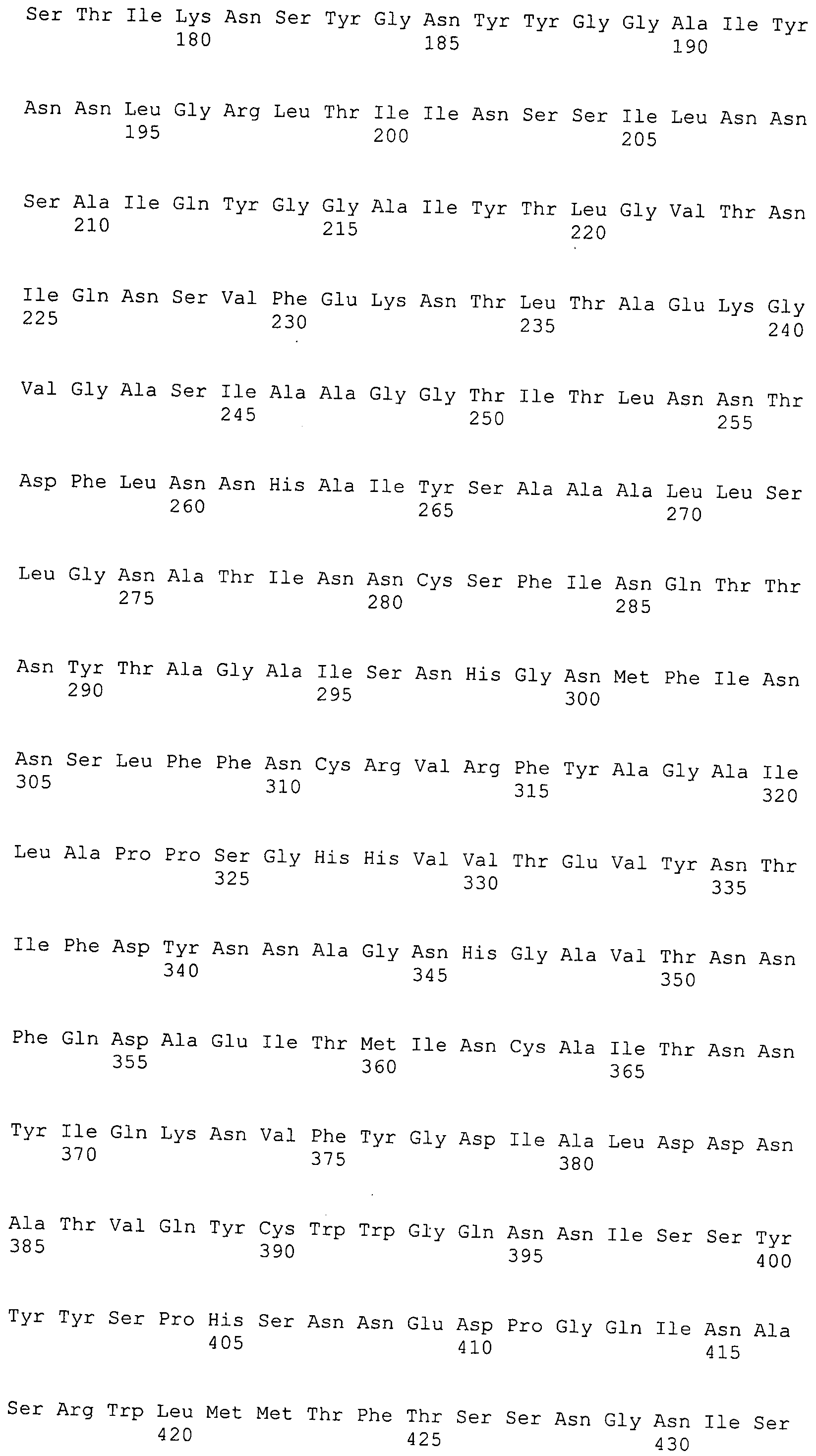
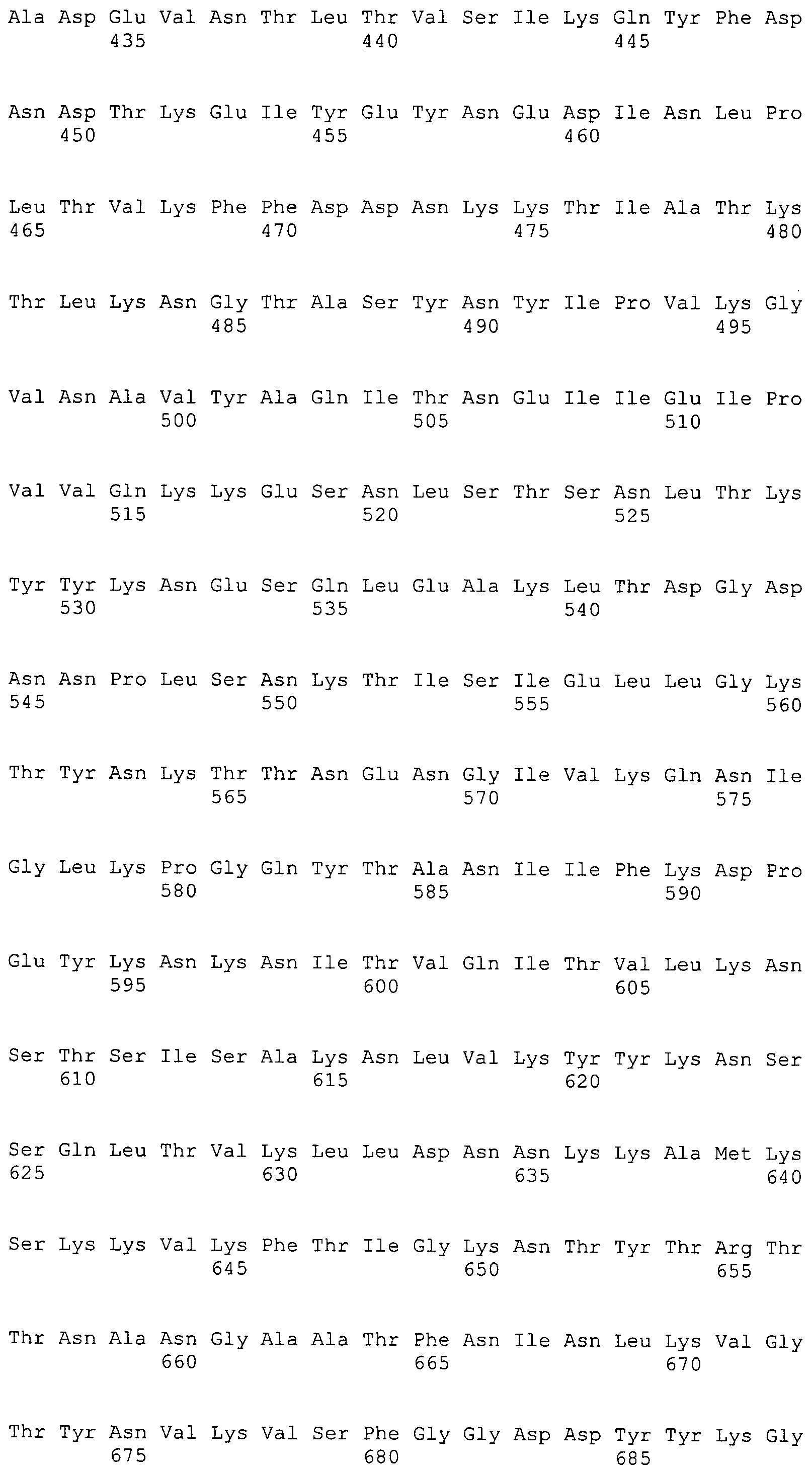

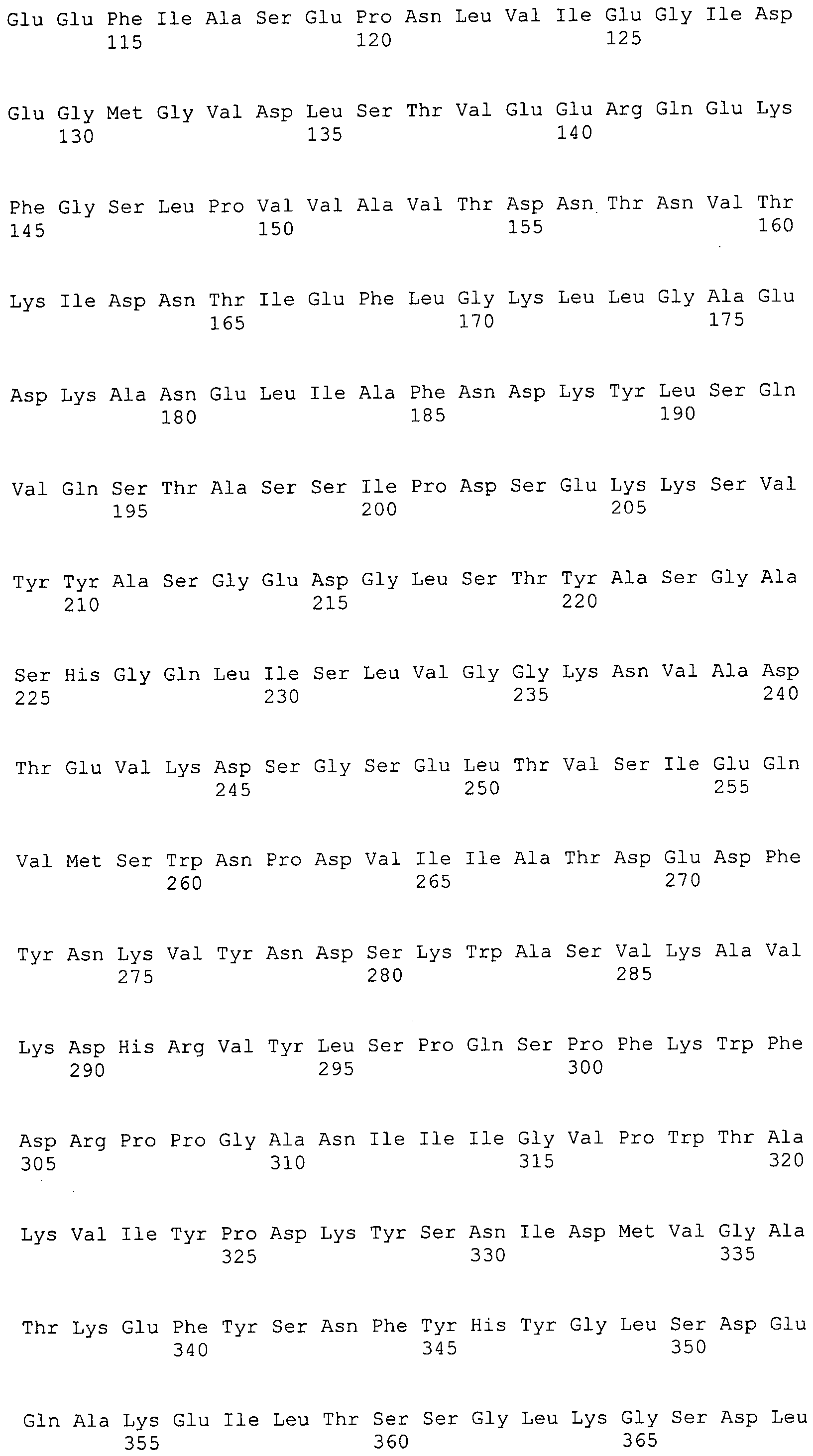
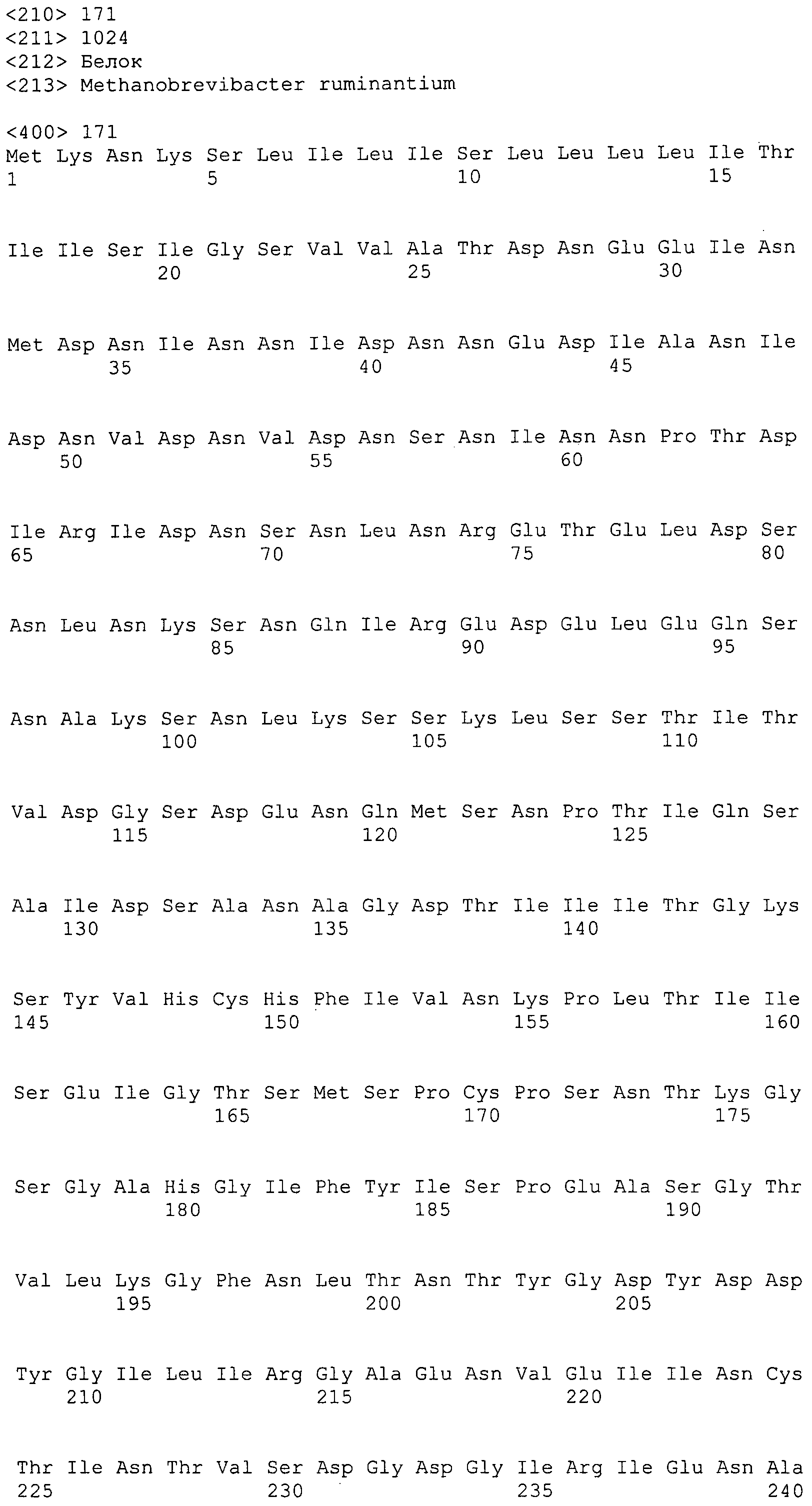

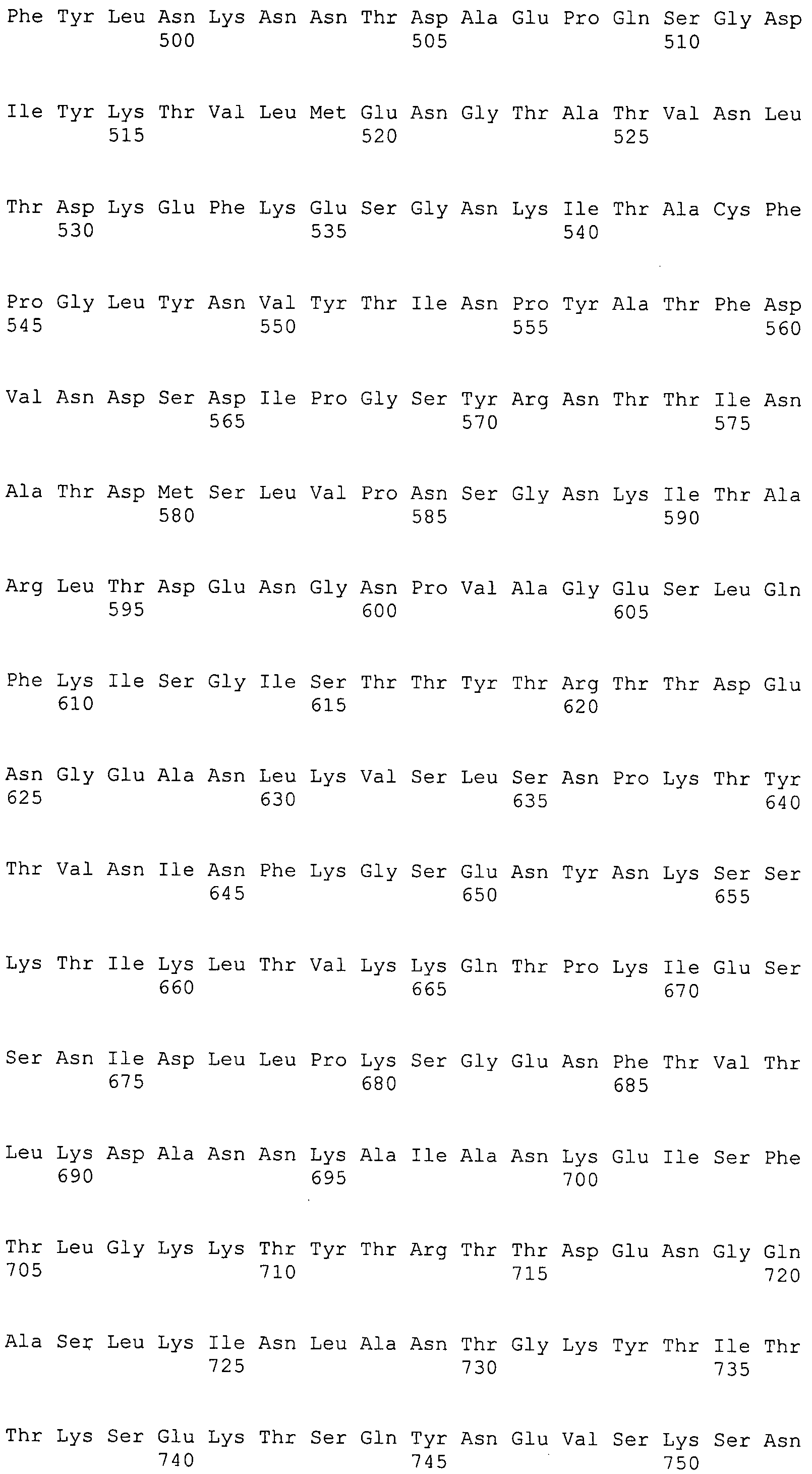
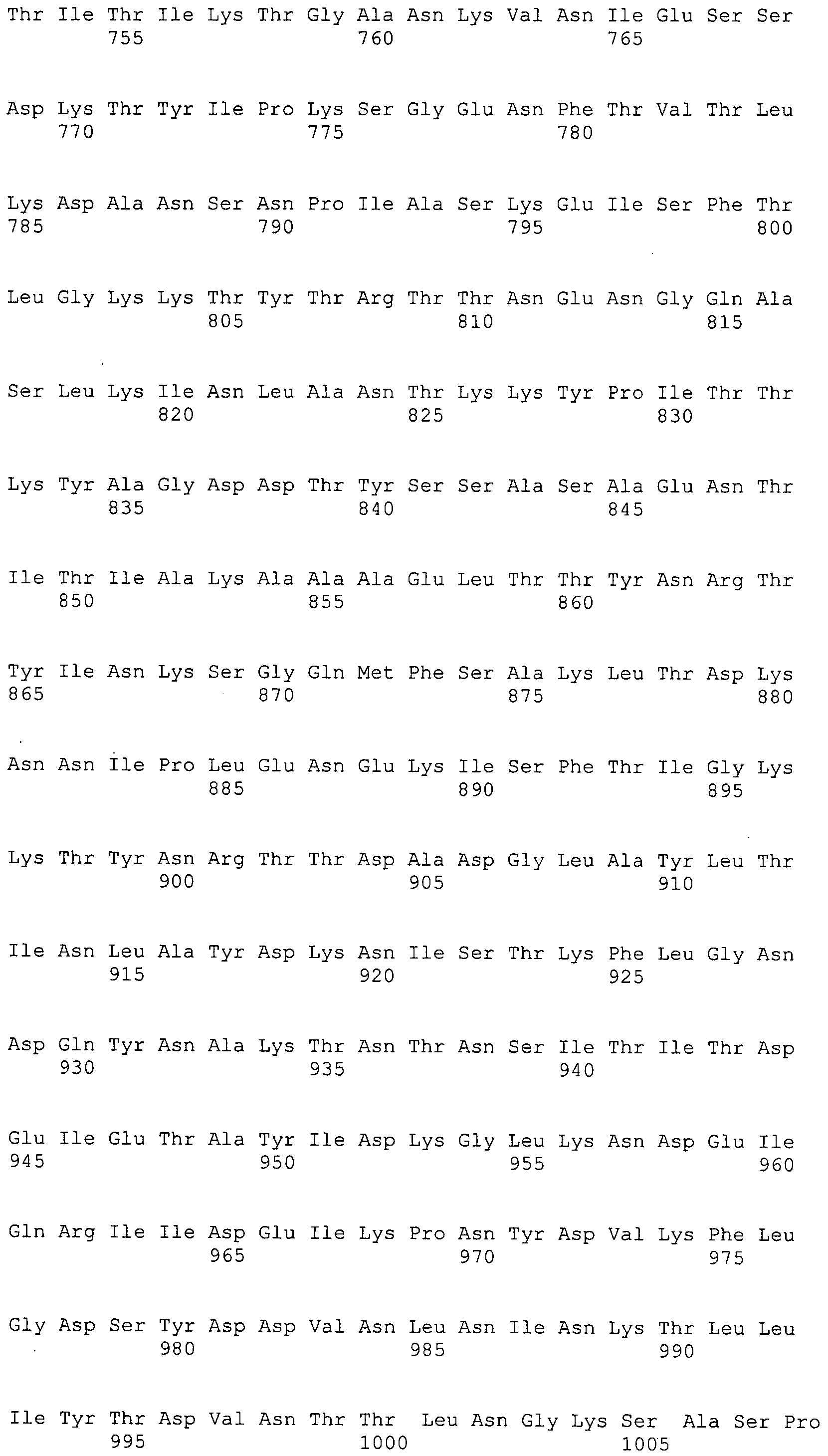

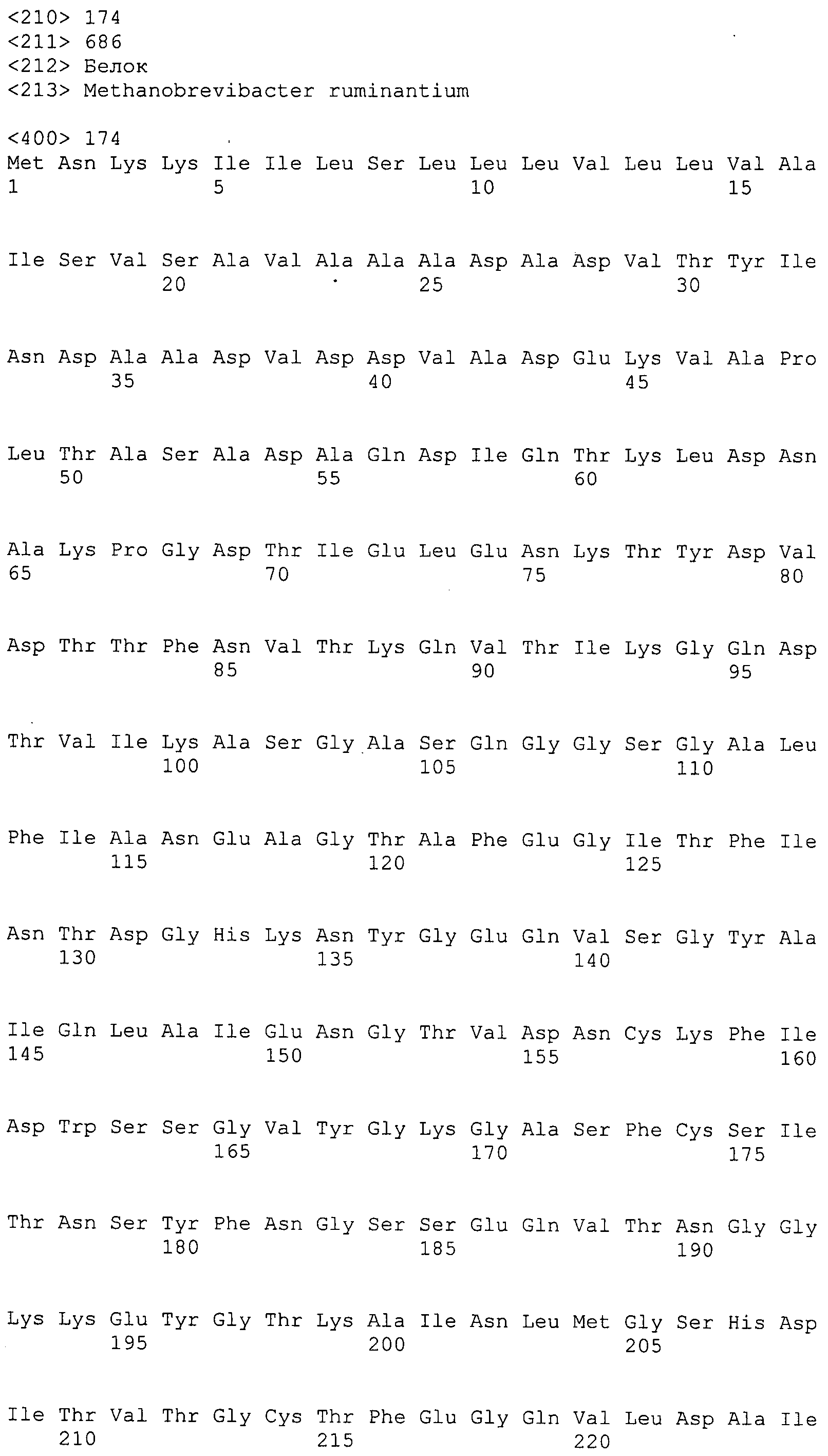


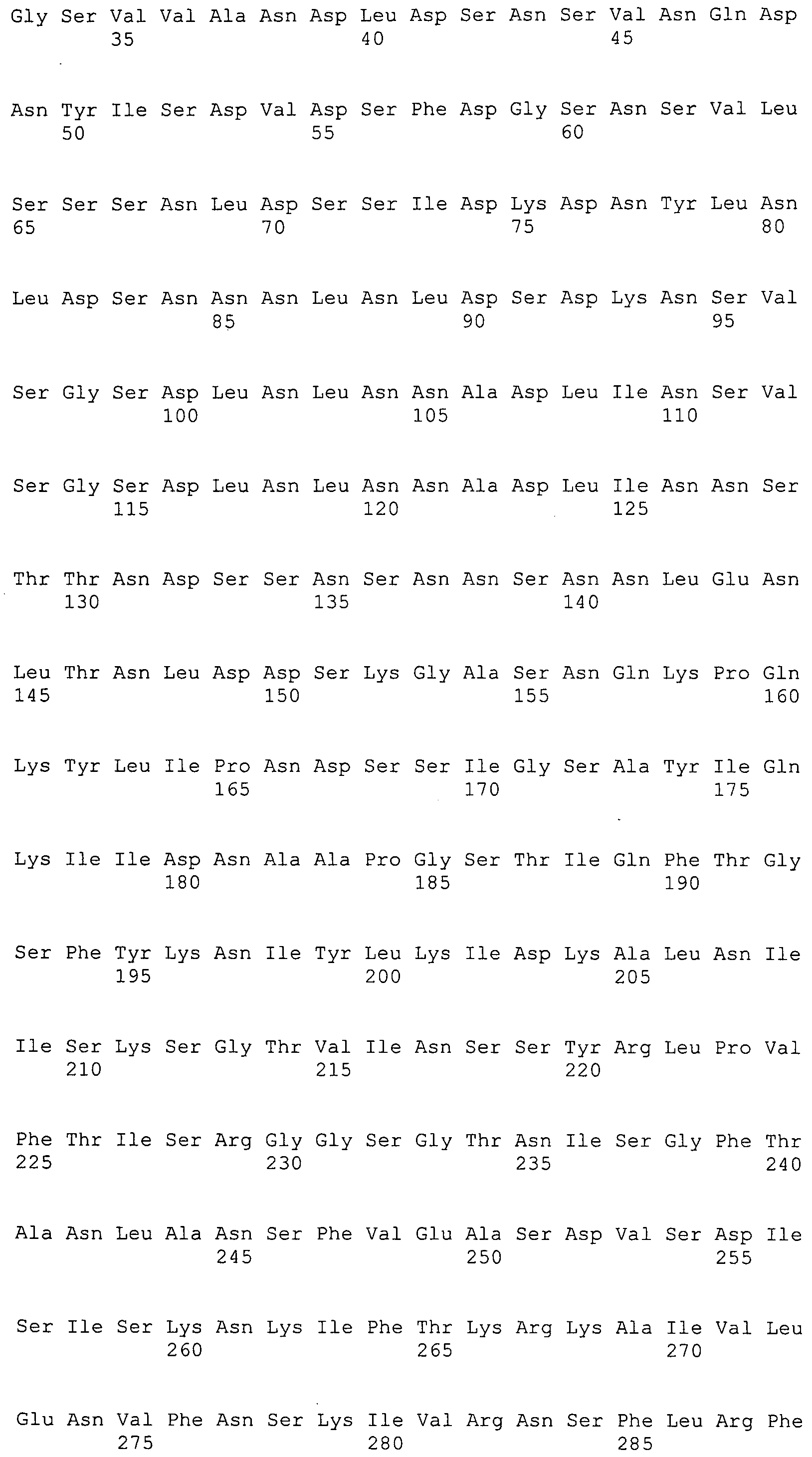



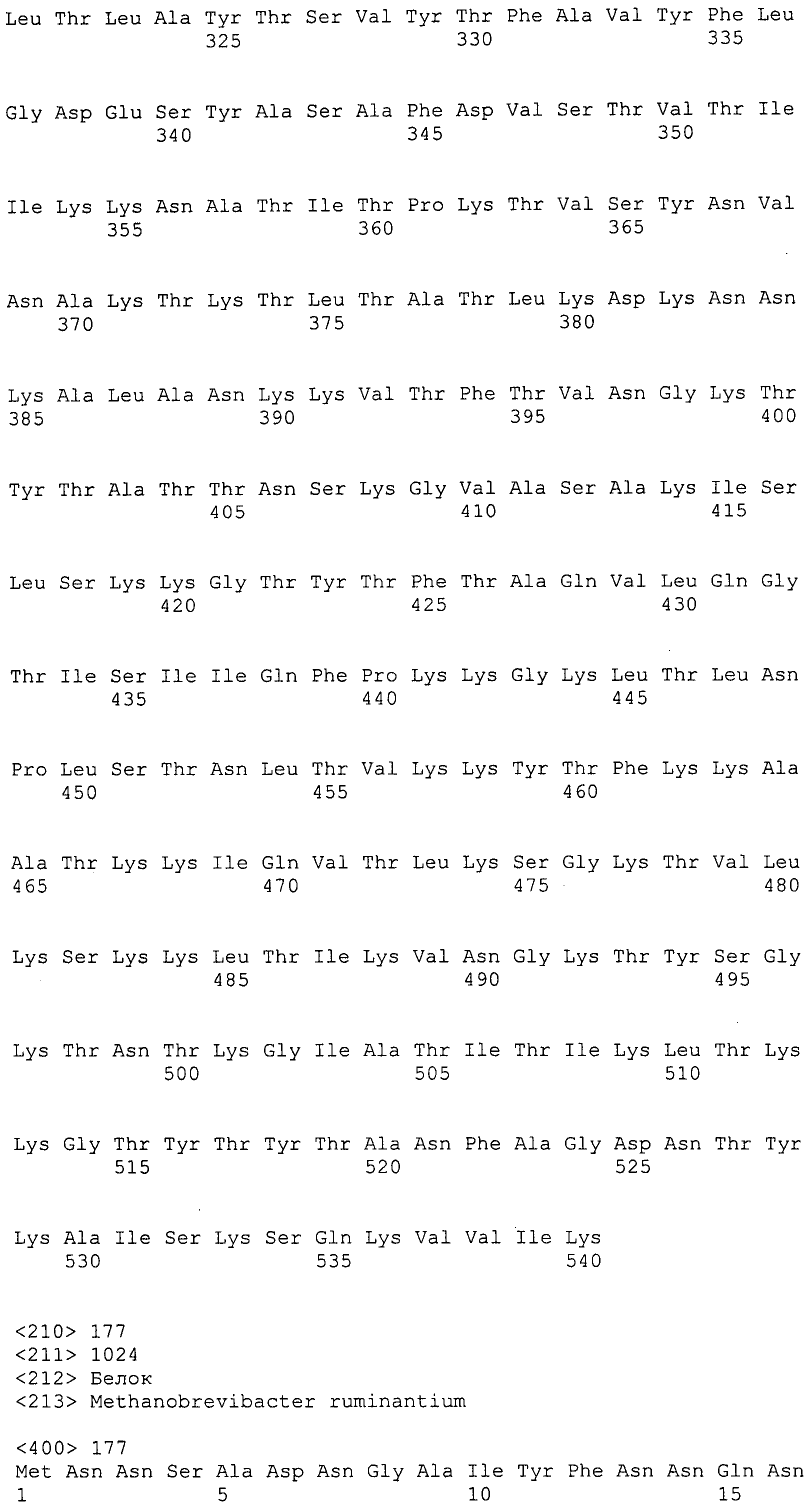

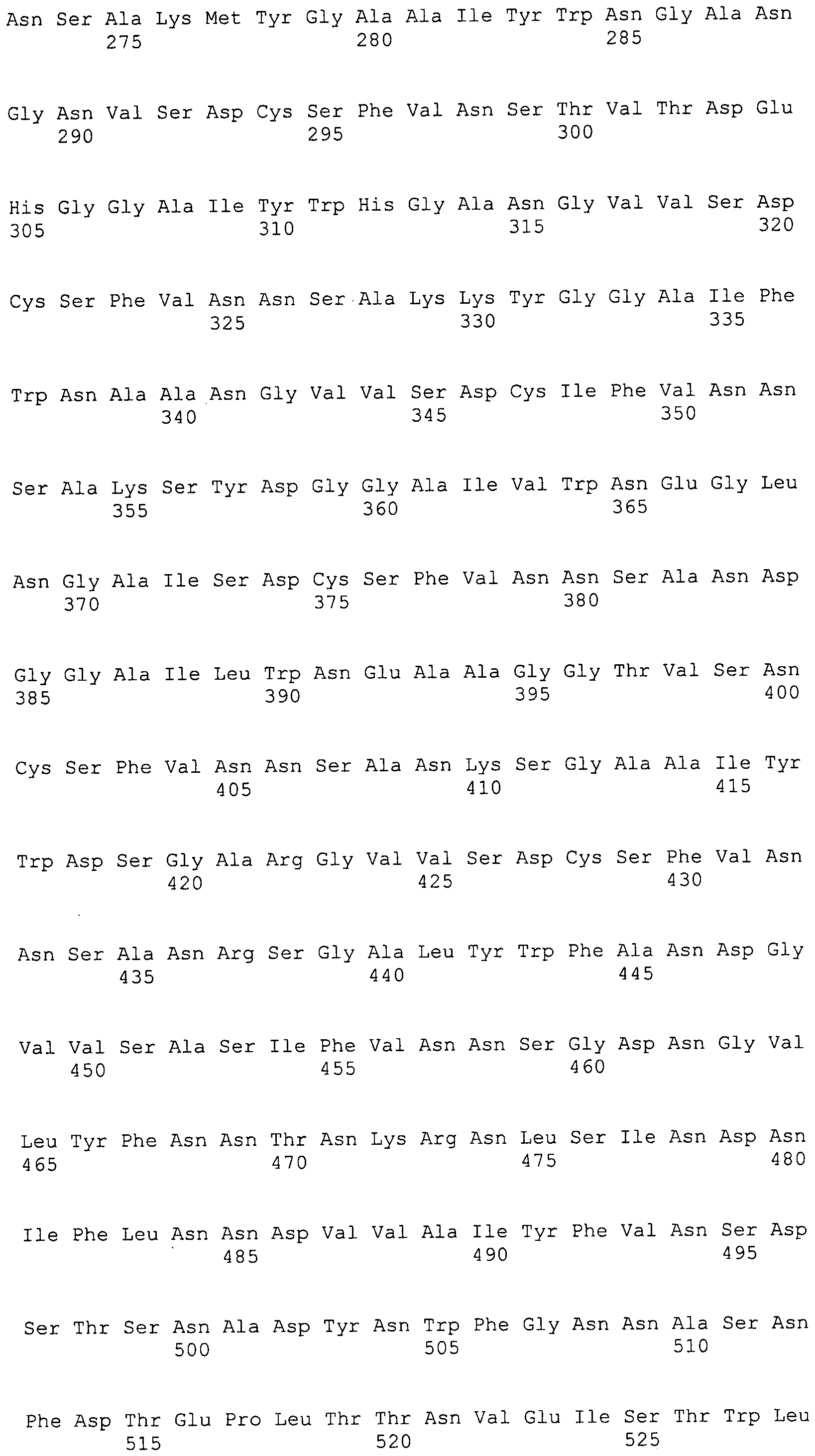
















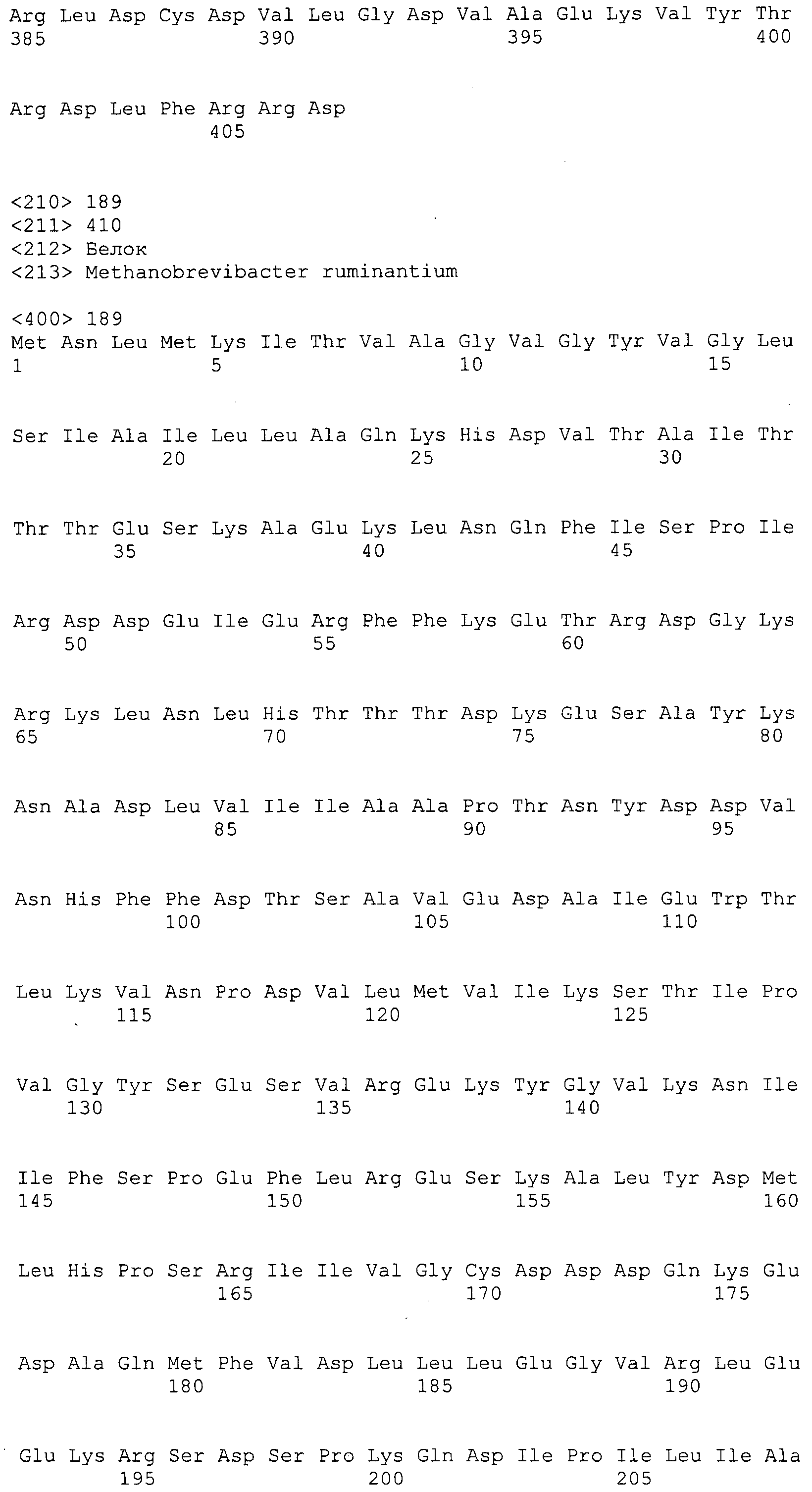








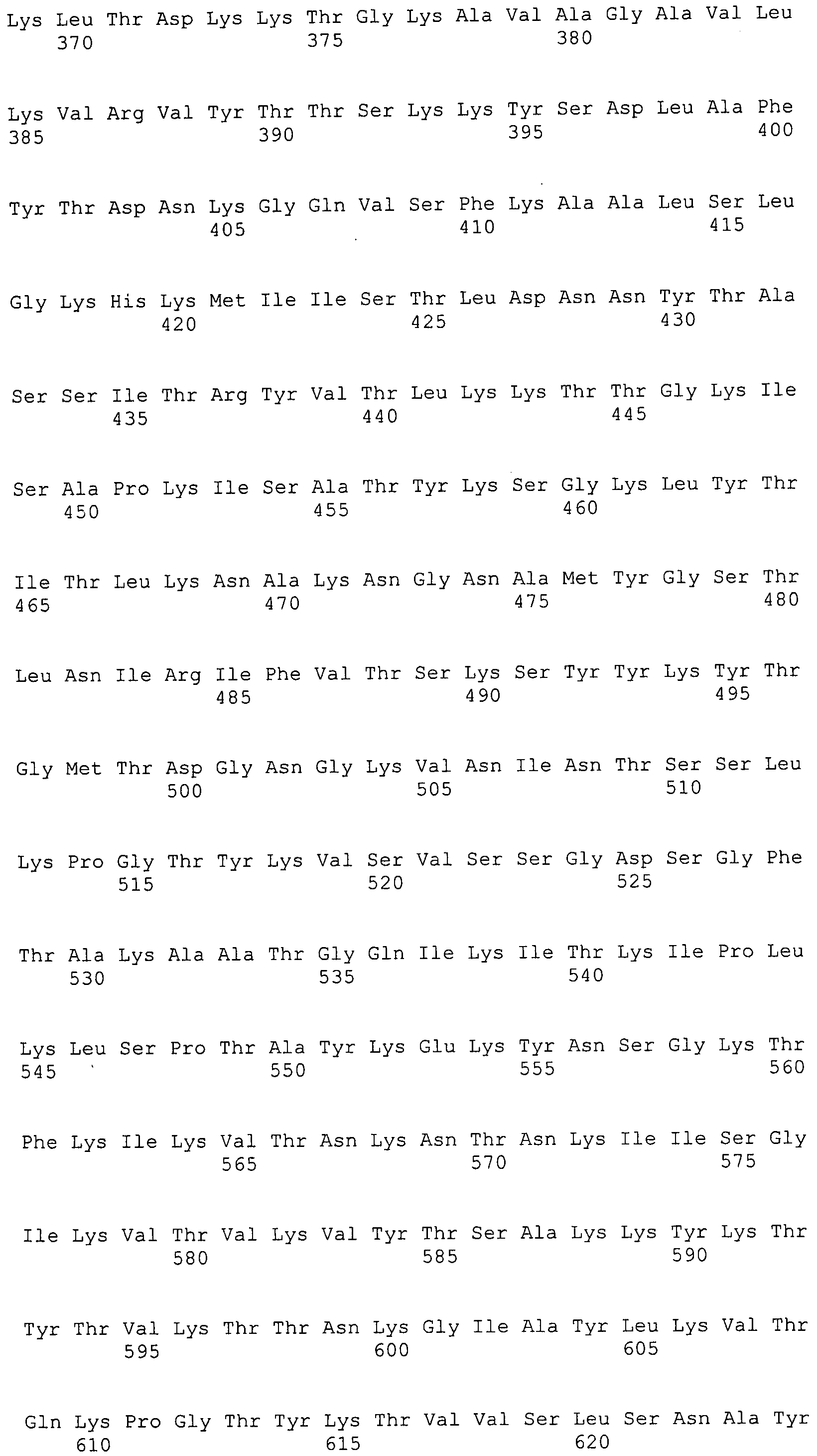
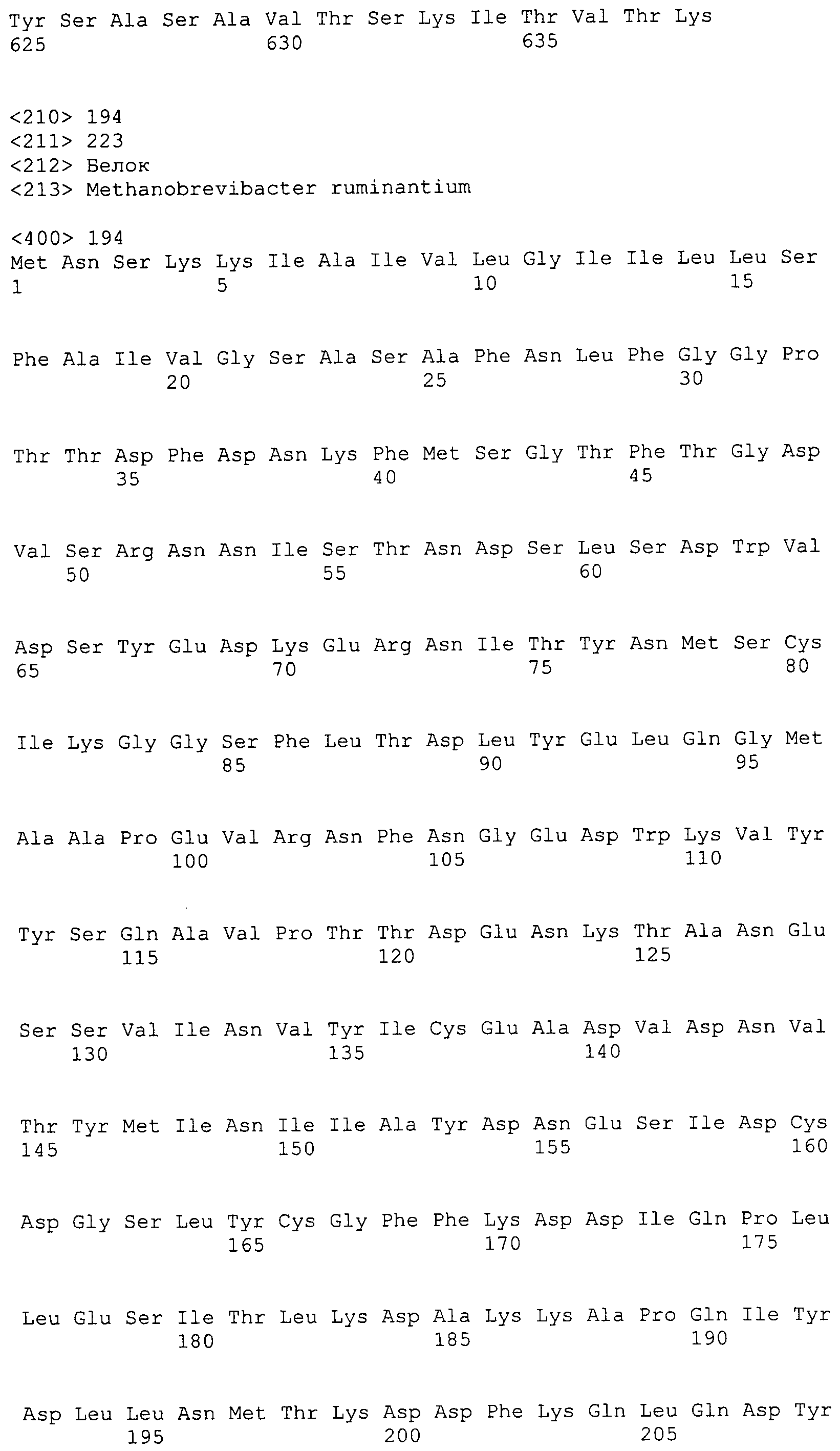


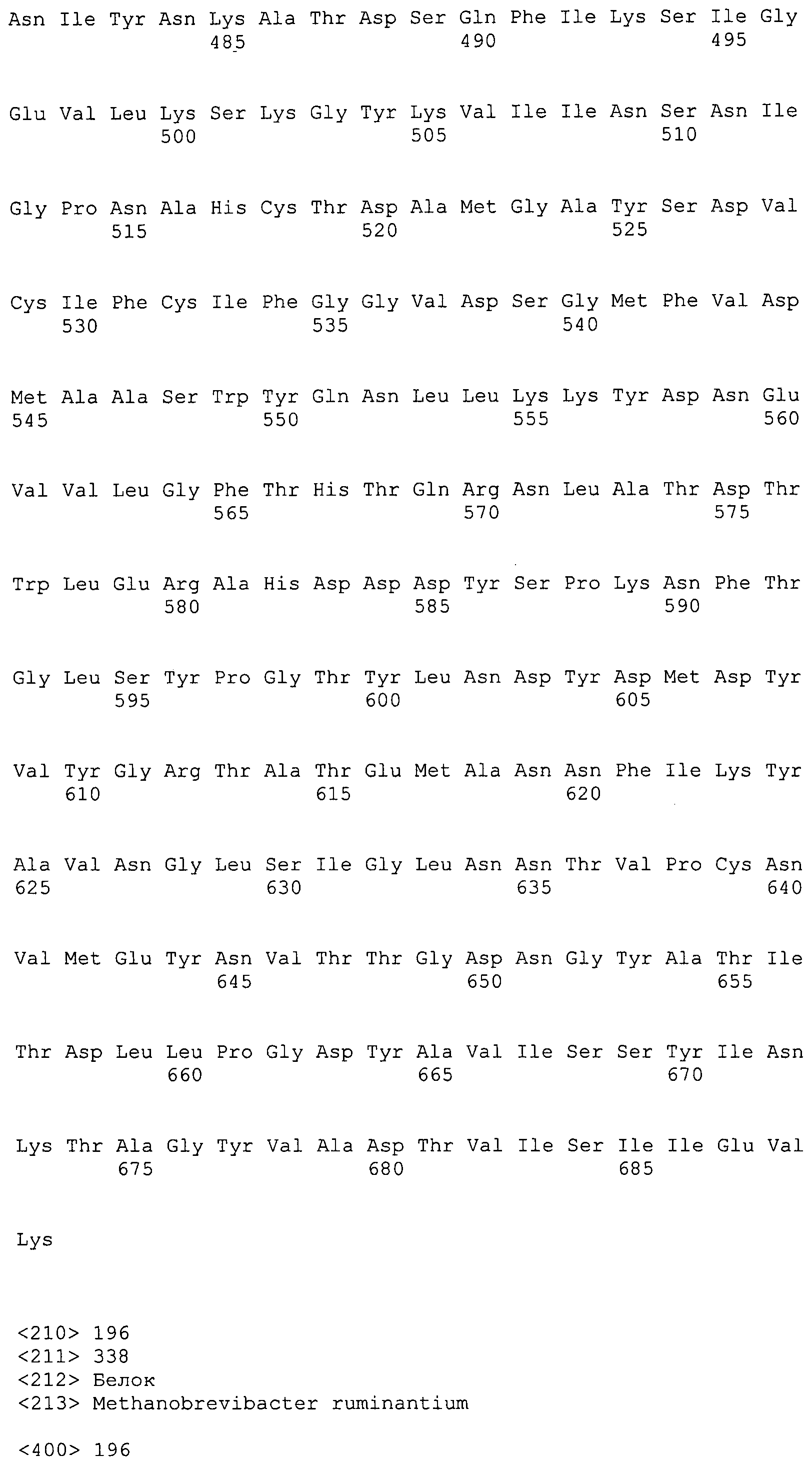



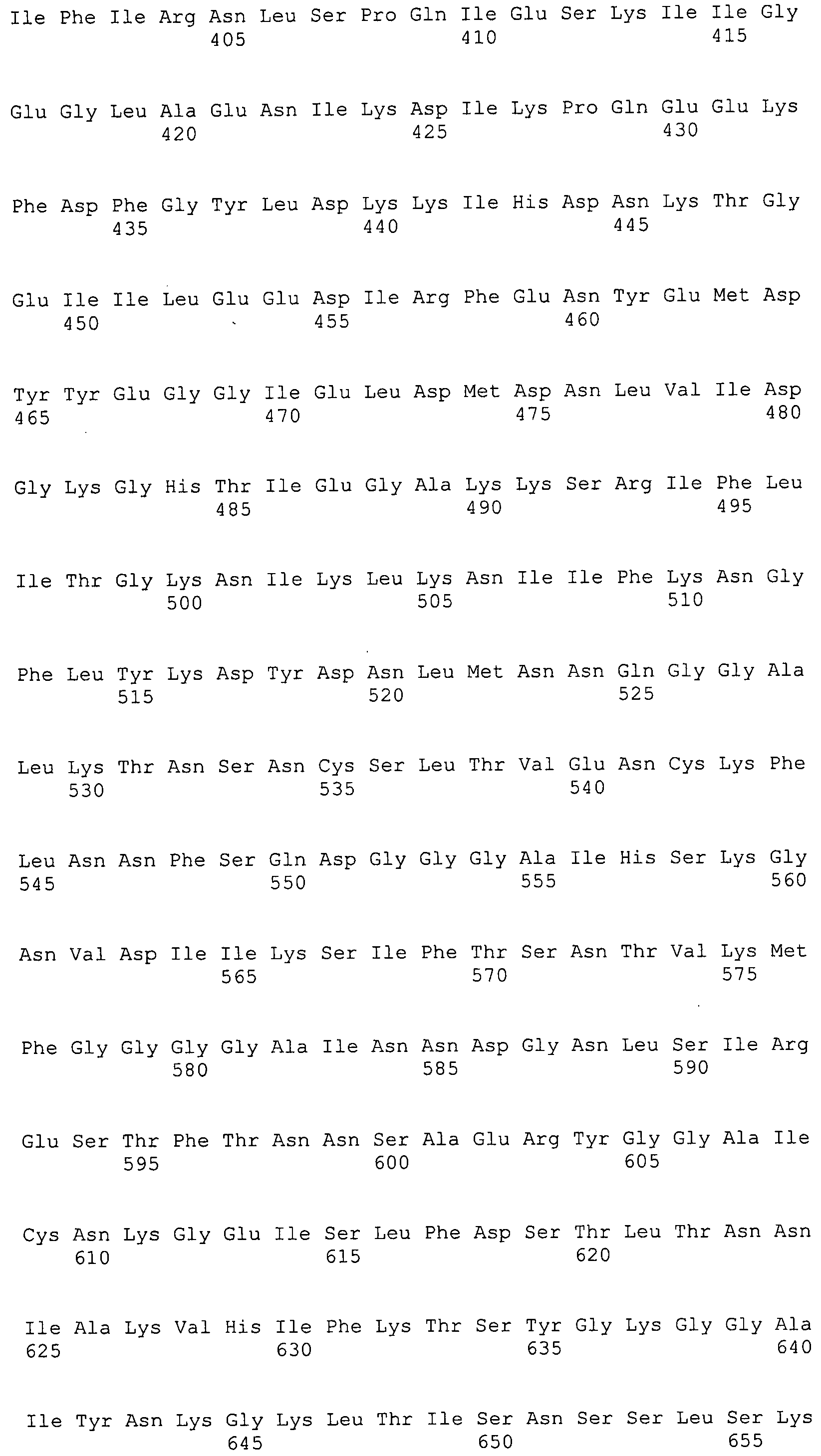






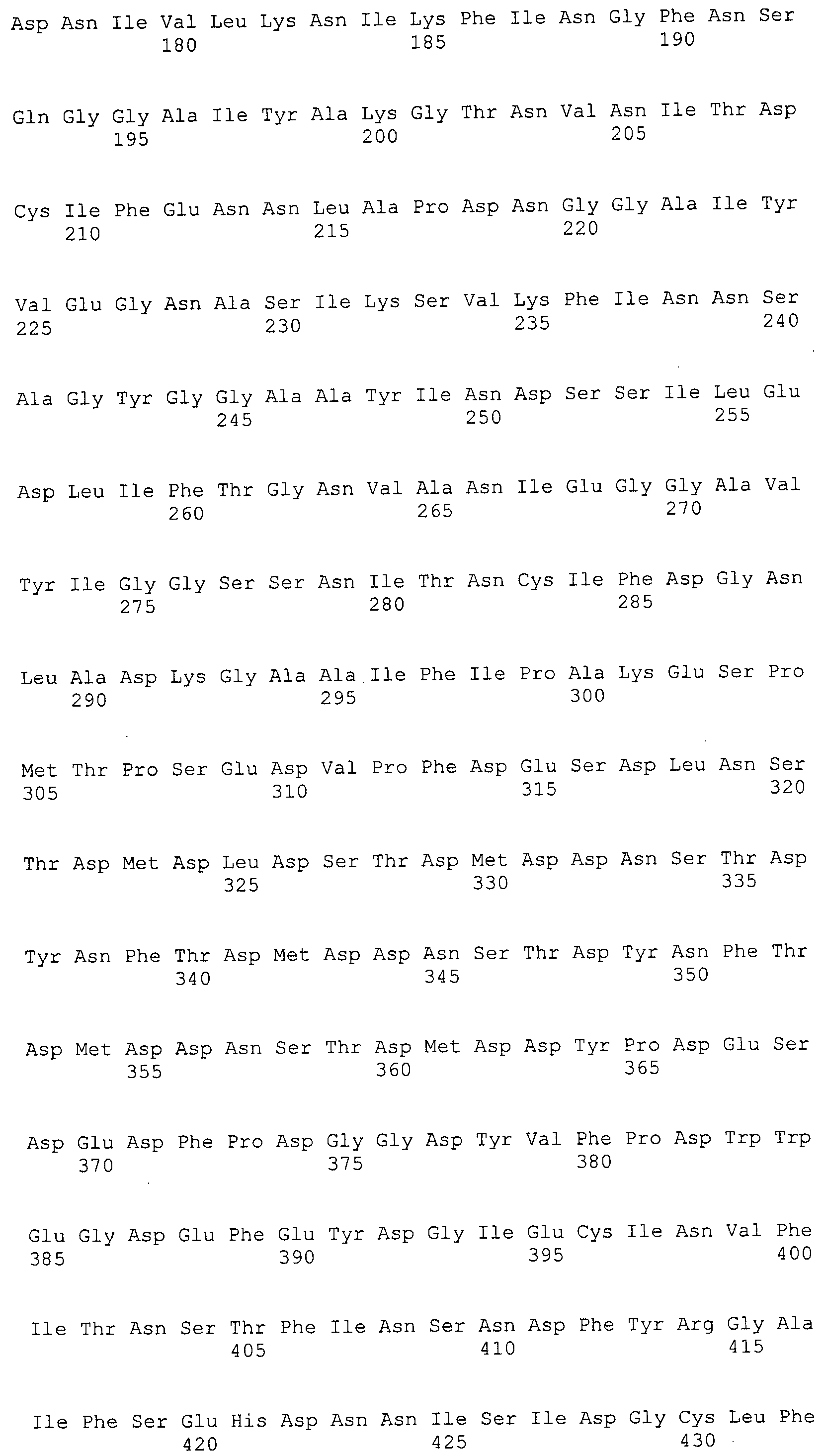








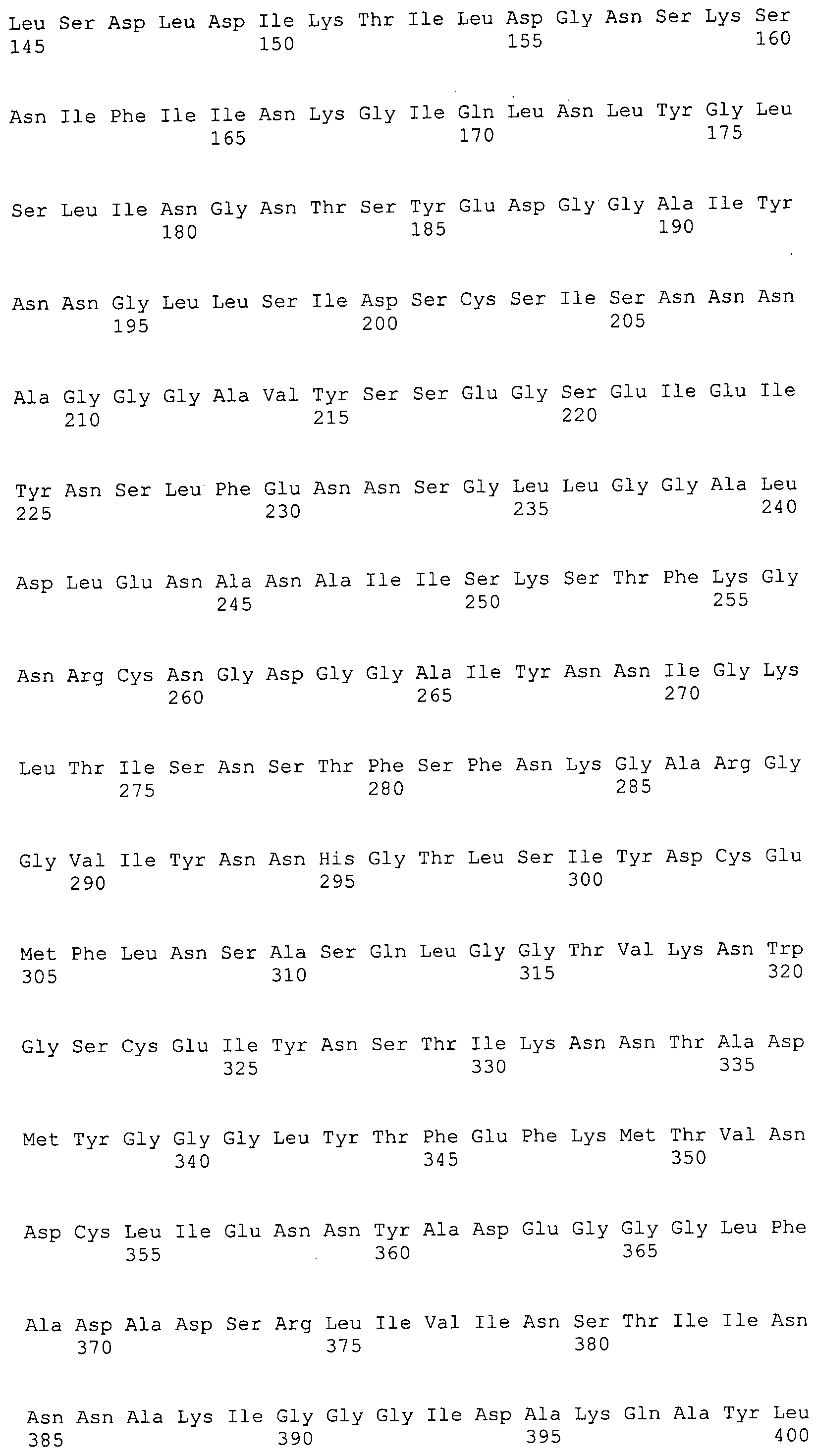
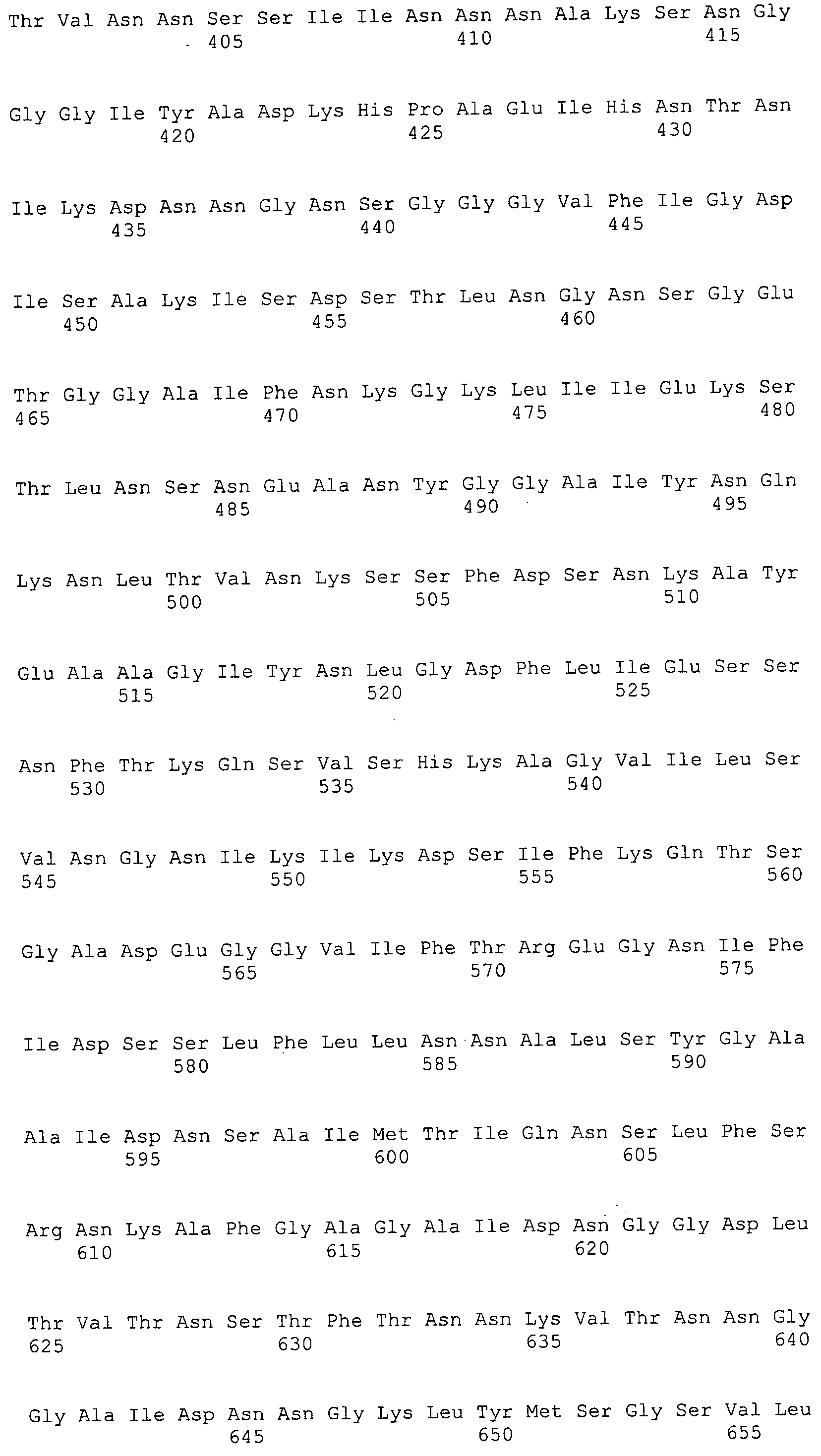
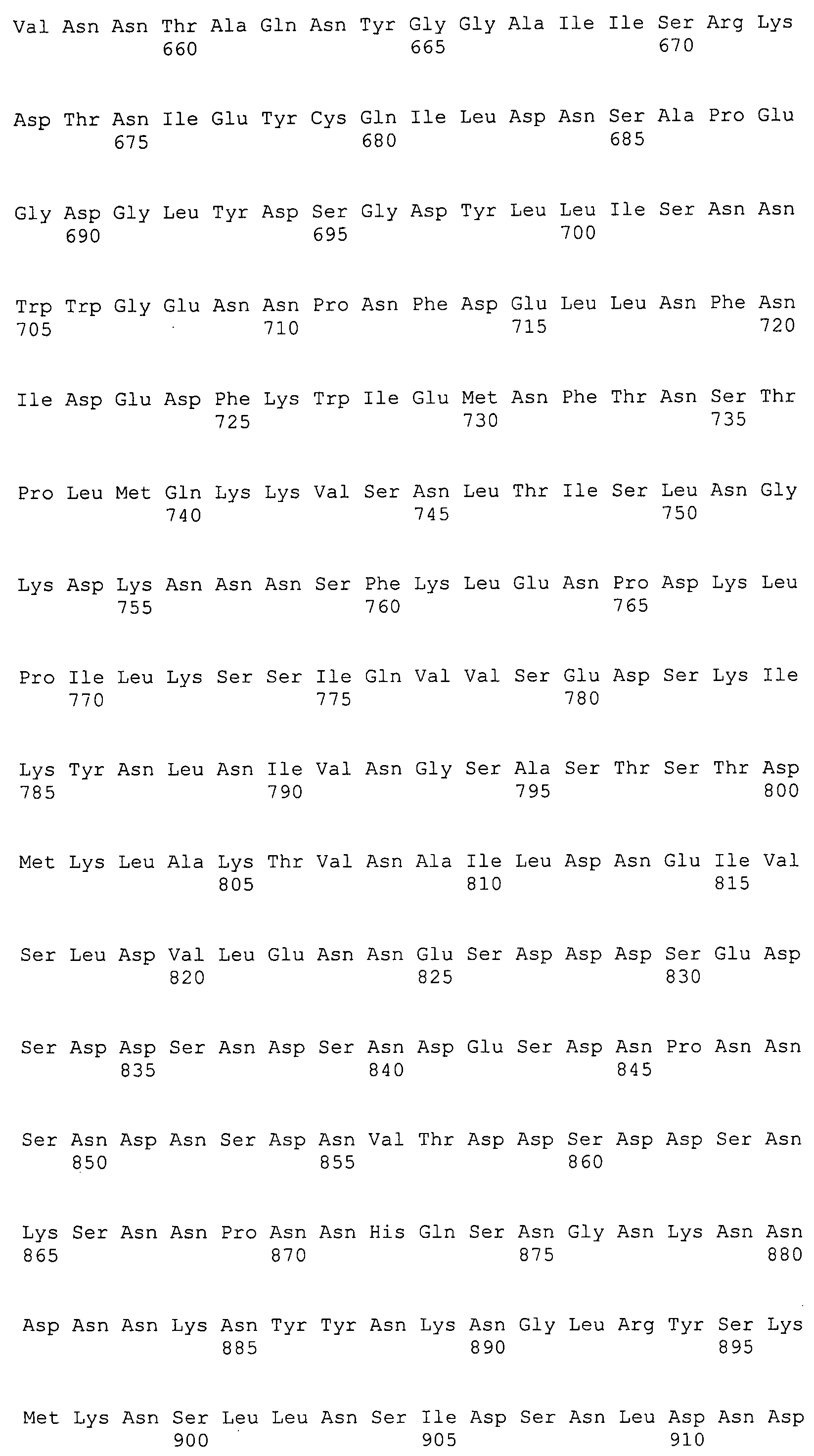
















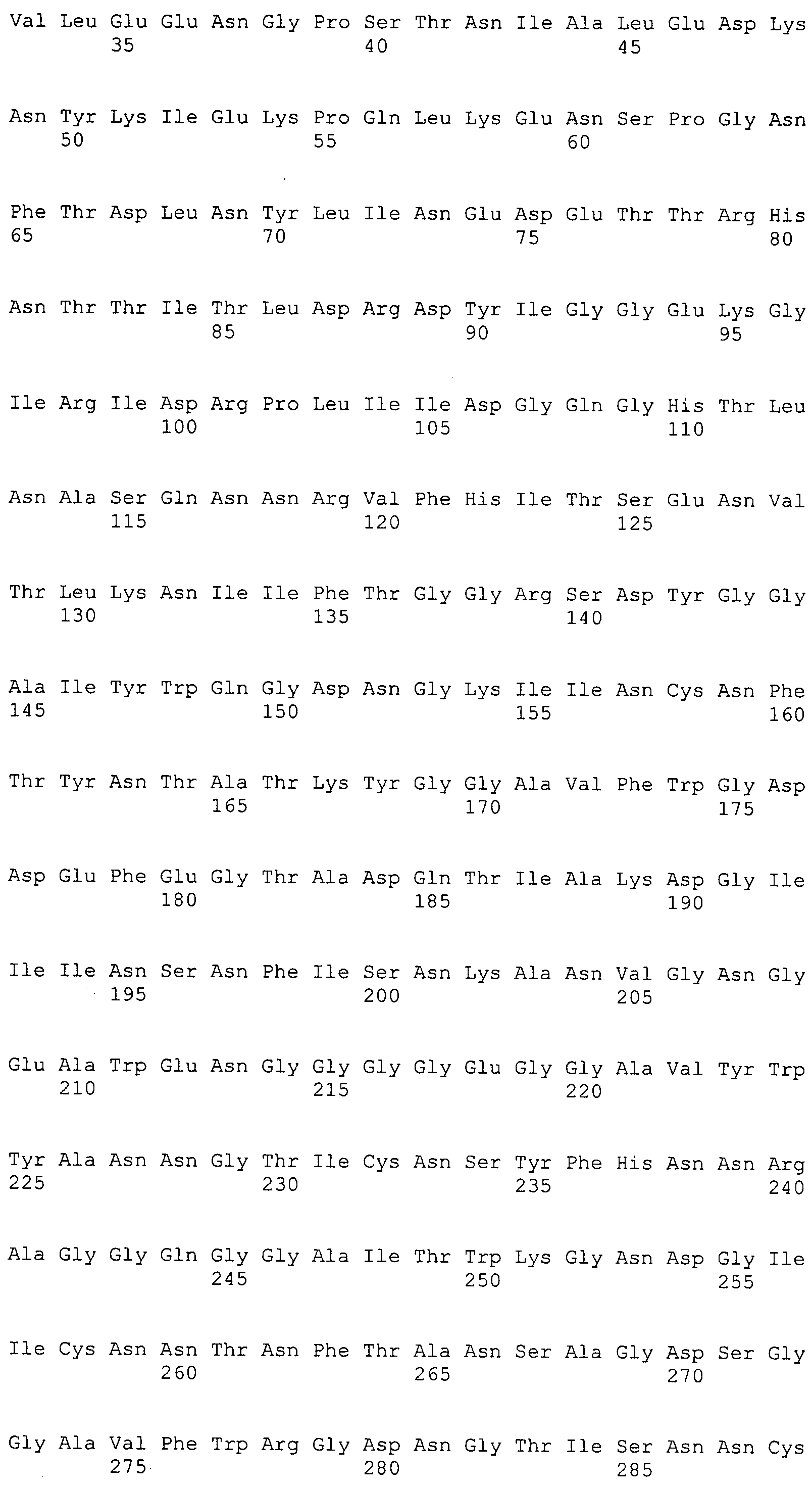





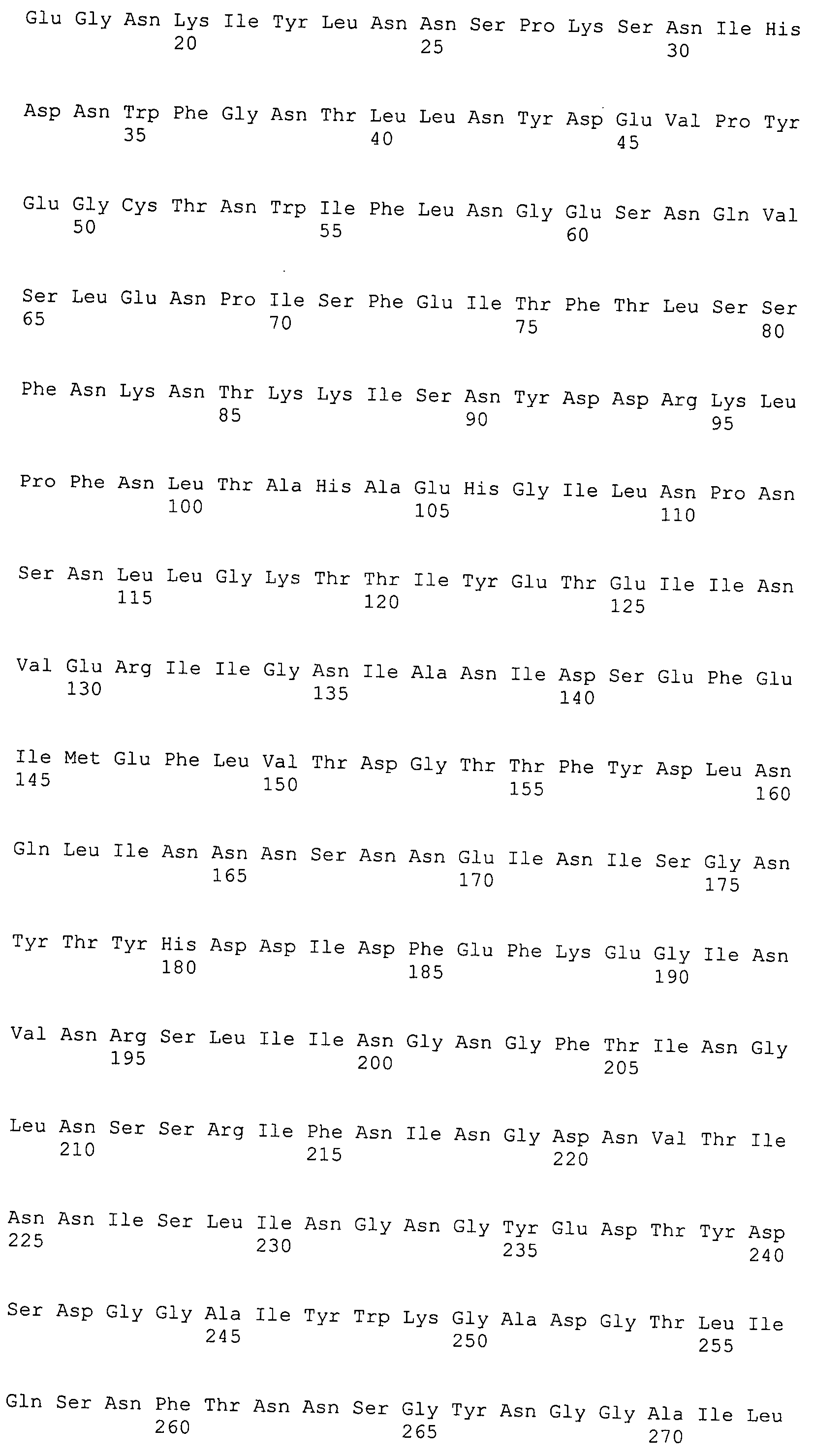

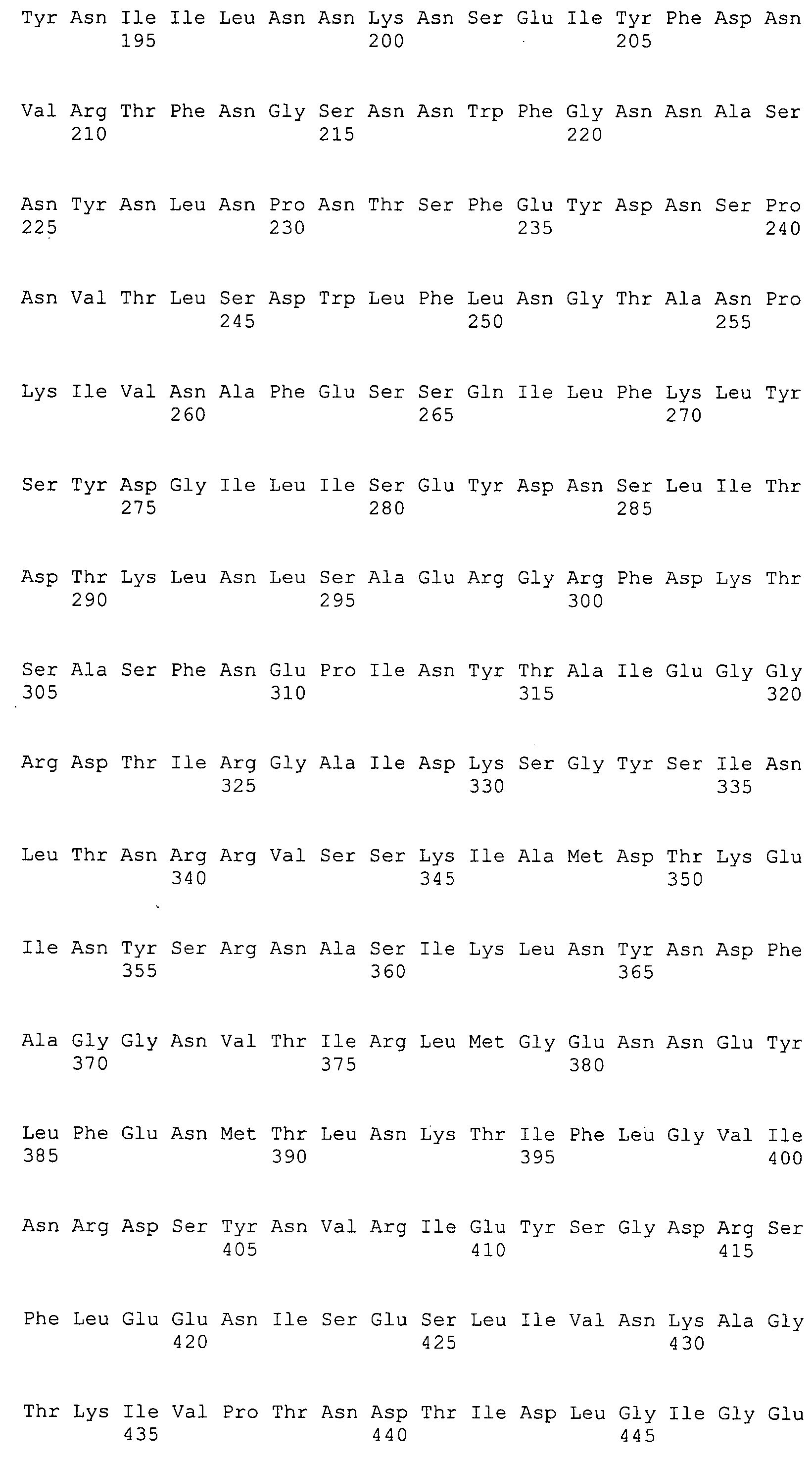



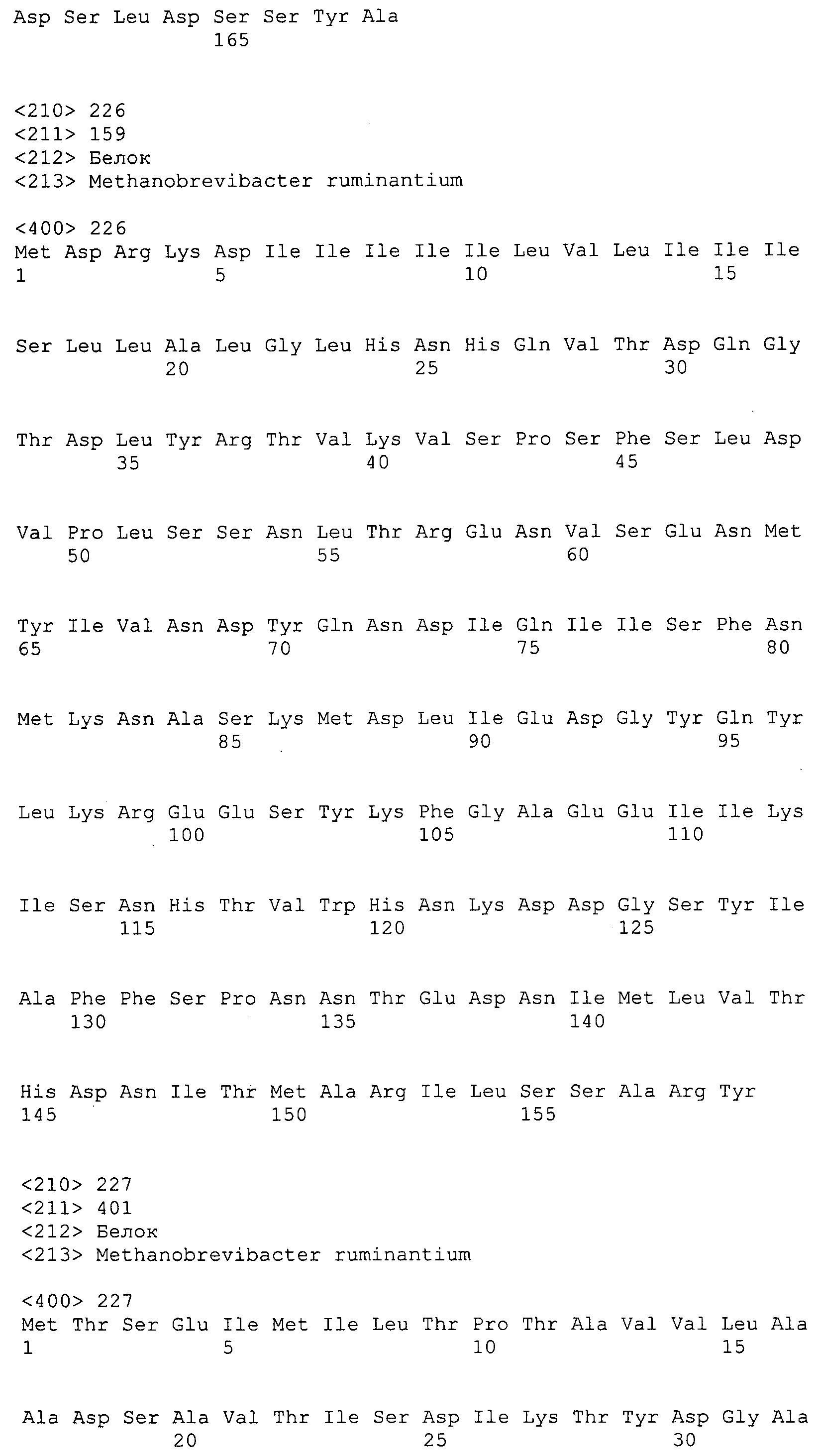


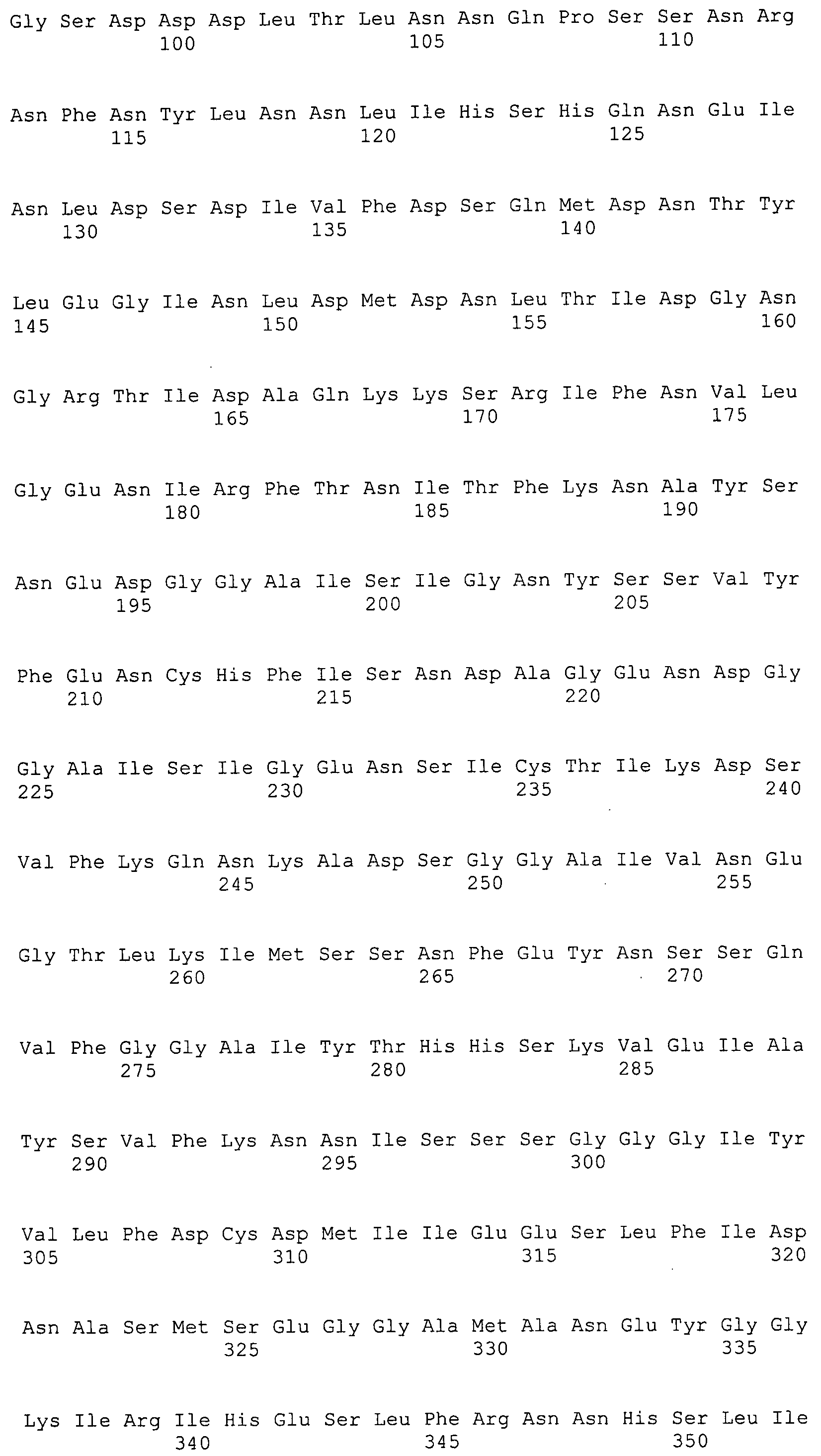











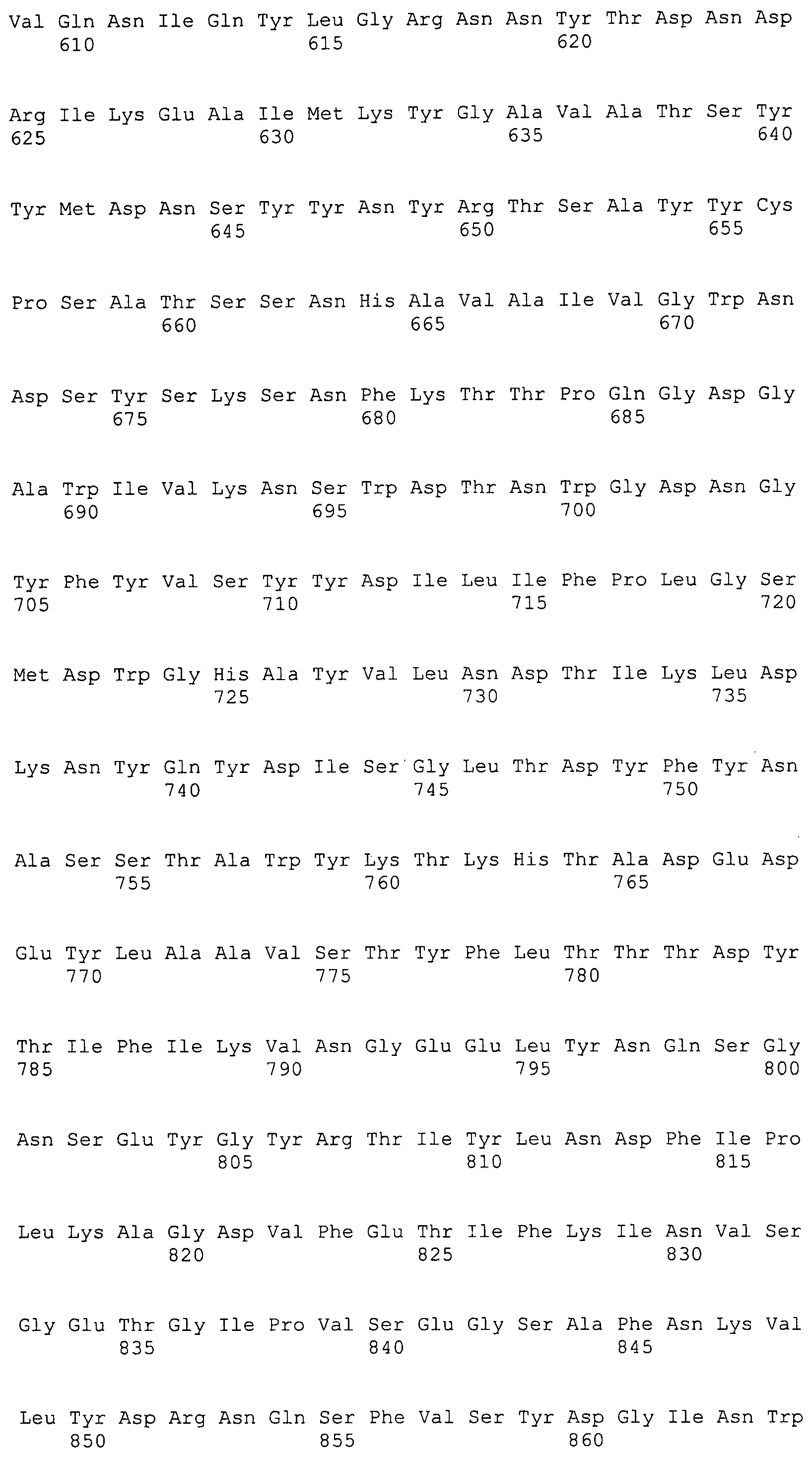


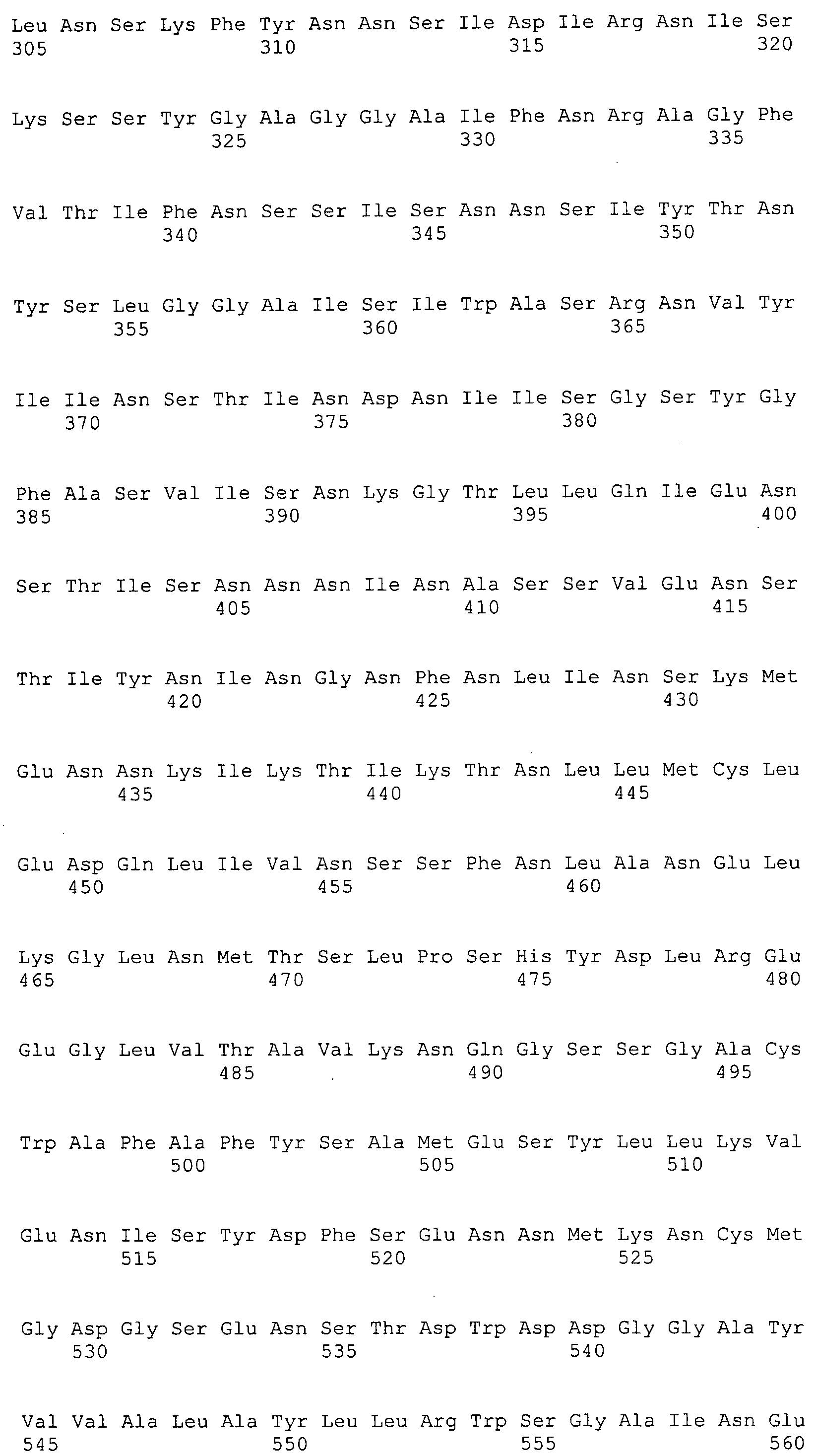

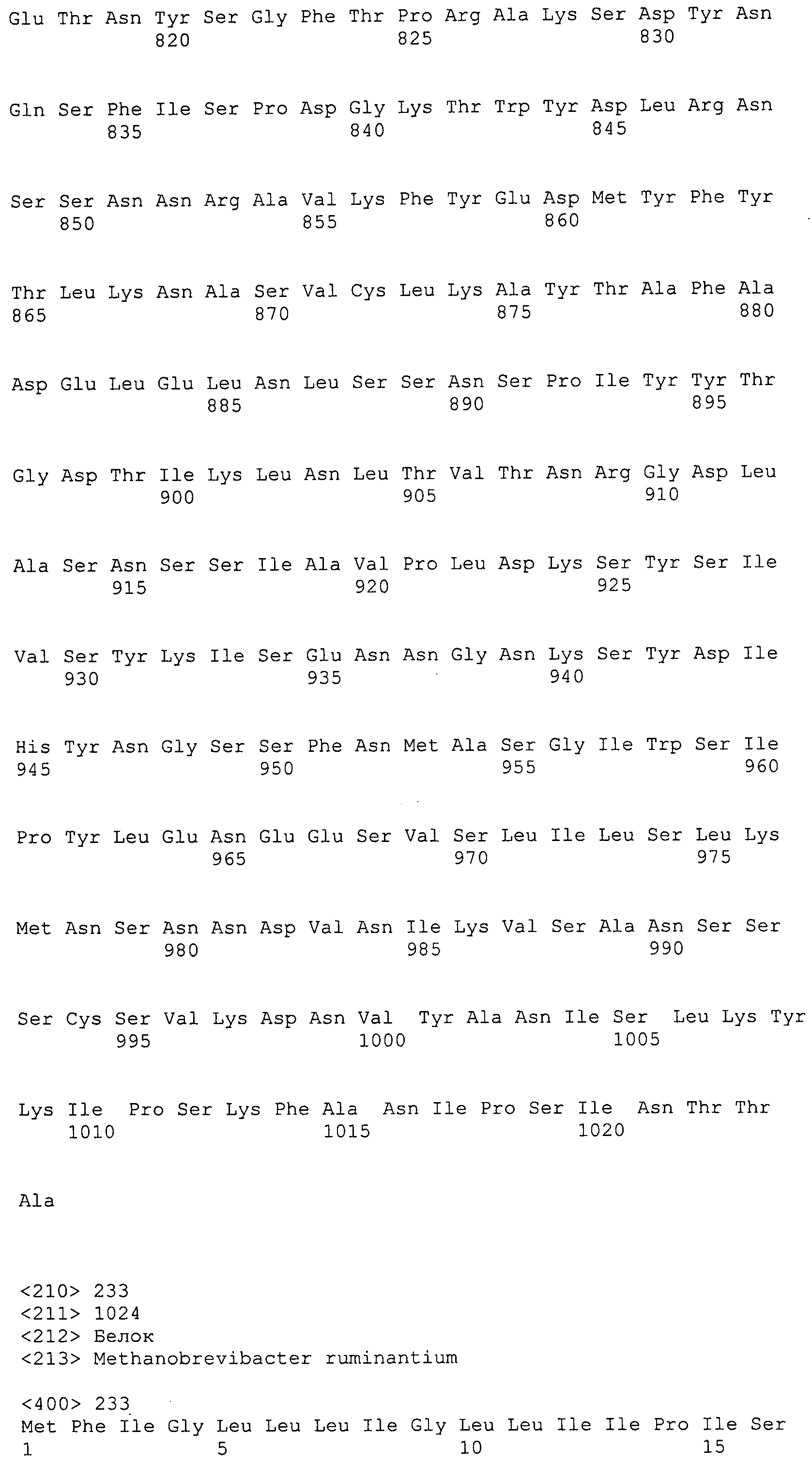












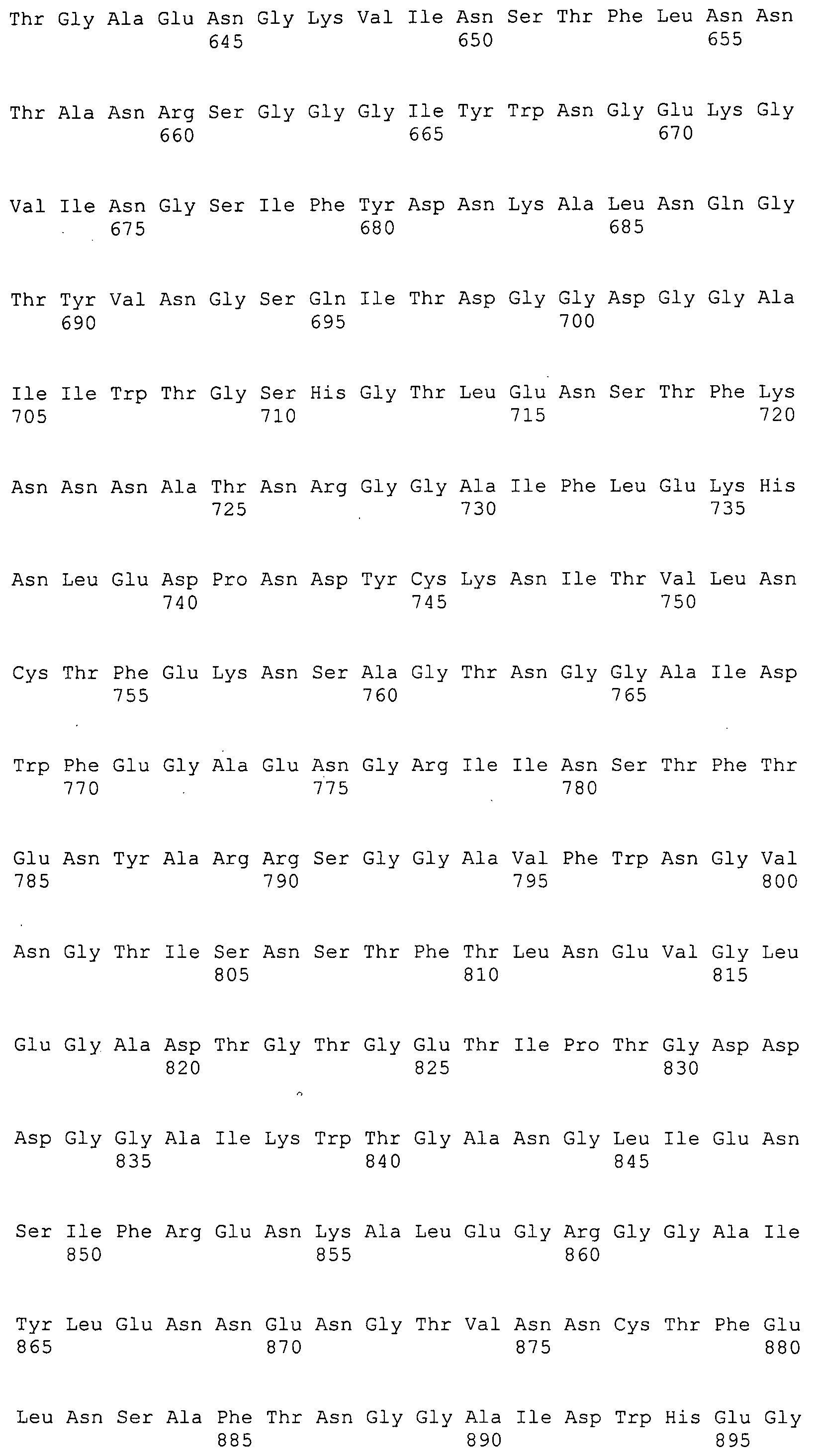
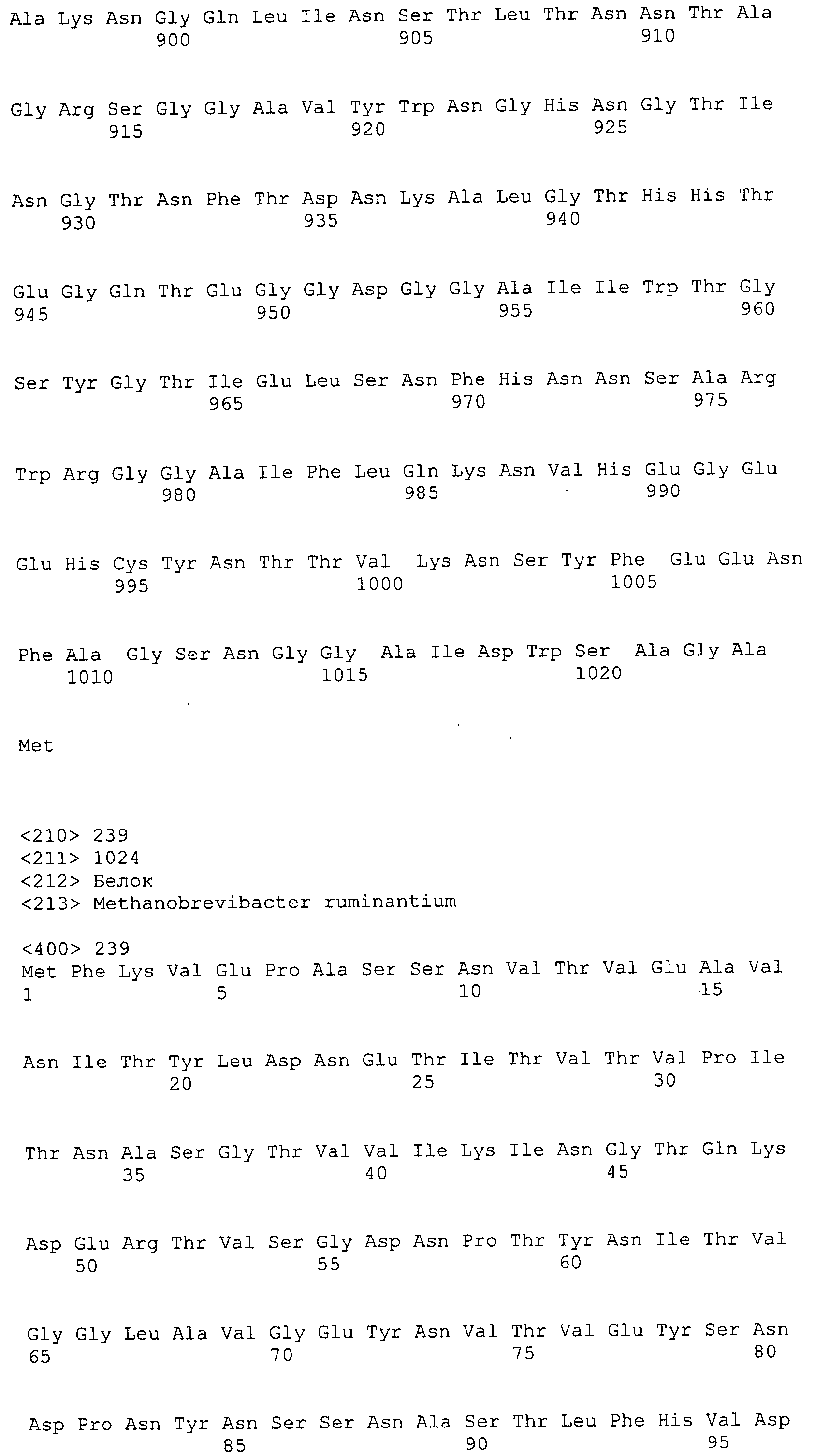

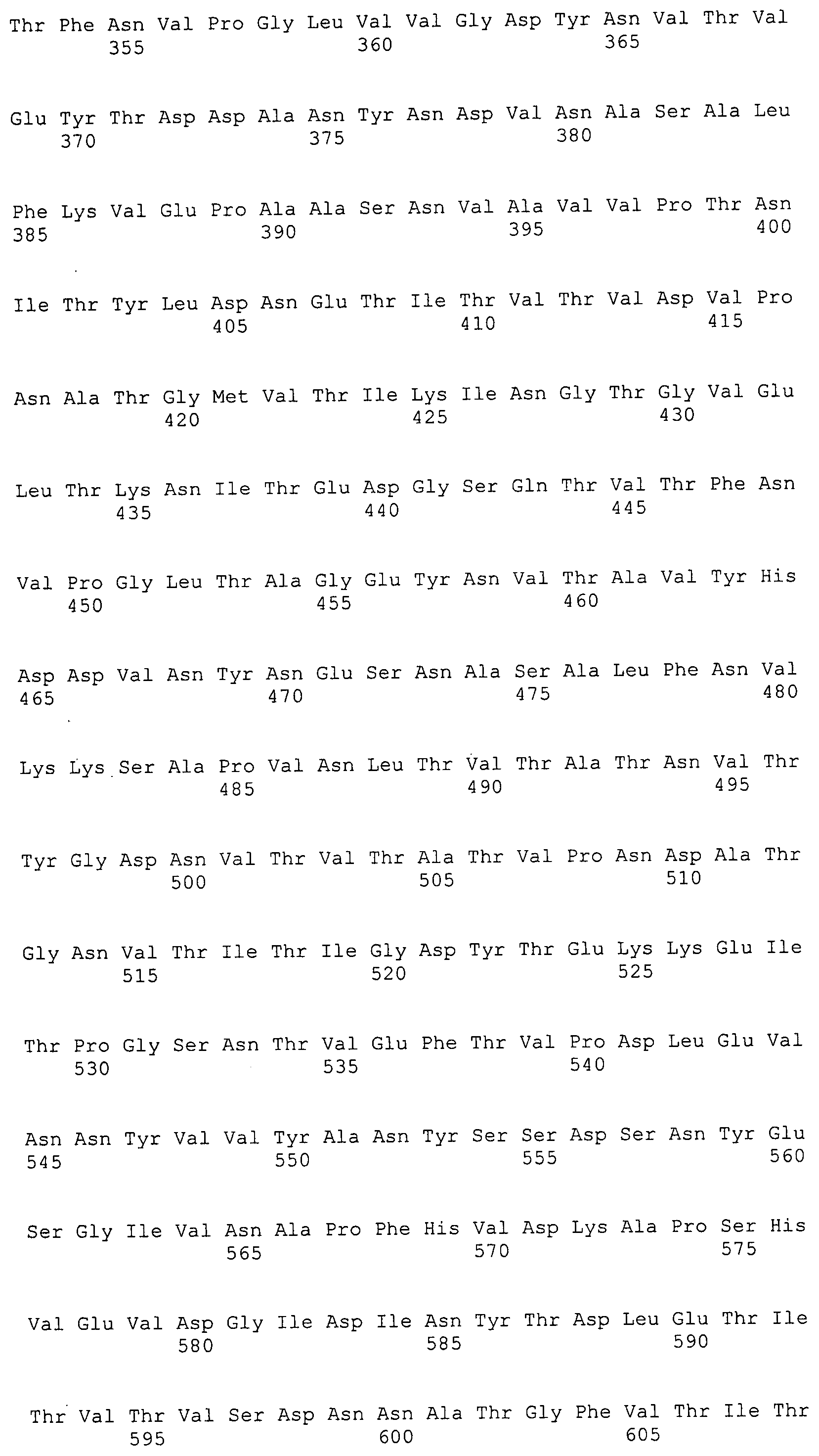














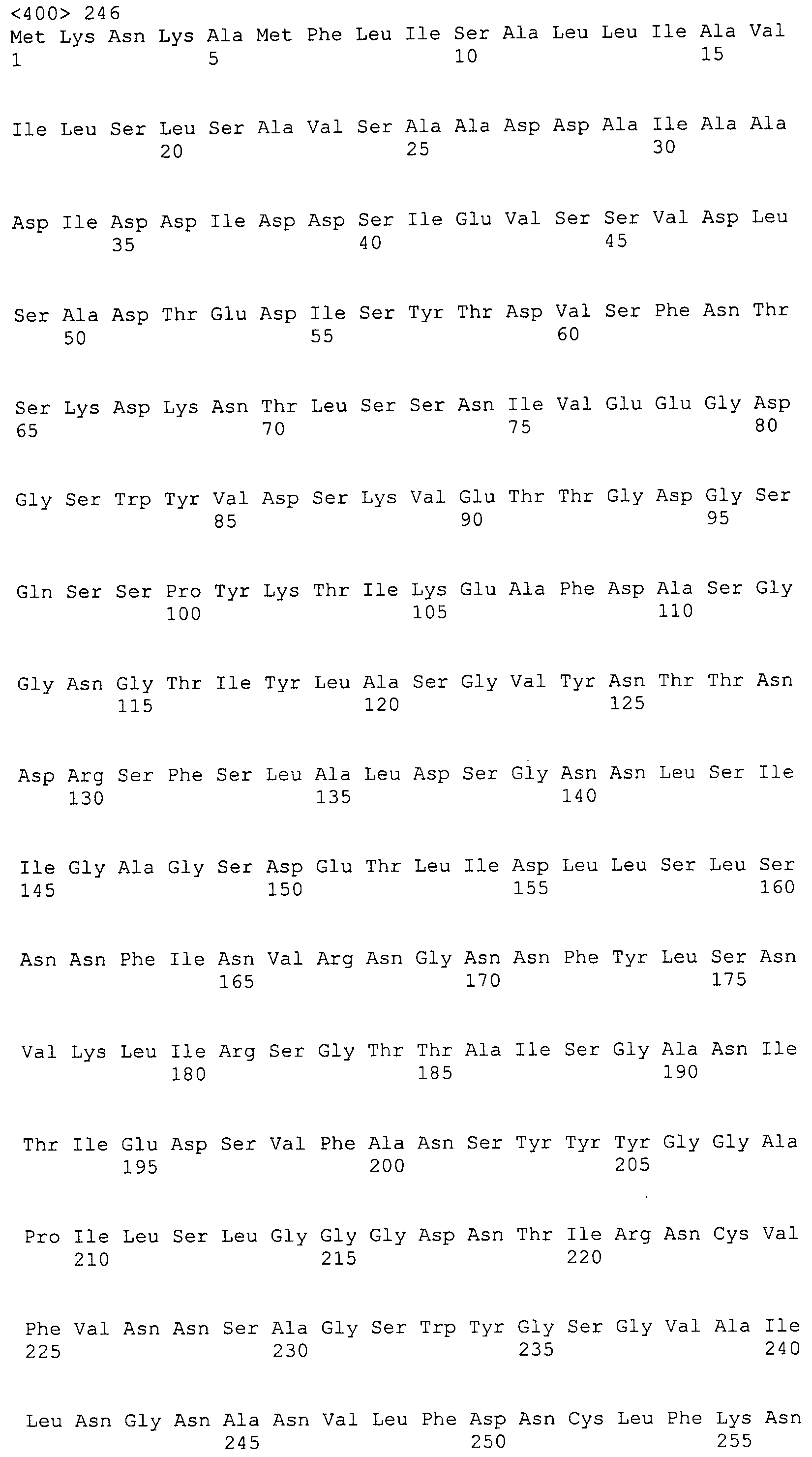
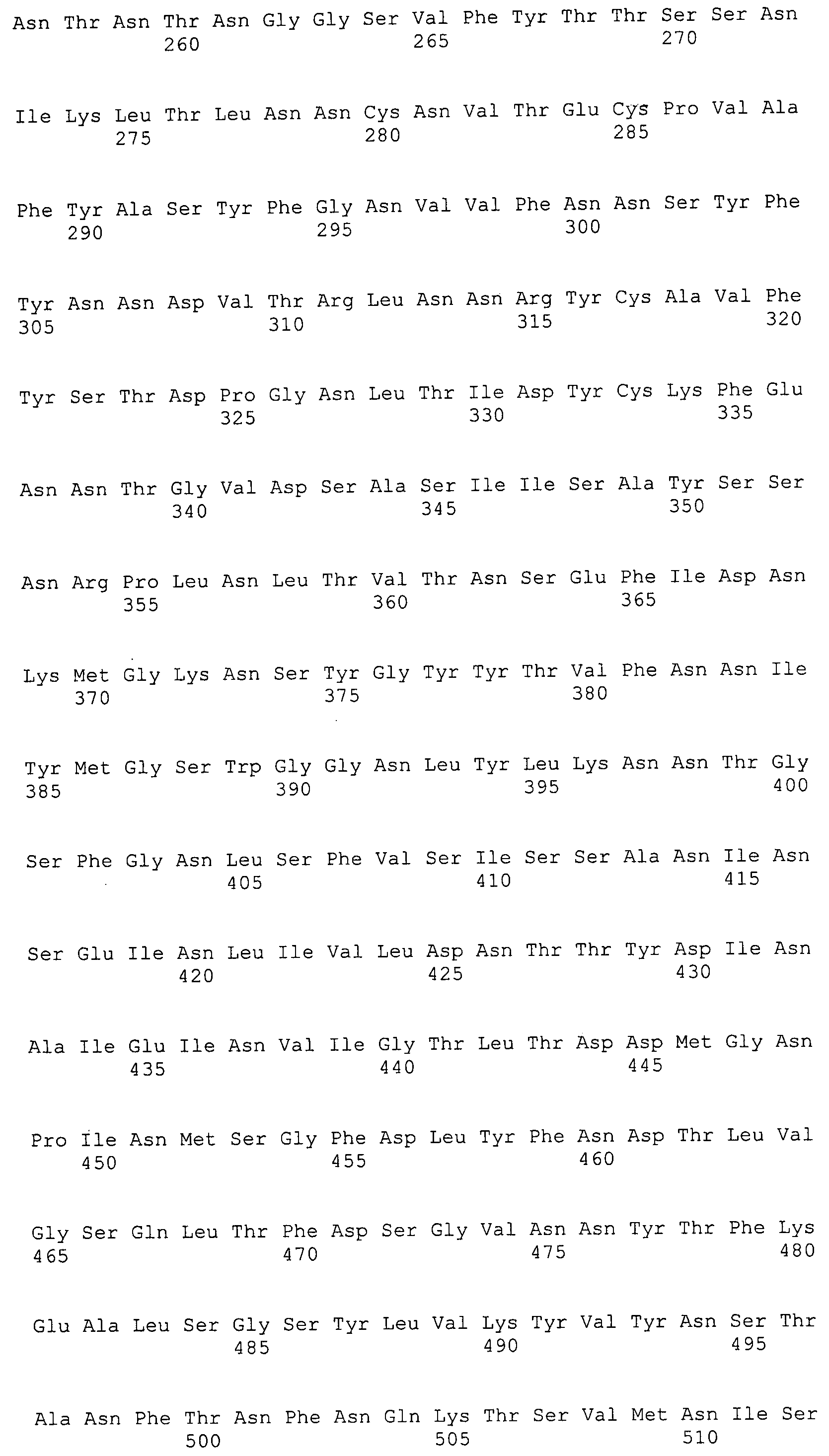



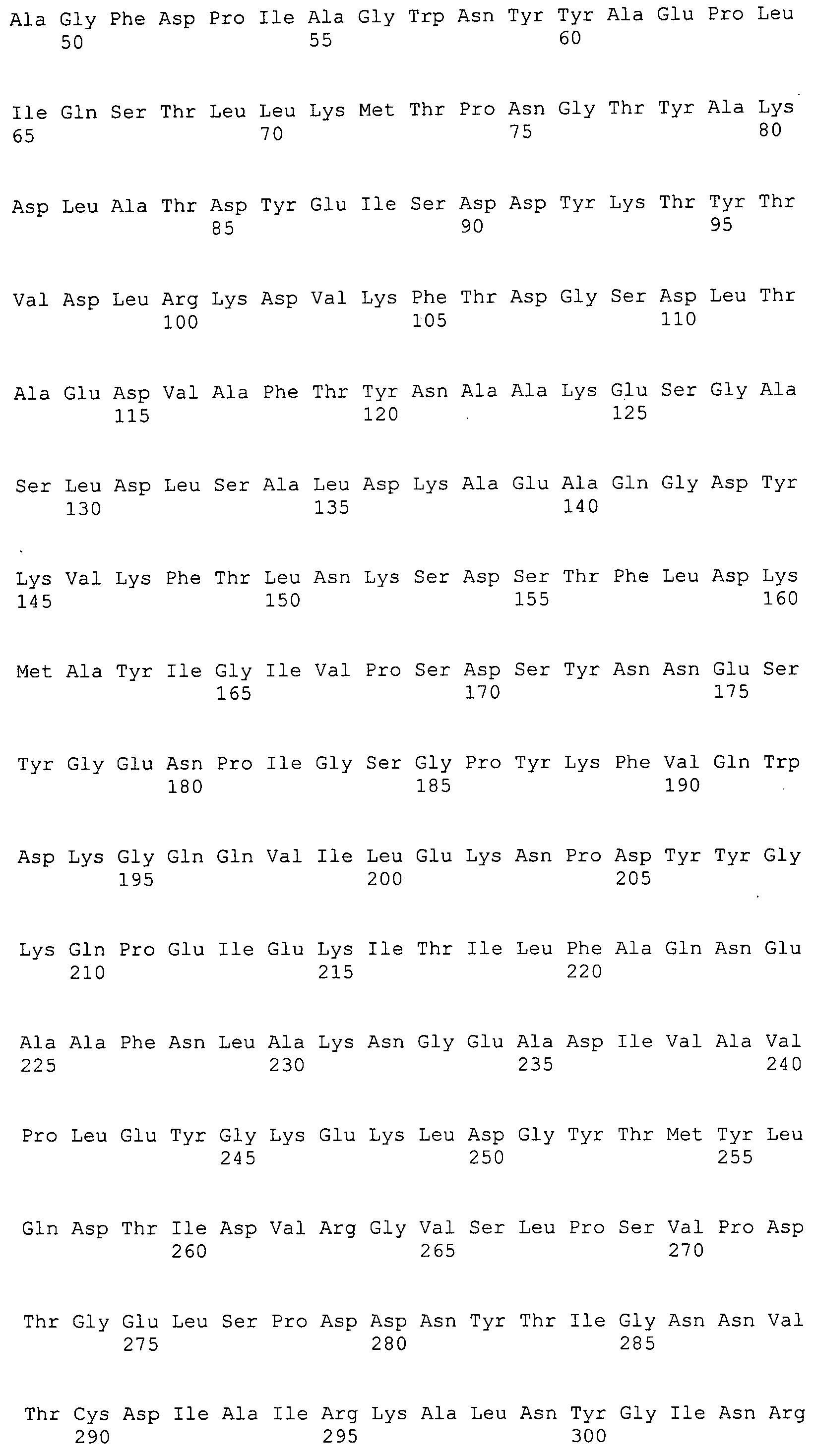



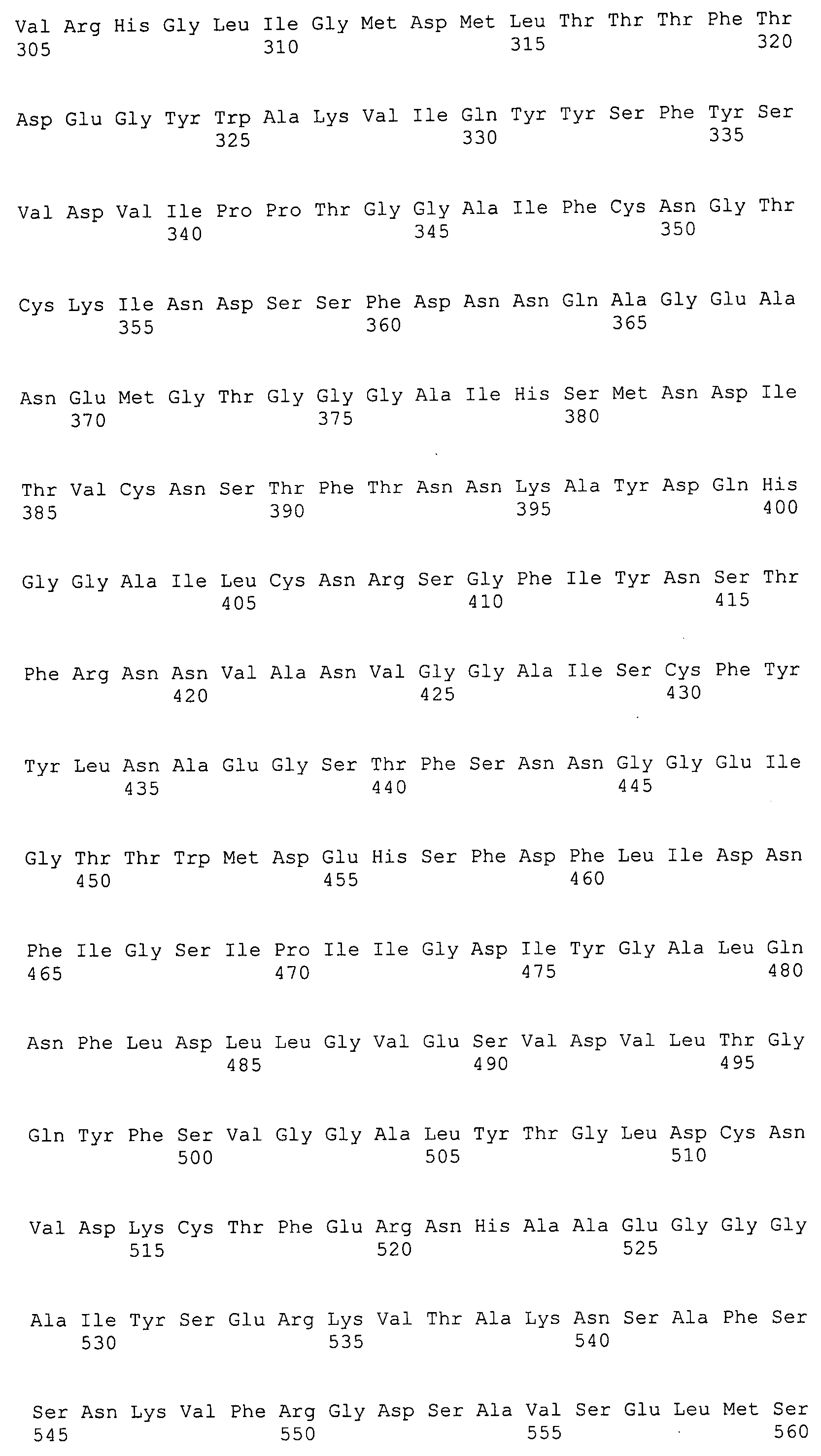

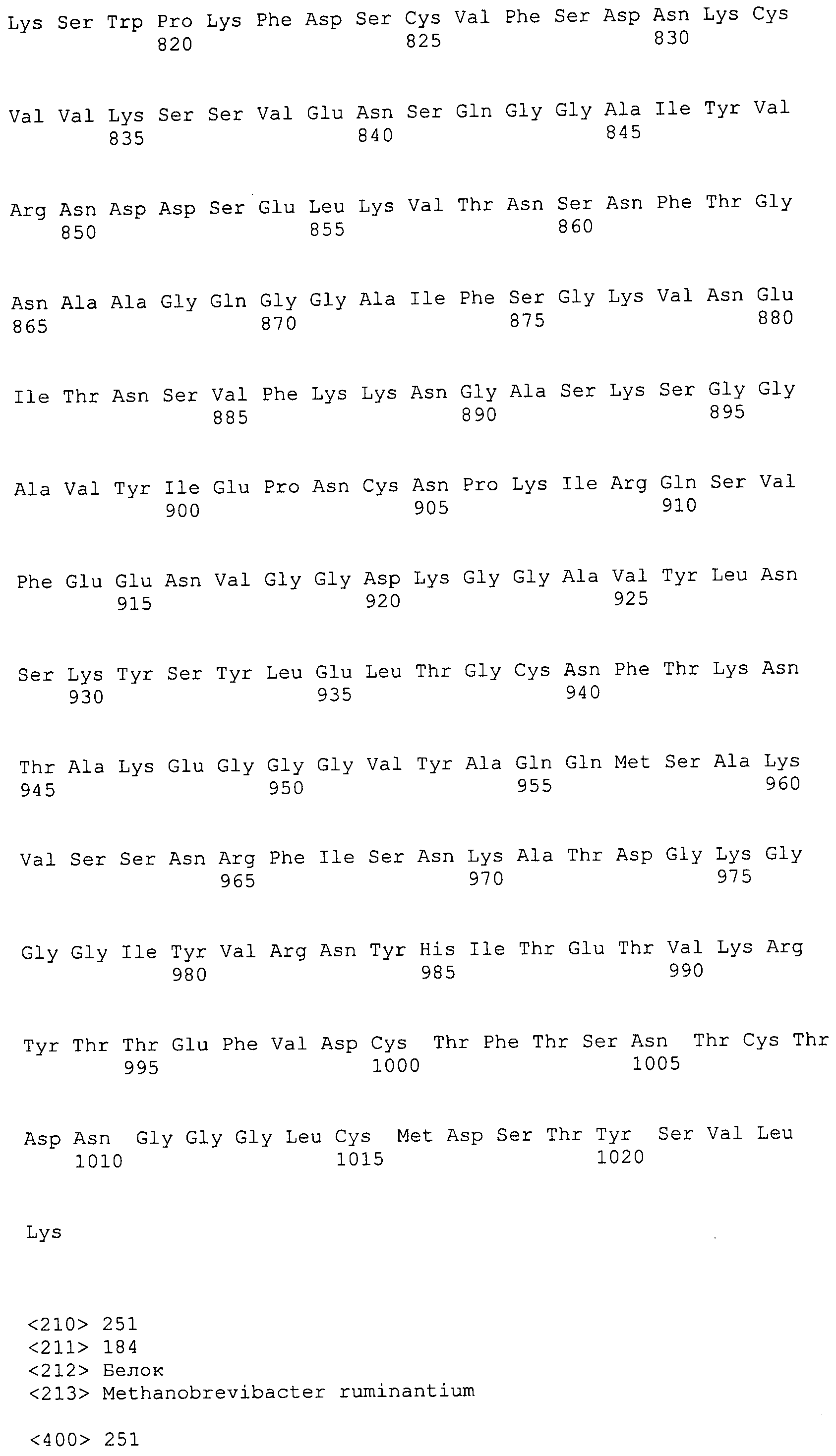



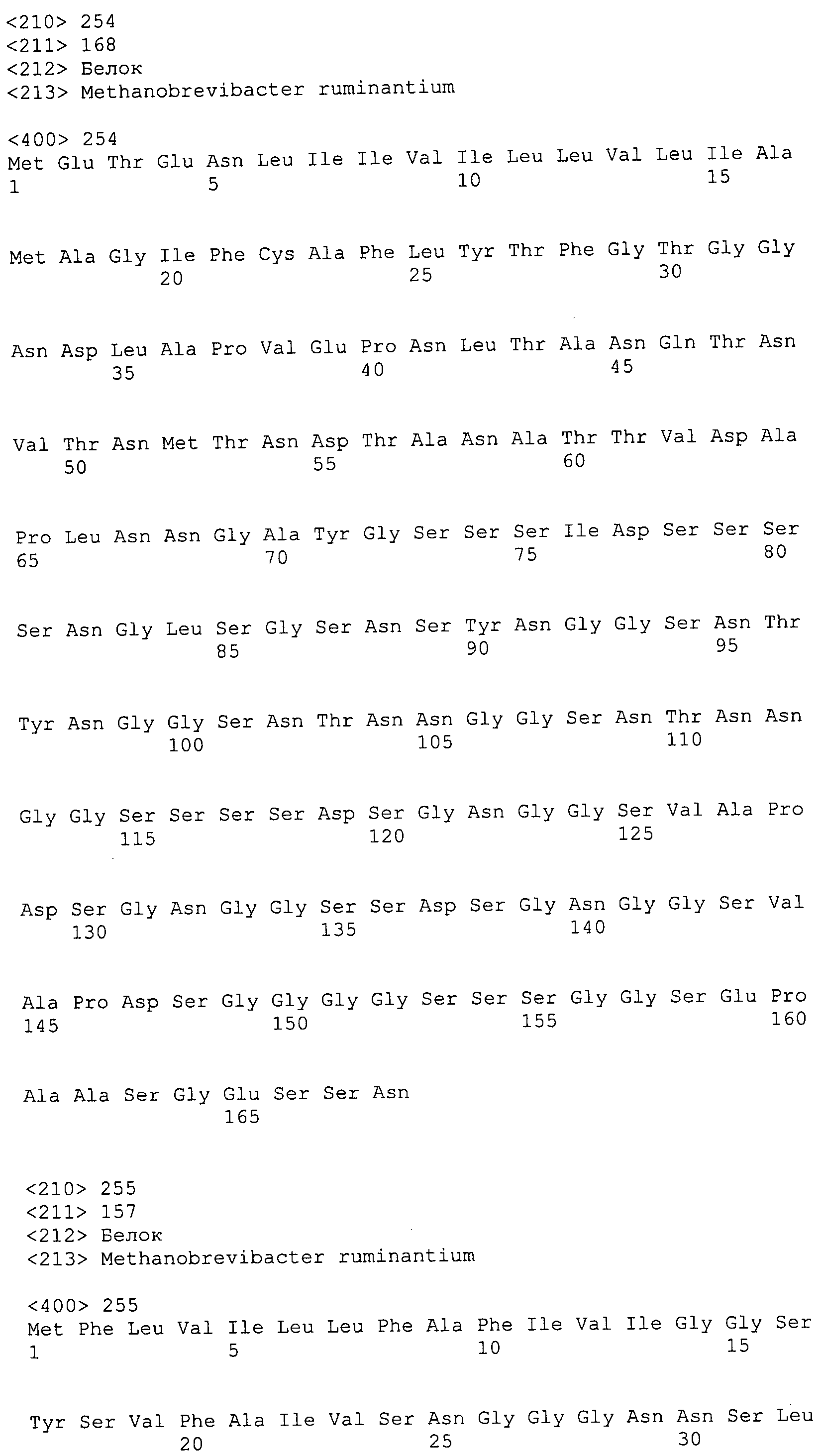

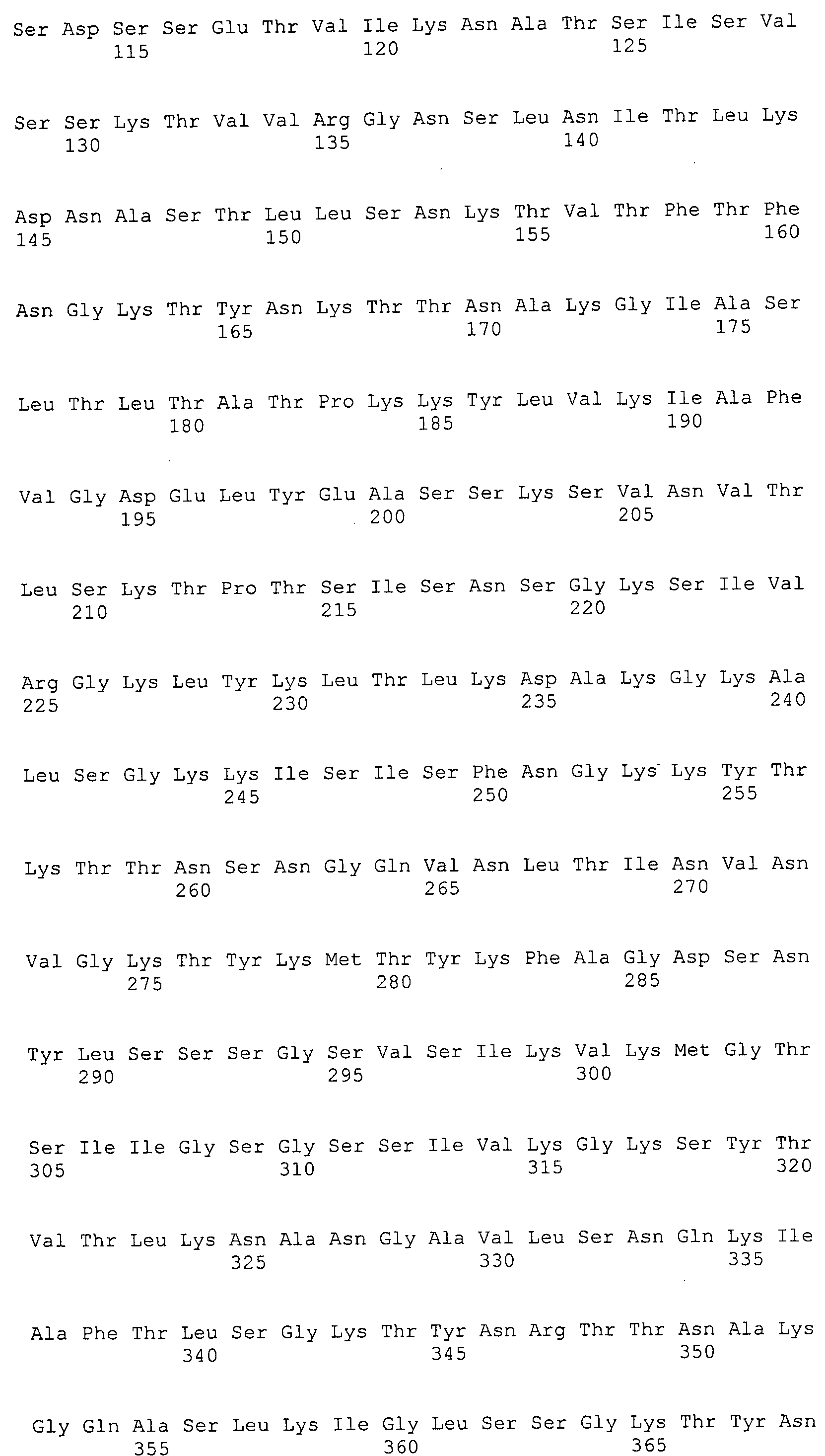
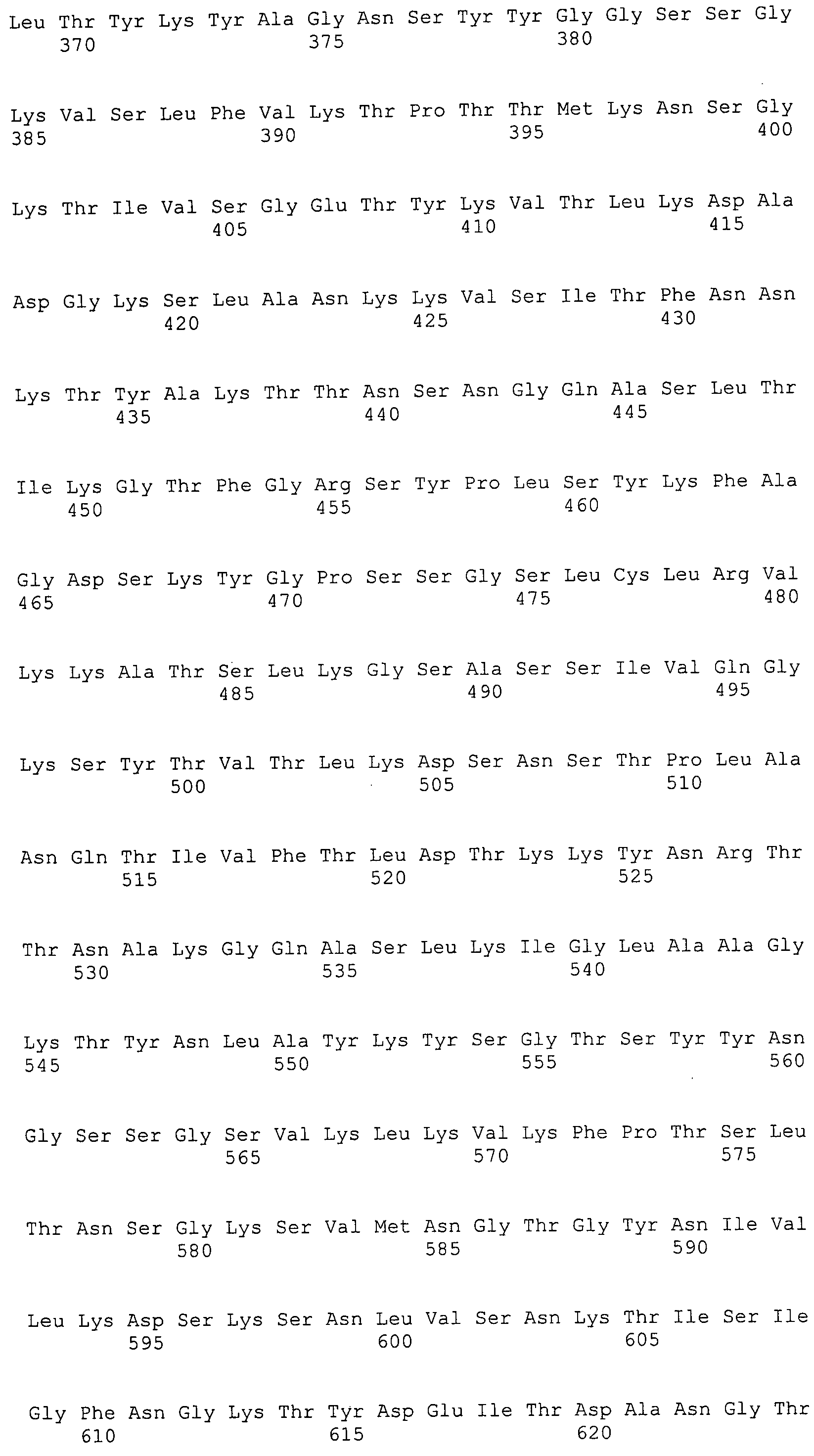
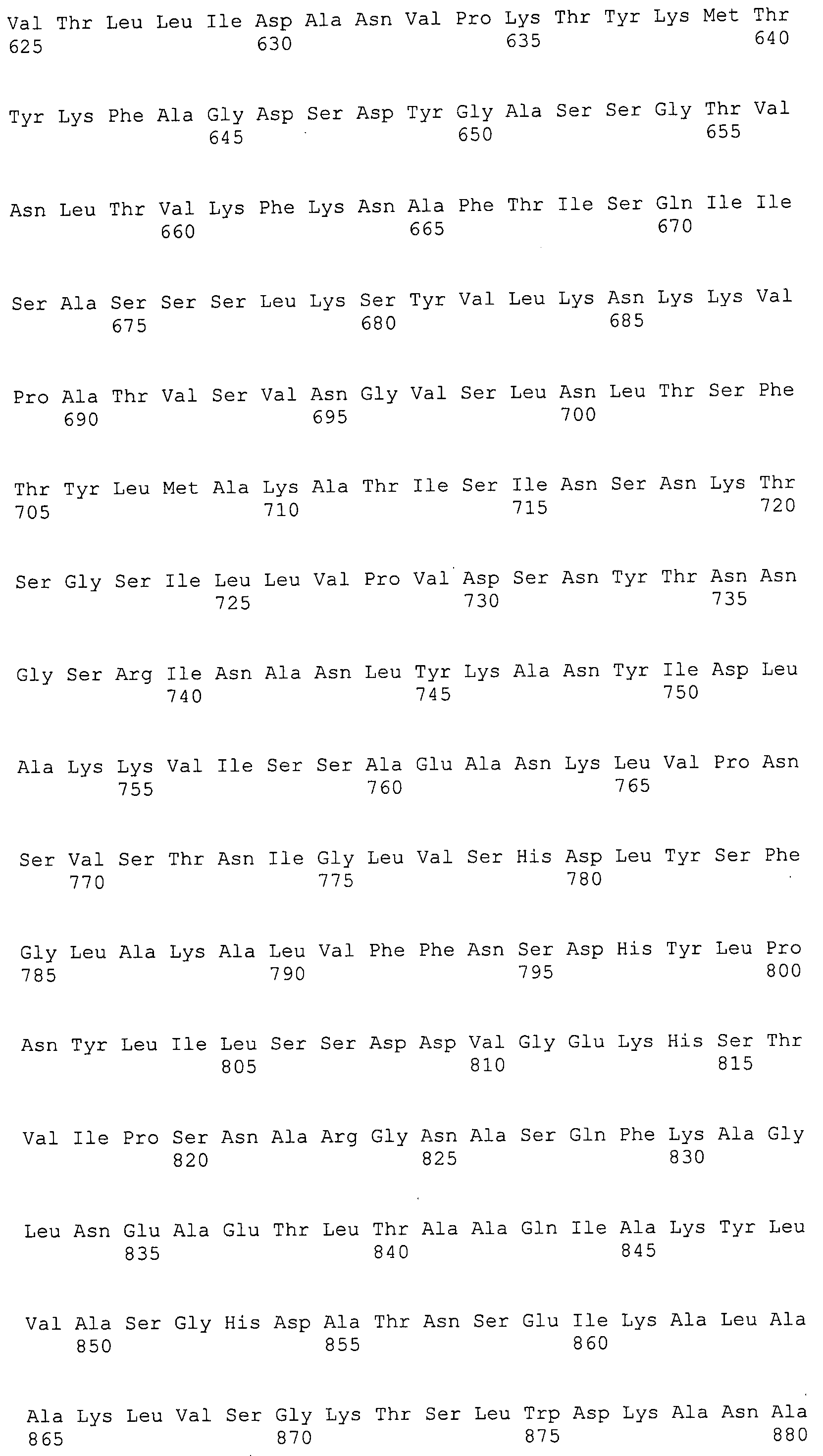













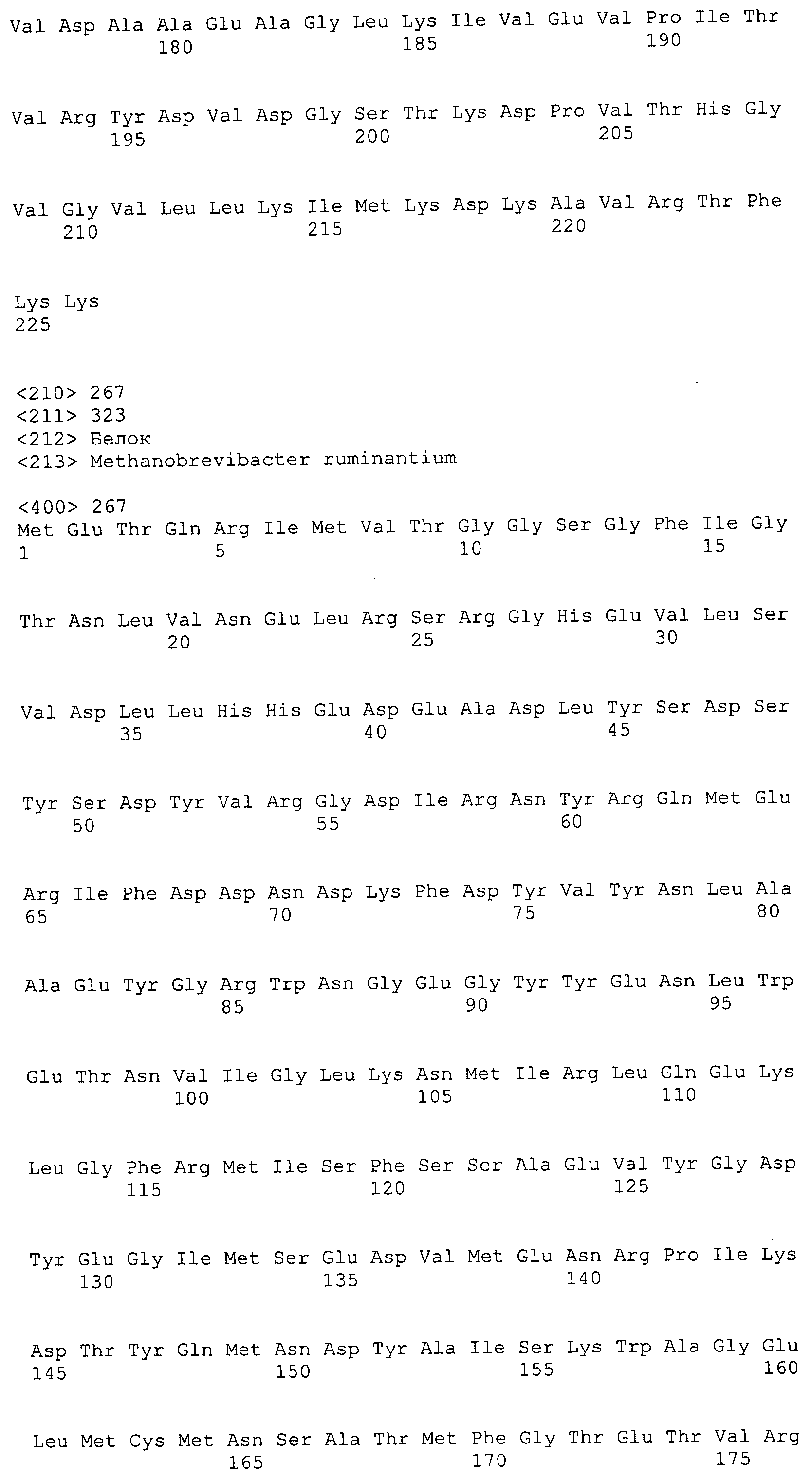












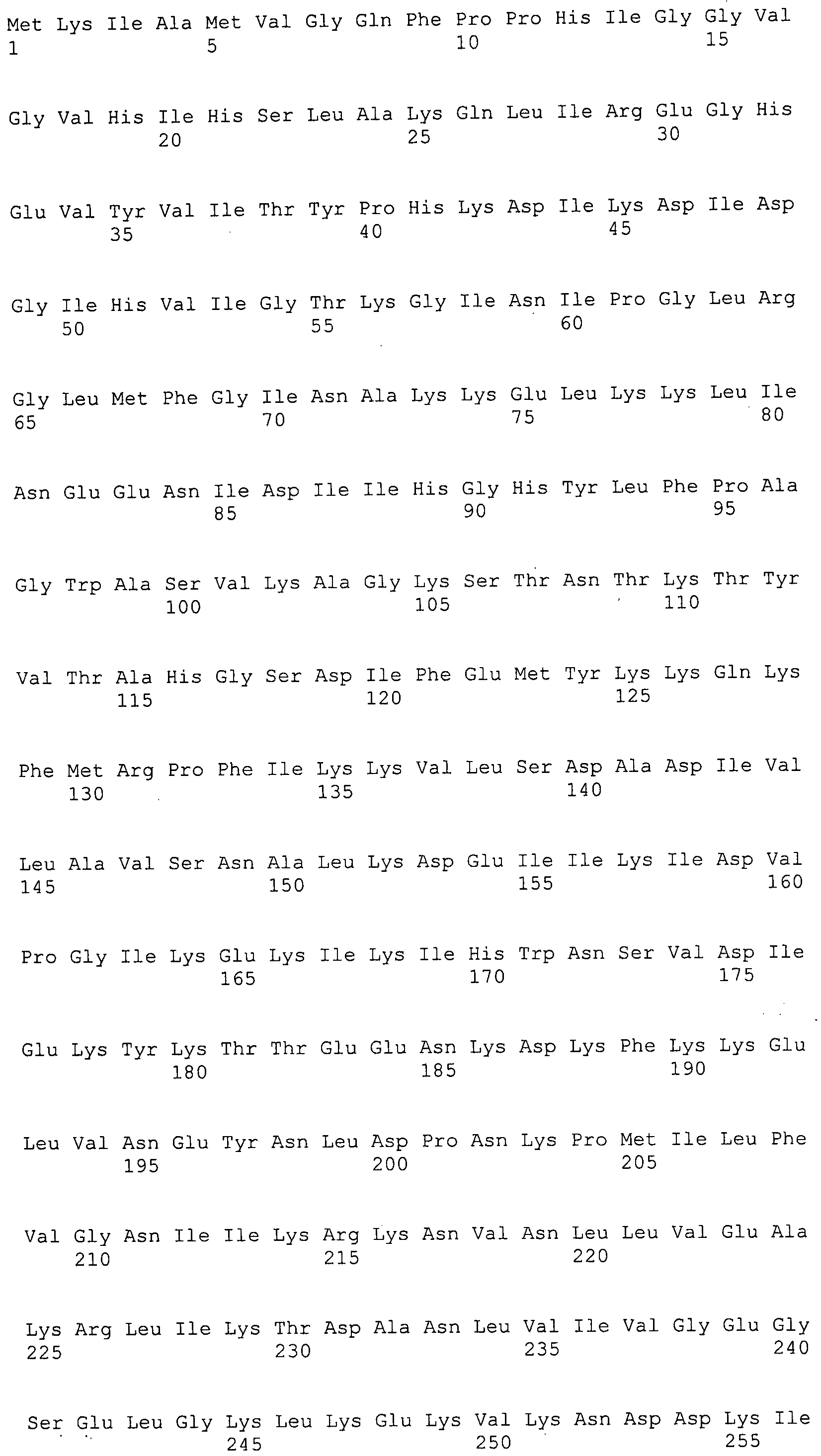





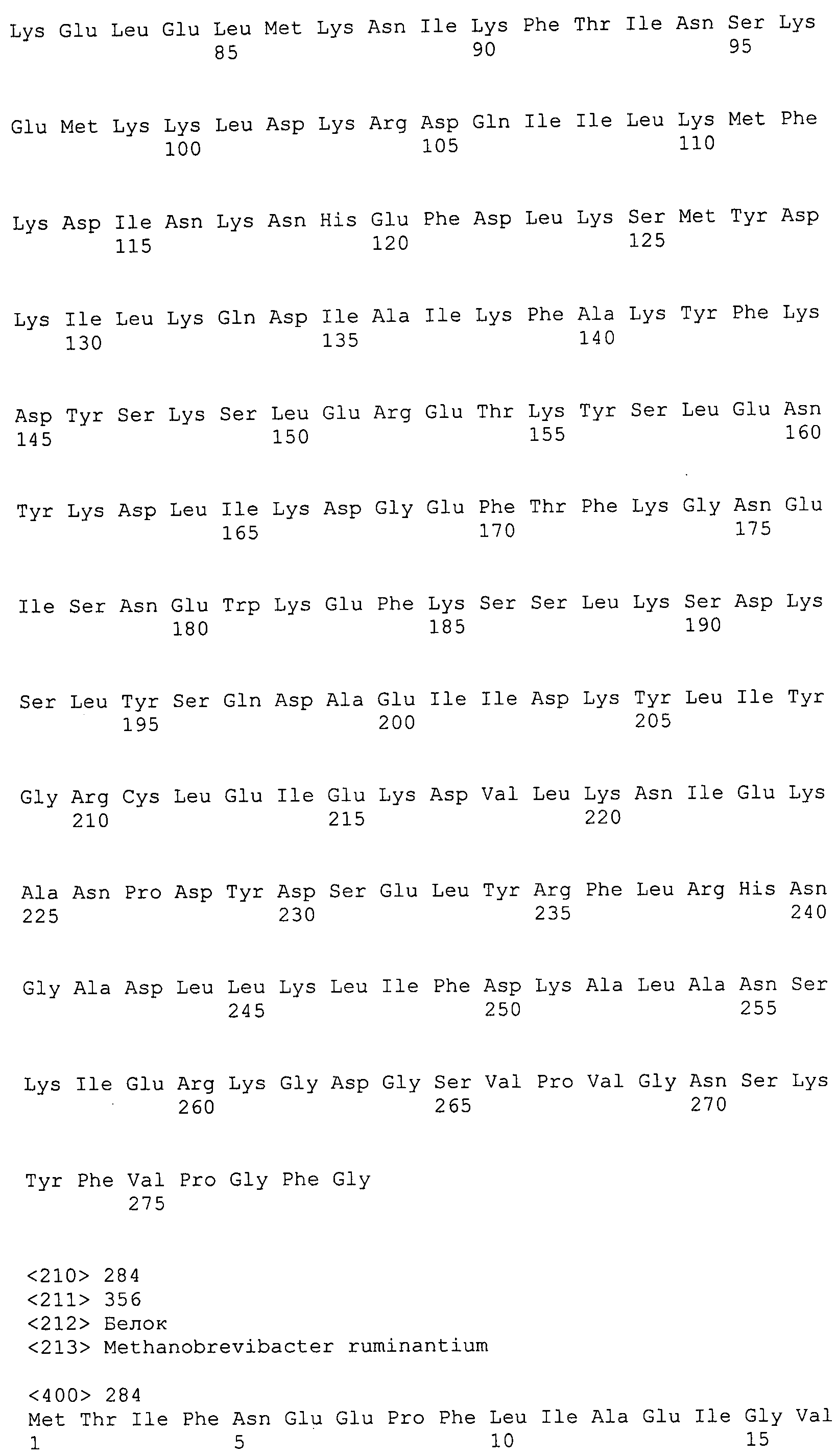
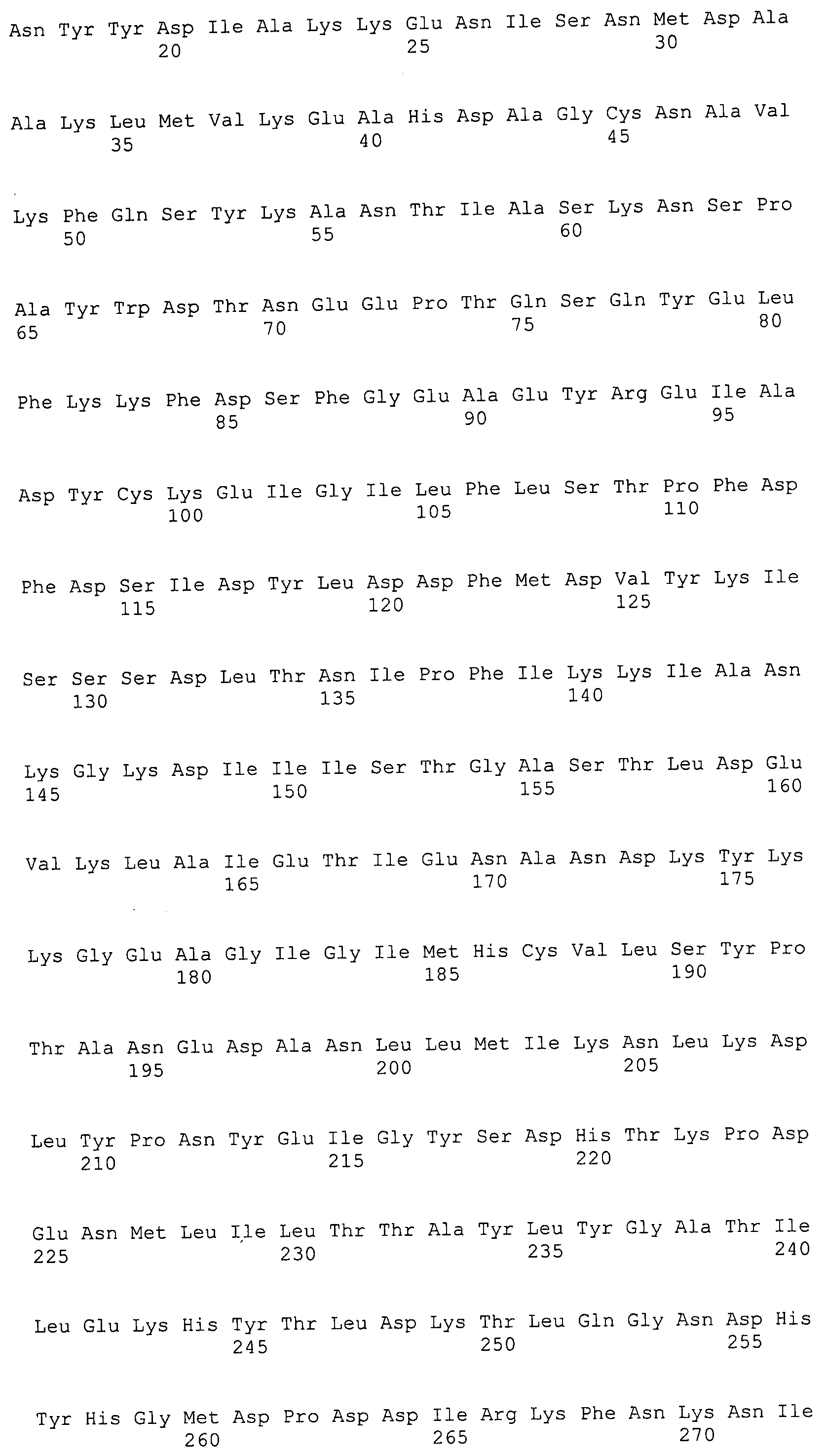








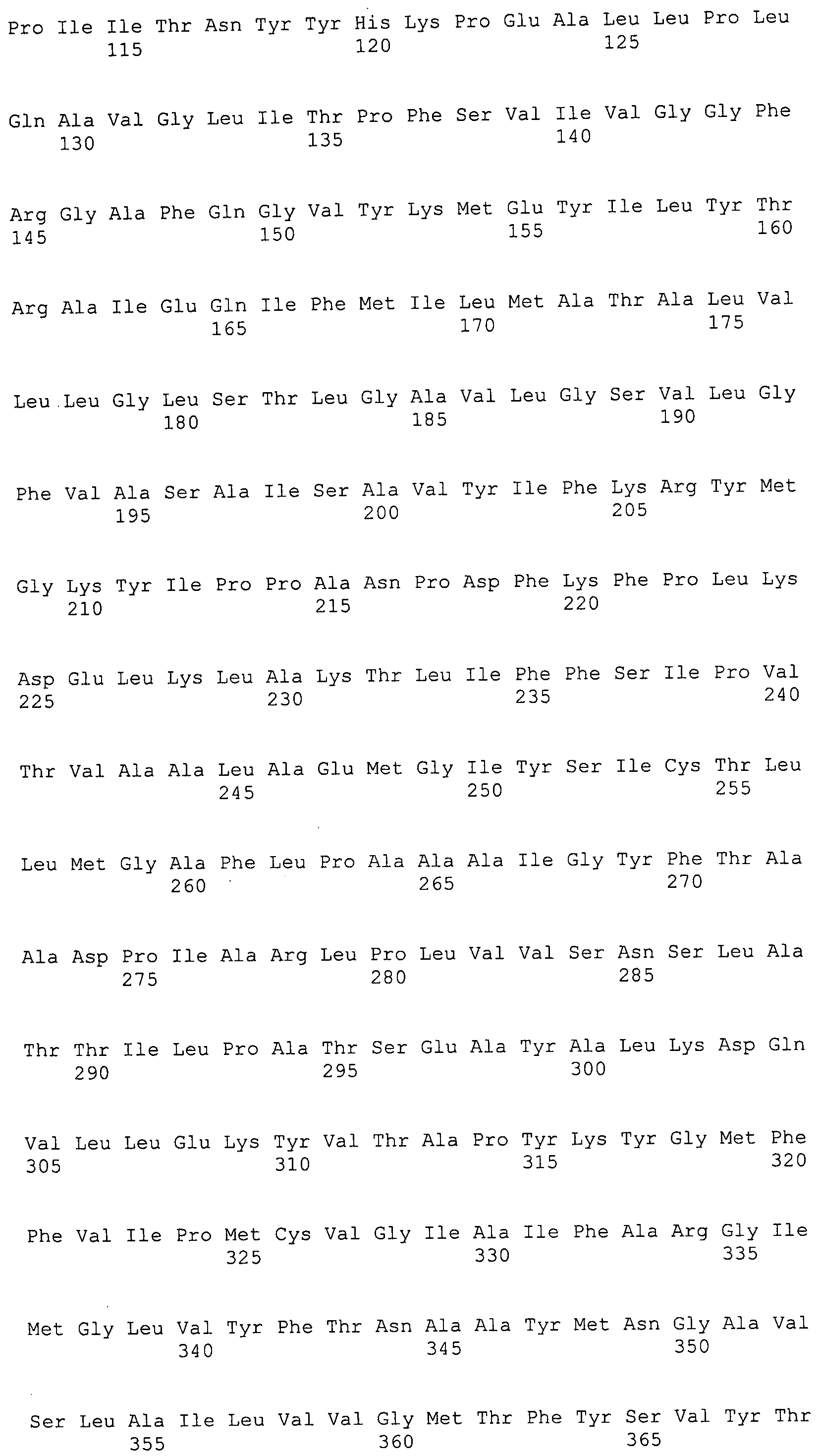



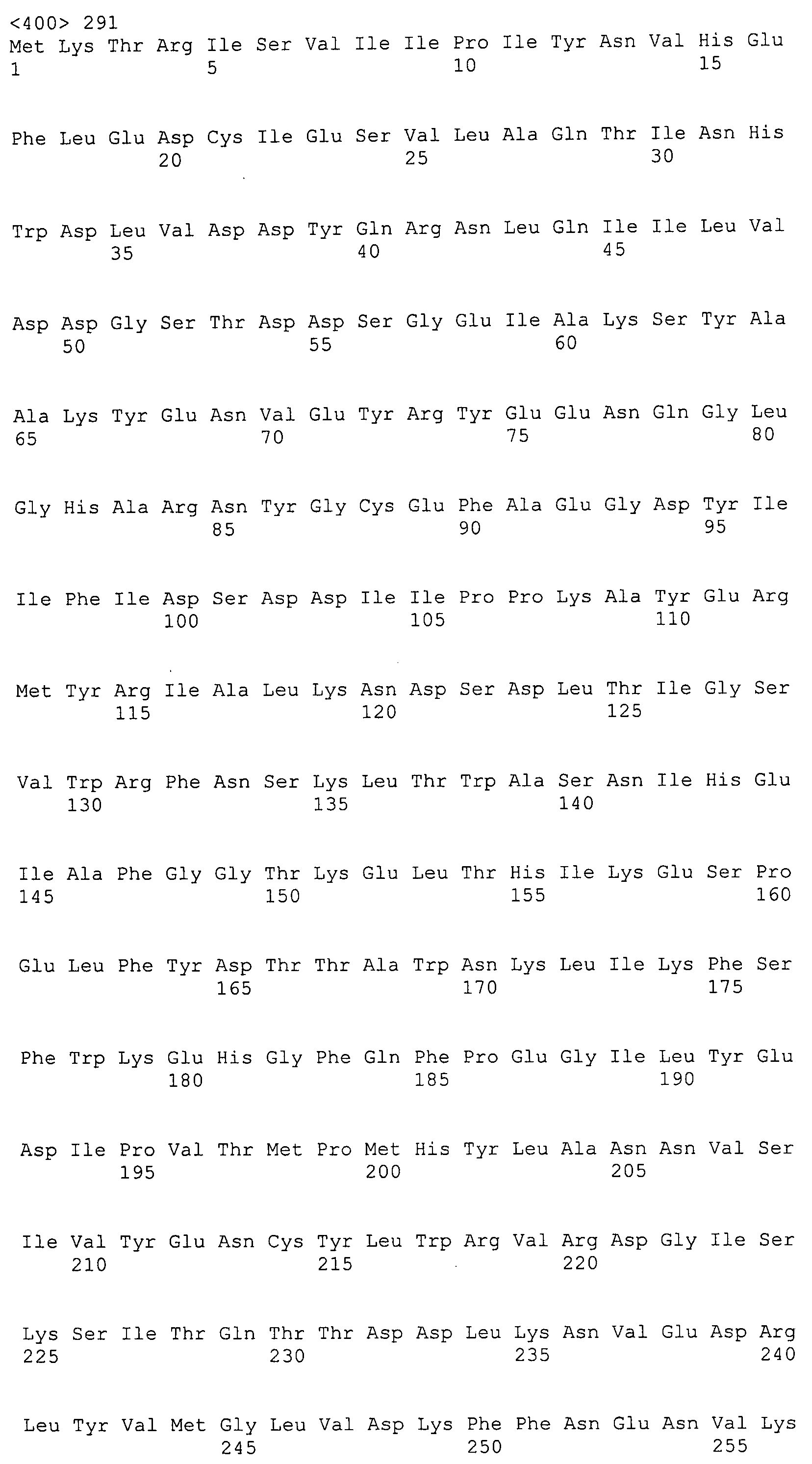

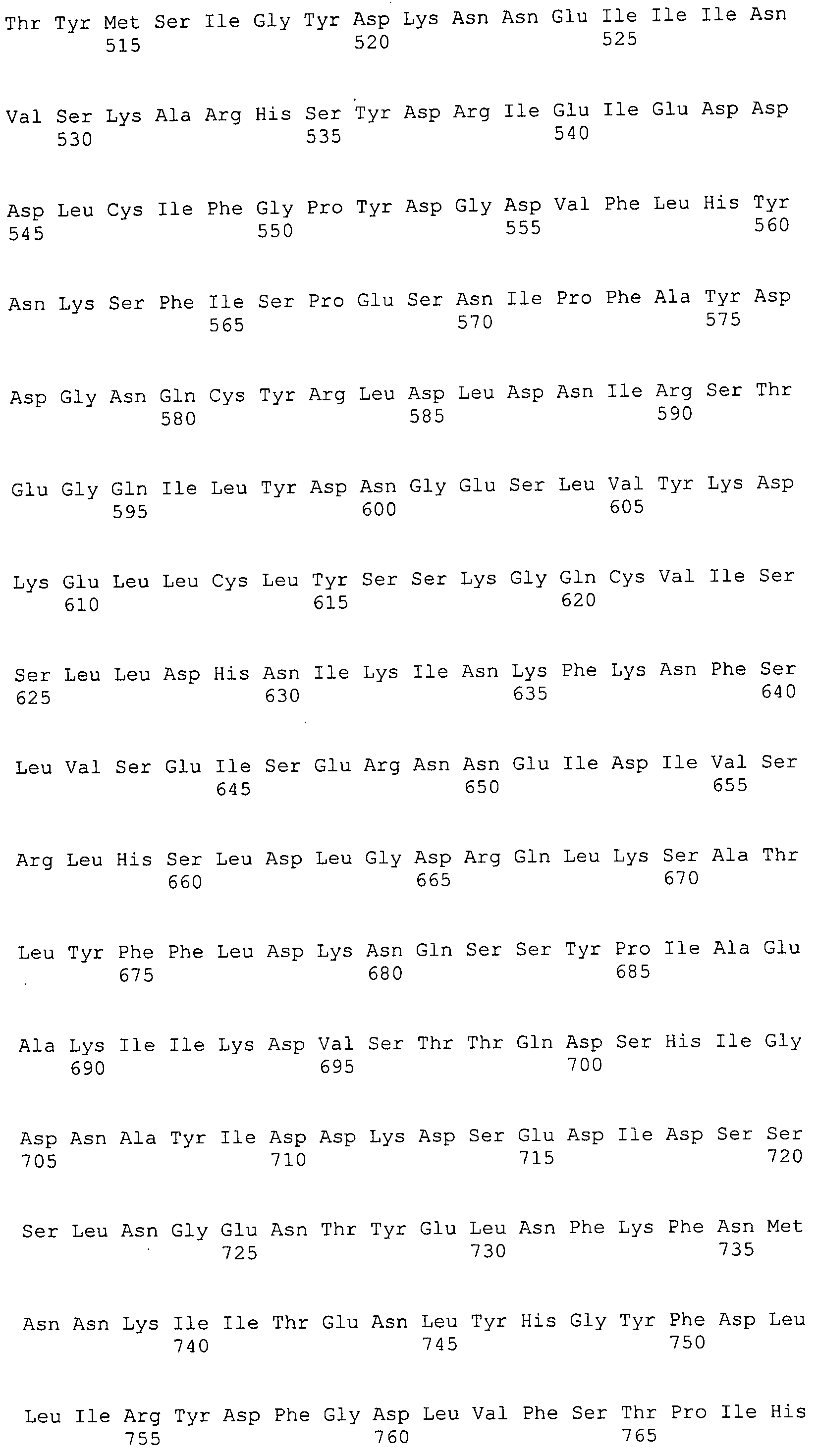

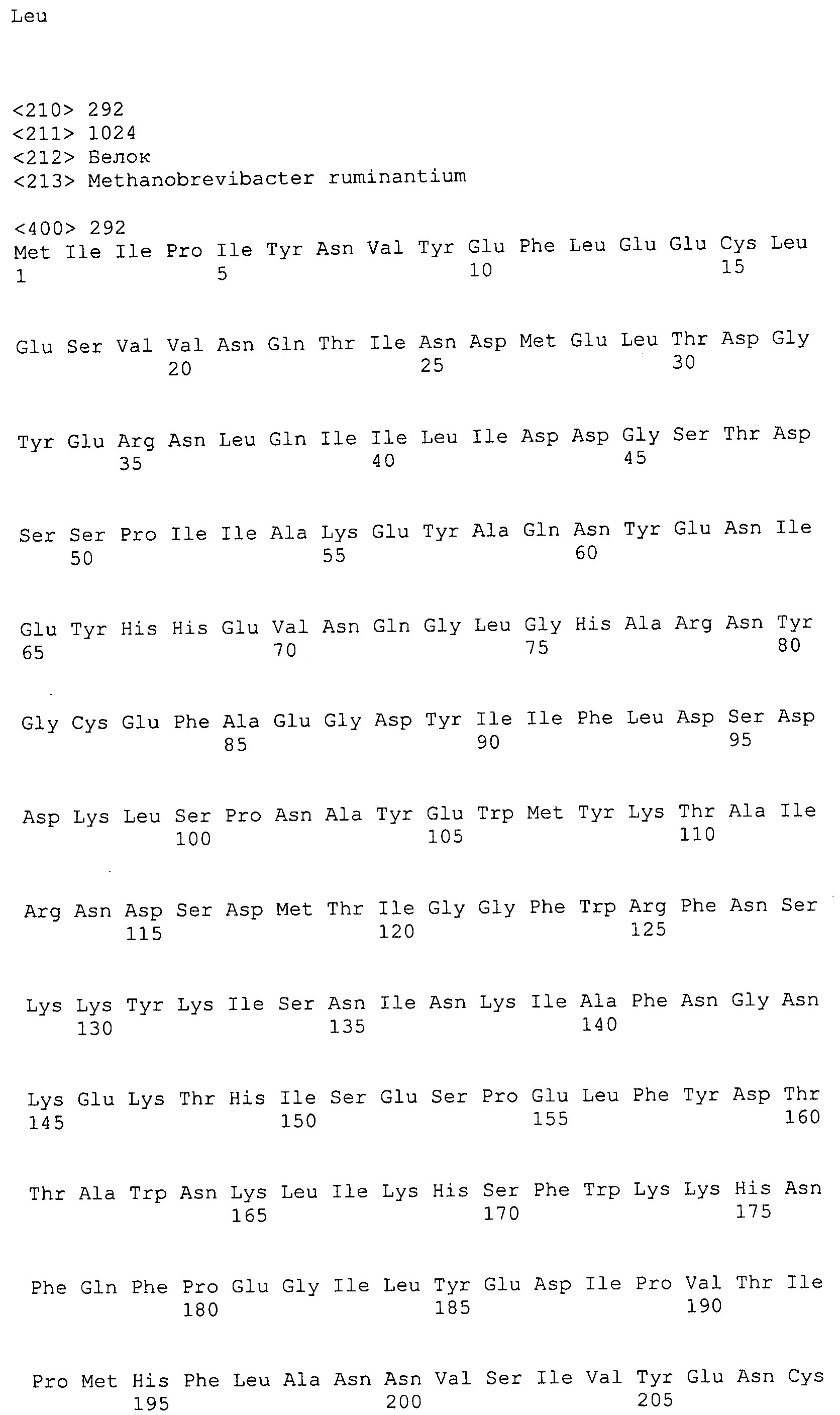
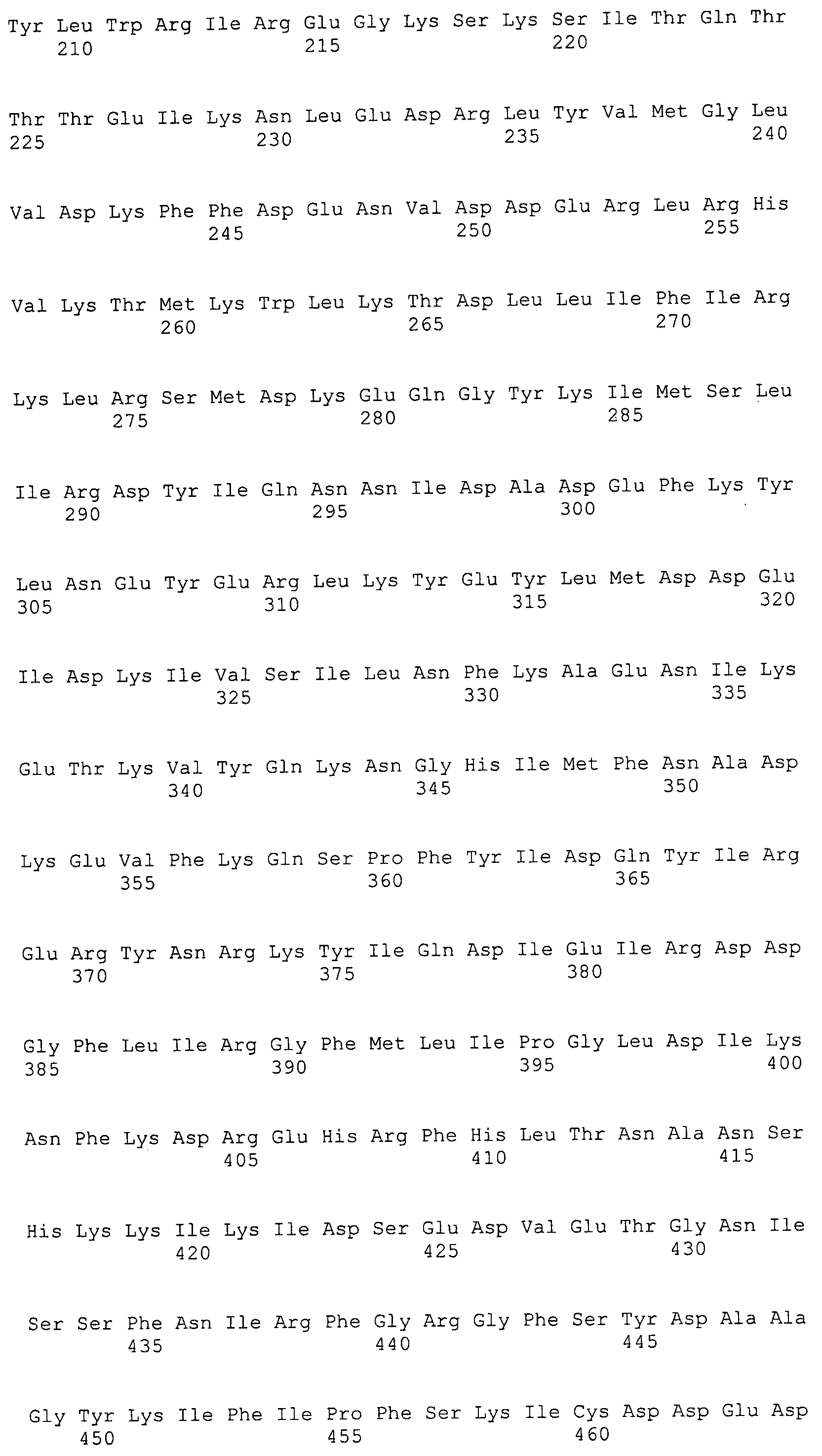




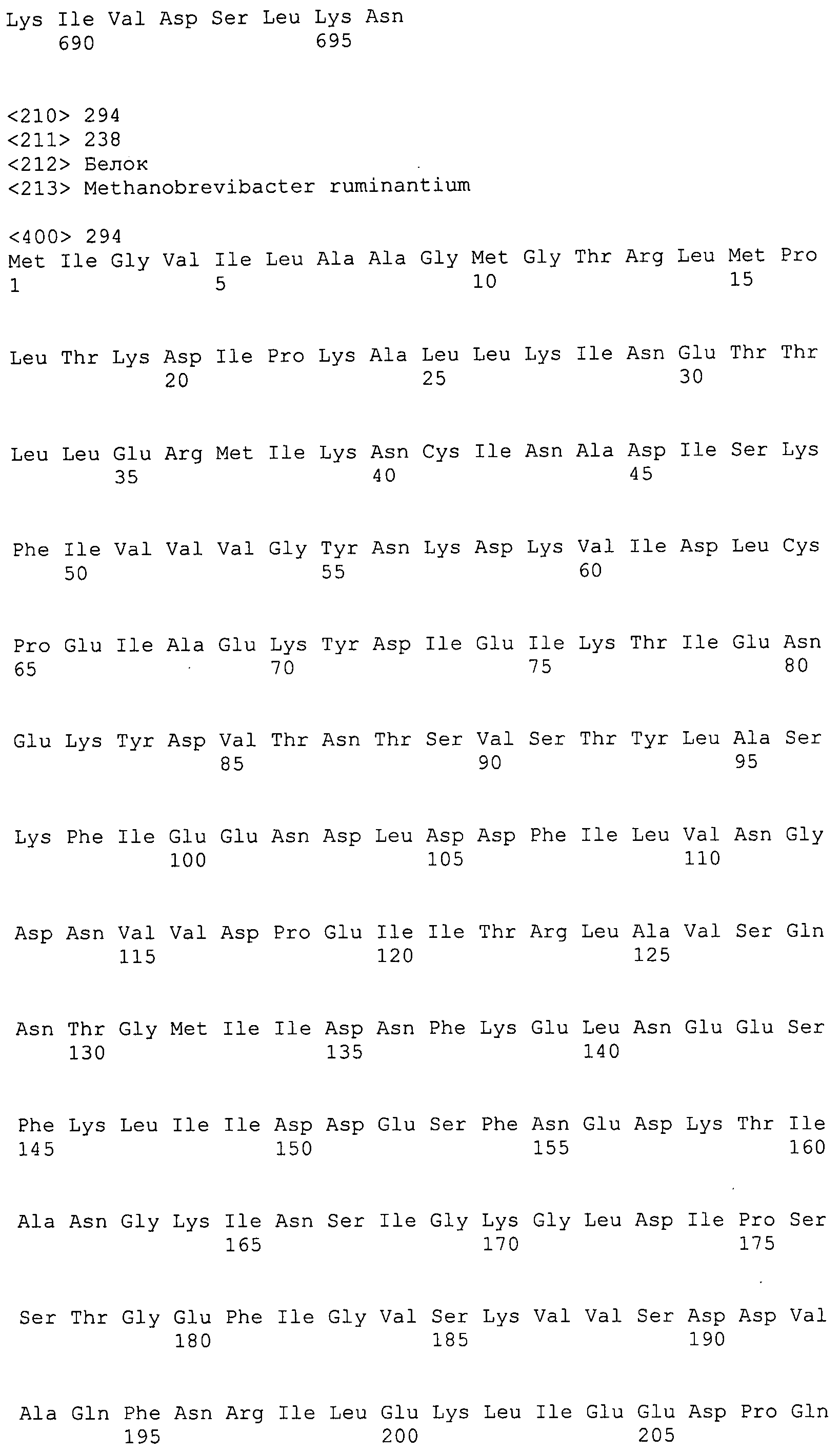




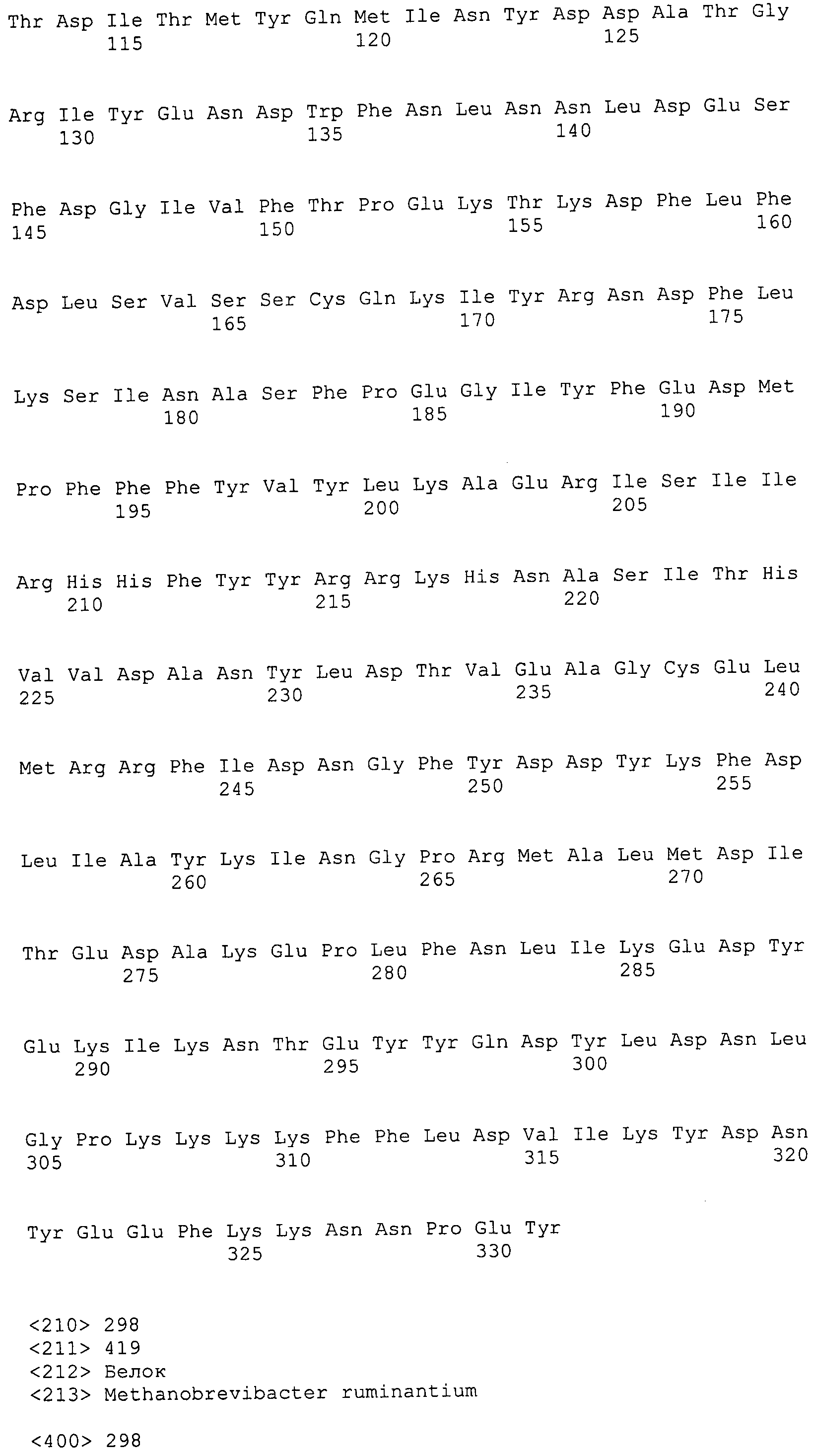





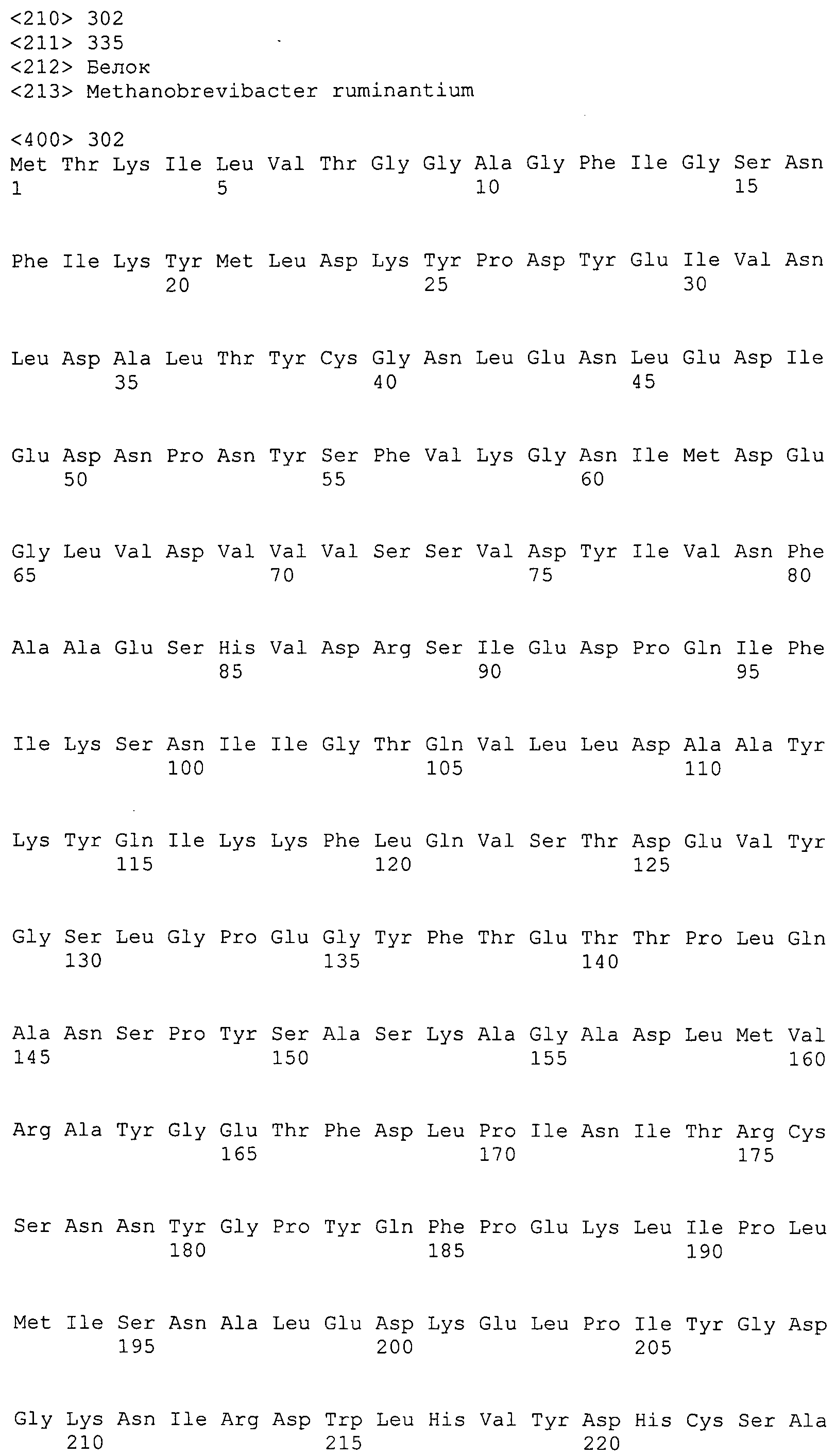


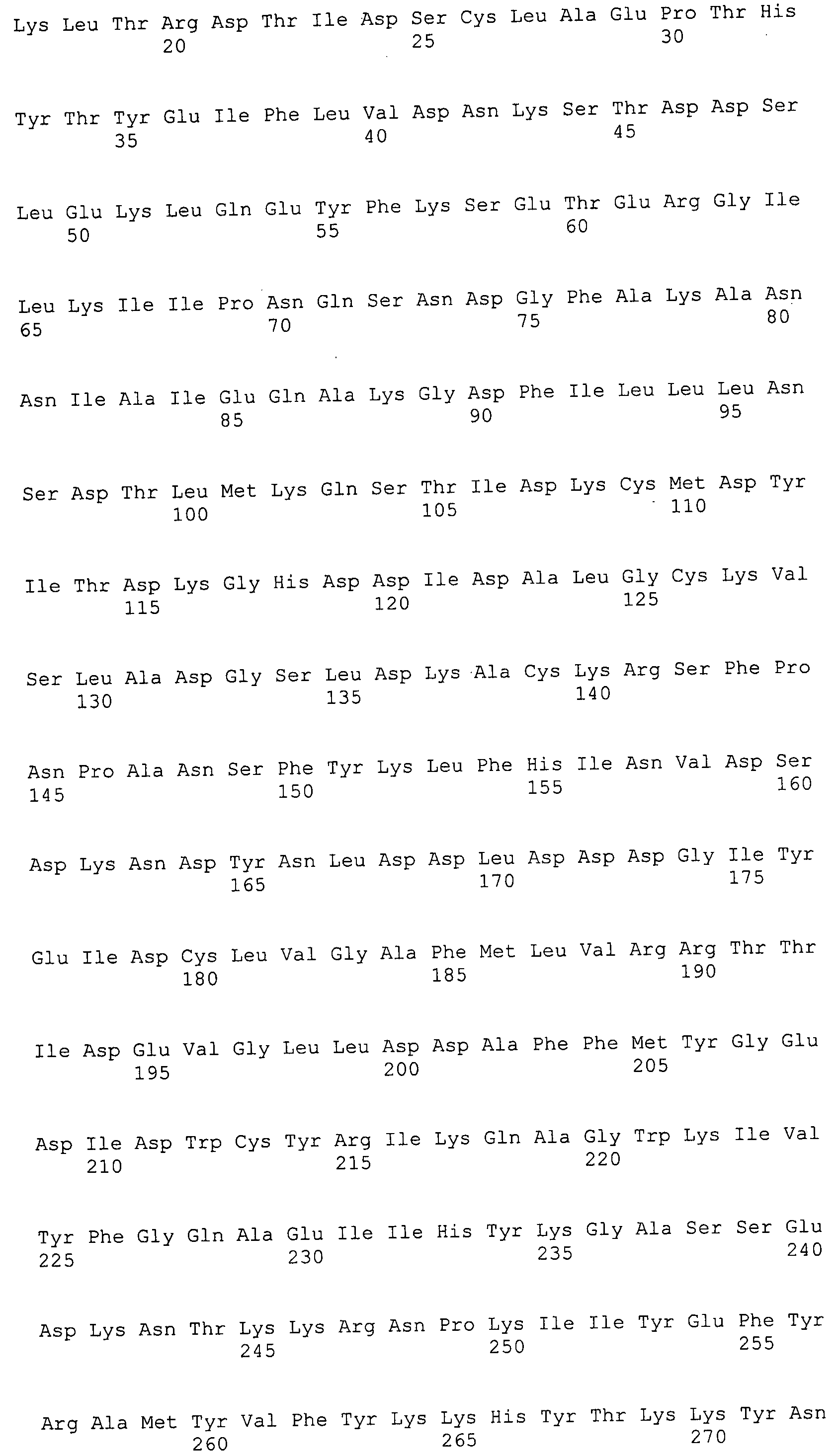


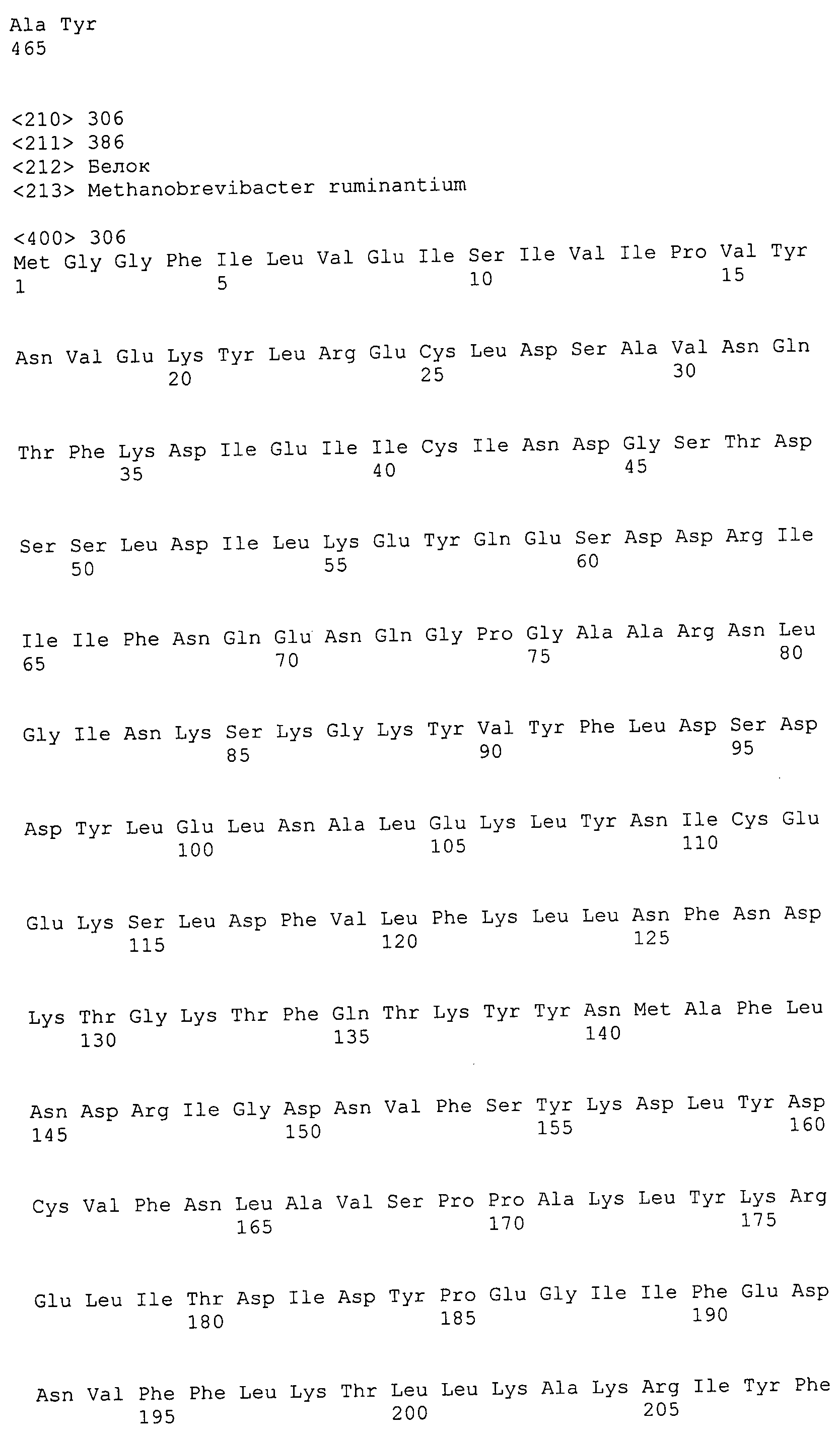

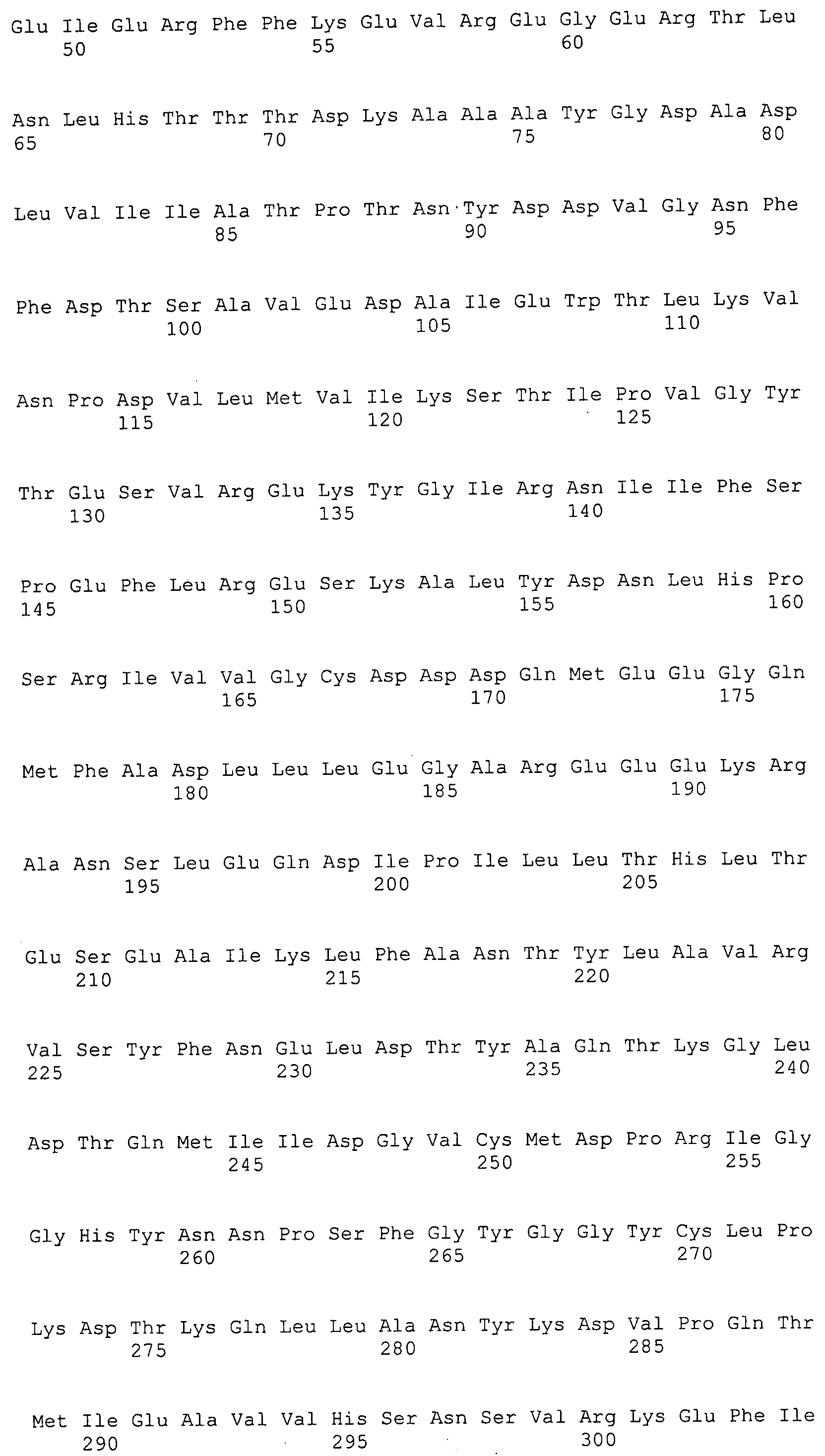

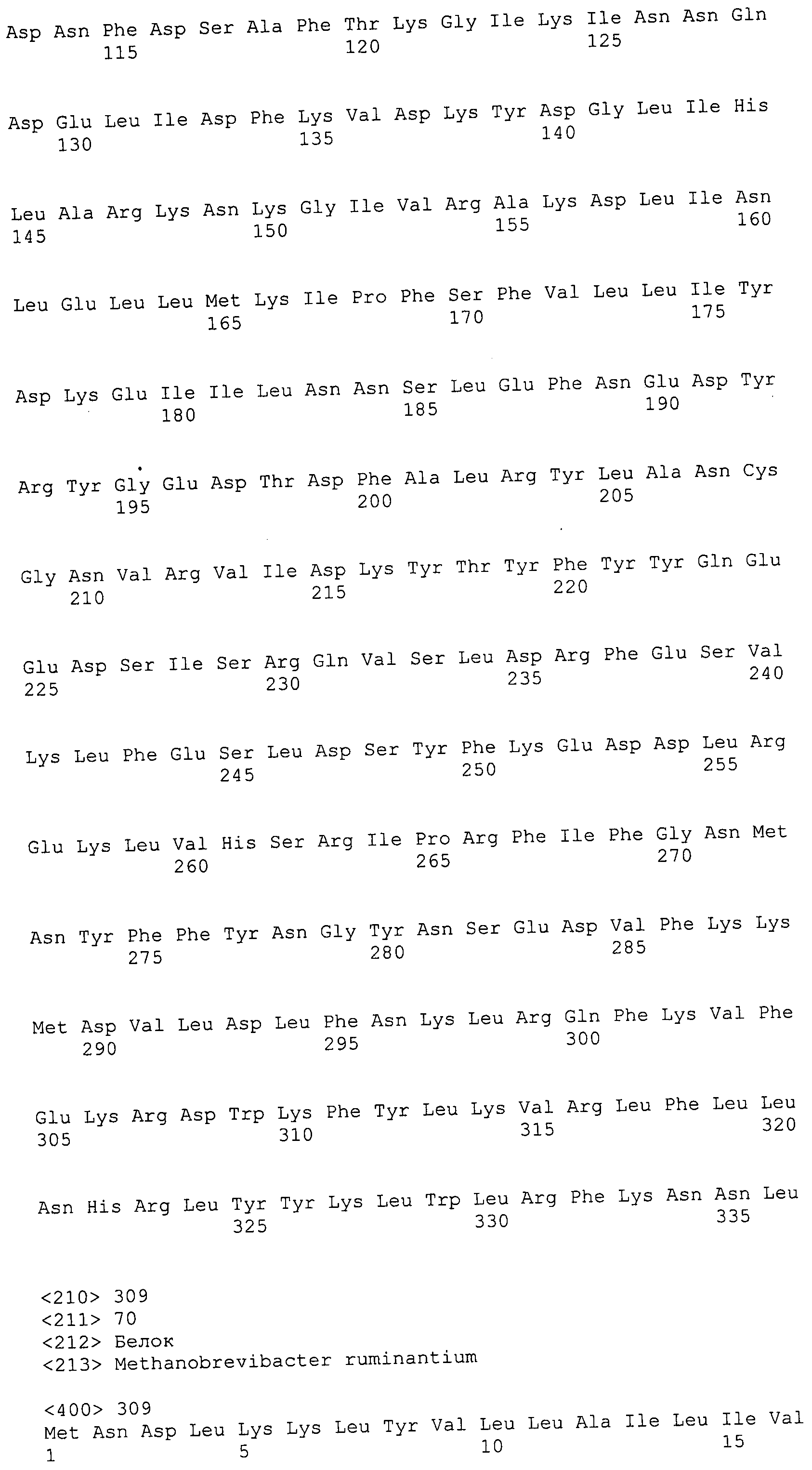



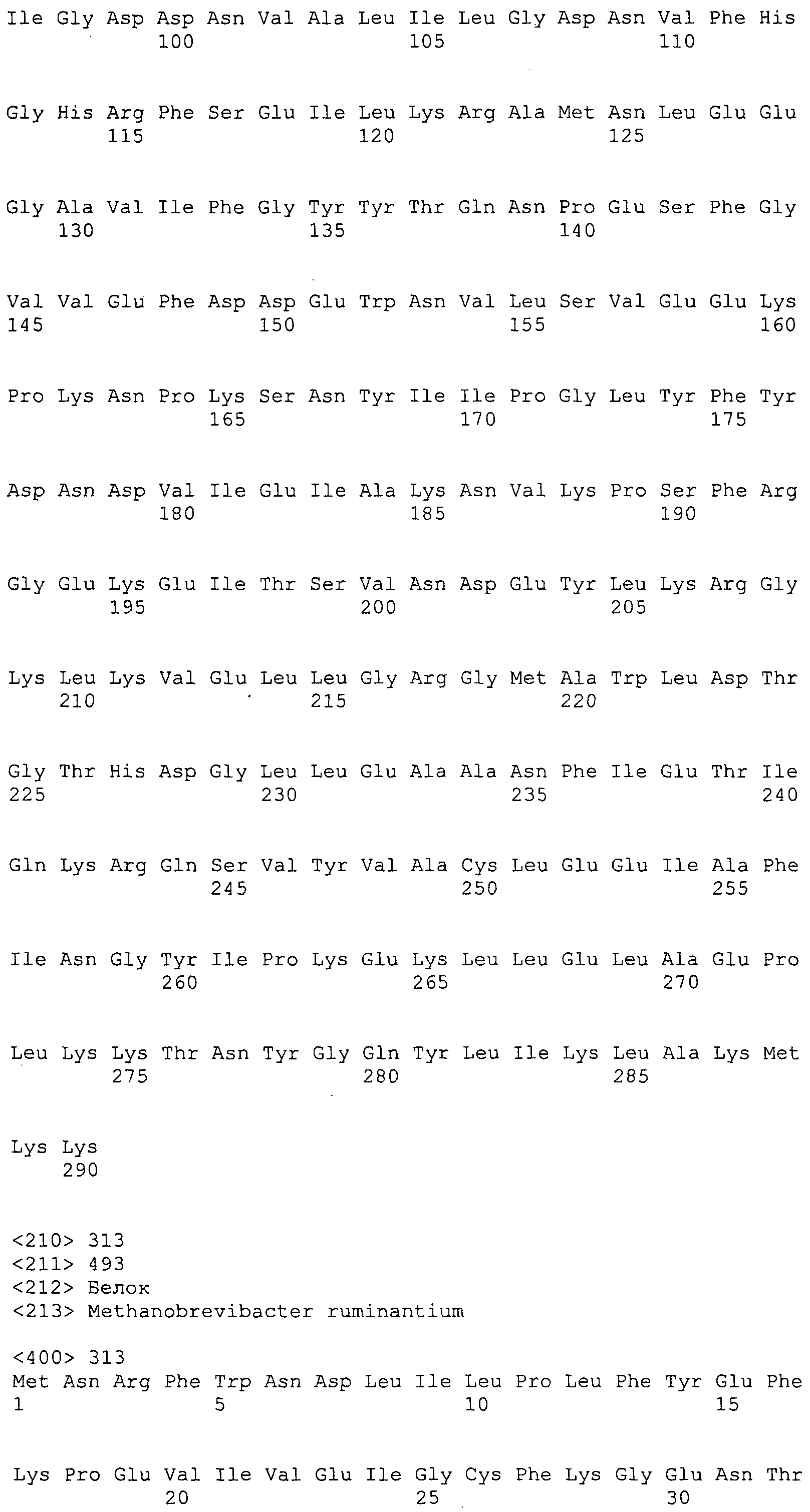
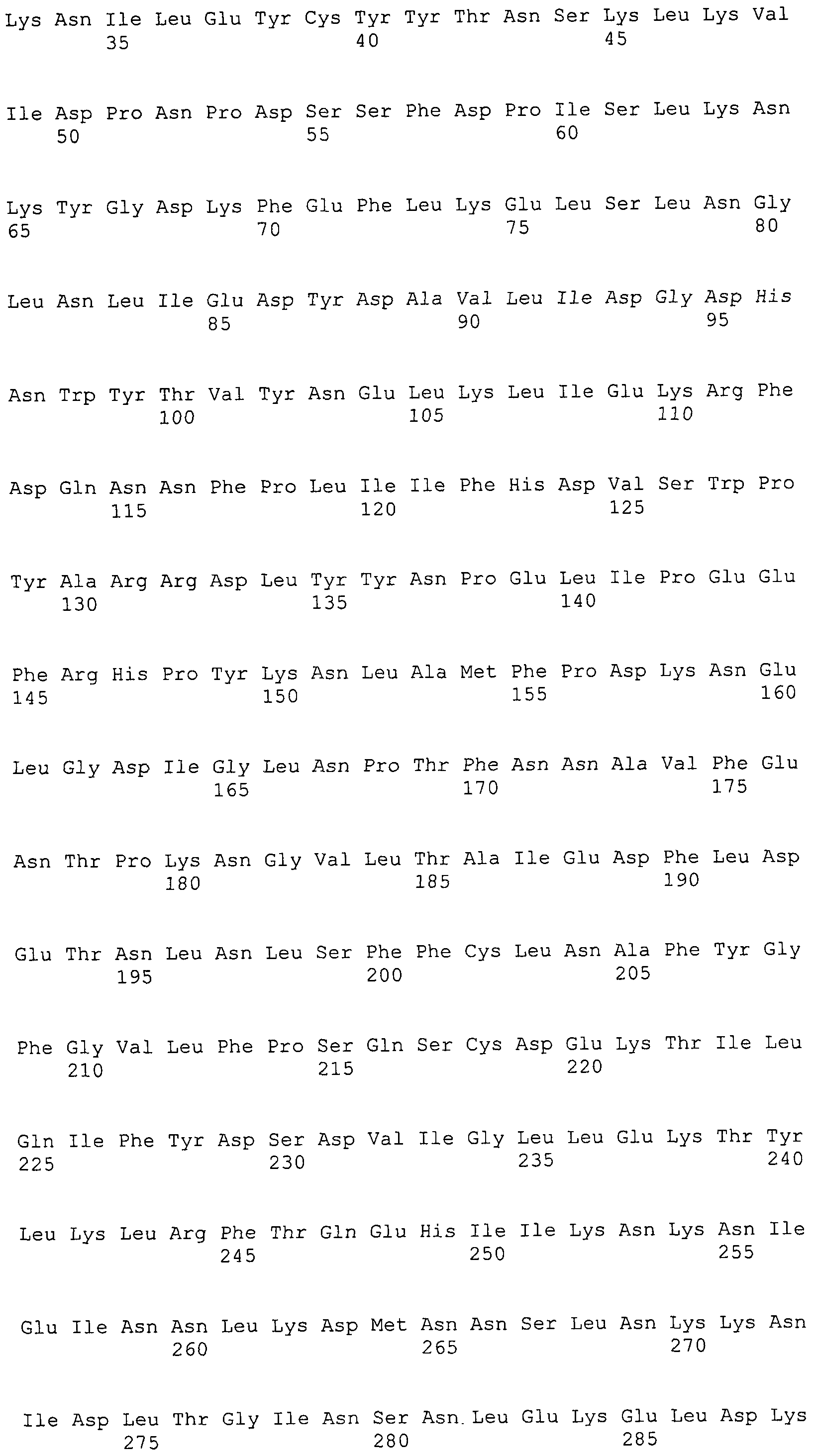


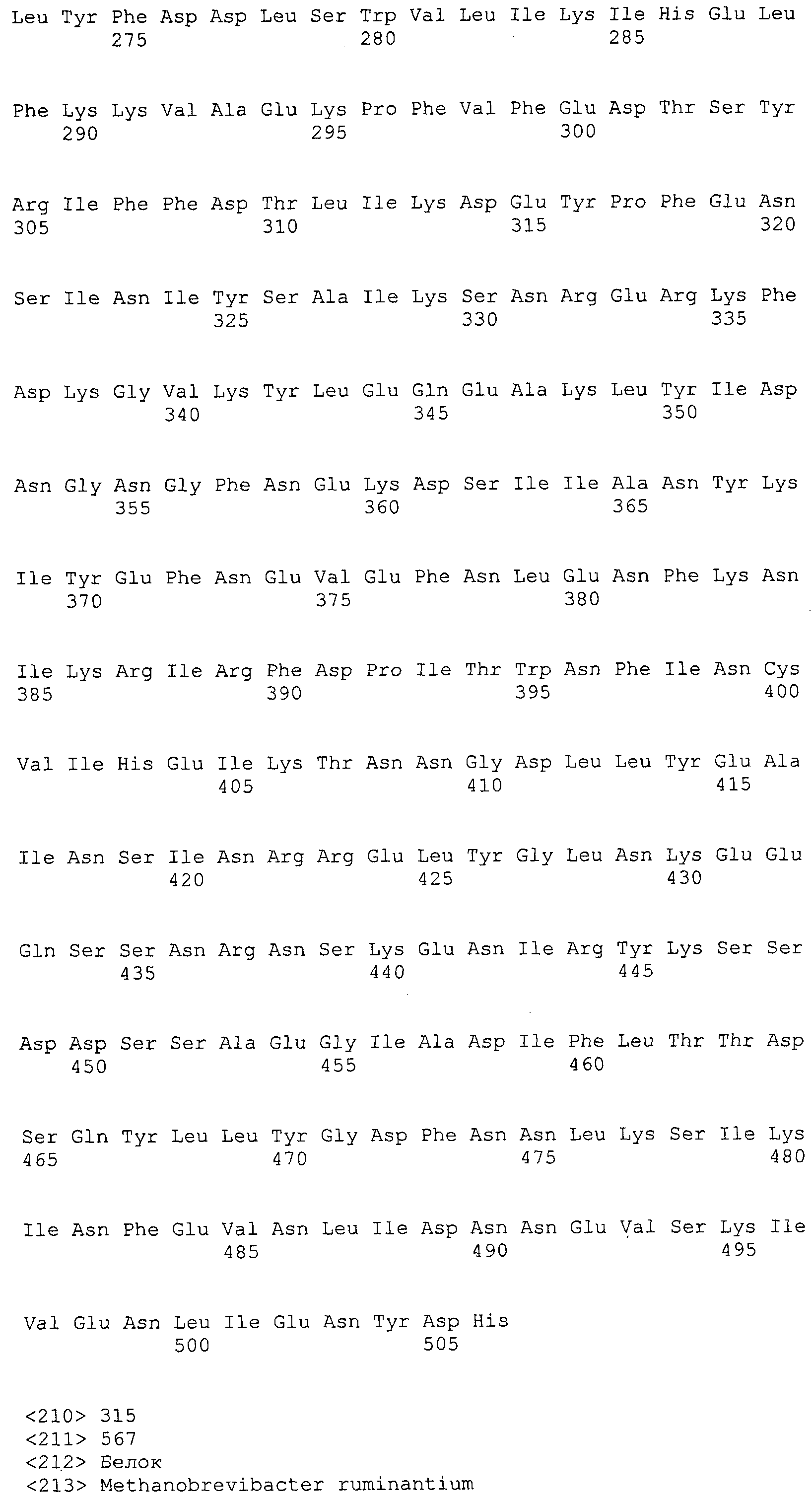

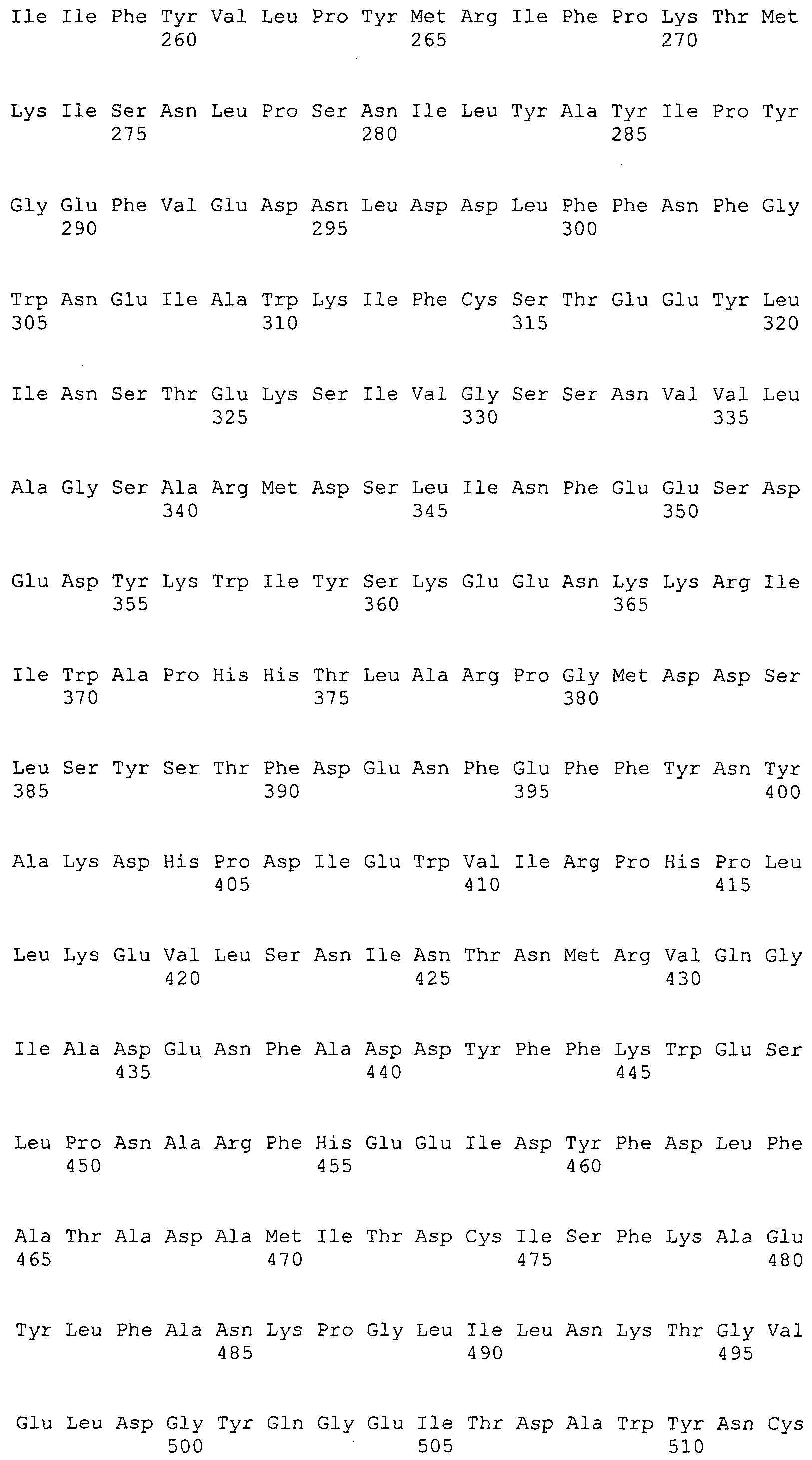

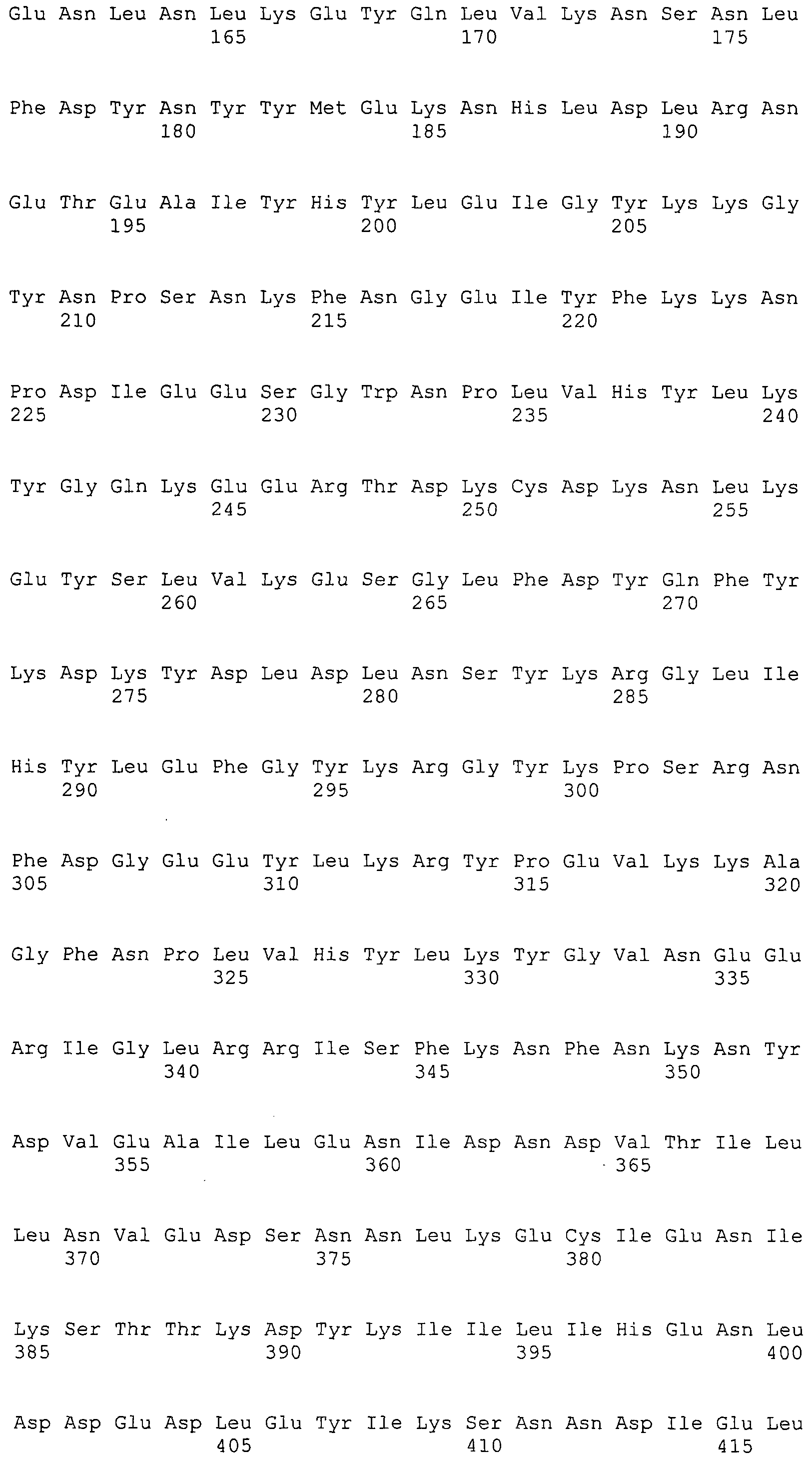
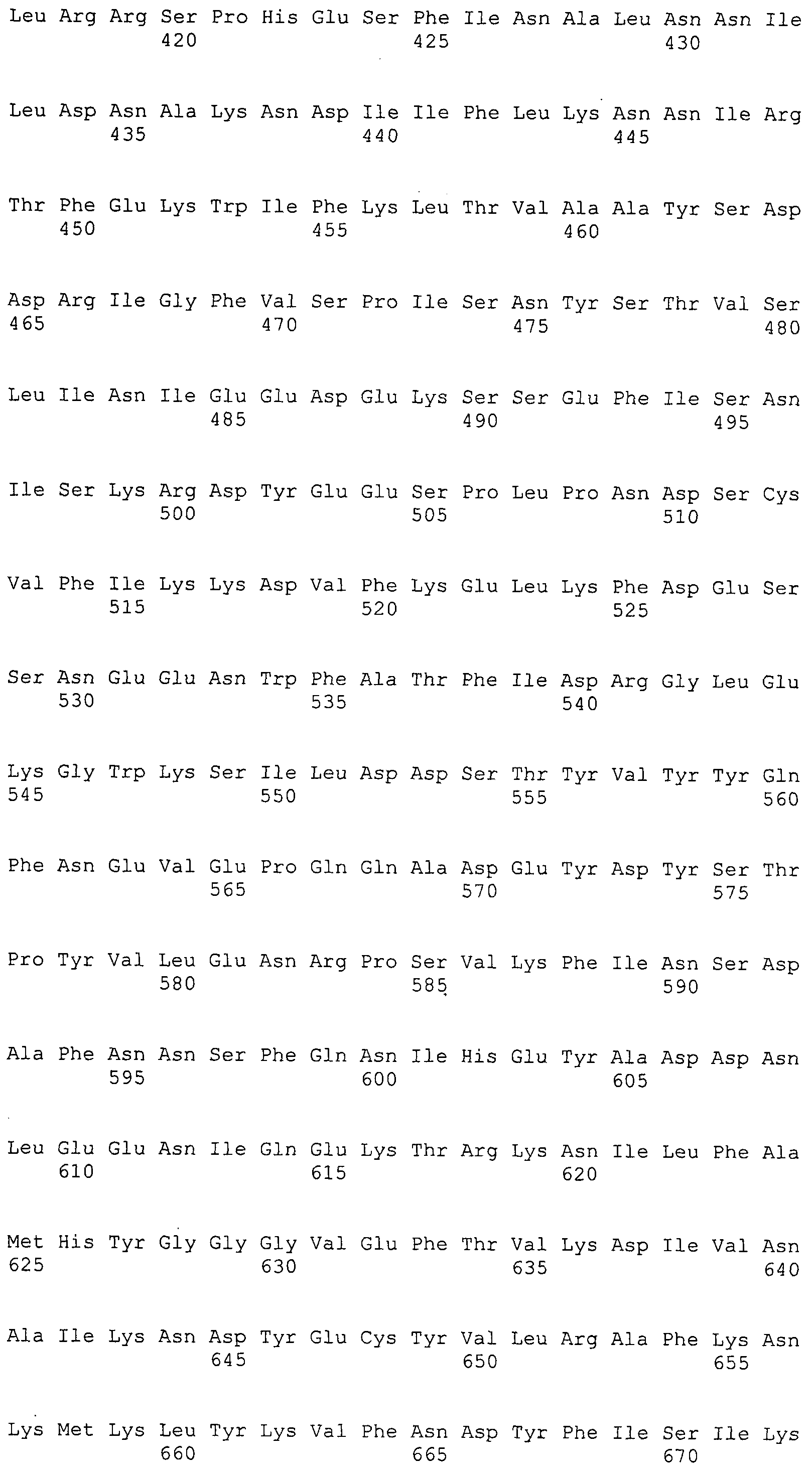
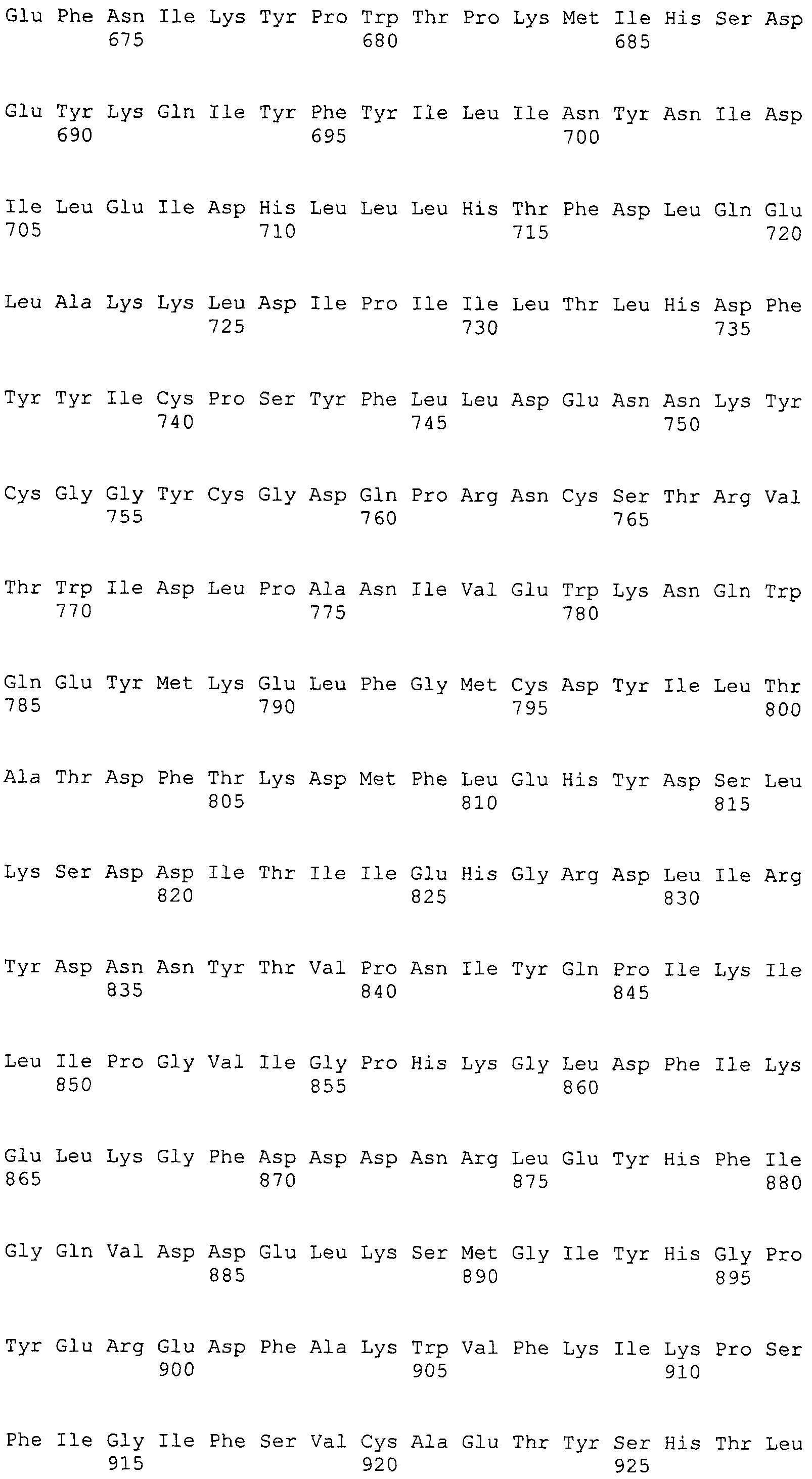















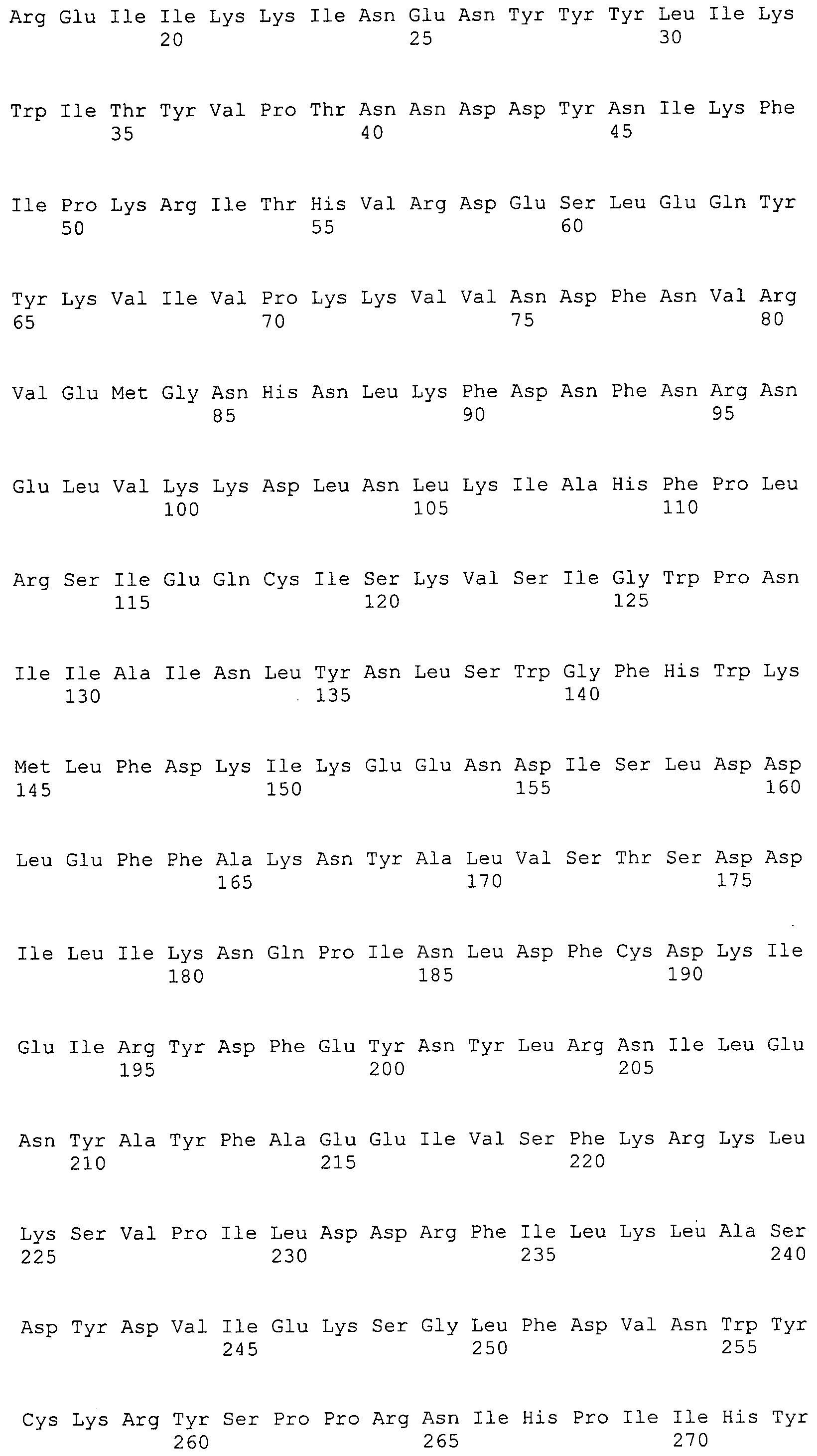



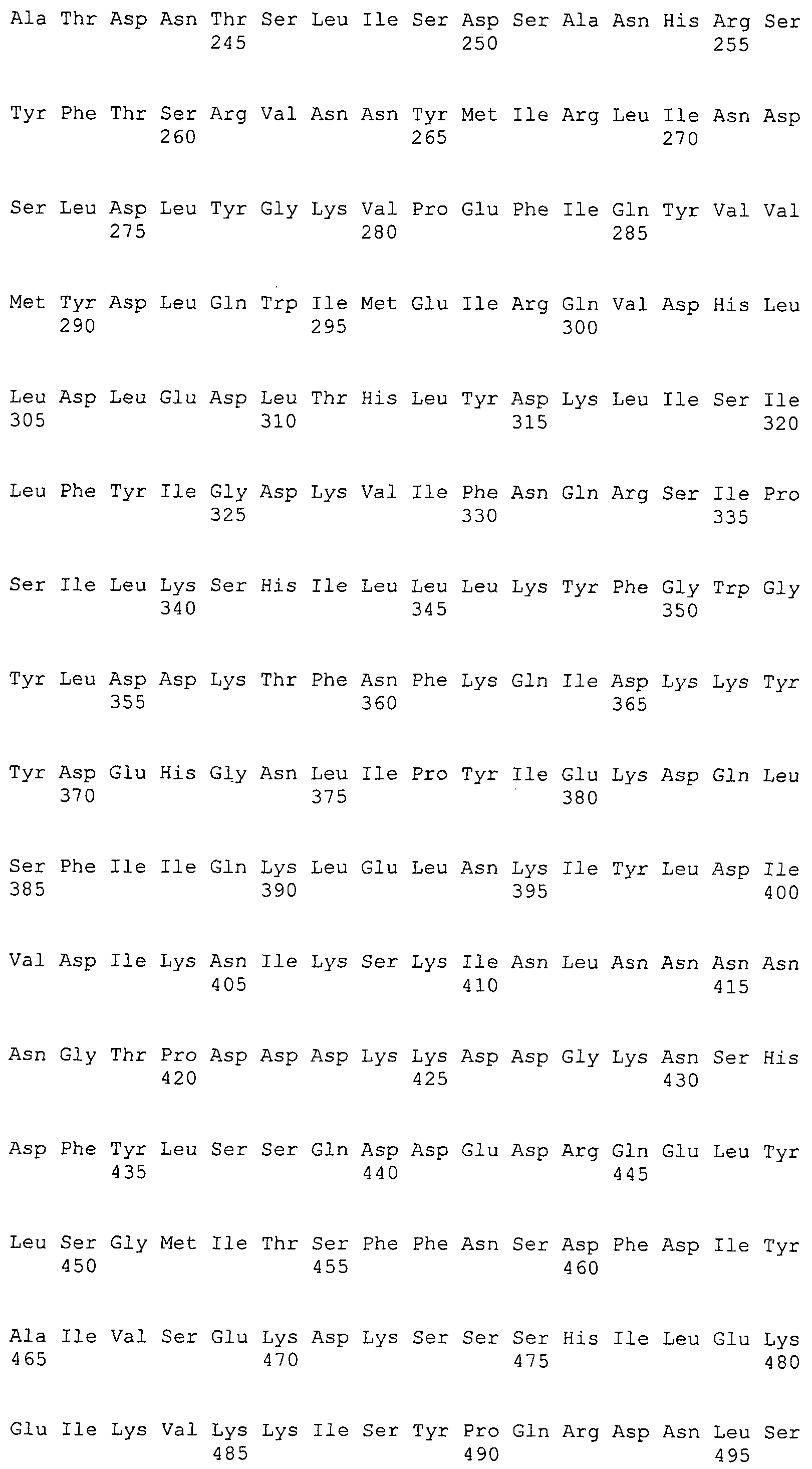
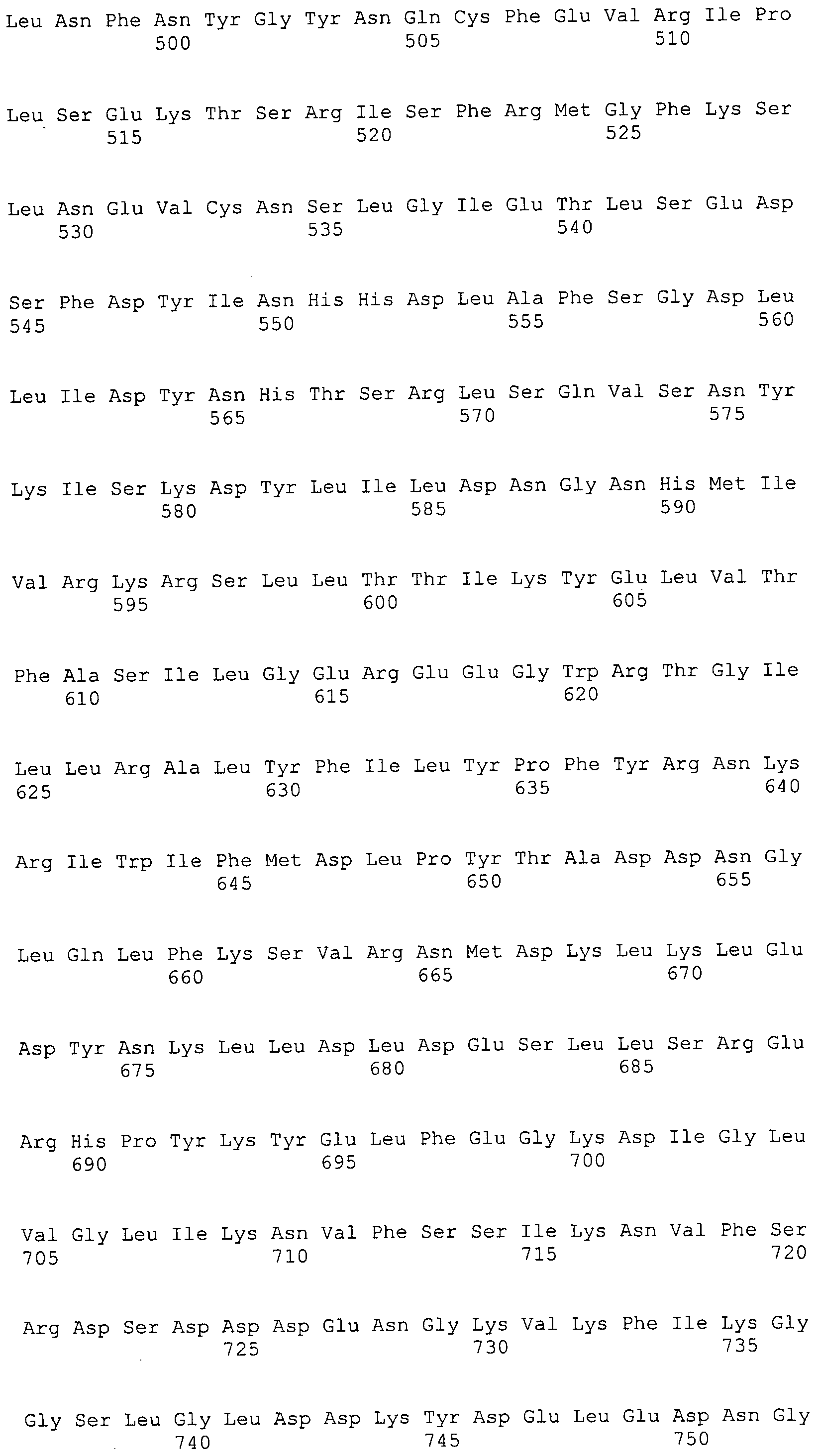







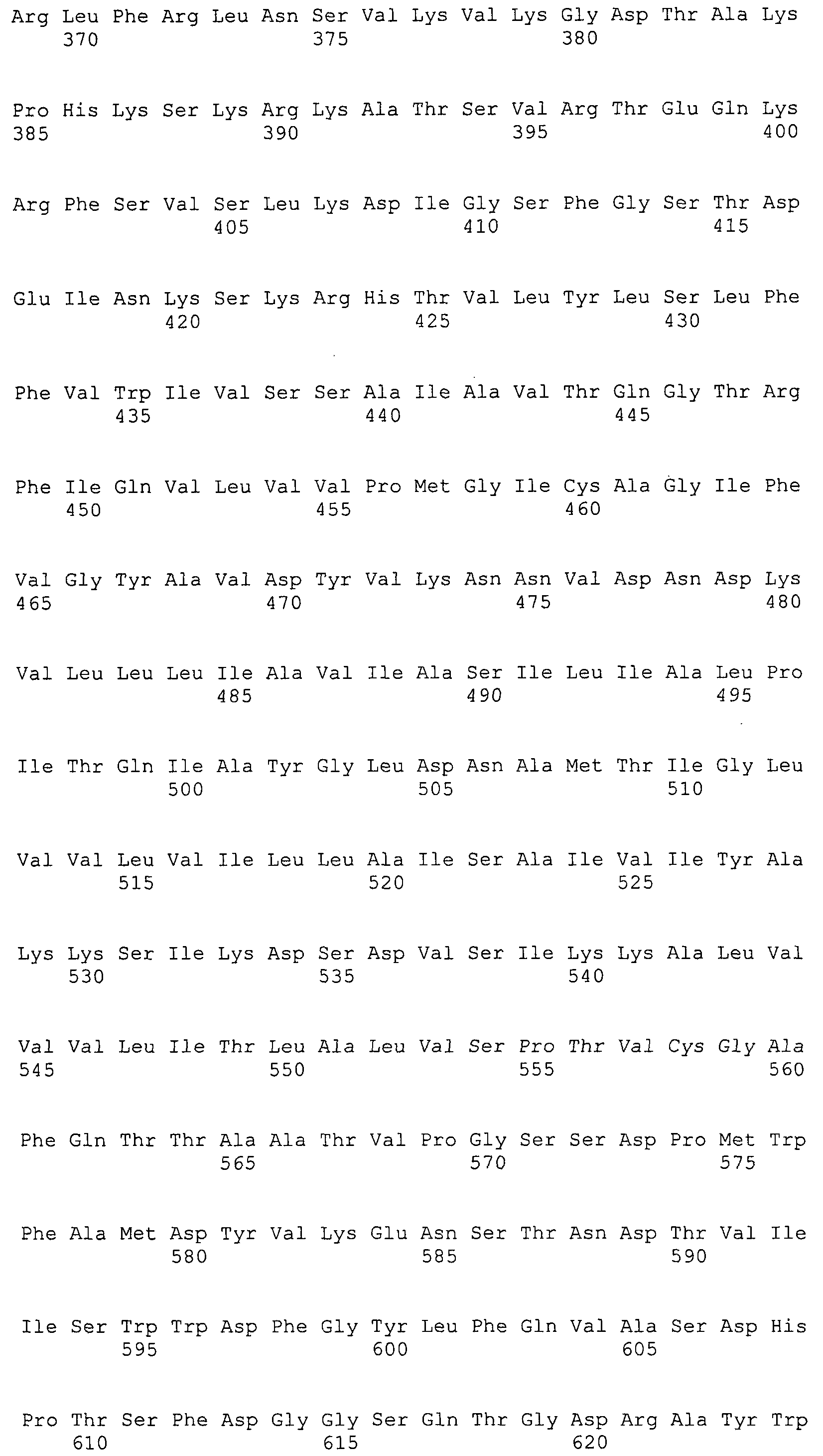
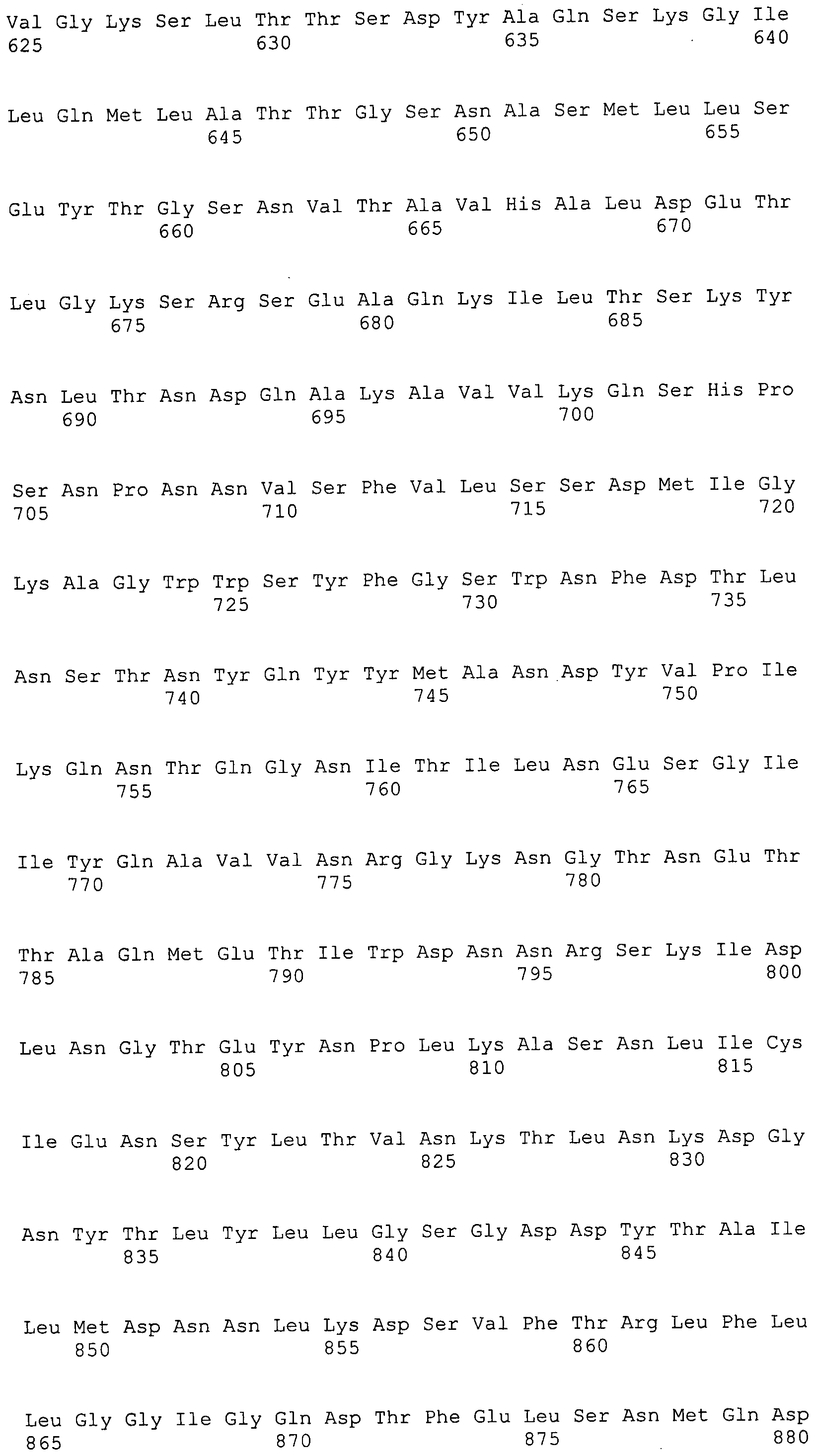







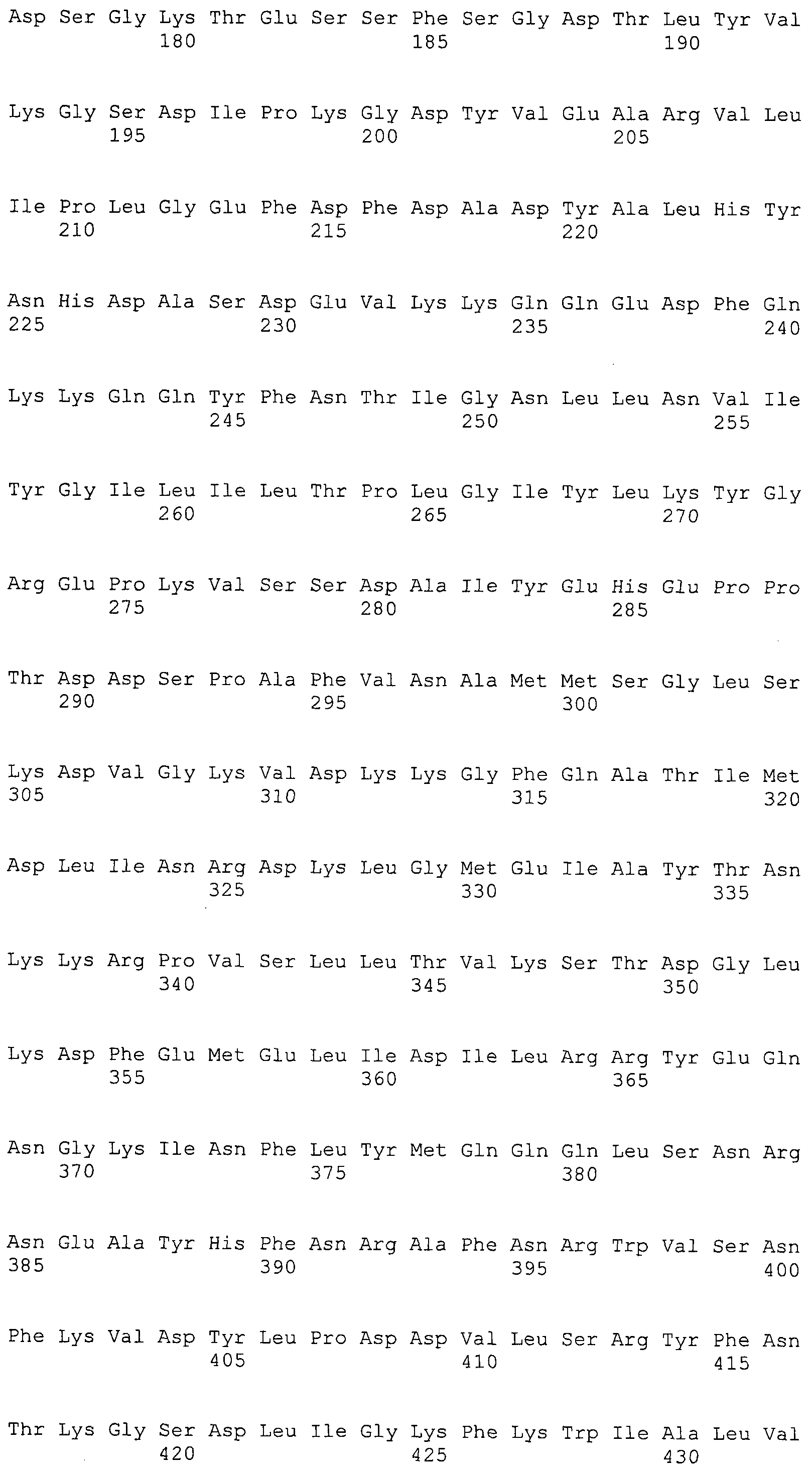
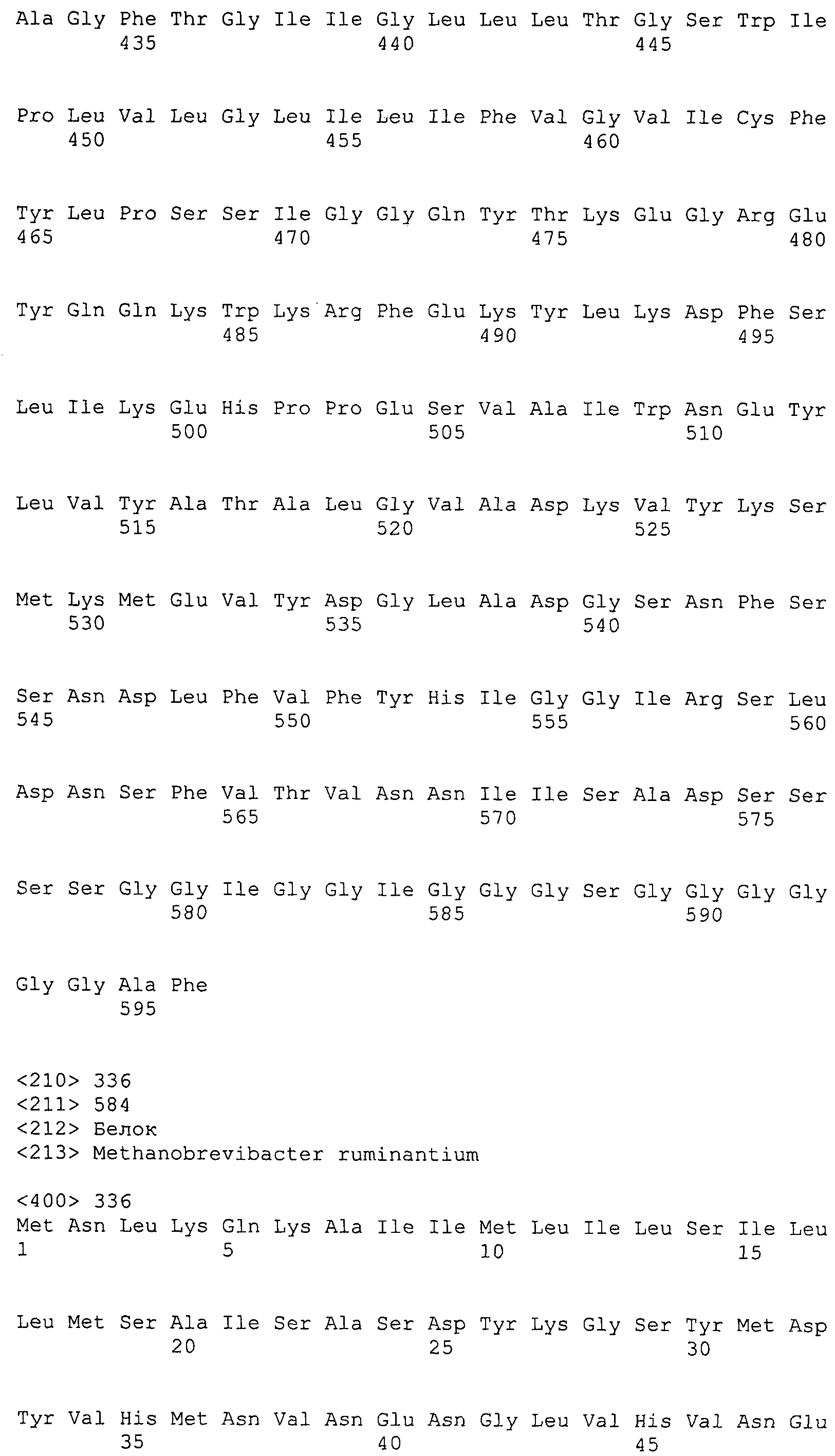

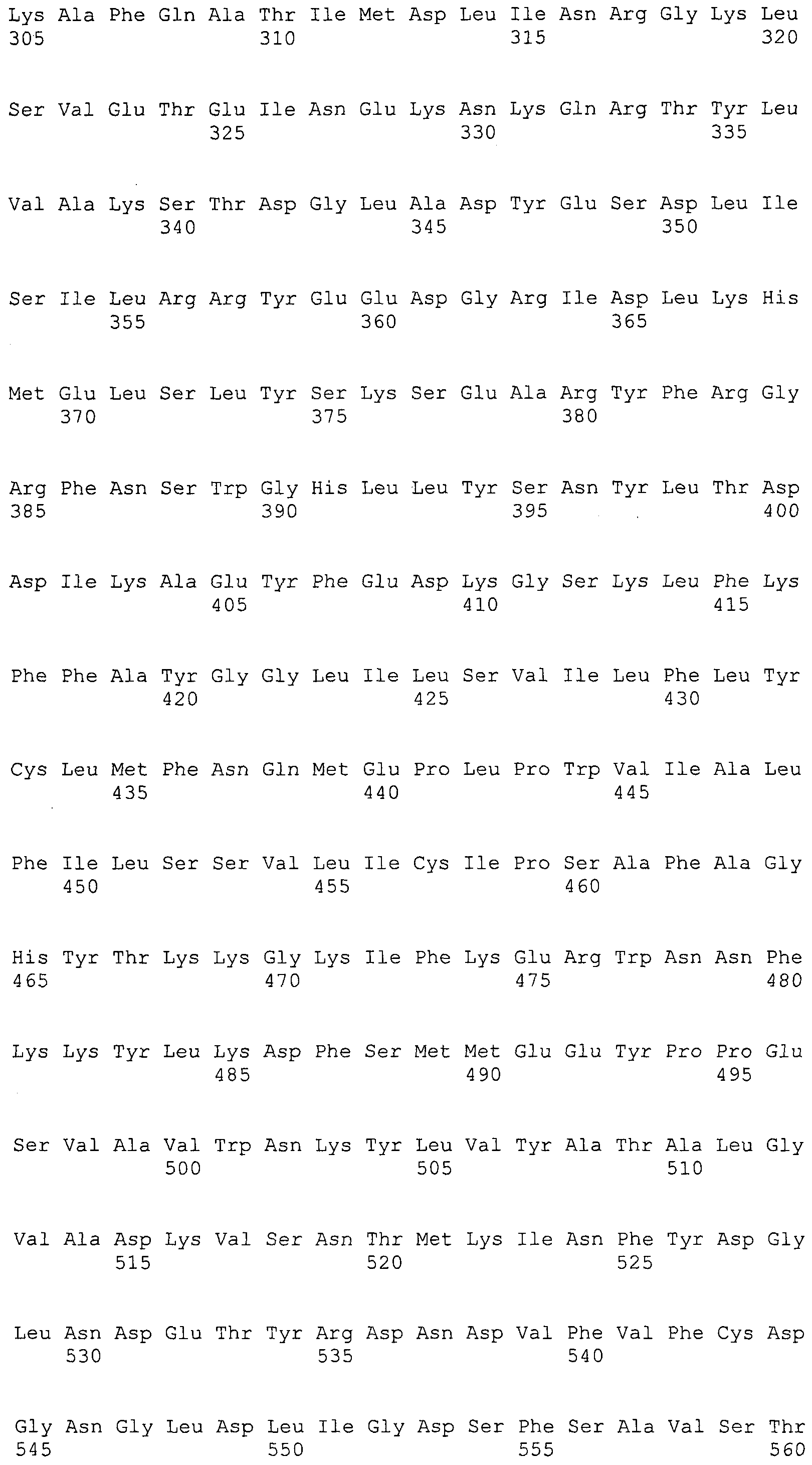
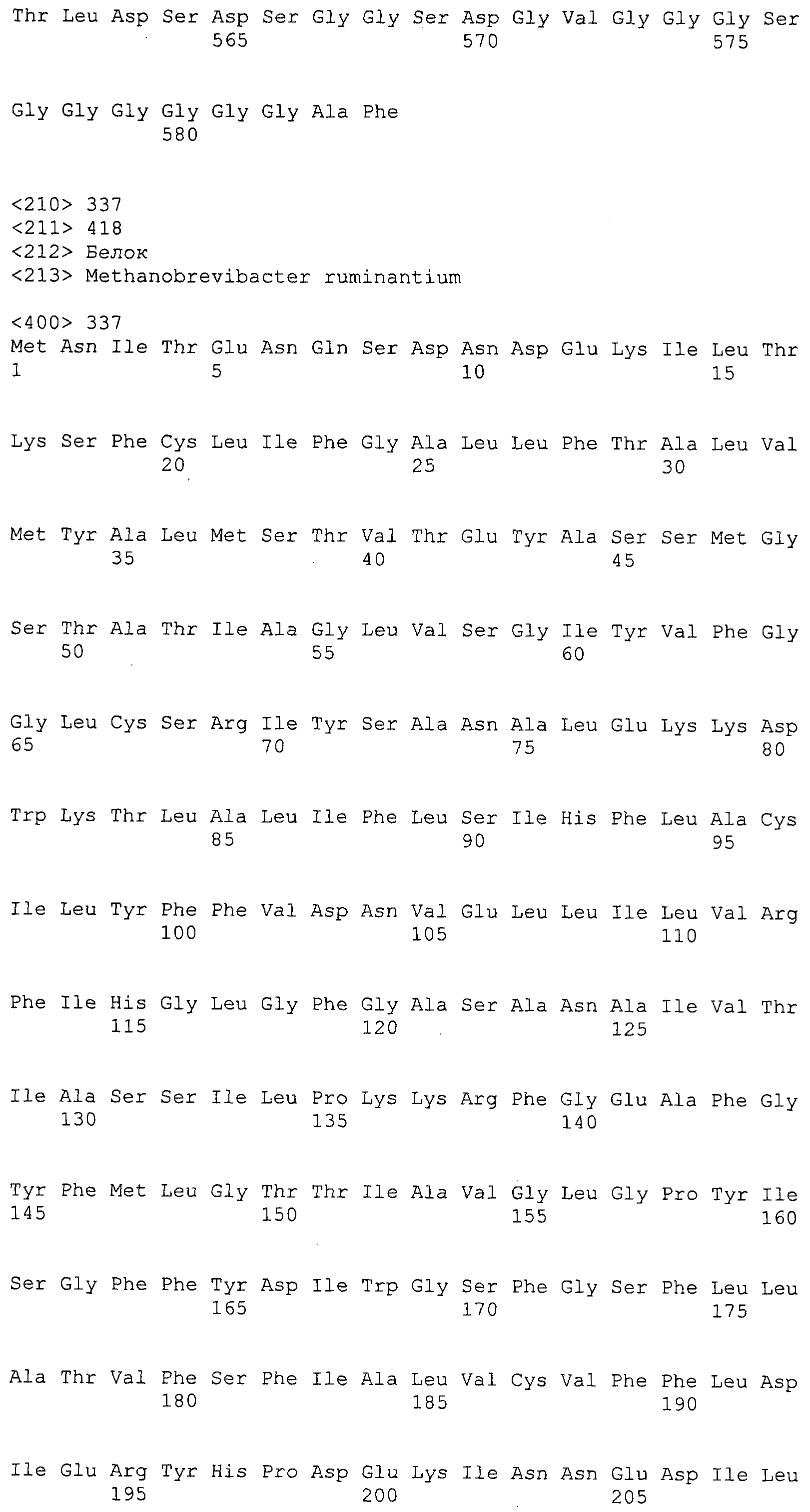




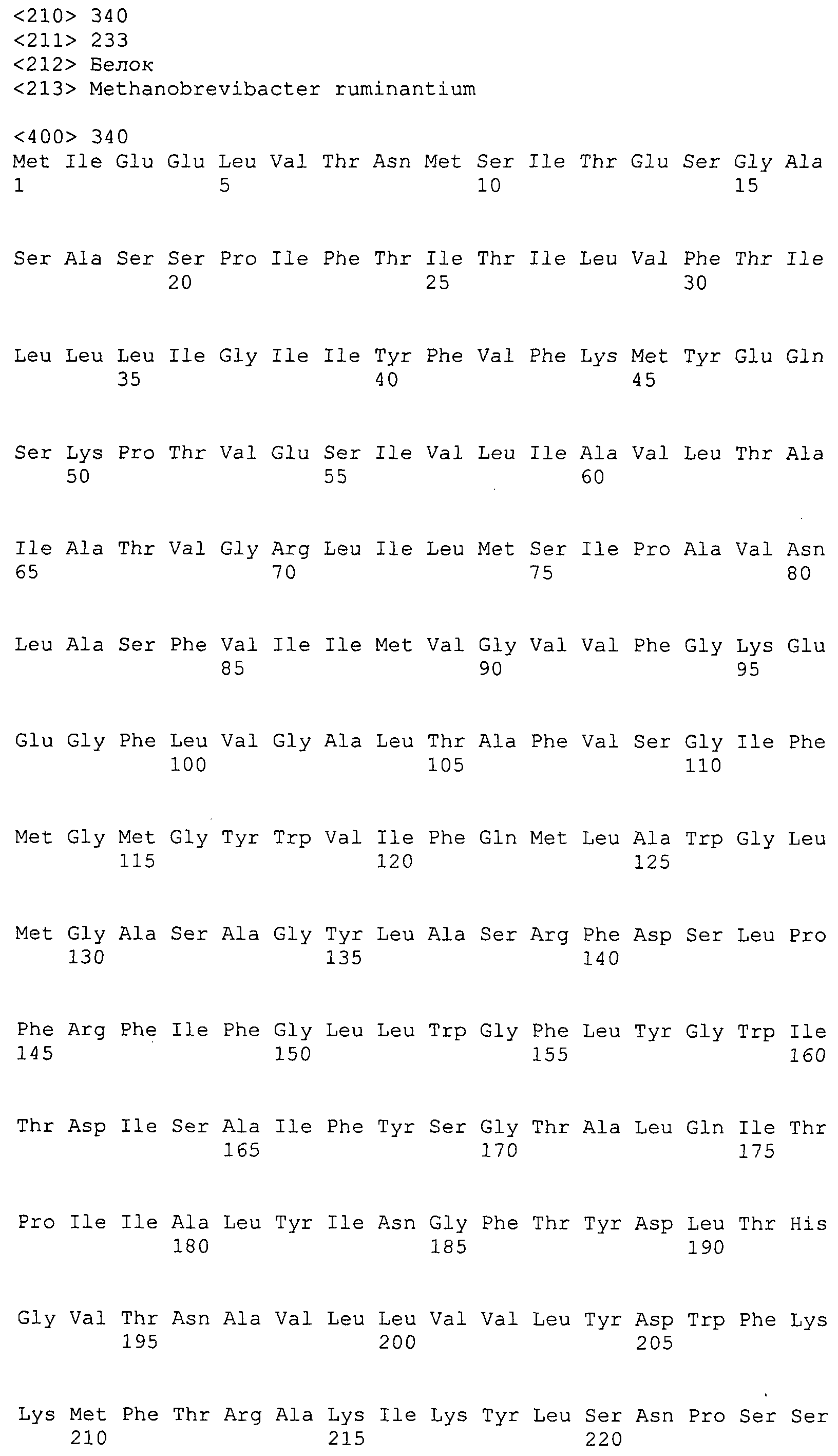



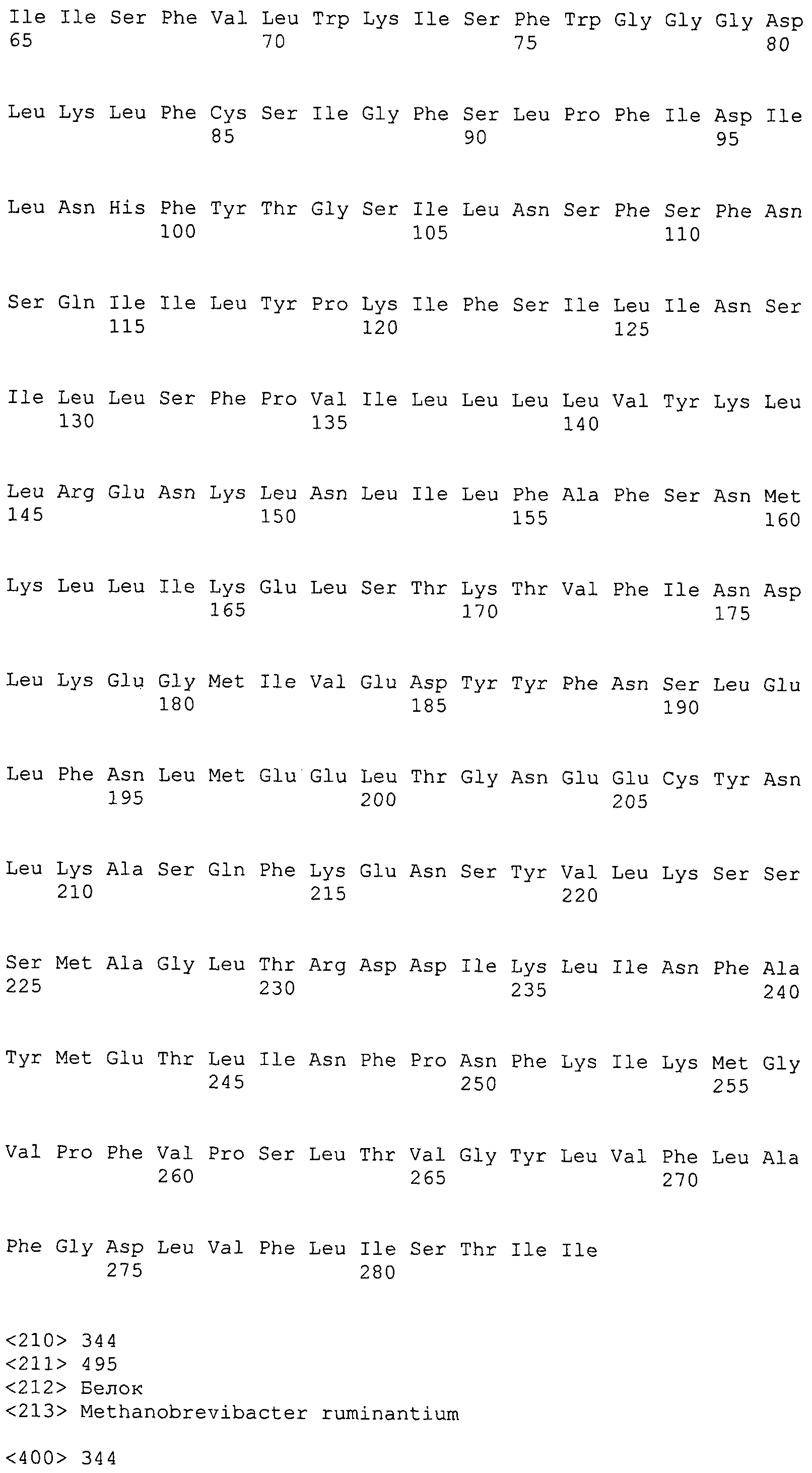


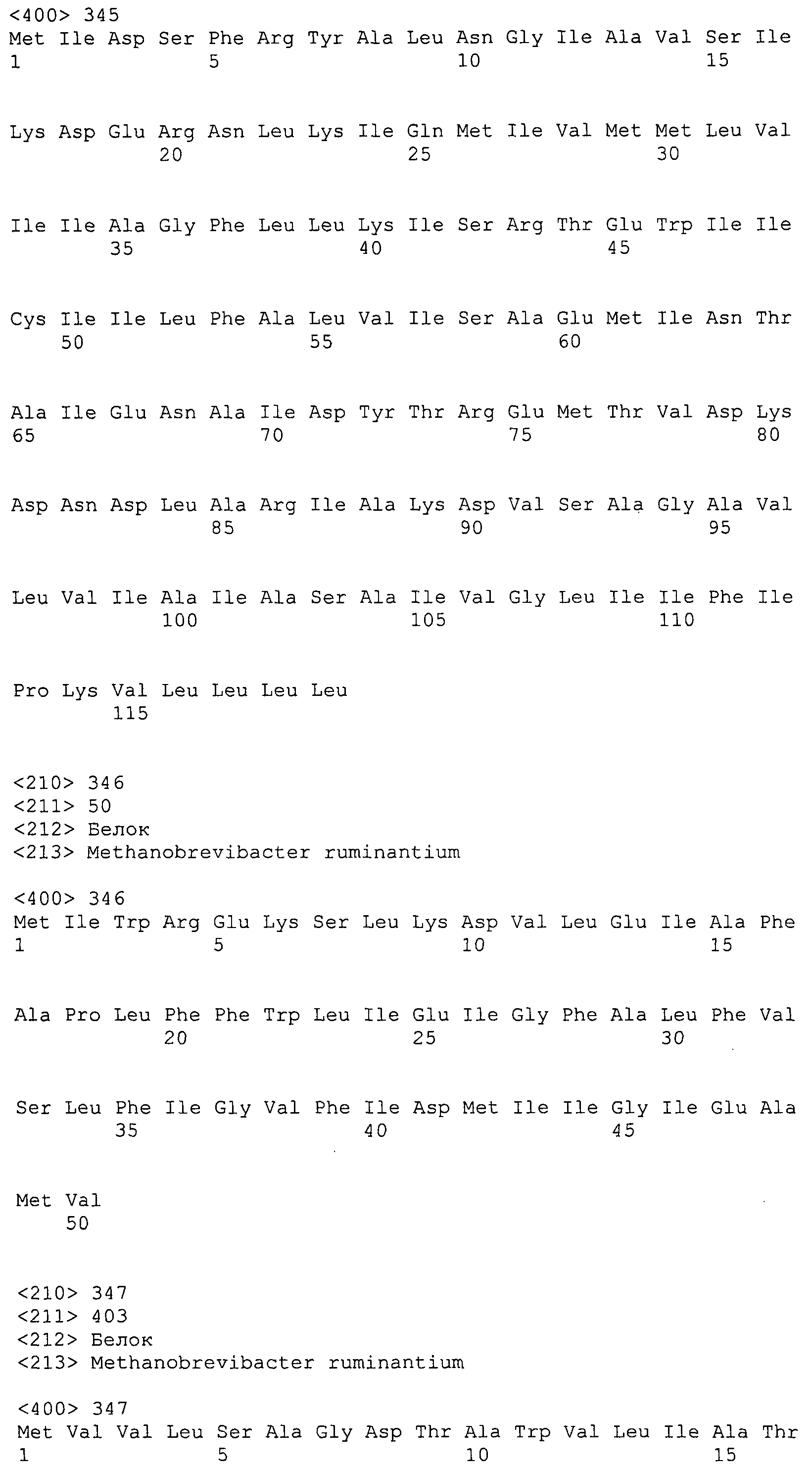
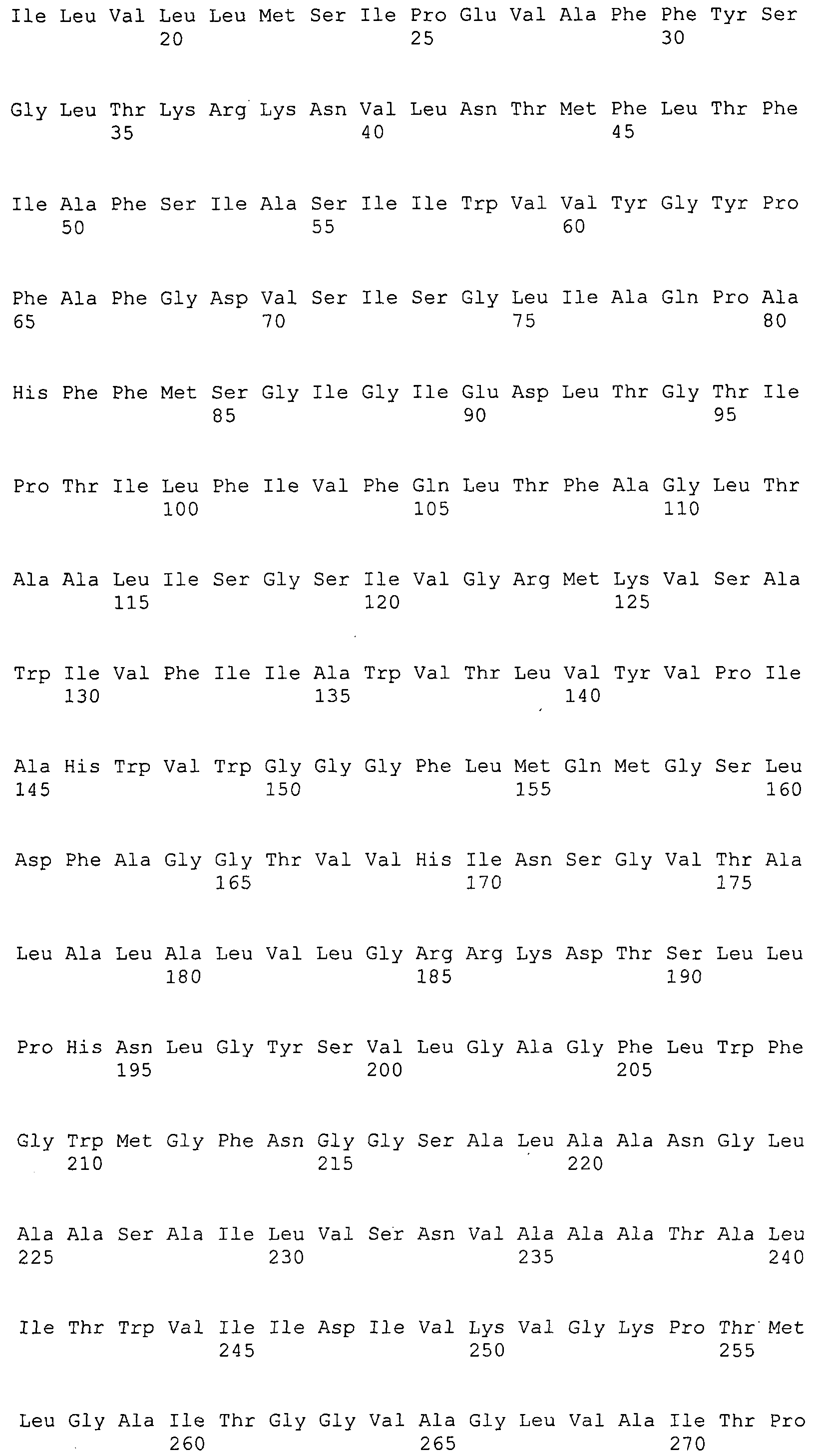








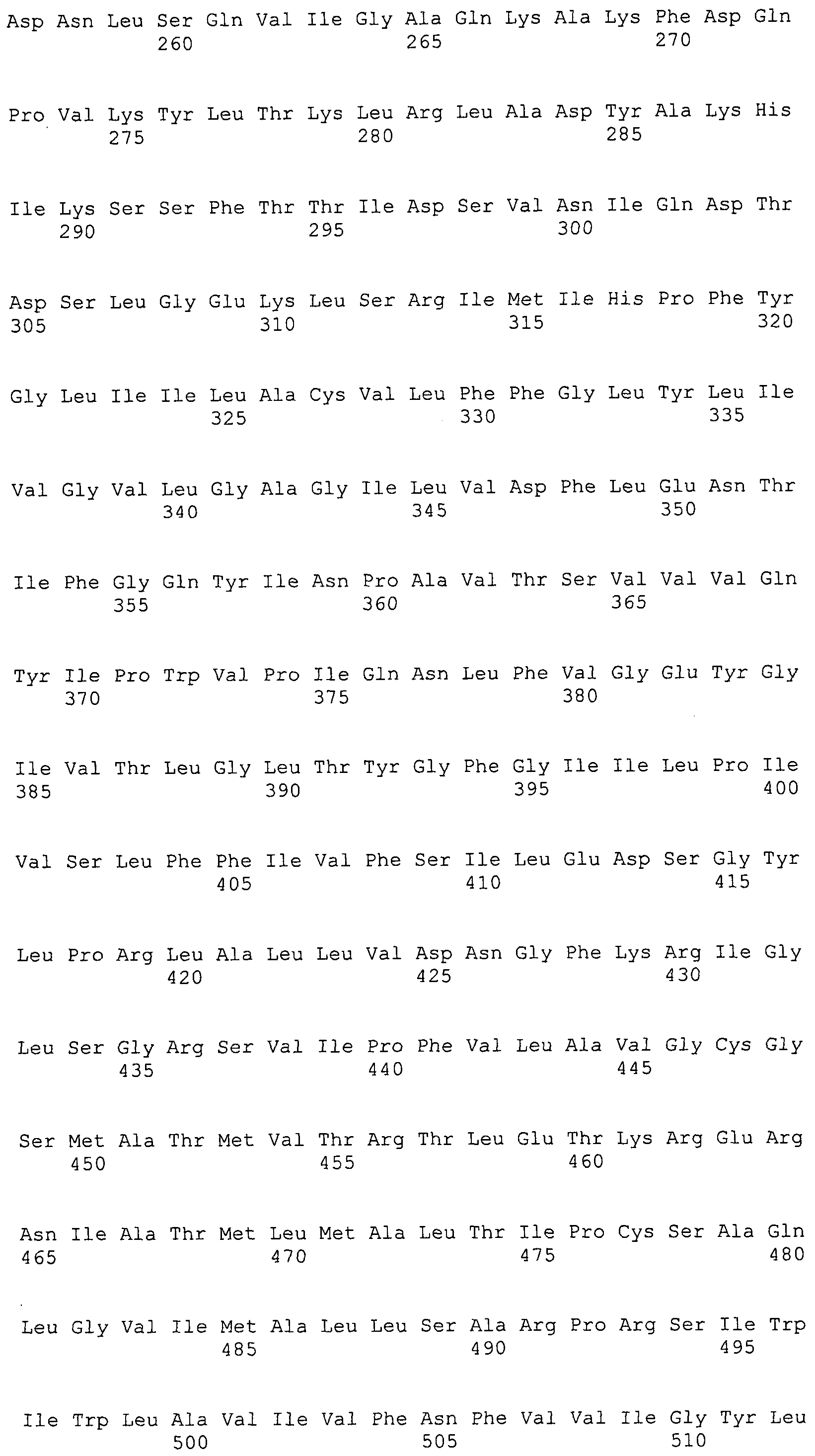



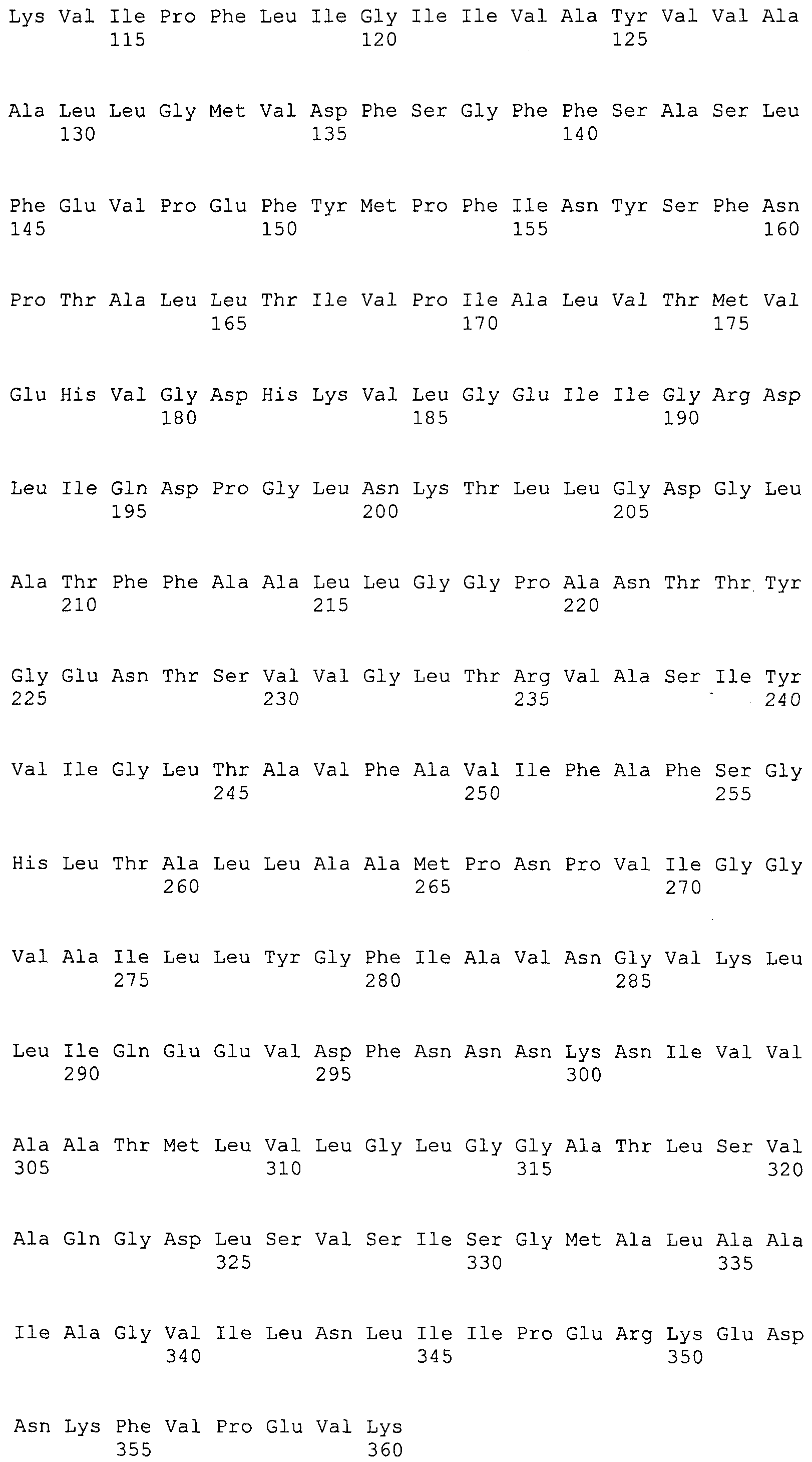












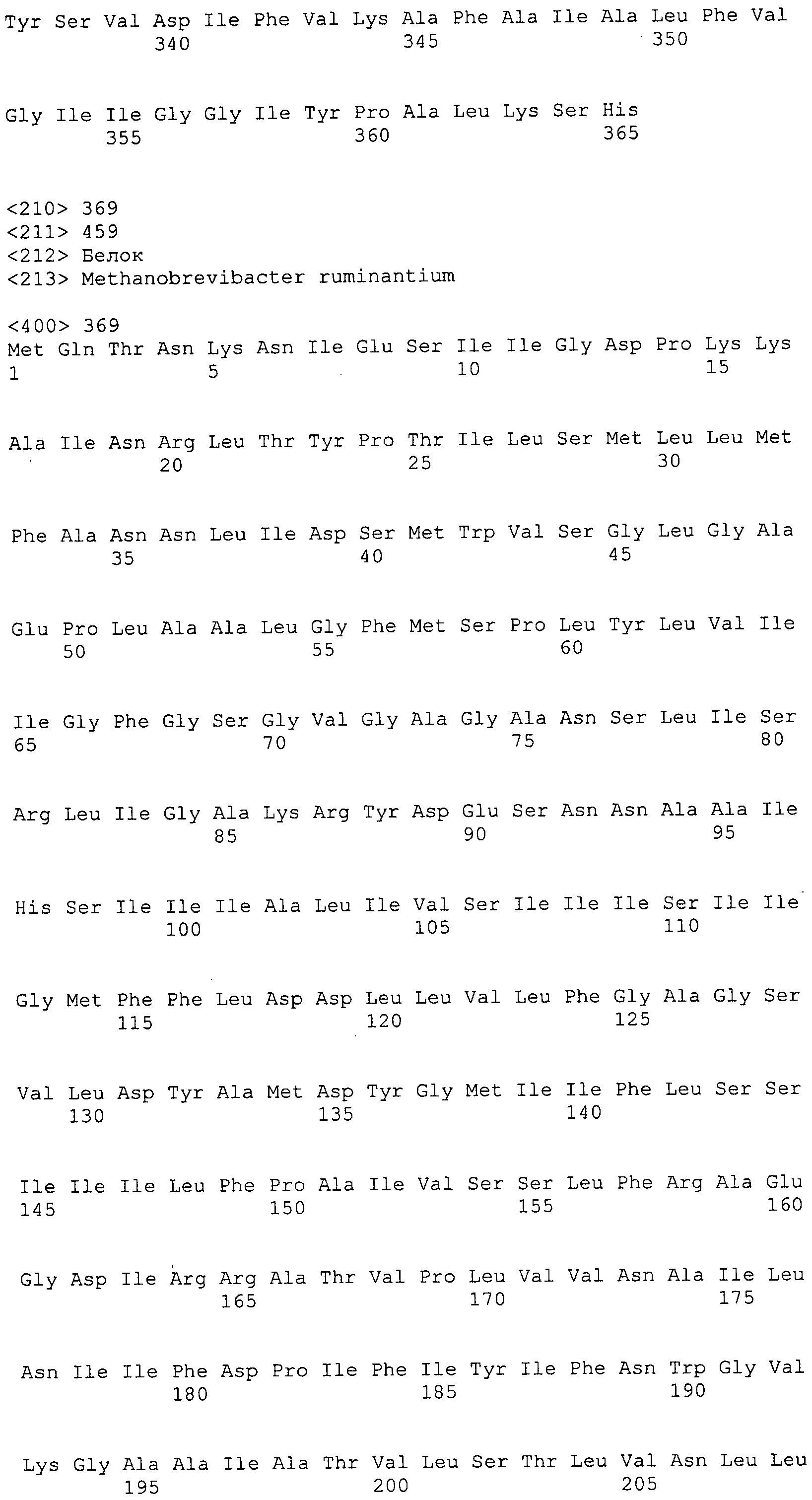

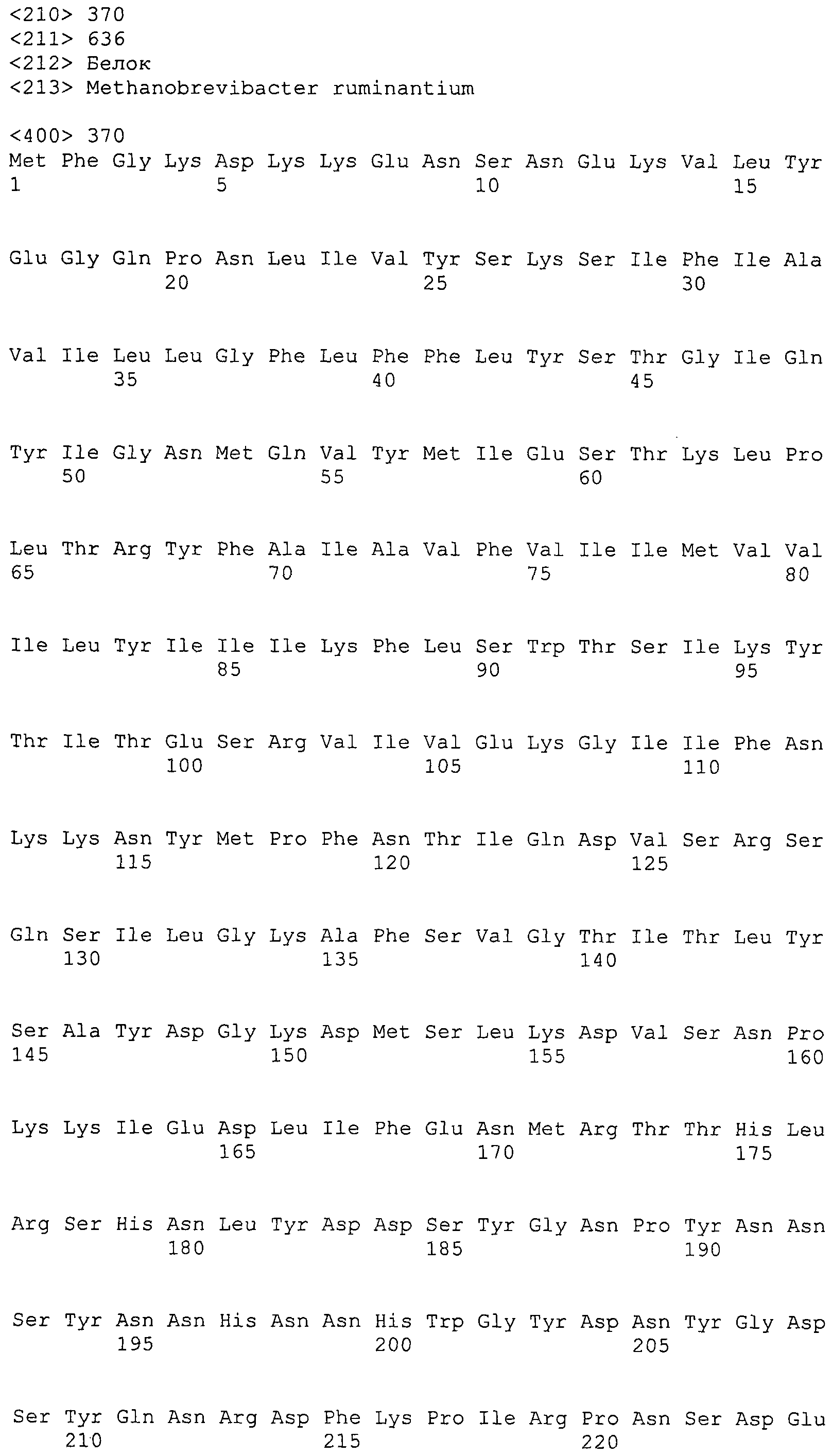


















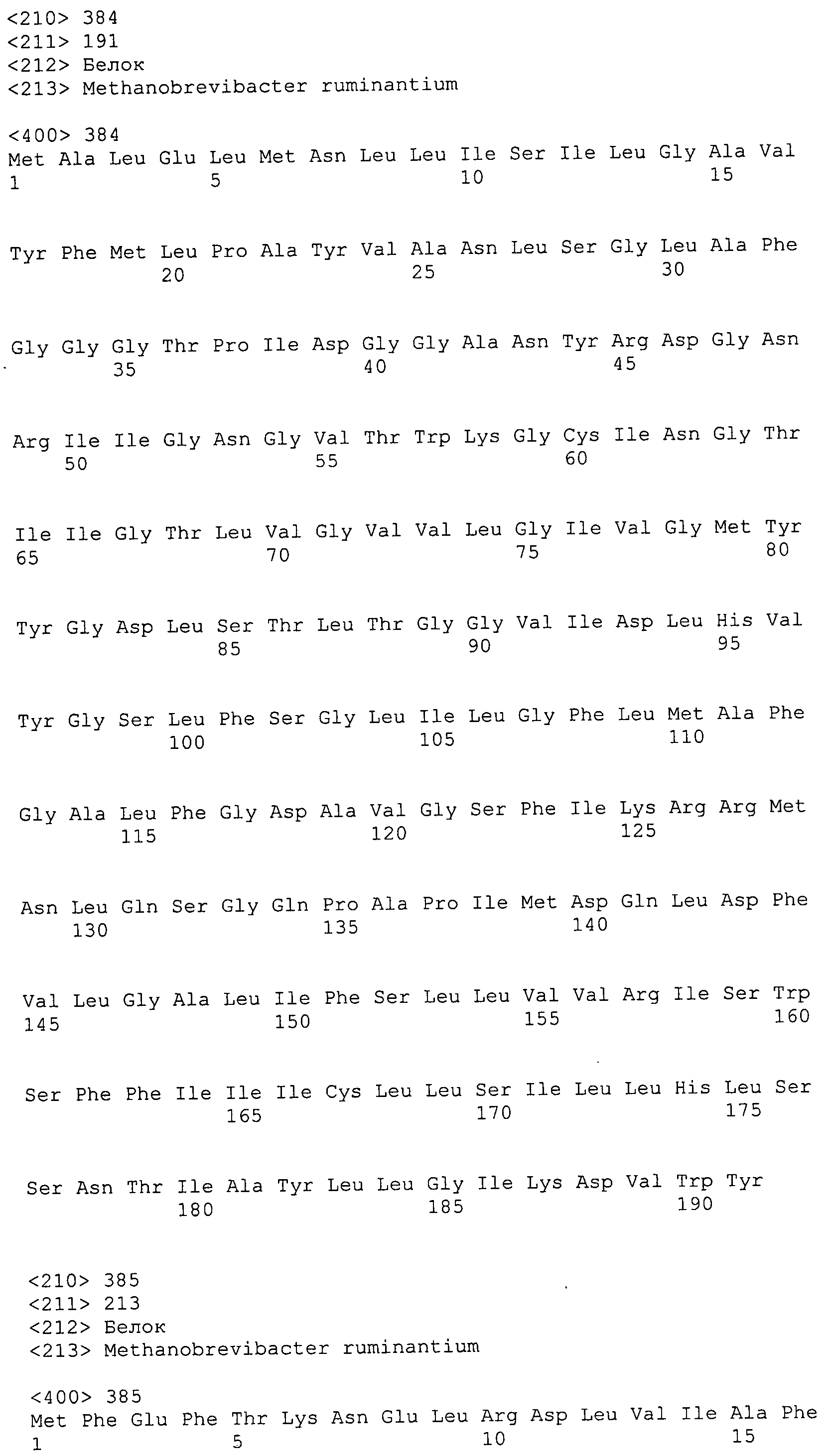








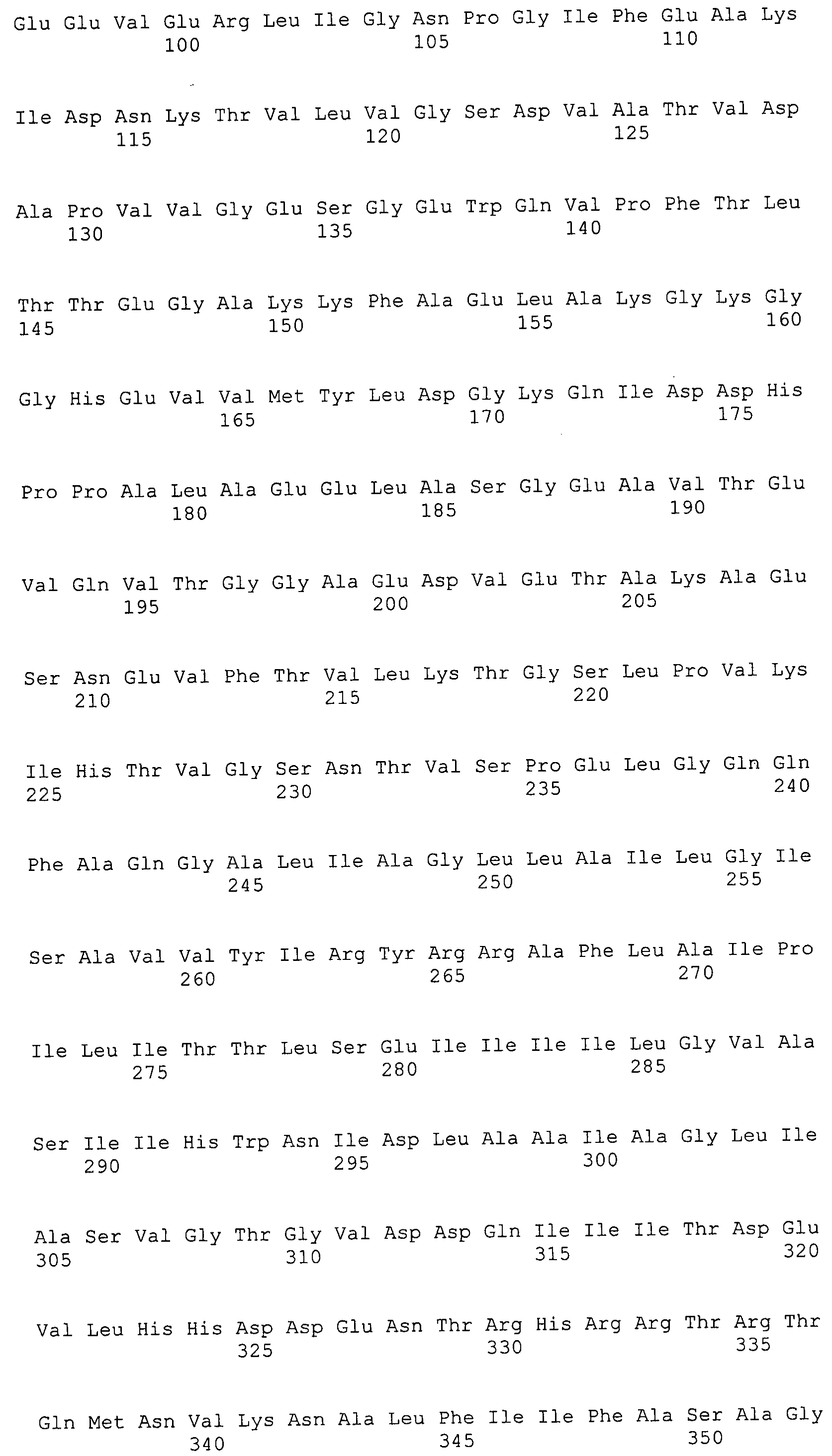

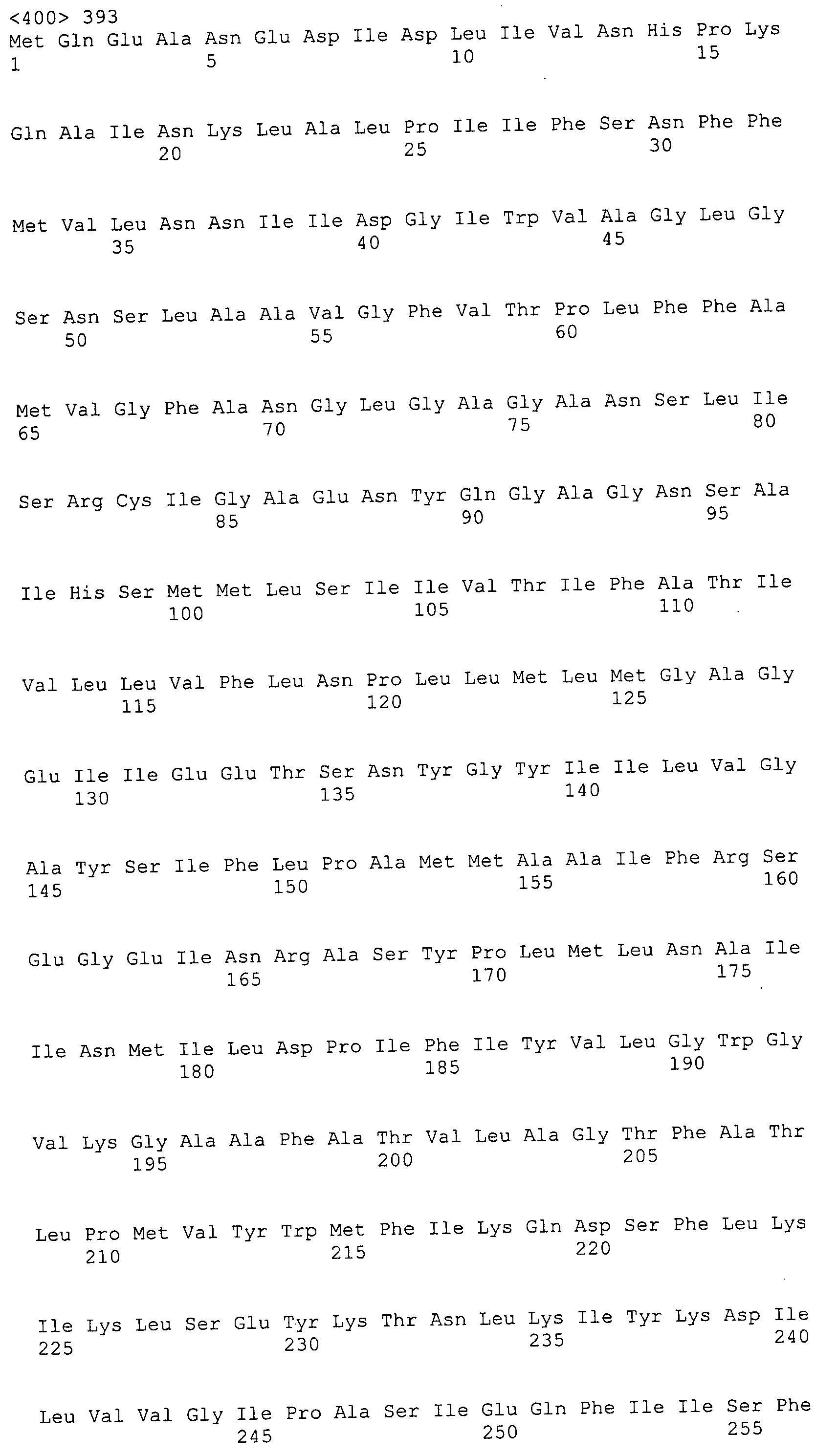
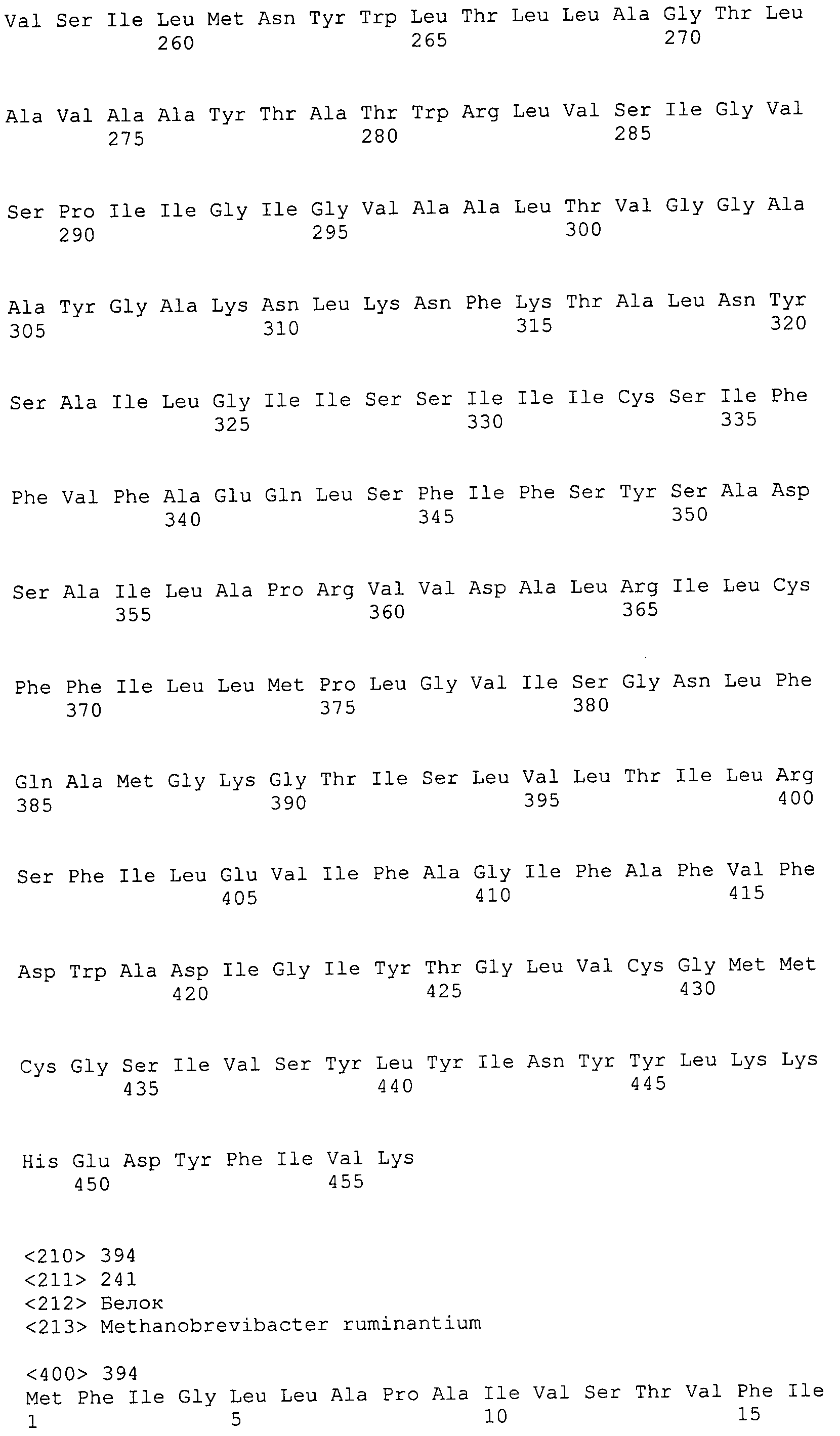
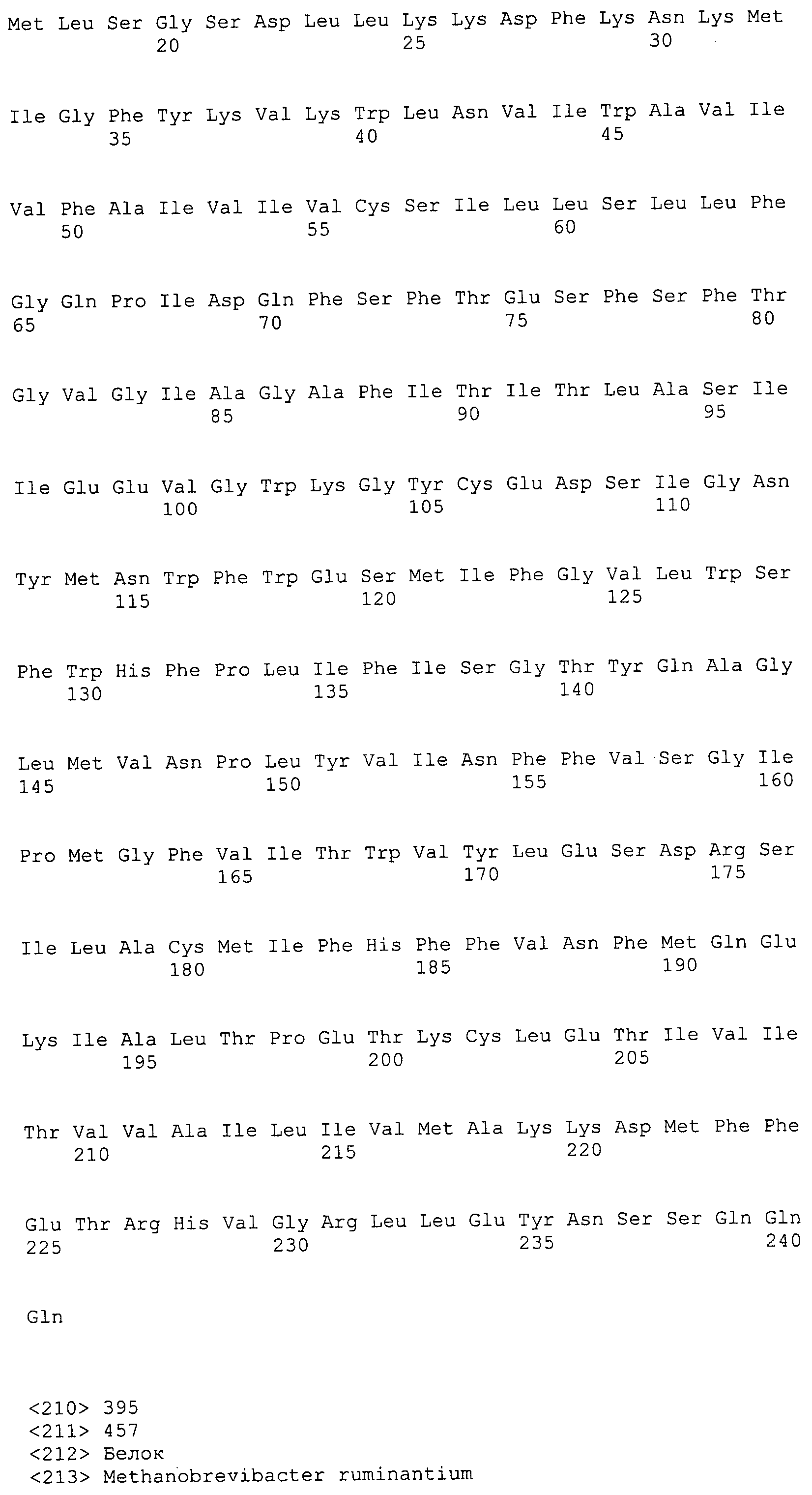
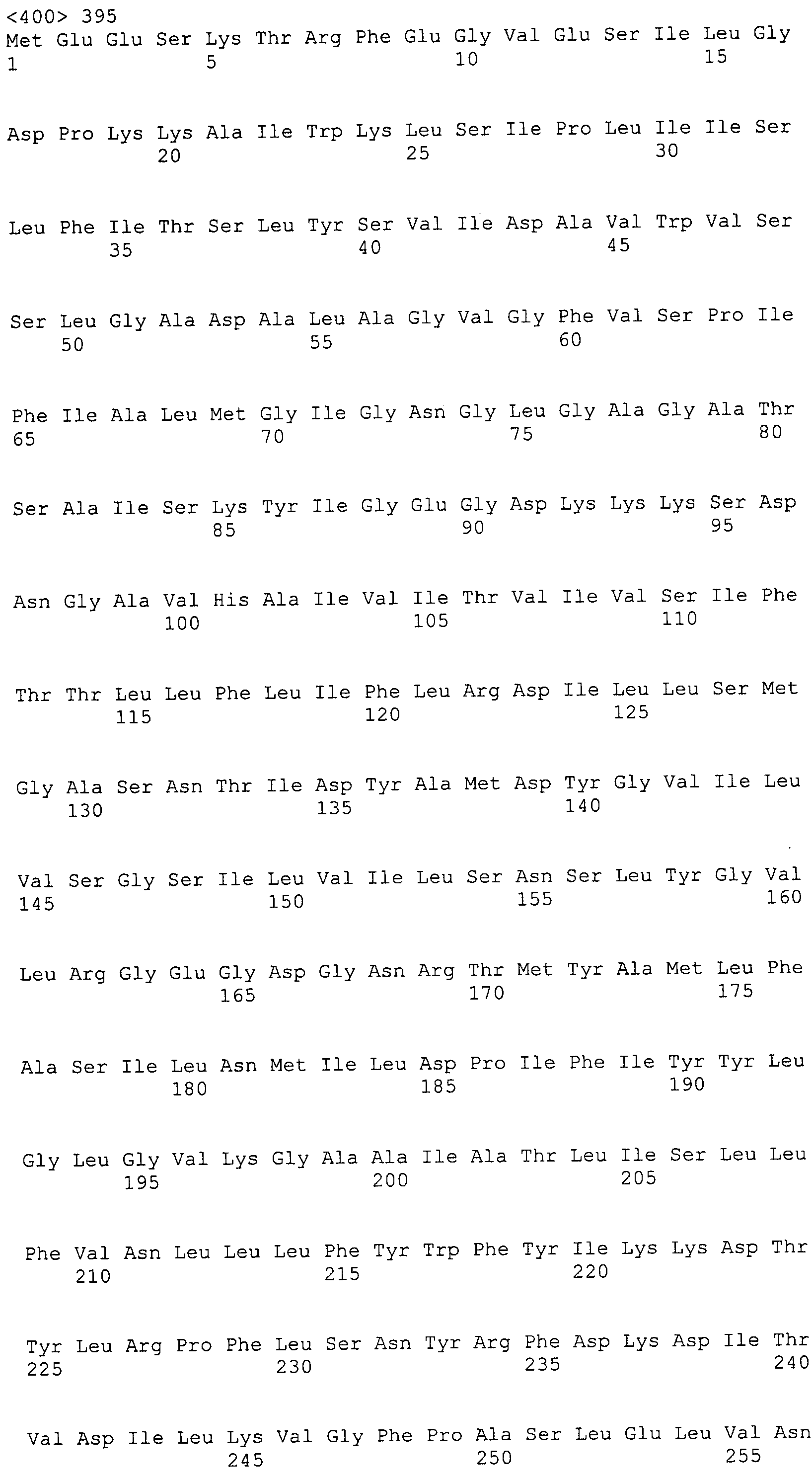


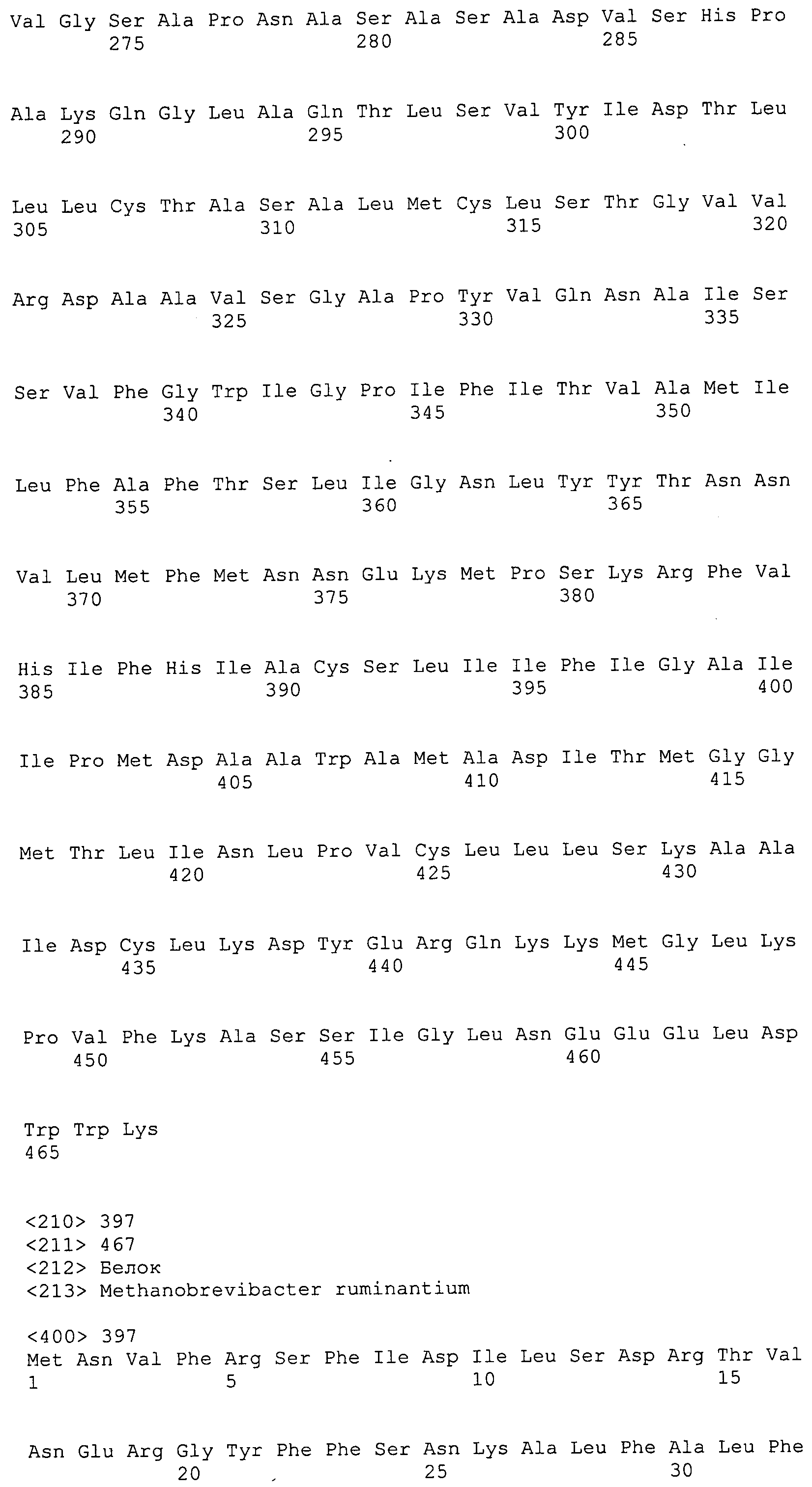



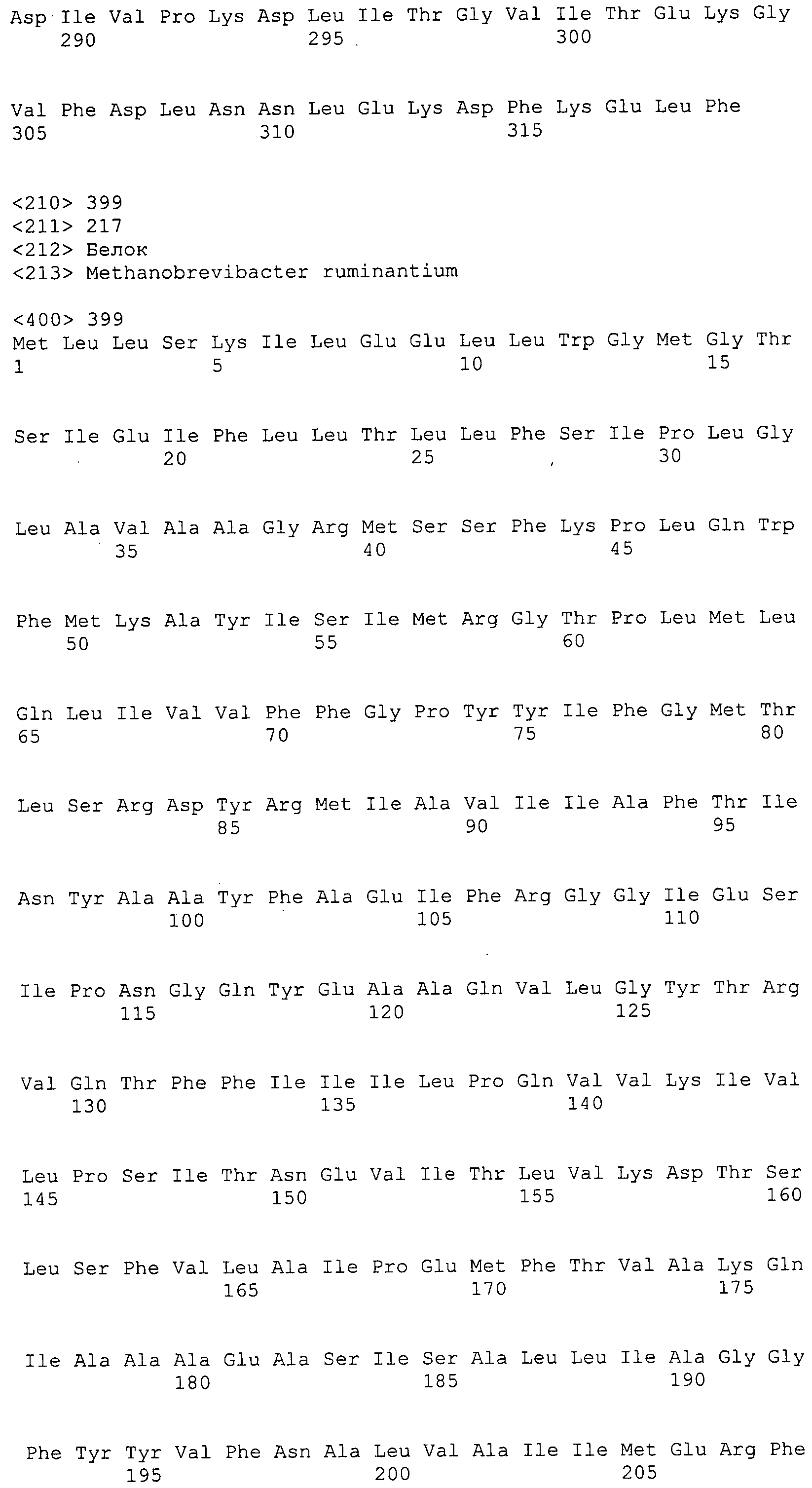

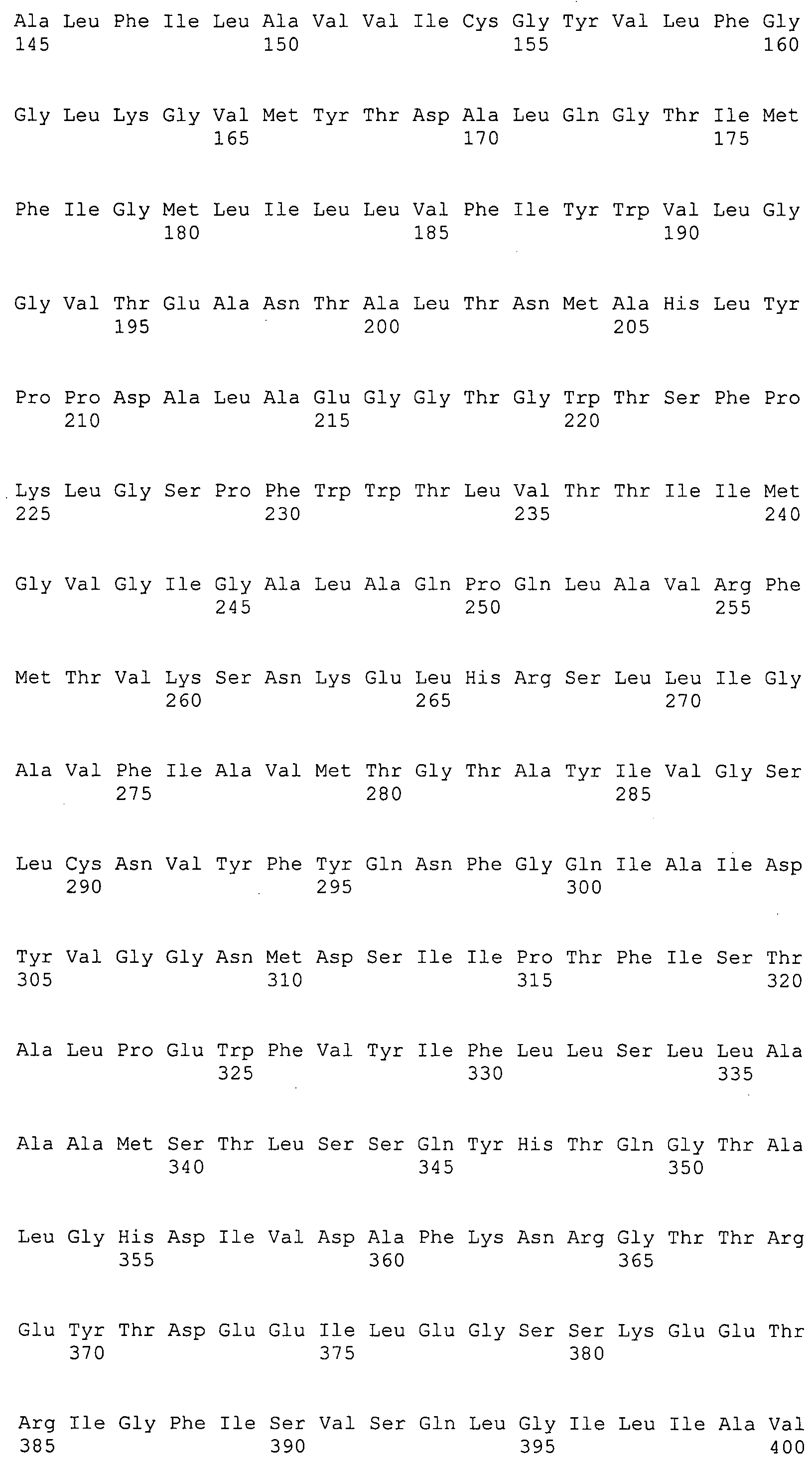






















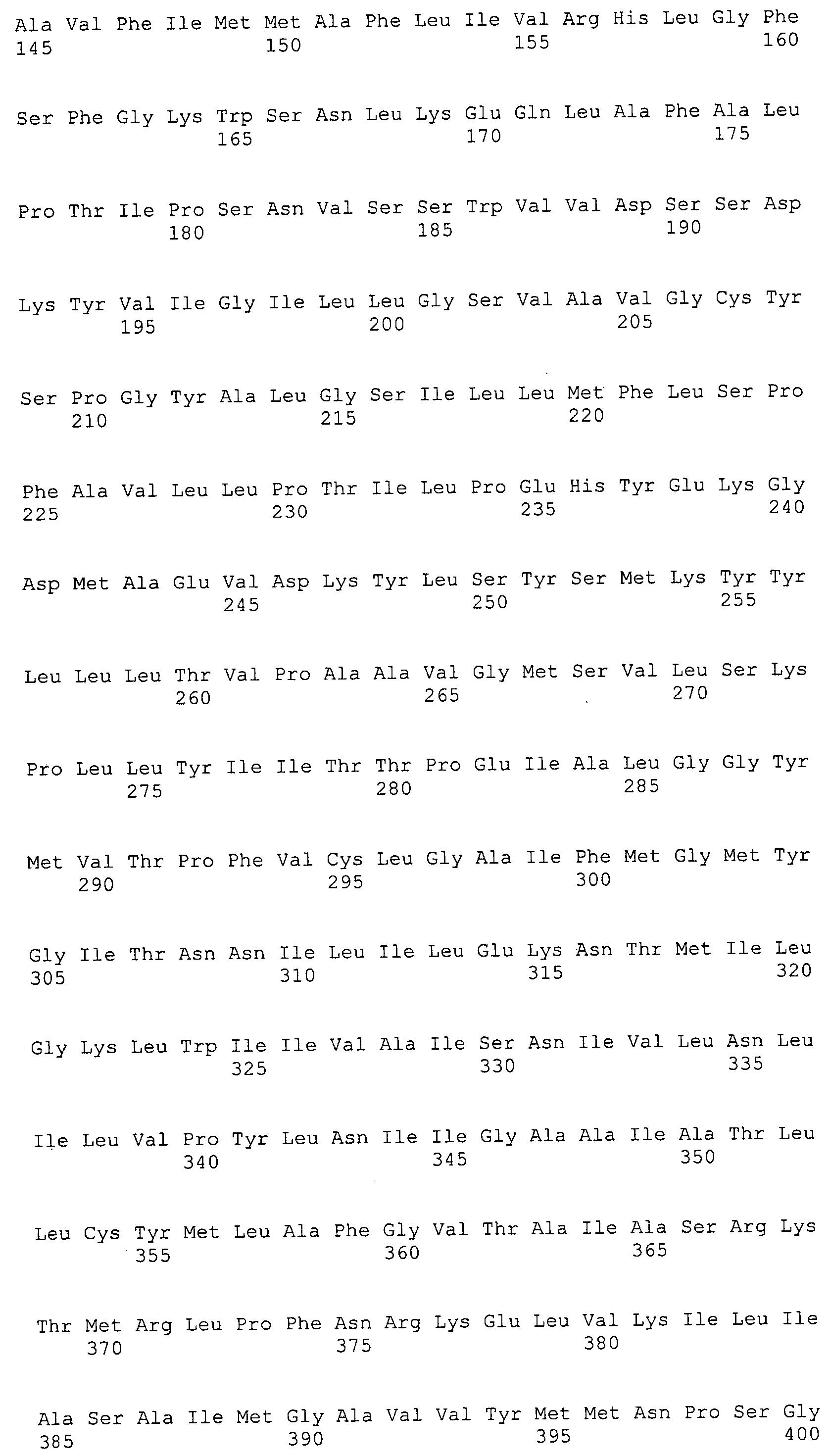




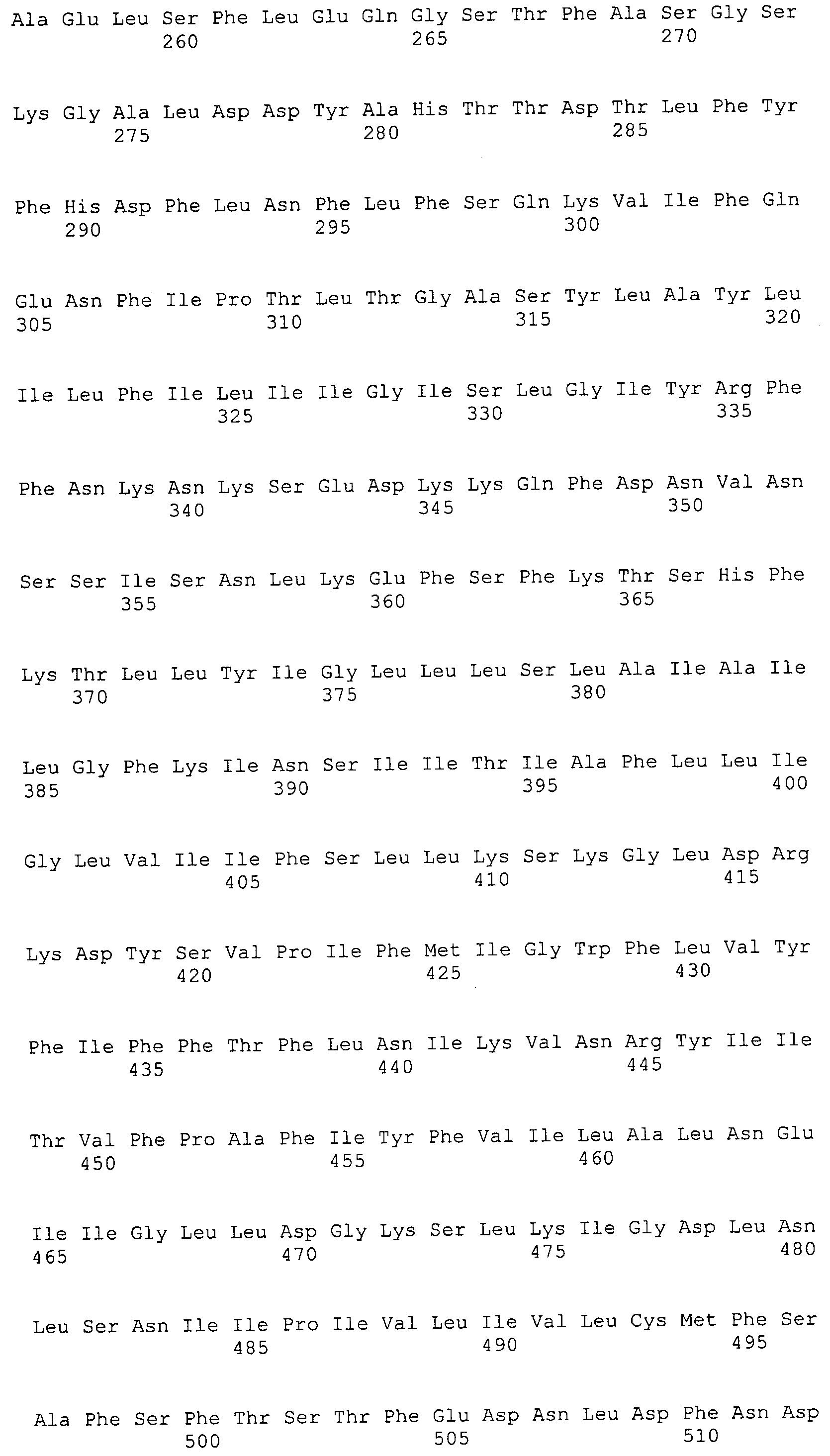







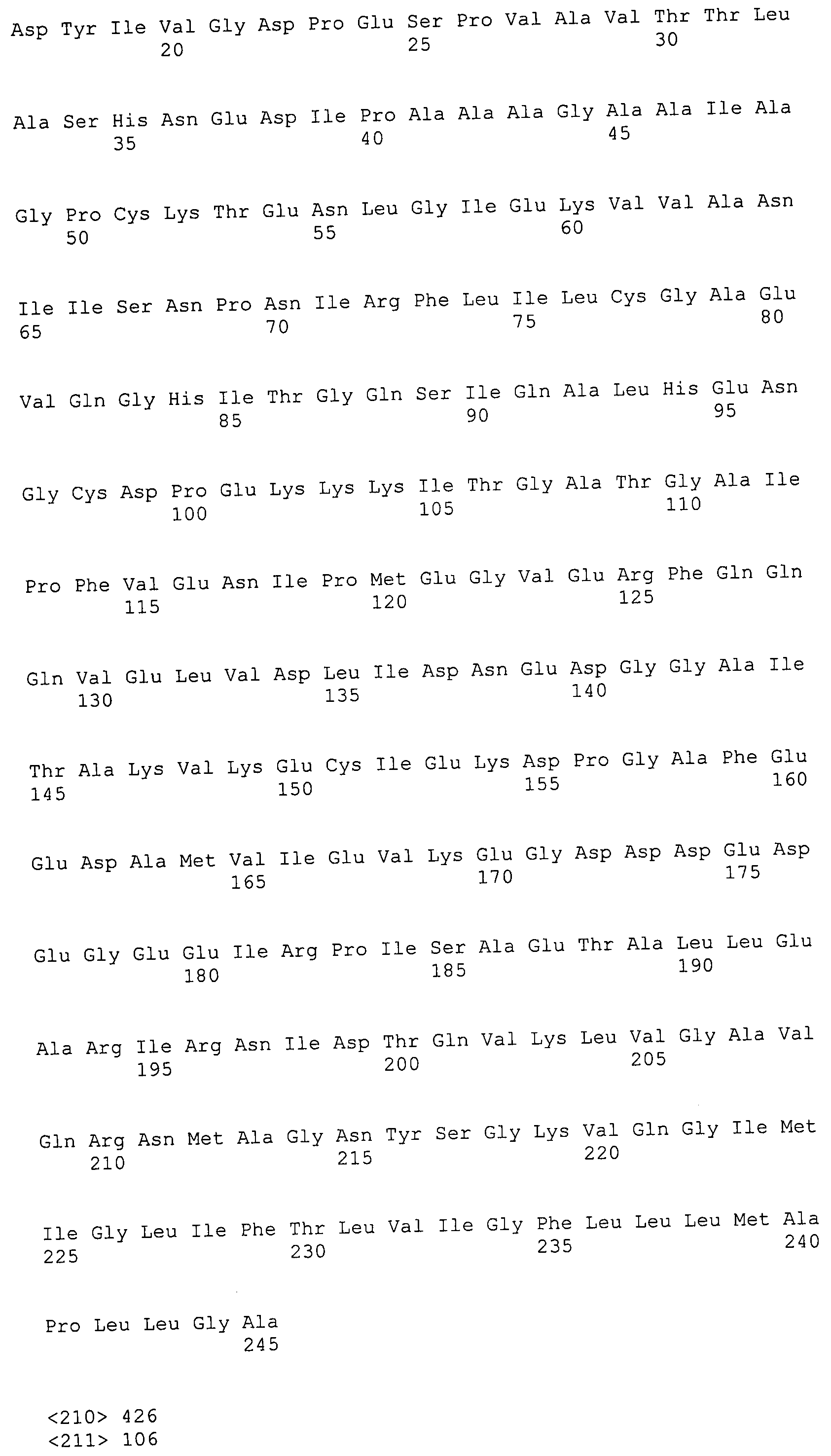



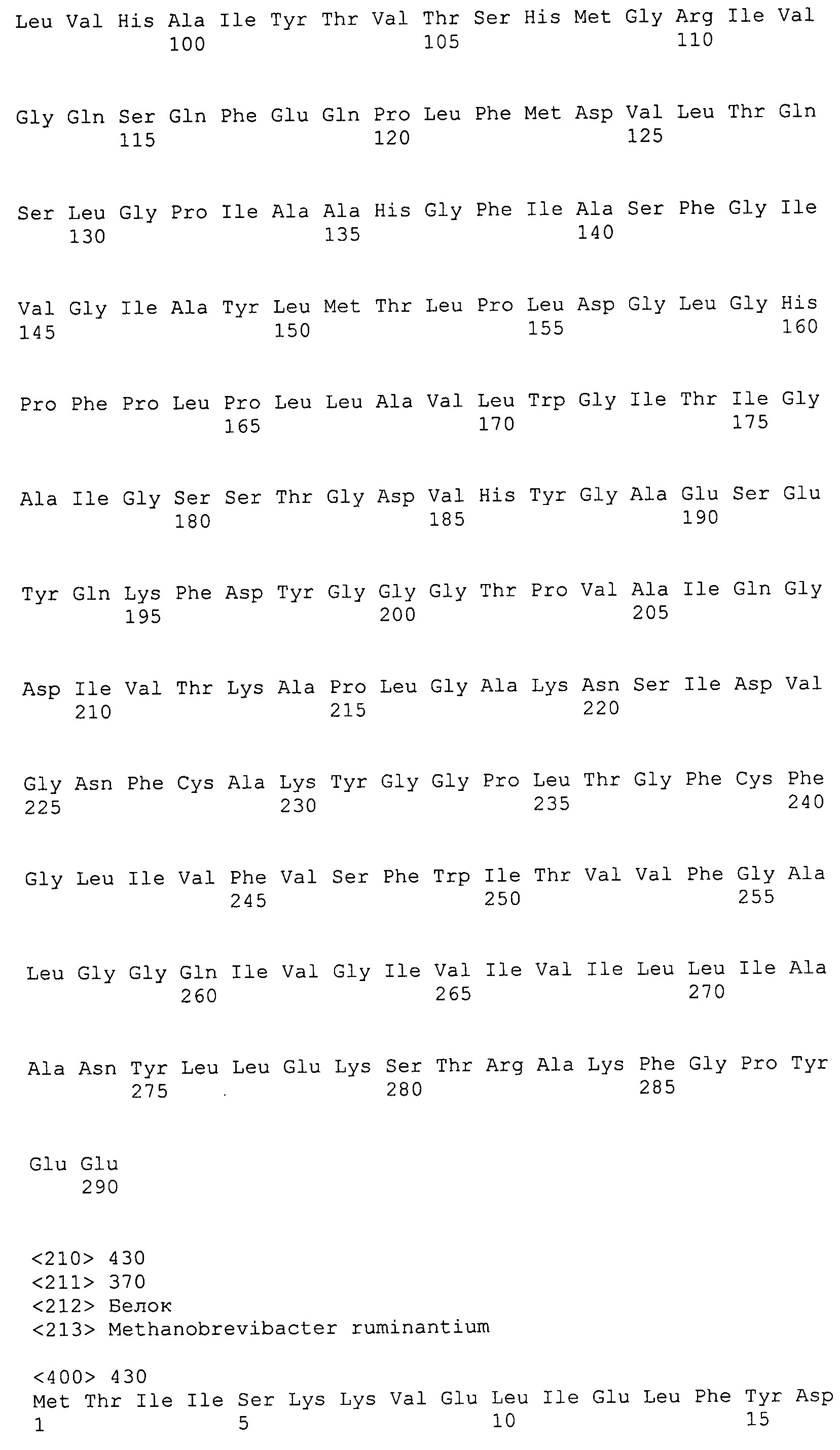


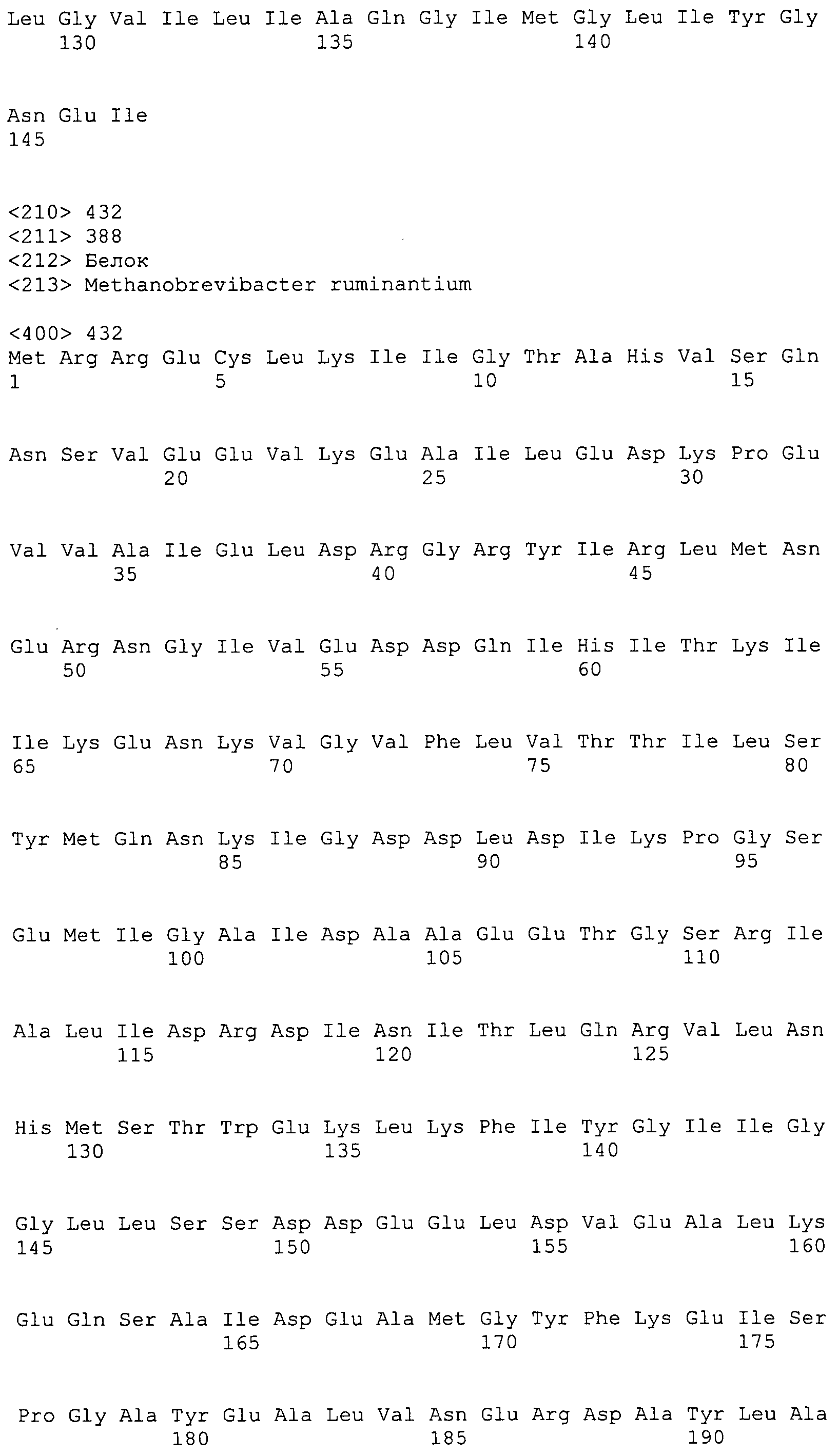





















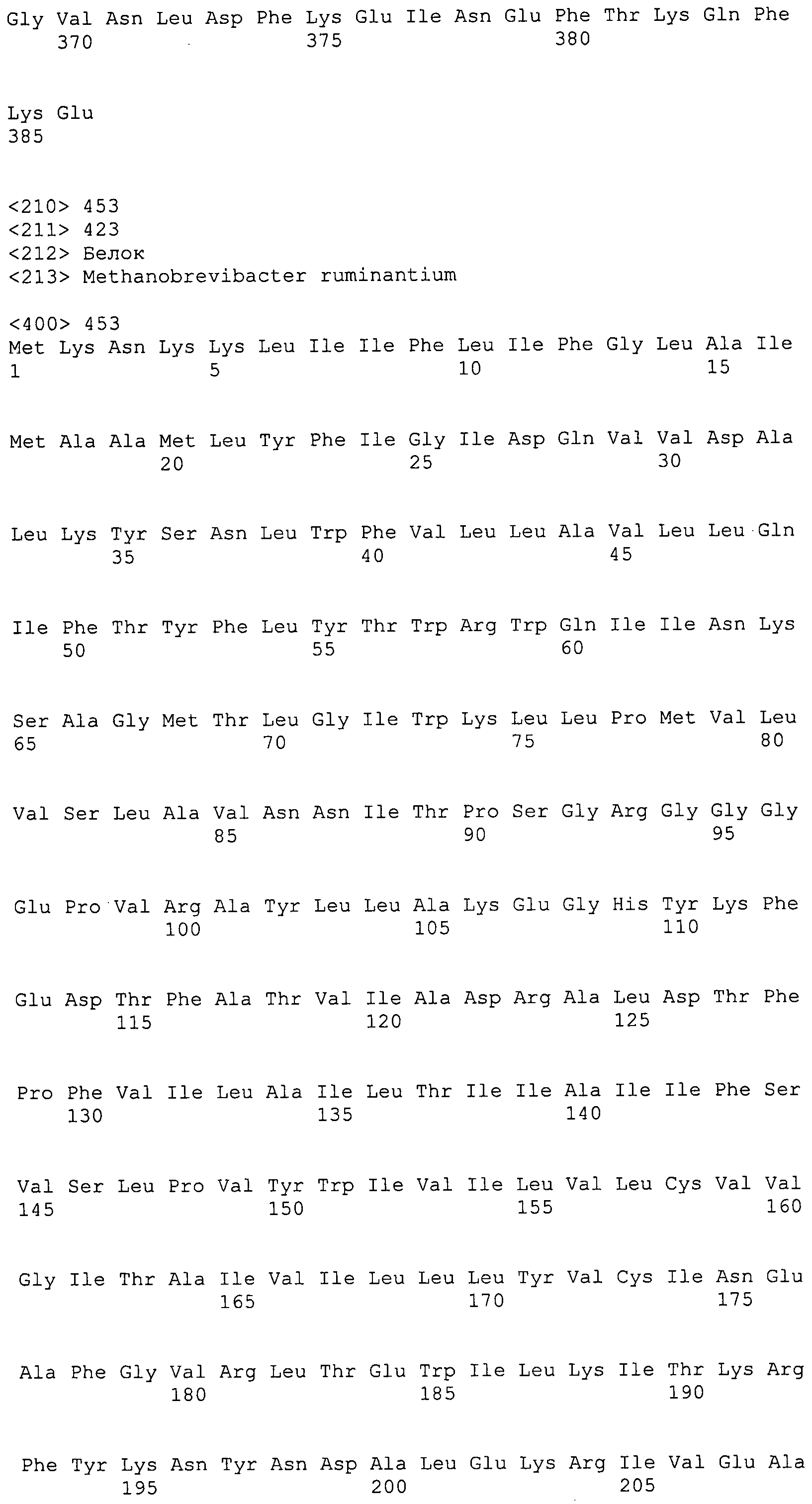



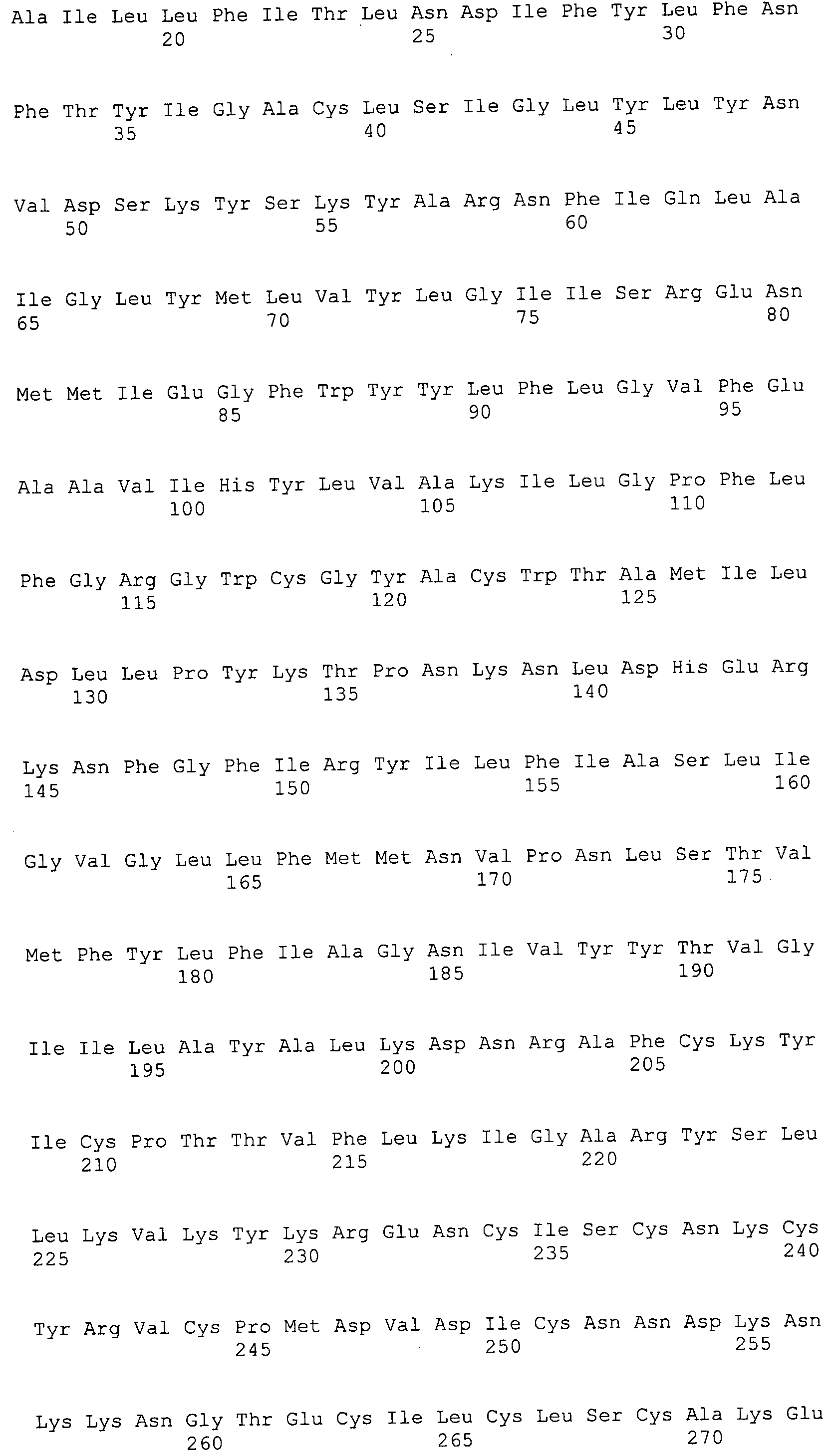









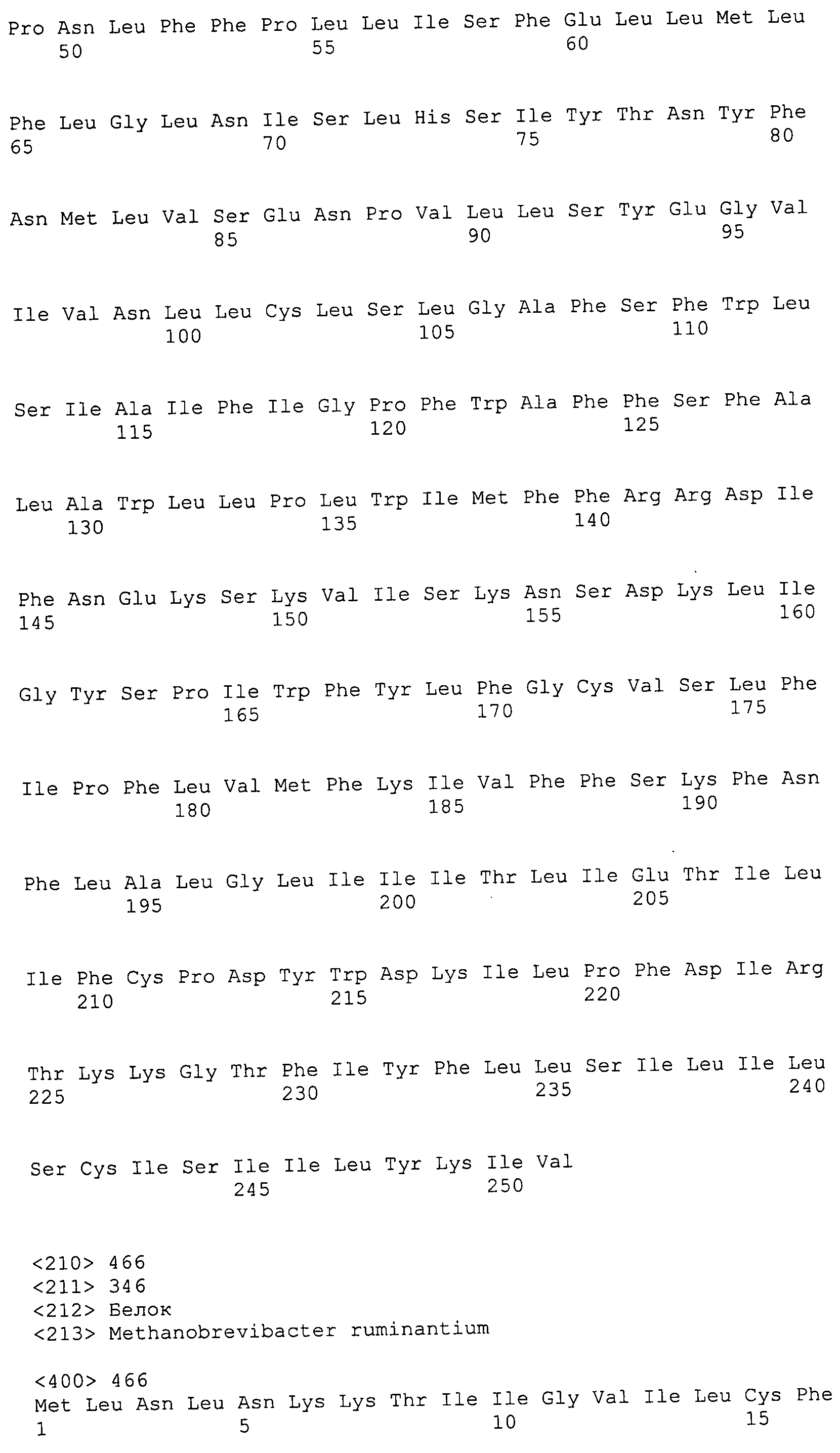


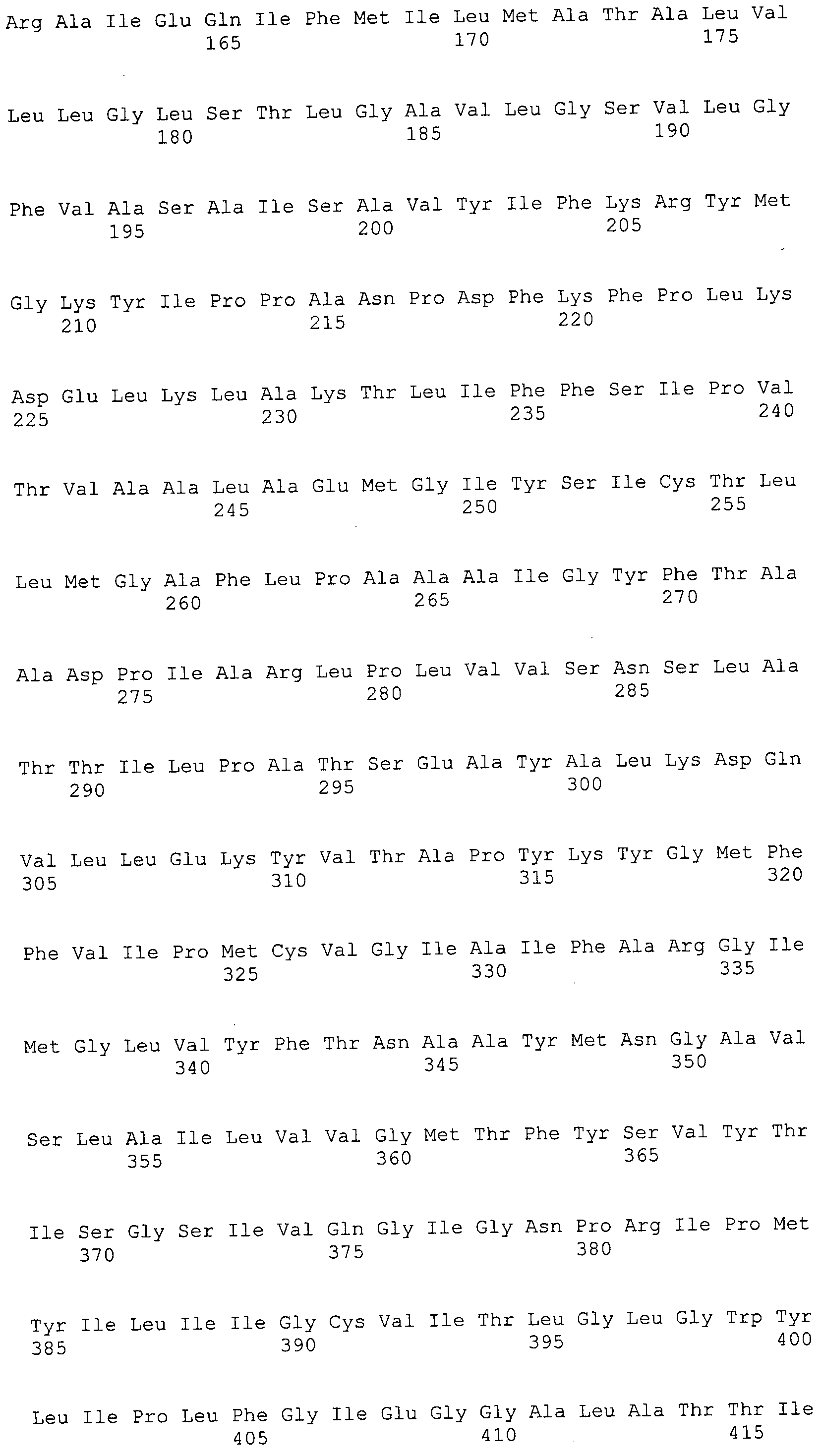








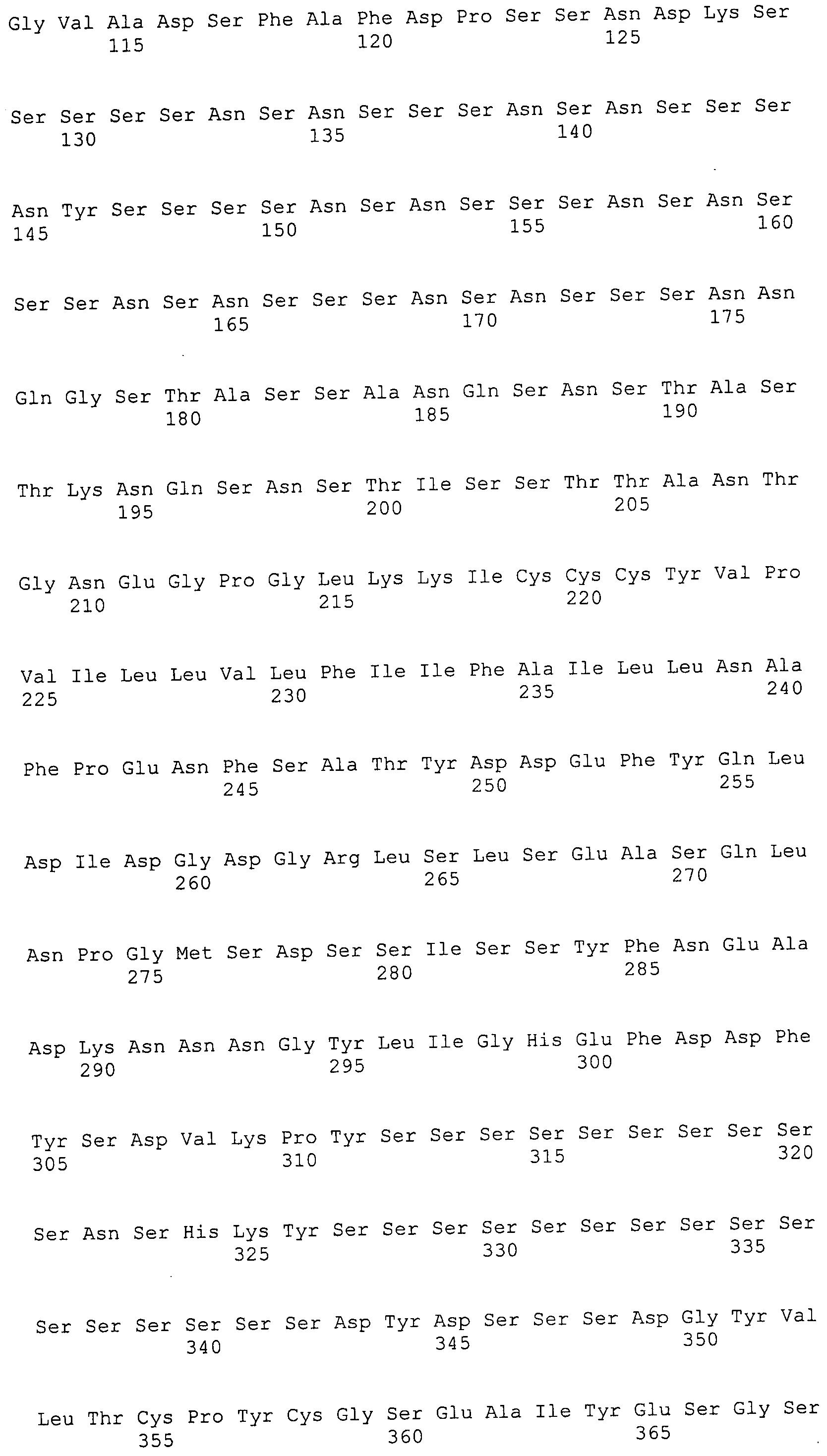

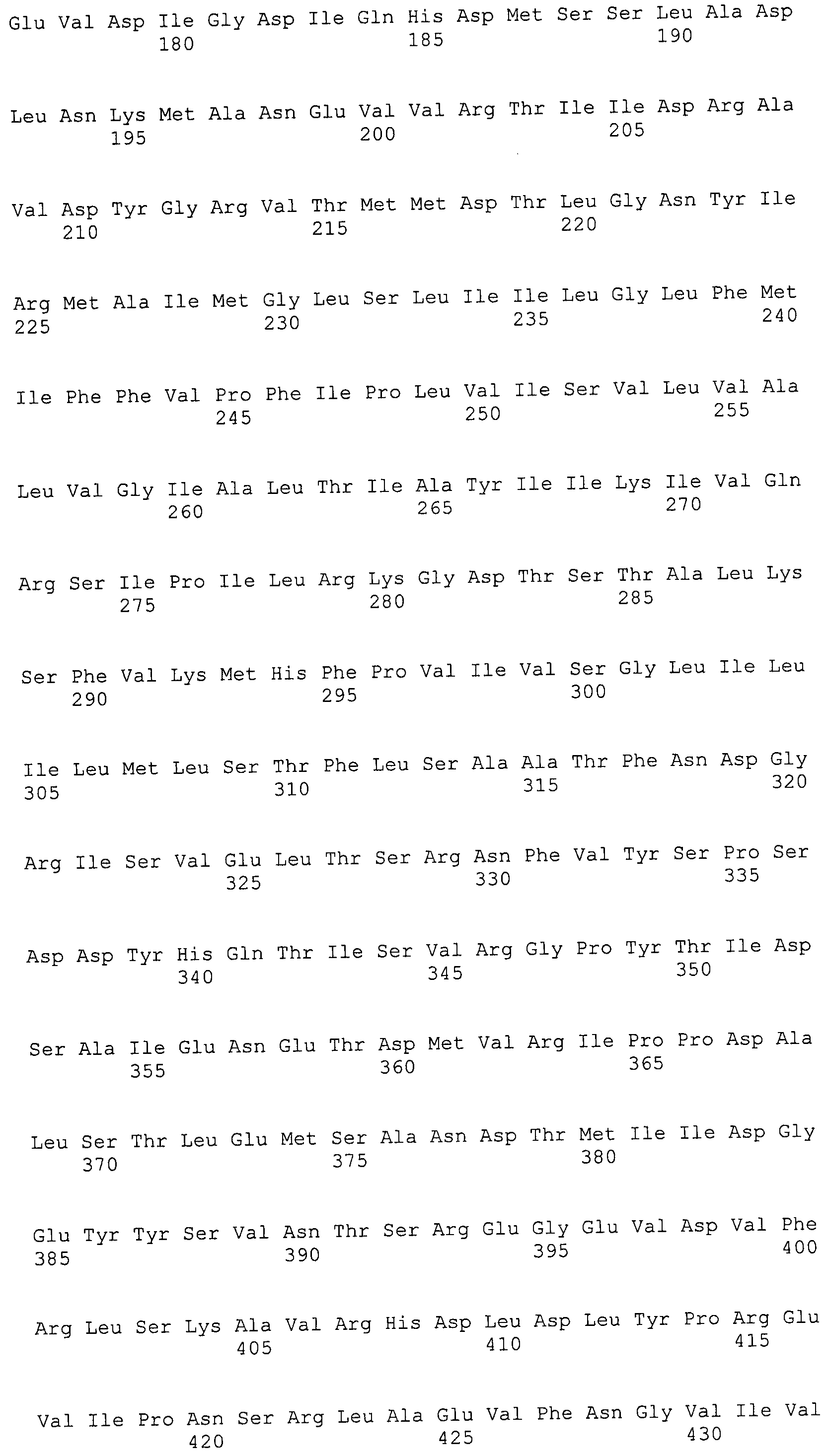



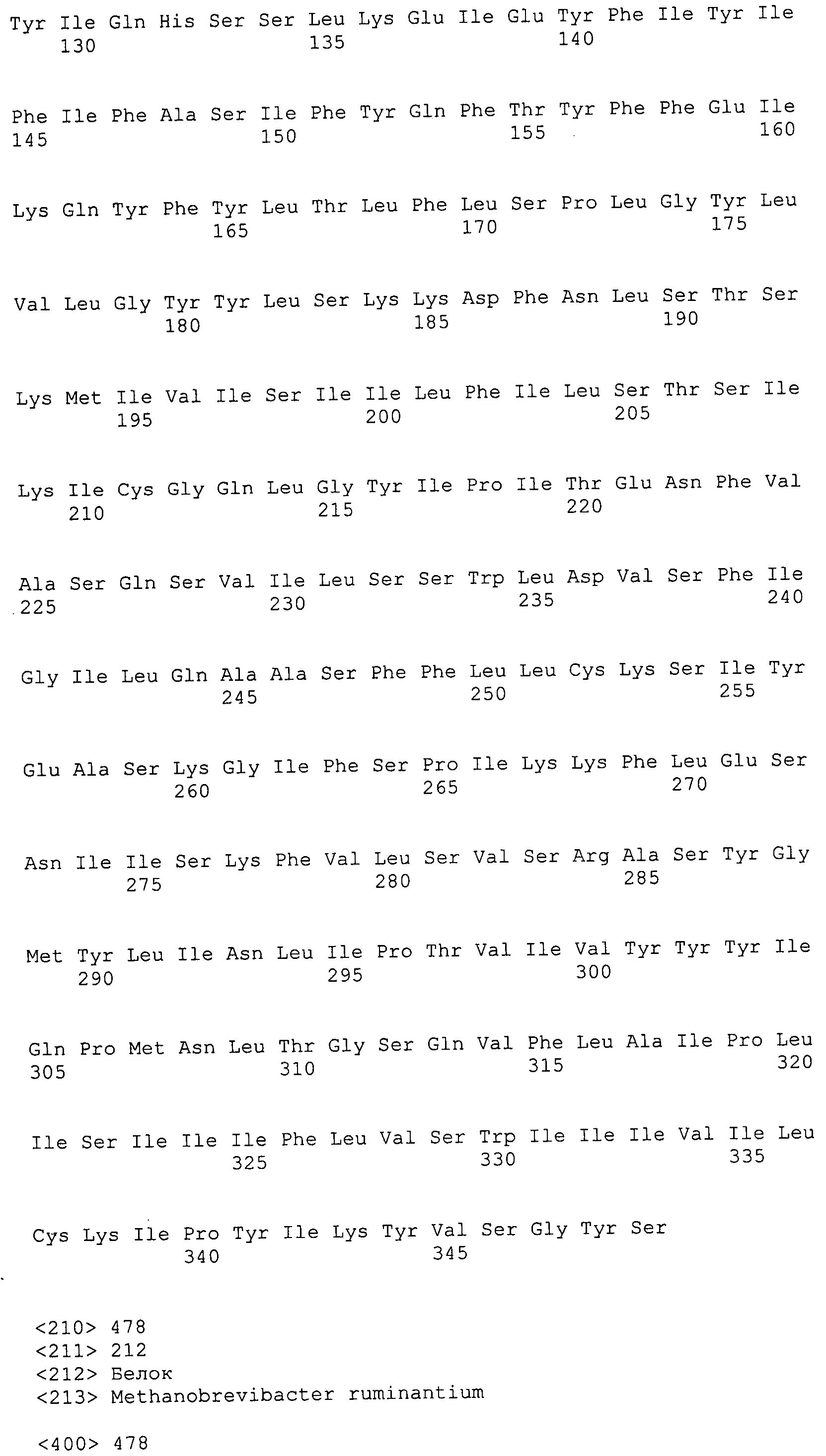
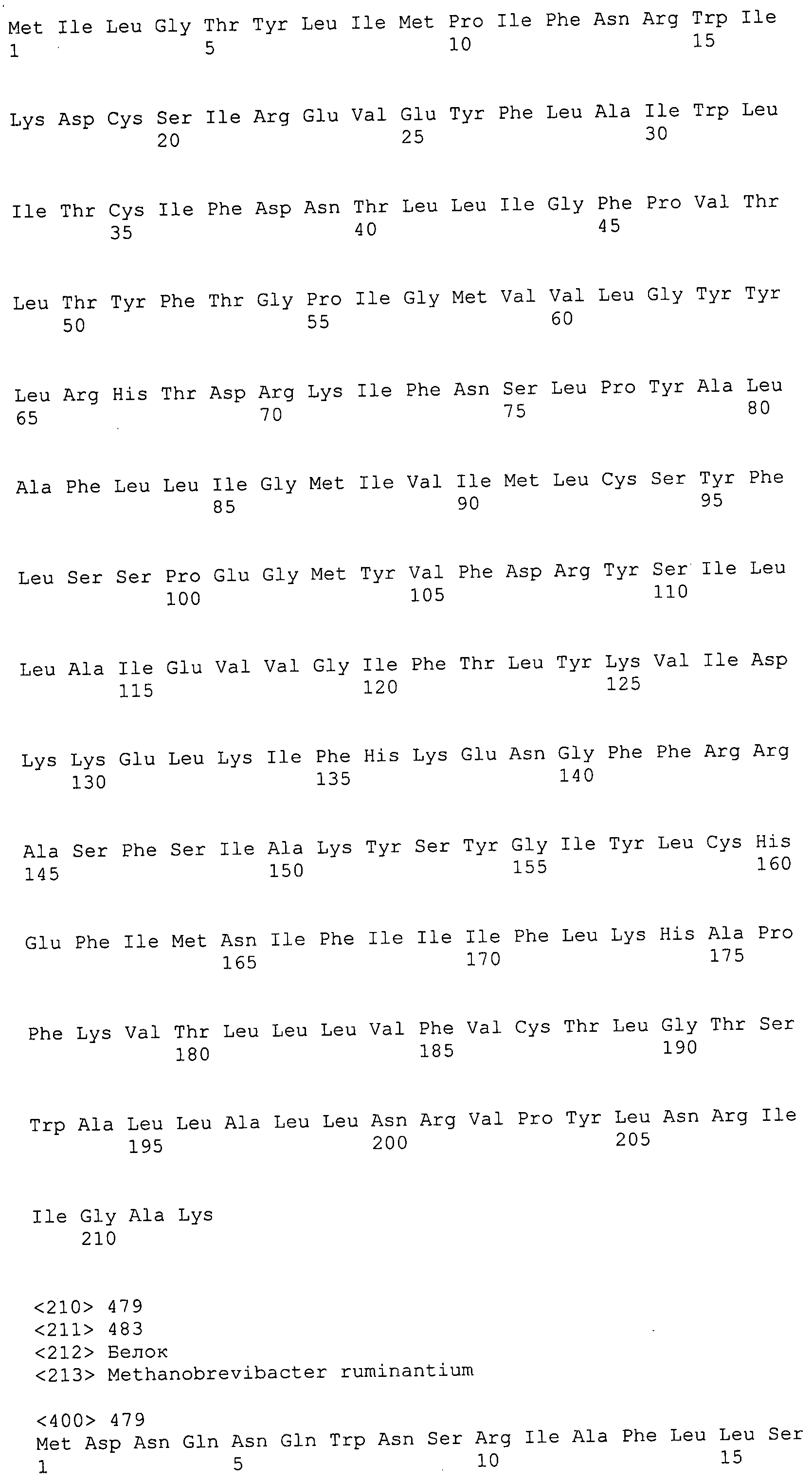

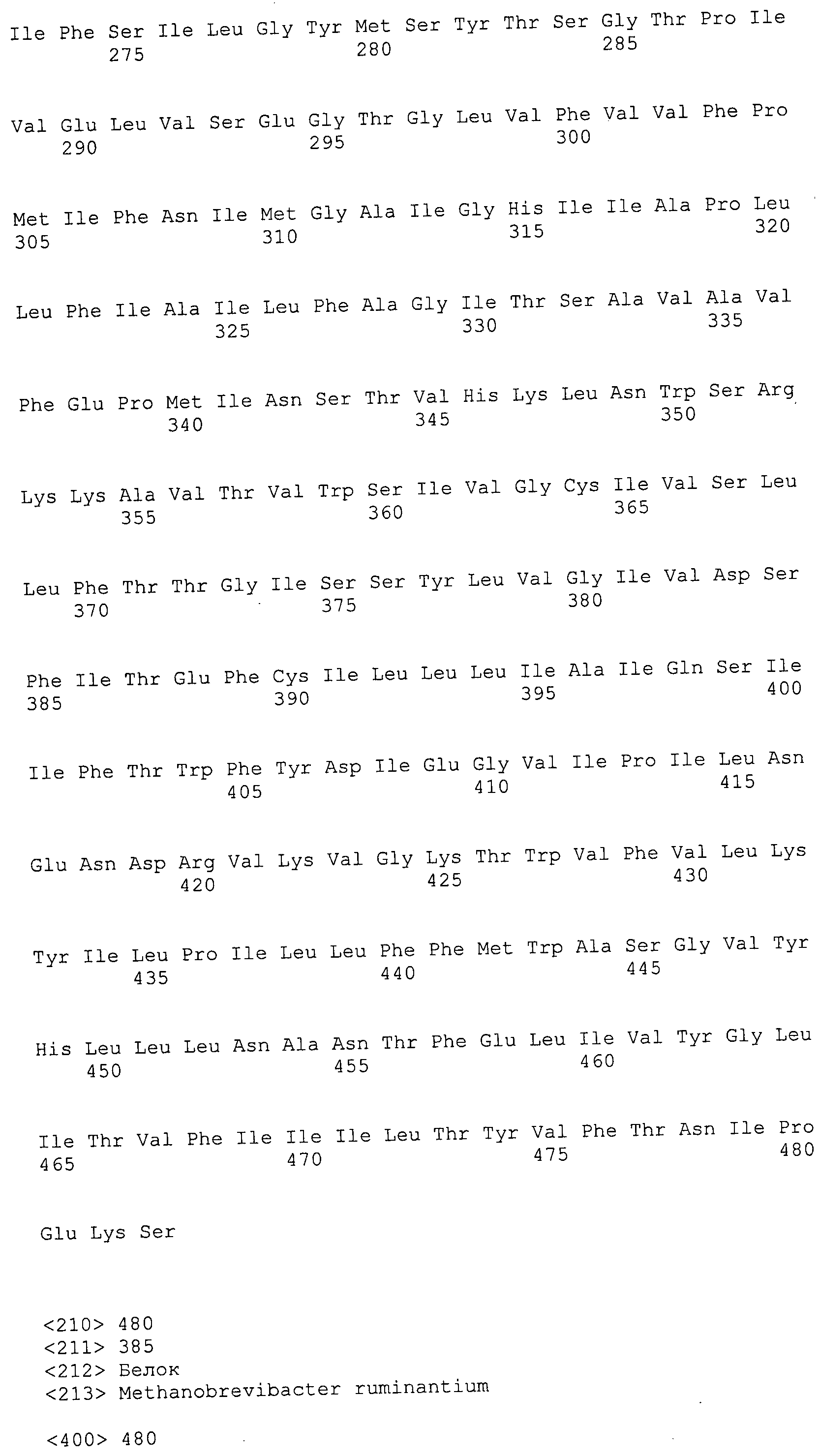
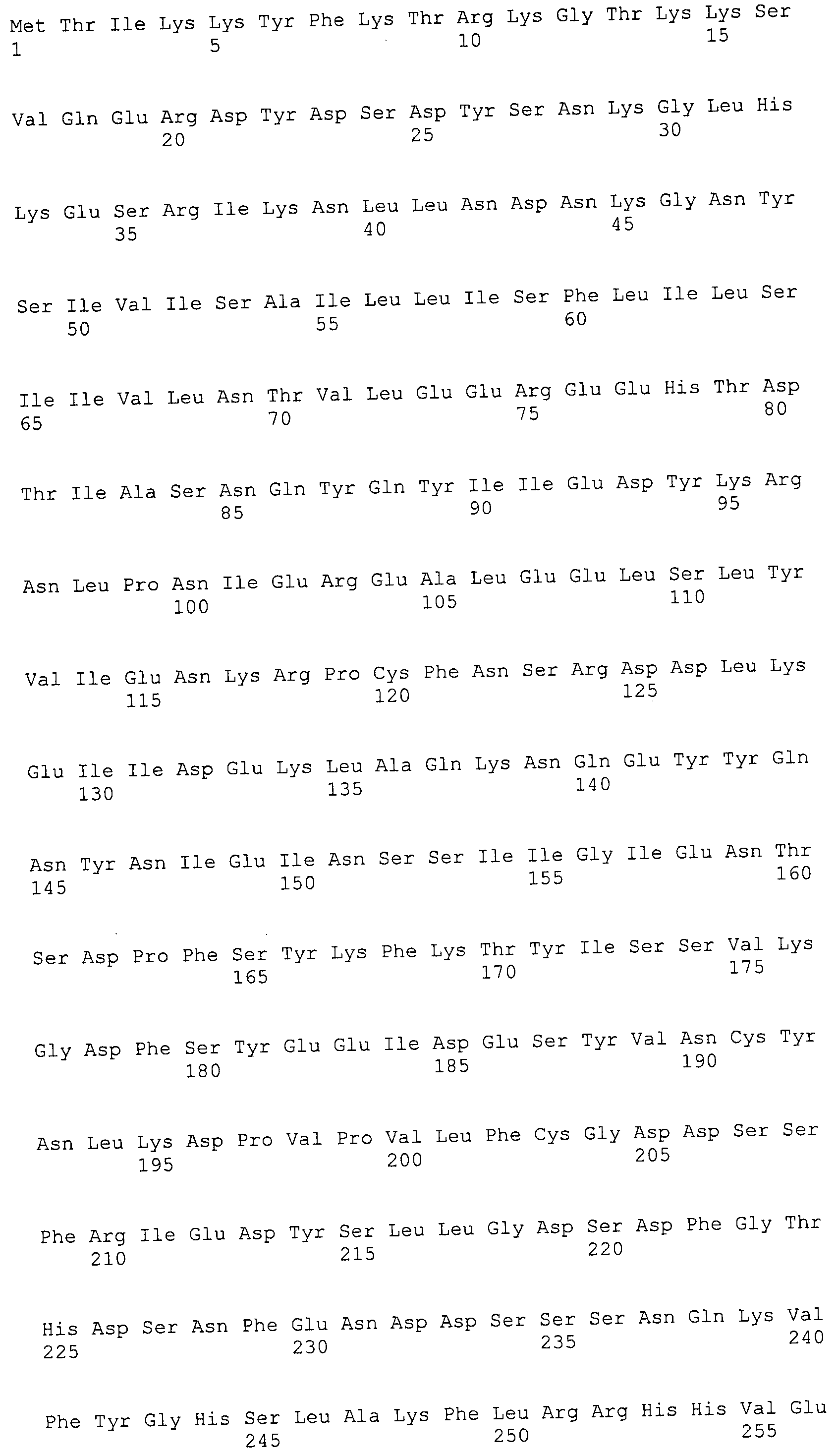


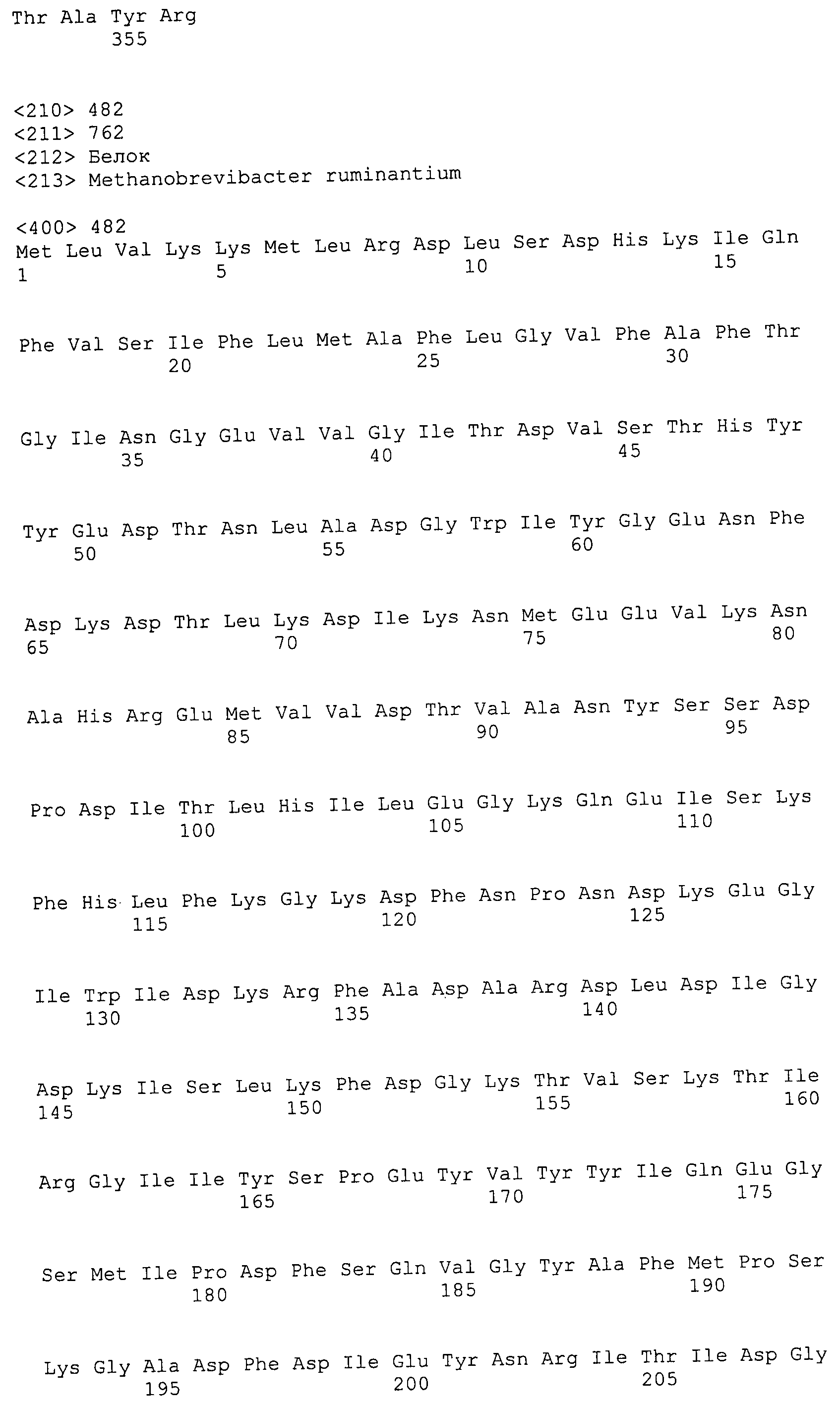









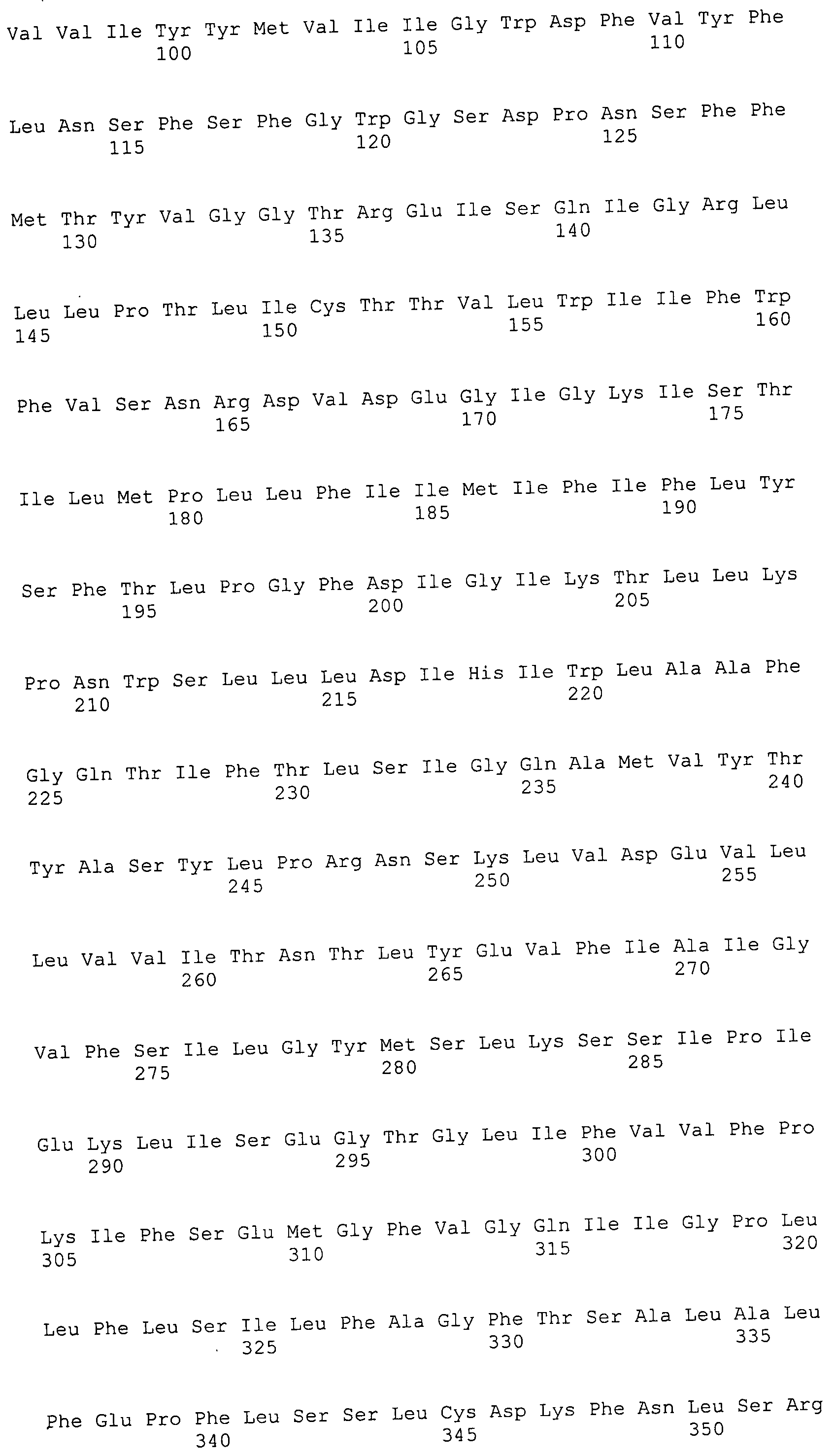





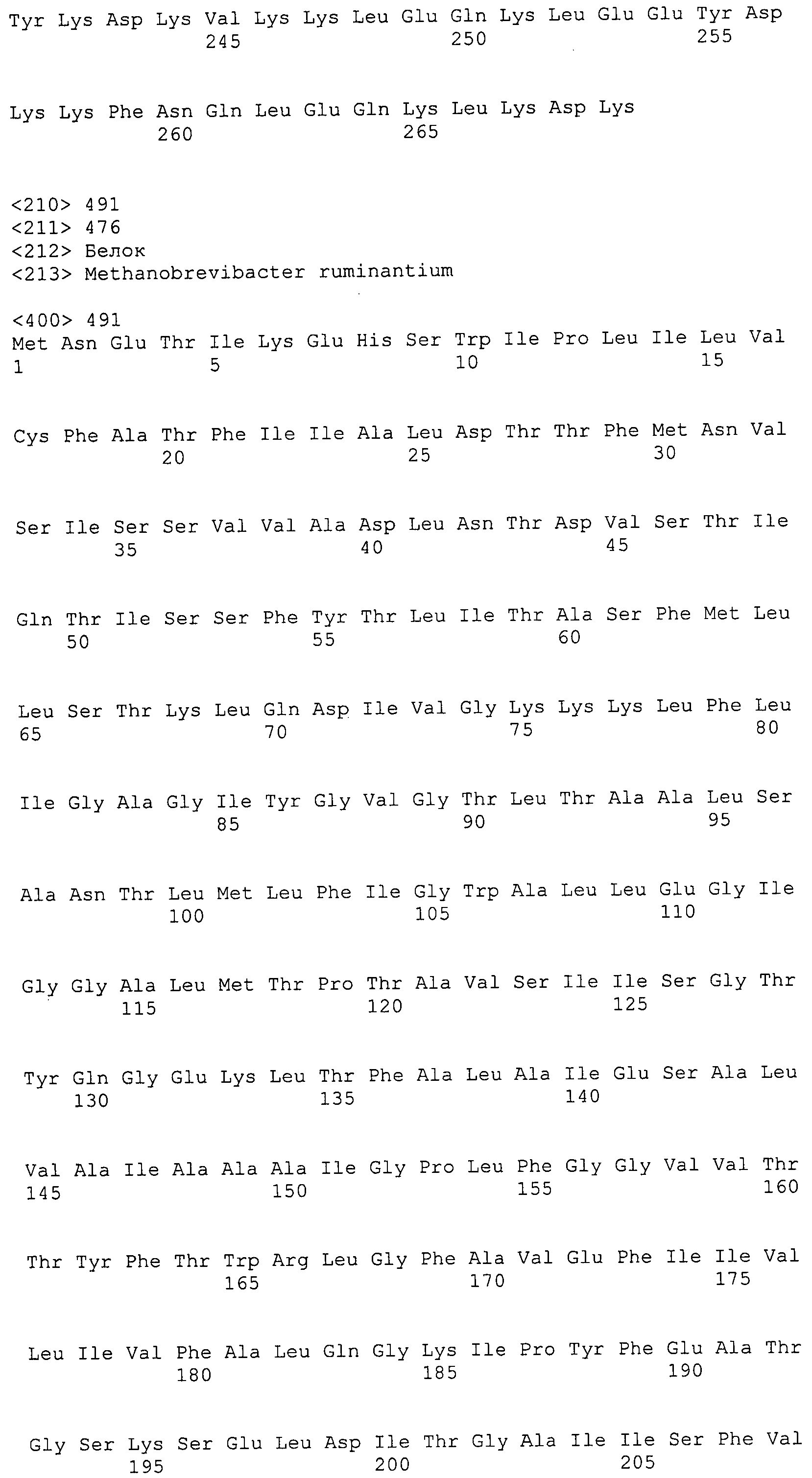
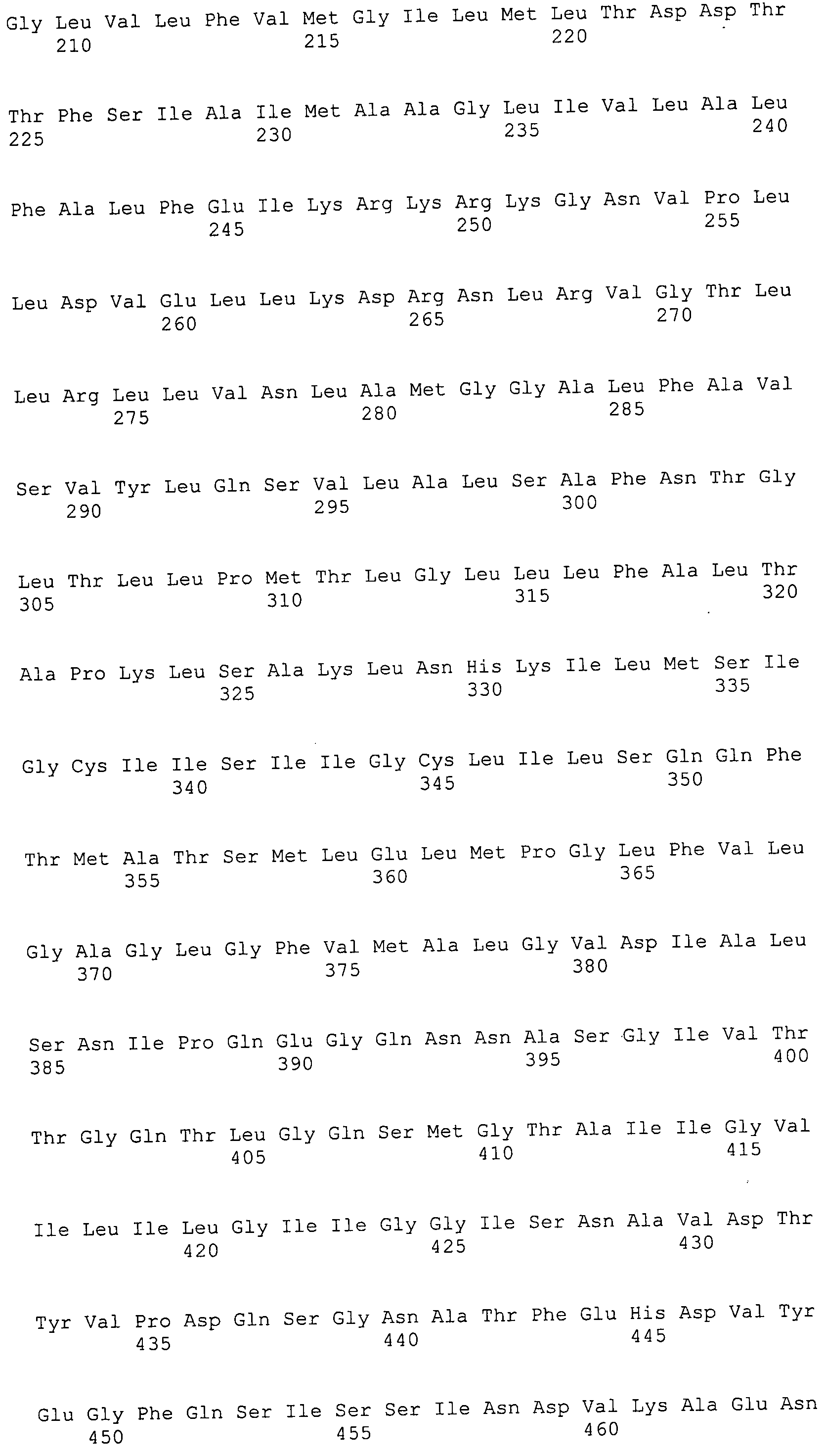









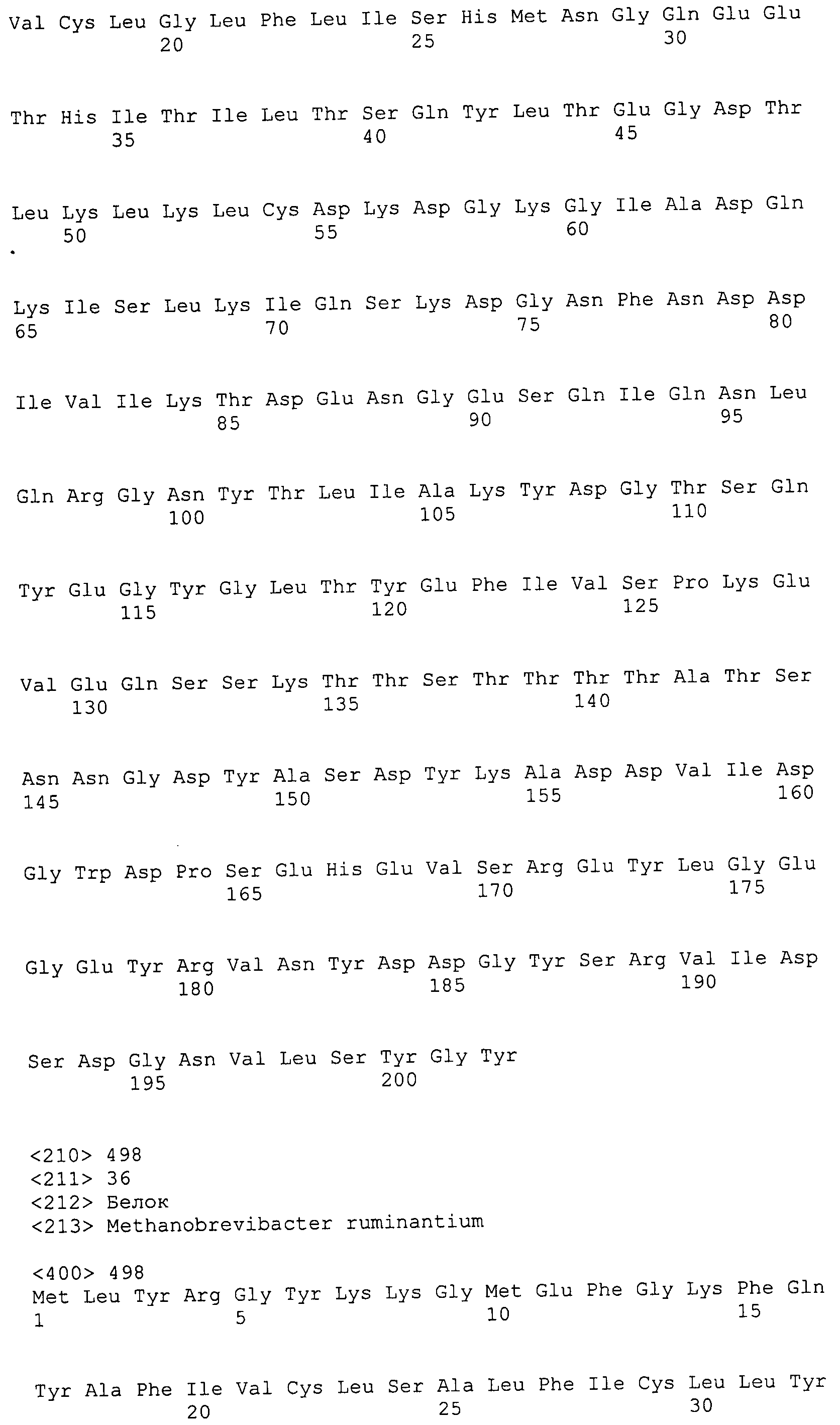

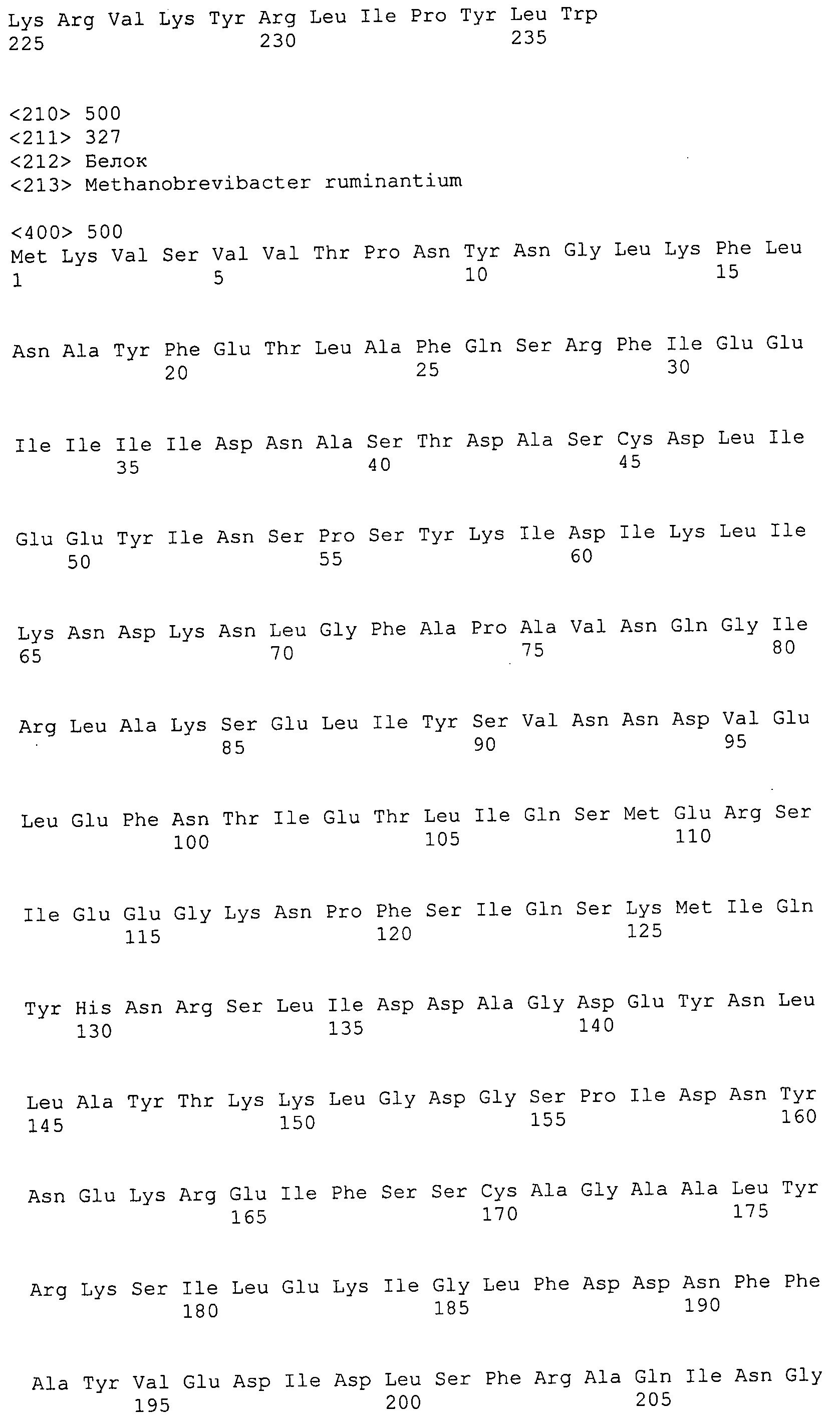

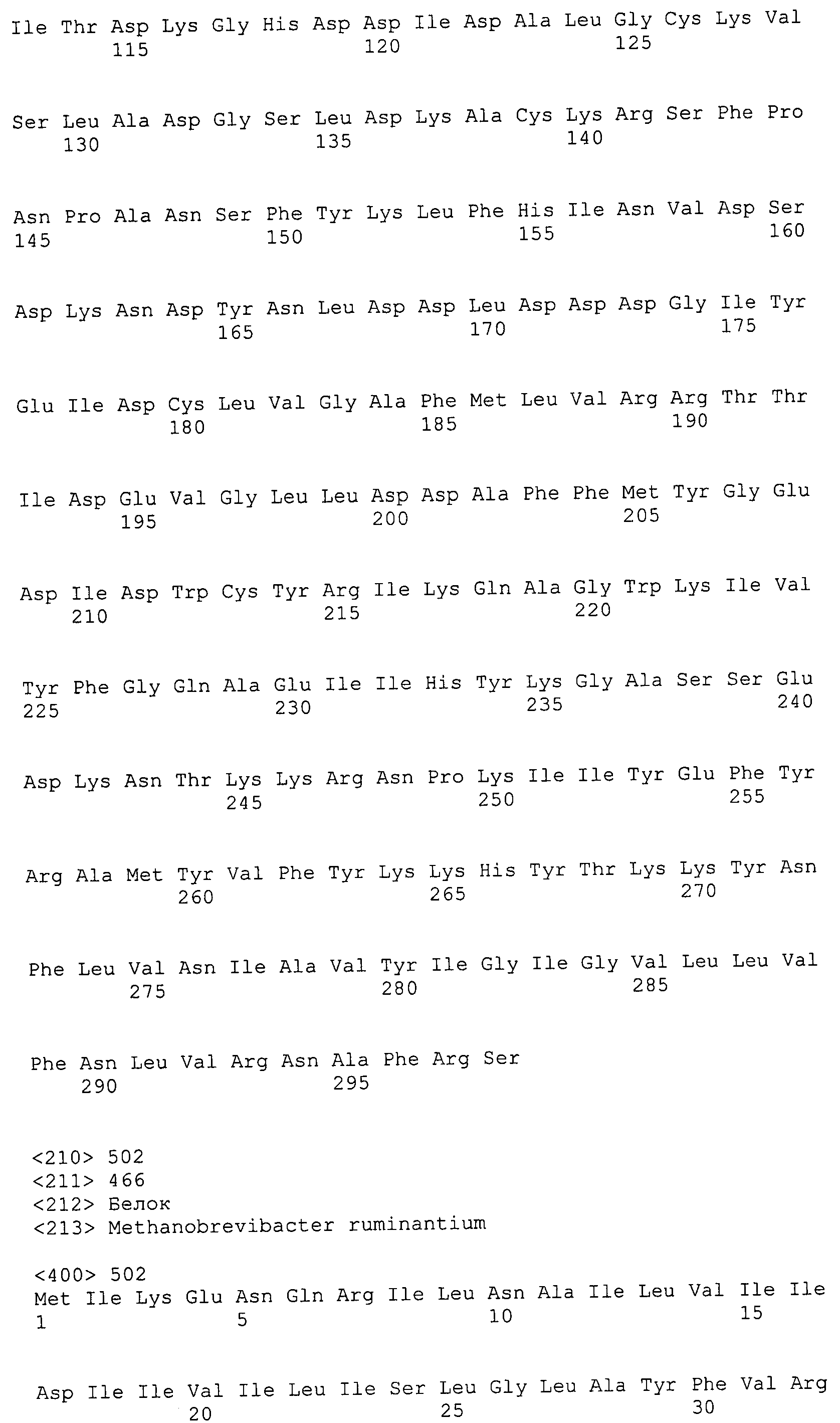
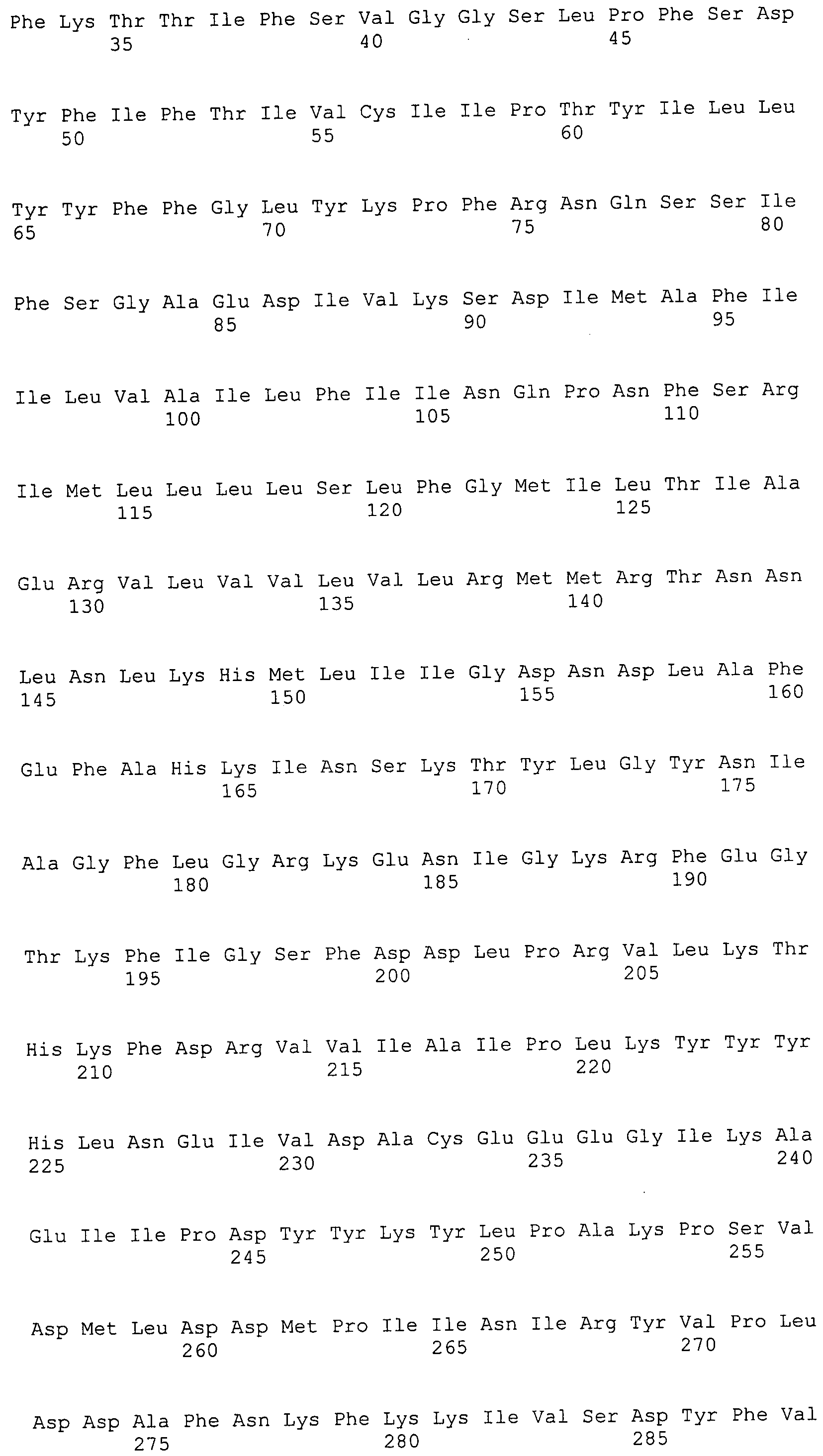


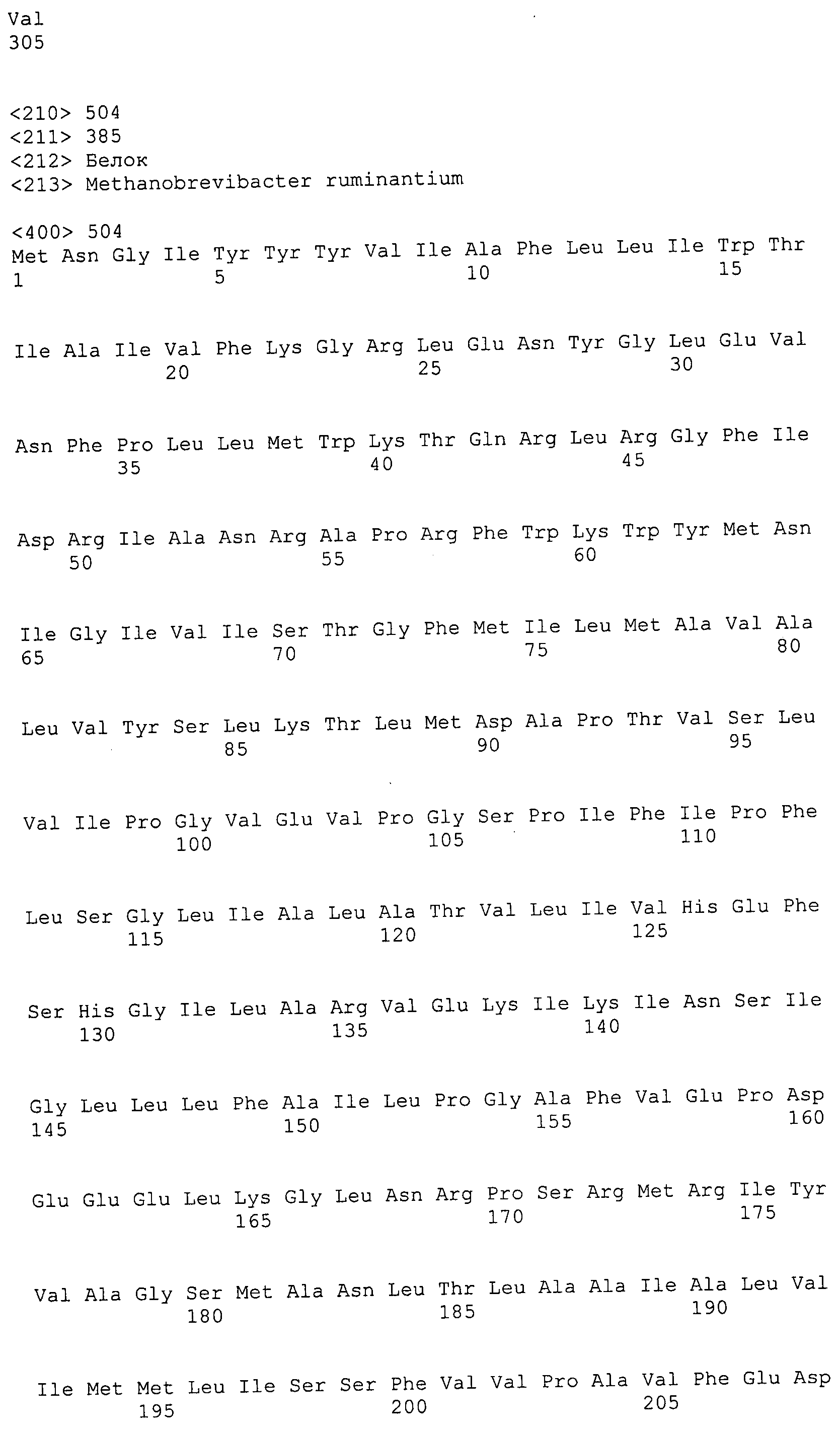
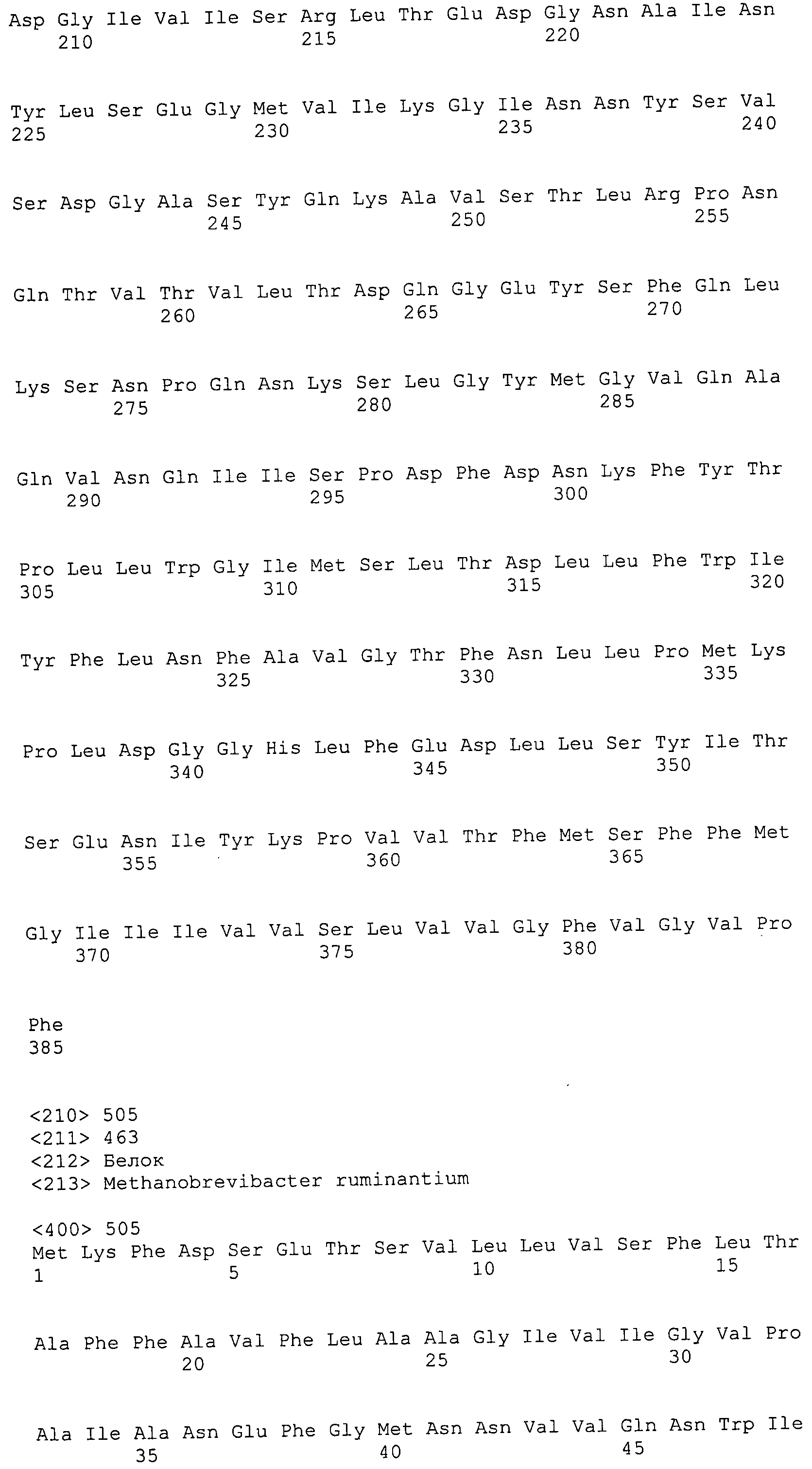
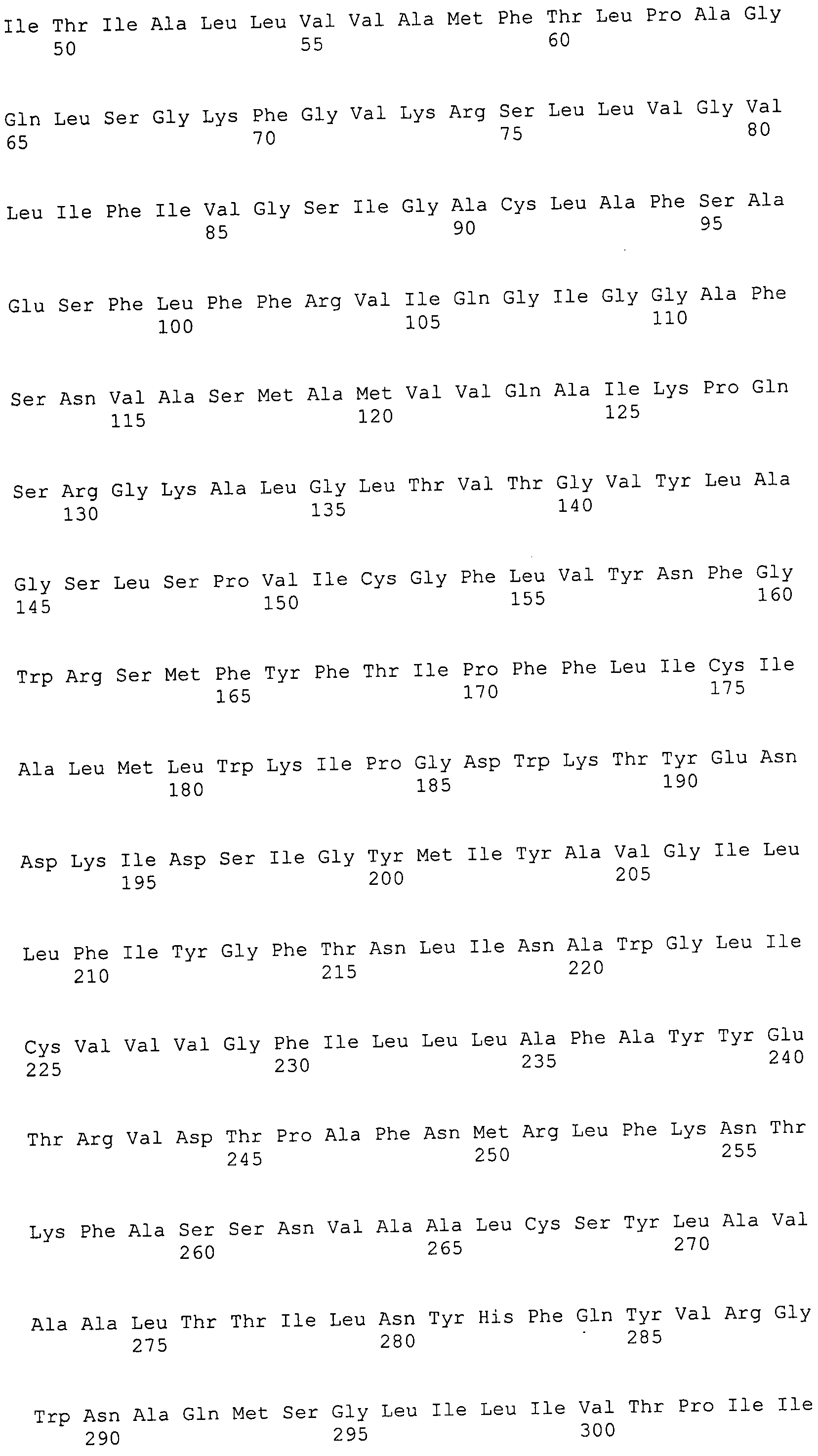

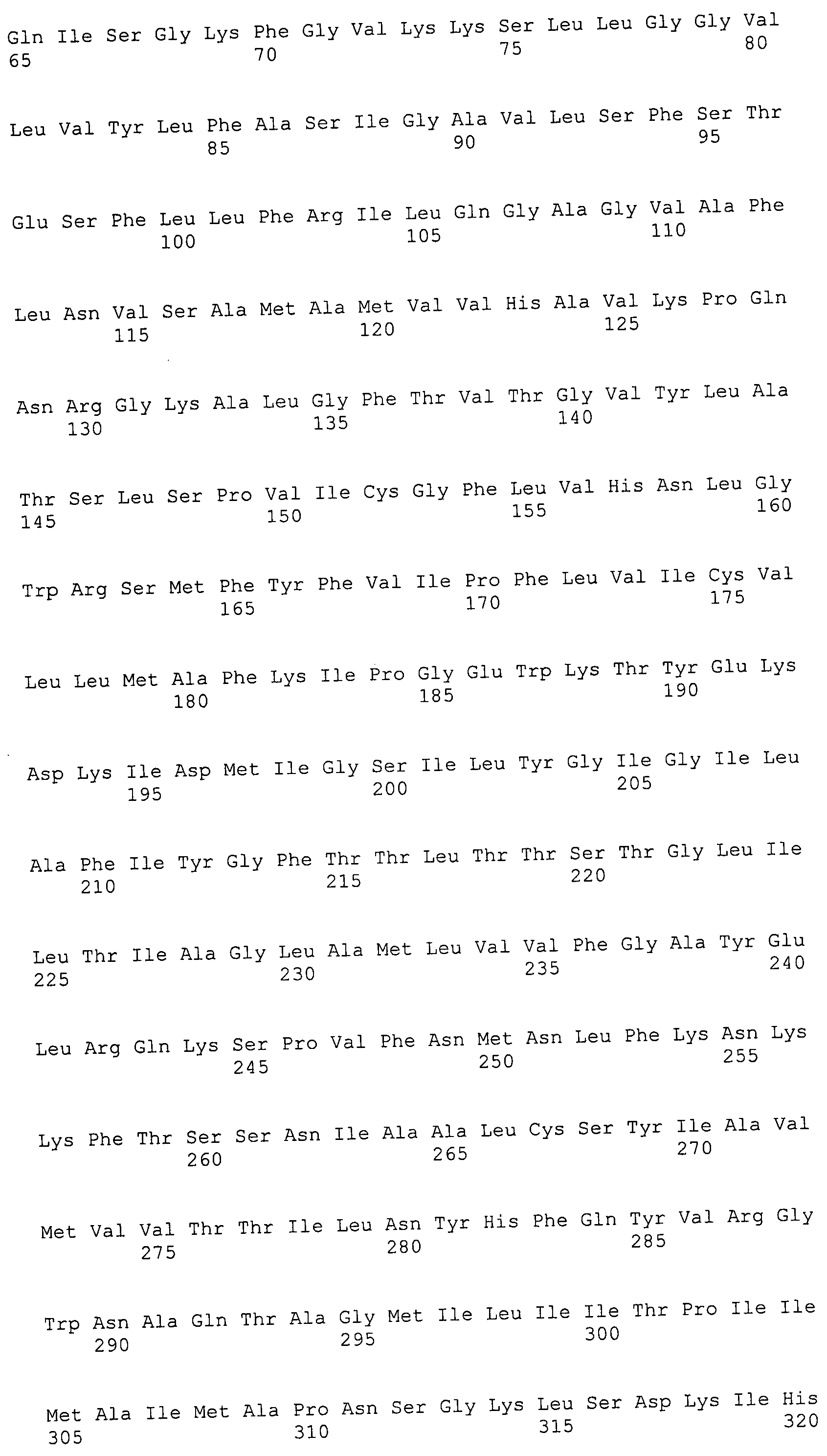










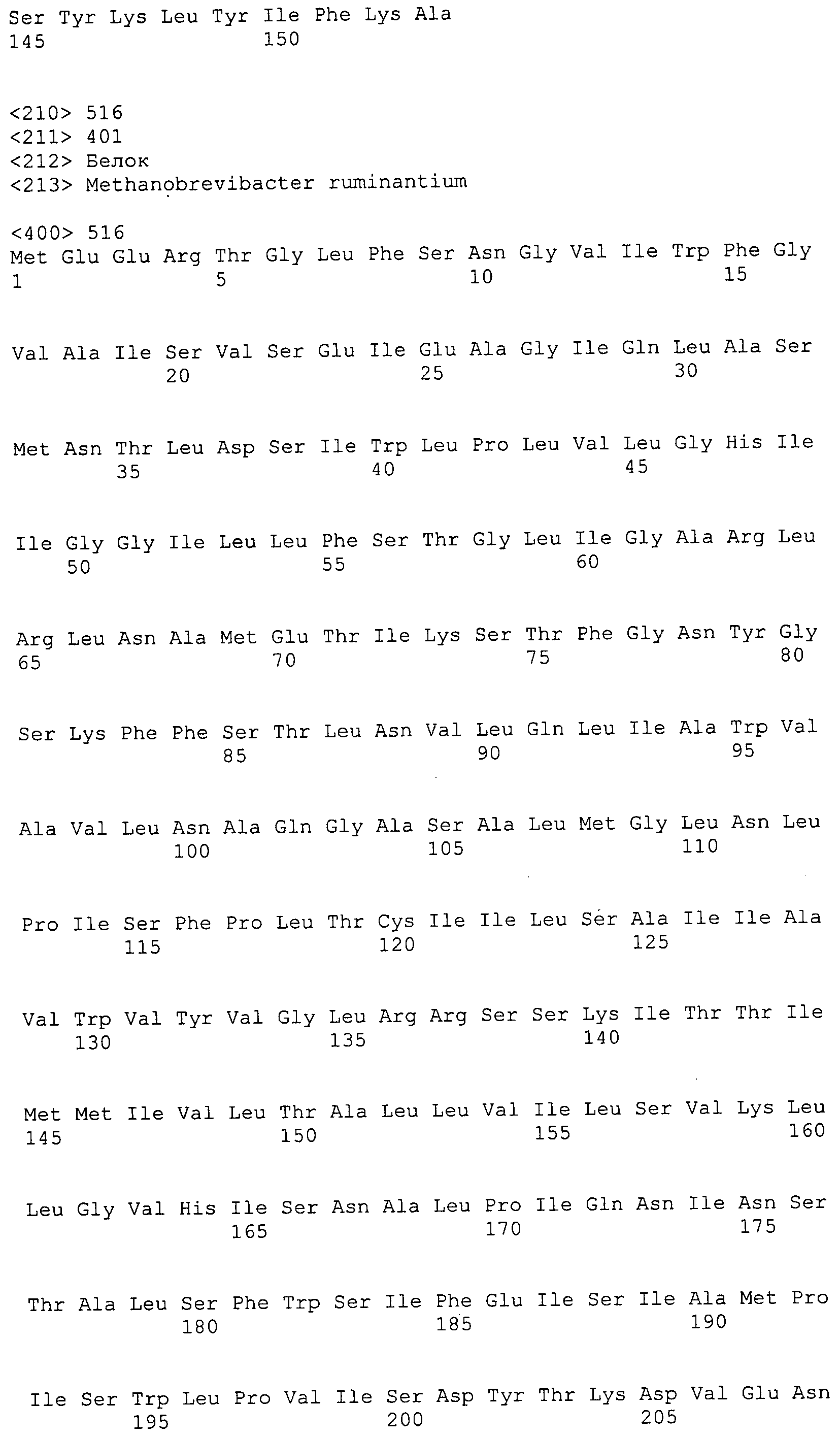
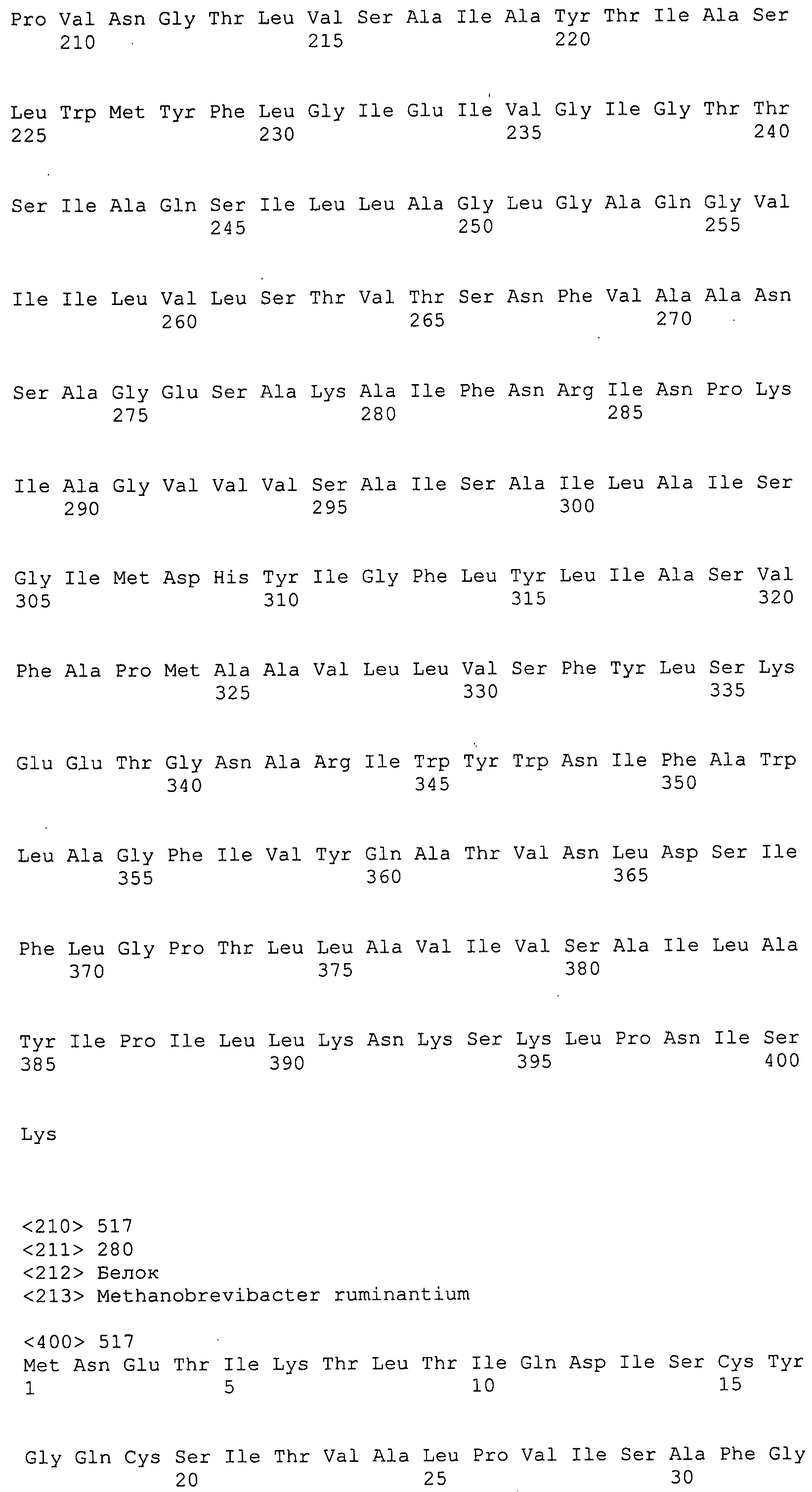

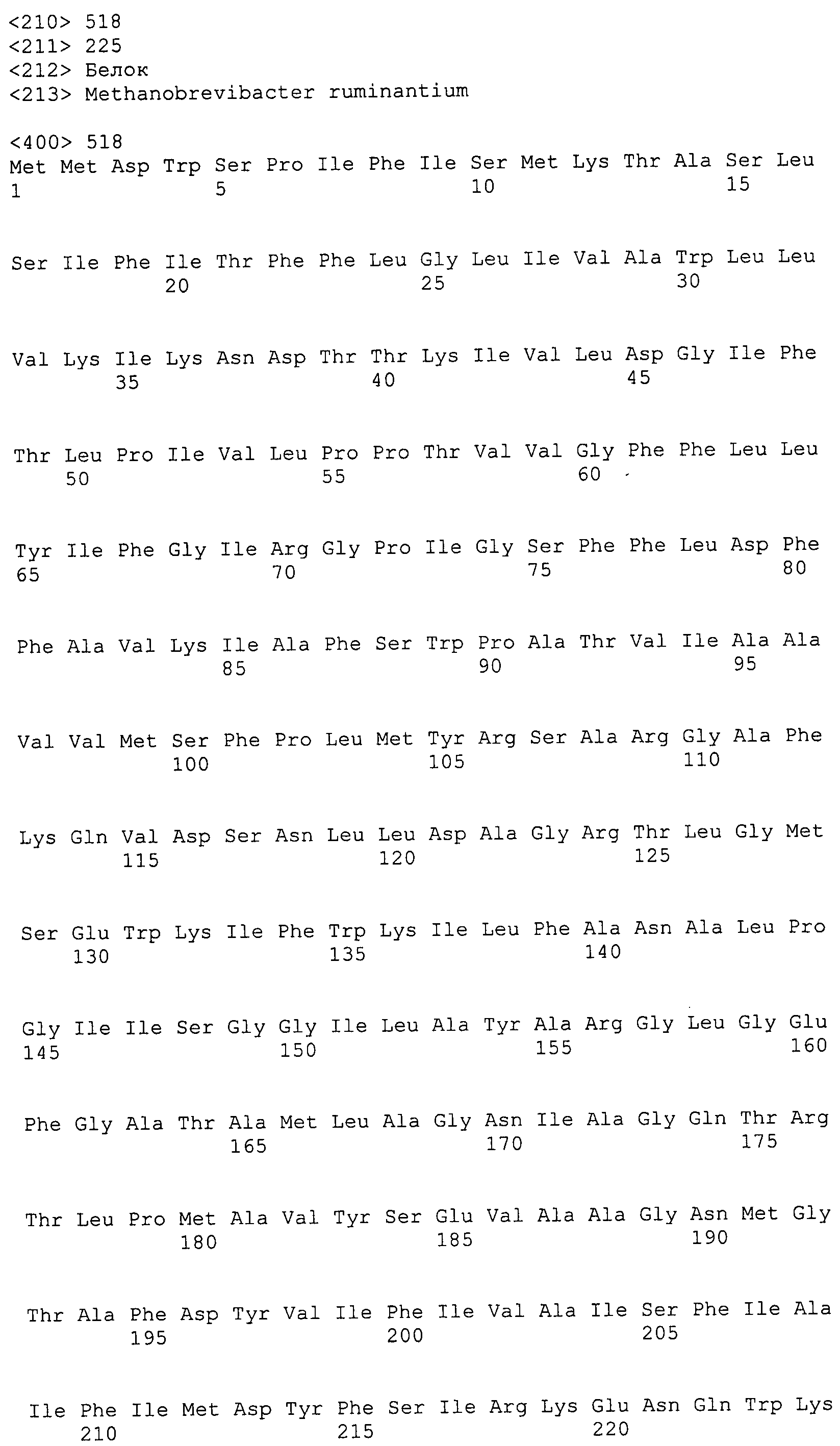




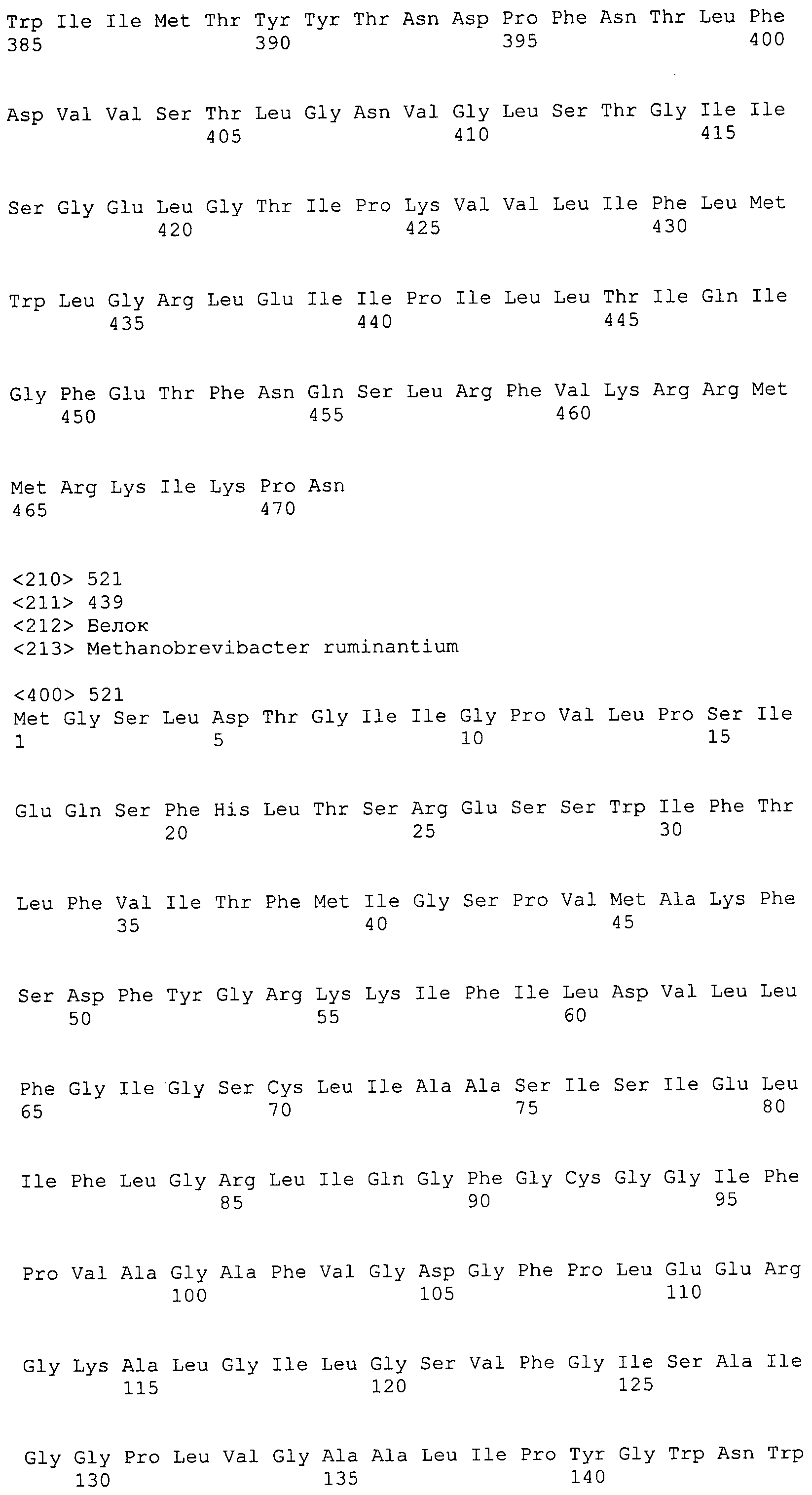


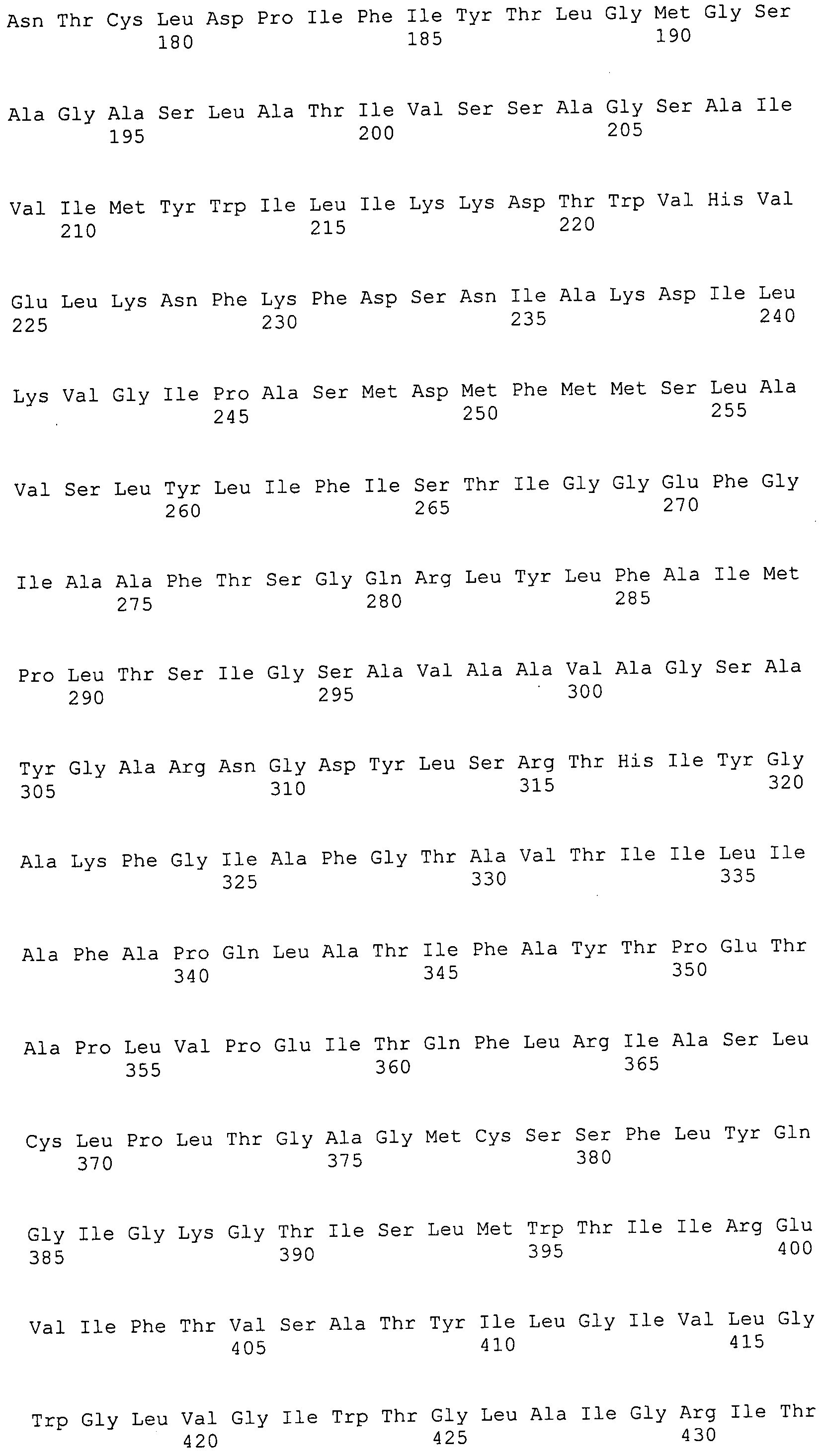
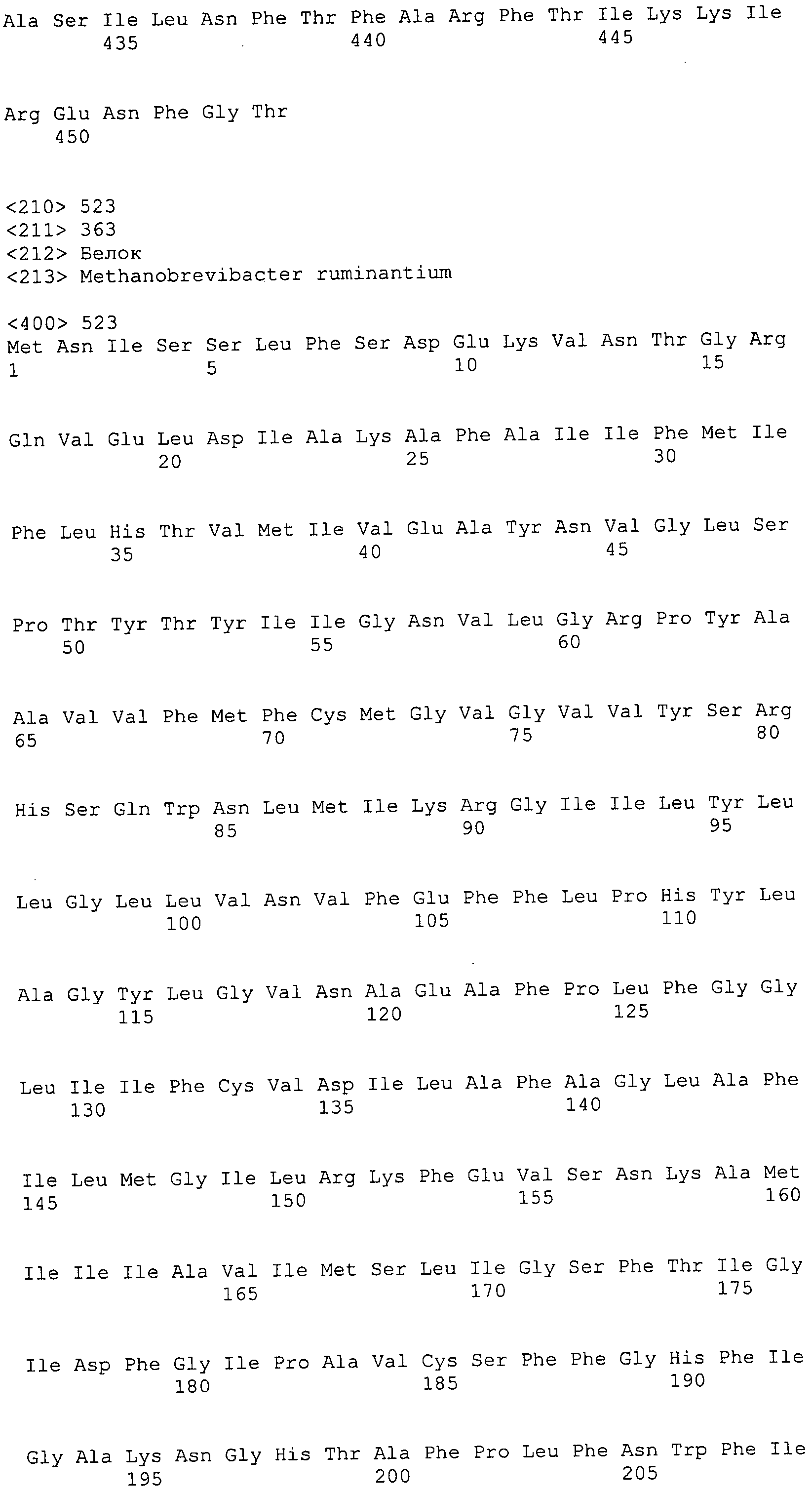







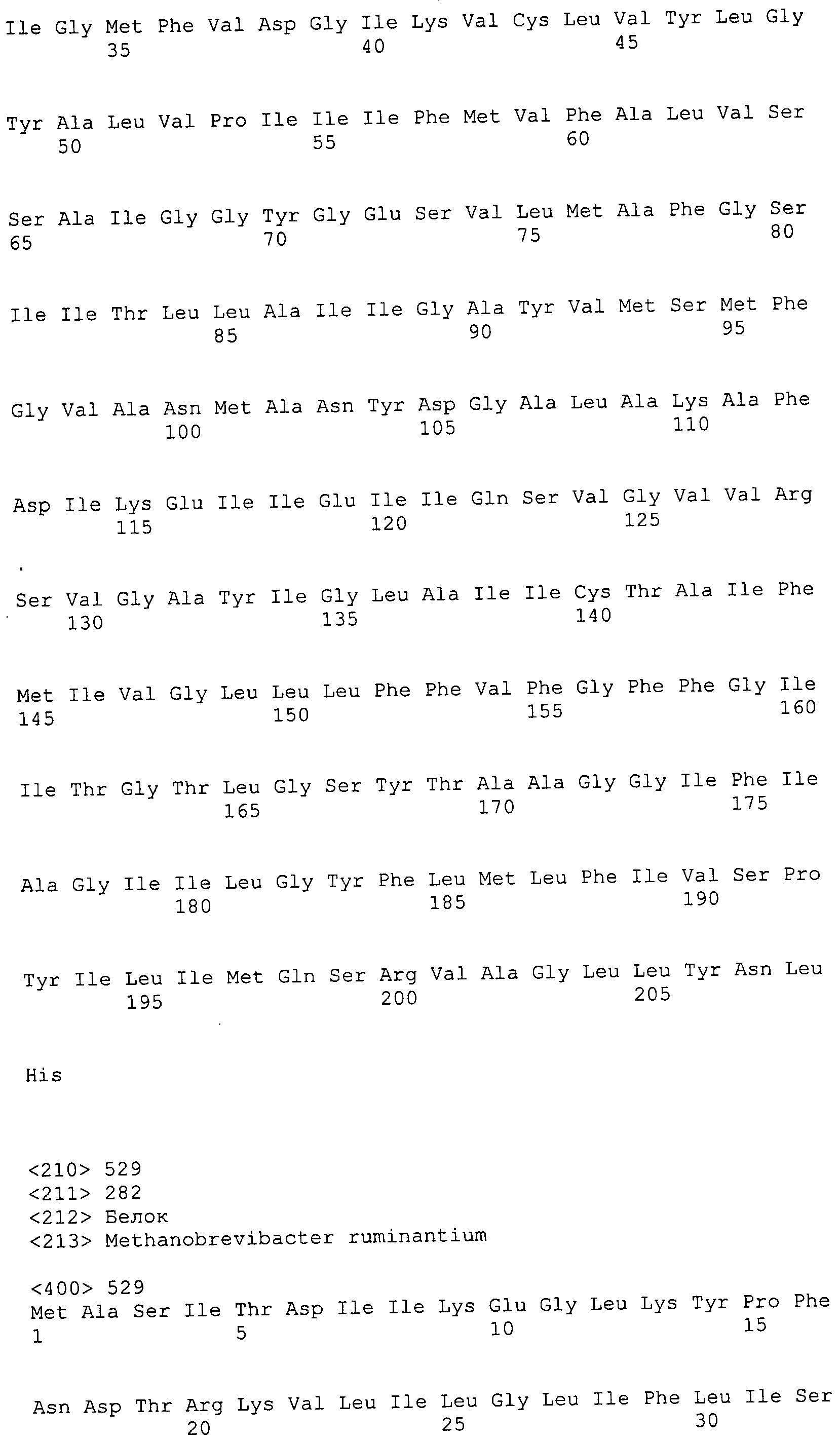




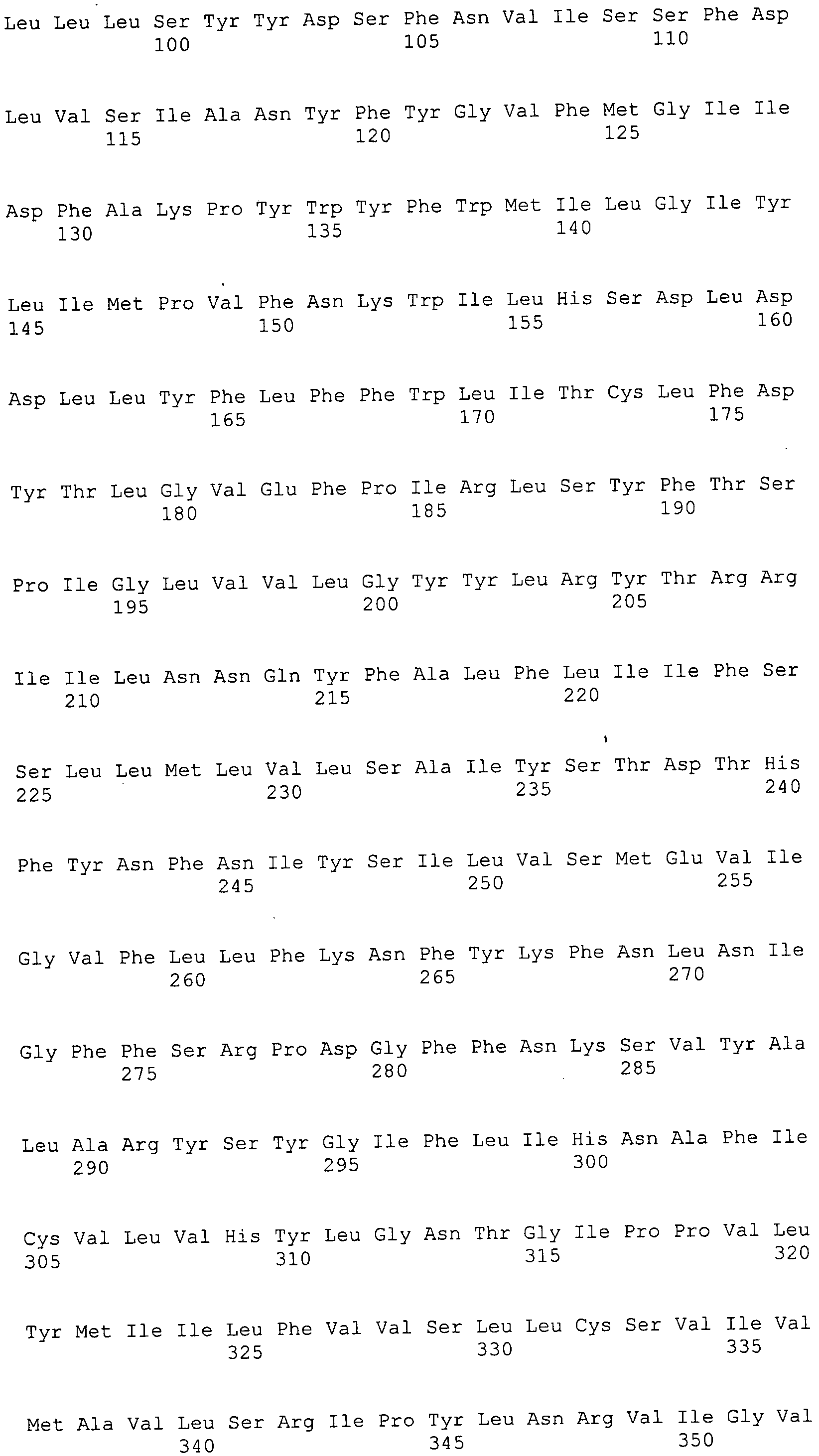








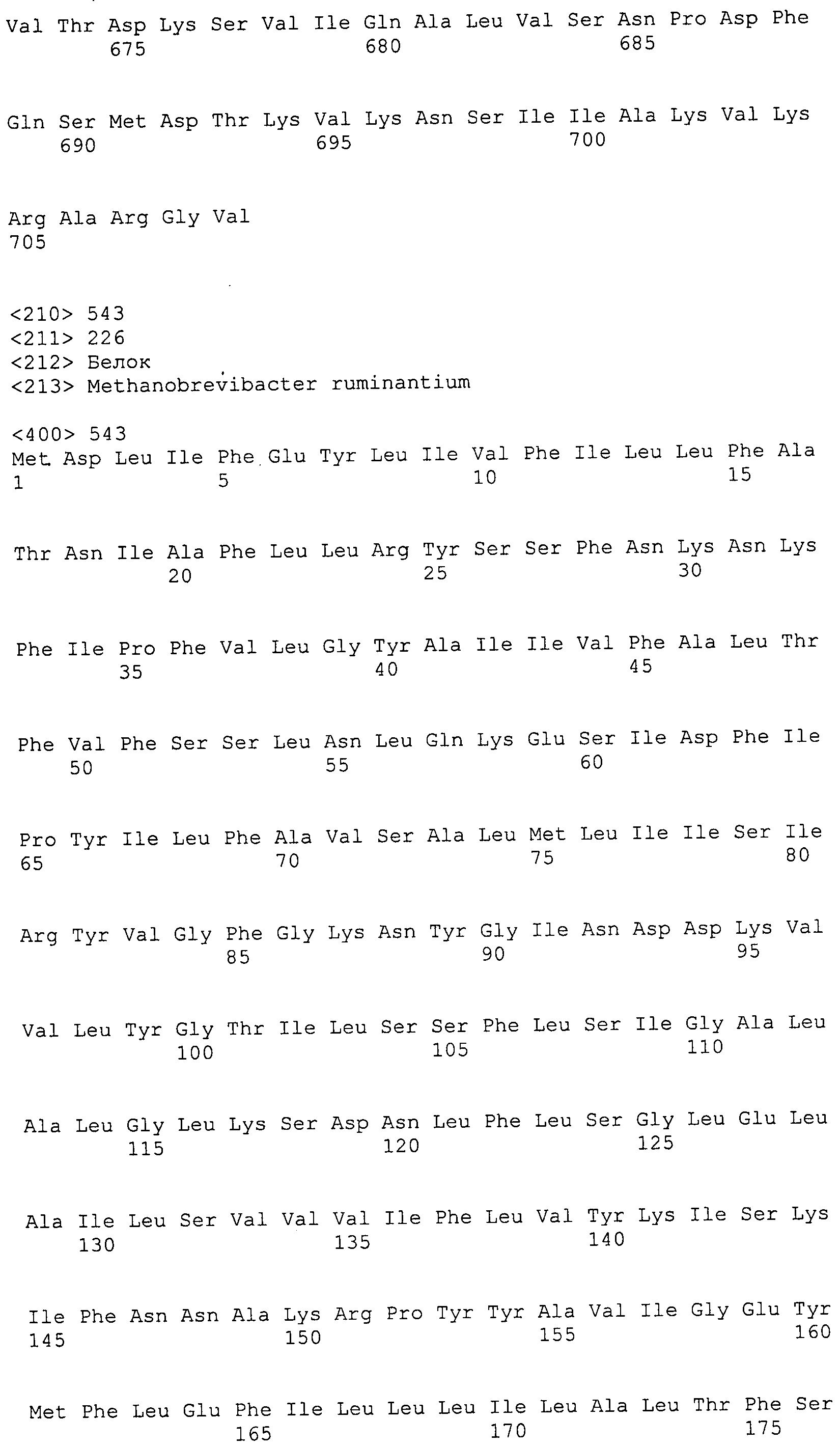


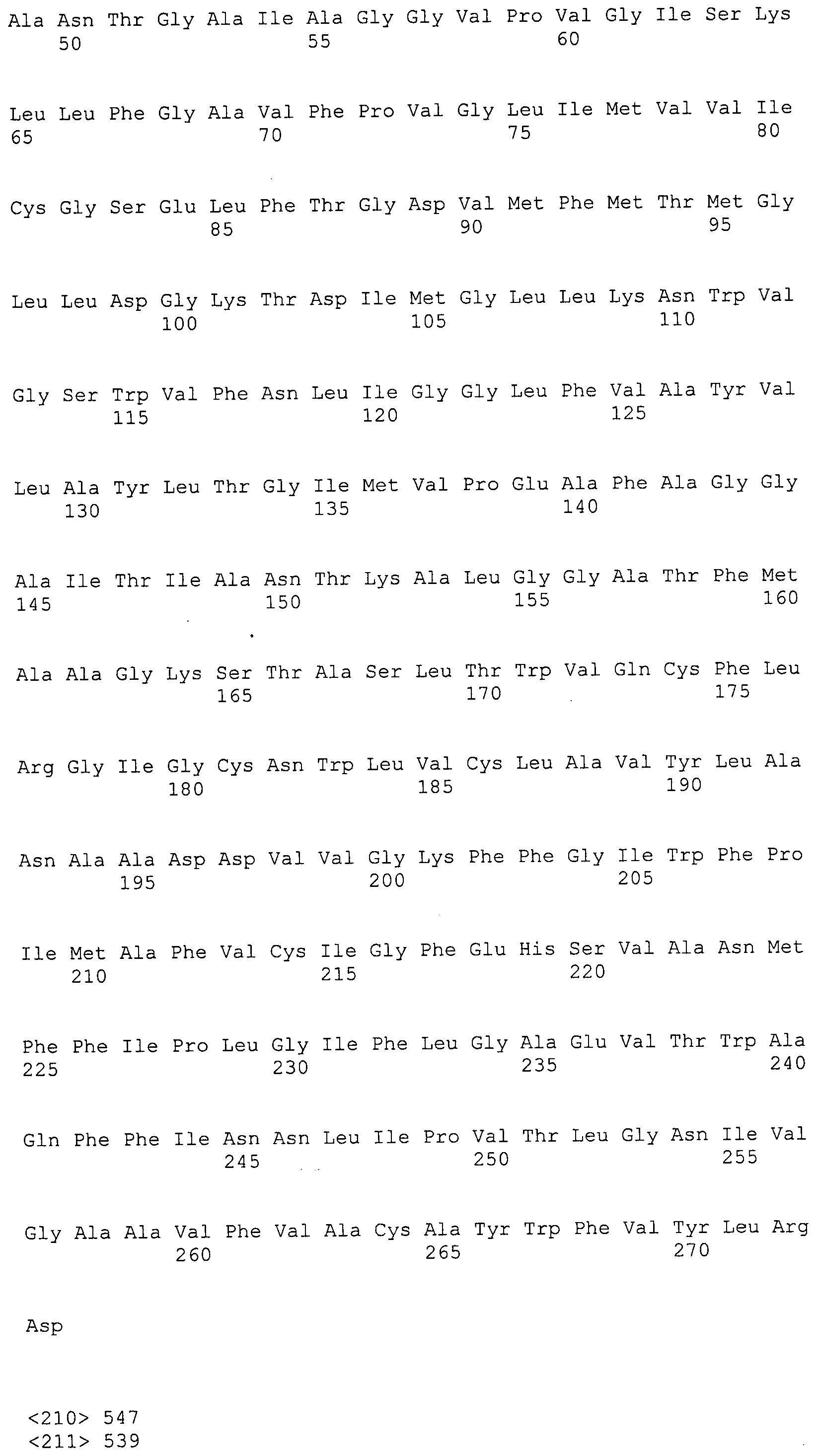
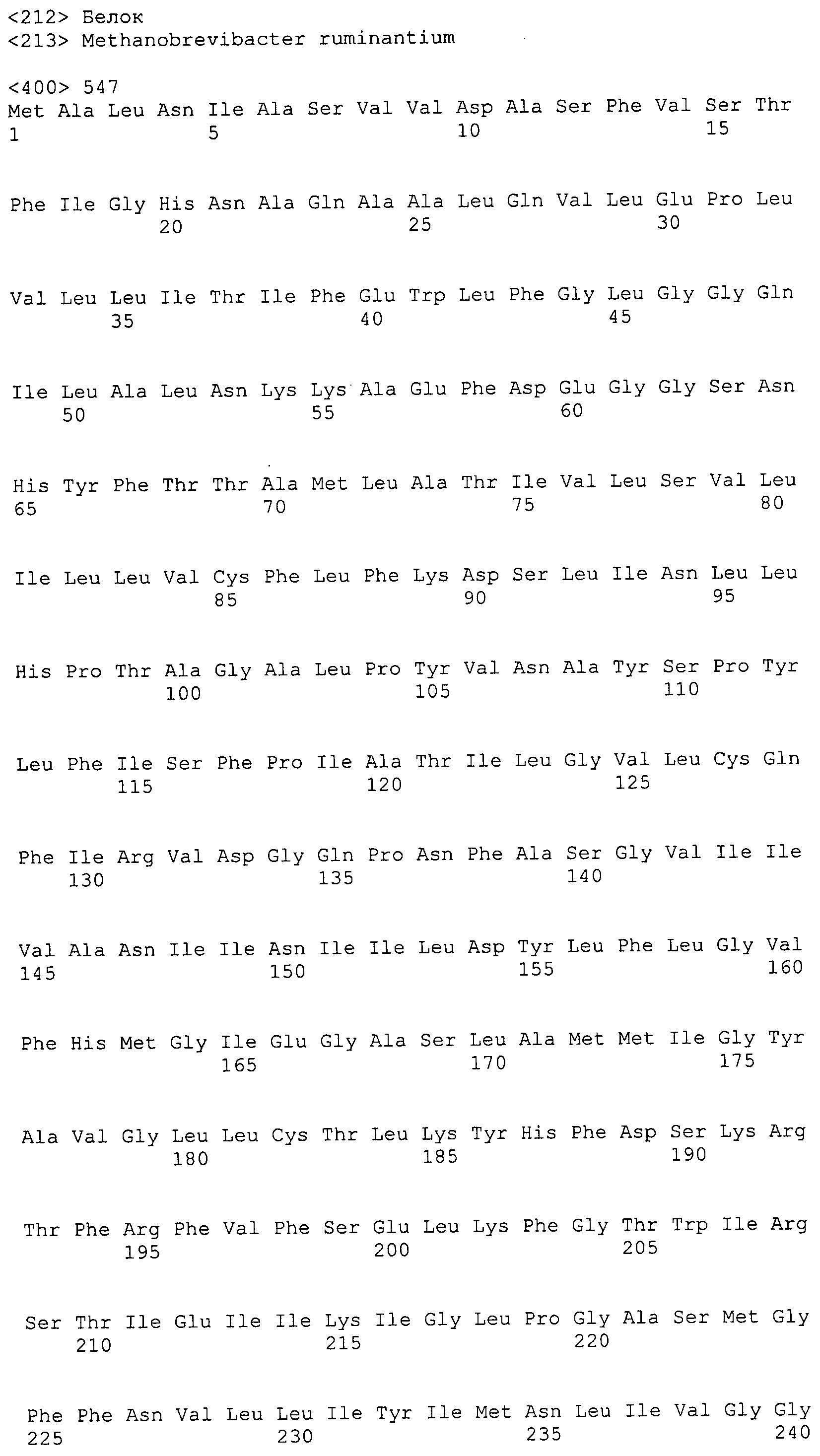







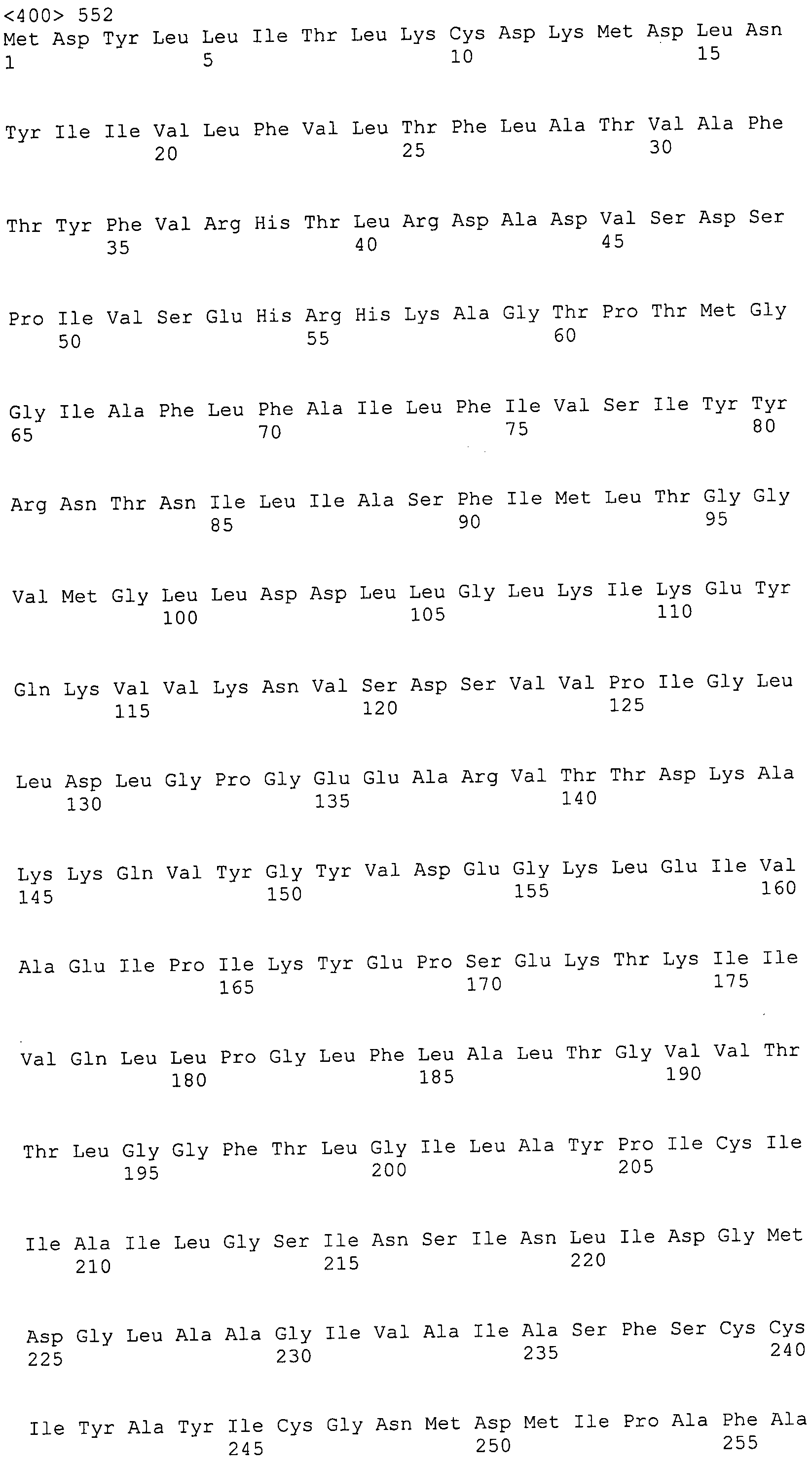


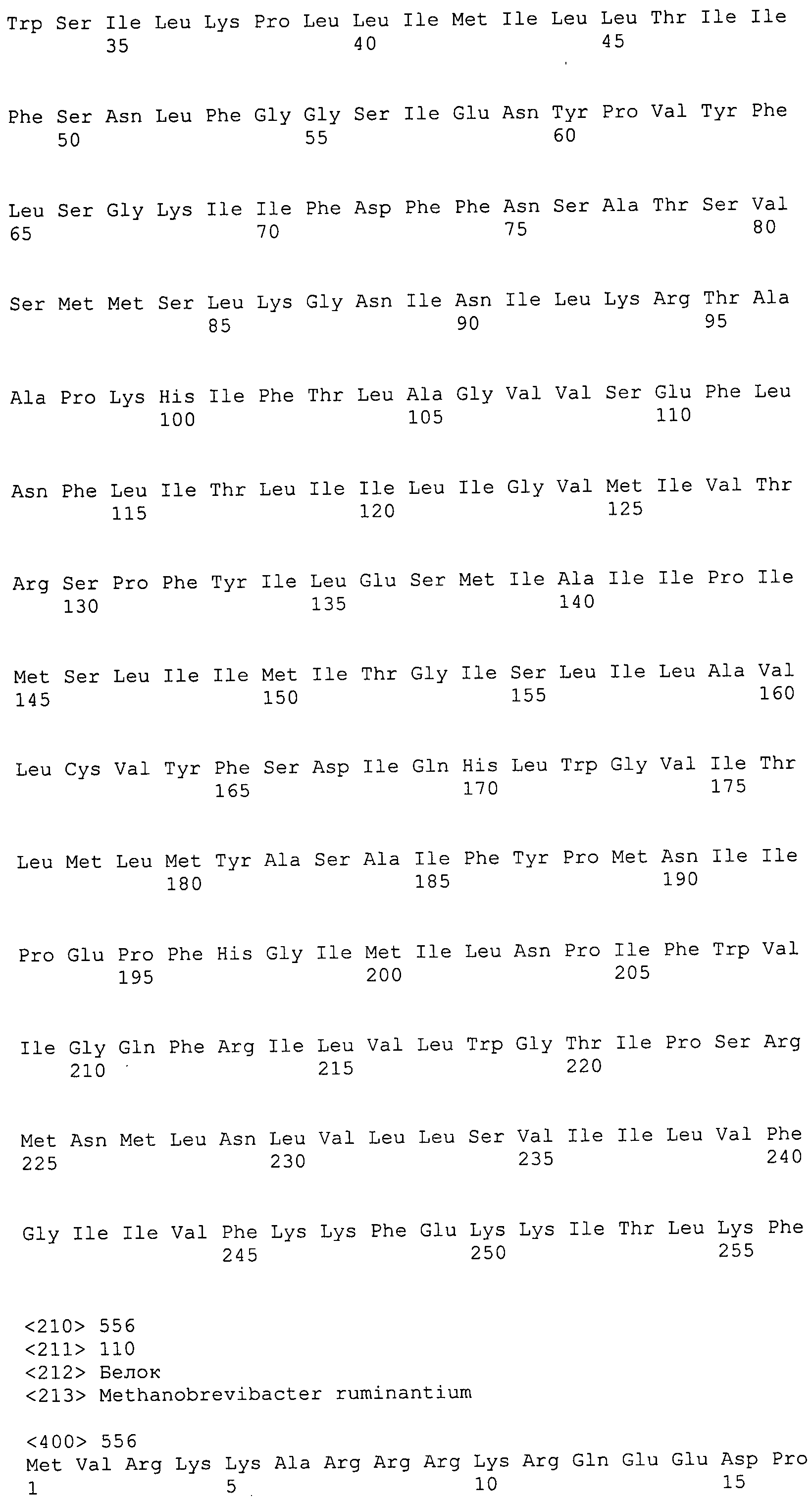




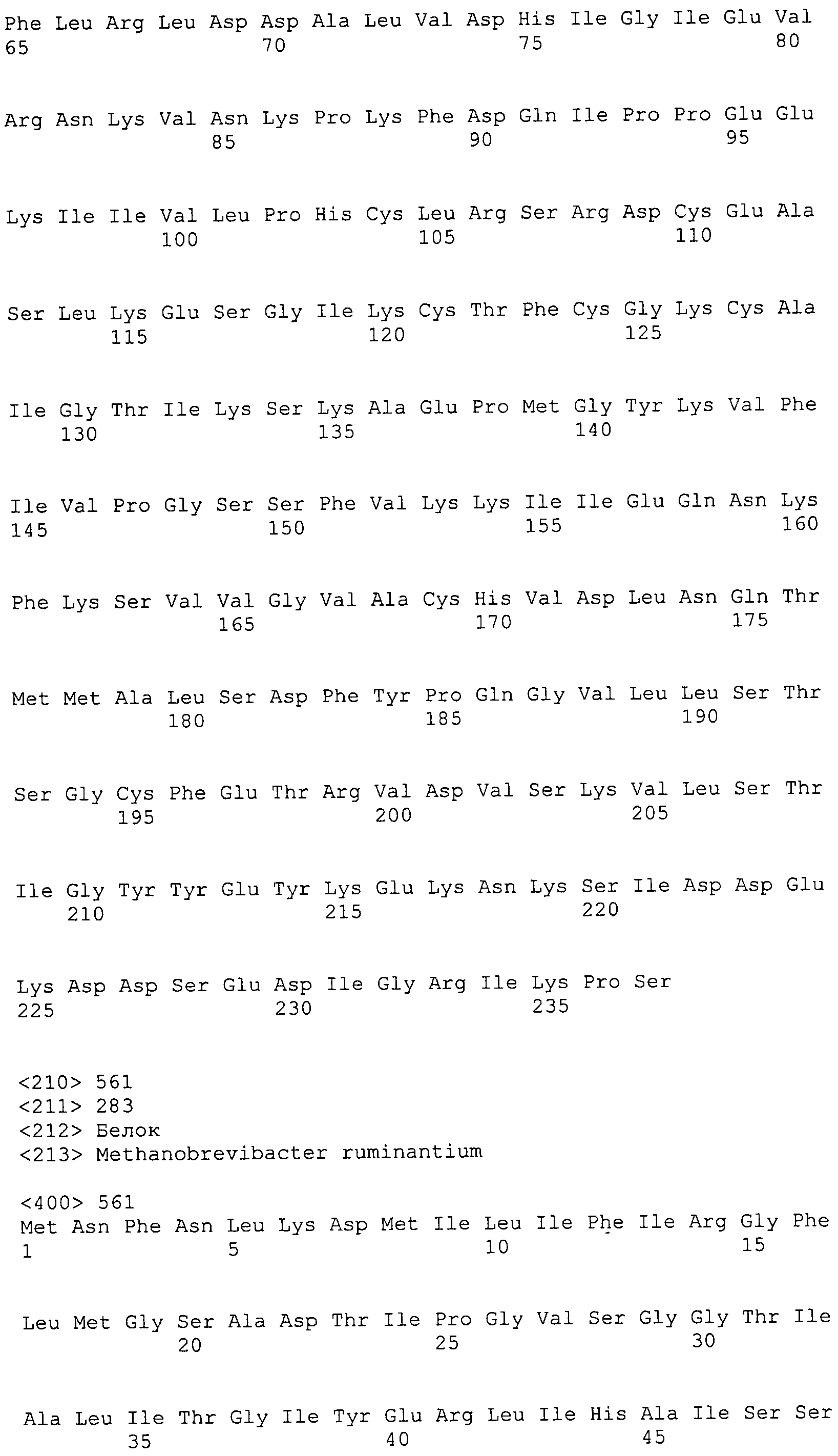




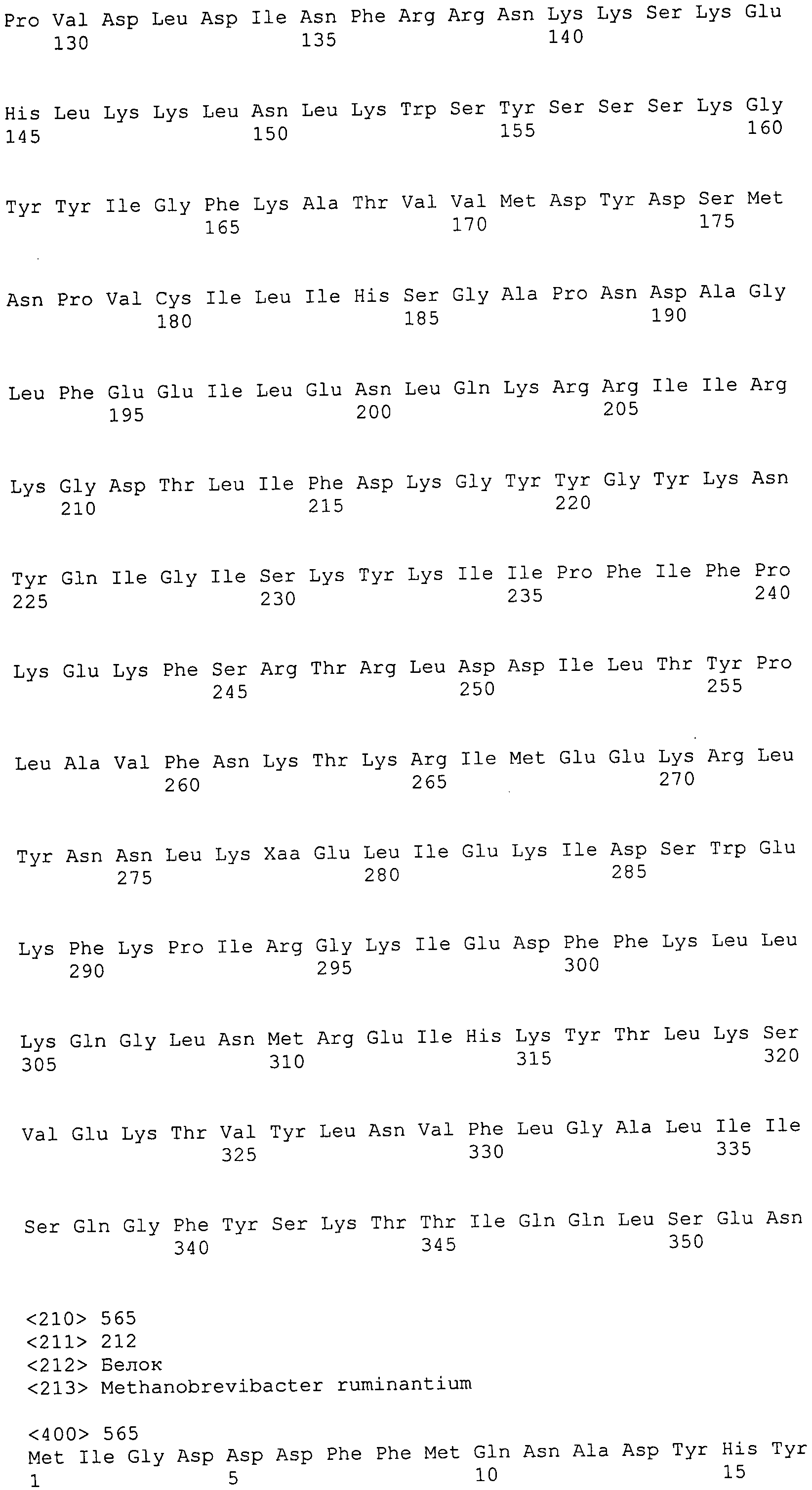










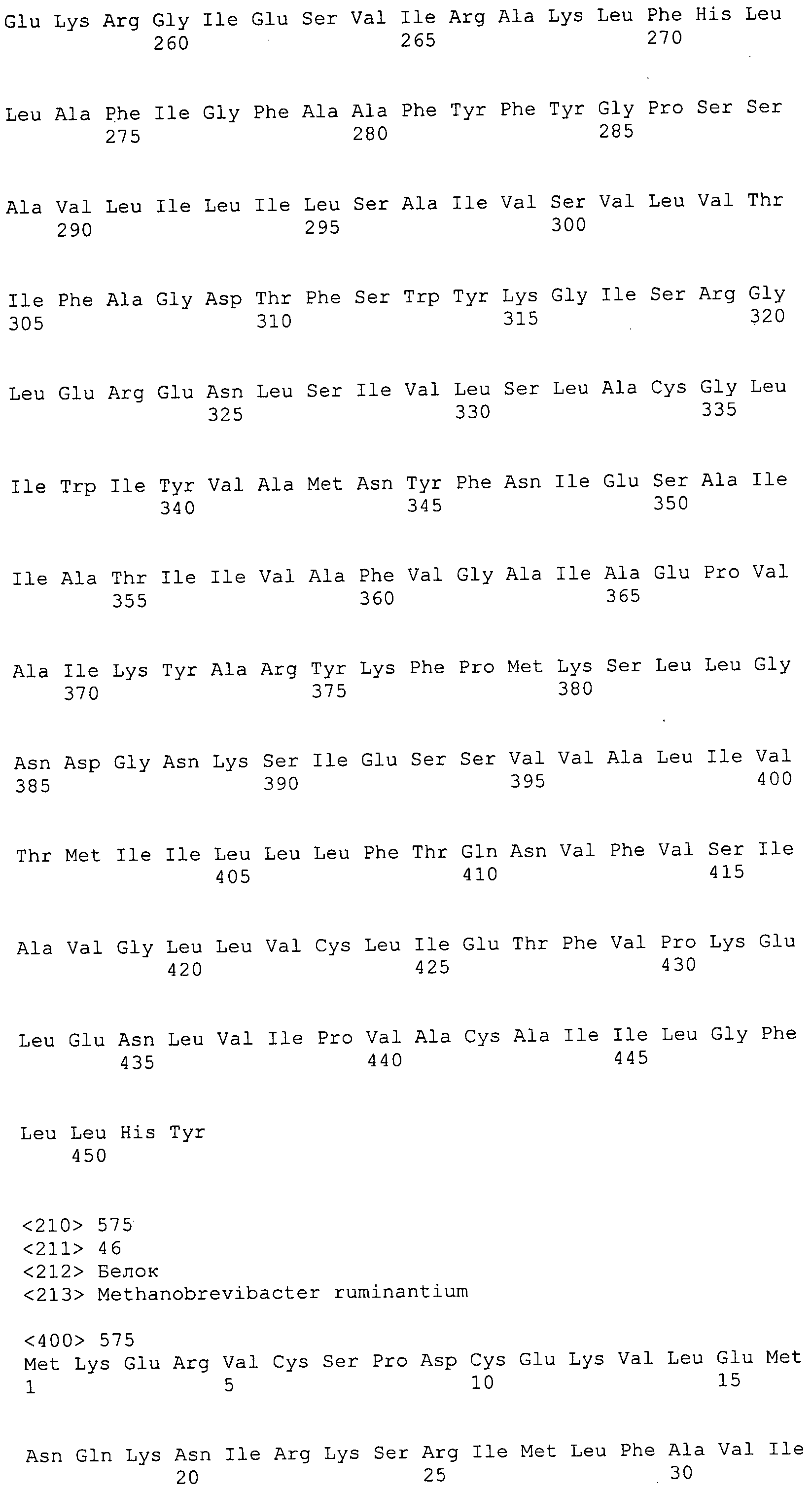



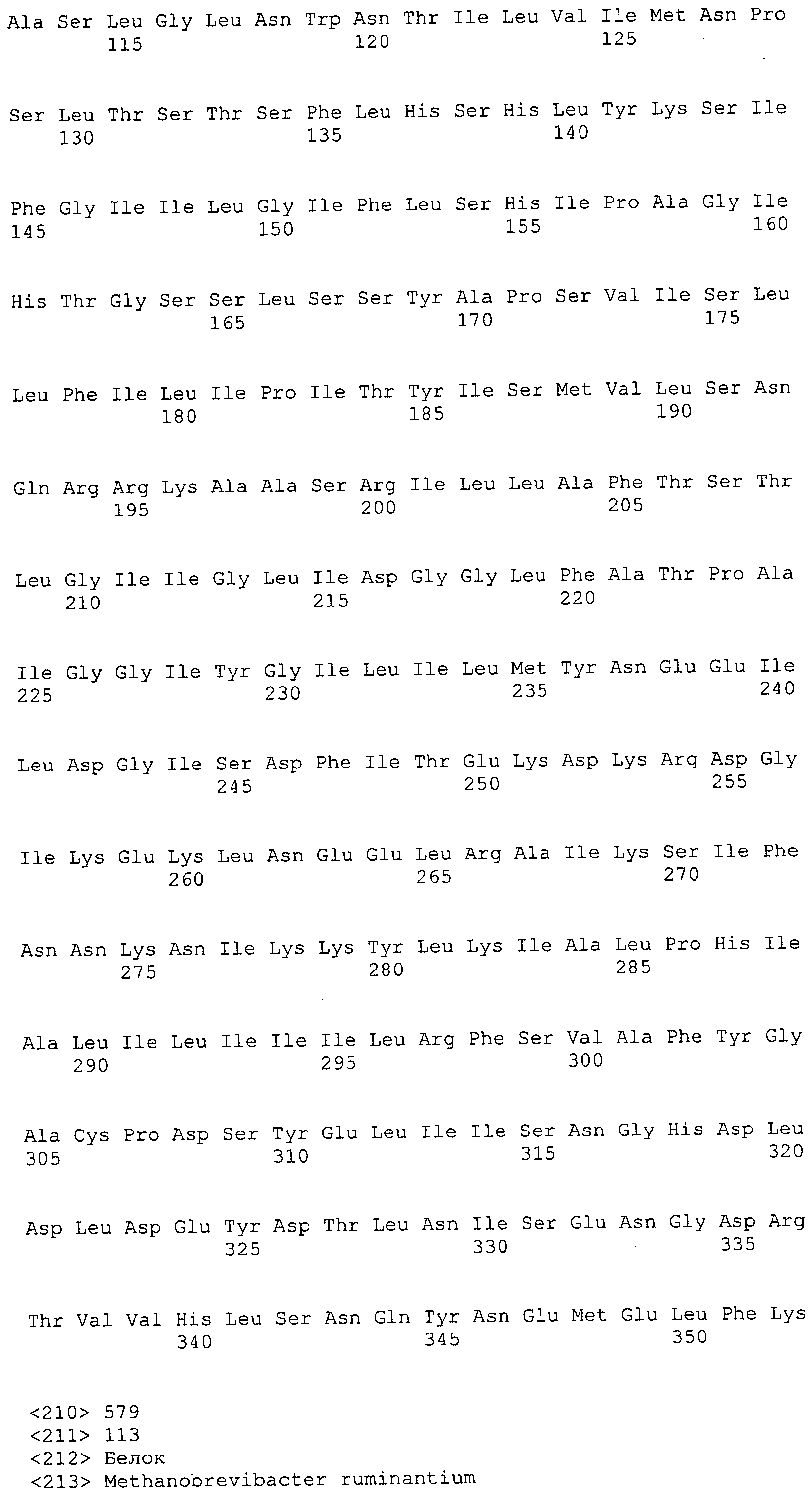


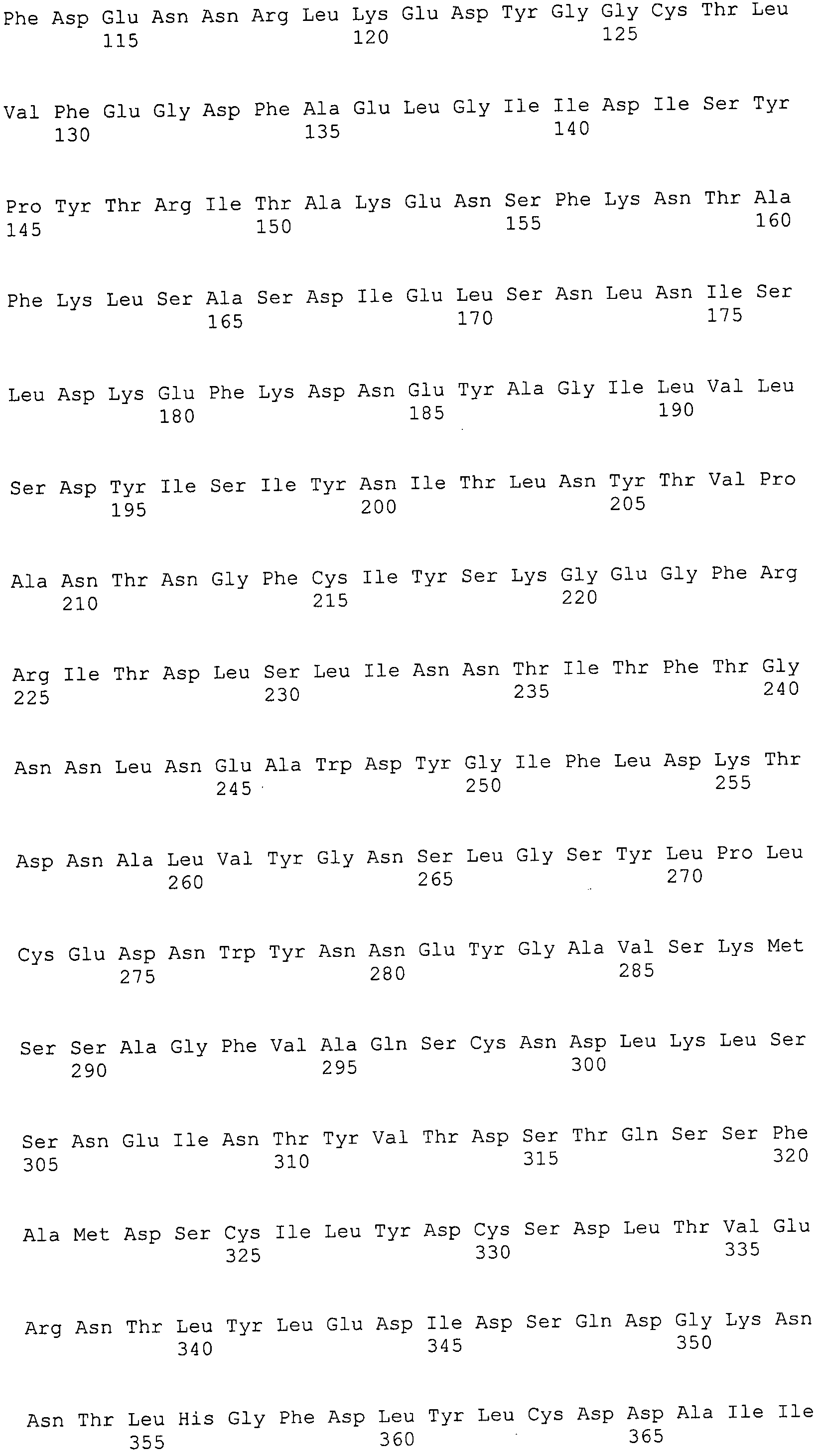

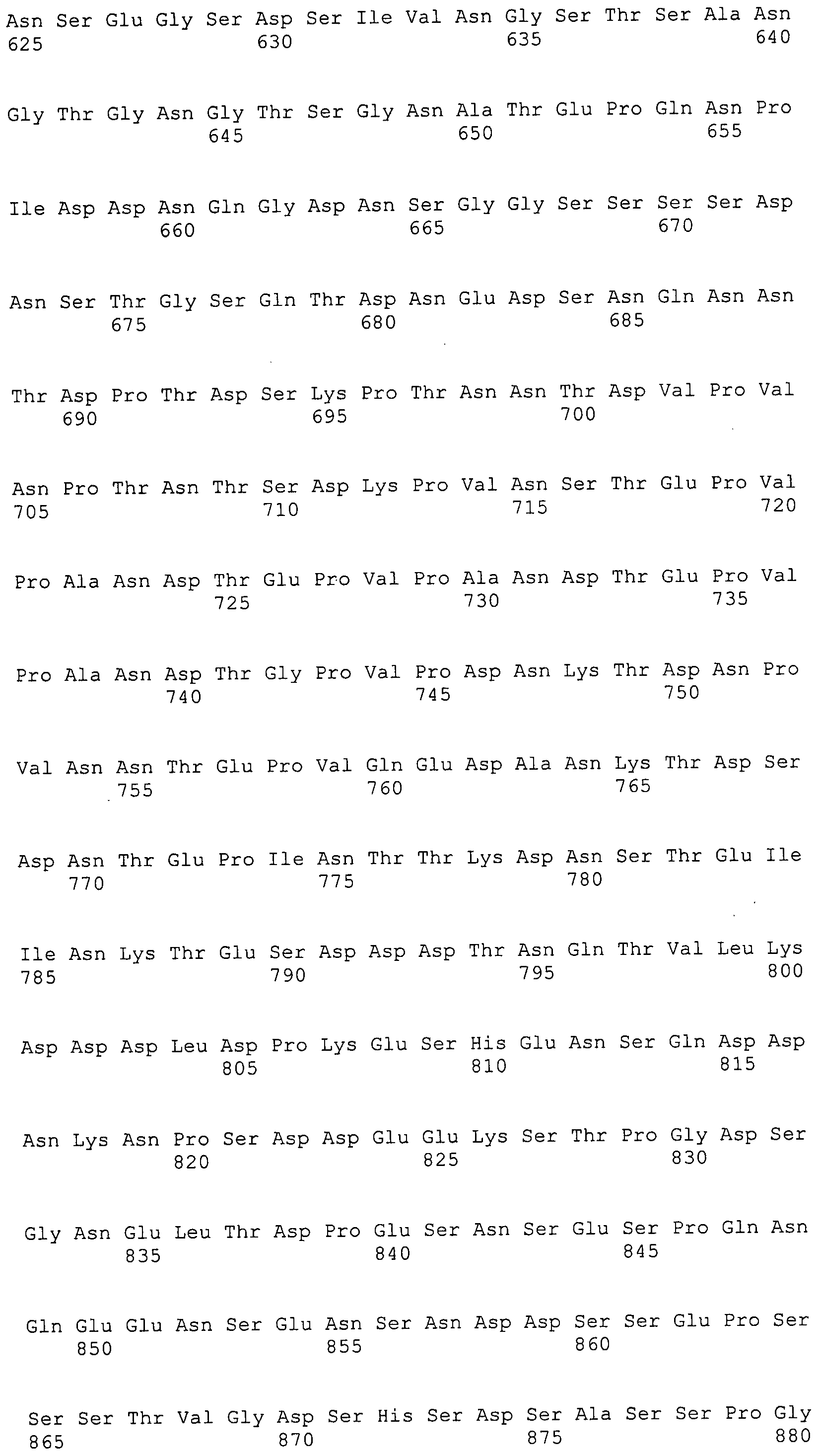







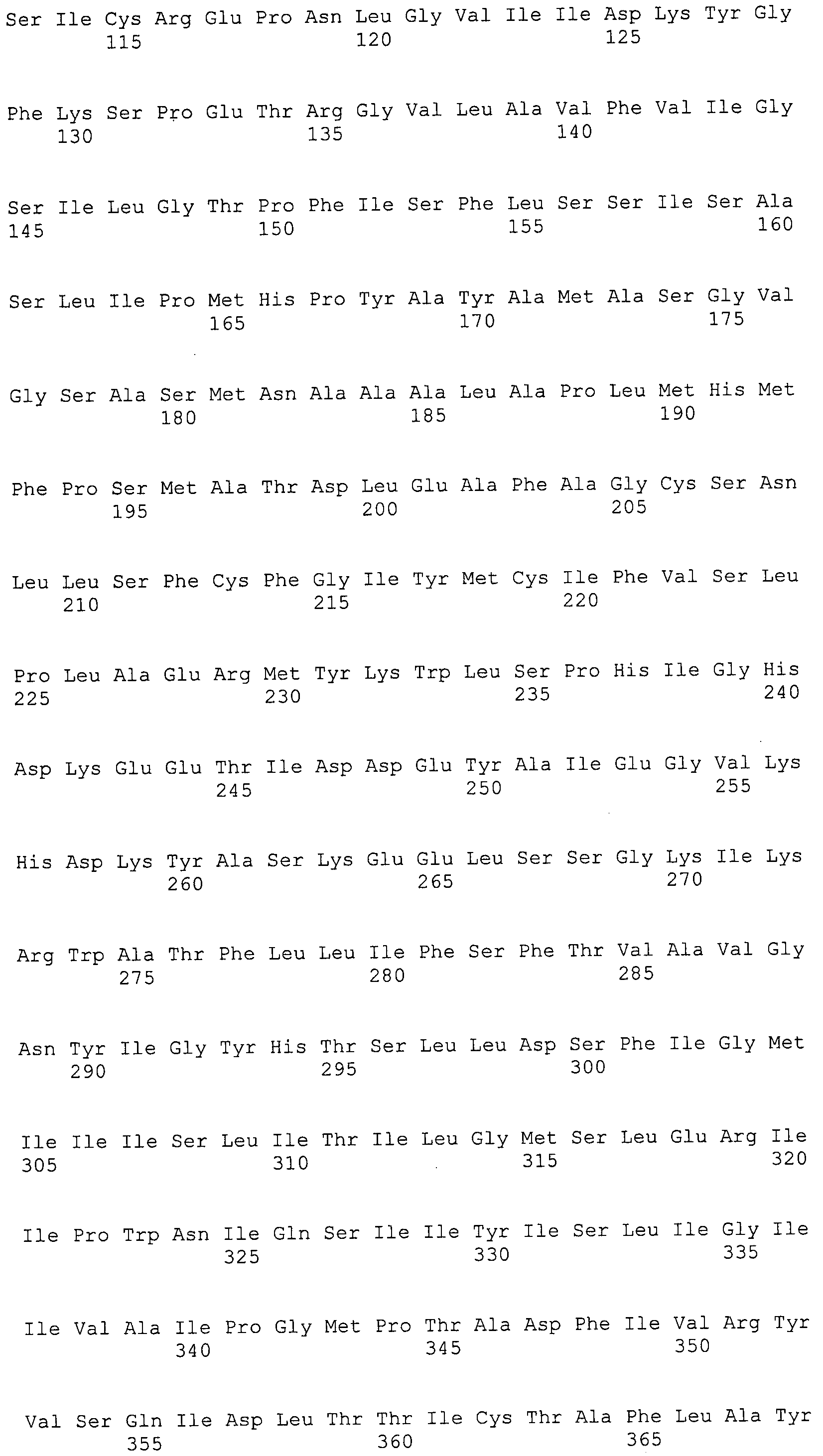




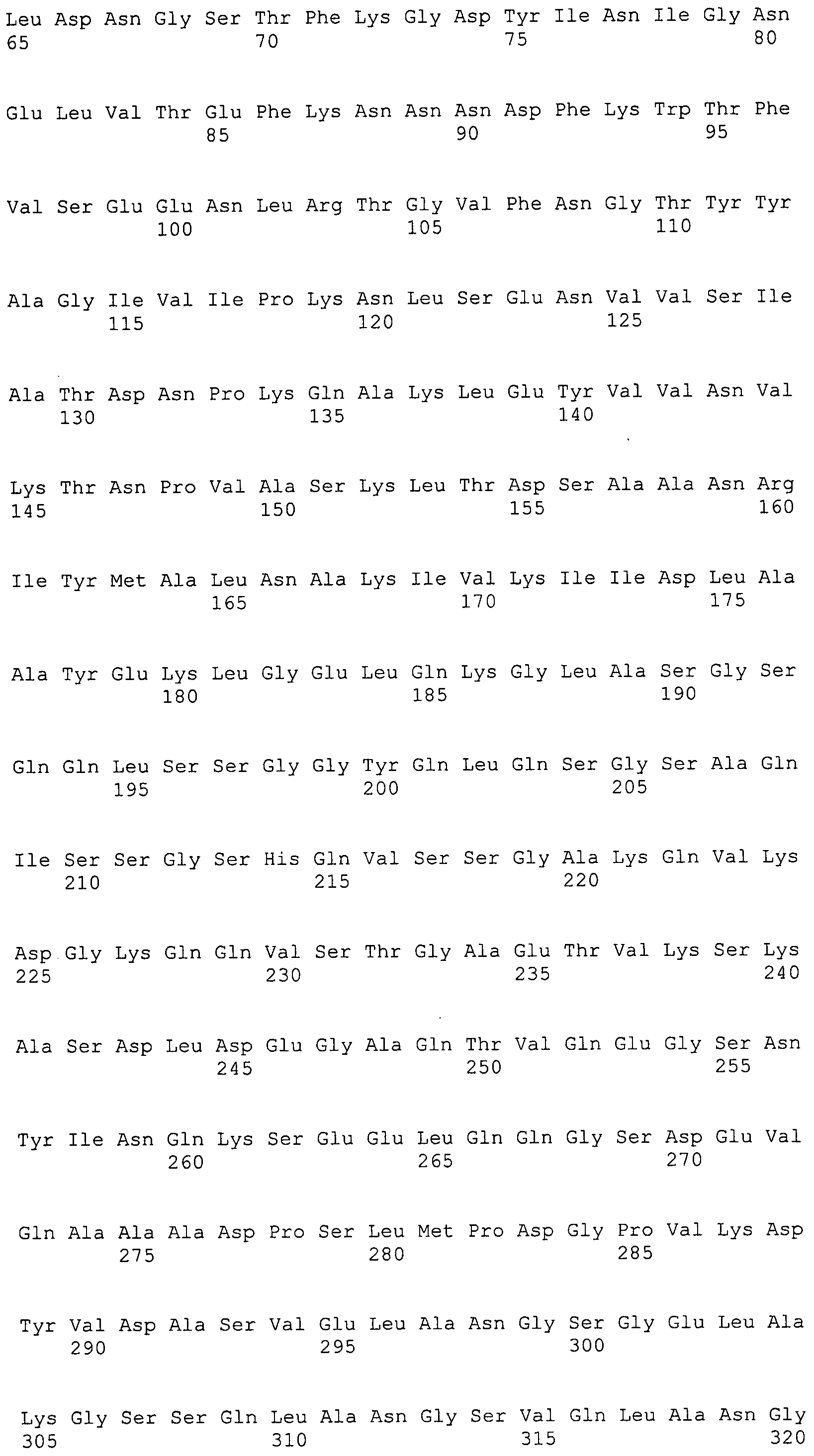



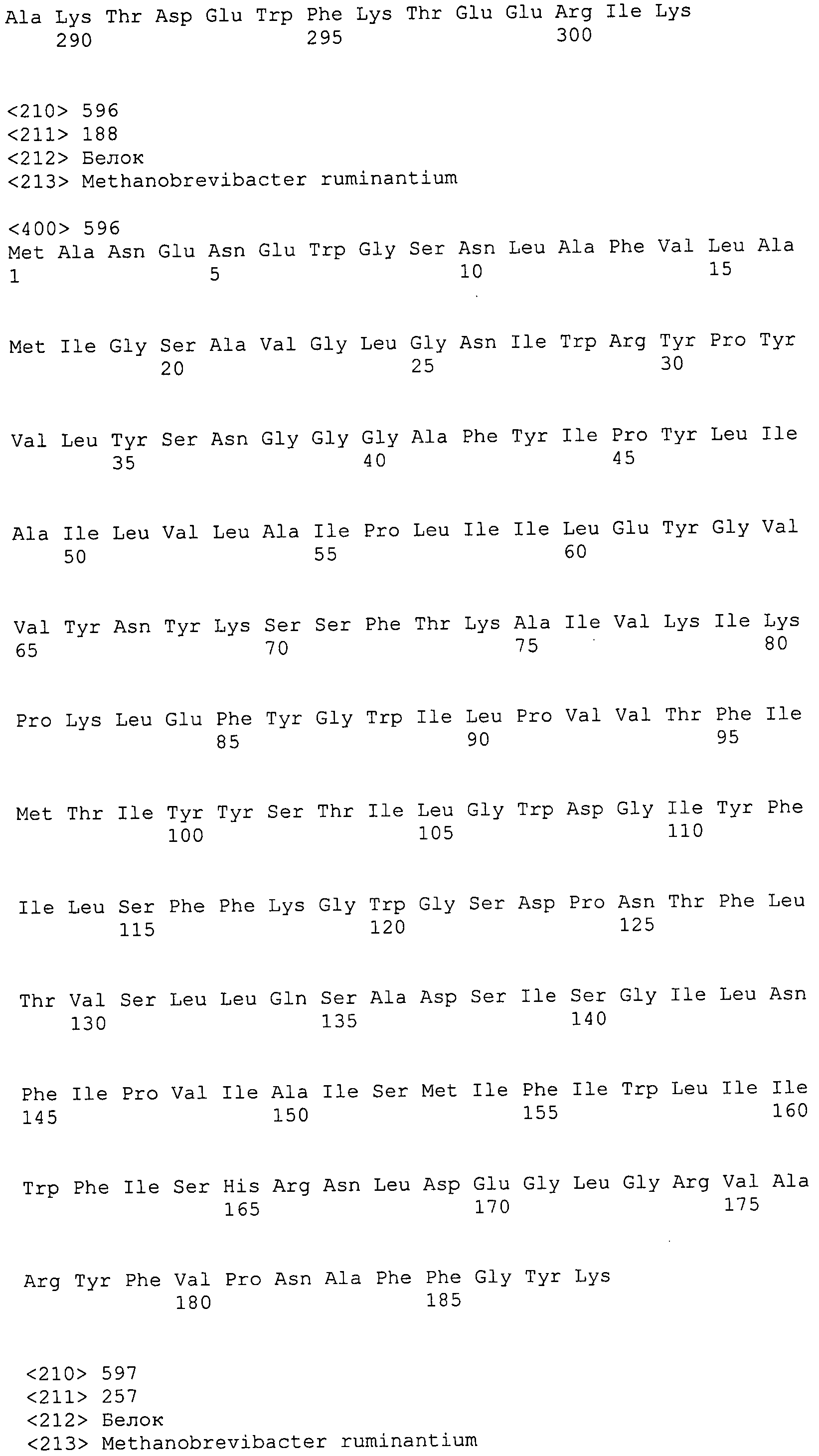



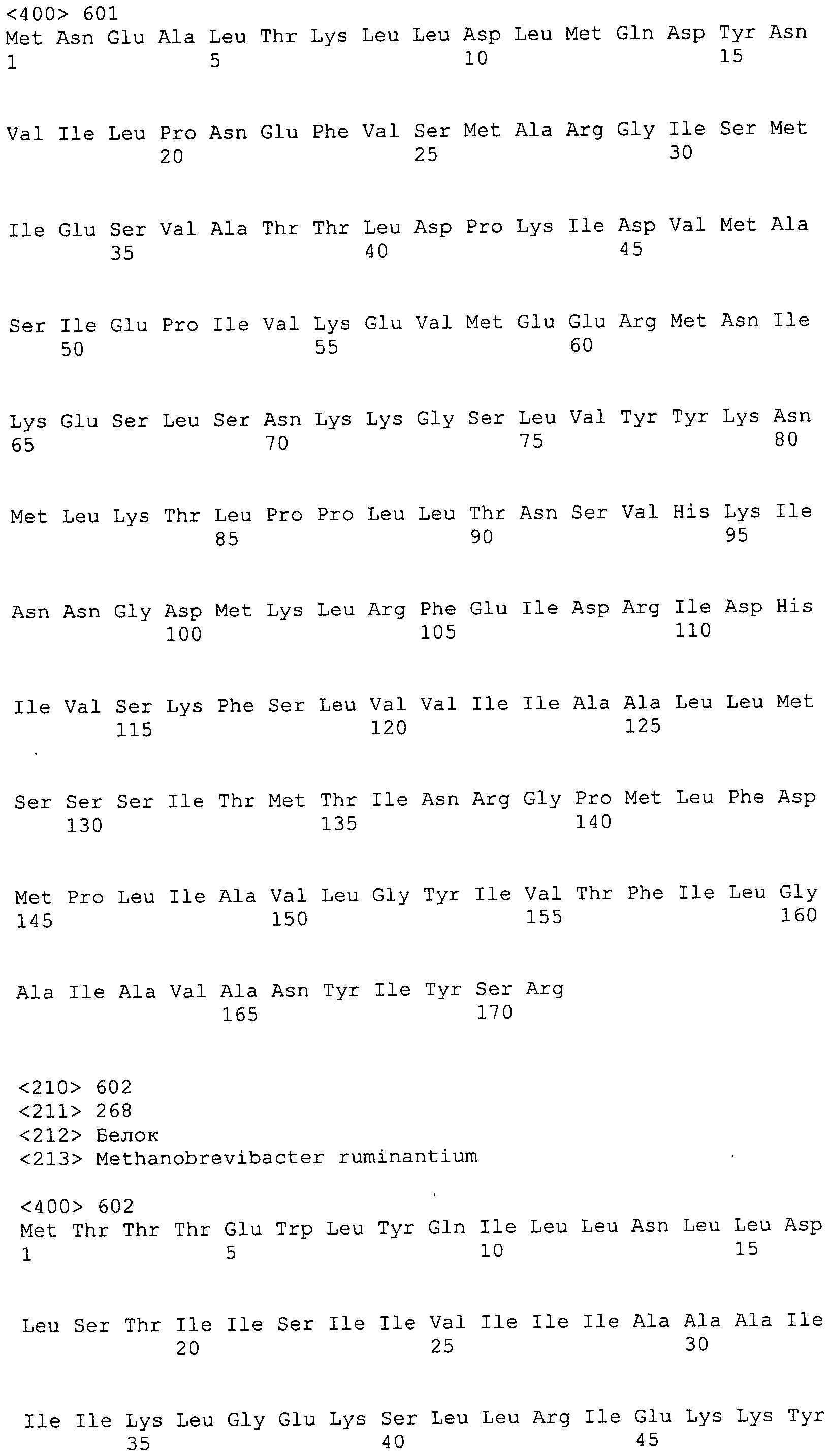
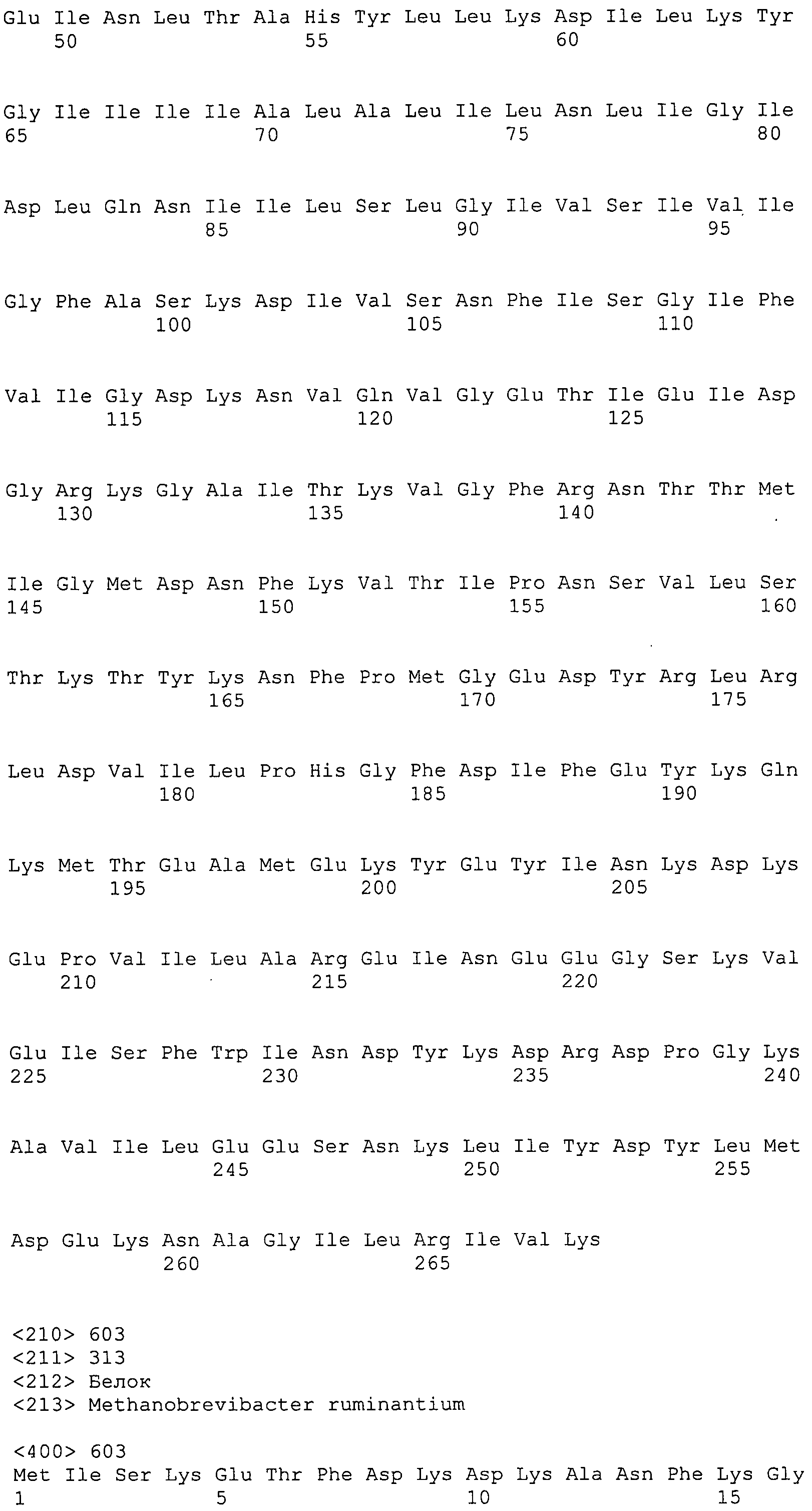



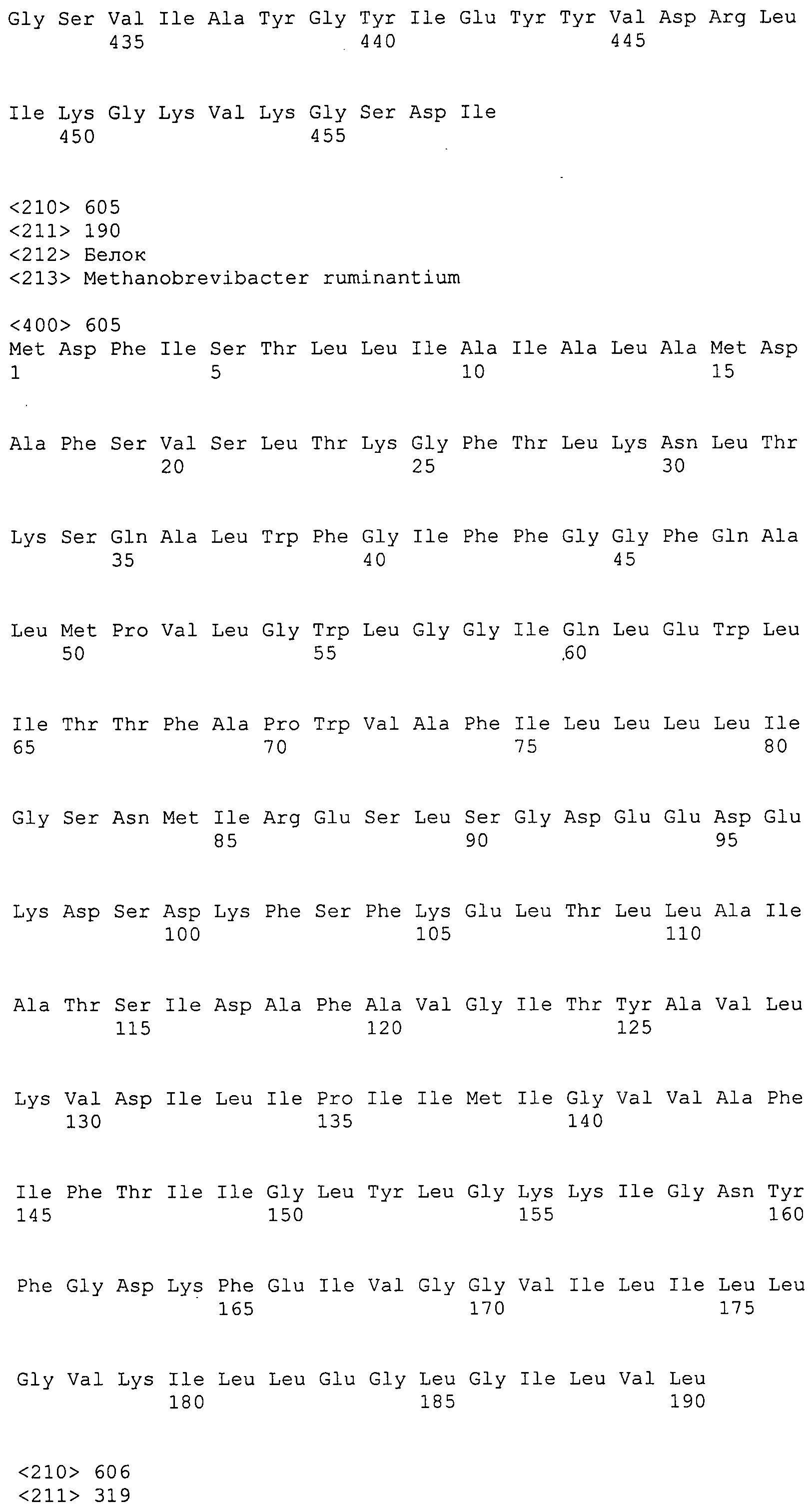


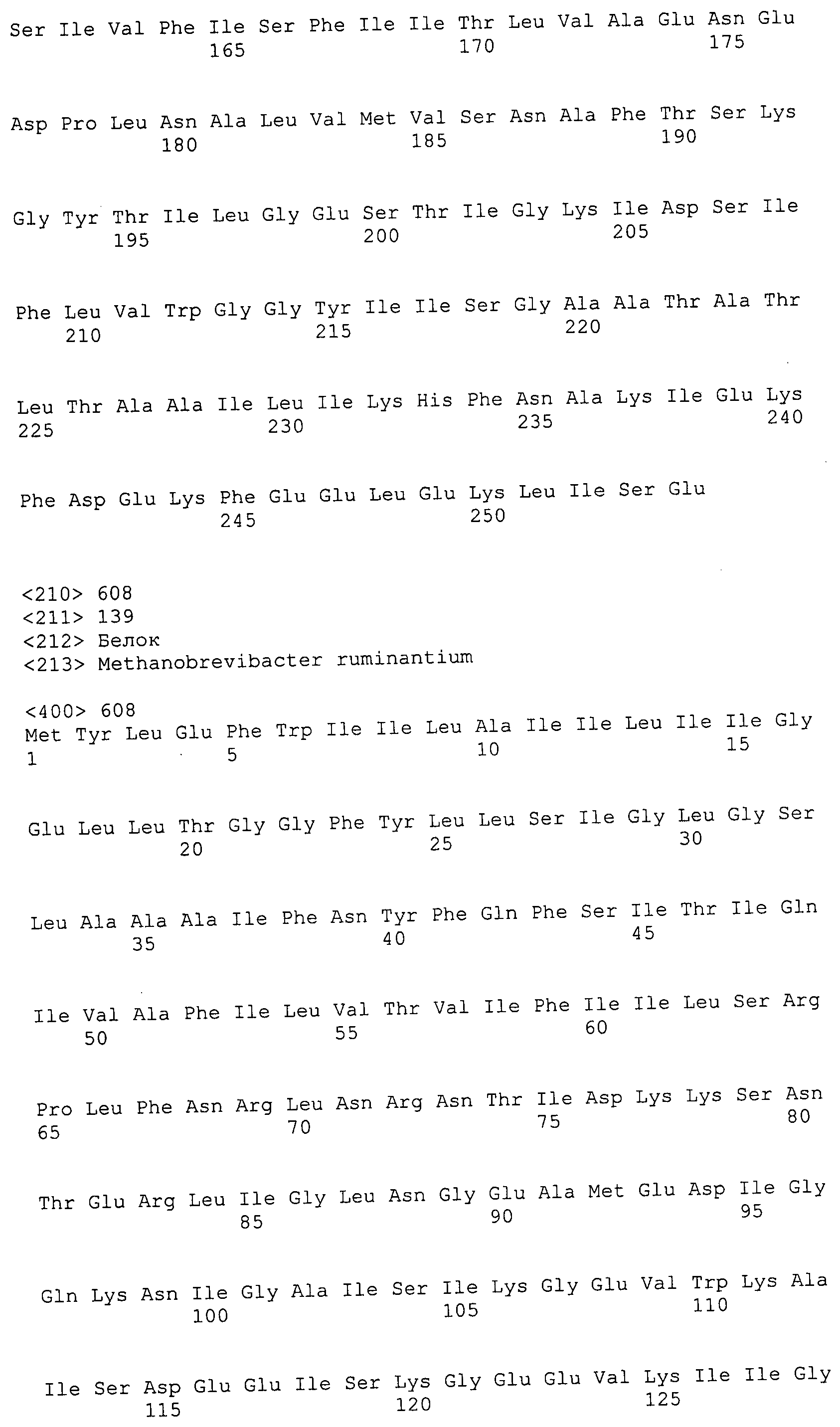





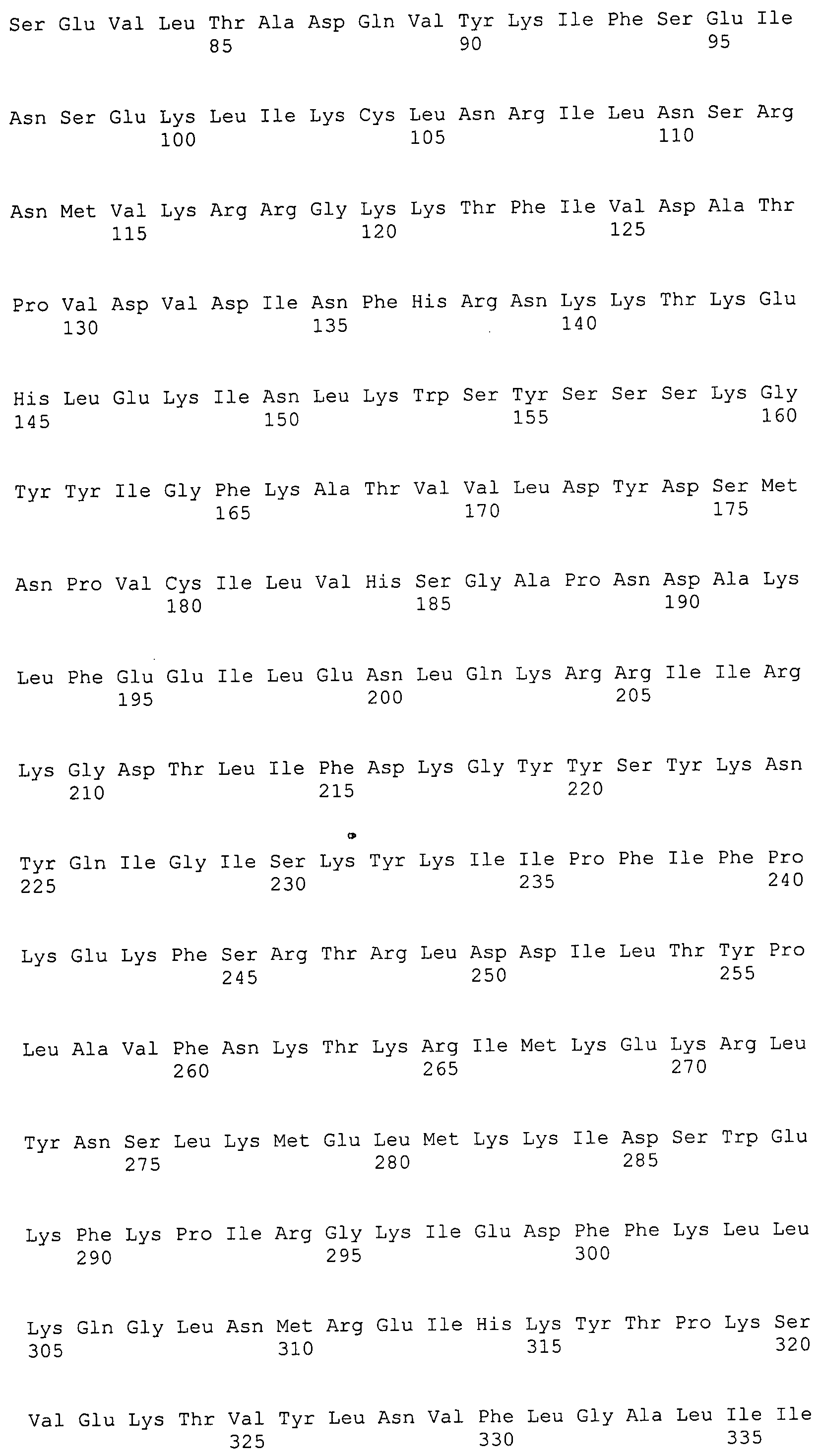




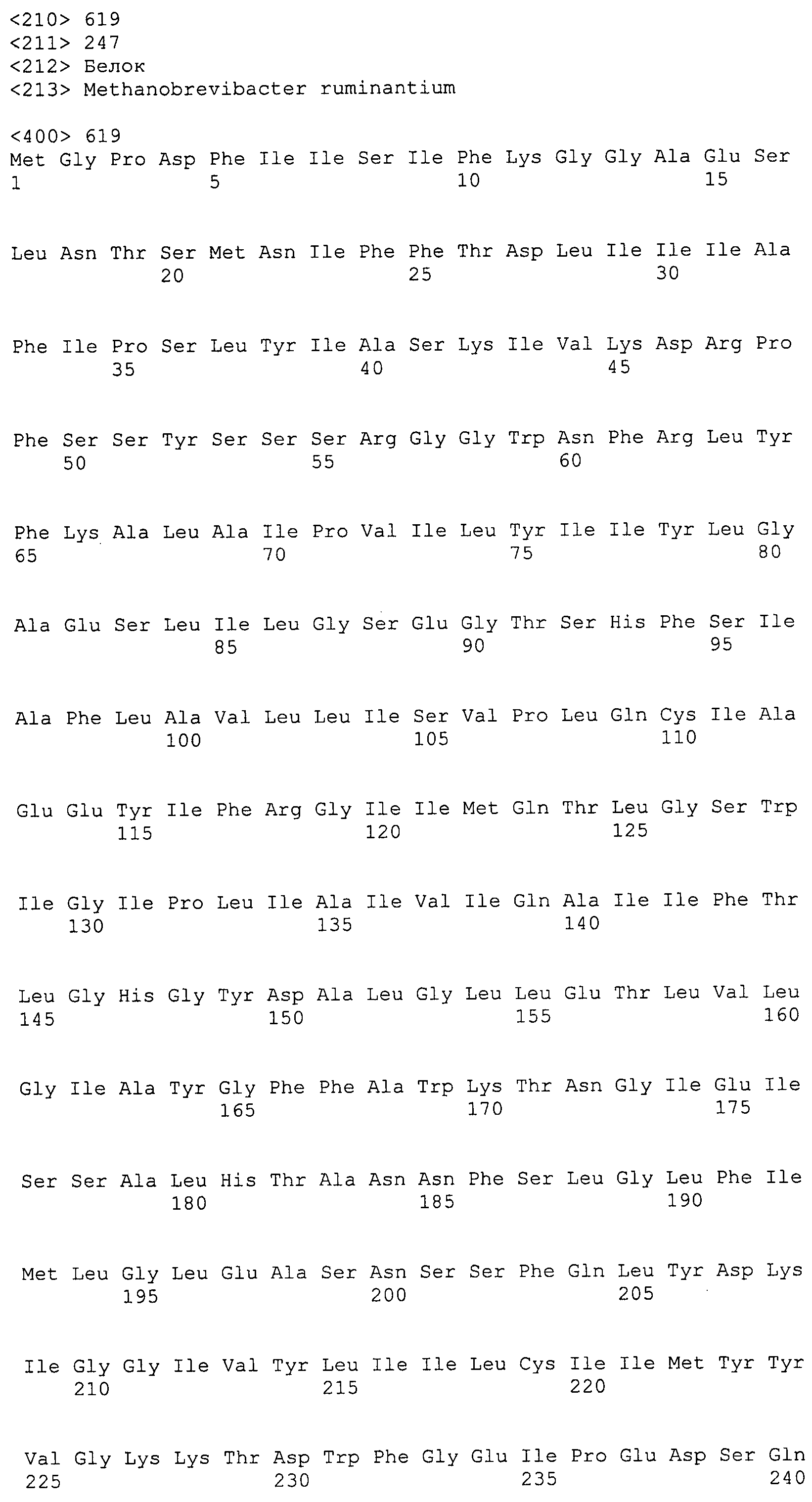
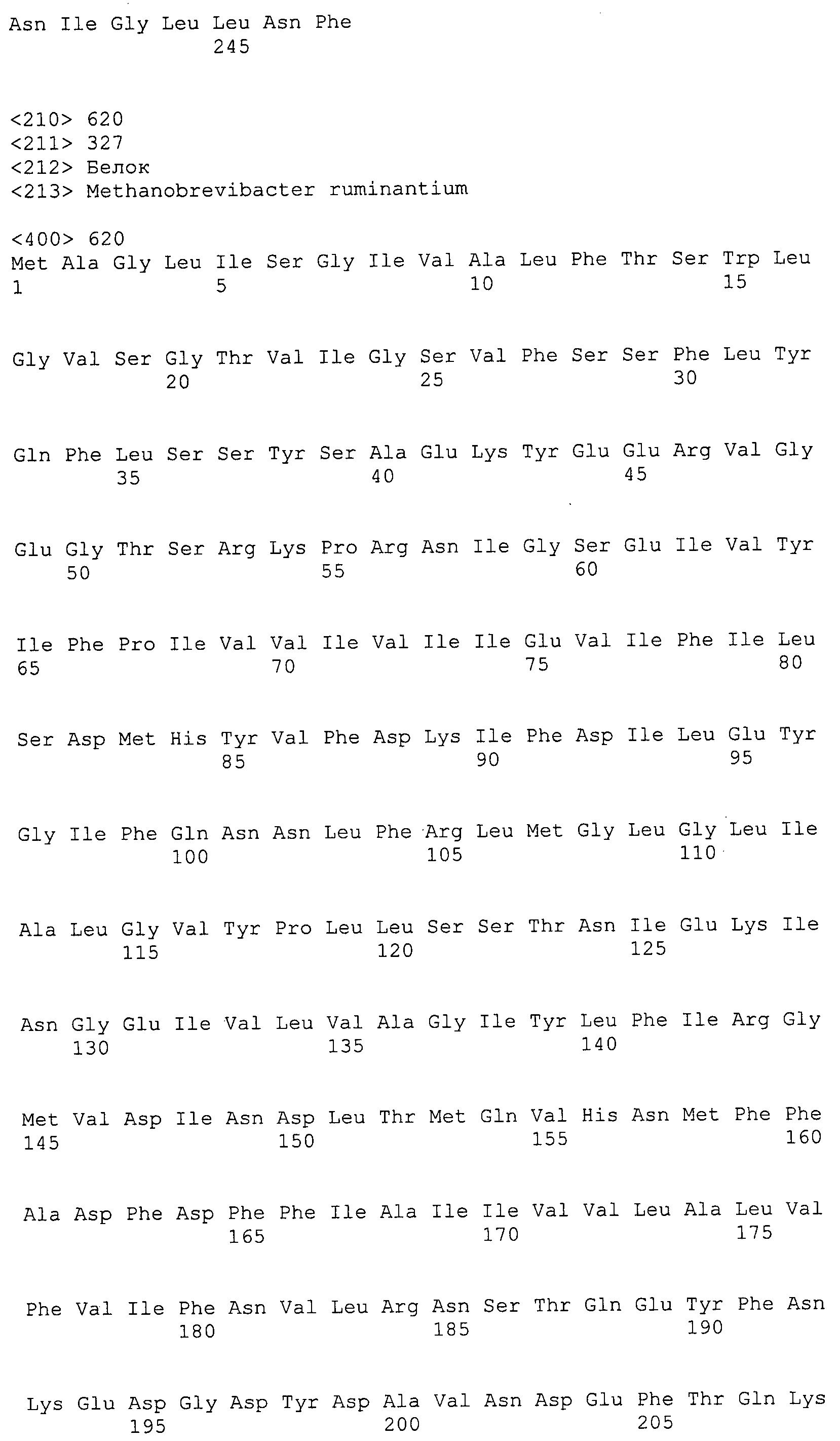






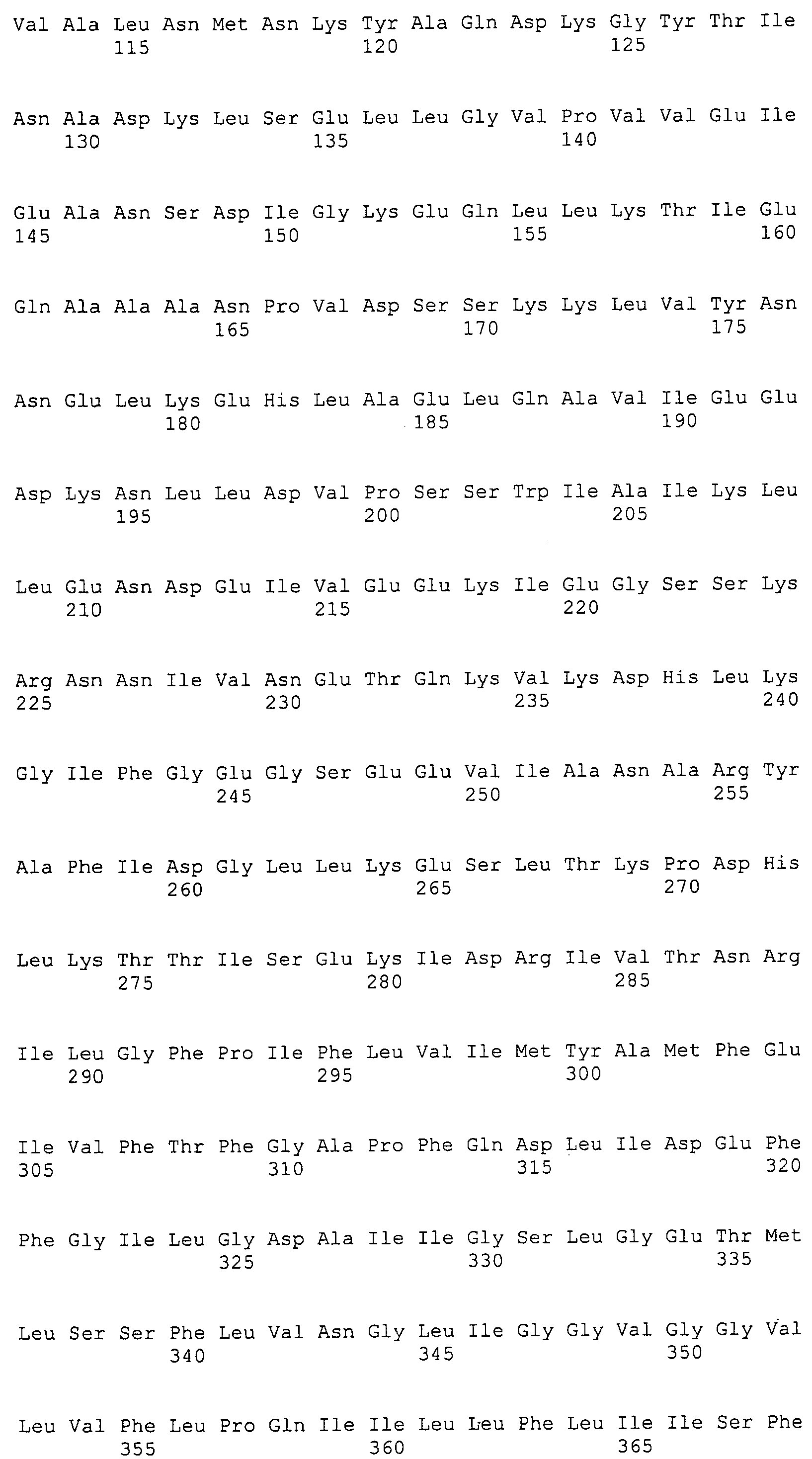















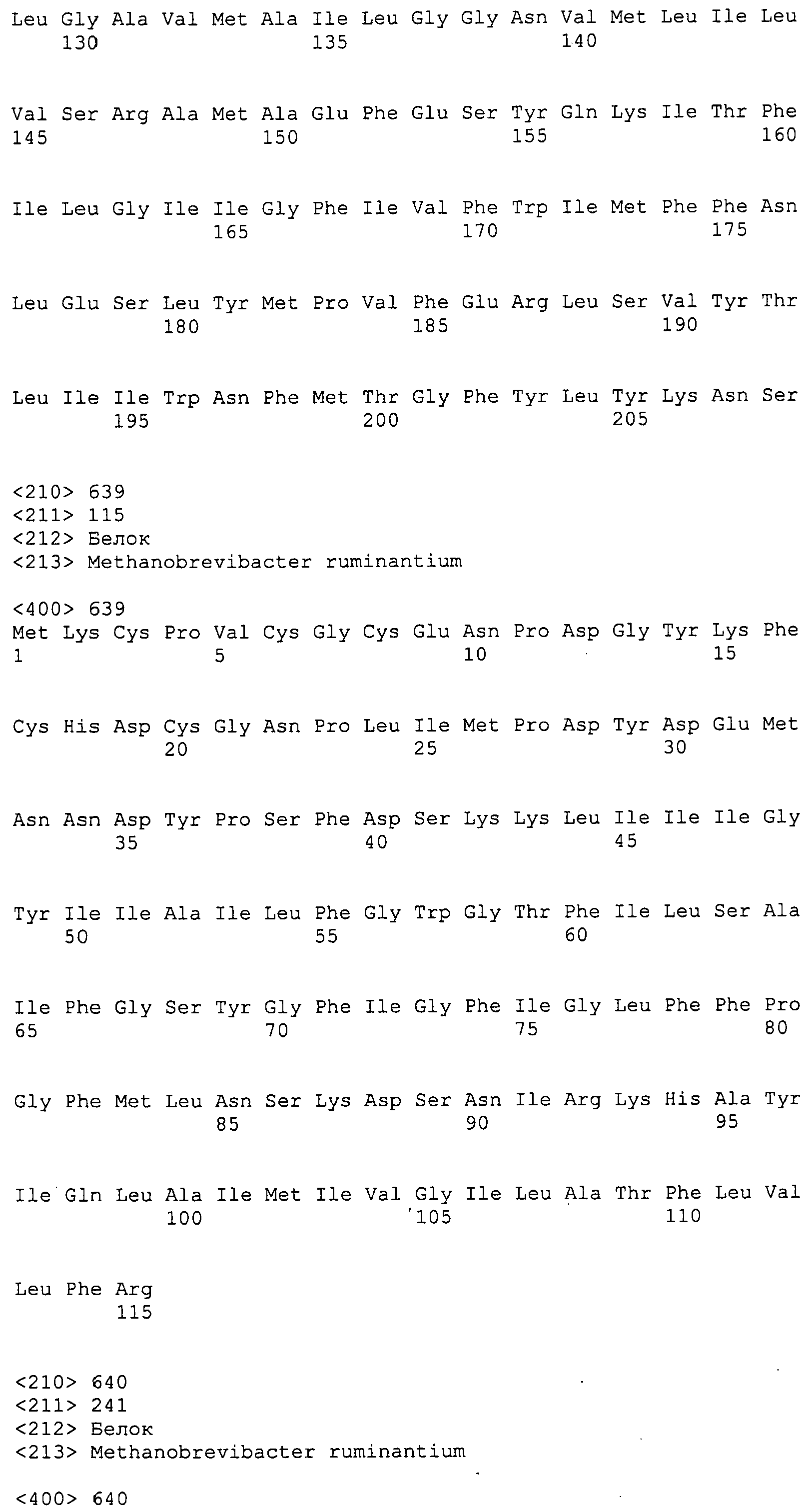
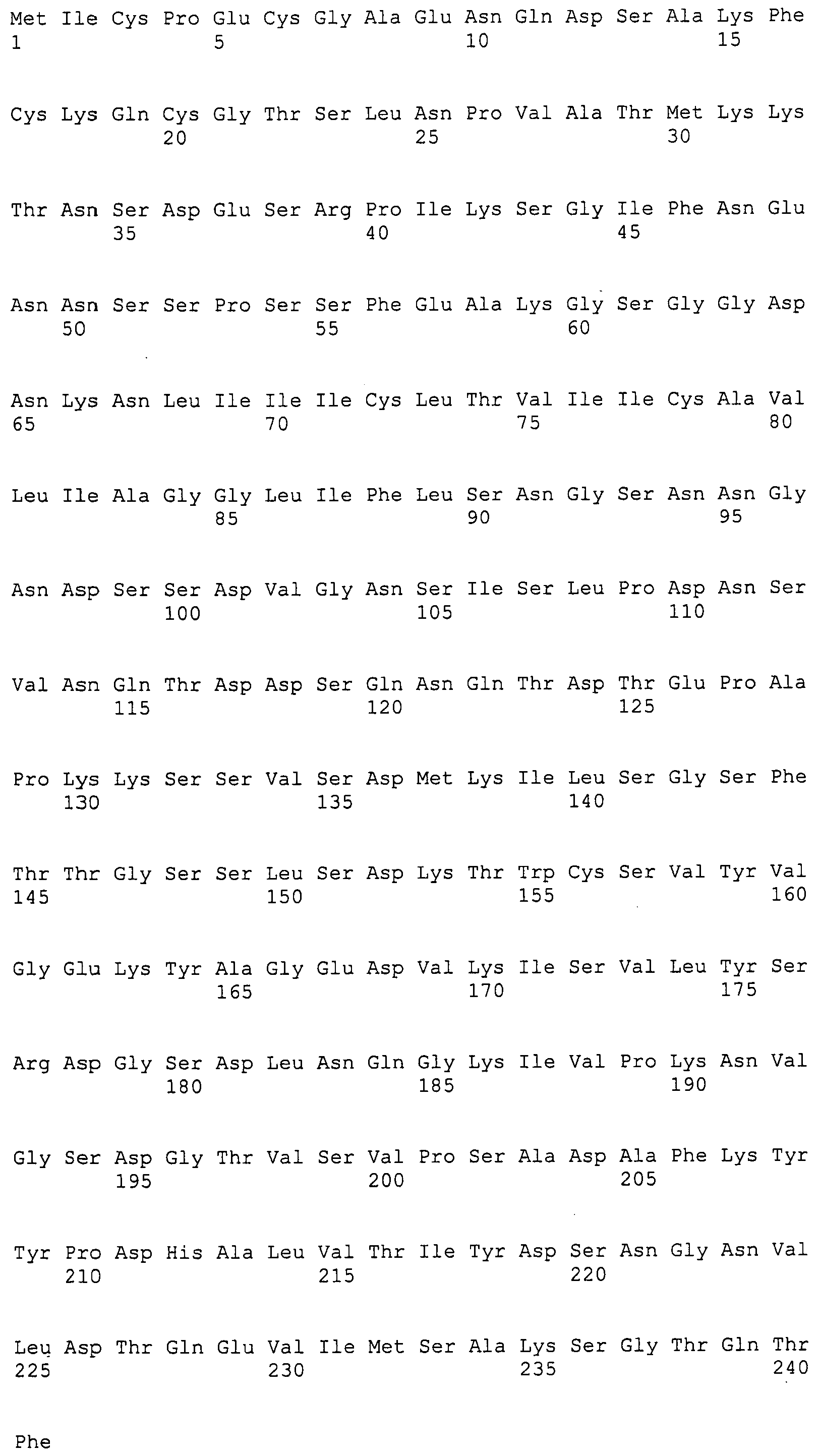


















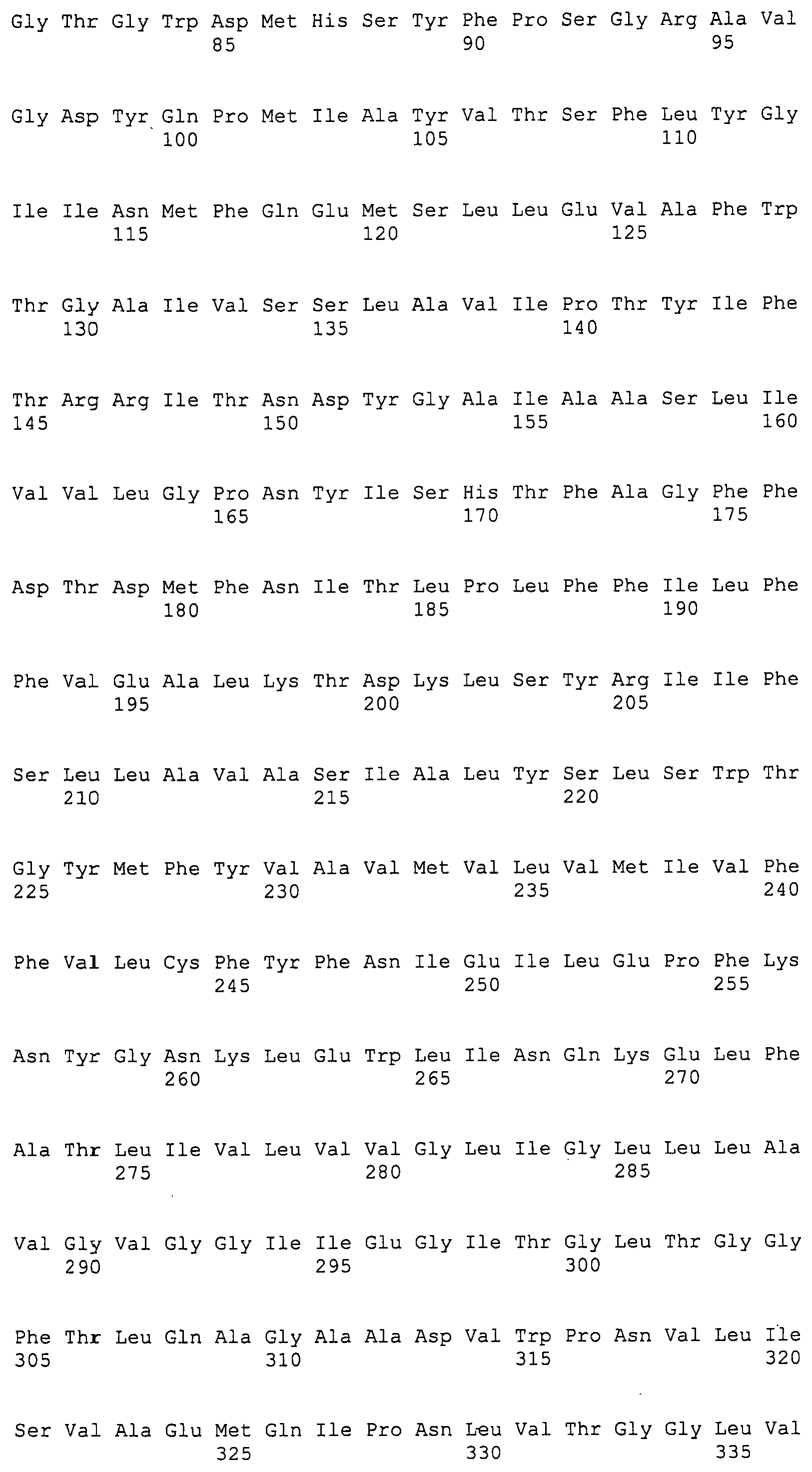

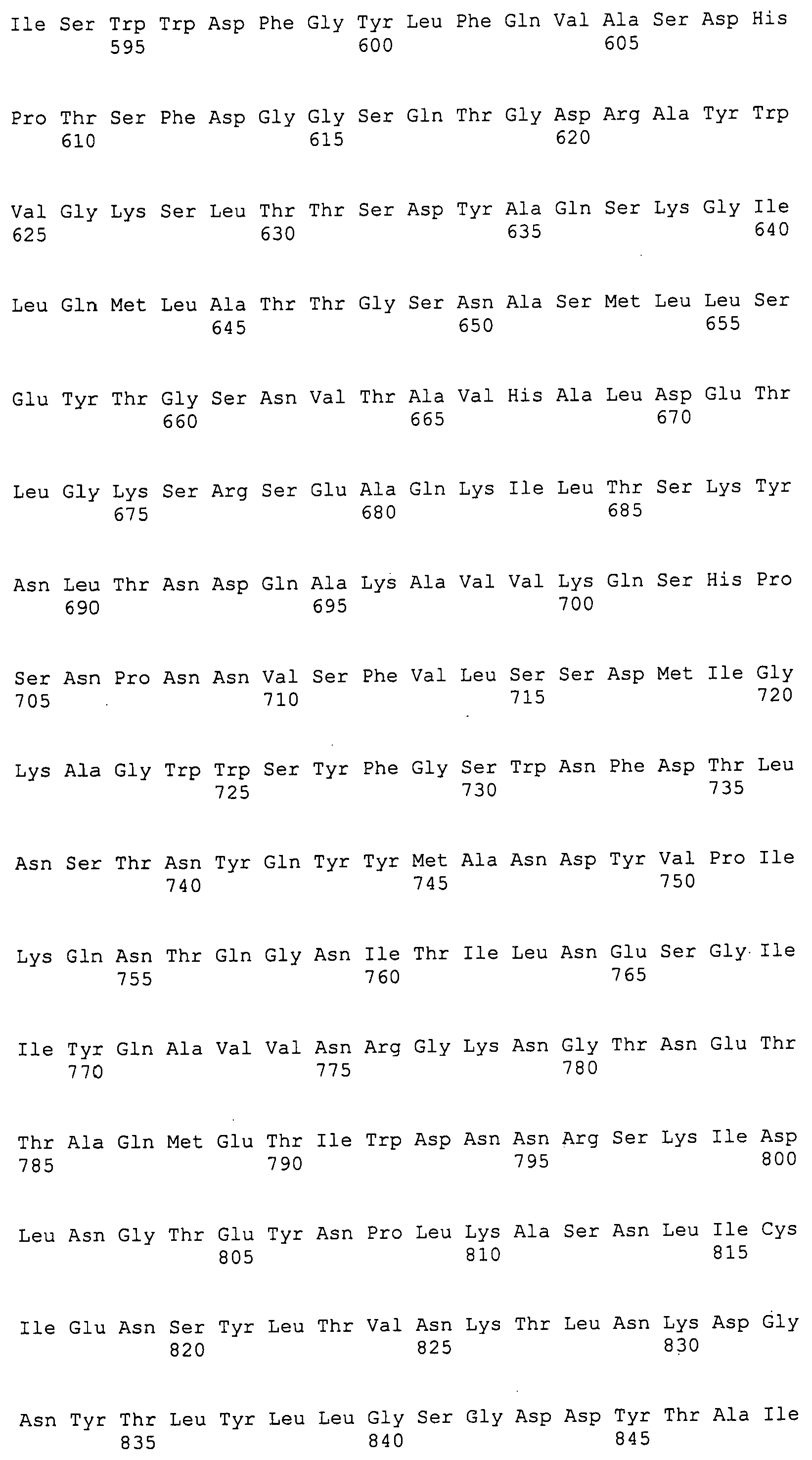

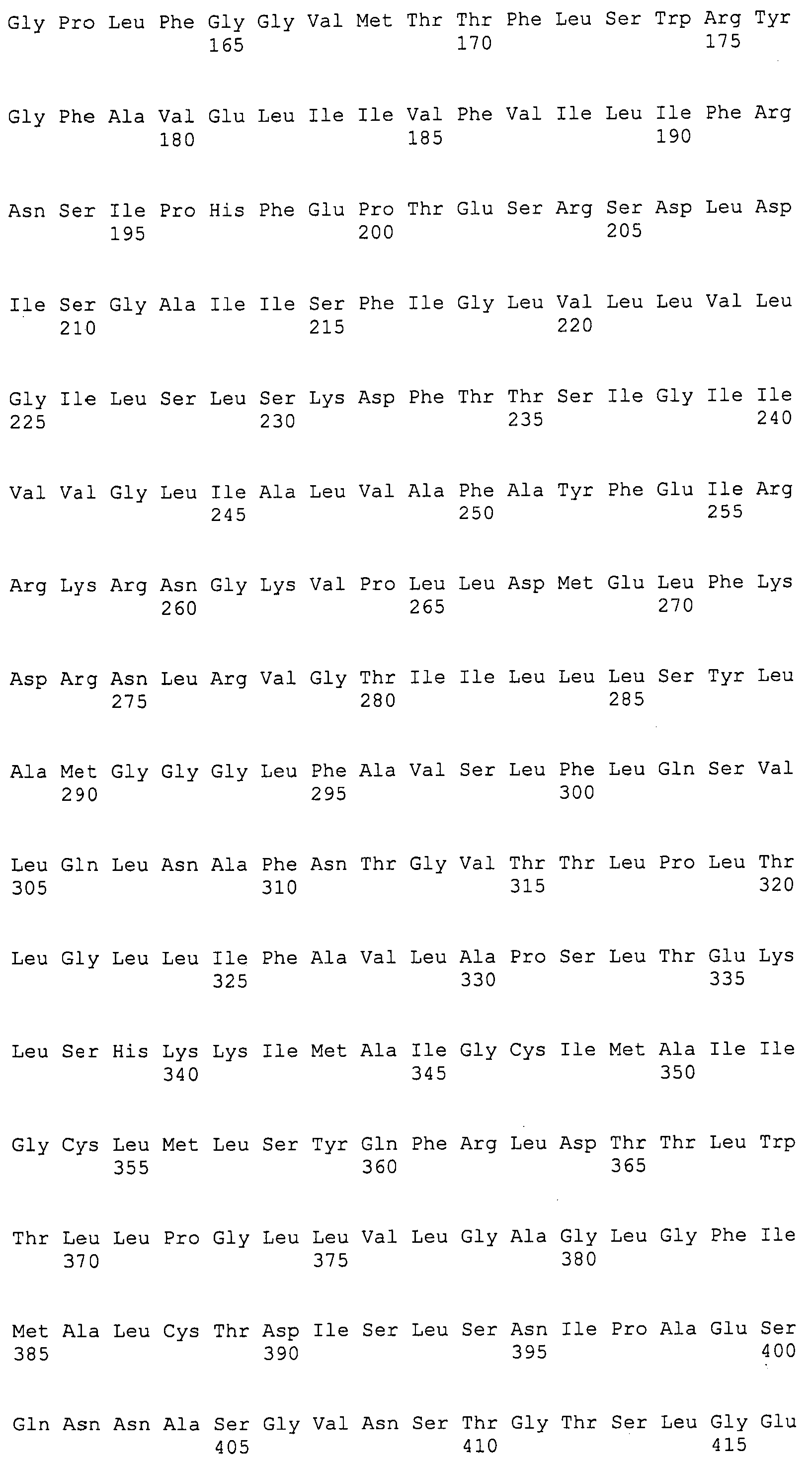

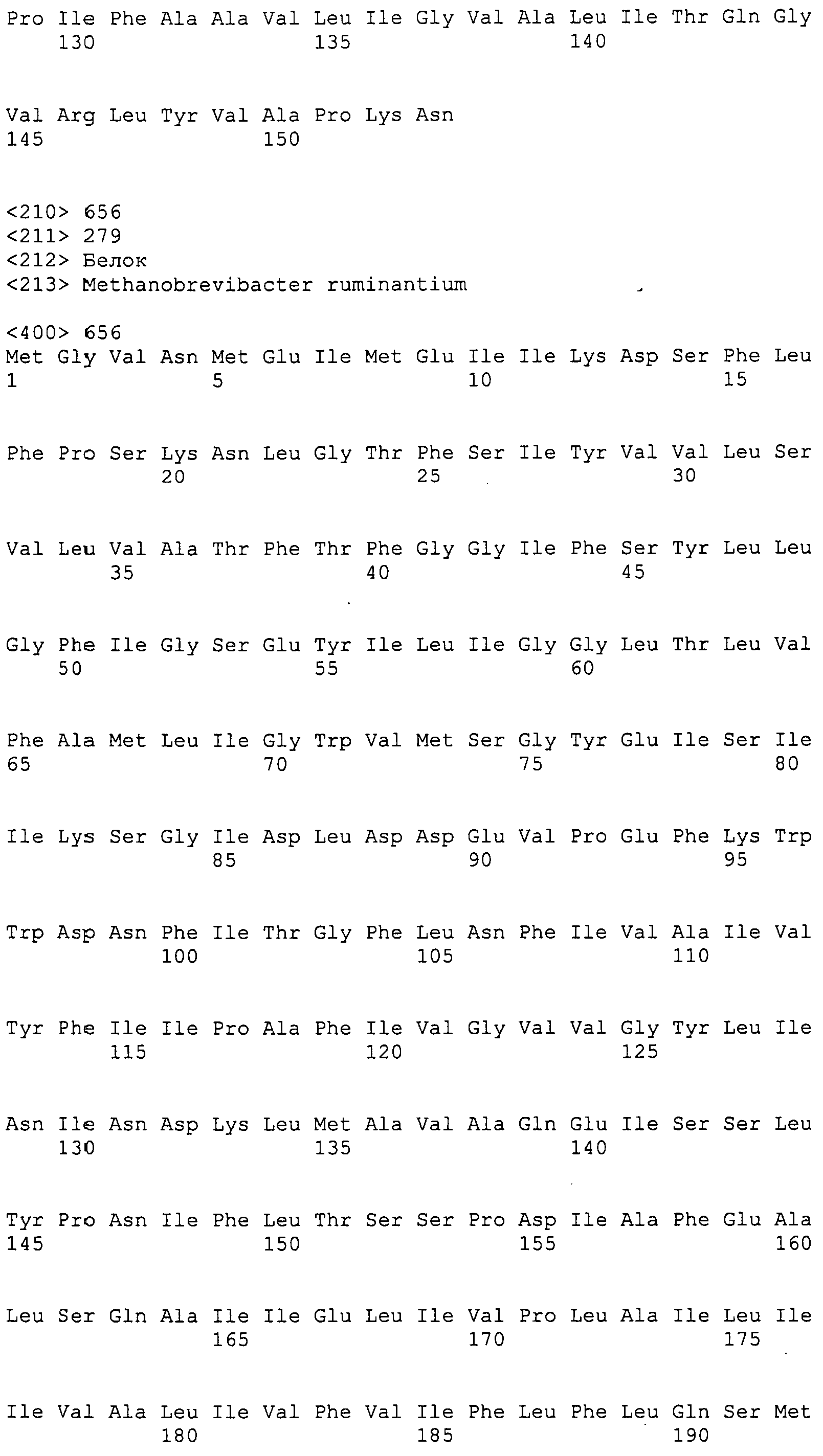


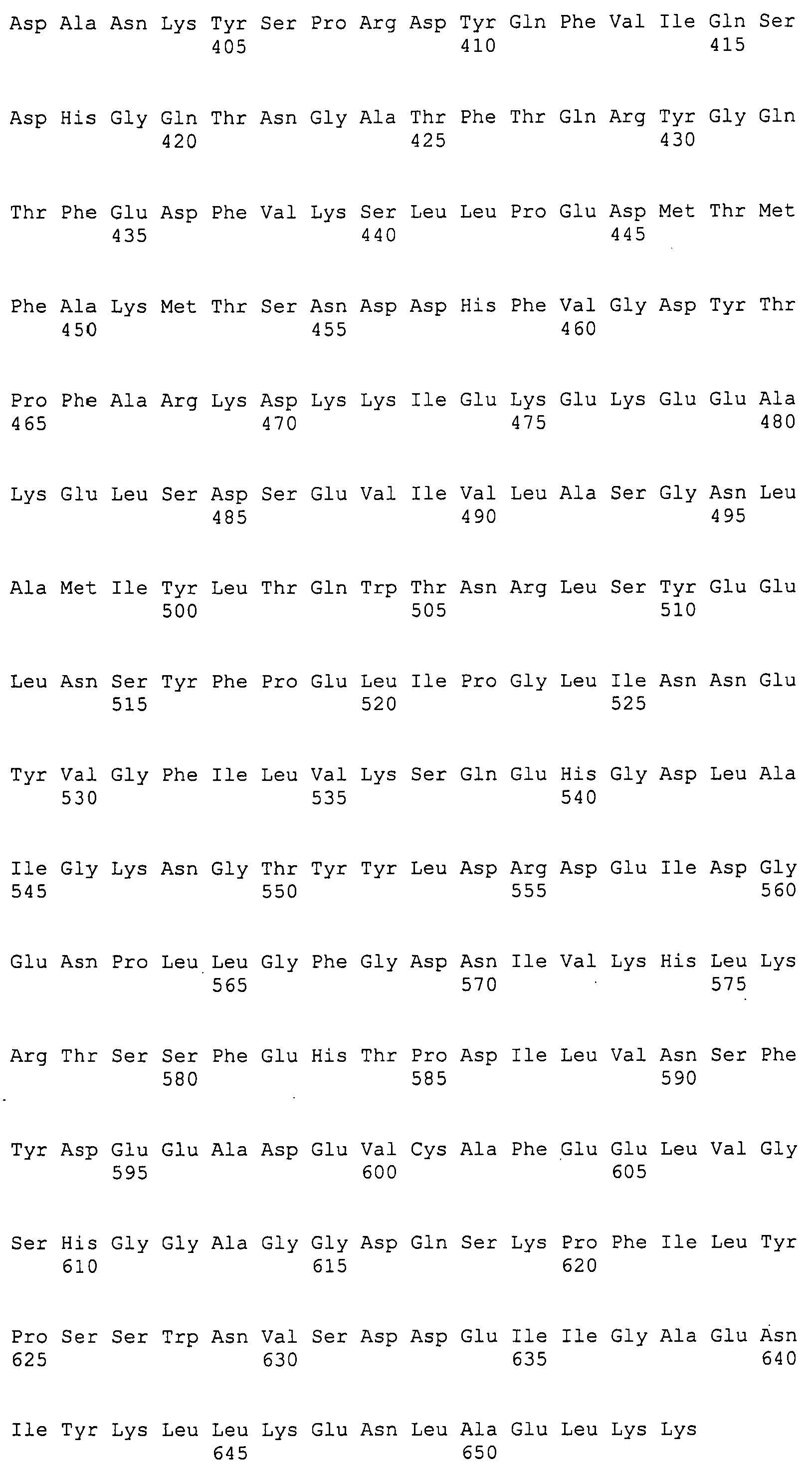






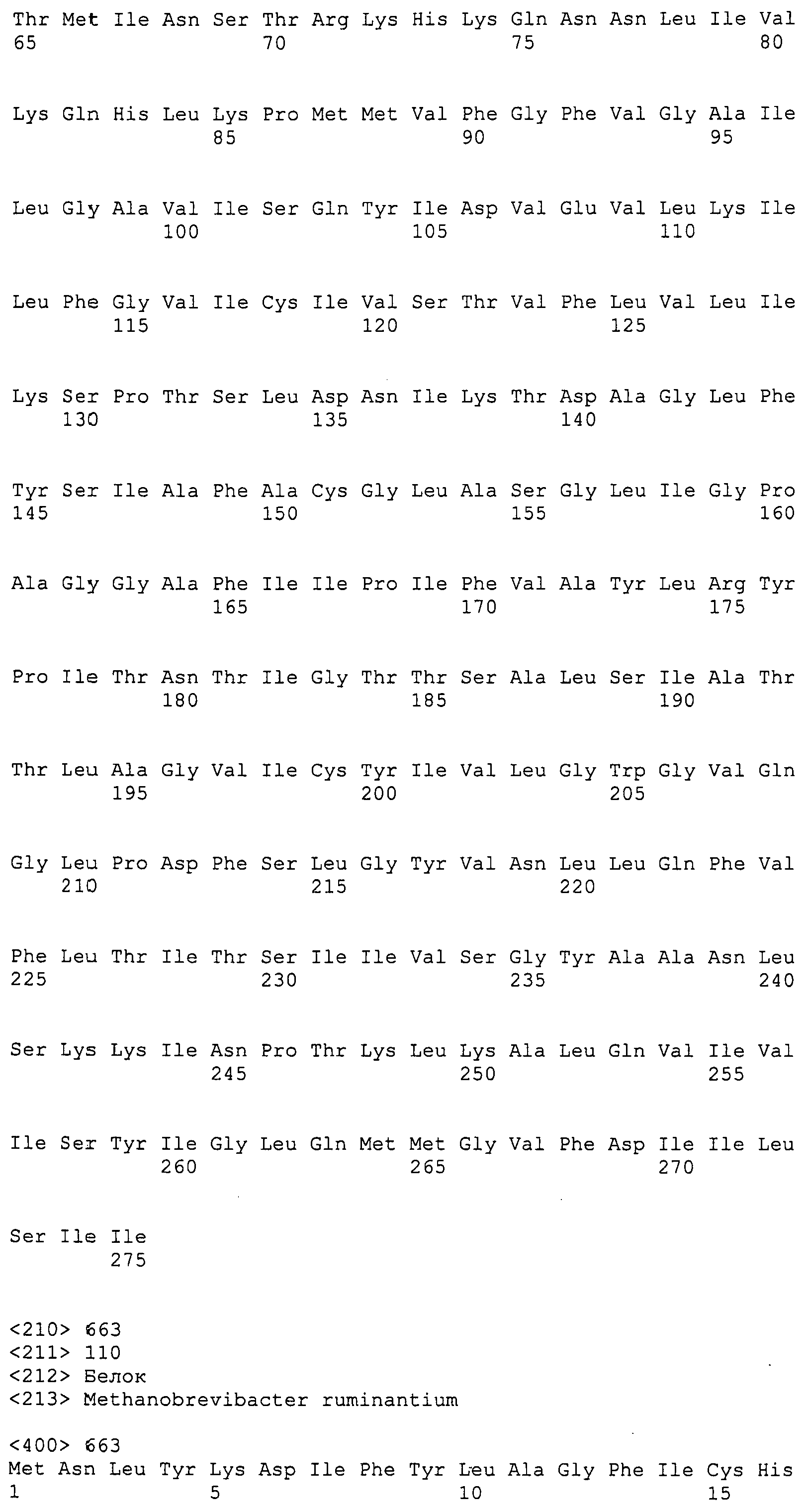











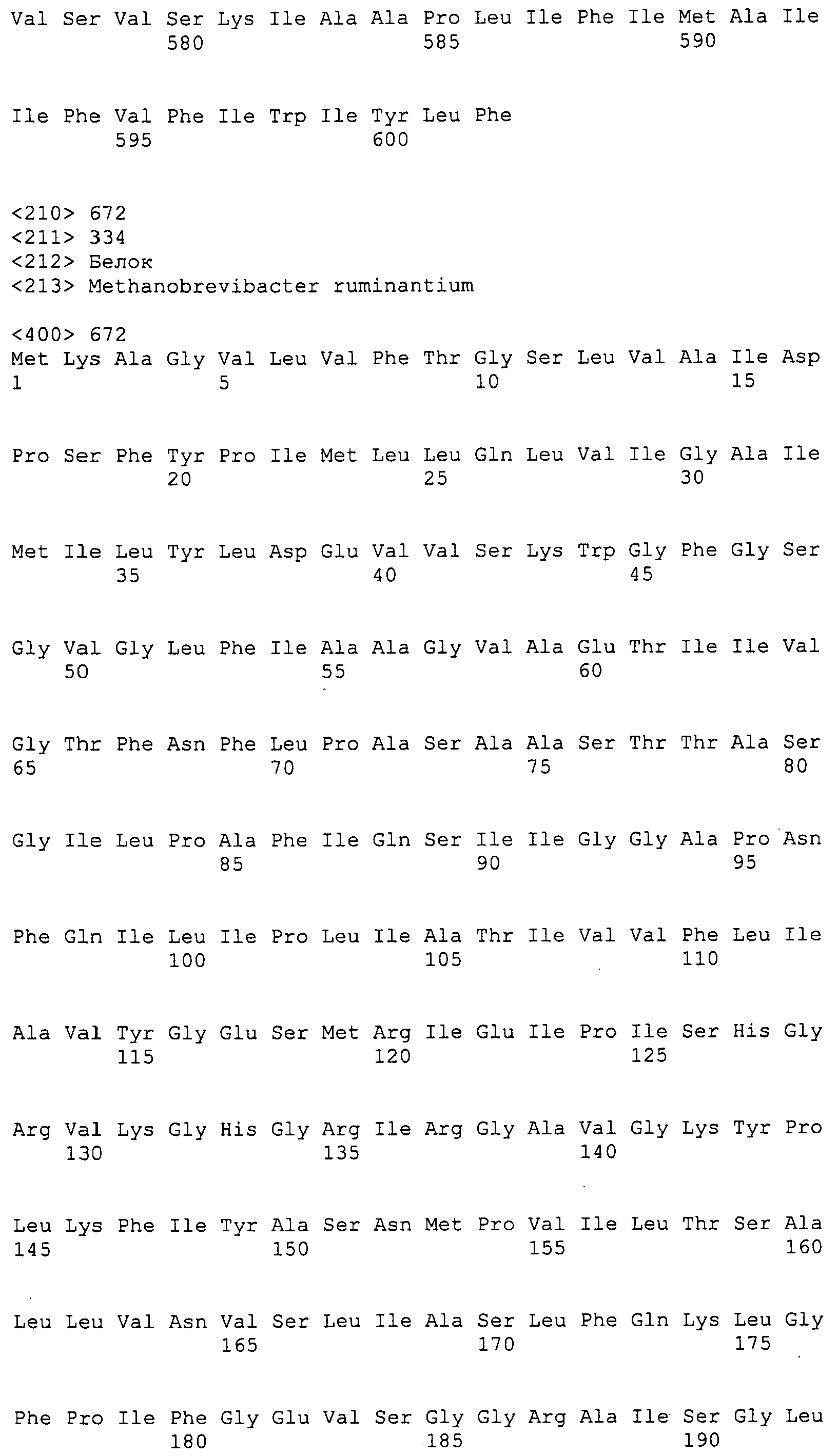















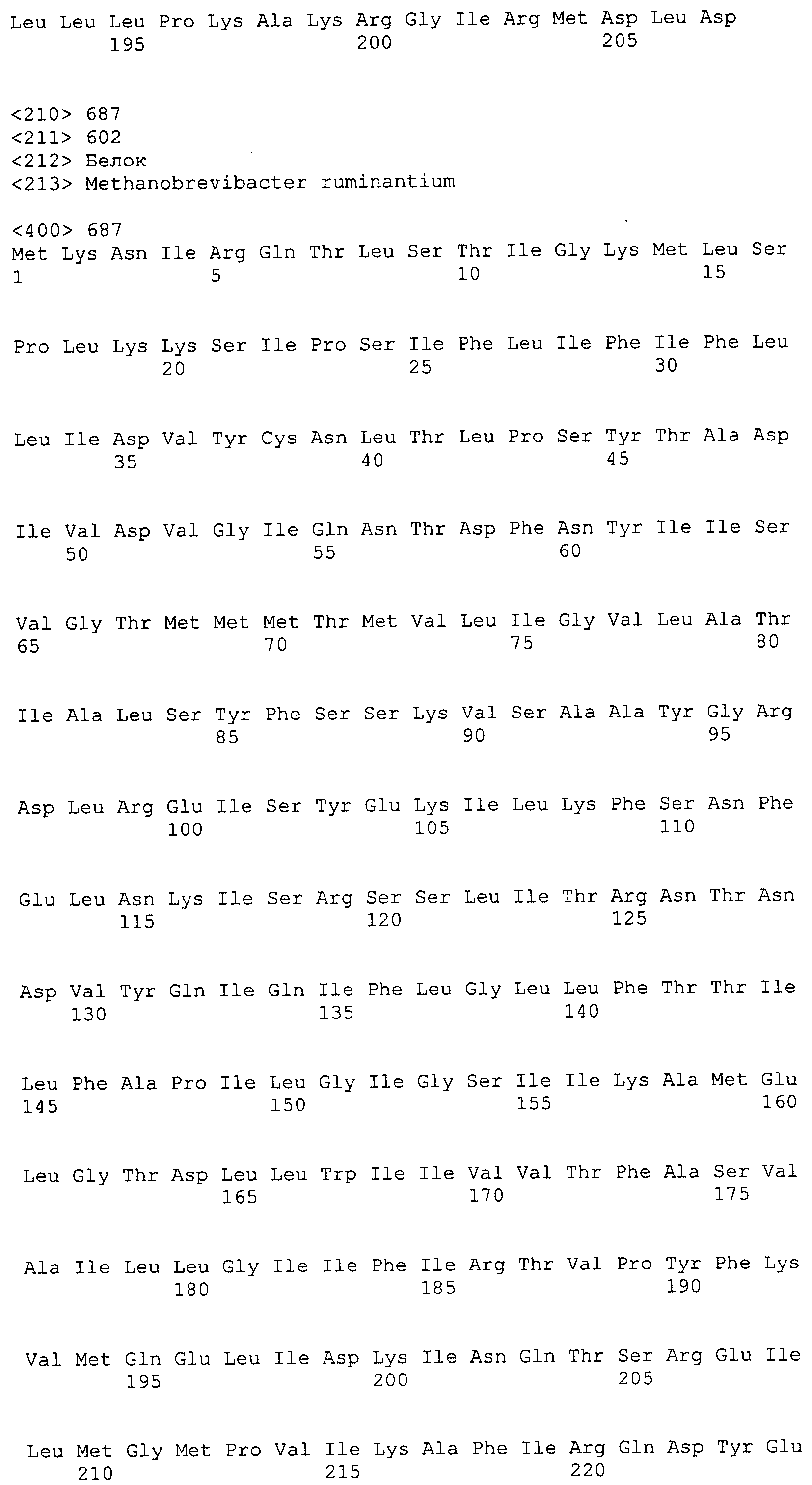




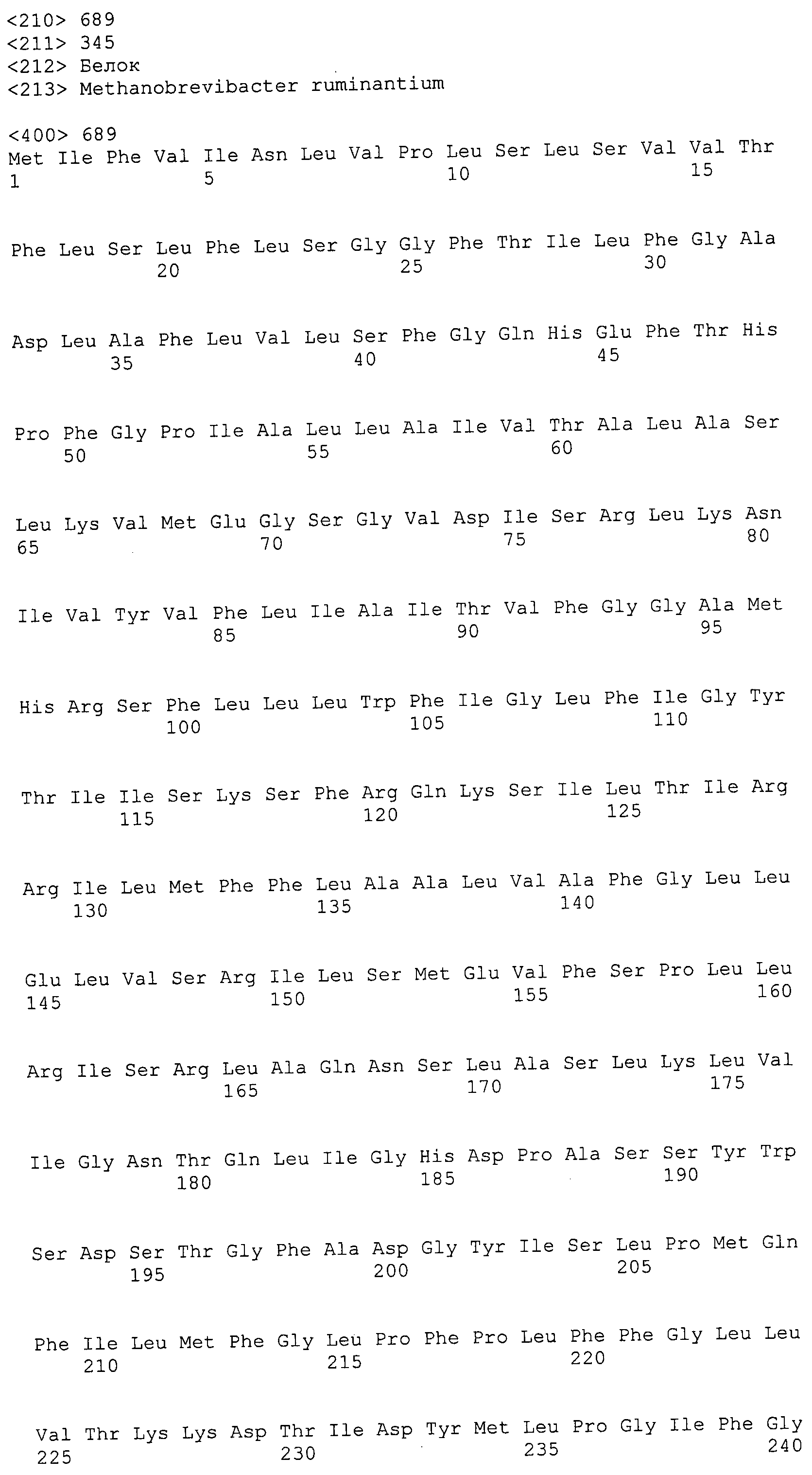





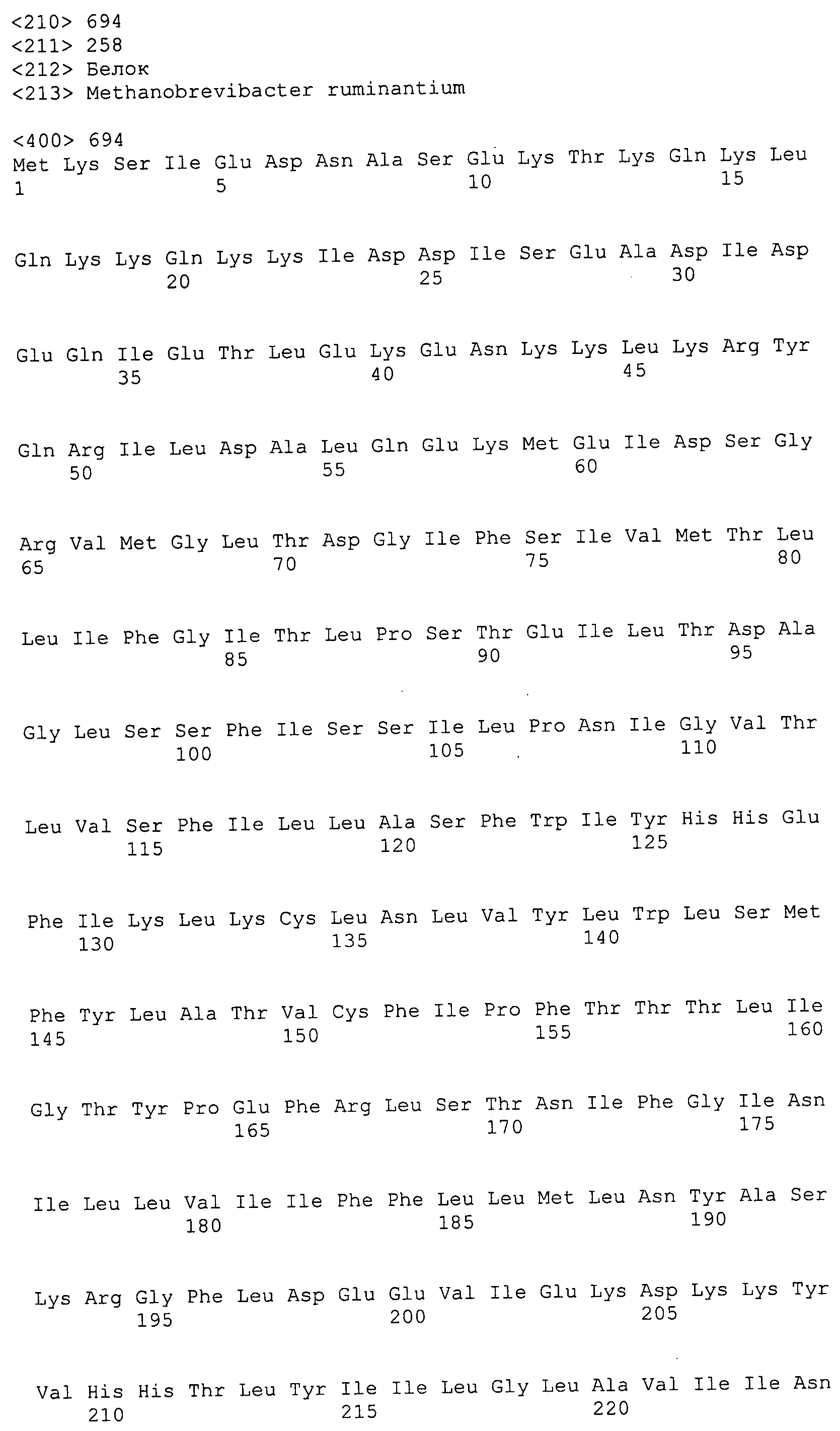

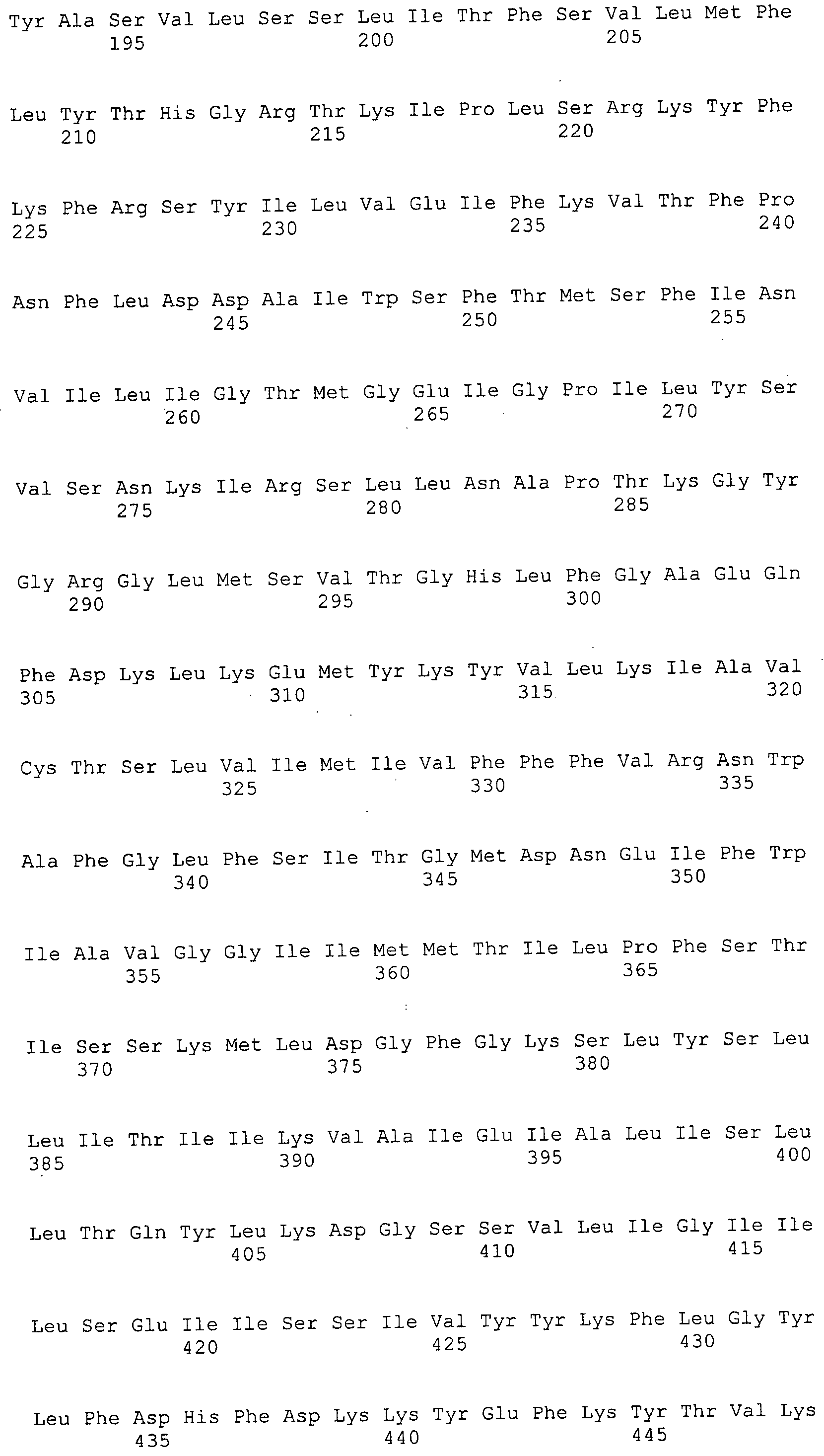

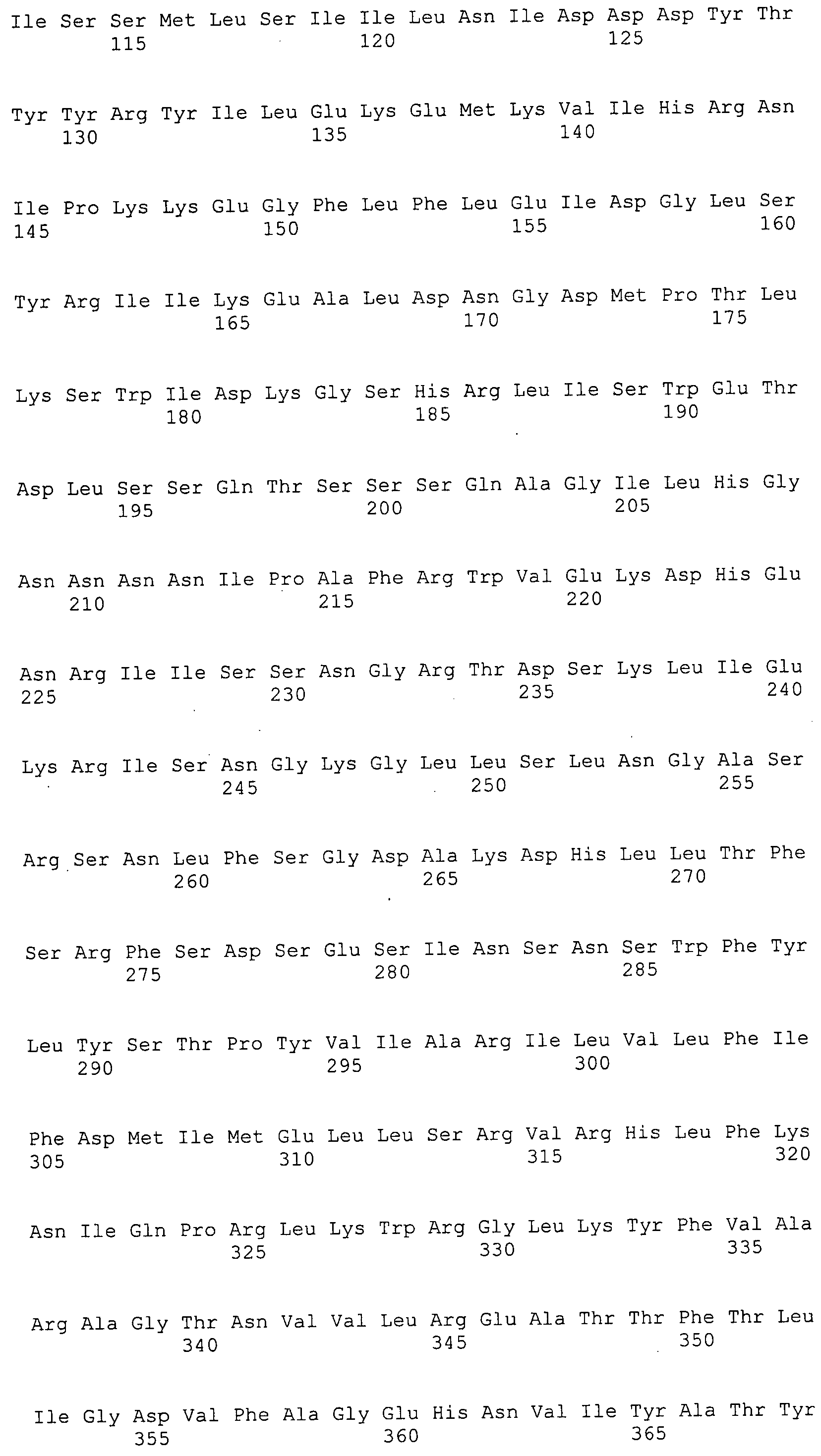

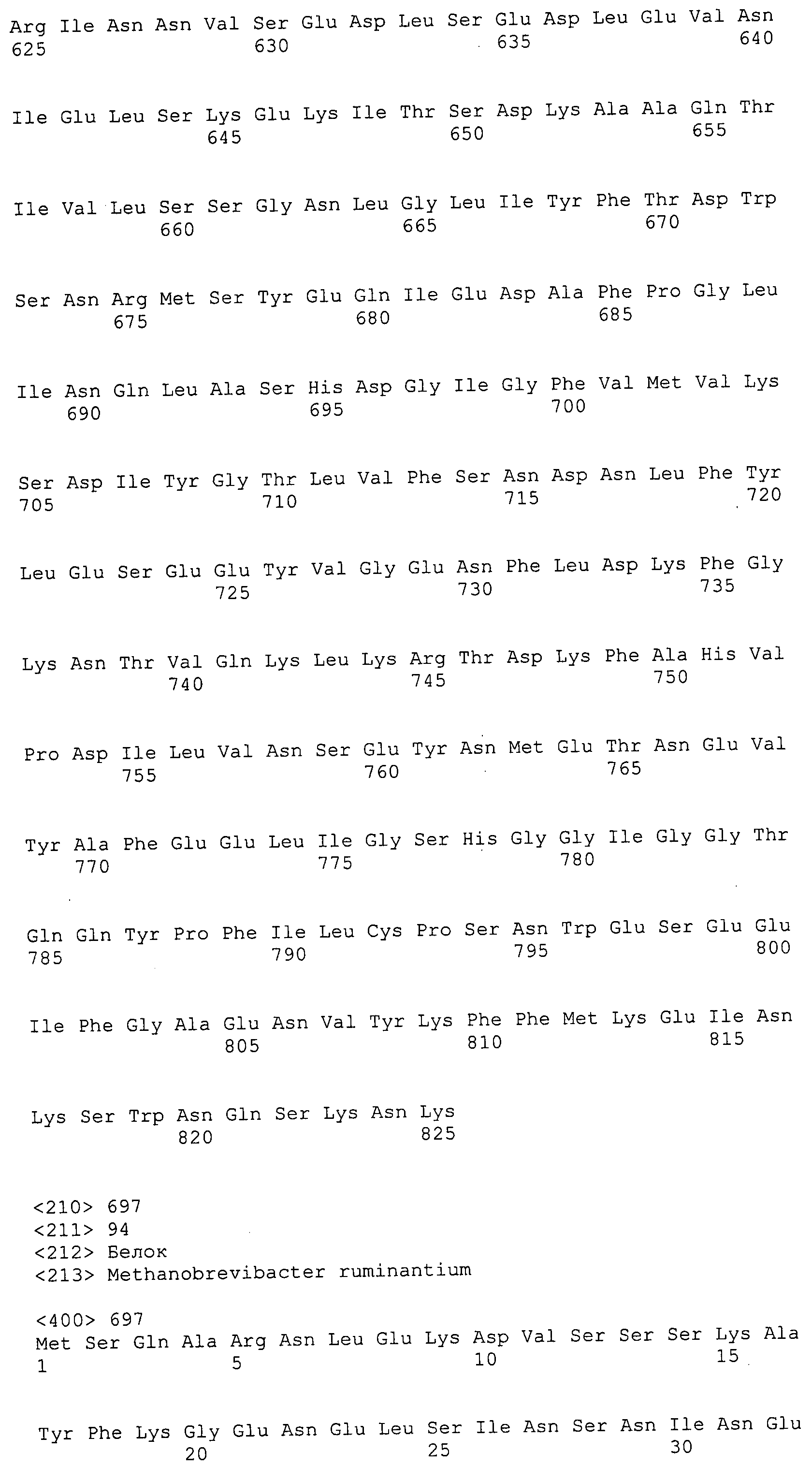




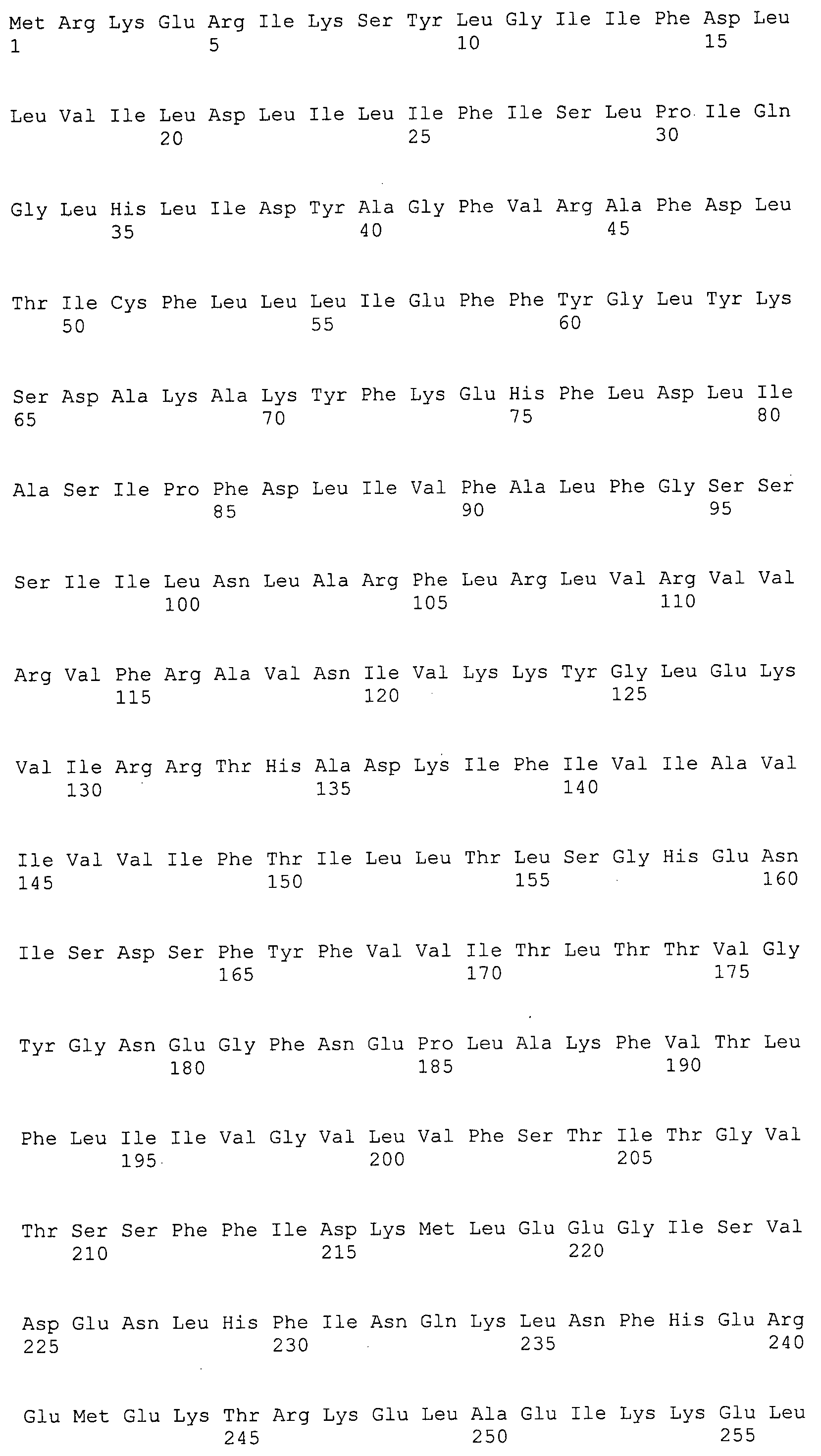







































































































































































































































































































































































































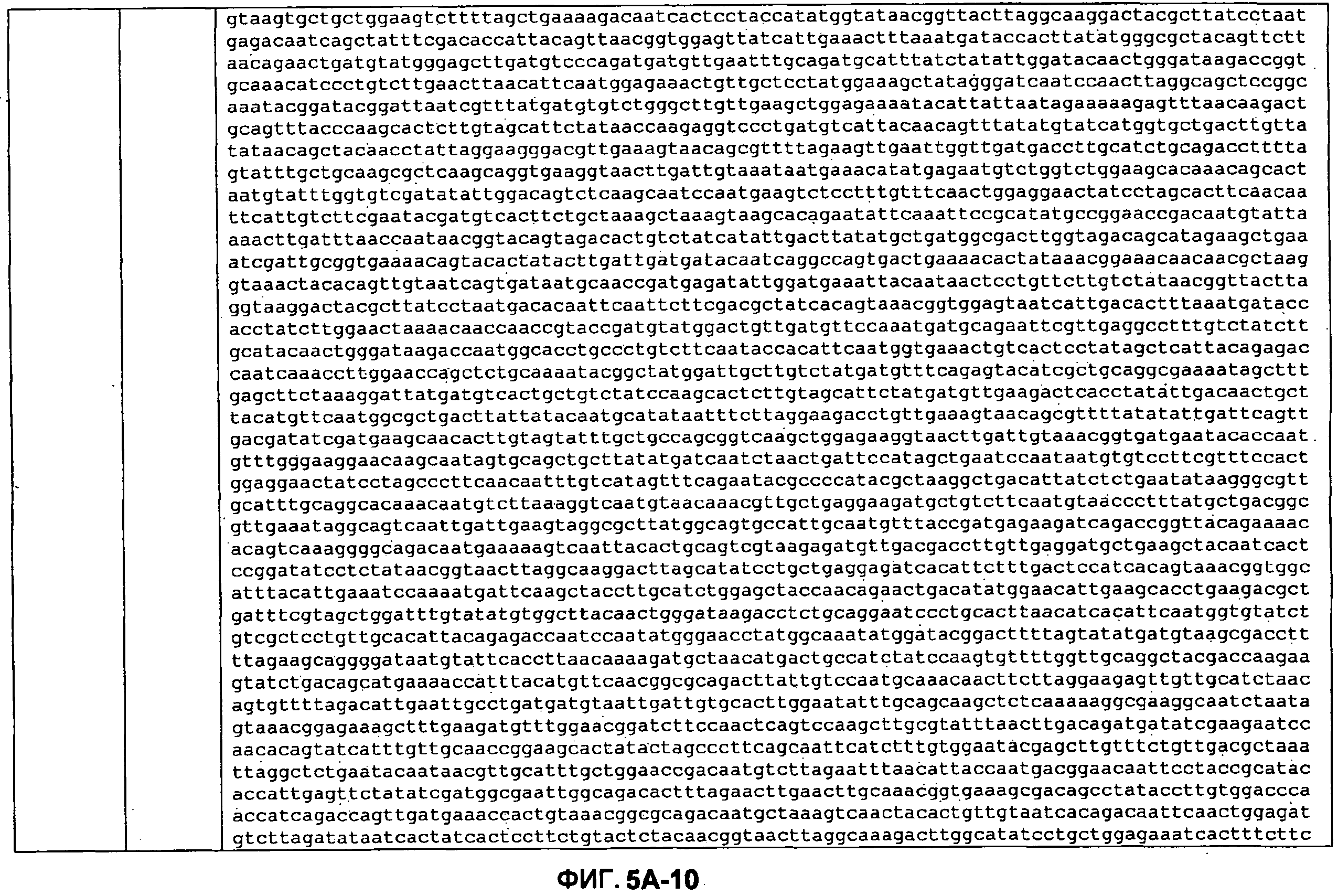
















































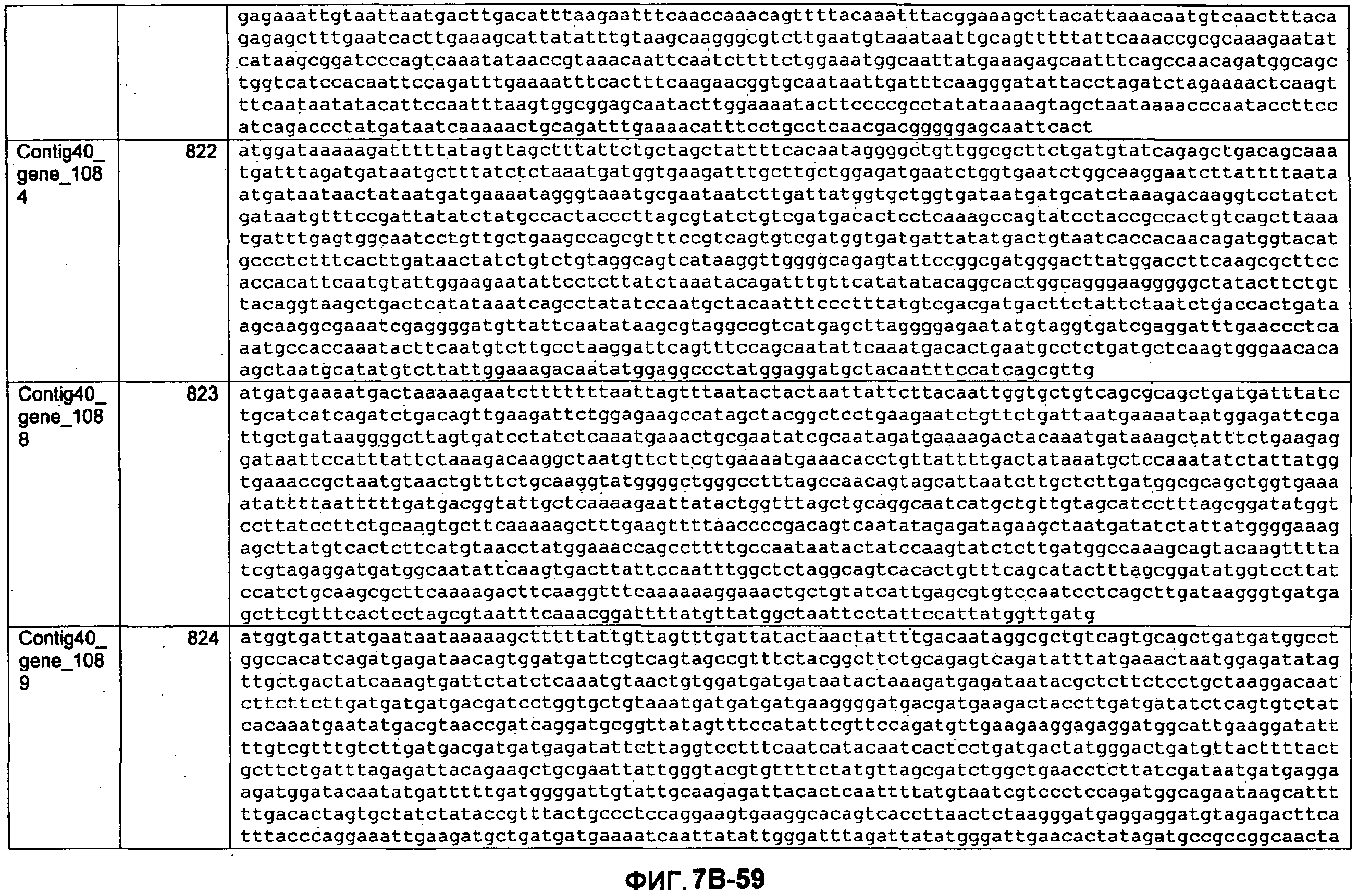













































































































































































































































Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет заявок на патент США № 60/975104 от 25 сентября 2007 г., № 60/989840 от 22 ноября 2007 г. и № 60/989841 от 22 ноября 2007 г., содержание каждой из которых включено в настоящее описание в виде ссылок в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к компонентам микробных клеток, которые могут быть использованы для выработки антител, в том числе к пептидам, к полипептидам, в состав которых входят эти пептиды, к полинуклеотидам, которые кодируют эти пептиды или полипептиды, и к антителам, направленным к этим пептидам, полипептидам или полинуклеотидам. Изобретение также относится к векторам экспрессии и клеткам-хозяевам для продуцирования этих пептидов, полипептидов, полинуклеотидов и антител. Изобретение, кроме того, относится к способам и композициям, особенно к композициям вакцин, для детекции, таргетирования и подавления микробных клеток, особенно клеток-метанопродуцентов, с помощью одного или нескольких раскрытых пептидов, полипептидов, полинуклеотидов, антител, векторов экспрессии и клеток-хозяев.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В Новой Зеландии сельскохозяйственная деятельность учитывает выбросы большинства парниковых газов. Таким образом, сокращение сельскохозяйственных выбросов парниковых газов является важным для выполнения обязательств Новой Зеландии в рамках Киотского протокола. Протокол требует сокращения выбросов парниковых газов до уровня 1990 года к концу первого периода действия обязательств (2008-2012 годы). Для этого сельскохозяйственный комплекс и правительство Новой Зеландии создали научно-исследовательское объединение пастбищных парниковых газов (PGGRC), чтобы найти способы сокращения выбросов Новой Зеландией сельскохозяйственных парниковых газов.
Важной частью деятельности PGGRC были исследования в области сокращения выбросов метана пастбищным животноводством жвачных в Новой Зеландии. Снижение выбросов метана жвачными представляет коммерческий интерес по двум причинам. Во-первых, невыполнение обязательств в рамках Киотского протокола заставит правительство покупать дополнительные объемы разрешенных выбросов углерода. В настоящее время эта стоимость оценивается в 350 млн. долларов. Во-вторых, производство метана приводит к потере 8-12% суммарной энергии, производимой в рубце. Вместо этого эта энергия может быть использована для улучшения продуктивности жвачных.
Метан образуется в рубце бактериями, называемыми метанопродуцентами, которые являются частью типа Euryarchaeota в царстве Archaea. Большинство метанопродуцентов растут на CO2 и H2 в качестве единственного источника энергии, но некоторые из них для роста могут использовать ацетатные или метиловые соединения. В рубце существует несколько различных родов метанопродуцирующих архей, но виды рода Methanobrevibacter, особенно M. ruminantium и M. smithii, считаются преобладающими метанопродуцентами у жвачных Новой Зеландии. M. ruminantium в настоящее время является объектом проекта секвенирования генома, финансируемого PGGRC. Этот проект является первым секвенированием генома метанопродуцентов из рубца, и он направлен на создание лучшего понимания биологии Methanobrevibacter, чтобы обнаружить мишени для подавления образования метана.
Для снижения производства метана в рубце необходимо подавление метанопродуцентов или инактивация их метаболического пути метаногенеза. Средство для подавления производства метана заключается в определении конкретных молекул, которые подавляют клетки-метанопродуценты. Это может быть достигнуто, например, путем использования средств, таргетирующих метанопродуценты. В одном из подходов можно получить вакцины, таргетирующие микробные клетки. Таким образом, было бы полезно идентифицировать компоненты, в особенности, компоненты клеточных поверхностей микробных клеток, в том числе пептиды и полипептиды, а также связанные с ними полинуклеотиды и антитела, которые могут быть использованы для противомикробных вакцин.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно изобретению описаны выделенные пептиды, полипептиды и полинуклеотиды М. ruminantium, в частности компоненты клеточных поверхностей М. ruminantium, равно как и векторы экспрессии, клетки-хозяева и антитела, а также способы их применения, как это подробно описано в настоящем описании.
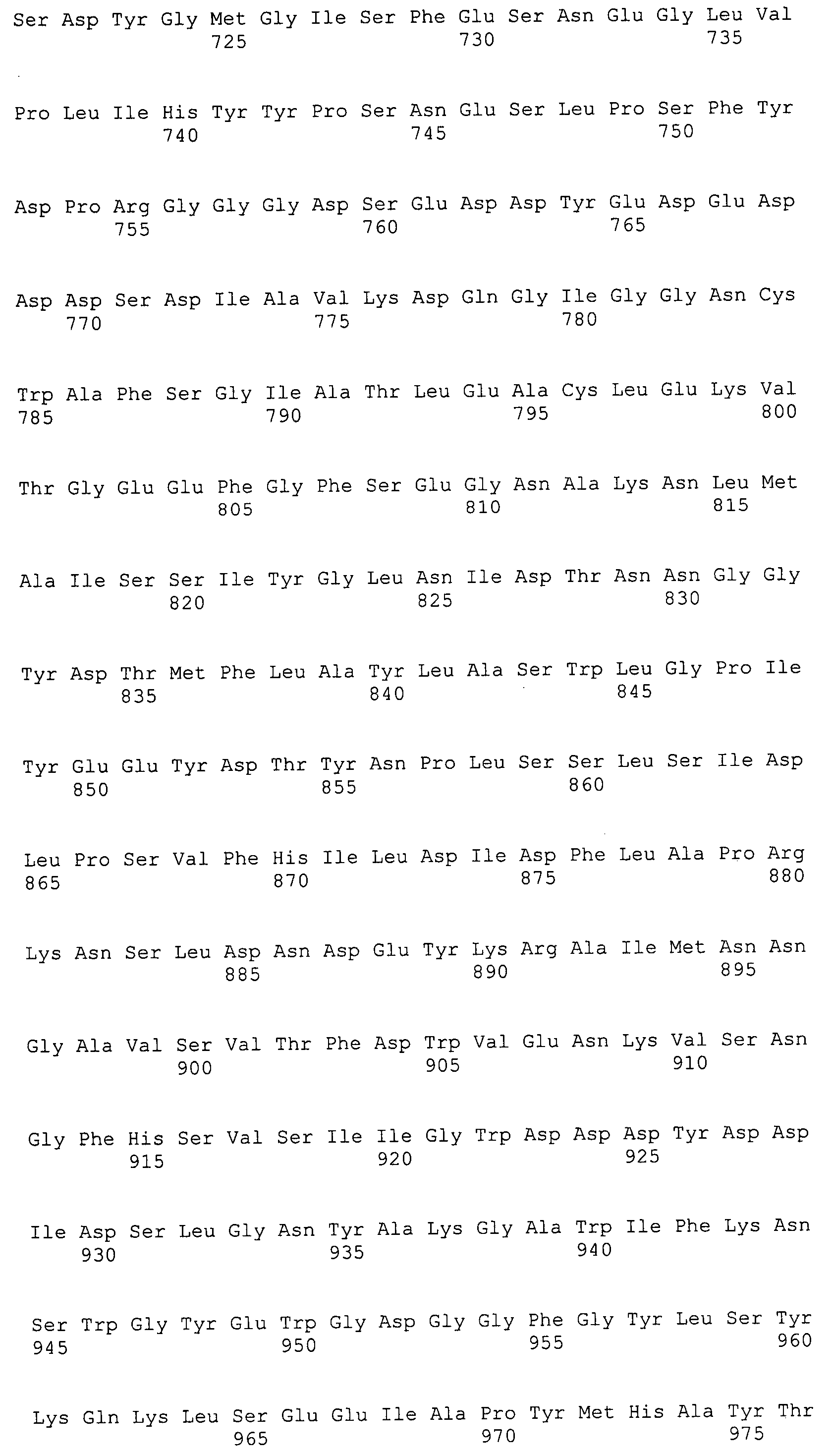
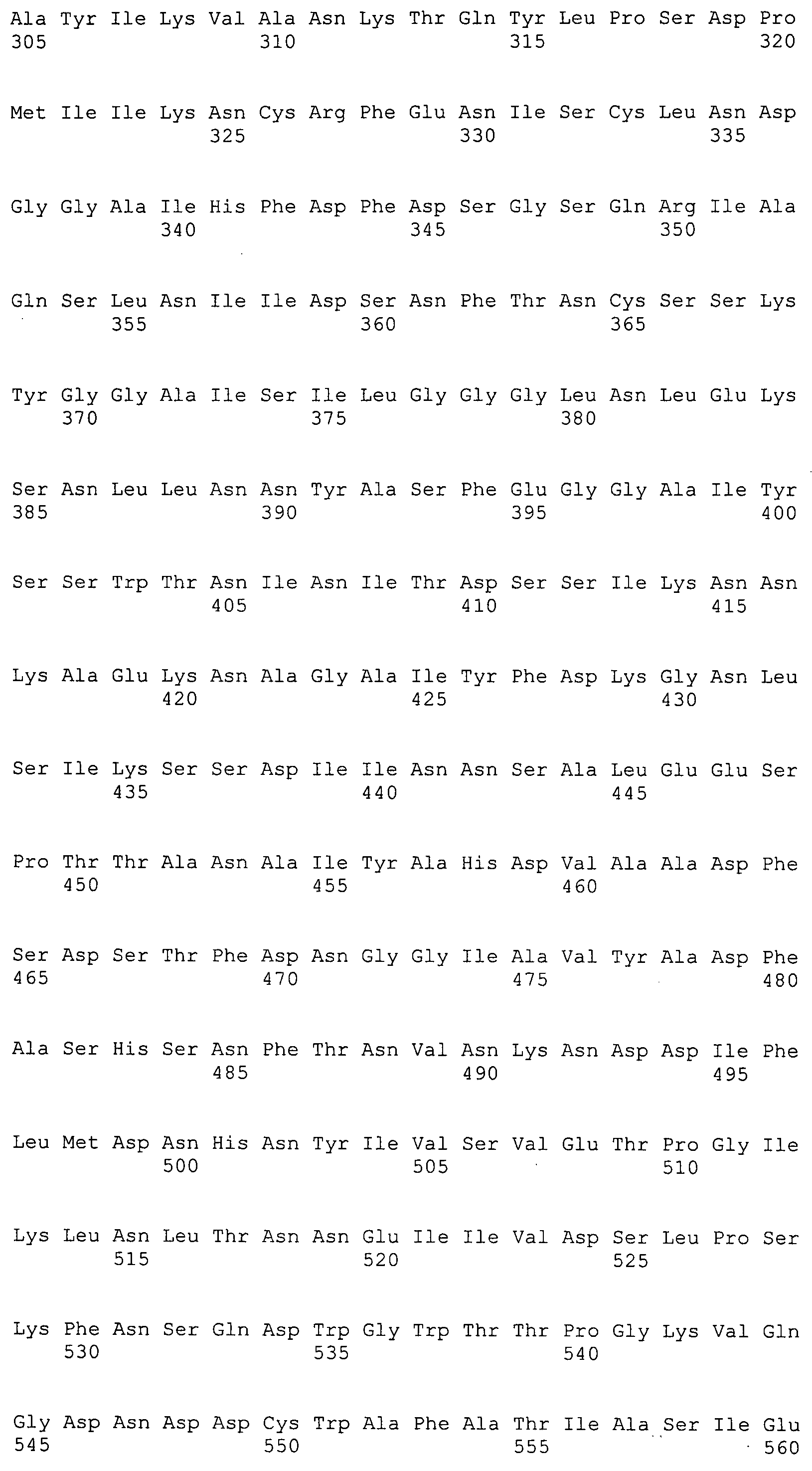
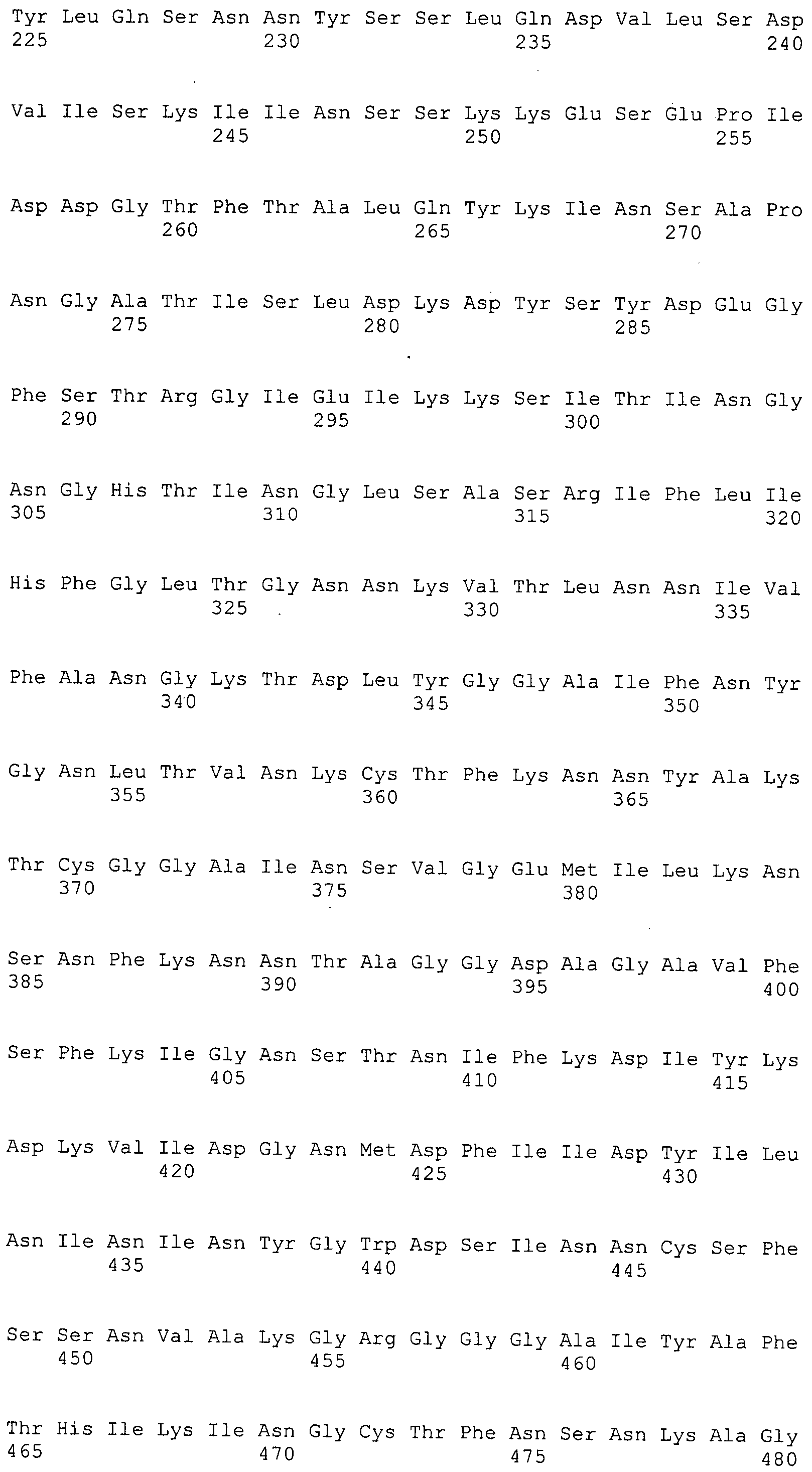
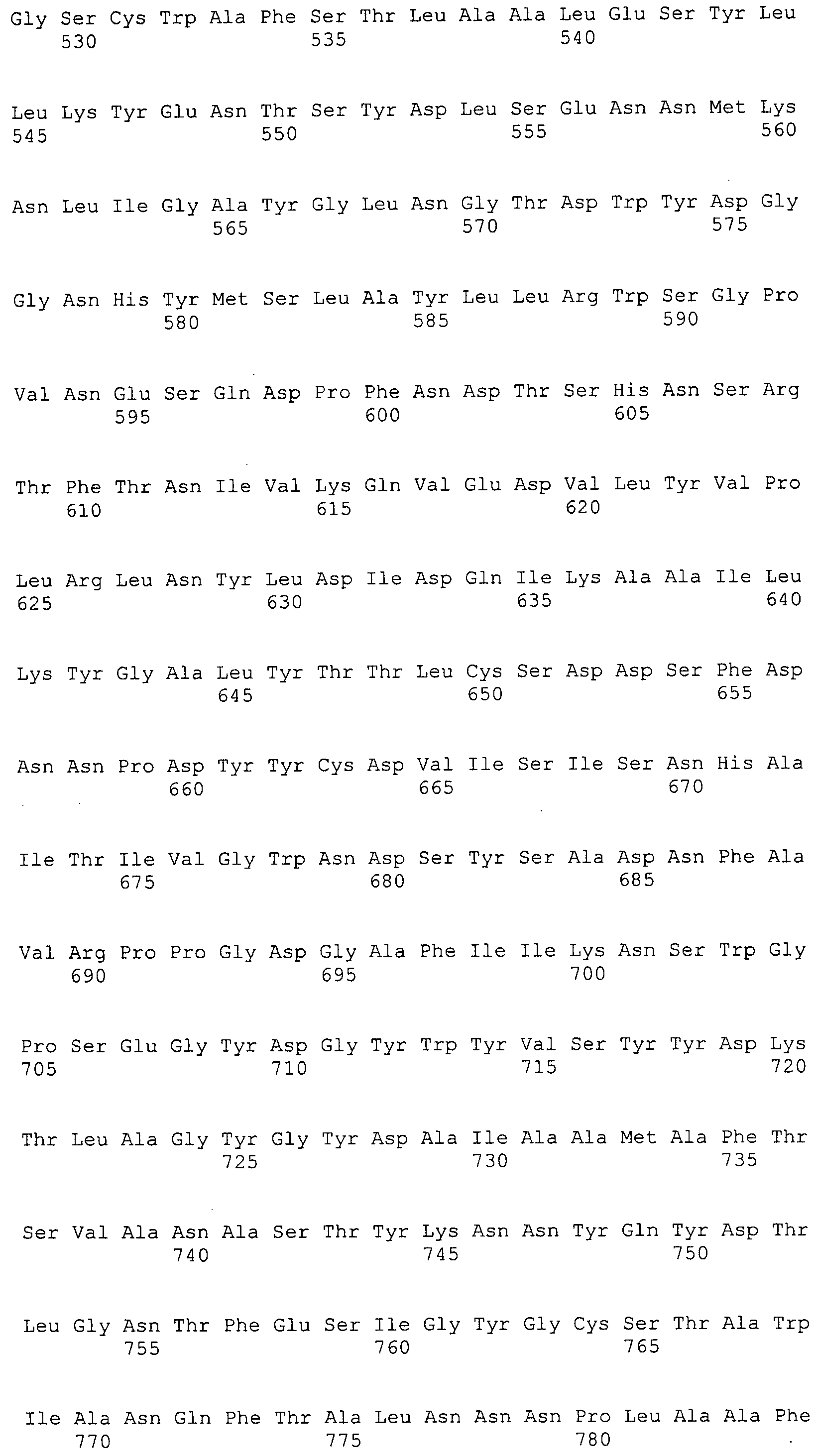
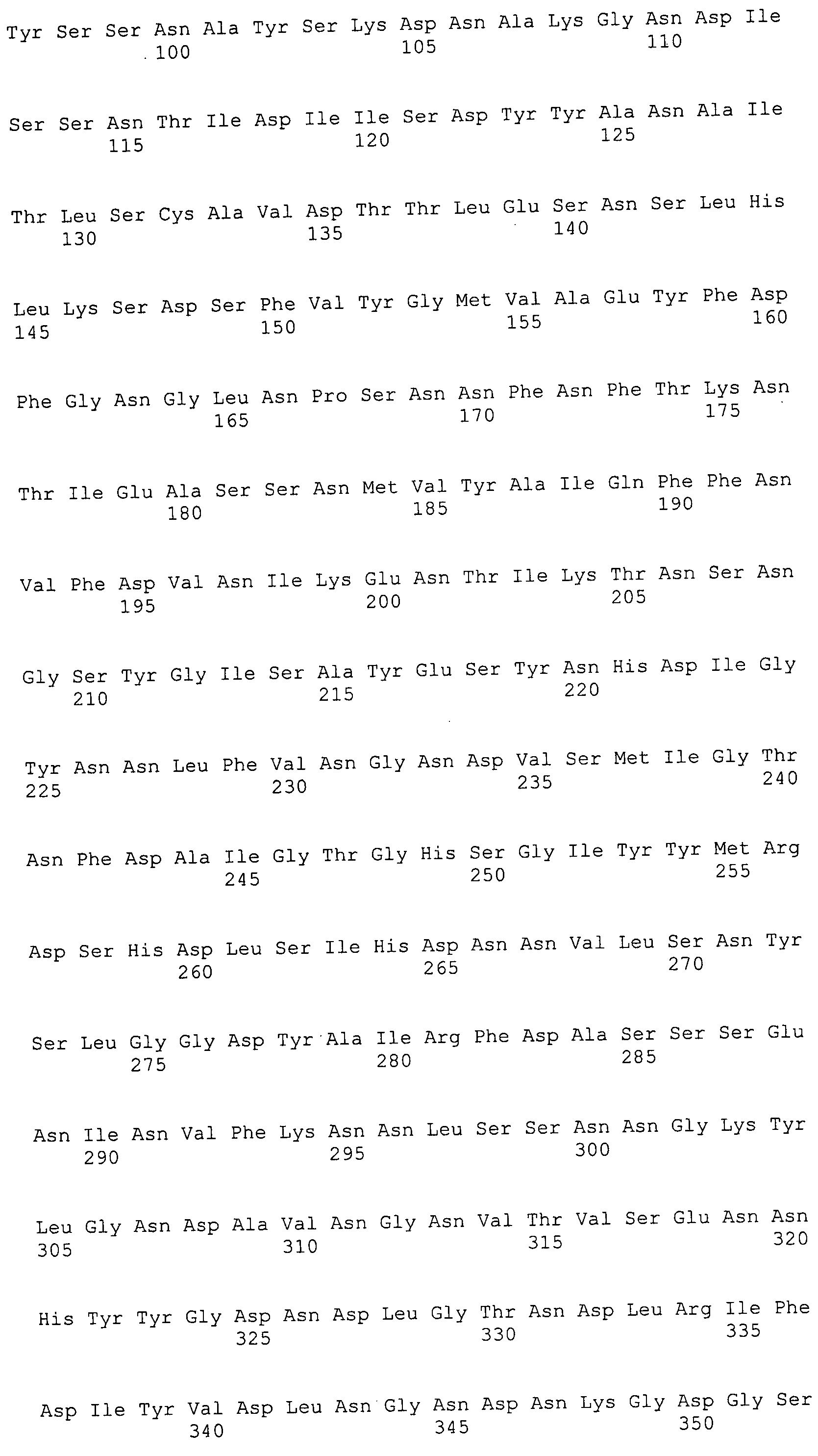
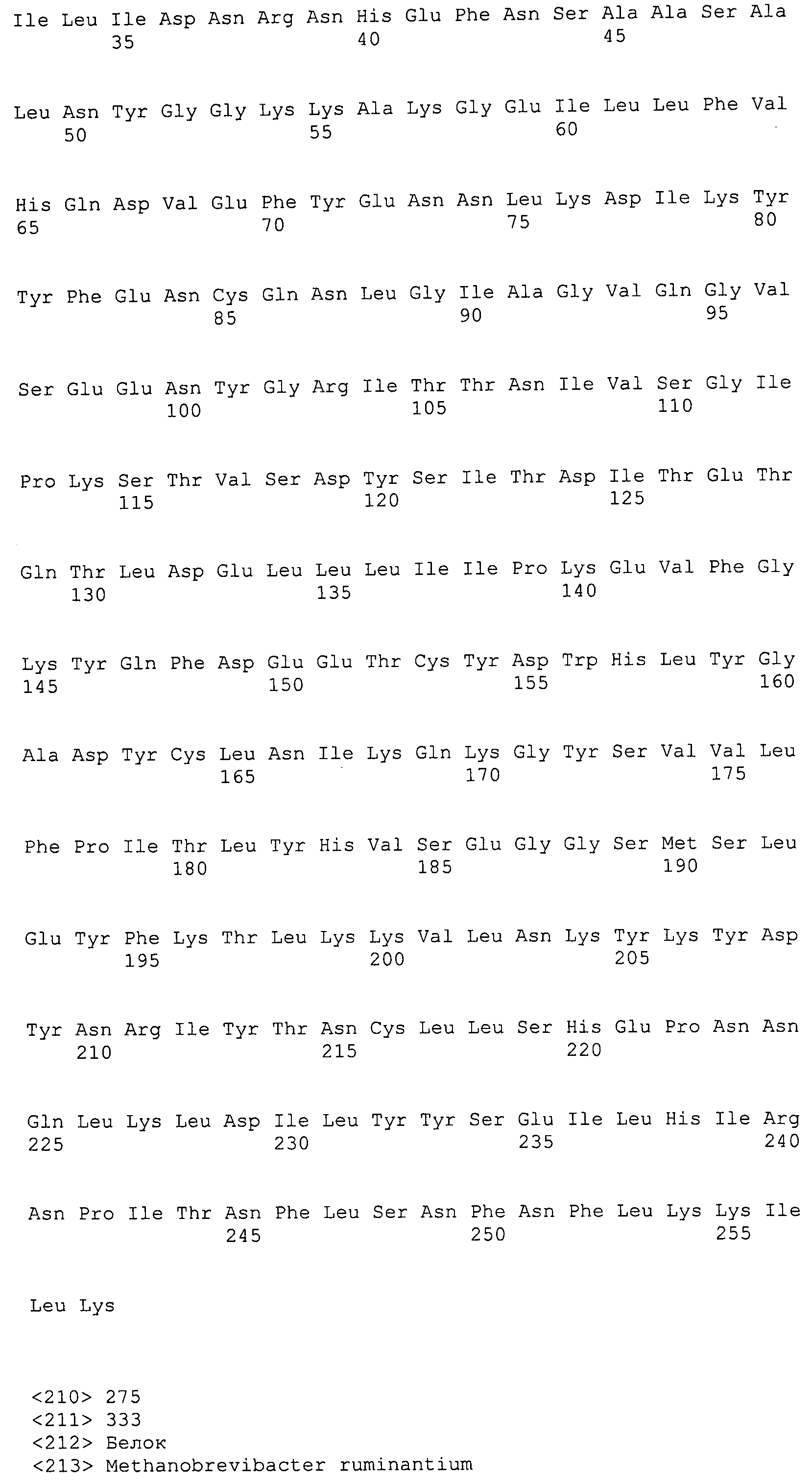
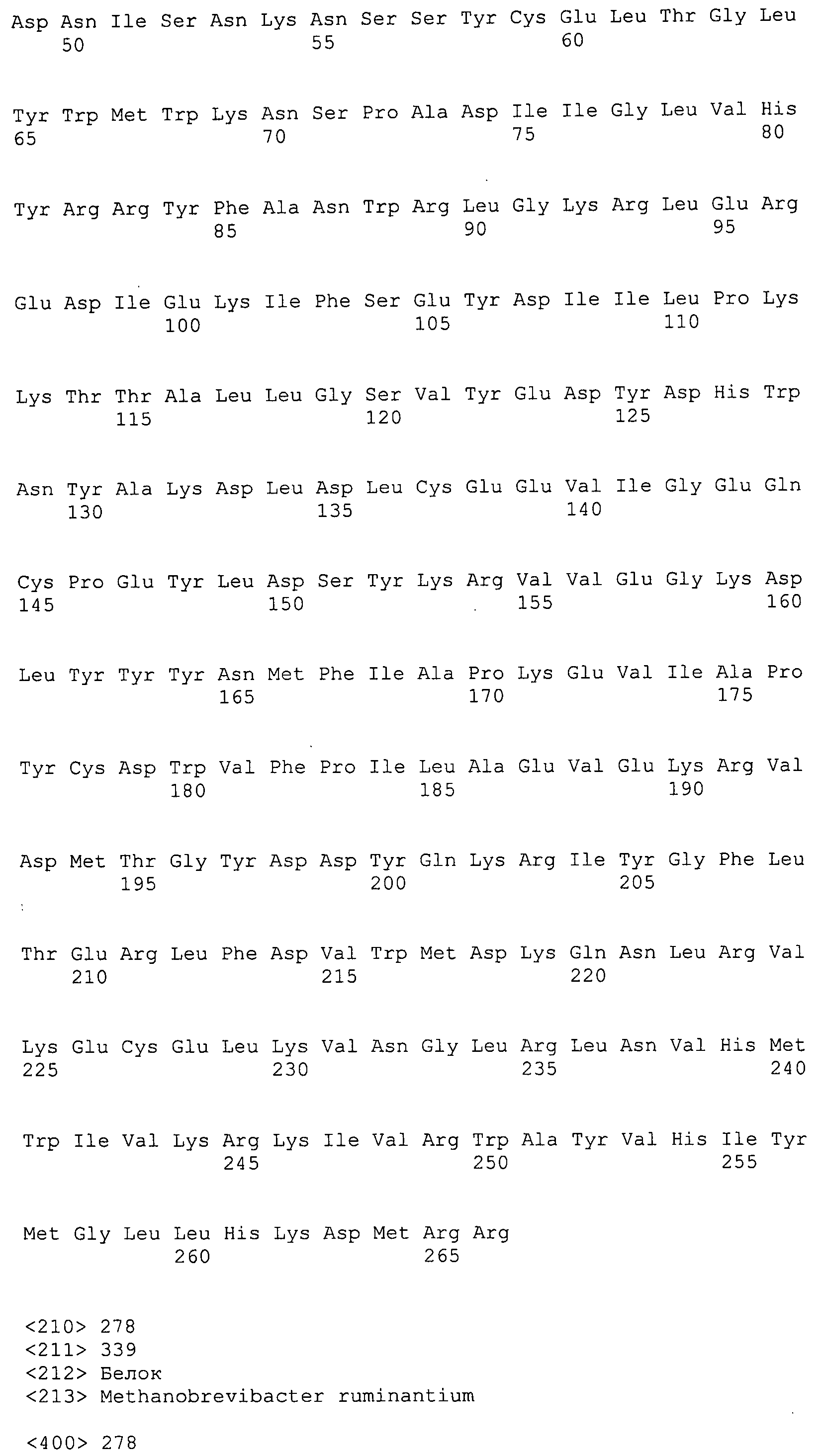
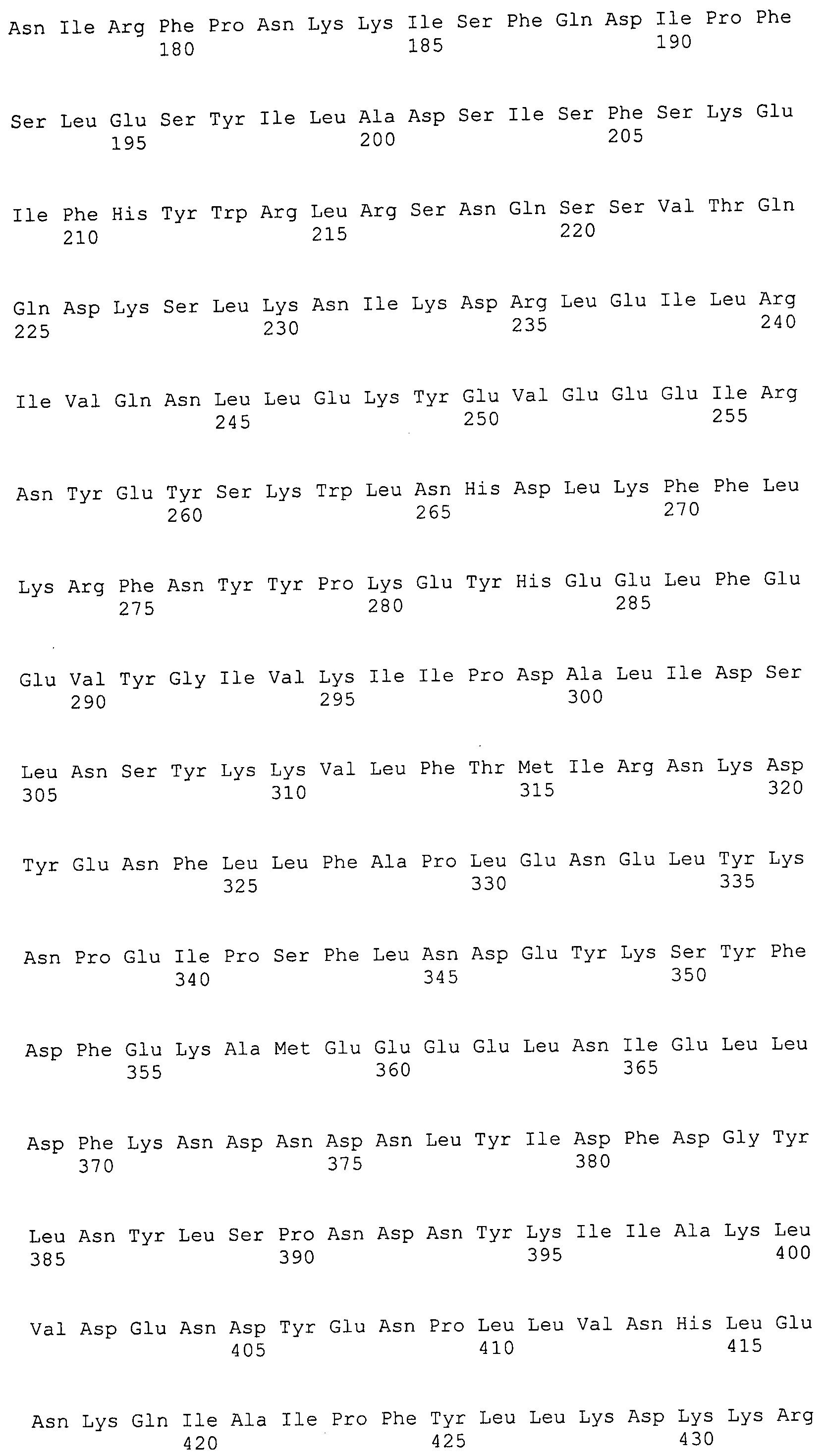
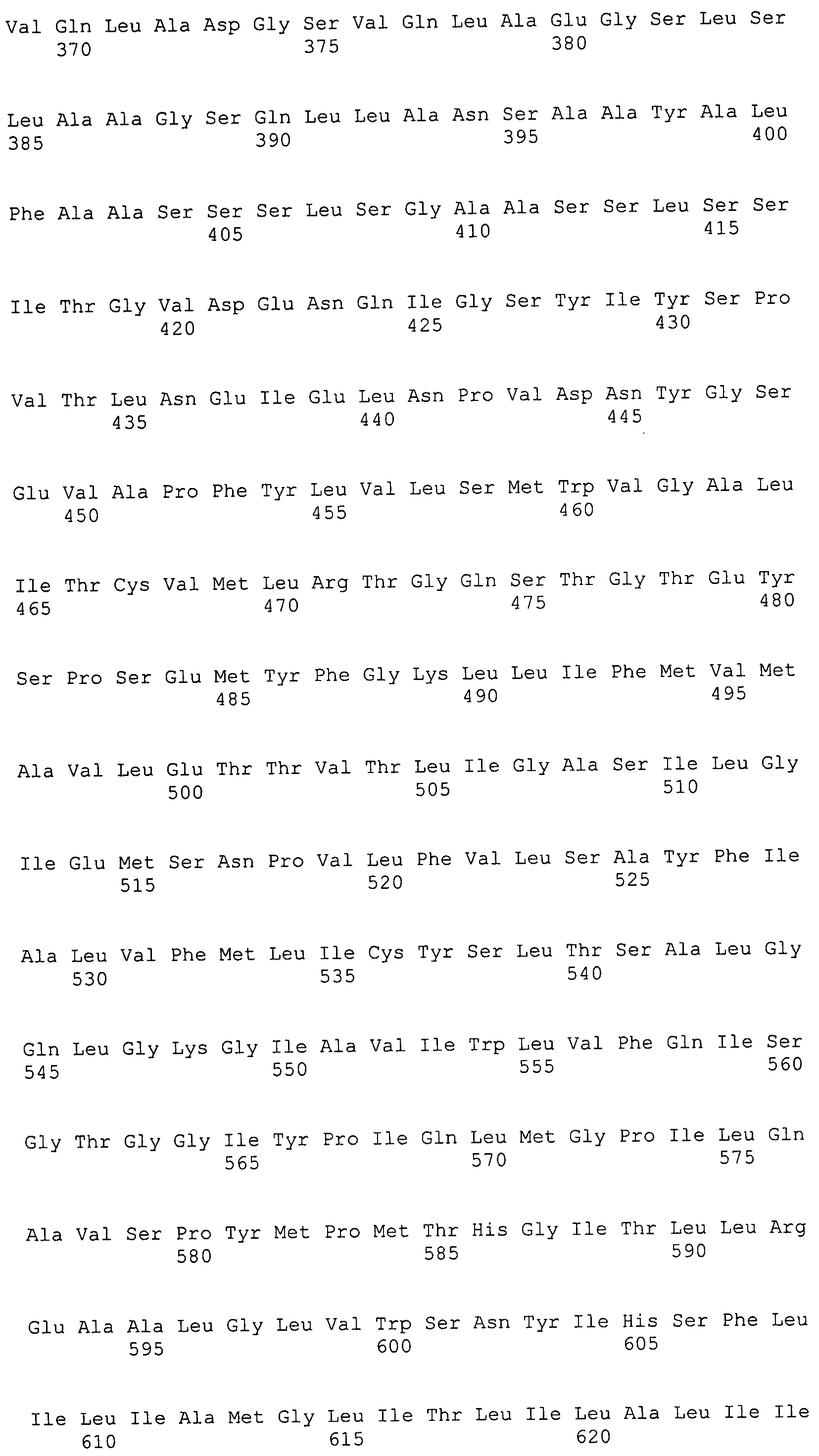
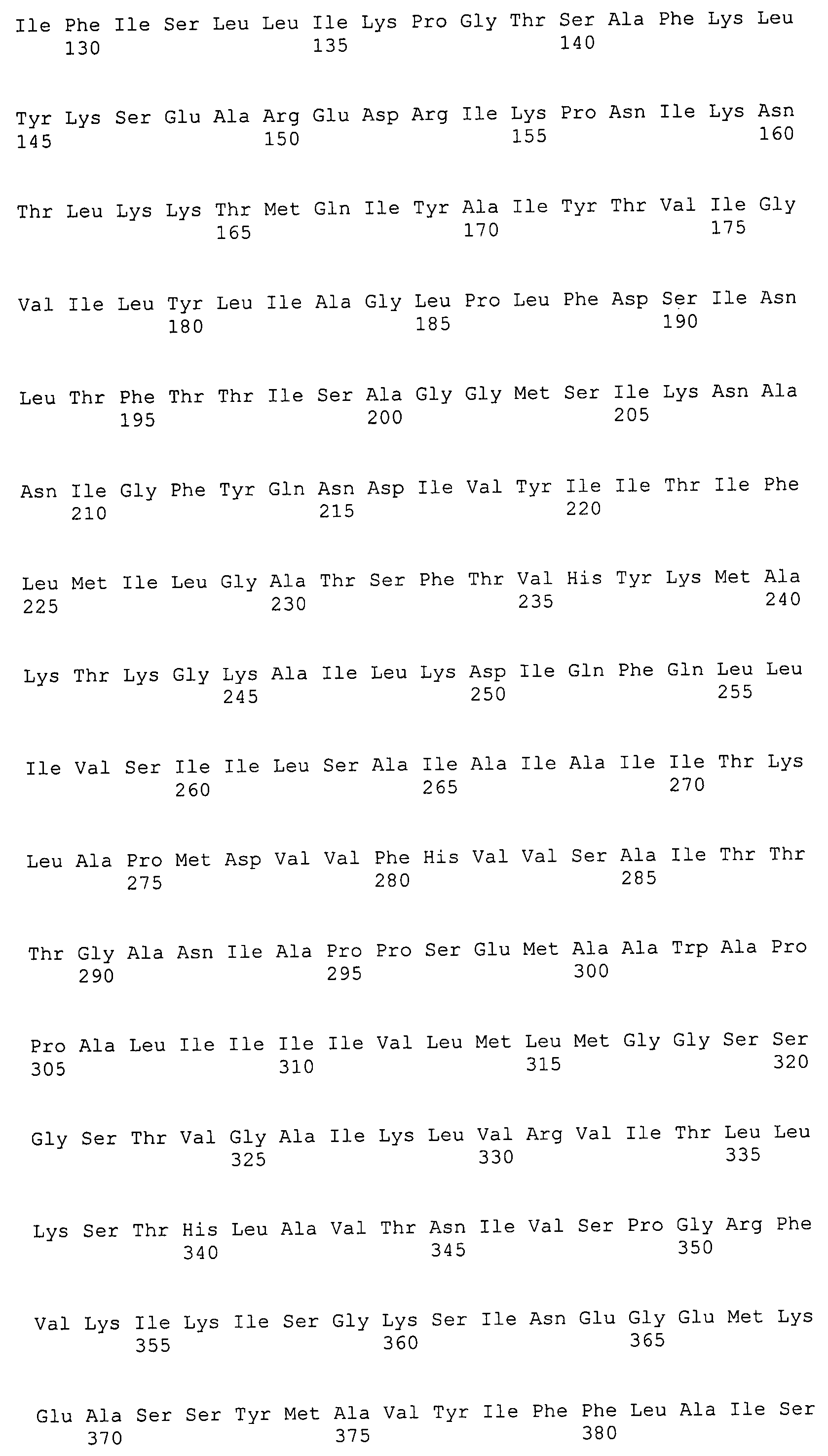
Согласно изобретению конкретно описан выделенный пептид, включающий, например, по меньшей мере фрагмент одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702. В конкретном аспекте этот пептид включает по меньшей мере фрагмент аминокислотной последовательности любой из SEQ ID NO:45-260 и 332-702. В еще одном аспекте пептид включает по меньшей мере фрагмент аминокислотной последовательности любой из SEQ ID NO:10-17. В другом аспекте пептид представляет собой фрагмент, например, содержащий по меньшей мере одну аминокислотную последовательность, включающую внеклеточный домен любой из SEQ ID NO:10-17, 45-260 и 332-702.
Согласно изобретению конкретно описан выделенный полипептид, включающий, например, по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702. В конкретном аспекте полипептид включает аминокислотную последовательность любой из SEQ ID NO:45-260 и 332-702. В еще одном аспекте полипептид включает аминокислотную последовательность любой из SEQ ID NO:10-17. В другом аспекте полипептид представляет собой фрагмент, например, содержащий по меньшей мере одну аминокислотную последовательность, включающую внеклеточный домен любой из SEQ ID NO:10-17, 45-260 и 332-702.
Согласно изобретению дополнительно описан выделенный полинуклеотид, включающий кодирующую последовательность по меньшей мере одного пептида. В одном аспекте полинуклеотид содержит кодирующую последовательность по меньшей мере фрагмента аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702. В конкретном аспекте полинуклеотид содержит кодирующую последовательность по меньшей мере фрагмента любой из SEQ ID NO:45-260 и 332-702. В еще одном аспекте полинуклеотид содержит кодирующую последовательность по меньшей мере фрагмента любой из SEQ ID NO:10-17. В другом аспекте полинуклеотид содержит фрагмент последовательности, кодирующей, например, по меньшей мере одну аминокислотную последовательность, включающую внеклеточный домен любой из SEQ ID NO:10-17, 45-260 и 332-702.
Согласно изобретению дополнительно описан выделенный полинуклеотид, включающий кодирующую последовательность по меньшей мере одного полипептида. В одном аспекте полинуклеотид содержит последовательность, кодирующую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702. В конкретном аспекте полинуклеотид содержит кодирующую последовательность любой из SEQ ID NO:45-260 и 332-702. В еще одном аспекте полинуклеотид содержит кодирующую последовательность для любой из SEQ ID NO:10-17. В другом аспекте полинуклеотид содержит фрагмент последовательности, кодирующей, например, по меньшей мере одну аминокислотную последовательность, включающую внеклеточный домен любой из SEQ ID NO:10-17, 45-260 и 332-702.
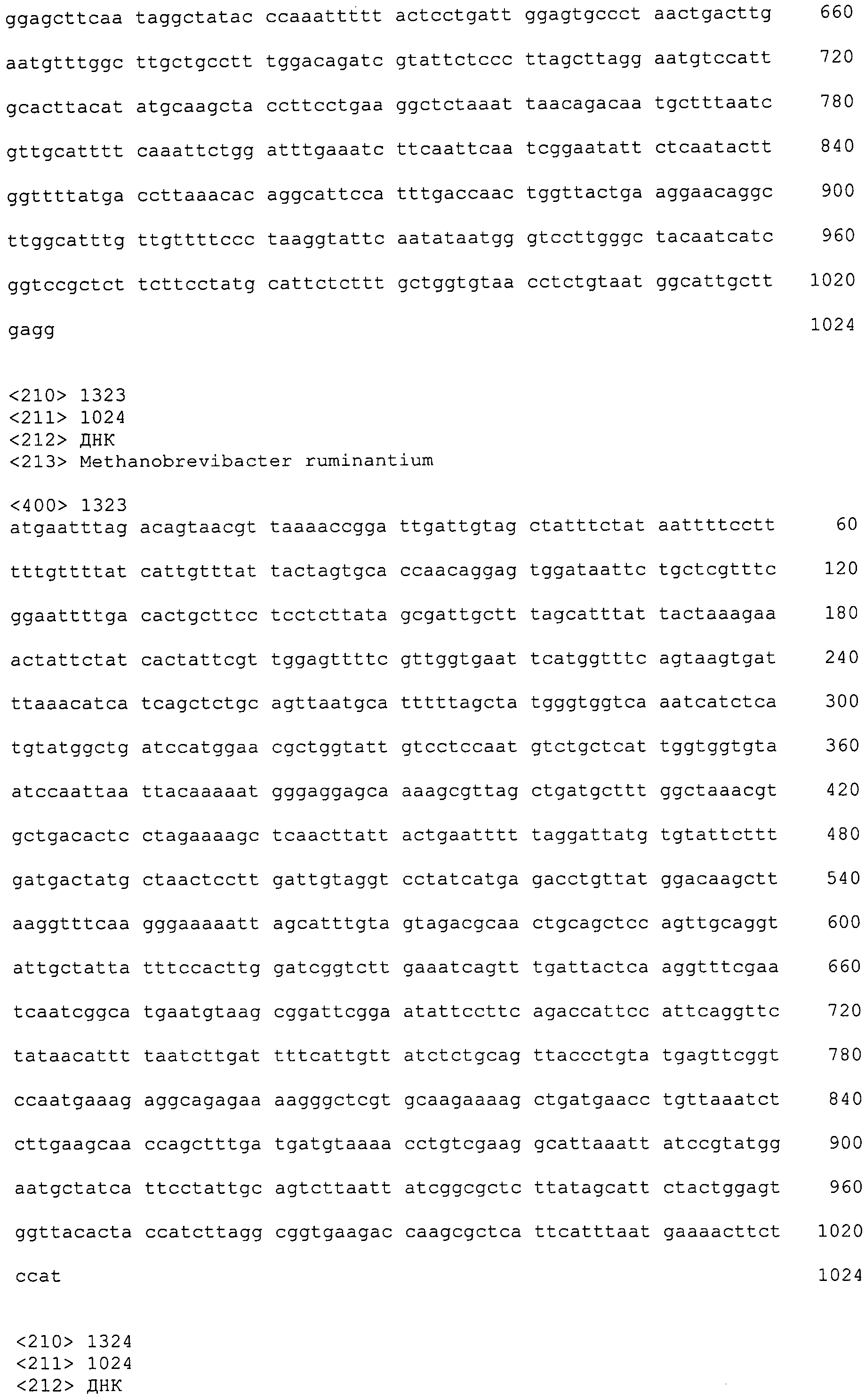
В дополнительном аспекте согласно изобретению описан выделенный полинуклеотид, включающий, например, последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:703-1395. В конкретном аспекте полинуклеотид содержит последовательность нуклеиновой кислоты с SEQ ID NO:703-710. В другом аспекте полинуклеотид представляет собой фрагмент или олигонуклеотид, включающий, например, последовательность нуклеиновой кислоты, включающую внеклеточный домен, кодируемый любой из SEQ ID NO:703-710, 737-931 и 1003-1395. Кроме того, изобретение включает выделенный полинуклеотид или его фрагмент, гибридизуемый с любой из этих последовательностей нуклеиновых кислот с SEQ ID NO:703-1395. Изобретение дополнительно включает выделенный полинуклеотид, включающий комплемент, обратный комплемент, обратную последовательность или их фрагменты любой из этих последовательностей нуклеиновых кислот.
Согласно изобретению описан вектор экспрессии, включающий полинуклеотид по изобретению. В одном аспекте вектор экспрессии содержит последовательность, кодирующую по меньшей мере фрагмент аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702. В конкретном аспекте вектор экспрессии содержит кодирующую последовательность по меньшей мере фрагмента по меньшей мере одной из SEQ ID NO:45-260 и 332-702. В еще одном аспекте вектор экспрессии содержит последовательность, кодирующую по меньшей мере одну аминокислотную последовательность по меньшей мере одной из SEQ ID NO:10-17. В другом аспекте вектор экспрессии содержит последовательность, кодирующую по меньшей мере одну аминокислотную последовательность, включающую внеклеточный домен любой из SEQ ID NO:10-17, 45-260 и 332-702.
Согласно изобретению также описана клетка-хозяин, например микробная клетка-хозяин, включающая по меньшей мере один вектор экспрессии.
Согласно изобретению конкретно описано антитело, направленное к пептиду, полипептиду или полинуклеотиду, как указано в настоящем описании. В некоторых аспектах антитело направлено к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702. В альтернативных аспектах антитело направлено к по меньшей мере фрагменту полипептидной последовательности, выбранной из группы, состоящей из SEQ ID NO:10-17, 45-260 и 332-702. В конкретном аспекте антитело связывается по меньшей мере с фрагментом пептидной последовательности любой из SEQ ID NO:10-17. В еще одном аспекте антитело связывается по меньшей мере с фрагментом полипептидной последовательности любой из SEQ ID NO:45-260 и 332-702. В альтернативном аспекте антитело связывается по меньшей мере с фрагментом пептида или полипептида, включающего внеклеточный домен любой из SEQ ID NO:10-17, 45-260 и 332-702. В другом аспекте антитело включает одну или несколько химер или конъюгатов по меньшей мере с одним клеточным ингибитором, например с соединениями, препятствующими метаногенезу (например, с бромэтансульфокислотой), с антителами и с фрагментами антител, с лизирующими ферментами, с пептид-нуклеиновыми кислотами, с антимикробными пептидами и с другими антибиотиками, как описано подробно в настоящем описании.
Согласно изобретению дополнительно описаны модифицированные пептиды или полипептиды, например по меньшей мере один из SEQ ID NO:1-702, в том числе биологически активные модификации, фрагменты, варианты и производные, описанные в настоящем описании. Также описаны полинуклеотиды, кодирующие эти модифицированные пептиды или полипептиды, а также модификации, фрагменты, варианты и производные раскрытых полинуклеотидов; антитела, полученные с помощью этих модифицированных пептидов, полипептидов или полинуклеотидов; векторы экспрессии, включающие эти полинуклеотиды, и клетки-хозяева, включающие эти векторы. Далее описаны модифицированные антитела, в том числе биологически активные модификации, фрагменты, варианты и производные, описанные в настоящем описании. В отдельных аспектах в композициях и способах по изобретению используют эти модифицированные пептиды, полипептиды, полинуклеотиды, антитела либо соответствующие векторы экспрессии или клетки-хозяева.
Согласно изобретению описана композиция, включающая выделенный пептид или полипептид, например по меньшей мере один из SEQ ID NO:1-702. Также описана композиция, включающая выделенный полинуклеотид, например по меньшей мере один из SEQ ID NO:703-1395. Согласно изобретению дополнительно описана композиция, включающая антитело, например, направленное к последовательности пептидов, полипептидов или полинуклеотидов, раскрытых в настоящем описании. Далее описана композиция, которая включает вектор экспрессии или клетку-хозяина, включающую вектор экспрессии, в соответствии с изобретением. Эта композиция может включать любые из биологически активных модификаций, фрагментов, вариантов и производных, описанных в настоящем описании. Композиции могут включать по меньшей мере один клеточный ингибитор (например, в виде химеры или конъюгата) и могут быть составлены, например, в виде фармацевтических композиций, в частности в виде композиций вакцин.
Согласно изобретению также описана композиция по изобретению как составляющая набора для таргетирования и/или подавления микробных клеток, особенно клеток-метанопродуцентов, в соответствии с раскрытыми способами. Наборы содержат: a) по меньшей мере одну композицию, как описано выше; и b) факультативно, инструкцию по использованию, например по таргетированию клеток или по подавлению клеточного роста или репликации у метанопродуцентов или других микробов.
Согласно изобретению также описан способ получения пептида или полипептида, например по меньшей мере фрагмента любой из SEQ ID NO:1-702, включающий: a) культивирование вектора экспрессии или клетки-хозяина, включающей вектор экспрессии, который содержит по меньшей мере часть последовательности, кодирующей по меньшей мере один пептид или полипептид, в условиях, пригодных для экспрессии данного пептида или полипептида; и b) извлечение пептида или полипептида из культуры. В конкретных аспектах пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702 или их модифицированных последовательностей.
Согласно изобретению также описан способ получения антитела, например, направленного по меньшей мере к фрагменту любой из SEQ ID NO:1-702, включающий: a) культивирование вектора экспрессии или клетки-хозяина, включающей вектор экспрессии, который содержит по меньшей мере часть последовательности, кодирующей по меньшей мере одно антитело или фрагмент антитела, в условиях, пригодных для экспрессии этого антитела или фрагмента антитела; и b) извлечение этой аминокислотной последовательности из культуры. В конкретных аспектах антитело или фрагмент антитела направлен по меньшей мере к одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702 или их модифицированных последовательностей. В альтернативном аспекте антитело получают иммунизацией животного-хозяина, как об этом подробно описано в настоящем описании.
Согласно изобретению дополнительно описан способ получения антитела, например, направленного по меньшей мере к фрагменту любой из SEQ ID NO:1-702, которое включает химеру или конъюгат по меньшей мере с одним клеточным ингибитором. Такой способ включает: a) культивирование вектора экспрессии или клетки-хозяина, включающей вектор экспрессии, который содержит последовательность, кодирующую по меньшей мере одно антитело или фрагмент антитела, в условиях, пригодных для экспрессии этого антитела или фрагмента антитела; b) получение химеры или конъюгата с данным антителом или фрагментом антитела (например, путем экспрессии фьюжн-последовательности или химической конъюгации с данным клеточным ингибитором); и c) извлечение химеры или конъюгата.
В конкретных аспектах антитело направлено по меньшей мере к одному фрагменту любой из SEQ ID NO:1-702 или их модифицированных последовательностей. В дальнейших аспектах ингибитор выбирают из соединений, препятствующих метаногенезу (например, бромэтансульфокислота), из антител и из фрагментов антител, из лизирующих ферментов, из пептид-нуклеиновых кислот, из антимикробных пептидов и из других антибиотиков, как описано подробно в настоящем описании. В альтернативном аспекте антитело получают иммунизацией животного-хозяина, а затем конъюгацией, как это подробно описано в настоящем описании.
Кроме того, согласно изобретению описан способ подавления (например, ингибирования роста или репликации) микробной клетки, в частности клетки-метанопродуцента, включающий: введение клетки в контакт с антителом или фрагментом антитела, например, направленного по меньшей мере к фрагменту любой из SEQ ID NO:1-702, либо с химерой или конъюгатом антитела либо с любым модифицированным антителом.
В качестве еще одного способа клетку подавляли введением композиции вакцины, как подробно описано в настоящем описании.
Согласно изобретению далее описан способ подавления (например, ингибирования роста или репликации) микробной клетки, в частности клетки-метанопродуцента, включающий: a) факультативно, получение или выделение по меньшей мере одного антитела, как указано в настоящем описании; и b) введение клетки в контакт с антителом. В конкретном аспекте антитело направлено по меньшей мере к фрагменту любой из SEQ ID NO:1-702 либо их модифицированным последовательностям. В некоторых аспектах антитело дополнительно включает по меньшей мере один клеточный ингибитор, присоединенный, например, в виде химеры или конъюгата. В других аспектах антитело вводят пациенту в виде композиции, например в виде композиции вакцины.
Кроме того, согласно изобретению описан способ подавления (например, ингибирования роста или репликации) микробной клетки, в частности клетки-метанопродуцента, включающий: a) факультативно, получение или выделение по меньшей мере одного пептида или полипептида, как указано в настоящем описании; и b) введение пептида или полипептида пациенту для индукции на них иммунного ответа. В конкретном аспекте пептид или полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702 или их модифицированных последовательностей. В других аспектах пептид или полипептид вводят пациенту в виде композиции, например в виде композиции вакцины.
Согласно изобретению, кроме того, описан способ детекции и/или измерения концентраций полипептидов, в частности полипептида на поверхности клетки, либо соответствующих пептидов или полинуклеотидов, включающий: 1) введение образца от пациента в контакт с антителом, направленным к этому полипептиду (например, по меньшей мере к фрагменту любой из SEQ ID NO:1-702 или их модифицированных последовательностей), или с соответствующим пептидом или полинуклеотидом (например, по меньшей мере с одним фрагментом из SEQ ID NO:703-1395 или с их модифицированными последовательностями); и 2) определение наличия или концентрации образовавшегося комплекса антител с соответствующим полипептидом, пептидом или полинуклеотидом в образце. Такие способы также могут быть использованы для детекции и/или измерения титров микробных клеток, в частности клеток-метанопродуцентов.
Согласно изобретению также описан способ детекции и/или измерения концентраций полинуклеотидов, в частности полинуклеотида, кодирующего компонент клеточной поверхности, включающий: 1) введение образца от пациента в контакт с комплементарным полинуклеотидом (например, с последовательностью, комплементарной по меньшей мере фрагменту любой из SEQ ID NO:703-1395 или их модифицированных последовательностей); и 2) определение наличия или концентрации гибридизационного комплекса, образовавшегося с полинуклеотидом в образце. Такие способы также могут быть использованы для детекции и/или измерения титров микробных клеток, в частности клеток-метанопродуцентов.
В конкретных аспектах в способах по изобретению используют компоненты in vivo или in vitro экспрессии. В других аспектах в этих способах используют пептиды, полипептиды, полинуклеотиды или антитела, вырабатываемые рекомбинантными, синтетическими или полусинтетическими средствами либо эндогенными средствами.
Иные аспекты и варианты осуществления по изобретению описаны ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Это изобретение описано со ссылкой на конкретные варианты осуществления такового и со ссылкой на фигуры.
ФИГУРЫ 1A-1C. Сравнение геномов Methanobacteriales (фиг. 1A); статистика генома M. ruminantium (фиг. 1B); гены, предположительно участвующие в метаногенезе видов Methanobacteriales (фиг. 1C).
ФИГУРА 2. Схема вакцинации.
ФИГУРА 3. Гуморальные иммунные ответы овец на вакцинацию препаратами клеточной стенки M. ruminantium и пептидами, разработанными против M. ruminantiummtr, а также белками клеточной поверхности.
ФИГУРА 4. Последовательности пептидов, использованные для производства антител.
ФИГУРЫ 5A-5B. Открытые рамки считывания, отобранные для производства антител: нуклеотидные последовательности (фиг. 5A); аминокислотные последовательности (фиг. 5B).
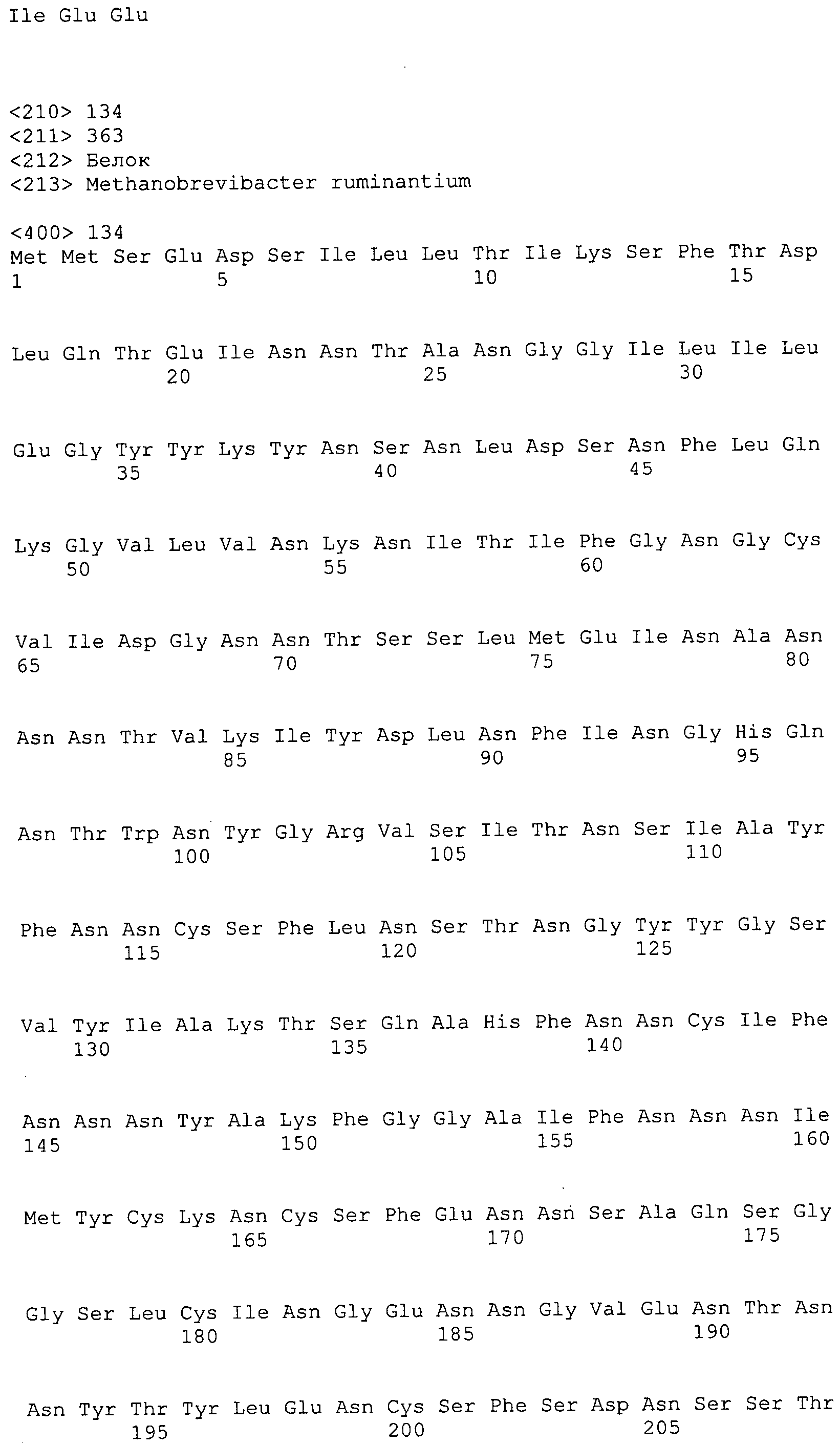
ФИГУРЫ 6A-6C. Открытые рамки считывания, кодирующие ферменты метаболического пути метаногенеза, идентифицированные у M. ruminantium: аннотирование (фиг. 6A); нуклеотидные последовательности (фиг. 6B); аминокислотные последовательности (фиг. 6C).
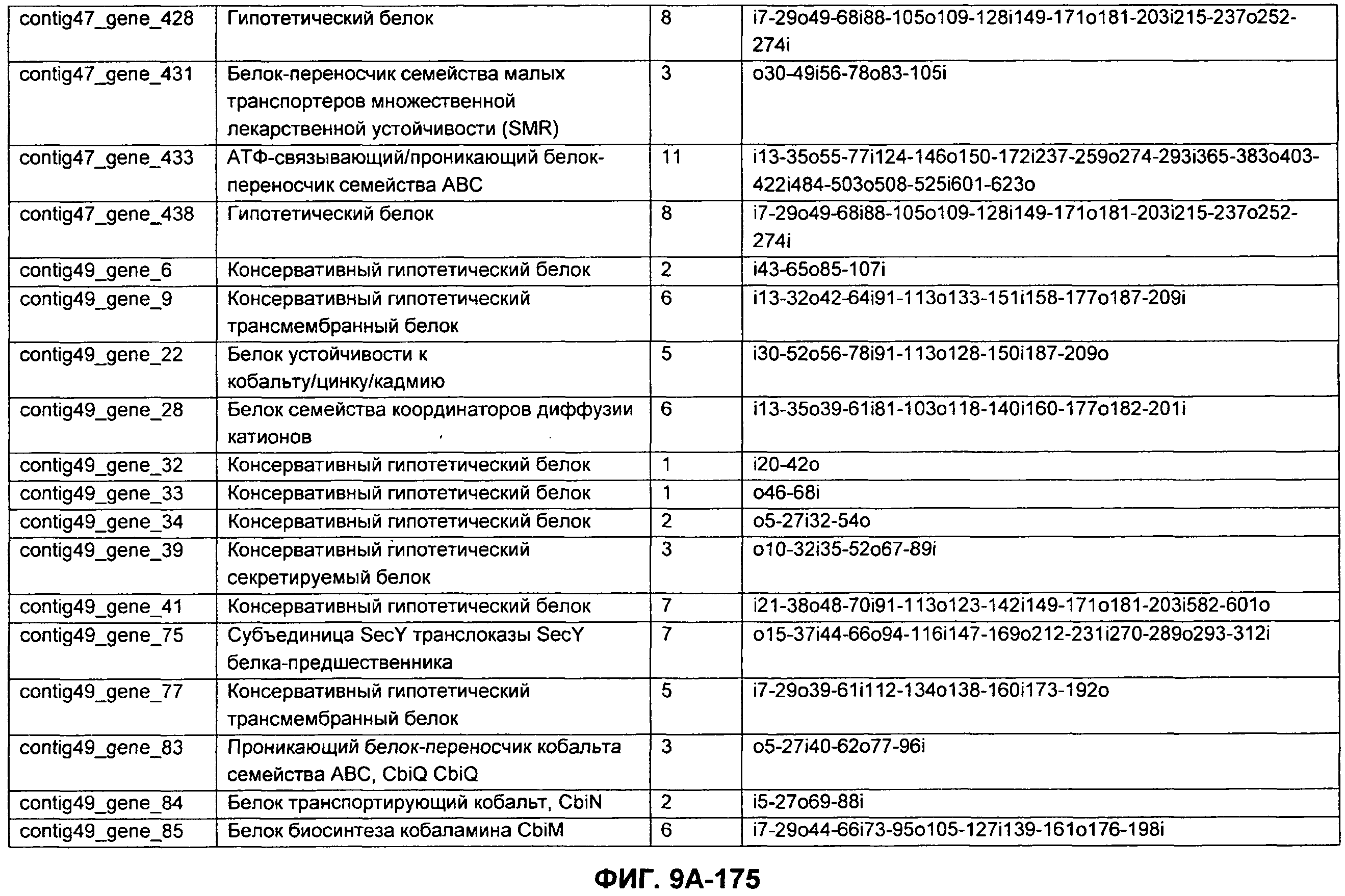
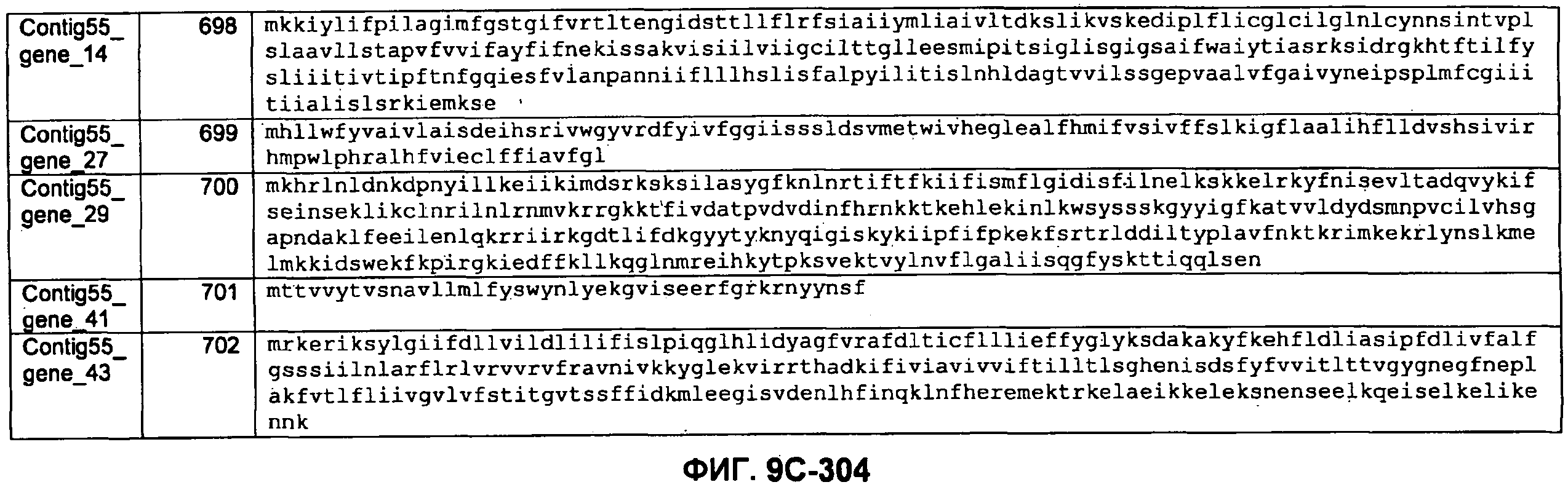
ФИГУРЫ 7A-7C. Открытые рамки считывания для белков клеточной поверхности, идентифицированные у M. ruminantium: аннотирование (фиг. 7A); нуклеотидные последовательности (фиг. 7B); аминокислотные последовательности (фиг. 7C).
ФИГУРЫ 8A-8C. Открытые рамки считывания, кодирующие биосинтез экзополисахаридов, идентифицированные у M. ruminantium: аннотирование (фиг. 8A); нуклеотидные последовательности (фиг. 8B); аминокислотные последовательности (фиг. 8C).
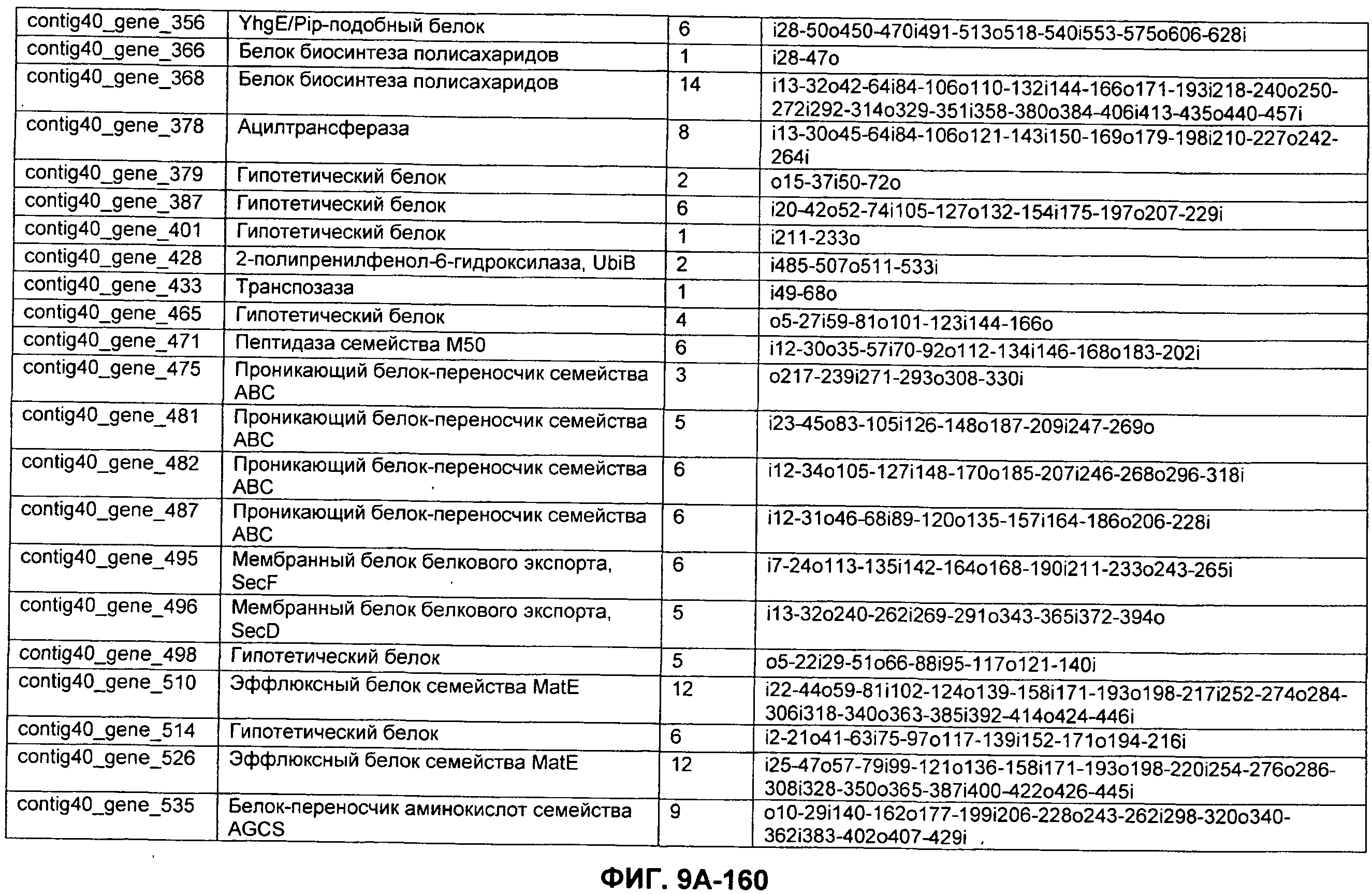
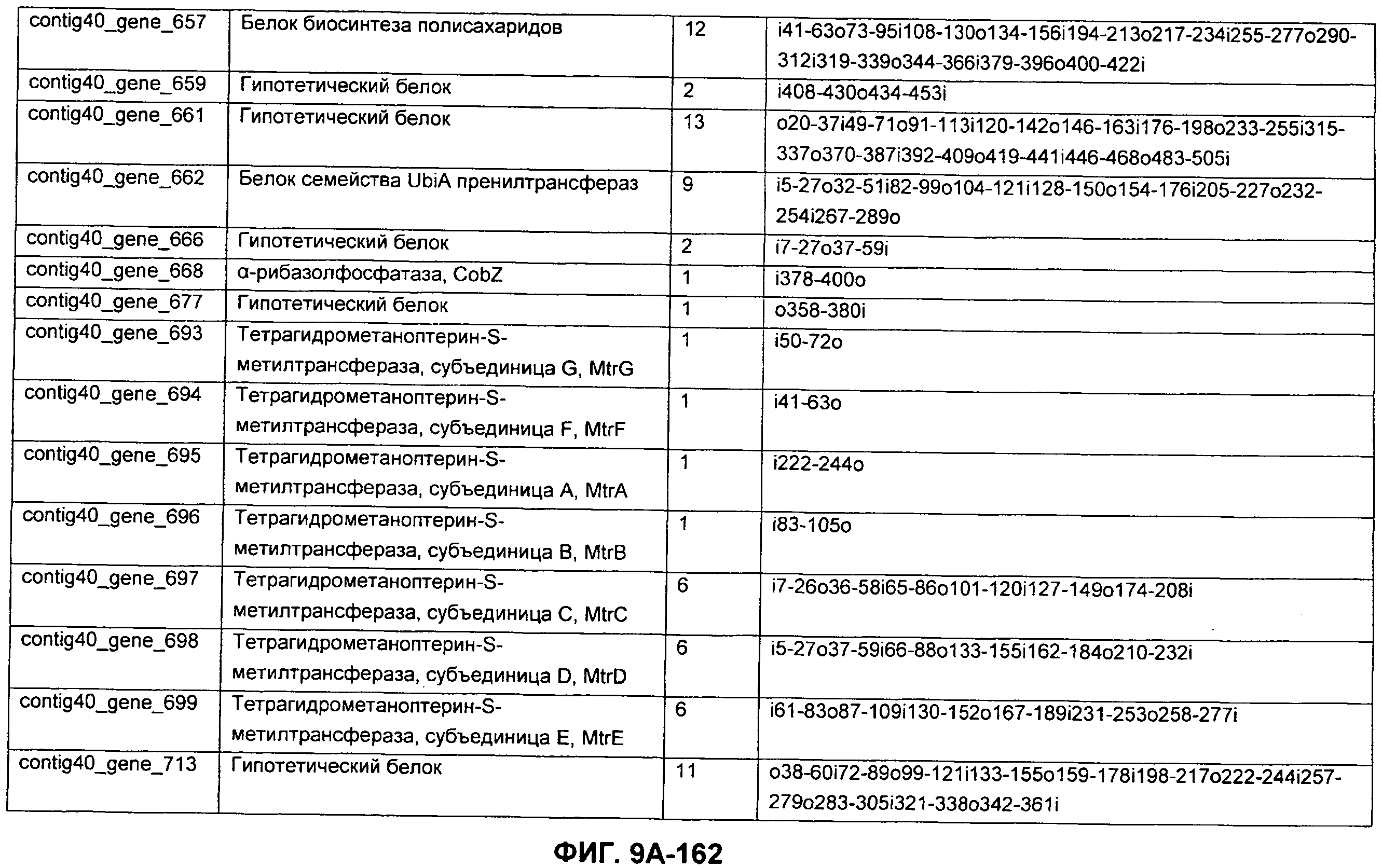
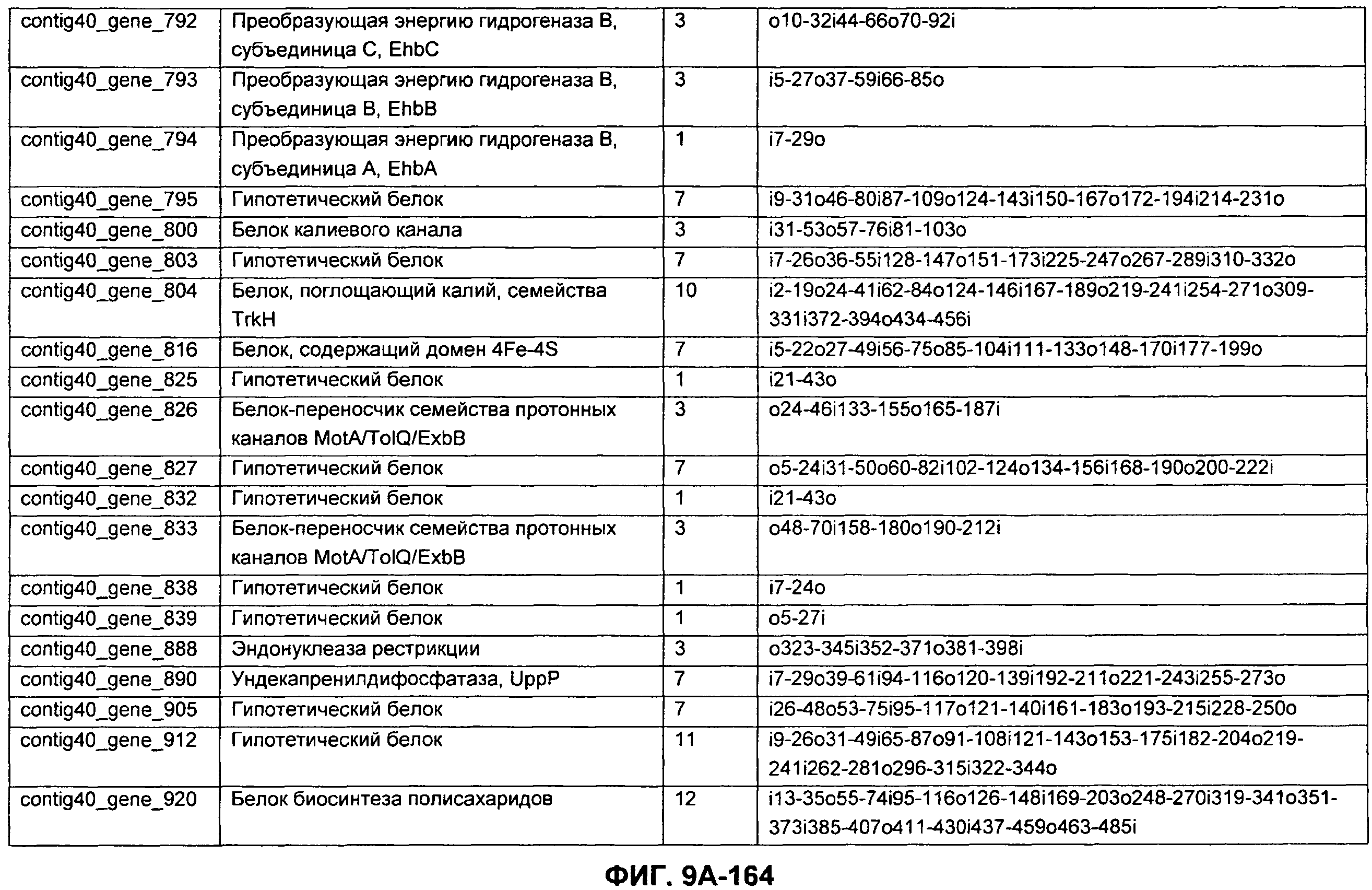
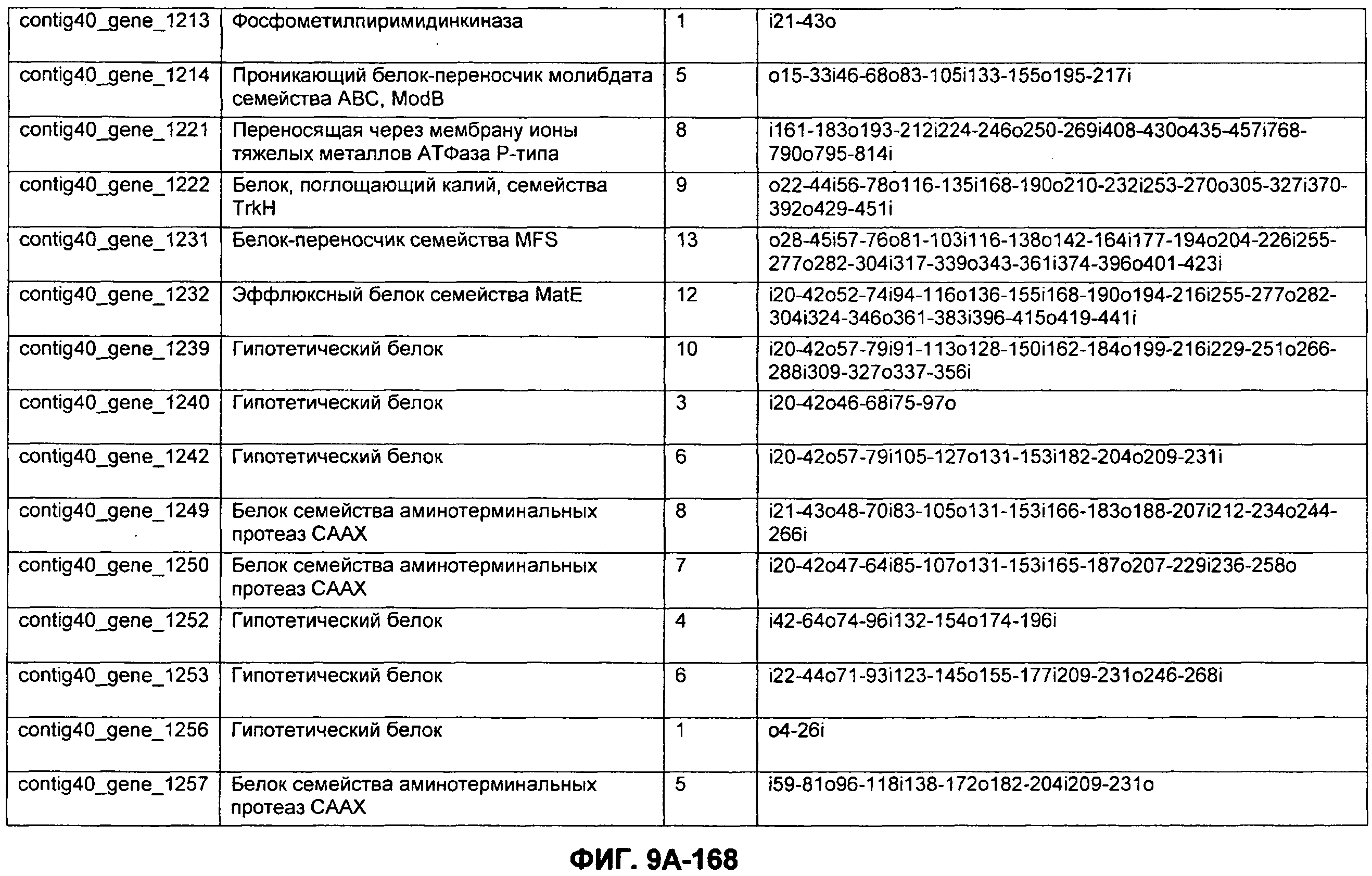
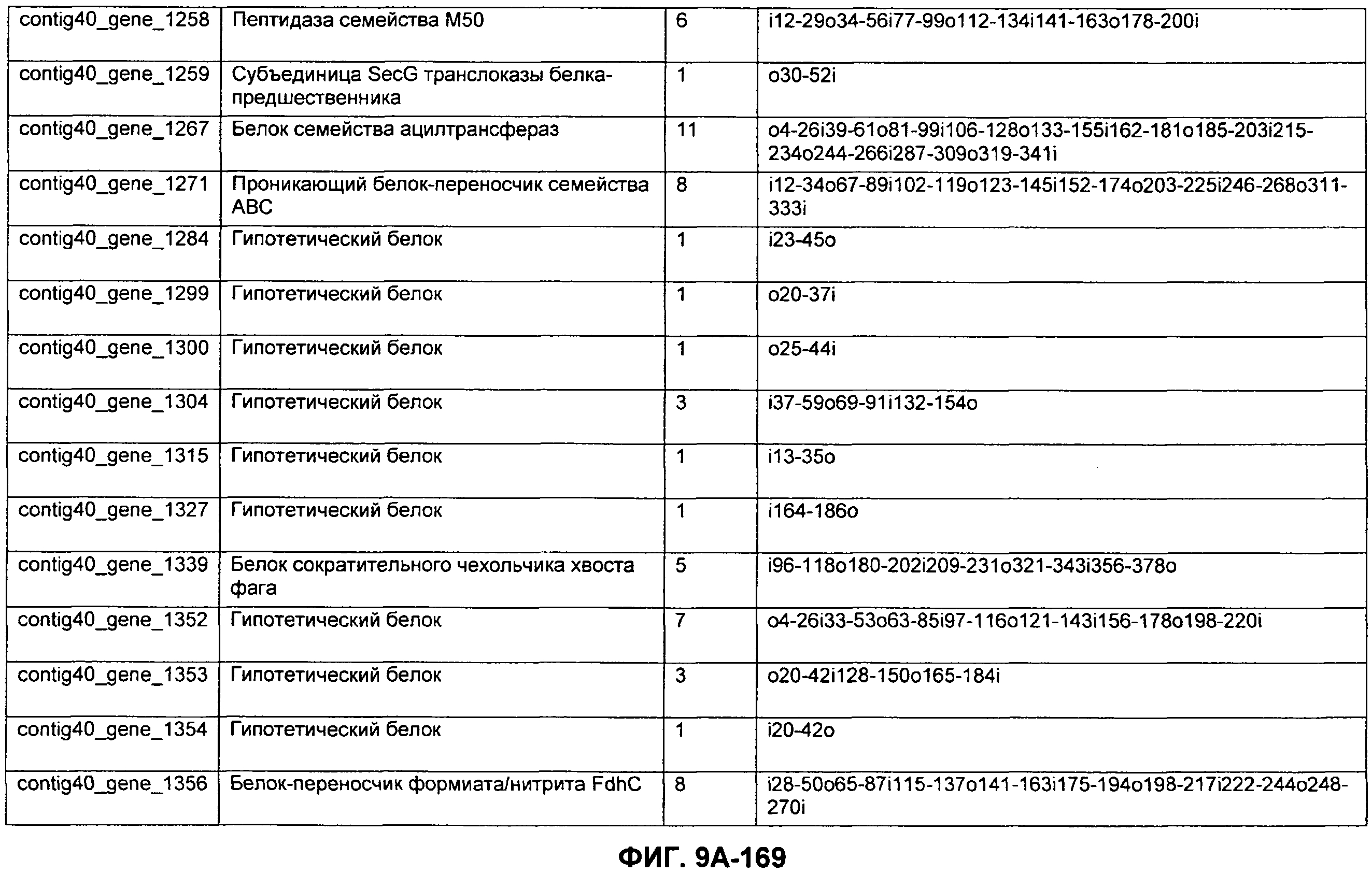
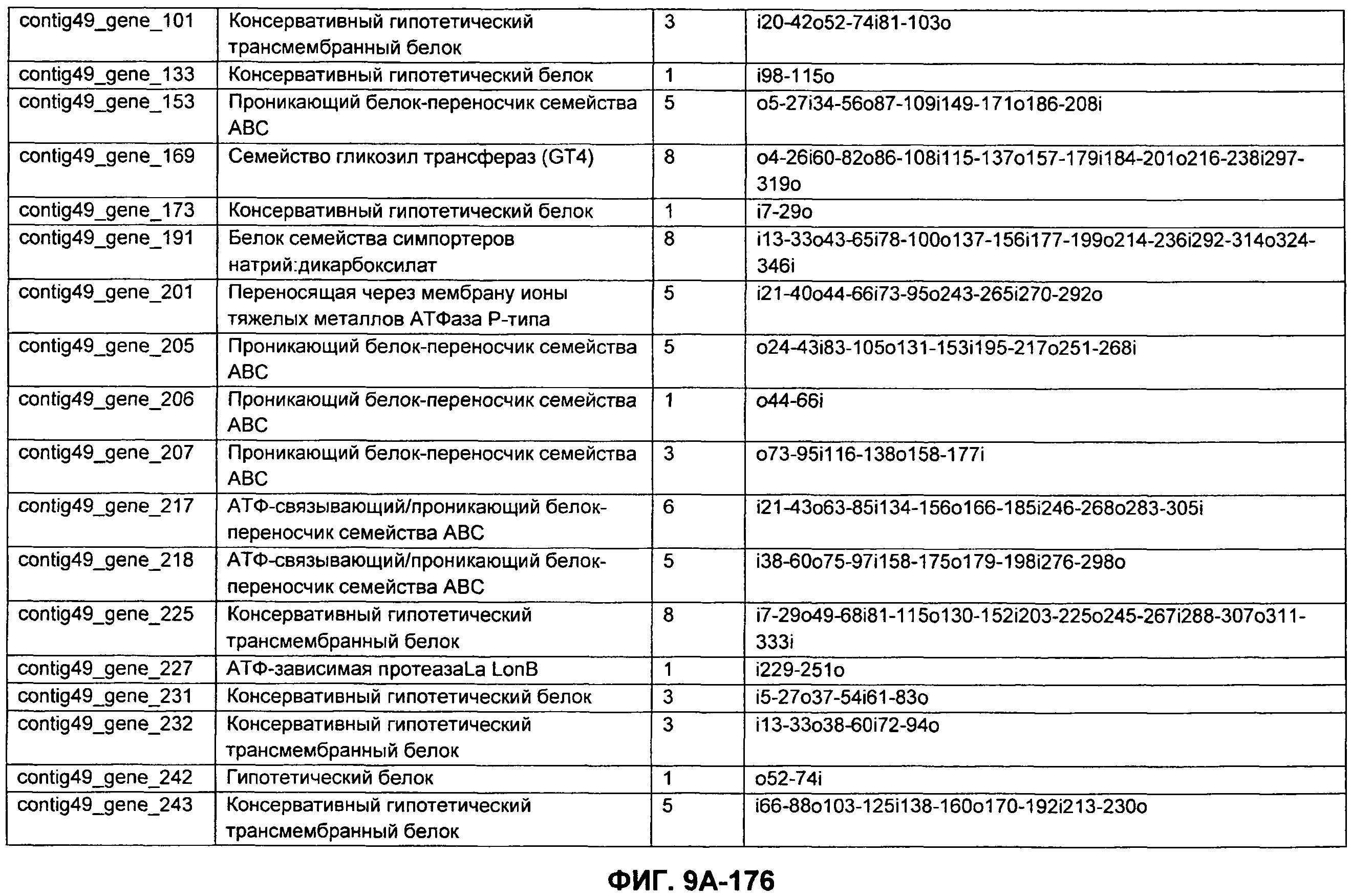
ФИГУРЫ 9A-9C. Открытые рамки считывания, включающие трансмембранные домены, идентифицированные у M. ruminantium: аннотирование (фиг. 9A); нуклеотидные последовательности (фиг. 9B); аминокислотные последовательности (фиг. 9C).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин «антитела» следует понимать в самом широком смысле, и он предположительно включает интактные моноклональные антитела и поликлональные антитела. Он также предположительно охватывает фрагменты и производные антител до той длины, пока они еще проявляют желательную биологическую активность. Антитела включают молекулы иммуноглобулина и иммунологически активные части молекул иммуноглобулинов (Ig), то есть молекулы, содержащие антигенсвязывающий сайт, который специфически связывается (иммунохимически реагирует) с антигеном. Они включают, не исчерпываясь перечисленными, поликлональные, моноклональные, химерные, одноцепочечные, Fc, Fab, Fab' и Fab2 фрагменты, а также библиотеку экспрессируемых Fab.
Молекулы антител относятся к какому-либо из классов: IgG, IgM, IgA, IgE и IgD, которые отличаются друг от друга по природе тяжелой цепи, присутствующей в молекуле. Они включают подклассы, например, такие как IgG1, IgG2 и другие. Легкой цепью могут быть каппа-цепь или лямбда-цепь. Ссылка в настоящем описании на антитела включает ссылку на все классы, подклассы и типы. Также включены химерные антитела, например моноклональные антитела или их фрагменты, которые специфичны для более чем одного источника, например для одной или более последовательностей мыши, человека или жвачных животных. Дополнительно включены «верблюжьи» антитела (одноцепочечные миниантитела семейства верблюдовых) или нанотела. Понятно, что каждая ссылка на «антитела» или любой похожий термин в настоящем описании включает интактные антитела, а также любые фрагменты, модификации, производные или их варианты.
«Видоизмененные» последовательности нуклеиновых кислот, кодирующие пептиды, полипептиды или антитела, используемые в настоящем описании, включают указанные последовательности с делециями, вставками или заменами различных нуклеотидов, что дает в результате полинуклеотид, который кодирует те же или функционально эквивалентные последовательности. Кодируемый пептид, полипептид или антитело может также быть «видоизменен» и содержать такие делеции, вставки или замены аминокислотных остатков, которые вызывают «молчащие» изменения и в результате дают функционально эквивалентные последовательности. Умышленные аминокислотные замены могут быть проделаны на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков до тех пор, пока сохраняется биологическая активность (например, ассоциация клеток, ассоциация мембран) или иммуногенная/иммунологическая активность. Например, отрицательно заряженные аминокислоты могут включать аспарагиновую и глутаминовую кислоты, положительно заряженные аминокислоты могут включать лизин и аргинин, а аминокислоты с незаряженными полярными концевыми группами, имеющие сходные значения гидрофильности, могут включать лейцин, изолейцин и валин, глицин и аланин, аспарагин и глутамин, серин и треонин, также фенилаланин и тирозин.
«Аминокислотной последовательностью», используемой в настоящем описании, называется последовательность олигопептида, пептида, полипептида, белка или антитела, и любого его фрагмента, и любых молекул, имеющих природное, рекомбинантное, синтетическое или полусинтетическое происхождение. Последовательности по изобретению содержат по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 150, 200, 250 аминокислот, предпочтительно по меньшей мере от 5 до 10, от 10 до 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 100, от 100 до 150, от 150 до 200 или от 200 до 250 аминокислот. Последовательности сохраняют биологическую активность (например, влияние на рост клеток и/или пролиферацию) или иммуногенную/иммунологическую активность аминокислотной последовательности. «Аминокислотная последовательность» и любые похожие термины не исчерпываются только полной, нативной аминокислотной последовательностью, связанной с полноразмерной молекулой, но также включают и любые их фрагменты, модификации, производные и варианты.
«Амплификацией», используемой в настоящем описании, называется производство дополнительных копий последовательности нуклеиновой кислоты, и ее, как правило, проводят с помощью технических средств полимеразной цепной реакции (ПЦР), хорошо известных в данной области (Dieffenbach, C.W. and G. S. Dveksler (1995) PCR Primer, a Laboratory Manual, Cold Spring Harbor Press, Plainview, NY).
Терминами «биологически активный» или «функциональный», используемыми в настоящем описании, называется пептид или полипептид, сохраняющий одну или несколько структурных, иммуногенных или биохимических функций (например, ассоциация клеток, ассоциация мембран) последовательности природного происхождения.
Терминами «клеточный ингибитор» или «ингибитор», используемыми в настоящем описании, называются средства, которые уменьшают или блокируют рост или репликацию микробных клеток, особенно клеток-метанопродуцентов. Клеточный ингибитор может действовать так, чтобы уменьшить или блокировать, например, клеточное деление. Ингибитор может уменьшить или блокировать, например, синтез ДНК, синтез РНК, синтез белка или посттрансляционные модификации. Ингибитор может также уменьшить или блокировать активность ферментов, участвующих в метаболическом пути метаногенеза. Ингибитор может также таргетировать клетку для распознавания компонентами иммунной системы. Подавление клетки также включает убийство клеток и клеточную смерть, например, в результате лизиса, апоптоза, некроза и т.д. Полезные ингибиторы включают, не исчерпываясь перечисленными, соединения, препятствующие метаногенезу (например, бромэтансульфокислота), антитела и фрагменты антител, лизирующие ферменты, пептид-нуклеиновые кислоты, антимикробные пептиды и другие антибиотики, как подробно описано в настоящем описании.
Терминами «комплементарный» или «комплементарность», используемыми в настоящем описании, называется нормальное связывание полинуклеотидов в щадящих солевых и температурных условиях путем спаривания оснований. Для последовательности A-G-T комплементарной последовательностью является T-C-A, обратный комплемент представляет собой A-C-T, и обратной последовательностью является T-G-A. Комплементарность между двумя одноцепочечными молекулами может быть частичной, при которой связываются лишь некоторые из нуклеиновых кислот, или она может быть полной, когда существует полная комплементарность между одноцепочечными молекулами. Степень комплементарности между цепями нуклеиновых кислот оказывает существенное влияние на эффективность и прочность гибридизации между цепями нуклеиновых кислот. Это имеет особое значение для реакций амплификации, которые зависят от связывания между цепями нуклеиновых кислот, а также для разработки и применения молекул пептид-нуклеиновых кислот (PNA).
Термином «производное», используемым в настоящем описании, называется химическая модификация нуклеиновой кислоты, кодирующей пептид, полипептид или антитело, либо нуклеиновой кислоты, комплементарной ей. Такие модификации включают, например, замещение водорода на алкил, ацил или аминогруппу. В предпочтительных аспектах производные нуклеиновых кислот кодируют пептид, полипептид или антитело, которые сохраняют биологическую или иммуногенную/иммунологическую активность природной молекулы. Производные пептида, полипептида или антитела представляют собой то, что модифицировано путем гликозилирования, пэгилирования или любого аналогичного процесса, который сохраняет одну или несколько биологических функций (например, ассоциация клеток, ассоциация мембран) или иммуногенную/иммунологическую активность последовательности, из которой они получены.
Термином «гомология», используемым в настоящем описании, называется степень комплементарности. Существует частичная гомология (то есть менее 100% идентичности) или полная гомология (то есть 100% идентичности). Частично комплементарная последовательность, которая по меньшей мере частично удерживает идентичную последовательность от гибридизации с целевой нуклеиновой кислотой, называется функциональным термином «практически гомологичный». Подавление гибридизации полностью комплементарной последовательности с целевой последовательностью может быть изучено с помощью гибридизационного анализа (например, саузерн-блоттинга или нозерн-блоттинга, гибридизации в растворе и т.п.) в условиях низкой строгости. Практически гомологичная последовательность или гибридизационный зонд будет конкурировать и подавлять связывание полностью гомологичной последовательности с целевой последовательностью в условиях низкой строгости. Это не означает, что условия низкой строгости таковы, что допускается неспецифическое связывание; условия низкой строгости требуют, чтобы связывание двух последовательностей друг с другом было специфическим (т.е. избирательным) взаимодействием.
Термином «гибридизация», используемым в настоящем описании, называется любой процесс, с помощью которого цепь нуклеиновой кислоты связывается с комплементарной цепью посредством спаривания оснований.
«Вставкой» или «добавлением», используемым в настоящем описании, называется изменение аминокислотной или нуклеотидной последовательности в результате добавления одного или нескольких аминокислотных остатков или нуклеотидов соответственно по сравнению с молекулой природного происхождения.
«Метанопродуцентами», используемыми в настоящем описании, называются микробы, которые производят газообразный метан, включающие Methanobrevibacter, Methanothermobacter, Methanomicrobium, Methanobacterium и Methanosarcina. Конкретные метанопродуценты включают, не исчерпываясь перечисленными, Methanobrevibacterruminantium (то есть штамм M1 или штамм DSM1093), Methanobrevibactersmithii, Methanobrevibacteracididurans, Methanobrevibacterthaueri, Methanobacterium bryantii, Methanobacterium formicicum, Methanothermobacter marburgensis, Methanothermvobacter wolfeii, Methanosphaera stadtmanae, Methanomicrobium mobile, Methanosarcina barkeri, Methanosarcina mazei, Methanococcoides burtonii и Methanolobus taylorii. Все роды и виды метанопродуцентов охватываются этим термином.
«Микробными» клетками, используемыми в настоящем описании, называются клетки микроорганизмов природного происхождения или генетически измененные, включая архебактерии, такие как метанопродуценты, галофилы и термоацидофилы, и эубактерии, такие как цианобактерии, спирохеты, протеобактерии, а также грамположительные и грамотрицательные бактерии.
Термином «модифицированный» называются видоизмененные последовательности и фрагменты последовательностей, варианты и производные, как описано в настоящем описании.
«Последовательностью нуклеиновых кислот» или «нуклеотидной последовательностью», используемыми в настоящем описании, называется последовательность полинуклеотида, олигонуклеотида или их фрагментов, а также ДНК или РНК природного, рекомбинантного, синтетического или полусинтетического происхождения, которые могут быть одно- или двухцепочечными и могут представлять смысловые или антисмысловые цепи, кодирующие и некодирующие области. Последовательности по изобретению предпочтительно включают по меньшей мере 12, 15, 30, 45, 60, 75, 90, 105, 120, 135, 150, 300, 450, 600, 750 нуклеотидов, предпочтительно по меньшей мере от 15 до 30, от 30 до 60, от 60 до 90, от 90 до 120, от 120 до 150, от 150 до 300, от 300 до 450, от 450 до 600, или от 600 до 750 нуклеотидов, или по меньшей мере 1000 нуклеотидов, или по меньшей мере 1500 нуклеотидов. Понятно, что каждая ссылка на «последовательность нуклеиновых кислот» или «нуклеотидную последовательность» в настоящем описании будет включать нативную, полноразмерную последовательность, а также любые комплементы, фрагменты, модификации, производные или их варианты.
Термином «олигонуклеотид» называется последовательность нуклеиновой кислоты длиной по меньшей мере 6, 8, 10, 12, 15, 18, 21, 25, 27, 30, или 36 нуклеотидов, или по меньшей мере от 12 до 36 нуклеотидов, или по меньшей мере от 15 до 30 нуклеотидов, которая может быть использована при ПЦР амплификации, секвенировании или гибридизационных анализах. Используемый в настоящем описании термин «олигонуклеотид» практически эквивалентен терминам «амплимеры», «праймеры», «олигомеры» и «зонды», как обычно формулируется в данной области.
Термином «полинуклеотид», использован ли он в единственном или множественном числе, как правило, называется какая-либо последовательность нуклеиновых кислот, например какой-либо полирибонуклеотид или полидезоксирибонуклеотид, которая может являться немодифицированной РНК или ДНК либо модифицированной РНК или ДНК. Эта последовательность включает, помимо прочего, одно- и двухцепочечные ДНК, ДНК, включающую одно- и двухцепочечные области, одно- и двухцепочечные РНК и РНК, включающую одно- и двухцепочечные области, гибридные молекулы ДНК и РНК, которые могут быть одноцепочечными или, что более типично, двухцепочечными или включать одно- и двухцепочечные области. Также сюда включаются трехцепочечные области, включающие РНК или ДНК или как ДНК, так и РНК. Специально включенными являются мРНК, кДНК и геномные ДНК, а также любые их фрагменты. Этот термин включает ДНК и РНК, которые содержат одно или несколько модифицированных оснований, таких как меченные тритием основания или минорные основания, такие как инозин. Данные полинуклеотиды по изобретению могут включать кодирующие или некодирующие последовательности, либо смысловые или антисмысловые последовательности, либо интерферирующие РНК, например малые интерферирующие РНК. Понятно, что каждая ссылка на «полинуклеотид» или аналогичный термин в настоящем описании будет включать полноразмерные последовательности, так же как и любые комплементы, фрагменты, модификации, производные или их варианты.
«Пептидом» и «полипептидом», используемыми в настоящем описании, называются выделенные пептиды или полипептиды по изобретению, полученные из любого вида, желательно микроорганизмов, из любого источника, будь то природного, синтетического, полусинтетического или рекомбинантного происхождения. В частности, пептид или полипептид по изобретению может быть получен из клеток метанопродуцентов, таких как клетки Methanobrevibacter, в частности M. ruminantium, или клетки M. smithii. Для рекомбинантного производства пептид или полипептид по изобретению может быть получен из микробных или эукариотических клеток, например, таких как Escherichia, Streptomyces, Bacillus, Salmonella, дрожжи, клеток насекомых, таких как дрозофилы, клеток животных, таких как клетки COS и СНО, или клеток растений. Понятно, что каждая ссылка на «пептид» или «полипептид» в настоящем описании будет включать полноразмерную последовательность, так же как и любые фрагменты, модификации, производные или их варианты.
«Пептид-нуклеиновой кислотой» или «PNA», используемой в настоящем описании, называется антисмысловая молекула или антигенное средство, которые включают основания, связанные через пептидный остов.
Термином «жвачные», используемым в настоящем описании, называются животные, у которых есть рубец в качестве особого рода пищеварительного органа. Жвачные включают, не исчерпываясь перечисленными, крупный рогатый скот, овец, коз, буйволов, лосей, антилоп, карибу и оленей.
Терминами «строгие условия» или «строгость», используемыми в настоящем описании, называются условия для гибридизации, обусловленные нуклеиновой кислотой, солью и температурой. Эти условия хорошо известны в данной области и могут быть изменены в целях выявления и детекции идентичных или родственных им полинуклеотидных последовательностей. См., например, Sambrook, J. et al. (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, и Ausubel, F. M. et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY. Многочисленные соответствующие условия, охватывающие либо низкую, либо высокую строгость, зависят от таких факторов, как длина и особенность последовательности (ДНК, РНК, нуклеотидный состав), природа целевой молекулы (ДНК, РНК, нуклеотидный состав), окружающие условия (в растворе или иммобилизованные на твердой подложке), концентрации солей и других компонентов (например, формамида, декстран сульфата и/или полиэтиленгликоля) и температура реакции (например, в диапазоне от примерно на 5°C ниже температуры плавления зонда до около 20°C-25°C ниже температуры плавления). Один или несколько факторов могут быть изменены для создания условий либо низкой, либо высокой строгости, отличных, но эквивалентных перечисленным выше условиям.
Термин «субъект» включает людей и отличных от человека животных. Отличные от человека животные включают, не исчерпываясь перечисленными, птиц и млекопитающих, таких как жвачные, и, в частности, мышей, кроликов, кошек, собак, свиней, овец, коз, коров и лошадей.
Терминами «практически очищенный» или «выделенный», используемыми в настоящем описании, называются последовательности нуклеиновых кислот или аминокислот, которые извлечены из своих клеточных, рекомбинантных или синтетических сред и по меньшей мере на 60% свободны, предпочтительно на 75%, а наиболее предпочтительно по меньшей мере на 90% свободны или по меньшей мере на 99% свободны от других компонентов, с которыми они связаны в своей среде. «Выделенные» полинуклеотиды и полипептиды были идентифицированы и отделены по меньшей мере от одной примесной молекулы, с которой они связаны в своем естественном состоянии. Соответственно понятно, что выделенные полинуклеотиды и полипептиды находятся в такой форме, которая отличается от формы и окружения, в которых они находятся в природе. Кроме того, следует понимать, что «выделенный» необязательно отражает точную меру (например, конкретный процент), до которой данная последовательность была очищена.
«Трансформация», используемая в настоящем описании, описывает процесс, посредством которого экзогенная ДНК входит и изменяет реципиентную клетку. Это может происходить в естественных или искусственных условиях с применением различных способов, хорошо известных в данной области. Трансформация может основываться на любом известном способе вставки чужеродных последовательностей нуклеиновых кислот в прокариотические и эукариотические клетки-хозяева. Данный способ выбирается в зависимости от типа клетки-хозяина, подлежащей трансформации, и может включать, не исчерпываясь перечисленным, вирусную инфекцию, электропорацию, тепловой шок, липофекцию и бомбардировку микрочастицами. Такие «трансформированные» клетки имеют в своем составе стабильно трансформированные клетки, в которых вставленная ДНК способна к репликации либо как автономно реплицируемая плазмида, либо как часть хромосомы-хозяина. Они также включают клетки, которые временно экспрессируют вставленную ДНК или РНК в течение ограниченного периода времени.
«Вакцины», используемые в настоящем описании, включают все компоненты и композиции для стимуляции иммунного ответа у субъекта. Особенно полезными в этом отношении являются субъединичные вакцины, в том числе пептидные вакцины, а также векторные вакцины, вакцины на основе нуклеиновых кислот, а также съедобные вакцины. Вакцины могут быть использованы для создания или усиления иммунной реакции на антиген, в частности микробный антиген. В конкретных аспектах вакцины содержат антигены, которые вызывают иммунологические защитные реакции, например образование антител, Т-хелперный и Т-клеточный ответы. Вакцины могут также включать антитела, например, для пассивной иммунизации.
«Вариантом» пептида, полипептида или антитела, используемым в настоящем описании, называется последовательность аминокислот, которая видоизменена по одной или нескольким аминокислотам. Вариант полинуклеотида видоизменен по одному или нескольким нуклеотидам. Вариант может являться результатом «консервативных замен», когда замещенные аминокислоты имеют сходные структурные и химические свойства, например замена лейцина на изолейцин. Реже вариант может являться результатом «неконсервативных замен», например замена глицина на триптофан. Аналогичные незначительные изменения могут также включать аминокислотные делеции, или вставки, или обе одновременно. Методологические принципы по определению, которые из аминокислотных остатков могут быть заменены, вставлены или делетированы без разрушения биологической или иммуногенной/иммунологической активности, можно обнаружить с помощью компьютерных программ, известных в данной области, например пакет программ LASERGENE (DNASTAR).
Изобретение также включает варианты, которые сохраняют по меньшей мере одну биологическую активность (например, ассоциацию клеток, ассоциацию мембран) или иммуногенную/иммунологическую активность. Предпочтительным вариантом является тот, что имеет практически ту же или функционально эквивалентную последовательность, например имеющую последовательность, не менее чем на 80%, а более предпочтительно по меньшей мере на 90% идентичную раскрытой в настоящем описании последовательности. Наиболее предпочтительным вариантом является тот, что имеет не менее 95%, не менее 97%, не менее 98% или не менее 99% идентичность раскрытой в настоящем описании последовательности. Процент идентичности определяется посредством выравнивания двух последовательностей, которые необходимо сравнить, как описано ниже, определяя число идентичных остатков в выравненных частях, разделив это число на общее число остатков в патентуемой (поисковой) последовательности и умножая результат на 100. Полезной программой выравнивания является AlignX (Vector NTI).
Описание изобретения
Метан образуется метанопродуцентами в передней кишке жвачных, которые действуют как окончательные восстановители углерода в системе рубца. Многоступенчатый метаболический путь метаногенеза хорошо выяснен главным образом из исследования «нерубцовых» метанопродуцентов, но адаптации, которые позволяют метанопродуцентам расти и выживать в рубце, не до конца понятны. Methanobrevibacter ruminantium является известным метанопродуцентом у жвачных Новой Зеландии. Как указано в настоящем описании, геном М. ruminantium был секвенирован, и показано, что его размер составляет примерно 3,0 м.п.о. с содержанием GC на уровне 33,68%. Были выявлены все компоненты метаболического пути метаногенеза, и сравнение этих последовательностей генов с аналогичными из Methanobacterium thermoautotrophicum и Methanosphaera stadtmanae свидетельствует, что генная организация метаногенеза у Methanobacteriales консервативна (фиг. 1C). Данный геном содержит много больших поверхностных белков с характеристиками, которые указывают, что они опосредуют ассоциацию с другими микробами рубца. В различных аспектах изобретения идентифицированные полинуклеотиды и полипептиды могут быть использованы в качестве средств для подавления метанопродуцентов и/или метаногенеза в рубце, а также дальнейшего выяснения роли М. ruminantium в образовании метана. Особенно полезными являются раскрытые полинуклеотиды и полипептиды, идентифицированные в качестве компонентов, участвующих в метаногенезе (фиг. 6A-6C), компонентов клеточной поверхности (фиг. 7A-7C), компонентов, участвующих в биосинтезе экзополисахаридов (фиг. 8A-8C), компонентов с трансмембранными доменами (фиг. 9A-9C), так же как и полинуклеотиды и полипептиды для выработки антител (фиг. 5A-5B).
Пептиды, полипептиды и полинуклеотиды
Изобретение включает пептиды и полипептиды, в том числе включающие по меньшей мере одну из SEQ ID NO:1-702, а также фрагменты, варианты и их производные. Пептиды и полипептиды по настоящему изобретению могут быть экспрессированы и использованы в различных анализах для определения их биологической активности. Пептиды и полипептиды могут быть использованы для крупномасштабного синтеза и схем выделения, например для коммерческого производства. Такие пептиды и полипептиды могут быть использованы для наращивания антител, чтобы выделить соответствующие последовательности аминокислот, а также количественно определить концентрации данных аминокислотных последовательностей. Пептиды и полипептиды могут быть использованы в вакцинах для таргетирования и подавления микробных клеток, особенно клеток-метанопродуцентов. Пептиды и полипептиды также могут быть использованы для продукции антител, подавляющих рост и репликацию таких клеток. Пептиды и полипептиды по настоящему изобретению также могут быть использованы в качестве композиций, например фармацевтических композиций, особенно композиций вакцин. В конкретных аспектах могут использоваться внутрирубцовые устройства замедленного высвобождения в сочетании с пептидами, полипептидами, антителами и композициями (например, фармацевтическими композициями, особенно композициями вакцин) по изобретению.
Пептиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) пептидов, включающих по меньшей мере фрагмент одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702 либо фрагментов, вариантов или их производных; (b) пептидов, включающих функциональный домен по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702, а также ее фрагментов и вариантов; и (c) пептидов, включающих по меньшей мере определенное количество смежных остатков по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702 либо ее вариантов или производных. В одном варианте осуществления изобретение включает выделенный пептид, включающий аминокислотную последовательность по меньшей мере одной из SEQ ID NO:1-9. Все эти последовательности коллективно именуются в настоящем описании как пептиды по изобретению.
Полипептиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) полипептидов, включающих по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702 либо ее фрагментов, вариантов или производных; (b) полипептидов, включающих функциональный домен по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702, а также ее фрагментов и вариантов; и (c) полипептидов, включающих по меньшей мере определенное количество смежных остатков по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-702 либо ее вариантов или производных. В одном варианте осуществления изобретение включает выделенный полипептид, включающий аминокислотную последовательность по меньшей мере одной из SEQ ID NO:1-9. Все эти последовательности коллективно именуются в настоящем описании как полипептиды по изобретению.
Изобретение также включает выделенный полинуклеотид, который кодирует пептид или полипептид с SEQ ID NO:1-702. Выделенные полинуклеотиды по настоящему изобретению имеют практическую значимость в картировании генома, в физическом картировании и в клонировании генов более или менее родственных компонентов клеточной поверхности. Зонды, разработанные с использованием полинуклеотидов по настоящему изобретению, могут быть использованы для детекции присутствия и изучения паттернов экспрессии генов в любом организме, имеющем в своих клетках достаточно гомологичные последовательности ДНК и РНК, с применением методов, которые хорошо известны в данной области, таких как методы слот-блоттинга или анализ с применением микрочипов. Зонды, разработанные с использованием полинуклеотидов по настоящему изобретению, могут быть использованы для секвенирования и ПЦР-амплификации. Полинуклеотиды по изобретению могут быть использованы для изготовления векторов экспрессии и в клетках-хозяевах для вакцин с целью таргетирования и подавления микробных клеток, особенно клеток-метанопродуцентов. Изобретение далее включает использование полинуклеотидов для продукции антител, подавляющих рост и репликацию таких клеток. Полинуклеотиды по настоящему изобретению также могут быть использованы в качестве композиций, например фармацевтических композиций, особенно композиций вакцин. В конкретных аспектах могут использоваться внутрирубцовые устройства замедленного высвобождения в сочетании с данными полинуклеотидами, векторами, клетками-хозяевами и композициями (например, фармацевтическими композициями, особенно композициями вакцин) по изобретению.
Полинуклеотиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) последовательностей, включающих последовательность, кодирующую по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702 либо ее фрагментов или вариантов; (b) комплементов, обратных последовательностей и обратных комплементов последовательности, кодирующей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702 либо ее фрагментов и вариантов; (c) открытых рамок считывания, содержащих последовательности, кодирующие по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702, а также ее фрагментов и вариантов; (d) функциональных доменов последовательности, кодирующей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702, а также ее фрагментов и вариантов; а также (e) последовательностей, включающих по меньшей мере определенное количество смежных остатков последовательности, кодирующей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-702 или ее вариантов; и (f) последовательностей, включающих по меньшей мере определенное количество смежных нуклеотидов любой из SEQ ID NO:703-1395. Также предусмотрены олигонуклеотидные зонды и праймеры, а также их варианты. Все эти полинуклеотиды и олигонуклеотидные зонды и праймеры далее в настоящем описании коллективно именуются полинуклеотидами по изобретению.
Специалистам в данной области ясно, что в результате вырожденности генетического кода можно произвести множество нуклеотидных последовательностей, кодирующих пептиды или полипептиды по изобретению, некоторые из которых имеют минимальную гомологию с нуклеотидными последовательностями какого-либо известного гена природного происхождения. Таким образом, изобретение рассматривает все без исключения возможные варианты нуклеотидной последовательности, которые могут быть сделаны путем выбора комбинаций на основе возможных вариантов кодона. Эти комбинации производятся в соответствии со стандартным триплетным генетическим кодом применительно к аминокислотным последовательностям природного происхождения, и все такие вариации должны рассматриваться как конкретно раскрытые.
Нуклеотидные последовательности, кодирующие пептиды и полипептиды либо их фрагменты или варианты предпочтительно способны к гибридизации с нуклеотидной последовательностью природного происхождения при подобранных должным образом параметрах пептида или строгости условий. Однако может оказаться выгодно производить нуклеотидные последовательности, кодирующие пептид, или полипептид, или его фрагмент, или производное, обладающие существенно отличной частотой использования кодона. Кодоны могут быть подобраны так, чтобы увеличить скорость, с которой происходит экспрессия пептида или полипептида в конкретном прокариотическом или эукариотическом хозяине в соответствии с частотой, с которой конкретные кодоны используются хозяином. Другие причины для существенной модификации нуклеотидной последовательности, кодирующей пептиды или полипептиды и их производные, не изменяя кодируемые аминокислотные последовательности, включают получение транскриптов РНК с более желательными свойствами, например с увеличенным временем полужизни, по сравнению с транскриптами, полученными из последовательности природного происхождения.
Изобретение также включает получение последовательностей ДНК или ее фрагментов, которые кодируют пептиды или полипептиды либо их фрагменты или варианты, полностью с помощью синтетической химии. После получения синтетическая последовательность может быть вставлена в любой из множества доступных векторов экспрессии и клеточные системы с использованием реагентов, которые хорошо известны в данной области. Кроме того, синтетическая химия может быть использована для внедрения мутаций в последовательность, кодирующую пептид или полипептид либо любые их варианты или фрагменты. Также включаются в изобретение последовательности полинуклеотида, способные к гибридизации с заявленными нуклеотидными последовательностями и, в частности, с указанными в SEQ ID NO:703-1395, в условиях различной строгости, как обсуждается в Wahl, G.M. and Berger, S.L. (1987; Methods Enzymol. 152:399-407), а также Kimmel, A.R. (1987; Methods Enzymol. 152:507-511).
Методы определения последовательности ДНК хорошо известны и повсеместно доступны в данной области и могут быть использованы в практике любого из вариантов осуществления по изобретению. При этих способах могут применяться такие ферменты, как фрагмент Кленова ДНК-полимеразы I, секвеназа (SEQUENASE) (U.S. Biochemical Corp, Cleveland, OH), Taq-полимераза (Perkin Elmer), термостабильная Т7 полимераза Amersham Pharmacia Biotech (Piscataway, NJ), или такие комбинации полимераз и «редакторских» нуклеаз, как найденные в системе амплификации элонгазы (ELONGASE Amplification System), реализуемой на рынке компанией Life Technologies (Gaithersburg, MD). Предпочтительно этот процесс автоматизировать с помощью таких приборов, как Hamilton Micro Lab 2200 (Hamilton, Reno, NV), Peltier Thermal Cycler (PTC200; MJ Research, Watertown, MA), ABI Catalyst, а также 373 и 377 секвенаторы ДНК (Perkin Elmer) либо Genome Sequencer 20™ (Roche Diagnostics).
Последовательности нуклеиновых кислот, кодирующие пептиды или полипептиды, могут быть продлены, используя частичную нуклеотидную последовательность и применяя различные способы, известные в данной области для обнаружения 3'-5'-дирекционных последовательностей, таких как промоторы и регуляторные элементы. Например, один способ, который может быть использован, «сайт-рестрикционная» ПЦР, использует универсальные праймеры для восстановления неизвестной последовательности, прилегающей к известному локусу (Sarkar, G. (1993) PCR Methods Applic. 2:318-322). В частности, геномную ДНК сперва амплифицируют в присутствии праймера к линкерной последовательности и праймера, специфичного к известной области. Амплифицированные последовательности затем подвергают второму раунду ПЦР с тем же линкерным праймером и другим специфическим праймером, внутренним для первого. Продукты каждого раунда ПЦР транскрибируют с помощью соответствующей РНК-полимеразы и секвенируют с помощью обратной транскриптазы.
Коммерчески доступные системы капиллярного электрофореза могут быть использованы для анализа размера или подтверждения нуклеотидной последовательности продуктов секвенирования или ПЦР. В частности, капиллярное секвенирование может использовать текучие полимеры для электрофоретического разделения, четыре различных флуоресцентных красителя (по одному для каждого нуклеотида), активируемых лазером, и детекцию излучаемых длин волн телекамерой на приборах с зарядовой связью. Интенсивность выхода/света может быть преобразована в электрический сигнал с помощью соответствующих программ (например, GENOTYPER и Sequence NAVIGATOR, Perkin Elmer), и весь процесс, от загрузки образцов до компьютерного анализа и отображения электронных данных, может контролироваться компьютером. Капиллярный электрофорез особенно предпочтителен для секвенирования малых фрагментов ДНК, которые могут присутствовать в ограниченном количестве в конкретном образце.
В другом варианте осуществления изобретения полинуклеотиды или их фрагменты, кодирующие пептиды или полипептиды, могут быть использованы в рекомбинантных молекулах ДНК для непосредственной экспрессии данных пептидов или полипептидов либо их фрагментов или вариантов в соответствующих клетках-хозяевах. Из-за природной вырожденности генетического кода могут быть получены другие последовательности ДНК, кодирующие практически те же или функционально эквивалентные последовательности аминокислот, и эти последовательности могут быть использованы для клонирования и экспрессии пептидов или полипептидов. Нуклеотидные последовательности по настоящему изобретению могут быть спроектированы с помощью способов, широко известных в данной области, с целью модификации последовательностей, кодирующих аминокислоты, по целому ряду причин, в том числе, не исчерпываясь перечисленными, изменений, модифицирующих клонирование, процессинг и/или экспрессию генных продуктов. Перетасовка ДНК путем случайной фрагментации и вторичной сборки с помощью ПЦР фрагментов гена и синтетических олигонуклеотидов может быть использована для конструирования нуклеотидных последовательностей. Например, может быть использован сайт-направленный мутагенез для вставки новых сайтов рестрикции, модификации моделей гликозилирования, изменения предпочтений кодонов, введения мутаций и так далее.
В другом варианте осуществления изобретения природные, видоизмененные или рекомбинантные последовательности нуклеиновых кислот, кодирующие пептиды или полипептиды, могут быть лигированы с гетерологичной последовательностью для кодирования химерного белка. Например, может оказаться полезным кодировать химерную последовательность, распознаваемую коммерчески доступными антителами. Химерный белок может быть также сконструирован так, чтобы содержать сайт расщепления, расположенный между пептидом или полипептидом по изобретению и гетерологичной белковой последовательностью, так что пептид или полипептид может быть расщеплен и очищен от гетерологичного остатка.
В другом варианте осуществления последовательности, кодирующие пептиды или полипептиды, могут быть синтезированы целиком или частично с помощью химических методов, хорошо известных в данной области (см. Caruthers, M.H. et al. (1980) Nucl. Acids Res. Symp. Ser. 215-223, Horn, T. et al. (1980) Nucl. Acids Res. Symp. Ser. 225-232). Альтернативно, сам полипептид может быть изготовлен с применением химических методов синтеза аминокислотной последовательности или ее фрагмента. Например, синтез полипептида может быть выполнен с использованием различных твердофазных методов (Roberge, J.Y. et al. (1995) Science 269:202-204; Merrifield J. (1963) J. Am. Chem. Soc. 85:2149-2154), а автоматический синтез может быть достигнут, например, с помощью синтезатора пептидов ABI 431A Peptide Synthesizer (Perkin Elmer). Различные фрагменты пептидов или полипептидов могут быть химически синтезированы отдельно и объединены с помощью химических методов для получения полноразмерной молекулы.
Вновь синтезированный пептид или полипептид может быть выделен с помощью препаративной высокоэффективной жидкостной хроматографии (например, Creighton, T. (1983) Proteins Structures and Molecular Principles, W.H. Freeman and Co., New York, NY). Состав синтетических пептидов или полипептидов может быть подтвержден аминокислотным анализом или секвенированием (например, процедурой деградации по Эдману; Creighton, см. выше). Кроме того, последовательность аминокислот в пептиде, или полипептиде, или любой его части может быть изменена в процессе прямого синтеза и/или объединена посредством химических методов с последовательностями других белков или с любой их частью, чтобы получить вариант молекулы.
Для того чтобы экспрессировать биологически активные пептиды или полипептиды, нуклеотидные последовательности, кодирующие последовательности или функциональные эквиваленты, могут быть вставлены в подходящий вектор экспрессии, т.е. вектор, который содержит элементы, необходимые для транскрипции и трансляции вставленных кодирующих последовательностей. Могут быть использованы способы, хорошо известные специалистам в данной области, для конструирования векторов экспрессии, содержащих последовательности, кодирующие пептид или полипептид, и соответствующие элементы контроля транскрипции и трансляции. Эти способы включают in vitro методы рекомбинантной ДНК, синтетические методы и генетическую рекомбинацию in vivo. Такие методы описаны в Sambrook, J. et al. (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, а также в Ausubel, F.M. et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY.
Целый ряд векторов экспрессии/систем клеток-хозяев может быть использован для удержания и экспрессии последовательностей, кодирующих пептиды и полипептиды по изобретению. Таковые включают, не исчерпываясь перечисленными, микроорганизмы, такие как бактерии, трансформированные рекомбинантным фагом, плазмидными или космидными ДНК-векторами экспрессии; дрожжи, трансформированные дрожжевыми векторами экспрессии; системы клеток насекомых, инфицированные вирусными векторами экспрессии (например, бакуловирусная); системы растительных клеток, трансформированные вирусными векторами экспрессии (например, вирус мозаики цветной капусты, CaMV, вирус мозаики табака, TMV) либо бактериальными векторами экспрессии (например, плазмиды Ti или pBR322); либо системы животных клеток. Для бактерий полезные плазмиды включают pET, pRSET, pTrcHis2 и pBAD плазмиды от Invitrogen, pET и pCDF плазмиды от Novagen, а также Director™ плазмиды от Sigma-Aldrich. Для метанопродуцентов полезные плазмиды включают, не исчерпываясь перечисленными, pME2001, pMV15 и pMP1. Изобретение не ограничивается лишь использованными векторами экспрессии или клетками-хозяевами.
«Элементы контроля» или «регуляторные последовательности» представляют собой те нетранслируемые области векторов, энхансеры, промоторы, 5'- и 3'-нетранслируемые области, которые взаимодействуют с белками клеток-хозяев для осуществления транскрипции и трансляции. Такие элементы могут различаться по своей эффективности и специфичности. В зависимости от векторной системы и использованных клеток-хозяев может быть использовано любое число подходящих элементов транскрипции и трансляции, в том числе конститутивные и индуцируемые промоторы. Например, при клонировании в бактериальные системы могут быть использованы индуцируемые промоторы, такие как гибридный lacZ промотор фагмиды BLUESCRIPT (Stratagene, LaJolla, CA) или плазмиды pSPORTI (Life Technologies) и им подобные. Бакуловирусный полиэдриновый промотор может быть использован в клетках насекомых. Промоторы и энхансеры, образованные из геномов клеток растений (например, из генов белков теплового шока, RUBISCO и запасных белков) или вирусов растений (например, из вирусных промоторов или лидерных последовательностей), могут быть клонированы в данный вектор.
В бактериальных системах число векторов экспрессии может быть выбрано в зависимости от применения, предполагаемого для пептида или полипептида. Например, когда необходимо большое количество пептида или полипептида, могут быть использованы векторы, предназначенные для высокого уровня экспрессии химерных белков, которые легко могут быть очищены. Такие векторы включают, не исчерпываясь перечисленными, многофункциональные векторы клонирования и экспрессии в E. coli, такие как BLUESCRIPT (Stratagene), в котором последовательность, кодирующая полипептид, может быть лигирована в вектор в одной рамке считывания с последовательностями аминоконцевого Met и последующими 7 остатками β-галактозидазы так, чтобы производился гибридный белок; pIN векторы (Van Heeke, G. and S.M. Schuster (1989) J. Biol. Chem. 264:5503-5509); и им подобные.
pGEX векторы (Promega, Madison, WI) также могут быть использованы для экспрессии пептидов или полипептидов в виде химерных белков с глутатион-S-трансферазой (GST). Как правило, такие химерные белки растворимы и легко могут быть очищены от лизированных клеток адсорбцией на гранулах глутатион-агарозы с последующей элюцией в присутствии свободного глутатиона. Белки, произведенные в таких системах, могут быть сконструированы так, чтобы включать гепариновый, тромбиновый или фактор Ха сайты расщепления протеазами и чтобы интересующий клонированный пептид или полипептид мог быть освобожден от GST фрагмента по усмотрению. В дрожжах Saccharomyces cerevisiae может быть использован ряд векторов, содержащих конститутивные или индуцируемые промоторы, такие как альфа-фактор, алкогольоксидаза и PGH. Для обзора см. Ausubel et al. (выше), а также Grant et al. (1987) Methods Enzymol. 153:516-544.
Конкретные сигналы инициации также могут быть использованы для достижения более эффективной трансляции последовательностей, кодирующих пептиды или полипептиды по изобретению. Такие сигналы включают инициирующий кодон ATG и примыкающие последовательности. В случаях когда последовательности, кодирующие пептид или полипептид, его инициирующий кодон и последовательности в 3'-5' направлении, вставлены в соответствующий вектор экспрессии, не нужно никаких дополнительных транскрипционных или трансляционных сигналов контроля. Однако в тех случаях, когда вставлена только кодирующая последовательность или ее фрагмент, должны быть предусмотрены экзогенные трансляционные сигналы контроля, включая инициирующий кодон ATG. Кроме того, инициирующий кодон должен находиться в правильной рамке считывания, чтобы обеспечить трансляцию всей вставки. Экзогенные трансляционные элементы и инициирующие кодоны могут быть различного происхождения, как природного, так и синтетического. Эффективность экспрессии может быть усилена путем включения энхансеров, предназначенных для конкретной используемой клеточной системы, например, описанных в литературе (Scharf, D. et al. (1994) Results Probl. Cell Differ. 20:125-162).
Кроме того, штамм клеток-хозяев может быть выбран по его способности модулировать экспрессию вставленных последовательностей или подвергать процессингу экспрессированный пептид или полипептид желательным образом. Такие модификации последовательности включают, не исчерпываясь перечисленными, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидизацию и ацилирование. Посттрансляционный процессинг, который расщепляет «пре-про» форму пептида или полипептида, может также использоваться для обеспечения правильной инсерции, фолдинга и/или функции. Различные клетки-хозяева, которые имеют специфичное клеточное устройство и характерные механизмы для посттрансляционной активности, могут быть поставлены Американской коллекцией типовых культур (ATCC; Bethesda, MD) и могут быть выбраны для обеспечения правильной модификации и процессинга последовательности. Конкретные клетки-хозяева включают, не исчерпываясь перечисленными, клетки-метанопродуценты, такие как клетки Methanobrevibacter, в частности M. ruminantium, или клетки M. smithii. Клетки-хозяева включают, например, Rhodotorula, Aureobasidium, Saccharomyces, Sporobolomyces, Pseudomonas, Erwinia и Flavobacterium; или такие другие организмы, как Escherichia, Lactobacillus, Bacillus, Streptomyces и им подобные. Конкретные клетки-хозяева включают Escherichia coli, которые особенно подходят для использования по настоящему изобретению, Saccharomyces cerevisiae, Bacillus thuringiensis, Bacillus subtilis, Streptomyces lividans и им подобные.
Есть несколько методов введения нуклеиновых кислот в клетки эукариот, культивируемые in vitro. К ним относятся химические методы (Feigner et al., Proc. Natl. Acad. Sci., USA, 84:7413 7417 (1987); Bothwell et al., Methods for Cloning and Analysis of Eukaryotic Genes, Eds., Jones and Bartlett Publishers Inc., Boston, Mass. (1990), Ausubel et al., Short Protocols in Molecular Biology, John Wiley and Sons, New York, NY (1992); и Farhood, Annal. NY Acad. Sci., 716:23-34 (1994)), использование протопластов (Bothwell, выше) или электрических импульсов (Vatteroni et al., Mutn. Res., 291:163-169 (1993); Sabelnikov, Prog. Biophys. Mol. Biol., 62:119-152 (1994); Bothwell et al., выше; и Ausubel et al., выше), применение ослабленных вирусов (Davis et al., J. Virol. 1996, 70(6), 3781-3787; Brinster et al. J. Gen. Virol. 2002, 83(Pt 2), 369-381; Moss, Dev. Biol. Stan., 82:55-63 (1994); и Bothwell et al., выше), а также физические методы (Fynan et al., Int J Immunopharmacol. 1995 Feb; 17(2):79-83; Johnston et al., Meth Cell Biol., 43(Pt A): 353-365 (1994); Bothwell et al., выше; и Ausubel et al., выше).
Успешная доставка нуклеиновых кислот в ткани животных может быть достигнута с помощью катионных липосом (Watanabe et al., Mol. Reprod. Dev., 38:268-274 (1994)), прямой инъекции депротеинизированных ДНК или РНК в мышечную ткань животных (Robinson et al., Vacc, 11:957-960 (1993); Hoffman et al., Vacc. 12:1529-1533; (1994); Xiang et al., Virol., 199:132-140 (1994); Webster et al., Vacc, 12:1495-1498 (1994); Davis et al., Vacc, 12:1503-1509 (1994); Davis et al., Hum. Molec Gen., 2:1847-1851 (1993); Dalemans et al. Ann NY Acad. Sci. 1995, 772, 255-256. Conry, et al. Cancer Res. 1995, 55(7), 1397-1400) и эмбрионы (Naito et al., Mol. Reprod. Dev., 39:153-161 (1994); и Burdon et al., Mol. Reprod. Dev., 33:436-442 (1992)), внутримышечной инъекции самореплицирующейся РНК-вакцины (Davis et al., J Virol 1996, 70(6), 3781-3787; Balasuriya et al. Vaccine 2002, 20(11-12), 1609-1617) или внутрикожной инъекции ДНК, используя технологию «генной пушки» (Johnston et al., выше).
В данной области известно множество протоколов для детекции и оценки экспрессии пептидов или полипептидов по изобретению с использованием либо поликлональных, либо моноклональных антител, специфичных для данного белка. Примеры включают иммуноферментный анализ (ELISA), радиоиммунологический анализ (RIA) и флуоресцентную сортировку клеток (FACS). Двухслойный иммуноферментный анализ на основе моноклональных антител может быть применен с помощью моноклональных антител, реагирующих с двумя неинтерферирующими эпитопами пептида или полипептида, но также может быть применен анализ конкурентного связывания. Эти и другие тесты кроме других мест описаны в Hampton, R. et al. (1990; Serological Methods, a laboratory Manual, APS Press, St Paul, MN), а также в Maddox, D.E. et al. (1983; J. Exp. Med. 158:1211-1216).
Специалистам в данной области известно большое разнообразие меток и методов конъюгации, и это может быть использовано в различных анализах нуклеиновых кислот и аминокислот. Средства для получения меченых гибридизационных или ПЦР зондов для детекции последовательностей, связанных с полинуклеотидами, включают олиго-мечение, ник-трансляцию, концевое мечение или ПЦР-амплификацию с использованием меченых нуклеотидов. Альтернативно последовательности, кодирующие пептиды или полипептиды либо любые их фрагменты или варианты, могут быть клонированы в вектор для получения мРНК-зонда. Такие векторы известны в данной области, коммерчески доступны и могут быть использованы для синтеза РНК-зондов in vitro путем добавления соответствующих РНК-полимераз, таких как T7, T3 или SP6, и мечения нуклеотидов. Эти процедуры могут проводиться с помощью различных коммерчески доступных наборов от Amersham Pharmacia Biotech, Promega, и US Biochemical. Подходящие репортерные молекулы или метки, пригодные для упрощения детекции, включают радионуклиды, ферменты, люминесцентные, хемилюминесцентные или хромогенные реагенты, а также субстраты, кофакторы, ингибиторы, магнитные частицы и им подобные.
Векторы экспрессии или клетки-хозяева, трансформированные векторами экспрессии, могут культивироваться в условиях, пригодных для экспрессии и выделения пептида или полипептида из культуры. Культура может включать компоненты для экспрессии in vitro или in vivo. Компоненты экспрессии in vitro включают таковые для лизатов ретикулоцитов кролика, лизатов E. coli и экстрактов зародышей пшеницы, например, системы Expressway™ или RiPs от Invitrogen, системы Genelator™ от iNtRON Biotechnology, системы EcoPro™ или STP3™ от Novagen, системы TNT® Quick Coupled от Promega и системы EasyXpress от QIAGEN. Пептид или полипептид, получаемый из культуры, может секретироваться или содержаться внутри клетки в зависимости от последовательности и/или используемого вектора. В конкретных аспектах векторы экспрессии, кодирующие пептид или полипептид, могут быть сконструированы содержащими сигнальные последовательности, которые направляют секрецию пептида или полипептида через прокариотическую или эукариотическую клеточную мембрану.
Другие конструкции могут включать аминокислотный домен, который способствует очистке пептида или полипептида. Такие домены включают, не исчерпываясь перечисленными, металл-хелатирующие домены, такие как гистидин-триптофановые (например, 6X-HIS (SEQ ID NO:1396)) модули, позволяющие очистку на иммобилизованных металлах, домены белка А, позволяющие очистку на иммобилизованных иммуноглобулинах, и домен, используемый в инсерционно/аффинной системе очистки FLAG® (Immunex Corp., Seattle, WA). Пригодные эпитопные маркеры включают 3XFLAG®, HA, VSV-G, V5, HSV, GST, GFP, MBP, GAL4 и β-галактозидазу. Пригодные плазмиды включают те, что содержат биотиновый маркер (например, плазмиды PinPoint™ от Promega), кальмодулинсвязывающий белок (например, плазмиды pCAL от Stratagene), стрептавидинсвязывающий пептид (например, плазмиды InterPlay™ от Stratagene), c-myc или FLAG® маркер (например, плазмиды иммунопреципитации от Sigma-Aldrich) или гистидиновый маркер (например, плазмиды QIAExpress от QIAGEN).
Для облегчения очистки векторы экспрессии могут включать расщепляемые линкерные последовательности, такие как специфичные для фактора Ха или энтерокиназы (Invitrogen, San Diego, CA). Например, вектор может включать один или более линкеров между доменом очистки и пептидом или полипептидом. Один такой вектор экспрессии обеспечивает возможность экспрессии химерного белка, включающего пептид или полипептид по изобретению и нуклеиновую кислоту, кодирующую 6 остатков гистидина (SEQ ID NO:1396), предшествующего тиоредоксиновому или энтерокиназному сайту расщепления. Остатки гистидина облегчают очистку на IMAC (аффинная хроматография на иммобилизованных ионах металла, как описано в Porath, J. et al. (1992) Prot. Exp. Purif. 3:263-281), тогда как энтерокиназный сайт расщепления служит средством для очистки пептида или полипептида от химерного белка. Обсуждение векторов, содержащих химерные белки, приводится в Kroll, D.J. et al. (1993; DNA Cell Biol. 12:441-453).
Антитела и вакцины
Антитела по изобретению могут быть получены с помощью способов, широко известных в данной области. Конкретно, очищенные пептиды, полипептиды или полинуклеотиды могут быть использованы для получения антител в соответствии с известными способами. Такие антитела могут включать, не исчерпываясь перечисленными, поликлональные, моноклональные, химерные и одноцепочечные антитела, Fab фрагменты и фрагменты, полученные с помощью экспрессирующей Fab библиотеки. Нейтрализующие антитела (т.е. те, которые подавляют функцию) особенно предпочтительны для использования с вакцинами.
Для производства антител могут быть иммунизированы различные носители, включая коз, кроликов, крыс, мышей, людей и других, посредством инъекции пептида, полипептида, полинуклеотида или любого их фрагмента, которые обладают иммуногенными свойствами. В зависимости от биологического вида носителя могут быть использованы различные адъюванты для повышения иммунного ответа. Такие адъюванты включают, не исчерпываясь перечисленными, адъювант Фрейнда, такие минеральные гели, как гидроксид алюминия, и такие поверхностно-активные вещества, как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин фисуреллы и динитрофенол. Среди адъювантов, используемых у людей, особенно предпочтительны БЦЖ (бациллы Кальметта-Герена) и Corynebacterium parvum.
Предпочтительно, чтобы пептиды, полипептиды или фрагменты, используемые для индукции антител, имели аминокислотную последовательность, включающую по меньшей мере пять аминокислот, а более предпочтительно не менее 10 аминокислот. Кроме того, желательно, чтобы они были идентичны части аминокислотной последовательности природного белка, и они могут содержать полную аминокислотную последовательность малой молекулы природного происхождения. Короткие отрезки аминокислот могут быть слиты с фрагментами другого белка, такого как гемоцианин фисуреллы и антитело, полученное против химерной молекулы.
Моноклональные антитела могут быть получены с помощью любого метода, который предусматривает производство антител стабильными клеточными линиями в культуре. К ним относятся, не исчерпываясь перечисленными, гибридомный метод, гибридомный метод на основе человеческих B-клеток и гибридомный метод на основе вируса Эбштейн-Барра (Kohler, G. et al. (1975) Nature 256:495-497; Kozbor, D. et al. (1985) J. Immunol. Methods 81:31-42; Cote, R.J. et al. (1983) Proc. Natl. Acad. Sci. 80:2026-2030; Cole, S.P. et al. (1984) Mol. Cell Biol. 62:109-120).
Помимо этого могут быть использованы методы, разработанные для производства «химерных» антител, например комбинирование генов антител мыши и генов антител человека для получения молекулы с соответствующей антигенной специфичностью и биологической активностью (Morrison, S.L. et al. (1984) Proc. Natl. Acad. Sci. 81:6851-6855; Neuberger, M.S. et al. (1984) Nature 312:604-608; Takeda, S. et al. (1985) Nature 314:452-454). Альтернативно могут быть адаптированы методы, описанные для получения одноцепочечных антител, используя способы, известные в данной области, для получения специфичных одноцепочечных антител. Антитела со сходными специфичностями, но различного антиидиотипического состава, могут быть получены путем перетасовки цепей из случайных комбинаторных иммуноглобулиновых библиотек (Burton D.R. (1991) Proc. Natl. Acad. Sci. 88:11120-3).
Специалисты в данной области, имеющие отношение к данному изобретению, по достоинству оценят термины «диатела» и «триатела». Это молекулы, содержащие вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) коротким пептидным линкером, слишком коротким, чтобы позволить образование пары между двумя доменами на одной и той же цепи. Это способствует образованию пар с комплементарными доменами одной или более цепей и способствует образованию димерных или тримерных молекул с двумя или более функциональными сайтами связывания антигена. Полученные в результате молекулы антитела могут быть моноспецифическими или мультиспецифическими (например, бивалентными в случае диател). Такие молекулы антител могут быть созданы из двух или более антител с помощью методологии, стандартной для области, к которой относится изобретение; например, описанной в Todorovska et al. (Design and application of diabodies, triabodies and tetrabodies for cancer targeting. J. Immunol. Methods. 2001 Feb 1; 248(1-2):47-66).
Антитела можно также получить, индуцируя in vivo продукцию в популяции лимфоцитов либо скринируя иммуноглобулиновые библиотеки или панели высокоспецифичных связывающих реагентов, как описано в литературе (Orlandi, R. et al. (1989) Proc. Natl. Acad. Sci. 86:3833-3837; Winter, G. et al. (1991) Nature 349:293-299).
Могут быть получены фрагменты антител, которые содержат специфичные сайты связывания. Например, такие фрагменты включают, не исчерпываясь перечисленными, F(ab')2 фрагменты, которые могут быть получены пепсиновым протеолизом молекулы антитела, и Fab фрагменты, которые могут быть созданы восстановлением дисульфидных мостов F(ab')2 фрагментов. Альтернативно могут быть созданы Fab экспрессирующие библиотеки для быстрой и простой идентификации моноклональных Fab фрагментов с желательной специфичностью (Huse, W.D. et al. (1989) Science 254:1275-1281).
Различные иммуноферментные анализы могут быть использованы для скрининга, чтобы выявить антитела, обладающие специфичностью связывания. Многочисленные протоколы для конкурентного связывания или радиоиммунного анализа с использованием либо поликлональных, либо моноклональных антител с установленными специфичностями хорошо известны в данной области. Такие иммуноферментные анализы обычно включают контроль над образованием комплексов между пептидом, полипептидом или полинуклеотидом и специфичными для него антителами. Двухслойный иммуноферментный анализ на основе моноклональных антител может быть применен с помощью моноклональных антител, реагирующих с двумя неинтерферирующими эпитопами пептида или полипептида, но также может быть применен анализ конкурентного связывания (Maddox, выше).
Описанные в настоящем описании антитела обладают способностью таргетировать и/или подавлять клетки и также полезны в качестве молекул-носителей для доставки дополнительных ингибиторных молекул в микробные клетки. Химия соединений для присоединения к аминокислотам хорошо развита, и целый ряд различных типов молекул может быть связан с антителами. Наиболее универсальные способы присоединения основаны на наличии свободных амино- (альфа-амино- или Lys), сульфгидрильных (Cys) или карбоксильных групп (Asp, Glu или альфа-карбоксильных). Могут быть использованы способы присоединения, чтобы соединить антитело с клеточным ингибитором через карбокси- или аминотерминальный остаток. В некоторых случаях последовательность включает несколько остатков, способных реагировать с избранной химией. Это может быть использовано для получения мультимеров, содержащих более одного клеточного ингибитора. Альтернативно антитело может быть укорочено или выбрано так, чтобы реакционноспособные остатки были локализованы либо на амино-, либо на карбоксильном конце последовательности.
Например, репортерная молекула, такая как флуоресцеин, может быть специфически присоединена по остатку лизина (Ono et al., 1997) с использованием N-α-Fmoc-Nε-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден-3-метилбутил)-L-лизина во время синтеза полипептида. После синтеза могут быть присоединены 5- и 6-сукцинимидильные эфиры карбоксифлуоресцеина после удаления 4,4-диметил-2,6-диоксоциклогекс-1-илидена посредством обработки гидразином. Таким образом, может быть достигнуто присоединение ингибиторной молекулы к антителу путем включения остатка лизина в последовательность полипептида, а после этого реакции со специально преобразованным клеточным ингибитором.
Также может быть использован EDC - (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид) или карбодиимидный способ присоединения. Карбодиимиды могут активировать карбоксильные группы боковой цепи аспарагиновой и глутаминовой кислот, так же как и карбокситерминальную группу, чтобы превратить их в реакционноспособные сайты для присоединения первичных аминов. Активированное антитело смешивают с клеточным ингибитором, получая конечный конъюгат. Если клеточный ингибитор активирован первым, EDC-способ будет присоединять клеточный ингибитор через N-концевой альфа-амин и, возможно, через амин боковой цепи Lys, если он присутствует в последовательности.
m-Малеимидобензоил-N-гидроксисукцинимидный эфир (MBS) является гетеробифункциональным реагентом, который может быть использован для соединения антитела с клеточным ингибитором через цистеины. Присоединение происходит по тиоловым группам остатков цистеина. Если выбранная последовательность не содержит Cys, является обычным присоединение остатков Cys по N- или C-концу, чтобы получить в высокой степени управляемую сшивку антитела с клеточным ингибитором. Для целей синтеза может оказаться полезным, чтобы цистеин находился на N-конце антитела. MBS особенно подходит для применения по настоящему изобретению.
Глютаральдегид может быть использован в качестве бифункционального реагента присоединения, который связывает два соединения через их аминогруппы. Глютаральдегид обеспечивает исключительно гибкий спейсер между антителом и клеточным ингибитором для подходящей экспозиции. Глютаральдегид представляет собой очень реакционноспособное соединение и вступает в реакцию с Cys, Tyr и в ограниченной степени с His. Глютаральдегидный способ присоединения особенно полезен, когда полипептид содержит только одну свободную аминогруппу на своем аминоконце. Если антитело содержит более одной свободной аминогруппы, может сформироваться большой мультимерный комплекс.
В одном аспекте антитела по изобретению могут быть химерными (например, клонированы в общей рамке считывания) или связанными (например, путем химического присоединения) с клеточными ингибиторами, такими как антимикробные средства. К их числу относятся антимикробные пептиды, к примеру белок, увеличивающий бактерицидность/проницаемость, катионные антимикробные белки, лизоцимы, лактоферрины и кателицидины (например, из нейтрофилов; см., например, Hancock and Chappie, 1999, Antimicrob. Agents Chemother.43:1317-1323; Ganz and Lehrer, 1997, Curr. Opin. Hematol. 4:53-58; Hancock et al., 1995, Adv. Microb. Physiol. 37:135-175). Антимикробные пептиды также включают дефензины (например, из эпителиальных клеток или нейтрофилов) и бактерицидные белки тромбоцитов (см., например, Hancock and Chappie, 1999, Antimicrob. Agents Chemother. 43:1317-1323). Дополнительные антимикробные пептиды включают, не исчерпываясь перечисленными, грамицидин S, бацитрацин, полимиксин B, тахиплезин, бактенецин (например, бактенецин крупного рогатого скота), раналексин, цекропин A, индолицидин (например, индолицидин крупного рогатого скота) и низин (например, бактериальный низин).
Также включены в качестве антимикробных средств ионофоры, которые способствуют переносу ионов (таких, как натрий) через липидный барьер, такой как клеточная мембрана. Два ионофорных соединения, особенно подходящих для этого изобретения, представляют собой румензин (RUMENSIN™) (Eli Lilly) и лазалоцид (Lasalocid) (Hoffman LaRoche). Другие ионофоры включают, не исчерпываясь перечисленными, салиномицин, авопарцин, аридцин и актапланин. Другие антимикробные средства включают монензин (Monensin™) и азитромицин, метронидазол, стрептомицин, канамицин и пенициллин, а также, обычно, β-лактамы, аминогликозиды, макролиды, хлорамфеникол, новобиоцин, рифампицин и фторхинолоны (см., например, Horn et al., 2003, Applied Environ. Microbiol. 69:74-83; Eckburg et al., 2003, Infection Immunity 71:591-596; Gijzen et al., 1991, Applied Environ. Microbiol. 57:1630-1634; Bonelo et al., 1984, FEMS Microbiol. Lett. 21:341-345; Huser et al., 1982, Arch. Microbiol. 132:1-9; Hilpert et al., 1981, Zentbl. Bakteriol. Mikrobiol. Hyg. 1 Abt Orig. C 2:21-31).
Особенно полезными ингибиторами являются соединения, которые блокируют метаногенез или препятствуют ему, в том числе бромэтансульфоновая кислота, например 2-бромэтансульфоновая кислота (BES), или ее соль, например, натриевая соль. Молибдат (Mo) натрия является ингибитором восстановления сульфатов и может быть использован с бромэтансульфоновой кислотой. Другие соединения, эффективные против метаногенеза, включают, не исчерпываясь перечисленными, нитрат, формиат, фторметил, хлороформ, хлоралгидрат, сульфит натрия, этилен и ненасыщенные углеводороды, ацетилен, жирные кислоты, такие как линолевая и цис-олеиновая кислоты, насыщенные жирные кислоты, такие как бегеновая и стеариновая кислоты, а также люмазин (например, 2,4-птеридиндион). Дополнительные соединения включают 3-бромпропан-сульфонат (BPS), пропионовую кислоту и этил-2-бутиноат.
Далее включены в качестве антимикробных средств лизирующие ферменты, в том числе лизоцим фага, эндолизин, лизоцим, лизин, лизин фага, мурализин, мурамидаза и виролизин. Полезные ферменты проявляют способность к гидролизу специфических связей в клеточной стенке бактерий. Конкретные лизирующие ферменты включают, не исчерпываясь перечисленными, глюкозаминидазы, которые гидролизуют гликозидные связи между аминосахарами (например, N-ацетилмурамовая кислота и N-ацетилглюкозамин) пептидогликана, амидазы, расщепляющие N-ацетилмурамоил-L-аланин амидную связь между гликановой цепью и перекрестносшитым пептидом, и эндопептидазы, которые гидролизуют межпептидные связи (например, цистеиновые эндопептидазы), и эндоизопептидазы, которые разрушают псевдомуреин метанопродуцентов семейства Methanobacteriaceae.
Дополнительно в качестве антимикробных средств включены PNA. PNA представляют собой пептид-нуклеиновые кислоты-гибриды, у которых фосфатный каркас был заменен ахиральным и нейтральным каркасом из N-(2-аминоэтил)-глициновых звеньев (см., например, Eurekah Bioscience Collection. PNA and Oligonucleotide Inhibitors of Human Telomerase. G. Gavory and S. Balasubramanian, Landes Bioscience, 2003). Основания A, G, T, C присоединены к амидному азоту каркаса через метиленкарбонильные связи (P.E. Nielsen et al., Science 1991. 254:1497-1500; M. Egholm et al., Nature 1993. 365:566-568). PNA связывают комплементарные последовательности с высокой специфичностью и с большей аффинностью по сравнению с аналогичными ДНК или РНК (M. Egholm et al., выше). PNA/ДНК или PNA/РНК гибриды также показали более высокую термическую стабильность по сравнению с соответствующими ДНК/ДНК или ДНК/РНК дуплексами (M. Egholm et al., выше). PNA также обладают высокой химической и биологической стабильностью из-за неприродного амидного каркаса, который не распознается нуклеазами и протеазами (V. Demidov et al., Biochem Pharmacol 1994, 48:1310-1313). Обычно PNA имеют в длину по меньшей мере 5 оснований и включают концевой лизин. PNA может быть пэгилированным для дополнительного удлинения продолжительности их жизни (Nielsen, P.E. et al. (1993) Anticancer Drug Des. 8:53-63).
В одном конкретном аспекте антитела по изобретению могут быть химерными или связанными с другими антителами или их фрагментами. Добавленные антитела или фрагменты антител могут быть направлены против микробных клеток, либо конкретно - против клеток метанопродуцентов, либо - против одного или более компонентов клетки. Например, мишенью могут служить белки клеточной поверхности, к примеру наружные клеточные рецепторы. В некоторых аспектах антитела или фрагменты антител могут быть сконструированы содержащими последовательности, экспрессируемые именно субъектами, например последовательности человека или жвачных. Также включены химерные антитела, к примеру моноклональные антитела или их фрагменты, специфичные против более чем одного источника, например против одной или более последовательностей мыши, человека или жвачных. Дополнительно включены «верблюжьи» антитела или нанотела.
Антитела по изобретению находят свое практическое применение для таргетирования микробной клетки, в частности клетки метанопродуцентов. В некоторых аспектах данные антитела могут быть использованы для ассоциации или связывания с клеточной стенкой или мембраной и/или для подавления роста или репликации клетки. По этой причине данные антитела могут быть использованы для кратковременного или длительного прикрепления к клетке либо для того, чтобы служить посредниками при разрушении или поглощении клетки и/или лизисе. Для осуществления таргетирования микробную клетку можно подвергнуть действию антитела, выделенного из организма хозяина, либо произведенного векторами экспрессии и/или клетками-хозяевами, либо с помощью синтетической или полусинтетической химии, как подробно описано в настоящем описании. В качестве альтернативы антитела могут быть произведены самим организмом хозяина в ответ на введение пептидов, полипептидов или полинуклеотидов, раскрытых в настоящем описании. Понятно, что антитела по изобретению, так же как и соответствующие полинуклеотиды, векторы экспрессии, клетки-хозяева, пептиды и полипептиды, могут быть использованы для таргетирования различных микробов, например Methanobrevibacter ruminantium, которые являются основными метанопродуцентами у жвачных, и Methanobrevibacter smithii, которые являются основными метанопродуцентами у людей. В конкретных аспектах антитела либо соответствующие полинуклеотиды, векторы экспрессии, клетки-хозяева, пептиды или полипептиды доставляют субъектам в виде композиции, подробно описанной в настоящем описании, например, путем использования внутрирубцовых устройств замедленного высвобождения.
В различных аспектах средства по изобретению (например, один или несколько пептидов, полипептидов, полинуклеотидов и антител) могут быть включены в состав композиций, например фармацевтических композиций, особенно композиций вакцин. Данная композиция содержит, например: a) выделенный пептид или его модификацию, фрагмент, вариант или производное; b) выделенный полипептид или его модификацию, фрагмент, вариант или производное; c) выделенный полинуклеотид или его модификацию, фрагмент, вариант или производное; d) вектор экспрессии, включающий этот полинуклеотид; e) клетку-хозяина, включающую этот вектор экспрессии; либо (f) антитело или его модификацию, фрагмент, вариант или производное. Композиции по изобретению могут быть специально упакованы в качестве части набора для таргетирования и/или подавления микробных клеток, особенно клеток-метанопродуцентов, в соответствии с раскрытыми способами. Наборы содержат по меньшей мере одну композицию, как описано в настоящем описании, и инструкцию по использованию для таргетирования клеток или для подавления клеточного роста или репликации у метанопродуцентов или других микробов.
Для вакцин может быть использован целый ряд подходов для повышения иммуногенности антигенов, например, с использованием антигенных частиц; антигенных полимеров и полимеризации; эмульгаторов; микрокапсуляции антигенов, убитых бактерий и бактериальных продуктов; химических адъювантов и цитокинов; а также средств таргетирования антигенов на антиген-презентирующие клетки (для обзора см. Paul, Fundamental Immunology, 1999, Lippincott-Raven Publishers, New York, NY, p. 1392-1405).
Чтобы привести антигены в дисперсное состояние, может быть использовано осаждение квасцами. При использовании гидроксида алюминия или фосфата алюминия изучаемый антиген внедряется в нерастворимый, гелеобразный преципитат или же связывается с преформированным гелем путем электростатических взаимодействий. Антигены могут быть подвергнуты мягкой тепловой агрегации. Антигены, демонстрирующие самоагрегацию, также могут быть использованы. Липосомы, виросомы и иском-вакцинные комплексы (ISCOM) также полезны для формирования частиц.
Чтобы содействовать полимеризации, в качестве добавки к адъювантам могут быть использованы неионные блок-сополимеры, например полимеры полиоксипропилена и полиоксиэтилена, с которым может быть связан антиген. Они были выбраны в качестве компонентов комбинированной адъювантной композиции двумя компаниями: Syntex (SAF-1, Syntex Adjuvant Formulation-1) и Ribi Chemical Co. Углеводные полимеры маннозы (например, маннан) или β1-3 глюкозы (например, глюкан) могут быть использованы аналогичным образом (Okawa Y., Howard C.R., Steward M.W. Production of anti-peptide antibody in mice following immunization of mice with peptides conjugated to mannan. J Immunol Methods 1992; 142:127-131; Ohta M., Kido N., Hasegawa T., et al. Contribution of the mannan side chains to the adjuvant action of lipopolysaccharides. Immunology 1987; 60:503-507).
Различные средства могут быть использованы для эмульгирования, в том числе эмульсии «вода-в-масле», такие как адъюванты Фрейнда (например, неполный адъювант Фрейнда), или другие смеси, включающие микроскопические вкрапления воды, стабилизированные сурфактантом, таким как маннидмоноолеат в дисперсионной фазе минерального масла или других масел, таких как сквалан. Альтернативный подход состоит в использовании эмульсий «масло-в-воде», таких как MF5963 (Chiron), или других смесей, включающих масляные вкрапления сквалена и смесь эмульгаторов TWEEN80 и SPAN85 и химических иммуномодуляторов, таких как производные мурамил-дипептида, например мурамил-трипептид-фосфатидилэтаноламин (MTP-PE) (Valensi J-PM, Carlson J.R., Van Nest GA. Systemic cytokine profiles in Balb/c mice immunized with trivalent influenza vaccine containing MF59 oil emulsion and other advanced adjuvants. J Immunol 1994; 153:4029-4039). Небольшие количества полисорбата 80 и сорбиттриолеата также могут быть использованы в данных смесях. В качестве другого примера может быть использован SAF-165 (Syntex) или другие смеси «масло-в-воде», включающие Pluronic L121, сквален и TWEEN80.
Микрокапсулы, в частности биодеградируемые микрокапсулы, могут быть использованы для изготовления вакцин с контролируемым высвобождением (Chang TMS. Biodegradable, semi-permeable microcapsules containing enzymes hormones, vaccines and other biologicals. J Bioeng 1976; 1:25-32; Langer R. Polymers for the sustained release of macromolecules: their use in a single step method of immunization. Methods Enzymol 1981; 73:57-75). Цианоакрилаты представляют собой иную форму биодеградируемых полимеров. Так, например, в качестве адъюванта для пероральной иммунизации может быть использован поли(бутил-2-цианоакрилат) (O'Hagan D.T., Palin K.J., Davis S.S. Poly (butyl-2-cyanoacrylate) particles as adjuvants for oral immunization. Vaccine 1989; 7:213-216). Микрокапсулы полезны для вакцинации слизистой оболочки. Особенно подходят частицы очень малых размеров (наночастицы). Желудочному пищеварению может противостоять покрытый энтеросолюбильной оболочкой полимер, а также при необходимости покрытие веществами, повышающими всасывание в кишечнике.
Различные бактерии помимо убитых M. tuberculosis могут быть использованы в качестве адъювантов. Там, где препарат убитых бактерий сам по себе является высокоантигенным, адъювантные свойства распространяются на совместно вводимый антиген. Полезные организмы включают Bordetella pertussis, Corynebacterium parvum и Nippostrongylus brasiliensis. Пептидные и липидные компоненты бактерий также могут использоваться. Иллюстративные компоненты включают ацетилмурамоил-L-аланил-D-изоглютамин или мурамил-дипептид (MDP) (Ellouz F., Adam A., Ciorbaru R., Lederer E. Minimal structural requirements for adjuvant activity of bacterial peptidoglycans. Biochem Biophys Res Commun 1974; 59:1317-1325), MDP (мурабутид) (Chedid L., Parant M.A., Audibert F.M., et al. Biological activity of a new synthetic muramyl dipeptide devoid of pyrogenicity. Infect lmmun 1982; 35:417-424), треонил-MDP (Allison A.C., Byars N.E. An adjuvant formulation that selectively elicits the formation of antibodies of protective isotypes and cell-mediated immunity. J Immunol Methods 1986; 95:157-168) и MTP-PE. Липидные адъюванты могут включать липополисахаридные эндотоксины грамотрицательных бактерий, таких как Escherichia, Salmonella и Pseudomonas. В некоторых подходах структура липида А может быть химически модифицирована, чтобы снизить токсичность, но сохранить иммуногенность, например, как для монофосфорилированного липида А (MPL) (Johnson A.G., Tomai M., Solem L., Beck L., Ribi E. Characterization of non-toxic monophosphoryl lipid. Rev Infect Dis 1987; 9:S512).
Различные химические вещества могут быть использованы в качестве адъювантов, включая полинуклеотиды, такие как поли-I:C и поли-A:U, витамин D3, сульфат декстрана, инулин, диметилдиоктадецилбромид аммония (DDA), авридин, углеводные полимеры, аналогичные маннану, и димиколят трегалозы (Morein B., Lovgren-Bengtsson K., Cox J. Modern adjuvants: functional aspects. In: Kaufmann SHE, ed. Concepts in vaccine development. Berlin: Walter de Gruyter, 1996:243-263). Также включены полифосфазины (первоначально применявшиеся в качестве средств, способствующих замедленному высвобождению) и белок Leishmania, LeIF. Цитокины могут также использоваться в качестве адъювантов, например, IL-2, IL-4, IL-6, IL-10, GM-CSF и IFN-γ.
Для таргетирования антигенпрезентирующих клеток могут быть использованы C3d домены, Fc домены и CTB домены (Dempsey P.W., Allison MED, Akkaraju S., Goodnow C.C., Fearon D.T. C3d of complement as a molecular adjuvant: bridging innate and acquired immunity. Science 1996; 271:348-350; Sun J-B, Holmgren J., Czerkinsky C. Cholera toxin B subunit: an efficient transmucosal carrier-delivery system for induction of peripheral immunological tolerance. Proc Natl Acad Sci USA 1994; 91:10795-10799; Sun J-B, Rask C., Olsson T., Holmgren J., Czerkinsky C. Treatment of experimental autoimmune encephalomyelitis by feeding myelin basic protein conjugated to cholera toxin B subunit. Proc Natl Acad Sci USA 1996; 93:7196-7201).
Также могут быть использованы особые адъюванты для доставки через слизистую оболочку, например CT, LT и фрагмент C столбнячного токсина (Elson C.J., Ealding W. Generalized systemic and mucosal immunity in mice after mucosal stimulation with cholera toxin. J Immunol 1984; 132:2736-2743; Holmgren J., Lycke N., Czerkinsky C. Cholera toxin and cholera B subunit as oral- mucosal adjuvant and antigen vector systems. Vaccine 1993; 11:1179-1184; Clements J.D., Hartzog N.M., Lyon F.L. Adjuvant activity of Escherichia coli heat-labile enterotoxin and effect on the induction of oral tolerance in mice to unrelated protein antigens. Vaccine 1988; 6:269-277; Gomez-Duarte O.G., Galen J., Chatfield S.N., Rappuoli R., Eidels L., Levine M.M. Expression of fragment C of tetanus toxin fused to a carboxyl-terminal fragment of diphtheria toxin in Salmonella typhi CVD 908 vaccine strain. Vaccine 1995; 13:1596-1602).
Терапия и диагностика
Пептиды, полипептиды, полинуклеотиды и антитела по настоящему изобретению считаются полезными для здоровья. В конкретных аспектах вакцины, нацеленные на метанопродуценты, могут быть использованы для восстановления запаса энергии субъекта, которая обычно теряется в виде метана. Изобретение по этой причине связано с фармацевтической композицией (особенно композицией вакцины) в сочетании с фармацевтически приемлемой лекарственной основой для использования с любым из способов, рассмотренных выше. Такие фармацевтические композиции могут включать пептид, полипептид или антитела в сочетании с клеточным ингибитором. Альтернативно фармацевтические композиции могут включать полинуклеотид, вектор экспрессии или клетки-хозяева, как подробно описано в настоящем документе. Данные композиции могут быть введены отдельно или в комбинации с по меньшей мере одним другим средством, таким как стабилизирующий состав, который может вводиться в любой стерильной, биосовместимой фармацевтической лекарственной основе, в том числе, не исчерпываясь перечисленными, в физиологическом растворе, буферном физиологическом растворе, глюкозе и воде. Данные композиции могут быть введены субъекту отдельно или в комбинации с другими средствами, лекарствами (например, антимикробными препаратами) или гормонами.
В дополнение к активным ингредиентам эти фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включая наполнители и вспомогательные ингредиенты, которые способствуют переработке активных соединений в препараты, которые могут быть использованы фармацевтически. Более подробную информацию о методах составления рецептуры и введения можно найти в последнем издании Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, PA). Фармацевтические композиции, использованные в этом изобретении, могут вводиться любым числом способов, включая, но не исчерпываясь перечисленными, оральный, внутривенный, внутримышечный, внутриартериальный интрамедуллярный, интратекальный, внутрижелудочковый, трансдермальный, подкожный, внутрибрюшинный, интраназальный, энтеральный, локальный, сублингвальный или ректальный способы.
Фармацевтические композиции для перорального введения могут быть созданы с помощью фармацевтически приемлемых лекарственных основ, известных в данной области, в дозировках, подходящих для перорального введения. Такие лекарственные основы дают возможность фармацевтическим композициям быть созданными в виде таблеток, пилюлей, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и тому подобных для приема внутрь субъектом. Фармацевтические препараты для перорального применения могут быть получены путем сочетания активных соединений с твердым наполнителем, по желанию - растирания полученной смеси и переработки смеси гранул, после добавления соответствующих вспомогательных ингредиентов, если желательно, чтобы получить сердцевины таблеток или драже. Подходящие наполнители представляют собой такие углеводные или белковые наполнители, как сахара, в том числе лактоза, сахароза, маннит или сорбит; крахмалы из кукурузы, пшеницы, риса, картофеля и других растений; целлюлоза, такая как метилцеллюлоза, гидроксиметилцеллюлоза или карбоксиметилцеллюлоза натрия; смола, включая гуммиарабик и трагакант; и белки, такие как желатин и коллаген. При желании могут быть добавлены дезинтегрирующие или солюбилизирующие средства, такие как перекрестно сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Фармацевтические препараты, которые могут быть использованы перорально, включают сборно-разборные твердые капсулы из желатина, а также мягкие, запечатанные капсулы из желатина и покрытия, такого как глицерин или сорбит. Сборно-разборные твердые капсулы могут содержать активные ингредиенты, смешанные с наполнителем или связующими веществами, такими как лактоза и крахмалы, смягчающие компоненты, такие как тальк, стеарат магния, и, факультативно, стабилизаторы. В мягких капсулах активные соединения могут быть растворены или суспендированы в соответствующих жидкостях, таких как жирные масла, растворе или жидком полиэтиленгликоле в присутствии или отсутствии стабилизаторов. Дражированные сердцевины могут быть использованы в сочетании с подходящими покрытиями, такими как концентрированные растворы сахара, которые могут также содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, лаковые растворы, а также подходящие органические растворители или смеси растворителей. Красители и пигменты могут быть добавлены к покрытиям таблеток или драже для идентификации продукции или в качестве отличительного признака количества активного вещества, т.е. дозировки.
Фармацевтические составы, подходящие для парентерального введения, могут быть созданы на основе водных растворов, предпочтительно физиологически совместимых буферов, таких как раствор Хэнкса, раствор Рингера или буферный физиологический раствор. Водные суспензии для инъекции могут содержать вещества, повышающие вязкость суспензии, такие как натриевая карбоксиметилцеллюлоза, сорбитол или декстран. Дополнительно суспензии активных соединений могут быть получены в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или инертные основы включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, либо липосомы. Нелипидные поликатионные аминополимеры также могут использоваться для доставки. Факультативно, данная суспензия может также содержать подходящие стабилизаторы или средства, увеличивающие растворимость соединений, чтобы обеспечить получение высококонцентрированных растворов. Для локального или назального введения в рецептуре используются смачивающие вещества, подходящие для проникновения через конкретный барьер. Такие смачивающие вещества широко известны в данной области.
Фармацевтические композиции по настоящему изобретению могут быть изготовлены способом, известным в данной области, например, с помощью обычных процессов смешивания, растворения, дробления, производства драже, растирания в порошок, эмульгирования, расфасовки по капсулам, инкапсуляции в липосомы или лиофилизации. Фармацевтическая композиция может быть приготовлена в виде соли и может быть образована многими кислотами, в том числе, не исчерпываясь перечисленными, соляной, серной, уксусной, молочной, винной, яблочной, янтарной и т.д. Соли, как правило, лучше растворимы в водных или других протонированных растворителях, чем соответствующие формы их свободных оснований. В других случаях предпочтительным препаратом может являться лиофилизированный порошок, который может содержать что-либо на выбор или все из следующего: 1-50 мМ гистидин, 0,1%-2% сахароза и 2%-7% маннит, в диапазоне рН от 4,5 до 5,5, что комбинируется с буфером перед использованием. После изготовления фармацевтических композиций их можно поместить в подходящую стандартную тару и маркировать этикеткой для лечения указанных заболеваний. Для введения композиции по изобретению такая маркировка должна включать количество, частоту и способ введения.
Фармацевтические композиции, пригодные для использования по изобретению, включают композиции, в которых активные ингредиенты содержатся в количестве, эффективном для достижения поставленной цели. Для любого соединения терапевтически эффективная доза может быть приблизительно подсчитана сначала либо в тестах на клетках, например на микробных клетках или, в частности, на клетках метанопродуцентов, либо у моделей на животных, как правило, мышах, кроликах, собаках и свиньях, или видах жвачных животных, таких как овца, корова, олени и козы. Модели на животных также могут быть использованы для определения подходящей концентрации и пути введения. Такая информация может быть использована для определения эффективных доз и способов приема. Нормальная дозировка количеств может варьироваться от 0,1 до 100000 мкг, вплоть до суммарной дозы около 1 г, в зависимости от пути введения. Методологические принципы определения конкретной дозировки и способы доставки приводятся в литературе и в целом доступны практикующим в данной области. Специалисты в данной области будут использовать различные рецептуры для полинуклеотидов и для полипептидов. Аналогично доставка пептидов или полипептидов, полинуклеотидов или антител будет специфична для конкретных клеток, заболеваний, мест и т.д.
Точная дозировка будет определяться врачом с учетом факторов, имеющих отношение к субъекту, которому необходимо лечение. Способ применения и дозы корректируются для обеспечения достаточных уровней активного средства либо для поддержания желательного эффекта. Факторы, которые могут быть приняты во внимание, включают тяжесть болезненного состояния, общее состояние здоровья субъекта, возраст, вес и пол, рацион, время и частоту введения, лекарственную(ые) комбинацию(и), чувствительность реакции, а также толерантность/ответ на терапию. Фармацевтические композиции пролонгированного действия можно вводить каждые 3-4 дня, каждую неделю или раз в две недели в зависимости от периода полувыведения и почечного клиренса конкретного состава. Композиции могут вводиться совместно с одним или более дополнительным антимикробным средством, в том числе с соединениями против метаногенеза (например, бромэтансульфокислота), антителами и фрагментами антител, лизирующими ферментами, пептид-нуклеиновыми кислотами, антимикробными пептидами и другими антибиотиками, как подробно описано в настоящем документе. Совместное введение может быть одновременным или последовательным либо может чередоваться с повторным введением.
Особенно полезны для композиций по изобретению (например, фармацевтических композиций) составы или механизмы замедленного высвобождения. Например, внутрирубцовые устройства включают, не исчерпываясь перечисленными, Time Capsule™ Bolus range от компании Agri-Feeds Ltd., Новая Зеландия, изначально разработанное внутри компании AgResearch Ltd., Новая Зеландия, как раскрыто в WO 95/19763 и NZ 278977, а также CAPTEC от Nufarm Health & Sciences, подразделения Nufarm Ltd., Окленд, Новая Зеландия, как раскрыто в AU 35908178, PCT/AU81/100082 и Laby et al., 1984, Can. J. Anim. ScL 64 (Suppl), 337-8, и все включены в настоящий документ в виде ссылки. В качестве конкретного примера данное устройство может включать пружину и поршень, которые выжимают состав, преодолевая сопротивление отверстия в конце цилиндра.
В качестве дополнительного варианта осуществления изобретение связано с композицией для водной добавки, например композицией для вливания в ротовую полость животного или пищевой добавкой, например компонента корма жвачных, для использования с любым из способов, рассмотренных выше. В конкретных аспектах данная пищевая добавка содержит не менее одного съедобного растительного материала, а также пептид или полипептид по изобретению. Альтернативно пищевая добавка содержит по меньшей мере один съедобный растительный материал и полипептид или пептид либо полинуклеотид, кодирующий данный пептид или полипептид, раскрытые в настоящем описании, например вектор экспрессии или клетку-хозяина, включающего данный вектор экспрессии. В частности, данная композиция также включает клеточный ингибитор как гибридизованный или связанный с результирующей последовательностью. Предпочтительный растительный материал включает что-либо из сена, травы, зерна или муки, например сено бобовых, травяное сено, кукурузный силос, травяной силос, силос бобовых, зерно кукурузы, овес, ячмень, барду винокурен, пивоварную барду, муку соевых бобов и муку семян хлопчатника. В частности, травяной силос полезен в качестве составной части пищи жвачных животных. Растительный материал может быть генетически модифицирован, чтобы содержать один или более компонентов по изобретению, например один или более полипептид или пептид, полинуклеотид или вектор.
В другом варианте осуществления антитела, которые специфически связывают пептиды, полипептиды или полинуклеотиды по изобретению, могут быть использованы для определения присутствия микробов, особенно метанопродуцентов, или в тестах для контроля титров таких микробов. Данные антитела, полезные для диагностических целей, могут быть получены таким же образом, как описано выше. Диагностические тесты включают способы, которые используют данные антитела и метки для детекции пептида или полипептида в жидкостях организма человека или экстрактах из клеток или тканей. Данные антитела могут быть использованы с модификациями или без них, а также могут быть помечены путем присоединения к ним либо ковалентно, либо нековалентно репортерной молекулы. Может быть использован широкий спектр репортерных молекул, известных в данной области, некоторые из которых описаны выше.
Множество протоколов измерения уровней пептида, полипептида или полинуклеотида известны в данной области (например, ELISA, RIA и FACS) и служат основой диагностики наличия или титров микробов, особенно метанопродуцентов. Нормальные или стандартные титры установлены путем объединения биологических жидкостей или клеточных экстрактов, взятых у здоровых субъектов, например у здоровых людей или жвачных, с антителом в условиях, подходящих для образования комплекса. Количество образований стандартных комплексов можно подсчитать различными способами, но предпочтительно фотометрическим способом. Количества пептида, полипептида или полинуклеотида, экспрессируемого субъектом, контрольные и обработанные образцы (например, образцы от вакцинированных субъектов) сравнивают со стандартными значениями. Отклонение значений для субъектов от стандартных значений устанавливает параметры для определения наличия или титров данного микроба.
В другом варианте осуществления по изобретению данные полинуклеотиды могут быть использованы для диагностических целей с использованием специфической гибридизации и/или методов амплификации. Полинуклеотиды, которые могут быть использованы, включают олигонуклеотиды, комплементарные молекулы РНК и ДНК, а также PNA. Данные полинуклеотиды могут быть использованы для детекции и количественного анализа экспрессии генов в образцах, в которых экспрессия может коррелировать с наличием или титрами микроба. Можно использовать диагностический тест для разграничения отсутствия, наличия и изменения микробных титров, а также для контроля титров в течение терапевтического вмешательства.
В одном аспекте гибридизация с зондами ПЦР может быть использована для идентификации последовательности нуклеиновых кислот, особенно геномных последовательностей, кодирующих пептиды или полипептиды по изобретению. Специфичность зонда, создан ли он из высокоспецифичной области, например 10 уникальных нуклеотидов в 5' регуляторной области, либо из менее специфичной области, например в 3' кодирующей области, а также строгость условий гибридизации или амплификации (максимальной, высокой, средней или низкой) определят, будет ли зонд идентифицировать только последовательности природного происхождения, аллели, либо родственные последовательности. Зонды также могут использоваться для выявления родственных последовательностей и должны предпочтительно содержать не менее 50% нуклеотидов любой из кодирующих последовательностей. Гибридизационные зонды по «связанному» изобретению могут быть ДНК или РНК и происходить от нуклеотидной последовательности SEQ ID NO:703-1395 либо их комплементов, или модифицированных последовательностей, или геномных последовательностей, включая промоторные и энхансерные элементы природного происхождения.
Способы получения специфичных гибридизационных зондов для ДНК включают клонирование последовательности нуклеиновых кислот в векторы для производства мРНК зондов. Такие векторы известны в данной области, коммерчески доступны и могут быть использованы для синтеза РНК-зондов in vitro путем добавления соответствующих РНК-полимераз и соответствующих меченых нуклеотидов. Гибридизационные зонды могут быть помечены различными репортерными группами, например радионуклидами, такими как32P или35S, или ферментативными метками, такими как щелочная фосфатаза, присоединенная к зонду через авидин/биотиновые системы соединений, и им подобные. Данные полинуклеотиды могут быть использованы в саузерн-блоттинг или нозерн-блоттинг анализах, дот-блот-анализе или других мембранных технологиях, в ПЦР-технологии либо в экспресс-пробе с импрегнированным субстратом (dipstick), при скрининге рандомизированных пептидных библиотек, иммобилизованных на твердых штырьках (pin), в иммуноферментных анализах (ELISA) или в микрочипах, использующих жидкости или ткани биопсий субъекта для выявления присутствия или титров микроба. Такие качественные и количественные методы хорошо известны в данной области.
В конкретном аспекте в различных анализах могут быть полезны данные последовательности нуклеиновых кислот, меченные стандартными методами, и добавленные в образец жидкости или ткани субъекта в условиях, подходящих для гибридизации и/или амплификации. После соответствующего периода инкубации образец промывают, а сигнал количественно оценивают и сравнивают со стандартным значением. Если общая сумма сигналов в исследуемом образце существенно отличается от сравниваемого контрольного образца, наличие измененных концентраций нуклеотидных последовательностей в образце является индикатором наличия или титров микроба. Такие анализы могут также применяться для оценки эффективности конкретного режима вакцинации в исследованиях на животных, в клинических испытаниях или при контроле лечения субъекта.
Для обеспечения основы диагностики наличия или титров микроба установлен нормальный или стандартный профиль экспрессии. Это можно осуществить путем объединения биологических жидкостей или клеточных экстрактов, взятых у нормальных субъектов, с полинуклеотидом или его фрагментом в условиях, пригодных для гибридизации и/или амплификации. Стандартные титры могут быть количественно определены путем сравнения значений, полученных от нормальных субъектов, со значениями, полученными в эксперименте, в котором используется известное количество практически очищенного полинуклеотида. Стандартные значения, полученные для нормальных образцов, можно сравнить со значениями, полученными для образцов от субъектов, подвергнутых воздействию роста микроорганизмов. Отклонение между значениями для стандарта и субъекта используется для установления наличия или титров данного микроорганизма.
Как только микроорганизм идентифицирован и инициирован протокол вакцинации, на регулярной основе могут повторяться анализы гибридизации и/или амплификации, чтобы определить, начинает ли снижаться уровень экспрессии у субъекта по отношению к наблюдаемому у нормального субъекта. Результаты, полученные из последовательных тестов, могут быть использованы, чтобы показать эффективность вакцинации в течение периода от нескольких дней до нескольких месяцев.
Специальное диагностическое применение олигонуклеотидов, спроектированных на основе данных последовательностей нуклеиновых кислот, могут включать использование полимеразной цепной реакции. Такие олигомеры могут быть химически синтезированы, созданы ферментативно или произведены in vitro. Олигомеры предпочтительно состоят из двух нуклеотидных последовательностей, одна в смысловой ориентации (5'→3'), а другая в антисмысловой ориентации (3'→5'), применяемых при оптимальных условиях для идентификации конкретных генов и заболеваний. Те же два олигомера, встроенные серии олигомеров или даже вырожденный пул олигомеров могут быть использованы при менее строгих условиях для детекции и/или количественного определения близкородственных последовательностей ДНК или РНК.
Способы, которые могут также быть использованы для количественного анализа экспрессии, включают мечение радиоизотопами или биотинилирование нуклеотидов, совместную амплификацию контрольной нуклеиновой кислоты, а также стандартные кривые, на которые интерполируются экспериментальные результаты (Melby, P.C. et al. (1993) J. Immunol. Methods, 159:235-244; Duplaa, C. et al. (1993) Anal. Biochem. 229-236). Скорость количественного анализа серийных образцов может быть увеличена путем выполнения теста в формате ELISA, где интересующий олигомер представлен в различных разведениях, а спектрофотометрический или колориметрический сигнал дает быстрое количественное определение.
В дальнейших вариантах осуществления олигонуклеотиды или более длинные фрагменты, полученные из любых данных полинуклеотидов, описанных в настоящем описании, могут быть использованы в качестве мишеней в микрочипах. Микрочип может быть использован для контроля уровня экспрессии большого числа генов одновременно (генерации образа матрицы), а также выявления генетических вариантов, мутаций и полиморфизмов. Эта информация может быть использована для определения функции гена, чтобы понять генетические основы заболевания, диагностировать заболевание, а также разработать и осуществлять контроль за воздействием терапевтических средств. В одном варианте осуществления данный микрочип изготавливается и используется в соответствии со способами, известными в данной области, которые были описаны в заявке РСТ WO 95/11995 (Chee et al.), в Lockhart, D.J. et al. (1996; Nat. Biotech. 14:1675-1680) и в Schena, M. et al. (1996; Proc. Natl. Acad. Sci. 93:10614-10619).
В одном аспекте олигонуклеотиды могут быть синтезированы на поверхности микрочипов с использованием процедуры химического присоединения и аппарата нанесения струйной печати, такого как описан в заявке РСТ WO 95/251116 (Baldeschweiler et al.). В другом аспекте могут быть использованы матрица с координатной сеткой, аналогичная дот-блоту или слот-блоту (аппарат HYBRIDOT, Life Technologies), чтобы распределить и связать фрагменты кДНК или олигонуклеотидов с поверхностью субстрата с использованием вакуумной системы, тепловых, ультрафиолетовых, механических и химических процедур присоединения. В еще одном аспекте матрица может производиться вручную или с помощью имеющихся в продаже устройств, материалов и машин (в том числе многоканальные дозаторы и роботизированные инструменты; Brinkmann, Westbury, N.Y.) и может включать, например, 24, 48, 96, 384, 1024, 1536 или 6144 точечных углублений или лунок (например, как в многолуночном планшете) или больше или любое другое число отделов, от 2 до 1000000, что делает пригодным эффективное использование коммерчески доступных приборов.
В целях проведения анализа проб с помощью микрочипов из биологических образцов экстрагировали полинуклеотиды. Данные биологические образцы могут быть получены из каких-либо телесных жидкостей (крови, мочи, слюны, слизи, желудочного сока и т.д.), культивированных клеток, биопсий или других препаратов тканей. Для изготовления зондов данные полинуклеотиды, экстрагированные из образца, использовали для создания последовательностей нуклеиновых кислот, которые комплементарны нуклеиновым кислотам на микрочипе. Если микрочип содержит кДНК, антисмысловые РНК являются подходящими зондами. Таким образом, в одном аспекте мРНК используется для получения кДНК, которая в свою очередь и в присутствии флуоресцентных нуклеотидов используется для получения фрагментов или антисмысловых РНК-зондов. Эти флуоресцентно меченые зонды инкубируют с микрочипом, чтобы последовательности зонда гибридизовались с олигонуклеотидными кДНК микрочипов. В другом аспекте последовательности нуклеиновых кислот, использованные в качестве зондов, могут включать полинуклеотиды, фрагменты и комплементарные или антисмысловые последовательности, полученные с использованием рестриктаз, ПЦР технологий и наборов для олигонуклеотидного мечения (Amersham Pharmacia Biotech), хорошо известных в области технологии гибридизации.
В другом варианте осуществления изобретения пептиды или полипептиды по изобретению либо их функциональные или иммуногенные фрагменты или олигопептиды могут быть использованы для скрининга библиотек соединений в любом из различных методов скрининга лекарственных средств. Фрагмент, используемый в таком скрининге, может находиться свободным в растворе, прикрепленным к твердой подложке, находиться на клеточной поверхности или внутри клеток. Можно оценить образование связывающих комплексов между пептидом или полипептидом и тестируемым средством.
Один из методов скрининга лекарственных средств, которые могут быть использованы, предусматривает высокопроизводительный скрининг соединений, обладающих подходящей связывающей аффинностью к пептиду или полипептиду, представляющему интерес, как описано в опубликованной заявке РСТ WO 84/03564. В этом методе большое количество различных низкомолекулярных тестируемых соединений синтезированы на твердой подложке, такой как пластиковые штырьки или какая-либо другая поверхность. Тестируемым соединениям дают возможность прореагировать с пептидом, или полипептидом или их фрагментами и промывают. Связавшийся пептид или полипептид затем детектируют методами, хорошо известными в данной области. Очищенный пептид или полипептид можно также нанести непосредственно на планшеты для использования в вышеупомянутых методах скрининга лекарственных средств. Альтернативно могут быть использованы ненейтрализующие антитела для захвата пептида и его иммобилизации на твердую подложку.
В другом методе можно использовать конкурентный анализ скрининга лекарственных средств, в котором нейтрализующие антитела, способные связывать пептид или полипептид, специфически конкурируют с тестируемым соединением за связывание с данным пептидом или полипептидом. Таким способом антитела могут быть использованы для детекции присутствия тестируемого соединения, которое имеет один или несколько сайтов связывания антигена, общих с антителом.
ПРИМЕРЫ
Примеры, описанные в настоящем описании, предназначены для целей иллюстрации вариантов осуществления по изобретению. Другие варианты осуществления, способы и виды анализа находятся в пределах компетенции обыкновенных специалистов в области молекулярной диагностики, и подробно описывать их далее нет необходимости. Другие варианты осуществления в пределах данной области считаются частью этого изобретения.
ПРИМЕР 1: Оценка размеров генома
Methanobrevibacter ruminantium, штамм M1T (DSM1093), выращивали на среде BY+ (минимальная среда, Joblin et al., 1990), составленной из (г/л): NaCl (1), KH2PO4 (0,5), (NH4)2SO4 (0,25), CaCl2·2H2O (0,13), MgSO4·7H2O (0,2), K2HPO4 (1), осветленной рубцовой жидкости (300 мл), дистиллированной H2O (360 мл), NaHCO3 (5), резазурина (0,2 мл), L-цистеин-HCl (0,5), дрожжевого экстракта (2) и раствора микроэлементов Балха (10 мл) (дополнительные микроэлементы; Balch et al., 1979), который содержит (г/л): нитрилотриуксусную кислоту (1,5), MgSO4·7H2O (3), MnSO4·H2O (0,5), NaCl (1), FeSO4·7H2O (0,1), CoCl2·6H20 (0,1), CaCl2·2H2O (0,1), ZnSO4·7H2O (0,1), CuSO4·5H2O (0,01), AlK(SO4)2·12H2O (0,01), H3BO3 (0,01), Na2MoO4·2H2O (0,01), NiSO4·6H20 (0,03), Na2SeO3 (0,02) и Na2WO4·2H2O (0,02). Геномную ДНК экстрагировали путем замораживания клеточного дебриса в жидком N2 и размельчения с использованием заранее охлажденных, стерилизованных ступки и пестика. Клеточные гомогенаты погружали в агарозные вставки, и последующие манипуляции проводились во вставках, чтобы уменьшить физическую фрагментацию геномной ДНК. Расщепления проводили рестриктазами и фрагменты ДНК разделяли с помощью гель-электрофореза в пульсирующем поле (PFGE).
ПРИМЕР 2: Клонирование и секвенирование ДНК
Геномную ДНК M. ruminantium секвенировали согласно Agencourt Biosciences Corporation (Massachusetts, USA) с помощью подхода «стрельба дробью» с клонированием стохастических геномных фрагментов (Fleischmann et al., 1995), а также согласно Macrogen Corporation (Rockville, MD, USA) с помощью пиросеквенирования. Вкратце, в Escherichia coli были созданы библиотеки ДНК M. ruminantium посредством стохастического физического разрушения геномной ДНКи разделения фрагментов с помощью гель-электрофореза. Большие фрагменты в диапазоне 40 т.п.о. извлекали из геля и использовали для создания фосмидной библиотеки больших вставок. Фрагменты ДНК в диапазоне от 2 до 4 т.п.о. извлекали и использовали для создания плазмидной библиотеки малых вставок.
Клоны, полученные в результате дополнительного подращивания библиотек больших и малых вставок, и их фосмидную или плазмидную ДНК выделяли и определяли их последовательности, применяя технологию высокопроизводительного секвенирования. Было секвенировано достаточное число клонов, чтобы теоретически 8 раз перекрыть геном M. ruminantium. Дополнительное перекрытие последовательностей получили посредством пиросеквенирования стохастически нарезанных фрагментов геномной ДНК (Macrogen Corporation) до окончательного теоретического перекрытия генома примерно в 10 раз.
ПРИМЕР 3: Последовательность сборки и аннотирование
Последовательности ДНК выравнивали, чтобы найти перекрытия последовательностей, и монтировали в непрерывные (контиги) последовательности с помощью программы Paracel Genome Assembler (Paracel Inc, CA, USA) и пакета программ Штадена (Staden et al., 1998) в сочетании с последовательностью из ПЦР как прямой, так и обратной. Контиги анализировали с помощью программы обнаружения открытых рамок считывания (ORF) GLIMMER (Gene Locator interpolated Markov Model ER, Delcher et al., 1999), и каждую ORF анализировали программой BLAST (Basic Local Alignment Search Tool (Altschul et al., 1997), включающей разрывы, относительно неизбыточной базы нуклеотидных и белковых структур национального центра биотехнологической информации (NCBI).
Контиги из последовательности 8-кратного предварительного этапа объединяли случайным образом посредством искусственных соединений последовательностей, создавая «псевдомолекулу», и представляли на рассмотрение Института исследования генома - The Institute for Genomic Research, (TIGR, DC, USA) - для автоаннотирования. Контиги, смонтированные по результатам 10-кратного пиросеквенирования, повторно анализировали с помощью программы GLIMMER и ORF автоаннотировали с помощью программы GAMOLA (Global Annotation of Multiplexed On-site Blasted DNA sequences; Altermann and Klaenhammer, 2003). Найденные автоматически аннотирования впоследствии проверяли вручную. ORF классифицировали по функции, используя базу данных по кластерам ортологичных белков (COG) (порог 1e-02) (Tatusov et al., 2001).
Белковые мотивы определяли с помощью HMMER (hypertext transfer protocol://hmmer.wustl.edu), используя библиотеки PFAM HMM и TIGRFAM, с общим и местным выравниванием (hypertext transfer protocol://pfam.wustl.edu), а также стандартные и фрагментированные модели TIGRFAM HMMs (hypertext transfer protocol://worid wide web.tigr.org/TIGRFAMs) соответственно (порог 1e-02). тРНК определяли с помощью TRNASCAN-SE (Lowe and Eddy, 1997), а нуклеотидные повторы определяли с использованием пакетов программного обеспечения KODON (Applied Maths, Austin, TX, USA) и REPUTER (Kurtz and Schleiermacher, 1999). Геномный атлас образов создавали с помощью GENEWIZ (Jensen et al., 1999). Реконструкции метаболических путей из расчетного генома открытых рамок считывания (ORFeome) M. ruminantium проводили совместно с он-лайн базой данных Киотской энциклопедии генов и геномов (KEGG, Kanehisa et al., 2004) с использованием самостоятельно разработанного программного обеспечения (PathwayVoyager; Altermann and Klaenhammer, 2005).
ПРИМЕР 4: Результаты секвенирования и анализ
Оценка размера генома M. ruminantium посредством расщепления рестриктазами геномной ДНК и разделение фрагментов по размерам посредством PFGE указывают на одну хромосому длиной приблизительно 2,5-2,9 м.п.о. Первоначальное секвенирование клонов больших и малых вставок (6-кратное предварительное перекрытие) и монтаж последовательности в контиги показал, что область генома длиной 40 т.п.о. представлена крайне избыточно (>20-кратно), особенно в библиотеке малых вставок. Возможно, это произошло из-за высокого числа копий плазмиды (хотя не было выявлено никаких внехромосомных ДНК) либо из-за лизогенного бактериофага, реплицируемого при росте культуры, используемой для экстракции ДНК. Из-за погрешностей определения этих больших последовательностей проводили дополнительное секвенирование (2-кратное теоретическое перекрытие генома) только для клонов больших вставок, что дало в результате 8-кратное перекрытие на основании секвенирования по Сэнгеру. Последовательность 8-кратного предварительного этапа смонтировали в 756 контигов, соединенных через 105 структурных мостиков. Проводили дальнейшее пиросеквенирование до дополнительного 10-кратного перекрытия, и включение этих последовательностей в монтаж привело в результате к сокращению числа контигов до 27. Последующее закрытие разрывов с помощью методов обратной ПЦР и ПЦР длинных фрагментов сократили число контигов до 14.
Совмещенная длина последовательности из 14 контигов показывает, что данный геном несколько длинее (2920443 п.о.), чем размер, оцененный по PFGE (фиг. 1A), и значительно больше, чем геном его ближайшего родственника М. smithii (1,9 м.п.о.). Общее содержание G+C, равное 32,7%, близко к сообщавшемуся диапазону от 27,5% до 31,6%, опубликованному для штаммов M. ruminantium (Balch et al., 1979). Анализ последовательности предсказывает 2672 ORF, а общее число попаданий в семейства белков (TIGRFam и PFam) и кластеров ортологичных групп (COG) указаны на фиг. 1B. Присутствуют все гены, по предсказаниям принимающие участие в метаногенезе, от H2 + CO2 и формиата (фиг. 1C и фиг. 6A-6C). Однако предварительная последовательность M. ruminantium не содержит системы метил-коэнзим редуктазы II (mcr II или mrt). В других метанопродуцентах кластер mcrII кодирует изофермент фермента метил CoM редуктазы I, который активируется в процессе роста при высоком парциальном давлении H2 (Reeve et al., 1997). H2 быстрыми темпами используется в рубце и не накапливается в высокой концентрации, так что M. ruminantium, как представляется, адаптирован для использования низких концентраций H2 только посредством системы mcrI.
Сравнение предварительного генома M. ruminantium с близкородственными M. smithii и Mt. thermoautotrophicus выявило ряд областей различий. Некоторые из генетических различий кодируют очень большие поверхностные белки из большого семейства аспарагин/треонин-богатый белок, которые могут содержать повторные последовательности CPOMP и DUF11 (полиморфные белки наружной мембраны хламидий и домен неизвестной функции соответственно), вероятно опосредующие взаимодействия с поверхностями или другими микроорганизмами в окружающей среде рубца (см. фиг. 7A-7C). Сходные повторные последовательности также найдены в больших поверхностных белках, кодируемых геномами и Ms. stadtmanae, и M. smithii (Samuel et al., 2007).
Ранее сообщалось, что M. ruminantium способен инкапсулироваться (Smith and Hungate, 1958), и анализ последовательностей показывает, что этот процесс кодируется более 50 генами (гликозил трансфераз (GT), других трансфераз, эпимераз и транспортных белков), участвующими в синтезе и экспорте экзополисахаридов, подтверждая факт отделки его поверхности полисахаридами (см. фиг. 8A-8C). У M. ruminantium есть по меньшей мере 30 гликозил трансфераз (6 GT1, 21 GT2, 2 GT4 и 1 GT66; см. фиг. 8A-8C) по сравнению с 28 у M. smithii (1 GT1; 22 GT2; 4 GT4 и 1 GT66) и 41 у M. stadtmanae (2 GT1; 26 GT2; 12 GT4 и 1 GT66) (Samuel et al., 2007; Fricke et al., 2006; Coutinho and Henrissat, 1999). Это довольно большое число генов, предназначенных для кодировки этими организмами поверхностных полисахаридов, и предполагается, что это является важным фактором для выживания в среде желудочно-кишечного тракта.
Анализ нуклеотидных повторов показал присутствие в геноме M. ruminantium по меньшей мере двух областей прямых повторов с диспергированными спейсерами (SPIDR). SPIDR представляют собой нуклеотидные повторы (обычно менее 40 п.о.), сложенные из идентичных сегментов, разделенных гетерологическими последовательностями, и впервые описанные у прокариот (Jansen et al., 2002). SPIDR I у M. ruminantium имеет уникальную организацию генов, состоящую из двух идентичных структурных повторов фланкирующей области длиной 17 т.п.о., содержащих кластер ассоциированных cas-генов. Сходные структурные повторы найдены в геномах ряда метанопродуцентов. Methanocaldococcus jannaschii содержит 18 копий мультикопийных повторяющихся нуклеотидных элементов (Bult et al., 1996), состоящих из длинного (391-425 п.о.) повторяющегося сегмента, за которым следуют до 25 коротких (27-28 п.о.) повторяющихся сегментов, которые сами разделены на уникальные последовательности от 31 до 51 п.о. Геном Ms. stadtmanae содержит область длиной 4,8 т.п.о., в которой элемент длиной 30 п.о. повторяется 59 раз (Fricke et al., 2006). Mt. thermoautotrophicus содержит два расширенных повтора (3,6 и 8,6 т.п.о.), которые содержат повторяющуюся последовательность длиной 372 п.о., а затем 47 и 124 копии одной и той же повторяющейся последовательности длиной 30 п.о., разделенные уникальной последовательностью от 34 до 38 п.о. в длину (Smith et al., 1997). Биологическая функция этих SPIDR неизвестна, хотя современная гипотеза предполагает, что эта система является функциональным аналогом систем эукариот малых интерферирующих РНК и представляет собой защитную систему против чужеродных репликонов, действующих по принципу антисмысловых РНК (Jansen et al., 2002; Haft et al., 2005; Godde and Bickerton/2006; Makarova et al., 2006).
В геноме M. ruminantium также кодировано большое количество ORF, предположительно кодирующих белки с трансмембранными доменами, которые, следовательно, должны содержать области, экспонированные на клеточной поверхности (фиг. 9A, 9B и 9C).
ПРИМЕР 5: Получение и тестирование антител
Препараты клеточных стенок M. Ruminantium
Клеточные стенки M. ruminantium получали замораживанием клеточного дебриса в жидком N2 и размельчением с использованием заранее охлажденных, стерилизованных ступки и пестика. Мелкоразмолотые клетки ресуспендировали в трипсин-фосфатном буфере (40 мг трипсина/200 мл 0,1 М фосфатного буфера, рН 7,9) и инкубировали при 37°С в течение 2 часов. Препарат затем центрифугировали при 48000g в течение 30 минут при 4°С и полученный осадок дважды промывали стерильной дистиллированной H2O и лиофильно высушивали.
Получение антител
Девять пептидных последовательностей, которые согласно прогнозам локализованы на наружной стороне клетки, идентифицированы в геноме М. ruminantium и выбраны в качестве потенциальных антигенов. По пять миллиграммов каждого из этих пептидов синтезировали (Invitrogen) и их чистоту проверяли масс-спектроскопией. Пептиды и кодирующие их последовательности приведены на фиг. 4. Полные последовательности нуклеиновых кислот и аминокислот приведены на фиг. 5. По два миллиграмма каждого пептида оставляли неконъюгированными для ELISA, а 3 мг конъюгировали с гемоцианином фисуреллы (KLH) для иммунизации животных.
Программа вакцинации приведена на фиг. 2 и протекала следующим образом. Для каждой иммунизации использовали одну овцу (1-3 лет), у которой предварительно забирали столько крови, чтобы получить 2-5 мл преиммунной сыворотки в день 0. За этим последовали первичные внутрикожные (ID) инъекции 200 мкг конъюгированного пептида в CFA (полный адъювант Фрейнда) в 10-15 мест в день 0. Внутрикожные (ID) инъекции 200 мкг KLH-пептида в IFA (неполный адъювант Фрейнда) в 10-15 мест были сделаны в день 14 и 200 мкг KLH-пептида в CFA в 10-15 мест в день 28. Еще пять внутрикожных (ID) инъекций по 200 мкг KLH-пептида в IFA в 10-15 мест были сделаны в дни 56, 70, 84, 98 и 112. Четыре контрольных забора крови (2-5 мл) проводили в дни 42, 56, 84 и 112. Производственный забор крови, давший около 1000 мл антисывороток, проводили в конце стандартного протокола.
Титр антител определяли с помощью иммуноферментного анализа (ELISA) с химерным пептидом-GGG (пептид-козий гамма-глобулин), иммобилизованным на твердую фазу (0,1 мкг/100 мкл/лунку) высокосвязывающего 96-луночного планшета. Сначала сыворотку разбавляли в 50 раз, а затем дополнительно разбавляли в виде 2-кратных серийных разведений. ELISA-титр рассчитывали как предполагаемый коэффициент разбавления, дающий в итоге значение OD при 405 нм порядка 0,2, полученное из нелинейного регрессионного анализа кривой серийных разведений. Детекцию осуществляли, применяя конъюгат вторичного антитела с HRP и субстрат ABTS.
Образование антител овцы в ответ на вакцинацию показан на фиг. 3. Все сыворотки овец на 6-й неделе имели титры, которые были по меньшей мере в 32 раза выше, чем до иммунизации (1:1600). Наиболее антигенным препаратом был mtrD-пептид, титр которого был в 1024 раз выше, чем титр до иммунизации. Наименее иммуногенными препаратами были mtrE-пептид, ORF508 и ORF819 пептиды поверхностного белка. Препараты клеточных стенок М. ruminantium вызвали положительный иммунный ответ (в 256 раз выше, чем преиммунные титры), но они не сохранялись более 15 недель, несмотря на несколько бустерных иммунизаций.
Связывание антител с клетками М. ruminantium
Для контроля связывания антител с клетками М. ruminantium тест ELISA проводили следующим образом. Планшеты MaxiSorp для ELISA (Nunc) покрывали целыми клетками М. ruminantium (40 мкл клеток в 2 мл натрийкарбонатного буфера) и фракциямицитозольных белков М. ruminantium. Образцы сыворотки крови разбавляли 1/20 (25 мкл в 475 мкл разбавителя) в PBS/твин-20, содержащем 1% казеин (вес/объем), и инкубировали при комнатной температуре в течение 1 часа. Планшет промывали 6 раз PBS/твин-20. При подсчете учитывали отрицательную контрольную сыворотку, полученную от той овцы, у которой не было молозива, как у ягненка.
Для детекции использовали конъюгат IgG-HRP осла против овцы/козы (Batch 061005 Star 88P от Serotec) и по 50 мкл 1/5000 разбавления (2 мкл в 10 мл растворителя) добавляли в каждую лунку. Затем добавляли (50 мкл/лунку) субстрат 3,3',5,5'-тетраметилбензидина (TMB), и реакцию инкубировали при комнатной температуре в темноте в течение 15 мин. Затем добавляли стоп-раствор (0,05 M H2SO4, 50 мкл/лунку) и показания планшета снимали при 450 нм.
Анализ подавления роста M. Ruminantium
Образцы иммунных сывороток оттаивали в анаэробном ламинарном шкафу и по 0,1 мл каждого из 10 образцов помещали в пробирку на 1,5 мл для микроцентрифуги. Смесь (1 мл) инкубировали при комнатной температуре с открытой крышкой в анаэробном ламинарном шкафу в течение ночи для удаления растворенного кислорода. Преиммунные сыворотки служили в качестве отрицательного контроля. Комбинированный образец сывороток (0,3 мл) добавляли в трех повторах к 5 мл растущей в пробирках Хангейта культуры М. ruminantium в анаэробном ламинарном шкафу. В пробирки Хангейта закачивали газ (80% H2 и 20% CO2) и культуры инкубировали при 39°C на качалке (100 об/мин). Рост метанопродуцентов контролировали путем измерения OD при 600 нм на спектрофотометре и газово-хроматографического определения потребления водорода и производства метана.
Анализы ELISA показали, что антитела, генерируемые против каждого из антигенов, связываются с клетками М. ruminantium, иммобилизованными на планшетах для микротитрования. Было показано, что антитела связываются с клетками М. ruminantiumin vitro, хотя препараты одного антитела, добавленные к культурам М. ruminantium, не подавляют рост метанопродуцентов или не снижают количество образованного метана. Тем не менее, препарат, состоящий из объединенных образцов антисывороток для каждого из 10 различных антигенов, по-видимому, усиливает агрегацию клеток при добавлении в культуры М. ruminantium.
ПРИМЕР 6: Краткое описание
Methanobrevibacterruminantium был выбран для секвенирования генома из-за своего преобладания в рубце при различных пищевых условях (с учетом выращивания и молекулярных данных детекции), доступности культур, удобства для обычного роста в лабораторных условиях, а также относительно большого количества предыдущих исследований и справочной литературы для этого организма. Для значительного числа генов М. ruminantium были определены функции, и тем самым определена подробная картина жизни этого организма в рубце. Зависимость М. ruminantium от простых субстратов (H2 + CO2, формиат) и его взаимодействия с окружающей средой рубца через поверхностные белки и экзополисахариды являются важными целями для подавления. Подобным же образом SPIDR перспективны как для конкретного таргетирования М. ruminantium, так и для будущих генетических манипуляций, способствующих определению функции гена. Данные по последовательностям поясняют метаболизм этого организма и то, как он взаимодействует с другими микробами и указывает на консервативность систем и компонентов между метанопродуцентами, которые могут быть инактивированы для предотвращения или снижения образования метана в рубце.
БИБЛИОГРАФИЯ
Altermann E., Klaenhammer T.R. (2005) PathwayVoyager: pathway mapping using the Kyoto Encyclopedia of Genes and Genomes (KEGG) database. BMC Genomics 6:60-66.
Altermann, E., and T. R. Klaenhammer. 2003. GAMOLA: a new local solution for sequence annotation and analyzing draft and finished prokaryotic genomes. Omics 7:161-169.
Altschul S.F., Madden T.L., Schaffer A.A., Zhang J., Zhang Z., Miller W., Lipman D.J. (1997) Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Research 25, 3389-3402.
Balch W.E., Fox G.E., Magrum L.J., Woese C.R., Wolfe R.S. (1979) Methanogens: revaluation of a unique biological group. Microbiological Reviews 43, 260-296.
Baresi, L. and Bertani, G. 1984. Isolation of a bacteriophage for a methanogeπic bacterium. In Abstracts of the Annual Meeting of the American Society for Microbiology. Washington DC: American Society for Microbiology, p. 133.
Bickle, T.A. and D.H. Kruger. 1993. Biology of DNA restriction. Microbiol. Rev. 57:434-450.
Bult C.J., et al. (1996) Complete genome sequence of the methanogenic archaeon, Methanococcusjannaschii. Science 273, 1058-1073.
Coutinho P.M., Henrissat B. (1999) Carbohydrate-active enzymes: an integrated database approach. In 'Recent Advances in Carbohydrate Bioengineering' (Eds H.J. Gilbert, G. Davies, B. Henrissat and B. Svensson) pp. 3-12 (The Royal Society of Chemistry, Cambridge) (Carbohydrate Active Enzymes database, hypertext transfer protocol://world wide web.cazy.org/).
Delcher A.L., Harmon D., Kasif S., White O., Salzberg S.L. (1999) Improved microbial gene identification with GLIMMER. Nucleic Acids Research 27, 4636-4641.
Fleischmann et al., 1995. Whole-genome random sequencing and assembly of Haemophilus influenzae Rd Science 269:496-512.
Fricke W.F., Seedorf H., Henne A., Kruer M., Liesegang H., Hedderich R., Gottschalk G., Thauer R.K. (2006) The genome sequence of Methanosphaera stadtmanae reveals why this human intestinal archaeon is restricted to methanol and H2 for methane formation and ATP synthesis. Journal of Bacteriology 188, 642-658.
Godde J.S., Bickerton A. (2006) The repetitive DNAe called CRISPRs and their associated genes: evidence of horizontal transfer among prokaryotes. Journal of Molecular Evolution 62, 718-729.
Haft D.H., Selengut J., Mongodin E.F., Nelson K.E. (2005) A guild of 45 CRISPR-associated (Cas) protein families and multiple CRISPR/Cas subtypes exist in prokaryotic genomes. PLoS Computational Biology 1:474-483.
Jansen R., Embden J.D., Gaastra W., Schouls L.M. (2002) Identification of genes that are associated with DNA repeats in prokaryotes. Molecular Microbiology 43, 1565-1575.
Jansen R., van Embden J.D., Gaastra W., Schouls L.M. (2002) Identification of a novel family of sequence repeats among prokaryotes. OMICS: A journal of integrative biology 6, 23-33.
Jensen, L.J., Friis, C. and Ussery, D.W. 1999 Three views of microbial genomes. Res. Microbiol. 150, 773-777.
Joblin K.N., Naylor G.E., Williams A.G. (1990) Effect of Methanobrevibacter smithii on xylanolytic activity of anaerobic ruminal fungi. Applied and Environmental Microbiology 56, 2287-2295.
Kanehisa M., Goto S., Kawashima S., Okuno Y., Hattori M. (2004) The KEGG resource for deciphering the genome. Nucleic Acids Research 32, D277-D280.
Kiener, A., Konig, H., Winter, J. and Leisinger, T. 1987. Purification and use of Methanobacterium wolfei pseudomurein endopeptidase for lysis of Methanobacterium thermoautotrophicum. J. Bacteriol. 169, 1010-1016.
Knox, M.R. and Harris, J.E. 1986. Isolation and characterisation of a bacteriophage of Methanobrevibacter smithii. In Abstracts of the XIV International Congress on Microbiology. Manchester International Union of Microbiological Societies.
Kurtz S., Schleiermacher C. (1999) REPuter fast computation of maximal repeats in complete genomes. Bioinformatics 15, 426-427.
Lowe T.M., Eddy S.R. (1997) tRNAscan-SE: a program for improved detection of transfer RNA genes in genomic sequence. Nucleic Acids Research 25, 955-964.
Loenen, W. and N. Murray. 1986. Modification enhancement by restriction alleviation protein (Ra 1) of bacteriophage lambda. J. Mol. Biol. 190:11-22.
Lucchini, S., F. Desiere, and H. Brussow. 1999. Comparative genomics of Streptococcus thermophilus phage species supports a modular evolution theory. J. Virol. 73:8647-8656.
Luo, Y.N., Pfister, P., Leisinger, T. and Wasserfallen, A. 2002. Pseudomurein endoisopeptidases PeiW and PeiP, two moderately related members of a novel family of proteases produced in Methanothermobacter strains. FEMS Microbiol. Lett. 208, 47-51.
Makarova, K.S., Aravind, L. and Koonin, E.V. 1999. A superfamily of archaeal, bacterial, and eukaryotic proteins homologous to animal transglutaminases. Protein Sci. 8, 1714-1719.
Makarova K.S., Grishin N.V., Shabalina S.A., Wolf Y.I., Koonin E.V. (2006) A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biology Direct 1:7-32.
New Zealand Statistics 2005 (www.stats.govt.nz)
New Zealand's Greenhouse Gas Inventory 1990-2004. The National Inventory Report and Common Reporting Format. (2006) Ministry for the Environment. Hypertext transfer protocolV/www.mfe.govt.nz/publications/climate/nir-apr06/nir-apr06.pdf.
Rawlings, N.D., Morton, F.R. and Barrett, A.J. 2006. MEROPS: the peptidase database. Nucleic Acids Res. 34, D270-D272.
Reeve J.N., Nolling J., Morgan R.M., Smith D.R. (1997) Methanogenesis: genes, genomes and who's on first? Journal of Bacteriology 179, 5975-5986.
Samuel B.S., Hansen E.E., Manchester J.K., Coutinho P.M., Henrissat B., Fulton R., Latreille P., Kim K., Wilson R.K., Gordon J.I. (2007) Genomic adaptations of Methanobrevibacter smithii to the human gut. Proceedings of the National Academy of Sciences USA 104, 10643-10648.
Smith D.R., et al. (1997) Complete genome sequence of Methanobacterium thermoautotrophicum ΔH: Functional analysis and comparative genomics. Journal of Bacteriology 179, 7135-7155.
Smith P.H., Hungate RE (1958) Isolation and characterization of Methanobacterium ruminantium n. sp. Journal of Bacteriology 75, 713-718.
Staden R., Beal K.F., Bonfield J.K. (1998) The Staden Package. Methods in Molecular Biology: Bioinformatics Methods and Protocols 132, 115-130.
Tatusov R.L., Natale D.A., Garkavtsev I.V., Tatusova T.A., Shankavaram U.T., Rao B.S., Kiryutin B., Galperin M.Y., Fedorova N.D., Koonin E.V. (2001) The COG database: new developments in phylogenetic classification of proteins from complete genomes Nucleic Acids Research 29, 22-28.
Все публикации и патенты, упомянутые в приведенном выше патентном описании, включены в настоящее описание в виде ссылки. Там, где в вышеизложенном описании была сделана ссылка на нечто целое, имеющее свои известные эквиваленты, эти эквиваленты включены в настоящее описание как индивидуально изложенные. Хотя изобретение было описано применительно к конкретным предпочтительным вариантам осуществления, следует понимать, что изобретение, как заявлено, не должно быть неоправданно ограничено такими конкретными вариантами осуществления. Следует учесть, что изобретение может быть подвергнуто новым модификациям, как описано в настоящем описании, не отклоняясь от духа и сферы применения изобретения.
Реферат
Изобретение относится к области биохимии, в частности к выделенному полипептиду, который является биологической мишенью для ингибирования клетки-метанопродуцента, а также к выделенному полинуклеотиду, который кодирует этот полипептид. Раскрыты вектор экспрессии и клонирующий вектор, содержащие этот полинуклеотид, и клетки-хозяева, содержащие указанный вектор экспрессии. Описаны молекула-конъюгат или слитая молекула для ингибирования клетки-метанопродуцента, а также антитело или его функциональный фрагмент, которое связывается с вышеуказанным полипептидом. Изобретение также охватывает фармацевтическую композицию и способы ингибирования и идентификации клетки-метанопродуцента с использованием описанных молекулы-конъюгата или слитой молекулы и антитела или его фрагмента. Изобретение позволяет эффективно ингибировать клетки-метанопродуценты. 13 н. и 6 з.п. ф-лы, 9 ил., 6 пр.
Формула
a) характеризующийся последовательностью SEQ ID NO:641;
b) который является функциональным вариантом SEQ ID NO:641 и характеризуется последовательностью, которая по меньшей мере на 90% идентична полноразмерной последовательности SEQ ID NO:641; или
c) который является функциональным фрагментов SEQ ID NO:641.
a) последовательностью, кодирующей полноразмерную последовательность SEQ ID NO:641;
b) SEQ ID NO:1312;
c) последовательностью, кодирующей полипептид, который по меньшей мере на 90% идентичен полноразмерной последовательности SEQ ID NO:641; или
d) последовательностью, которая комплементарна любой из последовательностей (a)-(c).
а) который содержит полинуклеотид, кодирующий полипептид по п.1; или
b) содержащий полинуклеотид по п.2.
a) который содержит полинуклеотид, кодирующий полипептид по п.1; или
b) содержащий полинуклеотид по п.2.
а) которая генетически модифицирована таким образом, что содержит полипептид по п.1;
b) которая генетически модифицирована таким образом, что содержит полинуклеотид по п.2; или
c) которая содержит вектор по п.3.
а) полипептид по п.1; или
b) антитело или фрагмент антитела по п.9 или 10; и
которая дополнительно содержит соединение против метаногенеза, сигнальную последовательность, литический фермент, пептид-нуклеиновую кислоту, антимикробный пептид или антибиотик.
а) антитела или фрагмента антитела по п.9 или 10; или
b) молекулы-конъюгата или слитой молекулы по п.11.

Комментарии