Фармацевтический препарат - RU2542512C2
Код документа: RU2542512C2
Чертежи








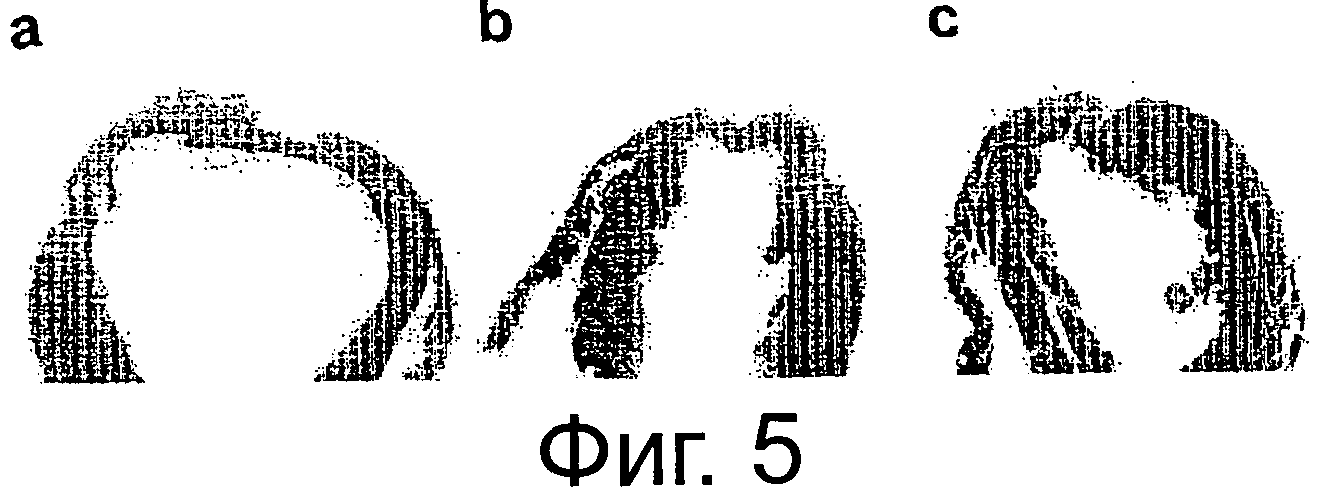














Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическому препарату для лечения внутренних воспалительных процессов, предпочтительно внутренних процессов, связанных с ишемией.
Уровень техники
Гипоксия, состояние кислородного голодания, может происходить, когда повреждены легкие или снижено кровообращение. Ишемия, снижение кровообращения, может вызываться обструкцией артерии или вены сгустком крови (тромбоз) или закупоркой сосудов любым другим образом (эмболия) или заболеванием сосудов, таким как атеросклероз. Снижение кровообращения может иметь внезапное начало и короткую продолжительность (острая ишемия) или может возникать медленно с длительным течением или частыми рецидивами (хроническая ишемия). Острая ишемия часто связана с регионарным, необратимым некрозом ткани (инфаркт), тогда как хроническая ишемия обычно связана с временным гипоксическим повреждением ткани. Однако если снижение перфузии длительное или тяжелое, то хроническая ишемия может быть связана с инфарктом. Инфаркты обычно происходят в селезенке, легких, мозге и сердце, в результате чего возникают такие заболевания, как интестинальный инфаркт, инфаркт легкого, ишемический инсульт и инфаркт миокарда.
Патологические изменения в ишемических нарушениях зависят от длительности и тяжести ишемии и от продолжительности выживаемости пациента. Некроз может наблюдаться при инфаркте в первые 24 ч, в течение которых в жизнеспособной ткани развивается острый воспалительный ответ, приводя к инфаркту с миграцией лейкоцитов в зону омертвевшей ткани. В последующие дни происходит постепенный «выход из строя» и удаление клеток из инфарктной зоны фагоцитами и замещение коллагеновым или глиальным рубцом.
Гипоперфузия или инфаркт в одном органе часто затрагивает другие органы. Например, ишемия легких, вызванная, например, эмболией легких, затрагивает не только легкие, но также влияет на сердце и другие органы, такие как мозг, под действием гипоксического стресса. Инфаркт миокарда, который часто включает блокаду коронарных артерий вследствие тромбоза, сужение стенок артерий или вирусную инфекцию сердца, может приводить к застойной сердечной недостаточности и системной гипотензии. Могут развиваться вторичные осложнения, такие как полная ишемическая энцефалопатия, если остановка сердечной деятельности сопровождается длительной гипоперфузией. Церебральная ишемия, наиболее часто возникающая вследствие закупорки сосудов из-за атеросклероза, может изменяться по тяжести от преходящих ишемических приступов (TIA) до инфаркта мозга или инсульта. Хотя симптомы TIA временные и обратимые, TIA тенденция к рецидивированию часто сопровождается инсультом.
Окклюзивная болезнь сосудов включает болезнь коронарных артерий, которая может привести к инфаркту миокарда, и болезнь периферических артерий, которая может затрагивать брюшную аорту, ее основные ветви и артерии нижних конечностей. Болезнь периферических артерий включает болезнь Бюргера, болезнь Рейно и акроцианоз. Хотя болезни периферических артерий обычно вызываются атеросклерозом, существуют и другие причины, которые включают, напр., диабет и др. осложнения, связанные с болезнью периферических артерий, включают тяжелые судороги икроножных мышц, стенокардию, патологический ритм сердца, сердечную недостаточность, сердечные приступы, инсульт и почечную недостаточность.
Ишемические и гипоксические заболевания являются главной причиной заболеваемости и смертности. Сердечно-сосудистые заболевания являются причиной смерти во всем мире в 30% случаях. Среди различных сердечно-сосудистых заболеваний ишемическая болезнь сердца и нарушения мозгового кровообращения являются причиной приблизительно 17% смертей.
В настоящее время лечение ишемических и гипоксических заболеваний основано на облегчении симптомов и лечении «причинных» заболеваний. Например, лечение инфаркта миокарда включает применение нитроглицерина и анальгетиков для контроля боли и облегчения сердечной нагрузки. Другие лекарственные средства, включая дигоксин, диуретики, амринон, бета-блокаторы, снижающие содержание жиров агенты и ингибиторы ангиотензин-конвертирующих ферментов, используются для стабилизации состояния, но ни один из этих способов лечения не направлен прямо на повреждение ткани, вызванное ишемией и гипоксией.
Вследствие недостаточности современного лечения существует потребность в способах, которые эффективны в лечении процессов, включая гипоксию. Также существует потребность в способах, которые эффективны в профилактике повреждения тканей, вызванного ишемией, которая возникает вследствие, напр., атеросклероза, диабета и легочных заболеваний.
Обычно состояния, связанные с ишемией и гипоксией, сопровождаются воспалением. Следовательно, требуются средства и методы, которые также уменьшают воспаление.
Цель изобретения
Целью настоящего изобретения является обеспечение средств, которые позволяют проводить эффективное лечение внутренних воспалительных состояний, предпочтительно состояния, ассоциированного с ишемией.
Раскрытие изобретения
Настоящее изобретение относится к фармацевтическому препарату для лечения внутреннего воспалительного состояния, предпочтительно внутреннего состояния, связанного с ишемией, причем препарат содержит:
a) физиологический раствор, содержащий мононуклеарные клетки периферической крови (РВМС) или их субпопуляцию, или
b) супернатант раствора а), в котором раствор а) получают путем культивирования РВМС или их субпопуляции в физиологическом растворе, не содержащем РВМС-пролиферирующие и РВМС-активирующие вещества, в течение по меньшей мере 1 часа.
Отсюда вытекает, что введение фармацевтического препарата, который определен выше, пациенту, страдающему от внутреннего воспалительного состояния, предпочтительно внутреннего процесса, связанного с ишемией, приводит к смягчению соответствующих симптомов и к излечению.
Фармацевтический препарат настоящего изобретения содержит культивированные РВМС или их субпопуляцию и/или супернатант, в котором культивированы РВМС. При культивации РВМС эти клетки экспрессируют и секретируют вещества, подобные цитокинам, которые отличаются от тех, которые экспрессируются и активируются в активированных РВМС. Это означает, что секретом РВМС настоящего изобретения отличается от секретома активированных РВМС. Клетки настоящего изобретения не переносят часть клеточной поверхности, стимулированной продукцией секретома. Таким образом, неожиданно, что РВМС, которые не контактировали с РВМС-активирующими веществами, типа РНА или LPS, можно использовать для лечения внутренних воспалительных процессов, в частности ишемических состояний, которые показывают, что секретом этих клеток содержит вещества, обеспечивающие лечение таких или аналогичных состояний.
РВМС согласно настоящему изобретению получают путем культивирования их в физиологическом растворе, который не содержит РВМС-пролиферирующие и РВМС-активирующие вещества. При этом РВМС инкубируют в физиологическом растворе в течение по меньшей мере 1 часа. Такое минимальное время культивации требуется для высвобождения РВМС-секретируемых цитокинов и других лечебных веществ.
Часть РВМС препарата согласно настоящему изобретению можно получить из цельной крови, используя способы, известные из уровня техники, такие как фиколловый градиент, гипотонический лизис и др. Эти способы хорошо известны из уровня техники.
РВМС фармацевтического препарата можно получить из пула доноров или из того же индивидуума, которому будут вводить препарат.
РВМС или их субпопуляции присутствуют в препарате согласно настоящему изобретению в их жизнеспособной форме.
Физиологический раствор, из которого получают супернатант, содержит по меньшей мере 500, предпочтительно по меньшей мере 1000, более предпочтительно по меньшей мере 105, даже более предпочтительно по меньшей мере 106клеток на мл раствора или на единицу дозирования.
Препарат настоящего изобретения может содержать по меньшей мере 500, предпочтительно по меньшей мере 1000, более предпочтительно по меньшей мере 105, даже более предпочтительно по меньшей мере 106, РВМС на мл или на единицу дозирования.
Осуществление изобретения
"Физиологический раствор", в используемом здесь значении, относится к жидкому раствору, в котором РВМС культивированы перед их использованием в фармацевтическом препарате согласно настоящему изобретению.
"Физиологический раствор" также относится к раствору, который не приводит к гибели РВМС в течение часа, предпочтительно в течение 30 мин. Если число жизнеспособных РВМС снижается в растворе на 75%, более предпочтительно на 90% за один час, предпочтительно за 30 мин, то считается, что раствор не является "физиологическим раствором", как определено здесь. "Физиологический раствор" не вызывает спонтанный лизис РВМС при взаимодействии с указанным раствором.
В данном случае стадия "культивирования" или "культивации" включает или состоит из стадии "инкубирования", стадии, в которой клетки взаимодействуют с раствором в течение определенного времени (по меньшей мере, 1 ч, предпочтительно по меньшей мере 4 ч, более предпочтительно по меньшей мере 8 ч, даже более предпочтительно по меньшей мере 12 ч) при условиях, которые обычно используются для культивирования РВМС.
Термин "состояние, связанное с ишемией" в контексте настоящего изобретения может использоваться взаимозаменяюще с термином "ишемические состояния" и обозначает любое состояние, заболевание или расстройство, в котором области тела человека или животного не обеспечиваются кислородом в достаточной степени, что приводит к повреждению или дисфункции ткани. Патологическое состояние может характеризоваться сокращением или прекращением кровоснабжения в органе или части органа, что может быть вызвано сужением или закупоркой кровяного сосуда. Такие состояния в совокупности относятся здесь к термину "ишемия" или "связанное с ишемией состояние" или "состояние, связанное с ишемией". В заболеваниях сердца, например, ишемия часто используется для описания сердечной мышцы, которая не получает нужного количества обогащенной кислородом крови из-за суженных или заблокированных коронарных артерий. Симптомы ишемии зависят от органа, который "ишемизирован". Относительно сердца ишемия часто приводит к стенокардии. В мозге ишемия может привести к инсульту. Ишемические состояния сопровождаются воспалением.
Неограничивающие примеры патологических состояний, которые относятся к воспалению, в частности к ишемии, включают раны, ишемию миокарда, ишемию конечностей, ишемию ткани, ишемически-реперфузионное повреждение, стенокардию, заболевание коронарных артерий, заболевание периферических артерий, инфаркт, ишемический инфаркт, застарелые раны, диабетические раны, инфаркт миокарда, застойную сердечную недостаточность, инфаркт легкого, кожные наружные раны и др.
Несмотря на вышеуказанное, патологическое состояние в контексте изобретения может характеризоваться повреждением или дисфункцией эндотелиальных клеток, т.е. раной. Неограничивающие примеры ран, которые можно излечивать с помощью препарата настоящего изобретения, включают застарелые раны, диабетические раны, язвы, ожоги, воспалительные заболевания кожи и пищеварительного тракта.
Термины "внутренний процесс", "внутренний воспалительный процесс" и "внутренние процессы, связанные с ишемией" относятся к процессам и заболеваниям, которые происходят внутри организма индивидуума и которые вызваны острыми или латентными гипоксией и воспалением в органах-мишенях млекопитающих, необходимых для оптимального функционирования (напр., повреждение костей, сердца, печени, почек, мозга, кожи).
"Физиологический раствор", в используемом здесь значении, относится к раствору, который имеет осмотическое давление, не приводящее к деструкции РВМС или их субпопуляций, и который можно вводить прямо индивидууму.
Термин "свободный от РВМС-пролиферирующих и РВМС-активирующих веществ" относится к физиологическому раствору, который не содержит вещества, которые активируют РВМС и индуцируют пролиферацию РВМС или их субпопуляций. Эти вещества включают PHA, LPS и др.
Согласно предпочтительному воплощению настоящего изобретения воспалительный процесс выбирают из группы заболеваний млекопитающих, которые связаны с гипоксией и воспалением функциональных органов-мишеней.
Согласно особенно предпочтительному воплощению настоящего изобретения внутренний воспалительный процесс, предпочтительно внутренний процесс, связанный с ишемией, выбирают из группы, состоящей из ишемии миокарда, ишемии конечностей, ишемии тканей, ишемически-реперфузионного повреждения, стенокардии, болезни коронарных артерий, болезни периферических артерий, инсульта, ишемического инсульта, инфаркта миокарда, застойной сердечной недостаточности, травмы, заболевания кишечника, мезентериального инфаркта, инфаркта легкого, перелома кости, регенерации ткани после имплантации зубов, аутоиммунных заболеваний, ревматических болезней, аллотрансплантата и реакции отторжения аллотрансплантата.
Субпопуляции мононуклеарных клеток периферической крови (РВМС) предпочтительно представляют собой Т-клетки, В-клетки или NK-клетки. Конечно, возможно использовать комбинации этих клеток: Т-клетки и В-клетки; Т-клетки и NK-клетки; В-клетки и NK-клетки; Т-клетки, В-клетки и NK-клетки. Способы обеспечения и изолирования указанных клеток известны.
Неожиданно оказалось, что РВМС настоящего изобретения можно культивировать в любом растворе при условии, что указанный раствор не содержит вещества, которые не являются фармацевтически подходящими, приводят к немедленной гибели РВМС, активируют РВМС и стимулируют пролиферацию РВМС (как отмечено выше). Таким образом, используемый раствор по меньшей мере проявляет осмотические свойства, которые не приводят к лизису РВМС. Физиологический раствор предпочтительно является физиологическим солевым раствором, предпочтительно физиологическим растворов NaCl, цельной кровью, фракцией крови, предпочтительно сывороткой, или средой для культивирования клеток.
Среду для культивирования клеток предпочтительно выбирают из группы, состоящей из RPMI, DMEM, X-vivo и Ultraculture.
Согласно особенно предпочтительному воплощению настоящего изобретения клетки настоящего изобретения культивируют при условиях, вызывающих стресс.
Термин "при условиях, вызывающих стресс", в используемом здесь значении, относится к условиям культивирования, приводящим к получению стрессовых клеток. Условия, вызывающие стресс для клеток, включают, среди прочих, нагревание, химические реагенты, облучение, гипоксию, осмотическое давление (т.е. нефизиологические осмотические условия) и др.
Дополнительный стресс для клеток настоящего изобретения приводит к дальнейшему усилению экспрессии и секреции веществ, полезных для лечения внутренних воспалительных состояний, предпочтительно внутренних состояний, связанных с ишемией.
Согласно предпочтительному воплощению настоящего изобретения условия, вызывающие стресс, включают гипоксию, озонирование, нагревание (напр., более чем на 2°С, предпочтительно более чем на 5°С, более предпочтительно более чем на 10°С выше оптимальной температуры культивирования РВМС, т.е. 37°С), облучение (напр., УФ-облучение, гамма-излучение), воздействие химических реагентов, осмотическое давление (т.е., осмотические условия, которые превышены по меньшей мере на 10% по сравнению с осмотическими условиями, обычно встречающимися в биологической жидкости, в частности в крови), рН-сдвиг или их комбинации.
Если для стрессирования РВМС настоящего изобретения применяют облучение, то клетки предпочтительно облучают дозой по меньшей мере 10 Гр, предпочтительно по меньшей мере 20 Гр, более предпочтительно по меньшей мере 40 Гр, при этом в качестве источника цезия предпочтительно используют Cs-137.
Согласно предпочтительному воплощению настоящего изобретения неактивированные РВМС или их популяцию культивируют в среде в течение по меньшей мере 4 ч, предпочтительно в течение по меньшей мере 6 ч, более предпочтительно в течение по меньшей мере 12 ч.
Фармацевтический препарат согласно настоящему изобретению можно вводить различными способами в зависимости от состояния, которое подвергается лечению. Таким образом, указанный препарат предпочтительно адаптирован для подкожного введения, внутримышечного введения, внутриорганного введения (напр., интрамиокардиального введения) и внутривенного введения.
Фармацевтический препарат согласно настоящему изобретению может содержать фармацевтически подходящие эксципиенты, такие как разбавители, стабилизаторы, носители и др. В зависимости от пути введения препарат согласно настоящему изобретению обеспечивается в соответствующей лекарственной форме: инъекционный раствор и др. Способы приготовления таких лекарственных форм хорошо известны для специалиста в данной области.
Для увеличения срока хранения препарата согласно настоящему изобретению раствор а) или супернатант b) лиофилизируют. Способы лиофилизации таких препаратов хорошо известны специалисту в данной области.
Перед применением лиофилизированный препарат может контактировать с водой или водным раствором, содержащим буферы, стабилизаторы, соли и др.
Другой аспект настоящего изобретения относится к применению препарата, как отмечено выше, для изготовления лекарственного средства для лечения внутреннего воспалительного состояния, предпочтительно внутреннего состояния, связанного с ишемией.
Еще другой аспект настоящего изобретения относится к способу приготовления фармацевтического препарата, как описывается здесь, который включает следующие стадии:
a) обеспечение мононуклеарных клеток периферической крови (PBMCs) или их популяции,
b) культивирование клеток стадии а) в физиологическом растворе, не содержащем РВМС-пролиферирующие и РВМС-активирующие вещества, в течение по меньшей мере 1 часа,
c) изолирование клеток стадии b) и/или их супернатанта, и
d) приготовление фармацевтического препарата, используя клетки и/или супернатант стадии с).
Препарат настоящего изобретения можно получать путем инкубирования или культивирования РВМС в физиологическом растворе в течение по меньшей мере 1 часа, предпочтительно по меньшей мере 4 ч, более предпочтительно по меньшей мере 8 ч, даже более предпочтительно по меньшей мере 12 ч. В течение данной стадии РВМС начинают синтезировать и секретировать вещества, которые пригодны для лечения внутренних воспалительных состояний. Перед, после и в течение стадии культивирования клетки не активируются путем добавления РВМС-активирующих веществ, типа РИА или LPS. После стадии культивации клетки и/или супернатант культуры изолируют с последующим применением в приготовлении конечного фармацевтического препарата. Как обсуждалось выше, фармацевтический препарат может содержать культивированные РВМС, супернатант культуры, в котором указанные клетки инкубировались, или как культивированные РВМС, так и культуральную среду.
Согласно предпочтительному воплощению настоящего изобретения, клетки подвергают воздействию условий, вызывающих стресс, перед или в течение стадии b), где указанные условия, вызывающие стресс, включают гипоксию, озонирование, нагревание, облучение, воздействие хемикантов, осмотическое давление (напр., вызванное добавлением соли, в частности NaCl, для повышения осмотического давления по сравнению с кровяным), рН-сдвиг (т.е., изменение рН посредством добавления кислот или гидроксидов с получением значения рН от 6,5 до 7,2 или от 7,5 до 8,0) или их комбинации.
Согласно предпочтительному воплощению настоящего изобретения, перед или в течение стадии b) клетки облучают дозой в по меньшей мере 10 Гр, предпочтительно по меньшей мере 20 Гр, более предпочтительно по меньшей мере 40 Гр, подвергают озонированию, нагревают или облучают УФ-лучами.
Другой аспект настоящего изобретения относится к препарату, получаемому способом, как описано выше.
Другой аспект настоящего изобретения относится к способу лечения внутренних воспалительных состояний, предпочтительно внутренних состояний, связанных с ишемией, путем введения индивидууму, нуждающемуся в лечении, подходящего количества фармацевтического препарата согласно настоящему изобретению. В зависимости от состояния, которое подвергают лечению, препарат настоящего изобретения вводят внутримышечно, внутривенно, внутриорганно (напр., интрамиокардиально) или подкожно.
В предпочтительном воплощении настоящего изобретения, фармацевтический препарат содержит по меньшей мере 500, предпочтительно по меньшей мере 1000, более предпочтительно по меньшей мере 105, даже более предпочтительно по меньшей мере 106 РВМС на мл, получаемые способом, как указано выше. Соответственно по меньшей мере 500, предпочтительно по меньшей мере 1000, более предпочтительно по меньшей мере 105, даже более предпочтительно по меньшей мере 106 РВМС вводят индивидууму, которого подвергают лечению.
Настоящее изобретение дополнительно иллюстрируется посредством следующих чертежей и примеров, при этом не ограничивается ими.
Фиг.1 показывает: (а) протокол исследования и моменты времени оценки сердечной функции путем эхокардиографии, гистологии и иммуногистологии; (b) процент облученных и необлученных крысиных РВМС, положительно окрашенных аннексином после 18-ти часового периода культивирования.
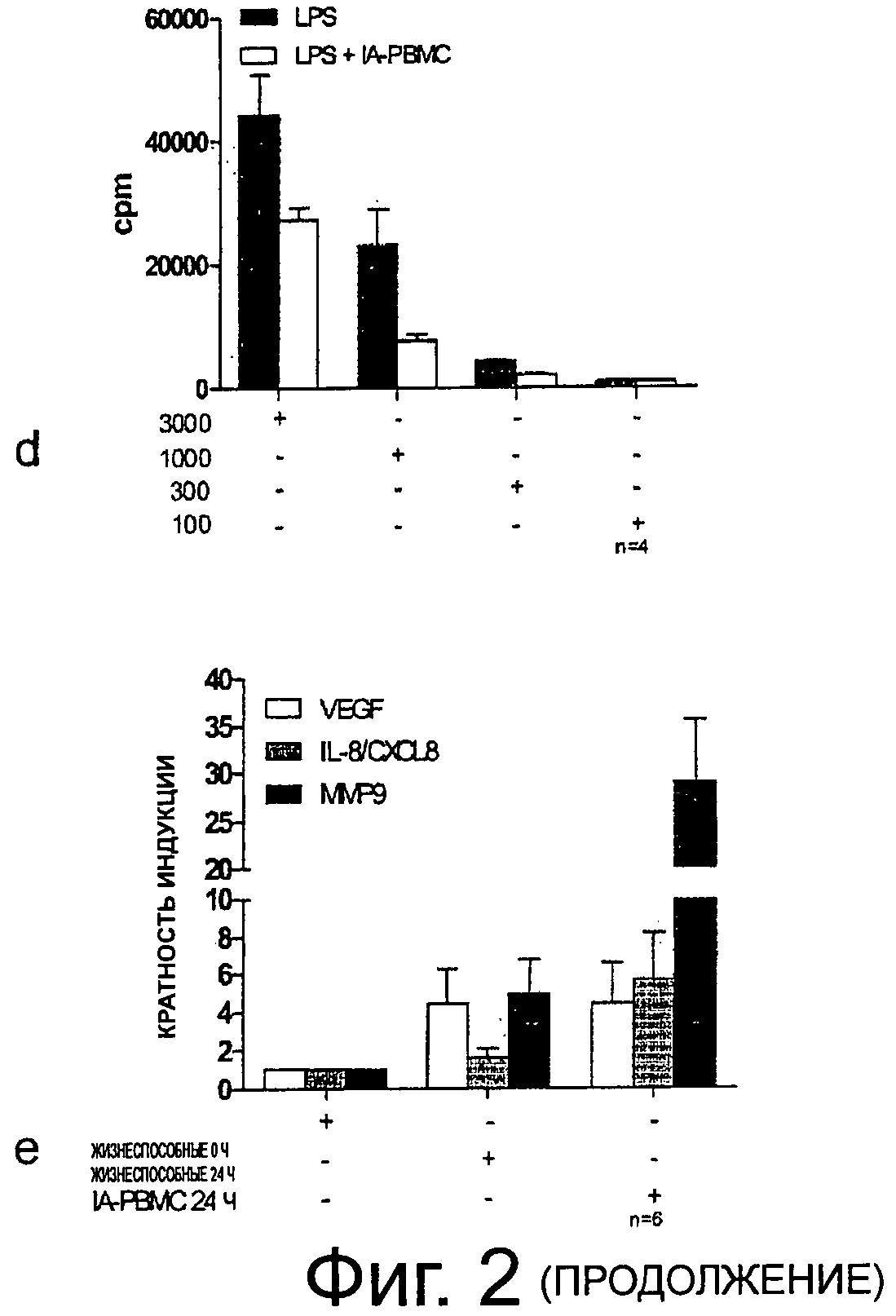
Фиг.2 (a): FACS-анализ показывает, что облучение приводит к индукции апоптоза в человеческих РВМС с зависящим от времени повышением экспрессии аннексина в течение 48 ч. (b) Совместная инкубация LPS-стимулированных РВМС или моноцитов с облученными апоптическими аутологичными РВМС демонстрирует пониженную секрецию провоспалительного цитокина IL-1β в зависимости от дозировки, (с) В меньшей степени этот результат также коррелирует с профилем секреции IL-6 LPS-стимулированных РВМС и моноцитов в присутствии IA-PBMC. (d) Добавление аутологичных IA-PBMC в реакцию смешанных лимфоцитов с LPS-стимуляцией снижает Т-клеточную пролиферацию, что измеряется числом импульсов в минуту (cpm). (е) RT-ПЦР-анализ экспрессии РНК в реальном времени VEGF, IL-8/CXCL8 и ММР-транскриптов показывает повышение экспрессии IL-8/CXCL8 и в особенности ММР9 в облученных РВМС после 24-ти часового периода культивации, (f) ELISA-анализ VEGF, IL-8/CXCL8 и ММР9 демонстрируют, что ММР9 в основном находится в клеточных лизатах, тогда как различия в VEGF и 1b-8/СХСL8-протеиновой секреции остаются практически на том же уровне в обоих жизнеспособных клетках и IA-PBMC. (g) Человеческие фибробласты, инкубированные в супернатантах, полученных из клеточной культуры жизнеспособных или IA-PBMC, проявляют стойкое повышение экспрессии VEGF, IL-8/CXCL8 и ММР9-транскриптов в анализе ПЦР в реальном времени, причем пиковые значения найдены для фибробластов, инкубированных в IA-PBMC-супернатантах.
Фиг.3 (а, b, с): CFSE-меченные сингенные РВМС, введенные в хвостовую вену крыс после искусственного инфаркта миокарда, были обнаружены в основном в селезенке (b), в меньшей степени в печени (а) и не обнаружены в инфарктном сердце (с), (d, е, f): НЕ-окрашенные инфарктные зоны крыс, инъецированных либо средой (d) либо жизнеспособными РВМС (е), показывают сравнимые характристики ишемического миокарда, инфильтрированного иммунными клетками, ткани, полученные из крыс, получавших IA-PBMC, показывают очень интенсивную инфильтрацию, (g, h, i): Крысы, получавшие жизнеспособные клетки (h), показывают немного больше CD68+окрашенных клеток в инфарктной зоне, чем леченные средой крысы (g), но в 3 раза большее количество CD68+детектированных у IA-PBMC-инъецированных животных, (j, k, 1): Наибольшие уровни S100P+клеток обнаружили у крыс, получавших только среду, по сравнению с применением жизнеспособных РВМС или IA-PBMC.
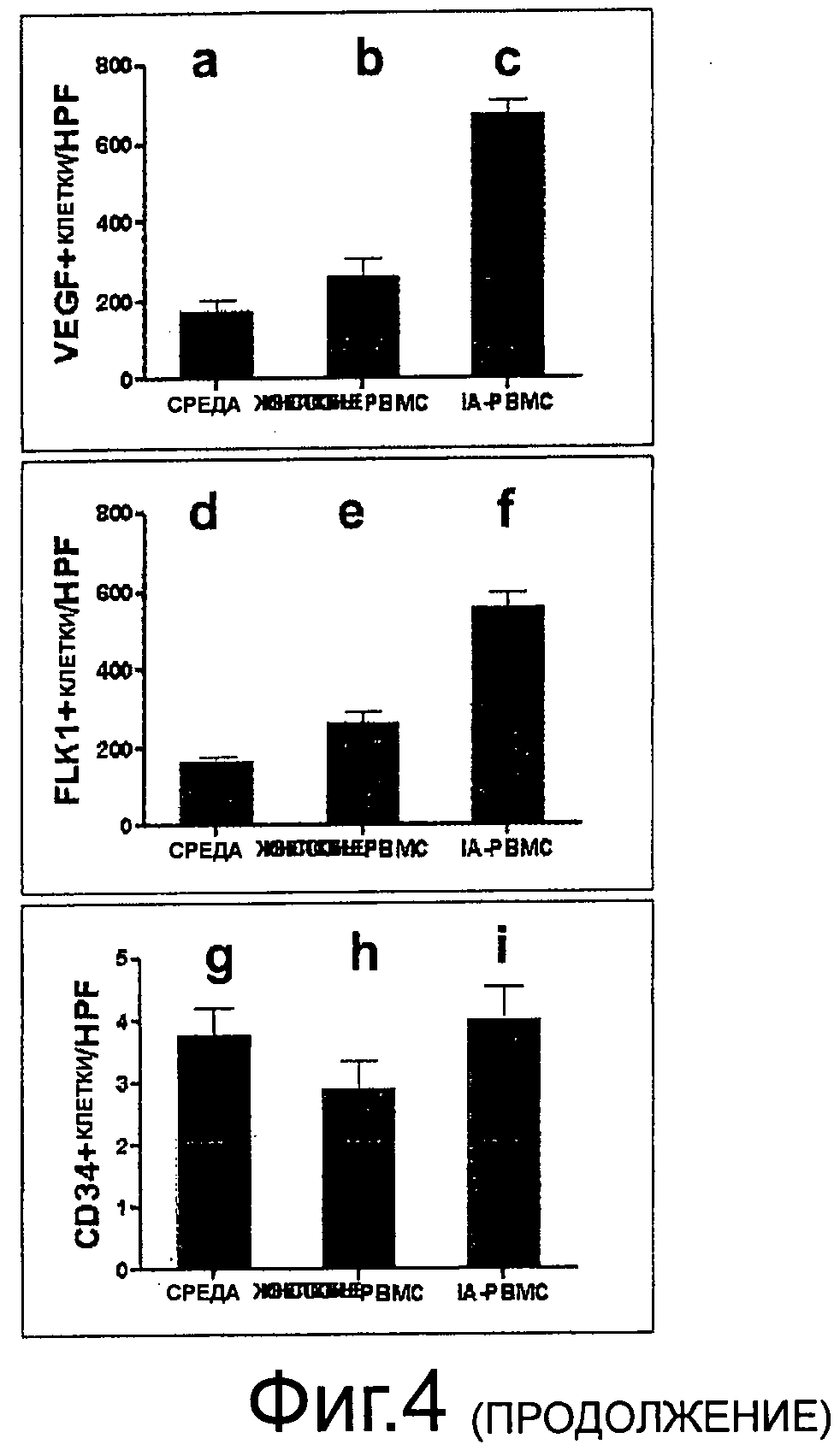
Фиг.4 (а, b, с): Почти в 4 раза большее количество клеток, окрашенных для VEGF, обнаружили в инфарктной ткани миокарда, полученной из животных, инъецированных IA-PCMC (с), по сравнению с лечением средой (а) или жизнеспособными клетками (b), (d, е, f): Аналогичные характеристики экспрессии найдены для VEGF-рецептора KDR/FLK1 с максимальными значениями в группе IA-PBMC (f) по сравнению со средой (d) и жизнеспособными клетками (е). (g, h, i): Не зафиксировали различий для CD34 во всех трех группах, (j, k, 1) Иммуногистологический анализ для маркерного c-kit в инфарктных сердцах показывает высокое содержание позитивно-окрашенных клеток и плотную локализацию у крыс, инъецированных IA-PBMC (1), и некоторых клетках у животных, получавших среду (j) и жизнеспособные клетки (к).
Фиг.5 (a, b, с): Гистологический анализ ишемических крысиных сердец, эксплантированных через 6 недель после индукции инфаркта миокарда (окрашивание Elastica van Gieson), сердца из инъецированных средой животных (а) кажутся более расширенными и показывают большее увеличение фиброзной ткани, увеличение рубца снижается у крыс, инъецированных жизнеспособными клетками (b) с некоторыми признаками дилатации, некоторое количество образования рубцовой ткани зафиксировано у IA-PBMC-инъецированных животных (с), (d) Данные статистического анализа, полученные из планиметрического анализа образца, взятого через 6 недель после LAD-лигирования, показывают среднее увеличение рубца на 24,95%±3,6 у инъецированных средой, на 14,3%±1,3 у инъецированных жизнеспособными РВМС и на 5,8%±2 у IA-PBMC-инъецированных животных (среднее+SEM). (е, f, g): оценка параметров сердечной функции фракции укорочения, фракции изгнания и эндосистолического диаметра с помощью эхокардиографии показывает лучшее восстановление после инфаркта миокарда у животных, инъецированных IA-PBMC.
Фиг.6а показывает, что ни нестимулированные жизнеспособные РВМС, ни IA-PBMC не секретируют происходящий в основном из моноцитов провоспалительный цитокин TNF-α (Значимости выражены следующим образом: * р=0.05, ** р=0.001; n=8)
Фиг.6b демонстрирует стойкую индукцию секреции провоспалительного интерферона-γ после активации по сравнению с нестимулированными РВМС(Значимости выражены следующим образом: * р=0,05, ** р=0,001; n=8)
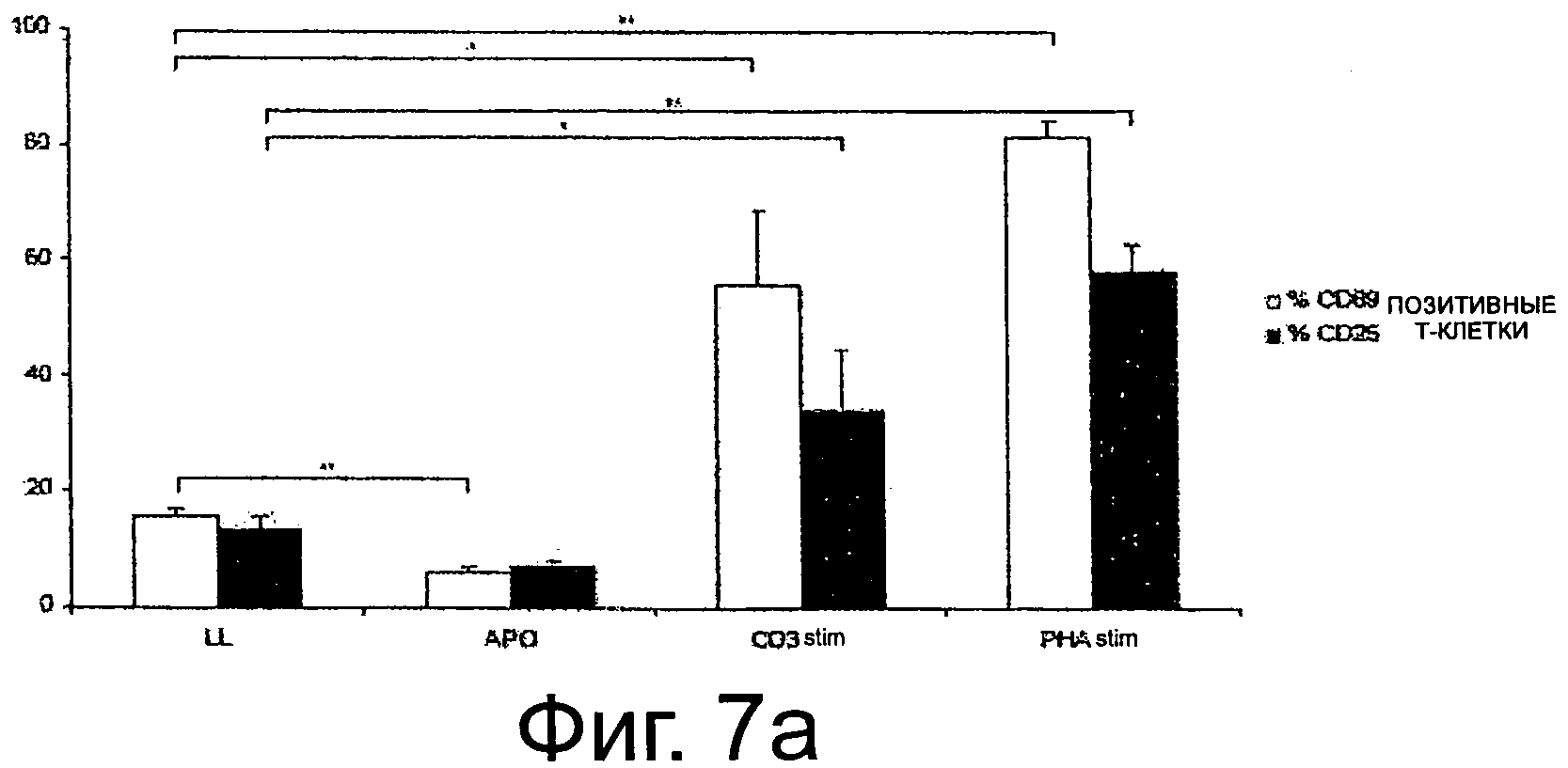
Фиг.7а показывает подытоженные результаты проточного цитометрического анализа. РВМС лишали Т-клеток и оценивали экспрессию активационных маркеров CD69 и CD25 (Значимости выражены следующим образом: * р=0.05, ** р=0.001; n=4)
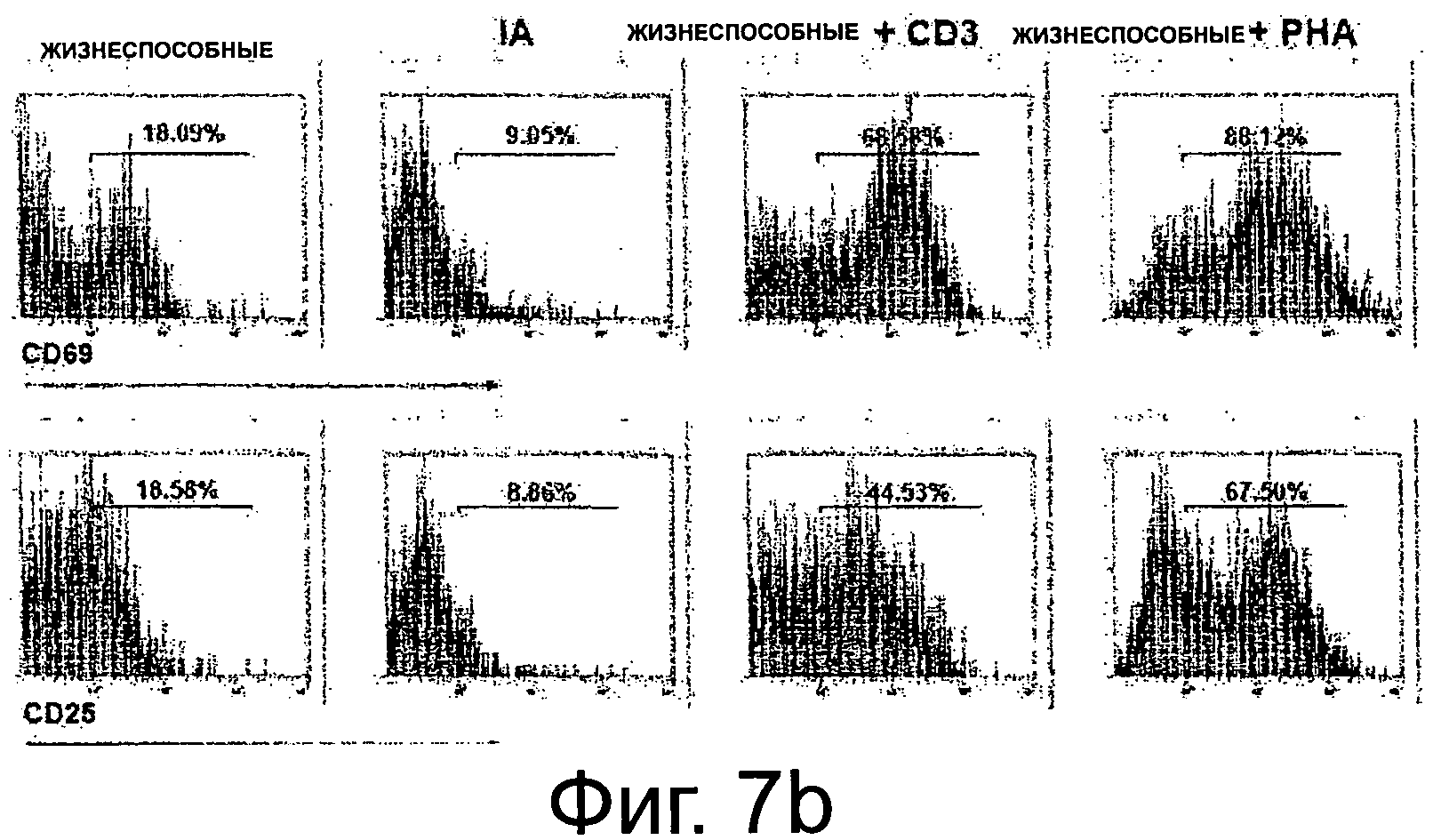
Фиг.7b показывает репрезентативный FACS-анализ РВМС или активированных (PHA, mAb к CD3). Gating представляет % положительных клеток.
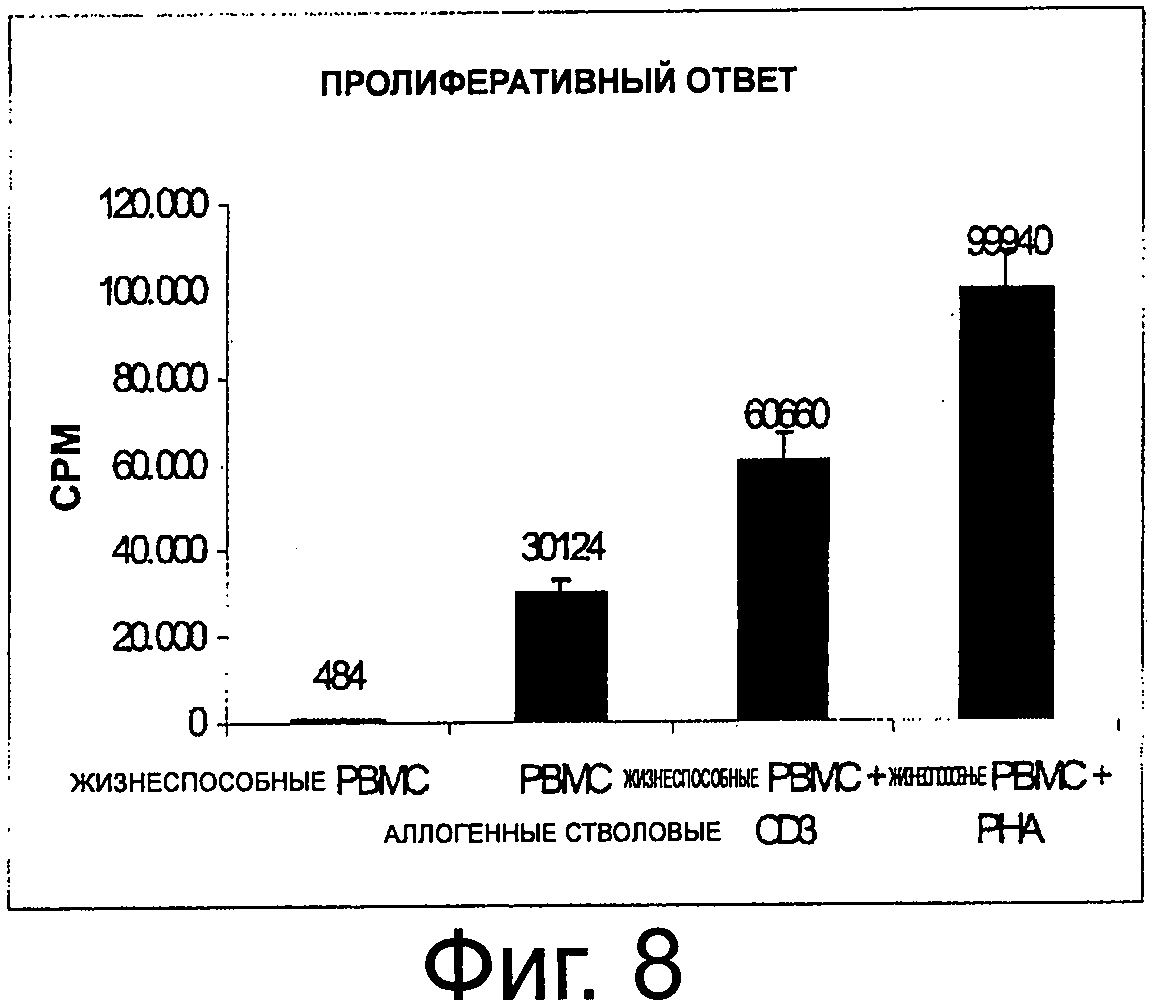
Фиг.8 показывает высокие скорости пролиферации, как зарегистрировано с помощью включения 3[Н]-тимидина стимулированных РВМС при сравнении с жизнеспособными РВМС, культивироваными в RPMI без стимуляции.
Фиг.9 показывает ингибирование Т-клеточного ответа РВМС-секретомы в анализе Т-клеточной пролиферации.
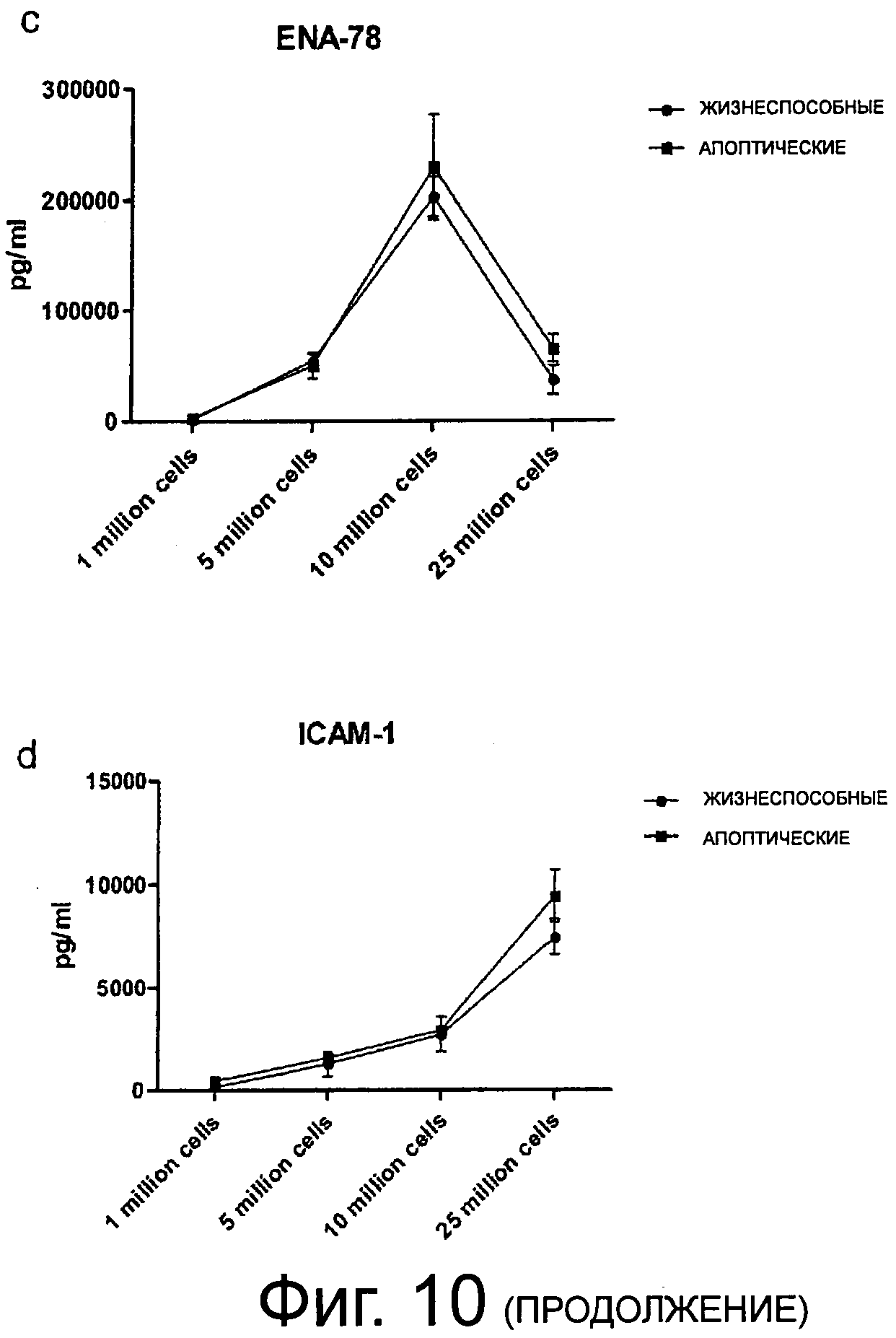
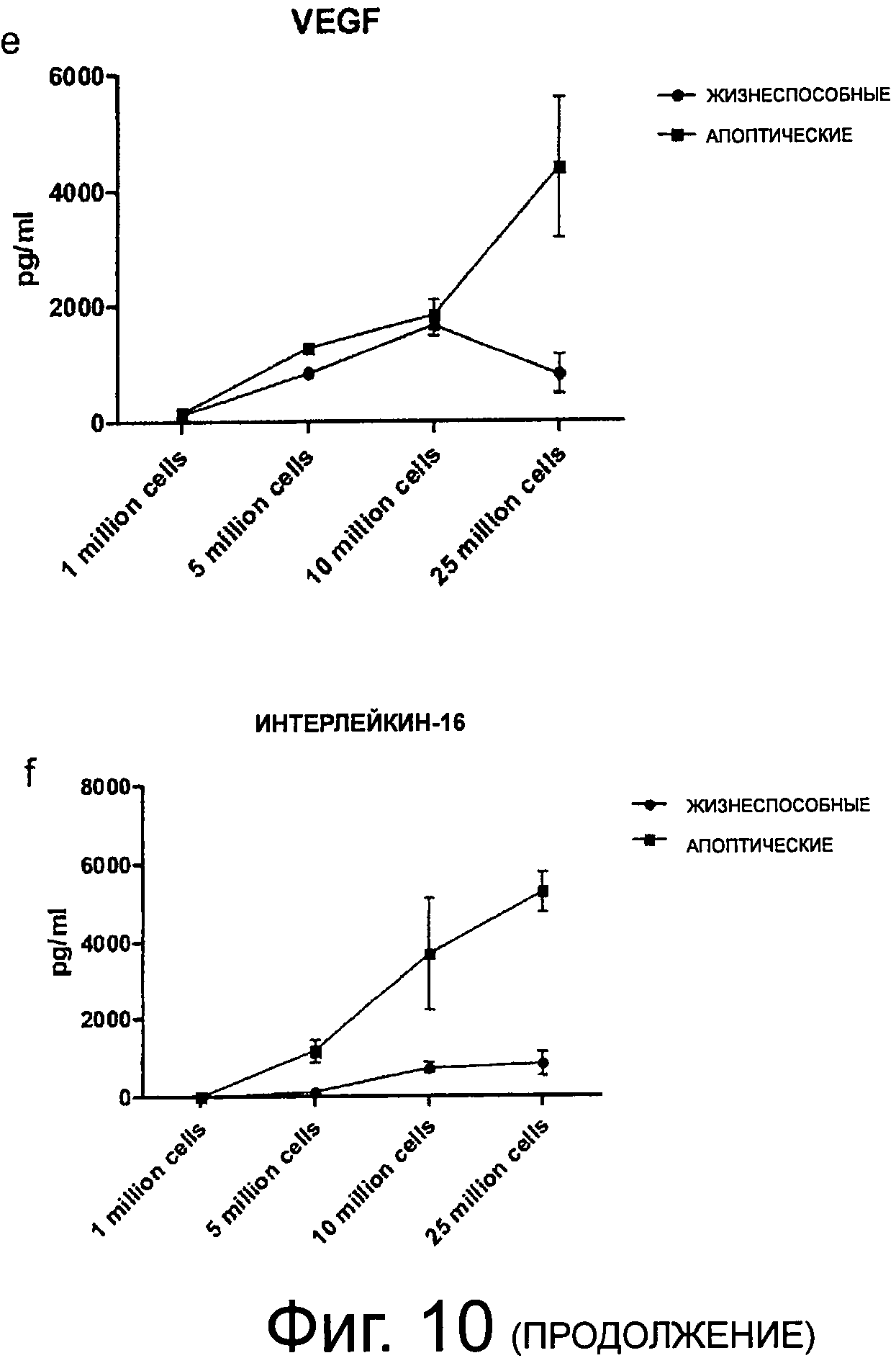
Фиг.10 (a-f) показывает уровни супернатантов Интелейкина-8, Gro-альфа, ENA-78, ICAM-1, VEGF и Интерлейкина-16. Апоптические РВМС показывают значительно разные характеристики секреции этих цитокинов и хемокинов относительно ангиогенеза и иммуносупрессии по сравнению с жизнеспособными клетками. Этот эффект даже более выражен, если клетки инкубировали при высоких плотностях.
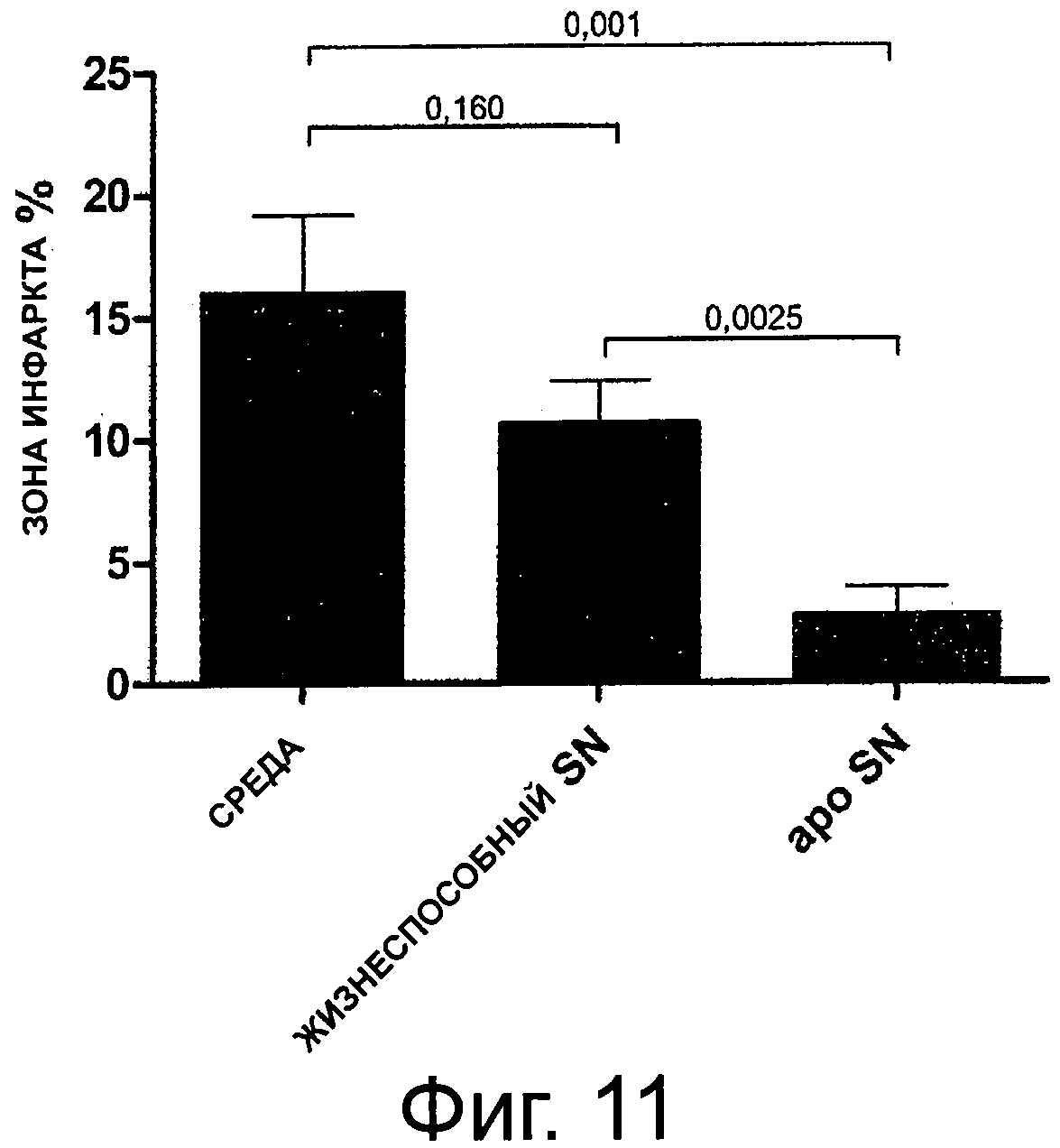
Фиг.11 показывает протяженность рубцовой ткани миокарда через 6 недель после экспериментального лигирования LAD (как % левого желудочка). Животных, которым вливали супернатанты клеточной культуры, разделяли по апоптическим клеткам, показывающим значительное снижение отложения коллагена, меньшее рубцовое распространение и более жизнеспособный миокард.
Фиг.12 (а-с) показывает макроскопический вид сердец крыс, извлеченных из организмов через 6 недель после экспериментального инфаркта миокарда. Животным переливали супернатанты из облученных апоптических клеток (с), показывая сниженное отложение коллагена и гораздо меньшие инфарктные зоны по сравнению со средой (а) или супернатантами от жизнеспособных клеток (b). Рубцовая ткань окрашена зеленым для лучшей визуализации.
Фиг.13 (a-d) показывает репрезентативный эхокардиографический анализ (М-Mode). Сердечная функция была значительно лучше у крыс, получавших IA-PBMC-супернатанты (с), по сравнению с крысами, получавшими среду (а) и жизнеспособные клетки (b). Эхокардиографическое изображение от ложнооперированной крысы представлено в (d).
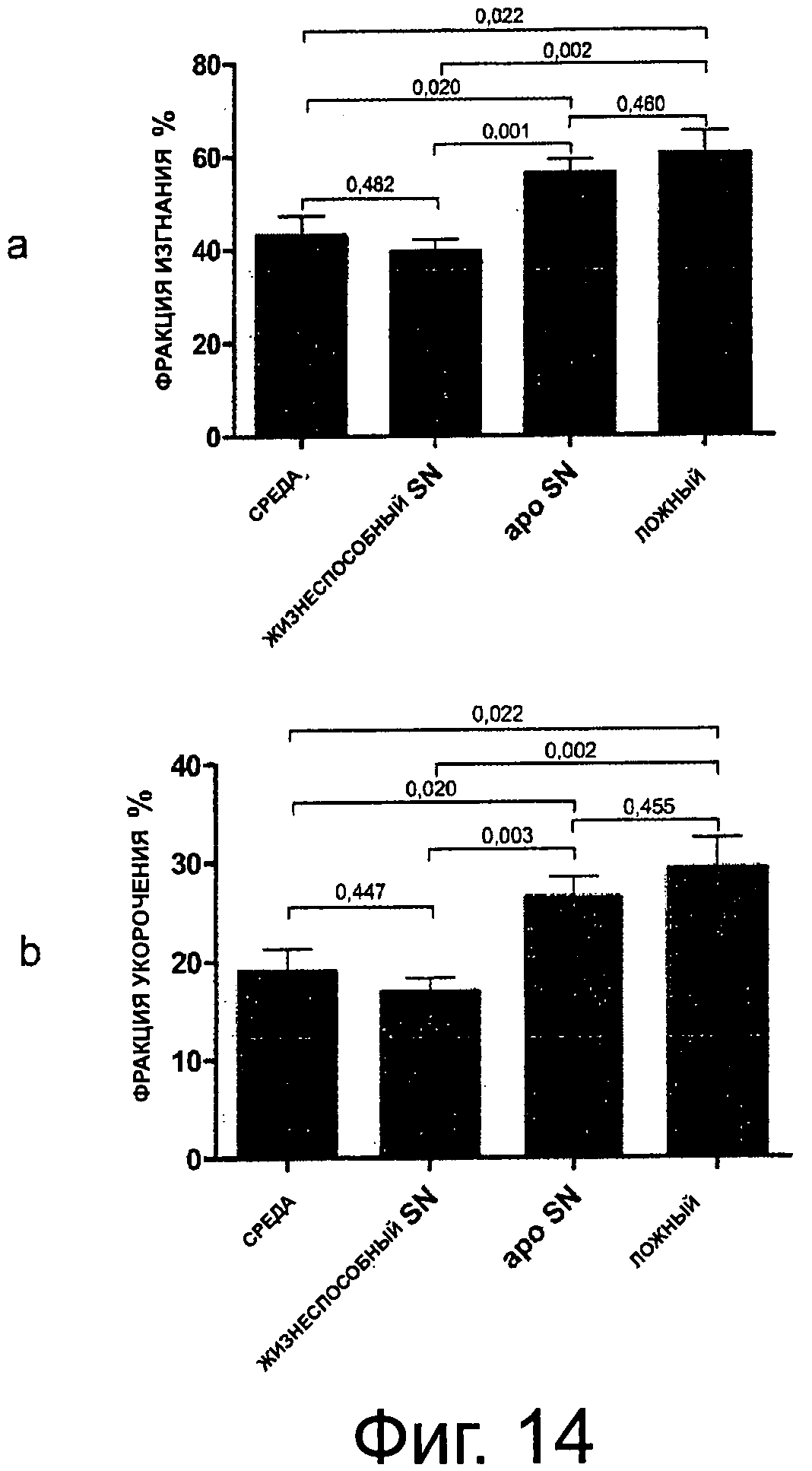
Фиг.14 (а, b) показывает эхокардиографический анализ, проведенный через 6 недель после инфаркта миокарда. Крысы, леченные супернатантами из облученных апоптических РВМС, показывают значительно лучшую сердечную функцию по сравнению с животными, которым вливали среду или супернатант жизнеспособной клеточной культуры.
Фиг.15 показывает кривые выживаемости Каплан-Мейера для всех четырех групп лечения. Обе группы животных, которым вливали супернатант жизнеспособной или апоптической РВМС-клеточной культуры, показывают лучшую выживаемость по сравнению с крысами, которым вливали среду (р<0.1).
Фиг.16 показывает эксперименты по анти-СD3 и РНА-стимуляции, выполненные с РВМС.
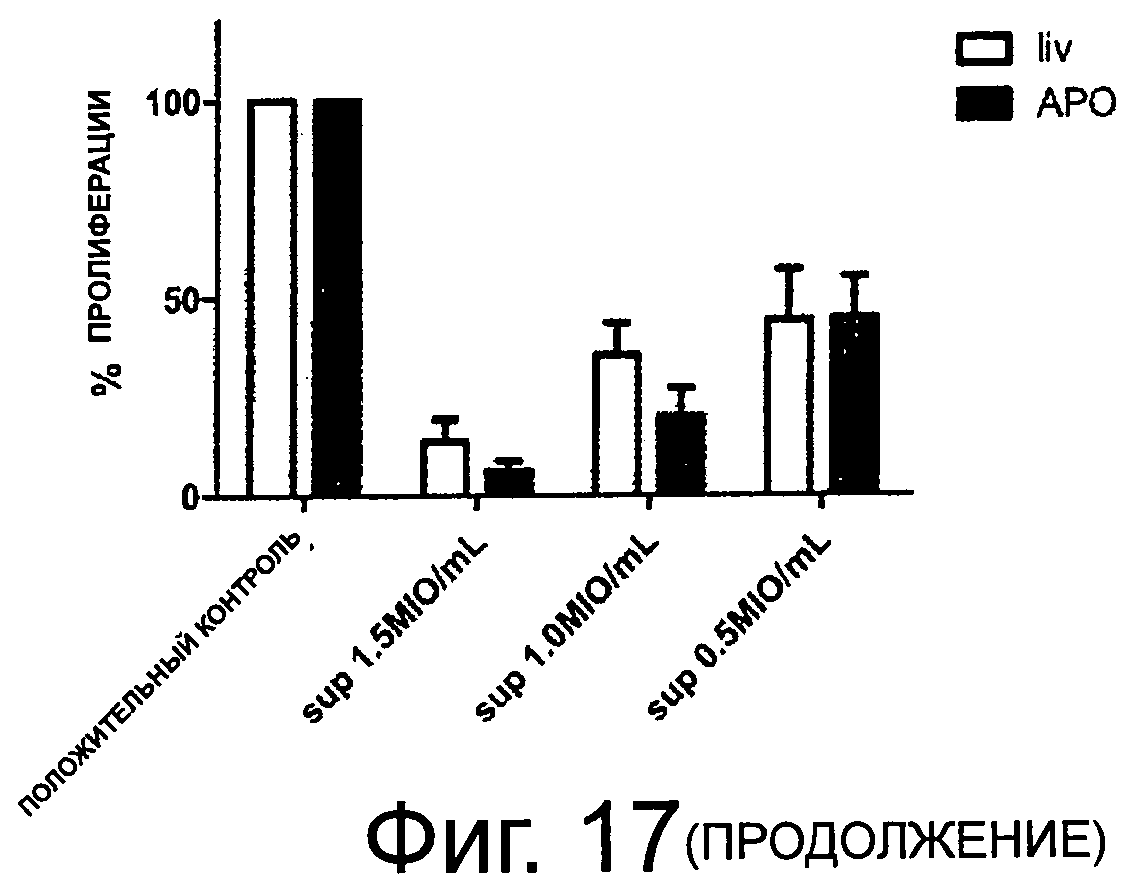
Фиг.17 показывает пролиферацию РВМС при стимуляции анти-СО3, РНА и смешанными лимфоцитами.
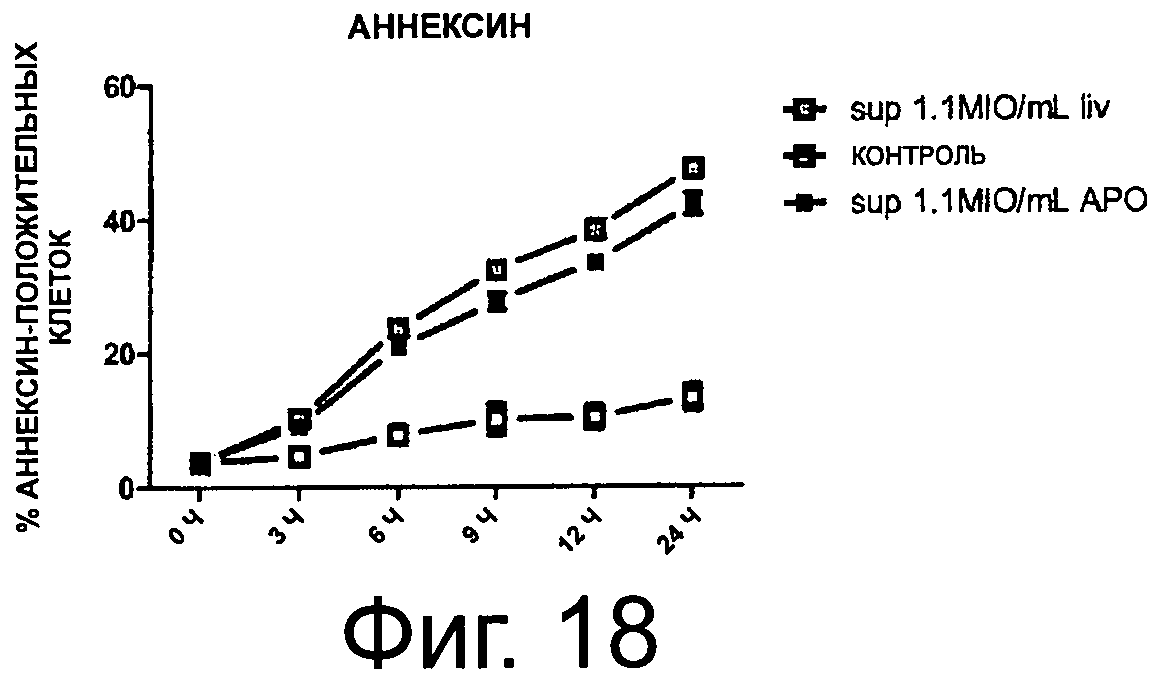
Фиг.18 показывает уровень Аннексии-V и PI-позитивности супернатанта CD4+клеток, инкубированных вместе с РВМС-супернатантами.
Фиг.19 показывает ингибирование активации CD25 и CD69 в CD4+клетках посредством РВМС-супернатанта.
Фиг.20 показывает, что «обесценивание» IL-10 и TGF-β не повышает скорости пролиферации CD4+клеток.
ПРИМЕРЫ: Пример 1:
Острый инфаркт миокарда (AMI) часто приводит к застойной сердечной недостаточности. Несмотря на современную фармакологическую и механическую реваскуляризацию, для замены нарушенного миокарда до сих пор экспериментально не определена эффективная терапия. Неотъемлемым компонентом процесса ремоделинга после AMI является воспалительный ответ и развитие неоангиогенеза после AMI. Этот процесс опосредуется цитокинами и воспалительными клетками в инфарктном миокарде, который фагоцитирует апоптическую и некротическую ткань и инициирует хоуминг интерстициальных дендритных клеток (IDC) и макрофагов. Клинические испытания, имеющие цель ослабить AMI, индуцированный воспалительным ответом, оттягивали, поскольку системная иммуносупрессия (стероиды) приводила к увеличению размера инфаркта и задерживала заживление миокарда. На основании этих данных можно сделать вывод, что воспалительный ответ после AMI ответственен за стабилизацию ткани и формирование рубца. Новое поле деятельности в регенеративной сердечно-сосудистой медицине появилось, когда исследователи наблюдали, что удаленные стволовые клетки определяют участки повреждения и активируют структурное и функциональное восстановление. Применяя этот подход, Orlic et al. инъецировали c-kit-положительные эндотелиальные клетки-предшественники (ЕРС) в пограничную зону экспериментального AMI, вследствие чего повышался неоангиогенез и регенерация миокарда и сосудистых структур. Эта работа дала толчок потоку публикаций, которые продемонстрировали регенеративный потенциал "клеточной терапии", однако все еще остается неясным, вызван ли этот терапевтический эффект трансплантированными клетками самими по себе, восстановлением немигрирующих кардиальных стволовых клеток, или за счет активации до сих пор неизвестных паракринных и иммунологических механизмов. Ишемия в инфарктном миокарде вызвана апоптическими процессами и вызывает изменения в липидах клеточной поверхности в омертвелых клетках. Хорошо изученная модификация состоит в потере фосфолипидной асимметрии и воздействии фосфатидилсерина (PS). Этот PS распознается макрофагами и дендритными клетками (антигенпрезентирующими клетками, АРС) посредством лигандов, таких как тромбоспондин, CD14 и CD36. При физиологических состояниях эти рецепторы служат в качестве поглощенного апоптического и некротического дебриса и инициируют процесс латентной "чистки". Этот процесс фагоцитоза с помощью АРС приводит к фенотипическому противовоспалительному ответу, что определено увеличенной продукцией IL-10 и TGF-P, и ослаблению функции АРС. Исходя из клинического значения существуют сообщения, которые демонстрируют, что вливание апоптических клеток выступает в модели трансплантации гемопоэтическими клетками (НС) для приживления аллогенных НС и для приостановки острой реакции "трансплантант против хозяина" (GVHD). Кроме того, в моделях трансплантации солидных органов вливание донорных апоптических клеток повышает срок жизнеспособности трансплантированного сердца. В отличие от воспаления и относительно восстановления клеток-предшественников из костного мозга (ВМ) показано, что опсонизация апоптических клеток устанавливает усиленную продукцию VEGF и CXC8/IL-8 АРС. В дополнение к последним цитокинам, также было определено, что ММР9 является жизненно важным для ЕРС-восстановления и высвобождается из костного мозга.
В настоящее время "status quo" в лечении AMI направлен на раннюю реперфузию и восстановление острозакупоренной коронарной артерии и воспаление миокарда после инфаркта является очевидной пользой, несмотря на то, что это состояние повышает повреждение миокарда и препятствует эндогенным механизмам восстановления.
Материалы и методы
Индукция апоптоза РВМС и получение супернатантов
Для экспериментов in vivo кровь брали у здоровых молодых добровольцев. Апоптоз индуцировали путем облучения цезием Cs-137 дозой 60 Гр (человеческие РВМС) или дозой 45 Гр для экспериментов in vivo (крысиные РВМС). Клетки ресуспендировали в бессывороточной культуральной среде Ultra Culture Medium (Cambrex Corp., USA), содержащей 0,2% гентамицина сульфат (Sigma Chemical Co, USA), 0,5% β-меркаптоэтанол (Sigma, USA), 1% L-глутамин (Sigma, USA), и культивировали в увлажненной атмосфере в течение 24 ч для экспериментов in vitro (концентрация клеток, 1×106 мл). Индукцию апоптоза регистрировали с помощью метода двойного окрашивания аннексин V-ФИТЦ (FITC/PI) (Becton Dickinson, USA) на проточном цитометре. Аннексин-позитивность РВМС определяли при >70% и вследствие чего их обозначали «1А-РВМС». Необлученные РВМС служили в качестве контроля и их обозначали «жизнеспособные-РВМС». Из обоих экспериментальных установок собирали супернатанты и использовали в качестве экспериментальных элементов, как описано ниже (SN-жизнеспособные-РВМС, SN-IA-PBMC).
Эксперименты со стимуляцией LPS
Человеческие РВМС и моноциты (чистота >95%) разделяли с использованием системы с магнитными гранулами (негативный отбор Miltenyi Biotec, USA). РВМС и моноциты совместно инкубировали в течение 4 часов вместе с апоптическими аутологичными РВМС в различных концентрациях (аннексин-позитивность >70%) и Липополисахаридом (1 нг/мл LPS; Sigma Chemical Co, USA). Супернатанты стабилизировали и хранили замороженными при -80°С до последующего использования. Определяли высвобождение IL-6 и IL-1β, используя коммерчески доступные наборы ELISA (BenderMedSystems, Austria).
Приготовление дендритных клеток (DC), полученных из моноцитов, и стимуляция Т-клеток
РВМС изолировали из гепаринизированной цельной крови здоровых доноров путем стандартного центрифугирования в градиенте плотности вместе со средой фиколл-пак (Ficoll-Paque, GE Healthcare Bio-Sciences АВ, Sweden). Т-клетки и моноциты разделяли посредством магнитной сортировки с использованием техники MACS (Miltenyi Biotec). Очищенные Т-клетки получали посредством отрицательного истощения CD l1b, CD14, CD16, CD19, CD33 и МНС класс II-положительных клеток с соответствующим моноклональным антителом. Моноциты обогащали путем использования биотинилированного CD14 mAb VIM 13 (чистота 95%). DC генерировали путем культивирования очищенных моноцитов крови в течение 7 дней в комбинации с GM-CSF (50 нг/мл) и IL-4 (100 мкг/мл). Затем, DC дифференциально стимулировали. Созревание индуцировали либо путем добавления 100 нг/мл LPS из Escherichia coli (серотип 0127-В8, Sigma Chemie) в течение 24 ч, либо путем добавления LPS в течение 2 ч с последующим культивированием дендритных клеток вместе с апоптическими клетками в соотношении 1:1 в течение 22 ч. Дополнительно, DC обрабатывали только апоптическими клетками (1:1) в течение 24 ч. Для смешанной лейкоцитарной реакции (MLR) аллогенные очищенные Т-клетки (1×105/лунку) инкубировали в 96-луночных планшетах для клеточных культур (Corning Costar) вместе с подобранным количеством дифференциально стимулированных DC в течение 6 дней. Анализ выполняли трижды. Пролиферацию Т-клеток контролировали путем регистрации включения [метил-3Н]тимидина (ICN Pharmaceuticals), добавленного через 5 дней. Клетки собирали через 48 часов и регистрировали включенный [метил-3Н]тимидин на сцинтилляцинном счетчике микропланшет.
Клеточная культура, выделение РНК и приготовление кДНК жизнеспособных РВМС, IA-PBMC и SN-обученных фибробластов
IA-PBMC, жизнеспособные-РВМС (1×106 клеток), оба состояния культивировали в течение 24 ч в культуральной среде Ultra Culture Medium и исследовали фибробласты, приведенные в контакт SN-жизнеспособными-РВМС/SN-IА-РВМС (1×105 фибробластов полученных из Cascade Inc. (USA), культивировали в модифицированной по способу Дульбекко среде Игла (DMEM, Gibco BRL, USA), дополненной 10% эмбриональной бычьей сывороткой (FBS, РАА, Austria), 25 мМ L-глутамина (Gibco, BRL, USA) и 1% пенициллин/стрептомицином (Gibco), и высеивали в 12-луночные планшеты; фибробласты инкубировали совместно с SN-жизнеспособными-РВМС, SN-IA-PBMC в течение 4 и 24 ч соответственно). После экстракции РНК РВМС и фибробластов (используя RNeasy, QilAGEN, Austria), следуя инструкциям производителя, транскрибировали кДНК с использованием набора для синтеза кДНК iScript (BioRad, USA), как указано в инструкции.
Количественная ПЦР в реальном времени
Экспрессию мРНК измеряли с помощью ПЦР в реальном времени с использованием LightCycler Fast Start DNA Master SYBR Green I (Roche Applied Science, Penzberg, Germany) согласно протоколу изготовителя. Праймерами для VEGF служили: прямой: 5 '-CCCTGATGAGATCGAGTACATCTT-3', обратный: 5'- ACCGCCTCGGCTTGTCAC-3'; для IL-8 прямой: 5 -CTCTTGGCAGCCTTCCTGATT-3', обратный: 5 -TATGCACTGACATCTAAGTTCTTTAGCA-3'; для ММР9 прямой: 5'-GGGAAGATGCTGGTGTTCA-3', обратный: 5 -CCTGGCAGAAATAGGCTTC-3' и для β-2-микроглобулина β 2М прямой: 5'-GATGAGTATGCCTGCCGTGTG-3', обратный: 5'-CAATCCAAATGCGGCATCT-3'. Относительную экспрессию генов-мишеней рассчитывали путем сравнения с конститутивным геном β2М, используя формулу, приведенную Wellmann et al. (Clinical Chemistry. 47 (2001) 654-660, 25). Эффективность пар праймеров определяли, как описано в A. Kadi et al. Vascular Pharmacology. 38 (2002) 219-227.
Высвобождение проангиогенетических факторов и ММР9 жизнеспособными РВМС и IA-PBMC после культивирования
IA-PBMC (5*105) и жизнеспособные РВМС инкубировали в атмосфере влажного воздуха в течение 24 ч. Через 24 ч собирали супернатанты и сразу же замораживали при -80°С до анализа. Лизаты соответствующих клеток служили в качестве контроля. Высвобождение проангиогенетических факторов (VEGF-A, CXCL-8/IL-8, GMCSF, GCSF) и ММР9, считающегося фактором высвобождения c-kit-клеток, анализировали с помощью ELISA (R&D, USA), следуя инструкциям производителя. Планшеты считывали при длине волны 450 нм на счетчике Wallac Multilabel 1420 (PerkinElmer, USA).
Восприимчивость сингенных IA-PBMC и жизнеспособных РВМС для AMI-эксперимента in vivo
Сингенные крысиные РВМС для экспериментов in vivo разделяли с помощью центрифугирования в градиенте плотности из цельной крови, полученной от пердварительно гепаринизированных крыс путем пунктирования сердца. Апоптоз индуцировали путем облучения цезием Cs-137 дозой 45 Гр для экспериментов in vivo и культивировали в течение 18 ч, как описано выше (аннексин-окрашивание >80% IA-PBMC, аннексин-окрашивание <30% жизнеспособных РВМС, 1×106/мл).
Индукция инфаркта миокарда
Инфаркт миокарда индуцировали у взрослых крыс-самцов линии Sprague-Dawley путем лигирования LAD, как ранее описано (Trescher К, et al. Cardiovasc Res. 2006: 69(3): 746-54). Вкратце, животным делали интраперитонеальную анастезию смесью ксилазина (1 мг/100 г массы тела) и кетамина (10 мг/100 г массы тела) и автоматически вентилировали. Выполняли левостороннюю торакотомию и накладывали лигатуру, используя пролен 6-0, вокруг LAD под левым предсердием. Непосредственно после приступа ишемии 8×106 апоптических РВМС, суспендированных в 0,3 мл клеточной культуральной среды, вливали в хвостовую вену. Вливание только клеточной культуральной среды жизнеспособных РВМС и имитация операции соответственно служили в данном эксперименте в качестве негативного контроля. Схема эксперимента на крысах представлена на фиг.1 (фиг.1a, b).
Отслеживание апоптических клеток
8×106 сингенных крысиных РВМС метили 15 мкМ карбоксифлуоресцеиндиацетат-сукцинимидил эфиром (CFSE, Fluka BioChemika, Buchs, Switzerland) при комнатной температуре в течение 10 мин. Мечение останавливали путем добавления эмбриональной телячьей сыворотки (FCS). Индуцировали апоптоз (аннексии V >70%) и инъецировали клетки после процедуры лигирования. Через 72 ч после операции крыс умерщвляли и печень, селезенку и сердце обрабатывали, следуя стандартной процедуре, для замороженных участков (n=4). Образцы анализировали с помощью конфокальной лазерной сканирующей микроскопии (лазерный сканирующий микроскоп ZEISS LSM 510, Germany), как ранее описано (Kerjaschki D, J Am Soc Nephrol. 2004; 15: 603-12).
Гистология и иммуногистохимия in vivo
Всех животных умерщвляли либо через 72 ч, либо через 6 недель после развития экспериментального инфаркта. Сердца извлекали из организмов и затем разрезали на части по уровню наибольшего распространения инфарктной зоны (n=8-10). Срезы фиксировали 10% нейтральным буферным формалином и заливали парафином для (иммуно-) гистологического окрашивания. Образцы ткани окрашивали гематоксилин-эозином (Н&Е) и elastic-van-Gieson (evg). Иммунопатологическую оценку выполняли с использованием следующих антител, направленных к CD68 (МСА 341R, AbD Serotec, UK), VEGF (05-443, Upstate/Milipore, USA), Flk-1 (sc-6251, Santa Cruz Biotechnology, USA), CD34 (sc-52478, Santa Cruz Biotechnology, USA), c-kit (sc-168, Santa Cruz Biotechnology, USA), SI00 beta (sc-58841, Santa Cruz Biotechnology, USA). Образцы ткани оценивали на микроскопе Olympus Vanox АНВТЗ (Olympus Vanox AHBT3, Olympus Optical Co. Ltd., Japan) при 200-кратном увеличении и фиксировали в цифровом формате с использованием камеры ProgRes CapturePro С12 plus (Jenoptik Laser Optik Systeme GmbH, Germany).
Определение размера инфаркта миокарда с помощью планиметрии
Для определения размера инфарктной зоны использовали программное обеспечение Image J planimetry (Rasband, W.S., Image J, U. S. National Institutes of Health, USA). Размер инфарктной миокардиальной ткани (% левого желудочка) рассчитывали путем деления области по окружности инфарктной зоны на общие эндокардиальные и эпикардиальные окружности левого желудочка. Планиметрические оценки осуществляли на образцах ткани, окрашенных evg, для лучшего сравнения некротических зон. Размер инфаркта выражали как процент общей левой желудочковой зоны.
Определение сердечной функции с помощью эхокардиографии
Через шесть недель после индукции инфаркта миокарда крыс анестезировали 100 мг/кг кетамина и 20 мг/кг ксилазина. Сонографическое исследование выполняли на системе Vivid 5 (General Electric Medical Systems, USA). Анализы выполнялись опытным оператором, который не видел группы лечения, к которым были отнесены животные (EW). Графики M-mode записывали от вида парастернальной короткой оси и получали систолические и диастолические параметры. Диаметры желудочков и их объемы определяли в систоле и диастоле. Укорочение фракции рассчитывали следующим образом: FS(%)=((LVEDD - LVESD)/ LVEDD)*100%
Статистические методы
Статистический анализ выполняли с использованием программного обеспечения SPSS (SPSS Inc., USA). Все данные представлены как среднее±стандартная ошибка среднего. Нормальное распределение проверяли с использованием теста Колмогорова-Смирнова. Парные двусторонние t-критерии для зависимых выборок и непарные t-критерии для независимых выборок применяли для расчета значимостей. Для приведения р-значений для множественных сравнений использовали поправку Бонферрони-Холма. Р-значения<0,05 считались статистически значимыми.
Результаты
Индукция апоптоза с помощью облучения цезием (IA-PBMC)
Для оценки иммуномодуляторного потенциала апоптических клеток сначала определяли клеточный ответ на индукцию апоптоза посредством облучения цезием человеческих мононуклеарных клеток периферической крови (РВМС) с помощью проточной цитометрии, используя Аннексин-V/PI окрашивание, на проточном цитометре.
Облучение вызывало позитивность для Аннексина в РВМС дозозависимым образом и достигало пикового значения за 24 ч по сравнению с жизнеспособными РВМС. Жизнеспособные клетки служили в качестве контроля (фиг.2а). Поскольку Аннексин-V-связывание достигало наибольшего значения через 24 ч, следующие исследования in vitro выполняли после этого периода культивации (IA-PBMC). Жизнеспособные РВМС служили в анализе ПЦР в реальном времени (RT-PCR) и экспериментах с использованием супернатантов в качестве контроля.
Доказательства иммуносупрессивных характеристик IA-PBMC in vitro
Интерлейкин-iβ и IL-6 признаны как главные провоспалительные медиаторы инфаркта миокарда in vivo. Для подтверждения гипотезы, оказывают ли действие IA-PBMC на клеточный ответ, человеческие моноциты и РВМС инкубировали совместно с IA-PBMC и клетки-мишени стимулировали LPS. Обнаружили дозозависимое снижение секреции IL-lβ и IL-6 в культурах обоих клеточных типов, как определено с помощью ELISA (фиг.2b, с). Для определения антипролиферативных эффектов IA-PBMC в аллогенной модели использовали реакцию смешанных лимфоцитов (MLR). Аллогенные очищенные Т-клетки использовали и эти эффекторные клетки инкубировали с возрастающими дозами дендритных клеток с/без добавления IA-PBMC. Фиг.2d показывает, что совместная инкубация IA-PBMC снижает скорость пролиферации дозозависимым образом.
IA-PBMC и жизнеспособные РВМС показывают повышенную транскрипцию мРНК VEGF, IL-8/CXL8 и ММР9.
Для обоснования, приводит ли облучение к усиленной транскрипции мРНК белков, которые, как известно, связаны с мобилизацией ЕРС, РВМС анализировали после разделения и после индукции апоптоза (24 ч). Жизнеспособные РВМС служили в качестве контроля (жизнеспособные РВМС или IA-PBMC). РНК-транскрипция показала небольшое различие экспрессии VEGF, что определено с помощью RT-PCR, при этом стойкое увеличение IL-8/CXCL8 и ММР9. Максимальная индукция для IL-8/CXL8 в IA-PBMC была увеличена в 6 раз по сравнению с 2-кратным увеличением в жизнеспособных клетках, и в 30 раз по сравнению с 5-кратным увеличением для ММР9 соотвественно (фиг.2е).
IA-PBMC и жизнеспособные РВМС секретируют паракринные факторы, которые вызывают высвобождение эндотелиальных клеток-предшественников (ЕРС).
SN, полученные из IA-PBMC и жизнеспособных РВМС, исследовали на количество VEGF, IL-8/CXCL8, GMCSF, GCSF и ММР9, используя ELISA, после 24-х часового культивирования. Как показано на фиг.2F, VEGF, IL-8/CXCL8 и ММР9 показывали прирост. GM-CSF и G-CSF не обнаруживались. Интересным было обнаружение, что ММР9 показывал максимальные результаты в клеточных лизатах.
SN, полученные из IA-PBMC и жизнеспособных РВМС, увеличивают проангиогенную мРНК-транскрипцию в мезенхимальных фибробластах.
Поскольку стромальными клетками в костном мозге являются фибробласты, то исследовали, способна ли совместная инкубация фибробластов с SN, полученными из IA-PBMC и жизнеспособных РВМС, повышать уровни VEGF, IL-8/CXCL8 и ММР9 мРНК-транскрипции, факторы, ответственные за мобилизацию ЕРС. Выполняли RT-PCR на 4 и 24 ч. Наивысшие уровни индукции детектировали для IL-8/CXCL8 в клетках, культивированных в IA-PBMC SN, достигая почти 120-кратной индукции за 4 ч по сравнению с контролем. Этот ответ также выявлен за 24 ч. Похожий ответ был обнаружен для VEGF, тогда как повышение экспрессии ММР9 в основном происходит через 24 ч. Эти данные показывает, что SN содержит паракринные факторы, которые позволяют фибробластам увеличивать мРНК-продукты, ответственные за проангиогенные эффекты в ВМ (фиг.2g).
Адоптивный перенос CFSE-меченных IA-PBMC в модели инфаркта миокарда у
крыс
Поскольку было подтверждено, что культивированные IA-PBMC являются и противовоспалительными, и проангиогенными in vitro, IA-PBMC и жизнеспособные РВМС вливали в модели крысиного острого AMI. Сначала определяли, проявляют ли эти культивированные клетки хоуминг после инфаркта. CFSE-меченные IA-PBMC инъецировали в хвостовую вену крысам сразу после лигирования LAD-артерии. Репрезентативная гистология представлена на фиг.За, b, с. Большинство CFSE IA-PBMC задерживались в селезенке и печени в течение 72 ч. В сердце клетки не обнаруживались.
Отклоненный ранний воспалительный иммунный ответ в AMI, леченном IA-PBMC
При внимательном изучении Н.Е.-окрашивания AMI-крысы, леченные контрольными инфарктными и жизнеспособными лейкоцитами (жизнеспособными РВМС), показали смешанный клеточный инфильтрат в раневой зоне в соответствии с грануляционной тканью с избытком нейтрофилов, макрофагов/моноцитов, лимфомононуклеарных клеток, фибробластов и активированных пролиферативных эндотелиальных клеток, смешанных с дистрофическими кардиомиоцитами (фиг.3d, е) в течение 72 ч после развития AMI. Для сравнения, AMI-крысы, леченные IA-PBMC, показывают густой мономорфный инфильтрат в раневых зонах, которые состоят из среднеразмерных моноцитоидных клеток с эозинофильной цитоплазмой, плотным ядром и окружены веретенообразной структурой (фиг.3f). В дополнение, можно обнаружить некоторые лимфомононуклеарные клетки, особенно плазменные клетки, фибробласты и эндотелиальные клетки. Иммуногистохимический анализ показывает, что клеточный инфильтрат в IA-PBMC AMI крысах состоит из избыточного количества CD68+моноцитов/макрофагов (фиг.3i), которых намного меньше в других двух группах (MCI, жизнеспособные РВМС, IA-PBMC, поле зрение под большим увеличением, HPF, 60,0±3,6, 78,3±3,8, 285,0±23,0 (SEM) соответственно) (фиг.3g, h). Содержание Виментин-положительных мезенхимальных клеток аналогично во всех группах, хотя S100+дендритные клетки главным образом найдены в контрольной группе инфаркта (AMI, жизнеспособные РВМС, IA-PBMC, HPF 15,±1,7, 12,4±2,3, 8,4±1,2 (SEM) соответственно по сравнению с группами лечения (фиг.3j, k, h, репрезентативная гистология, n=5)).
Ранний хоуминг VEGF+, Flkl+и c-kit+клеток в IA-PBMC-леченном AMI
Поскольку IA-PBMC показывает густой мономорфный инфильтрат в раневых зонах, которые состоят из моноциоидных клеток среднего размера с эозинофильной цитоплазмой и плотным ядром, изучали множественные поверхностные маркеры, связанные с неоангиогенезом и регенеративной способностью. Эта клеточная популяция, идентифицированная в Н.Е.-окрашивании в IA-PBMC-леченной АМ1-группе, окрашивалась интенсивно на фактор роста эндотелия сосудов (VEGFa), Flk-1 и c-kit (CD 117) (фиг.4 с, f, i). экспрессия обоих маркеров была снижена в контрольной AMI-группе и AMI-группе, леченной жизнеспособными РВМС (фиг.4а, b, d, е, j). Интересно, что IA-PBMC-леченный AMI показывал повышенное содержание CD34+клеток в густо уплотненной инфарктной зоне, которая относится к сосудистой структуре, что, как предполагается, относится к колонизации CD34+клетками (I) по сравнению с контролем (G, Н) (репрезентативная гистология, n=5)
Уменьшенный размер инфарктного повреждения в IA-PBMC-леченном AMI
В планиметрическом анализе, осуществленном на EVG, были индуцированы окрашенные образцы ткани из сердца, эксплантированного через 6 недель после инфаркта миокарда, крысы, получавшие физиологический раствор, показывали коллагеновый рубец, занимающий около 24.95%±3,58 (SEM) левого желудочка с признаками дилятации. У IA-РВМС-леченных крыс эти признаки были почти аннулированы с размерами инфаркта 5,81%±2,02 (SEM) по сравнению с 14,3%±1,7 (SEM) у леченных жизнеспособными РВМС (фиг.5а,b,с).
Функция LV усиливается в IA-PBMC-леченном AMI
Внутривенное введение сингенных культивированных IA-PBMC значительно улучшало эхокардиографические параметры по сравнению с животными, леченными жизнеспособными РВМС или культуральной средой. Фракция укорочения (SF) показывала значения 29,16%±4,65 (SEM) у ложнооперированных животных, 18,76%±1,13 (SEM) у леченных средой AMI-животных, 18,46%±1,67 (SEM) в AMI-группе, леченной жизнеспособными РВМС, и 25,14%±2,66 (SEM) у IA-PBMC-леченных крыс (фиг.5е). Фракция изгнания (EF) составляла 60,58%±6,81 (SEM) у ложнооперированных животных и снижалась до 42,91%±2,14 (SEM) у AMI-животных, леченных средой, и до 42,24%±3,28 (SEM) у животных, получающих жизнеспособные РВМС, тогда как у крыс, леченных IA-PBMC, EF составляла 53,46%±4,25.
Анализ конечно-систолического и конечно-диастолического диаметров (LVESD, LVEDD), конечно-систолического и конечно-диастолического объемов (LVESV, LVEDV) показывали сравнимые характеристики с ранее обнаруженными значениями. Получавшие физиологический раствор животные и леченные жизнеспособными РВМС крысы показывали значения LVEDD 10,43 мм ±0,21 (SEM) и 11,03 мм ±0,40 соответственно, IA-РВМС-крысы представляли даже немного сниженный диастолический диаметр левого желудочка - 8,99 мм±0,32 по сравнению с 9,47 мм ±0,64 у ложнооперированных животных. Различия в систолических диаметрах были менее выраженными, но в той же упорядоченности (панель 5 (а, b, с)).
Заключение
Эти результаты демонстрируют, что облученные апоптические РВМС (IA-PBMC) индуцируют иммунную супрессию in vitro и связаны с секрецией проангиогенных белков. Таким образом, культивированные жизнеспособные-РВМС и IA-PBMC вливали крысам с моделью острого AMI и демонстрировали, что такое лечение вызывает массивный хоуминг FLKl+/c-kit+положительных ЕРС в инфарктный миокард в течение 72 ч и вызывает значительное функциональное восстановление за 6 недель.
Совместное культивирование IA-PBMC в иммуноанализе приводит к снижению продукции IL-lβ и IL-6 и ослабляет реакцию смешанных лимфоцитов (MLR). Оба иммунных параметра описаны для определения роли в воспалении после ишемии миокарда. В дополнение, наблюдается, что жизнеспособные- и IA-PBMC секретируют CXCL8/IL-8 и ММР9 в клеточной среде в течение 24 ч. Описано, что эти белки ответственны за неоангиогенез и восстановление ЕРС из ВМ в ишемический миокард. Хемокин CXCL8/IL-8 принадлежит к семейству CXCL, которое состоит из небольших (<10 кДа) гепаринсвязывающих полипептидов, которые связываются с и имеют сильную хемотаксическую активность для эндотелиальных клеток. Три аминокислотных остатка на N-конце (Glu-Leu-Arg, мотив ELR) определяют связывание СХС-хемокинов, таких как IL-8 и Gro-альфа, с СХС-рецепторами 1 и 2 на эндотелиальных клетках и стимулируют эндотелиальный хемотаксис и ангиогенез. В дополнение было идентифицировано, что ММР9-секреция является главной в мобилизации ЕРС, поскольку эта матричная протеиназа служит в качестве сигнала для высвобождения растворимого kit-лиганда (sKitL), хемокина, который вызывает переход эндотелиальных и гематопоэтических стволовых клеток (ЕРС) из латентной в пролиферативную нишу в ВМ. В следующем анализе in vitro было продемонстрировано, что супернатант (SN), полученный из культивированных жизнеспособных- и IA-PBMC, имеет способность к усилению мРНК транскрипции CXCL8/IL-8 и ММР9 в мезенхимальных фибробластах. Эти данные показывают, что SN, полученный из жизнеспособных и облученных РВМС, содержит паракринные факторы, которые создают биологическую ситуацию в ВМ, которая приводит к высвобождению c-kit+ЕРС в кровообращение.
Для подтверждения любого полезного эффекта данной суспензии из культуральных клеток in vivo использовали модель повреждения миокарда с открытой грудной клеткой и вливание культивированных жизнеспособных- и IA-PBMC непосредственно сразу после лигирования LAD в экспериментальной модели на крысах. Сначала доказали, что CSFE-меченные IA-PBMC задерживаются в основном в селезенке и печени. Эти данные показывают, что "клеточная терапия" не проводится для инфарктного миокарда. Для сравнения, наиболее вероятно, что паракринные эффекты, либо вызванные "модифицированной" культуральной средой одной или вызванные "иммуноопосредованной цитокиновой бурей" вследствие взаимодействия суспензии культуральных клеток, являются причинными для регенеративного эффекта в AMI. Поскольку немедленное воспаление после острой ишемии определяет план развития гистологического анализа желудочковой дилатации через 72 ч после возникновения AMI. Можно показать, что IA-PBMC-леченные крысы показывали массивный хоуминг CD68+ и VEGFa/FLKl/c-kit+положительных популяций ЕРС-клеток за этот период времени. Для сравнения, больше S100β-положительных дендритных клеток было обнаружено в контрольном AMI, показывая повышенное АРС-основанное воспаление в контрольном AMI.
Результаты, показанные для IA-PBMC-леченных крыс, частично отражают ранее полученные сведения о естественном пути инфаркта миокарда. Относительно воспаления: при нормальных условиях процесс ремоделинга опосредуется цитокинами и воспалительными клетками в инфарктном миокарде, который инициирует процесс репарации ран, который характеризуется фагоцитозом и поглощением некротической ткани, гипертрофией выживших миоцитов, ангиогенезом и, в ограниченном масштабе, пролиферацией клеток-предшественников. Показан любой экспериментальный подход для того, чтобы начался воспалительный ответ после инфаркта в моделях AMI. При интерпретации оперативных данных гистологии утверждается, что 1А-РВМС-суспензия культуральных клеток в AMI приводит к улучшенному переходу от воспаления к c-kit+ ЕРС-фазе восстановления. Предыдущая работа подтвердила, что костный мозг терапии клетками-предшественниками после AMI улучшает сердечную функцию, независимо от того, происходит или нет трансдифференцировка клеток в кардиомиоциты. Относительно c-kit+ ЕРС подтверждено, что клетки, полученные из костного мозга, играют значимую роль как незаменимые для восстановления сердечной функции. Фармакологическое подавление иматиниб мезилатом и отсутствие мобилизации c-kit+ ЕРС приводит к усиленному ответу со стороны миофибробластов после AMI со стремительным спадом сердечной функции.
Эти результаты показывают регенеративную способность введенных "сингенных" культивированных IA-PBMC у пациентов, страдающих от AMI, и показывают, что пациентам, которые страдают от острого AMI, будет полезным введение аутологичных (т.е. от пациентов, которые лечились, или от того же вида) IA-PBMC.
Пример 2: Мононуклеарные клетки периферической крови (РВМС) в стадии покоя показывают низкоактивационный маркер и сниженную продукцию воспалительных цитокинов.
Предполагается, что активированные мононуклеарные клетки периферической крови (РВМС) и их супернатанты (SN) являются полезными для регенерации раны (Holzinger С et al. Eur J Vase Surg. 1994 May; 8(3): 351-6.). В Примере 1 было показано, что неактивированные РВМС и SN, полученные из них, обладают полезными эффектами в экспериментальном остром инфаркте миокарда (AMI) и раневой модели. Поскольку неактивация РВМС должна подтверждаться экспериментально, исследовали, приводит ли культивация РВМС к повышению уровней активирующих Т-клетки маркеров (CD69, CD25) или к повышению секреции воспалительных цитокинов (активация MOH04HTOB=TNFα, Т-клеточная активация=INFγ). В контрольном эксперименте культивированные Т-клетки инициировали стимуляцией mAb к CD3 или фитогемагглютинина (РИА).
Методы и Результаты
Венозную кровь собирали в EDTA-пробирки от здоровых добровольцев. После разделения в градиенте плотности с использованием среды фиколл-гипак РВМС собирали и разделяли на жизнеспособные и облученные апоптические клетки (IA-PBMC). Для получения апоптических клеток РВМС облучали дозой 60 Гр (Цезий-137). Для проточного цитометрического анализа 500000 РВМС культивировали в 200 мкл бессывороточной среды. Клетки либо стимулировали РНА (7 мкг/мл) или CD3-mAb (10 мкг/мл), либо не стимулировали вовсе. Через 24 ч инкубации клетки промывали, окрашивали на CD3, CD69 и CD25 (R&D System) и оценивали на наличие поверхностных активационных маркеров на FC500 (Coulter). Для ELISA-анализа РВМС культивировали всю ночь при плотности 2,5×106 клеток/мл, либо с, либо без стимуляции РНА или CD3. Через 24 ч супернатанты собирали и замораживали при -20°С. Использовали коммерчески доступные ELISA-наборы для TNF-α (R&D) и INF-γ(Bender). Вкратце, планшеты MaxiSorp покрывали антителами против TNF-a и INF-y и оставляли на ночь. Через 24 ч планшеты промывали и дважды добавляли образцы в каждую лунку. После инкубации и добавления к каждой лунке добавляли Стрептавидин-HRP, ТМВ-субстрат. После развития цвета ферментативную реакцию останавливали добавлением серной кислоты. Значения оптической плотности считывали на планшет-ридере Wallac Victor3.
Результаты
FACS-анализ: Т-клетки, стимулированные CD3 и РНА, показывали повышение экспрессии активационных маркеров CD69 и CD25 через 24 ч инкубации. Нестимулированные и апоптические клетки экспрессировали только низкие количества CD69 и CD25 (фиг.6а, репрезентативный образец, фиг.6b, гистограмма, n=4). Статистическая значимость представлена звездочкой (хх р<0.001, x р<0.05). ELISA анализ: тогда как ни TNF-α, ни INF-γ не были обнаружены в нестимулированных РВМС-полученных супернатантах, супернатанты из РВМС, стимулированных РНА или CD3, показывали высокие уровни этих цитокинов, как представлено в ELISA-анализе (звездочки ** р<0,001, * р<0.05, n=8). Результаты четко показывают разный характер секреции воспалительных цитокинов по сравнению с нестимулированными РВМС.
Заключение
Эти данные показывают, что "нестимулированные РВМС" представляют явно разный фенотип (активационный маркер, цитокиновая секреция) по сравнению со стимулированными РВМС (mAb к РНА и CD3).
Фигура 6а показывает, что ни нестимулированные жизнеспособные РВМС, ни IA-PBMC не секретируют происходящий в основном из моноцитов провоспалительный цитокин TNF-α (Значимости выражены следующим образом: * р=0.05, ** р=0.001, n=8)
Фигура 6b демонстрирует стойкую индукцию секреции провоспалительного интерферона-γ после активации по сравнению с нестимулированными РВМС (Значимости выражены следующим образом: * р=0.05, ** р=0.001; n=8).
Фиг.7а показывает подытоженные результаты проточного цитометрического анализа. РВМС лишали Т-клеток и оценивали экспрессию активационных маркеров CD69 и CD25. (Значимости выражены следующим образом: * р=0.05, ** р=0.001; n=4) Фиг.7b показывает репрезентативный FACS-анализ РВМС или активированных (PHA, mAb к CD3). Gating представляет % положительных клеток.
Пример 3: Пролиферативная активность РВМС, культивированных в физиологическом растворе
Целью данного примера является подтверждение того, что РВМС не обладают пролиферативной активностью по сравнению с иммунными анализами, в которых используется стимуляция специфических (CD3), неспецифических (лектин, РНА) и аллогенных Т-клеток (реакции смешанных лимфоцитов, MLR) в 2-дневном (CD3, РНА) и 5-дневном (MLR) стимуляционных анализах.
Материалы и методы
РВМС разделяли от молодых здоровых добровольцев с помощью центрифугирования в градиенте плотности в среде Ficoll и ресуспендировали в RPMI (Gibco, USA), содержащей 0,2% гентамицин сульфат (Sigma Chemical Со, USA), 1% L-глутамин (Sigma, USA) при плотности 1*105 клеток на 200 мкл. Клетки-респондеры либо стимулировали с помощью MoAb к CD3 (10 мкг/мл, BD, NJ, USA), РНА (7 мкл/мл, Sigma Chemical Со, USA), либо облученными аллогенными РВМС в соотношении 1:1 (для MLR). Планшеты инкубировали в течение 48 ч или 5 дней и затем активировали в течение 18 ч 3[Н]-тимидином (3,7*104 Бк/лунку; Amersham Pharmacia Biotech, Sweden). Клетки собирали и включение 3[Н]-тимидина измеряли в жидкостном сцинтилляционном счетчике.
Результаты
Стимулированные РВМС показывают высокие скорости пролиферации, как зарегистрировано с помощью включения 3[Н]-тимидина при сравнении с жизнеспособными РВМС, культивированными в RPMI без стимуляции (фиг.8). Этот эффект наблюдали при добавлении Т-клеточного специфического стимула (РНА, CD3), а также в анализе, где пролиферацию стимулировали антигенпрезентирующими клетками (MLR).
Заключение
Этот тип эксперимента подразумевает, что жизнеспособные РВМС, сохраняющиеся в культуре вплоть до 5 дней, не пролиферируют, тогда как РВМС, стимулированные разными путями, показывают значимый пролиферативный ответ. В связи с чем можно сделать вывод, что культура РВМС без стимуляции не приводит к пролиферативному ответу.
Пример 4: Секретом из разделенных РВМС, хранящийся в стерильных условиях, обладает неоангиогенной способностью
Поскольку неоангиогенез и воспаление строго связаны друг с другом в условиях in vivo, было исследовано, оказывает ли также этот секретом из РВМС антипролиферативные эффекты на Т-клетки и, вследствие чего, препятствовали ли воспалительному иммунному ответу.
Материалы и методы
Секретом получали путем инкубирования РВМС (2.5*106/mL) от молодых здоровых добровольцев, разделенных с помощью центрифугирования в градиенте плотности в среде Ficoll в течение 24 ч в RPMI (Gibco, СА, USA), содержащей 0,2% гентамицинсульфат (Sigma Chemical Со, USA), 1% L-глутамин (Sigma, USA). Супернатанты разделяли от клеточной фракции и хранили при -80°С. Для анализа пролиферации аллогенные РВМС ресуспендировали с плотностью 1*105 клеток на 200 мкл RPMI после разделения. Клетки-респондеры стимулировали либо с помощью MoAb к CD3 (10 мкг/мл, BD, USA), либо РНА (7 мкл/мл, Sigma Chemical Со, USA). Добавляли супернатанты в разных разведениях. Планшеты инкубировали в течение 48 ч и затем активировали в течение 18 ч с помощью 3[Н]-тимидина (3,7*104 Бк/лунку; Amersham Pharmacia Biotech, Sweden). Клетки собирали и включение3[Н]-тимидина регистрировали в жидкостном сцинтилляционном счетчике.
Результаты
Секретом аллогенных РВМС показывал значительное снижение скоростей пролиферации, измеренных путем включения3[Н]-тимидина, при сравнении с положительными контролями (фиг.9). Этот эффект являлся дозозависимым и его можно видеть при анти-СО3, а также при РНА-стимуляции.
Значение
Этот тип экспериментов подразумевает, что секретом, полученный из жизнеспособных РВМС и сохраняемый в культуре в течение 24 ч, проявляет значимые антипролиферативные эффекты in vitro. Эти данные показывают, что супернатант, полученный из РВМС, или в лиофилизированной форме может служить в качестве потенциальной лекарственной основы для лечения заболеваний человека, которые связаны с воспалением, вызванным гипоксией, или других гипервоспалительных заболеваний (напр., аутоиммунных заболеваний, воспалительных заболеваний кожи).
Пример 5: Паракринные факторы, секретируемые мононуклеарными клетками периферической крови, сохраняют сердечную функцию.
В примере 1 показано, что переливание культивированных облученных апоптических клеток, полученных из периферической крови, значительно повышали восстановление сердечной функции после развития эксперименального инфаркта миокарда у крыс. Это улучшение основано на иммуносупрессивных признаках апоптических клеток, проангиогенных эффектах и индукции усиленного хоуминга c-kit+эндотелиальных клеток-предшественников (ЕРС).
В настоящем примере мононуклеарные клетки периферической крови (РВМС) либо жизнеспособные, либо облученные дозой 60 Гр инкубировали в течение 24 часов с получением кондиционированных клеточной культурой супернатантов. Супернатанты лиофилизировали и хранили замороженными до применения в экспериментах in vivo. Инфаркт миокарда индуцировали у крыс линии Sprague-Dawley путем лигирования левой передней нисходящей артерии. После приступа ишемии лиофилизированные супернатанты ресуспендировали и инъецировали внутривенно. Образцы ткани для гистологических и иммуногистологических исследований получали спустя три дня и шесть недель после развития инфаркта миокарда. Сердечную функцию оценивали с помощью эхокардиографии через шесть недель после AMI. Ложнооперированные и нелеченые животные служили в качестве контроля.
Крысы, которым вливали супернатанты, полученные из апоптических РВМС, показывали повышенный миокардиальный ангиогенез и усиленный хоуминг эндотелиальных клеток-предшественников за 72 часа по сравнению с контролями. Планиметрическое исследование фиброзных зон показывало уменьшение размеров инфаркта у животных, которым вливали супернатанты из апоптических клеток. Кроме того, эхокардиография показала значимое улучшение, касающееся пост-AMI ремоделинга, что явствует из уменьшенной фракции выброса и сохраненной желудочковой геометрии. Фракция выброса левого желудочка (LVEF) у крыс, получающих супернатанты из апоптических клеток, составляла среднее значение 56±4% по сравнению с 60±5% у ложнооперированных животных, тогда как нелеченые или инъецированные супернатантами жизнеспособных клеток животные показали значительное снижение LVEF до 44±3% и 41±4% соответственно (р<0.001).
Эти данные показывают, что супернатанты, полученные из облученных апоптических РВМС в экспериментальном AMI, подавляют воспаление и вызывают преимущественный хоуминг регенеративных ЕРС, приводя к сохранению желудочковой функции.
Методы
Клеточная культура человеческих РВМС для анализа in vitro
Человеческие мононуклеарные клетки периферической крови (РВМС) получали с помощью центрифугирования в градиенте плотности с использованием среды Ficoll, как ранее описано. Для индуцирования апоптоза в человеческих РВМС клетки облучали дозой 60 Гр (облучающий автомат для продуктов крови человека, Department of Hematology, General Hospital Vienna). Как жизнеспособные, так и облученные апоптические (IA-) РВМС инкубировали при температуре 37°С в течение 24 часов при разных плотностях клеток (1*106, 5*106, 10*106 и 25*106 клеток/миллилитр, n=5). Затем получали супернатанты и измеряли уровни секретированных белков с помощью иммуносорбентного анализа с ферментной меткой (ELISA, R&D Systems, Minneapolis, USA), согласно протоколам, поставляемым производителем.
Получение сингенных IA-PBMC и жизнеспособных-РВМС для AMI в эксперименте in vivo
Сингенные крысиные РВМС для экспериментов in vivo разделяли с помощью центрифугирования в градиенте плотности из цельной крови, полученной из предварительно гепаринизированных крыс путем пунктирования правого предсердия. Апоптоз индуцировали путем облучения цезием Cs-137 дозой 45 Гр для экспериментов in vivo и культивировали при 37°С при клеточной плотности 25* 106 клеток/миллилитр. Индукцию апоптоза путем облучения измеряли с помощью проточной цитометрии (аннексии V-окрашивание >80% для IA-PBMC, аннексии V-окрашивание <20% для жизнеспособных РВМС). Клетки инкубировали в течение 24 ч в увлажненной атмосфере (5% СO2, 37°С, относительная влажность 95%). Супернатанты удаляли и проводили диализ с пределом отсечения 3,5 кДа (Spectrum laboratories, Breda, The Netherlands) против 50 мМ аммония ацетата всю ночь при температуре 4°С. Затем супернатанты фильтровали в стерильных условиях и лиофилизировали. Лиофилизированную секретому хранили при -80°С и ресуспендировали заново для каждого эксперимента. Секретому отбирали для определения значения ее рН. Лиофилизированный порошок хранили при -80°С до проведения следующего эксперимента.
Индукция инфаркта миокарда
Эксперименты на животных были одобрены комитетом по изучению животных, Medical University of Vienna. Все эксперименты выполняли в соответствии с Руководством по использованию лабораторных животных и уходу за ними от National Institutes of Health (NIH). Инфаркт миокарда индуцировали у взрослых крыс линии Sprague-Dawley путем лигирования левой передней нисходящей артерии (LAD). Вкратце, животным делали интраперитонеальную анестезию смесью ксилазина (1 мг/100 г массы тела) и кетамина (10 мг/100 г массы тела) и механически вентилировали. Выполняли левостороннюю торакотомию и накладывали лигатуру, используя пролен 6-0, вокруг LAD под левым предсердием. Непосредственно после приступа ишемии лиофилизированные супернатанты, полученные из 8×106 апоптических РВМС и ресуспендированные в 0,3 мл клеточной культуральной среды, вливали в бедренную вену. Вливание только клеточной культуральной среды, супернатантов жизнеспособных РВМС и имитация операции служили в данном эксперименте в качестве негативного контроля соответственно. Схема эксперимента представлена на фиг.1.
Гистология и иммуногистохимия in vivo
См. пример 1.
Определение размера инфаркта миокарда с помощью планиметрии
См. пример 1.
Оценка сердечной функции с помощью эхокардиографии
См. пример 1.
Статистические методы
Статистический анализ выполняли с использованием программного обеспечения Graph Pad Prism (USA). Все данные представлены как среднее±стандартная ошибка среднего. Парные двусторонние t-критерии для зависимых выборок и непарные t-критерии для независимых выборок применяли для расчета значимостей.
Межгрупповые различия, касающиеся продолжительности острого инфаркта миокарда, сравнивали с помощью графического метода Каплан-Мейер. Для приведения р-значений для множественных сравнений использовали поправку Бонферрони-Холма. Р-значения <0,05 считались статистически значимыми.
Результаты
Определение паракринных факторов, секретированных IA-PBMC и жизнеспособными РВМС, с помощью ELISA
Результаты показаны на фиг.10-15.
Пример 6. Паракринные факторы, секретированные мононуклеарными клетками периферической крови, обладают иммуносупрессивными характеристиками.
В примере 1 представлены противовоспалительные эффекты РВМС-секретомы в экспериментальной модели острого инфаркта миокарда (AMI). В данном Примере показано, что применение РВМС-секретомы после индукции AMI ингибирует воспалительное повреждение сердечной мышцы посредством массивного подавления иммунного ответа.
Учитывая эти результаты, были исследованы возможные иммуносупрессивные эффекты секретомы в экспериментах in vitro. CD4+клетки играют ключевую роль в подготовке иммунного ответа, так как они являются важнейшими для поддержки других лейкоцитов (напр., макрофагов, В-клеток, цитотоксических Т-клеток) в иммунологическом процессе.
Материалы и методы Продукция РВМС-секретома
РВМС от здоровых добровольцев разделяли с помощью центрифугирования в градиенте плотности со средой Ficoll. Клетки ресуспендировали в среде Ultra Culture Medium (Lonza, Basel, Switzerland) при концентрации 1*106 клеток/мл (sup liv). Для получения секретомы из апоптических РВМС индуцировали апоптоз путем облучения дозой 60 Гр (sup АРА). Клетки инкубировали в течение 24 ч в увлажненной атмосфере (5% СO2, 37°С, относительная влажность 95%). Супернатанты удаляли и проводили диализ с пределом отсечения 3,5 кДа (Spectrum laboratories, Breda, The Netherlands) против 50 мМ аммония ацетата при температуре 4°С. Затем супернатанты фильтровали в стерильных условиях и лиофилизировали. Лиофилизированную секретому хранили при -80°С и ресуспендировали заново для каждого эксперимента. Секретом отбирали для определения значения его рН.
Разделение СБ4-клеток
CD4+клетки разделяли путем истощения He-CD4+Т-клеток, применяя систему магнитных микроносителей MACS (Miltenyi, Bergisch Gladbach, Germany). Клетки приготавливали заново и использовали непосредственно перед каждым экспериментом.
Измерение апоптоза
Апоптоз детектировали с помощью проточной цитометрии с использованием коммерчески доступного набора Аннексии V/PI (BD, New Jersey, USA). Апоптоз определяли по положительному окрашиванию аннексином, поздний апоптоз - по PI-позитивности.
Эксперименты по пролиферации
РВМС или очищенные CD4+клетки разводили в среде Ultra Culture, дополненной 0,2%, гентамицинсульфатом (Sigma, St. Louis, МО, USA), 0.5% Р-меркаптоэтанолом (Sigma, St Louis, MO, USA) и 1% GlutaMAX-I (Invitrogen, Carlsbad, CA, USA) до концентрации 1*105/лунку в 96-луночной планшете с круглым дном. Клетки стимулировали либо РНА (7 мкг/мл, Sigma, USA), CD3 (10 мкг/мл, BD, New Jersey, USA), IL-2 (10 мкг/мл, BD, USA), либо аллогенными облученными (60 Гр) РВМС для MLR в соотношении 1:1. Клетки инкубировали в течение 48 ч или 5 дней (MLR) с различными концентрациями РВМС-секретома, IL-10 или TGF-β. Затем клетки активировали в течение 18 ч3[Н]-тимидином (3,7×104 Бк/лунку; Amersham Pharmacia Biotech, Uppsala, Sweden). Клетки собирали и включение3[Н]-тимидина регистрировали в жидкостном сцинтилляционном счетчике.
Активационные маркеры
Очищенные CD4+клетки стимулировали анти-СD3 (10 мкг/мл) и инкубировали совместно с разными концентрациями РВМС-секретома. Клетки окрашивали для CD69 и CD25, следуя стандартному протоколу окрашивания для проточной цитометрии, и анализировали на проточном цитометре FC500 (Beckman Coulter, Fullerton, СА, USA).
Результаты
В предварительных экспериментах тестировали антипролиферативные свойства РВМС-супернатантов из жизнеспособных клеток (sup liv). В экспериментах стимуляции анти-СО3 и РНА скорости пролиферации были значительно снижены посредством добавления секретома (n=10).
Учитывая эти результаты, оценивали эффект РВМС-секретома на Т-хелперном компартменте, поскольку эти клетки играют значимую роль в запуске и сохранении иммунного ответа. По аналогии с фиг.16, высокоочищенные CD4+клетки потеряли свою пролиферативную способность из-за добавления секретома. Этот феномен наблюдался для супернатанта живых, а также апоптических облученных РВМС (фиг.17, n=5).
Следующим этапом было определение возможных эффектов секретома на жизнеспособность клеток. Для этого CD4+клетки в покое инкубировали с супернатантом и оценивали Аннексии V и PI-позитивность. Супернатанты из обоих, живых и апоптических, РВМС продемонстрировали значимые проапоптические эффекты (фиг.18, n=5).
Для определения, способен ли РВМС-секретом ингибировать CD4+клеточную активацию Т-клеточных активационных маркеров, оценивали CD25 и CD69 после анти-СО3-стимуляции CD4+клеток. Активация обоих маркеров являлась значимой и ингибировалась дозозависимым образом посредством РВМС-секретома (фиг.19, n=5).
В последнем эксперименте исследовали эффект иммуносупрессивных цитокинов IL-10 и TGF-β путем добавления нейтрализующих антител. Обнаружено, что ни IL-10, ни TGF-β не отвечают за антипролиферативные эффекты нашей РВМС-секретомы, поскольку «обесценивание» этих цитокинов не повышает скорости пролиферации (фиг.20, n=5).
Заключение
Эти эксперименты впервые показывают, что РВМС-серетома обладает иммуносупрессивными свойствами in vitro. Показано, что супернатант а) снижает скорости пролиферации в экспериментах стимуляции анти-СD3, РНА и MLR, b) имеет способность индуцировать апоптоз и ингибировать активацию CD4+клеток при Т-клеточном стимулировании.
Реферат
Настоящее изобретение относится к фармацевтической промышленности, а именно к препарату для лечения воспалительного состояния, связанного с ишемией. Фармацевтический препарат для лечения внутреннего воспалительного состояния, связанного с ишемией, содержащий: a) физиологический раствор, включающий, по меньшей мере, 10на мл мононуклеарных клеток периферической крови (PBMC) или их популяцию, или b) супернатант раствора a), где раствор a) получают путем культивирования PBMC или их популяции в физиологическом растворе, свободном от PBMC-пролиферирующих и PBMC-активирующих веществ, причем РВМС или их популяцию культивируют в условиях, вызывающих стресс перед или в течение культивирования. Применение препарата для изготовления лекарственного средства для лечения внутреннего воспалительного состояния, связанного с ишемией. Способ приготовления фармацевтического препарата. Вышеописанный фармацевтический препарат обладает повышенной эффективностью лечения внутренних воспалительных процессов, связанных с ишемией. 3 н. и 10 з.п. ф-лы, 20 ил., 6 пр.
Формула
a) физиологический раствор, включающий по меньшей мере 105 на мл мононуклеарных клеток периферической крови (PBMC) или их популяцию, или
b) супернатант раствора a), где раствор a) получают путем культивирования PBMC или их популяции в физиологическом растворе, свободном от PBMC-пролиферирующих и PBMC-активирующих веществ, в течение по меньшей мере 4 часа,
причем РВМС или их популяцию культивируют в условиях, вызывающих стресс перед или в течение культивирования.
a) обеспечение мононуклеарных клеток периферической крови (PBMC) или их популяции,
b) культивирование клеток стадии a) в физиологическом растворе, не содержащем PBMC-пролиферирующие и PBMC-активирующие вещества, в течение по меньшей мере 4 часов и в условиях, вызывающих стресс перед или в течение культивирования,
c) изолирование клеток стадии b) и их супернатанта или их супернатанта,
d) приготовление фармацевтического препарата, используя по меньшей мере 105 клеток на мл и супернатант со стадии c) или супернатант со стадии c).

Комментарии