Т-клетки центральной памяти против третьей стороны, способы их получения и их применение в трансплантации и лечении заболеваний - RU2636503C2
Код документа: RU2636503C2
Чертежи





















Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение, в некоторых вариантах его осуществления, относится к индуцирующим толерантность и/или «трансплантат против лейкемии» - реактивным клеткам против третьей стороны, имеющим фенотип Т-лимфоцита центральной памяти, и, в частности, но не исключительно, к способам их получения и применению в трансплантации и лечении заболеваний.
УРОВЕНЬ ТЕХНИКИ
Трансплантация костного мозга (BM) обеспечивает радикальное лечение для многих пациентов с гемобластозами и другими гематологическим заболеваниями. Однако, трансплантат BM содержит T-клетки донора, которые реагируют на антигены хозяина (Ags) и вызывают мультисистемное заболевание «трансплантат против хозяина» (GVHD). В начале 80-х годов трансплантация костного мозга (BMT) без вредного действия GVHD была продемонстрирована в идентичных по гаплотипу (три несовпадающих локуса HLA) условиях у пациентов с тяжелым комбинированным иммунодефицитом (SCID). Проблема GVHD, которая является почти всегда летальной в таких условиях, была полностью предотвращена деплецией T-клеток.
Однако, у пациентов с лейкозом клинический результат подвергнутого деплеции T-клетками BM оказался неутешительным, так как эффект предотвращения GVHD был скомпенсирован заметно увеличенной скоростью отторжения трансплантата. Было показано, что отторжение опосредовано устойчивыми к химиолучевой терапии T-клетками хозяина [Reisner et al., Proc Nati Acad Sci USA. (1986) 83:4012-4015]. Одним из способов решения этой проблемы является осуществление ВМТ после сверхлетального кондиционирования и функциональной инактивации T-клеток хозяина с помощью иммуносупрессивных лекарств. Тем не менее, данной стратегии препятствуют оппортунистические инфекции вследствие медленного восстановления иммунитета и значительной токсичности иммуносупрессантов.
Несмотря на то, что такой уровень смертности, связанной с процедурой трансплантации, может быть допустим у пациентов с высокой степенью риска лейкоза, он является неприемлемым у пациентов с ожидаемой длительной продолжительной жизни. Таким образом, оправданным является использование кондиционирования с пониженной интенсивностью с менее тяжелым подавлением иммунитета для облегчения приживления подвергнутого деплеции T-клетками трансплантата ВМ (TDBM), что связано с пониженным риском GVHD. Определение донорского химеризма при таком пониженном кондиционировании является самой желательной целью в трансплантационной биологии, так как в целом это связано с продолжительной толерантностью по отношению к клеткам или тканям исходного донора. В то же время заметные уровни иммуноцитов хозяина, выдерживающих умеренные подготовительные режимы, являются сложным препятствием для приживления донорских клеток.
Одним подходом к преодолению отторжения аллогенного TDBM является использование больших доз клеток BM. На моделях с грызунами было впервые продемонстрировано, что «мегадоза» трансплантата TDBM может преодолеть опосредованное T-клетками отторжение трансплантата [Lapidot et al., Blood (1989) 73:2025-2032; Bachar-Lustig et al., Nat Med. (1995) 1:1268-1273; Uharek et al., Blood (1992) 79:1612-1621]. Однако, значительное увеличение в инокуляте BM было трудно достигнуть у человека. Для решения этой проблемы гранулоцитарный колониестимулирующий фактор (G-CSF), который способствует мобилизации гемопоэтических стволовых клеток (HSC, CD34+ клетки человека) из ВМ, применяли для увеличения выхода HSC, собранных из крови, при этом подвергнутые деплеции T-клетками HSC были добавлены к обычному TDBM [Aversa et al., N Engi J Med. (1998) 339:1186-1193; Aversa et al., J Clin Oncol. (2005) 23:3447-3454; Reisner and Martelli, Immunol Today (1999) 20:343-347; Handgretinger et al., Bone Marrow Transplant. (2001) 27:777-783].
Трансплантаты с «мегадозой» CD34 породили интересные вопросы относительно того, как эти клетки преодолевают барьер, представленный предшественниками цитотоксических Т-лимфоцитов (CTL-p) хозяина. На данный вопрос был получен ответ, отчасти благодаря открытию того, что клетки во фракции CD34 наделены сильной "вето"-активностью [Gur et al.. Blood (2005) 105:2585-2593; Gur et al., Blood (2002) 99:4174-4181; Rachamim et al., Transplantation (1998) 65:1386-1393]. Было показано, что другие типы клеток также опосредуют вето-активность, включая Т-лимфоциты (например, CD8+ CTL), естественные клетки-киллеры и дендритные клетки. Прямое сравнение вето-реактивности разных типов клеток показало, что CTL обладают самым сильным вето-эффектом [Reich-Zeliger et al., J Immunol. (2004) 173:6654-6659].
Один подход, разработанный для получения вето-CTL без GVH реактивности, был описан Reisner и соавторами, в котором CTL были стимулированы против сторонних стимуляторов в отсутствие экзогенного IL-2. Данный подход был основан на наблюдении, что только активированные CTLp были способны перенести депривацию IL-2 в первичной культуре. Было показано, что данный способ in vitro и in vivo уменьшает GVH реактивность вето-CTL против третьей стороны [PCT публикация WO 2001/049243, Bachar-Lustig et al., Blood. 2003; 102:1943-1950; Aviner et al., Hum Immunol. (2005) 66:644-652]. Введение этих вето-CTL против третьей стороны реципиенту (вместе с трансплантатом) предотвращало отторжение трансплантата без индуцирования GVHD (PCT публикация WO 2001/049243).
Были рассмотрены различные подходы к трансплантации без отторжения трансплантата и/или заболевания «трансплантат против хозяина», некоторые обобщены далее.
PCT публикация WO 2007/023491 раскрывает применение толерогенных клеток для уменьшения или предотвращения отторжения несингенного трансплантата у субъекта. Описанные толерогенные клетки (например, CD4+CD25+ клетки) могут быть получены от любого донора, который является несингенным как по отношению субъекту, так и по отношению к трансплантату («сторонние» толерогенные клетки). Трансплантат (например, костный мозг) может быть получен от любого донора, который является аллогенным или ксеногенным по отношению к субъекту.
PCT публикация WO 2002/102971 раскрывает применение культивированных гемопоэтических клеток-предшественников (HPC), имеющих повышенную вето-активность для индуцирования толерантности к трансплантату, пересаженному от донора реципиенту. Описанные толерогенные клетки предпочтительно экспрессируют CD33 и вводятся до, одновременно или после трансплантации (например, трансплантата клетки или органа).
PCT публикация WO 2002/043651 раскрывает применение не индуцирующей GVHD популяции иммунных эффекторных клеток для лечения заболеваний. Для получения не индуцирующей GVHD популяции иммунных эффекторных клеток первая клеточная популяция (например, Т-лимфоциты) совместно культивируется со второй клеточной популяцией, являющейся несингенной по отношению к субъекту и несингенной по отношению к первой клеточной популяции (например, EBV-инфицированные B-лимфоциты) в условиях, которые включают недостаточность IL-2 с последующим добавлением IL-2. Полученные иммунные эффекторные клетки могут быть использованы для лечения заболеваний, таких как злокачественные заболевания, вирусные заболевания и аутоиммунные заболевания.
Патент США 6,759,035 раскрывает способы ингибирования отторжения трансплантата и индуцирования толерантности T-клеток в трансплантате плотного органа реципиента. Описанные способы включают удаление мононуклеарных клеток периферической крови (PBMC) из донора и реципиента, культивирование клеток донора и реципиента вместе в присутствии соединения, которое индуцирует супрессорную активность T-клеток (например, TGF-β IL-15 и IL-2), и введение реципиенту супрессорных T-клеток реципиента вместе с трансплантатом для предотвращения гибели донорских клеток в результате действия T-клеток реципиента, индуцируя таким образом толерантность и продолжительную выживаемость трансплантата.
Патент США 6,803,036 раскрывает способы обработки клеток донора для ослабления заболевания «трансплантат против хозяина» у пациента-реципиента. Описанные способы включают удаление PBMC из донора и обработку клеток супрессивной композицией (например, IL-10, IL-2, IL-4, IL-15 и TGF-β в течение времени, достаточного для индуцирования толерантности T-клеток. Клетки затем вводят реципиенту-пациенту. Обработанные клетки могут быть добавлены в стволовые клетки донора до введения пациенту.
В PCT публикации WO 2010/049935 описана изолированная популяция клеток, включающая не индуцирующие GVHD клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки являются клетками, индуцирующими толерантность и способными к хоумингу в лимфоузлы после трансплантации.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется способ получения изолированной популяции клеток, включающей клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки являются клетками, индуцирующими толерантность, обладающими активностью против заболеваний и способными к хоумингу в лимфоузлы после трансплантации, при этом способ включает: (a) контактирование мононуклеарных клеток периферической крови (PBMC) со сторонним антигеном или антигенами в присутствии IL-21 для обогащения антиген-реактивных клеток; и (b) культивирование клеток, полученных на стадии (a), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде, что делает возможной пролиферацию клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm), с получением таким образом изолированной популяции клеток.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется способ получения изолированной популяции клеток, включающей клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки являются клетками, индуцирующими толерантность и/или обладающими активностью «трансплантат против лейкемии» (GVL) и способными к хоумингу в лимфоузлы после трансплантации, при этом способ включает: а) обработку неприлипающих мононуклеарных клеток периферической крови (PBMC) агентом, способным деплецировать CD4+ и/или CD56+ клетки для получения CD8+ Т клеток; (b) контактирование CD8+ T-клеток со сторонними дендритными клетками в присутствии IL-21 в течение от 12 часов до 5 дней для обогащения антиген-реактивных клеток; (с) культивирование клеток, полученных на стадии (b), со сторонними дендритными клетками в присутствии IL-21, IL-15 и IL-7 в течение от 12 часов до 3 дней; и (d) культивирование клеток, полученных на стадии (с), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде в течение 5-20 дней для пролиферации клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm), с получением таким образом изолированной популяции клеток.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется способ получения изолированной популяции клеток, включающей клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки обладают активностью против заболеваний, являются способными к хоумингу в лимфоузлы после трансплантации, при этом способ включает: обработку неприлипающих мононуклеарных клеток периферической крови (PBMC) агентом, способным деплецировать CD4+ и/или CD56+ клетки для получения CD8+ Т клеток; (b) контактирование CD8+ T-клеток с несингенными дендритными клетками в присутствии IL-21 в течение от 12 часов до 5 дней для обогащения антиген-реактивных клеток; (с) культивирование клеток, полученных на стадии (b), с несингенными дендритными клетками в присутствии IL-21, IL-15 и IL-7 в течение от 12 часов до 3 дней; и (d) культивирование клеток, полученных на стадии (с), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде в течение 5-20 дней для пролиферации клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm), с получением таким образом изолированной популяции клеток.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется изолированная популяция клеток, включающая клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), при этом, по меньшей мере, 50% изолированной популяции клеток представляет собой CD3+CD8+ клетки, из которых, по меньшей мере, 50% включают CD3+, CD8+, CD62L+, CD45RA-, CD45RO+ сигнатуру, а также представляют собой клетки, индуцирующие толерантность и/или обладающие активностью против заболеваний и способные к хоумингу в лимфоузлы после трансплантации.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется изолированная популяция клеток, включающая клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки являются клетками, индуцирующими толерантность и/или обладающими активностью против заболеваний и способными к хоумингу в лимфоузлы после трансплантации, полученная в соответствии с описываемыми способами.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется способ лечения заболевания у нуждающегося в этом субъекта, при этом заболевание выбрано из группы, состоящей из злокачественной опухоли, вирусного заболевания и аутоиммунного заболевания, при этом способ включает введение субъекту терапевтически эффективного количества изолированной популяции клеток настоящего изобретения для лечения субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется способ лечения субъекта, нуждающегося в клеточной или тканевой трансплантации, при этом способ включает: (a) трансплантацию клеточного или тканевого трансплантата субъекту; и (b) введение субъекту терапевтически эффективного количества изолированной популяции клеток настоящего изобретения с целью лечения субъекта.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения заявляется способ лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток, при этом способ включает:
(a) трансплантацию незрелых гемопоэтических клеток субъекту; и
(b) введение субъекту терапевтически эффективного количества изолированной популяции клеток настоящего изобретения с целью лечения субъекта.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает деплецию неприлипающих клеток из PBMC до стадии (a).
В соответствии с некоторыми вариантами осуществления изобретения способ также включает деплецию CD4+ и/или CD56+ клеток из PBMC до стадии (a).
В соответствии с некоторыми вариантами осуществления изобретения способ также включает отбор CD45RA+ и/или CD45RO- клеток из PBMC до стадии (a).
В соответствии с некоторыми вариантами осуществления изобретения PBMC включают CD8+ T-клетки.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает культивирование клеток, полученных на стадии (a), со сторонним антигеном или антигенами в присутствии IL-21, IL-15 и IL-7 после стадии (a) и до стадии (b).
В соответствии с некоторыми вариантами осуществления изобретения сторонний антиген или антигены включают дендритные клетки.
В соответствии с некоторыми вариантами осуществления изобретения дендритные клетки представляют собой облученные дендритные клетки.
В соответствии с некоторыми вариантами осуществления изобретения сторонний антиген или антигены выбраны из группы, состоящей из сторонних клеток, клеточного антигена, вирусного антигена, бактериального антигена, экстракта белка, очищенного белка и синтетического пептида, презентируемого аутогенными или неаутогенными презентирующими клетками или на искусственном носителе или на искусственных антиген-презентирующих клетках.
В соответствии с некоторыми вариантами осуществления изобретения сторонние клетки представляют собой стимуляторные клетки, выбранные из группы, состоящей из клеток, очищенных из лимфоцитов периферической крови, селезенки или лимфоузлов, цитокин-активированных лимфоцитов периферической крови (PBL), размноженных in vitro антиген-презентирующих клеток (APC), размноженных in vitro искусственных антиген-презентирующих клеток.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает отбор CD45RA+ и/или CD45RO- клеток из PBMC после стадии (a) и до стадии (b).
В соответствии с некоторыми вариантами осуществления изобретения CD8+ T-клетки включают наивные CD8+ T-клетки.
В соответствии с некоторыми вариантами осуществления изобретения дендритные клетки включают размноженные in vitro дендритные клетки.
В соответствии с некоторыми вариантами осуществления изобретения дендритные клетки включают облученные дендритные клетки.
В соответствии с некоторыми вариантами осуществления изобретения контактирование в присутствии IL-21 осуществляется в течение от 12 часов до 5 дней.
В соответствии с некоторыми вариантами осуществления изобретения контактирование в присутствии IL-21 осуществляется в течение 2-3 дней.
В соответствии с некоторыми вариантами осуществления изобретения контактирование в присутствии IL-21 осуществляется в течение 3 дней.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает отбор активированных клеток после стадии (a) и до стадии (b).
В соответствии с некоторыми вариантами осуществления изобретения способ также включает отбор активированных клеток после стадии (b) и до стадии (с).
В соответствии с некоторыми вариантами осуществления изобретения отбор активированных клеток осуществляется путем отбора CD137+ и/или CD25+ клеток.
В соответствии с некоторыми вариантами осуществления изобретения отбор активированных клеток осуществляется в течение 12-72 часов после контактирования.
В соответствии с некоторыми вариантами осуществления изобретения культивирование с применением стороннего антигена или антигена в присутствии IL-21, IL-15 и IL-7 осуществляется в течение от 12 часов до 3 дней.
В соответствии с некоторыми вариантами осуществления изобретения присутствие IL-21, IL-15 и IL-7 в свободной от антигенов среде длится 5-20 дней.
В соответствии с некоторыми вариантами осуществления изобретения культивирование в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде осуществляется в течение 7-11 дней.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает деплецию аллореактивных клеток после стадии (b).
В соответствии с некоторыми вариантами осуществления изобретения способ также включает деплецию аллореактивных клеток после стадии (d).
В соответствии с некоторыми вариантами осуществления изобретения деплеция аллореактивных клеток осуществляется путем деплеции CD137+ и/или CD25+ клеток после контактирования клеток, включающих фенотип Т-лимфоцита центральной памяти (Tcm), с антиген-презентирующими клетками хозяина (APC).
В соответствии с некоторыми вариантами осуществления изобретения мононуклеарные клетки периферической крови (PBMC) являются сингенными по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения мононуклеарные клетки периферической крови (PBMC) являются несингенными по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения несингенные PBMC являются ксеногенными или аллогенными по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти, включают CD3+, CD8+, CD62L+, CD45RA-, CD45RO+ сигнатуру.
В соответствии с некоторыми вариантами осуществления изобретения, по меньшей мере, 50% изолированной популяции клеток представляет собой CD3+CD8+ клетки, из которых, по меньшей мере, 50% имеют данную сигнатуру.
В соответствии с некоторыми вариантами осуществления изобретения злокачественное заболевание включает лейкемию или лимфому.
В соответствии с некоторыми вариантами осуществления изобретения изолированная популяция клеток является сингенной по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения изолированная популяция клеток является несингенной по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает кондиционирование субъекта в сублетальных, летальных или сверхлетальных условиях перед трансплантацией.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат является сингенным по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат получен от донора, выбранного из группы, состоящей из HLA-идентичного аллогенного донора, HLA-неидентичного аллогенного донора и ксеногенного донора.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат включает незрелые гемопоэтические клетки.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат выбран из группы, состоящей из печени, поджелудочной железы, селезенки, почки, сердца, легкого, кожи, кишки и лимфоидной/гемопоэтической ткани или органа.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат предназначен для совместной трансплантации нескольких органов.
В соответствии с некоторыми вариантами осуществления изобретения совместная трансплантация включает трансплантацию незрелых гемопоэтических клеток и солидного органа.
В соответствии с некоторыми вариантами осуществления изобретения незрелые гемопоэтические клетки и солидный орган или получены от одного донора.
В соответствии с некоторыми вариантами осуществления изобретения незрелые гемопоэтические клетки трансплантируют до, одновременно или после трансплантации солидного органа.
В соответствии с некоторыми вариантами осуществления изобретения изолированная популяция клеток вводится до, одновременно или после клеточного или тканевого трансплантата.
В соответствии с некоторыми вариантами осуществления изобретения изолированная популяция клеток является сингенной по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения изолированная популяция клеток является несингенной по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат и изолированная популяция клеток получены от одного донора.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат является сингенным по отношению к субъекту, а изолированная популяция клеток является несингенной по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения клеточный или тканевый трансплантат является сингенным по отношению к субъекту и изолированная популяция клеток является сингенной по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения изолированная популяция клеток вводится до, одновременно или после незрелых гемопоэтических клеток.
В соответствии с некоторыми вариантами осуществления изобретения незрелые гемопоэтические клетки и изолированная популяция клеток получены от одного донора.
В соответствии с некоторыми вариантами осуществления изобретения донор является несингенным по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения незрелые гемопоэтические клетки и изолированная популяция клеток получены от субъекта.
В соответствии с некоторыми вариантами осуществления изобретения способ также включает кондиционирование субъекта в сублетальных, летальных или сверхлетальных условиях перед трансплантацией.
В соответствии с некоторыми вариантами осуществления изобретения субъектом является человек.
Если не указано иное, все технические и/или научные термины, использованные здесь, имеют такое же значение, которое понимается специалистами в области, к которой относится изобретение. Хотя способы и материалы, аналогичные или эквивалентные описанным здесь, могут применяться при осуществлении или проверке вариантов осуществления изобретения, возможные примеры способов и/или материалов описаны ниже. В случае противоречия описание, включая определения, будет обладать приоритетом. Кроме того, материалы, способы и примеры являются лишь иллюстративными и не рассматриваются в качестве ограничивающих.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
В качестве примеров дано описание некоторых вариантов осуществления изобретения со ссылкой на прилагающиеся фигуры. При более подробном обращении к фигурам подчеркивается, что показанные подробности приведены только в качестве примера и для целей иллюстративного обсуждения вариантов осуществления изобретения. Благодаря этому, описание, взятое вместе с фигурами, делает очевидным для специалистов в данной области осуществление вариантов изобретения на практике.
На фигурах:
ФИГ. 1A-B представляют собой схематичные диаграммы, отображающие аутогенные (Фигура 1A) и аллогенные (Фигура 1B) условия, имеющие отношение к человеку. Следует отметить, что данные условия отличаются друг от друга в плане происхождения донора костного мозга (BM) (относятся к хозяину или являются аллогенными), респондеров (относятся к хозяину или являются аллогенными) и стимуляторов (относятся к любому аллогенному донору или являются сторонними не являющимися перекрестно-реактивными по отношению к MHC хозяина), которые принимают участие в получении Tcm.
ФИГ. 2A-B представляют собой схематичные диаграммы, отображающие сингенные (Фигура 2A) и аллогенные (Фигура 2B) условия у мышей. Следует отметить, что данные условия отличаются друг от друга в плане происхождения донора BM (сингенный или F1 или аллогенный), респондеров (сингенные или F1, или аллогенные) и стимуляторов (аллогенные или сторонние), которые принимают участие в получении Tcm.
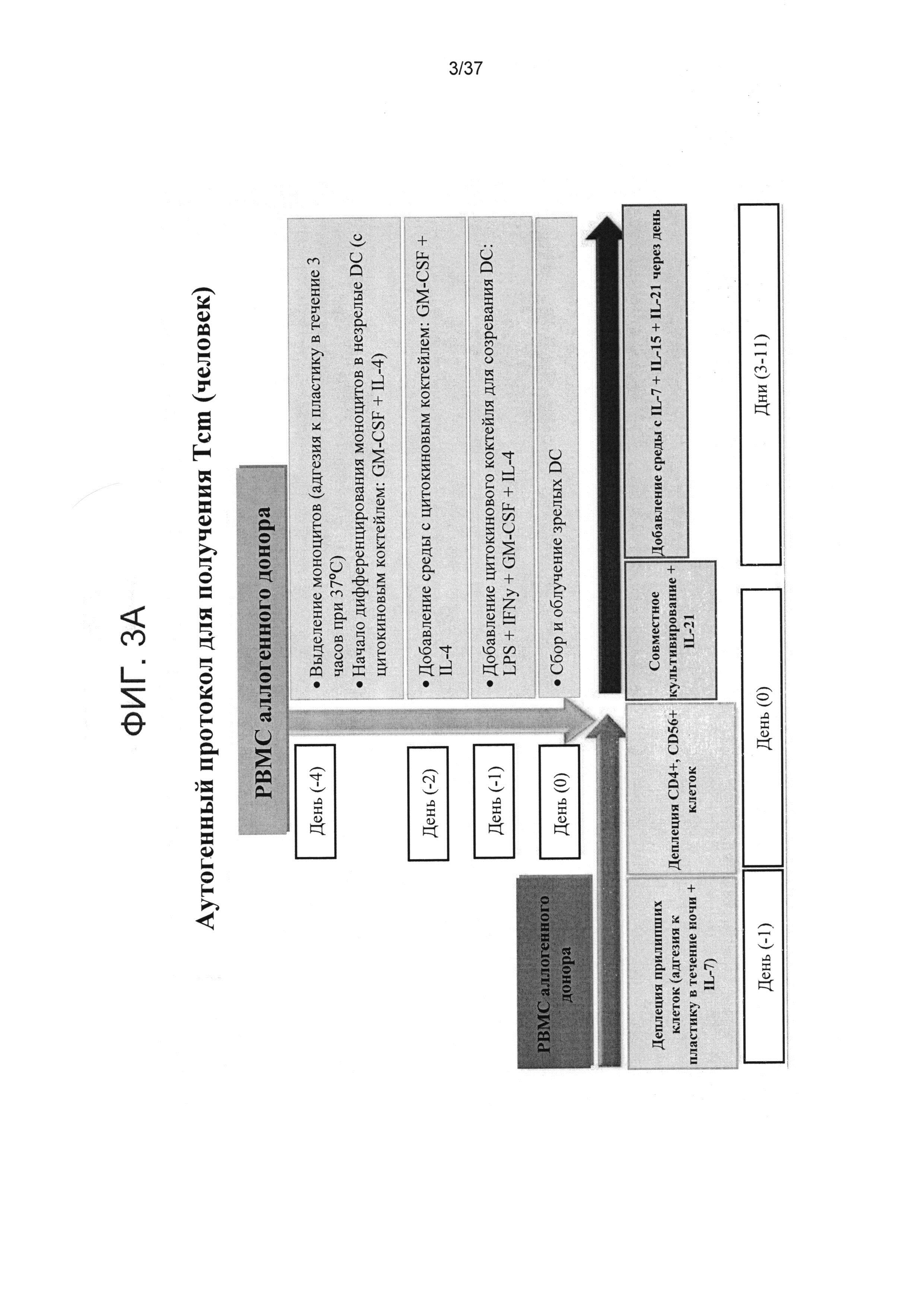
ФИГ. 3A-B представляют собой схематичные диаграммы, отображающие аутогенный протокол у человека для получения Tcm (Фигура 3A) по сравнению с сингенным протоколом у мышей (Фигура 3B).
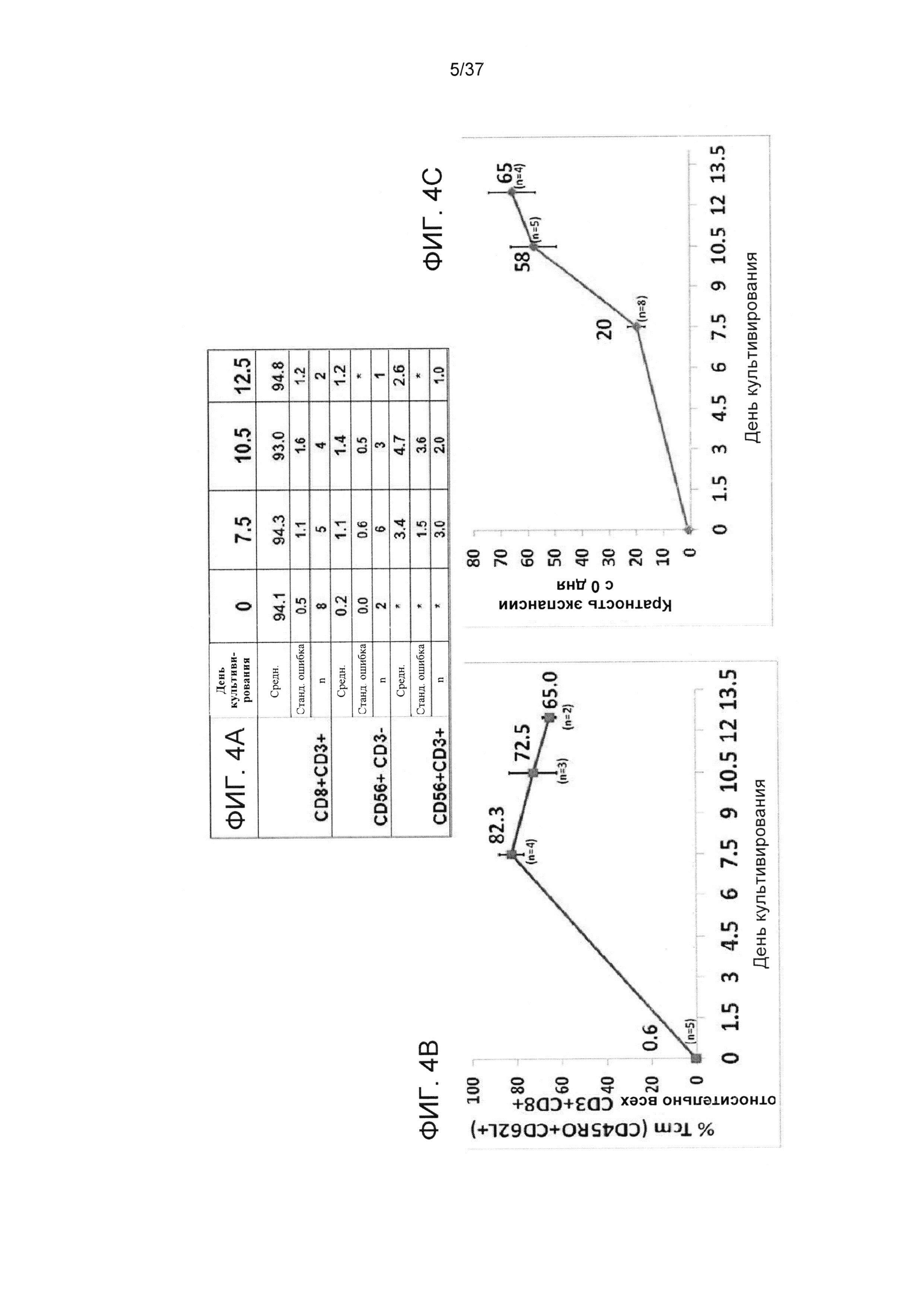
ФИГ. 4A-C отображают динамику индуцирования центральной памяти против третьей стороны ("контрольные эксперименты"). Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC при соотношении 4:1 в среде, содержащей IL-21, в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали в среде, содержащей IL-7 и IL-15 до 12,5 дня. На 7,5, 10,5 и 12,5 дни определяли фенотип клеток (на основе экспрессии маркера на поверхности) (Фигура 4А) и долю Tcm (CD62L+CD45RO+) относительно всех CD8 T-клеток с применением FACS анализа (Фигура 4B), а также количество клеток с помощью эксклюзии с применением трипанового синего (Фигура 4C). Для каждого момента времени данные отражают среднее значение±SE из n независимых экспериментов.
На ФИГ. 5A-C показан типичный эксперимент, демонстрирующий роль прайминга с алло генным DC. Следует отметить, что IL-21 самостоятельно или IL-7 в комбинации с IL-15 без DC прайминга не индуцирует фенотип центральной памяти у наивных CD8 T-клеток и плохо способствует их культивированию. Фигура 5A отображает наивные CD8 T-клетки, которые стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в среде, содержащей IL-21, в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с применением IL-7 и IL-15 до 13 дня ("контрольная группа"=d(0-3) IL21+DC d(3-13)IL7+IL15); Фигуры 5B-C отображают наивные CD8 T-клетки, которые культивировали с применением IL-21 (Фигура 5B) или комбинации IL-7 и IL-15 (Фигура 5C) в отсутствие стимуляции до 10 дня или 13 дня, соответственно.
На ФИГ. 6A-B показана роль прайминга с аллогенным DC, продемонстрированная за счет степени среднего относительного воздействия на уровень Tcm и кратности экспансии по сравнения с контрольной группой для сравнения. Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в среде, содержащей IL-21, в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с применением IL-7 и IL-15 до 13 дня ("Контрольная группа"=d(0-3)IL21+DC d(3-13)IL7+IL15). Альтернативно, наивные CD8 T-клетки культивировали с применением IL-21 или комбинации IL-7 и IL-15 при отсутствии стимуляции до 13 дня. Оценивали количество клеток с помощью эксклюзии с применением трипанового синего (Фигура 6A) и долю Tcm (CD62L+CD45RO+) относительно всех CD8 T-клеток с применением FACS анализа (Фигура 6B). Для каждого момента времени данные отражают среднее значение±SE из n независимых экспериментов.
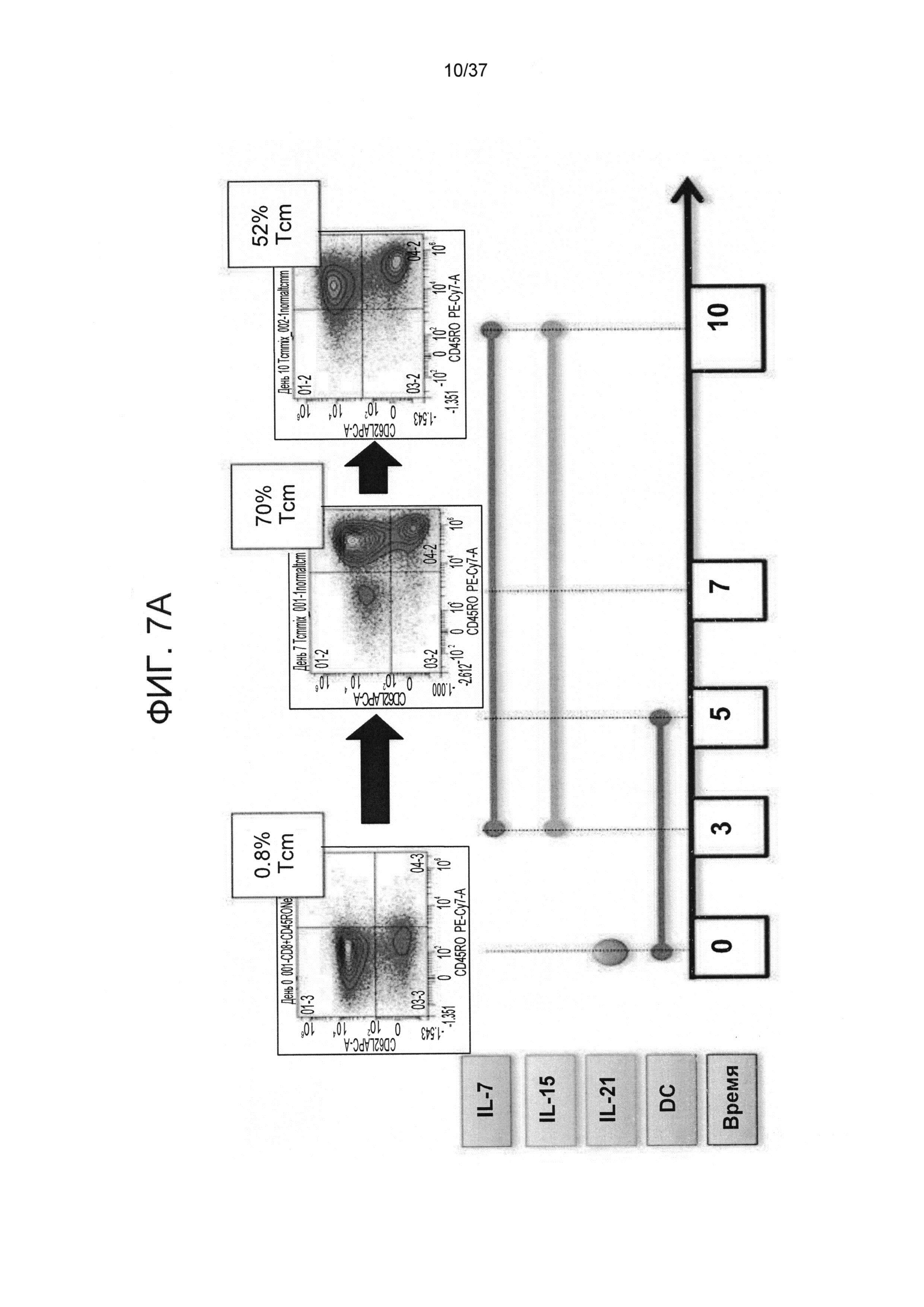
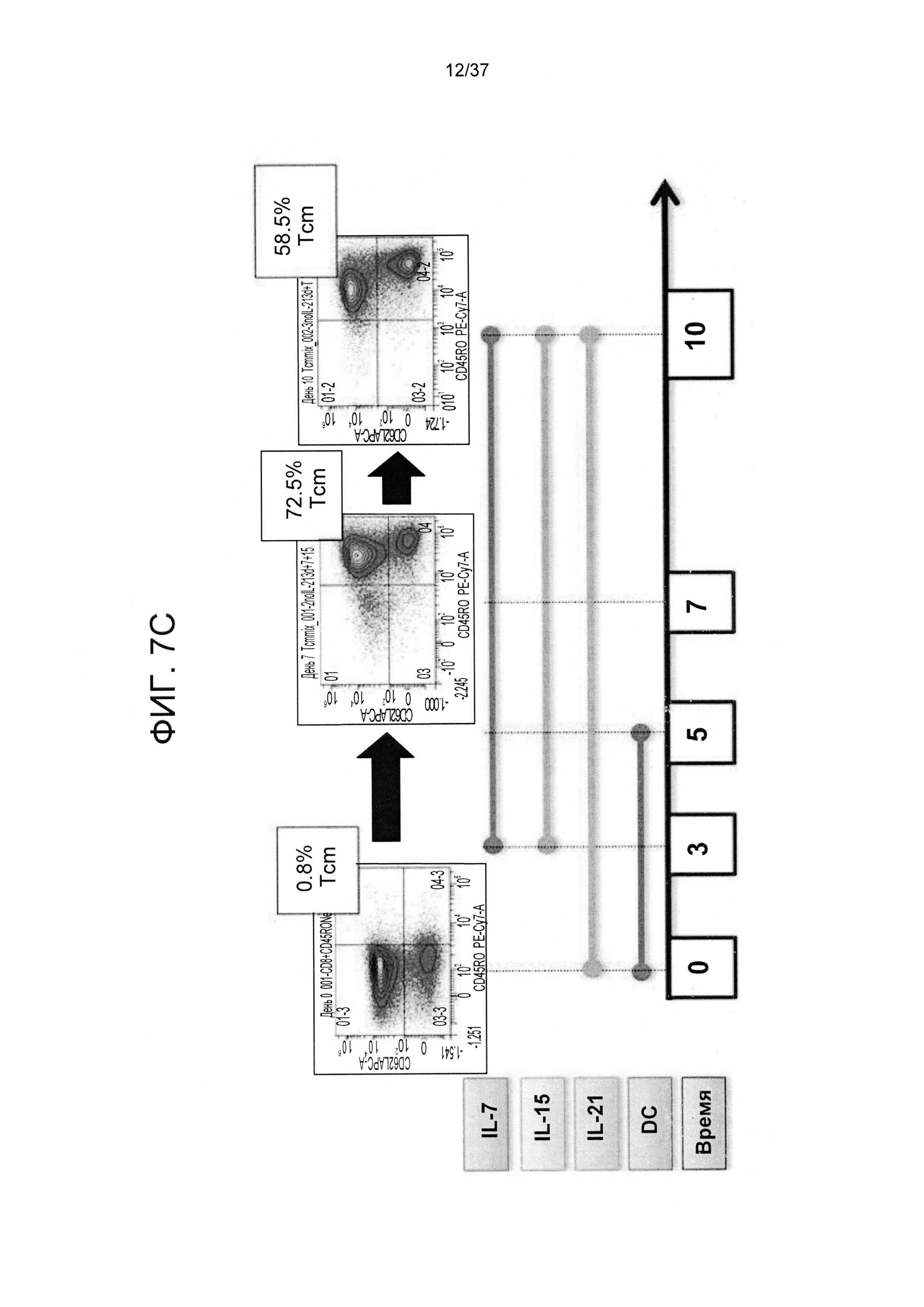
На ФИГ. 7A-C показан типичный эксперимент, демонстрирующий роль IL-21 в прайминге и фазы экспансии Tcm против третьей стороны. Следует отметить, что исключение IL-21 на стадии прайминга снижала экспансию и индуцирование Tcm, в то время как присутствие IL-21 в культуре увеличивало индуцирование Tcm. На Фигуре 7A показаны наивные CD8 T-клетки, которые стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в среде, содержащей IL-21, в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с применением IL-7 и IL-15 до 13 дня ("контрольная группа"=d(0-3) IL21+DC d(3-13)IL7+IL15); Фигуры 7B-C отображают наивные CD8 T-клетки, которые стимулировали облученными аллогенными сторонними DC в соотношении 4:1 при отсутствии IL-21 в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с применением IL-7 и IL-15 до 13 дня (Фигура 7B) или стимулировали облученными аллогенными сторонними DC в соотношении 4:1 при продолжительном присутствии IL-21 на фазе прайминга (IL-21 самостоятельно) и фазе экспансии (совместно с IL-7 и IL-15) (Фигура 7С).
На ФИГ. 8A-B показано условие в отношении IL-21 для оптимального уровня выхода Tcm (среднее на основе нескольких независимых экспериментов). Наивные CD8 T-клетки обрабатывали как описано выше, при этом культуры оценивали на предмет количества клеток с применением эксклюзии на основе трипанового синего (Фигура 8А) и доли Tcm (CD62L+CD45RO+) относительно всех CD8 T-клеток с применением FACS анализа (Фигура 8B). Результаты каждого эксперимента показаны отдельно, при этом линии означают средние результаты n экспериментов.
На ФИГ. 9A-B показано оптимальное соотношение респондер/DC для индуцирования Tcm фенотипа и устойчивой экспансии. 4×105 наивных CD8 T-клеток стимулировали против облученного аллогенного стороннего DC в повышенном количестве в присутствии IL-21 в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с применением IL-7 и IL-15 до 13 дня ("контрольная группа"=d(0-3) IL21+100,00 DC d(3-13) IL7+IL15). Культуры оценивали на предмет количества клеток с применением эксклюзии на основе трипанового синего (Фигура 9A) и доли Tcm (CD62L+CD45RO+) относительно всех CD8 T-клеток с применением FACS анализа (Фигура 9B). Результаты каждого эксперимента показаны отдельно, при этом линии означают средние результаты n экспериментов.
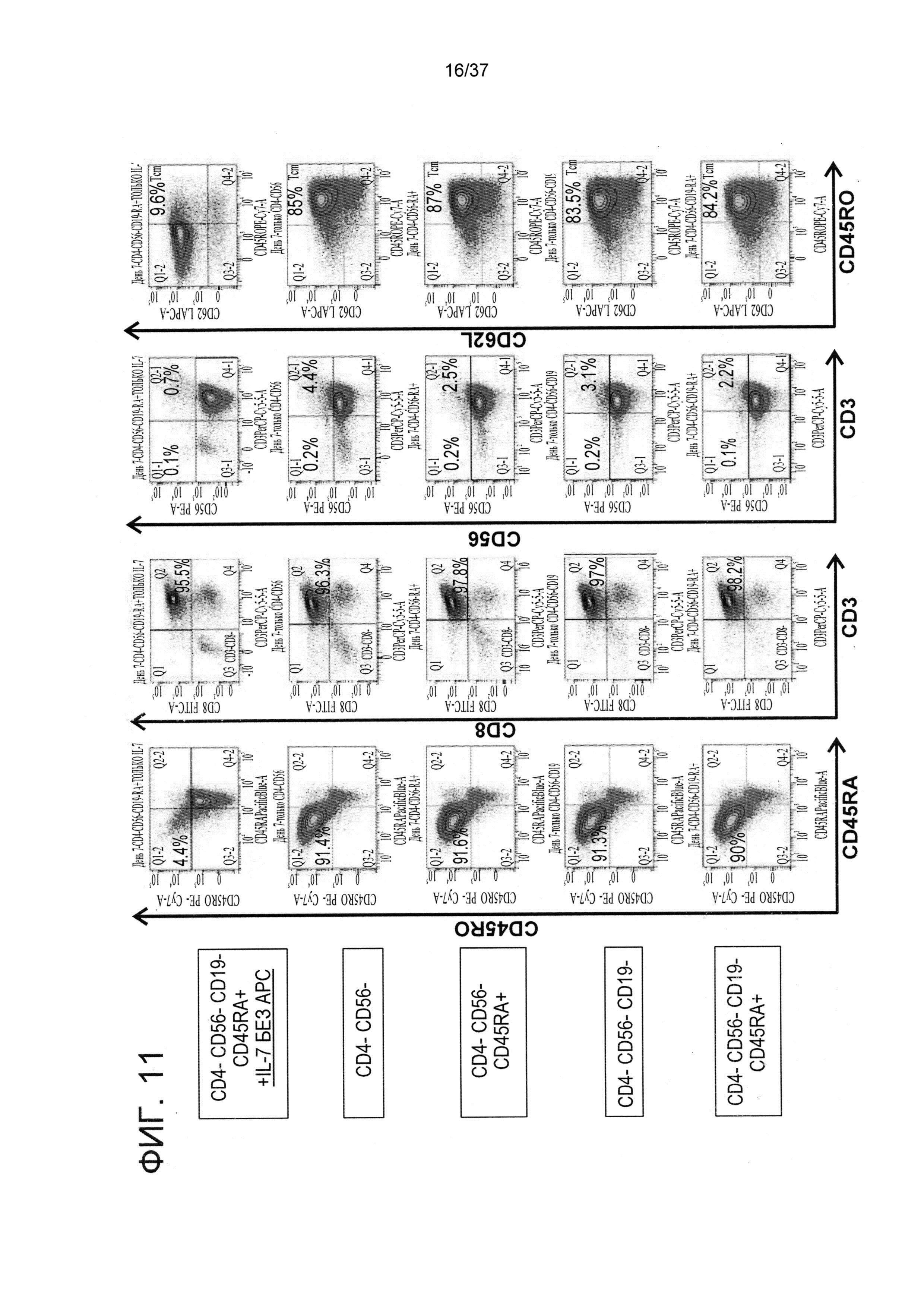
На ФИГ. 10 показана оценка воздействия различных GMP реагентов на получение CD8+ и наивных CD8+CD45RA+ T-клеток. Донорские PBMC были получены из прилипающих клеток путем культивирования в течение ночи в планшетах, специально разработанных для удаления прилипающих миелоидных клеток (верхняя часть фигуры), при этом в 0 день неприлипающие клетки были разделены на четыре тестовые группы, каждую из которых подвергали различным протоколам магнитного сортинга. Клетки оценивали на предмет клеточной композиции и Tcm фенотипа с помощью FACS анализа. Результаты в левой колонке (CD45RO и CD45RA) относятся к CD3+CD8 клеткам. Данные результаты отражают типичный эксперимент из двух независимых проведенных экспериментов.
На ФИГ. 11 показан типичный эксперимент, показывающий влияние различных GMP реагентов, применяемых для выделения CD8+ T-клеток, на долю CD8+ T-клеток с Tcm фенотипом и контаминацию NK и NKT клетками спустя 7 дней после стимулирования сторонними DC. Для сравнения применяли не подвергнутые стимулированию клетки в культуре исключительно с IL-7 (верхняя часть фигуры). Результаты в самой левой колонке (CD45RO и CD45RA) и самой правой колонке (CD62L и CD45RO) относятся к CD3+CD8+ клеткам.
На ФИГ. 12 показан типичный эксперимент, показывающий влияние различных GMP реагентов, применяемых для выделения CD8+ T-клеток, на долю CD8+ T-клеток с Tcm фенотипом и контаминацию NK и NKT клетками спустя 14 дней после стимулирования сторонними DC. Для сравнения применяли не подвергнутые стимулированию клетки в культуре исключительно с IL-7 (верхняя часть фигуры). Результаты в самой левой колонке (CD45RO и CD45RA) и самой правой колонке (CD62L и CD45RO) относятся к CD3+CD8+ клеткам.
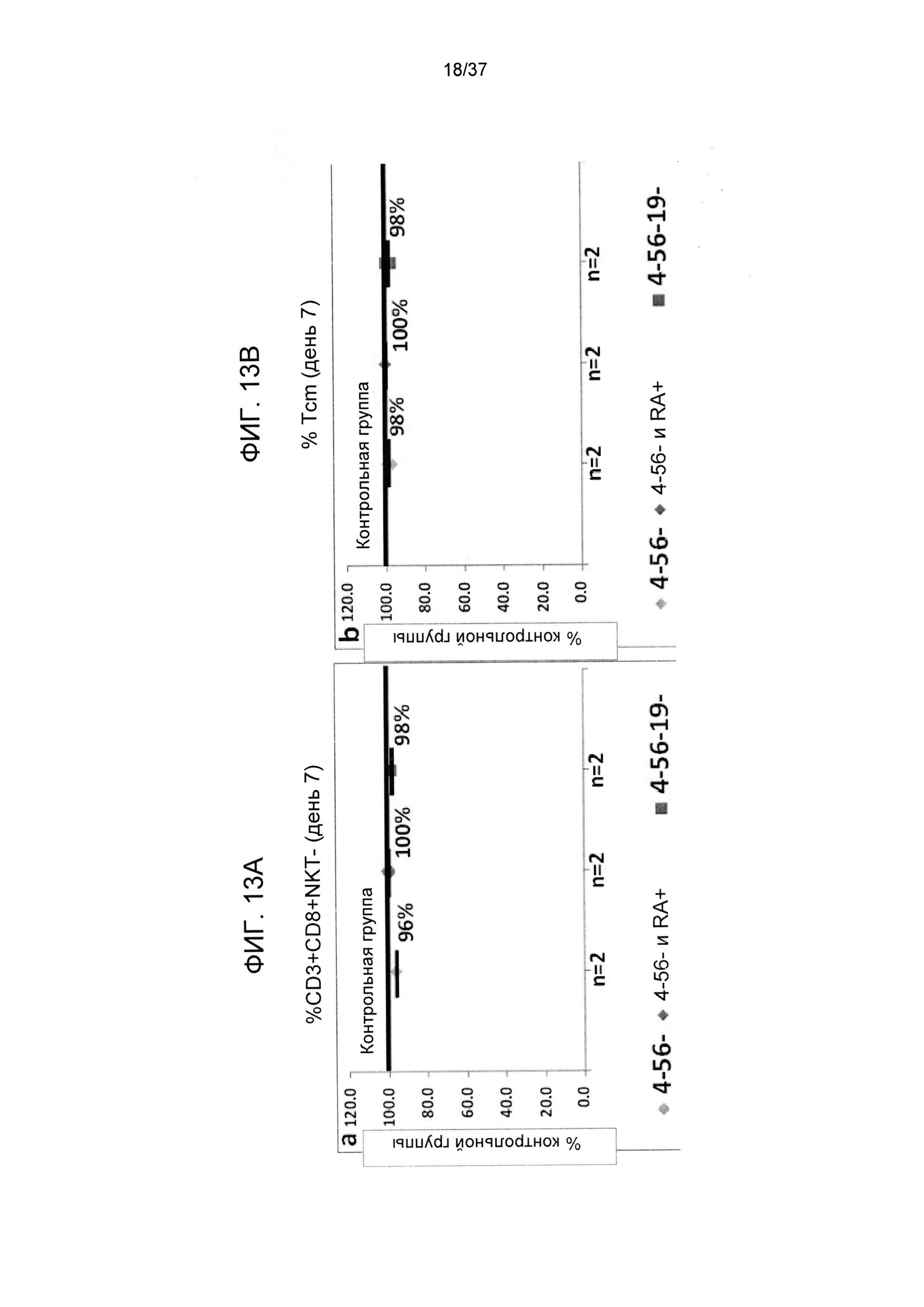
На ФИГ. 13A-В показано влияние различных GMP реагентов, применяемых для выделения CD8 T-клеток, на уровни CD8 T-клеток с Tcm фенотипом спустя 7 дней после стимулирования против сторонних DC. Средняя доля CD3+CD8+NKT- T-клеток (Фигура 13A) и Tcm (Фигура 13B) показана в виде доли уровней, достигнутых в оптимальной контрольной группе с применением всех 4 реагентов (CD4/CD56/CD19/CD45RA).
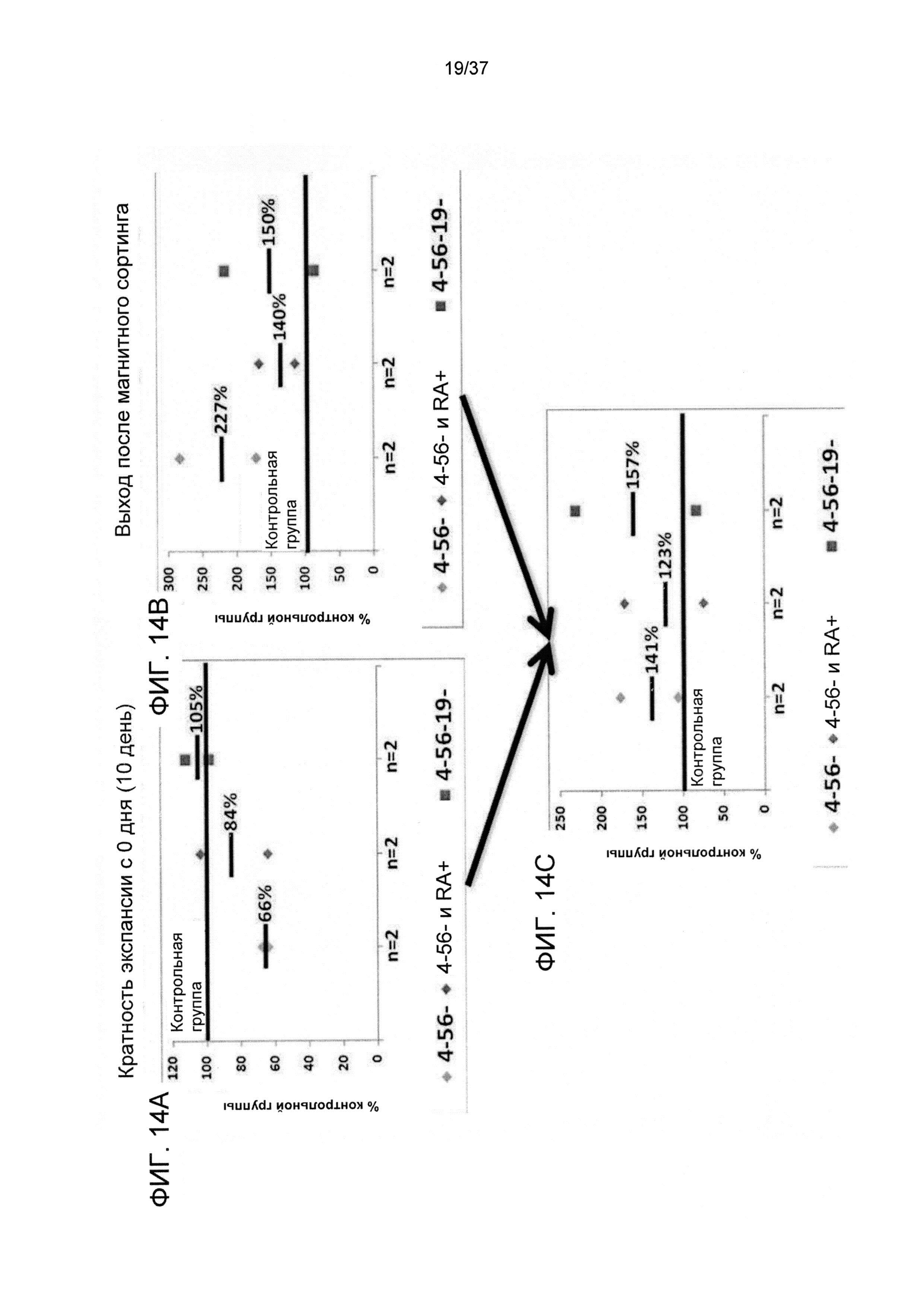
На ФИГ. 14A-C показано влияние различных GMP реагентов, применяемых для выделения CD8 T-клеток, на итоговый выход CD8 T-клеток с Tcm фенотипом спустя 10 дней после стимулирования против сторонних DC.
Средняя кратная степень экспансии от 0 дня до 10 дня (Фигура 14A) и средний выход после магнитного сортинга (Фигура 14B) показаны в виде доли уровней, достигнутых в оптимальной контрольной группе с применением всех четырех реагентов для отбора (CD4/CD56/CD19/CD45RA). Выход Tcm на 10 день (Фигура 14C) был подсчитан путем умножения выхода после магнитного сортинга (в 0 день) на степень кратности экспансии начиная с 0 дня (на 10 день).
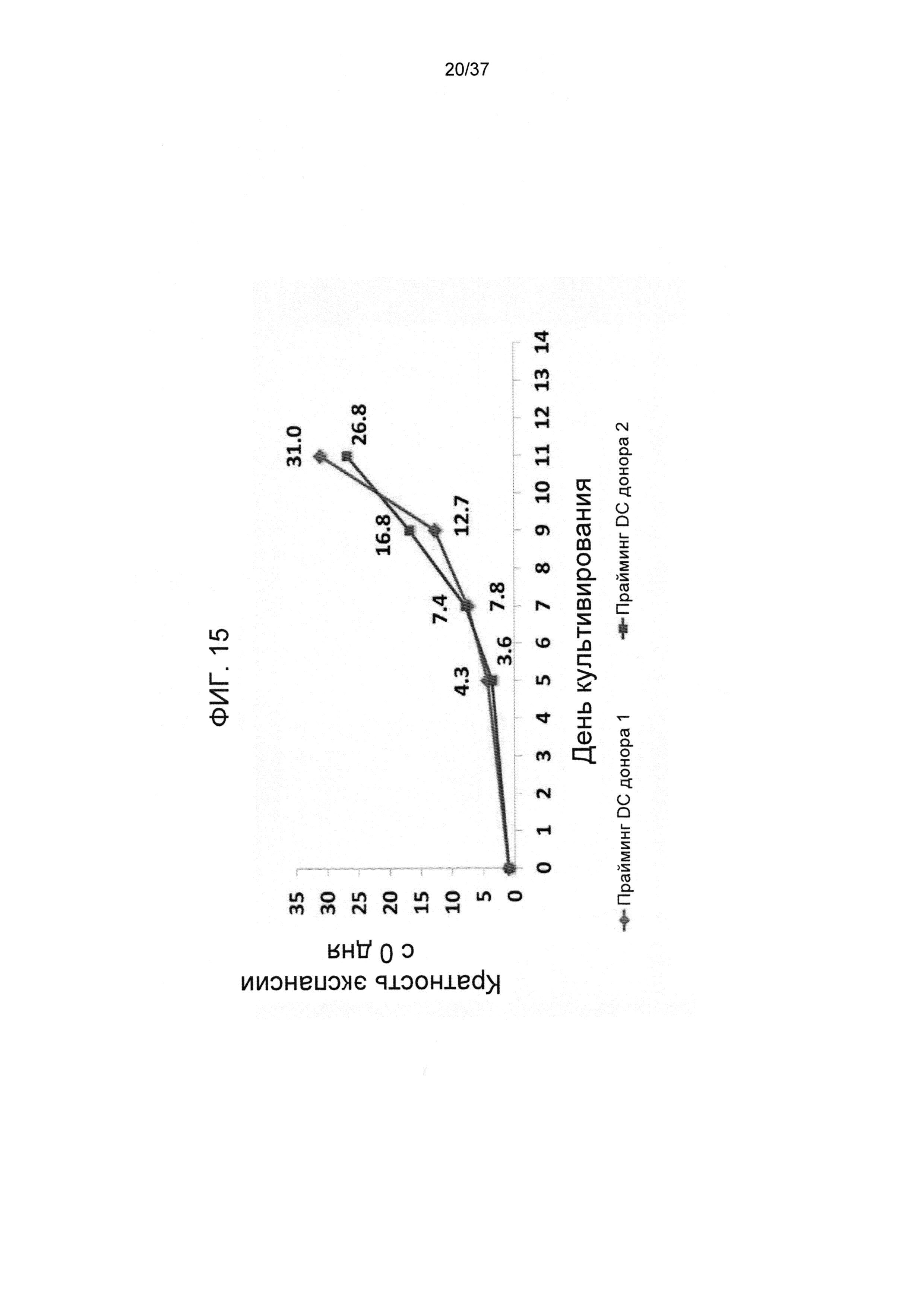
На ФИГ. 15 показано, что изменение источника аллогенных DC стимуляторов обладало лишь малым влиянием на потенциал экспансии Tcm клеток. CD8 T-клетки получали с помощью лейкафереза с применением заморозки путем деплеции CD4+ и CD56+ клеток с использованием системы CliniMacs. Полученные CD8 T-клетки затем разделяли на две тестовые группы, при этом каждую из них стимулировали различным облученными аллогенными сторонними DC при соотношении 6:1 в среде, содержащей IL-21, в течение 3 дней в культуральных контейнерах. После этого клетки не подвергали дальнейшей активации и культивировали в среде, содержащей IL-7, IL-15 и IL-21 до 11 дня. На 5, 7, 9 и 11 дни количество клеток определяли с помощью эксклюзии на основе трипанового синего.
На ФИГ. 16A-B показано, что изменение источника аллогенных DC стимуляторов обладало лишь малым влиянием клеточную композицию. CD8 T-клетки получали с помощью лейкафереза с применением заморозки путем деплеции CD4+ и CD56+ клеток с использованием системы CliniMacs для выделения в большом объеме. Полученные CD8 T-клетки затем разделяли на две тестовые группы, при этом каждую из них стимулировали различным облученными аллогенными сторонними DC (Фигуры 16A и 16B, соответственно) при соотношении 6:1 в среде, содержащей IL-21, в течение 3 дней в культуральных контейнерах. После этого клетки не подвергали дальнейшей активации и культивировали в среде, содержащей IL-7, IL-15 и IL-21, до 11 дня. На 0, 5, 9 и 12 дни клеточные культуры оценивали на предмет клеточной композиции с помощью FACS анализа. Все результаты относятся к лимфогейту и живому гейту (7AAD-).
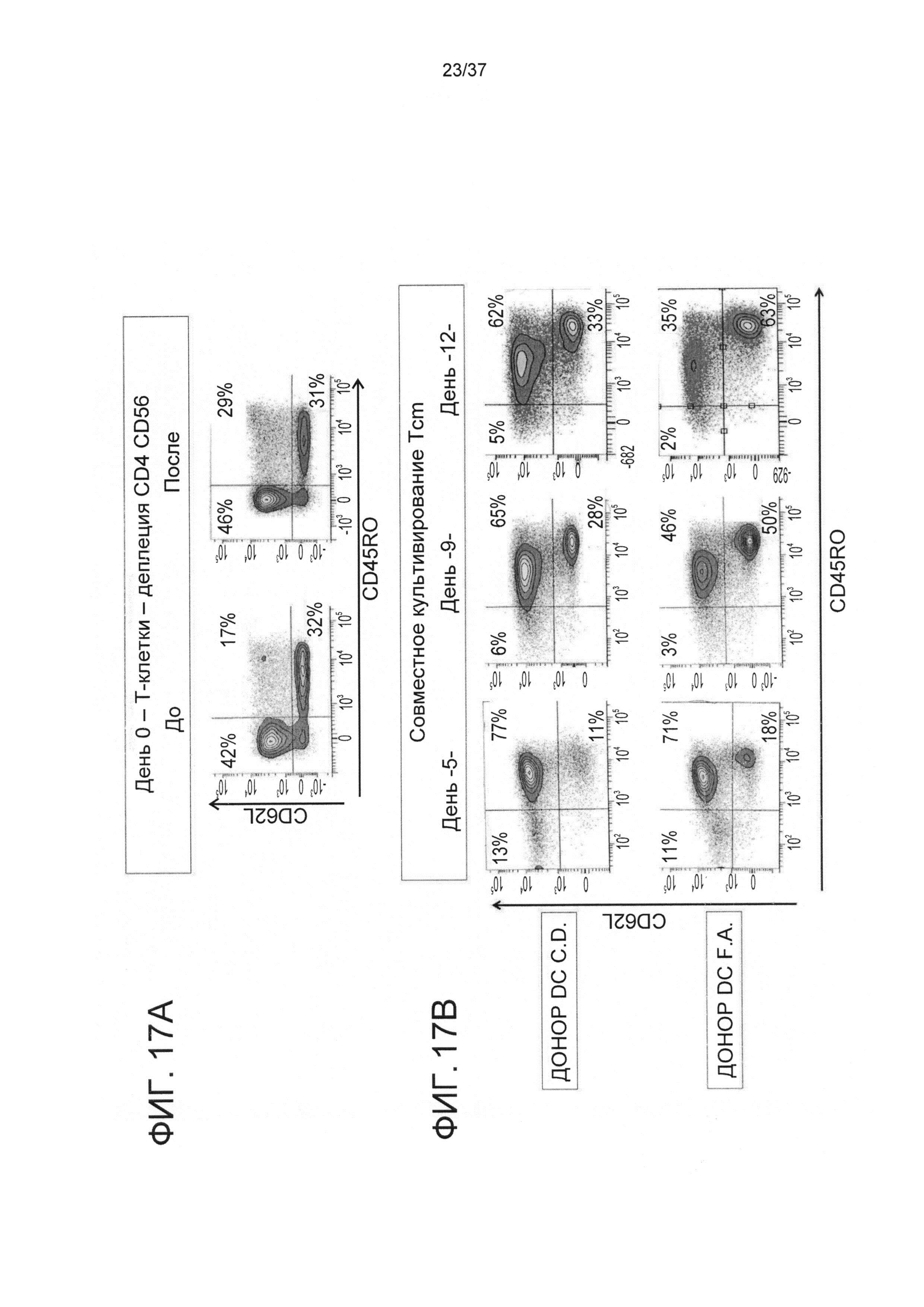
На ФИГ. 17A-B показано, что изменение источника аллогенных DC стимуляторов обладало лишь малым влиянием клеточную композицию. CD8 T-клетки получали с помощью лейкафереза с применением заморозки путем деплеции CD4+ и CD56+ клеток с использованием системы CliniMacs. Полученные CD8 T-клетки затем разделяли на две тестовые группы, при этом каждую из них стимулировали различным облученными аллогенными сторонними DC при соотношении 6:1 в среде, содержащей IL-21, в течение 3 дней в культуральных контейнерах. После этого клетки не подвергали дальнейшей активации и культивировали в среде, содержащей IL-7, IL-15 и IL-21, до 11 дня. На 0, 5, 9 и 12 дни клеточные культуры оценивали на предмет композиции Tcm фенотипа (CD45RO+CD62L+) с помощью FACS анализа. Все результаты относятся к лимфогейту и живому гейту (7AAD-) и CD8 T-клеткам CD3+CD8+CD56-CD16-).
На ФИГ. 17C показана доля апоптозных клеток спустя 22 часа после начала реакции смешанных лимфоцитов ((MLR) с B-клеточной лимфомой и клеточными линиями лейкемии плазматических клеток. Предварительно помеченные CalceinAM Daudi, Н.Му2 C1R HLA А2 K66A мутантные или L363 клеточные линии культивировали в течение 22 часов с или без 5-кратного избытка Tcm против третьей стороны. Клетки аннексии V+ определяли с помощью FACS. Данные показаны в виде среднего значения ±SD пятикратных культур. ***p<0.001 значения означают статистически значимые изменения по сравнению с образцами, культивируемыми в отсутствие Tcm.
На ФИГ. 18 показан типичный эксперимент, показывающий получение CD8 T-клеток на 14 день до анализа "трансплантат против лейкемии" (GVL) путем интенсивной деплеции T-клеток, не являющихся CD8 (то есть CD4+T-клеток, γ/δ T-клеток, B-клеток, NK-клеток, дендритных клеток, моноцитов, гранулоцитов и эритроцитов), с помощью сортинга с применением магнитных шариков.
На ФИГ. 19A-D показаны линии клеток Н.Му C1R ("Neo") и Н.Му C1R HLA A2 K66A мутантных трансфертных ("K66A") B-клеточных лимфобластоидов, которые были помечены CalceinAM, витальным красителем, который высвобождается при гибели клетки, и затем культивировались в течение 22 часов с или без Tcm клеток против третьей стороны при соотношении 1:5 в пользу Tcm клеток против третьей стороны. Спустя 22 часа клетки отделяли и анализировали выживаемость путем измерения количества выживших окрашенных Calcein+ клеток и апоптоза с помощью аннексии V+ клеток из окрашенных Calcein+ популяций с помощью FACS. На Фигурах 19A-B и Фигурах 19C-D показаны два независимых эксперимента, соответственно; на Фигурах 19A и 19C показан киллинг, а на Фигурах 19B и 19D показан апоптоз.
Доля киллинга B-лимфобластных клеточных линий была подсчитана с помощью следующей формулы:
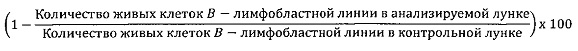
Отрицательные значения означают, что B-клеточные лимфобластные клеточные линии пролиферировались в присутствии Tcm.
Доля клеток B-лимфобластных линий, подвергнутых определенному апоптозу, была подсчитана с помощью следующей формулы:=(% Calcein+AnnexinV+ клеток B-лимфобластной линии в анализируемой лунке)-(% Calcein+AnnexinV+ клеток B-лимфобластной линии в контрольной лунке).
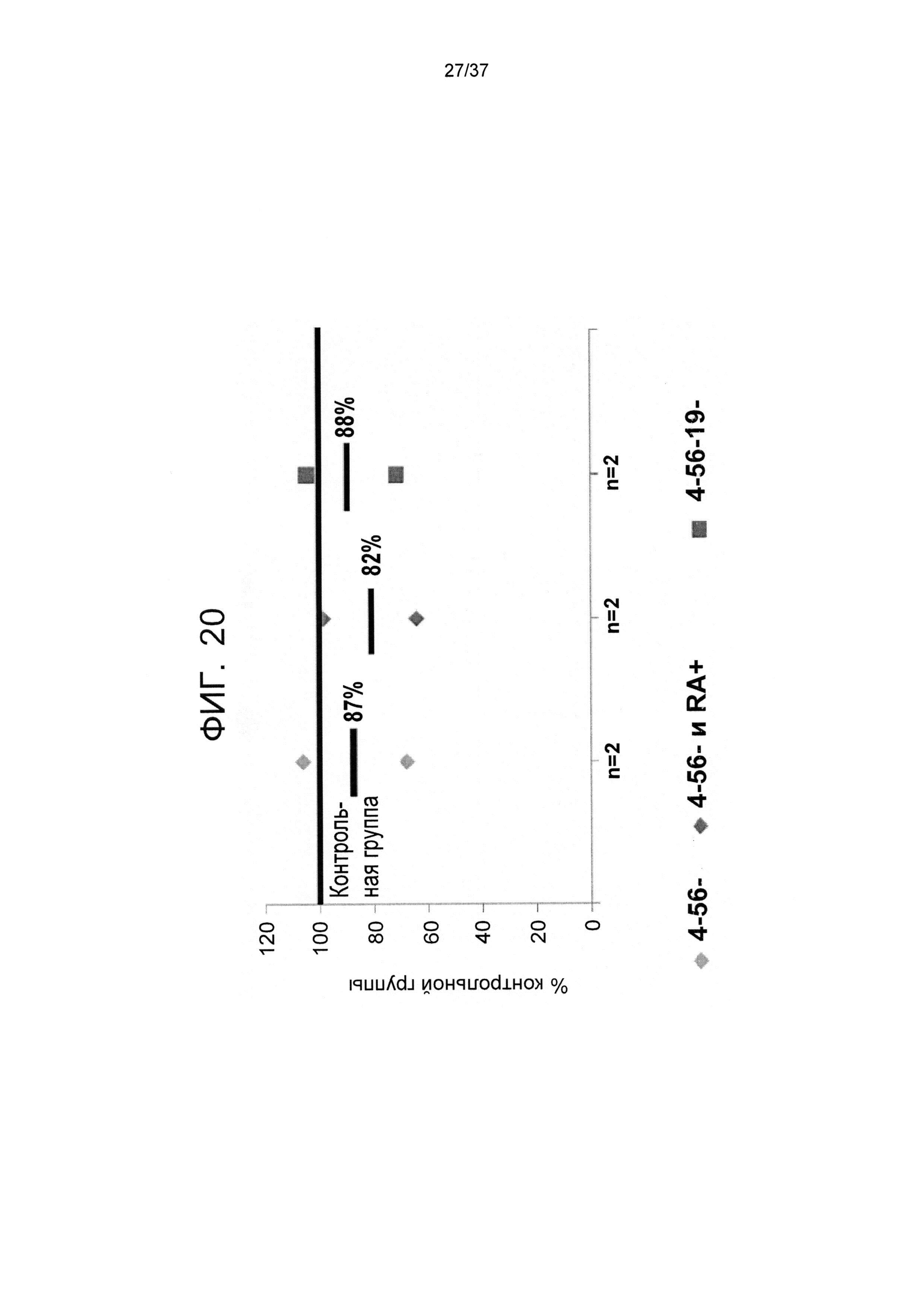
На ФИГ. 20 показано влияние различных GMP реагентов, применяемых для выделения CD8 T-клеток, на уровни K66A киллинга. Н.Му C1R HLA А2 K66A мутантные трансфектные клеточные линии культивировали в течение 22 часов с или без Tcm клеток против третьей стороны при соотношении 1:5 в пользу Tcm клеток против третьей стороны. Спустя 22 часа клетки отделяли и анализировали выживаемость путем измерения количества выживших окрашенных Calcein+ клеток и с помощью FACS (среднее значение двух независимых экспериментов). Средняя доля киллинга Н.Му C1R HLA А2 K66A мутантных клеток показана в виде доли уровней, достигнутых оптимальной контрольной группой, изолированной с применением всех четырех реагентов (CD4/CD56/CD19/CD45RA).
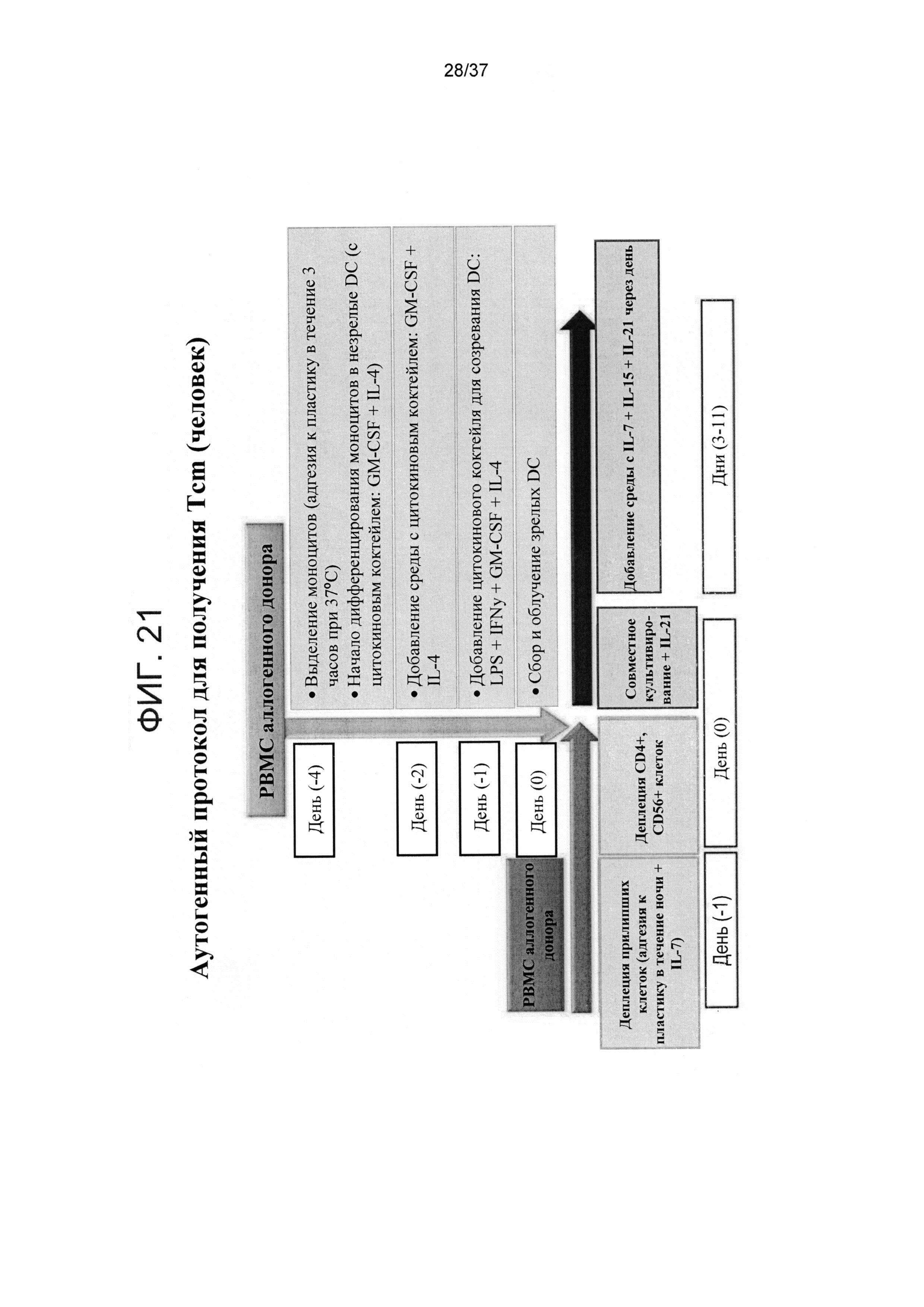
ФИГ. 21-22 представляют собой схематичные иллюстрации, показывающие протоколы получения Tcm для аутогенной (Фигура 21) и аллогенной (Фигура 22) трансплантации.
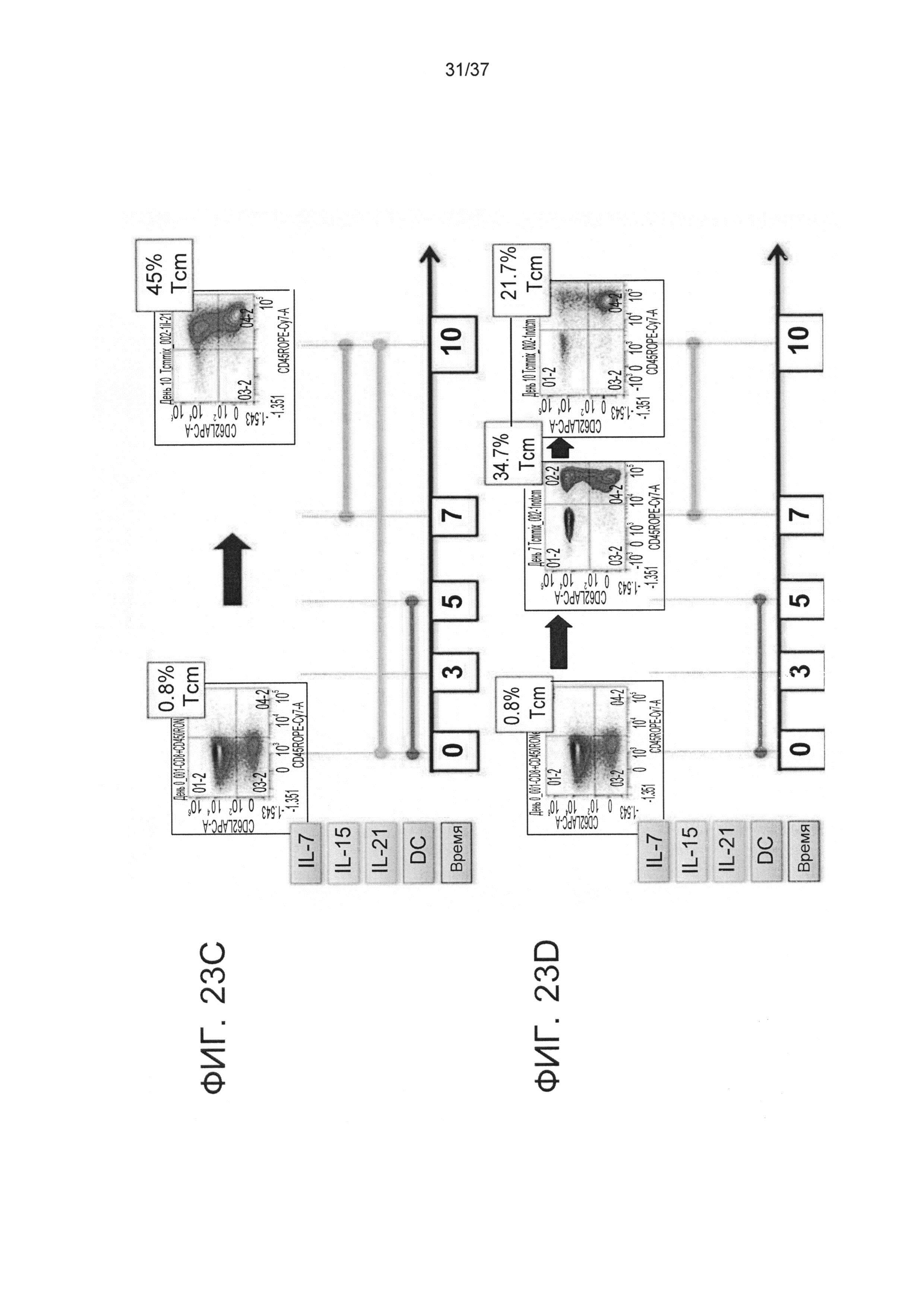
На ФИГ. 23A-D показан типичный эксперимент, демонстрирующий влияние времени добавления цитокинов на индуцирование Tcm фенотипа у CD8 T-клеток, стимулируемых аллогенным сторонним зрелым DC на основе моноцитов. Фигура 23A отображает наивные CD8 T-клетки, которые стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в среде, содержащей IL-21, в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали в среде, содержащей IL-7 и IL-15 до 13 дня ("контрольная группа"=d(0-3) IL21+DC d(3-13)IL7+IL15); На Фигуре 23B показаны наивные CD8 T-клетки, которые были подвергнуты стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии IL-21 в течение 7 дней. После этого клетки не подвергали дальнейшей активации и культивировали с IL-7 и IL-15 до 13 дня; на Фигуре 23С показаны CD8 T-клетки, которые были подвергнуты стимулированию облученными аллогенными сторонними DC при соотношении 4:1 с продолжительным присутствием IL-21 на стадии прайминга (IL-21 самостоятельно) и на стадии экспансии (совместно с IL-15); на Фигуре 23D показаны CD8 T-клетки, которые были подвергнуты стимулированию облученными аллогенными сторонними DC при соотношении 4:1 с депривацией цитокинов в течение 7 дней. После этого клетки не подвергали дальнейшей активации и культивировали только с IL-15 до 13 дня.
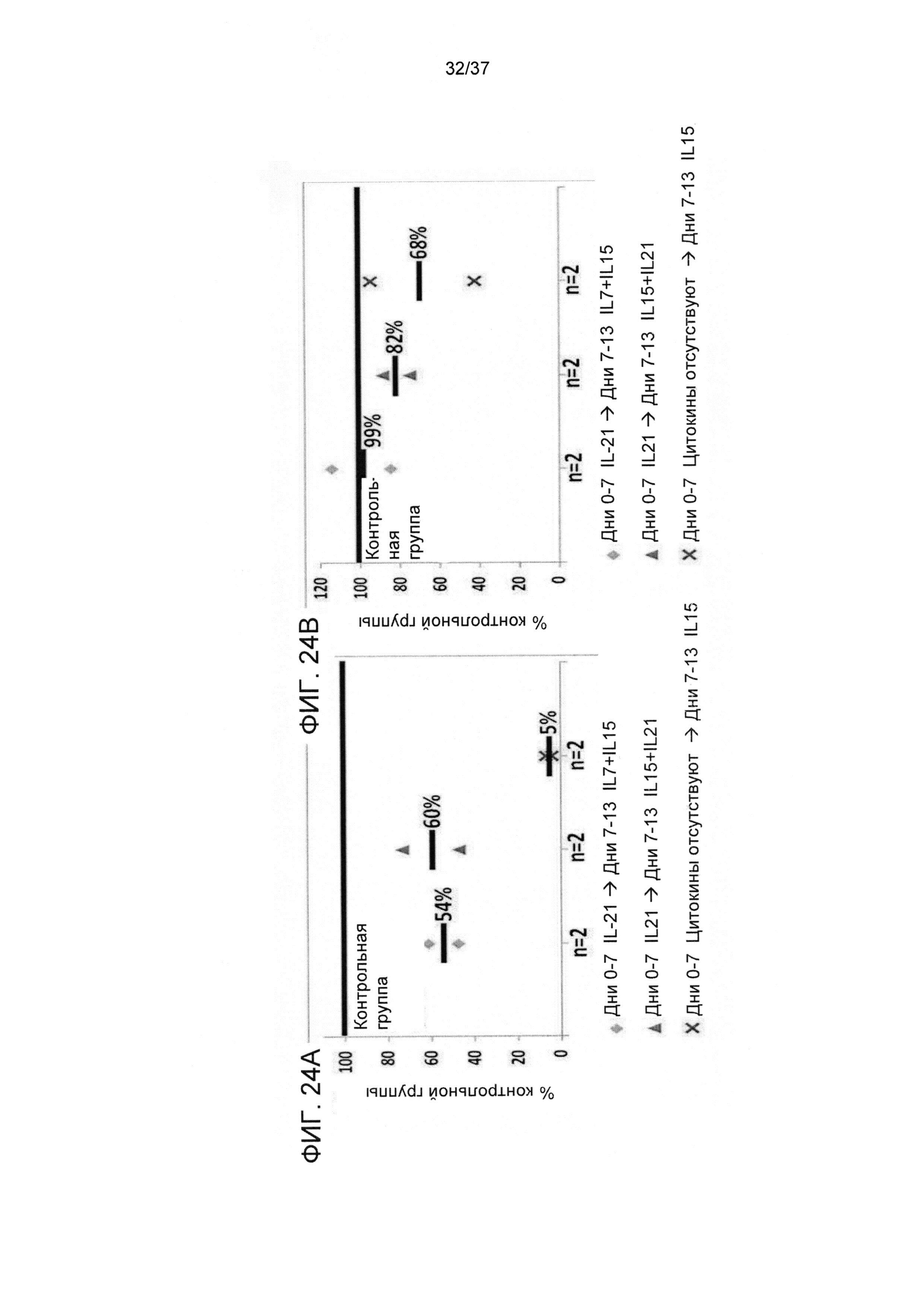
На ФИГ. 24A-B показана роль времени добавления цитокинов в аллогенной модели на людях; результаты экспериментов. Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в среде, содержащей IL-21, в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с IL-7 и IL-15 до 13 дня ("контрольная группа"=d(0-3) IL21→d(3-13)IL7+IL15). Другие группы обрабатывали как указано под графиками. Культуры оценивали на предмет количества клеток с применением эксклюзии на основе трипанового синего (Фигура 24A) и доли Tcm (CD62L+CD45RO+) относительно всех CD8 T-клеток с применением FACS анализа (Фигура 24 В). Для каждого момента времени данные отражают среднее значение ±SE указанного количества (п) независимых экспериментов.
На ФИГ. 25 показано получение определенных CD8 T-клеток против третьей стороны путем позитивного отбора CD137+ клеток. Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC (при соотношении 5.7:1) в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Экспрессия CD137 на CD8 T-клетках была проанализирована с помощью FACS.
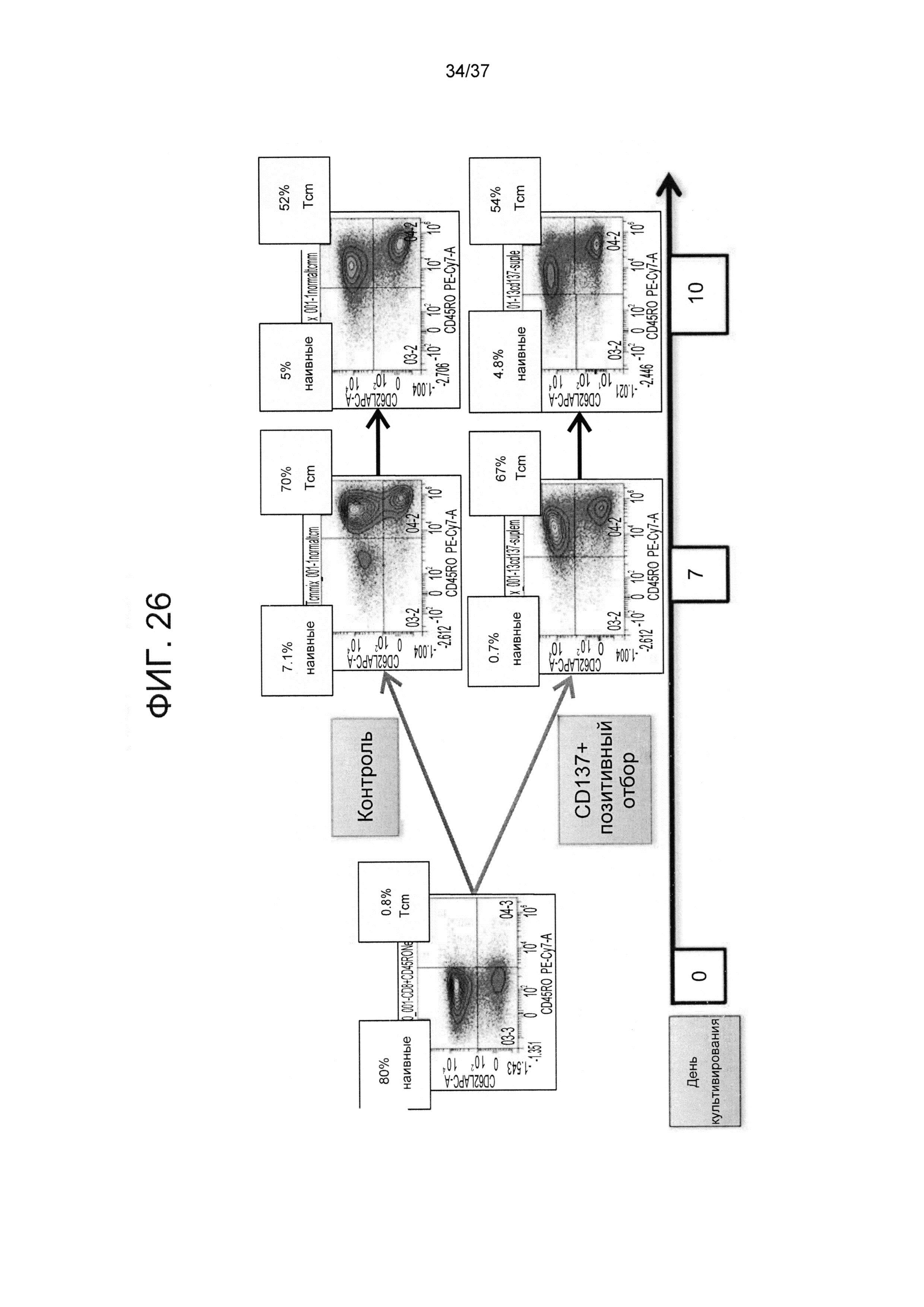
На ФИГ. 26 показано, что получение определенных CD8 T-клеток против третьей стороны путем позитивного отбора CD137+ клеток не снижает степени получения Tcm фенотипа. Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в присутствии IL-21 в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с IL-7 и IL-15 до 10 дня ("контрольная группа"). Альтернативно, наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC при соотношении 5,7:1 в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Затем CD137+ подвергали повторному стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии IL-21 до 3 дня. После этого клетки культивировали с IL-7 и 1L-15 до 10 дня. Клетки анализировали на предмет доли Tcm (CD62L+CD45RO+) относительно всех CD8 T-клеток с помощью FACS анализа.
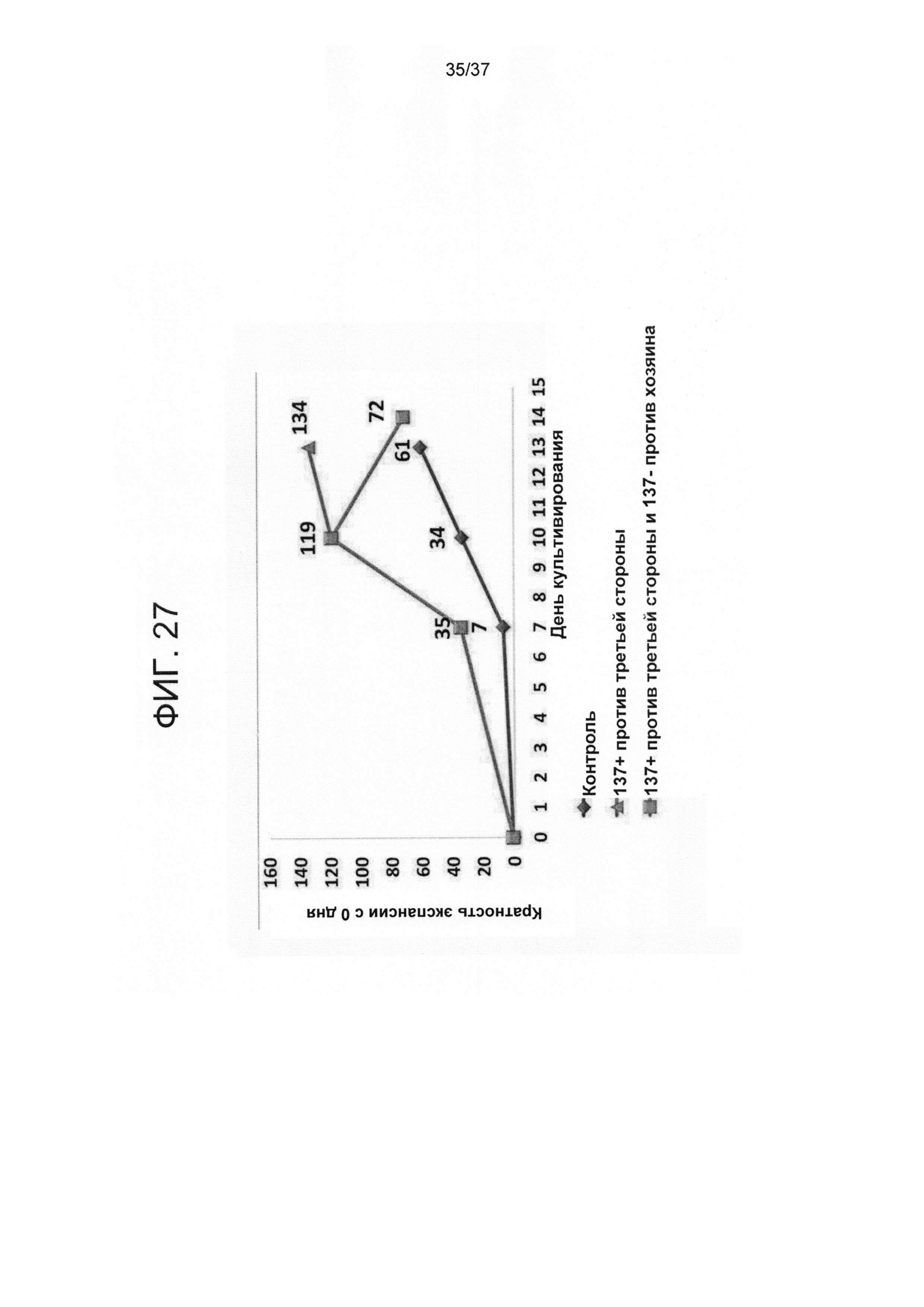
На ФИГ. 27 показано сравнение динамики пролиферации. Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в присутствии IL-21 в течение 3 дней. Клетки не подвергали дальнейшей активации после этого и культивировали с IL-7 и IL-15 до 14 дня ("контрольная группа"). Альтернативно, наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC при соотношении 5,7:1 в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Затем CD137+ подвергали повторному стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии IL-21 до 3 дня. После этого клетки культивировали с IL-7 и IL-15 до 10 дня. На 10 день клетки разделяли на две тестовые группы. В первой группе клетки продолжали культивировать с IL-7 и IL-15 до 14 дня ("CD137+ против третьей стороны") в то время как клетки во второй тестовой группе были активированы облученными PBMC хозяина в присутствии IL-7 и IL-15 (при соотношении 1 к 2). Спустя 24 часа CD137+ клетки подвергали деплеции с помощью магнитного сортинга. Подвергнутые деплеции CD137 клетки повторно высевали с IL-7 и IL-15 и культивировали до 14 дня ("CD137+ против третьей стороны и CD137- против хозяина"). В указанные дни клетки подсчитывали с помощью эксклюзии на основе трипанового синего.
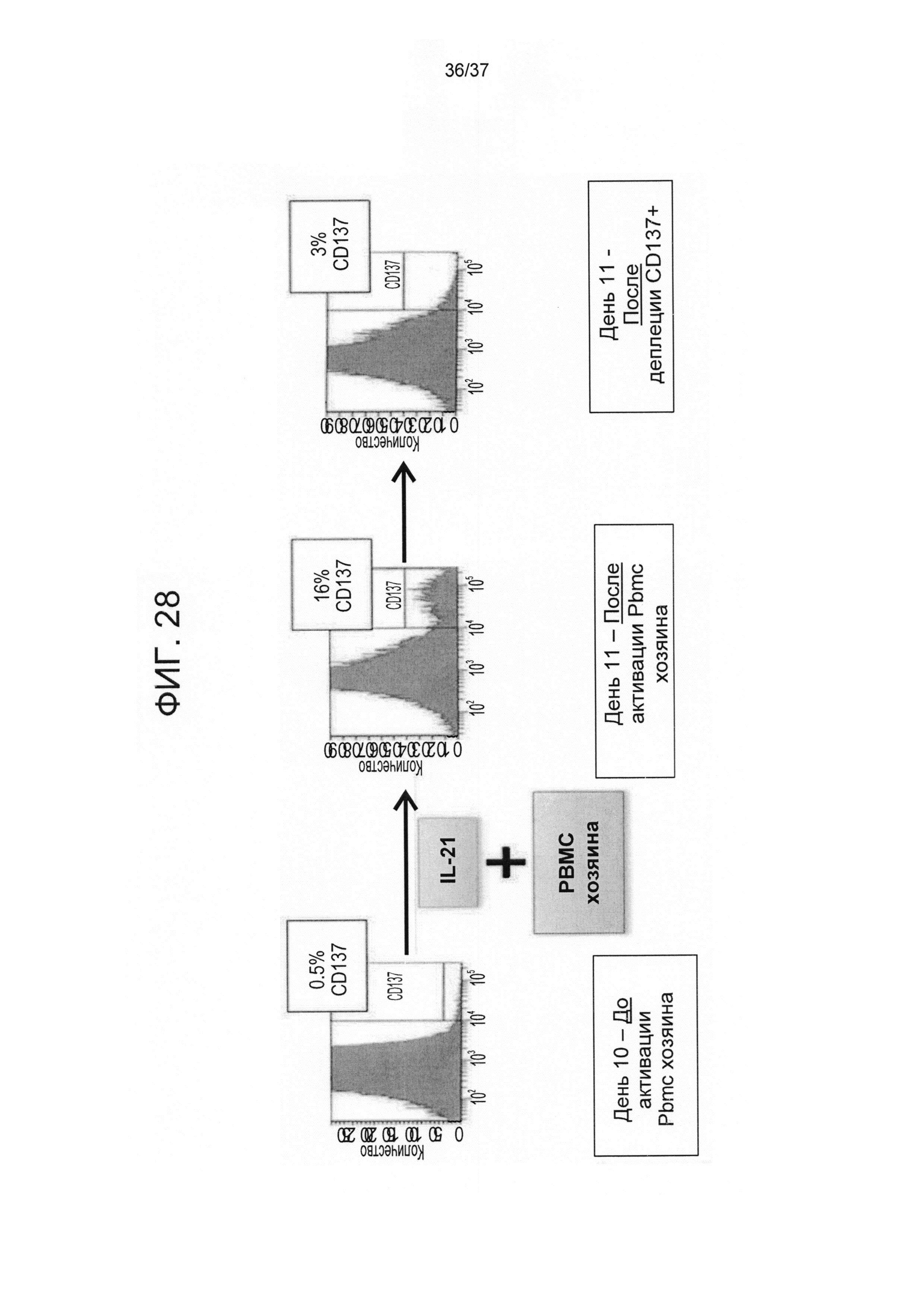
На ФИГ. 28 показана деплеция клонов против хозяина путем деплеции CD137+ клеток после активирования облученными PBMC хозяина. На 10 день культивирования, 9 дней спустя позитивного отбора клонов против третьей стороны, клетки активировали облученными PBMC хозяина (при 1:2 соотношении в пользу PBMC хозяина) в присутствии IL-7 и IL-15. Спустя 24 часа количество CD137+ клеток сокращают. Экспрессия CD137 на CD8 T-клетках была проанализирована с помощью FACS анализа.
На ФИГ. 29 показано, что двухстадийный способ магнитного сортинга на основе повышения регуляции CD137 после антиген-специфичной активации CD8 T-клеток позволяет успешно получить клоны против хозяина и увеличивает долю клеток, специфичных по отношению к сторонним антигенам. Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в присутствии IL-21 в течение 3 дней. Клетки не подвергали дальнейшей активации после этого и культивировали с IL-7 и IL-15 до 14 дня ("контрольная группа"). Альтернативно, наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC при соотношении 5.7:1 в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Затем CD137+ подвергали повторному стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии IL-21 до 3 дня. После этого клетки культивировали с IL-7 и IL-15 до 10 дня. На 10 день клетки разделяли на две тестовые группы. В первой группе клетки продолжали культивировать с IL-7 и IL-15 до 14 дня ("CD137+ против третьей стороны"), в то время как клетки во второй тестовой группе были активированы облученными PBMC хозяина в присутствии IL-7 и IL-15 (при соотношении 1 к 2). Спустя 24 часа CD137+ клетки подвергали деплеции с помощью магнитного сортинга. Подвергнутые деплеции CD137 клетки повторно высевали с IL-7 и IL-15 и культивировали до 14 дня ("CD137+ против третьей стороны и CD137- против хозяина"). На 14 день аллореактивность против третьей стороны и против хозяина оценивали с помощью CFSE анализа против сторонних или облученных PBMC хозяина. Для проведения CFSE анализа 1×106 CFSE+ респондеров культивировали с или без 2×106 облученных (20 Гр) PBMC стимуляторов в течение 84 часов в присутствии IL-7. Спустя 84 часа клетки отделяли и анализировали клеточное деление путем подсчета количества слабоокрашенных CFSE CD8 T-клеток (CD3+CD8+CD56-) с помощью FACS. Для получения абсолютных значений количества клеток образцы суспендировали в постоянном объеме, при этом для каждого образца получали данные с помощью проточной цитометрии в рамках постоянного, предварительно определенного периода времени. Количество определенных делящихся клеток=(Количество делящихся клеток с APC)-(Количество делящихся клеток без APC). Отрицательные значения означают, что количество делящихся клеток в ответ на активацию PBMC хозяина было даже меньше, чем количество делящихся клеток без какой-либо активации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в некоторых вариантах его осуществления, относится к индуцирующим толерантность и/или «трансплантат против лейкемии »-реактивным клеткам против третьей стороны, имеющим фенотип Т-лимфоцита центральной памяти, и, в частности, но не исключительно, к способам их получения и применению в трансплантации и лечении заболеваний.
Принципы и действие настоящего изобретения можно лучше понять при обращении к чертежам и сопровождающим описаниям.
Перед подробным объяснением, по меньшей мере, одного варианта осуществления изобретения должно быть понятно, что изобретение не обязательно ограничивается в плане его применения подробностями, изложенными в последующем описании или приведенными для иллюстрации с помощью Примеров. Возможны другие варианты осуществления или применения изобретения, которые можно выполнить разными способами. Кроме того, должно быть понятно, что фразеология и терминология, которая используется здесь, предназначена для целей описания и не должна рассматриваться в качестве ограничивающей.
При осуществлении настоящего изобретения на практике, авторы настоящего изобретения раскрывают усовершенствованную популяцию T-клеток центральной памяти против третьей стороны (Tcm), которые мигрируют в лимфоузлы после трансплантации и индуцируют толерантность и активность против заболевания (например, активность "трансплантат против лейкемии" (GVL)) без индуцирования реакции «трансплантат против хозяина» (GVH).
Как показано здесь ниже и в разделе Примеры далее, авторы раскрыли новые способы получения Tcm клеток для аллогенных и аутогенных вариантов применения. Как показано на Фигурах 1A и 21, аутогенные Tcm клетки, которые обладают активностью против заболеваний (например, противоопухолевой активностью), получали путем подвергания CD8+ T-клеток аллогенным стимулам (например, дендритным клеткам) в присутствии IL-21 в течение 3 дней с последующим добавлением IL-15 и IL-7 к клеткам с антигенными стимулами еще на 1-2 дня. Далее, полученные клетки культивировали в свободной от антигенов среде в присутствии IL-21, IL-15 и IL-7 в течение дополнительных 6-8 дней.
Как показано на Фигурах 1 В и 22, аллогенные Tcm клетки, которые представляют собой индуцирующие толерантность клетки и обладают GVL активностью, были получены сначала путем подвергания CD8+ T-клеток сторонним стимулам (например, дендритным клеткам) в присутствии IL-21 в течение 3 дней. Спустя приблизительно 14 часов после начала культивирования активированные клетки отбирали с помощью позитивного отбора CD137+, при этом данные клетки повторно культивировали с IL-21. Далее IL-15 и IL-7 добавляли в IL-21 культуру с антигенными стимулами еще на 1-2 дня. Далее, полученные клетки культивировали в свободной от антигенов среде в присутствии IL-21, IL-15 и IL-7 в течение дополнительных 6-8 дней. В конце культивирования количество аллореактивных клеток среди Tcm клеток сокращают путем деплеции CD137+ клеток и последующего контактирования Tcm клеток с антиген-презентирующими клетками хозяина (например, дендритными клетками).
Клетки, полученные авторами, включали более чем 50% CD3+CD8+ клеток, из которых более чем 50% представляли собой Tcm клетки (то есть включали CD3+, CD8+, CD62L+, CD45RA-, CD45RO+ сигнатуру, см., например, Пример 1 из раздела Примеры далее) и обладали TCR-независимой противолейкозной активностью (см. Пример 2).
Вместе данные результаты обосновывают применение Tcm клеток против третьей стороны в качестве способствующих трансплантации клеток и для применения при лечении заболеваний в ситуациях, при которых аллогенная трансплантация является оправданной (например, трансплантация гемопоэтических стволовых клеток или трансплантация в солидный орган). Более того, данные результаты обосновывают применение Tcm клеток против третьей стороны при лечении заболеваний в ситуациях, при которых необходима аутогенная трансплантация, например при гемобластозах.
Таким образом, в соответствии с одним аспектом настоящего изобретения предлагается изолированная популяция клеток, включающая не индуцирующие GVHD клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), при этом данные клетки являются индуцирующими толерантность и способными к хоумингу в лимфоузлы после трансплантации.
Использующееся здесь выражение «изолированная популяция клеток» относится к клеткам, которые были изолированы из их естественной среды (например, тела человека).
Использующийся здесь термин «не-GVHD» означает имеющие значительно сниженную или отсутствующую реактивность «трансплантат против хозяина». Таким образом, клетки настоящего изобретения являются полученными в виде практически не вызывающих болезнь «трансплантат против хозяина» (GVHD), что подтверждается выживаемостью, весом и общим видом подвергнутого трансплантации субъекта через 100 дней после трансплантации.
Использующийся здесь термин «сингенный» относится к клетке или ткани, которая получена от индивида, который является в значительной степени генетически идентичным субъекту. Как правило, практически полностью инбредные
млекопитающие, клоны млекопитающих или гомозиготные млекопитающие-близнецы являются сингенными.
Примеры сингенных клеток или тканей включают клетки или ткани, полученные от субъекта (также называемые в данной области «аутогенными»), клона субьекта или гомозиготного близнеца субъекта.
Использующийся здесь термин «несингенный» относится к клетке или ткани, которая получена от индивида, который является аллогенным или ксеногенным по отношению к лимфоцитам субъекта.
Использующийся здесь термин «аллогенный» относится к клетке или ткани, которая получена от донора, который принадлежит к такой же линии, что и субъект, но является по существу неклональным по отношению к субъекту. Как правило, аутбредные, незиготные млекопитающие-близнецы одной линии являются аллогенными друг с другом. Предпочтительно, чтобы аллогенный донор был HLA-идентичным или HLA-неидентичным по отношению к субъекту.
Использующийся здесь термин «ксеногенный» относится к клетке или ткани, которая по существу экспрессирует антигены разных линий относительно линий значительной доли лимфоцитов субъекта. Как правило, аутбредные млекопитающие разных линий являются ксеногенными друг с другом.
Настоящее изобретение предусматривает, что ксеногенные клетки или ткани получены от разных линий, например, но без ограничения, крупного рогатого скота (например, коров), непарнокопытных (например, лошадей), свиней (например, поросят), козьих (например, коз, овец), кошачьих (например, Felis domestica), псовых (например, домашних собак), грызунов (например, мышей, крыс, кроликов, морских свинок, песчанок, хомяков) или приматов (например, шимпанзе, макак-резус, макак, мартышек).
Клетки или ткани ксеногенного происхождения (например, полученные от свиней) предпочтительно получены от источника, свободного от зоонозов, таких как эндогенный ретровирус свиней. Аналогично, клетки или ткани человека предпочтительно получены от по существу непатогенных источников.
Использующееся здесь выражение «клетки против третьей стороны» относится к лимфоцитам (например, Т-лимфоцитам), которые направлены (например, с помощью T-клеточного распознавания) против стороннего антигена или антигенов.
Использующееся здесь выражение «сторонний антиген или антигены» относится к растворимому или нерастворимому (такому как мембраносвязанный) антигену или антигенам, которые не присутствуют ни у донора, ни у реципиента, как подробно отражено далее.
Например, сторонние антигены могут представлять собой сторонние клетки, антигены вирусов, такие как, например, вирус Эпштейна-Барра (EBV) или цитомегаловирус (CMV), или антигены бактерий, такие как флагеллин. Вирусные или бактериальные антигены могут быть презентированы инфицированными ими клетками (например, клеточной линией) или приготовленными иным способом для экспрессирования вирусных/бактериальных белков. Аутогенные или неаутогенные антиген-презентирующие клетки могут применяться для презентации коротких синтетических пептидов, конденсированных или нагруженных в них. Такие короткие пептиды могут представлять собой пептиды, извлеченные из вируса, или пептиды, представляющие любой другой антиген.
Специализированное программное обеспечение может быть использовано для анализа вирусной или другой последовательностей для идентификации иммуногенетических коротких пептидов, т.е. пептидов, представленных в контексте молекулы МНС класса I или молекулы MHC класса II.
Сторонние клетки могут быть аллогенными или ксеногенными по отношению к реципиенту (более подробное объяснение представлено далее). В случае аллогенных сторонних клеток, такие клетки имеют HLA-антигены, отличные от донорских, но которые не являются перекрестно-реактивными с HLA-антигенами реципиента, так что клетки против третьей стороны, полученные против таких клеток, не являются реактивными против трансплантата или антигенов реципиента.
В соответствии с одним вариантом осуществления настоящего изобретения аллогенные или ксеногенные сторонние клетки представляют собой стимулирующие клетки, выбранные из группы, состоящей из клеток, очищенных из лимфоцитов периферической крови (PBL), селезенки или лимфоузлов, цитокин-активированных PBL и размноженных in vitro антиген-презентирующих клеток (APC), in vitro размноженных дендритных клеток (DC) и искусственных антиген-презентирующих клеток.
Искусственная APC настоящего изобретения может быть сконструирована для включения аутогенной MHC с помощью стороннего пептида или сторонней MHC без необходимости "обучения" экзогенным пептидом. Таким образом, в соответствии с одним вариантом осуществления изобретения искусственная APA включает K562 опухолевые клетки, трансфицированные сторонней MHC детерминантной и костимулирующей молекулой [как описано ранее у, например, Suhoski MM et al., Mol Ther. (2007) 15(5):981-8] или фибробласты, трансфицированные ими.
Сторонние антигены могут быть презентированы на клеточных, вирусных или бактериальных поверхностях, или получены и/или очищены из них. Кроме того, вирусный или бактериальный антиген может размещаться на инфицированной клетке, а клеточный антиген может размещаться на искусственном носителе, таком как липосома или искусственная антиген-презентирующая клетка (например, лейкозная или фибробластная клеточная линия, трансфицированная сторонним антигеном или антигенами).
Сторонний антиген может также включать синтетический пептид, презентируемый аутогенными презентирующими клетками, неаутогенными презентирующими клетками или на искусственном носителе или на искусственных антиген-презентирующих клетках.
Кроме того, сторонними антигенами могут являться, например, белки, экстрагированные или очищенные из разных источников. Примером очищенного белка, который может служить в качестве стороннего антигена согласно настоящему изобретению, может являться овальбумин. Возможны другие примеры.
Применение клеток, вирусов, бактерий, инфицированных вирусом, инфицированных бактерий, вирусных пептидов или бактериальных пептидов, презентирующих клетки в качестве сторонних антигенов, является особенно эффективным, поскольку такие сторонние антигены включают множество различных антигенных детерминант и таким образом направляют образование клеток разных популяций против третьей стороны, которые могут затем служить для более быстрого выделения T-клеток в случаях, когда такое выделение требуется, например, после летального или су 6 летального облучения или химиотерапии.
Более того, при направлении клеток против третьей стороны против сторонних антигенов, данные клетки приобретают активность против заболеваний. Термин "активность против заболеваний" означает активность (например, "убивающую" способность) Tcm клеток в отношении пораженной клетки (например, раковой клетки, такой, которая обладает активностью "трансплантат против лейкемии" (GVL)). Данная активность, как правило, связана с TCR-независимым киллингом, опосредуемым LFA1-I/CAM1 связыванием [Arditti et al., Blood (2005) 105(8):3365-71. Epub 2004 Jul 6].
В соответствии с одним вариантом осуществления изобретения клетки против третьей стороны включают дендритные клетки.
В соответствии с одним вариантом осуществления изобретения клетки против третьей стороны включают зрелые дендритные клетки.
Способы получения сторонних дендритных клеток, которые могут применяться в качестве стимулирующих клеток для индуцирования Tcm клеток, хорошо известны из уровня техники. Таким образом, в качестве неограничивающего примера мононуклеарные клетки периферической крови (PBMC) могут быть получены от стороннего донора несингенных клеток [например, в случае, если Tcm клетки являются сингенными, то есть аутогенными, дендритные клетки (DC) могут быть несингенными, например аллогенными по отношению к субъекту; при этом если Tcm клетки являются несингенными, например аллогенными, DC отбираются у донора, являющегося несингенным, например аллогенным, при этом HLA не совпадает ни с субъектом, ни с Tcm клетками]. Моноциты могут быть затем изолированы с помощью адгезии к пластику и культивированы (например, на планшетах для клеточных культур) с применением среды для DC клеток (например, DC среды Cellgro) с добавлением сыворотки человека (например, 1% сыворотки человека), пенициллина/стрептомицина и GM-CSF (UI/мл) и IL-4 (20 нг/мл) (доступны от, например, Peprotech, Гамбург, Германия). Спустя около 48 часов культивирования может быть добавлена DC среда, включающая GM-CSF (1600 UI/мл) и IL-4 (20 нг/мл).
Спустя около 24 часов неприлипшие клетки могут быть собраны, при этом крупные клетки (в основном, незрелые DC) могут быть ресуспендированы в свежей среде, содержащей GM-CSF (800 UI/мл), IL-4 (20 нг/мл), LPS (например, от E.coli 055:В5 при 10 нг/мл) и IFNy 100 UI/мл) (доступны от, например, Peprotech, Гамбург, Германия), засеяны и культивированы в течение ночи. На следующий день неприлипшие клетки могут быть удалены, при этом прилипшие DC могут быть аккуратно отделены с применением, например, холодного PBS/1% HS после культивирования на льду в течение 20 минут с получением таким образом крупных клеток, состоящих из зрелых DC.
В соответствии с одним вариантом осуществления изобретения сторонние клетки включают облученные дендритные клетки.
Для этого, в соответствии с одним вариантом осуществления изобретения DC облучают с применением около 5-10 Гр, около 10-20 Гр, около 20-30 Гр, около 20-40 Гр, около 20-50 Гр, около 10-50 Гр. В соответствии с определенным вариантом осуществления изобретения DC облучают с применением около 10-50 Гр (например, 30 Гр).
В соответствии с некоторыми вариантами осуществления изобретения клетки против третьей стороны настоящего изобретения включают фенотип Т-лимфоцита центральной памяти (Tcm).
Использующееся здесь выражение «фенотип Т-лимфоцита центральной памяти (Tcm)» относится к субпопуляции цитотоксических T-клеток, которые мигрируют в лимфоузлы. У людей клетки с Tcm фенотипом, как правило, включают CD3+/CD8+/CD62L+/CD45RO+/ CD45RA- сигнатуру. Предпочтительно, чтобы Tcm клетки могли экспрессировать все сигнатурные маркеры на одной клетке или могли экспрессировать только часть этих маркеров на одной клетке.
Предпочтительно, чтобы, по меньшей мере, 30%, по меньшей мере, 40%, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95% или даже 100% изолированной популяции клеток представляли собой CD3+CD8+ клетки. В соответствии с определенным вариантом осуществления изобретения изолированная популяция клеток включает около 70-90% CD3+CD8+ клеток.
Предпочтительно, чтобы, по меньшей мере, 30%, по меньшей мере, 40%, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95% или даже 100% CD3+CD8+ клеток обладали сигнатурой Tcm клеток. В соответствии с определенным вариантом осуществления изобретения около 30-80% CD3+CD8+ клеток обладают сигнатурой Tcm клеток (например, 40-50%).
В соответствии с одним вариантом осуществления изобретения предусмотрена изолированная популяция клеток, включающая клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), при этом, по меньшей мере, 50%) изолированной популяции клеток представляет собой CD3+CD8+ клетки, из которых, по меньшей мере, 50% включают CD3+, CD3+, CD8+, CD62L+, CD45RA-, CD45RO+ сигнатуру, а также представляют собой клетки, индуцирующие толерантность и/или обладающие активностью против заболеваний (например, активностью "трансплантат-против-лейкемии" (GVL)) и способные к хоумингу в лимфоузлы после трансплантации.
Как отмечалось, Tcm клетки обычно мигрируют в лимфоузлы после трансплантации. В соответствии с некоторыми вариантами осуществления изобретения Tcm клетки против третьей стороны настоящего изобретения могут мигрировать в любой из лимфоузлов после трансплантации, например в периферические лимфоузлы и мезентриальные лимфоузлы. Природа хоуминга данных клеток позволяет им проявить свой эффект толерантности эффективно и быстро.
Таким образом, Tcm клетки против третьей стороны настоящего изобретения являются индуцирующими толерантность клетками.
Использующееся здесь выражение «индуцирующие толерантность клетки» относится к клеткам, которые вызывают слабый ответ клеток реципиента (например, T-клеток реципиента) при контакте с ними по сравнению с ответом клеток реципиента в отсутствие введенных индуцирующих толерантность клеток. Индуцирующие толерантность клетки включают вето-клетки (т.е. T-клетки, которые приводят к апоптозу T-клеток хозяина при контакте с ними), как было описано ранее в PCT публикации WO 2001/049243 и WO 2002/102971.
В соответствии с некоторыми вариантами осуществления изобретения Tcm клетки настоящего изобретения могут представлять собой негенетически модифицированные клетки или генетически модифицированные клетки (например, клетки, которые генетически сконструированы для экспрессирования или неэкспрессирования определенных генов, маркеров или пептидов, или для секреции или несекреции определенных цитокинов). Любой известный в данной области способ может быть реализован в рамках генетического инжениринга клеток, например, с помощью инактивации соответствующего гена/ов или внедрения антисмысловой РНК, препятствующей экспрессии полипептида (см., например, WO/2000/039294, включенную здесь в виде ссылки).
В соответствии с некоторыми вариантами осуществления изобретения предусмотрен способ получения изолированной популяции клеток, при этом способ включает: контактирование мононуклеарных клеток периферической крови (PBMC) со сторонним антигеном или антигенами в присутствии IL-21 для обогащения антиген-реактивных клеток; и (b) культивирование клеток, полученных на стадии (a), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде, что делает возможной пролиферацию клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm).
Tcm клетки против третьей стороны настоящего изобретения, как правило, получают с помощью контактирования сингенных или несингенных мононуклеарных клеток периферической крови (PBMC) со сторонним антигеном или антигенами (такими, как описано выше) в культуре с добавлением IL-21 (в культуре, иначе являющейся свободной от цитокинов, то есть без добавления каких-либо дополнительных цитокинов). Данную стадию обычно осуществляют в течение около 12-24 часов, около 12-36 часов, около 12-72 часов, 24-48 часов, 24-36 часов, около 24-72 часов, около 48-72 часов, 1-2 дней, 2-3 дней, 1-3 дней, 2-4 дней, 1-5 дней, 2-5 дней, 2-6 дней, 1-7 дней, 2-8 дней, 8-10 дней или 1-10 дней, что позволяет получать антиген-реактивные клетки. В соответствии с определенным вариантом осуществления изобретения контактирование сингенных или несингенных PBMC со сторонним антигеном или антигенами (такими как описано выше) в культуре с добавлением IL-21 (иначе являющейся свободной от цитокинов культурой) проводят в течение 1-5 дней (например, 3 дней). Данную стадию обычно проводят в присутствии около 0,001-3000 нг/мл, 0,001-1000 нг/мл, 0,01-1000 нг/мл, 0,1-1000 нг/мл, 1-1000 нг/мл, 10-1000 нг/мл, 10-500 нг/мл, 10-300 нг/мл, 10-100 нг/мл, 100-1000 нг/мл, 1-100 нг/мл, 1-50 нг/мл, 1-30 нг/мл, 10-50 нг/мл, 10-30 нг/мл, 10-20 нг/мл, 20-30 нг/мл, 20-50 нг/мл, 30-50 нг/мл, 30-100 нг/мл, 1-10 нг/мл, 0,1-10 нг/мл, 0,1-100 нг/мл, 1 нг/мл, 10 нг/мл-100 нг/мл IL-21. В соответствии с определенным вариантом осуществления изобретения концентрация IL-21 составляет 10-50 нг/мл (например, 30 нг/мл).
В соответствии с определенным вариантом осуществления изобретения контактирование сингенных или несингенных PBMC со сторонним антигеном или антигенами осуществляется в свободной от цитокинов культуре (например, с добавлением только IL-21), при этом данный режим культивирования обеспечивает выживаемость и получение только тех клеток, которые подвергаются стимулированию и активации сторонним антигеном или антигенами (то есть антиген-реактивных клеток), поскольку данные клетки секретируют цитокины (например, IL-2), которые обеспечивают их выживание (все остальные клетки погибают при данных условиях культивирования).
Соотношение стороннего антигена или антигенов (например, дендритных клеток) и PBMC обычно составляет от около 1:2 до около 1:10, например, около 1:4, около 1:6, около 1:8 или около 1:10. В соответствии с определенным вариантом осуществления изобретения соотношение стороннего антигена или антигенов (например, дендритных клеток) и PBMC составляет от около 1:2 до около 1:8 (например, 1:4).
Далее, клетки против третьей стороны культивируют в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде для обеспечения пролиферации клеток с Tcm фенотипом. Данную стадию обычно осуществляют в течение около 12-24 часов, около 12-36 часов, около 12-72 часов, 24-48 часов, 24-36 часов, около 24-72 часов, около 48-72 часов, 1-20 дней, 1-15 дней, 1-10 дней, 1-5 дней, 5-20 дней, 5-15 дней, 5-10 дней, 1-2 дней, 2-3 дней, 1-3 дней, 2-4 дней, 2-5 дней, 2-8 дней, 2-10 дней, 4-10 дней, 4-8 дней, 6-8 дней, 8-10 дней, 7-9 дней, 7-11 дней, 7-13 дней, 7-15 дней, 10-12 дней, 10-14 дней, 12-14 дней, 14-16 дней, 14-18 дней, 16-18 дней или 18-20 дней. В соответствии с определенным вариантом осуществления изобретения клетки против третьей стороны культивируют в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде в течение около 7-11 дней (например, 8 дней).
Данную стадию обычно проводят в присутствии IL-21 при концентрации около 0,001-3000 нг/мл, 0,001-1000 нг/мл, 0,01-1000 нг/мл, 0,1-1000 нг/мл, 1-1000 нг/мл, 10-1000 нг/мл, 10-500 нг/мл, 10-300 нг/мл, 10-100 нг/мл, 100-1000 нг/мл, 1-100 нг/мл, 1-50 нг/мл, 1-30 нг/мл, 10-50 нг/мл, 10-30 нг/мл, 10-20 нг/мл, 20-30 нг/мл, 20-50 нг/мл, 30-50 нг/мл, 30-100 нг/мл, 1-10 нг/мл, 0,1-10 нг/мл, 0,1-100 нг/мл, 1 нг/мл-100 нг/мл IL-21. В соответствии с определенным вариантом осуществления изобретения концентрация IL-21 составляет 10-50 нг/мл (например, 30 нг/мл).
Данную стадию также проводят в присутствии IL-15 при концентрации 0,001-3000 нг/мл, 0,001-1000 нг/мл, 0,01-1000 нг/мл, 0,05-1000 нг/мл, 0,1-1000 нг/мл, 0,5-1000 нг/мл, 0,05-500 нг/мл, 0,05-500 нг/мл, 0,1-100 нг/мл, 0,1-10 нг/мл, 0,5-100 нг/мл, 1-100 нг/мл, 5-100 нг/мл, 1-50 нг/мл, 5-50 нг/мл, 1-10 нг/мл, 5-10 нг/мл, 1-5 нг/мл, 2-3 нг/мл, 2-7 нг/мл, 3-5 нг/мл, 3-7 нг/мл, 4-5 нг/мл, 5-6 нг/мл, 5 нг/мл-7 нг/мл, 1 нг/мл-8 нг/мл, 10 нг/мл-100 нг/мл, 10 нг/мл-1000 нг/мл, 100 нг/мл-1000 нг/мл. В соответствии с определенным вариантом осуществления изобретения концентрация IL-15 составляет 1-10 нг/мл (например, 5 нг/мл).
Данную стадию также проводят в присутствии IL-7 при концентрации 0,001-3000 нг/мл, 0,001-1000 нг/мл, 0,01-1000 нг/мл, 0,05-1000 нг/мл, 0,1-1000 нг/мл, 0,5-1000 нг/мл, 0,05-500 нг/мл, 0,05-500 нг/мл, 0,1-100 нг/мл, 0,1-10 нг/мл, 0,5-100 нг/мл, 1-100 нг/мл, 5-100 нг/мл, 1-50 нг/мл, 5-50 нг/мл, 1-10 нг/мл, 5-10 нг/мл, 1-5 нг/мл, 2-3 нг/мл, 2-7 нг/мл, 3-5 нг/мл, 3-7 нг/мл, 4-5 нг/мл, 5-6 нг/мл, 5 нг/мл-7 нг/мл, 1 нг/мл-8 нг/мл, 10 нг/мл-100 нг/мл, 10 нг/мл-1000 нг/мл, 100 нг/мл-1000 нг/мл. В соответствии с определенным вариантом осуществления изобретения концентрация IL-7 составляет 1-10 нг/мл (5 нг/мл).
Путем лабораторных экспериментов и скрининга авторы определили ряд критериев, которые могут быть применены для увеличения пролиферации клеток против третьей стороны, имеющих фенотип Т-лимфоцита центральной памяти (Tcm), избавленных от "трансплантат-против-хозяина" (ОУН)-реактивных клеток и/или улучшенных до обладающих реактивностью против заболеваний (например, GVL) клеток.
В соответствии с одним вариантом осуществления изобретения количество неприлипших клеток в PBMC сокращают перед контактированием со сторонним антигеном или антигенами в присутствии IL-21.
В соответствии с одним вариантом осуществления изобретения количество CD4+ и/или CD56+ клеток в PBMC сокращают перед контактированием со сторонним антигеном или антигенами в присутствии IL-21.
В соответствии с одним вариантом осуществления изобретения PBMC отбирают на основе наличия CD45RA+ клеток перед контактированием со сторонним антигеном или антигенами в присутствии IL-21.
Деплеция CD4+ и/или CD56+ клеток может быть осуществлена с применением любого способа, известного из уровня техники, например с помощью аффинной очистки (например, с применением MACS шариков, FACS сортировщика и/или окрашивания в рамках ELISA). Данная стадия может быть полезен для повышения чистоты CD8+ клеток в культуре (т.е. удаления других лимфоцитов в культуре клеток, например, CD4+ T-клеток или NK-клеток) или для увеличения количества CD8+ T-клеток.
В соответствии с одним вариантом осуществления изобретения PBMC включают неприлипающие клетки.
В соответствии с одним вариантом осуществления изобретения PBMC включают CD8+ T-клетки.
В соответствии с одним вариантом осуществления изобретения PBMC включают наивные CD8+ T-клетки.
Отбор наивных CD8+ T-клеток может быть осуществлен путем отбора клеток, экспрессирующих CD45RA+, и/или клеток, экспрессирующих CD45RO-, и может быть осуществлен с применением любого способа, известного из уровня техники, например с помощью аффинной очистки (например, с применением MACS шариков, FACS сортировщика и/или окрашивания в рамках ELISA).
В соответствии с одним вариантом осуществления изобретения PBMC включают CD45RA+ клетки.
Дополнительная стадия, который может быть осуществлен в соответствии с настоящими концепциями, включает культивирование PBMC клеток со сторонним антигеном или антигенами в присутствии IL-21, IL-15 и IL-7 перед удалением стороннего антигена или антигенов из клеточной культуры (то есть до получения свободной от антигенов среды). Данную стадию обычно осуществляют в течение около 12-24 часов, около 12-36 часов, около 12-72 часов, 24-48 часов, 24-36 часов, около 24-72 часов, около 48-72 часов, 1-2 дней, 2-3 дней, 1-3 дней, 2-4 дней, 1-5 дней или 2-5 дней с теми же дозировками IL-21, IL-15 и IL-7, которые указаны выше. В соответствии с определенным вариантом осуществления изобретения культивирование PBMC клеток со сторонним антигеном или антигенами в присутствии IL-21, IL-15 и IL-7 осуществляют в течение от 12 часов до 4 дней (например, 1-2 дней).
Кроме того или альтернативно, может быть осуществлен дополнительный двухстадийный процесс, позволяющий проводить отбор и выделение активированных клеток. Данная отборочная стадия способствует удалению потенциальных реактивных T-клеток хозяина в ситуациях, когда PBMC являются несингенными по отношению к субъекту (как описано более подробно ниже).
Таким образом, выделение активированных клеток может быть осуществлено в рамках двухстадийного подхода. На первой стадии активированные клетки отбирают перед культивированием клеток в присутствии IL-15 и IL-7. Данная первая стадия обычно осуществляется после первоначального контактирования PBMC со сторонним антигеном или антигенами в присутствии IL-21. Данный отборочный процесс позволяет отбирать только те клетки, которые были активированы сторонним антигеном (например, экспресс-маркеры активации как описано ниже) и обычно осуществляется в течение около 12-24 часов, около 24-36 часов, около 12-36 часов, около 36-48 часов, около 12-48 часов, около 48-60 часов, около 12-60 часов, около 60-72 часов, около 12-72 часов, около 72-84 часов, около 12-84 часов, около 84-96 часов, около 12-96 часов после первоначального контактирования PBMC со сторонним антигеном или антигенами. В соответствии с определенным вариантом осуществления изобретения отборочный процесс осуществляют в течение около 12-24 часов (например, 14 часов) после первоначального контактирования PBMC со сторонним антигеном или антигенами.
Выделение активированных клеток может быть осуществлено с помощью аффинной очистки (например, с применением MACS шариков, FACS сортировщика и/или окрашивания в рамках ELISA) и может быть проведено для любых маркеров активации, включая маркеры клеточной поверхности, такие как, но без ограничения, CD69, CD44, CD25, CFSE, CD137, и неклеточные маркеры поверхности, такие как, но без ограничения, IFN-γ и IL-2. Выделение активированных клеток может быть также осуществлено с помощью очистки на основе морфологии (например, выделения крупных клеток) с применением любого способа, известного из уровня техники (например, с помощью FACS). Как правило, активированные клетки также отбирают на основе экспрессии CD8+ клеток. Кроме того, для эффективного выделения активированных клеток может применяться любая комбинация описанных выше способов.
В соответствии с некоторыми вариантами осуществления настоящего изобретения отбор активированных клеток осуществляется путем отбора CD137+ и/или CD25+ клеток.
Вторая стадия выделения активированных клеток обычно осуществляется в конце культивирования (то есть после культивирования в свободной от антигенов среде с IL-21, IL-15 и IL-7). На данной стадии снижается количество аллореактивных клеток за счет деплеции клеток, которые были активированы после контактирования Т-лимфоцитов центральной памяти с облученными антиген-презентирующими клетками хозяина (APC, например дендритные клетки). Как указано выше, выделение активированных клеток может быть осуществлено с помощью аффинной очистки (например, с применением MACS шариков, FACS сортировщика и/или окрашивания в рамках ELISA) и может быть проведено для любых маркеров активации, включая маркеры клеточной поверхности, такие как, но без ограничения, CD69, CD44, CD25, CFSE, CD137, или неклеточные маркеры поверхности, такие как, но без ограничения, IFN-γ и IL-2.
В соответствии с одним вариантом осуществления настоящего изобретения, деплеция аллореактивных клеток осуществляется путем деплеции CD137+ и/или CD25+ клеток.
Далее следует ряд неограничивающих примеров протоколов, которые могут применяться в соответствии с некоторыми вариантами осуществления изобретения.
В соответствии с одним вариантом осуществления изобретения предусмотрен способ получения изолированной популяции клеток, включающей клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки являются клетками, индуцирующими толерантность и/или обладающими активностью против заболеваний (например, активностью «трансплантат против лейкемии» (GVL)) и способными к хоумингу в лимфоузлы после трансплантации, при этом способ включает: (a) обработку неирилипающих мононуклеарных клеток периферической крови (PBMC) агентом, способным подвергать деплеции CD4+ и/или CD56+ клетки для получения CD8+ T-клеток; (b) контактирование CD8+ T-клеток со сторонними дендритными клетками в присутствии IL-21 в течение от 12 часов до 5 дней для обогащения антиген реактивных клеток; (с) культивирование клеток, полученных на стадии (b), со сторонними дендритными клетками в присутствии IL-21, IL-15 и IL-7 в течение от 12 часов до 3 дней; и (d) культивирование клеток, полученных на стадии (с), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде в течение 5-20 дней для пролиферации клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm).
Описанный выше протокол обычно применяется для несингенной трансплантации и таким образом применяемые PBMC, как правило, являются аллогенными по отношению к субъекту (например, полученными от аллогенного донора).
В соответствии с одним вариантом осуществления изобретения предусмотрен способ получения изолированной популяции клеток, включающей клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm), причем указанные клетки обладают активностью против заболеваний (например, противоопухолевой клеточной активностью) и являются способными к хоумингу в лимфоузлы после трансплантации, при этом способ включает: (a) обработку не прикрепленных мононуклеарных клеток периферической крови (PBMC) агентом, способным подвергать деплеции CD4+ и/или CD56+ клетки для получения CD8+ Т клеток; (b) контактирование CD8+ T-клеток с несингенными дендритными клетками в присутствии IL-21 в течение от 12 часов до 5 дней для обогащения антиген-реактивных клеток; (с) культивирование клеток, полученных на стадии (b), с несингенными дендритными клетками в присутствии IL-21, IL-15 и IL-7 в течение от 12 часов до 3 дней; и (d) культивирование клеток, полученных на стадии (с), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде в течение 5-20 дней для пролиферации клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm).
Описанный выше протокол обычно применяется для сингенной трансплантации и таким образом применяемые PBMC, как правило, являются аутогенными по отношению к субъекту (например, полученными от субъекта).
Таким образом, как сказано выше, PBMC могут быть сингенными или несингенными по отношению к субъекту.
В соответствии с некоторыми вариантами осуществления изобретения несингенные PBMC настоящего изобретения могут быть аллогенными или ксеногенными по отношению к субъекту (подробное объяснение представлено ниже).
Источник PBMC будет определяться с учетом предполагаемого применения клеток (см. дальнейшие подробности ниже) и находится в компетенции опытного специалиста в данной области, особенно в свете приведенного здесь подробного описания.
Применение индуцирующих толерантность клеток настоящего изобретения является особенно полезным в ситуациях, когда необходимо устранить отторжение трансплантата и преодолеть болезнь «трансплантат против хозяина» (GVHD), например, при трансплантации аллогенных или ксеногенных клеток или тканей.
Таким образом, в соответствии с другим аспектом настоящего изобретения предусмотрен способ лечения субъекта, нуждающегося в клеточной или тканевой трансплантации, при этом способ включает трансплантацию клетки или органа субъекту и введение субъекту терапевтически эффективного количества изолированной популяции клеток.
Использующийся здесь термин «лечение» включает отмену, значительное ингибирование, замедление или реверсию прогрессирования состояния, значительное ослабление клинических или внешних симптомов состояния или значительное предотвращение появления клинических или внешних симптомов состояния.
Использующийся здесь термин «субъект» или «нуждающийся в этом (лечении) субъект» относится к млекопитающему, предпочтительно человеку, мужчине или женщине любого возраста, которым требуется клеточная или тканевая трансплантация, или которые страдают заболеванием, которое может быть излечено с применением Tcm клеток. Как правило, субъект (также называемый здесь реципиентом) нуждается в клеточной или тканевой трансплантации из-за расстройства или патологического или нежелательного состояния, заболевания или синдрома, или физического, морфологического или физиологического отклонения, которое восприимчиво к лечению с помощью клеточной или тканевой трансплантации. Примеры таких нарушений представлены ниже.
Использующееся здесь выражение «клеточная или тканевая трансплантация» относится к клетке тела (например, отдельной клетке или группе клеток) или ткани (например, солидным тканям/органам или мягким тканям, которые могут быть трансплантированы полностью или частично). Примеры тканей, которые могут быть трансплантированы согласно настоящему изобретению, включают, но без ограничения, ткани печени, поджелудочной железы, селезенки, почки, сердца, легкого, кожи, кишечника и лимфоидные/кроветворные ткани (например, лимфоузлы, Пейеровы бляшки тимуса или костный мозг). Примеры клеток, которые могут быть трансплантированы согласно настоящим концепциям, включают, но без ограничения, незрелые гемопоэтические клетки, включая стволовые клетки. Более того, настоящее изобретение также предполагает трансплантацию целых органов, таких как, например, почки, сердца, печени или кожи.
В зависимости от применения способ может быть осуществлен с применением клеток или тканей, которые являются сингенными или несингенными по отношению к субъекту.
В соответствии с одним вариантом осуществления настоящего изобретения субъектом и донором является человек.
В зависимости от применения и доступных источников, клетки или ткани настоящего изобретения могут быть получены из пренатального организма, постнатального организма, взрослого или трупного донора. Более того, в зависимости от необходимого варианта применения, клетки или ткани могут быть наивными или генетически модифицированными. Данные детерминации находятся в пределах компетенции обычного специалиста в данной области.
Любой известный в данной области способ может применяться для получения клетки или ткани (например, для трансплантации).
Трансплантацию клетки или ткани субъекту можно осуществить разными способами, в зависимости от разных параметров, таких как, например, тип клетки или ткани; тип, стадия или тяжесть заболевания реципиента (например, органная недостаточность); физических или физиологических параметров, специфичных для субъекта; и/или требуемого терапевтического результата.
Пересадку клеточного или тканевого трансплантата настоящего изобретения можно осуществить путем пересадки клеточного или тканевого трансплантата в любую анатомическую локализацию в зависимости от применения. Клеточный или тканевый трансплантат можно пересадить в гомотопную анатомическую локализацию (нормальная анатомическая локализация для трансплантата) или в эктопическую анатомическую локализацию (патологическая анатомическая локализация для трансплантата). В зависимости от применения, клеточный или тканевый трансплантат можно преимущественно имплантировать под почечную капсулу или в почки, тестикулярную жировую клетчатку, под кожу, сальник, воротную вену, печень, селезенку, полость сердца, сердце, грудную полость, легкие, кожу, поджелудочную железу и/или внутрибрюшинное пространство.
Например, ткань печени согласно настоящему изобретению может быть трансплантирована в печень, воротную вену, под почечную капсулу, под кожу, в сальник, селезенку и внутрибрюшинное пространство. Трансплантация печени в разные анатомические локализации, такие как указанные, широко практикуется в данной области для лечения заболеваний, восприимчивых к лечению с помощью пересадки печени (например, печеночной недостаточности). Аналогично,
трансплантация ткани поджелудочной железы в соответствии с настоящим изобретением может быть успешно выполнена путем пересадки ткани в воротную вену, печень, поджелудочную железу, тестикулярную жировую клетчатку, подкожно, в сальник, кишечную петлю (субсероза U петли тонкого кишечника) и/или внутрибрюшинное пространство. Трансплантация ткани поджелудочной железы может быть использована для лечения заболеваний, восприимчивых к лечению путем пересадки поджелудочной железы (например, диабета). Аналогично, трансплантацию тканей, таких как почки, сердце, легкие или ткани кожи можно осуществить в разные описанные выше анатомические локализации для лечения реципиентов, страдающих, например, от почечной недостаточности, сердечной недостаточности, легочной недостаточности или повреждения кожи (например, ожогов).
Способ настоящего изобретения можно также использовать, например, для лечения реципиента, страдающего от заболевания, требующего трансплантации незрелых гемопоэтических клеток.
В последнем случае незрелые аутогенные, аллогенные или ксеногенные гемопоэтические клетки (включая стволовые клетки), которые могут быть получены, например, из костного мозга, мобилизированной периферической крови (путем, например, лейкафереза), фетальной печени, желточного мешка и/или пуповинной крови донора, и которые предпочтительно являются подвергнутыми деплеции по T-клеткам незрелыми гемопоэтическими CD34+ клетками, могут быть трансплантированы реципиенту, страдающему от заболевания. Такое заболевание включает, но без ограничения, лейкемию, такую как острый лимфобластный лейкоз (ALL), острый нелимфобластный лейкоз (ANLL), острый миелоцитарный лейкоз (AML) или хронический миелоцитарный лейкоз (CML), тяжелый комбинированный иммунодефицит (SCID), включающий аденозиндеаминазу (ADA), остеопетроз, апластическую анемию, болезнь Гоше, талассемию и другие врожденные или наследственные гемопоэтические нарушения.
Предпочтительно, чтобы незрелые аутогенные, аллогенные или ксеногенные гемопоэтические клетки настоящего изобретения можно было трансплантировать реципиенту любым способом, известным в данной области для трансплантации клетки, таким как, но без ограничения, инфузия клеток (например, внутривенно I.V.) или внутрибрюшинно.
Иногда при трансплантации клеточного или тканевого трансплантата по настоящему изобретению пациенту, имеющему поврежденный орган, может быть предпочтительным вначале, по меньшей мере, частично удалить поврежденный орган у субъекта для того, чтобы обеспечить оптимальное развитие трансплантата и его структурную/функциональную интеграцию с анатомией/физиологией субъекта.
В соответствии с одним вариантом осуществления изобретения незрелые гемопоэтические клетки и изолированная популяция клеток получают от одного донора.
В соответствии с одним вариантом осуществления изобретения незрелые гемопоэтические клетки и изолированная популяция клеток получают от одного субъекта.
Способ настоящего изобретения также предусматривает совместную трансплантацию нескольких органов (например, сердечных и легочных тканей) в случае, если такая процедура может оказать благотворное воздействие на субъекта.
В соответствии с одним вариантом осуществления изобретения совместная трансплантация включает трансплантацию незрелых гемопоэтических клеток и солидной ткани/органа или ряда солидных органов/тканей.
В соответствии с одним вариантом осуществления изобретения незрелые гемопоэтические клетки и солидный орган или получены от одного донора.
В соответствии с другим вариантом осуществления изобретения, незрелые гемопоэтические клетки и солидный орган/ткань или органы/ткани получены от различных (несингенных) доноров.
В соответствии с одним вариантом осуществления изобретения незрелые гемопоэтические клетки трансплантируют до, одновременно или после трансплантации солидного органа.
В соответствии с одним вариантом осуществления изобретения гемопоэтический химеризм сначала индуцируется у субъекта путем трансплантации незрелых гемопоэтических клеток вместе с Tcm клетками настоящего изобретения, что ведет к толерантности других тканей/органов, трансплантируемых от одного донора.
В соответствии с одним вариантом осуществления изобретения Tcm клетки настоящего изобретения применяют непосредственно для снижения отторжения трансплантируемых тканей/органов, трансплантируемых от одного донора.
В другом варианте осуществления изобретения клеточный или тканевый трансплантат и изолированная популяция клеток получены от одного донора.
В другом варианте осуществления изобретения клеточный или тканевый трансплантат является сингенным по отношению к субъекту, а изолированная популяция клеток является несингенной по отношению к субъекту.
В другом варианте осуществления изобретения клеточный или тканевый трансплантат является сингенным по отношению к субъекту, при этом изолированная популяция клеток является сингенной по отношению к субъекту.
После трансплантации клеточного или тканевого трансплантата субъекту, согласно современным учениям, желательно, в соответствии со стандартной медицинской практикой, наблюдать за ростом функциональных характеристик и иммуносовместимостью органа согласно любой стандартной методике, существующей в данной области. Например, функциональность тканевого трансплантата поджелудочной железы можно отслеживать после трансплантации с помощью стандартных тестов функции поджелудочной железы (например, анализа уровней инсулина в сыворотке). Аналогично, трансплантат ткани печени можно наблюдать после трансплантации с помощью стандартных тестов функции печени (например, анализа уровней альбумина в сыворотке, общего белка, ALT, AST и билирубина, и анализа времени свертывания крови). Структурное развитие клеток или тканей можно отслеживать с помощью компьютерной томографии или ультразвуковой визуализации.
В зависимости от контекста трансплантации, в целях приживления клеточного или тканевого трансплантата, способ может также преимущественно включать кондиционирование субъекта в сублетальных, летальных или сверхлетальных условиях перед трансплантацией.
В соответствии с использованным здесь значением термины "сублетальное", "летальное" или "сверхлетальное" при применении в отношении кондиционирования субъектов настоящего изобретения означают миелотоксическое и/или лимфоцитотоксическое лечение, которое, при применении в отношении соответствующей группы субъектов, соответственно, как правило, является: нелетальным по отношению к по существу всем членам группы; летальным по отношению к некоторым, но не всем членам группы; или летальным или по существу летальным по отношению ко всем членам группы при нормальных условиях стерильности.
В соответствии с одним вариантом осуществления изобретения стадию кондиционирования осуществляют путем кондиционирования субъекта при сверхлетальных условиях, таких как миелоаблативные условия.
Альтернативно, стадия кондиционирования может быть осуществлена путем кондиционирования субъекта при летальных или сублетальных условиях, таких как кондиционирование субъекта при миелоредукционных условиях.
Примеры кондиционных агентов, которые могут применяться для кондиционирования субъекта, включают, без ограничения, облучение, фармакологические агенты и индуцирующие толерантность клетки (как описано здесь).
Примеры фармакологических агентов включают миелотоксичные лекарства, лимфоцитотоксичные лекарства и иммуносупрессантные лекарства.
Примеры миелотоксичных лекарств включают, без ограничения, бусульфан, диметилмилеран, мелфалан и тиотепа.
Способ может также преимущественно включать кондиционирование субъекта иммуносупрессивной терапией до, одновременно или после трансплантации клеточного или тканевого трансплантата.
Примеры подходящих схем иммуносупрессии включают введение иммуносупрессивных препаратов, вызывающих толерантность клеточных популяций (как подробно описано далее), и/или иммуносупрессивное облучение.
Обширное руководство по выбору и введению подходящих иммунодепрессивных схем для трансплантации приведено в литературе данной области (например, см.: Kirkpatrick СН. and Rowlands DT Jr., 1992. JAMA. 268, 2952; Higgins RM. et al., 1996. Lancet 348, 1208; Suthanthiran M. and Strom ТВ., 1996. New Engl. J. Med. 331, 365; Midthun DE. et al., 1997. Mayo Clin Proc. 72, 175; Morrison VA. et al., 1994. Am J Med. 97, 14; Hanto DW, 1995. Annu Rev Med. 46, 381; Senderowicz AM. et al., 1997. Ann Intern Med. 126, 882; Vincenti F. et al, 1998. New Engl. J. Med. 338, 161; Dantal J. et al. 1998. Lancet 351, 623).
Предпочтительно, схема иммуносупрессии состоит из введения, по меньшей мере, одного иммуносупрессирующего агента субъекту.
Примеры иммуносупрессивных препаратов включают, но без ограничения, метотрексат, циклофосфамид, циклоспорин, циклоспорин А, хлорохин, гидроксихлорохин, сульфасалазин (сульфасалазопирин), соли золота, D-пеницилламин, лефлуномид, азатиоприн, анакинру, инфликсимаб (REMICADE), этанерцепт, блокаторы TNF-альфа, биологический агент, который воздействует на воспалительный цитокин, и нестероидные противовоспалительные препараты (NSAID). Примеры NSAID включают, но без ограничения, ацетилсалициловую кислоту, салицилат-холин магния, дифлунизал, салицилат магния, салсалат, салицилат натрия, диклофенак, этодолак, фенопрофен, флурбипрофен, индометацин, кетопрофен, кеторолак, меклофенамат, напроксен, набуметон, фенилбутазон, пироксикам, сулиндак, толметин, ацетаминофен, ибупрофен, ингибиторы Сох-2, трамадол, рапамицин (сиролимус) и аналоги рапамицина (такие как CCI-779, RADOOl, AP23573). Данные агенты могут быть введены по отдельности или в комбинации.
Независимо от типа трансплантата, для предотвращения отторжения трансплантата и болезни «трансплантат против хозяина», способ настоящего изобретения использует новые Tcm клетки против третьей стороны (как описано подробно выше).
В соответствии со способом настоящего изобретения данные Tcm клетки против третьей стороны вводятся одновременно, до или после трансплантации клеточного или тканевого трансплантата.
Tcm клетки против третьей стороны могут вводиться любым способом, известным в области трансплантации клеток, таким как, но без ограничения, инфузия клеток (например, внутривенно I.V.) или внутрибрюшинное введение.
Без привязки к теории, терапевтически эффективное количество представляет собой количество Tcm клеток против третьей стороны, достаточное для толеризации, противоракового действия и/или восстановления иммунитета без индуцирования GVHD. Поскольку Tcm клетки настоящего изобретения мигрируют в лимфоузлы после трансплантации, для достижения благоприятного действия/ий клеток (например, толеризации, противоопухолего действия и/или восстановления иммунитета) может потребоваться меньшее количество клеток (по сравнению с дозой клеток, применяемой ранее, см., например, WO 2001/049243). Следует учесть, что могут потребоваться более низкие уровни иммуносупрессивных препаратов в сочетании с Tcm клетками настоящего изобретения (например, исключение рапамицина из терапевтического протокола).
Определение терапевтически эффективного количества находится в компетенции опытного специалиста в данной области, особенно в свете подробного описания, приведенного здесь.
Для любого состава, который используется в способах изобретения, терапевтически эффективное количество или доза может быть установлена на основании анализов in vitro и анализов культуры клеток. Например, доза может быть составлена на животных моделях для достижения требуемой концентрации или титра. Такую информацию можно использовать для более тщательного определения эффективных доз для человека.
Например, в случае трансплантации ткани количество Tcm клеток против третьей стороны, инфузируемых реципиенту, должно быть больше, чем 1×104/кг массы тела. Количество Tcm клеток против третьей стороны, инфузируемых реципиенту, должно, как правило, быть в диапазоне от 1×103/кг массы тела до 1×104/кг массы тела, от 1×104/кг массы тела до 1×105/кг массы тела, от 1×104/кг массы тела до 1×106/кг массы тела, от 1×104/кг массы тела до 1×107/кг массы тела, от 1×104/кг массы тела до 1×108/кг массы тела, от 1×103/кг массы тела до 1×105/кг массы тела, от 1×104/кг массы тела до 1×106/кг массы тела, от 1×106/кг массы тела до 1×107/кг массы тела, от 1×105/кг массы тела до 1×107/кг массы тела, от 1×106/кг массы тела до 1×108/кг массы тела. В соответствии с определенным вариантом осуществления изобретения, количество Tcm клеток против третьей стороны, инфузируемых реципиенту, находится в диапазоне от 1×105/кг массы тела до 1×107/кг массы тела.
Таким образом, новые Tcm клетки против третьей стороны настоящего изобретения могут быть применены в качестве адъювантной терапии для клеточного или тканевого трансплантата (как описано выше). Кроме того, новые Tcm клетки настоящего изобретения также обладают активностью против заболеваний (например, противоопухолевой клеточной активностью, как описано подробно выше) и таким образом могут быть использованы per se для лечения заболеваний.
В соответствии с определенным вариантом осуществления изобретения для получения активности «трансплантат против пораженной клетки» (например, противоопухолевого действия, такого как антилейкозная терапия) могут применяться сингенные, а также несингенные клетки.
Таким образом, способ настоящего изобретения может применяться для лечения любого заболевания, такого как, но без ограничения, злокачественное заболевание, заболевание, связанное с пересадкой трансплантата, инфекционное заболевание, такое как вирусное заболевание или бактериальное заболевание, воспалительное заболевание и/или аутоиммунное заболевание.
Заболевания, которые можно лечить с применением способов настоящего изобретения, включают, но без ограничения, злокачественные заболевания, такие как лейкоз (например, острый лимфатический, острый лимфобластный, пре-B-клеточный острый лимфобластный, острый лимфобластный T-клеточный лейкоз, острый-мегакариобластный, моноцитарный, острый миелогенный, острый миелоидный, острый миелоидный с эозинофилией, B-клеточный, базофильный, хронический миелоидный, хронический, эозинофильный, Фрейнда, гранулоцитарный или миелоцитарный, волосатоклеточный, лимфоцитарный, мегакариобластный, моноцитарный, моноцитарно-макрофагальный, миелобластный, миелоидный, миеломоноцитарный, плазмоклеточный, пре-B-клеточный, промиелоцитарный, подострый, T-клеточный, лимфосаркому, предрасположенность к миелоидной злокачественной опухоли, острый нелимфоцитарный лейкоз, T-клеточный острый лимфоцитарный лейкоз (T-ALL) и B-клеточный хронический лимфоцитарный лейкоз (B-CLL)], лимфому (например, болезнь Ходжкина, неходжкинскую лимфому, B-клеточную, Беркитта, кожную T-клеточную, ретикулоклеточную, лимфобластную, T-клеточную, тимусную), карциному, бластому и саркому; заболевания, связанные с пересадкой трансплантата (например, отторжение трансплантата, хроническое отторжение трансплантата, подострое отторжение трансплантата, гиперострое отторжение трансплантата, острое отторжение трансплантата и реакция «трансплантат против хозяина»); инфекционные заболевания, включающие, но без ограничения, хронические инфекционные заболевания, подострые инфекционные заболевания, острые инфекционные заболевания, вирусные заболевания (например, EBV, CMV, HIV), бактериальные заболевания, протозойные заболевания, паразитарные заболевания, микозы, микоплазменные заболевания и прионные заболевания; воспалительные заболевания (например, хронические воспалительные заболевания и острые воспалительные заболевания); и аутоиммунные заболевания (например, сердечно-сосудистые заболевания, ревматоидные заболевания, эндокринные заболевания, желудочно-кишечные заболевания, кожные заболевания, болезни печени, неврологические заболевания, мышечные заболевания, заболевания почек, заболевания, относящиеся к репродуктивной системе, заболевания соединительных тканей и системные заболевания).
Таким образом, способ настоящего изобретения может также успешно применяться при лечении заболевания у субъекта, одновременно способствуя приживлению трансплантата клеток или тканей, сингенных по отношению к Tcm клеткам против третьей стороны (например, в ситуациях, когда клеточный или тканевый трансплантат и клетки против третьей стороны получены от одного донора).
Использующийся здесь термин «около» означает ±10%.
Термины «содержит», «содержащий», «включает», «включающий», «имеющий» и их конъюгаты означают «включающий, но не ограничивающийся».
Термин «состоящий из» означает «включающий и ограничивающийся».
Термин «состоящий по существу из» означает, что композиция, способ или структура может включать дополнительные ингредиенты, стадии и/или части, но только в случае, если дополнительные ингредиенты, стадии и/или части существенно не изменяют базовые и новые характеристики заявленной композиции, способа или структуры.
Использующиеся здесь существительные в единственном числе включают их множественное число, если в контексте четко не указано иное. Например, термин «соединение» или «по меньшей мере, одно соединение» может включать множество соединений, включая их смеси.
По тексту данной заявки разные варианты осуществления настоящего изобретения могут быть представлены в формате диапазона. Должно быть понятно, что описание в формате диапазона представлено для удобства и краткости, и не должно рассматриваться как ограничение объема изобретения. Соответственно, описание диапазона должно рассматриваться в качестве охватывающего все возможные поддиапазоны, а также отдельные численные значения внутри этого диапазона. Например, описание диапазона, такого как от 1 до 6, должно рассматриваться в качестве охватывающего поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и так далее, а также отдельные значения внутри этого диапазона, например, 1, 2, 3, 4, 5 и 6. Это применимо вне зависимости от ширины диапазона.
Во всех случаях, когда здесь указан числовой диапазон, это означает включение любого числа (дробного или целого) внутри указанного диапазона. Выражения «в диапазоне/изменяется в диапазоне», где первый указывает число и второй указывает число, и «в диапазоне/изменяется от», где первый указывает на число «до» второго числа, используются здесь взаимозаменяемо и означают включение первого и второго указанных чисел и всех дробных и целых числа между ними.
Использующийся здесь термин «способ» означает способы, средства, методики и процедуры, предназначенные для выполнения поставленной задачи, при этом термин включает, но без ограничения, такие способы, средства, методики и процедуры, которые являются известными или легко разрабатываемыми исходя из известных способов, средств, методик и процедур практикующими врачами в области химии, фармакологии, биологии, биохимии и медицины.
Предпочтительно, чтобы определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, могли быть также предусмотрены в комбинации в одном варианте осуществления. Напротив, разные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут также быть предусмотрены отдельно или в любой приемлемой подкомбинации, или в любом другом описанном варианте осуществления изобретения. Определенные признаки, описанные в контексте различных вариантов осуществления изобретения, не должны рассматриваться как главные признаки данных вариантов осуществления изобретения, если вариант осуществления изобретения является неработоспособным без этих элементов.
Разные варианты осуществления и аспекты настоящего изобретения, как подчеркнуто здесь выше, и как заявлено в формуле изобретения ниже, находят экспериментальное подтверждение в следующих примерах.
ПРИМЕРЫ
Последующие примеры, вместе с представленными выше описаниями, иллюстрируют данное изобретение неограничивающим образом.
В целом используемая здесь номенклатура и лабораторные методики, используемые в настоящем изобретении, включают молекулярные, биохимические, микробиологические и рекомбинантные ДНК методики. Такие методики всесторонне описаны в литературе. См., например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" т. I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", т. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методологии, приведенные в патентах США 4,666,828; 4,683,202; 4,801,531; 5,192,659 и 5,272,057; "Cell Biology: А Laboratory Handbook", т. I-III Cellis, J. E., ed. (1994); "Current Protocols in Immunology" т. I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8-e издание), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W.H. Freeman and Co., New York (1980); доступные результаты иммунологических анализов подробно описаны в патентной и научной литературе, см., например, патенты США 3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 и 5,281,521; "Oligonucleotide Synthesis" Gait, М.J., ed. (1984); "Nucleic Acid Hybridization" Hames, B.D., and Higgins S.J., eds. (1985); "Transcription and Translation" Hames, B.D., and Higgins S.J., Eds. (1984); "Animal Cell Culture" Freshney, R.I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, В., (1984) и "Methods in Enzymology" т. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); все из которых приведены здесь для ссылки в своей полноте. Другие общие ссылки приведены по всему этому документу. Предполагается, что указанные здесь методики хорошо известны в данной области и приведены для удобства читателя. Вся содержащаяся здесь информация включена здесь в виде ссылки.
ОБЩИЕ МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДИКИ
Мононуклеарные клетки периферической крови (PBMC)
PBMC выделяли из цельной крови пациентов и здоровых добровольцев с помощью центрифугирования в градиенте плотности Ficoll. Согласно инструкциям, клетки подвергали HLA-типированию I класса с помощью серологических методик как было описано [Manual of Tissue Typing Techniques. Washington DC, National Institute of Allergy and Infectious Diseases, NIH DHEW Publication 76-545, 1976, стр. 22].
Линии опухолевых клеток
Применяли Н.Му2 C1R HLA А2 K66A трансфектные клетки и Н.Му2 C1R HLA А2 трансфектные линии B-клеток дикого типа.
Применяли C1R, лимфобластоидную линию B-клеток человека с отсутствующими поверхностными HLA А и В антигенами, полученную из Hmy.2 В-LCL с помощью гамма-облучения с последующим отбором для моноклональных антител класса I и комплемента как было описано [Storkus WJ, et al. Proc. Natl. Acad. Sci. USA (1989) 86: 2361-2364].
Применяли CIR-neo, стабильную линию трансфектных клеток, полученную в 1987 с помощью электропорации клеточной линии C1R модифицированным неомицин-резистентным эукариотическим вектором pSP65-Neo (вектор не содержал вставки) как было описано [Grumet FC, et al. Hum. Immunol. (1994) 40: 228-234].
Получение дендритных клеток
Моноциты выделяли с помощью адгезии к пластику и культивировали на 6-луночных планшетах с применением 3 мл среды Cellgro DC с добавлением 1% сыворотки человека и пенициллина/стрептомицина плюс GM-CSF (800 UI/мл) и IL-4 (20 нг/мл) (Peprotech, Гамбург, Германия). Спустя 48 часов культивирования добавляли 1,5 мл среды (+GM-CSF при 1600 UI/мл и IL4 при 20 нг/мл). Спустя 24 часа неприлипшие клетки собирали, при этом крупные клетки (в основном, незрелые DC) подсчитывали, ресуспендировали в свежей среде, содержащей GM-CSF 800 UI/мл, IL-4 20 нг/мл, LPS из E.coli 055:В5 при 10 нг/мл (Sigma, Дизенхофен, Германия) и IFNy (Peprotech, 100 UI/мл), и высевали в количестве приблизительно 106 DC на лунку в 2 мл и культивировали в течение ночи. На следующий день неприлипшие клетки удаляли, при этом прилипшие DC осторожно отделяли с помощью холодного PBS/1% HS после культивирования на льду в течение 20 минут.Подсчитывали количество крупных клеток, состоящих из зрелых DC. Клетки облучали 30 Гр для исключения избыточного роста некоторых потенциально загрязняющих NK- T-клеток или T-клеток памяти и затем применяли для стимулирования T-клеток.
Выделение наивных CD8 T-клеток из PBMC
Наивные CD8 T-клетки сначала выделяли с помощью негативного отбора с применением набора для негативного отбора CD8 (Miltenyi, Бергиш-Гладбах, Германия) в соответствии с инструкциями производителя. Антиген-опытные CD8+ T-клетки подвергали деплеции с применением CD45RO- шариков на LD колонке.
Получение CD8 T-клеток центральной памяти человека против третьей стороны
Наивные CD8 T-клетки выделяли и ресуспендировали в T-клеточной среде с добавлением IL-21 (Peprotech, 30 нг/мл). Облученные DC добавляли при соотношении ОС:T-клетки 1:4 с 4×105 T-клетками на лунку 48-луночного планшета. Общий объем каждой лунки составлял 500 мкл.
Спустя 72 часа после начала культивирования добавляли 500 мкл T-клеточной среды с IL-7 и IL-15 (Peprotech, итоговая концентрация 5 нг/мл), при этом в последующем клетки питали каждые 2-3 дня как указано в разделе "результаты".
GVL анализ
Н.Му C1R ("Neo") и Н.Му C1R HLA А2 K66A мутантные трансфертные ("K66A") клетки В-лимфобластной линии получали с помощью центрифугирования в градиенте плотности Ficoll и метили 0,15 мкг/мл CalceinAM (Molecular Probes, Inc, Eugene, OR), витальным красителем, который высвобождается при смерти клетки, в соответствии с инструкциями производителя. Далее, 2×105 меченных Calcein клеток В-лимфобластной линии культивировали с или без Tcm против третьей стороны в течение 22 часов при соотношении 1 к 5 в пользу Tcm против третьей стороны на 24-луночных планшетах. Перед совместным культивированием в Tcm против третьей стороны повышали количество CD8+ T-клеток с помощью набора для негативного отбора (Miltenyi, Бергиш-Гладбах, Германия). В MLR не добавляли экзогенные цитокины. Клетки отделяли и анализировали выживаемость путем измерения количества выживших окрашенных Calcein клеток В-лимфобластной линии с помощью FACS. Для определения апоптоза с помощью AnnexinV+образцы культивировали с 5 мкл AnnexinV-APC (BD) в течение 15 минут при комнатной температуре. Далее несвязанный AnnexinV вымывали, при этом образцы анализировали с помощью FACS. Для получения абсолютных значений количества клеток образцы суспендировали в постоянном объеме, при этом для каждого образца получали данные с помощью проточной цитометрии в рамках постоянного предварительно определенного периода времени и сравнивали с данными, полученными с фиксированным объемом и фиксированным количеством клеток. Степень выживаемости приведена по отношению к выживаемости клеток В-лимфобластной линии самостоятельно.
Доля киллинга клеток В-лимфобластных линий была подсчитана с помощью следующей формулы:
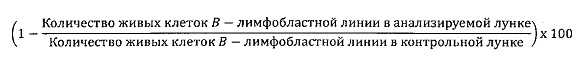
Доля клеток B-лимфобластных линий, подвергнутых определенному апоптозу, была подсчитана с помощью следующей формулы:=(% Calcein+AnnexinV+ клеток B-лимфобластной линии в анализируемой лунке)-(% Calcein+AnnexinV+ клеток B-лимфобластной линии в контрольной лунке).
Двухстадийный подход к деплеции аллореактивности с применением магнитного сортинга на основе CD137 маркера активации
Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 6:1 в присутствии IL-21 (Peprotech, 30 нг/мл). После 14 часов культивирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга (Miltenyi, Бергиш-Гладбах, Германия). Затем CD137+ подвергали повторному стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии IL-21 (Peprotech, 30 нг/ил) до 3 дня. После этого клетки культивировали с 5 нг/мл IL-7 и 5 нг/мл IL-15 (Peprotech) до 10 дня. На 10 день клетки разделяли на две тестовые группы. В первой группе клетки продолжали культивировать с IL-7 и IL-15 до 14 дня в то время как клетки во второй тестовой группе были активированы облученными PBMC хозяина в присутствии IL-7 и IL-15 (при соотношении 1 к 2). Спустя 24 часа CD137+ клетки подвергали деплеции с помощью магнитного сортинга. Подвергнутые деплеции CD137 клетки повторно высевали с IL-7 и IL-15 и культивировали до 14 дня ("CD137+ против третьей стороны и CD137- против хозяина"). На 14 день аллореактивность против третьей стороны и против хозяина оценивали с помощью CFSE анализа против сторонних или облученных PBMC хозяина.
Для проведения CFSE анализа 1×106 CFSE+респондеров культивировали с или без 2×106 облученных (20 gy) PBMC стимуляторов в течение 84 часов в присутствии IL-7. Спустя 84 часа клетки отделяли и анализировали клеточное деление путем подсчета количества слабоокрашенных CFSE CD8 T-клеток (CD3+CD8+CD56-) с помощью FACS. Для получения абсолютных значений количества клеток образцы суспендировали в постоянном объеме, при этом для каждого образца получали данные с помощью проточной цитометрии в рамках постоянного, предварительно определенного периода времени. Количество определенных делящихся клеток=(Количество делящихся клеток с APC) - (Количество делящихся клеток без APC). Отрицательные значения означают, что количество делящихся клеток в ответ на активацию PBMC хозяина было даже меньше, чем количество делящихся клеток без какой-либо активации.
ПРИМЕР 1
Получение и оптимизация T-клеток центральной памяти человека против третьей стороны (Tcm)
В целях переноса описанных выше исследований на мышах для клинического применения процедуру оптимизировали для получения цитотоксических Т-лимфоцитов человека против третьей стороны (CTL). С этой целью исследовали различные параметры, включая различные реагенты для выделения CD8 клеток-респондеров, композицию стимуляторов и среду цитокинов.
Потенциально, согласно результатам приведенной выше модели на мышах, лечение с применением T-клеток центральной памяти (Tcm) может быть полезно в контексте аутогенного [Lask A et al., Blood (ASH Annual Meeting Abstracts), (2010) 116: 424] или аллогенного трансплантата костного мозга (ВМТ) [Ophir Е et al., Blood. (2010) 115(10): 2095-104; Ophir E., 37-ая ежегодная встреча ЕВМТ, 3-6 апреля 2011, Париж, Франция. Oral Presentation Abstract Nr: 662].
В аутогенных условиях у человека (Фигура 1A) Tcm против третьей стороны могут быть введены совместно с аутогенным BMT. Собственные CD8+ T-клетки пациента выделяют и стимулируют против аллогенных дендритных клеток от аллогенного донора.
В аутогенных условиях у человека (Фигура IB) Tcm против третьей стороны могут быть трансплантированы совместно с аллогенными Т-деплецированными BM-клетками. Наивные CD8+ T-клетки, полученные от аллогенного донора BM, служат в качестве респондеров, при этом донорские дендритные клетки против третьей стороны применяются в качестве стимуляторов для получения нереактивных Tcm хозяина. В целях исключения GVHD сторонний донор выбран таким образом, чтобы ни одна из его аллелей HLA класса I не совпадала с аллелями HLA класса I хозяина.
В то время как у мышей и людей базовый предполагаемый протокол одинаково включал выделение CD8 T-клеток с последующим стимулированием против клеток против третьей стороны (Фигуры 1A-B и 2A-B), в предназначенном для людей протоколе было необходимо модифицировать некоторые другие протоколы, как показано в Таблице 1 ниже.
С учетом того, что аутогенные Tcm не связаны с риском GVHD, оптимизация протокола получения главным образом концентрировалась на достижении эффективного культивирования CD8 T-клеток против третьей стороны с фенотипом центральной памяти.
Как видно на Фигуре 3A, был разработан новый протокол на основе трех основных стадий: отбора CD8 T-клеток из PBMC; b) стимулирования против аллогенных дендритных клеток (DC) в течение 3 дней в присутствии IL-21; и с) культивирования в свободной от антигенов среде с IL-7, IL-15 и IL-21 в течение дополнительных 8 дней.
Таким образом, в данном новом разработанном протоколе различные параметры отличаются от параметров, используемых для получения Tcm мышей (Таблица 1 и Фигуры 3A-B). Основные различия связаны с происхождением ткани для респондеров и стимуляторов (PBMC по сравнению со спленоцитами), стимуляторами (дендритные клетки по сравнению со спленоцитами), а также цитокиновой композицией.
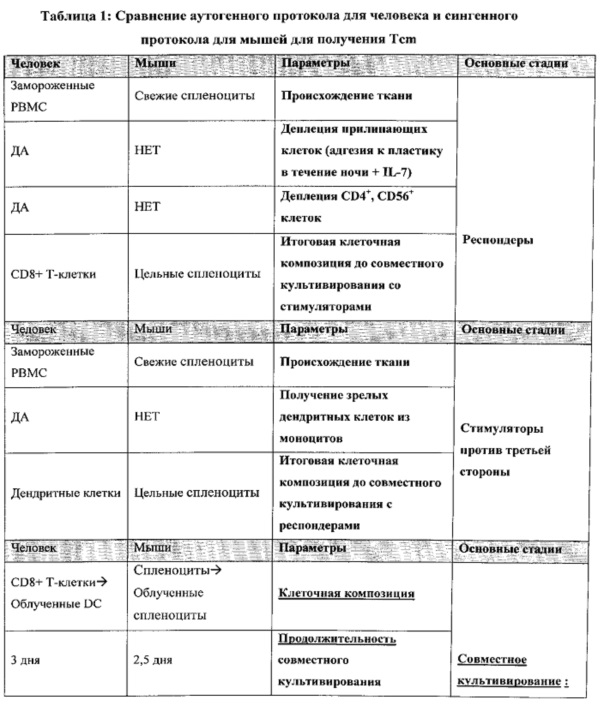
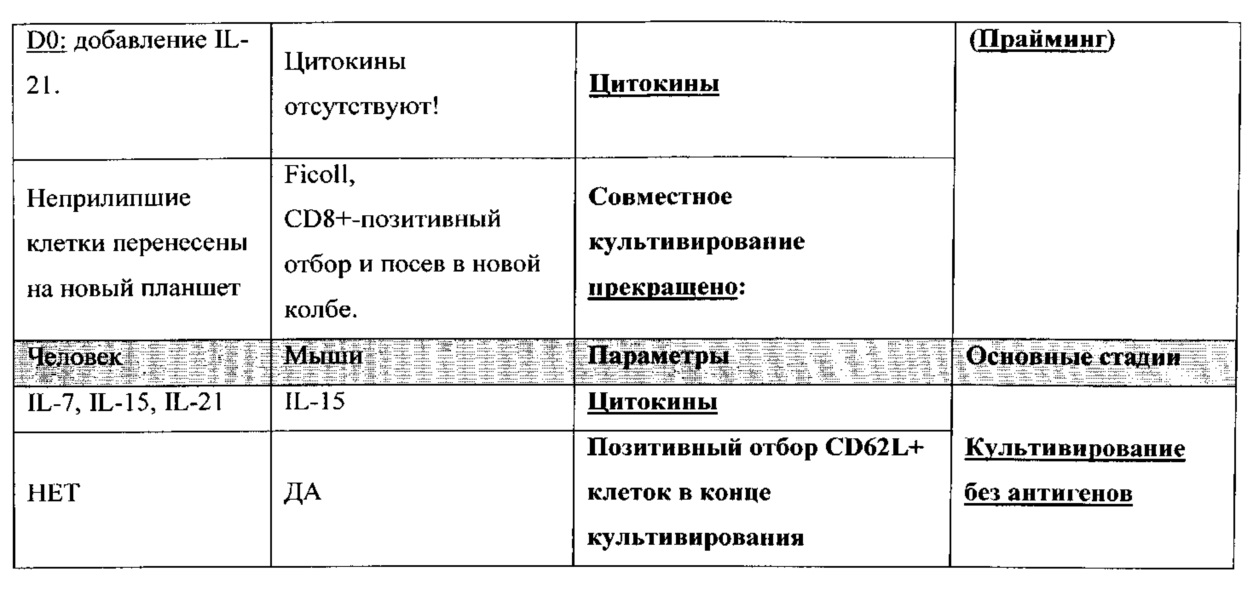
Оптимизация GPM протокола для получения Tcm человека против третьей стороны:
Первоначальные попытки разработать протокол для человека для получения Tcm против третьей стороны были основаны на недавнем исследовании Wolfl et al. [Wolfl M et al., Cancer Immunol Immunother (2011) 60(2): 173-186], в котором описана процедура получения антиген-специфичных CD8 T-клеток человека с фенотипом центральной памяти.
Настоящий подход был основан на стимулировании против "обученных" антигеном DC в присутствии IL-21 в течение 3 дней с последующим культивированием в присутствии IL-7 и IL-15 в течение дополнительных 8 дней.
В данных первоначальных экспериментах, которые привели к впечатляющей экспансии Tcm против третьей стороны и впоследствии служили в качестве базы для сравнения для дальнейшей оптимизации, применяли следующие стадии: а) получение CD8 T-клеток из PBMC с помощью деплеции He-CD8+ клеток, (то есть CD4+ T-клеток, γ/δ T-клеток, B-клеток, NK-клеток, дендритных клеток, моноцитов, гранулоцитов и эритроидных клеток); b) получение наивных клеток путем деплеции активированных клеток, экспрессирующих CD45RO; и с) стимулирование наивных CD8 T-клеток против аллогенных дендритных клеток в присутствии IL-21 в течение 3 дней с последующей экспансией в свободной от антигенов среде с IL-7 и IL-15 в течение дополнительных 8 дней.
Результаты данных первоначальных сравнительных экспериментов, показанные на Фигурах 4A-C, позволили оценить роль различных параметров в протоколе путем определения влияния каждого параметра на уровень экспансии клеток и уровень экспрессии фенотипа Tcm (как описано более подробно ниже).
Роль прайминга с DC против третьей стороны
С учетом того, что аутогенные Tcm по определению не несут риска GVHD, первым исследованным параметром была роль стимулирования против DC против третьей стороны. Данная стадия был первоначально предназначен для снижения риска GVHD в аллогенных условиях путем селективной экспансии клонов против третьей стороны в отсутствие стимулирования клонов против хозяина, опосредующих GVHD.
Как показано на Фигурах 5A-С и 6A-B, наивные CD8 T-клетки, выращенные с IL-21 в отсутствие аллогенного стимулирования дендритными клетками, обладали низким уровнем пролиферации (2,7±1,1% от уровня контрольной группы) с приблизительно 0,4-кратной экспансией на 7 день (большинство клеток погибло до 10 дня) и сохранением наивного фенотипа (CD45RO-CD62L+, малая морфология) (уровень Tcm составлял лишь 10% от уровня контрольной группы). Аналогично низкий уровень дифференциации и экспансии был обнаружен, когда клетки культивировали с IL-7 и IL-15 в отсутствие аллогенного стимулирования дендритными клетками; при данных условиях клетки сохраняли наивный фенотип (уровень Tcm составлял лишь 7±1,6% от уровня контрольной группы), хотя пролиферация была несколько повышена (12±3,2% значения контрольной группы, соответствуя приблизительно 6-кратной экспансии на 13 день). Таким образом, роль аллогенных DC против третьей стороны была крайне важна для индуцирования Tcm фенотипа и для устойчивой экспансии клеток.
Роль IL-21 на стадиях прайминга и экспансии Tcm против третьей стороны
В основном стандартные протоколы экспансии T-клеток на стадии экспансии у мышей и человека осуществляют в свободной от антигенов среде. Тем не менее, в отличие от протокола у мышей, в протокол у человека, описанный Wolfl et al. (Wolfl et al. 2011, supra), был добавлен только IL-15 (Фигура ЗВ), при этом экспансия клеток осуществлялась в присутствии IL-7 и IL-15. Кроме того, учитывая, что было показано, что IL-21 является полезным при добавлении на первоначальной стадии прайминга, роль IL-21 была определена здесь.
Интересно, что, как показано на Фигурах 7A-C и 8A-B, в то время как прайминг наивных CD8 T-клеток аллогенной DC в присутствии или при отсутствии IL-21 оказывал только малое влияние на клеточную композицию (данные не показаны), прайминг при отсутствии IL-21 препятствовал получению Tcm фенотипа (CD45RO+CD62L+) (только 69±18% уровня Tcm в контрольной группе), а также приводил к сниженной пролиферации (76±23% уровня экспансии в контрольной группе) (Фигуры 8A-B). Даже в рамках одного их четырех экспериментов, в котором экспансия не была снижена (140% от уровня контрольной группы) Tcm фенотип составлял лишь 35% уровня Tcm в контрольной группе, что свидетельствует о том, что прайминг в присутствии IL-21 важен как для экспансии, так и для индуцирования Tcm фенотипа в популяции наивных CD8 T-клеток.
Интересным является то, что продолжительное присутствие IL-21 на стадии прайминга (IL-21 самостоятельно) и стадии экспансии (в комбинации с IL-7 и IL-15) значительно увеличивало индуцирование клеток фенотипа центральной памяти (108±1,9% уровня Tcm в контрольной группе) (Фигуры 7A-C и 8A-B). Влияние продолжительного присутствия IL-21 на экспансию клеток было менее устойчивым, несмотря на явное увеличение среднего уровня (135±47% значений, установленных в контрольной группе), что в двух из трех экспериментов приводило к небольшому уменьшению экспансии (95% и 81% контрольных значений, соответственно), в то время как в третьем эксперименте приводило к значительному увеличению экспансии (228%), что свидетельствует о том, что добавление IL-21 на стадиях прайминга и экспансии может являться желательным (Фигуры 8A-B).
Композиции стимуляторыых клеток против третьей стороны
Описанные выше результаты показывают, что последовательное добавление IL-21, IL-7 и IL-15 должно сопровождаться аллогенным стимулированием зрелыми полученными из моноцитов DC для успешного индуцирования Tcm фенотипа и для устойчивой экспансии клеток.
Для упрощения процедуры был проведен эксперимент для определения того, должно ли основное аллогенное стимулирование осуществляться с помощью облученных PBMC вместо зрелых полученных из моноцитов DC, требующих 4 дня для приготовления.
Как видно в Таблице 2 ниже, через 7 дней культивирования эффективность индуцирования Tcm фенотипа PBMC, в отличие от стимуляторов на основе зрелых полученных из моноцитов DC (md-mDC), была очень схожей при очистке наивных CD8 T-клеток (92% против 92%, соответственно) и при применении неотделенных CD8 T-клеток в качестве респондеров (77% против 80%). Тем не менее, PBMC стимуляторы не были способны обеспечить тот же уровень Tcm экспансии, что и DC с применением наивных CD8 T-клеток (6,75 против 20,5, соответственно) или неотделенных CD8 T-клеток (1,8 против 16) в качестве респондеров.

MLR культура, в которой наивные CD8 T-клетки или неотделенные CD8 Т-респондеры были подвергнуты стимулированию против зрелых полученных из моноцитов DC (8:1 соотношение респондер/DC) или PBMC (1:1 соотношение респондер/PBMC) от одного аллогенного донора в среде, содержащей IL-21 в течение 3 дней. После этого клетки культивировали с IL-7 и IL-15 до 7 дня без дальнейшего активирования. На 7 день культивирования различные группы были исследованы на предмет процентной доли Tcm с применением FACS анализа и количества клеток с применением эксклюзии с применением трипанового синего.
Таким образом, в отличие протокола у мышей, в котором облученные спленоциты были достаточны для индуцирования экспансии, в протоколе у человека аллогенные зрелые полученные из моноцитов DC являются критически важными для хорошей экспансии Tcm клеток и не могут быть заменены аллогенными PBMC.
Определение оптимального соотношения респондер/DC для индуцирования Tcm фенотипа и экспансии клеток.
Для определения оптимального соотношения респондер/DC применяли MLR систему, как описано выше, за исключением того, что тестировали различные соотношения респондер/DC. Как видно на Фигурах 9A-B, при применении 4×105 респондеров оптимальный уровень Tcm фенотипа был достигнут при добавлении 50-100×103 DC, при этом экспансия была оптимальной при наиболее низкой концентрации DC. Были проведены дальнейшие эксперименты при более низких соотношениях респондер/DC.
Определение итогового аутогенного протокола исключительно на основе GPM реагентов
При определении удовлетворительного аутогенного протокола для получения Tcm против третьей стороны был проведен эксперимент для разработки эквивалентной процедуры исключительно на основе коммерчески доступных в настоящее время GMP реагентов для проведения тестирования данного подхода на людях.
Деплеция прилипающих клеток на пластиковых тарелках
Перед оптимизацией процесса отбора CD8 T-клеток был проведен эксперимент для достижения значительного первоначального уровня обогащения путем удаления прилипших к пластику клеток, присутствующих в PBMC.Данный процесс не только увеличивает концентрацию желаемых CD8+ T-клеток, но также является полезным при обработке криоконсервированных PBMC человека в отличие от свежих спленоцитов, применяемых в модели на мышах. Данный эксперимент показал, что культивирование в течение ночи с 10% сывороткой человека и IL-7 позволяло оттаявшим клеткам выделяться перед подверганием процессу магнитного обогащения.
Насыщение наивных CD8 T-клеток
Далее внимание было сконцентрировано на адаптации процесса обогащения наивных CD8 T-клеток для применения с используемыми в клинической практике реагентами с использованием наименьшего возможного количества антител.
Как показано на Фигуре 10, иллюстрирующей типичный эксперимент, желаемая популяция CD8 T-клеток составляет 21% клеток на - день после деплеции прилипших клеток, в то время как другие крупные "загрязняющие" субпопуляции включают CD4 T-клетки (61%), B-клетки (7%) и NK-клетки (7%). Таким образом, CD4 клетки составляют наибольшее загрязнение, при этом ранее было показано, что они конкурируют с CD8 T-клетками; данные клетки таким образом следовало удалить. Аналогичным образом, было важно удалить NK-клетки, которые, как известно, увеличивают издержки в IL-15 культурах. С другой стороны, B-клетки обладают склонностью к гибели в данных культуральных условиях. Таким образом, потенциальная деплеция анти-CD4 и анти-CD56 магнитными шариками была первоначально исследована при наличии и отсутствии деплеции CD 19+B-клеток.
Кроме того, поскольку в PBMC пациентов с B-клеточными заболеваниями уровни CD8 T-клеток ниже по сравнению со здоровыми донорами, был проведен параллельный анализ для определения возможности пропуска обогащения наивных CD8 T-клеток путем позитивного отбора CD45RA+ клеток, поскольку это также снижает количество высвобождаемых CD8 T-клеток.
Таким образом в - 1 день донорские PBMC были сначала подвергнуты деплеции из прилипших клеток путем культивирования в течение ночи на планшетах для культивирования тканей greiner-bio-one CELLSTAR (Greiner Bio-One Ltd., Стоунхаус, Соединенное Королевство), специально предназначенных для удаления прилипших миелоидных клеток, при этом в 0 день неприлипшие клетки были разделены на четыре экспериментальные группы, каждая из которых подвергалась различному протоколу магнитного сортинга. В 0, 7, 10 и 14 дни культивирования клетки анализировали на предмет клеточной композиции и Tcm фенотипа с помощью FACS анализа, а также на предмет экспансии путем подсчета количества живых клеток с помощью эксклюзии на основе трипанового синего.
Как видно на Фигуре 10, минимальный магнитный сортинг клеток с применением только анти-СБ4 и анти-СВ56 шариков снизил процентную долю CD4 T-клеток и NK-клеток с 61% и 7% до 12% и 1%, соответственно, что привело к обогащению CD8 T-клеток с 23% до 60%. Тем не менее, данная процедура была связана с повышением уровней B-клеток с 7% до 24%. Добавление анти-CD19 в коктейль для деплеции позволило полностью деплецировать B-клетки, что привело к повышению насыщения CD8 T-клеток (90%). Добавление второй стадии позитивного насыщения наивных клеток анти-CD45RA увеличило процентную долю наивных клеток (CD45RO-CD45RA+ на CD3+CD8+) с 53% до магнитного сортинга до 91% в обеих группах. Тем не менее, Данная стадия не сильно повлиял на итоговый уровень CD8 T-клеток, увеличившийся с 60% до 66% при применении анти-CD4 и анти-CD56, или с 90% до 94%, когда стадия негативного отбора также включала анти-CD19.
После магнитного сортинга клеток все четыре группы подвергали праймингу аллогенными дендритными клетками в присутствии IL-21 в течение 3 дней, затем клетки культивировали в свободной от антигенов среде до 14 дня в присутствии IL-21, IL-7 и IL-15. В качестве контрольной группы для не подвергнутых культивированию клеток наивные CD8 T-клетки, обогащенные на стадии деплеции с применением анти-С04, анти-С056 и анти-CD 19, а также на стадии позитивного обогащения с применением анти-CD45RA, культивировали в свободной от антигенов среде в присутствии только IL-7 до 14 дня.
Интересным является то, что в то время как в 0 день группы, обработанные или не обработанные анти-CD 19 показывали заметно различные уровни CD8 T-клеток, данная разница была устранена уже на 7 день (Фигура 11), а также при тестировании на 14 день (Фигура 12), скорее всего в связи с селективной гибелью B-клеток в культуре. Аналогично, позитивный отбор CD45RA+ клеток после первоначальной очистки CD8+ T-клеток вносил лишь малый вклад в итоговый уровень обогащения CD8+ T-клеток Tcm фенотипом. Таким образом, все четыре группы показали аналогичные уровни желаемых клеток с небольшим преимуществом двух групп, которые также были насыщены наивными клетками с помощью анти-CD45RA.
Данный показанный выше первоначальный результат в типичном эксперименте был также проанализирован путем сравнения средних результатов, полученных в контрольной группе, подвергнутой действию оптимальных реагентов для выделения клеток ("CD4- CD56- CD 19-, CD45RA+"), с другими группами, в которых была осуществлена попытка исключить применение анти-CD 19 или анти-CD45RA.
Таким образом, средняя процентная доля CD8 T-клеток (Фигура 13A) и, что более важно, процентная доля Tcm (Фигура 13 В) во всех экспериментальных группах при подсчете в виде процентной доли уровня, достигнутого в оптимальной контрольной группе, были очень похожи.
С другой стороны, были обнаружены значительные различия в средней экспансии каждой клеточной фракции при тестировании на 10 день культивирования в диапазоне от 65,6±0,5% до 105,2±6,8% (Фигура 14A). Тем не менее, различия в способности к экспансии были нейтрализованы за счет сниженного выхода, связанного со второй стадией очистки (Фигура 14B).
Как видно на Фигуре 14C, на которой показан итоговый подсчитанный выход Tcm на 10 день, добавление второй стадии позитивного обогащения наивных клеток анти-CD45RA только снизило итоговый выход Tcm клеток с 141% до 123% при применении первоначальной деплеции анти-CD4 и анти-CD56 или с 157% до 100%, когда стадия негативного отбора также включала анти-CD19.
Данные результаты совместно свидетельствуют о том, что протокол на основе минимального применения реагентов для выделения CD8 T-клеток, конкретно негативного отбора анти-CD4 и анти-CD56, является удовлетворительным для клинического применения в аутогенных условиях.
ПРИМЕР 2
Получение Tcm человека против третьей стороны в крупном масштабе в пластиковых контейнерах с применением GMP реагентов
Для симулирования условий, предполагаемых при применении собственных PBMC пациентов, для получения аутогенных Tcm первоначально осуществляли две крупномасштабные процедуры лейкафереза от двух нормальных доноров, при этом большое количество мононуклеарных клеток было подвергнуто криоконсервации (были разделены на несколько групп). Каждую группы применяли для одного крупномасштабного эксперимента. В рамках первого эксперимента были обнаружены некоторые проблемы, включая сложность получения DC из замороженных контейнеров в соответствии с протоколом Wurzburg и поиск источников нового IL-15 уровня GMP, относительно которого биологическая активность не была ясной. Данные проблемы, которые привели к очень слабой экспансии CD8 T-клеток (примерно 3-кратной), были скорректированы в последующих экспериментах за счет применения описываемого протокола для DC (как описано выше) и за счет применения подходящей концентрации IL-15 (то есть 300 U/мл).
Как видно на Фигуре 15, при получении PBMC одного донора в рамках двух крупномасштабных экспериментов против различных DC против третьей стороны был достигнут одинаковый уровень экспансии CD8 T-клеток в диапазоне от 26,8 до 31,0-кратного на 11 день. С учетом того, что в данный день клетки демонстрировали линейный рост, является вероятным, что могла быть достигнута дальнейшая экспансии в более позднее время. Тем не менее, данный уровень экспансии является удовлетворительным, поскольку он делает возможным потенциальное введение до 3×107 на кг массы тела. Интересным является то, что в то время как в 0 день было установлено, что лейкаферезный препарат был в значительной степени загрязнен CD14+ моноцитами и CD20 B-клетками, данные клетки исчезли при культивировании клеток, при это итоговая клеточная композиция в 12 день включала 94% и 98% CD8+CD3+ T-клеток, соответственно (Фигуры 16A-B).
Важным является то, что количество Tcm фенотипа, полученное в двух культурах против различных DC, соответствовало диапазону экспериментов с малым масштабом несмотря на некоторую встречающуюся вариабельность (Фигуры 17A-B). Таким образом, в то время как в 5 день в обоих экспериментах был установлен высокий уровень Tcm фенотипа (77% и 71%, соответственно), данный уровень понижался более значительно в культуре против 2-го донора DC на 9 день (65% против 46%) и на 12 день (62% против 35%). Данная вариабельность, которая не наблюдалась в значительной степени в экспериментах с малым масштабом, может быть частично объяснена относительной сложностью удаления DC в 5 день, поскольку они прилипают к пластиковому контейнеру с меньшей вероятностью по сравнению с их адгезией к планшетам, применявшимся в экспериментах с малым масштабом. Таким образом, более длительное присутствие DC и стимулирование ими может вести к более заметному уровню перехода от Tcm к Teff фенотипу.
ПРИМЕР 3
GVL потенциал Tcm человека против третьей стороны против определенной клеточной линии
С учетом того, что в аутогенных условиях потенциальное применение Tcm против третьей стороны служит исключительно для киллинга остаточных опухолевых клеток (в аллогенных условиях это также служит для повышения приживления BM клеток), является важным разработать прямой анализ на цитотоксическую способность ex vivo, который может применяться для качественного контроля до инфузирования Tcm пациенту. С этой целью применяли TCR-независимый анализ на основе демонстрации Lask et al. [Lask A et al., J Immunol. (2011) 187(4):2006-14], заключающейся в том, что MHC мутировавшая линия, не распознаваемая TCR из-за данной мутации, все же может быть уничтожена CTL против третьей стороны благодаря их TCR-независимому механизму киллинга. Понятно, что в случае возможности применения по отношению к Tcm человека, данная киллерная модальность может служить для различения Tcm киллинга от киллинга, опосредуемого NK-клетками.
Для ответа на данный вопрос проводили реакцию смешанных лимфоцитов (MLR) с Tcm против третьей стороны в отношении B-клеточной лимфомы и плазматических клеток линий лейкозных клеток, при этом процентную долю апоптозных клеток измеряли спустя 22 часа. Как видно на Фигуре 17C, на которой показан типичный эксперимент, отмеченная GVL реактивность демонстрировалась Tcm.
В другом эксперименте CD8 T-клетки сначала обогащали путем интенсивной деплеции клеток, не являющихся CD8 T-клетками (то есть CD4+ T-клеток, γ/δ T-клеток, B-клеток, NK-клеток, дендритных клеток, моноцитов, гранулоцитов и эритроцитов) с помощью сортинга с применением магнитных шариков. Как видно на Фигуре 18, на которой показан типичный эксперимент, процентная доля загрязняющих NK- и NKT-клеток была очень низкой (ниже 0,1% для NK-клеток и ниже 1,9% для NKT-клеток) во всех четырех тестируемых группах.
Высокоочищенные CD8 T-клетки затем культивировали с двумя типами клеток: линией Н.Му C1R HLA-A2 K66A мутантных клеток (K66A) для демонстрации TCR-независимого киллинга и b) Н.Му C1R (Neo), лимфобластоидной линией B-клеток с отсутствием поверхностных HLA А и В антигенов, являющейся таким образом нечувствительной к киллингу Tcm за счет механизма, который требует взаимодействия между CD8 молекулой на Tcm и α3 доменом на MHC целевых лейкозных клеток.
Как показано на Фигурах 19A-D, Tcm против третьей стороны демонстрировался отмеченный киллинг K66A мутировавших целевых клеток по сравнению с Н.Му C1R (Neo) клетками с отсутствием MHC-I.
Таким образом, Tcm человека, аналогично CTL человека против третьей стороны, могут убивать B-клеточные опухолевые клетки за счет TCR-независимого механизма киллинга, в отличие от NK-опосредованного киллинга, требующего экспрессии МНС на целевых клетках.
Наиболее важным является то, что дальнейший анализ путем сравнения средних результатов, полученных в контрольной группе, подвергнутой воздействию оптимальных реагентов для выделения клеток ("CD4- CD56- CD19-, CD45RA+"), с другими группами, в которых применение анти-CD19 или анти CD45RA (Фигуры 19A-D) было снижено, показал, что процентная доля TCR-независимого киллинга линии Н.Му C1R HLA-A2 K66A мутантных клеток во всех экспериментальных группах (подсчитана в виде процентной доли уровня, достигнутого в оптимальной контрольной группе) была очень похожей (Фигура 20) (P>0,05 при сравнении всех трех тестовых групп с контрольной группой).
Данные результаты совместно свидетельствуют о том, что GVL реактивность, продемонстрированная клетками, выделенными с минимальным применением реагентов для выделения CD8 T-клеток, не уступает реактивности, связанной с более интенсивными протоколами выделения.
Киллинг аутогенных B-CLL опухолевых клеток Tcm in vivo осуществляли с применением Hu/SCID модели, ранее используемой для демонстрации указанного В-CLL киллинга CTL против третьей стороны.
ПРИМЕР 4
Получения аллогенных Tcm клеток человека против третьей стороны Инициирование нового подхода GMP уровня для минимизации риска GVHD при применении аллогенных Tcm человека против третьей стороны
Как было продемонстрировано на модели с мышами, Tcm против третьей стороны могут быть очень полезны для индуцирования толерантности при аллогенных ВМТ [Ophir Е. et al. Blood. (2010) 115(10):2095-104]. В данном случае наивные CD8+ T-клетки, полученные от аллогенного донора ВМ, служат в качестве респондеров, при этом донорские дендритные клетки против третьей стороны (DC) применяются в качестве стимуляторов для получения нереактивных Tcm хозяина. В целях исключения GVHD сторонний донор выбран таким образом, чтобы ни одна из его аллелей HLA класса I не совпадала с аллелями HLA класса I хозяина.
Несмотря на это, с учетом того, что пациенты-люди могут быть более склонными к GVHD, чем инбредные мыши, клинический перенос данного подхода должен осуществляться с осторожностью. Дополнительные алло-деплецирующие стадии, такие как фото-деплеция или отбор активированных клеток в конце периода алло-стимулирования против третьей стороны, могут потребоваться для дальнейшего снижения риска GVHD.
Модификации аутогенного протокола у человека (для аллогенного протокола)
Как показано на Фигурах 21-22, протокол для получения Tcm в аллогенных условиях отличается от протокола для аутогенных условий в двух основных стадиях:
a) Отбор CD45RA+ клеток с последующим выделением CD8 T-клеток. T-клетки памяти обладают более низким порогом активации, чем наивные T-клетки, которые могут вызывать неспецифическую опосредованную цитокинами экспансию фракции T-клеток памяти. Данные клетки могут включать клоны, которые являются кросс-реактивными относительно антигенов хозяина, таким образом увеличивая риск индуцирования GVHD. В целях минимизации данного эффекта, вызванного различием в процентной доли наивных T-клеток среди различных являющихся людьми доноров, а также снижения риска GVHD, наивные CD8 Т-(CD45RA+CD8+) клетки применяли в качестве источника для получения Tcm клеток.
b) Удаление потенциальных реактивных по отношению к донору T-клеток в конце культивирования путем деплеции CD137+ активированных CD8 T-клеток.
Увеличение периода депривации IL-7 и IL-15.
Как описано в отношении аутогенных культур (выше), авторы установили, что наивные CD8 T-клетки, подвергнутые воздействию IL-7 и IL-15 пролиферируют антиген-независимым образом. С другой стороны, наивные CD8 T-клетки, подвергнутые воздействию IL-21 при отсутствии аллогенного стимулирования не пролиферировали и даже не выживали в течение более 7 дней культивирования. Таким образом, перенос добавления IL-7 и IL-15 с 3 дня на 7 день может потенциально вести к селективной деплеции клонов против хозяина, не отвечающих за стимуляторы против третьей стороны.
В целях определения оптимального времени добавления vis-à-vis аллореактивной деплеции цитокинов наивные CD8 T-клетки стимулировали облученными аллогенными DC против третьей стороны при соотношении 4:1 в присутствии или при отсутствии IL-21 в течение 7 дней. После этого клетки не подвергали дальнейшей активации и культивировали с IL-7 и IL-15 (Фигура 23 В), IL-15 и IL-21 (Фигура 23C) или исключительно с IL-15 (Фигура 23D) до 13 дня; полученные популяции клеток сравнивали с наивными CD8 T-клетками, культивируемыми в соответствии с контрольной группой, культивируемой согласно описанию для аутогенных условий (культивирование на (0-3) день с IL-21 и DC; с добавлением IL7+IL15 на (3-13) день (Фигура 23A).
С помощью той же последовательности добавления цитокинов, что и в случае контрольной группы, но с отличающимся выбором времени, добавление IL-21 было продлено с 3 до 7 дней, при этом IL-7 и IL-15 добавляли на 7 день, а не на 3 день, что ухудшило экспансию клеток (Фигура 24A) (пролиферация только 54±7% от уровня контрольной группы). Тем не менее, уровень индуцирования фенотипа центральной памяти был схожим (Фигура 24 В (99±14,8% уровня контрольной группы).
Как показано, удаление IL-7 и увеличение добавления IL-21 в конце культивирования снизило экспансию клеток (Фигура 24A) (60±13% уровня пролиферации контрольной группы), а также снизило уровень получения фенотипа центральной памяти (82±6,8% уровня Tcm контрольной группы, Фигура 24B).
Прайминг наивных CD8 T-клеток с применением 7-дневной депривации цитокинов с последующим добавлением только IL-15 в 7 день значительно снизил потенциал экспансии клеток (только 5±1,3% уровня пролиферации контрольной группы), а также снизил уровень получения фенотипа центральной памяти (Фигура 24B) (68±26% уровня Tcm контрольной группы).
Был проанализирован наиболее критический параметр, а именно деплеция реактивных по отношению к хозяину клонов (на основе тестов с подходящими донорами, которые являлись полностью различными в плане HLA I класса клеток против третьей стороны, применявшихся для стимулирования). Также выполняются другие эксперименты для оптимизации периода депривации цитокинов.
Двухстадийный подход к деплеции аллореактивности с применением магнитного сортинга на основе CD137 маркера активации
Изящным способом деплеции клонов против хозяина на основе концепции действия против третьей стороны может являться двухстадийный способ магнитного сортинга, включающий следующие стадии отбора CD137:
a. Позитивный отбор специфичный по отношению к третьей стороне клонов при начале культивирования.
b. Деплеция специфичных клонов против хозяина к концу культивирования.
Недавно CD137 был описан как подходящий маркер для антиген-специфичной активации CD8+ T-клеток человека, поскольку CD137 не экспрессируется на CD8+ T-клетках в состоянии покоя, при этом его экспрессия надежно индуцируется спустя 24 часа стимулирования.
В целях оценки данного подхода наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Затем CD137+ клетки были подвергнуты повторному стимулированию облученными аллогенными сторонними DC в присутствии IL-21 до 3 дня. После этого клетки культивировали с IL-7 и IL-15 до 10 дня и активировали облученными PBMC хозяина в присутствии IL-7 и IL-15. Спустя 24 часа активирования CD137+ клетки подвергали деплеции с помощью магнитного сортинга. Подвергнутые деплеции CD137 клетки повторно высевали с IL-7 и IL-15 и культивировали до 14 дня. В выбранные дни количество клеток анализировали путем эксклюзии с применением трипанового синего, при этом также анализировали процентную долю Tcm (CD62L+CD45RO+) в популяции CD8 T-клеток с применением FACS анализа. Частотность аллореактивных клеток против хозяина и против третьей стороны оценивали с помощью CFSE анализа против облученных PBMC хозяина или против третьей стороны. Данные результаты сравнивали с результатами, полученными в контрольной группе, стимулируемой в присутствии IL-21 в течение 3 дней и далее культивируемой с IL-7 и IL-15 ("контрольная группа").
Таким образом, как видно на Фигуре 25, в то время как непосредственно после обогащения наивных CD8 T-клеток (0 день) только 0,7% всех CD8 T-клеток экспрессировали CD137+, при активировании против сторонних DC в присутствии IL-21 в течение 14 часов процентная доля CD8 T-клеток, экспрессирующих CD137+, относительно всех CD8 T-клеток увеличилась до 8,3% по сравнению с 2,5% при отсутствии DC стимулирования. Магнитный сортинг данной подгруппы активированных клеток приводил к значительному обогащению CD137+ клеток (85%, соответственно), при этом уровень CD62L+CD8 T-клеток относительно всех CD8 T-клеток значительно снизился с 84% до 14% (данные не показаны).
Как показано в Таблице 5 ниже, данный позитивный отбор был связан со сниженным уровнем выделения клеток. Таким образом, в 0 день выход из PBMC с подвергнутыми деплеции прилипшими клетками после обогащения наивных CD8 T-клеток составлял 7,6%, при этом в 1 день после позитивного отбора CD137+выход снижался до 0,25% (3,3%) от 7,6%). При оценке на 7 день культивирования тестовая группа CD8 T-клеток, подвергнутая позитивному отбору CD137+ клеток, была очень похожа на контрольную группу в плане процентной доли Tcm клеток (67% против 70%, соответственно), при этом данное сходство между группами в плане процентной доли Tcm также сохранялось на 10 день культивирования (54% против 52%, соответственно) (Фигура 26).
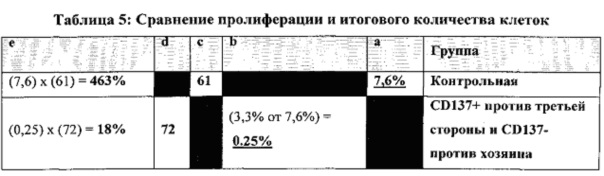
Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в присутствии IL-21 в течение 3 дней. Клетки не подвергали дальнейшей активации после этого и культивировали с IL-7 и IL-15 до 14 дня ("контрольная группа"). Альтернативно, наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC при соотношении 5,7:1 в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Затем CD137+ клетки были подвергнуты повторному стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии IL-21 до 3 дня. После этого клетки культивировали с IL-7 и IL-15 до 10 дня. На 10 день клетки активировали облученными PBMC хозяина в присутствии IL-7 и IL-15 (при соотношении 1 к 2). Спустя 24 часа активирования CD137+ клетки подвергали деплеции с помощью магнитного сортинга. Подвергнутые деплеции CD137 клетки повторно высевали с IL-7 и IL-15 и культивировали до 14 дня ("CD137+ против третьей стороны и CD137- против хозяина"). В указанные дни клетки подсчитывали с помощью эксклюзии на основе трипанового синего.
a=Выход после обогащения наивных CD8 T-клеток (представлено как процентная доля начального количества PBMC-прилипших клеток).
b=Выход после активирования сторонними DC и обогащения CD137+CD8 T-клеток (представлено как процентная доля начального количества PBMC-прилипших клеток).
c=Кратность экспансии с 0 дня до 13 дня.
d=Кратность экспансии с 0 дня до 14 дня.
e=Итоговое количество клеток=(Выход)×(Кратность экспансии с 0 дня) (представлено как процентная доля начального количества PBMC-прилипших клеток).
Более того, когда клеточную композицию (% CD8 T-клеток, % NK-клеток и % NKT-клеток) анализировали на 7 день и 10 день культивирования, тестовая группа CD8 T-клеток, подвергнутая позитивному отбору CD137+ клеток, была очень похожа на контрольную группу в плане ее клеточной композиции (Таблица 6 ниже).
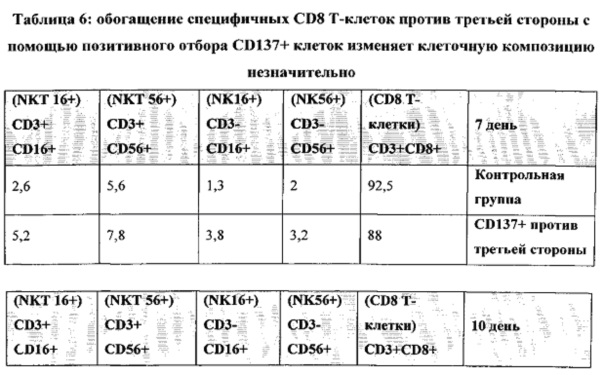
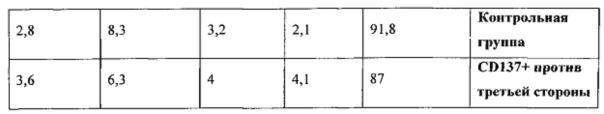
Наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC в соотношении 4:1 в присутствии IL-21 в течение 3 дней. После этого клетки не подвергали дальнейшей активации и культивировали с IL-7 и IL-15 до 10 дня ("контрольная группа"). Альтернативно, наивные CD8 T-клетки стимулировали облученными аллогенными сторонними DC при соотношении 5.7:1 в присутствии IL-21. Спустя 14 часов активирования CD137+ клетки были позитивно отобраны с помощью магнитного сортинга. Затем CD137+ клетки подвергали повторному стимулированию облученными аллогенными сторонними DC при соотношении 4:1 в присутствии 1L-21 до 3 дня. После этого клетки культивировали с IL-7 и IL-15 до 10 дня. Клетки анализировали на предмет клеточной композиции с помощью FACS анализа.
С другой стороны, как показано на Фигуре 27, тестовая группа CD8 T-клеток, подвергнутая позитивному отбору CD137+ клеток, обладала превосходящим потенциалом экспансии по сравнению с контрольной группой в обеих точках времени (35- против 7-кратной экспансии с 0 дня до 7 дня, соответственно, и 119- против 34-кратной экспансии с 0 дня до 10 дня, соответственно). На 10 день группа CD8 T-клеток, подвергнутая позитивному отбору CD137+ клеток, была разделена на две тестовые группы. В первой группе клетки продолжали культивировать с IL-7 и IL-15 до 14 дня ("CD137+ против третьей стороны"), в то время как клетки во второй тестовой группе были активированы облученными PBMC хозяина в присутствии IL-7 и IL-15. Спустя 24 часа активирования CD137+ клетки подвергали деплеции с помощью магнитного сортинга. CD137-деплецированные клетки затем повторно высевали с IL-7 и IL-15 и культивировали до 14 дня ("CD137+ против третьей стороны и CD137- против хозяина").
При анализе на 13 день CD8 T-клетки из тестовой группы, подвергнутой позитивному отбору CD137+, продолжали показывать превосходящий потенциал экспансии по сравнению с контрольной группой в обеих точках времени (134- против 61-кратной экспансии, соответственно). С другой стороны, CD8 T-клетки из тестовой группы, подвергнутой позитивному отбору CD137+ против третьей стороны и деплеции CD137+ клеток против хозяина, показывали меньший потенциал экспансии при анализе на 14 день (72-кратная экспансия) (Фигура 27), что свидетельствует о том, что экспансия клеток между днями 11 и 14 не может компенсировать потерю клеток, вызванную деплецией аллореактивных CD137+ специфичных против хозяина клеток.
Как показано на Фигуре 28, когда CD137 экспрессию оценивали на 10 день, только 0,5% всех CD8 T-клеток среди CD8 T-клеток, подвергнутых позитивному отбору CD137+ клеток, экспрессировали CD137+. Таким образом, CD8 T-клетки в данной группе значительно снизили экспрессию CD137 (с 85% в 1 день до лишь 0,5% в 10 день).
Тем не менее, спустя 24 часа активирования облученными PBMC хозяина (при соотношении 1 к 2 в пользу PBMC хозяина) процентная доля CD8 T-клеток, экспрессирующих CD137+ относительно всех CD8 T-клеток, увеличилась до 16%. Деплеция данных CD137+ клеток с помощью магнитного сортинга снизила процентную долю CD8 T-клеток, экспрессирующих CD137, относительно всех CD8 T-клекок с 16% до 3%.
Итоговый анализ остаточной аллореактивности против хозяина был осуществлен на 14 день путем сравнения уровня CFSE-сохраняющих клеток при стимулировании против PBMC хозяина по сравнению со сторонними PBMC в присутствии IL-7.
Как показано на Фигуре 29, количество клеток, специфически делящихся после стимулирования сторонними PBMC, было приблизительно в 3 раза больше в группе, подвергнутой позитивному и негативному отбору на основе CD137, по сравнению с контрольной группой (2259 против 741 делящихся клеток, соответственно). Наиболее важным является то, что удаление CD137+ клеток к концу культивирования полностью исключило пролиферацию в ответ на PBMC хозяина, в отличие от контрольной группы, которая демонстрировала заметную пролиферацию (134 делящихся клетки). Интересным является то, что группа, подвергнутая позитивному отбору клеток, активированных против третьей стороны, без удаления клонов против хозяина к концу культивирования демонстрировала более высокий уровень реактивных по отношению к хозяину клеток по сравнению с контрольной группой, что свидетельствует о потенциальной кросс-реактивности между MHC аллотипами стимуляторов хозяина и сторонних стимуляторов (несмотря на умышленное несовпадение по типу HLA). Таким образом, в то время как важность стадии деплеции против хозяина к концу культивирования является очевидной, необходимы дальнейшие исследования для оценки потенциальной роли первого позитивного отбора активированных против третьей стороны клеток.
Тем не менее, как показано в Таблице 5 выше, успешная деплеция специфичных против хозяина клонов с помощью двухстадийного магнитного сортинга вносит вклад в намного более низкий уровень выделения клеток в конце культивирования (18% против 463%, представлено в виде процентной доли от исходного количества PBMC-прилипших клеток, соответственно).
В целом данный предварительный эксперимент свидетельствует о том, что деплеция аллореактивности с помощью двухстадийного магнитного сортинга на основе маркера активации CD137 является возможной и может быть встроена в настоящий протокол для получения не реактивных по отношению к хозяину аллогенных Tcm клеток. Обнадеживающими факторами являются: 1) высокие уровни экспрессии, индуцируемые за счет аллогенной активации при позитивном отборе, были полностью снижены на 10 день, что сделало возможной другую аллоактивацию против антигенов хозяина. 2) Клеточная композиция и процентная доля Tcm клеток не были значительно затронуты магнитным сортингом, что подтверждается маркером активации CD137. 3) Удаление CD137+ клеток к концу культивирования полностью исключило пролиферацию в ответ на PBMC хозяина, в отличие от контрольной группы, которая демонстрировала заметную пролиферацию (134 делящихся клетки). Настоящее исследование включает: 1) применение блокирования FcR перед стадией позитивного отбора. 2) Применение DC хозяина вместо PBMC для более эффективного обнаружения реактивных по отношению к хозяину клеток в конце культивирования. 3) Добавление являющихся клинически более доступными маркеров активации, подобных CD25 или захвату IFN-гамма, на стадии деплеции.
Выводы:
Применение деплеции CD137 в конце процесса получения Tcm может являться допустимым подходом для дальнейшей деплеции аллореактивности данных клеток.
Проанализированы попытки продолжить улучшение применения деплеции CD137 наряду с деплецией CD25, доступных в виде GPM реагентов.
Кроме того, осуществлены эксперименты по минимизации потенциальной кросс-реактивности за счет применения искусственных АРС, несущих только одну HLA-I аллель.
Несмотря на то, что изобретение было описано в отношении его определенных вариантов, очевидно, что существует много альтернатив, модификаций и вариантов, которые будут очевидны опытным в данной области специалистам. Соответственно, предусмотрено включение всех данных альтернатив, модификаций и вариантов, которые находятся в пределах сущности и широкого объема прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены полностью в виде ссылки в том же объеме, как если бы они были отдельной публикацией, патентом или патентной заявкой. К тому же, размещение или идентификация любой ссылки в данной заявке не должно рассматриваться как признание того, что такая ссылка существует в качестве прототипа настоящего изобретения. В том смысле, в котором используются заголовки разделов, они не должны рассматриваться в качестве обязательного ограничения.
Реферат
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения изолированной популяции клеток, включающей не индуцирующие трансплантат против хозяина (GVHD) клетки против третьей стороны, имеющие фенотип Т-лимфоцита центральной памяти (Tcm). Способ включает: (a) обработку неприлипающих мононуклеарных клеток периферической крови (РВМС) агентом, способным подвергать деплеции CD4+ и/или CD56+ клетки для получения CD8+ Т-клеток; (b) контактирование указанных CD8+ Т-клеток со сторонним антигеном или антигенами в присутствии IL-21 в течение от 12 часов до 5 дней для обеспечения обогащения антиген-реактивных клеток; и (c) культивирование указанных клеток, полученных на стадии (b), в присутствии IL-21, IL-15 и IL-7 в свободной от антигенов среде в течение 5-20 дней для обеспечения пролиферации клеток, имеющих указанный фенотип Т-лимфоцита центральной памяти (Tcm) с получением таким образом изолированной популяции клеток. Группа изобретений относится также к вариантам способа получения вышеуказанных клеток и к способам лечения субъекта, нуждающегося в клеточной или тканевой трансплантации, а также в трансплантации незрелых гемопоэтических клеток. Использование данной группы изобретений позволяет применять популяцию клеток, имеющих фенотип Т-лимфоцита центральной памяти (Tcm) и способных к хоумингу в лимфоузлы после трансплантации для индукции толерантности. Указанные клетки против третьей стороны имеют фенотип Т-лимфоцита центральной памяти, включающий CD3, CD8, CD62L, CD45RA, CD45ROсигнатуру, и где по меньшей мере 50% изолированной популяции клеток представляют собой CD3+CD8+ клетки. 7 н. и 15 з.п. ф-лы, 4 пр., 6 табл., 29 ил.

Комментарии