Аутологичные клетки моноцитарного происхождения, индуцирующие аутотолерантность, и их применение в фармацевтических препаратах - RU2346041C2
Код документа: RU2346041C2
Чертежи









Описание
Изобретение относится к аутологичным клеткам моноцитарного происхождения, способным индуцировать иммунную аутотолерантность у пациента. Указанные клетки далее обозначены как "STIC" (клетки, индуцирующие аутотолерантность). Изобретение относится также к применению STIC в фармацевтических препаратах для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, таких как аутоиммунные и аллергические заболевания.
Применительно к настоящему изобретению термин "аутологичные клетки" означает, что STIC получены из моноцитов крови соответствующего пациента, которому должны быть введены указанные STIC.
Авторы настоящего изобретения установили, что клетки по изобретению способны индуцировать регуляторные Т-клетки (TregCD4+25+). Поэтому настоящее изобретение относится также к индукции и/или получению in vitro регуляторных Т-клеток.
Иммунная система защищает организм от потенциально патогенных антигенов, таких как, например, микроорганизмы, и при этом обычно не взаимодействует с элементами самого организма, то есть здоровая иммунная система толерантна к "аутоантигенам".
Нарушение аутотолерантности происходит тогда, когда специфические адаптивные (приобретенные) иммунные реакции направлены против аутоантигенов.
Нормальным следствием адаптивной иммунной реакции против чужеродного антигена является удаление данного антигена их организма. Однако при возникновении адаптивной иммунной реакции против аутоантигенов механизмы иммунных эффекторов не могут полностью элиминировать данный антиген, в результате чего возникает постоянная реакция. Вследствие этого эффекторные пути иммунитета вызывают хроническое воспалительное поражение тканей, которое может оказаться летальным (см. публикацию Immuno Biology 5, The Immune System In Health and Disease, Garland Publishing 2001, Chapter 13, pages 501-522).
Адаптивные иммунные реакции возникают в результате активации антигенспецифических Т- и/или В-клеток, при этом считается, что аутоиммунитет инициируется аналогичным образом (Immuno Biology, loc. cit. p. 501).
Один из предпочтительных вариантов осуществления изобретения относится к лечению и/или профилактике аутоиммунных заболеваний с использованием фармацевтических препаратов, содержащих STIC.
Можно выделить две основные группы аутоиммунных заболеваний. Заболевания, в которых аутоиммунитет ограничен определенными органами организма, известны как "органспецифические" аутоиммунные заболевания, в то время как в случае "системных" аутоиммунных заболеваний поражаются многие ткани организма. Примеры органспецифических аутоиммунных заболеваний включают хронический лимфоматозный тиреоидит и болезнь Грейвса, которые поражают главным образом щитовидную железу, и инсулинзависимый сахарный диабет типа I, который поражает панкреатические островки. Примеры системных аутоиммунных заболеваний включают системную красную волчанку и первичный ксеродерматоз, которые могут поражать разные ткани, такие как кожа, почки и головной мозг (см. публикацию Immuno Biology, loc.cit, page 503).
Существуют аутоиммунные заболевания, которые, как считается, опосредованы главным образом Т-клетками, в частности, инсулинзависимый сахарный диабет, ревматоидный артрит и рассеянный склероз, при этом в других заболеваниях главную роль играет образование антител к антигенам поверхности клеток или матриксу, как, например, в случае аутоиммунной гемолитической анемии, аутоиммунной тромботической пурпуры, синдрома Гудпастура, обыкновенной пузырьчатки или острой ревматической атаки; еще одну группу заболеваний составляют смешанные иммунные заболевания, опосредованные как Т-клетками, так и В-клетками, какими, например, являются смешанная цироглобулиномия, системная красная волчанка или ревматоидный артрит (см. публикацию Immuno Biology, loc. cit, Fig. 13.1 on page 502).
Другой вариант осуществления изобретения относится к лечению аллергический заболеваний при помощи клеток STIC по настоящему изобретению, которые входят в состав фармацевтических препаратов.
Недавно было сделано предположение, что регуляторные Т-клетки играют важную роль в регулировании иммунного гомеостаза, то есть общей иммунной реакции, возникающей на любую инфекционную или антигенную мишень, включая иммунную аутотолерантность; см. публикации Takeshi Takahashi and Shimon Sakaguchi, International Review of Cytology, 225, 1-32 (2003); Shimon Sakaguchi, Vox Sang 83, 151-153 (2002), Kathryn J. Wood and Shimon Sakaguchi, Nature Reviews Immunology, 3, 199-210 (2003).
Как указано в публикации Takahashi et al., loc. cit. page 1, Abstract, "накопленные данные показывают, что опосредуемый Т-клетками доминирующий контроль за аутореактивными Т-клетками способствует сохранению иммунной аутотолерантности, и ее нарушение может вести к возникновению аутоиммунного заболевания. Усилия, направленные на трансдифференцировку популяций таких регуляторных Т-клеток, показали, что регуляторной активностью обладают CD 25+ клетки в популяции CD4+ клеток здоровых незараженных животных, включая человека. CD25+ и CD4+ регуляторные Т-клетки продуцируются здоровым тимусом в виде функционально отличной субпопуляции Т-клеток. Указанные клетки играют важную роль не только в предотвращении аутоиммунитета, но также в регулировании разных иммунных реакций".
Помимо аутоиммунных заболеваний, опосредованных Т-клетками, В-клетки иммунной системы могут активировать аутоагрессивные заболевания, обусловленные продуцированием антител против аутоантигенных клеток (включая мастоциты), тканей и органов.
Хорошо известно, что активация В-клеток зависит от Т-клеток и выражается в том, что Т-клетки-хелперы стимулируют клональную экспансию В-клеток в результате представления специфических антигенов. Указанные антигены могут быть выделены из фрагментированных аллергенов и затем процессированы в Т-клетках с образованием низкомолекулярных пептидов. После чего происходит представление таких антигенов при помощи главного комплекса гистосовместимости (МНС) для стимуляции антигенспецифической активации.
Для предотвращения неконтролируемой или избыточной активации В-клеток, вызываемой специфическими аллергенами, которая, с одной стороны, ведет к возникновению аллергических заболеваний, и, с другой стороны, может индуцировать нарушение аутотолерантности (см. выше), регуляторные Т-клетки обладают способностью препятствовать обусловленной Т-клетками активации В-клеток и предотвращать избыточное и неконтролируемое продуцирование антител.
Поэтому подобно аутоиммунным заболеваниям аллергические заболевания можно контролировать, увеличивая количество регуляторных Т-клеток (CD4+/CD25+ Т-клетки). В частности, было установлено, что у мышей, страдающих ЕАЕ ("экспериментальный аллергический энцефаломиелит"), болезнь ослабевает через две недели после введения указанным животным CD4+ Т-клеток, при этом выздоровление ассоциировано с устойчивостью к любой последующей индукции заболевания (Bach, J.F. "Regulatory T Cells under Scrutiny" Nature Reviews Immunology 3: 189-198 (2003); Land, Z et al. "Effect of cyclophosphamide on suppressor-cell activity in mice unresponsive to EAE" J. Immunol. 123: 21556-2160 (1979)). Указанные воздействия аналогичны воздействиям, продемонстрированным для мышей NOD, у которых развитие аутоиммунного диабета можно остановить благодаря введению CD4+ клеток, которые защищают указанных мышей от новых вспышек аутоиммунного заболевания (Bach, J.F., loc. cit.).
Примеры аллергических заболеваний, которые могут быть ассоциированы с аутоиммунными реакциями, включают все типы аллергий, индуцированных чужеродными белками, органическими и неорганическими веществами, попадающими в организм. Особое значения в данной связи имеют аллергии, вызываемые пыльцой, такие как, например, сенная лихорадка, и аллергии, вызываемые такими аллергенами как лекарственные средства, химические вещества, вирусы, бактерии, грибы, бытовая пыль, пищевые компоненты, металлы, газ, элементы тела животных, такие как шелушение кожи или шерсть, и испражнения животных.
В настоящее время отсутствуют эффективные терапевтические методы для профилактики и/или лечения заболеваний, возникающих вследствие нарушения аутотолерантности.
Для лечения органспецифических аутоиммунных заболеваний применяют заместительную терапию, трансплантацию или симптоматическую терапию противовоспалительными средствами, такими как кортизон. Для лечения системных аутоиммунных заболеваний часто используют иммуносупрессивные средства. Очевидно, что такие "методы лечения" являются проблематичными во многих отношениях и характеризуются серьезными побочными эффектами.
Известно, что до 5% населения страдают аутоиммунными заболеваниями (Sakagushi, loc. cit., page 151, left column). Поэтому существует насущная потребность в эффективных средствах профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, которые просты в применении, не вызывают опасные для здоровья побочные эффекты и позволяют снизить затраты, связанные с использованием известных в настоящее время методов и средств для лечения таких заболеваний.
Настоящее изобретение решает проблему получения усовершенствованных средств для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности.
Для решения данной проблемы авторы настоящего изобретения предлагают использовать аутологичные клетки моноцитарного происхождения, индуцирующие аутотолерантность (STIC), полученные у позвоночных, в частности, у млекопитающих и более предпочтительно у человека. Указанные клетки получают способом, описанным в настоящем изобретении, в результате осуществления которого создают модифицированные клетки, способные увеличивать количество регуляторных Т-лимфоцитов (CD4+/CD25+ Т-клеток) в организме пациента. При введении в количестве около 105 клеток/кг массы тела указанные клетки могут служить для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности.
Краткое описание чертежей
Фиг.1. Определение методом проточной цитометрии способности GM-7 связываться с исходными моноцитами до (график с левой стороны) и после (график с правой стороны) модификации клеток по настоящему изобретению. На оси Х указано число связанных клеток.
Фиг.2. Смешанная культура лимфоцитов, содержащая CD14+ моноциты, полученные у пациента В (GM-7-: столбец серого цвета; GM-7+: столбец черного цвета), клетки-респондеры, полученные у МНС-дискордантного донора А, и облученные клетки, полученные у донора В, и используемая для сравнения супрессорной активности CD14+/GM-7+ и CD14+/GM-7- клеток.
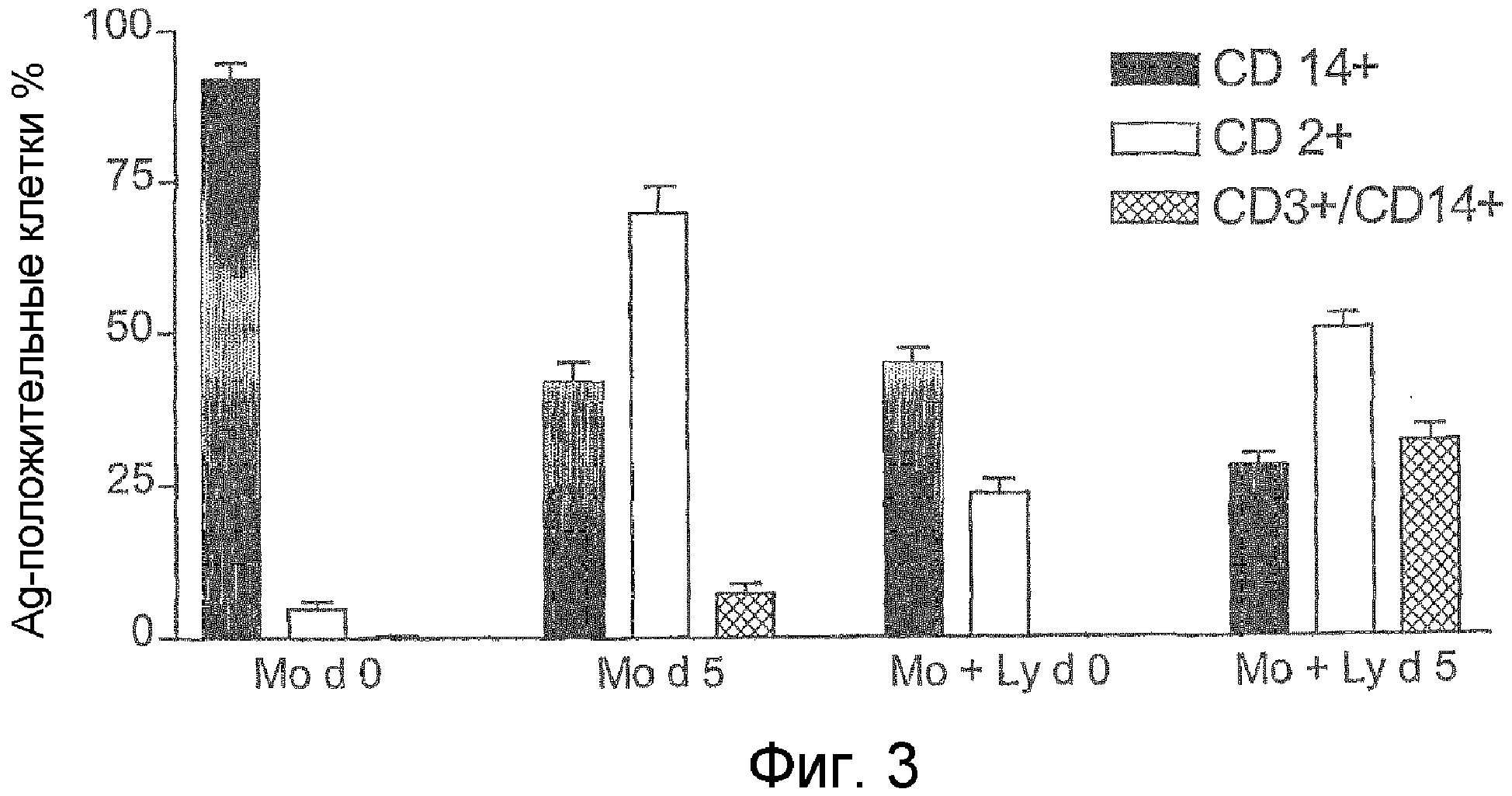
Фиг.3. Определение методом проточной цитометрии числа CD14+ моноцитов и CD2+ лимфоцитов во фракции моноцитов, а также числа CD-14+/CD3+ клеток, эффективно действующих в качестве TAIC, для выявления влияния процесса очистки клеток, используемых для увеличения числа моноцитов, в начале культивирования на образование иммуносупрессорных CD14+/CD3+ клеток.
Фиг.4. Смешанная культура лимфоцитов, содержащая РНА-стимулированные лимфоциты (PhaLy) и TAIC ("Mo+Ly" или "Mo"), предварительно инкубированная в двух экспериментах с ингибитором (1-МТ) индоламин-2,3-диоксигеназы (IDO) для определения влияния 1-МТ на супрессорную активность TAIC.
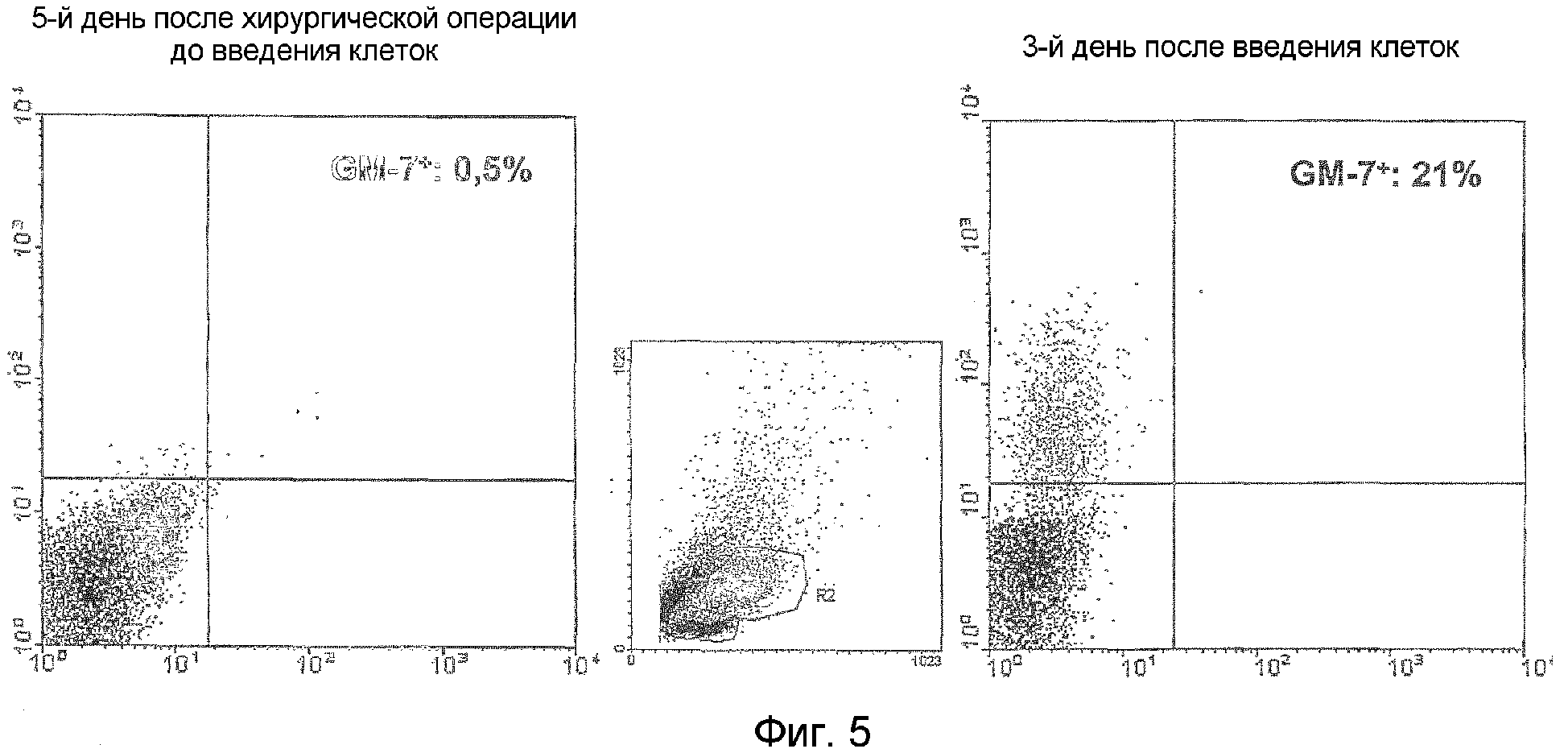
Фиг.5. Определение методом проточной цитометрии экспрессии GM-7 в крови оперированных пациентов до (левая фигура) и после (правая фигура) инъекции TAIC для выявления влияния TAIC на экспрессию GM-7 in vivo в клетках крови.
Фиг.6. Окрашивание Н&Е срезов ободочной кишки мышей, страдающих хроническим колитом, вызванным декстрансульфатом натрия (DSS), иллюстрирующее состояние ободочной кишки у животного в группе 3, не получавшего никакого лечения (фиг. 6А/В), у животного в группе 1, которому вводили STIC в день +1 после прекращения воздействия DSS (фиг. 6С/D), у животного в группе 4, которому вводили "контрольные клетки" в день +1 (фиг. 6Е), и у животного, которому вводили STIC в день +7 (фиг. 6F). (2,5-кратное увеличение на фиг. 6А/C/E; 10-кратное увеличение на фиг. 6В/D/F).
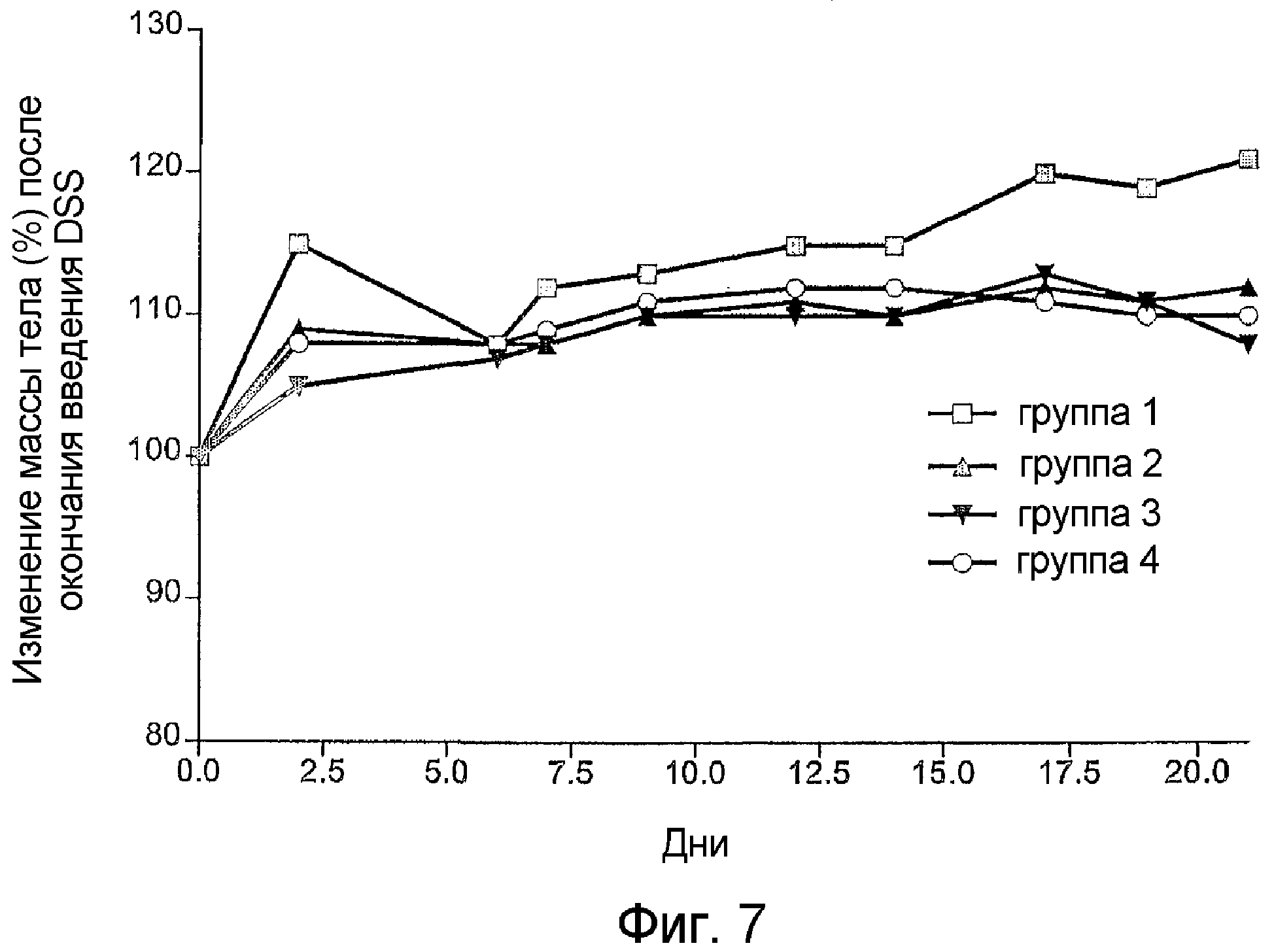
Фиг.7. Изменения массы тела мышей, страдающих хроническим колитом, вызванным декстрансульфатом натрия (DSS), на протяжении 3 недель после прекращения воздействия DSS. Животным в группе 1

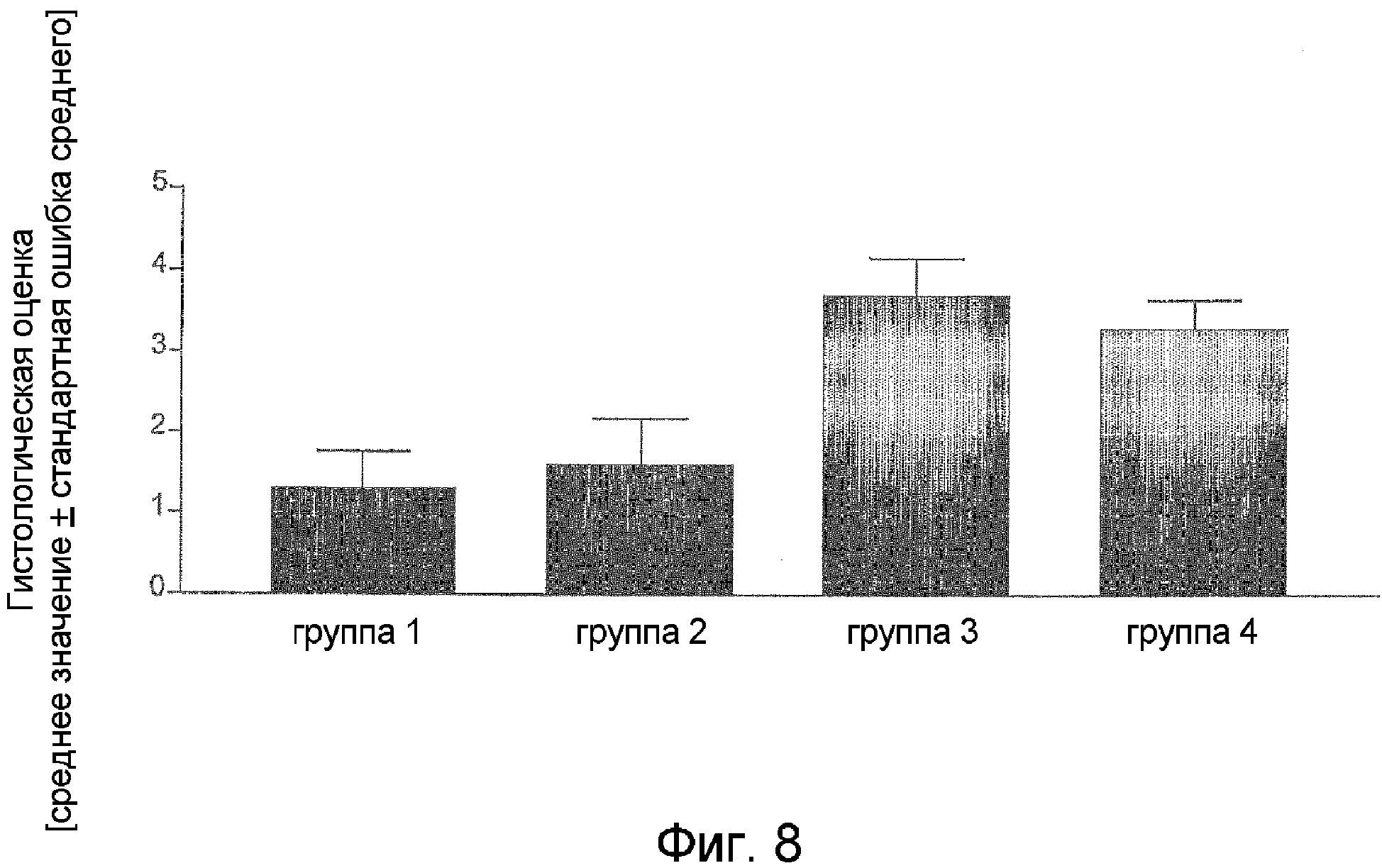
Фиг.8. Результаты балльной оценки гистохимически окрашенных срезов ободочной кишки у мышей, страдающих хроническим колитом, вызванным декстрансульфатом натрия (DSS). Животным в группе 1 вводили STIC в день +1, животным в группе 2 вводили STIC в день +7, животные в группе 3 не получали никакого лечения, в то время как животным в группе 4 вводили "контрольные клетки" в день +1. (оценка 0 = отсутствие колита; оценка 1 = минимальный колит; оценка 2 = колит средней тяжести; оценка 3 = тяжелый колит; и оценка 4 = язвенный колит, сопровождающийся разрушением всей слизистой оболочки).
Фиг.9. Изменения массы тела мышей в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с тяжелым комбинированным иммунодефицитом (SCID), по сравнению с массой тела мышей через 6 недель после начала эксперимента, когда их подвергали воздействию клеточной терапии. Животным в группе 1


Фиг.10. Измерение длины ободочной кишки (фиг. 10А) и массы селезенки (фиг. 10В) у мышей, которым вводили STIC (группа 1), у контрольных мышей, не получавших никакого лечения (группа 2), и у мышей, которым вводили "контрольные клетки" (группа 3), в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID. Приведенные величины являются средними значениями ± стандартная ошибка среднего.
Фиг.11. Балльная оценка гистохимически окрашенных срезов ободочной кишки у мышей в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID, через шесть недель после переноса клеток. Животным в группе 1 вводили STIC, животные в группе 2 не получали никакого лечения и им не инъецировали клетки, в то время как животным в группе 3 вводили "контрольные клетки". Приведенные величины являются средними значениями ± стандартная ошибка среднего. (оценка 0 = отсутствие колита; оценка 1 = минимальный колит; оценка 2 = колит средней тяжести; оценка 3 = тяжелый колит; и оценка 4 = язвенный колит, сопровождающийся разрушением всей слизистой оболочки).
Фиг.12. Окрашивание Н&Е срезов ободочной кишки у мышей в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID, иллюстрирующее состояние ободочной кишки у двух животных в группе 2, не получавших никакого лечения (фиг. 12А/В), у двух животных в группе 3, которым вводили "контрольные клетки" (фиг. 12С/D), и у двух животных в группе 1, которым вводили STIC (фиг. 12Е/F) (100-кратное увеличение).
Сущность изобретения
Основные стадии способа получения аутологичных клеток моноцитарного происхождения, индуцирующих аутотолерантность (STIC), включают:
(а) выделение моноцитов из крови соответствующего пациента, которому должны быть введены указанные клетки;
(b) размножение моноцитов в приемлемой культуральной среде, содержащей фактор колониеобразования макрофагов (далее именуемый М-CSF) в качестве стимулятора роста;
(с) стимуляцию моноцитов γ-интерфероном (далее именуемым γ-IFN); и
(d) получение клеток, индуцирующих аутотолерантность, образовавшихся на стадии с), путем отделения клеток от культуральной среды.
Аналогичный способ описан в заявке на патент Германии DE 10231655.4 и в заявке на международный патент РСТ/EP03/07551. В вышеуказанных более ранних заявках на патент полученные таким образом клетки именуются "клетками, индуцирующими приживаемость трансплантата" (TAIC). Указанные клетки используют для индукции приживаемости аллогенной донорской ткани у реципиента. Важно отметить, что клетки TAIC, описанные в заявке DE 10231655.4 и в заявке РСТ/EP03/07551, выделяют из моноцитов донора и вводят реципиенту для индукции приживаемости трансплантата. Из вышеизложенного следует, что клетки TAIC являются аллогенными для пациента, подлежащего лечению TAIC.
В отличие от этого в основе настоящего изобретения лежит концепция "аутологичного лечения"; то есть пациенту, страдающему нарушением аутотолерантности, в частности аутоиммунными заболеваниями и/или аллергиями, вводят клетки, индуцирующие аутотолерантность (STIC), которые выделяют из аутологичных моноцитов.
Поэтому, хотя TAIC и STIC выделяют из моноцитов по существу одинаковым способом, TAIC являются аллогенными клетками для подлежащего лечению пациента, в то время как STIC являются аутологичными клетками.
Установлено, что при осуществлении способа продуцирования STIC стимуляция γ-IFN является решающей стадией (см. пример 2).
В контексте настоящего изобретения термин "клетки моноцитарного происхождения, индуцирующие аутотолерантность (STIC)" означает популяцию клеток, получаемую на стадии (d) вышеописанного способа. Указанная популяция клеток помимо клеток, выделенных из моноцитов и позволяющих эффективно индуцировать аутотолерантность, содержит также лимфоциты (см. пример 4) и необязательно другие клетки, выделенные из фракции мононуклеарных клеток, например гранулоциты. Число клеток, выделенных из моноцитов, в популяции STIC предпочтительно составляет 50-90%, более предпочтительно 60-70% от общего числа клеток.
В контексте настоящего изобретения термин "общее число клеток" означает число жизнеспособных клеток в рассматриваемой популяции клеток. Указанное число можно определить "методом исключения при помощи трипанового синего", так как данный краситель позволяет отличить жизнеспособные клетки от нежизнеспособных клеток оптическими средствами.
STIC обычно можно использовать для индукции аутотолерантности в количестве 104-106 клеток на килограмм массы тела, предпочтительно в количестве 105 клеток на килограмм массы тела. Можно производить повторное введение STIC.
Было установлено, что для STIC по настоящему изобретению не характерен риск образования злокачественного новообразования как при испытании на животных, так и в культуре; такой результат, который вряд ли можно ожидать в любом другом случае, достигнут благодаря происхождению исходных моноцитов, из которых выделены клетки по настоящему изобретению.
Как будет подробно описано ниже, из фракции клеток, присутствующих в STIC, выделенных из моноцитов, можно получить другие субпопуляции клеток, обладающих оптимизированными свойствами индукции аутотолерантности.
В результате культивирования in vitro и стимуляции исходных клеток (моноцитов) γ-интерфероном образуются клетки STIC, которые содержат субпопуляцию клеток (см. пример 3), связывающих моноклональное антитело GM-7, экспрессируемое линией клеток гибридомы DSM ACC2542. Моноклональное антитело GM-7 является антителом иммуноглобулина изотипа IgG2а, легкая цепь которого представляет собой каппа-изотип. Отличительным свойством данного антитела является сильная способность связываться с моноцитами, модифицированными в условиях культивирования по настоящему изобретению, так как вышеуказанное антитело не узнает исходные моноциты, то есть не связывается с исходными клетками (см. пример 3). Кроме того, с участием 20 добровольцев было установлено, что GM-7 не связывается с клетками человека в периферической крови (см. фиг.5).
Как описано в заявке РСТ/EP03/075551, данное антитело было получено в результате иммунизации мышей клетками TAIC (соответствующими STIC), выделенными из моноцитов человека методами, известными специалистам в данной области (Davis, W.C. "Methods in Molecular Biology: Monoclonal Antibody Protocols", New York: Humana Press Inc. Totowa, 1995). Линия клеток гибридомы была получена в результате слияния В-клетки, образующей данное антитело, с миеломной клеткой, полученной у мыши. Методы, используемые для получения таких линий клеток, известны в данной области (Davis, W.C. "Methods in Molecular Biology: Monoclonal Antibody Protocols", New York: Humana Press Inc. Totowa, 1995; Kohler, G., Milstein, C. "Continuous cultures of fused cells secreting antibody of predefined specificity", Nature 256, 495-497 (1975)). Линия клеток гибридомы, продуцирующая антитело GM-7, было депонирована на основании правил Будапештского соглашения в депозитарий DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkultur GmbH, Braunschweig, Germany) под номерами доступа DSM ACC2542.
На фиг.1 показана определенная проточной цитометрией способность GM-7 связываться с моноцитами после модификации in vitro по настоящему изобретению. Как можно видеть на данной фигуре, CD14-положительные моноциты, непосредственно полученные из фракции мононуклеарных клеток, не связывают антитело GM-7 (участок серого цвета соответствует незакрашенному контрольному антителу). В отличие от этого после культивирования в присутствии M-CSF и стимуляции γ-IFN часть моноцитов экспрессирует антиген, который распознается моноклональным антителом GM-7. Моноклональное антитело GM-7 является изотипом к-IgG2а. Таким образом, способ по настоящему изобретению вызывает изменение фенотипического паттерна экспрессии антигена на клеточной мембране модифицированных моноцитов (фиг.1).
Моноклональное антитело GM-7 специфически связывается с данной популяцией клеток, которая наряду с клетками, полученными способом по настоящему изобретению, содержит наиболее эффективные клетки, индуцирующие аутотолерантность (см. фиг.5).
Поэтому предпочтительный вариант осуществления изобретения относится к таким клеткам STIC, которые способны связывать антитело GM-7. Указанные клетки далее именуются STICGM7.
Таким образом, антитело GM-7 по настоящему изобретению является чрезвычайно эффективным и простым в обращении агентом, служащим для отбора и очистки клеток, индуцирующих аутотолерантность (STIC). С помощью данного антитела способом по настоящему изобретению можно создать гомогенную и высокоэффективную популяцию клеток STIC.
В соответствии с предпочтительным вариантом осуществления изобретения клетки, индуцирующие аутотолерантность, полученные на стадии с) вышеописанного способа по настоящему изобретению, которые экспрессируют антиген, связывающийся с антителом GM-7, можно отобрать непосредственно из культуральной среды после выполнения стадии с), либо их можно выделить из популяции клеток, полученной после отделения клеток от культуральной среды на стадии d) вышеуказанного способа по настоящему изобретению, путем связывания с антителом GM-7, продуцируемым линией клеток гибридомы DSM ACC2542.
Чтобы произвести отбор STIC по настоящему изобретению, указанное антитело вводят в соприкосновение с образцом в условиях, при которых происходит связывание антитела с индуцирующими аутотолерантность клетками, присутствующими в образце. Комплексы, образующиеся в результате реакции связывания, затем отделяют от образца. Для данной цели антитело может быть иммобилизовано на носителе до контактирования с образцом; например, оно может быть связано с матрицей, пригодной для выполнения хроматографии, или с так называемыми "магнитными гранулами". Вышеописанным способом можно отделить и сконцентрировать клетки, индуцирующие аутотолерантность, из образца большого объема.
Для получения клеток, индуцирующих аутотолерантность, после отделения комплекса от образца разъединяют связь, существующую между антителом и клетками, индуцирующими аутотолерантность. Связь можно разъединить методами, хорошо известными в данной области, такими как, например, конкурентное замещение или промывка солевыми растворами. Соответствующие методы описаны, например, в публикации Utz U. et al. ("Analysis of the T-cell Receptor repertoire of human T-cell leukemia virus type-1 (HTLV-1) Tax-specific CD8+ Cytotoxic T Lymphocytes from patients with HTLV-1 associated disease: Evidence for the oligoclonal expansion" J. of Virology Feb. 1996, 843-851).
Кроме того, моноклональное антитело GM-7 позволяет произвести качественное и количественное обнаружение in vitro клеток моноцитарного происхождения, индуцирующих аутотолерантность, по настоящему изобретению в образцах крови и/или ткани пациента. Образование в образце комплексов, свидетельствующих о наличии и количестве клеток, индуцирующих аутотолерантность, можно определить известными методами.
Комплексы можно обнаружить, связав ("пометив") антитело GM-7 с детектируемой молекулой, которая, например, ковалентно связана с антителом. Приемлемые детектируемые молекулы описаны во многих научных публикациях в области молекулярной диагностики и включают наряду с прочими флуоресцентные красители, такие как изотиоцианат флуоресцеина или тетраметилродамин-5-изотиоцианат, люминесцентные красители, молекулы, меченные радиоактивным изотопом, и ферменты, такие как пероксидазы (см. публикацию Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998).
Методы обнаружения антитела зависят от молекулы, выбранной для мечения антитела. В настоящем изобретении антитело GM-7 было связано с флуоресцентной молекулой изотиоцианата флуоресцеина (FITC), благодаря чему антитело можно было обнаружить методом проточной цитометрии и/или флуоресцентной микроскопии. Методы мечения антител при помощи FITC известны специалистам, работающим в данной области.
Альтернативно комплекс можно также обнаружить двухстадийным методом с использованием вторичных антител. В данной связи немеченное антитело GM-7 можно обнаружить в комплексе при помощи другого меченого антитела (см. публикацию Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998). Вышеуказанный двухстадийный метод обнаружения является гораздо более чувствительным, чем прямое обнаружение связывания антитела по настоящему изобретению, так как с одним антителом GM-7 можно связать несколько меченых вторичных антител (амплификация сигнала).
Кроме того, с помощью антитела GM-7 можно обнаружить STIC в периферической крови пациента, которому были введены клетки STIC, например, путем "мониторинга", в процессе которого определяют число клеток в периферической крови через определенные промежутки времени.
Как должно быть очевидно специалисту в данной области, можно получить моноклональные антитела против STIC из моноцитов позвоночных, отличных от человека, в частности из моноцитов приматов и свиней, модифицированных в соответствии с настоящим изобретением. При этом иммунизацию соответствующих животных-хозяев и образование соответствующей линии клеток гибридомы выполняют способом, описанным выше для STIC человека.
Особенно предпочтительный вариант осуществления изобретения относится к субпопуляции STIC по данному изобретению, которая коэкспрессирует антигены CD3 и CD14 на поверхности клеток. Указанные клетки далее именуются STICCD3+/CD14+. Как будет более подробно описано ниже, установлено, что такие клетки индуцируют образование регуляторных Т-лимфоцитов.
STIC, коэкспрессирующие поверхностные антигены CD3 и CD14, могут быть непосредственно отобраны из клеток, индуцирующих аутотолерантность, которые образуются на стадии с) вышеописанного способа по настоящему изобретению, могут быть отобраны из популяции клеток, полученной после отделения клеток от культуральной среды на стадии d) вышеописанного способа по данному изобретению, или могут быть альтернативно отобраны из популяции STICGM7.
Кроме того, на примере клеток TAIC, описанных в заявке РСТ/EP03/07551, было продемонстрировано, что клетки, полученные способом по настоящему изобретению, в большом количестве экспрессируют гены Foxp3, CTLA4 и интегрин αЕβ7 (см. пример 6, который соответствует примеру 12 в заявке РСТ/EP03/07551). В отличие от этого исходные моноциты не экспрессируют указанные гены или экспрессируют их в небольшом количестве. Поэтому увеличение экспрессии генов Foxp3, CTLA4 и интегрина αЕβ7 является отличительным признаком клеток STICCD3+/CD14+.
Как показано в примере 6, экспрессия маркеров Foxp3, CTLA4 и интегрина αЕβ7 ранее была описана только для регуляторных Т-лимфоцитов. Т-лимфоциты, коэкспрессирующие поверхностные антигены CD4 и CD25, представляют собой субпопуляцию регуляторных Т-лимфоцитов, которые именуются также "супрессорными клетками". Их функция заключается в подавлении иммунной реакции организма. В частности, установлено, что Foxp3 является специфическим фактором транскрипции, который служит в качестве гена, контролирующего образование регуляторных Т-клеток, и специфически экспрессируется указанными клетками. В соответствии с настоящим изобретением желательно, чтобы клетки STICCD3+/CD14+ экспрессировали по крайней мере 1×10-9, более предпочтительно по крайней мере 5×10-9 и особенно предпочтительно по крайней мере 1×10-8 мкг РНК Foxp3 на мкг общей РНК.
CTLA4 аналогичным образом считается маркером для обнаружения регуляторной функции Т-лимфоцитов, в частности CD4/CD25-положительных Т-лимфоцитов (см. литературу, приведенную в примере 6). В соответствии с настоящим изобретением клетки STICCD3+/CD14+ должны предпочтительно экспрессировать по крайней мере 5×10-7, более предпочтительно по крайней мере 3×10-6 и особенно предпочтительно по крайней мере 5×10-6 мкг РНК CTLA4 на мкг общей РНК.
Интегрин αЕβ7, узнающий кадгерин эпителия, был недавно описан в публикации Lehmann et al., in PNAS 99, pages 13031-13036 (2002) в качестве нового маркера для субпопуляции сильнодействующих регуляторных Т-лимфоцитов, взаимодействующих с эпителием. Экспрессия РНК интегрина αЕβ7 должна по настоящему изобретению составлять в клетках STICCD3+/CD14+ предпочтительно по крайней мере 1×10-12, более предпочтительно по крайней мере 1×10-11, особенно предпочтительно по крайней мере 1×10-10 и наиболее предпочтительно по крайней мере 1×10-9 мкг на 1 мкг общей РНК.
Как показано в таблице, приведенной в примере 6, прямое сокультивирование клеток по данному изобретению с лимфоцитами вызывает значительное увеличение числа регуляторных Т-лимфоцитов, в частности, CD4+/CD25+ клеток в популяции лимфоцитов с сильно увеличенной экспрессией генов Foxp3, CTLA4 и интегрина αЕβ7. В данном примере далее показано, что такой эффект не наблюдается в том случае, если клетки по настоящему изобретению сокультивируют с лимфоцитами непрямым методом.
Полученные результаты показывают, что стимуляция образования и/или размножения регуляторных Т-клеток клетками по настоящему изобретению имеет непосредственное отношение к индукции аутотолерантности указанными клетками.
Пример 7 (соответствующий примеру 13 в заявке РСТ/EP03/07551) подтверждает гипотезу об участии клеток по настоящему изобретению в индукции подавления иммунной реакции со ссылкой на клетки TAIC, описанные в заявке РСТ/EP03/07751 (см. выше). В указанном примере лимфоциты, полученные у животных-реципиентов, инкубировали in vitro с иммуносупрессорными клетками, полученными у соответствующих животных-доноров. Для индукции толерантности лимфоциты реципиента, которые предварительно инкубировали с TAIC донора, инъецировали животным вместо TAIC. Подобным образом можно было индуцировать донор-специфическую толерантность, в то время как у животных, которым вводили лимфоциты реципиента, которые не сокультивировали с TAIC, полученными у донора, не возникала толерантность.
STIC по настоящему изобретению можно использовать как есть или в виде фармацевтического препарата. Клетки, полученные на стадии d) вышеописанного способа по настоящему изобретению, можно использовать сразу. Примерно 10-50% от общего числа клеток в популяциях, полученных таким образом, образованы лимфоцитами и гранулоцитами, присутствующими в изоляте исходных моноцитов (фракция мононуклеарных клеток). Указанные клетки поддерживают образование STIC по настоящему изобретению, выделенных из моноцитов, на стадии культивирования (см. пример 4); они не препятствуют индукции аутотолерантности, если STIC по настоящему изобретению используются в виде фармацевтического препарата.
Однако в соответствии с другими предпочтительными вариантами осуществления изобретения субпопуляции STICGM7 и/или STICCD3+/CD14+ могут быть выделены из всей популяции STIC, полученной при осуществлении способа по настоящему изобретению (см. выше), и использованы для индукции аутотолерантности.
Клетки STIC, STICGM7 и/или STICCD3+/CD14+ могут находиться в культуральной среде (см. пример 2) в течение по крайней мере 48 часов, не утрачивая при этом способность индуцировать аутотолерантность.
При использовании в качестве фармацевтического препарата клетки STIC, субпопуляции STICGM7 и/или STICCD3+/CD14+, суспендированные, например, в АВ0-совместимой сыворотке человека (универсально пригодной для применения), можно вводить внутривенно в виде кратковременного вливания.
В данном контексте фармацевтические препараты могут содержать STIC по настоящему изобретению в комбинации с известными противовоспалительными средствами и/или известными иммуносупрессантами, такими как стероиды, в частности кортизон, метотрексат, циклофосфамид, азатиоприн, 5-аминосалициловая кислота (5-ASA), антитела к TNF-α, α-интерферон и В-клеточные антитела, такие как, например, ритуксимаб, для лечения органспецифических или системных аутоиммунных заболеваний.
Кроме того, STIC по настоящему изобретению можно использовать для лечения аллергических заболеваний в комбинации с антигистаминными средствами, препаратами теофиллина, β-миметическими средствами, стероидами, такими как кортизон, и хромоглициновой кислотой.
Подробное описание изобретения
Исходными клетками для осуществления способа по настоящему изобретению являются аутологичные моноциты крови, то есть моноциты, выделенные из крови соответствующего пациента, которому должны быть введены клетки по данному изобретению. Аутологичные моноциты предпочтительно выделяют из крови человека. Моноциты могут быть получены любым способом, в частности лейкаферезом, или из фракции мононуклеарных клеток цельной крови (лейкоцитная пленка). Лейкаферез является особенно предпочтительным способом.
Лейкаферез является общим названием многостадийного способа, выполняемого при помощи коммерчески доступного аппарата для афереза, в котором происходит отбор цельной крови из организма человека, разделение ее на фракции и возврат в организм пациента всех фракций за исключением фракции мононуклеарных клеток. Указанный способ может быть выполнен, например, в соответствии с подробным описанием, приведенным в европейском патенте № 0591194 В1.
Альтернативно кровь, обработанную антикоагулянтом, сначала разделяют на плазму, лейкоциты и эритроциты методами, известными в данной области, предпочтительно центрифугированием. После центрифугирования плазма находится в супернатанте; под супернатантом расположен слой, полностью содержащий лейкоциты. Данный слой определяется также как лейкоцитная пленка. Под указанным слоем находится фаза, содержащая эритроциты (гематокрит).
В соответствии со способом по настоящему изобретению сначала выделяют и разделяют фракцию мононуклеарных клеток для получения моноцитов, например, производя центрифугирование известными методами. В соответствии с предпочтительным вариантом осуществления способа по настоящему изобретению фракцию мононуклеарных клеток помещают на среду для отделения лимфоцитов (фиколл-гипак) и центрифугируют (см. пример 1). В примере 1 описан предпочтительный вариант осуществления изобретения, в котором эритроциты и мертвые клетки, которые все еще могут находиться во фракции мононуклеарных клеток, отделяют центрифугированием, при этом лейкоциты, включающие моноциты, находятся в виде изолята на разделяющей среде. Затем фазу лейкоцитов можно осторожно удалить пипеткой и несколько раз центрифугировать и промывать для обогащения моноцитов в изоляте. В процессе выполнении данного способа моноциты накапливаются в основании центрифужного сосуда вместе с частью лимфоцитов.
В соответствии с особенно предпочтительным вариантом осуществления способа по настоящему изобретению условия получения изолята, содержащего моноциты, контролируют таким образом, чтобы изолят содержал помимо моноцитов примерно 10-50% лимфоцитов от общего числа клеток. Изолят предпочтительно содержит примерно 50-90%, особенно предпочтительно 60-70% моноцитов и примерно 10-50%, особенно предпочтительно 20-50% лимфоцитов от общего числа клеток, при этом разница необязательно восполняется гранулоцитами.
Как показано в примере 4, присутствие лимфоцитов в количестве 20-30% от общего числа клеток при культивировании исходных моноцитов с M-CSF и γ-интерфероном вызывает образование значительно большего количества CD3/CD14-дважды положительных STIC, что происходит даже при наличии небольшого количества лимфоцитов (около 5%) (см. фиг.3).
Чтобы получить достаточное количество STIC, необходимо сначала размножить моноциты. С этой целью можно использовать известную питательную среду, пригодную для выращивания моноцитов; однако указанная среда должна содержать фактор роста М-CSF (фактор колониеобразования макрофагов). М-CSF (также именуемый CSF-1) продуцируется моноцитами, фибробластами, лимфоцитами и эндотелиальными клетками. Концентрация М-CSF в культуральной среде может предпочтительно составлять 2-20 мкг/л среды, более предпочтительно 4-6 мкг/л и особенно предпочтительно 5 мкг/л.
Питательная среда предпочтительно не содержит гранулоцитарный фактор колониеобразования макрофагов (GM-CSF), так как выход STIC сокращается в присутствии данного фактора.
Клетки необходимо последовательно или одновременно стимулировать γ-IFN, то есть указанные клетки необходимо культивировать в присутствии γ-IFN. Моноциты необходимо стимулировать γ-IFN после фазы первоначального размножения, длящейся 3-6 дней в культуральной среде, содержащей фактор роста. Стимуляцию γ-IFN предпочтительно начинают на 4-й день после начала культивирования в присутствии М-CSF и продолжают в течение предпочтительно 24-72 часов, более предпочтительно 48 часов, в условиях термостата, то есть при 37°С в атмосфере с 5% СО2.
Концентрация γ-IFN в среде может составлять 0,1-20 нг/мл, предпочтительно 1-10 нг/мл и особенно предпочтительно 5 нг/мл.
Стимуляция γ-IFN может быть начала одновременно с размножением моноцитов в среде, содержащей фактор роста. Однако стимуляцию желательно начинать через 3-6 дней после начала фазы первоначального размножения. Процесс размножения клеток и стимуляции γ-IFN должен продолжаться в общей сложности в течение не более 8 дней. В любом случае обработку γ-IFN необходимо производить таким образом, чтобы она продолжалась после фазы размножения в течение по крайней мере 24 часов, максимум 72 часов, предпочтительно 48 часов. Период размножения и стимуляции клеток должен продолжаться в общей сложности в течение 4-8 дней.
В соответствии с предпочтительным вариантом осуществления изобретения размножение и стимуляцию γ-интерфероном выполняют аналогично примеру 2, причем сначала размножают моноциты в культуральной среде, содержащей фактор роста, и через 3-6 дней в культуральную среду вводят γ-IFN в количестве, необходимом для достижения в среде концентрации, равной 0,1-20 нг/мл, предпочтительно 1-10 нг/мл и особенно предпочтительно 5 нг/мл.
Способ по настоящему изобретению предпочтительно осуществляют в сосудах для культивирования, поверхность которых предварительно сенсибилизируют фетальной телячьей сывороткой (FCS) или предпочтительно АВ0-совместимой сывороткой человека (см. пример 2). Для сенсибилизации FCS поверхность сосудов для культивирования перед применением покрывают FCS и после взаимодействия в течение нескольких часов, в частности 4-72 часов, предпочтительно 12-48 часов и особенно предпочтительно 24 часов, удаляют FCS, не прилипшую к поверхности должным образом. Сенсибилизацию АВ0-совместимой сывороткой человека выполняют аналогично вышеописанному способу.
На стадии культивирования клетки оседают в основании сосуда для культивирования примерно через 24 часа. Благодаря адгезивным свойствам моноциты и STIC, выделенные из моноцитов в ходе данного процесса, прикрепляются к основанию соответствующего сосуда для культивирования. В случае замены культуральной среды в процессе культивирования, как это описано в примере 2, сначала осторожно удаляют супернатант, например, путем отсасывания пипеткой или декантирования и затем вводят свежую культуральную среду. Однако клетки, прикрепленные к основанию, предпочтительно не промывают или промывают очень осторожно, чтобы не удалить присутствующие в них лимфоциты.
Прикрепленные клетки можно удалить механически, например, при помощи тонкого скребка для клеток или шпателя.
В соответствии с предпочтительным вариантом осуществления способа по настоящему изобретению полное удаление клеток производят в результате обработки приемлемым ферментом, например трипсином (см. пример 2). Раствор трипсина (0,1-0,025 г/л, предпочтительно 0,05 г/л) оставляют воздействовать на клетки в течение 2-10 минут при 35°С-39°С, предпочтительно при 37°С, в присутствии 5% СО2.
Активность фермента затем блокируют обычным способом, после чего свободно флотирующие клетки STIC можно получить обычным центрифугированием. Клетки необходимо сразу же использовать необязательно в виде суспензии в приемлемой среде, например, PBS. Однако клетки можно хранить в течение нескольких дней, например в течение примерно 2-3 дней, в питательной среде (см. пример 2), причем указанная консервирующая среда не должна содержать фактор роста и γ-IFN. Клетки могут находиться в такой питательной среде в виде STIC в течение по крайней мере 48 часов.
Для хранения в течение более продолжительных периодов времени клетки могут быть подвергнуты глубокому замораживанию. Методы глубокого замораживания живых клеток известны в данной области; см. публикацию Griffith M. et al., "Epithelial Cell Culture, Cornea", in Methods of tissue engineering, Atala A. and Lanza R.P., Academic Press 2002, chapter 4, pages 131-140. Предпочтительной суспендирующей средой для глубокого замораживания клеток по настоящему изобретению является АВ0-совместимая сыворотка или FCS, содержащие DMSO.
В соответствии с одним вариантом осуществления изобретения суспензию клеток, содержащую клетки, индуцирующие аутотолерантность, полученные на стадиях с) или d), можно очистить для отделения клеток, связывающих антитело GM-7, с целью получения субпопуляции STICGM7. Методы выполнения такой очистки подробно описаны выше.
В соответствии с другим предпочтительным вариантом осуществления изобретения из популяции STIC выделяют клетки, коэкспрессирущие антигены CD3 и CD14 на своей поверхности. Методы отделения таких клеток известны в данной области. Примеры таких методов включают сортировку клеток с активацией флуоресценции (FACS), сортировку магнитными иммуногранулами и сортировку клеток путем магнитной активации (MACS) или так называемый метод розеткообразования [см. публикацию Gmelig-Meyling F. et al. "Simplified procedure for the separation of human T- and non-T-cells", Vox Sang. 33, 5-8 (1977)].
Отбор субпопуляции STICCD3+/CD14+ можно производить непосредственно из популяции STIC, полученной на стадиях с) или d) вышеописанного способа по настоящему изобретению, или из субпопуляции STICGM7. Последний способ предполагает поэтапное обогащение STICCD3+/CD14+.
В предпочтительном варианте осуществления изобретения клетки субпопуляции STICCD3+/CD14+ по настоящему изобретению используют как есть для получения фармацевтической композиции, предназначенной для профилактики и/или лечения аутоиммунных заболеваний in vivo.
Примерами таких аутоиммунных заболеваний являются:
- ревматические заболевания с аутоиммунными признаками, в частности ревматоидный артрит, системная красная волчанка (SLE), ксеродерматоз, склеродермия, дерматомиозит, полимиозит, синдром Рейтера;
- сахарный диабет;
- аутоиммунные заболевания крови и кровеносных сосудов, в частности, аутоиммунная гемолитическая анемия (AIHA), аутоиммунная тромботическая пурпура (ITP), синдром антител против фосфолипидов, васкулит (группа нодозного полиартериита, гранулематоз Вегенера, аллергический васкулит, гигантоклеточный артериит), системная красная волчанка, смешанная цироглобулинемия;
- аутоиммунные заболевания печени, в частности, аутоиммунный гепатит, первичный билиарный цирроз печени и первичный склерозирующий холангит;
- аутоиммунные заболевания щитовидной железы, в частности, хронический лимфоматозный тиреоидит, болезнь Грейвса;
- аутоиммунные заболевания центральной нервной системы, в частности, рассеянный склероз, миастения; и
- буллезные заболевания кожи, в частности, обыкновенная пузырчатка, вегетирующая пузырчатка, листовидная пузырчатка, себорейная пузырчатка и бразильская пузырчатка.
Пригодность STIC для индукции аутотолерантности продемонстрирована для мышей в двух модельных системах искусственно индуцированного колита, напоминающего аутоиммунное заболевание (см. примеры 8 и 9).
Указанные модели представляют собой хронический колит, вызванный декстрансульфатом натрия (DSS), (пример 8) и хронический экспериментальный колит, вызванный переносом CD62L+/CD4+ лимфоцитов мышам с тяжелым комбинированным иммунодефицитом (SCID) (пример 9). В обеих моделях у мышей вызывали хронический колит, симптомы которого напоминают язвенный колит человека.
В обеих модельных системах введение STIC вскоре после возникновения заболевания вызывает подавление типичных симптомов колита по сравнению с животными, не получавшими никакого лечения, или с животными, которым вводили "контрольные клетки", не содержащие STIC (см. примеры 8 и 9).
Как было указано выше, повышенные иммунные реакции также имеют место при возникновении аллергий. Бэч и др. (Bach et al., loc. cit.) установили, что CD4+ клетки, включающие в качестве субпопуляции CD4+/CD25+ клетки, могут ослаблять развитие экспериментального аллергического энцефаломиелита (ЕАЕ). Поскольку, как показано в данном описании изобретения, введение STIC индуцирует увеличение популяции CD4+/CD25+ Т-клеток, указанные клетки можно также использовать для лечения аллергических заболеваний.
Таким образом, в соответствии с другим предпочтительным вариантом осуществления изобретения STIC-содержащие фармацевтические препараты используют для профилактики и/или лечения аллергических заболеваний.
Фармацевтические препараты могут содержать жизнеспособные клетки STIC по настоящему изобретению, полученные на стадии d) способа по данному изобретению, которые суспендируют в фармацевтически приемлемом носителе предпочтительно в количестве от около 1×105 до 1×107 клеток/мл и более предпочтительно около 1×106 клеток/мл препарата.
В другом предпочтительном варианте осуществления изобретения клетки субпопуляции STICGM7 по настоящему изобретению используют как есть для получения фармацевтической композиции, предназначенной для профилактики и/или лечения in vivo заболеваний, обусловленных нарушением аутотолерантности.
В одном варианте осуществления изобретения такой фармацевтический препарат содержит жизнеспособные клетки STICGM7 по настоящему изобретению, связывающиеся с антителом GM-7, которые суспендированы в фармацевтически приемлемом жидком носителе предпочтительно в количестве от около 1×106 до 1×108 клеток/мл и более предпочтительно около 1×106 клеток/мл препарата.
В наиболее предпочтительном варианте осуществления изобретения такой фармацевтический препарат может содержать жизнеспособные клетки STICCD3+/CD14+ по настоящему изобретению, коэкспрессирующие антигены CD3 и CD14, предпочтительно в количестве от около 5×105 до 5×107 клеток/мл и более предпочтительно около 5×106 клеток/мл препарата.
Вышеописанные фармацевтические препараты могут содержать клетки по настоящему изобретению, суспендированные в физиологически хорошо переносимой среде. Приемлемыми средами, например, являются раствор Рингера, физиологический раствор или 5-20% раствор альбумина человека и тому подобные.
Фармацевтические композиции, содержащие STIC по настоящему изобретению, можно вводить разными способами в зависимости от части тела, пораженной соответствующим заболеванием. В предпочтительных вариантах осуществления изобретения указанные фармацевтические композиции можно вводить внутривенно, интрапортально, подкожно, внутрикожно, внутрибрюшинно или интратекально. Указанные фармацевтические композиции можно также вводить непосредственно в пораженный орган, такой как печень или мышца, путем ингаляции или внутриполостного введения.
Фармацевтические препараты, содержащие STIC в качестве активных ингредиентов, можно также использовать для профилактики аутоиммунных заболеваний в тех случаях, когда известен ген, отвечающий за возникновение данного заболевания. Если у пациента диагностирован ген, ассоциированный с одним или несколькими аутоиммунными заболеваниями, возникновение такого заболевания можно предотвратить путем введения STIC, выделенных из аутологичных моноцитов, в раннем детстве. В предпочтительном варианте осуществления изобретения аутологичные клетки STIC сокультивируют с аутологичными лимфоцитами и пептидом, экспрессированным соответствующим геном. В результате такого культивирования образуются аутологичные регуляторные Т-лимфоциты, специфичные к соответствующему генному продукту. Указанные регуляторные Т-лимфоциты затем могут быть вторично введены соответствующему пациенту в соответствии с описанием, приведенным в нижеследующем примере 7 (соответствующем примеру 13 в заявке РСТ/EP03/07551).
В другом варианте осуществления изобретения STIC можно использовать для профилактики периодически возникающих аутоиммунных заболеваний, таких как, например, ревматоидный артрит. Благодаря введению фармацевтического препарата, содержащего STIC, после первого или последующего рецидива заболевания можно предотвратить повторные вспышки данного заболевания.
Клеточные препараты по настоящему изобретению могут содержать жизнеспособные клетки STIC, полученные на стадии d) способа по данному изобретению. Альтернативно указанные препараты могут содержать клетки, относящиеся к субпопуляциям клеток STICGM7, связывающихся с антителом GM-7, или клеток STICCD3+/CD14+, коэкспрессирующих антигены CD3 и CD14 на своей поверхности. Указанные препараты могут содержать соответствующие клетки в количестве, равном предпочтительно 1×105, более предпочтительно по крайней мере 5×105 и наиболее предпочтительно по крайней мере 1×106 клеток/мл, суспендированных в жидкой среде-носителе. Указанная среда может быть культуральной или транспортирующей средой, хорошо переносимой клетками, такой как 5-20% раствор альбумина человека. Альтернативно клетки в препарате могут быть подвергнуты глубокому замораживанию и находиться в приемлемой консервирующей среде, такой как, например, RPMI, содержащей 50% раствор альбумина человека и 10% DMSO.
И наконец, данное изобретение относится к способу, в соответствии с которым клетки, индуцирующие аутотолерантность, по настоящему изобретению (STIC, STICGM7 или STICCD3+/CD14+) используют для образования или размножения in vitro аутологичных регуляторных Т-лимфоцитов. Как показано в примере 6 (соответствующем примеру 12 в заявке РСТ/EP03/07551), прямое сокультивирование in vitro клеток TAIC, соответствующих STIC, с лимфоцитами вызывает значительную пролиферацию регуляторных Т-лимфоцитов, в частности CD4+/CD25+ лимфоцитов. Поэтому можно производить и/или размножать аутологичные регуляторные Т-лимфоциты, в частности CD4+/CD25+ лимфоциты, в результате прямого сокультивирования клеток STIC, выделенных из моноцитов пациента, с аутологичными лимфоцитами.
Прямое культивирование in vitro по настоящему изобретению означает, что клетки STIC и лимфоциты сокультивируют при непосредственном физическом контактировании в одной и той же среде, например в жидкой среде, описанной в примере 6.
При осуществлении данного способа среда предпочтительно содержит соответствующие клетки, то есть STIC и лимфоциты, в примерно одинаковом количестве, равном предпочтительно по крайней мере 1×105, более предпочтительно по крайней мере 5×105 и наиболее предпочтительно по крайней мере 1×106 клеток/мл, суспендированных в жидкой среде-носителе; указанная среда может быть культуральной средой или транспортирующей средой, хорошо переносимой клетками, такой как 5-20% раствор альбумина человека. Сокультивирование предпочтительно выполняют в физиологических условиях при температуре около 37°С, например, в термостате в течение предпочтительно 3-5 дней, более предпочтительно 4 дней.
В примере 7 (соответствующем примеру 13 в заявке РСТ/EP03/07551) показано, что трансплантат приживляется не только при введении реципиенту TAIC, полученных из моноцитов донора, но и при вторичном введении реципиенту его собственных лимфоцитов, которые предварительно сокультивировали прямым способом in vitro с TAIC, полученными из моноцитов донора. Аналогичным образом аутотолерантность можно индуцировать в результате вторичного введения пациенту аутологичных лимфоцитов, которые предварительно подвергали прямому сокультивированию с клетками STIC, полученными из аутологичных моноцитов данного пациента.
В соответствии с другим вариантом осуществления изобретения регуляторные Т-лимфоциты могут быть получены in vitro из лимфоцитов пациента, подлежащего лечению, в результате прямого сокультивирования лимфоцитов, полученных у данного пациента, с клетками STIC, полученными из моноцитов указанного пациента. Вторичное введение реципиенту сокультивированных лимфоцитов стимулирует индукцию аутотолерантности, как это показано в примере 7.
Полученные таким образом регуляторные Т-лимфоциты можно выделить методом FACS, описанным в данной заявке (см. выше), и использовать в фармацевтическом препарате, предназначенном для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, в котором клетки суспендированы в вышеописанном фармакологически приемлемом носителе.
Настоящее изобретение далее проиллюстрировано примерами.
За исключением особо оговоренных случаев в примерах использованы нижеследующие среды и вещества.
1. Раствор пенициллина/стрепомицина.
10000 единиц пенициллина в виде натриевой соли пенициллина G и 1000 мкг стрептомицина в виде сульфата стрептомицина на 1 мл физиологического раствора хлорида натрия (NaCl, 0,85%) (№ по каталогу компании Gibco 15140122).
2. Трипсин-EDTA
0,5 г трипсина и 0,2 г EDTA (4 Na)/л
3. RPMI 1640 (однократная, жидкая среда (11875)), содержащая L-глутамин
Среды RPMI 1600 (Roswell Park Memorial Institute) представляют собой обогащенные составы, которые можно широко использовать для культивирования клеток млекопитающих:
Ссылка: Moore G.E., et al.,J.A.M.A. 199: 519 (1967)
4. PBS (физиологический раствор с фосфатным буфером Дульбекко), см. J. Exp. Med. 98:167 (1954):
5. Фиколл-гипак
Среда для отделения лимфоцитов (сополимер сахарозы и эпихлоргидрина, грамм-молекулярная масса 400000; плотность 1,077, доведенная до требуемого значения при помощи диатризоата натрия).
6. L-Глутамин
Жидкость: 29,2 мг/мл
7. Фактор колониеобразования макрофагов (M-CSF)
Рекомбинантный M-CSF человека, полученный из E. coli; содержит в качестве мономера (18,5 кДа) 135 аминокислотных остатков, включающих N-концевой метионин; присутствует в виде гомодимера с молекулярной массой 37 кДа; (№ по каталогу компании SIGMA М 6518).
8. γ-Интерферон (γ-IFN)
Рекомбинантный γ-IFN человека, полученный из E. coli; белок с молекулярной массой 16,7 кДа, содержащий 143 аминокислотных остатка (№ по каталогу компании CHEMICON IF002).
9. Декстрансульфат натрия
Sigma-Aldrich 31403, соль, молекулярная масса 40 кДа.
Пример 1
Выделение моноцитов из цельной крови
Цельную кровь получали у людей двумя разными методами:
а) Лейкаферез. Лейкаферез выполняли в системе для афереза COBE® Spectra™ (Gambro BCT, Lakewood, CO, USA) в мононуклеарном режиме (MNZ) в соответствии с инструкциями изготовителя (COBE Spectra Version 4.7/5.1/6.0/7.0).
b) Обычное разделение элементов крови. 450 мл цельной крови смешивали в трехкамерном мешке с 63 мл стабилизирующего раствора, содержащего в одном литре Н2О 3,27 г лимонной кислоты, 26,3 г тринатрийцитрата, 25,5 г декстрозы и 22,22 г дигидроксифосфата натрия во избежание свертывания крови и для питания клеток. Показатель рН раствора был равен 5,6-5,8.
Для разделения элементов крови смесь подвергали "интенсивному центрифугированию" со скоростью 4000 об/мин в течение 7 минут при 20°С. В результате центрифугирования происходило расслаивание корпускулярных и некорпускулярных элементов крови на три слоя. Мешок помещали в сжимающее устройство, предназначенное для указанной цели, в котором эритроциты вытеснялись в нижнюю камеру мешка, плазма вытеснялась в верхнюю камеру мешка и так называемая лейкоцитная пленка оставалась в средней камере мешка и имела объем около 50 мл.
При осуществлении обоих методов фракцию только что полученных мононуклеарных клеток в количестве 50 мл делили на 2 части по 25 мл каждая и помещали на 25 мл разделяющей среды фиколл-гипак, которую предварительно вводили в две 50 мл пробирки Falcon.
Полученный препарат центрифугировали в течение 30 минут со скоростью 2500 об/мин без торможения. После центрифугирования эритроциты и мертвые клетки, которые могли еще присутствовать во фракции мононуклеарных клеток, находились под фазой фиколла, при этом лейкоциты, включая моноциты, находились на фиколле в виде белой интерфазы.
Белую интерфазу, включающую моноциты, затем осторожно удаляли пипетированием и смешивали с 10 мл физиологического раствора с фосфатным буфером (PBS).
Данный препарат затем трижды центрифугировали в течение 10 минут со скоростью 1800 об/мин без торможения, супернатант удаляли пипетированием после каждого центрифугирования и вводили свежий PBS.
Клеточный дебрис, накапливающийся в основании центрифужного сосуда (пробирки Falcon), содержал фракцию мононуклеарных клеток, то есть моноциты.
с) Моноциты, необходимые для выполнения экспериментов на мышах в примерах 8 и 9 (с использованием генетически идентичных мышей), были получены из селезенок сингенных мышей-доноров. Селезенки пропускали через сито с мелкими ячейками под небольшим давлением и отделенные таким образом клетки вторично суспендировали в PBS. Суспендированные клетки селезенки расслаивали в 25 мл разделяющей среды фиколла-гипака, которую предварительно вводили в 50 мл пробирки Falcon. Затем выполняли вышеописанную процедуру.
Пример 2
Размножение и модификация моноцитов
Моноциты культивировали и размножали в питательной среде следующего состава:
Питательная среда содержала 2,5 мкг/500 мл M-CSF.
Моноциты, полученные в примере 1, суспендировали в общем количестве 106 клеток в 10 мл питательной среды и переносили на чашку Петри (с диаметром 100 мм). Чашку Петри предварительно заполняли чистым инактивированным FCS, который выливали через 24 часа, в результате чего была получена чашка, сенсибилизированная FCS.
Чашку Петри закрывали крышкой и выдерживали в течение 3 дней в термостате при 37°С. Клетки оседали на основании чашки Петри через 24 часа. На второй день супернатант отсасывали пипеткой и чашку Петри снова заполняли 10 мл свежей питательной среды.
На 4-ый день добавляли 50 нг γ-интерферона в 10 мл питательной среды, чашку снова закрывали и выдерживали еще 48 часов в термостате при 37°С.
Затем на чашку Петри пипеткой переносили 10 мл раствора трипсина, разведенного PBS в отношении 1:10. Закрытую чашку Петри выдерживали в течение 10 минут в термостате при 37°С.
Клетки, прикрепленные к основанию чашки Петри, отделяли при помощи скребка для клеток так, что большая часть (>90%) клеток флотировала в супернатанте.
Весь супернатант (10 мл раствора трипсина + 10 мл среды) отсасывали пипеткой, объединяли в 50 мл пробирке Falcon и центрифугировали в течение 10 минут со скоростью 1800 об/мин. Супернатант сливали и к осадку (оставшийся клеточный дебрис) добавляли свежую питательную среду (см. выше) в количестве 1 мл на 106 клеток. Подсчет клеток для определения точной дозы производили известными методами, описанными, например, в публикации Hay R.J., "Cell Quantification and Characterisation", in Methods of Tissue Engineering, Academic Press 2002, Chapter 4, p. 55-84.
Суспензию клеток центрифугировали (1800 об/мин, 10 минут, см. выше) и вводили клеточный дебрис в PBS или для лечения человека в NaCl (физиологический раствор). Клетки могут быть сразу же введены внутривенно или в течение 48 часов.
Альтернативно после центрифугирования и сливания супернатанта, содержащего трипсин, добавляли FCS/DMSO в качестве среды для замораживания клеток и подвергали клетки глубокому замораживанию в объеме 10 мл.
Среда для замораживания содержала 95% FCS и 5% DMSO. Примерно 106 клеток вводили в 1 мл указанной среды и охлаждали в следующей последовательности:
30 минут на льду;
2 часа при -20°С в предварительно охлажденной камере из пенопласта;
24 часа при -80°С в камере из пенопласта;
хранение в небольших пробирках в жидком азоте (N2) при -180°С.
На фиг.1 показаны фенотипические изменения экспрессии антигенов, определенные методом проточной цитометрии, в моноцитах, используемых после культивирования и стимуляции γ-IFN. Культивирование и стимуляция γ-IFN исходных моноцитов вызывает значительно более высокое связывание GM-7 после модификации (правый график на фиг.1) по сравнению с клетками до модификации (левый график на фиг.1).
Приведенные ниже примеры 3-7 взяты из заявки РСТ/EP03/07551. В указанных примерах рассмотрены клетки, индуцирующие приживляемость трансплантата (TAIC), которые были описаны в указанной заявке. Благодаря сходству между клетками TAIC, описанными в заявке РСТ/EP03/07551, и клетками, индуцирующими аутотолерантность, (STIC) по настоящему изобретению (см. выше) результаты, приведенные в указанных примерах, применимы также к клеткам STIC.
В частности, результаты, полученные в нижеследующих примерах 3-7, показывают, что:
- популяцию клеток с оптимизированной супрессорной функцией можно выделить из популяции TAIC, полученной после культивирования исходных моноцитов с M-CSF и стимуляции γ-IFN, благодаря наличию моноклонального антитела GM-7 (пример 3);
- лимфоциты, присутствующие во фракции моноцитов, оказывают сильное влияние на образование CD14+/CD3+ клеток, эффективно действующих в качестве TAIC (пример 4);
- ингибитор IDO 1-метилтриптофан не влияет на супрессорную функцию TAIC (пример 5);
- прямое сокультивирование in vitro клеток TAIC донора А с лимфоцитами донора В вызывает образование регуляторных Т-клеток, то есть CD4+/CD25+ лимфоцитов (пример 6); и
- физическое межклеточное взаимодействие TAIC донора с лимфоцитами реципиента in vivo вызывает образование регуляторых Т-клеток, способных предотвращать отторжение органа (пример 7).
Пример 3
Связывание антитела GM-7 с TAIC
Моноклональное антитело GM-7 было получено в результате иммунизации мышей клетками TAIC человека, полученными в соответствии с описанием, приведенным в заявке РСТ/EP03/07551. Клетки гибридомы, продуцирующие данное антитело, были депонированы в "Deutsche Sammlung fur Mikroorganismen" под номером доступа DSM ACC2542. Приведенные ниже результаты показывают, что данное антитело специфически связывается с антигеном, экспрессируемым только на CD14+ клетках, которые были подвергнуты 6-дневной модификации ex situ при помощи M-CSF и двухдневной стимуляции γ-IFN по настоящему изобретению.
На фиг.1 показана определенная методом проточной цитометрии способность GM-7 связываться с моноцитами после модификации in vitro, то есть после трансформации в клетки TAIC. Очевидно, что CD14-положительные моноциты, полученные непосредственно из лейкоцитной пленки, не связывают антитело GM-7 (левое изображение; участок, закрашенный серым цветом, соответствует контрольному антителу). В отличие от этого часть моноцитов после культивирования в M-CSF и стимуляции γ-IFN экспрессирует антиген, который распознается моноклональным антителом GM-7. После культивирования, описанного в примере 2, примерно 80% трансформированных моноцитов способны связывать моноклональное антитело GM-7 (правое изображение).
В другом эксперименте супрессорную активность CD14+/GM-7+ клеток сравнивали с активностью CD14+/GM-7- клеток в смешанной культуре лимфоцитов (MLC). Смешанная культура лимфоцитов была получена способом, описанным в публикации Kurnick, J.T. "Cellular Assays" in: Diagnostic Immunopathology, [Colvin R.B., Bhan A.K., McCluskey, R.U (ed.), Raven Press, New York, pages 751-771 (1994)].
В данном примере клетки TAIC были получены у пациента В. Как показано на фиг.2, существует значительное различие между супрессорной активностью GM-7-положительных и GM-7-отрицательных клеток TAIC. Только GM-7-положительная фракция популяции TAIC, полученная после 6-дневной обработки М-CSF и 2-дневной стимуляции γ-IFN, оказывает значительное ингибирующее действие на пролиферативную активность Т-клеток-респондеров пациента А после стимуляции клетками пациента В.
Пример 4
Влияние лимфоцитов на образование CD3+/CD14+ клеток в процессе культивирования моноцитов
Влияние лимфоцитов, присутствующих во фракции моноцитов, на образование CD14+/CD3+ клеток, действующих в качестве TAIC, определяли в результате сравнения двух разных популяций.
Для первой популяции (далее именуемой "Mo") фракцию моноцитов первоначально получали из интерфазы лейкоцитной пленки в соответствии с описанием, приведенным в примере 1. Как описано в примере 2, указанные клетки затем переносили на стадию культивирования с M-CSF. Через один час после начала культивирования моноциты, прикрепленные к основанию колбы для культуры тканей, пять раз промывали 10 мл PBS, при этом количество лимфоцитов, присутствующих в культуре, уменьшалось до <5% (4,8±2,4%), в то время как количество полученных обогащенных моноцитов (CD14+) превышало 90% (92±5,6%). Дополнительными клетками в данной популяции были В-лимфоциты и гранулоциты.
Клетки во второй популяции (далее именуемой "Mo+Ly") также получали из интерфазы лейкоцитной пленки в виде фракции моноцитов в соответствии с описанием, приведенным в примере 1. Однако в отличие от популяции "Mo" клетки, прикрепленные к основанию колбы для культуры тканей, промывали только один раз через 24 часа после начала культивирования по примеру 2. В результате этого была получена популяция клеток, которая состояла из 45 ± 5,3% CD14+ моноцитов и 23,5 ± 8,9% CD2+ лимфоцитов. Аналогично популяции "Mo" в данной популяции также присутствовали лимфоциты и гранулоциты.
Количества клеток соответствующих типов в общей популяции клеток определяли методом проточной цитометрии в трех экспериментальных популяциях (см. фиг.3). Результаты приведены в виде средних значений, включающих стандартное отклонение.
В начале культивирования (день 0) невозможно было определить CD14+/CD3+ клетки ни в популяции "Mo", ни в популяции "Mo+Ly". После культивирования клеток в течение пяти дней эксперимент прекращали и исследовали клетки методом FACS после отделения от основания колбы для культуры тканей в соответствии с описанием, приведенным в примере 2. Было установлено, что относительное количество CD14+ клеток сократилось в указанных популяциях с 92% до 42% в популяции "Mo" и с 45% до 28% в популяции "Mo+Ly". По-видимому, лимфоциты пролиферируют быстрее, чем моноциты; относительное количество лимфоцитов увеличилось в популяции "Mo" с 4,8% до 69,8% и в популяции "Mo+Ly" с 23,5% до 50,6%. В процессе культивирования CD14+/CD3+ клетки, действующие в качестве TAIC, образуются в обеих культурах. В данном контексте важно отметить, что значительно большее увеличение CD14+/CD3+ клеток наблюдалось в популяции "Mo+Ly", составляя 32,0 ± 5,3%, по сравнению с популяцией "Mo", в которой количество указанных клеток было равно только 7,2 ± 3,2%.
Полученные результаты показывают, что очистка клеток с целью обогащения моноцитов до относительного количества более 90% в начале культивирования отрицательно влияет на образование иммуносупрессорных CD14+/CD3+ клеток в популяции TAIC, в то время как способ, описанный в примерах 1 и 2, позволяет получить значительно более высокий выход CD14+/CD3+ клеток.
Пример 5
Определение влияния ингибитора IDO 1-метилтриптофана на иммуносупрессорную активность TAIC
Для определения возможного влияния ингибитора фермента индоламин-2,3-диоксигеназы (IDO) 1-метилтриптофана (1-МТ) на супрессорную функцию клеток TAIC, образованных в популяциях "Mo" и "Mo+Ly" (см. пример 4), были получены разные смешанные культуры лимфоцитов (MLC) с Т-клетками, стимулированными РНА (фитогемаглютинин), в присутствии и отсутствии 1-МТ.
В указанных смешанных культурах лимфоцитов 50000 лимфоцитов с 2 мкг РНА (именуемых "PhaLy") переносили в лунки 96-луночного планшета и пролиферировали в течение 144 часов. Лимфоциты, культивированные только в среде без добавления РНА, использовали в качестве контрольных лимфоцитов (именуемых "Ly").
Для определения пролиферация РНА-стимулированных лимфоцитов в разных сокультурах были получены и исследованы 4 нижеследующие популяции:
После культивирования в течение 144 часов все контрольные культуры и сокультуры продолжали культивировать еще 24 часа в присутствии3[H]-тимидина ("радиоактивный"), после чего определяли количество включенного тимидина, меченного радиоактивным изотопом, в виде числа импульсов/мин (см. фиг.4). В данном случае установленная величина радиоактивности определяет количество меченого тимидина, включенного в ДНК, и поэтому может служить мерой скорости пролиферации лимфоцитов. Величины, приведенные на фиг.4, соответствуют средним значениям для трех определений в 3 экспериментах с указанием стандартного отклонения.
Полученные результаты показали, что лимфоциты, не стимулированные РНА ("Ly"), пролиферируют в незначительной степени, при этом наблюдаемая средняя радиоактивность равна 367 импульсам/мин (см. фиг.4). В отличие от этого стимуляция 2 мкг НРА вызывает значительное увеличение скорости пролиферации лимфоцитов ("PhaLy"), причем наибольшее включение меченого тимидина в указанных образцах было измерено при среднем значении, равном 18459 импульсам в минуту.
Добавление TAIC к культурам лимфоцитов существенно уменьшало скорость пролиферации при введении клеток из популяции "Mo+Ly" по примеру 4 (значение, определенное для PhaLy + "Mo+Ly", равно 1498 импульсам/мин), и уменьшало скорость пролиферации в меньшей степени при введении клеток из популяции "Mo" по примеру 4 (значение, измеренное для PhaLy + "Mo", равно 3369 импульсам/мин).
Результаты, полученные после добавления 2 мкмоль 1-метилтриптофана (1-МТ) к популяциям, содержащим "Mo+Ly" и "Mo" вместе со стимулированными лимфоцитами, показали, что 1-метилтриптофан (1-МТ) синергично увеличивает супрессорную функцию TAIC, при этом уменьшение радиоактивности было более сильным для клеток TAIC из популяции "Mo+Ly" (измеренное значение равно 267 импульсам/мин), чем для клеток TAIC из популяции "Mo" (измеренное значение равно 390 импульсам/мин).
Пример 6
Сокультивирование in vitro клеток TAIC человека с аллогенными лимфоцитами для получения регуляторных Т-клеток
Для проверки индуцирования клетками TAIC образования у реципиента регуляторных Т-клеток, то есть CD4+/CD25+ лимфоцитов, было исследовано in vitro несколько разных культур TAIC с лимфоцитами и проанализировано образование регуляторных Т-клеток в результате такого культивирования.
Для этого клетки TAIC донора А сокультивировали in vitro с лимфоцитами донора В прямым или непрямым методом. При прямом сокультивировании было обеспечено прямое межклеточное контактирование клеток TAIC (донора А) с лимфоцитами (донора В), а при непрямом сокультивировании была использована мембрана ("перегородка для культур клеток", размер пор 0,4 мкм, Falcon, № заказа 353090), которая делала возможным обмен среды, но не допускала физического контактирования двух популяций клеток. Прямое или непрямое сокультивирование осуществляют в течение предпочтительно 3-5 дней, более предпочтительно в течение 4 дней в условиях термостата, то есть при 37°С в атмосфере 5% СО2.
После культивирования определяли соответствующее число регуляторных Т-клеток (CD4+/CD25+) в обеих популяциях, а также в контрольных культурах, в которых TAIC или лимфоциты культивировали отдельно. Кроме того, в контрольной популяции, в которой отдельно культивировали TAIC, определяли число CD3+/CD14+ клеток, представляющих собой часть популяции клеток TAIC, обладающую наиболее значительной супрессорной функцией в смешанной культуре лимфоцитов.
Во всех популяциях методом FACS определяли поверхностные антигены клеток и анализировали число соответствующих популяций клеток в общем количестве клеток.
Кроме того, методом PCR определяли относительную экспрессию трех новых основных генов, специфически экспрессированных регуляторными Т-клетками (Foxp3, CTLA-4 и интегрин αЕβ7) в соответствующей популяции клеток (см. таблицу). Foxp3 является специфическим фактором транскрипции и считается геном, контролирующим образование регуляторных Т-клеток, который специфически экспрессируют указанные клетки [см. публикацию Hori, S. et al., "Control of Regulatory T-cell Development by the Transcription Factor Foxp3", Science 299, 1057-1061 (2003)].
CTLA-4 является еще одним фактором, используемым в качестве маркера для определения регуляторной функции CD4+/CD25+ Т-клеток (см. публикации Khattri, R. et al., "An essential role for Scurfin in CD4+/CD25+ Т regulatory cells", Nature Immunology, online publication, doi:10.1038/ni909 (2003); Shimizu, J. et al. "Stimulation of CD25+/CD4+ regulatory Т cells through GITR breaks immunological self-tolerance", Nature Immunology, online publication, doi:10.1038/ni759 (2003); Cobbold, S.P. et al. "Regulatory Т cells in the induction and maintenance of peripheral transplantation tolerance", Transpl. Int. 16(2), 66-75 (2003)].
Интегрин αЕβ7 является интегрином, который связывается с катерином эпителия и может быть использован в качестве маркера для наиболее сильной субпопуляции регуляторных CD25+ Т-клеток [см. публикацию Lehmann, J. et al "Expression of the integrin αЕβ7 identifies unique subsets of CD25+ as well as CD25- regulatory T cells" PNAS 99(20), 13031-13036 (2002)].
Экспрессию Foxp3, CTLA-4 и интегрина αЕβ7 определяли количественным методом PCR, используя GAPDH и β-актин, два гена "домашнего хозяйства", в качестве контрольных генов; с одной стороны, измеренные величины были скоррелированы друг с другом, и значение, полученное для CD14+/CD3- клеток, было принято равным 1; с другой стороны, абсолютные количества РНК были определены в мкг на 1 мкг общей РНК для корреляции измеренной супрессии, достигаемой TAIC in vitro, и образования дважды положительных клеток CD4+/CD25+ со скоростью экспрессии соответствующих генов. Для выполнения количественной PCR использовали стандартные методы, хорошо известные квалифицированному специалисту (см. публикацию Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998).
В таблице показано, что в популяции лимфоцитов, полученной в результате прямого сокультивирования, процентное содержание дважды положительных клеток CD4+/CD25+ многократно увеличивается до значения, равного 8,7%, по сравнению с количеством CD4+/CD25+ лимфоцитов, полученных в результате непрямого сокультивирования или в контрольных культурах, где были соответственно получены значения, равные 2,38% и 2,65%.
Субпопуляция CD4+/CD25+ клеток экспрессирует наибольшие относительные количества мРНК для всех испытанных основных генов по сравнению с экспрессией в CD4+/CD25- клетках (см. таблицу). Хотя экспрессия Foxp3 увеличивается примерно в 10 раз (37 по сравнению с 3,75), экспрессия CTLA-4 достигает еще большего максимального значения (4699 по сравнению с 0,376). Увеличение экспрессии третьего основного гена интегрина αЕβ7 в CD4+/CD25+ клетках в процессе сокультивирования является почти таким же высоким, что и для CTLA-4, так как абсолютное количество мРНК интегрина увеличивается до 1,4×10-9 в CD4+/CD25+ клетках по сравнению с 3,4×10-12 мкг мРНК/мкг общей РНК в CD4+/CD25- клетках.
После непрямого сокультивирования относительное количество мРНК Foxp3 в субпопуляции CD4+/CD25+ клеток составляет только 10 и является даже ниже, чем относительное количество, экспрессированное лимфоцитами в контрольной культуре, которая экспрессирует относительное количество мРНК Foxp3, равное 15.
Относительное количество мРНК CTLA-4, экспрессированное лимфоцитами в контрольной культуре, составляет 0,375 в популяции CD4+/CD25+ клеток и 0,1 в популяции CD4+/CD25- клеток.
Экспрессия CTLA-4 в субпопуляции CD14+/CD3+ клеток TAIC была аналогична экспрессии Foxp3 и значительно выше, чем во всех других популяциях клеток.
В данной связи следует отметить, что экспрессия CTLA-4 (относительное значение равно 12,500) была в несколько раз выше в субпопуляции CD14+/CD3+ клеток, чем экспрессия Foxp3, относительное значение которой было равно 50.
Экспрессия интегрина αЕβ7 не была обнаружена в субпопуляции CD14+/CD3- клеток TAIC, в то время как аналогично экспрессии двух других анализированных генов экспрессия интегрина в субпопуляции CD14+/CD3+ клеток TAIC, измеренная в виде абсолютного значения в мкг РНК на 1 мкг общей РНК, достигала наибольшего значения (3,4×109 мкг/мкг общей РНК).
Значительное увеличение экспрессии трех маркеров лимфоцитов Foxp3, CTLA-4 и интегрина αЕβ7 в клетках TAIC, выделенных из моноцитов, по сравнению с нормальными лимфоцитами является весьма неожиданным и до настоящего времени не наблюдалось в моноцитах или клетках, выделенных из моноцитов.
В заключение можно отметить, что результаты, полученные в данном примере и приведенные выше, показывают следующее: если предположить, что уровень экспрессии Foxp3, CTLA-4 и интегрина αЕβ7 соответствует иммунорегуляторным свойствам соответствующих клеток, как это было продемонстрировано в описании изобретения, то супрессорная активность субпопуляции CD3+/CD14+ клеток TAIC ассоциирована с высокой экспрессией указанных трех генов. Это кажется еще более удивительным, если учесть, что указанные маркеры до настоящего времени были описаны только для лимфоцитов и не соотносились с клетками моноцитарного происхождения.
Как было показано выше, прямое сокультирование TAIC с лимфоцитами вызывает образование значительно большего количества CD4+/CD25+ лимфоцитов по сравнению с непрямым сокультивированием и культивированием только лимфоцитов. Такой вывод подтверждает предположение, что in vivo (то есть в организме пациента) регуляторные Т-клетки образуются после введения TAIC. Полученные результаты согласуются с известной иммунорегуляторной функцией CD4+/CD25+ лимфоцитов, а также с тем, что содержание мРНК Foxp3, CTLA-4 и интегрина αЕβ7 в указанных клетках значительно выше, чем в лимфоцитах, полученных в результате непрямого сокультивирования, или в контрольных лимфоцитах.
Пример 7
Индукция in vivo толерантности к трансплантату под действием лимфоцитов, полученных в результате сокультивирования с TAIC in vitro
Результаты и выводы, приведенные в примере 6, были подтверждены in vivo в эксперименте на животных. В данном примере животным в отобранных инбредных комбинациях инъецировали лимфоциты, полученные у реципиента, которые в течение 5 дней предварительно подвергали прямому сокультивированию с TAIC, полученными у донора. Другим животным инъецировали в качестве контрольной культуры лимфоциты реципиента, которые культивировали в среде отдельно.
У животных, которым вводили аутологичные сокультивированные лимфоциты реципиента до аллогенной трансплантации сердца, возникала специфическая толерантность к донору, в то время как контрольные животные, которым вводили не подвергнутые сокультивированию контрольные лимфоциты реципиента, остро отторгали трансплантированное сердце в течение 10-14 дней.
Подобный результат был подтвержден методом проточной цитометрии, с помощью которого определяли экспрессию GM-7 в крови оперированных пациентов до инъекции (левая фигура) и после инъекции лимфоцитов, подвергнутых сокультивированию с TAIC. Фракция GM-7-связывающих клеток увеличивается примерно с 0,5% до инъекции примерно до 21% после инъекции, свидетельствуя об образовании регуляторных Т-клеток, способных связывать GM-7.
Полученные результаты показывают, что физическое межклеточное взаимодействие TAIC донора с лимфоцитами реципиента индуцирует образование регуляторных Т-клеток, которые сами по себе способны модифицировать сингенную иммунную систему реципиентов, обеспечивая подавление потенциально аллореактивных Т-клеток и предотвращая отторжение органа.
Пример 8
Применение клеток, индуцирующих аутотолерантность (STIC), для лечения хронического колита, вызванного декстрансульфатом натрия (DSS)
Колит может быть вызван у мышей химическим путем в результате перорального введения декстрансульфата натрия вместе с питьевой водой. Введение указанного вещества в течение 7 дней приводит к возникновению острого колита, и повторное введение DSS на протяжении по крайней мере четырех циклов с последующим потреблением животными обычной воды в течение 10 дней вызывает возникновение хронического колита, напоминающего язвенный колит человека.
Данная система хорошо подходит для иммунологических или молекулярных исследований (см., например, публикации Herfarth, H. et al. "Nuclear factor KB activity and intestinal inflammation in dextran sulphate sodium (DSS)-induced colitis in mice is suppressed by gliotoxin" Clin. Exp. Immunol. 120, 59-65 (2000); Egger, В et al. "Mice lacking transforming growth factor α have an increased susceptibility to dextran sulfate-induced colitis" Gastroenterology 113, 825-832 (1997)] и использована в данном изобретении для проверки возможности применения STIC для лечения хронического варианта DSS-вызванного колита, напоминающего аутоиммунный язвенный колит человека.
Здоровых самок мышей BALB/c (с массой тела 20 г) содержали в условиях с неограниченным доступом к воде и кормили стандартным кормом. Мышам на протяжении четырех циклов давали в качестве питья воду, содержащую 5% (мас/об) декстрансульфата натрия (DSS; данный раствор далее определяется как DSS-вода), и затем необработанную воду в соответствии с нижеследующей схемой:
После 58-го дня у всех мышей наблюдались симптомы хронического колита, который длился в течение по крайней мере 2 месяцев (фиг. 6А и 6В).
Затем мышей произвольно распределяли в четыре разные группы:
Всех мышей умерщвляли на 79-й день, через три недели после окончания четвертого цикла потребления в качестве питья DSS-воды.
В ходе экспериментов массу тела животных измеряли три раза в неделю во время введения DSS и на протяжении трех последующих недель. Изменения массы тела животных выражены в процентах (потеря или прирост массы) по сравнению с массой тела мышей на 59-й день, когда была начата клеточная терапия. Изменения в пределах около 5-15% считаются значительными.
Изменения массы тела мышей в течение 3 недель после окончания потребления мышами DSS показаны на фиг. 7. Как можно видеть на данной фигуре, введение STIC в день +1 (группа 1 = □) вызывает соответствующий возрасту прирост массы, который отсутствует у животных, которых не подвергали лечению (группа 3 = ▼), у животных, которым вводили "контрольные клетки" в день +1 (группа 4 = ● и у животных, которым вводили STIC в день +7 (группа 2 = ▲) в процессе развития болезни. Приведенные величины являются средними значениями, полученными у 5-7 мышей в группе, при этом стандартное отклонение всегда ниже ± 15%.
В другом эксперименте ткань ободочной кишки гистологически окрашивали гематоксилином и эозином (H&E). Окрашивание H&E выполняли методом, описанным в публикации Woods, A.E. and Ellis, R.C. (eds.) (Laboratory Histopathology: A Complete Reference, vol. 1 & 2; Churchill & Livingstone, 1994). Состояние окрашенной слизистой оболочки оценивали два независимых патоморфолога, не знакомых с методикой эксперимента, в соответствии с нижеследующей схемой:
Результаты балльной оценки показаны на фиг.8. Через три недели после окончания четвертого цикла потребления в качестве питья DSS-воды контрольные животные в группе 3 (которым не инъецировали клетки) имели среднюю оценку около 4, в то время как животные в группе 1 (которым вводили STIC в день +1) или в группе 2 (которым вводили STIC в день +7) имели значительно меньшие средние балльные оценки, соответственно равные примерно 1 (группа 1) и примерно 1,5 (группа 2). Животные, которым вводили "контрольные клетки" (группа 4), имели среднюю оценку около 3, которая является почти такой же высокой, как и оценка мышей, не получавших никакого лечения (группа 3).
Полученные результаты сопоставимы с результатами гистологической оценки окрашенных срезов ободочной кишки (окрашивание H&E, см. выше), как показано на фиг.6. Данная оценка имеет наиболее важное значение для определения эффекта лечения с помощью клеток STIC. На фиг. 6А (2,5-кратное увеличение) и 6В (10-кратное увеличение) показано состояние ободочной кишки у животных в группе 3, не получавших никакого лечения, где видна сильно разрушенная слизистая оболочка и большое количество клеток воспалительного инфильтрата в окружающих тканях. На указанных фигурах показана прогрессирующая стадия колита. В отличие от прогрессирующего развития колита у животных, не получавших никакого лечения, (фиг. 6А/В), морфология слизистой оболочки в значительной степени сохранена у животных в группе 1, которым вводили STIC в день +1 (фиг. 6С (2,5-кратное увеличение) и 6D (10-кратное увеличение)). У указанных животных можно видеть лишь незначительные признаки воспаления и разрушения слизистой оболочки без проникновения в окружающие ткани. Срезы ободочной кишки у животного в группе 4, которому вводили "контрольные клетки" в день +1 (фиг. 6Е; 2,5-кратное увеличение), и у животного в группе 2, которому вводили STIC в день +7 (фиг. 6F; 2,5-кратное увеличение), характеризуются признаками прогрессирующего колита с сильно разрушенной слизистой оболочкой и наличием большого количества клеток воспалительного инфильтрата в окружающих тканях, которые аналогичны признакам, наблюдаемым у животных, не получавших никакого лечения (фиг. 6А/В).
Результаты рассмотренных выше экспериментов показывают, что введение STIC в день +1 после окончания потребления мышами DSS для индукции колита может подавлять или значительно ослаблять симптомы колита. У животных, которым вводили STIC, отсутствует значительная потеря массы тела (фиг. 7), их гистологическая оценка значительно ниже по сравнению с животными, не получавшими никакого лечения, (фиг. 8) и общее состояние слизистой оболочки ободочной кишки является почти нормальным, о чем свидетельствуют результаты гистологического окрашивания срезов ободочной кишки (фиг. 6 С/D). Клетки STIC, введенные в день +7, (группа 2) не способны лечить колит, прогрессирующий в течение 7 дней до введения STIC. Хотя в данном случае не происходит реверсии колита, прекращается развитие болезни, о чем свидетельствует более низкая гистологическая оценка у животного в группе 2 по сравнению с животным в группе 3, не получавшим никакого лечения (фиг. 8). Такое явление является специфическим для модели DSS-вызванного колита, использованной в данном примере, и не может быть перенесено на другие заболевания.
Смесь клеток костного мозга, клеток периферической крови и клеток селезенки, представляющих собой некультивированные клетки, полученные из селезенки сингенных мышей, не пригодны для лечения колита, так как у животных, которым вводили указанные клетки, (группа 4) обнаружены такие же тяжелые симптомы, как и у животных, не получавших никакого лечения (фиг. 6 E/F; фиг. 7 и 8). Такой результат ясно свидетельствует о том, что только клетки STIC способны лечить колит в отличие от других клеток, присутствующих в смеси клеток, используемых для получения STIC в процессе культивирования.
Пример 9
Применение клеток, индуцирующих аутотолерантность, (STIC) для лечения колита, вызванного у мышей с тяжелым комбинированным иммунодефицитом путем переноса CD4+CD62L+ лимфоцитов
Искусственная индукция колита у мышей с SCID (тяжелый комбинированной иммунодефицит) является еще одним методом анализа STIC и их способности лечить аутоиммунные заболевания.
Мыши с SCID не имеют Т- и В-клеток. Их иммунная система может быть восстановлена путем переноса специфической субпопуляции клеток щитовидной железы. Указанные клетки, именуемые CD4+CD62L+ или CD62Lhigh, репопулируют иммунную систему, но из-за отсутствия контроля они также вызывают возникновение спонтанного колита с хроническим воспалением. Данная модельная система является так называемой "моделью хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID" [см., например, публикацию Mudter, J. et al. "A new model of chronic colitis in SCID mice induced by adoptive transfer of CD62L+ CD4+ T cells: Insights into the regulatory role of interleukin-6 on apoptosis" Pathology 70, 170-176 (2002)], которая позволяет произвести более специфический анализ популяций клеток, участвующих в возникновении колита, служащего в качестве примера аутоиммунных заболеваний.
Указанную модель используют для исследования потенциала клеток STIC для лечения колита, вызванного нарушением иммунной системы. Данная модель позволяет произвести механические исследования, но считается более слабой по сравнению с модельной системой DSS (см. приведенный выше пример 8), так как иммунная система не полностью репопулирована.
Мышам BALB/c SCID (с массой тела 18-22 г) внутрибрюшинно инъецируют 1×106 CD4+/CD62L-селектинhigh Т-клеток, выделенных из селезенок здоровых мышей BALB/c при помощи системы сортировки клеток магнитными гранулами (Milteny Biotech, Germany) в PBS. Мышей содержат в условиях с неограниченным доступом к воде и кормят стандартным кормом.
Через 4-6 недель после переноса CD4+/CD62L-селектинhigh Т-клеток у мышей возникает колит. Возникновение колита определяют по изменению массы тела.
Затем мышей произвольно распределяют в три разные группы:
Всех крыс умерщвляли через 10-12 недель после переноса вызывающих болезнь Т-клеток или после того, как у контрольных животных в основной контрольной группе 2 возникали признаки колита, определяемые по изменениям массы тела.
Аналогично модели DSS, описанной в примере 8, массу тела животных измеряли три раза в недели на протяжении всего эксперимента. Изменения массы тела животных выражены в процентах (потеря или прирост массы) по сравнению с массой тела мышей через 6 недель после начала эксперимента, когда была начата клеточная терапия. Изменения в пределах около 5-15% считаются значительными.
Изменения массы тела у мышей на протяжении всего эксперимента показаны на фиг. 9. Через 6 недель мыши во всех группах имеют почти одинаковую массу тела. В то время как введение STIC через 6 недель (группа 1 =

Сразу же после умерщвления у животных определяли длину ободочной кишки и массу селезенки. Обе величины позволяют оценить степень воспаления, но являются не очень чувствительными.
На фиг.10 показаны результаты измерений длины ободочной кишки (фиг. 10А) и массы селезенки (фиг. 10В). Как можно видеть на данной фигуре, ободочные кишки животных, которым вводили STIC (группа 1), значительно длиннее (примерно 11 см), и их селезенки значительно меньше (примерно 50 мг) по сравнению с контрольными животными. У контрольных животных в группе 2 были более короткие ободочные кишки (примерно 10,3 см) и увеличенные селезенки (примерно 100 мг), что свидетельствует о сильном воспалении, при этом у животных, которым вводили контрольные клетки (группа 3), наблюдались менее выраженные признаки колита (длина ободочной кишки около 10,6 см и масса селезенки около 60 мг) по сравнению с контрольными животными (группа 2), но более сильный колит по сравнению с животными, которым вводили STIC (группа 1).
В другом эксперименте ткань ободочной кишки гистологически окрашивали гематоксилином и эозином (окрашивание H&E; Woods, A.E. and Ellis, R.C. (eds.); Laboratory Histopathology: A Complete Reference, vol. 1 & 2; Churchill & Livingstone, 1994). Как было указано в примере 8, состояние слизистой оболочки оценивали два независимых патоморфолога, не знакомых с методикой эксперимента. Схема оценки слизистой оболочки была такой же, как в примере 8:
Средняя оценка приведена на фиг.11. Через шесть недель после переноса клеток контрольные животные в группе, которым не инъецировали никаких клеток, имели среднюю оценку около 3, указывающую на наличие тяжелого колита. Мыши в группе 1, которым вводили STIC, и мыши в группе 2, которым вводили контрольные клетки, через 6 недель имели значительно более низкие средние оценки, соответственно равные примерно 1,5 (свидетельствующие о наличии минимального колита; группа 1) и примерно 2,5 (свидетельствующие о наличии колита средней тяжести; группа 2).
Полученные результаты также согласуются с результатами гистологической оценки срезов ободочной кишки, окрашенных H&E, как можно видеть на фиг.12 (100-кратное увеличение). На фиг. 12 А/В показано состоянии ободочных кишок у животных в группе 3, которые не получали никакого лечения после индукции колита CD62Lhigh Т-клетками. В обоих примерах отмечена явная инфильтрация мононуклеарными клетками и значительная утрата целостности слизистой оболочки, поражение крипты и инфильтрация подслизистой основы и мышечной пластинки. Инъекция "контрольных клеток" (моноциты, выделенные из крови без использования М-CSF и не стимулированные γ-интерфероном, ткань костного мозга и/или селезенки) не предотвращала инфильтрацию мононуклеарными клетками и утрату слизистой оболочки, как показано на фиг. 12С/D. В обоих образцах обнаружена также значительная инфильтрация подслизистой основы лимфоцитами, но мышечная пластинка все еще остается неповрежденной. Введение STIC после индукции колита CD62Lhigh Т-клетками значительно улучшает целостность слизистой оболочки (фиг. 12Е/F). На срезах ободочной кишки в обоих образцах видна лишь незначительная инфильтрация лимфоцитами, отсутствует разрушение крипты и поражение подслизистой основы и мышечной пластинки в анализированных сегментах кишечника.
Аналогично результатам, полученным для введения STIC с целью лечения хронического колита, вызванного декстрансульфатом натрия (DSS), (см. приведенный выше пример 8) на примере использования модели хронического экспериментального колита у мышей с SCID, вызванного переносом CD62L+/CD4+ лимфоцитов, также показано, что клетки STIC способны подавлять или значительно ослаблять симптомы вызванного колита. У мышей, которым вводили STIC, наблюдается соответствующий возрасту прирост массы тела (фиг. 9), из ободочной кишка является значительно длиннее (фиг. 10А) и масса селезенки значительно меньше (фиг. 10В), чем у мышей в контрольной группе, страдающих тяжелым воспалением ободочной кишки. И наконец, гистологическая оценка мышей, которым вводили STIC, значительно ниже по сравнению с животными, не получавшими никакого лечения (фиг. 11), и гистологический анализ срезов ободочной кишки у мышей, которым вводили STIC, свидетельствует о наличии незначительных признаков или о полном отсутствии признаков колита (фиг. 12).
По сравнению с эффектом лечения колита при помощи STIC смесь клеток костного мозга, клеток периферической крови и клеток селезенки, представляющих собой некультивированные клетки, полученные из селезенки сингенных мышей, характеризуется гораздо меньшей эффективностью, так как у животных, которым вводили указанные клетки (группа 3), наблюдаются гораздо более тяжелые симптомы, чем у животных, которым вводили STIC (фиг. 9, 10 А/В, 11 и 12). В отличие от результатов, полученных в примере 8 c использованием модельной системы DSS, в модели колита, вызванного CD62Lhigh клетками, контрольные клетки могут ослаблять симптомы колита в некоторой степени, так как у животных, которым вводили контрольные клетки, наблюдаются менее тяжелые симптомы по сравнению с контрольными животными, которым не вводили никаких клеток.
В соответствии с результатами, полученными в примере 8, приведенные данные также ясно свидетельствуют о том, что клетки STIC по настоящему изобретению способны лечить аутоиммунные заболевания.
Реферат
Настоящее изобретение относится к медицине, а именно к иммунотерапии. Предложен способ получения и/или размножения аутологичных регуляторных Т-клеток моноцитарного происхождения, коэкспрессирующих на своей поверхности антигены CD3 и CD14. Клетки пригодны для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, в частности, аутоиммунных заболеваний и аллергий, а также для производства фармацевтических препаратов. Данные клетки являются аутологичными для пациента, которому они должны быть введены. 10 н. и 28 з.п. ф-лы, 4 табл., 12 ил.

Комментарии