Способы лечения воспалительных заболеваний ободочной кишки - RU2515156C2
Код документа: RU2515156C2
Чертежи















Описание
Область техники, к которой относится изобретение, и известный уровень техники
Настоящее изобретение в некоторых вариантах его осуществления относится к способам лечения воспалительных заболеваний ободочной кишки с использованием прикрепляющихся клеток из жировой ткани или ткани плаценты и, более конкретно, но не исключительно, к способам лечения язвенного колита или болезни Крона с использованием прикрепляющихся клеток.
В развивающемся медицинском мире существует растущая потребность в больших количествах стволовых клеток взрослого человека с целью их пересадки и тканевой инженерии. Кроме того, лечение стволовыми клетками взрослого человека постоянно развивается в отношении терапии и лечения различных состояний, таких как гематопоетические нарушения, заболевание сердца, болезнь Паркинсона, болезнь Альцгеймера, удар, ожоги, мышечная дистрофия, аутоиммунные нарушения, диабет и артрит.
В последние годы значительная активность сфокусирована на терапевтическом потенциале мезенхимальных стволовых клеток (MSCs) в плане их различного медицинского применения, включая репарацию тканей поврежденных органов, таких как мозг, сердце, кость и печень, и для поддержки трансплантаций костного мозга (BMT). MSCs, гетерогенная популяция клеток, полученных из, например, костного мозга, жировой ткани, плаценты и крови, способна к дифференцировке в различные типы зрелых мезенхимальных клеток (например, в ретикулярные эндотелиальные клетки, фибробласты, адипоциты, остеогенные клетки-предшественники), в зависимости от влияний различных биологически активных факторов. Соответственно, MSCs широко исследуются в регенеративной медицине в качестве основы для построения новых тканей, таких как кость, хрящ и жировая ткань для репарации повреждения или замещения патологических тканей и в качестве лечения генетических и приобретенных заболеваний. Более того, способность MSCs к мультипотентности, легкость их выделения и культивирования, а также их высокий потенциал экспансии ex vivo делает их привлекательным терапевтическим средством.
Воспалительное заболевание кишечника (IBD), группа воспалительных состояний толстого кишечника и тонкого кишечника включает болезнь Крона и язвенный колит и является хроническим, рецидивирующим и стихающим состоянием неизвестной природы, которое поражает, по меньшей мере, 1 из 1000 людей в западных странах.
Болезнь Крона (также известная как гранулематозный колит и регионарный энтерит), аутоиммунное заболевание, вызываемое поражающим воздействием иммунной системы на желудочно-кишечный тракт и индукцией воспаления в желудочно-кишечном тракте, представляет собой воспалительное заболевание, которое может поражать любую часть желудочно-кишечного тракта от ротовой полости до ануса, вызывая широкий спектр симптомов. В первую очередь оно вызывает боль в брюшной полости, диарею, рвоту и потерю веса, но может также вызывать осложнения вне желудочно-кишечного тракта, такие как кожная сыпь, артрит и воспаление глаза. В настоящее время не существует известного лекарственного или хирургического лечения болезни Крона, и варианты лечения ограничиваются контролированием симптомов, поддержанием ремиссии и предотвращением рецидива (например, составы 5-аминосалициловой (5-ASA) кислоты, кортикостероиды, такие как преднизон и гидрокортизон, и иммуномодуляторы, такие как азатиоприн и меркаптопурин).
Язвенный колит, форма колита, представляет собой заболевание кишечника, конкретно толстого кишечника или ободочной кишки, которое включает характерные язвы или открытые раны в ободочной кишке. Главным симптомом активной формы заболевания является обычно постоянная диарея, смешанная с кровью. Современное лечение язвенного колита включает противовоспалительные лекарственные средства, иммуносупрессию и биологическое лечение, направленное на специфические компоненты иммунного ответа. Иногда необходима колэктомия (частичное или полное удаление толстой кишки путем хирургического вмешательства), и это рассматривается как лечение заболевания.
Okamoto et al. [Okamoto et al., выше] и Matsumoto et al. [Matsumoto et al., Gastroenterology (2005) 128: 1851-1867] продемонстрировали, что клетки, происходящие из костного мозга (BMDCs), могут возрождать популяцию эпителия желудочно-кишечного тракта человека после заболевания трансплантат против хозяина или образования язвы желудка после облучения и трансплантации костного мозга. Komori et al. 2005 [Komori et al., J Gastroenterol (2005) 40:591-599] также сообщали о временном увеличении эпителиальных клеток слизистой, происходящих из костного мозга, и миофибробластов в процессе заживления язв желудка и индуцированного тринитробензолсульфоновой кислотой (TNBS) колита у крыс. Кроме того, компания Osiris (www.osiris.com), специализирующаяся на клинической медицине, дает оценку Prochymal, продукту, происходящему из MSCs костного мозга, для лечения болезни Крона. Osiris в настоящее время проводит многоцентровое испытание для оценки безопасности и эффективности Prochymal для болезни Крона.
В публикации PCT № WO 2008/100498 раскрываются способы лечения заболеваний, связанных с иммунной системой (например, воспалительного заболевания кишечника, болезни трансплантат против хозяина), с использованием стволовых клеток плаценты или стволовых клеток пуповины. Раскрытые стволовые клетки происходят из плаценты млекопитающих, независимо от морфологии, маркеров клеточной поверхности или количества пересевов после первичного культивирования, и прикрепляются к субстрату тканевой культуры (например, к пластику для культивирования ткани или к покрытому фибронектином планшету для тканевой культуры).
В публикации США № 20080213227 раскрываются способы лечения аутоиммунных заболеваний и воспалительных заболеваний (например, воспалительного заболевания кишечника и болезни Крона) путем введения мезенхимальных стволовых клеток в эффективном количестве. Раскрытые мезенхимальные клетки могут быть получены из прикрепляющихся клеток костного мозга или периостальных клеток, или альтернативно из крови, кожи, пуповинной крови, мышцы, жировой ткани, кости или перихондрия.
В публикации PCT № WO 2007/108003 раскрываются способы клеточной экспансии, которые включают культивирование прикрепляющихся клеток из плаценты или жировой ткани в условиях трехмерного культивирования, которое поддерживает клеточную экспансию. Предлагаются также клетки, полученные таким образом, и варианты их применения.
Краткое изложение сущности изобретения
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, предлагается способ лечения язвенного колита или болезни Крона у нуждающегося в этом индивидуума, причем способ включает введение индивидууму терапевтически эффективного количества прикрепляющихся клеток из плаценты или жировой ткани, в результате чего происходит лечение язвенного колита или болезни Крона.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, предлагается применение прикрепляющихся клеток из плаценты или жировой ткани для получения лекарственного средства, идентифицированного как для лечения язвенного колита или болезни Крона.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения предлагается продукт производства, включающий упаковочный материал, который включает этикетку для использования при лечении язвенного колита или болезни Крона, причем в упаковочный материал упаковано фармацевтически эффективное количество прикрепляющихся клеток из плаценты или жировой ткани.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки включают позитивный маркер экспрессии, выбранный из группы, состоящей из CD73, CD90, CD29 и CD105.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки включают негативный маркер экспрессии, выбранный из группы, состоящей из CD3, CD4, CD45,
CD80, HLA-DR, CD11b, CD14, CD19, CD34 и CD79.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки способны подавлять иммунную реакцию.
В соответствии с некоторыми вариантами осуществления изобретения, подавление иммунной реакции включает подавление активности Т-клеток.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки получают из трехмерной (3D) культуры.
В соответствии с некоторыми вариантами осуществления изобретения, трехмерная (3D) культура включает 3D-биореактор.
В соответствии с некоторыми вариантами осуществления изобретения, культивирование прикрепляющихся клеток в 3D культуре производят в условиях перфузии.
В соответствии с некоторыми вариантами осуществления изобретения, культивирование прикрепляющихся клеток производят в течение, по меньшей мере, трех дней.
В соответствии с некоторыми вариантами осуществления изобретения, культивирование прикрепляющихся клеток производят до тех пор, пока, по меньшей мере, 10% прикрепляющихся клеток пролиферируют.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки включают профиль экспрессии генов, как описано в таблице 11.
В соответствии с некоторыми вариантами осуществления изобретения прикрепляющиеся клетки включают культивируемые клетки из плаценты или жировой ткани в условиях 2-х-мерного (2D) культивирования.
В соответствии с некоторыми вариантами осуществления изобретения, по меньшей мере, 12% прикрепляющихся клеток находится в S и/или G2/M фазе пролиферации.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки включают профиль экспрессии генов, как описано в таблице 8.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки менее коммитированы в сторону остеогенной линии дифференцировки по сравнению с прикрепляющимися клетками, происходящими из костного мозга, при выращивании и обеспечении возможности дифференцироваться в тех же самых условиях.
В соответствии с некоторыми вариантами осуществления изобретения, прикрепляющиеся клетки менее коммитированы в сторону адипогенной линии дифференцировки по сравнению с прикрепляющимися клетками, происходящими из костного мозга, при выращивании и обеспечении возможности дифференцироваться в тех же самых условиях.
В соответствии с некоторыми вариантами осуществления изобретения, продукт производства кроме того, включает дополнительное лекарственное средство для лечения воспаления ободочной кишки.
В соответствии с некоторыми вариантами осуществления изобретения, продукт производства дополнительно включает иммуносупрессорный агент.
В соответствии с некоторыми вариантами осуществления изобретения, продукт производства дополнительно включает противовоспалительный агент.
Если не указано иначе, все технические и/или научные термины, используемые в настоящем описании, имеют то же самое значение, что и обычно понимаемое специалистом в области техники, к которой принадлежит изобретение. Хотя методы и вещества, сходные или эквивалентные описанным в настоящем документе, могут быть использованы в практике или тестировании вариантов осуществления изобретения, иллюстративные методы и/или вещества описываются ниже. В случае конфликта должно контролироваться описание патента, включая определения. Кроме того, вещества, методы и примеры являются только иллюстративными и не предназначены для обязательного ограничения.
Краткое описание фигур
В настоящем документе только в качестве примера описаны некоторые варианты осуществления изобретения со ссылкой на сопровождающие фигуры. В настоящем разделе при конкретной ссылке на фигуры в подробностях подчеркивается, что представленные подробности даны в качестве примера и в целях иллюстративного обсуждения вариантов осуществления изобретения. В этом отношении описание, взятое вместе с фигурами, делает очевидным для специалистов в данной области техники, как варианты осуществления изобретения могут быть осуществлены на практике.
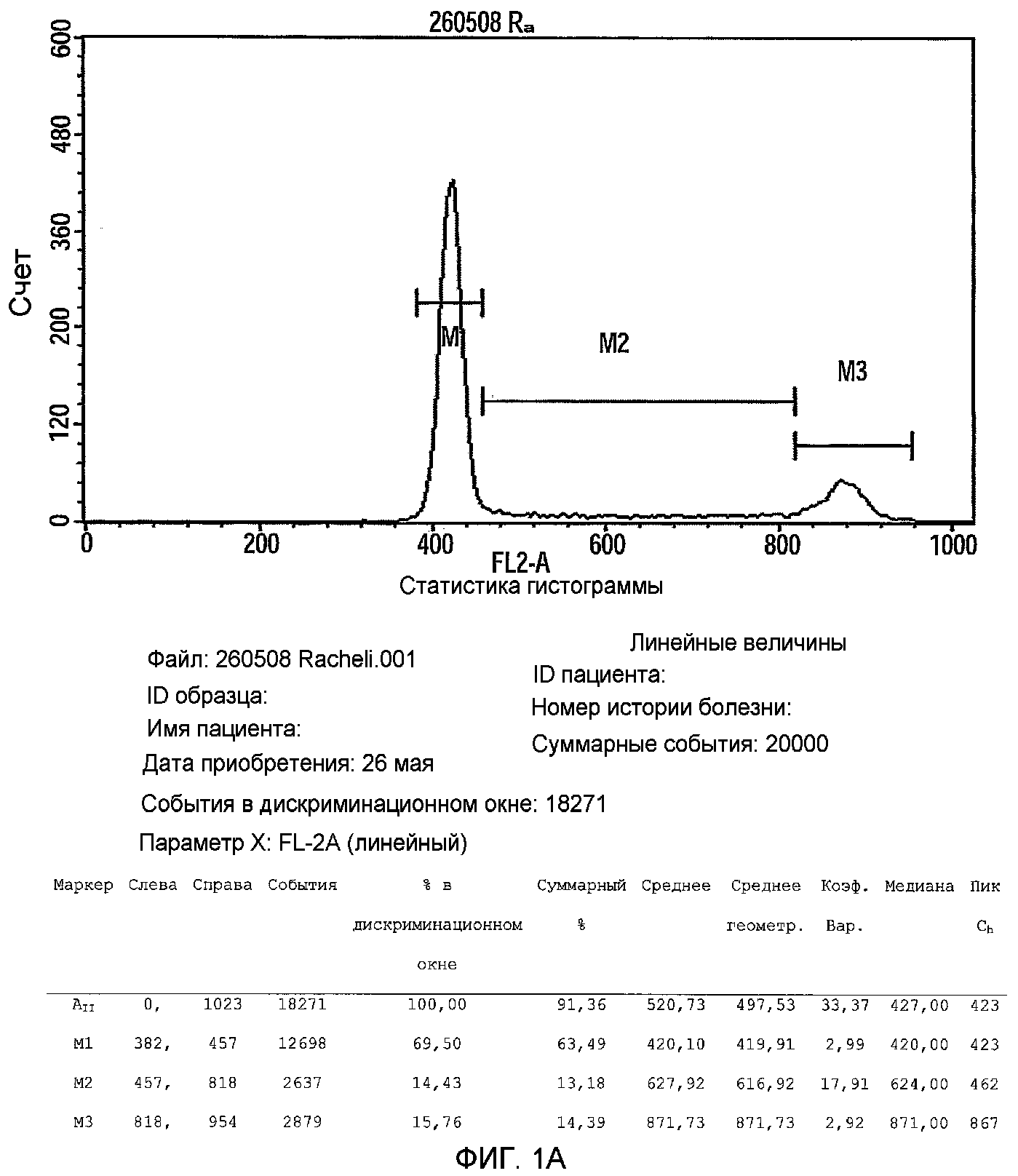
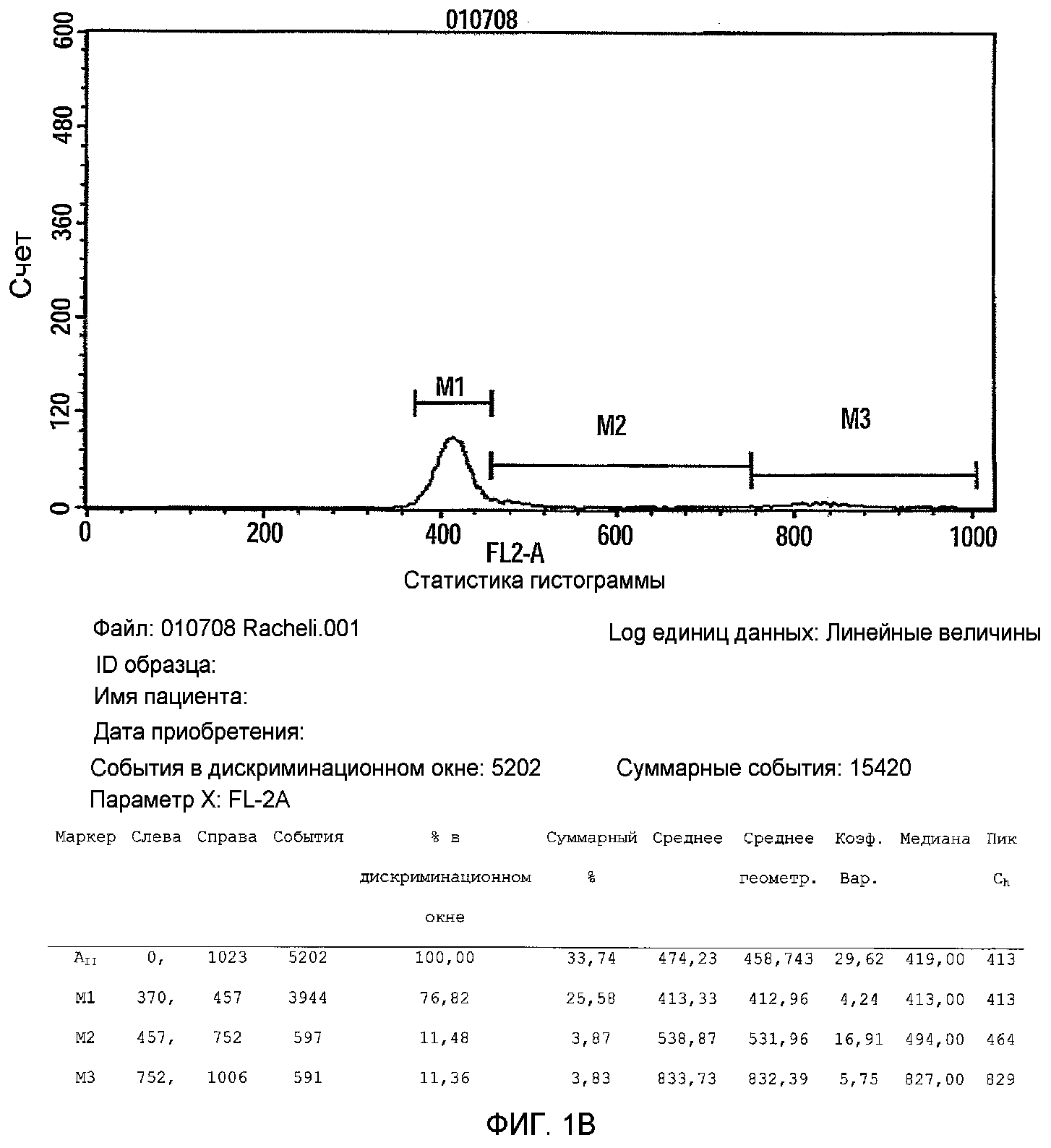
Фиг.1A-B представляют собой фигуры, изображающие анализ клеточного цикла 2D прикрепляющихся клеток плаценты, подходящих для применения в соответствии с настоящими указаниями (фиг.1A), или прикрепляющихся клеток, полученных в соответствии с указаниями патента WO/2007/108003, обозначенных как PLX (фиг.1B). Клетки фиксировали в 70% EtOH O.N, центрифугировали и ресуспендировали в растворе йодида пропидия (PI) и затем анализировали с помощью FACS.
Фиг.2 представляет собой гистограмму, изображающую экспрессию маркеров 2D прикрепляющихся клеток плаценты, подходящих для применения в соответствии с настоящими указаниями. Отмечается, что негативная экспрессия была зарегистрирована для CD11b, CD34, HLA-DR, CD14, CD19 и CD45, тогда как позитивная экспрессия была отмечена для CD29, CD73, CD90 and CD105.
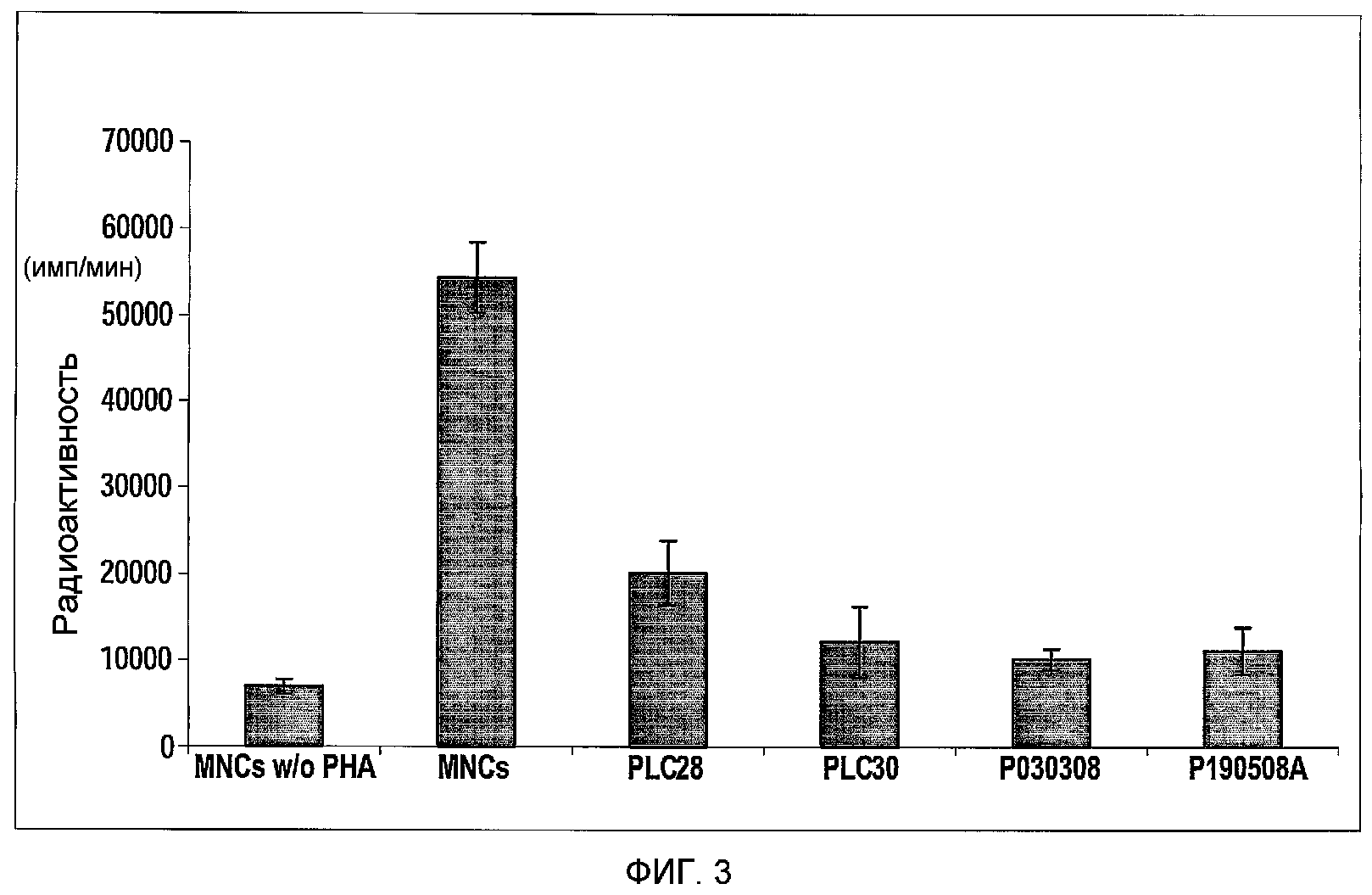
Фиг.3 представляет собой гистограмму, изображающую снижение ответа клеток лимфоцитарного ряда под действием 2D прикрепляющихся клеток плаценты, подходящих для применения в соответствии с настоящими указаниями. Мононуклеарные клетки (MNCs) периферической крови (PB) стимулировали PHA (10 мкг/мл). Одну из четырех различных партий 2D прикрепляющихся клеток добавляли к стимулированным MNCs. По три параллельных из каждой группы высевали в 96-луночные планшеты.
Фиг.4A-F представляет собой фотографии, изображающие рост клеток костного мозга и плаценты в условиях остеогенной или адипогенной линий дифференцировки. Клетки, происходящие из костного мозга (фиг.4A-C), или клетки, происходящие из плаценты (фиг.4D-F), высевали в ростовой среде (фиг.4A и 4D), в среде для остеогенной дифференцировки (фиг.4B и 4E) или в среде для адипогенной дифференцировки (фиг.4C и 4F) в 24-луночном планшете, покрытом витронектином и коллагеном. Среду меняли каждые 3-4 дня. В конце периода роста клетки фиксировали, окрашивали и снимали, как подробно описано в последующем разделе примеров.
Фиг.5A-F представляет собой фотографии, изображающие рост клеток костного мозга и плаценты в модифицированных условиях остеогенной или адипогенной линий дифференцировки. Клетки, происходящие из костного мозга (фиг.5A-C), или клетки, происходящие из плаценты (фиг.5D-F), высевали в ростовой среде (фиг.5A и 5D), в среде для остеогенной дифференцировки (фиг.5B и 5E) или в среде для адипогенной дифференцировки (фиг.5C и 5F) в 24-луночном планшете, покрытом витронектином и коллагеном. Среду меняли каждые 3-4 дня. В конце периода роста клетки фиксировали, окрашивали и снимали, как подробно описано в последующем разделе примеров.
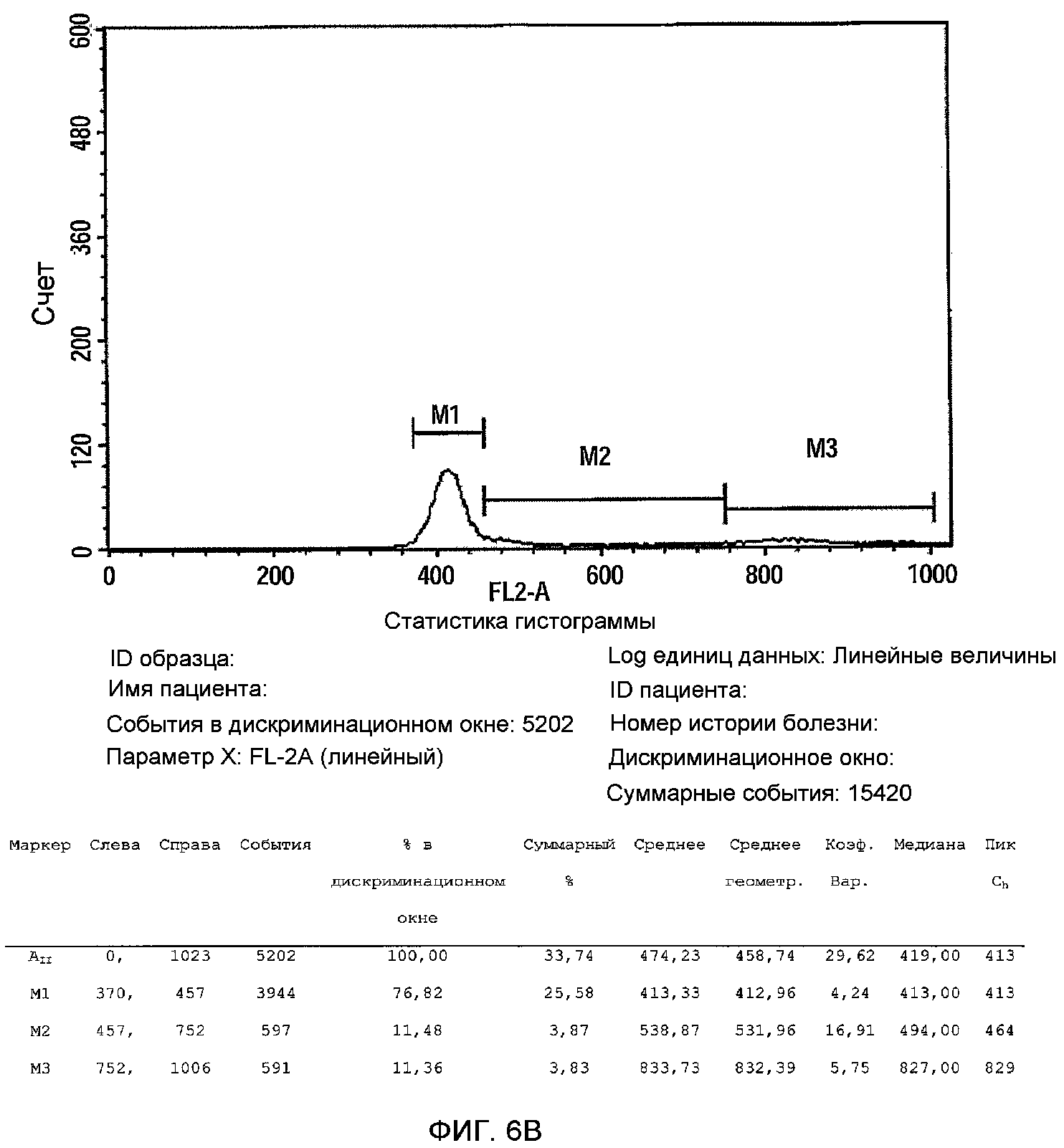
На фиг.6A-B изображен анализ клеточного цикла 3D прикрепляющихся клеток, полученных Plurix (обозначается как PLX, фиг.6B) and Celligen (PLX-C, фиг.6A). Клетки фиксировали в 70% EtOH O.N, центрифугировали и ресуспендировали в растворе йодида пропидия (PI) и затем анализировали с помощью FACS.
На фиг.7A-C изображена экспрессия типичных для фибробластов маркеров, но отсутствие экспрессии типичных для эндотелия маркеров на PLX-C. На фиг.7A изображена негативная экспрессия эндотелиального маркера CD31; на фиг.7B изображена негативная экспрессия эндотелиального маркера KDR; и на фиг.7C изображена позитивная экспрессия маркера фибробластов человека (D7-FIB). Отмечается, что красные гистограммы для изотипа IgG1 (ФИТЦ) представляют собой негативный контроль, тогда как синие гистограммы, представляют собой позитивно окрашенные клетки.
На фиг.8A-D изображена экспрессия стимуляторных и костимуляторных молекул на клетках PLX-C. На фиг.8A изображена экспрессия CD80 на PLX-C; на фиг.8B изображена экспрессия CD86 на PLX-C; на фиг.8C изображена экспрессия CD40 на PLX-C; и на фиг.8D изображена экспрессия HLA-A/B/C на PLX-C. Негативные контроли получали с флуоресцентными молекулами соответствующего изотипа. Отмечается, что красные гистограммы указывают на популяцию клеток, экспрессирующих маркер PLX-C, синие гистограммы указывают на популяцию клеток, экспрессирующих маркер костного мозга (BM), и зеленые гистограммы указывают на популяцию клеток, экспрессирующих маркер мононуклеарных клеток (MNC).
На фиг.9A-B изображено ингибирование пролиферации лимфоцитов под действием PLX-C. На фиг.9A изображены тесты смешанной реакции лимфоцитов (MLR), выполненные с 2×105 мононуклеарными клетками (MNC, донор А), происходящими из периферической крови (PB), стимулированными равным количеством облученных (30 Дж/кг) MNCs, происходящих из PB (донор В), с последующим добавлением возрастающих количеств клеток PLX-C к культурам. Три параллельных из каждой группы высевали в 96-луночные планшеты. Скорость пролиферации измеряли по включению [3H]-тимидина; на фиг.9B изображены MNCs, происходящие из периферической крови (PB), стимулированные ConA (1,5 мг/мл). К культурам добавляли повышающиеся количества клеток PLX-C. Три параллельных из каждой группы высевали в 96-луночные планшеты. Скорость пролиферации измеряли по включению [3H]-тимидина.
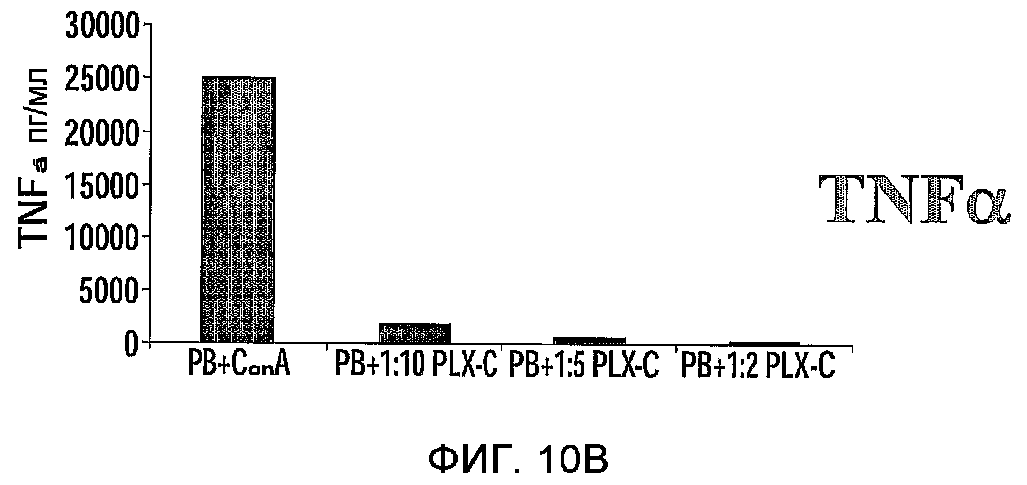
На фиг.10A-C изображена регуляция PLX-C секреции провоспалительных и антивоспалительных цитокинов после совместного культивирования с клетками периферической крови. На фиг.10A-B изображена секреция IFNγ (фиг.10A) и TNFα (фиг.10B) после совместного культивирования MNCs, происходящих от человека (выделенных из периферической крови), стимулированных ConA, с PLX-C; на фиг.10C изображена секреция IFNγ, TNFα и ИЛ-10 после совместного культивирования MNCs, происходящих от человека (выделенных из периферической крови), стимулированных LPS, с PLX-C. Супернатанты собирали и подвергали анализу на цитокины с использованием ELISA.
Фиг.11 представляет собой гистограмму, изображающую макроскопическую оценку тканей ободочной кишки мышей с колитом по показателю Уоллеса. TNBS (мыши с моделированием колита), TNBS+5-ASA (мыши с колитом, которые получали лечение по золотому стандарту), TNBS+2D прикрепляющиеся клетки (партия 1) в/бр, TNBS+3D прикрепляющиеся клетки (PLX-C, партия 2) в/бр, TNBS+2D прикрепляющиеся клетки (партия 1) в/в и TNBS+3D прикрепляющиеся клетки (PLX-C, партия 2) в/в. Макроскопические оценки проводились вслепую двумя исследователями.
Фиг.12 представляет собой гистограмму, изображающую микроскопическую оценку тканей ободочной кишки мышей с колитом по показателю Ameho. TNBS (мыши с моделированием колита), TNBS + 5-ASA (мыши с колитом, которые получали лечение по золотому стандарту), TNBS+2D прикрепляющиеся клетки (партия 1) в/бр, TNBS+3D прикрепляющиеся клетки (PLX-C, партия 2) в/бр, TNBS+2D прикрепляющиеся клетки (партия 1) в/в и TNBS+3D прикрепляющиеся клетки (PLX-C, партия 2) в/в. Гистологические оценки проводились вслепую двумя исследователями.
Фиг.13 представляет собой гистограмму, изображающую уровень экспрессии мРНК ИЛ-1β в тканях ободочной кишки мышей с колитом. У мышей вызывали колит путем внутриректального введения TNBS и им вводили 2D или 3D (PLX-C) прикрепляющиеся клетки внутрибрюшинным или внутривенным путем. Суммарную РНК выделяли из тканей ободочной кишки различных экспериментальных групп и уровни экспрессии ИЛ-1β оценивали с помощью ОТ-ПЦР.
Фиг.14 представляет собой гистограмму, изображающую микроскопическую оценку тканей ободочной кишки крыс с колитом. У крыс вызывали колит путем введения TNBS внутрь ободочной кишки и им вводили PLX-C клетки внутрибрюшинным (в/бр) или внутривенным (в/в) путем.
Описание конкретных вариантов осуществления изобретения
Настоящее изобретение в некоторых вариантах его осуществления относится к способам лечения воспалительных заболеваний ободочной кишки с использованием прикрепляющихся клеток из жировой ткани или ткани плаценты и более конкретно, но не исключительно, к способам лечения язвенного колита или болезни Крона с использованием прикрепляющихся клеток.
Принципы и процесс настоящего изобретения могут быть лучше поняты при ссылке на фигуры и сопровождающие описания.
Перед подробным объяснением, по меньшей мере, одного варианта осуществления изобретения должно быть понятно, что изобретение необязательно ограничивается его применением в тех подробностях, которые изложены в последующем описании или проиллюстрированы в примерах. Допускаются другие варианты осуществления изобретения, или исполнения его на практике, или выполнения различными способами. Должно быть понятно также, что используемые в настоящем описании формулировки и терминология применяются с целью описания и не должны рассматриваться как ограничивающие.
При осуществлении настоящего изобретения на практике изобретатель настоящего изобретения неожиданно обнаружил, что прикрепляющиеся клетки из тканей плаценты могут эффективно использоваться для лечения язвенного колита и болезни Крона.
Как показано в настоящем описании ниже и в последующем разделе примеров, изобретатель настоящего изобретения открыл путем сложных экспериментов, что прикрепляющиеся клетки, полученные из ткани плаценты или жировой ткани и прокультивированные в условиях 2D (пример 2) или 3D (примеры 1 и 3) культивирования, могут быть эффективно использованы для лечения воспаления ободочной кишки, такого как язвенный колит, как показано как на мышиной (пример 4), так и на крысиной (пример 5) экспериментальных моделях. Изобретатель настоящего изобретения показал, что внутривенное (в/в) или внутрибрюшинное (в/бр) введение 2D или 3D прикрепляющихся клеток настоящего изобретения приводит к существенному улучшению воспалительного состояния ткани ободочной кишки, определенного с помощью как макроскопической, так и микроскопической оценки ободочной кишки (фиг.11, 12 и 14). Этот противовоспалительный эффект был так же эффективен, как и золотой стандарт лечения с помощью 5-ASA. Взятые вместе указания настоящего изобретения описывают ценность противовоспалительного действия прикрепляющихся клеток настоящего изобретения и предлагают их применение для лечения воспалительных заболеваний ободочной кишки, таких как язвенный колит и болезнь Крона.
Таким образом, в соответствии с одним аспектом настоящего изобретения, предлагается способ лечения язвенного колита или болезни Крона у нуждающегося в этом индивидуума, причем способ включает введение индивидууму терапевтически эффективного количества прикрепляющихся клеток из ткани плаценты или жировой ткани, осуществляя тем самым лечение язвенного колита или болезни Крона.
Используемый в настоящем описании термин «лечение» относится к предотвращению, лечению, обращению, ослаблению, облегчению, сведению к минимуму, подавлению или прекращению вредного влияния язвенного колита или болезни Крона. Специалисты в данной области техники должны понимать, что для оценки развития патологии могут быть использованы различные методы и тесты и сходно различные методы и тесты могут быть использованы для оценки ослабления, ремиссии или регрессии патологии.
Используемый в настоящем описании термин «язвенный колит» относится к патологическому состоянию кишечника, форме воспалительного заболевания кишечника (IBD), конкретно толстой кишки или ободочной кишки, которое включает характерные язвы или открытые бороздки в ободочной кишке. Заболевание язвенным колитом обычно диагностируется по следующим рецидивирующим симптомам - постоянной диарее, смешанной с кровью, с постепенным появлением. Язвенный колит в соответствии с указаниями настоящего изобретения относится к любой стадии или тяжести язвенного колита (например, к ремиссии заболевания или к острой форме заболевания).
Используемый в настоящем описании термин «болезнь Крона» относится к воспалительному состоянию, которое может затрагивать любую часть желудочно-кишечного тракта от ротовой полости до ануса, известному также как гранулематозный колит или регионарный энтерит, и представляет собой форму воспалительного заболевания кишечника (IBD). Болезнь Крона является типом аутоиммунного заболевания и обычно диагностируется по следующим рецидивирующим симптомам - боли в животе, диарее (которая может быть с примесью крови), рвоте, потере веса, кожной сыпи, артриту и воспалению глаз. Болезнь Крона в соответствии с указаниями настоящего изобретения относится к любой стадии или тяжести болезни Крона (например, к ремиссии заболевания, острой форме заболевания, рецидиву).
Применяемое в настоящем описании выражение «нуждающийся в этом индивидуум» относится к млекопитающему, предпочтительно к индивидууму, являющемуся человеком, мужской или женской особи любого возраста, у которого диагностирован вероятный или точный язвенный колит или болезнь Крона, например к индивидууму, который перенес воспалительное заболевание ободочной кишки. Диагностика язвенного колита или болезни Крона может включать любой диагностический тест, такой как, например, лабораторные тесты, эндоскопическую оценку, биопсию слизистой (для язвенного колита), осуществление рентгеноскопии с барием (для болезни Крона) и КТ или МРТ сканирование (для болезни Крона).
Следует понимать, что настоящее изобретение также предполагает лечение других воспалительных состояний ободочной кишки, включая, но не ограничиваясь этим, хронические воспалительные заболевания кишечника (Garcia Herola A. et al., Gastroenterol Hepatol. 2000 Jan 23; (1):16), глютеновую энтеропатию (Landau YE. and Shoenfeld Y. Harefuah 2000 Jan 16; 138 (2):122) и илеит, с использованием прикрепляющихся клеток по настоящему изобретению.
Как указывалось в настоящем описании выше, способ в соответствии с этим аспектом настоящего изобретения осуществляется путем введения индивидууму терапевтически эффективного количества прикрепляющихся клеток из плаценты или жировой ткани.
Применяемое в настоящем описании выражение «прикрепляющиеся клетки» относится к гомогенной или гетерогенной популяции клеток, рост которых зависит от прикрепления, т.е. для роста in vitro требуется прикрепление к поверхности.
Применяемое в настоящем описании выражение «жировая ткань» относится к соединительной ткани, которая включает жировые клетки (адипоциты).
Применяемый в настоящем описании термин «ткань плаценты» относится к любой части женского органа млекопитающих, который выстилает маточную стенку и в течение беременности является оболочкой плода, к которой он прикреплен через пуповину. После родов плацента изгоняется (и обозначается как послеродовая плацента). В иллюстративном варианте осуществления плацента относится к целой плаценте.
В соответствии с указаниями настоящего изобретения прикрепляющиеся клетки, происходящие из плаценты или жировой ткани, могут быть размножены с использованием двухмерных (2D) или трехмерных (3D) условий культивирования.
Применяемое в настоящем описании выражение «двухмерная культура» относится к культуре, в которой клетки помещены в условия, которые совместимы с клеточным ростом, наряду с тем, что клеткам позволяют расти в одной плоскости. Условия в двухмерной культуре изобретения создаются таким образом, чтобы делать возможным распространение прикрепляющихся клеток.
Применяемое в настоящем описании выражение «трехмерная культура» относится к культуре, в которой клетки помещены в условия, которые совместимы с клеточным ростом, наряду с тем, что клеткам позволяют расти в более чем в одном слое. Вполне понятно, что окружение клетки in situ в живом организме (или в ткани) представляет собой трехмерную структуру. Клетки окружены другими клетками. Они поддерживаются в сложной сети волокон внеклеточного матрикса наноразмера, который позволяет создать различное местное микроокружение. Его внеклеточные лиганды опосредуют не только прикрепление к базальной мембране, но также доступ к разнообразным кровеносным и лимфатическим сосудам. Кислород, гормоны и питательные вещества переносятся к клеткам, а отходы удаляются. Условия в трехмерной культуре изобретения создаются таким образом, чтобы имитировать такое окружение, как это будет дополнительно проиллюстрировано ниже.
Должно быть понятно, что условия при двухмерном и трехмерном культивировании являются такими, чтобы делать возможным распространение прикрепляющихся клеток.
Применяемые в настоящем описании термины «распространяющиеся» и «распространение» относятся к поддержанию клеток по существу в отсутствие их дифференцировки и в конечном итоге в условиях клеточного роста, т.е. увеличения популяции клеток (например, по меньшей мере, в 2 раза) без дифференцировки, сопровождающей такое увеличение.
Применяемые в настоящем описании термины «поддерживающиеся» и «поддержание» относятся к возобновлению клеток по существу в отсутствие их дифференцировки, т.е. по существу к стабильной клеточной популяции без дифференцировки, сопровождающей такую стабильность.
Как указывалось, прикрепляющиеся клетки этого аспекта изобретения получают из жировой ткани или ткани плаценты.
Клетки плаценты могут быть получены из плаценты после доношенной беременности или плаценты после преждевременных родов. Плаценту предпочтительно собирают сразу после оттока крови. Плаценту предпочтительно перфузировали в течение периода времени, достаточного для удаления остаточных клеток. Используемый в настоящем описании термин «перфузировать» или «перфузия» относится к акту заливания или пропускания жидкости через или сквозь орган или ткань. Ткань плаценты может происходить от любого млекопитающего; например, источником ткани плаценты является человек. Подходящим источником ткани плаценты является плацента после доношенной беременности (например, через 1-6 часов), однако источник ткани или клеток плаценты или метод выделения ткани плаценты не является решающим для изобретения.
Прикрепляющиеся клетки, происходящие из плаценты, могут быть получены как из плодной (т.е. амниона или внутренних частей плаценты, см. пример 1), так и материнской (т.е. базальной децидуальной оболочки и выстилающей полость матки децидуальной оболочки) частей плаценты. Образцы ткани промывают в физиологическом буфере [например, в забуференным фосфатом физиологическим раствором (ЗФР) или буфером Хенкса]. Суспензии из единичных клеток делают путем обработки ткани гидролитическим ферментом (см. ниже) и/или измельчая и прокачивая кусочки ткани через нейлоновый фильтр или путем осторожного пипетирования (Falcon, Becton, Dickinson, San Jose, CA) промывающим буфером.
Прикрепляющиеся клетки, происходящие из жировой ткани, могут быть выделены с помощью разнообразных методов, известных специалистам в данной области техники. Например, такие методы описаны в патенте США № 6153432. Жировая ткань может происходить от сальника/висцерального жира, жировой ткани молочной железы, гонад или других источников жировой ткани. Одним источником жировой ткани является жир сальника. У человека жировую ткань обычно выделяют путем липосакции.
Выделенные прикрепляющиеся клетки из плаценты или жировой ткани могут быть извлечены путем обработки ткани гидролитическими ферментами, такими как коллагеназа, трипсин и/или диспаза; и/или эффективными концентрациями гиалуронидазы или ДНКазы; и этилендиаминтетрауксусной кислотой (ЭДТА); при температуре между 25-50°С в течение периодов от 10 минут до 3 часов. Клетки можно затем пропустить через нейлоновый или марлевый фильтр с ячейками от 20 микрон до 1 мм. Клетки затем подвергают дифференциальному центрифугированию прямо в средах или через градиент Фиколла или Перколла или другой корпускулярный градиент. Клетки центрифугируют при скоростях от 100 до 3000 х g в течение периодов от 1 минуты до 1 часа при температуре между 4-50°С (см. патент США № 7078230).
В дополнение к прикрепляющимся клеткам, происходящим из плаценты или жировой ткани, в изобретении также предусматривается применение прикрепляющихся клеток из других тканевых источников, которые характеризуются фенотипом стромальных стволовых клеток (как далее будет описано в настоящем документе ниже). Тканевые источники, из которых могут быть извлечены прикрепляющиеся клетки, включают, но не ограничиваются этим, пуповинную кровь, кожу головы, волосяные фолликулы [например, как описано в патентной заявке США 20060172304], семенники [например, как описано в статье Guan K., et al., Nature. 2006 Apr 27;440(7088): 1199-203], слизистую носовой полости человека [например, как описано в статье Marshall, CT., et al., Histol Histopathol. 2006 Jun;21(6):633-43], эмбриональный желточный мешок [например, как описано в статье Geijsen N, Nature. 2004 Jan 8;427(6970): 148-54] и амниотическую жидкость [Pieternella et al. (2004) Stem Cells 22:1338-1345], все источники, как известно, включают мезенхимальные стволовые клетки. Прикрепляющиеся клетки из этих тканевых источников могут быть выделены путем культивирования клеток на поверхности для прикрепления, изолируя таким способом прикрепляющиеся клетки от других клеток в исходной популяции.
Независимо от источника (например, плаценты или жировой ткани) извлечение клеток предпочтительно производится в стерильных условиях. После получения извлеченных клеток им дают возможность прикрепиться к веществу для прикрепления (например, с конфигурацией в виде поверхности) для выделения в результате этого прикрепившихся клеток. Культивирование затем происходит в условиях 2D (как описано в примере 2 раздела примеров), и клетки могут быть затем перенесены в условия 3D (как описано в примерах 1 и 3 раздела примеров).
Применяемый в настоящем описании термин «вещество для прикрепления» относится к синтетическому веществу, природному веществу или их сочетанию, нецитотоксичному (т.е. биологически совместимому), обладающему химической структурой (например, заряженными группами, экспонированными на поверхности), которая может удержать клетки на поверхности.
Примеры веществ для прикрепления, которые могут быть использованы в соответствии с этим аспектом изобретения, включают, но не ограничиваются этим, полиэфир, полипропилен, полиалкилен, полифторхлорэтилен, поливинилхлорид, полистирол, полисульфон, ацетат целлюлозы, стекловолокно, керамическую частицу, матригель, компонент внеклеточного матрикса (например, фибронектин, хондронектин, ламинин), коллаген, поли-L-молочную кислоту и инертное металлическое волокно.
Следует принимать во внимание, что высевание клеток плаценты или жировой ткани обычно производится при плотности в культуре 3±0,2×103 клеток/см2. После высевания клеточные культуры обычно культивируют в инкубаторе для тканевых культур в условиях увлажнения с 5% CO2 при 37°С.
Дальнейшие стадии очистки или обогащения стромальными стволовыми клетками могут быть произведены с использованием методов, которые хорошо известны в данной области техники (таких как с помощью FACS с использованием экспрессии маркеров стволовых клеток, как будет дополнительно описано в настоящем документе ниже).
Неограничивающие примеры основных сред, пригодных для культивирования в соответствии с изобретением, включают минимально необходимую среду Игла, ADC-1, LPM (не содержащую бычий сывороточный альбумин), F10 (HAM), F12 (HAM), DCCM1, DCCM2, RPMI 1640, среду BGJ (с или без модификации Fitton- Jackson), основную среду Игла (BME с добавлением соли основания Игла), модифицированную Дульбекко среду Игла (DMEM - без сыворотки), Yamane, IMEM-20, модифицированную Глазго среду Игла (GMEM), среду Leibovitz L-15, среду McCoy's 5A, среду M199 (M199E - с солью основания Игла), среду M199 (M199H - с солью основания Хенкса), минимально необходимую среду Игла (MEM-E - с солью основания Игла), минимально необходимую среду Игла (MEM-H - с солью основания Хенкса) и минимально необходимую среду Игла (MEM-NAA с заменимыми аминокислотами), среди многих других включающие среду 199, CMRL 1415, CMRL 1969, CMRL 1066, NCTC 135, MB 75261, MAB 8713, DM 145, Williams' G, Neuman & Tytell, Higuchi, MCDB 301, MCDB 202, MCDB 501, MCDB 401, MCDB 411, MDBC 153. Предпочтительной средой для использования по изобретению является DMEM. Эти и другие пригодные среды имеются в продаже среди прочих у GIBCO, Grand Island, N. Y., USA и Biological Industries, Bet HaEmek, Israel. Описание ряда этих сред суммировано в книге Methods in Enzymology, Volume LVIII, "Cell Culture", pp. 62 72, под редакцией William B. Jakoby and Ira H. Pastan, опубликованной Academic Press, Inc.
Среда может быть дополнена, например, сывороткой, такой как сыворотка плодов телят или других видов, и необязательно или альтернативно ростовыми факторами, витаминами (например, аскорбиновой кислотой), цитокинами, солями (например, B-глицерофосфатом), стероидами (например, дексаметазоном) и гормонами, например гормоном роста, эритропоетином, тромбопоетином, интерлейкином-3, интерлейкином-6, интерлейкином-7, колониестимулирующим фактором макрофагов, лигандом c-kit/фактором стволовых клеток, лигандом остеопротегерина, инсулином, инсулиноподобными факторами роста, эпидермальным фактором роста, фактором роста фибробластов, фактором роста нервов, цилиарным нейротрофическим фактором, фактором роста из тромбоцитов и морфогенным белком кости в концентрациях от пикограмм/мл до миллиграмм/мл.
Дополнительно признается также, что в культуральную среду могут быть добавлены дополнительные компоненты. Такие компоненты могут представлять собой антибиотики, противогрибковые агенты, альбумин, аминокислоты и другие компоненты, известные в области техники культивирования клеток. Кроме того, могут быть добавлены компоненты для увеличения процесса дифференцировки, когда это необходимо (см. дополнительно ниже).
Следует принимать во внимание, что в случае, когда прикрепляющиеся клетки изобретения вводятся индивидууму, являющемуся человеком, клетки и культуральная среда (например, с описанными выше добавками среды) должны быть по существу свободны от ксенобиотиков, т.е. лишены любых загрязнений животного происхождения, например микоплазмой. Например, культуральная среда может содержать добавки заместителей сыворотки, добавки сыворотки человека и/или факторов, полученных синтетическим или рекомбинантным путем.
Как указывалось, как только прикрепляющиеся клетки получены, их можно высевать в 2D или 3D окружение (см. примеры 1, 2 и 3 раздела примеров далее). Следует иметь в виду, что клетки могут быть перенесены на матрикс с 3D-конфигурацией непосредственно после выделения или, альтернативно, они могут быть высеяны в 3D окружение после условий 2D (как указывалось в настоящем описании выше).
Следует принимать во внимание, что в процессе культивирования в условиях 2D прикрепляющиеся клетки можно постоянно пересевать. В соответствии с вариантом осуществления настоящего изобретения клетки могут быть пересеяны в течение, по меньшей мере, 4 пассажей, по меньшей мере, 5 пассажей, по меньшей мере, 6 пассажей, по меньшей мере, 7 пассажей или, по меньшей мере, 8 пассажей. Должно быть понятно, что клетки обычно пересевают, когда культура достигнет приблизительно 70-80% конфлюэнтности, обычно через 3-5 дней (1,5-2 удваиваний). Более того, при культивировании в условиях 2D клетки могут быть выращены в культуральной среде, лишенной добавок антибиотиков, по меньшей мере, от 2 пассажей, по меньшей мере, 3 пассажей или, по меньшей мере, 4 пассажей.
Таким образом, в случае 2D культуры культивирование производят в течение приблизительно, по меньшей мере, 2 дней, 3 дней, 4 дней, 5 дней, 10 дней, 20 дней, месяца или даже более. Для увеличения количества клеток можно также производить пересевание. Должно быть понятно, что культуральная среда может быть заменена для того, чтобы продлить или улучшить условия культивирования.
2D прикрепившиеся клетки могут быть собраны, когда пролиферируют, по меньшей мере, приблизительно 12% клеток, во избежание неконтролируемой дифференцировки и старения.
2D прикрепившиеся клетки некоторых вариантов осуществления настоящего изобретения включают, по меньшей мере, приблизительно 10%, 28%, 30%, 50%, 80% или более пролиферативно-активных клеток (как может быть оценено с помощью мониторинга S и/или G2/M фаз путем FACS).
Как указывалось, прикрепляющиеся клетки могут быть перенесены в 3D окружение.
Таким образом, веществу для прикрепления этого аспекта изобретения придается форма для 3D культивирования, обеспечивая тем самым матрикс для роста, который существенно повышает доступную поверхность контакта для прикрепления клеток так, что создается имитация инфраструктуры ткани (например, плаценты).
Для крупномасштабного получения культивирование может быть произведено в 3d биореакторе.
Примеры таких биореакторов включают, но не ограничиваются этим, биореактор с потоком вытеснения, биореактор с непрерывно перемешиваемым резервуаром, биореактор с неподвижным слоем, биореакторную систему CelliGen Plus® (New Brunswick Scientific (NBS) или биореакторную систему BIOFLO 310 (New Brunswick Scientific (NBS).
Как показано в примере 3 раздела примеров, биореактор Celligen способен осуществлять 3D экспансию прикрепляющихся клеток в контролируемых условиях (например, рН, температуры и уровня кислорода) и при постоянной перфузии средой для постоянного клеточного роста. Более того, в клеточных культурах можно проводить прямой мониторинг уровней концентрации глюкозы, лактата, глутамина, глутамата и аммония. Скорость потребления глюкозы и скорость образования лактата прикрепляющимися клетками дает возможность измерять скорость клеточного роста и определять время их сбора.
Другие 3D биореакторы, которые могут быть использованы в изобретении, включают, но не ограничиваются этим, биореактор с непрерывно перемешиваемым резервуаром, в котором культуральная среда непрерывно подается в биореактор, а продукт непрерывно выводится для поддержания постоянной во времени стационарной фазы в реакторе. Биореактор с перемешиваемым резервуаром с барабаном с волокнистой подложкой имеется в продаже, например, у New Brunswick Scientific Co., Edison, NJ, биореактор со стационарной подложкой, биореактор с подъемом потока воздуха, где воздух обычно подается через дно центральной дочерней трубы, поднимается вверх с образованием пузырьков и высвобождает отработавший газ на вершине колонны, биореактор с перфузией высеянных клеток с помощью полиактивных пен [как описано в статье Wendt, D. et al., Biotechnol Bioeng 84: 205-214, (2003)], биореактор с перфузией радиальными потоками с трубчатыми пористыми каркасами из поли-L-молочной кислоты (PLLA) [как описано в статье Kitagawa et al., Biotechnology and Bioengineering 93(5): 947-954 (2006)]. Другие биореакторы, которые могут быть использованы по изобретению, описаны в патентах США №№ 6277151, 6197575, 6139578, 6132463, 5902741 и 5629186.
Высевание клеток предпочтительно производится при 100000-1500000 клеток/мм в момент высевания. В иллюстративном варианте осуществления высевается суммарно 150±30×106 клеток, высевается 3-5×106 клеток/г носителя или высевается 0,015-0,1×106 клеток/мл.
Культивирование производится в течение, по меньшей мере, приблизительно 2 дней, 3 дней, 4 дней, 5 дней, 10 дней, 20 дней, месяца или даже более. Должно быть понятно, что культивирование в биореакторе может удлинять этот период. Культивирование прикрепляющихся клеток в 3D культуре может производиться в условиях непрерывного потока культуральной среды. Для увеличения количества клеток может также производиться пересевание. Следует также принимать во внимание, что культуральная среда может быть заменена для продления или улучшения условий культивирования.
В соответствии с вариантом осуществления настоящего изобретения культивирование прикрепляющихся клеток в 3D культуре может производиться в условиях перфузии культуральной среды. Обычно скорость перфузии определяется по концентрации глюкозы в культуральной среде прикрепляющихся клеток. Таким образом, в соответствии с указаниями настоящего изобретения культуральная среда может быть заменена, когда концентрация глюкозы составляет приблизительно 500 мг/л, приблизительно 550 мг/л или приблизительно 600 мг/л.
3D прикрепившиеся клетки могут быть собраны, когда пролиферируют, по меньшей мере, приблизительно 10% клеток, во избежание неконтролируемой дифференцировки и старения.
3D прикрепившиеся клетки некоторых вариантов осуществления настоящего изобретения включают, по меньшей мере, приблизительно 10%, 28%, 30%, 50%, 80% или более пролиферативно-активных клеток (как может быть оценено с помощью мониторинга S и/или G2/M фаз путем FACS).
Прикрепившиеся клетки некоторых вариантов осуществления настоящего изобретения могут включать, по меньшей мере, один «фенотип стромальных стволовых клеток».
Применяемый в настоящем описании термин «фенотип стромальной стволовой клетки» относится к структурному или функциональному фенотипу, типичному для стромальной (т.е. мезенхимальной) клетки, происходящей из костного мозга.
Применяемое в настоящем описании выражение «стволовая клетка» относится к клетке, которая не прошла окончательную дифференцировку.
Таким образом, например, клетки могут иметь веретенообразную форму. Альтернативно или дополнительно клетки могут экспрессировать маркер или набор маркеров (например, маркер поверхности), типичный для стромальных стволовых клеток. Примеры маркеров поверхности стромальных стволовых клеток (позитивных и негативных) включают, но не ограничиваются этим, CD105+, CD29+, CD44+, CD73+, CD90+, CD3-, CD4-, CD34-, CD45-, CD80-, CD19-, CD5-, CD20-, CD11B-, CD14-, CD19-, CD79-, HLA-DR- и FMC7-. Другие маркеры стромальных стволовых клеток включают, но не ограничиваются этим, тирозингидроксилазу, нестин и H-NF.
В соответствии с конкретным вариантом осуществления настоящего изобретения прикрепляющиеся клетки не экспрессируют Oct-4.
Должно быть понятно, что 2D прикрепляющиеся клетки ткани плаценты, созданные в соответствии с указаниями настоящего изобретения, обладают профилем экспрессии генов по существу, как описано в таблице 8 последующего раздела примеров. В то же время 3D прикрепляющиеся клетки ткани плаценты, созданные в соответствии с указаниями настоящего изобретения, обладают профилем экспрессии генов по существу, как описано в таблице 11 последующего раздела примеров.
В соответствии с иллюстративным вариантом осуществления 2D и 3D прикрепляющиеся клетки настоящего изобретения менее коммитированы к дифференцировке в сторону остеогенной или адипогенной линии по сравнению с прикрепляющимися клетками из костного мозга, растущими и дифференцирующимися в тех же самых условиях.
Примеры функциональных фенотипов, типичных для стромальных стволовых клеток, включают, но не ограничиваются этим, супрессорную активность в отношении Т-клеток (они не стимулируют Т-клетки, а наоборот, подавляют их) и активность, поддерживающую гематопоетические стволовые клетки.
В соответствии с одним вариантом осуществления изобретения прикрепляющиеся клетки изобретения способны подавлять иммунную реакцию у индивидуума.
Применяемое в настоящем описании выражение «подавление иммунной реакции у индивидуума» относится к снижению или ингибированию иммунной реакции, возникающей у индивидуума в ответ на антиген (например, на чужеродную клетку или ее часть). Иммунный ответ, который может быть подавлен прикрепляющейся клеткой, включает гуморальные иммунные ответы и клеточные иммунные ответы, которые включают специфическое узнавание антигенов патогена с помощью антител и Т-лимфоцитов (пролиферации Т-клеток) соответственно.
Как показано в примерах 4-5 последующего раздела примеров, 2D и 3D прикрепляющиеся клетки настоящего изобретения, как обнаружено, индуцируют противовоспалительный эффект при воспалительных состояниях ободочной кишки. Должно быть дополнительно понятно, что этот эффект может быть опосредован самими клетками или секретируемым ими фактором, обладающим противовоспалительным действием даже в отсутствие клеток. Таким образом, прикрепляющиеся клетки настоящего изобретения предпочтительно могут быть использованы для лечения воспаления кишечника, такого как в случае язвенного колита и болезни Крона.
Выражение «введение индивидууму» относится к введению клеток изобретения в ткань-мишень. Клетки могут происходить от реципиента или от аллогенного или ксеногенного донора. Это выражение также охватывает «трансплантацию», «замещение клеток» или «пересадку» клеток изобретения индивидууму.
В соответствии с конкретными вариантами осуществления изобретения прикрепляющиеся клетки можно вводить индивидууму любыми путями, известными специалисту в данной области техники, например путем внутривенного (в/в), внутримышечного (в/м) или внутрибрюшинного (в/бр) введения.
Клетки, которые можно вводить в соответствии с этим аспектом изобретения, включают описанные выше прикрепляющиеся клетки, которые можно культивировать в трехмерном или двухмерном окружении, а также их частично или окончательно дифференцированные мезенхимальные и немезенхимальные производные.
Методы получения линий дифференцировки конкретных клеток из стромальных стволовых клеток изобретения хорошо известны в данной области техники. См., например, патенты США №№ 5486359, 5942225, 5736396, 5908784 и 5902741.
Клетки могут не подвергаться какому-либо воздействию или быть генетически модифицированными, так чтобы быть направленными в сторону интересующей линии дифференцировки (см. патентную заявку США № 20030219423).
Клетки могут происходить из аутологичного или неаутологичного источника (т.е. аллогенного или ксеногенного) из свежих или замороженных (например, криогенно законсервированных) препаратов.
Так как неаутологичные клетки могут индуцировать иммунную реакцию при введении в организм, разработано несколько подходов для снижения вероятности отторжения неаутологичных клеток. Они включают либо подавление иммунной системы реципиента, либо инкапсулирование неаутологичных клеток в изолирующие от иммунной системы, полупроницаемые мембраны перед трансплантацией.
Методы инкапсулирования обычно классифицируются как микрокапсулирование, включающее маленькие сферические наполнители, и макрокапсулирование, включающее более крупные листовые слоистые мембраны и мембраны из полых волокон (Uludag, H. et al. Technology of mammalian cell encapsulation. Adv Drug Deliv Rev. 2000; 42: 29-64).
Методы получения микрокапсул известны в данной области техники и включают, например, раскрытые Lu MZ, et al., Cell encapsulation with alginate and alpha-phenoxycinnamylidene-acetylated poly(allylamine). Biotechnol Bioeng. 2000, 70: 479- 83, Chang TM and Prakash S. Procedures for microencapsulation of enzymes, cells and genetically engineered microorganisms. Mol Biotechnol. 2001, 17: 249-60, и Lu MZ, et al., A novel cell encapsulation method using photosensitive poly(allylamine alpha- cyanocinnamylideneacetate). J Microencapsul. 2000, 17: 245-51.
Например, микрокапсулы получают путем комплексирования модифицированного коллагена с тройным сополимером оболочки-2-гидроксиэтилметилакрилатом (HEMA), метакриловой кислотой (MAA) и метилметакрилатом (MMA), что ведет к толщине капсулы 2-5 мкм. Такие микрокапсулы могут быть дополнительно инкапсулированы в дополнительные 2-5 мкм оболочки из тройного сополимера для того, чтобы придать отрицательный заряд гладкой поверхности и свести к минимуму абсорбцию белками плазмы Chia, S.M. et al. Multi-layered microcapsules for cell encapsulation Biomaterials. 2002 23: 849-56).
Другие микрокапсулы создаются на основе альгината, морского полисахарида (Sambanis, A. Encapsulated islets in diabetes treatment. Diabetes Technol. Ther. 2003, 5: 665-8) или его производных. Например, микрокапсулы могут быть получены путем полиэлектролитного комплексирования полианионов альгината натрия и сульфата натрий-целлюлозы с поликатионом гидрохлорида поли(метилен-со-гуанидин)а в присутствии хлорида кальция.
Должно быть понятно, что инкапсулирование клеток улучшается, когда используются более мелкие капсулы. Таким образом, контроль качества, механическая стабильность, диффузионные свойства и активность in vitro инкапсулированных клеток улучшаются, когда размер капсулы снижается от 1 мм до 400 мкм (Canaple L. et al., Improving cell encapsulation through size control. J Biomater Sci Polym Ed. 2002; 13:783-96). Более того, биокапсулы с нанопорами с хорошо контролируемым размером пор, настолько малым как 7 нм, с химически подогнанной поверхностью и точной микроконфигурацией, как обнаружено, создают успешное микроокружение для иммуноизоляции клеток (Williams D. Small is beautiful: microparticle and nanoparticle technology in medical devices. Med Device Technol. 1999, 10: 6-9; Desai, T.A. Microfabrication technology for pancreatic cell encapsulation. Expert Opin Biol Ther. 2002, 2: 633-46).
Примеры иммуносупрессорных агентов, которые могут быть использованы, включают, но не ограничиваются этим, метотрексат, циклофосфамид, циклоспорин, циклоспорин А, хлороквин, гидроксихлороквин, сульфасалазин (сульфасалазопирин), соли золота, D-пеницилламин, лефлуномид, азатиоприн, анакинра, инфликсимаб (REMICADE), этанерсепт, блокаторы TNF-альфа, биологический агент, мишенью которого являются воспалительные цитокины, и нестероидные противовоспалительные лекарственные средства (NSAIDs). Примеры NSAIDs включают, но не ограничиваются этим, ацетилсалициловую кислоту, холинсалицилат магния, дифлунизал, салицилат магния, салсалат, салицилат натрия, диклофенак, этодолак, фенопрофен, флурбипрофен, индометацин, кетопрофен, кеторолак, меклофенамат, напроксен, набуметон, фенилбутазон, пироксикам, сулиндак, толметин, ацетаминофен, ибупрофен, ингибиторы Cox-2 и трамадол.
В зависимости от патологического состояния индивидууму можно вводить дополнительные химические лекарства (например, иммуномодуляторные, химиотерапевтические, противовоспалительные и т.д.) или клетки.
Для лечения воспалительных состояний ободочной кишки, включая язвенный колит и болезнь Крона, может быть использовано любое лечение, известное специалисту в данной области техники, включая, например, аминосалицилаты (например, месалазин, балсалазид, олсалазин), кортикостероиды (например, кортизон, преднизон, преднизолон, кортифем, гидрокортизон, метилпреднизолон, беклометазон, будесонид), иммуносупрессорные лекарства (например, меркаптопурин, азатиоприн, метотрексат, такролимус), биологическое лечение (например, инфликсимаб, визилизумаб), гепарин низкой молекулярной массы (LMWH), модификации диеты (например, волокна) и хирургическое вмешательство.
Индивидууму можно также вводить противовоспалительный агент, такой как, но, не ограничиваясь этим, алклофенак; алклометазона дипропионат; алгестона ацетонид; альфа-амилаза; амцинафал; амцинафид; амфенака натриевая соль; амиприлозы гидрохлорид; анакинра; аниролак; анитразафен; апазон; балсалазида динатриевая соль; бендазак; беноксапрофен; бензидамина гидрохлорид; бромелаины; броперамол; будесонид; карпрофен; циклопрофен; цинтазон; клипрофен; клобетазола пропионат; клобетазона бутират; клопирак; клотиказона пропионат; корметазона ацетат; кортодоксон; дефлазакорт; десонид; дезоксиметазон; дексаметазона дипропионат, диклофенака калиевая соль; диклофенака натриевая соль; дифлоразона диацетат; дифлумидона натриевая соль; дифлунизал; дифлупреднат; дифталон; диметилсульфоксид; дроциномид; эндрисон; энлимомаб; эноликама натриевая соль; эпиризол; этодолак; этофенамат; фелбинак; фенамол; фенбуфен; фенклофенак; фенклорак; фендорсал; фенпипалон; фентиазак; флазалон; флуазакорт; флуфенамовая кислота; флумизол; флунизолида ацетат; флуниксин; флуниксина меглумин; флуокортина бутил; фторметолона ацетат; флуквазон; флурбипрофен; флуретофен; флутиказона пропионат; фурапрофен; фуробуфен; галцинонид; галобетазола пропионат; галопредона ацетат; ибуфенак; ибупрофен; ибупрофена алюминиевая соль; ибупрофена пиконол; илонидап; индометацин; индометацина натриевая соль; индопрофен; индоксол; интразол; изофлупредона ацетат; изоксепак; изоксикам; кетопрофен; лофемизола гидрохлорид; ломоксикам; лотепреднола этабонат; меклофенамата натриевая соль; меклофенамовая кислота; меклоризона дибутират; мефенамовая кислота; мезаламин; мезеклазон; метилпреднизолона сулептанат; мотифлумат; набуметон; напроксен; напроксена натриевая соль; напроксол; нимазон; олсалазина натриевая соль; орготекин; орпаноксин; оксапрозин; оксифенбутазон; паранилина гидрохлорид; пентозана полисульфата натриевая соль; фенбутазона натрийглицерат; пирфенидон; пироксикам; пироксикама циннамат; пироксикама оламин; пирпрофен; предназат; прифелон; продоловая кислота; проквазон; проксазол; проксазола цитрат; римексолон; ромазарит; салколекс; салнацедин; салсалат; сангинария хлорид; секлазон; серметацин; судоксикам; сулиндак; супрофен; талметацин; талнифлумат; талосалат; тебуфелон; тенидап; тенидапа натриевая соль; теноксикам; тесикам; тесимид; тетридамин; тиопинак; тиксокортола пивалат; толметин; толметина натриевая соль; триклонид; трифлумидат; зидометацин; зомепирака натриевая соль.
В любом из описанных в настоящем документе методов клетки можно вводить либо как таковые, либо, предпочтительно, в виде части фармацевтической композиции, которая дополнительно включает фармацевтически приемлемый носитель.
Применяемый в настоящем описании термин «фармацевтическая композиция» относится к препарату прикрепляющихся клеток изобретения (т.е. прикрепляющихся клеток из плаценты или жировой ткани, которые получены после 2D или 3D культивирования), с другими химическими компонентами, такими как фармацевтически приемлемые носители и наполнители. Целью фармацевтической композиции является облегчение введения клеток индивидууму.
В настоящем описании далее термин «фармацевтически приемлемый носитель» относится к носителю, или разбавителю, который не вызывает существенного раздражения у индивидуума и не аннулирует биологическую активность и свойства вводимого соединения. Примерами носителей без ограничения являются пропиленгликоль, физиологический раствор, эмульсии и смеси органических растворителей с водой.
В настоящем описании термин «наполнитель» относится к инертному веществу, добавленному к фармацевтической композиции для дополнительного облегчения введения соединения. Примеры наполнителей без ограничения включают карбонат кальция, фосфат кальция, различные сахара и типы крахмалов, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
В соответствии с предпочтительным вариантом осуществления изобретения фармацевтический носитель представляет собой водный физиологический раствор соли.
Способы составления и введения лекарств могут быть найдены в "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, последнее издание, которое включено в настоящее описание в качестве ссылки.
Фармацевтическую композицию можно вводить системно (как подробно описано в настоящем документе выше). Альтернативно, фармацевтическую композицию можно вводить местно, например путем инъекции фармацевтической композиции непосредственно в область ткани больного.
Фармацевтические композиции изобретении могут быть получены с помощью способов, хорошо известных в данной области техники, например посредством общепринятых процессов смешивания, растворения, гранулирования, создания драже, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации.
Фармацевтические композиции для применения в соответствии с изобретением, таким образом, могут быть составлены традиционным способом с использованием одного или более физиологически приемлемых носителей, включая наполнители и вспомогательные агенты, которые облегчают процессинг активных ингредиентов в препаратах, которые могут быть использованы фармацевтически. Соответствующий состав зависит от выбранного пути введения.
Для инъекций активные ингредиенты фармацевтической композиции могут быть составлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера, физиологический солевой раствор или замораживающая среда, содержащая криоконсерванты. Для введения через слизистую в составе используются пенетранты, подходящие для проникновения через барьер. Такие пенетранты обычно известны в данной области техники.
Определение терапевтически эффективного количества действительно находится в пределах способностей специалистов в данной области техники, особенно в свете предлагаемого в настоящем описании подробного раскрытия.
Для любого препарата, используемого в способах изобретения, терапевтически эффективное количество или доза может быть определена первоначально из тестов в клеточной культуре in vitro. Предпочтительно доза определяется на животной модели для достижения желаемой концентрации или титра. Такой состав может быть использован для более точного определения пригодных доз у людей.
Токсичность и терапевтическую эффективность активных ингредиентов, описанных в настоящем документе, можно определять с помощью стандартных фармацевтических процедур in vitro, в клеточных культурах или на экспериментальных животных. Данные, полученные из этих тестов in vitro и в клеточных культурах и из исследований на животных, могут быть использованы для определения диапазона дозировок для использования у человека. Дозировка может варьироваться в зависимости от применяемой формы дозирования и используемого пути введения. Точный состав, путь введения и дозировку может выбрать лечащий индивидуума врач, принимая во внимание состояние больного (см., например, Fingl, et al., 1975, in "The Pharmacological Basis of Therapeutics", Ch. 1 p.l).
Количество дозированного состава и интервал могут быть подобраны индивидуально до уровней активного ингредиента, которые достаточны для эффективной регуляции синтеза нейротрансмиттеров имплантированными клетками. Дозировки, необходимые для достижения желаемого эффекта, должны зависеть от индивидуальных характеристик и пути введения. Для определения концентраций в плазме могут быть использованы методы их детекции.
В зависимости от тяжести состояния и реакции на лечение дозирование может представлять собой однократное или многократное введение в течение курса лечения, продолжающегося от нескольких дней до нескольких недель или до достижения уменьшения патологического состояния.
Количество композиции для введения должно, конечно, зависеть от индивидуума, подвергаемого лечению, тяжести болезни, способа введения, решения врача, предписывающего лечение и т.д. Дозировка и установление времени лечения должны зависеть от тщательного и постоянного мониторинга изменения состояния индивидуума.
Модели воспалительных заболеваний ободочной кишки включают животные модели язвенного колита, такие как, но не ограничиваясь этим, колит, индуцированный тринитробензолсульфоновой кислотой (TNBS), у крыс и мышей [Komori et al., J Gastroenterol (2005) 40: 591-599; и примеры 4-5 в настоящем описании ниже].
Композиции, включающие препарат изобретения, составленный с фармацевтически совместимым носителем, могут быть также получены, помещены в подходящий контейнер и снабжены этикеткой для лечения указанного состояния.
Композиции изобретения могут быть представлены, если это желательно, в упаковке или дозирующем устройстве, таких как одобренный FDA набор, который может содержать одну или более единиц лекарственных форм, содержащих активный ингредиент. Упаковка может, например, включать металлическую или пластиковую фольгу, как, например, блистерная упаковка. Упаковка или дозирующее устройство могут сопровождаться инструкциями по введению. Упаковка или дозатор могут также снабжаться уведомлением, связанным с контейнером, в форме, предписанной правительственным учреждением, регулирующим производство, использование или продажу фармацевтических агентов, причем это уведомление отражает одобрение учреждением формы композиций или введения человеку или животным. Такое уведомление, например, может быть снабжено этикеткой с одобрением управлением по контролю за продуктами и лекарствами США для предписания лекарств или вкладышем об одобрении продукта.
Прикрепляющиеся клетки изобретения могут быть подходящим образом составлены в виде фармацевтических композиций, которые могут быть подходящим образом упакованы в виде продукта производства. Такой продукт производства включает маркировку для использования при лечении язвенного колита или болезни Крона, упаковочный материал, в который упаковано фармацевтически эффективное количество прикрепляющихся клеток из плаценты или жировой ткани.
Должно быть понятно, что продукт производства может дополнительно включать добавочные лекарственные средства для лечения воспалительных состояний ободочной кишки, включая, например, противовоспалительные агенты, иммуномодуляторные агенты, противовоспалительные агенты и другие лекарственные средства для лечения воспалительных состояний ободочной кишки (как описано более подробно в настоящем документе выше).
Используемый в настоящем описании термин «приблизительно» относится к ±10%.
Термины «содержит», «содержащий», «включает», «включающий», «обладающий» и их однокоренные слова обозначают «включающий, но не ограничивающийся этим».
Термин «состоящий из» обозначает «включающий и ограничивающийся этим».
Термин «состоящий по существу из» означает, что композиция, способ или структура могут включать дополнительные ингредиенты, стадии и/или части, но только если дополнительные ингредиенты, стадии и/или части фактически не изменяют основных и новых характеристик заявляемых композиции, способа или структуры.
Применяемая в настоящем описании единственная форма «a», «an» и «the» включает ссылки на множественную, если в контексте ясно не указано иначе. Например, термин «соединение» или «по меньшей мере, одно соединение» может включать множество соединений, включая их смеси.
На протяжении этой заявки различные варианты осуществления данного изобретения могут быть представлены в формате диапазонов. Должно быть понятно, что описание в формате диапазонов дается просто для удобства и краткости и не должно толковаться как жесткое ограничение объема изобретения. Соответственно, описание диапазона должно рассматриваться как необходимое раскрытие всех возможных подгрупп диапазона, а также индивидуальных цифровых величин в пределах диапазона. Например, описание такого диапазона, как от 1 до 6, должно рассматриваться как имеющее конкретно раскрытые подгруппы диапазона, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также индивидуальные числа в пределах диапазона, например 1, 2, 3, 4, 5 и 6. Это применяется независимо от широты диапазона.
Всякий раз, когда в настоящем описании указывается цифровой диапазон, подразумевается, что он включает любые процитированные числа (дробные или целые) в пределах указанного диапазона. Выражения «размах диапазонов/диапазоны между», первое указывает число и второе указывает число, и «размах диапазонов/диапазоны от» первое указывает число «до», второй указывает число, они используются в настоящем описании взаимозаменяемо и подразумевают включение первого и второго указанных чисел и все дробные и целые числа между ними.
Применяемый в настоящем описании термин «способ» относится к образу действий, способам, методам и процедурам для осуществления данной задачи, включая, но не ограничиваясь этим, такие образ действия, способы, методы и процедуры, которые либо известны, либо легко разрабатываются на основе известных образа действий, способов, методов и процедур практикующими специалистами в химической, фармакологической, биологической, биохимической и медицинской областях техники.
Должно быть понятно, что определенные отличительные признаки изобретения, которые для ясности описываются в контексте отдельных вариантов осуществления, могут также предлагаться в сочетании в одном варианте осуществления. Наоборот, различные отличительные признаки изобретения, которые для краткости описываются в контексте одного варианта осуществления, могут также предлагаться отдельно или в любом подходящем более дробном сочетании или как это подходит для любого другого описанного варианта осуществления изобретения. Определенные отличительные признаки, описанные в контексте различных вариантов осуществления, не должны рассматриваться как необходимые отличительные признаки этих вариантов осуществления до тех пор, пока вариант осуществления становится не эффективным без этих элементов.
Различные варианты осуществления и аспекты настоящего изобретения, как определено в настоящем описании выше и как заявлено в разделе формулы изобретения ниже, находят экспериментальное подтверждение в последующих примерах.
ПРИМЕРЫ
В настоящий момент делается ссылка на последующие примеры, которые совместно с представленным выше описанием иллюстрируют изобретение в неограничивающей форме.
В целом используемая в настоящем описании номенклатура и применяемые в настоящем изобретении лабораторные методы включают молекулярные, биохимические, микробиологические методы и методы рекомбинантной ДНК. Такие методы полностью раскрыты в литературе. См., например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методы, представленные в патентах США №№ 4666828; 4683202; 4801531; 5192659 и 5272057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W. H. Freeman and Co., New York (1980); доступные иммунотесты широко описываются в патентной и научной литературе, см., например, патенты США №№ 3791932; 3839153; 3850752; 3850578; 3853987; 3867517; 3879262; 3901654; 3935074; 3984533; 3996345; 4034074; 4098876; 4879219; 5011771 и 5281521; "Oligonucleotide Synthesis" Gait, M. J., ed. (1984); "Nucleic Acid Hybridization" Hames, B. D., and Higgins S. J., eds. (1985); "Transcription and Translation" Hames, B. D., and Higgins S. J., Eds. (1984); "Animal Cell Culture" Freshney, R. L, ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, B., (1984) и "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); все они включены в качестве ссылки, как если бы полностью были изложены в настоящем описании. На всем протяжении настоящего документа предлагаются другие общие ссылки. Используемые в настоящем описании методы, как считается, должны быть хорошо известны в данной области техники и предлагаются для удобства читателя. Вся содержащаяся в них информация включена в настоящее описание в качестве ссылки.
ПРИМЕР 1
Методы создания 3D прикрепляющихся клеток из плаценты
Прикрепляющиеся клетки получали, как описано ранее (см. WO/2007/108003), в биореакторной системе, содержащей 3D носители, для получения 3D-прикрепляющихся клеток (обозначаемых в настоящем описании как PLX).
Материалы и экспериментальные процедуры
Прикрепляющиеся клетки из плаценты
Внутренние части доношенной плаценты (медицинский центр Bnei Zion, Haifa, Израиль) вырезали в стерильных условиях, промывали 3 раза буфером Хэнка и инкубировали в течение 3 часов при 37°С с 0,1% коллагеназой (1 мг/мл ткани; Sigma-Aldrich, St. Lewis, MO). Путем мягкого пипетирования суспендированные клетки затем промывали DMEM с добавкой 10% FCS, смеси Pen-Strep-Nystatin (100 Ед/мл:100 мкг/мл:1,25 Ед/мл) и 2 мМ L-глутамина, высевали в сосуды 75 см2 и инкубировали при 37°С в инкубаторе для клеточных культур в условиях увлажнения с 5% CO2.
Двумерное (2D) выращивание клеток
Клеткам давали прикрепиться к поверхности пластика в течение 72 часов, после чего среду меняли через каждые 3-4 дня. После 2-3 пассажей клетки хранили при криогенной температуре, размораживали и высевали для повторного выращивания в сосудах. После достижения 60-80% конфлуентности клетки отделяли от сосуда для выращивания с помощью 0,25% трипсина-ЭДТА и высевали в новые сосуды (обычно через каждые 3-5 дней) с проведением 2-5 дополнительных пассажей. После этого культивированные клетки собирали для анализа или для культивирования в биореакторах.
Биореактор PluriXTM Plug Flow
Биореактор PluriXTM Plug Flow (Pluristem, Haifa, Израиль; см. патент США № 6911201 и WO/2007/108003) загружали 1-100 мл 3-мерных пористых носителей (4 мм в диаметре), изготовленных из матрикса нетканого полотна или полиэфира. Эти носители способны обеспечить размножение большого количества клеток в относительно небольшом объеме. Стеклянная посуда была разработана и произведена Pluristem (Pluristem, Haifa, Израиль). Биореактор помещали в инкубатор при 37°С при скорости потока, регулируемой и отслеживаемой с помощью клапана и перистальтического насоса. Биореактор содержит порт для введения образца и инъекции, обеспечивающий последовательное высевание клеток. Культуральная среда с pH 6,7-7,4 поступала из резервуара. В резервуар вводили отфильтрованную газовую смесь, содержащую воздух/CO2/O2 в разных соотношениях в зависимости от плотности клеток в биореакторе. Доля O2 доводилась по уровню растворенного О2 на выходе биореактора, определяемого с помощью монитора. Газовую смесь направляли в резервуар через силиконовые трубки или диффузор (Degania Bet, Emek Hayarden, Израиль). Культуральную среду пропускали через сепарирующий контейнер, обеспечивающий сбор циркулирующих, неприкрепленных клеток. Циркуляция среды обеспечивалась перистальтическим насосом. Биореактор был дополнительно снабжен дополнительным портом для введения образца и контейнерами для непрерывной замены среды.
Получение 3D-прикрепленных клеток (PLX)
Неконфлуентные первичные 2D культуры прикрепленных клеток человека, выращенные, как описано выше, обрабатывали трипсином, промывали, ресуспендировали в DMEM с добавкой 10% FCS, смеси Pen-Strep-Nystatin (100 Ед/мл:100 мкг/мл:1,25 Ед/мл) и 2 мМ L-глутамина и высевали (103-105 клеток/мл) через порт для инъекций на 3D носители в стерильном биореакторе Plug Flow. Перед инокуляцией биореактор наполняли PBS-Ca-Mg (Biological Industries, Beit Ha'emek, Израиль), автоклавировали (120°С, 30 мин) и промывали средой для выращивания по Дульбекко, содержащей 10% инактивированную нагреванием сыворотку плодов телят и смесь Pen-Strep-Nystatin (100 Ед/мл:100 мкг/мл:1,25 Ед/мл). Скорость потока поддерживали на уровне 0,1-5 мл/мин. Процесс высевания включал прекращение циркуляции на 2-48 ч, что тем самым давало возможность клеткам осесть на носители. Биореактор поддерживали в условиях контролируемых температуры (37°С) и pH (pH 6,7-7,4) с помощью инкубатора, снабжаемого стерильным воздухом и CO2 по мере необходимости. Среду для выращивания меняли 2-3 раза в неделю. Циркулирующую среду заменяли свежей средой DMEM через каждые 4 часа - 7 дней. При плотности клеток 1×106-1×107 клеток/мл (после 12-40 дней выращивания) из биореактора удаляли всю среду и биореактор и носители промывали 3-5 раз ЗФР. 3D-прикрепленные клетки отделяли от носителей с помощью трипсина-ЭДТА (Biological Industries, Beit Ha'emek, Израиль; 3-15 минут при легком перемешивании, 1-5 раз) и затем ресуспендировали в DMEM и хранили при криогенной температуре.
ПРИМЕР 2
Методы получения 2D-прикрепляющихся клеток для использования в соответствии с настоящими указаниями и получения тем самым 2D прикрепляющихся клеток
Получали 2D прикрепляющиеся клетки, проявляющие свойства, отличные от свойств описанных выше 3D прикрепляющихся клеток (PLX, пример 1). После этого 2D прикрепленные клетки из костного мозга или плаценты выращивали в условиях, стимулирующих дифференцировку остеоцитов или адипоцитов.
Материалы и экспериментальные процедуры
Процесс получения 2D прикрепленных клеток
Получение ткани человека
Все плаценты были получены в родильном отделении с одобрения Комитета Хельсинки по медицинской помощи. Соответственно, все доноры плаценты подписывали информированное согласие, и производились скрининг доноров и тестирование доноров (IPC1). Сразу после получения плаценты от донора (во время процедуры кесарева сечения) ее помещали в стерильный пластиковый мешок и затем в пенопластовую коробку с мешочками льда. Плаценту вывозили и немедленно помещали в карантинную зону до получения разрешения для использования со стороны контроля качества (QC) и гарантирования качества (QA). Все последующие стадии получения производили в карантине, приспособленной чистой комнате до поступления утвержденных QC результатов теста на микоплазму, и клетки выделяли для 2D выращивания клеток.
Выделение и обработка прикрепляющихся клеток
Сначала плаценту разрезали на кусочки в асептических условиях в вытяжном шкафу с ламинарным потоком, промывали буферным раствором Хэнка и инкубировали в течение 3 часов при 37°С с 0,1% коллагеназой (1 мг коллагеназы/мл ткани). Добавляли 2D клеточную среду (2D среда, включающая DMEM с добавлением 10% FBS, 0,25 мкг/мл фунгизона и 50 мкг/мл гентамицина) и переваренную ткань грубо фильтровали через стерильную металлическую сетку, собирали в стерильный стакан и центрифугировали (10 минут, 1200 об/мин, 4°С). С помощью легкого пипетирования суспендированные клетки затем промывали 2D средой с добавлением антибиотиков, высевали в 80 см2 сосуды и инкубировали при 37°С в инкубаторе для тканевой культуры в условиях увлажнения с подачей 5% CO2. Спустя 2-3 дня, в течение которых клеткам давали возможность прикрепиться к поверхности сосуда, клетки промывали ЗФР и добавляли 2-мерную среду.
Двумерное (2D) выращивание клеток
Перед первым пассажем образцы среды для выращивания в количестве 10% от общего количества сосудов в карантине объединяли и сдавали на тестирование микоплазмы (IPC2). Если обнаруживалось, что клетки негативны в отношении микоплазмы (набор EZ-PCR Micoplasma, Biological Industries, Israel), клетки освобождались из карантина. После 1-2 дополнительных пассажей клетки переносили в чистую комнату для получения 2D культуры (2DP). В комнате 2DP культивирование продолжали посредством еще 3-5 пассажей (отметим, что клетки выращивали в 2D среде с добавлением антибиотиков до пассажа 2, после чего выращивали в 2D среде без антибиотиков). После пассажа 4 отбирали образец IPC-3 для определения иммунологического фенотипа. На протяжении процесса культуры выращивали в инкубаторе для культуры ткани в условиях увлажнения с 5% CO2 при 37°С. После в общей сложности 6-8 пассажей (9-16 удвоений клеток) клетки собирали и хранили при криогенной температуре в качестве запаса 2D клеток (2DCS).
Первый пассаж обычно проводили спустя 10-15 дней. Начиная с пассажа 2 вплоть до пассажа 6-8 клетки пассировали при достижении культурой 70-80% конфлуентности, обычно через 3-5 дней (1,5-2 удвоение). Клетки отделяли от сосудов с помощью 0,25% трипсина-ЭДТА (4 минуты при 37°С) и высевали с получением плотности культуры 3±0,2×103 клеток/см2. Размер сосудов для тканевой культуры увеличивали в соответствии с продолжением пассажей. Процесс культивирования начинали в сосуде для культуры ткани 80 см2, продолжали в 175 см2, затем в 500 см2 (утроенный сосуд) и, наконец, клетки высевали в клеточную фабрику из 10 подносов (6320 см2).
Перед хранением при криогенной температуре в конце периода выращивания 2DSC собирали среду для выращивания и получали образец для отсылки в сертифицированную GLP лабораторию для тестирования микоплазмы (IPC4).
Процедура криоконсервации запасаемого продукта 2D клеток
Для криоконсервации 2DCS 2D культивируемые клетки собирали в асептических условиях с помощью 0,25% трипсина-ЭДТА. Клетки центрифугировали (1200 об/мин, 10 мин, 4°С), подсчитывали и ресуспендировали в 2D среде.
Для замораживания клеточные суспензии разбавляли 1:1 2D средой для замораживания (конечные концентрации составляли 10% ДМСО, 40% ЗФР и 50% 2D среды). Из одной плаценты получали приблизительно 1,5-2,5×109 клеток. 4 мл клеток хранили при конечной концентрации 10×106/мл в 5-мл полипропиленовых сосудах для криоконсервации. Сосуды помечали и переносили в морозильник с контролируемой скоростью охлаждения для процесса с постепенным снижением температуры (1°С/мин), после чего их переносили для хранения в газовую фазу морозильника на жидком азоте, находящегося в комнате для хранения с охлаждением. Этот материал обозначали как запасаемая партия 2D клеток (2DCS).
Анализ клеточного цикла
2D прикрепляющиеся клетки и клетки PLX фиксировали 70% EtOH O.N, центрифугировали и ресуспендировали в растворе пропидия йодида (PI), содержащем 2 мкг/мл PI (Sigma), 0,2 мг/мл РНКазы A (Sigma) и 0,1% (об./об.) тритона (Sigma) в течение 30 минут. Клеточный цикл анализировали с помощью FACS.
Матрица (микроматрица) для анализа экспрессии генов
Прикрепляющиеся клетки получали из доношенных плацент человека и размножали с помощью 2D культур или в соответствии с указаниями WO/2007/108003 (как подробно описано в примерах 1-2). Для дальнейшего анализа было получено по три разных партии клеток при использовании каждого из методов размножения.
Из клеток экстрагировали РНК (набор Qiagen-Rneasy micro) и наносили на матрицу Affymetrix экспрессии всего генома GeneChip® Human Exon 1.0 ST Array (Affymetrix, Santa Clara, California, США).
Анализ мембранных маркеров с помощью FACS
Клетки окрашивали моноклональными антителами, как описано ранее. Вкратце, 400000-600000 клеток суспендировали в 0,1 мл буфера для проточного цитометра в 5-мл пробирке для тестирования в течение 15 минут при комнатной температуре (RT) в темноте с каждым из следующих моноклональных антител (MAbs): конъюгированным с FITC MAb против CD29 человека (eBioscience), конъюгированным с PE MAb против CD73 человека (Becton Dickinson), конъюгированным с PE MAb против CD105 человека (eBioscience), конъюгированным с PE MAb против CD90 человека (Becton Dickinson), конъюгированным с FITC MAb против CD45 человека (IQProducts), конъюгированным с PE MAb против CD19 человека (IQProducts), конъюгированным с PE MAb против CD14 человека (IQProducts), конъюгированным с FITC MAb против HLA-DR человека (IQProducts), конъюгированным с PE MAb против CD34 человека (IQProducts), конъюгированным с FITC MAb против CD31 человека (eBioscience), конъюгированным с FITC MAb против KDR человека (R&D systems), MAb против маркера фибробластов человека (D7-FIB) (ACRIS), конъюгированным с FITC MAb против CD80 человека (BD), конъюгированным с FITC MAb против CD86 человека (BD), конъюгированным с FITC MAb против CD40 человека (BD), конъюгированным с FITC MAb против HLA-ABC человека (BD), конъюгированным с FITC изотипом IgG1 (IQ Products), конъюгированным с PE изотипом IgG1 (IQ Products).
Клетки промывали дважды буфером для проточного цитометра, ресуспендировали в 500 мкл буфера для проточного цитометра и анализировали с помощью проточной цитометрии с использованием проточного цитометра FC-500 (Beckman Coulter). Отрицательные контроли получали с флуоресцирующими молекулами соответствующего изотипа.
Анализ иммуномодуляции
Мононуклеарные клетки от человека (MNCs) выделяли из периферической крови. Суспензию 200000 MNCs на 200 мкл среды (среда RPMI 1640, содержащая 20% ЗФР на 96 лунок) стимулировали 10 мкг PHA/мл (SIGMA) в присутствии 20000 2D прикрепленных клеток в течение 5 дней в условиях увлажнения, 5% CO2 при 37°С. Использовали 4 разные партии 2D прикрепленных клеток. Три повтора каждой группы высевали в 96-луночный планшет. В период последних 18 ч 5-дневного культивирования клетки подвергали импульсному воздействию 1 мкКи3H-тимидина и затем собирали на стекловолоконном фильтре. Захват тимидина количественно оценивали с помощью сцинтилляционного счетчика.
Индукция остеогенеза в 2D прикрепленных клетках
Остеогенез проводили в соответствии с набором для остеогенеза Chemicon (cat № scr028, Millipore, MA, США).
Среда для индукции остеогенеза
Готовили свежую среду для индукции остеогенеза перед каждой сменой среды с использованием компонентов набора (см. таблицу 1 ниже).
Для получения 1 мМ раствора дексаметазона к 100 мкл 10 мМ раствора дексаметазона добавляли 900 мкл этанола. Исходный раствор хранили вместе с другими компонентами набора при -20°С. Сосуд с 50 мл сыворотки инактивировали нагреванием, разделяли на 5-мл аликвоты и хранили при -20°С до использования.
Покрытие 24-луночных планшетов для культивирования тканей
Смесь для покрытия, включающую 12 мкг/мл витронектина и 12 мкг/мл коллагена (оба входят в состав набора), готовили разбавлением каждого из них 1×ЗФР.
После этого смесь для покрытия добавляли в лунки для покрытия поверхностей лунки (готовили 5 лунок x 2 планшета). Планшеты инкубировали в течение ночи при комнатной температуре. После этого смесь для покрытия удаляли и лунки промывали ЗФР. Планшеты осушали непосредственно перед использованием.
Выращивание клеток
Клетки из плаценты (plc11-3-1) или клетки из костного мозга (BM108) помещали (200000 клеток на лунку) в 1 мл среды для выращивания, включающей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco). Клетки из плаценты (4 лунки × 2 планшета) или клетки из костного мозга (1 лунка × 2 планшета) выращивали до 100% конфлуентности (обычно в течение ночи) перед инициацией остеогенной дифференцировки.
После достижения клетками 100% конфлуентности среду для выращивания отсасывали и заменяли 1 мл среды для индукции остеогенеза (день 1 дифференцировки). Среду для индукции остеогенеза заменяли свежей средой каждые 2-3 дня на протяжении в общей сложности 14-17 дней.
В качестве контроля один из двух планшетов (для каждого типа клеток) инкубировали не со средой для остеогенной дифференцировки, а со средой для выращивания (описанной в настоящем описании выше).
На 17 день остеоциты фиксировали и окрашивали раствором ализаринового красного, как описано подробно ниже.
Протокол окрашивания
Окрашивание остеоцитов производили, начиная с осторожного отсасывания среды из каждой лунки (осторожного, чтобы не отсосать клетки). Затем клетки фиксировали инкубацией в охлажденном на льду 70% этаноле в течение 1 часа при комнатной температуре. Спирт затем осторожно отсасывали и клетки промывали дважды водой (5-10 минут на каждую промывку). Воду затем отсасывали и к клеткам добавляли раствор ализаринового красного (500-1000 мкл). Клетки инкубировали с раствором ализаринового красного при комнатной температуре в течение 30 минут. Ализариновый красный удаляли и клетки промывали 4 раза 1 мл воды и осушали после каждой промывки. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты микроскопически визуализировали с помощью инвертированного микроскопа Nikon.
Индукция остеогенеза в модифицированной среде для индукции остеогенеза (2D прикрепленные клетки)
Среду для индукции остеогенеза готовили заново перед каждой заменой среды с использованием компонентов, перечисленных в таблице 2 ниже, вместе с витамином D.
Сосуд с 50 мл сыворотки инактивировали нагреванием, разделяли на 5-мл аликвоты и хранили при -20°С до использования.
Покрытие 48-луночных планшетов для культивирования тканей
Смесь для покрытия, включающую 12 мкг/мл витронектина и 12 мкг/мл коллагена (оба от Chemicon), готовили разбавлением каждого из них 1×ЗФР.
После этого смесь для покрытия добавляли в лунки для покрытия поверхностей лунки (готовили 5 лунок × 2 планшета). Планшеты инкубировали в течение ночи при комнатной температуре. После этого смесь для покрытия удаляли и лунки промывали один раз ЗФР. Планшеты осушали непосредственно перед использованием.
Выращивание клеток
Клетки из плаценты (фетальные клетки PLC 8-2-1, PLC 15 3-4-2 или PLC 19-4-3-1) помещали (100000 клеток на лунку) в 0,5 мл среды для выращивания, включающей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco) (4 лунки × 2 планшета). Клетки из костного мозга (BM109) помещали (150000 клеток на лунку) в 0,5 мл среды для выращивания (как описано выше) (1 лунка × 2 планшета). Клетки выращивали до 10% конфлуентности (обычно в течение ночи) перед инициацией остеогенной дифференцировки.
После достижения клетками 100% конфлуентности среду для выращивания отсасывали и заменяли 0,5 мл среды для индукции остеогенеза (день 1 дифференцировки). Среду для индукции остеогенеза заменяли свежей средой каждые 2-3 дня на протяжении в общей сложности 26 дней.
В качестве контроля один из двух планшетов (для каждого типа клеток) инкубировали не со средой для остеогенной дифференцировки, а со средой для выращивания (описанной в настоящем описании выше).
На 26 день остеоциты фиксировали и окрашивали раствором ализаринового красного, как описано подробно ниже.
Протокол окрашивания
Окрашивание остеоцитов производили, начиная с осторожного отсасывания среды из каждой лунки (осторожного, чтобы не отсосать клетки). Затем клетки фиксировали инкубацией в охлажденном на льду 70% этаноле в течение 1 часа при комнатной температуре. Спирт затем осторожно отсасывали и клетки промывали дважды водой (5-10 минут на каждую промывку). Воду затем отсасывали и к клеткам добавляли раствор ализаринового красного (500-1000 мкл). Клетки инкубировали с раствором ализаринового красного при комнатной температуре в течение 30 минут. Ализариновый красный удаляли, и клетки промывали 4 раза 1 мл воды и осушали после каждой промывки. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты микроскопически визуализировали с помощью инвертированного микроскопа Nikon.
Индукция адипогенеза в 2D прикрепленных клетках
Адипогенез проводили в соответствии с набором для адипогенеза Chemicon (набор для адипогенеза Chemicon, cat № scr020, Millipore, MA, США).
Среда для индукции адипогенеза
Среды для индукции или поддержания адипогенеза готовили непосредственно перед каждой заменой среды с использованием компонентов, описанных в таблицах 3 и 4 ниже.
Выращивание клеток
Клетки из плаценты (plc11-3-1) или клетки из костного мозга (BM108) помещали (200000 клеток на лунку) в 1 мл среды для выращивания, включающей DMEM (Invitrogen, Gibco), 10 % FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco). Клетки из плаценты (4 лунки × 2 планшета) или клетки из костного мозга (1 лунка × 2 планшета) выращивали до 10% конфлуентности (обычно в течение ночи) перед инициацией адипогенной дифференцировки.
После достижения клетками 100% конфлуентности среду для выращивания отсасывали и заменяли 1 мл среды для индукции адипогенеза (день 1 дифференцировки). Среду для индукции адипогенеза заменяли свежей средой каждые 2-3 дня на протяжении в общей сложности 25 дней (как подробно описано в таблице 5 ниже в настоящем описании). Отметим, что монослои адипогенных клеток были чрезвычайно хрупкими и могли быть легко удалены с планшетов, в связи с чем замены среды производили путем аккуратных замен среды во избежание разрушения липидных капель.
В качестве контроля один из двух планшетов (для каждого типа клеток) инкубировали не со средой для адипогенной дифференцировки, а со средой для выращивания (описанной в настоящем описании выше).
На 25 день адипоциты фиксировали и окрашивали раствором масляного красного, как подробно описано ниже.
Протокол окрашивания
Окрашивание адипоцитов производили, начиная с осторожного отсасывания среды из каждой лунки (осторожного, чтобы не отсосать клетки). Затем клетки фиксировали инкубацией в 4% параформальдегиде в течение 30-40 минут при комнатной температуре. Фиксатор затем осторожно отсасывали и клетки промывали три раза ЗФР (5-10 минут на каждую промывку). ЗФР затем отсасывали и клетки дважды промывали водой. После этого воду отсасывали и к клеткам добавляли раствор масляного красного (500-1000 мкл). Клетки инкубировали с раствором масляного красного при комнатной температуре в течение 50 минут. Раствор масляного красного удаляли и клетки промывали 4 раза 1 мл воды и осушали после каждой промывки. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты микроскопически визуализировали с помощью инвертированного микроскопа Nikon.
Получение раствора масляного красного
Использовали 0,25 г исходного масляного красного, который растворяли в 50 мл изопропанола путем инкубации 10-15 мин в бане при 37°С.
Для использования 30 мл исходного красителя смешивали с 20 мл DDW (оставляли на 10 минут и затем фильтровали через бумажный фильтр для кофе). Раствор масляного красного готовили заново для каждого использования.
Индукция адипогенеза в модифицированной среде для индукции адипогенеза (2D прикрепленные клетки)
Среду для индукции адипогенеза готовили заново перед каждой заменой среды с использованием компонентов, описанных в таблице 6 ниже.
Выращивание клеток
Клетки из плаценты (фетальные клетки PLC 8-2-1, PLC 15 3-4-2 или PLC 19-4-3-1) помещали (100000 клеток на лунку) в 0,5 мл среды для выращивания, включающей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco) (5 лунок × 2 планшета).
Клетки из костного мозга (BM109) помещали (100000 клеток на лунку) в 0,5 мл среды для выращивания, включающей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco) (4 лунки × 2 планшета). Клетки выращивали до 100% конфлуентности (обычно в течение ночи) перед инициацией адипогенной дифференцировки.
После достижения клетками 100% конфлуентности среду для выращивания отсасывали и заменяли 0,5 мл среды для индукции адипогенеза (день 1 дифференцировки). Среду для индукции адипогенеза заменяли свежей средой каждые 2-3 дня на протяжении в общей сложности 3-4 недель.
В качестве контроля один из двух планшетов (для каждого типа клеток) инкубировали не со средой для адипогенной дифференцировки, а со средой для выращивания (описанной в настоящем описании выше).
На 26 день адипоциты фиксировали и окрашивали раствором масляного красного, как описано подробно ниже.
Протокол окрашивания
Окрашивание адипоцитов производили, начиная с осторожного отсасывания среды из каждой лунки (осторожного, чтобы не отсосать клетки). Затем клетки фиксировали инкубацией в 4% параформальдегиде в течение 30-40 минут при комнатной температуре. Фиксатор затем осторожно отсасывали и клетки промывали три раза ЗФР (5-10 минут на каждую промывку). ЗФР затем отсасывали и клетки дважды промывали водой. После этого воду отсасывали и к клеткам добавляли раствор масляного красного (500-1000 мкл). Клетки инкубировали с раствором масляного красного при комнатной температуре в течение 50 минут. Раствор масляного красного удаляли и клетки промывали 3 раза 1 мл дважды дистиллированной воды и осушали после каждой промывки. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты микроскопически визуализировали с помощью инвертированного микроскопа Nikon.
Получение раствора масляного красного
Использовали 0,25 г исходного масляного красного, который растворяли в 50 мл изопропанола путем инкубации 10-15 мин в бане при 37°С.
Для использования 30 мл исходного красителя смешивали с 20 мл DDW (оставляли на 10 минут и затем фильтровали через бумажный фильтр для кофе). Раствор масляного красного готовили заново для каждого использования.
Результаты
Как показано в таблице 7 ниже, обработка 2D прикрепленных клеток, пригодных для использования в соответствии с настоящими указаниями, отличается от стадии 2D PLX (WO/2007/108003) в нескольких аспектах. Во-первых, в новую среду для культивирования 2D прикрепленных клеток антибиотики добавляли только во время начальной стадии культивирования (вплоть до пассажа 2). Кроме того, новые 2D прикрепленные клетки криоконсервировали лишь после 5-8 пассажей (т.е. в конце культуры), а не во время промежуточных стадий 2D роста, как в случае процесса PLX.
Изменения в процессе получения 2D прикрепленных клеток привели к изменениям в свойствах полученных клеток. Эти различия суммированы в настоящем описании ниже.
Анализ клеточного цикла 2D прикрепленных клеток по сравнению с 3D прикрепленными клетками WO/2007/108003 - 2D прикрепленные клетки сравнивали с 3D прикрепленными клетками для оценки распределения клеток между разными фазами клеточного цикла. Как ясно из фиг.1A-B, 2D прикрепленные клетки проявляли типичный пролиферативный профиль (распределение клеток между разными фазами клеточного цикла). Конкретно, 28% клеток находились в S и G2/M фазах (фиг.1A). Эти результаты показали, что клетки были собраны во время пролиферации и что условия культивирования поддерживали клеточный рост.
Напротив, 3D прикрепленные клетки проявляли меньшую скорость клеточной пролиферации. Менее 8% клеток находились в S и G2/M фазах (фиг.1B). Эти результаты показали, что клетки были собраны тогда, когда имел место низкий уровень пролиферации, и что условия в биореакторе были субоптимальными для поддержания клеточного роста.
Сравнение между 2D клетками, пригодными для использования в соответствии с настоящими указаниями, и клетками, полученными по указаниям WO/2007/108003, с помощью микроматриц. Анализ экспрессии генов с помощью микроматриц позволил одновременно отследить профили экспрессии всего генома прикрепленных клеток, полученных из плацент человека с доношенной беременностью, размноженных с помощью 2D культур или в соответствии с указаниями WO/2007/108003 (PLX, см. пример 1 в настоящем описании выше). Эти результаты позволили оценить молекулярный механизм, лежащий в основе фенотипического различия между клетками, полученными с помощью этих разных методов выращивания (см. таблицу 8 ниже).
Характеристика мембранных маркеров на 2D прикрепленных клетках, пригодных для использования в соответствии с настоящими указаниями - поверхностные антигены, экспрессируемые 2D прикрепленными клетками, оценивали с использованием моноклональных антител. Эти клетки представляли собой стабильно прикрепленные клетки, которые размножались in vitro без утраты фенотипа и без проявления признаков изменений кариотипа. Анализ мембранных маркеров 2D прикрепленных клеток с помощью проточной цитометрии показал высокую долю клеток, экспрессирующих CD105, CD73, CD90 и CD29. Более того, высокая доля клеток не экспрессировала CD45, CD34 и маркеры поверхности CD19, CD11b, CD14 и HLA-DR (фиг.2).
Иммуномодуляция 2D прикрепляющимися клетками - Затем исследовали иммуногенность 2D прикрепляющихся клеток. Как показано на фиг.3, четыре разные партии 2D прикрепляющихся клеток были способны снижать пролиферацию лимфоцитов, вызываемую митогенными стимулами фитогемагглютинина (PHA), по данным измерений включения тимидина.
Индукция остеоцитов - остеоцитная дифференцировка прикрепленных клеток из плаценты или костного мозга в среде для индукции остеогенеза приводила к дифференцировке более 50% клеток из костного мозга, как это было продемонстрировано позитивным окрашиванием ализариновым красным (фиг.4B). Напротив, ни одна из клеток из плаценты не проявляла каких-либо признаков остеогенной дифференцировки (см. фиг.4B и 4E и таблицу 9 ниже).
Затем, 2D прикрепленные клетки, берущие начало из костного мозга или плаценты, стимулировали к дифференцировке в модифицированной остеогенной среде, включающей витамин D и более высокие концентрации дексаметазона, соответствующей предшествующим указаниям по модификации протокола остеогенной дифференцировки [Parloni et al. (2008) Stem Cells 26(2): 300-11]. Как следует из результатов, более 50% клеток из костного мозга подвергались дифференцировке в остеоциты, как это было продемонстрировано позитивным окрашиванием ализариновым красным (см. фиг.5B). Однако ни одна из клеток из плаценты не проявляла каких-либо признаков остеогенной дифференцировки (см. фиг.5E и таблицу 9 выше в настоящем описании).
Индукция адипоцитов - дифференцировка в адипоциты 2D прикрепленных клеток из плаценты или костного мозга в среде для индукции адипоцитов приводила к дифференцировке более 50% клеток из костного мозга (см. фиг.4C), как это демонстрируется позитивным окрашиванием масляным красным и типичными морфологическими изменениями (например, накоплением жировых капелек в цитоплазме). Напротив, ни одна из клеток из плаценты не дифференцировалась в адипоциты (см. фиг.4F и таблицу 9 выше в настоящем описании).
Затем, 2D прикрепленные клетки, берущие начало из костного мозга или плаценты, стимулировали к дифференцировке в адипоциты в модифицированной среде, включающей более высокий уровень индометацина, соответствующей предшествующим указаниям по модификации протокола адипоцитной дифференцировки [Parloni et al. (2007), выше]. Как следует из результатов, более 50% клеток из костного мозга подвергались дифференцировке в адипоциты (см. фиг.5C), как это было продемонстрировано позитивным окрашиванием масляным красным и типичными морфологическими изменениями (например, накоплением жировых капелек в цитоплазме). Напротив, ни одна из клеток из плаценты не проявляла морфологических изменений, типичных для адипоцитов (см. фиг.5F и таблицу 9 выше в настоящем описании).
ПРИМЕР 3
Методы создания 3D прикрепленных клеток, пригодных для использования в соответствии с настоящими указаниями, и созданные с их помощью 3D прикрепленные клетки
Были получены 3D прикрепленные клетки (PLX-C), которые проявляют свойства, отличные от свойств описанных выше 3D прикрепленных клеток (PLX, пример 1).
Материалы и экспериментальные процедуры
Проточный биореактор с затвором CelligenTM
Получение 3D прикрепленных клеток для использования по настоящему изобретению с помощью CelligenTM (PLX-C клеток) состояло из нескольких основных стадий. Процесс начинался с получения плаценты при плановом родоразрешении посредством кесарева сечения в срок.
Затем из целых плацент выделяли прикрепляющиеся клетки, выращивали в сосудах для тканевой культуры (2D культуры), собирали и хранили в жидком азоте в качестве запаса 2D-клеток (2DCS), подходящее количество 2DCS размораживали, промывали и высевали на носители в биореакторах для дальнейшего выращивания в виде 3D-культуры. После 4-21 дней выращивания в биореакторах клетки собирали и криоконсервировали в газовой фазе жидкого азота как PLX-C.
Получение ткани человека
Все полученные плаценты поступали из родильного отделения с одобрения Комитета Хельсинки по медицинской помощи. Соответственно, все доноры плаценты подписывали информированное согласие, и производились скрининг доноров и тестирование доноров (IPC1). Сразу после получения плаценты от донора (во время процедуры кесарева сечения) ее помещали в стерильный пластиковый мешок и затем в пенопластовую коробку с мешочками льда. Плаценту вывозили и немедленно помещали в карантинную зону до получения разрешения для использования со стороны контроля качества (QC) и гарантирования качества (QA). Все последующие стадии получения производили в карантине, приспособленной чистой комнате до поступления утвержденных QC результатов теста на микоплазму, и клетки выделяли для 2-мерного выращивания.
Выделение и обработка прикрепляющихся клеток
Сначала ткань целой плаценты разрезали на кусочки в асептических условиях в вытяжном шкафу с ламинарным потоком, промывали буферным раствором Хэнка и инкубировали в течение 3 часов при 37°С с 0,1% коллагеназой (1 мг коллагеназы/мл ткани). Добавляли 2D клеточную среду (2D среда, включающая DMEM с добавлением 10% FBS, 0,25 мкг/мл фунгизона и 50 мкг/мл гентамицина), и переваренную ткань грубо фильтровали через стерильную металлическую сетку, собирали в стерильный стакан и центрифугировали (10 минут, 1200 об/мин, 4°С). С помощью легкого пипетирования суспендированные клетки затем промывали 2D-средой с добавлением антибиотиков, высевали в 80 см2 сосуды и инкубировали при 37°С в инкубаторе для тканевой культуры в условиях увлажнения с подачей 5% CO2. Спустя 2-3 дня, в течение которых клеткам давали возможность прикрепиться к поверхности сосуда, клетки промывали ЗФР и добавляли 2D-среду.
Двумерное (2D) выращивание клеток
Перед первым пассажем образцы среды для выращивания в количестве 10% от общего количества сосудов в карантине объединяли и сдавали на тестирование микоплазмы (IPC2). Если обнаруживалось, что клетки негативны в отношении микоплазмы (набор EZ-PCR Micoplasma, Biological Industries, Израиль), клетки освобождались из карантина. После 1-2 дополнительных пассажей клетки переносили в чистую комнату для получения 2D (2DP). В комнате 2DP культивирование продолжали посредством еще 3-5 пассажей (отметим, что клетки выращивали в 2D-среде с добавлением антибиотиков до пассажа 3, после чего клетки выращивали в 2D-среде без антибиотиков). После пассажа 4 отбирали образец IPC-3 для определения иммунологического фенотипа. На протяжении процесса культуры выращивали в инкубаторе для культуры ткани в условиях увлажнения с 5% CO2 при 37°С. После в общей сложности 6-8 пассажей (9-16 удвоений клеток) клетки собирали и хранили при криогенной температуре в качестве запаса 2D-клеток (2DCS).
Первый пассаж обычно проводили спустя 10-15 дней. Начиная с пассажа 2 вплоть до пассажа 6-8 клетки пассировали при достижении культурой 70-80% конфлуентности, обычно через 3-5 дней (1,5-2 удвоений). Клетки отделяли от сосудов с помощью 0,25% трипсина-ЭДТА (4 минуты при 37°С) и высевали с получением плотности культуры 3±0,2×103 клеток/см2. Размер сосудов для тканевой культуры увеличивали в соответствии с продолжением пассажей. Процесс культивирования начинали в сосуде для культуры ткани 80 см2, продолжали в 175 см2, затем в 500 см2 (утроенный сосуд) и, наконец, клетки высевали в клеточную фабрику из 10 подносов (6320 см2).
Перед криоконсервацией в конце периода выращивания 2DSC собирали среду для выращивания и получали образец для отсылки в сертифицированную GLP лабораторию для тестирования микоплазмы (IPC4).
Процедура криоконсервации запасаемого продукта 2D-клеток
Для криоконсервации 2DCS 2D-культивируемые клетки собирали в асептических условиях с помощью 0,25% трипсина-ЭДТА. Клетки центрифугировали (1200 об/мин, 10 мин, 4°С), подсчитывали и ресуспендировали в 2D-среде.
Для замораживания клеточные суспензии разбавляли 1:1 2D-средой для замораживания (конечные концентрации составляли 10% ДМСО, 40% ЗФР и 50% 2D-среды). Из одной плаценты получали приблизительно 1,5-2,5×109 клеток. 4 мл клеток хранили при конечной концентрации 10×106/мл в 5-мл полипропиленовых сосудах для криоконсервации. Сосуды помечали и переносили в морозильник с контролируемой скоростью охлаждения для процесса с постепенным снижением температуры (1°С/мин), после чего их переносили для хранения в газовую фазу морозильника на жидком азоте, находящегося в комнате для хранения с охлаждением. Этот материал обозначали как запасаемая партия 2D-клеток (2DCS).
Инициация процедур трехмерного (3D) культивирования
Для инициации 3D культуры подходящее количество (150±30×106) клеток из 2DCS размораживали в комнате 2DP и промывали средой 3D (DMEM с 10% FBS и 20 мМ Hepes) для удаления ДМСО перед высеванием в заранее подготовленные биореакторные системы. Содержимое каждого сосуда 2DCS пипетировали и разбавляли 1:9 предварительно нагретой (37°С) 3D-средой. Клетки центрифугировали (1200 об/мин, 10 мин, 4°С) и вновь ресуспендировали в 50-100 мл предварительно нагретой (37°С) 3D-среды в 250-мл стерильной бутыли. Отбирали образец, и клетки подсчитывали с помощью красителя трипанового синего для определения количества и жизнеспособности клеток. Клеточную суспензию переносили в вытяжном шкафу с ламинарным потоком в 0,5-л бутыль для высевания. Из бутыли для высевания клеточную суспензию переносили под действием силы тяжести через стерильные трубки в биореактор.
Получение прикрепленных клеток в биореакторе CelliGen (PLX-C)
Описание биореактора
Фазу выращивания 3D проводили с использованием биореакторной системы CelliGen Plus® или BIOFLO 310 [(New Brunswick Scientific (NBS)]. Биореакторную систему использовали для культивирования клеточной культуры, условия в которой были пригодны для высоких концентраций клеток. Процесс культивирования осуществляли с использованием биореактора в режиме перфузии. Биореактор лабораторного масштаба был собран из двух основных систем - контрольной системы и самого биореактора (сосуда и дополнительного оборудования). Параметры процесса отслеживались и контролировались с помощью контрольной консоли, которая включала соединительные устройства для зондов, мотор и насосы, контуры регулирования растворенного кислорода (DO), pH, перфузии и встряхивания (с помощью мотора), систему контроля газов, систему циркуляции воды и нагревания для контроля температуры и интерфейс для оператора. Параметры контролируемого процесса (такие как температура, pH, DO и т.д.) можно было вывести на интерфейс оператора и отслеживать с помощью сконструированного контроллера.
Процедура выращивания клеточной культуры в биореакторах
Как отмечалось в разделе выше настоящего описания, 150±30×106 клеток из криоконсервированных 2DCS размораживали, промывали и высевали в стерильный биореактор. Биореактор содержал 30-50 г носителей (дисков FibraCel®, NBS), изготовленных из полиэфира и полипропилена, и 1,5±0,1 л 3D-среды. Среду для выращивания в биореакторе хранили при следующих условиях: 37°С, 70% растворенного кислорода (DO) и pH 7,3. Отфильтрованные газы (воздух, CO2, N2 и O2) вводились как определялось контрольной системой для поддержания величины DO на уровне 70% и величины pH на уровне 7,3. В течение первых 24 часов среду перемешивали при 50 оборотах в минуту (об/мин) и повышали скорость до 200 об/мин на 2 день. В течение первых 2-3 дней клетки выращивали в пакетном режиме. Перфузию начинали, когда концентрация глюкозы в среде снижалась ниже 550 мг/л. Среду качали из контейнера для подачи в биореактор с использованием стерильной силиконовой трубки. Все соединения трубок производили под ламинарным потоком с использованием стерильных разъемов. Перфузию доводили ежедневно для поддержания концентрации глюкозы постоянной на уровне приблизительно 550±50 мг/л. Каждые 1-2 дня отбирали образец среды для выращивания для определения концентрации глюкозы, лактата, глутамина, глутамата и аммония (анализатор BioProfile 400, Nova Biomedical). Отношение скорости потребления глюкозы и скорости образования лактата клеточной культурой давало возможность измерить скорость клеточного роста. Эти параметры использовали для определения времени сбора на основе собранных экспериментальных данных.
Сбор выращенных 3D клеток PLX-C из биореактора
Процесс сбора клеток начинали в конце фазы роста (4-10 дней). Отбирали два образца среды для выращивания. Один образец готовили для отправки в сертифицированную GLP лабораторию для тестирования микоплазмы в соответствии со стандартами USP и Eu, а другой образец переносили в морозильник с контролируемой скоростью замораживания для процесса постепенного снижения температуры (1°С/мин), после чего его переносили для хранения в газовой фазе морозильника на жидком азоте, расположенного в комнате для хранения при охлаждении, на случай необходимости повторного тестирования микоплазмы. Эти образцы среды рассматривались как часть тестирования микоплазмы конечного продукта и результаты рассматривались как часть критериев для освобождения продукта.
Выращенную 3D культуру собирали в ламинарной области класса-100 в комнате 3DP следующим образом:
Содержимое сосуда биореактора удаляли в пустой контейнер через трубку за счет силы тяжести. Сосуд открывали путем удаления верхней крышки и носители асептически переносили с помощью стерильного пинцета из бункера в верхнюю корзиночную сетку. После этого сосуд биореактора закрывали и вновь наполняли 1,5 л предварительно нагретого ЗФР (37°С). Скорость встряхивания увеличивали до 150 об/мин в течение 2 минут. ЗФР удаляли с помощью трубки под давлением или под действием силы тяжести в пустой сосуд. Процедуру промывки повторяли дважды.
Для отделения клеток от носителей в сосуд биореактора добавляли 1,5 л предварительно нагретого до 37°С раствора трипсина-ЭДТА (трипсин 0,25%, ЭДТА 1 мМ) и носители встряхивали в течение 5 минут при 150 об/мин, 37°С. Клеточную суспензию собирали в 5-л стерильный контейнер, содержащий 250 мл ЗФР. Клеточную суспензию разделяли между 4500-мл стерильными пробирками для центрифугирования и отбирали образец для тестирования микоплазмы. Закрытые центрифужные пробирки переносили через активную зону 3DP для переноса в комнату для заполнения класса 10000 (FR1), в которой клетки асептически разносили и криоконсервировали в качестве PLX-C.
Анализ клеточного цикла
Клетки PLX-C, полученные с помощью Celligen, и клетки PLX, полученные с помощью Plurix, фиксировали 70% EtOH O.N, центрифугировали и ресуспендировали в растворе пропидия йодида (PI), содержащем 2 мкг/мл PI (Sigma), 0,2 мг/мл РНКазы A (Sigma) и 0,1% (об./об.) тритона (Sigma) в течение 30 минут. Клеточный цикл анализировали с помощью FACS.
Матрица (микроматрица) для анализа экспрессии генов
Прикрепляющиеся клетки получали из доношенных плацент человека и размножали c помощью Plurix или Celligen. Для дальнейшего анализа было получено по три разных партии клеток при использовании каждого из методов размножения.
Из клеток экстрагировали РНК (набор Qiagen-Rneasy micro) и наносили на матрицу Affymetrix экспрессии всего генома. микроматрица представляла собой GeneChip® Human Exon 1.0 ST Array (Affymetrix, Santa Clara, California, США).
Анализ мембранных маркеров с помощью FACS
Клетки окрашивали моноклональными антителами, как описано ранее. Вкратце, 400000-600000 клеток суспендировали в 0,1 мл буфера для проточного цитометра в 5-мл пробирке для тестирования в течение 15 минут при комнатной температуре (RT) в темноте с каждым из следующих моноклональных антител (MAbs): конъюгированным с FITC MAb против CD29 человека (eBioscience), конъюгированным с PE MAb против CD73 человека (Becton Dickinson), конъюгированным с PE MAb против CD105 человека (eBioscience), конъюгированным с PE MAb против CD90 человека (Becton Dickinson), конъюгированным с FITC MAb против CD45 человека (IQProducts), конъюгированным с PE MAb против CD19 человека (IQProducts), конъюгированным с PE MAb против CD14 человека (IQProducts), конъюгированным с FITC MAb против HLA-DR человека (IQProducts), конъюгированным с PE MAb против CD34 человека (IQProducts), конъюгированным с FITC MAb против CD31 человека (eBioscience), конъюгированным с FITC MAb против KDR человека (R&D systems), MAb против маркера фибробластов человека (D7-FIB) (ACRIS), конъюгированным с FITC MAb против CD80 человека (BD), конъюгированным с FITC MAb против CD86 человека (BD), конъюгированным с FITC MAb против CD40 человека (BD), конъюгированным с FITC MAb против HLA-ABC человека (BD), конъюгированным с FITC изотипом IgG1 (IQ Products), конъюгированным с PE изотипом IgG1 (IQ Products).
Клетки промывали дважды буфером для проточного цитометра, ресуспендировали в 500 мкл буфера для проточного цитометра и анализировали с помощью проточной цитометрии с использованием проточного цитометра FC-500 (Beckman Coulter). Отрицательные контроли получали с флуоресцирующими молекулами соответствующего изотипа.
Реакция смешанных лимфоцитов (MLR)
2×105 MNC из периферической крови (PB) (от донора A) стимулировали равным количеством облученных (3000 рад) MNCs из PB (от донора B). К культурам добавляли PLX-Cs в возрастающем количестве. Три повтора каждой группы высевали в 96-луночные планшеты. Клетки культивировали в среде RPMI 1640, содержащей 20% ЗФР. Планшеты импульсно метили 1 мкКи3H-тимидина в течение последних 18 час 5-дневного культивирования. Клетки собирали на стекловолоконном фильтре и захват тимидина количественно определяли с помощью сцинтилляционного счетчика.
Для окрашивания CFSE клетки PB-MNC окрашивали на CFSE (Molecular Probes) для измерения пролиферации перед культивированием. Клетки собирали через 5 дней и интенсивность окрашивания CFSE определяли с помощью проточной цитометрии.
ELISA
ELISA проводили, как описано ранее. Вкратце, MNCs (выделенные из периферической крови) стимулировали 5 мкг/мл ConA (Sigma), 0,5 мкг/мл LPS (SIGMA) или 10 мкг/мл PHA (SIGMA) в присутствии PLX-C в увлажненной атмосфере 5% CO2 при 37°С. Собирали супернатанты и подвергали их анализу на цитокины с использованием наборов ELISA для IFNγ (DIACLONE), TNFα (DIACLONE) и IL-10 (DIACLONE).
Результаты
Изменения в получении с помощью Celligen по сравнению с Plurix дали несколько важных различий (суммированных в таблице 10 ниже).
Изменения в процессе получения привели к изменениям в свойствах полученных прикрепленных клеток. Эти различия суммированы ниже.
Анализ клеточного цикла PLX, полученных с помощью Plurix, по сравнению с PLX-C, полученных с помощью Celligen
Клетки PLX-C, полученные с помощью Celligen, сравнивали с клетки PLX, полученными с помощью Plurix, для оценки распределения клеток между разными фазами клеточного цикла. Как ясно из фиг.6A-B, клетки PLX-C, размноженные с помощью Celligen, проявляли типичный пролиферативный профиль (распределения клеток между разными фазами клеточного цикла). Конкретно, 28% клеток находились в фазах S и G2/M (фиг.6A). Эти результаты показали, что клетки были собраны во время пролиферации и что условия биореактора Celligen поддерживали клеточный рост.
Сравнение клеток, полученных с помощью Plurix и Celligen, с использованием микроматриц
Анализ экспрессии генов с помощью микроматриц позволил одновременно отследить профили экспрессии всего генома прикрепляющихся клеток, полученных из плацент человека с доношенной беременностью, размноженных с помощью Plurix (PLX) или Celligen (PLX-C). Эти результаты позволили оценить молекулярный механизм, лежащий в основе фенотипического различия между клетками, полученными с помощью этих разных методов выращивания (см. таблицу 11 ниже).
Экспрессия клеточных маркеров на клетках PLX-C
Антигены поверхности, экспрессируемые PLX-C, тестировали с использованием моноклональных антител. Результаты показали, что клетки PLX-C характеризовались позитивными маркерами: CD73, CD29 и CD105 и негативными маркерами: CD34, CD45, CD19, CD14 и HLA-DR (данные не показаны). Описания по тесту на иммунный фенотип были установлены как: ≥90% для всех позитивных маркеров и ≤3% для всех негативных маркеров.
Более того, как показано на фиг.7A-B, культуры PLX-C не экспрессировали эндотелиальных маркеров, как продемонстрировано по негативному окрашиванию на два эндотелиальных маркера CD31 и KDR. Однако экспрессия на PLX-C маркера, типичного для фибробластов, была очевидной (экспрессия D7-fib, фиг.7C).
Иммуногенность и иммуномодуляторные свойства клеток PLX-C
Так как PLX-C состоят из прикрепляющихся клеток, происходящих из плаценты, предполагается, что они экспрессируют HLA типа I, который экспрессируются всеми клетками организма, и, как известно, индуцируют аллореактивный иммунный ответ. HLA типа II и другие костимуляторные молекулы обычно экспрессируются только на поверхности антигенпрезентирующих клеток (APCs).
Для того чтобы оценить иммуногенность полученных клеток PLX-C, осуществляли оценку экспрессии костимуляторных молекул на поверхности их клеточных мембран. Анализ FACS показал отсутствие CD80, CD86 и CD40 на мембранах клеток PLX-C (фиг.8A-C). Более того, PLX-C экспрессировали низкие уровни HLA класса I при определении с помощью окрашивания на HLA A/B/C (фиг.8D). Экспрессия стимуляторных и костимуляторных молекул была сходной с MSCs, происходящими из костного мозга (BM) (как показано на фиг.8A-D).
Для дополнительного исследования иммуногенности, а также иммуномодуляторных свойств клеток PLX-C осуществляли тесты по смешанной лимфоцитарной реакции (MLR). Как показано на фиг.9A-B, клетки PLX-C и избегают аллоузнавания, и снижают ответ Т-клеток при измерении по включению тимидина. Более того, снижение пролиферации лимфоцитов (оцениваемое по измерению имп/мин) было тем больше, чем больше росло количество клеток PLX-C (дозозависимым образом). PLX-C также снижали пролиферацию лимфоцитов после митогенных стимулов, таких как конкавалин A (Con A, фиг.9B) и фитогемагглютинин (PHA), и после неспецифической стимуляции анти-CD3, анти-CD28 (данные не представлены).
Для исследования механизма действия, с помощью которого PLX-C осуществляют иммуномодуляцию пролиферации лимфоцитов, и для рассмотрения опосредуется ли это действие межклеточным взаимодействием или секрецией цитокинов, мононуклеарные клетки (MNCs), происходящие из PB, стимулировали PHA с использованием метода межлуночного переноса (который предотвращает контакт между клетками, но позволяет цитокинам диффундировать между двумя компартментами). Результаты показали, что ингибирование пролиферации поддерживалось, даже когда контакт между клетками ингибировался (данные не представлены).
Секреция цитокинов
Как описано в настоящем документе выше, LX-C снижают скорость пролиферации лимфоцитов, очевидно, через растворимые факторы. Дальнейшее исследование цитокинов, секретируемых лимфоцитами в ответ на PLX-C, осуществляли для выяснения механизма действия PLX-C. Как изображено на фиг.10A-B, культивирование мононуклеарных клеток с PLX-C слегка снижало секрецию провоспалительного цитокина INFγ и резко снижало секрецию TNFα (даже в присутствии низких количеств PLX-C). Кроме того, после стимуляции липополисахаридом (LPS) секреция ИЛ-10 MNCs, происходящими из PB, повышалась в присутствии PLX-C, тогда как уровень секреции TNFα снижался дозозависимым образом (фиг.10C).
Следует принимать во внимание, что клетки PLX-C по указаниям настоящего изобретения были также способны осуществлять хоминг в ишемических тканях после внутримышечного или внутривенного введения мышам (данные не представлены).
ПРИМЕР 4
Противовоспалительное действие клеток PLX-C in vivo в мышиной модели острого колита
Материалы и экспериментальные методы
TNBS модель воспаления кишечника
Колит индуцировали у восприимчивых линий грызунов путем внутриректального закапывания гаптенизирующего вещества TNBS (тринитробензолсульфоновой кислоты) в этаноле. Использование TNBS в этаноле основано на предшествующих сообщениях о том, что этанол требуется для разрушения барьера слизистой, тогда как TNBS гаптенизирует аутологичные или микробные белки ободочной кишки, придавая им иммуногенность в отношении иммунной системы хозяина [Wirtz et al., Nature Protocols (2007) 2(3): 541-546].
Кратко, для индукции колита мышей анестезировали в течение 90-120 минут и им вводили внутриректально TNBS (40 мкл, 150 мг/кг), растворенной в 1:1 смеси 0,9% NaCl в 100% этаноле. Контрольные мыши получали 1:1 смесь 0,9% NaCl в 100% этаноле или физиологический раствор с использованием того же самого метода.
Мышей забивали через 5 дней после введения TNBS для оценки противовоспалительного действия терапевтических клеток (PLX-C клеток) по настоящему изобретению. Введение PLX-C оценивали при внутривенном (в/в) введении или при внутрибрюшинном (в/бр) введении клеток через 1 день после индукции колита.
Животные
В этих экспериментах использовали мышей C57b16. Суммарно использовали 90 мышей, которые были подразделены на 9 следующих групп:
1) 10 контрольных мышей (не получавших никакого лечения)
2) 10 контрольных мышей + партия 1 PLX-C-I в/бр (2*106 клеток)
3) 10 контрольных мышей + партия 1 PLX-C-I в/в (1*106 клеток)
4) 10 мышей TNBS (мышей с моделью колита)
5) 10 мышей TNBS + 5-аминосалициловая кислота (5-ASA)
6) 10 мышей TNBS + партия 1 PLX-C-I в/в (1*106 клеток)
7) 10 мышей TNBS + партия 1 PLX-C-I в/бр (2*106 клеток)
8) 10 мышей TNBS + партия 2 PLX-C-I в/в (1*106 клеток)
9) 10 мышей TNBS + партия 2 PLX-C-I в/в (2*106 клеток)
Получение 2D прикрепляющихся клеток, происходящих из плаценты
Как подробно описано в примере 2 в настоящем описании выше.
Получение 3D прикрепляющихся клеток, происходящих из плаценты (клеток PLX-C)
Как подробно описано в примере 3 в настоящем описании выше.
Носитель
В качестве контрольного носителя использовали PlasmaLyte, содержащий 5% альбумин.
Тесты и оценка
Осуществляли макроскопическую и гистологическую оценки колита в образцах ободочной кишки, собранных от мышей различных экспериментальных групп через 5 дней после введения TNBS. Макроскопическую и гистологическую оценки проводились вслепую двумя исследователями.
Макроскопический анализ
Ободочную кишку каждой мыши исследовали под препаровальной лупой (увеличение × 5) для оценки макроскопических повреждений в соответствии с критериями Уоллеса. По показателю Уоллеса оценивали макроскопические повреждения по шкале от 0 до 10 на основе признаков, отражающих воспаление, таких как гиперемия, утолщение кишечника и распространение изъязвления.
Гистологический анализ
Для гистологической оценки в соответствии с критериями Ameho использовали образец ободочной кишки, расположенный точно на 2 см выше анального отверстия. Эта классификация (по шкале от 0 до 6) принимала во внимание степень воспалительного инфильтрата, наличие эрозии, изъязвление или некроз и глубину и поверхностное распространение повреждений.
Молекулярный анализ колита
Количественная оценка экспрессии мРНК ИЛ-1 бета
Суммарную РНК выделяли из цельных тканей ободочной кишки мышей с использованием набора Rneasy (Macherey Nagel, Hoerdt, France) в соответствии с инструкциями производителя. Количественную оценку РНК проводили с использованием спектрофотометрии. После обработки при 37°С в течение 30 минут 20-50 единицами ДНКазы I, свободной от РНКазы (Roche Diagnostics Corporation, Indianapolis, IN, USA), использовали олиго-dT праймеры (Roche Diagnostics Corporation, Indianapolis, IN, USA) для синтеза одноцепочечной кДНК. мРНК количественно оценивали при использовании SYBR green Master Mix (Applera, Courtaboeuf, France) со специфическими для мыши олигонуклеотидами для ИЛ-1β: S: 5'-gATCCACACTCTCCAgCTgCA-3' (SEQ ID NO: 1) и AS: 5'-CAACCAACAAgTgATATTCTCCATg-S' (SEQ ID NO: 2) в GeneAmp Abiprism 7000 (Applera, Courtaboeuf, France). Калибровку проводили при каждом тестировании и включали контроли без матрицы. Каждый образец наносили в трех повторах. Интенсивность красителя SYBR green анализировали с использованием компьютерной программы Abiprism 7000 SDS (Applera, Courtaboeuf, France). Все результаты нормализовали на не подверженный влиянию ген домашнего хозяйства β-актин (олигонуклеотиды для β-актина: S: 5'-gggTCAgAAggATTCCTATg-3' SEQ ID NO: 3; AS: 5' ggTCTCAAACATgATCTggg-3' SEQ ID NO: 4).
Результаты
Как подробно описано в настоящем документе выше, мышей забивали на 5 день после индукции колита с помощью внутриректального введения TNBS на день 0 и прикрепляющиеся клетки вводили на 1 день. Мышам вводили либо 2D прикрепляющиеся клетки (в настоящем описании далее партия 1) или PLX-C прикрепляющиеся клетки (в настоящем описании далее партия 2), полученные из плаценты 1 или плаценты 2 соответственно. После забоя мышей проводили макроскопическую и микроскопическую оценки ободочной кишки.
Как представлено на фиг.11, мыши, получавшие в/в инъекцию 2D или PLX-C клеток (партия 1 или 2, соответственно), демонстрировали существенное улучшение воспалительного состояния ткани ободочной кишки, как представлено по показателю Уоллеса. Это противовоспалительное действие было настолько же эффективным, что и золотой стандарт лечения 5-ASA). Должно быть понятно, что и в/бр введение 2D прикрепляющихся клеток (партия 1) также приводило к удовлетворительному улучшению показателя Уоллеса на мышиной модели колита.
Микроскопическая оценка ободочной кишки показала, что введение клеток PLX-C (партия 2) либо в/бр, либо в/в путями существенно снижало воспаление ободочной кишки на гистологическом уровне по сравнению с мышами TNBS (как представлено по показателю Ameho, фиг.12). Улучшение у групп с этим лечением было значительно лучше по сравнению с группами TNBS, получавшими лечение 5-ASA.
Далее, суммарную РНК выделяли из тканей ободочной кишки и оценивали уровни экспрессии ИЛ-1β с помощью ОТ-ПЦР (как подробно описано в настоящем документе выше). Как очевидно из результатов (фиг.13), в/в введение клеток PLX-C (партия 2) существенно снижало уровень экспрессии ИЛ-1β в тканях ободочной кишки. Должно быть понятно, что, хотя уровни экспрессии РНК ИЛ-1β снижались несущественно при в/бр введении (2D или 3D прикрепляющихся клеток, партии 1 и 2, соответственно) и в/в введении (2D прикрепляющихся клеток, партия 1), введение как PLX-C, так и 2D клеток тем не менее приводило к существенному снижению воспаления на основе оценок на макроскопическом и микроскопическом уровне у мышей с колитом.
Взятые вместе эти результаты продемонстрировали, что введение прикрепляющихся клеток плаценты настоящего изобретения (2D и 3D PLX-C клеток) ведет к существенному улучшению воспалительного состояния ободочной кишки в мышиной модели острого колита.
ПРИМЕР 5
Противовоспалительное действие клеток PLX-C in vivo в крысиной модели острого колита
Материалы и экспериментальные методы
TNBS модель воспаления кишечника
У крыс вызывали колит путем введения внутрь ободочной кишки 22 мг TNBS, растворенной в 1:1 смеси EtOH и воды. Через 24 часа после индукции колита крысам вводили препараты в соответствии с исследуемым типом лечения.
Крысы, используемые в этом исследовании, были подразделены на три экспериментальные группы (как подробно описано ниже). Через одиннадцать дней после индукции колита всех крыс забивали и повреждение ободочной кишки оценивали как микроскопически, так и макроскопически.
День введения TNBS обозначали как день 0, клетки PLX-C вводили на день 1 и крыс забивали на 11 день.
Животные
В этих экспериментах использовали 12 самок крыс Lewis (100-120 г). Суммарно использовали 12 крыс, которые подразделяли на 4 следующих группы:
1) 4 крысам вводили в/бр 5×106 клеток PLX-C-I
2) 4 крысам вводили в/в 5×106 клеток PLX-C-I
3) 2 крысы получали в/бр PlasmaLyte (контрольная группа)
4) 2 крысы получали в/в PlasmaLyte (контрольная группа)
Получение прикрепляющихся клеток, происходящих из плаценты (клеток PLX-C)
Клетки получали, как подробно описано в примере 3 в настоящем описании выше.
Макроскопическая оценка повреждения ободочной кишки
Макроскопическую оценку повреждения ободочной кишки проводили в соответствии со следующими критериями:
0 - без повреждения
1 - гиперемия, но без язв
2 - фиброз, но без язв
3 - изъязвление/некроз менее 1 см
4 - изъязвление/некроз менее 2 см
5 - изъязвление/некроз более 2 см
Микроскопическая (гистологическая) оценка повреждения ободочной кишки
Микроскопическую оценку повреждения ободочной кишки проводили в соответствии со всеми следующими критериями (A+B+C+D):
A. Распространение изъязвления:
0 - без язвы
1-2 - небольшие язвы (менее 3 мм)
3-5 большие язвы (более 3 мм)
B. Субмукозная инфильтрация:
0 - нет
1 - слабая
2-3 - умеренная
4-5 - тяжелая
C. Абсцессы крипт:
0 - нет
1-2 - редкие
3-5 - диффузные
D. Толщина стенки (мкм):
0 - менее 470
1 - менее 600
2 - менее 700
3 - менее 800
4 - менее 900
5 - более 900
Результаты
Как очевидно из фиг.14, введение 3D прикрепляющихся клеток настоящего изобретения (клеток PLX-C) ведет к существенному улучшению микроскопических показателей (по гистологической оценке) острого колита у крыс.
Хотя изобретение описано в связи с конкретными вариантами его осуществления, несомненно, что многообразные альтернативные варианты, модификации и вариации должны быть очевидны специалистам в данной области техники. Соответственно, подразумевается охват всех таких альтернативных вариантов, модификаций и вариаций, которые соответствуют духу и попадают в широкий объем прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки, упомянутые в этом описании, включены в настоящий документ в полном объеме при описании, в той же степени, как если бы каждая индивидуальная публикация, патент или патентная заявка были бы конкретно и индивидуально указаны как включаемые в настоящее описание в качестве ссылки. Кроме того, цитирование или обозначение любой ссылки в этой заявке не должно толковаться как допущение того, что такая ссылка пригодна в качестве уровня предшествующей техники для настоящего изобретения. В той степени, в которой используются заголовки разделов, они не должны толковаться как обязательно ограничивающие.
Реферат
Группа изобретений относится к медицине, в частности к гастроэнтерологии, и касается лечения язвенного колита или болезни Крона. Способ лечения включает введение в организм терапевтически эффективного количества прикрепляющихся клеток из плаценты, культивированных таким образом, что не дифференцируются в адипоциты или остеоциты. Предложено также применение указанных клеток для получения лекарственного средства, предназначенного для лечения язвенного колита или болезни Крона. Предложенный продукт производства для лечения язвенного колита или болезни Крона включает в упаковочном виде фармацевтически эффективное количество этих клеток. Изобретения обеспечивают существенное уменьшение воспалительного процесса в ободочной кишке при моделировании указанных заболеваний, в т.ч. за счет патогенетических механизмов лечения, помимо Т-лимфоцитарной супрессии. 3 н. и 28 з.п. ф-лы, 5 пр., 12 табл., 16 ил.
Формула
Документы, цитированные в отчёте о поиске
Комбинации для лечения иммуновоспалительных расстройств
Способ выделения мезенхимальных стволовых клеток

Комментарии