Способ лечения иммунной дисфункции, такой как реакция "трансплантат против хозяина" или "хозяин против трансплантата" - RU2497530C2
Код документа: RU2497530C2
Чертежи







Описание
Ссылка на родственные заявки
Настоящая заявка является частичным продолжением заявки США номер 11/269 736, поданной 9 ноября 2005, которая является частичным продолжением заявки США номер 11/151 689, поданной 13 июня 2005, которая является частичным продолжением заявки США номер 10/963 444, поданной 11 октября 2004 (оставленной без движения), которая является частичным продолжением заявки США номер 10/048 757, поданной 1 февраля 2002, которая является перешедшей на национальную стадию заявкой США PCT/US00/21387, поданной 4 августа 2000 и опубликованной 15 февраля 2001 на английском языке как WO 01/11011, по которой испрашивается в соответствии с 35 U.S.С. §119(е) приоритет предварительных заявок США номера 60/147 324, поданной 5 августа 1999, и номера 60/164 650, поданной 10 ноября 1999, и частичным продолжением заявки США номер 10/467 963, поданной 11 августа 2003, которая является перешедшей на национальную стадию заявкой США PCT/US02/04652, поданной 14 февраля 2002 и опубликованной 22 августа 2002 на английском языке как WO 02/064748, по которой испрашивается в соответствии с 35 U.S.С. §119(е) приоритет предварительных заявок США номера 60/268 786, поданной 14 февраля 2001, номера 60/269 062, поданной 15 февраля 2001, номера 60/310 625, поданной 7 августа 2001, и номера 60/343 836, поданной 25 октября 2001, все эти заявки и публикации приведены в данный документ в качестве ссылки в полном объеме, и для настоящей заявки испрашивается полное преимущество их приоритета.
Область техники, к которой относится изобретение
Областью техники, к которой относится изобретение, является иммуномодуляция полипотентными зрелыми клетками-предшественниками («МАРС») и их применение для модулирования иммунного ответа в основных и дополнительных лечебных мероприятиях.
Уровень техники изобретения
Терапевтическое использование органных трансплантатов, включая трансплантаты костного мозга, неуклонно возрастало со времени их первого применения. Это стало важным способом выбора лечения большого числа заболеваний, включая, но ими не ограничиваясь, гематологические, иммунологические и онкологические заболевания.
К сожалению, терапевтическое использование трансплантации часто осложняется, оказывается неэффективным или прерывается отрицательным иммунным ответом, вызванным трансплантатом. К числу наиболее выраженных отрицательных реакций, с которыми приходится сталкиваться вследствие трансплантации, относятся (i) реакция «хозяин против трансплантата» («HVG») (отторжение трансплантата иммунокомпетентным хозяином) и (ii) заболевание «трансплантат против хозяина» («GVHD») (процессы, которые обнаруживаются в основном в иммунокомпрометированном хозяине, если он распознается иммунокомпетентными клетками трансплантата как чужеродный).
Конечно, отторжения трансплантата у хозяина можно было бы избежать полной совместимостью донора и хозяина. Однако, за исключением аутологичной ткани, лишь однояйцевых близнецов можно считать в самом деле сингенными. Полная совместимость конкретного донора и другого конкретного хозяина/реципиента практически невозможна. Таким образом, использование аутологичной ткани представляет собой единственный способ добиться полной совместимости. К сожалению, ткань хозяина, как правило, не пригодна или не была выделена до возникновения такой необходимости. Зачастую необходимость в трансплантации возникает, по существу, для замены поврежденной ткани хозяина. Поэтому сингенную ткань, несмотря на эффективное решение проблем отрицательного ответа хозяина на пересаженную ткань, как правило, использовать на практике невозможно.
При невозможности сингенной совместимости отрицательные иммунные эффекты, которые возникают при трансплантации, можно смягчить насколько это возможно совместимостью аллогенных донора и хозяина. Для повышения шансов на успех лечения используют типирование крови и/или ткани на совместимость доноров и хозяев. Но даже самая точная совместимость аллогенной ткани, тем не менее, не предотвращает тяжелой реакции HVG и, соответственно, трансплантация включает применение иммуносупрессии и иммуносупрессорных лекарственных препаратов, что обсуждается ниже.
Другим подходом для предотвращения осложнений HVG, возникающих при трансплантации, являлось повреждение иммунной системы реципиентного хозяина. Этого добивались, используя радиационную терапию и/или иммуносупрессорную химиотерапию и/или антитела. Полученная супрессия иммунного ответа хозяина часто довольно эффективно способствует приживлению трансплантата (такого как костный мозг) в хозяине. Однако иммуноабляция или супрессия повреждает иммунную защиту хозяина. Это приводит к тому, что хозяин становится крайне восприимчивым к инфекциям даже после незначительного воздействия инфекционных агентов. Присоединение инфекции является основной причиной заболеваемости и смертности среди пациентов, перенесших трансплантацию.
Повреждение иммунной системы хозяина также вызывает или отягощает другую серьезную проблему, с которой сталкиваются при трансплантации - заболевание «трансплантат против хозяина» («GVHD»). GVHD имеет место, если ткань донора содержит иммунокомпетентные клетки, которые распознают белки МНС реципиента как чужеродные. Это приводит к активации Т-клеток, и они секретируют цитокины, такие как IL-2 (интерлейкин 2), IFNγ (интерферон гамма) и TNFα (фактор некроза опухоли альфа). Эти сигналы запускают иммунную атаку на мишени реципиента, к которым относятся кожа, желудочно-кишечный тракт, печень и лимфоидные органы (Ferrara and Deeg, 1991). GVHD представляет собой особенно большую проблему в трансплантатах костного мозга, где, как было показано, оно должно опосредоваться в первую очередь Т-лимфоцитами (Grebe and Streilein, 1976). Фактически, у примерно 50% пациентов с трансплантированным костным мозгом развивается острое GVHD. Многие из этих пациентов умирают (от 15% до 45%).
Существуют также и другие дисфункции, расстройства и заболевания иммунной системы, которые возникают как первичные патологии и как вторичные эффекты других патологий и/или их лечения. К ним относятся новообразования, патологии костного мозга, патологии крови, аутоиммунные заболевания и некоторые воспалительные заболевания, как дополнительно обсуждается ниже. Основная и дополнительная терапия этих расстройств и заболеваний, подобно основной и дополнительной терапии HVG и GVHD, часто включает использование иммуносупрессорных лекарственных препаратов. Все применяемые в настоящее время способы лечения имеют недостатки и побочные эффекты.
Иммуносупрессирующие лекарственные препараты
Большие усилия были направлены на разработку лекарственных препаратов для лечения этих дисфункций иммунной системы, чтобы смягчить или устранить их негативные эффекты, не вызывая дополнительных отрицательных побочных эффектов. В стремлении к этой цели достигнут некоторый прогресс, и для профилактики и/или лечения этих дисфункций было разработано и используется большое число лекарственных препаратов. Введение более эффективных из этих лекарственных препаратов расценено как огромное достижение в практической трансплантологии, но не является идеальным. В действительности, ни одно из иммуносупрессорных лекарственных препаратов, на сегодняшний день доступных для клинического использования в трансплантации, не является абсолютно эффективным. Все лекарственные препараты имеют серьезные недостатки и отрицательные побочные эффекты, как вкратце обобщается ниже. Для обзора см. статью Farag (2004), «Хроническое заболевание трансплантат против хозяина: куда мы движемся?», Bone Marrow Transplantation 33: 569-577.
Кортикостероиды, которые используют в основном для лечения воспаления и воспалительных заболеваний, известны как иммуносупрессоры и многими считаются оптимальным основным лечением HVG и GVHD. Они, по крайней мере, частично ингибируют пролиферацию Т-клеток и иммунные реакции, зависящие от Т-клеток, ингибируя экспрессию определенных генов цитокинов, включенных в активацию Т-клеток и иммунный ответ, зависящий от Т-клеток.
Циклоспорин является одним из наиболее часто используемых лекарственных препаратов для иммунной супрессии и профилактики HVG и GVHD. В большинстве случаев он является сильным иммуносупрессором. Несмотря на то, что он может эффективно снижать отрицательные иммунные реакции у пациентов, перенесших трансплантацию, он также ослабляет иммунную систему настолько, что пациенты остаются легко восприимчивыми к инфекциям. Следовательно, пациентам гораздо легче заразиться при воздействии патогенов, и они имеют незначительную способность добиться эффективного иммунного ответа на инфекции. Даже условно-патогенные микроорганизмы впоследствии могут стать опасными для жизни. Циклоспорин также вызывает множество других нежелательных побочных эффектов.
Метотрексат также широко используется для профилактики и лечения HVG и GVHD самостоятельно или в сочетании с другими лекарственными препаратами. Исследованиями было показано, что если он и эффективен, то, по-видимому, менее эффективен, чем циклоспорин. Как и циклоспорин, метотрексат вызывает множество побочных эффектов, некоторые из них могут оказаться пагубными для здоровья пациентов.
FK-506 представляет собой макролид-подобное соединение. Как и циклоспорин, его получают из грибов. Иммуносупрессорные эффекты циклоспорина и FK-506 схожи. Образуя гетеродимерный комплекс с соответствующими им цитоплазматическими рецепторными белками (т.е. с циклофилином и FK-связывающим белком), они блокируют начальные процессы Т-клеточной активации. Это впоследствии приводит к ингибированию фосфатазной активности кальцийнейрина, посредством чего, в конечном счете, ингибируя экспрессию ядерных регуляторных белков и генов, отвечающих за Т-клеточную активацию.
К другим лекарственным препаратам, используемым для иммуносупрессии, относятся антитимоцитарный глобулин, азатиоприн и циклофосфамид. Их преимущества не были подтверждены. Для блокирования иммунного ответа, активированного Т-клетками, также использовали рапамицин, другое макролид-подобное соединение, которое влияет на ответ Т-клеток на IL-2. У экспериментальных животных для ингибирования отторжения аллотрансплантата было найдено производное микофеноловой кислоты RS-61443. Мизорибин, имидазольный нуклеозид, блокирует биосинтез пурина и ингибирует пролиферацию стимулированных митогеном Т- и В-клеток способом, подобным азатиоприну и RS-61443. На доклинических моделях трансплантации у дезоксиспергуалина, синтетического аналога спергуалина, обнаружили способность проявлять иммуносупрессорные свойства. Антиметаболит бреквинар натрия является ингибитором дигидрооротатдегидрогеназы и посредством ингибирования синтеза пиримидина блокирует образование нуклеотидов уридина и цитидина. Берберин и его фармакологически приемлемые соли использовали в качестве иммуносупрессора для лечения аутоиммунных заболеваний, таких как ревматизм, для лечения аллергии и для профилактики отторжения трансплантата. Было сообщено, что берберин ингибирует продукцию антител В-клетками и, как правило, подавляет гуморальный иммунный ответ, но не влияет на пролиферацию Т-клеток. См. патент Японии 07-316051 и патент США № 6 245 781.
Ни один из этих иммуносупрессорных лекарственных препаратов, используют ли его самостоятельно или в сочетании с другими средствами, не является абсолютно эффективным. Все они, как правило, все же оставляют пациентов восприимчивыми к HVG и GVHD и снижают их способность защищаться против инфекции. Это делает их гораздо более чувствительными к инфекции и гораздо менее способными победить инфекции при заражении. Более того, все эти лекарственные препараты вызывают тяжелые побочные эффекты, включая в числе прочих, например, желудочно-кишечную токсичность, нефротоксичность, гипертонию, миелосупрессию, гепатотоксичность и гипертрофию десен. Ни один из них не подтвердил, что лечение этим препаратом полностью приемлемо или эффективно. В целом, учитывая эти недостатки, в настоящее время не существует полностью удовлетворяющего фармацевтически приемлемого лечения отрицательной дисфункции иммунной системы и/или реакций, таких как HVG и GVHD.
Долгое время полагали, что можно было бы разработать более специфичный тип иммунной супрессии, лишенный этих недостатков. Например, средство, которое бы супрессировало или устраняло конкретно аллореактивные Т-клетки, должно быть эффективно против HVG и GVHD (по меньшей мере, для аллогенных трансплантатов) без отрицательных побочных эффектов, возникающих при использовании средств, которые в целом разрушают и повреждают иммунную систему. Однако до сих пор такого(их) средства(в) не разработано.
Использование в трансплантации стволовых клеток
с ограниченными потенциями
Недавно вызвало интерес использование стволовых клеток вместо или вместе с иммуносупрессорными средствами. В этой области получены некоторые обнадеживающие результаты. За последние несколько лет выделили и охарактеризовали большое число стволовых клеток. Они варьируют от клеток с сильно ограниченным потенциалом дифференциации и ограниченной способностью культурального роста до клеток, по-видимому, с неограниченным потенциалом дифференциации и неограниченной способностью культурального роста. Как правило, первые проще извлечь и можно получить из большого числа тканей взрослого индивида. Последние можно было бы получить из герминативных клеток и эмбрионов, их называют эмбриональными стволовыми («ES») клетками, эмбриональными герминативными («EG») клетками и герминативными клетками. Эмбриональные стволовые («ES») клетки обладают неограниченной способностью самоподдержания и могут дифференцироваться во все типы клеток. ES клетки получают из внутренней клеточной массы бластоцисты. Эмбриональные герминативные («EG») клетки получают из примордиальных герминативных клеток постимплантационного эмбриона. Значение стволовых клеток, полученных из ткани взрослого индивида, оказалось ограниченным, поскольку они являются иммуногенными, обладают ограниченным потенциалом дифференциации и ограниченной способностью размножения в культуре. ES, EG и герминативные клетки лишены этих недостатков, но у них наблюдается заметная предрасположенность к образованию тератом у аллогенных хозяев, чаще реализуемая из-за важности их использования в лечении. Поэтому существует пессимистичная точка зрения относительно их ценности для практического применения, несмотря на их преимущественно обширный потенциал дифференциации. Стволовые клетки, полученные из эмбрионов, также являются предметом этических разногласий, что может препятствовать их использованию в лечении заболеваний.
Определенные усилия по поиску альтернативы ES, EG и герминативным клеткам сосредоточены на клетках, полученных из ткани взрослого индивида. Между тем как стволовые клетки взрослого индивида были идентифицированы в большинстве тканей млекопитающих, их потенциал дифференциации ограничен и намного уже, чем у ES, EG и герминативных клеток. В самом деле, многие такие клетки могут давать рост лишь одному или нескольким типам дифференцированных клеток, а многие другие ограничиваются одной эмбриональной линией дифференцировки.
Например, гематопоэтические стволовые клетки могут дифференцировать лишь с образованием клеток гематопоэтической линии, нервные стволовые клетки дифференцируются лишь в клетки нейроэктодермального происхождения, а мезенхимные стволовые клетки («MSC») ограничиваются клетками мезенхимного происхождения. Вследствие приведенного выше рассмотрения ограничений, рисков и противоречий и отношения к ES, EG и герминативным клеткам, в основной части работы по использованию стволовых клеток в трансплантации применяли MSC. Результаты, полученные за последние несколько лет, наглядно показывают, что аллотрансплантаты MSC не вызывают иммунную реакцию HVG, которая является ответом, всегда наблюдаемым в случае трансплантации между аллогенными индивидами иной ткани. Более того, результаты указывают на то, что MSC, по крайней мере, при определенных условиях ослабляют иммунный ответ лимфоцитов.
Вместе с тем, эти результаты непосредственно указывают на то, что MSC могли бы использоваться для уменьшения HVG и/или GVHD, которые обычно должны совровождать аллогенную трансплантацию, поскольку наблюдаемые иммуносупрессорные эффекты MSC оказались в большой степени дозозависимыми, и для проявления иммуносупрессорного эффекта требовались относительно высокие дозы. Фактически, снижение пролиферации лимфоцитов в анализах смешанной культуры лимфоцитов in vitro «замечали» лишь при соотношении MSC к лимфоцитам 1:10 или выше. Более того, наблюдаемый эффект ингибирования снижался и становился неощутимым как при снижении дозы MSC, так и при соотношениях наличия клеток MSC, фактически представленных для стимуляции пролиферации Т-клеток, ниже 1:100. Подобные дозозависимые эффекты также наблюдали в анализах стимулированной митогеном пролиферации лимфоцитов. См. для анализа статьи Ryan et al. (2005) «Мезенхимные стволовые клетки предотвращают аллогенное отторжение», J. Inflammation 2: 8; Le Blanc (2003) «Иммуномодулирующие эффекты мезенхимных стволовых клеток эмбриона и взрослого индивида», Cytotherapy 5(6): 485-489, и Jorgensen et al. (2003) «Инженерия мезенхимных стволовых клеток для иммунотерапии», Gene Therapy 10: 928-931. Дополнительные результаты суммируются ниже.
Например, Bartholomew с соавторами обнаружили, что MSC павиана не стимулировали аллогенные лимфоциты к пролиферации in vitro и что MSC уменьшали пролиферацию митогенстимулированных лимфоцитов более чем на 50% в анализах смешанной культуры лимфоцитов in vitro. Они дополнительно показали, что введение MSC in vitro увеличивает жизнеспособность трансплантата кожи (по сравнению с контролями). Как для результатов, полученных in vitro, так и для результатов, полученных in vivo, требовались высокие дозы MSC: для результатов, полученных in vitro, соотношение с лимфоцитами 1:1. Количество MSC, которое должно потребоваться при таком подходе к соотношению in vivo у людей может оказаться слишком высоким с практической точки зрения. Это может ограничить ценность MSC. См. Bartholomew et al. (2002): «Мезенхимные стволовые клетки подавляют пролиферацию лимфоцитов in vitro и продляют срок жизни трансплантата кожи in vivo», Experimental Hematology 30: 42-48.
Maitra с соавторами изучили эффекты MSC человека на приживление аллогенных клеток пуповинной крови человека после совместной инфузии в облученных сублетальными дозами мышей NOD-SCID. Они обнаружили, что MSC человека способствуют приживлению и не активируют аллогенные Т-клетки в in vitro исследованиях пролиферации. Они также обнаружили, что MSC человека подавляют in vitro активацию аллогенных Т-клеток человека митогеном. Эти эффекты оказались дозозависимыми и для супрессии требовались относительно высокие соотношения. (Maitra et al. (2004) Bone Marrow Transplantation 33: 597-604.)
Недавно Le Blanc с соавторами сообщили об успехе лечения одного пациента с острым GVHD IV степени, которая, как правило, является фатальной, введением «HLA-гаплоидентичных» MSC. Пациентом был 9-летний мальчик с острым лимфобластным лейкозом, который находился в своей третьей ремиссии. Вначале пациент получал радиотерапию и циклофосфамид, после чего вводили клетки крови, которые были идентичны его собственным клеткам по локусам HLA-A, HLA-B и HLA-DRбета1. Их получили от донора, женщины, которая не была ему родственницей. Несмотря на интенсивную терапию, включающую введение большого количества иммуносупрессантов, на 70 день после трансплантации у пациента развилось острое GVHD IV степени. Его многократно поразили инвазивные бактериальные, вирусные и грибковые инфекции.
В этой критической ситуации была сделана попытка трансплантировать другие стволовые клетки крови. От матери пациента выделяли гаплоидентичные MSC и выращивали in vitro в течение трех недель. Клетки собирали и вводили пациенту внутривенно в количестве 2×106 клеток на килограмм. Ни признаков токсичности, ассоциированной с MSC, ни существенных побочных эффектов выявлено не было. Многие симптомы исчезли в течение нескольких дней после трансплантации; но остаточные явления болезни были заметны. После нескольких дополнительных внутривенных инъекций MSC теми же способами симптомы и GVHD пациента полностью исчезли. После выписки пациент находился в ремиссии еще один год. Согласно авторам, в их эксперименте этот пациент уникален в смысле выживаемости при GVHD такой степени тяжести. Результаты, сообщенные Le Blanc et al, являются как многообещающими, так и вдохновляющими и должны стать стимулом для разработки эффективных способов лечения, в которых использовались бы стволовые клетки. Le Blanc et al. (2004) «Лечение тяжелой формы острого заболевания «трансплантат против хозяина» HLA-гаплоидентичными мезенхимными стволовыми клетками», Lancet 363: 1439-41.
И все-таки эти результаты, включая и результаты Le Blanc с соавторами, выявляют возможные недостатки MSC. Клетки необходимо вводить стандартными иммуносупрессорными способами, которые впоследствии продолжат вызывать негативные иммунные реакции. Очевидно, чтобы достичь эффекта, понадобится очень высокая дозировка MSC, что повлечет увеличение стоимости, большую трудоемкость введения, больший риск развития токсичности и других опасных побочных эффектов и другие недостатки.
В свете этих ограничений для используемой в настоящее время стволовой клетки, основанной на способах лечения, связанных с трансплантацией, явно существует крайняя необходимость в клетках-предшественниках, которые можно было бы использовать всем - или хотя бы большинству - реципиентов без необходимости совместимости гаплотипов хозяин-реципиент. Кроме того, существует необходимость в клетках с большей «специфической активностью», поскольку они являются терапевтически эффективными при меньших дозах, и их введение не ставит проблем, связанных со схемами лечения большими дозами, требуемыми для получения положительных результатов при использовании MSC. Кроме того, существует необходимость в клетках, которые имели бы по существу неограниченный потенциал дифференциации для образования клеток, которые появились бы в организме, нуждающемся в этом.
Соответственно, существовала потребность в клетках, которые имели бы способность ES, EG и герминативных клеток к самоподдержанию и дифференциации, но не были бы иммуногенными; не формировали бы тератом при аллотрансплантации или ксенотрансплантации хозяину; не вызывали бы других проблем, связанных с безопасным использованием, возникающих при применении ES, EG и герминативных клеток; без труда выделялись бы из легко доступных источников, таких как плацента, пуповина, пуповинная кровь, кровь и костный мозг; могли бы надежно храниться в течение длительного периода; могли быть получены легко и без риска для добровольцев, доноров или пациентов и других людей, давших согласие на это; и не вызывали бы технических и материальных трудностей, сопровождающих получение и работу с ES, EG и герминативными клетками.
Недавно выделили и охарактеризовали тип клеток, названных в данном документе полипотентными зрелыми клетками-предшественниками («МАРС») (см., например, патент США № 7015037, который приведен в качестве ссылки в полном объеме). («МАРС» также может обозначаться как «MASC».) Эти клетки обладают многими преимуществами ES, EG и герминативных клеток, не имея многих их недостатков. Например, МАРС способны неограниченно долго культивироваться без потери своего потенциала дифференциации. В мышах NOD-SCID у них наблюдается эффективное долгосрочное приживление и самостоятельные многочисленные направления дифференцировки, и все это без данных о формировании тератомы (часто наблюдаемой с ES, EG и герминативными клетками) (Reyes, M. and C.M. Verfaillie (2001) Ann N Y Acad Sci. 938: 231-5).
Сущность изобретения
В некоторых своих вариантах осуществления, поэтому, изобретение относится к клеткам, которые: (i) не являются ни эмбриональными стволовыми клетками, ни эмбриональными герминативными клетками, ни герминативными клетками; (ii) могут дифференцироваться по меньшей мере в один тип клеток любого по меньшей мере из двух из эмбриональных линий - эндодермальной, эктодермальной и мезодермальной; (iii) при введении несингенному индивиду не провоцируют отрицательный иммунный ответ; и (iv) при введении индивиду могут модулировать иммунный ответ. В этом отношении в определенных вариантах осуществления изобретение относится к клеткам, которые, в дополнение к вышеуказанному, являются иммуносупрессорными. Более того, в соответствии с вышеуказанным, различные варианты осуществления изобретения относятся к клеткам, которые обладают иммуномодулирующими свойствами, что можно использовать в лечении, таком как предотвращение, профилактика, улучшение, снижение, уменьшение, минимизация, устранение и/или излечение негативных иммунных реакций и/или процессов в хозяине. В некоторых вариантах осуществления изобретения клетки используют в этой связи самостоятельно или совместно с другими терапевтическими средствами и способами воздействия, такими как основные терапевтические способы воздействия. В некоторых вариантах осуществления изобретения клетки используют в дополнительном терапевтическом способе воздействия, в котором их можно использовать либо в качестве единственного терапевтического средства, либо совместно с другими терапевтическими средствами. В некоторых вариантах осуществления изобретения клетки используют, самостоятельно или с другими терапевтическими средствами или способами воздействия, как в одном или нескольких основных терапевтических способах воздействия, так и в одном или нескольких дополнительных терапевтических способах воздействия.
Согласно изобретению, в данном документе клетки описываются более подробно и, как правило, в данном документе называются «полипотентными зрелыми клетками-предшественниками», сокращенно «МАРС». Нужно отдать должное тому, что эти клетки не являются ни ES, ни EG, ни герминативными клетками, и что они способны дифференцироваться в типы клеток, по меньшей мере, двух из трех линий первичных зародышевых слоев (эктодермы, мезодермы и эндодермы), т.е. в клетки всех трех первичных линий.
Например, МАРС могут образовывать среди многих других следующие клетки и другие клетки их линий дифференцировки: внутренние клетки мезодермы, мышечные клетки, клетки костной ткани, клетки хрящевой ткани, эндокринные клетки, экзокринные клетки, эндотелиальные клетки, клетки, образующие волосы, клетки, формирующие зубы, висцеральные клетки мезодермы, гематопоэтические клетки, стромальные клетки, стромальные клетки костного мозга, нейрональные клетки, нейроэктодермальные клетки, эпителиальные клетки, клетки глаза, клетки поджелудочной железы и гепатоцит-подобные клетки. В числе клеток, образуемых МАРС, среди многих других присутствуют остеобласты, хондробласты, адипоциты, клетки скелетных мышц, скелетные миоциты, клетки билиарного эпителия, ацинозные клетки поджелудочной железы, мезангиальные клетки, гладкомышечные клетки, клетки сердечной мышцы, кардиомиоциты, остеоциты, клетки, образующие сосуды, олигодендроциты, нейроны, включая серототинэргические, GABAэргические, допаминэргические нейроны, клетки глии, клетки микроглии, эпителиальные клетки поджелудочной железы, клетки эпителия кишечника, эпителиальные клетки печени, клетки эпителия кожи, эпителиальные клетки почки, клетки почечного эпителия, клетки панкреатического островка, фибробласты, гепатоциты и другие клетки тех же линий, что и вышеуказанные.
МАРС обладают теломеразной активностью, необходимой для самосохранения, и, как полагают, необходимой для поддержания в недифференцированном состоянии. Как правило, они также экспрессируют oct-3/4. Oct-3/4 (oct-3A у людей) в остальных случаях специфичен для ES, EG и герминативных клеток. Его рассматривают как маркер недифференцированных клеток, которые обладают способностью к обширной дифференциации. В основном полагают также, что oct-3/4 имеет значение в поддержании клетки в недифференцированном состоянии. Oct-4 (oct-3 у людей) представляет собой фактор транскрипции, экспрессируемый в эмбрионе на стадии предгаструлы, в эмбрионе на ранней стадии дробления, в клетках внутренней клеточной массы бластоцисты и в клетках эмбриональной карциномы («ЕС») (Nichols, J. et al. (1998) Cell 95: 379-91), и подавляется, когда клетки индуцируются к дифференциации. Ген oct-4 (oct-3 у людей) у людей транскрибируется по меньшей мере в двух вариантах сплайсинга, oct-3А и oct-3В. Вариант сплайсинга oct-3В обнаруживают во многих дифференцированных клетках, тогда как сообщается, что вариант сплайсинга oct-3А (также ранее названный oct-3/4) специфичен для недифференцированных стволовых клеток эмбриона. См. статью Shimozaki et al. (2003) Development 130: 2505-12. Экспрессия oct-3/4 играет важную роль в определении ранних этапов эмбриогенеза и дифференциации. Oct-3/4 в сочетании с rox-1 вызывает активацию транскрипции белка rex-1, содержащего «цинковые пальцы», который также требуется для поддержания клеток ES в недифференцированном состоянии (Rosfjord, E. and Rizzino, A. (1997) Biochem Biophys Res Commun 203: 1795-802; Ben-Shushan, E. et al. (1998) Mol Cell Biol 18: 1866-78).
Как правило, МАРС также экспрессируют другие маркеры, считающиеся специфичными для первичных стволовых клеток. К ним относятся rex-1, rox-1 и sox-2. Rex-1 находится под контролем oct-3/4, который активирует экспрессию расположенного ниже rex-1. Rox-1 и sox-2 экспрессируются в клетках, отличных от ES.
Различные варианты осуществления изобретения относятся к способам использования МАРС для предотвращения, профилактики, лечения, улучшения, снижения, уменьшения, минимизации, устранения и/или излечения заболевания и/или отрицательного иммунного ответа и/или процессов у индивида. Определенные варианты осуществления изобретения относятся к способам использования самих клеток в качестве основного терапевтического способа воздействия. В некоторых вариантах осуществления изобретения в качестве основного терапевтического способа воздействия используют клетки вместе с одним или несколькими другими средствами и/или терапевтическими способами воздействия. В некоторых вариантах осуществления изобретения клетки используют в качестве дополнительного терапевтического способа воздействия, то есть в качестве дополнительного к другому, основному терапевтическому способу воздействия. В некоторых вариантах осуществления клетки используют в качестве единственного действующего вещества дополнительного терапевтического способа воздействия. В других клетки используют в качестве дополнительного терапевтического способа воздействия вместе с одним или несколькими другими средствами или способами терапевтического воздействия. В некоторых вариантах осуществления клетки используют как в качестве основных, так и в качестве дополнительного терапевтических средств и/или способов воздействия. В обоих случаях клетки можно использовать самостоятельно и в основном и/или в дополнительном способе воздействия. Их также можно использовать вместе с другими терапевтическими средствами или способами воздействия в основном или в дополнительном способе воздействия или в обоих способах.
Как обсуждалось выше, основное лечение представляет собой терапевтическое средство, терапию и/или терапевтический способ воздействия, мишени (то есть то, на что хотят воздействовать) представляют собой основную дисфункцию, такую как заболевание, то есть то, что нужно лечить. Дополнительное лечение, такое как терапия и/или терапевтический способ воздействия, можно применять в сочетании с основным лечением, таким как терапевтическое средство, терапия и/или терапевтический способ воздействия, для воздействия на основную дисфункцию, такую как заболевание, и для дополнения эффекта основного лечения, тем самым, увеличивая эффективность всего лечебного режима. Дополнительное лечение, такое как средство, терапия и/или терапевтический способ воздействия, также можно применять для воздействия на осложнения и/или побочные эффекты, вызванные основной дисфункцией, такой как заболевание, и/или вызванные лечением, таким как терапевтическое средство, терапия и/или терапевтический способ воздействия. В отношении любых из этих применений, один, два, три или более основных способов лечения можно использовать совместно с одним, двумя, тремя или более дополнительными способами лечения.
В некоторых вариантах осуществления МАРС вводят индивиду до появления дисфункции, такой как заболевание, побочный эффект и/или отрицательный иммунный ответ. В некоторых вариантах осуществления клетки вводят при развитии дисфункции. В некоторых вариантах осуществления клетки вводят после стабилизации дисфункции. Клетки можно вводить на любом этапе в процессе развития, персистирования и/или распространения дисфункции или после ее снижения.
Как рассмотрено выше, варианты осуществления изобретения относятся к клеткам и способам основной или дополнительной терапии. В определенных вариантах осуществления изобретения клетки вводят аллогенному индивиду. В некоторых вариантах осуществления они аутологичны индивиду. В некоторых вариантах осуществления они сингенны индивиду. В некоторых вариантах осуществления клетки являются ксеногенными для индивида. В различных вариантах осуществления изобретения МАРС, будь они аллогенными, аутологичными, сингенными или ксеногенными, являются слабо иммуногенными или неиммуногенными для индивида. В некоторых вариантах осуществления МАРС обладают достаточно низкой иммуногенностью или являются неиммуногенными и, как правило, не вызывающими отрицательный иммунный ответ, так что при введении аллогенным индивидам их можно использовать в качестве «универсальных» донорных клеток без типирования тканей и анализа на совместимость. В соответствии с различными вариантами осуществления изобретения МАРС также можно хранить и поддерживать в банках клеток и, таким образом, иметь в распоряжении для использования в случае необходимости.
Во всех этих и других смыслах, варианты осуществления изобретения относятся к клеткам МАРС млекопитающих, включая людей в одном из вариантов осуществления, а в других вариантах осуществления обезьян, крыс и мышей, собак, свиней, коз, овец, лошадей и коров. МАРС, полученные от млекопитающих, как описано выше, могут быть использованы во всех способах и других аспектах описанного в данном документе изобретения.
В соответствии с различными вариантами осуществления изобретения МАРС можно выделить из множества отделов тела и тканей таких млекопитающих, включая, но ими не ограничиваясь, костный мозг, кровь, селезенку, печень, мышцы, мозг и другие, обсуждаемые ниже. В некоторых вариантах осуществления МАРС перед использованием культивируют.
В некоторых вариантах осуществления МАРС создают генно-инженерными способами, например, для улучшения их иммуномодулирующих свойств. В некоторых вариантах осуществления генно-инженерные МАРС получают культивированием in vitro. В некоторых вариантах осуществления генно-инженерные МАРС получают из трансгенного организма.
В различных вариантах осуществления МАРС вводят индивиду любым способом для эффективной доставки средств клеточной терапии. В некоторых вариантах осуществления клетки вводят инъекционно, включая местное и/или системное введение. В определенных вариантах осуществления клетки вводят внутрь и/или поблизости от участка дисфункции, на который им предназначено воздействовать. В некоторых вариантах осуществления клетки вводят инъекционно в область, расположенную на расстоянии от участка дисфункции. В некоторых вариантах осуществления клетки вводят системно, например, внутривенной инъекцией.
В некоторых вариантах осуществления МАРС вводят однократно, двукратно, трехкратно или более, чем три раза до достижения желаемого терапевтического эффекта или пока не станет ясно, что продолжение введения не принесет пользы индивиду. В некоторых вариантах осуществления МАРС вводят непрерывно в течение некоторого времени, например, внутривенно капельно. Можно вводить МАРС в течение короткого отрезка времени, в течение нескольких дней, недель, месяцев, лет или в течение более продолжительного отрезка времени.
В следующих пронумерованных параграфах описывается несколько наглядных вариантов осуществления изобретения, которые поясняют некоторые из его аспектов и особенностей. Они не исчерпывают иллюстраций его многочисленных аспектов и вариантов осуществления, и поэтому не являются каким-либо образом ограничивающими изобретение. В настоящем документе описываются многие другие аспекты, особенности и варианты осуществления изобретения. Многие другие аспекты и варианты осуществления будут без труда понятны специалисту в данной области при прочтении данной заявки и рассмотрении ее в свете предшествующего уровня и знаний в этой области.
Пронумерованные ниже параграфы являются соотносящимися с самими собой. Фраза «по любому из вышеуказанных или последующих» относится ко всем предыдущим и ко всем последующим пронумерованным параграфам и их содержанию. В этой совокупности пронумерованных параграфов все фразы вида «по #» являются непосредственными ссылками на данный пронумерованный параграф, т.е. «по 46.» означает согласно параграфу 46. Все перекрестные ссылки являются комбинаторными, за исключением избыточностей и несоответствий рамкам изобретения. Перекрестные ссылки используются однозначно для получения четкого описания, представляющего указание различных сочетаний предмета изобретения одного с другим.
1. Способ лечения иммунной дисфункции индивида, содержащий: введение индивиду, имеющему риск заболевания, болеющему или перенесшему иммунную дисфункцию, эффективным путем и в эффективном количестве для лечения иммунной дисфункции, клеток (МАРС), которые: не являются эмбриональными стволовыми клетками, эмбриональными герминативными клетками или герминативными клетками; могут дифференцироваться, по меньшей мере, в один тип клеток любого по меньшей мере из двух из эмбриональных линий - эндодермальной, эктодермальной и мезодермальной; не провоцируют у индивида отрицательного иммунного ответа; и эффективны в лечении иммунной дисфункции.
2. Способ дополнительного лечения индивида, содержащий: введение индивиду, имеющему риск заболевания, болеющему или перенесшему иммунную дисфункцию, эффективным путем и в эффективном количестве для лечения иммунной дисфункции, клеток (МАРС), которые: не являются эмбриональными стволовыми клетками, эмбриональными герминативными клетками или герминативными клетками; могут дифференцироваться, по меньшей мере, в один тип клеток любого, по меньшей мере, из двух из эмбриональных линий - эндодермальной, эктодермальной и мезодермальной; не провоцируют у индивида отрицательного иммунного ответа; и эффективны в лечении иммунной дисфункции, где клетки вводят дополнительно к одному или нескольким другим способам лечения, применяемым индивиду для лечения того же заболевания, для лечения какого-либо другого заболевания или их обоих.
3. Способ по любому из вышеуказанных или последующих, в котором указанные клетки могут дифференцироваться, по меньшей мере, в один тип клеток любого их эндодермального, эктодермального и мезодермального зародышевых листков.
4. Способ по любому из вышеуказанных или последующих, в котором указанные клетки экспрессируют теломеразу.
5. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются положительными по oct-3/4.
6. Способ по любому из вышеуказанных или последующих, в котором указанные клетки до их введения индивиду были подвергнуты, по меньшей мере, 10-40 клеточным делениям в культуре.
7. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются клетками млекопитающих.
8. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются клетками человека, лошади, коровы, козы, овцы, свиньи, крысы или мыши.
9. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются клетками человека, крысы или мыши.
10. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются клетками человека.
11. Способ по любому из вышеуказанных или последующих, в котором указанные клетки получают из клеток, выделенных из любой ткани, выбранной из группы: ткань плаценты, ткань пуповины, пуповинная кровь, костный мозг, кровь, ткань селезенки, ткань вилочковой железы, ткань спинного мозга, жировая ткань и ткань печени.
12. Способ по любому из вышеуказанных или последующих, в котором указанные клетки получают из клеток, выделенных из любой ткани, выбранной из группы: ткань плаценты, ткань пуповины, пуповинная кровь, костный мозг, кровь и ткань селезенки.
13. Способ по любому из вышеперечисленных или последующих, в котором указанные клетки получают из клеток, выделенных из любой ткани, выбранной из группы: ткань плаценты, ткань пуповины, пуповинная кровь, костный мозг или кровь.
14. Способ по любому из вышеуказанных или последующих, в котором указанные клетки получают из клеток, выделенных из какого-либо одного или нескольких образцов костного мозга или крови.
15. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются аллогенными индивиду.
16. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются ксеногенными индивиду.
17. Способ по любому из вышеуказанных или последующих, в котором указанные клетки являются аутологичными индивиду.
18. Способ по любому из вышеуказанных или последующих, в котором индивидом является млекопитающее.
19. Способ по любому из вышеуказанных или последующих, в котором индивидом является домашнее животное, относящееся к млекопитающим, сельскохозяйственное животное, относящееся к млекопитающим, экспериментальное животное, относящееся к млекопитающим, или обезьяна.
20. Способ по любому из вышеуказанных или последующих, в котором индивидом является человек.
21. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду однократно или несколькими дозами, содержащими от 104 до 108 указанных клеток на килограмм массы индивида.
22. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду однократно или несколькими дозами, содержащими от 105 до 107 указанных клеток на килограмм массы индивида.
23. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду однократно или несколькими дозами, содержащими от 5×106 до 5×107 указанных клеток на килограмм массы индивида.
24. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду однократно или несколькими дозами, содержащими от 2×107 до 4×107 указанных клеток на килограмм массы индивида.
25. Способ по любому из вышеуказанных или последующих, в котором в дополнение к указанным клеткам указанному индивиду вводят один или несколько факторов.
26. Способ по любому из вышеуказанных или последующих, в котором в дополнение к указанным клеткам указанному индивиду вводят один или несколько факторов роста, факторов дифференцировки, сигнальных факторов и/или факторов, которые повышают хоминг.
27. Способ по любому из вышеуказанных или последующих, в котором в дополнение к указанным клеткам указанному индивиду вводят один или несколько цитокинов.
28. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду дополнительно к другому лечению, которое применяют до, одновременно или после введения указанных клеток.
29. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду дополнительно к введению индивиду одного или нескольких иммуносупрессорных средств.
30. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивиду пересаживают или пересадили трансплантат, в который дополнительно вводят указанные клетки.
31. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивиду пересаживают или пересадили трансплантат почки, сердца, легкого, печени или другого органа, в который дополнительно вводят указанные клетки.
32. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивиду пересаживают или пересадили трансплантат костного мозга, вены, артерии, мышцы или другой ткани, в который дополнительно вводят указанные клетки.
33. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивиду пересаживают или пересадили трансплантат клеток крови, островковых клеток или регенерирующих клеток другой ткани или органа, в который дополнительно вводят указанные клетки.
34. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивиду пересаживают или пересадили трансплантат клеток крови, в который дополнительно вводят указанные клетки.
35. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивиду пересаживают или пересадили трансплантат костного мозга, в который дополнительно вводят указанные клетки.
36. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивид получил, получит или получает лечение одним или несколькими иммуносупрессорными средствами, в которые дополнительно вводят указанные клетки.
37. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивид получил, получит или получает лечение одним или несколькими препаратами, выбранными из следующей группы: кортикостероид, циклоспорин А, циклоспорин-подобное иммуносупрессорное средство, циклофосфамид, антитимоцитарный глобулин, азатиоприн, рапамицин, FK-506 и макролид-подобное иммуносупрессорное средство, отличное от FK-506, рапамицина, и моноклональное антитело в качестве иммуносупрессорного средства (т.е. иммуносупрессорное означает иммуносупрессорное моноклональное антитело или средство, содержащее моноклональное антитело целиком или одну или несколько его частей, такое как химерный белок, содержащий Fc или Ar-связывающий сайт моноклонального антитела), в которые дополнительно вводят указанные клетки.
38. Способ по любому из вышеуказанных или последующих, в котором в дополнение к лечению указанными клетками индивид получил, получит или получает лечение одним или несколькими препаратами, выбранными из следующей группы: кортикостероид, циклоспорин А, азатиоприн, рапамицин, циклофосфамид, FK-506 или моноклональное антитело в качестве иммуносупрессорного средства, в которые дополнительно вводят указанные клетки.
39. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к введению индивиду одного или нескольких антибиотиков.
40. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к введению индивиду одного или нескольких противогрибковых средств.
41. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к введению индивиду одного или нескольких противовирусных средств.
42. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к введению индивиду любого сочетания двух или нескольких любых иммуносупрессорных средств и/или антибиотиков и/или противогрибковых средств и/или противовирусных средств.
43. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к трансплантации для лечения реакции «хозяин против трансплантата» у индивида, которая снижает или могла бы снизить терапевтическую эффективность трансплантата и/или приводит или могла бы привести к отторжению трансплантата.
44. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду с ослабленной иммунной системой, например, поврежденной в одном или нескольких звеньях иммунной системой и/или устраненной иммунной системой.
45. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к облучению или химиотерапии или к сочетанию облучения и химиотерапии, которые либо применили, применяют, либо применят индивиду.
46. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в дополнение к получаемым в настоящее время облучению или химиотерапии или сочетанию облучения и химиотерапии.
47. Способ по любому из вышеуказанных или последующих, в котором иммунная система индивида ослаблена, повреждена и/или устранена облучением, химиотерапией или сочетанием облучения и химиотерапии.
48. Способ по любому из вышеуказанных или последующих, в котором индивидом является реципиент несингенного трансплантата клеток крови или костного мозга, иммунная система индивида ослаблена или устранена облучением, химиотерапией или сочетанием облучения и химиотерапии, а у индивида имеется риск развития или у него уже развилось заболевание «трансплантат против хозяина».
49. Способ по любому из вышеуказанных или последующих, в котором индивидом является реципиент несингенного трансплантата клеток крови или костного мозга, иммунная система индивида ослаблена или устранена облучением, химиотерапией или сочетанием облучения и химиотерапии, и индивиду вводят иммуносупрессорные лекарственные препараты, где, кроме того, индивид имеет риск развития или у него развилось заболевание «трансплантат против хозяина», и для лечения заболевания «трансплантат против хозяина» в дополнение к одному или нескольким другим способам лечения (то есть: к трансплантации, облучению, химиотерапии и/или иммуносупрессорным лекарственным препаратам) указанному индивиду вводят указанные клетки.
50. Способ по любому из вышеуказанных или последующих, в котором индивид станет или является реципиентом несингенного трансплантата и имеет риск или у него уже развилась реакция «хозяин против трансплантата», где для лечения реакции «хозяин против трансплантата» вводят указанные клетки.
51. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает неоплазмой, и в дополнение к ее лечению вводят указанные клетки.
52. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает неоплазмой клеток крови или костного мозга, и в дополнение к ее лечению вводят указанные клетки.
53. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает доброкачественной неоплазмой клеток костного мозга, миелопролиферативным расстройством, миелодиспластическим синдромом или острым лейкозом, и указанные клетки вводят в дополнение к их лечению.
54. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает доброкачественной неоплазмой клеток костного мозга, и указанные клетки вводят в дополнение к их лечению.
55. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает миелопролиферативным расстройством, и указанные клетки вводят в дополнение к их лечению.
56. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает одним или несколькими заболеваниями из следующей группы: хроническим миелолейкозом («CLM») (также называемым хроническим гранулоцитарным лейкозом), миелофиброзом неясной этиологии, первичным тромбоцитозом, истинной полицитемией или другим миелопролиферативным расстройством, и указанные клетки вводят в дополнение к их лечению.
57. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает миелодиспластическим синдромом, и указанные клетки вводят в дополнение к его лечению.
58. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает острым лейкозом, и указанные клетки вводят в дополнение к его лечению.
59. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает одним или несколькими заболеваниями, выбранными из группы, состоящей из острой множественной миеломы, миелобластного лейкоза, хронического миелоцитарного лейкоза («CML»), острого промиелоцитарного лейкоза, острого лимфобластного лейкоза пре-В-формы, хронического лимфолейкоза («CLL»), В-клеточной лимфомы, волосатоклеточного лейкоза, миеломы, острого лимфобластного лейкоза Т-формы, периферической Т-клеточной лимфомы, других лимфолейкозов, других лимфом или других острых лейкозов, и указанные клетки вводят в дополнение к их лечению.
60. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает анемией или другим заболеванием крови, и указанные клетки вводят в дополнение к их лечению.
61. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает заболеванием, выбранным из группы: гемоглобинопатии, талассемия, синдром недостаточности костного мозга, серповидно-клеточная анемия, апластическая анемия, анемия Фанкони или иммунная гемолитическая анемия, и указанные клетки вводят в дополнение к их лечению.
62. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает одним или несколькими заболеваниями, выбранными из группы, состоящей из рефрактерной анемии, рефрактерной анемии с кольцевыми сидеробластами, рефрактерной анемии с избытком бластов, рефрактерной анемии с избытком бластов на стадии трансформации, хронического миеломоноцитарного лейкоза или другого миелодиспластического синдрома, и указанные клетки вводят в дополнение к их лечению.
63. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает анемией Фанкони, и указанные клетки вводят в дополнение к ее лечению.
64. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает иммунной дисфункцией, и указанные клетки вводят в дополнение к ее лечению.
65. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает врожденным иммунодефицитом, и указанные клетки вводят в дополнение к его лечению.
66. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает аутоиммунной дисфункцией, расстройством или заболеванием, и указанные клетки вводят в дополнение к их лечению.
67. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает одной или несколькими аутоиммунными заболеваниями из следующего списка: болезнь Крона, синдром Гийена-Барре, красная волчанка (также называемая «SLE» и системна красная волчанка), рассеянный склероз, миастения gravis, неврит зрительного нерва, псориаз, ревматоидный артрит, базедова болезнь, зоб Хасимото, тиреоидит Орда, сахарный диабет (1 типа), синдром Рейтера, аутоиммунный гепатит, первичный билиарный цирроз, антифосфолипидный синдром («APS»), синдром пляшущих глаз («OMS»), височный артериит, острый диссеминированный энцефаломиелит («ADEM» и «ADE»), синдром Гудпасчера, гранулематоз Вегенера, глютеновая болезнь, пузырчатка, полиартрит и тепловая форма аутоиммунной гемолитической анемии, и указанные клетки вводят в дополнение к их лечению.
68. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает одной или несколькими аутоиммунными заболеваниями из следующего списка: болезнь Крона, красная волчанка (также называемая «SLE» и системная красная волчанка), рассеянный склероз, миастения gravis, псориаз, ревматоидный артрит, базедова болезнь, зоб Хасимото, сахарный диабет (1 типа), синдром Рейтера, первичный билиарный цирроз, глютеновая болезнь, полиартрит и тепловая форма аутоиммунной гемолитической анемии, и указанные клетки вводят в дополнение к их лечению.
69. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает одним или несколькими заболеваниями из следующего списка, предположительно имеющими аутоиммунный компонент: эндометриоз, интерстициальный цистит, нейромиотония, склеродермия, прогрессирующая системная склеродермия, витилиго, вульводиния, болезнь Шагаса, саркоидоз, синдром хронической усталости и дисавтономия, и указанные клетки вводят в дополнение к их лечению.
70. Способ по любому из вышеуказанных или последующих, в котором индивид имеет риск заболевания или страдает воспалительным заболеванием, и указанные клетки вводят в дополнение к его лечению.
71. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей одно или несколько других фармацевтически активных средств.
72. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей одно или несколько других иммуносупрессорных средств.
73. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей один или несколько препаратов из следующего списка: кортикостероид, циклоспорин А, циклоспорин-подобное иммуносупрессорное средство, циклофосфамид, антитимоцитарный глобулин, азатиоприн, рапамицин, FK-506 и макролид-подобное иммуносупрессорное средство, отличное от FK-506, рапамицина, и иммуносупрессорное средство, представляющее собой моноклональное антитело.
74. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей один или несколько препаратов из следующего списка: кортикостероид, циклоспорин А, азатиоприн, циклофосфамид, рапамицин, FK-506 и иммуносупрессорное средство, представляющее собой моноклональное антитело.
75. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей один или несколько антибиотиков.
76. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей одно или несколько противогрибковых средств.
77. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят в смеси, содержащей одно или несколько противовирусных средств.
78. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивид парентерально.
79. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду одним или несколькими парентеральными способами, выбранными из следующего списка: внутривенная, внутриартериальная, внутрисердечная, интраспинальная, внутриоболочечная, внутрикостная, внутрисуставная, интрасиновиальная, внутрикожная, интрадермальная, подкожная и внутримышечная инъекция.
80. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду одним или несколькими парентеральными способами, выбранными из следующего списка: внутривенная, внутриартериальная, внутрикожная, интрадермальная, подкожная и внутримышечная инъекция.
81. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду одним или несколькими парентеральными способами, выбранными из следующего списка: внутривенная, внутриартериальная, внутрикожная, подкожная и внутримышечная инъекция.
82. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду шприцом с иглой для подкожных инъекций.
83. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду по катетеру.
84. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят хирургической имплантацией.
85. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду имплантацией, используя артроскопическую процедуру.
86. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в или на подложке.
87. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду в инкапсулированной форме.
88. Способ по любому из вышеуказанных или последующих, в котором указанные клетки находятся в смеси подходящим для введения образом каким-либо одним или несколькими способами, выбранными из следующего списка: оральный, ректальный, эпикутанный, внутриглазной, назальный и легочный.
89. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду однократно.
90. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят индивиду серией из двух или нескольких доз подряд.
91. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят однократно, двумя дозами или несколькими дозами, где дозы являются одинаковыми или различными, и их вводят через равные или неравные промежутки времени.
92. Способ по любому из вышеуказанных или последующих, в котором указанные клетки вводят за период от менее одного дня до одной недели, от одной недели до одного месяца, от одного месяца до одного года, от одного года до двух лет или более двух лет.
93. Способ лечения иммунной дисфункции индивида, содержащий введение индивиду, страдающему иммунной дисфункцией, способом и в количестве, эффективных для лечения иммунной дисфункции у индивида, клеток, которые: не являются эмбриональными стволовыми клетками, эмбриональными герминативными клетками или герминативными клетками; могут дифференцироваться, по меньшей мере, в один тип клеток любого, по меньшей мере, из двух из эмбриональных линий - эндодермальной, эктодермальной и мезодермальной; не провоцируют отрицательный иммунный ответ у индивида; и эффективны в лечении иммунной дисфункции индивида.
94. Способ дополнительного лечения иммунной дисфункции индивида, содержащий введение индивиду, страдающему иммунной дисфункцией, способом и в количестве, эффективных для лечения иммунной дисфункции у индивида, клеток, которые: не являются эмбриональными стволовыми клетками, эмбриональными герминативными клетками или герминативными клетками; могут дифференцироваться, по меньшей мере, в один тип клеток любого, по меньшей мере, из двух из эмбриональных линий - эндодермальной, эктодермальной и мезодермальной; не провоцируют отрицательный иммунный ответ у индивида; и эффективны в лечении иммунной дисфункции индивида, где клетки вводят индивиду в дополнение к одному или нескольким другим способам лечения, которые применяют индивиду для лечения той же самой иммунной дисфункции, для лечения одной или нескольких других дисфункций или и того и другого.
Другие аспекты изобретения описываются в последующем описании или становятся очевидными из последующего описания и находятся в рамках изобретения.
Краткое описание фигур
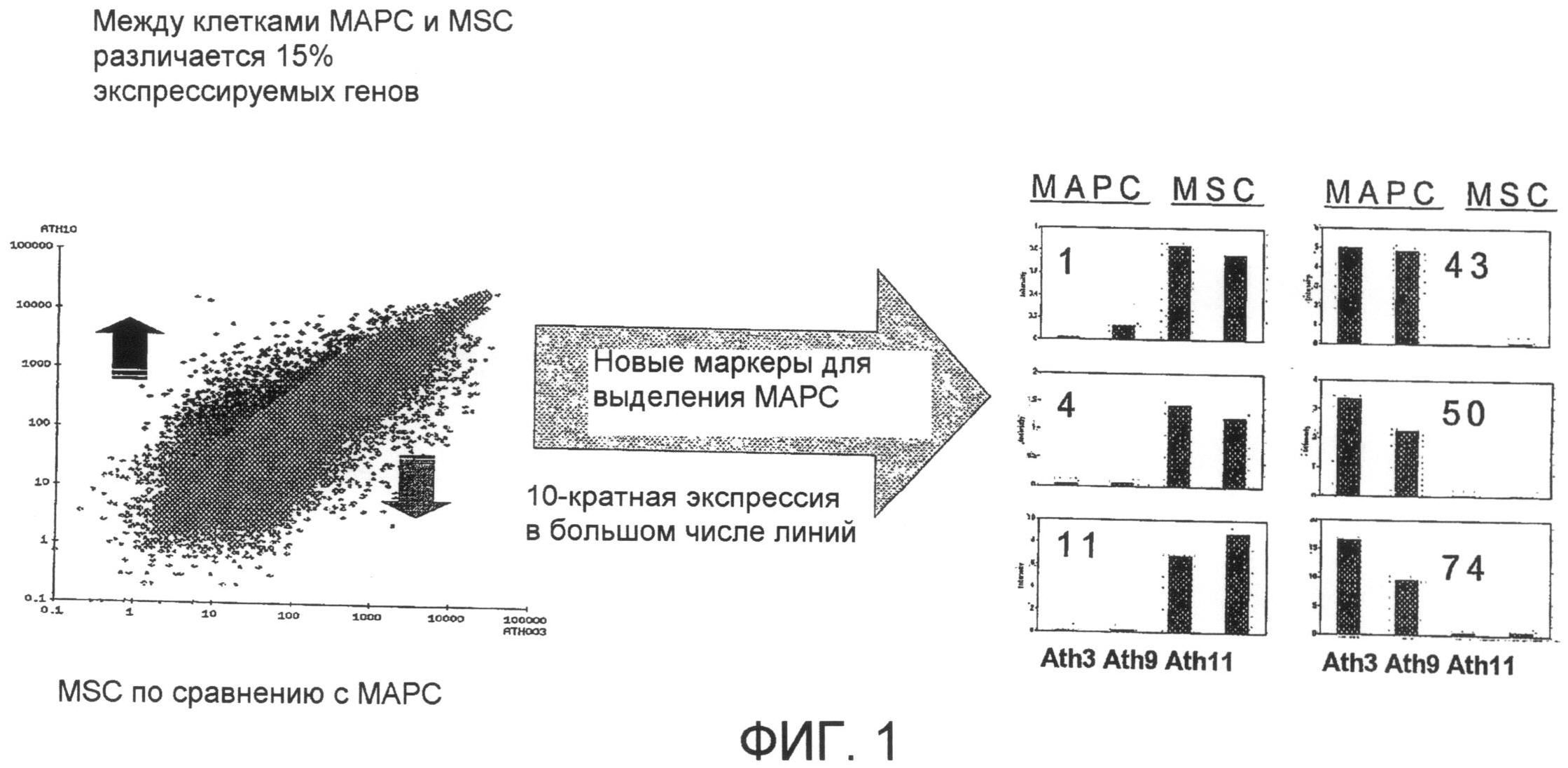
На фиг. 1 схематически представлены результаты изучения профилей транскрипции, которое осуществляли для наработки (идентификации) маркеров генов и поверхностных рецепторов, которые различаются между МАРС согласно изобретению и другими стволовыми клетками и клетками-предшественниками, которые являются более коммитированными. В результате экспериментов получена панель из 75 маркеров, имеющих 10-кратное различие в уровне экспрессии между культурами MSC и клетками МАРС.
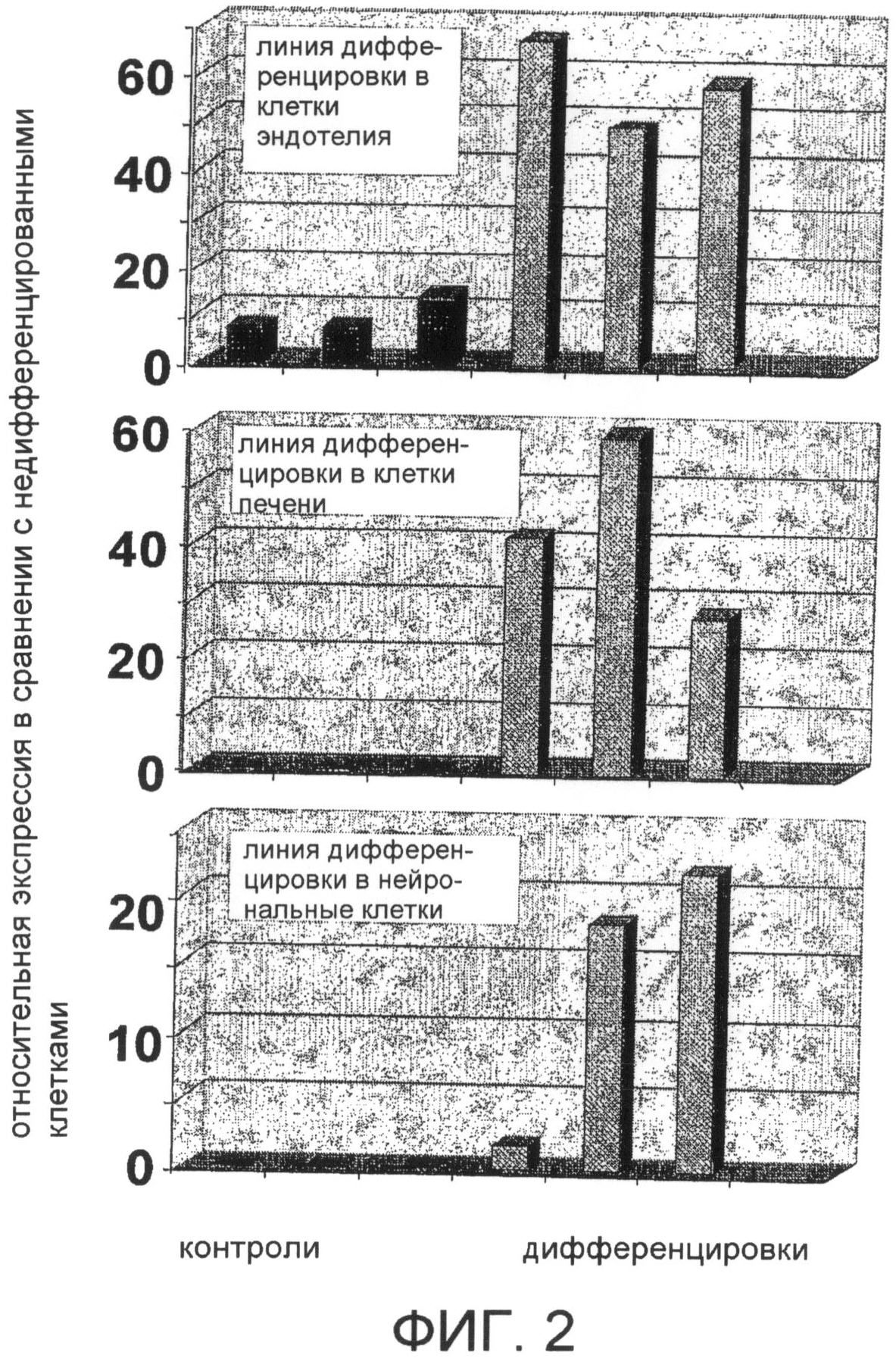
На фиг. 2 представлен ряд графиков, показывающих три линии дифференцировки МАРС крыс, меченных GFP. Результаты указывают на то, что МАРС могут дифференцироваться в клетки всех трех эмбриональных линий (зародышевых листков). Как дополнительно описано ниже, для дифференциации в клетки эндотелия МАРС культивировали на планшетах, покрытых фибронектином, в присутствии фактора роста эндотелия сосудов В (VEGF-B). Для дифференцировки в гепатоциты клетки выращивали на планшетах, покрытых матригелем, и обрабатывали фактором роста фибробластов-4 (FGF-4) и фактором роста гепатоцитов (HGF). Нейрональную дифференцировку индуцировали последовательной обработкой в основным FGF (bFGF), одновременно FGF-8 и белком звукового ежа (SHH), и полученным из мозга нейротрофическим фактором (BDNF). Через две недели из клеток экстрагировали мРНК, и использовали ее для проведения количественного ПЦР-анализа, используя праймеры, специфичные для определения различных маркеров линий дифференцировки. При выполнении всех анализов клетки, выращиваемые в отсутствие цитокинов, индуцирующих линию дифференцировки, служили контролем. Уровни экспрессии маркеров линий дифференцировки сначала стандартизировали к уровню экспрессии гена внутреннего контроля (GAPDH), который не участвует в процессе дифференцировки. Затем оценивали успешность дифференцировки, рассчитывая относительную экспрессию в дифференцированных или в контрольных клетках по сравнению с уровнями в родительской линии крыс, используя в качестве границы успешной дифференцировки более чем 5-кратное увеличение относительной экспрессии. У дифференцированных МАРС крыс наблюдали значительную экспрессию маркеров эндотелия: фактора Виллебранда и РЕСАМ-1 (верхний график); маркеров печени: альбумина, цитокератина-18 и HNF-1a (средний график); и маркеров нейронов/астроцитов: GFAP, нестина и NF-200 (нижний график).
На фиг. 3 представлена пара гистограмм, демонстрирующих низкую иммуногенность (верхний график) и иммуносупрессию (нижний график) МАРС в реакциях смешанных культур лимфоцитов (MLR), как дополнительно описано ниже. На верхнем графике: В+В = донор В + донор В; В+А = донор В + донор А; В+К = донор В + донор К; В+R = донор В + донор R; В+Т = донор В + донор Т; донор В + РНА; В+ВМРС = донор В + МАРС. Аналогичный результат был получен на двенадцати различных донорах. На нижнем графике: донор W + донор W; донор W + донор A; донор W + донор Т; донор W + MSC; донор W + MAPC(17); донор W + PHA; донор W + донор A + MSC; донор W + донор A + MAPC (17); донор W + донор T + MSC; донор W + донор T + MAPC (17); донор W + донор P + MSC; донор W + донор P + MAPC (17). РНА представляет собой фитогемагглютинин (положительный контроль на активацию Т-клеток).
На фиг. 4 представлен график, демонстрирующий, что МАРС могут вызывать супрессию пролиферации Т-клеток, стимулированных ConA, как описано в примере 6. Подпись «LN only» означает результаты контрольных реакций без участия МАРС. Числа рядом с МАРС указывают на количество клеток, использованных в анализах.
На фиг. 5А представлен график, демонстрирующий иммуносупрессорные эффекты клеток МАРС мышей Lewis в реакциях смешанных культур лимфоцитов, как описано в примере 7. Во вставке на фиг. 5А перечисляется количество клеток МАРС, участвовавших в каждой реакции. Во вставке R обозначает отвечающие клетки, а S обозначает стимулирующие клетки (облученные макрофаги селезенки крыс DA).
На фиг. 5B представлен график, демонстрирующий иммуносупрессорные эффекты клеток МАРС крыс Спраг-Доули в реакциях смешанных культур лимфоцитов, как описано в примере 7. Подписи и сокращения - такие же, как на фиг. 5А.
На фиг. 6 представлен график, демонстрирующий, что инфузия клеток МАРС не влияет отрицательно на здоровье реципиентов, что определяется по частоте их дыхательных движений. График дополнительно описан в примере 8.
На фиг. 7 показана гистограмма, на которой представлены результаты эксперимента, демонстрирующего способность клеток МАРС подавлять происходящий в данный момент иммунный ответ. На графике показано, что МАРС являются сильными иммуносупрессорами в MLR как в том случае, когда их добавляют одновременно с активатором Т-клеток (стимулятором) (день 0, левая часть графика), так и в случае, когда их добавляют через 3 дня после введения активатора Т-клеток (стимулятора) (день 3, правая часть графика). Подробности экспериментов дополнительно описаны в примере 10.
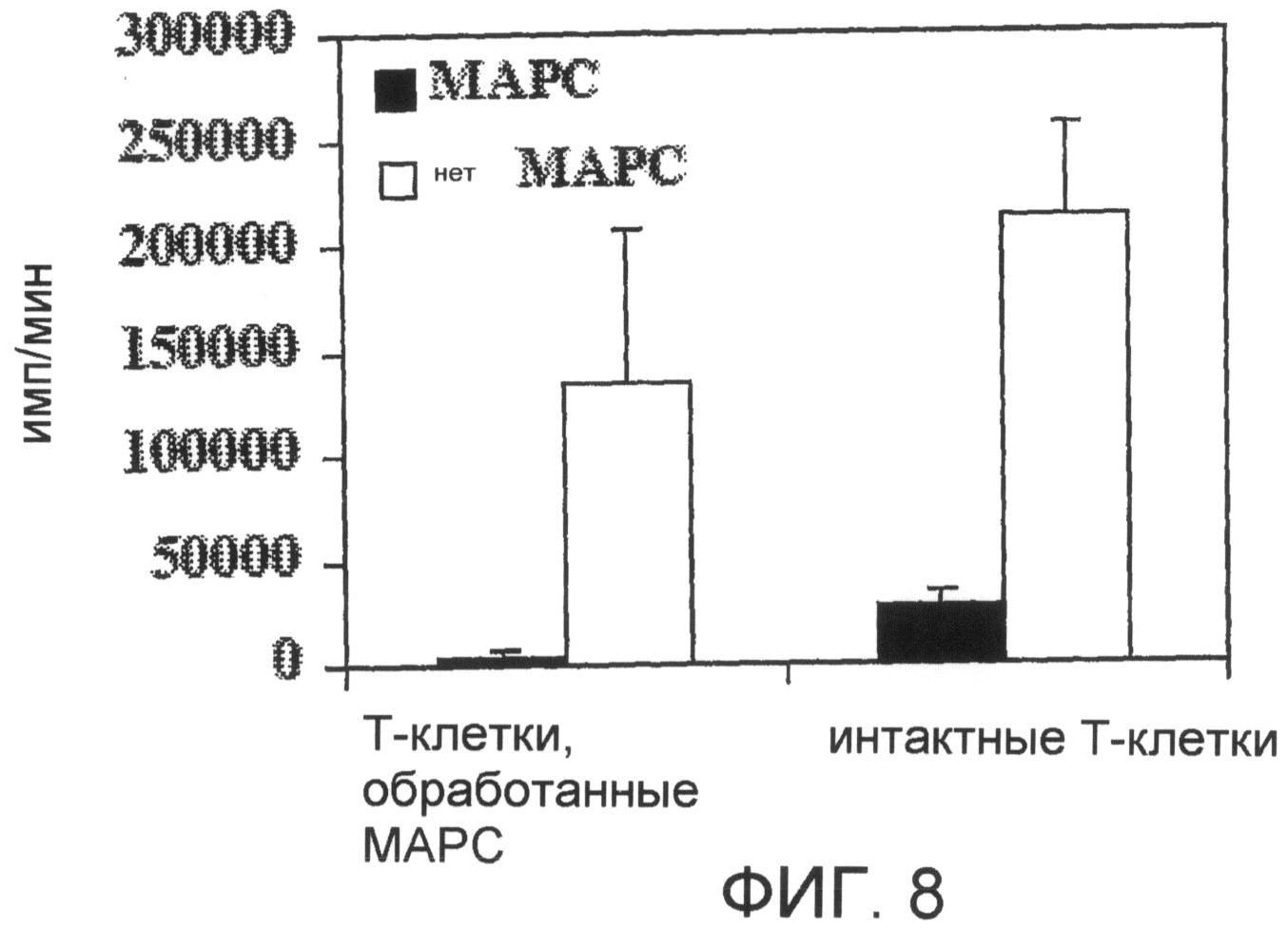
На фиг. 8 представлена гистограмма, на которой показано, что ингибирование клетками МАРС пролиферации Т-клеток в MLR является обратимым. Результаты представлены в виде величины имп/мин +/- σ культуры в трех повторах. График дополнительно описан в примере 11.
На фиг. 9 представлена гистограмма, на которой показано, что МАРС ингибируют GVHD, как описано в примере 13.
Определения
В настоящем документы использованы определенные термины, которые имеют представленные ниже значения.
«Дополнительно» означает совместно, вместе с, в дополнение к, в сочетании с пр.
«Совместно вводить» может относиться к одновременному или последовательному введению двух или более средств.
«Цитокины» относятся к клеточным факторам, которые индуцируют или усиливают движение клеток, такое как хоминг клеток МАРС или других стволовых клеток, клеток-предшественников или дифференцированных клеток. Цитокины также могут стимулировать такие клетки к делению.
«Отрицательный» означает здесь неблагоприятный. Например, «отрицательная иммунная реакция» означает здесь неблагоприятную иммунную реакцию, например, недостаточную или слишком слабую, слишком сильную и/или извращенную. К числу отрицательных иммунных реакций относятся неблагоприятные иммунные реакции, которые появляются при иммунных заболеваниях. К примерам таких реакций относятся недостаточность иммунных реакций при иммунодефицитных заболеваниях и патологически увеличенные и/или извращенные иммунные реакции при аутоиммунных заболеваниях. Также к числу отрицательных иммунных реакций относятся иммунные реакции, которые препятствуют излечению, включая нормальные при других обстоятельствах иммунные реакции. К их примерам относятся иммунные реакции, включенные в отторжение трансплантатов и пересаженных тканей, и ответ иммунокомпетентных клеток в трансплантатах и пересаженных тканях, который вызывает заболевание «трансплантат против хозяина».
«Факторы дифференцировки» относятся к клеточным факторам, таким как факторы роста, которые индуцируют коммитирование линии дифференцировки.
«Дисфункция» означает здесь расстройство, заболевание или отрицательное воздействие нормального при других обстоятельствах процесса. Например, к иммунной дисфункции относятся иммунные заболевания, такие как аутоиммунные заболевания и иммунодефициты. К ней также относятся иммунные реакции, которые препятствуют излечению, включая нормальные при иных обстоятельствах иммунные реакции, которые препятствуют излечению. К примерам таких дисфункций относятся иммунные реакции, включенные в отторжение трансплантатов и пересаженных тканей и ответ иммунокомпетентных клеток в трансплантатах и пересаженных тканях, который вызывает заболевание «трансплантат против хозяина».
«Клетки ЕС» относятся к клеткам эмбриональной карциномы.
«Эффективное количество», как правило, означает количество, которое обеспечивает желаемый местный или системный эффект. Например, эффективным количеством является количество, достаточное для достижения благоприятного или желаемого клинического результата. Эффективные количества могут быть получены все сразу однократным введением или дробными количествами, что позволяет получить эффективное количество за серию из нескольких введений. Например, эффективное количество МАРС могло быть введено за одно или несколько введений и могло включать любое заранее выбранное количество клеток. Точное определение того, что должно считаться эффективным количеством, может основываться на факторах, индивидуальных для каждого индивида, включающих его размер, возраст, повреждение и/или пролеченные заболевание или повреждение, и время, прошедшее с момента появления повреждения или начала заболевания. На основании этих соображений, которые являются стандартными в данной области, специалист будет способен определить эффективное количество, которое необходимо дать индивиду. Таким образом, например, специалист в данной области, такой как лечащий врач, на основании известных свойств клеток МАРС, описанных в данном документе и в данной области, и рассмотрения вышеуказанных факторов, будет способен определить эффективное количество клеток МАРС, которое необходимо дать индивиду. Как используется в настоящем документе, «эффективная доза» означает то же, что и «эффективное количество».
«Клетки EG» относятся к герминативным клеткам эмбриона.
«Пересадка» относится к процессу контакта клеток и in vivo встраивания в имеющуюся ткань, представляющую интерес.
«Обогащенная популяция» означает относительное увеличение количества клеток МАРС по сравнению с другими клетками или компонентами в исходной популяции, например, увеличение количества МАРС по сравнению с одним или несколькими типами клеток, отличными от клеток МАРС, в культуре, такой как первичная культура, или in vivo.
«Клетки ES» относятся к эмбриональным стволовым клеткам.
«Рост» относится к размножению клетки или клеток без их дифференцировки.
«Анемия Фанкони» означает здесь наследственное заболевание анемия Фанкони.
«GVHD» относится к заболеванию «трансплантат против хозяина», которое означает процессы, которые возникают в основном у иммунокомпрометированном хозяина, если он распознается иммунокомпетентными клетками трансплантата как чужеродный.
«HVG» относится к реакции «хозяин против трансплантата», которая означает процессы, которые возникают при отторжении трансплантата хозяином. Как правило, HVG запускается, если трансплантат распознается иммунокомпетентными клетками хозяина как чужеродный (не свой).
«Выделенный» относится к клетке или клеткам, которые не ассоциируются с одной или несколькими клетками или одним или несколькими клеточными компонентами, которые ассоциированы с клеткой или клетками in vivo.
«МАРС» представляет собой аббревиатуру выражения «полипотентная зрелая клетка-предшественник». Он относится к клетке, отличной от ES, EG, герминативной клетки, которая может давать развитие линиям дифференцировки клеток более чем одного зародышевого слоя, например, всех трех зародышевых слоев (т.е. эндодермы, мезодермы и эктодермы). МАРС также обладают теломеразной активностью. Они могут быть положительными по oct-3/4 (например, по oct-3A человека). Они также могут экспрессировать rex-1 и rox-1. Кроме того, они могут экспрессировать sox-2, SSEA-4 и/или nanog. Термин «зрелая» по отношению к МАРС не является ограничивающим. Он лишь означает, что эти клетки не являются ES, EG или герминативными клетками. Здесь «клетка МАРС» стоит обычно в единственном числе, а «клетки МАРС» - во множественном числе. МАРС также были отнесены к полипотентным зрелым стволовым клеткам (MASC). См. патент США № 7015037, содержание которого приведено в данный документ в качестве ссылки для описания МАРС/MASC и способов их выделения и выращивания.
«MASC» см. МАРС.
«MNC» относится к мононуклеарным клеткам.
«Способ воздействия» означает вид, подход, средство или способ, например, терапевтический способ воздействия; т.е. вид терапии.
«MSC» представляет собой аббревиатуру выражения «мезенхимные стволовые клетки».
«Полипотентные» по отношению к МАРС означает способность при дифференцировке приводить к развитию линий дифференцировки клеток более чем одного зародышевого слоя, например, всех трех первичных зародышевых слоев (т.е. эндодерме, мезодерме и эктодерме).
«Персистенция» относится к способности клеток противостоять отторжению и сохраняться и/или увеличиваться в количестве за промежуток времени (например, дни, недели, месяцы или годы) in vivo.
«Предшественник» в выражении «полипотентные зрелые клетки-предшественники» (МАРС) указывает на то, что эти клетки могут давать развитие другим клеткам, таким как более дифференцированные клетки. Термин не является ограничивающим и не ограничивает эти клетки конкретным направлением дифференцировки.
«Самосохранение» относится к способности продуцировать реплицируемые дочерние стволовые клетки, имеющие потенциал дифференцировки, идентичный таковому у клеток, из которых они произошли. Аналогичным термином, используемым в этом контексте, является «пролиферация».
«Индивид» представляет собой позвоночное, такое как млекопитающее, такое как человек. К млекопитающим относятся, но ими не ограничиваются, человек, сельскохозяйственные животные, спортивные животные и домашние животные. К индивидам, нуждающимся в лечении способами согласно изобретению, относятся индивиды, страдающие расстройством, дисфункцией или заболеванием (такими как иммунодефицит или дисфункция, такая как HVG и GVHD), или страдающие от их побочного эффекта или от их лечения, на которые можно положительно повлиять путем введения клеток МАРС либо в виде основного, либо в виде дополнительного лечения.
«Трансплантат» в настоящем документе означает встраиваемые индивиду клетки, ткани или органы. Трансплантат может быть получен от данного индивида, из культуры или из источника, отличного от индивида.
Под «лечением» или «способом воздействия» подразумевается лечение, профилактика, улучшение, подавление или излечение дефицита, дисфункции, заболевания или другого процесса, приводящего к отрицательному эффекту, такому как иммунодефицит, дисфункция, заболевание иммунной системы или другой процесс, который отрицательно влияет на функции или свойства иммунной системы или который мешает лечению.
Подробное описание изобретения
Введение
МАРС являются весьма перспективным средством лечения заболевания технологиями клеточной трансплантации, такими как восстановление ткани и органа, как при самостоятельном использовании, так и при использовании в сочетании с другими способами воздействия. К числу возможных преград на пути осуществления перспективы использования клеток МАРС в лечении заболеваний и восстановлении тканей или органов относятся отрицательные иммунные реакции, которые обычно осложняют или препятствуют успеху трансплантации, такой как трансплантация крови и костного мозга и трансплантация твердого органа. Наиболее опасными среди этих иммунных осложнений являются отторжение трансплантата иммунной системой хозяина (в настоящем документе называемое реакцией «хозяин против трансплантата» и «HVG») и системное повреждение иммунокомпрометированного хозяина, которое происходит, если при контакте с чужеродными компонентами хозяина активируются иммунокомпетентные клетки трансплантата (в настоящем документе называемое заболеванием «трансплантат против хозяина» и «GVHD»).
Было обнаружено (как подробно описывается в другом месте настоящего документа), что МАРС не провоцируют иммунный ответ у аллогенных хозяев. Таким образом, трансплантация клеток МАРС аллогенному хозяину не должна вызывать отторжения аллогенного трансплантата (т.е. HVG).
Более того, также было обнаружено, что аллогенные МАРС могут быть введены хозяину в высокой концентрации без отрицательного воздействия на дыхательную функцию, указывая на то, что не возникает патологической агглютинации и/или отложения в легких.
Кроме того, было обнаружено (как подробно описывается в другом месте настоящего документа), что МАРС могут модулировать иммунные реакции. В частности, в связи с этим было обнаружено, что МАРС могут подавлять иммунные реакции, включая, но ими не ограничиваясь, иммунные реакции, вовлеченные, например, в HVG и GVHD, название лишь двух из них. Еще точнее, было обнаружено, что МАРС могут подавлять пролиферацию Т-клеток даже в присутствии возможных стимуляторов Т-клеток, таких как конканавалин А и аллогенные стимулирующие клетки.
Более того, было обнаружено, что даже относительно небольшие количества МАРС могут подавлять эти реакции. В самом деле, in vitro для снижения на 50% ответа Т-клеток на возможные стимуляторы достаточно лишь 3% клеток МАРС в реакциях смешанной культуры лимфоцитов.
Соответственно, в этом смысле в определенных аспектах изобретения некоторые варианты осуществления относятся к композициям и способам и тому подобному для лечения, улучшения и/или излечения или устранения отрицательных иммунных реакций, таких как реакции, которые возникают при трансплантации.
Низкая иммуногенность аллогенных МАРС, их способность подавлять отрицательные иммунные реакции и их высокая специфическая активность делает их особенно ценными для дополнительных лечебных мероприятий в лечении заболеваний с негативным иммунным компонентом. К числу таких заболеваний относятся аутоиммунные заболевания, в которых, как правило, заболевание вызывается дисфункцией собственной иммунной системы индивида. Клетки МАРС также могут быть использованы в качестве иммуносупрессорных дополнительных лечебных мероприятий для лечения отрицательных иммунных реакций, которые возникают в трансплантологии. К их примерам относятся HVG у иммунокомпетентных хозяев и GVHD у иммунокомпрометированных хозяев. Клетки МАРС, кроме того, могут использоваться в дополнительной иммуносупрессорной терапии в лечении большого числа неоплазм, анемий и болезней крови, и в лечении некоторых воспалительных заболеваний. Связанные с этим заболевания подробно обсуждаются ниже.
Используя способы, описанные в данном документе для выделения, характеристики и распространения МАРС, вместе с описанием в данном документе иммуносупрессирующих свойств МАРС, МАРС могут быть использованы для профилактики, подавления или уменьшения иммунных расстройств, дисфункций или заболеваний, включающих, например, отрицательные иммунные реакции, такие как вытекающие из других лечебных мероприятий, к которым относятся реакции, осложняющие трансплантацию, такие как HVG и GVHD. К таким расстройствам, дисфункциям и заболеваниям также относятся среди прочих врожденные иммунные расстройства и аутоиммунные заболевания.
В этих и других смыслах клетки МАРС могут использоваться как в основных, так и в дополнительных терапевтических средствах и способах воздействия. Клетки МАРС могут быть использованы в лечебных целях самостоятельно или вместе с другими средствами. Клетки МАРС могут быть введены перед, во время и/или после применения таких средств. Аналогично, используемые самостоятельно или с другими средствами, клетки МАРС могут быть введены перед, во время и/или после трансплантации. При введении во время трансплантации клетки МАРС могут быть введены вместе с трансплантируемым материалом или отдельно. При раздельном введении клетки МАРС могут быть введены последовательно или одновременно с трансплантатом. Более того, клетки МАРС могут быть введены перед трансплантатом и/или после трансплантата.
К другим средствам, которые можно использовать в сочетании с клетками МАРС при трансплантации, относятся, в частности, иммуномодулирующие средства. Большое число таких средств описывается в другом месте данного документа. В определенных вариантах осуществления изобретения иммуномодулирующие средства являются иммуносупрессорными средствами, такими как описанные в другом месте данного документа. К числу таких средств относятся кортикостероиды, циклоспорин А, циклоспорин-подобные иммуносупрессорные соединения, азатиоприн, циклофосфамид и метотрексат.
Клетки МАРС могут быть введены хозяину большим числом способов, как обсуждается в другом месте данного документа. В определенных вариантах осуществления клетки МАРС вводят инъекционно, например, внутривенной инъекцией. В некоторых вариантах осуществления клетки МАРС инкапсулируют для введения. В некоторых вариантах осуществления клетки МАРС вводят in situ. К примерам этого введения относятся in situ введение клеток МАРС в трансплантат твердого органа и в пластику органа. Эти и другие формы введения обсуждаются ниже.
В некоторых вариантах осуществления изобретения клетки МАРС вводят в дозах, рассчитанных по соотношению МАРС (клеток) к массе тела (весу). По-другому, клетки МАРС могут быть введены в дозах фиксированного количества клеток. Дозировки, способы введения, препараты и тому подобное подробно обсуждаются в другом месте данного документа.
Механизмы действия
Не ограничиваясь каким-либо одним или несколькими поясняющими механизмами иммуномодулирующих и других свойств, активности и эффектов клеток МАРС, важно заметить, что они могут модулировать иммунные реакции большим числом способов. Например, клетки МАРС могут обладать прямыми эффектами на трансплантат или на хозяина. Такое непосредственное влияние, как правило, объясняется прямым контактом клеток МАРС с клетками хозяина или трансплантата. Контакт может происходить со структурными составляющими клеток или с компонентами их непосредственного окружения. Такие прямые механизмы могут включать непосредственный контакт, диффузию, введение или другие процессы, хорошо известные специалистам в данной области. Прямая активность и эффекты клеток МАРС могут быть ограничены в пространстве, таком как область нанесения или участок тела, достигаемый инъекцией.
Клетки МАРС также могут «возвращаться домой» в ответе на «хоминг» сигналы, такие как сигналы, которые высвобождаются в участках повреждения или заболевания. Поскольку хоминг часто опосредуется сигналами, природная функция которых заключается в привлечении клеток к сайтам, где необходима репарация, движение хоминга может быть эффективным способом концентрации клеток МАРС к мишеням для терапевтического воздействия. Этот эффект можно стимулировать специфическими факторами, как рассматривается ниже.
Клетки МАРС также могут модулировать иммунные процессы своим ответом на факторы. Этот ответ может возникать дополнительно или альтернативно к прямой модуляции. К таким факторам можно отнести факторы хоминга, митогены и другие стимулирующие факторы. К ним также можно отнести факторы дифференцировки и факторы, которые запускают определенные процессы в клетке. К числу последних относятся факторы, которые вызывают секрецию клетками других специфических факторов, таких как факторы, которые вовлекаются в привлечение клеток, таких как стволовые клетки (включая клетки МАРС), к сайту повреждения или заболевания.
В дополнение или альтернативно к вышеуказанному клетки МАРС могут секретировать факторы, которые действуют на эндогенные клетки, такие как стволовые клетки или клетки-предшественники. Данные факторы могут действовать на другие клетки, вызывая, усиливая, уменьшая или подавляя их активность. Клетки МАРС могут секретировать факторы, которые действуют на стволовые клетки, клетки-предшественники или дифференцированные клетки, побуждая эти клетки к размножению и/или дифференцировке. Клетки МАРС, которые «стремятся домой», к сайту, где необходима репарация, могут секретировать трофические факторы, которые привлекают к этому сайту другие клетки. Таким образом, клетки МАРС могут привлекать к сайту, где они необходимы, стволовые клетки, клетки-предшественники или дифференцированные клетки. Клетки МАРС также могут секретировать факторы, которые побуждают такие клетки к размножению или дифференцировке.
Секреция таких факторов, включая трофические факторы, может способствовать большей эффективности клеток МАРС, например, ограничивая воспалительное повреждение, ограничивая проницаемость сосудов, увеличивая жизнеспособность клеток и вызывая и/или расширяя хоминг репарирующих клеток к сайтам повреждения. Такие факторы также могут воздействовать непосредственно на пролиферацию Т-клеток. Такие факторы также могут влиять на дендритные клетки, уменьшая их фагоцитарную и антиген-представляющую функции, что также может влиять на активность Т-клеток.
Этими и другими механизмами клетки МАРС могут обеспечить благоприятные иммуномодулирующие эффекты, включающие, но ими не ограничивающиеся, супрессию нежелательных и/или отрицательных иммунных реакций, ответов, функций, заболеваний и тому подобного. Клетки МАРС в различных вариантах осуществления изобретения обеспечивают благоприятные иммуномодулирующие свойства и эффекты, которые можно использовать сами по себе или в виде дополнительного лечения для предотвращения, профилактики, снижения, уменьшения, улучшения, смягчения, воздействия, устранения и/или излечения отрицательных иммунных процессов и/или состояний. К таким процессам и состояниям относятся, например, аутоиммунные заболевания, анемии, неоплазмы, HVG, GVHD и некоторые воспалительные расстройства, как более подробно описывается в другом месте данного документа. Для этих и других целей клетки МАРС можно использовать в частности у млекопитающих. С этой целью в различных вариантах осуществления изобретения клетки МАРС используют для лечения людей, часто в дополнение к другим лечебным мероприятиям.
Применение МАРС
Получение МАРС
МАРС могут быть получены из большого числа тканей, таких как клетки костного мозга, как подробнее обсуждается в другом месте данного документа.
Во многих вариантах осуществления препараты, содержащие клетки МАРС, получают клонированными. По существу, клетки МАРС в этих препаратах являются генетически идентичными друг другу и при правильном получении и поддерживании свободными от других клеток.
В некоторых вариантах осуществления могут использоваться менее чистые препараты МАРС, чем вышеуказанные. Хотя это и редкость, но если для исходного этапа клонирования требуется более одной клетки, могут появляться менее чистые популяции. Если не все присутствующие клетки являются клетками МАРС, при распространении будет продуцироваться смешанная популяция, в которой клетки МАРС являются лишь одним из по меньшей мере двух типов клеток. Чаще смешанные популяции возникают при введении клеток МАРС в смеси с одним или несколькими другими типами клеток.
Во многих вариантах осуществления чистота клеток МАРС для введения индивиду составляет около 100%. В других вариантах осуществления она составляет от 95% до 100%. В некоторых вариантах осуществления она составляет от 85% до 95%. Особенно в случае смесей с другими клетками, процент содержания клеток МАРС может составлять 25-30%, 30-35%, 35-40%, 40-45%, 45-50%, 60-70%, 70-80%, 80-90% или 90-95%.
Количество клеток МАРС в данном объеме может быть определено хорошо известными и принятыми способами и средствами. Процент клеток МАРС в данном объеме смеси клеток может быть определен примерно теми же способами. Клетки можно легко подсчитать вручную или используя автоматический счетчик клеток. Специфические клетки в данном объеме можно определить, используя специфическое окрашивание и визуальную оценку и автоматизированными способами, используя специфически связывающийся реагент, как правило, антитела, флуоресцентные метки и флуоресцентный сортер клеток.
В иммуномодуляцию клетками МАРС могут вовлекаться недифференцированные клетки МАРС. В нее могут вовлекаться клетки МАРС, которые коммитированы на определенное направление дифференцировки. В такую иммуномодуляцию также могут вовлекаться клетки МАРС, которые дифференцировались в менее потентную стволовую клетку с ограниченным потенциалом дифференциации. В нее также могут вовлекаться клетки МАРС, которые дифференцировались в тип клеток конечной стадии дифференциации. Оптимальный тип или смесь типов клеток МАРС должны быть определены конкретными обстоятельствами их использования, и определение эффективного типа или сочетания клеток МАРС специалистом в данной области должно быть стандартной процедурой.
Препараты
Выбор препарата для введения клеток МАРС для данного применения будет зависеть от множества факторов. Самыми важными из них должны быть вид индивида, природа расстройства, дисфункции или заболевания, подвергаемых лечению, и его тяжесть и локализация у индивида, вид других применяемых лечебных мероприятий и средств, оптимальный способ введения клеток МАРС, жизнеспособность клеток МАРС, вводимых этим способом, схема лечения и другие факторы, которые будут очевидны специалисту в данной области. В частности, например, выбор подходящих носителей и других вспомогательных веществ будет зависеть от требуемого способа введения и вида конкретной лекарственной формы, например, жидкой лекарственной формы (например, смешена ли композиция в растворе, суспензии, геле или другой жидкой форме, такой как длительно высвобождающая форма или форма, наполненная жидкостью).
Например, жизнеспособность клеток может являться важным критерием эффективности клеточной терапии. Это верно как для основных, так и для дополнительных лечебных мероприятий. Другая проблема возникает, если мишенные участки являются неблагоприятными для засева клеток и роста клеток. Это может препятствовать доступу к данному участку и/или приживлению там клеток МАРС с лечебной целью. Различные варианты осуществления изобретения содержат меры, направленные на увеличение жизнеспособности клеток и/или на преодоление проблем, поставленных препятствиями для засевания и/или роста.
К примерам композиций, содержащих клетки МАРС, относятся жидкие препараты, включая суспензии и препараты для внутримышечного или внутривенного введения (например, инъекционного введения), такие как стерильные суспензии или эмульсии. Такие композиции могут содержать смесь клеток МАРС с подходящим носителем, разбавителем или наполнителем, таким как стерильная вода, физиологический раствор, глюкоза, декстроза или тому подобное. Композиции также могут быть лиофилизованными. В зависимости от способа введения и желаемого препарата композиции могут содержать вспомогательные вещества, такие как увлажняющие или эмульгирующие средства, буферы, добавки, увеличивающие загустевание или вязкость, консерванты, средства, придающие запах и цвет и тому подобное. В традиционных пособиях, таких как «REMINGTON'S PHARMACEUTICAL SCIENCE», 17th edition, 1985, приведенном в данный документ в качестве ссылки, можно проконсультироваться по вопросу получения подходящих препаратов, не проводя излишних экспериментов.
Композиции согласно изобретению часто предлагаются в удобной форме в виде жидких препаратов, например, изотоничных водных растворов, суспензий, эмульсий или вязких композиций, которые могут быть забуферены до выбранного значения рН. Жидкие препараты обычно легче получить, чем гели, другие вязкие композиции и плотные композиции. Кроме того, жидкие композиции несколько более удобны для введения, особенно инъекционного. В то же время, для увеличения времени контакта с конкретными тканями вязкие композиции могут быть смешаны в подходящем интервале вязкости.
Для повышения стабильности, стерильности и изотоничности композиций часто необходимо включать различные добавки, такие как антимикробные консерванты, антиоксиданты, хелаторы и буферы в числе прочих. Предохранение от воздействия микроорганизмов может быть обеспечено различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и тому подобными. Во многих случаях будет желательно включить изотоничные агенты, например, сахара, хлорид натрия и тому подобные. Более длительное всасывание инъекционной фармацевтической формы может быть обусловлено использованием средств, которые замедляют всасывание, например, моностеаратом алюминия и желатином. По настоящему изобретению, тем не менее, любой используемый носитель, разбавитель или добавка должен быть совместим с клетками.
Растворы, суспензии и гели МАРС обычно содержат помимо клеток еще и большое количество воды (предпочтительно очищенной стерилизованной воды). Также могут присутствовать незначительные количества других ингредиентов, таких как регуляторы рН (например, основание, такое как NaOH), эмульгаторы или диспергирующие средства, буферы, консерванты, увлажнители и загустители (например, метилцеллюлоза).
Как правило, композиции должны быть изотоничными, т.е. при правильном получении для введения у них должно быть то же осмотическое давление, что и в крови и слезной жидкости.
Желаемой изотоничности композиций по настоящему изобретению можно достичь, используя хлорид натрия или другие фапмацевтически приемлемые средства, такие как декстроза, борная кислота, тартрат натрия, пропиленгликоль или другие неорганические или органические растворы. Среди буферов, содержащих ионы натрия, особенно предпочтителен хлорид натрия.
Вязкость композиций при желании можно поддерживать на выбранном уровне, используя фармацевтически приемлемый загуститель. Предпочитается метилцеллюлоза, поскольку ее несложно достать, она недорого стоит и с ней легко работать. К другим подходящим загустителям относятся, например, ксантановая камедь, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, карбомер и тому подобное. Предпочтительная концентрация загустителя будет зависеть от выбранного средства. Важным моментом является использование количества, которое обеспечит достижение выбранного значения вязкости. Обычно, добавляя такие загустители, из растворов получают вязкие композиции.
Для увеличения срока годности композиций МАРС можно использовать фармацевтически приемлемый консервант или стабилизатор клеток. При включении таких консервантов выбор композиций, которые не влияли бы на жизнеспособность или эффективность МАРС, целиком находится в компетенции специалиста.
Специалисты в данной области должны знать, что компоненты композиций должны быть химически инертными. Специалисту, разбирающемуся в основах химии и фармацевтики, это будет несложно сделать. Проблем можно легко избежать, обратившись к стандартным пособиям или путем простых экспериментов (не проводя лишних исследований), используя информацию, полученную из настоящего описания, из упомянутых в данном описании документов и, как правило, доступную в данной области.
Стерильные растворы для инъекций могут быть получены путем введения клеток по настоящему изобретению, в требуемое количество соответствующего растворителя, при желании, с различными количествами других ингредиентов.
В некоторых вариантах осуществления клетки МАРС смешивают в стандартной лекарственной форме для инъекций, такой как раствор, суспензия или эмульсия. Фармацевтические препараты, приемлемые для введения клеток МАРС, как правило, представляют собой стерильные водные растворы и взвеси. Наполнителями для инъекционных препаратов могут быть растворитель или диспергирующая среда, содержащая, например, воду, соль, забуференный фосфатом физиологический раствор, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобное) и их приемлемые смеси.
Специалист может легко определить количество клеток и выбираемые добавки, носители и/или наполнители в композициях для применения в способах согласно изобретению. Как правило, любые добавки (в дополнение к клеткам) представлены в количестве от 0,001 до 50% по массе в растворе, таком как забуференный фосфатом физиологический раствор. Действующее вещество присутствует в количестве порядка от микрограммов до миллиграммов, таком как от около 0,0001 до около 5% по массе, предпочтительно от около 0,0001 до около 1% по массе, наиболее предпочтительно от около 0,0001 до около 0,05% по массе или от около 0,001 до около 20% по массе, предпочтительно от около 0,01 до около 10% по массе, и наиболее предпочтительно от около 0,05 до около 5% по массе.
В связи с этим, чтобы добиться приемлемого ответа, для любой композиции, предназначенной для введения животному или человеку, и для любого конкретного способа введения предпочтительно определить: токсичность, например, определением летальной дозы (LD) и LD50 на модели подходящего животного, например, грызуна, такого как мышь или крыса; и дозировку композиции(ий), концентрацию в ней компонентов и выбор времени введения композиции(ий). Их определение не требует проведения дополнительного исследования, достаточно знаний специалиста, этого описания и документов, упоминаемых в нем. А также без дополнительного экспериментирования можно установить промежуток времени между последовательными введениями.
В некоторых вариантах осуществления клетки МАРС являются инкапсулированными для введения, особенно если инкапсулирование усиливает эффективность лечения или создает преимущества в использовании и/или увеличивает срок хранения. Инкапсулирование в некоторых вариантах осуществления, где оно повышает эффективность опосредованной МАРС иммуносупрессии, может приводить также к снижению необходимости лечения иммуносупрессорными лекарственными препаратами.
Также, инкапсулирование в некоторых вариантах осуществления создает препятствие для иммунной системы индивида, что может дополнительно снижать иммунный ответ индивида на клетки МАРС (которые, как правило, являются неиммуногенными или лишь слабо иммуногенными в аллогенных трансплантатах), вследствие чего снижая любое отторжение трансплантата или воспаление, которые могли бы возникнуть при введении данных клеток.
Во множестве вариантов осуществления, где клетки МАРС вводят в смеси с клетками другого типа, которые являются в основном более иммуногенными в аллогенном или ксеногенном окружении, инкапсулирование может снижать или устранять отрицательные иммунные реакции хозяина на клетки, отличные от МАРС, и/или GVHD, которое могло бы возникнуть у иммунокомпрометированного хозяина в том случае, если добавочные клетки оказались бы иммунокомпетентными и распознавали бы хозяина как чужеродный организм.
Перед имплантацией клетки МАРС можно инкапсулировать мембранами, а также капсулами. Предполагается, что можно использовать любой доступный из многочисленных способов инкапсулирования клеток. В некоторых вариантах осуществления клетки инкапсулируют по отдельности. В некоторых вариантах осуществления многие клетки инкапсулируют в одну мембрану. В вариантах осуществления, в которых после имплантации клетки должны быть удалены, удобный способ изъятия может обеспечить структура относительно большого размера, заключающая в себе многие клетки, например, находящиеся в единственной мембране.
В различных вариантах осуществления для микроинкапсуляции клеток МАРС можно использовать большое количество веществ. К таким веществам относятся, например, полимерные капсулы, микрокапсулы из альгинат-поли-L-лизин-альгината, капсулы из поли-L-лизин-альгината бария, капсулы из альгината бария, полиакрилнитрил/поливинилхлоридные (PAN/PVC) полые волокна и полиэфирсульфоновые (PES) полые волокна.
Методики микроинкапсуляции клеток, которые могут быть использованы для введения клеток МАРС, известны специалистам в данной области и описываются, например, в статьях Chang, P., et al., 1999; Matthew, H.W., et al., 1991; Yanagi, K., et al., 1989; Cai Z.H., et al., 1988; Chang, T.M., 1992 и в патенте США № 5 639 275 (в котором описывается, например, биосовместимая капсула для длительного поддержания клеток, которые постоянно экспрессируют биологически активные молекулы). Дополнительные способы инкапсулирования содержатся в европейской патентной публикации № 301777 и пат. США № 4353888; 4744933; 4749620; 4814274; 5084350; 5089272; 5578442; 5639275 и 5676943. Все вышеупомянутые источники приведены в данный документ в качестве ссылки в разделах, относящихся к инкапсуляции клеток МАРС.
В определенных вариантах осуществления клетки МАРС встраивают в полимер, такой как биополимер или синтетический полимер. К примерам биополимеров относятся, но ими не ограничиваются, фибронектин, фибрин, фибриноген, тромбин, коллаген и протеогликаны. В полимер также могут быть встроены и другие факторы, такие как рассмотренные выше цитокины. В других вариантах осуществления изобретения клетки МАРС могут быть встроены в межгелевые промежутки трехмерного геля. Большой полимер или гель, как правило, должен имплантироваться хирургическим путем. Полимер или гель, который может быть составлен в достаточно небольшие частицы или волокна, может быть введен другими обычными более удобными нехирургическими способами.
Фармацевтические композиции согласно изобретению могут быть получены во многих формах, к которым относятся таблетки, твердые или мягкие желатиновые капсулы, водные растворы, суспензии и липосомы и другие длительно высвобождающие препараты, такие как оформленные полимерные гели. Жидкие фармацевтические композиции для орального введения могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для смешивания перед использованием с водой или другим приемлемым носителем. Такие жидкие фармацевтические композиции могут содержать стандартные добавки, такие как суспендирующие средства, эмульгаторы, неводные носители (к которым могут относиться пищевые масла) или консерванты. Лекарственная форма для орального введения может быть смешана таким образом, чтобы клетки после прохождения через желудок высвобождались в кишечнике. Такие препараты описываются в патенте США № 6306434 и в содержащихся в нем ссылках.
Фармацевтические композиции, приемлемые для ректального введения, можно получить в виде свечей, содержащих лекарственное средство в дозах на один прием. К подходящим наполнителям относятся физиологический раствор и другие вещества, обычно используемые в данной области.
Для ингаляторного введения клетки могут доставляться в удобной форме из инсуффлятора, небулайзера или контейнера, находящегося под давлением, или другими удобными средствами доставки аэрозольного спрея. Контейнеры под давлением могут содержать приемлемый пропеллент, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, углекислый газ или другой подходящий газ. В случае аэрозоля под давлением, дозированную единицу можно определить, создав клапан для доставки дозированного количества.
Альтернативно, для введения ингаляцией или инсуффляцией средство может иметь форму сухой порошкообразной композиции, например, порошкообразной смеси модулятора и подходящей порошкообразной основы, такой как лактоза или крахмал. Порошкообразная композиция может быть представлена в стандартной лекарственной форме, например, в виде капсул или кассет или, например, желатиновых или блистерных пластинок, из которых порошок может быть введен с помощью ингалятора или инсуффлятора. Для интраназального применения клетки могут быть введены посредством жидкого спрея, например, посредством пластикового распылителя.
Другие действующие вещества
Клетки МАРС могут быть введены с другими фармацевтически активными средствами. В некоторых вариантах осуществления одно или несколько таких средств составляют в смесь с клетками МАРС для введения. В некоторых вариантах осуществления клетки МАРС и одно или несколько средств находятся в отдельных препаратах. В некоторых вариантах осуществления композиции, содержащие клетки МАРС и/или одно или несколько средств, составляют в смеси, принимая во внимание дополнительный эффект от использования друг с другом.
Клетки МАРС могут быть введены в препарате, содержащем иммуносупрессорные средства, например, любое сочетание любого количества кортикостероида, циклоспорина А, циклоспорин-подобного иммуносупрессорного средства, циклофосфамида, антитимоцитарного глобулина, азатиоприна, рапамицина, FK-506 и макролид-подобного иммуносупрессорного средства, отличного от FK-506 и рапамицина. В определенных вариантах осуществления к таким средствам относятся кортикостероид, циклоспорин А, азатиоприн, циклофосфамид, рапамицин и/или FK-506. Иммуносупрессорные средства, согласно вышеуказанному, могут быть лишь такими дополнительными средствами или могут сочетаться с другими средствами, такими как другие средства, упоминаемые в данном документе. К другим иммуносупрессорным средствам относятся такролимус, микофенолят мофетил и сиролимус.
К таким средствам также относятся антибиотики, противогрибковые средства и противовирусные средства, это названия лишь некоторых других фармакологически активных веществ и композиций, которые могут использоваться согласно вариантам осуществления изобретения.
К типичным антибиотикам или противогрибковым соединениям относятся, но ими не ограничиваются, пенициллин, стрептомицин, амфотерицин, ампициллин, гентамицин, канамицин, микофеноловая кислота, налидиксовая кислота, неомицин, нистатин, паромомицин, полимиксин, пуромицин, рифампицин, спектиномицин, тетрациклин, тилозин, зеоцин и цефалоспорины, аминогликозиды и эхинокандины.
Дополнительные добавки этого типа связывают с тем фактом, что клетки МАРС, подобно другим стволовым клеткам, после введения индивиду могут «возвращаться домой» в окружение, благоприятное для их роста и функционирования. Такой «хоминг» часто концентрирует клетки в участках, где они необходимы, таких как участки иммунного расстройства, дисфункции или заболевания. Известно большое количество веществ, стимулирующих хоминг. К ним относятся факторы роста и трофические сигнальные средства, такие как цитокины. Их можно использовать для усиления хоминга клеток МАРС к сайтам, на которые нацелено лечебное воздействие. Их можно вводить индивиду перед лечением клетками МАРС, вместе с клетками МАРС или после введения клеток МАРС.
Определенные цитокины, например, изменяют или влияют на миграцию клеток МАРС или их дифференцированных аналогов к участкам, где необходимо лечебное воздействие, таким как иммунокомпрометированные участки. К цитокинам, которые могут быть использованы в этой связи, относятся, но ими не ограничиваются, фактор стромальных клеток-1 (SDF-1), фактор стволовых клеток (SCF), ангиопоэтин-1, фактор роста плаценты (PIGF), колониестимулирующий фактор гранулоцитов (G-CSF), цитокины, которые стимулируют экспрессию эндотелиальных молекул адгезии, таких как ICAM и VCAM, и цитокины, которые вызывают или снижают хоминг.
Их можно вводить индивиду в виде лечения, предшествующего основной терапии, вместе с клетками МАРС или после введения клеток МАРС для усиления хоминга к желаемым сайтам и для достижения лучшего терапевтического эффекта либо путем усиления хоминга, либо другими механизмами. Такие факторы можно сочетать с клетками МАРС в препарате, подходящем для их совместного введения. Альтернативно, такие факторы могут быть смешаны и введены отдельно.
Порядок введения, препараты, дозы, частота применения и способы введения факторов (таких как рассмотренные выше цитокины) и клеток МАРС в основном будут зависеть от расстройства или заболевания, подвергаемого воздействию, его тяжести, индивида, других применяемых лечебных мероприятий, стадии расстройства или заболевания и прогностических факторов, между прочими. Основные схемы лечения, которые установлены для других способов воздействия, создают основу для определения подходящей дозировки в непосредственном или дополнительном лечении клетками МАРС. Все это, вместе с дополнительной информацией, предложенной в данном документе, должно помочь специалисту определить подходящие процедуры введения согласно вариантам осуществления изобретения без излишнего экспериментирования.
Пути введения
Клетки МАРС могут быть введены индивиду любым из множества способов, известных специалистам в данной области, которые могут быть использованы для введения индивиду клеток.
К числу способов, которые можно использовать в этой связи в вариантах осуществления изобретения, относятся способы парентерального введения клеток МАРС. К парентеральным способам введения, используемым в различных вариантах осуществления изобретения, относятся между прочими: внутривенное, внутриартериальное, внутрисердечное, интраспинальное, внутриоболочечное, внутрикостное, внутрисуставное, интрасиновиальное, внутрикожное, интрадермальное, подкожное и/или внутримышечное введение. В некоторых вариантах осуществления используют внутривенное, внутриартериальное, внутрикожное, интрадермальное, подкожное и/или внутримышечное введение. В некоторых вариантах осуществления используют внутривенное, внутриартериальное, внутрикожное, подкожное и/или внутримышечное введение.
В различных вариантах осуществления изобретения клетки МАРС вводят системно. Системное введение, такое как внутривенная инъекция, является одним из самых простых и наименее инвазивных способов введения клеток МАРС. В некоторых случаях в этом способе для достижения оптимальной эффективности и/или хоминга МАРС к мишенным сайтам могут потребоваться высокие дозы МАРС. Во множестве вариантов осуществления для обеспечения оптимального эффекта в мишенных сайтах клетки МАРС могут быть введены нацеленными и/или локализованными инъекциями.
В некоторых вариантах осуществления изобретения клетки МАРС могут быть введены индивиду шприцом с гиподермальной иглой. В различных вариантах осуществления клетки МАРС вводят индивиду по катетеру. В различных вариантах осуществления клетки МАРС вводят хирургической имплантацией. Кроме того, в этой связи в различных вариантах осуществления изобретения клетки МАРС вводят индивиду имплантацией, используя артроскопическую процедуру. В некоторых вариантах осуществления клетки МАРС вводят индивиду в или на твердой подложке, такой как полимер или гель. В различных вариантах осуществления клетки МАРС вводят индивиду в инкапсулированной форме.
В дополнительных вариантах осуществления изобретения клетки МАРС находятся в смеси подходящим образом для оральной, ректальной, эпикутанной, глазной, назальной и/или пульмонарной доставки и вводят в соответствии с этим.
Дозировка
Композиции могут быть введены в дозах и методиками, хорошо известными специалистам в медицине и ветеринарии, с учетом таких факторов, как возраст, пол, вес и состояние конкретного пациента, и вводимый препарат (например, твердый в сравнении с жидким). Дозы для людей и других млекопитающих могут быть определены без излишнего экспериментирования специалистом в данной области на основании настоящего описания, процитированных в настоящем документе источников и знаний в данной области.
Доза клеток МАРС, подходящая для использования в соответствии с различными вариантами осуществления изобретения, будет зависеть от большого числа факторов. Она может значительно варьировать при разных обстоятельствах. К параметрам, которые будут определять оптимальные дозы клеток МАРС для применения в основном и дополнительном лечении, как правило, будут относиться несколько или все параметры из следующего списка: заболевание, подвергаемое лечению, и его стадия; вид индивида, состояние его здоровья, пол, возраст, масса тела и интенсивность обмена веществ; иммунокомпетентность индивида; другие применяемые лечебные мероприятия; и возможные осложнения, предполагаемые на основании истории болезни или генотипа индивида. К данным параметрам также могут относиться следующие факторы: являются ли клетки МАРС сингенными, аутологичными, аллогенными или ксеногенными; их потенциальные возможности (специфическая активность); сайт и/или локализация, на которые должны быть нацелены клетки МАРС, чтобы быть эффективными; и такие характеристики данного сайта, как доступность для клеток МАРС и/или приживление клеток МАРС. К дополнительным параметрам относится совместное введение с клетками МАРС других факторов (таких как факторы роста и цитокины). При определении оптимальной дозы в данной ситуации также нужно принять во внимание способ, каким клетки составлены в смесь, способ их введения и степень, с которой клетки будут локализоваться в мишеневых сайтах после введения. В конечном счете, определение оптимальной дозировки обязательно должно обеспечить эффективную дозу, которая не является ни нижней границей максимального положительного эффекта, ни верхней границей, где отрицательные эффекты, связанные с дозой клеток МАРС, превосходят преимущества повышенной дозы.
Оптимальная доза клеток МАРС для некоторых вариантов осуществления будет находиться в диапазоне доз, используемых при аутологичной трансплантации мононуклеаров костного мозга. Для достаточно очищенных препаратов клеток МАРС оптимальные дозы в различных вариантах осуществления должны находиться в диапазоне от 104 до 108 клеток МАРС/кг массы реципиента на введение. В некоторых вариантах осуществления оптимальная доза на введение должна составлять от 105 до 107 клеток МАРС/кг. Во многих вариантах осуществления оптимальная доза на введение должна составлять от 5×105 до 5×106 клеток МАРС/кг. Для справки, большие дозы из вышеуказанных аналогичны дозам ядросодержащих клеток, используемых при аутологичной трансплантации мононуклеаров костного мозга. Некоторые из меньших доз аналогичны количеству клеток CD34+/кг, используемых при аутологичной трансплантации мононуклеаров костного мозга.
Необходимо учесть, что единичная доза может быть доставлена сразу, по частям или длительно за отрезок времени. Целая доза также может быть доставлена к одному участку или по частям распространенно в несколько участков.
В различных вариантах осуществления клетки МАРС могут быть введены в начальной дозе и далее поддерживаться дополнительным введением клеток МАРС. Клетки МАРС могут быть введены вначале одним способом, а далее вводиться тем же способом или одним или несколькими другими способами. Уровни МАРС индивида можно поддерживать постоянным введением клеток. В различных вариантах осуществления клетки МАРС вводятся внутривенно либо изначально, либо для поддержания их уровня у индивида, или и то и другое. В большом числе вариантов осуществления используют другие формы введения в зависимости от состояния пациента и других факторов, рассмотренных в другом месте данного документа.
Отмечено, что, как правило, людей лечат дольше, чем экспериментальных животных; но лечение, как правило, имеет линейную зависимость от длительности заболевания и эффективности лечения. Специалист в данной области должен учитывать это при использовании результатов других методик, выполненных на людях и/или животных, таких как крысы, мыши, обезьяны и тому подобные, для определения подходящих для людей доз. Такие расчеты, исходящие из этих соображений и учитывающие руководство, предлагаемое настоящим описанием, и предшествующий уровень техники, должны помочь специалисту сделать это без излишнего экспериментирования.
Подходящие схемы лечения для первичного введения и последующих доз или для последовательных введений могут быть одинаковыми или могут различаться. Соответствующие схемы лечения могут быть установлены специалистом в данной области на основании настоящего описания, процитированных в нем документов и знаний в данной области.
Доза, периодичность введения и продолжительность лечения будут зависеть от многих факторов, включая природу заболевания, индивида и другие лечебные мероприятия, которые могут применяться. Соответственно, для введения клеток МАРС может использоваться большое число схем лечения.
В некоторых вариантах осуществления клетки МАРС вводят индивиду однократно. В других клетки МАРС вводят индивиду последовательно серией из двух или более доз. В некоторых других вариантах осуществления, в которых клетки МАРС вводят однократно, двукратно и/или более чем двумя дозами, дозы могут быть одинаковыми или различаться, и их могут вводить через равные или неравные промежутки времени.
Клетки МАРС могут быть введены с разной периодичностью за большой отрезок времени. В некоторых вариантах осуществления клетки МАРС вводят за период в менее чем один день. В других вариантах осуществления их вводят за два, три, четыре, пять или шесть дней. В некоторых вариантах осуществления клетки МАРС вводят один или несколько раз в неделю в течение нескольких недель. В других вариантах осуществления их вводят за период от нескольких недель до одного или нескольких месяцев. В различных вариантах осуществления их можно вводить в течение нескольких месяцев. В других их можно вводить в течение одного или нескольких лет. Как правило, продолжительность лечения должна быть пропорциональна длительности заболевания, эффективности применяемых лечебных мероприятий, состоянию и ответу на терапию индивида, подвергнутого лечению.
Терапевтическое применение иммуномодулирующих клеток МАРС
Иммуномодулирующие свойства клеток МАРС можно использовать в лечении большого количества расстройств, дисфункций и заболеваний, например, таких, к которым по существу в виде вторичного эффекта или побочного эффекта лечения приводят отрицательные процессы и эффекты иммунной системы. Ниже рассматривается несколько примеров.
Многие варианты осуществления в этой связи включают введение клеток МАРС индивиду с ослабленной (или компрометированной) иммунной системой либо в виде монотерапии, либо в виде дополнительной терапии к другому лечению. Во множестве вариантов осуществления в этой связи клетки МАРС вводят индивиду дополнительно к облучению или химиотерапии или сочетанию облучения и химиотерапии, которые либо уже применили, применяют или будут применять индивиду. Во многих таких вариантах осуществления облучение, химиотерапия или сочетание облучения и химиотерапии являются частью трансплантации. А также во множестве вариантов осуществления клетки МАРС вводят для лечения отрицательной иммунной реакции, такой как HVG и GVHD.
В большом числе вариантов осуществления в этой связи индивидом является реципиент несингенного, обычно аллогенного, трансплантата клеток крови или клеток костного мозга, причем иммунная система индивида ослаблена или устранена облучением, химиотерапией или сочетанием облучения и химиотерапии, индивиду вводят иммуносупрессорные лекарственные препараты, индивид имеет риск развития или у него развилось заболевание «трансплантат против хозяина», а клетки МАРС вводят индивиду в дополнение к какому-либо одному или нескольким способам воздействия из следующего списка: трансплантация, облучение и/или химиотерапия и иммуносупрессорные лекарственные препараты для лечения, такого как улучшение, угнетение или устранение, у индивида заболевания «трансплантат против хозяина».
Неоплазмы
Термин «неоплазма», как правило, означает расстройства, включающие клональную пролиферацию клеток. Неоплазмы могут быть доброкачественными, то есть не прогрессирующими и не рецидивирующими, а значит и, как правило, не угрожающими жизни. Неоплазмы также могут быть злокачественными, это означает, что они прогрессивно ухудшаются, метастазируют и, как правило, являются опасными для жизни, а часто и фатальными.
В различных вариантах осуществления индивиду, страдающему неоплазмой, в дополнение к ее лечению вводят клетки МАРС. Например, в некоторых вариантах осуществления изобретения в этой связи индивид имеет риск или страдает неоплазмой клеток крови или костного мозга и перенес или перенесет трансплантацию крови или костного мозга. Используя описанные в настоящем документе способы выделения, характеристики и выращивания клеток МАРС вместе с описаниями в настоящем документе иммуносупрессирующих свойств клеток МАРС, для лечения, такого как профилактика, подавление или уменьшение, отрицательных иммунных реакций, таких как HVG и GVHD, которые могут осложнить трансплантацию, применяют МАРС.
В большом числе вариантов осуществления, включающих трансплантацию, клетки МАРС могут быть использованы с целью иммуносупрессии самостоятельно или вместе с другими средствами. Клетки МАРС могут быть введены перед, во время или после одного или нескольких трансплантатов. При введении вместе с трансплантатом клетки МАРС могут быть введены раздельно или вместе с трансплантируемым материалом. При раздельном введении клетки МАРС могут быть введены последовательно или одновременно с другими трансплантируемыми материалами. Более того, клетки МАРС могут быть введены перед трансплантатом и/или после, вместо или в дополнение к введению в то же или почти в то же время, что и введение трансплантата.
К другим средствам, которые можно использовать в сочетании с клетками МАРС в частности при трансплантации, относятся иммуномодулирующие средства, такие как описанные в другом месте данного документа, конкретно, иммуносупрессорные средства, точнее, описанные в другом месте данного документа, особенно в этой связи одно или несколько из следующих средств: кортикостероид, циклоспорин А, циклоспорин-подобное иммуносупрессорное соединение, азатиоприн, циклофосфамид, метотрексат и иммуносупрессорное средство в виде моноклонального антитела.
К числу неопластических заболеваний костного мозга, которые подвергаются воздействию клетками МАРС в вариантах осуществления изобретения в этой связи, относятся миелопролиферативные расстройства («MPD»); миелодиспластические синдромы (или состояния) («MDS»), лейкозы и лимфопролиферативные заболевания, включающие множественную миелому и лимфомы.
MPD отличаются патологической и автономной пролиферацией клеток костного мозга. Данное заболевание может включать клетки лишь одного или нескольких типов. Обычно в MPD вовлекаются три линии дифференцировки клеток, а именно эритроцитарная, гранулоцитарная и тромбоцитарная. Вовлечение трех линий дифференцировки варьирует при разных MPD и между заболеваниями определенных типов. Обычно на них воздействуют раздельно, и в данной неоплазме воздействуют преимущественно на одну линию дифференцировки клеток. MPD не являются однозначно злокачественными; но их относят к неоплазмам и характеризуют патологической самостоятельной репликацией гематопоэтических клеток-предшественников в костном мозге. И все же MPD способны прогрессировать в острые лейкозы.
Подобно MPD, MDS являются клональными расстройствами и они характеризуются патологической самостоятельной репликацией гематопоэтических клеток-предшественников в костном мозге. Как и MPD они могут прогрессировать в острые лейкозы. В большинстве, но не во всех случаях MDS обнаруживают цитопению периферической крови (исключением является хронический миеломоноцитарный лейкоз), в то время как при MPD этого не обнаруживают.
Лабораторные и клинические признаки этих расстройств могут изменяться при их течении и между конкретными случаями. Признаки могут частично совпадать, и постановка точного диагноза, который отличает одно заболевание от всех других, может быть проблематичной. Для диагностики неоплазм гематопоэтических клеток костного мозга, таким образом, требуется особая предосторожность, чтобы не поставить неверный диагноз, например, доброкачественного расстройства, тогда как на самом деле оно окажется чрезвычайно злокачественным.
К числу миелодиспластических синдромов (MDS), которые можно лечить клетками МАРС в виде основной или дополнительной терапии в различных вариантах осуществления изобретения, относятся следующие заболевания: хронический миелолейкоз («CML»)/хронический гранулоцитарный лейкоз («CGL»), идиопатический миелофиброз, первичный тромбоцитоз и истинная полицитемия.
К числу миелопролиферативных расстройств (MPD), которые можно лечить клетками МАРС в виде основной или дополнительной терапии в различных вариантах осуществления изобретения, относятся следующие заболевания: рефрактерная анемия, рефрактерная анемия с кольцевидными сидеробластами, рефрактерная анемия с избытком бластов, рефрактерная анемия с избытком бластов на стадии трансформации и хронический миеломоноцитарный лейкоз.
К числу лимфопролиферативных расстройств, включающих множественные миеломы и лимфомы, которые можно лечить клетками МАРС в виде основной или дополнительной терапии в различных вариантах осуществления изобретения, относятся следующие заболевания: пре-В острый лимфобластный лейкоз, хронический лимфолейкоз («CLL»), В-клеточная лимфома, волосатоклеточный лейкоз, миелома, множественная миелома, Т-клеточный острый лимфобластный лейкоз, периферическая Т-клеточная лимфома, другие лимфоидные лейкозы и другие лимфомы.
К числу неоплазм, которые можно лечить клетками МАРС в виде основной или дополнительной терапии в различных вариантах осуществления изобретения, также относятся следующие заболевания: доброкачественная неоплазма клеток костного мозга, миелопролиферативное расстройство, миелодиспластический синдром или острый лейкоз; хронический миелолейкоз («CML») (также называемый хроническим гранулоцитарным лейкозом («CGL»)), идиопатический миелофиброз, первичный тромбоцитоз, истинная полицитемия, другие миелопролиферативные расстройства, острая множественная миелома, миелобластный лейкоз, острый промиелоцитарный лейкоз, пре-В острый лимфобластный лейкоз, хронический лимфолейкоз («CLL»), В-клеточная лимфома, волосатоклеточный лейкоз, миелома, Т-клеточный острый лимфобластный лейкоз, периферическая Т-клеточная лимфома, другие лимфоидные лейкозы, другие лимфомы или другие острые лейкозы.
Клетки МАРС могут применяться в дополнение к лечению любого их вышеуказанных заболеваний.
Способы воздействия, включающие иммуноабляцию или повреждение
Острые лейкозы часто трудно поддаются лечению способами, которые были бы эффективны в лечении других злокачественных опухолей. Частично это обусловлено подвижностью клеток костного мозга, включая клетки неоплазмы. Частично это может быть обусловлено диффузным распределением костного мозга по всему скелету. И частично это обусловлено несомненно природой самих клеток и их трансформацией.
На сегодняшний день стандартное лечение гематологических злокачественных опухолей включает удаление всех гематопоэтических клеток пациента. Не существует способа сделать это, не удалив также здоровые гематопоэтические клетки пациента. Обычно пациента лечат, используя химио-радиотерапию в достаточно высоких дозах для уничтожения практически всех клеток костного мозга, как нормальных, так и неопластических. Побочные эффекты лечения оказываются тяжелыми, и эти эффекты являются неприятными, болезненными и физически и эмоционально изнуряющими пациентов. В процессе лечения удаляется не только больная ткань и клетки, оно также опустошается гематопоэтическая система и иммунная система пациента. Лечение оставляет его компрометированным, зависящим от переливаний крови и настолько сильно восприимчивым к инфекции, что даже минимальное в другом случае воздействие инфекционного агента может оказаться фатальным.
Нормальную гематопоэтическую способность восстанавливают после этого либо аутологичными, либо аллогенными трансплантатами периферической крови или костного мозга. К сожалению, иммунную систему пациента не только сильно компрометируют лечением устранения, но также в случае аллогенной трансплантации преднамеренным подавлением иммунной системы для профилактики отторжения трансплантата и достижения приживления и пролиферации новых гематопоэтических стволовых клеток, которые должны заново заселить костный мозг пациента и восстановить гематопоэтическую и иммунную системы пациента.
При выполнении таких трансплантаций, направленных на восстановление гематопоэтической и иммунной систем у иммунокомпрометированного хозяина, было встречено большое количество осложнений. Одно из них представляет собой отторжение оставшимися иммунокомпетентными клетками и иммунными процессами хозяина, в настоящем документе называемыми реакцией HVG. Другие запускаются иммунокомпетентными клетками трансплантата, что в настоящем документе обозначается как GVHD.
Этих осложнений можно было бы избежать, используя сингенный или аутологичный материал донора. Однако сингенные доноры, как правило, являются редкостью, а у аутологичных трансплантатов есть большой риск рецидива заболевания. Поэтому в трансплантатах в основном используются аллогенные клетки и ткани, полученные от доноров, совместимых по HLA. К сожалению, эта процедура приводит к GVHD от легкой до тяжелой степени у большинства получающих этот вид терапии. При отсутствии, по меньшей мере, улучшения эти иммунные реакции приведут к неудаче трансплантации, и сами могут оказаться фатальными для пациента.
Для подавления иммунных реакции, чтобы смягчить осложнения после трансплантации, такие как HVG и GVHD, рассмотренные в данном документе выше, разработано множество средств. Некоторые из них достаточно эффективны для снижения отрицательных иммунных реакций до контролируемого уровня в некоторых видах трансплантации, таких как трансплантация костного мозга и периферической крови. Эти средства до некоторой степени улучшили прогноз пациентов, перенесших трансплантацию; но ни одно из них не является абсолютно эффективным, и все они имеют достаточно существенные недостатки.
Было обнаружено (как более подробно описано в другом месте данного документа), что клетки МАРС не провоцируют иммунный ответ у аллогенных хозяев. Трансплантация клеток МАРС аллогенному хозяину, таким образом, не вызывает отторжения аллогенного трансплантата (т.е. HVG).
Более того, также было обнаружено, что аллогенные клетки МАРС могут быть введены хозяину в высокой концентрации без отрицательного воздействия на дыхательную функцию.
Кроме того, было обнаружено (как более подробно описано в другом месте данного документа), что клетки МАРС могут модулировать иммунные реакции. В частности, в этой связи было обнаружено, что клетки МАРС могут подавлять иммунные реакции, включая, но ими не ограничиваясь, иммунные реакции, вовлеченные, например, в реакцию HVG и GVHD, названия лишь двух из них. В частности, еще более подробно было обнаружено в этой связи, что клетки МАРС могут подавлять пролиферацию Т-клеток, даже в присутствии возможных стимуляторов Т-клеток, таких как конканавалин А и аллогенные или ксеногенные стимулирующие клетки.
Более того, было обнаружено, что даже относительно небольшие количества клеток МАРС могут подавлять эти реакции. На самом деле, in vitro лишь 3% клеток МАРС в реакциях смешанной культуры лимфоцитов достаточно для снижения ответа Т-клеток на 50%.
Соответственно, варианты осуществления изобретения относятся к композициям, способам и тому подобному для лечения, такого как улучшение и/или излечение или устранение неоплазм, таких как неоплазмы гематопоэтических клеток, в частности, костного мозга.
К их числу относятся такие неплазмы, которые представляют собой миелопролиферативные расстройства (MPD), такие как хронический миелолейкоз (также называемый «хроническим гранулоцитарным лейкозом» и «CGL»), идиопатический миелофиброз, первичный тромбоцитоз, истинная полицитемия; миелодиспластические синдромы (MDS), такие как рефрактерная анемия, рефрактерная анемия с кольцевидными сидеробластами, рефрактерная анемия с избытком бластов, рефрактерная анемия с избытком бластов на стадии трансформации, хронический миеломоноцитарный лейкоз; и однозначно злокачественные неоплазмы - острые лейкозы - такие как острый миелобластный лейкоз, хронический миелогенный лейкоз (CML), острый промиелоцитарный лейкоз, В-клеточный острый лимфобластный лейкоз, CLL, В-клеточная лимфома, волосатоклеточный лейкоз, миелома, Т-клеточный острый лимфобластный лейкоз, периферическая Т-клеточная лимфома и другие лимфоидные лейкозы и лимфомы.
Клетки МАРС могут быть введены в дополнение к лечению любого из вышеуказанных заболеваний.
Анемии и другие болезни крови
В различных вариантах осуществления изобретения клетки МАРС могут быть использованы для лечения анемии или другой болезни крови, чаще в качестве дополнительной терапии. К числу различных вариантов осуществления в этой связи относятся варианты осуществления, в которых клетки МАРС используют в лечении следующих анемий и/или болезней крови либо в виде монотерапии, либо, как правило, в дополнение к основному лечению: гемоглобинопатий, талассемии, синдрома недостаточности костного мозга, серповидоклеточной анемии, апластической анемии или иммунной гемолитической анемии. Также к болезням относят рефрактерную анемию, рефрактерную анемию с кольцевидными сидеробластами, рефрактерную анемию с избытком бластов, рефрактерную анемию с избытком бластов на стадии трансформации, хронический миеломоноцитарный лейкоз и другие заболевания, относящиеся к миелодиспластическому синдрому, а в некоторых вариантах осуществления анемию Фанкони.
Клетки МАРС могут вводиться в дополнение к лечению любого из вышеуказанных заболеваний.
Заболевания иммунной системы
Варианты осуществления изобретения относятся к использованию иммуномодуляции клетками МАРС для лечения дисфункции, расстройства или заболевания иммунной системы либо в виде монотерапии, либо в качестве дополнительной терапии. Варианты осуществления в этой связи относятся к врожденным иммунодефицитам и аутоиммунным дисфункциям, расстройствам и заболеваниям. Различные варианты осуществления относятся в этой связи к использованию клеток МАРС в лечении, самостоятельном или дополнительном, болезни Крона, синдрома Гийена-Барре, красной волчанки (также называемой «SLE» и системной красной волчанкой), рассеянного склероза, миастении gravis, неврита зрительного нерва, псориаза, ревматоидного артрита, базедовой болезни, зоба Хашимото, тиреоидита Орда, сахарного диабета (I типа), синдрома Рейтера, аутоиммунного гепатита, первичного билиарного цирроза, антифосфолипидного синдрома («APS»), синдрома пляшущих глаз («OMS»), височного артериита, острого диссеминированного энцефаломиелита («ADEM» и «ADE»), синдрома Гудпасчера, грануломатоза Вегенера, глютеновой болезни, пузырчатки, полиартрита и аутоиммунной гемолитической анемии с тепловыми агглютининами.
Среди них к особенным вариантам осуществления относят болезнь Крона, красную волчанку (также называемую «SLE» и системной красной волчанкой), рассеянный склероз, миастению gravis, псориаз, ревматоидный артрит, базедову болезнь, зоб Хашимото, сахарный диабет (Iтипа), синдром Рейтера, первичный билиарный цирроз, глютеновую болезнь, полиартрит и аутоиммунную гемолитическую анемию с тепловыми агглютининами.
Кроме того, клетки МАРС используют в этой связи во множестве вариантов осуществления самостоятельно и, как правило, дополнительно, для лечения большого числа заболеваний, предположительно имеющих аутоиммунный компонент, включая, но ими не ограничиваясь, варианты осуществления, которые можно использовать в лечении эндометриоза, интерстициального цистита, нейромиотонии, склеродермы, прогрессирующей системной склеродермии, витилиго, вульводинии, болезни Шагаса, саркоидоза, синдрома хронической усталости и дисавтономии.
К врожденным расстройствам иммунной системы относятся тяжелый комбинированный иммунодефицит (SCID), включающий, но ими не ограничивающийся, SCID с недостаточностью аденозин-дезаминазы (ADA-SCID), Х-сцепленный SCID, SCID с отсутствием Т- и В-клеток, SCID с отсутствием Т-клеток, В-клетки нормальные, синдром Оменна, нейтропению, включающую, но ими не ограничивающуюся, синдром Костманна, миелокатексис; атаксию-телеангиэктазию, синдром обнаженных лимфоцитов, общий вариабельный иммунодефицит, синдром ДиДжорджи, дефицит адгезии лейкоцитов; и нарушения фагоцитов (фагоциты представляют собой клетки иммунной системы, которые могут поглощать и убивать инородные организмы), включающие, но ими не ограничивающиеся, синдром Чедиака-Хигаши, хроническую гранулематозную болезнь, недостаток актина нейтрофилов, ретикулярный дисгенез.
Клетки МАРС могут вводиться дополнительно к лечению любого из вышеуказанных заболеваний.
Воспалительные заболевания
Кроме того, в большом числе вариантов осуществления изобретения клетки МАРС могут использоваться в лечении воспалительных заболеваний либо в качестве самостоятельного средства, либо в дополнение к основному лечению. Во многих таких вариантах осуществления клетки МАРС могут использоваться для лечения тяжелых воспалительных состояний, таких как состояния, возникающие при острой аллергической реакции или сопутствующие другим заболеваниям или способам лечения. По большей части в настоящее время использование клеток МАРС в этой связи ограничивается острыми случаями, когда индивид имеет риск потери трудоспособности или летального исхода.
Клетки МАРС могут вводиться дополнительно к лечению любого из вышеуказанных заболеваний.
МАРС, описанные в патенте США № 7015037
В данной области описываются клетки МАРС человека. В данной области известны способы выделения клеток МАРС человека и мыши. Поэтому на настоящий момент специалист в данной области имеет возможность получить аспираты костного мозга, биоптаты мозга или печени и другие органы и выделить клетки, используя методики положительной или отрицательной селекции, доступные специалисту в данной области, на основании генов, которые экспрессируются (или не экспрессируются) в этих клетках (например, с помощью функциональных или морфологических анализов, таких как описанные в вышеуказанных заявках, которые приведены в данный документ в качестве ссылки). Такие способы описываются, например, в патенте США № 7015037, содержание которого приведено в данный документ в качестве ссылки для описания клеток МАРС и способов их получения.
Выделение и выращивание клеток МАРС, описанные в РСТ/US00/21387
В данной области известны способы выделения клеток МАРС человека и мыши. Они описываются, например, в патенте США № 7 015 037, РСТ/US00/21387 (опубликованном в виде WO 01/11011) и РСТ/US02/04652 (опубликованном в виде WO 02/064748), и данные способы вместе с характеристикой описанных там клеток МАРС приведены в данный документ в качестве ссылки.
Впервые клетки МАРС были выделены из костного мозга, но впоследствии обнаружены и в других тканях, включая мозг и мышцы (Jiang, Y. et al., 2002). Таким образом, клетки МАРС могут быть выделены из большого числа источников, включая костный мозг, плаценту, пупочный канатик и пуповинную кровь, мышцы, мозг, печень, спинной мозг, кровь или кожу. Например, клетки МАРС могут быть получены из аспиратов костного мозга, которые можно получить стандартными средствами, доступными специалистам в данной области (см., например, Muschler, G.F., et al., 1997; Batinic, D., et al., 1990).
Фенотип клеток МАРС человека в условиях, описанных в патенте США № 7015037
Иммунофенотипический анализ путем FACS клеток МАРС человека, полученных после 22-25 клеточных делений, указывал на то, что эти клетки не экспрессируют CD31, CD34, CD36, CD38, CD45, CD50, CD62E и -P, HLA-DR, Muc18, STRO-1, cKit, Tie/Tek; и экспрессируют низкие уровни CD44, HLA класса I и β2-микроглобулина, но экспрессируют CD10, CD13, CD49b,CD49e, CDw90, Flk1 (N>10).
Если клетки подвергали >40 делениям в культурах, пересеянных с плотностью около 2×103/см2, то фенотип становился более гомогенным и отсутствовали клетки, экспрессировавшие HLA класса I или CD44 (n=6). Если клетки выращивали с большей плотностью, они экспрессировали высокие уровни Muc18, CD44, HLA класса I и β2-микроглобулина, что аналогично фенотипу, описанному для MSC (N=8) (Pittenger, 1999).
Иммуногистохимический анализ показал, что клетки МАРС человека, выращенные с плотностью посева около 2 х 103/см2, экспрессировали EGF-R, TGF-R1 и -2, BMP-R1A, PDGF-R1a и -В и что небольшая субпопуляция (от 1 до 10%) клеток МАРС окрашивалась антителами против SSEA4 (Kannagi, R, 1983).
Используя чипы на основе кДНК фирмы Clontech, определяли профиль экспрессируемых генов клеток МАРС человека, культивированных с плотностью посева около 2×103/см2 в течение 22 и 26 клеточных делений:
А. Клетки МАРС не экспрессировали CD31, CD36, CD62E, CD62P, CD44-H, cKit, Tie, рецепторов IL1, IL3, IL6, IL11, G CSF, GM-CSF, Epo, Flt3-L или CNTF и экспрессировали низкие урвни HLA класса I, CD44-E и мРНК Muc-18.
Б. Клетки МАРС экспрессировали мРНК цитокинов ВМР1, ВМР5, VEGF, HGF, KGF, MCP1; рецепторы цитокинов Flk1, EGF-R, PDGF-R1α, gp130, LIF-R, активин-R1 и -R2, TGFR-2, BMP-R1A; рецепторы адгезии CD49c, CD49d, CD29; и CD10.
В. Клетки МАРС экспрессировали мРНК hTRT и TRF1; фактор транскрипции домена POU oct-4, sox-2 (совместно с oct-4 необходим для поддержания ES/EC в недифференцированном состоянии, Uwanogho D., 1995), sox 11 (отвечает за развитие нейронов), sox 9 (за хондрогенез) (Lefebvre V., 1998); факторы транскрипции семейства homeodeomain: Hox-a4 и -а5 (отвечают за развитие шейки матки и скелета грудной клетки; органогенез респираторного тракта) (Packer AI, 2000), Hox-a9 (миелопоэз) (Lawrence H, 1997), Dlx4 (отвечает за развитие переднего мозга и периферических структур головы) (Akimenko MA, 1994), MSX1 (мезодерма эмбриона, сердце и мышцы взрослого индивида, хондро- и остеогенез) (Foerst-Potts L. 1997), PDX1 (поджелудочная железа) (Offield MF, 1996).
Г. C помощью ОТ-ПЦР подтверждали присутствие oct-4, LIF-R и мРНК hTRT.
Д. Кроме того, с помощью ОТ-ПЦР было показано, что в клетках МАРС экспрессировались мРНК rex-1 и мРНК rox-1.
Oct-4, rex-1 и rox-1 экспрессировались в клетках МАРС, полученных из костного мозга человека и мышей и из печени и мозга мышей. Клетки МАРС человека экспрессировали LIF-R и положительно окрашивались на наличие SSEA-4. В заключение, было обнаружено, что уровни oct-4, LIF-R, rex-1 и мРНК rox-1 повышены в клетках МАРС человека, культивированных менее 30 клеточных делений, что приводило к появлению фенотипически более однородных клеток. Наоборот, клетки МАРС, культивированные с высокой плотностью, снижали экспрессию этих маркеров. Это связано со старением раньше 40 клеточных делений и потерей способности дифференцироваться в клетки, отличные от хондробластов, остеобластов и адипоцитов. Таким образом, наличие oct-4 в сочетании с rex-1, rox-1 и sox-2 коррелировало с наличием более низкодифференцированных клеток в культурах клеток МАРС.
В данной области хорошо известны способы культивирования клеток МАРС (см., например, патент США № 7015037, который приведен данный документ в качестве ссылки к способам культивирования клеток МАРС). Плотность культивирования клеток МАРС может варьировать от около 100 клеток/см2 или около 150 клеток/см2 до около 10000 клеток/см2, включая от около 200 клеток/см2 до около 1500 клеток/см2 и до около 2000 клеток/см2. Плотность может варьировать между видами. Кроме того, оптимальная плотность может варьировать в зависимости от условий культивирования и источника клеток. Специалист в данной области способен определить оптимальную плотность для имеющихся условий культивирования и клеток.
Кроме того, на любом этапе во время выделения, выращивания и дифференциации клеток МАРС в культуре можно использовать эффективные концентрации атмосферного кислорода менее около 10%, включая около 3-5%.
Настоящее изобретение дополнительно описывается следующими не ограничивающими его примерами.
Примеры
ПРИМЕР 1: Клетки МАРС человека (из мононуклеарных клеток костного мозга)
Мононуклеарные клетки костного мозга получали из аспиратов костного мозга, взятых из заднего края подвздошного гребня у >80 здоровых людей-добровольцев. От каждого индивида получали от десяти до ста кубических сантиметров костного мозга. Из костного мозга центрифугированием в градиенте плотности Фиколл-Paque (Sigma Chemical Co., St Louis, MO) получали мононуклеарные клетки («MNC»). MNC костного мозга инкубировали с CD45 и микросферами гликофорина А (Miltenyi Biotec, Sunnyvale, CA) в течение 15 минут и удаляли клетки CD45+ GlyA+, поместив образец в поле магнита SuperMACS. Элюированные клетки на 99,5% представляли собой CD45- GlyA-.
Истощение клеток CD45+ GlyA+ привело к выходу клеток CD45- GlyA-, которые составили примерно от 0,05 до 0,10% всех мононуклеарных клеток костного мозга. Клетки отбирали так, чтобы они не экспрессировали общий антиген лейкоцитов CD45 или маркер эритроидного предшественника гликофорин-А (GlyA). Клетки CD45- GlyA- составляют 1/103 мононуклеарных клеток костного мозга. Клетки CD45- GlyA-
помещали в лунки, покрытые фибронектином в 2% растворе FCS, EGF, PDGF-BB, дексаметазона, инсулина, линолевой кислоты и аскорбиновой кислоты. Через 7-21 день появились небольшие скопления адгезировавших клеток. Используя анализы предельных разведений, показано, что частота встречаемости клеток, давших рост этим адгезивным скоплениям, составляет 1/5×103 клеток CD45- GlyA-. При появлении колоний (около 103 клеток) клетки собирали трипсинизацией и повторно высевали каждые 3-5 дней в разведении 1:4 в тех же условиях культивирования. Плотность клеток поддерживали на уровне 2-8×103 клеток/см2.
ПРИМЕР 2: Клетки МАРС мыши
Все ткани получали в соответствии с рекомендациями Университета Миннесоты IACUC. Мононуклеарные клетки (BMMNC) получали разделением на Фиколл Hypaque. BM получали от 5-6 недельных мышей линии ROSA26 или C57/BL6. Альтернативно, мышечную ткань и ткань мозга получали от 3-4 дневных мышей линии 129. Мышцы проксимальных частей передних и задних конечностей отделяли и тщательно измельчали. Ткань обрабатывали 0,2% раствором коллагеназы (Sigma Chemical Co., St Louis, MO) в течение 1 часа при 37°С с последующей обработкой 0,1% раствором трипсина (Invitrogen, Grand Island, NY) в течение 45 минут. Клетки затем энергично растирали в порошок и пропускали через фильтр с размером пор 70 мкм. Суспензии клеток собирали и центрифугировали в течение 10 минут при 1600 об/мин. Ткань мозга иссекали и тщательно измельчали. Клетки разъединяли инкубацией в 0,1% растворе трипсина и 0,1% растворе ДНКазы (Sigma) в течение 30 минут при 37°C. Клетки затем энергично растирали в порошок и пропускали через фильтр с размером пор 70 мкм. Суспензии клеток собирали и центрифугировали в течение 10 минут при 1600 об/мин.
BMMNC или суспензии клеток мышц или мозга в концентрации 1×105/см2 помещали в среду накопления [2% раствор FCS в минимальной поддерживающей среде Дульбекко с недостатком глюкозы (LG-DMEM), содержащей по 10 нг/мл каждого из следующих фаторов: фактора роста тромбоцитов (PDGF), эпидермального фактора роста (EGF) и фактора ингибирования лейкемии (LIF)] и поддерживали с плотностью 5×103/см2. Через 3-4 недели от клеток, обработанных трипсином/ЭДТА, с помощью микромагнитных сфер отделяли клетки CD45+ GlyA+. Полученные клетки CD45- GlyA- в количестве 10 клеток/лунка помещали в 96-луночные планшеты, покрытые FN, и выращивали до плотности клеток между 0,5 и 1,5×103/см2. Потенциал роста клеток МАРС оказался схожим вне зависимости от ткани, из которой их получали.
ПРИМЕР 3: Клетки МАРС крыс
ВМ и MNC от крыс линий Sprague Dawley, Lewis или Wistar получали и помещали в условия, аналогичные описанным для получения клеток МАРС мышей.
ПРИМЕР 4: клонирование клеток МАРС мышей и крыс
Чтобы показать, что дифференцированные клетки являлись производными одной клетки и клетки МАРС на самом деле представляют собой «клональные» полипотентные клетки, были созданы культуры, в которых клетки МАРС были трансдуцированы ретровирусным вектором. Было обнаружено, что недифференцированные клетки МАРС и их потомство имеют ретровирус, встроенный в геноме в один и тот же участок.
Были проведены исследования с использованием двух независимо полученных популяций клеток МАРС линии ROSA26, двух популяций клеток МАРС линии C57BL/6 и одной популяции МАРС крыс, наращенных в течение от 40 до >90 PDs, а также с трансдуцированными eGFP «клональными» мышиными и «клональными» крысиными МАРС. Было показано отсутствие различий между клетками, трансдуцированными и не трансдуцированными eGFP. Известно, что в дифференцированных клетках МАРС продолжается экспрессия eGFP.
В частности, BMMNC мышей и крыс, культивированные в течение трех недель на FN с EGF, PDGF-BB и LIF, трансдуцировали за два последовательных дня онкоретровирусным вектором, кодирующим eGFP. После этого истощали запас клеток CD45+ и GlyA+ и клетки субкультивировали в количестве 10 клеток/лунка. В течение 85 PDs увеличивали количество клеток BMMNC крыс, трансдуцированных eGFP. Альтернативно, использовали клетки МАРС мышей, количественно увеличенные в течение 80 PDs. Высевая на чашку Петри 100 клеток МАРС из культур, поддерживаемых в течение 75 PDs и повторно увеличивая их количество до >5×106 клеток, создавали субкультуры недифференцированных клеток МАРС. Количественно увеличенные клетки МАРС побуждали к дифференциации in vitro в эндотелий, нейроэктодерму и эндодерму. Путем окрашивания антителами, специфичными для данных типов клеток, была показана линейная дифференциация.
ПРИМЕР 5: Клетки МАРС человека не являются иммуногенными
Мезенхимные стволовые клетки in vitro показали низкую иммуногенность и способность приживляться между аллогенными реципиентами

На фиг. 3 представлено, что клетки МАРС человека in vitro показывают низкую иммуногенность и оказывают иммуносупрессорное действие при добавлении в реакциях MLR к Т-клеткам c другими потенциями (Tse, W. et al. (2003)). Результаты совпадали между всеми протестированными парами донор-реципиент.
В соответствии с процедурами, описанными Tse, W. et al. (2003), для этих экспериментов получали отвечающие и стимулирующие клетки, и осуществляли реакции MLR.
ПРИМЕР 6: Клетки МАРС модулируют ответы Т-клеток
Способность клеток МАРС модулировать, а в данном случае подавлять, иммунную реактивность иллюстрируется анализами пролиферации Т-клеток, например, такими, которые могут быть выполнены согласно следующему.
Получение отвечающих Т-клеток
Отвечающие клетки получали из лимфатических узлов крыс Lewis. Лимфатические узлы извлекали из крыс хирургическим путем и сразу же помещали в 3-5 мл среды (полная среда RPMI или полная среда DMEM) в чашки Петри размером 60×15 мм. Лимфатические узлы измельчали с помощью нейлонового фильтра (используя ручной плунжер шприца). Дисперсии помещали в пробирки объемом 50 мл и центрифугировали при 1,250 об/мин в течение 8 минут. Полученные супернатанты (среду) отбрасывали. Осадки (содержащие клетки) ресуспендировали в свежей среде (полная среда RPMI или полная среда DMEM). Клетки трижды отмывали и затем ресуспендировали в свежей среде. Плотность ресуспендированных клеток определяли подсчетом количества клеток, находящихся в известном объеме. Клетки хранили на льду. Перед использованием клетки ресуспендировали в среде (полная среда RPMI или полная среда DMEM) с плотностью 1,25×106 клеток/мл.
Получение клеток МАРС
Клетки МАРС получали от крыс Lewis или Sprague-Dawley, после чего замораживали, как описано выше. Оттаявшие клетки затем облучали дозой 3000 рад. Облученные клетки затем ресуспендировали в среде (полная среда RPMI или полная среда DMEM) до плотности 0,4×106 клеток/мл, 0,8×106 клеток/мл и 1,6×106 клеток/мл.
Получение конканавалина А
Для активации Т-клеток использовали конканавалин А («ConA»). ConA растворяли в PBS (полной среде RPMI или полной среде DMEM) до конечных концентраций 0 (только PBS), 10, 30 и 100 мкг/мл.
Порядок выполнения анализа
Каждая экспериментальная точка на графике основана, по меньшей мере, на трех определениях.
В лунки планшетов для микротитрования (96-луночные, плоскодонные) добавляли по 20 мкл каждого раствора ConA, после чего добавляли отвечающие клетки в объеме 80 мкл/лунка и клетки МАРС в объеме 100 мкл/лунка. Планшеты инкубировали при 37°C в инкубаторах с увлажнением в атмосфере 5% СО2 в течение 4-5 дней. В планшетах генерировались импульсы3Н-тимидина с радиоактивностью 1 мкКи/лунка в течение последних 14-18 часов культивирования. После этого клетки автоматически собирали на стекловолоконные фильтры, используя аппарат для сбора клеток Tomtec. Накопленный тимидин подсчитывали на сцинтилляционном счетчике для микропланшетов. Результаты выражали в виде усредненного количества импульсов в минуту (СРМ) +/-SD.
Конечные концентрации ConA в ростовой среде в лунках составили 0, 1, 3,16 и 10 мкг/мл. Клетки МАРС присутствовали в лунках в количествах 0, 0,4, 0,8 и 1,6×105 клеток/лунка.
Описанные ниже результаты иллюстрируются на фиг. 4.
Результаты
Повышенные количества ConA приводили к дозозависимой стимуляции пролиферации Т-клеток (Фиг. 4, только LN). Клетки МАРС крыс Lewis ингибировали пролиферацию Т-клеток, стимулированных ConA. Величина ингибирования зависела от дозы клеток МАРС. Максимальное ингибирование, 50%, обнаруживалось при самой высокой дозе МАРС, использованной в этих экспериментах, и при низких и средних дозах ConA. Эти результаты представлены графически на Фиг. 4, они показывают, что клетки МАРС подавляют пролиферацию активированных Т-клеток.
ПРИМЕР 7: Клетки МАРС подавляют пролиферацию стимулированных Т-клеток
Способность клеток МАРС подавлять реакции пролиферации сингенных и несовместимых (аллогенных) Т-клеток демонстрируется результатами реакций смешанных культур лимфоцитов. В приведенном ниже примере показаны супрессивные эффекты клеток МАРС на Т-клетки крыс Lewis, стимулированные облученными клетками селезенки крыс DA. Клетки МАРС как сингенных крыс Lewis, так и несовместимых (аллогенных) крыс Sprague-Dawley ингибировали ответы Т-клеток дозозависимым образом. Эксперименты выполняли согласно следующему.
Получение отвечающих Т-клеток
Отвечающие клетки получали из лимфатических узлов крыс Lewis, как описано выше.
Стимулирующие клетки облученной селезенки
Из крыс DA хирургическим путем удаляли селезенки. Затем из селезенок, по существу, так как описано выше для выделения отвечающих клеток из лимфатических узлов крыс Lewis, выделяли спленоциты. Выделенные клетки селезенки облучали дозой 1800 рад. Клетки затем ресуспендировали до плотности 4×106/мл и хранили на льду до использования.
Получение клеток МАРС
Сингенные клетки МАРС получали от крыс Lewis, как описано выше. Несовместимые (аллогенные) клетки МАРС получали от крыс Sprague-Dawley тем же способом. Как клетки МАРС крыс Lewis, так и клетки МАРС крыс Sprague-Dawley облучали дозой 3000 рад, после чего ресуспендировали в полной среде RPMI до плотности 0,03×106/мл, 0,06×106/мл, 0,125×106/мл, 0,25×106/мл, 0,5×106/мл, 1×106/мл и 2×106/мл.
Порядок выполнения анализа
В лунки 96-луночного планшета для микротитрования помещали следующие компоненты: 100 мкл клеток МАРС (в разведениях, указанных выше) или 100 мкл среды; 50 мкл матричного раствора стимулирующих клеток или контроля; 50 мкл каждого матричного раствора отвечающих клеток или контроля; и среду (полная среда RPMI или полная среда DMEM) до конечного объема 200 мкл/лунка. Для всех анализов использовали 96-луночные плоскодонные планшеты для микротитрования.
Каждая точка на графике основана, по меньшей мере, на трех определениях.
Планшеты инкубировали при 37°С в инкубаторах с увлажнением в атмосфере 5% СО2 в течение 4-5 дней. В планшетах генерировались импульсы3Н-тимидина с радиоактивностью 1 мкКи/лунка в течение последних 14-18 часов культивирования. После этого клетки автоматически собирали на стекловолоконные фильтры, используя аппарат для сбора клеток Tomtec. Накопленный тимидин подсчитывали на сцинтилляционном счетчике для микропланшетов. Результаты выражали в виде усредненного количества импульсов в минуту (СРМ) +/-SD.
Результаты
Экспозиция Т-клеток, полученных из лимфатических узлов крыс Lewis (отвечающие) со стимулирующими клетками, представляющими собой облученные спленоциты крыс DA (стимуляторы), привела к значительному пролиферативному ответу отвечающих клеток, как показано на фигурах 5А и 5В под заголовком «МАРС отсутствуют».
Добавление повышенных доз сингенных клеток МАРС крыс Lewis (фиг. 5А) и несовместимых (аллогенных) HLA-гаплоидентичных клеток МАРС крыс Sprague-Dawley (фиг. 5В) привело к значительному дозозависимому ингибированию активации Т-клеток. Максимальные уровни ингибирования составили ~80%. Даже при самых низких дозах МАРС наблюдалось 40-50% ингибирование.
В контролях встраивания3Н-тимидина не было обнаружено, это указывает на то, что встраивание было обусловлено исключительно пролиферацией активированных отвечающих Т-клеток, как показано на фиг. 5А и 5В.
В сущности, данные результаты показывают, что сингенные и HLA-гаплоидентичные (аллогенные) клетки МАРС подавляют пролиферацию Т-клеток даже в присутствии потенциально активирующих спленоцитов несовместимых крыс. В этих экспериментах в реакции наблюдается максимальное ингибирование при равнозначных количествах (200000 клеток) каждого из ее участников: стимуляторов, отвечающих клеток и клеток МАРС. В этих условиях ингибирование составило ~80%. В реакции наблюдалось значительное ингибирование при гораздо более низких соотношениях клеток МАРС к другим клеткам. Например, при концентрации клеток МАРС 1,5% наблюдалось 50% ингибирование (3000 МАРС к 200000 каждого из типов клеток). Результаты демонстрируют не только то, что клетки МАРС обладают сильным иммуносупрессорным эффектом, но также что относительно небольшого количества клеток МАРС достаточно для ингибирования относительно большого количества компетентных Т-клеток даже в присутствии сильных активаторов Т-клеток.
ПРИМЕР 8: МАРС являются безопасными
Основным непосредственным риском внутривенного введения большого числа клеток является аккумуляция скоплений клеток в легких, что приводит к дыхательной недостаточности и может вызвать остановку сердечной деятельности. Чтобы показать безопасность использования в этой связи клеток МАРС, мы оценили эффекты внутривенного введения клеток МАРС на частоту дыхательных движений у крыс Buffalo.
Клетки МАРС были получены от крыс Lewis, как описано выше («клетки МАРС Lewis»). Спленоциты также получали от крыс Lewis, как описано выше, для использования в качестве контролей («Спленоциты Lewis»).
В каждой группе одна из крыс-самок Lewis служила в качестве донора спленоцитов (условие эксперимента). В каждой группе в качестве реципиентов использовали двух крыс-самок Buffalo (условие эксперимента).
Клетки вводили крысам, как указано ниже. Данные представлены графически на фиг. 6. Соответствие точек на графике конкретным крысам, как пронумеровано ниже, приводится на вертикальной легенде в правой части фиг. 6. Все крысы являлись крысами Buffalo.
Как указано выше, крысам вводили 1,2, 2,5, 5 или 10 миллионов клеток МАРС или 1,2, 2,5, 5 или 10 миллионов спленоцитов. Это соответствует 5,10, 25 или 50 миллионам клеток/кг. Частоту дыхательных движений измеряли перед (0 мин) и через 1,5 и 10 минут после внутривенного введения клеток МАРС или спленоцитов. Для получения частоты дыхательных движений в минуту измеряли частоту дыхательных движений в течение 20 секунд и умножали эти числа на 3. Нормальной для крыс является частота дыхательных движений от 60 до 140/мин.
Результаты
После внутривенных инъекций клеток выживали все животные. В различных условиях в частоте дыхательных движений не было обнаружено значительных отличий или тенденций. Данные результаты представлены на фиг. 6. Поскольку перед введением клеток животным давали наркоз, исходная частота дыхательных движений (0 мин) незначительно снижалась. В каждой временной точке измерения группировали случайным образом.
Вкратце, внутривенное введение 5-50 миллионов клеток МАРС/кг не привело к изменениям частоты дыхательных движений или летальному исходу какой-либо из крыс при любых данных условиях. Результаты показывают, что внутривенное введение клеток МАРС является безопасным даже при высоких дозах.
ПРИМЕР 9: Экспрессия клетками МАРС иммунных маркеров
Иммуномодулирующая природа клеток МАРС была дополнительно охарактеризована путем определения в клетках МАРС маркеров регуляции иммунитета, таких как описанные Barry et al. (2005). Маркеры определяли, используя маркер-специфичные антитела и анализ FACS.
Клетки МАРС костного мозга крыс выделяли, культивировали и собирали, как описано выше. Для выполнения анализа FACS клетки суспендировали в PBS в концентрации 1-2×108 клеток/мл. В каждую серию полипропиленовых пробирок размером 12×75 добавляли 200 мкл суспензии клеток. В каждую пробирку добавляли маркер-специфическое антитело или контроль и затем инкубировали их в течение 15-20 минут при комнатной температуре. В конце инкубационного периода к каждой пробирке добавляли 2 мл PBS и затем центрифугировали при 400×g в течение 5 минут. Супернатанты отбрасывали и клетки ресуспендировали в каждой пробирке в 100 мкл PBS. В каждую пробирку в соответствующем объеме добавляли флуоресцентно меченное вторичное антитело и пробирки снова инкубировали в течение 15-20 минут при комнатной температуре, все это делали в темноте. После этого в каждую пробирку добавляли 2 мл PBS и вновь центрифугировали при 400×g в течение 5 минут. Супернатанты отбрасывали и клетки в каждой пробирке ресуспендировали в 200 мкл PBS и хранили на льду до проведения анализа FACS.
Результаты рассчитывают и наглядно представляют в таблице 1. Как показано в таблице, клетки МАРС крыс являются: (а) положительными по МНС класса I, CD11c, CD29 и CD90 и (б) отрицательными по МНС класса II, CD11b, CD31, CD40, CD45, CD54, CD80, CD86, CD95 и CD106. Отрицательные результаты были проверены для каждого антитела позитивным окрашиванием контрольных клеток, включающих клетки периферической крови и эндотелия крыс. Эти паттерны экспрессии маркеров, как маркеров, которые определяются в клетках МАРС, так и маркеров, которые не были определены, находятся в полном соответствии с низким иммуностимулирующим профилем клеток МАРС.
Таблица 1 - Определение в клетках МАРС маркеров, относящихся к иммунным клеткам
ПРИМЕР 10: Клетки МАРС подавляют предварительно стимулированные Т-клетки в реакциях MLR
Клетки
Отвечающие клетки получали из лимфатических узлов крыс Lewis, как описано выше. В качестве стимуляторов использовали спленоциты, полученные из крыс Buffalo или DA, как описано выше. Клетки МАРС получали, как описано выше.
Порядок выполнения
В первую группу реакций MLR одновременно со спленоцитами добавляли клетки МАРС (как было сделано в вышеуказанных примерах). Кроме того, клетки МАРС добавляли ко второй группе реакций MLR, которые проводили аналогично первой группе. Однако клетки МАРС во вторую группу добавляли через 3 дня после добавления спленоцитов (или контроля). Таким образом, в первую группу клетки МАРС добавляли перед тем, как Т-клетки начнут пролиферировать в ответ на воздействие спленоцитов. Во вторую группу клетки МАРС добавляли, когда ответ Т-клеток на спленоциты продолжался 3 дня. Все планшеты инкубировали в общей сложности в течение 4 дней, после чего подсчитывали число импульсов3Н-тимидина и собирали, как описано в вышеуказанных примерах. Или же эксперименты выполняли, как описано для реакций MLR в вышеуказанных примерах.
Каждая точка на графике нанесена на основании, по меньшей мере, трех определений.
Результаты
Как можно увидеть в правой части фигуры 7, клетки МАРС значительно подавляют пролиферацию Т-клеток в реакциях MLR при добавлении их через три дня после стимуляции аллогенными спленоцитами. Сопоставив левую и правую стороны фиг. 7, можно увидеть, что клетки МАРС значительно подавляют происходящую реакцию пролиферации. Количественные результаты по клеткам Buffalo показывают, что клетки МАРС, добавленные через 3 дня после стимуляции, подавляли пролиферацию Т-клеток на 50% по сравнению с контролями (правая сторона фигуры) и на 75% при добавлении одновременно со стимулирующими спленоцитами (левая сторона фигуры). Аналогичные результаты получены для клеток DA: клетки МАРС, добавленные через 3 дня после стимуляции, подавляли пролиферацию Т-клеток на 33% по сравнению с контролями (правая сторона фигуры) и на 70% при добавлении одновременно со стимулирующими спленоцитами (левая сторона фигуры).
Во всех случаях степень иммуносупрессии клетками МАРС зависела в основном от количества клеток МАРС, которые добавляли в реакцию. Другими словами, иммуносупрессия зависела от дозы клеток МАРС, добавленных в реакции MLR.
Перечисленные выше публикации приводятся в данный документ в качестве ссылки в полном объеме в отношении конкретного изучаемого предмета, по поводу которого их процитировали.
ПРИМЕР 11: Ингибирование клетками МАРС Т-лимфоцитов является обратимым
Т-клетки культивировали со стимуляторами, представлявшими собой аллогенные спленоциты, в течение 13 дней в присутствии или в отсутствии облученных клеток МАРС. После 13-дневного культивирования Т-клетки извлекали и вновь высевали с облученными аллогенными спленоцитами в присутствии или в отсутствии клеток МАРС и культивировали в течение 4 дней.
Пролиферация Т-клеток, которую ингибировало наличие облученных клеток МАРС во время начального периода культивирования, восстанавливалась при отсутствии клеток МАРС во время второго культивирования. Наличие клеток МАРС при втором культивировании ингибировало пролиферацию Т-клеток по сравнению с пролиферацией при начальном культивировании вплоть до 90% ингибирования при соотношении клеток МАРС к Т-клеткам 1:2. Результаты, представленные на фиг. 8, наглядно демонстрируют, что ингибирование пролиферации Т-клеток посредством клеток МАРС в реакциях MLR является обратимым и что клетки МАРС ингибируют как первичные, так и вторичные пролиферативные ответы Т-клеток.
ПРИМЕР 12: клетки МАРС предотвращают GVHD
Способность клеток МАРС супрессировать GVHD была продемонстрирована на модели крыс, как указано далее. Т-клетки от доноров-крыс Buffalo служили в качестве «трансплантата» для реципиентов-крыс Lewis × Buffalo. Пересаженные клетки Buffalo активировались «чужеродными» клетками Lewis в хозяине, что приводило к GVHD у данной модели.
Крыс-реципиентов F1 (Lewis × Buffalo) в день 0 облучали сублетально однократной дозой 600 рад. В тот же день им внутривенно вводили 2×107 клеток костного мозга и 10×107 Т-клеток (спленоцитов) от доноров-крыс Buffalo. Крыс наблюдали 3 раза в неделю на наличие признаков GVHD, оцениваемых по положению тела, активности, структуре шерсти, коже и снижению веса.
Группа 1 не получила клеток МАРС. Группа 2 получила 2,5×106 клеток МАРС в день 1. Группа 3 получила 2,5×106 клеток МАРС в каждый день с 1 по 8. В каждой группе находилось по пять крыс. Результаты представлены на фиг. 9. Введение клеток МАРС однозначно повысило выживаемость крыс. К концу эксперимента (на 42 день) осталось в живых сорок процентов крыс в группе 2 и шестьдесят процентов крыс в группе 3, тогда как все крысы, не получившие клеток МАРС (группа 1) умерли от GVHD к 21 дню.
Реферат
Группа изобретений относится к области медицины, а именно к трансплантологии, и может быть использована для лечения реакции «трансплантат против хозяина (GVHD). Для этого индивиду вводят полипотентные клетки, которые не являются эмбриональными стволовыми клетками, эмбриональными герминативными клетками, герминативными клетками. Клетки могут дифференцироваться в один тип клеток любой по меньшей мере из двух эмбриональных линий - эндодермальной, эктодермальной и мезодермальной. Клетки экспрессируют теломеразу, являются аллогенными для индивида и не провоцируют отрицательный иммунный ответ. Группа изобретений также относится к вышеуказанным клеткам, которые являются выращенными и подверглись по меньшей мере от 10 до 40 циклам удвоения клеток в культуре, а также экспрессируют специфические маркеры (oct-3/4, rex-1 и rox-1). Данный способ позволяет использовать полипотентные зрелые клетки-предшественники дополнительно для иммуносупрессии при трансплантации. 4 н. и 7 з.п.ф-лы, 10 ил., 1 табл., 12 пр.

Комментарии