Рекомбинантные пробиотические бактерии - RU2723324C2
Код документа: RU2723324C2
Чертежи






































Описание
В соответствии с настоящим изобретением предложены рекомбинантные пробиотические бактерии, в частности для применения при лечении воспалительного нарушения функции кожи, а также способ лечения воспалительного нарушения функции кожи.
Настоящая заявка испрашивает приоритет согласно международной заявке РСТ/ЕР2015/052345, содержание которой полностью включено в настоящую заявку посредством ссылки.
Макрофаги являются одним из типов лейкоцитов и могут быть обнаружены практически во всех тканях. Макрофаги играют важную роль в неспецифической защите, а также помогают инициировать специфичные защитные механизмы путем привлечения других иммунных клеток, таких как лимфоциты.
Макрофаги существуют в виде резидентных тканеспецифичных макрофагов или происходят из циркулирующих моноцитов крови, которые дифференцируются в макрофаги.
Макрофаги имеют различные состояния активации. Известны два различных по характеру состояния активации: классически активированные макрофаги, которые также обозначаются как M1-поляризованные макрофаги, и активированные иными способами макрофаги, которые также обозначаются как М2-поляризованные макрофаги.
M1-поляризованные макрофаги включают иммунные эффекторные клетки с активным воспалительным фенотипом. M1-поляризованные макрофаги характеризуются высокими уровнями экспрессии провоспалительных цитокинов, выработкой больших количеств реакционноспособных промежуточных радикалов азота и кислорода, усилением ответа, опосредованного Th1-клетками, а также сильной противомикробной и противоопухолевой активностью.
М2-поляризованные макрофаги имеют противовоспалительный фенотип. Как полагают, М2-поляризованные макрофаги участвуют в сдерживании распространения паразитов, а также в усилении ремоделирования тканей и прогрессирования опухоли, помимо этого они обладают иммунорегуляторными функциями. М2-макрофаги также характеризуются эффективной фагоцитарной активностью, высокими уровнями экспрессии поглощающих молекул (скавенджеров).
Мононуклеарные фагоциты в активированном состоянии характеризуются пластичностью и гибкостью. Например, фенотип M1-поляризованных или М2-поляризованных макрофагов можно полностью изменить в условиях in vitro и in vivo.
Макрофаги могут изменять несколько раз профиль секреции цитокинов и хемокинов в зависимости от стимула в их микроокружении. Например, первичные М1-поляризованные макрофаги человека могут быть повторно поляризованы под действием секретируемых факторов, выделяемых их партнерами, в М2-поляризованные макрофаги, и наоборот, в условиях in vitro и in vivo.
Помимо обеспечения первой линии защиты от патогенов мононуклеарные фагоциты вовлечены в ремоделирование и восстановление тканей при гомеостатических состояниях и состояниях при повреждении.
Более того, макрофаги вносят значимый вклад в контроль над воспалением, при этом M1-поляризованные макрофаги вовлечены в инициирование и поддержание воспаления, тогда как М2-поляризованные макрофаги связаны с контролированием процесса хронического воспаления.
Например, макрофаги подвергаются динамическим изменениям на разных этапах заживления ран. M1-поляризованные макрофаги опосредуют повреждение тканей и инициируют воспалительные реакции. Помимо этого, на ранних этапах реакции заживления раны макрофаги, инфильтрующие кожу, проявляют фенотип М2-поляризации и поддерживают образование высоковаскуляризованной, обогащенной клетками грануляционной ткани.
Воспаление можно охарактеризовать как острое воспаление при таких состояниях как сепсис, травма и заживление ран или хроническое воспаление, например, при таких заболеваниях, как ревматоидный артрит, язвенный колит, болезнь Крона и т.д. Многие другие заболевания, такие как рак, различные виды диабета, атеросклероз, болезнь Альцгеймера и ожирение, также связаны с воспалением, контроль над которым нарушен.
Острый воспалительный ответ включает каскад событий, опосредованных большим количеством клеток и молекул, которые обнаруживают проникающие патогены или поврежденные ткани, посылают сигналы и привлекают другие клетки и молекулы, устраняют провоцирующие агенты и, наконец, восстанавливают гомеостаз организма.
При сепсисе и травме такой ответ сопровождается макроскопическими проявлениями, такими как лихорадка и повышенная частота сердечных сокращений. В других тканях воспаление проявляется как покраснение, отек и боль.
Прямая циклическая связь воспаления, которое ведет к повреждению/дисфункции, что в свою очередь вызывает воспаление, может привести к стойкому, нерегулируемому воспалению, которое способствует нарушению функции органов и летальному исходу. Для надлежащего заживления тканей необходим тщательно регулируемый воспалительный ответ.
Восстановление целостности кожи и гомеостаза после повреждений требует сложного и динамичного взаимодействия эпителиальных и мезенхимальных клеток с резидентными тканеспецифичными клетками и привлекаемыми гемопоэтическими клетками для выполнения последовательных этапов реакции заживления воспаления, формирования ткани и созревания. На раннем этапе реакции заживления преобладает воспалительная фаза, которая характеризуется локальной активацией врожденной иммунной системы, что приводит к немедленному притоку нейтрофилов с последующей инфильтрацией моноцитами крови, которые дифференцируются в макрофаги.
Промежуточный этап реакции заживления включает фазу формирования ткани, которая характеризуется развитием грануляционной ткани, заполняющей раневое пространство в дерме. Образование грануляционной ткани включает проникновение эндотелиальных клеток, приводящее к ангиогенезу, приток фибробластов и накопление вспомогательных макрофагов.
Депонирование временного внеклеточного раневого матрикса облегчает адгезию, миграцию и пролиферацию клеток. Помимо этого, сложные эпидермально-мезенхимальные взаимодействия на краю раны стимулируют пролиферацию и миграцию кератиноцитов для восстановления эпидермального барьера.
Образование грануляционной ткани продолжается до тех пор, пока раневое пространство не будет заполнено, и покрывающий эпидермис не будет восстановлен. После того, как образование эпидермального барьера завершено, начинается завершающий этап реакции заживления, который характеризуется созреванием ткани. Во время фазы созревания ткани грануляционная ткань трансформируется в рубцовую ткань.
Во время восстановления кожи врожденный иммунный ответ резидентных клеток, а также привлеченных воспалительных клеток, вовлечен в борьбу с проникающими микробами, способствует очищению раны, но также может поддерживать процесс восстановления, путем высвобождая ряда факторов роста.
Однако из-за высвобождения провоспалительных и цитотоксических медиаторов неконтролируемая активность макрофагов также может нанести ущерб восстановлению тканей.
Несбалансированное воспаление, характеризующееся увеличением количества макрофагов, является признаком ослабленной реакции восстановления при заболеваниях человека, что приводит к образованию незаживающих хронических ран. Дополнительными факторами, которые вовлечены в образование незаживающих хронических ран, являются, например, диабет, заболевания вен или артерий, инфекция и нарушения обмена веществ в пожилом возрасте.
Существуют различные способы лечения хронических ран, включая применение антибиотиков для лечения инфекций, очистку ран, вакуумные повязки и оксигенацию.
Другие способы включают, например, применение факторов роста.
Например, бекаплермин представляет собой рекомбинантный фактор роста тромбоцитов человека ВВ. Бекаплермин продается под торговым названием регранекс (Regranex) и показан для лечения диабетических невропатических язв нижних конечностей, которые распространяются в подкожную ткань или за ее пределы и имеют надлежащее кровоснабжение.
Бекаплермин также показан в качестве вспомогательного средства, но не замещающего препарата, для ухода за язвами стопы, включая первичную хирургическую обработку раны, уменьшение пролежней и борьбу с инфекцией.
Однако в ретроспективном групповом пострегистрационном исследовании у пациентов, которых лечили с использованием трех или более тюбиков геля регранекс, наблюдали повышенную смертность на фоне развития рака.
Другим используемым фактором роста является рекомбинантный фактор роста эпидермиса человека, который продается под торговым названием гель Реген-D (REGEN-D) и применяется для лечения хронических диабетических язв стопы.
Трафермин также представляет собой рекомбинантный фактор роста фибробластов человека 2, который продается под торговым названием «Fiblast Spray». Трафермин используется для лечения пролежневых язв и других язв кожи, включая ожоговые язвы и черные язвы.
После ежедневного применения трафермина или плацебо в течение шести недель пациентами, имеющими хроническую невропатическую диабетическую язву стопы, размер язвы оценивали посредством еженедельного клинического обследования и компьютеризированных визуализирующих методов исследований. Еженедельное уменьшение периметра и площади язв было одинаковым в обеих группах, также как и скорость линейного распространения, начиная с момента включения в исследование и до шестой недели после начала лечения. Процент заживленной области в конце исследования также достоверно не различался. Согласно Richards et al. (1995) местное применение трафермина не имело преимуществ по сравнению с плацебо для лечения хронической невропатической диабетической язвы стопы.
Два заменителя дермы, содержащих эмбриональные клетки человека, которые выделяют различные факторы роста после внесения в пораженную раневую область, также доступны коммерчески.
Заменитель дермы дермаграфт состоит из фибробластов, внеклеточного матрикса и биоабсорбируемого каркаса. Дермаграф производят из фибробластов человека, полученных из донорской крайней плоти новорожденного.
Во время процесса производства, фибробласты человека высевают на биоабсорбируемый полиглактиновый каркас.
Коммерчески доступный заменитель дермы аплиграф содержит два типа клеток, полученных из крайней плоти новорожденного. Живые кератиноциты и фибробласты человека встраивают в раневой коллагеновый матрикс типа 1.
Недостатком вышеупомянутых заменителей дермы является сравнительно высокая цена, обусловленная производственным процессом. Например, материнскую кровь проверяют для выявления присутствия вирусов человека, таких как вирус иммунодефицита 1 и 2, вирус гепатита В, вирус гепатита С, сифилис, Т-лимфотропный вирус человека типа 1 и 2, а также вирус Эпштейна-Барр.
Еще один коммерчески доступный препарат продается под торговой маркой прокурен (Procuren). Прокурен представляет собой состав для заживления ран, полученный из тромбоцитов, предназначенный для лечения незаживающих ран. Прокурен представляет собой аутологичный продукт, полученный из тромбоцитов, который готовят из образца крови пациента.
Однако отсутствует достаточное количество доказательств эффективности продуктов, полученных из аутологичных тромбоцитов, включая аутологичный фактор роста тромбоцитов, для лечения хронических незаживающих ран или лечения других состояний, таких как острые хирургические раны.
Помимо этого, количество факторов роста, обеспечиваемых вышеупомянутыми заменителями дермы, а также продуктами, полученными из аутологичных тромбоцитов, значительно варьирует в зависимости от качества исходного материала.
Задача настоящего изобретения заключается в том, чтобы обеспечить альтернативный способ лечения воспалительного нарушения функции кожи, в частности хронического воспалительного нарушения функции кожи, который обеспечивает легкое применение эффективных факторов при хроническом, предпочтительно воспалительном, нарушении функции кожи.
Помимо этого для лечения воспалительного нарушения функции кожи необходимо обеспечить контролируемое количество эффективных факторов, способствующих заживлению.
Задача настоящего изобретения решается путем обеспечения рекомбинантных пробиотических бактерий в соответствии с п. 1, содержащих (а) последовательность(и) нуклеиновой кислоты, кодирующую первый гетерологичный фактор, (а) последовательность(и) нуклеиновой кислоты, кодирующую второй гетерологичный фактор, и предпочтительно (а) последовательность(и) нуклеиновой кислоты, кодирующую третий гетерологичный фактор, при условии, что указанный первый фактор, указанный второй фактор и указанный третий фактор функционально различаются,
при этом указанный первый фактор представляет собой фактор роста, при этом указанный второй фактор выбран из группы, состоящей из М2-поляризующих факторов, и при этом предпочтительно указанный третий фактор выбран из группы, состоящей из М2-поляризующих факторов и факторов роста.
Предпочтительно указанные рекомбинантные пробиотические бактерии по п. 1 содержат по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую первый гетерологичный фактор, по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую второй гетерологичный фактор, и по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую третий гетерологичный фактор, при условии, что указанный первый фактор, указанный второй фактор и указанный третий фактор функционально различаются,
при этом указанный первый фактор представляет собой фактор роста, при этом указанный второй фактор выбран из группы, состоящей из М2-поляризующих факторов, и при этом указанный третий фактор выбран из группы, состоящей из М2-поляризующих факторов и факторов роста.
Предпочтительные варианты реализации рекомбинантных пробиотических бактерий раскрыты в зависимых пунктах 2-22 формулы изобретения.
Задача настоящего изобретения дополнительно решается путем обеспечения рекомбинантных пробиотических бактерий в соответствии с п. 17 для применения в лечении воспалительного нарушения функции кожи, предпочтительно хронического воспалительного нарушения функции кожи, причем указанные рекомбинантные пробиотические бактерии содержат:
по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую первый гетерологичный фактор, и по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую второй гетерологичный фактор,
при этом указанный первый фактор представляет собой фактор роста, при этом указанный второй фактор выбран из группы, состоящей из М2-поляризующих факторов.
Предпочтительно указанные рекомбинантные пробиотические бактерии по п. 17 содержат по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую первый гетерологичный фактор, по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую второй гетерологичный фактор, и по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую третий гетерологичный фактор, при условии, что указанный первый фактор, указанный второй фактор и указанный третий фактор функционально различаются,
при этом указанный первый фактор представляет собой фактор роста, при этом указанный второй фактор выбран из группы, состоящей из М2-поляризующих факторов, и при этом указанный третий фактор выбран из группы, состоящей из М2-поляризующих факторов и факторов роста.
Задача настоящего изобретения дополнительно решается путем обеспечения способа лечения воспалительного нарушения функции кожи, предпочтительно хронического воспалительного нарушения функции кожи, в соответствии с п. 23, при этом указанный способ включает этап введения рекомбинантных пробиотических бактерий по любому из пп. 1-22 индивидууму, страдающему указанным нарушением функции кожи.
Авторы настоящего изобретения неожиданно обнаружили, что рекомбинантные пробиотические бактерии, содержащие вышеуказанные последовательности нуклеиновых кислот, могут быть использованы в лечении воспалительного нарушения функции кожи, предпочтительно хронического воспалительного нарушения функции кожи.
Предпочтительные варианты реализации настоящего изобретения раскрыты в зависимых пунктах формулы изобретения.
В соответствии с настоящим изобретением термин «функционально отличающийся фактор» или «функционально отличающиеся друг от друга» означает, что соответствующие факторы предпочтительно связываются с различными рецепторами и/или активируют разные вторичные мессенджеры в клетке-мишени. Вторичными мессенджерами являются внутриклеточные сигнальные молекулы, высвобождаемые клеткой, чтобы инициировать физиологические изменения.
В соответствии с настоящим изобретением термин «функциональный аналог» фактора обозначает агент, который связывается с идентичным рецептором (рецепторами), как и соответствующий фактор, и предпочтительно активирует идентичные вторичные мессенджеры в клетке-мишени.
Например, функциональный аналог низина связывается с NisK, который действует как рецептор для зрелой молекулы низина или его функционального аналога, и предпочтительно приводит к последующему фосфорилированию NisR. Фосфорилированный NisR индуцирует транскрипцию с соответствующего промотора низина.
Предпочтительно идентичность аминокислотной последовательности «функционального аналога» указанного первого, второго и третьего гетерологичного фактора составляет по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 93%, еще более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 97%.
В соответствии с настоящим изобретением термин «гетерологичный фактор» означает фактор, предпочтительно белок, который не встречается в природе или не экспрессируется указанными пробиотическими бактериями.
«Функциональный аналог» также может быть обозначен как биологически подобный.
При упоминании «гетерологичного фактора (факторов)» в целом или при упоминании конкретного «гетерологичного фактора (факторов)», таких как, например, ФРФ-2, ИЛ-4, КСФ-1 и т.д., подразумевают, что указанный термин включает их функциональный аналог(аналоги).
Рекомбинантные пробиотические бактерии, содержащие вышеупомянутые последовательности нуклеиновых кислот, способны постоянно и/или в результате индукции вырабатывать уникальную комбинацию соответствующего первого, второго и предпочтительно третьего гетерологичных факторов путем транскрипции и трансляции соответствующих последовательностей нуклеиновых кислот.
Указанная уникальная комбинация факторов включает по меньшей мере один фактор роста и по меньшей мере один М2-поляризующий фактор.
Предпочтительно указанная уникальная комбинация факторов включает фактор роста, первый М2-поляризующий фактор и второй М2-поляризующий фактор, отличный от указанного первого М2-поляризующего фактора. В другом варианте, указанная уникальная комбинация факторов содержит первый фактор роста, М2-поляризующий фактор и второй фактор роста, отличный от указанного первого фактора роста.
Рекомбинантные пробиотические бактерии предпочтительно обеспечивают доставку нескольких из по меньшей мере двух, предпочтительно по меньшей мере трех гетерологичных факторов по п. 1 в пораженную ткань, модулируя тем самым местную иммунную систему и обеспечивая заживление.
Предпочтительно рекомбинантные пробиотические бактерии высвобождают соответствующий первый гетерологичный фактор и второй гетерологичный фактор, а также предпочтительно третий гетерологичный фактор, после применения при указанном воспалительном нарушении функции кожи, предпочтительно указанном хроническом воспалительном нарушении функции кожи.
Помимо этого рекомбинантные пробиотические бактерии, используемые в соответствии с настоящим изобретением, предпочтительно обеспечивают постоянное высвобождение соответствующего первого гетерологичного фактора и второго гетерологичного фактора, а также предпочтительно третьего гетерологичного фактора, после внесения в очаг воспалительного нарушения функции кожи, предпочтительно хронического воспалительного нарушения функции кожи.
Следовательно, в настоящем изобретении предложен значительно улучшенный, более безопасный и экономически эффективный способ лечения субъектов, страдающих указанным воспалительным нарушением функции кожи, предпочтительно указанным хроническим воспалительным нарушением функции кожи.
Предпочтительно соответствующий первый, второй и третий гетерологичные факторы, после высвобождения из бактерий, проявляют биологическую активность, которая поддерживает заживление указанного воспалительного нарушения функции кожи, предпочтительно хронического воспалительного нарушения функции кожи.
Первый гетерологичный фактор представляет собой фактор роста.
Предпочтительно указанный фактор роста выбран из группы, состоящей из факторов роста фибробластов (ФРФ), факторов роста эндотелия сосудов (ФРЭС), эпидермальных факторов роста (ЭФР), инсулиноподобных факторов роста (ИФР), факторов роста тромбоцитов (ФРТ), трансформирующего фактора роста бета (ТФР-бета), фактора роста нервов (ФРН), активинов, их функциональных аналогов, их биологических аналогов и их смесей.
Следует понимать, что функциональные аналоги вышеупомянутых или нижеупомянутых факторов или их биологические аналоги также могут быть использованы в пределах объема настоящего изобретения, как заявлено в формуле изобретения.
Факторы роста фибробластов - это семейство факторов роста, которые участвуют в ангиогенезе, заживлении ран и различных эндокринных путях передачи сигналов.
У человека было выявлено 22 члена семейства ФРФ, ФРФ-1 - ФРФ-14 и ФРФ-16 - ФРФ-23, которые можно применять в настоящем изобретении.
ФРФ-1 - ФРФ-10 связываются с рецепторами факторов роста фибробластов (FGFR).
Фактор роста фибробластов 1 также известен как кислотный фактор роста фибробластов. Фактор роста фибробластов 2 также известен как основный фактор роста фибробластов. Помимо этого, фактор роста фибробластов 7 также известен как фактор роста кератиноцитов (KGF), и фактор роста фибробластов 10 также известен фактор роста кератиноцитов 2 (KGF-2).
В предпочтительном варианте реализации настоящего изобретения факторы роста фибробластов выбраны из группы, состоящей из ФРФ-1, ФРФ-2, ФРФ-3, ФРФ-4, ФРФ-5, ФРФ-6, ФРФ-7, ФРФ-8, ФРФ-9, ФРФ-10 и их смесей, более предпочтительно ФРФ-1, ФРФ-2, ФРФ-7, ФРФ-10 и их смесей, более предпочтительно ФРФ-2, ФРФ-7, их функциональных аналогов, их биологических аналогов и их смесей, еще более предпочтительно ФРФ-2.
Например, ФРФ-1 и ФРФ-2 могут стимулировать ангиогенез и являются митогенными для нескольких типов клеток, присутствующих в очаге воспалительного нарушения функции кожи, включая фибробласты и кератиноциты. Помимо этого, ФРФ-7 может стимулировать повторную эпителизацию раны паракринным способом.
Фактор роста фибробластов 2 (ФРФ-2), предпочтительно фактор роста фибробластов человека 2 (чФРФ-2), вовлечен в различные биологические процессы, включая заживление ран и рост опухоли.
мРНК этого гена содержит множественные сайты полиаденилирования и подвергается альтернативной трансляции с кодонов, отличных от AUG, и AUG-старт кодонов, что приводит к образованию пяти различных изоформ с различными свойствами. Изоформы, транслированные с кодонов, отличных от AUG, локализованы в ядре и отвечают за интракринное действие, тогда как AUG-инициированная форма в основном является цитозольной и отвечает за паракринное и аутокринное действие ФРФ-2.
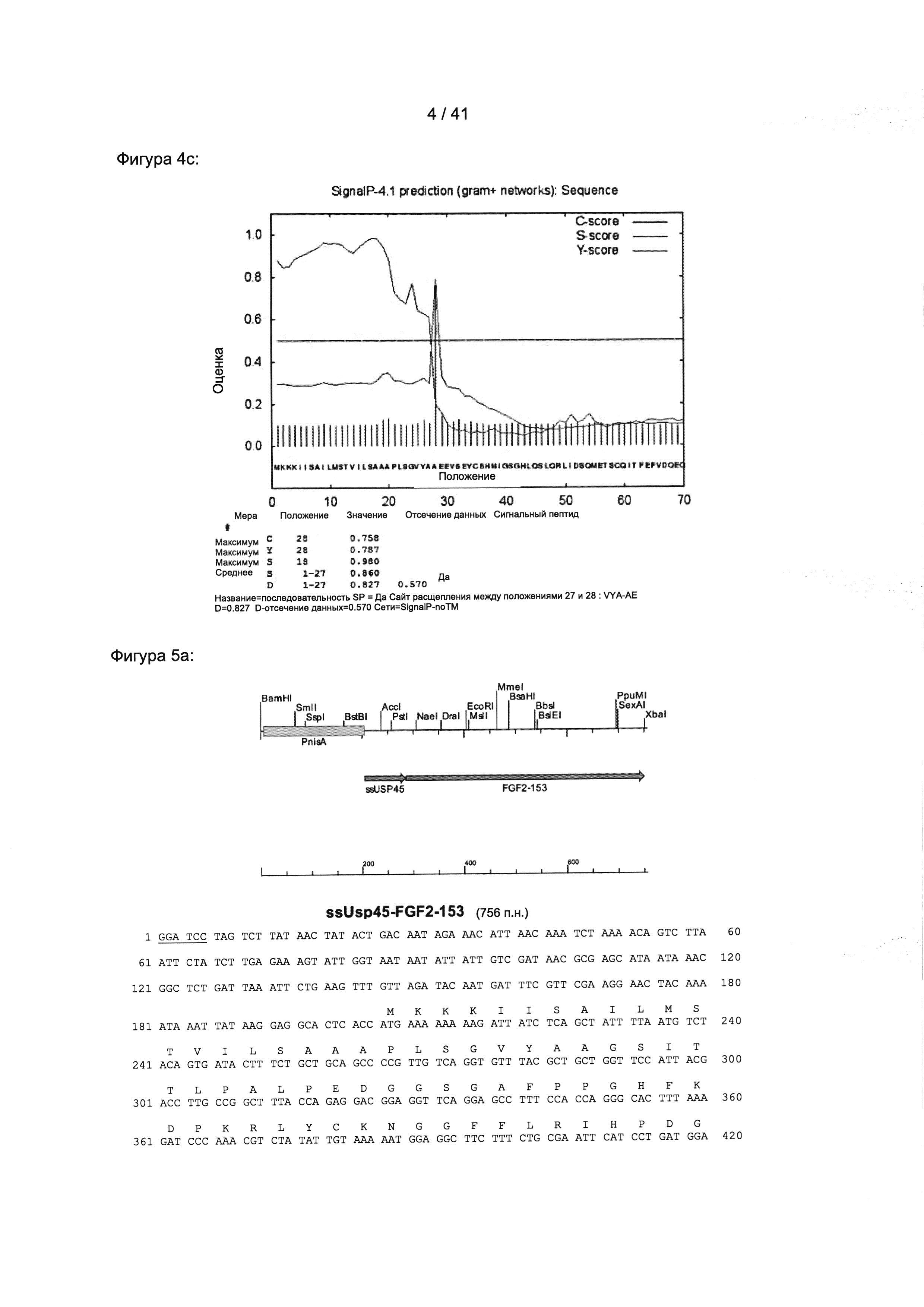
Нуклеиновая последовательность мРНК фактора роста фибробластов человека 2 (чФРФ-2) доступна под номером доступа NCBI NM_002006.4. Соответствующая аминокислотная последовательность AUG-изомера доступна под номером доступа NCBI NP_001997.5, а также под номером доступа UniProt Р09038, версия 182, и также представлена на Фигуре 22а.
Препробелок включает пробелок, который содержит аминокислоты 1-142 препробелка, и зрелый пептид фактора роста фибробластов человека 2, который содержит аминокислоты 143-288 препробелка.
Согласно предпочтительному варианту реализации настоящего изобретения фактор роста фибробластов 2 содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 26-30, еще более предпочтительно аминокислотную последовательность SEQ ID NO: 28. Аминокислотная последовательность SEQ ID NO: 28 представлена на Фигуре 22b.
Инсулиноподобные факторы роста (ИФР) представляют собой белки с высокой степенью сходства с инсулином. Инсулиноподобные факторы роста включают два белка ИФР-1 и ИФР-2, которые могут быть использованы в настоящем изобретении.
Семейство эпидермальных факторов роста (ЭФР) представляет собой белки с очень сходными структурными и функциональными характеристиками и включает такие белки как эпидермальный фактор роста (ЭФР), связывающий гепарин ЭФР-подобный фактор роста (ГС-ЭФР), трансформирующий фактор роста альфа (ТФР-α), амфирегулин (AR), эпирегулин (EPR), эпиген (EPGN), бетацеллюллин (ВТС), нейрегулин-1 (NRG1), нейрегулин-2 (NRG2), нейрегулин-3 (NRG3) и нейрегулин-4 (NRG4), предпочтительно эпидермальный фактор роста (ЭФР), связывающий гепарин ЭФР-подобный фактор роста (ГС-ЭФР), трансформирующий фактор роста-α (ТФР-α), амфирегулин (AR), эпирегулин (EPR), эпиген (EPGN) и бетацеллюлин (ВТС), еще более предпочтительно эпидермальный фактор роста (ЭФР), связывающий гепарин ЭФР-подобный фактор роста (ГС-ЭФР) и трансформирующий фактор роста-α (ТФР-α), которые можно использовать в настоящем изобретении.
Эпидермальный фактор роста (ЭФР), предпочтительно эпидермальный фактор роста человека (чЭФР), стимулирует рост различных эпидермальных и эпителиальных тканей в условиях in vivo и в условиях in vitro и некоторых фибробластов в культуре клеток. Помимо этого, чЭФР оказывает значительное влияние на дифференциацию конкретных клеток в условиях in vivo и является мощным митогенным фактором для множества культивируемых клеток эктодермального и мезодермального происхождения.
Эпидермальный фактор роста человека существует по меньшей мере в трех изоформах, полученных путем альтернативного сплайсинга.
Аминокислотная последовательность препробелка изоформы 1 эпидермального фактора роста человека доступна под номером доступа NCBI NP_001954.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001963.2.
Препробелок изоформы 1 содержит сигнальный пептид, который содержит аминокислоты 1-22 препробелка, пропептид, который содержит аминокислоты 23-1207 препробелка, и зрелый пептид эпидермального фактора роста человека, который содержит аминокислоты 971-1023 препробелка.
Аминокислотная последовательность препробелка изоформы 2 эпидермального фактора роста человека доступна под номером доступа NCBI NP_001171601.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001178130.1. Аминокислотная последовательность препробелка изоформы 3 эпидермального фактора роста человека доступна под номером доступа NCBI NP_001171602.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001178131.1. Аминокислотные последовательности изоформ 1 и 3 эпидермального фактора роста человека также доступны под номером доступа UniProt Р01133, версия 180, и также представлены на Фигуре 25а-25с. Аминокислотная последовательность зрелого эпидермального фактора роста человека представлена на Фигуре 25d.
Связывающий гепарин ЭФР-подобный фактор роста (ГС-ЭФР), предпочтительно связывающий гепарин ЭФР-подобный фактор роста человека (чГС-ЭФР) является важным фактором роста при эпителизации, которая необходима для заживления кожной раны. чГС-ЭФР оказывает митогенное действие на кератиноциты и фибробласты, а также влияет на их миграцию. чГС-ЭФР также способствует восстановлению кожи и ангиогенезу, что необходимо для заживления ран. чГС-ЭФР является основным компонентом раневых жидкостей. чГС-ЭФР выделяется макрофагами, моноцитами и кератиноцитами. Помимо этого, связывание чГС-ЭФР с протеогликанами гепарансульфата на клеточной поверхности усиливает его митогенные способности, повышает скорость заживления ран кожи, уменьшает время заживления кожи после трансплантации кожи человека и способствует быстрому заживлению язв, ожогов и эпидермальных расколотых ран.
Аминокислотная последовательность препробелка связывающего гепарин ЭФР-подобного фактора роста человека доступна под номером доступа NCBI NP_001936.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001945.2.
Предшественник связывающего гепарин ЭФР-подобного фактора роста человека содержит сигнальный пептид, который содержит аминокислоты 1-19 предшественника, пробелок связывающего гепарин ЭФР-подобного фактора роста, который содержит аминокислоты 20-208 предшественника, и зрелый пептид эпидермального фактора роста человека, который содержит аминокислоты 63-148 предшественника.
Аминокислотная последовательность связывающего гепарин ЭФР-подобного фактора роста человека также доступна под номером доступа UniProt Q99075, версия 151, и также представлена на Фигуре 26а. Аминокислотная последовательность зрелого связывающего гепарин ЭФР-подобного фактора роста человека представлена на Фигуре 26b.
Трансформирующий фактор роста-α (ТФР-α), предпочтительно трансформирующий фактор роста-α человека (чТФР-α), может вырабатываться макрофагами, клетками головного мозга и кератиноцитами. чТФР-α индуцирует развитие эпителия. чТФР-α и чЭФР связываются с одним и тем же рецептором, рецептором эпидермального фактора роста (EGFR, ErbB-1, HER1 у человека). Связывание ТФР-α с EGFR может инициировать множество событий пролиферации клеток, включая заживление ран.
Трансформирующий фактор роста-α человека существует в виде по меньшей мере пяти изоформ, полученных путем альтернативного сплайсинга.
Аминокислотная последовательность препробелка изоформы 1 трансформирующего фактора роста альфа человека доступна под номером доступа NCBI NP_003227.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_003236.2.
Предшественник изоформы 1 трансформирующего фактора роста альфа человека содержит сигнальный пептид, который содержит аминокислоты 1-23 предшественника, пробелок изоформы 1 трансформирующего фактора роста альфа, который содержит аминокислоты 24-160 предшественника, и зрелый пептид трансформирующего фактора роста альфа, который содержит аминокислоты 40-89 предшественника.
Аминокислотная последовательность препробелка изоформы 2 трансформирующего фактора роста альфа человека доступна под номером доступа NCBI NP_001093161.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001099691.1.
Аминокислотная последовательность препробелка изоформы 3 трансформирующего фактора роста альфа человека доступна под номером доступа NCBI NP_001295087.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001308158.1.
Аминокислотная последовательность препробелка изоформы 4 трансформирующего фактора роста альфа человека доступна под номером доступа NCBI NP_001295088.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001308159.1.
Аминокислотная последовательность препробелка изоформы 5 трансформирующего фактора роста альфа человека доступна под номером доступа NCBI AAF05090.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI AF 149097.1.
Аминокислотные последовательности предшественников изоформ 1 и 5 трансформирующего фактора роста альфа человека также доступны под номерами доступа UniProt Р01135, версия 168, и представлены на Фигурах 27а-27е. Аминокислотная последовательность зрелого трансформирующего фактора роста альфа человека представлена на Фигуре 27f.
Амфирегулин (AREG), предпочтительно амфирегулин человека (hAREG), является другим лигандом рецептора ЭФР. Амфирегулин человека является аутокринным фактором роста, а также митогеном для широкого круга клеток-мишеней, включая астроциты, Шванновские клетки и фибробласты. Амфирегулин человека способствует пролиферации эпителиальных клеток.
Аминокислотная последовательность препробелка амфирегулина человека доступна под номером доступа NCBI NP_001648.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001657.3.
Предшественник препробелка амфирегулина человека содержит сигнальный пептид, который содержит аминокислоты 1-19 препробелка, пропептид, который содержит аминокислоты 20-100 препробелка, и зрелый пептид трансформирующего фактора роста альфа, который содержит аминокислоты 101-187 препробелка.
Аминокислотная последовательность препробелка амфирегулина человека также доступна под номером доступа UniProt P15514, версия 147, и также представлена на Фигуре 28а. Аминокислотная последовательность зрелого амфирегулина человека представлена на Фигуре 28b.
Эпирегулин (EPR), предпочтительно эпирегулин человека (hEPR), является лигандом рецептора ЭФР, который может стимулировать пролиферацию клеток и/или ангиогенез.
Аминокислотная последовательность препробелка эпирегулина человека доступна под номером доступа NCBI NP_001423.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001432.1.
Препробелок эпирегулина человека содержит сигнальный пептид, который содержит аминокислоты 1-29 препробелка, проэпирегулин, который содержит аминокислоты 30-169 препробелка, и зрелый эпирегулин, который содержит аминокислоты 60-108 препробелка.
Аминокислотная последовательность препробелка эпирегулина человека также доступна под номером доступа UniProt O14944, версия 146, и также представлена на Фигуре 29а. Аминокислотная последовательность зрелого эпирегулина человека представлена на Фигуре 29b.
Эпиген (EPGN), предпочтительно эпиген человека (hEPGN), способствует размножению эпителиальных клеток. Эпиген человека существует в виде по меньшей мере семи изоформ, полученных путем альтернативного сплайсинга.
Аминокислотная последовательность предшественника изоформы 1 эпигена человека доступна под номером доступа NCBI NP_001257918.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001270989.1.
Предшественник изоформы 1 эпигена человека содержит сигнальный пептид, который содержит аминокислоты 1-22 предшественника, и зрелый эпиген, который содержит аминокислоты 23-154 предшественника.
Аминокислотная последовательность предшественников изоформ 1-7 эпигена человека также доступна под номер доступа UniProt Q6UW88, версия 101, и также представлена на Фигуре 30a-30g. Аминокислотная последовательность зрелого эпигена человека представлена на Фигуре 30h.
Бетацеллюлин (ВТС), предпочтительно бетацеллюлин человека (hBTC), является фактором роста, который также связывается с рецептором эпидермального фактора роста и который синтезируется многими взрослыми тканями и культивируемыми клетками, включая клетки гладких мышц и эпителиальные клетки. Аминокислотная последовательность предшественника пробетацеллюлина человека доступна под номером доступа NCBI NP_001720.1. Соответствующая нуклеиновая последовательность мРНК доступна под номером доступа NCBI NM_001729.1.
Предшественник пробетацеллюлина человека содержит сигнальный пептид, который содержит аминокислоты 1-31 предшественника, пробетацеллюлин, который содержит аминокислоты 32-178 предшественника, и зрелый бетацеллюлин, который содержит аминокислоты 32-111 предшественника.
Аминокислотная последовательность предшественника пробетацеллюлина человека также доступна под номером доступа UniProt Р35070, версия 139, и также представлена на Фигуре 31а. Аминокислотная последовательность зрелого бетацеллюлина человека представлена на Фигуре 31b.
Инсулиноподобный фактор роста 1 (ИФР-1) также называется соматомедин С. Нуклеиновая последовательность мРНК ИФР-1 человека доступна под номером доступа NCBI NM_000618.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000609.1, а также под номером доступа UniProt Р05019, версия 178.
Препробелок содержит сигнальный пептид, который содержит аминокислоты 1-21 препробелка, и пептид инсулиноподобного фактора роста 1 человека, который содержит аминокислоты 49-118 препробелка.
Нуклеиновая последовательность мРНК инсулиноподобного фактора роста человека 2 (чИФР-2) доступна под номером доступа NCBI NM_000612.4. Соответствующая аминокислотная последовательность препробелка инсулиноподобного фактора роста человека 2 доступна под номером доступа NCBI NP_000603.1, а также под номером доступа UniProt Р01344, версия 192.
Препробелок содержит сигнальный пептид, который содержит аминокислоты 1-24 препробелка, и зрелую цепь инсулиноподобного фактора роста 2, которая содержит аминокислоты 25-91 препробелка.
Семейство факторов роста эндотелия сосудов (ФРЭС) представляет собой группу факторов роста, которая включает ФРЭС-А, ФРЭС-В, ФРЭС-С, ФРЭС-D и плацентарный фактор роста (PGF), которые можно использовать в настоящем изобретении.
Согласно предпочтительному варианту реализации настоящего изобретения фактор роста эндотелия сосудов представляет собой фактор роста эндотелия сосудов А (ФРЭС-А).
ФРЭС-А может индуцировать ангиогенез, васкулогенез и размножение эндотелиальных клеток.
Нуклеиновая последовательность мРНК фактора роста эндотелия сосудов человека А (чФРЭС-А) доступна под номером доступа NCBI NM_001025366.1. Соответствующая аминокислотная последовательность фактора роста эндотелия сосудов человека А доступна под номером доступа NCBI NP_001020537.2, а также под номером доступа UniProt Р15692, версия 197.
Белок-предшественник фактора роста эндотелия сосудов человека А содержит сигнальный пептид, который содержит аминокислоты 1-26 белка-предшественника, а также зрелый фактор роста эндотелия сосудов человека А, который содержит аминокислоты 27-232 белка-предшественника.
Фактор роста тромбоцитов (ФРТ) регулирует размножение и деление клеток. Фактор роста тромбоцитов человека (чФРТ) содержит четыре субъединицы, ФРТ-А, ФРТ-В, ФРТ-С и ФРТ-D, образующие гомо- или гетеродимеры соответствующих субъединиц, которые могут быть использованы в настоящем изобретении.
Предпочтительно фактор роста тромбоцитов представляет собой ФРТ-АА, ФРТ-ВВ, ФРТ-АВ, ФРТ-СС, ФРТ-DD или их смесь.
Более предпочтительно фактор роста тромбоцитов представляет собой димерный белок, состоящий из двух субъединиц ФРТ-А, димерный гликопротеин, состоящий из двух субъединиц ФРТ-В, димерный гликопротеин, состоящий из субъединицы ФРТ-А и субъединицы ФРТ-В или их смесь.
Нуклеиновая последовательность мРНК субъединицы А фактора роста тромбоцитов человека (чФРТ-А) доступна под номером доступа NCBI NM_002607.4. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_002598.4, а также под номером доступа UniProt Р04085, версия 159.
Соответствующий препробелок субъединицы А ФРТ человека кодирует сигнальный пептид, который содержит аминокислоты 1-20 препробелка, и зрелую субъединицу А фактора роста тромбоцитов, которая содержит аминокислоты 87-211 препробелка.
Нуклеиновая последовательность мРНК субъединицы В фактора роста тромбоцитов человека (чФРТ) доступна под номером доступа NCBI NM_002608.1. Соответствующая аминокислотная последовательность препробелка субъединицы В фактора роста тромбоцитов человека доступна под номером доступа NCBI NP_002599.1, а также под номером доступа UniProt Р01127, версия 181.
Препробелок субъединицы В ФРТ человека кодирует сигнальный пептид, который содержит аминокислоты 1-20 препробелка, и зрелую форму субъединица В фактора роста тромбоцитов человека, которая содержит аминокислоты 82-190 препробелка.
Фактор роста гепатоцитов (ФРГ) представляет собой фактор роста, который секретируется мезенхимными клетками и действует главным образом на эпителиальные клетки и эндотелиальные клетки, а также на гемопоэтические клетки-предшественники, и может быть использован в настоящем изобретении.
ФРГ секретируется в виде единого препробелка и расщепляется сериновой протеиназой на альфа-цепь массой 69 кДа и бета-цепь массой 34 кДа. Аминокислотная последовательность препробелка, а также соответствующей альфа-цепи и бета-цепи, представлена на Фигурах 23а-23с.
Нуклеиновая последовательность мРНК фактора роста гепатоцитов человека (чФРГ) доступна под номером доступа NCBI NM_000601.3. Соответствующая аминокислотная последовательность препробелка фактора роста гепатоцитов человека доступна под номером доступа NCBI NP_000592.3, а также под номером доступа UniProt Р14210, версия 186.
Препробелок содержит сигнальный пептид, который содержит аминокислоты 1-31 препробелка, альфа-цепь фактора роста гепатоцитов человека, которая содержит аминокислоты 32-494 препробелка, и бета-цепь фактора роста гепатоцитов человека, которая содержит аминокислоты 495-728 препробелка.
Трансформирующий фактор роста бета (ТФР-бета), предпочтительно трансформирующий фактор роста бета человека (чТФР-бета), представляет собой цитокин, который секретируется многими типами клеток, включая макрофаги.
ТФР-β существует в виде по меньшей мере трех изоформ, ТФР-β1, ТФР-β2 и ТФР-β3, которые могут быть использованы в настоящем изобретении. Аминокислотные последовательности соответствующих белков-предшественников и зрелых белков представлены на Фигурах 21a-21g.
Трансформирующий фактор роста человека β1 представляет собой секретируемый белок, который расщепляется на ассоциированный с латентностью пептид (LAP) и зрелый пептид ТФР-β1. Зрелый пептид может образовывать гомодимер или гетеродимер ТФР-β1 с другими членами семейства ТФР-β.
Нуклеиновая последовательность мРНК предшественника трансформирующего фактора роста β1 человека доступна под номером доступа NCBI NM_000660.4. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000651.3 или номером доступа UniProt Р01137, версия 199.
Аминокислотная последовательность предшественника ТФР-β1 человека содержит сигнальный пептид, который содержит аминокислоты 1-29 белка-предшественника, ассоциированный с латентностью пептид, который содержит аминокислоты 30-278 белка-предшественника, и зрелый трансформирующий фактор роста β1, который содержит аминокислоты 279-390 белка-предшественника.
Трансформирующий фактор рост β2 (ТФР-β2), предпочтительно трансформирующий фактор роста человека β2 (чТФР-β2), представляет собой многофункциональный цитокин, который регулирует пролиферацию, дифференцировку, адгезию и миграцию многих типов клеток.
Были выявлены варианты транскрипта гена трансформирующего фактора роста β2 человека, полученные в результате альтернативного сплайсинга, которые кодируют две различные изоформы.
Нуклеиновая последовательность мРНК предшественника изоформы 1 трансформирующего фактора роста β2 человека доступна под номером доступа NCBI NM_001135599.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001129071.1.
Предшественник изоформы 1 трансформирующего фактора роста β2 человека содержит сигнальный пептид, который содержит аминокислоты 1-20 белка-предшественника, ассоциированный с латентностью пептид, который содержит аминокислоты 21-302 белка-предшественника, и зрелый трансформирующий фактор роста β2, который содержит аминокислоты 303-414 белка-предшественника.
Нуклеиновая последовательность мРНК предшественника изоформы 2 трансформирующего фактора роста β2 человека доступна под номером доступа NCBI NM_003238.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_003229.1. Белок-предшественник содержит сигнальный пептид, который содержит аминокислоты 1-20 белка-предшественника, ассоциированный с латентностью пептид, который содержит аминокислоты 21-302 белка-предшественника, и зрелый пептид ТФР-β2, который содержит аминокислоты 303-414 белка-предшественника.
Аминокислотная последовательность трансформирующего фактора роста β2 дополнительно доступна под номером доступа UniProt Р61812, версия 128.
Трансформирующий фактор роста β3 (ТФР-β3), предпочтительно трансформирующий фактор роста β3 человека (чТФР-β3), представляет собой секретируемый цитокин, который участвует в эмбриогенезе и дифференцировке клеток.
Нуклеиновая последовательность мРНК белка-предшественника трансформирующего фактора роста β3 человека доступна под номером доступа NCBI NM_003239.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_003230.1, а также под номером доступа UniProt P10600, версия 170.
Белок-предшественник содержит сигнальный пептид, который содержит аминокислоты 1-23 белка-предшественника, ассоциированный с латентностью пептид, который содержит аминокислоты 24-30 белка-предшественника, и зрелый пептид трансформирующего фактора роста β3, который содержит аминокислоты 301-412 белка-предшественника.
Предпочтительно трансформирующий фактор роста β содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 19-25.
Активины представляют собой связанные дисульфидными связями димерные белки, первоначально очищенные из гонадных жидкостей как белки, которые стимулировали высвобождение гипофизарного фолликулостимулирующего гормона (ФСГ). Активины обладают широким спектром биологической активности, включая индукцию мезодермы, дифференцировку нейрональных клеток, ремоделирование костной ткани, кроветворение и участие в функционировании репродуктивной системы.
Активины представляют собой гомодимеры или гетеродимеры различных изоформ бета-субъединицы, в то время как ингибины представляют собой гетеродимеры уникальной альфа-субъединицы и одной из различных бета-субъединиц.
Известны четыре бета-субъединицы, бета А, бета В, бета С и бета Е.
Второй гетерологичный фактор выбирают из группы, состоящей из M2-поляризующих факторов.
Предпочтительно М2-поляризующие факторы действуют на неполяризованные макрофаги, M1-поляризованные макрофаги, а также недифференцированные моноциты и другие клетки-предшественники макрофагов.
Также предпочтительно указанные М2-поляризующие факторы индуцируют М2-поляризацию неполяризованных макрофагов, M1-поляризованных макрофагов, а также недифференцированных моноцитов и других клеток-предшественников макрофагов.
Специалисту в данной области техники известно, что макрофаги могут претерпевать специфичную дифференцировку в зависимости от локального микроокружения тканей. По аналогии с поляризацией Т-хелперов типа 1 (TH1) и Т-хелперов типа 2 (TH2) были определены два различных состояния поляризации макрофагов: классически активированный (M1-поляризованный) фенотип макрофагов и активированный иным способом (М2-поляризованный) фенотип макрофагов.
Фенотип М2-поляризованных макрофагов может быть дополнительно разделен на подгруппы: М2а-поляризованный, M2b-поляризованный и М2с-поляризованный фенотип на основании профилей экспрессии генов.
M1-поляризованные и М2-поляризованные макрофаги имеют различные профили экспрессии хемокинов и рецепторов хемокинов.
M1-поляризованные макрофаги предпочтительно секретируют привлекающий TH1-клетки хемокиновый (СХС-мотив) лиганд 9 (CXCL9) и хемокиновый (СХС-мотив) лиганд 10 (CXCL10). М2-поляризованные макрофаги предпочтительно секретируют хемокиновый (СС-мотив) лиганд 17 (CCL17), хемокиновый (СС-мотив) лиганд 22 (CCL22) и хемокиновый (СС-мотив) лиганд 24 (CCL24).
М2-поляризующее действие гетерологичного фактора может быть определено, например, путем приведения неполяризованных макрофагов, M1-поляризованных макрофагов или клеток-предшественников макрофагов, предпочтительно моноцитов, в контакт с по меньшей мере одним М2-поляризующим фактором, с последующим определением экспрессии и/или секреции маркеров М2-поляризации.
Например, линия неполяризованных макрофагов мыши, линия M1-поляризованных макрофагов мыши или линия клеток-предшественников макрофагов мыши, предпочтительно линия моноцитов мыши, может быть приведена в контакт с по меньшей мере одним М2-поляризующим фактором с получением линии М2-поляризованных макрофагов мыши. М2-поляризацию линий макрофагов мыши можно детектировать, например, путем определения экспрессии следующих факторов: аргиназы 1 (ARG1), интерлейкина 10 (ИЛ-10), рецептора маннозы С типа 1 (MRC1) и Ym1, также называемого фактор хемотаксиса эозинофилов, полученный из Т-лимфоцитов (ECF-L) или хитиназаподобного белка 3 (Chil3). M1-поляризацию линий макрофагов мыши можно детектировать, например, путем определения экспрессии и/или высвобождения следующих факторов: фактора некроза опухолей альфа (ФНО-альфа, ФНО-α), интерлейкина 6 (ИЛ-6), хемокинового (СС-мотив) лиганда 2 (CCL2) и хемокинового (СС-мотив) лиганда 4 (CCL4).
Предпочтительно М2-поляризованные макрофаги человека получают из моноцитов человека, которые инкубируют в присутствии по меньшей мере одного М2-поляризующего фактора. М2-поляризацию макрофагов, полученных из моноцитов человека, можно детектировать, например, путем определения экспрессии и/или высвобождения следующих факторов: антагониста рецептора интерлейкина 1 (IL1RA), простагландина Е2 (ПГЕ2), интерлейкина 10 (ИЛ-10) и трансформирующего фактора роста бета (ТФР-β).
Недавно было показано, что макрофаги способны к обратной поляризации от М2 к M1 в условиях in vitro, и наоборот, в ответ на изменения уровней цитокинов в их микроокружении (Davis et al.(2013)). Помимо этого, изменение поляризации является быстрым и происходит на уровне экспрессии генов, белка, метаболита и противомикробной активности.
Макрофаги также представляют собой одну из основных популяций инфильтрирующих лимфоцитов, ассоциированных с солидными опухолями. Ассоциированные с опухолью макрофаги (ТАМ) играют важную роль в противоопухолевом иммунитете и обладают функциями, которые аналогичны функциям М2-поляризованных макрофагов, такой фенотип также обозначается M2d ТАМ поляризация.
Соответствующие факторы, которые необходимы для стимуляции и/или активации соответствующей поляризации (M1, М2а, M2b, М2с и M2d ТАМ), известны специалистам в данной области техники и раскрыты, например, в Нао et al. (2012) или Duluc et al. (2007).
Предпочтительно соответствующие вторые гетерологичные факторы и необязательно третий гетерологичный фактор индуцируют М2-поляризацию после экспрессии в указанных рекомбинантных пробиотических бактериях и высвобождаются из бактерий в очаг воспалительного, предпочтительно хронического воспалительного, нарушения функции кожи.
Противовоспалительные М2-поляризованные макрофаги затем предпочтительно стимулируют ангиогенез, депонирование соединительной ткани и заживление ран, что приводит к улучшению, предпочтительно излечению, указанного воспалительного, предпочтительно хронического воспалительного, нарушения функции кожи, которое лечат.
Согласно предпочтительному варианту реализации настоящего изобретения указанный М2-поляризующий фактор выбран из группы, состоящей из М2-поляризующих цитокинов, М2-поляризующих хемокинов и их смесей. Предпочтительно указанный М2-поляризующий фактор индуцирует М2 с поляризацию.
Также предпочтительно указанный М2-поляризующий фактор выбран из группы, состоящей из интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10), интерлейкина 13 (ИЛ-13), колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), их функциональных аналогов, их биологических аналогов, и их смесей, предпочтительно состоящей из интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10), интерлейкина 13 (ИЛ-13), колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), а также их смесей, еще более предпочтительно из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4), интерлейкина 13 (ИЛ-13), их функциональных аналогов, их биологических аналогов и их смесей, еще более предпочтительно из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4), интерлейкина 13 (ИЛ-13), а также их смесей.
Интерлейкин 4 (ИЛ-4), предпочтительно интерлейкин 4 человека (чИЛ-4), представляет собой гшейотропный цитокин. Интерлейкин 4 является лигандом рецептора интерлейкина 4. Рецептор интерлейкина 4 также связывается с интерлейкином 13 (ИЛ-13) и может принимать участие во многих перекрывающихся функциях интерлейкина 4 и интерлейкина 13.
Также показано, что интерлейкин 4 (ИЛ-4) способен индуцировать пролиферацию. Помимо этого, интерлейкин 4 (ИЛ-4) индуцирует выработку коллагена.
Нуклеиновая последовательность мРНК предшественника изоформы 1 интерлейкина 4 человека доступна под номером доступа NCBI NM_000589.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000580.1 и представлена на Фигуре 18а.
Нуклеиновая последовательность мРНК предшественника изоформы 2 интерлейкина 4 человека доступна под номером доступа NCBI NM_172348.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_758858.1 и представлена на Фигуре 18b.
Аминокислотная последовательность интерлейкина 4 человека также доступна под номером доступа UniProt Р05112, версия 178.
Аминокислотные последовательности содержат сигнальный пептид, который содержит аминокислоты 1-24 предшественников изоформы 1 и изоформы 2 интерлейкина 4.
Предпочтительно интерлейкин 4 человека содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 10-14.
Интерлейкин 13 (ИЛ-13), предпочтительно интерлейкин 13 человека (чИЛ-13), представляет собой иммунорегудяторный цитокин, который вырабатывается главным образом активированными TH2 клетками.
Нуклеиновая последовательность мРНК предшественника интерлейкина 13 человека доступна под номером доступа NCBI NM_002188.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_002179.2, а также под номером доступа UniProt Р35225, версия 157, и представлена на Фигуре 20а.
Предшественник интерлейкина 13 содержит сигнальный пептид, который содержит аминокислоты 1-24 белка-предшественника интерлейкина 13, зарегистрированного под номером доступа UniProt Р35225, версия 157.
Предпочтительно интерлейкин 13 содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 17 и 18.
Интерлейкин 10 (ИЛ-10), предпочтительно интерлейкин 10 человека (чИЛ-10), представляет собой цитокин, который вырабатывается главным образом моноцитами и в меньшей степени лимфоцитами. Интерлейкин 10 оказывает плейотропное действие при иммунной регуляции и воспалении. Например, интерлейкин 10 подавляет экспрессию цитокинов TH1-лимфоцитами.
Нуклеиновая последовательность мРНК предшественника интерлейкина 10 человека доступна под номером доступа NCBI NM_000572.2. Соответствующая аминокислотная последовательность может быть найдена под номером доступа NCBI NP_000563.1, а также под номером доступа UniProt Р22301, версия 156, и представлена на Фигуре 19а.
Аминокислотная последовательность предшественника интерлейкина 10 человека включает сигнальный пептид, который содержит аминокислоты 1-18 белка-предшественника интерлейкина 10 человека.
Предпочтительно интерлейкин 10 содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 15-16.
Колониестимулирующий фактор 1 (КСФ-1), который также известен как макрофагальный колониестимулирующий фактор (М-КСФ), представляет собой цитокин, который контролирует выработку, дифференцировку и функцию макрофагов.
Вследствие альтернативного сплайсинга КСФ-1 человека существует в виде разных изоформ, которые могут быть использованы в настоящем изобретении.
Нуклеиновая последовательность мРНК изоформы 1 КСФ-1 человека, которая также называется предшественником изоформы А макрофагального колониестимулирующего фактора, доступна под номером доступа NCBI NM_000757.5. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000748.3 и представлена на Фигуре 16а.
Нуклеиновая последовательность мРНК предшественника изоформы 2 КСФ-1 человека, которая также называется предшественником изоформы В макрофагального колониестимулирующего фактора 1 человека, доступна под номером доступа NCBI NM_172210.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_757349.1 и представлена на Фигуре 16b.
Нуклеиновая последовательность мРНК предшественника изоформы 3 КСФ-1 человека, которая также называется предшественником изоформы С макрофагального колониестимулирующего фактора 1, доступна под номером доступа NCBI NM_172211.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_757350.1 и представлена на Фигуре 16с.
Соответствующие аминокислотные последовательности также доступны под номером доступа UniProt Р09603, версия 158. Изоформа 1 была выбрана в качестве канонической последовательности UniProt.
Соответствующие белковые последовательности предшественника изоформы 1-3 КСФ-1 человека содержат N-концевой сигнальный пептид, который содержит аминокислоты 1-32 соответствующих аминокислотных последовательностей.
Активная форма КСФ-1 человека может быть обнаружена во внеклеточном пространстве в виде гомодимера, соединенного дисульфидными связями. Активная форма образуется путем протеолитического расщепления связанного с мембраной предшественника, что приводит к потере N-концевого сигнального пептида.
Предпочтительно колониестимулирующий фактор 1 содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 1-6.
Интерлейкин 34 (ИЛ-34) представляет собой цитокин, который также усиливает дифференцировку и жизнеспособность моноцитов и макрофагов.
Вследствие альтернативного сплайсинга интерлейкин 34 человека существует в виде двух изоформ, которые могут быть использованы в настоящем изобретении.
Нуклеиновая последовательность мРНК предшественника изоформы 1 интерлейкина 34 человека доступна под номером доступа NCBI NM_001172772.1. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001166243.1 и представлена на Фигуре 17а.
Нуклеиновая последовательность мРНК предшественника изоформы 2 интерлейкина 34 человека доступна под номером доступа NCBI NM_001172771.1. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001166242.1 и представлена на Фигуре 17b.
Соответствующая аминокислотная последовательность также доступна под номером доступа UniProt Q6ZMJ4, версия 80.
Предшественник интерлейкина 34 человека содержит сигнальный пептид, который содержит аминокислоты 1-20 из соответствующих аминокислотных последовательностей белков-предшественников.
Предпочтительно интерлейкин 34 содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 7-9.
Согласно предпочтительному варианту реализации настоящего изобретения указанный М2-поляризующий фактор способствует дифференцировке и жизнеспособности моноцитов и макрофагов путем связывания с рецептором колониестимулирующего фактора 1.
Рецептор колониестимулирующего фактора 1 (КСФ-1R), который также известен как рецептор макрофагального колониестимулирующего фактора, представляет собой тирозиновую киназу, которая действует как рецептор клеточной поверхности и играет существенную роль в регуляции выживания, пролиферации и дифференцировки макрофагов и моноцитов.
КСФ-1R способствует, например, высвобождению провоспалительных хемокинов в ответ на связывание лиганда с КСФ-1R и тем самым играет важную роль при врожденном иммунном ответе и воспалительных процессах.
Предпочтительно М2-поляризующий фактор представляет собой по меньшей мере один лиганд рецептора колониестимулирующего фактора 1 (КСФ-1R).
Лиганды КСФ-1R известны специалисту в данной области техники и включают интерлейкин 34 (ИЛ-34) и колониестимулирующий фактор 1 (КСФ-1). Предпочтительно указанный лиганд рецептора колониестимулирующего фактора 1 выбран из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), их функциональных аналогов и их биологических аналогов.
Также предпочтительно указанный лиганд рецептора колониестимулирующего фактора 1 представляет собой лиганд рецептора колониестимулирующего фактора 1 человека, еще более предпочтительно указанный лиганд выбран из группы, состоящей из колониестимулирующего фактора 1 человека (чКСФ-1), интерлейкина 34 человека (чИЛ-34), их функциональных аналогов и их биологических аналогов.
В другом предпочтительном варианте реализации настоящего изобретения указанный лиганд рецептора колониестимулирующего фактора 1 представляет собой белок, содержащий одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 1-9.
Согласно предпочтительному варианту реализации настоящего изобретения указанный первый, второй и/или третий гетерологичные факторы экспрессируются с секреторной сигнальной последовательностью, предпочтительно N-концевым сигнальным пептидом или пропептидом. После экспрессии соответствующего фактора секреторная сигнальная последовательность, предпочтительно N-концевой сигнальный пептид или пропептид, может быть удалена путем посттрансляционной модификации. В другом варианте, указанный первый, второй и/или третий гетерологичные факторы могут быть экспрессированы в зрелой форме, предпочтительно без секреторной сигнальной последовательности, предпочтительно N-концевого сигнального пептида или пропептида.
Согласно предпочтительному варианту реализации настоящего изобретения указанные рекомбинантные пробиотические бактерии по п. 1 содержат по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую первый гетерологичный фактор, по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую второй гетерологичный фактор, и по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую третий гетерологичный фактор, при условии, что указанный первый фактор, указанный второй фактор и третий фактор функционально различаются,
при этом указанный первый фактор представляет собой фактор роста, при этом указанный второй фактор выбран из группы, состоящей из М2-поляризующих факторов, и при этом указанный третий фактор выбран из группы, состоящей из М2-поляризующих факторов и факторов роста.
Согласно предпочтительному варианту реализации настоящего изобретения указанный второй гетерологичный фактор и указанный третий гетерологичный фактор выбраны из группы, состоящей из М2-поляризующих факторов, причем указанный второй фактор и указанный третий фактор представляют собой функционально различные Деполяризующие факторы.
Иными словами, указанный второй гетерологичный фактор представляет собой первый М2-поляризующий фактор и указанный третий гетерологичный фактор представляет собой второй М2-поляризующий фактор, который функционально отличается от указанного первого М2-поляризующего фактора.
Предпочтительно указанный первый М2-поляризующий фактор представляет собой М2-поляризующий фактор, выбранный из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4) и интерлейкина 13 (ИЛ-13), и указанный второй М2-поляризующий фактор представляет собой М2-поляризующий фактор, выбранный из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10) и интерлейкина 13 (ИЛ-13), при условии, что указанный второй М2 поляризующий фактор функционально отличается от указанного первого М2 поляризующего фактора.
Также предпочтительно указанный первый M2-поляризующий фактор представляет собой лиганд рецептора колониестимулирующего фактора 1 (КСФ-1R) и указанный второй М2-поляризующий фактор представляет собой М2-поляризующий фактор, выбранный из группы, состоящей из интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10), интерлейкина 13 (ИЛ-13), их функциональных аналогов, их биологических аналогов и их смесей.
Другие предпочтительные комбинации М2-поляризующих факторов включают:
колониестимулирующий фактор 1 и интерлейкин 4,
колониестимулирующий фактор 1 и интерлейкин 13,
колониестимулирующий фактор 1 и интерлейкин 10,
интерлейкин 34 и интерлейкин 4,
интерлейкин 34 и интерлейкин 13,
интерлейкин 34 и интерлейкин 10,
интерлейкин 4 и интерлейкин 10 или
интерлейкин 13 и интерлейкин 10.
Вышеупомянутые дополнительные предпочтительные комбинации М2-поляризующих факторов комбинируют с по меньшей мере одним из указанных выше факторов роста, предпочтительно с фактором роста, выбранным из группы, состоящей из фактора роста фибробластов 1, фактора роста фибробластов 2, фактора роста фибробластов 7, фактора роста фибробластов 10, фактора роста гепатоцитов, трансформирующего фактора роста бета (ТФР-бета), эпидермального фактора роста (ЭФР), связывающего гепарин ЭФР-подобного фактора роста (ГС-ЭФР), трансформирующего фактора роста альфа (ТФР-α) и фактора роста тромбоцитов ВВ.
Предпочтительно указанный первый, второй и третий гетерологичные факторы представляют собой комбинацию:
- фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина 4,
- фактора роста фибробластов 2, интерлейкина 34 и интерлейкина 4,
- фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина 13,
- фактора роста фибробластов 2, интерлейкина 34 и интерлейкина 13,
- фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина 10,
- фактора роста фибробластов 2, интерлейкина 34 и интерлейкина 10,
- фактора роста фибробластов 7, колониестимулирующего фактора 1 и интерлейкина 4,
- фактора роста фибробластов 7, интерлейкина 34 и интерлейкина 4,
- фактора роста фибробластов 7, колониестимулирующего фактора 1 и интерлейкина 13,
- фактора роста фибробластов 7, интерлейкина 34 и интерлейкина 13,
- фактора роста фибробластов 7, колониестимулирующего фактора 1 и интерлейкина 10,
- фактора роста фибробластов 7, интерлейкина 34 и интерлейкина 10,
- трансформирующего фактора роста бета, колониестимулирующего фактора 1 и интерлейкина 4,
- трансформирующего фактора роста бета, интерлейкина 34 и интерлейкина 4,
- трансформирующего фактора роста бета, колониестимулирующего фактора 1 и интерлейкина 13,
- трансформирующего фактора роста бета, интерлейкина 34 и интерлейкина 13
- трансформирующего фактора роста бета, колониестимулирующего фактора 1 и интерлейкина 10,
- трансформирующего фактора роста бета, интерлейкина 34 и интерлейкина 10,
- трансформирующего фактора роста альфа, колониестимулирующего фактора 1 и интерлейкина 4,
- трансформирующего фактора роста альфа, интерлейкина 34 и интерлейкина 4,
- трансформирующего фактора роста альфа, колониестимулирующего фактора 1 и интерлейкина 13,
- трансформирующего фактора роста альфа, интерлейкина 34 и интерлейкина 13
- трансформирующего фактора роста альфа, колониестимулирующего фактора 1 и интерлейкина 10,
- трансформирующего фактора роста альфа, интерлейкина 34 и интерлейкина 10
- фактора роста тромбоцитов ВВ, колониестимулирующего фактора 1 и интерлейкина 4,
- фактора роста тромбоцитов ВВ, интерлейкина 34 и интерлейкина 4,
- фактора роста тромбоцитов ВВ, колониестимулирующего фактора 1 и интерлейкина 13,
- фактора роста тромбоцитов ВВ, интерлейкина 34 и интерлейкина 13,
- фактора роста тромбоцитов ВВ, колониестимулирующего фактора 1 и интерлейкина 10, или
- фактора роста тромбоцитов ВВ, интерлейкина 34 и интерлейкина 10.
Также предпочтительно указанный первый, второй и третий гетерологичные факторы представляют собой комбинацию фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина 4, их функциональных аналогов и биологических аналогов.
Предпочтительно дополнительная стимуляция М2-поляризации неполяризованных макрофагов, M1-поляризованных макрофагов, а также недифференцированных моноцитов и других клеток-предшественников макрофагов достигается путем высвобождения двух или более М2-поляризующих факторов из пробиотических бактерий согласно настоящему изобретению.
Согласно другому варианту реализации указанный первый фактор представляет собой первый фактор роста, выбранный из группы, состоящей из вышеупомянутых факторов роста, и указанный третий фактор представляет собой второй фактор роста, выбранный из группы, состоящей из вышеуказанных факторов роста, который функционально отличается от указанного первого фактора роста. Предпочтительно указанный второй фактор роста представляет собой трансформирующий фактор роста бета (ТФР-бета).
Другие предпочтительные комбинации факторов роста включают:
- фактор роста фибробластов 1 и трансформирующий фактор роста бета,
- фактор роста фибробластов 2 и трансформирующий фактор роста бета,
- фактор роста фибробластов 7 и трансформирующий фактор роста бета,
- фактор роста фибробластов 10 и трансформирующий фактор роста бета,
- фактор роста тромбоцитов ВВ и трансформирующий фактор роста бета,
- трансформирующий фактор роста альфа и трансформирующий фактор роста бета,
- эпидермальный фактор роста и трансформирующий фактор роста бета,
- связывающий гепарин ЭФР-подобный фактор роста и трансформирующий фактор роста бета,
- фактор роста гепатоцитов и трансформирующий фактор роста бета, или
- фактор роста эндотелия сосудов А и трансформирующий фактор роста бета. Вышеупомянутые дополнительные предпочтительные комбинации факторов роста предпочтительно комбинируют с М2-поляризующим фактором, выбранным из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10), интерлейкина 13 (ИЛ-13), а также их смесей, предпочтительно колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4), интерлейкина 13 (ИЛ-13), а также их смесей.
Рекомбинантные пробиотические бактерии согласно настоящему изобретению предназначены для применения в лечении воспалительного нарушения функции кожи, предпочтительно хронического воспалительного нарушения функции кожи.
Согласно предпочтительному варианту реализации настоящего изобретения указанное воспалительное нарушение функции кожи, предпочтительно указанное хроническое воспалительное нарушение функции кожи, представляет собой воспалительное заболевание кожи, предпочтительно хроническое воспалительное заболевание кожи или воспалительное заболевание соединительной ткани, предпочтительно хроническое воспалительное заболевание соединительной ткани. Указанное воспалительное заболевание кожи может включать обморожение, экзему, псориаз, дерматит, язву, рану, красную волчанку, нейродермит и их комбинации, предпочтительно обморожения, дерматит, язву, рану, а также их комбинации, более предпочтительно рану, язву и их комбинации, еще более предпочтительно язву.
Указанное воспалительное, предпочтительно хроническое воспалительное, заболевание кожи также может включать воспалительную, предпочтительно хроническую воспалительную, травму кожи, которая может прогрессировать в хроническое воспалительное состояние.
Обморожение представляет собой медицинское состояние, при котором локализованное поражение кожи и других тканей вызвано охлаждением, и может включать разрушение тканей. Указанное обморожение также может включать ознобыши (ознобление), которые представляют собой поверхностные изъязвления кожи, возникающие в результате воздействия холода и влажности. Повреждение капиллярного русла кожи вызывает покраснение, зуд, воспаление и иногда волдыри. Помимо этого, предпочтительно указанные виды обморожения представляют собой разные типы ознобления.
Указанная рана может представлять собой ожоговую рану, химическую рану, индуцированную облучением рану, ишемическую рану или механическую рану.
Указанная язва может представлять собой пролежневую язву или трофическую язву. Указанная язва также может представлять собой венозную язву, артериальную язву, диабетическую язву или пролежневую язву.
Указанная язва также может находиться на этапе предизъязвления вышеуказанных язв без каких-либо видимых признаков открытой раны кожи. При отсутствии медицинского вмешательства этап предизъязвления может прогрессировать до изъязвления.
Указанная рана также может представлять собой острую рану или хроническую рану, предпочтительно хроническую рану.
Хронические раны известны специалисту в данной области техники и включают, например, хронические венозные язвы, хронические артериальные язвы, хронические диабетические язвы и хронические пролежневые язвы. Хронические раны также могут быть вызваны радиационным отравлением или ишемией. Предпочтительно указанная хроническая рана представляет собой по меньшей мере одну из хронической венозной язвы, хронической артериальной язвы, хронической пролежневой язвы и хронических стадий их предизъязвления, предпочтительно одну из хронической венозной язвы, хронической артериальной язвы и хронической пролежневой язвы.
Хроническая венозная язва обычно возникает на нижних конечностях и составляет приблизительно 70%-90% хронических ран, поражая главным образом пациентов пожилого возраста.
Другой важной причиной хронических ран является диабет. Риск ампутации у пациентов, страдающих сахарным диабетом, выше на 15%, по сравнению с общей популяцией, вследствие хронических язв. Диабет вызывает невропатию, которая ингибирует ноцицепцию и восприятие боли. Следовательно, пациенты могут не заметить небольшие раны на ногах и ступнях, и, следовательно, могут не предотвратить инфекцию или повторное повреждение.
Еще одна проблема заключается в том, что диабет вызывает подавление иммунной системы и повреждение мелких кровеносных сосудов, что приводит к уменьшению оксигенации ткани. Угнетение надлежащей оксигенации тканей значительно увеличивает распространенность хронических ран.
Пролежневые язвы, которые также известны как язвы-пролежни или пролежни, могут возникнуть независимо от наличия диабетического состояния. Пролежневые язвы представляют собой локализованные поражения кожи и/или подкожной клетчатки, которые могут возникнуть над костистыми выступами в результате давления или давления в комбинации со сдвигом или трением.
Диабет является основным эндокринным нарушением обмена веществ, которое поражает все большее количество людей, при этом заболеваемость диабетом уже приблизилась к мировой пандемии. Изъязвление нижних конечностей, например, диабетические язвы стопы, является одним из серьезных долгосрочных осложнений, связанных с диабетом, которое может поддерживаться и усиливаться исходным расстройством регенерации тканей.
В США, ЕС и Японии насчитывается приблизительно 13 миллионов пациентов с хроническими ранами, из которых приблизительно 2,8 миллионов страдают изъязвлением нижних конечностей, таким как диабетические язвы стопы.
Изъязвление нижних конечностей, например, диабетические язвы стопы, с трудом поддается лечению, при этом конкретные стандартные, неинвазивные способы лечения отсутствуют. Изъязвление нижних конечностей нуждается в интенсивной медицинской помощи и крайне изнурительно для пациентов, а также связано со значимой потерей качества жизни.
Примерно у 24% пациентов, страдающих изъязвлением нижних конечностей, потребуется ампутация, что приведет к длительной нетрудоспособности.
Ежегодные расходы на здравоохранение для пациентов, страдающих изъязвлением нижних конечностей, составляют примерно 100 миллиардов долларов США. Помимо этого, пятилетняя смертность среди пациентов, страдающих изъязвлением нижних конечностей, приблизительно на 45% выше, чем этот показатель для многих видов рака.
В настоящее время стандартное терапевтическое лечение хронических ран, включая диабетические раны, такие как изъязвления нижних конечностей, сосредоточено, прежде всего, на борьбе с инфекцией и на усилении повторной васкуляризации. Несмотря на применение перечисленных стратегий, частота ампутаций у пациентов, страдающих изъязвлением нижних конечностей, остается неприемлемо высокой.
Помимо этого, даже в тех случаях, когда основное заболевание или причина изъязвления, например, сахарный диабет или хроническая венозная недостаточность, улучшено и/или излечено, например, путем регулирования уровня сахара в крови или введения лекарственных средств для контроля артериального давления, соответственно, лечение существующих язв по-прежнему может занимать очень много времени.
Следовательно, чтобы решить проблему отсутствия конкретного, неинвазивного способа лечения хронических ран, включая диабетические раны, такие как изъязвление нижних конечностей, крайне необходимы новые стратегии, которые помогут активировать и усилить заживление ран у пациентов, страдающих хроническими ранами.
Предпочтительно, в случае хронической раны, уникальная комбинация факторов, предпочтительно факторов, которые высвобождаются из указанных пробиотических бактерий, позволяет осуществлять перепрограммирование указанной хронической раны в острую рану, которая затем может быть закрыта.
Согласно предпочтительному варианту реализации настоящего изобретения рекомбинантные пробиотические бактерии должны быть введены местно и/или путем подкожной инъекции, еще более предпочтительно должны быть введены местным путем.
Рекомбинантные пробиотические бактерии предпочтительно должны быть введены местным путем в очаг воспалительного, предпочтительно хронического воспалительного, нарушения функции кожи, подлежащего лечению.
Рекомбинантные пробиотические бактерии могут быть введены местным путем в очаг воспалительного, предпочтительно хронического воспалительного, нарушения функции кожи и/или путем подкожной инъекции в непосредственной близости от очага нарушения функции кожи, предпочтительно по краям или в полость очага воспалительного, предпочтительно хронического воспалительного, нарушения функции кожи.
После применения рекомбинантных пробиотических бактерий согласно настоящему изобретению указанные бактерии экспрессируют указанный первый и второй гетерологичные факторы, предпочтительно указанный первый, второй и третий гетерологичные факторы.
Помимо этого, прогрессирование предизъязвления до открытой раны может быть предотвращено путем местного применения или подкожной инъекции рекомбинантных пробиотических бактерий согласно настоящему изобретению вблизи и/или внутрь очага предизъязвления.
Рекомбинантные пробиотические бактерии предпочтительно получают путем трансформации пробиотических бактерий с использованием по меньшей мере одной последовательности нуклеиновой кислоты, кодирующей указанный первый гетерологичный фактор, и по меньшей мере одной последовательности нуклеиновой кислоты, кодирующей указанный второй гетерологичный фактор, и предпочтительно по меньшей мере одной последовательности нуклеиновой кислоты, кодирующей указанный третий гетерологичный фактор.
Подходящие пробиотические бактерии для получения рекомбинантных пробиотических бактерий согласно настоящему изобретению представляют собой непатогенные бактерии. Предпочтительно непатогенные бактерии представляют собой неинвазивные бактерии. Согласно другому предпочтительному варианту реализации настоящего изобретения рекомбинантные пробиотические бактерии представляют собой грамположительные бактерии, предпочтительно грамположительные неспорообразующие бактерии. Также предпочтительно указанные пробиотические бактерии представляют собой неколонизирующие бактерии, лишенные способности размножаться в желудочно-кишечном тракте.
Согласно другому предпочтительному варианту реализации настоящего изобретения рекомбинантные пробиотические бактерии включают грамположительные бактериальные штаммы, пригодные для пищевых продуктов.
В соответствии с предпочтительным вариантом реализации настоящего изобретения рекомбинантные пробиотические бактерии могут быть получены из одного и того же бактериального штамма или смеси различных бактериальных штаммов.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии классифицируются как «признанные безопасными» (GRAS) Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA).
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии имеют статус «квалифицированной презумпции безопасности» (QPS-статус), согласно определению Европейского агентства по безопасности продуктов питания (EFSA). Внедрение подхода «квалифицированной презумпции безопасности» (QPS) для оценки выбранных микроорганизмов описано в EFSA Journal, Vol. 587, 2007, pages 1-16.
Согласно другому предпочтительному варианту реализации настоящего изобретения пробиотические бактерии представляют собой непатогенные бактерии, принадлежащие к типу Firmicutes или Actinobacteria. Предпочтительно пробиотические бактерии представляют собой непатогенные бактерии из по меньшей мере одного рода, выбранного из группы, состоящей из Bifidobacterium, Corynebacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Pediococcus, Propionibacterium и Streptococcus.
Согласно другому предпочтительному варианту реализации настоящего изобретения пробиотические бактерии представляют собой молочнокислые бактерии (LAB). Молочнокислые бактерии включают филогенетические ветви грамположительных, кислотоустойчивых, обычно неспорообразующих, анаэробных бактерий, которые обладают общими метаболическими и физиологическими характеристиками. Подходящие бактерии вырабатывают молочную кислоту в качестве основного метаболического конечного продукта синтеза углеводов.
Молочнокислые бактерии давно известны и используются, например, при ферментации продуктов питания. Помимо этого, несколько штаммов молочнокислых бактерий вырабатывают белковые бактериоцины.
Помимо этого, молочнокислые бактерии имеют статус общепризнанных как безопасные (GRAS) вследствие их повсеместного присутствия в пищевых продуктах и участия в поддержании здоровой микрофлоры поверхностей слизистых оболочек человека.
Согласно другому предпочтительному варианту реализации настоящего изобретения пробиотические бактерии исключают болезнетворные и/или условно-патогенные бактерии.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии принадлежат к роду Bifidobacterium sp., включая, но не ограничиваясь перечисленными, Bifidobacterium actinocoloniiforme, Bifidobacterium adolescentis, Bifidobacterium aesculapii, Bifidobacterium angulatum, Bifidobacterium Bifidobacterium animalis, например, Bifidobacterium animalis subsp. animalis или Bifidobacterium animalis subsp. lactis, Bifidobacterium asteroides, Bifidobacterium biavatii, Bifidobacterium bifidum, Bifidobacterium bohemicum, Bifidobacterium bombi, Bifidobacterium boum, Bifidobacterium breve, Bifidobacterium callitrichos, Bifidobacterium catenulatum, Bifidobacterium choerinum, Bifidobacterium coryneforme, Bifidobacterium crudilactis, Bifidobacterium cuniculi, Bifidobacterium denticolens, Bifidobacterium dentium, Bifidobacterium faecale, Bifidobacterium gallicum, Bifidobacterium gallinarum, Bifidobacterium globosum, Bifidobacterium indicum, Bifidobacterium infantis, Bifidobacterium inopinatum, Bifidobacterium kashiwanohense, Bifidobacterium lactis, Bifidobacterium longum, например. Bifidobacterium longum subsp. infantis, Bifidobacterium longum subsp. Longum или Bifidobacterium longum subsp. suis, Bifidobacterium magnum, Bifidobacterium merycicum, Bifidobacterium minimum, Bifidobacterium mongoliense, Bifidobacterium moukalabense, Bifidobacterium pseudocatenulatum, Bifidobacterium pseudolongum, например, Bifidobacterium pseudolongum subsp. globosum или Bifidobacterium pseudolongum subsp. pseudolongum, Bifidobacterium psychraerophilum, Bifidobacterium pullorum, Bifidobacterium reuteri, Bifidobacterium ruminantium, Bifidobacterium saeculare, Bifidobacterium saguini, Bifidobacterium scardovii, Bifidobacterium stellenboschense, Bifidobacterium subtile, Bifidobacterium stercoris, Bifidobacterium suis, Bifidobacterium thermacidophilum, например, Bifidobacterium thermacidophilum subsp. porcinum или Bifidobacterium thermacidophilum subsp. thermacidophilum, Bifidobacterium thermophilum или Bifidobacterium tsurumiense.
Предпочтительно пробиотические бактерии не включают Bifidobacterium dentium.
Предпочтительно пробиотические бактерии представляют собой бактерии, имеющие статус «квалифицированной презумпции безопасности» (QPS-статус) в роду Bifidobacterium sp., включая, но не ограничиваясь ими, Bifidobacterium adolescentis, Bifidobacterium animalis, Bifidobacterium longum, Bifidobacterium breve или Bifidobacterium bifidum.
Согласно одному варианту реализации пробиотические бактерии принадлежат к роду Corynebacterium sp., включая, но не ограничиваясь ими, Corynebacterium accolens, Corynebacterium afermentans, например, Corynebacterium afermentans subsp. afermentans или Corynebacterium afermentans subsp. lipophilum, Corynebacterium ammoniagenes, Corynebacterium amycolatum, Corynebacterium appendices, Corynebacterium aquatimens, Corynebacterium aquilae, Corynebacterium argentoratense, Corynebacterium atypicum, Corynebacterium aurimucosum, Corynebacterium auris, Corynebacterium auriscanis, Corynebacterium betae, Corynebacterium beticola, Corynebacterium bovis, Corynebacterium callunae, Corynebacterium camporealensis, Corynebacterium canis, Corynebacterium capitovis, Corynebacterium casei, Corynebacterium caspium, Corynebacterium ciconiae, Corynebacterium confusum, Corynebacterium coyleae, Corynebacterium cystitidis, Corynebacterium deserti, Corynebacterium diphtheriae, Corynebacterium doosanense, Corynebacterium durum, Corynebacterium efficiens, Corynebacterium epidermidicanis, Corynebacterium equi, Corynebacterium falsenii, Corynebacterium fascians, Corynebacterium felinum, Corynebacterium flaccumfaciens, например, Corynebacterium flaccumfaciens subsp. betae, Corynebacterium flaccumfaciens subsp. flaccumfaciens, Corynebacterium flaccumfaciens subsp. Oortii или Corynebacterium flaccumfaciens subsp. poinsettiae, Corynebacterium flavescens, Corynebacterium frankenforstense, Corynebacterium freiburgense, Corynebacterium freneyi, Corynebacterium glaucum, Corynebacterium glucuronolyticum, Corynebacterium glutamicum, Corynebacterium halotolerans, Corynebacterium hansenii, Corynebacterium hoagie, Corynebacterium humireducens, Corynebacterium ilicis, Corynebacterium imitans, Corynebacterium insidiosum, Corynebacterium iranicum, Corynebacterium jeikeium, Corynebacterium kroppenstedtii, Corynebacterium kutscheri, Corynebacterium lactis, Corynebacterium lilium, Corynebacterium lipophiloflavum, Corynebacterium liquefaciens, Corynebacterium lubricantis, Corynebacterium macginleyi, Corynebacterium marinum, Corynebacterium maris, Corynebacterium massiliense, Corynebacterium mastitidis, Corynebacterium matruchotii, Corynebacterium michiganense, например, Corynebacterium michiganense subsp. insidiosum, Corynebacterium michiganense subsp. michiganense, Corynebacterium michiganense subsp. nebraskense, Corynebacterium michiganense subsp. sepedonicum или Corynebacterium michiganense subsp. tessellarius, Corynebacterium minutissimum, Corynebacterium mooreparkense, Corynebacterium mucifaciens, Corynebacterium mustelae, Corynebacterium mycetoides, Corynebacterium nebraskense, Corynebacterium nigricans, Corynebacterium nuruki, Corynebacterium oortii, Corynebacterium paurometabolum, Corynebacterium phocae, Corynebacterium pilbarense, Corynebacterium pilosum, Corynebacterium poinsettiae, Corynebacterium propinquum, Corynebacterium pseudodiphtheriticum, Corynebacterium pseudotuberculosis, Corynebacterium pyogenes, Corynebacterium pyruviciproducens, Corynebacterium rathayi, Corynebacterium renale, Corynebacterium resistens, Corynebacterium riegelii, Corynebacterium seminale, Corynebacterium sepedonicum, Corynebacterium simulans, Corynebacterium singulare, Corynebacterium sphenisci, Corynebacterium spheniscorum, Corynebacterium sputi, Corynebacterium stationis, Corynebacterium striatum, Corynebacterium suicordis, Corynebacterium sundsvallense, Corynebacterium terpenotabidum, Corynebacterium testudinoris, Corynebacterium thomssenii, Corynebacterium timonense, Corynebacterium tritici, Corynebacterium tuberculostearicum, Corynebacterium tuscaniense, Corynebacterium ulcerans, Corynebacterium ulceribovis, Corynebacterium urealyticum, Corynebacterium ureicelerivorans, Corynebacterium uterequi, Corynebacterium variabile, Corynebacterium vitaeruminis или Corynebacterium xerosis.
Предпочтительно пробиотические бактерии не включают Corynebacterium diphtheriae, Corynebacterium amicolatum, Corynebacterium striatum, Corynebacterium jeikeium, Corynebacterium urealyticum, Corynebacterium xerosis, Corynebacterium pseudotuberculosis, Corynebacterium tenuis, Corynebacterium striatum или Corynebacterium minutissimum.
Предпочтительно пробиотические бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Corynebacterium, включая, но не ограничиваясь ими, Corynebacterium ammoniagenes, Corynebacterium casei, Corynebacterium flavescens или Corynebacterium variabile.
Согласно другому варианту реализации настоящего изобретения бактерии включают бактерии рода Enterococcus sp., включая, но не ограничиваясь ими, Enterococcus alcedinis, Enterococcus aquimarinus, Enterococcus asini, Enterococcus avium, Enterococcus caccae, Enterococcus camelliae, Enterococcus canintestini, Enterococcus canis, Enterococcus casseliflavus, Enterococcus cecorum, Enterococcus columbae, Enterococcus devriesei, Enterococcus diestrammenae, Enterococcus dispar, Enterococcus durans, Enterococcus eurekensis, Enterococcus faecalis, Enterococcus faecium, Enterococcus flavescens, Enterococcus gallinarum, Enterococcus gilvus, Enterococcus haemoperoxidus, Enterococcus hermanniensis, Enterococcus hirae, Enterococcus italicus, Enterococcus lactis, Enterococcus lemanii, Enterococcus malodoratus, Enterococcus moraviensis, Enterococcus mundtii, Enterococcus olivae, Enterococcus pollens, Enterococcus phoeniculicola, Enterococcus plantarum, Enterococcus porcinus, Enterococcus pseudoavium, Enterococcus quebecensis, Enterococcus raffinosus, Enterococcus ratti, Enterococcus rivorum, Enterococcus rotai, Enterococcus saccharolyticus, например, Enterococcus saccharolyticus subsp. saccharolyticus или Enterococcus saccharolyticus subsp. taiwanensis, Enterococcus saccharominimus, Enterococcus seriolicida, Enterococcus silesiacus, Enterococcus solitarius, Enterococcus sulfureus, Enterococcus termitis, Enterococcus thailandicus, Enterococcus ureilyticus, Enterococcus viikkiensis, Enterococcus villorum или Enterococcus xiangfangensis.
Предпочтительно пробиотические бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Enterococcus, включая, но не ограничиваясь ими, Enterococcus durans, Enterococcus faecalis или Enterococcus faecium.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии представляют собой бактерии из рода Lactobacillus sp., включая, но не ограничиваясь ими, Lactobacillus acetotolerans, Lactobacillus acidifarinae, Lactobacillus acidipiscis, Lactobacillus acidophilus, Lactobacillus agilis, Lactobacillus algidus, Lactobacillus alimentarius, Lactobacillus amylolyticus, Lactobacillus amylophilus, Lactobacillus amylotrophicus, Lactobacillus amylovorus, Lactobacillus animalis, Lactobacillus antri, Lactobacillus apinorum, Lactobacillus apis, Lactobacillus apodemi, Lactobacillus aquaticus, Lactobacillus arizonensis, Lactobacillus aviaries, например, Lactobacillus aviarius subsp. araffinosus или Lactobacillus aviarius subsp. aviarius, Lactobacillus backii, Lactobacillus bavaricus, Lactobacillus bifermentans, Lactobacillus bobalius, Lactobacillus bombi, Lactobacillus brantae, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus bulgaricus, Lactobacillus cacaonum, Lactobacillus camelliae, Lactobacillus capillatus, Lactobacillus carnis, Lactobacillus casei, например, Lactobacillus casei subsp. alactosus, Lactobacillus casei subsp. casei, Lactobacillus casei subsp. pseudoplantarum, Lactobacillus casei subsp. rhamnosus или Lactobacillus casei subsp. tolerans, Lactobacillus catenaformis, Lactobacillus cellobiosus, Lactobacillus ceti, Lactobacillus coleohominis, Lactobacillus collinoides, Lactobacillus composti, Lactobacillus concavus, Lactobacillus confusus, Lactobacillus coryniformis, например, Lactobacillus coryniformis subsp. coryniformis или Lactobacillus coryniformis subsp. torquens, Lactobacillus crispatus, Lactobacillus crustorum, Lactobacillus curieae, Lactobacillus curvatus, например, Lactobacillus curvatus subsp. curvatus или Lactobacillus curvatus subsp. melibiosus, Lactobacillus cypricasei, Lactobacillus delbrueckii, например, Lactobacillus delbrueckii subsp. bulgaricus, Lactobacillus delbrueckii subsp. delbrueckii, Lactobacillus delbrueckii subsp. indicus, Lactobacillus delbrueckii subsp. jakobsenii, Lactobacillus delbrueckii subsp. lactis или Lactobacillus delbrueckii subsp. sunkii, Lactobacillus dextrinicus, Lactobacillus diolivorans, Lactobacillus divergens, Lactobacillus durianis, Lactobacillus equi, Lactobacillus equicursoris, Lactobacillus equigenerosi, Lactobacillus fabifermentans, Lactobacillus faecis, Lactobacillus farciminis, Lactobacillus farraginis, Lactobacillus ferintoshensis, Lactobacillus fermentum, Lactobacillus floricola, Lactobacillus florum, Lactobacillus fornicalis, Lactobacillus fructivorans, Lactobacillus fructosus, Lactobacillus frumenti, Lactobacillus fuchuensis, Lactobacillus furfuricola, Lactobacillus futsaii, Lactobacillus gallinarum, Lactobacillus gasseri, Lactobacillus gastricus, Lactobacillus ghanensis, Lactobacillus gigeriorum, Lactobacillus graminis, Lactobacillus halotolerans, Lactobacillus hammesii, Lactobacillus hamsteri, Lactobacillus harbinensis, Lactobacillus hayakitensis, Lactobacillus heilongjiangensis, Lactobacillus helsingborgensis, Lactobacillus helveticus, Lactobacillus heterohiochii, Lactobacillus hilgardii, Lactobacillus hokkaidonensis, Lactobacillus hominis, Lactobacillus homohiochii, Lactobacillus hordei, Lactobacillus iners, Lactobacillus ingluviei, Lactobacillus intestinalis, Lactobacillus iwatensis, Lactobacillus jensenii, Lactobacillus johnsonii, Lactobacillus kalixensis, Lactobacillus kandleri, Lactobacillus kefiranofaciens, например, Lactobacillus kefiranofaciens subsp. kefiranofaciens или Lactobacillus kefiranofaciens subsp. kefirgranum, Lactobacillus kefiri, Lactobacillus kefirgranum, Lactobacillus kimbladii, Lactobacillus kimchicus, Lactobacillus kimchiensis, Lactobacillus kimchii, Lactobacillus kisonensis, Lactobacillus kitasatonis, Lactobacillus koreensis, Lactobacillus kullabergensis, Lactobacillus kunkeei, Lactobacillus lactis, Lactobacillus leichmannii, Lactobacillus lindneri, Lactobacillus malefermentans, Lactobacillus mali, Lactobacillus maltaromicus, Lactobacillus manihotivorans, Lactobacillus mellifer, Lactobacillus mellis, Lactobacillus melliventris, Lactobacillus mindensis, Lactobacillus minor, Lactobacillus minutus, Lactobacillus mucosae, Lactobacillus murinus, Lactobacillus nagelii, Lactobacillus namurensis, Lactobacillus nantensis, Lactobacillus nasuensis, Lactobacillus nenjiangensis, Lactobacillus nodensis, Lactobacillus odoratitofui, Lactobacillus oeni, Lactobacillus oligofermentans, Lactobacillus oris, Lactobacillus oryzae, Lactobacillus otakiensis, Lactobacillus ozensis, Lactobacillus panis, Lactobacillus pantheris, Lactobacillus parabrevis, Lactobacillus parabuchneri, Lactobacillus paracasei, например, Lactobacillus paracasei subsp. paracasei или Lactobacillus paracasei subsp. tolerans, Lactobacillus paracollinoides, Lactobacillus parafarraginis, Lactobacillus parakefiri, Lactobacillus paralimentarius, Lactobacillus paraplantarum, Lactobacillus pasteurii, Lactobacillus paucivorans, Lactobacillus pentosus, Lactobacillus perolens, Lactobacillus piscicola, Lactobacillus plantarum, например, Lactobacillus plantarum subsp. argentoratensis или Lactobacillus plantarum subsp. plantarum, Lactobacillus pobuzihii, Lactobacillus pontis, Lactobacillus porcinae, Lactobacillus psittaci, Lactobacillus rapi, Lactobacillus rennini, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus rimae, Lactobacillus rodentium, Lactobacillus rogosae, Lactobacillus rossiae, Lactobacillus ruminis, Lactobacillus saerimneri, Lactobacillus sakei, например, Lactobacillus sakei subsp. carnosus или Lactobacillus sakei subsp. sakei, Lactobacillus salivarius, например, Lactobacillus salivarius subsp. salicinius или Lactobacillus salivarius subsp. salivarius, Lactobacillus sanfranciscensis, Lactobacillus saniviri, Lactobacillus satsumensis, Lactobacillus secaliphilus, Lactobacillus selangorensis, Lactobacillus senioris, Lactobacillus senmaizukei, Lactobacillus sharpeae, Lactobacillus shenzhenensis, Lactobacillus sicerae, Lactobacillus silagei, Lactobacillus siliginis, Lactobacillus similes, Lactobacillus sobrius, Lactobacillus songhuajiangensis, Lactobacillus spicheri, Lactobacillus sucicola, Lactobacillus suebicus, Lactobacillus sunkii, Lactobacillus suntoryeus, Lactobacillus taiwanensis, Lactobacillus thailandensis, Lactobacillus thermotolerans, Lactobacillus trichodes, Lactobacillus tucceti, Lactobacillus uli, Lactobacillus ultunensis, Lactobacillus uvarum, Lactobacillus vaccinostercus, Lactobacillus vaginalis, Lactobacillus versmoldensis, Lactobacillus vini, Lactobacillus viridescens, Lactobacillus vitulinus, Lactobacillus xiangfangensis, Lactobacillus xylosus, Lactobacillus yamanashiensis, например, Lactobacillus yamanashiensis subsp. mali или Lactobacillus yamanashiensis subsp. yamanashiensis, Lactobacillus yonginensis, Lactobacillus zeae или Lactobacillus zymae.
Предпочтительно пробиотические бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Lactobacillus sp., включая, но не ограничиваясь ими, штамм Lactobacillus acidophilus NP 28, штамм Lactobacillus acidophilus NP51, штамм Lactobacillus subsp. lactis NP7, штамм Lactobacillus reuteri NCIMB 30242, штамм Lactobacillus casei Shirota, штамм Lactobacillus reuteri DSM 17938, штамм Lactobacillus reuteri NCIMB 30242, штамм Lactobacillus acidophilus NCFM, штамм Lactobacillus rhamnosus HN001, штамм Lactobacillus rhamnosus HN001, штамм Lactobacillus reuteri DSM 17938, штамм Lactobacillus casei subsp.rhamnosus GG, Lactobacillus acidophilus, Lactobacillus lactis, Lactobacillus acetotolerans, Lactobacillus acidifarinae, Lactobacillus acidipiscis, Lactobacillus acidophilus, Lactobacillus alimentarius, Lactobacillus amylolyticus, Lactobacillus amylovorus, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus cacaonum, Lactobacillus casei subsp. casei, Lactobacillus collinoides, Lactobacillus composti, Lactobacillus coryniformis subsp. coryniformis, Lactobacillus crispatus, Lactobacillus crustorum, Lactobacillus curvatus subps. curvatus, Lactobacillus delbrueckii subsp. bulgaricus, Lactobacillus delbrueckii subsp. delbrueckii, Lactobacillus delbrueckii subsp. lactis, Lactobacillus dextrinicus, Lactobacillus diolivorans, Lactobacillus fabifermentans, Lactobacillus farciminis, Lactobacillus fermentum, Lactobacillus fructivorans, Lactobacillus frumenti, Lactobacillus gasseri, Lactobacillus ghanensis, Lactobacillus hammesii, Lactobacillus harbinensis, Lactobacillus helveticus, Lactobacillus hilgardii, Lactobacillus homohiochii, Lactobacillus hordei, Lactobacillus jensenii, Lactobacillus johnsonii, Lactobacillus kefiri, Lactobacillus kefiranofadens subsp.kefiranofaciens, Lactobacillus kefiranofadens subsp. kefirgranum, Lactobacillus kimchii, Lactobacillus kisonensis, Lactobacillus mail, Lactobacillus manihotivorans, Lactobacillus mindensis, Lactobacillus mucosae, Lactobacillus nagelii, Lactobacillus namurensis, Lactobacillus nantensis, Lactobacillus nodensis, Lactobacillus oeni, Lactobacillus otakiensis, Lactobacillus panis, Lactobacillus parabrevis, Lactobacillus parabuchneri, Lactobacillus paracasei subsp.paracasei, Lactobacillus parakefiri, Lactobacillus paralimentarius, Lactobacillus paraplantarum, Lactobacillus pentosus, Lactobacillus perolens, Lactobacillus plantarum subsp. plantarum, Lactobacillus pobuzihii, Lactobacillus pontis, Lactobacillus rapi, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus rossiae, Lactobacillus sakei subsp carnosus, Lactobacillus sakei subsp. sakei, Lactobacillus sali varius subsp. salivarius, Lactobacillus sanfranciscensis, Lactobacillus satsumensis, Lactobacillus secaliphilus, Lactobacillus senmaizukei, Lactobacillus siliginis, Lactobacillus spicheri, Lactobacillus suebicus, Lactobacillus sunkii, Lactobacillus tucceti, Lactobacillus vaccinostercus, Lactobacillus versmoldensis или Lactobacillus yamanashiensis.
Предпочтительно пробиотические бактерии представляют собой бактерии, имеющие статус «квалифицированной презумпции безопасности» (QPS) в роду Lactobacillus sp., включая, но не ограничиваясь ими, Lactobacillus acidophilus, Lactobacillus amylolyticus, Lactobacillus amylovorus, Lactobacillus alimentarius, Lactobacillus aviaries, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus casei, Lactobacillus crispatus, Lactobacillus curvatus, Lactobacillus delbrueckii, Lactobacillus farciminis, Lactobacillus fermentum, Lactobacillus gallinarum, Lactobacillus gasseri, Lactobacillus helveticus, Lactobacillus hilgardii, Lactobacillus johnsonii, Lactobacillus kefiranofaciens, Lactobacillus kefiri, Lactobacillus mucosae, Lactobacillus panis, Lactobacillus paracasei, Lactobacillus paraplantarum, Lactobacillus pentosus, Lactobacillus plantarum, Lactobacillus pontis, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus sakei, Lactobacillus salivarius, Lactobacillus sanfranciscensis или Lactobacillus zeae.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии принадлежат к роду Lactococcus sp., включая, но не ограничиваясь ими, Lactococcus chungangensis, Lactococcus formosensis, Lactococcus fujiensis, Lactococcus garvieae, Lactococcus lactis, например, Lactococcus lactis subsp. cremoris, Lactococcus lactis subsp. hordniae, Lactococcus lactis subsp. lactis или Lactococcus lactis subsp. tructae, Lactococcus piscium, Lactococcus plantarum, Lactococcus raffinolactis или Lactococcus taiwanensis.
Предпочтительно пробиотические бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Lactococcus, включая, но не ограничиваясь ими, Lactococcus lactis subsp. cremoris, Lactococcus lactis subsp. Lactis и Lactococcus raffinolactis.
Предпочтительно пробиотические бактерии представляют собой Lactococcus lactis, предпочтительно Lactococcus lactis subsp. lactis, Lactococcus lactis subsp. lactis biovariant diacetylactis или Lactococcus lactis subsp. cremoris, более предпочтительно Lactococcus lactis subsp. cremoris.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии принадлежат к роду Leuconostoc sp., включая, но не ограничиваясь ими, Leuconostoc amelibiosum, Leuconostoc argentinum, Leuconostoc carnosum, Leuconostoc citreum, Leuconostoc cremoris, Leuconostoc dextranicum, Leuconostoc durionis, Leuconostoc fallax, Leuconostoc ficulneum, Leuconostoc fructosum, Leuconostoc gasicomitatum, Leuconostoc gelidum, например, Leuconostoc gelidum subsp. aenigmaticum, Leuconostoc gelidum subsp. gasicomitatum или Leuconostoc gelidum subsp. gelidum, Leuconostoc holzapfelii, Leuconostoc inhae, Leuconostoc kimchii, Leuconostoc lactis, Leuconostoc mesenteroides, например, Leuconostoc mesenteroides subsp. cremoris, Leuconostoc mesenteroides subsp. dextranicums, Leuconostoc mesenteroides subsp. Mesenteroides или Leuconostoc mesenteroides subsp. suionicum, Leuconostoc miyukkimchii, Leuconostoc oeni, Leuconostoc paramesenteroides, Leuconostoc pseudoficulneum или Leuconostoc pseudomesenteroides.
Предпочтительно бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Leuconostoc sp., включая, но не ограничиваясь ими, Leuconostoc carnosum, Leuconostoc citreum, Leuconostoc fallax, Leuconostoc holzapfelii, Leuconostoc inhae, Leuconostoc kimchii, Leuconostoc lactis, Leuconostoc mesenteroides subsp. cremoris, Leuconostoc mesenteroides subsp. dextranicums, Leuconostoc mesenteroides subsp. mesenteroides, Leuconostoc palmae или Leuconostoc pseudomesenteroides.
Предпочтительно пробиотические бактерии представляют собой бактерии, имеющие статус «квалифицированной презумпции безопасности» (QPS) в роду Leuconostoc sp., включая, но не ограничиваясь ими, Leuconostoc citreum, Leuconostoc lactis, Leuconostoc mesenteroides subsp. cremoris, Leuconostoc mesenteroides subsp. dextranicum или Leuconostoc mesenteroides subsp. mesenteroides.
Согласно другому варианту реализации настоящего изобретения бактерии принадлежат роду Pediococcus sp., включая, но не ограничиваясь ими, Pediococcus acidilactici, Pediococcus argentinicus, Pediococcus cellicola, Pediococcus claussenii, Pediococcus damnosus, Pediococcus dextrinicus. Pediococcus ethanolidurans, Pediococcus halophilus, Pediococcus inopinatus, Pediococcus lolii, Pediococcus parvulus, Pediococcus pentosaceus, Pediococcus siamensis, Pediococcus stilesii или Pediococcus urinaeequi.
Предпочтительно пробиотические бактерии представляют собой бактерии, имеющие статус «квалифицированной презумпции безопасности» (QPS) в роду Pediococcus sp., включая, но не ограничиваясь ими, Pediococcus acidilactici, Pediococcus dextrinicus или Pediococcus pentosaceus.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии принадлежат к роду Propionibacterium sp., включая, но не ограничиваясь ими, Propionibacterium acidifaciens, Propionibacterium acidipropionici, Propionibacterium acnes, Propionibacterium australiense, Propionibacterium avidum, Propionibacterium cyclohexanicum, Propionibacterium damnosum, Propionibacterium freudenreichii, например, Propionibacterium freudenreichii subsp. freudenreichii или Propionibacterium freudenreichii subsp. shermanii, Propionibacterium granulosum, Propionibacterium innocuum, Propionibacterium jensenii, Propionibacterium lymphophilum, Propionibacterium microaerophilum, Propionibacterium olivae, Propionibacterium propionicum или Propionibacterium thoenii.
В соответствии с одним вариантом реализации пробиотические бактерии не включают Propionibacterium acnes.
Также предпочтительно пробиотические бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Propionibacterium sp., включая, но не ограничиваясь ими, Propionibacterium acidipropionici, Propionibacterium freudenreichii subsp. Freudenreichii, Propionibacterium freudenreichii subsp. shermanii, Propionibacterium jensenii или Propionibacterium thoenii.
Также предпочтительно пробиотические бактерии представляют собой Propionibacterium freudenreichii, еще более предпочтительно Propionibacterium freudenreichii subsp. freudenreichii или Propionibacterium freudenreichii subsp. shermanii.
Согласно другому варианту реализации настоящего изобретения пробиотические бактерии принадлежат к роду Streptococcus sp., включая, но не ограничиваясь ими, Streptococcus acidominimus, Streptococcus adjacens, Streptococcus agalactiae, Streptococcus alactolyticus, Streptococcus anginosus, Streptococcus australis, Streptococcus bovis, Streptococcus caballi, Streptococcus canis, Streptococcus caprinus, Streptococcus castoreus, Streptococcus cecorum, Streptococcus constellatus, например, Streptococcus constellatus subsp. constellatus, Streptococcus constellatus subsp. pharynges или Streptococcus constellatus subsp. viborgensis, Streptococcus cremoris, Streptococcus criceti, Streptococcus cristatus, Streptococcus cuniculi, Streptococcus danieliae, Streptococcus defectivus, Streptococcus dentapri, Streptococcus dentirousetti, Streptococcus dentasini, Streptococcus dentisani, Streptococcus devriesei, Streptococcus didelphis, Streptococcus difficilis, Streptococcus downei, Streptococcus durans, Streptococcus dysgalactiae, например, Streptococcus dysgalactiae subsp. dysgalactiae или Streptococcus dysgalactiae subsp. equisimilis, Streptococcus entericus, Streptococcus equi, например, Streptococcus equi subsp. equi, Streptococcus equi subsp. ruminatorum или Streptococcus equi subsp. zooepidemicus, Streptococcus equinus, Streptococcus faecalis, Streptococcus faecium, Streptococcus ferus, Streptococcus gallinaceus, Streptococcus gallinarum, Streptococcus gallolyticus, например, Streptococcus gallolyticus subsp. gallolyticus, Streptococcus gallolyticus subsp. macedonicus или Streptococcus gallolyticus subsp. pasteurianus, Streptococcus garvieae, Streptococcus gordonii, Streptococcus halichoeri, Streptococcus hansenii, Streptococcus henryi, Streptococcus hongkongensis, Streptococcus hyointestinalis, Streptococcus hyovaginalis, Streptococcus ictaluri, Streptococcus infantarius, например. Streptococcus infantarius subsp. coli или Streptococcus infantarius subsp. infantarius, Streptococcus infantis, Streptococcus iniae, Streptococcus intermedius, Streptococcus intestinalis, Streptococcus lactarius, Streptococcus lactis, например, Streptococcus lactis subsp. cremoris, Streptococcus lactis subsp. diacetilactis или Streptococcus lactis subsp. lactis, Streptococcus loxodontisalivarius, Streptococcus lutetiensis, Streptococcus macacae, Streptococcus macedonicus, Streptococcus marimammalium, Streptococcus massiliensis, Streptococcus merionis, Streptococcus minor, Streptococcus mitis, Streptococcus morbillorum, Streptococcus moroccensis, Streptococcus mutans, Streptococcus oligofermentans, Streptococcus oralis, Streptococcus orisasini, Streptococcus orisuis, Streptococcus ovis, Streptococcus parasanguinis, Streptococcus parauberis, Streptococcus parvulus, Streptococcus pasteurianus, Streptococcus peroris, Streptococcus phocae, например, Streptococcus phocae subsp. phocae или Streptococcus phocae subsp. salmonis, Streptococcus plantarum, Streptococcus pleomorphus, Streptococcus pluranimalium, Streptococcus plurextorum, Streptococcus pneumonia, Streptococcus porci, Streptococcus porcinus, Streptococcus porcorum, Streptococcus pseudopneumoniae, Streptococcus pseudoporcinus, Streptococcus pyogenes, Streptococcus raffinolactis, Streptococcus ratti, Streptococcus rifensis, Streptococcus rubneri, Streptococcus rupicaprae, Streptococcus saccharolyticus, Streptococcus salivarius, например, Streptococcus salivarius subsp. salivarius или Streptococcus salivarius subsp. thermophilus, Streptococcus saliviloxodontae, Streptococcus sanguinis, Streptococcus shiloi, Streptococcus sinensis, Streptococcus sobrinus, Streptococcus suis, Streptococcus thermophilus, Streptococcus thoraltensis, Streptococcus tigurinus, Streptococcus troglodytae, Streptococcus uberis, Streptococcus urinalis, Streptococcus ursoris, Streptococcus vestibularis или Streptococcus waius.
Предпочтительно пробиотические бактерии представляют собой бактерии, классифицируемые как «признанные безопасными» (GRAS) в роду Streptococcus sp., включая, но не ограничиваясь ими, штамм Streptococcus thermophilus Th4, Streptococcus gallolyticus subsp. macedonicus, Streptococcus salivarius subsp. salivarius или Streptococrus salivarius subsp. thermophilus.
Предпочтительно пробиотические бактерии представляют собой бактерии, имеющие статус «квалифицированной презумпции безопасности» (QPS) в роду Streptococcus sp., включая, но не ограничиваясь указанным, Streptococcus thermophilus.
Согласно предпочтительному варианту реализации настоящего изобретения указанные пробиотические бактерии не вырабатывают эндотоксины или другие потенциально токсичные вещества. Следовательно, указанные пробиотические бактерии безопасны в использовании и не являются вредными для субъекта после применения.
Предпочтительно указанные пробиотические бактерии не производят споры. Бактериальные споры не являются частью полового цикла, однако представляют собой устойчивые структуры, используемые для выживания в неблагоприятных условиях. Поскольку указанные пробиотические бактерии предпочтительно не производят споры, то указанные рекомбинантные пробиотические бактерии не могут выжить, например, без питательных веществ или в условиях отсутствия ауксотрофных факторов.
Предпочтительно указанные пробиотические бактерии не вырабатывают тельца включения. Тельца включения часто содержат гиперэкспрессированные белки, и агрегация указанных гиперэкспрессированных белков в тельцах включения может быть необратимой.
Поскольку указанные пробиотические бактерии предпочтительно не вырабатывают тельца включения, количество указанного первого, второго и третьего гетерологичных факторов после транскрипции и трансляции соответствующих последовательностей нуклеиновых кислот не уменьшается при внутриклеточном накоплении в тельцах включения.
Также предпочтительно указанные пробиотические бактерии также не вырабатывают внеклеточные протеиназы. Внеклеточные протеиназы могут секретироваться бактериями для разрушения внеклеточных структур, таких как белки, для получения питательных веществ, таких как углерод, азот или сера. Внеклеточные протеиназы также могут действовать в качестве экзотоксина и могут являться примером фактора вирулентности при бактериальном патогенезе.
Из-за отсутствия внеклеточных протеиназ безопасность указанных пробиотических бактерий после применения у субъекта предпочтительно повышается. Помимо этого, указанные пробиотические бактерии предпочтительно не разрушают соответствующий первый, второй и третий гетерологичные факторы после высвобождения из указанных рекомбинантных пробиотических бактерий.
Предпочтительно указанные пробиотические бактерии лишены всех природных плазмид. Вследствие отсутствия всех природных плазмид указанные пробиотические бактерии предпочтительно не обладают устойчивостью к антибиотикам.
Также предпочтительно указанные пробиотические бактерии лишены факторов интеграции хозяина, необходимых для конъюгативной транспозиции.
Природные плазмиды могут быть в целом классифицированы на конъюгативные плазмиды и неконъюгативные плазмиды. Конъюгативные плазмиды содержат набор для переноса генов или TRA-гены, которые способствуют половой конъюгации различных клеток. В сложном процессе конъюгации плазмида может быть передана от одной бактерии к другой посредством половых пилей, кодируемых некоторыми из TRA-генов. Неконъюгативные плазмиды не способны инициировать конъюгацию, следовательно, они могут быть переданы только с помощью факторов хозяина, необходимых для конъюгативной транспозиции, таких как конъюгативные плазмиды.
Вследствие отсутствия факторов интеграции хозяина, необходимых для конъюгативной транспозиции, перенос гена указанной нуклеиновой кислоты(кислот), кодирующей соответствующий первый, второй и третий гетерологичные факторы указанных пробиотических бактерий, к другим микроорганизмам является весьма маловероятным, предпочтительно перенос генов подавлен.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанные рекомбинантные пробиотические бактерии представляют собой молочнокислые бактерии, предпочтительно вида Lactobacillus или Lactococcus. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный вид Lactococcus представляет собой Lactococcus lactis subsp. cremoris.
Молочнокислые бактерии дополнительно выделяют молочную кислоту в качестве основного метаболического конечного продукта ферментации углеводов. Известно, что молочная кислота стимулирует размножение и пролиферацию эндотелия. Помимо этого, молочная кислота обладает антибактериальным действием, которое уменьшает вероятность бактериальной инфекции в очаге нарушения функции кожи.
Методики трансформации вышеуказанных пробиотических бактерий известны специалисту в данной области техники и описаны, например, в Green and Sambrook (2012): «Molecular cloning: a laboratory manual», 4 изд., Cold Spring Harbour Laboratory Press (Cold Spring Harbor, NY, USA)
После трансформации рекомбинантные пробиотические бактерии содержат по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую указанный первый гетерологичный фактор, и по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую указанный второй гетерологичный фактор, и предпочтительно по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую указанный третий гетерологичный фактор.
Согласно одному варианту реализации настоящего изобретения по меньшей мере одна последовательность нуклеиновой кислоты, кодирующая указанный первый гетерологичный фактор, и по меньшей мере одна последовательность нуклеиновой кислоты, кодирующая указанный второй гетерологичный фактор, и предпочтительно по меньшей мере одна последовательность нуклеиновой кислоты, кодирующая указанный третий гетерологичный фактор, расположены в различных субпопуляциях рекомбинантных пробиотических бактерий.
Например, каждая из соответствующих последовательностей нуклеиновых кислот локализована в отдельных субпопуляциях пробиотических бактерий, которые комбинируют для получения рекомбинантных пробиотических бактерий согласно настоящему изобретению.
Соответствующая индивидуальная субпопуляция, содержащая соответствующие последовательности нуклеиновых кислот, например, может быть получена из одного и того же вида или из различных видов вышеуказанных пробиотических бактерий.
Например, различные виды рекомбинантных пробиотических бактерий, экспрессирующих различные гетерологичные факторы, могут быть использованы для адаптации экспрессии и предпочтительно высвобождения соответствующих гетерологичных факторов из пробиотических бактерий.
Согласно предпочтительному варианту реализации настоящего изобретения соответствующие последовательности нуклеиновых кислот присутствуют в рекомбинантных пробиотических бактериях в различном количестве копий. Например, рекомбинантные пробиотические бактерии содержат по меньшей мере одну копию соответствующих последовательностей нуклеиновых кислот, кодирующих указанный первый, указанный второй и/или предпочтительно указанный третий фактор.
Количество копий соответствующей последовательности нуклеиновой кислоты может быть увеличено для усиления экспрессии соответствующего гетерологичного фактора.
Предпочтительно соотношение копий соответствующих последовательностей нуклеиновых кислот, кодирующих указанный первый, указанный второй и/или указанный третий факторы, составляет 1:1:1.
Эффективность трансляции может быть повышена путем обеспечения дополнительных копий последовательности нуклеиновой кислоты, которая транскрибируется рекомбинантными пробиотическими бактериями.
Согласно другому варианту реализации настоящего изобретения субпопуляция рекомбинантных пробиотических бактерий содержит по меньшей мере одну нуклеотидную последовательность, кодирующую два из трех гетерологичных факторов, при этом предпочтительно третий гетерологичный фактор кодируется последовательностью нуклеиновой кислоты, расположенной во второй субпопуляции рекомбинантных пробиотических бактерий.
Согласно предпочтительному варианту реализации настоящего изобретения последовательности нуклеиновых кислот, кодирующие все три гетерологичных фактора, расположены в одной популяции рекомбинантных пробиотических бактерий.
Согласно другому предпочтительному варианту реализации настоящего изобретения соответствующие последовательности нуклеиновых кислот расположены на по меньшей мере одной хромосоме и плазмиде указанных рекомбинантных пробиотических бактерий.
Локализация последовательности нуклеиновой кислоты на хромосоме рекомбинантных пробиотических бактерий или на плазмиде указанных рекомбинантных пробиотических бактерий определяет, помимо всего прочего, количество белка, транслируемого бактериями, поскольку уровни экспрессии на плазмиде выше по сравнению с уровнями экспрессии на хромосоме.
Согласно другому предпочтительному варианту реализации настоящего изобретения по меньшей мере одна последовательность нуклеиновой кислоты, кодирующая соответствующий гетерологичный фактор, обеспечена на хромосоме бактерий и по меньшей мере одна последовательность нуклеиновой кислоты, кодирующая другой гетерологичный фактор, обеспечена на плазмиде указанных рекомбинантных пробиотических бактерий.
Соответствующая последовательность нуклеиновой кислоты, кодирующая третий фактор, затем может быть обеспечена на хромосоме или на плазмиде рекомбинантных пробиотических бактерий.
Согласно другому варианту реализации настоящего изобретения соответствующие последовательности нуклеиновых кислот обеспечены на отдельных участках хромосомы рекомбинантных пробиотических бактерий или на различных плазмидах указанных рекомбинантных пробиотических бактерий.
Согласно особенно предпочтительному варианту реализации настоящего изобретения все последовательности нуклеиновой кислоты, кодирующие указанные гетерологичные факторы, обеспечены на одной плазмиде, например, каждая из них находится под контролем и функционально соединена с отдельным промотором.
Согласно другому особенно предпочтительному варианту реализации настоящего изобретения соответствующие последовательности нуклеиновых кислот, кодирующие соответствующие гетерологичные факторы, расположены в одном опероне, который функционально соединен и находится под контролем одного промотора.
Оперон представляет собой функционирующую единицу ДНК, содержащую кластер генов под контролем одного промотора. Гены транскрибируются вместе с нитями мРНК и транслируются вместе в цитоплазме или подвергаются транс-сплайсингу с образованием моноцистронных мРНК, которые транслируются по отдельности.
Предпочтительно соответствующие последовательности нуклеиновых кислот, кодирующие соответствующие гетерологичные факторы, расположенные в указанном отдельном опероне, обеспечены совместно с последовательностями нуклеиновых кислот, кодирующими участок связывания рибосомы для инициации трансляции.
Предпочтительно последовательности нуклеиновых кислот, кодирующие участок связывания рибосомы, расположены в направлении 5'-конца относительно стартового ко дона, который в свою очередь расположен в направлении 5'-конца относительно той же цепи, которая подвергается трансляции. Последовательность предпочтительно является комплементарной 3'-концу рибосомной РНК 16S.
Предпочтительно соответствующие последовательности нуклеиновых кислот, кодирующие соответствующие гетерологичные факторы, расположенные в указанном отдельном опероне, обеспечены совместно с последовательностью нуклеиновой кислоты, кодирующей секреторную сигнальную последовательность на 5'-конце открытой рамки считывания (ОРС) гетерологичного фактора, что приводит к получению гибридного белка, содержащего секреторную сигнальную последовательность и гетерологичный фактор.
Согласно другому предпочтительному варианту реализации настоящего изобретения последовательности нуклеиновых кислот находятся под контролем и функционально соединены с конститутивным промотором или индуцируемым промотором, предпочтительно с индуцируемым промотором.
Например, последовательности нуклеиновых кислот, кодирующие соответствующие гетерологичные факторы, могут находиться под контролем и могут быть функционально соединены с отдельными промоторами, которые могут представлять собой конститутивный промотор или индуцируемый промотор, более предпочтительно индуцируемый промотор.
Конститутивный промотор активен в клетке при всех условиях, в то время как индуцируемый промотор становится активным в ответ на конкретный индуктор.
Промотор представляет собой последовательность нуклеиновой кислоты, которая инициирует транскрипцию конкретного гена. Промоторы расположены вблизи участка начала транскрипции гена, на той же самой нити, а также в направлении 5'-конца ДНК, что и указанный участок, который расположен в направлении 5'-конца той же цепи, которая подвергается транскрипции.
Предпочтительно соответствующий используемый промотор представляет собой аутологичный промотор из пробиотических бактерий, который обеспечивает экспрессию соответствующей последовательности нуклеиновой кислоты.
Согласно другому варианту реализации настоящего изобретения соответствующий промотор представляет собой гетерологичный промотор, предпочтительно прокариотический промотор, более предпочтительно промотор из бактерий.
Согласно другому предпочтительному варианту реализации настоящего изобретения экспрессия по меньшей мере одной последовательности нуклеиновой кислоты находится под контролем индуцируемого промотора, при этом указанная по меньшей мере одна последовательность нуклеиновой кислоты экспрессируется в присутствии по меньшей мере одного индуктора.
Предпочтительно указанный индуцируемый промотор, который индуцируется под действием индуктора, представляет собой промотор по меньшей мере для одного микробного гена, который кодирует пептид лантибиотика.
Пептиды лантибиотиков известны специалисту в данной области техники. Лантибиотики представляют собой класс пептидов, которые содержат характерную полициклическую тиоэфирную аминокислоту лантионин, а также ненасыщенные аминокислоты, дегидроаланин и 2-аминоизомасляную кислоту.
Лантионин, например, представляет собой моносульфидный аналог цистеина и состоит из двух остатков аланина, которые сшиты посредством тиоэфирной связи между бета-атомами углерода.
Лантибиотики вырабатываются многими грамположительными бактериями.
Согласно предпочтительному варианту реализации настоящего изобретения указанный индуцируемый промотор представляет собой промотор низина из Lactococcus lactis, промотор бизина из Bifidobacterium longum, промотор оптилина из Bacillus subtilis, промотор сальваризина из Streptococcus salivarius, промотор эпидермина из Staphylococcus epidermidis, промотор галлидермина из Staphylococcus gallinarum, промотор мутацина из мутированных штаммов Streptococcus, промотор стрептина из Streptococcus pyogenes, промотор стрептококка из Streptococcus pyogenes, промотор лактицина из Lactococcus lactis, промотор эпидермина из Staphylococcis epidermidis, промотор эпиланзина из Staphylococcus epidermidis, промотор рер5 из Staphylococcus epidermidis, промотор lactocins из Lactobacillus sakei, промотор сальварицина из Streptococcus salivarius или Streptococcus pyogenes, промотор плантаризина из Lactobacillus plantarum, промотор термофиллина из стрептококка, промотор бовицина из стрептококка или их комбинации.
Также предпочтительно указанный индуцируемый промотор представляет собой PnisA, PnisZ, PnisQ, PnisF, PnisU или их комбинации из Lactococcus lactis.
Согласно предпочтительному варианту реализации настоящего изобретения индуктор представляет собой по меньшей мере один пептид лантибиотика или его функциональный аналог, предпочтительно выбранный из группы, состоящей из низина А, низина Z, низина Q, низина F, низина U, их функциональных аналогов и их смесей.
Система экспрессии генов под контролем низина доступна коммерчески, например, от MoBiTec GmbH (Геттинген, Германия) под торговым названием NICE®, которая была разработана в NIZO Food Research (Эде, Нидерланды).
Низин, который хорошо известен специалистам в данной области техники, представляет собой пептид лантибиотика, содержащий 34 аминокислоты, с широким спектром хозяев. Например, низины из Lactococcus lactis коммерчески доступны от Sigma-Aldrich Chemie GmbH (Мюнхен, Германия).
Низин широко используется в качестве консерванта в пищевых продуктах. Первоначально низин синтезируется рибосомами в виде предшественника. После последующих ферментативных модификаций модифицированная молекула транслоцируется через цитоплазматическую мембрану и расщепляется с образованием зрелой формы.
Низин индуцирует свою собственную экспрессию. Экспрессия последовательности нуклеиновой кислоты, представляющей интерес, может быть индуцирована добавлением субингибирующего количества низина, которое предпочтительно находится в диапазоне от 0,01 до 50 нг/мл культуральной среды, еще более предпочтительно от 0,1 до 5 нг/мл культуральной среды, при этом представляющий интерес ген расположен после индуцируемых промоторов системы, индуцируемой низином.
Помимо этого, система NICE была перенесена в другие грамположительные бактерии, например, Leuconostoc lactis, Lactobacillus brevis, Lactobacillus helveticus, Lactobacillus plantarum, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus zooepidemicus, Enterococcus faecalis или Lactobacillus subtilis.
Индуцируемый промотор низина, который предпочтительно выбран из PnisA, PnisZ, PnisQ, PnisF, PnisU и их комбинаций, может быть интегрирован в хромосому пробиотических бактерий, используемую совместно с по меньшей мере одной последовательностью нуклеиновой кислоты, кодирующей указанный первый гетерологичный фактор, указанный второй гетерологичный фактор и/или предпочтительно указанный третий гетерологичный фактор.
Предпочтительно указанный индуцируемый промотор представляет собой PnisA.
Согласно другому варианту реализации настоящего изобретения соответствующие промоторы вместе с по меньшей мере одной последовательностью нуклеиновой кислоты, обеспечены на плазмиде, которую затем трансформируют в пробиотические бактерии.
Соответствующая последовательность нуклеиновой кислоты экспрессируется в присутствии низина.
Подходящие плазмиды коммерчески доступны, например, от MoBiTec GmbH, (Геттинген, Германия), такие как pNZ8008, pNZ8148, pNZ8149 и pNZ8150.
Согласно другому предпочтительному варианту реализации настоящего изобретения гены NisR и NisK также обеспечены на хромосоме или на плазмиде используемых пробиотических бактерий. Соответствующий белок NisR и NisK принадлежит к семейству бактериальных двухкомпонентных систем передачи сигналов. NisK представляет собой гистидиновую протеинкиназу, которая находится в цитоплазматической мембране, где она предпочтительно действует как рецептор для зрелой молекулы низина. После связывания низина с NisK он автофосфорилируется и переносит фосфатную группу на NisR, являющийся регулятором ответа, который активируется после фосфорилирования NisK.
Активированный NisR индуцирует транскрипцию с промотора PnisA, промотора PnisF, промотора PnisZ, промотора PnisQ и/или промотора PnisU.
Соответствующие регуляторы экспрессии генов низина NisR и NisK могут быть обеспечены, например, на хромосоме пробиотических бактерий и/или на плазмиде.
Подходящие плазмиды коммерчески доступны и включают, например, плазмиду pNZ9530 (MoBiTec GmbH, Геттинген, Германия). Плазмида pNZ9530 несет гены NisR и NisK и предпочтительно используется для клонирования в штаммах Lactococcus и в штаммах других родов молочнокислых бактерий, которые не содержат интегрированных в хромосому регуляторных генов. Например, плазмида pMSP3535 была описана Brian et al. (2000) для индуцированной низином экспрессии в Enterococcus faecalis и доступна, например, в AddGene, некоммерческого хранилища плазмид (плазмида №46886).
Последовательность нуклеиновой кислоты плазмиды pMSP3535 доступна под номером доступа NCBI AY303239.1.
Согласно другому предпочтительному варианту реализации настоящего изобретения используют пробиотические бактерии, которые содержат регуляторные гены для экспрессии генов, контролируемой низинами, NisR и NisK.
Подходящие штаммы коммерчески доступны, например, от Mobitec GmbH (Геттинген, Германия). Подходящие штаммы включают, например, штамм Lactococcus lactis NZ 9000, штамм Lactococcus lactis NZ9100, штамм Lactococcus lactis NZ3900.
Подходящий штамм также включает штамм Lactococcus lactis NZ3000, который коммерчески доступен, например, от MoBiTec GmbH. Штамм Lactococcus lactis NZ3000 представляет собой штамм, не содержащий NisR и NisK. Штамм Lactococcus lactis NZ3000 может быть использован, когда экспрессия указанной последовательности(ей) нуклеиновой кислоты находится под контролем конститутивного промотора.
Согласно другому предпочтительному варианту реализации настоящего изобретения пробиотические бактерии представляют собой штамм Lactococcus lactis NZ3900, который является штаммом, пригодным для применения в пищевых продуктах. Штамм Lactococcus lactis NZ3900 содержит систему отбора плазмиды, которая основана не на устойчивости к антибиотикам, а на способности расти на лактозе.
Штамм Lactococcus lactis NZ3900 не вырабатывает эндотоксины или другие потенциально токсичные вещества. Помимо этого, штамм Lactococcus lactis NZ3900 не вырабатывает тельца включения и не производит споры. Более того штамм Lactococcus lactis NZ3900 не вырабатывает внеклеточные протеиназы.
Согласно другому предпочтительному варианту реализации настоящего изобретения последовательности нуклеиновых кислот, кодирующие соответствующие гетерологичные факторы, модифицированы для повышения экспрессии, секреции и/или стабильности кодируемого гетерологичного фактора.
Подходящие модификации известны специалистам в данной области техники и включают, например, корректировку частоты использования кодонов по меньшей мере одной последовательности нуклеиновой кислоты для используемых пробиотических бактерий.
Например, по меньшей мере одна последовательность нуклеиновой кислоты может быть сконструирована так, чтобы соответствовать профилю частоты использования кодонов применяемых пробиотических бактерий. Помимо этого, в дополнение к общей оптимизации кодонов могут быть использованы таблицы специфичных кодонов, например, таблицы кодонов для высокого уровня экспрессии генов рибосомных белков соответствующих пробиотических бактерий, чтобы дополнительно увеличить трансляцию кодируемых факторов.
Подходящие модификации также включают, например, встраивание последовательности нуклеиновой кислоты, кодирующей секреторную сигнальную последовательность на 5'-конце открытой рамки считывания (ОРС) гетерологичного фактора, чтобы получить гибридный белок, содержащий секреторную сигнальную последовательность и указанный гетерологичный фактор. Секреторная сигнальная последовательность предпочтительно расположена на N-конце соответствующего гетерологичного фактора.
Секреторная сигнальная последовательность предпочтительно направляет вновь синтезированный белок к плазматической мембране. На конце секреторной сигнальной последовательности, предпочтительно сигнального пептида или пропептида, предпочтительно находится участок аминокислотной последовательности, который распознается и отщепляется сигнальной пептидазой с образованием свободной секреторной сигнальной последовательности, предпочтительно сигнального пептида или пропептида, и зрелого гетерологичного фактора, который секретируется во внеклеточное пространство.
У бактерий существуют два основных пути секреции белков через цитоплазматическую мембрану. Общий путь секреции, называемый Sec-путь, катализирует трансмембранную транслокацию белков в их развернутой конформации, после чего они складываются с образованием своей нативной структуры на другой стороне мембраны.
«Двойной аргининовый» (Arg-Arg мотив) путь транслокации, названный Tat-путь, катализирует транслокацию секреторных белков в сложенном состоянии.
Подходящие последовательности сигналов секреции включают, например, сигнальный пептид.
Предпочтительно последовательность сигнала секреции представляет собой нативный сигнальный пептид или пропептид соответствующего гетерологичного фактора, кодируемого последовательностью нуклеиновой кислоты, который предпочтительно представляет собой предшественник и/или препробелок соответствующего фактора.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанная последовательность сигнала секреции представляет собой гомологичную секреторную последовательность из указанных рекомбинантных пробиотических бактерий, предпочтительно указанная последовательность сигнала секреции представляет собой сигнальную последовательность убиквитин-специфичной пептидазы 45 (Usp 45) Lactococcus sp. Сигнал секреции Usp 45 имеет очень высокую эффективность секреции. Другие сигналы секреции известны специалисту в данной области техники и включают, например, SP310, SPEXP4 и AL9 Lactococcus sp.
Например, нативный сигнальный пептид гетерологичного фактора может быть заменен гомологичной последовательностью сигнала секреции из пробиотических бактерий, используемых для экспрессии указанного гетерологичного фактора.
Последовательность сигнала секреции предпочтительно улучшает эффективность секреции гетерологичного соответствующего фактора. Например, в Lactococcus lactis большинство белков секретируются посредством Sec-пути. Белки синтезируются в качестве предшественников, содержащих зрелый фрагмент белков с N-концевым сигнальным пептидом. Сигнальный пептид направляет белок к цитоплазматической мембране. После отщепления сигнального пептида зрелый белок высвобождается во внеклеточное пространство.
Также предпочтительно секреторный сигнал содержит аминокислотную последовательность SEQ ID NO: 34.
Согласно другому предпочтительному варианту реализации настоящего изобретения соответствующий гетерологичный фактор экспрессируется в виде пропептида, содержащего усиливающий секрецию фактор или не содержащего указанный фактор. Пропептид может быть расщеплен протеазами для высвобождения зрелого гетерологичного фактора.
Согласно другому предпочтительному варианту реализации настоящего изобретения рекомбинантные пробиотические бактерии содержат по меньшей мере один инактивированный ген, кодирующий ключевой белок, необходимый для жизнеспособности указанных пробиотических бактерий.
Согласно предпочтительному варианту реализации настоящего изобретения ключевой белок, который необходим для жизнеспособности указанных пробиотических бактерий, представляет собой белок, еще более предпочтительно фермент, необходимый для синтеза органического соединения, необходимого для жизнеспособности указанных пробиотических бактерий.
После инактивации указанного ключевого белка, предпочтительно фермента, соответствующее органическое соединение представляет собой ауксотрофный фактор, который необходим для жизнеспособности рекомбинантных пробиотических бактерий и должен быть восполнен, чтобы поддерживать жизнеспособность рекомбинантных пробиотических бактерий.
Предпочтительно указанный ауксотрофный фактор представляет собой витамин, аминокислоту, нуклеиновую кислоту и/или жирную кислоту.
Например, аминокислоты и нуклеотиды представляют собой биологически важные органические соединения, которые являются предшественниками белков и нуклеиновых кислот, соответственно.
Согласно другому предпочтительному варианту реализации настоящего изобретения по меньшей мере один ген, необходимый для жизнеспособности пробиотических бактерий, выбран из группы, состоящей из аланинрацемазы (alaR), тимидилатсинтазы (thyA), аспарагинсинтетазы (asnH), СТР-синтазы (pyrG), триптофансинтазы (trbBA) и их комбинаций.
Например, аланинрацемаза представляет собой фермент, который катализирует превращение L-аланина в D-аланин. D-аланин, вырабатываемый под действием аланинрацемазы, используется для синтеза пептидогликанов. Пептид огликан обнаруживается в клеточных стенках всех бактерий.
Специалисту в данной области техники известно, что инактивация гена аланинрацемазы (alaR) у бактерий приводит к зависимости бактерий от внешнего источника D-аланина для поддержания целостности клеточной стенки.
Специалисту в данной области техники известно, что, например, Lactococcus lactis и Lactobacillus plantarum содержат один ген alaR. Инактивация гена влияет на встраивание D-аланина в клеточную стенку.
Бактерия Lactococcus lactis, например, с инактивированным геном аланинрацемазы (alaR) зависит от внешнего источника D-аланина, чтобы иметь возможность синтезировать пептидогликан и включать D-аланин в липотейхоевую кислоту (LTA). Указанные бактерии быстро подвергаются цитолизу при удалении D-аланина, например, в середине фазы экспоненциального размножения.
Штаммы молочнокислых бактерий, дефицитные по аланинрацемазе, могут быть получены, например, способами, известными в данной области техники.
Тимидилатсинтаза представляет собой фермент, который катализирует превращение дезоксиуридинмонофосфата (дУМФ) в монофосфат дезокситимидилата (дТМФ). дТМФ представляет собой один из трех нуклеотидов, образующих тимин (дТМФ, дТДФ и дТТФ). Тимидин входит в состав нуклеиновых оснований в ДНК.
Специалисту в данной области техники известно, что тимидилатсинтаза играет решающую роль на ранних этапах биосинтеза ДНК. Например, повреждение ДНК или делеция участка ДНК может происходить под действием эндогенных факторов и факторов окружающей среды.
Помимо этого, синтез ДНК необходим для пролиферации пробиотических бактерий.
Инактивация гена тимидилатсинтазы (thyA) у бактерий приводит к зависимости бактерий от внешнего источника тимидина для поддержания целостности ДНК.
Аспарагинсинтетаза представляет собой фермент, который синтезирует аминокислоту аспарагин из аспартата. Инактивация гена аспарагинсинтетазы (asnH) приводит к неспособности синтезировать соответствующую аминокислоту, которая становится ауксотрофным фактором.
СТР-синтаза представляет собой фермент, участвующий в синтезе пиримидинов. СТР-синтаза осуществляет взаимное превращение уридин-5'-трифосфата (УТФ) и цитидинтрифосфата (ЦТФ). Инактивация гена СТР-синтазы (pyrG) приводит к тому, что бактерии теряют способность синтезировать цитозиновые нуклеотиды в ходе синтеза de novo, а также с помощью путей синтеза уридина клеточной стенки.
ЦТФ становится ауксотрофным фактором, который должен быть восполнен для синтеза РНК и ДНК.
Триптофансинтаза представляет собой фермент, который катализирует два последних этапа биосинтеза аминокислоты триптофана.
Инактивация гена триптофансинтазы (trpBA) приводит к неспособности бактерий синтезировать соответствующую аминокислоту, которая становится ауксотрофным фактором.
Способы инактивации указанного гена, необходимого для жизнеспособности пробиотических бактерий, известны специалисту в данной области техники и включают удаление гена, мутирование гена, эпигенетическую модификацию указанного гена, опосредованное РНК-интерференцией (RNAi) подавление указанного гена, трансляционное ингибирование указанного гена или их комбинации.
Согласно другому предпочтительному варианту реализации настоящего изобретения соответствующий ауксотрофный фактор обеспечивается совместно с указанными пробиотическими бактериями.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный инактивированный ген, необходимый для жизнеспособности пробиотических бактерий, используется для сдерживания с помощью факторов окружающей среды.
После применения рекомбинантных пробиотических бактерий, содержащих по меньшей мере один инактивированный ген, необходимый для жизнеспособности указанных пробиотических бактерий, соответствующий ауксотрофный фактор должен быть обеспечен извне, например, путем внесения среды или культуральной среды.
В том случае, если рекомбинантные пробиотические бактерии высвобождаются в окружающую среду, ауксотрофный фактор отсутствует, и предпочтительно рекомбинантные пробиотические бактерии погибают.
Помимо этого, применение ауксотрофного фактора, обеспечиваемого извне, позволяет контролировать биосинтез и высвобождение соответствующих гетерологичных факторов.
Предпочтительно по меньшей мере один из указанного первого фактора, указанного второго фактора и указанного третьего фактора представляет собой фактор, который может высвобождаться из указанных рекомбинантных пробиотических бактерий. Также предпочтительно по меньшей мере один из указанного первого фактора, указанного второго фактора и указанного третьего фактора секретируется из указанных рекомбинантных пробиотических бактерий.
Например, у грамположительных бактерий, таких как молочнокислые бактерии, белки, которые секретируются из бактерии, предпочтительно синтезируются в виде предшественника, содержащего N-концевой сигнальный пептид и зрелый фрагмент белка. Предшественники распознаются секреторными молекулярными комплексами бактерий и перемещаются через цитоплазматическую мембрану. Сигнальный пептид затем отщепляется и разрушается, и зрелый белок секретируется из бактерий, например, в супернатант культуры или в область воспалительного нарушения функции кожи.
Например, Lactococcus lactis способны секретировать белки как с низкой молекулярной массой, например, менее 10 кДа, так и с высокой молекулярной массой, например, молекулярной массой более 160 кДа, посредством Sec-зависимого пути.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один из указанного первого фактора, указанного второго фактора и указанного третьего фактора высвобождается из указанных рекомбинантных пробиотических бактерий через цитоплазматическую мембрану с повышенной проницаемостью.
Например, при использовании низина в качестве индуктора для синтеза белка в указанных рекомбинантных пробиотических бактериях, низин также образует поры в цитоплазматической мембране, через которые по меньшей мере один из указанного первого фактора, указанного второго фактора и указанного третьего фактора высвобождается из пробиотических бактерий.
Согласно другому варианту реализации настоящего изобретения цитоплазматическая мембрана указанных рекомбинантных пробиотических бактерий становится более проницаемой вследствие нарушенного синтеза компонентов клеточной стенки.
Например, указанные рекомбинантные пробиотические бактерии содержат инактивированный ген аланинрацемазы (alaR). В отсутствие D-аланина указанные рекомбинантные пробиотические бактерии не могут поддерживать целостность цитоплазматической мембраны, и впоследствии по меньшей мере один из указанного первого фактора, указанного второго фактора и указанного третьего фактора высвобождается из указанных рекомбинантных пробиотических бактерий.
В процессе заживления указанного воспалительного нарушения функции кожи высвобожденный первый гетерологичный фактор, второй гетерологичный фактор и/или третий гетерологичный фактор может подвергаться разложению, например, с помощью протеазного расщепления, что может привести к потере биологической активности указанных гетерологичных факторов.
Разложение или истощение указанных гетерологичных факторов может быть компенсировано замедленным высвобождением указанных гетерологичных факторов из указанных рекомбинантных пробиотических бактерий. Предпочтительно указанные рекомбинантные пробиотические бактерии экспрессируют с постоянным уровнем по меньшей мере один из указанного первого гетерологичного фактора, указанного второго гетерологичного фактора и указанного третьего гетерологичного фактора. Предпочтительно указанные рекомбинантные пробиотические бактерии постоянно высвобождают указанные гетерологичные факторы.
Согласно предпочтительному варианту реализации настоящего изобретения указанные пробиотические бактерии представлены в виде фармацевтической композиции для применения в лечении указанного воспалительного нарушения функции кожи.
Предпочтительно указанная фармацевтическая композиция содержит по меньшей мере один фармацевтически приемлемый носитель или вспомогательное вещество, которое также предпочтительно является подходящим для предполагаемого пути введения.
Предпочтительно указанный фармацевтически приемлемый носитель или указанное фармацевтически приемлемое вспомогательное вещество содержит по меньшей мере один полимерный носитель, предпочтительно выбранный из группы, состоящей из полисахаридов, сложных полиэфиров, полиметакриламида и их смесей. Например, указанный фармацевтически приемлемый носитель представляет собой гидрогель, который, например, дополнительно обеспечивает оптимальную влажность окружающей среды, чтобы стимулировать заживление раны. Помимо этого, фармацевтически приемлемый носитель способствует адгезии указанных рекомбинантных пробиотических бактерий в очаге указанного воспалительного нарушения функции кожи после нанесения.
Предпочтительно указанная фармацевтическая композиция дополнительно содержит по меньшей мере одно питательное вещество для указанных рекомбинантных пробиотических бактерий, предпочтительно указанное вещество выбрано из группы, состоящей из углеводов, витаминов, минералов, аминокислот, микроэлементов и их смесей.
Также предпочтительно указанная фармацевтическая композиция дополнительно содержит по меньшей мере один компонент для стабилизации по меньшей мере одного из указанного первого фактора, указанного второго фактора и указанного третьего фактора.
Указанное стабилизирующее соединение предпочтительно выбрано из группы, состоящей из противомикробных агентов, криопротекторов, ингибиторов протеаз, восстанавливающих агентов, хелатирующих металл агентов и их смесей.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанные рекомбинантные пробиотические бактерии находятся в растворе, заморожены или высушены, предпочтительно лиофилизированы или высушены распылением.
Предпочтительно указанные рекомбинантные пробиотические бактерии предназначены для применения в растворе, например, в виде указанной фармацевтической композиции.
Согласно другому варианту реализации указанные рекомбинантные пробиотические бактерии заморожены или высушены, предпочтительно лиофилизированы или высушены распылением. Рекомбинантные пробиотические бактерии могут быть восстановлены перед использованием.
После применения рекомбинантные пробиотические бактерии могут быть приведены в контакт с по меньшей мере одним указанным индуктором, предпочтительно для того чтобы индуцировать экспрессию по меньшей мере одного из указанного первого фактора, указанного второго фактора и указанного третьего фактора.
Также предпочтительно по меньшей мере один из указанного первого фактора, указанного второго фактора и указанного третьего фактора высвобождается из указанных бактерий после индукции их экспрессии.
Литературные источники
Brian et al. (2000): «Improved vector for nisin-controlled expression in gram-positive bacteria», plasmid 44 (2), 2000, pages 183 to 190.
Davis et al. (2013): Macrophage M1/M2 polarization dynamically adapts to changes in cytokine microenvironments in cryptococcus neoformans infection, mbio. 4(3), 2013, e00264-13. doi:10.1128/mBio. 00264-13.
de Ruyter et al. (1996): Functional analysis of promoters in the nisin gene cluster of Lactococcus lactis. J. Bacteriol. 178 (12), 1996, pages 3434 to 3439.
Duluc et al. (2007): Tumor-associated leukemia inhibitory factor and IL-6 skew monocyte differentiation into tumor-associated macrophage-like cells, Blood 110(13), 2007, pages 4319 to 4330.
Hao et al. (2012): Macrophages in tumor microenvironments and the progression of Tumors: Clin. Dev. Immunol. 2012, pages 1 to 11
van Asseldonk et al. (1993): Functional analysis of the Lactococcus lactis usp45 secretion signal in the secretion of a homologous proteinase and a heterologous alpha-amylase. Mol. Gen. Genet. 240 (3), 1993, pages 428-434.
van Asseldonk et al. (1990): Cloning of usp45, a gene encoding a secreted protein from Lactococcus lactis subsp. lactis MG1363. Gene 95 (1), 1990, pages 155 to 160.
Richard et al. (1995): Effect of topical basic fibroblast growth factor on the healing of chronic diabetic neuropathic ulcer of the foot. A pilot, randomized, double-blind, placebo-controlled study; Diabetes Care 18 (1), 1995, page 64 to 69.
Последовательности
SEQ ID NO: 1-3 соответствуют предшественнику изоформ 1-3 КСФ-1 человека, соответственно, включая сигнальный пептид.
SEQ ID NO: 4 соответствует зрелому КСФ-1 человека.
SEQ ID NO: 5 соответствует синтетической конструкции КСФ-1, используемой в примере 1, включая сигнал секреции Usp45 из Lactococcus lactis, который содержит аминокислоты 1-27 указанного белка, и зрелый КСФ-1 человека, который содержит аминокислоты 28-185 указанного белка.
SEQ ID NO: 6 соответствует синтетической конструкции КСФ-1, полученной после секреции из Lactococcus lactis, экспрессирующих рКСФ-1.
SEQ ID NO: 7 и 8 соответствуют предшественнику изоформ 1 и 2 ИЛ-34 человека, соответственно, включая сигнальный пептид.
SEQ ID NO: 9 соответствует зрелому ИЛ-34 человека.
SEQ ID NO: 10 и 11 соответствуют предшественнику изоформ 1 и 2 ИЛ-4 человека, соответственно, включая сигнальный пептид.
SEQ ID NO: 12 соответствует зрелому ИЛ-4 человека.
SEQ ID NO: 13 соответствует синтетической конструкции ИЛ-4 человека, используемой в примере 1, включая сигнал секреции Usp45 из Lactococcus lactis, который содержит аминокислоты 1-27 указанного белка, и зрелый ИЛ-4 человека, который содержит аминокислоты 28-185 указанного белка.
SEQ ID NO: 14 соответствует синтетической конструкции ИЛ-4, полученной после секреции из Lactococcus lactis, экспрессирующих рИЛ-4.
SEQ ID NO: 15 соответствует предшественнику ИЛ-10 человека, включая сигнальный пептид.
SEQ ID NO: 16 соответствует зрелому ИЛ-10 человека.
SEQ ID NO: 17 соответствует предшественнику ИЛ-13 человека, включая сигнальный пептид.
SEQ ID NO: 18 соответствует зрелому ИЛ-13 человека.
SEQ ID NO: 19 соответствует предшественнику ТФР-β1 человека, включая сигнальный пептид.
SEQ ID NO: 20 соответствует зрелому ТФР-β1 человека.
SEQ ID NO: 21 и 22 соответствуют предшественнику изоформы 1 и 2 ТФР-β2 человека, соответственно, включая сигнальный пептид.
SEQ ID NO: 23 соответствует зрелому ТФР-β2 человека.
SEQ ID NO: 24 соответствует препробелку ТФР-β3 человека, включая сигнальный пептид.
SEQ ID NO: 25 соответствует зрелому ТФР-β3 человека.
SEQ ID NO: 26 соответствует препробелку ФРФ-2 человека, включая пропептид.
SEQ ID NO: 27 соответствует зрелому ФРФ-2 человека после секреции (hFGF2-155).
SEQ ID NO: 28 соответствует частичной последовательности зрелого ФРФ-2 человека.
SEQ ID NO: 29 соответствует синтетической конструкции ФРФ-2 человека, использованной в примере 1, включая сигнал секреции Usp45 из Lactococcus lactis, который содержит аминокислоты 1-27 указанного белка, и зрелый ФРФ-2 человека, который соответствует аминокислотам 136-288 последовательности, представленной в SEQ ID NO: 26.
SEQ ED NO: 30 соответствует варианту чФРФ-2-153 ФРФ-2 человека, использованному в примере 1, после секреции из Lactococcus lactis, экспрессирующих рФРФ.
SEQ ID NO: 31 соответствует ФРГ человека.
SEQ ID NO: 32 соответствует альфа-цепи ФРГ человека.
SEQ ID NO: 33 соответствует бета-цепи ФРГ человека.
SEQ ID NO: 34 соответствует сигналу секреции Usp45 из Lactococcus lactis.
SEQ ID NO: 35 соответствует последовательности нуклеиновой кислоты плазмиды pNZ8149.
SEQ ID NO: 36-43 соответствуют праймерам, используемым в примерах.
SEQ ID NO: 44 соответствует последовательности нуклеиновой кислоты промотора низина А из Lactococcus lactis.
SEQ ID NO: 45 соответствует последовательности нуклеиновой кислоты синтетической конструкции ssUsp45-FGF2-153, содержащей промотор низина А, сигнальную последовательность Usp45 и ген чФРФ-2-153.
SEQ ID NO: 46 соответствует последовательности нуклеиновой кислоты плазмиды рФРФ-2.
SEQ ID NO: 47 соответствует последовательности нуклеиновой кислоты синтетической конструкции ssUsp45-hИЛ-4, содержащей промотор низина А, сигнальную последовательность Usp45 и ген чИЛ-4.
SEQ ID NO: 48 соответствует последовательности нуклеиновой кислоты плазмиды рИЛ-4.
SEQ ID NO: 49 соответствует последовательности нуклеиновой кислоты синтетической конструкции ssUsp45-чКCФ-1, содержащей промотор низина А, сигнальную последовательность Usp45 и ген чКСФ-1.
SEQ ID NO: 50 соответствует последовательности нуклеиновой кислоты плазмиды рКСФ-1.
SEQ ID NO: 51-53 соответствуют последовательностям нуклеиновых кислот, обеспечивающим соответствующие участки связывания рибосомы, включая стартовый кодон (ATG) соответствующей открытой рамки считывания, используемой в примерах.
SEQ ID NO: 54 соответствует последовательности нуклеиновой кислоты 3'-конца рибосомальной РНК 16S (рРНК) из Lactococcus lactis.
SEQ ID NO: 55 соответствует последовательности нуклеиновой кислоты синтетической конструкции КСФ-RBS1-ФРФ-RBS2-ИЛ-4, представленной на Фигуре 24b. SEQ ID NO: 56 соответствует последовательности нуклеиновой кислоты синтетической конструкции ФРФ-RBS1-ИЛ-4-RBS2-КСФ, представленной на Фигуре 24с. SEQ ID NO: 57 соответствует последовательности нуклеиновой кислоты синтетической конструкции ИЛ4-RBS1-КСФ-RBS2-ФРФ, представленной на Фигуре 24d.
SEQ ID NO: 58 соответствует аминокислотной последовательности препробелка изоформы 1 эпидермального фактора роста из Homo sapiens. SEQ ID NO: 59 соответствует аминокислотной последовательности препробелка изоформы 2 эпидермального фактора роста из Homo sapiens. SEQ ID NO: 60 соответствует аминокислотной последовательности препробелка изоформы 3 эпидермального фактора роста из Homo sapiens. SEQ ID NO: 61 соответствует аминокислотной последовательности зрелого эпидермального фактора роста из Homo sapiens. SEQ ID NO: 62 соответствует аминокислотной последовательности предшественника связывающего гепарин ЭФР-подобного фактора роста из Homo sapiens. SEQ ID NO: 63 соответствует аминокислотной последовательности зрелого связывающего гепарин ЭФР-подобного фактора роста из Homo sapiens.
SEQ ID NO: 64 соответствует аминокислотной последовательности препробелка изоформы 1 трансформирующего фактора роста альфа из Homo sapiens. SEQ ID NO: 65 соответствует аминокислотной последовательности препробелка изоформы 2 трансформирующего фактора роста альфа из Homo sapiens. SEQ ID NO: 66 соответствует аминокислотной последовательности препробелка изоформы 3 трансформирующего фактора роста альфа из Homo sapiens. SEQ ID NO: 67 соответствует аминокислотной последовательности препробелка изоформы 4 трансформирующего фактора роста альфа из Homo sapiens. SEQ ID NO: 68 соответствует аминокислотной последовательности препробелка изоформы 5 трансформирующего фактора роста альфа из Homo sapiens. SEQ ID NO: 69 соответствует аминокислотной последовательности зрелого трансформирующего фактора роста альфа из Homo sapiens.
SEQ ID NO: 70 соответствует аминокислотной последовательности препробелка амфирегулина из Homo sapiens. SEQ ID NO: 71 соответствует аминокислотной последовательности зрелого амфирегулина из Homo sapiens.
SEQ ID NO: 72 соответствует аминокислотной последовательности препробелка эпирегулина из Homo sapiens. SEQ ID NO: 73 соответствует аминокислотной последовательности зрелого эпирегулина из Homo sapiens.
SEQ ID NO: 74 соответствует аминокислотной последовательности предшественника изоформы 1 эпигена из Homo sapiens. SEQ ID NO: 75 соответствует аминокислотной последовательности предшественника изоформы 2 эпигена из Homo sapiens. SEQ ID NO: 76 соответствует аминокислотной последовательности предшественника изоформы 3 эпигена из Homo sapiens. SEQ ID NO: 77 соответствует аминокислотной последовательности предшественника изоформы 4 эпигена из Homo sapiens. SEQ ID NO: 78 соответствует аминокислотной последовательности предшественника изоформы 5 эпигена из Homo sapiens. SEQ ID NO: 79 соответствует аминокислотной последовательности предшественника изоформы 6 эпигена из Homo sapiens. SEQ ID NO: 80 соответствует аминокислотной последовательности предшественника изоформы 7 эпигена из Homo sapiens. SEQ ID NO: 81 соответствует аминокислотной последовательности зрелого эпигена из Homo sapiens.
SEQ ID NO: 82 соответствует аминокислотной последовательности предшественника бетацеллюлина из Homo sapiens. SEQ ID NO: 83 соответствует аминокислотной последовательности зрелого бетацеллюлина из Homo sapiens.
Нижеследующие Фигуры и примеры приведены исключительно для иллюстративных целей. Настоящее изобретение не должно быть истолковано, как ограниченное следующими примерами:
Фигуры:
На Фигуре 1 представлены результаты исследования эталонного белка ФРФ-2 человека методом электрофореза в ДСН-ПААГ.
На Фигуре 2 показана карта плазмиды вектора экспрессии pNZ8149. «LacF» обозначает селективный маркер для размножения штамма хозяина NZ3900 в присутствии лактозы; «Pnis» обозначает промотор низина А из оперона низина Lactococcus lactis; «Т» обозначает терминатор; «repC» и «repA» обозначают гены репликации. Последовательность нуклеиновой кислоты также представлена в SEQ ID NO: 35.
На Фигуре 3 представлена последовательность нуклеиновой кислоты промотора низина A L. lactis, который также представлен на SEQ ID NO: 44.
На Фигурах 4а, 4b и 4с представлены значения SignalP 4.1, полученные с использованием аминокислотной последовательности, представленной в SEQ ID NO: 29, SEQ ID NO: 13 и SEQ ID NO: 5, соответственно.
На Фигурах 5a, 5b и 5c представлены синтезированные вставки, используемые в примере 1, а также соответствующая аминокислотная последовательность. «ФРФ-2-153» обозначает вставку, кодирующую ФРФ-2 человека. «чИЛ-4» обозначает вставку, кодирующую ИЛ-4 человека. «чКСФ-1» обозначает вставку, кодирующую КСФ-1 человека. «PnisA» обозначает промотор низина А из оперона низина Lactococcus lactis. «ssUsp45» обозначает сигнальную последовательность гена Usp45 из Lactococcus lactis. Звездочка обозначает стоп-кодон. Соответствующие последовательности нуклеиновых кислот также представлены в SEQ ID NO: 45, SEQ ID NO: 47 и SEQ ID NO: 49.
На Фигурах 6а, 6b и 6с представлены результаты исследования потенциальных колоний Lactococcus lactis NZ3900, экспрессирующих рФРФ-2, рИЛ-4 и рКСФ-1, соответственно, методом ПЦР для анализа колоний.
На Фигурах 7а, 7b и 7с представлены карты плазмид, а также последовательности нуклеиновых кислот плазмид рФРФ-2, рИЛ-4 и рКСФ-1, соответственно, для экспрессии и секреции чФРФ-2, чИЛ-4 и чКСФ-1, соответственно, в Lactococcus lactis. «Pnis» обозначает промотор низина А из оперона низина Lactococcus lactis; «Т» обозначает терминатор; «rерС» и «rерА» обозначают гены репликации. Последовательности нуклеиновых кислот плазмид рФРФ-2, рИЛ-4 и рКСФ-1 представлены в SEQ ID NO: 46, SEQ ID NO: 48 и SEQ ID NO: 50, соответственно.
На Фигуре 8 представлены результаты исследования методом вестерн-блоттинга образцов ферментации Lactococcus, экспрессирующих NZ3900 (рФРФ-2), при различных условиях индукции. «0,5/5» обозначает индукцию при OD600=0,5 с использованием 5 нг/мл низина; «3/5» обозначает индукцию при OD600=3 с использованием 5 нг/мл низина, «Т» обозначает временную точку, при которой образец был отобран из ферментационной суспензии.
На Фигуре 9 представлены результаты исследования методом электрофореза в ДСН-ПААГ образцов супернатанта (Sup) из опытов с ферментацией в контролируемых условиях после окрашивания Кумасси синим (Coom), и результаты исследования методом вестерн-блоттинга (WB) образцов ферментации Lactococcus, экспрессирующих NZ3900 (рИЛ-4). «0,5/5» обозначает индукцию при OD600=0,5 с использованием 5 нг/мл низина; «3/5» обозначает индукцию при OD600=3 с использованием 5 нг/мл низина, «Т» обозначает временную точку, при которой образец был отобран из ферментационной суспензии.
На Фигуре 10 представлены результаты исследования методом электрофореза в ДСН-ПААГ образцов супернатанта (Sup) из опытов с ферментацией в контролируемых условиях после окрашивания Кумасси синим (Coom) образцов ферментации Lactococcus, экспрессирующих NZ3900 (рКСФ-1). «0,5/5» обозначает индукцию при OD600=0,5 с использованием 5 нг/мл низина; «3/5» обозначает индукцию при OD600=3 с использованием 5 нг/мл низина, «Т» обозначает временную точку, при которой образец был отобран из ферментационной суспензии.
На Фигуре 11 представлены результаты исследования методом вестерн-блоттинга (WB) образцов ферментации Lactococcus, экспрессирующих NZ3900 (рКСФ-1). «0,5/5» обозначает индукцию при OD600=0,5 с использованием 5 нг/мл низина; «3/5» обозначает индукцию при OD600=3 с использованием 5 нг/мл низина, «Т» обозначает временную точку, при которой образец был отобран из ферментационной суспензии.
На Фигуре 12 представлены параметры размножения закисляющих культур для эксперимента с индукцией в условиях, которые напоминают обстоятельства заживления ран.
На Фигуре 13 представлены результаты исследования выработки чФРФ-2 в супернатанте после индукции при рН=5 или OD600=3 методами электрофореза в ДСН-ПААГ и вестерн-блоттинга.
На Фигуре 14а представлены результаты количественного исследования миграции фибробластов человека, описанного в примере 4а, после 72 часов воздействия рекомбинантных пробиотических бактерий, экспрессирующих чФРФ-2 или коммерчески доступного продукта фибласта (Fiblast).
На Фигуре 14b представлены результаты количественного исследования миграции фибробластов человека, описанного в примере 4а, после 72 часов воздействия рекомбинантных пробиотических бактерий, экспрессирующих чИЛ-4, или рекомбинантного ИЛ-4 человека.
На Фигуре 14с представлены результаты исследования индукции фосфорилирования ERK 1+2 в нормальных фибробластах кожи человека (НФКЧ) под действием культуральной среды AUP-10, содержащей 0,4-80 нг/мл ФРФ-2, и под действием рчФРФ-2.
На Фигуре 14d представлены результаты исследования индукции фосфорилирования ERK 1+2 в клетках M-NFS-60 под действием культуральной среды AUP-14, содержащей 0,2-40 нг/мл КСФ-1, и под действием рчКСФ-1.
На Фигуре 14е представлены результаты ингибирования ЛПС-индуцированной выработки мРНК ФНО-альфа в клетках человека ТНР-1, как описано в примере 4с.
На Фигуре 14f представлены результаты исследования индукции экспрессии РНК генов М2 для рецептора маннозы 1 макрофагов (Mrc1) и Kruppel-подобного фактора 4 (KLF4) в макрофагах, полученных из ТНР1, как описано в примере 4d.
На Фигуре 14g представлены результаты оценки влияния AUP-12 и чрИЛ-4 на транскрипционную активность STAT-6 в гибридной линии глиальных клеток человека МО3.13, как описано в примере 4е.
На Фигуре 14h представлены результаты оценки влияния AUP-12 и чрИЛ-4 на транскрипционную активность STAT-6 в клетках мезонефроса человека 293Т, как описано в примере 4е.
На Фигуре 15а представлены результаты экспериментов по заживлению ран, описанных в примере 5.
На Фигуре 15b представлены результаты сравнения статуса заживления ран для контроля, положительного контроля и AUP-16-обработанной ткани после указанных временных точек, описанных в примере 5.
На Фигуре 15с представлены результаты сравнения оставшейся раневой области после 8-го дня и 12-го дня для положительного контроля (группа лечения 17) и AUP-16-обработанной ткани (группа лечения 18), описанных в примере 5.
На Фигуре 16а представлена аминокислотная последовательность предшественника изоформы а макрофагального колониестимулирующего фактора 1 из Homo sapiens. На Фигуре 16b представлена аминокислотная последовательность предшественника изоформы b макрофагального колониестимулирующего фактора 1 из Homo sapiens. На Фигуре 16с представлена аминокислотная последовательность предшественника изоформы с макрофагального колониестимулирующего фактора 1 из Homo sapiens. На Фигуре 16d представлена аминокислотная последовательность зрелого человека макрофагального колониестимулирующего фактора 1.
На Фигуре 17а представлена аминокислотная последовательность предшественника изоформы 1 интерлейкина 34 из Homo sapiens. На Фигуре 17b представлена аминокислотная последовательность предшественника изоформы 2 интерлейкина 34 из Homo sapiens. На Фигуре 17с представлена аминокислотная последовательность интерлейкина 34 из Homo sapiens.
На Фигуре 18а представлена аминокислотная последовательность предшественника изоформы 1 интерлейкина 4 из Homo sapiens. На Фигуре 18b представлена аминокислотная последовательность предшественника изоформы 2 интерлейкина 4 из Homo sapiens. На Фигуре 18с представлена аминокислотная последовательность интерлейкина 4 из Homo sapiens.
На Фигуре 19а представлена аминокислотная последовательность предшественника интерлейкина 10 из Homo sapiens. На Фигуре 19b представлена аминокислотная последовательность интерлейкина 10 из Homo sapiens.
На Фигуре 20а представлена аминокислотная последовательность предшественника интерлейкина 13 из Homo sapiens. На Фигуре 20b представлена аминокислотная последовательность интерлейкина 13 из Homo sapiens.
На Фигуре 21а представлена аминокислотная последовательность предшественника трансформирующего фактора роста бета 1 из Homo sapiens. На Фигуре 21b представлена аминокислотная последовательность трансформирующего фактора роста бета 1 из Homo sapiens. На Фигуре 21с представлена аминокислотная последовательность предшественника изоформы 1 трансформирующего фактора роста бета 2 из Homo sapiens. На Фигуре 21d представлена аминокислотная последовательность предшественника изоформы 2 трансформирующего фактора роста бета 2 из Homo sapiens. На Фигуре 21е представлена аминокислотная последовательность трансформирующего фактора роста бета 2 из Homo sapiens. На Фигуре 21f представлена аминокислотная последовательность препробелка трансформирующего фактора роста бета 3 из Homo sapiens. На Фигуре 21g представлена аминокислотная последовательность трансформирующего фактора роста бета 3 из Homo sapiens.
На Фигуре 22а представлена аминокислотная последовательность предшественника фактора роста фибробластов 2 из Homo sapiens. На Фигуре 22b представлена аминокислотная последовательность фрагмента фактора роста фибробластов 2 из Homo sapiens.
На Фигуре 23а представлена аминокислотная последовательность фактора роста гепатоцитов из Homo sapiens. На Фигуре 23b представлена аминокислотная последовательность альфа-цепи фактора роста гепатоцитов из Homo sapiens. На Фигуре 23с представлена аминокислотная последовательность бета-цепи фактора роста гепатоцитов из Homo sapiens.
На Фигуре 24а показан обзор трех участков связывания рибосомы, используемых в примере 2d. Соответствующие последовательности синтезированных последовательностей ДНК КСФ-RBS1-ФРФ-RBS2-ИЛ-4, ФРФ-RBS1-ИЛ-4-RBS2-КСФ и ИЛ-4-RBS-КСФ-RBS2-ФРФ, используемых в примере 2d, представлены на Фигурах 24b-24d, соответственно, а также приведены в SEQ ID NO: 55, SEQ ID NO: 56 и SEQ ID NO: 57, соответственно. На Фигурах 24e-24g показаны соответствующие гели после электрофореза в ДСН-ПААГ, а также исследования методом вестерн-блоттинга, полученные с использованием конструкций отдельных оперонов, использованных в примере 2d.
На Фигуре 25а представлена аминокислотная последовательность препробелка изоформы 1 эпидермального фактора роста из Homo sapiens. На Фигуре 25b представлена аминокислотная последовательность препробелка изоформы 2 эпидермального фактора роста из Homo sapiens. На Фигуре 25с представлена аминокислотная последовательность препробелка изоформы 3 эпидермального фактора роста из Homo sapiens. На Фигуре 25d представлена аминокислотная последовательность зрелого эпидермального фактора роста из Homo sapiens.
На Фигуре 26а представлена аминокислотная последовательность предшественника связывающего гепарин ЭФР-подобного фактора роста из Homo sapiens. На Фигуре 26b представлена аминокислотная последовательность зрелого связывающего гепарин ЭФР-подобного фактора роста из Homo sapiens.
На Фигуре 27а представлена аминокислотная последовательность препробелка изоформы 1 трансформирующего фактора роста альфа из Homo sapiens. На Фигуре 27b представлена аминокислотная последовательность препробелка изоформы 2 трансформирующего фактора роста альфа из Homo sapiens. На Фигуре 27с представлена аминокислотная последовательность препробелка изоформы 3 трансформирующего фактора роста альфа из Homo sapiens. На Фигуре 27d представлена аминокислотная последовательность препробелка изоформы 4 трансформирующего фактора роста альфа из Homo sapiens. На Фигуре 27е представлена аминокислотная последовательность препробелка изоформы 5 трансформирующего фактора роста альфа из Homo sapiens. На Фигуре 27f представлена аминокислотная последовательность зрелого трансформирующего фактора роста альфа из Homo sapiens.
На Фигуре 28а представлена аминокислотная последовательность препробелка амфирегулина из Homo sapiens. На Фигуре 28b представлена аминокислотная последовательность зрелого амфирегулина из Homo sapiens.
На Фигуре 29а представлена аминокислотная последовательность препробелка эпирегулина из Homo sapiens. На Фигуре 29b представлена аминокислотная последовательность зрелого эпирегулина из Homo sapiens.
На Фигуре 30а представлена аминокислотная последовательность предшественника изоформы 1 эпигена человека из Homo sapiens. На Фигуре 30b представлена аминокислотная последовательность предшественника изоформы 2 эпигена человека из Homo sapiens. На Фигуре 30с представлена аминокислотная последовательность предшественника изоформы 3 эпигена человека из Homo sapiens. На Фигуре 30d представлена аминокислотная последовательность предшественника изоформы 4 эпигена человека из Homo sapiens. На Фигуре 30е представлена аминокислотная последовательность предшественника изоформы 5 эпигена человека из Homo sapiens. На Фигуре 30f представлена аминокислотная последовательность предшественника изоформы 6 эпигена человека из Homo sapiens. На Фигуре 30g представлена аминокислотная последовательность предшественника изоформы 7 эпигена человека из Homo sapiens. На Фигуре 30h представлена аминокислотная последовательность зрелого эпигена из Homo sapiens.
На Фигуре 31а представлена аминокислотная последовательность предшественника бетацеллюлина из Homo sapiens. На Фигуре 31b представлена аминокислотная последовательность зрелого бетацеллюлина из Homo sapiens.
На Фигуре 32а представлена аминокислотная последовательность зрелого фактора роста фибробластов 2 из Homo sapiens. На Фигуре 32b представлена аминокислотная последовательность варианта чФРФ-2-153 фактора роста фибробластов 2, используемого в примерах.
На Фигуре 33 представлена аминокислотная последовательность варианта интерлейкина 4 человека (чИЛ-4), используемого в примерах.
На Фигуре 34 представлена аминокислотная последовательность варианта колониестимулирующего фактора 1 человека (чКСФ-1), используемого в примерах.
На Фигуре 35 представлена аминокислотная последовательность сигнала секреции белка Usp45 Lactococcus, используемого в примерах.
Примеры
1. Общие экспериментальные процедуры:
Если не указано иное, эксперименты в примерах выполняли в соответствии с протоколом производителя аналитических систем. Если не указано иное, указанные химические вещества были получены от Sigma-Aldrich Chemie Gmbh (Мюнхен, Германия), Merck KGaA (Дармштадт, Германия), Thermo Fisher Scientific Inc. (Валтман, Массачусетс, США) или Becton Dickinson and Company (Франклин-Лейке, Нью-Джерси, США).
1.1 Ростовые среды
Для разных целей клетки выращивали в различных средах. Для общих способов клонирования использовали среду М17 (Oxoid Deutschland GmbH, Везел, Германия), содержащую 0,5% глюкозы или лактозы.
Чтобы контролировать отбор колоний, пригодных для применения в пищевых продуктах, использовали среду Elliker, на которой колонии лактококков приобретают желтый цвет при размножении в присутствии лактозы. Желтая окраска представляет собой рН-эффект, который изменяет цвет индикаторного красителя бромкрезолового фиолетового в непосредственной близости от растущей колонии, а также самой колонии.
Состав среды Elliker:
- 20 г/л триптона
- 5 г/л дрожжевого экстракта
- 4 г/л NaCl,
- 1,5 г/л Na-ацетата (не содержащего воды)
- 0,5 г/л L(+)-аскорбиновой кислоты
- 15 г/л агара
рН=6,8
Стерилизация: 15 мин при 121°С.
После стерилизации и охлаждения добавляли 1% лактозы из 20% исходного раствора, стерилизованного путем нагревания и фильтрации, и 0,004% бромкрезолового фиолетового (0,4% раствор, стерилизованный путем фильтрации).
Для различных способов ферментации и других функциональных экспериментов с использованием размножения бактерий использовали среду IM1, не содержащую ингредиентов животного происхождения. Лактоза, единственный оставшийся ингредиент животного происхождения, может быть получена фармацевтической степени чистоты.
Состав среды IM1:
- 5% моногидрата лактозы (Scharlab S.L., Барселона, Испания)
- 1,5% соевого пептона
- 1% дрожжевого экстракта
- 1 мМ MgSO4×7 H2O
- 0,1 мМ MnSO4×4H2O
рН=6,7
Стерилизация: 15 мин при 110°С.
Во время ферментации буфер не добавляли, поскольку рН автоматически регулируется с помощью 2,5 М NaOH. Для культивирования исследуемых культур в условиях подкисления к среде в пробирках добавляли 2% Na-бета-глицерофосфата.
Указанный буфер нейтрализует вырабатываемый лактат и позволяет культуре достичь плотности клеток OD600=4-5.
Исходные растворы готовых конструкций NZ3900 (рФРФ-2), NZ3900 (рИЛ-4) и NZ3900 (рКСФ-1) получали после размножения в среде IM1 с добавлением лактозы и Na-бета-глицерофосфата путем добавления глицерина до конечной концентрации 20%. Исходные растворы хранили при -80°С.
1.2 Индукция выработки белка с использованием системы NICE®
Систему NICE® индуцировали с использованием концентраций низина, находящихся в диапазоне 0,1-10 нг/мл низина. Низин из Lactococcus lactis получали от Sigma (номер продукта N5764).
1.3 Методики молекулярного клонирования
Для молекулярного клонирования использовали стандартные методики, например, описанные в Green and Sambrook (2012): «Molecular cloning: a laboratory manual», 4 изд., Cold Spring Harbour Laboratory Press (Cold Spring Harbor, NY, USA).
Секвенирование нуклеотидных последовательностей, синтез генов и синтез праймеров выполняли в сторонней компании BaseClear (Лейден, Нидерланды).
1.4 Процедуры ферментации
Процедуры ферментации проводили в 0,5 л ферментере Multifors с 6 реакционными сосудами (Infors Benelux, Велп, Нидерланды). Инокуляцию проводили с использованием 1% предварительной культуры, которую вносили в среду IM1; скорость перемешивания составляла 200 оборотов в минуту, и температура инкубации составляла 30°C. В ходе опытов рН контролировали с помощью 2,5 М NaOH. Показатель рН, температуру и добавление NaOH непрерывно контролировали.
Индукцию с использованием низина проводили в различные моменты времени цикла размножения, используя различные количества низина, указанные в разделе результатов. Образцы также отбирали, как указано в разделе результатов.
1.5 Ферментация с использованием системы Cinac
Для мониторинга закисляющих культур использовали блок контроля рН Cinac (AMS France, Фрепийон, Франция) для непрерывного измерения изменений рН. Для того чтобы обеспечить одинаковые значения рН культуры смешивали с помощью магнитной мешалки при 200 об/мин.
1.6 Обработка образцов
Для проведения электрофореза в ДСН-ПААГ и вестерн-блоттинга образцы обрабатывали с получением трех фракций: (i) фракции супернатанта, (ii) общего клеточного экстракта (содержащего свободный от клеток экстракт, фрагменты клеточной стенки и другие твердые частицы), и (iii) свободного от клеток экстракта.
Фракцию супернатанта получали путем смешивания 1 мл супернатанта после ферментации с 150 мкл ТХУ и инкубировали при 4°С в течение не менее 1 ч. Осадок собирали центрифугированием при 20000g. Осадок использовали немедленно или хранили при -20°С; после дополнительного этапа центрифугирования для удаления следов ТХУ осадок повторно суспендировали в 15 мкл 5 мМ Трис-HCl, рН=7,5.
Затем вносили 5 мкл 4× буфера для приготовления образцов (содержащего 75 мМ ДТТ), и суспензию нагревали в течение 20 мин при 70°С. Во всех случаях в гель вносили по 20 мкл образцов.
Общие клеточные экстракты получали следующим образом: осадок из 10 мл образца периодической культуры или 1 мл ферментационной культуры растворяли в 1 мл 5 мМ Трис-HCl, рН=7,5 и переносили в пробирку с гранулами, содержащую 500 мг циркониевых гранул, и замораживали при -20°С до проведения дальнейшей обработки. После оттаивания полученную суспензию встряхивали с использованием шариковой мельницы FastPrep (MP Biomedicals LLP, Санта-Ана, Калифорния, США) 4 раза по 30 секунд при скорости 4 с периодическим охлаждением в течение 1 мин на льду. После осаждения гранул в течение 1 мин по 15 мкл супернатантов смешивали с 5 мкл буфера для загрузки образцов и обрабатывали, как указано выше.
Свободный от клеток экстракт получали путем центрифугирования общего клеточного экстракта в течение 1 мин при 20000g. Последующую подготовку образца для электрофореза в ДСН-ПААГ проводили, как описано выше.
1.7 Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (электрофорез в ДСН-ПААГ)
Электрофорез в ДСН-ПААГ проводили с использованием коммерчески доступной системы NuPAGE (Life Technologies GmbH, Дармштадт, Германия) в соответствии с протоколом производителя.
Эталонный белок ФРФ-2 человека получали от Sigma Aldrich. 50 мкг растворяли в 25 мкл 5 мМ Трис, рН=7,5 до достижения конечной концентрации 2 мкг/мкл. В пробном эксперименте по 5 и 10 мкг вносили в гель для электрофореза в ДСН-ПААГ после смешивания с 4-кратно концентрированным буфером для загрузки с получением 1-кратной концентрации буфера для загрузки.
Как показано на Фигуре 1, анализ полосок на геле указывает на присутствие мономеров, небольшого количества димера и очень небольшого количества тримера чФРФ-2. Дорожки 1 и 4 = маркер SeeBlue; дорожка 2 = 5 мкг ФРФ-2 и дорожка 3 = 10 мкг чФРФ-2. Данный гель исследовали без добавления ДТТ в буфер для загрузки и буфер для геля.
Эталонный белок ИЛ-4 человека получали от R&D systems (Миннеаполис, Миннесота, США). ИЛ-4 человека растворяли в фосфатно-солевом буфере (ФСБ) (5,8 мМ Na2HPO4, 4,2 мМ NaH2PO4, 145 мМ NaCl), чтобы получить конечную концентрацию 100 мкг/мл. В качестве стандарта 1 мкг вносили в каждую дорожку для окрашивания Кумасси синим, и 0,1 мкг для окрашивания серебром и вестерн-блоттинга.
Эталонный белок КСФ-1 человека получали от Abсam PLC (Кембридж, Великобритания). КСФ-1 человека растворяли в стерильной воде с получением конечной концентрации 100 мкг/мл. В качестве стандарта 1 мкг вносили в дорожку для окрашивания Кумасси синим, и 0,1 мкг для окрашивания серебром и вестерн-блоттинга.
1.8 Вестерн-блоттинг
Вестерн-блоттинт белков также проводили с использованием системы NuPAGE (модуль XCell Blot) в соответствии с протоколом LifeTechnologies. Мембрану для блоттинга предварительно вырезали из нитроцеллюлозной мембраны от Thermo Fisher Scientific Inc. В качестве буфера для переноса использовали NuPage Transfer buffer (20×) от Life Technologies. Перенос белков проводили при 35 В в течение 1 ч.
Для детектирования ФРФ-2 человека использовали очищенное моноклональное мышиное антитело к ФРФ-2 человека (BD Transduction laboratories, Гейдельберг, Германия) в разведении 1:250. Вторичное антитело представляло собой конъюгированное с пероксидазой хрена (ПХ) антитело к IgG мыши в разведении 1:10000, полученное от

Для детектирования ИЛ-4 человека использовали моноклональное мышиное антитело IgG1 к ИЛ-4 человека от R&D systems (клон №3007) в разведении 1:500. Вторичное антитело представляло собой ПХ-конъюгированное антитело к IgG мыши в разведении 1:10000, полученное от

Для детектирования КСФ-1 человека использовали поликлональные антитела кролика к М-КСФ человека от Abсam PLC (клон ab9693) в разведении 1:2000. Вторичное антитело представляло собой ПХ-конъюгированное антитело к IgG кролика в разведении 1:2000, полученное от

Вестерн-блоты проявляли с использованием хемилюминесцентного субстрата SuperSignal West Pico, полученного от Thermo Fisher Scientific Inc.
1.9 N-концевое секвенирование аминокислотных последовательностей
Для проведения N-концевого секвенирования аминокислотных последовательностей чФРФ-2, чИЛ-4 и чКСФ-1 из супернатанта культур с контролируемой ферментацией полосы из двух дорожек гелей после электрофореза в ДСН-ПААГ, окрашенных Кумасси синим, вырезали и отправляли в Eurosequence (Гронинген, Нидерланды).
Пример 1: Наработка плазмид для экспрессии
1.1 Секвенирование плазмиды pNZ8149
Плазмиду pNZ8149 использовали в качестве вектора для экспрессии фактора роста фибробластов человека 2 (чФРФ-2), интерлейкина 4 (чИЛ-4) и колониестимулирующего фактора человека 1 (чКСФ-1) в L. lactis. Плазмиду pNZ8149 подвергали селекции в клетках-хозяевах с помощью механизма отбора в присутствии определенных питательных веществ на основании размножения L. lactis в присутствии лактозы.
В качестве контроля плазмидную ДНК выделяли и секвенировали (праймеры приведены в таблице 1). Не было обнаружено различий с имеющейся в настоящее время последовательностью. Последовательность pNZ8149 представлена в SEQ ID NO: 35.
1.1.1 Фактор роста фибробластов человека 2 (чФРФ-2)
Зрелая форма чФРФ-2 содержит 155 аминокислот и обозначается далее как чФРФ-2-155. чФРФ-2-155 имеет молекулярную массу 17,3 кДа и ИТ 9,85. Молекула содержит 4 остатка цистеина.
Вариант чФРФ-2, использованный для клонирования и экспрессии в L. lactis, лишен первых двух аминокислот, метионина и аланина, и, следовательно, содержит 153 аминокислоты. Следовательно, в дальнейшем этот вариант обозначают как чФРФ-2-153. чФРФ-2-153 имеет молекулярную массу 17,1 кДа и ИТ 9,85. Этот вариант также содержит четыре остатка цистеина.
Соответствующая аминокислотная последовательность ФРФ-2-155 человека представлена ниже на Фигуре 32а и приведена в последовательности SEQ ID NO: 27:
MAAGSITTLP ALPEDGGSGA FPPGHFKDPK RLYCKNGGFF LRIHPDGRVD GVREKSDPHI KLQLQAEERG WSIKGVCAN RYLAMKEDGR LLASKCVTDE CFFFERLESN NYNTYRSRKY TSWYVALKRT GQYKLGSKTG PGQKAILFLP MSAKS
Подчеркнутые аминокислоты обозначают первые две аминокислоты, метионин и аланин, которые отсутствуют в варианте чФРФ-2-153. Аминокислотная последовательность варианта чФРФ-2-153 представлена на Фигуре 32b и приведена в последовательности SEQ ID NO: 30.
Последовательность ФРФ-2-155 представляет собой последовательность зрелого ФРФ-2 человека после секреции. В условиях in vivo указанная последовательность подвергается дальнейшему расщеплению. Однако различные существующие рекомбинантные продукты основаны на последовательности из 155 аминокислот, с добавлением остатка N-концевого метионина или без него.
1.1.2 Интерлейкин 4 человека (чИЛ-4)
Зрелый белок чИЛ-4 содержит 129 аминокислот, которые соответствуют аминокислотам 25-153 в аминокислотной последовательности, доступной под номером NCBI NP_000580.1. Зрелый белок имеет молекулярную массу 14,96 кДа и ИТ 9,36. Молекула содержит 6 остатков цистеина.
Аминокислотная последовательность зрелого ИЛ-4 человека представлена ниже на Фигуре 18с и приведена в последовательности SEQ ID NO: 12:
HKCDITLQEI IKTLNSLTEQ KTLCTELTVT DIFAASKNTT EKETFCRAAT VLRQFYSHHE KDTRCLGATA QQFHRHKQLI RFLKRLDRNL WGLAGLNSCP VKEANQSTLE NFLERLKTIM REKYSKCSS
Вариант чИЛ-4, который используется для клонирования и экспрессии в L. lactis, содержит дополнительный остаток аланина на N-конце зрелого белка и, следовательно, содержит 130 аминокислот. Указанный вариант имеет молекулярную массу 15,03 кДа и ИТ 9,36. Этот вариант также содержит 6 остатков цистеина.
Соответствующая аминокислотная последовательность варианта чИЛ-4 человека, который используется для клонирования и экспрессии, представлена ниже на Фигуре 33 и приведена в последовательности SEQ ID NO: 14:
AHKCDITLQE IIKTLNSLTE QKTLCTELTV TDIFAASKNT TEKETFCRAA TVLRQFYSHH EKDTRCLGAT AQQFHRHKQL IRFLKRLDRN LWGLAGLNSC PVKEANQSTL ENFLERLKTI MREKYSKCSS
Дополнительный остаток аланина на N-конце подчеркнут в указанной выше аминокислотной последовательности.
1.1.3 Колониестимулирующий фактор человека 1 (чКСФ-1)
Аминокислотная последовательность, использованная для экспрессии, получена из последовательности предшественника КСФ-1 человека, содержащей 554 аминокислоты, доступной под номером доступа NCBI NP_000748.3. Использованная последовательность начинается с аминокислоты 33 (Е), которая является первой аминокислотой зрелого чКСФ-1, и заканчивается аминокислотой 181 (Q).
Помимо этого, к С-концу были добавлены дополнительные 9 аминокислот, которые занимают в нативном белке положения 480-488 (GHERQSEGS). Чтобы улучшить эффективность удаления сигнального пептида сигнальной пептидазой к N-концу добавили дополнительный остаток аланина. Полученная аминокислотная последовательность приведена ниже на Фигуре 34 и представлена в последовательности SEQ ID NO: 6:
AEEVSEYCSH MIGSGHLQSL QRLIDSQMET SCQITFEFVD QEQLKDPVCY LKKAFLLVQD IMEDTMRFRD NTPNAIAIVQ LQELSLRLKS CFTKDYEEHD KACVRTFYET PLQLLEKVKN VFNETKNLLD KDWNIFSKNC NNSFAECSSQ GHERQSEGS
Дополнительный остаток аланина на N-конце подчеркнут в указанной выше аминокислотной последовательности. Дополнительные 9 аминокислот, добавленные к С-концу, показаны жирным шрифтом. Белок, кодируемый указанной последовательностью, содержит 159 аминокислот, имеет молекулярную массу 18,5 кДа и ИТ 4,72. Белок содержит 7 остатков цистеина.
1.2 Конструирование плазмиды для экспрессии чФРФ-2, чИЛ-4 и чКСФ-1 в Lactococcus lactis
Цель эксперимента состояла в том, чтобы экспрессировать и секретировать чФРФ-2, чИЛ-4 и чКСФ-1, например, в супернатант ростовой среды L. lactis. Для этого использовали сигналы для транскрипции, трансляции и секреции белков. Сигналы для транскрипции и трансляции присутствовали в системе экспрессии NICE® L. lactis и происходили из промотора низина A L. lactis. Промотор низина A L. lactis представлен на Фигуре 3 и в последовательности SEQ ID NO: 44, и, например, описан в Ruyter et al. (1996).
На Фигуре 3 дополнительно показан -10 элемент и -35 элемент промотора, а также участок связывания рибосомы (RBS). Стартовый кодон ATG соответствующего целевого белка расположен непосредственно после двух остатков цистеина на 3'-конце последовательности.
Сигнал секреции был получен из белка Usp45 Lactococcus, который описан, например, в van Asseldonk et al. (1993) и van Asseldonk et al. (1990).
Сигнал секреции белка Usp45 Lactococcus представлен ниже на Фигуре 35 и приведен в последовательности SEQ ID NO: 34:
MKKKIISAIL MSTVILSAAA PLSGVYA
В клетке существует механизм, который обеспечивает отщепление сигнальной последовательности от белка-мишени после секреции белка. Эта реакция катализируется сигнальной пептидазой, которая имеет определенное предпочтение в отношении некоторых аминокислот в положениях вокруг сайта расщепления.
Для оптимизации сайта расщепления использовали доступную через интернет программу SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/).
С помощью указанной программы было установлено, что оптимальное расщепление аминокислотной последовательности чФРФ-2 происходит при удалении первых двух аминокислот чФРФ-2-155, при этом указанный вариант белка чФРФ-2-155 начинается с остатка Ala и содержит 153 аминокислоты (вариант чФРФ-2-153).
Соответствующая аминокислотная последовательность белка-предшественника чФРФ-2-153, используемого для анализа с помощью программы SignalP 4.1, представлена ниже и приведена в последовательности SEQ ID NO: 29:
MKKKIISAIL MSTVILSAAA PLSGVYAAGS ITTLPALPED GGSGAFPPGH FKDPKRLYCK NGGFFLRIHP DGRVDGVREK SDPHIKLQLQ AEERGWSIK GVCANRYLAM KEDGRLLASK CVTDECFFFE RLESNNYNTY RSRKYTSWYV ALKRTGQYKL GSKTGPGQKA ILFLPMSAKS
Подчеркнутые аминокислоты обозначают сигнал секреции белка Usp45 Lactococcus.
С помощью программы SignalP 4.1 было установлено, что оптимальное расщепление аминокислотной последовательности чИЛ-4 происходит при добавлении остатка аланина к N-концу зрелого белка ИЛ-4 с получением белка, содержащего 130 аминокислот.
Соответствующая аминокислотная последовательность белка-предшественника чИЛ-4, используемого для анализа с помощью программы SignalP 4.1, представлена ниже и приведена в последовательности SEQ ID NO: 13:
MKKKIISAIL MSTVILSAAA PLSGVYAAHK CDITLQEIIK TLNSLTEQKT LCTELTVTDI FAASKNTTEK ETFCRAATVL RQFYSHHEKD TRCLGATAQQ FHRHKQLIRF LKRLDRNLWG LAGLNSCPVK EANQSTLENF LERLKTIMRE KYSKCSS
Подчеркнутые аминокислоты обозначают сигнал секреции белка Usp45 Lactococcus.
С помощью программы SignalP 4.1 было установлено, что оптимальное расщепление аминокислотной последовательности чКСФ-1 происходит при добавлении остатка аланина к N-концу зрелого белка чКСФ-1 с получением белка, содержащего 159 аминокислот.
Соответствующая аминокислотная последовательность белка-предшественника чКСФ-1, используемого для анализа с помощью программы SignalP 4.1, представлена ниже и приведена в последовательности SEQ ID NO: 5:
MKKKIISAIL MSTVILSAAA PLSGVYAAEE VSEYCSHMIG SGHLQSLQRL IDSQMETSCQ ITFEFVDQEQ LKDPVCYLKK AFLLVQDIME DTMRFRDNTP NAIAIVQLQE LSLRLKSCFT KDYEEHDKAC VRTFYETPLQ LLEKVKNVFN ETKNLLDKDW NIFSKNCNNS FAECSSQGHE RQSEGS
Подчеркнутые аминокислоты обозначают сигнал секреции белка Usp45 Lactococcus.
На Фигуре 4а представлены показания программы SignalP 4.1, полученные для аминокислотной последовательности, приведенной в SEQ ID NO: 29, в которой сигнал секреции белка Usp45 гибридизован с N-концом чФРФ-2-153. Полученные значения свидетельствуют о присутствии явного сайта расщепления между аминокислотами 27 и 28 предшественника чФРФ-2-153, также указаны оценки для этого сайта расщепления.
На Фигуре 4b представлены показания программы SignalP 4.1, полученные для аминокислотной последовательности, приведенной в SEQ ID NO: 13, в которой сигнал секреции белка Usp45 гибридизован с N-концом чИЛ-4. Полученные значения свидетельствуют о присутствии явного сайта расщепления между аминокислотами 27 и 28 предшественника чИЛ-4, также представлены оценки для этого сайта расщепления.
На Фигуре 4с представлены показания программы SignalP 4.1, полученные для аминокислотной последовательности, приведенной в SEQ ID NO: 5, в которой сигнал секреции белка Usp45 гибридизован с N-концом чКСФ-1. Полученные значения свидетельствуют о присутствии явного сайта расщепления между аминокислотами 27 и 28 предшественника чКСФ-1, также приведены оценки для этого сайта расщепления.
Частота использования кодонов для соответствующих генов, кодирующих чФРФ-2-153, чИЛ-4 и чКСФ-1, была адаптирована для обычной частоты применения кодонов L. lactis. Это стандартная процедура поставщика синтеза генов.
Помимо этого, аналогичную сигнальную последовательность Usp45 использовали для всех трех белков. Следовательно, экспрессия всех трех белков и посттрансляционное отщепление сигнального пептида в одной и той же бактериальной клетке было улучшено.
Синтезировали фрагмент чФРФ-2, который содержал промотор низина А, сигнальную последовательность Usp45 и ген чФРФ-2-153. Нуклеиновая последовательность искусственной конструкции ssUsp45-ФРФ-2-153 приведена в SEQ ID NO: 45 и представлена на Фигуре 5. Частота использования кодонов была оптимизирована для обычной частоты применения кодонов L. lactis.
На Фигуре 5а показана синтезированная вставка, а также соответствующая аминокислотная последовательность, полученная после транскрипции и трансляции. ФРФ-2-153 обозначает вставку, кодирующую ФРФ-2 человека. PnisA обозначает промотор низина А из оперона низина Lactococcus lactis. ssUsp45 обозначает сигнальную последовательность гена Usp45 из Lactococcus lactis. Звездочка обозначает стоп-кодон. Помимо этого, сайты рестрикции, распознаваемые эндонуклеазами BamHI (положение 1-6) и XbaI (положение 751-756), в последовательности нуклеиновой кислоты обозначены подчеркиванием.
Синтезировали фрагмент чИЛ-4, который содержал промотор низина А, сигнальную последовательность Usp45 и ген чИЛ-4. Нуклеиновая последовательность искусственной конструкции ssUsp45-чИЛ-4 приведена в SEQ ID NO: 47 и представлена на Фигуре 5b. Частота использования кодонов была оптимизирована для обычной частоты применения кодонов L. lactis.
На Фигуре 5b показана синтезированная вставка, а также соответствующая аминокислотная последовательность, полученная после транскрипции и трансляции. чИЛ-4 обозначает вставку, кодирующую ИЛ-4 человека. PnisA обозначает промотор низина А из оперона низина Lactococcus lactis. ssUsp45 обозначает сигнальную последовательность гена Usp45 из Lactococcus lactis. Звездочка обозначает стоп-кодон. Помимо этого, сайты рестрикции, распознаваемые эндонуклеазами BamHI (положение 1-6) и XbaI (положение 682-687) в последовательности нуклеиновой кислоты, обозначены подчеркиванием.
Синтезировали фрагмент чКСФ-1, который содержал промотор низина А, сигнальную последовательность Usp45 и ген чКСФ-1. Нуклеиновая последовательность искусственной конструкции ssUsp45-чКСФ-2 приведена в SEQ ID NO: 49 и представлена на Фигуре 5с. Частота использования кодонов была оптимизирована для обычной частоты применения кодонов L. lactis.
На Фигуре 5с показана синтезированная вставка, а также соответствующая аминокислотная последовательность, полученная после транскрипции и трансляции. чКСФ-1 обозначает вставку, кодирующую КСФ-1 человека. PnisA обозначает промотор низина А из оперона низина Lactococcus lactis. ssUsp45 обозначает сигнальную последовательность гена Usp45 из Lactococcus lactis. Звездочка обозначает стоп-кодон. Помимо этого, сайты рестрикции, распознаваемые эндонуклеазами BamHI (положение 1-6) и XbaI (положение 769-774) в последовательности нуклеиновой кислоты, обозначены подчеркиванием.
Готовые продукты синтеза генов получали от BaseClear, каждый в виде фрагмента, клонированного в вектор Е. coli pUC57.
Фрагменты клонировали в плазмиду pNZ8149 путем расщепления плазмиды pUC57, содержащей соответствующие продукты синтеза генов, с использованием ферментов рестрикции BamHI и XbaI. Фрагменты после рестрикции BamHI и XbaI, содержащие соответствующие продукты синтеза гена, выделяли и лигировали в плазмиду pNZ8149, разрезанную с использованием PsuI и XbaI, с получением соответствующих плазмид рФРФ-2, рИЛ-4 и рКСФ-1. Соответствующие эндонуклеазы рестрикции были получены от Thermo Fisher Scientific Inc.
Соответствующую смесь после лигирования трансформировали в штамм L. lactis NZ3900. Проверку плазмиды проводили методом ПЦР для анализа колоний. Соответствующие нуклеиновые последовательности используемых праймеров приведены в таблице 1 ниже. Результаты представлены на Фигурах 6а-6с.
На Фигуре 6а представлены результаты исследования потенциальных колоний штамма L. lactis NZ3900, экспрессирующего рФРФ-2, методом ПЦР для анализа колоний. Дорожка 1: лямбда-ДНК, расщепленная HindIII; дорожка 2: pNZ8149 (пустой вектор), который амплифицировали с использованием праймеров nis2 и seqlacF (ожидаемый размер фрагмента 391 п.н.); дорожки 3 и 4 выделенные колонии, амплифицированные с использованием праймеров nis2 и seqlacF (ожидаемый размер фрагмента 907 п.н.).
На Фигуре 6b представлены результаты исследования потенциальных колоний штамма L. lactis NZ3900, экспрессирующего рИЛ-4, методом ПЦР для анализа колоний. Дорожка 1: лямбда-ДНК, расщепленная HindIII; дорожка 2: pNZ8149 (пустой вектор), который амплифицировали с использованием праймеров nis2 и seqlacF (ожидаемый размер фрагмента 391 п.н.); дорожки 11 и 12 выделенные колонии, амплифицированные с использованием праймеров nis2 и seqlacF (ожидаемый размер фрагмента 838 п.н.).
На Фигуре 6с представлены результаты исследования потенциальных колоний штамма L. lactis NZ3900, экспрессирующего рКСФ-1, методом ПНР для анализа колоний. Дорожка 1: лямбда-ДНК, расщепленная HindIII; дорожка 2: pNZ8149 (пустой вектор), который амплифицировали с использованием праймеров nis2 и seqlacF (ожидаемый размер фрагмента 391 п.н.); дорожка 3: выделенная колония, которую амплифицировали с использованием праймеров nis2 и seqlacF (ожидаемый размер фрагмента 925 п.н.).

На Фигуре 7а показана карта плазмиды и последовательность нуклеиновой кислоты плазмиды рФРФ-2 для экспрессии и секреции чФРФ-2 в Lactococcus lactis. lacF обозначает селективный маркер для размножения штамма-хозяина NZ3900 в присутствии лактозы; PnisA обозначает промотор низина А из оперона низина Lactococcus lactis; ssUSP45 обозначает сигнальную последовательность гена Usp45 L. lactis. Т обозначает терминатор; repC и repA обозначают гены репликации. Последовательность нуклеиновой кислоты плазмиды рФРФ-2 также приведена в SEQ ID NO: 46.
На Фигуре 7b показана карта плазмиды и последовательность нуклеиновой кислоты плазмиды рИЛ-4 для экспрессии и секреции чИЛ-4 в Lactococcus lactis. lacF обозначает селективный маркер для размножения штамма-хозяина NZ3900 в присутствии лактозы; PnisA обозначает промотор низина А из оперона низина Lactococcus lactis; ssUSP45 обозначает сигнальную последовательность гена Usp45 L. lactis. Т обозначает терминатор; repC и repA обозначает гены репликации. Последовательность нуклеиновой кислоты плазмиды рИЛ-4 также приведена в SEQ ID NO: 48.
На Фигуре 7с показана карта плазмиды и последовательность нуклеиновой кислоты плазмиды рКСФ-1 для экспрессии и секреции чКСФ-1 в Lactococcus lactis. lacF обозначает селективный маркер для размножения штамма-хозяина NZ3900 в присутствии лактозы; PnisA обозначает промотор низина А из оперона низина Lactococcus lactis; ssUsp45 обозначает сигнальную последовательность гена Usp45 L. lactis. Т обозначает терминатор; repC и repA обозначают гены репликации. Последовательность нуклеиновой кислоты плазмиды рКСФ-1 также приведена в SEQ ID NO: 50.
Пример 2: Исследование выработки рекомбинантных факторов в Lactococcus lactis
Для того чтобы исследовать выработку и секрецию соответствующих рекомбинантных факторов чФРФ-2, чИЛ-4 или чКСФ-1 из Lactococcus lactis, пять колоний после исходной трансформации отбирали для дальнейшего анализа. Указанные колонии сначала очищали с помощью высевания и выделения одиночной колонии. Пять колоний индивидуально инокулировали в среду M17, содержащую лактозу, выращивали до OD600≈0,5 и индуцировали с использованием 1 нг/мл низина.
Размножение культур прекращали, и культуры собирали через 2 ч после добавления низина. Характеристики и определенная задержка размножения у всех культур были аналогичны после добавления низина (данные не приведены).
а) Выработка чФРФ-2 в L. lactis NZ3900 (рФРФ-2) в контролируемых условиях ферментации
Для того чтобы установить выход культуры NZ3900 (рФРФ-2), проводили эксперименты с ферментацией в контролируемых условиях.
Проводили следующие пять экспериментов с ферментацией:
1. NZ3900 (рФРФ-2) без индукции;
2. NZ3900 (рФРФ-2), индуцированная при OD600=0,5 с использованием 5 нг/мл низина;
3. NZ3900 (рФРФ-2), индуцированная при OD600=3 с использованием 5 нг/мл низина;
4. NZ3900 (pNZ8149), индуцированная при OD600=0,5 с использованием 5 нг/мл низина;
5. NZ3900 (pNZ8149), индуцированная при OD600=3 с использованием 5 нг/мл низина.
Образцы отбирали при t=0 (перед индукцией), t=2 часа, t=4 часа и t=6 часов после индукции с указанным количеством низина.
Эксперименты с использованием культур 4 и 5 проводили, чтобы установить влияние 5 нг/мл низина на размножение культуры вследствие активации промотора низина, после которого в данном случае отсутствует ген-мишень. Не наблюдали какого-либо влияния на размножение (данные не приведены).
Исследования методом вестерн-блоттинга проводили с использованием образцов обоих условий индукции. Детектирование чФРФ-2 проводили с использованием антител, описанных выше в пункте 1.8.
На Фигуре 8 представлены дорожки 3 и 4 вестерн-блотов для оценки исходной экспрессии ФРФ-2 без индукции низином.
Помимо этого, на Фигуре 8 показано, что после индукции культуры при OD600=0,5 выработка чФРФ-2 сильно индуцируется и увеличивается на протяжении почти 6 часов после момента индукции.
Полоски чФРФ-2 из геля после электрофореза в ДСН-ПААГ (индукция при OD600=0,5 с использованием 5 нг/мл низина, моменты времени t=4 и t=6) выделяли и отправляли в Eurosequence BV (Гронинген, Нидерланды) для N-концевого секвенирования аминокислотной последовательности.
После очистки образцов определяли предварительную N-концевую аминокислотную последовательность. Определенная последовательность представляла собой: Ala-Gly-Ser-Ile-Thr-Thr.
Полученная последовательность точно соответствует ожидаемой последовательности после отщепления сигнальной последовательности. Ожидаемая последовательность имеет вид: AGSITTLPAL. Полученные результаты означают, что чФРФ-2 экспрессируется, секретируется и правильно расщепляется в L. lactis.
Супернатант культуры NZ3900 (рФРФ-2), индуцированной при t=0,5 с использованием 5 нг/мл низина, использовали в нижеследующих примерах. Культура была обозначена AUP-10.
b) Выработка чИЛ-4 в L. lactis NZ3900 (рИЛ-4) при ферментации в контролируемых условиях
Для того чтобы установить выход культур NZ3900 (рИЛ-4), проводили эксперименты с ферментацией в контролируемых условиях:
1. NZ3900 (рИЛ-4) без индукции;
2. NZ3900 (рИЛ-4), индуцированная при OD600=0,5 с использованием 5 нг/мл низина;
3. NZ3900 (рИЛ-4), индуцированная при OD600=3 с использованием 5 нг/мл низина.
Образцы отбирали при t=0 (перед индукцией), t=2 часа, t=4 часа и t=6 часов после индукции с указанным количеством низина.
Выработку чИЛ-4 исследовали во фракции супернатанта и свободного от клеток экстракта с помощью электрофореза в ДСН-ПААГ в комбинации с вестерн-блоттингом. Детектирование чИЛ-4 проводили с использованием антител, описанных выше в пункте 1.8.
При электрофорезе в ДСН-ПААГ в буфер для приготовления образца и подвижный буфер добавляли ДТТ, чтобы облегчить диссоциацию дисульфидных мостиков. Эти же гели после электрофореза в ДСН-ПААГ также использовали для вестерн-блоттинга для специфичного детектирования чИЛ-4.
При добавлении ДТТ чИЛ-4 образует одну полосу белка в геле, окрашенном Кумасси синим, а также при вестерн-блоттинге (см. Фигуру 9).
Препарат эталонного белка чИЛ-4 также использовали без белка-носителя. Полоса стандартного белка находится на той же высоте, что и белка, который вырабатывается клетками L. lactis NZ3900 (рИЛ-4).
Результаты исследования методом вестерн-блоттинга позволили получить более подробные данные об экспрессии чИЛ-4 в L. lactis NZ3900 (рИЛ-4).
Индукция происходит, когда культуру индуцируют при OD600=0,5 с использованием 5 нг/мл низина, но не при индукции при OD600=3 с использованием 5 нг/мл низина. Выработка чИЛ-4 продолжается вплоть до по меньшей мере 6 ч. В этот период концентрация ИЛ-4 в супернатанте возрастает.
Полоски чИЛ-4 из геля после электрофореза в ДСН-ПААГ (индукция при OD600 = 0,5 с использованием 5 нг/мл низина, моменты времени t=4 и t=6) выделяли и отправляли в Eurosequence BV для N-концевого секвенирования аминокислотной последовательности.
После очистки образцов определяли предварительную N-концевую аминокислотную последовательность. Определенная последовательность имела вид: Ala-His-Lys-Cys.
Полученная последовательность точно соответствует ожидаемой последовательности после отщепления сигнальной последовательности. Ожидаемая последовательность имела вид: AHKCDITLQE.
Полученные результаты означают, что чИЛ-4 экспрессируется, секретируется и правильно расщепляется в L. lactis.
Супернатант культуры NZ3900 (рИЛ-4), индуцированной при OD600=0,5 с использованием 5 нг/мл низина, использовали в нижеследующих примерах. Культуру обозначили AUP-12.
с) Выработка чКСФ-1 в L. lactis NZ3900 (рКСФ-1) при ферментации в контролируемых условиях
Для того чтобы установить выход культуры NZ3900 (рКСФ-1), проводили эксперименты с ферментацией в контролируемых условиях. Проводили следующие три эксперимента с ферментацией.
1. NZ3900 (рКСФ-1) без индукции;
2. NZ3900 (рКСФ-1), индуцированная при OD600=0,5 с использованием 5 нг/мл низина;
3. NZ3900 (рКСФ-1), индуцированная при OD600=3 с использованием 5 нг/мл низина.
Культуру NZ3900 (рКСФ-1) обозначили AUP-14.
Образцы отбирали при t=0 (перед индукцией), t=2 часа, t=4 часа и t=6 часов после индукции с указанным количеством низина.
Выработку чКСФ-1 исследовали во фракции супернатанта и свободного от клеток экстракта с помощью электрофореза в ДСН-ПААГ в комбинации с вестерн-блоттингом. Детектирование чКСФ-1 проводили с использованием антител, описанных выше в пункте 1.8.
При проведении электрофореза в ДСН-ПААГ в буфер для приготовления образцов и подвижный буфер добавляли ДТТ, чтобы облегчить диссоциацию дисульфидных мостиков. Эти же гели после электрофореза в ДСН-ПААГ также использовали для вестерн-блоттинга для специфичного детектирования чКСФ-1.
Результаты исследования методом вестерн-блоттинга (см. Фигуру 11) указывают на присутствие небольшого количества димера в дорожке с эталонным белком. Помимо этого, гель, окрашенный Кумасси синим (см. Фигуру 10), также свидетельствует о присутствии полосы, размер которой аналогичен таковому для эталонного белка.
В неиндуцированных культурах не удалось детектировать выработку чКСФ-1 в исходных условиях. В культурах, индуцированных при OD600=0,5 с использованием 5 нг/мл низина, выработка КСФ-1 увеличивается с течением времени вплоть до по меньшей мере 6 ч. Наблюдали лишь небольшое количество продуктов разложения.
Полосы чКСФ-1 из геля после электрофореза в ДСН-ПААГ (индукция при OD600=0,5 с использованием 5 нг/мл низина, моменты времени t=4 и t=6), выделяли и подвергали N-концевому секвенированию аминокислотной последовательности.
После очистки образцов определяли предварительную N-концевую аминокислотную последовательность. Определенная последовательность имела вид: Ala-Glu-Glu-Val-Ser.
Полученная последовательность точно соответствует ожидаемой последовательности после отщепления сигнальной последовательности. Ожидаемая последовательность имеет вид: AEEVSEYCSH.
Полученные результаты означают, что чКСФ-1 экспрессируется, секретируется и правильно расщепляется в L. lactis.
Супернатант культуры NZ3900 (рКСФ-1), индуцированный при OD600=0,5 с использованием 5 нг/мл низина, использовали в нижеследующих примерах. Культуру обозначили AUP-14.
d) Выработка чФРФ-2, чИЛ-4 и чКСФ-1 в L. lactis NZ3900 с одного оперона при ферментации в контролируемых условиях
Получали 3 конструкции с использованием 3 из 6 перестановок трех генов (ФРФ-2, ИЛ-4, КСФ-1):
a). чФРФ-2, чИЛ-4, чКСФ-1;
b). чКСФ-1, чФРФ-2, чИЛ-4;
c). чИЛ-4, чКСФ-1, чФРФ-2.
Для конструирования оперонов каждый ген обеспечивали его собственным участком связывания рибосомы для инициации трансляции и собственным сигнальным пептидом для секреции белка. В отношении сигнального пептида ранее было решено использовать одну и ту же сигнальную последовательность (ssUsp45) для всех трех генов. Чтобы избежать больших идентичных нуклеотидных областей на плазмиде в непосредственной близости друг от друга (возможность интра-плазмидой рекомбинации/делеций), один и тот же сигнальный пептид кодировали с помощью различных кодонов на основе вырожденности кодонов и частоты применения кодонов L. lactis.
Для каждого из первых генов 3 конструкций использовали участок связывания рибосомы из гена низина A (nisA). Для двух других генов каждой из 3 конструкций участки связывания рибосомы из гена гаммы-субъединицы АТФ-синтазы (atpG) и гена галактозид-О-ацетилтрансферазы (lacA) выбирали на основе хорошего соответствия 3'-концому рРНК 16S L. lactis, как описано в Bolotin et al. (2001) («The complete genome sequence of the lactic acid bacterium Lactococcus lactis ssp. lactis IL1403», Genome Res. Volume 11, pages 731 to 753). Нуклеотидная последовательность генома L. lactis IL1403 доступна в NCBI под номером доступа АЕ 005176.1.
Обзор всех трех участков связывания рибосомы представлен на Фигуре 24а. Помимо этого последовательности нуклеиновых кислот, обеспечивающие соответствующие участки связывания рибосомы, включая стартовый кодон (ATG) соответствующей открытой рамки считывания, также приведены в SEQ ID NO: 51 в SEQ ID NO: 53.
3'-Конец рРНК 16S L. lactis (5' GGAUCACCUCCUUUCU 3') приведен в SEQ ID NO: 54. На Фигуре 24а рРНК 16S показана как рДНК 16S, в которой урацил (U) был заменен тимидином (Т).
На Фигуре 24а также представлена шестинуклеотидная консенсусная последовательность из последовательности Шайна-Дальгарно (5'-AGGAGG-3'). Последовательность Шайна-Дальгарно представляет собой участок связывания рибосомы в прокариотической иРНК, обычно расположенный приблизительно на 8 оснований левее стартового кодона. Последовательность РНК помогает привлекать рибосомы к мРНК, чтобы инициировать синтез белка, путем совмещения рибосомы со стартовым кодоном.
Три оперона конструировали так, чтобы синтезированные последовательности могли быть клонированы в один этап в плазмиду pNZ8149 с использованием сайтов PsuI и NcoI вектора (BamHI и PsuI совместимы). Помимо этого, сайты MluI вводили перед участками связывания рибосомы перед генами 2 и 3. Соответственно, создание оставшихся трех оперонов можно было осуществлять путем делеции среднего гена и клонирования третьего гена с помощью ПЦР с использованием сайтов NcoI и XbaI плазмиды.
Соответствующие последовательности синтезированных нуклеиновых кислот представлены на Фигурах 24b и 24d и приведены в SEQ ID NO: 55-SEQ ID NO: 57. Частота использования кодонов трех генов была адаптирована для L. lactis.
Экспрессию с каждой из 3 конструкций контролировали с помощью одного промотора низина А, за которым были расположены указанные выше последовательности нуклеиновых кислот, кодирующих белок-предшественник чФРФ-2-153, белок-предшественник чИЛ-4 и белок-предшественник чКСФ-1, полученные в примере 1.
Готовые продукты синтеза генов получали из BaseClear, каждый в виде фрагмента, клонированного в вектор Е. coli pUC57.
Указанные фрагменты клонировали в плазмиду pNZ8149 путем расщепления плазмиды pUC57, содержащей соответствующие продукты синтеза генов, ферментами рестрикции BamHI и NcoI. Фрагменты после рестрикции BamHI/NcoI, содержащие соответствующие продукты синтеза генов, выделяли и лигировали в плазмиду pNZ8149, разрезанную PsuI и NcoI, с получением соответствующих плазмид:
- pC-F-I (содержит фрагмент продукта синтеза гена КСФ-RBS1-ФРФ-RBS2-ИЛ-4 после рестрикции BamHI/NcoI),
- pF-I-C (содержит фрагмент продукта синтеза гена ФРФ-RBS1-ИЛ-4-RBS2-КСФ после рестрикции BamHI/NcoI), и
- pI-C-F (содержит фрагмент продукта синтеза гена ИЛ-4-RBS-КСФ-RBS2-ФРФ после рестрикции BamHI/NcoI).
Соответствующие использованные эндонуклеазы рестрикции получали от Thermo Fisher Scientific Inc.
Соответствующие конструкции трансформировали в L. lactis NZ3900.
По 5 колоний каждой из трех конструкций выращивали при ферментации с регулируемым показателем рН, индуцировали при OD600=0,5 с использованием 5 нг/мл низина и собирали через 4 часа.
1 мл супернатанта осаждали ТХУ и вносили в одну лунку геля для электрофореза в ДСН-ПААГ. Один гель окрашивали Кумасси синим и другие обрабатывали для проведения вестерн-блоттинга для трех белков-мишеней.
Соответствующие гели после электрофореза в ДСН-ПААГ, а также вестерн-блоты обрабатывали, как описано выше и изображено на Фигурах 24e-24g.
Как можно видеть на Фигуре 24е, конструкция а) pF-I-С (ФРФ-2, чИЛ-4, чКСФ-1) приводила к экспрессии и секреции большого количества ФРФ-2, а также небольшого количества ИЛ-4 и КСФ-1.
Как можно видеть на Фигуре 24f, конструкция b) pC-F-I (чКСФ-1, чФРФ-2, чИЛ-4) приводила к экспрессии и секреции большого количества КСФ-1 и ФРФ-2, а также среднего количества ИЛ-4.
Как можно видеть на Фигуре 24g, конструкция с) pI-C-F (чИЛ-4, чКСФ-1, чФРФ-2) приводила к экспрессии и секреции большого количества ИЛ-4 и незначительно более низкого количества КСФ-1 и ФРФ-2. Гели, окрашенные Кумасси синим, свидетельствовали о наиболее эффективной выработке и индукции всех трех белков.
Три целевых белка могут быть клонированы и экспрессированы с одного оперона с высвобождением соответствующих белков чИЛ-4, чКСФ-1 и чФРФ-2 в супернатант.
Пример 3: Индукция выработки ФРФ-2 в условиях, которые напоминают обстоятельства заживления ран
Физиологические условия в ране отличаются от условий in vitro или условий в ферментере.
В этой связи эксперимент был спроектирован так, чтобы проверить индукцию системы NICE® и, следовательно, выработку чФРФ-2 в условиях, когда штамм NZ3900 не размножается или размножается исключительно с минимальной скоростью. Эти условия имеют место, если показатель рН культуры достиг 5,0, и когда культура переходит в стационарную фазу.
Эксперимент проводили в 200 мл колбах с перемешиванием и контролем рН. В качестве ростовой среды использовали среду IM1 с добавлением 2% масс./об. Na-бета-глицерофосфата и 0,5% масс/об. лактозы. Проводили следующие эксперименты по ферментации:
1. NZ3900 (рФРФ-2) - без индукции;
2. NZ3900 (рФРФ-2) - индукция, когда культура достигает рН=5, с использованием 1 нг/мл низина;
3. NZ3900 (рФРФ-2) - индукция, когда культура достигает рН=5, с использованием 0,1 нг/мл низина;
4. NZ3900 (рФРФ-2) - индукция, когда культура достигает OD600=3, с использованием 1 нг/мл низина;
5. NZ3900 (рФРФ-2) - индукция, когда культура достигает OD600=3, с использованием 0,1 нг/мл низина.
Культуры собирали через 3 часа после индукции. Контрольную культуру собирали в то же самое время, что и культуры, которые были индуцированы при рН 5,0. Результаты представлены на Фигуре 11.
На Фигуре 12 показано, что размножение и динамика изменения рН идентичны во всех пяти культурах и что индукция низином не оказывает влияния на размножение или динамику изменения рН.
Образование чФРФ-2 измеряли в 1 мл супернатанта культуры с помощью электрофореза в ДСН-ПААГ и вестерн-блоттинга. На Фигуре 13 видно, что в условиях подавления размножения клеток или в фазе замедления размножения клеток низин не индуцирует экспрессию генов. По сравнению с выработкой ФРФ-2 в исходных условиях (без индукции) количество ФРФ-2 в супернатанте культур увеличивается лишь незначительно или не увеличивается.
Результаты исследования методом вестерн-блоттинга показали, что чФРФ-2 детектируется в супенатантах всех пяти культур. Помимо этого, детектировали два продукта разложения чФРФ-2.
Полученные результаты означают, что весь ФРФ-2 с сигнальной последовательностью, который вырабатывается в клетке, подвергается расщеплению и секретируется.
Ген ФРФ-2 человека клонировали в вектор экспрессии NICE® пищевого класса для Lactococcus lactis.
Экспрессия гена ФРФ-2 может быть индуцирована добавлением низина. чФРФ-2 секретируется в супернатант в концентрации приблизительно 100-200 нг/мл. Определение N-концевой аминокислотной последовательности секретируемого ФРФ-2 выявило, что белок правильно расщеплен.
Индукция выработки ФРФ-2 приводит к ограниченной задержке размножения, но не остановке размножения.
При контролируемой ферментации выработка ФРФ-2 была индуцирована в широком диапазоне кривой размножения (между OD600=0,5-3). Самый высокий уровень выработки ФРФ-2 наблюдали после индукции при OD600=0,5 с использованием 5 нг/мл низина.
Плазмида рФРФ-2 является стабильной в течение по меньшей мере 100 поколений в штамме NZ3900 при неселективных условиях, таких как размножение в присутствии глюкозы.
Пример 4а: Количественное исследование миграции фибробластов человека
Биологическую активность ФРФ-2, высвобождаемого из Lactococcus lactis NZ3900 (рФРФ-2), и ИЛ-4, высвобождаемого из Lactococcus lactis NZ3900 (рИЛ-4), в отношении заживления ран оценивали путем измерения миграции нормальных фибробластов кожи человека (НФКЧ) в искусственную зону миграции. Действие исследуемого соединения оценивали с помощью анализа изображения восстановления раны.
Lactococcus lactis NZ3900 (рФРФ-2), описанные в примере 2а, и Lactococcus lactis NZ3900 (рИЛ-4), описанные в примере 2b, индуцировали при OD600=0,5 с использованием 5 нг/мл низина. Через 6 ч ферментации соответствующие супернатанты культур выделяли, лиофилизировали и хранили при -20°С, как описано выше.
Для проведения последующих исследований из лиофилизированных супернатантов готовили исходные растворы с концентрацией 1 мг/мл путем восстановления порошка раствором трис-HCl (5 мМ, рН=7,6). Исходный раствор AUP-10 получали из супернатанта культуры Lactococcus lactis NZ3900 (рФРФ-2), описанной в примере 2а. Исходный раствор AUP-12 получали из супернатанта культуры Lactococcus lactis NZ3900 (рИЛ-4), описанной в примере 2b.
Исходные растворы разбавляли средой для проведения количественного исследования №1 до конечной концентрации 0,5 нг/мл, 1 нг/мл, 2,5 нг/мл и 5 нг/мл, соответственно, для AUP-10 (ФРФ-2), и до конечной концентрации 0,1 нг/мл, 1 нг/мл, 5 нг/мл и 10 нг/мл, соответственно, для AUP-12 (ИЛ-4).
Указанные концентрации для исходных растворов, а также разведения относятся к общему количеству белка, который присутствует в соответствующем растворе и который в основном соответствует количеству ФРФ-2 и ИЛ-4 в супернатантах культуры Lactococcus lactis NZ3900 (рФРФ-2), описанной в примере 2а, и культуры Lactococcus lactis NZ3900 (рИЛ-4), описанной в примере 2b, соответственно.
Помимо этого рекомбинантный основный ФРФ человека (Fiblast), который был приобретен у Kaken Pharmaceutical Co., Inc (Токио, Япония), разбавляли средой для проведения количественного исследования №1 до конечной концентрации 0,5 нг/мл, 1 нг/мл, 2,5 нг/мл и 5 нг/мл, соответственно.
Рекомбинантный ИЛ-4 человека, который был приобретен у R&D systems (Миннеаполис, Миннесота, США), разбавляли трис-HCl (5 мМ, рН=7,6) до конечной концентрации 0,1 нг/мл, 1 нг/мл, 5 нг/мл и 10 нг/мл, соответственно.
Нормальные фибробласты кожи человека (НФКЧ) были получены от Lonza Group AG (Базель, Швейцария).
Фибробласты высевали в 96-луночные микропланшеты, предназначенные для исследования миграции, и инкубировали в течение 24 часов.
- Условия культивирования: 37°С, 5% СО2.
- Культуральная среда: среда Игла в модификации Дульбекко (DMEM) с добавлением 2 мМ L-глутамина, 50 ед./мл пенициллина, 50 мкг/мл стрептомицина и 10% фетальной сыворотки теленка (ФСТ) по объему.
Лунки указанных планшетов покрывали раствором коллагена, и прокладку, предотвращающую высевание клеток, помещали в центре лунки, чтобы ограничить высев клеток наружными кольцевыми областями лунки, создавая тем самым искусственную рану (зону миграции). Затем клетки помечали с использованием кальцеина-АМ, полученного от Thermo Fisher Scientific.
Кальцеин-АМ представляет собой проникающий в клетки краситель, который может быть использован для определения жизнеспособности клеток в большинстве эукариотических клеток. В живых клетках после гидролиза сложного ацетоксиметильного эфира внутриклеточными эстеразами нефлуоресцентный кальцеин-АМ превращается во флуоресцентную форму кальцеина с испусканием в зеленой части спектра.
После 30 минут инкубации прокладки удаляли и культуральную среду заменяли средой для проведения количественного исследования №1, содержащей исследуемые соединения (ФРФ-2, Fiblast, ИЛ-4 или рекомбинантный чИЛ-4), или только средой для проведения количественного исследования №1 (контроль) или контрольной средой (10% ФСТ). Клетки затем инкубировали в течение 72 часов. Все экспериментальные условия выполняли при n=5.
Среда для проведения количественного исследования №1: DMEM с добавлением 2 мМ L-глутамина, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина.
Миграцию клеток в зону миграции наблюдали через 0, 24, 48 и 72 часа инкубации с использованием микроскопа NIKON Diaphot 300 (объектив с 4-кратным увеличением), и изображения получали с помощью камеры Nikon DX-1200.
Поверхность искусственной раны измеряли в каждый момент времени и сопоставляли с площадью до миграции, измеренной в Т0 для визуализации и количественной оценки восстановления раны. Действие исследуемых соединений на миграцию клеток сравнивали с необработанным контролем.
Соответствующие применяемые концентрации составили 0,5 нг/мл, 1,0 нг/мл, 2,5 нг/мл и 5,0 нг/мл для чФРФ-2 и 0,1 нг/мл, 1 нг/мл, 5 нг/мл и 10 нг/мл для чИЛ-4. После 72 ч воздействия исследуемых соединений миграцию фибробластов сравнивали с фибробластами, которые инкубировали с ростовой средой (контроль).
Процент восстановления области искусственной раны представлен на Фигурах 14а и 14b.
На Фигуре 14а показано значительное увеличение миграции фибробластов после инкубации с рекомбинантными пробиотическими бактериями, экспрессирующими чФРФ-2. В экспериментальных условиях количественного исследования рекомбинантный основный ФРФ человека (Fiblast,), приобретенный у Kaken Pharmaceutical Co., Inc (Токио, Япония), не модулировал миграцию и пролиферацию НФКЧ.
чФРФ-2, который экспрессируется в рекомбинантных пробиотических бактериях AUP-10, полученных в примере 2а, обладает биологической активностью.
На Фигуре 14b показано, что культуральная среда AUP-12, содержащая 0,1-10 нг/мл чИЛ-4, индуцирует пролиферацию НФКЧ, аналогично рчИЛ-4.
чИЛ-4, который экспрессируется в рекомбинантных пробиотических бактериях AUP-12, полученных в примере 2b, обладает биологической активностью.
Пример 4b: ERK1- и ERK2-фосфорилирование в нормальных фибробластах кожи человека и в лимфобластах мыши
Биологическую активность ФРФ-2, высвобождаемого из Lactococcus lactis NZ3900 (рФРФ-2), дополнительно оценивали путем измерения фосфорилирования киназы, регулируемой внеклеточными сигналами 1 (ERK1), и киназы, регулируемой внеклеточными сигналами 2 (ERK2), в нормальных фибробластах кожи человека (НФКЧ).
Биологическую активность КСФ-1, высвобождаемого из Lactococcus lactis NZ3900 (рКСФ-1), оценивали путем измерения фосфорилирования киназы, регулируемой внеклеточными сигналами 1 (ERK1), и киназы, регулируемой внеклеточными сигналами 2 (ERK2), в линии лимфобластов мыши M-NFS-60.
Исходный раствор AUP-10 получали, как описано выше в примере 4а.
Помимо этого культуру Lactococcus lactis NZ3900 (рКСФ-1), описанную в примере 2с (AUP-14), индуцировали при OD600=0,5 с использованием 5 нг/мл низина. Через 6 ч ферментации супернатант культуры выделяли, лиофилизировали и хранили при -20°С. Для дальнейшего исследования из лиофилизированного супернатанта готовили исходный раствор с концентрацией общего белка 1 мг/мл путем восстановления порошка трис-HCl (5 мМ, рН=7,6) с получением исходного раствора AUP-14.
Исходные растворы дополнительно разбавляли соответствующей средой, не содержащей сыворотки, до конечной концентрации 0,4 нг/мл, 4 нг/мл, 40 нг/мл и 80 нг/мл, соответственно, для AUP-10 (ФРФ-2) и конечной концентрации 0,2 нг/мл, 2 нг/мл, 20 нг/мл и 40 нг/мл, соответственно, для AUP-14 (КСФ-1).
Рекомбинантный основный ФРФ человека от Kaken Pharmaceutical Со. разбавляли средой, не содержащей сыворотки (среда для проведения количественного исследования №1) до конечной концентрации 0,5 нг/мл, 5 нг/мл, 50 нг/мл и 100 нг/мл, соответственно.
Рекомбинантный КСФ-1 человека, который был приобретен у Abcam PLC (Кембридж, Великобритания), разбавляли средой, не содержащей сыворотки (среда для проведения количественного исследования №2) до конечной концентрации 0,2 нг/мл, 2 нг/мл, 20 нг/мл и 40 нг/мл, соответственно.
Нормальные фибробласты кожи человека (НФКЧ) высевали в 96-луночные микропланшеты и инкубировали в течение 24 часов в условиях, описанных выше в примере 4а.
Клетки мыши M-NFS-60 (АТСС® CRL-1838™) получали от LGC Standards GmbH (Везел, Германия). Клетки высевали в 96-луночные микропланшеты и инкубировали в течение 24 часов при следующих условиях:
- Условия культивирования: 37°С.
- Культуральная среда: среда RPMI-1640 (Life Technologies Corporation, Карлсбад, Калифорния, США) с добавлением 0,05 мМ 2-меркаптоэтанола, 62 нг/мл рекомбинантного макрофагального колониестимулирующего фактора человека (М-КСФ), 50 ед./мл пенициллина, 50 мкг/мл стрептомицина и фетальной сыворотки теленка до конечной концентрации 10% по объему.
- Среда для проведения количественного исследования №2: среда RPMI-1640, дополненная 0,05 мМ 2-меркаптоэтанола, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина.
НФКЧ в фазе экспоненциального размножения инкубировали в среде, не содержащей сыворотки (в среде для количественного исследования №1), в течение 24 часов, переносили в пробирки производства компании Eppendorf (0,5×105 клеток/пробирку) и инкубировали в течение 15 мин при 37°С в среде, не содержащей сыворотки (в среде для количественного исследования №1), в среде, содержащий 0,5 нг/мл, 5 нг/мл, 50 нг/мл и 100 нг/мл рчФРФ-2 или разведения исходного раствора AUP-10 в конечных концентрациях, указанных выше. Затем клетки промывали фосфатно-солевым буфером (ФСБ) и ресуспендировали в буфере для лизиса.
Клетки мыши M-NFS-60 в фазе экспоненциального размножения инкубировали в среде, не содержащей сыворотки (в среде для количественного исследования №2), в течение 24 часов, переносили в пробирки производства компании Eppendorf (2×106клеток/пробирку) и инкубировали с Ki-20227 в концентрации 1 мкМ в течение 1 часа. Ингибитор c-fms, Ki-20227, полученный от Abcam PLC, использовали в качестве контроля для оценки специфичности рецептора КСФ-1 (КСФ-1R).
Через 1 ч инкубации с Ki-20227 клетки инкубировали в течение 15 мин при 37°С в среде для количественного исследования №2, содержащей 0,2, 2, 20 и 40 нг/мл рчКСФ-1 или разведения исходного раствора AUPA-14 в конечной концентрации, указанной выше. Затем клетки промывали ФСБ и ресуспендировали в буфере для лизиса.
Буфер для лизиса содержит 0,5% по объему Surfact-Amps NP-40 (Pierce Biotechnology, Рокфорд, Иллинойс, США), 20 мМ Hepes (рН=8,0), 0,35 М NaCl, 0,1 мМ ЭГТА, 0,5 мМ ЭДТА, 1 мМ MgCl2, 20% по объему глицерина, 1 мМ ДТТ, 1 мкг/мл лейпептина, 0,5 мкг/мл пепстатина, 0,5 мкг/мл апронитина и 1 мМ фтористого фенилметилсульфонила.
Клетки инкубировали в течение 15 мин на льду, и клеточные белки получали путем центрифугирования. Концентрацию белка определяли с помощью количественного исследования по методу Брэдфорд (Bio-Rad), и 50 мкг белков кипятили в буфере Лэммли и подвергали электрофорезу в 10% полиакриламидном геле с добавлением додецилсульфата натрия. Разделенные белки переносили на нитроцеллюлозные мембраны (24 В) в течение 30 мин. Блоты блокировали в трис-солевом буферном растворе, содержащем 0,1% твин-20 и 5% обезжиренного сухого молока, экспрессию фосфорилированных форм ERK 1+2 и общее количество ERK 1+2 определяли с использованием следующих специфичных антител.
Для детектирования ERK1 и ERK2 использовали поликлональные антитела кролика к ERK1 и ERK2 человека (цельная антисыворотка, полученная от Sigma-Aldrich Chemie GmbH, Мюнхен, Германия, каталожный номер № М5670) в разведении 1:10000. Вторичное антитело представляло собой соединенное с пероксидазой хрена (ПХ) антитело к IgG кролика в разведении 1:10000, полученное от

Для детектирования фосфорилированных форм ERK1 и ERK2 использовали очищенное моноклональное антитело мыши к p-ERK человека (Е-4) (Santa Cruz Biotechnology, Inc., Гейдельберг, Германия, каталожный номер № SC-7383) в разведении 1:1000. p-ERK (Е-4) представляет собой эпитоп мышиного моноклонального антитела, соответствующий последовательности, содержащей фосфорилированный остаток Tyr204 ERK, полученной от человека. Моноклональное антитело детектирует ERK1, фосфорилированную в остатке Tyr 204, и соответственно фосфорилированную форму ERK 2 мыши, крысы и человека.
Вторичное антитело представляло собой соединенное с пероксидазой хрена (ПХ) антитело к IgG мыши в разведении 1:10000, полученное от

Индукцию фосфорилирования ERK1 + 2 количественно оценивали с помощью программного обеспечения ImageJ (Национального института здоровья, Бетесда, Мэриленд, США).
Как следует из Фигуры 14с, культуральная среда AUP-10, содержащая 0,4-80 нг/мл ФРФ-2, индуцирует фосфорилирование ERK 1+2 в НФКЧ, аналогично рчФРФ-2.
Как следует из Фигуры 14d, культуральная среда AUP-14, содержащая 0,2-40 нг/мл КСФ-1, индуцируют фосфорилирование ERK 1+2 в мышиных клетках M-NFS-60, аналогично рчКСФ-1.
Пример 4с: Ингибирование индуцированной липополисахаридом (ЛПС) М1-активации мононуклеарных клеток периферической крови человека (МКПК)
Линию клеток человека ТНР-1 (АТСС® TIB-202™) получали от LGC Standards GmbH. Клетки высевали в 96-луночные микропланшеты и инкубировали в течение 24 часов при следующих условиях:
- Условия культивирования: 37°С, 5% СО2.
- Культуральная среда: среда RPMI-1640 (Life Technologies Corporation, Карлсбад, Калифорния, США) с добавлением 0,05 мМ 2-меркаптоэтанола, 50 ед./мл пенициллина, 50 мкг/мл стрептомицина и фетальной сыворотки теленка до конечной концентрации 10% по объему.
- Среда для количественного исследования №2: среда RPMI-1640, дополненная 0,05 мМ 2-меркаптоэтанола, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина.
Линия клеток ТНР1 представляет собой линию моноцитов человека, полученную от пациента с острым моноцитарным лейкозом. Клетки ТНР-1 дифференцировали в макрофаги и поляризовали в соответствии с установленными протоколами. Для поляризации использовали липополисахарид (ЛПС), полученный из Escherichia coli (серотип 026:В6 - получен от Sigma-Aldrich), и гамма-интерферон (ИФН-γ), полученный от U-Cytech (Утрехт, Нидерланды).
В общих чертах, 1 миллион клеток ТНР1 высевали в 6-луночные планшеты в 3 мл среды DMEM с добавлением 100 нг/мл форбол-12-миристат-13-ацетата (РМА), который получали от Sigma-Aldrich, в течение 24 часов, чтобы вызвать дифференцировку в неполяризованные макрофаги (неполяризованные макрофаги, полученные из ТНР-1).
После дифференцировки неполяризованные макрофаги, полученные из ТНР-1, обрабатывали в течение 48 часов ЛПС (1 мкг/мл) и ИФН-γ (100 Ед/мл) в среде DMEM, чтобы индуцировать M1 фенотип с получением M1-поляризованных макрофагов, полученных из ТНР-1.
Для ингибирования M1-поляризации неполяризованные макрофаги, полученные из ТНР-1, сначала инкубировали с разведениями исходного раствора AUP-12, полученными в примере 4а, или с разведениями исходного раствора рекомбинантного ИЛ-4 человека (рчИЛ-4) в течение 18 часов и затем стимулировали, как описано выше с использованием ЛПС и ИФН-γ в течение дополнительных 48 часов.
Исходный раствор AUP-12 с общей концентрацией белка 1 мг/мл разбавляли до концентрации 0,1%, 1%, 10% и 20% по объему средой DMEM. Исходный раствор рчИЛ-4 разбавляли до концентрации 0,1 нг/мл, 1 нг/мл, 10 нг/мл и 20 нг/мл по объему средой DMEM.
Клетки собирали, и общую РНК экстрагировали с использованием набора для выделения РНК High Pure (Roche Diagnostics). Общую РНК (1 мкг) подвергали обратной транскрипции с использованием набора для синтеза кДНК iScript™ (Bio-Rad; Геркулес, Калифорния, США), и полученную кДНК исследовали методом ПЦР в реальном времени, используя iQTM SYBR Green Supermix (Bio-Rad, Геркулес, Калифорния, США). ПЦР в реальном времени проводили с использованием системы детектирования для ПЦР в реальном времени CFX96 (Bio-Rad, Геркулес, Калифорния, США). Ген HPRT использовали для стандартизации экспрессии мРНК в каждом образце, и экспрессию генов количественно оценивали с использованием метода 2-ΔΔCt. В качестве маркера M1 поляризации использовали выработку мРНК фактора некроза опухоли альфа (ФНО-α).
На Фигуре 14е показано ингибирование ЛПС-индуцированной выработки мРНК ФНО-α в клетках ТНР-1 человека.
Как следует из Фигуры 14е, культуральная среда AUP-12 ингибирует ЛПС-индуцированную выработку мРНК ФНО-α в клетках ТНР-1 человека, аналогично рчИЛ-4. Эффективная доза рчИЛ-4 составляет 1-20 нг/мл.
Знак * на Фигуре 14е означает р-значение Р<0,05 по сравнению с ЛПС по отдельности. Столбики ошибок обозначают стандартное отклонение.
Пример 4d: Индукция М2-поляризации в макрофагах, полученных из ТНР1
Чтобы индуцировать М2-поляризацию неполяризованные макрофаги, происходящие из ТНР-1, полученные в примере 4с, инкубировали в течение 18 часов с разведениями исходного раствора AUP-12, полученными в примере 4а, или с разведениями исходного раствора рекомбинантного ИЛ-4 человека (рчИЛ-4) с конечной концентрацией 20 нг/мл.
Исходный раствор AUP-12 с общей концентрацией белка 1 мг/мл разбавляли до концентрации 0,1% и 1% по объему средой DMEM.
Клетки исследовали, как описано выше. После поляризации клетки собирали и экстрагировали общую РНК. Общую РНК подвергали обратной транскрипции, и полученную кДНК исследовали методом ПЦР в реальном времени. ПЦР в реальном времени проводили с использованием системы детектирования для ПЦР в реальном времени CFX96. Ген HPRT использовали для стандартизации экспрессии мРНК в каждом образце, и экспрессию генов количественно оценивали с использованием метода 2-ΔΔCt. В качестве маркера М2 поляризации использовали макрофагальный рецептор маннозы 1 человека (MRC1) и Kruppel-подобный фактор 4 (KLF4).
На Фигуре 14f показана индукция экспрессии РНК генов М2 для макрофагального рецептора маннозы 1 (MRC1) и Kruppel-подобного фактора 4 (KLF4) в макрофагах, полученных из ТНР1.
Как следует из Фигуры 14f, культуральная среда AUP-12 индуцирует экспрессию РНК генов М2 для макрофагального рецептора маннозы 1 (MRC1) и Kruppel-подобного фактора 4 (KLF4) в макрофагах, полученных из ТНР1, аналогично рчИЛ-4. Эффективная доза рчИЛ-4 составляет 2-20 нг/мл.
Знак * на Фигуре 14f означает р-значение Р<0,05 по сравнению с М0 (М0 = РМА-индуцированные ТНР1) и Mn = не индуцированные ТНР1. ** на Фигуре 14f означает р-значение Р<0,05 по сравнению с Mn = не индуцированные ТНР1. Столбики ошибок обозначают стандартное отклонение.
Пример 4е: Влияние среды AUP-12 на транскрипционную активность STAT-6 в различных клеточных линиях
Для того чтобы определить биологическую активность рекомбинантного ИЛ-4 и AUP-12 в отношении транскрипционной активности STAT6 использовали линии клеток МO3.13 (человека) и НЕК293Т (человека), кратковременно совместно трансфецированные плазмидами, несущими STAT6 и STAT6-Luc (Addgene Inc, Кембридж, Массачусетс, США).
Клетки мезонефроса человека НЕК293Т (АТСС® CRL-3216™) получали от LGC Standards GmbH. Клетки высевали в 96-луночные микропланшеты и инкубировали в течение 24 часов при следующих условиях:
- Условия культивирования: 37°С, 5% СО2.
- Культуральная среда: среда DMEM, дополненная 50 ед./мл пенициллина, 50 мкг/мл стрептомицина и фетальной сывороткой теленка до конечной концентрации 10% по объему.
Гибридную линию глиальных клеток (олигодендроцитов) человека МО3.13 получали от Tebu-Bio GmbH (Оффенбах, Германия). Клетки высевали в 96-луночные микропланшеты и инкубировали в течение 24 часов при следующих условиях:
- Условия культивирования: 37°С.
- Культуральная среда: среда DMEM, дополненная 50 ед./мл пенициллина, 50 мкг/мл стрептомицина и фетальной сывороткой теленка до конечной концентрации 10% по объему.
Трансфекцию плазмидами, несущими STAT6 и STAT6-Luc, выполняли с использованием реагента RotiFect™ (Carl Roth GmbH Co. KG, Карлсруэ, Германия) в соответствии с рекомендациями производителя. Клетки обрабатывали в течение 6 часов с использованием 0,1 нг/мл, 1 нг/мл, 10 нг/мл, 20 нг/мл и 100 нг/мл рекомбинантного ИЛ-4 человека (чрИЛ-4) и разведений исходного раствора AUP-12. Исходный раствор AUP-12 разбавляли до концентрации 0,1%, 1%, 10% и 20% по объему средой DMEM.
Затем клетки лизировали в 25 мМ трис-фосфатном буфере, рН=7,8, содержащем 8 мМ MgCl2, 1 мМ ДТТ, 1% тритона Х-100 и 7% глицерина.
Активность люциферазы измеряли с использованием Autolumat LB 953 (EG&G Бертхолд, США) в соответствии с инструкциями для набора для количественного исследования люциферазы (Promega, Мэдисон, Висконсин, США). Результаты специфичных трансактиваций выражены в виде относительной индукции по сравнению с необработанными клетками.
На Фигуре 14g показана транскрипционная активность STAT-6 для среды AUP-12 и чрИЛ-4 в гибридной линии глиальных клеток человека (МО3.13).
На Фигуре 14h показана транскрипционная активность STAT-6 для среды AUP-12 и чрИЛ-4 в линии клеток мезонефроса человека 293.
Как следует из Фигур 14g и 14h, культуральная среда AUP-12 индуцирует транскрипционную активность STAT-6 в гибридной линии глиальных клеток человека (МО3.13), а также в линии клеток мезонефроса человека 293, аналогично рчИЛ-4. Эффективная доза рчИЛ-4 составляет от 0,1 до 20 нг/мл.
Пример 5: Эксперименты по исследованию закрытия ран
Последствия применения пробиотических бактерий, экспрессирующих ФРФ-2, КСФ- 1 и ИЛ-4 человека по отдельности или в комбинации, при полнослойных эксцизионных ранах у диабетических мышей db/db исследовали в комбинированном фармакокинетическом (ФК)/фармакодинамическом (ФД) исследовании эффективности. Далее бактерии, экспрессирующие ФРФ-2 (AUP-10), ИЛ-4 (AUP-12) и КСФ-1 (AUP14), оценивали по отдельности или в виде трехкомпонентной комбинации (т.е. AUP-10 + AUP-12 + AUP14) и сравнивали их эффективность с положительным контролем (т.е. комбинацией рекомбинантного белка ТФР-альфа + ФРТ-ВВ). Помимо этого бактерии, экспрессирующие ФРФ-2, ИЛ-4 и КСФ-1 в одной бактериальной клетке (AUP-16), оценивали и сравнивали с контрольным носителем (т.е. физиологическим раствором + пленочная повязка или среда IM1 + пленочная повязка) и положительным контролем (ТФР-альфа + ФРТ -ВВ).
Пациенты с сахарным диабетом склонны к нарушению процесса заживления ран, при этом особенно распространенными являются язвы на ногах. Аналогичное медленное заживление ран также характерно для животных с диабетом, включая мышей со спонтанным диабетом (db/db), которых покупали у The Jackson Laboratory (Bar Harbor, Мэн, США).
В первом исследовании и последующем втором исследовании использовали 99 самцов мышей, страдающих диабетом (название линии BKS.Cg-Dock7m +/+ Leprdb/J, торговый код 00642), в возрасте приблизительно 10 недель.
Рекомбинантные пробиотические бактерии, экспрессирующие ФРФ-2, КСФ-1 или ИЛ-4 человека по отдельности или в виде трехкомпонентной комбинации, а также рекомбинантные пробиотические бактерии, экспрессирующие ФРФ-2, ИЛ-4 и КСФ-1 в одной бактериальной клетке, вносили в раны в день ранения (день 0) и их выживание оценивали через 6 часов после внесения. Для того чтобы облегчить определение выработки ФРФ-2, КСФ-1 и/или ИЛ-4 указанными бактериями, внесенными в раны, из ран отбирали образцы раневой жидкости через 6 часов и 1, 2 и 7 дней. Системную кровь и основные органы собирали через 6 и 24 часа и 7 дней, чтобы облегчить анализ ФК/ФД. Раны, которые обрабатывали только средой IM1, использовали в качестве контролей для определения показателей ФК/ФД в данном исследовании.
Для того чтобы оценить влияние указанных рекомбинантных пробиотических бактерий на процесс заживления ран, бактерии, экспрессирующие ФРФ-2, КСФ-1 и ИЛ-4 человека, а также бактерии, экспрессирующие ФРФ-2, КСФ-1 или ИЛ-4 человека по отдельности, вносили в раны в день ранения (день 0) и затем ежедневно вплоть до 6 дня после ранения. Заживление ран, обработанных указанными рекомбинантными пробиотическими бактериями, сравнивали с заживлением ран, которые обрабатывали только средой IМ1.
Помимо этого рекомбинантный фактор роста тромбоцитов человека ВВ (рч-ФРТ-ВВ) в комбинации с рекомбинантным трансформирующим фактором роста альфа человека (рч-ТФР-α) использовали в качестве «положительного контроля» в данном исследовании. Положительный контроль получали в 0,25% носителе гидроксипропилметилцеллюлозе (ГПМЦ), который готовили путем растворения 0,5 г гидроксипропилметилцеллюлозы, полученной от Sigma Aldrich (Сент-Луис, Миссури, США), в 100 мл дистиллированной воды, с последующим добавлением гидроксида натрия, чтобы довести показатель рН до 7,0.
Комбинация ФРТ-ВВ и ТФР основана на исследовании, проведенном Brown RL et al. (Brown RL, Breeden MP, Greenhalgh DG.: «PDGF and TGF-alpha act synergistically to improve wound healing in the genetically diabetic mouse. J. Surg. Res. 56(6), 1994, pages 562-570). В работе Brown et al. описано, что улучшенное закрытие ран наблюдали при использовании комбинации ФРТ-ВВ и ТФР-альфа по сравнению с лечением с использование факторов роста по отдельности.
Заживление ран исследовали на макроскопическом и гистологическом уровнях. Заживление ран исследовали на макроскопическом уровне для определения (i) начала восстановления кожи, и (ii) закрытия раны.
Закрытие раны и компоненты этого процесса, контракцию раны и повторную эпителизацию раны, определяли на основании цифровых фотографий, сделанных через 0, 4 и 7 дней после ранения. Гистологические оценки формирования грануляционной ткани (глубина) и ширины раны (кранио-каудальная контракция) проводили на обычных окрашенных срезах (гематоксилином и эозином). Указанные гистологические оценки проводили на тканях, собранных на 7-й день после ранения.
Развитие нежелательных явлений контролировали и полностью документировали.
Создание полнослойных экспериментальных ран и применение способов лечения
После экспериментального ранения животных содержали в отдельных клетках (размер клетки 500 см2 с подстилкой из опилок, которые заменяли три раза в неделю) в контролируемых условиях при температуре окружающей среды 23°С с 12-часовым циклом свет/темнота. Животные имели свободный доступ к корму и воде (CRM-P, код продукта 801722, SDS diets, Великобритания). Для акклиматизации к окружающей обстановке перед проведением экспериментов животных содержали в течение 5-7 дней без воздействия внешних факторов, за исключением смены подстилки и восполнения корма и воды. После проведения процедур по обезболиванию животных помещали в теплую окружающую среду и наблюдали до полного восстановления от указанной процедуры. Все животные получили соответствующее обезболивание (бупренорфин) после операции и получили дополнительные обезболивающие препараты по мере необходимости.
Все процедуры на животных проводили в учреждении, имеющем лицензию МВД Великобритании, в соответствии с требованиями лицензии МВД Великобритании (PCD: 50/2505; PPL: 40/3614; PIL: IBCEFDF55; PIL: 134817249). Состояние здоровья животных контролировали ежедневно на протяжении всего исследования.
Животных рандомизировали в группы для получения одной из 18 схем лечения в соответствии с таблицами 2а и 2b.
В 0-й день животных анестезировали (изофлуран + воздух), спинки выбривали и очищали марлей, пропитанной физиологическим раствором. Кожу затем протирали 70% этанолом и вытирали насухо стерильной марлей. Одну стандартизированную полнослойную рану (10,0 мм × 10,0 мм) создавали на коже левого бока каждого подопытного животного.
Раны у животных во всех группах затем перевязывали с использованием бандажа из прозрачной перевязочной пленки Bioclusive (Wound Management Systagenix, Гатвик, Великобритания); после чего животные получали один из видов лечения, описанных ниже (см. таблицу 2а и 2b)), путем инъекции через пленку Bioclusive с использованием иглы 27G.
Для каждого вида лечения соответствующие неиндуцированные рекомбинантные пробиотические бактерии обеспечивали в 10 мл среды IM1 со следующей плотностью клеток (колониеобразующих единиц (КОЕ) на мл среды):


Схема лечения «комбинация» представляет собой трехкомпонентную комбинацию, полученную из смеси неиндуцированной культуры NZ3900 (рФРФ-2), полученной в примере 2а, неиндуцированной культуры NZ3900 (рКСФ-1), полученной в примере 2с, и неиндуцированной культуры NZ3900 (рИЛ-4), полученной в примере 2b. Смесь имеет общую плотность клеток 3×108 КОЕ/мл.
Перед началом лечения соответствующие неиндуцированные рекомбинантные пробиотические бактерии, обеспеченные в 10 мл среды IМ1, инкубировали при 30°С без встряхивания, и оптическую плотность определяли спектрофотометрически при длине волны 600 нм (OD600).
При OD600=0,5 вносили низин до конечной концентрации 5 нг/мл. После дополнительной инкубации в течение 30 мин при 30°С индуцированную культуру помещали при 10°С. Затем соответствующую индуцированную культуру вводили путем инъекции через пленку Bioclusive с использованием иглы 27G.
Различные виды лечения применяли в соответствии со схемой, описанной в таблице 2а и 2b. Животные в группах лечения 1-9 получили однократную инъекцию объемом 50 мкл в 0-й день. Животные в группах лечения 10-18 получили семь последовательных инъекций, разделенных на однократные инъекции по 50 мкл в сутки в 0, 1, 2, 3, 4, 5 и 6 день.
Через шесть часов после первого применения лечения раневую жидкость собирали у всех животных в группах 1-4. Раневую жидкость, собранную в группе комбинированного лечения (grp 1), обрабатывали так, чтобы подсчитать КОЕ рекомбинантных пробиотических бактерий. Жидкости, взятые из ран в остальных группах, хранили на льду с добавлением воды до их помещения при температуре -80°С для длительного хранения. После сбора раневых жидкостей всех животных в этих группах умерщвляли (с помощью способа, одобренного МВД Великобритании). Перед умерщвлением животных образцы системной крови отбирали путем сердечной пункции в пробирки с ЭДТА. Одну половину образца крови центрифугировали для получения плазмы; оставшуюся половину хранили при 4°С в течение ночи перед отправкой в Langford Veterinary Services Ldt. (Бристоль, Великобритания), где проводили полный и дифференциальный анализ крови. Посмертные образцы печени, почек, селезенки, сердца, легочной ткани и дренирующих лимфатических узлов собирали у всех животных (плазму крови и ткани помещали в криопробирки, которые быстро замораживали в жидком азоте и затем хранили при -80°С).
Через 24 часа после первого применения лечения раневую жидкость собирали у всех животных в группах 5-9 и хранили, как описано выше. Кровь собирали и хранили, затем животных умерщвляли. Образцы раневой жидкости, цельной крови, плазмы крови и тканей собирали и хранили, как описано выше.
Через день после первого применения различные виды лечения повторно вносили во все раны в группах 10-15 с суточными интервалами вплоть до 6-го дня.
Через 2 дня после первого применения лечения (1 день после второго применения) раневую жидкость собирали у всех животных в группах 10-15 и хранили, как описано выше.
Через 7 дней после первого применения лечения (один день после последнего применения лечения на 6-й день) раневую жидкость собирали у всех животных в группах 10-15 и хранили, как описано выше. Кровь собирали и хранили, затем животных умерщвляли. После умерщвления животных ткани раны и краевые ткани собирали и обрабатывали для гистологического исследования (см. раздел 3.7). Образцы раневой жидкости, цельной крови, плазмы крови и тканей собирали и хранили, как описано выше.
На 4 и 7 день после нанесения ран животных в группах 10-15 повторно анестезировали, их раны оценивали и фотографировали с помощью цифровой камеры вместе с калибровочной/идентификационной пластинкой. На 4-й день аналогичную оценку проводили с повязкой из пленки Bioclusive на ране. На 7-й день перевязочные материалы и некротические ткани удаляли, раны затем очищали с помощью стерильной марли, пропитанной физиологическим раствором, и вытирали сухой стерильной марлей. Раны оценивали и фотографировали с помощью цифровой камеры вместе с калибровочной/идентификационной пластинкой.


Визуализирующее исследование закрытия раны
Программное обеспечение для анализа изображений Image Pro (версия 4.1.0.0, Media Cybernetics, США) использовали для измерения закрытия раны на основании изображений ран в группах 10-15 и 16-18 с течением времени. Для каждой раны в каждый момент времени (дни 4 и 7 для групп 10-15 и дни 4, 7, 8 и 12 для групп 16-18) открытую раневую поверхность измеряли и выражали как % области раны относительно дня 0.
Выживание рекомбинантных пробиотических бактерий через 6 часов после внесения.
Через шесть часов после введения в рану комбинации бактерий, экспрессирующих ФРФ-2, ИЛ-4 и КСФ-1, раневую жидкость экстрагировали, и проводили подсчет бактериальных колониеобразующих единиц (КОЕ). Результаты подсчета КОЕ для 5 ран приведены в таблице 3.
Полученный результат подтверждает, что бактерии являются жизнеспособными в ране и способны к пролиферации после пребывания в ране в течение 6 часов, это свидетельствует о том, что вышеуказанные рекомбинантные пробиотические бактерии могут быть использованы для доставки терапевтических комбинаций белков в раны.

Реакция заживления ран в различных группах лечения
Реакцию заживления ран в различных группах лечения после нанесения раны оценивали путем визуального осмотра через 4 и 7 дней после начала лечения.
Визуальный осмотр невооруженным глазом, а также количественный анализ с помощью программного обеспечения для анализа изображений Image Pro групп 10-15 выявил, что заживление ран имеет место уже через четыре дня после начала лечения. Помимо этого на седьмой день мыши, получавшие трехкомпонентную комбинацию рекомбинантных пробиотических бактерий, экспрессирующих ФРФ-2, ИЛ-4 и КСФ-1 (группы лечения 1, 5 и 10), имели лучшую реакцию заживления (присутствовало накопление розовой/красной грануляционной ткани, а также эпителизация раны) по сравнению с отдельными группами лечения с использованием пробиотических бактерий, экспрессирующих ФРФ-2, (AUP-10), пробиотических бактерий, экспрессирующих ИЛ-4 (AUP-12), и пробиотических бактерий, экспрессирующих КСФ-1 (AUP-14), а также по сравнению с положительным контролем (т.е. ТФР-альфа и ФРТ-ВВ). Результаты представлены на Фигуре 15а.
На Фигуре 15а представлены результаты оценки реакции заживления ран в различных группах лечения.
Отдельные группы лечения имеют сравнимую реакцию заживления ран, которая превосходит реакцию в группах, получавших среду IM1 (группа, получавшая носитель). Полученные результаты выявили синергическое действие комбинации ФРФ-2, ИЛ-4 и КСФ-1 при заживлении ран.
Мыши, которые получали ФРФ-2 (AUP-10), также имели признаки образования грануляционной ткани и васкуляризации, но не эпителизации. Помимо этого, можно отметить проницаемость кровеносных сосудов при использовании пробиотических бактерий, экспрессирующих ФРФ-2 по отдельности. При использовании пробиотических бактерий, экспрессирующих ИЛ-4 (AUP-12), и пробиотических бактерий, экспрессирующих КСФ-1 (AUP-14), в основном наблюдали эпителизацию раны, но не гранулирование, тогда как раны, обработанные трехкомпонентной комбинацией рекомбинантных пробиотических бактерий (AUP-10 + AUP-12 + AUP-14) характеризуются образованием грануляционной ткани, а также эпителизацией раны. Не было обнаружено проницаемости кровеносных сосудов.
Важно знать, что при диабетических язвах стопы (у человека) эпителизация зависит от формирования грануляционной ткани. Без формирования грануляционной ткани эпителизация не может произойти, и рана не закрывается.
В группах 16-18 влияние AUP-16 (рекомбинантные бактерии, экспрессирующие ФРФ-2, ИЛ-4 и КСФ-1 в одной бактериальной клетке) сравнивали с введением носителя (физиологический раствор + повязка) и положительным контролем (т.е. ТФР-альфа + ФРТ-ВВ). В течение 4, 8 и 12 дней культура AUP-16 обеспечивала лучшие результаты в заживлении ран по сравнению с группой положительного контроля (ТФР-альфа + ФРТ-ВВ). Результаты представлены на Фигуре 15b.
Сравнение статуса заживления ран для контроля (группа 16, получавшая физиологический раствор), положительного контроля (группа лечения 17) и ткани, обработанной AUP-16 (группа лечения 18), после нанесения раны и через 4, 8 и 12 дней представлено на Фигуре 15b.
День 0 представляет исходную рану сразу после ранения. Одна и та же рана также показана на 4, 8 и 12 день. Соответствующие фотографии масштабировали аналогичным образом, чтобы визуализировать закрытие раны. Черная полоса на каждой фотографии представляет 1 см.
Сравнение оставшейся раневой области после 8-го дня и 12-го дня для положительного контроля (группа 17) и ткани, обработанной AUP-16 (группа лечения 18), представлено на Фигуре 15с.
Оставшуюся раневую область измеряли на фотографиях ран с помощью программного обеспечения для анализа изображений Image Pro и выражали как % раневой области по сравнению с 0-ым днем.
На 12 день наблюдали почти полное закрытие ран в ранах, обработанных комбинацией (AUP-16). Данный вывод подтверждается тем, что оставшаяся раневая область составляет 1,37% по сравнению с областью раны на 0-й день сразу после нанесения раны.
Помимо этого, как следует из Фигур 15а и 15b, в ранах, обработанных трехкомпонентной комбинацией, а также AUP-16 наблюдали значительное лучшее закрытие раны по сравнению с ранами, обработанными рекомбинантным фактором роста тромбоцитов человека ВВ в комбинации с рекомбинантным трансформирующим фактором роста человека альфа (положительный контроль), в частности на 12-й день.
Было обнаружено, что все бактериальные схемы лечения, исследованные в данном эксперименте, AUP-10, AUP-12 и AUP-14, при применении по отдельности или в виде трехкомпонентной комбинации, а также AUP-16, способствовали восстановлению ран у диабетических мышей db/db, которые являются общепринятой и одной из лучших проверенных животных моделей замедленного заживления ран у человека.
Эксцизионные раны у мышей db/db характеризуются достоверно замедленным закрытием ран, уменьшенным образованием грануляционной ткани, уменьшенной васкуляризацией раневого ложа и заметно сниженной пролиферацией, например, как описано в Michaels et al. (2007) («db/db mice exhibit severe wound-healing impairments compared with other murine diabetic strains in a silicone-splinted excisional wound model», Wound Rep. Reg. 15, pages 665 to 670).
Экспериментальные результаты ясно показывают, что применение рекомбинантных пробиотических бактерий согласно настоящему изобретению обеспечивает значительное улучшение в лечении ран у человека, особенно хронических ран.
Применение рекомбинантных пробиотических бактерий согласно настоящему изобретению индуцирует образование грануляционной ткани, увеличение васкуляризации раневого ложа и усиление пролиферации, что приводит к более эффективному и ускоренному закрытию ран, даже в модели, проявляющей серьезное нарушение процесса заживления ран.
Следовательно, полученные результаты указывают на то, что применение рекомбинантных пробиотических бактерий согласно настоящему изобретению оказывает положительное влияние на воспалительные, предпочтительно хронические воспалительные, нарушения функции кожи, такие как обморожение, экзема, псориаз, дерматит, язва, рана, красная волчанка, нейродермит и их комбинации, предпочтительно дерматит, язва, рана и их комбинации, более предпочтительно язва.
Например, хронические раны, такие как хронические венозные язвы, хронические артериальные язвы, хронические диабетические язвы и хронические пролежни, можно лечить путем применения рекомбинантных пробиотических бактерий согласно настоящему изобретению, поскольку нарушения процесса заживления ран, наблюдаемые при соответствующих хронических ранах, преодолеваются после применения рекомбинантных пробиотических бактерий согласно настоящему изобретению.
Реферат
Изобретение относится к популяции рекомбинантных пробиотических бактерий для лечения и/или облегчения заживления раны, фармацевтической композиции для лечения и/или облегчения заживления раны, содержащей указанную популяцию, а также способу лечения и/или облегчения заживления раны с использованием указанной композиции или популяции. Предложенная популяция рекомбинантных пробиотических бактерий содержит последовательность(и) нуклеиновой кислоты, кодирующую(ие) первый гетерологичный фактор, последовательность(и) нуклеиновой кислоты, кодирующую(ие) второй гетерологичный фактор, и предпочтительно последовательность(и) нуклеиновой кислоты, кодирующую(ие) третий гетерологичный фактор, где клетки указанной популяции содержат последовательность(и) нуклеиновой кислоты, кодирующую(ие) первый гетерологичный фактор, и/или последовательность(и) нуклеиновой кислоты, кодирующую(ие) второй гетерологичный фактор, и/или предпочтительно последовательность(и) нуклеиновой кислоты, кодирующую(ие) третий гетерологичный фактор. При этом указанный первый фактор, указанный второй фактор и указанный третий фактор функционально различаются. При этом указанный первый фактор представляет собой фактор роста, при этом указанный второй фактор выбран из группы, состоящей из М2-поляризующих факторов, и предпочтительно указанный третий фактор выбран из группы, состоящей из М2-поляризующих факторов и факторов роста. Фармацевтическая композиция для лечения и/или облегчения заживления раны содержит эффективное количество указанной популяции рекомбинантных пробиотических бактерий и фармацевтически приемлемый носитель или вспомогательное вещество. Способ лечения и/или облегчения заживления раны включает этап введения указанной популяции рекомбинантных пробиотических бактерий или указанной композиции нуждающемуся в этом индивидууму. Изобретение является эффективным в лечении и/или облегчении заживления ран. 3 н. и 22 з.п. ф-лы, 3 табл., 5 пр., 35 ил.
Формула
Документы, цитированные в отчёте о поиске
Промоторы lactococcus и их применение:

Комментарии