Направленно вводимые в митохондрии производные убихинона в качестве антиоксидантов для снижения окислительного стресса, фармацевтическая композиция, способ получения, способ лечения - RU2487880C2
Код документа: RU2487880C2
Чертежи











Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к амфифильным антиоксидантным соединениям, содержащим липофильную катионную группу, синтезу, композиции и физико-химическим свойствам указанных соединений, которые благоприятствуют их использованию, например, в качестве фармацевтических препаратов.
Предшествующий уровень техники
Окислительный стресс способствует целому ряду дегенеративных заболеваний человека, связанных со старением, таких как болезнь Паркинсона и болезнь Альцгеймера, а также хорея Гентингтона и наследственная атаксия Фридрейха, и неспецифическим нарушениям, которые аккумулируются с возрастом. Он также способствует воспалительному и ишемически-реперфузионному повреждению ткани при инсульте и сердечном приступе, а также в процессе трансплантации органа и оперативном лечении. Чтобы предупредить нарушение, вызываемое окислительным стрессом, разработан целый ряд антиоксидантных методов лечения. Однако большинство из них не нацелены в клетки, и поэтому являются менее, чем оптимально эффективными. Более того, многие такие антиоксиданты обладают неблагоприятными физико-химическими свойствами, которые ограничивают, например, их биодоступность и их способность проникать в орган-мишень и осуществлять лечебное действие.
Митохондрии представляют собой внутриклеточные органеллы, ответственные за энергетический обмен веществ. Соответственно, митохондриальные дефекты являются повреждающими, особенно для нервных и мышечных тканей, имеющих высокую энергетическую потребность. Они также являются основным источником свободных радикалов и реакционноспособных кислородсодержащих фрагментов, которые вызывают окислительный стресс внутри большинства клеток. Поэтому заявители полагают, что доставка антиоксидантов селективно в митохондрии будет более эффективна, чем использование не вводимых направленно антиоксидантов. В соответствии с этим, настоящее изобретение относится к обеспеченности антиоксидантами, которые могут быть доставлены митохондриям.
Липофильные катионы могут аккумулироваться в митохондриальной матрице вследствие своего положительного заряда (Rottenberg, 1979, Methods Enzymol., 55, 547. Chen, 1988, Ann. Rev. Cell Biol., 4,155). Такие ионы могут накапливаться при условии, что они являются достаточно липофильными, чтобы экранировать положительный заряд или делокализовать его на большой площади поверхности, а также при условии, что не существует пути активной утечки, и катион не принимает участия в обмене веществ или сразу же не отравляет клетку.
Поэтому настоящее изобретение направлено на разработку подхода, с помощью которого можно использовать способность митохондрий концентрировать специфические липофильные катионы и закреплять связанные антиоксиданты, так чтобы целевым образом направить антиоксидант к основному источнику свободных радикалов и реакционноспособным кислородсодержащим фрагментам, вызывающим окислительный стресс.
Примеры антиоксидантов, которые показывают хорошую антиокислительную способность in vivo, а также проявляют слабое антиоксидантное действие по отношению к отделению-мишени in vivo, включают Коэнзим Q (CoQ) и Идебенон. Оба эти соединения обладают низкой биодоступностью и должны быть введены в очень высокой дозе, чтобы быть эффективными, и поэтому имеют низкую терапевтическую эффективность в сравнении с введенной дозой.
Не желая привязываться к какой-либо теории, авторы полагают, что для соединения антиоксидантная активность in vivo или ex vivo (как например, антиоксидантная активность или митохондриальное накопление) ни в коей мере не является единственным фактором, определяющим функциональность антиоксиданта и/или эффективность in vivo (как например, эффективность лечебного действия). Хотя действительно верно, что для того, чтобы быть использованным в качестве направленно вводимого в митохондрии антиокислительного соединения настоящего изобретения, антиоксидантное соединение должно проявлять подходящее антиоксидантное действие in vivo или ex vivo, чтобы быть эффективным in vivo, направленно вводимое в митохондрии антиоксидантное соединение должно проявлять другие желательные физико-химические свойства, такие как, например, подходящая биодоступность, подходящая локализация или распределение внутри митохондрии-мишени и/или подходящая стабильность.
Не желая привязываться к какой-либо теории, авторы изобретения полагают, что направленно вводимые в митохондрии антиоксидантные соединения настоящего изобретения проявляют преимущественное антиоксидантное действие, включая биодоступность и/или направленное введение в митохондрии и накопление in vivo, по меньшей мере, частично за счет их физико-химических свойств, таких как, например, их амфифильность, их физическая структура и/или размеры, их гидрофобность от низкой до средней и/или коэффициент распределения. Поэтому такие соединения являются терапевтически эффективными при низких дозировках в сравнении с другими антиоксидантными соединениями.
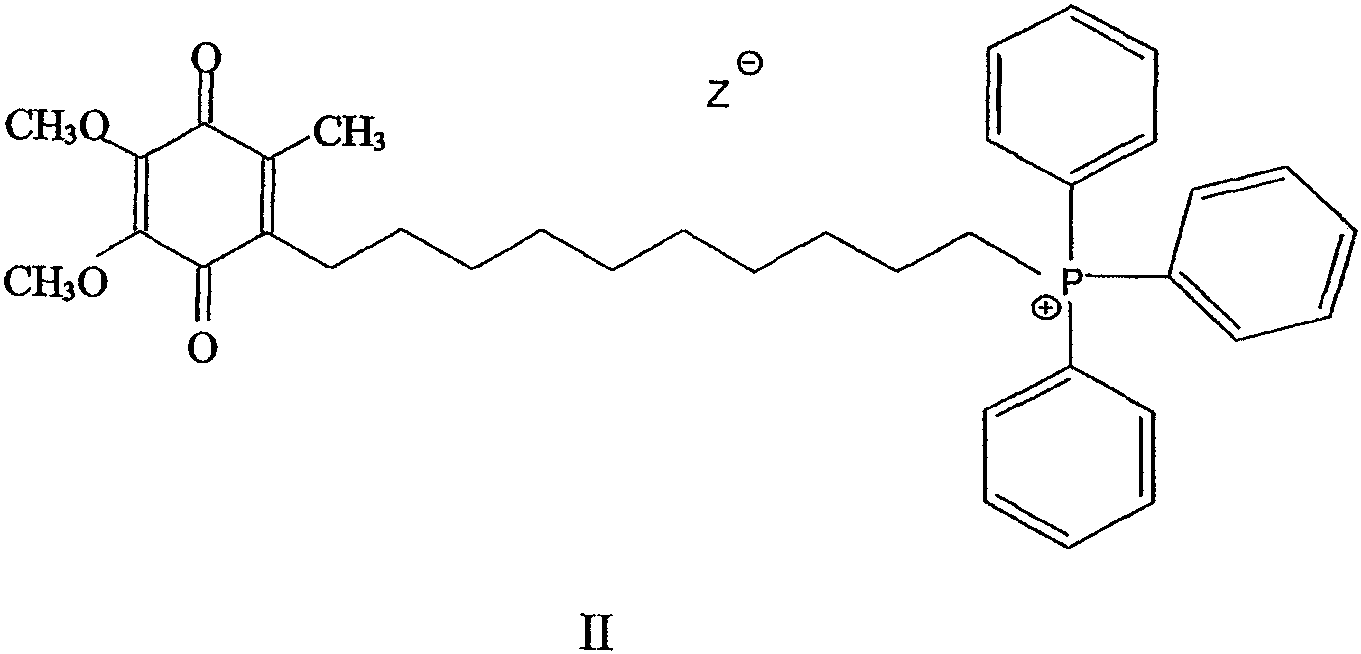
В патенте США №6331532 в пояснительных примерах соединений митохинола и митохинона (названных объединено как митохинол/митохинон) раскрыта перспектива направленного введения в митохондрии молекул антиоксиданта, связанного с липофильным катионом, ковалентно соединенным с молекулой антиоксиданта. Данное в патенте в качестве примера соединение (несмотря на общий вид длины мостичных связей) представляет собой соединение митохинона формулы
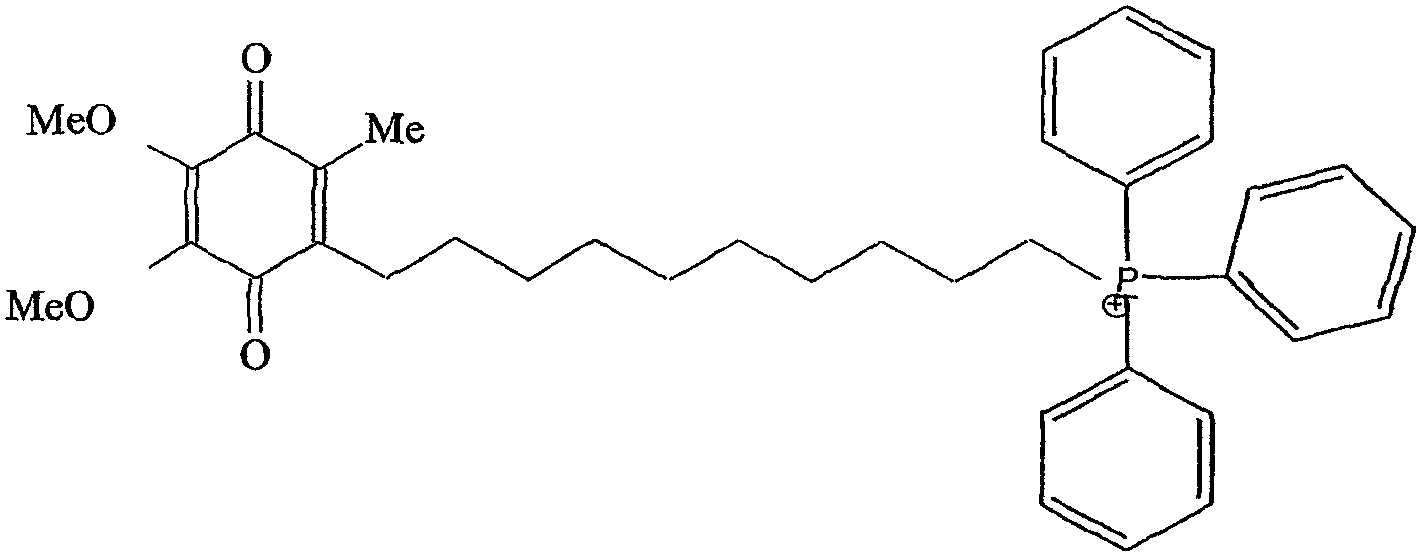
с длиной углеводородной цепочки в 10 атомов углерода (т.е. мостиком С10). Его восстановленная форма, митохинол, также содержит С10 мостик.
Авторы изобретения установили, что митохинон/митохинол, несмотря на отличное атиокислительное действие, направленность и накоплениение в митохондриях in vitro и in vivo, оказались несколько нестабильными в виде бромида. Авторы изобретения также установили, что физико-химические свойства митохинона/митохинола, как раскрыто в патенте США №6331532, меньше подходят для фармацевтического состава, например, когда введение их осуществляется перорально или парентерально, и/или когда осуществляется направленное введение соединения в митохондрию в ткани внутренних органов (например, мозга, сердца, печени или других органов).
Примеры соединений настоящего изобретения подходят для использования в фармацевтических композициях. Они должны быть в форме, отличной от кристаллической, и/или твердой форме, но подлежат превращению в твердую форму при смешении с другими агентами, такими как, например, носители, наполнители, агенты комплексообразования или другие добавки и т.п., например, циклодекстрины. Преимущественно такие агенты являются фармацевтически приемлемыми.
Авторы изобретения оценили потребность, чтобы предложить примеры амфифильных, направленно вводимых в митохондрии антиоксидантных соединений настоящего изобретения с их положительным зарядом в сочетании с подходящим анионом, чтобы обеспечить соединение в форме общей нейтрализованной соли, включая твердые или кристаллические продукты. Однако авторы изобретения установили, что в формах такой соли некоторых солеобразующих анионов лучше всего избегать, так как они реакционноспособны к антиоксидантному соединению, например, молекуле антиоксиданта, связывающему фрагменту или липофильному катионному фрагменту, и/или могут привести к расщеплению молекулы антиоксиданта или отщеплению от него. Другие солеобразующие анионы считаются фармацевтически нежелательными. Например, нитратные остатки рассматриваются фармацевтическими компаниями в целом не подходящими и фармацевтически или экологически неприемлемыми, тогда как бромоводород, часто используемый для солеобразования таких соединений, обладает нуклеофильными свойствами, которые могут привести к возникновению реакционной активности по отношению к молекулам антиоксиданта, например, отщеплению метильной группы от молекулы антиоксиданта соединения общей формулы (II) и/или некоторому общему снижению стабильности всего соединения. Например, авторы определили, что бромоводородная соль митохинона несколько нестабильна.
Поэтому авторы изобретения полагают, что формы солей, включая формы солей как жидкие, так твердые или кристаллические формы, направленно вводимых в митохондрии антиоксидантов лучше всего ассоциируются с анионом или подобным фрагментом, который не является нуклеофильным, и/или анионом, который не обладает реакционной активностью относительно любого из фрагментов, включая антиоксидантное соединение или его комплекс. Также предпочтительно, чтобы анион был фармацевтически приемлемым.
Цель изобретения
В соответствии с этим, цель настоящего изобретения относится к фармацевтически приемлемым амфифильным антиоксидантным соединениям и композициям, лекарственным формам и способам, связанных с указанными соединениями, которые могут быть использованы, например, при лечении болезней или состояний, связанных с окислительным стрессом, или к обеспечению общественности ценным выбором.
Краткое изложение сущности изобретения
В первом аспекте настоящее изобретение относится к соединению, содержащему липофильный катионный фрагмент, связанный соединяющим фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, причем катионный фрагмент может направленно вводить в митохондрии молекулы антиоксиданта, и форма соли химически стабильна и/или анионный компонент не обладает реакционной активностью к молекуле антиоксиданта, катионному фрагменту или соединительному фрагменту.
В одном варианте осуществления молекулой антиоксиданта является хинон или хинол.
В другом варианте осуществления молекула антиоксиданта выбрана из группы, включающей витамин В и производные витамина В, антиоксиданты разрыва цепи, включающие бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, общие акцепторы радикалов, включающие дериватизированные фуллерены, спиновые ловушки, включающие производные 5,5-диметилпирролин-N-оксида, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
В одном варианте осуществления липофильный катионный фрагмент является замещенным или незамещенным катионом трифенилфосфония.
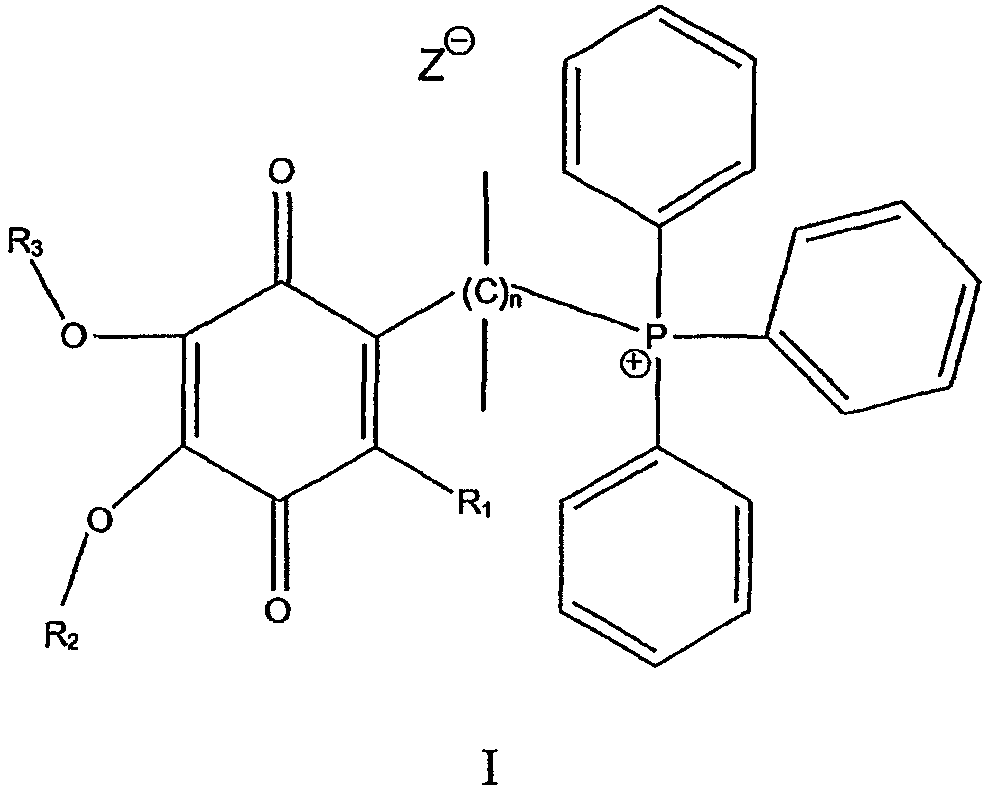
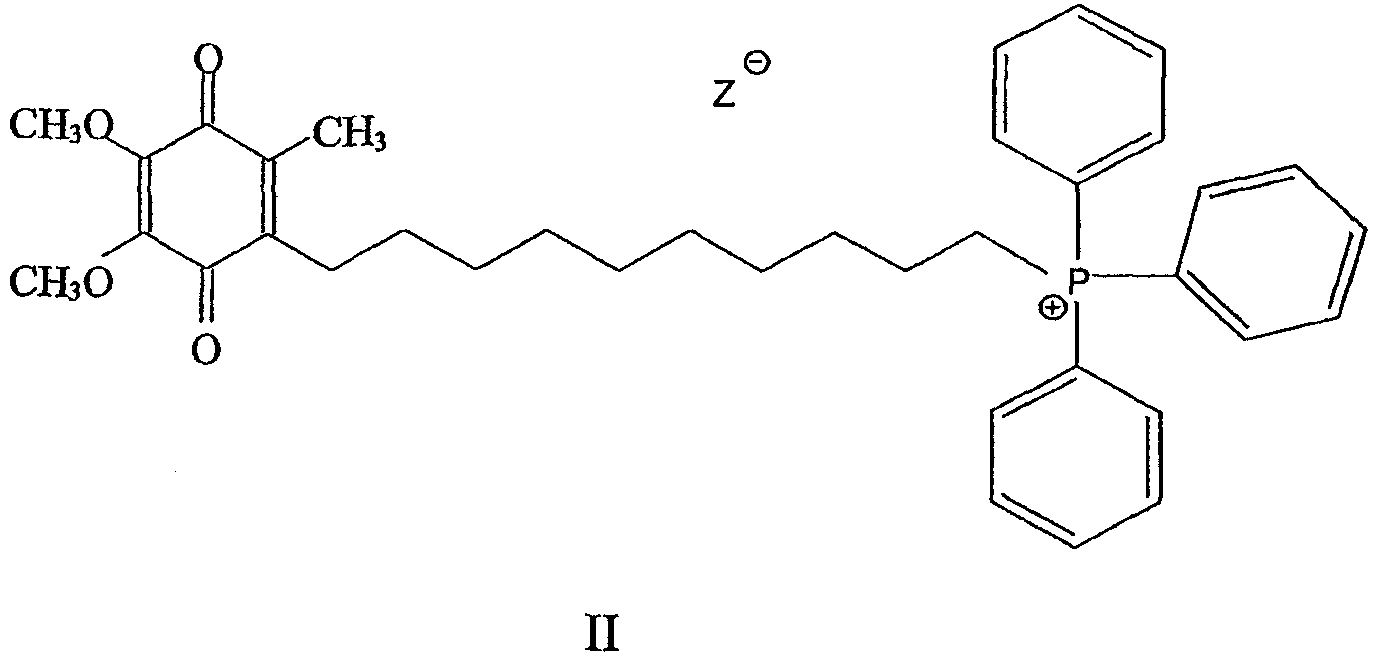
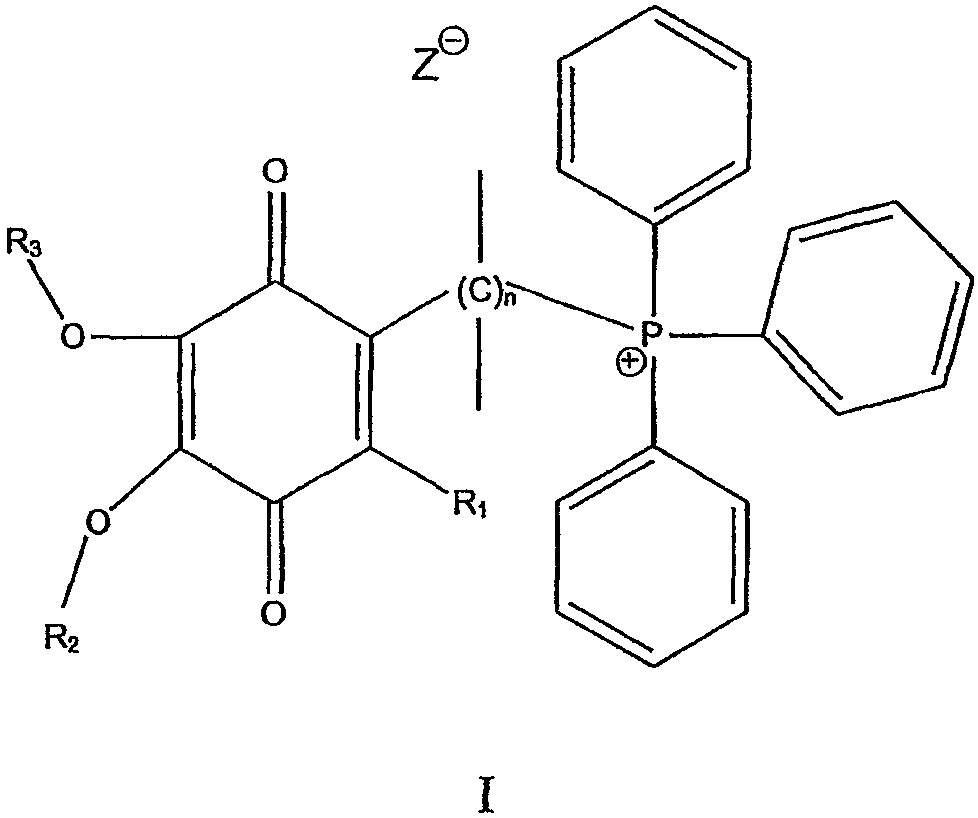
В одном варианте осуществления соединение имеет общую формулу I
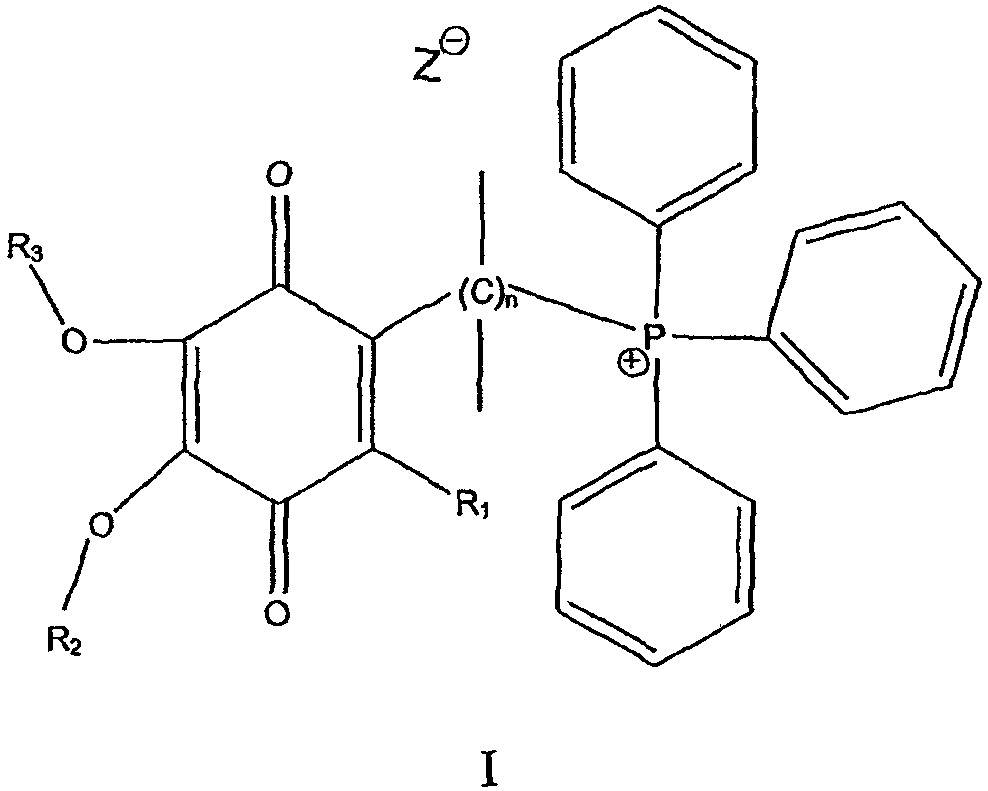
и/или его хинольную форму, в котором группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны С1-С5 алкильных (возможно замещенных) групп или Н, в котором n означает целое число от примерно 2 до примерно 20 и в котором Z означает нереакционноспособный анион.
Предпочтительно Z выбран из группы, включающей алкил- или арилсульфонаты или нитраты.
Предпочтительно каждая связь С-С в мостике (С)n является насыщенной.
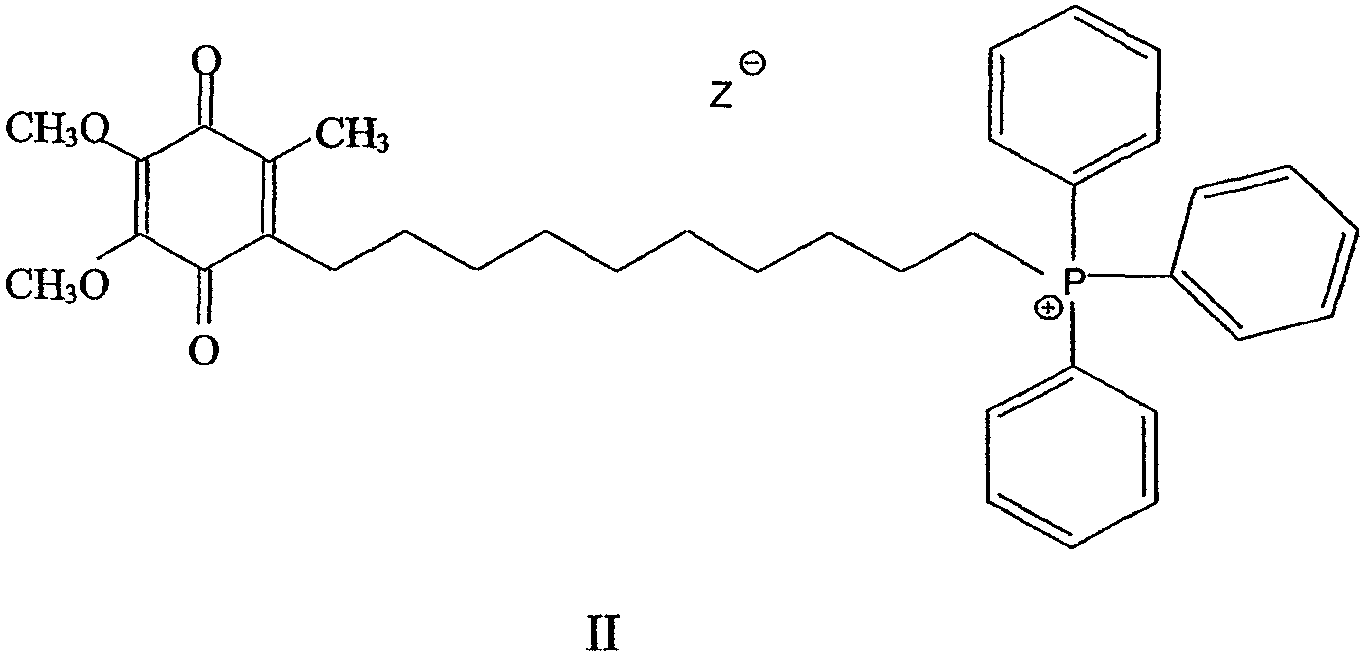
В предпочтительном варианте осуществления соединение имеет формулу

и/или его хинольную форму, где Z означает не являющийся нуклеофильным анион.
Более предпочтительно соединение имеет формулу

В другом аспекте изобретение относится к фармацевтической композиции, содержащей или включающей соединение, содержащее липофильный катионный фрагмент, связный соединительно фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, причем катионная группа способна направленно водить в митохондрии молекулы антиоксиданта, а форма соли является химически стабильной и/или анионный компонент не проявляет реакционной активности по отношению к молекуле антиоксиданта, катионному фрагменту или соединительному фрагменту.
В одном варианте осуществления молекулой антиоксиданта является хинон или хинол.
В других вариантах осуществления молекула антиоксиданта выбрана из группы, включающей витамин Е и производные витамина Е, антиоксиданты распада цепи, включая бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, общие акцепторы радикалов, включающие дериватизированные фуллерены, спиновые ловушки, включающие производные 5,5-диметилпирролин-N-оксида, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
В одном варианте осуществления липофильная катионная группа представляет собой замещенный или незамещенный катион трифенилфосфония.
В одном варианте осуществления соединение имеет общую формулу I.
и/или его хинольную форму, где группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны С1-С5 алкильных (возможно замещенных) групп или Н, где n означает целое число от примерно 2 до примерно 20 и где Z означает нереакционноспособный анион.
Предпочтительно Z выбран из группы, включающей алкил- или арилсульфонаты или нитраты.
Предпочтительно каждая связь углерод-углерод в (С)n мостике является насыщенной.
В дополнительном варианте осуществления соединение имеет формулу
и/или его хинольную форму, где Z представляет собой не являющийся нуклеофильным анион.
В другом варианте осуществления композиция включает соединение, имеющее формулу II, и/или его хинольную форму, где Z не является нуклеофильным анионом и где композиция содержит циклодекстрин.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
Более предпочтительно композиция включает соединение, имеющее формулу
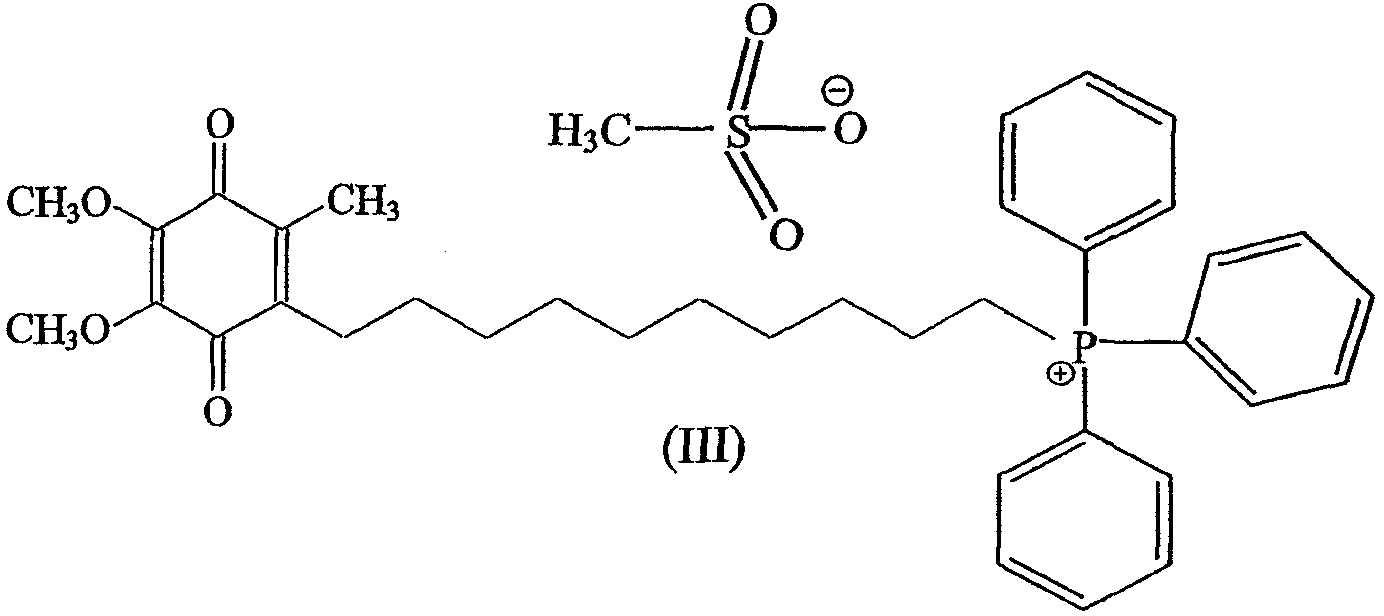
в которой циклодекстрин представляет собой β-циклодекстрин, более предпочтительно молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В одном варианте осуществления фармацевтическая композиция составлена для перорального введения.
В дополнительном варианте осуществления фармацевтическая композиция составлена для парентерального введения.
В дополнительном аспекте настоящее изобретение относится к лекарственной форме, содержащей или включающей соединение, содержащее липофильный катионный фрагмент, связанный соединительным фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, причем катионные фрагменты способны направленно вводить в митохондрии молекулы антиоксиданта, а форма соли является химически стабильной и/или анионный компонент не проявляет реакционной активности по отношению к молекуле антиоксиданта, катионному фрагменту или соединительному фрагменту, вместе с любым фармацевтически приемлемым разбавителем и/или носителем и/или наполнителем.
В одном варианте осуществления молекулой антиоксиданта является хинон или хинол.
В других вариантах осуществления молекула антиоксиданта выбрана из группы, включающей витамин Е и производные витамина Е, антиоксиданты распада цепи, включающие бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, общие акцепторы радикалов, включающие дериватизированные фуллерены, спиновые ловушки, включающие производные 5,5-диметилпирролин-N-оксида, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
В одном варианте осуществления липофильный катионный фрагмент представляет собой катион замещенного или незамещенного трифенилфосфония.
В одном варианте соединение имеет общую формулу I
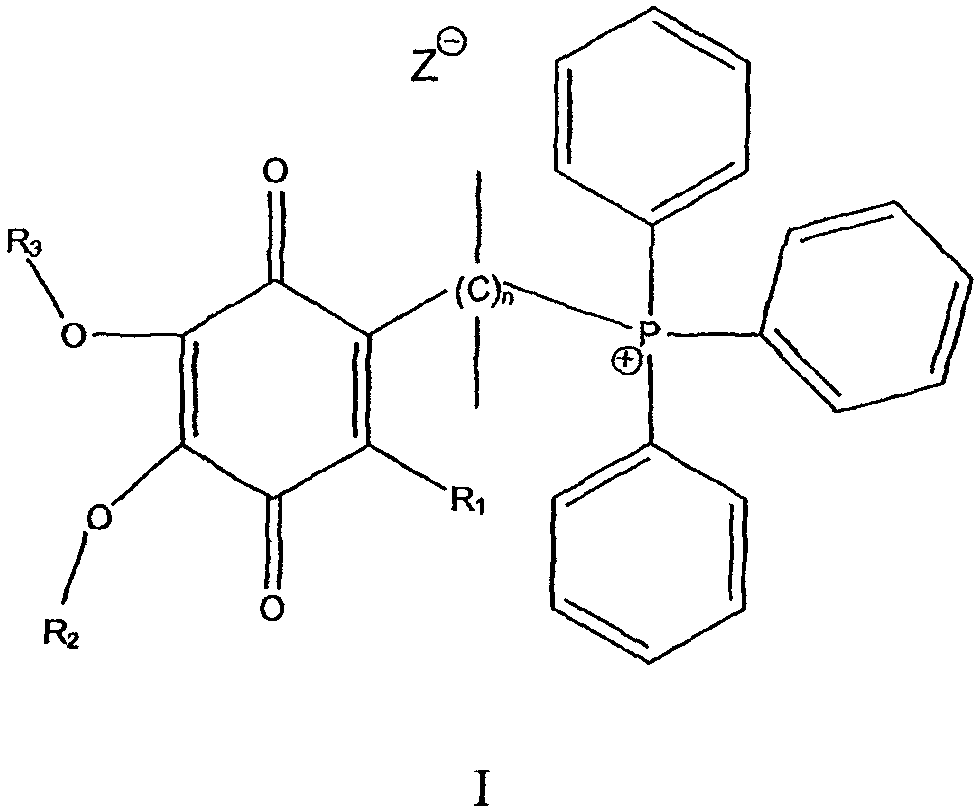
и/или его хинольную форму, где группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны С1-С5 алкильных (возможно замещенных) групп или Н, где n означает целое число от примерно 2 до примерно 20 и где символ Z означает нереакционноспособный анион.
Предпочтительно символ Z выбран из группы, включающей алкил- или арилсульфонаты или нитраты.
Предпочтительно каждая связь углерод-углерод в (С)n мостике является насыщенной.
В дополнительном варианте осуществления соединение имеет формулу и/или его хинольную форму, где Z не является нуклеофильным анионом.
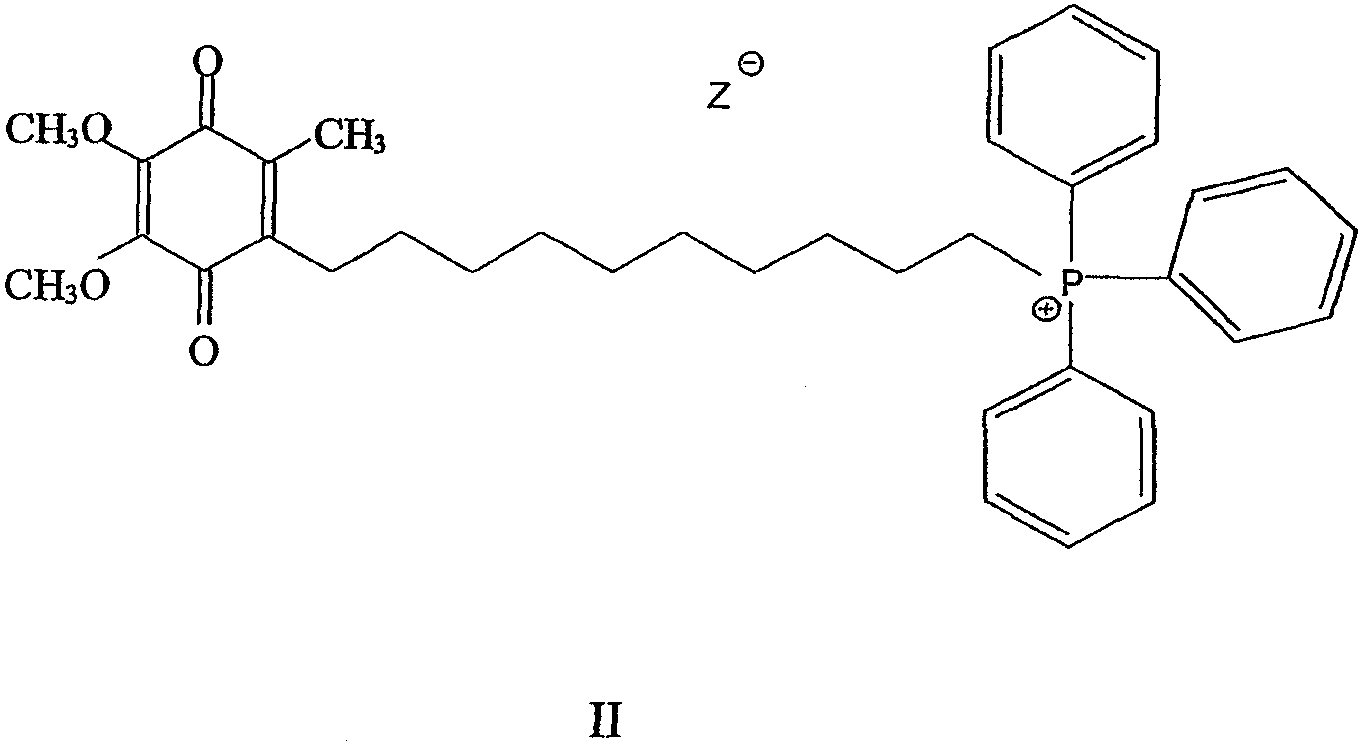
В дополнительном варианте осуществления лекарственная форма содержит соединение, имеющее формулу II, и/или его хинольную форму, где Z не является нуклеофильным анионом и где композиция содержит циклодекстрин.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
Более предпочтительно лекарственная форма содержит соединение, имеющее формулу
где циклодекстрин представляет собой β-циклодекстрин, более предпочтительно молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В одном варианте осуществления лекарственная форма целесообразно подходит для перорального введения.
В дополнительном варианте осуществления лекарственная форма целесообразно подходит для парентерального введения.
В дополнительном аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли, композиции или лекарственной форме настоящего изобретения для использования при профилактике или лечении окислительного стресса у млекопитающих введением соединения или его соли указанному млекопитающему.
В одном варианте осуществления соединением является соединение формулы II или его фармацевтически приемлемая соль.
В другом варианте осуществления указанное введение проводят на первый день при дозировке, превышающей суточную дозу в примерно от 1,02 до примерно 2,0 раз, с последующим введением соединения или его соли в суточной дозе в течение следующих дней.
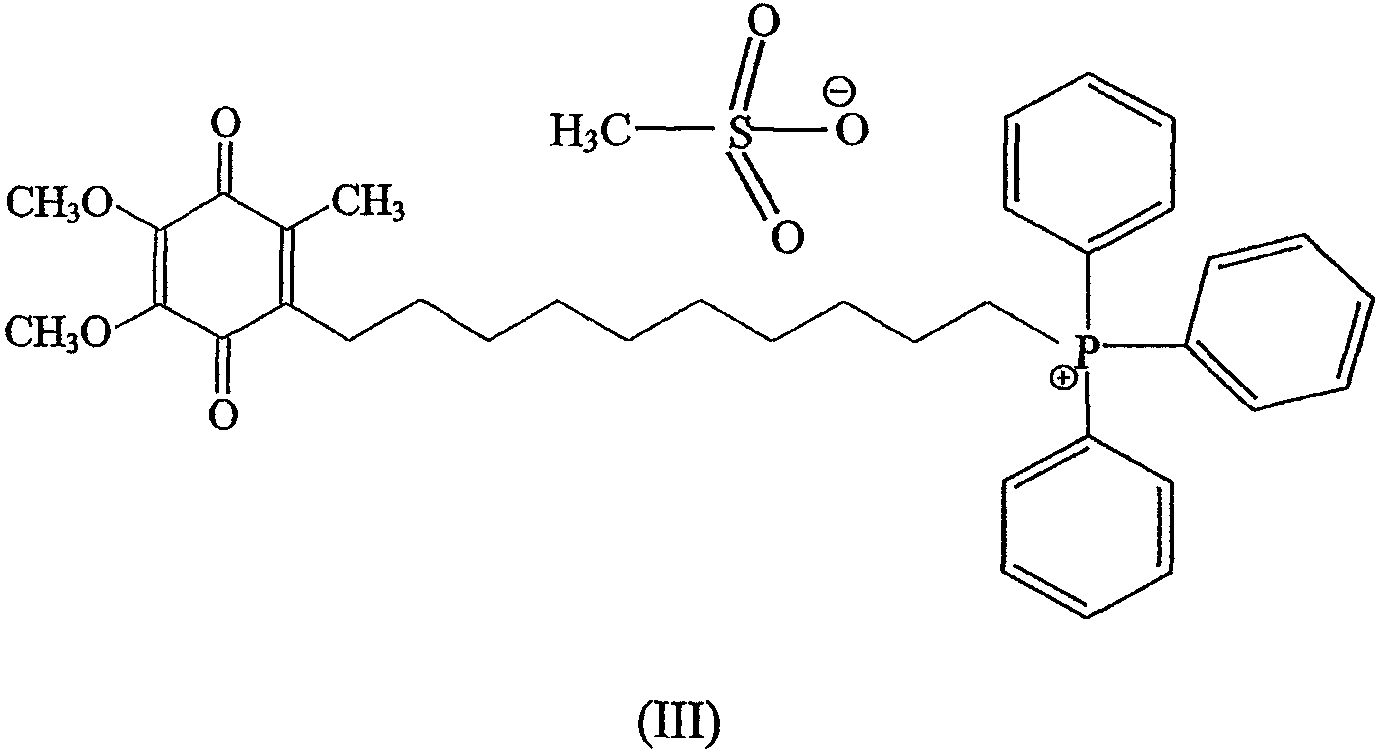
Предпочтительно солью является соль метансульфонат, а соединение объединяют с циклодекстрином.
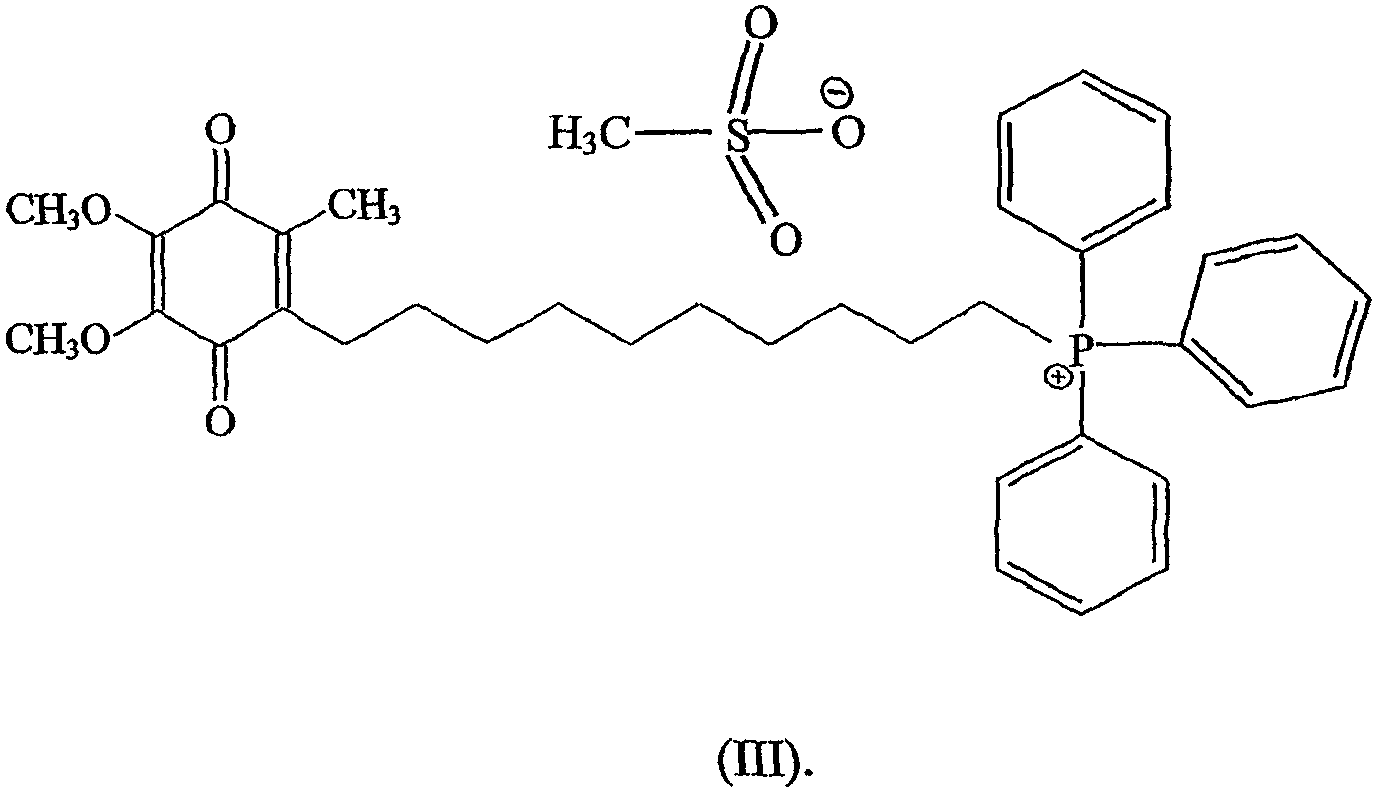
Более предпочтительное соединение имеет формулу
Предпочтительно циклодекстрином является β-циклодекстрин, более предпочтительно молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В дополнительном аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли, композиции или лекарственной форме настоящего изобретения для использования в профилактике или лечении симптомов старения у млекопитающих введением соединения или его соли указанному млекопитающему.
В одном варианте осуществления соединением является соединение формулы II или его фармацевтически приемлемая соль.
В другом варианте осуществления указанное введение проводят в первый день в дозировке, превышающей суточную дозу примерно в 1,02-2,0 раза, с последующим введением соединения или его соли в суточной дозе в течение последующих дней.
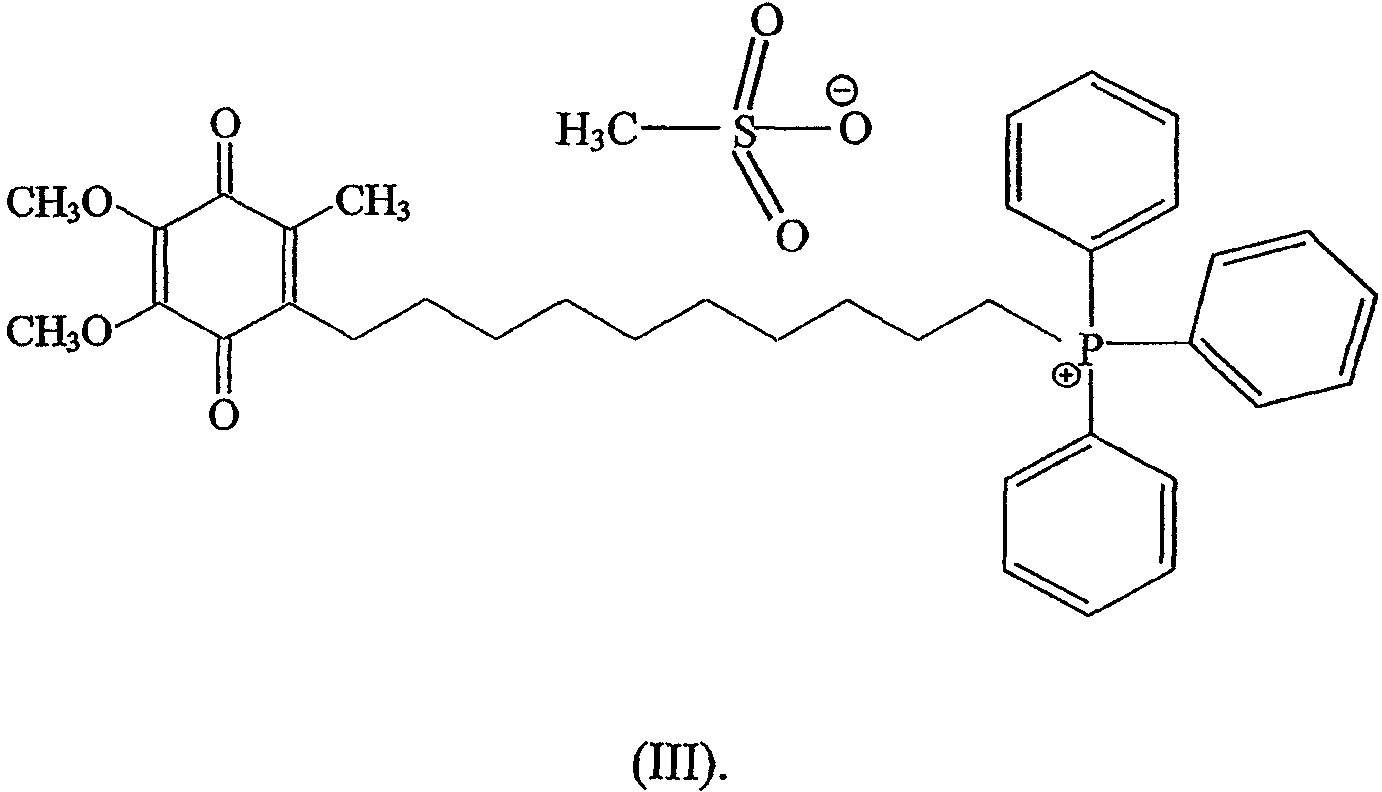
Предпочтительно солью является соль метансульфонат, а соединение объединяют с циклодекстрином.
Более предпочтительно соединение имеет формулу
Предпочтительно циклодекстрином является β-циклодекстрин, более предпочтительно молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В дополнительном аспекте настоящее изобретение относится к стабильному соединению, включающему липофильный катионный фрагмент, связанный соединительным фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, где
катионный фрагмент способен направленно вводить в митохондрии молекулы антиоксиданта, и
анионным компонентом не является ион галогена, а
анионный компонент не является нуклеофильным и/или
анионный компонент не проявляет реакционной активности относительно катионного фрагмента, соединительного фрагмента или молекулы антиоксиданта.
В одном варианте осуществления молекула антиоксиданта представляет собой хинон или хинол.
В другом варианте осуществления молекула антиоксиданта выбрана из группы, включающей витамин Е или производные витамина Е, антиоксиданта разрыва цепи, включающий бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, общие акцепторы радикалов, включающие дериватизированные фуллерены, спиновые ловушки, включающие производные 5,5-диметилпирролин-N-оксид, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
В одном варианте осуществления липофильным катионным фрагментом является катион замещенного или незамещенного трифенилфосфония.
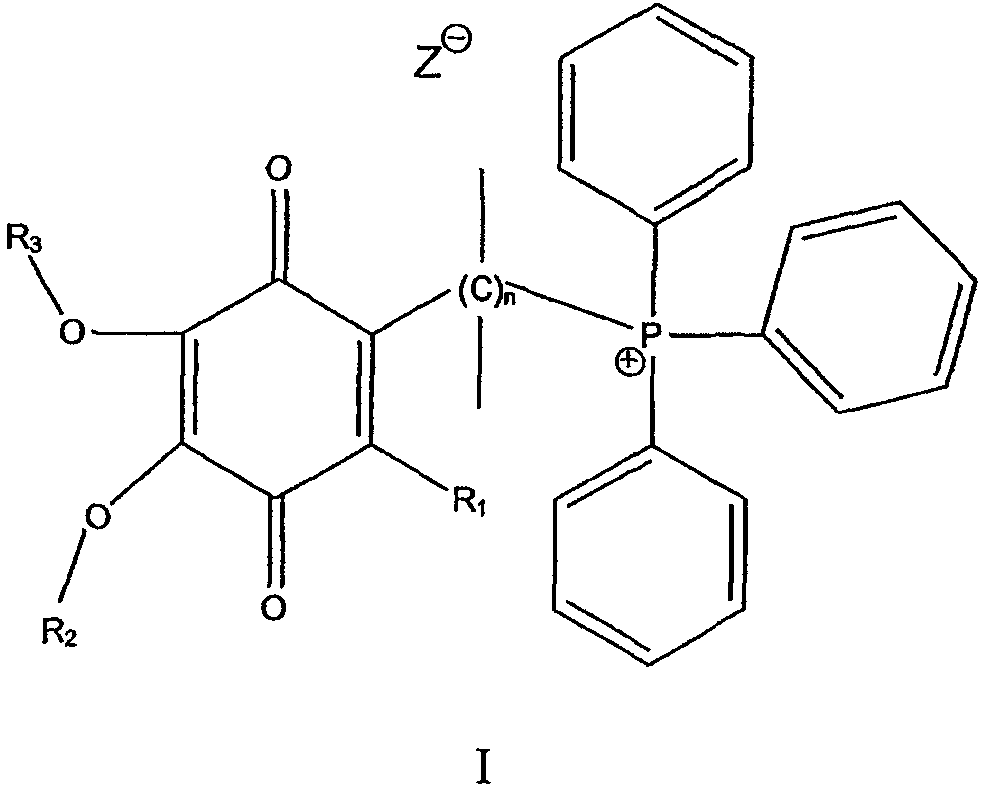
В одном варианте осуществления соединение имеет общую формулу I

и/или его хинольную форму, где группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны из С1-С5 алкильных (возможно замещенных) групп или Н, где n означает целое число от примерно 2 до примерно 20 и где символ Z означает нереакционноспособный анион.
Предпочтительно Z выбран из группы, включающей алкил- или арилсульфонаты или нитраты.
Предпочтительно каждая связь углерод-углерод в (С)n мостике является насыщенной.
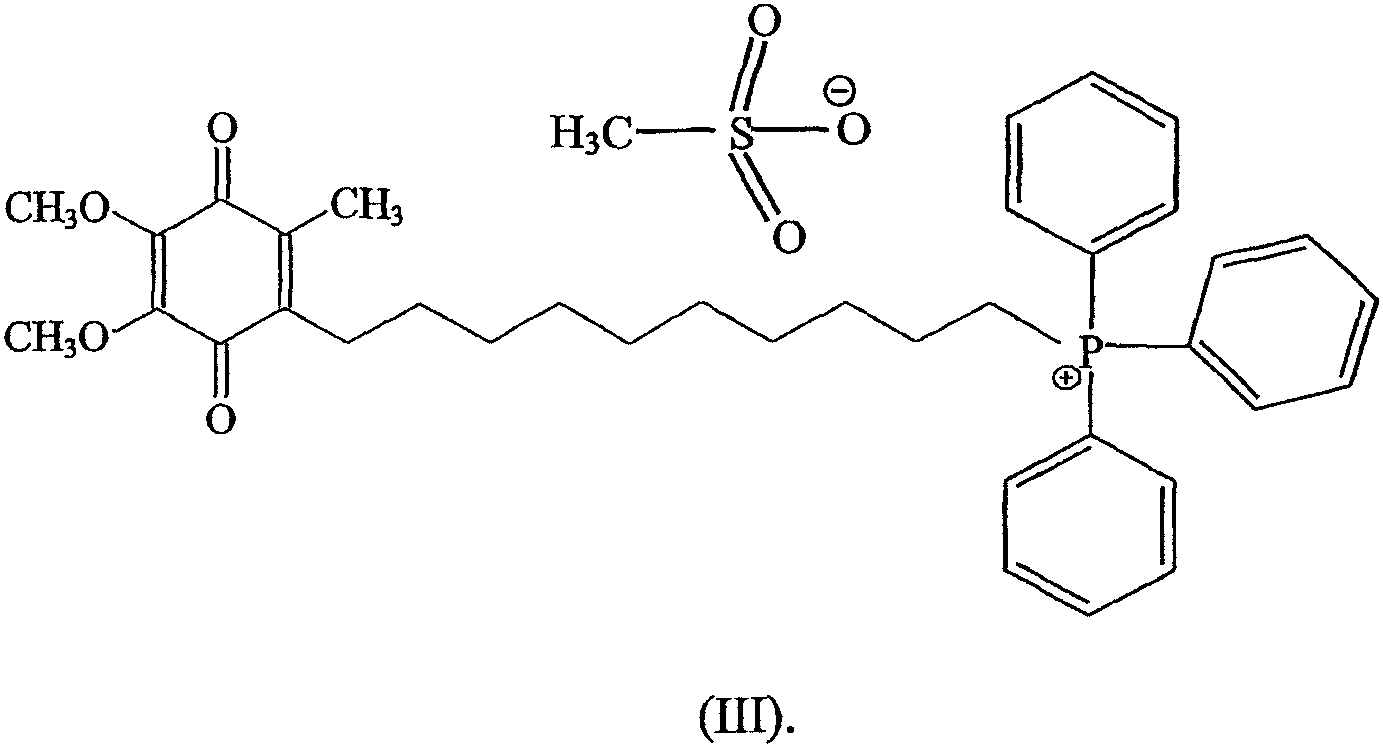
В предпочтительном варианте осуществления соединение имеет формулу
и/или его хинольную форму, где Z не является нуклеофильным анионом.
Более предпочтительно соединение имеет формулу
В другом аспекте изобретение относится к фармацевтической композиции, содержащей или включающей стабильное соединение, включающее катионный фрагмент, которым является липофильный катионный фрагмент, связанный соединительным фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, причем
катионный фрагмент способен направленно вводить в митохондрии молекулы антиоксиданта и
анионный компонент не является ионом галогена и
анионный компонент не является нуклеофильным и/или
анионный компонент не проявляет реакционной активности по отношению к катионному фрагменту, соединительному фрагменту или молекуле антиоксиданта.
В одном варианте осуществления молекула антиоксиданта представляет собой хинон или хинол.
В других вариантах осуществления молекула антиоксиданта выбрана из группы, включающей витамин Е или производные витамина Е, антиоксиданты разрыва цепи, включающие бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, общие акцепторы радикалов, включающие дериватизированные фуллерены, спиновые ловушки, включающие производные 5,5-диметилпирролин-N-оксида, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
В одном варианте осуществления липофильный катионный фрагмент представляет собой катион замещенного или незамещенного трифенилфосфония.
В одном варианте осуществления соединение имеет общую формулу I
и /или его хинольную форму, где группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны из С1-С5 алкильных (возможно замещенных) групп или Н, где n означает целое число от примерно 2 до примерно 20 и где символ Z означает нереакционноспособный анион.
Предпочтительно Z выбран из группы, включающей алкил- или арилсульфонаты или нитраты.
Предпочтительно каждая связь углерод-углерод в (С)n мостике является насыщенной.
В дополнительном варианте осуществления соединение имеет формулу
и/или его хинольную форму, где Z не является нуклеофильным анионом.
В дополнительном варианте осуществления композиция включает соединение, имеющее формулу II, и/или его хинольную форму, где Z не является нуклеофильным анионом и где композиция включает циклодекстрин.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
Более предпочтительно композиция включает соединение, имеющее формулу

в которой циклодекстрином является β-циклодекстрин, более предпочтительно молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В одном варианте осуществления фармацевтическая композиция составлена для перорального ведения.
В дополнительном варианте осуществления фармацевтическая композиция составлена для парентерального введения.
В дополнительном аспекте настоящее изобретение относится к лекарственной форме, содержащей или включающей стабильное соединение, включающее липофильный катионный фрагмент, связанный соединительным фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, вместе с фармацевтически приемлемым разбавителем и/или носителем и/или наполнителем, причем
катионный фрагмент способен целенаправленно вводить в митохондрии молекулы антиоксиданта и
анионный компонент не является атомом галогена и
анионный компонент не является нуклеофильным и/или
анионный компонент не проявляет реакционной активности по отношению к катионному фрагменту, соединительному фрагменту или молекуле антиоксиданта.
В одном варианте осуществления молекула антиоксиданта представляет собой хинон или хинол.
В других вариантах осуществления молекула антиоксиданта выбрана из группы, включающей витамин Е и производные витамина Е, антиоксидант разрыва цепи, включающий бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, общие акцепторы радикалов, включающие дериватизированные фуллерены, спиновые ловушки, включающие производные 5,5-диметилпирролин-N-оксида, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
В одном варианте осуществления липофильный катионный фрагмент представляет собой катион замещенного или незамещенного трифенилфосфония.
В одном варианте соединение имеет общую формулу I

и/или его хинольную форму, где группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны из С1-С5 алкильных (возможно замещенных) групп или Н, где n означает целое число от примерно 2 до примерно 20 и где символ Z означает нереакционноспособный анион.
Предпочтительно Z выбран из группы, включающей алкил- или арилсульфонаты или нитраты.
Предпочтительно каждая связь углерод-углерод в (С)n мостике является насыщенной.
В дополнительном варианте осуществления соединение имеет формулу

и/или его хинольную форму, где Z не является нуклеофильным анионом.
В дополнительном варианте осуществления лекарственная форма включает в себя соединение, имеющее формулу II, и/или его хинольную форму, где Z не является нуклеофильным анионом и где композиция включает в себя циклодекстрин.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
Более предпочтительно лекарственная форма включает в себя соединение, имеющее формулу

в которой циклодекстрином является β-циклодекстрин, более предпочтительно молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В одном варианте осуществления лекарственная форма целесообразно подходит для перорального введения.
В дополнительном варианте осуществления лекарственная форма целесообразно подходит для парентерального введения.
В дополнительном аспекте настоящее изобретение включает лекарственную форму, подходящую для перорального введения, содержащую в качестве активного ингредиента соединение согласно настоящему изобретению, соединение представляет собой или составлено как кристаллическая форма и/или не жидкая форма.
В дополнительном аспекте настоящее изобретение относится к лекарственной форме, подходящей для парентерального введения и включающей в качестве активного ингредиента соединение согласно настоящему изобретению.
В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, подходящей для лечения больных, которые могут получить облегчение от снижения окислительного стресса или снижения симптомов старения, которая содержит или включает эффективное количество соединения настоящего изобретения в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями, носителями или разбавителями.
В одном варианте соединением является соединение формулы I.
В одном примере соединение образует комплекс с циклодекстрином.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
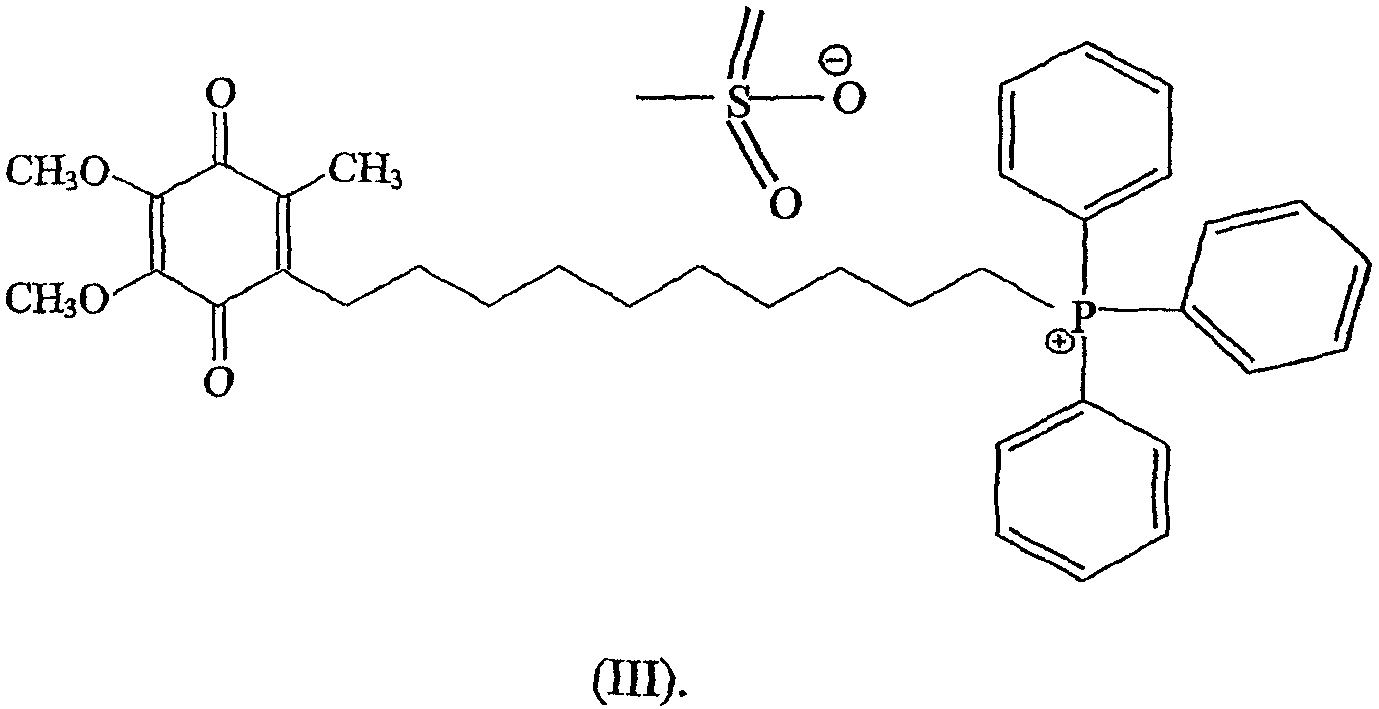
Более предпочтительно соединением является соединение формулы (III), а цклодекстрином является β-циклодекстрин, более предпочтительно и молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В дополнительном аспекте изобретение относится к способу снижения окислительного стресса в клетке, который включает стадию контактирования указанной клетки с соединением настоящего изобретения.
В одном варианте осуществления соединением является соединение формулы 1.
В одном примере соединение образует комплекс с циклодекстрином.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
Более предпочтительно соединением является соединение формулы (III), а циклодекстрином является β-циклодекстрин, более предпочтительно и молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В одном варианте осуществления фармацевтическая композиция составлена для перорального введения.
В дополнительном варианте осуществления фармацевтическая композиция составлена для парентерального введения.
В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, подходящей для лечения больных, страдающих или предрасположенных к болезни Паркинсона, болезни Альцгеймера, хореи Гентингтона или наследственной атаксии Фридрейха, которая содержит или включает эффективное количество соединения настоящего изобретения в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями, носителями или разбавителями.
Предпочтительно указанное лечение предназначено для больных, страдающих от или предрасположенных к наследственной атаксии Фридрейха.
Также в дополнительном аспекте настоящее изобретение относится к способу лечения или профилактики больных, которые могли бы получить облегчение от снижения окислительного стресса, который содержит или включает стадию введения указанному больному соединения настоящего изобретения.
В одном варианте соединением является соединение формулы I.
В одном примере соединение образует комплекс с циклодекстрином.
В различных примерах молярное отношение соединения к циклодекстрину составляет от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или примерно 1:1, например, молярное отношение соединения к циклодекстрину составляет примерно 1:2.
Более предпочтительно соединением является соединение формулы (III), а циклодекстрином являктся β-циклодекстрин, более предпочтительно и молярное отношение соединения к циклодекстрину составляет примерно 1:2.
В одном варианте осуществления указанное введение представляет собой пероральное введение.
В другом варианте указанное введение представляет собой парентеральное введение.
В другом аспекте изобретение относится к способу лечения или профилактики пациентов, которые почувствовали бы облегчение от снижения окислительного стресса или снижения симптомов старения, который включает стадию введения пациенту соединения настоящего изобретения.
Еще в другом аспекте изобретение относится к способу лечения или профилактики пациентов, страдающих или предрасположенных к болезни Паркинсона, болезни Альцгеймера, хореи Гентингтона или наследственной атаксии Фридрейха, который содержит или включает стадию введения указанным пациентам соединения настоящего изобретения.
Предпочтительно способ лечения или профилактики относится к больным, страдающим или предрасположенным к наследственной атаксии Фридрейха.
В другом аспекте изобретение относится к способу снижения окислительного стресса в клетках, который включает стадию введения в клетки соединения настоящего изобретения.
В другом аспекте изобретение относится к применению соединений, описанных выше, при получении или производстве лекарства, лекарственной формы или фармацевтической композиции, эффективной для использования в целях снижения окислительного стресса у пациентов.
В другом аспекте изобретение относится к применению соединений, описанных выше, при получении или производстве лекарства, лекарственной формы или фармацевтической композиции, эффективной для использования в целях снижения симптомов старения у пациентов.
В дополнительном аспекте изобретение относится к применению соединений настоящего изобретения при получении или производстве лекарства, лекарственной формы или фармацевтических композиций, эффективных для использования при лечении или профилактики у пациентов, страдающих от или предрасположенных к болезни Паркинсона, болезни Альцгеймера, хореи Гентингтона или наследственной атаксии Фридрейха, который содержит или включает стадию введения указанным пациентам соединения настоящего изобретения.
Предпочтительно лекарство, лекарственная форма или фармацевтическая композиция является эффективной при использовании в лечении или профилактике пациентов, страдающих от или предрасположенных к атаксии Фрифдрейха.
В другом аспекте изобретение относится к применению соединений, описанных выше, при получении или производстве лекарства, лекарственной формы или фармацевтической композиции, эффективной для использования при снижении окислительного стресса в клетках.
Предпочтительно указанное получение или производство осуществляют при использовании другого материала или материалов, более предпочтительно фармацевтически приемлемых разбавителей, наполнителей и/или носителей.
В дополнительном аспекте настоящее изобретение относится к способу синтеза соединения с фрагментом или фрагментом формулы I
и/или его хиноновой формы) где группы R1, R2 и R3, которые могут быть одинаковыми или различными, выбраны из С1-С5 алкильных (возможно замещенных) групп, где n означает целое число от 2 до 20, указанный способ содержит или включает смешение с декстрином.
Предпочтительно каждая связь углерод-углерод в (С)n мостике является насыщенной.
В дополнительном аспекте настоящее изобретение относится к способу синтеза соединения, имеющего формулу
указанный способ содержит или включает смешение с циклодекстрином.
В дополнительном аспекте настоящее изобретение относится к способу синтеза соединения, имеющего формулу
по существу как описано в настоящем описании.
Любое обсуждение документов, актов, материалов, устройств, статей или т.п., которое включено в настоящее описание изобретения, сделано единственно с целью изложения контекста настоящего изобретения. Не следует считать признанием, что любой или все из этих позиций, взятых из известного уровня, или являющихся общими с известными знаниями в данной области, важны для настоящего изобретения, так как существовали до даты приоритета каждого пункта формулы изобретения настоящей заявки.
Во всем тексте настоящего описания слово “включать” или его варианты, такие как “включает” или “включающий”, следует понимать как заключающий в себе указанный элемент, целое число или стадию, или группу элементов, целых чисел или стадий, но не охватывающий никакой другой элемент, целое число или стадию, или группу элементов, целых чисел или стадий.
Во всем тексте описания термин “хинон”, использованный самостоятельно или в сочетании с другим термином для описания окисленной формы соединения, следует понимать как включающий в пределах объема притязаний восстановленную форму этого соединения, то есть, хинольную форму. Аналогично этому, ссылка на хинон, например при структурном описании, также включает в пределах объема притязаний хинольную форму.
Во всем тексте описания термин “хинол”, использованный самостоятельно или в сочетании с другим термином для описания восстановленной формы соединения, следует понимать как включающий в пределах описания окисленную форму этого соединения, то есть, форму хинона. Аналогично этому, ссылка на хинол, например, при структурном описании, также включает в пределах объема притязаний форму хинона.
Как использовано в тексте описания, термин “и/или” включает оба значения: и “и”, и “или” как варианты.
Как использовано в тексте описания, термин “коэффициент распределения” и “коэффициент распределения (октанол : вода)” относится к коэффициенту распределения в системе октан-1-ол/солевой раствор с фосфатным буфером, определенному при 25°С или 37°С (смотри Kelso, G.F., Porteous, C.M., Coulter, C.V., Huges, G. Porteous, W.K., Ledgerwood, E.C., Smith, R.A.J. and Murphy, M.P. 2001, J. Biol. Chem., 276, 4588., Smith, R.A.J., Porteous, C.M., Coulter, C.V. and Murphy, M.P., 1999, Eu. J. Biochem., 263, 709. Smith, R.A.J., Porteous, C.M., Gane, A.M. and Murphy, M.P. 2003. Proc. Nat. Acad. Sci., 100, 5407), или коэффициент распределения в системе октанол/вода, рассчитанный с использованием программы Advanced Chemistry Development (ACD) Software Solaris V4.67, как описано в публикации Jauslin, M.L., Wirth, T., Meier, T., and Schoumacher, F., 2002, Hum. Mol. Genet. 11, 3055.
Как использовано в тексте, фраза “приемлемый для фармацевтического препарата” включает в пределах ее значения не только приемлемость относительно фармацевтического введения, но также в отношении состава, например, приемлемой стабильности, срока хранения, гигроскопичности, приготовления и т.п.
Как использовано в тексте, “нереакционноспособный анион” представляет собой анион, который не проявляет реакционной активности относительно молекулы антиоксиданта, липофильного катиона или соединительного фрагмента. Например, если один такой фрагмент соединения включает мишень нуклеофильной атаки, анион не является нуклеофильным.
Хотя определеннее в широком объеме, изобретение не ограничивается им, но также содержит варианты осуществления, для которых в следующем описании даны примеры.
В частности, лучшее понимание изобретения дает ссылка на прилагаемые чертежи.
Краткое описание чертежей
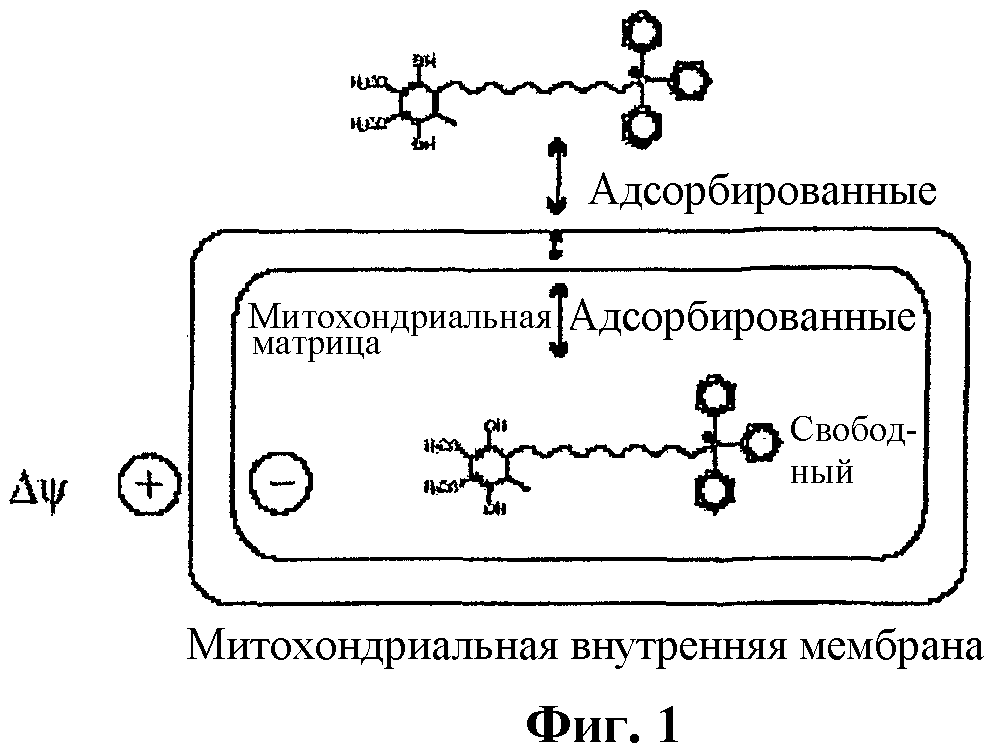
На фиг.1 изображена схема проникновения амфифильного антиоксиданта в митохондрию, где показано проникновение Митохинона-С10 в возбужденный митохондрион.
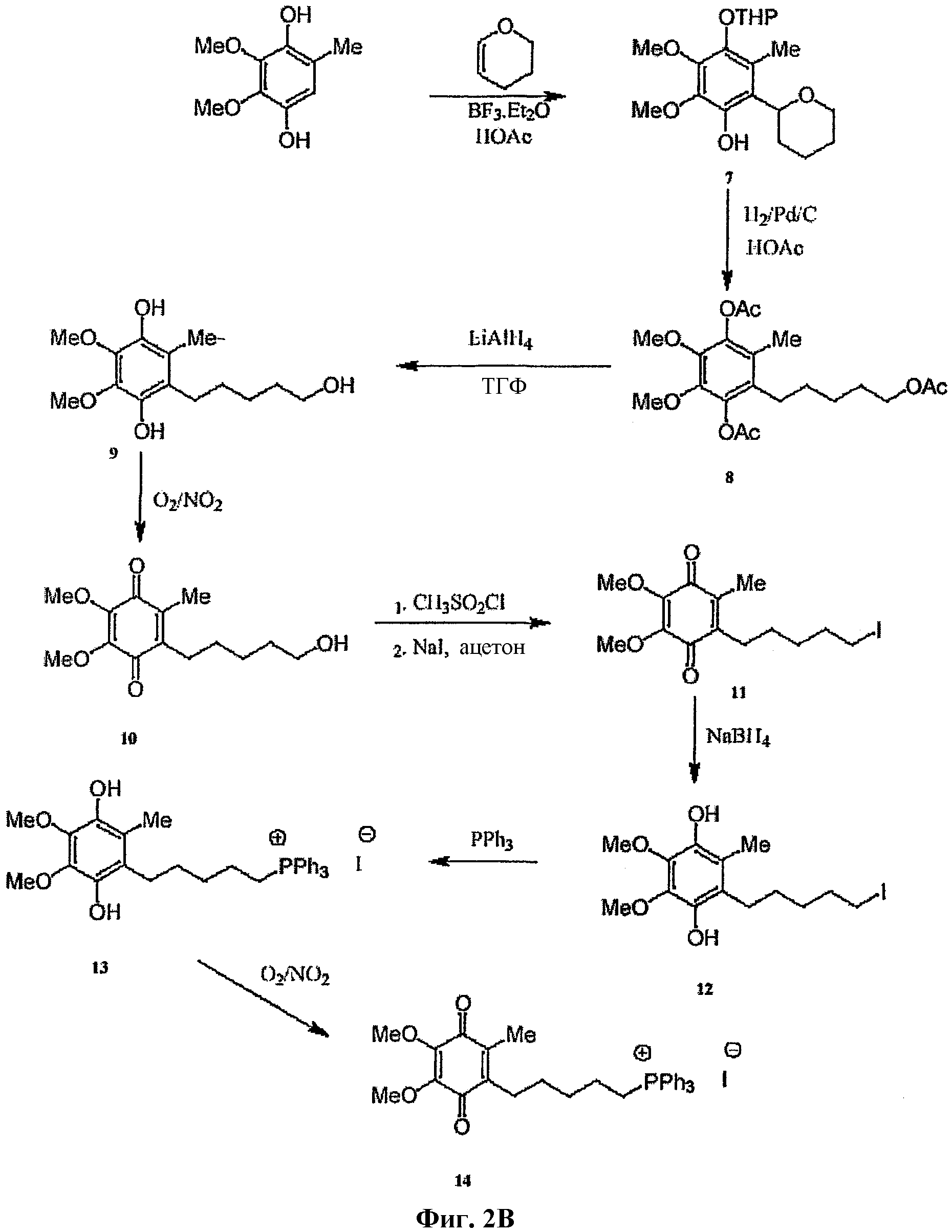
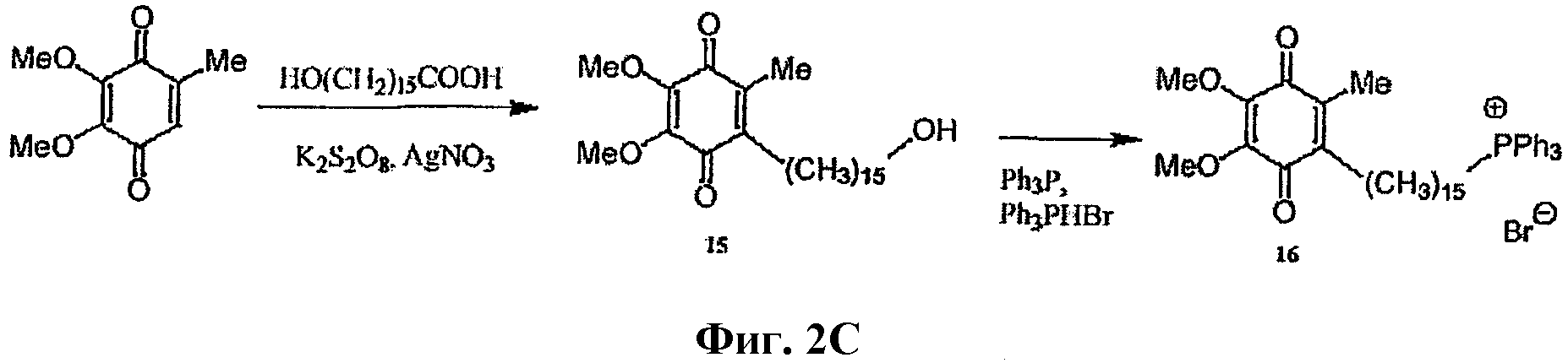
На фиг.2 изображена схема синтеза для А: Митохинона-С3; В: Митохинона-С5; С: Митохинона-С15.
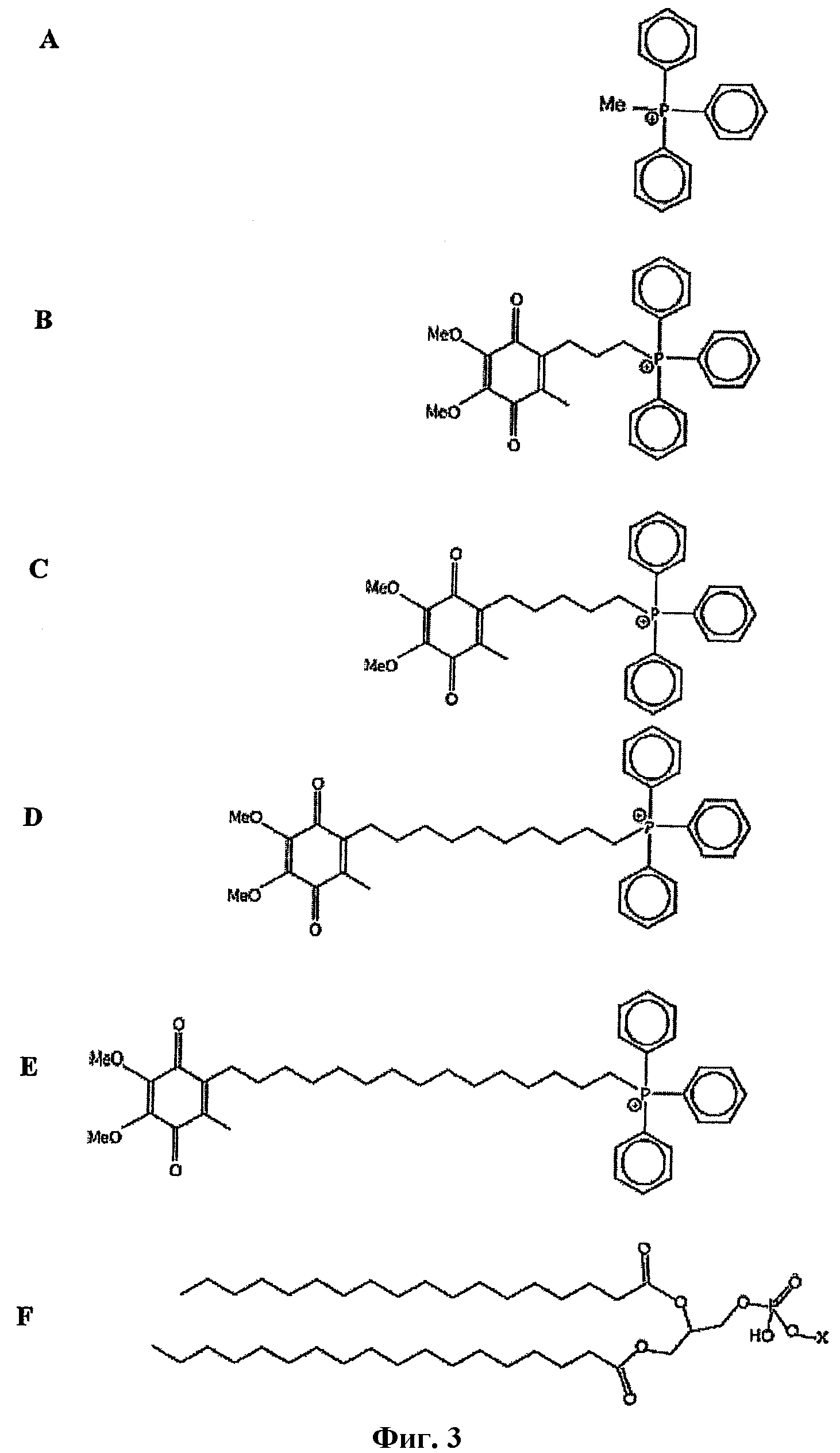
На фиг.3 изображена структура антиоксидантов ряда Митохинона и родственных соединений ТРМР. Фосфолипид, изображенный в том же масштабе, выровнен с антиоксидантами ряда Митохинона для обозначения возможной максимальной глубины проникновения убихинольной боковой цепи в один листок фосфолипидного двойного слоя. А: ТРМР; В: Митохинон-С3; С: Митохинон-С5; D: Митохинон-С10; Е: Митохинон-С15; F: фосфолипид.
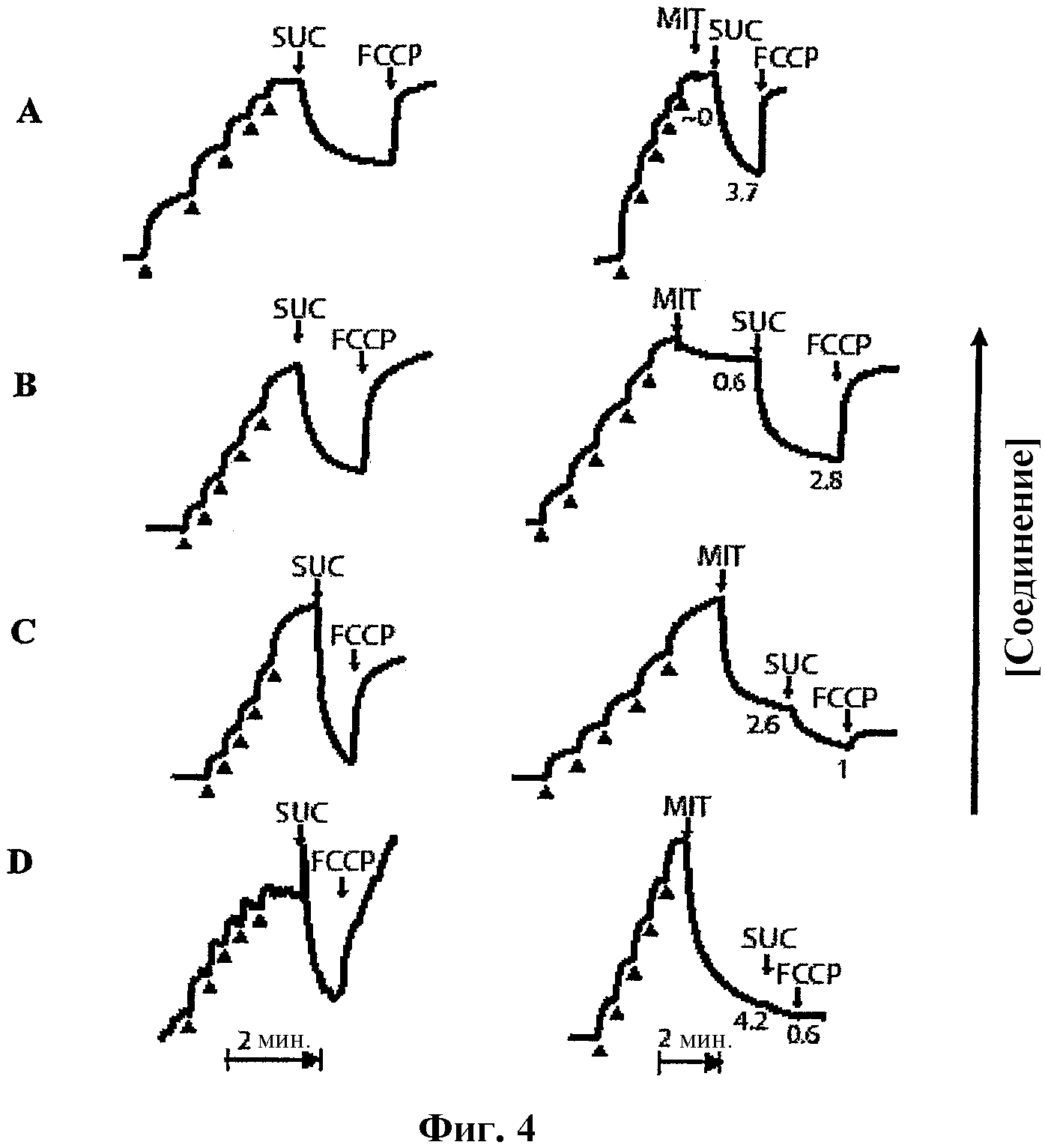
На фиг.4 представлены графики, показывающие поглощение и связывание антиоксидантов митохондрией, измеренное с использованием ионоселективного электрода. А: Митохинон-С3; В: Митохинон-С5; С: Митохинон-С10; D: Митохинон-С15. Слева представлены панели митохондрии (1 мг белка/мл) в присутствии ротенона, а затем добавляют антиоксиданты пятью последовательными добавлениями объемом 1 мкМ (черные стрелки сверху) для калибровки отклика электрода. Справа панели электродов были сначала калиброваны пятью последовательными добавлениями объемом 1 мкМ (черные стрелки сверху), а затем добавили митохондрии (1 мг белка/мл). Во всех случаях был добавлен сукцинат для генерирования мембранного потенциала, и был добавлен FCCP для диссипации его. Данные представляют собой типичные отклики на эксперимент, повторенный, по меньшей мере, 2-3 раза.
На фиг.5 представлены графики, показывающие антиоксидантную эффективность антиоксиданта. А: Митохондрии были возбуждены сукцинатом (черные стрелки) или инкубированием с АТР регенерирующей системой, включающей АТР, пируват фосфоенола и пируват киназы (белые стрелки). Через 30 сек предварительного инкубирования с различными аналогами Митохинона, ТРМР или носителями индуцировали окислительный стресс добавлением 50 мкМ FeCl2 и 300 мкМ Н2О2. Через 15 минут инкубирования при 37°С установили липидное пероксидирование измерением TBAR. Результаты означают ± интервал двух независимых экспериментов. Легкий защитный эффект Митохинона С-5 от пероксидации липида в присутствии АТР обусловлен некоторым количеством Митохинона-С5, добавленнего из основного раствора и находящегося в убихинольной форме. В: Митохондриальный мембранный потенциал, индуцированный сукцинатом или АТР регенерирующей системой, измеряли по аккумулированию [3H]TPMP. Результаты означают ± интервал двухразового определения 25-ти минутной инкубации. Мембранные потенциалы через 5 минут инкубации были те же (данные не представлены). С: Измеряли концентрационную зависимость предотвращения аккумулирования TBAR антиоксидантами. Все инкубирования проводили в присутствии сукцината, как описано для А. Результаты выразили в % ингибирования TBARS составом, приняв величину образца, подвергнутого воздействию FeCl2/H2O2 в отсутствие аналогов Митохинона за 0% ингибирования, а контрольный образец (без добавления FeCl2/H2O2) за 100%. Показанные данные представляют собой типичные результаты титрования для каждой концентрации, определенные трижды ± SD. IC50концентрации для предупреждения пероксидации липида. Результаты означают средние значения ± sem, рассчитанные по трем независимым титрованиям, как показано в пункте С. Статистическую значимость относительно IC50 для митохинона-С3 определяли с использованием учебного теста по двум пологим участкам: *р<0,05; **р<0,005.
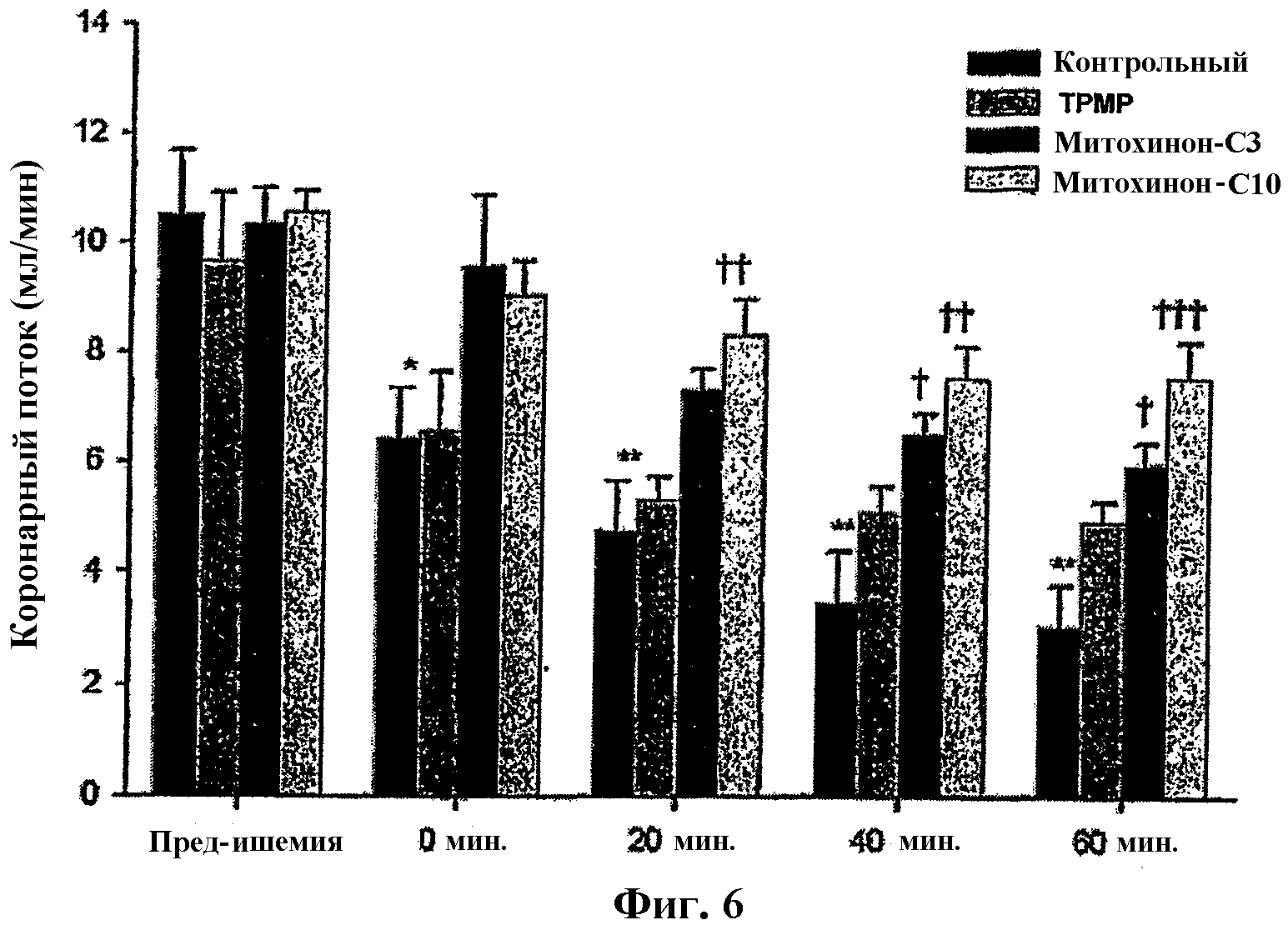
На фиг.6 представлена диаграмма, показывающая влияние митохинона-С10 и Митохинона-С3 на синусовый коронарный поток.
На фиг.7 представлена диаграмма, показывающая влияние Митохинона-С10 и Митохинона-С3 на диастолическое давление в левом желудочке.
На фиг.8 представлена диаграмма, показывающая влияние Митохинона-С10 и Митохинона-С3 на сердечный ритм.
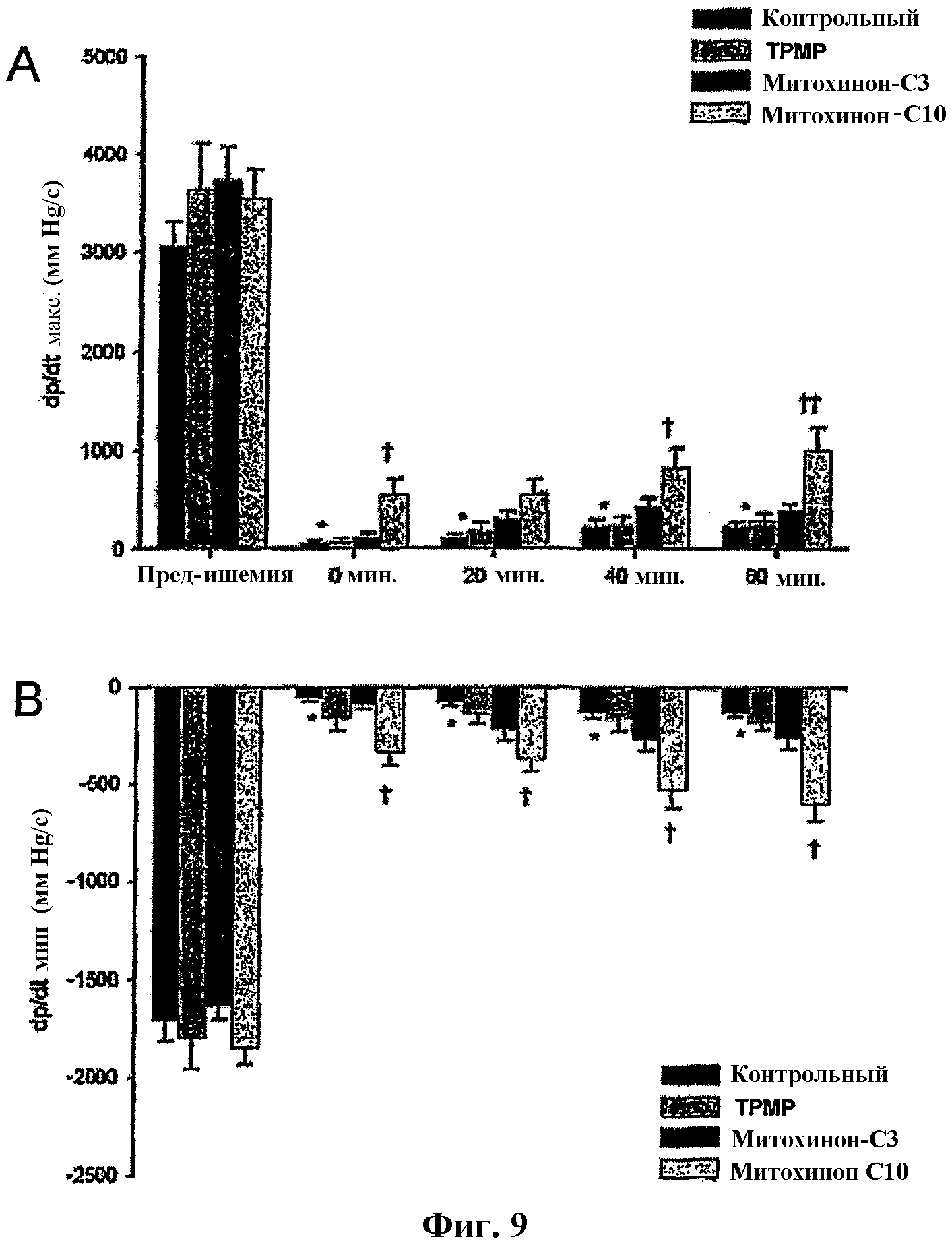
На фиг.9 представлены диаграммы, показывающие изменение ритма в левом желудочке.
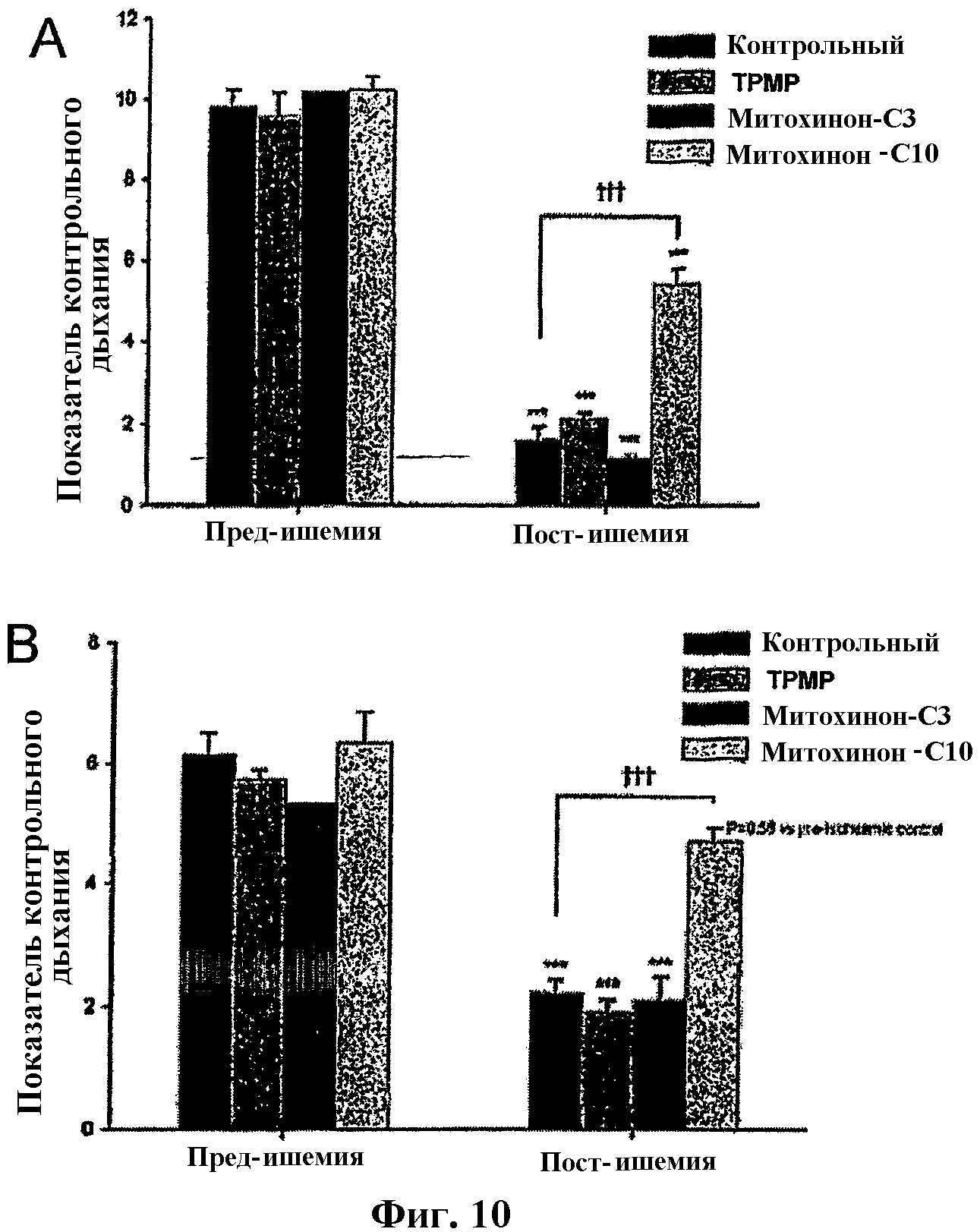
На фиг.10 представлены диаграммы, показывающие влияние Митохинона-С10 и Митохинона-С3 на постишемическую митохондриальную дыхательную функцию.
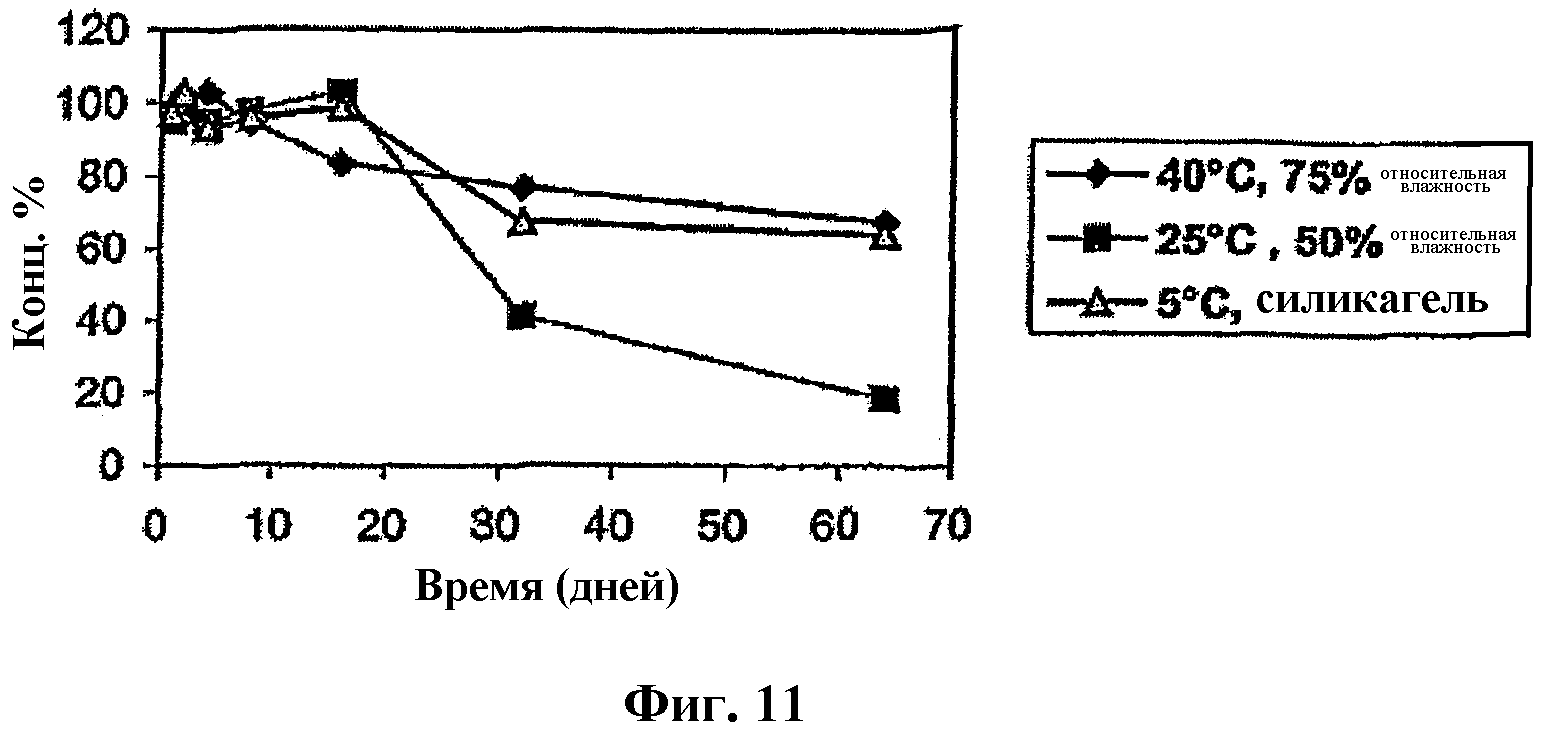
На фиг.11 представлены графики, отражающие стабильность чистого Митохинона-С10 (серия №3) в чистых стеклянных пузырьках при 40°С, 75% относительной влажности; 25°С, 50% относительной влажности; и 5°С над силикагелем.
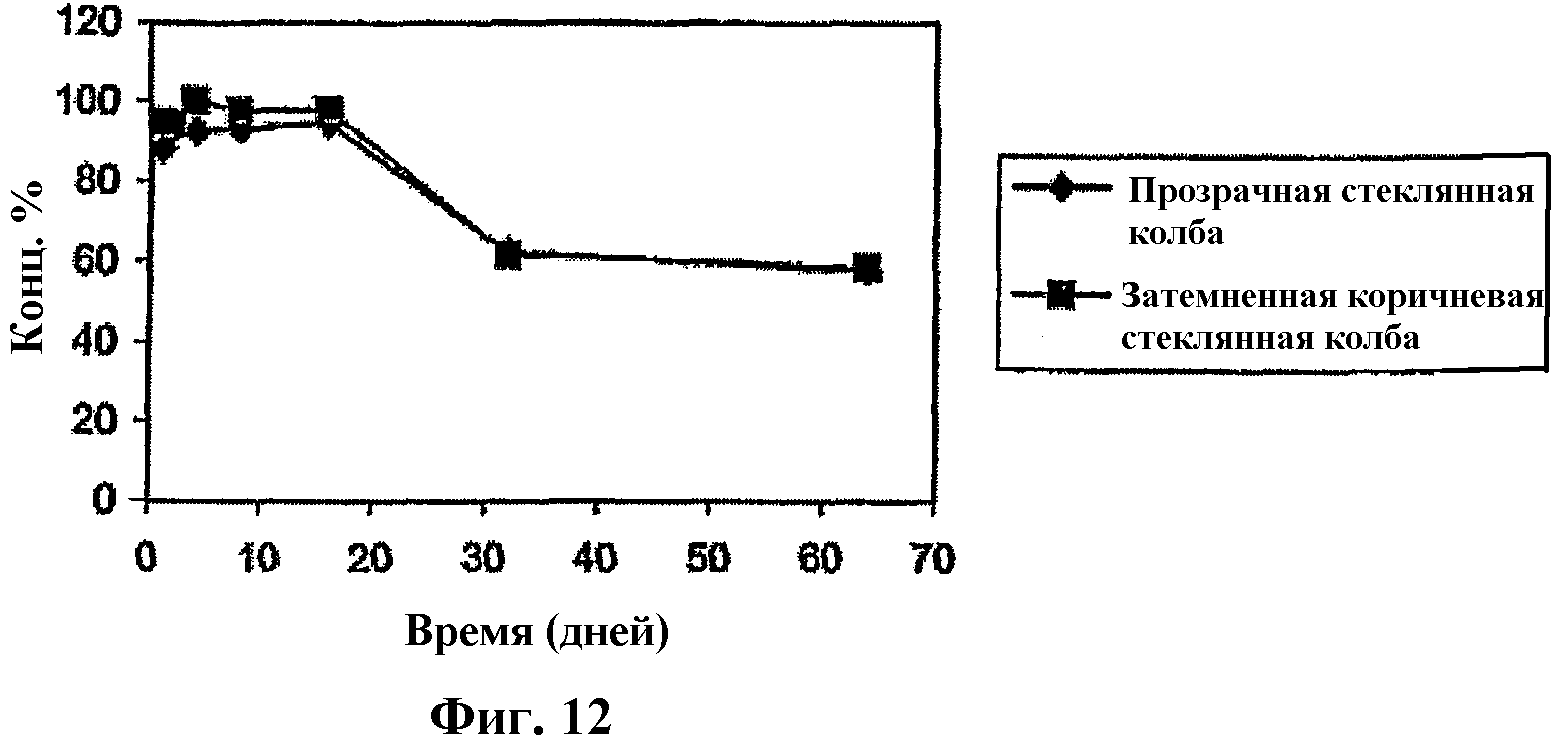
На фиг.12 представлены график, отражающий стабильность Митохинона-С10 (серия №4) при 25°С, 50% относительной влажности.
На фиг.13 представлен график, отражающий стабильность комплекса Митохинона-С10 и β-циклодекстрина (1:1) при 4°С над силикагелем, 50% относительной влажности и 40°С, 75% относительной влажности.
На фиг.14 представлен график, отражающий стабильность комплекса Митохинона-С10 и β-циклодекстрина (1:2) при 4°С над силикагелем, 25°С, 50% относительной влажности и 40°С, 75% относительной влажности.
На фиг.15 представлен график, отражающий стабильность комплекса Митохинона-С10 и β-циклодекстрина (1:4) при 4°С над силикагелем, 25°С, 50% относительной влажности и 40°С, 75% относительной влажности.
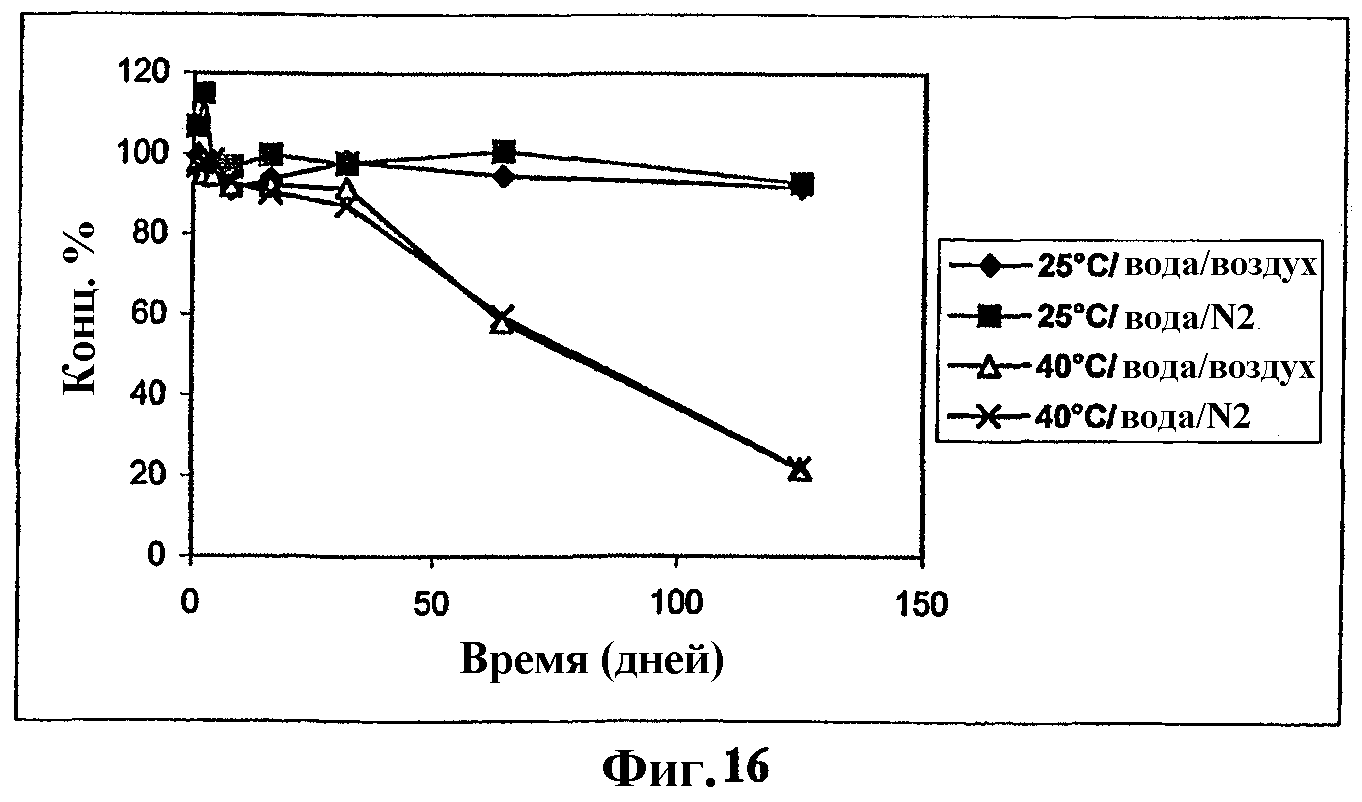
На фиг.16 представлен график, показывающий стабильность мезилата Митохинона-С10 в воде.
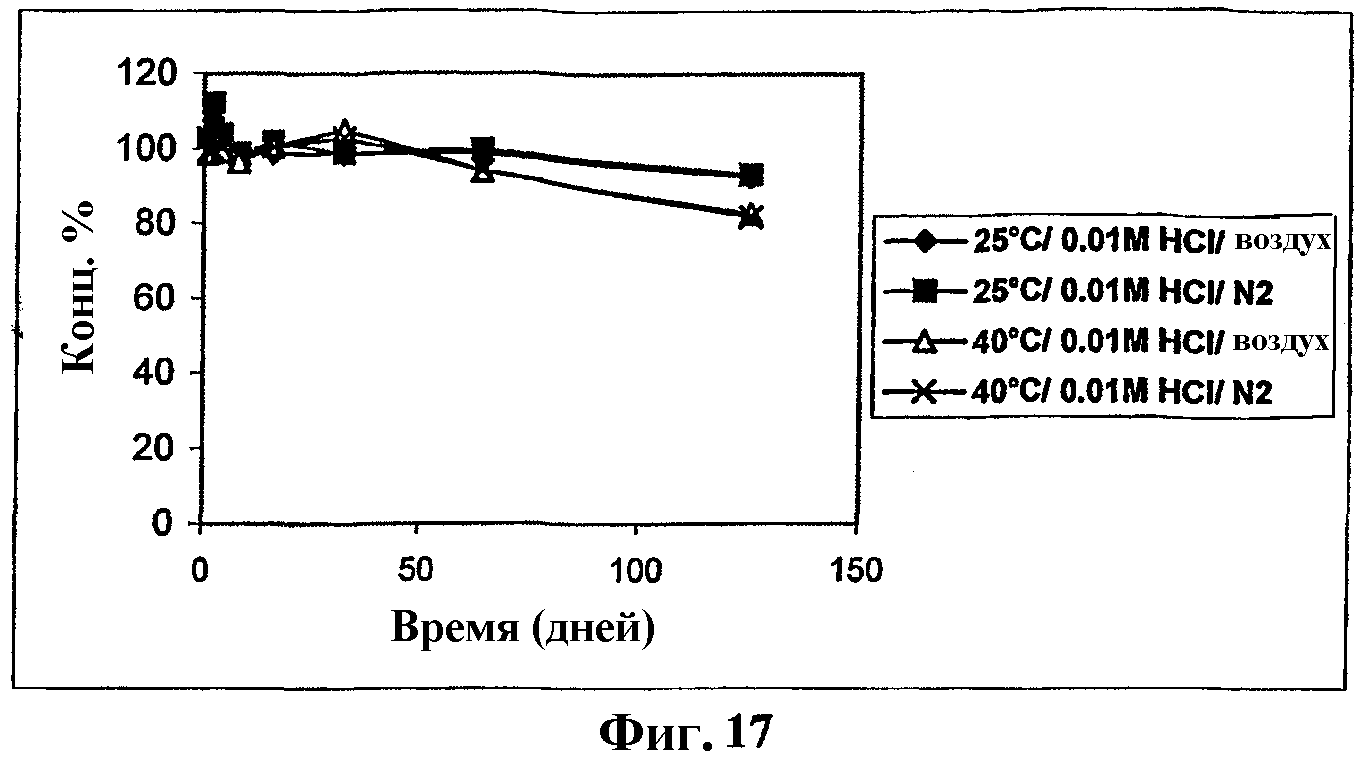
На фиг.17 представлен график, показывающий стабильность мезилата Митохинона-С10 в 0,01 М HCl.
На фиг.18 представлен график, показывающий стабильность мезилата Митохинона-С10 в IPB, рН 7,4.
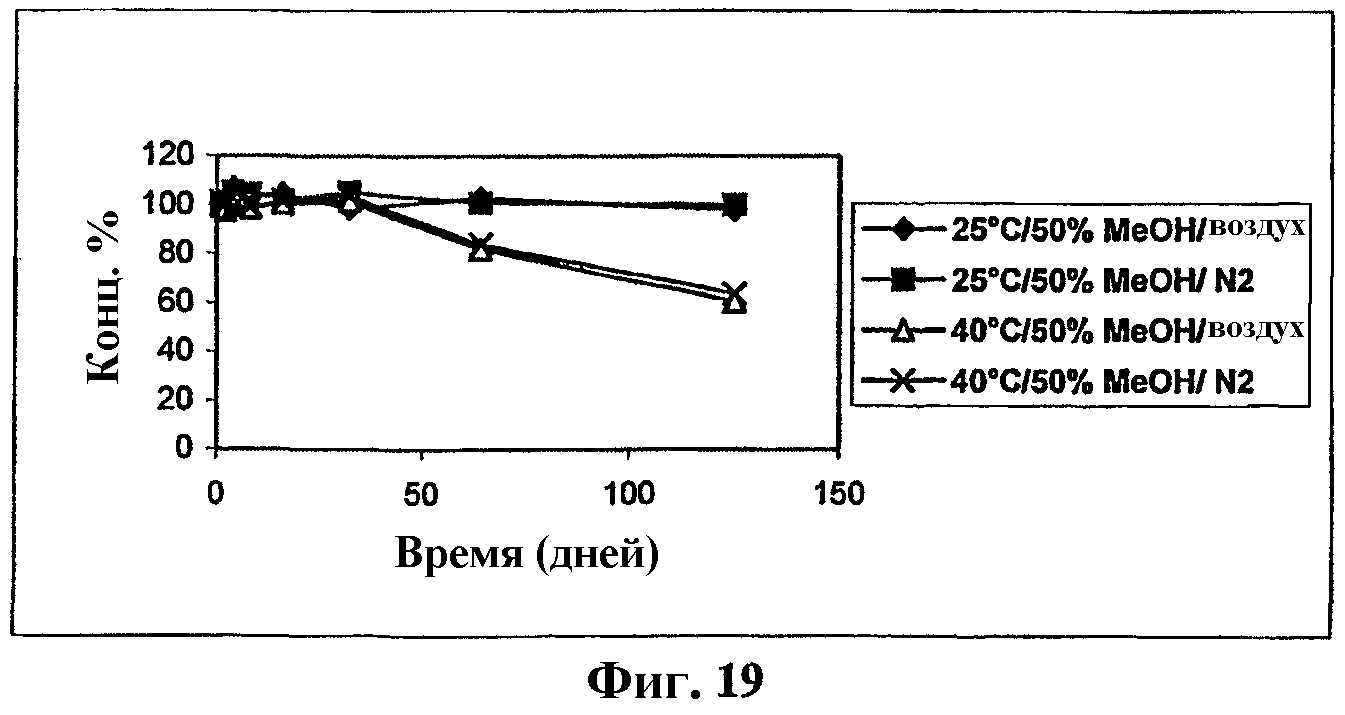
На фиг.19 представлен график, показывающий стабильность мезилата Митохинона-С10 в 50% MeOH.
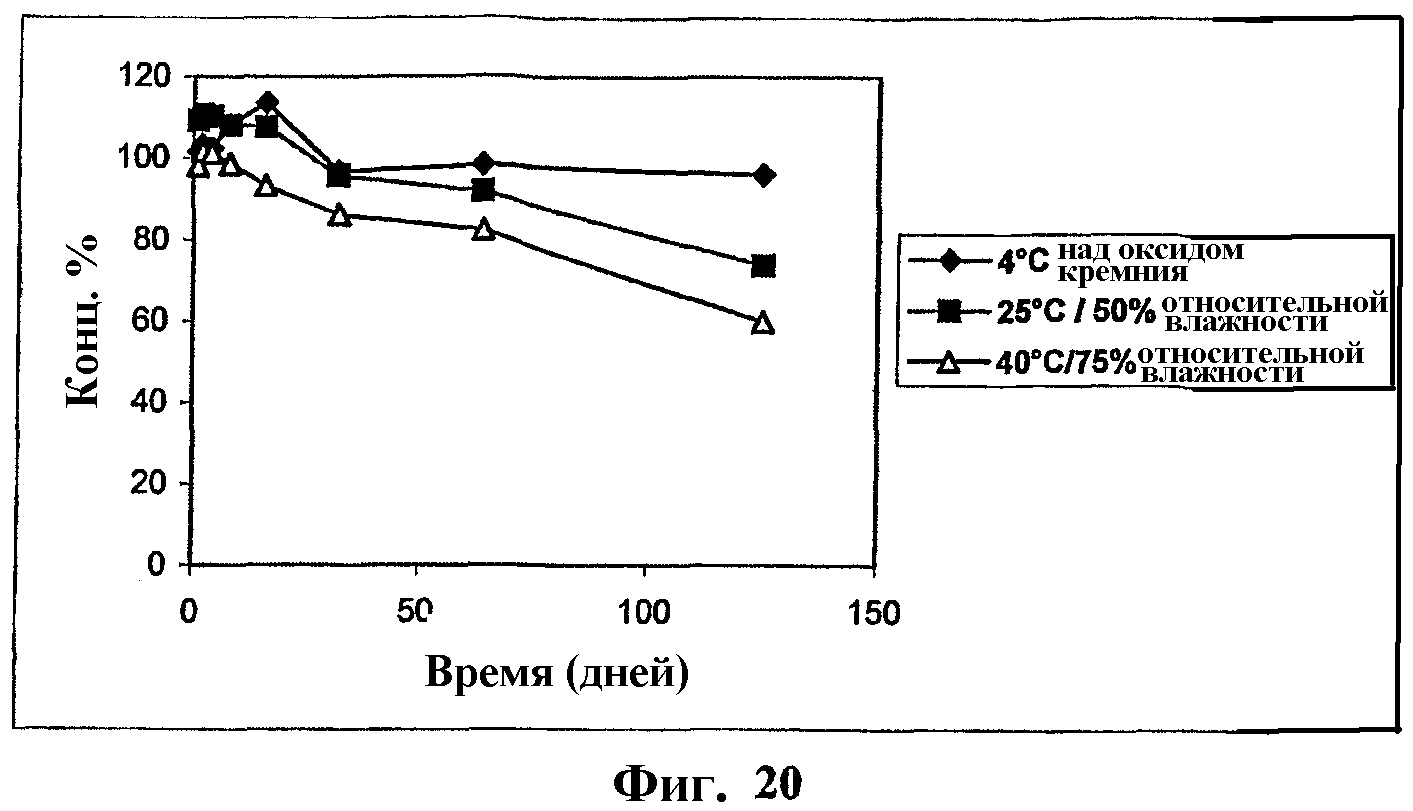
На фиг.20 представлен график, показывающий стабильность в твердом состоянии мезилата Митохинона-С10 при 40°С, 75% относительной влажности; и 25°С, 50% относительной влажности и 4°С над синим силикагелем.
На фиг.21 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) в воде.
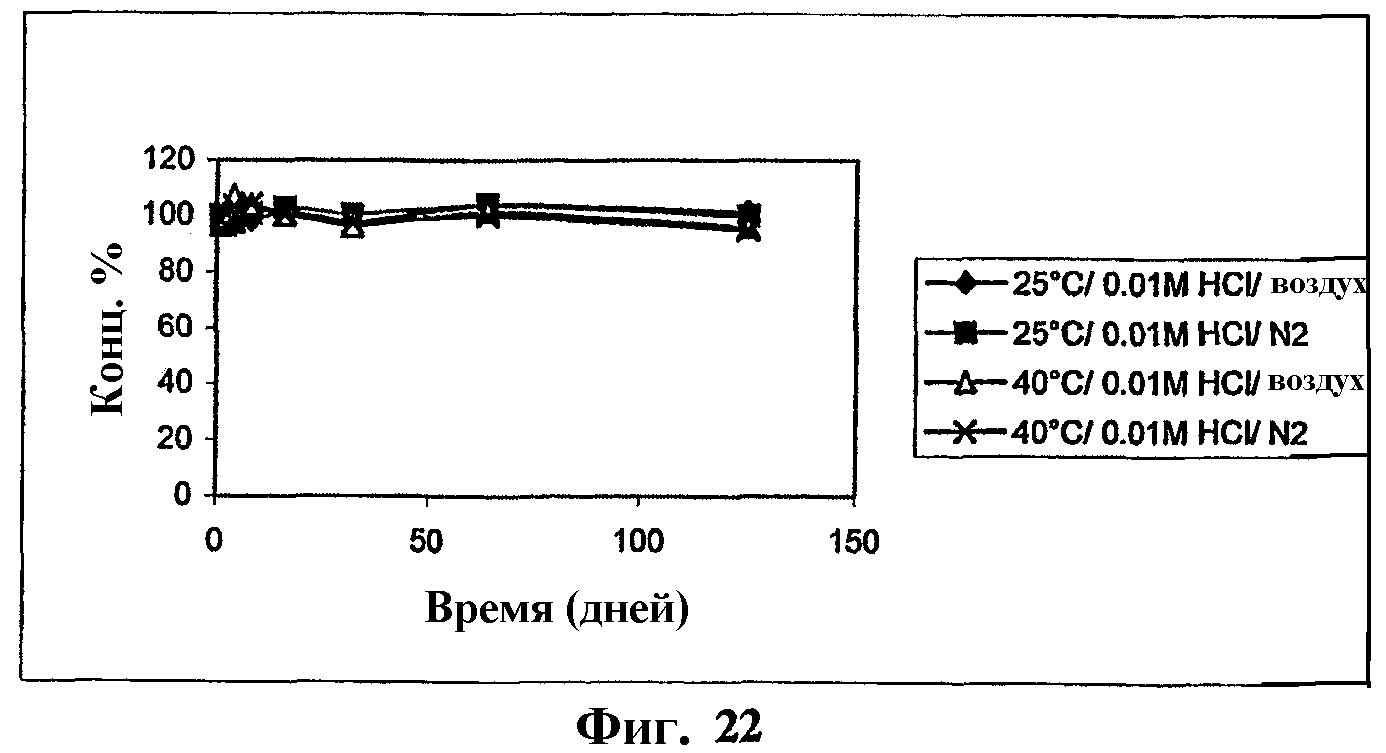
На фиг.22 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) в 0,01 М HCl.
На фиг.23 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) в IPB, рН 7,4.
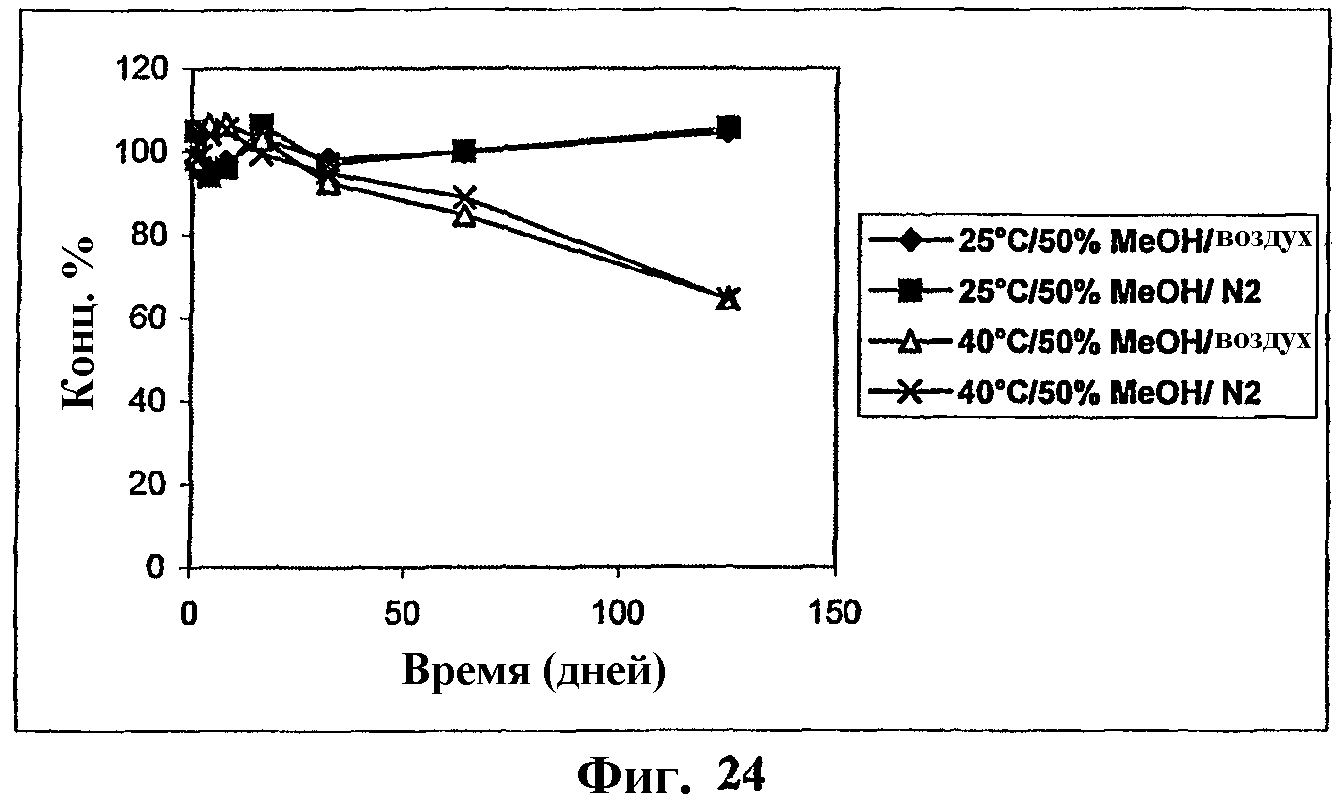
На фиг.24 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) в 50% МеОН.
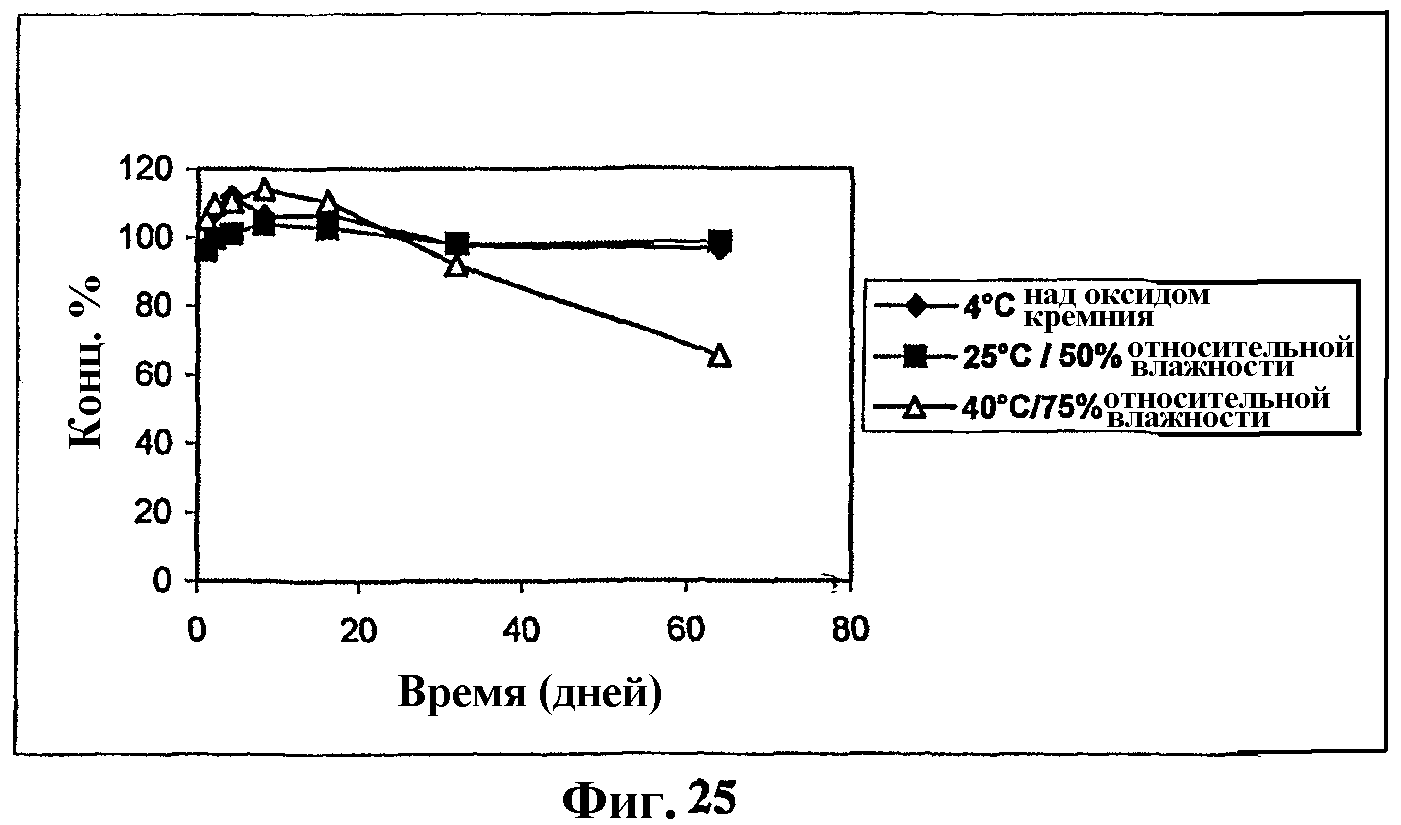
На фиг.25 показан график, показывающий стабильность в твердофазном состоянии комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) при 40°С, 75% относительной влажности; при 25°С, 50% относительной влажности и 4°С над синим силикагелем.
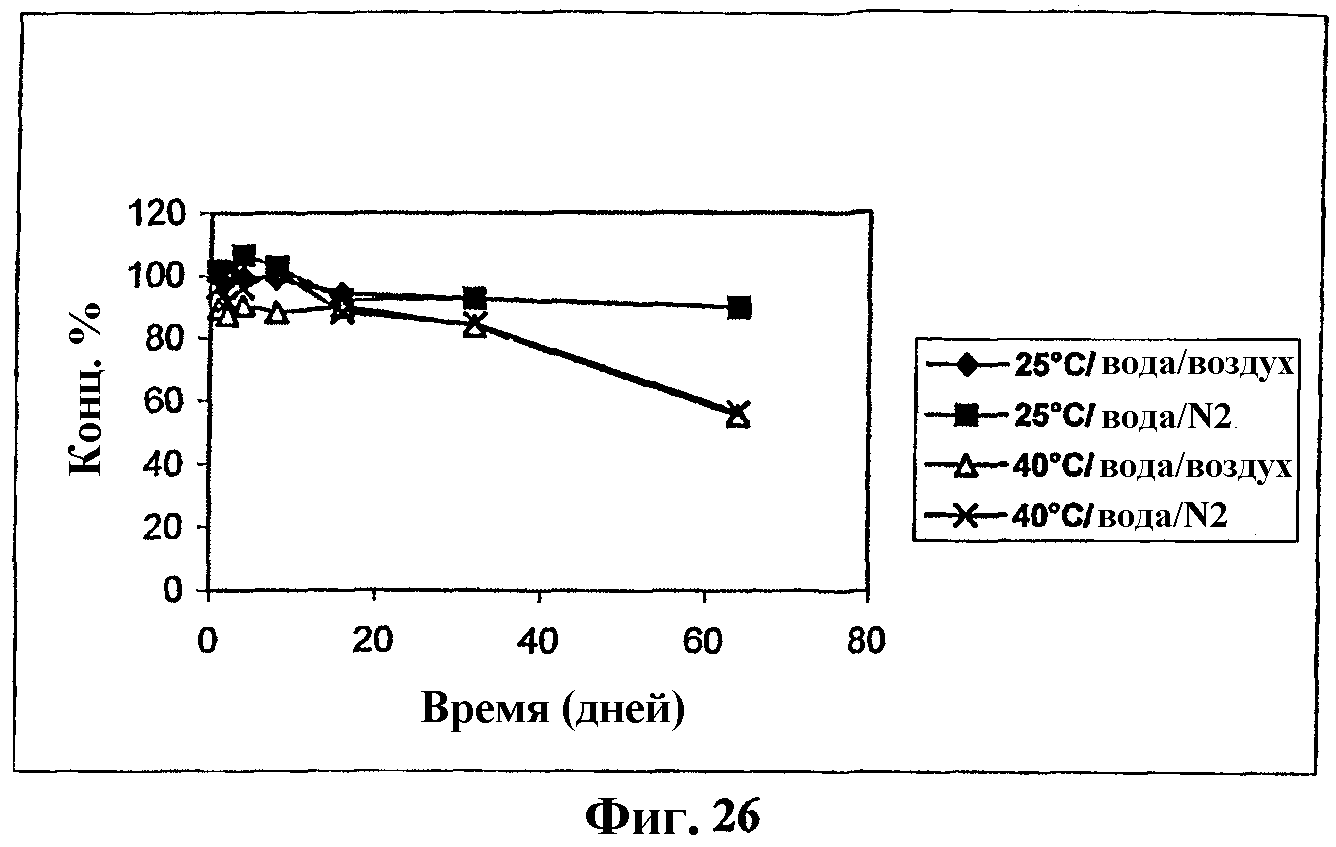
На фиг.26 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) в воде.
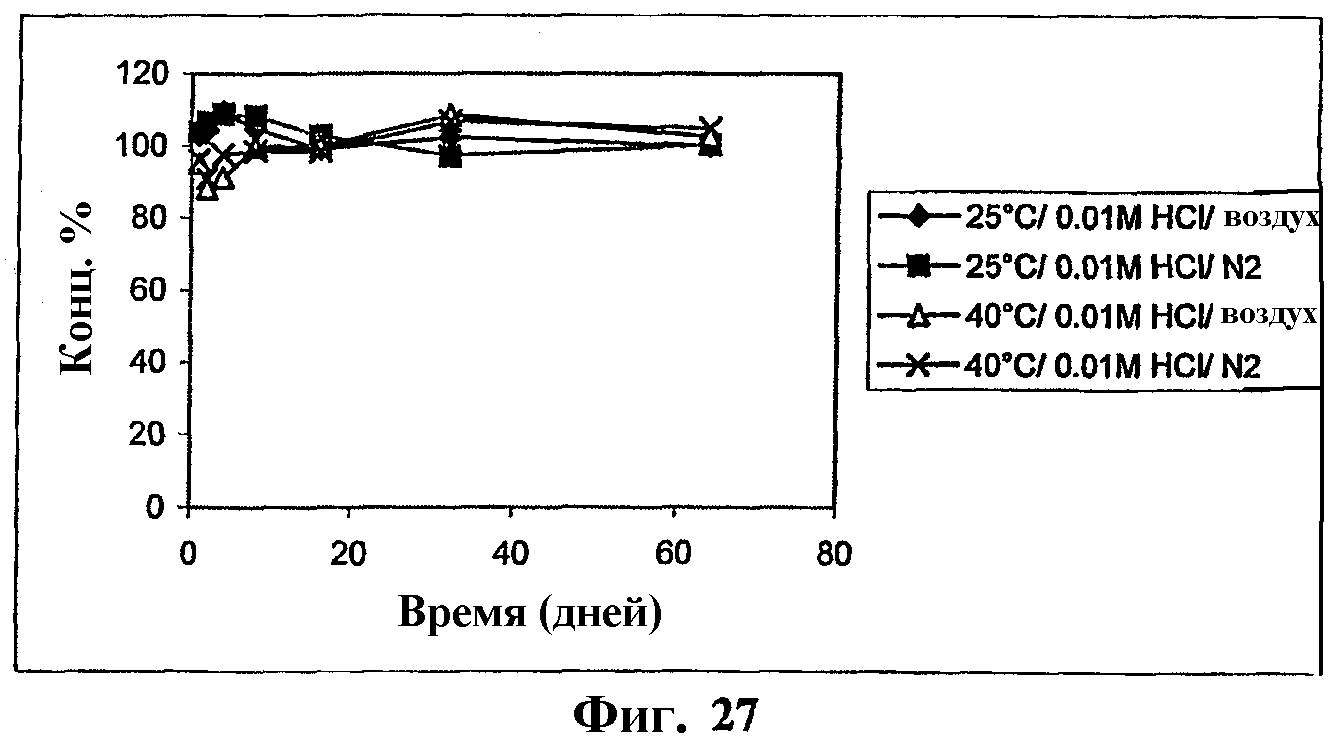
На фиг.27 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:1) в 0,01 М HCl.
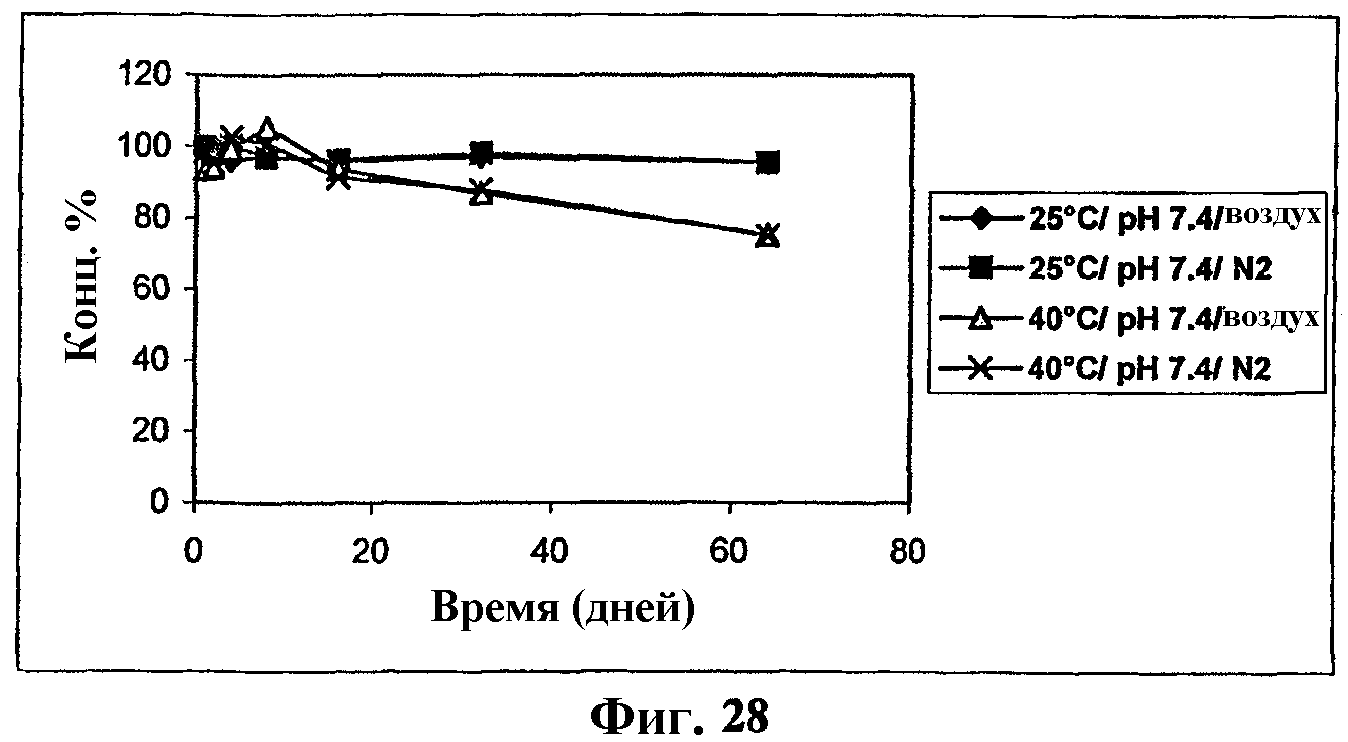
На фиг.28 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:1) в IPB, рН 7,4.
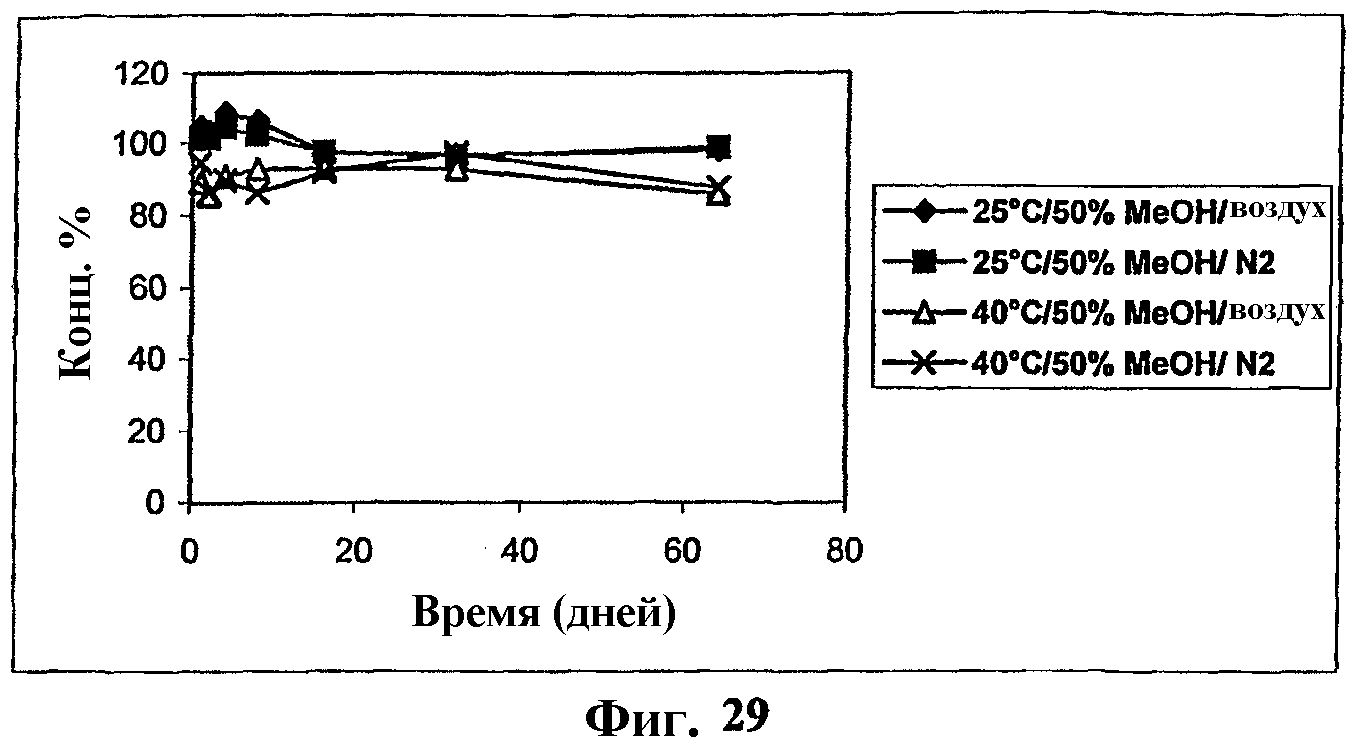
На фиг.29 представлен график, показывающий стабильность комплекса мезилат Митохинона-С10-β-циклодекстрин (1:1) в 50% метаноле.
На фиг.30 представлен график, показывающий стабильность в твердофазном состоянии комплекса мезилат Митохинона-С10-β-циклодекстрин (1:1) при 40°С, 75% относительной влажности; 25°С, 50% относительной влажности и 4°С над синим силикагелем.
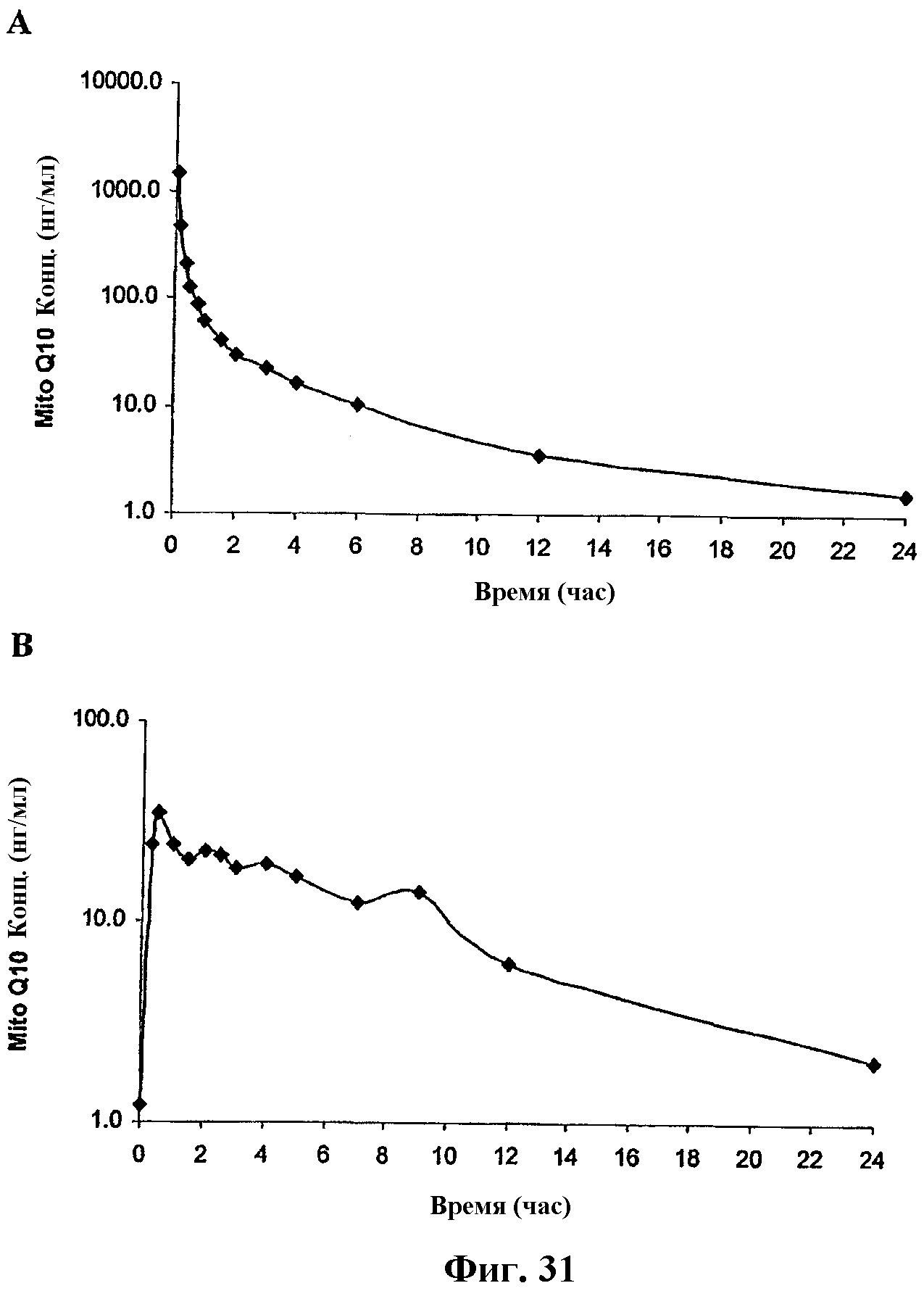
На фиг.31 представлены графики изменения концентрации Митохинона-С10 в плазме крови после однократного IV (A) (10 мг/кг) и перорального (В) (50 мг/кг) введения крысам мезилата Митохинона-С10 в виде комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2) (n=5). Фармакокинетические параметры, полученные по этим данным, представлены в таблице 11.
Подробное описание изобретения
Как отмечено выше, основная цель настоящего изобретения заключается в направленном введении соединений в митохондрии, главным образом, в целях лечения и/или профилактики со снижением окислительного стресса.
Митохондрия имеет значительный мембранный потенциал, составляющий до 180 мВ по ее внутренней мембране (отрицательная внутренняя сторона). Вследствие этого потенциала, мембранные проницаемые липофильные катионы аккумулируются в несколько сот слоев внутри митохондриальной матрицы.
Авторы изобретения установили, что при соединении липофильных катионов (например, липофильного катиона трифенилфосфония) с молекулой антиоксиданта образующееся амфифильное соединение может быть введено в митохондриальную матрицу внутри нетронутых клеток. Антиоксидант затем направленно поступает в основное место образования свободных радикалов и реакционноспособных фрагментов кислорода внутри клетки, а не распределяется статистически.
Авторы дополнительно установили, что свойства антиоксиданта, такие как, например, природа молекулы антиоксиданта, физические и химические свойства соединительного фрагмента, такие как, например, длина или липофильность соединительного фрагмента и/или природа липофильного катиона, влияют на эффективность соединения антиоксиданта in vivo и усиливают функциональную активность соединения антиоксиданта. Для антиокислительных соединений настоящего изобретения эффективность in vivo может частично включать подходящую биодоступность, подходящую стабильность, подходящую фармакокинетику, подходящую антиоксидантную активность и/или подходящую митохондриальную мишень и/или накопление.
В принципе, любой липофильный катион и любой антиоксидант, способный к транспортировке в и/или через митохондриальную мембрану, и накапливаемый на или внутри митохондрий нетронутых клеток, может быть использован при получении соединений настоящего изобретения.
Однако предпочтительно, чтобы липофильный катион представлял собой катион трифенилфосфония, представленный в настоящем описании в качестве примера. Другие липофильные катионы, которые могут быть ковалентно соединены с антиоксидантами в соответствии с настоящим изобретением, включают катионы трибензиламмония и фосфония. В некоторых примерах антиоксидантных соединений настоящего изобретения липофильный катион соединен с молекулой антиоксиданта насыщенной линейной углеродной цепочкой, содержащей от 1 до примерно 30 атомов углерода, например, от 2 до примерно 20, от примерно 2 до примерно 15, от примерно 3 до примерно 10 или от примерно 5 до примерно 10 атомов углерода. В особенно предпочтительном примере линейная углеродная цепочка содержит 10 атомов углерода.
Предпочтительно углеродная цепочка представляет собой алкиленовую группу (например, С1-С20, или С1-С15), хотя углеродные цепочки, которые необязательно включают одну или несколько двойных или тройных связей, также входят в объем притязаний настоящего изобретения. В него также входят углеродные цепочки, которые содержат один или несколько заместителей (таких как гидроксил, карбоксильные или амидные группы) и/или содержат одну или несколько боковых цепей или разветвлений, как те, что выбраны из незамещенных или замещенных алкильных, алкенильных или алкинильных групп. В него также входят углеродные цепи, которые включают более примерно 30 атомов углерода, но чья длина эквивалентна линейной насыщенной углеродной цепи, содержащей от примерно 1 до примерно 30 атомов углерода.
Специалисты в данной области оценят тот факт, что фрагменты, отличающиеся от линейных алкиленовых, могут быть использованы для ковалентного соединения молекулы антиоксиданта с липофильным катионом, например, замещенные или разветвленные алкильные группы, пептидные связи и т.п.
В некоторых вариантах осуществления липофильный катион соединен с молекулой антиоксиданта линейной цепочечной алкиленовой группой, содержащей от 1 до 10 атомов углерода, такой как, например, этиленовая, пропиленовая, бутиленовая, пентиленовая или дециленовая группа.
Молекулы антиоксиданта, используемые в настоящем изобретении, включают те, которые требуют взаимодействия с восстановителями для проявления антиокислительной активности, независимо от того, является ли она исходной активностью антиоксиданта или циркуляционной антиоксидантной активностью или обоими типами активности. Например, антиоксидантные соединения настоящего изобретения, которые включают в качестве активной антиоксидантной молекулы хинольную молекулу, могут быть введены в форме хинона. Чтобы действовать как антиоксидант, то есть, обладать антиоксидантной активностью, хинон должен быть восстановлен до хинольной формы взаимодействием с восстановителем, таким как, например, митохондриальный восстановитель, такой как Комплекс II, для проявления исходной антиоксидантной активности. Последующее взаимодействие окисленной хиноновой формы с восстановителями может привести к проявлению циркуляционной антиксидативной активности.
Другие примеры молекул антиоксидантов, которые могут быть использованы в настоящем изобретении, включают те, которые уже существуют в восстановленной форме и не требуют осуществления взаимодействия с восстановителями для проявления исходной антиоксидантной активности. Несмотря на это, последующее взаимодействие окисленной формы такой молекулы антиоксиданта с митохондриальными восстановителями может привести к проявлению циркуляционной антиоксидантной активности. Например, антиокислительная молекула витамина Е может быть введена в восстановленной форме и поэтому не требует взаимодействия с восстановителями для проявления исходной антиоксидантной активности, но может затем провзаимодействовать с восстановителями, такими как, например, эндогенный хиноновый фонд, с циркуляцией в результате этого антиоксидантной активности.
Другие примеры молекул антиоксидантов, которые могут быть использованы в настоящем изобретении, включают те, которые не дают циркуляционную активность при взаимодействии с митохондриальными восстановителями.
Примеры молекул антиоксидантов, используемых в настоящем изобретении, включают витамин Е и производные витамина Е, антиоксиданты разрыва цепи, такие как бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, хинолы и общие акцепторы радикалов, такие как дериватизированные фуллерены. Кроме того, могут быть использованы спиновые ловушки, которые взаимодействуют со свободными радикалами с образованием стабильных свободных радикалов. Они включают производные 5,5-диметилпирролин-N-оксид, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
Предпочтительные антиоксидантные соединения, включающие антиоксидантные соединения общей формулы I и II, могут быть легко получены, например, по следующей реакции:
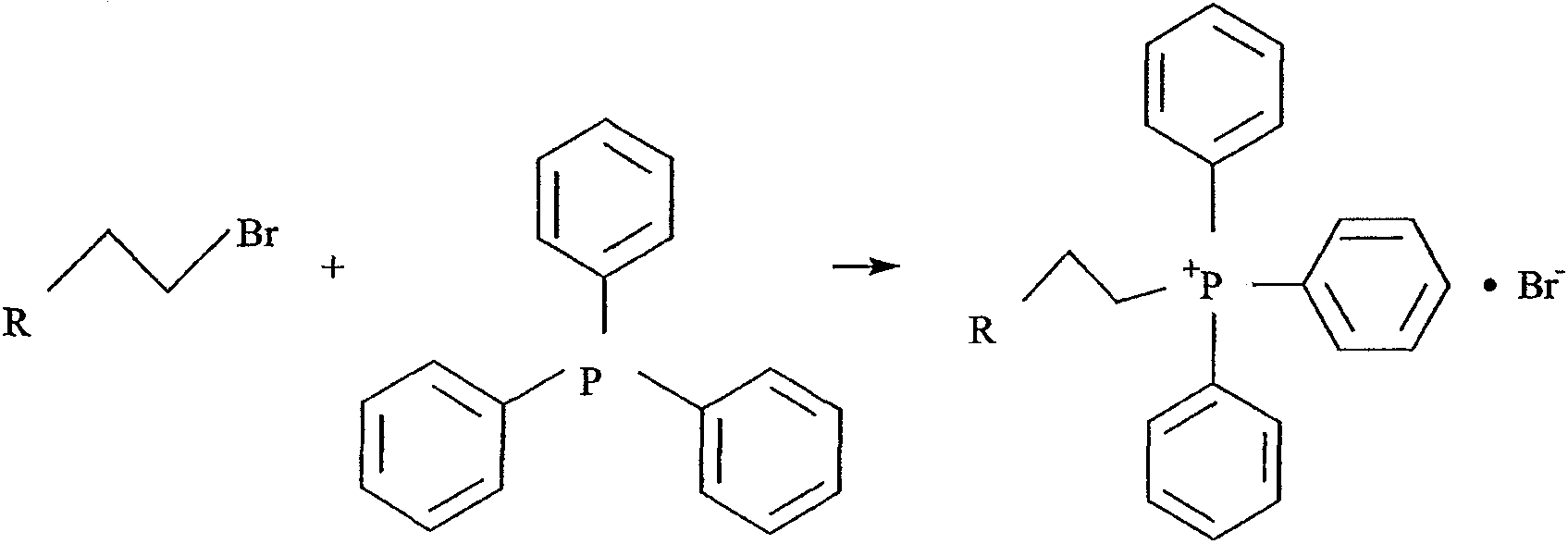
Общая схема синтеза заключается в нагревании предшественника, содержащего подходящую отщепляемую группу, предпочтительно алкилсульфонильного, бром- или йодсодержащего предшественника, с более чем 1 эквивалентом трифенилфосфина, под атмосферой аргона в течение нескольких дней. Фосфониевое соединение затем выделяют в виде его соли. Чтобы осуществить это, продукт растирают повторно с диэтиловым эфиром до тех пор, пока не останется беловатое твердое вещество. Его затем растворяют в хлороформе или дихлорметане и осаждают диэтиловым эфиром для удаления избытка трифенилфосфина. Это повторяют до тех пор, пока твердое вещество не перестанет растворяться в хлороформе. В этой точке продукт перекристаллизовывают несколько раз из подходящего растворителя, такого как хлороформ, ацетон, этилацетат или высшие спирты.
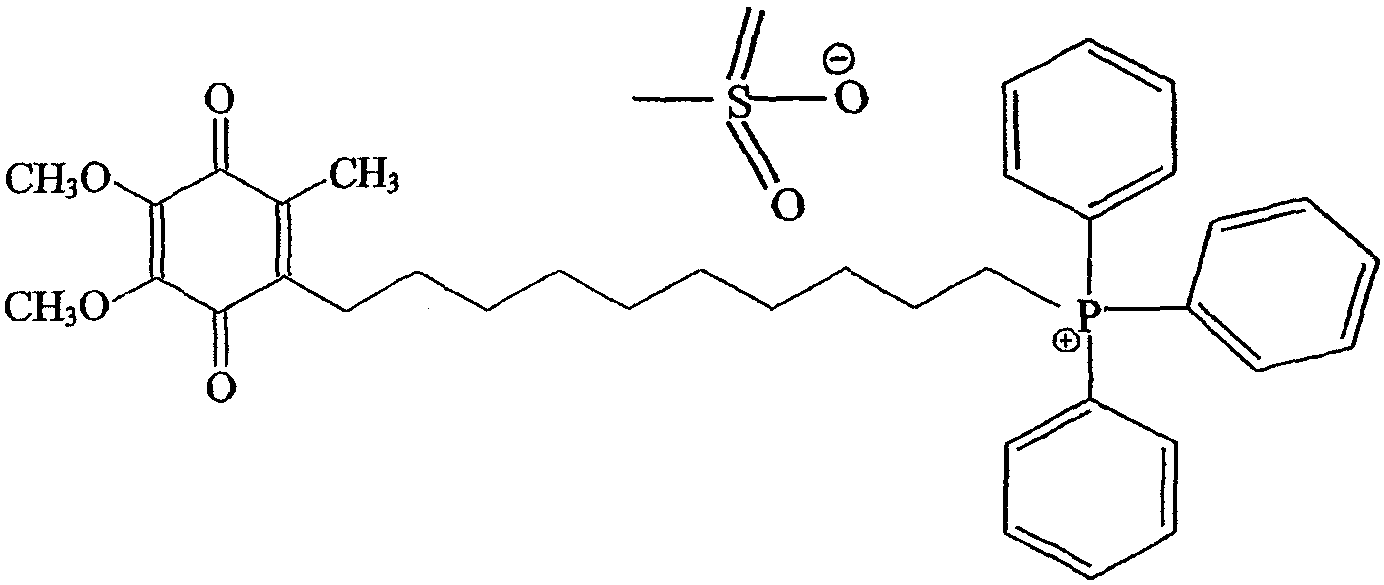
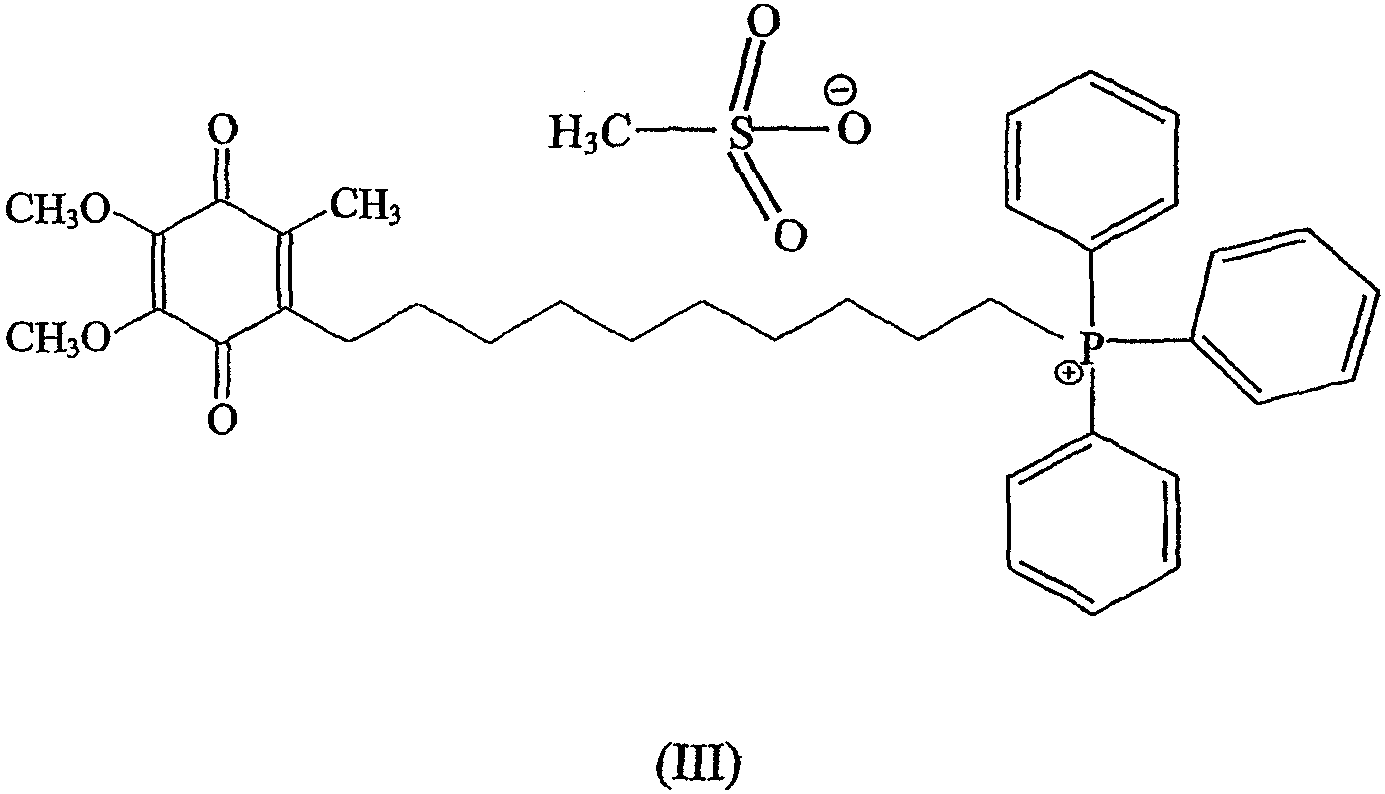
Предпочтительный метод синтеза, который может быть использован для получения стабильной формы предпочтительного, направленно вводимого в митохондрии антиоксидантного соединения формулы III (также называемого в данном описании мезилат Митохинона-С10 или метансульфонат Митохинона С-10), изложен ниже в примере 1.
Также будет понятно, что анион антиоксидантного соединения, полученного таким образом, может быть легко обменен на другой фармацевтически или фармакологически приемлемый анион, если это желательно или необходимо, при использовании ионообменной или другой технологии, известной в данной области.
Заявители установили, что стабильность солевой формы антиоксидантного соединения увеличивается, когда анион не проявляет реакционной активности относительно молекулы антиоксиданта, соединительного фрагмента или липофильного катионного фрагмента. Например, в случае предпочтительных примеров антиоксидантных соединений настоящего изобретения анион не является нуклеофильным. Желательно также, чтобы анион был фармацевтически приемлемым анионом. Также предпочтительно, чтобы для фармакологического состава анион не проявлял реакционной активности по отношению к другим агентам, входящим в формулу состава.
Примеры не являющихся нуклеофильными анионов включают гексафторантимонат, арсенат или -фосфат, или тетрафенилборат, тетра(перфторфенил)борат или другие тетрафторбораты, трифторметансульфонат, арил- или алкилсульфонаты, такие как метансульфонат и п-толуолсульфонат, и фосфаты.
Примеры фармацевтически приемлемых анионов включают ионы галогена, такие как ион фтора, ион хлора, ион брома и ион йода; анионы солей неорганических кислот, такие как нитрат, перхлорат, сульфат, фосфат и карбонат; фармацевтически приемлемые анионы солей низших алкилсульфоновых кислот, таких как метансульфоновой кислоты, и солей этаносульфоновой кислоты; фармацевтичеки приемлемые анионы солей арилсульфоновых кислот, таких как соли бензолсульфоновой кислоты, 2-нафталинсульфоновой кислоты и п-толуолсульфоновой кислоты; фармацевтически приемлемые анионы солей органических кислот, таких как соли трихлоруксусной кислоты, трифторуксусной кислоты, гидроксиуксусной кислоты, бензойной кислоты, миндальной кислоты, масляной кислоты, пропионовой кислоты, муравьиной кислоты, фумаровой кислоты, янтарной кислоты, лимонной кислоты, винной кислоты, щавелевой кислоты, малеиновой кислоты, уксусной кислоты, яблочной кислоты, молочной кислоты и аскорбиновой кислоты; и фармацевтически приемлемые анионы солей кислых аминокислот, такие как соли глутаминовой кислоты и аспарагиновой кислоты.
В случае предпочтительных примеров антиоксидантных соединений настоящего изобретения предшественник аниона галогена меняют на арильные и алкилсульфонатные анионы. Примеры включают, но не ограничивают объема притязаний, бензолсульфонат, п-толуолсульфонат, 2-нафталинсульфонат, метансульфонат, этаносульфонат, пропансульфонат. Особенно предпочтительным анионом является анион метансульфоната. Как описано выше, пример антиоксидантного соединения согласно изобретениию, в котором анионом является метансульфонат, является особенно предпочтительным антиокислительным соединением формулы III, называемого по тексту описания метансульфонатом Митохинона-С10 или мезилатом Митохинона-С10.
Та же общая методика может быть использована для получения широкого ряда направленно вводимых в митохондрии соединений с фрагментом R различных антиоксидантов, присоединенным к фрагменту или фрагментам трифенилфосфония (или другому липофильному катионному фрагменту). Они будут включать серии производных витамина Е, в которых длина мостика, соединяющего функциональную группу витамина Е с фрагментом трифенилфосфония (или другим липофильным катионным фрагментом), является различной. Другие антиоксиданты, которые могут быть использованы в качестве группы R, включают антиоксиданты разрыва цепи, такие как бутилсодержащий гидроксианизол, бутилсодержащий гидрокситолуол, хинолы и общие акцепторы радикалов, такие как дериватизированные фуллерены. Кроме того, спиновые ловушки, которые взаимодействуют со свободными радикалами с образованием стабильных свободных радикалов, также могут быть синтезированы. Они будут включать производные 5,5-диметилпирролин-N-оксида, трет-бутилнитрозобензол, трет-нитрозобензол, α-фенил-трет-бутилнитрон и родственные соединения.
Будет понятно, что для антиоксидантных соединений настоящего изобретения, как для любого лекарства, активность in vitro ни в коей мере не является определяющим параметром для функциональности или эффективности in vivo. Антиокислительное действие антиоксидантных соединений настоящего изобретения можно определить такими методами, как те, что описаны в данном тексте, с использованием, например, выделенных митохондрий и/или выделенных клеток. Хотя действительно верно, что для того, чтобы быть использованными в качестве направленно вводимых в митохондрии антиоксидантных соединений настоящего изобретения, антиоксидантное соединение должно проявлять подходящим образом высокое антиоксидантное действие в такой пробе, но чтобы быть эффективным in vivo, направленно вводимое в митохондрии антиоксидантное соединение должно проявлять другие желательные физико-химические свойства, например, обладать подходящей биодоступностью, стабильностью или антиокислительной эффективностью.
Примеры антиоксидантных соединений, которые показывают хорошую антиоксидантную активность и также проявляют плохую биодоступность относительно отдела-мишени in vivo, включают Коэнзим Q (CoQ) и Идебенон. Оба эти соединения должны быть введены в очень высокой дозировке (например, 0,5-1,2 г) для достижения минимальных клинических эффектов у больных людей.
Примеры направленно вводимых в митохондрии антиоксидантных соединений настоящего изобретения проявляют хорошую антиоксидантную активность и биодоступность и являются таким образом эффективными in vivo при низких дозах введения. Определение биодоступности предпочтительного, амфифильного, направленно вводимого в митохондрии антиоксидантного соединения настоящего изобретения, мезилата Митохинона-С10 и его комплекса с циклодекстрином, представлено в описании в примере 11. Авторы полагают, что антиоксидантные соединения настоящего изобретения являются эффективными при направленном введении в митохондрии антиокислительной активности, проявляя при этом одно или несколько преимуществ, заключающихся в доступности в кристаллической или твердой форме и возможности использования для приготовления составов в твердой форме, обладают повышенной стабильностью, улучшенной биодоступностью и/или улучшенным антиокислительным действием. Физические и химические свойства антиоксидантных соединений настоящего изобретения, как полагают авторы, не привязываясь ни к какой теории, относятся к предпочтительным свойствам антиоксидантных соединений настоящего изобретения, и позволяют использовать их в композициях, составах и способах в тех областях применения, в которых антиоксидантные соединения известного уровня могут оказаться менее подходящими из-за их химических и физических свойств.
В некоторых вариантах осуществления изобретения антиоксидантное соединение представляет собой хинольное производное формулы II, определенное выше. Например, хинольное производное согласно изобретению представляет собой соединение Митохинон-С10 (конкретной солью которого является соединение формулы III), как определено выше. Другим примером соединения настоящего изобретения является соединение формулы I, в котором (С)n представляет собой (СН2)5, а хинольный фрагмент является таким же, что и у Митохинона-С10, названное в описании Митохиноном-С5 (смотри фиг.3С). Еще дополнительным примером соединения настоящего изобретения является соединение формулы I, в котором (С)n представляет собой (СН2)3, хинольный фрагмент тот же, что у Митохинона-С10, которое названо в описании Митохиноном-С3 (смотри фиг.3В). Еще одним примером соединения настоящего изобретения является соединение формулы I, в котором (С)nпредставляет собой (СН2)15, а хинольный фрагмент тот же, что и у Митохинона-С10, названное в описании Митохиноном-С15 (смотри фиг.3В).
Как только получено, антиоксидантное соединение настоящего изобретение в любой фармацевтически целесообразной форме и возможно включающее фармацевтически приемлемые носители, наполнители, разбавители, комплексообразователи или добавки, будет введено пациенту, нуждающемуся в лечении и/или профилактике. После введения соединение будет направленно создавать антиоксидантную активность в митохондриях внутри клеток пациента.
Антиоксидантные соединения настоящего изобретения могут быть введены пациентам пероральным и/или парентеральным путем.
Антиоксидантное соединение должно быть составлено в виде стабильной, безопасной фармацевтической композиции для введения пациенту. Композиция может быть получена согласно известным методам растворением или суспендированием количества антиоксидантного ингредиента в разбавителе. Количество антиоксидантного соединения составляет от 0,1 мг до 1000 мг на мл разбавителя. Может быть добавлен ацетатный, фосфатный, цитратный или глютаматный буфер для доведения рН конечной композиции до величины от 5,0 до 9; возможно карбогидратный регулятор изотоничности или регулятор изотоничности на основе многоатомного спирта и консервант, выбранный из группы, включающей м-крезол, бензиловый спирт, метил, этил, пропил и бутилпарабены, и также может быть добавлен фенол. Для получения желательной концентрации раствора используют достаточное количество воды для инъекций. При желании, в состав композиции могут быть включены дополнительные регуляторы изотоничности, такие как хлорид натрия, а также другие наполнители. Однако такие наполнители должны поддерживать общую тоничность антиоксидантного соединения.
Термин буфер, буферный раствор или раствор с буфером при использовании применительно к концентрации ионов водорода или рН, относится к способности системы, особенно водного раствора, сопротивляться изменению рН при добавлении кислоты или основания, или при разбавлении растворителем. Отличительной особенностью растворов с буферами, которые претерпевают незначительные изменения рН при добавлении кислоты или основания, является присутствие либо слабой кислоты и соли слабой кислоты, либо слабого основания и соли слабого основания. Примером первой упомянутой системы является уксусная кислота и ацетат натрия. Изменение рН незначительно, так как количество введенных гидроксильных ионов не превышает способность буферной системы нейтрализовать их.
Стабильность парентерального состава настоящего изобретения увеличивается при поддержании рН состава в интервале значений приблизительно от 5,0 до 9,5. Другие интервалы рН включают, например, от 5,5 до 9,0, или от 6,0 до 8,5, или от 6,5 до 8,0 или от 7,0 до 7,5.
Буфер, использованный при практическом осуществлении настоящего изобретения, выбран любой из числа следующих, например, ацетатный буфер, фосфатный буфер или глутаматный буфер, наиболее предпочтительным буфером является фосфатный буфер.
Наполнители или носители также могут быть использованы для ускорения введения соединения. Примеры носителей и наполнителей включают карбонат кальция, фосфат кальция, различные сахара, такие как лактоза, глюкоза или сахароза, или типы крахмала, производные целлюлозы, желатин, полиэтиленгликоли и физиологически совместимые растворители.
Стабилизатор может быть включен в состав настоящего изобретения, но, что важно, не обязательно. Однако если он входит в рецептуру состава, то стабилизатором, используемым при практическом осуществлении изобретения, является карбогидрат или многоатомный спирт. Многоатомные спирты включают такие соединения, как сорбит, маннит, глицерин и полиэтиленгликоли (ПЭГи). Карбогидраты включают, например, маннозу, рибозу, трегалозу, мальтозу, инозит, лактозу, галактозу, арабинозу или лактозу.
Подходящие стабилизаторы включают, например, многоатомные спирты, такие как сорбит, маннит, инозит, глицерин, ксилит и сополимер полипропилен/этиленгликоля, а также различные полиэтиленгликоли (ПЭГи) молекулярной массы 200, 400, 1450, 3350, 4000, 6000 и 8000).
Фармакопея Соединенных Штатов (USP) утверждает, что к препаратам, содержащихся в контейнерах для многократной дозы должны быть добавлены антимикробные агенты в бактериостатической или фунгистатической концентрации. Они должны присутствовать в достаточной концентрации в момент использования для предотвращения роста микроорганизмов, неминуемо попадающих в препарат при извлечении части содержимого подкожной иглой и шприцем или при использовании других инвазивных средств для доставки, таких как перьевые инжекторы. Антимикробные агенты должны быть оценены на совместимость со всеми другими компонентами рецептуры, а их активность должна бать оценена в общей формуле, чтобы убедиться в том, что конкретный агент, который эффективен в одной рецептуре, не эффективен в другой. Не редко удается обнаружить, что конкретный агент будет эффективен в одной рецептуре, но не эффективен в другой рецептуре.
Консервантом, в общем фармацевтическом смысле, является вещество, которое предотвращает или ингибирует рост микробов и может быть добавлено к фармацевтическому составу для этой цели, чтобы избежать последующей порчи состава микроорганизмами. Хотя количество консерванта невелико, тем не менее, он может ухудшить общую стабильность антиоксидантного соединения. Таким образом, даже выбор консерванта может оказаться затруднительным.
Хотя консервант для использования в практике настоящего изобретения может составлять от 0,005 до 1,0% (м/о), предпочтительный интервал для каждого консерванта, одного или в комбинации с другими, составляет: бензиловый спирт (0,1-1,0%), или м-крезол (0,1-0,6%), или фенол (0,1-0,8%),или комбинация метил- (0,05-0,25%), этил-, пропил- или бутил (0,005%-0,03%) парабенов. Парабены представляют собой сложные низшие алкиловые эфиры пара-гидроксибензойной кислоты.
Подробное описание каждого консерванта представлено в “Remington's Pharmaceutical Science”, а также Pharmaceutical Dosage Forms: Parenteral Medications, Vol.1, 1992, Avis et al. Для этих целей кристаллическая хлороводородная соль триентина может быть введена парентарально (включая подкожные инъекции, внутривенные, внутримышечные, интрадермальные инъекции или инфузные методы введения) или вдыхание распыленных лекарственных веществ в составах лекарственной формы, содержащих традиционные нетоксичные, фармацевтически приемлемые носители, вспомогательные средства и наполнители.
Также может оказаться желательным добавить хлорид натрия или другую соль для регулирования тоничности фармацевтического состава, в зависимости от выбранного регулятора изотоничности. Однако это не обязательно и зависит от конкретного выбранного состава. Парентеральные составы должны быть изотоническими или по существу изотоническими, в противном случае произойдет сильное раздражение или возникнет боль в месте введения.
Желательная изотоничность может быть достигнута за счет использования хлорида натрия или других фармацевтически приемлемых агентов, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль, полиолы (такие как манит или сорбит) или другие неорганические или органические растворимые вещества. Обычно композиция является изотонической с кровью пациента.
При желании парентеральный состав может быть загущен загустителем, таким как метилцеллюлоза. Состав может быть приготовлен в виде эмульсии, типа вода-в-масле или масло-в-воде. Может быть использован любой из широкого ряда фармацевтически приемлемых эмульгаторов, включая, например, порошок аравийской камеди, неионогенное поверхностно-активное вещество или ионное поверхностно-активное вещество.
Может оказаться также желательным добавить в фармацевтический состав подходящий диспергатор или суспендирующий агент, они могут включать, например, водные суспензии, такие как синтетические и природные камеди, т.е. трагакант, аравийскую камедь, альгинат, декстран, карбоксиметилцеллюлозу натрия, метилцеллюлозу, поливинилпирролидон или желатин.
Наполнителем самого большого значения для фармацевтических продуктов является вода. Вода подходящего для парентерального введения качества должна быть получена либо перегонкой, либо обратным осмосом. Только такими средствами возможно отделить различные жидкость, газ и твердое загрязняющее вещество от воды. Вода для инъекций является предпочтительным водным носителем для использования в фармацевтических составах настоящего изобретения. Вода может быть продута газообразным азотом для удаления любых следов кислорода или свободных радикалов кислорода из воды.
Возможно также, чтобы другие ингредиенты присутствовали в парентеральных фармацевтических составах настоящего изобретения. Такие дополнительные ингредиенты могут включать смачивающие агенты, масла (например, такое растительное масло, как кунжутное масло, арахисовое масло или оливковое масло), анальгетики, эмульгаторы, антиоксиданты, наполнители, регуляторы изотоничности, ионы металлов, маслянистые наполнители, протеины (например, альбумин человеческой сыворотки, желатин или протеины) и цвиттерионы (например, такие аминокислоты, как бетаин, таурин, аргинин, глицин, лизин и гистидин). Такие дополнительны ингредиенты, безусловно, не должны отрицательно влиять на общую стабильность фармацевтического состава настоящего изобретения.
Контейнеры также составляют отдельную часть состава для инъекций и могут рассматриваться как компонент, так как нет контейнера, который бы был полностью нерастворимым или не влиял в какой-то мере на жидкость, которую он содержит, особенно если жидкость является водной. Поэтому выбор контейнера для конкретной инъекции должен базироваться с учетом состава композиции в контейнере, а также раствора и лечения, для которого он будет предназначен.
Для того, чтобы обеспечить введение иглы из гиподермического шприца в пузырек с многократной дозой и повторную герметизацию после выемки иглы, каждый пузырек закрывается резиновой пробкой, закрепленной на месте алюминиевой накладкой.
Крышки для стеклянных пузырьков, такие как West 4416/50, 4416/50 (с тефлоновым верхом) и 4406/40, Abbot 5139, или любые эквивалентные пробки могут быть использованы для закрытия пузырьков с лекарственной формой препарата. Эти крышки проходят тест на целостность крышки при испытании с использованием схемы лечения пациента, например, крышка должна выдержать, по меньшей мере, примерно 100 инъекций.
Каждый из компонентов фармацевтического состава, описанного выше, известен в данной области и описан в книге Pharmaceutical Dosage Forms: Parenteral Medications, Vol.1, 2nd ed., Avis etal., Mercel Dekker, New York, N.Y. 1992, которая включена в настоящее описание в качестве ссылки во всей полноте.
Процесс получения вышерассмотренного состава включает стадии компаундирования, стерильного фильтрования и наполнения. Методика компаундирования может, например, включать растворение ингредиентов в конкретном порядке, например, сначала консервант, затем стабилизатор/регулятор изотоничности, буферы, а затем антиоксидантное соединение, или растворение всех ингредиентов, образующих парентеральный состав, одновременно. Примером одного из способов получения парентерального состава для введения является растворение антиоксидантного соединения, например, комплекса мезилат Митохинона-С10-β-циклодекстрин (1:2), в воде и разбавление полученной смеси в физиологическом растворе с фосфатным буфером.
В альтернативном варианте, парентеральные составы настоящего изобретения получают смешением ингредиентов согласно общепринятым методикам. Например, выбранные компоненты могут быть смешаны в смесителе или другом стандартном устройстве с получением концентрированной смеси, которая может быть затем доведена до конечной концентрации и вязкости добавлением воды, загустителя, буфера, 5%-го альбумина человеческой сыворотки или дополнительного растворимого вещества для регулирования изотоничности.
В альтернативном варианте, антиоксидантное соединение может быть упаковано как сухое вещество и/или порошок, восстанавливаемый растворителем с образованием парентерального состава согласно настоящему изобретению для использования в момент восстановления.
Кроме того, процесс приготовления может включать любой подходящий способ стерилизации при разработке парентерального состава настоящего изобретения. Типичные процессы стерилизации включают фильтрование, обработку паром (влажное тепло), сухое тепло, газы (например, этиленоксид, формальдегид, диоксид хлора, пропиленоксид, бета-пропиолактон, озон, хлорпикрин, надуксусная кислота, метилбромид и т.п.), радиационное облучение и асептическое обращение.
Подходящие пути парентерального введения включают внутривенное, внутримышечное, подкожное, интрадермальное, субдермальное, внутрисуставное, интратекальное, внутрибрюшинное и т.п. введение. Внутривенный путь введения является предпочтительным. Введение через слизистую оболочку также допустимо. Дозировка и режим дозирования будут зависеть от массы тела и состояния здоровья пациента.
Фармацевтически приемлемые наполнители, носители, разбавители, агенты комплексообразования либо добавки могут быть выбраны, например, для увеличения стабильности антиоксидантного соединения, ускорения синтеза или состава фармацевтической композиции и/или для увеличения биодоступности антиоксидантного соединения.
Например, молекулы носителя, такого как циклодекстрин и его производные, хорошо известны в данной области из-за их потенциального действия в качестве агентов комплексообразования, способных изменить физико-химические свойства молекул препарата. Например, циклодекстрины могут стабилизировать (как от термических воздействий, так и окислительных воздействий), снижать летучесть и изменять растворимость активнодействующих агентов, с которыми они соединены в комплексы. Циклодекстрины представляют собой циклические молекулы, состоящие из кольцевых звеньев глюкопиранозы, которые образуют тороидальные структуры. Внутренняя часть молекулы циклодекстрина является гидрофобной, а наружная часть - гидрофильной, обеспечивая таким образом растворимость в воде молекулы циклодекстрина. Степень растворимости может быть изменена за счет замещения гидроксильных групп на внешней стороне циклодекстрина. Аналогично этому, гидрофобность внутренней части может быть изменена путем замещения, хотя обычно гидрофобная природа внутренней части позволяет накапливать относительно гидрофобные молекулы-гости внутри полости. Накапливание одной молекулы внутри другой известно как комплексообразование, а образующийся продукт называют аддуктом. Примеры производных циклодекстрина включают сульфобутилциклодекстрин, мальтозилциклодекстрин, гидроксипропилциклодекстрин и их соли.
Способы получения фармацевтически приемлемой композиции, включающей аддукт направленно вводимого в митохондрию антиоксидантного соединения, в данном случае Митохинона-С10 в комплексе с β-циклодекстрином, раскрыты в настоящем описании в примере 1 и примере 7. Способы получения фармацевтически приемлемых композиций, содержащих аддукт предпочтительного направленно вводимого в митохондрии антиоксидантного соединения мезилата Митохинона-С10 в комплексе с β-циклодекстрином, раскрыты в настоящем описании в примере 9 и примере 10.
Физико-химические свойства, включающие, например, фармацевтические свойства комплекса антиоксидантное соединение-циклодекстрин, могут быть изменены, например, изменением молярного отношения антиоксидантного соединения к циклодекстрину или изменением его самого. Например, для предпочтительных антиоксидантных соединений общей формулы I молярное отношение антиоксидантного соединения к циклодекстрину (антиоксидантное соединение:циклодекстрин) может составлять от примерно 10:1 до примерно 1:10, от примерно 5:1 до примерно 1:5, от примерно 4:1 до примерно 1:4, от примерно 2:1 до примерно 1:2 или 1:1. В другом примере предпочтительное молярное отношение пояснительного антиоксидантного соединения Митохинона-С10 к циклодекстрину составляет 1:2, и циклодекстрином является β-циклодекстрин.
В альтернативном варианте, фармацевтически целесообразная форма антиоксидантного соединения может быть получена так, чтобы увеличить стабильность и биодоступность антиоксидантного соединения. Например, на таблетки могут быть нанесены кишечные покрытия для предотвращения выделения антиоксидантного соединения в желудке, либо для снижения риска неприятных побочных эффектов или сохранения стабильности антиоксидантного соединения, которое в противном случае может подвергаться деструкции под воздействием желудочной среды. Большинство полимеров, которые используются для этой цепи, представляют собой поликислоты, которые действуют в силу того факта, что их растворимости в водной среде зависят от рН, и они требуют условий с рН выше, чем нормальные значения, существующие в желудке.
Один предпочтительный тип пероральной структуры с регулированным выделением является кишечное покрытие твердой лекарственной формы. Кишечные покрытия облегчают введение соединений, физически остающихся в лекарственной форме в течение определенного промежутка времени при воздействии желудочного сока, хотя кишечные покрытия предназначены распадаться в кишечной жидкости и быть готовыми для поглощения. Задержка поглощения зависит от скорости прохождения по кишечно-желудочному тракту, и поэтому скорость освобождения желудка является важным фактором. Для некоторых путей введения лекарственная форма многократного типа, такая как гранулы, может быть предпочтительнее одноразового типа. Поэтому в одном варианте осуществления изобретения антиоксидантные соединения согласно изобретению могут содержаться в лекарственной форме многократного типа с кишечным покрытием. В более предпочтительном варианте осуществления лекарственную форму антиоксидантного соединения готовят получением частиц, содержащих антиоксидантное соединение - агент кишечного покрытия на инертном материале ядра. Эти гранулы могут привести к пролонгированной абсорбции антиоксидантного соединения с хорошей биодоступностью.
Типичные агенты кишечного покрытия включают, но не ограничивают объема притязаний, фталат гидроксипропилметилцеллюлозы, сополимер метакриловой кислоты и сложного эфира метакриловой кислоты, поливинилацетат-фталат и ацетат-фталат целлюлозы.
Примеры предпочтительных антиоксидантных соединений настоящего изобретения и/или составов и/или их комплексов проявляют преимущественные фармацевтические свойства. Например, из них легко готовить составы, они химически и физически стабильны, легко растворимы в воде, имеют низкую гигроскопичность и характеризуются хорошим сроком хранения.
Далее изобретение будет описано более подробно с ссылкой на следующую, не ограничивающую объема притязаний экспериментальную часть.
Пример 1. Синтез Митохинона-С10
Ниже дано описание предпочтительного способа синтеза предпочтительной стабильной соли пояснительного направленно вводимого в митохондрии антиоксидантного соединения Митохинона-С10, мезилата Митохинона-С10 и его комплекса с циклодекстрином.
Стадия 1
Схема:
Этап:
1. Идебенон (А1, 0,25 кг, 0,74 моль) растворяют в 2,5 л ДХМ химически чистого и смесь затем охлаждают до 10±3°С в инертной атмосфере.
2. Триэтиламин (0,152 кг, 1,5 моль) добавляют одной порцией при температуре окружающей среды и смесь отстаивают до установления равновесия при 10±3°С.
3. Затем постепенно добавляют раствор метансульфонилхлорида (0,094 кг, 0,82 моль) в 0,5 л ДХМ с такой скоростью, чтобы поддерживать внутреннюю температуру приблизительно на 10-15°С. (При таких условиях добавление заканчивается через 75 минут).
4. Реакционную смесь перемешивают дополнительно в течение 15-30 минут.
5. IPC проверяют на степень завершенности методом ТСХ (Rf 0,65, 5% этанол/дихлорметан).
6. Затем смесь промывают водой (0,85 л) и насыщенным водным раствором бикарбоната натрия (0,85 л).
7. Органический слой выпаривают до получения красной жидкости при пониженном давлении при 40-45°С. После высушивания в течение дополнительных 2-4 часов под высоким вакуумом при температуре окружающей среды полученный в результате сырой А2 используют непосредственно на следующей стадии. Выход не известен, так как жидкость захватывает растворитель.
Стадия 2
Схема:
Этап:
1. Мезилат идебенона (А2, при условии 100% выхода с последней стадии, 0,31 кг, 0,74 моль) растворяют в 2-х л метанола и смесь затем охлаждают до 0-5°С под инертной атмосферой.
2. Частями добавляют боргидрид натрия (0,03 кг, 0,79 моль) с такой скоростью, чтобы внутренняя температура не превышала 15°С. Завершение реакции будет сопровождаться изменением цвета: красный→желтый (В этих условиях добавление завершается через 20 минут).
3. Реакционную смесь перемешивают дополнительно в течение 10-30 минут.
4. IPC проверяют на степень завершенности методом ТСХ (А3 Rf 0,60, 5% этанол/дихлорметан, А2 Rf 0,65).
5. Затем реакцию обрывают добавлением 2-х л 2М-го раствора соляной кислоты и трижды экстрагируют 1,2 л дихлорметана.
6. Объединенные органические фазы затем промывают один раз 1,2 л воды и сушат над безводным сульфатом магния (0,24 кг).
7. Затем органическую фазу выпаривают и при пониженном давлении получают сироп желто-коричневого цвета при температуре 40-45°С. После высушивания в течение дополнительных 2-8 часов под высоким вакуумом при температуре окружающей среды полученный сырой продукт А3, 0,304 кг, 98% выход, используют непосредственно на следующей стадии.
Стадия 3
Схема:
Этап:
1. Кусочки трифенилфосфина (0,383 кг, 1,46 моль) добавляют к мезилату идебенола (А3, 0,304 кг, 0,73 моль) в соответствующего размера круглодонную колбу.
2. Затем колбу присоединяют к ротационному испарителю и содержимое ее нагревают под вакуумом до температуры бани 80-85°С.
3. При этой температуре смесь должна образовать гомогенный расплав. Как только образуется расплав, образования газа не наблюдается, вакуум заменяют инертной атмосферой и смесь осторожно вращают на бане, температура которой установлена на 80-85°С, приблизительно в течение 3 дней.
4. IPC проверяют на завершенность методами1Н и31Р ЯМР. Требуется минимальная конверсия 95% для дальнейшей обработки продукта.
5. Затем смесь охлаждают примерно до комнатной температуры и растворяют в 0,8 л дихлорметана.
6. Затем частями добавляют 3,2 л этилацетата при слабом нагревании до выпадения в осадок желательного продукта из избытка трифенилфосфина.
7. Небольшой объем растворителя удаляют выпариванием при пониженном давлении (для удаления ДХМ) и оставшуюся смесь охлаждают затем примерно до температуры окружающей среды и декантируют.
8. Оставшийся сиропообразный остаток подвергают затем той же процедуре промывания еще дважды, а затем окончательно высушивают под высоким вакуумом до постоянного веса и получают желто-коричневый вспененный продукт 0,441 кг, 89% выход (Примечание: продукт все еще содержит некоторое количество растворителя, смотри ЯМР). Полученный таким образом А4 используют непосредственно на следующей стадии.
Стадия 4
Схема:
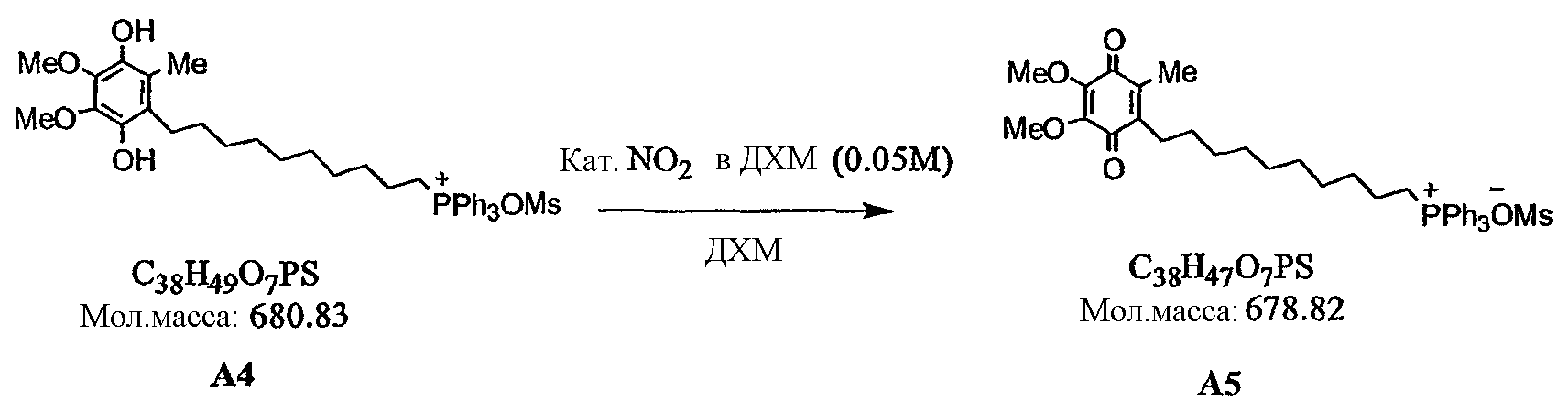
Этап:
1. Сырую соль мезилата митохинола (0,44 кг, примерно 0,65 моль) растворяют в 6 л безводного ДХМ и колбу продувают кислородом.
2. Содержимое колбы интенсивно перемешивают в атмосфере кислорода в течение 30 минут для обеспечения насыщения растворителя газом.
3. 0,1 л раствора 0,65 М NO2 в сухом ДМХ (2 моль % NO2) быстро добавляют одной порцией и смесь интенсивно перемешивают в атмосфере кислорода в течение 4-8 часов при температуре окружающей среды.
4. Затем проводят IPC проверку на степень завершенности (методом1Н ЯМР и возможно31Р ЯМР).
5. Если окисление неполное, то добавляют еще 2 моль % NO2 в виде раствора в ДХМ. Это должно привести реакцию до завершения. IPC проверка осуществляется как описано выше. В этих условиях для завершения реакции требуется 8 моль% NO2 в виде раствора в ДХМ.
6. Затем растворитель удаляют выпариванием при пониженном давлении и получают сиропообразный остаток красного цвета. Этот остаток растворяют в 2 л дихлорметана при 40-45°С.
7. Затем частями добавляют 3,2 л этилацетата при слабом нагревании до выпадения в осадок желательного продукта. Небольшой объем растворителя удаляют выпариванием при пониженном давлении (для удаления ДХМ) и оставшуюся смесь затем охлаждают примерно до температуры окружающей среды и декантируют.
8. Маслянистый остаток окончательно сушат под высоким вакуумом до постоянного веса и получают стеклообразный продукт красного цвета (419 г, 94% выход). Полученный таким образом А5 используют непосредственно на следующей стадии.
Стадия 5
Схема:
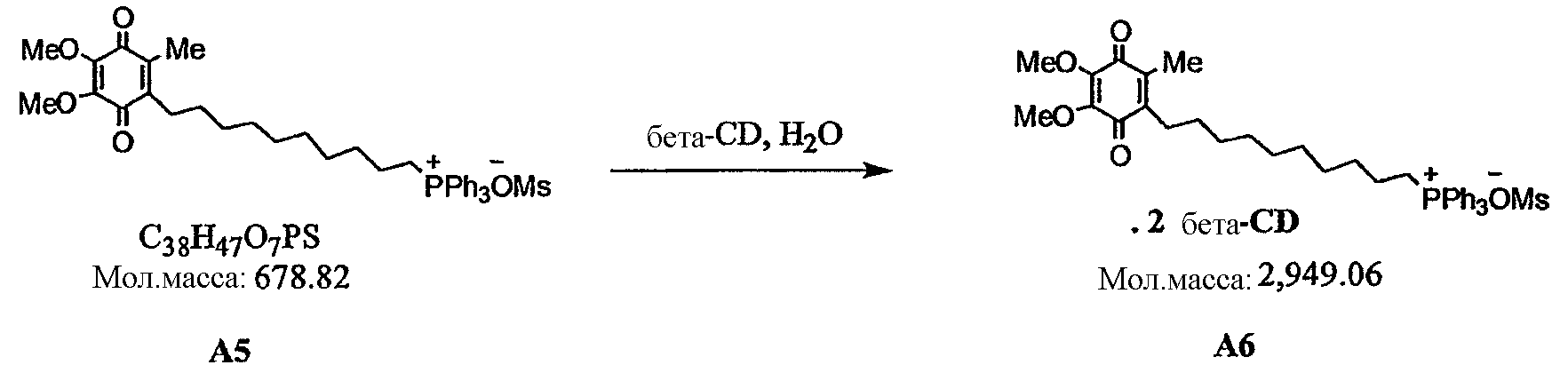
Этап:
1. Сырую соль мезилата митохинона (А5, 0,419 кг) растворяют в 6 л воды при слабом нагревании при 40-43°С.
2. Бета-циклодекстрин, 1,24 кг, отдельно растворяют в 20 л воды при нагревании при 60°С.
3. Эти два раствора охлаждают приблизительно до комнатной температуры и объединяют с получением гомогенной смеси. Этот раствор следует хранить при температуре <5°С.
4. Затем этот раствор оранжевого цвета замораживают при -20°С и лиофилизируют порциями до постоянного веса (по меньшей мере, 48 часов).
5. Образующееся твердое вещество затем аккуратно измельчают с получением однородного свободнотекучего порошка желто-оранжевого цвета (1,433 кг).
Проведен альтернативный синтез, при котором этап окисления 3 стадии 4 способа синтеза, описанного выше, достигается при барботировании кислорода через раствор, что указывает на возможность осуществления реакции окисления по существу до конца окислительными средствами, отличающимися от окисления NO2.
Пример 2. Синтез направленно вводимых в митохондрии антиоксидантных соединений
Методы химического синтеза Митохинона-С3, Митохинона-С5 и Митохинона-С15, отражены на фиг.2 и описаны ниже. Спектры ядерного магнитного резонанса получены при использовании прибора Varian 300 МГц. Для1Н-ЯМР внутренним стандартом в CdCl3 ,был тетраметилсилан. Для31Р ЯМР внешним стандартом был 85%-я фосфорная кислота. Химические сдвиги (δ) представлены в млн.д относительно стандарта. Элементные анализы проведены Campbell Microanalytical Laboratory, University of Otago. Электрораспылительная масс-спектрометрия осуществлена при использовании жидкостного хроматографического масс-спектрометра LCMS-QP800X. Маточные растворы готовили в абсолютном этаноле и хранили при -20°С в темноте.
Митохинон-С3 (6). Схема синтеза Митохинона-С3 показана на фиг.2А, Исходный материал, 2,3,4,5-тетраметокситолуол (1) (Lipshutz, B.H., Kim, S.-k., Mollard, P. И Stvens, K.L. (1998) tetrahedron 54, 1241-1253) получен восстановлением 2,3-диметокси-5-метил-1,4-бензохинона (CoQ) до гидрохинола (Garpino, L.A., Triolo, S.A. and Berglund, R.A. (1989) J. Org. Chem. 54, 3303-3310) c последующим метилированием с получением 1 (Lipshutz, B.Y., Kim, S.-k., Mollard, P. And Stevens, K.L. (1998) Tetrahedron 54, 1241-1253). Раствор 1 (6,35 г, 29,9 ммоль) в сухом гексане (80 мл) и N,N,N',N'-тетраметилэтилендиамине (8,6 мл) помещают в цилиндрический смеситель с пламенной сушкой в трубку Шленка (Schlenk) c пламенной сушкой под атмосферой азота. Раствор н-бутиллития (1,6 М, 26,2 мл) в гексане медленно добавляют при комнатной температуре и смесь охлаждают и перемешивают при 0°С в течение 1 часа. После охлаждения до -78°С добавляют сухой тетрагидрофуран (ТГФ) и небольшое количество реакционной смеси удаляют, реакцию обрывают D2Oи исследуют методом1Н ЯМР, чтобы убедиться в завершении реакции метилирования. Затем желтую суспензию переносят во вторую трубку Шленка с пламенной сушкой, содержащей CuCN (0,54 г, 6,03 ммоль), под атмосферой азота при -78°С. Смесь нагревают до 00С в течение 10 минут, затем охлаждают до -78°С, добавляют аллилбромид (3,62 мл), реакционную смесь перемешивают в течение ночи (19 часов) и позволяют нагреться ей до комнатной температуры. Реакцию обрывают 10% водным NH4Cl (75 мл) и экстрагируют простым эфиром (2×200 мл). Объединенные эфирные экстракты промывают Н2О (2×150 мл), 10%м водным NH4OH (200 мл) и насыщенным водным раствором NaCl (200 мл). Органические растворители сушат над MgSO4, фильтруют и растворитель удаляют ротационным испарением под вакуумом, в результате чего получают сырой продукт (7,25 г). Колоночная хроматография на силикагеле и элюирование 20%-й смесью простой эфир/гексан дает чистый 1,2,3,4-тетраметокси-5-метил-6-(2-пропенил)бензол (2) (Yoshioka, T., Nishi, T., Kanai, T., Aizawa, Y., Wada, K., Fujita, T. And Horikoshi, H., (1993), Eur. Pat. Appl, EP 549366 A1) (6,05 г, 83,5 %).1Н ЯМР: δ 5,84-5,98 (1H, м, -CH=C), 4,88-5,03 (2H, м, =CH2), 3,78, 3,80, 3,90, 3,92 (12H, с, OMe), 3,38 (2H, д, J=7,0 Гц, Ar-CH2), 2,14 (3H, с, Ar-Me) млн.д.
Раствор 2 (8,0 г, 33,05 ммоль) в сухом ТГФ (45 мл) добавляют по каплям в течение 20 минут под аргоном к перемешиваемой суспензии 9-борабицикло[3,3,1]нонана в ТГФ (79 мл, 39,76 ммоль, 0,5 М) при 25°С. Образовавшийся раствор перемешивают в течение ночи при комнатной температуре и еще в течение 2-х часов при 65°С под аргоном. Затем смесь охлаждают до 0°С и по каплям приливают 3М NaOH (53 мл), а затем 30% водный Н2О2 (53 мл). После 30 минут перемешивания при комнатной температуре водную фазу насыщают NaCl и 3 раза экстрагируют ТГФ. Объединенные органические фракции промывают насыщенным водным NaCl, сушат (Na2SO4), фильтруют и выпаривают, в результате чего получают маслянистый остаток (11,5 г), который очищают колоночной хроматографией на силикагеле (200 г, уплотненного смесью простой эфир/гексан 1:9). Элюирование смесью простой эфир/гексан 1:4 дает чистый 3-(2,3,4.5-тетраметокси-6-метилфенил)пропан-1-ол (3) в виде вязкого бесцветного масла (6,85 г, 80%).1Н ЯМР: δ 3,91, 3,90, 3,84, 3,79 (12H, с, OMe), 3,56 (2H, т, J=7,0 Гц, -CH2-OH), 2,72 (2H, т, J=7,0 Гц, Ar-CH2), 2,17 (3H, с, Ar-Me), 1,74 (2H, квинтет, J=7,0 Гц, -CH2-) млн.д. Элементный анализ: рассчитано для C14H23O5 C 62,2; H 8,2. Найдено: С 62,2; Н 8,4%.
Раствор 3 (3,88 г, 15 ммоль) и триэтиламина (3,0 г, 30 ммоль, 4,2 мл) в CH2Cl2 (50 мл) перемешивают при комнатной температуре в течение 10 минут. По каплям добавляют метансульфонилхлорид (1,8 г , 1,20 мл, 15,75 ммоль) в CH2Cl2 (50 мл) в течение 20 минут и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь разбавляют CH2Cl2 (50 мл) и органический слой промывают Н2О (5×100 мл), 10% водным раствором NaHCO3 (100 мл), сушат (MgSO4), фильтруют и растворитель удаляют под вакуумом на ротационном испарителе, в результате чего получают 1-(3-метансульфонилоксипропил)-2-метил-3,4,5,6-тетраметоксибензол (4) в виде жидкости (4,8 г, 95%).1Н ЯМР: δ 4,27 (2H, т, J=7,0 Гц, -CH2-O-SO2-Me), 3,91, 3,89, 3,82, 3,78 (12H, с, OMe), 3,03 (3H, с, -O-SO2-Me), 2,70 (2H, т, J=7,0 Гц, Ar-CH2-), 2,17 (3H, с, Ar-Me), 1,9 (2H, м, -CH2-) млн.д.
Сырой метансульфонат 4 (3,30 г, 9,8 ммоль) используют непосредственно в следующей реакции, смешивая со свежеизмельченной смесью трифенилфосфина (4,08 г, 15,6 ммоль) и NaI (7,78 г, 51,9 ммоль) в трубке Кимакса (Kimax) и запаивая ее под аргоном. Затем смесь держат при температуре 70-74°С, перемешивая магнитной мешалкой в течение 3-х часов, во время которых смесь меняется от расплавленной вязкой жидкости до стеклообразного твердого вещества. Трубку охлаждают до комнатной температуры и остаток перемешивают с CH2Cl2 (30 мл). Затем суспензию фильтруют и фильтрат испаряют досуха. Остаток растворяют в минимальном количестве CH2Cl2 и растирают с избытком простого эфира (250 мл) до выпадения белого осадка. Твердый осадок фильтруют и промывают простым эфиром, сушат в вакууме и получают чистый [3-(2,3,4,5-тетраметокси-6-метилфенил)пропил]трифенилфосфонийиодид (5) (5,69 г, 90%).1Н ЯМР: δ 7,82-7,65 (15H, м, Ar-H), 3,88, 3,86, 3,74, 3,73 (12H, с, OMe), 3,76-3,88 (2H, м, СН2-Р+), 2,98 (2H, т, J=7,0 Гц, CH2-Ar), 2,13 (3H, с, Ar-Me), 1,92-1,78 (2H, м, -CH2-) м.д.,31P ЯМР (121,4 МГц) δ 25,32 млн.д. Элементный анализ: рассчитано для C32H36IO5P: C 59,8; H 5,7; P 4,8; найдено: C 59,8; H 5,8; P 4,5%.
Раствор иодида 5 (4,963 г, 7,8 ммоль) в CH2Cl2 (80 мл) встряхивают с 10%-м водным раствором NaNO3 (50 мл) в разделительной воронке в течение 5 мин. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают под вакуумом, в результате чего получают нитратную соль 5 (4,5 г, 7,8 ммоль, 100%), которую растворяют в смеси CH3CN и Н2О (7:3, 38 мл) и перемешивают при 0°С на ледяной бане. Затем добавляют пиридин-2,6-дикарбоновую кислоту (6,4 г, 39 ммоль), а после этого по каплям приливают раствор цериевого нитрата аммония (21,0 г, 39 ммоль) в CH3CN/H2O (1:1, 77 мл) в течение 5 минут. Реакционную смесь перемешивают при 0°С в течение 20 минут, а затем при комнатной температуре еще в течение 10 мин. Затем реакционную смесь выливают в Н2О (200 мл) и экстрагируют CH2Cl2 (200 мл), сушат (Na2SO4), фильтруют и выпаривают под вакуумом, в результате чего получают сырой нитрат [3-(4,5-диметокси-2-метил-3,6-диоксо-1,4-циклогексадиен-1-ил)пропил]трифенилфосфония (6). Весь продукт растворяют в CH2Cl2 (100 мл) и встряхивают в течение 10 мин с 20% водным раствором KBr (50 мл). Органический слой отделяют, сушат и выпаривают под вакуумом, в результате чего получают бромидную соль 6 (4,1 г, 93,6%),1Н ЯМР δ 7,90-7,65 (15H, м, Ar-H), 4,15-4,05 (2H, м, СН3-Р+), 3,96, 3,95, (6H, с, OMe), 2,93 (2H, т, J=7,0 Гц, CH2-Ar), 2,15 (3H, с, Ar-Me), 1,85-1,70 (2H, м, -CH2-) млн.д.,31P ЯМР δ 25,29 млн.д.
Раствор бромида 6 (3,65 г, 6,5 ммоль) в CH2Cl2 (75 мл) встряхивают с 10% м/о водного раствора метансульфоната натрия (100 мл) в разделительной воронке в течение 5 минут. CH2Cl2 слой отделяют, сушат (Na2SO4), фильтруют и выпаривают под вакуумом, в результате чего получают метансульфонатную соль [3-(4,5-диметокси-2-метил-3,6-диоксо-1,4-циклогексадиен-1-ил)пропил]трифенилфосфония (6) (3,7 г, 98%).1Н ЯМР: δ 7,88-7,60 (15H, м, Ar-H), 3,93, 3,92, (6H, с, OMe), 3,90-3,78 (2H, м, CH2-P+), 2,85 (2H, т, J=7,0 Гц, CH2-Ar), 2,70 (3H, с, OSO2CH3), 2,09 (3H, с, Ar-Me), 1,82-1,68 (2H, м, -CH2-) млн.д.,31P ЯМР (121,4 МГц) δ 25,26 млн.д. Элементный анализ. Рассчитано для C31H33O7PS: C 64,1; H 5,7; P 5,3; S 5,5. Найдено: C 63,8; H 5,9; S 5,3; P 5,2%.
Митохинон-С5 (14). Схема синтеза Митохинона-С5 показана на фиг.2В. Дигидропиран (46,83 г, 0,55 ммоль) добавляют к 2,3-диметокси-5-метил-1,4-бензогидрохинону (CoQ0) (50 г, 0,275 моль), растворенному в уксусной кислоте (500 мл), и перемешивают при комнатной температуре в течение 10 минут. К этому раствору добавляют BF3.Et2O (38,57 г, 0,271 моль). Образующийся раствор перемешивают при комнатной температуре. По истечении этого времени сырую реакционную смесь выливают в ледяную воду (500 мл) и экстрагируют хлороформом (1000 мл). Органический экстракт промывают насыщенным раствором соли (500 мл) и сушат (MgSO4). Растворитель удаляют под вакуумом и получают сырой 2,3-диметокси-5-метил-6-(тетрагидропиран-2-ил)-4-(тетрагидропиран-2-илокси)фенол (7) в виде масла красного цвета (115 г), которое используют без дополнительной очистки. Раствор сырого 7 (110 г) в смеси уксусная кислота/хлорная кислота (97,5:2,5, 500 мл) гидрируют над 5% палладий/уголь (5,42 г) при атмосферном давлении и комнатной температуре до окончания поглощения водорода (три дня). Затем реакционную смесь фильтруют через целитовый фильтр и твердый остаток промывают этанолом (500 мл). Объединенный фильтрат разделяют на три равные части и каждую часть добавляют к дистиллированной воде (1000 мл) и экстрагируют CH2Cl2 (2×200 мл). Объединенные органические экстракты промывают насыщенным раствором соли (500 мл), насыщенным раствором бикарбоната натрия (500 мл), насыщенным раствором соли (300 мл), а затем сушат (MgSO4). Затем смесь фильтруют и растворители удаляют под вакуумом, в результате чего получают сырой 4-ацетокси-3-(5-ацетоксипентил)-5,6-диметокси-2-метилфенилацетат (8) в виде масла красного цвета (110 г), которое используют на последующей этапе без дополнительной очистки.1Н ЯМР: δ 4,0-4,15 (2H, м, -CH2-O), 3,86 (6H, с, 2x OMe), 2,58 (2H, т, J=7,0 Гц, -CH2-Ar), 2,12 (3H, с, Ar-Me), 2,06 (6H, с, 2x CH3-С=O), 2,02 (3H, с, CH3-C=O), 1,35-1,70 (6H, м, -CH2CH2CH2-) млн.д.
Литийалюминийгидрид (8,0 г, 0,21 моль) добавляют к сухому ТГФ (500 мл) в 1 литровой круглодонной колбе, снабженной магнитной мешалкой, обратным холодильником и погруженной в водяную баню комнатной температуры. Раствор сырого 8 (74 г) в сухом свежеперегнанном ТГФ (100 мл) по каплям приливают к смеси ТГФ/LiAlH4 в течение промежутка времени 25-30 минут. Добавляют дополнительно сухой ТГФ (200 мл) для облегчения перемешивания и реакционную смесь оставляют перемешиваться на 5 час при комнатной температуре. Затем реакцию обрывают добавлением по каплям 3М HCl (20 мл) с последующим медленным добавлением дистиллированной воды (70 мл). Затем реакционную смесь фильтруют и фильтрат промывают насыщенным раствором соли (2×300 мл), сушат (MgSO4), фильтруют и растворитель удаляют под вакуумом. Зеленый остаток, остающийся на фильтровальной воронке, растворяют в 15% HCl (500 мл) и CH2Cl2 (1×300 мл, 2×200 мл). Органические фракции объединяют и промывают насыщенным раствором соли (400 мл), сушат (MgSO4), фильтруют и выпаривают под вакуумом. Этот экстракт объединяют с материалом с этапа обработки фильтрата и получают сырой 2-(5-гидроксипентил)-5,6-диметокси-3-метилбензол-1,4-диол (9) (68,3 г) в виде масла красного цвета. Этот продукт 9 очищают с использованием колоночной хроматографии на силикагеле (600 г, уплотненный 10% смесью простой эфир/ CH2Cl2). Элюирование 10% смесью простой эфир/ CH2Cl2 дает некоторое количество непрореагировавшего 8 и исходного материала 2,3-диметокси-5-метил-1,4-бензогидрохинона. Элюирование 20% смесью простой эфир/ CH2Cl2 дает смесь 9 и хинона 10 (14,14 г, 19% из 2,3-диметокси-5-метил-1,4-бензохинола). Соединение 9 медленно превращается в хинон 10 при стоянии на воздухе, и удовлетворительные результаты элементного анализа не удается получить.1Н ЯМР: δ 5,41 (1H, с, Ar-OH), 5,38 (1Н, с, Ar-OH), 4,88 (6H, с, 2 x Ar-OMe), 3,65 (2H, т, J=6,3 Гц, CH2-OH), 2,61 (2H, т, J=6,4 Гц, Ar-CH2), 2,14 (3H, с, Ar-Me), 1,42-1,68 (6H, м, 3x-CH2-) млн.д.
Раствор хинола 9 (7,5 г, 27,7 ммоль) в CH2Cl2 (150 мл) насыщают газообразным кислородом при атмосферном давлении и добавляют раствор NO2 в CH2Cl2 (1 мл, 1,32 М). Реакционную смесь перемешивают при комнатной температуре под атмосферой кислорода в течение 18 часов, и к этому времени ТСХ (40 % простой эфир/CH2Cl2) показывает, что образование хинона 2-(5-гидроксипентил)-5,6-диметокси-3-метил-[1,4]бензохинона (10) завершено. Затем растворитель удаляют под вакуумом и получают продукт 10 (Yu, C.A. and Yu, L. (1982) Biochemistry 21, 4096-4101) (7,40 г) в виде масла красного цвета.1Н ЯМР: δ 3,99 (6H, с, 2 x Ar-OMe), 3,65 (2Н, т, J=6,3 Гц, CH2-OH), 2,47 (2H, т, J=6,3 Гц, Ar-CH2), 2,01 (3H, с, Ar-Me), 1,52-1,60 (2H, м, -CH2-), 1,37-1,43 (4H, м, -CH2CH2-) млн.д.
Готовят раствор 10 (7,40 г, 27,3 ммоль) в CH2Cl2 (150 мл) и триэтиламине (5,46 г, 5,46 ммоль) и добавляют к нему раствор метансульфонилхлорида (2,48 г, 30 ммоль) в CH2Cl2 (50 мл) в течение 30 минут при перемешивании. После перемешивания в течение дополнительных 1,5 часов при комнатной температуре реакционную смесь промывают дистиллированной водой (5×100 мл), насыщенным раствором бикарбоната натрия (150 мл) и сушат (MgSO4). Смесь фильтруют и растворитель удаляют под вакуумом, в результате чего получают сырой метансульфонат (9,03 г) в виде масла красного цвета.1Н ЯМР: δ 4,19 (2H, т, J=7,5 Гц, -CH2-OMc), 3,95 (6H, с, 2xAr-OMe), 2,98 (3H, с, OSO2CH3), 2,44 (2H, т, J=7,5 Гц, Ar-CH2-), 1,98 (3H, с, Ar-Me), 1,75 (2H, квинтет, J=7,5 Гц, -CH2-), 1,38-1,48 (4H, м, -CH2-CH2-) млн.д. Метансульфонат растворяют в 10% (м/о) NaI в ацетоне (100 мл) и перемешивают в течение 44 часов при комнатной температуре. Затем смесь концентрируют под вакуумом и к остатку добавляют Н2О (100 мл). Смесь экстрагируют CH2Cl2 (3×70 мл) и объединенные органические экстракты промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и растворитель удаляют под вакуумом, в результате чего получают сырой 2-(5-иодпентил)-5,6-диметокси-3-метил-[1,4]бензохинон (11). Этот продукт очищают колоночной хроматографией на силикагеле (150 г). Элюирование CH2Cl2 и 10% смесью простой эфир/ CH2Cl2 дает чистый 11 (7,05 г, 69%) в виде масла красного цвета.1Н ЯМР: δ 3,99 (6H, с, 2 x Ar-OMe), 3,18 (2H, т, J=6,9 Гц, CH2-I), 2,47 (2H, т, J=7,2 Гц, Ar-CH2), 2,02 (3H, с, Ar-Me), 1,85 (2H, квинтeт, J=7,5 Гц, -CH2-), 1,38-1,48 (4H, м, -CH2-CH2-) млн.д. Элементный анализ. Рассчитано для C14H19IO4: С 44,5; Н 5,1; I 33,6. Найдено: С 44,6; Н 5,1; I 33,4%.
Раствор 11 (1,14 г, 2,87 ммоль) в метаноле (20 мл) обрабатывают NaBH4 (0,16 г, 4,3 ммоль) и смесь становится бесцветной в течение 1 минуты. Через 5 минут при комнатной температуре добавляют 5% водный раствор HCl (100 мл) и раствор экстрагируют CH2Cl2 (2×50 мл). Органические фракции объединяют, сушат (MgSO4), фильтруют и растворитель удаляют под вакуумом, в результате чего получают 12 (1,15 г, 100%) в виде чувствительного к воздействию кислорода масла желтого цвета, которое используют без промедления.1Н ЯМР: δ 5,36, 5,31 (2H, с, Ar-OH), 3,89 (6H, с, 2x Ar-OMe), 3,20 (2H, т, J=7,5 Гц, -CH2-I), 2,62 (2H, т, J=7,5 Гц, -CH2-Ar), 2,15 (3H, с, Me), 1,82-1,92 (2H, м, -CH2-), 1,45-1,55 (4H, м, -CH2-CH2-) млн.д. Смесь 12 (1,15 г, 2,87 ммоль) и трифенилфосфина (1,2 г, 4,31 ммоль) помещают в трубку Кимакса (Kimax) с цилиндрической мешалкой. Трубку продувают аргоном, плотно закрывают, нагревают и перемешивают в течение 14 часов при 700С. Образуется темное твердое вещество, которое растворяют в CH2Cl2 (10 мл) и растирают с простым эфиром (200 мл), образующийся белый осадок быстро отфильтровывают. Осадок, который становится липким под воздействием воздуха, повторно растворяют в CH2Cl2 и выпаривают под вакуумом, в результате чего получают сырой продукт иодид [5-(2,5-дигидрокси-3,4-диметокси-6-метилфенил)пентил]трифенилфосфония (13) (2,07 г, 115%) в виде коричневого масла. Материал не стабилен при хранении в течение продолжительных периодов времени и используется, как только становится доступным для последующих реакций.1Н ЯМР: δ 7,84-7,68 (15H, м, Ar-H), 5,45 (1H, с, Ar-OH), 5,35 (1H, с, Ar-OH), 3,89 (3H, с, Ar-OMe), 3,87 (3H, с, Ar-OMe), 3,65 (2H, м, -CH2-+PPh3), 2,54 (2H, т, J=7,0 Гц, Ar-CH2), 2,08 (3H, с, Ar-Me), 1,65-1,75 (2H, м, -CH2-), 1,45-1,55 (4H, м, -CH2CH2-) млн.д.,31P ЯМР δ 25,43 млн.д.
Раствор 13 (2,07 г) в CH2Cl2 (50 мл) насыщают газообразным кислородом и добавляют раствор NO2 в CH2Cl2 (0,5 мл, 1,32 М). Затем реакционную смесь перемешивают при комнатной температуре под атмосферой кислорода в течение 18 часов. Растворитель удаляют под вакуумом и получают сырой продукт иодид [5-(4,5-диметокси-2-метил-3,6-диоксо-1,4-циклогексадиен-1-ил)пентил]трифенилфосфония (14) в виде масла красного цвета. Этот остаток повторно растворяют в CH2Cl2 (10 мл) и растирают с простым эфиром (200 мл), в результате чего получают исходный желтый остаток, который через несколько минут сгущается в масло красного цвета. Растворители сливают и остаток растворяют в CH2Cl2, растворитель удаляют под вакуумом и получают продукт (14) (1,866 г) в виде масла красного цвета. Аликвотное количество (0,880 г) 14 очищают колоночной хроматографией на силикагеле (20 г). Элюирование CH2Cl2 дает некоторое количество неидентифицированного материала пурпурного цвета. Элюирование смесью 5% этанол/ CH2Cl2 дает чистый иодид 14 (0,606 г) в виде масла красного цвета.1Н ЯМР: δ 7,84-7,68 (15H, м, Ar-H) 3,98 (6H, с, 2xAr-OMe), 3,65 (2H, м, CH2-P+), 2,40 (2H, т, J=7,5 Гц, Ar-CH2), 2,00 (3H, с, Ar-Me), 1,71 (4H, м, -CH2-), 1,43 (2H, м, -CH2-) млн.д.,31P ЯМР (121,4 МГц) δ 25,47 млн.д. Элементный анализ. Рассчитано для C32H36IO4P: С 59,8; Н 5,7; I 19,8; Р 4,8. Найдено: С 60,0; Н 5,3; I 19,7; Р 4,7%.
Митохинон-С15 (16). Схема синтеза Митохинона-С15 показана на фиг.2С. Раствор K2S2O8 (0,450 г, 1,66 ммоль) в Н2О (25 мл) по каплям приливают в течение 2,5 часов к перемешиваемой суспензии AgNO3(0,262 г, 1,54 ммоль), 16-гидроксигексадекановой кислоты (0,408 г, 1,50 ммоль) и 2,3-диметокси-5-метил-1,4-бензохинона (0,271 г, 1,49 ммоль) в Н2О:CH3CN (1:1, 36 мл), поддерживаемой при температуре 75°С. После перемешивания в течение 10 минут смесь охлаждают и экстрагируют простым эфиром (4×30 мл). Объединенную органическую фазу промывают Н2О (2×100 мл), NaHCO3(1М, 2×50 мл) и насыщенным NaCl (2 х 50 мл). Органическую фазу сушат (Na2SO4), фильтруют и концентрируют под вакуумом, в результате чего получают масло красного цвета (0,444 г). Колоночная хроматография сырого масла (силикагель, 15 г) и элюирование смесями CH2Cl2 и простого эфира (0%, 5%, 20%) дает 2-(15-гидроксипентадецил)-5,6-диметокси-3-метил-[1,4]бензохинон (15) (0,192 г, 33%) в виде масла красного цвета.1Н ЯМР: δ 3,99, 3,98 (6H, с, OMe), 3,64 (2H, т, J=6,5 Гц, -CH2OH), 2,45 (2H, т, J=7,5 Гц, -CH2-кольцо), 1,4-1,2 (26H, м, -(CH2)13-). Элементный анализ. Рассчитано для С24Н40О5: С 70,6; Н 9,9. Найдено: С 70,5; Н 9,8%.
Смесь трифенилфосфина (0,066 г, 0,25 ммоль), Ph3PHBr (0,086 г, 0,25 ммоль) и 15 (0,101г, 0,25 ммоль) перемешивают в атмосфере аргона в закрытой трубке Кимакса при 70°С в течение 24 часов, к этому времени она превращается в вязкое красное масло. Остаток растворяют в минимальном количестве CH2Cl2 (0,5 мл) и выливают в простой эфир (10 мл) с получением маслянистого осадка красного цвета. Растворители затем сливают, а остаток растворяют в СН3ОН (0,5 мл) и разбавляют Н2О (10 мл), содержащей 48% HBr (1 капля). Образуется красный осадок и после осаждения осадка верхний слой сливают, а остаток промывают водой (5 мл). Затем остаток растворяют в этаноле (5 мл) и растворитель удаляют под вакуумом. Остаток повторно растворяют в CH2Cl2 (0,5 мл), разбавляют простым эфиром (5 мл), растворитель сливают и остаток помещают в вакуумную систему (0,1 мбар) на 24 часа, в результате чего получают бромид [15-(4,5-диметокси-2-метил-3,6-диоксо-1,4-циклогексадиен-1-ил)пентадецил]трифенилфосфония (16) (0,111 г, 61%) в виде вспененного продукта желтого цвета, который превращается в красное масло при контакте с воздухом.1Н ЯМР: (299 МГц) δ 7,6-8,0 (15H, м, Ar-H), 3,89 (6H, с, OMe), 3,9 (2H, м, -CH2-P), 2,6 (2H, м, -CH2-кольцо), 1,7-1,1 (26H, м, -(CH2)13-) млн.д.,31P ЯМР (121,4 МГц) δ 25,71 млн.д. Электрораспылительной масс-спектрометрией найдено (М+) 653, рассчитано для С42Н54О4Р+ 653. Аналитические данные, полученные при сжигании, оказываются неудовлетворительными вследствие непостоянных уровней содержания растворителей.
Пример 3. Свойства пояснительных направленно вводимых в митохондрии антиоксидантных соединений
Настоящее изобретение признает, что для того, чтобы быть подходящими для широкого ряда областей применения, например, для составов лекарственных форм, таких как таблетки, существует преимущество, обусловленное способностью образовывать кристаллические или твердые формы направленно вводимыми в митохондрии антиоксидантными соединениями. Аналогично этому, авторы изобретения, не желая быть связанными никакой теорией, полагают, что антиокислительное действие соединений настоящего изобретения обусловлено, по меньшей мере, частично их физико-химическими свойствами.
Коэффициенты распределения для различных антиоксидантных соединений представлены в таблице 1. Коэффициенты распределения октан-1-ол/ПБС определены добавлением 400 нмоль соединения к 2 мл насыщенного ПБС октан-1-ола и смешением в течение 30 минут при 37°С с 2 мл насыщенного октан-1-олом ПБС. Концентрации соединения в двух фазах измерены по УФ поглощению на длине волны 269 нм и количественно рассчитаны по стандартным кривым соединения в насыщенном окстан-1-олом ПБС или насыщенном ПБС октан-1-оле (Kelso, G.F., Porteous, C.M., Couler, C.V., Hughes, G., Porteus, W.K., Ledgerwood, E.C., Smith, R.A.J., and Murphy, M.P., 2001, J. Biol Chem. 276, 4588; Smith, R.A.J., Porteous, C.M., Coulter, C.V. and Murphy, M.P. 1999, Eur. J. Biochem. 263, 709). Маточные растворы соединений готовят в абсолютном этаноле и хранят при -20°С в темноте. [3H]TPMP получен от American Radiolabelled Chemicals Inc. (MO, USA).
Особенно следует отметить низкий коэффициент распределения соединений с небольшим числом атомов углерода в мостике, связывающем молекулу антиоксиданта и фосфоний. Например, соединение согласно настоящему изобретению, названному в описании как Митохинон-С3, которое имеет мостик из 3-х атомов углерода, характеризуется коэффициентом распределения приблизительно в 50 раз меньше, чем наблюдаемый для родственного соединения, Митохинона-С10 (таблица 1).
Данныеа-с представляют собой коэффициенты распределения в системе октан-1-ол/физиологический раствор с фосфатным буфером, определенные при 25°С или 37°С как описано выше, или коэффициенты распределенияd в системе октанол/вода, рассчитанные по программе Advanced Chemistry Development (ACD) Software Solaris V4, 67, как описано в публикации Jauslin, M.L., Wirth, T., Meier, T., and Schoumacher, F., 2002, Hum. Mol. Genet 11, 3055.
a Kelso, G.F., Porteous, C.M., Coulter, C.V., Hughes, G., Porteus, W.K., Ledgerwood, E.C., Smith, R.A.J., and Murphy, M.P., 2001, J. Biol Chem. 276, 4588.
b Smith, R.A.J., Porteous, C.M., Coulter, C.V. and Murphy, M.P. 1999, Eur. J. Biochem. 263, 709
c Smith, R.A.J., Porteous, C.M., Gane, A.M., and Murphy, M.P. 2003, Proc. Nat. Acad. Sci., 100, 9, 5407.
Из коэффициентов распределения окстан-1-ол/ПБС ясно, что Митохинон-С3, Митохинон-С5, Митохинон-С10 и Митохинон-С15 охватывают широкий интервал гидрофобности. В этом Митохинон-С3 аналогичен простому, относительно растворимому в воде катиону ТРМР, тогда как данные для Митохинона-С15 указывают, что он имеет очень низкую растворимость в воде. Как известно, катионы алкилтрифенилфосфония, такие как Митохинона, абсорбируются на фосфолипидных двойных слоях с катионом на уровне карбоксильных кислотных групп, тогда как гидрофобная алкильная группа проникает в гидрофобное ядро мембраны. Полагают, что чем длиннее метиленовый мостик, тем глубже убихинольный антиоксидант будет проникать в гидрофобное ядро мембраны. Авторы полагают, что для этих соединений будет иметь место максимальная степень, с которой происходит проникновение в один листок мембраны, как показано на фиг.3, на которой представлены варианты Митохинона, соединенные с типичным фосфолипидом. Эти модели показывают, что фрагмент убихинола Митохинона-С3 только проникает в близкие к поверхности мембраны слои, тогда как для Митохиона-С10 и Митохинона-С15 глубина этого проникновения близка к ядру фосфолипидного двойного слоя.
Авторы изобретения синтезировали ряд антиоксидантных соединений с различной гидрофобностью и глубиной проникновения в фосфолипидный двойной слой.
Пример 4. Митохондриальное поглощение направленно вводимых соединений
Чтобы показать, что направленное введение в митохондрии является эффективным, определяют поглощение митохондриями как отклик на мембранный потенциал пояснительных антиоксидантных соединений Митохинона-С3, Митохинона-С5, Митохинона-С10 и Митохинона-С15.
Для измерения поглощения антиоксидантных соединений возбужденной митохондрией сконструировали ионоселективный электрод (Smith, R.F., Kelso, G.F., James, A.M. and Murphy, M.P. (2004) Meth. Enzymol, 382, 45-67; Davey, G.P., Tipton, K.F. and Murphy, M.P. (1992) Biochem. J. 288, 439-443; Kamo, N., Muratsugu, M., Hongoh, R. and Kobatake, Y. (1979) J. Membr. Biol. 49, 105-121)/ Электрод и электрод сравнения Ag/AgCl помещают через воздухонепроницаемую крышку Perspex в 3 мл инкубационную камеру, обеспеченную перемешиванием и термостатированием при 30°С, снабженную инжекционным отверстием для добавления субстратов. Для измерения поглощения антиоксидантного соединения митохондрии печени крысы (1 мг протеина/мл) инкубировали при 30°С в среде KCl (120 мМ KCl, 10 мМ HEPES, pH 7,2, 1 мМ EGTA), нигерицина (1 мкг/мл) и ротенона (8 мкг/мл). Добавили сукцинат (10 мМ) и FCCP (500 нМ), куда указано. Сигнал от ионоселективного электрода проходит в систему сбора данных PowerLab Data через передний усилитель рН и анализируются с помощью компьютерной программы Chart, все оборудование от ADInstruments.
Митохондрии печени крысы готовят гомогенизацией с последующим дифференциальным центрифугированием в охлажденном льдом буфере, содержащем 250 мМ сахарозы, 5 мМ Tris-HCl, 1 мМ EGTA, pH 7,4 (Chappel, J.В. and Hansford, R.G. (1972) в книге Subcellular components: preparation and fractionation, pp.77-91 (Birnie, G.D., Ed.) Butterworths, London). Определяют концентрацию протеина по биуретовой пробе с использованием в качестве стандарта BSA (Gornall, A.G., Bardawill, C.J. and David, M.M. (1949) J. Biol. Chem. 177, 751-766). Митохондриальный мембранный потенциал измеряют добавлением 500 нМ ТРМР, дополненного 50 nCi[3H]TPMP, в митохондрии, суспендированные в среде KCl (120 мМ KCl, 10 мМ HEPES, pH 7,2, 1 мМ EGTA) при 25°С (Brand, M.D. (1995) в книге: Bioenergetics - a practical approach, pp.39-62 (Brown, G.C. and Cooper, C.E., Eds.) IRL, Oxford). После инкубирования митохондрии таблетируют центрифугированием, и определяют количества [3H]TPMP в верхнем слое и таблетках сцинтилляционным счетчиком и рассчитывают мембранный потенциал, принимая митохондриальный объем 0,5 мкл/мг митохондриального протеина и поправку на ТРМР связывание 0,4 (Brown, G.C. and Brand, M.D. (1985) Biochem. J. 225, 399-405).
Авторы изобретения сконструировали ионоселективные электроды для измерения их концентраций в стационарном состоянии (Smith, R.A., Kelso, G.F., James, A.M. and Murphy, M.P. (2004) Meth. Enzymol. 382, 45-67; Davey, G.P., Tipton, K.F. and Murphy, M.P. (1992) Biochem. J. 288, 439-443; Kamo, N., Muratsugu, M., Hongoh, R. and Kobatake, Y. (1979) J.Membr. Biol. 49, 105-121). Отклик этих электродов на простые катионы трифенилфосфония, такие как ТРМР является Нернстианским с линейной зависимостью напряжения на электроде от log10 [концентрация катиона] и наклоном ~ 60 мВ при 30°С (Davey, G.P., Tipton, K.F. and Murphy, M.P. (1992) Biochem. J. 288, 439-443; Kamo, N., Muratsugu, M., Hongoh, R. and Kobatake, Y. (1979) J. Membr. Biol. 49, 105-121). Наиболее гидрофильное соединение, Митохинон-С3, также дает Нернстианскую зависимость для электрода с наклоном близким 60 мВ при концентрации выше 10 мМ. Это показано на фиг.4А, справа, в виде логарифмической зависимости напряжения на электроде от последовательных добавлений 1 пМ Митохинона-С3 в отсутствие митохондрий. Для Митохинона-С5, Митохинона-С10 и Митохинона-С15 электрод также реагировал быстро и стабильно на последовательные добавления в отсутствие митохондрий (фиг.4В, 4С и 4D, соответственно, диаграммы справа). Однако в этих случаях отклики электрода не были Нернстианскими, как полагают авторы, вследствие большей гидрофобности этих соединений. Даже если так, то для всех четырех антиоксидантных соединений ионоселективный электрод позволяет измерять свободные концентрации соединений и, таким образом, их поглощение митохондриями в реальном времени.
Для измерения поглощения антиоксидантного соединения митохондрии вводят в электродную камеру в присутствии ротенона для предотвращения возникновения мембранного потенциала (левая часть фиг.4). Затем делают пять последовательных добавлений антиоксидантного соединения по 1 мкМ для калибровки отклика электрода и сукцинат дыхательного субстрата для генерирования мембранного потенциала. Митохондриальное возбуждение приводит к быстрому поглощению всех типов антиоксидантных соединений митохондриями, а последующее добавление развязывающего FCCP уничтожает мембранный потенциал и приводит к его быстрому выделению из митохондрий (фиг.4А-I, слева). Эти эксперименты ясно показывают зависимое от напряжения поглощение митохондриальной мембраной Митохинона-С3, Митохинона-С5 и Митохинона-С10. И если Митохинон-С15 также поглощался митохондриями на стадии индуцирования мембранного потенциала, то отклик электрода на Митохинон-С15 в присутствии митохондрий был слабее, более шумным более склонным к сдвигу. Это отличается от электродного отклика для Митохинона-С15 в отсутствие митохондрий (см. диаграммы справа) и обусловлено его низкими свободными концентрациями в присутствии митохондрий.
Затем определяют степень связывания антиоксидантного соединения с невозбужденной митохондрией (фиг.4, справа). Для этих экспериментов различные антиоксидантные соединения сначала вводили в электродную камеру, а затем вводили митохондрии в присутствии ротенона для предупреждения возникновения мембранного потенциала. Снижение концентрации антиоксидантного соединения при введении митохондрий обусловлено связыванием антиоксидантного соединения с невозбужденными митохондриями. Последующее добавление сукцината для генерирования мембранного потенциала указывает на зависимое от мембранного потенциала поглощение соединений, которое затем принимает обратный характер при добавлении FCCP для уничтожения мембранного потенциала.
Свободная концентрация Митохинона-С3 не меняется при добавлении митохондрии, что указывает на то, что ничтожные количества Митохинона-С3 связываются с невозбужденной митохондрией (фиг.4А, справа). FCCP-чувствительное поглощение митохинона-С3 при возбуждении сукцинатом составило примерно 3,7 нмоль митохинона-С3/мг протеина, что соответствует коэффициенту накопления 2×103. Это согласуется с ожидаемым результатом, рассчитанным по уравнению Нернста, и митохондриальным мембранным потенциалом примерно 180 мВ, позволяя ввести поправки на внутримитохондриальное связывание.
Для Митохинона-С5 наблюдается некоторое связывание соединения с невозбужденными митохондриями (~0,6 нмоль/мг протеина), однако это ничтожно по сравнению с его последующим поглощением после возбуждения сукцинатом, примерно 2,8 нмоль Митохинона-С5/мг протеина, соответствующее коэффициенту накопления примерно 1,4×103 (фиг.4В, справа).
Для Митохинона-С10 наблюдается значительное связывание с невозбужденными митохондриями примерно 2,6 нмоль Митохинона-С10, и за этим следует дополнительное связывание примерно 1 нмоль/мг протеина при добавлении сукцината (фиг.4С, справа).
Почти весь свободный Митохинон-С15 связывается с невозбужденными митохондриями, но наблюдается некоторое дополнительное поглощение при возбуждении сукцинатом. Зависимое от мембранного потенциала поглощение Митохинона-С15 очевидно на левой диаграмме фиг.4D, где электродный отклик чрезвычайно чувствителен, чтобы позволить измерить небольшое количество свободного Митохинона-С15, когда электрод калиброван в присутствии митохондрий. В отличие от этого, поглощение Митохинона-С15 трудно увидеть на правой стороне фиг.4D, где электродный отклик значительно менее чувствителен, чтобы позволить измерить Митохинон-С15 в отсутствие митохондрий.
Эти эксперименты показывают, что длина метиленовых мостиков антиоксидантных соединений, по меньшей мере, частично определяет их степени адсорбции на митохондриальных мембранах (справа на фиг.4). Адсорбция меняется от ничтожной для Митохинона-С3 до почти полного связывания для Митохинона-С15. При добавлении Митохинона-С15 к невозбужденным митохондриям практически все соединение связывается, распределяется по обеим поверхностям внутренней и наружной мембран. Когда индуцирован мембранный потенциал, авторы полагают, что будет происходить значительное перераспределение соединения на обращенной к матрице поверхности внутренней мембраны с наружной поверхности внутренней мембраны и с наружной мембраны. Резюмируя, можно сказать, что все типы антиоксидантных соединений поглощаются митохондриями под действием мембранного потенциала, и чем длиннее метиленовый мостик, тем больше их адсорбция на фосфолипидном двойном слое.
Пример 5. Антиокислительная эффективность пояснительных соединений, направленно вводимых в митохондрии
Соединения настоящего изобретения также очень эффективны против окислительного стресса. Чтобы измерить антиоксидантную эффективность, оценивают способность антиоксидантных соединений предотвращать пероксидацию липидов в митохондриях, измеренную по накоплению TBARS в митохондриях под действием двухвалентного железа и пероксида водорода (фиг.5).
Чтобы количественно оценить пероксидацию липида, используют пробу TBARS. Митохондрии печени крысы (2 мг протеина/мг) инкубируют в 0,8 мл среды, содержащей 100 мМ KCl, 10 мМ Tris-HCl, pH 7,6 при 37°С, с добавлением либо 10 мМ сукцината и 8 мг/мл ротенона, либо АТР регенерирующей системы из 2,5 мМ АТР, 1 мМ фосфоенолпирувата и 4 Ед./мл пируваткиназы. Затем митохондрии подвергают окислительному стрессу добавлением 50 мМ FeCl2/300 мМ Н2О2 в течение 15 минут при 37°С. После инкубирования добавляют 64 мл 2% (м/о) бутилсодержащего гидрокситолуола в этаноле, а затем 200 мл 35% (о/о) HClO4 и 200 мл 1% (м/о) тиобарбитуровой кислоты. Затем инкубируют образцы в течение 15 минут при 100°С, центрифугируют (5 мин при 12000 × г) и верхний слой переносят в стеклянную пробирку. После добавления 3 мл воды и 3 мл бутан-1-ола образцы центрифугируют и позволяют разделиться двум фазам. Затем анализируют 200 мл пробы органического слоя в флуорометрическом анодном считывающем устройстве (λEx = 515 нм; λEm = 553 нм) для реакционных фрагментов тиобарбитуровой кислоты (TBARS) и сравнивают со стандартной кривой малондиальдегида (MDA), полученной из 0,01-5 мМ 1,1,3,3-тетраэтоксипропана (Kelso, G.F., Porteous, C.M., Coulter, C.V., Hughes, G., Porteous, W.K., Ledgerwood, E.C., Smith, R.A.J. and Mutphy, M.P. (2001) J. Biol. Chem. 276, 4588-4596).
Для митохондрий, возбужденных сукцинатом, фоновый уровень TBARS ничтожный, но он увеличивается до примерно 3,75 ммоль MDA/мг протеина под воздействием окислительного стресса (фиг.5А; сплошные диаграммы). Высокие концентрации (5 мкМ) любого из антиоксидантных соединений в значительной степени предотвращает накопление TBARS, тогда как простой катион ТРМР нет. Это подтверждает тот факт, что именно убихинольная боковая цепочка митохиноновых антиоксидантных соединений ответственна за антиокислительное действие, а никакие неспецифические взаимодействия катиона с митохондриями.
В этих экспериментах сукцинат будет поддерживать мембранный потенциал, чтобы осуществилось поглощение катиоов митохондриями и также обеспечивать переход убихиноновой формы митохиноновых антиоксидантных соединений к активной антиоксидантной убихинольной форме (Kelso, G.F., Porteous, C.M., Coulter, C.V., Hughes, G., Porteous, W.K., Ledgerwood, E.C., Smith, R.A.J. and Mutphy, M.P. (2001) J. Biol. Chem. 276, 4588-4596). Чтобы увидеть, требуется ли восстановление респираторной цепью для антиоксидантной активности митохиноновых антиоксидантных соединений, авторы изобретения инкубировали митохондрии в присутствии АТР и АТР регенерирующей системы. Гидролиз АТР и обращение митохондриальной АТР синтазы приводит к широкой накачке протонов, что увеличивает мембранный потенциал аналогично тому, который генерируется сукцинатом (фиг.5В). Это приведет к такому же поглощению митохинонового антиоксидантного соединения, как и для митохондрий, возбужденных сукцинатом, но в данном случае митохиноновые антиоксидантные соединения больше не будут превращаться в свои активные убихинольные формы по респираторной цепи. Митохиноновые антиоксидантные соединения оказываются неэффективными для предотвращения пероксидации липидов в митохондриях, возбужденных при гидролизе АТР (фиг.5а, белые диаграммы) по сравнению с существенной защитой, наблюдаемой в митохондриях, возбужденных сукцинатом (фиг.5b, черные диаграммы). Поэтому восстановление Митохиноновых антиоксидантных соединений респираторной цепью, а также накопление под действием митохондриального мембранного потенциала необходимы для проявления антиоксидантной активности митохиноновыми антиоксидантными соединениями.
Более низкие уровни пероксидации липида наблюдаются в контрольных образцах митохондрий, возбужденных сукцинатом, по сравнению с митохондриями, возбужденными АТР (фиг.5А). Это обусловлено защитным антиоксидантным действием эндогенного митохондриального фонда Коэнзима Q, который остается восстановленным в присутствии сукцината, но окисляется в присутствии АТР (James, A.M., Smith, R.A. and Murphy, M.P. (2004) Arch. Biochem. Biophys. 423, 47-56; Ernster, I., Forsmark, P. and Nordenbrand, K. (1992) Biofactors 3, 241-8). Резюмируя вышеизложенное, можно сказать, что все митохиноновые антиоксидантные соединения требуют активации респираторной цепью, чтобы быть эффективными антиоксидантами.
Для фиг.5А использовали одну концентрацию 5 пМ для всех митохиноновых антиоксидантных соединений. Чтобы сравнить их относительные антиоксидантные эффективности, авторы изобретения титровали соединения в присутствии сукцината: типичное титрование показано на фиг.5С. Эксперимент предполагает, что антиоксидантная эффективность этих соединений коррелирует с длиной метиленового мостика. Для количественной оценки этого авторы рассчитали величины IC50 для предупреждения пероксидации липидов четырьмя пояснительными митохиноновыми антиоксидантными соединениями (фиг.4D). Эти измерения подтверждают, что порядок антиоксидантной эффективности таков: Митохинон-С15 > Митохинон-С10 > Митохинон-С5 > Митохинон-С3.
Все митохиноновые антиоксидантные соединения накапливаются в митохондриях, приводимых в движение митохондриальным мембранным потенциалом. Для наиболее гидрофобного соединения, Митохинона-С15, этот эффект в значительной степени маскируется экстенсивным связыванием с фосфолипидным двойным слоем. Все соединения являются эффективными антиоксидантами и для стойкой антиоксидантной активности свыше 15 минут все требуют действия респираторной цепи для возвращения антиоксидантного соединения в его активную антиоксидантную форму после детоксикации промежуточных соединений пероксидации липида.
Пример 6. Влияние направленно вводимых в митохондрии антиоксидантных соединений на сердечную гемодинамику и митохондриальную функцию
Влияние введения направленно вводимых в митохондрии антиоксидантных соединений, в частности, Митохинона-С10 и Митохинона-С3, на сердечную деятельность оценивают при использовании перфузионной модели Лангендорфа изолированного сердца. Крыс разделяют по следующим четырем группам введения: контрольная (плацебо), ТРМР (метилтрифенилфосфоний), Митохинон-С10 и Митохинон-С3. После периода лечения крыс гуманно умерщвляют, а извлеченные сердца соединяют с изолированной перфузионной системой Лангендорфа. В этой системе использована ретро-перфузия через аорту для поддержания сердца в процессе измерения сердечной деятельности. Давление в левом желудочке измеряют баллоном в левом желудочке. Также измеряют коронарный поток.
На фиг.6 изображен коронарный поток при давлении в левом желудочке 10 мм Hg для каждой группы лечения. Коронарный поток измеряют в предишемическом состоянии и вновь в момент времени нуль минут, 20 минут, 40 минут и 60 минут с последующей индукцией ишемии. Проводят однонаправленное ANOVA и последующим тестом бонферрони. Значимость в зависимости от предишемического контрольного: *Р<0,05; **Р<0,01; ***Р<0,001. Зависимость значимости от соответствующего контрольного времени: †P<0,05; ††P<0,01; †††P<0,001.
Результаты показывают, что лечение митохиноном-С10 значительно восстанавливает индуцированное ишемией снижение коронарного потока. Митохинон-С3 имеет меньшее, но все же значительное влияние в последних временных точках. Отсутствие какого-либо эффекта при введении ТРМР указывает на то, что это молекула антиоксиданта Митохинона-С10 и Митохинона-С3, а не катион трифенилфосфония, ответственен за эффекты, наблюдаемые для направленно вводимых антиоксидантных соединений.
На фиг.7 показано влияние лечения на диастолическое давление в левом желудочке при 10 мм Hg. Диастолическое давление в левом желудочке измеряют до индуцирования ишемии и вновь в нулевой момент времени, 20 минут, 40 минут и 60 минут с последующим индуцированием ишемии. Статистическим анализом был ANOVA по рядам с последующим тестом Данна. Зависимость значимости от ишемического контрольного: *Р<0,05.
† представляет Р<0,05 через 60 минут после ишемического контроля. Результаты показывают, что лечение Митохиноном-С10 приводит к статистически заметному увеличению диастолического давления в левом желудочке по сравнению с крысами, не прошедшими лечения, восстановлению индуцированного ишемией снижения диастолического давления в левом желудочке. Отсутствие какого-либо эффекта при введении ТРМР указывает на то, что это молекула антиоксиданта Митхинона-С10, а не катион трифенилфосфония, обуславливает эффекты, наблюдаемые в случае направленно вводимых в митохондрии антиоксидантных соединений.
Затем определяли влияние введения Митохинона-С10 и Митохинона-С3 на сердечный ритм. На фиг.8 представлен сердечный ритм для каждой из групп лечения перед ишемией, в нулевой момент, 20 минут, 40 минут и 60 минут после индуцирования ишемии. Представленные результаты представляют собой одностороннюю ANOVA с последующим тестом бонферрони. *** представляет Р<0,001 в сравнении с предишемическим контрольным образцом. †† представляет Р<0,05 в сравнении с соответствующим постишемическим образцом. Результаты показывают, что лечение Митохиноном-С10 приводит к значительному восстановлению индуцированного ишемией снижения сердечного ритма по сравнению с контрольными крысами. Отсутствие какого-либо эффекта при введении ТРМР указывает на то, что именно молекула антиоксиданта Митохинона-С10, а не катион трифенилфосфония ответственен за эффекты, наблюдаемые для направленно вводимых в митохондрии антиоксидантных соединений.
Сердечную деятельность оценивали дополнительно, определяя эффект от введения направленно вводимых в митохондрии антиоксидантных соединений на частоту сокращения и расслабления сердца. На фиг.9А представлена частота сокращений в каждой из четырех групп лечения перед ишемией, в нулевой момент времени, 20 минут, 40 минут и 60 минут с последующим индуцированием ишемии. На фиг.9В представлена частота расслабления в каждой из четырех групп лечения перед ишемией, в нулевой момент времени, 20 минут, 40 минут и 60 минут с последующим индуцированием ишемии. В каждом случае проводили статистический анализ ANOVA по рядам с последующим тестом по Данну. * представляет значимость с Р<0,05 в зависимости от соответствующего пост-ишемического времени для контрольных образцов. †† представляет значимость с Р<0,01 в зависимости от соответствующего пост-ишемического времени для контрольных образцов.
Результаты показывают, что введение Митохинона-С10 имеет статистически значимый эффект, восстанавливая индуцированное ишемией снижение частоты сокращений и расслаблений левого желудочка в сравнении с контрольными крысами.
Вышепредставленные данные ясно показывают положительный эффект от введения направленно вводимых в митохондрии антиоксидантных соединений на сердечную деятельность. Для того, что определить, обусловлены ли наблюдаемые эффекты на сердечную деятельность влиянием направленно вводимых в митохондрии антиоксидантных соединений на функцию митохондрий, оценивали митохондриальную активность в пред- и пост-ишемическом состоянии для каждой группы лечения. На фиг.10А изображена респираторная функция митохондрий, связанная с NAD+, в пред- и пост-ишемическом состоянии для каждой из четырех групп лечения. На фиг.10В представлена респираторная функция, связанная с FAD, в пред- и пост-ишемическом состоянии для каждой из четырех групп лечения. *** представляет значимость с Р<0,001 в зависимости от пред-ишемического состояния контрольных крыс. ††† представляет значимость с Р<0,001 в зависимости от пост-ишемического состояния контрольных крыс.
Эти данные показывают, что Митохинон-С10 имеет статистически значимый положительный эффект на митохондриальную респираторную функцию после ишемии в сравнении с контрольными крысами. Эти результаты подтверждают вывод о том, что эффекты от введения направленно вводимых в митохондрии антиоксидантных соединений на сердечную деятельность обусловлены защитным действием на функцию митохондрий.
Пример 7. Стабильность комплексов Митохинона-С10 с β-циклодекстрином.
В предварительном изучении Митохинона-С10 в виде его бромида установлено, что он деструктирует во времени в твердом состоянии при хранении при 25°С, 50% относительной влажности и 40°С, 75% относительной влажности. Целью настоящего исследования явилось выяснение вопроса о возможности повышения стабильности в твердом состоянии Митохинона-С10 комплексообразованием его с β-циклодекстрином.
Партия Митохинона-С10 №6 и идебенон поставлялись Industrial Research Limited (New Zealand). β-циклодекстрин (партия №70Р225) был закуплен у ISP technologies Inc. NaCl, NaH PU и метанол (HPLC) были закуплены у BDH.
Изучение стабильности в твердом состоянии чистого Митохинона-С10
Образцы Митохинона-С10 (приблизительно 5 мг) аккуратно взвешивают в чистые пузырьки и кондиционируют при 25°С, 50% относительной влажности, 40°С, 75% относительной влажности и 4°С над диоксидом кремния. Пузырьки извлекают через 1, 2, 4, 8, 16, 32 и 64 дня и анализируют на содержание Митохинона-С10 градуированным методом ТСЖХ с использованием Митохинона-С10, хранившегося при -20°С над силикагелем в качестве контрольного.
Получение комплексов Митохинон-С10:β-циклодекстрин
Эти комплексы с различным молярным отношением (бромид Митохинона-С10:β-циклодекстрин 1:1, 1:2 и 1:4) готовят при использовании Митохинона-С10, партия №6.
Получение раствора β-циклодекстрина в воде
β-циклодекстрин (1,1397 г, соответствующий 1,0361 г после введения поправки на содержание влаги) аккуратно взвешивают и растворяют в дважды дистиллированной воде, диспергируя ультразвуком в течение 10 мин. Объем доводят до 100 мл водой.
Получение комплекса Митохинон-С10: β-циклодекстрин (молярное отношение 1:1)
Этанольный раствор бромида Митохинона-С10 (90 мг, соответствует 59,95 мг Митохинона-С10) выпаривают под атмосферой азота на горячей плитке, поддерживаемой при 40-50°С, в течение 8 мин. В стакан добавляют раствор β-циклодекстрина (10 мл) и дважды перегнанную воду (30 мл), затем диспергируют ультразвуком в течение 40 мин.
Получение комплекса Митохинон-С10: β-циклодекстрин (молярное отношение 1:2)
Этанольный раствор бромида Митохинона-С10 (89,8 мг, соответствует 59,82 мг Митохинона-С10) выпаривают под атмосферой азота на горячей плитке, поддерживаемой при 37-45°С, в течение 10 минут, а затем в течение 3 мин при 50°С. В стакан добавляют раствор β-циклодекстрина (20 мл) и дважды перегнанную воду (20 мл) и диспергируют содержимое ультразвуком в течение 30 мин.
Получение комплекса Митохинон-С10: β-циклодекстрин (молярное отношение 1:4)
Этанольный раствор бромида Митохинона-С10 (90 мг, соответствует 59,95 мг Митохинона С-10) выпаривают под атмосферой азота на горячей плитке, поддерживаемой при 37-50°С, в течение 12 мин. В стакан добавляют раствор β-циклодекстрина (40 мл)) и диспергируют содержимое ультразвуком в течение 20 мин.
Все вышеуказанные растворы замораживают и хранят при -18°С в течение ночи. Замороженные растворы размораживают в течение 2 дней с помощью сублимационной сушилки LABCONO. Лиофилизированные растворы хранят при -20°С.
Дифференциальная сканирующая калориметрия сублимированных комплексов Митохинон-С10:β-циклодекстрин
Дифференицальную сканирующую калориметрию (ДСК) трех сублимированных комплексов осуществляют с использованием дифференциального сканирующего калориметра PYRIS-1 фирмы Perkin Elmer. Образец Митохинона-С10 готовят выпариванием этанольного раствора под атмосферой газообразного азота при 35-50°С в течение 10 мин.
Используют алюминиевые кассеты (№0219-0041, поставляемые фирмой Perkin Elmer). Анализ проводят в токе азота. Пустые кассеты используют для получения базовой линии.
Интервал температуры сканирования составляет 50-160°С при начальной температуре, поддерживаемой при 50°С в течение 1 мин., с последующим увеличением до 160°С со скоростью 10°С /мин.
Оценка методом ТСЖХ
Метод ТСЖХ для Митохинона-С10 разработан на основе использования метанола и 0,01М раствора дигидрофосфата натрия (85:15) в качестве подвижной фазы при скорости течения 1 мл/мин и использования UV-VIS детекции при 265 нм. В качестве внутреннего стандарта используют идебенон. Колонкой является колонка типа Prodigy ODS3 100A (Phenomenex) с размером частиц 5 мкм. Позднее этот метод был модифицирован после получения новой колонки. Подвижной фазой, использованной в модифицированном методе, был метанол и 0,01М раствор дигидрофосфата натрия (80:20). Этот метод был утвержден. Перед анализом комплексов Митохинон-С10:β-циклодекстрин было проверено влияние β-циклодекстрина на метод ТСЖХ. Показано, что β-циклодекстрин не влияет на оценку Митохинона-С10 методом ТСЖХ.
Изучение стабильности комплексов Митохинон-С10: β-циклодекстрин
Так как было получено три комплекса Митохинона-С10 с β-циклодекстрином, количество Митохинона-С10 в образцах массой 5 мг в различных комплексах было различным. Для того, чтобы испытывать равные количества Митохиноа-С10 во всех трех комплексах, были взяты различные массы комплексов: 4 мг комплекса 1:1 с содержанием Митохинона-С10 1,473 мг; 6,5 мг комплекса 1:2 с содержанием Митохинона-С10 1,469 мг и 11,5 мг комплекса 1:4 с содержанием Митохинона-С10 1,467 мг, и использованы для исследования стабильности согласно стандартной процедуре (Standard Operating Process).
Объемы воды для ТСЖХ (1,5 мл) добавили в колбу с каждым образцом для полного растворения комплексов Митохинон-С10: β-циклодекстрин. Объемы (50 мкл) этих растворов довели до 1 мл водой. Объемы (100 мкл) этих разбавленных растворов комплексов Метахинон-С10: β-циклодекстрин смешали с 200 мл раствора внутреннего стандарта в метаноле концентрацией 10 мкг/мл. Образцы центрифугировали в течение 10 мин. со скоростью 1000 об/мин и впрыснули 50 мкл верхних слоев в систему ТСЖХ. Стандартную кривую получили при использовании растворов Митохинона-С10 в концентрационном интервале от 2,5 до 120 мкг/мл, содержащих 5 мг/мл растворов β-циклодекстрина.
Все соединения были слегка желто-оранжевого цвета и очень пушистые по внешнему виду. Цвет был неоднороден и был более насыщенным в направлении от дна колб для сублимирования.
Результаты ДСК представлены следующим образом:
Митохинон-С10: При анализе образца чистого Митохинона-С10 пики наблюдали при температуре выше 120°С. Для одного образца Митохинона-С10 наблюдали два заметных пика между 130°С и 140°С. При анализе другого образца, никаких заметных пиков не наблюдали, но небольшие пики наблюдали при температуре выше 120°С. После проведения анализа сосуды были разрезаны и образцы осмотрены. Образцы имели цвет от темно-зеленого до черного в обоих случаях.
β-циклодекстрин: Наблюдали широкий пик в интервале между 70°С и 85°С.
Комплекс Митохинон-С10: β-циклодекстрин (1:1): Никаких заметных пиков не наблюдали. После проведения анализа кювету вскрыли и образец осмотрели. Цвет образца претерпел небольшое изменение до светло-коричневого (незначительное изменение).
Комплекс Митохинон-С10: β-циклодекстрин (1:2): Никаких заметных пиков не наблюдали. После проведения анализа изменения цвета образца не наблюдали.
Комплекс Митохинон-С10: β-циклодекстрин (1:4): Никаких заметных пиков не наблюдали, но очень маленький экзотермический пик прослеживается при 120°С. После проведения анализа никакого изменения цвета образца не наблюдали.
Появление пиков в образце чистого Митохинона-С10 указывает, что в соединении происходят изменения при изменении температуры. Однако, поскольку пиков было много, и образец изменил цвет, это могло произойти вследствие деструкции. При анализе второго образца Митохинона-С10 он дал термограмму, отличающуюся от термограммы первого образца. В случае комплексов не было заметных пиков или какого-либо изменения цвета.
Результаты изучения стабильности в твердом состоянии чистого Митохинона-С10 (партия №3) даны в таблице 2 и на фиг.11.
Стабильность в твердом состоянии Митохинона-С10 (партия №3) в отсутствие света при 40°С, 75% относительной влажности; 25°С, 50% относительной влажности и 5°С над синим силикагелем. Данные представляют среднее значение из двух величин, выраженные в процентах от начального содержания.
Вследствие значительной нестабильности при 25°С, 50% относительной влажности по сравнению со стабильностью при 40°С, 75% относительной влажности изучение стабильности повторили при 25°С, 50% относительной влажности с Митхиноном-С10, партия №4. Второе исследование стабильности провели и в прозрачных и затемненных колбах и результаты представили в таблице 3 и на фиг.12.
Стабильность в твердом состоянии Митохинона-С10 (партия №4) измеряли в отсутствие света при 25°С, 50% относительной влажности. Результаты представляют среднее значение из трех величин, выраженные в процентах от исходного содержания.
В обеих партиях (партиях №3 и 4) Митохинон-С10, поставленный Chemistry Department, показал внезапное падение содержания через 16 дней. Однако для партии №4 деструкция не была так велика в период от 32 до 64 дней по сравнению с партией №3. Также наблюдали, что стабильность Митохинона-С10 не зависит от того, были ли колбы прозрачные или затемненные.
Митохинон-С10, поставленный IRL, был использован для получения комплексов Митохинон-С10: β-циклодекстрин. Митохинон-С10, поставленный IRL, представлял собой красновато-желтый сироп в этиловом спирте. Стабильность комплексов Митохинон-С10: β-циклодекстрин представлена в таблице 4 и на фиг.13, 14 и 15. Вследствие малого количества комплексов Митохинон-С10; β-циклодекстрин, доступных для исследования, нет результатов для 1-го дня и 4-го дня.
Стабильность в твердом состоянии комплексов Митохинон-С10:β-циклодекстрин в отсутствие света при 40°С, 75% относительной влажности; 25°С, 50% относительной влажности и 5°С над синим силикагелем. Результаты представляют средние значения из двух величин, выраженные в процентах.
Результаты показывают, что Митохинон-С10 может эффективно образовывать комплексы с β-циклодекстрином и может быть стабилизирован путем комплексообразования с β-циклодекстрином. Результаты показывают, что Митохинон-С10 в комплексах с β-циклодекстрином 1:1 и 1:2 был стабилен в различных условиях. Результаты также свидетельствуют о том, что стабильность Митохинона-С10 в комплексе 1:4 была ниже, чем стабильность Митохинона-С10 в комплексах с β-циклодекстрином 1:1 и 1:2.
Пример 8. Изучение стабильности мезилата Митохинона-С10
Стабильность раствора мезилата Митохинона-С10
Стабильность раствора мезилата Митохинона-С10 определяли в пяти растворителях; воде; 0,01М HCl, 0,01M NaOH, IPB (pH 7,4) и 50% МеОН при двух температурах 25°С и 40°С, при двух атмосферных условиях, воздухе и азоте, для 125 дней согласно стандартной методике исследования заявителя.
Готовили растворы мезилата Митохинона-С10 (100 мг/мл) в пяти растворителях разбавлением маточного раствора 1 мг/мл мезилата Митохинона-С10 в воде. Растворы (5 мл) поместили в стеклянные пузырьки, продули воздухом или азотом, закрыли и поставили на хранение. Отобрали аликвотные количества (0,25 мл) на 0, 1, 2, 4, 8, 16, 32, 64 и 125 день и методом ТСЖХ определили концентрацию Митохинона-С10.
Результаты представлены в таблице 5. Стабильность мезилата Митохинона-С10 в 0,01М NaOH не включены в данные, поскольку мезилат Митохинона-С10 разлагается в этом растворителе в течение 15 минут. Результаты показывают, что (а) стабильность раствора не зависит от атмосферы над раствором и (b) температура незначительно влияет на стабильность Митохинона-С10 во всех растворителях, за исключением HCl.
Данные представляют собой средние значения их двух величин, выраженные в процентах от величины в нулевой момент времени.
Стабильность раствора мезилата Митохинона-С10 в четырех растворителях также представлена на фиг.16, 17, 18 и 19.
Стабильность в твердом состоянии мезилата Митохинона-С10
Стабильность в твердом состоянии мезилата Митохинона-С10 изучали в отсутствие света в трех различных условиях: 40°С, 75% относительной влажности; 25°С, 50% относительной влажности и 4°С над синим силикагелем, согласно стандартным методикам испытаний заявителя.
Известную массу мезилата Митохинона-С10 помещают в прозрачные стеклянные флаконы и хранят в различных условиях. По два образца отбирают на 1, 2, 4, 8, 16, 32, 64 и 125 день и определяют концентрацию мезилата Митохинона-С10 методом ТСЖХ после растворения образцов в воде. Результаты представлены в таблице 6 и на фиг.20.
Мезилат Митохинона-С10 стабилен (разложение <10%) при 4°С над синим силикагелем в течение 125 дней и при 25°С/50% относительной влажности в течение 60 дней.
Данные представляют собой среднее значение из двух величин, выраженные в процентах от величины в нулевой момент времени.
Пример 9. Изучение стабильности комплекса мезилат Митохинона-С10: β-циклодекстрин (1:2)
Стабильность раствора комплекса мезилат Митохинона-С10 : β-циклодекстрин (1:2)
Стабильность раствора комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) определяют в пяти растворителях: воде, 0,01М HCl, 0,01M NaOH, IPB (pH 7,4) и 50% MeOH при двух температурах 25°С и 40°С, в двух атмосферных условиях, воздухе и азоте, в течение 64 дней согласно стандартным методам испытаний заявителя.
Готовят растворы комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) (100 мг/мл в расчете на мезилат Митохинона-С10) в пяти растворителях разбавлением маточного раствора комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) (1 мг/мл в расчете на мезилат Митохинона-С10) в воде. Растворы (5 мл) помещают в стеклянные пузырьки, продувают воздухом или азотом, закрывают и ставят на хранение. Отбирают аликвотные количества (0,25 мл) на 0, 1, 2, 4, 8, 16, 32, 64 и 125 день и методом ТСЖХ определяют концентрацию.
Результаты представлены в таблице 7 и на фиг.21, 22, 23 и 24. Стабильность комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) в 0,01М NaOH не включена в данные, поскольку комплекс мезилат Митохинона-С10:β-циклодекстрин (1:2) разлагается в этом растворителе в течение 15 минут. Результаты показывают, что (а) стабильность раствора не зависит от атмосферы над раствором и (b) температура значительно влияет на стабильность мезилата Митохинона-С10 в комплексе 1:2 с β-циклодекстрином во всех растворителях, за исключением HCl.
Данные представляют собой среднее из двух величин, выраженные в процентах от величины в нулевой момент времени.
Стабильность в твердом состоянии комплекса мезилат Митохинона-С10 : β-циклодекстрин (1:2)
Стабильность в твердом состоянии комплекса мезилат Митохинона-С10 : β-циклодекстрин (1:2) изучали в отсутствие света в трех различных условиях: 40°С, 75% относительной влажности; 25°С, 50% относительной влажности и 4°С над синим силикагелем, согласно стандартным методикам испытаний заявителя.
Известную массу комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) помещают в прозрачные стеклянные флаконы и хранят в различных условиях. По два образца отбирают на 1, 2, 4, 8, 16, 32, 64 и 125 день и определяют концентрацию комплекса мезилат Митохинона-С10:β-циклодекстрин методом ТСЖХ после растворения образцов в воде. Результаты представлены в таблице 8 и на фиг.25. Результаты показывают, что мезилат Митохинона-С10 стабилен в комплексе мезилат Митохинона-С10:β-циклодекстрин (1:2) при 4°С над синим силикагелем и при 25°С; 50% относительной влажности. При 40°С, 75% относительной влажности, 37% мезилата Митохинона-С10 в комплексе мезилат Митохинона-С10:β-циклодекстрин (1:2) разлагается в процессе хранения в течение 64 дней.
Данные представляют собой среднее значение из двух величин, выраженные в процентах от величины в нулевой момент времени. * означает две сильно различающиеся величины (71,9 и 31,1%).
Пример 10. Изучение стабильности комплекса мезилат Митохинона-С10 : β-циклодекстрин (1:1)
Стабильность в растворе
Стабильность раствора комплекса мезилат Митохинона-С10:β-циклодекстрин (1:1) определяют в пяти растворителях: воде, 0,01М HCl, 0,01M NaOH, IPB (pH 7,4) и 50% MeOH при двух температурах 25°С и 40°С, в двух атмосферных условиях, воздухе и азоте, в течение 64 дней согласно стандартным методам испытаний заявителя.
Готовят растворы комплекса мезилат Митохинона-С10:β-циклодекстрин (1:1) (100 мг/мл в расчете на мезилат Митохинона-С10) в пяти растворителях разбавлением маточного раствора комплекса мезилат Митохинона-С10:β-циклодекстрин (1:1) (1 мг/мл в расчете на мезилат Митохинона-С10) в воде. Растворы (5 мл) помещают в стеклянные пузырьки, продувают воздухом или азотом, закрывают и ставят на хранение. Отбирают аликвотные количества (0,25 мл) на 0, 1, 2, 4, 8, 16, 32, 64 и 125 день и методом ТСЖХ определяют концентрацию.
Результаты представлены в таблице 9 и на фиг.26, 27, 28 и 29. Стабильность комплекса мезилат Митохинона-С10:β-циклодекстрин (1:1) в 0,01М NaOH не включена в данные, поскольку мезилат Митохинона-С10 разлагается в этом растворителе в течение 15 минут. Результаты показывают, что (а) стабильность раствора не зависит от атмосферы над раствором и (b) температура значительно влияет на стабильность мезилата Митохинона-С10 в комплексе 1:1 с β-циклодекстрином в воде и IPB, но не в HCl или 50% MeOH.
Данные представляют собой среднее значение из двух величин, выраженные в процентах от величины в нулевой момент времени.
Стабильность в твердом состоянии
Стабильность в твердом состоянии комплекса мезилат Митохинона-С10 : β-циклодекстрин (1:1) изучали в отсутствие света в трех различных условиях: 40°С, 75% относительной влажности; 25°С, 50% относительной влажности и 4°С над синим силикагелем, согласно стандартным методикам испытаний заявителя.
Известную массу комплекса мезилат Митохинона-С10:β-циклодекстрин (1:1) помещают в прозрачные стеклянные флаконы и хранят в различных условиях. По два образца отбирают на 1, 2, 4, 8, 16, 32, 64 и 125 день и определяют концентрацию мезилата Митохинона-С10 методом ТСЖХ после растворения образцов в воде. Результаты представлены в таблице 10 и на фиг.30. Результаты показывают, что мезилат Митохинона-С10 стабилен при 4°С над синим силикагелем и при 25°С; 50% относительной влажности, но 37% мезилата Митохинона-С10 в комплексе мезилат Митохинона-С10:β-циклодекстрин (1:1) разлагается в процессе хранения в течение 125 дней при 40°С, 75% относительной влажности.
Данные представляют собой среднее значение из двух величин, выраженные в процентах от величины в нулевой момент времени.
Пример 11. Изучение фармакокинетики однократной IV и пероральной дозы комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) в крысах (Р2&P3)
Основываясь на результатах предыдущего фармакокинетического исследования бромида Митохинона-С10 и изучения острой пероральной токсичности комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2), дозы комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) для фармакокинетического исследования составили 50 мг/кг мезилата Митохинона-С10 для пероральной дозы и 10 мг/кг мезилата Митохинона-С10 для IV- кратной дозы.
Десять женских особей крыс линии Wistar (средняя масса приблизительно 236 г) канюлировали трубкой из Silastic в правую яремную вену под галотановой анестезией за 48 часов до эксперимента. Готовили свежий водный раствор комплекса мезилат Митохинона-С10:β-циклодекстрин (1:2) (10 мг/мл в расчете на мезилат Митохинона-С10) и вводили его либо перорально (n=5), либо IV путем (n=5). Отбирали образцы крови (0,2 мл) в момент времени 0, 5, 10, 20, 30, 45, 60, 90, 120, 180, 240, 360, 720 и 1440 (24 часа) минут после IV дозы и в момент времени 0, 15, 30, 60, 90, 120, 150, 180, 240, 300, 420, 540, 720 и 1440 (24 часа) минут после пероральной дозы. Образцы крови центрифугировали и образцы плазмы (0,1 мл) хранили при -20°С в холодильнике. Также собирали образцы мочи и кала за 24 часа.
Концентрацию мезилата Митохинона-С10- в плазме определяли методом ЭПР с использованием ТС/МС (Таблица 12).
Фармакокинетический анализ
Фармакокинетику Митохинона-С10 анализировали методом итерационного невзвешенного нелинейного регрессионного анализа с наименьшими квадратами с использованием MINIM. IV данные совпадали при использовании одно-, двух- и трехкамерных моделей. Модель, дающая наилучшее согласие, была моделью с минимальной величиной согласно информационному критерию Akaike (A.I.C. Akaike's information criterion). Установлено, что кривые зависимости изменения концентрации препарата в плазме во времени после введения препарата наилучшим образом и адекватно соответствуют трехкамерной открытой модели, описываемой следующим уравнением
C = Ae-αt+Be-βt+Ee-γt
в котором С представляет концентрацию препарат в плазме, А, В и Е означают математические коэффициенты, α означает константу скорости распределения в плазме, β означает константу скорости промежуточной фазы (распределения или исключения) и γ означает константу скорости конечной фазы и более медленным исключением. Полупериод исключения препарата (tЅ) на конечной фазе рассчитывали как tЅ=0,693/γ. Данные по пероральному введению (после 4 ч) согласуются с однокамерной моделью. Концентрационный пик (Cmax) и время достижения Cmax (tmax) получили непосредственно по кривой изменения концентрации во времени. Площадь под кривой изменения концентрации во времени (AUC) оценивали с использованием линейной формулы трапеций с экстраполяцией от последней измеренной концентрации до бесконечности, определенной с использованием константы скорости конечного исключения (γ). Общие клиренсы плазмы после внутривенного (CL) и перорального (CL/F) ведения оценивали как CL = доза/AUC. Объемы распределения рассчитывали как Vβ = доза / (AUC·β) и Vγ = доза/(AUC·γ). Абсолютную биодоступность (F) рассчитывали как F = AUCpo x дозаiv/AUCiv x Дозаpo. Среднее время нахождения (MRT - mean residence time) рассчитывали как AUMC/AUC. Кажущийся объем распределения в стационарном состоянии (Vss) рассчитывали как дозаiv x AUMC/(AUC)2.
Результаты и обсуждение
Кривые изменения средней концентрации мезилата Митохинона-С10 в плазме во времени после IV и перорального введения комплекса мезилат Митохинона-С10 : β-циклодекстрин (1:2) показаны на фиг.31, а средние фармакокинетические параметры перечислены в таблице 11. Данные по исходному содержанию мезилата Митохинона приложены (таблица 12).
После IV введения наступает фаза очень быстрого распределения с последующей фазой более медленного распределения или исходной фазой исключения с последующей фазой пролонгированного исключения в момент времени прибл. 4 ч. Зависимость изменения концентрации Митохинона-С10 во времени удовлетворяет трехкамерной модели с конечным полупериодом 1,8 ч, хотя полупериод, рассчитанный по данным дозы после 4 ч составляет 14,3 ч (таблица 13).
После перорального введения абсорбция Митохинона-С10 из ЖКТ крыс была быстрой. Пиковая концентрация Митохинона-С10 в плазме наблюдается в пределах 1 ч после перорального введения, а затем медленно падает во времени с полупериодом исключения, рассчитанным по данным после 4 ч, примерно 14 ч.
Установленная величина F составляет 12,4%.
Таблица 13
Фармакокинетика IV (P2) и пероральной (Р3) доз комплекса мезилат Митохинона-С10:β-циклодекстрин
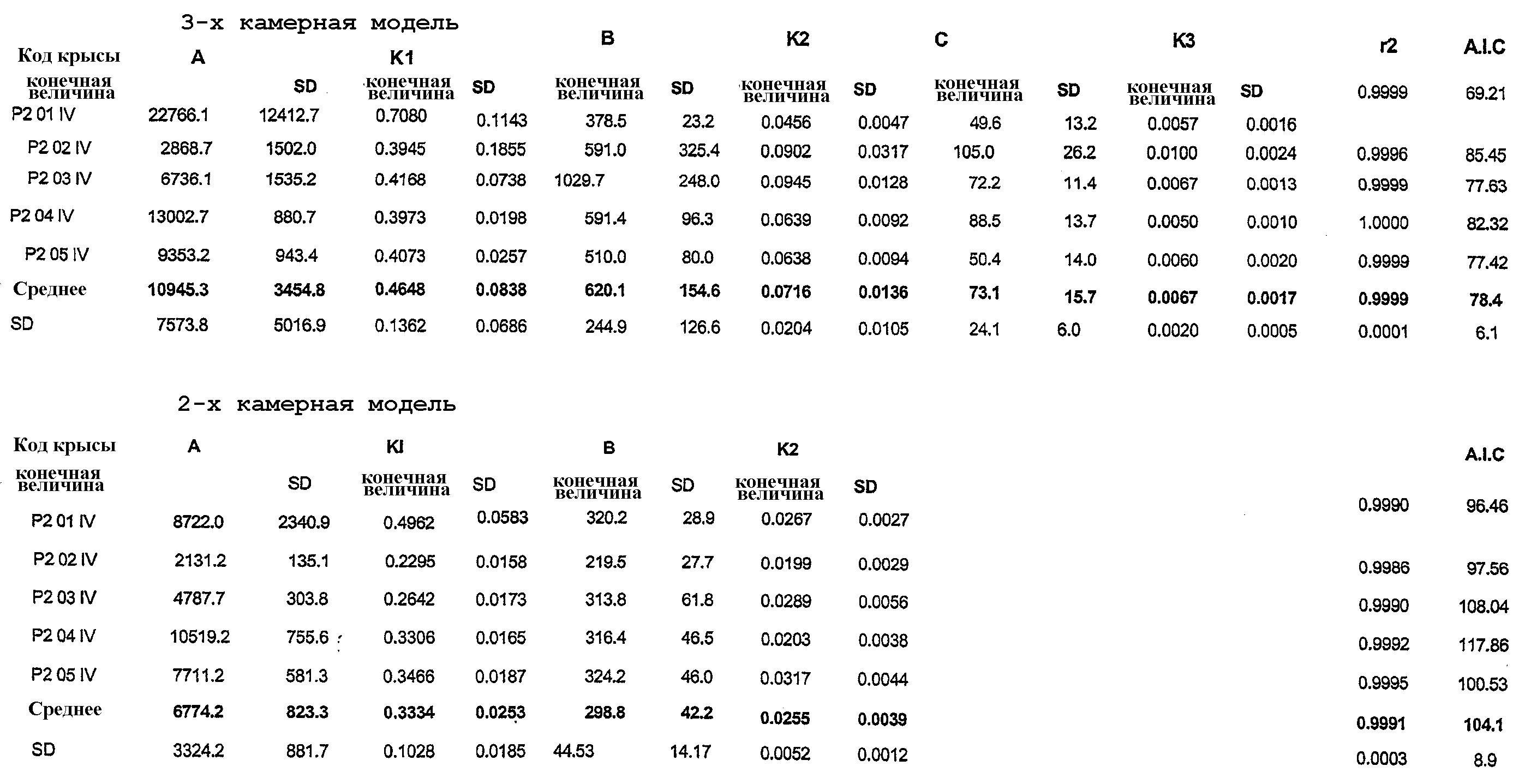
Все патенты, публикации, научные статьи и другие документы и материалы, на которые даны ссылки или которые упомянуты в описании, указывают на уровень специалистов в данной области, к которой относится изобретение, и каждый такой упомянутый документ и материал включен в описание в качестве ссылки в той степени полноты, как если бы он был включен в качестве ссылки отдельно полностью или изложен в описании во всей полноте. Заявители оставляют за собой право физически включать в данное описание любой или все материалы и информацию из любого такого патента, публикаций, научных статей, веб-сайтов, информации доступной с помощью электронных средств, и других ссылочных материалов или документов.
Конкретные способы и композиции, описанные в заявке, являются пояснительными для различных вариантов осуществления или предпочтительными вариантами осуществления и являются только примерами и не предназначены ограничивать объем притязаний изобретения. Другие цели, аспекты, примеры и варианты осуществления будут ясны специалистам в данной области при рассмотрении настоящего описания и охватываются существом изобретения, как определено объемом притязаний формулы изобретения. Специалистам в данной области будет понятно, что различные замены и модификации могут быть осуществлены в описанном изобретении без отклонения от объема притязаний и существа изобретения. Изобретение, иллюстративно описанное в настоящем описании, в подходящем варианте может быть осуществлено в отсутствие любого элемента или элементов, ограничения или ограничений, которые конкретно не раскрыты в описании как основные. Таким образом, например, в каждом случае вариантов осуществления и примеров настоящего изобретения любой из терминов “включающий”, “состоящий по существу” или “состоящий из” может быть заменен любым из двух других терминов в описании. Кроме того, термины “содержащий”, “включающий”, “состоящий” и т.п. следует читать в расширенном смысле и без ограничений. Способы и процессы, иллюстративно описанные в настоящем описании, подходящим образом могут быть осуществлены с различным порядком стадий, и они необязательно не ограничены в порядках стадий, указанных в них или в формуле изобретения. Также использованные в описании и прилагаемой формуле изобретения единственные формы артиклей “а”, “an” и “the” охватывают и множественные ссылки, если из контекста не явствует обратное. Таким образом, например, термин “клетка хозяина” включает множество (например, культуру или популяцию) таких клеток хозяина, и т.п. Ни при каких обстоятельствах патент не может быть интерпретирован как ограниченный конкретными примерами, вариантами осуществления или способами, конкретно раскрытыми в нем. Ни при каких обстоятельствах патент не может быть интерпретирован как ограниченный каким-либо утверждением, сделанным экспертизой или любым другим официальным лицом или служащим Патентного и Торгового Ведомства, если такое утверждение конкретно и без квалификации или замечаний не принято в ответе заявителя.
Термины и выражения, которые использованы, даны в смысле описания, а не ограничения, и нет никакого намерения использовать такие термины и выражения, чтобы исключить любой эквивалент отличительных признаков, показанных или описанных, или их части, но принято, что возможны различные модификации в пределах объема притязаний изобретения, как оно заявлено. Таким образом, следует понимать, что хотя настоящее изобретение конкретно раскрыто предпочтительными вариантами его осуществления и возможными отличительными признаками, специалисты в данной области могут прибегнуть к модификациям и изменениям концепции, раскрытой в описании, и такие модификации и изменения рассматриваются как входящие в объем притязаний настоящего изобретения, как определено прилагаемой формулой изобретения.
Изобретение описано широко и в общем. Каждый из более узких фрагментов и субгенерических групп, попадающих в общее существо изобретения, также составляет часть изобретения. Это включает общее описание изобретения, при условии или отрицательном ограничении исключения любого объекта из рода, независимо от того, является или нет исключенный материал конкретно рассмотренным в описании.
Другие варианты осуществления находятся в объеме притязаний формулы изобретения. Кроме того, там, где отличительные признаки или аспекты изобретения описаны в терминах групп Markush, специалистам в данной области будет понятно, что изобретение также описано в терминах любого отдельного члена или подгруппы членов группы Markush.
Соединения настоящего изобретения находят применение в селективной антиокислительной терапии людей с целью предупреждения митохондриального повреждения. Это может быть предупреждение повышенного митохондриального окислительного стресса, связанного с конкретными болезнями, такими как болезнь Паркинсона, или болезней, связанных с митохондриальными мутациями ДНК. Они также могут быть использованы для терапии клеточного транспланта при нейродегенеративных болезнях, для увеличения выживаемости трансплантированных клеток.
Кроме того, эти соединения могут быть использованы как профилактические средства для защиты органов в процессе трансплантации или улучшения ишемически-реперфузионного повреждения, которое случается в процессе оперативного лечения. Соединения настоящего изобретения также могут быть использованы для снижения повреждения клеток после инсульта и сердечного приступа или могут даваться в профилактических целях недоношенным детям, которые склонны к мозговой ишемии. Способы настоящего изобретения имеют многочисленные преимущества по сравнению с существующими в настоящее время антиоксидантными терапиями - они обеспечивают направленное накопление антиоксидантов в митохондриях, части клеток, находящейся под самым большим окислительным стрессом. Это в значительной степени увеличит эффективность антиоксидантных терапий.
Специалисты в данной области поймут, что представленное выше описание дано только на примерах и что различные комбинации липофильный катион/антиоксидант могут быть использованы без отклонения от объема притязаний изобретения.
Реферат
Изобретение относится к новому химически стабильному антиоксидантному соединению, содержащему липофильный катионный фрагмент, связанный соединяющим фрагментом с молекулой антиоксиданта, и анионный компонент для указанного катионного фрагмента, где антиоксидантное соединение представляет собой митохинон, выбранный из: 10-(6'-убихинонил)пропилтрифенилфосфония, 10-(6'-убихинонил)пентилтрифенилфосфония, 10-(6'-убихинонил)децилтрифенилфосфония и 10-(6'-убихинонил)пентадецилтрифенилфосфония, имеющий общую формулу I:или его хинольную форму, где R, Rи Rпредставляют собой СН, атом С в (С)является насыщенным и n означает 3, 5, 10 или 15, Z означает анионный компонент, который выбирают из группы, состоящей из метансульфоната и этансульфоната. Изобретение также относится к фармацевтической композиции для снижения окислительного стресса в клетке, содержащей указанное соединение и возможно содержащей β-циклодекстрин, к способу снижения окислительного стресса в клетке и к способу получения антиоксидантного соединения. 9 н. и 16 з.п. ф-лы, 31 ил., 13 табл., 11 пр.
Формула
липофильный катионный фрагмент, связанный соединяющим фрагментом с молекулой антиоксиданта; и
анионный компонент для указанного катионного фрагмента,
где антиоксидантное соединение представляет собой митохинон, выбранный из
10-(6'-убихинонил)пропилтрифенилфосфония,
10-(6'-убихинонил)пентилтрифенилфосфония,
10-(6'-убихинонил)децилтрифенилфосфония, и
10-(6'-убихинонил)пентадецилтрифенилфосфония, имеющее общую формулу I
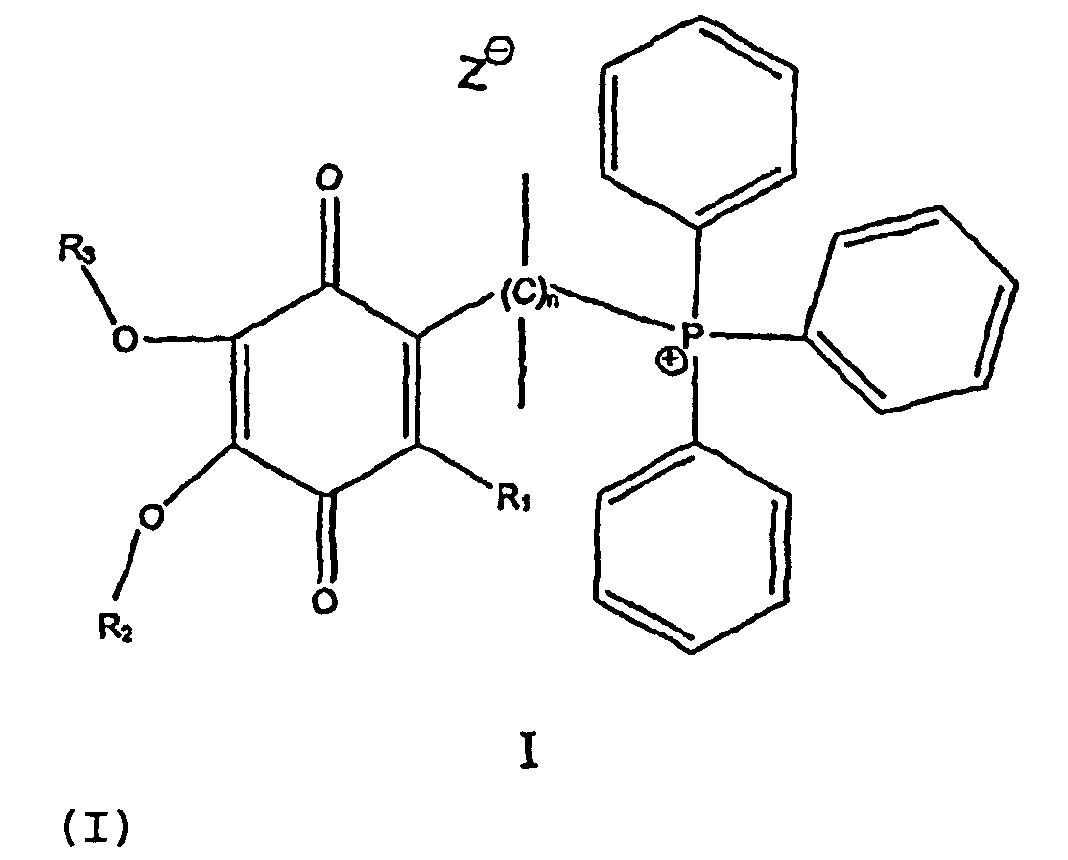
или его хинольную форму, где R1, R2 и R3 представляют собой СН3, атом С в (С)n является насыщенным и n означает 3, 5, 10 или 15, и Z означает анионный компонент, который выбирают из группы, состоящей из метансульфоната и этансульфоната.
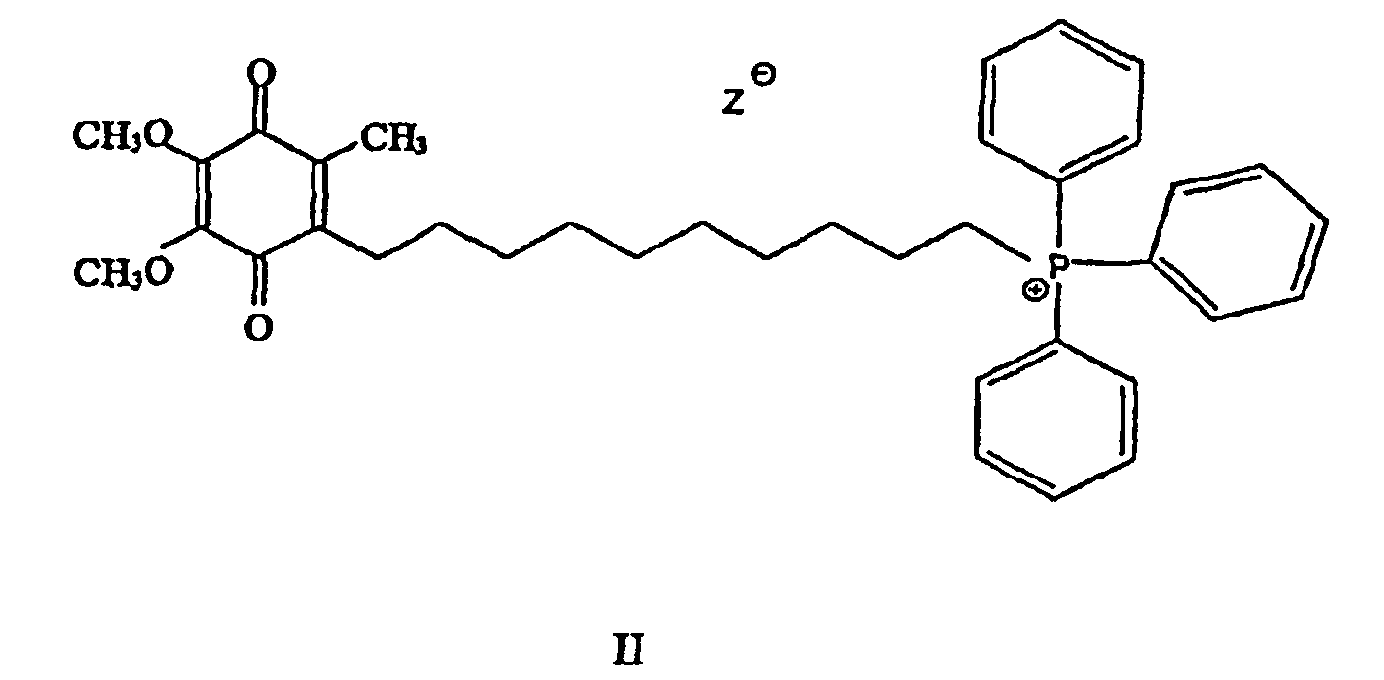
и/или его хинольная форма, где Z является анионным компонентом, выбранным из группы, состоящей из метансульфоната и этансульфоната.
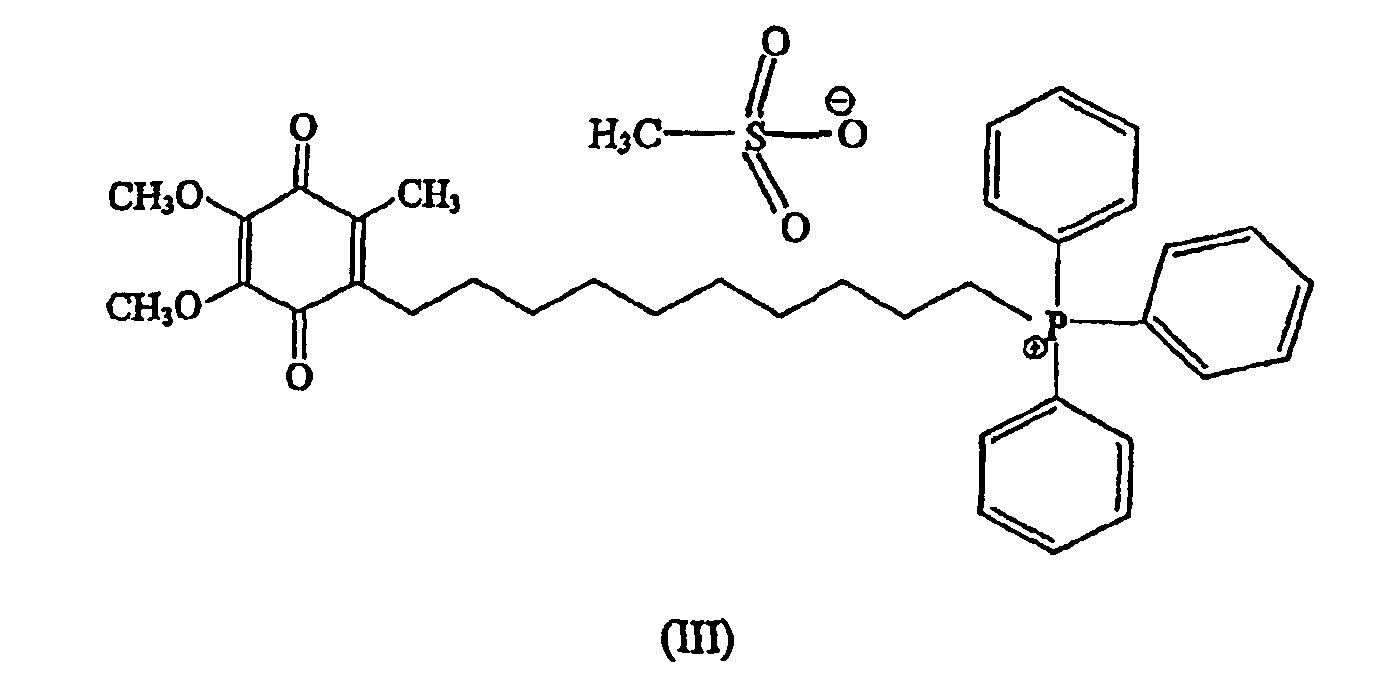
и/или его хинольная форма.

и/или его хинольная форма.
контактирование митохондрии с химически стабильным антиоксидантным соединением по пп.1, 2 или 4, тем самым снижая окислительный стресс в клетке.
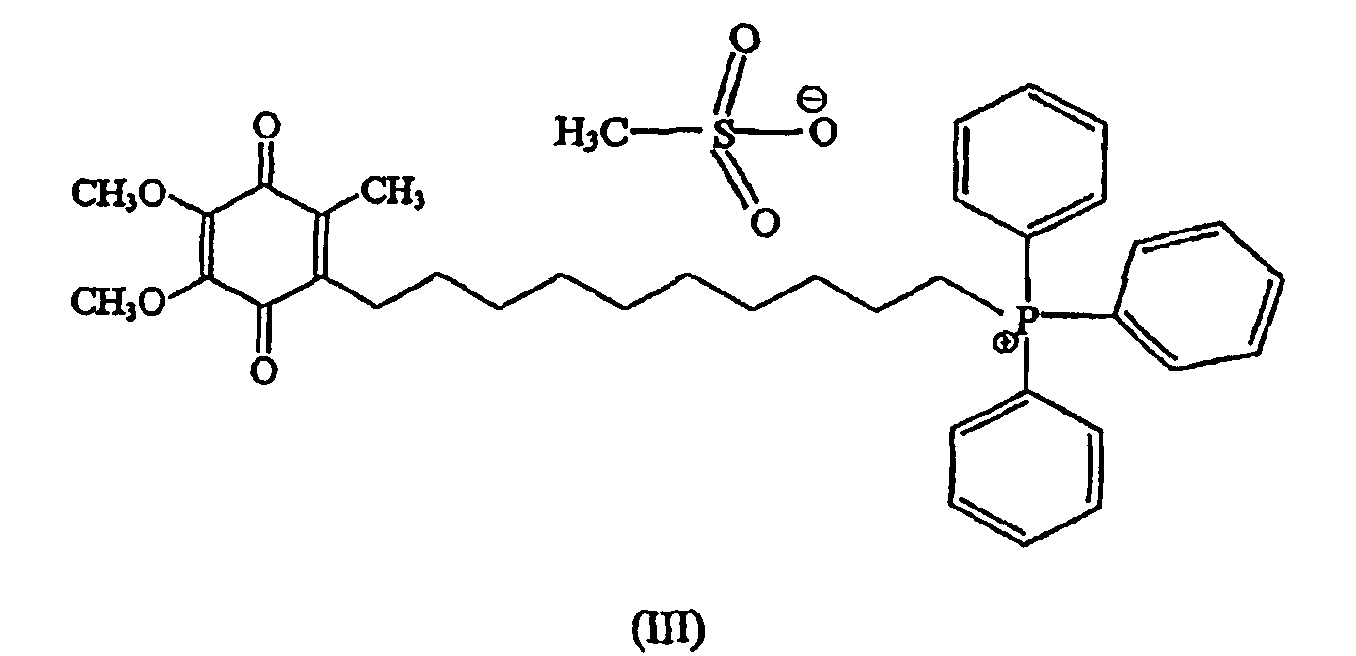
и/или его хинольной формой.
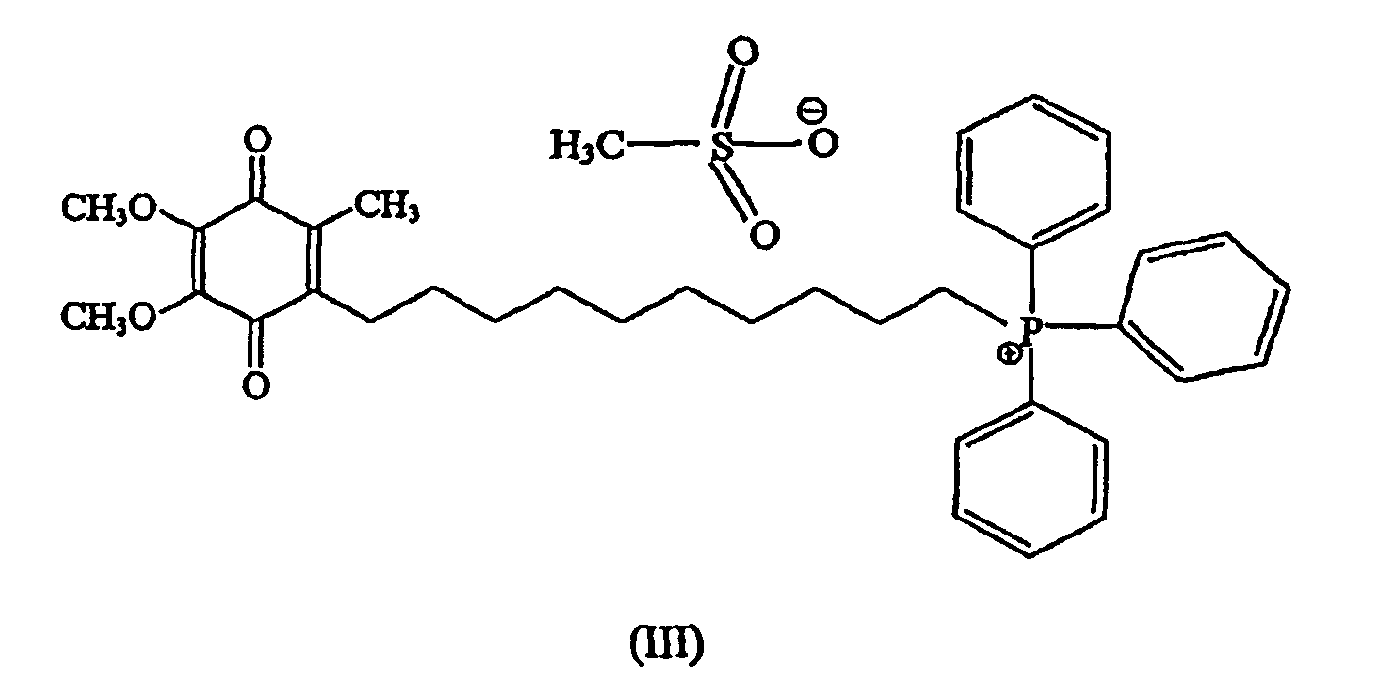
и/или его хинольная форма, включающий реакцию идебенонмезилата с трифенилфосфином.
(a) добавления триэтиламина к раствору идебенона для получения смеси идебенона и триэтиламина;
(b) охлаждения смеси идебенона и триэтиламина стадии (а); и
(c) взаимодействия смеси идебенона и триэтиламина с раствором метансульфонилхлорида для получения идебенонмезилата.
(i) стадия (а), где добавление триэтиламина предусматривает добавление молярного избытка триэтиламина по отношению к идебенону,
(ii) стадия (b), где охлаждение предусматривает охлаждение до 10±3°С, и
(iii) стадия (с), где взаимодействие подразумевает взаимодействие при примерно 10-15°С.

Комментарии