Способ получения препарата на основе магнитных наночастиц (мнч) оксида железа для мрт-диагностики новообразований - RU2659949C1
Код документа: RU2659949C1
Чертежи
Описание
Область техники
Изобретение относится к химии, в частности к способу получения магнитных наночастиц оксида железа, которые могут быть использованы в медицине в качестве контрастного агента при проведении магнитно-резонансного томографического (МРТ) исследования, в т.ч. для новообразований различной природы
Уровень техники
Для более точной диагностики различных отклонений от нормы с помощью МРТ широко применяются различные контрастные агенты, которые можно разделить на два основных класса, первый из которых включает Т1-контрастные агенты, представленные парамагнитными ионами металлов, содержащими большое количество неспаренных электронов (Gd3+, Eu3+, Cr3+, Mn2+, Fe3+), а второй - Т2-контрастные агенты, представленные магнитными наночастицами оксида железа, стабилизированными различными биосовместимыми покрытиями.
Заявляемое изобретение направлено на получение магнитных наночастиц (МНЧ) оксида железа и Т2-контрастного препарата на их основе, стабилизированных человеческим сывороточным альбумином (ЧСА) и/или бычьим сывороточным альбумином (БСА) с размером наночастиц (или глобул) до 50 нм. Т2-контрастные агенты являются негативными контрастами - их накопление понижает интенсивность сигнала на режимах, взвешенных по однородности магнитного поля при МРТ-исследовании. Существенным является тот факт, что Т2-контрастные агенты, обладая на порядки более высоким значением магнитной восприимчивости за счет входящих в их состав нанокристаллов оксида железа, имеют Т2-релаксивность в 50-100 раз более высокую, чем Т1-контрастные агенты, что снижает необходимую дозу для эффективного контрастирования.
На сегодняшний день основными методами получения магнитных наночастиц являются термическое разложение металлорганических прекурсоров в высококипящих органических растворителях в присутствии поверхностно активных веществ (ПАВ) (метод 1 - А.Н. Lu, E.L. Salabas, F. Schuth, Magnetic nanoparticles: Synthesis, protection, functionalization, and application, Angew. Chemie - Int. Ed. 46 (2007) 1222-1244. doi:10.1002/anie.200602866.) и соосаждение солей металлов в стехиометрических соотношениях (метод 2 - А.К. Gupta, М. Gupta, Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications, Biomaterials. 26 (2005) 3995-4021. doi:10.1016/j.biomaterials.2004.10.012). Метод 1 позволяет получать монодисперсные наночастицы, однако введение ПАВ делает полученные наночастицы гидрофобными, что препятствует их растворению в водной среде и не позволяет использовать для введения в организм. Метод 2 позволяет получать гидрофильные наночастицы, однако особенность метода заключается в получении смеси гетерогенных по размерам наночастиц, что не позволяет использовать их в дальнейшем из-за непостоянства состава и распределения по размерам.
Существуют также другие методы, такие как пиролиз, микроволновый синтез, сонохимический синтез, однако они не позволяют получать наночастицы оксида железа с требуемыми свойствами, пригодными для применения в МРТ-диагностике.
При использовании магнитных наночастиц в клинической практике в состав препаратов на их основе вводят биосовместимые, нетоксичные, биоразлагаемые компоненты для придания препарату стабильности и уменьшения токсичности.
Из уровня техники известен препарат Resovist®, производства компании Bayer Schering Pharma AG, представляющий собой магнитные наночастицы, покрытые декстраном размером более 100 нм.
Однако для этого препарата характерны очень короткие времена циркуляции в кровотоке (2-5 мин), связанные с размером наночастиц более 100 нм, а также накопление только в печени, что существенно ограничивает его применение в диагностике опухолевых заболеваний других органов.
Из уровня техники известны также магнитный нанокомпозит для контрастного агента, контрастный агент и агент для доставки лекарственного средства для диагностики и лечения (заявка на изобретение US 20130045160 A1 от 17.04.2013). В данном источнике представлено описание покрытия наночастиц амфифильными соединениями, в том числе альбумином, с получением магнитного нанокомпозита, состоящего из одной или нескольких магнитных наночастиц, распределенных в гидрофобном домене амфифильного соединения, и оболочку, содержащую гидрофильный домен амфифильного соединения, при этом гидрофобный домен связан с поверхностью магнитных наночастиц посредством физической связи, а не химической.
Недостатком является тот факт, что физические связи на порядки более слабые, чем химические, что приводит к нестабильности данных покрытий. Кроме того, при попадании в кровь, в случае физической иммобилизации за счет гидрофобных взаимодействий, оболочка амфифильного соединения будет замещаться белками плазмы крови, а сами амфифильные полимеры могут также сорбироваться на поверхности клеток крови, что приведет к изменению фармакокинетики препарата и ухудшению его доставки в опухолевый очаг.
Из уровня техники также известно решение, представленное в заявке на изобретение US 20080206146 A1 от 09.11.2007, описывающее магнитные наночастицы, способ их получения и использования. В документе раскрыты магнитные наночастицы, содержащие функциональную группу, обеспечивающую дифференциальное связывание с тканью головного мозга, сосудов и костной тканью, предназначенные для использования в качестве диагностического средства в МРТ-исследованиях и в качестве средства доставки лекарственного средства. Функционализированная магнитная наночастица инкапсулирована в матрицу из альбумина. Инкапсулирование в альбумин включает следующие стадии: 200 мг человеческого сывороточного альбумина (ЧСА) растворяют в 2,0 мл воды, содержащей магнитные наночастицы (MNP, например, частицы магнетита). Ph раствора повышают до 8,4 при постоянном перемешивании путем добавления по каплям 0,01 М и 0,1 М раствора NaOH. Затем при постоянном перемешивании по каплям добавляют 8,0 мл этанола, получая таким образом 10% раствор ЧСА. После добавления этанола добавляют 235 мкл 8% раствора глутаральдегида. Через 24 часа полученные наночастицы очищают путем трехкратного центрифугирования (16,100 g, 8 мин) и повторного ресуспендирования в воде в ванне с ультразвуком. Функционализированные магнитные наночастицы, покрытые ЧСА имеют средний диаметр от 60 нм до 990 нм в зависимости от рН препарата и используемых частиц.
Однако препарат данных наночастиц отличается существенной полидисперсностью наночастиц (разброс размеров от 60 до 990 нм), что ограничивает его использование в практике, так как наночастицы больших размеров обладают существенно меньшим временем полувыведения, что не позволяет им эффективно доставляться в опухолевый очаг.
Отличием заявляемого решения от известного заключается в использовании термического разложения ацетилацетоната железа для получения монодиспресных магнитных наночастиц с исходным гидродинамическим размером до 20 нм, преимущественно до 12 нм, способных растворяться в воде с последующими иммобилизацией ЧСА/БСА, стабилизацией глутаровым альдегидом и получением препаратов, содержащих МНЧ с гидродинамическим размером частиц менее 50 нм, что позволяет устранить недостатки, характерные для перечисленных аналогов.
Из уровня техники известен способ получения магнитных наночастиц (Hilda T.R. Wiogo, May Lim, Volga Bulmus, Jimmy Yun, and Rose Amal Stabilization of Magnetic Iron Oxide Nanoparticles in Biological Media by Fetal Bovine Serum (FBS) // Langmuir 2011, Vol. 27, №2, P. 843-850.), имеющих карбоксильные группы на поверхности с помощью смешения с фетальной сывороткой теленка. Указано, что подобные частицы имеют средний гидродинамический диаметр 180 нм и сохраняют его в течение 16 ч инкубации в питательной среде RPMI. Также показано, что иммобилизиция белков происходит нековалентно. Однако большой диаметр наночастиц (180 нм) может затруднить их диффузию по кровеносным сосудам к опухоли и тем самым понизить их эффективность в качестве контрастного агента. Нековалентная модификация поверхности может приводить к десорбции покрытия при введении в кровоток и соответственно к потере всех составляющих, закрепленных на покрытии. Кроме того, в данной статье отсутствуют данные о значении Т2-релаксивности, необходимом для оценки эффективности полученного контрастного агента для МРТ-диагностики.
Наиболее близким аналогом предложенного изобретения является контрастное вещество для проведения МРТ-исследования, способ его получения и способ МРТ-диагностики мультиформной глиобластомы (патент на изобретение RU 2530762 от 14.12.2012; Abakumov MA, et al. Nanomedicine. May 2015, Volume 11, Issue 4, pp. 825-833). Согласно указанным публикациям для получения магнитных наночастиц использовали термическое разложение ацетилацетоната железа (III) в бензиловом спирте. Синтез МНЧ проводили в токе инертного газа при постоянном перемешивании реакционной смеси и медленном нагреве до температуры 383 К, после чего выдерживали 1 ч при данной температуре для выпаривания воды из раствора, затем температуру реакционной смеси со скоростью 25 град/ч поднимали до 473 К, что в общей сложности составляет 9 часов, и выдерживали при данной температуре 40 ч. Через 40 ч реакционную смесь медленно охлаждали до комнатной температуры, добавляли 90 мл безводного ацетона и отделяли МНЧ центрифугированием при 2000 g в течение 10 мин Полученный осадок дважды промывали избытком ацетона после чего высушивали на роторном испарителе до полного удаления ацетона. Диаметр полученных наночастиц составлял, согласно данным просвечивающей электронной микроскопии, (14±4) нм. На следующем этапе технологического процесса осуществляли стабилизацию водных коллоидных растворов наночастиц оксида железа, для чего использовали бычий сывороточный альбумин (БСА). Для этого к 10 мг частиц добавляли 5 мл дистиллированной воды и доводили рН до 11 1М раствором NaOH. Затем полученную дисперсию обрабатывали ультразвуком в течение 10 мин и добавляли к ней 40 мг полимера, растворенного в 5 мл воды. Полученную смесь инкубировали 4 ч при комнатной температуре и постоянном перемешивании, затем диализовали против дистиллированной воды и добавляли 500 мкл 1М NaOH, а затем по каплям при перемешивании 2,3 мл 25%-ного водного раствора глутарового альдегида. Полученную смесь инкубировали при перемешивании 15 мин, а затем добавляли 500 мкл 3 М глицина с рН 9,2 для связывания непрореагировавших альдегидных групп. К полученному раствору добавляли 1 мл раствора боргидрида натрия в PBS концентрацией 2 мг/мл. Затем инкубировали 60 мин. Для отделения МНЧ, покрытых БСА (МНЧ-БСА) от избытка белка, раствор НЧ пропускали через целлюлозные центрифужные фильтры с диаметром пор 100 кДа. Затем полученный осадок ресуспендировали в воде и опять подвергали фильтрации. Процедуру повторяли до полного исчезновения белка в промывочной жидкости. Очистку белка от продуктов молекулярной сшивки проводили с помощью гель-фильтрации на носителе Sepharose CL-6B (высота и диаметр колонки 50 и 2,5 см соответственно, скорость потока 0,7 мл/мин). На следующем этапе получали конъюгаты магнитных наночастиц с моноклональными антителами к фактору роста эндотелия сосудов, имеющие гидродинамический диаметр менее 150 нм, которые в дальнейшем использовали в качестве контрастного вещества для МРТ-диагностики мультиформной глиобластомы.
Согласно способу по патенту RU 2530762 МРТ-исследование проводили до и после внутривенного введения полученного контрастного вещества, при этом МРТ-исследование проводят в режиме, обеспечивающем получение взвешенного по магнитной восприимчивости изображения исследуемого участка, а вывод о наличии мультиформной глиобластомы делают по результатам сравнения MP-снимков до и после введения контрастного вещества согласно областям уменьшения яркости изображения на МР-снимках.
Известный способ повышает достоверность и информативность диагностики за счет повышения контрастности областей, соответствующих тканям мультиформной глиобластомы, ее сосудов и очагов неоангиогенеза на MP-снимках. Однако полученные наночастицы обладали гидродинамическим диаметром 92 нм. Таким образом, недостатком описанного метода является невозможность получения наночастиц с покрытием ЧСА размером менее 50 нм из-за использования в технологическом процессе длительного кипячения (в течение 40 ч при температуре 200°С). В процессе кипения происходят процессы химического старения поверхности наночастиц (превращение ОН-групп в оксо-мостики), что приводит к уменьшению числа заряженных групп на поверхности наночастиц, что приводит к ослаблению стабилизации электростатического отталкивания и уменьшению плотности заряда, необходимого для сорбции белка. Кроме того, процессы химического старения приводят к увеличению изначального размера наночастиц, что негативно сказывается на их стабильности при ресуспендировании в водной среде. В целом оба эти процесса приводят к тому, что наночастицы, полученные после длительного нагрева существенно менее стабильны в водной среде склонны к агрегации, при этом агрегация исходных магнитных ядер приводит и к увеличению размеров конечных наночастиц (глобул), уже покрытых ЧСА.
Раскрытие изобретения
Задачей, решаемой в предложенном изобретении, является разработка способа получения магнитных наночастиц, стабилизированных сывороточным альбумином, пригодных для использования в качестве МРТ контрастных агентов для визуализации опухолей.
Техническим результатом изобретения является возможность получения магнитных наночастиц с исходным гидродинамическим размером (до стабилизации ЧСА/БСА) до 20 нм, и наночастиц (глобул), стабилизированных ЧСА/БСА, размером до 50 нм, за счет изменения режима кипячения раствора ацетилацетоната железа (III) в бензиловом спирте при получении первоначальных МНЧ - не более 4 ч. При кипячении более 4 часов происходят необратимые процессы старения на поверхности МНЧ, препятствующие их растворению в воде и сорбции ЧСА на их поверхность.
Препарат, полученный заявляемым способом, обеспечивает повышение эффективности проведения МРТ-исследования новообразований за счет улучшения проникновения препарата в опухолевый очаг при его введении в процессе МРТ. В этом случае становится возможным эффективное проникновение сквозь поры дефектных сосудов опухолевой ткани.
Технический результат изобретения достигается тем, что способ получения препарата для МРТ-диагностики опухолевых заболеваний, включает приготовление раствора ацетилацетоната железа (III) в бензиловом спирте с концентрацией 75-200 г/л с последующим нагревом в токе инертного газа до температуры кипения бензилового спирта в течение 4-8 часов и кипячением раствора от 30 мин до 4 часов с получением суспензии, после чего суспензию охлаждают, промывают полярным органическим растворителем, с получением наночастиц оксида железа Fe3O4, которые затем покрывают человеческим сывороточным альбумином и/или бычьим сывороточным альбумином, и полученное покрытие стабилизируют межмолекулярной сшивкой глутаровым альдегидом.
Для покрытия наночастиц человеческим сывороточным альбумином и/или бычьим сывороточным альбумином наночастицы растворяют в воде с рН 10-11 с получением концентрации 2-8 мг/мл, в полученный раствор добавляют БСА и/или ЧСА в виде водного раствора с концентрацией упомянутых БСА и/или ЧСА 4-16 мг/мл в соотношении 1:1 по объему с последующими диализом полученного раствора.
После стабилизации покрытия межмолекулярной сшивкой дополнительно проводят очистку от побочных продуктов реакции методом ультрафильтрации и стерилизацией путем фильтрации. При этом возможно проведение ультрафильтрации на фильтрах с диаметром пор 100-300 кДа.
В предпочтительном варианте использования изобретения нагрев ведут с постоянной скоростью.
В качестве полярного органического растворителя могут быть использованы водорастворимые алифатические одноатомные спирты, ацетоны, кетоны, нитрилы. При этом в качестве водорастворимого алифатического одноатомного спирта могут быть использованы этиловый спирт, метиловый спирт пропиловый спирт, в качестве кетонов - ацетон, бутанон-2, в качестве нитрилов - ацетонитрил.
Промывку осуществляют до исчезновения следов бензилового спирта. В частном варианте реализации изобретения промывку осуществляют объемами, равными не менее объема суспензии, не менее трех раз. Также промывку можно осуществлять посредством осаждения центрифугированием.
Полученный заявляемым способом препарат может быть представлен в форме раствора или лиофилизата.
Для МРТ-диагностики опухолевых заболеваний проводят МРТ-исследование объекта (человека или животного) до введения препарата в режимах, обладающих Т2 и Т2* взвешенностью, затем осуществляют внутривенное введение препарата в количестве 1-10 мг/кг массы тела объекта по содержанию железа и проведение МРТ-исследования объекта в режимах обладающих Т2 и Т2* взвешенностью в период не позднее 2 часов после введения препарата с последующим сравнением изменения интенсивностей исследуемой области на МРТ-изображениях, полученных до и после ведения препарата. При выявлении гипоинтенсивных областей делают вывод о наличии опухолевого заболевания с определением их границ.
Заявляемый способ позволяет сократить время на получение как непосредственно МНЧ, так и контрастного препарата - МНЧ с альбумином, характеризующегося наличием в нем агрегатов (нч) размером менее 50 нм. Таким образом, обеспечивается упрощение технологии получения контрастного препарата, в т.ч. и за счет исключения стадии гель фильтрации (при сравнении с технологий по прототипу). Заявляемый способ получения контрастного препарата занимает от 6, 5 до 10 часов, известные способы - 46 часов. Кроме того, при сравнении с технологиями других авторов, в их случае, не происходит образование стабильной смеси альбумина с МНЧ за счет химических связей. Преимуществом является также то, что заявляемый препарат выводится через почки в течение нескольких часов после введения, при этом иные препараты накапливаются в печени (Majumdar S, Zoghbi SS, Gore JC. Pharmacokinetics of superparamagnetic iron-oxide MR contrast agents in the rat. Invest Radiol. 1990; 25:771-777), обеспечивая снижение побочных эффектов от введения препарата. Кроме того, заявляемый препарат в течение года стабильно хранится в виде лиофилизата и ресуспендируется с сохранением параметров.
Краткое описание чертежей
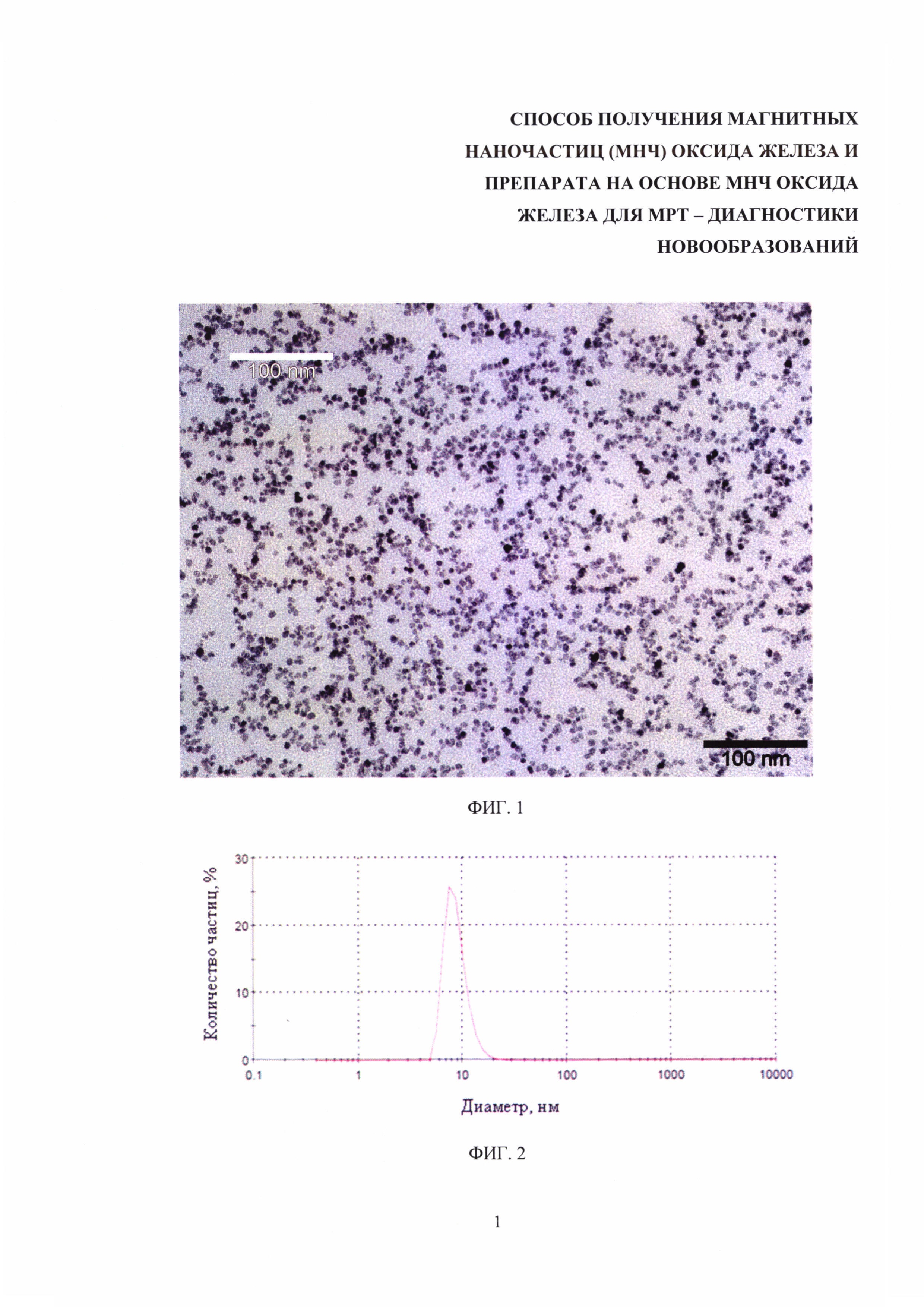
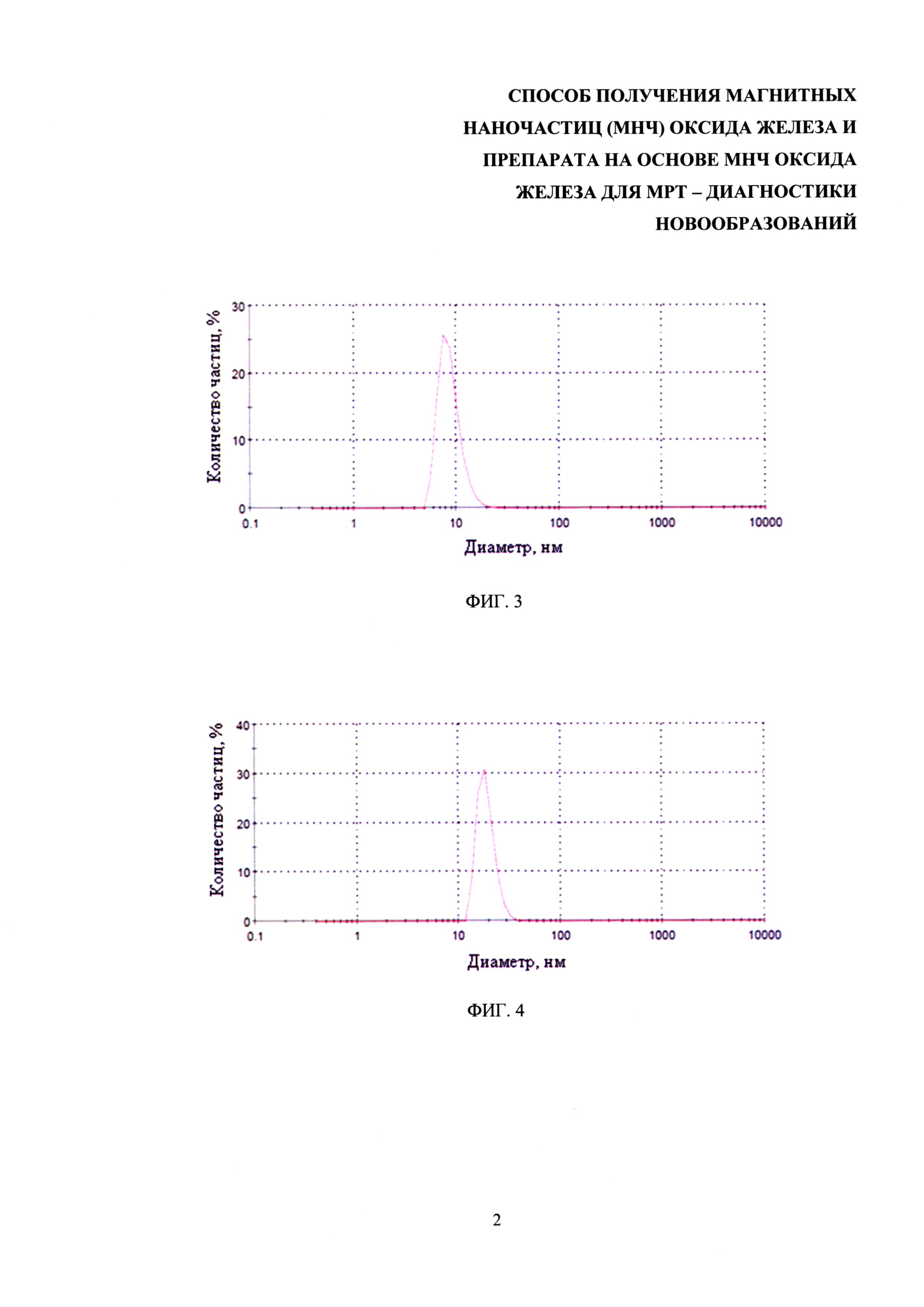
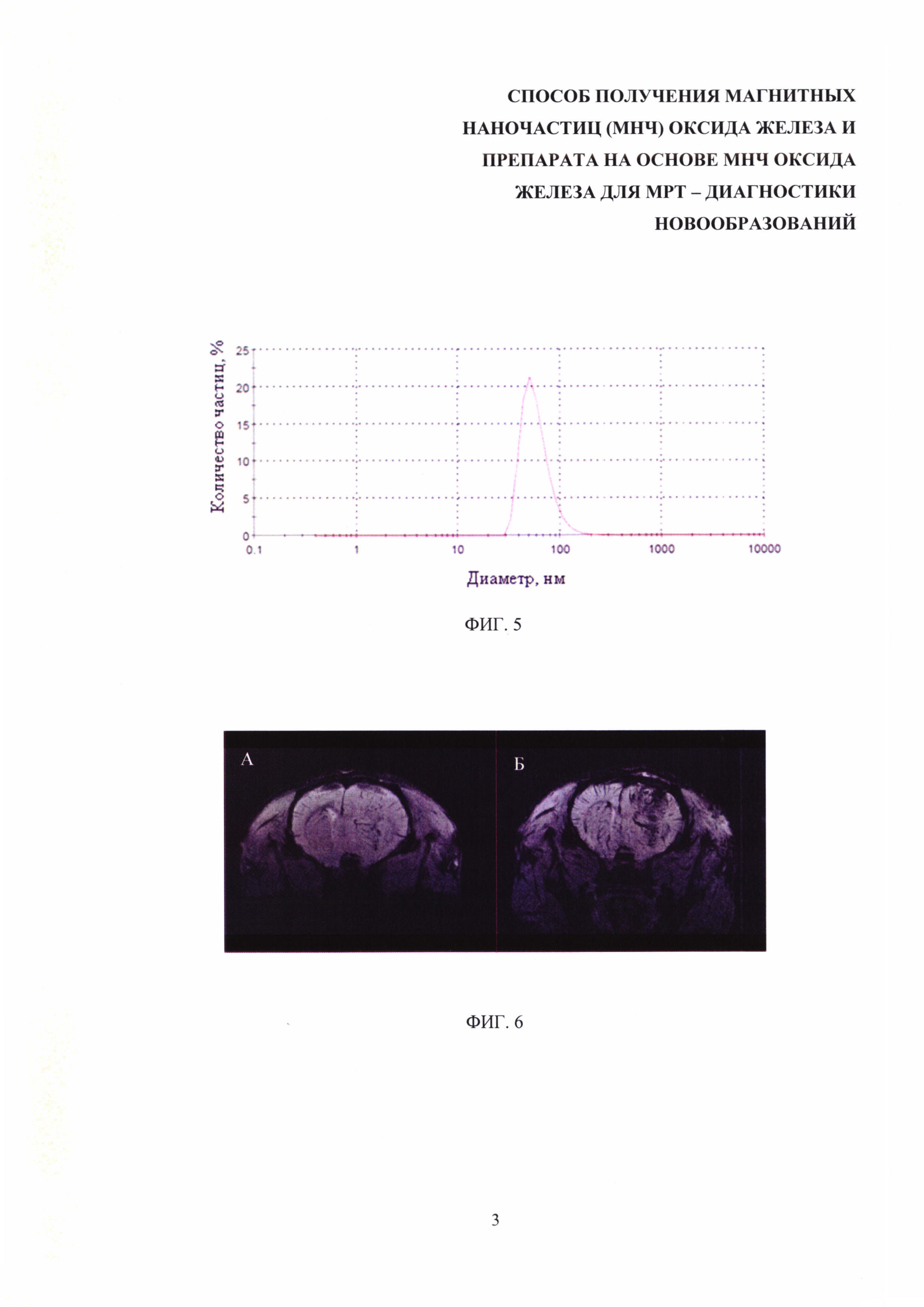
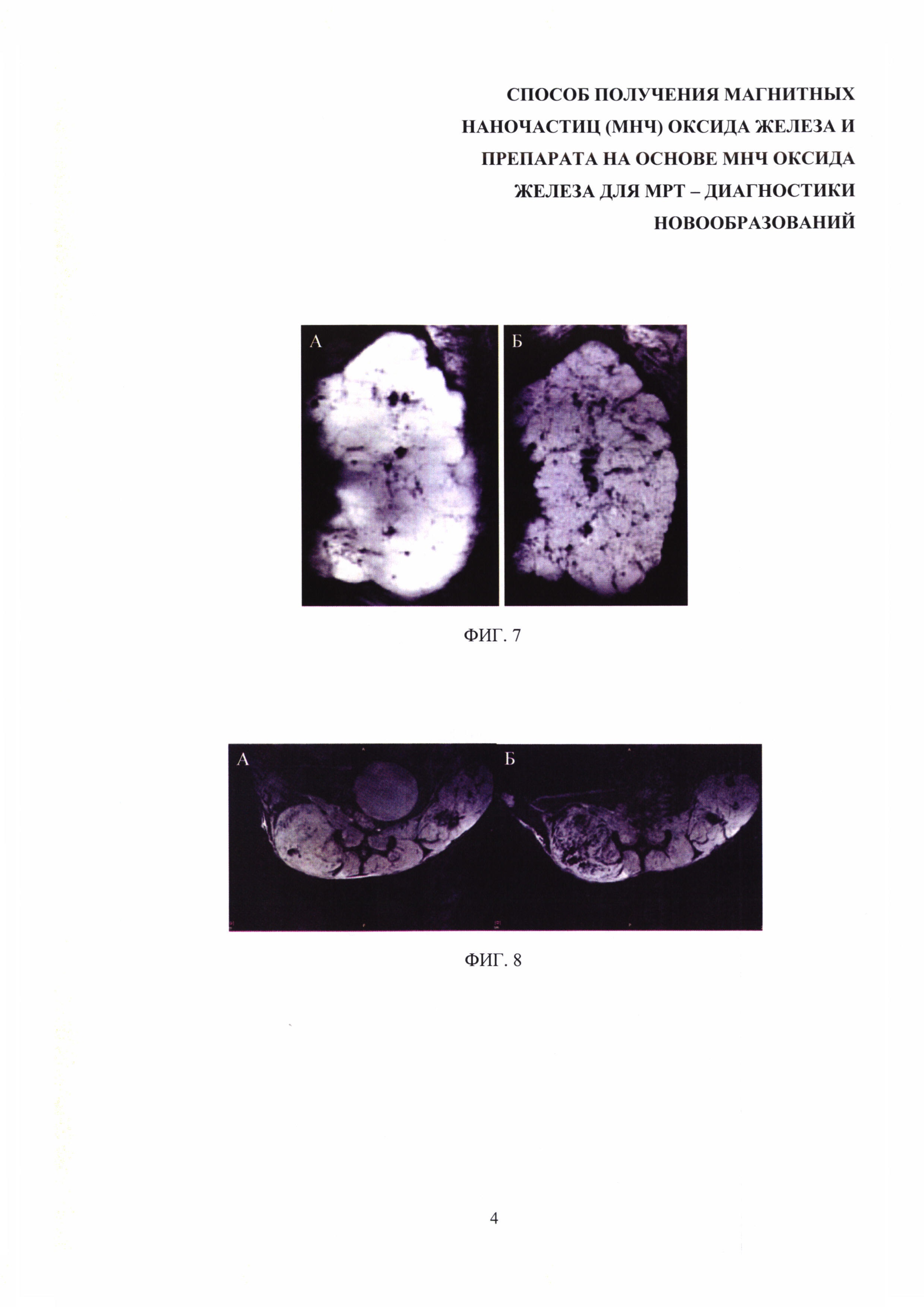
Изобретение поясняется чертежами, где на фиг. 1 представлена микрофотография наночастиц оксида железа, полученных заявляемым способом, при этом микрофотография получена с помощью просвечивающего электронного микроскопа; на фиг. 2 представлены результаты измерения гидродинамических размеров МНЧ, полученных после 30 мин кипячения в бензиловом спирте; на фиг. 3 - результаты измерения гидродинамических размеров МНЧ, полученных после 1 ч кипячения в бензиловом спирте; на фиг. 4 - результаты измерения гидродинамических размеров МНЧ, полученных после 4 ч кипячения в бензиловом спирте; на фиг. 5 - результаты измерения гидродинамических размеров МНЧ, полученных после 20 ч кипячения в бензиловом спирте; на фиг. 6 – МРТ-изображения опухоли головного мозга крысы С6 до (А) и через 5 мин после (Б) введения препарата на основе МНЧ оксида железа, полученного заявляемым способом; на фиг. 7 – МРТ-изображения слизистого рака печени РС-1 до (А) и через 5 мин после (Б) введения препарата на основе МНЧ оксида железа, полученного заявляемым способом; на фиг. 8 – МРТ-изображения аденокарциномы молочной железы мыши до (А) и через 5 мин после (Б) введения препарата на основе МНЧ оксида железа, полученного заявляемым способом.
Осуществление изобретения
Способ получения наночастиц оксида железа Fe3O4 предпочтительно для использования в качестве контрастного вещества в МРТ-диагностике опухолевых заболеваний, осуществляют следующим образом.
Ниже представлено подробное описание осуществления изобретения с указанием конкретных параметров количественного содержания компонентов и параметров процесса получения МНЧ и препарата для МРТ-диагностики, однако данное представление не ограничивает заявляемое изобретение указанными значениями/параметрами, а лишь демонстрирует возможность его реализации с достижением заявленного результата.
Для синтеза приготавливают раствор ацетилацетоната железа (III) в бензиловом спирте с концентрацией 75-200 г/л. Затем нагревают раствор ацетилацетоната железа (III) в бензиловом спирте с концентрацией 75-200 г/л в токе инертного газа до температуры кипения растворителя в течение 4-8 часов, предпочтительно 6 часов и дальнейшего кипячения в течение 30 мин - 4 ч. Реакционную смесь охлаждают до комнатной температуры, центрифугируют для отделения осадка наночастиц от раствора промывают ацетоном/этанолом, или метиловым спиртом, или пропиловым спиртом/ацетонитрилом, и после испарения растворителя получают магнитные наночастицы оксида железа.
Магнитные наночастицы (80±20 мг) помещают в 20 мл дистиллированной воды, добавляют 500 мкл 1 М NaOH для создания щелочной среды и перемешивают раствор до исчезновения осадка. После этого добавляют раствор человеческого сывороточного альбумина/ бычьего сывороточного альбумина (160±50 мг в 20 мл воды). Полученную смесь перемешивают в течение 15 мин, после чего крупные агрегаты частиц удаляют с помощью фильтрования на шприцевых фильтрах с диаметром пор 0,22-0,45 мкм. Затем к смеси добавляют 500-1500 мкл 25% водного раствора глутарового альдегида. Реакционную смесь инкубируют в течение 10-60 мин при постоянном перемешивании, после чего к ней добавляют 0,5-2 мл 3 М раствора глицина и перемешивают еще в течение 30 мин - 2 ч. После этого к реакционной смеси добавляют 0,5-4 мл раствора NaBH4 (10 мг/мл), и инкубируют в течение 30 мин - 4 ч.
Избыток низкомолекулярных веществ и свободных молекул ЧСА удаляют с помощью промывки фосфатно-солевым буфером на центрифужных фильтрах с краем пропускания 100-1000 кДа для глобулярных белков.
Полученные таким образом наночастицы способны растворятся в дистиллированной воде при рН 10-11, а при покрытии человеческим сывороточным альбумином образуют наночастицы, состоящие из кристаллических магнитных ядер оксида железа и оболочки человеческого сывороточного альбумина размером не более 40 нм.
Эксперименты проводят на животных с экспериментальной моделью глиомы или другой опухоли. Для визуализации глиомы животных помещают в MP-томограф и проводят MP сканирование в Т2 или Т2* взвешенном режиме. Затем животному вводят внутривенно раствор МНЧ, стабилизированных ЧСА. Введенная доза МНЧ в пересчете на концентрацию железа составляет 12010 мг/кг. МРТ-сканирование проводили на томографе Clinscan 7Т фирмы Bruker. Затем проводят МРТ-сканирование в Т2 или Т2* взвешенном режиме в течение 0-24 часов после внутривенного введения.
Преимущество использования в МРТ-диагностике наночастиц диаметром менее 50 нм обусловлено тем, что при уменьшении размеров наночастиц (глобул) существенно увеличивается время их циркуляции в крови, что позволяет увеличить эффективность визуализации, не прибегая к увеличению дозы. Кроме того, опухолевые сосуды обладают эффектом повышенной проницаемости и удержания из-за гиперэкспресии проангиогенных факторов, приводящих к ускоренному росту сосудистой сети. При этом поры, возникающие в сосудах, имеют диаметр 50-200 нм, и только наночастицы диаметра меньше 50 нм способны эффективно проникать сквозь такие поры в опухолевую ткань.
Пример 1. Синтез магнитных наночастиц Fe3O4
10,5 г ацетилацетоната железа (III) и 220 мл бензилового спирта нагревают при перемешивании в стеклянной колбе до температуры 50-70°С в течение 1 ч. После этого скорость нагревания составляет 25°С/ч. Спустя 30 мин после того, как температура реакционной смеси достигает температуры кипения, нагревание прекращают. К охлажденной до комнатной температуры реакционной смеси добавляли 90 мл ацетона, и осаждали наночастицы центрифугированием при 900g в течение 10 мин.
Пример 2-5. Синтез магнитных наночастиц Fe3O4
Синтез МНЧ проводят по методу, описанному в примере 1, за исключением того, что вместо ацетона добавляют метиловый спирт, этиловый спирт, пропиловый спирт, бутанон-2, ацетонитрил.
Пример 6. Синтез магнитных наночастиц Fe3O4, покрытых БСА/ЧСА
К 20 мг магнитных наночастиц оксида железа добавляют 5 мл дистиллированной воды, доводят рН до 11 и перемешивают вплоть до полного растворения. Затем добавляют 5 мл раствора БСА/ЧСА в воде с концентрацией 8 мг/мл при том же значении рН. Полученную смесь инкубируют 15 минут при комнатной температуре и постоянном перемешивании, затем фильтруют (диаметр пор фильтра 0,2-0,5 мкм). К 20 мл полученного раствора с концентрацией белка и Fe 4 мг/мл и 2 мг/мл соответственно добавляют 250 мкл 1М щелочи, а затем по каплям при перемешивании 230 мкл 25% водного раствора глутарового альдегида. Полученную смесь инкубируют при перемешивании 15 мин, а затем добавляют 250 мкл 3М водного раствора глицина с рН 9,2 и инкубируют 1 ч. Затем к раствору добавляют 332 мкл раствора боргидрида натрия в фосфатно-солевом буфере с концентрацией 10 мг/мл и инкубируют 2 ч, после чего промывают реакционную смесь буфером и измеряют концентрацию железа.
Пример 7. МРТ-визуализация экспериментальной опухоли головного мозга крысы С6
Эксперименты проводят на животных с экспериментальной моделью глиомы С6 другой опухоли. Для визуализации глиомы животных помещают в MP-томограф и проводят MP сканирование в Т2* взвешенном режиме со следующими параметрами: режим SWI: TE/TR=19/50 мс, толщина среза 0,5 мм, FOV=30 мм, разрешение 256/176.
Затем животному вводят внутривенно раствор МНЧ, стабилизированных ЧСА. Введенная доза МНЧ в пересчете на концентрацию железа составляет 5 мг/кг. МРТ-сканирование проводили на томографе Clinscan 7Т фирмы Bruker. Затем в Т2* взвешенном режиме со следующими параметрами: режим SWI: TE/TR=19/50 мс, толщина среза 0,5 мм, FOV=30 мм, разрешение 256/176 через 5 мин после введения препарата МНЧ.
Полученные в ходе проведенных экспериментов НЧ по примерам 1-5 и обладают размером менее 10 нм (фиг. 1)
При увеличении времени кипячения происходит постепенное увеличение размера наночастиц от 7,5 нм до 50 нм (фиг. 2-5).
Кроме того, при введении МНЧ животным, несущим экспериментальные опухоли и проведении МРТ-сканирования удается визуализировать несколько типов опухолей, в частности глиобластому головного мозга крысы С6, слизистый рак печени РС-1, аденокарциному молочной железы мыши 4Т1 (фиг. 6-8).
Реферат
Изобретение относится к химико-фармацевтической промышленности и представляет собой способ получения препарата для МРТ-диагностики опухолевых заболеваний, включающий приготовление раствора ацетилацетоната железа (III) в бензиловом спирте с концентрацией 75-200 г/л с последующим нагревом в токе инертного газа до температуры кипения бензилового спирта в течение 4-8 часов и кипячением раствора от 30 мин до 4 часов с получением суспензии, после чего суспензию охлаждают, промывают полярным органическим растворителем с получением наночастиц оксида железа FeO, которые затем покрывают человеческим сывороточным альбумином и/или бычьим сывороточным альбумином, и полученное покрытие стабилизируют межмолекулярной сшивкой глутаровым альдегидом. Изобретение обеспечивает получение магнитных наночастиц с исходным гидродинамическим размером (до стабилизации ЧСА/БСА) до 20 нм, и наночастиц, стабилизированных ЧСА/БСА, размером до 50 нм, за счет изменения режима кипячения раствора ацетилацетоната железа (III) в бензиловом спирте при получении первоначальных магнитных наночастиц. 10 з.п. ф-лы, 8 ил., 7 пр.

Комментарии