Способ получения композита окисленного глутатионас cis-диаминодихлорплатиной и фармацевтических композиций на его основе, регулирующих метаболизм, пролиферацию, дифференцировку и механизмы апоптоза нормальных и трансформированных клеток - RU2144374C1
Код документа: RU2144374C1
Чертежи














Описание
Изобретение относится к медицине, в частности к фармакологии, а именно к способам получения лекарственных средств на основе активных метаболитов пептидной природы, которые могут быть использованы в клинической практике для профилактики и лечения различных патологических синдромов и заболеваний посредством дифференцированного воздействия на процессы метаболизма, пролиферации, дифференцировки и апоптоза нормальных и трансформированных клеток.
Современная фармакоиндустрия невольно способствует геосоциальному масштабированию двух
медико-биологических проблем:
формированию резистентности (привыкания и падения фармакологической эффективности) к лекарственным препаратам, в том числе вследствие активации системы
MDR-генов;
формированию резорбтивных нежелательных эффектов, проявляющихся, в первую очередь, повреждением системы иммунокомпетентных клеток и гемопоэза: кардио-, гепато-, нефро- и
нейротоксичностью.
Основная причина этих негативных явлений - широчайшее применение собственно химиотерапевтических средств, весьма эффективных по своим физико-химическим механизмам, но чужеродных для организма по своей природе. Даже генно-инженерные препараты, несмотря на использование генов (ДНК) человека, в качестве матрицы для тиражирования используют одноклеточные организмы (кишечная палочка, дрожжевые клетки), которые вносят свой, следовательно, чужеродный вклад в нарабатываемые таким образом лекарственные препараты.
Поэтому теоретическая и практическая медицина все чаще и настойчивее обращает свой взор в сторону естественных ключевых метаболитов, то есть клеточных факторов (низкомолекулярных биохимических субстанций), самой природой предназначенных для запуска цепных реакций эндогенной наработки, модификации ряда биологически активных продуктов, следовательно физиологически важных и физиологически адекватных процессов. В ряде случаев подобные биохимические субстанции выступают в роли "биохимических гироскопов", предназначенных для восстановления нарушенного равновесия основополагающих метаболических процессов, например, анаболизма и катаболизма; или пролиферации и дифференцировки. Нарушения данных основополагающих механизмов жизнедеятельности формируют процессы гибели клеток (синдром цитолиза) или превращения их в злокачественные, то есть опухолевые клетки. Ключевые регуляторные метаболиты, своего рода "клеточные гормоны", как правило, являются факторами пептидной природы (обычно не более 3-20 аминокислот). Отсюда, получение синтетических аналогов данных метаболитов (биохимических субстанций), следовательно, препаратов с заранее заданными свойствами является актуальной проблемой, поскольку данные препараты выступают в качестве оптимальных инструментов метаболической терапии и практически не являются чужеродными.
Пептидными структурами, к которым обращаются достаточно активно, являются серосодержащие пептиды и их производные, в первую очередь - это группа тиолов. В частности, известен трипептид восстановленного глутатиона ( γ - глутамил-цистеинил-глицин; далее - GSH), биологические эффекты которого исследуются широчайшим образом.
Известен димер трипептида глутатиона - глутатион окисленный (бис-( γ-L-глутамил)-L-цистинил-бис-глицин) - далее GSSG, в котором две молекулы трипептида с вышеозначенной структурой соединены друг с другом ковалентной дисульфидной связью между цистеиновыми остатками.
Известно, что использование экзогенного синтетического аналога GSSG в опытах in vitro индуцирует синтез цитокинов и гемопоэтических факторов; а в условиях циклофосфановой и радиационной модели иммунодепрессии (опыты in vivo) обеспечивает нормализацию цитокинового профиля, наряду с восстановлением систем иммунитета и кроветворения (международная заявка WO 97/21444).
В свою очередь, лекарственные формы экзогенного GSSG, применяемые при тяжелых иммунодефицитных состояниях и угнетенном костномозговом кроветворении (клинические примеры, приводимые в международной заявке, по больным СПИД; больным с онкопатологией, апластической анемией, и другие) в течение различных сроков применения обеспечивало терапевтический эффект, восстанавливая иммунный статус организма (в том числе показатели противоопухолевого иммунитета); функциональную активность иммуногенеза и кроветворения.
При этом подчеркивается, что названными эффектами обладает именно и только окисленный глутатион (GSSG), то есть пептид с дисульфидной связью.
В международной заявке [1] красной нитью проходит положение о том, что предшествующий уровень техники в области применения биологически-активных веществ тиолового ряда был направлен на обеспечение повышенного уровня восстановленного глутатиона (GSH), т.е. на достижение антиоксидантных эффектов, в то время как в названном выше изобретении заявлялась биолого-медицинская целесообразность безусловно отличающегося фармакологического воздействия, а именно, достижения прооксидантных эффектов и формирования нового уровня редокс-контура в клетках посредством введения в организм GSSG, обладающего прооксидантным потенциалом. Согласно точке зрения авторов, только в этом случае запускаются механизмы индукции редокс-чувствительной экспрессии иммунологически значимых генов, активации метаболизма тиолов в клетках, следовательно, обеспечиваются благоприятные фармакологические свойства, в том числе системные цитопротекторные эффекты и регуляция состояния системы иммунитета в зависимости от ее исходного статуса: или это иммунодефицит, то есть гипореактивность; или это иммуноаутоагрессия, то есть гиперреактивность.
С учетом сказанного о расшифрованных авторами в международной заявке [1] биолого-фармакологических эффектах окисленной формы глутатиона (GSSG), ассоциированных с определенной фармакокинетикой экзогенного аналога GSSG в биологических средах, изобретательский замысел заявки направлен на достижение группы технических и фармацевтически приемлемых решений, которые будут эффективны для предотвращения восстановления GSSG в GSH и, тем самым, пролонгирования существования GSSG в окисленной форме в биологических средах. Достижение биолого-фармакологических эффектов окисленной формы глутатиона подтверждается результатами биомедицинских исследований, полученных в ходе комплексной и широкомасштабной программы доклинических и клинических исследований по изучению эффективности синтетических аналогов GSSG. В этой связи часть пунктов формулы заявки [1] утверждает концептуальную модель создания фармацевтических средств в различных лекарственных формах, содержащих в качестве действующего вещества производные окисленного глутатиона (GSSG) в виде: его солей; или использование композитных препаратов, включая комбинации GSSG с веществами, пролонгирующими или усиливающими действие GSSG или его солей; или производных в качестве новых композиций, то есть формул новых соединений, когда последние получают посредством создания ковалентной связи. При этом впервые было показано, что фармацевтически приемлемые производные GSSG в форме его солей; или комбинации с пролонгаторами пребывания GSSG в окисленной форме; или комбинации GSSG с усилителями/модуляторами, то есть все те технические решения, которые в той или иной степени стабилизируют молекулу GSSG в дисульфидной форме, - значительно эффективнее и целенаправленнее индуцируют продукцию цитокинов и гемопоэтических факторов в нормальных, но, в большей степени и целесообразнее, в патологических условиях.
Более того, лекарственные
формы производных GSSG,
характеризующиеся большей
степенью стабильности молекулы GSSG в дисульфидной форме, обладали новой
фармакокинетикой в биологических средах и проявляли способность:
а) индуцировать продукцию
более широкой палитры
цитокинов и гемопоэтических факторов, что определяло наличие в большей
степени модулирующих, а не только стимулирующих эффектов;
б)
воспроизведения эффектов некоторых
цитокинов, например
IL-2.
Следует подчеркнуть, что авторами впервые установлены [2] уникальные свойства природного окисленного глутатиона (GSSG) стимулировать/модулировать эндогенную продукцию цитокинов и гемопоэтических (в том числе колониестимулирующих, то есть ростовых) факторов. При этом стабилизация указанными фармацевтическими решениями времени пребывания в биологических средах экзогенно введенного GSSG в окисленной форме усиливала эти эффекты. В свою очередь, сегодня общеизвестны события, которые развиваются в клетках (тканях и, следовательно, в органах) после взаимодействия с цитокинами. Они обусловлены универсальным влиянием цитокинов на основные сигнал-передающие системы и через них на геном клеток, что определяет регулирующие эффекты цитокинов на пролиферацию, дифференцировку и апоптоз.
Сказанное определяет существование научной проблемы, заключающейся в создании новых фармацевтически приемлемых соединений с заранее заданными свойствами на основе GSSG со стабилизированной дисульфидной связью.
Известны способы получения димера трипептида глутатиона, то есть окисленного глутатиона - GSSG, из его предшественника, восстановленного глутатиона (GSH).
В настоящее время существуют три основных метода окисления восстановленной формы глутатиона. Во-первых, известно, что реакция окисления достаточно лабильных мepкaпто-SH-групп цистеина в молекуле глутатиона [3] окисляется уже такими мягкими окислителями как кислород воздуха [4, 5]. Однако скорость реакции в данном случае низкая и для количественного выхода требуется очень продолжительное время (многие сутки). Катализ ионами тяжелых металлов, и особенно токсичной меди, создает существенные трудности для получения чистого фармацевтического препарата.
Вторым изученным методом считается использование более мощных окислителей, например, таких как перекись водорода, йод, ферроцианид калия и др. [6, 7] . Реакции в этих случаях проходят значительно быстрее (от десятков минут до нескольких часов), однако их общим существенным недостатком является трудно контролируемые реакционные условия, что приводит к значительному загрязнению целевого вещества продуктами окисления, то есть производными соответствующих кислот. Это вызывает необходимость подключения дополнительных, иногда достаточно трудоемких, средств очистки, что резко удорожает процесс.
К третьей группе методов следует отнести использование в качестве окислителей газообразных веществ (окислы азота), сульфоксидов и других соединений, среди которых можно найти достаточно редкие и абсолютно неприемлемые для масштабирования [8, 9].
Все эти методы не дают повышения выхода целевого продукта по сравнению с ранее изложенными, в то же время их применение сопровождается дополнительными трудностями как с точки зрения технологии и безопасности, как в случае с окислами азота, или с труднодоступностью реагентов и их высокой себестоимостью.
Наиболее близким способом по технической сущности к заявляемому способу является способ получения окисленного глутатиона из восстановленного с использованием перекиси водорода как окислителя [6].
Процесс проводится в водном растворе рН около 8,0-8,5 с использованием эквивалента перекиси водорода при комнатной температуре. Время прохождения реакции около 1 часа, выход целевого продукта - 90%. Основными примесями (до 10%) являются продукты окисления, очистка от которых возможна только при использовании дорогостоящего метода препаративной ВЭЖХ, и поэтому может резко увеличить себестоимость препарата.
Задачей, на решение которой направлено заявляемое изобретение, является создание способа получения окисленного глутатиона со стабилизированной дисульфидной связью в процессе синтеза целевого продукта, что обеспечивается способом получения композита общей формулы: бис- ( γ - L-глутамил)-L-цистинил-бис-глицин динатриевая соль с cis-диаминодихлорплатиной в молярном соотношении 1000:1.
Согласно изобретению, композит характеризуется стабилизированной дисульфидной связью при введении его в биологические среды, а следовательно, большей продолжительностью времени полужизни препарата в биологических средах именно в форме дисульфида.
Общая процедура заявляемого способа получения композита заключается в использовании для реакции окисления восстановленного глутатиона в качестве окислителя перекиси водорода в комбинации с cis-диаминодихлорплатиной, выступающей в роли катализатора. При этом возможно использование меньшего количества перекиси водорода (0,9 эквивалента), что приводит к ликвидации продуктов переокисления в сочетании с очень высоким выходом целевого продукта (более 98% по данным ВЭЖХ). Таким образом целевой продукт получается сразу же с высокой степенью чистоты и не требует дополнительной очистки.
Следует отметить, что простое смешение готового окисленного глутатиона, полученного любым из изложенных выше способов, с комплексным соединением платины в указанной пропорции дает значительно меньший технологический и экономический эффект. В этом случае требуются дополнительные затраты на приобретение готового окисленного препарата (стоимость которого в 2-3 раза превышает стоимость восстановленной формы глутатиона) или самостоятельное проведение синтеза окисленной формы, выделение средств на дорогостоящую очистку полученного препарата, то есть получение композита в две стадии.
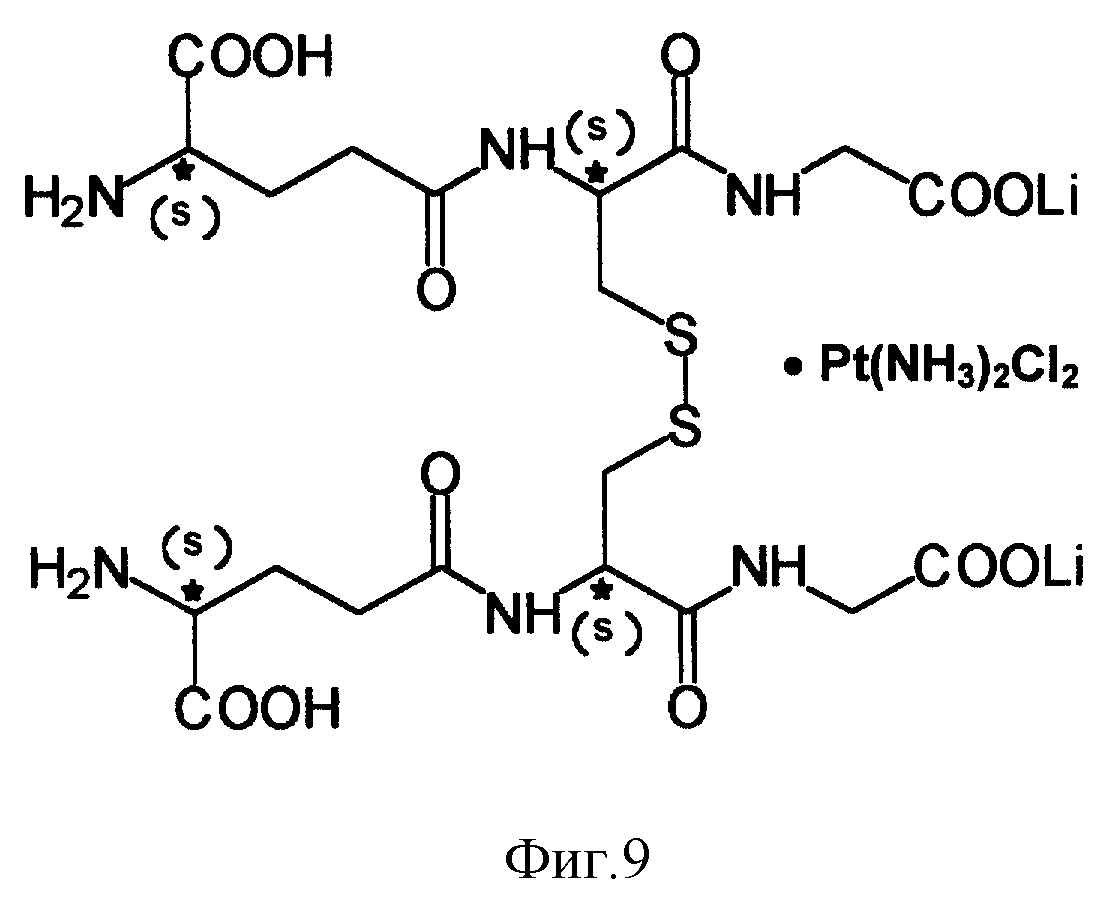
Заявляется способ получения нового биологически активного соединения - композита общей формулы: бис-( γ - L-глутамил)-L-цистинил-бис-глицин динатриевая соль с cis-диаминодихлорплатиной (далее - GSSG•Pt).
Структурная формула - приведена на фиг. 1.
Брутто-формула: C20H30N6O12
Na2S2 • [Pt(NH3)2Cl2]
Молекулярный вес: 656,59 на
C20H30N6O12
Na2S2 с содержанием Pt 0,022-0,042%.
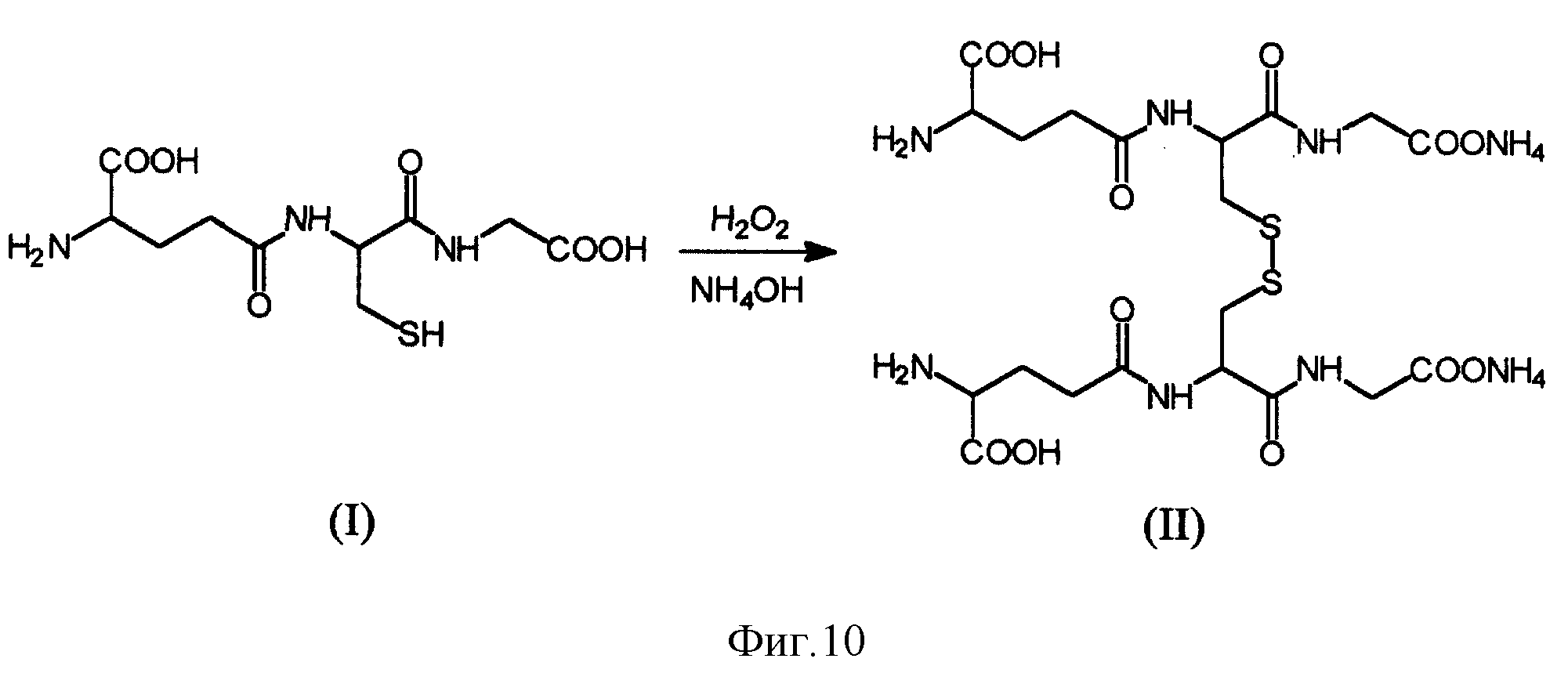
Согласно заявляемому способу образование композита происходит в одну стадию окисления восстановленной формы глутатиона, где добавка cis-диаминодихлорплатины выступает как катализатор реакции окисления. Это позволяет тщательно регулировать условия реакции, используя при этом меньшее, чем эквивалент, количество перекиси водорода, и благодаря этому исключить образование продуктов переокисления, сделав практически количественным выход целевого продукта. Таким образом, получение композита в одной стадии окисления приводит к значительному упрощению технологии и получению композита GSSG•Pt со стабилизированной дисульфидной связью.
Сущность заявляемого способа заключается в использовании водного раствора исходного восстановленного глутатиона в виде мононатриевой соли, к которому при комнатной температуре при перемешивании добавляется 0,9 эквивалента перекиси водорода и 0,001 эквивалента cis-диаминодихлорплатиной. Реакция окисления протекает около 1,5-2 часов. Контроль за полнотой прохождения окисления осуществляется методом ВЭЖХ. Завершение процесса осуществляется лиофильной сушкой реакционного раствора. В результате получают целевой продукт - композит, состоящий из окисленной формы глутатиона и cis-диаминодихлорплатины в мольном соотношении 1000:1, что подтверждается спектральным анализом на платину и натрий. Пептидная составляющая полученного композита по данным аминокислотного анализа, спектра ПМР, времени удерживания в ВЭЖХ соответствует гексапептиду - бис-( γ- L-глутамил)-L-цистинил-бис-глицину, то есть окисленной форме глутатиона. Содержание посторонних примесей не превышает 2%, выход продукта в виде динатриевой соли 96-98% в расчете на сухой композит.
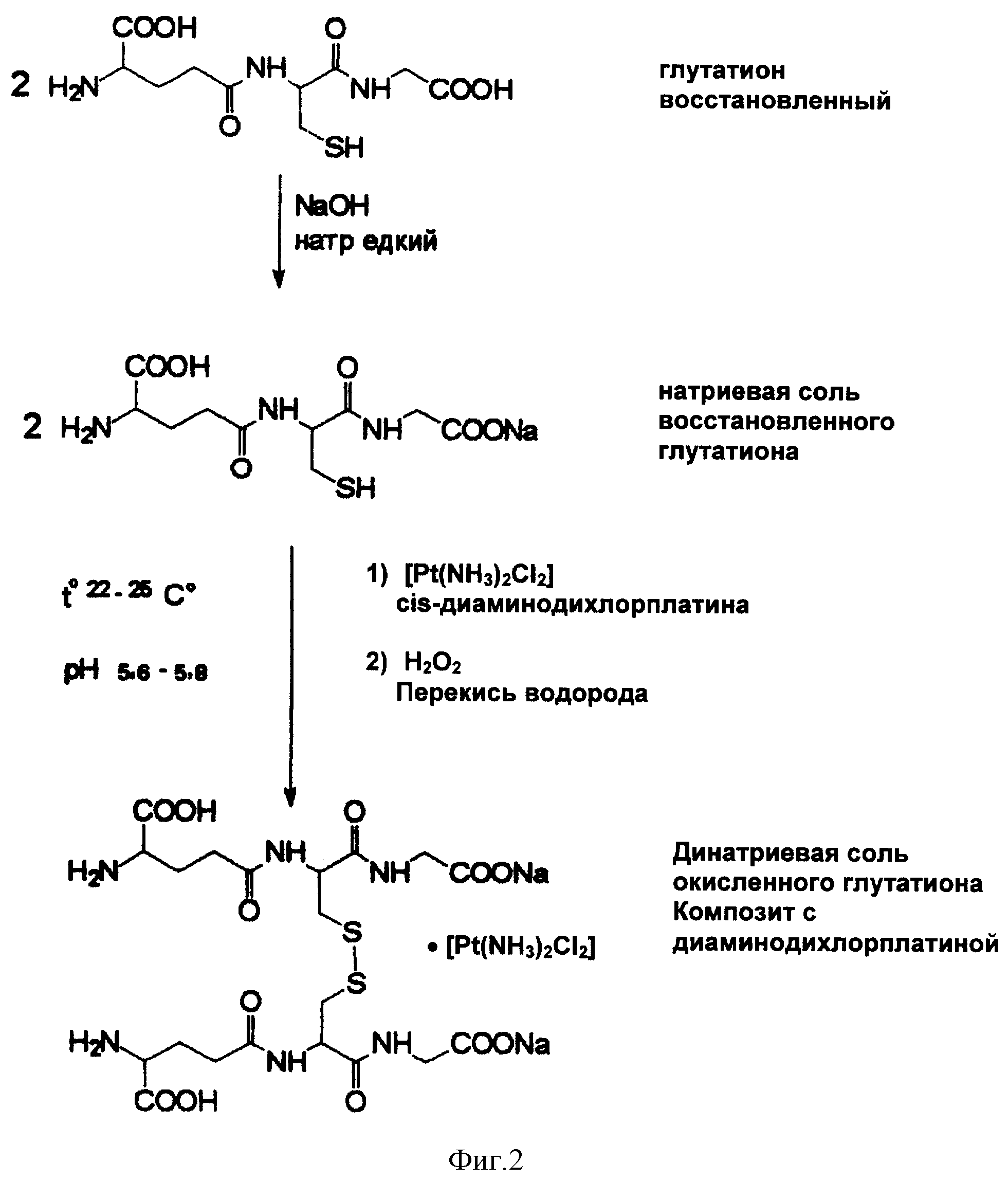
Схема синтеза композита - приведена на фиг. 2.
Методика синтеза. Восстановленный глутатион GSH 170 г. (0,55 моль) суспендируют в 200 мл воды и, при перемешивании, прибавляют 139 мл (0,55 моль) 4N раствора NAOH и затем 170 мл 0, 05% водного раствора cis-диаминодихлорплатины cis-[Pt(NH3)2Cl2].
Полученный прозрачный слегка желтый раствор охлаждают при помощи льда до температуры 18-20oC и добавляют 283 мл 3% раствора перекиси водорода (раствор H2O2) небольшими порциями в течение примерно 5 минут, с такой скоростью, чтобы температура реакционной смеси не превышала 22-25oC (погруженный термометр).
Через 30 минут после прибавления всего количества раствора перекиси водорода (H2O2) внутрь реакционного раствора помещают электрод pH-метра и определяют pH раствора, а затем по каплям добавляют 4N раствор натра едкого до pH 5,6-5,8, при этом контролируют температуру, которая должна быть в пределах 22-25oC. Далее охлаждение убирают и перемешивание продолжают уже при комнатной температуре в течение еще 30 минут.
Контроль полноты прохождения реакции окисления осуществляют методом ВЭЖХ. Жидкостной хроматограф для ВЭЖХ типа Beckman, Sol. Module 126, Det. 168, снабженный колонкой Luna Phenomenex ODS 4,6х250 мм, или аналогичный, подготавливают к работе согласно инструкции по пользованию. Для приготовления мобильной фазы для ВЭЖХ в мерную колбу вместимостью 1000 см3 помещают 20 см3 ацетонитрила (ТУ 6-09-14-2167-84), 1 см3 свежеперегнанной трифторуксусной кислоты и доводят объем до метки деионизованной водой. Перемешивают и дегазируют встряхиванием в вакууме.
Через 30 мин после прибавления всего количества раствора перекиси водорода осуществляют контроль за полнотой прохождения реакции методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Для этого из реакционной смеси при помощи микрошприца отбирают 10 мкл и растворяют их в 1 мл мобильной фазы (0,1% трифторуксусная кислота: ацетонитрил, 98:2). 20 мкл полученного раствора вводят в хроматограф Beckman 126 Solvent Module, Diod Array Detector Module 168, колонка Luna Phenomenex ODS 4,6х250 мм или аналогичный. Элюирование в изократическом режиме 30 мин в системе 0,1% трифторуксусная кислота: ацетонитрил, 98:2; скорость потока 1 мл/мин, детектирование при 220 нм, сканирование 190-600 нм.
Время удерживания в данных условиях для восстановленного глутатиона 5,0+0, 5 мин, время удерживания окисленного глутатиона (11,0±0,5) мин.
Если по данным ВЭЖХ после стандартного интегрирования хроматограммы содержание окисленной формы глутатиона составляет менее 97%, перемешивание продолжают в том же режиме еще 0,5 ч и контроль по ВЭЖХ повторяют.
Если результат равен или превышает 97%, реакцию считают законченной и переходят к фильтрованию реакционного раствора. Для этого используют фильтр с размером пор не более 0,7 мкм.
Потеря массы при сушке: не должна превышать 5% при сушке до постоянного веса при 100oC в вакууме (1 мм Hg) над CaCl2 и P2O2.
Содержание основного вещества в готовом продукте по данным ВЭЖХ не ниже 98%.
Таким образом получают окисленный глутатион в виде композита с cis-диаминодихлорплатиной.
Внешний вид: белый порошок без запаха.
Растворимость: растворим в воде, изотоническом растворе хлорида натрия 0,9% для инъекций; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен.
pH 0,1% раствора: 5.0-6.0 потенциометрически, прибор pH/mV/oC
meter Cole
Farmer, модель
59003-15 или
аналогичный
Подлинность:
а) аминокислотный анализ (6 н. HCl, 110oC, 20 ч),
глицин-2.0 ± 15%; глутаминовая кислота
- 2.0
± 15%;
цистеин-2.0
± 40%; аминокислотный
анализатор ААА "Т-339 М" Pragu или аналогичный.
б) ВЭЖХ - по времени выхода соответствует стандарту бис-( γ - L-глутамил)-L-цистинил-бис-глицин динатриевая соль.
Условия хроматографирования: прибор BECKMAN "Gold Nouveau Chromatography Data System" Version 1.0, Diod Array Detector Module 126 или аналогичный.
Проба - 20 мкл 0,1% раствора препарата в мобильной фазе, хроматографирование на колонке ULTRASPERE ODS 250х4,6 мм с обращенной C18-фазой в изократическом режиме ацетонитрил-0,1% трифторуксусная к-та (2:98); скорость потока 1 мл/мин, детектирование при 220 нм, сканирование 190-600 нм.
Чистота (содержание основного
вещества):
а)
по ВЭЖХ не ниже 98%,
б) по аминокислотному анализу:
не ниже 85 %
(анализ согласно Разделу "Подлинность", пункт "а" с точной навеской)
Методика
определения содержания
элементов
Точная навеска пробы (около 50 мг) растворялась
в 50 мл бидистиллированной воды и раствор использовался для анализа.
Содержание платины определялось количественно методом масс-спектрометрии с индуктивно-связанной плазмой на приборе модели PQe, фирмы VG Elemental, Англия.
Относительная точность анализа 5%.
Содержание других элементов определяется количественно методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой на приборе модели TRACE 61E фирмы Thermo Jarrell Ash, США. Относительная точность анализа 5%.
г) содержание натрия (Na) по эмиссионному
спектральному методу: (7,0 ± 0,5)%
д) содержание платины (Pt) по масс-спектральному
методу: (0,032 ± 0,01)%
Содержание элементов, мкг/г:
Серебро (Ag)
- < 1.0 (< 0.0001%)
Алюминий (Al) - 2.0
Мышьяк (As) - < 1.0
Барий (Ba) - < 0.50
Бериллий (Be) - < 0.05
Кальций (Ca)
- 7.0
Кадмий (Cd) - < 0.05
Кобальт (Со) - < 0.5
Хром (Cr) - 1.7
Медь (Си) - < 0.5
Железо (Fe) - < 1.0
Калий (К)
- < 2.5
Селен (Se) - < 2.0
Магний (Mg) - < 2.5
Марганец (Mn) - < 0.2
Молибден (Mn)
- < 0.2
Никель (Ni) - <
0.5
Свинец (Pb) - <
0.40
Стронций (Sr) - 1.9
Титан (Ti) - < 0.5
Ванадий (V) - < 0.5
Цинк (Zn) - 0.65
Сурьма (Sb) - <
0.5
Химические особенности структуры молекулы GSSG•Pt
Препарат GSSG•Pt представляет собой получаемый по заявляемой
технологии композит гексапептида бис-( γ
- L-глутамил)-L-цистинил-бис-глицин динатриевая соль, координационно-ковалентно связанная с cis-диаминодихлорплатиной (cis-платина). В изобретении
представлен новый разработанный авторами метод
синтеза структурного аналога GSSG - гексапептида с особой формой стабилизации дисульфидной (-S-S-) связи, что определяет новые биофизические и
биохимические свойства молекулы GSSG•Pt
(фиг.
3-5).
Принципиально новым техническим решением в разработке синтеза гексапептида со стабилизированной дисульфидной связью является использование каталитических микрограммовых количеств cis-диаминодихлорплатины в качестве катализатора процесса окисления двух молекул восстановленного глутатиона, что привело к образованию координационно-ковалентных и новых донорно-акцепторных связей.
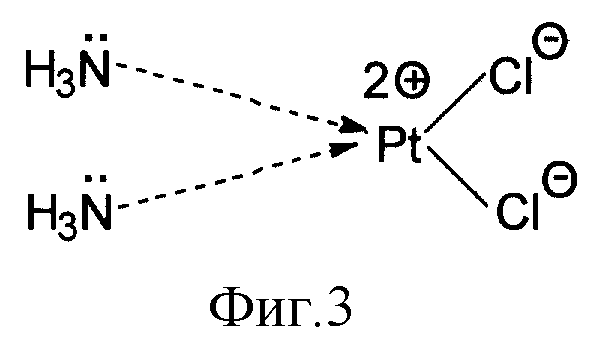
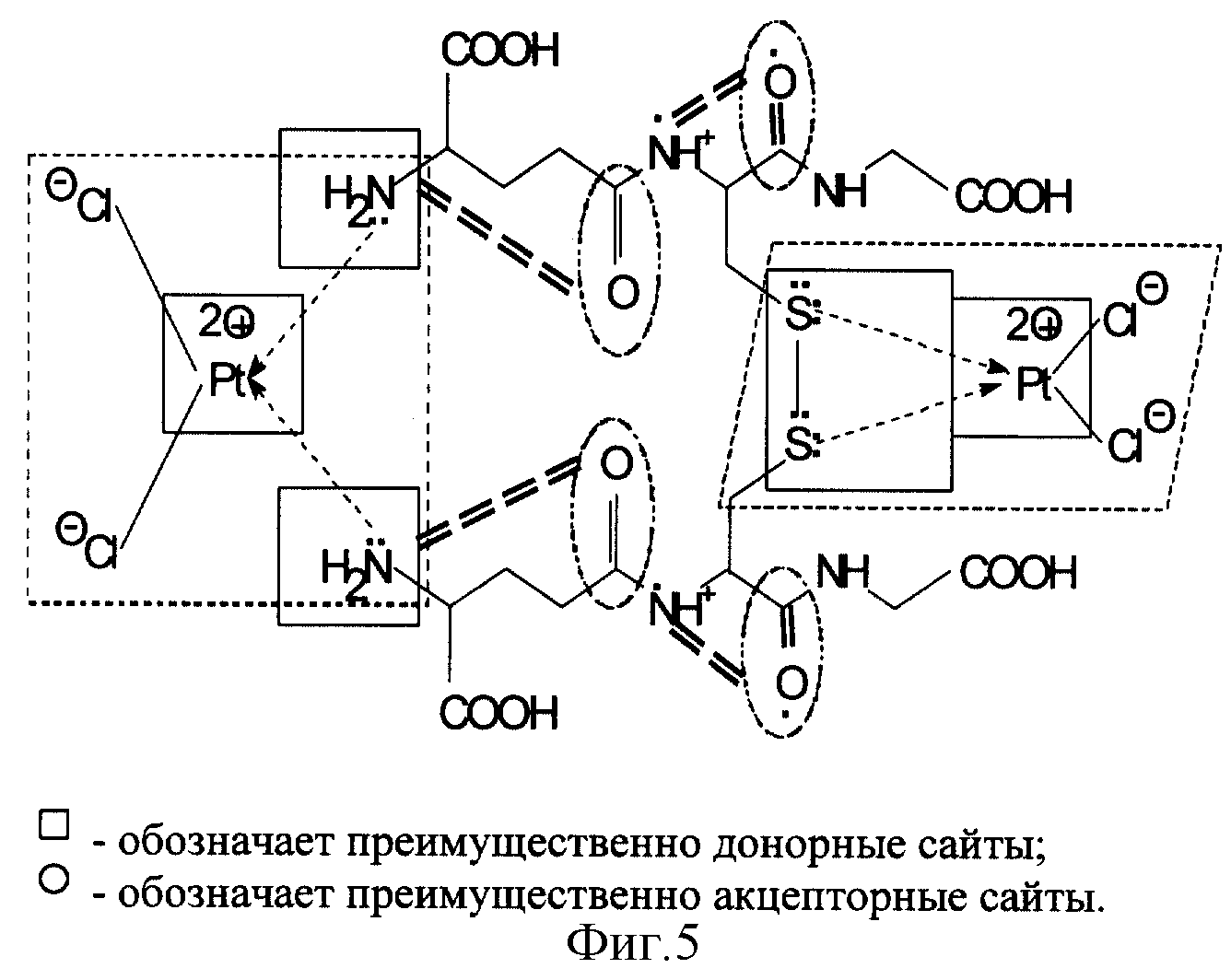
В молекуле cis-диаминодихлорплатины атом платины соединен с двумя атомами азота в NH3 группах за счет неподеленных электронов атомов азота, предоставляемых для образования донорно-акцепторных связей (фиг. 3).
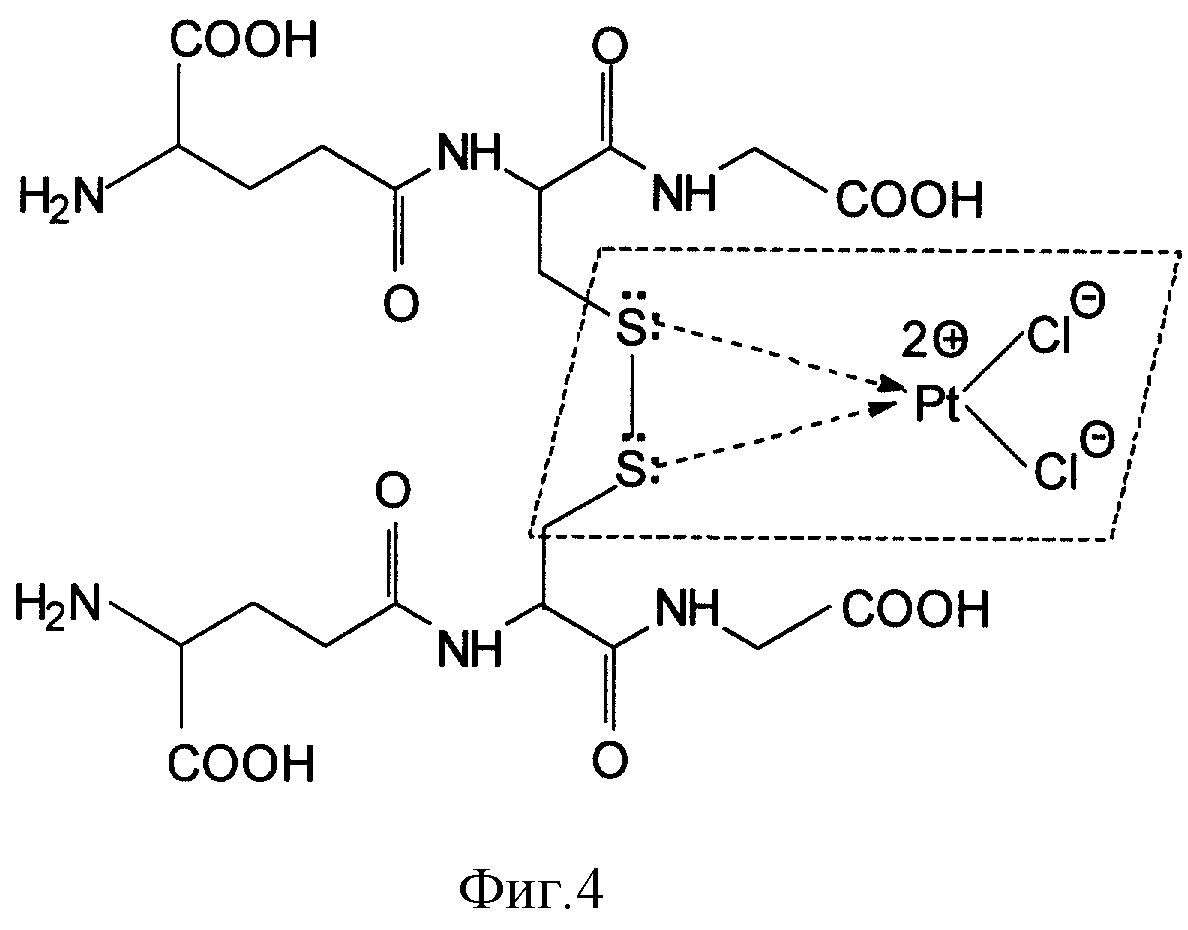
При взаимодействии с молекулой окисленного глутатиона GSSG возможен обмен лигандами, т. е. вместо групп NH3 в донорно-акцепторные связи с атомом платины вступают два атома серы, имеющие по две пары неподеленных электронов. Такая новая донорно-акцепторная связь может рассматриваться как более прочная и равновесие будет смещаться в сторону образования именно таких продуктов. Это связано с увеличением нуклеофильности атомов серы (наличие двух пар неподеленных электронов на более удаленных от ядра орбиталях) по сравнению с атомами азота. Поэтому возможна стабилизация дисульфидной связи в молекуле GSSG за счет включения атомов серы в cis-положении в плоскую структуру с атомом платины (фиг. 4).
Следует учитывать также возможность, дополнительно к рассмотренному, фактор стабилизации молекулы GSSG в препарате GSSG•Pt за счет сближения групп NH2 вследствие обмена лигандов - групп NH3 cis-диаминодихлорплатины на группы NH2 молекулы GSSG. Этим стабилизируется общая конформация молекулы GSSG (фиг. 5).
Указанные обстоятельства сказываются не только на стабильности молекулы GSSG в препарате GSSG•Pt, но и в ряде показателей новой химической реакционной способности GSSG•Pt.
Во-первых, резко увеличивается скорость и полнота прохождения реакции окисления восстановленного глутатиона GSH до окисленной формы GSSG.
Введение в каталитических количествах cis-диаминодихлорплатины в реакционную среду существенным образом повышает выход целевого продукта, степень чистоты и сокращает время реакции, что представляет собой сущность заявляемой технологии. Согласно разработанным нами режимам синтеза, чистота получаемого препарата по данным высокоэффективной жидкостной хроматографии достигает значений более 99% при проведении синтезов в промышленном масштабе, что значительно выше описываемых в литературе данных по получению обычного окисленного глутатиона (75-93% в зависимости от метода).
Во-вторых, при получении новых химических модификаций молекулы GSSG в препарате GSSG•Pt, связанных с ацилированием аминогрупп (например, бис-фенилаланилглутатион и др.) резко снижается риск протекания побочных реакций, связанных с затрагиванием атомов серы и разрушением дисульфидной связи. Такие реакции, например S-алкилирование, окисление до соответствующих кислот и др. , вызывают определенные трудности при работе и в данном случае могут быть сведены к минимуму или исключены.
В-третьих, химические модификации, связанные с образованием новых несимметричных дисульфидов (например, при реакции GSSG•Pt + цистеамин) будут, безусловно, проходить существенно легче в присутствии cis-диаминодихлорплатины. Это связано со стабилизацией вновь образующейся дисульфидной связи за счет включения атомов серы в циклическую систему с атомом платины, о чем говорилось ранее.
Следовательно, представленный в заявляемом изобретении новый метод синтеза молекулы GSSG и ее физико-химической модификации непосредственно в процессе синтеза (стабилизация дисульфидной связи и общей конформации молекулы; появление новых реакционно-способных функциональных сайтов) обеспечили получение биологически активного гексапептида - бис-( γ - L-глутамил)-L-цистинил-бис-глицина со стабилизированной дисульфидной связью - с новыми биофизическими, химическими и биохимическими параметрами структурно-функциональных качеств данного соединения.
Новые возможности химической модификации GSSG•Pt в целях получения семейства
препаратов с заданными
свойствами - класс тиопоэтинов
Цели химической
модификации.
При помощи химической модификации базовой молекулы GSSG•Pt возможно создание новых препаратов, в молекулах которых наряду с уже показавшей высокую медико-биологическую активность базовой структурой на основе композита окисленного глутатиона с cis-диаминодихлорплатиной, присутствуют фрагменты других ковалентно связанных биохимически активных молекул. Использование ковалентно-связанных комбинаций позволит усилить ряд важных характеристик препаратов, таких как стабильность и стандартизованность состава.
Кроме того, можно ожидать, что целенаправленно выбранные ковалентно связанные фрагменты биохимически важных молекул позволят существенно улучшить медико-биологические свойства базовой молекулы GSSG•Pt, сделав их более избирательными для каждой конкретной лечебной цели, резко увеличив эффективность в желаемом терапевтическом направлении. Это может быть обусловлено аддитивным эффектом фрагментов в биохимических механизмах действия, резким улучшением транспорта лекарственной молекулы к клетке- или молекуле-мишени, большим сродством к рецептору, нужным перераспределением окислительно-восстановительного потенциала и рядом других факторов, а также их сочетанием.
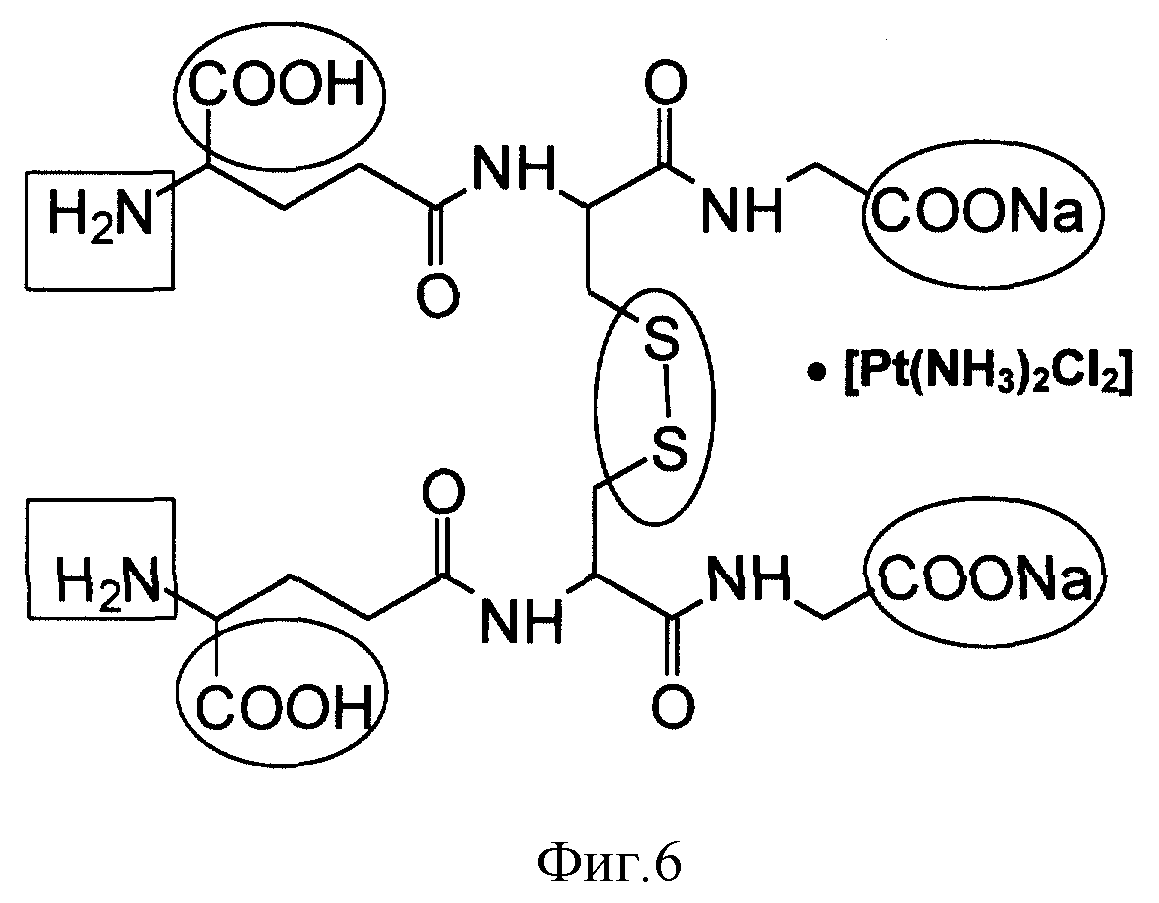
Основой для химических модификаций служит гексапептидный остов GSSG•Pt с двумя первичными аминогруппами глутаминовой кислоты, дисульфидной связью цистина и карбоксильными группами глицина и α- карбоксильными группами глутаминовой кислоты (фиг. 6).
Все направления модификации молекулы GSSG•Pt представителями различных классов химических соединений укладываются в рамки шести типовых химических реакций, которые приведены ниже, наряду с обозначением (с N 1 по N 29) общих формул новых композиций в каждом типе реакции синтеза производных GSSG•Pt.
1 ТИП
Реакции ацилирования
первичной
аминогруппы
глутаминовой кислоты.
Этот вариант наиболее подходит для ацилирования при помощи N-защищенных активированных производных аминокислот, по которому после стадии временной защиты меркапто-групп цистеина, конденсации (метод активированных эфиров), удалении N- и S-защитных групп и проведения окисления перекисью водорода с добавкой cis-диаминодихлорплатины, получают композиты GSSG•Pt, модифицированные аминокислотами по аминогруппам глутаминовой кислоты.
По этой схеме предложены следующие модификации:
1)
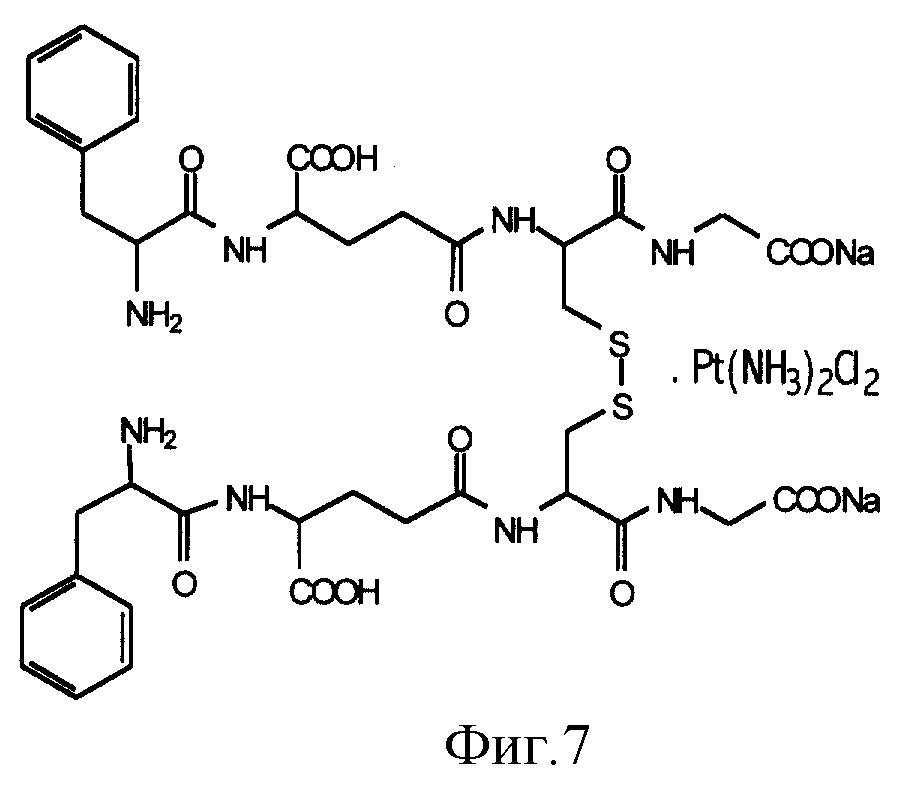
бис-фенилаланил- GSSG•
Pt
- структурная формула приведена на фиг.7
По этой принципиальной схеме синтезируются и все другие модификации GSSG•Pt, основанные на
ацилировании
аминогрупп производными защищенных
аминокислот, оксикислот, карбоновых кислот и их производных. Возможны небольшие изменения в методиках, связанные с конкретной природой
модифицирующей
молекулы.
2) бис-метионил-GSSG•Pt - (Met)2 GSSG•Pt
При синтезе данного производного требуется учитывать специфику молекулы метионина на стадии деблокирования BOC-защитной группы после стадии конденсации.
3) бис-аспартил-GSSG•
Pt
Введение
аспарагиновой кислоты
возможно по рассмотренной общей схеме, однако требуется применение временной защитной группы для β
- карбоксильной группы, которая по возможности
должна
удаляться
одновременно с BOC-защитной
группой.
Поэтому на стадии конденсации используется (3-трет-бутиловый эфир N-BOC-аспарагиновой кислоты, т.е. BOC-Asp(OBut)-OSu. Удаление защитных групп трифторуксусной кислотой.
4) бис-гистидил-GSSG•Pt
Имидазольное кольцо
гистидина в данном случае нельзя защищать Nim-бензильной
защитной
группой, которую невозможно
деблокировать каталитическим гидрогенолизом в присутствии S-S-дисульфидной группы цистина в
молекуле GSSG•Pt.
Поэтому используется ди-трет-бутилоксикарбонильное производное гистидина на стадии конденсации, т.е. BOC-His(BOC)-OSu. Удаление защитных групп, как и в предыдущих случаях, при помощи трифторуксусной кислоты.
5) бис-3-йод-тирозил-GSSG•Pt
Использование бензильной и бензилоксикарбонильной широко применяемых защитных
групп для гидроксильной группы тирозина невозможно, т.к. их
удаление проводится при помощи каталитического
гидрогенолиза. Оптимальный вариант в данном случае - кислотолабильная защитная группа
трет-бутиловый эфир. Используемое на стадии конденсации
производное тирозина - BOC-Tyr(OBut)-OSu.
6) ГAMK- GSSG•Pt; γ- aминoбутaнoил-GSSG•
Pt
Используется на стадии конденсации с молекулой
GSSG•
Pt кислотолабильная защитная группа
трет-бутилоксикарбонильная (BOC), как и в случаях с другими аминокислотами.
7) ГОМК-GSSG•Pt; γ
- гидроксибутаноил-GSSG•Pt
Для защиты гидроксильной группы
γ- оксимасляной кислоты применяется кислотолабильная
(удаляемый раствором трифторуксусной кислоты) трет-бутиловый
эфир.
Используемое на
стадии конденсации производное
ГAMK(OBut)-OSu
8) бис-липоил-GSSG•
Pt
В данном случае в молекуле липоевой кислоты нет боковых
функциональных групп, требующих
специальной защиты.
Поэтому на стадии конденсации возможно использование активированного (оксисукцинимидного) эфира липоевой кислоты. Обработка TFA не требуется.
10)
бис-3,
4-дигидроксифенилаланил-GSSG•Pt, биc-ДOФA-GSSG•Pt
Для введения молекулы ДОФА требуется предварительная защита двух гидроксильных групп
3,
4-дигидроксифенилаланина при
помощи
трет-бутиловых эфиров и защита аминогруппы BOC-защитной группой. Для
конденсации с молекулой GSSG•Pt получают активированный эфир (оксисукцинимидный или
пентафторфениловый) и используют
его в
мольном избытке. Удаление защитных групп одновременно при
помощи раствора трифторуксусной кислоты.
11) бис-карнозил-GSSG•Pt (бис
β
- аланил-L-гистидил-GSSG•
Pt)
Карнозин перед стадией конденсации
переводят в защищенное ди-BOC производное для аминогруппы β- аланина и имидазольной группы
гистидина.
Далее конденсация и последующее деблокирование по рассмотренной для других аминокислот схеме.
2 ТИП
Реакции образования амидных связей между
аминогруппами
GSSG•Pt и карбоксильными
группами
гетероциклических карбоновых кислот или
фосфоамидных связей с нуклеотидами при помощи стандартных реагентов, используемых для этих целей
(замещенные
карбодиимиды и др.).
12)
бис-никотиноил-GSSG•Pt
(бис-пиридин-3-карбоноил-GSSG•Pt)
Никотиновая кислота, не содержащая боковых функциональных групп,
может
вводится в конденсацию с GSSG•Pt без
получения защищенных
производных в виде соответствующих активированных эфиров, оксисукцинимидного или пентафторфенилового. Обработка
трифторуксусной
кислотой для деблокирования защитных групп не
нужна.
13) Уридин-5'-монофосфатил-GSSG•Pt, UMP-5'-GSSG•Pt
Для получения данной модификации
используются
классические методы, применяемые в химии нуклеотидов.
Уридин-5'-монофосфат в присутствии N,N-дициклогексил-карбодиимида может образовывать фосфоамидные связи в реакциях с аминами [10]
. В качестве
аминокомпоненты используют GSSG•Pt с
защищенными
карбоксильными группами, тетратриметилсилильное производное GSSG•Pt (TMS)4. При этом деблокирование проходит в
мягких
условиях в водно-спиртовых системах.
14)
инозин-5'-монофосфатил-GSSG•Pt, IMP-5'-SGGS•Pt
Схема синтеза аналогична предыдущей (UMP-5'-GSSG).
15)
фолликулилсукцинил-GSSG•
Pt
Связь между
GSSG•Pt и эстроном осуществляется за счет амидной и сложноэфирной связей через остаток сукцинила.
Эстрон переводится в активированное производное в реакции с янтарным ангидридом с последующей конденсацией при помощи N,N-дициклогексилкарбодиимида с защищенным GSSG•Pt, а также с тетра-триметилсилильным производным. Последующее деблокирование в водно-спиртовой системе.
16) Глицерол-1,3-дифосфатил-GSSG•Pt
Синтез модификации проводят
карбодиимидным методом, используя в
качестве
аминокомпоненты защищенный GSSG•Pt
- тетра-трисилильное
производное.
Схема близка к схеме получения фосфоамидных производных (см. синтез модификаций 13 и 14).
3 ТИП
Реакции образования амидных
связей между
карбоксильными группами GSSG•Pt и аминами. Реакционная способность всех четырех
карбоксильных групп различается не
существенно, поэтому образуется смесь продуктов, подлежащих
препаративному
разделению и идентификации.
17) тетра-допамин-GSSG•Pt
В
данном варианте в качестве
аминокомпоненты используется 3,4-ди-трет-бутиловый эфир допамина, а в
качестве
карбоксильной компоненты - ди-трет-бутилоксикарбонильное производное GSSG•Pt.
Конденсация при помощи N,
N-дициклогексил-карбодиимида, а деблокирование защитных групп при помощи
раствора
трифторуксусной кислоты
18) GSSG•Pt-теофиллин
Теофиллин
используется как
аминокомпонента;
GSSG•Pt как карбоксильная компонента в виде
ди-трет-бутилоксикарбонильного
производного. Конденсация с помощью комплекса "F". Деблокирование защитных групп
раствором
трифторуксусной
кислоты.
4 ТИП
Получение
комбинированных структур на основе молекулы
GSSG•Pt и цистеамина при образовании смешанных дисульфидов
(симметричных и
несимметричных)
19) Наиболее простая структура образуется при
реакции совместного окисления меркаптогрупп
исходных веществ. Дополнительные защитные группы и методы
конденсации не
требуются.
20) Соединение получается при образовании амидной связи между аминогруппой цистеамина и одной из карбоксильных групп GSSG•Pt. Требуется введение N-защитных групп и активация карбоксильных групп GSSG•Pt. По причине наличия четырех карбоксильных групп, необходимо дозирование компонентов и сложное хроматографическое разделение продуктов реакции.
21) Условия получения отличаются от структуры 20 наличием дополнительного эквивалента аминокомпоненты. При хроматографической очистке используется структура 20, как свидетель.
22) Получается из структуры 21 путем образования дополнительного дисульфидного мостика при реакции окисления меркаптогрупп. При хроматографическом разделении продуктов реакции необходимо иметь в качестве свидетеля структуру 21.
5 ТИП
Кроме модификаций на основе ковалентно связанных
фрагментов для молекулы GSSG•Pt имеются
широкие
возможности для образования химических
соединений солевого типа с ионными связями с
использованием ионогенных амино- и карбоксильных групп.
Солевые формы получают в водных растворах путем
прибавления соответствующего количества
солеобразующего компонента, основания или кислоты.
Пример солей по аминогруппам:
23)
диванадат GSSG•Pt - (HVO3
)2-GSSG•Pt
24)
дигидрофторид GSSG•Pt - (HF)2•
GSSG•Pt
Примеры солей по карбоксильным
группам:
25)
дилитиевая соль
GSSG•Pt (см. Пример реализации изобретения
N 2)
26) дидопаммониевая соль GSSG•Pt
27) цинковая соль GSSG•Pt
6
ТИП
Комбинации ионной и
ковалентной связей (например, по типу смешанных
дисульфидов).
28) GSSG-цистеамин Zn-соль
29) GSSG-цистеамин Li-соль
Для данных
модификаций
первоначально
синтезируют соединения с ковалентно-связанными
фрагментами. Далее получают солевые формы, добавляя необходимые количества
солеобразующего компонента (для рассмотренных
соединений
Zn(OH)2
и LiOH).
Новые биофизические
характеристики GSSG•Pt
Главная и первостепенная из них
- новое донорно-акцепторное состояние молекулы и
новое
качество
донорно-акцепторного взаимодействия в рамках одной и той же
молекулы GSSG•Pt. Почему это столь важно? Если активность и
физическое состояние клетки определяются, в основном,
соотношением
доноров и акцепторов электронов, то равновесие между акцепторами
и донорами электронов, обладающих равными биопотенциалами - один из
основных параметров жизни; изменение этого
равновесия
используется для регуляции различных функций и физико-химического состояния
клетки [11]. Источниками мобильных электронов, то есть донорами
π- электронов являются
неподеленные электронные
пары
азота, кислорода, серы. Иными словами, в клетках избыток активности
электронов; в активно делящихся клетках этот избыток резко возрастает,
формируя своего рода
электронное давление со сдвигом
акцепторно-донорного равновесия в пользу доноров. Акцепторов (в основном
это группы -C=O-) в клетке мало, хотя нормальная клетка все-таки
равновесна в
донорно-акцепторной динамике электронов жизни
- π- электронов. Злокачественная клетка характеризуется резчайшими
нарушениями донорно-акцепторного равновесия в пользу прессинга
доноров.
На фоне колоссального количества молекул вещества
доноров в раковых клетках практически нет акцепторов. Отсюда важным в
подобной ситуации является наличие молекул, обладающих ярко
выраженными
акцепторно-донорными свойствами, и, что удалось
достигнуть,
создав молекулу GSSG•Pt. Введение GSSG•Pt в
биологические среды (с учетом катализа атомом платины реакций
образования активных форм кислорода, в частности супероксиданион
радикалов;
синглетного кислорода) означает появление в клетках
пульсирующего редокс-контура, создаваемого молекулой GSSG•
Pt.
При этом каждую долю секунды молекула GSSG•Pt находится
либо
преимущественно в восстановленной, либо преимущественно в
окисленной форме.
Следующим инструментом формирования нового уровня редокс-контура клеток является взаимодействие GSSG• Pt с GSH клеток с образованием окислительно-восстановительной, т.е. донорно-акцепторной пары.
При наличии достаточного уровня GSH в клетках, что характерно для опухоле-трансформированных клеток с высоким пролиферативным импульсом, резко проявляются преимущественно прооксидантные, то есть окислительные свойства GSSG•Pt. В этом случае только в опухолевых клетках формируется окислительный стресс, приводящий к нарушению функционирования митохондрий опухолевых клеток и формирующий в этой связи внутриклеточный сигнал апоптоза опухолевых клеток.
Для нормальных, но "усталых", "истощенных" клеток GSSG•Pt означает оптимизацию окислительно-восстановительного потенциала, биоэнергетическое обеспечение метаболических превращений, редокс-чувствительная адекватная экспрессия функциональных сайтов генома, в частности, иммунологически значимых генов и факторов транскрипции.
В трансформированных клетках GSSG•Pt вызывает несовместимую с их жизнедеятельностью цепную реакцию акцепции (отбирания) π-электронов; нарушение митохондриальных окислительно-восстановительных реакций переноса электронов/протонов по дыхательной цепи; нарушение соотношения НАД•H+/НАДФ•H, то есть формирование внутриклеточного сигнала индукции механизмов апоптоза.
Новые биохимические свойства GSSG• Pt.
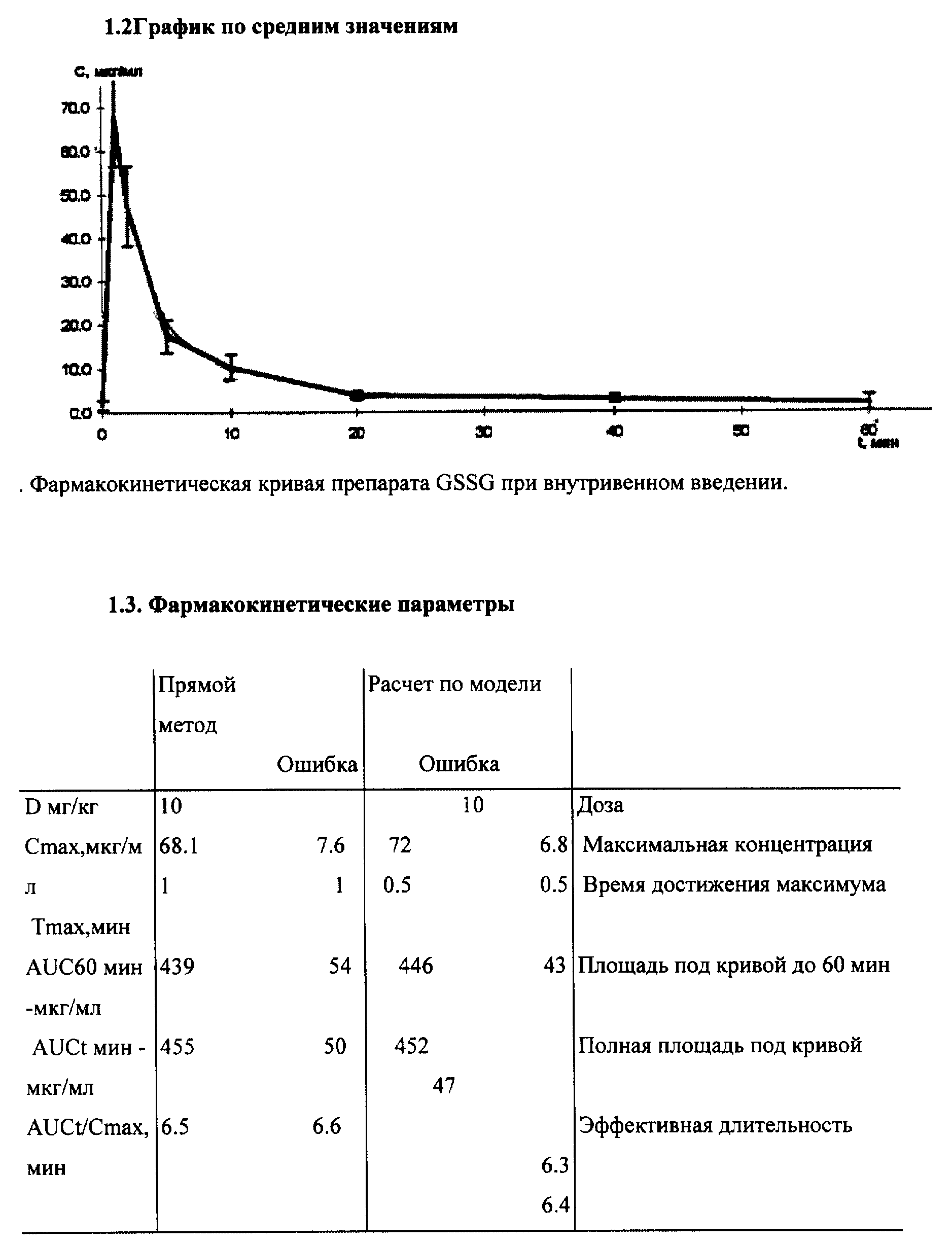
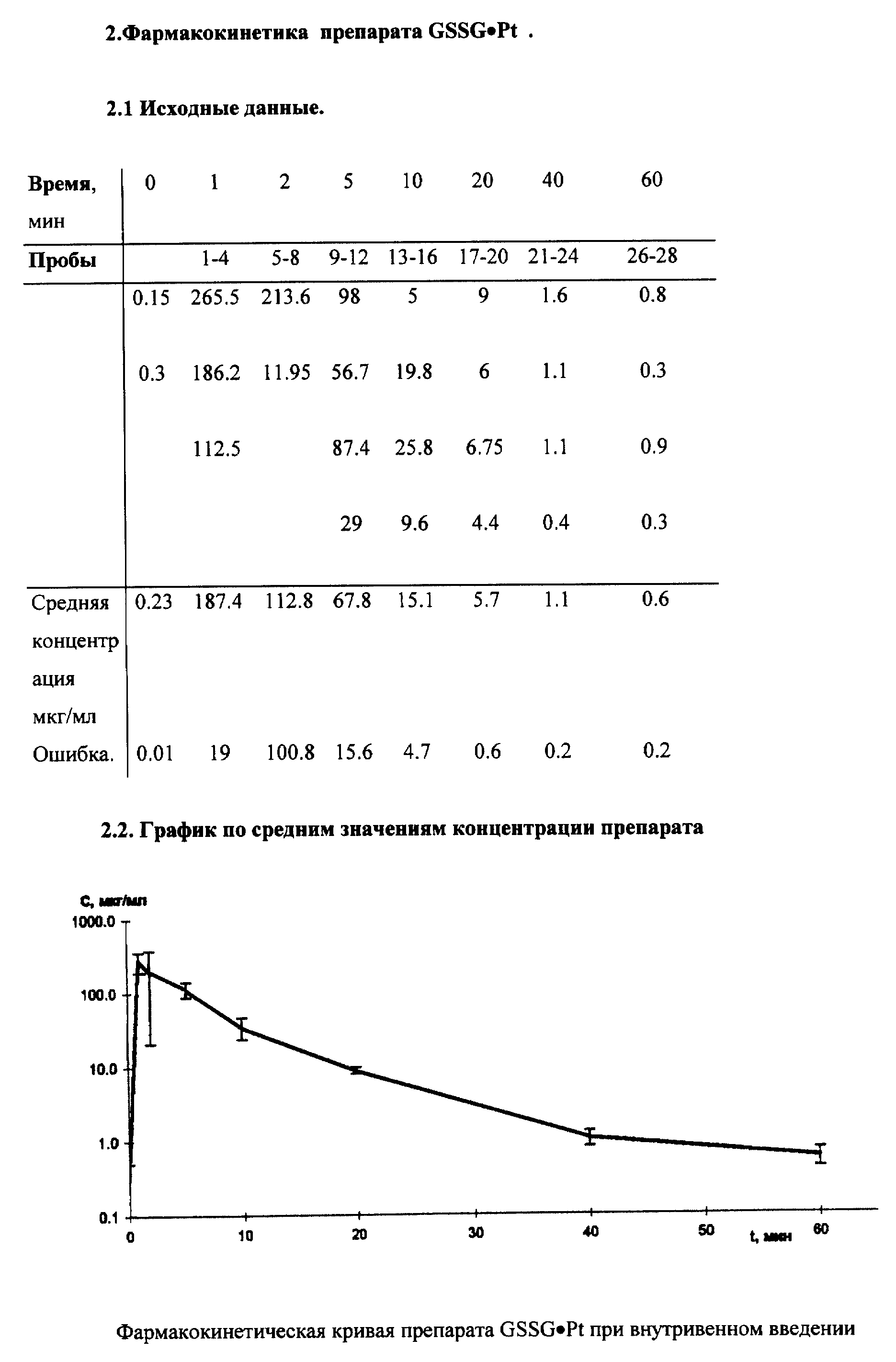
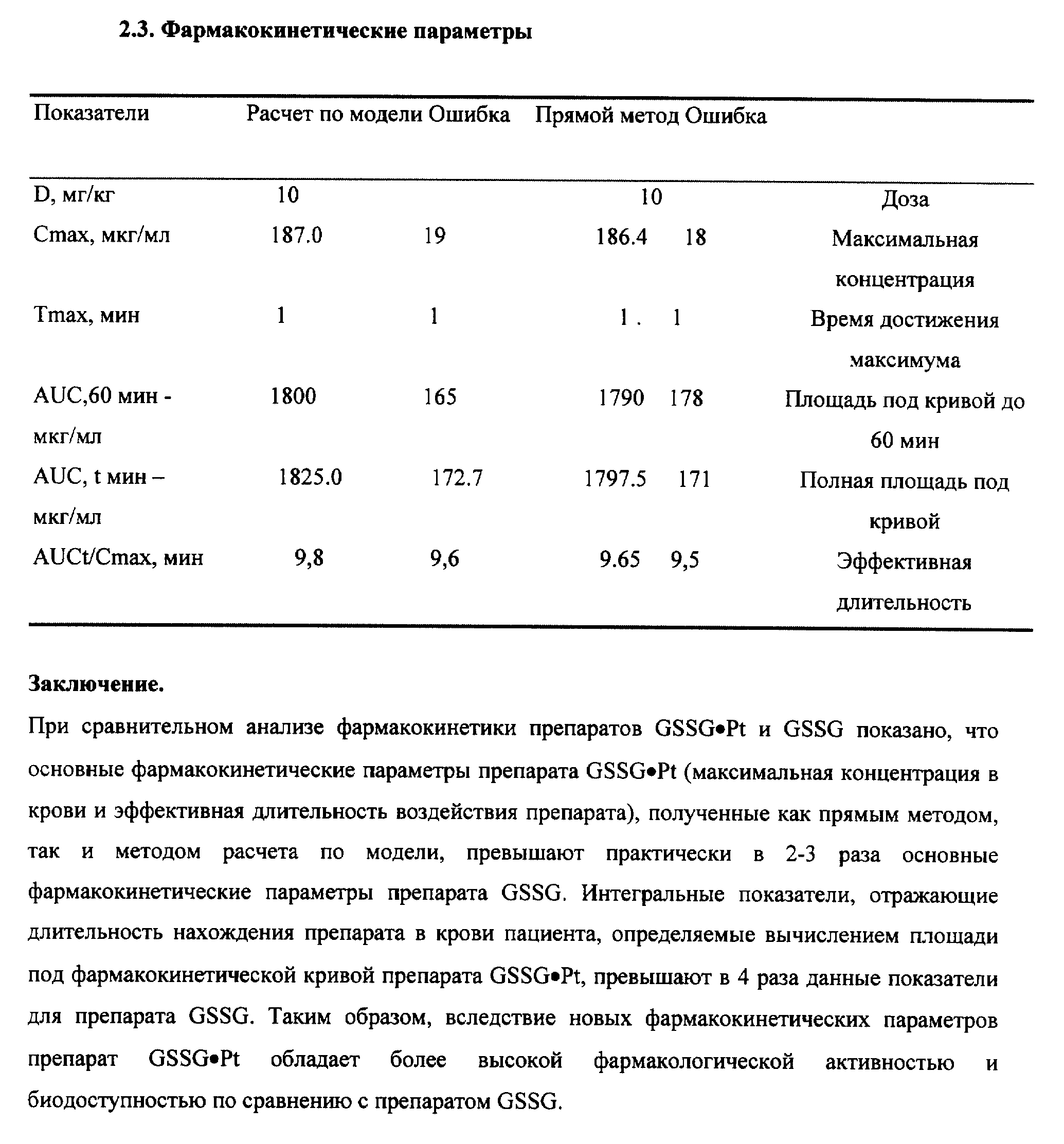
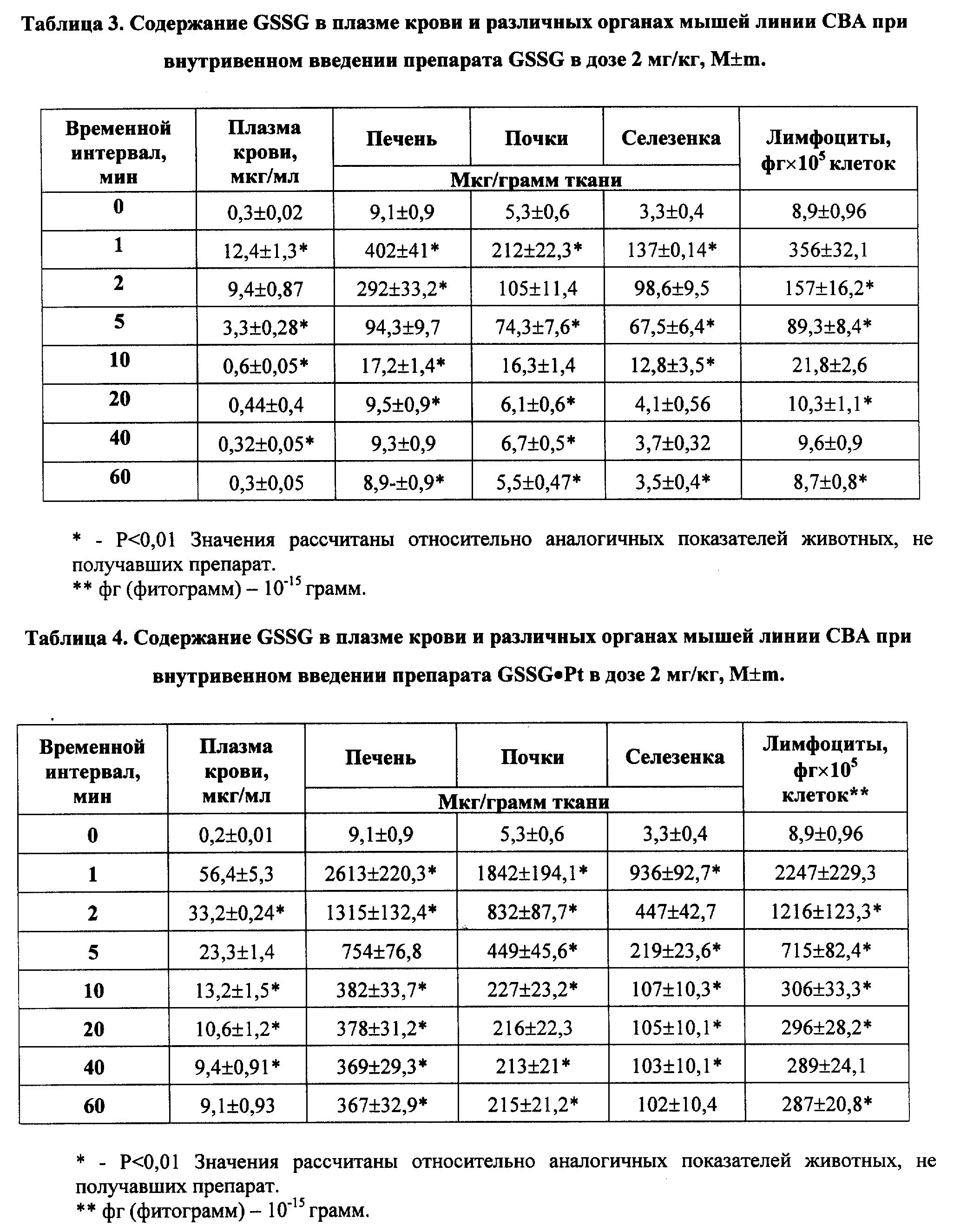
Новая фармакокинетика GSSG•Pt (по сравнению с GSSG) в крови и тканях (органах) при ее введении в биологические среды свидетельствует о том, что молекула GSSG•Pt гораздо менее доступна для ферментов метаболизма GSSG и, в первую очередь, для НАДФ• H+ -зависимой глутатионредуктазы, основного энзима восстановления GSSG в GSH. Отсюда время полужизни GSSG•Pt в дисульфидной форме в биологических средах значительно возросло (см. примеры реализации изобретения 3-4).
Принципиально новая фармакокинетика гексапептида со стабилизированной дисульфидной связью (GSSG•Pt) по сравнению с его структурным аналогом - окисленным глутатионом (GSSG) - обеспечило оптимальное проявление установленных нами новых биолого-фармакологических эффектов.
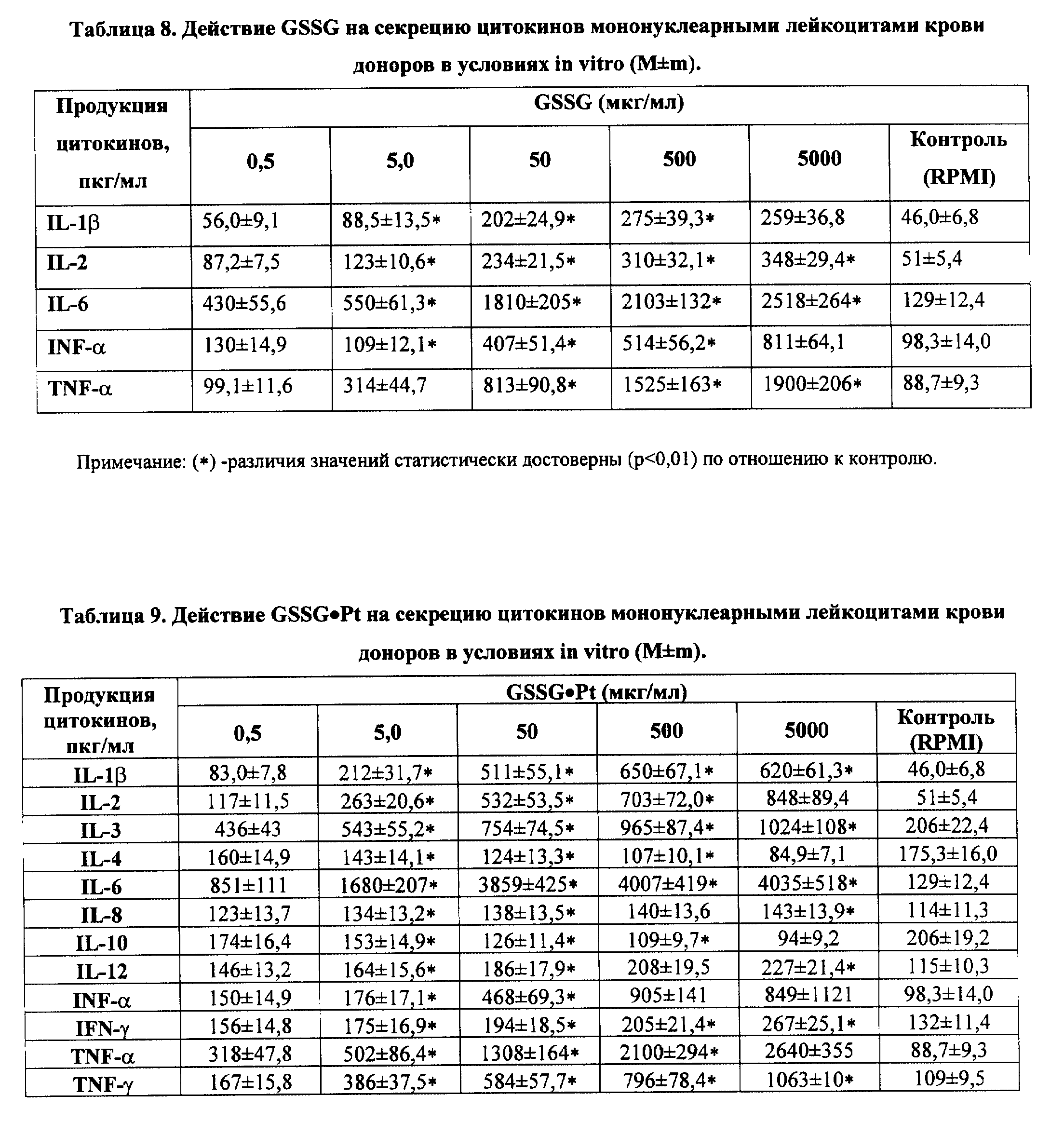
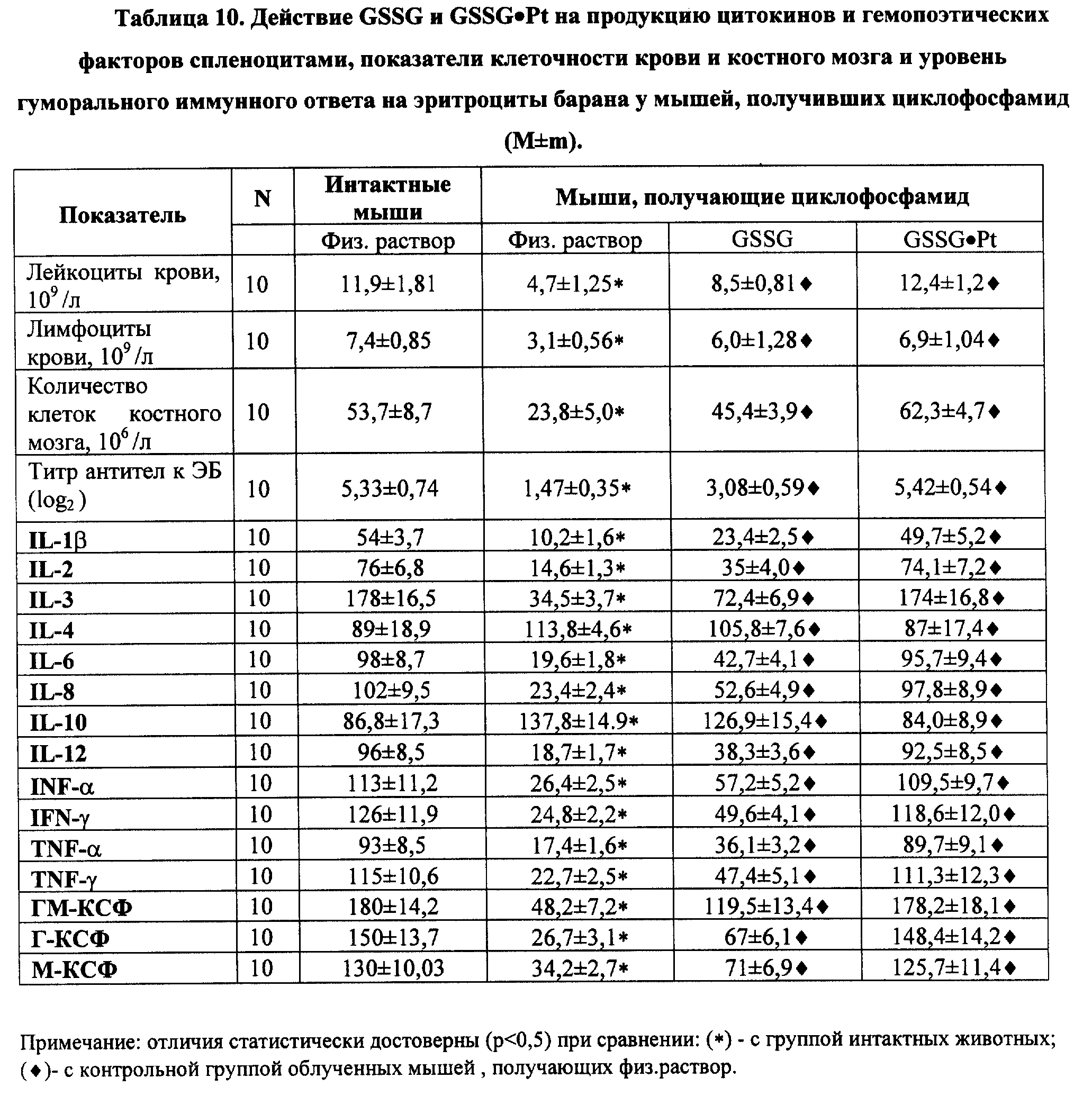
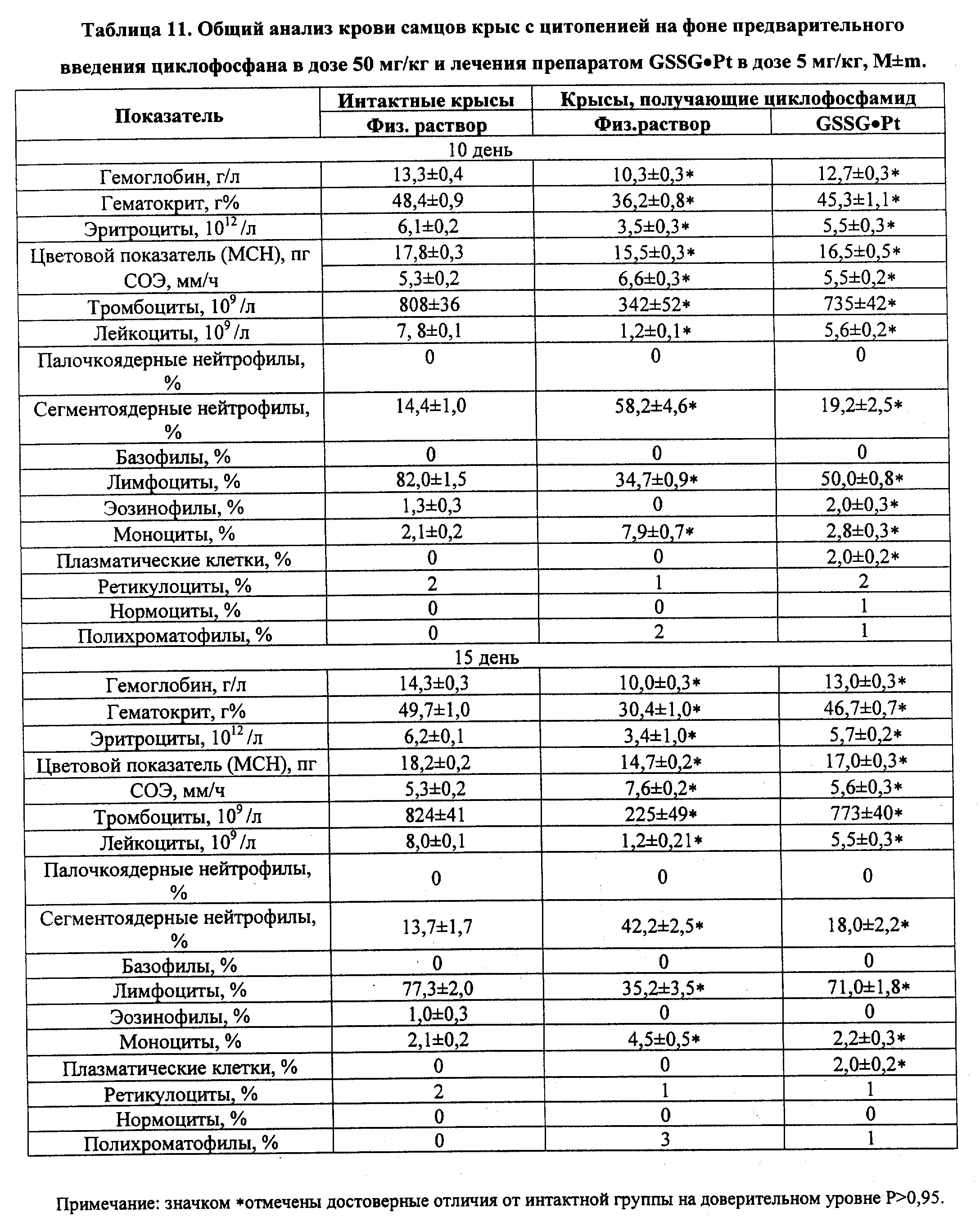
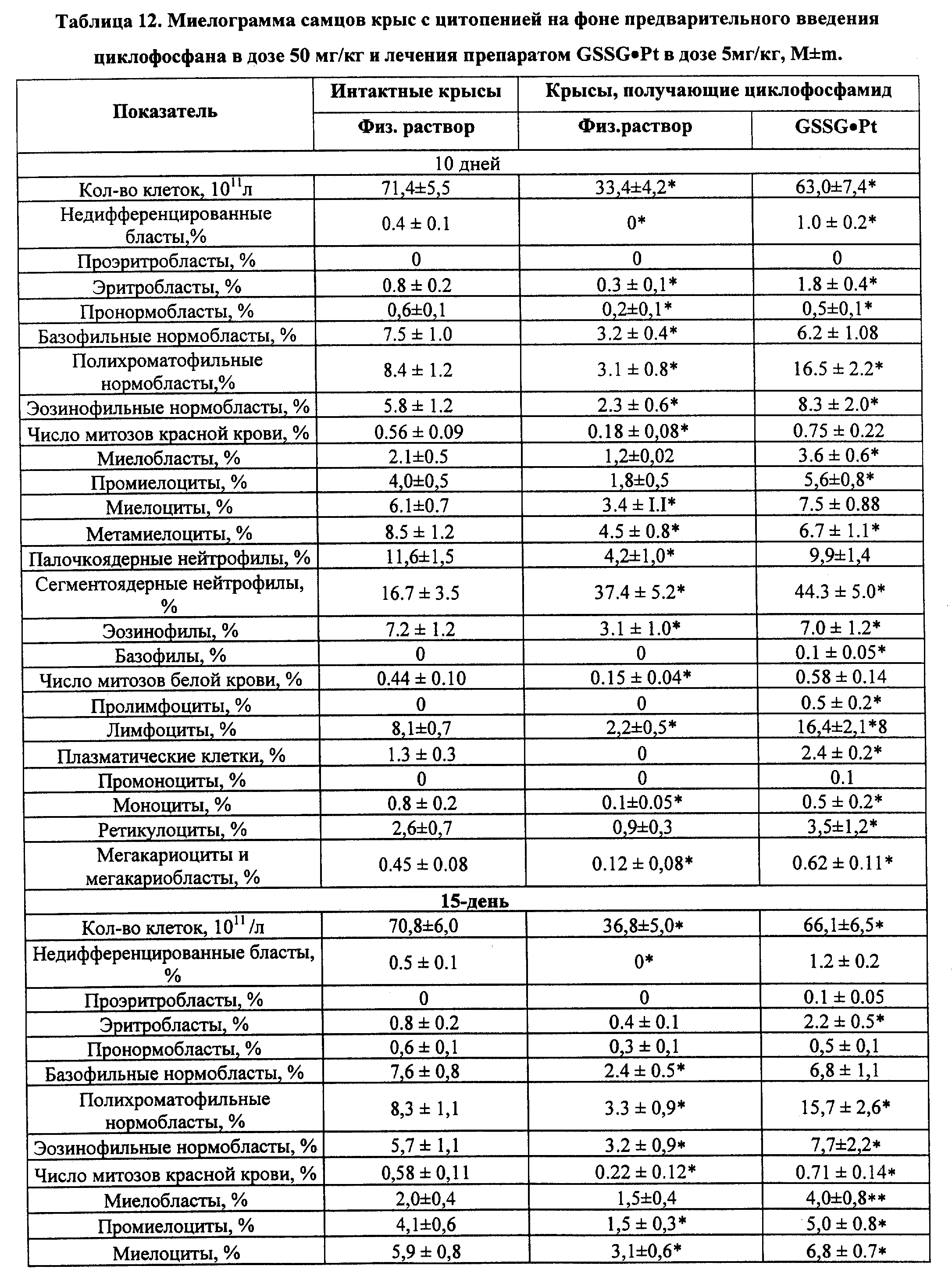
В частности, биологически активное соединение (GSSG•Pt) оказалось способным осуществлять стимуляцию/модуляцию эндогенной продукции гораздо более широкой палитры цитокинов, ростовых и гематопоэтических факторов в условиях радиационной и химической иммуносупрессии (IL- 1 α и β, IL-2, IL-3, IL-4, IL-6, IL-8, IL-10 и IL-12, TNF- α,IFN-α и IFN-γ, эритропоэтина, колониестимулирующие факторы) (см. примеры реализации изобретения 5-7); воспроизведение эффектов ряда цитокинов (IL-2, IL-12, IFN-α и IFN-γ в силу индукции механизмов редокс-чувствительной экспрессии иммунологически значимых генов и модификации "критических" цистеинов ключевых белков клеточных сигналпередающих систем (см. пример реализации изобретения 8); восстановление угнетенного костномозгового кроветворения, в том числе содержание эритроцитов, лейкоцитов и тромбоцитов, а также уровня цитокинов и уровня CD3+, CD4+, CD8+, CD16/56+, CD19/20+, CD25+, CD34+, CD95+ (см. примеры реализации изобретения 9-13) у пациентов, получающих лучевую и высокодозную полихимиотерапию; в условиях активной антибактериальной, противовирусной и противоопухолевой химиотерапии - гепатотропные эффекты, а также снижение проявлений кардио-, нефро- и нейротоксичности. Вероятно, самый важный аспект биолого-фармакологических эффектов GSSG•Pt - дифференцированное воздействие на нормальные (в том числе, испытывающие функциональное напряжение) и трансформированные клетки, а именно, способность GSSG•Pt стимулировать метаболизм, пролиферацию и дифференцировку нормальных клеток/тканей, и, в то же время, индуцировать механизмы апоптоза только в опухоле- и/или вирустрансформированных клетках. При этом, по нашим данным, осуществляется индукция p53-зависимого и p53-независимого, а также Bc1-2-интенсивного путей апоптоза (см. примеры реализации изобретения 14-16).
Таким образом, способ получения целевого продукта,
каким является композит
GSSG•Pt, обеспечивает
синтез субстанции как основы создания препаратов, обладающих рядом
новых свойств, а именно:
а) повышенной биохимической
стабильностью препарата, то есть
"неатакуемостью" ферментами
метаболизма GSSG, в первую очередь, НАДФ•H+-зависимой
глутатионредуктазой, что принципиально увеличивает время
полужизни препарата в биологических средах
именно в форме дисульфида;
б) биофизической компонентой с высоким уровнем
донорно-акцепторного потенциала;
в) наличием дополнительных
реакционно-способных сайтов в пределах данной
молекулы-композита,
следовательно, совершенно новой способности к химической
модификации.
Названные свойства GSSG•Pt
позволяют ему выступать в роли уникального клеточного
"гироскопа", который в
условиях действия экстремальных факторов среды
(физических,
химических и биологических) обеспечивает восстановление
равновесия:
в составе цитокинового профиля, то есть
цитокинов,
преимущественно регулирующих пролиферацию; и цитокинов,
преимущественно регулирующих дифференцировку иммунокомпетентных
клеток;
соотношения окислительно-восстановительного
потенциала клеток,
в том числе, донорно-акцепторного равновесия динамики
π- электронов в клетке вследствие нормализации
тиол-дисульфидного обмена; соотношения НАД/НАД•H и
НАДФ/НАДФ•H;
соотношения цАМФ и цГМФ, динамики вне- и
внутриклеточного
ионизированного кальция;
соотношение транскрипционных факторов дифференцировки (NFkB) и факторов
пролиферации (АР-1); соотношения
проявлений функциональной активности p53,
p21 и
ras-протеинов, - отсюда, равновесие
процессов пролиферации, дифференцировки и апоптоза клеток с учетом принципиально
различных проявлений этих
эффектов в нормальных и трансформированных
клетках.
В свою очередь, целенаправленные терапевтические эффекты производных GSSG•Pt относительно онкологических, инфекционных, иммунологических, ишемических, нейродегенеративных, метаболических, эндокринных и других заболеваний означают создание лекарственных препаратов, фармацевтическая эффективность которых базируется на функционально активном начале - GSSG•Pt - способного регулировать механизмы метаболизма, пролиферации, дифференцировки и апоптоза.
Таким образом, речь идет о методах получения нового класса лекарственных веществ, которые названы тиопоэтинами, рождающих при своей транслокации в биологические среды новый уровень метаболизма и генетической активности клеток.
В заявляемом изобретении, в том числе в примерах его реализации, нами используется следующая принятая в этой области медицины терминология.
Понятие "фармацевтически приемлемая соль", используемое в данной заявке, подразумевает производное GSSG•Pt в виде соли, при этом в данные формулы входят, например, катионы натрия, лития, цинка или ванадия, или соответственно - натриевая, литиевая, цинковая или ванадиевая соль.
Понятие "метаболизм", используемое в данной заявке, подразумевает совокупность всех биохимических реакций, происходящих в живом организме, отвечающих за сохранение жизнеспособности данного организма [12].
Понятие "пролиферация", используемое в данной заявке, подразумевает воспроизводство или умножение сходных форм (клеток) за счет составляющих (клеточных) элементов [13, 14].
Понятие "дифференцировка", используемое в данной заявке, подразумевает приобретение или обладание признаками, отличающими от оригинала, с переходом клетки от выполнения сравнительно примитивных функций к более сложным, специализированным функциям с появлением или усилением морфологической и/или функциональной гетерогенности, присущих данному типу клеток, посредством экспрессии тканеспецифических генов [15, 16, 17, 18].
Понятие "апоптоз", используемое в данной заявке, подразумевает морфологически распознаваемую форму генетически программированной, физиологической клеточной смерти, инициируемой внеклеточными либо внутриклеточными сигналами, при которой активируются ферменты (группы каспаз), вызывающие разрушение (фрагментацию) ядерной ДНК посредством внутринуклеосомных разрывов, морфологически проявляющийся (1) сморщиванием клетки, (2) конденсацией, отграничением и фрагментацией хроматина и (3) сохранением цитоплазматических структур - органелл, но с нарушением их взаимного расположения; в дальнейшем апоптотические клетки либо образовавшиеся из них т.н. апоптотические тельца, которые подвергаются фагоцитозу [19, 20, 21].
Понятие "цитокины", используемое в данной заявке, подразумевает белковой природы регуляторные вещества, продуцируемые различными видами клеток, играющие ключевую роль в развитии иммунного ответа, гематопоэзе и патогенезе различных заболеваний, осуществляющие свой эффект посредством активации генов, участвующие в регуляции всех звеньев иммунной системы (размножение и дифференцировка предшественников иммунокомпетентных клеток); представление антигена, пролиферация антигенсенсибилизированных лимфоцитов, дифференцировка В-лимфоцитов в антителопродуцирующие клетки, Т-лимфоцитов в функционально различные Т-лимфоциты; функции макрофагов, нейтрофилов, эозинофилов, тучных клеток и базофилов), а также контролирующие рост, дифференцировку, апоптоз и функциональную активность клеток различных тканей (включая фибробласты, хондроциты, кератиноциты, эндотелиоциты, клетки нервной ткани и кардиомиоциты) [19, 22].
В основу заявляемого изобретения положен метод синтеза композита окисленного глутатиона, содержащего каталитические (микрограммовые) количества платины (Pt), что обуславливает высокую реакционную способность GSSG•Pt, и новые возможности модификации данной базовой молекулы с получением ее фармацевтически приемлемых производных. Концептуальная модель создания фармацевтических средств, содержащих в качестве действующего вещества GSSG•Pt, производные GSSG•Pt в виде его солей; или использование производных GSSG•Pt в качестве новых композиций, то есть формул новых соединений, когда последние получают посредством образования сильных (ковалентных) и слабых (водородных, ионных) связей.
Согласно изобретению способ получения композита окисленного глутатиона осуществляют путем окисления восстановленного глутатиона в водном растворе перекиси водорода, причем окисление осуществляют в присутствии cis-диаминодихлорплатины, при этом режим лимитирующих факторов проведения данной стадии химической реакции заключается в использовании водного раствора восстановленного глутатиона в виде мононатриевой соли, к которому добавляют 0,9 эквивалента перекиси водорода и 0,001 эквивалента cis-диаминодихлорплатины, с последующей лиофильной сушкой реакционного раствора и получением композита, состоящего из динатриевой соли окисленного глутатиона с cis-диаминодихлорплатиной (GSSG•Pt).
Согласно изобретению исходный композит химически модифицируют посредством образования ковалентных, водородных или ионных связей с представителями различных классов химических соединений, таких как аминокислоты, оксикислоты, карбоновые кислоты, нуклеотиды и нуклеозиды.
Согласно изобретению исходный композит химически модифицируют посредством образования амидных связей между аминогруппами GSSG•Pt и карбоксильными группами аминокислот, оксикислот, карбоновых кислот и олигопептидов.
Согласно изобретению исходный композит химически модифицируют посредством образования фосфоамидных связей между аминогруппами GSSG•Pt и остатками фосфорной кислоты нуклеотидов, а также эфиров фосфорной кислоты и глицеринов.
Согласно изобретению исходный композит химически модифицируют посредством образования амидных связей между карбоксильными группами GSSG•Pt и биогенными аминами, включая производные пуриновых оснований.
Согласно изобретению исходный композит химически модифицируют посредством образования симметричных и несимметричных дисульфидов с тиол-содержащими соединениями.
Согласно изобретению исходный композит химически модифицируют посредством образования амидной и сложной эфирной связей для ковалентного связывания с остатками стероидных соединений.
Согласно изобретению исходный композит химически модифицируют посредством образования соединений GSSG•Pt солевого типа, где в качестве противоионов используют катионы металлов, производные аммониевых катионов и анионы неорганических кислот.
Согласно изобретению исходный композит, а также его соли химически модифицируют на основе использования аминокислот D-ряда, включая аминокислоты, входящие в формулу GSSG•Pt.
Согласно изобретению композит состоит из динатриевой соли окисленного глутатиона с cis-диаминодихлорплатиной (GSSG•Pt) в мольном соотношении 1000: 1 и имеет стабилизированную дисульфидную связь, что обеспечивает существенное увеличение продолжительности времени полужизни композита в биологических средах.
Согласно изобретению фармацевтическая композиция содержит в качестве активного начала эффективное количество композита и физиологически приемлемый носитель.
Согласно изобретению фармацевтическая композиция содержит физиологически приемлемый носитель и активное начало, представляющее собой эффективное количество композита в виде соли. При этом фармацевтически приемлемыми производными в форме солей могут являться натрий, литий, калий, кальций, цинк, железо, молибден, ванадий, магний, марганец или фтор содержащие соли.
Согласно изобретению фармацевтическая композиция содержит физиологически приемлемый носитель и активное начало, представляющее собой эффективное количество одного из фармацевтически приемлемого производного композита, полученного путем его химической модификации.
Согласно изобретению лекарственное средство, содержащее композит, или химически модифицированную соль, или одно из его фармацевтически приемлемых производных обладает максимальной тропностью к отдельным органам/тканям и целенаправленными биолого-фармакологическими эффектами, обеспечивающими регуляцию процессов метаболизма, пролиферации, дифференцировки в нормальных клетках и индукцию механизмов апоптоза в опухоле- и/или вирустрансформированных клетках.
Согласно изобретению лекарственное средство предназначено для модуляции эндогенной продукции цитокинов и гемопоэтических факторов и/или воспроизведения эффектов цитоконов и, отсюда, регуляции процессов метаболизма, пролиферации, дифференцировки и/или апоптоза.
Согласно изобретению лекарственное средство может быть использовано для лечения онкологических инфекционных, иммунологических, гематологических, ишемических, нейродистрофических, метаболических расстройств и эндокринопатий.
Согласно изобретению способ целенаправленной модуляции и/или воспроизведения эффектов цитокинов и гемопоэтических факторов, и/или индукции механизмов апоптоза в опухоле- и/или вирустрансформированных клетках заключается во введении в организм млекопитающих указанного выше лекарственного средства с использованием шкалы доз от 0,01 до 1,0 мг на кг массы тела, или от 1 до 100 мг на 1 м2 поверхности тела по крайней мере один раз в день в течение периода, необходимого для достижения лечебного эффекта.
Согласно заявляемому изобретению, авторы впервые показали, что препарат GSSG•Pt и его производные оказывают регулирующее воздействие на процессы эндогенной продукции цитокинов и, отсюда, на процессы пролиферации и дифференцировки субпопуляций T- и В-лимфоцитов (CD+-клеток). Это связано с тем, что препарат индуцирует наработку широкой гаммы цитокинов и CD+-лимфоцитов. Отсюда, в этой палитре, с точки зрения взаимодействия цитокинов, имеются и цитокины-агонисты, и цитокины-антагонисты по отношению к стимулируемым ими эффектам (например, "отношения" IL-1 α и β, и IL-4). В этой связи, в зависимости от исходного состояния системы иммуногенеза у пациентов: гипер- или гипоактивность - препараты группы GSSG•Pt поистине восстанавливают нарушенное равновесие в системе.
Таким образом, сущность заявляемого изобретения состоит в том, что в качестве действующего вещества (активной субстанции), обеспечивающей модуляцию эндогенной продукции цитокинов и гемопоэтических факторов, у субъектов, нуждающихся в этом, предлагается использовать структурный аналог окисленного глутатиона - композит гексапептида со стабилизированной дисульфидной связью (GSSG•Pt), который при парентеральном введении обладает новой способностью влиять на цитокиновый профиль, чем достигается регуляция процессов метаболизма, пролиферации и дифференцировки нормальных клеток.
При этом в опухоле- и/или вирустрансформированных клетках индуцируется механизм апоптоза вследствие мультицитокинактивирующего действия GSSG•Pt; его влияния на p53-зависимый и p53-независимый механизмы индукции апоптоза; а также посредством изменения донорно-акцепторного равновесия π-электронов в злокачественных (раковых) клетках.
Данные соединения и их лекарственные формы, полученные на основе GSSG•Pt, заявляются как лекарственные средства, способные в терапевтических целях в зависимости от исходного биологического состояния субъекта, нуждающегося в этом, стимулировать/модулировать эндогенную продукцию широкого спектра цитокинов и гемопоэтических факторов и/или воспроизводить эффекты цитокинов, а также осуществлять дифференцированное воздействие в отношении нормальных (регуляция метаболизма, пролиферации и дифференцировки) и трансформированных клеток (индукция механизмов апоптоза). При этом, говоря о трансформированных клетках, имеется в виду, что это опухоле- и/или вирустрансформированные клетки.
Особое предпочтение отдается производным GSSG•Pt в форме его натриевой, литиевой, калиевой, кальциевой, цинковой, молибденовой, ванадиевой, магниевой, марганцовой солей, железо- или фторсодержащих солей, а также производных GSSG•Pt, полученных посредством ковалентного связывания с фенилаланином или с метионином и некоторыми другими аминокислотами, включая D- и L-формы аминокислот.
Следует подчеркнуть, что максимальное проявление иммунологических, биохимических и молекулярно-биологических эффектов лечебного действия препарата GSSG•Pt достигается в том случае, когда используется комбинация, состоящая на 50% из GSSG•Pt, в котором все аминокислоты представлены в L-форме, и на 50% из GSSG•Pt, в котором две химически однозначные аминокислоты представлены в D-форме, а остальные - в L-форме.
Согласно предлагаемому изобретению, лекарственное средство, получаемое на основе GSSG•Pt, для лечения онкологических, инфекционных, гематологических, иммунологических, ишемических, нейродегенеративных, метаболических, эндокринных и других заболеваний, содержит в качестве фармацевтически активного компонента эффективное количество GSSG•Pt, или фармацевтически приемлемых производных GSSG•Pt в форме его солей; или композиций, представляющих собой GSSG•Pt, ковалентно связанный с фармацевтически приемлемым веществом из группы активных метаболитов. Предпочтительно, чтобы фармацевтически приемлемые производные GSSG•Pt для парентерального использования применяли в виде фармацевтически приемлемого раствора, например водного раствора, включая воду, растворы глюкозы, изотонические растворы хлорида натрия, забуференные солевые растворы.
Обнаруженная в процессе исследований (см. примеры реализации изобретения NN 5-16) индуцированная посредством GSSG•Pt стимуляция/модуляция эндогенной продукции цитокинов и гемопоэтических факторов и связанная с этими эффектами регуляция метаболизма, пролиферации, дифференцировки и механизмов апоптоза клеток, приводит к противоопухолевому, противоинфекционному, гемопоэтическому, иммуномодулирующему и другим фармакологическим эффектам, которые, в свою очередь, обеспечивают достижение лечебного или профилактического действия при различных заболеваниях.
Является предпочтительным, чтобы фармацевтически приемлемые производные GSSG•Pt вводили в организм в дозе от 0.01 до 1.0 мг основания GSSG•Pt на кг массы тела в пересчете на основание или соль GSSG•Pt; или в дозе от 1 до 100 мг на 1 м2 поверхности тела, а в случаях накожного применения/введения посредством инстилляций в дозе от 1 мг до 100 мг на 1 м2 поверхности тела, по крайней мере, однократно в каждый период времени, состоящий из 24 часов. Также данное вещество может быть введено путем последовательных инъекций или другим способом получено организмом с целью достижения общей дозировки от 0.01 до 1.0 мг на кг массы тела - случае введения основания или солей GSSG•Pt, и от 1.0 до 100 мг на 1 м2 поверхности тела в течение каждых 24 часов. Желательно, чтобы применение и введение данного вещества в организм проводили до тех пор, пока не будет получен желаемый эффект стимуляции продукции цитокинов и гемопоэтических факторов либо индукции апоптоза и тем самым регуляции метаболизма, пролиферации и дифференцировки клеток и не достигнут соответствующий терапевтический эффект.
Согласно заявляемому изобретению предлагается базовый лекарственный препарат и группа фармацевтически приемлемых препаратов, получаемых на основе GSSG• Pt, для лечения инфекционных, онкологических, гематологических, нейродегенеративных, ишемических и других заболеваний, а также заболеваний вследствие иммунных, метаболических и эндокринных нарушений, при которых стимуляция эндогенной продукции цитокинов и гемопоэтических факторов и/или индукция механизмов апоптоза является целесообразной. Указанные лекарственные средства в качестве активного начала содержат эффективное количество GSSG•Pt или его фармацевтически приемлемых производных. Целесообразно применять лекарственную форму препарата в виде инъекционного раствора, содержащего от 0.01 до 3.0% основания GSSG•Pt или его солей; и от 1.0 до 10% основания GSSG•Pt или его солей в случае применения препаратов GSSG•Pt в форме растворов для ингаляций, локальных инстилляций, глазных капель, интраназального введения или мазей для накожных аппликаций.
В изобретении заявляется также целесообразность получения на основе GSSG•Pt или его солей фармацевтически приемлемых композиций, то есть новых формул химических соединений, в которых GSSG•Pt ковалентно связан с фенилаланилом или получен в виде литиевой соли (см. примеры реализации изобретения 1 и 2).
Фармацевтически приемлемые производные GSSG•Pt целесообразно использовать как лекарственные средства в виде 0.01 - 3.0% инъекционного раствора со шкалой доз от 0.01 до 1.0 мг основания GSSG•Pt или его солей на кг веса тела; или в дозах от 1 до 100 мг на 1 м2 поверхности тела, один или более раз в день, однократно или последовательно до получения желаемого терапевтического эффекта.
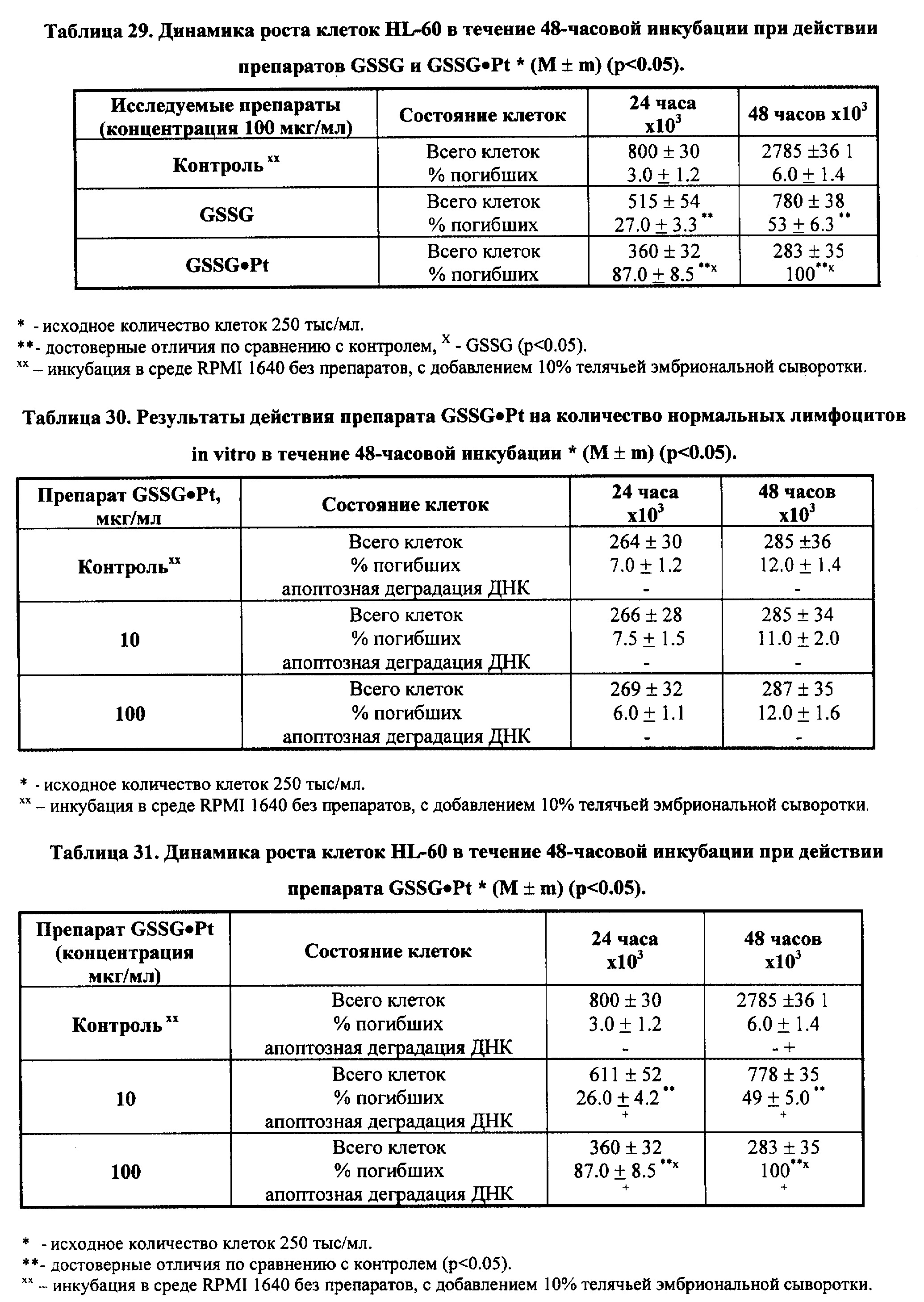
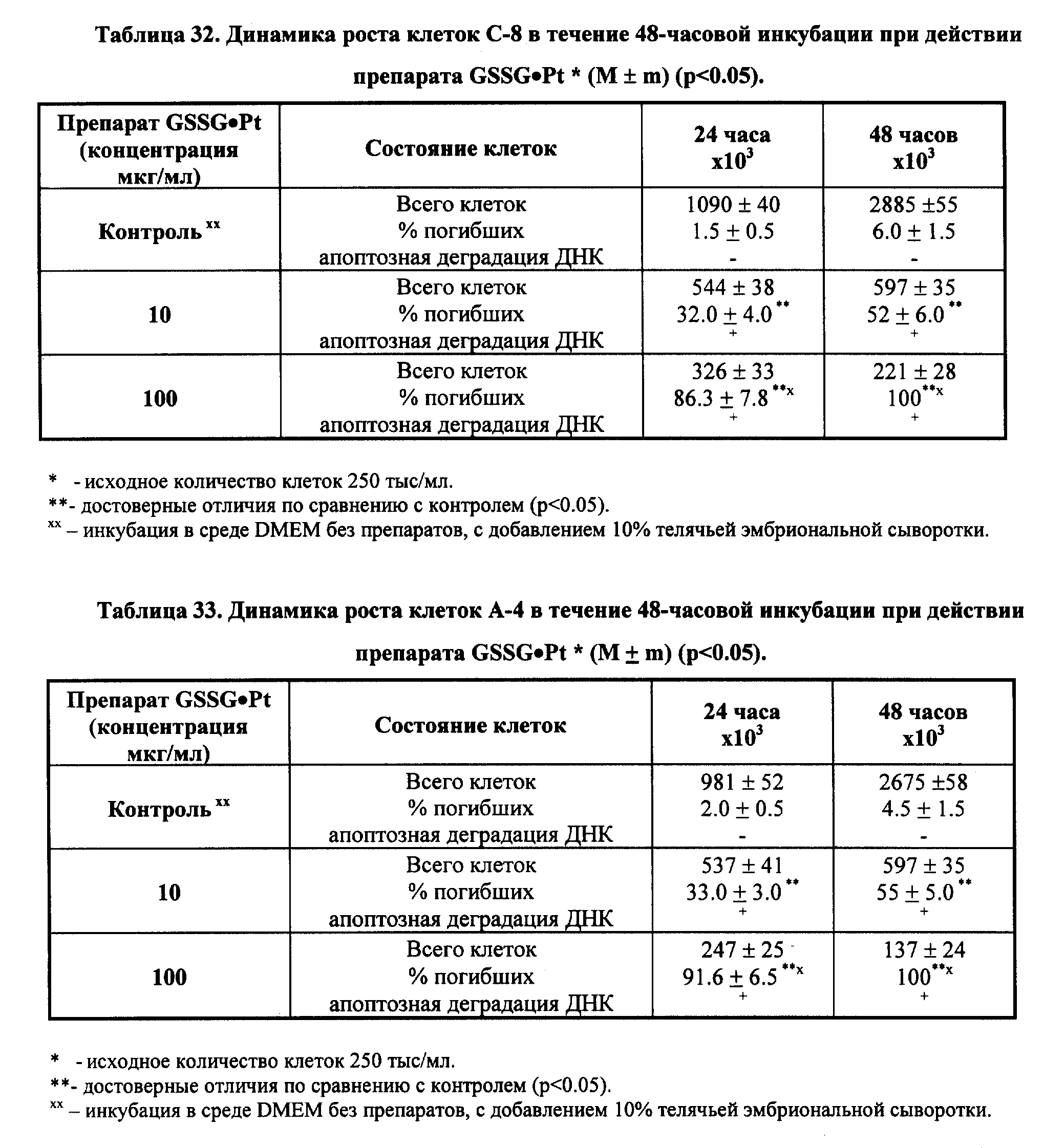
Выполненные экспериментальные и клинические исследования однозначно свидетельствуют о том, что терапевтические эффекты препаратов, полученных на базе GSSG•Pt и его производных, основываются на их мультицитокинактивирущем действии и способности воспроизводить эффекты цитокинов и гемопоэтических факторов. Вместе с тем, нами получены данные, свидетельствующие о возможности прямого противоопухолевого эффекта GSSG• Pt, особенно солей GSSG•Pt, применяемых в составе фармацевтически приемлемых лекарственных форм. Более того, действие GSSG•Pt проявляется дифференцированным эффектом относительно нормальных и опухолевых клеток. Исследования с применением нормальных и опухолевых клеток показало, что GSSG•Pt или GSSG•Pt в составе фармацевтически приемлемых композиций инициирует гибель опухолевых клеток по апоптотическому механизму. При этом в случае нормальных клеток их гибели не наблюдалось (см. примеры реализации изобретения 14-16).
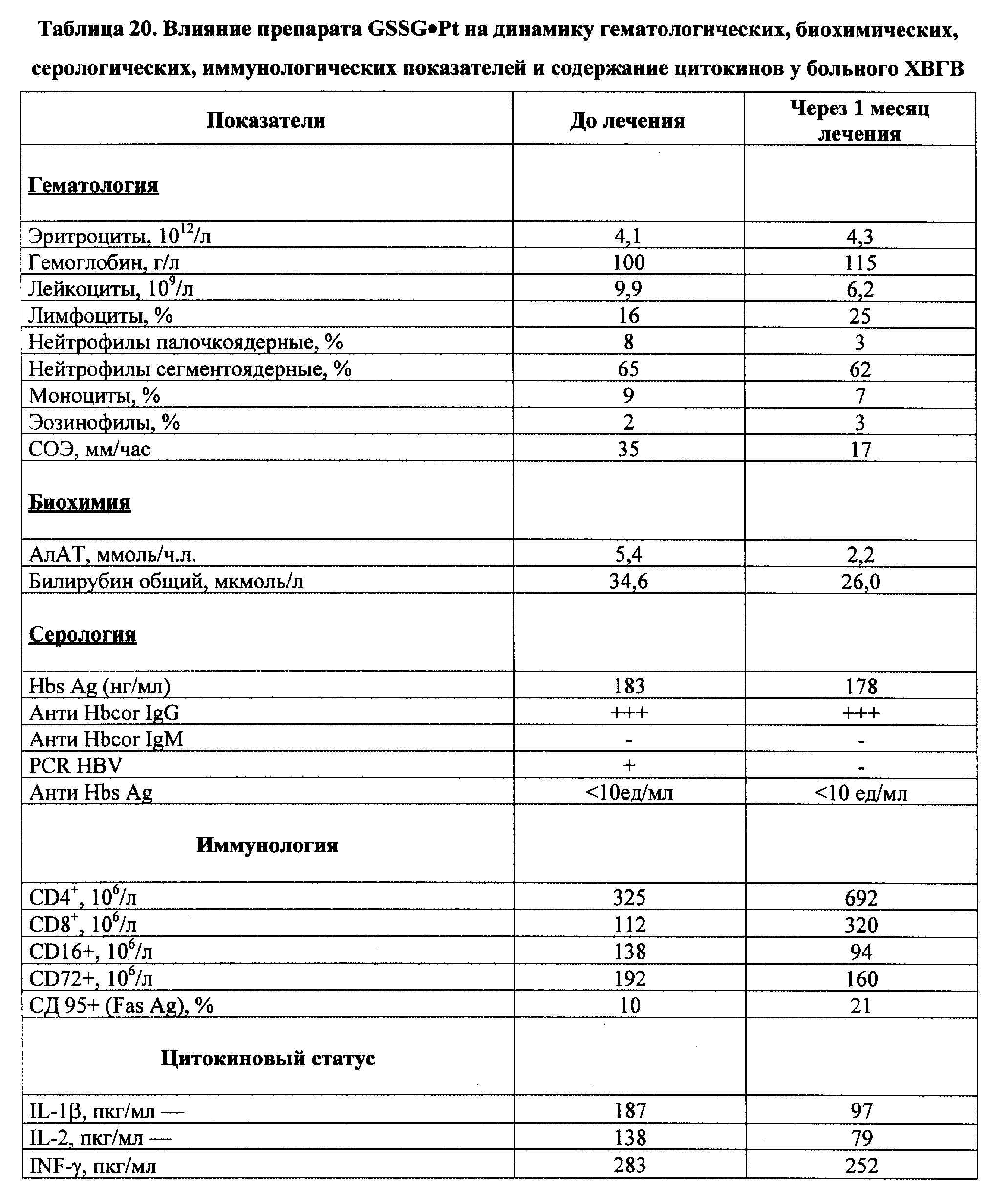
Следует также отметить высокую эффективность лекарственных форм на основе GSSG•Pt относительно индукции механизмов апоптоза в вирустрансформированных клетках, например в случае вирусных гепатитов В и С, что подтверждают приведенные ниже клинические примеры реализации изобретения 11-13.
Терапевтический эффект GSSG•Pt и его фармацевтически приемлемых производных, в частности солей, при лечении онкологических, инфекционных (вирусных) заболеваний может быть объяснен как стимуляцией продукции широкой палитры эндогенных цитокинов, так и уникальной способностью активировать апоптотическую гибель исключительно трансформированных клеток. Более того, может быть заявлено, что большинство из терапевтических эффектов GSSG•Pt и его фармацевтически приемлемых производных, как в экспериментальных, так и в клинических условиях, связано с выявленными нами свойствами GSSG•Pt и его лекарственных форм стимулировать/модулировать эндогенную продукцию цитокинов или воспроизводить их эффекты в отношении того, что касается регуляции (восстановления нормального соотношения) пролиферации и дифференцировки нормальных клеток и в то же время активировать апоптотическую гибель исключительно трансформированных клеток.
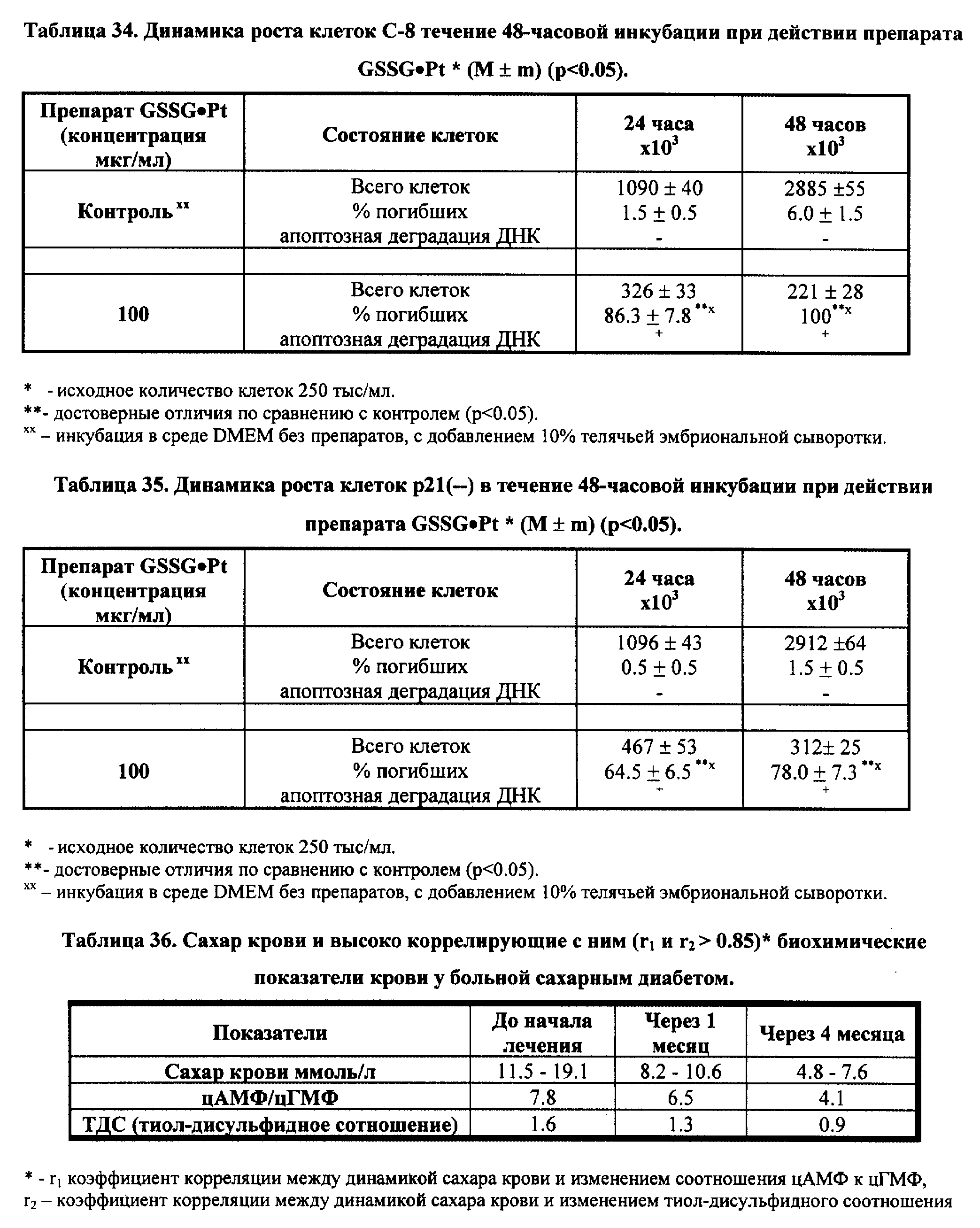
Столь же новым с точки зрения терапевтической платформы их формирования оказалось корригирующее влияние GSSG•Pt и его солей на метаболические нарушения, в частности на нарушения углеводного обмена при диабете II типа. В этом случае (см. пример реализации изобретения N 7) восстановление под действием GSSG•Pt (его ванадиевой соли) нормального соотношения ц-АМФ/ц-ГМФ, а также соотношения тиол-дисульфидного обмена в тканях обеспечило стабильную нормализацию содержания сахара в крови пациента, т.е. убедительный терапевтический эффект.
Резюмируя результаты выполненных экспериментальных, доклинических и клинических исследований препаратов на основе GSSG•Pt, следует подчеркнуть, что парентеральное (внутривенное, внутримышечное, подкожное; инстилляции в мочевой пузырь или per rectum) введение указанных лекарственных средств обеспечивает: а) стимуляцию/модуляцию эндогенной продукции IL-1 α и β, IL-2, IL-3, IL-4, IL-6, IL-8, IL-10 и IL-12, TNF α, IFN -α и IFN -γ, эритропоэтина, G-CSF, M-CSF и GM-CSF; отсюда - широкую гамму биохимических и иммунологических эффектов; б) воспроизведение эффектов названных цитокинов и гемопоэтических факторов в случае десенситизации рецепторов к цитокинам; а также в) индукцию механизмов апоптоза исключительно в опухоле- или вирустрансформированных клетках, вызывая в организме субъекта, нуждающегося в этом, соответствующий терапевтический эффект.
Применение данных фармацевтически приемлемых производных GSSG•Pt в виде его солей или композиций, обеспечивает получение лекарственных средств, обладающих преимущественным терапевтическим эффектом либо в отношении опухолевых заболеваний, либо вирусных инфекций, либо гематологических заболеваний, либо иммуноаутоагрессий; либо ишемических или эндокринных поражений; а также обладающих преимущественной тропностью (сродством) к тем или иным органам и тканям.
Приведенные ниже примеры реализации изобретения демонстрируют возможность его практической применимости и подтверждают его эффективность, а также целесообразность применения данных лекарственных средств в виде инъекционных растворов, содержащих от 0.01 до 3% основания GSSG•Pt или его солей с использованием шкалы доз от 0.01 до 0.5 мг на кг массы тела; или от 1 до 30 мг на 1 м2 поверхности тела. В случае применения препаратов GSSG•Pt в форме растворов для ингаляций, локальных инстилляций, глазных капель, интраназального введения или мазей для накожных аппликаций, или свечей, рекомендуемые концентрации находятся в диапазоне от 1 до 10% основания GSSG•Pt или его солей.
Активное вещество, композит гексапептида со стабилизированной дисульфидной связью - GSSG•Pt, обладающий способностью стимулировать/модулировать эндогенную продукцию цитокинов и гемопоэтических факторов, а также индуцировать апоптоз трансформированных клеток, получается оригинальным, разработанным авторами методом пептидного синтеза, изложенным в данном патенте. Полученный таким образом композит гексапептида (GSSG•Pt) с целью его дальнейшего применения у людей и животных, используется в виде фармацевтически приемлемых производных GSSG•Pt в инъекционной лекарственной форме, получаемой путем растворения сухого вещества в стерильной воде для инъекций или любом фармацевтически приемлемом растворителе с конечной концентрацией 0.01-3.0%. Для исследований в условиях in vitro GSSG•Pt или его производные могут растворяться в приемлемых для проведения соответствующих экспериментов жидкостях, таких как культуральные среды, изотонические солевые растворы, растворы глюкозы и т.д.
Предпочтительно, чтобы была использована водная основа или растворитель, в то же время могут быть использованы другие физиологически приемлемые основы или растворители. Для местного применения, включая применение в различные полости тела, могут быть использованы органические растворители или основы в виде мазей, паст, кремов или свечей.
Приготовление лекарственной формы для применения у людей и животных должно выполняться с соблюдением условий стерильности и апирогенности и должно исключать возможность химического или бактериального загрязнения лекарственной формы.
Инъекционные лекарственные формы GSSG•Pt, его солей и композиций были исследованы в экспериментах на животных, а также в ходе широких клинических испытаний и пилотных исследований на больных людях.
Таким образом, заявляется и обосновывается способ получения композита GSSG с cis-диаминодихлорплатиной; метод получения на основе GSSG•Pt нового класса лекарственных веществ (тиопоэтинов), лечебные эффекты которых определяются впервые установленными и ранее неизвестными свойствами осуществлять стимуляцию эндогенной продукции цитокинов и гемопоэтических факторов и воспроизведение их эффектов, следовательно, осуществлять стимуляцию и/или модуляцию пролиферации и дифференцировки нормальных клеток, а также индуцировать механизмы апоптоза в опухоле- и вирустрансформированных клетках.
Благодаря использованию максимально достижимой концентрации инъекционного раствора натриевой соли GSSG•Pt (10.0%, 100 мг/мл) в воде для инъекций (или в физиологическом растворе, а также благодаря использованию максимально переносимых объемов жидкости, инъецируемых мышам при внутрибрюшинном (в/б, 2.0 мл), внутривенном (в/в, 0.5 мл) и внутримышечном (в/м, 0.05 мл) введении, были достигнуты дозы GSSG•Pt, составляющие 5000 мг/кг (в/б), 1350 мг/кг (в/в) и 135 мг/кг (в/м), что превышает максимальную дозу, рекомендуемую для человека и составляющую 0.5 мг/кг, в 1000, 270 и 27 раз соответственно. Ни в одном из случаев не отмечалось гибели животных, а также каких-либо токсических проявлений, что фактически свидетельствует о нетоксичности GSSG•Pt, используемого в лекарственной форме раствора для инъекций, а также о нетоксичности применявшихся фармацевтических композиций, содержащих GSSG• Pt.
На фиг. 1 показана структурная формула - бис- γ - L-глутамил)-L-цистинил-бис-глицин динатриевая соль с cis-диаминодихлорплатиной.
На фиг. 2 показана схема синтеза композита динатриевой соли окисленного глутатиона с cis-диаминодихлорплатиной.
На фиг. 3 показана донорно-акцепторная связь между атомом платины и двумя группами NH3 за счет неподеленных электронов атомов азота.
На фиг. 4 представлен механизм стабилизации дисульфидной связи молекулы GSSG за счет обмена лигандов: NН3-групп на атомы серы дисульфидной связи, а также посредством образования донорно-акцепторной связи между атомом платины и двумя атомами серы за счет неподеленных электронов атомов серы.
На фиг. 5 представлены механизмы стабилизации общей конформации молекулы GSSG за счет механизма, показанного на фиг. 4, а также путем обмена лигандов NH3 на NH2 группы глутатиона (сближение NH2 групп и, соответственно, GS фрагментов), формирующих новую "биофизику" композита GSSG•Pt.
На фиг. 6 показаны основные сайты химической модификации молекулы GSSG•Pt.
На фиг. 7 показана структурная формула бис-фенилаланил-GSSG•Pt.
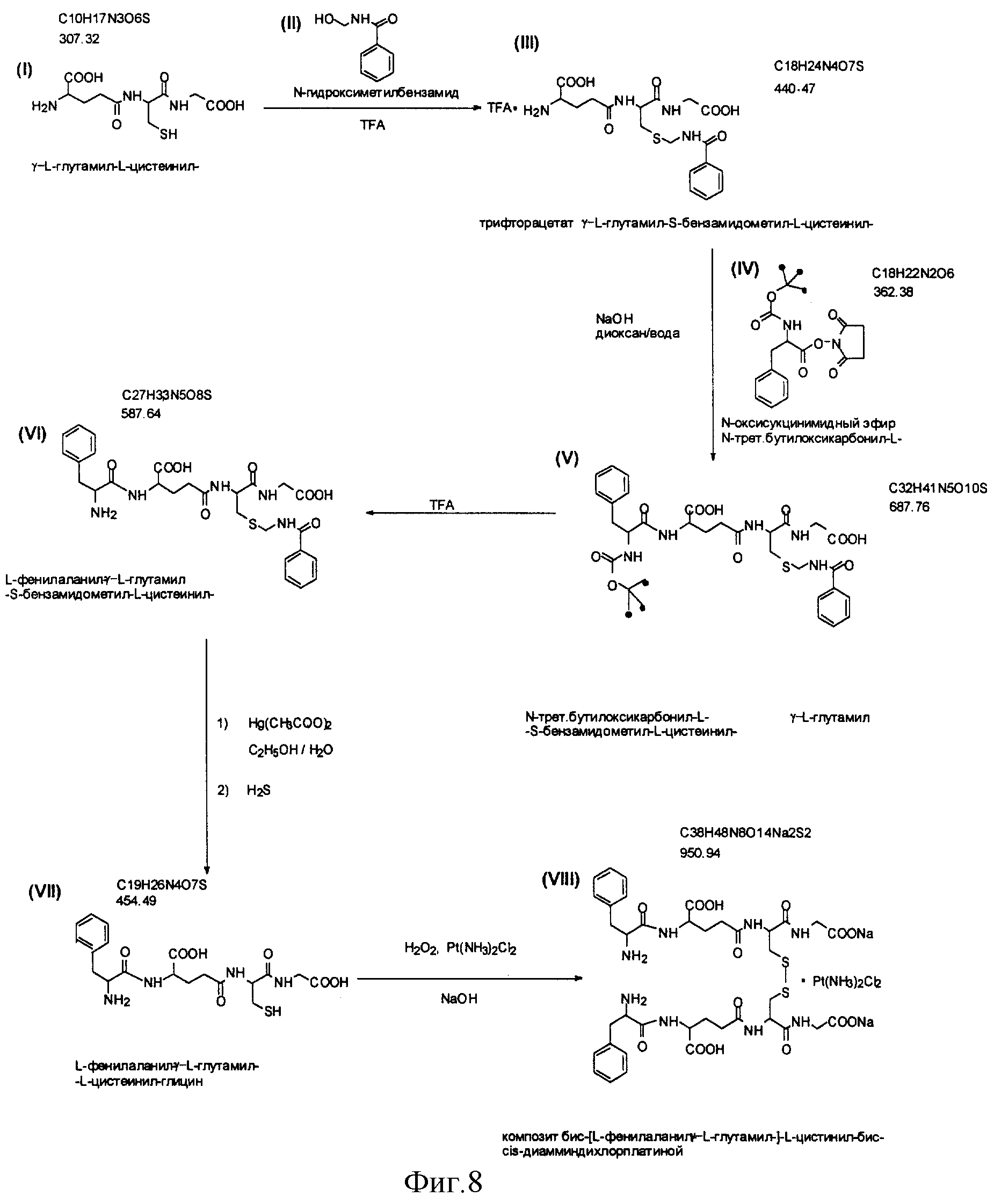
На фиг. 8 изображена схема синтеза бис-[L-фенилаланил -γ - L-глутамил-] -L-цистинил-бис-глицина на основе GSSG•Pt.
Пример 1
Синтез натриевой соли
бис-L-фенилаланил-( γ
- L-глутамил)- L-цистинил-бис-глицина
I.
Общая характеристика препарата.
1. Название: биc-(L-фeнилaлaнил -γ - L-глутaмил)-L-циcтинил-биc- rлицин динaтpиeвaя coль композит с cis-диаминодихлорплатиной.
2. Структурная формула - приведена на фиг. 7.
3. Брутто-формула: C38H48N8O14Na2S2 •
[Pt(NH3)2Cl2]
4. Молекулярный вес: 950,94 на C38H48
N8O14Na2S2
с содержанием Pt 0,033%
5.
Внешний вид: белый порошок без запаха.
6. Растворимость: растворим в воде, изотоническом растворе хлорида натрия 0,9% для инъекций; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
7. Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен.
8. pH 0,1% раствора:
5.75
потенциометрически
9. Подлинность:
а) аминокислотный анализ (6 н. HCl,
110oC, 20
ч), (допустимая погрешность 20%, для цистеина 35%),
в соответствии: глицин - 2,00;
глутаминовая кислота - 1,92; цистеин - 1,81; фенилаланин - 2,04;
б) ЯМР(1
H)-спектроскопия, в
соответствии "BRUKER" AM 500, 500 MHz, D2
O
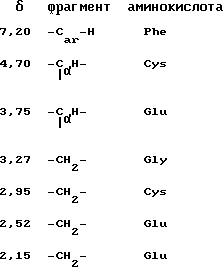
10. Чистота (содержание основного вещества):
а) ВЭЖХ: не менее 97%
прибор BECKMAN "Gold Nouveau Chromatography Data System" Version 1.0, Diod Array Detector Module 126. Проба 20 мкл 0,1% раствора препарата, хроматографирование на колонке ULTRASPERE ODS 250х4,6 мм с обращенной C18-фазой в изократическом режиме ацетонитрил - 0,1% трифторуксусная к-та (2:98); скорость потока 1 мл/мин, детектирование при 220 нм, сканирование 190-600 нм, PDA функции - Contour Plot, 3D.
б) по аминокислотному анализу 85% (анализ по п. 9а с точной навеской);
в) ТСХ
- гомогенен,
анализ проводится при нанесении в полосу 5 мкл 0.1% раствора
препарата.
Пластинки Kieselgel 60f (Merck) 10х5 см, система: н. бутанол - уксусная кислота - вода (4:1:1).
Проявление по
стандартным методикам - нингидрин и хлор/бензидин. Rf
=
0,15;
г) содержание натрия (Na) по эмиссионному спектральному методу 4,8 %;
д) содержание платины
(Pt) по
масс-спектральному методу 0,033%.
11. Найденное
содержание
элементов, мкг/г:
Серебро (Ag) - < 1.0 (< 0.0001%)
Алюминий (Al) - 2.0
Мышьяк (As)
- < 1.0
Барий (Ba) - <
0.50
Бериллий (Be)
- < 0.05
Кальций (Ca) - 7.0
Кадмий (Cd) - < 0.05
Кобальт (Со) - <
0.5
Хром (Cr) - 1.7
Медь
(Cu) - < 0.5
Железо (Fe)
- < 1.0
Калий (К) - < 2.5
Селен (Se) - < 2.0
Магний (Mg) - <
2.5
Марганец (Mn) - < 0.2
Молибден (Mn)
- <
0.2
Натрий (Na), мг/г - 48
Никель (Ni) - < 0.5
Свинец (Pb) - < 0.40
Платина (Pt), мкг/г
- 330
Стронций (Sr) - 1.9
Титан
(Ti)
- < 0.5
Ванадий (V) - < 0.5
Цинк (Zn) - 0.65
Сурьма (Sb) - <
0.5
Методика определения
Точная навеска пробы (около 50 мг)
растворялась в 50 мл бидистиллированной воды и раствор использовался для анализа.
Содержание платины определялось количественно методом масс-спектрометрии с индуктивно-связанной плазмой на приборе модели PQe, фирмы VG Elemental, Англия. Относительная точность анализа 5%.
Содержание других элементов определяется количественно методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой на приборе модели TRACE 61E, фирмы Thermo Jarrell Ash, США. Относительная точность анализа 5%.
12. Потеря массы при сушке: 10% при сушке до постоянного веса при 100oC в вакууме (1 мм Hg) над CaCl2 и Р2O5.
II Описание методики синтеза.
13) Химическая схема процесса - представлена на фиг. 8.
14) Описание методики
(III). Продукт (I)
γ
- L-глутамил-L-цистеинил-глицин в
количестве 3,07 г (10 ммоль) и
N-гидроксиметилбензамид
(II) в количестве 5,89 г (13 ммоль) растворяют в 30 мл безводной трифторуксусной кислоты (TFA)
и перемешивают
при комнатной температуре в течение
1 часа. Затем растворитель
отгоняют в вакууме при
40oC, к остатку добавляют 30 мл безводного этилового спирта, снова отгоняют
растворитель в вакууме и
эту операцию повторяют еще 2 раза.
Продукт кристаллизуют
растиранием в 50 мл
безводного диэтилового эфира, отфильтровывают, промывают на фильтре 2х20 мл безводным эфиром и
сушат далее в вакууме над
КОН и P2O5.
Перекристаллизация из
90% этанола. Выход 5,
50 г (80%). Rf = 0,43, Kieselgel 60f (Merck) 10х5 см, система:
н.бутанол - уксусная кислота - вода
(4:1:1).
(V). Продукт (III) в количестве 4,40 г (10 ммоль) перемешивают в смеси 15 мл дистиллированной воды и 25 мл диоксана, далее при перемешивании добавляют 10 мл (20 ммоль) 2 N раствора NaOH.
Затем в реакционную смесь вносят 3,62 г (10 ммоль) N-оксисукцинимидного эфира фенилаланина (IV) и перемешивание продолжают при комнатной температуре в течение 12 ч. Затем реакционную смесь упаривают в вакууме при 40oC досуха. Остаток растворяют в 200 мл этилацетата и промывают 2х50 мл 1 н. серной кислотой, водой, 1% раствором бикарбоната натрия (2х50), водой и сушат органический слой над безводным хлористым кальцием.
Далее этилацетат отгоняют в вакууме при 40oC досуха и продукт закристаллизовывают в системе этилацетат/эфир.
Кристаллы отделяют фильтрованием и сушат в вакууме над пятиокисью фосфора до постоянного веса. Выход продукта (V) 4, 88 г (70%). Rf = 0,80, Kieselgel 60f(Merck) 10х5 см, система: н.бутанол - уксусная кислота - вода (4: 1:1).
(VI). Продукт (V) 6,87 г (10 ммоль) растворяют в 20 мл перегнанной трифторуксусной кислоты и раствор выдерживают при комнатной температуре в течение 2 ч. Затем продукт высаживают абсолютным эфиром (около 200 мл), отфильтровывают и сушат в вакууме над КОН до постоянного веса. Выход продукта (V) 5,28 г (90%). Rf = 0,48, Kieselgel 60f (Merck) 10х5 см, система: н.бутанол - уксусная кислота - вода (4:1:1).
(VII). Продукт (IV) 5,87 г (10 ммоль) растворяют в 100 мл смеси метанол-вода (1: 1), добавляют 200 мл (10 ммоль) раствора ацетата ртути и смесь перемешивают при комнатной температуре 1 час. Затем через раствор барботируют ток сероводорода в течение 20 мин, проверяя полноту осаждения в пробе. Осадок сульфида ртути отфильтровывают, фильтрат упаривают в вакууме до объема 10 мл, добавляют 200 мл изопропилового спирта и закристаллизовывают продукт при охлаждении до 0-4oC. Кристаллы отфильтровывают, промывают изопропиловым спиртом, ацетоном и сушат в вакууме над P2O5. Выход продукта (VII) 3,72 (82%). Rf = 0,30, Kieselgel 60f (Merck) 10х5 см, система: н.бутанол - уксусная кислота - вода (4:1:1).
(VIII). Продукт (VII) 4,54 г (10 ммоль) суспендируют в 20 мл воды и при перемешивании прибавляют 5 мл (10 ммоль) 2N раствора NaOH и затем 4,8 мл 0,05% водного раствора cis-диаминодихлорплатины cis-[Pt(NH3)2Cl2]. Раствор охлаждают до температуры 18-20oC и небольшими порциями в течение примерно 2 минут добавляют 5,1 мл 3% раствора перекиси водорода с такой скоростью, чтобы температура не превышала 22-25oC. Через 30 минут после прибавления всего количества раствора перекиси водорода проводят измерение pH раствора и доводят его значение до 5,6 - 5,8 прибавлением необходимого количества 4N раствора NaOH, при этом контролируют температуру раствора, которая должна быть в пределах 22-25oC. Далее перемешивание продолжают уже без внешнего охлаждения в течение еще 30 минут и затем делают контрольный анализ реакционной смеси при помощи HPLC. Для этого из реакционного раствора отбирают 10 мкл и разбавляют их в 1 мл подвижной фазы. Если по данным HPLC содержание окисленной формы равно или превышает 95%, реакцию считают законченной. В противном случае перемешивание при комнатной температуре продолжают еще 30 мин и анализ по HPLC повторяют.
Далее реакционный раствор фильтруют через фильтр с размером пор не более 0,7 мкм и фильтрат лиофилизуют. Полученный сухой продукт досушивают в вакууме при 40oC над безводным хлористым кальцием до постоянного веса. Выход 4,51 г (95%).
Готовую субстанцию анализируют согласно пп. 5-12.
Пример 2
Синтез литиевой соли бис-( γ
- L-глутамил)-L-цистинил-бис-глицина
Общая характеристика
препарата
1. Название: бис-( γ
- L-глутамил)-L-цистинил-бис-глицин, композит с cis-диамминдихлорплатиной
2.
Структурная формула: приведена на фиг.9.
3.
Брутто-формула:
C20H30N6O12Li2S2 • [Pt(NH3)2
Cl2]
4. Молекулярный вес: 624,49 на
C20H30N6O12Li2S2 с содержанием Pt 0,032%
5. Внешний вид:
белый
порошок без запаха.
6. Растворимость: растворим в воде, изотоническом растворе хлорида натрия 0,9% для инъекций; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
7. Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен.
8. pH 0,1% раствора: 5.0-6.0
потенциометрически,
9. Подлинность:
а) аминокислотный
анализ (6 н. HCl, 110oC, 20 ч) в
соответствии: глицин - 2.0 (2.0); глутаминовая кислота - 1.9(2.0); цистеин
- 1.9(2.0); цистеин
- 1.7(2.0).
б) ЯМР(1H) - спектроскопия, в соответствии: СН2 ( δ 2.05, 2.40, 3.00, 3.80); CH ( δ 3.72, 4.65).
в) ВЭЖХ - по времени выхода соответствует стандарту.
10. Чистота (содержание основного
вещества):
а) по ВЭЖХ > 95%;
б) по аминокислотному анализу >
85%;
в) ТСХ
- гомогенен;
г) содержание лития (Li) по
эмиссионному
спектральному методу
2.2 ± 0.1%
д) содержание платины (Pt) по масс-спектральному методу: 0,01
- 0.02%
II
Поэтапная схема синтеза продуктов (А ---> В
---> Г)
А. Окисление
восстановленного глутатиона ( γ- L-глутамил-L-цистеинил-глицин)
A1 - стадия
обработки исходного восстановленного глутатиона перекисью
водорода при pH 8 - приведена на фиг.
10.
Исходное соединение (I): γ
- L-глутамил-L-цистеинил-глицин (GSH)
H
-γ- L-Glu-L-Cys-Gly-OH
Реагенты: 1)
перекись водорода (35%) Fluka
2)
водный аммиак (25%)
Условия реакции:
перемешивание водного раствора (I) и реагентов при 20oC при pH 8.0 в течение 20
мин.
A2 - выделение свободного
гексапептида бис-( γ
- L-глутамил)-L-цистинил-бис-глицин (приведена на фиг. 11)
Исходное соединение: реакционная смесь на стадии A1.
Реагенты: уксусная
кислота ледяная
Условия
реакции: подкисление реакционной смеси А1 ледяной
уксусной кислотой до pH 5.0,
фильтрация раствора и лиофильная сушка продукта.
Контроль прохождение стадии окисления А: методом ВЭЖХ на колонке типа Delta Pack C18 (0.1% TFA-MeCN, 0-25%); проверяют наличие пика (>97%) соединения (III) (7,4 ± 0.4 мин) и отсутствие пика соединения (I) (3.0 ± 0.3 мин).
В. Перевод окисленной формы (III) в литиевую соль - приведена на фиг. 12.
Исходное соединение: свободный гексапептид (III).
Реагенты: 1 N раствор LiOH.
Условия реакции:
а)
титрование водного раствора
соединения (III) двумя эквивалентами LiOH;
б) упаривание воды в вакууме
при 35-40oC;
в) высаживание продукта изопропиловым спиртом;
г)
фильтрование осадка;
д) промывка осадка ацетоном;
е) сушка продукта в вакууме (1 мм Hg)
при 35-40oC.
Контроль при прохождении стадии В: контролируются количества реагентов и технологические условия при сушке.
Г. Контроль качества готового продукта.
1. Содержание основного вещества по данным ВЭЖХ: > 95%.
Анализ проводится, используя 20 мкл 0,1% раствора препарата, на колонке 250х4,6 мм с обращенной C18-фазой в изократическом режиме ацетонитрил - 0,1% трифторуксусная к-та (2: 98); скорость потока 1 мл/мин, детектирование при 220 нм. Сравнение проводят по пику стандарта, полученного в тех же условиях.
2. Содержание основного вещества по данным спектрофотометрического анализа на содержание неокисленных тиольных групп: > 95%.
Анализ 0.12 мл 0.5% раствора препарата помещают в мерную колбу на 25 мл, добавляют 1 мл 0,1 мл раствора Трис-HCl буфера с pH 8.0, 0,01М ЭДТА и 1 мл 2% раствора NaBH4. Реакционную смесь инкубируют при температуре 20o C в течение 30 мин. Реакцию останавливают добавлением 0,6 мл 1М HCl в течение 2 мин порциями по 0.05 мл при перемешивании с последующим добавлением 2 мл ацетона в течение 3 мин при перемешивании. Затем добавляют 0.25 мл раствора реагента Элмана и доводят объем до метки 0.1 М раствором фосфатного буфера pH 8.0. Измеряют оптическую плотность раствора при 412 нм, раствор сравнения - вода. Параллельно процедуру проводят со стандартом препарата и сравнивают полученные данные.
3. Наличие посторонних примесей по данным ТСХ: препарат гомогенен.
Анализ проводится при нанесении в полосу 5 мкл 0.1% раствора препарата. Пластинки Kieselgel 60f (Merck) 10х5 см, система: н.бутанол-пиридин-уксусная кислота-вода (150: 100:30:120). Проявление по стандартным методикам нингидрином и хлор/бензидин.
4. Содержание лития (Li) по эмиссионному спектральному методу: (2.2 ± 0.1)%.
Пример 3
Фармакокинетика и метаболизм препаратов GSSG•Pt и GSSG в
плазме и тканях при внутривенном введении.
Целью исследования явилось изучение хроноконцентрационных кривых GSSG и изменение активности ферментов, участвующих в метаболизме GSSG при внутривенном введении препаратов GSSG•Pt и GSSG в различных дозах.
В рамках данного исследования оценивалось изменение концентрации окисленного глутатиона в плазме крови, печени, почках, селезенке и лимфоцитах животных в течение 60 минут при однократном внутривенном введении препаратов GSSG•Pt и GSSG в дозах 2 мг/кг массы тела и 20 мг/кг массы тела. Помимо этого, оценивались изменения активности ферментов, участвующих в метаболизме GSSG (НАДФ• H-зависимой глутатион-редуктазы, глутатион-пероксидазы, глутатион S-трасферазы, γ - глутамилтранспептидазы) [19, 22-26].
Эксперимент выполнялся на мышах линии СВА, самцах, стандартной массы 180-220 г. Пять групп животных (не менее 15 штук в каждой) были сформированы в рамках проведенного исследования. Описание групп приведено ниже.
Контрольная
группа:
N
1 - интактные животные, получившие вместо инъекции препаратов
инъекцию
растворителя исследуемых веществ (физиологического раствора);
Опытные группы:
N 2
- животные, получившие
инъекцию препарата GSSG в физиологическом растворе из расчета 2
мг/кг массы
тела;
N 3 - животные, получившие инъекцию препарата GSSG в
физиологическом растворе из
расчета 20 мг/кг массы
тела;
N 4 - животные, получившие инъекцию препарата
GSSG•Pt в
физиологическом растворе, из расчета 2 мг на кг массы тела;
N 5 - животные, получившие
инъекцию препарата
GSSG•Pt в физиологическом растворе, из расчета 20 мг на кг
массы тела.
Образцы крови забирали через 1, 2, 5, 10, 20, 40 и 60 мин, отделяли плазму и проводили анализ концентрации по стандартной методике, основными стадиями которой являются осаждение белков, удаление из образца неполярных и среднеполярных соединений и последующий хроматографический анализ со спектрофотометрическим детектированием при условиях изократического и линейного градиентного элюирования.
Изменения содержания GSSG в сыворотке крови, различных органах и лимфоцитах при внутривенном введении препаратов представлены в таблицах 1-4.
Активность ферментов, участвующих в метаболизме GSSG (глутатион-редуктазы: КФ. 1.6.4.2; глутатион-пероксидазы: КФ.1.11.1.9.; глутатион S-трасферазы: КФ.2.5.1.18.; γ - глутамилтранспептидазы: КФ.2.3.2.2.) определяли посредством стандартных наборов реактивов (КИТ) фирмы Boehringer Mannheim GmbH. Показатели изменения активности ферментов при внутривенном введении препаратов GSSG•Pt и GSSG в дозе 2 мг/кг приведены в таблицах 5, 6, 7.
При сравнении динамического распределения препаратов в сыворотке крови, печени, почках, селезенке и лимфоцитах видно четкое преимущество фармакокинетики препарата GSSG•Pt по сравнению с препаратом GSSG. Концентрация препарата GSSG к 10 минуте практически возвращается к исходной, тогда как концентрация препарата GSSG•Pt к этому моменту превышает в 50 раз исходные показатели и продолжает оставаться на данном высоком уровне до конца исследуемого периода. Кроме этого максимальная концентрация препарата GSSG•Pt в плазме крови и тканях превышает в 3 раза максимальную концентрацию препарата GSSG. Это определяет более высокую эффективную длительность воздействия препарата GSSG• Pt в сравнении с препаратом GSSG.
Как следует из материалов таблиц 5, 6, 7 препарат GSSG увеличивает активность ферментов, участвующих в метаболизме тиолов (примерно в 2 раза), с большим числом достоверных показателей, в то время как препарат GSSG•Pt активность ферментов практически не изменяет, а число достоверных показателей оказывается незначительным. Это свидетельствует о большой устойчивости препарата как субстрата по отношению к основным ферментам, принимающим участие в метаболизме глутатиона, а значит, приводит к более длительному нахождению в плазме крови и различных органах глутатиона в окисленном состоянии.
Таким образом, анализ полученных данных показал более высокую устойчивость препарата GSSG•Pt к селективному воздействию основных ферментов метаболизма глутатиона (в первую очередь, НАДФ•H-зависимой глутатион-редуктазы), что определяет новую динамику фармакокинетики препарата, способствуя проявлению новых биолого-фармацевтических эффектов, а следовательно, новых терапевтических эффектов препарата GSSG•Pt.
Пример 4 см. в конце описания.
Пример 5
Влияние GSSG•Pt и GSSG на продукцию
цитокинов мононуклеарными лейкоцитами
периферической крови человека in vitro.
Оценивали действие окисленного глутатиона (GSSG), а также его структурного аналога, представляющего собой гексапептид со стабилизированной дисульфидной связью, на продукцию цитокинов мононуклеарными лейкоцитами периферической крови человека в условиях in vitro.
Продукцию цитокинов лейкоцитами инициировали добавлением митогена, конканавалина А (ConA), который добавлялся в клеточную культуру сразу же после внесения исследуемых веществ. Супернатанты культур собирали через 24 часа после начала сочетанного воздействия ConA и исследуемых веществ и хранили до момента определения цитокинов при - 70oC.
Для оценки функционального состоянии клеток и их способности отвечать на митоген в присутствии каждой из оцениваемых концентраций исследуемых веществ контрольные культуры клеток, содержащие исследуемые вещества в идентичных концентрациях, инкубировали в течение 72 часов после начала сочетанного воздействия ConA и исследуемых веществ. За 16 часов до окончания инкубации в контрольные культуры вносили3H-тимидин и степень включения метки в ДНК расценивали как критерий функционального состояния клеточной тест системы.
Венозную кровь от здоровых доноров, мужчин, собирали в пластиковые гепаринизированные пробирки, тестированные на отсутствие эндотоксина (endotoxin tested). Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл- диатризоат натрия (Histopaque-1077, Sigma).
Концентрацию клеток доводили до 2•106 клеток на 1 мл "полной" культуральной среды (RPMI 1640, Sigma), содержащей 20 мМ HEPES, 2 мМ глутамина, 50 мкг/мл гентамицина и 10% фетальной телячьей сыворотки. Все использованные реагенты были "для культур тканей", Sigma. Жизнеспособность клеток оценивали по методу исключения с трипановым синим и 100 мкл клеточной суспензии (200.000 клеток) разносили в лунки плоскодонных 96-луночных планшетов для культур тканей. Клетки от каждого донора разносили не менее чем в 39 лунок.
Оценивали влияние 5 конечных концентраций (5000 мкг/мл; 500 мкг/мл; 50 мкг/мл; 5 мкг/мл; и 0.5 мкг/мл) тестируемых веществ - GSSG, а также GSSG•Pt. Каждую из концентраций создавали не менее чем в 6 лунках, внося 50 мкл "полной" культуральной среды, содержащей необходимое количество предварительно растворенных исследуемых веществ. Еще 6 лунок использовались для контроля (добавлялось 50 мкл только "полной" культуральной среды).
Непосредственно после внесения исследуемых веществ во все лунки (за исключением 3-х дополнительных, которые служили для оценки спонтанного захвата3 H-тимидина (без ConA)) вносили по 50 мкл "полной" культуральной среды, содержащей такое количество ConA (Sigma, для культур тканей), чтобы его конечная концентрация составляла 4.0 мкг/мл.
Через 24 часа инкубации планшетов при 37oC в присутствии 5% CO2 содержимое половины лунок (по 3 лунки из каждых 6, содержащих одинаковую концентрацию исследуемых веществ) отсасывали, подвергали центрифугированию, супернатанты замораживали и хранили при -70oC до момента определения присутствия цитокинов. Содержимое всех оставшихся заполненными лунок (3-х оставшихся) продолжали инкубировать при вышеописанных условиях.
Через 56 часов от начала инкубации во все оставшиеся лунки добавляли по 1.0 мкCi3H-тимидина и продолжали инкубацию еще 16 часов, после чего содержимое лунок извлекалось и при помощи клеточного харвестера (cell harvester) наносили на стекловолокнистые фильтры, которые последовательно обрабатывали 5% трихлоруксусной кислотой и этанолом. Фильтры высушивали и их радиоактивность (импульсы в 1 мин, имп/мин) определяли с помощью жидкостного сцинтиляционного счетчика Betaplate 1205 (LKB).
Значения радиоактивности фильтров для каждого триплета лунок усредняли и рассчитывали индекс митогенной стимуляции: отношение усредненных значений имп/мин ConA-стимулированных культур к усредненным значениям имп/мин в культурах, в которые не добавлялся ConA (3 лунки без ConA). По индексу стимуляции в качестве критерия судили о функциональном состоянии клеток в лунках, где оцениваемые вещества присутствовали в различных концентрациях, и о способности клеток отвечать на митогенную стимуляцию.
Последующему анализу на содержание цитокинов подвергали клеточные супернатанты 24-часовых культур только из тех триплетов лунок, в контрольных триплетах которых при 72 часовой инкубации была выявлена митогенная реакция на ConA с индексом стимуляции в диапазоне от 15 до 50.
Концентрации интерлейкина-lb (IL-lb); интерлейкина-2 (IL-2); интерлейкина-3 (IL-3); интерлейкина-4 (IL-4); интерлейкина-6 (IL-6); интерлейкина-8 (IL-8); интерлейкина-10 (IL-10); интерлейкина-12 (IL-12); фактора некроза опухолей α,γ(TNF-α,γ) и интерферона α,γ(INF-α,γ); определяли по методу ELISA с использованием коммерческих наборов фирмы Medgenix (Бельгия) и выражали в пкг/мл культуральных супернатантов.
Заметные результаты представлены в таблицах 8, 9. Согласно данным таблиц 8 и 9, добавление GSSG и GSSG•Pt в культуральную среду статистически приводило к достоверной и дозозависимой стимуляции продукции цитокинов мононуклеарными лейкоцитами человека. При этом GSSG•Pt оказывает более выраженное (в 1.5-2 раза) стимулирующее влияние на продукцию исследуемых цитокинов, причем стимулируя-регулируя выработку более широкой палитры цитокинов в исследовании по сравнению с действием GSSG. В таблицах 8 и 9 хорошо прослеживается корреляция изменений взаимосвязанных цитокинов (увеличение IL-lb, IL-2, TNF-α,γ нa фоне снижения IL-4, IL-10).
Таким образом, действие GSSG•Pt на мононуклеарные лейкоциты периферической крови людей в условиях in vitro приводит к убедительной стимуляции продукции более широкой палитры цитокинов в культуральную среду с учетом их взаиморегулирующих эффектов, чем подтверждается стимулирующее и регулирующее действие GSSG• Pt на естественную цитокин-продуцирующую способность клеток крови человека.
Пример 6
Влияние GSSG и GSSG•Pt на продукцию цитокинов и гемопоэтических
факторов, а
также показатели
кроветворения и иммунитета
при
циклофосфамид-индуцированной гемо- и иммунодепрессии.
1. Действие окисленного глутатиона (GSSG) и его структурного аналога, представляющего собой гексапептид со стабилизированной дисульфидной связью (GSSG•Pt), оценивали в модели гемо- и иммунодепрессии у мышей, индуцированной однократным введением цитостатика циклофосфамида (ЦФ).
В рамках данного исследования была проведена оценка влияния 5-дневного применения вышеперечисленных веществ на способность лимфоцитов селезенки мышей, подвергнутых действию ЦФ, продуцировать интерлейкин-1 ( α , b); интерлейкин-2 (IL-2); интерлейкин-3 (IL-3); интерлейкин-4 (IL-4); интерлейкин-6 (IL-6); интерлейкин-8 (IL-8); интерлейкин-10 (IL-10); интерлейкин-12 (IL-12); фактор некроза опухолей α, γ(TNF-α,γ) и интepфepoн α,γ(IFN-α,γ ); и GM-CSF, G-CSF, M-CSF в условиях in vitro. Помимо этого, оценивалась клеточность крови (число лейкоцитов и лимфоцитов) и костного мозга (число кариоцитов) на 8-й день после применения ЦФ. У части животных, получивших ЦФ и затем подвергнутых иммунизации эритроцитами барана (ЭБ), оценивали способность развивать гуморальный иммунный ответ к данному антигену.
Исследование было проведено на мышах линии CBA, самцах, массой 18-20 г, которым однократно вводился ЦФ (50 мг/кг, внутрибрюшинно). Четыре группы животных (не менее 15 мышей в каждой) было сформировано в рамках проведенного исследования. Описание групп приведено ниже.
Контрольные группы:
N 1 - интактные животные, получившие вместо инъекции ЦФ инъекцию
растворителя исследуемых веществ (физиологического раствора);
N 2
- животные, получившие инъекцию
ЦФ, у которых в
дальнейшем
применялся растворитель исследуемых веществ (физиологический
раствор) (контроль).
Опытные группы:
N 3 - животные,
получившие инъекцию ЦФ, у которых
в дальнейшем
применялось
исследуемое вещество GSSG в физиологическом растворе из
расчета 5 мг/кг массы тела;
N 4 - животные, получившие инъекцию ЦФ, у
которых в дальнейшем применялся
GSSG•Pt в
физиологическом
растворе, из расчета 5 мг на кг массы тела.
Через 24 часа после применения ЦФ по 5 животных из каждой группы было подвергнуто иммунизации эритроцитами барана (ЭБ, 107 эритроцитов в 0.5 мл физиологического раствора, внутрибрюшинно).
С 3-х суток после инъекции ЦФ (через 24 часа после иммунизации) животным начинали внутрибрюшинное введение контрольных или исследуемых веществ, как описано выше. Введение веществ продолжали в течение 5 дней (ежедневно, один раз в день).
Через 24 часа после окончания 5-дневного курса применения контрольных или исследуемых веществ (на 8-й день после инъекции ЦФ) мышей эвтаназировали и в стерильных условиях готовили суспензию спленоцитов для оценки спонтанной продукции цитокинов и гемопоэтических факторов лимфоцитами селезенки в условиях in vitro.
Параллельно с этим забирали образцы крови и костного мозга для оценки их клеточности (число лейкоцитов и лимфоцитов крови, кариоцитов костного мозга).
У иммунизированных животных на 7-й день после иммунизации (8-й день после инъекции ЦФ) оценивали сывороточный титр гемагглютининов к ЭБ.
В таблице 10 приведены показатели продукции цитокинов и гемопоэтических факторов спленоцитами, показатели клеточности крови и костного мозга и уровень гуморального иммунного ответа на эритроциты барана у мышей, получавших исследуемые вещества на фоне циклофосфан-индуцированной гемо- и иммунодепрессии.
Согласно данным, представленным в таблице 10, применение и GSSG•Pt практически нормализует продукцию цитокинов и гемопоэтических факторов клетками селезенки, в то время как GSSG оказывает незначительное стимулирующее действие. При этом GSSG•Pt стимулирует продукцию более широкой палитры цитокинов, а также оказывает выраженное регулирующее воздействие на изменение цитокинового статуса, что подтверждается положительной корреляцией изменений взаимозависимых цитокинов при соответствующем патологическом процессе.
Таким образом, применение препарата GSSG•Pt у животных, подвергнутых химической (циклофосфамид индуцированной) гемо- и иммунодепрессии, приводит к выраженной стимуляции и регуляции эндогенной продукции цитокинов и гемопоэтических факторов; оказывает восстанавливающее действие на параметры клеточности крови и костного мозга, а также на формирование иммунного ответа на эритроциты барана.
2. В рамках настоящей работы было также проведено исследование эффективности применения препарата GSSG•Pt на модели циклофосфановой цитопении (миелопении).
Работа проводилась на белых крысах-самцах массой 160 г. Циклофосфан вводился однократно под кожу спины в дозе 50 мг/кг массы тела (растворитель - вода для инъекций).
Три группы животных (не менее 15 мышей в каждой) было сформировано в рамках проведенного исследования. Описание групп приведено ниже.
Контрольные группы:
N 1 - интактные животные, получившие вместо
инъекции ЦФ инъекцию
растворителя исследуемых
веществ
(физиологического раствора);
N 2 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялся растворитель исследуемых веществ
(физиологический
раствор) (контроль).
Опытная группа:
N 3 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялся GSSG•Pt в физиологическом растворе, из
расчета 5 мг
GSSG на кг массы
тела.
С 2-х суток после инъекции ЦФ животным начинали внутримышечное введение контрольных или исследуемых веществ один раз в день в течение 10-15 дней.
В конце каждой серии (10 и 15 дней) экспериментальные группы подвергали эфтаназии передозировкой эфира и получали периферическую кровь (хвостовая вена) и костный мозг (бедренные кости) для анализа. Гематологические исследования проводили унифицированными стандартными методами. Результаты анализа периферической крови представлены в таблице 11, результаты анализа миелограммы - в таблице 12.
При анализе данных, приведенных в таблице 11, видно, что циклофосфан в дозе 50 мг/кг вызывает достаточно выраженную цитопению по всем форменным элементам крови с абсолютной и относительной лимфопенией, зависящей от срока наблюдения (максимально выраженную на 15 день). При этом следует отметить, что четыре животных погибли: на 9, 10, 12 и 14 дни. Практически у всех отмечалась вялость, гиподинамия, снижение массы тела.
Введение препарата GSSG•Pt оказывает выраженный стимулирующий эффект. Наблюдается улучшение общего состояния, положительная динамика массы тела, а появление в крови незрелых форм свидетельствует об активации костно-мозгового кроветворения. Гибели животных не отмечалось. Анализ показателей миелограммы показал, что циклофосфан в дозе 50 мг/кг обладает выраженным миелотоксическим действием. Особенно угнетаются эритро-, тромбоцито- и лимфопоэз. Миелосупрессия наиболее выражена на 15-й день.
Назначение препарата GSSG•Pt оказывает заметный миелостимулирующий эффект.
Таким образом, препарат GSSG•Pt в дозе 5 мг/кг при ежедневном введении курсом 10-15 дней оказывает выраженное миелостимулирующее действие при цито- и миелопении, вызванной циклофосфаном. Назначение препарата улучшает общее состояние животных, положительно влияет на динамику массы тела и снижает летальность на 30%.
Пример 7
Влияние GSSG и (Li•GSSG•Pt) на продукцию цитокинов и гемопоэтических факторов, а также
показатели
кроветворения и иммунитета при радиационной гемо- и
иммунодепрессии.
Действие окисленного глутатиона (GSSG) и его структурного аналога, представляющего собой литиевую соль гексапептида со стабилизированной дисульфидной связью (Li•GSSG•Pt), оценивалось в модели радиационной гемо- и иммунодепрессии у мышей, индуцированной однократным облучением в общей дозе 1 Гр [19, 22, 27-37].
В рамках данного исследования была проведена оценка влияния 7-дневного ежедневного применения исследуемых веществ (первое введение препаратов через два часа после облучения) на способность спленоцитов мышей, подвергнутых радиационному воздействию, продуцировать интерлейкин-1 α,b); интерлейкин-2 (IL-2); интерлейкин-3 (IL-3); интерлейкин-4 (IL-4); интерлейкин-6 (IL-6); интерлейкин-8 (IL-8); интерлейкин-10 (IL- 10); интерлейкин-12 (IL-12); фактор некроза опухолей α,γ(TNF-α,γ) и интерферон α,γ (INF-α,γ); и GM-CSF, G-CSF, M-CSF в условиях in vitro. Помимо этого, на 8-й день после облучения оценивалась клеточность крови (число лейкоцитов и лимфоцитов), селезенки и костного мозга (число кариоцитов), а также колониеобразующая способность клеток костного мозга и селезенки.
Исследование было проведено на мышах линии СВА, самцах, массой 18-20 г, которые были подвергнуты однократному рентгеновскому облучению в общей поглощенной дозе 1 Гр (расстояние от источника - 70 см, мощность 180 кВ, 15 мА, фильтр - 0.5 мм Cu, длительность облучения - 2 мин 28 с).
Было сформировано четыре группы животных (не менее 12 мышей в каждой). Описание групп приведено ниже.
Контрольные группы:
N 1 - интактные животные,
получившие стрессорное воздействие в виде ложного
облучения, у которых в дальнейшем применялся растворитель
исследуемого вещества (физиологический раствор);
N 2 - контрольные животные,
облученные в дозе 1 Гр, у которых в дальнейшем
применялся растворитель исследуемых веществ (физиологический
раствор).
Опытные группы:
N 3 - животные, облученные в дозе 1
Гр,
у которых в дальнейшем применялось исследуемое
вещество GSSG в физиологическом растворе из расчета 5
мг/кг
массы тела;
N 4 - животные, облученные в дозе 1 Гр, у которых в дальнейшем
применялось исследуемое вещество Li•GSSG•
Pt в физиологическом растворе из расчета 5
мг на кг массы
тела.
Через 2 часа после облучения животным начинали внутрибрюшинное введение контрольных или исследуемых веществ, как описано выше. Введение веществ продолжали в течение 7 дней (ежедневно, один раз в день).
Через 24 часа после окончания применения контрольных или исследуемых веществ (на 8-й день после облучения) мышей эвтаназировали и в стерильных условиях готовили суспензию спленоцитов для оценки спонтанной продукции цитокинов и гемопоэтических факторов (интерлейкин-1 ( α, b); интерлейкин-2 (IL-2); интерлейкин-3 (IL-3); интерлейкин-4 (IL-4); интерлейкин-6 (IL-6); интерлейкин-8 (IL-8); интерлейкин-10 (IL-10); интерлейкин-12 (IL- 12); фактор некроза опухолей α,γ (TNF α,γ); интерферон α,γ(INF-α ,γ); GМ-CSF; G-CSF; М-CSF) лимфоцитами селезенки в условиях in vitro.
Параллельно с этим забирали образцы крови, селезенки и костного мозга для оценки их клеточности (число лейкоцитов и лимфоцитов крови, кариоцитов селезенки и костного мозга).
Одновременно определяли гемопоэтическую колониеобразующую способность клеток костного мозга и селезенки методом прямого подсчета колониеобразующих единиц (КОЕ) в селезенке сингенных облученных мышей СВА, которым внутривенно вводили порции исследуемых суспензий клеток костного мозга и селезенки от животных исследуемых групп.
В таблице 13 приведены показатели продукции цитокинов и гемопоэтических факторов спленоцитами, показатели клеточности крови, селезенки и костного мозга, а также показатели колониеобразования (колониеобразующие единицы, КОЕ) костного мозга и селезенки облученных животных на 8 день после радиационного воздействия.
Как следует из материалов таблицы, применение Li•GSSG•Pt статистически достоверно восстанавливает продукцию цитокинов и гемопоэтических факторов клетками селезенки, тогда как GSSG оказывает менее выраженный эффект.
При этом Li• GSSG•Pt оказывает влияние на эндогенный синтез более широкого спектра цитокинов и гемопоэтических факторов, а также регулирует изменения цитокинового статуса с учетом данного патологического процесса.
Таким образом, применение препарата Li• GSSG•Pt, как заявляемого способа у животных, подвергнутых радиационной гемо- и иммунодепрессии, приводит к выраженной стимуляции-регуляции эндогенной продукции цитокинов и гемопоэтических факторов; эффективному восстановлению клеточности крови, лимфоидных и кроветворных органов, а также колониеобразующей активности костного мозга и селезенки.
Пример 8
Влияние
композита GSSG•Pt и его солей на процессы фосфатной модификации и содержание
лимфоцитов, несущих рецептор
IL-2
Исследовали молекулярные
механизмы воспроизведения иммуно-биохимических
эффектов цитокинов посредством композита GSSG•Pt и его солей.
Действие композита GSSG•Pt и его солей: натриевой (Na), литиевой (Li) и магниевой (Mg) оценивали в модели гемо- и иммунодепрессии у мышей, индуцированной однократным введением цитостатика циклофосфамида (ЦФ).
В контексте данного исследования была проведена оценка влияния 5-ти дневного применения вышеуказанных веществ на уровень фосфорилирования цитозольных белков лимфоцитов по тирозину и содержание "активных" лимфоцитов, несущих рецептор IL-2.
Исследование проведено на мышах линии CBA, самцах, массой 18-20 г, которым однократно вводился ЦФ (50 мг/кг, внутрибрюшинно). Через 24 часа после инъекции ЦФ животным начинали внутрибрюшинное введение исследуемых веществ в дозе 5 мг/кг. Введение веществ продолжали в течение 5 дней (ежедневно, 1 раз в день). Через 24 часа после окончания применения исследуемых веществ мышей эвтаназировали и забирали образцы крови для проведения исследований.
Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метризоат (Histopaque, Sigma). Концентрацию клеток доводили до 2х105 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМ глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим, и клеточную суспензию разносили в лунки 96-луночных планшетов из расчета 20 000 клеток на лунку.
Определение содержания лимфоцитов, несущих рецептор IL-2, проводили в соответствии с Horgan A.F. (1994) на мазках мононуклеарной взвеси. В качестве первых антител использовали моноклональные антитела к цепям p55 и p75 рецептора IL-2. Для визуализации первых антител использовали поликлональные кроличьи антитела против иммуноглобулинов мыши, меченные ФИТЦ. Подсчет количества лимфоцитов, содержащих рецептор IL-2, проводили в процентном соотношении к общему числу лимфоцитов.
Для метаболического мечения лимфоциты культивировали в среде Игла с добавлением 10% сыворотки крупного рогатого скота. Метаболическое мечение лимфоцитов [32P]ортофосфорной кислотой проводили с помощью инкубации клеток в течение 10-12 ч в бесфосфорной среде ДМЕ, содержащей 100 мк Ci/мл [32P] орто-фосфата. На одну пробу добавляли по 0,2 мл среды с изотопом. После инкубации клетки разрушали пипетированием и центрифугировали при 6000 g в течение 30 мин. Полученный супернатант использовали для иммунопреципитации поликлональными антителами к фосфотирозину по методу Fu (1992). Для осаждения иммунных комплексов использовали протеин A-сефарозу. После преципитации осадок трижды отмывали и активность осадка просчитывали на счетчике "Гамма".
Согласно результатам выполненных исследований (таблица 14) установлено, что действие композита GSSG•Pt на изолированные лимфоциты приводит к тому (см. таблицу 14), что уже через 10 минут наблюдается достоверное увеличение уровня фосфорилирования по тирозину цитозольных белков лимфоцитов, что является интегральным показателем активности сигналпередающих систем клеток. Данные изменения под действием композита GSSG•Pt в большей степени под действием производных GSSG•Pt обусловливают модуляцию редокс-чувствительной экспрессии генов, в первую очередь иммунологически важных генов, ответственных за синтез цитокинов и гемопоэтических факторов.
В таблице 15 приведены данные об уровне фосфорилирования по тирозину цитозольных белков лимфоцитов и процентное содержание лимфоцитов, несущих рецептор IL-2 у мышей линии CBA, получавших исследуемые вещества на фоне циклофосфамидиндуцированной гемо- и иммунодепрессии.
Применение солей GSSG•Pt приводит к увеличению процентного содержания лимфоцитов, несущих рецептор IL-2, практически нормализуя их количество (в норме - 18,3 ± 1,6%). Схожая закономерность была выявлена при исследовании уровня фосфорилирования по тирозину цитозольных белков лимфоцитов. Применение различных солей GSSG•Pt способствует восстановлению процентного содержания лимфоцитов, несущих рецептор IL-2, в условиях иммунодефицита, моделированного циклофосфамидом. При этом происходит увеличение уровня фосфорилирования по тирозину цитозольных белков сигналпередающих систем, что может выступать одним из факторов описанного иммуностимулирующего действия исследуемых веществ.
Таким образом, авторами установлено ранее неизвестное свойство композита GSSG• Pt и его солей воспроизводить (имитировать) регуляторные эффекты ряда цитокинов, в первую очередь IL-2. Под воспроизведением IL-2 мы имеем в виду индукцию GSSG• Pt внутриклеточных механизмов, реализующих регуляторные сигналы цитокина на систему иммунокомпетентных и гемопоэтических клеток. Приведенные исследования показали, что изменение уровня фосфорилирования по тирозину белков сигнал-передающих систем клеток органов иммуногенеза и гемопоэза в условиях иммунодефицита моделированного циклофосфамидом, приводит к эффекту динамичной нормализации содержания активных лимфоцитов.
Следовательно, использование композита GSSG•Pt или его производных в форме лекарственных средств в терапевтических целях не только стимулирует эндогенную продукцию цитокинов и гемопоэтических факторов, но также, особенно в случае десенситизации рецепторов, наблюдаемой, как правило, при онко- и ретровирусной патологии, обеспечивает воспроизведение иммуно-биохимических эффектов цитокинов.
Пример 9
Стимуляции
эндогенной продукции цитокинов и лечебный эффект препарата GSSG•Pt у
больного раком желудка, осложненным
канцероматозом брюшины, асцитом, спленомегалией и холестатическим
гепатитом.
Мужчина 33 лет наблюдается более двух лет по поводу неоплазмы желудка (аденокарцинома умеренной степени дифференцировки). В 1993 году больной оперирован по поводу малигнизированной язвы желудка и был обнаружен конгломерат плотных узлов в воротах печени, расцененный как метастазы.
В январе 1994 года проводимая химиотерапия (5-FU) осложнилась тяжелым холестазом, по поводу которого произведено чрескожное дренирование правого и левого печеночных протоков, а еще через 6 месяцев - холедохоеюностомия на сменных транспеченочных дренажах с брауновским анастомозом.
В ноябре 1995 года состояние ухудшилось. По данным обследования у больного - активный вторичный гепатит. Печень увеличена и болезненна, на 5-6 см выступает из-под края реберной дуги. Биохимические показатели крови патологически изменены, слабо поддаются коррекции проводимым лечением: гипербилирубинемия до 40,0 за счет непрямого билирубина (до 31,0); повышение активности трансаминаз в 5 раз; гипоальбуминемия - 26%; имеет место гипергаммаглобулинемия; гиперхолестеринемия-до 10,2 мкмоль/л.
При фиброгастродуоденоскопии (ноябрь 1995 г.) в средней трети тела желудка была обнаружена опухоль протяженностью 8 см. Опухоль плотная. Стенки желудка ригидные. Гистологически опухоль идентифицирована как аденокарцинома умеренной степени дифференцировки. В декабре 1995 года больному произведена эксплоративная лапаратомия. Обнаружен асцит с множественными высыпаниями по всей брюшине, спленомегалия. Случай признан неоперабельным.
Было принято решение использовать лекарственную форму GSSG. Препарат вводился парентерально (внутривенно и внутримышечно), и дополнительно использовалось локальное введение лекарственной формы посредством обкалывания опухоли через эндоскоп в трех точках. Средняя доза для внутривенного и внутримышечного введения 0,1 - 0.5 мг/кг; при локальном введении до 50 мг местно. Парентеральное введение препарата 2 раза в сутки (утром внутривенно; вечером - внутримышечные инъекции), через день, в течение трех недель; затем два раза в неделю в течение 4 недель. Обкалывание через эндоскоп один раз в семь дней. Через 2 месяца после начала лечения используемой лекарственной формой картина фиброгастродуоденоскопии: пищевод проходим, слизистая розовая, розетка кардии смыкается не полностью. Натощак в желудке умеренное количество пенистого секрета интенсивно окрашенного желчью, протяженность опухоли 4,8 см. Одновременно наблюдается уменьшение размеров печени до 3 см, а также существенное улучшение гематологических, биохимических показателей.
Через 6 месяцев после окончания лечения (июль 1996 года) состояние заметно ухудшилось. По данным обследования повторное развитие вторичного гепатита. Печень увеличена и болезненна, на 4 см выступает из-под края реберной дуги. Биохимические показатели крови патологически изменены, слабо поддаются коррекции проводимым лечением: гипербилирубинемия до 36,0 за счет непрямого билирубина (до 28,0); повышение активности трансаминаз в 4 раз; гипоальбуминемия - 21%; имеет место гипергаммаглобулинемия; гиперхолестеринемия - до 9,42 мкмоль/л.
При фиброгастродуоденоскопии (июль 1996 г.) в средней трети тела желудка была обнаружена опухоль протяженностью 6 см. Опухоль плотная. Стенки желудка ригидные. Гистологически - аденокарцинома умеренной степени дифференцировки. В августе 1996 года больному произведена эксплоративная лапаратомия. Повторно обнаружен асцит с множественными высыпаниями по всей брюшине, спленомегалия.
С учетом ранее проводимой терапии было принято решение использовать новый препарат GSSG•Pt, являющийся структурным аналогом ранее применяемого препарата GSSG. Препарат вводился по аналогичной схеме: парентерально (внутривенно и внутримышечно), и дополнительно использовалось локальное введение лекарственной формы посредством обкалывания опухоли через эндоскоп в трех точках. Средняя доза для внутривенного и внутримышечного введения 0,1 - 0,5 мг/кг; при локальном введении до 50 мг местно. Парентеральное введение препарата 2 раза в сутки (утром внутривенно; вечером - внутримышечные инъекции), через день, в течение трех недель; затем два раза в неделю в течение 4 недель. Обкалывание через эндоскоп один раз в семь дней.
Через 2 месяца после начала лечения данным препаратом - печень выступает из-под реберной дуги на 1 см; безболезненная при пальпации. По данным УЗИ - на месте определяемых ранее очаговых опухолевых изменений фиброзная ткань. Картина фиброгастродуоденоскопии: пищевод проходим, розетка кардии не смыкается; в просвете желудка светлая мутная жидкость со слюной. Слизистая желудка розовая. Опухоль протяженностью 1,5 см. Стенки желудка эластичные. Двенадцатиперстная кишка свободно проходима. Одновременно наблюдается существенное улучшение гематологических, биохимических показателей.
По сравнительном анализе терапевтической эффективности препаратов GSSG•Pt и GSSG выявлено преимущество применения препарата GSSG•Pt, что нашло отражение в яркой положительной динамике клинических, биохимических, гематологических и иммунологических показателей, данных ФГДС (уменьшение размеров опухоли на 75% при использовании препарата GSSG•Pt, в то время как при использовании препарата GSSG опухоль уменьшилась только на 40%) (таблицы N 16, 17). Кроме того, из таблицы N 17 видно, что препарат GSSG•Pt стимулирует выработку более широкой палитры цитокинов и гемопоэтических факторов, оказывая регулирующее воздействие на характер изменения их содержания.
Таким образом, в результате проведенного лечения с использованием препарата GSSG•Pt наблюдается выраженный регресс опухолевого процесса, с очевидными одновременными изменениями гематологических, биохимических и иммунологических параметров и существенным повышением качества жизни.
Пример N 10
Терапевтическая эффективность
препарата GSSG•Pt при раке легкого
Больной N 1: Резников
Евгений Фридрихович
Год рождения:
1938 г.р.
Диагноз: Рак верхней доли правого легкого.
Гистологический диагноз: ГНЦП N 45760
- мелкоклеточный рак
История болезни: N 4024.
Жалобы при поступлении: на кашель с трудно отделяемой мокротой слизистого характера, одышку при небольшой физической нагрузке.
Объективно: Состояние удовлетворительное.
Периферические лимфоузлы не увеличены. Дыхание жесткое, ослабленное в верхних и средних отделах правого легкого. Единичные сухие хрипы, одышка при малейшей физической нагрузке.
Рентгенограмма (исходные данные): Расширена тень верхнего отдела средостения за счет, вероятнее всего, увеличенных лимфоузлов паратрахеально справа. Расширена нечеткая тень верхнего полюса правого корня. На фоне выраженных интерстициальных изменений в обоих легких имеется дополнительная тень в периферическом отделе S3 правого легкого. Утолщены междолевые границы справа. Заключение: признаки метастазов в лимфоузлы корня, средостения, с явлениями лимфангоита.
Курс лечения: проведено 3 курса иммунохимиотерапии с использованием препарата GSSG• Pt.
После проведенной терапии: Состояние больного значительно улучшилось: сохраняется небольшая слабость, одышка исчезла.
Объективно: Состояние удовлетворительное. Периферические лимфоузлы не увеличены. В средних отделах правого легкого сохраняется ослабленное дыхание. В остальных отделах дыхание везикулярное. Хрипов нет.
Рентгенограмма (после проведенной терапии): Повышена прозрачность легочных полей. Небольшие инфильтративные затенения в S3 правого легкого. Корни не расширены. Дополнительных образований в проекции правого корня не выявлено. Тень верхнего отдела средостения не расширена. Выявляются единичные увеличенные паратрахеальные лимфоузлы.
Больной N 2: Семенов Петр Александрович
Год
рождения:
1945 г.р.
Диагноз: Рак правого легкого, метастазы в
печень
Гистологический
диагноз: N 45999,
мелкоклеточный рак
История болезни: N 4023
Жалобы
при
поступлении: на кашель с трудно отделяемой мокротой слизистого характера,
одышку при небольшой физической
нагрузке, слабость,
на боли в поясничной области постоянного характера, иррадиирующие в
живот.
Похудел за последний месяц на 6 кг.
Объективно: Состояние средней тяжести. Желтушность склер. Дыхание жесткое, ослабленное в верхних и средних отделах правого легкого. В правой надключичной области пальпируются увеличенные лимфоузлы плотной консистенции, слабо подвижные, размерами 3,0 см и 1,0 см, безболезненные. При аускультации дыхание жесткое, ослаблено в средних отделах справа. Единичные сухие хрипы, одышка при малейшей физической нагрузке. Печень на 3,5 см ниже реберной дуги.
При обследовании выявлен рак среднедолевого бронха справа, гиповентиляция средней доли, пневмонит. При УЗИ - признаки метастатического поражения печени.
Рентгенограмма (исходные данные): Средняя доля правого легкого уменьшена в объеме (в состоянии гиповентиляции). На фоне усиленного легочного рисунка определяется интенсивная, почти однородная инфильтрация с четкой границей по ходу горизонтальной междолевой плевры. Правый корень не дифференцируется. Состояние верхней, нижней доли правого легкого и левое легкое без особенностей. Органы средостения заметно не смещены.
Курс лечения: проведено 3 курса иммунохимиотерапии с использованием препарата GSSG•Pt.
После проведенной терапии: Состояние больного значительно улучшилось: исчезла слабость, одышка, появился аппетит, прибавил в весе на 5 кг. Нормализовались показатели крови.
По данным УЗИ и компьютерной томографии печени - полная регрессия опухолевого процесса.
Рентгенография
(после лечения)
На рентгенограмме грудной клетки определяется незначительный
ателектаз
части средней доли. Корни структурны, не
расширены; правый корень чуть подтянут вниз. Сердце в
размерах
не увеличено.
По сравнению с исходными данными отмечается значительно выраженная положительная динамика, более прозрачная стала легочная ткань справа (уменьшились проявления гиповентиляции), отсутствуют инфильтративные затенения.
Заключение:
При оценке терапевтической эффективности
препарата GSSG•Pt было установлено следующее
(см. таблицы
18, 19):
1. Нормализация клинических показателей
(улучшение общего состояния,
исчезновение патологических симптомов,
прибавка массы тела).
2. Изменение рентгенологической картины (увеличение прозрачности легочной ткани, исчезновение инфильтративных затенений, уменьшение ателектаза, гиповентиляции).
3. Нормализация гематологических показателей (повышение содержания эритроцитов, гемоглобина, восстановление лейкоцитарной формулы.
4. Изменение данных УЗИ и компьютерной томографии (полная регрессия опухолевого процесса).
5. Нормализация иммунологических показателей и повышение содержания СД16+, СД25+ клеток, что свидетельствует о восстановлении системы противоопухолевого надзора.
6. Индукция эндогенного синтеза более широкой палитры цитокинов, а также в модулирующем действии на взаиморегуляцию их содержания (корреляция изменения уровней содержания IL-l β, IL-4, TNF-α).
Таким образом, в приведенных клинических примерах показано, что применение препарата GSSG•Pt обеспечивает более быструю нормализацию клинических, рентгенологических, гематологических, и иммунологических параметров, обеспечивая более эффективную реставрацию системы иммунитета и гемопоэза. Сказанное является показателем регресса опухолевого процесса, что в конечном итоге ведет к существенному повышению качества жизни пациента.
Пример N 11
Терапевтическая эффективность препарата
GSSG•Pt при хроническом
вирусном
гепатите В (ХВГВ)
Больной N 1: Купченко Владимир Михайлович.
Год рождения: 1945 г.р.
Диагноз: ХВГВ, фаза репликации (PCR HBV+), умеренно выраженная степень активности.
История болезни: N 1068.
Жалобы при поступлении: на слабость, ощущение тяжести в правом подреберье, тошноту, отсутствие аппетита.
Анамнез заболевания: Последние шесть лет периодически отмечал появление ноющих болей в правом подреберье, слабость, периодическое изменение цвета мочи. При обследовании было обнаружено: гипербилирубинемия до 34 мкмоль/л, повышение АЛТ до 5,4 ммоль/ч.л. При стационарном обследовании были определены серологические маркеры ХВГВ и PCR HBV(+).
Объективно: Состояние удовлетворительное. Печень выступает из-под реберной дуги на 2 см.
Край печени плотный, болезненный.
Предшествующая терапия: не проводилась.
Курс лечения: Проведен курс иммуномодулирующей терапии с использованием препарата GSSG•Pt по схеме.
Состояние после проведенного курса лечения: Отмечается положительная динамика, которая выражается в значительном улучшении состояния больного, исчезновении слабости, тошноты, уменьшении ощущения тяжести в правом подреберье. Печень выступает на 0,5 см из-под реберной дуги. Край печени мягкий, безболезненный.
Больной N 2: Лукашенко Игорь Матвеевич.
Год рождения: 1964 г.р.
Диагноз: ХВГВ, фаза репликации (PCR HBV+), умеренно выраженная степень активности.
История болезни: N 1043.
Жалобы при поступлении: на выраженную слабость, отсутствие аппетита, потливость, потемнение мочи.
Анамнез заболевания: Считает себя больным с января 1996 года, когда впервые появились ноющие боли в правом подреберье, повышение температуры до 38,7oC, рвота, потемнение мочи. Был поставлен диагноз острого вирусного гепатита В, подтвержденный серологически. Получал дезинтоксикационную и антибактериальную терапию. Однако, все последующее время наблюдались повышенные показатели АЛТ и Hbs Ag, сохранялась репликативная активность вируса. При настоящем обследовании выявлены: гипербилирубинемия до 78 мкмоль/л, повышение АЛТ до 6,2 ммоль/ч.л. При стационарном обследовании были определены серологические маркеры ХВГВ и PCR HBV(+).
Объективно: Состояние удовлетворительное. Желтушность кожных покровов, иктеричность склер. Печень выступает из-под реберной дуги на 2,5 см. Край плотный, болезненный.
Предшествующая терапия: С 17.09.97 получал курс ацикловира 21 день. После окончания курса АЛТ оставалась повышенной - 2,1 мкмоль/ч.л, билирубин - 32 мкмоль/л. Уровень Hbs Ag не изменялся. Состояние пациента определялось выраженным астеновегетативным синдромом.
Курс лечения: проведен курс иммуномодулирующей терапии с использованием препарата GSSG•Pt по схеме.
Состояние после проведенного курса лечения: Отмечается яркая положительная динамика, которая выражается в улучшении общего состояния больного, исчезновении слабости, тошноты, потливости. Отсутствуют желтушность кожных покровов, иктеричность склер. Моча приобрела нормальный цвет. Печень выступает на 0,5 см из-под реберной дуги. Край печени стал более мягким, безболезненным.
Заключение:
При сравнительном анализе терапевтической
эффективности препарата GSSG•Pt было
установлено следующее (см. таблицы 20, 21):
1. Нормализация
биохимических
показателей (снижение АЛТ, билирубина);
2. Выраженное
снижение HBs Ag и прекращение репликации;
3.
Нормализация иммунологических показателей и повышение содержания
СД95+
клеток, что свидетельствует об активации процессов апоптоза
в
вирусинфицированных клетках;
4. Существенная
регуляция широкого спектра цитокинов.
Пример N 12.
Терапевтическая эффективность препаратов GSSG• Pt при остром вирусном гепатите В.
Фамилия,
имя, отчество пациента: Минина Оксана Александровна
Пол:
женский
Возраст: 20 лет
Амбулаторная карта: 678
Диагноз: Острый вирусный гепатит В, фаза репликации (PCR
HBV+), затяжное течение; хронический вирусный гепатит D, фаза
репликации (PCR Н DV+)
Жалобы при осмотре: Слабость, понижение
аппетита
Анамнез заболевания: Заболела в августе 1997
года, когда почувствовала резкую слабость, недомогание, боли в
позвоночнике, повышение температуры до 38,8oC. Через 10
дней
потемнела моча, появилась желтушность склер. Поступила для
лечения в клинику вирусных инфекций, где был проведен курс
дезинтоксикационной, спазмолитической, антибактериальной терапии. Однако,
сохранялись репликативная активность вируса и повышенная АЛТ.
Длительный цитолитический синдром явился основанием для
назначения препарата GSSG•Pt.
Предшествующее
лечение:
Не проводилось
Курс терапии препаратами группы
GSSG•Pt: с 30.10.97 по 23.11.97
Состояние
пациента после окончания курса лечения: Состояние удовлетворительное.
Отмечает
уменьшение слабости, повышение аппетита.
Заключение (см. таблицы 22-24): Проведение курса терапии препаратами группы GSSG•Pt обеспечило положительную динамику, которая выражается в нормализации биохимических показателей; прекращении репликации HCV и HDV; прекращении персистенции Hbs Ag; индукции процесса апоптоза вирус-инфицированных клеток; улучшении общего состояния; стабильном терапевтическом эффекте.
Пример
13
Терапевтическая эффективность препаратом
GSSG•Pt при хроническом вирусном гепатите С
Фамилия, имя,
отчество: 3. Виталий Валерьевич
Пол: мужской
Возраст:
18 лет
История болезни: N 1043
Диагноз: Хронический вирусный гепатит С, фаза репликации (PCR
HCV+),
умеренно выраженная степень активности; хронический вирусный гепатит В, фаза
интеграции (PCR HBV-), наркотическое опьянение,
наркомания.
Жалобы при осмотре: Слабость,
сильные боли
в правом подреберье, коленных суставах, позвоночнике, суставах кисти
Анамнез заболевания: Заметил боли в суставах
коленей, позвоночнике в начале августа 1997 года. При
обследовании крови
было обнаружено повышение уровня билирубина до 34,0 мкмоль/л и АЛТ - 2,1
ммоль/ч.л. При стационарном обследовании с 15.08.97
были определены анти HCV IgG и репликативная
активность вируса гепатита
С.
Анамнез жизни: Применять наркотики начал с 14 лет. Внутривенное их введение проводил с 17 лет. На момент осмотра применяет 2 г героина в день и находится в состоянии наркотической абстиненции.
Предшествующее лечение: Не проводилось
Курс препаратами GSSG•Pt: с 15.08.97 по
07.09.97
Состояние
пациента после окончания курса
лечения: Состояние удовлетворительное. Отмечает значительное уменьшение слабости,
отсутствие боли в правом подреберье, в суставах. Со слов
пациента, выход из
состояния наркотической абстиненции
прошел практически безболезненно и менее длительно. Отмечается нормализация
биохимических показателей и отсутствие репликативной активности
вируса.
Заключение (см. таблицы 25-27): Проведение курса терапии препаратом GSSG•Pt обеспечило положительную динамику, которая выражается в нормализации биохимических, серологических показателей, прекращении репликации HCV. Иммунологические показатели и данные цитокинового статуса коррелируют с купированием инфекционного процесса и отсутствием репликации вируса. При исследовании лимфоцитов периферической крови пациента методом проточной цитометрии с использованием моноклональных антител к FasAg (CD95+) после лечения показано увеличение CD95+-клеток, что свидетельствует об активации процесса программируемой клеточной гибели в вирус-инфицированных клетках. При наблюдении в динамике через месяц и три месяца после окончания отмечается стабилизация данного состояния.
Сопутствующее наркотическое опьянение и состояние абстиненции при применении препарата GSSG•Pt купировалось в более ранние сроки и проходило с меньшими для пациента страданиями.
Таким образом, курс лечения препаратом GSSG•Pt хронического гепатита С с репликативной активностью и
сопутствующим наркотическим
опьянением позволил
достигнуть следующих
результатов:
Нормализация биохимических показателей крови
Нормализация гематологических показателей
Отсутствие репликативной
активности вируса С
Нормализация
иммунологических показателей крови и цитокинового статуса
Индукция процесса апоптоза в лимфоцитах периферической крови
Быстрое купирование
состояния наркотической
обстиненции
Стабильный терапевтический эффект
Пример 14
Сравнительный анализ действия препаратов GSSG и GSSG•Pt на
динамику роста и
апоптотической деградации ДНК
нормальных и
трансформированных клеток.
Выполнили сравнительный анализ действия препаратов GSSG и GSSG•Pt на динамику роста и апоптотической деградации ДНК нормальных и трансформированных клеток (HL-60). Для этого осуществляли инкубацию GSSG и GSSG-Pt с клетками миелоидной линии HL-60, дефектных по гену p53 - ключевому участнику развития апоптоза, и нормальными лимфоцитами, полученными из крови здоровых доноров.
Венозную кровь от здоровых доноров собрали в гепаринизированные пробирки, тестированные на отсутствие эндотоксина. Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метриозат (Histopaque, Sigma). Концентрацию клеток доводили до 2• 106 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМоль/мл глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим и клеточную суспензию разносили в лунки 24-, 96-луночных планшетов из расчета 250 000 клеток на лунку.
Клетки перевиваемой миелоидной линии HL-60 выращивались в среде RPMI 1640 с добавкой 10% эмбриональной телячьей сыворотки. Культивирование клеточной суспензии проводили в закрытых флаконах, объем среды 12 мл, смену среды проводили каждые 4 дня. Непосредственно перед тестированием препаратов суспензию клеток в свежей среде переносили в планшеты с 24-мя лунками (концентрация клеток в каждой лунке 250 000 кл/мл) и добавляли испытуемые препараты GSSG и GSSG• Pt до конечной концентрации 100 мкг/мл в соответствующие лунки.
Тестирование эффектов действия исследуемых препаратов проводилось через сутки-двое после их внесения в культуру.
Процедура анализа заключалась в следующем: после инкубации сутки-двое подсчитывали общее количество клеток, количество погибших клеток по тесту с трипановым синим, затем клеточную суспензию центрифугировали при 3,000 g в эппендорфовских пробирках в течение 10 мин. Осадок клеток замораживали и хранили при -70oC до выделения ДНК. Выделение ДНК осуществляли фенольным методом по Кирби-Георгиеву. К клеточному осадку добавляли 0.5 мл 10% SDS и 0.5 мл ТЕ-буфера, содержащего 0.1 М ЭДТА и 0.01 М Трис-HCl pH 8.0 (буфер А) и ресуспендировали осадок, покачивая пробирку в течение 15 мин. После этого добавляли равный объем фенола, уравновешенного 0.01 М Трис-HCl буфером с pH 8.0, перемешивали в течение 2 минут и центрифугировали в эппендорфовских пробирках при 12,000 g 15 мин. По окончании центрифугирования верхнюю водную фазу повторно подвергали обработке фенолом. По окончании фенольной обработки проводили 2-х кратную обработку верхней водной фазы смесью фенол-хлороформ (1: 1), которую смешивали с водной фазой в равном объеме. Водную фазу отделяли центрифугированием при 12,000 g 10 мин, отсасывали и смешивали однократно с равным объемом хлороформа, после чего центрифугировали при 12,000 g и отделяли верхнюю фазу, ее смешивали с 2-мя объемами охлажденного до -20oC перегнанного этанола и оставляли на ночь при -20o C. Рыхлый осадок уплотняли центрифугированием при 12,000 g в течение 10 мин, сливали супернатант и промывали осадок 200 мкл 70% этанола, охлажденного до -20oC 5 мин, повторно центрифугировали в тех же условиях, после чего подсушивали осадок на воздухе 1 час. Далее его растворяли в 10 мкл буфера А, определяли количество ДНК по Дише и подвергали ее электрофорезу в 2% агарозном геле (использовали агарозу марки NA фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия)). Электрофоретическое разделение ДНК осуществляли в блоке 2% агарозного геля в аппарате фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). В качестве буферного раствора использовали 0.04 М трис-HCl буфер, pH 7.7, содержащий 0.02 М ацетата натрия и 0.002 М ЭДТА. Агарозу (2%) готовили на электродном буфере. Депротеинизированную ДНК (2-5 мкг) наносили в лунки геля. Электрофорез проводили при напряженности электрического поля 6 В/см в течение 3 часов. За движением образца следили по перемещению бромфенолового синего. По окончании электрофореза гелевый блок извлекали из камеры и помещали в ванночку с раствором этидия бромида (3 мкг/мл H2O) на 30 минут в темноте. По окончании инкубации гель промывали водой и просматривали в проходящем ультрафиолетовом излучении при длине волны 254 нм на трансиллюминаторе фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). Фотографировали гель фотоаппаратом "Зенит E" с красным светофильтром.
Результаты исследования представлены в таблицах 28, 29 и фиг. 13, 14. Как можно видеть из данных таблиц 28 и 29, действие GSSG и GSSG•Pt на нормальные и трансформированные клетки носит альтернативный характер. GSSG и GSSG•Pt стимулировали некоторую пролиферацию нормальных клеток (табл. 28). Электрофорез ДНК, выделенной из нормальных клеток (фиг. 28), показал наличие лишь следовых количеств апоптозных фрагментов на фоне гомогенной высокомолекулярной фракции, характерной для жизнеспособных клеток.
Напротив, в культуре опухолевых клеток миелоидного происхождения (HL-60) наблюдали активацию апоптоза и задержку клеточного деления под влиянием обоих препаратов (табл. 29, фиг. 14). Различия в действии препаратов носили количественный характер.
Так, количество погибших клеток HL-60 при действии препарата GSSG было достоверно ниже количества погибших клеток при действии препарата GSSG•Pt (табл. 29). Очевидным свидетельством более высокой эффективности действия на клетки HL-60 GSSG•Pt по сравнению с GSSG является характер апоптозных фрагментов выявляемых в результате электрофоретического анализа.
Электрофорез ДНК клеток HL-60, не инкубированных с препаратами, показал наличие высокомолекулярной, практически гомогенной ДНК, характерной для жизнеспособных клеток (фиг. 14, дорожка N 2). Электрофорез ДНК клеток, инкубированных в течение 24 и 48 часов с препаратами GSSG и GSSG•Pt, выявил олигонуклеосомную деградацию ДНК (фиг. 14, дорожки 1 и 3 соответственно) - апоптозную лесенку - бесспорный признак программируемой клеточной гибели. Однако, апоптозная лесенка из клеток HL-60, на которые воздействовали препаратом GSSG, содержит значительное количество высокомолекулярной ДНК, характерной для жизнеспособных клеток HL-60 (фиг. 14, дорожка N 1), в то время как высокомолекулярная ДНК в группе клеток, на которые воздействовали GSSG•Pt, практически отсутствует (фиг. 14, дорожка N 3).
Клетки HL-60 имеют дефект гена p53 (делеция гена p53) и индукция
апоптоза в них при
воздействии
GSSG и
GSSG•Pt может происходить лишь без участия продукта гена p53. В этой связи можно
говорить, что препараты GSSG и GSSG•Pt активируют внутренний контур
программируемой
гибели клеток
независимо от продукта гена p53. Дефект гена p53 встречается примерно в половине случаев
онкологических заболеваний, что в преломлении к результатам проведенных
экспериментов может
означать
эффективность препарата GSSG и особенно препарата GSSG Заключение. Проведенные эксперименты позволили получить
данные,
свидетельствующие о
способности препаратов GSSG и GSSG•Pt усиливать резистентность нормальных
клеток (лимфоцитов) и напротив, индуцировать апоптоз в трансформированных клетках, то есть
оказывать противоопухолевое
действие. Причем активность препарата GSSG•Pt в отношении индукции
апоптоза трансформированных клеток значительно превосходила таковую для препарата GSSG по
объективному критерию
жизнеспособности - наличию высокомолекулярной ДНК, которая имелась в значительном
количестве при действии GSSG и практически полностью отсутствовала в случае воздействия
GSSG•Pt. Таким образом,
данные, полученные на клетках миелоидной линии HL-60, дефектных по гену p53
- ключевому участнику развития апоптоза, позволяет утверждать, что: Пример 15
Выполнили сравнительный анализ действия препарата GSSG•Pt на динамику роста и
апоптотической деградации ДНК
трансформированных клеток различных линий (HL-60, С-8, А-4) в зависимости от
дефекта гена p53 - ключевого участника развития апоптоза и
ras-гена - мультипотентного
фактора клеточной реакции. Культура
клеток HL-60 представляет собой клетки человека миелолейкозного
происхождения дефектные по гену p53. С-8, А-4 являются
трансформированными фибробластами мыши,
несущими плазмиду с геном ras и геном
фактора усиления экспрессии E1a-фрагментом антигена аденовирусов
[38, 39]. При этом клетки А-4 дефектны по гену p53, а
С-8 содержат интактный ген p53. В
качестве
контроля клеток человека с интактным
геном p53 использовали взвесь лейкоцитов донорской крови. Клетки перевиваемой миелоидной линии
HL-60(p53--) выращивались в среде RPMI
1640 с
добавкой 10% эмбриональной телячьей
сыворотки. Культивирование клеточной суспензии проводили в закрытых
флаконах, объем среды 12 мл, смену среды
проводили каждые 4 дня. Непосредственно перед
тестированием препаратов суспензию клеток в
свежей среде переносили в планшеты с 24-мя лунками (концентрация
клеток в каждой лунке 250 000 кл/мл) и
добавляли испытуемые препараты GSSG•Pt до
конечной концентрации 10 - 100 мкг/мл в
соответствующие лунки. Венозную кровь от здоровых
доноров собрали в гепаринизированные
пробирки, тестированные на отсутствие эндотоксина.
Мононуклеарную фракцию лейкоцитов крови
получали центрифугированием в градиенте плотности фиколл-метриозат
(Histopaque, Sigma). Концентрацию
клеток доводили до 2•106 клеток на 1 мл
полной культуральной среды (RPMI 1640),
содержащей 20 мМ HEPES, 2 мМоль/мл глутамина, 50 мкг/мл
гентамицина и 10% эмбриональную
телячью сыворотку. Жизнеспособность клеток оценивали в тесте с
трипановым синим и клеточную суспензию разносили
в лунки 24-, 96-луночных планшетов из расчета 250 000
клеток на лунку. Трансформированные фибробласты мышей выращивались в среде
DMEM
с добавкой 10% эмбриональной телячьей сыворотки.
Культивирование клеточного монослоя проводили в
закрытых флаконах, объем
среды 12 мл, смену среды проводили каждые 4 дня. Непосредственно перед
тестированием препаратов суспензию клеток в свежей
среде переносили в планшеты с 24-мя лунками
(концентрация клеток в каждой
лунке 250 000 кл/мл) и добавляли испытуемый препарат GSSG•Pt до
конечной концентрации 10 - 100 мкг/мл в
соответствующие лунки. Тестирование
эффектов действия
исследуемых препаратов проводилось через сутки-двое после их внесения в культуру. Процедура анализа заключалась
в следующем: после инкубации сутки-двое подсчитывали
общее количество
клеток, количество погибших клеток по тесту с трипановым синим, затем клеточную
суспензию
центрифугировали при 3,000 g в
эппендорфовских пробирках в течение 10 мин. Осадок клеток
замораживали и
хранили при -70oC до выделения ДНК. Выделение ДНК осуществляли фенольным
методом по
Кирби-Георгиеву. К клеточному
осадку добавляли 0.5 мл 10% SDS и 0.5 мл ТЕ-буфера,
содержащего 0.1 М
ЭДТА и 0.01 М Трис-HCl pH 8.0 (буфер А), и ресуспендировали осадок, покачивая пробирку
в течение 15
мин. После этого добавляли
равный объем фенола, уравновешенного 0.01 М
Трис- HCI буфером с pH
8.0, перемешивали в течение 2 минут и центрифугировали в эппендорфовских пробирках при 12,
000 g 15 мин. По
окончании
центрифугирования верхнюю водную фазу повторно подвергали
обработке фенолом. По
окончании фенольной обработки проводили 2-х кратную обработку верхней водной фазы смесью
фенол-хлороформ (1:
1),
которую смешивали с водной фазой в равном объеме. Водную фазу
отделяли
центрифугированием при 12,000 g 10 мин, отсасывали и смешивали однократно с равным объемом хлороформа,
после чего
центрифугировали при 12,000 g и отделяли верхнюю фазу, ее смешивали с 2-мя
объемами охлажденного до -20oC перегнанного этанола и оставляли на ночь при -20oC. Рыхлый
осадок
уплотняли центрифугированием при 12,000 g в течение 10 мин, сливали
супернатант и промывали осадок 200 мкл 70% этанола, охлажденного до -20oC 5 мин, повторно центрифугировали в тех
же
условиях, после чего подсушивали осадок на воздухе 1 час. Далее его
растворяли в 10 мкл буфера А, определяли количество ДНК по Дише и подвергали ее электрофорезу в 2% агарозном геле (использовали
агарозу марки NA фирмы "Pharmacia LKB, Biotechnology Inc"
(Австрия)).
Электрофоретическое разделение ДНК осуществляли в блоке 2% агарозного геля в аппарате фирмы "Pharmacia LKB, Biotechnology Inc"
(Австрия). В качестве буферного раствора использовали
0.04 М трис-HCl
буфер, pH 7.7, содержащий 0.02 М ацетата натрия и 0.002 М ЭДТА. Агарозу (2%) готовили на электродном буфере.
Депротеинизированную
ДНК (2-5 мкг) наносили в лунки геля. Электрофорез
проводили при
напряженности электрического поля 6 В/см в течение 3 часов. За движением образца следили по перемещению
бромфенолового синего. По
окончании электрофореза гелевый блок извлекали из
камеры и помещали
в ванночку с раствором этидия бромида (3 мкг/мл H2O) на 30 минут в темноте. По окончании
инкубации гель промывали водой
и
просматривали в проходящем ультрафиолетовом
излучении при длине
волны 254 нм на трансиллюминаторе фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). Фотографировали
гель фотоаппаратом "Зенит E" с
красным светофильтром.
Результаты исследования
представлены в таблицах 30, 31, 32, 33. Как можно видеть из данных таблицы 31, GSSG•Pt
индуцирует апоптоз в культуре клеток
HL-60,
которые дефектны по гену p53.
Этот эффект весьма выражен
уже при концентрации 10 мкг/мл, однако при концентрации 100 мкг/мл он сильнее. Наблюдали
накопление апоптозных фрагментов ДНК, кратных
по
размеру ДНК нуклеосомы
- бесспорный признак программируемой
клеточной гибели. В противоположность этому на нормальные клетки
GSSG•Pt оказывал стимулирующий эффект - то есть
некоторую
пролиферацию клеток (табл. 30). Электрофорез ДНК,
выделенной из нормальных клеток показал что она представлена гомогенной
высокомолекулярной фракцией, характерной для жизнеспособных
клеток. Таким образом, различия в действии
препарата на нормальные и опухолевые клетки носили принципиально
разнонаправленный характер. Механизм разнонаправленного
действия
препарата GSSG•Pt может быть связан с
активацией p53-независимого пути апоптоза через Ras-сигнальную систему.
Ras-система обладает способностью стимулировать пролиферацию и
дифференцировку клеток через один каскад митогенных факторов и
индуцировать апоптоз (программированную клеточную гибель) через другой
каскад клеточных сигналов. Для проверки этого
сопоставляли эффект препарата GSSG•Pt на мышиные
фибробласты с усиленной экспрессией ras-гена, но отличающиеся по наличию гена
p53 - интактного (дикого типа) - клетки С-8(p53++) или с
генетическим дефектом - отсутствием гена p53 - клетки
А-4(p53--). Как видно из таблицы 32 и 33, эффект GSSG•Pt проявился в обеих
линиях клеток. Индукция апоптоза была сильно выражена.
Это
свидетельствует об активации p53-независимого пути
апоптоза. Наличие в обеих линиях клеток активированного гена ras может объяснять
выраженность апоптоза в трансформированных фибробластах,
даже
большую чем в HL-60 клетках. Это подтверждает индукцию
апоптоза через Ras-сигнальную систему. Эффект GSSG•Pt на клетки А-4 и
клетки С-8 при концентрации 10 мкг/мл не отличался
между собой.
Достоверно больший эффект GSSG•Pt на клетки А-4,
чем на клетки С-8, отмечали при концентрации 100 мкг/мл. Возможно отсутствие
p53-белка даже усиливает действие
Ras-сигнального пути индукции
апоптоза в опухолевых клетках. Дефект
гена p53 встречается примерно в половине случаев онкологических заболеваний,
что в преломлении к результатам
проведенных экспериментов может
означать эффективность препарата GSSG•Pt в
химиотерапии этих опухолей. Заключение.
Проведенные эксперименты позволили
получить данные, свидетельствующие о
способности препарата GSSG•Pt усиливать
резистентность нормальных клеток (лимфоцитов) и, напротив, индуцировать апоптоз
в трансформированных клетках,
то есть оказывать противоопухолевое
действие. Причем активность препарата GSSG•
Pt в отношении индукции апоптоза трансформированных клеток дефектных по гену p53
даже превосходила
таковую для клеток с интактным геном p53 при
высокой концентрации препарата. По объективному
критерию жизнеспособности - наличию высокомолекулярной ДНК, которая имелась в
значительном количестве
при действии GSSG-Pt на нормальные клетки
лейковзвеси доноров, клеточная гибель при этом
практически отсутствовала, тогда как в случае воздействия GSSG•Pt на
опухолевые клетки наблюдали
апоптозную деградацию ДНК-признак необратимой
индукции апоптозной гибели, даже в клетках
дефектных по гену p53, особенно при стимуляции Ras-сигнального пути. Ранее в
примере 9 показана активация
ряда цитокинов под действием препарата GSSG•
Pt. Учитывая, что действие цитокинов
может быть связано с активацией факторов Ras-сигнального пути, стимуляция
цитокинов может также
приводить к противоопухолевому эффекту через взаимодействие с
Ras-белком.
Следовательно, применение препарата GSSG•Pt обеспечивает: Пример 16 Выполнили сравнительный анализ
действия препарата
GSSG•Pt на динамику роста и апоптотической деградации ДНК
трансформированных
фибробластов линии клеток с активированным ras-геном, но интактным геном p21 (p21++; С-8) и
линию клеток
мышей нокаутированных по гену p21(p21--)(1). Клетки линии
p21++ являются
трансформированными фибробластами мыши, несущими плазмиду с геном ras и геном фактора усиления
экспрессии
E1a-фрагментом антигена аденовирусов, но содержат интактные гены p53 и p21.
Линия p21(-)
содержит интактные гены p53 и ras, но дефектна по гену p21. Это позволяет оценить действие
препарата
GSSG•Pt на индукцию апоптоза в условиях нарушения регуляции G1 фазы клеточного
деления
[38, 39]. Культуры клеток выращивались в среде DMEM с добавкой 10% эмбриональной телячьей
сыворотки. Культивирование клеточного монослоя проводили в закрытых флаконах, объем среды 12 мл,
смену
среды проводили каждые 4 дня. Непосредственно перед тестированием препаратов клетки
суспензировали в свежей среде и переносили в планшеты с 24-мя лунками Тестирование эффектов действия исследуемых
препаратов
проводилось через сутки-двое после их внесения в культуру.
Процедура анализа
заключалась в следующем: после инкубации сутки-двое подсчитывали общее количество клеток, количество погибших
клеток по
тесту с трипановым синим, затем клеточную суспензию
центрифугировали при 3,000
g в эппендорфовских пробирках в течение 10 мин. Осадок клеток замораживали и хранили при -70oC до
выделения
ДНК. Выделение ДНК осуществляли фенольным методом
по Кирби-Георгиеву. Лизис
клеток осуществляли добавлением 0.5 мл 10% SDS. В лизат вносили равный объем фенола, уравновешенного 0.01 М
Трис-HCl буфером
с pH 8.0, перемешивали в течение 2 минут и
центрифугировали в
эппендорфовских пробирках при 12,000 g 15 мин. Фенольную депротеинизацию повторяли дважды. После этого проводили 2-х
кратную обработку
водной фазы смесью фенол-хлороформ (1:1) и
однократно-хлороформом. Нуклеиновые кислоты осаждали добавлением 2-х объемов 96% этанола при -20oC в течение ночи. Осадок
уплотняли
центрифугированием при 12,000 g в течение 30 мин,
декантировали, промывали 70% этанолом и высушивали на воздухе. После высыхания осадок растворяли в буфере ТЕ. В полученном растворе
определяли
концентрацию ДНК (по Дише). Фракционный состав
нуклеиновых кислот определяли методом электрофореза в 2% агарозном геле (использовали агарозу марки NA фирмы "Pharmacia LKB, Biotechnology
Inc"
(Австрия)). Электрофоретическое разделение ДНК
осуществляли в блоке 2% агарозного геля в аппарате фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). Электрофорез проводили в ТАЕ буфере pH 7,4
(0.04 М
трис, 0.02 М ацетат натрия и 0.002 М ЭДТА)
при напряженности электрического поля 6 В/см в течение 3 часов. За движением образца следили по перемещению маркерного красителя бромфенолового
синего.
Результаты электрофореза детектировали в
проходящем ультрафиолетовом свете (λ= 254 нм) на трансиллюминаторе фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия) после окраски геля
раствором
этидиум бромида (5 мкг/мл).
Результаты исследования представлены в таблицах 34, 35. Как можно видеть из данных таблицы 34, GSSG•Pt индуцирует апоптоз в культуре
клеток p21++, в
которых активирован
ras-ген, что
проявлялось накоплением фрагментов ДНК, кратных по размеру ДНК нуклеосомы. В клетках p21(--), имеющих неактивированную
Ras-сигнальную
систему, но
дефектных по
контролю задержки
клеточного цикла в фазе G1 GSSG•Pt, индуцирует апоптоз в меньшей степени, чем в клетках p21++ (табл. 34, 35). Это может быть
связано с тем, что
Ras-система
обладает
способностью стимулировать
пролиферацию и дифференцировку клеток через один каскад митогенных факторов и индуцировать апоптоз (программированную клеточную
гибель) через другой
каскад
клеточных
сигналов. Отсутствие экспрессии
гена p21 может приводить к изменениям в соотношении работы отдельных каскадов Ras-сигнального пути и таким образом меньшей
стимуляции апоптоза
препаратом при
дефектах гена p21.
Дефект гена p21 встречается нечасто при онкологических заболеваний, что в преломлении к результатам проведенных экспериментов
может означать
эффективность
препарата
GSSG•Pt в химиотерапии
опухолей, кроме случаев меньшей эффективности при опухолях с мутациями в гене p21. Заключение.
Проведенные
эксперименты позволили
получить данные, свидетельствующие
о способности препарата GSSG•Pt активно индуцировать апоптоз в трансформированных клетках, то есть оказывать
противоопухолевое
действие. Усиленная экспрессия
ras-гена способствует индукции
апоптоза трансформированных клеток С-8, что свидетельствует в пользу реализации противоопухолевого действия препарата
GSSG•
Pt
через Ras-сигнальную систему.
Меньший эффект препарата при
отсутствии экспрессии гена p21 может быть связан с перераспределением факторов в митогенном и апоптозном каскадах
Ras-сигнального
пути. Тем не менее,
присутствие апоптозной
деградации ДНК - признак необратимой индукции апоптозной гибели, обнаруживается после воздействия препарата GSSG•Pt
даже в
клетках дефектных
по гену p21.
Сказанное позволяет
утверждать:
Препарат GSSG•Pt
индуцирует развитие
апоптоза даже при дефекте гена p21, но изменение соотношения эффекторных путей Ras-сигнальной системы влияет на
выраженность
этого процесса. Пример 17
Пол: женский
Анамнез заболевания: Впервые повышение
уровня
сахара стало обнаруживаться с 31-летнего возраста. В октябре 1994 года была госпитализирована в
эндокринологическое отделение
больницы N 16.
Наследственность по диабету отягощена по материнской
линии. Заболевание развивалось постепенно, уровень сахара в крови колебался от 12.1 до 15.7
ммоль/л, глюкозурия до 7%.
Предшествующее лечение: После начала заболевания больная
неоднократно находилась на стационарном лечении, в 1994 г. в течение полугода получала
инсулин-ленте S. N. C.-32 ед и пероральные
сахароснижающие препараты группы сульфонилмочевины, затем инсулин
был
отменен, принимала противодиабетические средства - букарбан, диабетон. Сахар крови
колебался от 10.7 до 15.4 ммоль/л,
глюкозурия
3-7%. В январе 1998 г. больная госпитализирована
с
курсом лечения препаратами: диабетон по 0.08 - по 2 таблетки утром и вечером,
глюкобай 0.1 х 3 раза в сутки.
Содержание сахара в крови, ммоль/л: В
связи с неэффективностью предыдущей терапии принято решение об
использовании препарата ванадиевой соли GSSG•Pt. Курс
терапии препаратом ванадиевой соли
GSSG•Pt в
стационаре: с 17.01.98 г. В течение 10 дней один
раз
в день внутривенное введение ванадиевой соли GSSG•Pt
(суточная доза 0.01-0.5 мг/кг). В
течение следующих
10 дней лечения внутривенное введение ванадиевой соли GSSG•
Pt
один раз в два дня (суточная доза - 0.01-0.5
мг/кг). В течение следующих 10 дней (третья
декада) лечения
внутримышечные инъекции ванадиевой соли GSSG•Pt один раз в день в
течение 20 дней (суточная доза 0.1-0.5
мг/кг). Терапия препаратом ванадиевой соли
GSSG•Pt проводилась
на фоне изменения схемы лечения препаратами диабетон и глюкобай.
Диабетон
принимала по 0.08 утром и
вечером, глюкобай по 0.05 х 3 раза в день. Сахар в
крови нормализовался и не
превышал 8.2 - 10.6 ммоль/л после еды. С момента выписки из
стационара больная
получала сопутствующую
терапию препаратом ванадиевой соли GSSG•Pt амбулаторно в
течение месяца.
Амбулаторный курс терапии препаратом ванадиевой соли
GSSG•Pt: В течение 2
последовательных месяцев лечения препаратом
ванадиевой соли GSSG•Pt у больной после дважды отмечалось снижение
уровня сахара в крови до 1.5 - 2.5 ммоль/л,
в связи с чем были уменьшены дозы
сахароснижающих препаратов.
Через 2 месяца лечения глюкобай был отменен. Состояние
больной после окончания курса лечения: Комментарий к динамике показателей сахара крови,
цАМФ/цГМФ, тиол-дисульфидного
соотношения и других
анализируемых
параметров. Динамика количества сахара крови является
интегративным критерием эффективности действия
противодиабетических препаратов.
Комбинированная терапия
пероральными
гипогликемизирующими средствами (диабетон и глюкобай) совместно с препаратом
ванадиевой соли GSSG•Pt привела к
нормализации сахара крови, уменьшению
терапевтической дозы
препарата диабетон и
необходимости отмены препарата глюкобай. Характер изменения гематологических
и биохимических показателей, параметров
иммунного статуса, в значительной
степени свидетельствует
о нормализации обмена и
системных реакций в целом, что не позволяет дифференцировать составляющую
противодиабетической активности препарата
ванадиевой соли GSSG•Pt. В
этой связи были
использованы показатели -цАМФ/цГМФ
и тиол-дисульфидного соотношения (ТДС), позволяющие принципиально
охарактеризовать молекулярный механизм
воздействия препарата ванадиевой соли
GSSG•Pt
на комплекс клеточных реакций гомеостаза
сахара крови. В частности, ключевые внутриклеточные мессенджеры
цАМФ и цГМФ определяют интенсивность
потока глюкозы во внутриклеточные
обменные процессы.
При этом цГМФ зависимые ферментативные
клеточные системы определяют интенсивность поглощения глюкозы
клетками. В свою очередь уровень цГМФ
определяется окислительным потенциалом
клетки. В
частности, оксиданты повышают уровень цГМФ,
напротив антиоксиданты оказывают депрессивное действие на его
содержание. Таким образом, тиол-дисульфидное
соотношение (ТДС) в клетке,
отражающее
уровень равновесия анти- и прооксидантов, определяет и
величину внутриклеточного показателя цАМФ/цГМФ. В
преломлении к целостному организму мы вправе
анализировать эти показатели в крови
как
интегрирующей внутренней среде во взаимосвязи с колебаниями
уровня сахара крови, потому что метаболизм глюкозы
является неотъемлемой составляющей
жизнедеятельности всех типов клеток нашего
организма, наряду с тиол-дисульфидным обменом, системами циклических
нуклеотидов. Полученные
результаты свидетельствуют о
гипогликемизирующем влиянии препарата ванадиевой соли
GSSG•Pt на содержание сахара крови. Причем этот эффект не упреждает,
а следует за динамикой увеличения цГМФ
(снижение значения показателя
цАМФ/цГМФ) и депрессией величины ТДС (прирост
количества окисленных форм тиолов). С учетом регуляторных возможностей окисленными
формами тиолов уровня цГМФ, а
последнего в регуляции уровня сахара в
крови, можно постулировать принципиальный
механизм регуляторного гипогликемизирующего влияния препарата ванадиевой соли GSSG•
Pt. В частности,
регуляторное воздействие препарата ванадиевой соли
GSSG•Pt на редокс
контур клетки
приводит к приросту уровня оксидантной составляющей, что в свою очередь перераспределяет
баланс в системе
циклических нуклеотидов в пользу цГМФ (индукция
активности гуанилатциклазы и
ингибирование
фосфодиэстеразы, ферментов синтеза и распада цГМФ соответственно). Регуляторное воздействие
цГМФ
стимулирует процессы связывания глюкозы клеткой и как итог
снижение сахара в
крови.
Заключение - использование препарата ванадиевой соли GSSG•Pt в схеме комбинированного
лечения диабета позволило получить следующие терапевтические
эффекты: Источники информации
2. Патент РФ N 2089179, А 61 К 38/02, 1997. 3.
Досон Р., Эллиот Д., Эллиот У.,
Джонс К. Справочник биохимика. - М.: Мир, 1991. 4. Tam J.P. et al// Int.
J. Pept.
Prot. Res. vol. 29. p. 421-431, 1987. 5. Ahmed
A.K.
et al// J. Biol. Chem. 250, p.
8477-8482, 1975. 6. Kamber В. et al// Helv. Chim. Acta. vol. 63, p.
899-915,
1980. 7. Hope D.B. et al// J. Biol. Chem., vol.
237, p.
1563-1566, 1962. 8. William A., Kato et al.// Chem. Pharm. Bull., vol. 34 (2), p. 486-495, 1986. 9. A. Meister et al.// Ann. Rev. Biochem., p/711-718,
1983. 10. Chambers
R.W. J. Am. Chem. Soc., 80, 3752, 1958. 11. Szent-Gyorgyi A. , Proc. Natl.
Acad.
Sci. U.S., 58, 2012 (1967); Introduction to a Submolecular
Biology, Academic
Press, New York
(1960). 12. Бохински Р. Современные воззрения в биохимии. - М.: Мир, 1987, с.
291. 13. Англо-русский медицинский
энциклопедический словарь. - М.: 1995,
с. 519. 14. Miller-Keane. Encyclopedia & Dictionary of Medicine, Nursing, &
Allied
Health. 5thedition,
W.B.Saunders Company, 1992, p. 1221.
15. Хорст А.
Молекулярные основы патогенеза болезней. - М.: Медицина, 1982, с. 125. 16.
Brian WJ
Mahy. A Dictionary of
Virology. 2-е изд. - Academic Press, 1997, с. 87. 17.
Англо-русский медицинский энциклопедический словарь. - М.: 1995, с. 179. 18.
Miller-Keane.
Encyclopedia & Dictionary of Medicine, Nursing, & Allied
Health. 5thedition, W.B.Saunders Company, 1992, p. 424. 19. Harrison's Principles of
Internal
Medicine,
14thedition, p. 511, 1998. 20.
Apoptosis: a role in
neoplasia, C.D. Gregory, 1996. 21. The Molecular Biology of Apoptosis, D.L.Vaux,
A.Strasser;
Proc.
Natl. Acad. Sci. USA 93 (1996). 22. Грачева
Л.А. Цитокины в
онкогематологии. - М.: 1996. 23. Textbook of biochemistry: with clinical
correlations. Ed. Devlin T.
M., 3rd ed. 1992, Wiley-Liss, Inc., NY. p. 522-525. 24. Kehrer
J.P., Lund L.G. Cellular reducing equivalents and oxidative stress. Free Radio Biol Med.
1994 Jul. 17(1). P 65-75. 25. Beckett G.J., Hayes J.D. Glutathine
S-transferase: biomedical
applications. Advan. Clin. Chem. 1993, vol. 30, P. 281-380. 26. E.Busse,
G.Zimmer, B.Schopohl, and
Kornhuber. Influence of α-Lipoic Acid on
Intracellular glutathione in vitro
and in vivo. // Arzneim. - Forch. / Drug Res. 42 (1), Nr. 6 (1992). 27.
Holmlund J.Т.
Cytokines.
Cancer Chemother Biol Response Modif. 1993. 14P
150-206. 28.
Hansson M., Soderstrom Т. The colony stimulating factors. Med Oncol Tumor Pharmacother. 1993.
10(1-2). P
5-12. 29. Dillman R. O. The clinical experience
with interleukin-2 in cancer
therapy. Cancer Biother. 1994 Fall. 9(3). P 183-209. 30. Whittington R.,
Faulds D.
Interleukin-2. A
review of its pharmacological properties and
therapeutic use in patients with
cancer. Drugs. 1993 Sep. 46(3). P 446-514. 31. Hieber U. , Heim M.E. Tumor
necrosis
factor for the
treatment of malignancies. Oncology. 1994 Mar-Apr.
51(2). P 142-53. 32. Morstyn G. , Sheridan W.P. Hematopoietic growth factors in cancer chemotherapy.
Cancer
Chemother Biol Response
Modif. 1993. 14P 353-70. 33.
Neidhart J. A.
Hematopoietic cytokines. Current use in cancer therapy. Cancer. 1993 Dec 1. 72(11 Suppl). P 3381-6. 34. Meister A.
Anderson M.E. Glutathione. Annu. Rev. Biochem., 1983,
52:
711-60. 35. Sokolovsky M., Wilchek M., Patchornik A. On the synthesis of cysteine peptides. J.
Amer. Chem. Soc. 1964, Mar.
86(6), P 1202-6. 36. John J. Reiners,
Jr,
Effat Kodari, Roseann E.Cappel fnd Hiram F.Gilbert. Assessment of antioxidant/prooxidant status of murine
skin. Part 2$5%: Quantitation of
glutation and glutation disulfide. // Carcinogenesis
Vol.
12. pp. 2345-2352. 37. A.Stacchini, L.Fubini, E.Gatti, L.Mutti, W.Piacibello, F.Canavio,
G. Scagliotti, E. Pozzi and
M.Aglietta. In vivo effect of human granulocyte-macrofage
colony-stimulating factor (GM-CSF) on neutrophil GM-CSF receptors. // Leucemia, 1995. Vol. 9. p. 1-6. 38. S.W.Lowe; H.E.Ruby;
T.Jacks and D.E.Hoksman "P53-dependent apoptosis
modulates the Cytotoxicity of Anticancer Agents" //Cell - 1993 - 74, pp. 703-711. 39. Y Xu;
E.M.Yang; J.Brugalos; T.Jacks; D.Baltimor
"Involvement of p53 and p21 in cellular defects
and tumorogenesis in Atm -/- mice" // Mol. Cel. Biol. - 1988, -18(7) - pp. 4385-4390.
препараты GSSG
и
GSSG•Pt индуцируют
внутренний контур развития апоптоза независимо от продукта гена p53;
препарат третьего поколения GSSG•Pt обладает более высокой
химиотерапевтической
активностью, чем препарат первого
поколения GSSG.
Анализ действия
препарата GSSG•Pt на динамику роста и апоптотическую
деградацию ДНК нормальных и
трансформированных клеток дефектных по
антионкогену p53 и с повышенной экспрессией ras-гена.
индуцию
апоптоза независимо
от продукта гена p53;
реализацию химиотерапевтической
активности через индукцию
Ras-зависимого пути апоптоза.
Анализ действия
препарата GSSG•
Pt на динамику роста и апоптотическую деградацию ДНК в культурах
трансформированных клеток
мышей, дефектных по антионкогенам.
(концентрация клеток в каждой
лунке
250 000 кл/мл). Затем добавляли испытуемый препарат GSSG•Pt до
конечной
концентрации 100 мкг/мл в соответствующие лунки.
препарат GSSG•Pt реализует химиотерапевтическую активность, через индукцию Ras-зависимого пути
апоптоза.
Терапевтический эффект
ванадиевой соли GSSG•Pt у больной сахарным диабетом
Фамилия, имя, отчество пациента:
Бронавец Лидия
Сергеевна.
Возраст: 37
лет
Амбулаторная карта: N 63
Диагноз: Сахарный диабет. Инсулинонезависимый тип - тип II.
Диабетическая ангиопатия IV
степени.
в 9.00 - 12.6
в
12.00 - 12.0
в 14.00 - 15.3
в 17.00 - 19.1
в 6.00
- 11.5
Глюкозурия до 3%.
В
течение
одного месяца были назначены внутримышечные инъекции ванадиевой соли
GSSG•Pt (суточная доза - 0.01 - 0.5
мг/кг).
После четырех месяцев лечения с
использованием препарата
ванадиевой соли
GSSG•Pt в качестве сопровождения базовой терапии общее состояние
больной существенно улучшилось и может быть оценено
как удовлетворительное. Динамика
гематологических,
биохимических,
иммунологических показателей крови приведена в таблицах 36 и 37.
улучшение качества жизни и
стабилизацию уровня сахара в крови;
снижение дозы принимаемых сахароснижающих
препаратов;
нормализацию гематологических, биохимических и
иммунологических показателей.
1. WO 97/21444, A 61 К 38/02, 19.06.97.
Реферат
Изобретение относится к медицине, в частности к фармакологии, а именно к способам получения лекарственных средств на основе активных метаболитов пептидной природы. Способ получения биологически активного соединения - композита, состоящего из динатриевой соли окисленного глутатиона с сis-диаминодихлорплатиной (GSSG•Pt), проводят в одну стадию окисления восстановленной формы глутатиона, где добавка сis-диаминодихлорплатины выступает как катализатор реакции окисления. Технический результат: Способ позволяет регулировать условия реакции, используя при этом меньшее эквивалента количество перекиси водорода, исключив образование продуктов переокисления и сделав количественным выход целевого продукта. Композит и его химические модификации характеризуются стабилизированной дисульфидной связью при введении его в биологические среды, что увеличивает время полужизни препарата в биологических средах. Созданы фармацевтические композиции, полученные на основе композита, его химических модификаций, продемонстрированы применение этих композиций для изготовления лекарственных средств и способ их использования. 7 с. и 21 з.п. ф-лы, 14 ил., 37 табл.
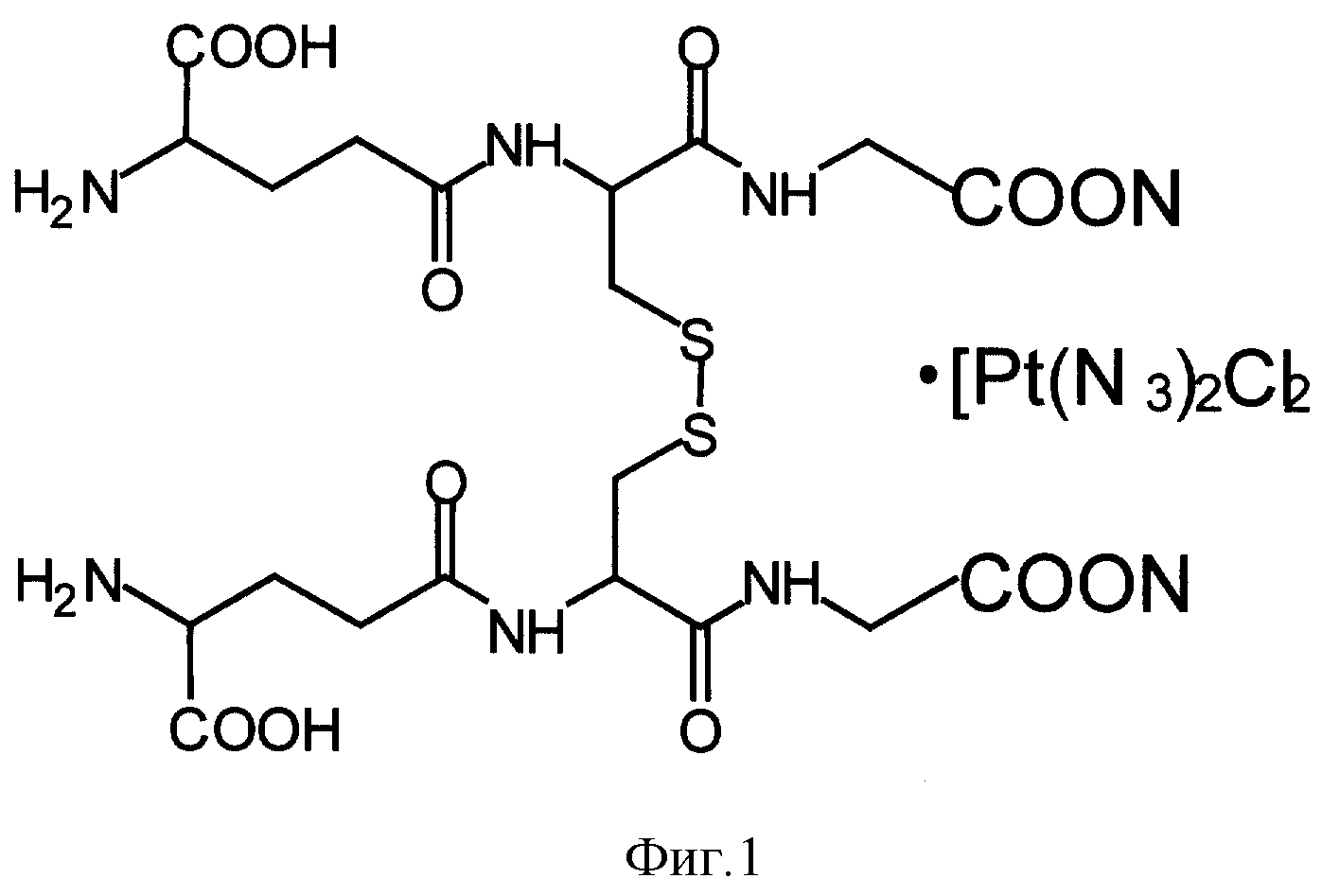

Комментарии