Композит гексапептида со стабилизированной дисульфидной связью с веществом металлом, фармацевтические композиции на его основе, способы их получения и применения для лечения заболеваний на основе регуляции метаболизма, пролиферации, дифференцировки и меха - RU2153350C1
Код документа: RU2153350C1
Чертежи




















































Описание
Изобретение относится к медицине, в частности к фармакологии, а именно к способам получения лекарственных средств, на основе активных метаболитов пептидной природы, которые могут быть использованы в клинической практике для профилактики и лечения различных патологических синдромов и заболеваний посредством дифференцированного воздействия на процессы метаболизма, пролиферации, дифференцировки и апоптоза нормальных и трансформированных клеток.
Современная фармакоиндустрия, постоянно интенсифицирующая внедрение в практическую медицину противоинфекционной и противоопухолевой химиотерапии, способствует масштабированию двух медико-биологических проблем: формированию резистентности (привыкания и падения фармакологической эффективности) к лекарственным препаратам, в том числе вследствие активации системы MDR-генов; и формированию резорбтивных нежелательных эффектов, проявляющихся в первую очередь повреждением системы иммунокомпетентных клеток и гемопоэза: кардио-, гепато-, нефро- и нейротоксичностью. Основная причина этих негативных явлений - широчайшее применение синтезируемых химиотерапевтических средств, средств, продуцируемых одноклеточными организмами весьма эффективных по своим физико-химическим механизмам, но чужеродных для человеческого организма по своей природе.
В этой связи теоретическая и практическая медицина все настойчивее обращает свой взор в сторону естественных ключевых метаболитов, представляющих собой внутриклеточные биохимические факторы, как правило, пептидной природы, предназначенные для запуска цепных реакций обмена веществ в клетках, наработки и модификации ряда биологически активных соединений, и регуляции физиологически важных и физиологически адекватных процессов.
Метаболиты, к которым обращаются достаточно активно, являются, в частности, серосодержащие пептиды и их производные, в первую очередь - это группа тиолов. В этой группе известен трипептид восстановленного глутатиона γ - глутамил-цистеинил-глицин; далее - GSH), биологические эффекты которого исследуются широчайшим образом.
Известен димер трипептида глутатиона - глутатион окисленный (бис-(γ -L-глутамил)-L-цистинил-бис-глицин - далее GSSG), в котором две молекулы трипептида с вышеозначенной структурой соединены друг с другом ковалентной дисульфидной связью между цистеиновыми остатками.
Установлены [1] уникальные свойства окисленного глутатиона (GSSG) стимулировать/модулировать эндогенную продукцию цитокинов и гемопоэтических (в том числе колониестимулирующих, то есть ростовых) факторов. При этом стабилизация указанными в [1] фармацевтическими решениями времени пребывания в биологических средах экзогенно введенного GSSG в окисленной форме усиливало эти эффекты. Известны процессы, развивающиеся в клетках (тканях и, следовательно, в органах) после взаимодействия с цитокинами, которые обусловлены универсальным влиянием цитокинов на основные сигнал-передающие системы и через них на геном клеток, что определяет регулирующие эффекты цитокинов на пролиферацию, дифференцировку и апоптоз.
В международной заявке WO 97/21444- [2] представлена группа лекарственных средств, содержащих в качестве действующего вещества производные окисленного глутатиона (GSSG) в виде его солей; или использование композитных препаратов, включая комбинации GSSG с веществами, пролонгирующими или усиливающими действие GSSG или его солей; или производных в качестве новых композиций, то есть формул новых соединений, когда последние получают посредством создания ковалентной связи между GSSG и вторым веществом. При этом впервые было показано, что технические решения, которые в той или иной степени стабилизируют молекулу GSSG в дисульфидной форме, значительно эффективнее и целенаправленнее индуцируют продукцию цитокинов и гемопоэтических факторов в нормальных, но в большей степени и целесообразнее в патологических условиях. Более того, лекарственные формы производных GSSG, характеризующиеся большей степенью стабильности молекулы GSSG в дисульфидной форме, обладали новой фармакокинетикой в биологических средах и проявляли способность индуцировать продукцию более широкой палитры цитокинов и гемопоэтических факторов, что определяло наличие в большей степени модулирующих, а не только стимулирующих эффектов; воспроизведения эффектов некоторых цитокинов, например IL-2.
Известны способы получения димера трипептида глутатиона, то есть окисленного глутатиона - GSSG из его предшественника, восстановленного глутатиона (GSH).
В настоящее время существуют три основных метода окисления восстановленной формы глутатиона. Во-первых, известно, что реакция окисления достаточно лабильных меркапто-SH-групп цистеина в молекуле глутатиона [3] окисляется уже такими мягкими окислителями как кислород воздуха [4, 5]. Однако скорость реакции в данном случае низкая и для количественного выхода требуется очень продолжительное время (многие сутки). Катализ ионами тяжелых металлов, и особенно токсичной меди создает существенные трудности для получения чистого фармацевтического препарата.
Вторым методом является использование более мощных окислителей, например, таких как перекись водорода, йод, ферроцианид калия и др. [6, 7]. Реакции в этих случаях проходят значительно быстрее (от десятков минут до нескольких часов), однако их общим существенным недостатком является трудно контролируемые реакционные условия, что приводит к значительному загрязнению целевого вещества продуктами окисления, то есть производными соответствующих кислот. Это вызывает необходимость подключения дополнительных, иногда достаточно трудоемких средств очистки, что резко удорожает процесс.
К третьей группе методов следует отнести использование в качестве окислителей газообразных веществ (окислов азота), сульфоксидов и других соединений, среди которых можно найти достаточно редкие и абсолютно неприемлемые для масштабирования [8, 9].
Наиболее близким способом по технической сущности к способу получения окисленного глутатиона как композита со стабилизированной дисульфидной связью является способ получения окисленного глутатиона из восстановленного с использованием перекиси водорода как окислителя [6]. Процесс проводится в водном растворе pH около 8,0-8, 5 с использованием эквивалента перекиси водорода, при комнатной температуре. Время прохождения реакции около 1 ч, выход целевого продукта - 90%. Основными примесями (до 10%) являются продукты окисления, очистка от которых возможна только при использовании дорогостоящего метода препаративной ВЭЖХ, и поэтому может резко увеличить себестоимость препарата.
Заявляемым изобретением решается задача создания и получения нового фармацевтически приемлемого соединения с заданными свойствами на основе GSSG, т. е. структурного аналога окисленного глутатиона, а именно гексапептида со стабилизированной дисульфидной связью.
В заявляемом изобретении используется следующая, принятая в этой области терминология.
"Композит" обозначает смесь различных химических веществ. "Смесь" может быть физической смесью или химической смесью, то есть в ней может присутствовать химическое взаимодействие, включающее химическую связь или электростатическое взаимодействие. В одном из воплощений изобретения смесь может быть приготовлена посредством растворения и/или суспендирования различных химических веществ в растворе и высаживания либо отфильтровывания полученного сухого вещества. В другом воплощении идеи изобретения смесь может быть гомогенным раствором, включающим различные химические вещества.
"Соединением на основе окисленного глутатиона" называется любое соединение, обладающее базовой структурой димера трипептида глутатиона, в котором димер включает группу или соль, или производное глутаминовой кислоты, связанное с цистеиновой группой, или солью, или производным, связанным с группой или солью, или производным глицина, и каждая единица соответственно связана друг с другом посредством атомов серы цистеина, формирующими связь сера-сера (дисульфидная связь). "Производное" может быть получено при реакции, по крайней мере, одной реактивной группы соединения на основе окисленного глутатиона или предшественника с другим химическим веществом. Примером соединения на основе окисленного глутатиона является сам GSSG•Pt, т.е. гексапептид со стабилизированной дисульфидной связью.
Понятие "фармацевтически приемлемая соль" подразумевает производное композита в виде соли, приемлемой для введения в организм, не оказывающей нежелательные, вредные эффекты на организм и включающей, например, катионы натрия, лития, цинка или ванадия, или соответственно - натриевая, литиевая, цинковая или ванадиевая соль.
Понятие "фармацевтически приемлемая композиция" (дериват) подразумевает композит или его производное как фармацевтически приемлемое вещество и может включать, коме того, группу активных метаболитов или другие химические соединения. Например, композиция или производное может включать и быть ковалентно связанным с фенилаланином или цистеамином.
Понятие "метаболизм" подразумевает совокупность всех биохимических реакций, происходящих в живом организме, отвечающих за сохранение жизнеспособности данного организма [12].
Понятие "пролиферация" подразумевает воспроизводство или умножение сходных форм (клеток) за счет составляющих (клеточных) элементов [13, 14].
Понятие "дифференцировка" подразумевает приобретение или обладание признаками, отличающими от оригинала, с переходом клетки от выполнения сравнительно примитивных функций к более сложным, специализированным функциям с появлением или усилением морфологической и/или функциональной гетерогенности, присущих данному типу клеток, посредством экспрессии тканеспецифических генов [15, 16, 17, 18].
Понятие "апоптоз" подразумевает морфологически распознаваемую форму генетически программированной, физиологической клеточной смерти, инициируемой внеклеточными либо внутриклеточными сигналами [19, 20, 21].
Понятие "цитокины" подразумевает белковой природы регуляторные вещества, продуцируемые различными видами клеток, играющие ключевую роль в развитии иммунного ответа, гематопоэзе и патогенезе различных заболеваний, осуществляющие свой эффект посредством активации генов, участвующие в регуляции всех звеньев иммунной системы [19, 22].
Понятие "лекарственное средство", используемое в данной заявке, подразумевает использование любой лекарственной формы, содержащей композит настоящего изобретения, например GSSG•Pt или производные, которые обладают терапевтическим эффектом при лечении онкологических, инфекционных, гематологических, иммунологических, нейродистрофических и других заболеваний.
Под "онкологическими и инфекционными заболеваниями", "депрессией кроветворения и иммунитета различного происхождения" и "другими заболеваниями" понимаются любые указанные заболевания или состояния, вызванные или сопровождающиеся угнетением красного или белого ростка кроветворения либо депрессией количественных или функциональных показателей системы иммунитета, а также любые другие заболевания или патологические состояния, при которых стимуляция/модуляция эндогенной продукции вышеупомянутых цитокинов и гемопоэтических факторов, и/или индукция механизмов апоптоза была бы целесообразна по соображениям, очевидным для специалиста в соответствующей области медицины.
В настоящем изобретении раскрывается ряд соединений на основе окисленного глутатиона, имеющих стабилизированную дисульфидную связь, и, в частности, композит, включающий соединение на основе окисленного глутатиона и вещества-металла, в соотношении от 3000: 1 до 1:1, в котором вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия, при этом соединение на основе окисленного глутатиона химически взаимодействует с веществом-металлом. В одном из воплощений изобретения вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия. Группа данных металлов, выбранных в связи с тем, что платина и палладий обладают каталитическими свойствами в отношении влияния на окислительные реакции. Предпочтительно, чтобы металлом была платина, так как она при меньших концентрациях является эффективным катализатором. В идеальном варианте вещество-металл в комбинации с соединением на основе окисленного глутатиона представляет собой вещество, растворимое в биологических средах. Незначительные части вещества-металла могут быть нерастворимы, пока эта нерастворимая часть не оказывает какие-либо токсические или опасные эффекты на биологические системы. Вещество-платина выбирается из группы, включающей соль платины, координационное соединение платины и органометаллическое соединение платины. Предпочтительно, чтобы вещество-платина было координационным соединением платины, таким, как цис-платин (cis-Pt(NH3)2Cl2 или хлорид платины (хлористая соль платины)).
В предпочтительном воплощении изобретение представляет собой новое соединение на основе окисленного глутатиона и cis-диаминодихлорплатины. В описании используется удобное краткое обозначение: например, композит, включающий сам GSSG и цис-платин, будет обозначаться как GSSG•Pt. Производные будут обозначаться с помощью добавленных химических групп, например бис-[гистидил]-GSSG• Pt.
В настоящем изобретении также приводится способ получения окисленного глутатиона как композита со стабилизированной дисульфидной связью общей формулы: бис-( γ - L-глутамил)-L-цистинил-бис-глицин динатриевая соль с веществом- платиной, таким как cis-диаминодихлорплатина, в предпочтительном мольном соотношении 3000:1, наиболее предпочтительно в мольном соотношении 1000:1.
Согласно изобретению, композит характеризуется стабилизированной дисульфидной связью при введении его в биологические среды, а следовательно, большей продолжительностью времени полужизни препарата в биологических средах именно в форме глутатион дисульфида.
Общая методика получения композита в настоящем изобретении заключается в использовании восстановленного глутатиона в реакции окисления с добавлением окислителя перекиси водорода в комбинации с веществом-платиной, в частности с cis-диаминодихлорплатиной в качестве катализатора. Это позволяет использовать меньшее количество перекиси водорода (например, 0,9 эквивалента), благодаря этому исключить образование продуктов переокисления и приводит к очень высокому выходу GSSG (более 98% по данным ВЭЖХ). Таким образом, полученный продукт является очень чистым и не требует дополнительной очистки.
Следует отметить, что простое смешение готового окисленного глутатиона, полученного любым из изложенных выше способов, с комплексным соединением платины в указанной пропорции дает значительно меньший технологический и экономический эффект. В этом случае требуются дополнительные затраты на приобретение готового окисленного препарата (стоимость которого в 2-3 раза превышает стоимость восстановленной формы глутатиона), или самостоятельное проведение синтеза окисленной формы, выделение средств на дорогостоящую очистку полученного препарата, то есть получение композита в две стадии.
В изобретении заявляется метод стабилизации дисульфидной связи соединения на основе окисленного глутатиона. Метод включает взаимодействие соединения на основе окисленного глутатиона с веществом-металлом. Вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия. "Стабилизация дисульфидной связи" относится к процессу сохранения связи между двумя атомами серы и предотвращения быстрого превращения соединения на основе окисленного глутатиона (GSSG) в восстановленную форму (GSH). Или же стабилизация дисульфидной связи может приводить к увеличению времени существования соединения на основе окисленного глутатиона. При сохранении соединения на основе глутатиона в окисленной форме в течение более длительного времени это соединение может быть фармацевтически эффективным в течение соответственно более длительного времени в биологических средах.
Одно из воплощений изобретения - "взаимодействие соединения на основе окисленного глутатиона с веществом-металлом" - включает наличие соединения на основе глутатиона и реакцию этого соединения с окислителем и веществом-металлом. Термин "соединение на основе глутатиона" относится к любому соединению, обладающему структурой, включающей глутаминовую кислоту/соль/производное, связанное с цистеином/солью/производным, связанным с глицином/солью/производным. Примеры соединения на основе глутатиона включают сам глутатион или любое производное, где производное может быть получено посредством реакции реактивной группы с другим химическим веществом. Полученный продукт будет структурным аналогом окисленного глутатиона, т.е. гексапептидом со стабилизированной дисульфидной связью. Таким образом, в этом воплощении соединение на основе глутатиона находится в восстановленной форме, такой, как GSH, и реакция с окислителем включает окисление соединения на основе глутатиона для получения связи "сера-сера". Окислителем может быть любое вещество, которое может разрывать S-H связь соединения на основе глутатиона, получая атом водорода и соединение, имеющее радикал на основе серы, который в конечном итоге может реагировать с другим радикалом на основе серы, приводя к образованию связи "сера-сера". В технике хорошо известны различные окислители, которые могут разрывать S-H связь. В предпочтительном воплощении окислитель выбирается из группы, состоящей из кислорода и перекиси водорода.
В этом методе реакция соединения на основе глутатиона с окислителем и веществом-платиной включает реакцию окисления. Относительные количества реагентов - предпочтительно 1 эквивалент соединения на основе глутатиона с менее чем 1 эквивалентом окислителя, такого, как перекись водорода, и более предпочтительно с 0,9 эквивалента перекиси водорода. В другом воплощении идеи изобретения реакция окисления включает реакцию между 1 эквивалентом соединения на основе глутатиона с от 0,0003 эквивалента до 1 эквивалента вещества-платины, предпочтительно от 0,001 эквивалента до 1 эквивалента, более предпочтительно от 0,001 эквивалента до 0,1 эквивалента, и даже более предпочтительно от 0,001 эквивалента до 0,01 эквивалента, в присутствии менее чем 1 эквивалента окислителя. В другом воплощении 1 эквивалент соединения на основе глутатиона вступает в реакцию с 1 эквивалентом вещества-платины в присутствии менее чем 1 эквивалента окислителя.
В одном из воплощений изобретения метод включает окисление соединения на основе глутатиона посредством 0, 9 эквивалента перекиси водорода и 0,001 эквивалента цис-платина. Одним из преимуществ данного метода является увеличение скорости окисления соединения на основе глутатиона. Другим преимуществом этого метода является то, что увеличивается выход получаемого композита более чем до 98% и этот увеличенный выход сопровождается возросшей чистотой. Очисткой этого метода является то, что увеличивается выход получаемого композита более чем до 98% и этот увеличенный выход сопровождается возросшей чистотой. Очистка этого композита существенно упрощается до такой степени, при которой может быть использована жидкостная хроматография, позволяющая получить чистоту выше 99%, что соответствует фармацевтическим стандартам. Методы в предыдущей технике позволяли достигнуть чистоты 75-93% окисленного глутатиона в зависимости от метода.
В предпочтительном воплощении композит синтезируется в одну стадию посредством окисления восстановленного глутатиона в присутствии cis-диаминодихлорплатины, которая может функционировать в качестве катализатора реакции окисления. Условия реакции могут точно регулироваться с помощью менее чем 1 эквивалента перекиси водорода. Впоследствии может быть уменьшено образование продуктов переокисления, что приводит к практически количественному выходу продукта. Таким образом, этот одноэтапный синтез композита обеспечивает существенное технологическое упрощение и производство композита GSSG•Pt со стабилизированной дисульфидной связью.
Сущность данного способа заключается в использовании водного
раствора исходного восстановленного глутатиона в виде
мононатриевой соли, к
которому при комнатной температуре при перемешивании добавляется 0,9 эквивалента перекиси водорода и 0,001 эквивалента
одного из нижеперечисленных комплексных водорастворимых
соединений платины
или
палладия состава:
a) Pt[(NH3)2]Cl2•cis-диаминодихлорплатина (II),
б) K2[PtCl4] potassium
tetrachloroplatinate
(II),
в) K2[PdCl4] potassium tetrachloropalladate (II),
выступающими в роли катализатора
реакции окисления.
Реакция окисления протекает около 1,5-2 ч. Контроль за полнотой прохождения окисления осуществляется методом ВЭЖХ. Завершение процесса осуществляется лиофильной сушкой реакционного раствора. В результате получают целевой продукт - композит, состоящий из окисленной формы глутатиона и cis-диаминодихлорплатины в мольном соотношении 1000:1, что подтверждается спектральным анализом на платину и натрий. Пептидная составляющая полученного композита по данным аминокислотного анализа, спектра ПМР, времени удерживания в ВЭЖХ соответствует гексапептиду - бис-( γ - L-глутамил)-L-цистинил-бис-глицину, то есть окисленной форме глутатиона. Содержание посторонних примесей не превышает 2%, выход продукта в виде динатриевой соли 96-98% в расчете на сухой композит.
МЕТОДИКА СИНТЕЗА КОМПОЗИТА GSSG С КОМПЛЕКСНЫМ СОЕДИНЕНИЕМ ПЛАТИНЫ (II) ИЛИ ПАЛЛАДИЯ (II).
Восстановленный глутатион GSH 170 г (0,55 моль) суспендируют в
200
мл воды и прибавляют при перемешивании 139 мл (0,
55 моль) 4N раствора
NаOH и затем один из трех нижеперечисленных растворов:
а) 170 мл 0,05% водного раствора cis-диаминодихлорплатины
[Pt(NH3)2Cl2] (0,28
мМоль);
б) 235
мл 0,05% водного раствора тетрахлорплатината калия K2[PtCl4] (0,28 мМоль);
в) 185 мл 0,
05%
водного раствора тетрахлорпалладата K2
[PtCl4] (0,28
мМоль).
Полученный прозрачный слегка желтый раствор охлаждают при помощи льда до температуры 18-20o C и добавляют 283 мл 3% раствора перекиси водорода (раствор H2 O2) небольшими порциями в течение примерно 5 мин, с такой скоростью, чтобы температура реакционной смеси не превышала 22-25oC (погруженный термометр).
Через 30 мин после прибавления всего количества раствора перекиси водорода (H2O2), внутрь реакционного раствора помещают электрод pH-метра и определяют pH раствора, а затем по каплям добавляют 4N раствор натра едкого до pH 5,6-5,8, при этом контролируют температуру, которая должна быть в пределах 22-25oC. Далее охлаждение убирают и перемешивание продолжают уже при комнатной температуре в течение еще 30 мин.
Контроль полноты прохождения реакции окисления осуществляют методом ВЭЖХ. Жидкостной хроматограф для ВЭЖХ типа Beckman, Sol. Module 126, Det-168, снабженный колонкой Luna Phenomenex ODS 4,6х250 mm, или аналогичный, подготавливают к работе согласно инструкции по пользованию. Для приготовления мобильной фазы для ВЭЖХ в мерную колбу вместимостью 1000 см3 помещают 20 см3 ацетонитрила (ТУ 6-09-14-2167-84), 1 см3 свежеперегнанной трифторуксусной кислоты и доводят объем до метки деионизованной водой. Перемешивают и дегазируют встряхиванием в вакууме.
Через 30 мин после прибавления всего количества раствора перекиси водорода осуществляют контроль за полнотой прохождения реакции методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Для этого из реакционной смеси при помощи микрошприца отбирают 10 мкл и растворяют их в 1 мл мобильной фазы (0,1% трифторуксусная кислота: ацетонитрил, 98:2). 20 мкл полученного раствора вводят в хроматограф Beckman 126 Solvent Module, Diod Array Detector Module 168, колонка Luna Phenomenex ODS 4,6х250 mm или аналогичный. Элюирование в изократическом режиме 30 мин в системе 0,1% трифторуксусная кислота: ацетонитрил, 98:2; скорость потока 1 мл/мин, детектирование при 220 нм, сканирование 190-600 нм.
Время удерживания в данных условиях для восстановленного глутатиона 5,0+0,5 мин, время удерживания окисленного глутатиона 11, 0±0,5 мин.
Если по данным ВЭЖХ после стандартного интегрирования хроматограммы содержание окисленной формы глутатиона составляет менее 97%, перемешивание продолжают в том же режиме еще 0,5 ч и контроль по ВЭЖХ повторяют.
Если результат равен или превышает 97%, реакцию считают законченной и переходят к фильтрованию реакционного раствора. Для этого используют фильтр с размером пор не более 0,7 мкм.
Потеря массы при сушке не должна превышать 5% при сушке до постоянного веса при 100oC в вакууме (1 мм Hg) над CaCl2 и P2O5.
Содержание основного вещества в готовом продукте по данным ВЭЖХ не ниже 98%.
Таким образом получают окисленный глутатион в виде композита с комплексным соединением Pt(II) или Pd(II).
Внешний вид: белый порошок без запаха.
Растворимость: растворим в воде, изотоническом растворе хлорида натрия 0, 9% для инъекций; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен. pH 0,1% раствора: 5.0-6.0 потенциометрически, прибор pH/mV/oC meter Cole Parmer, модель 59003-15 или аналогичный.
Подлинность:
а)
аминокислотный анализ
(6 н. HCl, 110oC, 20 ч), глицин - 2.0 ± 15%;
глутаминовая кислота
- 2.0 ± 15%; цистеин-2.0 ± 40%; аминокислотный
анализатор ААА
"Т-339 М" Pragu или аналогичный.
б) ВЭЖХ - по времени выхода соответствует стандарту бис- ( γ - L-глутамил)-L-цистинил-бис-глицин динатриевая соль.
Условия хроматографирования: прибор BECKMAN "Gold Nouveau Chromatography Data System" Version 1.0, Diod Array Detector Module 126 или аналогичный.
Проба - 20 мкл 0,1% раствора препарата в мобильной фазе, хроматографирование на колонке ULTRASPERE ODS 250х4,6 мм с обращенной C18 фазой в изократическом режиме ацетонитрил-0,1% трифторуксусная к-та (2:98); скорость потока 1 мл/мин, детектирование при 220 нм, сканирование 190-600 нм.
Чистота (содержание
основного вещества):
а)
по ВЭЖХ не ниже 98%.
б) по
аминокислотному анализу:
не ниже 85% (анализ согласно Разделу "Подлинность",
пункт "а" с точной навеской)
Методика определения содержания
элементов
Точная навеска пробы (около 50
мг) растворялась в 50 мл
бидистиллированной воды и раствор использовался для
анализа.
Содержание платины определялось количественно методом масс-спектрометрии с индуктивно-связанной плазмой на приборе модели PQe, фирмы VG Elemental, Англия.
Относительная точность анализа 5%.
Содержание других
элементов определяется количественно методом
атомно-эмиссионной
спектрометрии с индуктивно-связанной плазмой на приборе модели
TRACE 61E фирмы Thermo Jarrell Ash, США.
Относительная точность анализа
5%:
г) содержание натрия (Na) по
эмиссионному
спектральному методу: 7,0 ± 0,5%
д) содержание платины
(Pt) по масс-спектральному методу: 0,032
± 0,01%
е)
содержание палладия (Pd) по
масс-спектральному
методу: 0,017 ± 0,01%
Содержание элементов, мкг/г:
Серебро
(Ag) - <1.0 (менее 0.0001%)
Алюминий (Al) - 2.0
Мышьяк (As) - <
1.0
Барий (Ba) - <0.50
Бериллий (Be) - <0.05
Кальций (Ca)
- 7.0
Кадмий (Cd) - <
0.05
Кобальт (Co)
- <0.5
Хром (Cr)
- 1.7
Медь (Cu) - <0.5
Железо (Fe) - <1.0
Калий (K) - <
2.5
Селен (Se) - <
2.0
Магний (Mg)
- <2.5
Марганец
(Mn) - <0.2
Молибден (Mn) - <0.2
Никель (Ni) - <0.5
Свинец
(Pb) - <0.40
Стронций (Sr)
- 1.9
Титан (Ti) - <0.5
Ванадий (V) - <0.5
Цинк (Zn) - 0.65
Сурьма (Sb) - <0.5.
В изобретении заявляется метод стимуляции/регуляции эндогенной продукции цитокинов и гемопоэтических факторов. Метод включает этапы по введению в организм млекопитающего, нуждающегося в стимуляции цитокинов, гемопоэтических факторов, или и тех и других, эффективного количества композита. Композит состоит из соединения на основе окисленного глутатиона и вещества-металла в соотношении от 3000:1 до 1:1. Вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия. Метод осуществляется в течение такого периода времени, при котором для стимуляции эндогенной продукции позволяет получить терапевтический эффект.
В настоящем изобретении заявляется метод усиления и пролонгирования способности соединения на основе окисленного глутатиона стимулировать эндогенную продукцию цитокинов и гемопоэтических факторов. Метод включает этапы взаимодействия соединения на основе окисленного глутатиона с веществом-металлом в соотношении от 3000:1 до 1:1. Вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия.
В настоящем изобретении заявляется метод лечения лица, страдающего каким-либо заболеванием. Метод включает введение лицу, нуждающемуся в таком лечении, композита, состоящего из соединения на основе окисленного глутатиона и вещества-металла в соотношении от 3000:1 до 1:1 в количестве, эффективном для стимуляции эндогенной продукции цитокинов и/или гемопоэтических факторов, или и тех и других, до достижения терапевтического эффекта. Вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия. Терапевтический эффект включает облегчение, профилактику или лечение нежелательного состояния организма и может включать процесс, выбираемый из группы, состоящей из регуляции пролиферации нормальных клеток, регуляции дифференцировки нормальных клеток, и индукции апоптоза трансформированных клеток, где трансформированные клетки могут включать больные клетки, в первую очередь опухоле- трансформированные и вирус-трансформированные клетки.
В одном из воплощений изобретения соединение на основе окисленного глутатиона имеет общую
формулу:

в которой A, В, D, E, G и H может выбираться из группы, состоящей из органической части и соли органической части. Предпочтительно, чтобы "органическая часть" позволяла соединению на основе окисленного глутатиона сохранять растворимость в биологических средах и, кроме того, органическая часть не должна привносить токсические свойства в соединение на основе окисленного глутатиона в применяемых дозах. Понимается, что A, B, D, E, G и H могут быть одинаковыми или различаться. Предпочтительно, чтобы каждая из групп A-H могла включать часть, выбираемую из группы, состоящей из аминогрупп, карбоксильных групп и амидов. Например, A-H могут означать аминокислоты или их производные, связанные амидной связью. Или же любые две из A-H групп могут быть связаны друг с другом, по крайней мере, одной ковалентной связью. Таким образом, A-H могут быть частью циклической структуры.
В одном из воплощений изобретения композит включает соединение на основе окисленного глутатиона в количестве, значительно превосходящем количества вещества-металла, предпочтительно в соотношении от 3000:1 до 1:1, более предпочтительно от 1000:1 до 1:1, более предпочтительно от 1000:1 до 10:1, даже более предпочтительно от 1000:1 до 100:1. В другом воплощении идеи изобретения композит включает равные количества соединения на основе окисленного глутатиона и вещества-металла, то есть соотношение 1:1.
В одном из воплощений изобретения соединение на основе окисленного глутатиона - это сам окисленный глутатион (GSSG) и его соли, где оба A и E - это -CO2H, оба B и D - это -NH2, и оба G и H - это -CO2M, где M - это противоион. Противоион может быть протоном, ионом с органическим основанием, таким как тетралкил-аммоний, щелочной металл, щелочноземельный металл, или переходный металл. Понимается, что в водной среде любая группа из A-H включает ионизированную группу, то есть A и E могут быть -CO2, и B и D могут быть -NH2+, и ионизированные группы нейтрализуются соответствующими противоионами.
Композит может быть получен различными методами, например при взаимодействии вещества-металла с глутатионом в присутствии окислителя, или же при добавлении вещества-металла к соединению на основе окисленного глутатиона.
Данные соединения и их лекарственные формы, полученные на основе композит с веществом GSSG•Pt, заявляются как лекарственные средства, способные в терапевтических целях в зависимости от исходного биологического состояния субъекта, нуждающегося в этом, стимулировать/модулировать эндогенную продукцию широкого спектра цитокинов и гемопоэтических факторов и/или воспроизводить эффекты цитокинов, а также осуществлять дифференцированное воздействие в отношении нормальных (регуляция метаболизма, пролиферации и дифференцировки) и трансформированных клеток (индукция механизмов апоптоза). Понятие "трансформированные клетки" означает опухоле- и/или вирус-трансформированные клетки.
Изобретение поясняется рисунками, которые являются схематичными и были сделаны без намерения передать изображение в точном масштабе. В рисунках каждый идентичный или почти идентичный компонент, приведенный на разных рисунках, представлен одной цифрой. Для ясности не каждый элемент обозначен на каждом рисунке, и не каждый компонент для каждого воплощения идеи изобретения приведен в случае, если иллюстрация не является необходимой для того, чтобы позволить обычному специалисту в данной области понять изобретение.
На фиг. 1 показана структурная формула бис-(γ - L-глутамил)-L-цистинил-бис-глицин динатриевой соли с cis-диаминодихлорплатиной.
На фиг. 2 показана схема синтеза композита динатриевой соли окисленного глутатиона с cis-диаминодихлорплатиной.
На фиг. 3 показана донорно-акцепторная связь между атомом платины и двумя группами NH3 за счет неподеленных электронов атомов азота.
На фиг. 4 представлен предполагаемый механизм стабилизации дисульфидной связи молекулы GSSG за счет обмена лигандов: NH3-групп на атомы серы дисульфидной связи, а также посредством образования донорно-акцепторной связи между атомом платины и двумя атомами серы за счет неподеленных электронов атомов серы.
На фиг. 5 представлены предполагаемые механизмы общей стабилизации молекулы GSSG за счет механизма, показанного на фиг.4, а также путем обмена лигандов NH3 на NH2 группы глутатиона (сближение NH2 групп и соответственно GS фрагментов), формирующих новую "биофизику" композита GSSG•Pt, где (□) обозначают донорные сайты, а (O) - акцепторные сайты.
На фиг. 6 показаны основные сайты (обведены кругами) химической модификации молекулы GSSG•Pt.
На фиг. 7 показана структурная формула бис-фенилаланил-GSSG•Pt
На фиг. 8
изображена
схема
синтеза бис-[L-фенилаланил- γ
-L-глутамил-]-L-цистинил-бис-глицина с cis-диаминодихлорплатиной.
На фиг. 9 показана структурная формула литиевой соли бис-(γ - L-глутамил)-L-цистинил-бис-глицина.
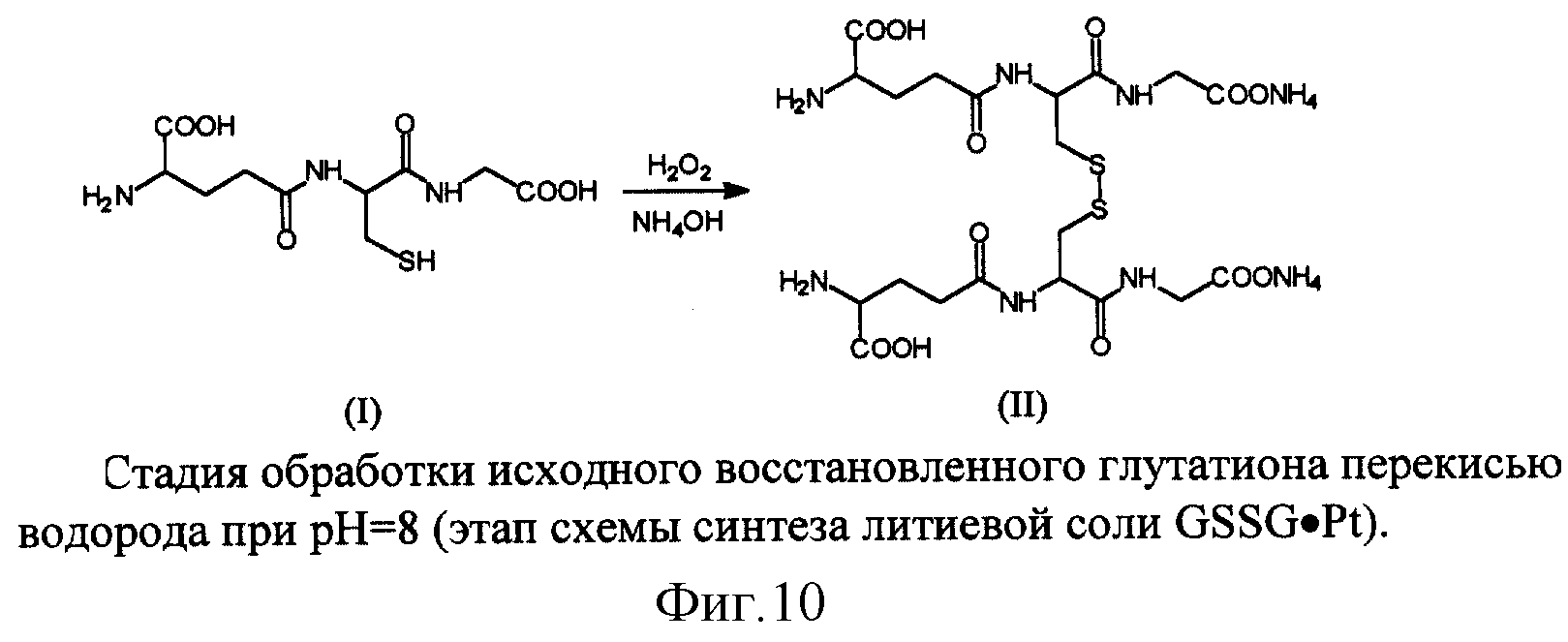
На фиг. 10 показана стадия обработки исходного восстановленного глутатиона перекисью водорода при pH 8 (стадия схемы синтеза литиевой соли GSSG•Pt).
На фиг. 11 показано извлечение свободного гексапептида бис-(γ- L-глутамил)-L-цистинил-бис-глицина (III, стадия схемы синтеза литиевой соли GSSG• Pt).
На фиг. 12 показан перевод окисленной формы GSSG (III) в литиевую соль GSSG•Pt.
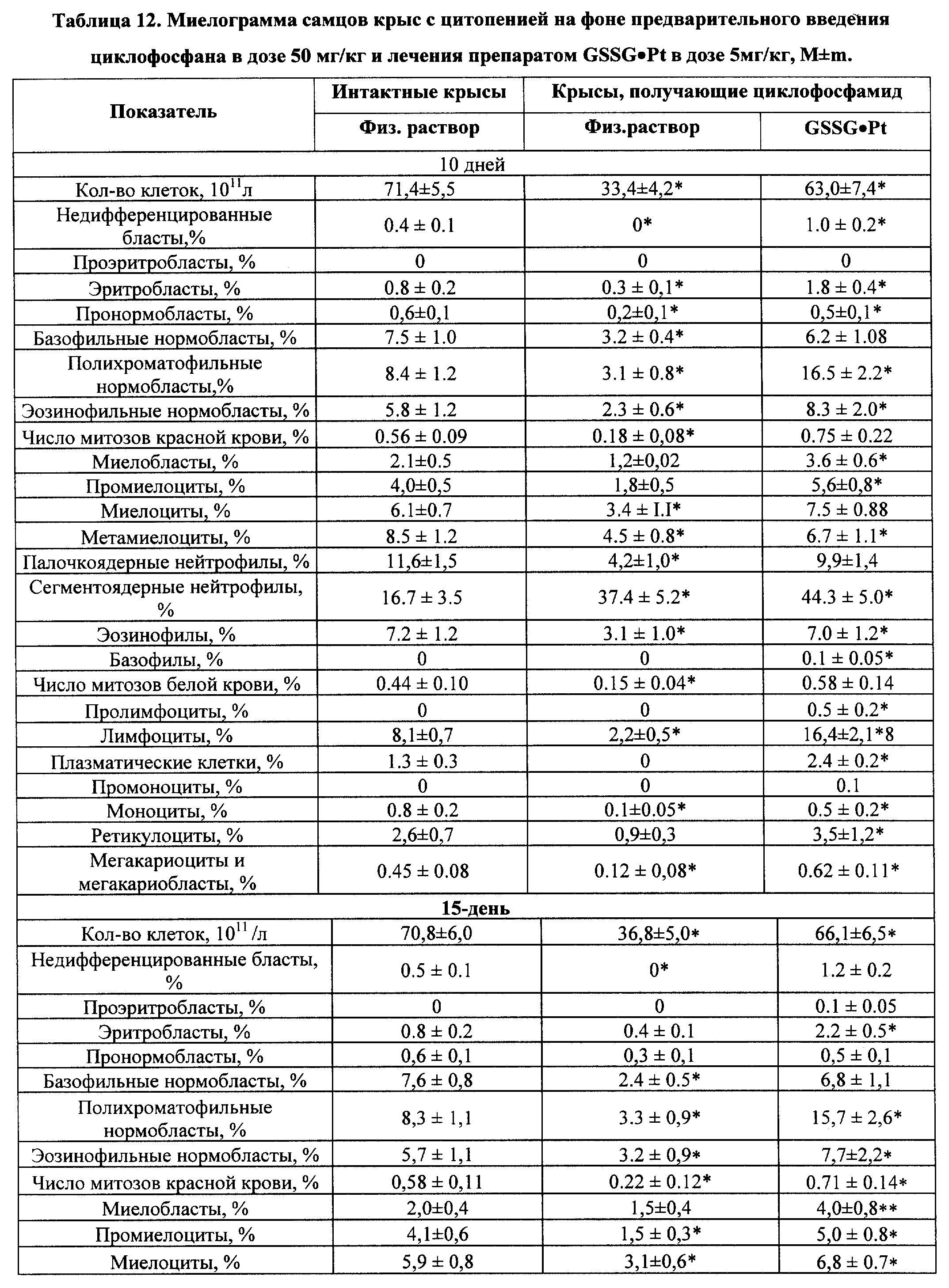
На фиг. 13 показан характер деградации ДНК в нормальных клетках контрольной группы (1), после обработки: GSSG (2); GSSG•Pt (3) - время инкубации - 48 ч.
На фиг. 14 показан характер деградации ДНК в клетках HL-60 контрольной группы (2), после обработки: GSSG (1); GSSG•Pt (3) - время инкубации - 48 ч.
На фиг. 15 (а) показана структурная формула S-тиоэтиламина•глутатион дисульфида.
На фиг. 15(б) показана структурная формула бис-[DL-6,8- тиооктанил] •глутатион дисульфида.
На фиг. 15(в) показана структурная формула [β- аланил-L-гистидил] • глутатион дисульфида.
На фиг. 15(г) показана структурная формула [9-β- D-рибофуранозил] •глутатион дисульфида.
На фиг. 15(д) показана структурная формула бис-[L-2-амино-4-[метилтио] бутаноил]•глутатион дисульфида.
На фиг. 16(а) показана структурная формула бис-[метионил]• глутатион дисульфида.
На фиг. 16(б) показана структурная формула бис-[аспартил]•глутатион дисульфида.
На фиг. 16(в) показана структурная формула бис-[гистидил] •глутатион дисульфида.
На фиг. 16(г) показана структурная формула бис-[3- иодин-тирозил] •глутатион дисульфида.
На фиг. 16(д) показана структурная формула бис-[γ- аминобутаноил] • глутатион дисульфида.
На фиг. 16(е) показана структурная формула бис- [γ- гидроксибутаноил] •глутатион дисульфида.
На фиг. 16(ж) показана структурная формула бис-[3, 4-дигидроксифенилаланил]•глутатион дисульфида.
На фиг. 17(а) показана структурная формула бис-никотиноил-глутатион дисульфида (бис-[пиридин-3- карбонил]• глутатион дисульфида).
На фиг. 17(б) показана структурная формула уридин-5'- монофосфатоил• глутатион дисульфида.
На фиг. 17(в) показана структурная формула инозин-5'- монофосфатоил•глутатион дисульфида.
На фиг. 17(г) показана структурная формула фолликулилсукцинил •глутатион дисульфида.
На фиг. 17(д) показана структурная формула глицерол-1,3- дифосфатил•глутатион дисульфида.
На фиг. 18(а) показана структурная формула тетра-допамин• глутатион дисульфида.
На фиг. 18(б) показана структурная формула теофиллин•глутатион дисульфида.
На фиг. 19(а) показана структурная формула бис- [карнозил]•глутатион дисульфида.
На фиг. 20(а) показана структурная формула несимметричного смешанного дисульфидного соединения.
На фиг. 20(б) показана структурная формула симметричного смешанного дисульфидного соединения.
На фиг. 20(в) показана структурная формула симметричного смешанного дисульфидного соединения с двойным мостиком.
На фиг. 21(а) показана структурная формула диванадиевой соли.
На фиг. 21(б) показана структурная формула дигидрофтористой соли.
На фиг. 21(в) показана структурная формула дилитиевой соли.
На фиг. 21(г) показана структурная формула дицинковой соли.
На фиг. 22 показана структурная формула полипептида [антиген или антитело]•глутатион дисульфида.
Согласно изобретению структурная формула бис-(γ- L-глутамил)- L-цистинил-бис-глицин динатриевой соли с cis-диаминодихлорплатиной приведена на фиг. 1. (Брутто-формула: C20H30N6 O12 Na2S2•[Pt(NH3)2Cl2] ; молекулярный вес: 656,59 на C20 H30N6O12 Na2S2 с содержанием Pt 0,022-0,042%).
Схема синтеза композита приведена на фиг. 2.
Согласно изобретению увеличенная стабилизация дисульфидной связи может быть результатом взаимодействия атомов серы с веществом-платиной.

Во взаимодействии между веществом-платиной и молекулой окисленного глутатиона (GSSG) существует возможность обмена лигандами, т.е. вместо NH3 групп два атома серы, имеющие по две пары неподеленных электронов, могут включаться в образование в донорно-акцепторные связи с атомом платины. Следует учитывать также возможность дополнительно к рассмотренному, стабилизацию дисульфидной связи за счет сближения групп NH2 соединения на основе окисленного глутатиона и стабилизации общей конформации молекулы GSSG (фиг. 5).
При помощи химической модификации базовой молекулы GSSG•Pt возможно создание новых препаратов, в молекулах которых наряду с уже показавшей высокую медико-биологическую активность базовой структурой на основе композита окисленного глутатиона с cis- диаминодихлорплатиной присутствуют фрагменты других ковалентно связанных биохимически активных молекул. Использование ковалентно связанных комбинаций позволит усилить ряд важных характеристик препаратов, таких, как стабильность и неизменность состава. Основой для химических модификаций служит гексапептидный остов GSSG•Pt с двумя первичными аминогруппами глутаминовой кислоты, дисульфидной связью цистина и карбоксильными группами глицина и α-карбоксильными группами глутаминовой кислоты (фиг. 6).
Целенаправленно выбранные ковалентно связанные фрагменты биохимически важных молекул могут существенно улучшить медико- биологические свойства базовой молекулы вещества GSSG•Pt, сделав их более избирательными для каждой конкретной лечебной цели, резко увеличив эффективность в желаемом терапевтическом направлении. Это может быть обусловлено аддитивным эффектом фрагментов в биохимических механизмах действия, резким улучшением транспорта лекарственной молекулы к клетке- или молекуле-мишени, большим сродством к рецептору, нужным перераспределением окислительно- восстановительного (редокс) потенциала и рядом других факторов, а также их сочетанием.
В одном из воплощений изобретения соединение на основе окисленного глутатиона может быть производным глутатиона и цистеамина. Глутатион может быть извлечен после приготовления композита или он может быть извлечен до приготовления композита, т.е. GSH может быть модифицирован до окисления в димер. На фиг. 15 (а, б,в,г,д) приведены различные примеры производных соединений на основе глутатиона, с последующим получением соединений на основе окисленного глутатиона.
В одном из воплощений изобретения соединение на основе окисленного глутатиона имеет ацилированную первичную аминогруппу глутаминовой кислоты. Этот вариант наиболее подходит для ацилирования при помощи N-защищенных активированных производных аминокислот, по которому после стадии временной защиты меркапто- групп цистеина, с последующей конденсацией (метод активированных эфиров), удаления N- и S-защитных групп и проведения окисления перекисью водорода с добавкой cis-диаминодихлорплатины, получают композиты GSSG•Pt, модифицированные аминокислотами по аминогруппам глутаминовой кислоты. В этом воплощении соединение на основе окисленного глутатиона может выбираться из группы, состоящей из бис-[метионил] •глутатион дисульфида (фиг. 16(а)), бис-[аспартил] •глутатион дисульфида (фиг. 16(б)), бис-[гистидил]•глутатион дисульфида (фиг. 16(в)), бис-[3-иодин-тирозил]•глутатион дисульфида (фиг. 16(г)), бис-[γ - аминобутаноил] •глутатион дисульфида (фиг. 16(д)), бис-[γ- гидроксибутаноил] •глутатион дисульфида (фиг. 16(е)), бис-[3,4-дигидроксифенилаланил]• глутатион дисульфида (фиг. 16(ж)).
В случае, когда в композит включены фенилаланильные группы, то соединение - это бис-фенилаланил-GSSG•Pt (см. фиг. 7).
Согласно показанной ниже базовой схеме, все другие модификации GSSG•Pt, основанные на ацилировании аминогрупп производными защищенных аминокислот, оксикислот, карбоновых кислот и их производных. Возможны небольшие изменения в методиках, связанные с конкретной природой модифицирующей молекулы. Протективные группы для исходной соединения GSH включают Bam (N-гидроксиметилбензамид). Аминокислота (AA) может быть защищена такими группами, как BOC (бутил-карбамат) или O-Su (N-оксисукцинимидный эфир; см. фиг. 8).

При синтезе бис-метионил-GSSG•Pt, т.е. (Met)2GSSG•Pt вставка метиониновой группы может включать деблокирование BOC-защитной группы после стадии конденсации.
В случае композита бис-аспартил-GSSG•Pt аспарагиновая кислота может быть введена по рассмотренной общей схеме. Предпочтительно, чтобы временная защитная группа для β- карбоксильной группы удалялась, по возможности, одновременно с BOC-защитной группой, если это необходимо. На стадии конденсации может использоваться β-трет.бутиловый эфир N-BOC-аспарагиновой кислоты, т. е. BOC-Asp(OBut)-OSu. Защитные группы могут быть удалены трифторуксусной кислотой.
В случае композита бис-гистидил-GSSG•Pt имидазольное кольцо гистидина может быть защищено посредством ди-трет- бутилоксикарбонильного производного гистидина, т.е. BOC-His(BOC)-OSu, которое может использоваться на стадии конденсации. Удаление защитных групп, как и в предыдущих случаях, может осуществляться при помощи трифторуксусной кислоты.
В случае композита бис-3-йод-тирозил-GSSG•Pt возможной защитной группой является кислотолабильная защитная группа, такая как трет-бутиловый эфир. Используемым на стадии конденсации производным тирозина может быть BOC-Tyr(OBut)-OSu.
В случае композита ГАМК-GSSG•Pt (γ -аминобутаноил-GSSG•Pt) на стадии конденсации может использоваться кислотолабильная трет-бутилоксикарбонильная (BOC) защитная группа.
В случае композита ГОМК-GSSG•Pt (γ-гидроксибутаноил-GSSG•Pt) для защиты гидроксильной группы γ -оксимасляной кислоты применяется кислотолабильная (удаляемый раствором трифторуксусной кислоты) трет-бутиловый эфир. Используемым на стадии конденсации производным может быть ГАМК(OBut )-OSu.
В случае композита бис-липоил-GSSG• Pt считается, что боковые функциональные группы не требуют специальной защиты. На стадии конденсации возможно использование активированного (гидроксисукцинимидного) эфира липоевой кислоты. Может не требоваться обработка TFA.
В случае композита бис-3, 4-дигидроксифенилаланил-GSSG•Pt (бис-ДОФА-GSSG•Pt) для введения молекулы ДОФА может требоваться предварительная защита двух гидроксильных групп 3, 4- дигидроксифенилаланина при помощи трет-бутиловых эфиров и защита аминогруппы BOC-защитной группой. Для конденсации с предшественником композита может быть получен активированный эфир (гидроксисукцинимидный или пентафторфениловый), используемый в мольном избытке. Удаление защитных групп может происходить одновременно при помощи раствора трифторуксусной кислоты.
В случае композита бис-[карнозил]-GSSG•Pt (бис- β -аланил-L-гистидил-GSSG•Pt) карнозин может быть защищен как ди-BOC производное аминогруппы β -/ аланина и имидазольной группы гистидина перед конденсацией. Далее конденсация и последующее деблокирование может осуществляться по рассмотренной для других аминокислот схеме. Структурная формула бис-[карнозил]-GSSG приведена на фиг.19а.
В другом воплощении идеи изобретения соединение на основе окисленного глутатиона имеет амидную или фосфороамидную связь с частью, выбираемой из группы, состоящей из гетероциклических углекислот и нуклеотидов. В этом воплощении примеры соединения на основе окисленного глутатиона включают бис-[никотиноил] •глутатион дисульфида (бис-[пиридин-3-карбонил]•глутатион дисульфида) (фиг. 17а), уридин-5'-монофосфатоил•глутатион дисульфида (фиг. 17б), инозин-5'-монофосфатоил•глутатион дисульфида (фиг. 17в), фолликулилсукцинил•глутатион дисульфида (фиг. 17г) и глицерол-1, 3-дифосфатоил•глутатион дисульфида (фиг. 17д).
В случае композита бис-никотиноил-GSSG•Pt (бис-пиридин-3- карбоноил-GSSG•Pt) никотиновая кислота, не содержащая боковых функциональных групп, может вводиться в конденсацию с предшественником композита без получения защищенных производных в виде соответствующих активированных эфиров, таких как оксисукцинимидный или пентафторфениловый. Обработка трифторуксусной кислотой для деблокирования защитных групп может не требоваться.
В случае композита уридин-5'-монофосфатил-GSSG•Pt (UMP-5'-GSSG•Pt) уридин-5'-монофосфат в присутствии N, N- дициклогексил-карбодиимида может образовывать фосфоамидные связи в реакциях с аминами [10]. Предшественник композита может иметь защищенные карбоксильные группы, такие как тетратриметилсилильные производные, используемые в качестве аминокомпоненты Деблокирование может проходить в мягких водно-спиртовых системах.
В случае композита инозин-5'-монофосфатил-GSSG•Pt (IMP-5'- GSSG•Pt) схема синтеза наиболее вероятно будет аналогична схеме по предыдущему производному (UMP-5'-GSSG).
В случае композита фолликулилсукцинил-GSSG•Pt связь между GSSG•Pt и эстроном осуществляется за счет амидной и сложноэфирной связей через остаток сукцинила. Эстрон может быть переведен в активированное производное посредством реакции с янтарным ангидридом с последующей конденсацией при помощи N, N-дициклогексилкарбодиимида с защищенным или блокированным предшественником композита, а также с тетра-триметилсилильными производными. Деблокирование может проходить в водно-спиртовой системе.
В случае композита глицерол-1,3-дифосфатил-GSSG•Pt модификации может проводиться карбодиимидным методом, используя защищенный предшественник композита, а в качестве аминокомпоненты - тетра-трисилильное производное. Схема, сходная со схемой синтеза фосфоамидных производных (см. Примеры 13 и 14).
В другом воплощении изобретения соединение на основе окисленного глутатиона выбирается из группы, состоящей из тетра- допамин•глутатион дисульфида (см. фиг. 18а) и теофиллин•глутатион дисульфида (см. фиг. 18б). Образование амидных связей может осуществляться между карбоксильными группами композита и аминами. Реакционная способность всех четырех карбоксильных групп различается не существенно, поэтому образуется смесь продуктов.
В случае композита тетра-допамин-GSSG•Pt в качестве аминокомпоненты может использоваться 3,4-ди-трет-бутиловый эфир допамина, а в качестве карбоксильной компоненты может использоваться ди-трет-бутилоксикарбонильное производное композита. Конденсация может осуществляться при помощи N,N-дициклогексил-карбодиимида, а деблокирование защитных групп может осуществляться при помощи раствора трифторуксусной кислоты.
В случае композита GSSG•Pt-теофиллин теофиллин может использоваться как аминокомпонента; а предшественник композита - как карбоксильная компонента в виде ди-трет-бутилоксикарбонильного производного. Конденсация может осуществляться с помощью комплекса "F". Удаление защитных групп может осуществляться раствором трифторуксусной кислоты.
В другом воплощении изобретения соединение на основе окисленного глутатиона может включать смешанные дисульфиды. Возможные комбинированные структуры могут включать смешанные дисульфидные образования (симметричные и несимметричные) (см. фиг. 20а-20в).
Одна структура (см. фиг. 20б) может образовываться посредством совместного окисления меркаптогрупп исходных веществ. Дополнительные защитные группы и методы конденсации могут не требоваться.
Другое соединение (см. фиг. 20а) получается при образовании амидной связи между аминогруппой цистеамина и одной из карбоксильных групп предшественника композита. Может потребоваться введение N-защитных групп и активация карбоксильных групп предшественника композита. По причине наличия четырех карбоксильных групп может потребоваться манипулирование стехиометрией и/или осуществление хроматографического разделения полученных продуктов.
Условия получения структуры 20а отличаются от структуры 20б наличием дополнительного эквивалента аминокомпоненты. При хроматографической очистке используется структура 20б как свидетель.
Структуры 20в получается из структуры 20б путем образования дополнительной дисульфидной связи при реакции меркаптогрупп. При хроматографическом разделении продуктов может потребоваться иметь в качестве свидетеля структуру 20б.
В другом воплощении изобретения соединение на основе окисленного глутатиона может быть солью, выбираемой из группы, состоящей из солей щелочных металлов, солей щелочноземельных металлов и солей переходных металлов. Примерами таких солей являются диванадиевые соли (см. фиг. 21а), дигидрофтористые соли (см. фиг. 21б), дилитиевые соли (см. фиг. 21в), дидопаммониевые соли и дицинковые соли (см. фиг. 21г).
Соли могут образовываться посредством внесения соответствующего количества солеобразующих компонентов, основания или кислоты. Примеры солей по аминогруппам включают диванадат GSSG•Pt ((HVO3)2-GSSG•Pt) или дигидрофторид GSSG•Pt ((HF)2 •GSSG• Pt). Примеры солей по карбоксильным группам включают дилитиевую соль GSSG•Pt (см. Пример N2), дидопаммониевая соль GSSG• Pt или цинковая соль GSSG•Pt.
Согласно изобретению препарат, состоящий из композита, такого как гексапептида бис-(γ-L-глутамил) -L-цистинил-бис-глицин динатриевой соли и cis-диаминодихлорплатина (cis-платин), получают по описанному выше методу.
Другими предпочтительными производными, включающими производные вещества GSSG•Pt в виде солей натрия, лития, калия, кальция, цинка, молибдена, ванадия и других солей, а также производные GSSG•Pt, полученные посредством ковалентного связывания с фенилаланином, или с метионином, и с некоторыми другими аминокислотами, включая D и L формы аминокислот; или с цистеамином, или с липоевой кислотой, или с инозином.
Одно из воплощений изобретения - проявление новых иммунологических, биохимических и молекулярно-биологических эффектов может быть достигнуто в случае использования комбинации, состоящей на 50% из GSSG•Pt, в котором все аминокислоты представлены в L-форме, и на 50% из GSSG•Pt, в котором две химически однозначные аминокислоты представлены в D-форме, а остальные - в L-форме.
Одним из воплощений изобретения является образование полипептидного соединения на основе формирования ковалентных связей между GSSG•Pt и белковой молекулой (веществом полипептидной природы). Важно при этом, что в качестве белкового вещества используется либо антиген, получаемый из микроорганизмов, либо антитело, получаемое в результате иммунизации животных организмов антигеном. На фиг. 22 приведен пример соединений GSSG•Pt и белковых веществ на основе образования пептидной связи CO-NH между карбоксильными группами одного и аминогруппами другого вещества. Создание конъюгатов белковых молекул с молекулой GSSG•Pt за счет образования пептидных (амидных) связей между одной из карбоксильных групп GSSG•Pt и α- или ε-NH2-группами белка. В качестве реагента для конъюгирования используется водорастворимый карбодиимид или глутаровый альдегид. Очистка целевого продукта при помощи диализа и гель-хроматографии.
Новая фармакокинетика GSSG• Pt (по сравнению с самим GSSG) в крови и тканях (органах) при ее введении в биологические среды свидетельствует о том, что молекула GSSG•Pt гораздо менее доступна для ферментов метаболизма GSSG и в первую очередь для НАДФ•H+-зависимой глутатионредуктазы, основного энзима восстановления GSSG в GSH. Отсюда время полужизни GSSG•Pt в дисульфидной форме в биологических средах значительно возросло (см. Примеры NN 3-4).
Принципиально новая фармакокинетика гексапептида со стабилизированной
дисульфидной связью (GSSG•Pt) обеспечила
оптимальное
проявление
выявленных нами новых
биолого-фармакологических эффектов, а именно:
стимуляция/модуляция эндогенной продукции
гораздо более широкой палитры цитокинов, ростовых и
гематопоэтических факторов
в условиях радиационной
и химической иммуносупрессии (IL- 1 α и β, IL-2, IL-3, IL-4, IL-6, IL-8,
IL-10 и IL-12, TNF-α, IFN-α и IFN-γ,
эритропоэтина,
колониестимулирующие факторы) (см.
Примеры NN 5-7);
воспроизведение эффектов ряда цитокинов (IL-2,
IL-12, IFN-α и IFN-γ в силу индукции механизмов
редокс-чувствительной
экспрессии иммунологически значимых генов и
модификации "критических" цистеинов ключевых белков
клеточных сигнал-передающих систем (см. Пример N 8);
восстановление
угнетенного
костномозгового кроветворения, в том числе содержание
эритроцитов, лейкоцитов и тромбоцитов, а также уровня
цитокинов и уровня CD3+, CD4+, CD8+,
CD16/56+,
CD19/20+, CD25+, CD34+,
CD95+ (см. Примеры NN 9-13) у
пациентов, получающих лучевую и высокодозную полихимиотерапию;
гепатотропные эффекты, а
также снижение проявлений кардио-, нефро- и нейротоксичности
(в условиях активной антибактериальной,
противовирусной и противоопухолевой химиотерапии);
дифференцированное воздействие на
нормальные (в том числе испытывающие функциональное напряжение) и
трансформированные клетки, а именно
стимуляция метаболизма, пролиферации и дифференцировки
нормальных клеток/тканей, и в то же время
способность индуцировать механизмы апоптоза только в опухоле- и/или
вирус-трансформированных
клетках.
Другим проявлением выявленных нами новых биолого-фармакологических эффектов является корригирующее влияние вещества GSSG•Pt и его солей на метаболические нарушения, в частности на нарушения углеводного обмена при диабете II типа. В этом случае (см. Пример N 7) восстановление под действием вещества GSSG•Pt (его ванадиевой соли) нормального соотношения ц-АМФ/ц-ГМФ, а также соотношения тиол-дисульфидного обмена в тканях обеспечило стабильную нормализацию содержания сахара в крови пациента, т.е. убедительный терапевтический эффект.
Таким образом, способ получения композита обеспечивает
синтез
различных композитов как
основы создания препаратов, обладающих рядом новых свойств, а именно:
повышенной биохимической стабильностью препарата, то есть "не-атакуемостью" ферментами
метаболизма GSSG, в первую
очередь, НАДФ•H+-зависимой глутатионредуктазой, что
принципиально
увеличивает время полужизни препарата в биологических средах именно в форме дисульфида;
новой
биофизической компонентой с высоким уровнем донорно-акцепторного потенциала;
наличием
дополнительных реакционно-способных сайтов в пределах данной молекулы-композита, и,
следовательно,
совершенно новой способностью к химической модификации.
Названные
свойства композита
позволяют ему выступать в роли уникального клеточного "гироскопа", который в
условиях действия
экстремальных факторов среды (физических, химических и биологических) обеспечивает
восстановление
равновесия:
в составе цитокинового профиля, то есть цитокинов,
преимущественно регулирующих
пролиферацию; и цитокинов, преимущественно регулирующих дифференцировку
иммунокомпетентных клеток;
соотношения окислительно-восстановительного потенциала
клеток,
в том числе
донорно-акцепторного равновесия динамики электронов в клетке вследствие нормализации
тиол-дисульфидного обмена;
соотношения НАД/НАД•H и НАДФ/НАДФ•H;
соотношения
цАМФ и цГМФ,
динамики вне- и внутриклеточного ионизированного кальция;
соотношения транскрипционных факторов
дифференцировки (NFkB) и факторов пролиферации (АР-1); соотношения
проявлений
функциональной
активности p53, p21 и ras-протеинов, отсюда равновесие процессов
пролиферации, дифференцировки и апоптоза
клеток с учетом принципиально различных проявлений этих эффектов
в нормальных
и
трансформированных клетках.
Присутствие химического взаимодействия между дисульфидной связью соединения на основе окисленного глутатиона и веществом-платиной может играть биофизическую роль в электронном равновесии в биологических системах. Химическое взаимодействие может быть приблизительно представлено как донорно-акцепторная пара, в которой пары неподеленных электронов атомов серы могут потенциально взаимодействовать с электронно-дефицитным веществом, таким как вещество-платина. Учитывая, что активность и физическое состояние клетки определяются, по крайней мере, частично взаимодействием доноров/акцепторов в биологических системах, то равновесие между акцепторами и донорами электронов, обладающих равными биопотенциалами, может быть одним из основных параметров жизни. Изменение этого равновесия может использоваться для регуляции различных функций и физико-химического состояния клетки [11]. Источники мобильных электронов могут включать π-электроны, такие как неподеленные электронные пары азота, кислорода и серы. Акцепторных групп (например, -C=O-) в клетке мало, которая может быть уравновешена посредством донорно-акцепторной динамики электронов-доноров, таких как π -электроны.
Злокачественная клетка может быть охарактеризована как имеющая редчайшие нарушения донорно-акцепторного равновесия в пользу избытка донорных электронов. В раковых клетках практически нет молекул акцепторов. Возможным разрешением такого дисбаланса в данной ситуации является наличие молекул, обладающих акцепторно-донорными свойствами в пределах одной молекулы, такой как вещество GSSG•Pt. Введение GSSG•Pt в биологические среды вызывает восстановление электронного равновесия в биологических средах. Такое восстановление может включать катализ атомом платины реакций, включающих образования активных форм кислорода, например, супероксиданион радикалов, синглетного кислорода.
Как известно, клеточный баланс электронов представляет собой взаимодействие GSSG•Pt с GSH клеток с образованием окислительно-восстановительной, т. е. донорно-акцепторной пары. При наличии высокого уровня GSH в клетках, что характерно для опухоле-трансформированных клеток с высоким пролиферативным импульсом, резко проявляются преимущественно прооксидантные, то есть окислительные свойства GSSG• Pt. В этом случае только в опухолевых клетках формируется окислительный стресс, приводящий к нарушению функционирования митохондрий опухолевых клеток и формирующий внутриклеточный сигнал апоптоза опухолевых клеток.
Для нормальных, но "усталых", "истощенных" клеток это может быть оптимизацией окислительно-восстановительного потенциала, биоэнергетического обеспечения метаболических превращений, редокс-чувствительной адекватной экспрессией функциональных сайтов генома, в частности иммунологически значимых генов и факторов транскрипции.
В трансформированных клетках GSSG•Pt может вызывать несовместимую с их жизнедеятельностью цепную реакцию акцепции (отбирания) π-электронов; нарушение митохондриальных окислительно-восстановительных реакций переноса электронов/протонов по дыхательной цепи; нарушение соотношения НАД•H+ /НАДФ•H, то есть формирование внутриклеточного сигнала индукции механизмов апоптоза.
Активное вещество - композит гексапептида со стабилизированной дисульфидной связью - GSSG•Pt, - обладающий способностью стимулировать/модулировать эндогенную продукцию цитокинов и гемопоэтических факторов, а также индуцировать апоптоз трансформированных клеток, может быть получен оригинальным, разработанным авторами методом пептидного синтеза, изложенным в данном патенте. Полученный таким образом композит гексапептида (GSSG•Pt) с целью его дальнейшего применения у людей и животных используется в виде фармацевтически приемлемых производных GSSG•Pt в инъекционной лекарственной форме, получаемой путем растворения сухого вещества в стерильной воде для инъекций или любом фармацевтически приемлемом растворителе с конечной концентрацией 0.01-3.0%. Для исследований в условиях in vitro GSSG•Pt или его производные могут растворяться в приемлемых для проведения соответствующих экспериментов жидкостях, таких, как культуральные среды, изотонические солевые растворы, растворы глюкозы и т.д.
Инъекционные лекарственные формы GSSG•Pt, его солей и композиций были исследованы в экспериментах на животных, а также в ходе широких клинических испытаний и пилотных исследований на больных людях. Приготовление лекарственной формы для применения у людей и животных должно выполняться с соблюдением условий стерильности и апирогенности и должно исключать возможность химического или бактериального загрязнения лекарственной формы.
Следует отметить, что препарат, включающий композит и его производные, оказывает регулирующее воздействие на процессы эндогенной продукции цитокинов и отсюда на процессы пролиферации и дифференцировки субпопуляций T- и B-лимфоцитов (CD+-клеток). Препарат может индуцировать наработку широкой гаммы цитокинов и гемопоэтических факторов, и CD+ -лимфоцитов. Отсюда в этой палитре с точки зрения взаимодействия цитокинов имеются и цитокины-агонисты, и цитокины-антагонисты по отношению к стимулируемым ими эффектам (например, "отношения" IL-1 α и β и IL-4). В этой связи в зависимости от исходного состояния системы иммуногенеза у пациентов: гипер- или гипоактивность - препараты настоящего изобретения могут восстанавливать нарушенное равновесие.
Данное положение иллюстрируется в Примерах NN 9-13, где показано, что у больных с угнетенной системой иммунитета (онкобольные, получающие лучевую или полихимиотерапию) индукция синтеза цитокинов (IL-1 α и β IL-2, IL-3, IL-4, IL-6, IL-10 и IL-12, IFN-α и IFN-γ) может сопровождаться восстановлением содержания CD3+, CD4+, CD8+, CD16/56+, CD25+, CD34+; а у пациентов с проявлениями иммуноаутоагрессии - на клонах цитотоксических лимфоцитов или фибробластах в случае вирусного гепатита С экспрессируется Fas-Ag (CD95+), что способствует индукции механизмов апоптоза и элиминации вирус-инфицированных и/или "агрессивных" клеток.
Еще одно преимущество настоящего изобретения включает обнаружение того, что воздействие композита на изолированные лимфоциты человека вызывает через 10 мин (пик наблюдается на 30 мин - максимальный уровень фосфорилирования цитозольных белков лимфоцитов) после парентерального введения вещества GSSG•Pt достоверное возрастание уровня фосфорилирования по тирозину цитозольных белков лимфоцитов, что является интегративной характеристикой активности клеточных сигнал-передающих систем. Эти изменения состояния ключевых факторов ц-АМФ, ц-ГМФ, инозитол-фосфат-зависимых сигнальных систем вследствие действия вещества GSSG•Pt (см. Пример N 8) вызывают редокс-чувствительную экспрессию генов, в первую очередь иммунологически значимых генов, ответственных за синтез цитокинов и гемопоэтических факторов. Следовательно, применение вещества GSSG•Pt в лечебных целях не только стимулирует эндогенную продукцию цитокинов и гемопоэтических факторов, но и обеспечивает воспроизведение биохимических и физиологических эффектов цитокинов, в частности в случае потери чувствительности рецепторов к цитокинам, что наблюдается при онкологической и ретровирусной патологии.
В опухоле- и/или вирус-трансформированных клетках индуцируется механизм апоптоза вследствие мультицитокинактивирующего действия вещества GSSG•Pt, его влияния на p53-зависимый и p53-независимый механизмы индукции апоптоза, а также посредством изменения донорно-акцепторного равновесия π-электронов в злокачественных (раковых) клетках (см. Примеры NN 14-16).
В зависимости от исходного биологического состояния пациента, в том числе от состояния его системы иммунитета: иммунодефицит, то есть гипореактивность; или иммуноаутоагрессия, то есть гиперреактивность; наличие опухоле- или вирус-трансформированных клеток, - композит и/или его фармацевтически приемлемые производные способны выступать соответственно как стимуляторы/модуляторы эндогенной продукции цитокинов и/или как индукторы механизмов апоптоза.
Терапевтический эффект вещества GSSG•Pt и его фармацевтически приемлемых производных, в частности его солей при лечении онкологических, инфекционных (вирусных) заболеваний, может быть объяснен стимуляцией продукции широкой палитры эндогенных цитокинов с выявленной нами способностью активировать апоптотическую гибель исключительно трансформированных клеток.
Композит может вводиться различными методами: перорально или в виде раствора, выбираемого из группы, включающей растворы для ингаляций, локальных инстилляций, глазных капель, интраназального введения, мазей для накожных аппликаций, внутривенных растворов, инъекционных растворов и свечей. Предпочтительно, чтобы глутатион вводился парентерально или местно.
В одном из воплощений изобретения композит вводится в дозировке от 0.1 мг/кг до 1.0 мг/кг веса тела. В другом воплощении идеи изобретения композит вводится в дозировке от 1 мг/м2 до 100 мг/м2 поверхности тела. В другом воплощении идеи изобретения препараты могут применяться один или более раз в день, посредством однократного или в течение нескольких дней пульсового или длительного введения до достижения желательного терапевтического эффекта.
В предпочтительном воплощении изобретения фармацевтически приемлемые производные вещества GSSG•Pt вводятся в организм в дозировке от 0.1 мг/кг до 1.0 мг/кг вещества GSSG•Pt на 1 кг веса тела для вещества GSSG•Pt или его соли; или в дозе от 1 мг/м2 до 100 мг/м2 поверхности тела и в случае а также, когда применяется накожно/посредством инстилляций, в дозе от 1 мг/м2 до 100 мг/м2 поверхности тела, по крайней мере, в течение каждого дня. Также препарат может вводиться посредством инъекций или каким-либо иным способом в организм до достижения суммарной суточной дозы от 0.1 мг/кг до 1.0 мг/кг на 1 кг веса тела для основания GSSG•Pt и его солей, и дозе от 1 мг до 100 мг на 1 м2 поверхности тела в течение дня.
При применении композита в виде раствора предпочтительно, чтобы раствор имел концентрацию от 1% до 10% композита. Предпочтительно, чтобы фармацевтически приемлемые производные вещества GSSG•Pt для парентерального использования находились в фармацевтически приемлемом растворителе, таком, как, например, водный раствор, включая воду, раствор глюкозы, изотонические растворы хлорида натрия, забуференные солевые растворы. Могут использоваться другие растворители или носители. При применении композита в форме для инъекций предпочтительно, чтобы форма для инъекций состояла из композита в растворе в концентрации 0.01% до 3.0%.
Для местного применения, включая применение в различные полости тела, могут быть использованы органические растворители или основы в виде мазей, паст, кремов или свечей.
Выполненные экспериментальные и клинические исследования однозначно свидетельствуют о том, что терапевтические эффекты препаратов, полученных на базе GSSG•Pt и его производных, основываются на их мультицитокинактивирущем действии и способности воспроизводить эффекты цитокинов и гемопоэтических факторов, что позволяет считать показанными их для лечения различных онкологических заболеваний.
Для лечения рака легкого предпочтительно применение GSSG•Pt при 1-й или 4-й стадии процесса в монорежиме. При 2-3-й стадии GSSG•Pt может применяться в сочетании с традиционной химиотерапией. Дозировки GSSG•Pt от 30 до 50 мг/м2 поверхности тела. Месячный курс включает дозировки от 10 до 100 мг/м2 поверхности тела для внутривенного (в/в) и внутримышечного (в/м) введения препарата.
Для лечения меланомы может быть особенно эффективным бис-[-иодин-тирозил] -GSSG•Pt. Месячный курс может включать в/в и в/м ежедневное введение препарата в дозах от 30 до 100 мг/м2 поверхности тела.
Для лечения колоректального рака, аденокарциномы желудка и поджелудочной железы предпочтительно использование бис-[цистеамин]-GSSG•Pt и может вводиться путем внутривенных и подкожных инъекций в дозах от 10 до 30 мг/м2 поверхности тела.
Для лечения рака молочной железы предпочтительно применение цистеамин-GSSG•Pt путем в/в и подкожных инъекций в дозах 10-100 мг/м2 поверхности тела в качестве предоперационной подготовки и послеоперационного ведения пациента. Поддерживающая терапия до 1 года посредством применения цистеамин-GSSG•Pt в сочетании с традиционной химиотерапией курсами длительностью до 2 недель. Перерывы между курсами могут быть до 1 месяца.
Для лечения рака простаты предпочтительно применение цинковой соли GSSG•Pt путем в/в инъекций и посредством введения препарата в лимфатическое пространство в дозах от 10 до 100 мг/м2 поверхности тела. Средняя продолжительность курса может быть от 3 до 7 недель.
Для лечения рака яичников предпочтительно применение теофиллин-GSSG•Pt в качестве противоопухолевого средства и в качестве препарата, восстанавливающего чувствительность опухоли к цис-платину. Препарат может вводиться внутривенно и эндолюмбально в дозах от 10 до 100 мг/м2 поверхности тела в течение от 3 до 7 недель. Возможно сочетание с антиэстрогенной терапией.
Для лечения острого лимфобластного лейкоза предпочтительно внутривенное применение литиевой соли GSSG•Pt в виде месячного курса в дозах от 10 до 50 мг/м2 поверхности тела в сочетании с традиционной химиотерапией.
Для лечения острого миелобластного лейкоза предпочтительно внутривенное применение литиевой соли GSSG•Pt в сочетании с цистеамин-GSSG•Pt путем в/в инъекций в дозах от 10 до 100 мг/м2 поверхности тела. Продолжительность курса может быть 3 недели. Поддерживающая терапия может повторяться через 3 месяца в течение 1 года курсами по 14-17 дней.
Лечение туберкулеза может подразумевать туберкулез как диссеминированный процесс с деструктивными патологическими изменениями (КВ+) и бактериовыделением (БК+). Предпочтительно применение бис-[гистидил]-GSSG•Pt путем в/в и в/м инъекций в течение 1 месяца в дозе 3-10 мг/кг веса тела. Последующие 2 месяца доза может быть 1-5 мг/кг веса тела. Препараты могут вводиться внутривенно два раза в неделю или внутримышечно через день.
Для лечения вирусного гепатита B и C, а также микст-инфекций (HBV и HCV) предпочтительно применение GSSG•Pt и инозин-5-монофосфатил-GSSG•Pt (IMP-5-GSSG•Pt) путем в/в и в/м инъекций в суточной дозе 30 и 40-50 мг соответственно. В случае гепатита B (HBV) продолжительность курса лечения может быть до 1 месяца. В случае гепатита C (HCV) и микст-инфекций предпочтительно, чтобы продолжительность курса лечения была не менее 3 месяцев с перерывом в 10-12 дней после каждого месяца.
Для лечения герпеса предпочтительно, чтобы курсовая терапия включала GSSG•Pt и инозин-5-монофосфатил-GSSG•Pt (IMP-5- GSSG•Pt) таким же образом, как в случае больных с гепатитом С (HCV).
Для лечения менингита, сепсиса предпочтительно применение тетра-допамин-GSSG•Pt путем в/в и в/м инъекций в суточной дозе 3-10 мг/кг веса тела. В случае больных с менингитом рекомендуется применение интралюмбальных инъекций препарата в дозе 30-70 мг один раз в 3-4 дня до нормализации клинического состояния больного, показателей крови и ликвора.
Для лечения перитонита предпочтительно применение GSSG•Pt и тетра-допамин-GSSG•Pt путем в/в и в/м инъекций в суточной дозе 30-70 мг на период 10-14 дней до полной нормализации клинического состояния и объективных показателей (анализы крови и мочи, "печеночная" биохимия).
Для лечения особо опасных инфекций вирусной природы (лихорадка долины Рифт) и бактериальной природы (туляремии), в том числе посредством повышения иммунореактивности вакцинотерапии названных заболеваний, предпочтительно применение полипептидного соединения в составе GSSG•Pt белковых веществ в виде антигена или антител. В этом случае комбинированный препарат применяется внутримышечно и/или подкожно один раз в день в дозе 3-7 мг/кг веса тела (по GSSG•Pt) в целях профилактики заболеваний и достижения терапевтического эффекта.
Для лечения острого панкреатита предпочтительно применение GSSG•Pt и IMP-5-GSSG•Pt путем в/в и п/к (вдоль левой реберной дуги) инъекций в суточной дозе 3-10 мг/кг веса тела предпочтительно каждый день в течение 1-й недели, затем 3 раза в неделю последующие 14-17 дней.
Для лечения гнойных послеоперационных осложнений предпочтительно применение GSSG•Pt и IMP-5-GSSG•Pt аналогично применению при перитоните.
Для лечения СПИДа предпочтительно применение GSSG•Pt и уридин-[5-монофосфатил] -GSSG•Pt (UMP-5-GSSG•Pt) путем в/в и в/м инъекций с чередованием через день в суточной дозе 1-3 мг/кг веса тела в течение 30 дней. Общая длительность курса лечения может быть до 6 месяцев с перерывами в 2-3 недели после каждого месяца терапии. В случае СПИД-ассоциированной энцефалопатии рекомендуется применение GSSG•Pt и UMP-5-GSSG•Pt в однократной дозе от 30 до 70 м соответственно один раз в 7 дней в течение месяца.
Для лечения иммуносупрессий инфекционных заболеваний радиационного или токсического (химического) происхождения предпочтительно применение GSSG•Pt и UMP-5-GSSG•Pt путем в/в и в/м инъекций в дозе 1-3 мг/кг веса тела ежедневно, в течение 10-12 дней до нормализации гемопоэза и реставрации иммунитета.
Для лечения гломерулонефрита предпочтительно применение GSSG•Pt и литиевой соли GSSG•Pt путем в/в и в/м инъекций в суточной дозе 10-30 мг 1-2 раза ежедневно в течение 2 недель. Последующее лечение предпочтительно включает в/м инъекции только в дозе 30 мг один раз в день в течение месяца. Полная длительность курса до 3-х месяцев с 2-недельными перерывами после каждого месяца.
Для лечения ревматоидного артрита предпочтительно применение GSSG• Pt и литиевой соли GSSG•Pt путем в/в и п/к инъекций вблизи пораженных суставов в дозировке 10 мг два раза в день в течение 3 месяцев. Предпочтительно, чтобы последующее лечение включало только подкожные инъекции, 1 инъекция 2-3 раза в неделю в течение 3 месяцев.
Для лечения коллагеноза предпочтительно применение GSSG•Pt и литиевой соли GSSG•Pt аналогично применению при ревматоидном артрите. Лечение может также включать дополнение не более чем 500 мг витамина C в день.
Для лечения системной красной волчанки курс лечения предпочтительно может включать GSSG•Pt и литиевую соль GSSG•Pt аналогично применению при коллагенозе.
Для лечения атопических форм аллергических состояний (аллергический ринит, атопический дерматит, бронхиальная астма и крапивница) предпочтительно применение GSSG• Pt и дигидрофторид-GSSG•Pt[(HF)2•GSSG•Pt] путем п/к и в/м инъекций, а также капель в нос в дозировке 0.1-1 мг/кг веса тела 2 раза в день в течение 3-х недель. Предпочтительно не менее 2 или 3 лечебных курсов, обычно весной и поздней осенью.
Для лечения диабета 1-го типа предпочтительно применение ванадиевой соли GSSG•Pt (диванадат-GSSG•Pt) путем в/в и в/м инъекций в дозировке 1-2 мг/кг веса тела одновременно с бис-[никотиноил]-GSSG•Pt в дозировке 1-3 мг/кг веса тела. Предпочтительно проведение лечебных курсов длительностью 3-4 недели каждые 3 месяца.
Для лечения диабета 2-го типа предпочтительно применение бис-[липоил]-GSSG•Pt путем в/в и в/м инъекций в дозировке 3-7 мг/кг веса тела одновременно с бис-[никотиноил]-GSSG•Pt в дозировке 1-3 мг/кг веса тела (в основном в составе капельницы на основе 0,5% раствора глутаминовой кислоты). Лечебные курсы могут проводиться в течение 1 месяца 2-3 раза в год.
Для лечения ишемических состояний головного мозга, включая пост-инсультные состояния (например, детский церебральный паралич), предпочтительно применение бис-[фенилаланил] -GSSG•Pt путем в/в и в/м инъекций в дозировке 1-7 мг/кг веса тела в виде лечебных курсов длительностью 3-4 недели с перерывами между курсами до 1 месяца. Общая продолжительность терапии может быть до 2 лет.
Для лечения ишемической болезни сердца (ИБС), проявляющейся в основном в виде синдрома нарушения проводимости и аритмиями (тахиаритмии, брадиаритмии, нарушение желудочковой проводимости вследствие блокады ножек или ветвей пучка Гиса), предпочтительно применение бис-[карнозил]-GSSG•Pt (бис- β - аланил-L-гистидил- GSSG•Pt) путем в/в и в/м инъекций в дозировке 2-5 мг/кг веса тела в виде лечебных курсов длительностью 3-4 недели.
Для лечения ишемической болезни сердца (ИБС) предпочтительно применение глицерол-[1,3-дифосфатил] -GSSG•Pt путем в/в и в/м инъекций в дозировке 2-5 мг/кг веса тела в основном в составе капельниц с 5% раствором глюкозы. Длительность лечебных курсов от 2-х до 3-х недель, 2-3 раза в год.
Для лечения нейродегенеративных заболеваний, таких, как болезнь Альцгеймера, наследственная хорея (Генгтингтона), болезнь Паркинсона, боковой амиотрофический склероз, нейро-СПИД, предпочтительно применение бис-[3,4-дигидроксифенилаланина] -GSSG•Pt путем в/в, п/к (вдоль шейно-грудного отделов позвоночника) и в/м инъекций в дозировке 1-5 мг/кг веса тела в виде лечебных курсов длительностью до 1 месяца в течение 1 года. Перерывы между курсами могут быть 2-3 недели.
Для лечения демиелинизирующих заболеваний, таких как рассеянный склероз, предпочтительно применение бис-[3, 4- дигидроксифенилаланина]-GSSG•Pt путем в/в и п/к (вдоль позвоночника) инъекций и эндолюмбально в дозировке 1-10 мг/кг веса тела в виде лечебных курсов длительностью до 1 месяца. Общая продолжительность лечения может быть до 1 года. Эндолюмбально препарат может вводиться 1-2 раза в месяц.
В виде психо- и ноотропных препаратов, могущих применяться для лечения нейродегенеративных заболеваний, таких как гипоксия головного мозга (пост-ишемические состояния), может использоваться γ - гидрокси-[бутаноил]-GSSG•Pt путем в/в и в/м инъекций в дозировке 1-4 мг/кг веса тела в виде лечебных курсов длительностью от 2 до 4 недель. Эндолюмбально вводить препарат рекомендуется раз в неделю, в дозировке 1 мг/кг веса тела.
Для лечения маниакально-депрессивного психоза, а также шизофрении, рекомендуется применение γ - амино-[бутаноил]-GSSG•Pt путем в/в и в/м инъекций в дозировке 3-5 мг/кг веса тела в виде лечебных курсов длительностью от 4 до 6 недель 2-3 раза в год.
Для лечения атеросклероза и других метаболических заболеваний рекомендуется применение бис-[никотиноил]-GSSG• Pt (бис-пиридин-3-карбаноил-GSSG•Pt) путем в/в и в/м инъекций в дозировке 1-3 мг/кг веса тела в виде лечебных курсов длительностью от 2-3 недели 3 раза в год.
При лечении эндокринных заболеваний рекомендуется применение фолликулил-[сукцинил] -GSSG• Pt путем в/м и п/к инъекций в дозировке 3-10 мг/кг веса тела в виде лечебных курсов длительностью 1 месяц 3-4 раза в год.
Приведенные ниже примеры реализации изобретения демонстрируют возможность его медицинского применения и подтверждают эффективность, а также целесообразность использования семейства разработанных лекарственных средств с учетом приведенной широкой палитры заболеваний (Примеры NN9-17).
ПРИМЕРЫ
РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Пример N 1
Синтез натриевой соли бис-(L-фенилаланил- γ
- L-глутамил)- L-цистинил-бис-глицина
I.
Общая характеристика препарата
1.
Название: бис-(L-фенилаланил- γ
- L-глутамил)-L-цистинил-бис- глицин динатриевая соль
композит с
cis-диаминодихлорплатиной.
2. Структурная формула - приведена на фиг. 7.
3. Брутто-формула: C38H48N8O14
Na2
S2•[Pt(NH3)2
Cl2]
4. Молекулярный вес:
950,94 на C38H48N8O14Na2
S2 с
содержанием Pt 0,033%
5. Внешний вид: белый
порошок без запаха.
6. Растворимость: растворим в воде, изотоническом растворе хлорида натрия 0,9% для инъекций; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
7. Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен.
8. pH 0,1% раствора: 5.75 потенциометрически.
9. Подлинность:
а) аминокислотный анализ (6 н.
HCl, 110oC, 20 ч), (допустимая
погрешность 20%, для цистеина 35%), в
соответствии: глицин - 2,00; глутаминовая кислота
- 1,92; цистеин - 1,81; фенилаланин - 2,
04;
б) ЯМР(1H) - спектроскопия, в соответствии
"BRUKER" AM 500, 500 MHz, D2O
(см. табл. A).
10. Чистота
(содержание основного вещества):
а)
ВЭЖХ: не менее 97%
прибор BECKMAN "Gold Nouveau
Chromatography Data System" Version 1.0, Diod Array
Detector Module 126. Проба 20 мкл 0,1%
раствора препарата, хроматографирование на колонке
ULTRASPERE ODS 250х4,
6 мм с обращенной C18
фазой в изократическом режиме ацетонитрил - 0,1%
трифторуксусная к-та (2:98); скорость потока
1 мл/мин, детектирование при 220 нм, сканирование
190-600 нм, PDA
функции -Contour Plot, 3D.
б) по аминокислотному анализу 85% (анализ
по п.9а с точной навеской);
в) ТСХ
- гомогенен, анализ проводится при нанесении в полосу
5 мкл 0.1%
раствора препарата. Пластинки
Kieselgel 60f(Merck) 10х5 см, система: н.бутанол
- уксусная кислота - вода (4:1:1).
Проявление по стандартным методикам - нингидрин и хлор/бензидин.
Rf= 0,15;
г)
содержание натрия (Na) по эмиссионному спектральному методу 4,8%;
д) содержание платины (Pt)
по масс-спектральному методу 0,033%.
11.
Найденное
содержание элементов,
мкг/г:
Серебро (Ag) - <1.0 (менее 0.0001%)
Алюминий (Al) - 2.0
Мышьяк (As)
- <1.0
Барий (Ba) - <0.50
Бериллий
(Be)
- <0.05
Кальций (Ca) - 7.0
Кадмий (Cd) - <0.05
Кобальт (Co) - <0.5
Хром (Cr) - 1.7
Медь (Cu) - <0.5
Железо (Fe)
- <1.0
Калий (K) - <2.5
Селен (Se) - <2.0
Магний (Mg) - <2.5
Марганец (Mn) - <0.2
Молибден (Mn) - <
0.2
Натрий (Na) - 48 мг/г
Никель (Ni) - <0.5
Свинец (Pb)
- <0.40
Платина (Pt) - 330
мкг/г
Стронций
(Sr) - 1.9
Титан (Ti) - <
0.5
Ванадий (V) - <0.5
Цинк (Zn) - 0.65
Сурьма (Sb)
- <0.5
Методика определения
Точная навеска пробы (около 50 мг) растворялась в 50 мл
бидистиллированной воды и раствор использовался для анализа.
Содержание платины определялось количественно методом масс-спектрометрии с индуктивно-связанной плазмой на приборе модели PQe, фирмы VG Elemental, Англия.
Относительная точность анализа 5%.
Содержание других элементов определяется количественно методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой на приборе модели TRACE 61Е, фирмы Thermo Jarrell Ash, США. Относительная точность анализа 5%.
12. Потеря массы при сушке: 10% при сушке до постоянного веса при 100oC в вакууме (1 мм Hg) над CaCl2 и P2 O5.
II Описание
методики синтеза
13. Химическая схема процесса
- представлена на
фиг. 8.
14. Описание методики
(III) Продукт (I)
γ- L-глутамил-L-цистеинил-глицин в
количестве 3,07 г (10 ммоль) и N-гидроксиметилбензамид (II) в
количестве 5,89 г (13
ммоль) растворяют в 30 мл безводной трифторуксусной кислоты (TFA) и
перемешивают при комнатной температуре в
течение 1 ч. Затем растворитель отгоняют в вакууме при 40oC, к остатку добавляют
30 мл безводного этилового спирта, снова отгоняют растворитель в
вакууме и эту операцию повторяют еще 2
раза. Продукт кристаллизуют растиранием в 50 мл безводного
диэтилового эфира, отфильтровывают,
промывают на фильтре 2х20 мл безводным эфиром и сушат далее в
вакууме над KOH и P2O5. Перекристаллизация из 90% этанола. Выход 5,50 г
(80%). Rf = 0,43, Kieselgel
60f (Merck) 10х5 см, система: н.бутанол-уксусная
кислота - вода (4:1:1).
(V) Продукт (III) в количестве 4,40 г (10 ммоль) перемешивают в смеси 15 мл дистиллированной воды и 25 мл диоксана, далее при перемешивании добавляют 10 мл (20 ммоль) 2 N раствора NaOH.
Затем в реакционную смесь вносят 3,62 г (10 ммоль) N-оксисукцинимидного эфира фенилаланина (IV) и перемешивание продолжают при комнатной температуре в течение 12 ч.
Затем реакционную смесь упаривают в вакууме при 40oC досуха. Остаток растворяют в 200 мл этилацетата и промывают 2х50 мл 1 н. серной кислотой, водой, 1% раствором бикарбоната натрия (2х50), водой и сушат органический слой над безводным хлористым кальцием.
Далее этилацетат отгоняют в вакууме при 40oC досуха и продукт закристаллизовывают в системе этилацетат/эфир.
Кристаллы отделяют фильтрованием и сушат в вакууме над пятиокисью фосфора до постоянного веса. Выход продукта (V) 4,88 г (70%). Rf = 0,80, Kieselgel 60f (Merck) 10х5 см, система: н.бутанол-уксусная кислота-вода (4:1: 1).
(VI) Продукт (V) 6,87 г (10 ммоль) растворяют в 20 мл перегнанной трифторуксусной кислоты и раствор выдерживают при комнатной температуре в течение 2 ч. Затем продукт высаживают абсолютным эфиром (около 200 мл), отфильтровывают и сушат в вакууме над KOH до постоянного веса. Выход продукта (V) 5,28 г (90%). Rf=0,48, Kieselgel 60f (Merck) 10х5 см, система: н. бутанол-уксусная кислота-вода (4:1:1).
(VII) Продукт (IV) 5,87 г (10 ммоль) растворяют в 100 мл смеси метанол-вода (1: 1), добавляют 200 мл (10 ммоль) раствора ацетата ртути и смесь перемешивают при комнатной температуре 1 ч. Затем через раствор барботируют ток сероводорода в течение 20 мин, проверяя полноту осаждения в пробе. Осадок сульфида ртути отфильтровывают, фильтрат упаривают в вакууме до объема 10 мл, добавляют 200 мл изопропилового спирта и закристаллизовывают продукт при охлаждении до 0-4o C. Кристаллы отфильтровывают, промывают изопропиловым спиртом, ацетоном и сушат в вакууме над P2 O5. Выход продукта (VII) 3,72 (82%). Rf =0,30, Kieselgel 60f (Merck) 10х5 см, система: н.бутанол-уксусная кислота-вода (4:1:1).
(VIII) Продукт (VII) 4, 54 г (10 ммоль) суспендируют в 20 мл воды и при перемешивании прибавляют 5 мл (10 ммоль) 2N раствора NaOH и затем 4,8 мл 0,05% водного раствора cis-диаминодихлорплатины cis-[Pt(NH3)2Cl2]. Раствор охлаждают до температуры 18-20oC и небольшими порциями в течение примерно 2 мин добавляют 5,1 мл 3% раствора перекиси водорода с такой скоростью, чтобы температура не превышала 22-25oC. Через 30 мин после прибавления всего количества раствора перекиси водорода проводят измерение pH раствора и доводят его значение до 5,6 - 5,8 прибавлением необходимого количества 4N раствора NaOH, при этом контролируют температуру раствора, которая должна быть в пределах 22-25oC. Далее перемешивание продолжают уже без внешнего охлаждения в течение еще 30 мин и затем делают контрольный анализ реакционной смеси при помощи HPLC. Для этого из реакционного раствора отбирают 10 мкл и разбавляют их в 1 мл подвижной фазы. Если по данным HPLC содержание окисленной формы равно или превышает 95%, реакцию считают законченной. В противном случае перемешивание при комнатной температуре продолжают еще 30 мин и анализ по HPLC повторяют.
Далее реакционный раствор фильтруют через фильтр с размером пор не более 0,7 мкм и фильтрат лиофилизуют. Полученный сухой продукт досушивают в вакууме при 40o C над безводным хлористым кальцием до постоянного веса. Выход 4,51 г (95%).
Готовую субстанцию анализируют согласно пп.5-12.
Пример N 2
Синтез литиевой
соли
бис-( γ
- L-глутамил)-L-цистинил-бис-глицина
Общая
характеристика препарата
1. Название: бис-( γ- L-глутамил)-L-цистинил-бис-глицин, композит с
cis-диамминдихлорплатиной
2.
Структурная формула: приведена на
фиг.9.
3. Брутто-формула: C20H30N6O12 Li2S2
•[Pt(NH3)2
Cl2]
4.
Молекулярный вес:
624,49 на C20H30N6 O12Li2S2 с содержанием
Pt 0,
032%
5. Внешний вид: белый
порошок без запаха.
6. Растворимость: растворим в воде, изотоническом растворе хлорида натрия 0,9% для инъекций; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
7. Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен.
8. pH 0, 1% раствора: 5.0-6.0 потенциометрически.
9.
Подлинность;
а) аминокислотный анализ (6 н. HCl, 110oC, 20 ч) в соответствии: глицин - 2.0 (2.0); глутаминовая
кислота
- 1.9 (2.0); цистеин - 1.9(2.0); цистеин
- 1.7(2.0).
б) ЯМР(1H) - спектроскопия, в соответствии: CH2 ( δ 2.05, 2.40, 3.00, 3.80); CH δ 3.72, 4.65).
в) ВЭЖХ - по времени выхода соответствует стандарту.
10. Чистота (содержание основного вещества):
а) по ВЭЖХ > 95%;
б) по
аминокислотному анализу > 85%;
в) ТСХ
- гомогенен;
г) содержание лития (Li) по эмиссионному спектральному методу 2.2 ± 0.1%
д)
содержание платины (Pt) по
масс-спектральному методу: 0,01 - 0,02%
II
Поэтапная схема синтеза
продуктов (А--->В--->Г)
А. Окисление восстановленного
глутатиона ( γ
- L-глутамил-L-цистеинил-глицин)
А1 - стадия обработки
исходного
восстановленного глутатиона перекисью водорода при pH 8 приведена на фиг. 10.
Исходное
соединение (I): γ- L-глутамил-L-цистеинил-глицин (GSH) H- γ
- L-Glu-L-Cys-Gly-OH
Реагенты: 1) перекись водорода (35%) Fluka
2) водный
аммиак (25%)
Условия
реакции: перемешивание водного раствора (I) и реагентов при 20oC
при pH 8.0 в течение 20 мин;
A2 - выделение свободного гексапептида
бис-( γ
- L-глутамил)-L-цистинил-бис-глицин (приведена на фиг. 11)
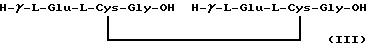
Исходное соединение: реакционная смесь на стадии А1.
Реагенты: уксусная кислота ледяная
Условия реакции: подкисление реакционной смеси А1 ледяной уксусной
кислотой до pH 5.0,
фильтрация раствора и лиофильная сушка продукта.
Контроль прохождения стадии окисления А: методом ВЭЖХ на колонке типа Delta Pack C18 (0.1% TFA-MeCN, 0-25%); проверяют наличие пика (>97%) соединения (III) (7.4 ± 0.4 мин) и отсутствие пика соединения (I) (3.0 ± 0.3 мин).
В. Перевод окисленной формы (III) в литиевую соль - приведена на фиг. 12.
Исходное соединение: свободный гексапептид (III).
Реагенты: 1 N раствор LiOH.
Условия
реакции:
а) титрование водного
раствора соединения (III) двумя эквивалентами LiOH;
б) упаривание воды в вакууме при
35-40oC;
в) высаживание продукта
изопропиловым спиртом;
г) фильтрование
осадка;
д) промывка осадка ацетоном;
е) сушка продукта в вакууме (1 мм Hg) при
35-40oC.
Контроль при прохождении стадии В: контролируются количества реагентов и технологические условия при сушке.
Г. Контроль качества готового продукта.
1. Содержание основного вещества по данным ВЭЖХ: >95%.
Анализ проводится, используя 20 мкл 0,1% раствора препарата, на колонке 250х4,6 мм с обращенной C18 фазой в изократическом режиме ацетонитрил - 0,1% трифторуксусная к-та (2: 98); скорость потока 1 мл/мин, детектирование при 220 нм. Сравнение проводят по пику стандарта, полученного в тех же условиях.
2. Содержание основного вещества по данным спектрофотометрического анализа на содержание неокисленных тиольных групп: >95%.
Анализ 0.12 мл 0.5% раствора препарата помещают в мерную колбу на 25 мл, добавляют 1 мл 0,1 мл раствора Трис-HCl буфера с pH 8.0, 0,01М ЭДТА и 1 мл 2% раствора NaBH4. Реакционную смесь инкубируют при температуре 20oC в течение 30 мин. Реакцию останавливают добавлением 0,6 мл 1М HCl в течение 2 мин порциями по 0.05 мл при перемешивании с последующим добавлением 2 мл ацетона в течение 3 мин при перемешивании. Затем добавляют 0.25 мл раствора реагента Элмана и доводят объем до метки 0.1 М раствором фосфатного буфера pH 8.0. Измеряют оптическую плотность раствора при 412 нм, раствор сравнения - вода. Параллельно процедуру проводят со стандартом препарата и сравнивают полученные данные.
3. Наличие посторонних примесей по данным ТСХ: препарат гомогенен.
Анализ проводится при нанесении в полосу 5 мкл 0.1% раствора препарата. Пластинки Kieselgel 60f (Merck) 10х5 см, система: н.бутанол-пиридин-уксусная кислота-вода (150: 100:30:120). Проявление по стандартным методикам нингидрином и хлор/бензидин.
4. Содержание лития (Li) по эмиссионному спектральному методу: 2.2 ± 0.1%.
Пример N 3
Фармакокинетика и метаболизм препаратов GSSG•Pt и GSSG в
плазме и тканях при внутривенном введении.
Целью исследования явилось изучение хроноконцентрационных кривых GSSG и изменение активности ферментов, участвующих в метаболизме GSSG при внутривенном введении препаратов GSSG•Pt и GSSG в различных дозах.
В рамках данного исследования оценивалось изменение концентрации окисленного глутатиона в плазме крови, печени, почках, селезенке и лимфоцитах животных в течение 60 мин при однократном внутривенном введении препаратов GSSG•Pt и GSSG в дозах 2 мг/кг массы тела и 20 мг/кг массы тела. Помимо этого, оценивались изменения активности ферментов, участвующих в метаболизме GSSG (НАДФ• H-зависимой глутатион-редуктазы, глутатион-пероксидазы, глутатион S-тpасфеpазы, γ - глутамилтранспептидазы) [19, 22-26].
Эксперимент выполнялся на мышах линии СВА, самцах, стандартной массы 180-220 г. Пять групп животных (не менее 15 штук в каждой) было сформировано в рамках проведенного исследования. Описание групп приведено ниже.
Контрольная
группа:
N 1 - интактные животные, получившие вместо инъекции препаратов инъекцию
растворителя исследуемых веществ (физиологического раствора);
Опытные
группы:
N 2
- животные,
получившие инъекцию препарата GSSG в физиологическом растворе из расчета 2 мг/кг массы
тела;
N 3 - животные, получившие инъекцию препарата GSSG в
физиологическом растворе из
расчета 20 мг/кг
массы тела;
N 4 - животные, получившие инъекцию препарата GSSG•Pt в
физиологическом растворе, из расчета 2 мг на кг массы тела;
N 5 - животные, получившие
инъекцию препарата
GSSG•Pt в физиологическом растворе, из расчета 20 мг на кг массы тела;
Образцы крови забирали через 1, 2, 5, 10, 20, 40 и 60
мин, отделяли плазму и проводили
анализ
концентрации по
стандартной методике, основными стадиями которой являются осаждение белков,
удаление из образца неполярных и среднеполярных соединений и
последующий хроматографический анализ
со
спектрофотометрическим
детектированием при условиях изократического и линейного градиентного
элюирования.
Изменения содержания GSSG в сыворотке крови, различных органах и лимфоцитах при внутривенном введении препаратов представлены в таблицах 1-4.
Активность ферментов, участвующих в метаболизме GSSG (глутатион-редуктазы: КФ. 1.6.4.2; глутатион-пероксидазы: КФ.1.11.1.9.; глутатион S-трасферазы: КФ.2.5.1.18.; γ- глутамилтранспептидазы: КФ.2.3.2.2.) определяли посредством стандартных наборов реактивов (КИТ) фирмы Boehringer Mannheim GmbH. Показатели изменения активности ферментов при внутривенном введении препаратов GSSG•Pt и GSSG в дозе 2 мг/кг приведены в таблицах 5, 6, 7.
При сравнении динамического распределения препаратов в сыворотке крови, печени, почках, селезенке и лимфоцитах видно четкое преимущество фармакокинетики препарата GSSG•Pt по сравнению с препаратом GSSG. Концентрация препарата GSSG к 10 мин практически возвращается к исходной, тогда как концентрация препарата GSSG•Pt к этому моменту превышает в 50 раз исходные показатели и продолжает оставаться на данном высоком уровне до конца исследуемого периода. Кроме этого максимальная концентрация препарата GSSG•Pt в плазме крови и тканях превышает в 3 раза максимальную концентрацию препарата GSSG. Это определяет более высокую эффективную длительность воздействия препарата GSSG•Pt в сравнении с препаратом GSSG.
Как следует из материалов таблиц 5, 6, 7, препарат GSSG увеличивает активность ферментов, участвующих в метаболизме тиолов (примерно в 2 раза), с большим числом достоверных показателей, в то время как препарат GSSG• Pt активность ферментов практически не изменяет, а число достоверных показателей оказывается незначительным. Это свидетельствует о большой устойчивости препарата как субстрата по отношению к основным ферментам, принимающим участие в метаболизме глутатиона, а значит, приводит к более длительному нахождению в плазме крови и различных органах глутатиона в окисленном состоянии.
Таким образом, анализ полученных данных показал более высокую устойчивость препарата GSSG•Pt к селективному воздействию основных ферментов метаболизма глутатиона (в первую очередь, НАДФ•H-зависимой глутатион-редуктазы), что определяет новую динамику фармакокинетики препарата, способствуя проявлению новых биолого-фармацевтических эффектов, а следовательно, новых терапевтических эффектов препарата GSSG•Pt.
Пример 4. Приведен в конце текста.
Пример N 5
Влияние GSSG•Pt и GSSG на продукцию цитокинов
мононуклеарными лейкоцитами
периферической крови человека in vitro.
Оценивали действие окисленного глутатиона (GSSG), а также его структурного аналога, представляющего собой гексапептид со стабилизированной дисульфидной связью (GSSG•Pt), на продукцию цитокинов мононуклеарными лейкоцитами периферической крови человека в условиях in vitro.
Продукцию цитокинов лейкоцитами инициировали добавлением митогена, конканавалина A (ConA), который добавлялся в клеточную культуру сразу же после внесения исследуемых веществ. Супернатанты культур собирали через 24 ч после начала сочетанного воздействия ConA и исследуемых веществ и хранили до момента определения цитокинов при -70oC.
Для оценки функционального состоянии клеток и их способности отвечать на митоген в присутствии каждой из оцениваемых концентраций исследуемых веществ, контрольные культуры клеток, содержащие исследуемые вещества в идентичных концентрациях, инкубировали в течение 72 ч после начала сочетанного воздействия ConA и исследуемых веществ. За 16 ч до окончания инкубации в контрольные культуры вносили3H-тимидин и степень включения метки в ДНК расценивали как критерий функционального состояния клеточной тест системы.
Венозную кровь от здоровых доноров, мужчин, собирали в пластиковые гепаринизированные пробирки, тестированные на отсутствие эндотоксина (endotoxin tested). Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-диатризоат натрия (Histopaque-1077, Sigma).
Концентрацию клеток доводили до 2•106 клеток на 1 мл "полной" культуральной среды (RPMI 1640, Sigma), содержащей 20 mM HEPES, 2 mM глутамина, 50 мкг/мл гентамицина и 10% фетальной телячьей сыворотки. Все использованные реагенты были "для культур тканей", Sigma. Жизнеспособность клеток оценивали по методу исключения с трипановым синим и 100 μл клеточной суспензии (200.000 клеток) разносили в лунки плоскодонных 96-луночных планшетов для культур тканей. Клетки от каждого донора разносили не менее чем в 39 лунок.
Оценивали влияние 5 конечных концентраций (5000 μг/мл; 500 μг/мл; 50 μ г/мл; 5 μг/мл; и 0.5 μг/мл) тестируемых веществ - GSSG, а также GSSG•Pt. Каждую из концентраций создавали не менее чем в 6 лунках, внося 50 μл "полной" культуральной среды, содержащей необходимое количество предварительно растворенных исследуемых веществ. Еще 6 лунок использовались для контроля (добавлялось 50 μл только "полной" культуральной среды).
Непосредственно после внесения исследуемых веществ во все лунки (за исключением 3 дополнительных, которые служили для оценки спонтанного захвата3H-тимидина (без ConA)) вносили по 50 μл "полной" культуральной среды, содержащей такое количество ConA (Sigma, для культур тканей), чтобы его конечная концентрация составляла 4.0 μг/мл.
Через 24 ч инкубации планшетов при 37oC в присутствии 5% CO2 содержимое половины лунок (по 3 лунки из каждых 6, содержащих одинаковую концентрацию исследуемых веществ) отсасывали, подвергали центрифугированию, супернатанты замораживали и хранили при -70oC до момента определения присутствия цитокинов. Содержимое всех оставшихся заполненными лунок (3-х оставшихся) продолжали инкубировать при вышеописанных условиях.
Через 56 ч от начала инкубации во все оставшиеся лунки добавляли по 1.0 μ Ci3H-тимидина и продолжали инкубацию еще 16 ч, после чего содержимое лунок извлекалось и при помощи клеточного харвестера (cell harvester) наносили на стекловолокнистые фильтры, которые последовательно обрабатывали 5% трихлоруксусной кислотой и этанолом. Фильтры высушивали и их радиоактивность (импульсы в 1 мин, имп/мин) определяли с помощью жидкостного сцинтиляционного счетчика Betaplate 1205 (LKB).
Значения радиоактивности фильтров для каждого триплета лунок усредняли и рассчитывали индекс митогенной стимуляции: отношение усредненных значений имп/мин ConA-стимулированных культур к усредненным значениям имп/мин в культурах, в которые не добавлялся ConA (3 лунки без ConA). По индексу стимуляции в качестве критерия судили о функциональном состоянии клеток в лунках, где оцениваемые вещества присутствовали в различных концентрациях, и о способности клеток отвечать на митогенную стимуляцию.
Последующему анализу на содержание цитокинов подвергали клеточные супернатанты 24-часовых культур только из тех триплетов лунок, в контрольных триплетах которых при 72- часовой инкубации была выявлена митогенная реакция на ConA с индексом стимуляции в диапазоне от 15 до 50.
Концентрации интерлейкина-1b (IL-1b); интерлейкина-2 (IL-2); интерлейкина-3 (IL-3); интерлейкина-4 (IL-4); интерлейкина-6 (IL-6); интерлейкина-8 (IL- 8); интерлейкина-10 (IL-10); интерлейкина-12 (IL-12); фактора некроза опухолей α,γ (TNF- α,γ ) и интерферона α,γ (IFN- α,γ ); определяли по методу ELISA с использованием коммерческих наборов фирмы Medgenix (Бельгия) и выражали в пкг/мл культуральных супернатантов.
Заметные результаты представлены в таблицах 8, 9. Согласно данным таблиц 8 и 9, добавление GSSG и GSSG•Pt в культуральную среду статистически приводило к достоверной и дозозависимой стимуляции продукции цитокинов мононуклеарными лейкоцитами человека. При этом GSSG• Pt оказывает более выраженное (в 1.5-2 раза) стимулирующее влияние на продукцию исследуемых цитокинов, причем стимулируя и регулируя выработку более широкой палитры цитокинов, в исследовании по сравнению с действием GSSG. В таблицах 8 и 9 хорошо прослеживается корреляция изменений взаимосвязанных цитокинов (увеличение IL-1b, IL-2, TNF- α,γ на фоне снижения IL-4, IL-10).
Таким образом, действие GSSG•Pt на мононуклеарные лейкоциты периферической крови людей в условиях in vitro приводит к убедительной стимуляции продукции более широкой палитры цитокинов в культуральную среду с учетом их взаиморегулирующих эффектов, чем подтверждается стимулирующее и регулирующее действие GSSG•Pt на естественную цитокин-продуцирующую способность клеток крови человека.
Пример
N 6
Влияние GSSG и
GSSG•Pt на продукцию цитокинов и гемопоэтических факторов, а также показатели кроветворения и иммунитета
при
циклофосфамид-индуцированной
гемо- и
иммунодепрессии.
1. Действие окисленного глутатиона (GSSG) и его структурного аналога, представляющего собой гексапептид со стабилизированной дисульфидной связью (GSSG•Pt), оценивали в модели гемо- и иммунодепрессии у мышей, индуцированной однократным введением цитостатика циклофосфамида (ЦФ).
В рамках данного исследования была проведена оценка влияния 5-дневного применения вышеперечисленных веществ на способность лимфоцитов селезенки мышей, подвергнутых действию ЦФ, продуцировать интерлейкин-1( α , b); интерлейкин-2 (IL-2); интерлейкин-3 (IL-3); интерлейкин-4 (IL-4); интерлейкин-6 (IL-6); интерлейкин-8 (IL-8); интерлейкин-10 (IL-10); интерлейкин-12 (IL-12); фактор некроза опухолей α, γ\ (TNF- α, γ ) и интерферон α,γ (IFN- α, γ ); и GM-CSF, G-CSF, M-CSF в условиях in vitro. Помимо этого, оценивалась клеточность крови (число лейкоцитов и лимфоцитов) и костного мозга (число кариоцитов) на 8-й день после применения ЦФ. У части животных, получивших ЦФ и затем подвергнутых иммунизации эритроцитами барана (ЭБ), оценивали способность развивать гуморальный иммунный ответ к данному антигену.
Исследование было проведено на мышах линии СВА, самцах, массой 18-20 г, которым однократно вводился ЦФ (50 мг/кг, внутрибрюшинно). Четыре группы животных (не менее 15 мышей в каждой) было сформировано в рамках проведенного исследования. Описание групп приведено ниже.
Контрольные
группы:
N 1 - интактные
животные, получившие вместо инъекции ЦФ инъекцию
растворителя исследуемых веществ (физиологического раствора);
N 2 - животные,
получившие инъекцию ЦФ, у
которых в дальнейшем
применялся
растворитель исследуемых веществ (физиологический
раствор) (контроль);
Опытные группы:
N 3 - животные, получившие инъекцию
ЦФ, у которых в
дальнейшем применялось
исследуемое
вещество GSSG в физиологическом растворе из расчета 5
мг/кг массы тела;
N 4 - животные, получившие инъекцию ЦФ, у которых в дальнейшем
применялся
GSSG•Pt в физиологическом
растворе,
из расчета 5 мг на кг массы тела.
Через 24 ч после применения ЦФ по 5 животных из каждой группы было подвергнуто иммунизации эритроцитами барана (ЭБ, 107 эритроцитов в 0.5 мл физиологического раствора, внутрибрюшинно).
С 3-х суток после инъекции ЦФ (через 24 ч после иммунизации) животным начинали внутрибрюшинное введение контрольных или исследуемых веществ, как описано выше. Введение веществ продолжали в течение 5 дней (ежедневно, один раз в день).
Через 24 ч после окончания 5-дневного курса применения контрольных или исследуемых веществ (на 8-й день после инъекции ЦФ) мышей эвтаназировали и в стерильных условиях готовили суспензию спленоцитов для оценки спонтанной продукции цитокинов и гемопоэтических факторов лимфоцитами селезенки в условиях in vitro.
Параллельно с этим забирали образцы крови и костного мозга для оценки их клеточности (число лейкоцитов и лимфоцитов крови, кариоцитов костного мозга).
У иммунизированных животных на 7-й день после иммунизации (8-й день после инъекции ЦФ) оценивали сывороточный титр гемагглютининов к ЭБ.
В таблице 10 приведены показатели продукции цитокинов и гемопоэтических факторов спленоцитами, показатели клеточности крови и костного мозга и уровень гуморального иммунного ответа на эритроциты барана у мышей, получавших исследуемые вещества на фоне циклофосфан- индуцированной гемо- и иммунодепрессии.
Согласно данным, представленным в таблице N 10, применение и GSSG•Pt практически нормализует продукцию цитокинов и гемопоэтических факторов клетками селезенки, в то время как GSSG оказывает незначительное стимулирующее действие. При этом GSSG• Pt стимулирует продукцию более широкой палитры цитокинов, а также оказывает выраженное регулирующее воздействие на изменение цитокинового статуса, что подтверждается положительной корреляцией изменений взаимозависимых цитокинов при соответствующем патологическом процессе.
Таким образом, применение препарата GSSG•Pt у животных, подвергнутых химической (циклофосфамид индуцированной) гемо- и иммунодепрессии, приводит к выраженной стимуляции и регуляции эндогенной продукции цитокинов и гемопоэтических факторов; оказывает восстанавливающее действие на параметры клеточности крови и костного мозга, а также на формирование иммунного ответа на эритроциты барана.
2. В рамках настоящей работы было также проведено исследование эффективности применения препарата GSSG•Pt на модели циклофосфановой цитопении (миелопении).
Работа проводилась на белых крысах-самцах массой 160 г. Циклофосфан вводился однократно под кожу спины в дозе 50 мг/кг массы тела (растворитель - вода для инъекций).
Три группы животных (не менее 15 мышей в каждой) было сформировано в рамках проведенного исследования. Описание групп приведено ниже.
Контрольные группы:
N 1 - интактные животные, получившие
вместо инъекции ЦФ инъекцию
растворителя исследуемых веществ
(физиологического раствора);
N 2 - животные,
получившие инъекцию ЦФ, у которых в дальнейшем применялся растворитель исследуемых
веществ (физиологический
раствор) (контроль);
Опытная группа:
N 3 - животные,
получившие инъекцию
ЦФ, у которых в дальнейшем применялся GSSG•Pt в физиологическом
растворе, из расчета 5 мг GSSG на кг
массы тела.
С 2-х суток после инъекции ЦФ животным начинали внутримышечное введение контрольных или исследуемых веществ один раз в день в течение 10-15 дней.
В конце каждой серии (10 и 15 дней) экспериментальные группы подвергали эфтаназии передозировкой эфира и получали периферическую кровь (хвостовая вена) и костный мозг (бедренные кости) для анализа. Гематологические исследования проводили унифицированными стандартными методами. Результаты анализа периферической крови представлены в таблице 11, результаты анализа миелограммы - в таблице 12.
При анализе данных, приведенных в таблице 11, видно, что циклофосфан в дозе 50 мг/кг вызывает достаточно выраженную цитопению по всем форменным элементам крови с абсолютной и относительной лимфопенией, зависящей от срока наблюдения (максимально выраженную на 15-й день). При этом следует отметить, что четыре животных погибли: на 9 -, 10 -, 12 - и 14 -й дни. Практически у всех отмечалась вялость, гиподинамия, снижение массы тела.
Введение препарата GSSG• Pt оказывает выраженный стимулирующий эффект. Наблюдается улучшение общего состояния, положительная динамика массы тела, а появление в крови незрелых форм свидетельствует об активации костно-мозгового кроветворения. Гибели животных не отмечалось. Анализ показателей миелограммы показал, что циклофосфан в дозе 50 мг/кг обладает выраженным миелотоксическим действием. Особенно угнетаются эритро-, тромбоцито- и лимфопоэз. Миелосупрессия наиболее выражена на 15-й день.
Назначение препарата GSSG•Pt оказывает заметный миелостимулирующий эффект.
Таким образом, препарат GSSG•Pt в дозе 5 мг/кг при ежедневном введении курсом 10-15 дней оказывает выраженное миелостимулирующее действие при цито- и миелопении, вызванной циклофосфаном. Назначение препарата улучшает общее состояние животных, положительно влияет на динамику массы тела и снижает летальность на 30%.
Пример N 7
Влияние GSSG и
(Li•GSSG•Pt) на
продукцию цитокинов и гемопоэтических факторов, а также показатели
кроветворения и иммунитета при
радиационной гемо- и иммунодепрессии
Действие окисленного
глутатиона (GSSG) и его
структурного аналога, представляющего собой литиевую соль гексапептида со
стабилизированной дисульфидной
связью (Li•GSSG•Pt), оценивалось в
модели радиационной
гемо- и
иммунодепрессии у мышей, индуцированной однократным облучением в общей дозе 1 Гр [19, 22,
27-37].
В рамках данного исследования была проведена оценка влияния 7-дневного ежедневного применения исследуемых веществ (первое введение препаратов через два часа после облучения) на способность спленоцитов мышей, подвергнутых радиационному воздействию, продуцировать интерлейкин-1( α ,b); интерлейкин-2 (IL-2); интерлейкин-3 (IL-3); интерлейкин-4 (IL- 4); интерлейкин-6 (IL-6); интерлейкин-8 (IL-8); интерлейкин-10 (IL-10); интерлейкин-12 (IL-12); фактор некроза опухолей α,γ (TNF- α,γ ) и интерферон α,γ (IFN- α, γ ); и GM-CSF, G-CSF, M-CSF в условиях in vitro. Помимо этого, на 8-й день после облучения оценивалась клеточность крови (число лейкоцитов и лимфоцитов), селезенки и костного мозга (число кариоцитов), а также колониеобразующая способность клеток костного мозга и селезенки.
Исследование было проведено на мышах линии СВА, самцах, массой 18-20 г, которые были подвергнуты однократному рентгеновскому облучению в общей поглощенной дозе 1 Гр (расстояние от источника - 70 см, мощность 180 кV, 15 мА, фильтр - 0.5 мм Cu, длительность облучения - 2 мин 28 с).
Было сформировано четыре группы животных (не менее 12 мышей в каждой). Описание групп приведено ниже.
Контрольные группы:
N1 - интактные животные, получившие
стрессорное
воздействие в виде ложного облучения, у
которых в дальнейшем
применялся
растворитель исследуемого вещества (физиологический раствор);
N2 - контрольные животные, облученные в
дозе 1 Гр, у
которых в дальнейшем применялся
растворитель исследуемых веществ
(физиологический раствор);
Опытные группы:
N3 - животные, облученные в дозе 1 Гр, у которых в
дальнейшем
применялось исследуемое вещество GSSG в
физиологическом растворе из расчета
5
мг/кг массы тела;
N4 - животные, облученные в дозе 1 Гр, у которых в дальнейшем применялось
исследуемое
вещество Li•GSSG•Pt в
физиологическом растворе из расчета 5 мг на кг
массы тела.
Через 2 ч после облучения животным начинали внутрибрюшинное введение контрольных или исследуемых веществ, как описано выше. Введение веществ продолжали в течение 7 дней (ежедневно, один раз в день).
Через 24 ч после окончания применения контрольных или исследуемых веществ (на 8-й день после облучения) мышей эвтаназировали и в стерильных условиях готовили суспензию спленоцитов для оценки спонтанной продукции цитокинов и гемопоэтических факторов (интерлейкин-1( α ,b); интерлейкин-2 (IL-2); интерлейкин-3 (IL-3); интерлейкин-4 (IL-4); интерлейкин-6 (IL-6); интерлейкин-8 (IL-8); интерлейкин-10 (IL-10); интерлейкин-12 (IL-12); фактор некроза опухолей α, γ (TNF- α,γ ); интерферон α,γ (IFN- α,γ ); GM-CSF; G-CSF; M-CSF) лимфоцитами селезенки в условиях in vitro.
Параллельно с этим забирали образцы крови, селезенки и костного мозга для оценки их клеточности (число лейкоцитов и лимфоцитов крови, кариоцитов селезенки и костного мозга).
Одновременно определяли гемопоэтическую колониеобразующую способность клеток костного мозга и селезенки методом прямого подсчета колониеобразующих единиц (КОЕ) в селезенке сингенных облученных мышей СВА, которым внутривенно вводили порции исследуемых суспензий клеток костного мозга и селезенки от животных исследуемых групп.
В таблицах N 13 приведены показатели продукции цитокинов и гемопоэтических факторов спленоцитами, показатели клеточности крови, селезенки и костного мозга, а также показатели колониеобразования (колониеобразующие единицы, КОЕ) костного мозга и селезенки облученных животных на 8-й день после радиационного воздействия.
Как следует из материалов таблицы, применение Li•GSSG•Pt статистически достоверно восстанавливает продукцию цитокинов и гемопоэтических факторов клетками селезенки, тогда как GSSG оказывает менее выраженный эффект.
При этом Li•GSSG•Pt оказывает влияние на эндогенный синтез более широкого спектра цитокинов и гемопоэтических факторов, а также регулирует изменения цитокинового статуса с учетом данного патологического процесса.
Таким образом, применение препарата Li•GSSG•Pt как заявляемого способа у животных, подвергнутых радиационной гемо- и иммунодепрессии, приводит к выраженной стимуляции-регуляции эндогенной продукции цитокинов и гемопоэтических факторов; эффективному восстановлению клеточности крови, лимфоидных и кроветворных органов, а также колониеобразующей активности костного мозга и селезенки.
Пример N 8
Влияние композита GSSG•Pt и его солей на процессы
фосфатной
модификации и содержание
лимфоцитов, несущих рецептор
IL-2
Исследовали
молекулярные механизмы воспроизведения иммуно-биохимических эффектов цитокинов посредством композита
GSSG•Pt и
его солей.
Действие композита GSSG•Pt и его солей: натриевой (Na), литиевой (Li) и магниевой (Mg) оценивали в модели гемо- и иммунодепрессии у мышей, индуцированной однократным введением цитостатика циклофосфамида (ЦФ).
В контексте данного исследования была проведена оценка влияния 5-дневного применения вышеуказанных веществ на уровень фосфорилирования цитозольных белков лимфоцитов по тирозину и содержание "активных" лимфоцитов, несущих рецептор IL-2.
Исследование проведено на мышах линии СВА, самцах, массой 18-20 г, которым однократно вводился ЦФ (50 мг/кг, внутрибрюшинно). Через 24 ч после инъекции ЦФ животным начинали внутрибрюшинное введение исследуемых веществ в дозе 5 мг/кг. Введение веществ продолжали в течение 5 дней (ежедневно, 1 раз в день). Через 24 ч после окончания применения исследуемых веществ мышей эвтаназировали и забирали образцы крови для проведения исследований.
Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метризоат (Histopaque, Sigma). Концентрацию клеток доводили до 2•105 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМ глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим, и клеточную суспензию разносили в лунки 96-луночных планшетов из расчета 20 000 клеток на лунку.
Определение содержания лимфоцитов, несущих рецептор IL-2, проводили в соответствии с Horgan A.F. (1994) на мазках мононуклеарной взвеси. В качестве первых антител использовали моноклональные антитела к цепям р55 и р75 рецептора IL-2. Для визуализации первых антител использовали поликлональные кроличьи антитела против иммуноглобулинов мыши, меченные ФИТЦ. Подсчет количества лимфоцитов, содержащих рецептор IL-2, проводили в процентном соотношении к общему числу лимфоцитов.
Для метаболического мечения лимфоциты культивировали в среде Игла с добавлением 10% сыворотки крупного рогатого скота. Метаболическое мечение лимфоцитов [32P]ортофосфорной кислотой проводили с помощью инкубации клеток в течение 10-12 ч в бесфосфорной среде ДМЕ, содержащей 100 мк Ci/мл [32P] орто-фосфата. На одну пробу добавляли по 0,2 мл среды с изотопом. После инкубации клетки разрушали пипетированием и центрифугировали при 6000 g в течение 30 мин. Полученный супернатант использовали для иммунопреципитации поликлональными антителами к фосфотирозину по методу Fu (1992). Для осаждения иммунных комплексов использовали протеин A-сефарозу. После преципитации осадок трижды отмывали и активность осадка просчитывали на счетчике "Гамма".
Согласно результатам выполненных исследований (таблица N 14) установлено, что действие композита GSSG•Pt на изолированные лимфоциты приводит к тому (см. таблицу 14), что уже через 10 мин наблюдается достоверное увеличение уровня фосфорилирования по тирозину цитозольных белков лимфоцитов, что является интегральным показателем активности сигнал-передающих систем клеток. Данные изменения под действием композита GSSG•Pt, в большей степени под действием производных GSSG•Pt обусловливают модуляцию редокс-чувствительной экспрессии генов, в первую очередь иммунологически важных генов, ответственных за синтез цитокинов и гемопоэтических факторов.
В таблице N 15 приведены данные об уровне фосфорилирования по тирозину цитозольных белков лимфоцитов и процентное содержание лимфоцитов, несущих рецептор IL-2 у мышей линии СВА, получавших исследуемые вещества на фоне циклофосфамид-индуцированной гемо- и иммунодепрессии.
Применение солей GSSG•Pt приводит к увеличению процентного содержания лимфоцитов, несущих рецептор IL-2, практически нормализую их количество (в норме - 18,3±1,6%). Схожая закономерность была выявлена при исследовании уровня фосфорилирования по тирозину цитозольных белков лимфоцитов. Применение различных солей GSSG•Pt способствует восстановлению процентного содержания лимфоцитов, несущих рецептор IL-2, в условиях иммунодефицита, моделированного циклофосфамидом. При этом происходит увеличение уровня фосфорилирования по тирозину цитозольных белков сигнал-передающих систем, что может выступать одним из факторов описанного иммуностимулирующего действия исследуемых веществ.
Таким образом, авторами установлено ранее неизвестное свойство композита GSSG•Pt и его солей воспроизводить (имитировать) регуляторные эффекты ряда цитокинов, в первую очередь IL-2. Под воспроизведением IL-2 мы имеем ввиду индукцию GSSG•Pt внутриклеточных механизмов, реализующих регуляторные сигналы цитокина на систему иммунокомпетентных и гемопоэтических клеток. Приведенные исследования показали, что изменение уровня фосфорилирования по тирозину белков сигнал-передающих систем клеток органов иммуногенеза и гемопоэза в условиях иммунодефицита, моделированного циклофосфамидом, приводит к эффекту динамичной нормализации содержания активных лимфоцитов.
Следовательно, использование композита GSSG•Pt или его производных в форме лекарственных средств в терапевтических целях не только стимулирует эндогенную продукцию цитокинов и гемопоэтических факторов, но также, особенно в случае десенситизации рецепторов, наблюдаемой, как правило, при онко- и ретровирусной патологии обеспечивает воспроизведение иммуно-биохимических эффектов цитокинов.
Пример N 9
Стимуляции эндогенной продукции цитокинов и лечебный эффект препарата GSSG•Pt у больного раком желудка,
осложненным канцероматозом брюшины,
асцитом, спленомегалией и
холестатическим гепатитом.
Мужчина 33 лет наблюдается более двух лет по поводу неоплазмы желудка (аденокарцинома умеренной степени дифференцировки). В 1993 году больной оперирован по поводу малигнизированной язвы желудка и был обнаружен конгломерат плотных узлов в воротах печени, расцененный как метастазы.
В январе 1994 года проводимая химиотерапия (5-FU) осложнилась тяжелым холестазом, по поводу которого произведено чрезкожное дренирование правого и левого печеночных протоков, а еще через 6 месяцев - холедохоеюностомия на сменных транспеченочных дренажах с брауновским анастомозом.
В ноябре 1995 года состояние ухудшилось. По данным обследования у больного - активный вторичный гепатит. Печень увеличена и болезненна, на 5-6 см выступает из-под края реберной дуги. Биохимические показатели крови патологически изменены, слабо поддаются коррекции проводимым лечением: гипербилирубинемия до 40,0 за счет непрямого билирубина (до 31,0); повышение активности трансаминаз в 5 раз; гипоальбуминемия - 26%; имеет место гипергаммаглобулинемия; гиперхолестеринемия - до 10,2 мкмоль/л.
При фиброгастродуоденоскопии (ноябрь 1995 г.) в средней трети тела желудка была обнаружена опухоль протяженностью 8 см. Опухоль плотная. Стенки желудка ригидные. Гистологически опухоль идентифицирована как аденокарцинома умеренной степени дифференцировки. В декабре 1995 года больному произведена эксплоративная лапаратомия. Обнаружен асцит с множественными высыпаниями по всей брюшине, спленомегалия. Случай признан неоперабельным.
Было принято решение использовать лекарственную форму GSSG. Препарат вводился парентерально (внутривенно и внутримышечно) и дополнительно использовалось локальное введение лекарственной формы посредством обкалывания опухоли через эндоскоп в трех точках. Средняя доза для внутривенного и внутримышечного введения 0,1 - 0.5 мг/кг; при локальном введении до 50 мг местно. Парентеральное введение препарата 2 раза в сутки (утром внутривенно; вечером - внутримышечные инъекции), через день, в течение трех недель; затем два раза в неделю в течение 4 недель. Обкалывание через эндоскоп один раз в семь дней. Через 2 месяца после начала лечения используемой лекарственной формой картина фиброгастродуоденоскопии: пищевод проходим, слизистая розовая, розетка кардии смыкается не полностью. Натощак в желудке умеренное количество пенистого секрета, интенсивно окрашенного желчью, протяженность опухоли 4,8 см. Одновременно наблюдается уменьшение размеров печени до 3 см, а также существенное улучшение гематологических, биохимических показателей.
Через 6 месяцев после окончания лечения (июль 1996 года) состояние заметно ухудшилось. По данным обследования повторное развитие вторичного гепатита. Печень увеличена и болезненна, на 4 см выступает из-под края реберной дуги. Биохимические показатели крови патологически изменены, слабо поддаются коррекции проводимым лечением: гипербилирубинемия до 36,0 за счет непрямого билирубина (до 28,0); повышение активности трансаминаз в 4 раза; гипоальбуминемия - 21%; имеет место гипергаммаглобулинемия; гиперхолестеринемия - до 9,42 мкмоль/л.
При фиброгастродуоденоскопии (июль 1996 г.) в средней трети тела желудка была обнаружена опухоль протяженностью 6 см. Опухоль плотная. Стенки желудка ригидные. Гистологически - аденокарцинома умеренной степени дифференцировки. В августе 1996 года больному произведена эксплоративная лапаратомия. Повторно обнаружен асцит с множественными высыпаниями по всей брюшине, спленомегалия.
С учетом ранее проводимой терапии было принято решение использовать новый препарат GSSG•Pt, являющийся структурным аналогом ранее применяемого препарата GSSG. Препарат вводился по аналогичной схеме: парентерально (внутривенно и внутримышечно) и дополнительно, использовалось локальное введение лекарственной формы посредством обкалывания опухоли через эндоскоп в трех точках. Средняя доза для внутривенного и внутримышечного введения 0,1 - 0.5 мг/кг; при локальном введении до 50 мг местно. Парентеральное введение препарата 2 раза в сутки (утром - внутривенно; вечером - внутримышечные инъекции), через день, в течение трех недель; затем два раза в неделю в течение 4 недель. Обкалывание через эндоскоп один раз в семь дней.
Через 2 месяца после начала лечения данным препаратом печень выступает из-под реберной дуги на 1 см; безболезненная при пальпации. По данным УЗИ - на месте определяемых ранее очаговых опухолевых изменений фиброзная ткань. Картина фиброгастродуоденоскопии: пищевод проходим, розетка кардии не смыкается; в просвете желудка светлая мутная жидкость со слюной. Слизистая желудка розовая. Опухоль протяженностью 1,5 см. Стенки желудка эластичные. Двенадцатиперстная кишка свободно проходима. Одновременно наблюдается существенное улучшение гематологических, биохимических показателей.
При сравнительном анализе терапевтической эффективности препаратов GSSG•Pt и GSSG выявлено преимущество применения препарата GSSG•Pt, что нашло отражение в яркой положительной динамике клинических, биохимических, гематологических и иммунологических показателей, данных ФГДС (уменьшение размеров опухоли на 75% при использовании препарата GSSG•Pt, в то время как при использовании препарата GSSG опухоль уменьшилась только на 40%) (Таблица N 16, 17). Кроме того, из таблицы N 17 видно, что препарат GSSG•Pt стимулирует выработку более широкой палитры цитокинов и гемопоэтических факторов, оказывая регулирующее воздействие на характер изменения их содержания.
Таким образом, в результате проведенного лечения с использованием препарата GSSG•Pt наблюдается выраженный регресс опухолевого процесса, с очевидными одновременными изменениями гематологических, биохимических и иммунологических параметров и существенным повышением качества жизни.
Пример N 10
Терапевтическая эффективность
препарата GSSG•Pt при раке легкого
Больной N
1: Резников Евгений
Фридрихович
Год рождения: 1938 г.р.
Диагноз: Рак верхней доли правого легкого.
Гистологический диагноз: ГНЦП N45760 - мелкоклеточный
рак
История
болезни: N 4024.
Жалобы при поступлении: на кашель с трудно отделяемой мокротой слизистого характера, одышку при небольшой физической нагрузке.
Объективно: Состояние удовлетворительное. Периферические лимфоузлы не увеличены. Дыхание жесткое, ослабленное в верхних и средних отделах правого легкого. Единичные сухие хрипы, одышка при малейшей физической нагрузке.
Рентгенограмма (исходные данные): Расширена тень верхнего отдела средостения за счет вероятнее всего увеличенных лимфоузлов паратрахеально справа. Расширена нечеткая тень верхнего полюса правого корня. На фоне выраженных интерстициальных изменений в обоих легких имеется дополнительная тень в периферическом отделе S3 правого легкого.Утолщены междолевые границы справа. Заключение: признаки метастазов в лимфоузлы корня, средостения, с явлениями лимфангоита.
Курс лечения: проведено 3 курса иммунохимиотерапии с использованием препарата GSSG•Pt.
После проведенной терапии: Состояние больного значительно улучшилось: сохраняется небольшая слабость, одышка исчезла.
Объективно: Состояние удовлетворительное. Периферические лимфоузлы не увеличены. В средних отделах правого легкого сохраняется ослабленное дыхание. В остальных отделах дыхание везикулярное. Хрипов нет.
Рентгенограмма (после проведенной терапии): Повышена прозрачность легочных полей. Небольшие инфильтративные затенения в S3 правого легкого. Корни не расширены. Дополнительных образований в проекции правого корня не выявлено. Тень верхнего отдела средостения не расширена. Выявляются единичные увеличенные паратрахеальные лимфоузлы.
Больной
N 2: Семенов Петр
Александрович
Год рождения: 1945 г.р.
Диагноз: Рак правого легкого,
метастазы в печень
Гистологический диагноз: N 45999, мелкоклеточный рак
История болезни:
N 4023
Жалобы при поступлении: на кашель с трудно отделяемой мокротой слизистого
характера, одышку при небольшой физической нагрузке, слабость, на боли в поясничной
области постоянного
характера,
иррадиирующие в живот. Похудел за последний месяц на 6 кг.
Объективно: Состояние средней тяжести. Желтушность склер. Дыхание жесткое, ослабленное в верхних и средних отделах правого легкого. В правой надключичной области пальпируются увеличенные лимфоузлы плотной консистенции, слабо подвижные, размерами 3,0 см и 1,0 см, безболезненные. При аускультации дыхание жесткое, ослаблено в средних отделах справа. Единичные сухие хрипы, одышка при малейшей физической нагрузке. Печень на 3,5 см ниже реберной дуги.
При обследовании выявлен рак среднедолевого бронха справа, гиповентиляция средней доли, пневмонит. При УЗИ - признаки метастатического поражения печени.
Рентгенограмма (исходные данные): Средняя доля правого легкого уменьшена в объеме (в состоянии гиповентиляции). На фоне усиленного легочного рисунка определяется интенсивная, почти однородная инфильтрация с четкой границей по ходу горизонтальной междолевой плевры. Правый корень не дифференцируется. Состояние верхней, нижней доли правого легкого и левое легкое без особенностей. Органы средостения заметно не смещены.
Курс лечения: проведено 3 курса иммунохимиотерапии с использованием препарата GSSG•Pt.
После проведенной терапии: Состояние больного значительно улучшилось: исчезла слабость, одышка, появился аппетит, прибавил в весе на 5 кг. Нормализовались показатели крови.
По данным УЗИ и компьютерной томографии печени - полная регрессия опухолевого процесса.
Рентгенография (после лечения)
На рентгенограмме грудной клетки определяется
незначительный ателектаз части средней доли. Корни структурны,
не расширены; правый корень чуть подтянут вниз.
Сердце в размерах не увеличено.
По сравнению с исходными данными отмечается значительно выраженная положительная динамика, более прозрачная стала легочная ткань справа (уменьшились проявления гиповентиляции), отсутствуют инфильтративные затенения.
Заключение:
При оценке терапевтической
эффективности препарата GSSG•Pt было установлено следующее
(см. Таблицы 18, 19):
1. Нормализация клинических показателей (улучшение
общего состояния, исчезновение
патологических симптомов, прибавка массы тела);
2. Изменение
рентгенологической картины (увеличение прозрачности легочной ткани, исчезновение инфильтративных
затенений, уменьшение
ателектаза, гиповентиляции);
3. Нормализация гематологических
показателей (повышение содержания эритроцитов, гемоглобина, восстановление лейкоцитарной формулы.
4. Изменение данных УЗИ и компьютерной томографии (полная регрессия опухолевого процесса).
5. Нормализация иммунологических показателей и повышении содержания CD16+, CD25+ клеток, что свидетельствует о восстановлении системы противоопухолевого надзора.
6. Индукция эндогенного синтеза более широкой палитры цитокинов, а также в модулирующем действии на взаиморегуляцию их содержания (корреляция изменения уровней содержания IL-1 β , IL-4, TNF- α).
Таким образом, в приведенных клинических примерах показано, что применение препарата GSSG•Pt обеспечивает более быструю нормализацию клинических, рентгенологических, гематологических и иммунологических параметров, обеспечивая более эффективную реставрацию системы иммунитета и гемопоэза. Сказанное является показателем регресса опухолевого процесса, что в конечном итоге ведет к существенному повышению качества жизни пациента.
Пример N 11
Терапевтическая эффективность препарата
GSSG•
Pt при хроническом вирусном гепатите В (ХВГВ)
Больной N1: Купченко Владимир Михайлович.
Год рождения: 1945 г.р.
Диагноз: ХВГВ, фаза репликации (PCR HBV+), умеренно выраженная степень активности.
История болезни: N 1068.
Жалобы при поступлении: на слабость, ощущение тяжести в правом подреберье, тошноту, отсутствие аппетита.
Анамнез заболевания: Последние шесть лет периодически отмечал появление ноющих болей в правом подреберье, слабость, периодическое изменение цвета мочи. При обследовании было обнаружено: гипербилирубинемия до 34 мкмоль/л, повышение АЛТ до 5,4 ммоль/ч.л. При стационарном обследовании были определены серологические маркеры ХВГВ и PCR HBV(+).
Объективно: Состояние удовлетворительное. Печень выступает из-под реберной дуги на 2 см. Край печени плотный, болезненный.
Предшествующая терапия: не проводилась.
Курс лечения: Проведен курс иммуномодулирующей терапии с использованием препарата GSSG•Pt по схеме.
Состояние после проведенного курса лечения: Отмечается положительная динамика, которая выражается в значительном улучшении состояния больного, исчезновении слабости, тошноты, уменьшении ощущения тяжести в правом подреберье. Печень выступает на 0,5 см из-под реберной дуги. Край печени мягкий, безболезненный.
Больной N2: Лукашенко Игорь Матвеевич.
Год рождения: 1964 г.р.
Диагноз: ХВГВ, фаза репликации (PCR HBV+), умеренно выраженная степень активности.
История болезни: N 1043.
Жалобы при поступлении: на выраженную слабость, отсутствие аппетита, потливость, потемнение мочи.
Анамнез заболевания: Считает себя больным с января 1996 года, когда впервые появились ноющие боли в правом подреберье, повышение температуры до 38, 7oC, рвота, потемнение мочи. Был поставлен диагноз острого вирусного гепатита B, подтвержденный серологически. Получал дезинтоксикационную и антибактериальную терапию. Однако все последующее время наблюдались повышенные показатели АЛТ и Hbs Ag, сохранялась репликативная активность вируса. При настоящем обследовании выявлены: гипербилирубинемия до 78 мкмоль/л, повышение АЛТ до 6,2 ммоль/ч.л. При стационарном обследовании были определены серологические маркеры ХВГВ и PCR HBV(+).
Объективно: Состояние удовлетворительное. Желтушность кожных покровов, иктеричность склер. Печень выступает из-под реберной дуги на 2,5 см. Край плотный, болезненный.
Предшествующая терапия: С 17.09.97 получал курс ацикловира 21 день. После окончания курса АЛТ оставалась повышенной - 2,1 мкмоль/ч•л, билирубин - 32 мкмоль/л. Уровень Hbs Ag не изменялся. Состояние пациента определялось выраженным астеновегетативным синдромом.
Курс лечения: проведен курс иммуномодулирующей терапии с использованием препарата GSSG•Pt по схеме.
Состояние после проведенного курса лечения: Отмечается яркая положительная динамика, которая выражается в улучшении общего состояния больного, исчезновении слабости, тошноты, потливости. Отсутствуют желтушность кожных покровов, иктеричность склер. Моча приобрела нормальный цвет. Печень выступает на 0,5 см из-под реберной дуги. Край печени стал более мягким, безболезненным.
Заключение:
При сравнительном анализе
терапевтической эффективности препарата GSSG•Pt было
установлено следующее (см. таблицы 20,
21):
1. Нормализация биохимических
показателей (снижение АЛТ, билирубина);
2.
Выраженное снижение HBs Ag и прекращение репликации;
3. Нормализация иммунологических
показателей и повышение содержания CD95+
клеток, что свидетельствует об активации процессов
апоптоза в вирусинфицированных клетках;
4.
Существенная регуляция широкого спектра
цитокинов.
Пример N 12
Терапевтическая эффективность препаратов GSSG•Pt
при остром вирусном гепатите B
Фамилия,
имя, отчество пациента: Минина Оксана
Александровна
Пол: женский
Возраст:
20
лет
Амбулаторная карта: 678
Диагноз: Острый вирусный гепатит В, фаза репликации
(PCR HBV+), затяжное течение; хронический
вирусный гепатит D, фаза репликации (PCR HDV+)
Жалобы при осмотре: Слабость, понижение
аппетита
Анамнез заболевания: Заболела в августе
1997 года, когда почувствовала резкую слабость,
недомогание, боли в позвоночнике, повышение
температуры до 38,8oC. Через 10 дней
потемнела моча, появилась желтушность склер. Поступила
для лечения в клинику вирусных инфекций, где был
проведен курс дезинтоксикационной,
спазмолитической, антибактериальной терапии. Однако
сохранялись репликативная активность вируса и повышенная
АЛТ. Длительный цитолитический синдром явился основанием
для назначения препарата
GSSG•Pt.
Предшествующее лечение:
Не проводилось
Курс терапии препаратами
группы GSSG•Pt: с 30.10.97 по 23.11.97
Состояние
пациента после окончания
курса лечения: Состояние удовлетворительное. Отмечает
уменьшение слабости, повышение аппетита.
Заключение (см. Таблицы 22-24): Проведение курса терапии препаратами группы GSSG• Pt обеспечило положительную динамику, которая выражается в нормализации биохимических показателей; прекращении репликации HCV и HDV; прекращении персистенции Hbs Ag; индукции процесса апоптоза вирус-инфицированных клеток; улучшении общего состояния; стабильном терапевтическом эффекте.
Пример N 13
Терапевтическая эффективность препаратом
GSSG•Pt
при
хроническом вирусном гепатите C
Фамилия,
имя, отчество: 3. Виталий
Валерьевич
Пол: мужской
Возраст: 18 лет
История болезни: N 1043
Диагноз:
Хронический
вирусный гепатит C, фаза репликации (PCR HCV+),
умеренно выраженная степень
активности; хронический вирусный гепатит B, фаза интеграции (PCR HBV-), наркотическое опьянение,
наркомания.
Жалобы при осмотре: Слабость, сильные боли в правом подреберье, коленных суставах, позвоночнике, суставах кисти.
Анамнез заболевания: Заметил боли в суставах коленей, позвоночнике в начале августа 1997 года. При обследовании крови было обнаружено повышение уровня билирубина до 34,0 мкмоль/л и АЛТ - 2,1 ммоль/ч.л. При стационарном обследовании с 15.08.97 были определены анти HCV IgG и репликативная активность вируса гепатита C.
Анамнез жизни:наркотики начал применять с 14 лет. Внутривенное их введение проводил с 17 лет. На момент осмотра применяет 2 г героина в день и находится в состоянии наркотической абстиненции.
Предшествующее лечение: Не проводилось
Курс препаратами GSSG•Pt: с
15.08.97 по
07.09.97
Состояние пациента после окончания
курса
лечения: Состояние удовлетворительное. Отмечает значительное уменьшение слабости, отсутствие боли в правом подреберье, в
суставах. Со слов
пациента, выход из состояния наркотической
абстиненции,
прошел практически безболезненно и менее длительно. Отмечается нормализация биохимических показателей и отсутствие
репликативной активности
вируса.
Заключение (см Таблицы 25-27): Проведение курса терапии препаратом GSSG•Pt обеспечило положительную динамику, которая выражается в нормализации биохимических, серологических показателей, прекращении репликации HCV. Иммунологические показатели и данные цитокинового статуса коррелируют с купированием инфекционного процесса и отсутствием репликации вируса. При исследовании лимфоцитов периферической крови пациента методом проточной цитометрии с использованием моноклональных антител к FasAg (CD95+) после лечения показано увеличение CD95+-клеток, что свидетельствует об активации процесса программируемой клеточной гибели в вирус-инфицированных клетках. При наблюдении в динамике через месяц и три месяца после окончания отмечается стабилизация данного состояния.
Сопутствующее наркотическое опьянение и состояние абстиненции при применении препарата GSSG•Pt купировалось в более ранние сроки и проходило с меньшими для пациента страданиями.
Таким образом, курс лечения препаратом GSSG•Pt хронического гепатита C с репликативной активностью и сопутствующим
наркотическим опьянением
позволил
достигнуть следующих
результатов:
Нормализация биохимических показателей крови
Нормализация гематологических показателей
Отсутствие
репликативной активности вируса
C
Нормализация
иммунологических показателей крови и цитокинового статуса
Индукция процесса апоптоза в лимфоцитах периферической крови
Быстрое купирование состояния
наркотической
абстиненции
Стабильный терапевтический эффект
Пример N 14
Сравнительный анализ действия препаратов GSSG и GSSG•Pt на
динамику роста и
апоптотической
деградации ДНК
нормальных и
трансформированных клеток
Выполнили сравнительный анализ действия препаратов GSSG и GSSG•Pt на динамику роста и
апоптотической
деградации ДНК нормальных и
трансформированных клеток
(HL-60). Для этого осуществляли инкубацию GSSG и GSSG-Pt с клетками миелоидной линии HL-60, дефектных по гену p53 - ключевому
участнику
развития апоптоза, и нормальными
лимфоцитами, полученными из
крови здоровых доноров.
Венозную кровь от здоровых доноров собрали в гепаринизированные пробирки, тестированные на отсутствие эндотоксина. Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метриозат (Histopaque, Sigma). Концентрацию клеток доводили до 2• 106 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМоль/мл глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим и клеточную суспензию разносили в лунки 24-, 96-луночных планшетов из расчета 250 000 клеток на лунку.
Клетки перевиваемой миелоидной линии HL-60 выращивались в среде RPMI 1640 с добавкой 10% эмбриональной телячьей сыворотки. Культивирование клеточной суспензии проводили в закрытых флаконах, объем среды 12 мл, смену среды проводили каждые 4 дня. Непосредственно перед тестированием препаратов суспензию клеток в свежей среде переносили в планшеты с 24 лунками (концентрация клеток в каждой лунке 250 000 кл/мл) и добавляли испытуемые препараты GSSG и GSSG•Pt до конечной концентрации 100 мкг/мл в соответствующие лунки.
Тестирование эффектов действия исследуемых препаратов проводилось через сутки, двое после их внесения в культуру.
Процедура анализа заключалась в следующем: после инкубации сутки, двое, подсчитывали общее количество клеток, количество
погибших клеток по тесту с трипановым синим, затем клеточную
суспензию
центрифугировали при 3,000 g в эппендорфовских пробирках в течение 10 мин. Осадок клеток замораживали и хранили при -70oC до выделения ДНК. Выделение ДНК осуществляли фенольным
методом
по Кирби-Георгиеву. К клеточному осадку добавляли 0.5 мл 10% SDS и 0.5 мл ТЕ-буфера, содержащего 0.1 М ЭДТА и 0.01 М
Трис-HCl
pH 8.0 (буфер А), и ресуспендировали осадок покачивая пробирку в
течение 15 мин. После этого добавляли равный объем фенола, уравновешенного 0.01 М Трис-HCl буфером с pH 8.0, перемешивали
в течение 2
мин и центрифугировали в эппендорфовских пробирках при 12,000 g
15
мин. По окончании центрифугирования верхнюю водную фазу повторно подвергали
обработке фенолом. По окончании
фенольной
обработки проводили 2-кратную обработку верхней водной фазы смесью
фенол-хлороформ (1:1), которую смешивали с водной фазой в равном объеме. Водную фазу отделяли центрифугированием при 12,
000 g 10
мин, отсасывали и смешивали однократно с равным объемом хлороформа,
после чего центрифугировали при 12,000 g и отделяли верхнюю фазу, ее смешивали с двумя объемами охлажденного до -20oC
перегнанного этанола и оставляли на ночь при -20oC.
Рыхлый
осадок уплотняли центрифугированием при 12,000 g в течение 10 мин, сливали супернатант и промывали осадок 200 мкл 70%
этанола,
охлажденного до -20oC 5 мин, повторно
центрифугировали в тех
же условиях, после чего подсушивали осадок на воздухе 1 ч. Далее его растворяли в 10 мкл буфера А, определяли
количество ДНК
по Дише и подвергали ее электрофорезу в 2%
агарозном геле (использовали
агарозу марки NA фирмы. "Pharmacia LKB, Biotechnology Inc" (Австрия)). Электрофоретическое разделение ДНК
осуществляли в блоке
2% агарозного геля в аппарате фирмы
"Pharmacia LKB, Biotechnology Inc"
(Австрия). В качестве буферного раствора использовали 0.04 М трис-HCl буфер, pH 7.7, содержащий 0.02 М
ацетата натрия и 0.002 М
ЭДТА. Агарозу (2%) готовили на
электродном буфере. Депротеинизированную
ДНК (2-5 мкг) наносили в лунки геля. Электрофорез проводили при напряженности электрического поля 6
В/см в течение 3 ч. За
движением образца следили по
перемещению бромфенолового синего. По окончании
электрофореза гелевый блок извлекали из камеры и помещали в ванночку с раствором этидия бромида
(3 мкг/мл H2O)
на 30 мин в темноте. По
окончании инкубации гель промывали водой и
просматривали в проходящем ультрафиолетовом излучении при длине волны 254 нм на трансиллюминаторе фирмы
"Pharmacia LKB,
Biotechnology Inc" (Австрия).
Фотографировали гель фотоаппаратом "Зенит E" с
красным светофильтром.
Результаты исследования представлены в таблицах 28, 29, и рисунках 13, 14. Как можно видеть из данных таблиц 28 и 29, действие GSSG и GSSG•Pt на нормальные и трансформированные клетки носит альтернативный характер. GSSG и GSSG•Pt стимулировали некоторую пролиферацию нормальных клеток (табл. 28). Электрофорез ДНК, выделенной из нормальных клеток (фиг. 28), показал наличие лишь следовых количеств апоптозных фрагментов на фоне гомогенной высокомолекулярной фракции, характерной для жизнеспособных клеток.
Напротив, в культуре опухолевых клеток миелоидного происхождения (HL-60) наблюдали активацию апоптоза и задержку клеточного деления под влиянием обоих препаратов (табл. 29, фиг. 14). Различия в действии препаратов носили количественный характер.
Так, количество погибших клеток HL-60 при действии препарата GSSG было достоверно ниже количества погибших клеток при действии препарата GSSG•Pt (табл. 29). Очевидным свидетельством более высокой эффективности действия на клетки HL-60 GSSG•Pt по сравнению с GSSG является характер апоптозных фрагментов, выявляемых в результате электрофоретического анализа.
Электрофорез ДНК клеток HL-60, не инкубированных с препаратами, показал наличие высокомолекулярной, практически гомогенной ДНК, характерной для жизнеспособных клеток (фиг. 14, дорожка N2). Электрофорез ДНК клеток, инкубированных в течение 24 и 48 ч с препаратами GSSG и GSSG•Pt, выявил олигонуклеосомную деградацию ДНК (фиг. 14, дорожки 1 и 3 соответственно) - апоптозную лесенку - бесспорный признак программируемой клеточной гибели. Однако апоптозная лесенка из клеток HL-60, на которые воздействовали препаратом GSSG, содержит значительное количество высокомолекулярной ДНК, характерной для жизнеспособных клеток HL-60 (фиг. 14, дорожка N 1), в то время как высокомолекулярная ДНК в группе клеток, на которые воздействовали GSSG•Pt, практически отсутствует (фиг. 14, дорожка N 3).
Клетки HL-60 имеют дефект гена p53 (делеция гена p53) и индукция апоптоза в них при воздействии GSSG и GSSG•Pt может происходить лишь без участия продукта гена p53. В этой связи можно говорить, что препараты GSSG и GSSG•Pt активируют внутренний контур программируемой гибели клеток не зависимо от продукта гена p53. Дефект гена p53 встречается примерно в половине случаев онкологических заболеваний, что в преломлении к результатам проведенных экспериментов может означать эффективность препарата GSSG и особенно препарата GSSG•Pt в химиотерапии этих опухолей.
Заключение. Проведенные
эксперименты позволили получить данные, свидетельствующие о
способности препаратов GSSG и GSSG•
Pt усиливать резистентность нормальных клеток (лимфоцитов). и напротив,
индуцировать апоптоз в
трансформированных клетках, то есть оказывать
противоопухолевое
действие. Причем активность препарата
GSSG•Pt в отношении индукции апоптоза трансформированных клеток
значительно превосходила
таковую для препарата GSSG, по объективному
критерию
жизнеспособности - наличию
высокомолекулярной ДНК, которая имелась в значительном количестве при действии GSSG и
практически полностью
отсутствовала в случае воздействия GSSG•Pt.
Таким образом,
данные, полученные
на клетках миелоидной линии HL-60, дефектных по гену p53 - ключевому участнику развития
апоптоза, позволяют
утверждать, что:
препараты GSSG и GSSG•Pt
индуцируют
внутренний
контур развития апоптоза не зависимо от продукта гена p53;
препарат третьего поколения
GSSG•Pt
обладает более высокой химиотерапевтической активностью, чем
препарат первого
поколения GSSG.
Пример N 15
Анализ действия препарата GSSG•Pt на
динамику роста и
апоптотическую деградацию ДНК нормальных и трансформированных
клеток,
дефектных по
антионкогену p53 и с повышенной экспрессией ras-гена
Выполнили сравнительный анализ
действия препарата
GSSG•Pt на динамику роста и апоптотической деградации ДНК
трансформированных
клеток различных линий (HL-60, C-8, A-4) в зависимости от дефекта гена p53 - ключевого
участника развития
апоптоза и ras-гена - мультипотентного фактора клеточной реакции.
Культура
клеток HL-60
представляет из себя клетки человека миелолейкозного происхождения, дефектные по гену p53.
C-8, A-4
- являются трансформированными фибробластами мыши, несущими плазмиду с
геном ras и
геном фактора
усиления экспрессии E1a- фрагментом антигена аденовирусов [38, 39]. При этом клетки A-4
дефектны по
гену p53, а C-8 содержат интактный ген p53. В качестве контроля клеток
человека с
интактным геном
p53 использовали взвесь лейкоцитов донорской крови.
Клетки перевиваемой миелоидной линии HL-60(p53 - -) выращивались в среде RPMI 1640 с добавкой 10% эмбриональной телячьей сыворотки. Культивирование клеточной суспензии проводили в закрытых флаконах, объем среды 12 мл, смену среды проводили каждые 4 дня. Непосредственно перед тестированием препаратов суспензию клеток в свежей среде переносили в планшеты с 24 лунками (концентрация клеток в каждой лунке 250 000 кл/мл) и добавляли испытуемые препараты GSSG•Pt до конечной концентрации 10 - 100 мкг/мл в соответствующие лунки.
Венозную кровь от здоровых доноров собрали в гепаринизированные пробирки, тестированные на отсутствие эндотоксина. Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метриозат (Histopaque, Sigma). Концентрацию клеток доводили до 2•106 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМоль/мл глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим и клеточную суспензию разносили в лунки 24-, 96-луночных планшетов из расчета 250 000 клеток на лунку.
Трансформированные фибробласты мышей выращивались в среде DMEM с добавкой 10% эмбриональной телячьей сыворотки. Культивирование клеточного монослоя проводили в закрытых флаконах, объем среды 12 мл, смену среды проводили каждые 4 дня. Непосредственно перед тестированием препаратов суспензию клеток в свежей среде переносили в планшеты с 24 лунками (концентрация клеток в каждой лунке 250 000 кл/мл) и добавляли испытуемый препарат GSSG•Pt до конечной концентрации 10 - 100 мкг/мл в соответствующие лунки.
Тестирование эффектов действия исследуемых препаратов проводилось через сутки, двое после их внесения в культуру.
Процедура анализа заключалась в следующем: после инкубации сутки, двое, подсчитывали общее количество клеток, количество погибших клеток по тесту с трипановым синим, затем клеточную суспензию центрифугировали при 3,000 g в эппендорфовских пробирках в течение 10 мин. Осадок клеток замораживали и хранили при -70oC до выделения ДНК. Выделение ДНК осуществляли фенольным методом по Кирби-Георгиеву. К клеточному осадку добавляли 0.5 мл 10% SDS и 0.5 мл ТЕ-буфера, содержащего 0.1 М ЭДТА и 0.01 М Трис-HCl pH 8.0 (буфер А) и ресуспендировали осадок. покачивая пробирку в течение 15 мин. После этого добавляли равный объем фенола, уравновешенного 0.01 М Трис-HCl буфером с pH 8.0, перемешивали в течение 2 мин и центрифугировали в эппендорфовских пробирках при 12,000 g 15 мин. По окончании центрифугирования верхнюю водную фазу повторно подвергали обработке фенолом. По окончании фенольной обработки проводили 2-кратную обработку верхней водной фазы смесью фенол- хлороформ (1: 1), которую смешивали с водной фазой в равном объеме. Водную фазу отделяли центрифугирование при 12,000 g 10 мин, отсасывали и смешивали однократно с равным объемом хлороформа, после чего центрифугировали при 12,000 g и отделяли верхнюю фазу, ее смешивали с 2 объемами охлажденного до -20oC перегнанного этанола и оставляли на ночь при -20oC. Рыхлый осадок уплотняли центрифугированием при 12,000 g в течение 10 мин, сливали супернатант и промывали осадок 200 мкл 70% этанола, охлажденного до -20oC 5 мин, повторно центрифугировали в тех же условиях, после чего подсушивали осадок на воздухе 1 ч. Далее его растворяли в 10 мкл буфера А, определяли количество ДНК по Дише и подвергали ее электрофорезу в 2% агарозном геле (использовали агарозу марки NA фирмы. "Pharmacia LKB, Biotechnology Inc" (Австрия)). Электрофоретическое разделение ДНК осуществляли в блоке 2% агарозного геля в аппарате фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). В качестве буферного раствора использовали 0.04 М трис-HCl буфер, pH 7.7, содержащий 0.02 М ацетата натрия и 0.002 М ЭДТА. Агарозу (2%) готовили на электродном буфере. Депротеинизированную ДНК (2-5 мкг) наносили в лунки геля. Электрофорез проводили при напряженности электрического поля 6 В/см в течение 3 ч. За движением образца следили по перемещению бромфенолового синего. По окончании электрофореза гелевый блок извлекали из камеры и помещали в ванночку с раствором этидия бромида (3 мкг/мл H2 O) на 30 мин в темноте. По окончании инкубации гель промывали водой и просматривали в проходящем ультрафиолетовом излучении при длине волны 254 нм на трансиллюминаторе фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). Фотографировали гель фотоаппаратом "Зенит E" с красным светофильтром.
Результаты исследования представлены в таблицах 30, 31, 32, 33. Как можно видеть из данных таблицы 31, GSSG•Pt индуцирует апоптоз в культуре клеток HL-60, которые дефектны по гену p53. Этот эффект весьма выражен уже при концентрации 10 мкг/мл, однако при концентрации 100 мкг/мл он сильнее. Наблюдали накопление апоптозных фрагментов ДНК, кратных по размеру ДНК нуклеосомы - бесспорный признак программируемой клеточной гибели.
В противоположность этому на нормальные клетки GSSG•Pt оказывал стимулирующий эффект, то есть некоторую пролиферацию клеток (табл. 30). Электрофорез ДНК, выделенной из нормальных клеток, показал что она представлена гомогенной высокомолекулярной фракцией, характерной для жизнеспособных клеток.
Таким образом различия в действии препарата на нормальные и опухолевые клетки носили принципиально разнонаправленный характер.
Механизм разнонаправленного действия препарата GSSG•Pt может быть связан с активацией p53-независимого пути апоптоза через Ras-сигнальную систему. Ras-система обладает способностью стимулировать пролиферацию и дифференцировку клеток через один каскад митогенных факторов и индуцировать апоптоз (программированную клеточную гибель) через другой каскад клеточных сигналов.
Для проверки этого сопоставляли эффект препарата GSSG•Pt на мышиные фибробласты с усиленной экспрессией ras-гена, но отличающиеся по наличию гена p53 - интактного (дикого типа) - клетки C-8(p53++) или с генетическим дефектом - отсутствием гена p53 - клетки A-4(p53--). Как видно из таблицы 32 и 33, эффект GSSG•Pt проявился в обеих линиях клеток. Индукция апоптоза была сильно выражена. Это свидетельствует об активации p53-независимого пути апоптоза. Наличие в обеих линиях клеток активированного гена ras может объяснять выраженность апоптоза в трансформированных фибробластах, даже большую, чем в HL-60 клетках. Это подтверждает индукцию апоптоза через Ras-сигнальную систему. Эффект GSSG•Pt на клетки A-4 и клетки C-8 при концентрации 10 мкг/мл не отличался между собой. Достоверно больший эффект GSSG•Pt на клетки A-4, чем на клетки C-8, отмечали при концентрации 100 мкг/мл. Возможно отсутствие p53-белка даже усиливает действие Ras-сигнального пути индукции апоптоза в опухолевых клетках.
Дефект гена p53 встречается примерно в половине случаев онкологических заболеваний, что в преломлении к результатам проведенных экспериментов может означать эффективность препарата GSSG•Pt в химиотерапии этих опухолей.
Заключение
Проведенные
эксперименты позволили получить данные, свидетельствующие о способности препарата GSSG•Pt усиливать
резистентность
нормальных клеток (лимфоцитов),
и напротив, индуцировать апоптоз в
трансформированных клетках, то есть оказывать противоопухолевое действие. Причем активность препарата GSSG•Pt в отношении
индукции апоптоза
трансформированных
клеток, дефектных по гену p53,
даже превосходила таковую для клеток с интактным геном p53 при высокой концентрации препарата. По
объективному критерию
жизнеспособности - наличию
высокомолекулярной ДНК,
которая имелась в
значительном количестве при действии GSSG-Pt на нормальные клетки лейковзвеси доноров клеточная гибель
при этом практически
отсутствовала, тогда как в
случае воздействия GSSG•
Pt на опухолевые
клетки наблюдали апоптозную деградацию ДНК-признак необратимой индукции апоптозной гибели, даже
в клетках, дефектных по гену
p53, особенно при
стимуляции Ras-сигнального пути. Ранее в
примере N 9
показана активация ряда цитокинов под действием препарата GSSG•Pt. Учитывая, что
действие цитокинов может быть связано с
активацией
факторов Ras-сигнального пути, стимуляция
цитокинов может
также приводить к противоопухолевому эффекту через взаимодействие с Ras-белком.
Следовательно, применение
препарата
GSSG•Pt обеспечивает:
индукцию
апоптоза не
зависимо от продукта гена p53;
реализацию химиотерапевтической активности
через индукцию Ras-зависимого пути апоптоза.
Пример N 16
Анализ действия
препарата
GSSG•Pt на динамику роста и апоптотическую деградацию ДНК в культурах
трансформированных клеток мышей, дефектных по
антионкогенам.
Выполнили сравнительный анализ действия препарата GSSG•Pt на динамику роста и апоптотической деградации ДНК трансформированных фибробластов линии клеток с активированным ras-геном, но интактным геном p21 (p21++; C-8) и линию клеток мышей, нокаутированных по гену p21 (p21--)(1).
Клетки линии p21++ являются трансформированными фибробластами мыши, несущими плазмиду с геном ras и геном фактора усиления экспрессии E1a- фрагментом антигена аденовирусов, но содержат интактные гены p53 и p21. Линия p21(--) содержит интактные гены p53 и ras, но дефектна по гену p21. Это позволяет оценить действие препарата GSSG•Pt на индукцию апоптоза в условиях нарушения регуляции G1 фазы клеточного деления [38, 39].
Культуры клеток выращивались в среде DMEM с добавкой 10% эмбриональной телячьей сыворотки. Культивирование клеточного монослоя проводили в закрытых флаконах, объем среды 12 мл, смену среды проводили каждые 4 дня. Непосредственно перед тестированием препаратов клетки суспензировали в свежей среде и переносили в планшеты с 24 лунками (концентрация клеток в каждой лунке 250000 кл/мл). Затем добавляли испытуемый препарат GSSG•Pt до конечной концентрации 100 мкг/мл в соответствующие лунки.
Тестирование эффектов действия исследуемых препаратов проводилось через сутки, двое, после их внесения в культуру.
Процедура анализа заключалась в следующем: после инкубации сутки, двое, подсчитывали общее количество клеток, количество погибших клеток по тесту с трипановым синим, затем клеточную суспензию центрифугировали при 3, 000 g в эппендорфовских пробирках в течение 10 мин. Осадок клеток замораживали и хранили при -70oC до выделения ДНК. Выделение ДНК осуществляли фенольным методом по Кирби-Георгиеву. Лизис клеток осуществляли добавлением 0.5 мл 10% SDS. В лизат вносили равный объем фенола, уравновешенного 0.01 М Трис-HCl буфером с pH 8.0, перемешивали в течение 2 мин и центрифугировали в эппендорфовских пробирках при 12,000 g 15 мин. Фенольную депротеинизацию повторяли дважды. После этого проводили 2-кратную обработку водной фазы смесью фенол-хлороформ (1:1) и однократно - хлороформом. Нуклеиновые кислоты осаждали добавлением двух объемов 96% этанола при -20oC в течение ночи. Осадок уплотняли центрифугированием при 12,000 g в течение 30 мин, декантировали, промывали 70% этанолом и высушивали на воздухе. После высыхания осадок растворяли в буфере ТЕ. В полученном растворе определяли концентрацию ДНК (по Дише). Фракционный состав нуклеиновых кислот определяли методом электрофореза в 2% агарозном геле (использовали агарозу марки NA фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия)). Электрофоретическое разделение ДНК осуществляли в блоке 2% агарозного геля в аппарате фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия). Электрофорез проводили в ТАЕ буфере pH 7,4 (0.04 М трис, 0.02 М ацетат натрия и 0.002 М ЭДТА) при напряженности электрического поля 6 В/см в течение 3 ч. За движением образца следили по перемещению маркерного красителя бромфенолового синего. Результаты электрофореза детектировали в проходящем ультрофиолетовом свете ( λ =254 нм) на трансиллюминаторе фирмы "Pharmacia LKB, Biotechnology Inc" (Австрия) после окраски геля раствором этидиум бромида (5 μg/ml).
Результаты исследования представлены в таблицах 34, 35. Как можно видеть из данных таблицы 34, GSSG•Pt индуцирует апоптоз в культуре клеток p21++, в которых активирован ras-ген, что проявлялось накоплением фрагментов ДНК, кратных по размеру ДНК нуклеосомы.
В клетках p21(- -), имеющих неактивированную Ras-сигнальную систему, но дефектных по контролю задержки клеточного цикла в фазе G1 GSSG•Pt, индуцирует апоптоз в меньшей степени, чем в клетках p21++ (табл. 34, 35). Это может быть связано с тем, что Ras-система обладает способностью стимулировать пролиферацию и дифференцировку клеток через один каскад митогенных факторов и индуцировать апоптоз (программированную клеточную гибель) через другой каскад клеточных сигналов. Отсутствие экспрессии гена p21 может приводить к изменениям в соотношении работы отдельных каскадов Ras-сигнального пути и таким образом меньшей стимуляции апоптоза препаратом при дефектах гена p21.
Дефект гена p21 встречается нечасто при онкологических заболеваний, что в преломлении к результатам проведенных экспериментов может означать эффективность препарата GSSG•Pt в химиотерапии опухолей, кроме случаев меньшей эффективности при опухолях с мутациями в гене p21.
Заключение
Проведенные эксперименты
позволили получить данные, свидетельствующие о
способности препарата
GSSG•
Pt активно индуцировать апоптоз в трансформированных клетках, то есть оказывать
противоопухолевое действие. Усиленная
экспрессия ras-гена способствует индукции
апоптоза трансформированных
клеток
C-8, что свидетельствует в пользу реализации противоопухолевого действия препарата
GSSG•Pt через Ras-сигнальную
систему. Меньший эффект препарата при
отсутствии экспрессии гена p21 может
быть связан с перераспределением факторов в митогенном и апоптозном каскадах
Ras-сигнального пути.
Тем не менее, присутствие апоптозной деградации ДНК - признак необратимой индукции апоптозной гибели, обнаруживается после воздействия препарата GSSG• Pt даже в клетках, дефектных по гену p21.
Сказанное позволяет
утверждать:
препарат
GSSG•Pt
реализует химиотерапевтическую активность, через индукцию Ras-зависимого
пути апоптоза;
препарат GSSG•Pt
индуцирует развитие апоптоза
даже при дефекте гена
p21, но изменение
соотношения эффекторных путей Ras-сигнальной системы влияет на выраженность
этого процесса.
Пример N 17
Терапевтический эффект
ванадиевой соли GSSG•Pt у больной
сахарным диабетом
Фамилия, имя, отчество пациента: Бронавец Лидия
Сергеевна.
Пол: женский
Возраст:
37 лет
Амбулаторная карта: N
63
Диагноз:
Сахарный диабет. Инсулинонезависимый тип - тип II. Диабетическая ангиопатия IV
степени.
Анамнез заболевания: Впервые повышение уровня сахара стало обнаруживаться с 31-летнего возраста. В октябре 1994 года была госпитализирована в эндокринологическое отделение больницы N 16. Наследственность по диабету отягощена по материнской линии. Заболевание развивалось постепенно, уровень сахара в крови колебался от 12.1 до 15.7 ммоль/л, глюкозурия до 7%.
Предшествующее лечение: После начала заболевания больная неоднократно находилась на стационарном лечении, в 1994 г. в течение полугода получала инсулин-ленте S. N. C.-32 ед и пероральные сахароснижающие препараты группы сульфонилмочевины, затем инсулин был отменен,принимала противодиабетические средства - букарбан, диабетон. Сахар крови колебался от 10.7 до 15.4 ммоль/л, глюкозурия 3-7%.
В январе 1998 г. больная госпитализирована с курсом лечения препаратами: диабетон по 0.08 - по 2 таблетки утром и вечером, глюкобай 0.1х3 раза в сутки.
Содержание сахара в крови:
в 9.00 - 12.6
ммоль/л;
в
12.00 - 12.0 ммоль/л;
в 14.00 - 15.3 ммоль/л;
в 17.00 - 19.1 ммоль/л;
в 6.00 - 11.5 ммоль/л.
Глюкозурия до 3%.
В связи с неэффективностью предыдущей терапии принято решение об использовании препарата ванадиевой соли GSSG•Pt.
Курс терапии препаратом ванадиевой соли GSSG• Pt в стационаре: с 17.01.98 г.
В течение 10 дней один раз в день внутривенное введение ванадиевой соли GSSG•Pt (суточная 0.01-0.5 мг/кг).
В течение следующих 10 дней лечения внутривенное введение ванадиевой соли GSSG•Pt один раз в два дня (суточная доза - 0.01-0.5 мг/кг).
В течение следующих 10 дней (третья декада) лечения внутримышечные инъекции ванадиевой соли GSSG•Pt один раз в день в течение 20 дней (суточная 0.1-0.5 мг/кг).
Терапия препаратом ванадиевой соли GSSG• Pt проводилась на фоне изменения схемы лечения препаратами диабетон и глюкобай. Диабетон принимала по 0.08 утром и вечером, глюкобай по 0.05 х 3 раза в день.
Сахар в крови нормализовался и не превышал 8.2-10.6 ммоль/л после еды. С момента выписки из стационара больная получала сопутствующую терапию препаратом ванадиевой соли GSSG•Pt амбулаторно в течение месяца.
Амбулаторный курс терапии
препаратом
ванадиевой соли GSSG•Pt:
В течение
одного месяца были назначены внутримышечные инъекции
ванадиевой соли GSSG•Pt (суточная доза - 0.01-0.5 мг/кг).
В течение двух последовательных месяцев лечения препаратом ванадиевой соли GSSG•Pt у больной после дважды отмечалось снижение уровня сахара в крови до 1.5- 2.5 ммоль/л, в связи с чем были уменьшены дозы сахароснижающих препаратов.
Через 2 месяца лечения глюкобай был отменен.
Состояние больной после окончания курса лечения:
После четырех
месяцев
лечения с использованием препарата ванадиевой соли
GSSG•Pt в качестве сопровождения базовой терапии
общее
состояние больной существенно улучшилось и может быть оценено как
удовлетворительное.
Динамика гематологических, биохимических,
иммунологических показателей крови приведена в таблицах 36 и
37.
Комментарий к динамике показателей сахара крови, цАМФ/цГМФ, тиол-дисульфидного соотношения и других анализируемых параметров.
Динамика количества сахара крови является интегративным критерием эффективности действия противодиабетических препаратов. Комбинированная терапия пероральными гипогликемизирующими средствами (диабетон и глюкобай) совместно с препаратом ванадиевой соли GSSG•Pt привела к нормализации сахара крови, уменьшению терапевтической дозы препарата диабетон и необходимости отмены препарата глюкобай. Характер изменения гематологических и биохимических показателей, параметров иммунного статуса в значительной степени свидетельствует о нормализации обмена и системных реакций в целом, что не позволяет дифференцировать составляющую противодиабетической активности препарата ванадиевой соли GSSG•Pt. В этой связи были использованы показатели -цАМФ/цГМФ и тиол-дисульфидного соотношения (ТДС), позволяющие принципиально охарактеризовать молекулярный механизм воздействия препарата ванадиевой соли GSSG•Pt на комплекс клеточных реакций гомеостаза сахара крови. В частности, ключевые внутриклеточные мессенджеры цАМФ и цГМФ определяют интенсивность потока глюкозы во внутриклеточные обменные процессы. При этом цГМФ зависимые ферментативные клеточные системы определяют интенсивность поглощения глюкозы клетками. В свою очередь уровень цГМФ определяется окислительным потенциалом клетки. В частности, оксиданты повышают уровень цГМФ, напротив, антиоксиданты оказывают депрессивное действие на его содержание. Таким образом, тиол-дисульфидное соотношение (ТДС) в клетке, отражающее уровень равновесия анти- и прооксидантов, определяет и величину внутриклеточного показателя цАМФ/цГМФ. В преломлении к целостному организму мы вправе анализировать эти показатели в крови, как интегрирующей внутренней среде, во взаимосвязи с колебаниями уровня сахара крови, потому что метаболизм глюкозы является неотъемлемой составляющей жизнедеятельности всех типов клеток нашего организма, наряду с тиол-дисульфидным обменом, системами циклических нуклеотидов.
Полученные результаты свидетельствуют о гипогликемизирующем влиянии препарата ванадиевой соли GSSG•Pt на содержание сахара крови. Причем этот эффект не упреждает, а следует за динамикой увеличения цГМФ (снижение значения показателя цАМФ/цГМФ) и депрессией величины ТДС (прирост количества окисленных форм тиолов). С учетом регуляторных возможностей окисленными формами тиолов уровня цГМФ, а последнего в регуляции уровня сахара в крови, можно постулировать принципиальный механизм регуляторного гипогликемизирующего влияния препарата ванадиевой соли GSSG• Pt. В частности, регуляторное воздействие препарата ванадиевой соли GSSG•Pt на редокс контур клетки приводит к приросту уровня оксидантной составляющей, что в свою очередь перераспределяет баланс в системе циклических нуклеотидов в пользу цГМФ (индукция активности гуанилатциклазы и ингибирование фосфодиэстеразы, ферментов синтеза и распада цГМФ соответственно). Регуляторное воздействие цГМФ стимулирует процессы связывания глюкозы клеткой и как итог снижение сахара в крови.
Заключение: - использование препарата ванадиевой
соли GSSG•Pt в схеме
комбинированного
лечения диабета позволило получить следующие терапевтические
эффекты:
улучшение качества жизни и стабилизацию уровня сахара в крови;
снижение дозы принимаемых
сахароснижающих
препаратов;
нормализацию гематологических, биохимических
и
иммунологических показателей.
Пример N 18
Сравнительное изучение адъювантного действия
препаратов GSSG-Pt
и GSSG-Pd на моделях брюшнотифозной химической и живой
туляремийной
вакцин
Оценку адъювантных свойств препаратов GSSG-Pt и
GSSG-Pd проводили в опытах на белых мышах,
которых иммунизировали
химической брюшнотифозной или живой туляремийной
вакцинами.
В опытах использовали взрослых рандомбредных мышей-самцов массой 18-21г, поставленных из питомника "Рапполово" РАМН. Для иммунизации применяли коммерческие препараты. Туляремийную вакцину вводили внутрибрюшинно в дозе 250 микробных клеток, брюшнотифозную вакцину - подкожно в ранее подобранной оптимальной дозе, эквивалентной 0,2 человеческой дозы.
Препараты GSSG-Pt и GSSG-Pd вводили в объеме 0,5 мл внутрибрюшинно 1 раз в сутки в течение 2 сут до иммунизации, а также в день иммунизации за 40-60 мин до инъекции антигена в дозе 5 мг/кг на одно введение. Животным контрольных групп в те же сроки вводили 0,5 мл изотонического раствора хлорида натрия.
Адъювантную эффективность GSSG-Pt и GSSG-Pd оценивали по их влиянию на клеточный и гуморальный иммунитет с помощью реакции гиперчувствительности замедленного типа (ГЗТ) и определения специфических антител. Тестирование осуществляли через 14 сут после иммунизации. При постановке реакции ГЗТ мышам подкожно в правую заднюю лапку вводили соответствующий антиген в объеме 0,05 мл (тулярин или О-антиген S. typhi), а в левую - такой же объем изотонического раствора хлорида натрия. Через 24 ч мышей эфтаназировали передозировкой эфира, на уровне голеностопного сустава отрезали обе задние лапки и их взвешивали, после чего рассчитывали индекс реакции. Антитела к соматическим антигенам возбудителей туляремии и брюшного тифа определяли в реакции непрямой гемагглютинации с использованием соответствующих антигенных эритроцитарных диагностикумов; влияние препаратов GSSG-Pt и GSSG-Pd на антителообразование оценивали по 2 критериям - частоте сероконверсий и высоте титров антител.
Результаты исследования представлены в таблицах 38-41.
Полученные данные свидетельствуют о том, что 3-кратное внутрибрюшинное введение препаратов GSSG-Pt и GSSG-Pd в дозе 5 мг/кг перед иммунизацией приводило к повышению иммунного ответа на химическую брюшнотифозную и живую туляремийную вакцины, что проявилось (по сравнению с контролем) в более интенсивном антителообразовании и в более высоком уровне реакции ГЗТ на соматические антигены этих микроорганизмов. Вместе с тем следует отметить, что адъювантный эффект обоих изучаемых препаратов был практически одинаков, так как незначительная разница в показателях иммунного ответа была статистически недостоверной.
Таким образом, новые производные окисленного глутатиона, содержащие платину или палладий, являются активными биолого-фармакологическими соединениями и обладают адъювантным действием в отношении антигенов туляремийного и брюшнотифозного микробов.
Источники
информации
1. Патент РФ N
2089179, МКИ A 61 K 38/02, 1997 г.
2. Международная заявка WO 97/21444, МКИ A 61 K 38/02, опубликована 19/06/97.
3. P. Досон, Д. Эллиот, У. Эллиот, К. Джонс. Справочник биохимика. М. "Мир", 1991 г.
4. Tam J.P. et.al// Int.J.Pept. Prot. Res.vol.29.p.421-431, 1987.
5. Ahmed A.K. et.al// J/ Biol. Chem. 250, p/ 8477-8482, 1975.
6. Kamber В. et.al// Helv. Chim.Acta. vol.63, p. 899-915, 1980.
7. Hope D.B. et.al// J. Biol. Chem., vol. 237, p. 1563-1566, 1962.
8. William A., Kato et. al.// Chem. Pharm. Bull., vol.34 (2), p. 486-495, 1986.
9. A. Meister et. al. // Ann. Rev. Biochem., p/ 711-718, 1983.
10. Chambers R.W., J.Am.Chem.Soc., 80, 3752, 1958.
11. Szent-Gyorgyi A" Proc. Natl. Acad. Sci. U.S., 58, 2012 (1967); Introduction to a Submolecular Biology, Academic Press, New York (1960).
12. P. Бохински, Современные воззрения в биохимии, стр.291, Москва, Мир, 1987 г.
13. Англо-русский медицинский энциклопедический словарь, М. 1995 г., с. 519.
14. Miller-Keane "Encyclopedia & Dictionary of Medicine, Nursing, & Allied Health", 5th edition, W.B.Saunders Company, 1992, p. 1221.
15. А. Хорст "Молекулярные основы патогенеза болезней", М. Медицина, 1982, с. 125.
16. Brian WJ Mahy "A Dictionary of Virology", 2-е изд. Academic Press, 1997, с. 87.
17. Англо-русский медицинский энциклопедический словарь, М. 1995 г., с. 179.
18. Miller-Keane "Encyclopedia & Dictionary of Medicine, Nursing, & Allied Health", 5th edition, W.B.Saunders Company, 1992, p. 424.
19. Harrison's Principles of Internal Medicine, 14th edition, p. 511, 1998.
20. Apoptosis: a role in neoplasia, C.D. Gregory, 1996.
21. The Molecular Biology of Apoptosis, D.L. Vaux, A.Strasser; Proc. Natl. Acad. Sci. USA 93 (1996).
22. Цитокины в онкогематологии, Грачева Л.А., Москва, 1996 г.
23. Textbook of biochemistry: with clinical correlations. Ed. Deviin T. M., 3 rd ed. 1992, Wiley-Liss, Inc., NY. p. 522-525.
24. Kehrer J.P., Lund L.G. Cellular reducing equivalents and oxidative stress. Free Radic Biol Med. 1994 Jul. 17(1).P65-75.
25. Beckett G.J., Hayes J.D. Glutathine S-transferase: biomedical applications. Advan. Clin. Chem. 1993, vol. 30, P. 281-380.
26. E. Busse, G. Zimmer, B. Schopohl, and Kornhuber. Influence of α-Lipoic Acid on Intracellular glutathione in vitro and in vivo. // Arzneim. - Forch. / Drug Res. 42(1), Nr. 6 (1992).
27. Holmlund J. Т. Cytokines. Cancer Chemother Biol Response Modif. 1993. 14P 150- 206.
28. Hansson M., Soderstrom Т. The colony stimulating factors. Med Oncol Tumor Pharmacother. 1993.10(1-2). P 5-12.
29. Dillman R. O. The clinical experience with interleukin-2 in cancer therapy. Cancer Biother. 1994 Fall. 9(3). P 183-209.
30. Whittington R., Faulds D. Interleukin-2. A review of its pharmacological properties and therapeutic use in patients with cancer. Drugs. 1993 Sep. 46(3). P 446-514.
31. Hieber U., Heim М. E. Tumor necrosis factor for the treatment of malignancies. Oncology. 1994 Mar-Apr. 51(2). P 142-53.
32. Morstyn G. , Sheridan W. P. Hematopoietic growth factors in cancer chemotherapy. Cancer Chemother Biol Response Modif. 1993. 14P 353-70.
33. Neidhart J. A. Hematopoietic cytokines. Current use in cancer therapy. Cancer. 1993 Dee 1. 72(11 Suppl). P 3381-6.
34. Meister A. Anderson M.E. Glutathione. Annu. Rev. Biochem., 1983, 52: 711-60.
35. Sokolovsky M., Wilchek M., Patchornik A. On the synthesis of cysteine peptides. J. Amer. Chem. Soc. 1964, Mar. 86(6), P 1202-6.
36. John J. Reiners, Jr, Effat Kodari, Roseann E.Cappel fnd Hiram F.Gilbert. Assessment of antioxidant/prooxidant status of murine skin. Part 2$5%: Quantitation of glutation and glutation disulfide. // Carcinogenesis Vol. 12. pp. 2345-2352.
37. A. Stacchini, L. Fubini. E. Gatti, L. Mutti, W.Piacibello, F. Sanavio, G. Scagliotti, E. Pozzi and M. Aglietta. In vivo effect of human granulocyte-macrofage colony-stimulating factor (GM-CSF) on neutrophil GM-CSF receptors. // Leucemia, 1995. Vol.9. p.1-6.
38. S.W. Lowe; H.E. Ruby; T. Jacks and D.E. Hoksman "P53- dependent apoptosis modulates the Cytotoxicity of Anticancer Agents"// Cell - 1993, -74, pp. 703-711.
39. Y Xu; E.M.Yang; J.Brugalos; T. Jacks; D. Baltimor "Involvement of p53 and p21 in cellular defects and tumorogenesis in Atm -/- mice' // Mol. Cell. Biol. - 1998, -18(7) - pp. 4385-4390.1
Реферат
Изобретение относится к медицине, в частности к фармакологии, а именно к способам получения лекарственных средств на основе активных метаболитов пептидной природы, которые могут быть использованы в клинической практике. Композит включает соединение на основе окисленного глутатиона и вещества-металла в соотношении 3000:1 и 1:1, в котором вещество-металл включает металл, выбираемый из группы, состоящей из платины и палладия, при этом соединение на основе окисленного глутатиона может быть дериватом или солью, выбираемой из группы, состоящей из солей щелочных металлов, солей щелочноземельных металлов и солей переходных металлов. Технический результат: расширение спектра средств для стимуляции, а также усиления и пролонгирования способности стимулировать эндогенную продукцию цитокинов и гемопоэтических факторов и для лечения лиц, страдающих заболеваниями, в основе которых лежат нарушения регуляции, метаболизма, пролиферации, дифференцировки и механизмов апоптоза клеток. 5 с. и 74 з.п. ф-лы, 22 ил., 42 табл.

Формула

где A, B, D, E, G и H могут быть одинаковыми либо различаться, и каждый из них выбирают из группы, состоящей из органической части и соли органической части.

где A, B, D, E, G и H могут быть одинаковыми либо различаться, и каждый из них выбирают из группы, состоящей из органической части и соли органической части.

где A, B, D, E, G и H могут быть одинаковыми либо различаться и, каждый из них выбирают из группы, состоящей из органической части и соли органической части.

Комментарии