Содержащий кремний биологически разлагаемый материал для проангиогенной терапии - RU2573989C9
Код документа: RU2573989C9
Чертежи




Описание
Настоящее изобретение касается содержащего кремний биологически разлагаемого материала для профилактики и/или лечения заболеваний, которые сопровождаются пониженным и/или нарушенным ангиогенезом, и/или заболеваний, для которых для процесса выздоровления необходимо повышение ангиогенеза.
Ангиогенезом называют рост маленьких кровеносных сосудов (капилляров) преимущественно путем почкования из имеющейся капиллярной системы. Речь идет о комплексном процессе, в котором с помощью различных ангиогенных факторов роста, как, например, фактора роста фибробластов (FGF) и фактора роста эндотелия сосудов (VEGF) для образования стенок сосуда активизируются необходимые эндотелиальные, адвентициальные и гладкие мышечные клетки. Ангиогенез имеет важное биологическое и медицинское значение. В современной медицине различают две формы терапевтического применения принципа ангиогенеза: антиангиогенная терапия и проангиогенная терапия. В проангиогенной протеиновой терапии используют факторы роста с ангиогенной способностью, в первую очередь, фактор роста фибробластов 1 (FGF-1) и фактор роста эндотелия сосудов (VEGF); на этих факторах роста основаны самые большие клинические испытания. А также факторы роста: эпидермальный фактор роста (EGF), фактор роста эндотелиальных клеток тромбоцитарного происхождения (PD-ECGF) и тромбоцитарный фактор роста (PDGF) и трансформирующий фактор роста (TGF) обладают определенным ангиогенным потенциалом. Предыдущие клинические исследования, в частности, с помощью FGF-1, являются многообещающими: так можно обнаружить как новые сосуды миокарды человека, так и улучшение миокардиального кровоснабжения (сопровождаемые увеличением нагрузки пациента).
Кремний является микроэлементом, который в связанной силикатной форме необходим для людей. Кремний является компонентом тех белков, которые отвечают за прочность и эластичность ткани. К тому же он также присутствует в соединительной ткани, костях, коже, волосах, ногтях и кровеносных сосудах. Кроме того, кремний укрепляет защитную систему организма, так называемую иммунную систему, и способствует заживлению ран. Последствиями недостатка кремния являются нарушение роста, ломкость костей с повышенным риском образования остеопороза, а также преждевременное выпадение волос, ломкие ногти и изменения кожи. Возможными изменениями кожи являются повышенное образование морщин, сухость, шелушение, повышенное ороговение, зуд, уплотнения и растущие болезненные трещины на коже из-за пониженной эластичности. Кроме того, защитная система организма, так называемая иммунная система, ослабевает из-за недостатка кремния, и возникает повышенная восприимчивость к инфекциям.
Соединения, содержащие кремний, были описаны для профилактики или лечения некоторых заболеваний. Однако до сегодняшнего момента было неизвестно, что соединения, содержащие кремний, также индуцируют или могут способствовать ангиогенным процессам, и тем самым принимаются во внимание в проангиогенной терапии.
US 2006/0178268 A1 описывает водный раствор, состоящий из неколлоидной кремниевой и борной кислоты, для лечения заболеваний костей, хрящей, кожи, артерий, соединительных тканей, суставов, волос, ногтей, кожи, а также остеопороза, ревматических заболеваний, артериосклероза, артрита, сердечно-сосудистых, аллергических и дегенеративных заболеваний.
US 2006/0099276 A1 раскрывает способ получения производного кремниевой кислоты при помощи гидролиза кремнийорганического соединения до олигомеров при одновременном присутствии четвертичного аммониевого соединения, аминокислоты или источника аминокислоты или их комбинаций. Экструдат кремниевой кислоты можно применять в качестве лекарства для лечения инфекций, заболеваний ногтей, волос, кожи, зубов, коллагеновых заболеваний, диффузных болезней соединительной ткани, остеопатии, остеопении, для образования клеток при дегенеративных процессах (старения).
US 6,335,457 B1 раскрывает твердое вещество, в котором кремниевая кислота образует комплекс с полипептидом. Также этот патент раскрывает применяемые при лечении смеси, содержащие указанное твердое вещество.
WO 2009/018356 A1 касается смеси, содержащей соединение фосфата натрия, аммониевое соединение и соль кремниевой кислоты для профилактики или лечения заболеваний, таких как рак предстательной железы, колоректальный рак, рак легких, рак молочной железы, рак печени, нейрональные опухоли, рак костей, ВИЧ, ревматический артрит, рассеянный склероз, вирус Эпштейна-Барр, фибромиалгия, синдром хронической усталости, диабет, синдром Бехчета, синдром раздраженного кишечника, болезнь Крона, пролежни, трофические язвы, ослабленная лучевой или химиотерапией иммунная система, гематомы или их комбинации.
WO 2009/052090 A2 описывает способ лечения воспалительных, аутоиммунных заболеваний, бактериальных или вирусных инфекций и рака путем применения композиции, содержащей соли кремниевой кислоты.
US 2003/0018011 A1 касается фармацевтической композиции с жирной кислотой и водорастворимым силикат-полимером в качестве противоаллергического или противовоспалительного вещества.
US 5,534,509 касается фармацевтической композиции, содержащей водорастворимый силикат-полимер в качестве активного вещества с сахаридом или сахарным спиртом в качестве инертного наполнителя для лечения аллергии, воспалений, боли или для улучшения периферической циркуляции крови или парестезии.
DE 19609551 С1 описывает получение биологически рассасывающихся филаментных волокон на основе сложного этилового эфира полигидрокси-кремниевой кислоты. Волокна используют в качестве армирующих волокон для биологически разлагающихся и/или биологически рассасывающихся (имплантатов) материалов. Также волокна можно применять для изготовления биологически разлагающихся нетканых материалов.
WO 01/42428 A1 описывает способ изготовления кожного имплантата, причем клетки кожи наносят на поверхность питательного раствора и наращивают с помощью элементов поверхности, состоящих из волокон, описанных в DE 19609551 С1.
ЕР 1262542 А2 касается способа получения клеток, тканей и органов in-vitro, причем в качестве опорного клеточного вещества и/или проводящей структуры согласно DE 19609551 C1 применяют волокнистую матрицу.
WO 2006/069567 A2 касается многослойного соединения, в котором в слое также используют волокнистую матрицу согласно DE 19609551 С1. Многослойное соединение можно использовать для лечения таких ран, как хронические диабетические нейропатические язвы, язвы голени, пролежни, вторично инфицированные раны, первично инфицированные раны, как, в частности, рваные раны или ссадины после абляции.
Кроме этого WO 2008/086970 A1, WO 2008148384 A1, РСТ/ЕР 2008/010412 и РСТ/ЕР 2009/004806 описывают получение другого применяемого согласно изобретению соединения сложного этилового эфира полигидрокси-кремниевой кислоты. В общем, соединения описывают для применения в качестве биологически рассасывающихся материалов в медицине, медицинской промышленности, технологии фильтрования, биотехнологии или производстве изоляционных материалов. Также упомянуто, что материалы можно предпочтительно использовать при лечении и заживлении ран. Волокна, например, можно использовать в качестве хирургического материала для наложения швов или армирующих волокон. Нетканый материал можно использовать на поверхностных ранах, при фильтрации биологической жидкости (например, крови) или в области биореакторов в качестве веществ, способствующих выращиванию.
В уровне техники не указано, что можно использовать вышеназванные биологически разлагаемые соединения сложного этилового эфира полигидрокси-кремниевой кислоты (например, в виде волокна или нетканого материала) для профилактики и/или лечения заболеваний, которые сопровождаются пониженным и/или нарушенным ангионегезом, и/или заболевания, для лечения которых необходимо повышение ангиогенеза. Хотя в вышеуказанных документах описано использование соединений сложного этилового эфира полигидрокси-кремниевой кислоты для лечения и заживления ран, и известно, что заживление ран связано с проангиогенными процессами, уровень техники не указывает, что можно использовать вышеназванные биологически разлагаемые соединения сложного этилового эфира полигидрокси-кремниевой кислоты, главным образом, в проангиогенной терапии. Неожиданным также явилось то, что ранее также не описывалось для других соединений, содержащих кремний, что их можно использовать для проангиогенной терапии.
Поэтому предметом настоящего изобретения является содержащий кремний биологически разлагаемый материал для профилактики и/или лечения заболеваний, которые сопровождаются пониженным и/или нарушенным ангиогенезом, и/или заболеваний, для которых повышенная норма ангиогенеза является необходимой для процесса заживления, причем содержащий кремний биологически разлагаемый материал является соединением сложного этилового эфира полигидрокси-кремниевой кислоты, при условии, что исключены такие раны, как хронические диабетические нейропатические язвы, язвы голени, пролежни, инфицированные раны, заживающие вторичным натяжением, чистые раны, заживающие первичным натяжением, как, в частности, рваные раны или ссадины после абляции. Изобретение также охватывает применение согласно изобретению содержащего кремний биологически разлагаемого соединения сложного этилового эфира полигидрокси-кремниевой кислоты для получения лекарств для профилактики и/или лечения заболеваний, которые сопровождаются пониженным и/или нарушенным ангиогенезом, и/или заболеваний, для которых повышенная норма ангиогенеза является необходимой для процесса заживления, при условии, что исключают такие раны, как хронические диабетические нейропатические язвы, язвы голени, пролежни, вторично инфицированные раны, первично инфицированные раны, как, в частности, рваные раны или ссадины после абляции.
В изобретение не включены те способы применения материала согласно изобретению, которые описаны в следующих патентных описаниях DE 19609551 С1, WO 01/42428 A1, EP 1262542 А2, WO 2006/069567 A2, WO 2008/086970 A1, WO 2008148384 A1, PCT/EP 2008/010412 и PCT/EP 2009/004806 и которые связаны с неоангиогенезом. Применение нетканого волокна из сложного этилового эфира полигидрокси-кремниевой кислоты в качестве составной части многослойного соединения для лечения таких ран, как хронические диабетические нейропатические язвы, язвы голени, пролежни, вторично инфицированные раны, первично инфицированные раны, как, в частности, рваные раны или ссадины после абляции, описано в WO 2006/069567 A2. EP 1262542 А2 описывает самые различные применения технологии культивирования тканей соединения сложного этилового эфира полигидрокси-кремниевой кислоты согласно изобретению. Понятие ″применения технологии культивирования тканей″ согласно настоящему изобретению ориентируется на продукты, способы и применение, описанные в EP 1262542 А2. Поэтому из изобретения исключены применения технологии культивирования тканей из содержащего кремний биологически разлагаемого материала согласно изобретению, обсуждаемые в EP 1262542 А2, при условии, что они должны быть связаны с проангиогенной терапией.
Понятие ″соединение сложного этилового эфира полигидрокси-кремниевой кислоты″ описывает все соединения общей формулы H[OSi8O12(OH)x(OC2H5)6-x]nOH согласно изобретению, где x означает 2-5 и n>1 (полимер). Содержащий кремний биологически разлагаемый материал, являющийся предметом изобретения, существует предпочтительно в виде материала в виде волокна, волокнистой матрицы, порошка, монолита и/или покрытия. Такой содержащий кремний биологически разлагаемый материал может быть получен согласно изобретению нижеописанными способами:
a) по меньшей мере, одной реакции гидролиз-конденсации тетраэтоксисилана,
b) выпаривания для получения однофазного раствора предпочтительно при одновременном бережном перемешивании реакционной системы,
c) охлаждения однофазного раствора и
d) созревания для получения материала на основе кремниевого золя,
e) вытягивания волокон материала на основе кремниевого золя для образования волокна или волокнистой матрицы и/или высушивания, в частности, распылительной сушки или лиофилизирования материала на основе кремниевого золя для образования порошка и при необходимости растворения порошка в растворителе для образования жидкой препаративной формы и/или нанесения покрытия из материала на основе кремниевого золя на предмет, подлежащий нанесению на него содержащего кремний биологически разлагаемого материала, и/или литья материала на основе кремниевого золя в форму для образования монолита.
Согласно изобретению содержащий кремний биологически разлагаемый материал предпочтительно находится в виде волокна, волокнистой матрицы (нетканого материала), порошка, жидкой препаративной формы и/или наносимого слоя.
В другом предпочтительном варианте осуществления изобретения содержащий кремний биологически разлагаемый материал получают описанным выше способом, причем тетраэтоксисилан на этапе a) при первоначальном значении рН 0-≤7, при необходимости в присутствии водорастворимого растворителя, предпочтительно этанола, при температуре 0-80°C подвергают кислотному катализу, и на этапе b) проводят выпаривание до получения однородного раствора с вязкостью в диапазоне 0,5-2 Па·с при скорости сдвига 10 с-1 при 4°C.
В другом варианте осуществления изобретения содержащий кремний биологически разлагаемый материал получают описанным выше способом, причем кислотный катализ на этапе a) проводят с азотнокислой H2O в молярном соотношении к кремниевому соединению в диапазоне 1:1,7-1:1,9, предпочтительно в диапазоне 1:1,7-1:1,8. Реакцию гидролиз-конденсации на этапе a) осуществляют преимущественно при температурах 20-60°C, предпочтительно 20-50°C в течение, по меньшей мере, 1 часа. Предпочтительно реакция гидролиз-конденсации на этапе a) происходит в течение нескольких часов, как, например, 8 или 16 часов. Эту реакцию также можно проводить в течение 4 недель. Этап (b) в предпочтительном варианте осуществления изобретения проводят в закрытом оборудовании, в котором может происходить перемешивание (предпочтительно в ротационном выпарном аппарате или емкости с мешалкой) при одновременном удалении растворителя (вода, этанол) с помощью выпаривания при давлении 1-1013 мбар, предпочтительно при давлении <600 мбар, выборочно при непрерывной подаче химически инертного газа-носителя для снижения парциального давления выпариваемых компонентов до 1-8 м3/ч (предпочтительно при 2,5-4,5 м3/ч), температуре реакции 30-90°С, предпочтительно 60-75°С, в частности, предпочтительно 60-70°С и преимущественно при бережном перемешивании реакционной системы при 80 об/мин (предпочтительно при 20-80 об/мин) до вязкости смеси 0,5-30 Па·с при скорости сдвига 10 с-1 при 4°С, предпочтительно 0,5-2 Па·с при скорости сдвига 10 с-1 при 4°С, в частности, предпочтительно около 1 Па·с (измерение при 4°С, скорости сдвига 10 с-1). В другом варианте осуществления изобретения содержащий кремний биологически разлагаемый материал на этапе с) охлаждают предпочтительно до 2-4°С. При этих низких температурах также предпочтительно проводят созревание (этап d). Для созревания может потребоваться несколько часов или дней, до 3-4 недель. Процесс созревания на этапе d) проводят предпочтительно до вязкости золя 30-100 Па·с при скорости сдвига 10 с-1 при 4°С и коэффициенте потерь 2-5 (при 4°С, 10 л/с, 1% деформации).
Вытягивание волокон материала на основе кремниевого золя на этапе е) предпочтительно проводят в процессе формования. Такой этап процесса формования может происходить в обычных условиях, как, например, описано в DE 19609551 С1 и DE 102004063599 A1. В предпочтительном варианте осуществления изобретения давление во время формования материала кремниевого золя выбирают таким образом, чтобы достичь пропускной способности, по меньшей мере, 80 г/ч относительно пропускной способности кремниевого золя.
Предпочтительно полученное таким образом волокно выгружают сразу после формования в течение 30-60 минут в таких же климатических условиях, как и в прядильной колонке (т.е., например, влажность воздуха ~19%, температура ~25°С). Этот этап обозначается далее как кондиционирование. Полученные на этом этапе волокна называются кондиционированными нитями.
В другом предпочтительном варианте осуществления кондиционированные нити перед их применением хранят при влажности воздуха, по меньшей мере, 35% (при комнатной температуре) в течение 1-30 минут и предпочтительно 1-10 минут (см. также таблицу 2).
Высушивание материала на основе кремниевого золя для образования порошка предпочтительно проводят при распылительной сушке или лиофизировании. Порошок также может быть получен при измельчении монолита или также волокон согласно изобретению и перемалывании. Для образования жидкой препаративной формы порошок растворяют в растворителе. Подходящие растворители в зависимости от применения (например, раствор для инъекций или суспензии) могут быть жидкими или маслянистыми.
Нанесение покрытия из содержащего кремний биологически разлагаемого материала на предмет, покрываемый материалом на основе кремниевого золя, предпочтительно осуществляют при погружении покрываемого предмета в кремниевый золь, при обливании или нанесении покрытия центробежным методом или распылении кремниевого золя.
Материал на основе кремниевого золя можно также согласно этапу d) - для образования монолита - наливать в форму и затем высушивать.
Другие конкретизирующие данные относительно получения содержащего кремний биологически разлагаемого материала, являющегося предметом изобретения, заимствованы из DE 19609551 C1, WO 01/42428 A1, ЕР 1262542 А2, WO 2006/069567 A2, WO 2008/086970 A1, WO 2008148384 A1, РСТ/ЕР 2008/010412 и РСТ/ЕР 2009/004806.
В смысле настоящего изобретения выражение "биологически разлагаемый" означает, что свойство согласно изобретению соединения сложного этилового эфира полигидрокси-кремниевой кислоты должно снижаться, если материал подвергают условиям, которые существуют, например, при регенерации ткани (например, раны). "Биологически разлагаемым" или "биоразлагаемым" в смысле изобретения соединение сложного этилового эфира полигидрокси-кремниевой кислоты является особенно в том случае, если оно полностью растворяется через 48 часов, предпочтительно 36 часов и, в частности, предпочтительно через 24 часа в 0,05 М трис pH=7,4 буферного раствора (Fluka 93371), подвергаясь термостатированию при 37°С.
Понятие "заболевания, которые сопровождаются пониженным и/или нарушенным ангиогенезом, и/или заболевания, для которых повышенная норма ангиогенеза является необходимой для процесса заживления″ описывает все те заболевания, которые можно лечить (или предотвратить) с помощью проангиогенной терапии. Такие болезни включают:
a) заболевания кровообращения и/или сердечно-сосудистой системы, как:
анемия, стенокардия, (периферический) облитерирующий эндартериит, артериосклероз, облитерирующий тромбангиит, инфаркт миокарда, ишемия, в частности, сердечной мышцы, легкого, кардиомиопатия, застойная сердечная недостаточность, заболевания коронарных артерий, как коронарный рестеноз, наследственная геморрагическая телеангиоэктазия, гиперхолесте-ринемия, ишемическое сердечное заболевание, миокардиальная системная склеродермия, миоинтимальная гиперплазия, закупоренные кровеносные сосуды, атеросклеротические заболевания периферических сосудов, портальная гипертензия, преэклампсия, ревматическое сердечное заболевание, повышенное кровяное давление, тромбоэмболические заболевания,
b) заболевания костей, хрящей или мышц, как:
восстановление костей/хрящей, костные дефекты, переломы, рост костей, заболевания хрящей, дегенерация костных дисков, остеоартрит, остеопороз, переломы позвоночника, фибромиалгия, полимиозит,
c) заболевания центральной нервной системы, как:
ишемия в центральной или периферической нервной системе, болезнь Альцгеймера, боковой (латеральный) амиотрофический склероз, автономная невропатия, аневризмы, церебральный инфаркт, апоплексический удар, цереброваскулярные заболевания, недостаточное цереброваскулярное кровоснабжение, слабоумие, эпилепсия, ишемическая компрессионная нейропатия, минимальный когнитивный дефицит, рассеянный склероз, нервные расстройства, болезнь Паркинсона, липоидно-клеточная сплено-гепатомегалия, полиневропатия, шизофрения, повреждения спинного мозга, токсическая нейропатия;
d) заболевания глаз, как:
глаукома; ретинопатия;
e) заболевания желудочно-кишечного тракта, как:
болезнь Крона, язва желудка, интестинальная ишемия, синдром раздраженного кишечника, панкреатит, язвенный колит;
f) гормональные заболевания или заболевания, связанные с обменом веществ, как:
сахарный диабет, диабетическая стопа, периферическая диабетическая ангиопатия;
g) заболевания иммунной системы, как:
аллергия, мастоцитоз, болезнь Шегрена, отторжение трансплантата, дефекты ткани при ревматических болезнях, как синдром Шегрена, дерматомиозит, системная красная волчанка, CREST-синдром, синдром Шарпа;
h) инфекционные заболевания, как:
септический шок
i) заболевания почек, как:
нефропатия, внутричерепное повышенное давление, ишемическая болезнь почек;
j) заболевания ротовой полости, как:
зубные бляшки, заболевания десен,
k) болезни репродуктивной системы, как:
эректильная дисфункция,
l) заболевания дыхательных путей, как:
астма, бронхопульмональная дисплазия, воспаление легких, респираторный дистресс-синдром,
m) заболевания кожи, как:
неспецифический дерматит, пролежни, дермальная ишемия, кожные нарывы, диабетическая гангрена, диабетические кожные язвы, рваные раны, псориаз, склеродермия, повреждения кожи, ожоги, хирургические раны, заживление ран
n) васкулярные заболевания, как:
васкулярная недостаточность, васкулярный рестеноз, васкулит, спазм сосудов, гранулематоз Вегенера
о) другие заболевания, как:
выпадение волос, лактатацидоз, ишемии конечностей, цирроз печени, ишемия печени, митохондриальная энцефалопатия, саркоидоз, повреждения мягких тканей (в частности, при несчастном случае, операции, или пороках развития), заболевания, которые следует лечить с помощью аутотрансплантатов тканей и/или органов.
Понятие "заболевания, которые сопровождаются пониженным и/или нарушенным ангиогенезом, и/или заболевания для которых повышенная норма ангиогенеза является необходимой для процесса заживления" описывает в предпочтительном варианте осуществления болезни, которые выбраны из следующих групп:
a) заболевания кровообращения, а также сердечно-сосудистой системы, как:
ишемия, в частности, сердечной мышцы;
b) заболевания центральной нервной системы, как:
ишемия центральной или периферической нервной системы.
c) заболевания ротовой полости, как:
зубные бляшки, заболевания десен.
d) повреждения мягких тканей, заболевания, которые следует лечить с помощью аутотрансплантатов тканей и/или органов.
Предмет изобретения также касается (применения) биологически разлагаемого(ых), содержащего(их) кремний материала(ов) согласно изобретению с аутотрансплантатами для лечения заболеваний, которые можно лечить с помощью аутотрансплантатов ткани и/или органов. При этом подходе согласно изобретению содержащий кремний биологически разлагаемый материал дополнительно применяют для аутотрансплантата, чтобы достичь улучшенного ангиогенеза и тем самым более быстрого введения и улучшенного приема аутологичного трансплантата в имеющейся ткани.
Другим предпочтительным предметом настоящего изобретения является содержащий кремний биологически разлагаемый материал как соединение сложного этилового эфира полигидрокси-кремниевой кислоты с содержанием этоксигрупп, по меньшей мере, 20%, предпочтительно, по меньшей мере, 25% и, в частности, предпочтительно 25-30%. Предпочтительно соединение сложного этилового эфира полигидрокси-кремниевой кислоты с таким содержанием этоксигрупп находится в виде волокна или матричного волокна.
Содержание этоксигрупп определяют известным стандартным способом отщепления эфира, методом Цейзеля в течение периода времени 1-4 недели после формования, причем соединение сложного этилового эфира полигидрокси-кремниевой кислоты перед измерением хранят при пониженной влажности воздуха (т.е., например, внутри упаковки с абсорбентами, как, например, описано в Европейской патентной заявке ЕР 09007271).
Другим предпочтительным предметом настоящего изобретения является содержащий кремний биологически разлагаемый материал как соединение сложного этилового эфира полигидрокси-кремниевой кислоты в виде волокна или матричного волокна, в котором волокна или матричное волокно обнаруживают сжимаемость, по меньшей мере, 17% предпочтительно 20% и, в частности, предпочтительно, по меньшей мере, 25%.
Сжимаемость определяют на следующих стадиях технологического процесса:
a) измерение плотности соединения сложного этилового эфира полигидрокси-кремниевой кислоты в виде волокна или матричного волокна, по меньшей мере, при двух различных значениях нажатия,
b) нанесение пары измеряемой величины (измеряемая плотность и давление) на диаграмму как плотность над log (плотности),
c) регрессия согласно (d/do)=(р/ро)-b, в которой ро означает давление 0,25 кПа, do означает рассчитанную плотность матричного волокна ро и b означает показатель кривой,
d) определение сжимаемости [k] на основе регрессии согласно k=(1-d1,25/do), в которой d1,25 соответствует плотности 1,25 Па, определенной из регрессии.
Сжимаемость определяют в течение одной недели после формования, причем соединение сложного этилового эфира полигидрокси-кремниевой кислоты перед измерением хранят при пониженной влажности воздуха (т.е., например, внутри упаковки с абсорбентами).
Подходящая дозировка соединения сложного этилового эфира полигидрокси-кремниевой кислоты составляет в общем 0,001-100 мг/кг массы тела в день и отпускается в одно- или многократной дозировке. Предпочтительно дозировка составляет 0,01-25 мг/кг, более предпочтительно 0,1-5 мг/кг в день. Способность к биологическому расщеплению соединений сложного этилового эфира полигидрокси-кремниевой кислоты также способствует тому, что соединения можно применять в более высокой дозировке и, например, они могут разлагаться в организме, например, храниться подкожно в течение длительного времени и способствовать проангиогенным процессам.
Материал согласно изобретению или его предшественник (как, например, вышеописанный на этапе d) содержащий кремниевый золь материал) можно обрабатывать используемыми в галеновых средствах носителями, наполнителями, веществами, влияющими на распад, связующими веществами, веществами, придающими скользкость, абсорбентами, разбавляющими средствами, веществами, улучшающими вкус, красителями и т.д., и преобразовывать в желаемую форму применения. При этом ссылаются на Remington's Pharmaceutical Science, 15-oe изд. Mack Publishing Company, East Pennsylvania (1980).
Материал согласно изобретению можно выпускать в подходящей форме для орального, мукозального (как, например, сублингвального, буккального, ректального, назального или вагинального), парентерального (как, например, подкожного, внутримышечного применения, с помощью болюсных инъекций, внутриартериального, внутривенного), трансдермального или локального применения (как, например, прямое нанесение на кожу или в виде местных аппликаций на незащищенный орган или рану).
Для орального применения, в частности, принимают во внимание таблетки, драже, таблетки в целлофановой упаковке, капсулы, пилюли, порошки, гранулят, пастилки, суспензии, эмульсии или растворы.
Таблетки, драже, капсулы и т.д. можно получить, например, как описано выше, при литье полученного на этапе d) содержащего кремниевый золь материала в таблетированной или капсульной форме для образования монолита. Таблетки и капсулы также могут быть получены согласно изобретению из вышеописанного материала в виде порошка обычными способами. Материал согласно изобретению или его предшественник можно смешивать с известными вспомогательными веществами, например инертными разбавителями, как декстроза, сахар, сорбит, маннит, поливинилпирролидон, взрывчатое вещество, как кукурузный крахмал или альгиновые кислоты, связующие вещества, как крахмал или желатин, связывающие вещества, как стеарат магния или тальк и/или средствами, улучшающими хранение, как, например, карбоксилполиметилен, карбоксиметилцеллюлоза, ацетатфталат целлюлозы или поливинилацетат. Таблетки также могут состоять из нескольких слоев. Материалы, содержащиеся в капсулах согласно изобретению, могут, например, быть получены при смешивании материалов согласно изобретению или их предшественника с инертным носителем, как молочный сахар или сорбит, полученное вещество помещают в желатиновые капсулы. Соответственно драже можно изготовить при нанесении на ядро, аналогично таблеткам, используемые материалы, например поливинилпирролидон или шеллак, гуммиарабик, тальк, окись титана или сахар. При этом оболочка драже также может состоять из нескольких слоев, причем можно использовать вышеназванные в таблетках вспомогательные вещества.
Для парентерального применения возможно применение растворов для вливания и инъекций. Для внутрисуставных инъекций соответственно можно применять приготовленные суспензии кристаллов. Для внутримышечных инъекций можно применять жидкие препаративные формы, как водные и маслянистые растворы для инъекций или суспензии и соответственные дюрантные препараты. Для ректального применения можно использовать вещество согласно изобретению, находящееся в суппозиториях, капсулах, растворах (например, клизмы) и мази, а также для системной, а также для локальной терапии. Далее в качестве препарата также должны быть названы средства для вагинального применения. Жидкие препаративные формы, как растворы для инъекций или суспензии, например, могут быть получены при смешивании вышеописанного вещества в виде порошка с подходящим водным или масляным растворителем. Другие способы получения известны специалисту. Растворы или суспензии, содержащие вещество согласно изобретению, могут дополнительно содержать средства для улучшения вкуса, как сахарин, цикламат или сахар, а также, например, ароматизаторы, как ванилин или экстракт апельсина. Кроме того они могут содержать суспендирующие вспомогательные вещества, как натрий-карбоксиметилцеллюлоза или консерванты, как р-гидроксибензоат. Подходящие суппозитории могут быть получены, например, при смешивании с предусмотренными для этого носителями, как нейтральные жиры или полиэтиленгликоль или их производные. Описанные растворы также можно использовать, например, для лечения зубных бляшек или болезней десен (например, при помощи инъекций или полоскания ротовой полости).
Для трансдермального применения существуют пластыри или смеси для местного нанесения в виде гелей, мазей, жирных мазей, крема, паст, пудры, молочка и настойки. Пластыри для раны предпочтительно состоят из волокон или волокнистой матрицы (нетканый материал) из веществ согласно изобретению, как описано в уровне техники.
В другом варианте осуществления изобретения на материал согласно изобретению или на его предшественник можно наносить покрытие, например, при погружении предмета, на который необходимо нанести покрытие, или корпуса, в вещество, содержащее кремниевый золь, описанное на этапе d), при обливании или нанесении покрытий центробежным методом или опрыскиванием таким веществом, содержащим кремниевый золь. Предпочтительно материал, содержащий кремний, применяют на имплантатах, аутотрансплантатах, протезах сосудов, зубных протезах или клапанах сердца, и в частности, предпочтительно на аутотрансплантатах, зубных протезах и клапанах сердца.
Вышеназванные наносимые формы могут также содержать другие фармацевтические биологически активные вещества, которые можно дополнительно добавлять во время процесса изготовления.
Пояснения
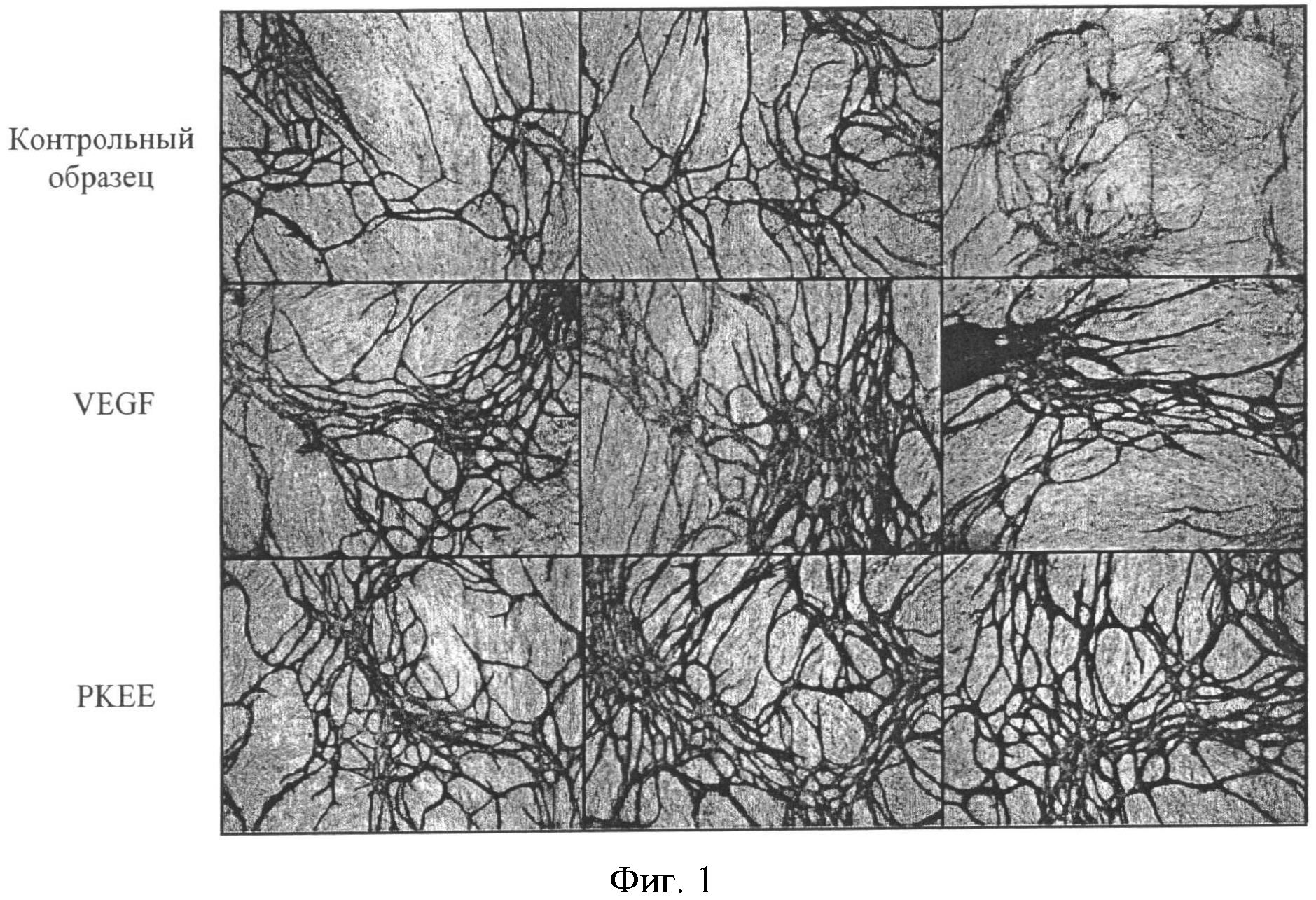
Фигура 1: Неоангиогенез при добавлении VEGF и материала согласно изобретению (РКЕЕ= соединения сложного этилового эфира полигидрокси-кремниевой кислоты) в виде матричного волокна к эндотелиальным клеткам человека (in vitro) выявили специфические антитела к поверхностному маркеру CD31. Испытание показывает неоангиогенез эндотелиальных клеток человека без добавления VEGF или РКЕЕ (отрицательный контроль).
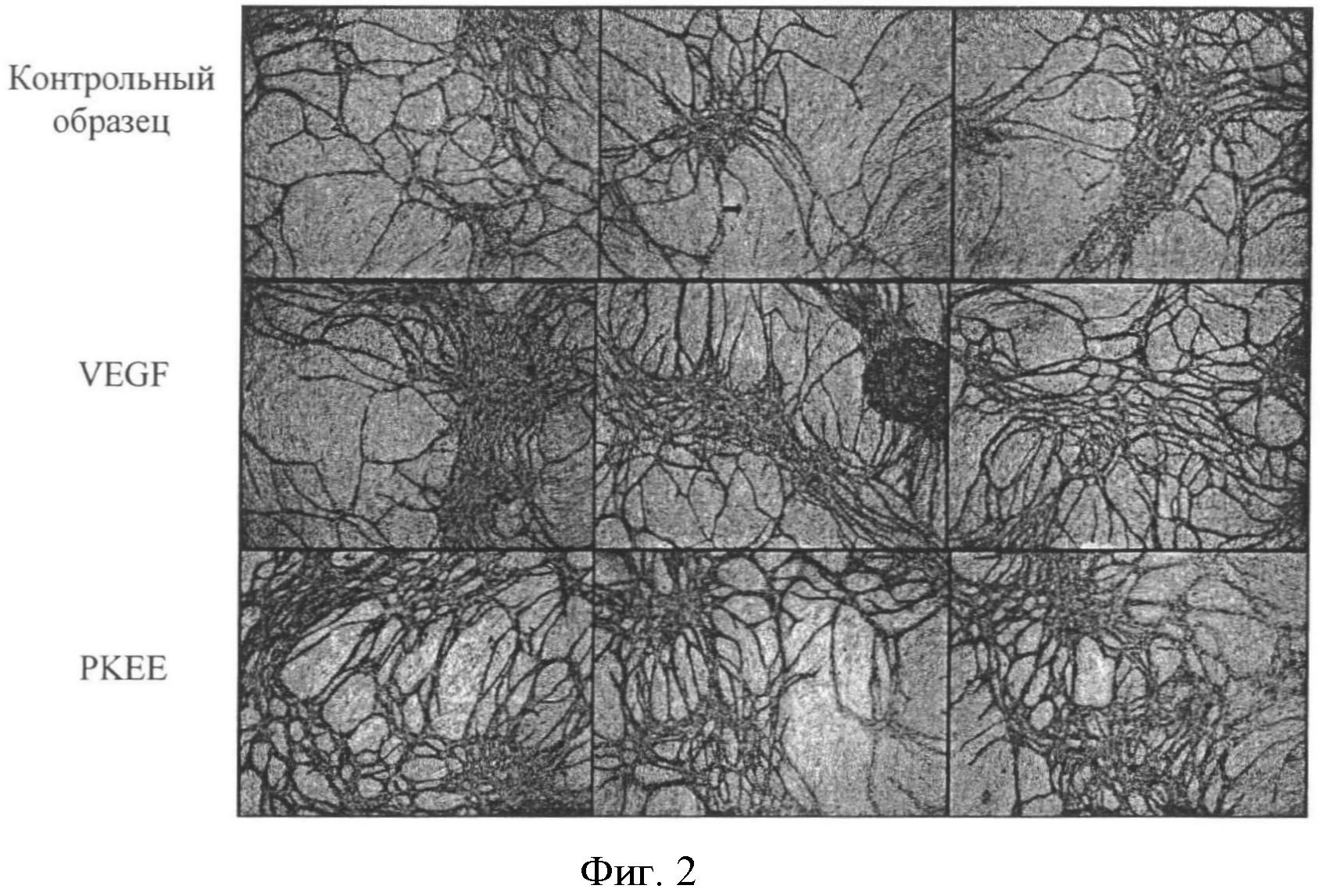
Фигура 2: Неоангиогенез при добавлении VEGF и материала согласно изобретению (РКЕЕ= соединения сложного этилового эфира полигидрокси-кремниевой кислоты) в виде матричного волокна к эндотелиальным клеткам человека (in vitro) выявили специфические антитела фактора Виллебранда (vWF). К= отрицательный контроль.
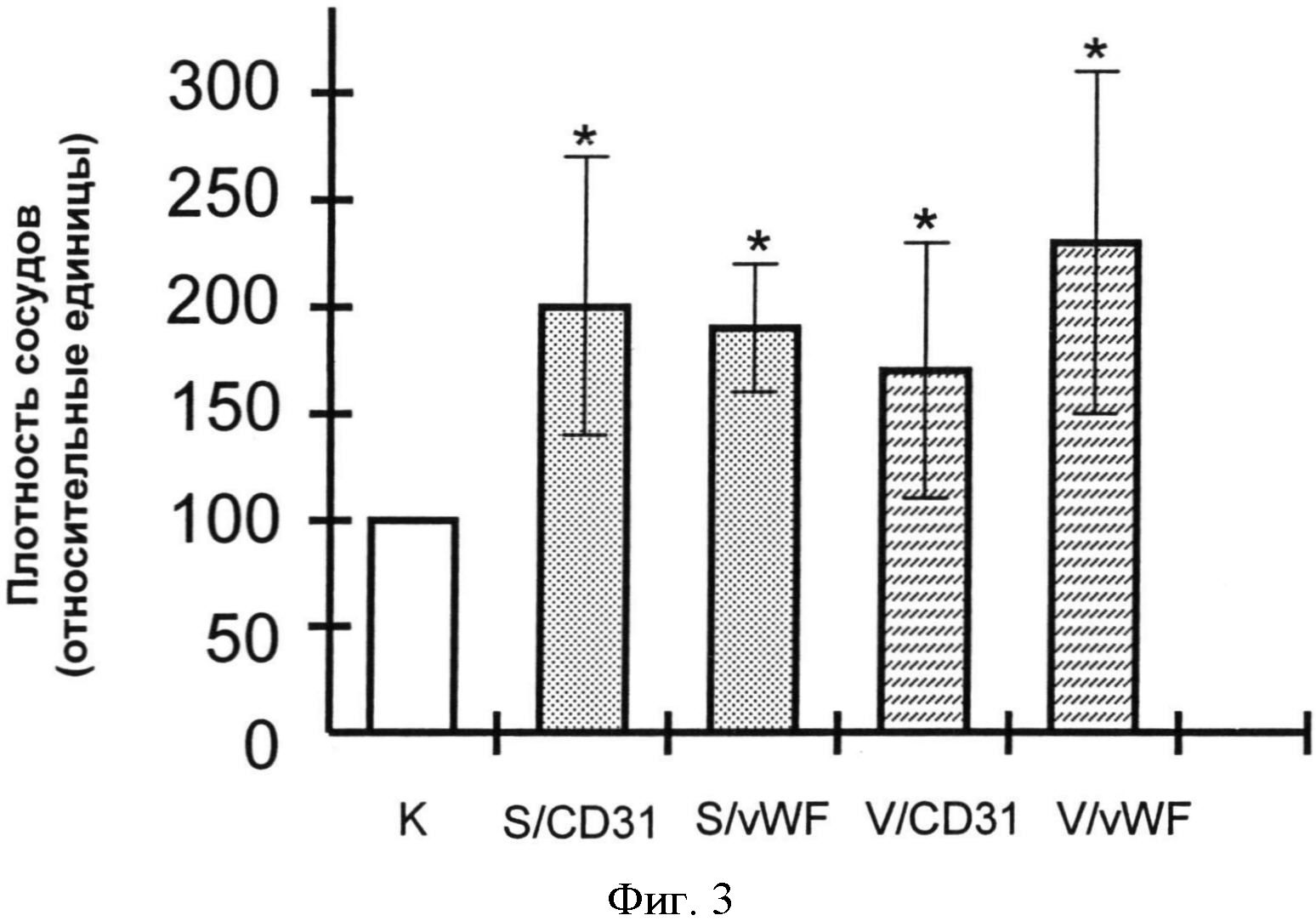
Фигура 3: Количественная оценка неоангиогенеза VEGF и материала согласно изобретению в виде матричного волокна (нетканого полотна) в человеческих эндотелиальных клетках. К= отрицательный контроль; S/CD31= материал согласно изобретению и доказательства неоангиогенеза над CD31-антителами; S/vWF= материал согласно изобретению и доказательства неоангиогенеза над vWF-антителами; V/CD31=VEGF и доказательства неоангиогенеза над CD31-антителами; V/vWF=VEGF и доказательства неоангиогенеза над vWF-антителами. *=р<0,05 по сравнению с контролем (t - критерий Стьюдента).
Фигура 4: Количественная оценка неоангиогенеза VEGF (V) и материала согласно изобретению в виде матричного волокна (S/T1= матричное волокно типа I; S/T2= матричное волокно типа II; S/T3= матричное волокно типа III; S/T4= матричное волокно типа IV, см. получение пример 1) в человеческих эндотелиальных клетках, принимая во внимание окрашивание микрососудов vWF антителами. К= отрицательный контроль; *=р<0,05 по сравнению с контролем (t - критерий Стьюдента).
Фигура 5: Количественная оценка неоангиогенеза VEGF (V) и материала согласно изобретению в виде матричного волокна (S/T1; S/T2; S/T3; S/T4= матричное волокно типа I, типа II, типа III, типа IV) в человеческих эндотелиальных клетках, принимая во внимание окрашивание микрососудов анти-CD31 антителами. К=отрицательный контроль; *=р<0,05 по сравнению с контролем (t - критерий Стьюдента).
Фигура 6: Количественный анализ VEGF-концентрации в жидкой фракции клеточных культур человеческих эндотелиальных клеток в отсутствии (контроль =К), а также в присутствии различных материалов согласно изобретению в виде матричного волокна (нетканое полотно; (S/T1; S/T2; S/T3; S/T4= матричное волокно типа I, типа II, типа III, типа IV)); #=р<0,05 по сравнению с контролем и по отношению к матричному волокну типов II-IV (критерий Тьюки); *=р<0,05 по сравнению с контролем (t - критерий Стьюдента).
Фигура 7: Количественный анализ влияния соленой морской воды на неоангиогенез в человеческих эндотелиальных клетках, принимая во внимание окрашивание микрососудов анти-CD31 антителах при контроле (К= только человеческие эндотелиальные клетки; K+Su= человеческие эндотелиальные клетки и добавление соленой морской воды), при добавлении согласно изобретению материала (Si= только материал согласно изобретению и Si+Su= материал согласно изобретению и соленая морская вода), а также добавление VEGF (V= добавление VEGF и V+Su= добавление VEGF и соленой морской воды). #=р<0,05 по сравнению с контролем (критерий Тьюки), *=р<0,05 по сравнению с культурами без соленой морской воды (t-критерий Стьюдента); Фигура 7 показывает, что материалы согласно изобретению индуцируют ангиогенез через VEGF. При наличии материала согласно изобретению (Si) можно наблюдать примерно 3,5-кратное повышение (по сравнению с контролем; примерно 350%) процентной части поверхности микрососудов. С помощью соленой морской воды этот эффект может усиливаться.
Примеры
1. Получение согласно изобретению матричного волокна из сложного этилового эфира полигидрокси-кремниевой кислоты
В качестве эдукта для реакции гидролизной конденсации помещают 1124,98 г ТЭОС (тетраэтоксисилана) в емкость с мешалкой. Добавляют 313,60 г EtOH в качестве растворителя. Смесь перемешивают. Отделенную смесь разбавляют 1 н HNO3 (55,62 г) с H2O (120,76 г) и добавляют смесь ТЭОС-этанола. Смесь перемешивают в течение 18 часов.
Затем смесь, полученную на этом этапе, выпаривали при температурах от 62°С под воздействием вынужденного потока и перемешивании (60 об/мин) до динамической вязкости (скорость сдвига 10 c-1 при 4°С) от 1 Па·с.
Затем раствор созревал в закрытом пропиленовом сосуде для созревания в неподвижном состоянии и вертикальном положении при температуре 4°С до динамической вязкости примерно 55 Па·с (скорость сдвига 10 с-1 при 4°С) и коэффициенте потерь 3,0.
Затем золь, полученный при созревании, подвергают прядению. Получение волокон производилось в обычном прядильном устройстве. Для этого прядильный раствор поместили в цилиндр под давлением, охлажденный до -15°С. Прядильный раствор выдавливали под давлением через насадку. Текучий, похожий на мед материал под воздействием собственного веса падает в прядильную шахту, находящуюся ниже цилиндра под давлением, длиной 2 м. В прядильной шахте установлена контролируемая температура и влажность. Температура составила 25°С, влажность воздуха 19%. При попадании волокон на специальный стол они почти сохранили цилиндрическую форму, однако были настолько текучими, что прилипли друг другу при соприкосновении в месте расположения волокон (нетканое полотно). Полученное таким образом волокно выгружают сразу после формования в течение 35 минут в такие же климатические условия, как и в прядильной колонке (т.е., например, влажность воздуха 19%, температура 25°С) (кондиционирование полученных волокон).
В общем, получено 8 различных видов нетканого полотна из сложного этилового эфира полигидрокси-кремниевой кислоты (типы I-IV, А1, А2, В1 и В2). Полученное волокно раскрывает диаметр около 50 мкм. Нетканое полотно А1, А2, В1 и В2 отличается разной пропускной способностью при формовании (и, соответственно, длительностью формования; см. таблицу 1). Указанная в таблице 1 в г/ч пропускная способность относится к общей пропускной способности золя. Давление в формовочном контейнере устанавливают таким образом, чтобы можно было достигнуть желаемой пропускной способности.
Нетканое полотно типа I, типа II, типа III и типа IV, отличается тем, что после вышеописанного этапа кондиционирования и упаковки нетканого материала до его использования его хранили разное количество времени в помещении с влажностью 35%-55% (см. таблицу 2). Во время хранения нетканого материала в упаковке влажность воздуха в ней благодаря наличию абсорбентов сильно снижается. Подходящие упаковки для хранения нетканого полотна взяли, например, из патентной заявки ЕР 09007271.
Различные условия получения приводят к различным свойствам нетканого материала, в частности, относительно сжимаемости этокси-количества нетканого материала после формования (см. таблицу 3).
Сжимаемость измерили и определили с помощью измерения плотности покрытия (толщиномером высокой точности модели 2000, фирмы Wolf Messtechnik GmbH) на основании стадий технологической обработки, названных в описании.
Содержание этоксигрупп определили стандартным способом при отщеплении эфира по методу Цейзеля. Исследуемое матричное волокно смешали с инертным стандартным раствором и нагревали с добавлением йодоводородной кислоты в газонепроницаемом закрытом стеклянном сосуде один час при 120°С. При этом имеющиеся этокси-группы превратили в этилиодид. Возникший таким образом этилиодид определяют при помощи газовой хроматографии, оценку осуществляют согласно методу внутренних стандартов. В качестве стандарта принимают толуол.
2. Неоангиогенез в эндотелиальных клетках человека
Примерная модель выполнения: Для определения неоангиогенеза использовали комплект оборудования для эссе исследования ангиогенеза фирмы TCS Cellworks (Букингем, Великобритания). Применяли пластинки с клеточной культурой с 24 отверстиями, основание которых было полностью покрыто клетками, состоящими из фибробластов и эндотелиальных клеток человека. Вся необходимая для проведения питательная клеточная среда, а также антитела для детектирования особых эндотелиальных клеток поверхностного антигена (CD31, фактор Виллебранда =vWF) также поступают из TCS Cellworks. Кроме того, для проведения опыта использовали подходящие для 24-волновых пластинок с клеточной культурой устройства для вертикального хранения из синтетических материалов, которые содержали различные субстраты. Содержимое устройства для вертикального хранения из синтетического материала отделяли с помощью мембраны среды культуры клеток. Однако по причине проницаемости мембраны возможен массообмен растворимыми веществами между содержимым устройства для вертикального хранения и питательной клеточной средой.
Проведение опыта: Клетки в испытываемых отверстиях пластинок с культурой накладывали слоями 300 мкл питательной клеточной среды на отверстие. Затем все отверстия оснащали устройствами для вертикального хранения из синтетического материала. Во время испытания соединения сложного этилового эфира полигидрокси-кремниевой кислоты соответственно 1 cm2 матричного волокна сложного этилового эфира полигидрокси-кремниевой кислоты поместили в вертикальное устройство и покрыли слоем из 350 мкл среды. Во время испытаний вертикальные устройства пополнили 350 мкл среды, в положительном контроле в вертикальные устройства добавили 350 мкл среды +2 нг/мл VEGF, и в отрицательном контроле вертикальные устройства заполнили 350 мкл среды +20 мкг/мл сурамина, сильного VEGF-ингибитора. Пластинки с культурой культивировали 7-12 дней, причем все три дня состоялся полный или частичный обмен среды или содержимого среды. В представленном на Фигуре 7 количественном анализе влияния соленой морской воды на неоангиогенез в эндотелиальных клетках человека соленую морскую воду поставляли одновременно с матричным волокном сложного этилового эфира полигидрокси-кремниевой кислоты (см. Si+Su) или VEGF (см. V+Su).
Анализ: Для определения процента ангиогенеза через 7-12 дней культивации вертикальные устройства и среду из пластинок с клеточной культурой удалили и плотно зафиксировали растущие клетки согласно предписанию производителя на дне пластинок с клеточной культурой. Для изображения образования микрососудов зафиксированные препараты окрасили с помощью особых эндотелиальных клеточных антител согласно предписанию производителя. Аналогично этому с помощью комплекта VEGF-ELISA-(R&D Systems, Абингдон, Великобритания) у всех полученных жидких фракций опыта определили концентрацию VEGF.
Результаты: После окрашивания соответственной культуры эндотелиальными клеточными антителами стало очевидно, что в культурах, которые инкубировали матричным волокном сложного этилового эфира полигидрокси-кремниевой кислоты, плотность образования микрососудов как после окрашивания CD31 (Фигура 1), так и после окрашивания vWF-особыми антителами (Фигура 2) была выше, чем в необработанном контроле и такой же или больше по сравнению с образованием микрососудов в положительном контроле, содержащем VEGF.
Для количественного определения упомянутых наблюдений использовали цифровые снимки результатов опыта, полученные с помощью ПО для обработки фотографий "ImageJ", для денситометрии. Как показано на Фигурах 3-5, относительная плотность сосудов в образцах, которые были обработаны матричным волокном сложного этилового эфира полигидрокси-кремниевой кислоты, характерно выше в контрольных культурах и сравнима с культурами, которые хранили в присутствии VEGF.
Для анализа влияния матричного волокна сложного этилового эфира полигидрокси-кремниевой кислоты на эндотелиальный VEGF-синтез вышеупомянутые опыты продолжили до 12 дней и для поддержания жизнедеятельности клеток не меняли питательную среду, а все 4 дня пополняли свежей. Благодаря этому смогли учитывать VEGF-количество, накопленное на протяжении всего опыта, и, таким образом, охватили VEGF-количество, которое лежало далеко за пределами обнаружения опыта. Как показано на Фигуре 6, инкубация эндотелиальных клеток матричным волокном сложного этилового эфира полигидрокси-кремниевой кислоты приводит к существенно повышенному VEGF-синтезу исходной опытной смеси, причем матричные волокна сложного этилового эфира полигидрокси-кремниевой кислоты типа I, в отличие от других типов силикатов, имеют повышенную VEGF-производительную способность.
Понятие "плотность сосудов" обозначает поверхность в пластинке с культурой, покрытую новыми возникшими капиллярными структурами, по отношению к общей поверхности. Измерение плотности сосудов осуществляют денситометрическим исследованием черных пиксельных частичек на черно-белой фотографии, окрашенной особыми антителами капиллярной структуры, по сравнению с белой поверхностью основания пластинки капиллярной структуры.
Понятие "процентная доля поверхности микрососудов" описывает, сколько процентов свободной поверхности (контроль соответствует 100%) получают с помощью микрососудов, индуцированных с помощью неоангиогенеза. Определение этих параметров осуществляли с помощью денситометрии. Для этого мы исследовали черно-белые фотографии культур для определения количества черных пикселей (= положительное окрашивание антителами эндотелиальных клеток).
3. Методы In vivo для неоангиогенеза материала согласно изобретению
Согласно изобретению матричное волокно сложного этилового эфира полигидрокси-кремниевой кислоты (А1, А2, В1 и В2) сравнили на примере животных (Свиньи; Middelkoop E, и др.. Porcine wound models for skin substitution and bum treatment. Biomaterials. апрель 2004; 25(9): 1559-67) с клиническим золотым стандартом (nSHT= сетчатый трансплантат расщепленного кожного лоскута; MDM = Matriderm® АО "Dr. Suwelack Skin & Health Care"). При этом йоркширским свиньям нанесли раны глубиной 3×3 см и 2,7 мм (открытые раны 3-ей степени). На эти открытые раны пересадили матричное волокно сложного этилового эфира полигидрокси-кремниевой кислоты (А1, А2, В1 и В2) согласно изобретению и контрольные образцы и сравнили друг с другом. Каждую матрицу нанесли на 4 различные раны. Через 13 дней после трансплантации с поверхности раны взяли биопсию и провели иммуногистохимию. При этом фактор Виллебранда окрасили по отношению к кровеносным сосудам (vWF; Ульрих ММ, и др.. Expression profile of proteins involved in scar formation in the healing process of full-thickness excisional wounds in the porcine model. Wound Repair Regen. июль - август 2007; 15(4):482-90) антителами. Окрашивание представили с помощью цифрового анализа образов. Для количественной оценки результатов применяли ПО NIS-Ar (Nikon). Наблюдали повышенное окрашивание (примерно в 2,8 раза) vWF-областей материалом согласно изобретению по сравнению с контрольными образцами (см. таблицу 4).

Реферат
Изобретение относится к медицине. Описан содержащий кремний биологически разлагаемый материал для профилактики и/или лечения заболеваний, которые сопровождаются пониженным и/или нарушенным ангиогенезом, и/или заболеваний, для которых для процесса выздоровления необходимо повышение ангиогенеза. Содержащий кремний биологически разлагаемый материал применяют в более высокой дозировке и он может разлагаться в организме, например, храниться подкожно в течение длительного времени и способствовать проангиогенным процессам. 6 з.п. ф-лы, 7 ил., 4 табл., 3 пр.
Формула
причем содержащий кремний биологически разлагаемый материал является соединением сложного этилового эфира полигидрокси-кремниевой кислоты общей формулы H[OSi8O12(OH)x(OC2H5)6-x]nOH, где х означает 2-5 и n>1,
причем материал находится в виде волокна, волокнистой матрицы, порошка, жидкой препаративной формы, монолита и/или наносимого слоя и является полученным посредством:
a) по меньшей мере, одной реакции гидролиз-конденсации тетраэтоксисилана,
b) выпаривания для получения однофазного раствора,
c) охлаждения однофазного раствора,
d) созревания, которое проводят до образования материала на основе кремниевого золя, и
e) получения материала на основе кремниевого золя путем вытягивания волокон для образования материала в виде волокна или волокнистой матрицы,
или высушивания материала на основе кремниевого золя для образования материала в виде порошка,
или высушивания материала на основе кремниевого золя для образования порошка и растворения порошка в растворителе для образования жидкой препаративной формы,
или нанесения покрытия из материала на основе кремниевого золя на предмет, подлежащий нанесению на него содержащего кремний биологически разлагаемого материала,
или литья материала на основе кремниевого золя в форму для образования монолита,
причем тетраэтоксисилан подвергают кислотному катализу на этапе а) при первоначальном значении pH от 0 до ≤7, при температуре 0-80°C, и на этапе b) выпаривание проводят до получения однофазного раствора с вязкостью в пределах 0,5-2 Па·с при скорости сдвига 10 с-1 при 4°C,
причем кислотный катализ на этапе а) проводят с азотнокислой Н2О в молярном соотношении к кремниевому соединению в пределах 1:1,7-1:1,9,
а заболевания выбраны из следующих групп:
а) заболевания кровообращения и/или сердечно-сосудистой системы, как:
анемия, стенокардия, окклюзия (периферических) артерий, артериосклероз, облитерирующий тромбангиит, инфаркт миокарда, ишемия, кардиомиопатия, застойная сердечная недостаточность, заболевания коронарных артерий, наследственная геморрагическая телеангиоэктазия, гиперхолестеринемия, ишемическое сердечное заболевание, миокардиальная системная склеродермия, миоинтимальная гиперплазия, закупоренные кровеносные сосуды, атеросклеротические заболевания периферических сосудов, портальная гипертензия, преэклампсия, ревматическое сердечное заболевание, повышенное кровяное давление, тромбоэмболические заболевания,
b) заболевания костей, хрящей или мышц, как:
восстановление костей/хрящей, костные дефекты, переломы, рост костей, заболевания хрящей, дегенерация межпозвоночных дисков, остеоартрит, остеопороз, переломы позвоночника, фибромиалгия, полимиозит,
c) заболевания центральной нервной системы, как:
ишемия в центральной или периферической нервной системе, болезнь Альцгеймера, боковой (латеральный) амиотрофический склероз, автономная невропатия, аневризмы, церебральный инфаркт, апоплексический удар, цереброваскулярные заболевания, недостаточное цереброваскулярное кровоснабжение, слабоумие, эпилепсия, ишемическая периферическая нейропатия, минимальный когнитивный дефицит, рассеянный склероз, нервные расстройства, болезнь Паркинсона, липоидно-клеточная спленогепатомегалия, полиневропатия, шизофрения, повреждения спинного мозга, токсическая нейропатия;
d) заболевания глаз, как:
глаукома; ретинопатия;
e) заболевания желудочно-кишечного тракта, как:
болезнь Крона, язва желудка, интестинальная ишемия, синдром раздраженного кишечника, панкреатит, язвенный колит;
f) гормональные заболевания или заболевания, связанные с обменом веществ, как:
сахарный диабет, диабетическая стопа, периферическая диабетическая ангиопатия;
g) заболевания иммунной системы, как:
аллергия, мастоцитоз, болезнь Шегрена, отторжение трансплантата, дефекты ткани при коллагенозах, дерматомиозит, системная красная волчанка, CREST-синдром, синдром Шарпа;
h) инфекционные заболевания, как:
септический шок;
i) заболевания почек, как:
нефропатия, внутричерепное повышенное давление, ишемическая болезнь почек;
j) заболевания ротовой полости, как:
зубные бляшки, заболевания десен,
k) болезни репродуктивной системы, как:
эректильная дисфункция,
i) заболевания дыхательных путей, как:
астма, бронхопульмональная дисплазия, воспаление легких, респираторный дистресс-синдром,
m) заболевания кожи, как:
неспецифический дерматит, пролежни, дермальная ишемия, кожные нарывы, диабетическая гангрена, диабетические кожные язвы, рваные раны, псориаз, склеродермия, повреждения кожи, ожоги, хирургические раны, заживление ран;
n) васкулярные заболевания, как:
васкулярная недостаточность, васкулярный рестеноз, васкулит, спазм сосудов, гранулематоз Вегенера;
о) другие заболевания, как:
выпадение волос, лактатацидоз, ишемии конечностей, цирроз печени, ишемия печени, митохондриальная энцефалопатия, саркоидоз, повреждения мягких тканей, заболевания, которые лечат с помощью аутотрансплантатов тканей и/или органов.
выпаривание для получения однофазного раствора на этапе b) осуществляют при одновременном бережном перемешивании реакционной системы, и/или
на этапе е) осуществляют высушивание путем распылительной сушки или лиофилизирования материала на основе кремниевого золя для образования порошка.

Комментарии