Анионные полимеры в качестве веществ для связывания токсинов и антибактериальных средств - RU2246938C2
Код документа: RU2246938C2
Чертежи
Описание
Данная заявка претендует на приоритет заявки США №09/541268, поданной 3 апреля 2000 г., и предварительной заявки №60/133975, поданной 13 мая 1999 г., которая полностью включена в нижеследующее описание изобретения в качестве ссылки.
Многие патогенные микроорганизмы продуцируют токсины, которые оказывают вредное воздействие на организм хозяина и в некоторых случаях вызывают его гибель. Токсины, продуцируемые патогенными микроорганизмами, можно разделить на две основные категории, а именно экзотоксины и эндотоксины.
Экзотоксины обычно являются белками или полипептидами. Указанные токсины, секретируемые патогенными микроорганизмами, могут перемещаться в организме хозяина и поражать области, удаленные от места заражения. Поражение экзотоксинами может сопровождаться различными симптомами, к которым относятся гемолиз, системный шок, разрушение лейкоцитов, рвота, паралич и диарея.
Энтеротоксины представляют собой экзотоксины, которые воздействуют на тонкий кишечник и вызывают сильное выделение жидкости в полость кишечника, что ведет к возникновению диареи. Энтеротоксины продуцируются разными бактериями, в том числе микроорганизмами, вызывающими пищевую интоксикацию, такими как Staphylococcus aureus, Clostridium perfringens и Bacillus cereus, а также кишечными патогенными микроорганизмами, в частности Vibrio cholerae, Escherichia coli и Salmonella enteritidis.
Эндотоксины являются липополисахаридами, липопротеинами, обнаруженными в наружном слое клеточной оболочки грамотрицательных бактерий. Указанные липополисахариды связаны с клеточной мембраной и высвобождаются в процессе цитолиза. Высвобождение эндотоксинов сопровождается такими симптомами, как лихорадка, диарея и рвота. В частности, эндотоксины стимулируют высвобождение клетками-хозяевами белков, эндогенных пирогенов, которые воздействуют на участок мозга, регулирующий температуру тела. Помимо лихорадки, диареи и рвоты у животного-хозяина быстро уменьшается количество лимфоцитов, лейкоцитов и тромбоцитов, что ведет к общему воспалению.
Хотя эндотоксины менее токсичны, чем экзотоксины, высокий уровень эндотоксинов может быть причиной летального исхода, особенно в случае геморрагического шока и некроза тканей. В качестве примеров бактерий, продуцирующих эндотоксины, можно привести бактерии родов Escherichia, Shigella и особенно Salmonella.
В некоторых случаях острое заболевание, вызванное экзотоксином, можно лечить, вводя нуждающемуся субъекту антитоксин. Антитоксин содержит антитела к токсину, выделенные из сыворотки животного, обычно лошади, которое было иммунизировано инъекцией токсоида, нетоксичного производного токсина. Однако эффективность антитоксинов ограничена, так как токсины быстро поглощаются клетками и становятся недоступными для антител. Кроме того, иммунная система субъекта может реагировать на чужеродные белки, присутствующие в антитоксине, возникновением сывороточной болезни.
Clostridium difficile представляет собой нозокомиальную инфекцию, которая особенно широко распространена в больницах и других лечебных учреждениях. Указанные микроорганизмы обычно поражают субъектов, у которых микрофлора кишечника нарушена введением антибиотика широкого спектра действия. Диарея и воспалительный колит, вызванные инфекцией, являются серьезным медицинским/хирургическим осложнением, которое ухудшает состояние субъекта, увеличивает смертность и срок пребывания в больнице в среднем примерно на три недели. Это особенно верно для пожилых людей и пациентов с серьезными сопутствующими заболеваниями, вероятность инфицирования которых достаточно высока. Диарея, обусловленная С. difficile, (CDAD) является причиной больших экономических затрат со стороны системы здравоохранения, которые только в США составляют 3-6 миллиардов долларов в год помимо обычных расходов на лечение в клинических условиях.
Лечение CDAD в настоящее время является малоэффективным. Такое лечение сводится к прекращению введения антибиотика, вызывающего CDAD, и как можно быстрому восстановлению нормальной микрофлоры кишечника. Однако в большинстве случаев этого бывает недостаточно, и для уничтожения микроорганизмов С. difficile используют другой антибиотик, в частности метронидазол или ванкомицин. При введении метронидазола ослабление симптомов заболевания происходит медленно, обычно в течение 4-8 дней. Кроме того, поскольку метронидазол также изменяет нормальную микрофлору, уничтожая большинство анаэробов в кишечнике, у 20% субъектов, прошедших лечение указанным препаратом, происходит рецидив CDAD, обычно в течение 1-2 недель после прекращения лечения. В серьезных случаях или при рецидиве CDAD можно использовать ванкомицин. Однако при лечении указанным лекарственным средством рецидив возникает так же, как и при введении метронидазола, но при этом имеет место нежелательный побочный эффект, связанный с появлением устойчивых к лекарственным средствам энтерококков и стафилококков.
Диарея и колит являются прямым результатом поражения и воспаления кишечника, вызываемого токсинами А и В С. difficile. Токсины А и В, продуцируемые С. difficile, поражают слизистую оболочку кишечника и являются этиологическими веществами, вызывающими воспалительный колит. В настоящее время отсутствуют терапевтические методы, позволяющие подавлять бактериальные токсины, продуцируемые С. difficile, которые поражают кишечник и вызывают воспаление, ведущее к возникновению диареи и колита. Фармацевтические средства, способные ингибировать токсины А и В, представляют собой наиболее многообещающий подход к лечению CDAD.
Поэтому существует потребность в усовершенствованном методе лечения заболеваний, обусловленных токсинами, который позволил бы существенно уменьшить или полностью устранить вышеуказанные проблемы.
Настоящее изобретение относится к способу ингибирования токсина у животного, в частности у человека, путем введения указанному животному терапевтически эффективного количества полимера, имеющего несколько боковых кислотных функциональных групп, которые присоединены непосредственно к главной цепи полимера или связаны с ней при помощи промежуточной группы. Промежуточная группа может представлять собой цепь длиной от 0 до около 20 атомов. Токсин обычно является экзотоксином, секретируемым патогенными микроорганизмами, в частности бактериями. В предпочтительном варианте осуществления изобретения полимер практически не содержит групп ангидридов кислоты.
В соответствии с другим вариантом осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим анионные полимеры, и к способам лечения CDAD и других видов диареи, обусловленной антибиотиками (AAD) у млекопитающих, в частности у человека. Терапевтические композиции по данному изобретению предпочтительно инактивируют токсины А и В С. difficile и эффективно предотвращают возникновение CDAD (профилактическое лечение), а также препятствуют рецидиву CDAD при лечении одним или несколькими антибиотиками (например, метронидазолом и ванкомицином).
Как указывалось выше, полимеры, используемые в описываемых способах, замещены кислотными или анионными группами. Приемлемыми кислотными функциональными группами являются группы карбоновой, сульфоновой, фосфоновой, сульфаминовой и бороновой кислот, гидросульфатные и гидрофосфатные группы. Кислотные группы могут также присутствовать в форме конъюгата с основанием в сочетании с приемлемым катионом.
В одном варианте осуществления изобретения предназначенный для введения полимер является сополимером, который характеризуется наличием первого мономера или повторяющегося звена, имеющего боковую кислотную функциональную группу, и второго мономера или повторяющегося звена, имеющего боковую гидрофобную группу. В другом варианте осуществления изобретения полимер характеризуется наличием мономера или повторяющегося звена, имеющего боковую кислотную функциональную группу и боковую гидрофобную группу. В вводимом полимере возможно присутствие мономера или повторяющегося звена, имеющего нейтральную гидрофильную группу, такую как гидроксильная или амидная группа.
Предпочтительные терапевтические композиции, предназначенные для использования в способах по данному изобретению, содержат полистиролсульфонат и его соли. Предпочтительные способы по данному изобретению включают введение пациенту терапевтически эффективного количества композиции по данному изобретению одновременно с антибиотиком широкого спектра действия, который при отсутствии полистиролсодержащей композиции по данному изобретению может способствовать возникновению CDAD или AAD. Введение указанного препарата одновременно с антибиотиком широкого спектра действия не оказывает влияния на эффективность антибиотика и в то же время позволяет предотвратить возникновение CDAD или AAD.
В другом варианте осуществления изобретения композиции по данному изобретению можно использовать отдельно или совместно с метронидазолом, ванкомицином или другими антибиотиками, применяемыми для лечения CDAD или AAD после возникновения указанного заболевания. В еще одном варианте осуществления изобретения композиции по данному изобретению можно использовать отдельно или совместно с другими антибиотиками, применяемыми для профилактики возникновения или рецидива заболевания.
Настоящее изобретение характеризуется многими преимуществами. Например, композиции, применяемые в способах по данному изобретению, можно легко получить, используя стандартные методы синтеза полимеров и дешевые исходные вещества. Способы по данному изобретению не влияют на активность антибиотиков широкого спектра действия, которые часто необходимы для лечения других инфекций, поэтому композиции по настоящему изобретению можно вводить вместе с указанными антибиотиками. При этом пациент может быть защищен от вредных побочных эффектов антибиотиков широкого спектра действия, часто вызывающих CDAD или AAD, благодаря профилактическому методу лечения согласно данному изобретению, проводимому одновременно с введением пациенту антибиотиков широкого спектра действия. Аналогичным образом, методы лечения согласно изобретению не влияют на действие метронидазола или ванкомицина, и поэтому их можно применять одновременно с введением указанных антибиотиков во время заболевания или после прекращения введения антибиотиков для профилактики рецидива болезни. Кроме того, композиции и методы лечения согласно изобретению можно использовать для проведения монотерапии с целью предупреждения возникновения заболевания (профилактики), лечения болезни после ее возникновения или предотвращения рецидива. Монотерапия согласно данному изобретению является особенно эффективной в том случае, когда пациент не переносит лечения антибиотиками.
Вышеуказанные и другие цели, особенности и преимущества данного изобретения будут очевидны из нижеследующего более подробного описания предпочтительных вариантов осуществления изобретения, проиллюстрированного прилагаемыми чертежами, на которых отличительные особенности рассмотрены с разных точек зрения. На чертежах, которые не требуют точного выдерживания масштаба, главное внимание уделено иллюстрации основных принципов изобретения.
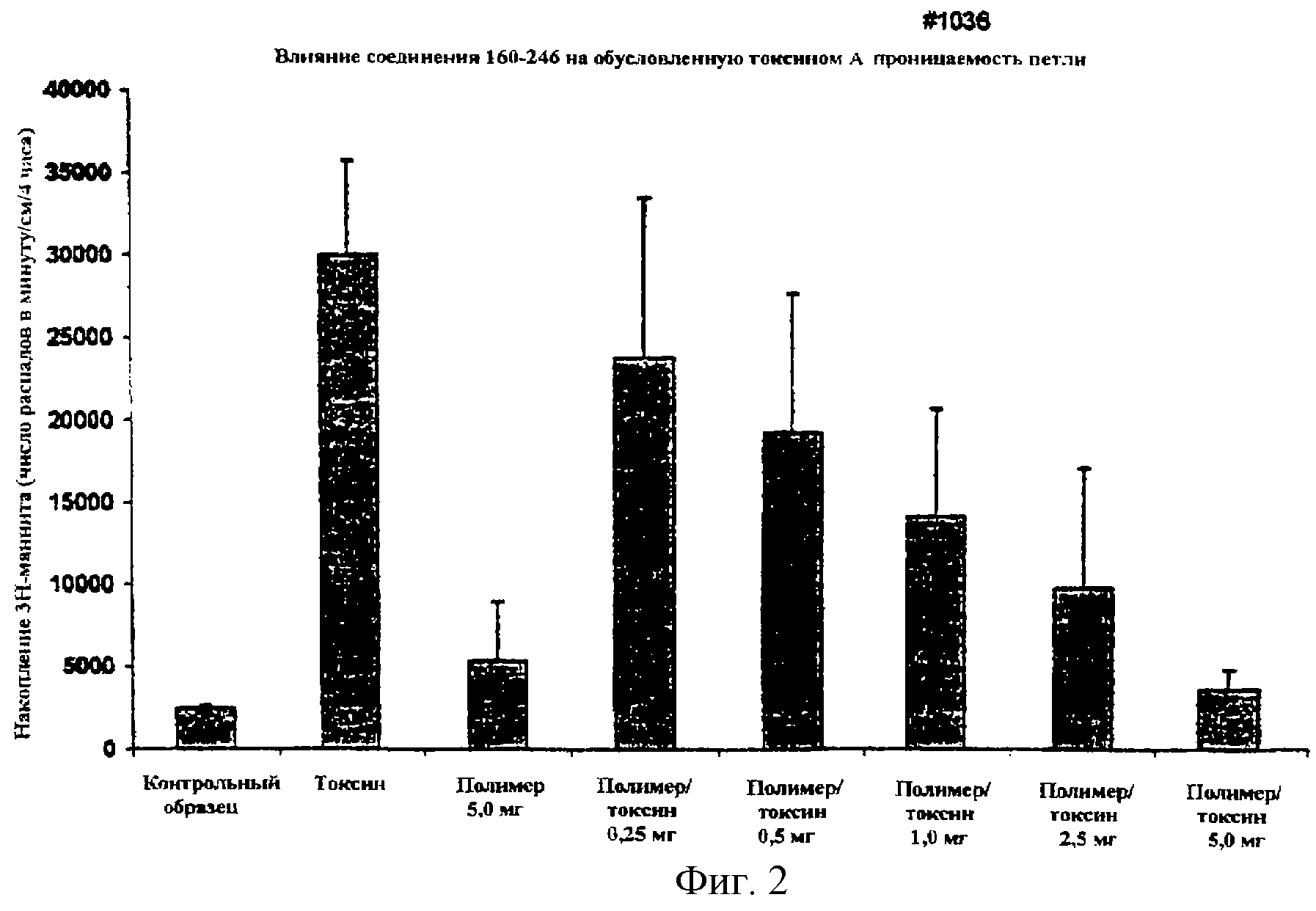
На фигурах 1 и 2 показано действие полистиролсульфоната (160-246) на токсин А, проиллюстрированное на двух животных моделях с использованием хомячков и более подробно описанное ниже.
Настоящее изобретение относится к способу ингибирования патогенного или микробного токсина у пациента, такого как человек, путем введения пациенту терапевтически эффективного количества полимера, имеющего несколько боковых кислотных функциональных групп. Кислотная функциональная группа может быть присоединена непосредственно к главной цепи полимера или связана с ней при помощи алифатической промежуточной группы с длиной цепи от 1 до около 20 атомов.
В используемом здесь значении термин "ингибирование микробного токсина" означает подавление активности токсина, вызывающего возникновение конкретного заболевания или болезненного состояния. Микробный токсин является эндотоксином или экзотоксином, продуцируемым такими микроорганизмами, как бактерии, грибы, простейшие или вирусы. Ингибирование токсина может происходить в соответствии с любым механизмом, который включает, но не ограничивается связыванием токсина полимером. В используемом здесь значении термин "терапевтически эффективное количество" означает количество, достаточное для полного или частичного устранения или предупреждения поражения тканей или других симптомов, обусловленных воздействием токсина на организм субъекта, либо для профилактики или ослабления дальнейшего развития таких симптомов.
Настоящее изобретение относится к способам и терапевтическим композициям, пригодным для лечения AAD, включая CDAD, и колита. В используемом здесь значении термин "лечение" болезней по данному изобретению означает профилактическое лечение млекопитающих, восприимчивых к AAD, CDAD или воспалительному колиту; лечение на начальной стадии возникновения AAD, CDAD или воспалительного колита; лечение AAD, CDAD или воспалительного колита в острой стадии заболевания; и лечение рецидива AAD, CDAD или воспалительного колита. В используемом здесь значении термин "восприимчивое" млекопитающее означает любое млекопитающее, подверженное возникновению или рецидиву заболевания вследствие использования антибиотиков широкого спектра действия, способных разрушить нормальную микрофлору и вызвать CDAD. Терапевтические композиции по данному изобретению предпочтительно содержат полистиролсульфонат, его соли и сополимеры.
Термин "мономер" в используемом здесь значении означает молекулу, которая до полимеризации содержит одну или несколько полимеризуемых функциональных групп и является повторяющимся звеном полимера. Сополимер характеризуется наличием двух или более разных мономеров.
В используемом здесь значении термин "главная цепь полимера" или "главная цепь" означает часть полимера, которая представляет собой непрерывную цепь, имеющую связи, образованные между мономерами в процессе полимеризации. Структуру главной цепи полимера можно описать на основе мономеров, из которых она образована, с учетом структуры ответвлений или боковых цепей, отходящих от главной цепи. Так, полиакриловая кислота имеет полиэтиленовую главную цепь, которая замещена группами карбоновой кислоты (-С(О)ОН) в виде боковых цепей.
"Боковая" группа означает часть молекулы, которая образует боковую цепь или часть боковой цепи, присоединенную к главной цепи полимера. Например, боковая группа может быть присоединена непосредственно к одному или нескольким атомам в главной цепи полимера или связана с главной цепью полимера при помощи промежуточной группы.
Мономер с кислотной функциональностью содержит боковую кислотную функциональную группу, такую как группа карбоновой, сульфоновой, фосфоновой, сульфаминовой или бороновой кислот, гидросульфатную или гидрофосфатную группу. Кислотные функциональные группы, о которых здесь идет речь, имеют кислотную протонированную форму или частично протонированную форму. Однако следует отметить, что любая кислотная функциональная группа может существовать в виде конъюгата с основанием или в депротонированной форме, в сочетании с фармацевтически приемлемым катионом. Вводимый полимер может содержать кислотные функциональные группы в протонированной, депротонированной или комбинированной форме. Приемлемыми катионами являются ионы щелочных металлов, такие как ионы натрия, калия и цезия, ионы щелочноземельных металлов, такие как ионы кальция и магния, ионы переходных металлов, а также ионы незамещенного и замещенного (первичного, вторичного, третичного и четвертичного) аммония. В одном варианте осуществления изобретения катион является ионом поливалентного металла, таким как Са2+, Мg2+, Zn2+, Al3+, Bi3+, Fe2+ или Fe3+.
Предпочтительно упомянутый полимер не содержит групп ангидрида кислоты. Например, такие группы составляют менее 5%, предпочтительно менее 2%. Более предпочтительно, когда ни одна из кислотных функциональных групп в полимере не находится в форме ангидрида.
Кислотная функциональная группа может быть присоединена непосредственно к главной цепи полимера или связана с ней при помощи промежуточной группы. Промежуточная группа является составной частью боковой цепи полимера и присоединяет кислотную функциональную группу к главной цепи полимера. Промежуточная группа может быть линейной, разветвленной или циклической, алифатической, ароматической или частично ароматической и частично алифатической. Приемлемые алифатические промежуточные группы включают группы с нормальной или разветвленной цепью, насыщенные или частично ненасыщенные углеводородные группы, в том числе алкиленовые группы, например полиметиленовые группы, такие как -(СН2)n-, где n означает целое число от 1 до около 20, и циклоалкиленовые группы, такие как 1,4-циклогексиленовая группа. Алкиленовая группа может быть замещена или не замещена. Приемлемыми заместителями алкилена являются гидроксильные группы и атомы галогена, например атомы фтора, хлора и брома. Алкиленовая группа может быть также прервана одним или несколькими гетероатомами, такими как атом кислорода, азота или серы. В качестве примеров можно привести оксаалкиленовые группы, например -(CH2)2O[(СН2)2O]n(СН2)2 -, где n означает целое число от 0 до около 3. Промежуточная группа может быть также частично ненасыщенной группой, такой как замещенная или незамещенная С2-С20-алкениленовая группа или С2-С20-алкениленовая группа, прерванная одним или несколькими гетероатомами. Приемлемые ароматические промежуточные группы включают орто-, мета- и парафениленовые группы, нафтиленовые группы и бифениленовые группы.
В одном варианте осуществления изобретения по крайней мере часть повторяющихся звеньев в полимере имеет боковую гидрофобную группу. Боковая гидрофобная группа может быть замещенной или незамещенной, насыщенной или частично ненасыщенной С2-С24-углеводородной группой, замещенной или незамещенной арильной или арилалкильной группой. Примерами приемлемых заместителей алкила являются атомы галогена, такие как атомы фтора или хлора, и арильные группы, такие как фенильная группа. Арильные заместители могут включать атомы галогенов, C1-С6-алкильные группы и C1-С6-алкоксильные группы. Боковая гидрофобная группа предпочтительно является С2-С24-алкильной группой с нормальной или разветвленной цепью.
В одном варианте осуществления изобретения предназначенный для введения полимер является гомополимером. В другом варианте осуществления изобретения предназначенный для введения полимер является сополимером, который содержит мономер с кислотными функциональными группами и гидрофобный мономер. Термин "гидрофобный мономер" в используемом здесь значении означает мономер, имеющий вышеописанную боковую гидрофобную группу. Приемлемыми гидрофобными мономерами являются, но не ограничиваются ими, замещенный или незамещенный N-С3-С24-алкилакриламид, такой как N-н-децилакриламид и N-изопропилакриламид; замещенные или незамещенные С3-С24-алкилакрилаты, такие как н-бутилакрилат и н-децилакрилат; стирол и замещенные стиролы, такие как пентафторстирол и 4-фторстирол; винилнафталин и винилбифенил. Сополимер может содержать разные компоненты, например от около 10 мол. % до около 50 мол. % гидрофобного мономера и от около 90 мол. % до около 50 мол. % мономера с кислотными функциональными группами.
В предпочтительном варианте осуществления изобретения предназначенный для введения полимер имеет повторяющееся звено с одной кислотной функциональной группой. В данном варианте осуществления изобретения две кислотные функциональные группы не могут быть присоединены к смежным атомам главной цепи полимера. В одном варианте осуществления изобретения предназначенный для введения полимер имеет повторяющееся звено или мономер общей формулы

где Х означает вышеописанную промежуточную группу или простую связь, R1 и R2 независимо означают водород или алкильную группу, предпочтительно метил или этил, и Y означает кислотную функциональную группу. Примерами приемлемых мономеров указанного типа являются акриловая кислота, метакриловая кислота, винилсульфоновая кислота, винилфосфоновая кислота, 3-аллилокси-2-гидрокси-1-пропансульфоновая кислота, винилуксусная кислоты и сложные эфиры винилового и аллилового спирта с минеральными кислотами, такими как серная, фосфорная и борная кислоты, в том числе винилгидросульфат, винилдигидрофосфат, аллилгидросульфат, аллилдигидрофосфат и их коньюгаты с основанием. Мономер может также представлять собой полимеризованный алкен, замещенный кислотной функциональной группой, такой как ундеценовая кислота, ундеценилгидросульфат и ундеценилсульфоновая кислота. Другие приемлемые примеры включают стирол с функциональными кислотными группами, такой как стиролсульфонат, стиролфосфонат и винилбензойная кислота, винилнафталин с кислотными функциональными группами, такой как винилнафталинсульфонат, и винилбифенил с кислотными функциональными группами, такой как винилбифенилсульфонат.
В другом варианте осуществления изобретения предназначенный для введения полимер имеет повторяющееся звено или мономер общей формулы
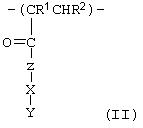
где Z означает кислород или NH и Х означает вышеописанную промежуточную группу или простую связь. Y означает кислотную функциональную группу и R1 и R2 независимо означают водород или алкильную группу, предпочтительно метил или этил. Примерами приемлемых мономеров указанного типа являются 2-акриламидогликолевая кислота и 2-акриламидо-2-метил-1-пропансульфоновая кислота.
Приемлемыми сополимерами, предназначенными для использования в способе по настоящему изобретению, являются сополимеры акриловой кислоты и С2-С20 -алкилакрилата, такие как сополимер акриловой кислоты и н-децилакрилата и сополимер акриловой кислоты и н-бутилакрилата. К таким сополимерам относятся также сополимеры акриловой кислоты и N-C2-C20-алкилакриламида, такие как сополимер акриловой кислоты и N-изо-пропилакриламида и сополимер акриловой кислоты и N-н-децилакриламида, а также сополимеры акриловой кислоты и стирола или замещенного стирола, такого как пентафторстирол или 4-фторстирол.
В другом варианте осуществления изобретения предназначенный для введения полимер является сополимером, содержащим мономер с кислотными функциональными группами, гидрофобный мономер и нейтральный гидрофильный мономер. Нейтральный гидрофильный мономер представляет собой мономер, содержащий полярную группу, которая практически не является ни кислотной, ни основной по физиологическому показателю рН. Примерами приемлемых нейтральных гидрофильных мономеров являются акриламид, N-(2-гидроксиэтил)акриламид, N-(3-гидроксипропил)акриламид, 2-гидроксиэтилакрилат, винилацетат, виниловый спирт и N-винилпирролидон. Приемлемым сополимером указанного типа является тройной сополимер акриловой кислоты, н-децилакрилата и акриламида.
Предназначенный для введения полимер может иметь также повторяющееся звено, содержащее боковую гидрофобную группу и боковую кислотную функциональную группу. Приемлемыми гидрофобными группами и кислотными функциональными группами являются вышеописанные группы. Полимеры указанного типа включают поли-2-алкилакриловую кислоту, в которой алкильная группа содержит от 2 до около 24 атомов углерода. Приемлемым полимером данного типа является поли-2-этилакриловая кислота или ее конъюгат с основанием. Предназначенный для введения полимер может также содержать первый мономер, имеющий боковую гидрофобную группу и боковую кислотную функциональную группу, и второй нейтральный гидрофильный мономер, аналогичный вышеописанным нейтральным гидрофильным мономерам.
В одном варианте осуществления изобретения предназначенный для введения полимер содержит первое повторяющееся звено, имеющее боковую кислотную функциональную группу, и второе повторяющееся звено, имеющее боковую группу, представляющую собой производное кислоты, такую как амидная группа или сложноэфирная группа. Приемлемыми примерами полимеров указанного типа могут быть полистиролсульфонат, в котором часть сульфонатных групп превращена в сульфонамидные группы или сложноэфирные группы сульфоната, и полиакрилат, в котором часть карбоксилатных групп превращена в амидные или сложноэфирные группы. Свойства полимера можно изменить, изменяя количество и химические свойства групп, вводимых в полимер в процессе амидирования или этерификации. В одном варианте осуществления изобретения полимер содержит повторяющиеся звенья с боковыми сложноэфирными группами, которые получают из спирта, такого как ментол, желчной кислоты, такой как холевая или литохолевая кислота, или алканола, такого как С4-С12-алканол с нормальной или разветвленной цепью. В другом варианте осуществления изобретения полимер содержит повторяющиеся звенья с боковыми амидными группами, которые получают из амина, такого как алкиламин, например С4-С12-алкиламин, с нормальной или разветвленной цепью или аммонийалкиламин. Приемлемыми аммонийалкиламинами являются соединения формулы R1(R2)(R3)N+CH2)nNH2, где R1, R2 и R3 независимо означают водород, С1-С12-алкильную группу или арилалкильную группу и n означает целое число от 1 до около 12.
В другом варианте осуществления изобретения предназначенный для введения полимер является сополимером, содержащим повторяющееся звено мономера с кислотными функциональными группами, катионное повторяющееся звено и необязательно гидрофобное повторяющееся звено и/или нейтральное гидрофильное повторяющееся звено. Например, повторяющееся звено с кислотными функциональными группами, гидрофобное и нейтральное гидрофильное повторяющееся звено могут включать любые повторяющиеся звенья вышеописанных типов. Катионное повторяющееся звено имеет положительный заряд в физиологических условиях и предпочтительно содержит боковую аминогруппу или аммониевую группу. Подходящими повторяющимися звеньями указанного типа являются звенья, описанные в заявке на патент США №08/934495, которая включена в данное описание изобретения в качестве ссылки. Примерами приемлемых катионных повторяющихся звеньев являются звенья аллиламина, N-замещенного аллиламина, кватернизованного аллиламина, диаллиламина, N-замещенного диаллиламина, квартернизованного диаллиламина, виниламина, N-замещенного виниламина, кватернизованного виниламина, N-аминоалкилакриламида и -метакриламида, N-аммонийалкилакриламида и -метакриламида, аминоалкилакрилата и -метакрилата, аммонийалкилакрилата и -метакрилата. Соотношение анионных и катионных повторяющихся звеньев может изменяться в широких пределах, например от около 95% анионного мономера и 5% катионного мономера в расчете на общее количество заряженных мономеров в полимере, до около 5% анионного мономера и 95% катионного мономера в расчете на общее количество заряженных мономеров, причем предпочтительно 75% или более мономеров являются анионными.
Предпочтительными полимерами по данному изобретению являются, но не ограничиваются ими:
поливинилсульфат, полипропенсульфат, полибутенсульфат, полипентенсульфат, полигексенсульфат, полигептенсульфат, полиоктенсульфат, полиноненсульфат, полидеценсульфат, полиундеценсульфат, полидодеценсульфат;
поливинилсульфонат, полипропенсульфонат, полибутенсульфонат, полипентенсульфонат, полигексенсульфонат, полигептенсульфонат, полиоктенсульфонат, полиноненсульфонат, полидеценсульфонат, полиундеценсульфонат, полидодеценсульфонат;
поливинилфосфат, полипропенфосфат, полибутенфосфат, полипентенфосфат, полигексенфосфат, полигептенфосфат, полиоктенфосфат, полиноненфосфат, полидеценфосфат, полиундеценфосфат, полидодеценфосфат;
поливинилфосфонат, полипропенфосфонат, полибутенфосфонат, полипентенфосфонат, полигексенфосфонат, полигептенфосфонат, полиоктенфосфонат, полиноненфосфонат, полидеценфосфонат, полиундеценфосфонат, полидодеценфосфонат;
карагинан, гепарин, гепарансульфат, декстрансульфат, пентозансульфат, ламинаринсульфат, хондроитинсульфат, дерматансульфат;
полистиролсульфонат, полистиролсульфат, полистиролсульфанилат, полисульфофенилаланин, политирозинсульфат, полисульфофенэтилакриламид, полисульфофенэтилметакриламид, поливинилнафталинсульфонат, поливинилнафталинсульфат, поливинилбифенилсульфонат, поливинилбифенилсульфат, полианетолсульфонат, поливинилбензойная кислота;
полисульфофенилпропен, полисульфофенилбутен, полисульфофенилпентен, полисульфофенилгексен, полисульфофенилгептен, полисульфофенилоктен, полисульфофенилнонен, полисульфофенилдецен, полисульфофенилундецен, полисульфофенилдодецен;
полисульфатфенилпропен, полисульфатфенилбутен, полисульфатфенилпентен, полисульфатфенилгексен, полисульфатфенилгептен, полисульфатфенилоктен, полисульфатфенилнонен, полисульфатфенилдецен, полисульфатфенилундецен, полисульфатфенилдодецен;
полифосфофенилпропен, полифосфофенилбутен, полифосфофенилпентен, полифосфофенилгексен, полифосфофенилгептен, полифосфофенилоктен, полифосфофенилнонен, полифосфофенилдецен, полифосфофенилундецен, полифосфофенилдодецен;
полифосфатфенилпропен, полифосфатфенилбутен, полифосфатфенилпентен, полифосфатфенилгексен, полифосфатфенилгептен, полифосфатфенилоктен, полифосфатфенилнонен, полифосфатфенилдецен, полифосфатфенилундецен, полифосфатфенилдодецен;
сульфированный поливинилфенилкетон, сульфированный полифенилсульфон, сульфированный поли-4-метилстирол, сульфированный поли-α -метилстирол, сульфированный блоксополимер полистирола, этиленоксида и стирола, сульфированный блоксополимер полиэтиленоксида, стирола и этиленоксида, сульфированный поли-4-метоксистирол, сульфированный полидифеноксифосфазен, сульфированный блоксополимер полиэтиленоксида и стирола, сульфированный блоксополимер полистирола и этилена, сульфированный полиаценафтилен, сульфированный поливинилкарбазол, сульфированный сополимер полистирола и бутадиена, сульфированный блоксополимер полистирола, сополимера этилена с бутиленом и стирола;
сополимер полистиролсульфоната и малеиновой кислоты, сополимер полистиролсульфоната и акриловой кислоты, сополимер полистиролсульфоната и метакриловой кислоты, сополимер полистиролсульфоната и акриламидометилпропансульфоната, сополимер полистиролсульфоната и итаконовой кислоты, сополимер полистиролсульфоната и винилбензойной кислоты;
сополимер полистиролсульфоната и хлорида диаллилметиламмония, сополимер полистиролсульфоната и хлорида диаллилдиметиламмония, сополимер полистиролсульфоната и хлорида диаллилметилоктиламмония, сополимер полистиролсульфоната и аллиламина, сополимер полистиролсульфоната и виниламина, сополимер полистиролсульфоната и хлорида винилбензилтриметиламмония;
сополимер полистиролсульфоната и стирола, сополимер полистиролсульфоната и октилстиролсульфонамида, сополимер полистиролсульфоната и метилстиролсульфоната, сополимер полистиролсульфоната, литохолевой кислоты и стиролсульфоната.
Полимеры, предназначенные для использования в способе по настоящему изобретению, могут быть линейными или сшитыми. Полимер можно сшить, например, путем введения в полимер многофункционального сомономера. Приемлемыми многофункциональными сомономерами являются диакрилаты, триакрилаты и тетраакрилаты, диметакрилаты, диакриламиды, диаллилакриламид, диметакриламиды, триаллиламин и ион тетраалкиламмония. Типичные примеры включают этиленгликольдиакрилат, пропиленгликольдиакрилат, бутиленгликольдиакрилат, этиленгликольдиметакрилат, бутиленгликольдиметакрилат, метиленбисметакриламид, этиленбисакриламид, этиленбисметакриламид, этилиденбисакриламид, этилиденбисметакриламид, пентаэритритолтетракрилат, триметилолпропантриакрилат, бисфенол А-диметакрилат и бисфенол А-диакрилат. Другими приемлемыми многофункциональными мономерами являются поливиниларены, такие как дивинилбензол. Количество сшивающего агента обычно составляет от около 1,0 мас.% до около 30 мас.% в расчете на массу полимера, предпочтительно от около 5 мас.% до около 25 мас.%.
Полимер может быть также сшит после полимеризации. Например, часть кислотных функциональных групп можно превратить в реакционноспособное производное известным в данной области методом. Например, группы карбоновой и сульфоновой кислот подвергают взаимодействию с тионилхлоридом, получая при этом соответственно ацилхлоридные и сульфонилхлоридные группы. Полученные реакционноспособные группы можно подвергнуть взаимодействию с диамином, двуатомным спиртом или аминоспиртом, предпочтительно с таким диамином, двуатомным спиртом или аминоспиртом, в котором аминогруппы и/или гидроксильные группы разделены алкиленовой цепью, такой как С3-С18-алкиленовая цепь. В результате осуществления указанной реакции в данной полимерной цепи образуются сложноэфирные и/или амидные группы, присоединенные к аналогичным группам в смежных полимерных цепях. Избыточное сшивание можно контролировать, например, регулируя количество кислотных функциональных групп, превращаемых в реакционноспособные группы.
Молекулярная масса полимера не имеет существенного значения, но желательно, чтобы она соответствовала предполагаемому способу введения, позволяла полимеру достичь требуемой области тела и оставаться в ней. Например, для лечения кишечной инфекции необходимо использовать полимер с достаточно высокой молекулярной массой или степенью сшивания, чтобы воспрепятствовать его частичному или полному поглощению из желудочно-кишечного тракта другими частями тела. Предназначенный для введения линейный полимер предпочтительно имеет молекулярную массу в диапазоне от 1 до около 1 миллиона дальтон или выше, в частности от 2000 дальтон до около 500000 дальтон, от 5000 дальтон до около 150000 дальтон или от около 25000 дальтон до около 1 миллиона дальтон. Альтернативно, молекулярная масса может составлять от около 100000 до около 1 миллиона или от около 400000 до около 1 миллиона дальтон.
Полимеры, предназначенные для использования в способе по настоящему изобретению, предпочтительно не должны подвергаться биологическому разложению и поглощению. То есть указанные полимеры не должны распадаться в физиологических условиях на фрагменты, поглощаемые тканями тела. Такие полимеры предпочтительно имеют негидролизуемую главную цепь, которая остается по существу инертной в условиях, характерных для целевой области тела, такой как желудочно-кишечный тракт. Особенно предпочтительным полимером является полистиролсульфонат. Указанный полимер предпочтительно является растворимым несшитым полистиролсульфонатом с молекулярной массой от около 400000 до 1 миллиона дальтон, в частности 600000 дальтон. Главные полимерные цепи, пригодные для настоящего изобретения, альтернативно включают полиакриламидные, полиакрилатные, поливинильные, полиэтилениминные и полистирольные главные цепи. Сополимер по настоящему изобретению может включать комбинацию из двух или более указанных элементов главной цепи. Предназначенный для введения полимер может представлять собой также полимер, полученный в результате конденсации, такой как полиамид или сложный полиэфир.
Количество вводимого полимера должно быть определено на индивидуальной основе, причем по меньшей мере частично необходимо принять во внимание вес больного, известные или предполагаемые патогенные микроорганизмы, тяжесть симптомов и желаемый результат лечения. Полимер можно вводить отдельно или в фармацевтической композиции, содержащей полимер и один или несколько фармацевтически приемлемых носителей, разбавителей или наполнителей. Фармацевтическая композиция может также включать одно или несколько дополнительных лекарственных средств, таких как антибиотики, противовоспалительные средства или аналгетики.
Полимер можно вводит в виде подкожной или другой инъекции, внутривенно, местно, перорально, парентерально, чрескожно или ректально через питательную трубку. Полимер или фармацевтическую композицию, содержащую полимер, предпочтительно вводят перорально. Форма введения полимера, например порошок, таблетка, капсула, раствор или эмульсия, зависит от способа введения. Терапевтически эффективное количество можно вводить в виде однократной дозы или нескольких доз, вводимых через определенные промежутки времени, например через определенное количество часов.
Для перорального введения полимеры можно дозировать в количестве от около 0,1 до 10 г/кг/сутки, предпочтительно от 1,0 до 7,0 г/кг/сутки и более предпочтительно от 2,0 до 6,6 г/кг/сутки.
Полимер можно также вводить в комбинации с одним или несколькими антимикробными средствами, например, выбираемыми из антибиотиков, известных в данной области. Предназначенный для введения антибиотик выбирают с учетом известных или предполагаемых патогенных микроорганизмов в соответствии с методами, известными в данной области. Например, если патогенным микроорганизмом является С. parvum, то в комбинации с полимером можно вводить такой антибиотик, как паромомицин. Полимер и антимикробное средство можно вводить одновременно, например, в одной или разных лекарственных формах или последовательно через определенные промежутки времени.
Термин "антимикробное средство" означает антибактериальные средства, противогрибковые средства, антисептики и тому подобные. Приемлемыми антимикробными средствами, известными в данной области, являются изониазид, рифампин, пиразинамид, этамбутол, эритромицин, ванкомицин, тетрациклин, хлорамфеникол, сульфонамиды, гентамицин, амоксициллин, пенициллин, стрептомицин, пара-аминосалициловая кислота, кларитромицин, клофазимин, миноциклин, сульфонамиды, этионамид, циклосерин, канамицин, амикацин, капреомицин, виомицин, тиацетазон, рифабутин и хинолоны, такие как ципрофлоксацин, офлоксацин и спарфлоксицин. Термин "антибактериальное средство" означает, но не ограничивается ими, природные антибиотики, продуцируемые микроорганизмами для подавления роста других микроорганизмов, и средства, синтезированные или модифицированные в лаборатории, которые обладают бактерицидным или бактериостатическим действием, например, антибактериальные средства на основе β-лактама, такие как карбенциллин; ампициллин, клоксациллин, оксациллин и пьерациллин, цефалоспорины и другие цефемы, в том числе цефаклор, цефамандол, цефазолин, цефоперазон, цефтаксим, цефокситин, цефтазидим, цефтриазон; карбапенемы, в том числе имипенем и меропенем; гликопептиды, макролиды, хинолоны (например, налидиксиновая кислота), тетрациклины, аминогликозиды (например, гентамицин и паромомицин), а также противогрибковые средства. Как правило, если антибактериальное средство обладает бактериостатическим действием, это означает, что данное средство препятствует росту бактериальных клеток (но не убивает бактерии); если указанное средство обладает бактериоцидным действием, это означает, что данное средство уничтожает бактериальные клетки (и может останавливать рост клеток до уничтожения бактерий).
Таким образом, вышеописанные полимеры и композиции можно использовать в медицине, например, для изготовления лекарственного средства, предназначенного для применения в описанных выше способах лечения.
В одном варианте осуществления изобретения полимер, содержащий несколько боковых кислотных функциональных групп, вводят в комбинации с катионным полимером, предпочтительно с полимером, имеющим аминогруппы и/или аммониевые группы. Примеры приемлемых полимеров указанного типа описаны в одновременно рассматриваемой заявке №08/934495, которая полностью включена в данное описание изобретения в качестве ссылки. Приемлемые катионные полимеры могут быть линейными или сшитыми. Настоящее изобретение относится к полимерам, включающим повторяющиеся звенья или мономеры, такие как аллиламин, диаллиламин, диаллилметиламин, виниламин, N-аминоалкилакриламид, N-аминоалкилметакриламид, аминоалкилакрилат, аминоалкилметакрилат, их кислотно-аддитивные соли и моноалкилированные, диалкилированные и триалкилированные (кватернизованные) производные. Приемлемые катионные полимеры включают гомополимеры указанных повторяющихся звеньев и сополимеры, имеющие по меньшей мере одно из указанных повторяющихся звеньев, и необязательно один или несколько гидрофобных мономеров и/или нейтральных гидрофильных мономеров, описанных выше. Полимер с кислотными функциональными группами и катионный полимер можно вводить в разных массовых отношениях одновременно в виде одной или разных лекарственных форм или последовательно через несколько минут или часов. Приемлемые дозы и способы введения могут быть легко определены специалистом в данной области. В одном варианте осуществления изобретения анионный полимер является полистиролсульфонатом и катионный полимер является полидиаллилметиламином или полидиаллилметиламином, в котором часть повторяющихся звеньев алкилирована, например, С4-С12-алкильной группой, такой как октильная или децильная группа.
Полимеры по настоящему изобретению можно получить способами, известными в данной области, например, путем прямой полимеризации мономера с кислотными функциональными группами или сополимеризации смеси мономеров, содержащей мономер с кислотными функциональными группами и по крайней мере один дополнительный сомономер, в частности, второй мономер с кислотными функциональными группами, гидрофобный мономер, нейтральный гидрофильный мономер, многофункциональный сшивающий мономер или их комбинацию. Смесь мономеров можно полимеризовать методами свободнорадикальной, катионной или анионной полимеризации, которые известны в данной области. Из-за различия констант сополимеризации двух или более мономеров молярное отношение мономеров в полученном сополимере может отличаться от молярного отношения мономеров в исходной реакционной смеси. Подобное различие реакционной способности может также привести к нестатистическому распределению мономеров в полимерной цепи.
Указанные полимеры могут быть также синтезированы нуклеофильным замещением боковой цепи активированного полимера. При осуществлении данного способа используют промежуточный полимер с лабильными боковыми цепями, которые могут быть легко замещены требуемой боковой цепью. Приемлемым полимером указанного типа является поли–N–акрилоилоксисукцинимид (pNAS), который подвергают взаимодействию с первичным амином, получая при этом N-замещенный полиакриламид. Другим приемлемым полимером с лабильными боковыми цепями является поли-4-нитрофенилакрилат, который также образует N-замещенный полиакриламид в результате взаимодействия с первичным амином.
Например, сополимер с полиакриламидной главной цепью, содержащий атомы азота амида, замещенные кислотной функциональной группой, и атомы азота амида, замещенные гидрофобной группой, можно получить, обрабатывая pNAS менее, чем одним эквивалентом (в расчете на N-акрилоил-оксисукцинимидный мономер) первичного амина, имеющего в качестве концевой группы кислотную функциональную группу, такую как, например, аминокислотную, в частности глициновую. Гидрофобную группу можно ввести, осуществляя взаимодействие по меньшей мере части остальных N-акрилоил-оксисукцинимидных мономеров со вторым первичным амином, таким как С2-С20 -алкиламин. Сополимер, содержащий также нейтральный гидрофильный мономер, можно получить, осуществляя взаимодействие любых оставшихся N-акрилоилоксисукцинимидных мономеров, например, с 2-амино-этанолом или аммиаком. Целый ряд сополимерных композиций можно легко получить, обрабатывая активированный полимер выбранными аминами в разных отношениях.
Полимеры, используемые в способе по настоящему изобретению, можно также синтезировать путем функционализации предшественника полимера при помощи кислотной функциональной группы. Например, полимер с боковыми цепями, имеющими арильные группы, можно сульфировать известными методами, чтобы получить полимер, содержащий боковые группы сульфоновой кислоты. Предшественники полимера, включающие гидроксильные группы, такие как поливиниловый спирт и полиаллиловый спирт, можно сульфировать известными методами, чтобы получить полимеры, содержащие сложноэфирные группы сульфата. Полимеры, имеющие как кислотные функциональные группы, так и гидрофобные группы, можно также синтезировать обычным способом. Например, поливинилареновый полимер, такой как полистирол, можно сульфировать, осуществляя взаимодействие с дымящей серной кислотой, что позволяет получить полистиролсульфонат.
Полимер с кислотными функциональными группами можно модифицировать, превращая по крайней мере часть кислотных групп в производное кислоты, такое как амид или сложный эфир. Например, полистиролсульфонат можно подвергнуть взаимодействию с субстехиометрическим количеством тионилхлорида в расчете на сульфонатные группы, в результате чего часть сульфонатных групп превращается в сульфонилхлоридные группы. Полученный полимер можно, например, подвергнуть взаимодействию с избытком первичного амина для превращения сульфонилхлоридных групп в N-замещенные сульфонамидные группы или со спиртом для превращения сульфонилхлоридных групп в сложноэфирные группы сульфоната. Гидрофобность полученного полимера можно изменять, изменяя N-заместитель или сложноэфирную функциональную группу либо то и другое вместе и степень превращения сульфонатных групп в сульфонамидные группы или сложноэфирные группы сульфоната.
Патогенные токсины, которые можно ингибировать способом по настоящему изобретению, включают, но не ограничиваются ими, такие токсины, как экзотоксины и/или эндотоксины, продуцируемые видом Streptococcus, включая Streptococcus pneumoniae. Streptococcus pyogenes и Streptococcus Sanguis; видом Salmonella, включая Salmonella enteritidis; видом Campylobacter, включая Campylobacter jejuni; видом Esterichia, включая Е. coli; видом Clostridia, включая Clostridium difficile и Clostridium botulinum; видом Staphylococcus, включая Staphylococcus aureus; видом Shigella, включая Shigella dysenteriae; видом Pseudomonas, включая Pseudomonas aeruginosa; видом Bordatells, включая Bordatella pertussis; видом Listeria, включая Listeria monocytogenes; Vibrio cholerae; видом Yersinia, включая Yersinia enterocolitica; видом Legionella, включая Legionella pneumophilia; видом Bacillus, включая Bacillus anthracis; видом Helicobacter; видом Corynebacteria; видом Actinobacillus; видом Aeromonas; видом Bacteroides, включая Bacteroides fragilis; видом Neisseria, включая N. meningitidis; видом Moraxella, таким как Moravella catarrhalis и видом Pasteurella. Настоящее изобретение относится также к токсинам простейших, таким как токсины, продуцируемые Entameoba histolytica и Acanthameoba; и токсинам паразитов.
Способ по данному изобретению можно также использовать для ингибирования вирусного токсина, такого как токсин, продуцируемый ротавирусом, вирусом иммунодефицита человека, вирусом гриппа, вирусом полиомиелита, вирусом везикулярного стоматита, вирусом коровьей оспы, аденовирусом, вирусом менингита, тогавирусами (такими как вирусы sindbis и semikifores), парамиксовирусами, вирусами папилломы. Токсины, которые можно ингибировать способом по данному изобретению, включают молекулы виропорина, продуцируемые указанными вирусами. Предпочтительным токсином, который можно ингибировать способом по настоящему изобретению, является белок ротавируса NSP4. Другими токсинами, которые можно ингибировать способом по данному изобретению, являются белок гриппа М2, белки ВИЧ Vpu и gp 41, белок пикорнавируса 3А, белок тогавируса 6К, белок респираторно-синцитиального вируса SH, белок коронавируса D3 и белок аденовируса Е5.
Инфекция может быть системного или локального типа. Предпочтительно инфекция может быть локализована в полости рта, глазу, желудочно-кишечном тракте, включая горло, на коже и в ухе, в частности в наружном слуховом проходе или среднем ухе.
Количество предназначенного для введения полимера должно быть определено на индивидуальной основе, причем по меньшей мере частично необходимо учесть вес больного, тяжесть симптомов и желаемый результат лечения. Полимер можно вводить отдельно или в фармацевтической композиции, содержащей полимер, приемлемый носитель или разбавитель и необязательно одно или несколько дополнительных лекарственных средств.
Полимер можно вводить системно или местно, например, в виде подкожной или другой инъекции, внутривенно, местно, перорально, парентерально, чрескожно или ректально. Способ введения обычно выбирают в зависимости от системного или локального типа инфекции. Форма вводимого полимера, например порошок, таблетка, капсула, раствор или эмульсия, зависит от способа введения. Терапевтически эффективное количество можно вводить в виде нескольких доз через определенные промежутки времени, например через определенное количество часов. Для введения полимера предпочтительно использовать несистемный способ введения, в частности пероральный или местный, например, путем нанесения на кожу, глаз, ткань полости рта, такую как слизистая оболочка полости рта, или на слизистую оболочку желудочно-кишечного тракта.
В предпочтительном варианте осуществления изобретения токсин является экзотоксином, продуцируемым патогенным бактериальным штаммом. Особое значение имеют такие патогенные микроорганизмы, как Escherichia coli, например штаммы Е. coli 06:H-, 0157:Н7, 0143 и другие культуры, выделенные в клинических условиях, а также Clostridium difficile. Вызывающий кишечное кровотечение штамм Е. coli (EHEC), такой как 0157:Н7, может стать причиной возникновения типичного кровавого поноса без лихорадки, известного как геморрагический колит. ЕНЕС продуцирует большое количество одного или двух родственных цитотоксинов, которые по своей структуре и функции подобны токсину Шига и определяются как Шига-подобные токсины (SLT I или SLT 2). Считается, что указанные Шига-подобные токсины разрушают слизистую оболочку кишечника, что ведет к возникновению геморрагического колита.
В предпочтительном варианте осуществления настоящего изобретения микробный токсин или токсины продуцируются Clostridium difficile. С. dificile продуцирует два токсина: токсин А и токсин В. Токсин А является энтеротоксином, который стимулирует инфильтрацию нейтрофилов и высвобождение веществ, вызывающих воспаление, что усиливает секрецию жидкости, изменяет проницаемость мембраны и вызывает геморрагический некроз. Токсин В является цитотоксином. С. difficile во многих случаях вызывает обусловленную антибиотиками диарею и дифтеритический колит, серьезное, потенциально смертельное воспаление толстой кишки. Для лечения инфицирования С. difficile обычно используют ванкомицин или метронидазол. В одном варианте осуществления изобретения подлежащим лечению заболеванием, вызываемым С. difficile, является гастроэнтерит, в частности обусловленная антибиотиками диарея или дифтеритический колит. В указанном варианте осуществления изобретения полимер можно вводить в сочетании с одним или несколькими антибиотиками, которые по меньшей мере частично эффективно воздействуют на С. difficile, такими как ванкомицин и метронидазол.
В используемом здесь значении термин "лечение" диареи, вызванной С. difficile, (CDAD) означает профилактическое лечение больных, восприимчивых к CDAD; лечение на начальной стадии возникновения CDAD; лечение CDAD в острой стадии заболевания; и лечение рецидива CDAD. В используемом здесь значении термин "терапевтически эффективное количество" означает количество, достаточное для профилактики, ослабления или устранения симптомов заболевания.
В предпочтительном варианте осуществления изобретения схема профилактики/лечения CDAD (которая позволяет предотвратить возникновение заболевания, ослабить или устранить симптомы заболевания после его возникновения или предотвратить рецидив заболевания) включает введение терапевтически эффективного количества лекарственной композиции, содержащей полистиролсульфонат, предпочтительно растворимый, несшитый полистиролсульфонат, более предпочтительно растворимый, несшитый полистиролсульфонат с молекулярной массой от около 400000 до 1 миллиона и особенно предпочтительно с молекулярной массой 600000. Не ограничиваясь каким-либо механизмом воздействия, авторы изобретения считают, что композиции по настоящему изобретению связывают токсины, например токсины, продуцируемые С. difficile. Токсин А является энтеротоксином, стимулирующим инфильтрацию нейтрофилов и высвобождение веществ, вызывающих воспаление, что усиливает секрецию жидкости, изменяет проницаемость мембраны и вызывает геморрагический некроз. Токсин В является цитотоксином. Считается, что указанные токсины вызывают симптомы CDAD и других типов AAD.
Настоящее изобретение относится также к способу профилактического лечения, которая включает введение терапевтической композиции, содержащей полистиролсульфонат, в качестве совместной терапии, осуществляемой одновременно с лечением антибиотиками широкого спектра действия. В используемом здесь значении термин "совместная терапия" означает схему лечения, в соответствии с которой два лекарственных средства вводят одновременно или последовательно с промежутками в несколько минут, часов или дней, причем указанные средства оказывают общее воздействие, позволяя получить требуемый терапевтический результат.
Ниже дано более конкретное описание настоящего изобретения со ссылкой на нижеследующие примеры.
ПРИМЕРЫ
Пример 1 - Синтез сополимера акриловой кислоты и стирола (2:1)
Получают раствор акриловой кислоты (15,0 г, 0,2 моль) и стирола (10,4 г, 0,1 моль) в ТГФ (200 мл). Раствор дегазируют быстрым потоком азота и добавляют азобисизобутиронитрил (АИБН) (1,47 г, 3 мол. % в расчете на общее количество мономера). Раствор дегазируют еще тридцать минут и реакционную смесь нагревают при 70°С в течение 14 часов. Раствор охлаждают и осаждают в н-гексане (800 мл). Гексан сливают с осажденного волокнистого белого продукта, после чего продукт промывают этилацетатом (300 мл) и дополнительной аликвотой гексана (200 мл). Полимер сушат в вакууме, получая при этом 21,6 г (84,6%) хрупкого белого твердого вещества.
Пример 2 - Синтез сополимера акриловой кислоты и децилакрилата (96:4)
Получают раствор акриловой кислоты (10,0 г, 133 ммоль) и н-децилакрилата (1,0 г, 4,71 ммоль) в диоксане (200 мл). Раствор дегазируют, пропуская через него быстрый поток азота, после чего к раствору добавляют АИБН (0,6 г, 5 мол. % в расчете на общее количество мономера). Раствор дегазируют еще тридцать минут и реакционную смесь нагревают при 70°С в течение 16 часов. Раствор охлаждают и осаждают в этилацетате (600 мл). Этилацетат сливают с волокнистого белого продукта, после чего продукт промывают этилацетатом (300 мл) и гексаном (200 мл). Полимер сушат в вакууме, получая при этом 9,0 г (81%) хрупкого белого твердого вещества.
Пример 3 - Синтез сополимера акриловой кислоты и н-бутилакрилата (9:1)
Получают раствор акриловой кислоты (10,0 г, 133 ммоль) и н-бутилакрилата (2,0 г, 14,41 ммоль) в диоксане (200 мл). Раствор дегазируют, пропуская через него быстрый поток азота, после чего к раствору добавляют АИБН (0,6 г, 5 мол. % в расчете на общее количество мономера). Раствор дегазируют еще тридцать минут и реакционную смесь нагревают при 70°С в течение 17 часов. Раствор охлаждают и осаждают в этилацетате (600 мл). Этилацетат сливают с волокнистого белого продукта, после чего продукт промывают этилацетатом (300 мл) и гексаном (200 мл). Полимер сушат в вакууме, получая при этом 9,0 г (81%) хрупкого белого твердого вещества.
Соответствующий сополимер актиловой кислоты и н-бутилакрилата (10:3) получают аналогичным способом.
Пример 4 - Синтез тройного сополимера акриловой кислоты, н-децилакрилата и акриламида (70:7,5:22,5)
Получают раствор акриловой кислоты (10,0 г, 133 моль), н-децилакрилата (3,0 г, 14,2 ммоль) и акриламида (3,0 г, 42,2 ммоль) в диоксане (200 мл). Раствор дегазируют быстрым потоком азота и добавляют АИБН (1,3 г). Раствор дегазируют еще тридцать минут и реакционную смесь нагревают при 70°С в течение 17 часов. В ходе реакции происходит осаждение полимера в виде волокнистого белого твердого вещества. Раствор охлаждают и диоксан сливают. Остаток промывают этилацетатом (600 мл), после чего этилацетат сливают. Полимер окончательно промывают гексанами (300 мл) и сушат в вакууме.
Пример 5 - Синтез тройного сополимера акриловой кислоты, н-бутилакрилата и акриламида (60:15:25)
Получают раствор акриловой кислоты (10,0 г, 133 моль), н-бутилакрилата (4,0 г, 31,4 ммоль) и акриламида (4,0 г, 56,3 ммоль) в диоксане (200 мл). Раствор дегазируют быстрым потоком азота и добавляют АИБН (1,3 г). Полученный раствор дегазируют еще тридцать минут и нагревают при 70°С в течение 17 часов. В ходе реакции происходит осаждение полимера в виде белого волокнистого твердого вещества. Раствор охлаждают и диоксан сливают. Полимер промывают этилацетатом (600 мл), гексанами (300 мл) и сушат в вакууме.
Пример 6 - Синтез сополимера акриловой кислоты и децилакрилата (10:2)
Получают раствор акриловой кислоты (10,0 г, 133 ммоль) и децилакрилата (5,64 г, 26,6 ммоль) в диоксане (300 мл). Раствор дегазируют быстрым потоком азота и добавляют АИБН (0,8 г). Полученный раствор дегазируют еще тридцать минут и реакционную смесь нагревают при 70°С в течение 16 часов. Раствор охлаждают и добавляют этилацетат (600 мл). Этилацетат сливают с образовавшегося волокнистого белого продукта. Полученный продукт вновь растворяют в диоксане (150 мл), осаждают этилацетатом (500 мл), фильтруют, промывают холодными гексанами (300 мл) и сушат в вакууме.
Пример 7 - Получение сшитого на 2% полиэтиленгликольметакрилатфосфатного геля
Полиэтиленгликольметакрилатфосфатный гель получают, осуществляя полимеризацию этиленгликольметакрилатфосфата (29,4 ммоль, 6,178 г) с дивинилбензолом (ДВБ) (0,926 ммоль, 0,1319 мл) в смеси этанол/вода (50/50) и используя в качестве инициатора 1 мол. % АИБН. Полученный эластичный гель делят на 2 порции, помещают в две 50 мл пробирки для центрифуги и 4 раза промывают этанолом, используя в общей сложности примерно 120 мл этанола. Гель сушат в течение ночи в печи с принудительной циркуляцией воздуха при 70°С. Высушенный гель измельчают, просеивают и трижды промывают водой в 50 мл пробирке для центрифуги. Гель сушат в течение ночи в печи с принудительной циркуляцией воздуха при 70°С.
Пример 8 - Получение сульфированных полистирольных гелей
Полистирольные гели получают нижеследующим способом, осуществляя полимеризацию стирола с дивинилбензолом в толуоле и используя в качестве инициатора 1 мол. % АИБН.
Полистирольный гель (6% ДВБ). Стирол (282 ммоль, 3,23 мл) вводят в 40 мл сосуд с мембранной крышкой. Добавляют толуол (5 мл) и раствор дегазируют в течение 15 минут. Получают раствор АИБН (0,9852 г в 10 мл толуола) и добавляют 0,5 мл к реакционному раствору. Раствор дегазируют еще 5 минут и выдерживают при 60°С в течение 21 часа. Образовавшийся прозрачный бесцветный гель промывают 5 раз этанолом в 50 мл пробирке для центрифуги и сушат в течение ночи в печи с принудительной циркуляцией воздуха при 70°С.
Описанным способом получают также полистирольные гели со следующими степенями сшивания: 4% ДВБ; 2% ДВБ; 1,5% ДВБ; 1% ДВБ и 0,5% ДВБ.
Сульфирование полистирольного геля
Высушенный полистирольный гель переносят в 40 мл стеклянный сосуд. Добавляют концентрированную серную кислоту (10 мл) и смесь нагревают при 100°С в течение 1 часа. Образовавшийся коричневый набухший гель оставляют охлаждаться до комнатной температуры и тщательно промывают метанолом до достижения рН, равного 4-5. Гель сушат в течение ночи в печи с принудительной циркуляцией воздуха. Высушенный гель измельчают в кофемолке, переносят в 50 мл пробирку для центрифуги и несколько раз промывают водой.
Пример 9 - Получение сульфированных поли-2-винилнафталиновых гелей
Поли-2-винилнафталиновые гели получают нижеследующим способом, осуществляя полимеризацию 2-винилнафталина с дивинилбензолом в толуоле и используя в качестве инициатора ~ 1 мол. % АИБН.
Поли-2-винилнафталиновый гель (2% ДВБ)
2-Винилнафталин (29,4 ммоль, 4,534 г) и дивинилбензол (0,6 ммоль, 85,46 микролитра) вводят в 40 мл сосуд с мембранной крышкой. Добавляют толуол (10 мл) и раствор нагревают, чтобы растворить мономер. Раствор дегазируют в течение 15 минут. Получают раствор АИБН (0,9852 г в 10 мл толуола) и добавляют 0,5 мл к полимеризуемому раствору. Раствор дегазируют еще 5 минут и выдерживают при 60°С в течение 21 часа. Образовавшийся прозрачный коричневый гель промывают этанолом (всего 2 л) путем гравитационного фильтрования и сушат в течение 2 дней в печи с принудительной циркуляцией воздуха при 70°С.
Сульфирование поли-2-винилнафталинового геля
Высушенный поли-2-винилнафталиновый гель переносят в 40 мл стеклянный сосуд. Добавляют концентрированную серную кислоту (10 мл) и смесь нагревают при 100°С в течение 1 часа. Образовавшийся коричневый набухший гель оставляют охлаждаться до комнатной температуры и тщательно промывают метанолом путем гравитационного фильтрования до достижения рН, равного 4-5. Гель промывают несколько раз водой. Затем гель сушат в течение 2 дней в печи с принудительной циркуляцией воздуха при 70°С.
Пример 10 - Получение сульфированных поли-4-винилбифениловых гелей
Поли-4-винилбифениловые гели получают нижеследующим способом, осуществляя полимеризацию 4-винилбифенила с дивинилбензолом в толуоле и используя в качестве инициатора ~ 1 мол. % АИБН.
Поли-4-винилбифениловый гель (2% ДВБ)
4-Винилбифенил (29,4 ммоль, 5,299 г) и дивинилбензол (0,6 ммоль, 85,46 микролитра) вводят в 40 мл сосуд с мембранной крышкой. Добавляют толуол (10 мл) и раствор нагревают, чтобы растворить мономер. Раствор дегазируют в течение 15 минут. Получают раствор АИБН (0,9852 г в 10 мл толуола) и добавляют 0,5 мл к полимеризуемому раствору. Раствор дегазируют еще 5 минут и выдерживают при 60°С в течение 21 часа. Образовавшийся прозрачный коричневый гель промывают этанолом (всего 2 л) путем гравитационного фильтрования и сушат в течение 2 дней в печи с принудительной циркуляцией воздуха при 70°С.
Сульфирование сшитого на 2% поли-4-винилбифенилового геля
Высушенный поли-4-винилбифениловый гель переносят в 40 мл стеклянный сосуд. Добавляют концентрированную серную кислоту (10 мл) и смесь нагревают при 100°С в течение 1 часа. Образовавшийся коричневый набухший гель оставляют охлаждаться до комнатной температуры и тщательно промывают метанолом путем гравитационного фильтрования до достижения рН, равного 4-5. Гель несколько раз промывают водой и сушат в течение 2 дней в печи с принудительной циркуляцией воздуха при 70°C.
Пример 11 - Получение сополимера полистиролсульфоната, стирола и н-N-октилсульфонамида
Полистиролсульфонат натрия (114,9 ммоль, 20 г) диспергируют в N,N-диметилформамиде ("ДМФ", 100 мл, безводный). Добавляют тионилхлорид (114,9 ммоль, 9,95 мл) и смесь нагревают при 60°С в течение 16 часов. Смесь выливают на лед и нейтрализуют 50% NaOH (водный раствор) до достижения рН около 6, 5. Раствор диализуют через систему трубок для диализа SpectraPor 6-8K MWCO, используя 4 раза по 13,5 л (4×3 галлона) деионизированной воды, пока проводимость диализата не будет равна 0,00 мСм/см. Образец лиофилизуют, получая при этом белый порошок.
Полистиролсульфонат с 10 мол. % н-октилсульфонамида
Полистиролсульфонат натрия (114,9 ммоль, 20 г) диспергируют в ДМФ (100 мл, безводный). Добавляют тионилхлорид (114,9 ммоль, 9,95 мл) и смесь нагревают при 60°С в течение 16 часов. Добавляют н-октиламин (11,486 ммоль, 1,8980 мл) и смесь перемешивают при комнатной температуре в течение 5,5 часов. Смесь выливают на лед и нейтрализуют 50% NaOH (водный раствор) до достижения рН, равного 6,1. Раствор диализуют через систему трубок для диализа SpectraPor 6-8K MWCO, используя 4 раза по 13,5 л (4×3 галлона) деионизированной воды, пока проводимость диализата не будет равна 0,00 мСм/см. Образец лиофилизуют, получая при этом белый порошок.
Полистиролсульфонат с 20 мол. % н-октилсульфонамида
Полистиролсульфонат натрия (114,9 ммоль, 20 г) диспергируют в ДМФ (100 мл, безводный). Добавляют тионилхлорид (114,9 ммоль, 9,95 мл) и смесь нагревают при 60°С в течение 16 часов. Добавляют н-октиламин (22,97 ммоль, 3,7967 мл) и смесь перемешивают при комнатной температуре в течение 5,5 часов. Смесь выливают на лед и нейтрализуют 50% NaOH (водный раствор) до достижения рН, равного 6,7. Раствор диализуют через систему трубок для диализа SpectraPor 6-8K MWCO, используя 4 раза по 13,5 л (4×3 галлона) деионизированной воды, пока проводимость диализата не будет равна 0,00 мСм/см. Образец лиофилизуют, получая при этом белый порошок.
Полистиролсульфонат с 30 мол. % н-октилсульфонамида
Полистиролсульфонат натрия (114,9 ммоль, 20 г) диспергируют в ДМФ (100 мл, безводный). Добавляют тионилхлорид (114,9 ммоль, 9,95 мл) и смесь нагревают при 60° С в течение 16 часов. Добавляют н-октиламин (34,457 ммоль, 5,6950 мл) и смесь перемешивают при комнатной температуре в течение 5,5 часов. Смесь выливают на лед и нейтрализуют 50% NaOH (водный раствор) до достижения рН, равного 6,5. Раствор диализуют через систему трубок для диализа SpectraPor 6-8K MWCO, используя 4 раза по 13,5 л (4×3 галлона) деионизированной воды, пока проводимость диализата не будет равна 0,00 мСм/см. Образец лиофилизуют, получая при этом белый порошок.
Полистиролсульфонат с 40 мол. % н-октилсульфонамида
Полистиролсульфонат натрия (114,9 ммоль, 20 г) диспергируют в ДМФ (100 мл, безводный). Добавляют тионилхлорид (114,9 ммоль, 9,95 мл) и смесь нагревают при 60°С в течение 16 часов. Добавляют н-октиламин (55,131 ммоль, 7,5934 мл) и смесь перемешивают при комнатной температуре в течение 5,5 часов. Смесь выливают на лед и нейтрализуют 50% NaOH (водный раствор) до достижения рН около 6,7. Раствор диализуют через систему трубок для диализа SpectraPor 6-8K MWCO, используя 4 раза по 13,5 л (4×3 галлона) деионизированной воды, пока проводимость диализата не будет равна 0,00 мСм/см. Образец лиофилизуют, получая при этом белый порошок.
Пример 12 - Синтез кальциевой соли полистиролсульфоната
В трехгорлую круглодонную колбу емкостью 500 мл вводят 2 г поли-4-стиролсульфоната натрия и 100 мл деионизированной воды. Смесь перемешивают несколько минут до получения однородного раствора. К полученному раствору полимера добавляют 6,46 мл 0,225 М раствора CaCl2. Реакционную смесь перемешивают при комнатной температуре в течение 15 часов.
Реакционную смесь очищают мембранным центрифугированием, используя фильтры для отделения вещества с молекулярной массой 3000. Раствор сушат при 70°С в печи с принудительной циркуляцией воздуха в течение 24 часов, получая при этом 1,4 г полимера в виде не совсем белого твердого вещества.
Пример 13 - Получение сшитых сополимеров стиролсульфоната с гидрофобными сомономерами
Гели сополимеров полистиролсульфоната и гидрофобных сомономеров получают нижеследующим способом, осуществляя сополимеризацию стиролсульфоната с акриламидом, н-бутилакриламидом, н-децилакриламидом или стиролом и используя в качестве сшивающего агента дивинилбензол (2%) или N,N-метиленбисакриламид (8%).
Полистиролсульфонатный гель (сшитый на 2%)
Полистиролсульфонат (29,4 ммоль, 5,119 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 10 мл этанола и 10 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната и акриламида (75 мол. %:23 мол. %:сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), акриламид (6,90 ммоль, 0,490 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 10 мл этанола и 10 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 19 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната и н-бутилакриламида (75 мол. %:23 мол%:сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), н-бутилакриламид (6,90 ммоль, 0,878 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 15 мл этанола и 5 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол.% АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната, акриламида и н-бутилакриламида (75 мол. %:11,5 мол. %:11,5 мол. %: сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), акриламид (3,45 ммоль, 0,245 г), н- бутилакриламид (3,45 ммоль, 0,439 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 15 мл этанола и 5 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, пропуская через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, светло-желтый гель.
Гель сополимера полистиролсульфоната и децилакриламида (75 мол. %:23 мол. %:сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), н-децилакриламид (6,90 ммоль, 1,458 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 15 мл этанола и 5 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол.% АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется желтовато-кремовый гель.
Гель сополимера полистиролсульфоната, акриламида и н-децилакриламида (75 мол. %:11,5 мол. %:11,5 мол. %: сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), акриламид (3,45 ммоль, 0,245 г), н-децилакриламид (3,45 ммоль, 0,729 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 15 мл этанола и 5 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется желтовато-кремовый гель.
Гель сополимера полистиролсульфоната и стирола (75 мол. %:23 мол. %:сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), стирол (6,90 ммоль, 0,7906 мл) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 10 мл этанола и 10 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол.% АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната, акриламида и стирола (75 мол.%:11,5 мол.%: 11,5 мол. %: сшитый на 2%)
Полистиролсульфонат (22,5 ммоль, 3,918 г), акриламид (3,45 ммоль, 0,245 г), стирол (3,45 ммоль, 0,3953 мл) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 10 мл этанола и 10 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната и акриламида (50 мол. %:48 мол. %:сшитый на 2%)
Полистиролсульфонат (15,0 ммоль, 2,612 г), акриламид (14,4 ммоль, 1,024 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 5 мл этанола и 15 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол.% АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната, акриламида и н-бутилакриламида (50 мол. %:24 мол. %:24 мол.%: сшитый на 2%)
Полистиролсульфонат (15,0 ммоль, 2,612 г), акриламид (7,2 ммоль, 0,512 г), н-бутилакриламид (7,2 ммоль, 0,916 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 5 мл этанола и 15 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната, акриламида и стирола (50 мол. %:24 мол. %:24 мол. %:сшитый на 2%)
Полистиролсульфонат (15,0 ммоль, 2,612 г), акриламид (7,2 ммоль, 0,512 г), стирол (7,2 ммоль, 0,8250 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 10 мл этанола и 10 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Гель сополимера полистиролсульфоната и акриламида (2 5 мол. %:73 мол. %:сшитый на 2%)
Полистиролсульфонат (7,5 ммоль, 1,306 г), акриламид (21,9 ммоль, 1,557 г) и дивинилбензол (0,6 ммоль, 85,5 микролитра) растворяют в 5 мл этанола и 15 мл воды в 40 мл сосуде с мембранной крышкой. Раствор дегазируют, барботируя через него азот, и добавляют 1 мол. % АИБН в виде раствора. Полимеризуемый раствор снова дегазируют и помещают в нагретый реактор при 60°С на 18 часов. Образуется прозрачный, бесцветный гель.
Все образцы очищают, разделяя гель на 2 порции и помещая в две 50 мл пробирки для центрифуги. Гели промывают этанолом минимум три раза, пока супернатант не становится прозрачным и бесцветным. Общий объем используемого этанола составляет примерно от 75 мл до 100 мл в зависимости от индекса набухания геля. Гели сушат в печи с принудительной циркуляцией воздуха при 60°С в течение 2 дней.
Гели измельчают в кофемолке и просеивают через сито с размером ячеек 140, 230 меш. Образец весом 0,5-1 г с частицами геля размером 140-230 трижды промывают водой в 50 мл пробирках для центрифуги. Некоторые образцы обладают высокой абсорбирующей способностью, и их приходится помещать в несколько пробирок. Вещество, находящееся в каждой пробирке, промывают в общей сложности 20-80 мл воды. Затем образцы 1 раз промывают МеОН, центрифугируют, декантируют и сушат в течение двух дней при 70°С. Гель промывают в общей сложности 20-80 мл воды.
Пример 14 - Получение поли-4-винилбифенилсульфоната
Полимеризация 4-винилбифенила
4-Винилбифенил (166,4 ммоль, 30 г) вводят в трехгорлую, круглодонную колбу емкостью 500 мл, оснащенную обратным холодильником, термопарой J-Kem и разделительной мембраной. Добавляют толуол (60 мл) и раствор дегазируют в течение 1 часа. Добавляют АИБН (1 мол. %, 0,294 ммоль, 0,2733 г) и раствор продолжают дегазировать еще 15 минут. Полимеризуемую смесь нагревают при 60°С в течение 21 часа. Образовавшийся прозрачный коричневый раствор выливают в 2 л метанола и перемешивают в течение нескольких часов. Мелкий коричневый порошок фильтруют, трижды промывают 500 мл метанола и сушат в печи с принудительной циркуляцией воздуха при 70°С. Получают мелкий коричневый порошок (28,02 г, выход 93,40%).
Сульфирование поли-4-винилбифенила
Поли-4-винилбифенил смешивают с концентрированной серной кислотой (100 мл) и нагревают при 100°С в течение 8 часов. В конце нагревания смесь превращается в прозрачный коричневый вязкий раствор. Раствор полимера выливают на лед и нейтрализуют до рН 6,2 50% водным раствором NaOH. Раствор диализуют через мембрану для диализа, отделяющую вещество с молекулярной массой 3500, используя 4 раза по 5 л деионизированной воды. Проводимость диализата составляет <0,1 мСм/см. Воду удаляют перегонкой в роторном испарителе, получая при этом прозрачное коричневое хлопьевидное твердое вещество.
Пример 15 - Получение поли-2-винилнафталинсульфоната
Полимеризация 2-винилнафталина
2-Винилнафталин (194,5 ммоль, 30 г) вводят в трехгорлую круглодонную колбу емкостью 500 мл, оснащенную обратным холодильником, термопарой J-Kem и разделительной мембраной. Добавляют толуол (60 мл) и раствор дегазируют в течение 1 часа. Затем добавляют АИБН (1 мол. %, 0,294 ммоль, 0,3195 г) и раствор дегазируют еще 15 минут. Полимеризуемую смесь нагревают при 60°С в течение 21 часа. Полученный прозрачный коричневый раствор выливают в 2 л метанола и перемешивают в течение нескольких часов. Мелкий коричневый порошок фильтруют, трижды промывают 500 мл метанола и сушат в течение ночи в печи с принудительной циркуляцией воздуха при 70°С. Получают мелкий коричневый порошок (28,45 г, выход 94,83%).
Сульфирование поли-2-винилнафталина
Поли-2-винилнафталин смешивают с концентрированной серной кислотой (100 мл) и нагревают при 100°С в течение 8 часов. В конце нагревания смесь превращается в прозрачный коричневый вязкий раствор. Раствор полимера выливают на лед и нейтрализуют до рН 6,4 50% водным раствором NaOH. Раствор диализуют через мембрану для диализа, отделяющую вещество с молекулярной массой 3500, используя 4 раза по 5 л деионизированной воды. Проводимость диализата составляет <0,1 мСм/см. Воду удаляют перегонкой в роторном испарителе, получая при этом прозрачное коричневое хлопьевидное твердое вещество.
Пример 16 - Сополимер поли-4-стиролсульфоната натрия, (-)-ментола и 4-стиролсульфоната с использованием 5% (-)-ментола
К смеси поли-4-стиролсульфоната натрия (30,0 г, 0,145 моль сульфоната) в 300 мл безводного ДМФ, перемешиваемой при комнатной температуре, добавляют тионилхлорид (17,3 г, 0,145 моль). Добавление производят медленно, чтобы температура не поднималась выше 50°С. Смесь продолжают перемешивать в течение ночи, после чего третью часть реакционной смеси обрабатывают пиридином (0,764 г, 0,0966 моль). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов и добавляют (-)-ментол (0,375 г, 0,00240 моль), полученную смесь перемешивают при комнатной температуре в течение ночи и затем при 50°С в течение 3 часов. Затем смесь медленно выливают в один литр воды, содержащей бикарбонат натрия (5 г). Вслед за этим добавляют дополнительное количество бикарбоната натрия до прекращения барботирования и достижения нейтрального рН. Продукт подвергают тщательному диализу и сушат потоком воздуха, получая при этом белое твердое вещество.
Пример 17 - Синтез сополимера поли-4-стиролсульфоната натрия, литохолевой кислоты и 4-стиролсульфоната с использованием 5% литохолевой кислоты
К смеси поли-4-стиролсульфоната натрия (30,0 г, 0,145 моль сульфоната) в 300 мл безводного ДМФ, перемешиваемой при комнатной температуре, добавляют тионилхлорид (17,3 г, 0,145 моль). Добавление производят медленно, чтобы температура не поднималась выше 50°С. Смесь продолжают перемешивать в течение ночи, после чего третью часть реакционной смеси обрабатывают пиридином (0,764 г, 0,0966 моль). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов и добавляют литохолевую кислоту (0,904 г, 0,00240 моль), полученную смесь перемешивают при комнатной температуре в течение ночи и затем при 50°С в течение 3 часов. Затем смесь медленно выливают в один литр воды, содержащей бикарбонат натрия (5 г). Вслед за этим добавляют дополнительное количество бикарбоната натрия до прекращения барботирования и достижения нейтрального рН. Продукт подвергают тщательному диализу и сушат потоком воздуха, получая при этом белое твердое вещество.
Эффективность полимеров, указанных в таблице 1, испытывают in vivo с использованием хомячков.
Пример 18 - Поли-3-стиролсульфонат натрия с 40% метронидазола
Поли-4-стиролсульфонат натрия (160-246-001, 25 г) растворяют в деионизированной воде (500 мл) в пластиковом ведре емкостью 3 литра, используя магнитную мешалку. Метронидазол (8,32 г) растворяют в деионизированной воде (600 мл) и 1М растворе НСl (0,75 экв) в отдельном химическом стакане требуемого размера. Раствор метронидазола медленно выливают в раствор поли-4-стиролсульфоната натрия. Полученный раствор перемешивают при комнатной температуре в течение примерно 17 часов. Раствор помещают в диализные мешки (6К- 8К MWCO) до достижения проводимости <0,05. Раствор полимера сушат в печи с принудительной циркуляцией воздуха при 70°С. Получают примерно 22 г полимера. Анализ ВЭЖХ показывает наличие 13,8% метронидазола.
Пример 19 - Сульфирование поли-4-метоксистирола
Поли-4-метоксистирол (1 г) помещают в сосуд емкостью 30 мл. В указанный сосуд добавляют концентрированную серную кислоту (5 мл). Смесь, перемешивая, нагревают при 100°С в течение 8 часов. Через 8 часов полимер растворяется (прозрачный темный раствор). Добавляют деионизированную воду (50 мл). Образец нейтрализуют, добавляя по каплям NaOH (50% раствор). Раствор помещают в диализные мешки (6К-8К MWCO) до достижения проводимости <0,1. Раствор полимера фильтруют и сушат в вакуумной печи с интенсивной циркуляцией воздуха.
Пример 20 - Сульфирование полидифеноксифосфазена
Полидифеноксифосфазен (1 г) помещают в сосуд емкостью 30 мл. В указанный сосуд добавляют концентрированную серную кислоту (5 мл). Смесь, перемешивая, нагревают при 100°С в течение 8 часов. Через 8 часов полимер растворяется (прозрачный желтый раствор). Добавляют деионизированную воду (50 мл). Образец нейтрализуют, добавляя по каплям NaOH (50% раствор). Раствор помещают в диализные мешки (6К- 8К MWCO) до достижения проводимости <0,1. Раствор полимера фильтруют и сушат в вуакуумной печи с интенсивной циркуляцией воздуха.
Пример 21 - Сульфирование блоксополимера этиленоксида, стирола и этиленоксида
Блоксополимер этиленоксида, стирола и этиленоксида (900 мг) помещают в сосуд емкостью 30 мл. В указанный сосуд добавляют концентрированную серную кислоту (5 мл). Смесь, перемешивая, нагревают при 100°С в течение 8 часов. Через 8 часов полимер не растворяется, поэтому в сосуд добавляют дополнительное количество концентрированной серной кислоты (5 мл). Смесь нагревают, перемешивая, при 110°С еще 8 часов. Указанную процедуру повторяют еще два раза. В общей сложности добавляют 20 мл концентрированной серной кислоты (5 мл, 100°С, 8 часов; 15 мл, 110°С, 24 часа). Затем добавляют деионизированную воду (50 мл). Образец нейтрализуют, добавляя по каплям NaOH (50% раствор). Раствор помещают в диализные мешки (6К - 8К MWCO) до достижения проводимости <0,1. Полимер фильтруют (оставшееся количество нерастворимого вещества) и сушат в вакуумной печи с интенсивной циркуляцией воздуха.
Пример 22 - Совместное введение полистиролсульфоната и полидиаллилметиламина
Растворимый полистиролсульфонат и сшитый С8-алкилированный полидиаллилметиламин (ПДМА) уменьшают смертность вследствие инфицирования С. difficile у животной модели колита, вызванного С. difficile, с использованием хомячков. Указанные полимеры связывают разные токсины in vitro. Полистиролсульфонат связывает токсин А С. difficile и защищает клетки в культуре от откругления под действием токсина А.
Сшитый C8-алкилированный ПДМА связывает токсины А и В in vitro и защищает клетки в культуре от откругления под действием указанных токсинов. Данный полимер примерно в пять раз эффективнее связывает токсин В, чем токсин A in vitro. Для достижения оптимального связывания токсинов А и В указанные полимеры испытаны при комбинированном введении животной модели колита, вызванного С. difiicile, с использованием хомячков. Лечение полимером начинают за 24 часа до заражения С. difficile. Хомячкам ежедневно вводят 3 суточные дозы полимера в 8 часов, 12 часов и 16 часов. Хомячкам в течение 7 дней вводят физиологический раствор (контрольная группа), только полистиролсульфонат, только сшитый С8-алкилированный ПДМА или комбинацию из двух полимеров в виде раздельных доз (2 дозы полистиролсульфоната, 1 доза С8 ПДМА). Животных наблюдают в течение 7 дней. Все животные, которым вводят физиологический раствор, погибают в течение указанного периода. Из животных, которым вводят полистиролсульфонат, на 7-й день выживают 80% особей, при этом у выживших животных заболевание протекает в легкой или средней форме. Из животных, которым вводят С8-алкилированный ПДМА, на 7-й день выживают 50% особей, при этом у выживших животных заболевание протекает в средней форме или полностью отсутствует. При введение комбинации полистиролсульфоната и С8-алкилированного ПДМА на 7-й день выживают 90% особей, при этом у 80% животных отсутствуют симптомы заболевания. Таким образом, введение комбинации растворимого полистиролсульфоната и С8-алкилированного ПДМА, по-видимому, позволяет эффективно лечить колит, вызванный С. difficile, in vivo.
Пример 23 - Опыты на связывание токсинов
Твердофазный иммуноферментный анализ (ELISA)
Твердофазный иммуноферментный анализ (ELISA) применяется в качестве серийного анализа для диагностики содержания токсинов С. difficile в пробах стула. Для выполнения данного анализа используют титрационные микропланшеты, покрытые очищенными моноклональными антителами к токсинам А и В С. difficile, которые связывают токсины в растворе. Связанные токсины затем детектируют при помощи аффинной очищенной поликлональной антисыворотки, которая связана с пероксидазой из хрена ("HRP"). Несвязанное антитело вымывают и связанный с антителом токсин детектируют при помощи окрашенного субстрата для HRP. Данный анализ позволяет обнаружить токсины А и В в нанограммовых количествах. Твердофазный иммуноферментный анализ используют для определения содержания свободного токсина после инкубации очищенного токсина А или В с разными полимерами в присутствии содержимого слепой кишки хомячков, позволяющего создать физиологически похожие условия, которые имеют место при связывании токсина in vivo.
Для выполнения анализа ELISA полимер (10 мг) отвешивают в четыре 1,5 мл пробирки Эппендорфа. В каждую пробирку добавляют 500 мкл содержимого слепой кишки, после чего содержимое пробирок перемешивают в приборе для встряхивания и помещают в прибор для покачивания на 1 час. Затем в каждую пробирку добавляют 500 мкл 200 нг/мл или 2000 нг/мл раствора токсина А или токсина В в фосфатном буфере до достижения конечной концентрации токсина, равной 1000 нг/мл или 100 нг/мл. Пробирки снова помещают в прибор для встряхивания и затем в прибор для покачивания еще на 1 час. Затем пробирки центрифугируют.
100 мкл разведенного супернатанта из каждой пробирки вводят во все лунки планшета, избегая попадания твердого вещества. Затем в каждую лунку добавляют 100 мкл конъюгата. Лунки закрывают приспособлением для заклеивания планшетов и инкубируют при 37°С в течение 1 часа. Содержимое лунок отсасывают в приемник для биологически опасных веществ (сосуд, содержащий вескодин или 10% хлорной извести в воде). Планшет промывают устройством для промывания планшетов, заполняя лунки 300 мкл промывочного буфера. После последней промывки планшет переворачивают и встряхивают, чтобы удалить остатки промывочного буфера на бумажные салфетки. В каждую лунку вводят 100 мкл разведенного на стадии 2 конъюгата. Планшет закрывают и инкубируют в течение 20 минут при комнатной температуре. Затем лунки пять раз промывают вышеуказанным устройством для промывания планшетов и встряхивают, чтобы удалить остатки буфера. В каждую лунку вводят 100 мкл смешанного субстрата, после чего планшет заклеивают и инкубируют в течение 15 минут при комнатной температуре. Затем в каждую лунку добавляют 150 мкл ингибирующего раствора и содержимое планшета осторожно перемешивают, поворачивая планшет на столе. Сразу же определяют величину оптической плотности при 450 нм.
Анализ культуры клеток
Токсины С. difficile вызывают округление клеток в культуре. Данное свойство можно использовать для детектирования подавления активности токсина полимерными соединениями. Чувствительность к токсинам А и В является различной у разных линий клеток. В данном случае использованы клетки Vero (линия клеток АТСС). Указанные клетки чувствительны к 600 пг токсина А и менее чем к 2 пг токсина В. При выполнении данного анализа клетки Vero помещают в 12-луночные планшеты с транслунками или 96-лучночные титрационные микропланшеты. Клетки высевают за 24 часа до начала испытания, и во время добавления токсина они представляют собой сливающиеся монослои. Полимеры (5 мг/мл) инкубируют в культуральных тканевых средах (минимальные поддерживающие среды с 10% фетальной телячьей сыворотки) с токсином А или токсином В, покачивая в течение 1 часа при комнатной температуре. После инкубации образцы обрабатывают по-разному в зависимости от того, являются ли они нерастворимыми гелями или растворимыми полимерами. Нерастворимые гели вводят в транслунки (0,5 мл/лунку), так как при прямом добавлении к монослоям гели закрывают клетки, не позволяя обнаружить округление клеток. Растворимые полимеры добавляют непосредственно к монослоям клеток в 96-луночных титрационных микропланшетах (0,1 мл/лунку). Клетки инкубируют при 37°С в течение 18 часов и следят за округлением клеток. В конце анализа определяют наименьшую концентрацию полимера, позволяющую защитить 50% и 100% монослоя от округления клеток в течение 18-часовой инкубации. В контрольных анализах активный полимер инкубируют с токсинами А и В, отдельно с каждым токсином А и В, и без токсина.
Анализ модели петли подвздошной кишки крысы
Целью данного анализа является измерение способности полимерных соединений предотвращать опосредованное токсином А накопление жидкости и проницаемость в лигированном участке подвздошной кишки крысы. Крыс анестезируют и 5 см участок подвздошной кишки крысы лигируют шелковой нитью. В этот участок вводят полимер (1-5 мг) и 5 мкг очищенного токсина А. Крысе делают также внутривенную инъекцию 10 мкСi3H-маннита в качестве маркера проницаемости кишечника. Токсин А увеличивает проницаемость сосудов в кишечнике, способствуя попаданию маннита в петлю. Через четыре часа после инъекции токсина А и полимера участок петли подвздошной кишки удаляют, взвешивают и измеряют общее накопление жидкости. Накопление3H-маннита измеряют сцинтилляционным счетчиком. Полимерные соединения, связывающие токсин А, блокируют накопление жидкости в кишечнике и проницаемость для3H-маннита. В конце анализа определяют концентрацию полимера, которая полностью ингибирует опосредованное токсином А накопление жидкости и проницаемость сосудов. В модифицированном варианте данного анализа полимер вводят через желудочный зонд. Крысам вводят раствор полимера 250 мг/кг при помощи желудочного зонда за 90 минут до создания петель подвздошной кишки. Токсин инъецируют в петли подвздошной петли, как указывалось выше.
Результаты
Результаты анализов ELISA, культуры клеток, модели петли подвздошной петли крысы и животной модели с использованием хомячков представлены в таблице 1 для разных полимеров. В указанной таблице приведены также соответствующие данные для холестериламина, катионного полимера, который используется в клинических условиях для нейтрализации токсинов С. difficile.
Данные, приведенные для животной модели с использованием хомячков, показывают процентное значение выживания животных на 5-й день после заражения С. difficile.
Результаты, приведенные в таблице 1, свидетельствуют о том, что все испытанные полистиролсульфонатные полимеры являются более эффективными во всех анализах, чем холестериламин.
Испытания in vivo
Методика испытаний
Хомячки очень восприимчивы к инфицированию С. difficile, причем они заболевают смертельной формой колита, если болезнь вызвана антибиотиками. Соединения оценивают в отношении их способности ингибировать активность токсинов С. difficile в животной модели колита, обусловленного С. difficile, с использованием хомячков. Самцы хомячков (80-100 г) приобретены в фирме Biobreeders Inc. (Falmouth MA). Всех животных содержат в группах по пять особей в микроизолированных клетках на обработанных в автоклаве подстилках (Beta Chips), при этом они имеют свободный доступ к обработанному в автоклаве корму и обработанной в автоклаве фильтрованной воде. Животные отдыхают в течение примерно 1 недели после поступления и до начала исследования. Для инфицирования животных использован штамм С. difficile, первоначально выделенный из возбудителя колита С. difficile человека. Данный штамм (HUC2-4) продуцирует токсины в умеренных и высоких количествах in vitro и in vivo. Суспензию 106-107 бактериальных клеток/мл получают из бульонной культуры, инкубируемой в течение ночи, и при помощи желудочного зонда вводят 0,1 мл в -1-й день. Через двадцать четыре часа всем животным подкожно инъецируют клеоцинфосфат IV® в дозе 10 мг/кг. Полимеры вводят группам из десяти животных при помощи желудочного зонда три раза в день. Требуемую дозу полимеров, составляющую 25-100 мг/день, вводят в виде трех отдельных доз по 0,75 мл каждая. Начало и продолжительность курса введения изменяется в зависимости от описанных ниже схем лечения. У животных ежедневно контролируют развитие болезни или смертность. Помимо этого у животных оценивают такие дополнительные параметры, как внешний вид, время появления клинических симптомов и наличие или отсутствие диареи ("мокрый хвост"). Умирающих животных и животных, выживших в конце исследования, безболезненно умерщвляют, вызывая асфиксию 100% СO2. В некоторых исследованиях получают содержимое слепой кишки и замораживают для последующего анализа токсина.
Введение клиндамицина (в 0-й день) предположительно вызывает заболевание у хомячков, инфицированных С. difficile (в -1-й день), вследствие нарушения нормальной микрофлоры кишечника и стимуляции пролиферации С. difficile. С. difficile является причиной возникновения смертельной формы колита у 90-100% инфицированных хомячков в течение 2-4 дней. Основной целью данного исследования является предотвращение летального исхода среди хомячков. Данная модель заболевания является очень тяжелой и провокационной, и CDAD у хомячков протекает в гораздо более тяжелой форме с точки зрения серьезности и продолжительности заболевания по сравнению с той же формой заболевания у человека. Фармацевтические композиции по данному изобретению исследуют при помощи животной модели CDAD с использованием хомячков в соответствии с двумя разными режимами лечения. Профилактическая модель служит для исследования возможности предварительного лечения связывающими токсин веществами с целью предотвращения CDAD несмотря на заражение продуцирующим токсин С. difficile. В терапевтической модели композиции вводят после возникновения CDAD.
Профилактическая модель
При использовании данной модели четыре разных дозы (25, 50, 75 или 100 мг/сутки, вводимые перорально по 0,750 мл три раза в день) фармацевтической композиции, содержащей полистиролсульфонат (или физиологический раствор в качестве контрольного вещества), вводят перорально самцам сирийских золотистых хомячков (по десять животных в двух испытательных группах) в течение 7 дней, начиная со 2-го по 5-й день. Хомячков заражают С. difficile (штамм Onderdonk (G69) в 1-й день и вводят клиндамицин в 0-й день. 100% животных, которым вводят плацебо, заболевают и погибают на 3-й день. В отличие от этого профилактическое введение испытуемой композиции способствует выживанию 70% и 90% животных в группах, которым вводят соответственно дозу, равную 50 мг/сутки и 100 мг/сутки. Хотя у всех животных происходит продуцирующее токсин заражение С. difficile, композиция, содержащая полистиролсульфонат, эффективно ингибирует токсины и сводит до минимума колит в период изменения микрофлоры кишечника. По мере восстановления нормальной микрофлоры С. difficile, по-видимому, оказывается неспособным конкурировать с ее воздействием, и его количество сокращается до непатогенного уровня.
Это свидетельствует о возможности связывания токсина на начальных стадиях воздействия токсина и предотвращения колита до его возникновения.
Терапевтическая модель
Лечение полимером начинают в 1-й день и вводят его в дозе 25, 50, 75 или 100 мг/сутки. Полимер вводят три раза в день в 0,7-1,5 мл стерильного физиологического раствора с 1-го по 7-й день, всего в течение 7 дней. За животными ведут наблюдение в течение 7-14 дней после окончания лечения с целью выявления у них характера развития болезни, смертности и клинических симптомов.
Модель комбинированной терапии
Животным вводят в комбинации 50-100 мг/сутки полимера и антибиотика в общем объеме 0,75 мл филиологического раствора с 1-го дня (через 48 часов после введения патогенного микроорганизма) по 5-й день. В качестве антибиотика используют метронидазол или ванкомицин. Доза метронидазола составляет 21 мг/сутки. Доза ванкомицина составляет 3 мг/сутки. Вслед за комбинированной терапией в течение еще 4 дней животным вводят 50-100 мг/сутки одного полимера. За животными ведут наблюдение в течение 7-14 дней после окончания лечения с целью выявления у них характера развития болезни, смертности и клинических симптомов.
Метронидазол позволяет эффективно предотвратить гибель хомячков от CDAD в течение всего периода активного введения данного лекарственного средства. Однако после окончания лечения указанным препаратом у 80-90% животных происходит рецидив CDAD, в результате чего они погибают в течение 3-6 дней после окончания введения метронидазола. Эксперименты показывают эффективность введения композиции, содержащей полистиролсульфонат (ПСС), после возникновения CDAD и для предотвращения рецидива заболевания. Смертность вследствие рецидива заболевания под действием С. difficile после окончания введения метронидазола снижается на 90% при введении животным высокой дозы композиции, содержащей полистиролсульфонат. Рецидив не возникает у 70% животных из испытательной группы, получающей низкую дозу полистиролсульфоната. При этом погибают все животные из контрольной группы, которым вводят физиологический раствор. Только 20% животных, которым вводят только метронидазол, выживают в течение 16 дней после введения последней дозы антибиотика (выжившие животные продолжают страдать диарей на 21-й день). Таким образом, ингибирование токсинов композицией, содержащей ПСС, позволяет предотвратить колит и другие патологии в течение периода времени, необходимого для восстановления нормальной микрофлоры после лечения метронидазолом, и не допустить рецидива заболевания.
Монотерапия композициями, содержащими ПСС
Проведено исследование лечения только композицией, содержащей ПСС, и сравнение полученных результатов со стандартным лечением одним метронидазолом. Композиции, содержащие ПСС, по настоящему изобретению превосходят метронидазол, позволяя вылечить 40% животных по сравнению с 20% животными в группе, получавшей только метронидазол. Из этого следует, что композиция, содержащая ПСС, является более эффективной по сравнению с метронидазолом в случае монотерапии. Композиции, содержащие ПСС, по-видимому, не влияют на активность антибиотиков.
Анализ культуры клеток Vero
Во всех исследованиях клетки Vero испытывают в 96-луночном планшете, вводя 4×104 клеток/лунку в количестве 100 мкл/лунку. Планшеты инкубируют в течение ночи при 37°С и используют на следующий день. Все среды, планшеты, пипетки и оборудование являются стерильными. Планшеты закрывают и опрыскивают EtOH перед тем, как поместить их в термостат.
Исследование токсинов А и В
Полимеры отвешивают в 15 мл конические пробирки сначала в количестве 10 мг/мл, доводя конечную концентрацию в лунках до 5 мг/мл. В пробирки обычно вводят примерно от 40 мг до 4 мл среды в качестве разбавителя. Избыток помещают в холодильник при 4°С для выполнения в случае необходимости повторных испытаний. Среды вводят пипеткой в пробирки в стерильных условиях, после чего пробирки интенсивно встряхивают. Если не образуется раствор полимера, пробирки помещают на водяную баню при 37°С в течение 15-20 минут. В данном эксперименте конечная концентрация токсина А составляет 10 нг/мл и токсина В составляет 1 нг/мл. Объем токсинов и полимера увеличивают в два раза и смешивают в отношении 1:1 до достижения однократной конечной концентрации для обоих веществ. Указанные растворы получают в конических пробирках и помещают на лед.
После полного растворения полимеров в стерильные 96-луночные планшеты вводят среды в количестве 100 мкл/лунку в ряды G-H и колонки 2-6 и 8-12 в рядах A-F. На одном планшете исследуют четыре полимера, причем каждый полимер занимает три ряда, один ряд предназначен только для полимера и сред, еще один ряд предназначен для токсина А и полимера и третий ряд предназначен для токсина В и полимера. Ниже показано распределение веществ по лункам.
После введения сред 200 мл раствора полимера добавляют в первые колонки каждого сегмента (колонка 1 или 7) и двукратно разбавленный раствор вводят в лунки планшета до конца секции (колонка 6 или 12). Среды добавляют в ряды A, D и Н и токсин А добавляют в ряды В, Е и G (колонки 1-6). Токсин В добавляют в ряды С, F и G (колонки 7-12). Токсин и среды добавляют в количестве 100 мкл/лунку, доводя общий объем в лунке до 200 мкл. Последний ряд (Н) не использован в данном анализе. Планшеты помещают на шейкер и инкубируют при комнатной температуре в течение одного часа.
Затем берут планшеты с клетками, которые в течение ночи находились в термостате, и при помощи пипеток из лунок отсасывают среды, используя устройство для вакуумного отсасывания. Каждый раз среды удаляют только из одного планшета, так как клетки высыхают во время этой операции. Удалив среды, к клеткам добавляют пипеткой смесь токсина/полимера. Раствор вводят в количестве 100 мкл/лунку, начиная с наименьшего количества токсина и кончая наибольшей концентрацией, используя одни и те же наконечники пипеток на протяжении всей процедуры. Наконечники пипеток меняют для каждого нового испытуемого полимера. Ряд Н не используют. Планшеты исследуют под микроскопом, чтобы убедиться в том, что монослой клеток не был поврежден во время отсасывания. Затем планшеты помещают в термостат при 37°С, проверяют через 18 часов после обработки полимером/токсином и определяют округление клеток, оценивая его от отсутствия округления клеток до частичного (50%) округления клеток.
Уменьшение дозы токсина В
Полимеры отвешивают в количестве 10 мг/мл (конечная концентрация 5 мг/мл) в конические пробирки. Для выполнения испытания обычно достаточно от 70 мг до 7 мл сред (используемый разбавитель). Полимеры, не образующие раствор, помещают на водяную баню при 37°С в течение 15-20 минут. Растворы, в которых полимеры полностью не растворяются, и гели испытывают в соответствии с методикой исследования геля. Токсин В получают, начиная с концентрации 2 нг/мл (конечная концентрация 1 нг/мл), и хранят на льду. Используют стерильные 96-луночные планшеты и среды добавляют в количестве 100 мкл/лунку во все лунки за исключением первой колонки. Каждый полимер испытывают в трех разных рядах (два полимера на одном планшете), при этом в первом ряду находится только полимер без токсина и в следующих двух рядах находится полимер и токсин В. В ряд G помещают более низкую дозу только токсина В и ряд Н не обрабатывают. Ниже показано распределение веществ по лункам.
200 мкл любой среды или токсина В помещают в первую колонку (среды для рядов с одним полимером) и разводят в два раза, перенося 100 мкл в новую колонку. Смесь полимера добавляют в количестве 100 мкл во все лунки за исключением рядов G и Н. В ряд G вводят 100 мкл среды и ряд Н не обрабатывают. Указанные планшеты помещают на шейкер в течение одного часа и, начиная с этого этапа, выполняют вышеописанную процедуру.
После добавления к клеткам токсина и полимера планшеты опрыскивают EtOH, помещают на ночь в термостат при 37°С и через 18 часов производят оценку. Оценка считается положительной для округленных клеток, отрицательной для нормальных клеток и +/- для лунок, в которых морфология является нормальной по крайней мере на 50%.
Методика исследования гелей
Гели исследуют с использованием двух разных концентраций полимеров в количестве 5 или 10 мг/мл. Концентрации токсинов составляют 100, 10, 1 для токсинов А и В. Указанные концентрации изменяют в зависимости от типа полимера. Каждый полимер отвешивают в двенадцать пробирок Эппендорфа. Токсины разводят в однократном объеме и 1 мл токсина добавляют в соответствующую пробирку Эппендорфа. В контрольные пробирки вводят только полимер (во всех концентрациях) и только токсины. Затем пробирки покачивают при комнатной температуре в течение одного часа и центрифугируют в течение пяти минут со скоростью 14000 оборотов/минуту. 200 мкл каждого образца вводят в одну лунку стерильных 96-луночных планшетов. Планшеты с клетками Vero вынимают из термостата и среды отсасывают (по одному планшету за один раз). 100 мкл смеси токсина/полимера вводят непосредственно в планшеты с клетками, планшеты закрывают, помещают в термостат на ночь и на следующий день производят оценку. Оценку выполняют в соответствии с вышеописанными методиками.
Эксперименты с использованием петли подвздошной кишки крыс
Ниже описано получение петель подвздошной кишки у анестезированных крыс. Данную экспериментальную модель можно использовать для испытания влияния энтеротоксичных веществ, таких как бактериальные токсины, на структуру и функцию кишечника; с ее помощью можно также определить действие предполагаемых защитных средств.
У каждого животного получают две кишечные петли длиной около 5 см, перевязывая подвздошную кишку шелковой нитью. Почечные ножки перевязывают во избежание экскреции маннита и меченного радиоактивным изотопом маннита (3H-маннита), вводимого в виде внутривенной инъекции. В указанные петли инъецируют испытуемые вещества (±токсин±полимер). Через четыре часа животных умерщвляют и петли удаляют. Секрецию жидкости в кишечник (показатель секреторной диареи) определяют, взвешивая петли и измеряя их длину. Проницаемость слизистой оболочки кишечника определяют, измеряя накопление меченного радиоактивным изотопом маннита (3H-маннита) в петле. Образцы ткани помещают также в фиксирующий раствор для последующей морфологической оценки поражения и воспаления слизистой оболочки.
Подготовка животных
Самцов крыс Wistar массой 200-250 г не кормят в течение ночи (18-22 часа) и содержат в клетках с проволочным основанием, чтобы сократить до минимума загрязнение клеток испражнениями. Воду крысы получают без ограничения. Петли подвздошной кишки полностью очищают от содержимого (пища и желчь), которое может связываться с токсином или испытуемыми веществами или изменять их естественные свойства.
Получение раствора
В каждую петлю подвздошной кишки вводят 0,5 мл одного или нескольких испытуемых веществ в физиологическом растворе с фосфатным буфером (PBS). Готовят четыре комплекта маркированных пробирок и маркированных шприцев (± токсин ± полимер). Токсин А прилипает к пластиковой посуде, вследствие чего уменьшается его эффективная концентрация. По этой причине пробирки и шприцы должны быть пригодны для повторного использования при обработке петель.
Токсин А
Токсин А производится на коммерческой основе фирмой TechLab Inc. и предоставляется в 0,5 мл ампулах, содержащих 2 мг/мл. В каждую петлу, предназначенную для введения токсина А, вводят всего 5 мкг или 2,5 мкл вышеуказанного раствора.
Полимер
В петли, предназначенные для введения полимера, вводят всего 10 мг в 0,5 мл PBS (20 мг/мл). Перед каждым экспериментом получают новые растворы/суспензии полимеров.
3H-Маннит
Исходный раствор 1 мCi/мл3H-маннита (маннит, D-[1-3 H(N)]-, номер по каталогу NEN NET101) помещают в холодильник. Каждому животному внутривенно вводят 10 мкСi3H-маннита в объеме 200 мкл (то есть 10 мкл исходного3H-маннита+190 мкл PBS на одного животного).
Анестезия
Животных анестезируют 35-60 мг/кг пентобарбитала (50 мг/мл раствора), который вводят в виде внутрибрюшинной инъекции. Таким образом, при помощи внутрибрюшинной инъекции 0,2-0,3 мл анестезируют крысу массой 200-250 г. Альтернативно можно использовать смесь кетамина/ксилазина. Указанную смесь можно получить, смешивая 5,4 мл кетамина (100 мг/мл) и 0,45 мл ксилазина (100 мг/мл). Животных анестезируют 0,25-0,3 мл указанной смеси и оставляют на десять-пятнадцать минут до начала действия анестезии. Действие анестезии, достаточной для хирургической операции, подтверждают отсутствием реакции на болезненный раздражитель (укол в лапу).
Подготовка к хирургической операции
По середине брюшной полости делают разрез и выводят на поверхность тела слепую кишку и тонкую кишку. Шелковой нитью 3.0 перевязывают ножку левой почки и сосудистую сеть. Внутренние органы располагают так, чтобы обнажить правую почку, и перевязывают ее почечную ножку, стараясь не повредить полую вену. Слепую кишку располагают так, чтобы можно было видеть тонкую кишку и питающую ее сосудистую сеть. Находят два отрезка подвздошной кишки длиной 5 см без какого-либо содержимого (пища или желчь) и накладывают лигатуру так, чтобы образовались две слепые петли. В полученные петли инъецируют требуемые испытуемые вещества. Вещества инъецируют в петлю ниже лигатуры по направлению к слепой кишке. Внутренние органы располагают так, чтобы можно было видеть полую вену, и внутривенно инъецируют 200 мкл раствора3H-маннита. Удалив иглу, слегка нажимают на место прокола, чтобы ускорить свертывание крови. После инъекции маннита внутренние органы возвращают в брюшную полость, при этом мышцы и кожу вокруг раны сшивают хирургическими нитями.
Инъецирование веществ в петли подвздошной кишки
5 мкг токсина А растворяют в 0,5 мл PBS (±полимер), полученную смесь вводят в шприц, который вкалывают в петлю. Затем содержимое шприца быстро инъецируют в кишечную петлю.
Уход за животными
После хирургической операции животных помещают в закрытую клетку с подстилкой из древесных опилок и оставляют в покое на 4 часа. Животные приходят в сознание в течение этого периода. Всех животных с признаками боли или беспокойства сразу же безболезненно умерщвляют.
Удаление и обработка петель
Через четыре часа после введения испытуемых веществ удаляют петли подвздошной кишки. Животных умерщвляют 100% СО2, открывают брюшную полость, петли идентифицируют визуально или при помощи хирургических маркеров. С петель срезают лишние ткани, после чего их иссекают хирургическим путем, убедившись в целостности содержимого петель. Петли помещают на лист бумаги для взвешивания, измеряют их длину и взвешивают. Дистальный конец петли вводят в предварительно взвешенный сосуд, отрезают его и собирают содержимое в сосуде. 500 мкл PBS инъецируют в проксимальный конец петли для вымывания содержимого из петли. Затем петлю разрезают пополам, 0,5 см отрезок отделяют, распрямляют и помещают в фиксирующий раствор.
Получение образца для измерения в сцинтилляционном счетчике
Пробирки взвешивают еще раз, чтобы определить объем содержимого петли. Затем пробирки интенсивно встряхивают и 200 мкл аликвотную пробу вводят в 7 мл пластиковую ампулу для сцинтилляционного счетчика. Указанные пробы смешивают с 5 мл смеси для сцинстилляционного счетчика Ultima Gold и встряхивают. Пробы оставляют для уравновешивания в течение ночи (чтобы сократить до минимума хемилюминесценцию), встряхивают и производят подсчет на следующий день.
Анализ МИК
Анализ минимальной ингибирующей концентрации (МИК) позволяет определить минимальную концентрацию антимикробного вещества, необходимую для подавления роста испытуемых микроорганизмов. Анализы МИК выполняют в отношении стандартной панели микроорганизмов для идентификации соединений, обладающих антимикробной активностью. Затем анализ МИК повторяют в отношении других специализированных микробных панелей; соединения испытывают в отношении биоцидной активности, времени уничтожения, токсичности для клеток культуры ткани, выращенных in vitro, и в некоторых случаях в отношении антимикробной активности in vivo.
Анализ МИК выполняют в соответствии со стандартами, установленными в Performance Standards for Antimicrobial Susceptibility Testing, 1998, vol. M100-S8, Eighth Informational Supplement, NCCLS, 940 West Valley Road, Suite 1400, Wayne, PA 19087.
Указанную процедуру можно коротко описать следующим образом. Испытуемые полимеры растворяют в 0,85% физиологическом растворе до конечной концентрации 5000 мкг/мл, доводят рН до 7,0 и полученный раствор стерилизуют фильтрованием через 0,22 мкм фильтр. Двукратные последовательные разбавления полимера получают в бульоне Мюллера-Хинтона и аликвоты катионов вводят в 96-луночные титрационные микропланшеты. Затем планшеты инокулируют 5×105 клеток/лунку целевого микроорганизма и инкубируют в течение 18-24 часов при 35°С. Оптическую плотность (ОП) измеряют при 590 нм и оценивают рост микроорганизмов (ОП>0,1 означает рост микроорганизмов; ОП<0,1 означает подавление роста). Значение МИК определяют в виде наименьшей концентрации соединения, подавляющей рост микроорганизмов.
Испытуемые микроорганизмы включают широкую панель аэробных грамотрицательных и грамположительных бактериальных штаммов, имеющих клиническую значимость, отдельные виды анаэробов (Clostridium difficile), а также несколько штаммов вида Candida.
Несмотря на то, что данное изобретение рассмотрено и описано со ссылкой на предпочтительные варианты его осуществления, специалистам в данной области должно быть понятно, что в данное изобретение могут быть внесены разные изменения, не выходящие за пределы его объема, изложенного в прилагаемой формуле изобретения.
Реферат
Изобретение относится к способу ингибирования токсина у животного, а также у человека при болезни желудочно-кишечного тракта (ЖКТ). Сущность изобретения заключается во введении субъекту терапевтически эффективного количества полимера, имеющего несколько боковых кислотных функциональных групп, которые присоединены непосредственно к главной цепи полимера или связаны с ней при помощи промежуточной группы. Промежуточная группа может иметь цепь длиной от 0 до около 20 атомов. Токсин обычно является экзотоксином, секретируемым патогенными микроорганизмами, такими как бактерии, например, при диарее. Технический результат - расширение арсенала средств борьбы с бактериальными поражениями ЖКТ. 9 н. и 30 з.п. ф-лы, 1 табл., 2 ил.
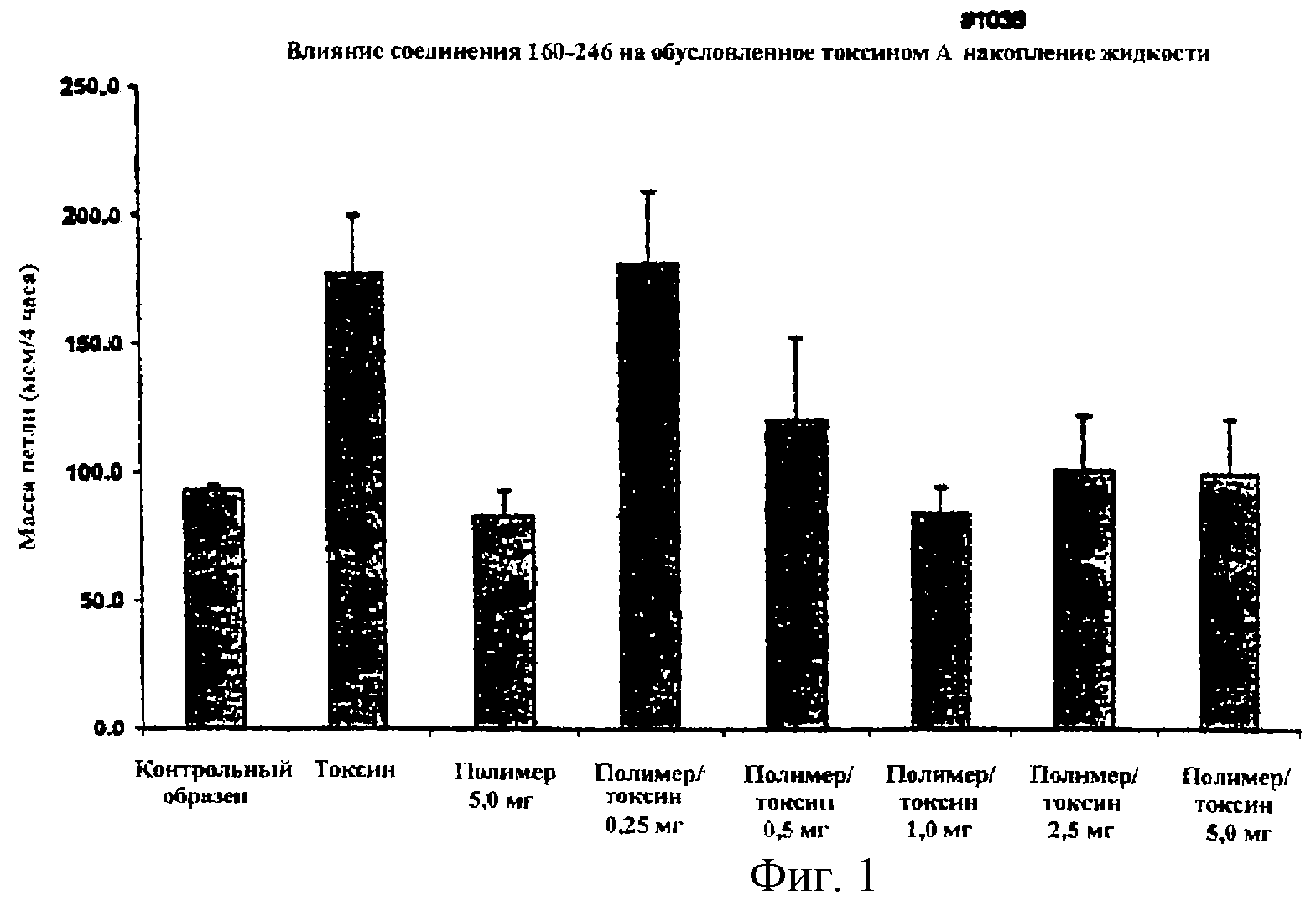
Формула



Комментарии