Гемостатическая композиция, включающая матрицу на основе сшитого производного гиалуроновой кислоты - RU2740191C2
Код документа: RU2740191C2
Чертежи


Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к гемостатической композиции и к способу ее получения, и, более конкретно, относится к гемостатической композиции, содержащей матрицу на основе сшитого производного гиалуроновой кислоты, которая подходит для применения для гемостаза, и к способу получения такой композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Во многих областях хирургических операций может быть индуцировано кровотечение, которое эффективно не контролируется наложением лигатуры или общими процедурами, или является неконтролируемым. Для остановки такого тяжелого кровотечения для ран можно применять гемостатическую композицию, и гемостатическая композиция, как таковая, требуется для предоставления вещества с сильной адгезивной силой и адекватным набуханием при нанесении на человеческие ткани, такие как раны.
В качестве примера гемостатической композиции, содержащей биосовместимое и биодеградируемое сухое стабильное гранулярное вещество, имеется Floseal®, и он представляет собой гемостатический агент широкого назначения, состоящий из гранулярной желатиновой матрицы, которая набухает в тромбинсодержащем растворе с образованием текучей пасты.
Однако, даже несмотря на то, что приведенный выше продукт имеет хорошую адгезивную силу и набухание, относящиеся к гемостатическому эффекту, он содержит сшитый и высушенный желатин, имеющий происхождение из коровьего источника, таким образом, могла бы быть озабоченность относительно безопасности при применении для хирургии у человека.
Гиалуроновая кислота является одним из компонентов человеческого организма и используется в разных целях, таких как приготовление напитков, косметических средств, лекарственных средств и т.д. В частности, известно то, что она имеет возможность стимулировать регенерацию тканей, и она является безопасной для человеческого организма, таким образом, ее разрабатывали и использовали в качестве компонента противоадгезивного агента. Согласно недавней литературе данная возможность гиалуроновой кислоты в качестве компонента гемостатической матрицы была предложена посредством комбинации с другим гемостатическим агентом, но в результате анализа авторов данного изобретения было показано то, что ее сложно смешивать с гемостатическим компонентом из-за локализованного гелеобразования в процессе гидратации, и вязкость, и гигроскопичность после гидратации являются низкими, и при нанесении смешанной композиции на раневую область она наносила вред раневой области из-за ее избыточно высокой адгезивной силы, и, таким образом, сложно использовать природную гиалуроновую кислоту в качестве композиции гемостатического агента.
При данных обстоятельствах, в результате интенсивных исследований авторов данного изобретения по преодолению вышеупомянутых проблем предшествующего уровня техники, они создали матрицу на основе производного гиалуроновой кислоты с подходящей адгезивной силой в отношении ткани и противоадгезивной способностью посредством сшивания гиалуроновой кислоты, и гомогенизировали ее до подходящего размера, и они разработали производное гиалуроновой кислоты, которое можно легко смешивать с другими гемостатическими компонентами, и она имеет подходящую адгезивную силу для лечения раны, и, посредством этого, они осуществили настоящее изобретение подтверждением того, что гемостатическая композиция, содержащая такое производное, демонстрирует превосходный гемостатический эффект.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Для того чтобы решить вышеупомянутые проблемы, первичной целью настоящего изобретения является предложение гемостатической композиции, содержащей матрицу на основе сшитого производного гиалуроновой кислоты.
Кроме того, другой целью настоящего изобретения является предложение способа получения гемостатической композиции, содержащей матрицу на основе сшитого производного гиалуроновой кислоты.
ПОЛЕЗНЫЕ ЭФФЕКТЫ
Гемостатическая композиция, содержащая матрицу на основе сшитого производного гиалуроновой кислоты по настоящему изобретению, имеет высокую водопоглощающую способность и подходящую адгезивную силу для гемостатического назначения. Кроме того, при применении по отношению к организму, она образует эффективный барьер, который может блокировать просачивания из кровеносного сосуда. В частности, свойство набухания сшитого производного гиалуроновой кислоты, содержащегося в данной гемостатической композиции, может увеличивать адгезивную силу на область кровотечения и создавать эффективный механической барьер против межтканевой адгезии.
Гемостатическая композиция по настоящему изобретению имеет лучшую адгезивную силу по отношению к тканям, чем традиционный раствор тромбина, и может полностью расщепляться и поглощаться in vivo после определенного периода времени. Кроме того, посредством применения безопасного производного гиалуроновой кислоты, которое имеет подходящую адгезивную силу по сравнению с раствором природной натриевой соли гиалуроновой кислоты, эта новая гемостатическая композиция исключает риск побочных эффектов, которые могут быть вызваны применением гемостатической композиции, полученной из экзогенных веществ, как описано выше.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
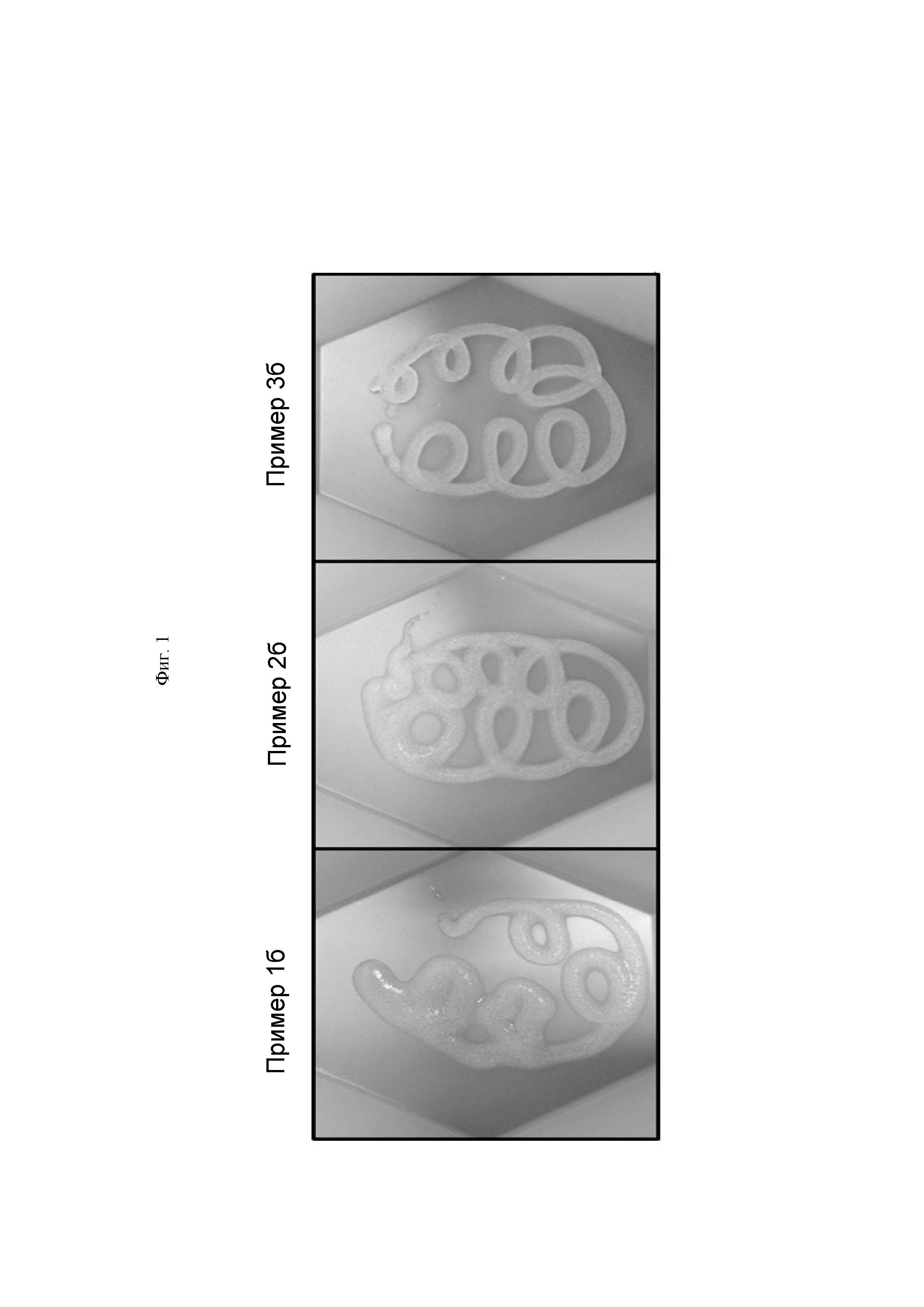
На ФИГ. 1 показан внешний вид гемостатической композиции, содержащей производное гиалуроновой кислоты, полученное согласно способам получения по настоящему изобретению.
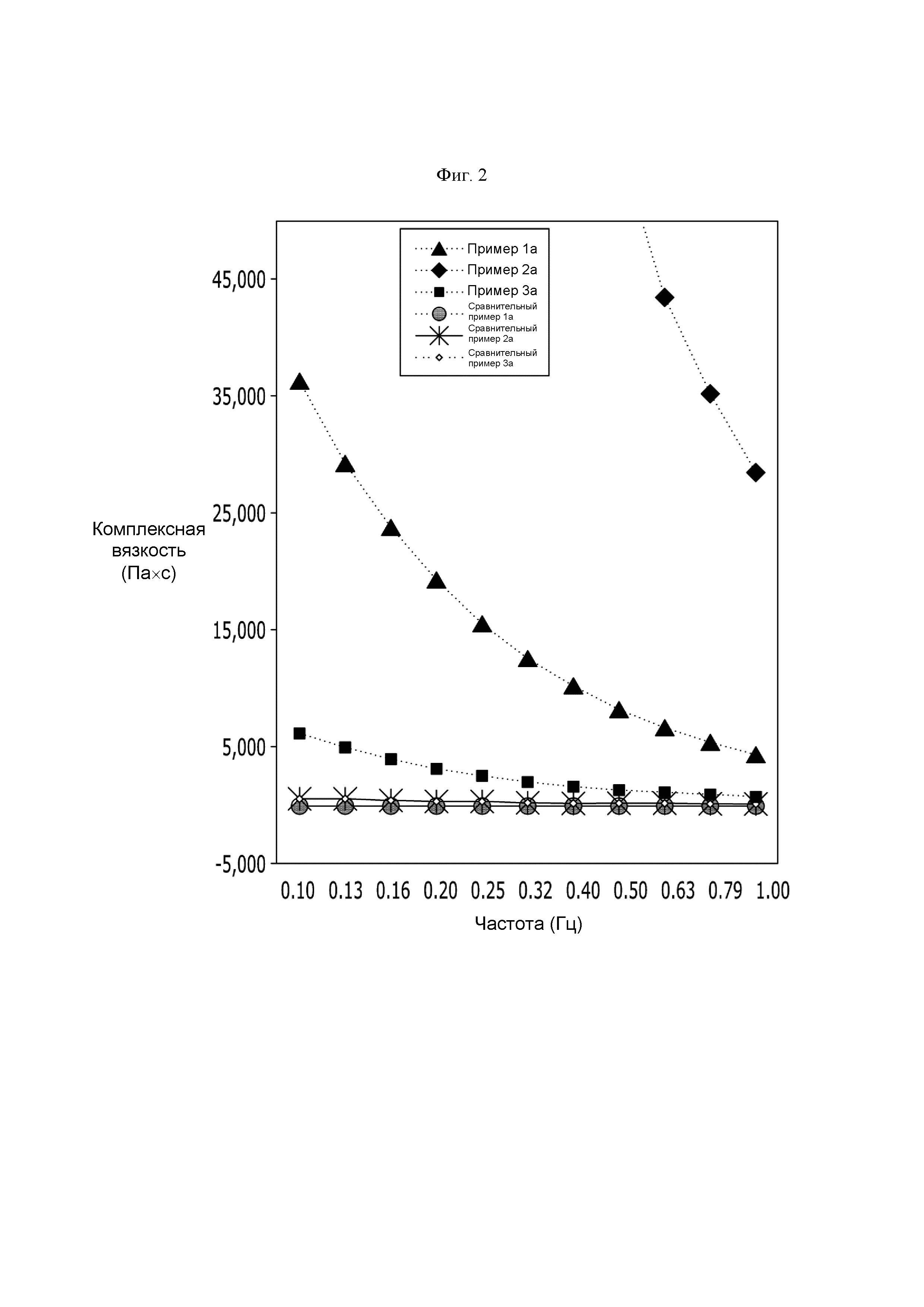
На ФИГ. 2 показан результат измерения комплексной вязкости и результат по значениям tanδ в интервале частоты от 0,1 Гц до 1 Гц для исследования реологических характеристик производного гиалуроновой кислоты, полученного так же, как и в Примерах 1а-3а и Сравнительных примерах 1а, 2а и Сравнительном примере 3а.
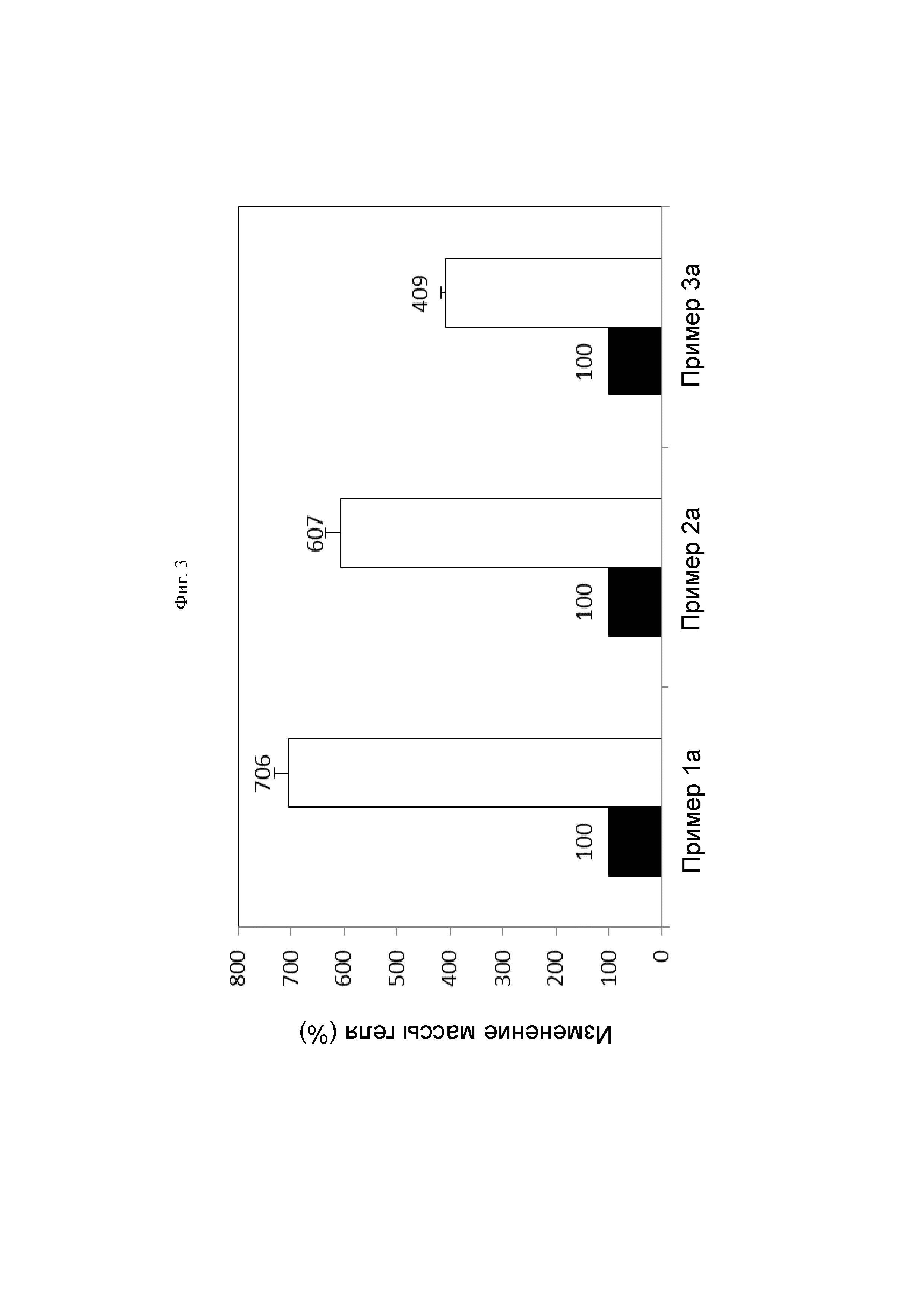
На ФИГ. 3 показан результат абсорбирующей способности производных гиалуроновой кислоты, полученных так же, как и в Примерах 1а-3а.
На ФИГ. 4 показан результат подтверждения поглощаемости жидкости гемостатической композиции, содержащей производные гиалуроновой кислоты, полученные так же, как и в Примерах 1б-3б, и гемостатической композиции, содержащей не сшитую гиалуроновую кислоту, полученную так же, как и в Сравнительном примере 4б.
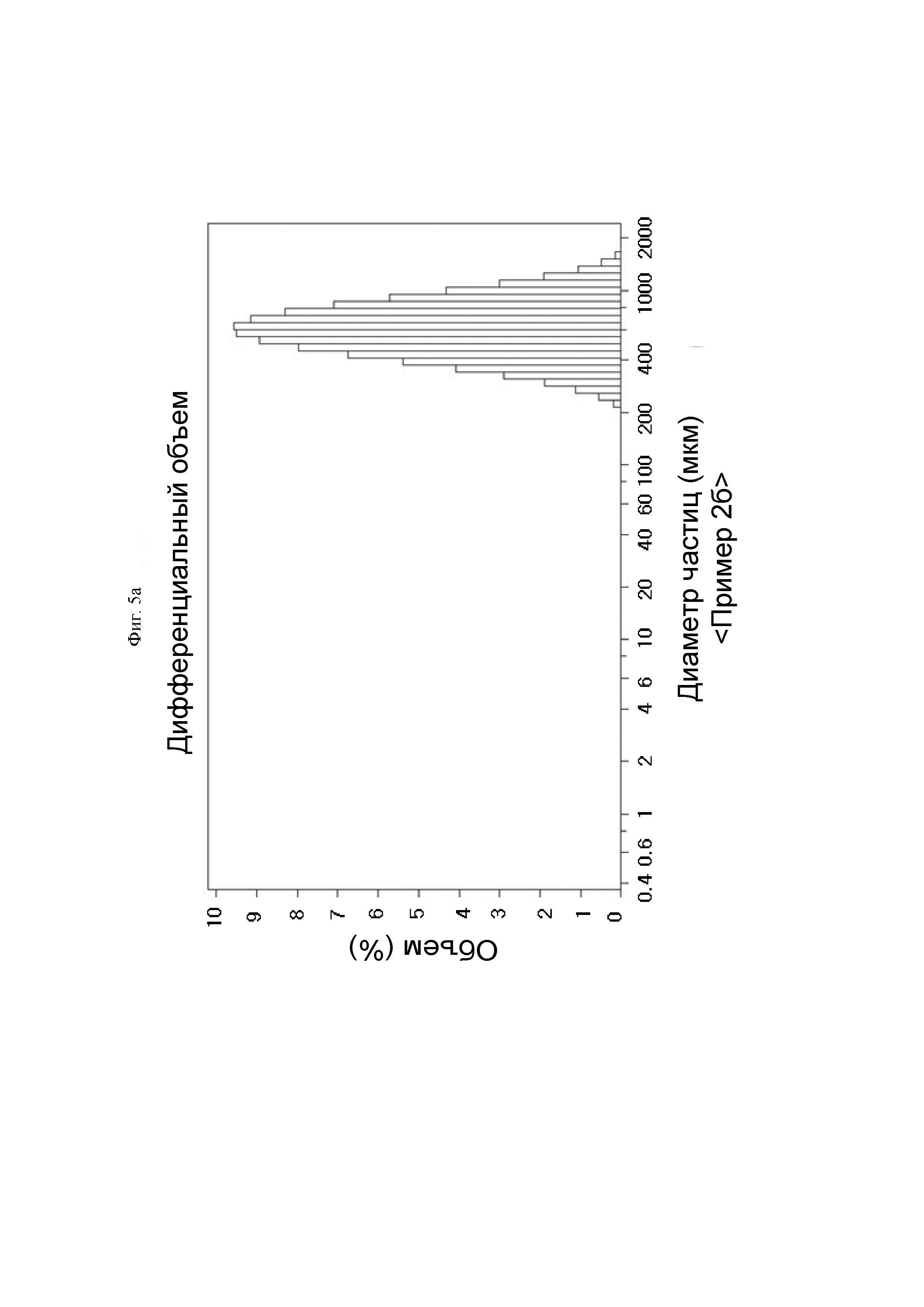
На ФИГ. 5а показан результат проведения анализа размера частиц гемостатической композиции, содержащей производное гиалуроновой кислоты, полученное так же, как и в Примере 2б.
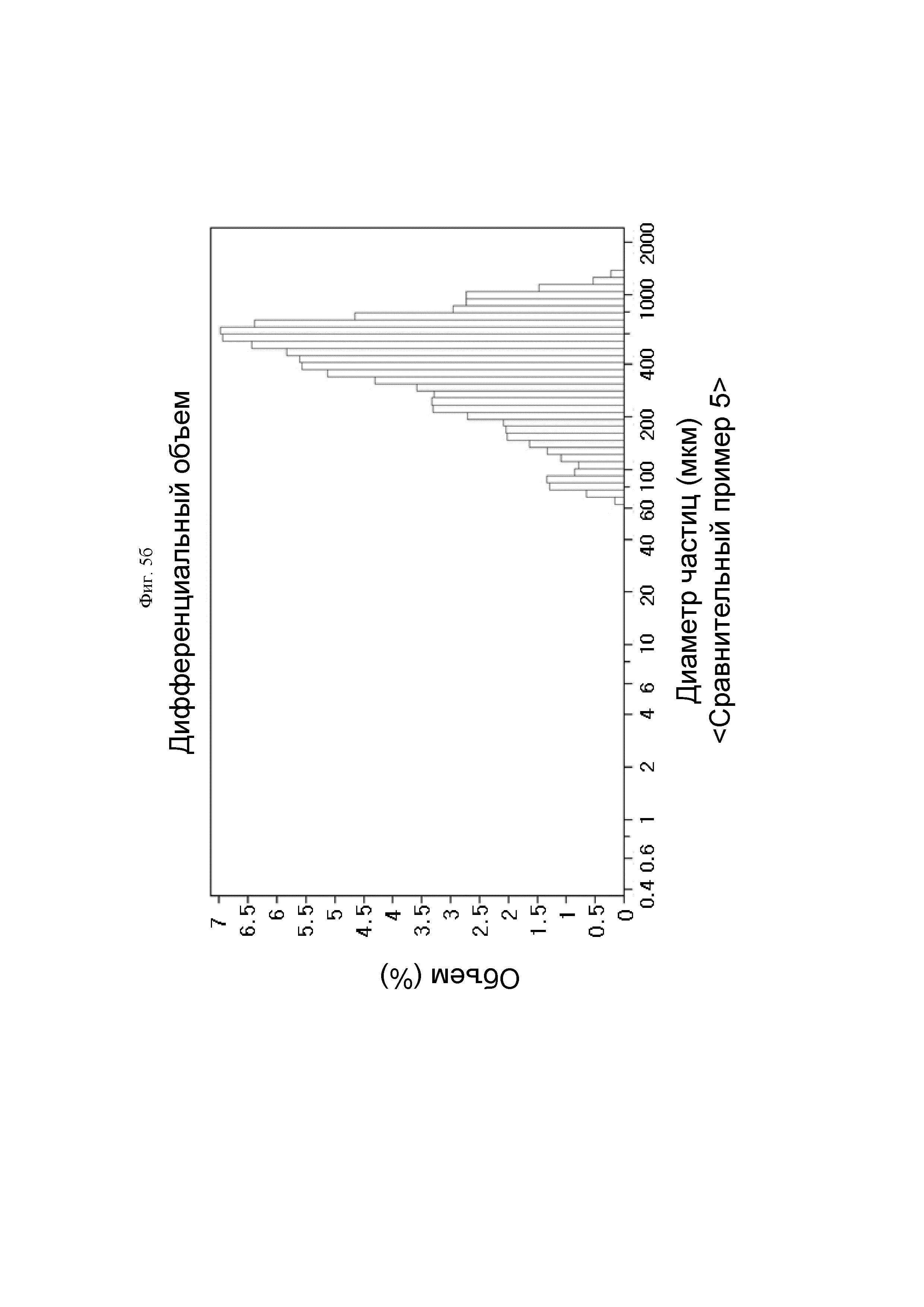
На ФИГ. 5б показан результат проведения анализа размера частиц гемостатической композиции, содержащей производное гиалуроновой кислоты, полученное так же, как и в Сравнительном примере 5.
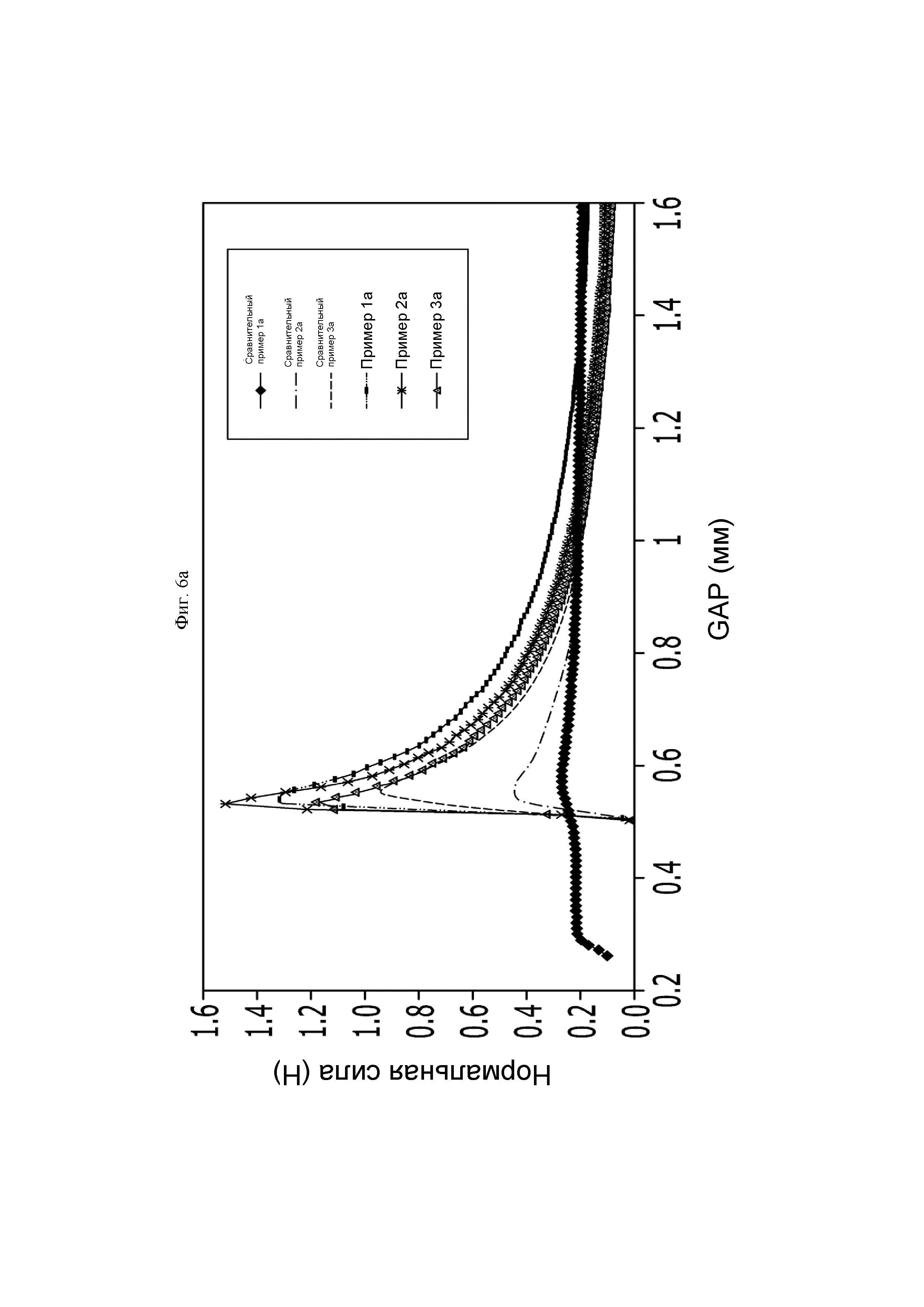
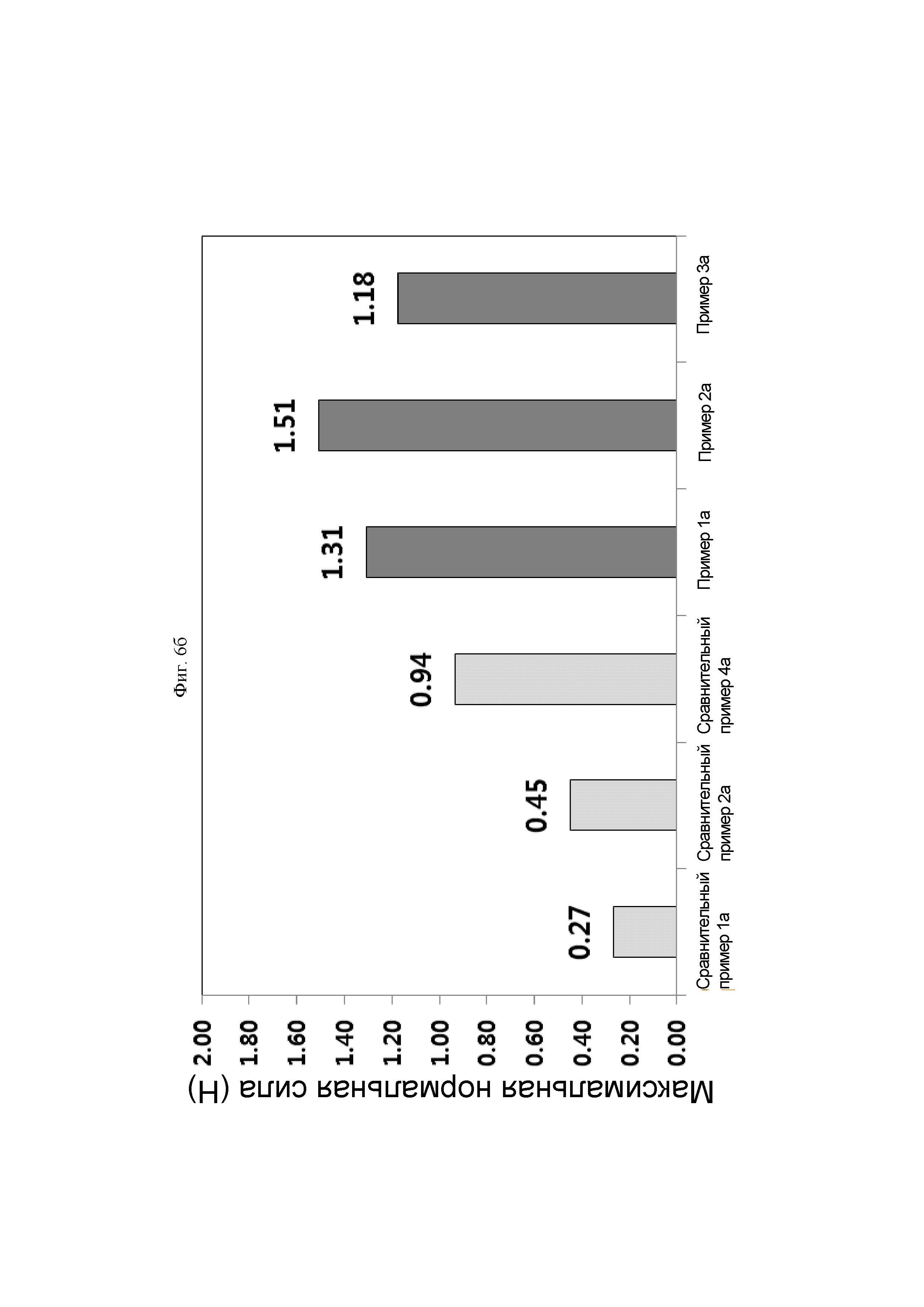
ФИГ. 6а и б представляют собой графики, показывающие адгезивную силу производных гиалуроновой кислоты, полученных так же, как и в Примерах 1а-3а и Сравнительных примерах 1а, 2а и 4а.
ФИГ. 7а представляет собой фотографию, показывающую внешний вид гемостатических композиций, полученных так же, как и в гемостатической Примере 2б и Сравнительных примерах 2б и 4б на плоской стеклянной пластинке.
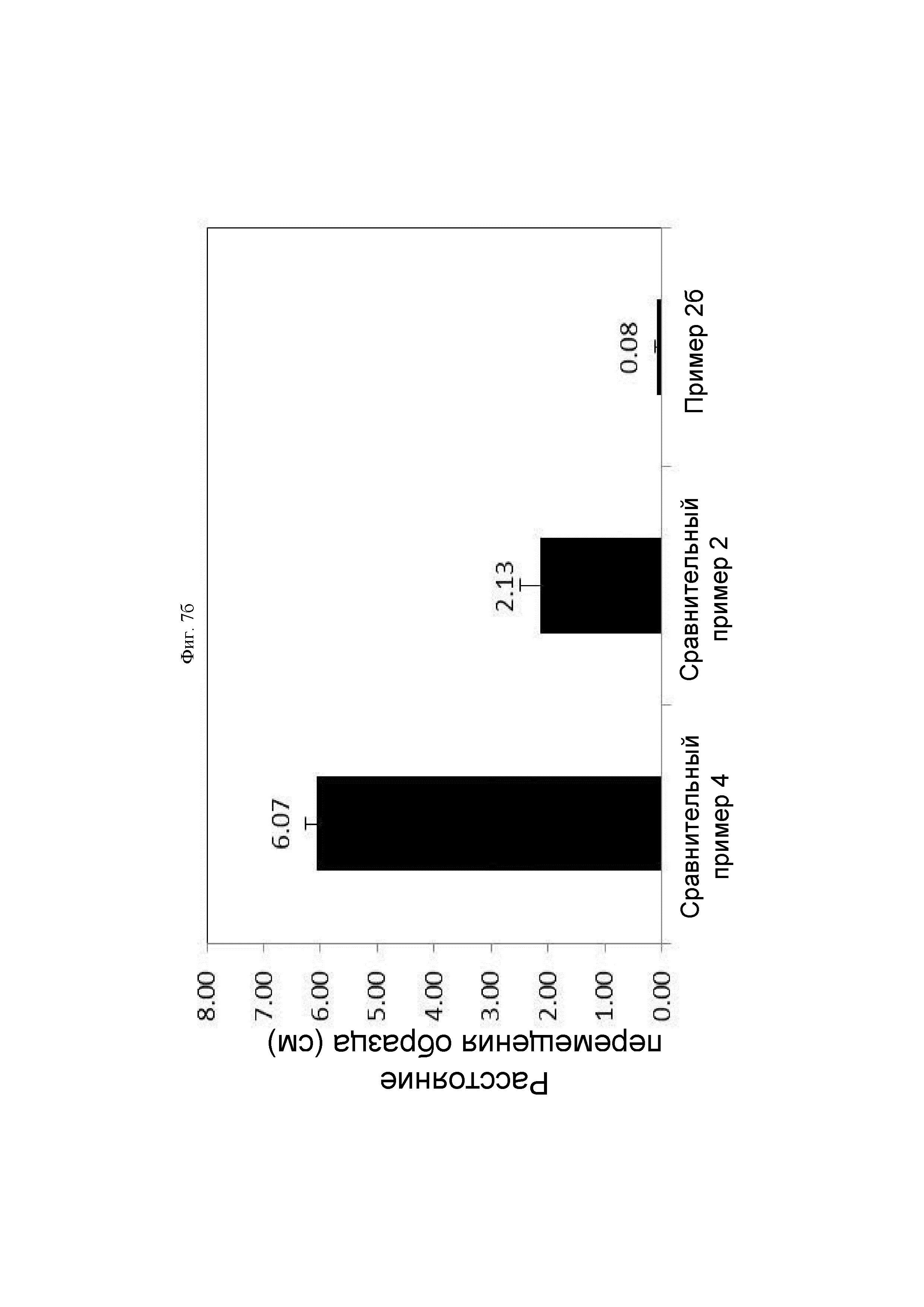
ФИГ. 7б представляет собой график, показывающий результат сравнительного анализа адгезивной силы гемостатических композиций, полученных в гемостатическом Примере 2б и Сравнительных примерах 2б и 4б, в виде расстояния движения образца.
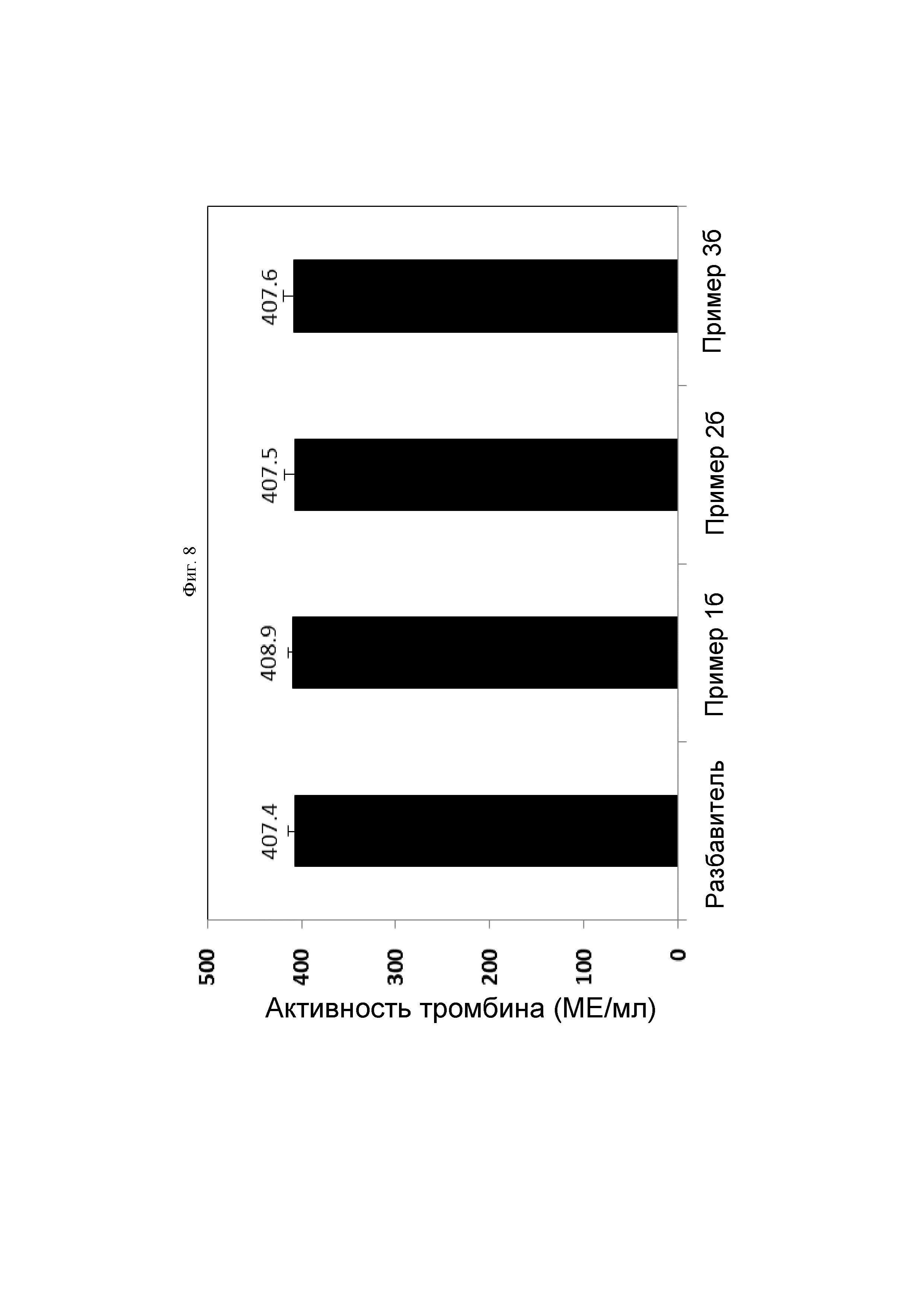
На ФИГ. 8 показан результат сравнения активностей тромбина разбавителя, содержащего тромбин, используемого в приготовлении гемостатической композиции, и гемостатических композиций, полученных так же, как и в Примерах 1б-3б.
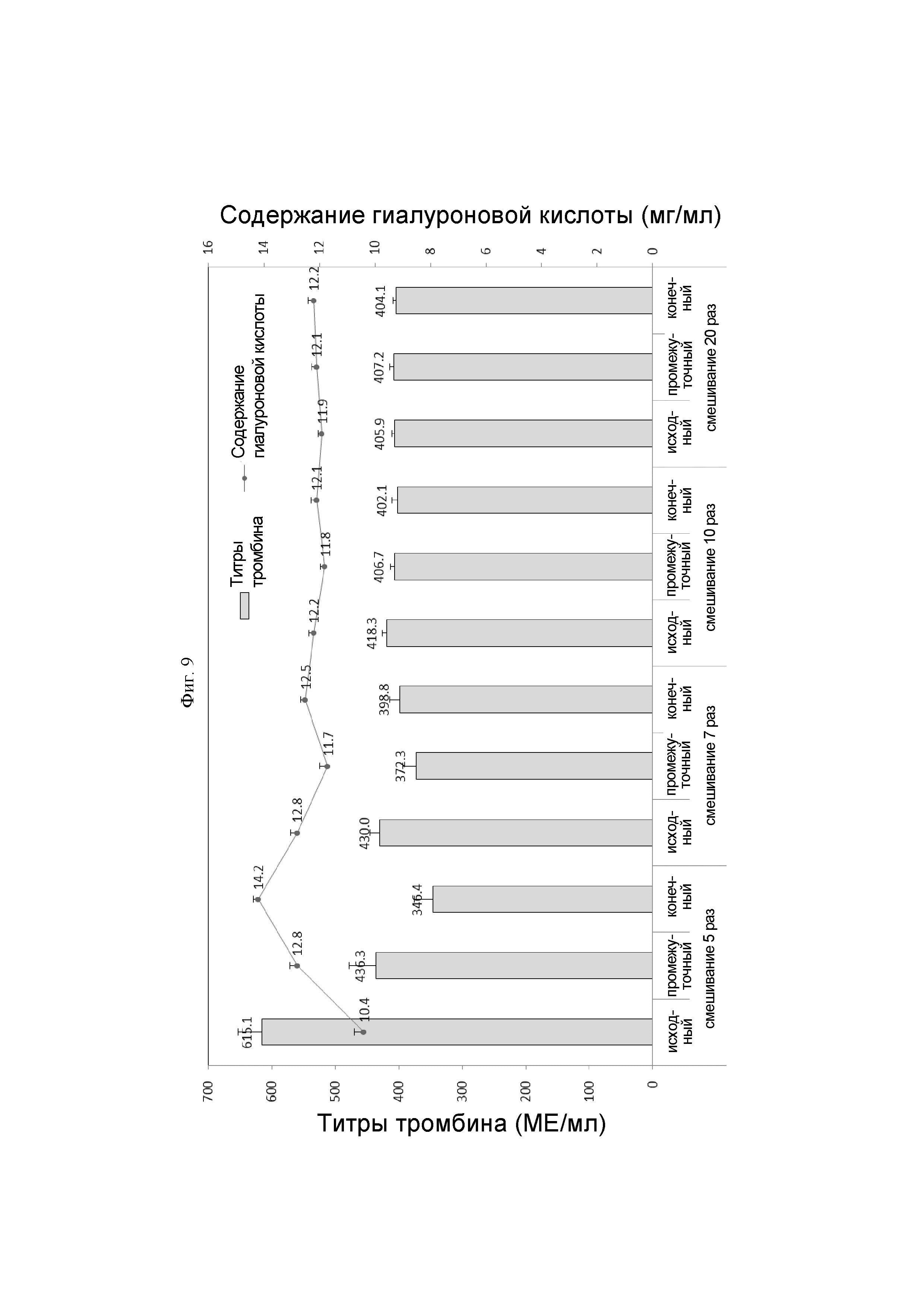
На ФИГ. 9 показаны изменения содержания гиалуроновой кислоты и титров тромбина согласно времени смешивания.
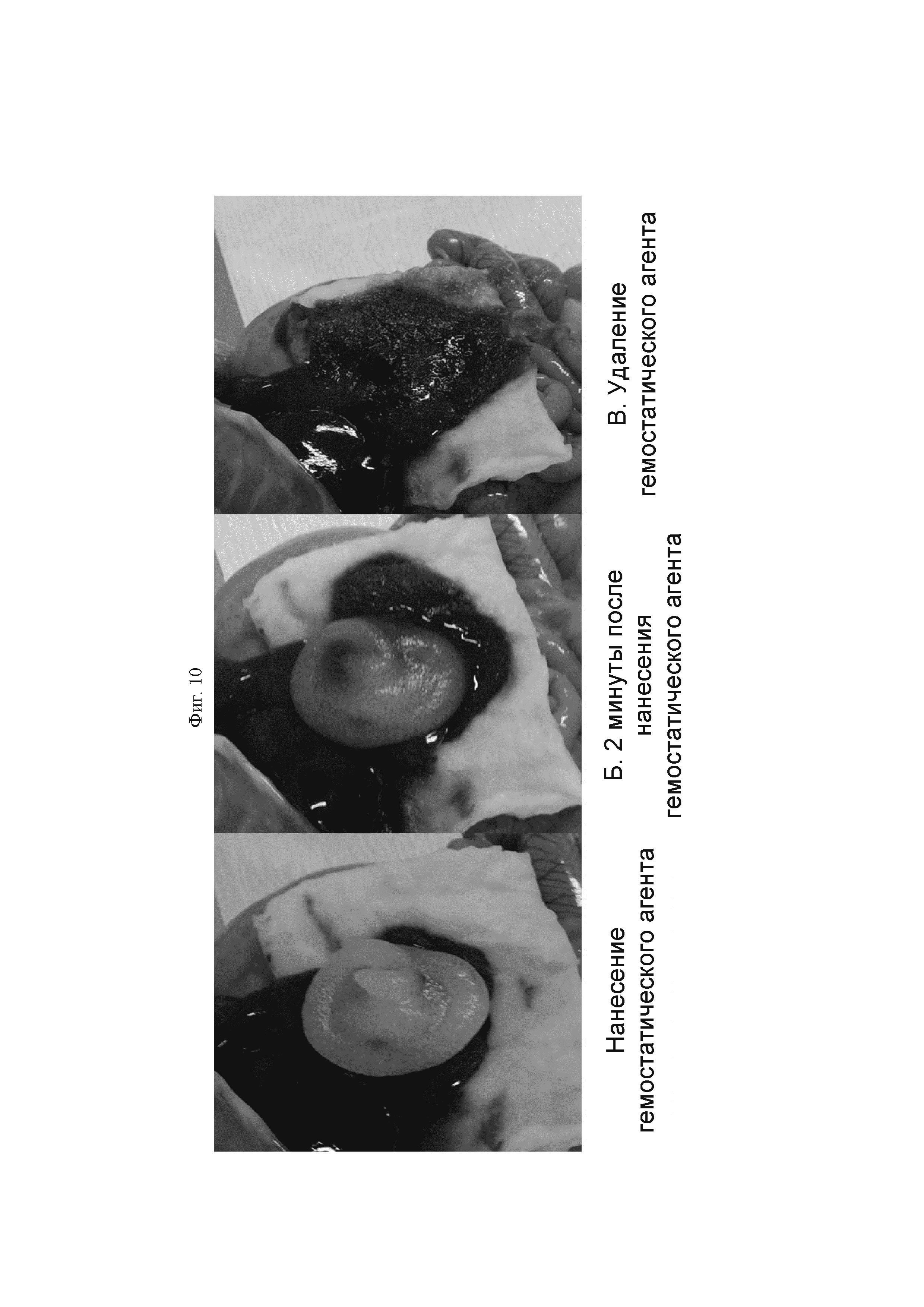
На ФИГ. 10 показан результат, подтверждающий гемостатическую способность Примера 3б при поражении печени у SD крысы.
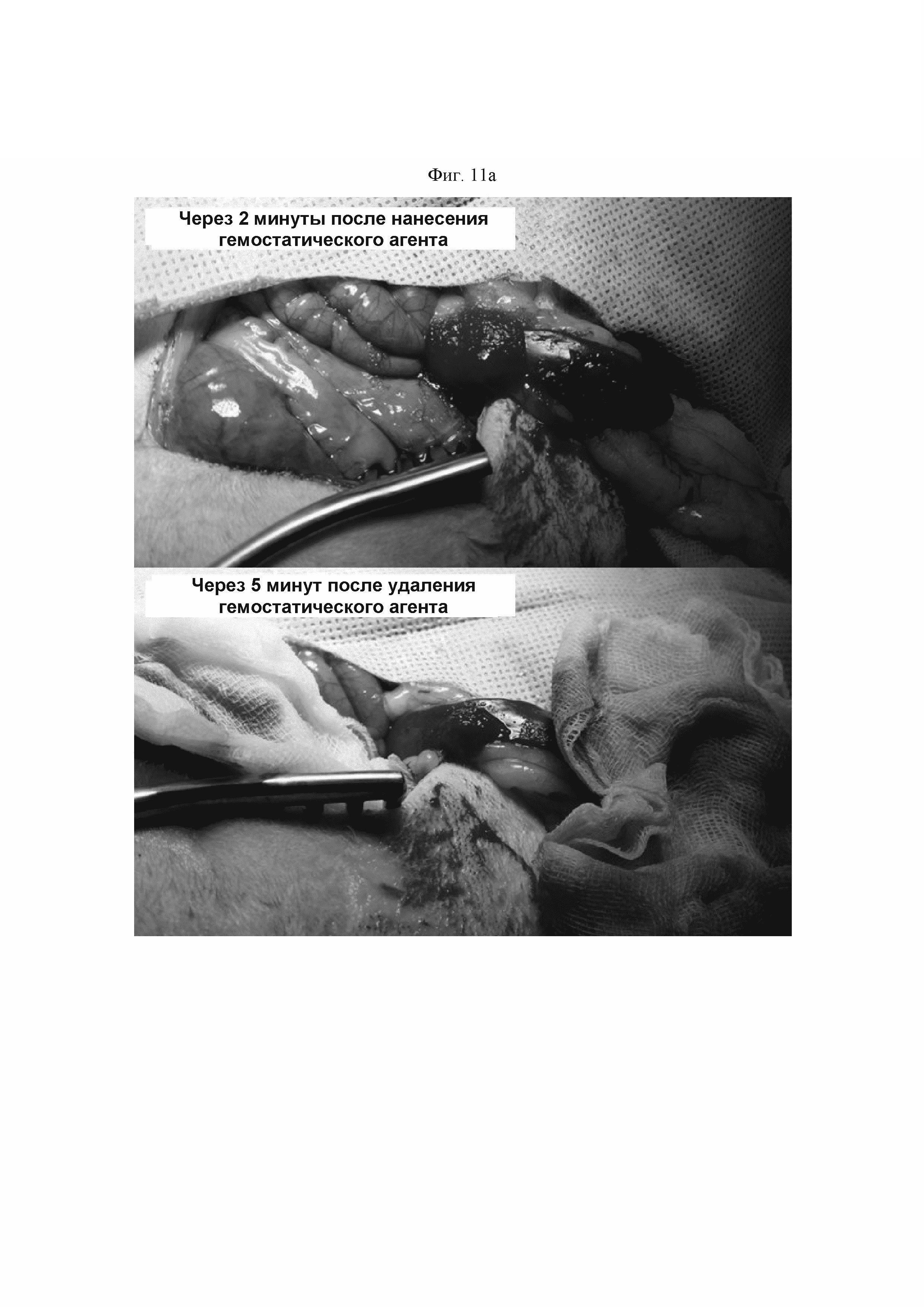
ФИГ. 11а представляет собой фотографию результата анализа, подтверждающего гемостатический эффект гемостатической композиции, полученной так же, как и в Примере 3б, при поражении селезенки кролика.
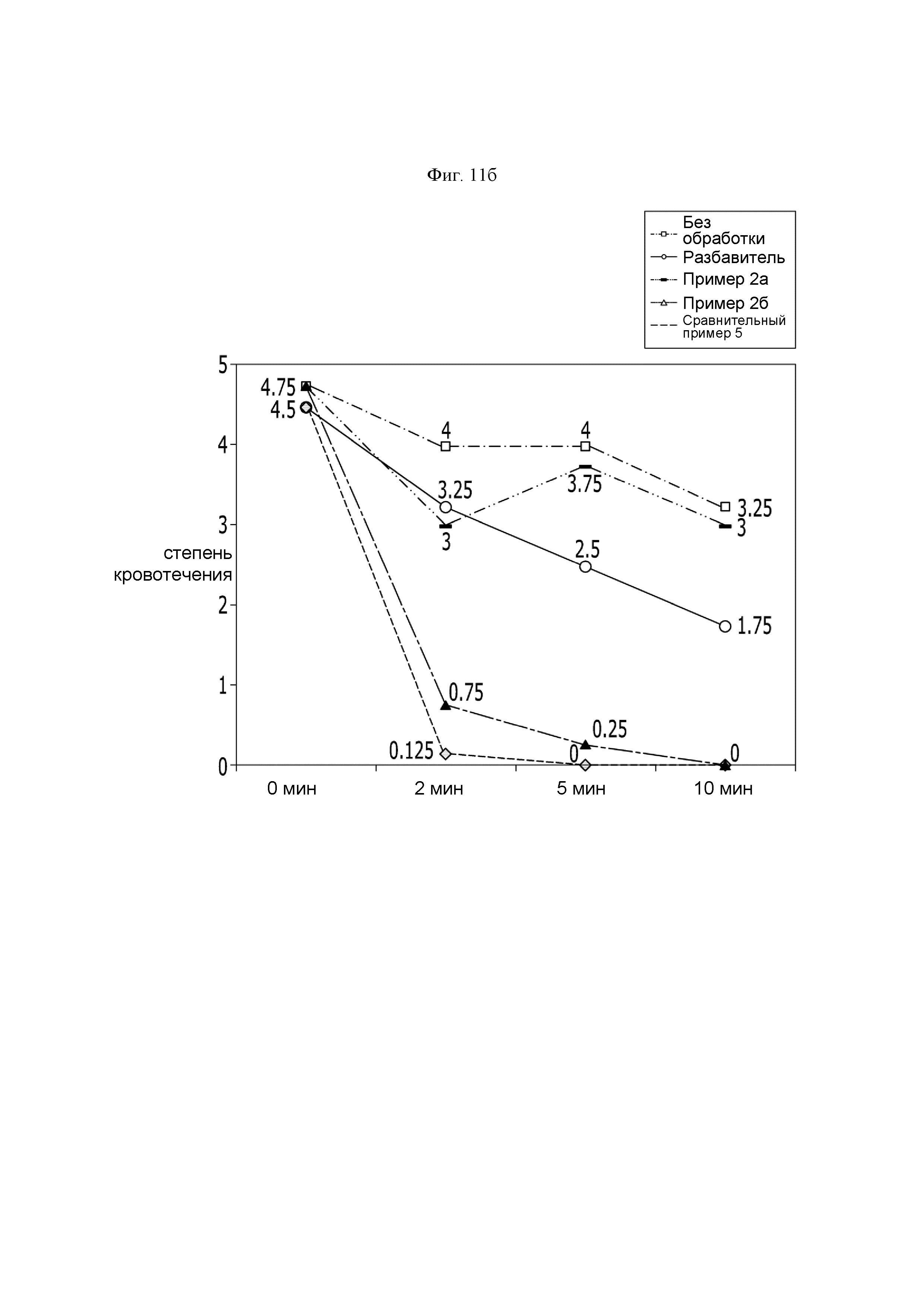
ФИГ. 11б представляет собой фотографию, показывающую гемостатический эффект гемостатической композиции, полученной в Примере 1-3, в виде степени кровотечения при поражении селезенки кролика.
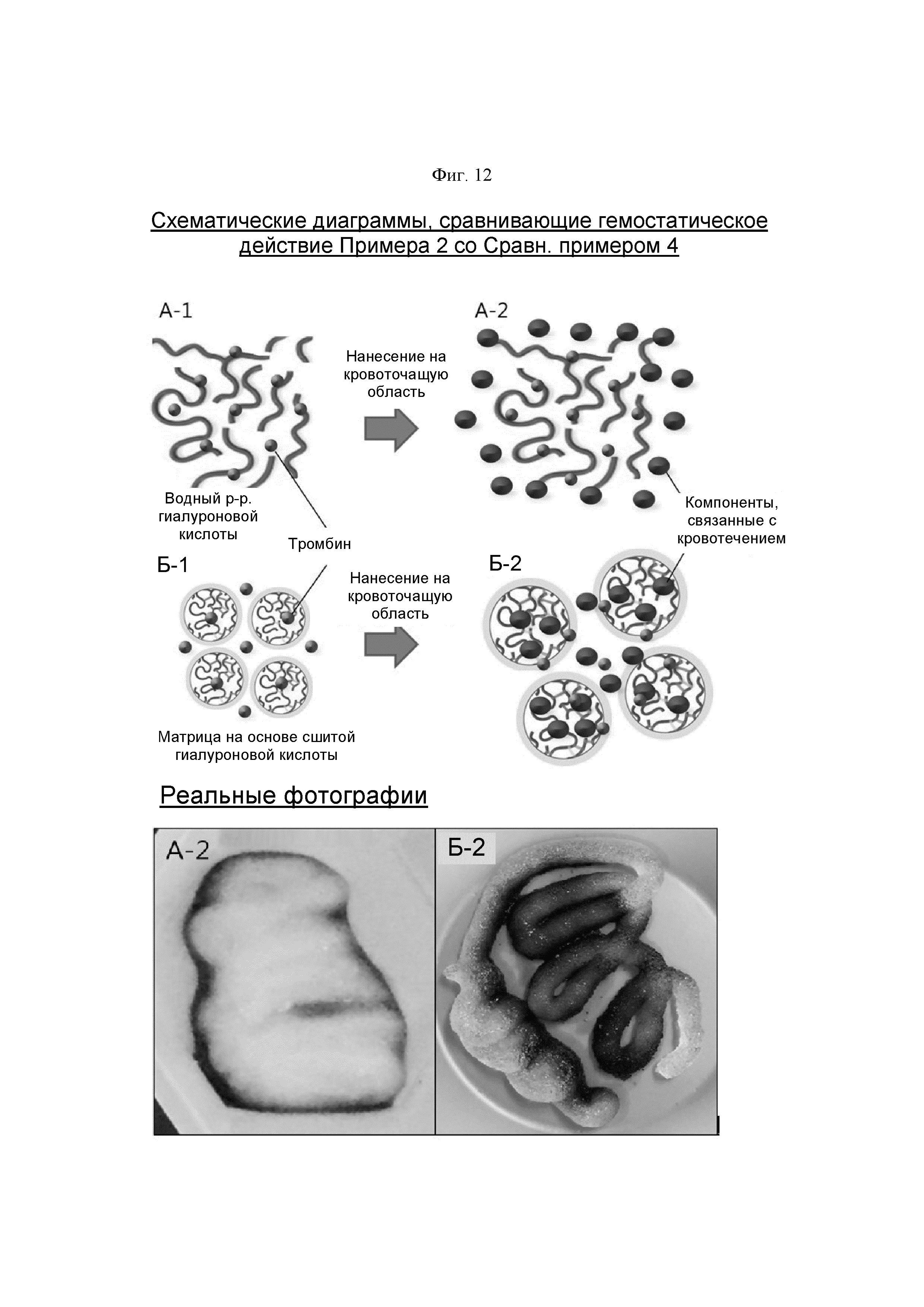
На ФИГ. 12 показаны схематические диаграммы, сравнивающие гемостатическое действие гемостатической композиции по настоящему изобретению и несшитой натриевой соли гиалуроновой кислоты. Нижняя часть показывает фактические фотографии гемостатической композиции по настоящему изобретению.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В качестве одного аспекта для достижения вышеупомянутых целей настоящее изобретение относится к гемостатической композиции, содержащей матрицу на основе сшитого производного гиалуроновой кислоты.
Гемостатическая композиция по настоящему изобретению является компонентом для гемостаза и содержит матрицу на основе сшитого производного гиалуроновой кислоты, имеющую подходящую гигроскопичность и вязкость. В качестве одного конкретного аспекта сшитое производное гиалуроновой кислоты может быть получено посредством сшивания гиалуроновой кислоты (НА) или ее солевой формы с использованием эпоксидного сшивающего агента, имеющего две или более чем две эпоксидные группы. Сшитая гиалуроновая кислота может сохранять природную гигроскопичность гиалуроновой кислоты и образовать матрицу посредством сшивания гиалуроновой кислоты, и гигроскопичность и вязкость для дополнительного раствора увеличиваются, тогда как адгезивная сила уменьшается, и, следовательно, данные характеристики обеспечивают однородное смешивание с раствором, содержащим гемостатический компонент.
Гиалуроновая кислота представляет собой природный гетерополисахарид, состоящий из чередующихся остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, и матрица на основе производного гиалуроновой кислоты может быть получена сшиванием с использованием эпоксидных агентов. В настоящем изобретении помимо гиалуроновой кислоты также может использоваться ее солевая форма.
Эпоксидный сшивающий агент, в частности, может представлять собой диглицидиловый простой эфир 1,4-бутандиола (BDDE), диглицидиловый простой эфир этиленгликоля (EGDGE), диглицидиловый простой эфир 1,6-гександиола, диглицидиловый простой эфир пропиленгликоля, диглицидиловый простой эфир поли(пропиленгликоля), диглицидиловый простой эфир поли(тетраметиленгликоля), диглицидиловый простой эфир неопентилгликоля, полиглицидиловый простой эфир полиглицерина, полиглицидиловый простой эфир диглицерина, полиглицидиловый простой эфир глицерина, полиглицидиловый простой эфир триметилпропана, 1,2-(бис(2,3-эпоксипропокси)этилен, полиглицидиловый простой эфир пентаэритритола или полиглицидиловый простой эфир сорбита, и, более конкретно, может представлять собой диглицидиловый простой эфир 1,4-бутандиола (BDDE).
Комплексная вязкость матрицы на основе сшитого производного гиалуроновой кислоты по настоящему изобретению составляет от 10 до 500000 Па×c при 1 Гц (25°С) (ротационный реометр (ТА instrument Ltd., DHR-1), температура: 25°С).
Кроме того, матрица на основе сшитого производного гиалуроновой кислоты имеет преимущества наличия более высокой водопоглощающей способности (ФИГ. 3) и большей степени набухания, чем природная гиалуроновая кислота. В частности, степень набухания матрицы на основе сшитого производного гиалуроновой кислоты в состоянии геля составляет от 300% до 1500%, и в случае сухого порошка (105°С, 6 часов) степень набухания составляет от 300% до 75000%.
Кроме того, матрица на основе сшитого производного гиалуроновой кислоты сшита согласно уникальным условиям синтеза по настоящему изобретению, таким образом, возрастает молекулярное связывание между гиалуроновой кислотой, и возрастает вязкоэластичность (ФИГ. 2), и она имеет подходящую для живой ткани адгезивную силу. Кроме того, поскольку сшитая часть не расщепляется эндогенной гиалуронидазой, она имеет свойства повышенной стабильности внутри организма при малом риске токсичности. Кроме того, она может образовать физический барьер на области ее нанесения в течение определенного времени после завершения гемостатической роли.
Из-за вышеупомянутых характеристик композиция по настоящему изобретению является особенно полезной для обеспечения гемостатического эффекта на кровоточащей области, включающей хирургическую кровоточащую область, кровоточащую область внешнего повреждения и т.д., и, следовательно, ее можно легко и с удобством использовать для медицинских применений, в частности, в применении для остановки кровотечения, когда происходят разные кровотечения, как, например, при хирургических операциях и т.д.
В качестве другого аспекта настоящее изобретение относится к способу получения гемостатической композиции, содержащей матрицу на основе сшитого производного гиалуроновой кислоты. В частности, способ получения может включать: 1) стадию взаимодействия гиалуроновой кислоты и эпоксидного сшивающего агента, который растворен в основном водном растворе, с получением сшитого производного гиалуроновой кислоты; и 2) стадию гомогенизации сшитого производного гиалуроновой кислоты для доведения его до подходящего размера.
Предпочтительно в способе получения производного гиалуроновой кислоты по настоящему изобретению получают производное гиалуроновой кислоты, полученное гомогенизацией продуктов, полученных посредством взаимодействия эпоксидного сшивающего агента, содержащего две или более чем две эпоксидные группы, с гиалуроновой кислотой (НА).
В способе получения по настоящему изобретению можно использовать гиалуроновую кислоту (НА) или ее солевую форму, и данные солевые формы включают по меньшей мере одну или более чем одну, выбранную из группы, состоящей из натриевой соли гиалуроновой кислоты, калиевой соли гиалуроновой кислоты, кальциевой соли гиалуроновой кислоты, магниевой соли гиалуроновой кислоты, цинковой соли гиалуроновой кислоты, кобальтовой соли гиалуроновой кислоты и тетрабутиламмонийной соли гиалуроновой кислоты.
В способе получения на стадии 1) можно использовать NaOH, КОН, водный раствор аммиака и т.д. в качестве основного водного раствора, используемого для ионизации для реакции сшивания гиалуроновой кислоты. Кроме того, концентрация гиалуроновой кислоты, растворенной в основном водном растворе, предпочтительно составляет от 50 до 200 мг/мл, и сшивающее отношение эпоксидного сшивающего агента (например, BDDE) варьирует, в зависимости от концентрации гиалуроновой кислоты, растворенной в основном водном растворе. В качестве одного примера, когда концентрация гиалуроновой кислоты, растворенной в основном водном растворе, составляет 20 мг/мл, содержание BDDE в качестве эпоксидного сшивающего агента составляет от 2% до 50% (отношение объема эпоксидного сшивающего агента к массе основного водного раствора, в котором растворена гиалуроновая кислота (об./масс.)), и когда концентрация гиалуроновой кислоты, растворенной в основном водном растворе, составляет 200 мг/мл, содержание BDDE составляет от 0,01% до 5% (отношение объема эпоксидного сшивающего агента к массе основного водного раствора, в котором растворена гиалуроновая кислота (об./масс.)). Кроме того, на стадии 1) температура реакции составляет от 4 до 80 градусов Цельсия, время реакции составляет от 12 часов до 48 часов, и давление при реакции составляет от 50,5 кПа до 202 кПа, предпочтительно - атмосферное давление.
Эпоксидный сшивающий агент стадии 1) может быть выбран из следующих: диглицидиловый простой эфир 1,4-бутандиола (BDDE), диглицидиловый простой эфир этиленгликоля (EGDGE), диглицидиловый простой эфир 1,6-гександиола, диглицидиловый простой эфир пропиленгликоля, диглицидиловый простой эфир поли(пропиленгликоля), диглицидиловый простой эфир поли(тетраметиленгликоля), диглицидиловый простой эфир неопентилгликоля, полиглицидиловый простой эфир полиглицерина, полиглицидиловый простой эфир диглицерина, полиглицидиловый простой эфир глицерина, полиглицидиловый простой эфир триметилпропана, 1,2-(бис(2,3-эпоксипропокси)этилен, полиглицидиловый простой эфир пентаэритрита или полиглицидиловый простой эфир сорбита, и, более конкретно, может быть использован диглицидиловый простой эфир 1,4-бутандиола (BDDE).
В качестве дополнительного одного аспекта, производное гиалуроновой кислоты, полученное на стадии 1), может быть промыто физиологическим раствором и т.д. до переработки на стадии 2). Помимо стадии промывки, производное гиалуроновой кислоты, полученное на стадии 1), может быть выделено и/или очищено способами, известными в данной области, например, перегонкой (при атмосферном давлении или пониженном давлении), перекристаллизацией, колоночной хроматографией, ионообменной хроматографией, гель-хроматографией, аффинной хроматографией, тонкослойной хроматографией, разделением фаз, экстракцией растворителем или диализом.
Кроме того, стадия 2) представляет собой стадию гомогенизации сшитого производного гиалуроновой кислоты, полученного на стадии 1), для получения его в виде геля. Гомогенизация может проводиться традиционными способами гомогенизации, например, способом гомогенизации посредством лопаток или способом гомогенизации посредством прессования, и она может проводиться по меньшей мере 3 раза для получения гомогенных частиц, но не ограничивается этим.
В частности, размер и форма производного гиалуроновой кислоты особенно не ограничиваются, и его размер и форма могут варьировать согласно интервалу, применимому с медицинской точки зрения, и размер гидрогеля, измельченного на стадии 2), предпочтительно составляет от 10 до 2000 мкм и, более конкретно, от 200 мкм до 800 мкм, но оно может быть измельчено до других размеров и использовано, если это необходимо.
Производное гиалуроновой кислоты, полученное посредством стадий 1)-2), можно использовать стерилизованным при высокой температуре и высоком давлении. Таким образом, в качестве одного дополнительного аспекта способ получения по настоящему изобретению может дополнительно включать стадию стерилизации производного гиалуроновой кислоты, полученного на стадии 2).
Комплексная вязкость гидрогеля, полученного согласно способу получения производного гиалуроновой кислоты по настоящему изобретению, составляет от 10 до 500000 Па×с при 1 Гц (25°С), и степень набухания составляет от 200% до 1500%.
Кроме того, в случае, когда производное гиалуроновой кислоты находится в виде порошка, степень набухания достигает 75000%.
В качестве другого аспекта, настоящее изобретение относится к набору для гемостаза, содержащему гемостатическую композицию по настоящему изобретению и фармацевтически приемлемый разбавитель.
В частности, набор для гемостаза по настоящему изобретению может содержать разбавитель, содержащий агент, индуцирующий свертывание, наряду с гемостатической композицией, содержащей производное гиалуроновой кислоты. Предпочтительно в наборе для гемостаза гемостатическая композиция, содержащая производное гиалуроновой кислоты: разбавитель, содержащая агент, индуцирующий свертывание, может иметь массовое отношение от 2:8 до 9:1.
Агент, индуцирующий свертывание, содержащийся в разбавителе, используемом для набора по настоящему изобретению, представляет собой вещество, которое индуцирует свертывание крови, и, например, он может представлять собой один или более чем один агент, выбранный из группы, состоящей из тромбина, любого компонента змеиного яда, активатора тромбоцитов, пептида, активирующего рецептор тромбина, преципитатора фибриногена, апротинина и фактора VIII, но не ограничивающийся ими. Предпочтительно он представляет собой тромбин. Тромбин может быть индуцирован от любого тромбинового агента, подходящего для применения у человека (т.е. фармацевтически приемлемого). Подходящий источник тромбина включает человеческую и коровью кровь, плазму или сыворотку (когда не предполагается иммунологическое отторжение, может применяться тромбин из других животных источников), и тромбин рекомбинантного происхождения (например, человеческий рекомбинантный тромбин) и аутологический человеческий тромбин может быть предпочтительным для некоторых применений, и это равным образом применимо к другим агентам, индуцирующим свертывание.
Фармацевтически приемлемый разбавитель используется в количестве для достижения предпочтительной конечной концентрации с использованием его готовой к применению композиции. Такой разбавитель, содержащий агент, индуцирующий свертывание, может содержать другие полезные компоненты, например, ион, буферный раствор, эксципиент, стабилизатор и т.д., помимо вышеупомянутого агента, индуцирующего свертывание. Предпочтительной солью является NaCl и/или СаСl2, и предпочтительным стабилизатором является глицин, и все из них используются в обычном количестве и концентрации, применимых для агента, индуцирующего свертывание, включающего тромбин (например, от 0,5 до 1,5% NaCl (например, 0,9%) и/или от 20 до 80 мМ СаСl2 (например, 40 мМ)). В дополнительных воплощениях разбавитель также может содержать буферный раствор или буферную систему, для буферизации при рН растворенной высушенной композиции, предпочтительно при рН от 3,0 до 10,0, более предпочтительно при рН от 6,5 до 8,5. Например, разбавитель может содержать воду уровня качества для инъекции и - независимо друг от друга - от 100 до 10000 ME (международные единицы)/флакон тромбина (предпочтительно от 1000 до 5000 МЕ/флакон), от 50 до 200 мМ NaCl (предпочтительно от 100 до 200 мМ), от 10 до 80 мМ СаСl2 (предпочтительно от 30 до 50 мМ) и от 5 до 100 мг/мл глицина (предпочтительно от 5 до 20 мг/мл). В качестве одного конкретного аспекта разбавитель, содержащий агент, индуцирующий свертывание, может содержаться в данном наборе в виде водного раствора, а вещество, выбранное из группы, состоящей из агента, индуцирующего свертывание, NaCl, СаCl2, альбумина и глицина, выделяется отдельно (например, форма, содержащаяся во флаконе в лиофилизированном виде), и при использовании данного набора вещество, выбранное из группы, состоящей из агента, индуцирующего свертывание, NaCl, СаСl2, альбумина и глицина, может быть растворено в водном растворе.
В другом воплощении разбавитель, содержащий агент, индуцирующий свертывание, может содержать ацетат натрия в малом количестве, в частности, от 1 до 50 мМ, предпочтительно от 10 до 30 мМ. Кроме того, разбавитель, содержащий агент, индуцирующий свертывание, может содержать меньше, чем 100 г/л маннита, предпочтительно меньше, чем 50 г/л, и может содержать меньше, чем 200 г/л лактозы, предпочтительно меньше, чем 100 г/л. Предпочтительно разбавитель, содержащий агент, индуцирующий свертывание, не обязательно может содержать ацетат натрия, маннит и лактозу. В частности, посредством содержания глицина в приведенном выше интервале, один глицин может поддерживать форму лиофилизированного осадка агента, индуцирующий свертывание, включающего тромбин, и также стабилизирует титр агента, индуцирующего свертывание, без ацетата натрия, маннита или лактозы.
Согласно предпочтительному воплощению, когда данный разбавитель содержит тромбин в качестве агента, индуцирующего свертывание, он предпочтительно содержит от 10 до 10000 ME тромбина/мл, в частности, от 250 до 5000 ME тромбина/мл. Предпочтительно такая готовая к применению форма набора для гемостаза содержит от 10 до 100000 международных единиц (ME) тромбина, более предпочтительно от 500 до 20000 ME, в частности, от 1000 до 10000 ME. В одном предпочтительном аспекте набор для гемостаза по настоящему изобретению может находиться в виде предварительно заполненного шприца. Термин «предварительно заполненный шприц» относится к шприцу, полученному заполнением определенного количества препарата для инъекции в том виде, в котором он находится, в шприц, и означает то, что он готов к применению, то есть, он может быть использован немедленно без необходимости взвешивания лекарственных средств и заполнения, например, в применяемый шприц.
В одном конкретном воплощении набор для гемостаза по настоящему изобретению может быть получен посредством присоединения предварительно заполненного шприца с гемостатической композицией, содержащей производное гиалуроновой кислоты по настоящему изобретению, к соединителю, и присоединение шприца, заполненного разбавителем, содержащим агент, индуцирующий свертывание, к другому терминалу соединителя для его инъекции, гидратируя, посредством этого, гемостатическую композицию, содержащую матрицу на основе сшитого производного гиалуроновой кислоты. Для получения гомогенных продуктов можно повторять возвратно-поступательную инъекцию между шприцем с производным гиалуроновой кислоты и шприцем с разбавителем, содержащим агент, индуцирующий свертывание, и они могут быть получены посредством возвратно-поступательных движений предпочтительно 5 раз или более чем 5 раз, более предпочтительно примерно 10 раз.
Такой набор для гемостаза по настоящему изобретению содержит гемостатическую композицию, содержащую производное гиалуроновой кислоты и разбавитель, содержащий тромбин в качестве агента, индуцирующего свертывание, в комбинации, демонстрируя, посредством этого, превосходный гемостатический эффект по сравнению с одним тромбином (см. ФИГ. 10 и т.д.).
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет далее более подробно описано со ссылкой на следующие примеры. Однако описание следующих примеров предназначено только для иллюстрации конкретных воплощений настоящего изобретения и не предназначено для ограничения или ограничивающей интерпретации объема данного изобретения описанным здесь содержанием.
Пример 1-3. Получение производных гиалуроновой кислоты для гемостатических композиций
A. Получение матриц на основе сшитого производного гиалуроновой кислоты
После получения 1 г натриевой соли гиалуроновой кислоты в каждом из 3 реакторов, в нее добавляли 0,25 н. раствор NaOH с достижением конечной массы 10,0 г (Пример 1а), 8,3 г (Пример 2а) и 7,1 г (Пример 3а). В полностью растворенный раствор добавляли 70 мкл (Пример 1а), 60 мкл (Пример 2а) и 50 мкл (Пример 3а) простого диглицидилового эфира 1,4-бутандиола (BDDE), и затем их перемешивали. Смешанные растворы помещали в водяную баню с постоянной температурой и подвергали взаимодействию при 30°С в течение 18 часов, и затем промывали буферным раствором для удаления непрореагировавших веществ. Полученные гели гомогенизировали 3 раза или более посредством способа прессования для контроля размера частиц, и затем их стерилизовали при 121°С в течение 15 минут. 3,0 г полученных производных гиалуроновой кислоты асептически взвешивали в 5 мл шприцах и затем заключительно стерилизовали при 127°С в течение 2 минут с получением предварительно заполненных шприцев с производным гиалуроновой кислоты (Пример 1а, 2а, 3а).
Б. Получение разбавителя
В расчете на 1 флакон добавляли сырье: 5000 ME тромбина, глицин, хлорид натрия, хлорид кальция и затем растворяли посредством добавления правильного количества воды для инъекции. Растворенный раствор асептически фильтровали и заполняли во флаконы, с последующей лиофилизацией. Лиофилизированный порошок полностью растворяли с использованием инъекции 0,9%-ного физиологического раствора сразу до применения в области кровотечения и использовали.
B. Получение гемостатических композиций, содержащих матрицу на основе сшитого производного гиалуроновой кислоты
Предварительно заполненные шприцы с производными гиалуроновой кислоты (Примеры 1а, 2а, 3а) присоединяли к соединителю, и производные гиалуроновой кислоты гидратировали с использованием разбавителя, содержащего тромбин. Для того чтобы получать гомогенные продукты в цилиндр осуществляли возвратно-поступательные движения между шприцем с производным гиалуроновой кислоты и шприцем с разбавителем, содержащим тромбин, затем по меньшей мере 10 раз проводили смешивание посредством возвратно-поступательных движений для получения гемостатических композиций (Примеры 1б, 2б, 3б). Внешний вид полученных гемостатических композиций, содержащих производное гиалуроновой кислоты, показан на ФИГ. 1.
Пример 4. Реологические характеристики производных гиалуроновой кислоты
Для исследования реологических характеристик производных гиалуроновой кислоты, полученных так же, как и в Примерах 1а-3а, противоадгезивного агента компании В (Сравнительный пример 1а), наполнителя на основе сшитой гиалуроновой кислоты компании G (Сравнительный пример 2а) и наполнителя на основе сшитой гиалуроновой кислоты компании L (Сравнительный пример 3а), которые имелись в продаже и содержали гиалуроновую кислоту, проводили анализ ротационным реометром. Значения по результатам комплексной вязкости и tanδ в интервале частоты от 0,1 Гц до 1 Гц были показаны на ФИГ. 2.
Посредством ФИГ. 2 и Таблицы 1 в Примерах 1а-3а демонстрируются более высокие значения коплексной вязкости, чем в Сравнительных примерах 1а-3а. Посредством этого можно видеть то, что производные гиалуроновой кислоты по настоящему изобретению (Примеры 1а-3а) имеют более высокую вязкость, чем Сравнительные примеры 1а-3а, и они образовали структуру с более высокой структурной стабильностью.

Пример 5. Степень набухания производных гиалуроновой кислоты
После добавления к 3,0 мл производных гиалуроновой кислоты, полученных также, как и в Примерах 1а-3а, 100 мл физиологического раствора их перемешивали в течение 10 минут. После выдерживания их при 37°С в течение 1 часа непоглощенный физиологический раствор удаляли, и затем подтверждали объем раствора, поглощенного производными гиалуроновой кислоты.
ФИГ. 3 представляет собой результат степени набухания производных гиалуроновой кислоты, полученных так же, как и в Примерах 1а-3а, и степень набухания Примера 1а составляет 706%, степень набухания Примера 2а составляет 607%, и степень набухания Примера 3а составляет 409%. Производные гиалуроновой кислоты по настоящему изобретению (Примеры 1а-3а) демонстрировали способность к поглощению для поглощения влаги в 4-7 раз или более превышающей их объем.
Пример 6. Сравнение поглощающей способности гемостатических композиций, содержащих производное гиалуроновой кислоты, и гемостатической композиции, содержащей несшитую гиалуроновую кислоту
Сравнительный пример 4: после растворения 1000 мг натриевой соли гиалуроновой кислоты в буферном растворе в концентрации 20% по массе данный раствор взвешивали в 5 мл шприце, и осуществляли конечную стерилизацию при 127°С в течение 2 минут (Сравнительный пример 4а). Способ получения гемостатической композиции с использованием разбавителя проводили так же, как и в Примерах 1б-3б, с получением конечной композиции (Сравнительный пример 4б).
ФИГ. 4 представляет собой результат, подтверждающий поглощаемость жидкости гемостатическими композициями, содержащими производное гиалуроновой кислоты, полученными так же, как и в Примерах 1б-3б, и композиции, полученной в Сравнительном примере 4б. Для подтверждения поглощаемости 5,0 г опытного образца наносили на чашку, и затем наливали на опытный образец 1,0 мл физиологического раствора с синим красителем для наблюдения поглощения жидкости.
Посредством ФИГ. 4 было проиллюстрировано явление того, что жидкость поглощалась между частицами быстрее в гемостатических композициях, содержащих производное гиалуроновой кислоты Примеры 1б-3б по сравнению со Сравнительным примером 4б.
Пример 7. Анализ размера частиц гемостатических композиций, содержащих производное гиалуроновой кислоты
Для измерения размера и распределения частиц гемостатической композиции, содержащей производное гиалуроновой кислоты Примера 2б, 3 г каждого образца разводили 15 мл дистиллированной воды, и частицы от 0,375 мкм до 2000 мкм подсчитывали с использованием анализатора размера частиц Beckman Coulter LS.
Результат был показан на ФИГ. 5а. ФИГ. 5б представляет собой результат анализа размера частиц гранулярной формы гемостатического агента Floseal® (Сравнительный пример 5).
Посредством ФИГ. 5а и б было подтверждено то, что средний размер частиц Примера 2б составлял 638,5 мкм, и средний размер частиц Сравнительного примера 5 составлял 462,8 мкм, и гемостатическая композиция Примера 2б демонстрировала равномерное распределение частиц по сравнению со Сравнительным примером 5.
Пример 8. Подтверждающий анализ адгезивной силы производных гиалуроновой кислоты
Для измерения значений липкости каждый образец Сравнительного примера 1а, Сравнительного примера 2а, Сравнительного примера 4а и Примеров 1а-3а загружали на чашку реометра и затем вращали при скорости сдвига 0,1 в течение 10 секунд, и измеряли значения нормальной силы при разделении геометрии со скоростью 0,1 мм/с.
На ФИГ. 6а и б показаны значения нормальной силы (Н) согласно GAP (мм) для каждого образца, и сравнение максимальных нормальных сил (Н), показанных на данной ФИГ., Примеры 1а-3а по настоящему изобретению демонстрировали более высокие значения нормальной силы, чем Сравнительный пример 1а (противоадгезивный агент компании В), Сравнительный пример 2а (продукт-наполнитель на основе сшитой гиалуроновой кислоты компании G) и Сравнительный пример 4а (раствор несшитой гиалуроновой кислоты). Другими словами, Примеры по настоящему изобретению демонстрировали большую адгезивную силу, чем Сравнительные примеры.
Пример 9. Сравнительный анализ адгезивной силы производных гиалуроновой кислоты
Для измерения адгезивной силы гемостатических композиций 3 г образца Сравнительного примера 2 получали посредством применения разбавителя так же, как и в Примере 2б (Сравнительный пример 2б).
Примерно 0,5 мл образцов Сравнительного примера 4б, Сравнительного примера 2б и Примера 2б наносили в виде капель на плоскую стеклянную чашку, наклоняли стеклянную чашку на 30 градусов, выдерживали в течение 5 минут при условиях окружающей среды, и затем измеряли длину перемещения каждого образца. Расстояние перемещения каждого образца рассчитывали по различию между длиной образца на стеклянной чашке, наклоненной на 30 градусов, и длиной образца на плоской стеклянной чашке.
На ФИГ. 7а и б проиллюстрирован внешний вид образцов Сравнительного примера 4б, Сравнительного примера 2б и Примера 2б, загруженных на плоскую стеклянную чашку, и Пример 2б демонстрировал более высокую адгезивную силу, чем Сравнительный пример 2б и Сравнительный пример 4б.
Пример 10. Эффект производных гиалуроновой кислоты на активность тромбина
Активность тромбина анализировали согласно способу количественного измерения тромбина 11-го издания Корейской фармакопеи. Подробный операционный способ является следующим.
Стандартный препарат тромбина растворяли в инъекционном физиологическом растворе при 25 градусах Цельсия с получением 4 видов стандартных растворов, содержащих 4,0, 5,0, 6,2 и 7,5 единиц в 1 мл, и затем 0,10 мл каждого добавляли в пробирку. 0,90 мл раствора фибриногена, предварительно нагретого при такой же температуре, добавляли с использованием микропипетки в пробирку со стандартным раствором тромбина, и, в то же самое время, активировали таймер и осуществляли легкое встряхивание, и измеряли время до первого появления свертывания фибрина. Проводили измерения 5 раз, соответственно, с 4 видами стандартных растворов, и рассчитывали их среднее значение.
Измерение для опытного образца проводили тем же самым способом при той же самой температуре, что и выше. Опытный образец растворяли в инъекционном физиологическом растворе, делали раствор, содержащий 5 единиц в 1 мл, и с использованием 0,10 мл данного раствора 5 раз повторяли приведенную выше операцию с измерением времени свертывания и расчетом среднего значения. Посредством единиц на абсциссе графика log-log и времени свертывания на ординате была получена калибровочная кривая взятием среднего значения времени свертывания посредством 4 видов стандартных растворов на графике. Значения единиц U рассчитывали посредством применения среднего значения времени свертывания опытных растворов на вышеупомянутой калибровочной кривой.
На ФИГ. 8 представлен результат сравнения тромбиновой активности раствора тромбина, который был разведен только в разбавителе, и гемостатических композиций, полученных так же, как и в Примерах 1б-3б. Титр тромбина разбавителя без производного гиалуроновой кислоты и титр тромбина гемостатических композиций, содержащих производное гиалуроновой кислоты, были аналогичными. В результате было подтверждено то, что производное гиалуроновой кислоты не влияло на активность тромбина.
Пример 11. Эффект производных гиалуроновой кислоты на тромбиновую активность
Для проверки изменений содержания гиалуроновой кислоты и титра тромбина посредством времени смешивания в процессе приготовления гемостатической композиции, 3,0 г производного гиалуроновой кислоты, полученного в Примере 2а, заполняли в предварительно заполненный шприц, и затем производное гиалуроновой кислоты гидратировали с использованием разбавителя, содержащего 1000 МЕ/мл тромбина. На Фиг. 9 показан результат анализа титра тромбина и содержания гиалуроновой кислоты образцов, в которых развивался процесс гидратации посредством возвратно-поступательных движений 5 раз, 7 раз, 10 раз и 20 раз соответственно.
Посредством ФИГ. 9 было подтверждено то, что смешивание между производным гиалуроновой кислоты и разбавителем для получения гомогенной гемостатической композиции должно было идти по меньшей мере 10 раз или более чем 10 раз.
Пример 12. Анализ гемостатического эффекта в крысиной модели
Для гемостатического эффекта в поражениях печени крысы SD тестировали препарат Примера 2б. Для данной животной модели проводили срединную лапаротомию, и затем с использованием скальпеля удаляли центральную ткань приблизительно шириной 1 см, длиной 1 см и глубиной 0,2 см. С использованием кончика апликатора на кровоточащую рану местно на поражения наносили приблизительно 1,0 мл назначенного опытного образца. Через 2 минуты после нанесения опытного образца нанесенный опытный образец удаляли, и степень кровотечения наблюдали в 1, 2, 5 и 10 минут после его удаления. Результат был проиллюстрирован на ФИГ. 10.
ФИГ. 10 представляет собой результат подтверждения гемостатического эффекта Примера 2б в поражениях печени крысы SD. Наблюдали то, что гемостатическая композиция, полученная также, как и в Примере 2б, поглощала кровь с течением времени. Через 2 минуты, когда гемостатический агент был удален влажной марлей, наблюдали гемостаз в пораненной ткани.
Пример 13. Анализ гемостатического эффекта в кроличьей модели
Для подтверждения гемостатического эффекта в поражениях селезенки кролика индуцировали кровотечение посредством 4 мм прокола в селезенке кролика. Приблизительно 1,0 мл назначенных опытных образцов местно наносили на рану, и затем их вдавливали пальцами в течение 5 секунд с использованием влажной марли для помощи в достижении опытным образцом области нанесения. Влажную марлю удаляли через 2 минуты, и опытный образец промывали с использованием физиологического раствора. Степень кровотечения наблюдали каждые 2, 5 и 10 минут после промывки, и результат был показан на ФИГ. 11а и б.
Посредством ФИГ. 11а и б были подтверждены превосходная адгезивная сила в отношении ткани и способность поглощать кровь гемостатической композиции, полученной так же, как и в Примере 2б. Через две минуты после ее удаления в Примере 2б наблюдали насыщение кровью из кровоточащей ткани, и гемостаз достигался без утечки продукта. Кроме того, даже после удаления гемостатического агента с использованием физиологического раствора не наблюдали повторного кровотечения и свернувшейся крови.
Реферат
Группа изобретений относится к области медицины и хирургии. Раскрыт набор для гемостаза, содержащий матрицу, представляющую собой сшитое производное гиалуроновой кислоты, полученное путем сшивания гиалуроновой кислоты или ее соли, и разбавитель, содержащий агент, индуцирующий свертывание. Также раскрыт способ получения указанной матрицы, входящей в состав набора, и способ получения гемостатической композиции с использованием указанного набора. Группа изобретений обеспечивает получение высоких вязкости, степени набухания, поглощающей способности, однородности размера частиц композиции и адгезивной силы. 3 н. и 8 з.п. ф-лы, 16 ил., 1 табл., 13 пр.
Формула
Документы, цитированные в отчёте о поиске
Комплексная матрица для медико-биологического применения

Комментарии