Терапевтическая apac-молекула, содержащая гепарин, конъюгированный с белком плазмы крови - RU2714112C2
Код документа: RU2714112C2
Чертежи















Описание
Область изобретения
Настоящее изобретение относится к антитромботической молекуле, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью; ее применению в качестве лекарственного средства; ее конкретной конфигурации и применению в качестве антикоагулянта и ингибитора тромбоцитов или ее конкретной конфигурации и применению, главным образом, в качестве либо антикоагулянта, либо ингибитора тромбоцитов; и способу ее получения. Изобретение находит применение как в медицинской промышленности, так и в ветеринарной индустрии.
Предшествующий уровень техники
Физиологический процесс коагуляции, во время которого циркулирующая кровь превращается из жидкости в гелеобразную матрицу, является сложным и включает большое число биохимических реакций, протекающих последовательно одна за другой.
В физиологический процесс свертывания крови вовлечены вызванные повреждением сосудов специфическая активация, адгезия и агрегация тромбоцитов с образованием сначала пробки или уплотнения и последующим отложением и "созреванием" фибрина с образованием стабильного сгустка. Первое из упомянутого выше, то есть активность тромбоцитов, можно ингибировать ингибиторами тромбоцитов, тогда как второе, то есть отложение фибрина, можно ингибировать антикоагулянтами.
Процесс свертывания крови начинается почти сразу после повреждения кровеносного сосуда, приводящего к поражениям эндотелиальной выстилки и/или более глубоко расположенных слоев сосуда. Появление крови в пространстве под эндотелием инициирует два процесса: изменения в тромбоцитах и воздействие субэндотелиального тканевого фактора на плазменный фактор свертывания крови VII, который среди других факторов коагуляции вносит значительный вклад в генерацию тромбина и образование фибрина.
При повреждении эндотелия расположенный ниже коллаген подвергается воздействию циркулирующих тромбоцитов, которые непосредственно связываются с коллагеном через коллаген-специфичные поверхностные гликопротеиновые рецепторы. Опосредованно, фактор фон Виллебранда приводит тромбоциты в тесный контакт с коллагеном и также образует мостики между тромбоцитами и коллагеном. Локализация тромбоцитов у внеклеточного матрикса способствует взаимодействию коллагена с гликопротеином VI тромбоцитов, запуская сигнальный каскад, который приводит к активации интегринов тромбоцитов и вызывает последующую адгезию тромбоцитов в месте повреждения. В результате этого в месте повреждения незамедлительно появляется пробка, образованная из тромбоцитов; этот процесс называется первичным гемостазом.
Одновременно протекает вторичный гемостаз, который включает так называемый 'коагуляционный каскад'. После фактора VII в сложный каскад вступают дополнительные факторы коагуляции или факторы свертывания крови, что приводит к ферментативному расщеплению фибриногена с образованием фибриновых нитей, которые упрочняют тромбоцитарную пробку. Коагуляционный каскад состоит из ряда стадий, где протеаза расщепляет и после этого активирует зимоген, который затем действует в качестве следующей протеазы в этой последовательности реакций. Завершением этих реакций является превращение растворимого белка фибриногена в нерастворимые нити фибрина на поверхностях активированных тромбоцитов. Вместе со сжимающими тромбоцитами фибриновые нити образуют стабильный сгусток крови. Имеющий большое значение фактор фон Виллебранда и фибриноген обеспечиваются посредством тромбоцитов, а также, в дополнение к этому, за счет плазмы крови.
Коагуляционный каскад обычно (и до некоторой степени искусственно) подразделяют на три пути: во-первых, путь тканевого фактора, во-вторых, контактный путь активации, которые оба активируют третий "финальный общий путь" фактора X и тромбина, приводящий к образованию фибрина. Главная роль пути тканевого фактора заключается в генерации "тромбинового взрыва", процесса, при котором тромбин, наиболее важная составляющая коагуляционного каскада с точки зрения его роли в активации по типу обратной связи, образуется очень быстро. Интересно отметить, что тромбин является связующим звеном между активацией тромбоцитов и коагуляцией, так как, несмотря на то, что образуется посредством коагуляционного каскада, он является наиболее мощным активатором тромбоцитов, поэтому терапевтические средства, для которых эта молекула может быть мишенью, вероятно, являются очень эффективными антитромботическими средствами.
Коагуляционный каскад представляет собой нормальный физиологический процесс, целью которого является предупреждение значительной кровопотери или геморрагии после повреждения сосудов. В конечном счете, сгустки крови преобразуются и резорбируются в ходе процесса, называемого фибринолизом. Главный фермент, отвечающий за этот процесс (плазмин), регулируется различными активаторами и ингибиторами. Кроме того, коагуляционная система перекрывается с иммунной системой и системой комплемента для осуществления физического захвата вторгающихся в сгустки крови микроорганизмов, повышения проницаемости сосудов и обеспечения фагоцитарных клеток хемотаксическими агентами. Помимо этого, некоторые из продуктов коагуляционной системы непосредственно обладают антимикробным действием.
Однако бывают моменты, когда сгусток крови (также известный как тромб) будет образовываться тогда, когда в этом нет необходимости. Например, при некоторых состояниях с повышенным риском, таких как острое медицинское заболевание, длительная иммобилизация, хирургическая операция или рак, может возрасти риск образования сгустка крови. Кроме того, физиологические проблемы, связанные с процессом коагуляции, могут провоцировать у индивидуума геморрагию, тромбоз, а иногда и то, и другое, что может иметь серьезные последствия в сочетании с атеросклеротическим сердечно-сосудистым заболеванием и/или сердечными аритмиями.
Антитромбоцитарные агенты и антикоагулянты применяют для лечения нарушений свертываемости крови. Антитромбоцитарные агенты включают аспирин, дипиридамол, тиклопидин, клопидогрел, тикагрелол и прасугрел; парентеральные ингибиторы гликопротеина IIb/IIIa используют во время коронарных вмешательств (ангиопластики и стентирования). Среди антикоагулянтов наиболее часто используют варфарин (и родственные кумарины) и гепарин, а парентеральные антикоагулянты прямого действия также включают ингибитор тромбина дабигатран и ингибиторы активированного фактора X, такие как ривароксабан, апиксабан и эдоксабан.
Антитромбин (AT) является ингибитором сериновых протеаз и одним из основных присутствующих в плазме крови ингибиторов протеаз, участвующих в коагуляции. AT блокирует/регулирует коагуляционный каскад, например, ингибируя тромбин (фактор IIa) и активированый фактор X (фактор Ха). Взаимодействие AT с этими факторами возрастает в присутствии гепарина (нефракционированного гепарина; UFH) и низкомолекулярных гепаринов (LMWH; фракционированного гепарина), которые ингибируют процесс коагуляции путем связывания с AT через специфическую пентасахаридную последовательность. Такое связывание приводит к конформационному изменению AT, которое усиливает ингибирование им факторов IIa, Ха и других протеаз, вовлеченных в процесс свертывания крови. После диссоциации гепарин и LMWH являются свободными для связывания с другими молекулами AT и, как следствие, ингибируют в большей степени тромбин и фактор Ха.
Кроме AT существуют другие природные антикоагулянты, среди которых важную роль играют белок С и S, ингибитор пути тканевого фактора и кофактор II гепарина. Активность этих молекул также усиливается гепаринами.
Стандартные препараты гепарина используют, прежде всего, для системного лечения тромбоза. Они являются наиболее эффективными в случае обедненных тромбоцитами тромбов, таких как венозные тромбы, где преобладает коагуляционная активность. Применяемые в клинике стандартные гепарины, хотя и являются эффективными в системном лечении тромбоза, блокируя дальнейшее развитие тромбоза, сами не являются достаточно эффективными для предотвращения вызываемых тромбоцитами тромботических осложнений в артериях, связанных с эндогенным разрывом атеросклеротической бляшки, или экзогенной ангиопластикой, или сосудистой либо микрососудистой хирургией.
Вмешательства на артериях, такие как ангиопластика [РТ(С)А означает чрескожную транслюминальную (коронарную) ангиопластику] со стентированием или без него и сосудистая либо микрососудистая хирургия, также как и (направленная) артерэктомия и периферическая либо легочная тромбэндартерэктомия представляют собой развивающиеся способы лечения сердечно-сосудистых заболеваний. Соответственно, вызываемый тромбоцитами артериальный тромбоз, который происходит в связи с эндогенными сосудистыми либо микрососудистыми повреждениями и/или экзогенными вмешательствами, такими как введение и поддержание артериовенозной фистулы или артериовенозных трансплантатов, представляет собой часто встречающуюся проблему, и в таких ситуациях традиционное системное антикоагуляционное лечение тромбоза часто имеет ограниченную эффективность.
Современное системное антитромботическое лечение в связи с вмешательствами на артериях включает комбинацию антикоагулянта, такого как UFH (со средней MW 15 кДа) или LMWH (со средней MW 7,5 кДа), с антитромбоцитарным лекарственным средством, таким как ацетилсалициловая кислота (ингибитор циклооксигеназы), клопидогрел или другие АДФ (аденозиндифосфат) антагонисты. В других разработках также представлены мощные антагонисты тромбоцитарного гликопротеина IIb/IIIa, фактора фон Виллебранда и рецепторов фибриногена, такие как абциксимаб, тирофибан и эптифибатид. Применение этих относительно новых, использующих внутривенное введение способов комбинированного лечения позволило предотвратить 30-35% случаев острой тромботической закупорки подвергнутых интервенционному вмешательству сосудов, склонных к тромбозу. Риск наиболее раннего кровотечения (основного кровотечения) у стационарных пациентов, требующий инфузии препаратов крови, составляет около 6-7%, а при использовании мощных блокаторов АДФ-рецепторов тромбоцитов число случаев основного кровотечения возрастает до 12-15% у амбулаторных пациентов в течение первого месяца. Связанный с этим риск смертности в 15-30 раз превышает риск в случае спонтанных кровотечений в течение первого месяца последующего наблюдения врача.
К сожалению, системное лечение нефракционированным гепарином имеет недостатки, такие как непредсказуемая биодоступность, короткий полупериод существования, неспецифическое связывание с белками, приводящее к ухудшенному функционированию антитромбина/АТ, и иммуногенные эффекты, что наряду с тромбоцитарным фактором 4 (PF4) приводит к тромбоцитопении и тромбозу. Эти нежелательные эффекты были смягчены путем применения низкомолекулярных фракционированных гепаринов, которые, к сожалению, также обладают ограниченной эффективностью в отношении артериального тромбоза вследствие ограниченного влияния на связанный с фибрином тромбин и на связанный с тромбоцитами фактор Ха и вследствие частичной нейтрализации активности гепарина секретируемым тромбоцитами PF4. Таким образом, существует огромная потребность в разработке эффективного, надежного и безопасного терапевтического средства для предупреждения и/или лечения тромбозов, связанных с сосудистыми или микрососудистыми повреждениями и вмешательствами.
Ранее (WO 9926983) авторы изобретения обнаружили, что синтетическая молекула, содержащая длинную цепь (75±25 кДа) нативных гепариновых протеогликанов (HEP-PG), получаемых из тучных клеток млекопитающих, в случае ее присоединения к белковому ядру проявляет мощные антитромботические свойства, основанные на ее способности ингибировать взаимодействия между тромбоцитами и коллагеном посредством сильного ингибирования активации тромбоцитов, инициированной адгезией тромбоцитов к коллагену. Поэтому эта молекула эффективна для антитромбоцитарного лечения и наилучшим образом подходит для локального применения, и ее идеально использовать в комбинации с системным антитромбоцитарным лекарственным средством. Полезным является то, что эта молекула, по меньшей мере при локальном введении, сохраняет системную функцию тромбоцитов, обеспечивающую нормальные гемостатические реакции.
Другие исследователи (US 5529986) получили синтетическую антитромботическую молекулу, содержащую присоединенные нефракционированные гепариновые цепи (примерно 20-100 цепей) к полиамиду с прямой цепью, такому как полилизин. Эта молекула имеет другой механизм действия по сравнению с механизмом, описанным в приведенной выше заявке WO 9926983, так как она связывается с антитромбином и усиливает его активность. Таким образом, эта молекула эффективна в качестве антикоагулянта.
Продолжающиеся исследования авторов данного изобретения привели их к разработке еще одного класса синтетических антитромботических молекул, основанных на применении гепарина. Однако авторы изобретения неожиданно обнаружили, что открытый ими новый класс молекул преимущественно обладает как антитромбоцитарной активностью, так и антикоагулянтной активностью. Насколько известно авторам изобретения, это первый случай идентификации молекул с таким двойным действием. Кроме того, авторы изобретения обнаружили, что предрасположенность открытого ими нового класса молекул действовать главным образом или в большей степени в качестве антитромбоцитарного или антикоагулянтного средства можно регулировать/моделировать, исходя из количества гепарина, присоединенного к каждой молекуле или включенного в каждую молекулу. Наконец, авторы изобретения также обнаружили, что открытый ими новый класс молекул обладает преимущественно локальным действием и поэтому может быть использован целенаправленно без опасений относительно системных эффектов.
Изложение сущности изобретения
Согласно первому аспекту изобретения предложена антитромботическая молекула, обладающая как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащая белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, при этом каждая цепь имеет MW (молекулярная масса) от 10 до 21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16.
Упомянутое в данном описании количество гепариновых цепей, присоединенных к указанному белку плазмы крови, определяют с использованием колориметрического анализа сульфатированного гликозаминогликана (набор для анализа Blyscan (например, Biocolor Ltd., UK)), применяя гепариновый стандарт в определенных концентрациях для получения калибровочной кривой, относительно которой могут быть прочитаны/измерены тестируемые образцы. Так, количество гепариновых цепей, упомянутых при изложении основной сущности изобретения, соотносится с данными в столбце 1 Таблицы I. Конкретный использованный анализ изложен в данном описании.
Антитромбоцитарная (АР) и антикоагулянтная (АС) активность является уникальным и очень полезным свойством, поскольку она дает молекулам возможность реагировать на случаи, когда необходима антитромбоцитарная активность и/или антикоагулянтная активность, например в изогнутых сосудах или стенозированных сосудах, где в месте стеноза необходимо АР действие, а в дистальном, также как и в проксимальном направлении, когда существует турбулентность и рост тромба опосредован тромбином, необходимо АС действие.
Помимо полезной двойной функциональности авторы изобретения также обнаружили, что молекулы по изобретению обладают сильной способностью связываться с внеклеточным матриксом, в том числе с коллагеном и фактором фон Виллебранда, и поэтому они обладают направленным локальным антитромботическим действием. Это является очень желательным свойством, поскольку означает, что эти молекулы можно использовать в конкретном месте для лечения конкретного состояния без опасения, что они могут оказать вредные системные антитромботические эффекты, которые вероятно могут привести к кровотечению или кровоизлиянию. Это полезное направленное действие имеет место независимо от пути введения, то есть локального или системного.
Упомянутое в данном описании направленное антитромботическое действие относится к способности молекул по изобретению удерживаться в месте применения в течение значительных периодов времени, например более 24 часов; и кроме того, идеально более 48 часов или 50 часов и даже до 120 часов включительно. Примечательно, что это удерживание в месте применения происходит как при введении снаружи, так и внутрь кровеносного сосуда.
В предпочтительном воплощении изобретения указанный белок плазмы крови представляет собой альбумин, глобулин или фибриноген, предпочтительно он представляет собой сывороточный альбумин или альфа-2-макроглобулин и более предпочтительно сывороточный альбумин человека (HSA) или альфа-2-макроглобулин человека. Общеизвестно, что сывороточный альбумин вырабатывается печенью, растворим в плазме крови и является наиболее распространенным белком крови у млекопитающих. Сывороточный альбумин является глобулярным водорастворимым белком с молекулярной массой приблизительно 66000 дальтон. Также известно, что альфа-2-макроглобулин (α2М и А2М) представляет собой большой белок плазмы крови, фактически он является самым большим основным белком в плазме, который не является иммуноглобулином, и вырабатывается главным образом печенью. Альфа-2-макроглобулин действует как антипротеаза и способен инактивировать большое множество протеиназ.
В еще одном предпочтительном воплощении изобретения указанный белок плазмы крови является рекомбинантным.
В еще одном предпочтительном воплощении изобретения указанный гепарин представляет собой нефракционированный гепарин. Еще более идеально, когда источником указанного гепарина является млекопитающее, идеально, человек или свинья. В случае, когда белок плазмы крови является человеческим, а гепарин является свиным или бычьим гепарином, указанная АРАС-молекула представляет собой химерную молекулу.
Предпочтительно, гепарин имеет MW, выбранную из группы, содержащей: 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 кДа, идеально 15, или 16, или 17 кДа.
В еще одном предпочтительном воплощении изобретения указанный гепарин является рекомбинантным.
В еще одном более предпочтительном воплощении изобретения указанная линкерная молекула, по меньшей мере когда связывание указанного гепарина с указанным белком плазмы крови является полным, представляет собой одиночную линкерную молекулу, которая связана с одной молекулой гепарина, поэтому присоединение одной линкерной молекулы к указанному белку плазмы крови приводит к присоединению одной молекулы гепарина к указанному белку плазмы крови. Таким образом, стехиометрическое отношение указанного линкера к указанному гепарину составляет 1:1. Предпочтительно, указанный линкер представляет собой аминный линкер и поэтому связывается с аминогруппами в указанном гепарине и белке плазмы крови; идеально, но не исключительно, указанный линкер конъюгируется с серином в гепариновой цепи, предпочтительно расположенным на конце или близко к концу указанной цепи, и идеально, но не исключительно, с лизином в белке плазмы крови. Еще более идеально, когда указанный линкер обеспечивает конъюгирование указанных гепарина и белка плазмы крови посредством дисульфидных мостиков. Еще более предпочтительно, указанный линкер представляет собой гетеро-бифункциональный кросс-линкер, такой как SPDP линкер (N-сукцинимидил-3-(2-пиридилдитио)пропионатный линкер), или гомо-бифункциональный кросс-линкер, такой как DTSP линкер.
SPDP (имеющийся в продаже, например, от Sigma-Aldrich или Thermo Scientific Pierce) представляет собой кросс-линкер с короткой цепью, используемый для амин-сульфгидрильного (amine-to-sulfhydryl) конъюгирования посредством N-гидроксисукцинимид-(NHS)-эфирной и пиридилдитиольной реакционноспособных групп, и он приводит к образованию расщепляемых (восстанавливаемых) дисульфидных связей с сульфгидрильными группами цистеина. Доступны его варианты с короткой цепью и длинной цепью. Вариант с длинной цепью доступен в сульфонированной форме и является водорастворимым. Авторы изобретения предпочитают использовать N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)пропионовой кислоты. Хотя все варианты SPDP содержат реакционноспособный в отношении аминов N-гидроксисукцинимидный (NHS) эфир, который будет взаимодействовать с лизиновыми остатками с образованием стабильной амидной связи и, на другом конце этого линкера находится пиридилдисульфидная группа, которая будет взаимодействовать с сульфгидрилами с образованием обратимой дисульфидной связи.
DTSP (ди(N-гидроксисукцинимидный (NHS) эфир 3,3'-дитиодипропионовой кислоты), имеющийся в продаже, например, от Sigma-Aldrich или Thermo Scientific Pierce) представляет собой кросс-линкер с короткой цепью, используемый для амин-аминного (amine-to-amine) конъюгирования посредством N-гидроксисукцинимид (NHS)-эфирных реакционноспособных групп. Доступны его варианты с короткой цепью и длинной цепью. Вариант с длинной цепью доступен в сульфонированной форме (N-гидроксисульфосукцинимидный (сульфо-NHS) эфир) и является водорастворимым. Варианты DTSP содержат две реакционноспособные в отношении аминов N-гидроксисукцинимид (NHS)-эфирные группы и дисульфидный мостик в составе спейсерной группы. N-Гидроксисукцинимидный эфир взаимодействует с остатками, содержащими первичные амины, с образованием стабильных амидных связей вместе с расщепляемой дисульфидной связью в линкерной молекуле.
Соответственно, общие формулы предпочтительной синтетической молекулы авторов изобретения могут быть выражены следующим образом:
(Нер-линкер)n-PIPr,
где n равно 4-16;
PIPr представляет собой белок плазмы крови, такой как сывороточный альбумин человека или альфа-2-макроглобулин человека; и
гепариновая (Hep) цепь обладает 10-21 кДа.
Более конкретно, если авторы изобретения используют предпочитаемый ими линкер, представляющий собой N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)пропионовой кислоты (SPDP) или ди(N-гидроксисукцинимидный эфир) 3,3'-дитиодипропионовой кислоты (DTSP), то предпочтительная синтетическая молекула авторов изобретения может быть выражена следующим образом:
(Hep-NH-CO-CH2-CH2-S-S-CH2-CH2-CO-NH)n-PIPr,
где n равно 4-16;
PIPr представляет собой белок плазмы крови, такой как сывороточный альбумин человека или альфа-2-макроглобулин человека; и
гепариновая цепь обладает 10-21 кДа.
Несмотря на то, что к каждому белку плазмы крови, например альбумину, конкретно HSA, можно присоединить до 36 цепей гепарина включительно, авторы изобретения обнаружили, что присоединение 4-16 гепариновых цепей к каждому белку плазмы крови обеспечивает получение желательной двойной функциональности: как антитромбоцитарной активности, так и антикоагулянтной активности. Кроме того, как показывают приведенные в настоящем описании данные, авторы изобретения также обнаружили, что присоединение менее 6 гепариновых цепей, идеально 4-6 гепариновых цепей, к каждому белку плазмы крови обеспечивает получение, главным образом или в большей степени, желательной антикоагулянтной активности, тогда как присоединение более 8 гепариновых цепей, идеально 8-16 гепариновых цепей, к каждому белку плазмы крови обеспечивает получение, главным образом или в большей степени, желательной антитромбоцитарной активности.
Соответственно, в еще одном предпочтительном воплощении изобретения указанная АРАС-молекула имеет 6 или меньше, например 4-6 гепариновых цепей, присоединенных к указанному белку плазмы крови, когда указанная молекула предназначена для использования, главным образом или в большей степени, в качестве антикоагулянта.
Соответственно, в еще одном предпочтительном воплощении изобретения указанная АРАС-молекула имеет 8 или больше, например 8-16 гепариновых цепей, присоединенных к указанному белку плазмы крови, когда указанная молекула предназначена для использования, главным образом или в большей степени, в качестве антитромбоцитарного средства / ингибитора тромбоцитов.
Соответственно, в еще одном предпочтительном воплощении изобретения указанная АРАС-молекула имеет 8 гепариновых цепей, присоединенных к указанному белку плазмы крови, когда указанная молекула предназначена для использования, главным образом или в большей степени, в качестве антитромбоцитарного средства / ингибитора тромбоцитов.
Соответственно, в еще одном предпочтительном воплощении изобретения указанная АРАС-молекула имеет 11 гепариновых цепей, присоединенных к указанному белку плазмы крови, когда указанная молекула предназначена для использования, главным образом или в большей степени, в качестве антитромбоцитарного средства / ингибитора тромбоцитов.
Таким образом, предпочтительное связывание некоторого количества гепариновых цепей с ядром каждого белка плазмы крови может оказать влияние на главную функцию синтетической молекулы. Этот важное свойство имеет техническое применение, так как хотя результатом применения молекул(ы) по изобретению, который следует достичь, является антитромботическое действие, имеют место случаи, когда требуется сделать акцент на антитромбоцитарной активности, и другие случаи, когда требуется дополнительно сделать акцент на антикоагулянтной активности. Например, при лечении таких сосудов, как вены, где скорость сдвига является относительно низкой, то есть где более широкий просвет сосуда и более низкая скорость движения крови, очень желательным является антитромботическое действие с преобладанием антикоагулянтной активности или с акцентом на нее. В свою очередь, при лечении таких сосудов, как артерии, или, например, артериовенозной фистулы, где скорость сдвига является относительно высокой, то есть где более высокая скорость движения крови, или сосудов с более малым просветом, так что скорость движения крови является высокой, очень желательным считается антитромботическое действие с преобладанием антитромбоцитарной активности или с акцентом на нее. Аналогичным образом, если используются имплантаты, такие как катетеры, стенты или устройства для осуществления баллонной ангиопластики, то на них можно нанести покрытие из АРАС-молекул по изобретению, и тип используемых АРАС-молекул в идеале будет определен, исходя из природы сосуда, в который должны быть встроены эти имплантаты.
Согласно второму аспекту изобретения предложена антитромботическая молекула, обладающая как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащая белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16, для применения в качестве лекарственного средства.
Согласно третьему аспекту изобретения предложена антитромботическая молекула, обладающая как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащая белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16, для применения в качестве антитромботического средства.
В предпочтительном воплощении этого аспекта изобретения указанное антитромботическое средство действует локально. Под этим авторы изобретения понимают, что антитромботическое средство связывается с внеклеточным матриксом и, следовательно, удерживается в месте применения или в месте предполагаемого действия с пролонгированной локальной активностью. Действительно, это локальное проявление активности является преимущественным, поскольку означает, что молекулы по изобретению эффективно нацелены на то место, где они наиболее необходимы, то есть где вероятно имеет место тромбоз, иными словами, на внеклеточный матрикс, где присутствуют/являются неотъемлемыми компонентами как коллаген, так и фактор фон Виллебранда.
Согласно четвертому аспекту изобретения предложено применение антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащей белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16, для применения в изготовлении лекарственного средства для лечения тромбоза или предполагаемого тромбоза.
Упомянутый в данном описании предполагаемый тромбоз относится к любому случаю, обстоятельству или состоянию, которые могут привести к тромбозу, таким как (без ограничения) проведение хирургического вмешательства, например хирургической тромбэктомии; в этом примере молекулы по изобретению могут быть введены в место операции или введены посредством инфузии в прооперированный сосуд, или введены посредством инфузии в соседний расположенный ниже сосуд, чья кровь будет течь рядом с указанным местом операции / к указанному месту операции.
В предпочтительном воплощении этого аспекта изобретения указанное лекарственное средство представляет собой антитромботическое средство; идеально, локального действия. Под локальным действием авторы изобретения понимают, что антитромботическое средство связывается с внеклеточным матриксом и, следовательно, удерживается в месте применения с пролонгированной локальной активностью. Действительно, это локальное проявление активности является преимущественным, поскольку означает, что молекулы по изобретению эффективно нацелены на то место, где они наиболее необходимы, то есть где вероятно имеет место тромбоз, иными словами, на внеклеточный матрикс, где присутствуют/являются неотъемлемыми компонентами как коллаген, так и фактор фон Виллебранда.
Согласно приведенным выше аспектам изобретения предпочтительно, чтобы указанная АРАС-молекула имела 6 или меньше, например 4-6, гепариновых цепей, присоединенных к указанному белку плазмы крови через указанные линкеры, когда указанная молекула предназначена для использования, главным образом или в большей степени, в качестве антикоагулянта.
Аналогичным образом, согласно приведенным выше аспектам изобретения предпочтительно, чтобы указанная АРАС-молекула имела 8 или более, например 8-16, гепариновых цепей, присоединенных к указанному белку плазмы крови через указанные линкеры, когда указанная молекула предназначена для использования, главным образом или в большей степени, в качестве антитромбоцитарного средства / ингибитора тромбоцитов.
В следующих предпочтительных воплощениях изобретения указанные АРАС-молекулы можно применять в лечении или предупреждении тромботических осложнений, таких как осложнения, связанные с эндогенным разрывом атеросклеротической бляшки; или после тромболитической терапии для предотвращения реокклюзии; или с экзогенной ангиопластикой; или сосудистой либо микрососудистой хирургией; вмешательствами на артериях, такими как ангиопластика, в частности, чрескожная транслюминальная (коронарная) ангиопластика со стентированием или без него; (направленной) артерэктомией; периферической или легочной тромбэндартерэктомией; вызываемым тромбоцитами артериальным тромбозом; сосудистыми либо микрососудистыми повреждениями; тромботической тромбоцитопенической пурпурой или экзогенными вмешательствами, такими как введение и поддержание артериовенозной фистулы или артериовенозных трансплантатов, и дефицитом антитромбина (AT).
Согласно пятому аспекту изобретения предложено применение антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащей белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16, для использования в лечении ишемически-реперфузионного повреждения, или острого почечного повреждения, или инфаркта миокарда, или инсульта, или окклюзионной болезни периферических артерий, или мезентериальной ишемии.
Альтернативно, согласно шестому аспекту изобретения предложено применение антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащей белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16, для использования в изготовлении лекарственного средства для лечения ишемически-реперфузионного повреждения, или острого почечного повреждения, или инфаркта миокарда, или инсульта, или окклюзионной болезни периферических артерий, или мезентериальной ишемии.
Согласно седьмому аспекту изобретения предложен способ получения антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, включающий:
1) модифицирование нефракционированной гепариновой (Hep) цепи с получением реакционноспособного продукта, имеющего сульфгидрильную (-SH) группу;
2) модифицирование белка плазмы крови, такого как сывороточный альбумин, с получением реакционноспособного продукта, имеющего пиридил-дитиоловую (-PDP) группу; и
3) связывание реакционноспособного продукта со стадии 1) с реакционноспособным продуктом со стадии 2) с использованием гетеро-бифункционального кросс-линкера.
В предпочтительном способе по изобретению указанный линкер представляет собой SPDP-линкер - N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)пропионовой кислоты (имеющийся в продаже (возможно, с качеством согласно GMP (надлежащая производственная практика)), например, от Sigma-Aldrich или Thermo Scientific Pierce).
Согласно восьмому аспекту изобретения предложен способ получения антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, включающий:
1) модифицирование нефракционированной гепариновой (Hep) цепи с получением реакционноспособного продукта, имеющего группу N-гидроксисукцинимидного (-NHS) эфира;
2) связывание реакционноспособного продукта со стадии 1) с белком плазмы крови, таким как сывороточный альбумин, содержащим первичные амины, с использованием гомо-бифункционального кросс-линкера.
В предпочтительном способе по изобретению указанный линкер представляет собой DTSP-линкер - ди(N-гидроксисукцинимидный эфир 3,3'-дитиодипропионовой кислоты (имеющийся в продаже (возможно, с качеством согласно GMP), например, от Sigma-Aldrich или Thermo Scientific Pierce).
Согласно девятому аспекту изобретения предложен способ лечения заболевания или состояния, выбранного из группы, содержащей:
тромботические осложнения, такие как осложнения, связанные с эндогенным разрывом атеросклеротической бляшки; с тромболитической терапией для предотвращения реокклюзии; вызываемый тромбоцитами артериальный тромбоз; сосудистые или микрососудистые повреждения; тромботическую тромбоцитопеническую пурпуру; ишемически-реперфузионное повреждение; острое почечное повреждение; инфаркт миокарда; инсульт; окклюзионную болезнь периферических артерий, мезентериальную ишемию и дефицит антитромбина (AT);
где подлежащему лечению индивидууму вводят эффективное количество антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащей белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16.
В предпочтительном воплощении этого аспекта изобретения указанную антитромботическую молекулу вводят после тромболитической терапии для предотвращения реокклюзии.
Еще более предпочтительно, когда указанное количество гепариновых цепей выбрано из группы, содержащей числа 8, 9, 10, 11 и 12.
Согласно десятому аспекту изобретения предложен способ лечения, выбранный из группы, содержащей:
экзогенную ангиопластику; сосудистую или микрососудистую хирургию; вмешательство на артериях; ангиопластику, в частности, чрескожную транслюминальную (коронарную) ангиопластику со стентированием или без него; (направленную) артерэктомию; периферическую или легочную тромбэндартерэктомию и экзогенные вмешательства, такие как введение и поддержание артериовенозной фистулы или артериовенозных трансплантатов;
где подлежащему лечению индивидууму вводят эффективное количество антитромботической молекулы, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, содержащей белок плазмы крови, к которому присоединены через множество линкерных молекул множество гепариновых цепей, каждая из которых имеет MW в диапазоне 10-21 кДа, и кроме этого, где количество указанных гепариновых цепей, присоединенных к указанному белку плазмы крови, выбрано из группы, содержащей числа 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16, до, входе или после указанного лечения.
В предпочтительном воплощении этого аспекта изобретения указанную антитромботическую молекулу вводят до осуществления любого одного или более чем одного из указанных выше способов лечения.
Еще более предпочтительно, когда указанное количество гепариновых цепей выбрано из группы, содержащей числа 8, 9, 10, 11 и 12.
Еще более предпочтительно, когда антитромботическую молекулу, обладающую как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью очищали посредством хроматографии, такой как хроматография с гидрофобным взаимодействием (HIC), используя бутил-сефарозную среду (GE Healthcare, USA), и/или ультра/диафильтрации. Однако АРАС-молекулы можно очищать другими способами, такими как анионобменная хроматография, или другими путями, известными специалистам в данной области техники.
В приведенной формуле изобретения и в предшествующей части описания изобретения, за исключением тех мест, когда контекст требует иного для формулирования или выражения необходимого смысла, слово "содержит" или такие его варианты, как "содержат" или "содержащий", используются в значении "включительно", то есть для конкретизации наличия установленных признаков, но не для исключения наличия или добавления дополнительных признаков в различные воплощения изобретения.
Все процитированные в этом описании ссылки, включая любой патент или патентную заявку, включены, таким образом, путем ссылки. Не является допустимым, что любая ссылка составляет предшествующий уровень техники. Также не является допустимым, что любой из документов предшествующего уровня техники составляет часть общеизвестных знаний в данной области техники.
Предпочтительные признаки каждого аспекта изобретения могут быть такими, как описано применительно к любому из других аспектов.
Другие признаки настоящего изобретения будут очевидны из следующих далее примеров. В общем, это изобретение распространяется на любой новый признак или любую новую комбинацию признаков, раскрытых в этом описании (включая прилагаемые формулу изобретения и графические материалы). Таким образом, следует понимать, что признаки, целые числа, характеристики, соединения или химические группировки, описанные в связи с конкретным аспектом, воплощением или примером изобретения, применимы к любому другому аспекту, воплощению или примеру, описанному в данной заявке, если нет с ним противоречия.
Кроме того, если не указано иное, любой признак, раскрытый в данной заявке, может быть заменен альтернативным признаком, который применяется для достижения такой же или подобной цели.
Далее настоящее изобретение будет описано исключительно на примере с конкретным упоминанием следующих фигур, при этом:
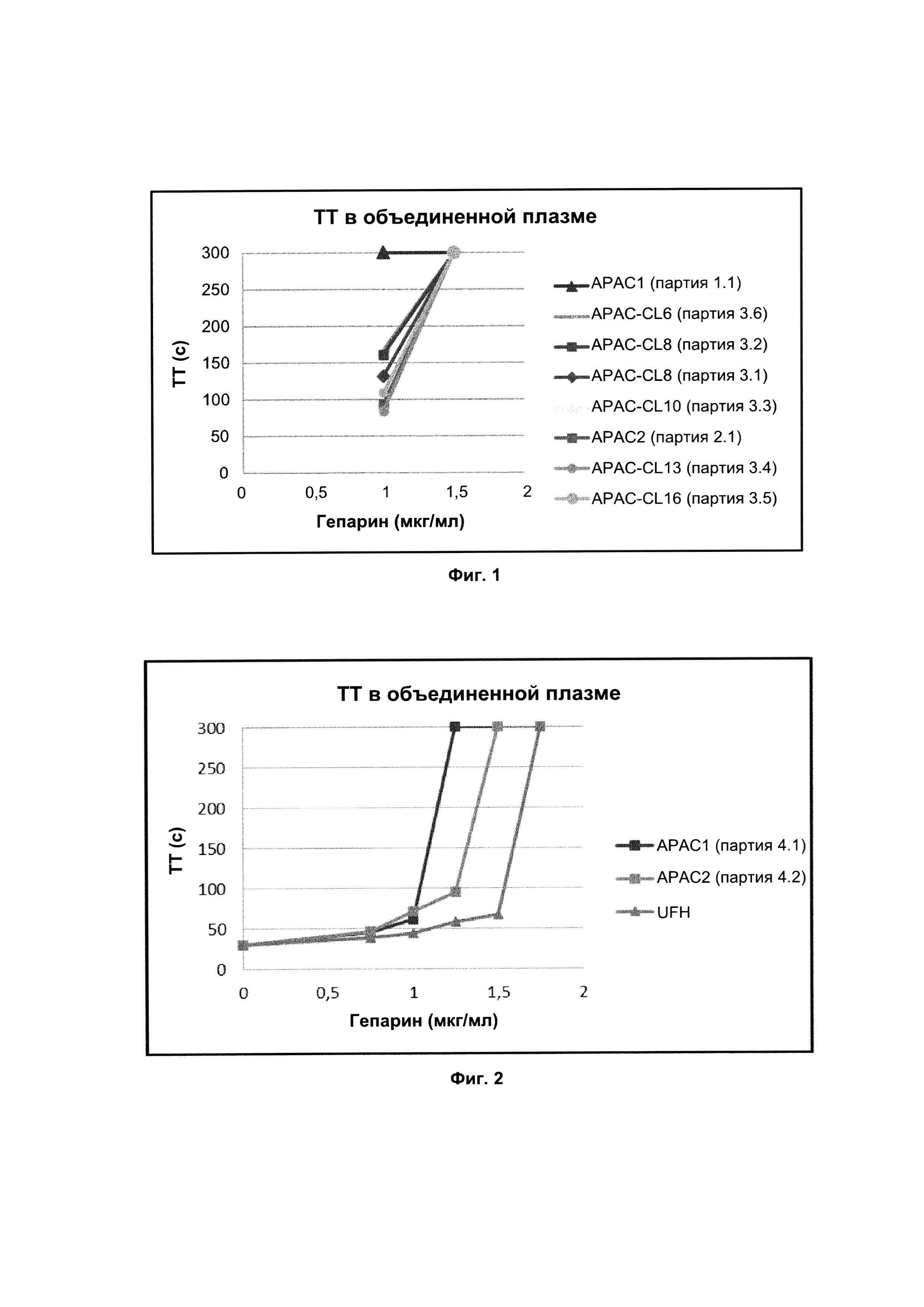
на Фиг. 1 показаны результаты исследования изменения тромбинового времени (ТТ) в присутствии АРАС1 первого поколения (партия 1.1, 4 Нер-цепи), АРАС2 второго поколения (партия 2.1, 11 Hep-цепей) и АРАС-(от CL6 до CL16) третьего поколения (партии: 3.1; 3.2; 3.3; 3.4; 3.5 и 3.6; 8, 8, 10, 13, 16 и 6 Нер-цепей, соответственно) в двух концентрациях при концентрации [С] гепарина (Hep) в объединенной плазме 1,0 и 1,75 мкг/мл. Базовое значение ТТ составляло 28 с;
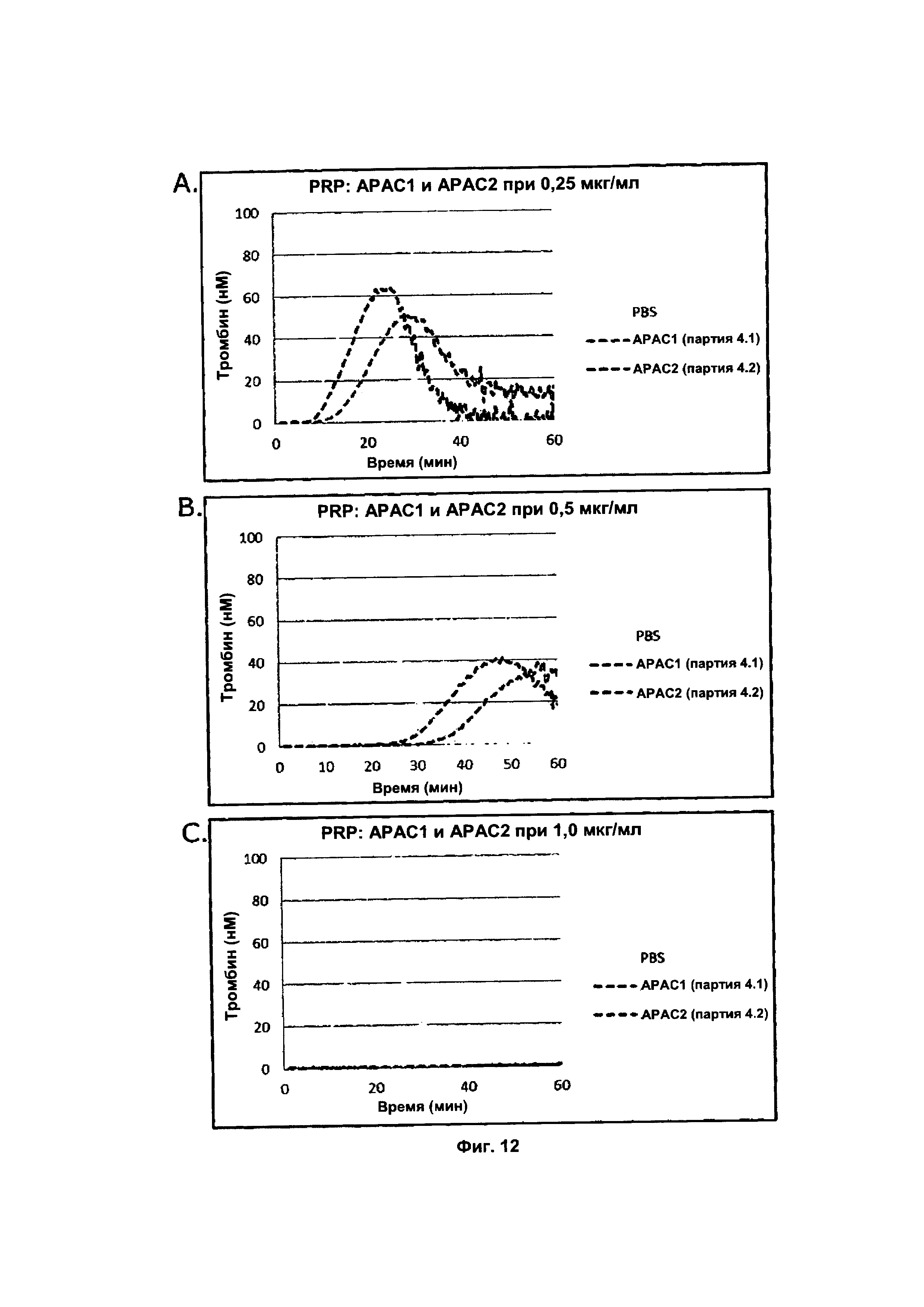
на Фиг. 2 показано тромбиновое время (ТТ) в присутствии АРАС1 четвертого поколения (партия 4.1, 4 Hep-цепи) и АРАС2 четвертого поколения (партия 4.2, 8 Hep-цепей) в трех-пяти концентрациях при [С] Hep в объединенной плазме 0,75, 1,0 и 1,75 мкг/мл. Базовое значение ТТ составляло 31 с;
на Фиг. 3 показано активированное частичное тромбопластиновое время (АРТТ) в присутствии АРАС1 первого поколения (партия 1.1, 4 Нер-цепи), АРАС2 второго поколения (партия 2.1, 11 Hep-цепей) и АРАС-СЦ8-16) третьего поколения (партии 3.1; 3.2; 3.3; 3.4 и 3.5; 8, 8, 10, 13 и 16 Нер-цепей, соответственно) в пяти концентрациях при [С] Hep в объединенной плазме 1, 2, 3, 6 и 8 мкг/мл. Базовое значение АРТТ составляло 30 с;
на Фиг. 4 показано сравнение уровня конъюгирования гепарина в АРАС для пяти разных концентраций гепарина с точки зрения пролонгирования (от 1 до 10 раз) АРТТ. Показаны результаты влияния АРАС1 (партия 1.1, 4 Нер-цепи), APAC-CL8 (партии 3.1 и 3.2, 8 Нер-цепей), APAC-CL10 (партия 3.3, 10 Нер-цепей), АРАС2 (партия 2.1, 11 Нер-цепей), APAC-CL13 (партия 3.4, 13 Нер-цепей), APAC-CL16 (партия 3.5, 16 Нер-цепей) на АРТТ при [С] Hep в объединенной плазме 1, 2, 3, 6, 8 мкг/мл. Базовое значение АРТТ составляло 30 с;
на Фиг. 5 показано АРТТ в присутствии АРАС1 четвертого поколения (партия 4.1, 4 Нер-цепи) и АРАС2 четвертого поколения (партия 4.2, 8 Нер-цепей) в пяти концентрациях при [С] Hep в объединенной плазме 1, 2, 3, 6 и 8 мкг/мл. Базовое значение АРТТ составляло 30 с;
на Фиг. 6 показана задержка генерации тромбина по калиброванным автоматизированным тромбограммам в присутствии А) 0,25 мкг/мл и В) 0,5 мкг/мл АРАС1 первого поколения (партия 1.1, 4 Нер-цепи), АРАС2 второго поколения (партия 2.1, 11 Нер-цепей) в сравнении с UFH и забуференным фосфатом физиологическим раствором (PBS) в объединенной плазме (РР), дополненной 5 пМ тканевого фактора (TF) и 4 мкМ фосфолипидов (PPL);
на Фиг. 7 показана задержка генерации тромбина по калиброванным автоматизированным тромбограммам в присутствии А) 1,0 мкг/мл и В) 1,5 мкг/мл АРАС1 первого поколения (партия 1.1, 4 Нер-цепи), АРАС2 второго поколения (партия 2.1, 11 Нер-цепей) в сравнении с UFH и PBS в объединенной плазме (РР), дополненной 5 пМ TF и 4 мкМ PPL;
на Фиг. 8 показана генерация тромбина по калиброванной автоматизированной тромбограмме в присутствии А) 0,25 мкг/мл и В) 0,5 мкг/мл АРАС-(CL6-CL6) третьего поколения (8, 8, 10, 13, 16 и 6 Нер-цепей) и PBS в объединенной плазме (РР), дополненной 5 М TF и 4 мкМ PPL. APAC-CL8 (партия 3.1 и 3.2, 8 Нер-цепей), APAC-CL10 (партия 3.3, 10 Нер-цепей), АРАС-CL13 (партия 3.4, 13 Нер-цепей), APAC-CL16 (партия 3.5, 16 Нер-цепей) и APAC-CL6 (партия 3.6, 6 Нер-цепей);
на Фиг. 9 показана генерация тромбина по калиброванной автоматизированной тромбограмме в присутствии А) 1,0 мкг/мл и В) 1,5 мкг/мл APAC-(CL6-CL16) (8, 8, 10, 13, 16 и 6 Нер-цепей) и PBS в объединенной плазме (РР), дополненной 5 М TF и 4 мкМ PPL. APAC-CL8 (партия 3.1 и 3.2, 8 Нер-цепей), APAC-CL10 (партия 3.3, 10 Нер-цепей), APAC-CL13 (партия 3.4, 13 Нер-цепей), APAC-CL16 (партия 3.5, 16 Нер-цепей) и APAC-CL6 (партия 3.6, 6 Нер-цепей);
на Фиг. 10 показана генерация тромбина по калиброванным автоматизированным тромбограммам в присутствии 0,25, 0,5, 1,0 и 1,5 мкг/мл UFH в обогащенной тромбоцитами плазме (PRP), дополненной 1 пМ TF, PPL для поддержки тромбоцитов;
на Фиг. 11 показана генерация тромбина по калиброванным автоматизированным тромбограммам в присутствии А) 0,25 мкг/мл и В) 0,5 мкг/мл АРАС1 (партия 1.1, 4 Нер-цепи) и АРАС2 (партия 2.1, 11 Нер-цепей) и UFH в PRP (донором является респондер с высокой восприимчивостью), дополненной 1 пМ TF, PPL для поддержки тромбоцитов;
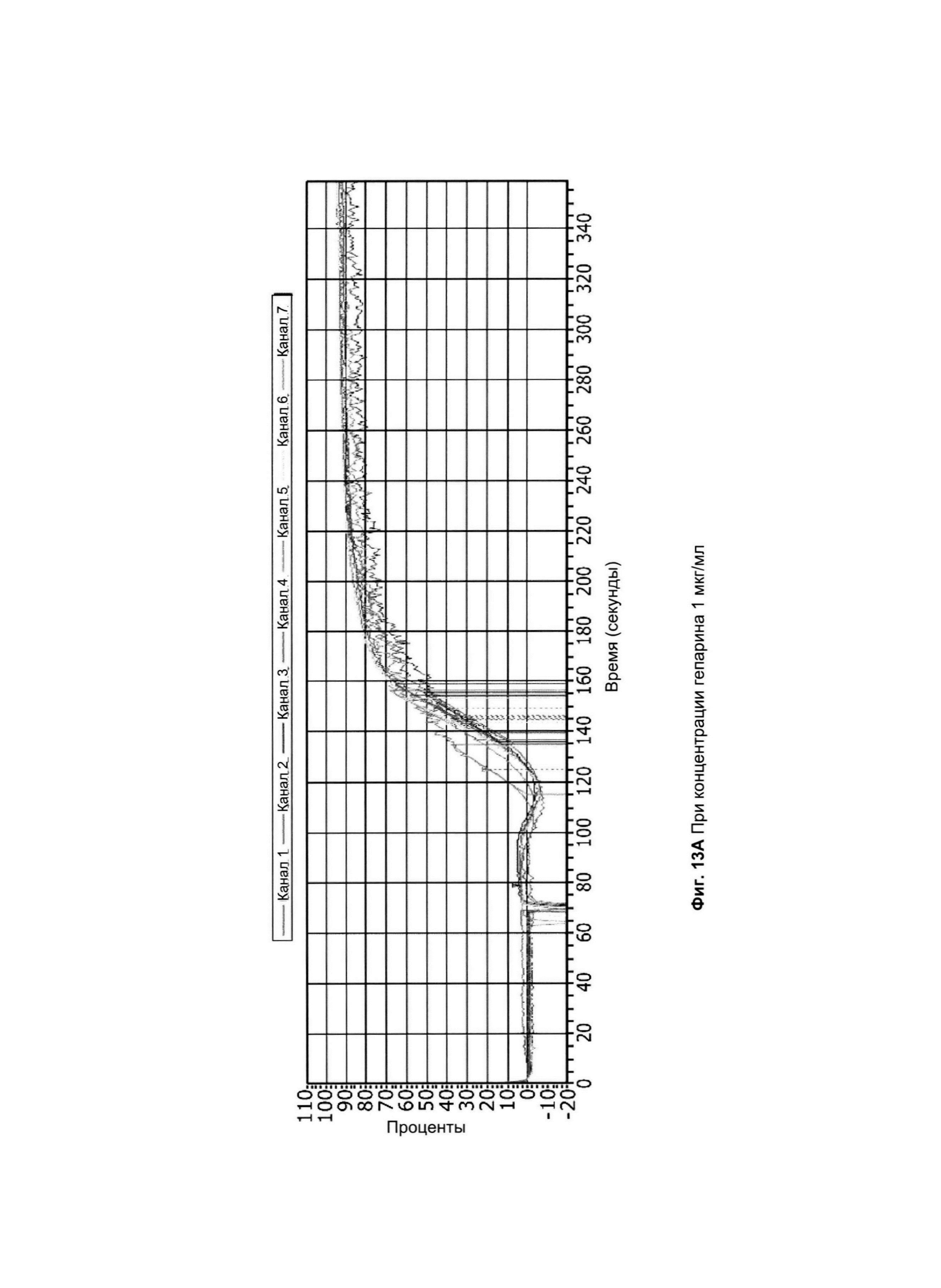
на Фиг. 12 показана генерация тромбина по калиброванным автоматизированным тромбограммам в присутствии А) 0,25 мкг/мл, В) 0,5 мкг/мл и С) 1,0 мкг/мл АРАС1 (партия 4.1, 4 Нер-цепи) и АРАС2 (партия 4.2, 8 Нер-цепей) и в PRP (донором является респондер с умеренной восприимчивостью), дополненной 1 пМ TF, PPL для поддержки тромбоцитов;
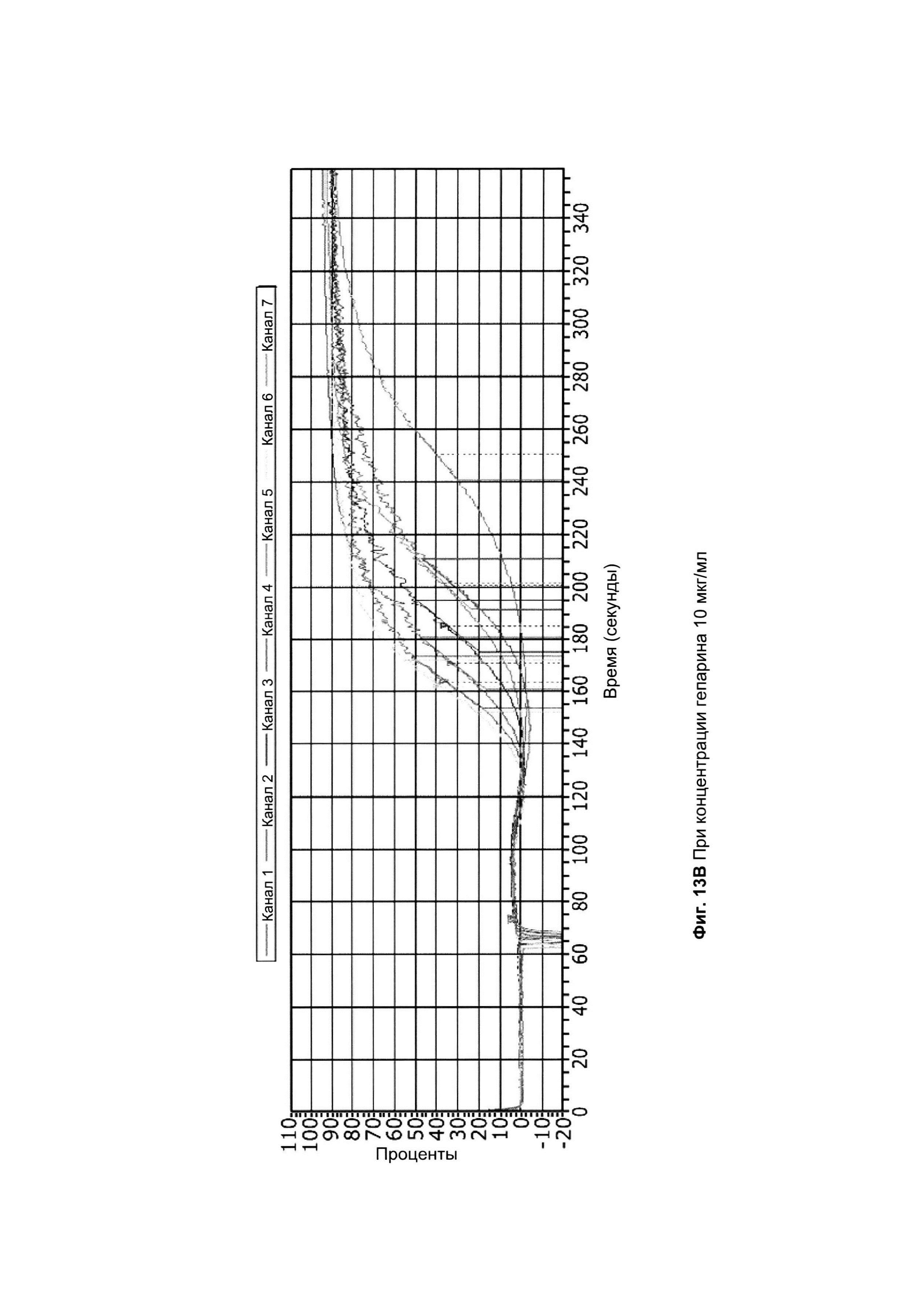
на Фиг. 13 показана индуцированная коллагеном агрегация в PRP в присутствии АРАС третьего поколения, АРАС-(CL6-CL6) (8, 8, 10, 13, 16 и 6 Нер-цепей). Приведен пример респондера с низкой восприимчивостью к АРАС при [С] Hep А) 1, В) 10 и С) 30 мкг/комл. Канал 1: APAC-CL8 (партия 3.1, 8 Нер-цепей), канал 2: APAC-CL8 (партия 3.2, 8 Нер-цепей), канал 3: APAC-CL10 (партия 3.3, 10 Нер-цепей), канал 4: APAC-CL13 (партия 3.4, 13 Нер-цепей), канал 5: APAC-CL16 (партия 3.5, 16 Нер-цепей), канал 6: APAC-CL6 (партия 3.6, 6 Нер-цепей) и канал 7: смесь APAC-CL10 и -16 (10 Нер-цепей и 16 Нер-цепей). [С] коллагена составляла 0,5 мкг/мл;
на Фиг. 14 показано ингибирование индуцированной коллагеном максимальной агрегации тромбоцитов в присутствии АРАС1 (партия 1.1, 4 Нер-цепи) в PRP для репрезентативного респондера с высокой (незакрашенный круг) и умеренной (незакрашенный квадрат) восприимчивостью к АРАС при 3, 10, 30, 60 и 90 мкг/мл. Также показано среднее значение ингибирования агрегации тромбоцитов у доноров в присутствии UFH (черный треугольник). Ингибирование максимальной агрегации тромбоцитов относительно разбавителя (PBS) показано в виде процентного отношения (%).
на Фиг. 15 показан график циклических уменьшений потока (cyclic flow reductions) (CFR) после локального применения UFH и АРАС1 (партия 1.1, 4 Нер-цепи) (в обоих случаях при 4 мг/мл; суммарно 2 мг) в месте только что выполненного повреждения в модифицированной модели острого тромбоза по Фолтсу на бабуинах. Сразу после восстановления базового тока крови артерию подвергали стенозированию (30%) до скорости потока 100 мл/мин. В месте повреждения, обработанном UFH (черный треугольник), наблюдали неоднократные окклюзии (5 CFR в течение 25 мин). Перед повторным стенозированием (на момент времени 20-50 мин) и усилением стеноза (на момент времени 180 мин) обработанное место повреждения промывали забуференным фосфатом физиологическим раствором (PBS).
Для сравнения, в случае обработки АРАС (незакрашенный круг) место только что выполненного повреждения оставляли открытым во время всего эксперимента: сначала в течение 120 мин при артериальном токе крови 100 мл/мин (незакрашенный круг), во-вторых, в течение 14 мин при ужесточенном стенозе (tightened srenosis) (60%) при артериальном токе крови 50 мл/мин (черный крест) и наконец в течение последовательных периодов времени 10 и 15 мин при резком стенозе (harsh stenosis) (90%) при токе крови 30 мл/мин (черные звездочки);
на Фиг. 16 показано сравнение АРАС1 (партия 1.1, 4 Нер-цепи) и UFH (в обоих случаях при 4 мг/мл) при индуцированном коллагеном тромбообразовании в текущей крови в модели на бабуинах (n=4). Уменьшенное отложение тромбоцитов наблюдали для: А) коллагеновых поверхностей в месте применения, где отложение тромбоцитов снижалось в присутствии АРАС1 на 34±13% (среднее значение и SD (стандартное отклонение), n=4) в сравнении с UFH (р=0,01), и В) тромба, который развивался на расстоянии 10 см дистально по отношению к коллагеновому сегменту, где отложение тромбоцитов снижалось в присутствии АРАС1 на 63±11% (среднее значение и SD, n=4) в сравнении с UFH (р=0,19). Образование фибрина также снижалось на 45%±14% (среднее значение и SD, n=4) (р=0,01) с помощью АРАС1 по сравнению с необработанным контролем, согласованно с двойным ингибирующим действием в отношении тромбоцитов и коагуляции;
на Фиг. 17 показано незамедлительное антикоагулянтное действие АРАС и UFH в плазме крыс. АРАС2 (партия 2.1, 11 Нер-цепей), использованные в количестве 16, 32 или 80 мкг для исследования ишемически-реперфузионного повреждения или острого почечного повреждения, представляли собой эффективные антикоагулянты при измерении с использованием анализа АРТТ. Для сравнения использовали нефракционированный гепарин (UFH, пунктирная черная линия) в том же диапазоне концентраций 16, 32 или 80 мкг. Видно, что эти два терапевтических средства при 16 мкг действовали сравнительно одинаково, при 32 мкг UFH пролонгировал АРТТ чуть больше, чем АРАС2, тогда как при 80 мкг UFH пролонгировал АРТТ значительно больше, чем АРАС2 (сплошная черная линия).
АРТТ в виде среднего значения ± SD через 10 мин после внутривенного (в.в.) введения АРАС2 или UFH в дозе 16 мкг (0,06 мг/кг), 32 мкг (0,13 мг/кг) и 80 мкг (0,32 мг/кг). n=5-8/группа. ***Р<0,001. В случае дозы 16 мкг АРТТ составляло 18,0±6,6 (n=7) для АРАС и 27±6,2 (n=4) для UFH. В случае дозы 32 мкг АРТТ составляло 17,4±4,0 (n=10) для АРАС и 25,2±2,0 (n=5) для UFH. В случае дозы 80 мкг АРТТ составляло 42,2±18 (n=8) для АРАС и 72-180 (n=5) для UFH. Пунктирная красная линия представляет собой базовое референсное значение для АРТТ. Дозы гепарина определяли, используя UFH в качестве стандарта в Blyscan анализе сульфатированного гликозаминогликана;
на Фиг. 18 показано нарушение функции почек и тубулоинтерстициальное поражение после 30-минутного билатерального почечного ишемически-реперфузионного повреждения. Влияние 16 или 32 мкг АРАС2 (партия 2.1, 11 Нер-цепей) на функцию почек при проведении анализа с использованием общепринятых маркеров сравнивали только с контрольным разбавителем, представляющим собой физиологический раствор (в.в.). В течение трех суток после обратимого ишемически-реперфузионного повреждения продолжительностью 30 мин анализировали маркеры функции почек - креатинин, мочевину и липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), и концентрация АРАС2 32 мкг значительно снижала уровни каждого маркера в каждый интервал времени; что подразумевает защитную роль АРАС2 при 32 мкг.
Чтобы проанализировать нарушение функции почек и тубулоинтерстициальное поражение после почечной ишемии, сыворотку крови крыс собирали ежесуточно в течение 3 суток после реперфузии. Уровни (А) креатинина, (В) азота мочевины и (С) NGAL, биомаркера тубулоинтерстициального поражения, в сыворотке крови у крыс, предварительно в.в. обработанных 16 мкг (0,06 мг/кг) и 32 мкг (0,13 мг/кг) АРАС. Контрольные крысы получали в.в. разбавитель, представляющий собой физиологический раствор. n = 8/группа. **Р<0,01. Дозы гепарина определяли, используя UFH в качестве стандарта в Blyscan анализе сульфатированного гликозаминогликана;
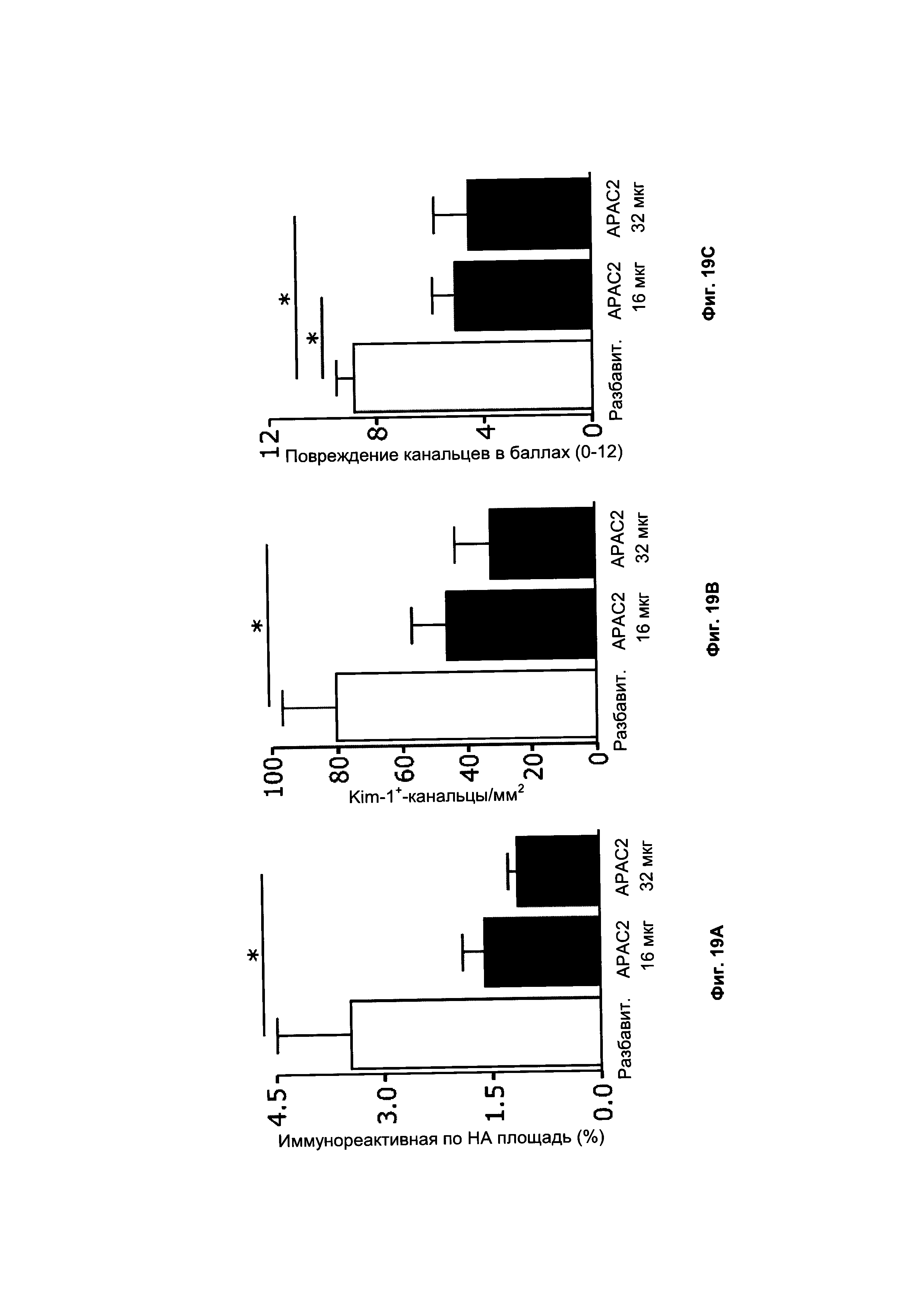
на Фиг. 19 показана активация врожденного иммунитета и гистопатология после 30-минутного билатерального почечного ишемически-реперфузионного повреждения. Заметные эффекты ишемически-реперфузионного повреждения после 30-минутного обратимого повреждения уменьшались путем применения или 16 или 32 мкг АРАС2 (партия 2.1, 11 Нер-цепей) в сравнении с контрольным разбавителем, представляющим собой физиологический раствор (в.в.). Почку исследовали в отношении А) лиганда врожденного иммунитета гиалуронана (НА), В) поражения канальцев с помощью маркера тубулоинтерстициального поражения Kim-1 (молекула-1 повреждения почек) и С) повреждения канальцев (уплощения, расширения, цилиндров и некроза) с использованием окрашивания гематоксилином и эозином (Н&Е).
Чтобы оценить активацию врожденного иммунитета и повреждение почек через 3 суток после реперфузии, поперечные срезы залитых парафином почек окрашивали для (А) лиганда врожденного иммунитета гиалуронана, (В) маркера тубулоинтерстициального поражения Kim-1 и (С) Н&Е для гистопатологического исследования крыс, предварительно в.в. обработанных 16 мкг (0,06 мг/кг) и 32 мкг (0,13 мг/кг) АРАС. (А) Положительную по гиалуронану площадь измеряли с помощью полученных на компьютере изображений. (С) С означает эпителиальные цилиндры; D означает расширение канальцев; острие стрелки означает эпителиальное уплощение; стрелка означает некроз эпителия. Контрольные крысы получали в.в. разбавитель, представляющий собой физиологический раствор. IgG контроли приведены во вставках. n = 8/группа. *Р<0,05. Дозы гепарина определяли, используя UFH в качестве стандарта в Blyscan анализе сульфатированного гликозаминогликана;
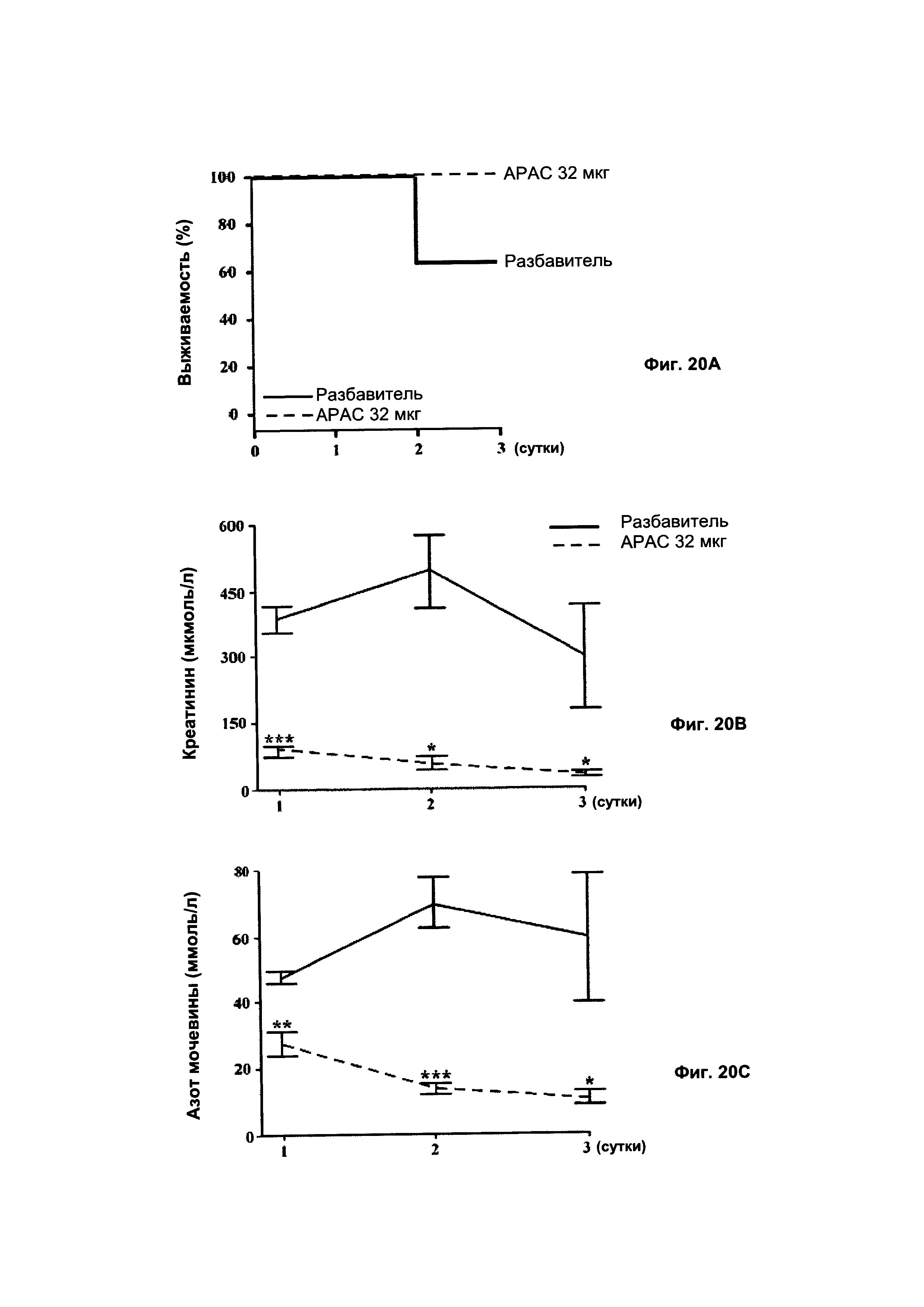
на Фиг. 20 показаны функционирование и общая выживаемость почек после тяжелого одночасового билатерального почечного ишемически-реперфузионного повреждения (IRI). Почки подвергали тяжелому IRI, пережимая обе почечные артерии на один час.Чтобы проанализировать постишемическую выживаемость и функционирование почек, сыворотку крови крыс собирали ежесуточно в течение 3 суток после реперфузии. Обработка 32 мкг АРАС (партия 2.1, 11 гепариновых цепей) способствовала сохранению ткани. (А) % выживаемости крыс в течение трехсуточного периода наблюдения, кроме того, уровни (В) креатинина и (С) азота мочевины в сыворотке крови у крыс, предварительно в.в. обработанных 32 мкг (0,13 мг/кг) АРАС, также демонстрировали положительные результаты; содержание креатинина и мочевины в сыворотке крови крыс снижалось, что предполагает сохранение функции почек. Контрольные крысы получали в.в. разбавитель, представляющий собой физиологический раствор. n = 8/группа. *Р<0,05; **Р<0,01; ***Р<0,001. Дозы гепарина определяли, используя UFH в качестве стандарта в GAG (гликозаминогликан) анализе.
На Фиг. 21 показано тромбиновое время (ТТ) в присутствии АРАС1 пятого поколения (партия 5.1, 4 Нер-цепи) при [С] Hep 1,0 и 2 мкг/мл и АРАС2 пятого поколения (партия 5.2, 8 Нер-цепей) при [С] Hep 2 мкг/мл в истощенной по антитромбину плазме крови. Дозы гепарина определяли, используя UFH в качестве стандарта в GAG анализе.
На Фиг. 22 показано активированное частичное тромбопластиновое время (АРТТ) в присутствии АРАС1 пятого поколения (партия 5.1, 4 Нер-цепи) при [С] Hep 4 и 5 мкг/мл и АРАС2 пятого поколения (партия 5.2, 8 Нер-цепей) и UFH при [С] Hep 4 мкг/мл в истощенной по антитромбину плазме крови. Дозы гепарина определяли, используя UFH в качестве стандарта в GAG анализе.
СПОСОБЫ
Конъюгирование
Цепи нефракционированного гепарина (Hep) конъюгировали с сывороточным альбумином человека (HSA) посредством дисульфидных мостиков, создаваемых с помощью двух альтернативных кросс-линкеров и реакционных путей, используя:
1) гетеро-бифункциональный кросс-линкер N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)пропионовой кислоты (SPDP). Для конъюгирования использовали свободные аминогруппы в Ser из Hep участка, взаимодействующего с линкером, и в Lys из HSA. Hep и HSA модифицировали в раздельных реакциях, получая сульфгидрильное (-SH) и пиридилдитиольное (-PDP) производные, соответственно. В заключительной реакции конъюгирования пиридилдитиольная группа HSA взаимодействовала с сульфгидрильной группой Hep с образованием в результате соединенного дисульфидными связями комплекса и высвобождением пиридин-2-тиона;
2) гомо-бифункциональный кросс-линкер ди(N-гидроксисукцинимидный (NHS) эфир) 3,3'-дитиодипропионовой кислоты (DTSP). Для конъюгирования использовали свободные аминогруппы в Ser из Hep участка, взаимодействующего с линкером, и в Lys из HSA. Сначала Hep модифицировали, получая N-гидроксисукцинимид-(NHS)-эфирное производное с высвобождением первой NHS-группы. В заключительной реакции конъюгирования Lys из HSA взаимодействовал с N-гидроксисукцинимид-(NHS)-эфирной группой из производного Hep с образованием в результате комплекса с расщепляемой дисульфидной связью в линкерном участке и высвобождением второй N-гидроксисукцинимидной группы.
Комплексы Hep-HSA очищали посредством хроматографии с гидрофобным взаимодействием (HIC), используя бутил-сефарозную среду (GE Healthcare, USA), или ультра/диафильтрации. В конце комплексы Hep-HSA элюировали в забуференный фосфатом физиологический раствор (PBS) с рН 7,4. Комплексы назвали АРАС- с добавлением индекса, обозначающего уровень конъюгирования Нер-цепей с HSA.
Общая формула для АРАС-комплексов, которые иллюстрируют настоящее изобретение, представляет собой:
(Hep-NH-CO-CH2-CH2-S-S-CH2-CH2-CO-NH)n-HSA,
где среднее число нефракционированных гепариновых цепей, присоединенных к HSA, обозначено как n.
Средний уровень конъюгирования (CL) Hep с HSA определяли, используя значения концентрации Hep и HSA и их средние молекулярные массы, с помощью следующих уравнений:
число молей Hep = [С] Hep / среднее значение MW Hep,
число молей HSA = [С] HSA / MW HSA,
CL = число молей Hep / число молей HSA,
MW Hep = 15800,
MW HSA = 66472.
Среднее значение MW для Hep полимера соответствует информации, полученной от производителя гепарина. Значение MW HSA основано на ALBU_HUMAN, Р02768 от UniProtKB/Swiss-Prot, для изоформы 1 без сигнального пептида и пропептида.
АРАС-комплексы. См. Таблицу I.
АРАС1 имеет среднее значение CL, составляющее 4-6 моль Hep на 1 моль HSA.
АРАС2 имеет среднее значение CL, составляющее 8-16 моль Hep на 1 моль HSA.
В 2010 году было изготовлено первое поколение АРАС, то есть АРАС1, в относительно большом (1 г) масштабе со средним значением CL 6 моль Hep на 1 моль HSA (CL 6:1; партия 1.1). АРАС1 демонстрировал как антикоагулянтную, так и антитромбоцитарную эффективности in vitro. В двух разных моделях острого тромбоза на бабуинах он поддерживал проходимость сосудов и уменьшал как тромбоз, так и накопление фибрина относительно контроля, представлявшего собой нефракционированный гепарин (UFH), то есть гепарин, который не был связан с HSA. Кроме того, АРАС1, меченный радиоактивной меткой (64Cu), обладал пролонгированной локализацией в месте локального введения на только что созданном анастомозе у крыс по сравнению с контролем, то есть UFH (исследование в IPS Therapeutics (IPST), Canada).
В 2011 году было изготовлено второе поколение АРАС, названных АРАС2 (партия 2.1), обладающих почти двукратным средним значением CL (11:1) Hep относительно HSA по сравнению с АРАС1. АРАС2 по сравнению с АРАС1 был более эффективным в отношении ингибирования индуцированной коллагеном агрегации тромбоцитов в обогащенной тромбоцитами плазме (PRP) при той же концентрации гепарина. Используя модель анастомоза у крыс, 64Си-меченный АРАС2 вводили внутрь сосуда, и он поддавался обнаружению в течение в два раза более длительного промежутка времени по сравнению с UFH контролем (IPST, Canada).
В 2012 году было изготовлено третье поколение АРАС (на этот раз в виде нескольких партий от 3.1 до 3.6). Шесть разных АРАС-комплексов (с CL от 6:1 до 16:1) изготавливали в мелком масштабе (размеры партий примерно по 50 мг), чтобы исследовать воспроизводимость самой реакции конъюгирования (CR). Эти АРАС-комплексы назвали (CR1-6) в соответствии с порядком изготовления, так что такие названия не отражают конкретных значений CL для этих продуктов. Поскольку протокол изготовления корректировали для мелкомасштабного получения, конечные характеристики продуктов могли быть слегка модифицированы согласно проведенным изменениям. Интересно, что соединения с более высоким значением CL были в одинаковой степени более эффективными, чем соединения с более низким значением CL, в отношении ингибирования индуцированной коллагеном агрегации тромбоцитов в PRP. С другой стороны, антикоагулянтная эффективность оказалась более выраженной в случае более низких значений CL.
В 2013 году было изготовлено четвертое поколение АРАС: АРАС1 (CL 4:1; партия 4.1) и АРАС2 (CL 8:1; партия 4.2).
В 2014 году было изготовлено пятое поколение АРАС: АРАС1 (CL 4:1; партия 5.1) и АРАС2 (CL 8:1; партия 5.2). Анализ партий 2014 года продолжается.
Количественное определение
Определение CL для АРАС-продуктов было трудоемким из-за природы конъюгированных молекул, то есть наличия как белка HSA, так и высокосульфатированных гепариновых группировок. Концентрацию HSA определяли с помощью анализа белка с использованием бицинхониевой кислоты (ВСА) в соответствии с инструкциями производителя (Pierce Biotechnology, USA). В 2013 году также было предпринято непосредственное УФ-измерение при 280 нм для проверки ВСА анализа, поскольку белок в ВСА анализе, по-видимо, был завышенным. Hep (гепарин от Leo, Leo Pharma, Denmark) определяли с помощью Blyscan анализа сульфатированного гликозаминогликана в соответствии с инструкциями производителя (Biocolor Ltd., UK), то есть Blyscan-анализа.
В 2010 и 2012 годах Hep анализировали относительно гликозаминогликанового (GAG) стандарта (хондроитин-4-сульфата из трахеи быка). С этим GAG стандартом концентрация Hep обычно была завышенной. Поэтому в 2013 году в Blyscan анализ в качестве нового стандарта включили исходный гепарин. В последующих анализах для более тщательного выполнения и с целью сравнения использовали как GAG, так и гепарин. Определение CL зависело от конкретного стандарта, использованного в гепариновом анализе (Таблица I), а также от анализа HSA. Тем не менее, во всех исследованиях, в которых сравнивали разные АРАС и контрольный UFH, концентрации Hep определяли с помощью одного и того же анализа с использованием любого стандарта из GAG или (в последнее время) Hep (анализ сульфатированного гликозаминогликана, набор для анализа Blyscan, Biocolor Ltd., UK).
Кратко, тестируемые образцы, подлежащие количественному определению, добавляли в микроцентрифужные пробирки, и объем доводили до 100 мкл, используя воду. При выполнении каждого анализа помимо холостого реагента (0 мкг; вода или PBS) также тестировали сульфатированный GAG стандарт из набора для анализа Blyscan или известный гепариновый стандарт в определенном диапазоне концентраций. Анализ начинали, добавляя 1,0 мл реагента-красителя Blyscan (1,9-диметил-метиленового синего в неорганическом буфере) и перемешивали в течение по меньшей мере 30 мин. Цвет содержимого пробирок с сульфатированным гепарином становился пурпурным/розовым. Полученный комплекс GAG-краситель отделяли от несвязанного красителя путем центрифугирования (больше 10000 × g в течение 10 минут). Супернатанты отбрасывали, добавляли 1,0 мл реагента Blyscan для диссоциации и перемешивали на вортексе. Затем полученный раствор анализировали с использованием спектофотометра при 656 нм. Стандарты, наряду с холостым реагентом, применяли для построения калибровочной кривой, которую использовали для определения концентрации гепарина. Значения оптической плотности находились в диапазоне от 0,05 до 1,5 единиц, в противном случае образцы повторно растворяли или разбавляли, соответственно.
Молекулярные массы
Определение молекулярных масс (MW) для АРАС еще не завершено, и молярность растворов можно указать только приблизительно. Исследования с использованием обычной гель-проникающей хроматографии (SEC) и метода, сочетающего SEC высокого давления и трехдетекторный модуль (TDA; с рефрактометром, вискозиметром и детекторами лево- и право-углового светорассеяния), указывают, ориентировочно, на двукратное увеличение MW между АРАС 1 (партия 1.1) и АРАС2 (партия 2.1).
Оценка АРАС функции in vitro
Материалы и методы
Процедура забора крови
Использовали кровь от здоровых доноров, которые не принимали никаких лекарственных средств в течение по меньшей мере 6-7 суток, предшествующих сбору образцов. Образцы собирали после ночного голодания посредством венопункции из находящейся спереди от локтевого сустава вены в стандартные вакумируемые пробирки для забора крови (0,109 М цитрат натрия, Vacuette 455322, Greiner Bio-one). Образец считался пригодным в течение 4 часов после забора крови.
Обогащенная тромбоцитами плазма и обедненная тромбоцитами плазма
Кровь центрифугировали при 180 × g в течение 12 мин при 22 градусах по шкале Цельсия для отделения обогащенной тромбоцитами плазмы (PRP). Для сбора обедненной тромбоцитами плазмы (РРР) оставшуюся кровь снова центрифугировали при 1500 × g в течение 10 мин при 22 градусах по шкале Цельсия. Количество тромбоцитов (PLT) в PRP измеряли с помощью устройства для подсчета клеток Sysmex КХ-21 (Sysmex Corporation, Japan) и, используя РРР, доводили до значения 150*106±10% PLT/мл для анализа с применением калиброванной автоматизированной тромбограммы (CAT) и до значения 300*106±10% PLT/мл для агонист-индуцированной PRP агрегации. Для получения внутрилабораторного пула плазмы крови, собирали кровь от 11 доноров и центрифугировали при 2000 × g в течение 10 мин. РРР повторно центрифугировали при 10000 × g в течение 10 мин для удаления всех оставшихся тромбоцитов. Образцы плазмы крови объединяли, хранили в виде аликвот и замораживали до применения. Для CAT плазму дважды центрифугировали.
Образцы плазмы крови
Антикоагулянтную эффективность АРАС-комплексов и UFH контроля тестировали при одинаковых концентрациях гепарина (Blyscan с GAG в качестве стандарта). Использовали три разные плазмы крови: лабораторную контрольную плазму, то есть стандартную человеческую плазму (SHP, Siemens, Germany), обработанную растворителем/детергентом (S/D) плазму (Octaplas, Octapharma, Switzerland) и внутрилабораторную объединенную плазму (РР, от 11 здоровых доноров). В заключение, в качестве примеров показаны результаты, полученные для внутрилабораторной объединенной плазмы.
Истощенную по антитромбину (AT) плазму (American Diagnostica, USA) использовали для изучения АТ-независимой антикоагулянтной эффективности АРАС и, в анализе АРТТ, UFH.
Коагуляция
Гепарин связывает комплекс антитромбина и тромбин (На) и усиливает способность антитромбина инактивировать тромбин и фактор коагуляции Ха и некоторые другие факторы коагуляции, расположенные выше во внутреннем и внешнем путях коагуляции. В то же время, низкомолекулярные гепарины (LMWH) связываются только с антитромбином, ингибируя почти только фактор Ха. Направленное воздействие на тромбин требует цепей большей длины, по меньшей мере последовательностей из 18 пентасахаридных звеньев в гепарине. Антикоагулянтную эффективность гепарин-содержащих образцов плазмы крови обычно тестируют по времени образования фибринового сгустка в РРР, не содержащей тромбоцитов и других клеток крови. Гепарин является высокосульфатированным и обладает большим отрицательным зарядом. Таким образом, неспецифическое связывание с циркулирующими белками плазмы крови или эндотелием сосудов может индуцировать другие взаимодействия, не исследованные в данной заявке.
Тромбиновое время
В анализе тромбинового времени (ТТ) (реагент Тромбин ВС, Siemens, Germany) разбавленную (40 мкл плазмы и 100 мкл Тромбина ВС) цитратную плазму дополняют стандартизированной большой дозой тромбина (0,8 международных единиц (МЕ)/мл) и измеряют время превращения фибриногена в фибриновый сгусток с помощью коагулометра (КС-4, Sigma-Amelung, USA).
Активированное частичное тромбопластиновое время
В анализе активированного частичного тромбопластинового времени (АРТТ, реагент Dade Actin FSL, Siemens, USA) образование сгустка индуцируют факторами коагуляции внутреннего пути (I, II, V, VIII, IX, X, XI, XII), представляющем собой контактную активацию, и путем рекальцификации плазмы. В этом эксперименте 50 мкл плазмы крови разбавляют 50 мкл Actin FSL (фосфолипиды сои и головного мозга кролика в 100 мкМ эллаговой кислоте) и рекальцифицируют, используя 50 мкл 25 мМ CaCl2. В присутствии достаточного количества гепарина начинается дозозависимое пролонгирование ТТ и АРТТ. В условиях клиники мониторинг степени антикоагуляции под действием введенного внутривенно гепарина осуществляют главным образом по АРТТ. Целевым для достижения терапевтического уровня антикоагуляции является пролонгирование от 1,5 до 3 раз по сравнению с контрольным образцом. Анализ АРТТ зависит от используемых реагента и коагулометра, но базовый диапазон обычно составляет 20-40 с.
Калиброванная автоматизированная тромбограмма
В экспериментах для оценки состояний, ассоциированных с риском кровотечения или тромбоза, используют генерацию тромбина (Hemker et al., Pathophysiol. Hemost. Thromb., 2002, 32: 249-53). Несмотря на то, что тромбин образуется в течение всего процесса коагуляции, для образования сгустка фибрина in vitro необходимо только от 2 до 5% от общего количества тромбина. Ввиду этого, обычные времена коагуляции (то есть ТТ и АРТТ) не учитывают большую часть тромбиновой активности в процессе коагуляции, которую можно зафиксировать методом Хемкера с использованием калиброванной автоматизированной тромбограммы (CAT). CAT позволяет оценить инициируемую тканевым фактором генерацию тромбина, за которой наблюдают путем детектирования расщепления флуорогенного тромбинового субстрата и параллельного сравнения образца с контролем, обладающим известной тромбиновой активностью. В процессе генерации тромбина на измеряемые характеристики тромбограммы оказывают влияние как анти-, так и прокоагулянтные факторы. Лаг-период характеризует время образования фибринового сгустка, отражая соотношение РТ (инициируется тканевым фактором (TF)) / АРТТ (инициируется эллаговой кислотой). Пик кривой показывает максимальную скорость общей генерации тромбина и время ее достижения (ttпика). Посредством площади под кривой, то есть эндогенного тромбинового потенциала (ЕТР), измеряют общее количество образовавшегося тромбина. В случае CAT генерацию тромбина можно оценить или в цитратной РРР, или в PRP. Тромбин активируется в рекальцифицированной плазме путем инициирования и дополнения образцов TF (5 пМ) и фосфолипидами (PPL) (4 мкМ) (РРР реагент, Stago, France) или TF (1 пМ, PRP реагент, Stago, France) для РРР и PRP, соответственно. С использованием CAT можно обнаружить дефицит или гиперактивность факторов свертывания крови, а в случае связанных с кровотечением расстройств определить возможность использования антикоагулянтов (подобных гепаринам или прямым ингибиторам тромбина) или заместительных терапий.
Агрегация тромбоцитов в PRP
Агрегацию тромбоцитов изучали турбидиметрическим методом Борна (J. Physiol., 1962, 162: 67-68) с использованием агрегометра Aggram (Helena Laboratories Inc., USA) при 37°C со скоростью вращения мешалки 1000 оборотов/мин. В качестве основного агониста использовали коллаген (фибриллы I типа, Kollagenreagens-Horm, Nycomed Pharma, Austria или коллаген от Chronolog, Chronolog Ltd., USA) в конечной концентрации 0,5 мкг/мл. Перед индуцированием агрегации тромбоцитов тестируемые вещества инкубировали в течение 2 мин с PRP при 22°С и в течение 1 мин при 37°С. По возможности измеряли максимальную агрегацию через 5 мин (изменение пропускания света в %), наклон и площадь под кривой.
Во всех анализах базовое значение измеряли, используя разбавитель (PBS, рН 7,4) в объеме, эквивалентном тестируемым веществам. Авторы изобретения также изучали другие агонисты; аденозиндифосфат (ADP), ристоцетин и родственный коллагену пептид (CRP). АРАС не ингибируют ADP-индуцированную агрегацию тромбоцитов, тогда как при высоких концентрациях имеет место ингибирование ристоцетин-индуцированной агрегации (данные не показаны). Антитромбоцитарная активность АРАС в отношении коллагена является наиболее заметным признаком в тестах агрегации тромбоцитов.
Модели острого тромбоза на бабуинах
Антитромботическую эффективность АРАС1 (партия 1.1) и UFH в сравнении с разбавителем изучали на двух общепринятых моделях острого тромбоза на анестезированных бабуинах. В модифицированной модели по Фолтсу создавали экстракорпоральный артериовенозный шунт (АВ-шунт) между бедренной артерией и веной. Ток крови контролировали с помощью внешнего зажима, размещенного на артерии, а мониторинг тока осуществляли с помощью датчика. Повреждение артерии выполняли снаружи, пережимая ее два раза на 10 секунд с помощью иглодержателя Martin (Hegar-Baumgartner ТС Gold, 14 см). Все боковые ветви вблизи от места повреждения лигировали. Шунт прокалывали иглой (26G) на расстоянии 1 см проксимально к месту доступа в сосуд для болюсной инъекции (4 мг/мл) либо АРАС1, либо UFH, либо забуференного фосфатом физиологического раствора (PBS). Место повреждения обрабатывали в течение 3 мин исследуемым веществом с последующим воздействием на него тока крови. Сразу после восстановления базового тока крови в место повреждения помещали внешний зажим, и поток снижали до 30-100 мл/мин (стеноз от 90 до 30%). Накопление тромбоцитов в стенозированной артерии детектировали по снижению тока крови и регистрировали в виде циклических уменьшений потока (CFR). При 5 мл/мин артерия считалась закупоренной, и тромб смещали путем разжатия зажима и промывки забуференным фосфатом физиологическим раствором (PBS). После восстановления базового тока крови снова применяли стенозирование и повторяли эксперимент.
Во второй модели на бабуинах индуцировали тромбоз, помещая покрытые коллагеном трансплантаты из PTFE (политетрафторэтилен) (2 см, просвет 4 мм) в выведенный наружу артериовенозный шунт. Тромбогенную коллагеновую поверхность обрабатывали в течение 10 мин АРАС или UFH (в обоих случаях в концентрации 4 мг/мл). Инициировали ток крови (100 мл/мин; 265-1) и осуществляли количественное определение отложения меченных индием-111 тромбоцитов и фибрина (накопления меченного йодом-125 фибриногена) за 60 мин.
Удерживание в месте повреждения
Эффективность, распределение и удерживание в месте введенных локально64Cu-меченного АРАС или UFH (3 мг/кг) оценивали посредством РЕТ(позитронно-эмиссионная томография)-визуализации анастомозов частично лигированных (2 незатянутых шва на расстоянии 1 см) бедренных артерий у крыс в течение 50 ч.
Модель ишемически-реперфузионного повреждения и острого почечного повреждения
Животные. Использовали специальных беспатогенных аутбредных самцов крыс Sprague Dawley (SD) (Harlan Laboratories; Horst, Nederland) массой 235-250 г. Крысы получали обычный корм для крыс и водопроводную воду без ограничений, и их содержали в условиях 12-часового цикла свет/темнота. За животными ухаживали в соответствии с Руководством по содержанию и использованию лабораторных животных, опубликованным Национальными институтами здравоохранения и Ведомством по уходу за животными и их использованию (National Institutes of Health and Office of Animal Care and Use) (National Research Council, Washington DC, National Academy Press, 1996).
Количества клеток крови и профиль коагуляции. Крысам SD вводили (n = 8/группа) в.в. АРАС2 (партия 2.1; 16 мкг, 32 мкг или 80 мкг) либо UFH (32 мкг) (инфузионный раствор 5000 МЕ/мл; 200 МЕ/мг; Leo Pharma, Denmark), разбавленные с помощью PBS (10 мМ фосфат натрия, 137 мМ хлорид натрия, 2,7 мМ хлорид калия при рН 7,4) до подходящей концентрации. Контрольные крысы получали в.в. разбавитель, представляющий собой физиологический раствор. Через 10 минут крыс умерщвляли для определения количеств клеток крови и анализа профиля коагуляции. Первый образец крови отбирали в 2 мл шприц, предварительно наполненный антикоагулянтом - 3,8%-ным цитратом натрия, и помещали в 3 мл полипропиленовые пробирки для образцов. Второй образец отбирали сразу после этого в другой 2 мл пустой шприц для отбора сыворотки крови крыс. Образцы обрабатывали по отдельности для определения количества клеток крови, анализа РРР, плазмы, а также сыворотки крови. Количества клеток крови определяли в образцах цитратной крови с помощью устройства для подсчета клеток Sysmex КХ-21. Для получения РРР кровь центрифугировали при 1200 × g в течение 15 мин (22°С) с отделением лейкоцитов и эритроцитов. Соблюдали осторожность, чтобы не нарушить лейкоцитную пленку при переносе РРР с помощью пипетки в новую пробирку. РРР центрифугировали второй раз при 16100 × g в течение 5 мин, после чего РРР собирали в новую пробирку. Если не использовали незамедлительно, то РРР хранили при -40°С.
Модель с пережатием почечной артерии. В зависимости от используемой в исследовании модели крысы SD (n = 8/группа) получали за 10 мин до или через 10 мин после начала теплой ишемии в.в. либо АРАС2 (партия 2.1; 16 мкг, 32 мкг или 80 мкг), либо UFH (32 мкг) (инфузионный раствор 5000 МЕ/мл, 200 мг/МЕ), разбавленные с помощью PBS до подходящей концентрации. Контрольные крысы получали в.в. разбавитель, представляющий собой физиологический раствор. Крыс анестезировали путем ингаляции изофлурана, и выполняли срединный разрез брюшной стенки. Обе почечные артерии пережимали на 30 или 60 мин в зависимости от используемой в исследовании модели. После удаления зажима почки проверяли на предмет восстановления тока крови и брюшную полость закрывали. Крысам вводили 1 мл PBS и 0,1 мл бупренорфина (темгезик; 0,3 мг/мл, Schering-Plough, Kenilworth, NJ) для поддержания послеоперационного баланса жидкости и обезболивания, соответственно.
Оценка почечной функции и острого почечного повреждения. Для оценки почечной функции и почечного повреждения отбирали образцы крови крыс из хвостовой вены под анестезией на 1-е, 2-е и 3-й сутки после повреждения почек. Сыворотку замораживали при -20°С до проведения дальнейшего анализа в отношении показателей креатинина и азота мочевины в отделе клинической химии HUSLAB, госпиталь университета Хельсинки, Хельсинки, Финляндия. В качестве биомаркера острого почечного повреждения использовали липокалин, ассоциированный с желатиназой нейтрофилов (NGAL) крысы. Уровни NGAL в сыворотке крови оценивали посредством ELISA (иммуноферментный твердофазный анализ), используя мышиное моноклональное антитело к NGAL (ABS 039-08 от BioPorto Diagnostics A/S, Gentofte, Denmark) через 3 суток после билатерального пережатия почечной артерии.
Иммуногистохимия. Для иммуногистохимического анализа на стеклянных пластинках готовили залитые парафином или криостатные поперечные срезы толщиной 4 мм и окрашивали, используя метод с применением АВС-пероксидазы (комплекса авидина и биотинилированной пероксидазы) (набор для ABC Vectastain Elite, Vector Laboratories). Результаты взаимодействия выявляли с помощью 3-амино-9-этилкарбазола (АЕС, Vector Laboratories). Для иммунного окрашивания образцы блокировали путем инкубирования в течение 20 мин с 1,5%-ной нормальной сывороткой крови козы / PBS, рН 7,40, после чего инкубировали с первичными антителами в оптимальном разведении при комнатной температуре в течение 30 мин (моноклональные антитела) или при +4°С в течение 15 часов (поликлональные антитела). Первичные антитела разбавляли 0,1%-ным бычьим сывороточным альбумином / PBS. После промывки в PBS эндогенную пероксидазную активность блокировали, инкубируя в течение 10 мин с 0,1%-ным раствором перекиси водорода (30%-ной) в PBS. После промежуточных промывок в PBS образцы далее инкубировали с биотинилированными антителами в PBS буфере при кт (комнатная температура) в течение 30 мин; детектировали с использованием комплекса авидин-биотинилированный хрен в PBS буфере при кт в течение 30 мин и результаты взаимодействия выявляли с помощью АЕС (Vector Laboratories). Проводили контрастное окрашивание срезов гемалюмом Майера. Для определения плотности положительных клеток подсчет проводили с использованием 40-кратного увеличения для четырех случайных полей каждого квандранта поперечного среза, и показания приведены в виде общего количества на 1 мм2. Использовали следующие антитела и разведения: CD8+ Т-клетки (5 мг/мл, 22071D) от BD Pharmingen, San Diego, СА и KIM-1 (8 мг/мл, AF3689) от R&D Systems, Abingdon, UK.
Проводили окрашивание парафиновых срезов по гиалуронану с использованием специального биотинилированного гиалуронан-связывающего комплекса (bHABC), содержащего биотинилированный G1-домен аггрекана и соединительный белок, полученный из суставного хряща быка, с использованием авидин-биотин-пероксидазной детекции (Vector Laboratories; разведение 1:200) с 0,05% 3,3-диаминобензидина (DAB) (Sigma Chemical Co., St. Louis, МО), как описано. Специфичность окрашивания контролировали, проводя обработку перед окрашиванием нескольких срезов гиалуронидазой из стрептомицетов в присутствии ингибиторов протеаз или осуществляя преинкубирование bHABP(биотинилированный гиалуронан-связывающий белок)-зонда с олигосахаридами гиалуронана. Для каждого образца делали по десять фотографий с 40-кратным увеличением и положительную по гиалуронану площадь измеряли с помощью полученных на компьютере изображений (Zeiss Axionvision 4.4, Carl Zeiss International). Среднюю для этих 10 измерений площадь использовали в статистических анализах. Все анализы проводились слепым методом двумя независимыми наблюдателями.
Гистология почек. Полуколичественную оценку выявляемого в гистологическом анализе повреждения осуществляли следующим образом: залитые парафином образцы почек толщиной 2 мм окрашивали гематоксилином и эозином. Нижеследующие параметры повреждения канальцев (уплощение, расширение, цилиндры и некроз) оценивали по степени тяжести по шкале от 0 до 3 баллов, как приведено ниже: балл 0 соответствует отсутствию повреждения, балл 1 соответствует легкому повреждению, балл 2 соответствует умеренному повреждению, балл 3 соответствует тяжелому повреждению, и представляли в виде суммарной балльной оценки повреждения канальцев (0-12).
Статистика. Все данные представляют собой средние значения +/- SEM (стандартная ошибка среднего), и их анализировали с использованием SPSS (пакет программ обработки статистических данных общественных наук) для Windows, версия 15.0 (SPSS Inc., Chicago, IL). Для сравнения двух групп использовали непараметрический U-критерий Манна-Уитни и параметрический t-критерий Стьюдента. Для сравнения нескольких групп использовали непараметрический критерий Краскела-Уоллиса с апостериорным критерием Данна и параметрический дисперсионный анализ (ANOVA) с коррекцией Даннета. Для выживаемости использовали анализ Каплана-Мейера с логарифмическим ранговым критерием (Мантела-Кокса). Значение Р<0,05 рассматривали как статистически значимое.
Результаты
Тромбиновое время
Пример измерения ТТ в объединенной плазме в присутствии АРАС-комплексов (CL от 6:1 до 16:1) производства 2010-2012 г.г. показан на Фиг. 1, а для АРАС1 (партия 4.1) и АРАС2 (партия 4.2) на Фиг. 2.
Фиг. 1
В концентрации 1 мкг/мл все АРАС-комплексы пролонгировали ТТ по меньшей мере в 1,5 раза, в то время как UFH пролонгировал ТТ в 1,3 раза по сравнению с базовым значением (30 с). АРАС1 (партия 1.1, 4 Нер-цепи) обеспечивал достижение максимального измеренного ТТ (300 с), в то время как АРАС2 (партия 2.1, 11 Нер-цепей) пролонгировал ТТ в 2,5 раза по сравнению с базовым значением (Фиг. 1). APAC-CL6 (6 Нер-цепей) пролонгировал ТТ в 5,5 раза, APAC-CL8, партия 3.2 (8 Нер-цепей) в 5,8 раза, партия 3.1 (8 Нер-цепей) в 4,3 раза, APAC-CL10 (10 Нер-цепей) в 2,4 раза, APAC-CL13 (13 Нер-цепей) в 2,5 раза и APAC-CL16 (16 Нер-цепей) в 3,7 раза по сравнению с базовым значением (Фиг. 1.). В концентрации 1,5 мкг/мл все АРАС и UFH обеспечивали достижение максимального измеренного времени.
Фиг. 2
АРАС1 (партия 4.1, 4 Нер-цепи) и АРАС2 (партия 4.2, 8 Нер-цепей) пролонгировали ТТ в 2,1-2,4 раза, соответственно (Фиг. 2). В концентрации 1,25 мкг/мл АРАС1 (партия 4.1, 4 Нер-цепи) обеспечивал достижение максимального измеренного ТТ (300 с), в то время как АРАС2 (партия 4.2, 8 Нер-цепей) пролонгировал ТТ в 3,2 раза (Фиг. 2.).
Активированное частичное тромбопластиновое время
Фиг. 3
Пример измерения АРТТ в объединенной плазме в присутствии АРАС1 (партия 1.1, 4 Нер-цепи), АРАС2 (партия 2.1, 11 Нер-цепей) и АРАС с CL от 6:1 до 16:1 из партий от 3.1 до 3.5 (8, 8, 10, 13, 16 Нер-цепей) показан на Фиг. 3.
По сравнению с базовым значением АРТТ (30 с) в концентрации 1 мкг/мл АРАС1 (партия 1.1) пролонгировал АРТТ в 1,4 раза, в то время как другие АРАС и UFH пролонгировали АРТТ в 1,1-1,2 раза. В концентрации 2 мкг/мл АРАС1 (партия 1.1) пролонгировал АРТТ в 2,0 раза, в то время как другие АРАС и UFH демонстрировали меньшее, 1,4-1,6-кратное, пролонгирование. По сравнению с базовым значением в концентрации 3 мкг/мл АРАС1 (партия 1.1, 4 Нер-цепи) пролонгировал АРТТ в 2,6 раза, APAC-CL8 (партии 3.1 и 3.2, 8 Нер-цепей) в 2,1 раза, APAC-CL10 (партия 3.3, 10 Нер-цепей) в 2,0 раза, АРАС2 (партия 2.1, 11 Нер-цепей) в 1,9 раза, APAC-CL13 (партия 3.4, 13 Нер-цепей), APAC-CL16 (партия 3.5, 16 Нер-цепей) и UFH все в 1,8 раза. В концентрации 6 мкг/мл АРАС1 (партия 1.1, 4 Нер-цепи) пролонгировал АРТТ в 6,7 раза, APAC-CL8 (партии 3.1 и 3.2, 8 Нер-цепей) в 5,4-4,7 раза, APAC-CL10 (партия 3.3, 10 Нер-цепей) в 4,5 раза, АРАС2 (партия 2.1, 11 Нер-цепей) в 4 раза, APAC-CL13 (партия 3.4, 13 Нер-цепей) в 3,8 раза, APAC-CL16 (партия 3.5, 16 Нер-цепей) в 3,6 раза и UFH в 3,1 раза. В концентрации 8 мкг/мл АРАС1 (партия 1.1, 4 Нер-цепи) пролонгировал АРТТ в 9,8 раза, APAC-CL8 (партии 3.1 и 3.2, 8 Нер-цепей) в 9,3-8,7 раза, APAC-CL10 (партия 3.3, 10 Нер-цепей) в 7,4 раза, APAC-CL13 (партия 3.4, 13 Нер-цепей) в 6,0 раза, АРАС2 (партия 2.1, 11 Нер-цепей) в 5,4 раза, APAC-CL16 (партия 3.5, 16 Нер-цепей) в 5,8 раза и UFH в 4,2 раза, по меньшей мере. При самой высокой использованной концентрации разница в АРТТ между АРАС1 (партия 1.1, 4 Нер-цепи) и APAC-CL10 (партия 3.3, 10 Нер-цепей) составила 25%, а между АРАС2 (партия 2.1, 11 Нер-цепей) 45%. В целом, наибольшее пролонгирование АРТТ по сравнению с базовым значением обычно отмечали в присутствии АРАС первого и второго поколения (партия 1.1 и 2.1, 4 и 11 Нер-цепей) с самыми низкими значениями CL.
Четвертое поколение АРАС (АРАС1 в сравнении с АРАС2) отличалось от предыдущих партий тем, что пролонгирование АРТТ было полностью аналогичным до использования более высокой (выше 6 мкг/мл) дозы Hep. Опять же, для антикоагуляции было выгодно более низкое связывание (CL) гепарина. В концентрации 1 мкг/мл АРАС1 (партия 4.1, 4 Нер-цепи) и АРАС2 (партия 4.2, 8 Нер-цепей) оба пролонгировали АРТТ в 1,2 раза по сравнению с базовым значением (29 с). В концентрации 2 мкг/мл АРАС1 (партия 4.1) и АРАС2 (партия 4.2) пролонгировали АРТТ схожим образом, в 1,4 и 1,3 раза, соответственно. В концентрации 3 мкг/мл АРАС1 (партия 4.1) и АРАС2 (партия 4.2) опять пролонгировали АРТТ схожим образом, в 1,8 и 1,7 раза, соответственно. В концентрации 6 мкг/мл АРАС1 (партия 4.1) и АРАС2 (партия 4.2) пролонгировали АРТТ в 3,9 и 3,4 раза, соответственно. В концентрации 8 мкг/мл АРАС1 (партия 4.1) и АРАС2 (партия 4.2) пролонгировали АРТТ в 7,5 и 6,0 раза, соответственно. При самой высокой использованной концентрации разница в АРТТ между АРАС1 (партия 4.1) и АРАС2 (партия 4.2) составила 21%.
Фиг. 4
Оцениваемое по АРТТ антикоагулянтное действие АРАС с разными уровнями связывания гепарина (CL) показано на Фиг. 4.
Фиг. 5
АРТТ в присутствии АРАС1 четвертого поколения (партия 4.1, 4 Нер-цепи) и АРАС2 четвертого поколения (партия 4.2, 8 Нер-цепей) показано на Фиг. 5.
Калиброванная автоматизированная тромбограмма (CAT) в РРР
Фиг. 6-9
На CAT, для снятия которой проводили инициацию тканевым фактором (5 пМ), активатором внешнего пути, показано антикоагулянтное действие в присутствии АРАС при более низких концентрациях, чем те, которые необходимы для пролонгирования АРТТ. При низкой концентрации гепарина в диапазоне 0,25-1,5 мкг/мл АРАС уменьшали величину пика и ЕТР и пролонгировали ttпика дозозависимым образом в случае всех трех разных протестированных образцов плазмы (РР, SHP и Octaplas). Тромбограммы, отображающие влияние АРАС1 первого поколения (партия 1.1, 4 Нер-цепи), АРАС2 второго поколения (партия 2.1, 11 Нер-цепей), UFH и APAC-CL (от 6 до 16) третьего поколения в объединенной плазме, показаны в качестве примеров на Фиг. 7-12. Данные о лаг-периоде (с), ЕТР (нМ), пике (нМ) и ttпика (с) для АРАС1 (партия 1.1, 4 Нер-цепи) и АРАС2 (партия 2.1, 11 Нер-цепей) суммированы в Таблице II, а для АРАС от APAC-CL6 до APAC-CL16 в Таблице III. Показано относительное изменение (%) этих величин по сравнению с разбавителем в качестве контроля. Для случая полного ингибирования генерации тромбина значения лаг-периода (с), ЕТР (нМ), пик (нМ), ttпика (с) приняты за 0.
При сравнении с UFH очевидно, что значения лаг-периода и ttпика были пролонгированными посредством всех АРАС во всех протестированных концентрациях. ЕТР снижался под действием АРАС по сравнению с UFH во всех концентрациях, за исключением APAC-CL6 (партия 3.6, 6 Нер-цепей) в концентрации 1,0 мкг/мл, где ЕТР был похож на ЕТР для UFH. Величина пика снижалась под действием АРАС по сравнению с UFH во всех концентрациях, за исключением АРАС2 (партия 2.1, 11 Нер-цепей) в концентрации 1,0 мкг/мл, где величина пика была похожа на величину для UFH. Генерация тромбина полностью прекращалась при использовании АРАС в концентрации 1,5 мкг/мл, за исключением APAC-CL6 (партия 3.6, 6 Нер-цепей), который демонстрировал величину пика, равную 15% от базового значения. В целом, АРАС1 (партия 1.1, 4 Нер-цепи) и АРАС2 (партия 2.1, 11 Нер-цепей) обладали относительно близким ингибированием генерации тромбина. Из третьего поколения АРАС с CL 13:1 и 16:1 были более мощными ингибиторами, чем АРАС с CL меньше 10.
Калиброванная автоматизированная тромбограмма в PRP
Фиг. 10-12
На этих фигурах представлены результаты исследования тромбоцит-зависимой генерации тромбина, то есть прокоагулянтной активности (для оценки риска кровотечения или тромбоза), и показано, что АРАС ингибируют генерацию тромбина.
В присутствии тромбоцитов инициирующий агент TF использовали в низкой концентрации (1 пМ), при этом генерация тромбина также была меньше, чем в случае CAT в плазме с добавленными PPL. При низкой концентрации Hep в диапазоне 0,25-1,5 мкг/мл АРАС уменьшали величину пика и ЕТР и пролонгировали ttпика дозозависимым образом в PRP от протестированных индивидуальных здоровых доноров.
Тромбограммы, отображающие влияние концентрации UFH на Фиг. 10, АРАС1 первого поколения (партия 1.1, 4 Нер-цепи), АРАС2 второго поколения (партия 2.1, 11 Нер-цепей) на Фиг. 11 и АРАС1 (партия 4.1, 4 Нер-цепи) и АРАС2 (партия 4.2, 8 Нер-цепей) четвертого поколения на Фиг. 12, показаны в качестве примеров использования отдельных концентраций, отражающих результат исследований. В концентрации 0,5 мкг/мл АРАС были по меньшей мере в два раза более мощными ингибиторами генерации тромбина, чем UFH. АРАС с CL 8:1 и 11:1 были более сильными ингибиторами тромбоцитарной/прокоагулянтной активности и уменьшали величину пика и ttпика в большей степени, чем АРАС с CL 6:1. В концентрации 1,0 мкг/мл разница в эффективности по отношению к UFH была еще более явно выраженной для всех АРАС.
В итоге, генерация тромбина была задержана, а активность тромбоцитов явно ингибирована с помощью АРАС по сравнению с UFH. Чем большее количество гепариновых цепей было конъюгировано, тем сильнее было ингибирование.
Индуцированная коллагеном агрегация тромбоцитов
Фиг. 13-14. Репрезентативные кривые агрегации для доноров, обладающих высокой (50% доноров), умеренной (30% доноров) и низкой восприимчивостью к АРАС (Фиг. 13), и объединенный анализ зависимости доза-ответ для АРАС1 в случае респондера с высокой и умеренной восприимчивостью (Фиг. 14).
Фиг. 13. АРАС от APAC-CL6 до -CL16 (при [С] Hep 1, 3, 10, 30 и 90 мкг/мл) тестировали в PRP с цитратным антикоагулянтом от 3 независимых доноров, каждый из которых обладал разной восприимчивостью (определенной как % ингибирования при концентрации гепарина 30 мкг/мл (общая ED50 (доза, терапевтически эффективная для 50% популяции)): респондеров с высокой, более 60%, низкой, менее 40%, и умеренной, 40-60%, восприимчивостью к АРАС в отношении индуцированной коллагеном (колл.; 0,5 мкг/мл) агрегации тромбоцитов. Определяли результаты, касающиеся максимальной агрегации (в %) и наклона кривой (скорости агрегации) в течение 6 мин.
АРАС от APAC-CL6 до APAC-CL16 (8, 8, 10, 13, 16 и 6 Нер-цепей) и АРАС1 (партия 1.1, 4 Нер-цепи) снижали скорость и максимальную агрегацию тромбоцитов, в то время как UFH не оказывал такого действия. АРАС с более высоким связыванием CL (11-16): 1 были более мощными ингибиторами, чем молекулы с более низким CL (6-10):1. Результаты в случае концентраций 1, 10 и 30 мкг/мл для респондера с низкой восприимчивостью представлены на Фиг. 13 для АРАС от APAC-CL6 до APAC-CL16. Кривые агрегации (связанные со скоростью агрегации) демонстрировали убывание дозозависимым образом в присутствии всех вариантов АРАС, хотя влияние на максимальную агрегацию было менее заметным. APAC-CL16 (партия 3.5, 16 Нер-цепей) был самым лучшим ингибитором для этого респондера с низкой восприимчивостью (донора 2) и снижал % максимальной агрегации с 92 до 38%.
Фиг. 14. АРАС1 (партия 1.1, 4 Нер-цепи) в концентрации 10 мкг/мл ингибировал на 90% максимальную агрегацию тромбоцитов в PRP от респондера с высокой восприимчивостью, в то время как для ингибирования на 75% агрегации в PRP от респондера с умеренной восприимчивостью требовалась концентрация 90 мкг/мл. Представлены результаты в случае концентраций АРАС1 3, 10, 30, 60 и 90 мкг/мл для респондеров с высокой и умеренной восприимчивостью.
Модели острого тромбоза на бабуинах
Фигуры 15-16
В модели острого тромбоза на бабуинах АРАС и UFH вводили локально в место повреждения в концентрации 4 мг/мл (Фиг. 15). В присутствии UFH артерию неоднократно (5 CFR/27 мин) пережимали до скорости потока 100 мл/мин (стенозирование до 30%). Для сравнения, АРАС1 (партия 1.1, 4 Нер-цепи) эффективно ингибировал тромбообразование до прерывания эксперимента, после периода наблюдения 120 мин. По окончании эксперимента, в момент времени 180 мин, артерию подвергали повторному стенозированию сначала до 50 мл/мин (60%-ное стенозирование) и окончательно до 30 мл/мин (90%-ное стенозирование), при этом АРАС продолжал ингибировать окклюзию в продолжение выбранных периодов тестирования (10 и 15 мин, соответственно). В контрольных экспериментах с использованием UFH и забуференного фосфатом физиологического раствора (PBS) происходили повторяющиеся CFR (результаты не показаны). В модели тромбоза на бабуинах на экстракорпоральном покрытом коллагеном трансплантате (Фиг. 16) АРАС1 снижал отложение тромбоцитов на коллагене на 34±13% (среднее значение и SD, n=4, р=0,01) в сравнении с UFH. Дистальное распространение тромба также снижалось на 63±11% (n=4, р=0,19). При использовании UFH результаты оказались аналогичны контрольным значениям в отсутствие обработки (n=21). Накопление фибрина снижалось под действием АРАС1 (45±14%), но не под действием UFH (1,1±0,1%; n=4, р=0,01).
В сочетании с сильным потенциалом удерживания и медленной деградацией, с использованием PET обнаруживали нерасщепленные АРАС в местах анастомоза у крыс в течение более 50 ч (до 120 ч), тогда как UFH не обнаруживали уже через 24 ч (n=2). Примерно 10% АРАС присоединялись непосредственно к месту применения на сосудах. И АРАС-комплексы, и UFH выводились через мочевыделительную систему.
Модель ишемически-реперфузионного повреждения и острого почечного повреждения
Фигуры 17-20
Примечательно, что хотя ишемически-реперфузионное повреждение было продемонстрировано в модели острого почечного повреждения, терапевтические средства по изобретению находят применение в случае любого другого реперфузионного повреждения и, следовательно, их можно применять для предупреждения, уменьшения интенсивности симптомов или лечения других таких повреждений, примерами которых являются инфаркт миокарда, или инсульт, или окклюзионная болезнь периферических артерий, или мезентериальная ишемия.
Проводили анализ восстановления функции почек после IRI. Использование АРАС2 (партия 2.1, 11 Нер-цепей) в дозах 16 или 32 мкг основывалось на результатах гематологических анализов на крысах. Клинически релевантный диапазон доз для АРАС2 и сопоставимые клинические дозы UFH основывались на предшествующих животных моделях. Дозу, связанную с антикоагулянтной эффективностью АРАС2 и UFH после внутривенной (в.в.) инъекции на момент времени 10 мин выбирали по АРТТ (Фиг. 17), когда UFH пролонгировал АРТТ в 3 раза больше, чем АРАС2 в самой высокой дозе (80 мкг). Крыс SD обрабатывали либо физиологическим раствором как разбавителем (в.в.), либо 16 или 32 мкг АРАС2 (в.в.) за 10 мин до того, как обе венозных артерии пережимали в продолжение 30 мин. Для оценки функции почек после ишемии, сыворотку и плазму крови крыс собирали в течение 3 суток после реперфузии. У крыс, обработанных 32 мкг АРАС2, уровни в сыворотке крови креатинина (**Р<0,01; Фиг. 18А) и азота мочевины (**Р<0,01; Фиг. 18 В) оказались сниженными по сравнению с обработанными разбавителем крысами. С использованием ELISA-анализа уровней в сыворотке крови липокалина, ассоциированного с желатиназой нейтрофилов (NGAL), биомаркера повреждения почек, выявили, что предварительная обработка 32 мкг АРАС2 также ослабляла тубулоинтерстициальное поражение (**Р<0,01; Фиг. 18С).
Предварительная обработка АРАС2 снижала экспрессию дистресс-ассоциированного лиганда рецепторов врожденного иммунитета гиалуронана и инфильтрацию воспалительных клеток в модели с 30-минутным билатеральным пережатием почечной артерии. Правые почки извлекали через 3 суток после реперфузии. Плотность маркера тубулоинтерстициального поражения Kim-1 показывала, что количество поврежденных иммунореактивных канальцев значительно снижалось в почках крыс, предварительно обработанных 32 мкг АРАС2, по сравнению с крысами, обработанными разбавителем (*Р<0,05; Фиг. 19В). Поскольку IRI индуцирует накопление в корковом веществе почек лиганда врожденного иммунитета гиалуронана (НА), авторы изобретения анализировали влияние предварительной обработки АРАС2 на экспрессию белка НА после IRI. В почках, подвергнутых 30-минутной теплой ишемии и 3-суточной реперфузии, предварительная обработка 32 мкг АРАС2 значительно уменьшала иммунореактивную по НА площадь по сравнению со случаем обработки почек разбавителем (*Р<0,05; Фиг. 19А).
Полуколичественная оценка повреждения канальцев, включающая анализ расширения канальцев, некроза эпителия, уплощения и цилиндров, выявила тяжелое повреждение канальцев в обработанных разбавителем почках через 3 суток (Фиг. 19). Предварительная обработка АРАС2 в дозе как 16, так и 32 мкг снижала общую балльную оценку повреждения канальцев, поскольку в выделенных поперечных срезах канальцев наблюдали только умеренное расширение канальцев и уплощение эпителия (*Р<0,05; Фиг. 19).
Предварительная обработка АРАС предотвращает острое почечное повреждение в модели с одночасовым билатеральным пережатием почечной артерии.
И наконец, авторы изобретения исследовали эффект предварительной обработки АРАС (партия 2.1, 11 гепариновых цепей) в модели тяжелого, практически необратимого IRI. Обе почечные артерии пережимали в продолжение одного часа. Крысы SD получали либо физиологический раствор как разбавитель (в.в.), либо 32 мкг (в.в.) за 10 мин до индукции теплой ишемии. Выживаемость крыс составляла 75% (6 из 8) в обработанной разбавителем группе и 100% (8 из 8) в группе, обработанной 32 мкг АРАС2 (*Р<0,05; Фиг. 20А).
Далее авторы изобретения анализировали почечную функцию, используя измерения креатинина и азота мочевины в сыворотке крови. Предварительная обработка АРАС2 снижала уровни креатинина и азота мочевины в сыворотке крови по сравнению со случаем обработки почек разбавителем (красная пунктирная линия; **Р<0,01 и ***Р<0,001; Фиг. 20В и С).
Тромбиновое время и активированное частичное тромбопластиновое время в истощенной по антитромбину плазме
Пример измерения ТТ и АРТТ в истощенной по AT плазме в присутствии АРАС1 (партия 5.1, 4 Нер-цепи) и АРАС2 (партия 5.2, 8 Нер-цепей) показан на Фиг. 21 и 22, соответственно. Концентрацию гепарина определяют с использованием исходного гепарина в качестве стандарта.
Фиг. 21
В концентрации 1 мкг/мл АРАС1 (партия 5.1, 4 Нер-цепи) пролонгировал ТТ по меньшей мере в 2 раза по сравнению с базовым значением, а при 2 мкг/мл обеспечивал достижение максимального измеренного времени ТТ (250 с). В концентрации 2 мкг/мл АРАС2 (партия 5.2, 8 Нер-цепей) пролонгировал ТТ в 4,6 раза по сравнению с базовым значением (Фиг. 21).
Фиг. 22
В концентрации 4 мкг/мл все АРАС1 (партия 5.1, 4 Нер-цепи) пролонгировали АРТТ в 1,4 раза по сравнению с базовым значением, а в концентрации 5 мкг/мл в 1,7 раза. В концентрации 4 мкг/мл АРАС2 (партия 5.2, 8 Нер-цепей) пролонгировал АРТТ в 1,9 раза по сравнению с базовым значением (Фиг. 22). В концентрации 4 мкг/мл UFH пролонгировал АРТТ в 1,6 раза по сравнению с базовым значением.
Заключения относительно уровня конъюгирования (CL) Hep и его связи с антикоагулянтными и антитромбоцитарными эффектами
Все варианты оказывают двойное антикоагулянтное и антитромбоцитарное действие (дейстие в отношении индуцированной коллагеном агрегации и тромбоцитарной прокоагулянтной активности).
АРАС с CL (6-16):1 обладают следующими общими антикоагулянтными свойствами:
(концентрацию гепарина оценивали с использованием стандарта GAG Blyscan)
• пролонгирование АРТТ похоже на таковое в случае UFH в клинических дозах (примерно 3 мкг/мл);
• пролонгирование АРТТ более эффективно, чем в случае UFH, в высоких клинических дозах (примерно 6-8 мкг/мл);
• АРАС с Hep CL 6:1 выглядят более мощными антикоагулянтами, чем АРАС с CL не менее 8:1, в особенности в более высоких концентрациях;
• генерация тромбина по CAT задержана и уменьшена как в РРР, так и в PRP при концентрациях более низких, чем необходимо для пролонгирования АРТТ (1,0 мкг/мл), по меньшей мере столь же эффективно, как и в случае применения UFH;
• АРАС с CL не менее 8:1 выглядят более мощными в ингибировании генерации тромбина в PRP, чем варианты с более низким CL.
АРАС обладают следующими антитромбоцитарными свойствами:
• снижают скорость и максимальную агрегацию тромбоцитов, индуцированную коллагеном в цитратной PRP, тогда как UFH не оказывает такого действия;
• АРАС с CL (8-16): 1 в одинаковой степени представляют собой более мощные ингибиторы индуцированной коллагеном агрегации тромбоцитов, чем молекулы с CL (4-6):1.
АРАС с
CL не более 6:1 пролонгируют ТТ в большей степени, чем АРАС с CL не менее 8;
CL не более 6:1 пролонгируют АРТТ в большей степени, чем АРАС с CL не менее 8;
CL не менее 8:1 ингибируют генерацию тромбина по CAT, в частности в PRP, в большей степени, чем АРАС с CL (4-6):1;
CL не менее 8:1 ингибируют индуцированную коллагеном агрегацию в PRP в большей степени, чем АРАС с CL (4-6):1.
В целом, для ингибирования как агрегации тромбоцитов, так и тромбоцитарной прокоагулянтной активности выгодно большее число гепариновых цепей, конъюгированных с HSA.

n.d. означает "не определено"





Реферат
Изобретение относится к области биотехнологии, конкретно к антитромботической молекуле, обладающей как антитромбоцитарной, так и антикоагулянтной (АРАС) активностью, и может быть использовано в медицине. Полученная молекула состоит из человеческого сывороточного альбумина и присоединенного множества гепариновых цепей с массами от 10 до 24 кДа и может быть использована в качестве антикоагулянта или ингибитора тромбоцитов. 4 н. и 21 з.п. ф-лы, 22 ил., 3 табл., 1 пр.

Комментарии