Гепарансульфаты - RU2700877C2
Код документа: RU2700877C2
Чертежи









































Описание
Область техники
Настоящее изобретение относится к гепарансульфатам и, в частности, но не исключительно, к гепарансульфатам, которые связываются с основным фактором роста фибробластов (ФРФ2).
Уровень техники
Основным недостатком подходов, основанных на использовании мезенхимальных стволовых клеток человека (МСКЧ) в клеточной терапии, является трудность получения достаточного количества клеток для целей терапии. Современные стратегии, которые включают использование субстратов внеклеточного матрикса (ВКМ) и фактора роста фибробластов 2 (ФРФ2), обеспечивают получение более высокого количества клеток, но вместе с тем приводят к увеличению количества дифференцированных клеток-предшественников в популяциях клеток.
Низкое количество МСКЧ, которое может быть ниже 0,01%-0,0001% от общего числа мононуклеарных клеток костного мозга, препятствует их широкому использованию. Помимо этого, существующие в настоящее время стратегии размножения ex vivo вызывают потерю мультипотентности, и обеспечивают достаточное количество клеток для трансплантации при их более низком качестве и меньшей функциональностью.
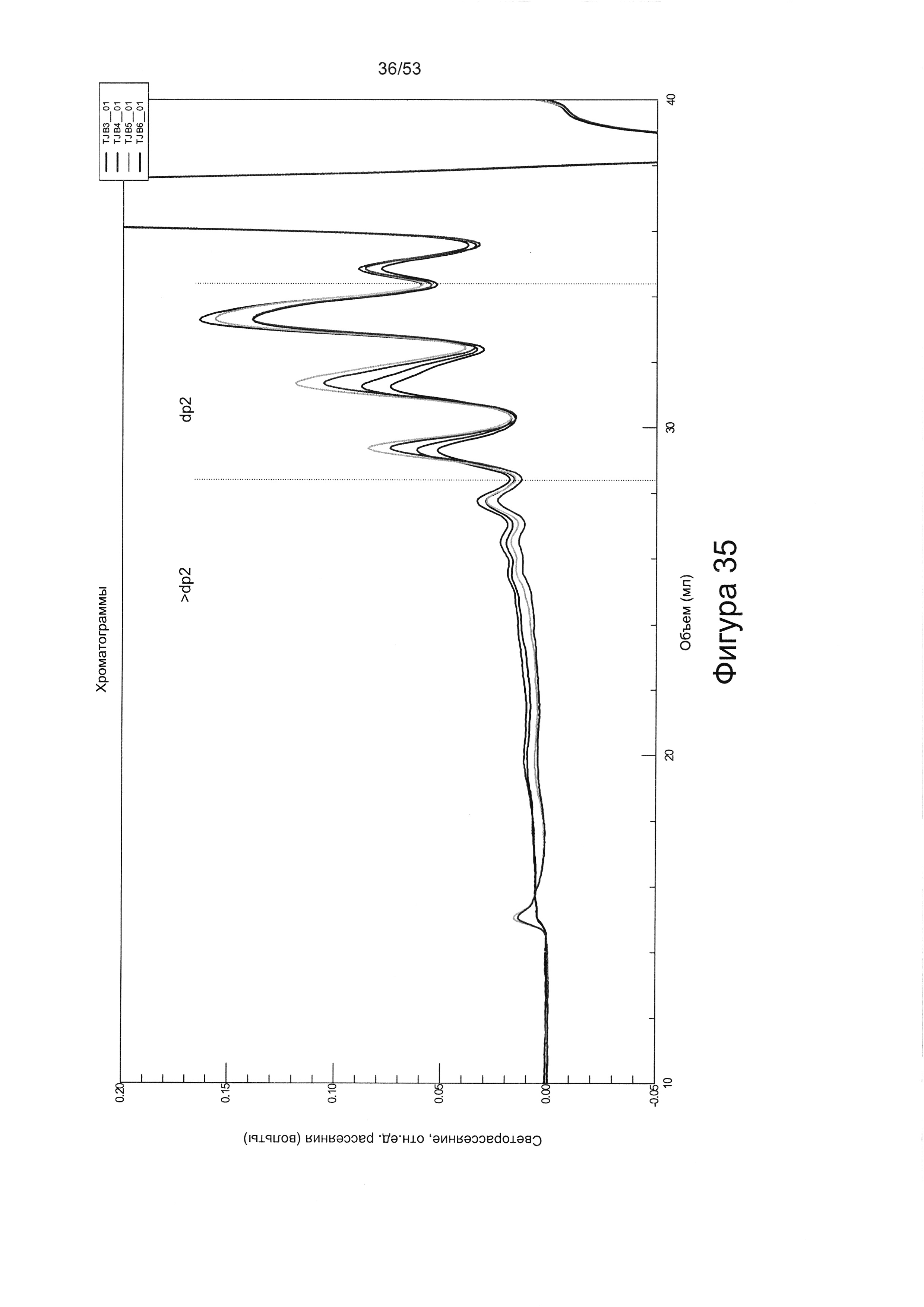
В работе Brickman et al. (Glycobiology Vo. 8 No. 5 pp. 463-471, 1998) описан гепарансульфат, названный HS2, который, как сообщается, способен взаимодействовать с ФРФ2. HS2 может быть получен из гепаранпротеогликанов клеток мыши на 10-й день эмбрионального развития, как описано Brickman и соавторами (см. выше). Было описано, что HS2 имеет молекулярную массу приблизительно 25 кДа и, следовательно, исходя из того, что средняя молекулярная масса дисахарида составляет 400 Да, состоит из приблизительно 60 дисахаридов. Дисахаридный состав HS2 приведен в работе Brickman et al. (Glycobiology Vo. 8 No. 5 pp. 463-471, 1998), WO 2010/011185, полностью включенной в настоящую заявку посредством ссылки. Профили расщепления HS2 под действием азотистой кислоты и гепаранлиазы показаны на Фигурах 29 и 30.
В работе Maccarana et al. (Minimal Sequence in Heparin/Heparan Sulfate Required for Binding of Basic Fibroblast Growth Factor. The Journal of Biological Chemistry. Vol. 268, No. 32, Issue 15, pp 23898-23905, 1993) описаны эксперименты, в которых изучали связывание ФРФ2 несколькими небольшими олигосахаридами, полученными из гепарина или гепарансульфата (ГС) из аорты человека. Одна октасахаридная фракция (В2) была использована, чтобы установить структуру октасахарида, который авторы назвали HS-8. Следует отметить, что вышеупомянутый HS-8 не является HS8 согласно настоящему изобретению, и совпадение номенклатуры является полностью случайным.
Для получения короткоцепочечпых олигосахаридов с четным или нечетным числом мономеров использовали гепарин из слизистой оболочки кишечника свиней, два образца гепарина, подвергнутого селективному О-десульфатированию, один образец, полученный путем предпочтительного 6-О-десульфатироваиия совместно с N-десульфатированием исходного материала с последующим повторным N-сульфатированием, другой образец, полученный с помощью селективного 2-О-десульфатирования в щелочных условиях, низкосульфатированный ГС, выделенный из аорты человека, и ГС из почек крупного рогатого скота.
Олигосахариды с четным числом мономеров получали из гепарина путем деполимеризации с помощью частичного дезаминирующего расщепления под действием азотистой кислоты, и полученные в результате реакции остатки 2,4-ангидро-D-маннозы восстанавливали NAB3H4. Меченые олигосахариды отделяли, чтобы получить молекулы с четным количеством мономеров, содержащие 4-14 сахаридов, и фракцию, содержащую 20-24 сахарида. Гепарин, подвергнутый селективному 6-О-десульфатированию, обрабатывали аналогичным образом с получением 4- и 12-мерных сахаридов. Выделенные и обессоленные олигосахариды подвергали обработке слабой кислотой. Олигосахариды гепарина с нечетным количеством мономеров получали с помощью дальнейшей обработки 20-24-мерных сахаридов гепариназой I.
4-14-мерные олигосахариды получали из ГС из аорты человека с помощью другой стратегии, включающей расщепление в участках, занятых блоками N-ацетилированного глюкозамина (GlcN). Образцы подвергали N-деацетилированию и затем дезаминированию азотистой кислотой. Такая обработка приводит к дезаминированию незамещенных блоков GlcN и расщеплению глюкозаминидиповых связей, в то время как блоки N-сульфатированного GlcN остаются неизменными. Продукты включают дисахариды GlcA-[1-3H]aManR (полученные из последовательностей (-GlcNAc)-(GlcA-GlcNac)n) и олигосахариды GlcA-GlcNSO3-HexAn-[1-3H]aManR (полученные из последовательностей (-GlcNac)-GlcA-(GlcNSO3-HexA)n-GlcNac-).
Олигосахариды, полученные с помощью описанных способов обработки, были короткоцепочечными и химически модифицированными вследствие осуществления способа их получения, что отличает их от ГС согласно настоящему изобретению.
Краткое описание изобретения
Настоящее изобретение относится к препарату гепарансульфата, гепарансульфату HS8. Было установлено, что HS8 связывается с ФРФ2 и усиливает пролиферацию стволовых клеток при сохранении их плюрипотентности/мультипотентности. HS8 относится к новому классу структурно и функционально родственных выделенных гепарансульфатов. Авторы настоящего изобретения выявили несколько близкородственных членов класса HS8, обладающих общим свойством связываться с гепаринсвязывающими доменами, полученными из ФРФ2, которые имеют общую короткую консенсусную последовательность (YCKNGGF). Члены класса HS8 способны стимулировать пролиферацию стволовых клеток и обогащать популяцию колониеобразующими единицами (КОЕ).
Согласно одному аспекту настоящего изобретения предложен гепарансульфат HS8. HS8 может быть обеспечен в выделенной форме или по существу очищенной форме. В настоящем изобретении может быть обеспечена композиция, в которой компонент гепарансульфата составляет по меньшей мере 80% HS8, более предпочтительно процентную долю, выбранную из по меньшей мере 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100%.
Согласно предпочтительным вариантам реализации настоящего изобретения HS8 способен связываться с пептидом или полипептидом, содержащим аминокислотную последовательность YCKNGGF (SEQ ID NO: 2). Указанный пептид может содержать одну или более дополнительных аминокислот на одном или обоих концах указанной последовательности. Например, пептид может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот на одном или обоих концах указанной последовательности.
Согласно некоторым вариантам реализации настоящего изобретения HS8 способен связываться с пептидом или полипептидом, содержащим или состоящим из аминокислотной последовательности, которая представляет собой любую из:
- YCKNGGF (SEQ ID NO: 2), или
- GHFKDPKRLYCKNGGF (SEQ ID NO: 1).
Согласно другим вариантам реализации настоящего изобретения полипептид представляет собой белок ФРФ2. Согласно некоторым вариантам реализации настоящего изобретения HS8 связывается с пептидом, содержащим или состоящим из аминокислотной последовательности, приведенной в любой из SEQ ID NO: 1, 2, или белком ФРФ2 с величиной KD менее 100 мкМ, более предпочтительно менее 50 мкМ, 40 мкМ, 30 мкМ, 20 мкМ или 10 мкМ.
HS8 может быть получен, выявлен, выделен или обогащен в соответствии со способом, предложенным авторами настоящего изобретения, описанным в настоящей заявке, который может включать следующие этапы:
(i) обеспечение твердой подложки, с прикрепленными к ней молекулами полипептида, причем указанный полипептид содержит гепаринсвязывающий домен, содержащий аминокислотную последовательность YCKNGGF;
(ii) приведение указанных молекул полипептида в контакт со смесью, содержащей гликозаминогликаны, так, чтобы обеспечить образование комплексов полипептид-гликозаминогликан;
(iii) отделение указанных комплексов полипептид-гликозаминогликан от остальной части смеси;
(iv) диссоциацию гликозаминогликанов из комплексов полипептид-гликозаминогликан;
(v) сбор указанных диссоциированных гликозаминогликанов.
Согласно некоторым вариантам реализации настоящего изобретения полипептид, прикрепленный к подложке, может содержать или состоять из аминокислотной последовательности, выбранной из:
- YCKNGGF (SEQ ID NO: 2), или
- GHFKDPKRLYCKNGGF (SEQ ID NO: 1).
В соответствии со способом, предложенным авторами настоящего изобретения, смесь может содержать гликозаминогликаны, полученные из коммерчески доступных источников. Один подходящий источник представляет собой фракцию гепарансульфата, например, коммерчески доступный гепарансульфат. Одна подходящая фракция гепарансульфата может быть получена при выделении гепарина из слизистой оболочки кишечника свиньи (например, Celsus Laboratories Inc. - иногда называемого «Celsus HS»).
Другие подходящие источники гепарансульфата включают гепарансульфат, полученный от любого млекопитающего (человека или млекопитающего, не относящегося к человеку), в частности, из почек, легких или слизистой оболочки кишечника. Согласно некоторым вариантам реализации настоящего изобретения гепарансульфат получен из слизистой оболочки кишечника, почек или легких свиньи (свиной) или коровы (бычий).
Согласно другому аспекту настоящего изобретения предложена композиция, содержащая HS8 в соответствии с любым из вышеуказанных аспектов и белок ФРФ2.
Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция или лекарственное средство, содержащее HS8 в соответствии с аспектами, описанными выше. Фармацевтическая композиция или лекарственное средство может дополнительно содержать фармацевтически приемлемый носитель, адъювант или разбавитель.
Согласно некоторым вариантам реализации настоящего изобретения указанная фармацевтическая композиция предназначена для применения в соответствии со способом лечения, при этом указанный способ включает восстановление и/или регенерацию ткани, например, сломанной кости. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция или лекарственное средство может дополнительно содержать белок ФРФ2. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция или лекарственное средство может дополнительно содержать мезенхимальные стволовые клетки.
Согласно другому аспекту настоящего изобретения HS8 предложен для применения в соответствии со способом терапевтического лечения. Способ терапевтического лечения может включать способ заживления ран в условиях in vivo, восстановления и/или регенерации ткани, восстановления и/или регенерации соединительной ткани, восстановления и/или регенерации костной ткани, и/или восстановления и/или регенерации костной ткани у млекопитающего или человека.
В родственном аспекте настоящего изобретения предложено применение HS8 в изготовлении лекарственного средства для применения в соответствии со способом терапевтического лечения. Согласно некоторым вариантам реализации настоящего изобретения способ терапевтического лечения включает восстановление и/или регенерацию сломанной кости у млекопитающего или человека.
Согласно другому аспекту настоящего изобретения предложен биосовместимый имплантат или протез, содержащий биоматериал и HS8. Согласно некоторым вариантам реализации настоящего изобретения имплантат или протез покрыт HS8. Согласно некоторым вариантам реализации настоящего изобретения имплантат или протез пропитан HS8. Имплантат или протез может быть дополнительно покрыт или пропитан белком ФРФ2 и/или мезенхимальными стволовыми клетками.
Согласно другому аспекту настоящего изобретения предложен способ получения биосовместимого имплантата или протеза, причем указанный способ включает этап, на котором биоматериал покрывают или пропитывают HS8. Согласно некоторым вариантам реализации настоящего изобретения способ дополнительно включает этап, на котором биоматериал покрывают или пропитывают белком ФРФ2 и/или мезенхимальными стволовыми клетками.
Согласно другому аспекту настоящего изобретения предложен способ лечения перелома кости у пациента, причем указанный способ включает введение пациенту терапевтически эффективного количества HS8. Согласно некоторым вариантам реализации настоящего изобретения способ включает введение HS8 в ткань, окружающую перелом. Согласно некоторым вариантам реализации настоящего изобретения указанный способ включает инъекцию HS8 в ткань, окружающую перелом. Согласно указанным способам HS8 может быть изготовлен в виде фармацевтической композиции или лекарственного средства, содержащего HS8 и фармацевтически приемлемый носитель, адъювант или разбавитель.
Согласно некоторым вариантам реализации настоящего изобретения указанный способ может дополнительно включать введение пациенту белка ФРФ2. В соответствии с указанными способами HS8 и белок ФРФ2 могут быть изготовлены в виде фармацевтической композиции, содержащей HS8 и белок ФРФ2, и фармацевтически приемлемый носитель, адъювант или разбавитель.
Согласно некоторым вариантам реализации настоящего изобретения указанный способ может дополнительно включать введение пациенту мезенхимальных стволовых клеток. В соответствии с указанными способами по меньшей мере два компонента из HS8, белка ФРФ2 и мезенхимальных стволовых клеток могут быть изготовлены в виде фармацевтической композиции, содержащей по меньшей мере два компонента из HS8, белка ФРФ2 и мезенхимальных стволовых клеток, и фармацевтически приемлемый носитель, адъювант или разбавитель.
Предпочтительно, в настоящем изобретении HS8, белок ФРФ2 и мезенхимальные стволовые клетки, соответственно, обеспечивают в терапевтически эффективных количествах. Согласно некоторым вариантам реализации настоящего изобретения способ лечения перелома кости дополнительно включает этап приготовления терапевтически эффективных количеств HS8 и/или белка ФРФ2, и/или мезенхимальных стволовых клеток в виде фармацевтической композиции, содержащей HS8 и/или белок ФРФ2, и/или мезенхимальные стволовые клетки и фармацевтически приемлемый носитель, адъювант или разбавитель, при этом указанную фармацевтическую композицию вводят пациенту.
Согласно другому аспекту настоящего изобретения предложен способ лечения перелома кости у пациента, включающий имплантацию хирургическим путем в ткань пациента в месте перелома или в окружающую его ткань биосовместимого имплантата или протеза, причем указанный имплантат или протез содержит биоматериал и HS8.
Согласно некоторым вариантам реализации настоящего изобретения указанный имплантат или протез покрыт HS8. Согласно некоторым вариантам реализации настоящего изобретения указанный имплантат или протез пропитан HS8. Согласно некоторым вариантам реализации настоящего изобретения указанный имплантат или протез дополнительно пропитан одним или обоими из белка ФРФ2 или мезенхимальных стволовых клеток.
Согласно другому аспекту настоящего изобретения предложена культуральная среда, содержащая HS8.
Согласно другому аспекту настоящего изобретения предложено применение HS8 в культуре клеток в условиях in vitro. В родственном аспекте настоящего изобретения предложено применение HS8 для выращивания соединительной ткани в условиях in vitro. В другом родственном аспекте настоящего изобретения предложен способ выращивания соединительной ткани в условиях in vitro, включающий культивирование мезенхимальных стволовых клеток совместно с экзогенно добавленным HS8.
В еще одном дополнительном аспекте настоящего изобретения предложен способ восстановления, замены или регенерации ткани у человека или животного-пациента, нуждающегося в таком лечении, включающий:
(i) культивирование мезенхимальных стволовых клеток в условиях in vitro совместно с HS8 в течение периода времени, достаточного для того чтобы указанные клетки образовали ткань;
(ii) сбор указанной ткани;
(iii) имплантацию указанной ткани в организм пациента в очаг травмы или заболевания для восстановления, замены или регенерации ткани у указанного пациента.
Ткань может представлять собой соединительную ткань, например, кость, хрящ, сухожилие или жир.
Согласно некоторым вариантам реализации настоящего изобретения способ дополнительно включает приведение мезенхимальных стволовых клеток в культуре в контакт с экзогенным белком ФРФ2.
Согласно другому аспекту настоящего изобретения предложена ткань, полученная путем культивирования мезенхимальных стволовых клеток в условиях in vitro в присутствии HS8. Согласно некоторым вариантам реализации настоящего изобретения ткань получена путем культивирования мезенхимальных стволовых клеток в условиях in vitro в присутствии HS8 и белка ФРФ2.
Согласно другому аспекту настоящего изобретения предложен способ культивирования стволовых клеток, например, мезенхимальных стволовых клеток, включающий культивирование стволовых клеток совместно с HS8.
Согласно некоторым аспектам настоящего изобретения предложен способ культивирования стволовых клеток в условиях in vitro, включающий культивирование стволовых клеток в условиях in vitro совместно с гепарансульфатом HS8. Указанный HS8 предпочтительно является экзогенным и выделенным, и внесен в культуру в качестве добавки, например, в качестве компонента культуральной среды.
Согласно предпочтительным вариантам реализации настоящего изобретения культивируемые стволовые клетки в тот период времени, когда они находились в контакте с HS8, размножаются с образованием популяции, т.е. увеличивается число стволовых клеток, и высокая доля клеток в культуре сохраняют мультипотентные или плюрипотентные характеристики исходной стволовой клетки (например, способность стволовой клетки дифференцироваться в определенные типы тканей, характерные для типа стволовой клетки). Например, предпочтительно одна из по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% стволовых клеток в культуре проявляет мультипотентные или плюрипотентные характеристики исходных стволовых клеток. Предпочтительно, HS8 увеличивает долю (например, процентное содержание) клеток в культуре, которые являются мультипотентными или плюрипотентными. Такая доля может быть измерена по отношению к количеству клеток в исходной культуре, которые являются мультипотентными или плюрипотентными. Согласно некоторым вариантам реализации настоящего изобретения увеличение доли мультипотентных или плюрипотентных клеток может быть сопоставлено с этим показателем в контрольной культуре стволовых клеток, подвергнутых соответствующим условиям культивирования, которые отличаются только наличием в культуральной среде экзогенного HS8. Культуры стволовых клеток могут необязательно содержать ФРФ2 или не содержать это белок.
В некоторых предпочтительных вариантах реализации указанный способ обеспечивает увеличение количества колониеобразующих единиц (КОЕ), то есть отдельных стволовых клеток, которые способны формировать колонии стволовых клеток, полученные из одной клетки-предшественника. Увеличение может быть измерено как увеличение доли клеток в культуре, которые представляют собой КОЕ, например, увеличение на величину, составляющую по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%. Увеличение может быть измерено в течение периода поддержания культуры, в течение одного пассажа или в течение выбранного числа пассажей, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более пассажей, при этом увеличение количества КОЕ определяют по отношению к количеству КОЕ в исходной культуре.
Соответственно, способы культивирования согласно настоящему изобретению обеспечивают пролиферацию стволовых клеток и увеличение количества стволовых клеток, при этом высокая доля потомства клеток является мультипотентной или плюрипотентной и/или представляет собой КОЕ. Соответственно, способы согласно настоящему изобретению обеспечивают предотвращение или уменьшение потери плюрипотентного или мультипотентного статуса плюрипотентных или мультипотентных стволовых клеток во время размножения стволовых клеток в культуре в условиях in vitro. Предложенные способы являются предпочтительными по сравнению с существующими способами культивирования стволовых клеток, при которых распространенным явлением является потеря характеристик стволовых клеток в потомстве клеток. Таким образом, способы согласно настоящему изобретению обеспечивают средства обогащения культур стволовых клеток мультипотентными/плюрипотентными стволовыми клетками и/или КОЕ, обеспечивая способ получения большого количества стволовых клеток для использования в медицине, диагностике и исследованиях.
Соответственно, способы согласно настоящему изобретению обеспечивают пролиферацию и размножение культур стволовых клеток при одновременном обогащении культур более высокой долей (например, процентным содержанием) клеток, которые являются плюрипотентными или мультипотентными, и/или представляют собой КОЕ.
Согласно одному аспекту настоящего изобретения предложен способ обогащения культуры мезенхимальных стволовых клеток (МСК) колониеобразующими единицами фибробластов (КОЕ-Ф), включающий культивирование МСК в условиях in vitro совместно с гепарансульфатом HS8.
Согласно другому аспекту настоящего изобретения предложен способ обогащения культуры мезенхимальных стволовых клеток (МСК) мезенхимальными стволовыми клетками и/или колониеобразующими единицами фибробластов (КОЕ-Ф), включающий культивирование МСК в условиях in vitro совместно с гепарансульфатом HS8 так, что культивируемые клетки пролиферируют, и популяция МСК размножается, причем размноженная популяция МСК характеризуется тем, что:
- ≤2% популяции МСК экспрессируют любой из CD45, CD34, CD14, CD19, HLA-DR; и
- ≥95% популяции МСК экспрессируют CD 105, CD73 и CD90; и
- ≥40% популяции МСК экспрессируют CD49a и/или
- ≥50% популяции МСК экспрессируют SSEA-4 и/или
- ≥20% популяции МСК экспрессируют STRO-1.
Согласно другому аспекту настоящего изобретения предложен способ обогащения культуры мезенхимальных стволовых клеток (МСК) мезенхимальными стволовыми клетками и/или колониеобразующими единицами фибробластов (КОЕ-Ф), включающий культивирование МСК совместно с гепарансульфатом HS8 и пассирование МСК в условиях in vitro, причем после одного или более пассажей популяция МСК характеризуется тем, что:
- ≤2% популяции МСК экспрессируют любой из CD45, CD34, CD14, CD19, HLA-DR; и
- ≥95% популяции МСК экспрессируют CD 105, CD73 и CD90; и
- ≥40% популяции МСК экспрессируют CD49a и/или
- ≥50% популяции МСК экспрессируют SSEA-4 и/или
- ≥20% популяции МСК экспрессируют STRO-1.
В настоящем изобретении предложена популяция или культура стволовых клеток или МСК, полученных или произведенных с помощью способа, описанного в настоящей заявке.
Популяция или культура МСК характеризуется тем, что:
- ≤2% популяции МСК экспрессируют любой из CD45, CD34, CD 14, CD 19, HLA-DR; и
- ≥95% популяции МСК экспрессируют CD 105, CD73 и CD90; и
- ≥40% популяции МСК экспрессируют CD49a и/или
- ≥50% популяции МСК экспрессируют SSEA-4 и/или
- ≥20% популяции МСК экспрессируют STRO-1.
Согласно некоторым вариантам реализации настоящего изобретения доля клеток в популяции МСК, которые экспрессируют CD49a, может быть выше или равна одному или более значениям из 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69% или 70%.
Согласно некоторым вариантам реализации настоящего изобретения доля клеток в популяции МСК, которые экспрессируют SSEA-4, может быть выше или равна одному или более значениям из 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79% или 80%.
Согласно некоторым вариантам реализации настоящего изобретения доля клеток в популяции МСК, которые экспрессируют STRO-1, может быть выше или равна одному или более значениям из 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49% или 50%.
Согласно некоторым вариантам реализации настоящего изобретения количество указанных пассажей может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более пассажей.
Способы культивирования стволовых клеток, описанные в настоящей заявке, могут включать этапы выделения и/или поддержания стволовых клеток в условиях in vitro. Например, способы, описанные в настоящей заявке, также могут включать один или более из следующих этапов:
- получение стволовых клеток, например, стромальных клеток или стромальных клеток костного мозга, из животного или человека,
- выделение стволовых клеток,
- разделение и/или выделение STRO-1-экспрессирующих МСК, например, с помощью проточной цитометрии или магнитной сортировки клеток или сортировки клеток с возбуждением флуоресценции (FACS),
- разделение и/или выделение STRO-1+bright МСК, например, с помощью проточной цитометрии или магнитной сортировки клеток или сортировки клеток с возбуждением флуоресценции,
- разделение и/или выделение STRO-1+bright/CD106+ МСК, например, с помощью проточной цитометрии или магнитной сортировки клеток или сортировки клеток с возбуждением флуоресценции,
- хранение стволовых клеток, например, криоконсервацию. Хранение может включать хранение клеток, полученных из животного или человека, перед культивированием в условиях in vitro или размножением, или хранение обогащенных/размноженных стволовых клеток.
Согласно другому аспекту настоящего изобретения предложен набор компонентов, содержащий заранее определенное количество HS8 и заранее определенное количество ФРФ2. Набор может включать первый контейнер, содержащий заранее определенное количество HS8, и второй контейнер, содержащий заранее определенное количество ФРФ2. Набор может дополнительно содержать заранее определенное количество мезенхимальных стволовых клеток. Набор может быть предназначен для применения в соответствии со способом терапевтического лечения. Способ терапевтического лечения может включать способ заживления ран в условиях in vivo, восстановления и/или регенерации соединительной ткани, восстановления и/или регенерации кости, и/или восстановления и/или регенерации костной ткани у млекопитающего или человека. Набор может быть обеспечен совместно с инструкциями для введения HS8, белка ФРФ2 и/или мезенхимальных стволовых клеток по отдельности, последовательно или одновременно, чтобы обеспечить терапевтическое лечение.
Согласно другому аспекту настоящего изобретения предложены продукты, содержащие терапевтически эффективные количества:
(i) HS8; и одного или обоих из
(ii) белка ФРФ2;
(iii) мезенхимальных стволовых клеток,
для одновременного, раздельного или последовательного применения в соответствии со способом терапевтического лечения. Способ терапевтического лечения может включать способ заживления ран в условиях in vivo, восстановления и/или регенерации соединительной ткани, восстановления и/или регенерации костной ткани, и/или восстановления и/или регенерации костной ткани у млекопитающего или человека. Продукты могут быть необязательно изготовлены в виде комбинированного препарата для совместного введения.
Дополнительные аспекты настоящего изобретения изложены ниже.
Согласно одному аспекту настоящего изобретения предложен гликозаминогликан (ГАГ), имеющий высокую аффинность связывания и отношении ФРФ2. Более предпочтительно ГАГ представляет собой гепарансульфат (ГС). В одном варианте реализации ГС был выделен из смеси ГАГ, полученной из слизистой оболочки кишечника свиньи (доступной от Celsus Laboratories Inc, Цинциннати, США, например, INW-08-045, гепарансульфат I, Celsus Lab Inc, НО-03102, НО-10595, 10×100 мг), с помощью способа, описанного в настоящей заявке, в котором полипептид, содержащий гепаринсвязывающий домен ФРФ2, имеющий аминокислотную последовательность YCKNGGF, был прикреплен к твердой подложке, обеспечивая тем самым образование комплексов ГАГ-полипептид. Диссоциация компонента ГАГ из комплексов ГАГ-полипептид позволила выделить уникальный ГС, названный в настоящей заявке «HS8». Согласно одному варианту реализации настоящего изобретения HS8 представляет собой ГС, выделенный путем присоединения полипептида GHFKDPKRLYCKNGGF (SEQ ID NO: 1) к твердой подложке, обеспечивая тем самым образование комплексов ГАГ-полипептид, с последующей диссоциацией компонента ГАГ из комплексов ГАГ-полипептид.
Авторы настоящего изобретения полагают, что HS8 может быть получен из фракций ГС, полученных из множества источников, включая ткань и/или внеклеточный матрикс млекопитающих (человека и млекопитающих, не относящихся к человеку).
Соответственно, в одном аспекте настоящего изобретения предложен HS8. HS8 может быть предложен в выделенной или очищенной форме. Согласно другому аспекту предложена культуральная среда, содержащая HS8.
Согласно еще одному аспекту настоящего изобретения предложена фармацевтическая композиция или лекарственное средство, содержащее HS8, возможно в комбинации с фармацевтически приемлемым носителем, адъювантом или разбавителем. Согласно некоторым вариантам реализации настоящего изобретения фармацевтические композиции или лекарственные средства могут дополнительно содержать белок ФРФ2. Фармацевтические композиции или лекарственные средства, содержащие HS8, предложены для применения в предупреждении или лечении травмы или заболевания. В настоящем изобретении также предложено применение HS8 в производстве лекарственного средства для предотвращения или лечения травмы или заболевания.
Согласно другому аспекту настоящего изобретения предложен способ предупреждения или лечения травмы или заболевания у пациента, нуждающегося в лечении, включающий введение указанному пациенту эффективного количества HS8. Вводимый HS8 может быть изготовлен в виде подходящей фармацевтической композиции или лекарственного средства и может дополнительно содержать фармацевтически приемлемый носитель, адъювант или разбавитель. Необязательно, фармацевтическая композиция или лекарственное средство также может содержать белок ФРФ2.
Согласно другому аспекту настоящего изобретения предложен способ стимуляции или ингибирования остеогенеза (образования остеобластов и/или костной ткани), включающий введение HS8 к клеткам-предшественникам костной ткани или стволовым клеткам костной ткани.
Согласно другому аспекту настоящего изобретения предложен способ стимуляции или ингибирования образования хрящевой ткани (хондрогенеза), включающий введение HS8 к клеткам-предшественникам хрящевой ткани или стволовым клеткам хрящевой ткани.
Способы стимулирования или ингибирования остеогенеза или образования хрящевой ткани могут быть осуществлены в условиях in vitro, путем приведения клеток-предшественников или стволовых клеток костной ткани или хрящевой ткани в контакт с HS8, возможно в присутствии экзогенно добавленного белка ФРФ2. Клетки-предшественники или стволовые клетки могут представлять собой мезенхимальные стволовые клетки. В том случае, когда стимулируется образование костной ткани, образованная ткань может быть собрана и использована для имплантации в организм пациента, человека или животного.
Соответственно, в одном аспекте настоящего изобретения предложена соединительная ткань, которая получена путем культивирования мезенхимальных стволовых клеток в условиях in vitro в присутствии HS8 (т.е. экзогенного HS8), и возможно в присутствии ФРФ2 (т.е. экзогенного ФРФ2). Соединительная ткань может представлять собой кость, хрящ, мышцу, жир, связку или сухожилие.
Предотвращение или лечение заболевания с использованием HS8 может включать восстановление, регенерацию или замену ткани, в частности, соединительной ткани, такой как кость, хрящ, мышца, жир, связка или сухожилие.
У пациентов, имеющих повреждение одной из перечисленных тканей, введение HS8 в очаг повреждения может быть использовано, чтобы стимулировать рост, пролиферацию и/или дифференцировку ткани в этом очаге. Например, стимуляция мезенхимальных стволовых клеток, присутствующих в очаге введения, или вблизи него, может привести, предпочтительно, в случае если ФРФ2 также присутствует в этом очаге, к пролиферации и дифференцировке мезенхимальных стволовых клеток в соответствующую соединительную ткань, обеспечивая тем самым замену/регенерацию поврежденной ткани и лечение травмы.
В другом варианте, соединительная ткань, полученная при культивировании мезенхимальных стволовых клеток в условиях in vitro совместно с HS8, может быть собрана и имплантирована в очаг травмы или заболевания, чтобы заменить травмированную или поврежденную ткань. Травмированная или поврежденная ткань возможно сначала может быть иссечена из очага травмы или заболевания.
Согласно другому аспекту может быть предложена фармацевтическая композиция, содержащая стволовые клетки, предпочтительно мезенхимальные стволовые клетки, и HS8. Введение, например, инъекция, композиции в очаг травмы, заболевания или повреждения обеспечивает регенерацию ткани в таком очаге.
Соответственно, HS8 можно использовать при заживлении ран в условиях in vivo, включая восстановление, регенерацию и/или замену тканей (например, заживление рубцовой ткани или сломанной кости), которое осуществляют с помощью непосредственного применения у пациента, нуждающегося в таком лечении, HS8, возможно в комбинации с ФРФ2 и/или стволовыми клетками. HS8 также можно использовать при получении в условиях in vitro ткани, пригодной для имплантации пациенту, нуждающемуся в восстановлении, регенерации и/или замене тканей.
Согласно другому аспекту настоящего изобретения предложен способ культивирования стволовых клеток в условиях in vitro, включающий культивирование стволовых клеток в условиях in vitro совместно с HS8. HS8 предпочтительно представляет собой экзогенный HS8, который приведен в контакт с культивируемыми клетками. HS8 может быть обеспечен в виде компонента культуральной среды или отдельно добавлен к культуре. Способ предпочтительно включает пролиферацию стволовых клеток. Способ предпочтительно включает поддержание плюрипотентного или мультипотентного статуса стволовых клеток на протяжении множества удвоений популяции или пассажей, например, одного из по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10 удвоений популяции или пассажей.
Согласно одному варианту реализации настоящего изобретения предложен способ размножения культуры стволовых клеток в условиях in vitro, включающий размножение отдельной стволовой клетки до популяции, содержащей более 1×103 стволовых клеток, причем указанный способ включает приведение культуры стволовых клеток в контакт с HS8.
Согласно другому варианту реализации настоящего изобретения предложен способ размножения культуры стволовых клеток в условиях in vitro из исходной культуры, содержащей от приблизительно 2000 до 5000 клеток на см2, до размноженной культуры, содержащей по меньшей мере в 1×103 раз больше стволовых клеток, включающий приведение культуры стволовых клеток в контакт с HS8. Согласно некоторым вариантам реализации настоящего изобретения период культивирования, необходимый для размножения культуры от исходного размера до размера размноженной культуры, составляет менее 40 дней, 30 дней, 25 дней.
Согласно другому варианту реализации настоящего изобретения предложен способ увеличения количества колониеобразующих единиц (КОЕ) в культуре стволовых клеток в условиях in vitro, включающий культивирование стволовых клеток совместно с HS8. Согласно некоторым вариантам реализации настоящего изобретения КОЕ экспрессируют один или более из CD49a, CD73, CD105, STRO-1 или CD90.
Согласно другому варианту реализации настоящего изобретения предложен способ увеличения доли STRO-1 или STRO-1+bright клеток в культуре мезенхимальных стволовых клеток в условиях in vitro, включающий культивирование мезенхимальных стволовых клеток совместно с HS8.
Согласно другому варианту реализации настоящего изобретения предложен способ предотвращения или уменьшения в условиях in vitro потери мультипотентного статуса мультипотентных стволовых клеток в процессе размножения стволовых клеток в культуре в условиях in vitro, включающий культивирование стволовых клеток совместно с HS8. Согласно некоторым вариантам реализации настоящего изобретения способ включает поддержание стволовых клеток в культуре в течение по меньшей мере 10 удвоений популяции.
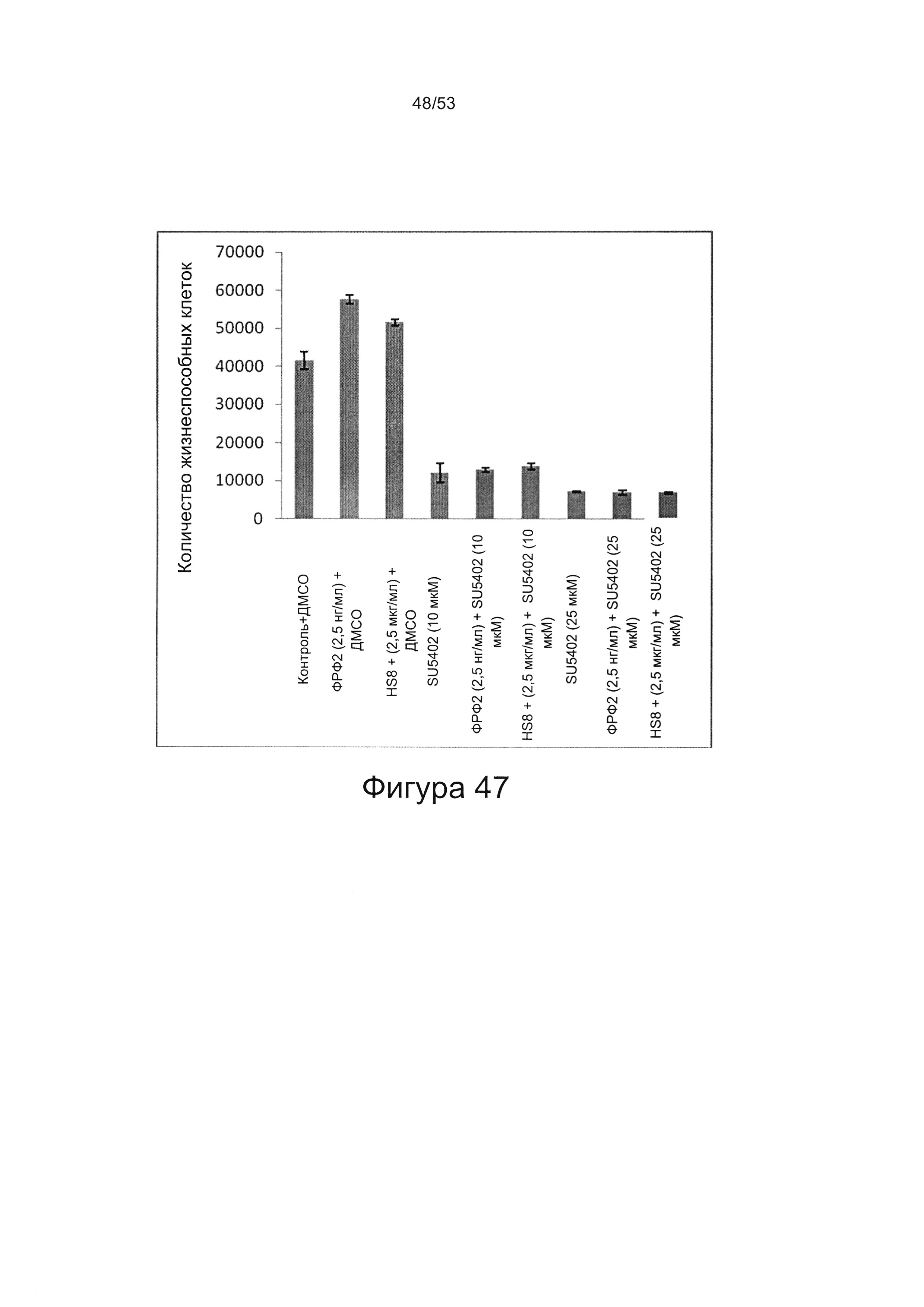
Как показано в настоящей заявке, HS8 способен стабилизировать ФРФ2, тем самым продлевая его действие. HS8 предотвращает разрушение ФРФ2 в культуральной среде (Фигура 46). Указанное свойство можно использовать для хранения препаратов ФРФ2 и получения культуральных сред, содержащих ФРФ2.
Таким образом, согласно одному аспекту настоящего изобретения предложена композиция, содержащая фактор роста и выделенный HS8. Фактор роста может представлять собой белковый фактор роста, и предпочтительно представляет собой ФРФ2. Композиция может содержать выделенный ФРФ2 и выделенный HS8. Согласно некоторым вариантам реализации настоящего изобретения композиция может представлять собой культуральную среду. Согласно другим вариантам реализации настоящего изобретения композиция может представлять собой фармацевтическую композицию или лекарственное средство, содержащее ФРФ2.
Указанная композиция может представлять собой препарат ФРФ2, содержащий ФРФ2 и выделенный HS8 в контейнере. Подходящий контейнер может представлять собой бутылку, флакон, пробирку или шприц.
В настоящем изобретении также предложен способ увеличения стабильности фактора роста, включающий приведение фактора роста в контакт с выделенным HS8.
Стабильность фактора роста может быть измерена в отношении его периода полувыведения, то есть количества времени, которое требуется для разложения и/или потери активности половины фактора роста, содержащегося в данной композиции. Фактор роста предпочтительно представляет собой белковый фактор роста, более предпочтительно ФРФ2. Действие HS8 направлено на поддержание и продление периода полувыведения ФРФ2. Способ может включать приведение выделенного HS8 в контакт с фактором роста (например, ФРФ2) в условиях in vitro, например, в качестве одного из этапов получения композиции фактора роста (ФРФ2), ее хранения или транспортировки. В другом варианте, способ может включать приведение выделенного HS8 в контакт с фактором роста (например, ФРФ2) в условиях in vivo, например, путем введения выделенного HS8 в ткань, в которой присутствует фактор роста (например, ФРФ2) [присутствующий в ткани природный фактор или экзогенно добавленный к ткани]. Способ также может включать этап внесения в ткань экзогенного фактора роста (например, ФРФ2).
Стабильность ФРФ2 в данной композиции или ткани, которая содержит выделенный HS8 (или к которой был добавлен выделенный HS8), может быть сопоставлена с этим показателем в аналогичной композиции, не содержащей HS8 (или в композиции, к которой не был добавлен выделенный HS8).
В композиции и способе, описанных выше, HS8 может присутствовать в очищенной форме, как описано в настоящей заявке. ФРФ2 может быть выделенным и/или очищенным, невыделенным или частично выделенным, например, представлять собой компонент материала внеклеточного матрикса, или присутствовать в композиции клеток.
Выделенный или очищенный ФРФ2 может представлять собой рекомбинантный ФРФ2. Рекомбинантный ФРФ2 коммерчески доступен от ряда производителей, таких как Peprotech; Merck Millipore, Массачусетс; Life Technologies Corporation; Gibco; и Invitrogen.
Возможно аспекты и варианты реализации настоящего изобретения не включают HS1 или HS2 (описанные в работе Brickman et al. (Glycobiology Vo. 8 No. 5 pp. 463-471, 1998 и в WO 2010/011185). Согласно некоторым вариантам реализации настоящего изобретения гепарансульфаты в соответствии с настоящим изобретением не включают HS2, и/или гепарансульфат, имеющий профиль расщепления на дисахариды под действием азотистой кислоты в соответствии с Фигурой 29, и/или гепарансульфат, имеющий профиль расщепления на дисахариды под действием азотистой кислоты в соответствии с Фигурой 30.
Описание предпочтительных вариантов реализации
Авторы настоящего изобретения выявили новый класс молекул гепарансульфатов, названных HS8. Было показано, что HS8 имеет следующие предпочтительные свойства:
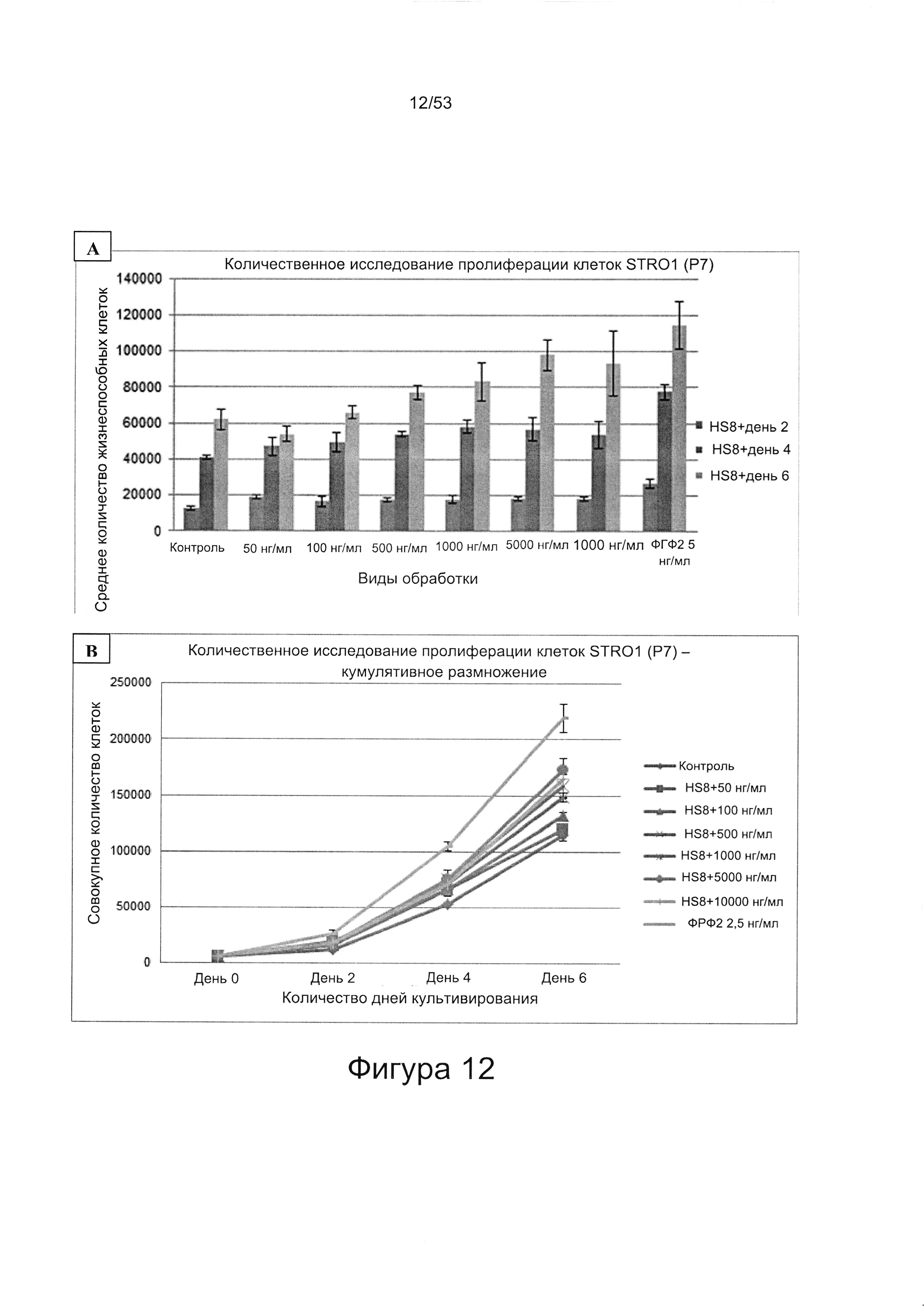
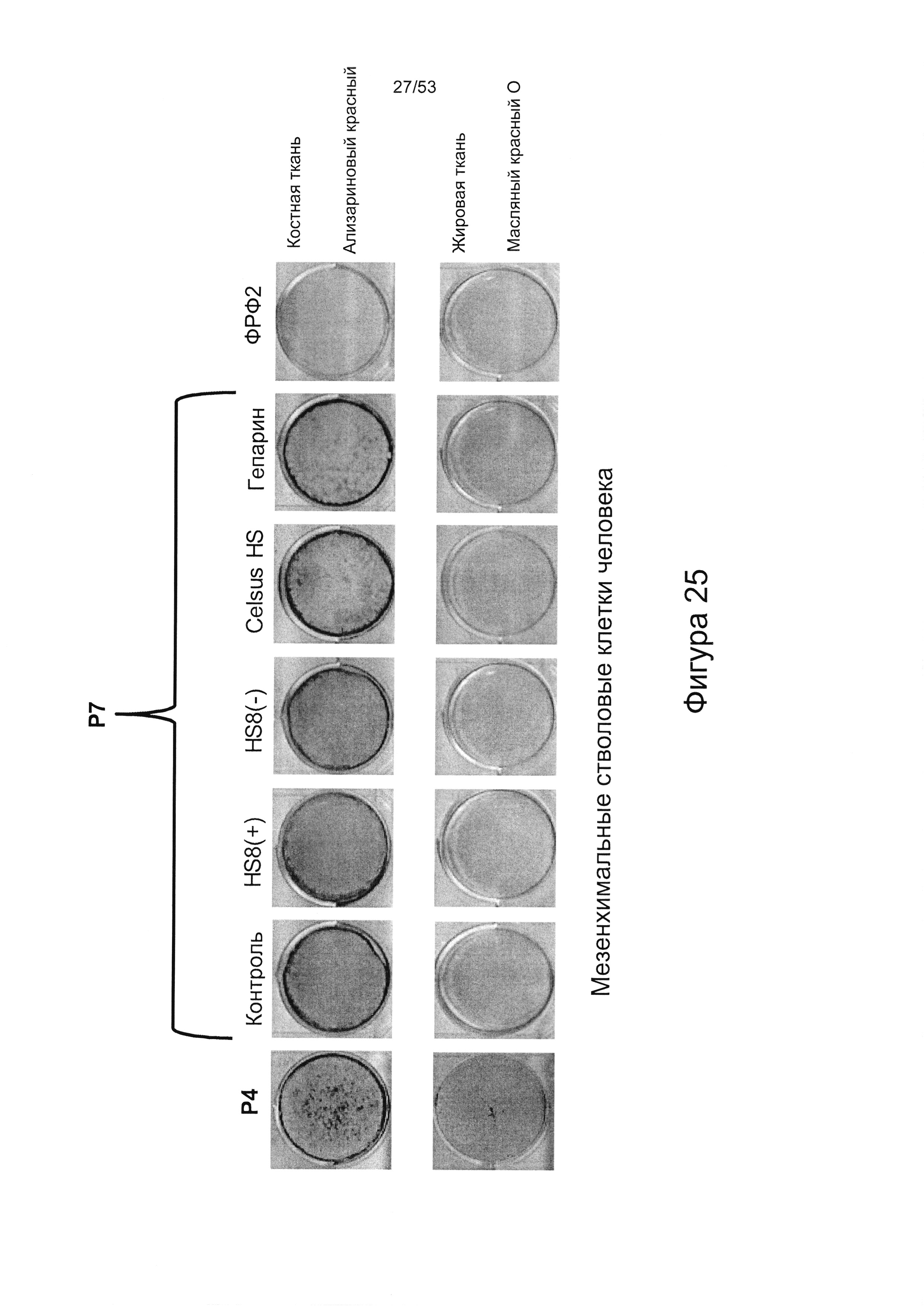
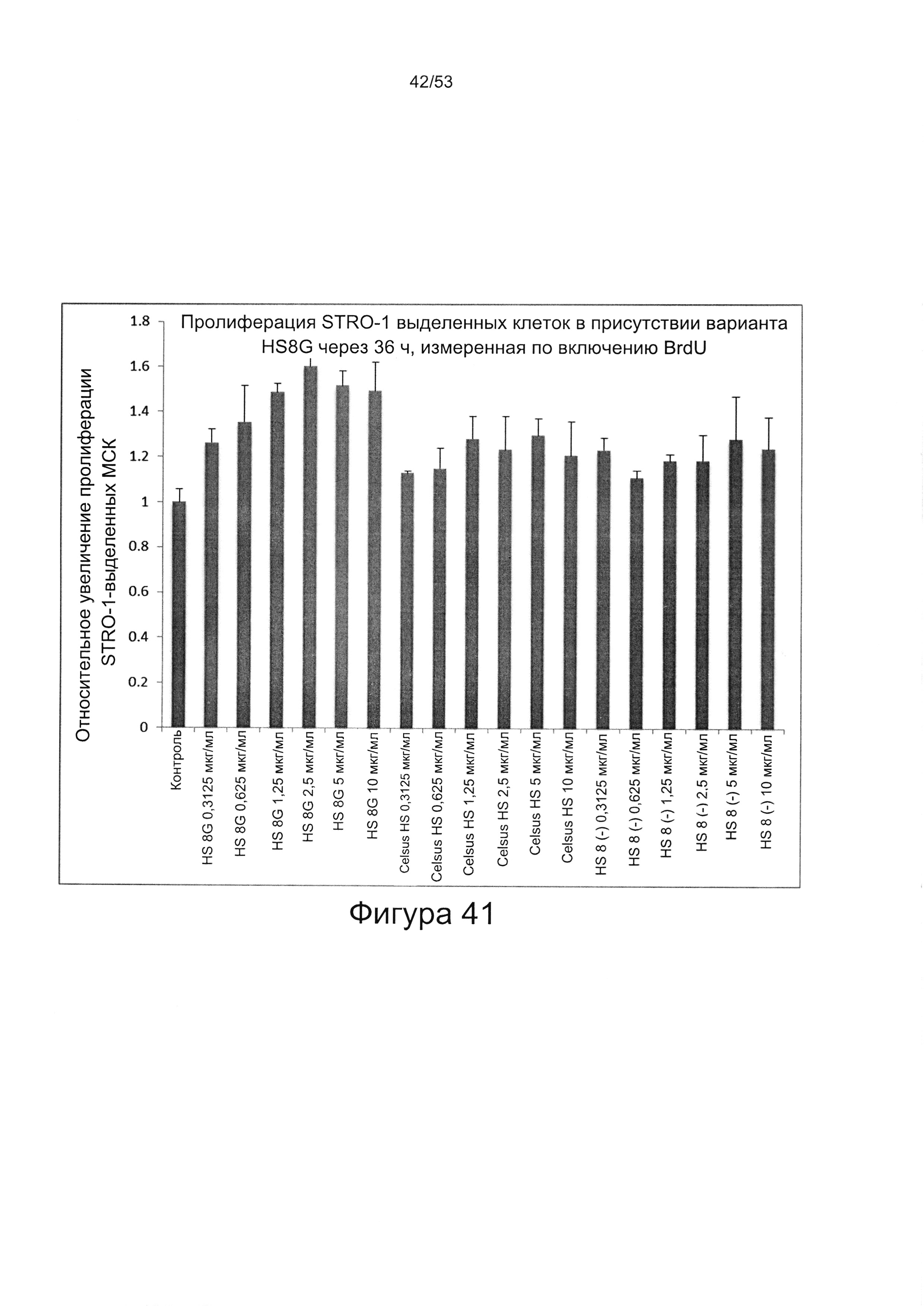
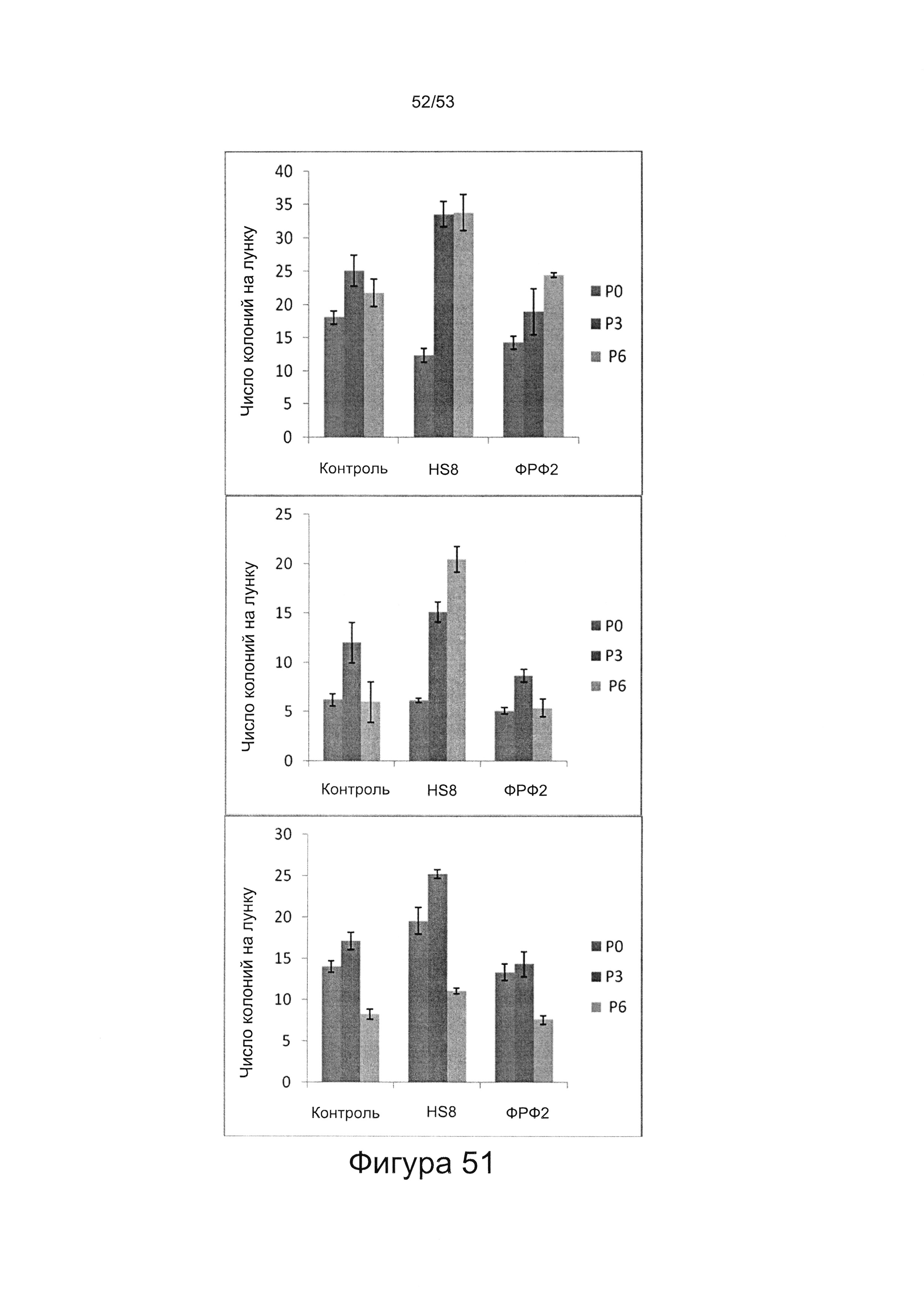
- HS8 обогащает популяцию мезенхимальными стволовыми клетками (МСК), экспрессирующими STRO-1 (Фигура 12, Фигура 14);
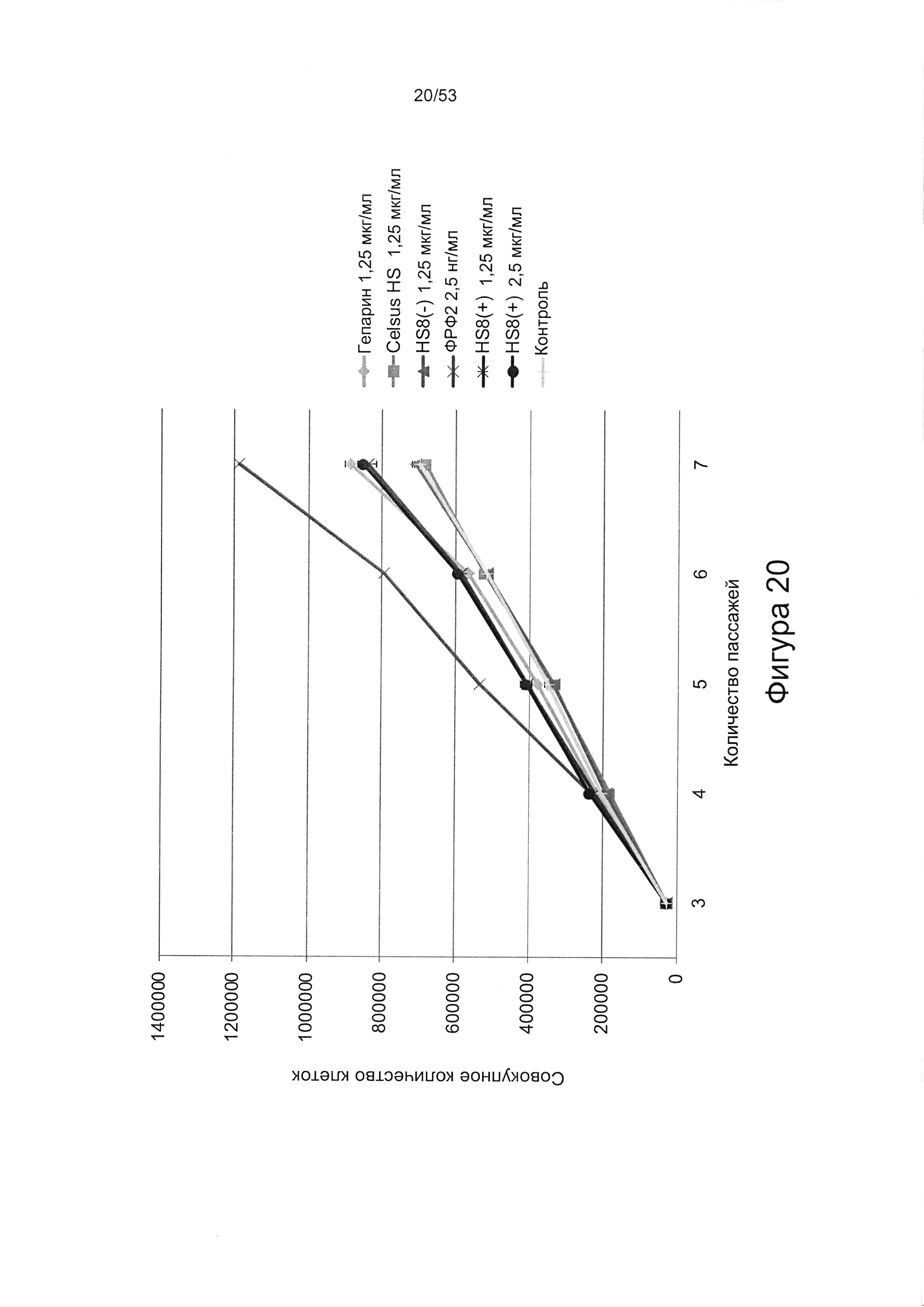
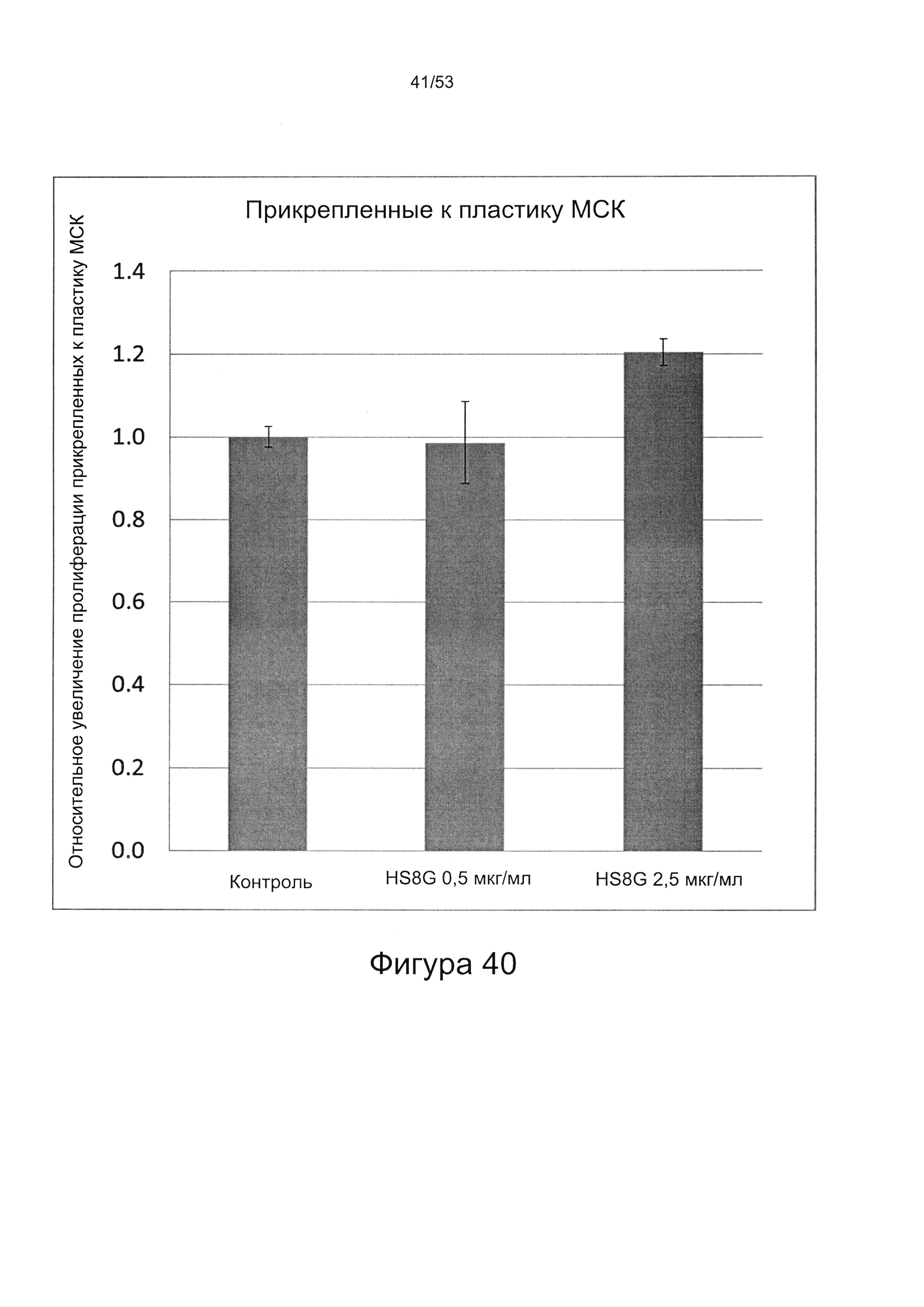
- HS8 приводит к увеличению размножения МСК, выделенных с помощью аффинного связывания STRO-1+ve, и МСК, выделенных с помощью прикрепления к пластиковой поверхности (Фигура 17, 18, 19,20).
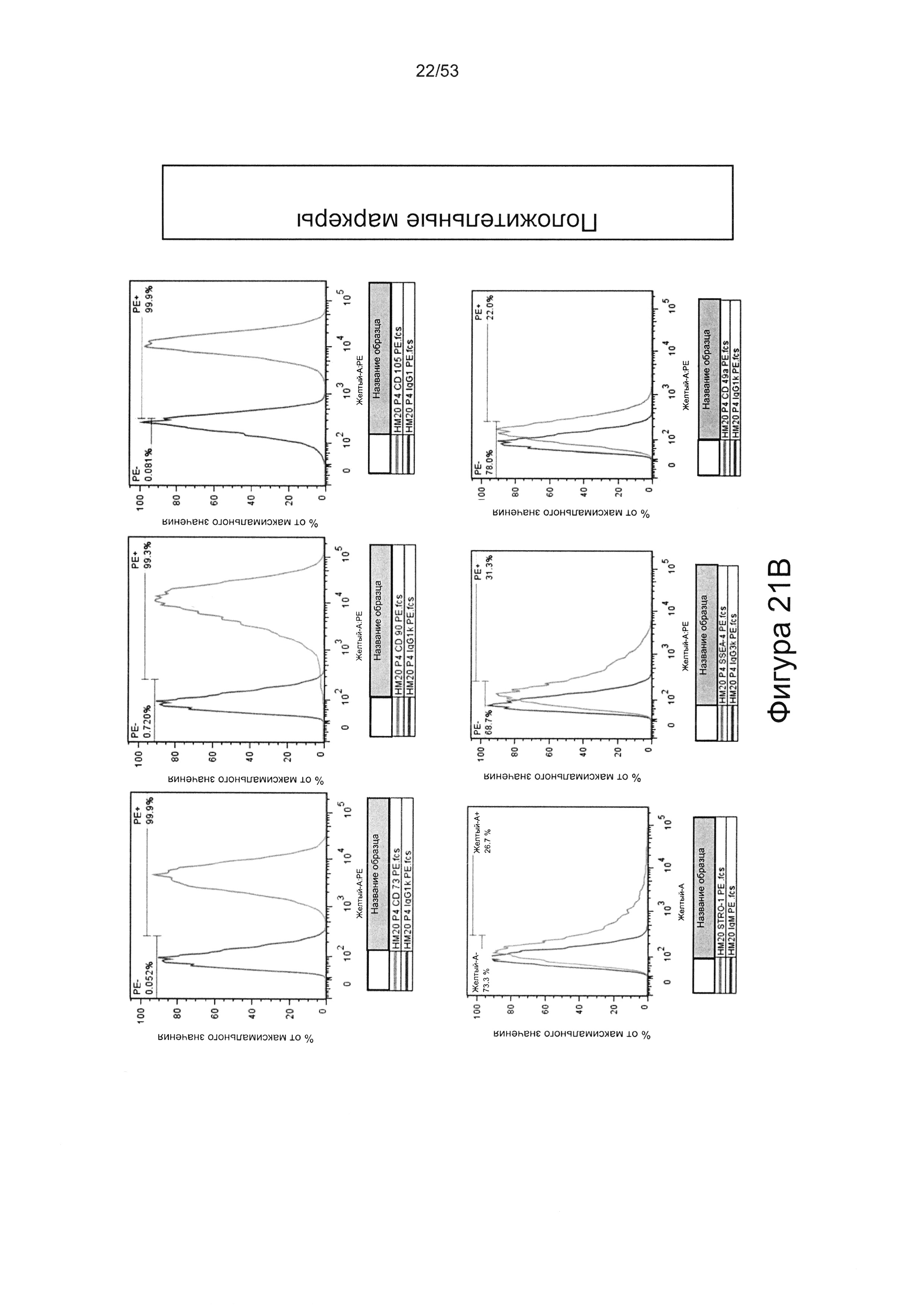
- в отличие от гепарансульфата, который лишен HS8 (фракция HS8-ve), HS8 обогащает популяцию клеток человеческими МСК, профиль экспрессии поверхностных маркеров которых соответствует признанному на международном уровне определению человеческих МСК (Фигура 22);
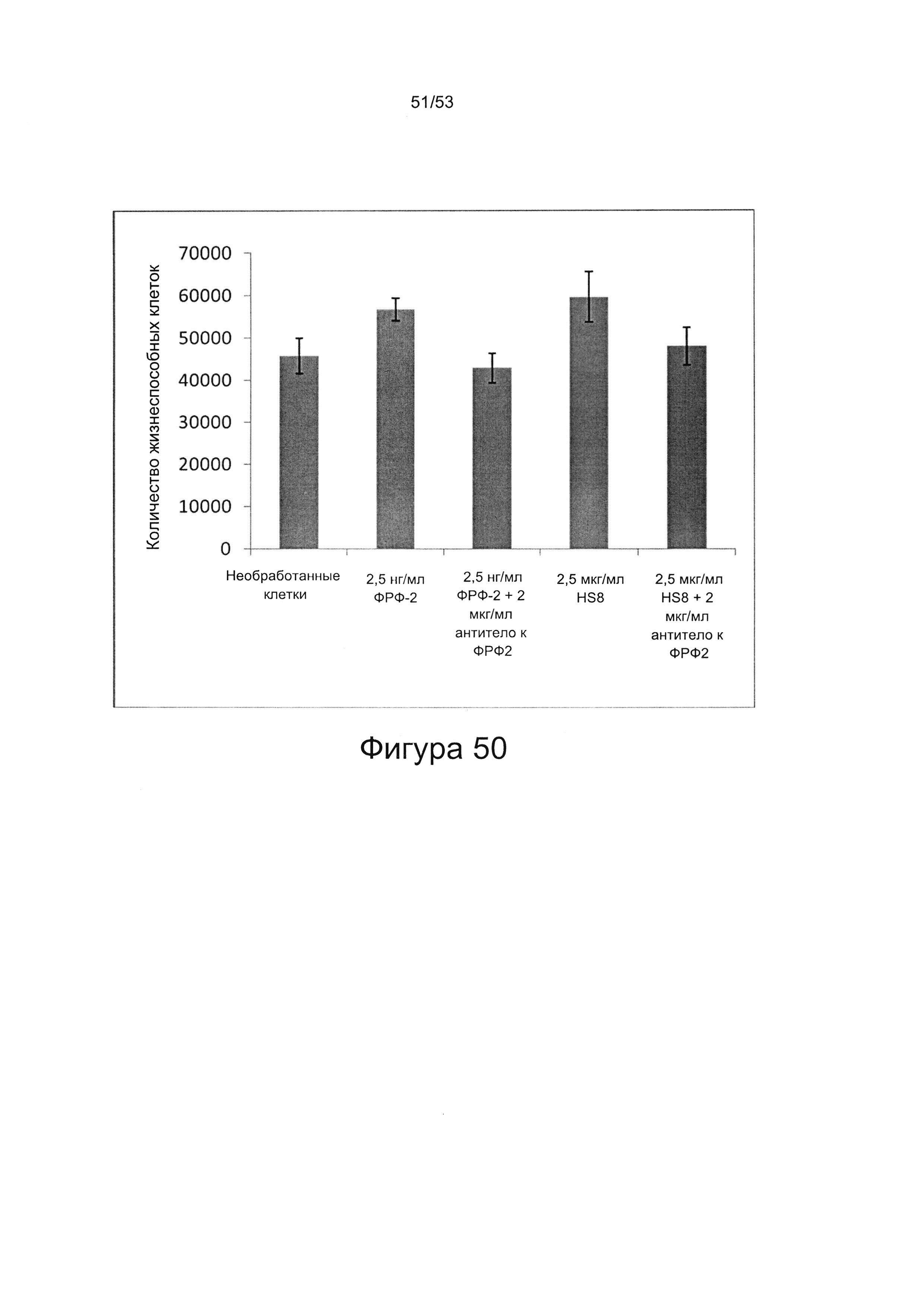
- культура МСКЧ с добавлением HS8 обеспечивает популяцию человеческих МСК, которые имеют высокий уровень экспрессии CD49a, SSEA-4 и STRO-1 (Фигура 22). Напротив, добавление ФРФ2, в качестве добавки к культуре, к МСКЧ негативно влияет на долю МСКЧ, которые экспрессируют STRO-1, и приводит к потере мультипотентности МСКЧ (Фигуры 22, 23 и 25).
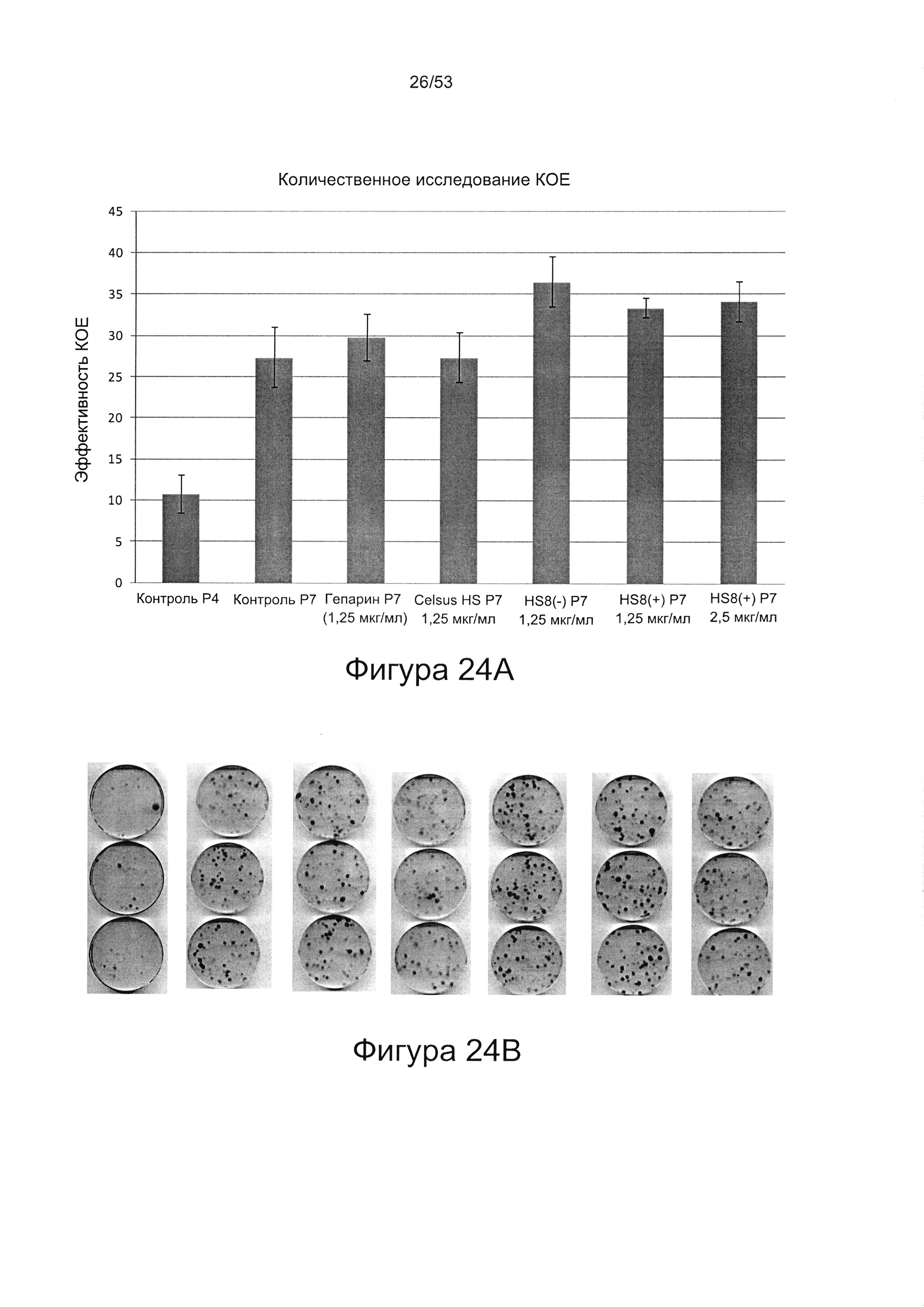
- HS8 увеличивает образование КОЕ-Ф;
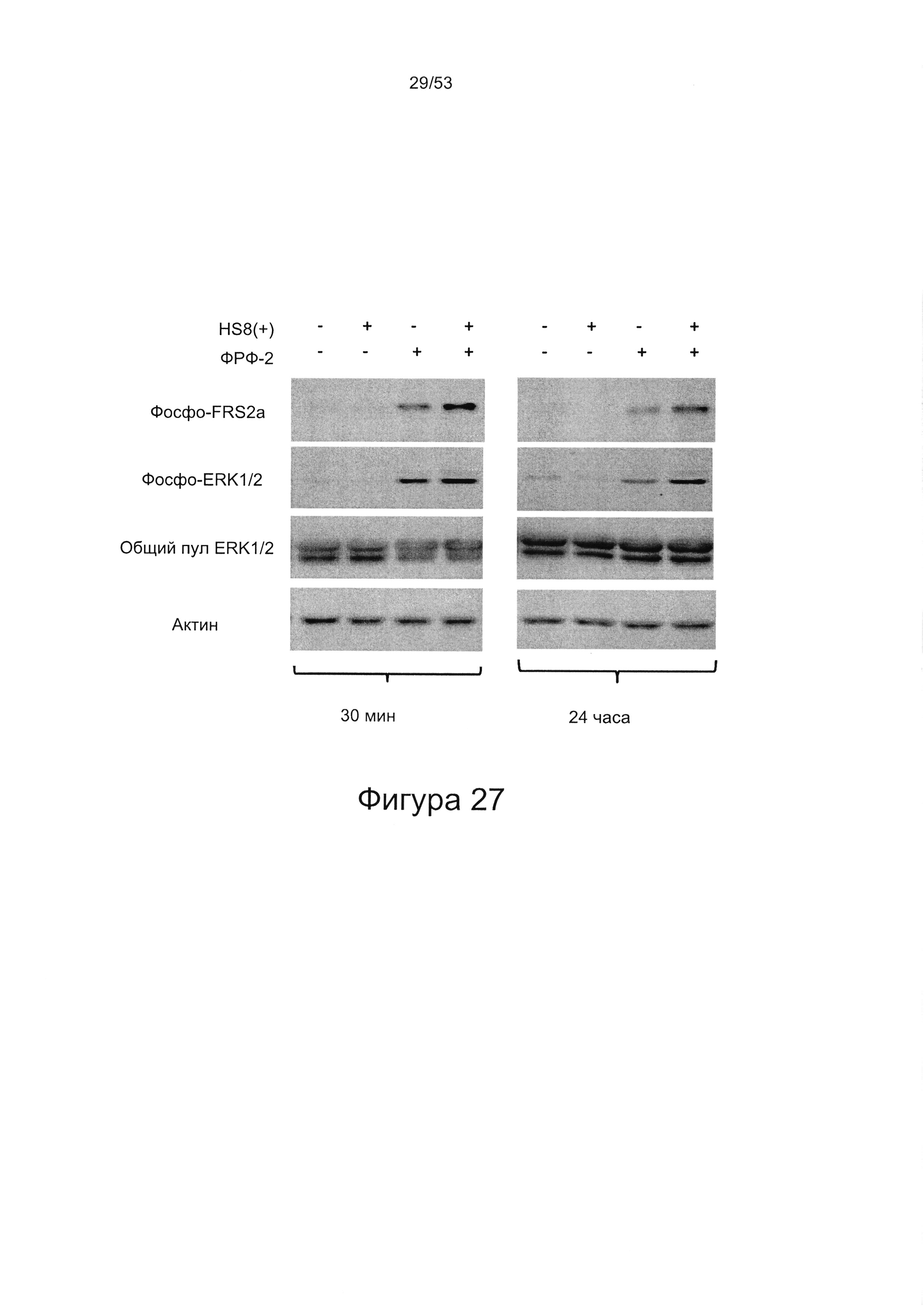
- HS8 усиливает размножение МСК, опосредованное ФРФ2 (Фигура 26);
- HS8 поддерживает передачу сигналов с участием ERK, опосредованную ФРФ2;
- HS8 способствует пролиферации мезенхимальных стволовых клеток (Фигуры 42 и 43).
HS8
Настоящее изобретение относится к классу молекул гепарансульфатов, называемых HS8. Молекулы HS8 могут быть получены с помощью способов обогащения смеси соединений, содержащей один или более ГАГ, которые связываются с полипептидом, соответствующим гепаринсвязывающему домену ФРФ2. В частности, молекулы HS8 могут быть получены путем обогащения гепарансульфатом, который связывается с гепарансвязывающим доменом ФРФ2, причем указанный домен содержит или состоит из аминокислотной последовательности YCKNGGF. Способ обогащения может быть использован для выделения HS8.
Настоящее изобретение также относится к смесям соединений, обогащенным HS8, и способам применения указанных смесей.
Помимо того, что HS8 может быть получен с помощью способа, описанного в настоящей заявке, также могут быть определены функциональные и структурные свойства HS8.
По своим функциональным свойствам HS8 способен связываться с пептидом, содержащим или состоящим из аминокислотной последовательности YCKNGGF (SEQ ID NO: 2). Указанный пептид может содержать одну или более дополнительных аминокислот на одном или обоих концах пептида. Например, пептид может представлять собой последовательность GHFKDPKRLYCKNGGF (SEQ ID NO: 1).
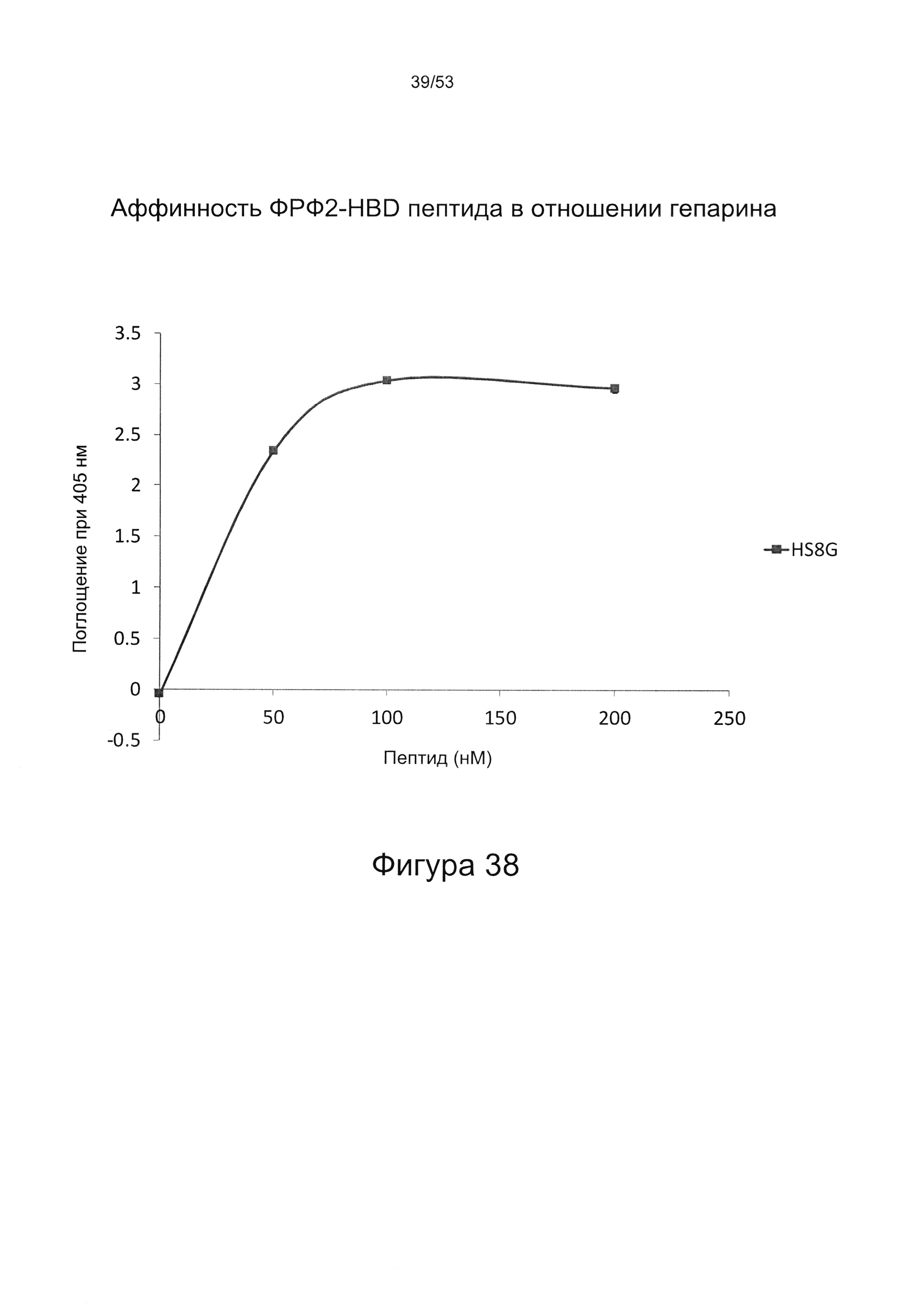
Предпочтительно, HS8 связывается с пептидом с величиной KD менее 100 мкМ, более предпочтительно с величиной KD менее 50 мкМ, 40 мкМ, 30 мкМ, 20 мкМ или 10 мкМ.
Предпочтительно, HS8 также связывается с белком ФРФ2 с величиной KD менее 100 мкМ, более предпочтительно с величиной KD менее 50 мкМ, 40 мкМ, 30 мкМ, 20 мкМ или 10 мкМ. Связывание HS8 и белка ФРФ2 может быть определено с помощью следующего количественного способа исследования.
ФРФ2 растворяют в блокирующем растворе (0,2% желатин в SAB) до концентрации 3 мкг/мл, и получают серию разведений от 0 мкг/мл до 3 мкг/мл в блокирующем растворе. Распределяют по 200 мкл каждого разведения ФРФ2 в трех повторах в лунки планшета для связывания гепарина/ГАГ, предварительно покрытые гепарином; инкубируют в течение 2 ч при 37°С, тщательно промывают три раза в SAB и добавляют по 200 мкл 250 нг/мл биотинилированного антитела к ФРФ2, растворенного в блокирующем растворе. Планшеты инкубируют в течение одного часа при 37°С, тщательно промывают три раза в SAB, затем добавляют по 200 мкл 220 нг/мл ExtrAvidin-AP, растворенного в блокирующем растворе, инкубируют в течение 30 минут при 37°С, осторожно трижды промывают в SAB и постукивают, чтобы удалить остаточную жидкость, затем добавляют по 200 мкл реагента для проявления окрашивания (п-нитрофенилфосфат SigmaFAST). Планшеты инкубируют при комнатной температуре в течение 40 минут, и затем регистрируют поглощение при длине волны 405 нм в течение одного часа.
При использовании указанного количественного способа исследования связывание может быть определено путем измерения поглощения и может быть определено по отношению к контролям, таким как белок ФРФ2 в отсутствие добавленного гепарансульфата или белок ФРФ2, к которому добавлен гепарансульфат, не связывающийся с белком ФРФ2.
Связывание HS8 предпочтительно является специфичным, в отличие от неспецифичного связывания и применительно к тому, что HS8 может быть выбран из других гепарансульфатов и/или ГАГ с помощью способа, включающего выбор гепарансульфатов, способных к высокоаффинному связывающему взаимодействию с пептидом, содержащим последовательность YCKNGGF, такую как SEQ ID NO: 1, или с белком ФРФ2.
HS8 в соответствии с настоящим изобретением предпочтительно увеличивает пролиферацию стволовых клеток, сохраняя при этом их плюрипотентность или мультипотентность.
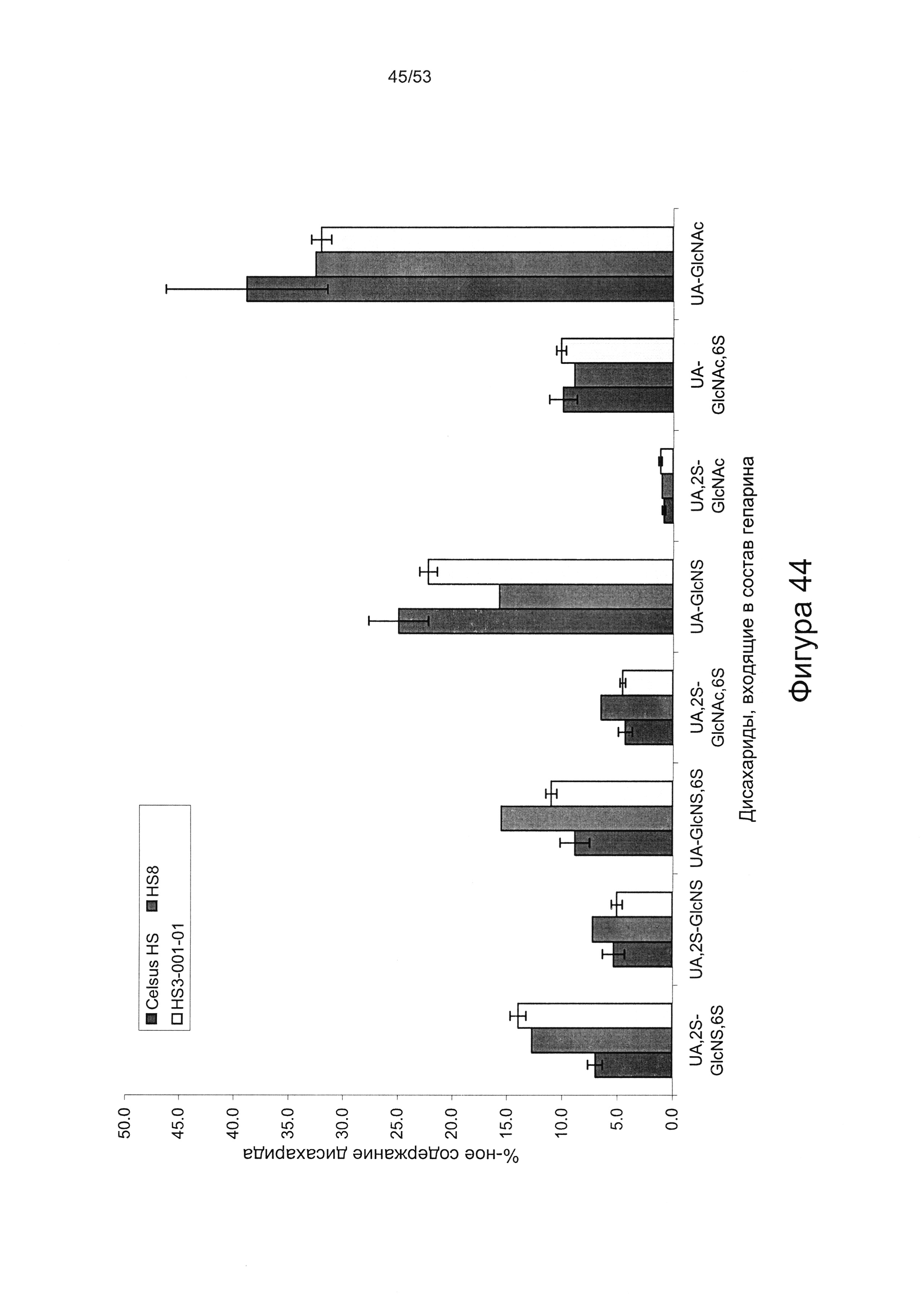
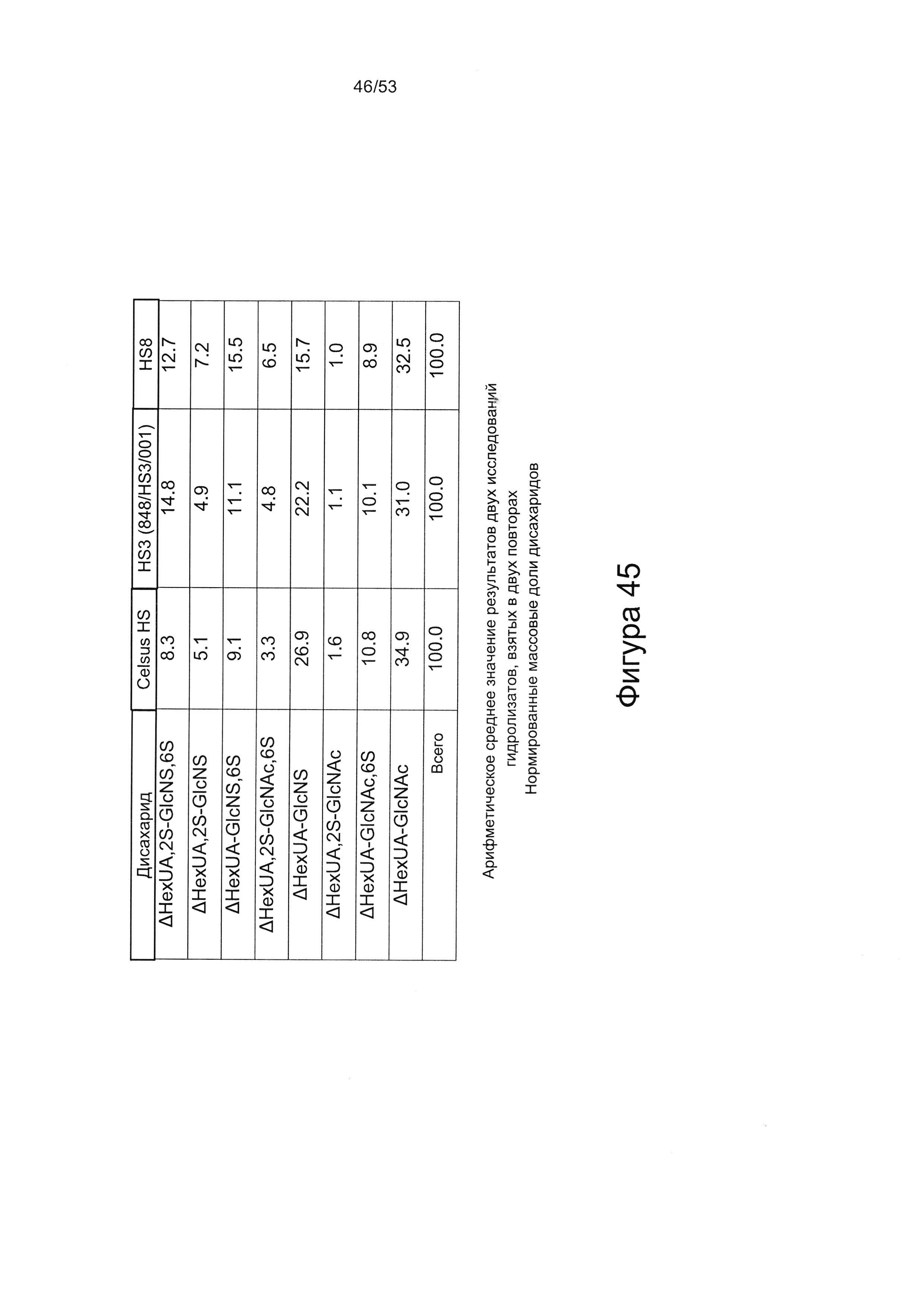
Дисахаридный состав HS8 после полного расщепления гепаринлиазами I, II и III с последующим исследованием полученных фрагментов дисахаридов с помощью капиллярного электрофореза показан на Фигурах 44 и 45.
HS8 в соответствии с настоящим изобретением включает гепарансульфат, дисахаридный состав которого находится в пределах ±10% (более предпочтительно ± одно значение из 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0,5%) от нормированных процентных значений, указанных для каждого дисахарида на Фигуре 45 для удерживаемых молекул HS8, или на Фигуре 44 для удерживаемых молекул HS8, согласно результатам определения дисахаридного состава HS8 после полного расщепления гепаринлиазой I, II и III с последующим исследованием полученных фрагментов дисахаридов с помощью капиллярного электрофореза.
Дисахаридный состав HS8, согласно результатам определения дисахаридного состава HS8 после полного расщепления гепаринлиазами I, II и III с последующим исследованием полученных фрагментов дисахаридов с помощью капиллярного электрофореза, может иметь состав дисахаридов в соответствии с любой из следующих таблиц:
или
или
или
или
или
Согласно предпочтительным вариантам реализации настоящего изобретения общая массовая доля 8 перечисленных дисахаридов составляет 100% (возможно ±3,0% или менее, или ±2,0% или менее, ±1,0% или менее, ±0,5% или менее).
Сравнение HS8 с ГС, который был выделен на основании высокой аффинности в отношении фактора роста ВМР2 и назван HS3 (описан в WO 2010/030244), показывает, что структурное различие HS8 по сравнению с HS3 характеризуется количеством следующих дисахаридов: ΔUA-GlcNS,6S и ΔUA-GlcNS. В частности, HS8 имеет более высокое процентное содержание ΔUA-GlcNS,6S, чем HS3, и более низкое процентное содержание ΔUA-GlcNS, чем HS3.
В этой связи HS8 может быть охарактеризован процентным содержанием ΔUA-GlcNS,6S составляющим 15,5±4,0 или менее, или ±3,5 или менее, или ±3,0 или менее, или ±2,5 или менее, или ±2,0 или менее, или ±1,5 или менее, или ±1,0 или менее, или ±0,5 или менее, или ±0,25 или менее, или ±0,1 или менее. HS8 может быть дополнительно или альтернативно охарактеризован процентным содержанием ΔUA-GlcNS составляющим 15,7±4,0 или менее, или ±3,5 или менее, или ±3,0 или менее, или ±2,5 или менее, или ±2,0 или менее, или ±1,5 или менее, или ±1,0 или менее, или ±0,5 или менее, или ±0,25 или менее, или ±0,1 или менее.
HS8 также может быть охарактеризован процентным содержанием ΔUA,2S-GlcNS6S составляющим 12,7±1,5 или менее, или ±1,0 или менее, или ±0,5 или менее, или ±0,25 или менее, или ±0,1 или менее.
HS8 также может быть охарактеризован процентным содержанием ΔUA,2S-GlcNS составляющим 7,2±2,0 или менее, или ±1,5 или менее, или ±1,0 или менее, или ±0,5 или менее, или ±0,25 или менее, или ±0,1 или менее.
HS8 также может быть охарактеризован процентным содержанием ΔUA,2S-GlcNAc,6S составляющим 6,5±1,5 или менее, или ±1,0 или менее, или ±0,5 или менее, или ±0,25 или менее, или ±0,1 или менее.
HS8 также может быть охарактеризован процентным содержанием ΔUA-GlcNAc,6S составляющим 8,9±0,5 или менее, или ±0,25 или менее, или ±0,1 или менее.
В перечисленных вариантах реализации процентное содержание остальных дисахаридных компонентов может представлять собой величину, указанную выше, или величину, приведенную на Фигуре 44 или 45 ± одно из следующих значений: 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0,5%.
Расщепление HS8 гепаринлиазами I, II и III, и/или исследование дисахаридов с помощью капиллярного электрофореза предпочтительно осуществляют в соответствии с примером 18.
Расщепление препаратов ГС ферментами гепаринлиазами может быть проведено следующим образом: каждый из препаратов ГС (1 мг) растворяют в 500 мкл буферного раствора на основе ацетата натрия (100 мМ, содержащего 10 мМ ацетата кальция, рН=7,0) и добавляют по 2,5 мЕд каждого из трех ферментов; образцы инкубируют при 37°С в течение ночи (24 ч) при осторожном переворачивании пробирок (9 оборотов в минуту); далее по 2,5 мЕд каждого из трех ферментов добавляют к образцам, которые затем инкубируют при 37°С в течение еще 48 ч при осторожном переворачивании пробирок (9 оборотов в минуту); продукты расщепления инактивируют путем нагревания (100°С, 5 мин) и затем лиофилизируют; продукты расщепления повторно суспендируют в 500 мкл воды, и отбирают по одной аликвоте (50 мкл) для исследования.
Капиллярный электрофорез (КЭ) дисахаридов, полученных в результате расщепления препаратов ГС, может быть осуществлен следующим образом: рабочий буфер для капиллярного электрофореза получают путем добавления водного раствора 20 мМ Н3РО4 к раствору 20 мМ Na2HPO4⋅12H2O, чтобы получить рН=3,5; буфер для промывки колонки содержит 100 мМ NaOH (полученный путем разбавления 50% масс./масс. NaOH); рабочий буфер и буфер для промывки колонки фильтруют с использованием фильтровального блока, оснащенного мембранными фильтрами из ацетата целлюлозы с размером пор 0,2 мкМ; исходные растворы дисахарида Is (например, 12) получают путем растворения дисахаридов в воде (1 мг/мл); калибровочные кривые для стандартов определяют путем приготовления смеси, содержащей все стандарты в количестве 10 мкг/100 мкл каждого дисахарида, и серии разведений, содержащей 10, 5, 2,5, 1,25, 0,625, 0,3125 мкг/100 мкл, включая 2,5 мкг внутреннего стандарта (ΔUA,2S-GlcNCOEt,6S). Продукты расщепления ГС разбавляют (50 мкл/мл) водой, и в каждый образец добавляют один и тот же внутренний стандарт (2,5 мкг). Растворы лиофилизируют и повторно суспендируют в воде (1 мл). Образцы фильтруют с использованием одноразовых гидрофильных фильтров для шприца, изготовленных из ПТФЭ.
Исследования проводят с использованием устройства для капиллярного электрофореза на непокрытой капиллярной колонке из плавленого кварца при 25°С, используя 20 мМ рабочий буфер и капиллярное напряжение 30 кВ. Образцы вводят в капиллярную колонку с помощью гидродинамической инъекции со стороны катода (обратная полярность). Перед каждым опытом капиллярную колонку промывают 100 мМ NaOH (2 мин), водой (2 мин) и предварительно кондиционируют рабочим буфером (5 мин). Система для пополнения объема буфера заменяет буфер во впускных и выпускных трубках, чтобы обеспечить одинаковые объемы, значения рН и ионной силы поддерживают постоянными. Контрольные образцы, содержащие только воду, испытывают в начале, середине и конце последовательности образцов. Поглощение измеряют при длине волны 232 нм. Все данные хранят в базе данных, затем извлекают и обрабатывают повторно.
Исследования продуктов расщепления могут быть выполнены с двумя или тремя повторами, и нормированную массовую долю дисахаридов в продукте расщепления ГС рассчитывают как среднюю величину для результатов исследований.
Согласно некоторым вариантам реализации настоящего изобретения HS8 имеет усредненную (среднюю) молекулярную массу в диапазоне от 18 до 27 кДа. Согласно некоторым вариантам реализации настоящего изобретения молекулярная масса может находиться в диапазоне от 20 до 25 кДа, от 21 до 25 кДа, от 21 до 24 кДа, от 21 до 23 кДа, от 20 до 24 кДа, от 20 до 23 кДа или от 20 до 22 кДа.
Согласно некоторым вариантам реализации настоящего изобретения цепь HS8 содержит по меньшей мере 25 дисахаридных блоков. Согласно некоторым вариантам реализации настоящего изобретения HS8 может содержать по меньшей мере 26 дисахаридов, по меньшей мере 27 дисахаридов, по меньшей мере 28 дисахаридов, по меньшей мере 29 дисахаридов, по меньшей мере 30 дисахаридов, по меньшей мере 31 дисахарид, по меньшей мере 32 дисахарида, по меньшей мере 33 дисахарида, по меньшей мере 34 дисахарида, по меньшей мере 35 дисахаридов, по меньшей мере 36 дисахаридов, по меньшей мере 37 дисахаридов, по меньшей мере 38 дисахаридов, по меньшей мере 39 дисахаридов, по меньшей мере 40 дисахаридов, по меньшей мере 41 дисахарид, по меньшей мере 42 дисахарида, по меньшей мере 43 дисахарида или по меньшей мере 44 дисахарида.
Чтобы выявить HS8 авторы настоящего изобретения использовали способ, который включает обогащение молекулами гликозаминогликанов, которые способны связываться с определенными полипептидами, имеющими гепаринсвязывающий домен. Выделенные смеси и/или молекулы ГАГ затем могут быть идентифицированы и испытаны для определения их способности модулировать размножение и дифференцировку клеток и тканей, экспрессирующих белок, содержащий гепаринсвязывающий домен. Такой способ обеспечивает контролируемое исследование влияния конкретных последовательностей ГАГ сахаридов на размножение и дифференцировку клеток и тканей как в условиях in vitro, так и в условиях in vivo. Указанный способ описан в заявке PCT/GB 2009/000469 (WO 2010/030244), включенной в настоящую заявку посредством ссылки. Авторы настоящего изобретения применили этот способ в отношении фактора роста фибробластов 2 (ФРФ2), чтобы выделить и охарактеризовать ГАГ, способные прочно связываться с ФРФ2.
Соответственно, для выявления HS8 авторы настоящего изобретения предложили способ выделения гликозаминогликанов, способных связываться с белками, содержащими гепарин-/гепарансвязывающие домены, включающий:
(i) обеспечение твердой подложки, с прикрепленными к ней молекулами полипептида, содержащего гепаринсвязывающий домен;
(ii) приведение указанных молекул полипептида в контакт со смесью, содержащей гликозаминогликаны, так, чтобы обеспечить образование комплексов полипептид-гликозаминогликан;
(iii) отделение указанных комплексов полипептид-гликозаминогликан от остальной части смеси;
(iv) диссоциацию гликозаминогликанов из комплексов полипептид-гликозаминогликан;
(v) сбор указанных диссоциированных гликозаминогликанов.
Авторы настоящего изобретения также предложили выделенные гликозаминогликаны, выявленные по их способности модулировать размножение или дифференцировку клеток или тканей. Для того чтобы обеспечить такие гликозаминогликаны авторы настоящего изобретения предложили способ выявления гликозаминогликанов, способных стимулировать или ингибировать размножение и/или дифференцировку клеток и/или тканей, включающий:
(i) обеспечение твердой подложки, с прикрепленными к ней молекулами полипептида, содержащего гепаринсвязывающий домен;
(ii) приведение указанных молекул полипептида в контакт со смесью, содержащей гликозаминогликаны, так, чтобы обеспечить образование комплексов полипептид-гликозаминогликан;
(iii) отделение указанных комплексов полипептид-гликозаминогликан от остальной части смеси;
(iv) диссоциацию гликозаминогликанов из комплексов полипептид-гликозаминогликан;
(v) сбор указанных диссоциированных гликозаминогликанов;
(vi) добавление собранных гликозаминогликанов к клеткам или тканям, в которых присутствует белок, содержащий аминокислотную последовательность гепаринсвязывающего домена;
(vii) измерение одного или более из таких показателей как пролиферация клеток, дифференцировка клеток, экспрессия одного или более белковых маркеров.
Авторы настоящего изобретения использовали указанные способы для выявления ГАГ, способного связываться с ФРФ2 (который они назвали HS8), причем полипептид, использованный авторами настоящего изобретения в данном способе, содержит гепаринсвязывающий домен GHFKDPKRLYCKNGGF (SEQ ID NO: 1).
В соответствии со способом, предложенным авторами настоящего изобретения, смесь, содержащая ГАГ, может содержать синтетические гликозаминогликаны. Однако предпочтительными являются ГАГ, полученные из клеток или тканей. Например, смесь может содержать внеклеточный матрикс, в котором материал внеклеточного матрикса получен путем соскабливания живой ткани in situ (то есть непосредственно из ткани в организме человека или животного, из которого он получен) или путем соскабливания ткани (живой или мертвой), которая была извлечена из организма человека или животного. В другом варианте, материал внеклеточного матрикса может быть получен из клеток, выращенных в культуре. Материал внеклеточного матрикса может быть получен из соединительной ткани или клеток соединительной ткани, например, кости, хряща, мышцы, жира, связки или сухожилия. В одном варианте был использован коммерчески доступный гепарансульфат из слизистой оболочки кишечника свиньи (Celsus HS).
Компонент ГАГ может быть извлечен из образца ткани или клеток или экстракта с помощью серии стандартных этапов разделения (например, с помощью анионообменной хроматографии), хорошо известных специалистам в данной области техники
Смеси ГАГ могут содержать смесь различных типов гликозаминогликанов, которые могут включать декстрансульфаты, хондроитинсульфаты и гепарансульфаты. Предпочтительно, смесь ГАГ, контактирующая с твердой подложкой, обогащена гепарансульфатом. Фракция ГАГ, обогащенная гепарансульфатом, может быть получена путем выполнения колоночной хроматографии на смеси ГАГ, например, хроматографии со слабыми, средними или сильными анионообменниками, а также жидкостной хроматографии высокого давления с сильным анионообменным материалом (SAX-HPLC), с отбором соответствующей фракции.
Собранные ГАГ могут быть подвергнуты дальнейшему исследованию с целью выявления ГАГ, например, определения состава или последовательности ГАГ, или определения структурных характеристик ГАГ. Структура ГАГ, как правило, очень сложна, и, принимая во внимание имеющиеся в настоящее время аналитические методики, точное определение структуры последовательности ГАГ в большинстве случаев не представляется возможным.
Однако собранные молекулы ГАГ могут быть подвергнуты частичному или полному расщеплению сахаридов (например, химическому расщеплению азотистой кислотой или ферментативному расщеплению лиазами, такими как гепариназа III) с получением сахаридных фрагментов, которые определяют характерные и диагностические свойства ГАГ. В частности, расщепление с образованием дисахаридов (или тетрасахаридов) может быть использовано для измерения процентного содержания каждого полученного дисахарида, что позволит получить характерный дисахаридный «отпечаток» ГАГ.
Профиль сульфатирования ГАГ также может быть определен и использован для определения структуры ГАГ. Например, для гепарансульфата профиль сульфатирования аминосахаров и в положениях С2, С3 и С6 может быть использован, чтобы охарактеризовать гепарансульфат.
Исследование дисахаридного состава, исследование тетрасахаридного состава и исследование характера сульфатирования можно использовать в комбинации с другими аналитическими методиками, такими как ВЭЖХ, масс-спектрометрия и ЯМР, каждая из которых может обеспечить уникальный спектр для ГАГ. При использовании в комбинации эти методики могут обеспечить окончательную структурную характеристику ГАГ.
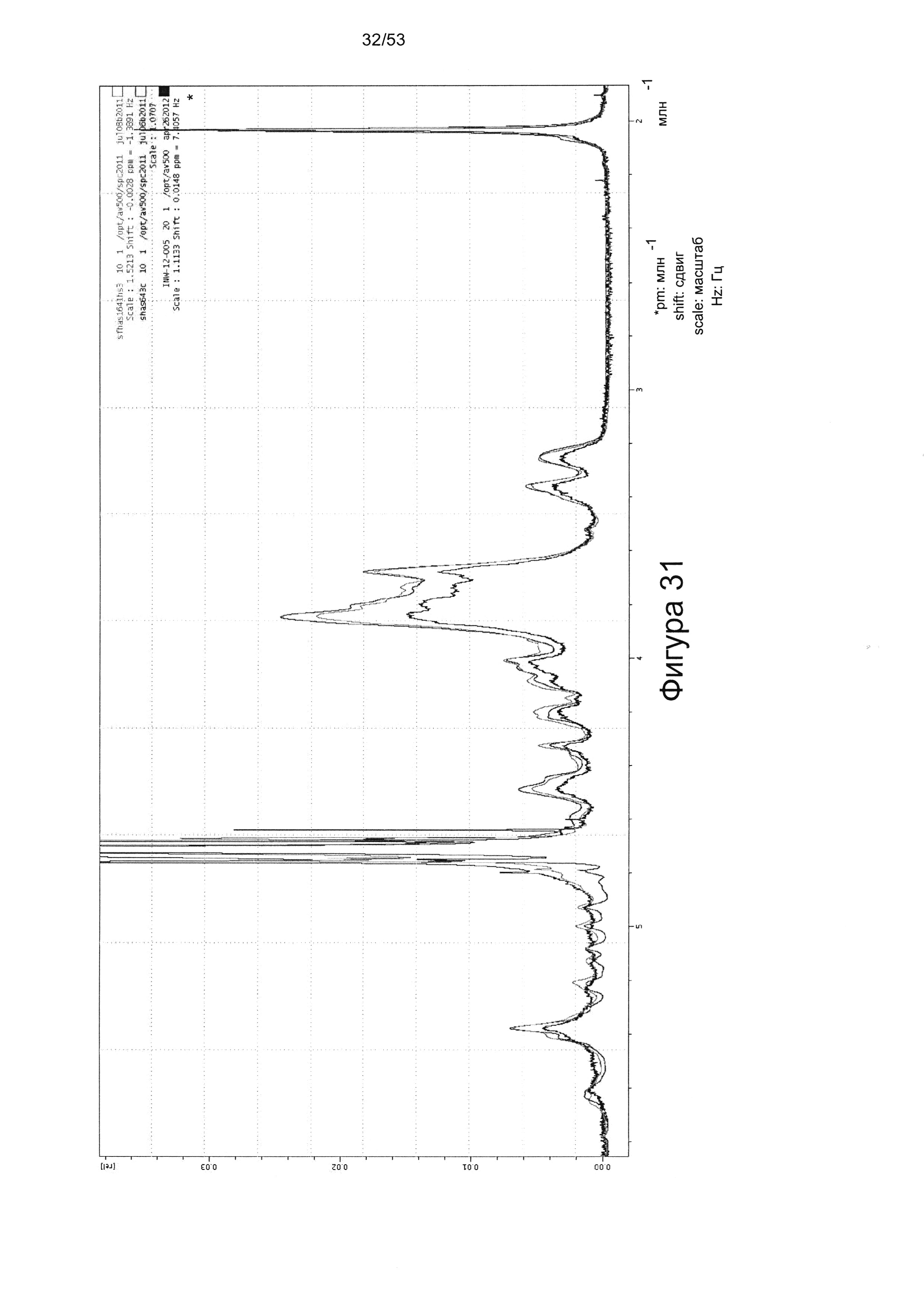
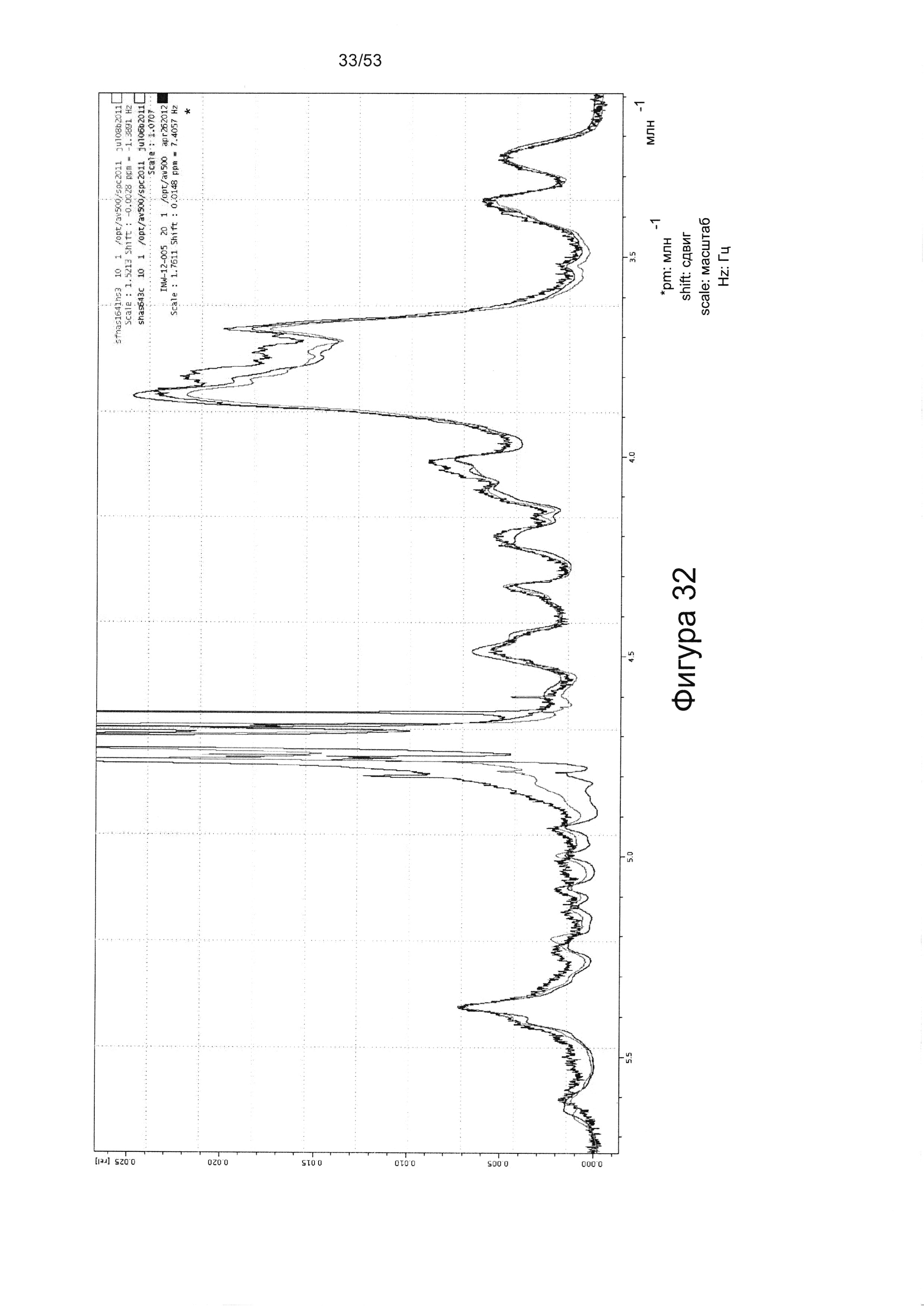
Например,1Н-ЯМР спектры HS8, по сравнению с Celsus HS (из которого был получен HS8) и HS3 (ГС, связывающий ВМР2), показаны на Фигурах 31 и 32. HS8 в соответствии с настоящим изобретением может иметь спектры1Н-ЯМР, которые соответствуют спектрам HS8, приведенным на Фигуре 31 или 32. Согласно некоторым вариантам реализации настоящего изобретения HS8 в соответствии с настоящим изобретением может иметь спектры1Н-ЯМР, в которых спектры при 4,0-3,5 м.д. соответствует таковым для HS8 на Фигуре 32 (верхняя линия между 3,8-3,7 м.д.). В некоторых вариантах реализации HS8 в соответствии с настоящим изобретением может иметь пик при приблизительно 3,8 м.д. и/или пик при приблизительно 3,7 м.д. Согласно некоторым вариантам реализации настоящего изобретения HS8 можно отличить от других HS8 по его уникальным1Н-ЯМР спектрам метина и/или метилена, например, как показано на Фигуре 32.
Высокоаффинное связывающее взаимодействие между ГАГ и гепаринсвязывающим доменом указывает на то, что ГАГ будет содержать специфичную сахаридную последовательность, которая способствует высокоаффинному связывающему взаимодействию. Следующий этап может включать определение полной или частичной сахаридной последовательности ГАГ или ключевой части ГАГ, вовлеченной в связывающее взаимодействие.
Комплексы ГАГ-полипептид могут быть подвергнуты обработке агентом, который лизирует цепи гликозаминогликанов, например, лиазой. Обработка лиазой может привести к отщеплению частей связанного ГАГ, которые не принимают участия в связывающем взаимодействии с полипептидом. Части ГАГ, которые принимают участие в связывающем взаимодействии с полипептидом, могут быть защищены от действия лиазы. После удаления лиазы, например, после этапа промывки, молекула ГАГ, которая остается связанной с полипептидом, представляет собой специфичного партнера по связыванию («лиганд ГАГ») полипептида. Вследствие более низкой сложности коротких молекул ГАГ, после диссоциации и сбора лиганда ГАГ можно ожидать более высокой степени структурной характеристики лиганда ГАГ. Например, комбинация результатов любого из исследований сахаридной последовательности (т.е. первичной (линейной) последовательности моносахаридов, содержащихся в лиганде ГАГ), профиля сульфатирования, исследования расщепления на дисахариды и/или тетрасахариды, спектров ЯМР, спектров масс-спектрометрии и спектров ВЭЖХ может обеспечить высокий уровень структурной характеристики лиганда ГАГ.
В настоящей заявке термины «обогащающий», «обогащение», «обогащенный» и т.д. описывают процесс (или состояние), при котором относительный состав смеси изменяется (или был изменен) так, что фракция данной смеси, полученная из одной или более из указанных молекул, увеличивается, в то время как фракция данной смеси, полученная из одной или более различных молекул, уменьшается.
ГАГ, выделенные путем обогащения, могут быть чистыми, т.е. содержать по существу только один тип ГАГ, или могут оставаться смесью различных типов ГАГ, смесью, имеющей высокое процентное содержание конкретных ГАГ, которые связываются с гепаринсвязывающим доменом, по сравнению с исходной смесью.
Выявленные ГАГ предпочтительно оказывают функциональное действие при контакте с клетками или тканями, в которых экспрессируется или содержится белок, содержащий гепаринсвязывающий домен. Функциональное действие может представлять собой модулирующее или потенцирующее действие.
Функциональное действие может заключаться в способствовании (стимулировании) или ингибировании пролиферации клеток определенного типа или дифференцировки клеток одного типа в другой, или экспрессии одного или более белковых маркеров. Например, ГАГ могут способствовать пролиферации клеток, то есть увеличению количества клеток, или способствовать дифференцировке стволовых клеток в специализированные типы клеток (например, мезенхимальных стволовых клеток в соединительной ткани), стимулировать или ингибировать экспрессию белковых маркеров, которые являются характерными для мультипотентного или дифференцированного состояния клеток (например, таких маркеров как активность щелочной фосфатазы, детектирование RUNX2, остерикса, коллагена I, II, IV, VII, X, остеопонтина, остеокальцина, BSPII, SOX9, аггрекана, ALBP, ССААТ/энхансер-связывающего белка-α (С/ЕВРα), связывающего липиды белка адипоцитов (ALBP), щелочной фосфатазы (ЩФ), костного сиалопротеина 2 (BSPII), коллагена 2а1 (Coll2a) и SOX9).
В настоящей заявке под термином «модулирующее действие» понимают действие, которое первая молекула оказывает на вторую молекулу, при этом нормальная функция второй молекулы в другом процессе или процессах модифицируется в присутствии первой молекулы. Модулирующее действие может быть агонистическим или антагонистическим.
Модулирующее действие может представлять собой потенцирующее действие. Термин «потенцирующее действие» подразумевает действие, направленное на увеличение эффективности. В предпочтительном варианте реализации настоящего изобретения термин «потенцирующее действие» относится к действию, которое первая молекула оказывает на вторую молекулу, при этом действие приводит к увеличению эффективности указанной второй молекулы в другом процессе или процессах. В другом предпочтительном варианте реализации настоящего изобретения под потенцирующим действием понимают действие выделенного ГАГ на гепаринсвязывающий фактор, причем указанное действие увеличивает эффективность указанного гепаринсвязывающего фактора.
В настоящей заявке способ «приведения в контакт» включает непосредственное физическое сближение двух или более дискретных молекул. Способ «приведения в контакт» включает непосредственное сближение двух или более отдельных молекул в течение периода времени и при условиях, достаточных для взаимодействия части этих двух или более отдельных молекул на молекулярном уровне. Предпочтительно, в настоящей заявке способ «приведения в контакт» включает непосредственное сближение смеси соединений, содержащей один или более ГАГ, и полипептида, соответствующего гепаринсвязывающему домену гепаринсвязывающего фактора. Примеры способов «приведения в контакт» включают смешивание, растворение, набухание, промывку. Согласно предпочтительным вариантам реализации настоящего изобретения «контакт» смеси ГАГ и полипептида является достаточным для образования комплексов, которые могут быть ковалентными, но предпочтительно являются нековалентными, между ГАГ и полипептидами, которые проявляют высокую аффинность в отношении друг друга.
Полипептид может содержать полноразмерную или почти полноразмерную первичную аминокислотную последовательность выбранного белка, содержащего гепаринсвязывающий домен. Благодаря сворачиванию, которое может происходить в более длинных полипептидах, что ведет к возможной маскировке гепаринсвязывающего домена от смеси ГАГ, предпочтительный полипептид является коротким. Предпочтительно полипептид будет иметь аминокислотную последовательность, которая содержит гепаринсвязывающий домен и возможно содержит одну или более аминокислот на одном или на каждом из N-конца и С-конца пептида. Дополнительные аминокислоты могут обеспечить добавление линкера или прикрепление молекул к полипептиду, которые необходимы для присоединения полипептида к твердой подложке.
Согласно предпочтительным вариантам реализации способа, предложенного авторами настоящего изобретения, в дополнение к ряду аминокислот в гепаринсвязывающем домене полипептид содержит 1-20, более предпочтительно 1-10, еще более предпочтительно 1-5 дополнительных аминокислот. Согласно некоторым вариантам реализации настоящего изобретения аминокислотная последовательность гепаринсвязывающего домена представляет собой по меньшей мере 80%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% аминокислот полипептида.
Для того чтобы прикрепить полипептиды к поверхности твердой подложки, полипептиды предпочтительно модифицированы для включения молекулярной метки, и поверхность твердой подложки модифицирована для включения соответствующего молекулярного зонда, имеющего высокую аффинность в отношении молекулярной метки, т.е. молекулярная метка и зонд образуют связывающуюся пару. Метка и/или зонд могут быть выбраны из любого одного из: антитела, клеточного рецептора, лиганда, биотина, любого фрагмента или производного этих структур, любой комбинации вышеуказанных, или любой другой структуры, с которой может связываться или иным образом специфично соединяться зонд, спроектированный или сконфигурированный для этих целей. Предпочтительная связывающаяся пара, которая подходит для использования в качестве метки и зонда, представляет собой биотин и авидин.
Полипептид получают из белка, представляющего интерес, который в данном случае представляет собой ФРФ2. Термин «полученный из» означает, что полипептид выбран, отобран или получен благодаря тому, что он содержит аминокислотную последовательность гепаринсвязывающего домена, который присутствует в белке, представляющем интерес. Аминокислотная последовательность гепаринсвязывающего домена может быть модифицирована по сравнению с таковой в белке, представляющем интерес, например, чтобы изучить влияние изменений в последовательности гепаринсвязывающего домена на связывание ГАГ.
В данном описании белок представляет собой ФРФ2. Аминокислотные последовательности предпочтительных гепаринсвязывающих доменов представляют собой GHFKDPKRLYCKNGGF (SEQ ID NO: 1) [которая обнаруживается с 157 по 172 аминокислотный остаток человеческого ФРФ2] или последовательность, содержащую последовательность YCKNGGF (SEQ ID NO: 2).
Специалисты в данной области техники поймут, что небольшие вариации аминокислотной последовательности конкретного полипептида могут обеспечить сохранение исходной функциональности этой части. Также следует понимать, что замена некоторых аминокислотных остатков в пределах пептида другими аминокислотными остатками, которые являются изостерическими и/или изоэлектронными, может как сохранить, так и улучшить определенные свойства незамещенного пептида. Такие вариации также включены в объем настоящего изобретения. Например, аминокислота аланин иногда может быть заменена аминокислотой глицином (и наоборот) при сохранении одного или более свойств пептида. Термин «изостерический» относится к пространственному сходству между двумя молекулами. Два примера фрагментов, которые являются изостерическими при умеренно повышенных температурах, включают изопропильные и трет-бутильные группы. Термин «изоэлектронный» относится к электронному сходству между двумя молекулами, примером является случай, когда две молекулы обладают функциональностью при аналогичной или сопоставимой величине рКа.
Полипептид, соответствующий гепаринсвязывающему домену, может быть синтетическим или рекомбинантным.
Твердая подложка может представлять собой любой субстрат, имеющий поверхность, к которой могут быть прикреплены молекулы, прямо или косвенно, посредством ковалентных или нековалентных связей. Твердая подложка может включать любой субстратный материал, который способен обеспечить физическую поддержку для зондов, которые прикреплены к поверхности. Твердая подложка может представлять собой матричную подложку. Материал, как правило, способен переносить условия, связанные с прикреплением зондов к поверхности и любой последующей обработкой, обращением или преобразованиями, которые имеют место в ходе выполнения количественного исследования. Материалы могут быть природными, синтетическими или представлять собой модификацию природного материала. Твердая подложка может представлять собой пластмассу (включая полимеры, такие как, например, поливинилхлорид, сополимеры циклоолефина, полиакриламид, полиакрилат, полиэтилен, полипропилен, поли-4-метилбутен, полистирол, полиметакрилат, полиэтилентерефталат, политетрафторэтилен (ПТФЭ или тефлон®), нейлон, поливинилбутират) и т.д., использованную по отдельности или в комбинации с другими материалами. Могут быть рассмотрены дополнительные жесткие материалы, такие как стекло, которое включает диоксид кремния и дополнительно включает, например, стекло, которое доступно как биостекло. Другие материалы, которые могут быть использованы, включают пористые материалы, такие как, например, стеклянные шарики с контролируемым размером пор. Любые другие материалы, известные в данной области техники, которые способны иметь одну или более функциональных групп, таких как любая из амино, карбоксильной, тиольной, гидроксильной или функциональной группы, например, встроенные на их поверхности, также включены в область настоящего изобретения.
Предпочтительные твердые подложки включают колонки, содержащие полипептид, иммобилизованный на поверхности колонки. Поверхность может представлять собой стенку колонки, и/или может быть предоставлена гранулами, упакованными в центральное пространство колонки.
Полипептид может быть иммобилизован на твердой подложке. Примеры способов иммобилизации включают: адсорбцию, ковалентное связывание, захват и удержание на мембране. В предпочтительном варианте реализации настоящего изобретения взаимодействие между полипептидом и матриксом является по существу постоянным. В другом предпочтительном варианте реализации настоящего изобретения взаимодействие между пептидом и матриксом является удовлетворительно инертными по отношению к ионообменной хроматографии. В предпочтительном варианте полипептид прикреплен к поверхности твердой подложки. Очевидно, что специалист в данной области техники будет иметь большой спектр вариантов для выбора химического и/или физического способа прикрепления двух молекул друг к другу. Все такие варианты включены в объем настоящего изобретения. В предпочтительном варианте полипептид адсорбирован на твердой подложке посредством взаимодействия биотина со стрептавидином. В типичном примере такого варианта реализации молекула биотина ковалентно связана с полипептидом, после чего конъюгат биотин-полипептид связывается со стрептавидином, который в свою очередь был ковалентно связан с твердой подложкой. Согласно другому варианту реализации настоящего изобретения спейсерный или линкерный фрагмент может быть использован для соединения молекулы биотина с полипептидом, и/или стрептавидина с матриксом.
Образование комплексов ГАГ-полипептид обеспечивается путем приведения смеси ГАГ в контакт с твердой подложки. Комплексы отделяют от остальной части смеси путем удаления оставшейся части смеси от твердой подложки, например, путем промывки твердой подложки, чтобы элюировать несвязанные материалы. В тех случаях, когда в качестве твердой подложки используется колонка, несвязанные компоненты смеси ГАГ могут быть элюированы из колонки, при этом комплексы ГАГ-полипептид остаются связанными с колонкой.
Следует понимать, что некоторые олигосахариды могут взаимодействовать с полипептидом неспецифичным образом. Согласно некоторым вариантам реализации настоящего изобретения олигосахарид, который взаимодействует с полипептидом неспецифичным образом, может быть включен или исключен из смеси соединений, обогащенных одним или более гликозаминогликанами, которые модулируют действие гепаринсвязывающего фактора. Пример неспецифического взаимодействия включает временную изоляцию в кармане молекулы, имеющей подходящий размер и/или форму. Также следует понимать, что такие олигосахариды могут элюироваться медленнее, чем те олигосахариды, которые вообще не взаимодействуют с пептидом. Также следует понимать, что соединения, которые связываются неспецифически, могут не требовать ввода того же внешнего стимула для их элюирования, как и для тех соединений, которые связываются специфичным образом (например, с помощью ионного взаимодействия). Способ, предложенный авторами настоящего изобретения, обеспечивает разделение смеси олигосахаридов на те компоненты указанной смеси, которые: связываются с полипептидом специфичным образом; те, которые связываются с полипептидом неспецифичным образом; и те, которые не связываются с полипептидом. Эти определения установлены эмпирическим путем для каждой пары ГАГ-пептид.
ГАГ, имеющие самую высокую аффинность и/или специфичность в отношении гепаринсвязывающего домена, могут быть выбраны путем варьирования условий (например, концентрации соли) на поверхности твердой подложки, где происходит связывание ГАГ и полипептида.
Соответственно, могут быть получены ГАГ, которые имеют высокую аффинность связывания в отношении белка, представляющего интерес, и/или гепаринсвязывающего домена белка, представляющего интерес. Величина аффинности связывания (Кd) может быть выбрана из одного из следующих значений: менее чем 10 мкМ, менее чем 1 мкМ, менее чем 100 нМ, менее чем 10 нМ, менее чем 1 нМ, менее чем 100 пМ.
ГАГ, полученные с помощью описанных способов, можно использовать для ряда вариантов применения, в условиях in vitro и/или в условиях in vivo. ГАГ могут быть обеспечены для применения при стимуляции или ингибировании размножения и/или пролиферации, и/или дифференцировки клеток или тканей в культуру клеток или тканей в условиях in vitro или в клетки или ткань в условиях in vivo.
ГАГ могут быть обеспечены в виде композиции для указанных целей. Например, могут быть предложены культуральные среды, содержащие ГАГ, полученный с помощью описанного способа, т.е. содержащий HS8.
Клетки или ткани, полученные из культур клеток или тканей в условиях in vitro в присутствии HS8, могут быть собраны и имплантированы человеку или животному-пациенту, нуждающемуся в лечении. В этой связи в настоящем изобретении предложен способ имплантации клеток и/или тканей, включающий следующие этапы:
a). культивирование клеток и/или тканей в условиях in vitro совместно с HS8;
b). сбор указанных клеток и/или тканей;
c). имплантацию указанных клеток и/или тканей человеку или животному-субъекту, нуждающемуся в лечении.
Клетки можно культивировать, частично, (а) совместно с HS8 в течение периода времени, достаточного для размножения, пролиферации или дифференцировки клеток или тканей. Например, период времени может быть выбран из: по меньшей мере 5 дней, по меньшей мере 10 дней, по меньшей мере 20 дней, по меньшей мере 30 дней или по меньшей мере 40 дней.
Согласно другому варианту реализации настоящего изобретения HS8 может быть изготовлен для применения в соответствии со способом терапевтического лечения, включая профилактику или лечение травмы или заболевания. В настоящем изобретении может быть предложена фармацевтическая композиция или лекарственное средство, содержащее HS8 и фармацевтически приемлемый разбавитель, носитель или адъювант. Такие фармацевтические композиции или лекарственные средства могут быть предложены для профилактики или лечения травмы или заболевания. В настоящем изобретении также предложено применение HS8 в производстве лекарственного средства для профилактики или лечения травмы или заболевания. Возможно фармацевтические композиции и лекарственные средства в соответствии с настоящим изобретением также могут содержать белок, представляющий интерес (т.е. ФРФ2), содержащий гепаринсвязывающий домен, с которым связывается ГАГ. Согласно другим вариантам реализации настоящего изобретения фармацевтические композиции и лекарственные средства могут дополнительно содержать стволовые клетки, например, мезенхимальные стволовые клетки.
Лечение травмы или заболевания может включать восстановление, регенерацию или замену клеток или ткани, такой как соединительная ткань (например, кость, хрящ, мышца, жир, сухожилие или связка). Для восстановления ткани фармацевтическая композиция или лекарственное средство, содержащее HS8, может быть введено непосредственно в очаг травмы или заболевания для стимулирования размножения, пролиферации и/или дифференцировки новой ткани, чтобы осуществить восстановление после травмы или вылечить или облегчить (например, обеспечить облегчение симптомов) патологическое состояние. Восстановление или регенерация ткани может быть улучшена путем комбинирования стволовых клеток в фармацевтической композиции или лекарственном средстве.
Для замены ткани HS8 может быть приведен в контакт с клетками и/или тканью во время культивирования в условиях in vitro клеток и/или ткани, чтобы получить клетки и/или ткань для имплантации в очаг травмы или заболевания у пациента. Имплантация клеток или ткани может быть использована для восстановления травмированной или пораженной ткани у пациента путем замены травмированной или пораженной ткани. Такая замена может включать иссечение травмированной/пораженной ткани и имплантацию новой ткани, полученной путем культивирования клеток и/или ткани совместно с HS8.
Следовательно, фармацевтические композиции и лекарственные средства в соответствии с настоящим изобретением могут содержать один из:
a). HS8;
b). HS8 в комбинации со стволовыми клетками;
c). HS8 в комбинации с белком, содержащим гепаринсвязывающий домен, связанный с HS8 (например, SEQ ID NO: 1);
d). HS8 в комбинации со стволовыми клетками и белком, содержащим гепаринсвязывающий домен, связанный с HS8 (например, SEQ ID NO: 1);
e). ткани или клетки, полученные из культуры клеток или ткани, приведенной в контакт с HS8.
HS8 может быть использован при восстановлении или регенерации тканей тела, особенно регенерации костной ткани, регенерации нервной ткани, образовании скелетной ткани, восстановлении сердечно-сосудистых повреждений и размножении и самообновлении эмбриональных и взрослых стволовых клеток. Соответственно, HS8 может быть использован для предотвращения или лечения широкого спектра заболеваний и травм, включая остеоартрит, замену хряща, лечение переломов костей любого рода (например, методы лечения, включающие объединение двух или более позвонков, лечение переломов длинных костей, патологий черепа), регенерации критических или несросшихся патологий костей.
Применение HS8 при восстановлении, регенерации или замене ткани может включать использование при заживлении ран, например, ускорение заживления ран, заживления рубцов или костной ткани и прививку ткани.
В другом аспекте настоящего изобретения предложен биологический каркас, содержащий HS8. Согласно некоторым вариантам реализации настоящего изобретения биологические каркасы согласно настоящему изобретению можно применять в области ортопедии, ангиопластики, протезирования, а также на коже и роговице. Биологические каркасы, предложенные в настоящем изобретении, включают устройства для доставки лекарственных препаратов с замедленным высвобождением, биопротезы клапанов, створки биопротезов клапанов, стенты с лекарственным покрытием, сосудистые трансплантаты, ранозаживляющее или кожные трансплантаты и ортопедические протезы, такие как кость, связка, сухожилие, хрящ и мышца. В предпочтительном варианте реализации настоящего изобретения биологический каркас представляет собой катетер, в котором внутренняя (и/или внешняя) поверхность содержит одно или более соединений ГАГ (включая HS8), присоединенных к катетеру.
В другом аспекте настоящего изобретения предложен один или более ГАГ (включая HS8), выделенных с помощью описанного способа, для применения в качестве адъюванта. Адьювант может представлять собой иммуноадъювант.
Согласно другому аспекту настоящего изобретения предложены фармацевтически приемлемые составы, содержащие смесь соединений, содержащих один или более ГАГ, причем указанная смесь обогащена в отношении HS8. В другом аспекте настоящего изобретения предложены фармацевтически приемлемые составы, содержащие:
(i) смесь соединений, содержащих один или более ГАГ, причем указанная смесь обогащена в отношении HS8; и
(ii) ФРФ2,
для раздельного, одновременного или последовательного введения. В предпочтительном варианте реализации настоящего изобретения композиция содержит смесь соединений, содержащих один или более ГАГ, причем указанная смесь обогащена в отношении HS8 и ФРФ2 в виде однородной смеси, и может быть введена единовременно пациенту, нуждающемуся в лечении.
Согласно другому аспекту настоящего изобретения предложен набор для применения при восстановлении или регенерации ткани, включающий (i) заранее определенное количество HS8, и (ii) заранее определенное количество ФРФ2.
Соединения в обогащенных смесях согласно настоящему изобретению могут быть введены субъекту в виде их фармацевтически приемлемой соли. Например, основные соли соединений в обогащенных смесях согласно настоящему изобретению включают, но не ограничиваются ими, соли, образованные фармацевтически приемлемыми катионами, такими как натрий, калий, литий, кальций, магний, аммоний и алкиламмоний. В объем настоящего изобретения также включены катионные соли, например, соли натрия или калия.
Следует понимать, что соединения обогащенных смесей согласно настоящему изобретению, которые несут карбоксильную группу, могут быть доставлены в форме пролекарства, подходящего для введения, в котором кислотный фрагмент этерифицирован (для придания ему формы -CO2R'). Термин «пролекарство» относится, в частности, к превращению группы -OR' в группу -ОН, или карбоксилат-анион на ее основании, в условиях in vivo. Соответственно, пролекарства согласно настоящему изобретению могут усиливать всасывание лекарственного препарата и/или доставку лекарственного препарата в клетки. Превращение пролекарств в условиях in vivo может быть усилено клеточными ферментами, такими как липазы и эстеразы, или путем химического расщепления, например, с помощью гидролиза сложноэфирной связи в условиях in vivo.
Лекарственные средства и фармацевтические композиции в соответствии с аспектами настоящего изобретения могут быть изготовлены для введения с помощью ряда путей, включая, но не ограничиваясь ими, инъекцию в очаг заболевания или травмы. Лекарственные средства и композиции могут быть изготовлены в жидкой или твердой форме. Жидкие составы могут быть изготовлены для введения путем инъекции в выбранную область организма человека или животного.
Введение предпочтительно осуществляют в «терапевтически эффективном количестве», которое является достаточным, чтобы оказать благоприятное терапевтическое действие у индивидуума. Фактически вводимое количество, частота и продолжительность курса введения будут зависеть от характера течения и степени тяжести травмы или заболевания, подлежащего лечению. Назначение курса лечения, например, принятие решений, касающихся дозировки и т.д., находится в пределах ответственности врачей общей практики и других врачей, и, как правило, осуществляется с учетом заболевания, подлежащего лечению, состояния отдельного пациента, места доставки, способа введения и других факторов, известных врачам общей практики. Примеры методик и протоколов, упомянутых выше, можно найти в Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins.
Стволовые клетки
Клетки, которые вступают в контакт с HS8, включают стволовые клетки.
HS8 может быть использован в пролиферации и/или дифференцировке стволовых клеток, и/или детерминации дифференцировки стволовых клеток.
Стволовые клетки, культивируемые и описанные в настоящей заявке, могут представлять собой стволовые клетки любого типа. Указанные стволовые клетки могут быть тотипотентными или мультипотентными (плюрипотентными). Указанные стволовые клетки могут быть эмбриональными или взрослыми стволовыми клетками из любой ткани и могут быть гемопоэтическими стволовыми клетками, нервными стволовыми клетками или мезенхимальными стволовыми клетками. Предпочтительно указанные стволовые клетки представляют собой взрослые стволовые клетки.
В настоящем описании под стволовыми клетками подразумевают любой тип клеток, которые способны к делению (т.е. самообновлению), остаются тотипотентными или мультипотентными (плюрипотентными) и дают начало специализированным клеткам.
Стволовые клетки, культивируемые в настоящем изобретении, могут быть получены или могут происходить из существующих культур или могут быть получены непосредственно из любой взрослой, эмбриональной или фетальной ткани, включая кровь, костный мозг, кожу, эпителий или пуповину (ткань, которую обычно отбрасывают).
Мультипотентность стволовых клеток может быть определена путем использования подходящих количественных способов исследований. Такие количественные способы исследований могут включать детектирование одного или более маркеров плюрипотентности, например, определение активности щелочной фосфатазы, детектирование RUNX2, остерикса, коллагена I, II, IV, VII, X, остеопонтина, остеокальцина, BSPII, SOX9, аггрекана, ALBP, ССААТ/энхансер-связывающего белка-α (С/ЕВРα), связывающего липиды белка адипоцитов (ALBP), щелочной фосфатазы (ЩФ), костного сиалопротеина 2, (BSPII), коллагена 2а1 (Coll2a) и SOX9.
Согласно некоторым предпочтительным вариантам реализации настоящего изобретения стволовые клетки представляют собой мезенхимальные стволовые клетки (МСК), например, те, которые способны дифференцироваться в соединительную ткань и/или клетки костной ткани, такие как хондроциты, остеобласты, миоциты и адипоциты.
Мезенхимальные стволовые клетки могут быть легко получены из костного мозга с помощью минимально инвазивных методов и могут быть размножены в культуре и дифференцированы в нужную клеточную линию. Дифференцировка может быть индуцирована применением специфичных факторов роста. Белки, члены надсемейства трансформирующих факторов роста бета (TGF-бета), такие как костные морфогенетические белки (BMPs), являются важными факторами хондрогенной и остеогенной дифференцировки мезенхимальных стволовых клеток.
Мезенхимальные стволовые клетки можно выделять и детектировать с помощью селективных маркеров, таких как STRO-1, из фракции CD34+ с указанием их потенциала в отношении репопуляции костного мозга. Указанные поверхностные клеточные маркеры находятся только на поверхности мезенхимальных стволовых клеток и указывают на плюрипотентность клеток.
Подходящие мезенхимальные стволовые клетки могут быть получены или могут происходить из мононуклеарных клеток костного мозга (МНККМ), собранных из аспиратов костного мозга (например, Wexler et al. Adult bone marrow is a rich source of human mesenchymal 'stem' cells but umbilical cord and mobilized adult blood are not. HAEMOPOIESIS AND LEUCOCYTES British Journal of Haematology 121(2):368-374, April 2003.) или из вартонова студня пуповины (например, Та et al. Long-term Expansion and Pluripotent Marker Array Analysis of Wharton's Jelly-Derived Mesenchymal Stem Cells. Stem Cells Dev. 2009 July 20 (Epub)).
Мезенхимальные стволовые клетки могут быть получены путем дифференцировки плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки человека или индуцированные плюрипотентные стволовые клетки, с применением подходящих дифференцирующих факторов, как известно в данной области техники.
Мезенхимальные стволовые клетки представляют собой плюрипотентные клетки-предшественники (мультипотентные), которые способны вырабатывать компоненты хряща, кости, мышцы, сухожилия, связки и жира. Указанные примитивные клетки-предшественники существуют в постнатальном периоде и проявляют характеристики стволовых клеток, а именно низкую частоту и высокую способность к самообновлению. Эти свойства в комбинации со свойственной им пластичностью в процессе развития организма породили огромный интерес к возможности их использования для замены поврежденных тканей. В сущности, указанные стволовые клетки можно культивировать для увеличения их количества, а затем трансплантировать в место повреждения или после высева в/на каркасы для создания надлежащих тканевых конструкций.
Следовательно, альтернативный подход к восстановлению/регенерации скелетной ткани, мышц, сухожилий, связок и крови заключается в выборе, размножении и модуляции соответствующих клеток-предшественников, таких как остеоидные клетки-предшественники (например, мезенхимальные стволовые клетки, хондроциты, остеобласты, миобласты, стволовые клетки костной ткани или клетки-предшественники костной ткани), в случае костной ткани в комбинации с проводящими или индуктивными каркасами для поддержки и направления регенерации, наряду с разумным выбором специфичных тканевых факторов роста.
Стволовые клетки могут быть получены из любого животного или человека, например, животных, не относящихся к человеку, например, кролика, морской свинки, крысы, мыши или другого грызуна (включая клетки от любого животного в отряде Rodentia), кошки, собаки, свиньи, овцы, козы, крупного рогатого скота, лошади, примата, не относящегося к человеку, или других позвоночных организмов, не относящихся к человеку; и/или млекопитающих животных, не относящихся к человеку; и/или человека. Предпочтительно стволовые клетки представляют собой человеческие стволовые клетки. Возможно стволовые клетки не являются человеческими стволовыми клетками. Возможно стволовые клетки не являются эмбриональными стволовыми клетками. Возможно стволовые клетки не являются тотипотентными стволовыми клетками.
Согласно еще одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая стволовые клетки или другие клетки, полученные с помощью любого из способов согласно настоящему изобретению, или их фрагменты или продукты. Фармацевтическую композицию можно использовать в способе терапевтического лечения. Подходящие фармацевтические композиции могут дополнительно содержать фармацевтически приемлемый носитель, адъювант или разбавитель.
Согласно другому аспекту настоящего изобретения стволовые клетки или другие клетки, полученные с помощью любого из способов согласно настоящему изобретению, можно использовать в способе терапевтического лечения, предпочтительно предложен способ терапевтического лечения, включающий введение индивидууму, нуждающемуся в лечении, терапевтически эффективного количества указанного лекарственного средства или фармацевтической композиции.
Стволовые клетки и другие клетки, полученные с помощью способов и методик культивирования в соответствии с настоящим изобретением, могут быть использованы для дифференцировки в другой тип клеток для использования в способе терапевтического лечения. Соответственно, дифференцированный тип клеток может быть получен из, и может рассматриваться в качестве продукта, стволовой клетки, полученной с помощью описанных способов и методик культивирования, которой затем обеспечили условия для дифференцировки. В настоящем изобретении могут быть предложены фармацевтические композиции, содержащие указанные дифференцированные клетки, возможно совместно с фармацевтически приемлемым носителем, адъювантом или разбавителем. Указанную фармацевтическую композицию можно использовать в способе терапевтического лечения.
Мезенхимальные стволовые клетки
Мезенхимальные стволовые клетки (МСК) первоначально были выделены из костного мозга, и их количество составляет лишь 1 клетку на 104-105 всех мононуклеарных клеток костного мозга (МНККМ) (Friedenstein et al. 1966). Указанные клетки способны образовывать колонии, полученные из одной клетки-предшественника, названные популяции КОЕ-Ф (колониеобразующая единица фибробластов). В настоящее время МСК выявлены во многих других тканях, включая жировую ткань (Gimble and Guilak 2003; Zuk et al. 2001), пуповинную кровь (Bieback et al. 2004; Erices et al. 2000; Goodwin et al. 2001; Kogler et al. 2004; Wagner et al. 2005) и мышцы (Jiang et al. 2002).
Минимальные критерии для мультипотентных мезенхимальных стромальных клеток человека (МСК) были установлены Международным обществом клеточной терапии (Dominici et al. Cytotherapy (2006) Vol. 8, No. 4, 315-317). Были предложены три критерия для определения человеческих МСК: прикрепление к пластику, экспрессия специфичных поверхностных антигенов и способность к мультипотентной дифференцировке. В частности, согласно заявлению Международного общества клеточной терапии: «Во-первых, МСК должны быть прикреплены к пластиковой поверхности во время поддержания в стандартных условиях культивирования с использованием колб для культивирования тканей. Во-вторых, ≥95% популяции МСК должны экспрессировать CD105, CD73 и CD90, согласно результатам измерения с помощью проточной цитометрии. Помимо этого, указанные клетки не должны экспрессировать (≤2% положительных клеток) CD45, CD34, CD14 или CD11b, CD79α или CD19 и HLA класса II (HLA-DR). В-третьих, указанные клетки должны быть способны дифференцироваться в остеобласты, адипоциты и хондробласты в стандартных условиях дифференцировки в условиях in vitro».
В работе Dominici et al. также выдвинуто утверждение, что биологическое свойство, которое наиболее однозначно идентифицирует МСК, заключается в их способности к мезенхимальной дифференцировке с образованием трех клеточных линий, таких как остеобласты, адипоциты и хондробласты, с использованием стандартных условий дифференцировки культур тканей в условиях in vitro. Авторы подтвердили, что дифференцировка в остеобласты может быть продемонстрирована с помощью окрашивания ализариновым красным или окрашивания по фон Коссу, дифференцировка в адипоциты наиболее легко может быть продемонстрирована с помощью окрашивания масляным красным О, и дифференцировка в хондробласты может быть продемонстрирована с помощью окрашивания альциановым синим или иммуногистохимического окрашивания коллагена типа II. В работе Dominici et al. указано, что наборы для таких количественных исследований являются коммерчески доступными, и что другие исследователи смогут продемонстрировать дифференцировку.
В работе Dominici et al. также установлено, что в будущем могут быть идентифицированы новые поверхностные маркеры, которые также могут быть использованы для определения МСК человека. В настоящее время известны три таких маркера: CD49a, SSEA-4 и STRO-1.
В работе Rider et al. сообщается, что клоны CD49a+ имели повышенный уровень экспрессии CD90 и CD 105 по сравнению с несортированными клетками, и показано, что клоны CD49a+ легко подвергались мультилинейной дифференцировке в клетки жировой, костной и хрящевой ткани по сравнению с несортированными клетками, что подтверждает выбор альфа-1-интегрина (CD49a) для обогащения мезенхимальными стволовыми клетками, и предложили стратегию выбора наиболее мультипотентных клеток из гетерогенного пула мононуклеарных стволовых клеток костного мозга (Rider et al. J.Mol. Hist (2007) 38:449-458). В работе авторов Rider et al. также сообщается, что клетки КОЕ-Ф связаны с экспрессией CD49a, что экспрессирующие CD49a клетки КОЕ-Ф также ко-экспрессируют STRO-1, и CD49a может быть использован для выделения МСК из крыс и мышей, помимо человека, эти результаты указывают на то, что CD49a может представлять собой консервативный маркер для обогащения.
В работе авторов Gang et al. сообщается, что эмбриональный антиген SSEA-4, специфичный для конкретной стадии развития, который обычно используют в качестве маркера для недифференцированных плюрипотентных эмбриональных стволовых клеток человека и расщепления до эмбрионов на стадии бластоцисты, также позволяет идентифицировать популяцию мезенхимальных стволовых клеток взрослого человека и может быть использован для выделения МСК (Gang et al., Blood 2007; 109:1743-1751).
В работе авторов Gang et al. также описано использование моноклонального антитела, которое связывается с поверхностным маркером STRO-1, при обогащении клоногенными стромальными клетками (КОЕ-Ф), так называемыми STRO-1+bright.
Гликозаминогликаны
В настоящей заявке термины «гликозаминогликаны» и «ГАГ» используются взаимозаменяемо и относятся к большой группе молекул, содержащих олигосахарид, в котором один или более из соединенных сахаридов содержат амино-заместитель или его производное. Примеры ГАГ включают хондроитинсульфат, кератансульфат, гепарин, дерматансульфат, гиалуронат и гепарансульфат.
В настоящей заявке термин «ГАГ» дополнительно включает те молекулы, которые представляют собой конъюгаты ГАГ. Пример конъюгата ГАГ включает протеогликозаминогликан (ПГАГ, протеогликан), в котором пептидный компонент ковалентно связан с олигосахаридным компонентом.
Гепарансульфат (ГС)
Гепарансульфат протеогликаны (HSPGs) представляют собой очень разнообразную подгруппу протеогликанов и состоят из боковых цепей гепарансульфат гликозаминогликанов, ковалентно присоединенных к белковому остову. Основной белок существует в трех главных формах: секретируемой форме, известной как перлекан, в форме, закрепленной в плазматической мембране, известной как глипикан, и трансмембранной форме, известной как синдекан. Эти формы являются распространенными компонентами поверхностей клеток млекопитающих и большей части внеклеточного матрикса. Существуют и другие белки, такие как агрин, или амилоидный белок-предшественник, в котором цепь ГС может быть прикреплена к менее часто встречающимся основным белкам.
«Гепарансульфат» («гепарансульфат» или «ГС») изначально синтезируется в аппарате Гольджи в виде полисахаридов, состоящих из тандемных повторов D-глюкуроновой кислоты (GlcA) и N-ацетил-О-глюкозамина (GlcNAc). Растущие цепи полисахаридов могут быть впоследствии модифицированы в ходе нескольких стадий: N-деацетилирования/N-сульфатирования GlcNAc, эпимеризации GlcA в положении С5 с образованием идуроновой кислоты (IdoA), О-сульфатирования в положении С2 IdoA и GlcA, О-сульфатирования в положении С6 N-сульфоглюкозамина (GlcNS) и в некоторых случаях О-сульфатирования в положении С3 GlcNS. N-деацетилирование/N-сульфатирование, 2-O-, 6-O- и 3'-О-сульфатирование ГС опосредовано специфичным действием N-деацетилазы/N-сульфотрансферазы ГС (HSNDST), 2-О-сульфотрансферазы ГС (HS2ST), 6-О-сульфотрансферазы ГС (HS6ST) и 3-О-сульфотрансферазы ГС, соответственно. На каждой из стадий модификации только часть потенциальных субстратов подвергается модификации, что приводит к значительному разнообразию последовательностей. Подобная структурная сложность ГС затрудняет определение их последовательностей и понимание взаимосвязи между структурой и функцией ГС.
Боковые цепи гепарансульфата состоят из чередующихся остатков D-глюкуроновой кислоты или L-идуроновой кислоты и D-глюкозамина, связанных с помощью (1→4) гликозидных связей. Глюкозамин часто представляет собой N-ацетилированную или N-сульфатированную и содержащую оба типа модификаций уроновую кислоту, и глюкозамин может быть дополнительно О-сульфатирован. Специфичность конкретного HSPG в отношении конкретного партнера по связыванию создается с помощью определенного профиля карбоксильных, сульфатных и ацетильных групп, присоединенных к глюкозамину и уроновой кислоте. В отличие от гепарина, гепарансульфат содержит меньше N- и О-сульфатных групп и больше N-ацетильных групп. Боковые цепи гепарансульфата связаны с остатком серина в основном белке посредством области тетрасахаридной связи (-глюкуронозил-β-(1→3)-галактозил-β-(1→3)-галактозил-β-(1→4)-ксилозил-β-1-О-(серин)).
Цепи гепарансульфата и основной белок могут подвергнуться ряду модификаций, которые в конечном итоге могут повлиять на их биологическую активность. Ранее полагали, что сложность ГС превосходит таковую нуклеиновых кислот (Lindahl et al., 1998, J. Biol. Chem. 273, 24979; Sugahara and Kitagawa, 2000, Curr. Opin. Struct. Biol. 10, 518). Изменения в молекулах ГС возникают в результате синтеза регулярных, высокосульфатированных последовательностей, состоящих из остатков cахаров, которые разделены областями несульфатированных дисахаридов, содержащих N-ацетилированный глюкозамин. Исходное превращение N-ацетилглюкозамина в N-сульфоглюкозамин создает точку для других модификаций, включая эпимеризацию глюкуроновой кислоты в идуроновую кислоту и сложный профиль О-сульфатирования на глюкозамине или идуроновой кислоте. Кроме того, в пределах немодифицированных, низкосульфатированных, N-ацетилированных последовательностей, остатки гексуроната остаются в виде глюкуроната, тогда как в высокосульфатированных N-сульфатированных областях преобладает эпимер идуроновой кислоты по положению С-5. Это ограничивает число потенциальных дисахаридных вариантов в любой конкретной цепи, но не распространенность каждого варианта. Большая часть модификаций происходит в N-сульфатированных доменах, или в непосредственной близости от них, вследствие этого в зрелой цепи присутствуют высокосульфатированные участки, разделенные доменами с низким уровнем сульфатирования (Brickman et al. (1998), J. Biol. Chem. 273(8), 4350-4359, которая полностью включена в настоящую заявку посредством ссылки).
Была выдвинута гипотеза, что высокоизменчивые цепи гепарансульфата играют ключевую роль в модуляции действия большого числа внеклеточных лигандов, включая регуляцию и представление клетке факторов роста и адгезии, посредством сложной комбинации аутокринных, юкстакринных и паракринных контуров обратной связи, контролируя тем самым внутриклеточную передачу сигналов и, следовательно, дифференцировку стволовых клеток. Например, несмотря на то, что гепарансульфат гликозаминогликаны могут быть охарактеризованы на генетическом уровне (Alberts et al. (1989) Garland Publishing, Inc, New York & London, pp. 804 и 805), молекулы гепарансульфат гликозаминогликана, выделенные из одного источника, могут отличаться по биологической активности. Как показано в работе Brickman et al., 1998, Glycobiology 8, 463, две отдельные группы гепарансульфат гликозаминогликанов, полученных из нейроэпителиальных клеток, могут специфично активировать ФРФ1 или ФРФ2, в зависимости от митогенного статуса. Аналогичным образом, способность гепарансульфата (ГС) взаимодействовать с ФРФ1 либо ФРФ2 описана в WO 96/23003. В соответствии с упомянутой заявкой на патент, соответствующий ГС, который способен взаимодействовать с ФРФ1, можно получить из мышиных клеток в период с приблизительно 11-го по приблизительно 13-й день эмбрионального развития, тогда как ГС, который способен взаимодействовать с ФРФ2, можно получить из мышиных клеток в период с приблизительно 8-го по приблизительно 10-й день эмбрионального развития.
Как указано выше, структура ГС весьма сложна и варьируется среди ГС. Действительно, как полагают, изменчивость структуры ГС играет важную роль в обеспечении различной активности каждого ГС в отношении стимуляции размножения клеток и контроля дифференцировки клеток. Считается, что структурная сложность ГС превосходит таковую нуклеиновых кислот, и, несмотря на то, что структура ГС может быть охарактеризована как последовательность повторяющихся дисахаридных блоков, имеющая специфичный и уникальный профиль сульфатирования, в настоящее время отсутствует стандартная методика секвенирования, эквивалентная тем, которые доступны для секвенирования нуклеиновых кислот, пригодная для определения структуры последовательности ГС. В отсутствие простых способов определения окончательной структуры последовательности ГС специалисты в данной области техники точно определяют и структурно характеризуют молекулы ГС с помощью ряда аналитических методик. Такие методики включают один или комбинацию способов количественного исследования дисахаридов, количественного исследования тетрасахаридов, ВЭЖХ и определения молекулярной массы. Перечисленные аналитические методики хорошо известны и используются специалистами в данной области техники.
Две методики получения ди- и тетрасахаридов из ГС включают расщепление азотистой кислотой и расщепление лиазой. Описание одного из способов осуществления указанных методик расщепления приведено ниже, исключительно в качестве примера, такое описание не ограничивает объем настоящего изобретения.
Расщепление под действием азотистой кислоты
Деполимеризация гепарансульфата под действием азотистой кислоты приводит в конечном итоге к разрушению углеводной цепи на отдельные дисахаридные компоненты, если реакция идет до конца.
Например, азотистая кислота может быть получена путем охлаждения 250 мкл 0,5 М H2SO4 и 0,5 М Ba(NO2)2 по отдельности на льду в течение 15 мин. После охлаждения Ba(NO2)2 объединяют с H2SO4 и перемешивают перед центрифугированием для удаления осадка сульфата бария. По 125 мкл HNO2 добавляли к образцам ГАГ, ресуспендированным в 20 мкл Н2О, и перемешивали перед инкубацией в течение 15 мин при температуре 25°С и периодическом перемешивании. После инкубации к образцу добавляли 1 М Na2CO3, чтобы довести значение рН до 6. Затем к образцу добавляют 100 мкл 0,25 М NaBH4 в 0,1 М NaOH, и смесь нагревают до 50°С в течение 20 мин. Затем смесь охлаждают до 25°С и подкисляют ледяной уксусной кислотой, чтобы довести значение рН образца до 3. После этого смесь нейтрализуют 10 М NaOH, и объем уменьшают с помощью сублимационной сушки. Готовые образцы разделяют на колонке Bio-Gel Р-2, чтобы отделить ди- и тетрасахариды для проверки степени расщепления.
Расщепление лиазой
Гепариназа III расщепляет цепи cахаров в местах глюкуронидных связей. Существует несколько гепариназ (I, II и III), каждая из которых проявляет относительно специфичную активность, деполимеризуя определенные последовательности гепарансульфатов в конкретных сайтах узнавания сульфатирования. Гепариназа I расщепляет цепи ГС, содержащие области NS вдоль цепи ГС. Это приводит к фрагментации сульфатированных доменов. Гепариназа III деполимеризует ГС, содержащие домены NA, что приводит к разделению углеводной цепи на отдельные сульфатированные домены. Гепариназа II в первую очередь расщепляет домены, содержащие «плечо» NA/NS, цепей ГС, в которых обнаружены различные профили сульфатирования. Примечание: повторяющийся дисахаридный остов полимера гепарана представляет собой уроновую кислоту, соединенную с аминсодержащим сахаром, глюкозамином. «NS» означает, что аминсодержащий сахар несет сульфат на аминогруппе, что позволяет сульфатировать другие группы по остаткам С2, С3 и С6. «NA» означает, что аминогруппа не сульфатирована и остается ацетилированной.
Например, для деполимеризации областей NA с использованием гепариназы III, фермент и лиофилизированные образцы ГС готовят в буфере, содержащем 20 мМ Трис-HCl, 0,1 мг/мл БСА и 4 мМ CaCl2 при рН=7,5. Например, гепариназа III может быть добавлена в концентрации 5 мЕд на 1 мкг ГС, с последующей инкубацией при 37°С в течение 16 ч перед остановкой реакции путем нагревания до 70°С в течение 5 мин.
Ди- и тетрасахариды можно элюировать с помощью колоночной хроматографии.
Перелом кости
Согласно некоторым аспектам настоящее изобретение относится к терапевтическому применению (у человека и/или животных) HS8 для лечения перелома кости.
Перелом кости является медицинским состоянием. В настоящей заявке термин «перелом» включает повреждение или травму кости, при которых кость треснула, потеряла целостность или сколота. Нарушение целостности относится к разрыву в кости. Перелом может быть вызван физическим воздействием, механическим напряжением или заболеваниями, такими как остеопороз или остеоартрит.
Ортопедическая классификация переломов включает закрытые или открытые переломы и простые или многофрагментные переломы. При закрытых переломах кожа остается неповрежденной, в то время как при открытом переломе кость может выступать на поверхность через рану, что связано с более высоким риском инфицирования. Простые переломы происходят вдоль одной линии, как правило, разделяя кость на два фрагмента. Многофрагментные переломы костей разъединяют кость на несколько частей.
Другие типы переломов включают компрессионный перелом, сдавленный перелом, спиральный перелом, полные и неполные переломы, поперечные, продольные и косые переломы и оскольчатые переломы.
У большинства субъектов заживление кости (сращение перелома) происходит естественным путем и инициируется после травмы. Кровотечение обычно приводит к свертыванию и привлечению лейкоцитов и фибробластов, с последующей выработкой коллагеновых волокон. Этот процесс сопровождается отложением (минерализацией) костного матрикса (гидроксиапатита кальция), что приводит к превращению коллагенового матрикса в костную ткань. Незрелая, повторно образованная кость, как правило, слабее, чем зрелая кость, и со временем незрелая кость подвергается процессу ремоделирования, чтобы получить зрелую «пластинчатую» кость. Весь процесс заживления кости занимает значительное время, как правило, много месяцев.
Кости, в которых происходят переломы и в отношении которых лечение с использованием HS8 может оказать терапевтический эффект, включают все типы костей, в частности все типы костей млекопитающих, включая, но не ограничиваясь ими, длинные кости (например, бедренную, плечевую, фаланги), короткие кости (например, запястные кости, предплюсновые кости), плоские кости (например, череп, ребра, лопатку, грудину, тазовый пояс), смешанные кости (например, позвонки), сесамовидные кости (например, коленную чашечку).
Кости, в которых происходят переломы и в отношении которых лечение с использованием HS8 может оказать терапевтический эффект, включают кости скелета (т.е. любую кость скелета), кости черепно-лицевой области, кости осевого скелета (например, позвонки, ребра), аппендикулярную кость (например, кость из конечности), кость тазового скелета (например, таз).
Кости, в которых происходят переломы и в отношении которых лечение с использованием HS8 может оказать терапевтический эффект, также включают кости головы (череп) и шеи, включая кости лица, такие как челюсть, нос и щеки. HS8 можно использовать для облегчения восстановления или регенерации кости при стоматологических или лицевых, или черепных хирургических вмешательствах, которые могут включать реконструкцию костей (в отличие от зубов) лица и/или ротовой полости, например, включая челюстную кость.
Перелом кости также включает патологическую пористость, например, которая проявляется у пациентов с остеопорозом.
В качестве примера, не ограничивающего объем настоящего изобретения, первичное действие HS8 может быть направлено на клетки, которые находятся в пределах, в непосредственной близости или мигрируют в раневой очаг, и может быть направлено на мезенхимальные стволовые клетки, стволовые клетки костной ткани, преостеобласты или остеобласты, или на любые из вспомогательных или васкулогенных клеток, обнаруженных или мигрирующих в раневое ложе или в окружающие его ткани.
В настоящем изобретении предложено применение HS8 и фармацевтических композиций и лекарственных средств, содержащих HS8, в соответствии со способом лечения перелома кости у субъекта-млекопитающего.
Лечение может включать заживление ран в кости. Лечение может включать восстановление, регенерацию и рост костной ткани. HS8 облегчает восстановление переломов, облегчая рост новой кости. HS8 улучшает скорость восстановления перелома, обеспечивая более быстрое заживление кости, что приводит к улучшению времени восстановления от травм. Лечение может привести к улучшению прочности кости.
Лечение также может включать лечение остеопороза или остеоартрита.
Предпочтительно HS8 вводят в ткань, окружающую перелом. Способ введения может включать введение непосредственно в костную ткань, в которой произошел перелом. Введение можно осуществлять в соединительную ткань, окружающую кость или перелом, или в сосудистое русло (например, в кровеносные сосуды) вблизи кости и снабжающие кость кровью. Введение можно осуществлять непосредственно в очаг травмы и в каллус, образованный при начальном заживлении раны.
Лекарственные средства и фармацевтические композиции согласно настоящему изобретению могут быть изготовлены для введения с помощью ряда путей введения. Наиболее предпочтительно HS8 изготавливают в текучей или жидкой форме для инъекций.
Согласно некоторым вариантам реализации настоящего изобретения HS8 изготавливают в виде состава с контролируемым высвобождением, например, в виде капсулы, содержащей лекарственный препарат, для имплантации в очаг раны. HS8 может быть прикреплен, нанесен или может пропитывать материал-носитель (например, биоматериал), такой как нановолокно или биоразлагаемая бумага или текстиль.
Фармацевтические композиции, лекарственные средства, имплантаты и протезы, содержащие HS8, также могут содержать ФРФ2. Благодаря способности HS8 связываться с ФРФ2, HS8 может действовать как носитель ФРФ2, облегчая доставку ФРФ2 в очаг раны.
Введение осуществляют предпочтительно в «терапевтически эффективном количестве», которое является достаточным для того чтобы улучшить заживление перелома кости по сравнению с соответствующим необработанным переломом. Фактически вводимое количество, частота и продолжительность курса введения будут зависеть от характера и степени тяжести перелома. Назначение курса лечения, например, принятие решений, касающихся дозировки т.д., находится в пределах ответственности врачей общей практики и других врачей, и, как правило, осуществляется с учетом характера перелома, состояния конкретного пациента, места доставки, способа введения и других факторов, известных врачам общей практики. Однократные или многократные дозы HS8 могут быть введены в соответствии с указанием лечащего врача. Исключительно в качестве примера, HS8 может быть доставлен в дозах, составляющих по меньшей мере 1 нг/мл, более предпочтительно по меньшей мере 5 нг/мл и возможно 10 нг/мл или более. Индивидуальные дозы HS8 могут быть на порядок меньше чем 1 мг и больше чем 1 мкг, например, приблизительно 5 мкг, приблизительно 10 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 50 мкг, приблизительно 100 мкг, приблизительно 0,5 мг или приблизительно 1 мг.Примеры методик и протоколов, упомянутых выше, можно найти в Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins.
HS8 может быть использован для лечения переломов кости, наряду с другими видами лечения, такими как введение обезболивающих или противовоспалительных лекарственных средств, иммобилизация и фиксация кости, например, иммобилизация травмированной конечности в гипсовой повязке, хирургическое вмешательство, например, для повторной фиксации кости или перемещения кости, чтобы исправить смещение, угловое смещение или вывих. В том случае, если требуется операция, HS8 можно вводить непосредственно в перелом (например, наносить на перелом) в ходе хирургической операции.
Биоматериалы
Фармацевтические композиции и лекарственные средства согласно настоящему изобретению могут быть обеспечены в форме биоматериала, который покрыт и/или пропитан HS8. Имплантат или протез может быть выполнен из биоматериала. Такие имплантаты или протезы могут быть имплантированы хирургическим путем для облегчения трансплантации клеток, роста кости, регенерации ткани, реструктуризации ткани и/или повторного моделирования ткани.
HS8 можно наносить на имплантаты или протезы, чтобы ускорить образование новой ткани в желаемом месте. Следует понимать, что гепарансульфаты, в отличие от белков, особенно устойчивы и обладают значительно лучшей способностью противостоять растворителям, необходимым для производства синтетических биокаркасов и нанесения на имплантаты и протезы.
Биоматериал может быть покрыт или пропитан HS8. Пропитка может включать образование биоматериала путем смешивания HS8 с конститутивными компонентами биоматериала, например, во время полимеризации, или путем всасывания HS8 в биоматериал. Покрытие может включать всасывание HS8 на поверхности биоматериала.
Биоматериал должен обеспечивать высвобождение HS8 из биоматериала, покрытого или пропитанного HS8, при введении или имплантации субъекту. Кинетика высвобождения из биоматериала может быть изменена путем модификации структуры биоматериала, например, пористости.
В дополнение к покрытию или пропитке биоматериала HS8, биоматериал может быть пропитан или покрыт одной или более биологически активными молекулами. Например, по меньшей мере одной молекулой, выбранной из группы, состоящей из: ВМР-2, ВМР-4, ОР-1, ФРФ1, ФРФ2, TGF-β1, TGF-β2, TGF-β3; VEGF; коллагена; ламинина; фибронектина; витронектина. В дополнение или в качестве альтернативного варианта вышеуказанных биоактивных молекул, биоматериал может быть пропитан или покрыт одним или более бисфосфонатами, наряду с HS8. Примеры подходящих бисфосфонатов могут включать по меньшей мере один, выбранный из группы, состоящей из: этидроната; клодроната; алендроната; памидроната; ризедроната; золедроната.
Биоматериалы, покрытые или пропитанные HS8, можно применять в медицинских и ветеринарных целях. Следует понимать, что настоящее изобретение может улучшить качество жизни пациента или потенциально продлить жизнь животного, например, ценного рысака для использования с целью разведения.
Биоматериал обеспечивает каркас или поддерживающий матрикс. Биоматериал может быть подходящим для имплантации в ткань или может быть подходящим для введения (например, в виде микрокапсул в растворе).
Имплантат или протез должен быть биологически совместимым, например, нетоксичным и обладать низкой иммуногенностью (наиболее предпочтительно он должен быть неиммуногенным). Биоматериал может быть биоразлагаемым так, что биоматериал разлагается при заживлении раны, в конечном итоге, оставляя в организме субъекта лишь регенерированную кость in situ. В другом варианте может быть использован небиоразлагаемый биоматериал, например, чтобы направлять процесс регенерации кости на протяжении большого участка разрыва и/или выступать в качестве структурной подложки в процессе заживления кости, при этом возможно может потребоваться хирургическое удаление биоматериала после успешного заживления раны.
Биоматериалы могут быть мягкими и/или гибкими, например, гидрогели, фибриновые сетки или решетки, или коллагеновые губки. «Гидрогель» представляет собой вещество, образованное при усадке или затвердевании органического полимера, который может быть природным или синтетическим, с образованием трехмерной структуры с открытой решеткой, которая улавливает молекулы воды или других растворов с образованием геля. Затвердевание может происходить путем агрегации, коагуляции, гидрофобных взаимодействий или сшивания.
В другом варианте биоматериалы могут представлять собой относительно жесткие структуры, например, образованные из твердых материалов, таких как пластики или биологически инертные металлы, такие как титан.
Биоматериал может иметь пористую матриксную структуру, которая может быть представлена сшитым полимером. Матрикс предпочтительно является проницаемым для питательных веществ и факторов роста, необходимых для роста кости.
Матриксные структуры могут быть образованы путем сшивания волокон, например, фибрина или коллагена, или жидких пленок альгината натрия, хитозана или других полисахаридов с соответствующими сшивающими агентами, например, солями кальция, полиакриловой кислотой, гепарином. Согласно другому варианту каркасы могут быть образованы в виде геля, изготовлены из коллагена или альгинатов, сшиты с использованием хорошо установленных способов, известных специалистам в данной области техники.
Подходящие полимерные материалы для образования матрикса включают, но не ограничиваются ими, биоразлагаемые/рассасывающиеся полимеры, которые могут быть выбраны из группы, включающей: агарозу, коллаген, фибрин, хитозан, поликапролактон, поли-DL-лактид-со-капролактон, поли-L-лактид-со-капролактон-со-гликолид, полигликолид, полилактид, полигидроксиалканоаты, их сополимеры, или биологически неразлагаемые полимеры, которые могут быть выбраны из группы, включающей: ацетат целлюлозы; бутират целлюлозы, альгинат, полисульфон, полиуретан, полиакрилонитрил, сульфированный полисульфон, полиамид, полиакрилонитрил, полиметилметакрилат, их сополимеры.
Коллаген является перспективным материалом для получения матрикса благодаря своей биосовместимости и полезному свойству поддерживать прикрепление и функции клеток (патент США №5019087; Tanaka, S.; Takigawa, Т.; Ichihara, S. & Nakamura, Т. Mechanical properties of the bioabsorbable polyglycolic acid-collagen nerve guide tube Polymer Engineering & Science 2006, 46, 1461-1467). Клинически приемлемые коллагеновые губки представляют собой пример матрикса и хорошо известны в данной области техники (например, доступны от Integra Life Sciences).
Фибриновые каркасы (например, фибриновый клей) обеспечивают альтернативный матриксный материал. Фибриновый клей нашел широкое клиническое применение в качестве герметика ран, резервуара для доставки факторов роста и в качестве вспомогательного компонента при размещении и закреплении биологических имплантатов (Rajesh Vasita, Dhirendra S Katti. Growth factor delivery systems for tissue engineering: a materials perspective. Expert Reviews in Medical Devices. 2006; 3(1):29-47; Wong C, Inman E, Spaethe R, Helgerson S. Thromb. Haemost. 2003 89(3):573-582; Pandit AS, Wilson DJ, Feldman DS. Fibrin scaffold as an effective vehicle for the delivery of acidic growth factor (ФРФ1). J. Biomaterials Applications. 2000; 14(3); 229-242; DeBlois Cote MF. Doillon CJ. Heparin-fibroblast growth factor fibrin complex: in vitro and in vivo applications to collagen based materials. Biomaterials. 1994; 15(9):665-672).
В работе авторов Luong-Van et al. (In vitro biocompatibility and bioactivity of microencapsulated heparan sulphate Biomaterials 28 (2007) 2127-2136), включенной в настоящую заявку посредством ссылки, описана длительная локализованная доставка ГС из микрокапсул поликапролактона.
Другой пример биоматериала представляет собой полимер, который включает гидроксиапатит или гиалуроновую кислоту.
Одним из примеров биоматериала, подходящего для использования в комбинации с HS8, является материал для заполнения пустот кости JAX™ (Smith & Nephew). Гранулы Jax состоят из высокочистого сульфата кальция и сохраняют свою форму, чтобы обеспечить каркас с контролируемой величиной пористости между различными гранулами и стабильностью миграции гранул. Гранулы Jax безопасно и полностью растворяются в организме.
Другие подходящие биоматериалы включают керамические или металлические материалы (например, титан), гидроксиапатит, трикальцийфосфат, матрикс на основе деминерализованной костной ткани (DBM), аутотрансплантаты (т.е. трансплантаты, полученные из ткани пациента), или аллотрансплантаты (трансплантаты, полученные из ткани животного, которое не является пациентом). Биоматериалы могут быть синтетическими (например, металл, фибрин, керамика) или биологическими (например, материалы-носители, изготовленные из ткани животных, например, млекопитающих, за исключением человека (например, корова, свинья), или человека).
Биоматериал может быть обогащен дополнительными клетками. Например, в биоматериал могут быть высеяны (или он может быть совместно синтезирован с ними) недифференцированные клетки-предшественники кости, например, стволовые клетки, такие как мезенхимальные стволовые клетки, более предпочтительно мезенхимальные стволовые клетки человека.
Субъект, которого лечат, может представлять собой любое животное или человека. Субъект предпочтительно представляет собой млекопитающее, более предпочтительно человека. Субъект может представлять собой млекопитающее, не относящееся к человеку (например, кролика, морскую свинку, крысу, мышь или другого грызуна (включая клетки любого животного из отряда Rodentia), кошку, собаку, свинью, овцу, козу, крупный рогатый скот (включая коров, например, молочных коров, или любое животное из отряда Bos), лошадь (включая любое животное из отряда Equidae), осла, и примата, не относящегося к человеку). Млекопитающее, не относящееся к человеку, может представлять собой домашнее животное или животное, которое содержат в коммерческих целях, например, скаковую лошадь, или сельскохозяйственных животных, таких как свиньи, овцы и крупный рогатый скот. Субъект может представлять собой самца или самку. Субъект может быть пациентом.
Способы в соответствии с настоящим изобретением можно осуществлять в условиях in vitro или в условиях in vivo, как указано. Термин «в условиях in vitro» подразумевает включение методик, осуществляемых с использованием клеток в культуре, тогда как термин «в условиях in vivo» предназначен для включения методик, осуществляемых с использованием интактных многоклеточных организмов.
Пассирование клеток
Способы, описанные в настоящей заявке, могут включать пассирование или разделение популяции клеток во время культивирования. Способы могут включать непрерывное или постоянное пассирование.
Термин «пассаж» в целом может относиться к процессу отбора аликвоты клеточной культуры, полной или частичной диссоциации клеток, разбавлению и инокуляции в среду. Пассирование можно повторять один или более раз. Аликвота может содержать всю или часть клеточной культуры. Клетки аликвоты могут быть полностью, частично конфлюентными или неконфлюентными. Пассирование может включать по меньшей мере некоторые из следующей последовательности стадий: аспирация, промывание, трипсинизация, инкубация, извлечение, блокирование, повторный высев и отбор аликвот. Может быть использован протокол, опубликованный лабораторией д-ра Хедрика (Hedrick), Университет штата Калифорния в Сан-Диего (http://hedricklab.ucsd.edu/Protocol/COSCell.html).
Клетки в культуре могут быть отделены от субстрата или колбы, и «разделены», подвергнуты дополнительному культивированию или пассированию, путем разбавления в среде для культивирования тканей, а затем повторно высеяны.
Процесс пассирования может быть повторен по меньшей мере один раз, например, два раза, три раза, четыре раза, пять раз и т.д. (как изложено ниже). В некоторых случаях пассирование можно повторять любое количество раз, например, до бесконечности. Наиболее предпочтительно процесс повторяют 3 или более раз, например, 5 или более раз, 6 или более раз, 7 или более раз, 8 или более раз, 9 или более раз, 10 или более раз, 11 или более раз, 12 или более раз, 13 или более раз, 14 или более раз, 15 или более раз, 16 или более раз, 17 или более раз, 18 или более раз, 19 или более раз, 20 или более раз, 21 или более раз, 22 или более раз, 23 или более раз, 24 или более раз, 25 или более раз.
Клетки могут быть отделены с помощью любых подходящих средств, таких как механические или ферментативные средства, известные в данной области техники. Клетки могут быть разрушены путем механической диссоциации, например, с помощью скребка для клеток или пипетки. Клетки могут быть отделены путем просеивания через сито соответствующего размера, например, с помощью сит с размером пор 100 микрон или 500 микрон. Клетки могут быть разделены путем ферментативного отделения, например, путем обработки коллагеназой или TrypLE и собраны. Отделение клеток может быть полным или частичным.
Разбавление может представлять собой любое подходящее разбавление. Клетки в культуре клеток могут быть разделены в любом подходящем соотношении. Например, клетки могут быть разделены в соотношении 1:2 или более, 1:3 или более, 1:4 или более или 1:5 или более. Клетки могут быть разделены в соотношении 1:6 или более, 1:7 или более, 1:8 или более, 1:9 или более или 1:10 или более. Соотношение при разделении клеток может составить 1:10 или более. Соотношение при разделении клеток может составить 1:11, 1:12, 1:13, 1:14, 1:15, 1:16, 1:17, 1:18, 1:19 или 1:20 или более. Соотношение при разделении клеток может составить 1:21, 1:22, 1:23, 1:24, 1:25 или 1:26 или более.
Соответственно, стволовые клетки можно пассировать 1 или более раз. Например, стволовые клетки можно пассировать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более раз. Стволовые клетки можно пассировать 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или более раз. Стволовые клетки можно размножать в культуре неопределенное количество раз.
Количество пассажей может быть выражено как количество поколений размножения клеток. Предложенные в настоящем изобретении способы и композиции пригодны для обеспечения размножения стволовых клеток в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более поколений. Стволовые клетки могут быть выращены в течение 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или более поколений.
Количество пассажей также может быть выражено в виде числа удвоений клеток. Предложенные в настоящем изобретении способы и композиции пригодны для обеспечения размножения стволовых клеток в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более удвоений клеток. Стволовые клетки могут быть выращены в течение 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или более удвоений клеток.
Стволовые клетки можно культивировать в течение более чем 5, более чем 10, более чем 15, более чем 20, более чем 25, более чем 30, более чем 40, более чем 45, более чем 50, более чем 100, более чем 200, более чем 500 или более чем 800 пассажей, поколений или удвоений клеток. Стволовые клетки можно поддерживать в культуре в течение 100, 200, 500 или более пассажей, поколений или удвоений клеток.
Согласно некоторым вариантам реализации настоящего изобретения при каждом пассаже клетки вступают в контакт с HS8. Согласно другим вариантам реализации настоящего изобретения HS8 может присутствовать в культуральной среде только в ограниченном числе пассажей культур, например, в одном из 50%, 60%, 70%, 75%, 80%, 90% или 95% пассажей культур.
Размноженные стволовые клетки могут сохранять по меньшей мере одну характеристику исходной стволовой клетки(ок), используемой для посева культуры. Стволовые клетки могут сохранять эту характеристику после одного или более пассажей. Стволовые клетки могут сохранять эту характеристику после множества пассажей. Стволовые клетки могут сохранять эту характеристику после указанного числа пассажей, как описано выше.
Характеристика может включать морфологическую характеристику, иммуногистохимическую характеристику, молекулярно-биологическую характеристику и т.д. Характеристика может включать биологическую активность. В частности, стволовые клетки могут быть охарактеризованы по наличию экспрессии, или поддержанию экспрессии, определенных молекулярных маркеров, таких как маркеры клеточной поверхности.
Детектирование маркеров может быть достигнуто с помощью любых средств, известных в данной области техники, например, иммунологических способов. Может быть использовано гистохимическое окрашивание, проточная цитометрия (FACS), Вестерн-блот, твердофазный иммуноферментный анализ (ИФА) и т.д.
Биологическая активность может включать жизнеспособность клеток после указанного числа пассажей. Жизнеспособность клеток может быть количественно определена различными способами, например, по включению трипанового синего. Протокол прижизненного окрашивания описан далее. Подходящий объем клеточной суспензии (20-200 мкл) помещают в соответствующую пробирку, добавляют равный объем 0,4% трипанового синего и осторожно перемешивают, выдерживают в течение 5 минут при комнатной температуре. По 10 мкл окрашенных клеток помещают в гемоцитометр и посчитывают количество жизнеспособных (неокрашенных) и мертвых (окрашенных) клеток. Рассчитывают среднее число неокрашенных клеток в каждом квадранте, и умножают на 2×104, чтобы получить количество клеток/мл. Процент жизнеспособных клеток представляет собой количество жизнеспособных клеток, деленное на число погибших и жизнеспособных клеток.
Жизнеспособность клеток может составлять 50% или более, 60% или более, 70% или более, 80% или более, 90% или более, 93% или более, 95% или более, 97% или более, 98% или более, 99% или более, или по существу 100%.
Размноженные стволовые клетки могут сохранять способность к дифференцировке в линии клеток, которые характерны для этого типа стволовых клеток. Способы индукции дифференцировки стволовых клеток в специфичные клоны известны в данной области техники и могут быть использованы для количественного исследования способности размноженных стволовых клеток. Все или существенная часть размноженных клеток могут сохранить указанную способность. Это количество может составить 50% или более, 60% или более, 70% или более, 80% или более, 90% или более, 93% или более, 95% или более, 97% или более, 98% или более, 99% или более, или по существу 100% размноженных стволовых клеток.
Размноженные стволовые клетки могут сохранять нормальный кариотип во время или после размножения. «Нормальный» кариотип представляет собой кариотип, который идентичен, аналогичен или по существу сходен с кариотипом исходной стволовой клетки, из которой получена стволовая клетка, или тот, который отличается от него, но каким-либо несущественным образом. Например, в нормальном кариотипе должны отсутствовать макроскопические аномалии, такие как транслокации, потери хромосом, делеции и т.д.
Кариотип может быть оценен с помощью ряда способов, например, визуально под оптическим микроскопом. Кариотипы могут быть подготовлены и исследованы, как описано в McWhir et al. (2006), Hewitt et al. (2007), и Gallimore and Richardson (1973). Кариотип клеток также может быть исследован с использованием стандартной методики G-полосы (доступна во многих лабораториях клинической диагностики, которые обеспечивают рутинное кариотипирование, таких как лаборатория цитогенетики в Окленде Калифорния) и сопоставлен с опубликованными кариотипами стволовых клеток.
Все или существенная часть размноженных клеток могут сохранять нормальный кариотип. Доля клеток с нормальным кариотипом может составлять 50% или более, 60% или более, 70% или более, 80% или более, 90% или более, 93% или более, 95% или более, 97% или более, 98% или более, 99% или более, или по существу 100%.
Культуральные среды
Культуральные среды, содержащие HS8 (предпочтительно выделенный HS8), могут быть любого типа, предпочтительно в виде жидкости или геля, и могут содержать другие питательные вещества и факторы роста (например, ФРФ2). Культуральные среды могут быть получены в сухой форме, например, порошковой форме, для восстановления до жидкости или геля. HS8 предпочтительно будет присутствовать в неследовых количествах. Например, концентрация HS8 в культуральной среде может быть в диапазоне от приблизительно 1 нг/мл культуральной среды до приблизительно 1000 нг/мл культуральной среды. Предпочтительно концентрация HS8 в культуральной среде составляет приблизительно 500 нг/мл или менее, более предпочтительно 250 нг/мл или менее, 100 нг/мл или менее, 90 нг/мл или менее, 80 нг/мл или менее, 70 нг/мл или менее, 60 нг/мл или менее, 50 нг/мл или менее, 40 нг/мл или менее, 30 нг/мл или менее, 20 нг/мл или менее, 10 нг/мл или менее, или 5 нг/мл или менее.
Дозы гепарансульфата
При использовании как в условиях in vitro, так и в условиях in vivo, HS8 может быть использован в концентрации или дозировке приблизительно 500 нг/мл или менее, более предпочтительно 250 нг/мл или менее, 100 нг/мл или менее, 90 нг/мл или менее, 80 нг/мл или менее, 70 нг/мл или менее, 60 нг/мл или менее, 50 нг/мл или менее, 40 нг/мл или менее, 30 пг/мл или менее, 20 нг/мл или менее, 10 нг/мл или менее, 5 нг/мл или менее; или приблизительно 100 мг или менее, 50 мг или менее, 40 мг или менее, 30 мг или менее, 20 мг или менее, 10 мг или менее, 5 мг или менее, 4 мг или менее, 3 мг или менее, 2 мг или менее, или 1 мг или менее; или в диапазоне приблизительно 0,3-5 мкг/мл, 0,3-4, 0,3-3, 0,3-2,5, 0,3-2, 0,3-1,5, 0,3-1,0, 0,3-0,9, 0,3-0,8, 0,3-0,7, 0,3-0,6, 0,3-0,5, 0,3-0,4, 1-2, 1-1,75, 1-1,5, 1-1,25, 1,25-2, 1,5-2 или 1,75-2 мкг/мл.
ФРФ2
В данном описании ФРФ2 относится к фактору роста фибробластов 2 (также известному как основной фактор роста фибробластов (оФРФ) или ФРФ-бета), который является членом семейства факторов роста фибробластов.
ФРФ2 присутствует в базальных мембранах многих тканей и, как полагают, остается связанным с мембраной при отсутствии сигнального стимула. ФРФ2 был вовлечен в процессы заживления ран, развития опухолей и ангиогенез.
Связывание ФРФ2 с его тирозинкиназным рецептором стимулирует сигнальный каскад, включающий активацию митоген-активируемой протеинкиназы (MEK) и фосфорилирование киназ, регулируемых внеклеточными сигналами (ERKs) (например, см. Ok-Jin Park et al., The Journal of Biological Chemistry, 285, (2010) 3568-3574).
Аминокислотная последовательность ФРФ2 из Homo sapiens приведена на Фигуре 28 (гепаринсвязывающий домен SEQ ID NO: 1 подчеркнут). Эта последовательность доступна в Genbank под регистрационным номером NP_001997.5 (GI:153285461).
В данном описании «ФРФ2» включает белки или полипептиды, последовательность которых по меньшей мере на 70%, более предпочтительно на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности ФРФ2, показанной на Фигуре 28.
Белок или полипептид ФРФ2 предпочтительно также содержит домен связывания гепарина, имеющий аминокислотную последовательность SEQ ID NO: 1, или аминокислотную последовательность, которая на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности SEQ ID NO: 1.
Белок или полипептид ФРФ2 может представлять собой фрагмент или укороченный вариант полпоразмерного белка или полипептида ФРФ2. Белок ФРФ2 может быть получен от, или происходить из, любого животного или человека, например, животных, не относящихся к человеку, например, кролика, морской свинки, крысы, мыши или другого грызуна (включая любое животное из отряда Rodentia), кошку, собаку, свинью, овцу, козу, крупный рогатый скот (включая коров, например, молочных коров, или любое животное из отряда Bos), лошадь (включая любое животное из отряда Equidae), осла, и примата, не относящегося к человеку, или другого позвоночного организма, не относящегося к человеку; и/или млекопитающего животного, не относящегося к человеку; и/или человека.
Дозы ФРФ2
При использовании в условиях in vitro и в условиях in vivo, ФРФ2 может быть использован в комбинации с HS8. В некоторых способах культивирования клеток согласно настоящему изобретению к культуре добавлен экзогенный HS2.
Подходящие концентрации или дозы ФРФ2 включают приблизительно 500 нг/мл или менее, более предпочтительно 250 нг/мл или менее, 100 нг/мл или менее, 90 нг/мл или менее, 80 нг/мл или менее, 70 нг/мл или менее, 60 нг/мл или менее, 50 нг/мл или менее, 40 нг/мл или менее, 30 нг/мл или менее, 20 нг/мл или менее, 10 нг/мл или менее, 5 нг/мл или менее; или приблизительно 100 мг или менее, 50 мг или менее, 40 мг или менее, 30 мг или менее, 20 мг или менее, 10 мг или менее, 5 мг или менее, 4 мг или менее, 3 мг или менее, 2 мг или менее, или 1 мг или менее; или в диапазоне приблизительно 0,1-5 нг/мл, 0,1-0,2, 0,1-0,3, 0,1-0,4, 0,1-0,5, 0,1-0,6, 0,1-0,7, 0,1-0,8, 0,1-0,9, 0,1-1,0, 0,1-1,5, 0,1-2,0, 0,1-2,5, 0,1-3,0, 0,1-3,5, 0,1-4,0, 0,1-4,5, 0,1-5,0 нг/мл.
Согласно некоторым вариантам реализации настоящего изобретения использование HS8 в условиях in vitro и в условиях in vivo исключает добавление экзогенного ФРФ2. Например, в некоторых способах культивирования клеток согласно настоящему изобретению к культуре не добавляют экзогенный ФРФ2.
Настоящее изобретение включает комбинацию описанных аспектов и предпочтительных признаков, за исключением случаев, когда такая комбинация явно недопустима или явным образом исключается.
Заголовки разделов, используемые в настоящей заявке, предназначены только для организационных целей и не должны быть истолкованы как ограничивающие описанный объект настоящего изобретения.
Аспекты и варианты реализации настоящего изобретения будут проиллюстрированы далее, в качестве примера, со ссылкой на прилагаемые чертежи. Дополнительные аспекты и варианты реализации будут очевидны специалистам в данной области техники. Все документы, упомянутые в тексте данного описания, включены в настоящую заявку посредством ссылки.
Краткое описание чертежей
Варианты и эксперименты, иллюстрирующие принципы настоящего изобретения, будут описаны далее со ссылкой на прилагаемые чертежи, на которых:
Фигура 1. График, на котором показано преимущественное связывание HS8 с ФРФ2 при концентрациях ФРФ2 равных 0, 25, 50 и 100 нг/мл. Линии данных на графике сверху вниз представляют: HS8+ (5 мкг/мл) (треугольники), гепарин (5 мкг/мл) (квадраты), Celsus HS (5 мкг/мл), HS8- (5 мкг/мл), в отсутствие ГАГ (ромбы).
Фигура 2. График, на котором показана специфичность HS8 (5 мкг/мл) в отношении ФРФ2. Линии данных на графике сверху вниз представляют: HS8+/ФРФ2 (ромбы), HS8+/ФРФ1, HS8-/ФРФ2, HS8+/ФРФ7, HS8+ /BMP2, HS8+ /VEGF, SAB/ФРФ2, HS8+ /PDGFBB.
Фигура 3. График, на котором показано дозазависимое увеличение количества STRO1 мезенхимальных стволовых клеток человека на 6 день в ответ на обработку HS8. Столбики слева направо представляют: контроль, HS8+ 50 нг/мл, HS8+ 100 нг/мл, HS8+ 500 нг/мл, HS8+ 1000 нг/мл, HS8+ 5000 нг/мл, HS8+ 10000 нг/мл.
Фигура 4. График, на котором показана пролиферация STRO1 мезенхимальных стволовых клеток человека в течение 6 дней в ответ на HS8+ 5000 нг/мл (квадраты) и контроль (ромбы).
Фигура 5. Таблица, в которой приведены пептиды гепаринсвязывающего домена ФРФ2.
Фигура 6. (А) Количество радиоактивных распадов в минуту (СРМ) для различных количеств пептида, (В) HS8, адсорбированный с помощью аффинной хроматографии.
Фигура 7. Схема, иллюстрирующая структуру количественных исследований аффинности связывания ГАГ.
Фигура 8. Оптимизация различных концентраций ГАГ, связывающихся с ФРФ2.
Фигура 9. График, на котором показаны различные ГАГ, связывающиеся с ФРФ2.
Фигура 10. Графики, на которых показано связывание (A) HS8 (HS8+) и (В) HS8(-) с различными белками.
Фигура 11. Графики, на которых показаны результаты количественных исследований с использованием гепариновых гранул: (А) оптимизация ФРФ2, (В) конкуренция гепариновых гранул с экзогенным гепарином и (С) величина конкуренции с различными ГАГ, выраженная в процентах.
Фигура 12. Графики, на которых показано количество жизнеспособных клеток STRO1 (А) в соответствующие дни, (В) кумулятивное размножение клеток.
Фигура 13. Графики, на которых показано количество жизнеспособных клеток НМ21 (А) в соответствующие дни, (В) кумулятивное размножение клеток.
Фигура 14. Графики, на которых показано количество жизнеспособных клеток STRO1 HM21 (А) в соответствующие дни, (В) кумулятивное размножение клеток.
Фигура 15. График, на котором показана связывающая способность различных ГАГ в отношении ФРФ2, согласно результатам оценки с использованием ГАГ-связывающих планшетов (Iduron). Фракция HS8 (HS8+) связывается с ФРФ2 почти так же как гепарин и лучше, чем сырой исходный Celsus HS и проточная фракция HS8-.
Фигура 16. Графики, на которых показана связывающая способность различных ГАГ в отношении гепаринсвязывающих факторов роста (HBGFs) ВМР-2, ФРФ1, ФРФ2, ФРФ7, PDGF-BB и VEGF, согласно результатам оценки с использованием ГАГ-связывающих планшетов (Iduron). (A) Celsus HS, (В) HS8, (С) фракция HS8-, (D) гепарин. Фракция HS8 (HS8+) преимущественно связывается с ФРФ2 по сравнению со всеми другими HBGFs и даже лучше чем гепарин. HS8- и сырой исходный Celsus HS проявляют незначительное предпочтение в отношении любого из HBGFs.
Фигура 17. График, на котором показаны дозазависимые ответы человеческих мезенхимальных стволовых клеток на HS8 (HS8+), согласно результатам определения по включению BrdU в течение 36 часов. ФРФ2 используется в качестве положительного контроля дозирования. Фракция HS8+ обеспечивает значительно более сильный стимул, чем другие испытанные ГАГ.
Фигура 18. Графики, на которых показаны дозазависимые ответы мезенхимальных стволовых клеток на HS8 (HS8+) (вверху) и ФРФ2 (внизу), согласно результатам, полученным с помощью метода подсчета клеток Guava ViaCount (проточная цитометрия), в течение указанных периодов времени (в сутках). ФРФ2 используется в качестве положительного контроля дозирования (нижний график). HS8 обеспечивает значительный стимул.
Фигура 19. График, на котором показаны дозазависимые ответы мезенхимальных стволовых клеток человека на возрастающие концентрации различных ГАГ, согласно результатам, полученным с помощью метода подсчета клеток Guava ViaCount (проточная цитометрия), в течение указанных периодов времени (в сутках). HS8 (HS8+), как правило, обеспечивал получение большего количества клеток.
Фигура 20. График, на котором показаны дозазависимые ответы мезенхимальных стволовых клеток человека на возрастающие концентрации различных ГАГ, согласно результатам, полученным с помощью метода подсчета клеток Guava ViaCount (проточная цитометрия) в течение не более 7 пассажей. ФРФ2 по отдельности обеспечивает самый сильный стимул; HS8 (HS8+) в обеих концентрациях, как правило, обеспечивал получение большего количества клеток, как и гепарин.
Фигура 21. Иллюстрация результатов типичного иммунного фенотипирования МСКЧ (Lonza) методом проточной цитометрии, на основе следующих маркеров: (А) Отрицательные маркеры: CD14, CD19, CD34, CD45, HLA-DR, и (В) Положительные маркеры: CD73, CD90, CD105, STRO-1, SSEA-4, CD49a.
Фигура 22. Таблица, в которой приведены количественные данные для иммунологически фенотипированных методом проточной цитометрии МСКЧ, выращенных в течение 7 пассажей в среде без добавок (контроль), в присутствии HS8 (HS8+), HS8-, сырого Celsus HS (CHS) или ФРФ2 по отдельности. В таблице показан процент клеток, экспрессирующих соответствующий поверхностный маркер: CD14, CD19, CD34, CD45, HLA-DR, CD73, CD90, CD105, CD49a, SSEA-4, STRO-1.
Фигура 23. Графическое представление результатов иммунного фенотипирования методом проточной цитометрии МСКЧ, выращенных в течение 4-7 пассажей в среде без добавок (контроль), в присутствии HS8 (HS8+), HS8-, сырого Celsus HS или ФРФ2 (2,5 нг/мл) по отдельности. (A) CD49a, (В) SSEA-4, (С) STRO-1.
Фигура 24. (А) Графическое представление и (В) микрофотографии культуральных планшетов для количественного исследования МСКЧ КОЕ после культивирования МСКЧ, выращенных в течение 4-7 пассажей (Р4, Р7) в культуральной среде без добавок (контроль), в присутствии гепарина, Celsus HS, HS8- и HS8 (HS8+).
Фигура 25. Микрофотографии, которые показывают способность МСКЧ дифференцироваться в клетки костной ткани (верхняя панель, ализариновый красный) и жировые клетки (нижняя панель, масляный красный О) после культивирования МСКЧ, выращенных в течение 4-7 пассажей (Р4, Р7) в культуральной среде без добавок (контроль), в присутствии HS8 (HS8+), HS8-, Celsus HS, гепарина и ФРФ2.
Фигура 26. HS8 усиливает ФРФ2-опосредованное размножение МСК. График, на котором показано количество МСКЧ после культивирования в нормальных поддерживающих средах (контроль), или средах, содержащих различные дозы HS8 (мкг/мл) и фиксированную дозу ФРФ2 (0,156 нг/мл).
Фигура 27. HS8 поддерживает передачу сигналов с участием ФРФ2. Результаты исследования методом Вестерн-блот, свидетельствующие о фосфорилировании ERK1/2 и фосфорилировании FRS2a через 30 минут и через 24 ч после стимуляции HS8 и/или ФРФ2.
Фигура 28. Аминокислотная последовательность человеческого ФРФ2. Последовательность SEQ ID NO: 1 подчеркнута.
Фигура 29. Дисахаридный состав гепарансульфата из нейроэпителия Е10 (HS2), полученный в результате расщепления азотистой кислотой. Радиоактивномеченый ГС был деполимеризован с помощью дезаминирующего расщепления с использованием HNO2 при низком значении рН. Дисахариды были выделены после обработки ГАГ с использованием HNO2, затем образцы разделяли на колонке Bio-Gel Р-2 1×120 см. Полученные дисахариды фракционировали с помощью ВЭЖХ с сильным анионообменником. Площади под пиками были интегрированы, чтобы получить дисахаридный состав и затем процентный состав в каждом образце.
Фигура 30. Дисахаридный состав гепарансульфата из нейроэпителия Е10 (HS2) после обработки гепаринлиазой. Гепарансульфат был полностью деполимеризован смесью гепаранлиаз. Полученные ненасыщенные дисахариды были выделены на колонке Р-2 и фракционированы с помощью хроматографии на колонке с сильным анионообменником. Площадь под каждой полученной кривой была интегрирована, чтобы рассчитать долю каждого дисахарида в каждом образце. Цифры представляют собой среднее значение двух экспериментов (для первичных образцов ГАГ) и трех экспериментов (для образцов, полученных из 2.3D). Более 97% дисахаридов были выделены из каждого образца.
Фигура 31. Спектры1Н-ЯМР для Celsus HS, HS8 и HS3 (растворы в D2O).
Фигура 32. Спектры1Н-ЯМР для Celsus HS, HS8 и HS3 (растворы в D2O) в увеличенном масштабе.
Фигура 33. Хроматограммы, полученные с помощью ВЭЖХ/эксклюзионной хроматографии/рефрактометрии, для Celsus HS #10697 и HS8, разделенных на двух колонках Superdex Peptide, элюированных с использованием 50 мМ ацетата аммония.
Фигура 34. Хроматограммы, полученные с помощью ВЭЖХ/эксклюзионной хроматографии/рефрактометрии, для гепарансульфата: Celsus HS #10697; не удерживаемого ВМР2 (848/HS3/001); удерживаемого ВМР2 (HS3) (848/HS3/001); первоначальный хроматографический опыт (HS3-001-01); последний хроматографический опыт (HS3-001-02). Препараты HS3 имели высокий пик (0,06-0,08) при приблизительно 15 мл.
Фигура 35. Хроматограммы, полученные с помощью ВЭЖХ/эксклюзионной хроматографии/рефрактометрии, для продуктов расщепления препаратов HS #10697 и HS #10595 от Celsus, полученных в результате действия гепаринлиазы I, II и III. Продукты расщепления гепаринлиазами получали в двух повторах. Вертикальная линия указывает точку отсечения данных для элюирования дисахаридов и олигосахаридов со степенью полимеризации (СП) более 2.
Фигура 36. Хроматограммы, полученные с помощью ВЭЖХ/эксклюзионной хроматографии/рефрактометрии, для HS8 (широкий пик при 18-20 мл), HS3-001-01 (пик при 19-20 мл), на двух колонках Superdex Peptide, элюированных с использованием 50 мМ ацетата аммония.
Фигура 37. Графики, на которых показана гепаринсвязывающая последовательность SEQ ID NO: 1.
Фигура 38. График, на котором отражена способность HS8 связываться с иммобилизованным гепарином.
Фигура 39. График, на котором отражена способность ФРФ2 связываться с HS8, очищенным с помощью аффинной хроматографии (колонка дериватизирована с помощью SEQ ID NO: 1). Степень связывания сравнивали с таковой для связывания с сырым, исходным ГС (HS-PM из слизистой оболочки свиней) или контролем, не содержащим сахара.
Фигура 40. График, на котором показана пролиферация мезенхимальных стволовых клеток, прикрепленных к пластиковой поверхности, в течение 6 дней в присутствии HS8.
Фигура 41. График, на котором показана пролиферация STRO-1-выделенных мезенхимальных стволовых клеток в течение 36 часов в присутствии выделенного HS8, согласно результатам измерения с помощью BrdU, по сравнению с сырым исходным Celsus HS (HS-PM), или несвязывающейся проточной фракцией ГС (HS8-).
Фигура 42. График, на котором показан нормированный дисахаридный состав для Celsus HS.
Фигура 43. График, на котором показан нормированный дисахаридный состав для HS3.
Фигура 44. График, на котором показан дисахаридный состав для Celsus HS, HS8 и HS3.
Фигура 45. Таблица, в которой приведены данные по процентному дисахаридному составу для Celsus, ГС, HS3 и HS8.
Фигура 46. График, на котором приведены результаты оценки стабильности ФРФ2 в отсутствие ГС, в присутствии гепарина, HS8, Celsus HS (HSPM) или HS8-. ФРФ2 стабилизирован в присутствии HS8.
Фигура 47. График, на котором показано, что SU5402 (ингибитор ФРФR1) блокирует пролиферацию МСКЧ, стимулированную HS8.
Фигура 48. График, на котором показано, что IMB-R1 (нейтрализующее антитело к ФPФR1) ингибирует пролиферацию МСКЧ, стимулированную HS8.
Фигура 49. График, на котором показано, что IMB-R1 (нейтрализующее антитело к ФPФR1) ингибирует пролиферацию МСКЧ, стимулированную HS8.
Фигура 50. График, на котором показано, что нейтрализующее антитело к ФРФ2 ингибирует пролиферацию МСКЧ, стимулированную HS8.
Фигура 51. Графики, на которых показано, что МСК человека, размноженные в содержащей HS8 среде, являются более клоногенными (3 отдельных донора).
Фигура 52. График и микрофотография КТ, на которых показано, что HS8 значительно усиливает заживление кости в крысиной модели патологий свода черепа критического размера.
Подробное описание изобретения
Подробное описание одного или более вариантов реализации настоящего изобретения приведено в прилагаемом описании ниже, включая конкретные детали наилучшего способа реализации, предусмотренного авторами изобретения для осуществления настоящего изобретения, приведенные в качестве примера. Специалист в данной области техники поймет, что настоящее изобретение может быть осуществлено, не ограничиваясь указанными конкретными деталями.
Примеры
Пример 1
Авторы настоящего изобретения изучили очистку нового ФРФ2-связывающего ГС из коммерчески доступных источников свиного гепарансульфата Celsus, пригодных для крупномасштабного получения препаратов гепарансульфата (ГС), которые можно легко использовать в клинике.
Была выбрана пептидная последовательность гепаринсвязывающего домена (ГСД) из ФРФ2, GHFKDPKRLYCKNGGF [SEQ ID NO: 1] (The structure of glycosaminoglycans and their interactions with proteins; Gandhi NS and Mancera RL., Chem Biol Drug Des. 2008 Dec; 72(6):455-82) и использована для очистки конкретных молекул ГС, связывающихся с ФРФ2.
После синтеза пептида его количественно исследовали с использованием [3Н]-гепарина, сравнивая специфичное, дозазависимое связывание3Н-гепарина с пептидом, которым была пропитана нитроцеллюлозная мембрана, с общим количеством импульсов3Н-гепарина. После того как было показано специфичное связывание3Н-гепарина с пептидом ФРФ2-ГСД, пептид использовали для выделения специфичного ГС из Celsus HS свиньи, который связывается с ФРФ2, с помощью аффинной хроматографии. Новая молекула ГС была названа HS8 (и получила другое название HS8G).
HS8 исследовали для определения специфичности его связывания с ФРФ2 с помощью гликозаминогликан (ГАГ)-связывающих планшетов, причем специфичное связывание HS8 с ФРФ2 измеряли в сравнении с гепарином, Celsus HS свиньи и отрицательной фракцией HS8.
ГАГ наносили на ГАГ-связывающий планшет (5 мкг/мл) в течение ночи, и затем инкубировали с рекомбинантным человеческим ФРФ2 (0-100 нг/мл), для проверки специфичности связывания ГАГ с ФРФ2 использовали метод ИФА.
Полученные результаты убедительно свидетельствуют о том, что HS8 более эффективно связывается с ФРФ2 по сравнению с другими молекулами ГАГ (Фигура 1). Способность HS8 связываться с ФРФ2 сравнивали с другими факторами роста (VEGF, ВМР2, PDGFBB, ФРФ1 и ФРФ7), с помощью которых выявили, что HS8 специфичен в отношении ФРФ2 (Фигура 2).
HS8 также изучали с помощью количественного способа исследования клеточной пролиферации в условиях in vitro, используя STROl мезенхимальные стволовые клетки человека (МСКЧ), чтобы определить биологическую активность HS8. HS8 использовали в различных дозах (50 нг/мл, 100 нг/мл, 500 нг/мл, 1000 нг/мл, 5000 нг/мл и 10000 нг/мл) в качестве применяемой по отдельности добавки к культуральной среде при кратковременном размножении МСКЧ, по сравнению с контролями. В отсутствие добавок экзогенных факторов роста в присутствии HS8 наблюдали дозазависимое размножение МСКЧ (Фигуры 3 и 4).
Пример 2
Мезенхимальные стволовые клетки (МСК)
Согласно общепринятому определению МСК представляют собой прикрепленные к пластику клетки, которые могут быть подвергнуты дифференцировке в условиях in vitro в остеогенные, хондрогенные, адипогенные, миогенные и другие линии, и с недавних пор название «мультипотентные мезенхимальные стромальные клетки» для обозначения МСК было введено в употребление Международным обществом клеточной терапии (Zulma et al., 2011). МСК обнаруживаются в костном мозге, жировой ткани, дерме, межпозвоночных дисках, амниотической жидкости, различных тканях зуба, плаценте человека и пуповинной крови (Si et al., 2011 и Zulma et al., 2011). Терапевтический потенциал МСК был признан и используется для многих целей в медицинской практике, таких как регенерация костной ткани и регенерация тканей, не относящихся к скелету. В последние годы было описано иммуносупрессорное и противовоспалительное действие МСК. Перечисленные виды действия обусловлены слабой иммуногенностью МСК, вследствие экспрессии низких уровней молекул главного комплекса гистосовместимости I (МНС-1) на их клеточной поверхности, способности подавлять активацию и пролиферацию Т- и В-лимфоцитов и модифицировать микроокружение травмированных тканей, защищая при этом поврежденные ткани (Si et al., 2011 и Zulma et al., 2011). Механизм MCK-опосредованной иммуносупрессии, которая может быть эффективно использована для лечения РТПХ, изменяется в зависимости от вида животного (Ren et al., 2009 и Shi et al., 2010). Цитокин-зависимая активация МСК мыши опосредована оксидом азота (NO), и цитокин-зависимая активация МСК человека осуществляется посредством индоламин-2,3-диоксигеназы (IDO).
Гепарин и гепарансульфат гликозаминогликаны (ГС ГAГ)
Гепарин вырабатывается и хранится в тучных клетках и, для сравнения, ГС ГАГ обнаруживаются во всех тканях животных и могут принимать форму протеогликана, в котором цепи ГС связаны с клеточной поверхностью или белками внеклеточного матрикса (ВКМ). ГС влияет на метаболизм, транспорт, передачу информации, клеточную адгезию, размножение и дифференцировку клеток, а также гомеостаз во всех системах органов (Bishop et al., 2007 и Gandhi et al., 2008). Гепарин и ГС представляют собой линейные полисахариды, состоящие из повторяющихся дисахаридных субъединиц уроновая кислота-(1→4)-D-глюкозамин. Уроновая кислота может представлять собой либо D-глюкуроновую кислоту, либо L-идуроновую кислоту. Помимо этого, модификации в конкретных местах приводят к образованию различных N-сульфатированных, О-сульфатированных и N-ацетилированных сложных последовательностей (Ori et al. 2008). Наиболее распространенным дисахаридом в гепарине является IdoA(2S)-(1→4)-GlcNS(6S), который придает сильный отрицательный заряд по всей длине цепи, в результате гепарин связывается с белками с низкой или отсутствующей селективностью. С другой стороны, ГС содержит несульфатированный дисахарид GlcA-(1→4)-GlcNA в качестве наиболее распространенной формы, которая приводит к возникновению сегрегированных блоков несульфатированных доменов NA и блоков высокосульфатированных, гепарин-подобных дисахаридов IdoA-(1→4)-GlcNS (домен NS). Домены NA и NS разделены переходными доменами NA/NS. Такое разнообразие структуры ГС обуславливает широкий спектр биологических функций.
Белки факторов роста фибробластов (ФРФ) и гепаринсвязывающие домены
Факторы роста фибробластов (ФРФ) представляют собой большое семейство полипептидных факторов роста, которое у человека состоит из 22 членов. Они играют важную роль в развитии, дифференцировке, пролиферации клеток, ангиогенезе и заживлении ран путем связывания и активации подсемейства тирозинкиназ, связанных с рецепторами ФРФ на клеточной поверхности, которые известны как рецепторы ФРФ (ФРФR) (Ornitz et al. 1996). Кроме того, ФРФ являются одними из наиболее изученных гепаринсвязывающих белков, и ГС ГАГ регулируют передачу сигналов с участием ФРФ за счет непосредственной связи молекул с рецепторами ФРФ (Pellegrini, 2001). Помимо этого, передача сигналов с участием ФРФ2 посредством рецептора ФРФ типа 1 имеет важное значение для размножения МСК (Gronthos et al., 1999).
Взаимодействия гепарина/ГС с ФРФ2
Различные исследования выявили общие структурные особенности в белковых сайтах связывания гепарина/ГС (Gandhi et al., 2008; Hileman et al., 1998 и Ori et al., 2008). Cardin и Weintraub в 1989 предприняли первую попытку определить гепаринсвязывающий домен (ГСД) после исследования 21 гепаринсвязывающего белка и предположили, что типичные гепаринсвязывающие сайты могут иметь последовательность ХВВХВХ или ХВВВХХВХ, в которой В представляет собой положительно заряженную аминокислоту (аргинин, лизин и редко гистидин) и X представляет собой гидропатический остаток. Следующая консенсусная последовательность ТХХВХХТВХХХТВВ была предложена авторами Hileman et al. в 1998 году после сравнения данных рентгеноструктурного исследования и ЯМР для нескольких белков. В указанной последовательности Т определяет поворот, В представляет собой основную аминокислоту (аргинин или лизин) и X представляет собой гидропатический остаток.
Как ожидается, сильные ионные взаимодействия будут существовать между ГАГ и белками, содержащими положительно заряженные основные аминокислоты, которые образуют ионные связи с отрицательно заряженными сульфатными или карбоксилатными группами на цепях гепарина. Их роль является определяющей для взаимодействия с гепарином и, возможно, с высокосульфатированными областями в ГС, такими как домены NS (Fromm et al., 1997 и Ori et al., 2008). Помимо этого, существуют и другие типы связей, а именно силы ван-дер-Ваальса, водородные связи и гидрофобные взаимодействия. Такие связи сыграют свою роль во взаимодействиях с более гетерогенным ГС, где также требуются нейтральные аминокислоты (Fromm et al., 1997 и Ori et al., 2008). В случае ФРФ2 аминокислоты глутамин и аспарагин играют важную роль во взаимодействии с ГС, образуя водородные связи с гидроксильными группами сахара в дополнение к ионным связям (Thompson et al., 1994).
Согласно результатам многочисленных опубликованных исследований, имеющимся к настоящему моменту, существуют различные пептидные последовательности, такие как гепаринсвязывающий домен ФРФ2, и те, которые были обобщены в таблице 1. В настоящей заявке авторы настоящего изобретения приняли систему нумерации, в которой аминокислоты пронумерованы в соответствии с полноразмерной последовательностью ФРФ2 (288 аминокислот).
Реакция трансплантат против хозяина (РТПХ)
Трансплантация кроветворных клеток (НСТ) представляет собой разновидность интенсивной терапии, используемой для лечения гематологических злокачественных заболеваний, причем число процедур трансплантации аллогенных кроветворных клеток ежегодно увеличивается (Ferrara et al., 2009). Основным осложнением НСТ является РТПХ, иммунологическое заболевание, которое в основном поражает желудочно-кишечный тракт, печень, кожу и легкие. Согласно данным, приведенным в Billingham, 1966-1967, для развития РТПХ необходимо наличие трех условий, в частности, 1) трансплантат должен содержать иммунологически компетентные клетки, которые представляют собой Т-лимфоциты, 2) реципиент должен экспрессировать тканевые антигены, которые не присутствуют у донора трансплантата, и 3) пациент должен быть неспособен выработать эффективный ответ, чтобы устранить трансплантированные клетки. Патофизиология РТПХ инициируется при использовании миелоаблативного режима кондиционирования для удаления пораженного костного мозга хозяина. Антигенпредставляющие клетки хозяина активируются в результате выработки цитокинов (ФНО, ИЛ-1, ЛПС) поврежденными тканями. После проведения аллогенной НСТ на этом этапе, активируются Т-клетки донора, которые, соответственно, вырабатывают большее количество цитокинов, что приводит к развитию клеточных и воспалительных ответов, вызывающих реакцию трансплантат против хозяина. Некроветворные стволовые клетки, МСК, могут уменьшить ответы, вызванные аллогенными Т-клетками, вследствие своего мощного иммуносупрессорного действия и улучшить РТПХ (Le Blanc et al., 2008; Meuleman et al., 2009 и Toubai et al., 2009).
Необходимость увеличения масштаба производства МСКЧ для применения в терапевтических целях
Основной недостаток применения МСКЧ в методах клеточной терапии заключается в сложности достижения достаточного количества клеток, несмотря на то, что они уже использовались в клиниках. Низкое количество МСКЧ, которое может быть ниже 0,01%-0,0001% от общего количества мононуклеарных клеток костного мозга, препятствует их широкому использованию. В соответствии с результатами, приведенными в работе Caplan, 2009, в которой костный мозг получали от доноров различного возраста, диспергировали, помещали в культуральные колбы, затем подсчитывали количество КОЕ-Ф, которое представляли в соответствии с возрастными декадами, в сравнении с МСК в расчете на количество ядросодержащих клеток костного мозга, наблюдали существенное снижение количества МСК в расчете на количество ядросодержащих клеток костного мозга, причем количество МСК уменьшилось в 10 раз в период от рождения до достижения подросткового возраста, и снизилось еще в 10 раз в период от подросткового возраста до пожилого. Очевидно, что с возрастом количество МСК в костном мозге уменьшается. Помимо этого, в работе Caplan отмечено, что снижение количества МСК соответствовало наблюдаемой скорости заживления переломов у молодых и взрослых людей. Для сравнения, титры кроветворных стволовых клеток в костном мозге, которые составляли приблизительно 1 на 104 ядерных клеток костного мозга, оставались неизменными на протяжении жизни человека.
Современные способы размножения МСКЧ
По мнению исследователей, имитация микросреды костного мозга при культивировании МСКЧ поможет достичь терапевтического количества МСКЧ для клинического применения. Как правило, имитация может быть достигнута с помощью двух общих способов, а именно выращивания МСКЧ в присутствии ВКМ и добавок экзогенного фактора роста. При использовании субстратов ВКМ наблюдали увеличение прикрепления МСКЧ и общего количества клеток (Grunert et al., 2007 и Matsubara et al., 2004), однако размноженные клетки не обладали свойствами стволовых клеток (Cool et al., 2005). Помимо этого, ФРФ2 обычно использовали в качестве добавки экзогенного фактора роста, что также приводило к заметному увеличению количества клеток (Ling et al., 2006 и Sotiropoulou et al., 2006) по сравнению с контролями со стандартными культуральными средами. В соответствии с результатами, полученными при выращивании клеток в присутствии субстратов ВКМ, клетки, выращенные в присутствии ФРФ2, также имели увеличенное количество дифференцированных клеток-предшественников, по сравнению с мультипотентными МСКЧ в контрольных условиях (Gronthos et al. 1999 и Walsh et al., 2000). Следовательно, выявление молекулы, которая усиливает пролиферацию МСКЧ, при которой может быть достигнуто терапевтическое количество МСКЧ без отрицательного влияния на стволовость, является очень перспективным в плане клинического использования МСКЧ для регенерации костной ткани и трансплантации костного мозга для облегчения РТПХ.
ГС ГАГ улучшают размножение МСКЧ, не влияя на стволовость клеток
В работе Nurcombe et al. в 1993 было показано, что активность ФРФ на мышиных нейрональных клетках-предшественниках регулируется ГС ГАГ, и это взаимодействие является необходимым условием для связывания ФРФ2 со своими рецепторами. Помимо этого, связывание ГС ГАГ с ФРФ существенно различалось в зависимости от периода времени, в частности на 9-й день ГС ГАГ, продуцируемые этими клетками, предпочтительно связывались с ФРФ2, тогда как к 11-му дню ГС ГАГ предпочтительно связывались с ФРФ1. Более того, такие уникальные гепарансульфаты выступают посредниками для связывания ФРФ2 со специфичными рецепторами путем взаимодействия с рецепторами на поверхности нейрональных клеток-предшественников (Brickman et al., 1995). В 1998 году, в работе Brickman et al. были представлены дополнительные доказательства этих результатов, полученные с помощью выделения и описания двух отдельных групп ГС из иммортализованных нейроэпителиальных клеток 2.3D мыши, полученных на 10-й день эмбрионального развития. Одна группа была получена из клеток в логарифмической фазе размножения и обладала повышенной активностью ФРФ2, тогда как другая группа была получена из клеток, подвергавшихся контактному ингибированию и дифференцировке, которая проявляла предпочтительное связывание с ФРФ1. Согласно результатам, полученным ранее в лаборатории авторов настоящего изобретения, препарат эмбрионального ГС ГАГ, названный HS2, увеличивал размножение МСКЧ без значительной потери мультипотентности и приводил к увеличению образования костной ткани у мышей, перенесших трансплантацию, в условиях in vivo. Этот факт свидетельствует о том, что компонент внеклеточного матрикса ГС ГАГ улучшает размножение МСКЧ, не оказывая негативного влияния на мультипотентность. Следовательно, существует конкретная потребность в варианте ГС, который имеет высокую аффинность связывания с ФРФ2 и усиливает его активность, направленную на размножение клеток, который может быть легко внедрен в крупномасштабное производство для применения в клинических условиях, в сравнении с HS2.
Результаты
Выделение гепарансульфата с более высокой аффинностью связывания с ФРФ2 с помощью колоночной хроматографии (HS8)
В соответствии со стратегией очистки ФРФ2-связывающего HS2, авторами настоящего изобретения была предпринята попытка очистки другого ФРФ2-связывающего ГС из коммерчески доступных источников свиного гепарансульфата Celsus (Celsus Laboratories, США) для того чтобы увеличить масштаб производства препарата ГС, который можно легко использовать в клиниках. Из всех пептидных последовательностей, которые представлены в таблице 1, для использования была выбрана последовательность157GHFKDPKRLYCKNGGF172 (Gandhi et al., 2008), названная ФРФ2-Gandhi-ГСД.
Количественный способ исследований с использованием [3Н]-гепарина
После синтеза пептидов их испытывали с помощью количественного способа исследований с использованием [3Н]-гепарина, чтобы оценить способность пептидов ФРФ2-ГСД связываться с гепарином. Известные количества пептидов или насыщающие количества пептидов высушивали на идентичных нитроцеллюлозных мембранах, которые сначала высушивали на воздухе и затем дополнительно высушивали в течение 45 мин в вакуумной печи при 80°С. Затем мембраны промывали 1× фосфатно-солевым буферным раствором (ФСБ) и инкубировали во флаконах для подсчета количества радиоактивных распадов с 0,1 мкКи [3Н]-гепарина (Perkin Elmer, Бостон, США) в 4% (масс./об.) бычьего сывороточного альбумина (БСА)/ФСБ в течение 16 часов. После этого мембраны промывали и определяли радиоактивность с помощью жидкостного сцинтилляционного анализатора Perkin Elmer Tri-Carb 2800 TCR.
В том случае, когда использовали известные количества пептида (SEQ ID NO: 1), количество импульсов в минуту увеличивалось в зависимости от дозы, в качестве положительного контроля использовали ВМР2-ГСД [Фигура 6(A)]. Однако максимальное количество импульсов в минуту было зарегистрировано, когда нитроцеллюлозные мембраны насыщали в 500 мкг/мл растворе пептида. Процент СРМ относительно общего количества импульсов чистого [3Н]-гепарина рассчитывали для каждого пептида при концентрации раствора 500 мкг/мл. ВМР2-ГСД (7,2%) имел максимальную величину СРМ, следующую позицию занимал ФРФ2-Gandhi-ГСД (4,97%). В соответствии с результатами, полученным с помощью количественного способа исследования с использованием [3Н]-гепарина, ФРФ2-Gandhi-ГСД использовали, чтобы адсорбировать с помощью аффинной хроматографии ГС (HS8) из свиного Celsus HS, обладающий более высокой аффинностью связывания с ФРФ2. Хроматограмма приведена на Фигуре 6 (В).
Характеристика HS8
Количественные способы оценки аффинности связывания ГАГ
Аффинность связывания HS8 с ФРФ2 и другими белками (R&D Systems) количественно оценивали, используя 96-луночные ГАГ-связывающие планшеты (Iduron, Великобритания), в которых специфичное связывание HS8+ с ФРФ2 измеряли в сравнении с гепарином (Sigma), свиным Celsus HS (Celsus Laboratories, США) и отрицательной фракцией HS8. ГАГ наносили на ГАГ-связывающие планшеты (2,5-10 мкг/мл) в течение ночи и блокировали 0,2% рыбьим желатином (Sigma) в стандартном буфере для количественного исследования (SAB) в течение 1 часа при 37°С.
Затем планшеты инкубировали с 200 мкл/лунку 0-100 нг/мл рекомбинантного человеческого ФРФ2 в течение 2 ч при 37°С, с последующей инкубацией в присутствии 200 мкл/лунку 250 нг/мл первичного биотинилированного антитела (R&D Systems) в течение 1 часа при 37°С. На следующем этапе планшет инкубировали с 200 мкл/лунку 220 нг/мл ExtrAvidin-AP (Sigma) в течение 30 мин при 37°С. В промежуток времени между инкубацией в течение ночи до последнего этапа планшет промывали 3 раза с использованием SAB после каждого этапа. Наконец, планшет инкубировали с 200 мкл/лунку п-нитрофенилфосфата SigmaFAST (Sigma) в течение 40 минут, и регистрировали поглощение при 405 нм с помощью счетчика для регистрации сигнала нескольких меток Victor3 1420, PerkinElmer.
Связывание всех ГАГ во всех 3 испытанных концентрациях (2,5, 5 и 10 мкг/мл) с ФРФ2 повышалось при увеличении количества ФРФ2 и достигало насыщения при 100 нг/мл ФРФ2 (Фигура 8). В ходе испытаний связывания различных ГАГ с ФРФ2 результаты со всей очевидностью показали, что HS8+ обладал самой высокой аффинностью связывания с ФРФ2, в сравнении с другими молекулами ГАГ (Фигура 9). При сравнении относительного различия Celsus HS:HS8+ при концентрации ФРФ2 100 нг/мл, соотношение составило 1; 1,51.
Затем были проведены исследования способности фракций HS8+ и HS8(-) связываться с различными белками (Фигура 10). HS8+ обладает более высокой аффинностью связывания с ФРФ2 по сравнению с VEGF, ВМР2, PDGFBB, ФРФ1 и ФРФ7 [Фигура 10 (А)]. С другой стороны, фракция HS8(-) обладает наибольшей аффинностью связывания с ФРФ1 по сравнению с другими белками [Фигура 10 (В)].
Способность различных ГАГ конкурировать с гепарином за связывание с ФРФ2 была испытана в данном количественном исследовании, адаптированном с модификациями из работы Ono et al., 1999. Известную концентрацию ФРФ2 (R&D Systems) смешивали с различными концентрациями ГАГ и инкубировали в течение 30 мин при комнатной температуре (RT) в микропробирке.
В пробирку добавляли 40 мкл раствора гранул [20 мкл гепарин-агарозных гранул (тип I, Sigma) и полиакриламидный гель (Bio-Gel Р-30, Bio-Rad)] и перемешивали в течение 30 мин при комнатной температуре. Гранулы гепарина промывали 3 раза с помощью центрифугирования (2000 об./мин в течение 1 минуты) в присутствии БСА-ФСБ (1% БСА в ФСБ) и 3 раза в ФСБТ (ФСБ, содержащий 0,02% Твин), затем в каждую пробирку вносили по 100 мкл биотинилированного антитела к ФРФ2, разбавленного в соотношении 1:500 (R&D Systems), и инкубировали при комнатной температуре в течение 1 часа. После промывки, как описано выше, добавляли по 100 мкл субстрата ТМВ, разбавленного в соотношении 1:10 (R&D Systems), и перемешивали в течение 30 мин при комнатной температуре. Добавляли раствор для остановки реакции (50 мкл 2 н H2SO4), и по 100 мкл супернатанта после центрифугирования переносили в лунки 96-луночного планшета. Поглощение регистрировали при длине волны 450 нм с помощью счетчика для регистрации нескольких меток Victor3 1420, Perkin Elmer.
Прежде всего, с помощью оптимизации концентрации ФРФ2 измеряли количество ФРФ2, необходимое для связывания с добавленным количеством гранул гепарина, и для следующей серии экспериментов была выбрана доза ФРФ2 равная 20 нг/мл [Фигура 11 (А)].
Затем, чтобы получить диапазон концентраций ГАГ, который будет использован в исследовании конкурентного связывания, первоначально использовали различные количества гепарина. Концентрация гепарина 50 мкг была практически достаточной, чтобы конкурировать с исходным гепарином, прикрепленным к гранулам [Фигура 11 (В)]. Следовательно, в исследовании конкурентного связывания использовали диапазон концентраций ГАГ от 0 до 50 мкг [Фигура 11 (С)]. При рассмотрении эффективности конкуренции, выраженной в процентах, было установлено, что гепарин являлся самым конкурентоспособным, при добавлении 50 мкг гепарина эта величина достигла приблизительно 13%, следующими по степени конкурентоспособности были HS8+ - 43%, Celsus HS - 50% и HS8(-) - 63%.
Количественные способы исследования пролиферации
В исследованиях пролиферации использовали два типа МСКЧ, полученных от 21-летнего латиноамериканского донора-мужчины, которые включали STRO1-положительные клетки, выделенные с помощью магнитно-активированной сортировки клеток (5-7 пассаж), и клетки НМ21, выделенные с помощью стандартной адгезии на пластике (5 пассаж). Клетки высевали в плотности 3000 клеток/см2 и обеспечивали прикрепление к планшету в течение 24 часов. Затем в среды вносили различные концентрации HS8+ в диапазоне от 50-10000 нг/мл, который использовали в качестве отдельной добавки для культуральных сред, и 2,5 нг/мл рекомбинантного человеческого ФРФ2 (R&D Systems), который использовали в качестве положительного контроля. Замену сред выполняли через 2 или 3 дня.
В экспериментах с использованием STRO1 клеток, в которых культуральные среды заменяли каждые 2 дня, повышающиеся концентрации HS8+ увеличивали количество жизнеспособных клеток, и к 6-му дню, по сравнению с контролем, концентрация HS8+ в 5000 нг/мл обеспечивала самое высокое количество клеток (Фигура 12). Для сравнения, в клетках НМ21, у которых культуральные среды заменяли каждые 3 дня, HS8+ в концентрации 10000 нг/мл к 6-му дню приводил к получению незначительно более высокого количества жизнеспособных клеток, по сравнению с контролями (Фигура 13).
Вследствие значительных различий, наблюдаемых при испытании двух типов клеток в отношении количества жизнеспособных клеток, были проведены количественные исследования пролиферации STRO1 и НМ21 клеток после 5 пассажа в течение 6 дней и сопоставлены с контролями, в которых культуральные среды заменяли каждые 3 дня. Клетки STRO1 имели незначительно более высокое количество пролиферирующих клеток, по сравнению с клетками НМ21, тем не менее, для обоих типов клеток контрольные и обработанные клетки давали почти идентичные количества пролиферирующих клеток (Фигура 14 (А)). Затем подсчитывали количество клеток STRO1, количество клеток/см2 на 6-й день с учетом данных, полученных в предыдущем эксперименте, основываясь на различных временных интервалах замены культуральных сред (Фигура 14 (В)). Интересным фактом является то, что в случае, когда замену культуральных сред проводили каждые 2 дня, по сравнению с заменой каждые 3 дня, увеличивалось количество клеток обоих типов, контрольных и обработанных клеток. Помимо этого, в том случае, когда замену культуральных сред проводили каждые 2 дня, количество обработанных клеток было выше, чем необработанных контрольных клеток.
Краткий обзор данных
Последовательность157GHFKDPKRLYCKNGGF172 использовали для получения ГС (HS8) с более высокой аффинностью связывания с ФРФ2 из препарата Celsus HS свиньи с помощью аффинной хроматографии.
Результаты, полученные с помощью количественного исследования связывания гликозаминогликана (ГАГ), убедительно указывают на то, что HS8+ имел самую высокую аффинность связывания с ФРФ2, по сравнению с другими молекулами ГАГ. Также при сравнении относительного различия Celsus HS:HS8+ при концентрации ФРФ2 в 100 нг/мл, соотношение составило 1;1,51. Согласно результатам исследования конкурентного связывания с использованием гранул гепарина, рассматривая эффективность конкуренции, выраженную в процентах, гепарин был самым конкурентоспособным при добавлении в количестве 50 мкг и достиг приблизительно 13%, следующими по конкурентоспособности были HS8+ - 43%, Celsus HS - 50% и HS8(-) - 63%. STRO1 + МСКЧ, выделенные с помощью магнитной сортировка клеток, и НМ21 МСКЧ, выделенные с помощью обычной адгезии на пластике, использовали в количественных способах исследования клеточной пролиферации, в которых более высокое количество клеток получали при использовании HS8+ в концентрации 5 мкг/мл в качестве отдельной добавки к культуральной среде, и при замене культуральных сред каждые 2 дня. В заключение следует отметить, что гепарансульфат (HS8), обладающий высокой аффинностью связывания с ФРФ2, был успешно выделен из группы коммерчески доступных источников гепарансульфатов, причем указанный гепарансульфат обладает более высокой аффинностью связывания с ФРФ2 и увеличивает способность МСКЧ к пролиферации.
В заключение также следует отметить, что авторы настоящего изобретения успешно выделили гепарансульфат (HS8), обладающий более высокой аффинностью связывания с ФРФ2, из группы коммерчески доступных источников гепарансульфатов и показали, что он имеет более высокую связывающую способность по сравнению с другими ГАГ, включая гепарин. Также HS8+ , при использовании в качестве отдельной добавки к культуральным средам, увеличивает пролиферацию клеток при замене культуральных сред каждые 2 дня. Соответственно, авторы настоящего изобретения полагают, что потребность в МСК высокого качества, размноженных в условиях ex vivo, была удовлетворена путем культивирования указанных клеток в присутствии гепарансульфата (HS8), модифицированного так, чтобы обеспечить высокую аффинность в отношении ФРФ2.
Дополнительные исследования
Выделение ГС (HS8), специфичного в отношении ФРФ2
Несмотря на успешное выделение HS8, который представляет собой ГС с более высокой аффинностью связывания с ФРФ2, дополнительные испытания других пептидных последовательностей ФРФ2 ГСД (таблица 1) были проведены с помощью количественных исследований с использованием [3Н]-гепарина, исследований связывания ГАГ и исследований прикрепления клеток в соответствии с Lee et al., 2007.
Количественные исследования аффинности связывания
Аффинность связывания HS8 уже была подтверждена с помощью ГАГ-связывающих планшетов и будет дополнительно обоснована с помощью точечного иммуноферментного анализа и оценки кинетики связывания с использованием BIAcore Т100 (Cain et al., 2005).
Количественные способы исследования конкурентного связывания
Результаты, полученные с помощью ИФА, будут дополнительно подтверждены методом Вестерн-блоттинга.
Количественные способы исследования пролиферации
Результаты количественных способов исследования пролиферации будут дополнительно подтверждены с использованием большего числа линий МСКЧ, а также клеток, перенесших меньшее количество пассажей. Помимо этого, краткосрочные количественные исследования пролиферации будут осуществлены с использованием реагентов BrdU (Roche) и WST-1 (Roche).
Исследование дисахаридного состава
Исследование дисахаридного состава HS8 будет осуществлено с использованием анионообменной хроматографии в соответствии с Murali et al., 2009, что позволит выявить состав HS8.
Стабильность ФРФ2
Количественные исследования стабильности будут проведены с использованием окрашивающего реагента Sypro и набора для ИФА Quantikine® для ФРФ2. При проведении количественных исследований с использованием Sypro, взаимодействие белка ФРФ2 с ГАГ будет измерено с помощью специфичного оранжевого красителя Sypro как значение температуры денатурации белков (Uniewicz et al., 2010). Количественные исследования ФРФ2 с помощью набора для ИФА Quantikine® будут проведены в соответствии с рекомендациями производителя (R&D Systems, Quantikine® ИФА, каталожный номер DFB50) для того чтобы измерить концентрации ФРФ2 в клеточных культурах. Результаты приведены на Фигуре 46.
Испытание биологической активности МСКЧ, выращенных в присутствии HS8 в условиях in vitro
Мультипотентность будет испытана в отношении прикрепления к пластиковой поверхности, дифференцировки в остеогенные, адипогенные и хондрогенные ткани, а также экспрессии поверхностных маркеров, измеренной с помощью проточной цитометрии (Dominici et al. 2006). Количественные исследования КОЕ-Ф будут выполнены, используя аспираты костного мозга и МСКЧ, размноженные в присутствии или в отсутствие HS8 (Cawthon, 2002 и Guillot et al., 2007). Иммуномодулирующая активность МСКЧ будет оценена с помощью количественных исследований, используя смешанную популяцию Т-лимфоцитов.
Испытание биологической активности МСКЧ, выращенных в присутствии HS8 в условиях in vivo
Клетки, выделенные и выращенные в присутствии HS8, будут использованы в моделях регенерации костной ткани мышей (Zannettino et al., 2010), а также будут использованы в ксеногенной NOD/SCID мышиной модели РТПХ человека (Tiasto et al., 2007 и Toubai et al., 2009).
Пример 3
Связывающую способность различных ГАГ в отношении ФРФ2 оценивали с использованием ГАГ-связывающих планшетов (Iduron). Связывающую способность различных ГАГ в отношении гепаринсвязывающих факторов роста (HBGF), ВМР-2, ФРФ1, ФРФ2, ФРФ7, PDGF-BB и VEGF, также оценивали с использованием ГАГ-связывающих планшетов (Iduron). Использованные материалы и способы описаны ниже.
Было установлено, что HS8 связывается с ФРФ2 почти с такой же аффинностью, что и гепарин, и определенно с более высокой аффинностью, чем сырой исходный Celsus HS и проточная фракция HS8- (Фигура 15).
HS8 (HS8+) связывается преимущественно с ФРФ2, по сравнению со всеми другими испытанными HBGF, и имеет более высокую связывающую способность в отношении ФРФ2, чем гепарин, т.е. HS8 проявляет специфичное связывание с ФРФ2. HS8- и сырой исходный Celsus HS проявляли незначительную специфичность в отношении любого из испытанных HBGF (Фигура 16).
Материалы
1. Стандартный буфер для исследования (SAB) - 100 мМ NaCl, 50 мМ ацетата натрия, 0,2% об./об. Твин-20, рН=7,2.
2. Блокирующий буфер - 0,4% рыбий желатин (Sigma, каталожный номер 67041) + SAB.
3. ГАГ-связывающий планшет (Iduron, Великобритания).
4. Белки, коммерчески доступные от R&D Systems: ВМР2 - каталожный номер 355 ВМ, ФРФ1 - каталожный номер 231 ВС, ФРФ2 - каталожный номер 233 FB, ФРФ7 -каталожный номер 251 KG, PDGF ВВ - каталожный номер 220 ВВ, VEGF - каталожный номер 293 VE.
5. Антитела, коммерчески доступные от R&D Systems: ВМР2 - каталожный номер ВАМ 3552, ФРФ1 - каталожный номер BAF232, ФРФ2 - каталожный номер ВАМ233, ФРФ7 - каталожный номер BAF251, PDGF ВВ - каталожный номер BAF220, VEGF - каталожный номер BAF 293.
6. ExtrAvidin-AP (Sigma, каталожный номер Е2636).
7. П-нитрофенилфосфат Sigma FAST (Sigma, N2770).
Описание способа
1. ГАГ растворяют в SAB (5 мкг/мл).
2. В лунки ГАГ-связывающего планшета вносят по 200 мкл раствора ГАГ и инкубируют в течение ночи при комнатной температуре в защищенном от света месте.
3. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
4. В планшет добавляют по 250 мкл/лунку блокирующего буфера и инкубируют в течение 1 часа при температуре 37°С в защищенном от света месте.
5. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
6. Белки растворяют в блокирующем буфере и выполняют серийные разведения: 0, 0,781, 1,56, 3,125 нМ.
7. По 200 мкл/лунку разбавленных белков вносят в ГАГ-связывающий планшет и инкубируют в течение 2 часов при 37°С.
8. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
9. В планшет добавляют по 200 мкл/лунку 250 нг/мл биотинилированного первичного антитела, разбавленного в блокирующем растворе, и инкубируют в течение 1 часа при 37°С.
10. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
11. В планшет добавляют по 200 мкл/лунку 220 нг/мл ExtrAvidin-AP, разбавленного в блокирующем растворе, и инкубируют в течение 30 мин при 37°С.
12. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
13. В планшет добавляют по 200 мкл/лунку реагента для проявления окрашивания п-нитрофенилфосфата Sigma FAST, растворенного в деионизированной воде, и инкубируют в течение 40 мин при комнатной температуре.
14. Поглощение регистрируют при длине волны 405 нм.
Пример 4
Количественное исследование пролиферации с включением BrdU проводили, чтобы установить влияние HS8 на пролиферацию МСКЧ (протокол описан ниже).
Зависимость ответа человеческих мезенхимальных стволовых клеток от дозы HS8 (HS8+) контролировали по включению BrdU в течение 36 часов. ФРФ2 использовали в качестве положительного контроля дозирования. Было установлено, что HS8+ усиливает пролиферацию МСКЧ и обеспечивает значительно более сильный стимул, чем другие ГАГ (Фигура 17).
Протокол (ИФА для оценки пролиферации клеток, BrdU (колориметрический) Roche)
1. Клетки высевают в плотности 5000 клеток в 190 мкл среды/лунку (96-луночный планшет).
2. Среды - DMEM с добавлением 1000 мг/л + 10% фетальной телячьей сыворотки (FCS) + 1% 2 мМ L-глутамина + 1% пенициллина/стрептомицина.
3. Планшет инкубируют в течение 6 часов при 37°С и 5% СО2.
4. После инкубации в течение 6 часов в намеченные лунки планшета согласно схеме вносят различные дозы испытываемых соединений в 10 мкл сред.
5. Концентрации ФРФ2 (нг/мл) и ГАГ (мкг/мл) - 10,5, 2,5, 1,25, 0,625, 0,3125.
6. Планшет инкубируют в течение 36 часов с указанными соединениями при 37°С и 5% CO2.
7. В каждую лунку вносят BrdU.
8. Проводят мечение клеток с использованием BrdU в течение 2 часов при 37°С и 5% СО2 (вносят по 20 мкл раствора BrdU для мечения).
9. Удаляют среду для мечения, постукивая по планшету.
10. Добавляют к клеткам по 200 мкл/лунку FixDenat и инкубируют в течение 30 мин при 15-25°С.
11. Раствор FixDenat тщательно удаляют, слегка пощелкивая и постукивая по планшету.
12. В планшет добавляют по 100 мкл/лунку рабочего раствора анти-BrdU-POD и инкубируют в течение 90 мин при 15-25°С.
13. Конъюгат антитела удаляют, слегка пощелкивая по планшету, и промывают лунки три раза с использованием 250 мкл/лунку раствора для промывания (1 × ФСБ).
14. Удаляют промывочный раствор, постукивая по планшету.
15. Добавляют по 100 мкл/лунку раствора субстрата и инкубируют в течение 30 мин при 15-25°С.
16. Измеряют поглощение при длине волны 370 нм (эталонная длина волны: 492 нм).
Пример 5
Количественное исследование пролиферации клеток методом проточной цитометрии проводили, чтобы установить влияние HS8 на пролиферацию МСКЧ (протокол описан ниже).
Зависимость ответа мезенхимальных стволовых клеток человека от дозы HS8 (HS8+) контролировали с помощью метода Guava ViaCount (на основе проточной цитометрии) в течение 6 дней. ФРФ2 использовали в качестве положительного контроля дозирования. Было установлено, что HS8 усиливал пролиферацию МСКЧ и обеспечивал сильное стимулирующее воздействие.
Протокол исследования пролиферации клеток
Материалы
1. НМ20 МСКЧ - клетки от латиноамериканского мужчины-донора в возрасте 20 лет (приобретены у Lonza).
2. ФРФ2 (R&D Systems, каталожный номер 233-FB-025).
3. Поддерживающие среды: DMEM (10 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
4. HS8(+) партия 2, HS8(-) партия 2, гепарансульфат из слизистой оболочки кишечника свиней (Celsus Laboratories, США), гепарин (Sigma, каталожный номер Н3149).
5. Реагент Guava Flex (Millipore).
Методы
1. Клетки НМ20 высевают на 24-луночные планшеты в плотности 3000 клеток/см2 в 500 мкл/лунку сред (0-й день).
2. 1-й день - заменяют среды свежими средами, содержащими повышающиеся концентрации ФРФ2 (нг/мл) и ГАГ (мкг/мл) - 10,5, 2,5, 1,25, 0,625, 0,3125, 0,156 в 500 мкл свежих сред.
3. Среды заменяют каждые 2 дня.
4. Клетки собирают в определенных временных точках (2-й день, 4-й день и 6-й день) путем обработки 100 мкл трипсина и нейтрализуют добавлением 100 мкл сред (t=2-й день) или 300 мкл сред (4-й и 6-й день).
5. Клетки подсчитывают в устройстве Guava (соотношение реагент Guava flex:суспензия клеток составляет 1:200).
Пример 6 - Выделение мезенхимальных стволовых клеток
Получение мононуклеарных клеток костного мозга человека (МНККМ)
Сбор костного мозга человека (КМ) и получение мононуклеарных клеток КМ путем разделения в градиенте плотности
1. После получения информированного согласия, приблизительно 40 мл костного мозга человека (КМ) собирают у здоровых молодых добровольцев (18-40 лет) путем аспирации из задней подвздошной кости (тазовая кость). КМ немедленно помещают в не содержащую консерванта пробирку объемом 50 мл, содержащую гепарин натрия (10000 единиц/пробирку).
2. Отбирают аликвоту объемом 10 мкл и разбавляют в соотношении 1:20, используя White Cell Fluid (WCF), количество ядерных клеток подсчитывают с помощью гемоцитометра.
3. К аспиратам КМ добавляют равный объем блокирующего буфера, тщательно перемешивают, затем фильтруют через клеточный фильтр Falcon с размером пор 70 мкм, чтобы удалить любые небольшие сгустки и костные фрагменты.
4. По 3 мл раствора Ficoll-Hypaque (Lymphoprep) разливают в нижнюю часть приблизительно 12-ти круглодонных полистироловых пробирок Falcon объемом 14 мл и тщательно наслаивают 7,5 мл разбавленного КМ.
5. Пробирки центрифугируют при 400 g в течение 30 мин при комнатной температуре.
6. С помощью одноразовой пластиковой пипетки Пастера выделяют полосу лейкоцитов из всех пробирок и объединяют в 4×14 мл полипропиленовых пробирках.
7. Клетки разводят промывочным буфером HHF, и осаждают МНККМ центрифугированием образца при 400 g в течение 10 мин при 4°С.
8. Буфер отсасывают и клетки объединяют в одну пробирку.
Выделение МСК с помощью прикрепления к пластику
1. Фракцию ядерных клеток КМ высевают в 15 см чашки в поддерживающие среды (DMEM, 1 г/л глюкозы, 10% ФТС, 2 мМ L-глутамина, 50 Ед/мл пенициллина и 50 Ед/мл стрептомицина) и обеспечивают прикрепление клеток в течение 3 дней до первой замены сред.
2. Клетки культивируют в поддерживающей среде с заменой среды каждые 3-4 дня и рутинно пассируют при достижении 85% конфлюентности с использованием 0,125% трипсина. При повторном высевании клетки высевают в плотности 3000/см2. Все культуры поддерживают в инкубаторе при 37°С и в увлажненной атмосфере с 5% СО2.
3. Клетки удаляют из культуры с использованием неферментного раствора для диссоциации клеток (CellStripper, Mediatech, США) и промывают один раз в ФСБ перед подсчетом. Аликвоты, содержащие по 1×105 клеток, затем вносят в 96-луночные планшеты, и клетки осаждают при 450 g в течение 5 мин. Затем добавляют растворы предварительно разбавленных антител для иммунного фенотипирования в 2% ФТС/ФСБ, и клетки инкубируют на льду в течение 20 мин. После этого клетки дважды промывают в 2% ФТС/ФСБ перед повторным суспендированием в 2% ФТС/ФСБ и исследуют на настольном проточном цитометре GUAVA РСА-96 (Guava Technologies Inc., США). Все образцы измеряют с тремя повторами.
Магнитно-активированная сортировка (MACS) STRO-1 положительных стромальных стволовых клеток костного мозга (ССККМ)
Использование MACS обеспечивает частичную очистку популяции ССККМ и обработку большого количества МНККМ без риска высокого уровня потери общего выхода стволовых клеток. После центрифугирования в градиенте плотности приблизительно 1-2×108 мононуклеарных клеток выделяют из аспирата КМ объемом 40 мл. Перед проведением иммунного окрашивания, МНККМ повторно суспендируют в 0,5 мл блокирующего буфера и инкубируют на льду в течение приблизительно 30 мин, чтобы уменьшить возможность связывания антител, опосредованного рецептором Fc.
Выделение STRO-1+ ССККМ с использованием магнитно-активированной сортировки клеток (MACS)
1. МНККМ осаждают центрифугированием при 400 g при 4°С в течение 10 мин и повторно суспендируют в 500 мкл супернатанта STRO-1 на 5×107 МНККМ и инкубируют на льду в течение 60 мин при периодическом осторожном перемешивании.
2. МНККМ дважды промывают промывочным буфером HHF и затем повторно суспендируют в 0,5 мл HHF, содержащем биотинилированное антитело козы к IgM мыши (специфичное в отношении μ-цепи), разбавленное в соотношении 1:50, и инкубируют при 4°С в течение 45 мин.
3. МНККМ промывают три раза в буфере для MACS и повторно суспендируют в 450 мкл буфера для MACS, к которому добавлено 50 мкл микрогранул стрептавидина (10 мкл микрогранул/107 клеток в 90 мкл буфера для MACS). Смесь инкубируют на льду в течение 15 мин.
4. После одной промывки в ледяном буфере для MACS, небольшую аликвоту клеток отбирают для исследования методом проточной цитометрии (предварительный образец). Оставшиеся клетки затем помещают на мини-колонку MACS (емкость колонки 108 клеток, Miltenyi Biotec, колонка MS). Клетки STRO-1- (отрицательная фракция) не удерживаются в колонке и протекают под действием силы тяжести в чистую 2 мл полипропиленовую пробирку в элюат, в то время как клетки STRO-1+ остаются прикрепленными к намагниченному матриксу.
5. Колонку промывают 3 раза с использованием 0,5 мл буфера для MACS, чтобы удалить любые неспецифически связанные клетки STRO-1-, которые собирают в чистую 2 мл полипропиленовую пробирку.
6. Клетки STRO-1+ (положительная фракция) выделяют, промывая колонку буфером для MACS, в чистую 2 мл полипропиленовую пробирку, после извлечения колонки из магнитного поля. Клетки STRO-1+ подсчитывают и обрабатывают для исследования методом проточной цитометрии с использованием двухцветной маркировки.
7. Небольшие образцы (0,5-1,0×105 клеток) из каждой фракции пре-MACS, STRO-1- и STRO-1+ отбирают в отдельные полипропиленовые пробирки объемом 2 мл, содержащие 0,2 мл конъюгата стрептавидин-FITC (в соотношении 1:50). Образцы клеток инкубируют в течение дополнительных 5 мин на льду для проведения оценки способа обогащения. Образец (1,0×105 клеток) немеченых пре-MACS клеток используют в качестве отрицательного контроля.
8. Образцы дважды промывают в HHF, фиксируют в растворе FACS Fix и затем исследуют методом проточной цитометрии для оценки степени чистоты и выделения.
9. В этой временной точке, частично очищенные STRO-1+ ССККМ могут быть размножены в культуре или дополнительно очищены с помощью проточной цитометрии с использованием двухцветной маркировки.
Оценка качества костного мозга с помощью количественного исследования эффективности образования колоний
Ожидаемая частота колонии КОЕ-Ф в аспиратах костного мозга человека составляет приблизительно 5-10 КОЕ-Ф на 105 высеянных клеток.
1. МНККМ высевают в 6-луночные планшеты для культивирования в плотности 0,3, 1,0 и 3,0×105 клеток на лунку в α-МЕМ с добавлением 20% (об./об.) ФБС, 2 мМ L-глутамина, 100 мкМ L-аскорбат-2-фосфата, 50 Ед/мл пенициллина, 50 мг/мл стрептомицина и β-меркаптоэтанола (5×10-5 М). Культуры создают в трех повторах и инкубируют при 37°С в 5% CO2 и >90% влажности в течение 12 дней.
2. Культуры на 12-й день культивирования дважды промывают с использованием ФСБ и затем фиксируют в течение 20 мин в 1% (масс./об.) параформальдегиде в ФСБ.
3. Фиксированные культуры затем окрашивают 0,1% (масс./об.) толуидиновым синим (в 1% растворе параформальдегида) в течение 1 ч, затем промывают водопроводной водой и дают высохнуть. Агрегаты, содержащие более 50 клеток, оценивают как КОЕ-Ф.
Флуоресцентно-активированная сортировка высокоочищенных стромальных стволовых клеток костного мозга
В связи с тем, что все измеримые КОЕ-Ф содержатся во фракции STRO-1+ МНККМ, ССККМ представляют собой лишь менее 2% от общей популяции STRO-1+. Большинство клеток STRO+-1 представляют собой гликофорин А+ ядерные эритроциты, и некоторые представляют собой В-клетки CD19+. Следовательно, выбор ССККМ на основании экспрессии только STRO-1 приводит лишь к частичному обогащению КОЕ-Ф (приблизительно 10-кратному). Все клоногенные ССККМ содержатся во фракции клеток STRO-1bright, которая может быть дополнительно разделена с помощью проточной цитометрии с использованием двухцветной маркировки на основании экспрессии маркеров, которые отсутствуют на ядерных эритроцитах и лимфоцитах, в частности, CD106 и CD146. Способы, описанные ниже, позволяют выделить минорную субпопуляцию из общей фракции клеток STRO-1+, STRO-1bright/CD106+ BMMSC (1,4%±0,3, n=20), в которой 1 клетка на каждые 2-3 высеянные клетки способна образовывать КОЕ-Ф. Подобный уровень обогащения практически в 5000 раз выше, чем средняя частота КОЕ-Ф, наблюдаемая для нефракционированных МНККМ (1 КОЕ-Ф на 10000 высеянных клеток).
Выделение STRO-1brigh,/CD106+ ССККМ с использованием сортировки клеток методом проточной цитометрии (FACS)
1. Перед проведением иммунного окрашивания, клетки STRO-1+ МНККМ (обычно 2-5×106 клеток из 1×108 МНККМ), выделенные с помощью MACS, повторно суспендируют в 0,5 мл HHF для подготовки к проведению иммунофлуоресцентного исследования с использованием двухцветной маркировки и проточной цитометрии.
2. Приблизительно по 3-5×105 клеток STRO-1+, выделенных с помощью MACS, распределяют в 3 надлежащим образом маркированные пробирки, к которым добавлены следующие реагенты:
(i) первичное антитело отсутствует (двойной отрицательный контроль), инкубируют на льду,
(ii) конъюгат стрептавидин-FITC (разбавленный в HFF в соотношении 1:100), инкубируют на льду в течение 30 мин (контроль FITC). Затем клетки дважды промывают в HHF,
(iii) 0,5 мл IgG мыши к CD106 человека (VCAM-1), разбавленного до концентрации 20 мкг/мл в HFF. Клетки STRO-1+ инкубируют на льду в течение 30 мин, дважды промывают в HHF и повторно суспендируют в 0,2 мл фикоэритрин (ФЭ)- конъюгированного антитела козы к IgG мыши (специфичного в отношении γ-цепи) (контроль ФЭ). Образец инкубируют, промывают и затем повторно суспендируют в HFF,
(iv) остальные 1-2×106 клеток STRO-1+, выделенных с помощью MACS, повторно суспендируют в 0,5 мл IgG мыши к CD106 человека (VCAM-1) и инкубируют, как описано выше, дважды промывают в HHF и повторно суспендируют в 0,2 мл фикоэритрин-конъюгированного Ig козы к IgG мыши (специфичного в отношении γ-цепи) и конъюгата стрептавидин-FITC (разбавленного в HHF в соотношении 1:100), и затем инкубируют на льду в течение 30 мин (образец для сортировки). Клетки промывают, как описано выше, и затем повторно суспендируют в HHF.
3. Образцы повторно суспендируют до концентрации 1×107 клеток/мл в HHF перед сортировкой с использованием любого сортера, оснащенного аргоновым лазером мощностью 250 МВт, испускающим свет с длиной волны 488 нм, который способен одновременно детектировать FITC и фикоэритрин. Образцы (I-III) используют, чтобы установить компенсацию для FITC и фикоэритрина.
4. Отсортированные клетки STRO-1bright/VCAM-1+ из образца (iv) собирают в пробирки, содержащие соответствующие культуральные среды, и смешивают.
5. Подсчет клеток проводят, как описано выше. Отсортированные клетки затем культивируют.
Культура ССККМ человека в условиях ex vivo
Среда с восполнением сыворотки
1. Популяции ССККМ, выделенные на основании экспрессии STRO-1bright/CD106+ (в плотности 1-3×104/см2), культивируют в колбах для культивирования тканей или планшетах, содержащих альфа-модификацию среды Игла (α-МЕМ) с добавлением 20% фетальной бычьей сыворотки, 100 мкМ L-аскорбат-2-фосфата, 2 мМ L-глутамина, 50 Ед/мл пенициллина и 50 мкг/мл стрептомицина, при 37°С в 4% СО2 и при относительной влажности >90% в течение 2 недель. Популяции первичных ССККМ пассируют при достижении культурами 80-90% конфлюентности.
2. Прикрепившиеся культуры промывают 1 раз бессывороточным HBSS, и клетки высвобождают с помощью ферментативного гидролиза путем добавления 2 мл 0,5% раствора трипсина/EDTA на колбу Т75 и инкубируют в течение 5-10 мин при 37°С.
3. Жизнеспособность клеток оценивают, разбавляя суспензию отдельных клеток в соотношении 1:5 в 0,4% растворе трипанового синего/ФСБ, и количество жизнеспособных клеток определяют с помощью гемоцитометра.
4. Суспензии отдельных МСК костного мозга объединяют и повторно высевают в плотности 0,5-1,0×104/см2 в культуральную среду α-МЕМ с добавлением 10% ФБС, 100 мкМ L-аскорбата-2-фосфата, 2 мМ L-глутамина, 50 Ед/мл пенициллина и 50 мкг/мл стрептомицина, и инкубируют при 37°С в 5% СО2 и при относительной влажности >90%. Культуры обеспечивают питательными веществами два раза в неделю путем аспирации среды и замены ее равным объемом свежеприготовленной среды, нагретой до 37°С.
Бессывороточная среда
Этот способ основан на модификации бессывороточной среды (SDM), первоначально разработанной для размножения гемопоэтических клеток-предшественников.
1. Покрытые фибронектином планшеты или колбы готовят путем предварительного покрытия с использованием раствора фибронектина в концентрации 5 мкг/см2 в течение 90 мин при комнатной температуре. После этого раствор фибронектина отсасывают, и культуральные сосуды промывают один раз стерильным ФСБ перед посевом клеток.
2. Популяции ССККМ (в плотности 1-3×104/см2), выделенные на основании экспрессии STRO-1bright/CD106+, культивируют в покрытых фибронектином колбах для культивирования тканей или планшетах, суспендированными в средах, содержащих α-МЕМ с добавлением 2% (масс./об.) бычьего сывороточного альбумина (фракция Кона V), 10 мкг/мл рекомбинантного человеческого инсулина, человеческого липопротеина низкой плотности, 200 мкг/мл насыщенного железом человеческого трансферрина, 2 мМ L-глутамина, дексаметазона натрия фосфата (10-8 М), 100 мкМ L-аскорбат-2-фосфата, β-меркаптоэтанола (5×10-5 М), 10 нг/мл тромбоцитарного фактора роста ВВ, 50 Ед/мл пенициллина и 50 мкг/мл стрептомицина.
3. Культуры затем инкубируют при 37°С в 4% CO2 и при относительной влажности >90% в течение 2 недель. Популяции первичных ССККМ пассируют при достижении культурами 80-90% конфлюентности.
Криоконсервация МСК, размноженных в условиях ex vivo
1. Суспензии отдельных клеток из культур размноженных МСК рутинно получают путем обработки трипсином/ЭДТА, как описано выше. Клетки затем разбавляют и промывают холодным HFF.
2. Клеточную массу повторно суспендируют до концентрации 1×107 клеток/мл в ФБС и поддерживают на льду. Затем постепенно добавляют равный объем сублимационной смеси (20% ДМСО в холодном ФБС) при осторожном перемешивании клеток, чтобы получить конечную концентрацию 5×106 клеток/мл в 10% ДМСО/ФБС. Аликвоты объемом 1 мл затем распределяют в криопробирки объемом 1,8 мл, предварительно охлажденные на льду, затем замораживают при скорости охлаждения -1°С в минуту с использованием морозильной камеры с контролем скорости замораживания.
3. Замороженные флаконы затем переносят в жидкий азот для длительного хранения. Восстановление замороженных исходных суспензий достигается путем быстрого оттаивания клеток на водяной бане при 37°С. Клетки затем повторно суспендируют в холодном HFF и центрифугируют при 280 g в течение 10 мин.
4. Для оценки жизнеспособности клеток суспензии клеток разводят в соотношении 1:5 в растворе 0,4% трипанового синего/ФСБ, и количество клеток определяют с помощью гемоцитометра. Как правило, описанный способ обеспечивает 80-90% жизнеспособных клеток.
Пример 7 - Количественное исследование колониеобразующих единиц фибробластов (КОЕ-Ф)
Свойство МСКЧ формировать КОЕ-Ф оценивали с помощью способа, описанного ниже. МСКЧ выращивали в одной из контрольных сред, не содержащей добавок, в течение 4 пассажей, и затем выращивали в одной из контрольных сред, не содержащей добавок, или в контрольных средах с добавлением одного из гепарина (1,25 мкг/мл), Celsus HS (1,25 мкг/мл), HS8- (1,25 мкг/мл), HS8 (HS8+) (1,25 мкг/мл) или HS8 (HS8+) (2,5 мкг/мл). Результаты приведены на Фигурах 24А и 24 В.
Материалы
1. МСКЧ (приобретены у Lonza).
2. Поддерживающие среды: DMEM (1000 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
3. Кристаллический фиолетовый 0,5% в 100% метаноле.
Способы
1. МСК высевают в трех повторах в плотности 150 клеток/см2 в чашки Петри размером 100×15 мм, содержащие по 10 мл/чашку поддерживающих сред.
2. Клетки культивируют в течение 14 дней с заменой сред на 7-й день.
3. На 14-й день планшеты окрашивают кристаллическим фиолетовым (0,5% в 100% метаноле), как описано ниже:
a. среды удаляют и чашки промывают два раза с использованием ФСБ,
b. вносят кристаллический фиолетовый в объеме по 10 мл/чашку и инкубируют в течение 30 минут,
c. планшеты промывают один раз с использованием ФСБ и один раз с использованием H2O и высушивают,
d. подсчитывают колонии, содержащие более 50 клеток, которые не контактировали с другими колониями.
Пример 8 - Мультипотентная характеристика МСК
Поддержание мультипотентности МСК испытывали с помощью количественного исследования способности МСК дифференцироваться в костную (остеогенез) и жировую ткани (адипогенез), в соответствии с методикой, описанной ниже. Результаты приведены на Фигуре 25.
Клетки
Клетки 4 пассажа (Р4) - МСКЧ, культивированные в нормальных поддерживающих средах
Клетки 7 пассажа (Р7) - МСКЧ, культивированные с Р4 по Р7 в нормальных поддерживающих средах, содержащих один из следующих компонентов:
Остеогенная дифференцировка
Материалы
1. МСКЧ (приобретены у Lonza).
2. Поддерживающие среды: DMEM (1000 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
3. Поддерживающие среды для обработки: DMEM (1000 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина, 10 нМ дексаметазона, 10 мМ β-глицеринфосфата и 25 мкг/мл L-аскорбат-2-фосфата.
4. Параформальдегид 4% в ФСБ.
5. Раствор ализаринового красного: 1,37 г в 100 мл H2O; рН=4,1-4,3.
Способы
1. Клетки высевали (3000 клеток/см2) в 6-луночные планшеты и культивировали в течение 24 часов.
2. Среды в контрольных лунках заменяли поддерживающими средами.
3. Среды в обработанных лунках заменяли поддерживающими средами, содержащими 10 нМ дексаметазона, 10 мМ β-глицеринфосфата и 25 мкг/мл L-аскорбат-2-фосфата.
4. Все клетки затем культивировали в течение 28 дней с заменой сред каждые 3 дня.
5. Затем клетки окрашивали ализариновым красным:
a. клетки промывали три раза с использованием ФСБ,
b. фиксировали клетки 4% параформальдегидом в течение 10 мин,
c. клетки промывали три раза бидистиллированной Н2О,
d. к клеткам добавляли раствор ализаринового красного и инкубировали в течение 30 минут при медленном покачивании,
e. клетки промывали три раза бидистиллированной Н2О,
f. окрашенные клетки высушивали на воздухе.
Адипогенная дифференцировка
Материалы
1. МСКЧ (приобретены у Lonza).
2. Поддерживающая среда для адипоцитов: DMEM (4500 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
3. Среда для обработки адипоцитов: DMEM (4500 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина, 1 мкМ дексаметазона, 10 мкМ инсулина, 20 мкМ индометазина и 115 мкг/мл 3-изобутил-1-метилксантина.
4. Параформальдегид 4% в ФСБ.
5. Раствор масляного красного О: 0,36% в 60% изопропанола.
Способы
1. Клетки высевали (18000/см2) в 6-луночные планшеты в трех повторах.
2. Клетки культивировали до достижения конфлюентности.
3. Среды в контрольных лунках заменяли поддерживающими средами для адипоцитов (4500 мг/л глюкозы).
4. Среды в обработанных лунках заменяли средами для обработки адипоцитов, содержащими 1 мкМ дексаметазона, 10 мкМ инсулина, 20 мкМ индометазина и 115 мкг/мл 3-изобутил-1-метилксантина.
5. Впоследствии клетки культивировали в течение 28 дней с заменой сред каждые 3 дня.
6. Клетки затем окрашивали масляным красным О:
a. клетки промывали три раза с использованием ФСБ,
b. фиксировали клетки 4% параформальдегидом в течение 60 мин,
c. клетки промывали один раз бидистиллированной Н2О,
d. к клеткам добавляли раствор масляного красного О и инкубировали в течение 1 часа при медленном встряхивании,
e. клетки промывали два раза с использованием 60% изопропанола,
f. клетки промывали от трех до пяти раз бидистиллированной Н2О,
g. оставляли бидистиллированную H2O на планшете или высушивали окрашенные клетки на воздухе.
Пример 9
Влияние HS8 на ФРФ2-опосредованное размножение МСКЧ изучали с использованием способа, описанного ниже. Было установлено, что HS8 усиливает ФРФ2-опосредованное размножение МСК (Фигура 26).
Клетки
Клетки 4 пассажа - МСКЧ, культивированные в нормальных поддерживающих средах с добавлением и без следующих компонентов:
Протокол исследования пролиферации клеток
Материалы
1. МСКЧ (приобретены у Lonza).
2. ФРФ2 (R&D Systems, каталожный номер 233-FB-025).
3. Поддерживающие среды: DMEM (1000 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
4. HS8 (HS8(+)), HS8(-), гепарансульфат из слизистой оболочки кишечника свиней (Celsus Laboratories, США), гепарин (Sigma, каталожный номер Н3149).
5. Реагент Guava Flex (Millipore).
Способы
1. Клетки высевают на 24-луночные планшеты в плотности 3000 клеток/см2 в 500 мкл/лунку сред (0-й день).
2. 1-й день - среды заменяют поддерживающими средами, содержащими ФРФ2 (0,156 нг/мл) по отдельности или ФРФ2 (0,156 нг/мл) с добавлением различных концентраций HS8(+): 10, 5, 2,5, 1,25, 0,625, 0,3125, 0,156 (мкг/мл) в 500 мкл свежих сред.
3. Среды заменяют каждые 2 дня.
4. Клетки собирают на 4-й день, используя 100 мкл трипсина, и нейтрализуют путем добавления 300 мкл сред.
5. Клетки подсчитывают с помощью устройства GUAVA (соотношение реагент Guava flex:суспензия клеток составляет 1:200).
Пример 10
Влияние HS8 на ФРФ2-опосредованную передачу сигналов с участием пути ERK изучали с использованием способа, описанного ниже. Было установлено, что HS8 усиливает/поддерживает ФРФ2-опосредованную передачу сигналов с участием пути ERK, согласно результатам измерения уровня фосфорилирования ERK1/2 и FRS2a (Фигура 27).
Клетки
Р4 - МСКЧ, культивированные в нормальных поддерживающих средах с добавлением и без следующих компонентов:
Вестерн-блот
Материалы
1. МСКЧ (приобретены у Lonza).
2. ФРФ2 (R&D Systems, каталожный номер 233-FB-025).
3. Поддерживающие среды: DMEM (1000 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
4. Бессывороточные среды: DMEM (1000 мг/л глюкозы), 0,2% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
5. Антитело к фосфо-FRS2a (Cell Signaling, каталожный номер 3861), разбавленное в соотношении 1:1000 в 5% БСА в TBST.
6. Антитело к фосфо-ERK1/2 (Cell Signaling, каталожный номер 9106L), разбавленное в соотношении 1:2000 в 5% БСА в TBST.
7. Антитело к обоим киназам ERK1/2 (Cell Signaling, каталожный номер 9102L), разбавленное в соотношении 1:1000 в 5% БСА в TBST.
8. Антитело к актину (Millipore Chemicon, каталожный номер MAB1501R), разбавленное в соотношении 1:8000 в 5% БСА в TBST.
Способы
1. Клетки высевают в плотности 10000/см2 на 6-луночные планшеты в поддерживающие среды.
2. 1-й день: среды заменяют бессывороточными средами из расчета 2 мл/лунку.
3. 3-й день: в лунки вносят исследуемые соединения. Необходимое количество HS8(+) и/или ФРФ2 дозируют в бессывороточных средах и добавляют из расчета 10 мкл/лунку.
4. Клетки собирают, исходя из объема 100 мкл/лунку, с использованием 1,5х буфера Лэммли в различные моменты времени (30 мин и 24 часа).
5. Лизаты нагревают в течение 5 мин при 95°С и хранят при -20°С.
6. Образцы подвергают только одному циклу замораживания-оттаивания.
7. По 20 мкл/лунку образца наносят на каждую дорожку 4-12% Бис-Трис ДСН-ПАА геля Novex, 10 лунок (Invitrogen, каталожный номер NP0335BOX).
9. Образцы в геле разделяют при 180 В с использованием 1× буфера MOPS в течение 50 мин.
10. Выделенные полосы белка переносят на нитроцеллюлозную мембрану при 100 В в 1× буфере для переноса в течение 1 часа 30 минут.
11. Нитроцеллюлозную мембрану окрашивают раствором пунцового S и разрезают на полоски в соответствии с размером белка, представляющего интерес.
12. Мембраны блокируют в 5% БСА или 5% обезжиренном молоке в TBST в течение периода времени от 30 мин до 1 часа при комнатной температуре с медленным встряхиванием.
13. Первичные антитела в рекомендуемых разведениях затем инкубируют в течение ночи при 4°С с медленным встряхиванием.
14. Блоты трижды промывают в TBST в течение 5 минут для каждой промывки.
15. Вторичные антитела в рекомендуемых разведениях затем инкубируют в течение периода от 1 часа до 2 часов при комнатной температуре с медленным встряхиванием.
16. Блоты трижды промывают в TBST в течение 5 минут для каждой промывки.
17. Блоты инкубируют с хемилюминесцентными реагентами и переносят в темную комнату для проявления рентгеновских пленок для визуализации полос.
Пример 11 - Исследование HS8 методом ЯМР
Образец HS8 хранили при -20°С до проведения исследования. Исследование методом ЯМР выполняли путем растворения в D2O (600 мкл), которая содержала внутренний стандарт tBuOH (200 мкл, δ1,24 м.д.), который используется для сравнения химического сдвига и количественной оценки. Celsus HS точно взвешивали в количестве ~1, 4 и 7 мг, растворяли в рабочем растворе D2O/tBuOH и исследовали в том же опыте, что и HS8. Линейная аппроксимация данных, полученных при использовании стандартных растворов, привела к получению величины регрессии 0,995 или выше для интеграции ацетилметиловой области, области δ3,15-3,25 м.д. и самой низкой части поля аномерной области δ5,15-5,65 м.д. по сравнению с внутренним стандартом.
Вследствие небольшого размера образца, что привело к низкому уровню сигнала по отношению к шуму, для расчета количества HS8 использовали только данные ацетильной области и получили значение 0,7 мг. В ходе второго эксперимента сопоставляли величины соотношения сигнал/шум для ацетильного пика, при этом зарегистрировали значение 0,5 мг. Это абсолютное значение, которое не имеет отношения к внутреннему стандарту. После трех этапов замораживания-оттаивания, проведенных для удаления tBuOH перед дальнейшим исследованием, зарегистрированная масса составила 1,2 мг. Следует отметить, что данные ВЭЖХ и эксклюзионной хроматографии могут быть интегрированы для получения приблизительной степени чистоты, составившей 58%, что позволяет предположить наличие 0,7 мг ГС ГАГ в материале. Поскольку зарегистрированное расхождение значений массы не является новым явлением в небольших образцах ГАГ, то было сделано предположение, что изменение влажности и доли соли может оказывать влияние на зарегистрированную массу.
Спектры1Н-ЯМР для HS8, Celsus HS и HS3* показаны на Фигуре 31. Разница в интенсивности HS8 (самый низкий пик при 4,8-4,6 м.д.) по сравнению с другими сигналами (Celsus HS имеет самый высокий пик при 4,8-4,9 м.д., и HS3 имеет пик промежуточной высоты) на показанном графике обусловлена нормированием всех спектров к высоте ацетилметильного резонанса: в случае данного образца HS8 незначительно лучшую компенсацию наблюдали при более узкой ширине спектральной линии, в результате чего ацетильный резонанс становился немного острее и выше.
Изменение химического состава HS8 по сравнению с Celsus HS дифференцируется только с помощью 2-D ЯМР.
Более тщательное изучение метановых и метиленовых областей1Н-ЯМР спектра HS8 выявило различия по сравнению с Celsus HS и HS3 (Фигура 32).
[*HS3 представляет собой выделенный гепарансульфат, имеющий специфичную и высокую аффинность связывания в отношении гепарансвязывающего домена ВМР-2. HS3 описан в WO 2010/030244]
Пример 12 - ВЭЖХ/эксклюзионная хроматография/рефрактометрия HS8 и других препаратов ГС
Препараты гепарансульфата (массой приблизительно 1 мг, точно взвешенные) растворяли в воде до концентрации 2 мг/мл. Концентрация продуктов расщепления указанных препаратов под действием гепаринлиаз I, II и III составила 2 мг/мл в воде. Растворы центрифугировали (14000 g, 2 мин), и аликвоты объемом по 200 мкл отбирали для исследования.
Система для эксклюзионной хроматографии, оснащенная рефрактометром, состоит из разделительного модуля Waters 2690 Alliance и рефрактометра Water 2410 (диапазон 64). Величину dn/dc для количественного определения на основании хроматограмм, зарегистрированных рефрактометрическим детектором, устанавливали как 0,129 (стандарт). Образцы вводили (50 мкл) и элюировали с использованием 50 мМ ацетата аммония при скорости потока 0,5 мл/мин из двух колонок Superdex™ Peptide 10/300 GL в серии (300×10 мм, GE Healthcare, Букингемшир, Великобритания). Данные собирали и исследовали с помощью программного обеспечения ASTRA (версия 4.73.04, Wyatt Technology Corp).
Результаты эксклюзионной хроматографии общего препарата HS8 выявили отличающийся эксклюзионный профиль. Исходный материал Celsus HS показывает сигнал выхода неудерживаемого компонента при 15 мл, при этом дополнительный материал, имеющий диапазон размеров, элюируется до приблизительно 23 мл элюента. Как показано на Фигуре 33, материал HS8 (удерживаемый аффинной колонкой для ФРФ2) показывает профиль размеров, обогащенный материалом, который покидает колонки для эксклюзионной хроматографии.
Полученные результаты отличаются от профиля размеров для препаратов HS3, проявляя промежуточный профиль размеров между профилями HS8 и Celsus HS (Фигура 34). На хроматограмме HS8 присутствует высокий сигнал соли при приблизительно 36 мл, поскольку данный образец получали в буфере, содержащем 50 мМ ацетата натрия (рН=7), а не в воде.
На Фигуре 35 приведены хроматограммы после эксклюзионной хроматографии двух различных партий ГС от Celsus. Партию #10697 использовали в качестве исходного материала для приготовления обоих препаратов HS3 и HS8. Расщепление обеих этих партий ферментами является аналогичным, за исключением того, что партия #10595, по-видимому, содержит большее количество материала, который совершенно не расщепляется и выходит из колонок.
Профиль размеров продуктов расщепления HS8 под действием гепаринлиазы (Фигура 36) довольно сильно отличается от такового для исходного материала Celsus HS (Фигура 35) или HS3 (Фигура 36). Профиль размеров, полученный для HS3, был очень похож на профиль, полученный с использованием продуктов расщепления, полученных ранее. На хроматограмме HS8, как и на хроматограмме для продуктов расщепления HS3, присутствует небольшой сигнал в исключенном объеме (15 мл), это указывает на то, что большая часть материала расщепляется в некоторой степени. Однако два продукта расщепления HS3 дают значительный и отчетливый сигнал при приблизительно 19 мл, в то время как HS8 дает широкий сигнал при приблизительно 18 мл.
Пример 13 - Количественный способ исследований с использованием [3Н]-гепарина
Гепаринсвязывающую способность последовательности SEQ ID NO: 1, полученной из аминокислотной последовательности ФРФ2, оценивали с использованием протокола, описанного ниже. Результаты приведены на Фигуре 37.
Материалы
1. Пептиды:
Gandhi et al. (HS8) - изготовлен в Технологическом университете Наньяна, Сингапур. GHFKDPKRLYCKNGGF-Ahx-(К)Биотин.
2. [3Н]-гепарин 0,1 мкКи (Perkin Elmer, Бостон, США).
3. Нитроцеллюлозная мембрана (Bio-Rad, США).
4. Бычий сывороточный альбумин 4% (масс./об.) в ФСБ.
5. Вакуумная печь (Thermo Fisher Scientific, США).
6. Жидкостный сцинтилляционный анализатор Tri-Carb 2800 TCR (Perkin Elmer, Бостон, США).
Способы
(1) Пептиды ФРФ2-ГСД растворяют до нужной концентрации (4,66×10-9, 9,32×10-9, 1,86×10-8, 3,73×10-8 моль) в ФСБ.
(2) Две одинаковые нитроцеллюлозные мембраны смачивают пептидами в известных концентрациях.
(3) Высушивают мембраны на воздухе в течение 1 часа.
(4) Дополнительно высушивают мембраны в вакуумной печи при 800°С в течение 45 минут.
(5) Мембраны промывают 3 раза с использованием ФСБ.
(6) Добавляют к мембранам 0,1 мкКи [3Н]-гепарина и инкубируют в течение 16 часов в сцинтилляционных флаконах для подсчета.
(7) Промывают мембраны 4 раза с использованием ФСБ.
(8) Радиоактивность определяют с помощью жидкостного сцинтилляционного анализатора Tri-Carb 2800 TCR (Perkin Elmer, Бостон, США).
Пример 14
Способность гепаринсвязывающего пептидного домена SEQ ID NO: 1 связаться с иммобилизованным гепарином оценивали с использованием протокола, описанного ниже. Результаты приведены на Фигуре 38.
Материалы
1. Стандартный буфер для исследования (SAB) - 100 мМ NaCl, 50 мМ ацетата натрия, 0,2% об./об. Твин 20, рН=7,2.
2. Блокирующий буфер - 0,4% рыбий желатин (Sigma, каталожный номер 67041) + SAB.
3. ГАГ-связывающий планшет (Iduron, Великобритания).
4. Пептиды:
Gandhi et al. (HS8) - Изготовлен в Технологическом университете Наньяна, Сингапур. GHFKDPKRLYCKNGGF-Ahx - (К)Биотин.
5. ExtrAvidin-AP (Sigma, каталожный номер Е2636).
6. П-нитрофенилфосфат Sigma FAST (Sigma, N2770).
Способ
1. Гепарин растворяют в SAB (5 мкг/мл).
2. По 200 мкл/лунку раствора гепарина вносят в ГАГ-связывающий планшет и инкубируют в течение ночи при комнатной температуре в защищенном от света месте.
3. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
4. Инкубируют планшет с 250 мкл/лунку блокирующего буфера в течение 1 часа при 37°С в защищенном от света месте.
5. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
6. Пептиды растворяют в блокирующем буфере и выполняют серийное разведение: 0, 50, 100, 200 нМ.
7. По 200 мкл/лунку разбавленного белка вносят в планшет, покрытый ГАГ, и инкубируют в течение 2 часов при 37°С.
8. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
9. Вносят по 200 мкл/лунку 220 нг/мл ExtrAvidin-AP, растворенного в блокирующем буфере, и инкубируют в течение 30 мин при 37°С.
10. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
11. Вносят по 200 мкл/лунку реагента для проявления окрашивания: п-нитрофенилфосфата Sigma FAST, растворенного в деионизированной воде, и инкубируют в течение 40 мин при комнатной температуре.
12. Регистрируют поглощение при длине волны 405 нм.
Пример 15
Была проведена оценка способности ФРФ2 связываться с HS8. Полученные результаты сопоставляли с величиной связывания с сырым исходным ГС (HS-PM из слизистой оболочки кишечника свиней) или контролем, не содержащим сахара. Результаты приведены на Фигуре 39.
Материалы
1. Стандартный буфер для исследования (SAB) - 100 мМ NaCl, 50 мМ ацетата натрия, 0,2% об./об. Твин 20, рН=7,2.
2. Блокирующий буфер - 0,4% рыбий желатин (Sigma, каталожный номер 67041) + SAB.
3. ГАГ-связывающий планшет (Iduron, Великобритания).
4. Белки, полученные от R&D Systems: ФРФ2 - 233 FB.
5. Антитела, полученные от R&D Systems: ФРФ2 - ВАМ233.
6. ExtrAvidin-AP (Sigma, каталожный номер Е2636).
7. П-нитрофенилфосфат Sigma FAST (Sigma, N2770).
Способ
1. ГАГ растворяют в SAB (5 мкг/мл).
2. По 200 мкл/лунку раствора ГАГ вносят в ГАГ-связывающий планшет и инкубируют в течение ночи при комнатной температуре в защищенном от света месте.
3. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
4. Планшет инкубируют с 250 мкл/лунку блокирующего буфера в течение 1 часа при 37°С в защищенном от света месте.
5. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
6. Растворяют белки в блокирующем буфере и выполняют серийное разведение: 0, 0,781, 1,56, 3,125 нМ.
7. В планшет, покрытый ГАГ, вносят по 200 мкл/лунку разбавленного белка и инкубируют в течение 2 часов при 37°С.
8. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
9. Вносят по 200 мкл/лунку 250 нг/мл биотинилированного первичного антитела, растворенного в блокирующем растворе, и инкубируют в течение 1 часа при 37°С.
10. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
11. В планшет вносят по 200 мкл/лунку 220 нг/мл ExtrAvidin-AP, растворенного в блокирующем растворе, и инкубируют в течение 30 мин при 37°С.
12. Планшет тщательно промывают 3 раза с использованием 250 мкл/лунку SAB.
13. В планшет вносят по 200 мкл/лунку реагента для проявления окрашивания: п-нитрофенилфосфата Sigma FAST, растворенного в деионизированной воде, и инкубируют в течение 40 мин при комнатной температуре.
14. Регистрируют поглощение при длине волны 405 нм.
Пример 16
Были проведены исследования пролиферации мезенхимальных стволовых клеток, прикрепленных к пластику, в течение 6 дней в присутствии HS8. Результаты приведены на Фигуре 40.
Протокол исследования пролиферации клеток
Материалы
1. НМ20 МСКЧ - получены от латиноамериканского донора-мужчины в возрасте 20 лет (приобретены у Lonza).
2. ФРФ2 (R&D Systems, каталожный номер 233-FB-025).
3. Поддерживающие среды: DMEM (1000 мг/л глюкозы), 10% ФТС, 1% пенициллина/стрептомицина, 2 мМ L-глутамина.
4. HS8.
5. Реагент Guava Flex (Millipore).
Способы
1. Клетки НМ20 высевают на 24-луночные планшеты в плотности 3000 клеток/см2 в 500 мкл/лунку сред (0-й день).
2. 1-й день - среды заменяют средами с добавлением ГАГ (мкг/мл) - 2,5 и 0,5.
3. Среды заменяют каждые 2 дня.
4. Клетки собирают в указанные моменты времени (6-й день) с использованием 100 мкл трипсина и нейтрализуют путем добавления 300 мкл сред.
5. Клетки подсчитывали с помощью устройства Guava (соотношение реагент Guava flex:суспензия клеток составляет 1:200).
Пример 17
Пролиферацию STRO-1 -выделенных мезенхимальных стволовых клеток в течение 36 часов в присутствии выделенного HS8, по сравнению с сырым исходным Celsus HS (HS-PM) или несвязывающейся проточной фракцией ГС (HS8-), измеряли по включению BrdU, как описано ниже. Результаты приведены на Фигуре 41 (на которой HS8G=HS8).
Протокол (ИФА для исследования пролиферации клеток. BrdU (колориметрический), Roche)
1. Клетки высевают в плотности 5000 клеток в 190 мкл сред/лунку (96-луночный планшет).
2. Среды - альфа-MEM +10% фетальной телячьей сыворотки (ФТС) +1% L-глутамина +1% пенициллина/стрептомицина +100 нм L-глутамата.
3. Планшет инкубируют в течение 6 часов при 37°С и 5% CO2.
4. Вносят различные дозы исследуемых соединений в 10 мкл сред в определенные лунки в соответствии со схемой после 6 часов инкубации.
5. ГАГ (мкг/мл) - 10, 5, 2,5, 1,25, 0,625, 0,3125.
6. Инкубируют в течение 36 часов с исследуемыми соединениями при 37° и 5% CO2.
7. Вносят BrdU в каждую лунку.
8. Клетки помечают с помощью BrdU в течение 2 часов при 37°С и 5% CO2 (вносят по 20 мкл BrdU раствора для маркировки/лунку).
9. Удаляют среду для маркировки, постукивая по планшету.
10. К клеткам добавляют по 200 мкл/лунку FixDenat и инкубируют в течение 30 мин при 15-25°С.
11. Тщательно удаляют раствор FixDenat, слегка пощелкивая и постукивая по планшету.
12. Вносят по 100 мкл/лунку рабочего раствора анти-BrdU-POD и инкубируют в течение 90 мин при 15-25°С.
13. Удаляют конъюгат антитела, пощелкивая по планшету, и промывают лунки три раза с использованием 250 мкл/лунку раствора для промывки (1×ФСБ).
14. Удаляют раствор для промывки, постукивая по планшету.
15. В планшет вносят по 100 мкл/лунку раствора субстрата и инкубируют в течение 30 мин при 15-25°С.
16. Регистрируют поглощение при длине волны 370 нм (эталонная длина волны 492 нм).
Пример 18 - Исследование дисахаридов с помощью капиллярного электрофореза (КЭ)
Гепарансульфат (ГС) получали от Celsus Laboratories Inc. (НО-03103, серия №НО-10697). Дисахаридные стандарты ΔUA,2S - GlcNS,6S; ΔUA,2S - GlcNS, ΔUA,2S -GlcNAc,6S, ΔUA - GlcNS,6S, ΔUA - GlcNS, UA - GlcNAc, ΔUA,2S - GlcNAc, ΔUA - GlcNAc,6S, ΔUA,2S - GlcN, ΔUA,2S - GlcN,6S, ΔUA - GlcN,6S, ΔUA - GlcN каталожный номер от HD001 до HD013, Iduron Ltd, Манчестер, Великобритания), полученные путем расщепления бактериальными гепариназами высокосортного свиного гепарина, были приобретены у Iduron Ltd, Манчестер, Великобритания. Синтетическое производное неприродного дисульфатированного дисахарида (ΔUA,2S-GlcNCOEt,6S) также было приобретено у Iduron для использования в качестве внутреннего стандарта. Олигосахариды гепарина (dp4, dp6, dp8, dp10, dp12 (каталожный номер HO04, HO06, HO08, НО10, НО12) и выборочно десульфатированные стандарты гепарина (2-O, 6-O и N-десульфатированный гепарин) (каталожный номер DSH001/2, DSH002/6, DSH003/N, Iduron Ltd, Манчестер, Великобритания) также были приобретены у Iduron Ltd, Манчестер, Великобритания.
Гепаринлиаза I (гепаритиназа, ЕС 4.2.2.8, также известная как гепаритиназа I), гепаринлиаза II (гепаритиназа II, номер ЕС не присвоен) и гепаринлиаза III (гепариназа, ЕС 4.2.2.7, также известная как гепаритиназа III) получены от Seikagaku Corporation, Япония. Ферменты, поставляемые в виде лиофилизированных порошков (0,1 Ед/флакон), растворяли в 0,1% БСА, чтобы получить растворы, содержащие 0,5 мЕд/мкл. Аликвоты (5 мкл; 2,5 мЕд) замораживали (-80°С) до использования.
Расщепление препаратов ГС ферментами гепаринлиазами
Каждый из препаратов ГС (1 мг) растворяли в 500 мкл буфера на основе ацетата натрия (100 мМ, содержащего 10 мМ ацетат кальция, рН=7,0) и добавляли по 2,5 мЕд каждого из трех ферментов. Образцы инкубировали при 37°С в течение ночи (24 ч), осторожно переворачивая пробирки (9 оборотов в минуту). К образцам дополнительно добавляли по 2,5 мЕд каждого из трех ферментов и инкубировали при 37°С в течение еще 48 ч, осторожно переворачивая пробирки (9 оборотов в минуту). Продукты расщепления инактивировали путем нагревания (100°С, 5 мин) и лиофилизировали. Продукты расщепления повторно суспендировали в 500 мкл воды, и отбирали аликвоту (50 мкл) для исследования с помощью КЭ.
Капиллярный электрофорез (КЭ)
Рабочий буфер для капиллярного электрофореза готовили путем добавления водного раствора 20 мМ Н3РО4 к раствору 20 мМ Na2HPO4⋅12Н2О до получения значения рН равного 3,5. Колонку промывали 100 мМ NaOH (получали путем разбавления 50% масс./масс. раствора NaOH). Рабочий буфер и раствор для промывания колонки фильтровали, используя фильтровальный блок Millipore, оснащенный мембранными фильтрами из ацетата целлюлозы с размером пор 0,2 мкМ (диаметром 47 мм; Schleicher and Schuell, Дассел, Германия).
Исходные растворы 12 стандартов дисахаридов получали путем растворения дисахаридов в воде (1 мг/мл). Для определения калибровочных кривых для стандартов, готовили смесь, содержащую все двенадцать стандартов. Исходный раствор смеси 12 стандартов содержал по 10 мкг/100 мкл каждого дисахарида, также готовили серию разведений, содержащих 10, 5, 2,5, 1,25, 0,625, 0,3125 мкг/100 мкл; включая 2,5 мкг внутреннего стандарта (ΔUA,2S-GlcNCOEt,6S). Продукты расщепления ГС разбавляли (50 мкл/мл) водой, и к каждому образцу добавляли аналогичный внутренний стандарт (2,5 мкг). Растворы лиофилизировали и повторно суспендировали в воде (1 мл). Образцы фильтровали с использованием одноразовых гидрофильных фильтров для шприцев, изготовленных из ПТФЭ (0,2 мкМ; диаметром 13 мм; Advantec Toyo Roshi, Kaisha, Ltd., Япония).
Исследования проводили с использованием устройства Agilent3DCE (Agilent Technologies, Вальдброн, Германия) на непокрытой капиллярной колонке из плавленого кварца (внутренний диаметр 75 мкм, общая длина 64,5 см и эффективная длина 56 см, Polymicro Technologies, Феникс, Арканзас, США, номер по каталогу TSP075375) при 25°С, используя 20 мМ рабочий буфер и капиллярное напряжение 30 кВ. Образцы вводили в капиллярную колонку с помощью гидродинамической инъекции (50 мбар ×12 сек) на катодном (обратная полярность) конце.
Перед проведением каждого опыта капиллярную колонку промывали с использованием 100 мМ NaOH (2 мин), воды (2 мин), и предварительно кондиционировали рабочим буфером (5 мин). Система восполнения буфера заменяла буфер во впускных и выпускных трубках, чтобы обеспечить одинаковые объемы, значения рН и ионной силы поддерживали постоянными. Контрольные пробы, содержащие только воду, испытывали в начале, середине и конце исследования последовательности образцов. Поглощение контролировали при длине волны 232 нм. Все данные сохраняли в базе данных ChemStore и впоследствии извлекали и повторно обрабатывали с использованием программного обеспечения ChemStation.
Одиннадцать из 12 дисахаридов гепарина в стандартной смеси разделяли с использованием условий, описанных выше. 12-й дисахарид, ΔUA-GlcN, не мигрирует в условиях, используемых для описанных экспериментов. Однако отсутствуют сообщения о присутствии этого дисахарида в гепарансульфатах. Значения R2 для стандартных калибровочных кривых варьировались от 0,9949 до 1,0.
Расщепление препаратов ГС под действием гепаринлиазы I, II и III проводили в двух повторах, и образцы из каждого повтора вводили дважды в колонку для КЭ. Таким образом, нормированная массовая доля дисахаридов в продуктах расщепления ГС представляет собой среднее арифметическое значение результатов исследования. Из 11 дисахаридов, разделенных в стандартных смесях, только восемь детектируются в продуктах расщепления ГС. Другие низкие сигналы наблюдаются на базовой линии электрофореграмм продуктов расщепления и могут соответствовать олигосахаридам со степенью полимеризации >2. Как упоминалось выше, более крупные олигосахариды будут иметь меньшую величину поглощения в УФ-области по сравнению с дисахаридами.
Образец Celsus HS (серия №10697) исследовали с двумя повторами, и результаты сопоставляли с данными, полученными в предыдущей серии исследований на этом же образце: эти результаты приведены на Фигуре 42. Была обнаружена четкая корреляция между результатами двух серий исследований.
Доли восьми дисахаридов в продуктах расщепления Celsus HS были аналогичны таковым согласно результатам других предшествующих исследований, при этом ΔUA-GlcNAc и ΔUA-GlcNS являлись главными компонентами, и ΔUA-GlcNAc,6S, ΔUA-GlcNS,6S и ΔUA,2S-GlcNS,6S представляли собой минорные компоненты (Фигура 42). Полученные результаты согласуются с большей долей моно- и несульфатированного дисахарида, меньшей долей дисульфатированного дисахарида и небольшой долей трисульфатированного дисахарида в соответствии с профилями ВЭЖХ/эксклюзионной хроматографии. ГС, который не удерживается на колонке, обогащен моно- и несульфатированными дисахаридами по сравнению с исходным материалом Celsus HS. Такой профиль для неудерживаемого материала также вполне отчетливо наблюдали на хроматограммах ВЭЖХ/эксклюзионной хроматографии.
В случае исследований HS8 объем образца позволял провести лишь одно исследование, вследствие этого для указанного препарата отсутствуют данные об ошибках. Результаты сравнения HS8, HS3 и Celsus HS приведены на Фигуре 44.
Дисахаридный состав для HS8 сопоставим с таковым для HS3 (ГС, выделенный из Celsus HS за счет наличия аффинности в отношении гепаринсвязывающего домена из ВМР2, как описано в WO 2010/030244) в том, что из Celsus HS в целом была получена более сульфатированная (заряженная) фракция. Однако существует неожиданное различие в том, что в HS8 присутствует большая доля UA-GlcNS,6s и меньшая доля US-GlcNS по сравнению с HS3.
Сырой Celsus HS, из которого был получен HS8, имеет среднюю молекулярную массу 20-25 кДа (по сравнению с ~15 кДа для гепарина), и процесс выявления HS8 с помощью аффинной хроматографии не привел к существенному изменению наблюдаемой молекулярной массы цепей ГС. Как ожидается, каждый дисахаридный блок имеет молекулярную массу в диапазоне от ~430 до ~650 кДа. Использование приближенной средней массы в 500 дальтон для одного дисахарида (средний дисахарид в составе гепарина весит ~650 дальтон, например) указывает (в качестве основного приближения), что длина цепи HS8 составляет приблизительно 44 кольца на средний (22 кДа) HS8.
Пример 19
После того как было выявлено, что HS8 преимущественно связывается с ФРФ2 и увеличивает скорость размножения МСКЧ, авторы настоящего изобретения дополнительно изучили механизм активности HS8.
Нейтрализующее антитело к ФРФ2 или ингибиторы ФРФR1 (оба, ингибитор киназы и нейтрализующее антитело) способны уменьшить пролиферативное действие HS8 на МСКЧ (Фигура 47-50), это подтверждает тот факт, что митогенное действие HS8 на МСКЧ опосредовано его взаимодействием с ФРФ2/ФРФR, но не с другими молекулами. В присутствии HS8 наблюдается задержка быстрого разрушения ФРФ2 (Фигура 46), это доказывает, что HS8 взаимодействует с ФРФ2, чтобы защитить его от разрушения в культуральной среде.
Было показано (выше), что HS8 усиливает самообновление МСКЧ, сохраняя мультипотентность. Чтобы проверить, может ли добавление HS8 к стандартной культуре МСКЧ ускорить размножение культуры, МСКЧ, полученные от трех индивидуальных доноров, выращивали по отдельности в среде с добавленным HS8. Было отмечено, что МСКЧ, подвергнутые воздействию HS8, были способны образовывать больше колоний (Фигура 51) и поддерживать фенотип, сходный с таковым для стволовых клеток, согласно результатам измерения с помощью проточной цитометрии для биомаркеров CD14, 19, 34, 45, HLA-DR, CD73, 90, 105, CD49a, SSEA-4 и STRO-1 у всех 3 доноров (например, данные представлены на Фигуре 22), несмотря на дополнительное удвоение клеток. Биомаркеры, указывающие на «стволовость», сохранялись в том случае, когда МСКЧ размножали в среде с добавлением HS8.
Авторы настоящего изобретения также установили, что указанные клетки способны легко дифференцироваться во все три линии мезенхимальных стволовых клеток (включая костную ткань, согласно результатам измерения с помощью окрашивания ализариновым красным, окрашивания по фон Коссу, масляным красным О и альциановым голубым) и обладают повышенным остеогенезом, это указывает на то, что такая стратегия может быть эффективной для лечения ортопедических травм. HS8 не оказывает отрицательного влияния на способность МСК дифференцироваться в костную ткань.
Исходя из вышеизложенного, авторы настоящего изобретения применили HS8 в модели патологий свода черепа у крыс (Фигура 52). Улучшенное заживление кости было очевидным, это позволяет предположить, что HS8 взаимодействует с ФРФ2 в очаге травмы, чтобы усилить активность эндогенных стволовых клеток и остеогенных клеток-предшественников посредством ФРФ2-зависимого механизма, подчеркивая тем самым терапевтические возможности этого подхода для лечения патологий костей свода черепа.
Список литературных источников
1. Ashikari-Hada, S., Habuchi, Н., Kariya, Y., Itoh, N., Reddi, A.H., and Kimata, K. (2004). Characterization of Growth Factor-binding Structures in Heparin/Heparan Sulfate Using an Octasaccharide Library. The Journal of Biological Chemistry 279(1)3, 12346-12354.
2. Baird, A., Schubert, D., Ling, N., and Guillemin, R. (1988). Receptor- and heparin-binding domains of basic fibroblast growth factor. Proc. Natl. Acad. Sci. USA 85, 2324-2328.
3. Billingham, R.E. (1966-67). The biology of graft-versus-host reactions. Harvey Lect 62, 21-78.
4. Bishop, J.R., Schuksz, M., and Esko, J.D. (2007). Heparan sulphate proteoglycans fine-tune mammalian physiology. Nature 446, 1030-1037.
5. Brickman, Y.G., Ford M.D., Small, D.H., Bartletti, P., F., and Nurcombe, V. (1995). Heparan sulfates mediate the binding of basic fibroblast growth factor to a specific receptor on neural precursor cells. J Biolo. Chem. 270(42), 24941-24948.
6. Brickman, Y.G., Nurcombe, V., Ford, M.D., Gallagher, J.T., Bartlett, P.F. and Turnbull, J.E. (1998). Structural comparison of fibroblast growth factor-specific heparan sulfates derived from a growing or differentiating neuroepithelial cell line. Glycobiology 8(5), 463-471.
7. Cain, S.A., Baldock, C, Gallagher, j., Morgan, A., Bax D.V., Weiss, A.S., Shuttleworth, A.C., and Kielty CM. (2005). Fibrillin-1 Interactions with heparin-Implications for microfibril and elastic fibre assembly. The Journal of biological Chemistry 280(34), 30526-30537.
8. Caplan, A.I. (2009). Why are MSCs therapeutic? New data: new insight. J Pathol 217,318-324.
9. Cardin, A.D., and Weintraub, H.J. (1989), Molecular modeling of protein-glycosaminoglycan interactions. Arterioscler. Thromb. Vasc. Biol. 9,21-32.
10. Cawthon, R.M. (2002) Telomere measurement by quantitative PCR. Nucleic Acids Res 30, e47.
11. Cool, S.M., and Nurcombe, V. (2005) Substrate Induction of Osteogenesis from Marrow-Derived Mesenchymal Precursors. Stem Cells Dev. 14(6), 632-642.
12. Dominici, M., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F.C., Krause, D.S., Deans R.J., Keating, A., Prockop, D.J., and Horwitz, E.M. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 8(4), 315-317.
13. Esch, F., Balrd, A., Ling, N., et al. (1985) Primary structure of bovine pituitary basic fibroblast growth factor (ФРФ) and comparison with the amino-terminal sequence of bovine brain acidic ФРФ. Proc Natl Acad Sci USA; 82:6507-6511.
14. Faham, S., Hileman, R.E., Fromm, J.R., Linhardt, R.J., and Rees, D.C. (1996) Heparin structure and interactions with basic fibroblast growth factor. Science 271, 1116-1120.
15. Ferrara, J.L.M., Levine, J.E., Reddy, P., and Holler, E. (2009). Graft-versus-host disease. Lancet 373, 1550-61.
16. Fromm, J.R., Hileman, R.E., Caldwell, E.E., Weiler, J.M., and Linhardt, R.J. (1997). Pattern and spacing of basic amino acids in heparin binding sites. Arch. Biochem. Biophys. 343,92-100.
17. Gandhi, N.S., and Mancera, R.L. (2008). The Structure of glycosaminoglycans and their interactions with proteins. Chem. Biol. Drug. Des. (2008) 72, 455-482.
18. Gronthos, S., Zannettino, A.C.W., Graves, S.E., Ohta, S., Hay, S.J., and Simmons, P.J. (1999). Differential cell surface expression of the STRO - 1 and alkaline phosphatase antigens on discrete developmental stages in primary cultures of human bone cells. J. Bone Min. Res. 14(1), 47-56.
19.

20. Guillot, P.V., Gotherstrom, C., Chan, J., Kurata, H. and Fisk, N.M. (2007) Human first-trimester fetal MSС express pluripotency markers and grow faster and have longer telomeres than adult MSC. Stem Cells 25, 646-654.
21. Hileman, R.E., Fromm, J.R., Weiler, J.M., and Linhardt, R.J. (1998). Glycosaminoglycan-protein interactions: definition of consensus sites in glycosaminoglycan binding proteins. Bioessays 20(2), 156-67.
22. Kinsella, L., Chen, H., Smith, J.A., Rudland, P.S., and Fernig D.G. (1998). Interactions of putative heparin-binding domains of basic fibroblast growth factor and its receptor, ФРФR-1, with heparin using synthetic peptides. Glycoconjugate Journal 15, 419-422.
23. Le Blanc, K., Frassoni, F., Ball, L., Locatelli, F, Roelofs, H., Lewis, I., Lanino, E., Sundberg, В., Bernardo, M.E., Remberger, M., Dini, G., Egeler, R.M., Bacigalupo, A., and Fibbe, W.,

24. Lee, J.Y., Choo, J.E., Choi, Y.S., Lee, K.Y., Min, D.S., Pi, S.H., Seol, Y.J., Lee, S.J., Jo, I.H., Chung, C.P., and Park, Y.J. (2007). Characterization of the surface immobilized synthetic heparin binding domain derived from human fibroblast growth factor-2 and its effect on osteoblast differentiation. J Biomed Mater Res A 15;83(4), 970-9.
25. Matsubara, Т., Tsutsumi. S., Pan, H., Hiraoka, H., Oda, R., Nishimura, M., Kawaguchi, H., Nakamura, K., and Kato, Y. (2004). A new technique to expand human mesenchymal stem cells using basement membrane extracellular matrix. Biochemical and Biophysical Research Communications313(3),503-508.
26. Meuleman, N., Tondreau, Т., Ahmad, I., Kwan, J., Crokaert, F., Delforge, A., Dorval, C, Martiat, P., Lewalle, P., Lagneaux, L., and Bron D.(2009). Infusion of mesenchymal stromal cells can aid hematopoietic recovery following allogeneic hematopoietic stem cell myeloablative transplant: a pilot study. Stem Cells Dev. 18(9), 1247-52.
27. Murali, S., Manton, K.J., Tjong, V., Su, X., Haupt, L.M, Cool, S.M., and Nurcombe, V. (2009) Purification and characterization of heparan sulfate from human primary osteoblasts. Journal of cellular biochemistry 108, 1132-1142 (2009).
28. Nurcombe, V., Ford, M.D., Wildschut, J.A., and Bartlett, P.F. (1993). Developmental regulation of neural response to ФРФ1 and ФРФ2 by heparan sulfate proteoglycan. Science, 260(5104), 103-106.
29. Ono, K., Hattori, H., Takeshita, S., Kurita, A., and Ishihara, M.(1999). Structural features in heparin that interact with VEGF165 and modulate its biological activity. Glycobiology. 9(7), 705-ll.
30. Ornitz, D.M., Xu, J., Colvin, J.S., McEwen, D.G., MacArthur, C.A., Coulieri, F., Gao, G., and Goldfarb, M. (1996). Receptor Specificity of the Fibroblast Growth Factor Family. J Biol. Chem. 271(25), 15292-15297.
31. Ori, A., Free, P., Courty, J., Wilkinson, M.C., and Fernig D.G. (2009). Identification of Heparin-binding Sites in Proteins by Selective Labeling. Molecular & Cellular Proteomics 8, 2256-2265.
32. Ori, A., Wilkinson, M.C., and Fernig, D.,G. (2008). The heparanome and regulation of cell function: structures, functions and challenges. Front Biosci. 1(13), 4309-38.
33. Pellegrini, L. (2001). Role of heparan sulfate in fibroblast growth factor signalling: a structural view. Curr. Opin. Struc. Biol. 11, 629-634.
34. Ren, G. S, J., Zhang, L., zhao, X., Ling, W., L'huillie, A., Zhang, J., Lu, Y., Roberts, A.I., Ji, W., Zhang, H., Rabson, A.B., and Shi, Y. (2009). Species Variation in the Mechanisms of Mesenchymal Stem Cell-Mediated Immunosuppression. Stem cells 27, 1954-1962.
35. Shi, Y., Hu, G., Su, J., Li, W., Chen, C., Shou, P. Xu, C, Chen, X., Huang, Y., Zhu, Z., Huang, X., Han, X., Xie, N., and Ren, G. (2010). Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair. Cell Research 20, 510-518.
36. Si, Y.L., Zhao, Y.L., Hao, H.J., Fu, X.B., and Han, W.D. (2011). MSCs: Biological characteristics, clinical applications and their outstanding concerns. Ageing Research Reviews 10, 93-103.
37. Sotiropoulou, P.A., Perez, S.A., Salagianni, M., Baxevanis, C.N, and Papamichail, M. (2006). Characterization of the Optimal Culture Conditions for Clinical Scale Production of Human Mesenchymal Stem Cells. Stem cells 24, 462-471.
38. Tisato, V., Naresh, K., Girdlestone, J., Navarrete, C, and Dazzi, F. (2007). Mesenchymal stem cells of cord blood origin are effective at preventing but not treating graft-versus-host disease. Leukemia 21, 1992-9.
39. Toubai, Т., Paczesny, S., Shono, Y., Tanaka, J., Lowler, K.P., Malter, C.T., Kasai, M., and Imamura, M. (2009). Mesenchymal stem cells for treatment and prevention of graft-versus-host disease after allogeneic hematopoietic cell transplantation. Curr. Stem. Cell. Res. Ther. 4(4), 252-9.
40. Thompson, L.D., Pantoliano, M.W., and Springer B.A. (1994). Energetic characterization of the basic fibroblast growth factor-heparin interaction: identification of the heparin binding domain. Biochemistry 33, 3831-3840.
41. Uniewicz, K.A., Ori, A., Xu, R., Ahmed, Y., Wilkinson, M.C, Fernig, D.G., and Yates, E.A. (2010). Differential Scanning Fluorimetry Measurement of Protein Stability Changes upon Binding to Glycosaminoglycans: A Screening Test for Binding Specificity. Anal. Chem., 82 (9), 3796-3802.
42. Walsh, S., Jefferiss, C, Stewart, K., Jordan, G.R., Screen, J., and Beresford, J.N. (2000). Expression of the developmental markers STRO-1 and alkaline phosphatase in cultures of human marrow stromal cells: regulation by fibroblast growth factor (ФРФ)-2 and relationship to the expression of ФРФ receptors 1-4. Bone 27(2). 185-195.
43. Zannettino, A.C., Paton, S., Itescu, S., and Gronthos, S. (2010). Comparative assessment of the osteoconductive properties of different biomaterials in vivo seeded with human or ovine mesenchymal stem/stromal cells. Tissue Eng Part A. 16(12), 3579-87.
44. Zulma Gazit, Z., Pelled, G. Sheyn, D., Kimelman, N. and Gazit, N. (2011). Mesenchymal Stem Cells. Principles of Regenerative Medicine Chapter 17, 285-304.
45. Friedenstein AJ, Piatetzky S II, Petrakova KV (1966) Osteogenesis intransplants of bone marrow cells. J Embryol Exp Morphol 16:381-390.
46. Gimble J, Guilak F (2003) Adipose-derived adult stem cells: isolation, characterization, and differentiation potential. Cytotherapy 5:362-369.
47. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH (2001) Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng 7:211-228.
48. Bieback K, Kern S, Kluter H, Eichler H (2004) Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood. Stem Cells 22:625-634.
49. Erices A, Conget P, Minguell JJ (2000) Mesenchymal progenitor cells in human umbilical cord blood. Br J Haematol 109:235-242.
50. Goodwin HS, Bicknese AR, Chien SN, Bogucki BD, Quinn CO, Wall DA (2001) Multilineage differentiation activity by cells isolated from umbilical cord blood: expression of bone, fat, and neural markers. Biol Blood Marrow Transplant 7:581-588.
51. Kogler G, Sensken S, Airey JA, Trapp T, Muschen M, Feldhahn N, Liedtke S, Sorg RV, Fischer J, Rosenbaum С et al. (2004) A new human somatic stem cell from placental cord blood with intrinsic pluripotent differentiation potential. J Exp Med 200:123-135.
52. Wagner W, Wein F, Seckinger A, Frankhauser M, Wirkner U, Krause U, Blake J, Schwager C, Eckstein V, Ansorge W, Ho AD (2005) Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood. Exp Hematol 33:1402-1416.
53. Jiang Y, Vaessen B, Lenvik T, Blackstad M, Reyes M, Verfaillie CM (2002) Multipotent progenitor cells can be isolated from postnatal murine bone marrow, muscle, and brain. Exp Hematol 30:896-904.
Реферат
Группа изобретений относится к области биотехнологии. Предложен выделенный или по существу очищенный гепарансульфат HS8, при этом указанный HS8 способен специфически и с высокой аффинностью связываться с полипептидом, состоящим из аминокислотной последовательности YCKNGGF (SEQ ID NO: 2) и имеющим от 0 до 20 дополнительных аминокислот на одном или на обоих концах указанной аминокислотной последовательности SEQ ID NO:2, при этом указанный по существу очищенный гепарансульфат HS8 содержит по меньшей мере 80% HS8, и при этом указанный гепарансульфат HS8 имеет определенный дисахаридный состав. Предложены композиция для усиления пролиферации стволовых клеток, фармацевтическая композиция для восстановления или регенерации ткани путем усиления пролиферации стволовых клеток, а также культуральная среда для усиления пролиферации стволовых клеток, содержащие эффективное количество указанного HS8. Предложены способы лечения заболевания, состояния или травмы ткани у пациента путем усиления пролиферации стволовых клеток, способ лечения перелома кости у пациента с использованием указанного HS8. Предложен биосовместимый имплантат или протез, содержащий биоматериал и указанный HS8, а также способ его получения. Предложен способ культивирования стволовых клеток в условиях in vitro, способ обогащения колониеобразующими единицами (КОЕ-Ф) культуры мезенхимальных стволовых клеток (МСК), а также способ увеличения стабильности фактора роста с использованием указанного HS8. Группа изобретений позволяет получать гепарансульфат HS8, способный обеспечивать эффективную пролиферацию МСК без потери их плюрипотентности/мультипотентности и замедлять деградацию ФРФ2 по сравнению с необработанным исходным Celsus HS или HS8-ve, что можно использовать для восстановления и/или регенерации различных тканей, в случаях когда усиление пролиферации стволовых клеток будет оказывать благоприятный эффект. 15 н. и 15 з.п. ф-лы, 52 ил., 19 пр.
Формула
Документы, цитированные в отчёте о поиске
Медицинские протезы, имеющие улучшенную биологическую совместимость

Комментарии