Аминоалкилдезоксипроизводное целлюлозы, способ его получения и средство, обладающее антитромбоцитарной активностью - RU2694342C1
Код документа: RU2694342C1
Описание
Изобретение относится к области химико-фармацевтической промышленности, а именно касается создания на основе целлюлозы аминобутилдезоксисодержащего производного в форме гидрохлорида, формула которого соответствует общей структуре (III), к способу его получения и применения, в качестве антиагрегантного средства, обладающего высокой ингибиторной активностью по отношению к агрегации тромбоцитов человека.
Предшествующий уровень техники.
В норме, многокомпонентная система гемостаза (сосудистая стенка, в основном интима, тромбоциты и другие форменные элементы крови, плазменные ферментные системы - свертывающая, антикоагулянтная и фибринолитическая - с их сложной нейрогуморальной регуляцией) у людей обеспечивает текучесть крови и препятствует развитию тромбоза или кровотечения [Hemostasis and Thrombosis: Practical Guidelines in Clinical managemaent // Edited by Saba HI, Roberts HR. John, Wiley & Sons, 2014, 344 p, ISBN 978-0-470-67050-7]. Последовательная активация на фосфолипидных поверхностях (тканевый фактор на клетках или активированные тромбоциты) факторов свертывания крови, сопровождающаяся включением механизмов положительной и отрицательной обратной связи, приводит к образованию тромбина, при этом, антикоагулянтная система ингибирует избыточную генерацию тромбина, а система фибринолиза обеспечивает лизис сгустка. Нарушение баланса про- и антикоагулянтных механизмов может привести к тромбозам или кровотечениям [Raskob GE, Anqchaisuksiri P., Blanco AN, Buller H., Gallus A., Hunt BJ, Hylek EM, Kakkar A., Konstantinides SV, McCumber M., Ozaki Y., Wendelboe A., Weitz JI. Thrombosis: A major contributor to global disease burden. ISTH Steering Committee for World Thrombosis Day // Thromb Res. 2014; 134: 931-938].
Для борьбы с тромбозами, наряду с антикоагулянтами и фибринолитиками, используют лекарственные средства, ингибирующие агрегацию тромбоцитов (антиагреганты или антитромбоцитарные средства) [Sibbing D., Angiolillo DJ, Huber K. Antithrombotic therapy for acute coronary syndrome: Past, present and future. // Thromb Haemost 2017; 117 (7): 1240-1248], [Gesheff Т., Barbour C. Oral antiplatelet agents for the management of acute coronary syndromes: A review for nurses and allied healthcare professionals // J Am Assoc Nurse Pract. 2017; 29 (2):104-115]. Тромбоциты (небольшие, 2-4 мкм, безъядерные плоские бесцветные форменные элементы крови, присутствующие только у млекопитающих) играют ключевую роль при нарушении целостности стенки сосуда [Mancuso ME, Santagostino Е. Platelets: much more than bricks in a breached wall. // Br J Haematol 2017; 178(2): 209-19]. На стадии адгезии тромбоциты связываются посредством мембранного рецептора гликопротеина (ГП) VI с экспонированным на поврежденной стенке сосуда коллагеном и посредством ГП комплекса Ib-IX-V на тромбоцитарной мембране с циркулирующим в кровяном русле фактором Виллебранда [Koltai K, Kesmarky G, Feher G, Tibold A, Toth K. Platelet Aggregometry Testing: Molecular Mechanisms, Techniques and Clinical Implications // Int. J. Mol. Sci. 2017, 18, 1803: 1-21], [Son E, Kim S-H, Yang W-K, Kim D-S, Cha J / Antiplatelet mechanism of an herbal mixture prepared from the extracts of Phyllostachys pubescens leaves and Prunus mume fruits // BMC Complementary and Alternative Medicine, 2017, 17:541; 1-11], [Gryglewski RJ. Prostacyclin among prostanoids. Pharmacol Rep. 2008; 60:3-11]. В результате из гранул тромбоцитов высвобождается ряд соединений медиаторов с проагрегантной активностью [Nieswandt B, Watson SP. Platelet-collagen interaction: is GPVI the central receptor. Blood. 2003; 102(2):449-61]. Высвобожденное содержание гранул активирует другие тромбоциты, что приводит к внутриклеточному увеличению концентрации ионов кальция [Ruggeri ZM, Mendolicchio GL. Adhesion mechanisms in platelet function. Circ Res. 2007; 100:1673-85], [Rumbaut RE, Thiagarajan P: Platelet-vessel wall interactions in hemostasis and thrombosis, Chapter 4. San Rafael (CA): Morgan & Claypool Life Sciences, 2010. ISBN 10: 1615040390] и последующим структурным/функциональным изменениям - форма тромбоцитов меняется с гладкого диска на сфероидальную с мембранными выростами [Pallister CJ, Watson MS: Haematology, Second edition, pp 334-336. Scion Publishing Ltd, 2010. ISBN 10: 1904842399]. После ряда сложных механизмов сигнальной трансдукции активируются ГП IIb/IIIa рецепторы мембраны тромбоцитов, обеспечивающие связь с фибриногеном, и образуются агрегаты [Joo SJ, Lee JW, Park YS. Increased activation of platelet glycoprotein IIb/IIIa in hypercholesterolemic patients. Korean Circ J 1998;28:2030-41], [Jackson S.P. The growing complexity of platelet aggregation//Blood 2007; 109(12):5087-95]. Кроме этого, на отрицательно заряженных поверхностях активированных тромбоцитов формируются протромбиназный (Xa-Va)/теназный (IXa-VIIIa) комплексы и генерируется огромное количество тромбина [Rubens C. Costa-Filho, Fernando A. Bozza. Platelets: an outlook from biology through evidence-based achievements in critical care // Ann Transl Med 2017;5(22):449], [Hoffman M, Monroe DM 3rd. A cell-based model of hemostasis. Thromb Haemost 2001;85:958-65], [Hoffman M, Monroe DM. Coagulation 2006: a modern view of hemostasis. Hematol Oncol Clin North Am 2007;21:1-11].
Тромбоциты участвуют во всех трех волнах тромбообразования [Wang Y, Ni H. Fibronectin maintains the balance between hemostasis and thrombosis//Cell Mol Life Sci 2016;73:3265-77]: (I) протеиновая волна; (II) срастание (accretion) тромбоцитов; (III) коагуляция крови. Для индукторов (агонистов) агрегации тромбоцитов на поверхности тромбоцитов есть специфические рецепторы, активация которых приводит к генерации сигнала и передаче его в клетку. Важнейший физиологический метаболит АДФ активирует пуринергические G protein связанные рецепторы тромбоцитов [Biology of Platelet Purinergic Receptors and Implications for Platelet Heterogeneity//M. Koupenova, K. Ravid//Frontiers in Pharmacology January 2018, 9, Article 37; 1-9]. Активность других агонистов тромбоцитов в некоторой степени зависит от высвобождения АДФ [Offermanns S., Toombs C, Hu Y, Simon M. Defective platelet activation in G alpha(q)-deficient mice//Nature. 1997; 389:183-186]. На поверхности каждого тромбоцита присутствует около 75000 ГП рецепторов Ilb/IIIa. Антагонисты этих рецепторов блокируют финальные этапы агрегации тромбоцитов - присоединение фибриногена к ГП [Rubens C. Costa-Filho, Fernando A. Bozza. Platelets: an outlook from biology through evidence-based achievements in critical care//Ann Transl Med 2017;5(22):449]. Блокада этих рецепторов предотвращает агрегацию тромбоцитов, индуцированную тромбином, тромбоксаном А2, АДФ, коллагеном и катехоламинами, а также активацию тромбоцитов при повреждении стенки. Для активации трех групп рецепторов тромбоцитов необходимы петли положительных обратных связей [Wang Y, Ni H. Fibronectin maintains the balance between hemostasis and thrombosis//Cell Mol Life Sci 2016;73:3265-77]: (I) Пуринергические рецепторы P2Y1 и P2Y12 активируются АДФ, высвобожденной из плотных гранул тромбоцитов; (II) Рецепторы 2-5-гидрокситриптамина 2A (5HT2A) активируются серотонином, высвобожденным из плотных гранул тромбоцитов; (III) Рецепторы тромбоксана стимулируются тромбоксаном А2 (TXA2), который синтезируется по тромбоцитарному циклооксигеназа 1 (COX1) - зависимому сигнальному пути.
Современная антиагрегантная терапия направлена на: подавление синтеза TXA2, что снижает избыточную активацию (аспирин и triflusal); противодействие функции пуринергических рецепторов тромбоцитов P2Y (клопидогрел, прасугрел и тикагрелор); подавление активности αIIbβ3 интегрина (ГП рецептор IIb/IIIa) тромбоцитов, что сдерживает агрегацию тромбоцитов (абциксимаб, ламифибана и тирофибан, эптифибатид); ингибирование фосфодиэстеразы, что увеличивает внутренний уровень cAMP/cGMP (дипиридамол, цилостазол); ингибирование PAR-1 рецепторов тромбоцитов, что блокирует активацию тромбином (voraxapar) [Metharom P, Berndt MC, Baker RI, et al. Current state and novel approaches of antiplatelet therapy. Arterioscler Thromb Vasc Biol 2015;35:1327-38]. Антитромботическая терапия, направленная на основные пути активации тромбоцитов, включающие синтез TxA2, АДФ-опосредованную сигнализацию, интегрин aIIbβ3 (GPIIb-IIIa) сигнализацию и другие механизмы, признана основой в лечении сердечно-сосудистых заболеваний [Fanaroff A, Rao S. Antiplatelet therapy in PCI // Interv Cardiol Clin. 2016; 5(2): 221-237].
Однако современные антитромбоцитарные лекарственные средства для профилактики и лечения инфаркта миокарда, ишемического инсульта и для лечения острого коронарного синдрома обладают рядом побочных эффектов [Capodanno D, Ferreiro JL, Angiolillo DJ. Antiplatelet therapy: new pharmacological agents and changing paradigms.//J Thromb Haemost. 2013; 111(Suppl):316-329], [Levi M, Eerenberg E, Kamphuisen PW. Bleeding risk and reversal strategies for old and new anticoagulants and antiplatelet agents//J Thromb Haemost. 2011; 9:1705-1712], [Tantry US, Gesheff M, Liu F, Bliden KP, Gurbel PA. Resistance to antiplatelet drugs: what progress has been made?//Expert Opin Pharmacother. 2014; 15:2553-2564], [Hochtl T, Pachinger L, Unger G, Geppert A, Wojta J, Harenberg J, Huber K. Antiplatelet drug induced isolated profound thrombocytopenia in interventional cardiology: a review based on individual case reports//J Thromb Thrombolysis. 2007; 24:59-64]. А к аспирину и клопидогрелю наблюдаются случаи резистентности [Le Quellec S., Bordet J, Neqrier C, Darqaud Y. Comparison of current platelet functional tests for the assessment of aspirin and clopidogrel response. A review of the literature//Thromb. Haemost. 2016; 116(4):638-50]. Эти обстоятельства ставят перед исследователями актуальную задачу поиска новых и безопасных средств, предназначенных для лечения и предупреждения тромботических поражений сосудов.
Некоторые полисахариды (их производные) как полусинтетические (микробного, растительного, животного происхождения), так и синтетические (в основном олигосахариды) ингибируют коагуляцию плазмы человека или агрегацию тромбоцитов. Как правило это полисахариды ионогенного, прежде всего анионного типа. Наиболее исследованными в этом отношении являются сульфатированные полисахариды. Вместе с тем существенный интерес в качестве антиагрегантных средств представляют аминосодержащие биополимеры. Например, известны данные об антитромоцитарной активности производных хитозана [Skorik Y. A. Kritchenkov A. S., Moskalenko Y. E., Golyshev A. A., Raik S. V., Whaley A. K., Vasina L. V., Sonin D. L. Synthesis of N-succinyl- and N-glutaryl-chitosan derivatives and their antioxidant, antiplatelet, and anticoagulant activity//Carbohydrate Polymers 2017, 166; 166-172]. Другим привлекательным полисахаридом для использования в этих целях является целлюлоза. Многие аминосодержащие производные целлюлозы водорастворимы, являясь типичными катионными полимерами, проявляют различные виды биологической активности, сохраняя вместе с тем положительные качества исходного полисахарида - линейную структуру, низкую токсичность, способность к безопасному выведению из организма.
Синтез на основе целлюлозы производных, содержащих аминогруппы может быть осуществлен несколькими путями. Использование для этой цели реакций нуклеофильного замещения открывает возможность синтезировать дезоксипроизводные целлюлозы. Промежуточным соединениями в этом случае обычно являются галогендезоксипроизводные целлюлозы [Takano T., Ishikawa J., Kamitakahara H., Nakatsubo F. The application of microwave heating to the synthesis of 6-amino-6-deoxycellulose//Carbohydrate Research 2007, 342, 2456-2460], [Carter Fox S., Edgar K. J. Staudinger Reduction Chemistry of Cellulose: Synthesis of Selectively O-Acylated 6-Amino-6-deoxy-cellulose//Biomacromolecules 2012, 13, 992-1001] или, что более практически целесообразно, эфиры арилсульфокислот, прежде всего п-толуолсульфокислоты (тозилаты целлюлозы).
Известно несколько способов синтеза тозилатов целлюлозы в водных средах или средах органических растворителей, с дальнейшим преобразованием аминов дезоксиполисахаридов. Описано получение аминометилдезоксицеллюлозы [Knaus S., Mais U., Binder W. H. Synthesis, characterization and properties of methylaminocellulose//Cellulose 2003. 10: 139-150], 6-аминоэтил-6-дезокси целлюлозы [Schmidt S., Liebert T., Heinze T. Synthesis of soluble cellulose tosylates in an eco-friendly medium//Green Chem., 2014,16, 1941-1946], 6-фенилэтиламино-6-дезокси производных целлюлозы [Heinze Th., Koschella A., Magdaleno-Maiza L., Ulrich A. S. Nucleophilic displacement reactions on tosyl cellulose by chiral amines//Polymer Bulletin 2001, 46, 7-13].
В настоящем изобретении представлено водорастворимое аминобутилдезоксипроизводное целлюлозы в виде гидрохлорида (АБЦ-HCl) с общей структурой III (см. рисунок) со свойством ингибирования агрегации тромбоцитов человека, индуцированной АДФ или коллагеном и способ его получения.
Известен сульфатированный олигосахарид (маннопентаозофосфат - SO4) с антитромботической активностью. Этот сахарид Cowden W. и Parish C. выделяли из дрожжей Pichia holstii [Patent US 6271215 B1 Aug.7 2001; Int. Cl. A 61K 31/715; Sulfated oligosaccharides having anticoagulant/antithrombotic activity//Inventor W.B. Cowden, C.R. Parish//Appl. No.: US 09/380,899 Mar 11 1997; Assignee The Australian National University]. С помощью описанного в патенте метода авторы получили сульфатированный олигосахарид (общая формула олигосахарида может быть представлена как: R1-(Rx)n-R2, где R1, R2 и каждая Rx единица может быть представлена одним и тем же моносахаридным звеном либо различными, а соседние моносахаридные звенья связанными 1→2, 1→3, 1→4 и/или 1→6 гликозидными связями и число «n» может составлять от 1 до 6). В концентрациях 21, 210, 2100 мкг/мл маннопентаозофосфат - SO4 снижал АДФ-индуцированную агрегацию тромбоцитов человека до 74, 72 и 56 (контроль - 81 отн. скорость агрегации), соответственно, а коллаген-индуцированную - до 97, 86, 79 (контроль - 114 отн. скорость агрегации), соответственно.
Недостаток данного изобретения обусловлен невысокой величиной ингибиторной активности в отношении АДФ- и коллаген - индуцированной агрегации тромбоцитов (снижалась только в 1.5 раза). Кроме этого, структура олигосахарида, отвечающая общей формуле, может быть представлена огромным набором олигосахаридов и разобраться какая из них ответственна за проявляемый биологический эффект является сложной задачей.
Наиболее близким к изобретению по структуре соединения (АБЦ-HCl) и способу его получения является аминометилдезоксицеллюлоза и ее синтез, описанный в работе [Knaus S., Mais U., Binder W.H. Synthesis, characterization and properties of methylaminocellulose // Cellulose 2003. 10: 139-150], по которому синтезируют промежуточный арилсульфоэфир этерификацией целлюлозы в растворе N,N-диметилацетамид (ДМАА)/LiCl в присутствии триэтиламина при температуре 8°С в течение 24 ч, с последующим выделением и очисткой тозилата целлюлозы. Далее тозилат целлюлозы обрабатывают водным раствором метиламина в ДМАА при температуре 60°С в течении 48 ч. Полученную в результате реакции нуклеофильного замещения 6-дезокси-6-аминометилцеллюлозу выделяют из реакционной среды осаждением в изопропиловом спирте, после чего промывают водой и сушат.
Недостатком данного способа является то, что синтез 6-аминометил-6-дезоксицеллюлозы требует больших избытков алкиламина. Использованный метиламин является соединением с низкой (-6°С) температурой кипения, что предполагает специальные условия реакции. В прототипе не описана водорастворимость получаемого дезоксиаминоалкилпроизводного целлюлозы и его антиагрегантные свойства.
Технический результат состоит в том, что предлагаемое в нашей заявке производное целлюлозы (АБЦ-HCl) - водорастворимо в виде фармакологически приемлемой солевой формы гидрохлорида, включает в свою структуру бутильный радикал, связанный с аминогруппой, обладает поликатионной природой, проявляет более эффективные антиагрегантные свойства. Для достижения одинакового с сульфатом маннопентаозофосфата эффекта предлагаемого производного целлюлозы требуется в 40 раз меньше.
Синтез АБЦ-HCl по сравнению с прототипом - 6-аминометил-6-дезоксицеллюлозой - менее затратен и вдвое менее продолжителен, токсичные растворители на последних стадиях синтеза и очистки заменены на безопасные растворители - диметилсульфоксид (ДМСО) и воду, исключено использование легкокипящего амина, такого как метиламин, что упрощает аппаратурное оформление.
Полученное соединение расширяет ассортимента антитромбоцитарных средств, имеет свойства ингибитора АДФ индуцированной или коллаген-индуцированной агрегации тромбоцитов. Выявлена высокая способность АБЦ-HCl ингибировать АДФ индуцированную агрегацию тромбоцитов человека в диапазоне плазменных концентраций от 0.0198 мг/мл до 1.9800 мг/мл и коллаген индуцированную агрегацию тромбоцитов человека в диапазоне плазменных концентраций от 0.02 мг/мл до 2 мг/мл.
Предложено антитромбоцитарное средство на основе водорастворимого гидрохлорида аминобутилдезокси целлюлозы со степенью замещения (содержание аминогрупп) - 0.9±0.1; молекулярной массой 50⋅103 в качестве средства для профилактики тромбозов.
Технический результат достигается тем, что получено аминобутилдезоксипроизводное целлюлозы в виде гидрохлорида с общей структурной формулой
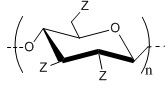
где Z=OH (степень замещения 2.1±0.1) или (C4H9)NH⋅HCl (степень замещения 0.9±0.1) или CH3(C6H4)SO3 (степень замещения <0.1).
Технический результат достигается тем, что способ получения аминобутилдезоксипроизводного целлюлозы в виде гидрохлорида, включающий синтез целевого продукта двухстадийным процессом, согласно изобретению, на первой стадии осуществляют синтез промежуточного соединения - тозилата целлюлозы этерификацией целлюлозы п-толуолсульфохлоридом в растворе ДМАА/LiCl, а на второй стадии проводят обработку тозилата целлюлозы аминобутилом при температуре 80°С в ДМСО и выделение производного целлюлозы, при этом выделение производного целлюлозы осуществляют путем получения гидрохлорида аминобутилдезоксипроизводного целлюлозы нейтрализацией синтезированного поликатиона раствором соляной кислоты, его очисткой и высушиванием.
Технический результат достигается тем, что применение аминобутилдезоксипроизводного целлюлозы в виде гидрохлорида в качестве средства обладающего ингибиторной активностью по отношению к агрегации тромбоцитов.
Способ осуществляется следующим образом.
Синтез проиллюстрирован схемой, включающую исходную, промежуточную и активную структуры в виде усредненных элементарных звеньев полимера, а также основные условия синтеза.
Схема. Способ синтеза АБЦ-HCl (схема). В скобах рядом с расшифровкой буквы, обозначающей данный радикал (R, Z) указана степень замещения в статистическом звене.
I: целлюлоза, где n=200±20.
II: тозилат целлюлозы, где R=H (2.05±0.05) или CH3(C6H4)SO2(0.95±0.05);
III: АБЦ-HCl, где Z=OH (2.1±0.1) или (C4H9)NH⋅HCl (0.9±0.1) или CH3(C6H4)SO3 (<0.1).
Условия: i-ДМАА/LiCl, CH3(C6H4)SO2Cl, N(C2H5)3, 6°C, 24 ч; ii-(C4H9)NH2, ДМСО, 80°C, 21 ч.
На первой стадии осуществляется синтез промежуточного соединения - тозилата целлюлозы (структура II). Для этого целлюлозу (I, степень полимеризации 200±20) растворяют в смеси ДМАА/LiCl, этерифицируют п-толуолсульфохлоридом в присутствии триэтиламина. Процесс этерификации осуществляют при мольном соотношении ангидроглюкозная единица целлюлозы/п-толуолсульфохлорид 1:1.8. Продолжительность этерификации 24 ч при температуре 6°С. Тозилат целлюлозы выделяют из реакционной смеси осаждением в изопропиловом спирте, затем промывают и сушат.
На второй стадии осуществляют обработку тозилата целлюлозы бутиламином. Для этого тозилат целлюлозы растворяют в ДМСО, прибавляют бутиламин до 4-х кратного мольного избытка по отношению к сульфоэфирным группировкам тозилата целлюлозы и выдерживают полученный раствор при температуре 80°С в атмосфере инертного газа при перемешивании в течение 21 ч. Полимер выделяют из реакционной смеси осаждением в изопропиловом спирте, последовательно промывают изопропиловым спиртом, затем водой, после чего растворяют в воде, подкисляемой прибавлением порциями 0.5 М раствора соляной кислоты, так, что бы после полного растворения производного целлюлозы рН раствора составлял 3.5±0.2. Полученный водный раствор АБЦ-HCl фильтруют, дополнительно очищают методом диализа и лиофилизируют. АБЦ-HCl представляет собой белый, хорошо растворимый в воде порошок. Степень замещения (аминобутильные группы) 0.9±0.1, средняя молекулярная масса 50⋅103. Содержание серы не более 0.7 мас %. Контроль структуры и чистоты промежуточных и целевых продуктов осуществляют методами элементного анализа, гель-хроматографии, ИК и ЯМР-спектроскопии.
Эксперименты по исследованию антиагрегационной способности соединений были выполнены с использованием венозной крови здоровых доноров, которую получали путем пункции кубитальной вены и стабилизировали 3.8%-ным раствором цитрата натрия в соотношении 9:1. Для приготовления богатой тромбоцитами плазмы кровь центрифугировали в течение 10 минут при 1000 об./мин, после чего верхний слой плазмы переносили в другую пробирку, а остаток повторно центрифугировали в течение 20 минут при 3000 об./мин для получения плазмы, бедной тромбоцитами. Агрегацию тромбоцитов исследовали на агрегометре фирмы Chrono-Log (Pensilvania, USA, Model 500) по методу G.Born [Born G.V. Aggregation of blood platelets by adernosine diphosphate and its reversal//Nature. 1962. V.194. №5. P. 927-929]. С этой целью в кювету прибора помещали 300 мкл богатой тромбоцитами плазмы. В качестве индуктора агрегации использовали раствор динатриевой соли аденозин-5'-дифосфата (АДФ; «Sigma-Aldrich»). Богатую тромбоцитами плазму человека инкубировали с исследуемым соединением или с буфером (0.05 М трис-HCl буфером, рН 7.4, содержащим 0.175 М NaCl), затем вносили АДФ (конечная концентрация 10-5 М) или коллаген (конечная концентрация 0.1 и 0.2 мг/мл). Агрегацию тромбоцитов определяли для АДФ в течение 5 мин, для коллагена за 15 мин. Оптическим контролем служил такой же объем плазмы, не содержащей тромбоцитов (пропускание света бедной тромбоцитами плазмы принимали за 100%). О степени агрегации судили по максимальной величине пропускания света в кювете с богатой тромбоцитами плазмой после окончания реакции агрегации тромбоцитов. На агрегатограмме (кривой агрегации тромбоцитов) определяли максимальную амплитуду кривой агрегации (в %) и угол наклона кривой агрегации (отн. ед. / мин.), отражающий скорость развития агрегации тромбоцитов. Статистический анализ полученных данных проводили в соответствии с общепринятыми методами вариационной статистики с использованием критерия Манна - Уитни и программы Биостатистика.
Изобретение поясняется следующими примерами:
Пример 1. Синтез аминосодержащего производного целлюлозы (АБЦ-HCl).
На первой стадии синтезировали тозилат целлюлозы. Для этого сухую порошковую целлюлозу массой 5.0 г (30.9 ммоль) растворяли в смеси состоящей из 200 мл ДМАА и 20.0 г LiCl. После получения гомогенного раствора его остужали до температуры 6°С, прибавляли к нему при перемешивании 10.6 г (55.6 ммоль) п-толуолсульфохлорида и 20.0 мл триэтиламина. Полученную реакционную смесь при этой температуре оставляли на 24 ч при перемешивании в атмосфере инертного газа. Эфир целлюлозы выделяли из реакционной смеси осаждением в изо-пропиловый спирт, затем промывали и сушили в вакууме.
Получено 9.4 г (96%) светло-желтого порошка. Содержание серы 9.89±0.03%, что соответствует степени замещения 0.95±0.05 (тозильные группы).
ИК (KBr, см−1): 3508 (OH), 2887 (CH2), 1597 (ν Ar), 1363 (νас.SO2), 1186 (νсSO2), 837 (ν SO-C).
ЯМР13C (75 МГц, DMSO-d6, δ, м.д.): 145.9, 132.7, 130.6, 128.5 (C ароматич.), 102.8-101.8 (C1), 78.6 (С4), 75.0 (С5), 73.5-73.4 (С2, C3), 68.7 (C6 тозил), 21.6 (CH3 ароматич.). С1-С6 углеродные атомы ангидроглюкозной единицы. По данным ЯМР этерификации подвергаются в основном гидроксильные группы при С6 атоме элементарного звена: сигнал незамещенного С6 атома ангидроглюкозной единицы отсутствует.
На второй стадии осуществляли реакцию нуклеофильного замещения тозилатных групп.Для этого обрабатывали полученный на предыдущей стадии тозилат целлюлозы н-бутиламином. Реакцию проводили следующим образом: 5.0 г (15.8 ммоль) тозилата целлюлозы растворяли в 80 мл ДМСО, прибавляли 4.6 г (63.2 ммоль) н-бутиламина и выдерживали полученный раствор при температуре 80°С в атмосфере инертного газа при перемешивании в течение 21 ч. Целевой аминодезоксиполисахарид выделяли из реакционной смеси осаждением в изо-пропиловый спирт, последовательно промывали изопропиловым спиртом, затем водой, после чего растворяли в воде, подкисляемой прибавлением 0.5 М раствора соляной кислоты, так, что бы после полного растворения производного целлюлозы рН раствора составлял 3.5±0.1. Полученный водный раствор АБЦ-HCl фильтровали, дополнительно очищали методом диализа (мембраны CtlluSep 4.5 кДа) и лиофилизировали.
Получали 3.4 г (85%) АБЦ-HCl в виде белого, хорошо растворимого в воде порошка. Элементный анализ: C 55.24±0.03, H 8.77±0.03, N 5.88±0.04, S 0.65±0.02, что соответствует степени замещения 0.90±0.1 (аминобутильные группы) и 0.03±0.01 для остаточных тозильных групп.
ИК-спектр (KBr, νmax, см-1): 2954, (νR2NH), 1597 (δNH), 816 (S-O), 1175 (SO2), сл.770 (δС-Н Ar).
ЯМР13С (75 МГц, DMSO-d6, δ, м.д.): 14.15 (-NCH2CH2CH2CH3), 19.94 (-NCH2CH2CH2CH3), 25.4 (-NCH2CH2CH2CH3), 54.0 (-NCH2CH2CH2CH3), 60.6 (C6), 69.3 (C4), 71.04 (C5), 73.8 (C2), 74.1-75.4 (C3), 103.4 (C1), 128.6 (ароматич.). С1-С6 углеродные атомы ангидроглюкозной единицы.
Пример 2. Оценка антиагрегантной активности при индукции АДФ.
Эксперименты проводили следующим образом: в кювету, содержащую 330 мкл богатой тромбоцитами плазмы, добавляли 33 мкл раствора (растворитель - 0.05 М трис-HCl буфер, рН 7.4, содержащий 0.175 М NaCl) исследуемого соединения, конечная концентрация 0.00198-1.98000 мг/мл) и инкубировали полученную смесь в течение 5 мин при температуре 37°С. Процесс агрегации тромбоцитов индуцировали, добавляя 33 мкл раствора АДФ (Sigma) в конечной концентрации 10-5 М (проведение опыта в последовательности “образец+плазма>инкубация+АДФ). В контрольных опытах богатую тромбоцитами плазму предварительно инкубировали с растворителем для исследуемого образца (0.05 М трис-HCl буфером, рН 7.4, содержащим 0.175 М NaCl) и после этого вносили индуктор агрегации тромбоцитов (проведение опыта в последовательности «буфер+плазма>инкубация+АДФ»), либо предварительно инкубировали богатую тромбоцитами плазму с раствором образца, а затем, вместо АДФ добавляли буфер (проведение опыта в последовательности «образец+плазма>инкубация+буфер»).
Самостоятельно АДЦ в исследованных концентрациях не способствовал агрегации тромбоцитов человека (табл.1, примечание пункт 1). С увеличением концентрации АДЦ в богатой тромбоцитами плазме человека с 0.00198 до 1.98 мг/мл снижалась АДФ-индуцированная агрегация тромбоцитов (табл. 1). Достоверность различий с показаниями в контроле мы наблюдали, начиная с концентрации 0.01980 мг/мл. И в концентрации 0.19800 мг/мл падение агрегации тромбоцитов было в 5.6 раз ниже, чем в контроле. Для достижения 50% ингибирования агрегации тромбоцитов потребовалось 0.1 мг/мл АДЦ.
Достоверное снижение, в сравнении с контролем, при увеличении концентрации АДЦ наблюдали и в скорости развития процесса (табл.2) и в площади под кривой агрегации тромбоцитов (табл.3).
Таблица 1. Влияние АДЦ на АДФ-индуцированную агрегацию тромбоцитов человека (%)
Примечание: К – контроль, буфер+плазма+АДФ; 1 - АДЦ+плазма+буфер; 2 - АДЦ+плазма+АДФ; * - P<0.05, достоверность различий с показаниями в контроле.
Таблица 2. Влияние АДЦ на наклон кривой АДФ-индуцированной агрегации тромбоцитов человека (отн. ед./мин)
Примечание: К - контроль, буфер+плазма+АДФ; 1 - АДЦ+плазма+буфер; 2 - АДЦ+плазма+АДФ; * - P<0.05, достоверность различий с показаниями в контроле.
Таблица 3. Влияние АДЦ на площадь под кривой АДФ-индуцированной агрегации тромбоцитов человека (отн. ед./мин)
Примечание: К - контроль, буфер+плазма+АДФ; 1 - АДЦ+плазма+буфер; 2 - АДЦ+плазма+АДФ; * - P<0.05, достоверность различий с показаниями в контроле.
Пример 3. Оценка антиагрегантной активности при индукции коллагеном.
Процесс агрегации тромбоцитов индуцировали, добавляя 33 мкл раствора коллагена (НПО “Ренам”) в конечных концентрациях 0.1 и 0.2 мг/мл (проведение опыта в последовательности “образец+плазма>инкубация+коллаген). В контрольных опытах богатую тромбоцитами плазму предварительно инкубировали с растворителем для исследуемого образца (0.05 М трис-HCl буфером, рН 7.4, содержащим 0.175 М NaCl) и после этого вносили индуктор агрегации тромбоцитов (проведение опыта в последовательности «буфер+плазма>инкубация+коллаген»), либо предварительно инкубировали богатую тромбоцитами плазму с раствором образца, а затем, вместо коллагена добавляли буфер (проведение опыта в последовательности «образец+плазма>инкубация+буфер»).
Самостоятельно АДЦ в исследованных концентрациях не способствовал коллаген индуцированной агрегации тромбоцитов человека (табл.4, концентрация коллагена 0 мг/мл). С увеличением концентрации АДЦ в богатой тромбоцитами плазме человека с 0.002 до 2 мг/мл индуцированная коллагеном агрегация тромбоцитов снижалась (табл.4). Достоверность различий с показаниями в контроле наблюдали, начиная с концентрации 0.02 мг/мл. Для достижения 50% ингибирования агрегации тромбоцитов индуцированной коллагеном в концентрациях 0.1 и 0.2 мг/мл, потребовалось 0.066 и 0.1 мг/мл АДЦ, соответственно.
Таблица 4. Влияние АДЦ на коллаген-индуцированную агрегацию тромбоцитов человека (%)
Примечание: К - контроль, буфер; Lag - время до начала агрегации тромбоцитов, мин;
* - P<0.05, достоверность различий с показаниями в контроле; «н.о.» - не определяли
Реферат
Изобретение относится к области химико-фармацевтической промышленности, а именно касается создания на основе целлюлозы аминобутилдезоксисодержащего производного в форме гидрохлорида, к способу его получения и применения в качестве антиагрегантного средства, обладающего высокой ингибиторной активностью по отношению к агрегации тромбоцитов человека. Аминобутилдезоксипроизводное целлюлозы в виде гидрохлорида с общей структурной формулой,где Z= OH (степень замещения 2,1±0,1) или (CH)NH·HCl (степень замещения 0,9±0,1) или CH(CH)SO(степень замещения <0,1); n – количество повторяющихся звеньев равное 200±20. Способ получения аминобутилдезоксипроизводного целлюлозы в виде гидрохлорида включает синтез целевого продукта двухстадийным процессом, при этом на первой стадии осуществляют синтез промежуточного соединения – тозилата целлюлозы этерификацией целлюлозы п-толуолсульфохлоридом в растворе ДМАА/LiCl, а на второй стадии проводят обработку тозилата целлюлозы аминобутилом при температуре 80°С в ДМСО и выделение производного целлюлозы, при этом выделение производного целлюлозы осуществляют путем получения гидрохлорида аминобутилдезоксипроизводного целлюлозы нейтрализацией синтезированного поликатиона раствором соляной кислоты, его очисткой и высушиванием. 3 н.п. ф-лы, 4 табл.
Формула
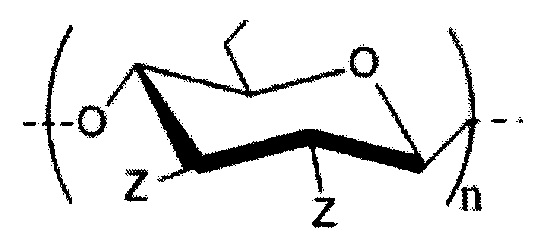

Комментарии