Композиция системы доставки на основе конъюгата для доставки полинуклеотида рнк-интерференции в клетку печени и способ ее получения - RU2623160C9
Код документа: RU2623160C9
Чертежи































Описание
УРОВЕНЬ ТЕХНИКИ
Доставка полинуклеотидов и других по существу не проникающих через клеточные мембраны соединений в живую клетку в значительной степени ограничена сложной системой клеточных мембран. Лекарственные средства, используемые в антисмысловой, РНКи и генной терапии, представляют собой относительно большие гидрофильные полимеры и часто несут сильный отрицательный заряд. Обе указанные физические характеристики сильно ограничивают их непосредственную диффузию через клеточную мембрану. По этой причине основным ограничением для доставки полинуклеотида является доставка указанного полинуклеотида через клеточную мембрану в цитоплазму или ядро клетки.
Один способ, который используется для in vivo доставки малой нуклеиновой кислоты, заключатся в присоединении нуклеиновой кислоты либо к малой нацеливающей молекуле, либо к липиду или стеролу. Несмотря на то, что при использовании указанных конъюгатов наблюдается некоторая доставка и активность, необходимая для этих методов очень высокая доза нуклеиновой кислоты делает их непрактичными.
Также было разработано множество реагентов трансфекции, которые обеспечивали достаточно эффективную доставку полинуклеотидов в клетки in vitro. Однако доставка полинуклеотидов in vivo с использованием указанных реагентов трансфекции является сложной и признана неэффективной из-за токсичности in vivo, нежелательных взаимодействий с компонентами сыворотки или слабым направленным действием. Реагенты трансфекции, которые хорошо работают in vitro, катионные полимеры и липиды, как правило, образуют большие катионные электростатические частицы и дестабилизируют клеточные мембраны. Положительный заряд реагентов трансфекции in vitro облегчает связывание с нуклеиновой кислотой через заряд-зарядовые (электростатические) взаимодействия, таким образом, приводя к образованию комплекса нуклеиновая кислота/реагент трансфекции. Положительный заряд также является полезным для неспецифического связывания носителя с клеткой и для слияния с мембраной, ее дестабилизации или разрушения. Дестабилизация мембран облегчает доставку по существу не проникающего через клеточные мембраны полинуклеотида через клеточную мембрану. Хотя указанные свойства облегчают перенос нуклеиновой кислоты in vitro, они обуславливают токсичность и обеспечивают неэффективное направленное действие in vivo. Катионный заряд приводит к взаимодействию с компонентами сыворотки, которое вызывает дестабилизацию взаимодействия полинуклеотид-реагент трансфекции, плохую биодоступность и слабое нацеливание. Мембранная активность реагентов трансфекции, которая может являться эффективной in vitro, часто вызывает токсичность in vivo.
Для доставки in vivo носитель (нуклеиновая кислота и связанный агент доставки) должен быть маленьким, менее 100 нм в диаметре, предпочтительно, менее 50 нм. Еще более маленькие комплексы, менее 20 нм или менее 10 нм, были бы более применимыми. Носители для доставки размером больше 100 нм имеют очень слабый доступ к клеткам in vivo, отличным от клеток кровеносных сосудов. Комплексы, образованные за счет электростатических взаимодействий, склонны агрегировать или распадаться под воздействием физиологических концентраций солей или компонентов сыворотки. Кроме того, катионный заряд на носителях для доставки in vivo приводит к нежелательным взаимодействиям с компонентами сыворотки и, таким образом, слабой биодоступности. Интересно, что сильный отрицательный заряд также может ингибировать направленную доставку in vivo, препятствуя взаимодействию, необходимому для нацеливания, т.е. связыванию направленных лигандов с клеточными рецепторами. Таким образом, для распределения и направленного действия in vivo являются желаемыми почти нейтральные носители. В отсутствие тонкой регуляции разрушающая или дестабилизирующая мембраны активность вызывает токсичность при использовании in vivo. Баланс между токсичностью носителя и доставкой нуклеиновой кислоты легче достигается in vitro, чем in vivo.
В публикации патента США 20040162260 Розема и др. (Rozema et al.) описали способ обратимой регуляции разрушающей мембрану активности мембраноактивного полиамина. Мембраноактивный полиамин обеспечивал средства разрушения клеточных мембран. рН-зависимая обратимая регуляция обеспечивала средство ограничения активности эндосом клеток-мишеней, ограничивая таким образом токсичность. Указанный способ основан на модификации 2-пропионов-3-метилмалеиновым ангидридом аминов в полиамине.

Указанная модификация приводила к превращению поликатиона в полианион путем превращения первичных аминов в пары карбоксильных групп (β-карбоксил и γ-карбоксил) и обратимому ингибированию мембранной активности полиамина. Розема и др. (Rozema et al., Bioconjugate Chem. 2003, 14, 51-57) показали, что β-карбоксил не обладал полностью явным отрицательным зарядом и сам по себе не был способен ингибировать мембранную активность. Было показано, что добавление γ-карбоксильной группы являлось необходимым для эффективного подавления мембранной активности. Для обеспечения совместной доставки нуклеиновой кислоты и носителя для доставки указанную нуклеиновую кислоту ковалентно связывали с полимером для доставки. Авторы продемонстрировали доставку полинуклеотидов в клетки in vitro с использованием описанной системы доставки на основе биологически лабильного конъюгата. Однако из-за того, что носитель обладал высоким отрицательным зарядом, поскольку и нуклеиновая кислота, и модифицированный полимер имели высокую плотность отрицательного заряда, указанная система не была эффективной для доставки in vivo. Отрицательный заряд, вероятно, подавлял клеточно-специфичное нацеливание и усиливал неспецифический захват ретикулоэндотелиальной системой (RES).
В публикации патента США 20080152661, Розема и др. (Rozema et al.) улучшили способ, описанный в опубликованной патенте США 20040162260, путем устранения высокой плотности отрицательного заряда модифицированного мембраноактивного полимера. Путем использования нейтральной гидрофильной нацеливающей группы (галактозной) и стерической стабилизирующей группы (PEG, ПЭГ) вместо γ-карбоксила 2-пропионо-3-метилмалеинового ангидрида Розема и др. (Rozema et al.) обеспечили сохранение общей растворимости в воде и обратимое подавление мембранной активности с достижением эффективного нацеливания на гепатоциты in vivo. Как и в предыдущих случаях, полинуклеотид был ковалентно связан с полимером трансфекции. Ковалентное присоединение полинуклеотида к полимеру трансфекции поддерживали для обеспечения гарантированной совместной доставки полинуклеотида с полимером трансфекции в клетки-мишени во время введения in vivo путем предотвращения отсоединения полинуклеотида от полимера трансфекции. Совместная доставка полинуклеотида и полимера трансфекции была необходима, поскольку указанный полимер трансфекции обеспечивал транспорт полинуклеотида через клеточную мембрану, либо снаружи клетки внутрь, либо из эндоцитозного компартмента в цитоплазму клетки. В публикации патента США 20080152661 была описана высокоэффективная доставка полинуклеотидов, в частности, олигонуклеотидов РНКи, в клетки печени in vivo с использованием указанного нового усовершенствованного физиологически чувствительного поликонъюгата.
Однако ковалентное присоединение нуклеиновой кислоты к полиамину имело неотъемлемые ограничения. Модификация полимеров для трансфекции для присоединения как нуклеиновой кислоты, так и маскирующих агентов, осложнялась зарядовыми взаимодействиями. Присоединение отрицательно заряженной нуклеиновой кислоты к положительно заряженному полимеру неизбежно приводит к агрегации, ограничивая, таким образом, концентрацию смеси. Агрегацию можно было бы преодолеть с использованием избытка поликатиона или полианиона. Однако указанный раствор ограничивает отношения, на основе которых могут быть приготовлены нуклеиновая кислота и полимер. Кроме того, присоединение отрицательно заряженной нуклеиновой кислоты к не модифицированному катионному полимеру вызывало конденсацию и агрегацию комплекса и подавляло модификацию полимера. Модификация полимера с образованием отрицательного полимера нарушала присоединение нуклеиновой кислоты.
Согласно предварительной заявке на патент США 61/307,490, Розема и др. (Rozema et al.) также усовершенствовали технологию, описанную в публикации патента США 20080152661. В предварительной заявке на патент США 61/307,490 (Rozema et al.) показано, что при тщательном выборе нацеливающих молекул и независимом присоединении подходящих нацеливающих молекул независимо к миРНК и к полимеру доставки, можно не соединять миРНК и полимер доставки, сохраняя при этом эффективное нацеливание обоих элементов на клетки in vivo и обеспечивая эффективную функциональную направленную доставку миРНК. Полимеры доставки, используемые в публикации патента США 20080152661 и предварительной заявке на патент США 61/307,490, представляли собой относительно большие синтетические полимеры, поли(винилэфиры) и поли(акрилаты). Более крупные полимеры обеспечивали возможность модификации нацеливающими лигандами для специфического связывания с клетками и молекулами PEG для повышенного экранирования. Более крупные полимеры были необходимы для эффективной доставки, возможно, благодаря повышенной мембранной активности и повышенной защите нуклеиновой кислоты в клеточных эндосомах. Более крупные поликатионы сильнее взаимодействуют как с мембранами, так и с анионными РНК.
Авторы настоящего изобретения разработали улучшенную систему доставки миРНК с использованием намного более маленького пептида доставки. Улучшенная система обеспечивает эффективную доставку миРНК с пониженной токсичностью и, соответственно более широким терапевтическим диапазоном.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно предпочтительному варианту реализации, изобретение относится к композиции для доставки полинуклеотида интерферирующей РНК в клетку печени in vivo, содержащей: а) направленный на рецептор асиалогликопротеина (ASGPr) обратимо маскированный пептид мелитина (пептид доставки) и b) полинуклеотид интерферирующей РНК, конъюгированный с гидрофобной группой, содержащей по меньшей мере 20 атомов углерода (конъюгат РНК). Пептид доставки и конъюгат миРНК синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полинуклеотид интерферирующей РНК не конъюгирован с пептидом доставки.
Согласно другому предпочтительному варианту реализации, изобретение относится к композиции для доставки полинуклеотида интерферирующей РНК в клетку печени in vivo, содержащей: а) нацеленный на ASGPr обратимо маскированный пептид мелитина (пептид доставки) и b) полинуклеотид интерферирующей РНК, конъюгированный с галактозным кластером (конъюгат РНК). Пептид доставки и конъюгат миРНК синтезируются раздельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полинуклеотид интерферирующей РНК не конъюгирован с полимером.
Согласно предпочтительному варианту реализации изобретения нацеленный на ASGPr обратимо маскированный пептид мелитина представляет собой пептид мелитина, обратимо модифицированный путем осуществления реакции первичных аминов указанного пептида с маскирующими агентами, содержащими лиганд ASGPr. Амин является обратимо модифицированным, если отщепление модифицирующей группы приводит к восстановлению указанного амина. Обратимая модификация пептида мелитина маскирующими агентами, описанными в настоящей заявке, приводит к обратимому ингибированию мембранной активности указанного пептида мелитина. В маскированном состоянии обратимо маскированный пептид мелитина не проявляет разрушающей мембрану активности. Для ингибирования мембранной активности и обеспечения нацеливания на клетку, т.е. образования обратимо маскированного пептида мелитина, требуется обратимая модификация более 80% или более 90% аминов на пептиде мелитина.
Предпочтительный маскирующий агент, содержащий лиганд ASGPr, имеет нейтральный заряд и содержит галактозамин или производное галактозамина, содержащее амино-реактивную группу дизамещенного малеинового ангидрида. Другой предпочтительный маскирующий агент, содержащий лиганд ASGPr, содержит галактозамин или производное галактозамина, содержащее поддающееся расщеплению пептидазой дипептид-n-амидобензильное амино-реактивное карбонатное производное. Реакция амино-реактивного карбоната с амином приводит к обратимой модификации амина с образованием амидобензилкарбаматной связи.
Согласно предпочтительному варианту реализации изобретения пептид мелитина включает мелитин пчелы Apis florea (маленькой или карликовой медоносной пчелы). Apis mellifera (западной или европейской или большой медоносной пчелы). Apis dorsata (гигантской медоносной пчелы), Apis cerana (азиатской медоносной пчелы) или его производные. Предпочтительный пептид мелитина содержит последовательность: Xaa1-Xaa2-Xaa3-Ala-Xaa5-Leu-Xaa7-Val-Leu-Xaa10-Xaa11-Xaa12-Leu-Pro-Xaa15-Leu-Xaa17-Xaa18-Trp-Xaa20-Xaa21-Хаа22-Хаа23-Хаа24-Хаа25-Хаа26, где:
Xaa1 представляет собой лейцин, D-лейцин, изолейцин, норлейцин, тирозин, триптофан, валин, аланин, диметилглицин, глицин, гистидин, фенилаланин или цистеин,
Хаа2 представляет собой изолейцин, лейцин, норлейцин или валин,
Хаа3 представляет собой глицин, лейцин или валин,
Хаа5 представляет собой изолейцин, лейцин, норлейцин или валин,
Хаа7 представляет собой лизин, серин, аспарагин, аланин, аргинин или гистидин,
Xaa10 представляет собой аланин, треонин или лейцин,
Xaa11 представляет собой треонин или цистеин,
Xaa12 представляет собой глицин, лейцин или триптофан,
Xaa15 представляет собой треонин или аланин,
Xaa17 представляет собой изолейцин, лейцин, норлейцин или валин,
Xaa18 представляет собой серин или цистеин,
Хаа20 представляет собой изолейцин, лейцин, норлейцин или валин,
Xaa21 представляет собой лизин или аланин,
Хаа22 представляет собой аспарагин или аргинин,
Хаа23 представляет собой лизин или аланин,
Хаа24 представляет собой аргинин или лизин,
Хаа25 представляет собой лизин, аланин или глутамин,
Хаа26 является необязательным и, в случае его наличия, представляет собой глутамин, цистеин, глутамин-NH2 или цистеин-NH2;
и по меньшей мере два из Xaa21, Хаа23 и Хаа25 представляют собой лизин.
Более предпочтительно, мелитин содержит последовательность: Хаа1-Хаа2-Хаа3-Ala-Хаа5-Leu-Xaa7-Val-Leu-Xaa10-Xaa11-Xaa12-Leu-Pro-Xaa15-Leu-Xaa17-Ser-Trp-Xaa20-Lys-Xaa22-Lys-Arg-Lys-Xaa26, где:
Xaa1 представляет собой лейцин, D-лейцин, норлейцин или тирозин,
Хаа2 представляет собой изолейцин, лейцин, норлейцин или валин,
Хаа3 представляет собой глицин, лейцин или валин,
Хаа5 представляет собой изолейцин, валин, лейцин или норлейцин,
Хаа7 представляет собой лизин, серии, аспарагин, аланин, аргинин или гистидин,
Xaa10 представляет собой аланин, треонин или лейцин,
Хаа11 представляет собой треонин или цистеин,
Xaa12 представляет собой глицин, лейцин или триптофан,
Xaa15 представляет собой треонин или аланин,
Xaa17 представляет собой изолейцин, лейцин или норлейцин,
Хаа20 представляет собой изолейцин, лейцин или норлейцин,
Хаа22 представляет собой аспарагин или аргинин, и
Хаа26 представляет собой глутамин или цистеин.
Наиболее предпочтительно, мелитин содержит последовательность: Xaa1-Xaa2-Gly-Ala-Xaa5-Leu-Lys-Val-Leu-Ala-Xaa11-Gly-Leu-Pro-Thr-Leu-Xaa17-Ser-Trp-Xaa20-Lys-Xaa22-Lys-Arg-Lys-Xaa26, где:
Xaa1, Хаа2, Хаа5, Xaa17 и Хаа20 независимо представляют собой изолейцин, лейцин или норлейцин,
Xaa11 представляет собой треонин или цистеин,
Хаа22 представляет собой аспарагин или аргинин, и
Хаа26 представляет собой глутамин или цистеин.
Предпочтительно маскирующий агент содержит нейтральный гидрофильный дизамещенный алкилмалеиновый ангидрид:

где R1 содержит нацеливающую на клетку группу. Предпочтительно алкильная группа представляет собой метальную или этильную группу. Предпочтительно нацеливающая группа содержит лиганд рецептора асиалогликопротеина. Пример замещенного алкилмалеинового ангидрида представляет собой производное 2-пропионо-3-алкилмалеинового ангидрида. Нейтральное гидрофильное производное 2-пропионо-3-алкилмалеинового ангидрида образовано в результате присоединения нейтральной гидрофильной группы к 2-пропионо-3-алкилмалеиновому ангидриду через γ-карбоксильную группу 2-пропионо-3-алкилмалеинового ангидрида:

где R1 содержит нейтральный лиганд ASGPr, и n=0 или 1. Согласно одному варианту реализации изобретения лиганд ASGPr связан с ангидридом через короткий PEG-линкер.
Предпочтительно маскирующий агент содержит гидрофильное подверженное расщеплению пептидазой (протеазой) дипептид-n-амидобензильное амино-реактивное карбонатное производное. В ферментативно расщепляемых линкерах согласно изобретению используется дипептид, связанный с активированной амидобензилом карбонатной группой. Лиганд ASGPr присоединен к амино-концу дипептида. Активированная амидобензилом карбонатная группа находится на карбокси-конце дипептида. Расщепляемые пептидазой линкеры, подходящие для применения согласно изобретению, имеют следующую структуру:

где R4 содержит лиганд ASGPr, и R3 содержит амино-реактивную карбонатную группу, и R1 и R2 представляют собой R-группы аминокислот. Предпочтительный активированный карбонат представляет собой пара-нитрофенол. Однако другие амино-реактивные карбонаты, известные в данной области техники, легко можно использовать вместо пара-нитрофенола. В результате реакции активированного карбоната с амином мелитина происходит связывание нацеливающего соединения, лиганда рецептора асиалогликопротеина, с пептидом мелитина поддающейся расщеплению пептидазой дипептид-амидобензилкарбаматной связью. Ферментативное расщепление дипептида приводит к отделению нацеливающего лиганда от пептида и инициирует реакцию элиминации, приводящую к регенерации амина пептида.
Дипептиды Glu-Gly, Ala-Cit, Phe-Cit («Cit» представляет собой аминокислоту цитруллин) показаны в Примере 3. Несмотря на то, что также допускается присутствие заряженных аминокислот, предпочтительными являются нейтральные аминокислоты.
Предпочтительный маскирующий агент обеспечивает функцию нацеливания за счет аффинности к рецепторам клеточной поверхности, т.е. маскирующий агент содержит лиганд рецептора клеточной поверхности. Предпочтительные маскирующие агенты содержат сахариды, обладающие аффинностью к ASGPr, включая, но не ограничиваясь ими: галактозу, N-ацетилгалактозамин и производные галактозы. Производные галактозы, обладающие аффинностью к ASGPr, хорошо известны в данной области техники. Важным признаком обратимо модифицированного мелитина является то, что более 80% аминов мелитина (в популяции пептидов) модифицированы путем присоединения лигандов ASGPr физиологически лабильными обратимыми ковалентными связями.
Согласно другому варианту реализации изобретения пептиды мелитина согласно изобретению также модифицированы на амино- или карбокси-конце путем ковалентного присоединения пространственного стабилизатора или конъюгата лиганд ASGPr-пространственный стабилизатор. Модификации амино или карбокси-конца пептида могут осуществляться во время синтеза с использованием стандартных методов, известных в данной области техники. Альтернативно, модификация амино- или карбокси-конца может осуществляться путем модификации цистеиновых остатков пептида мелитина, содержащего амино- или карбокси-концевые цистеиновые остатки. Предпочтительно пространственный стабилизатор представляет собой полиэтиленгликоль. Предпочтительно полиэтиленгликоли содержат 1-120 этиленовых звеньев. Согласно другому варианту реализации изобретения размер полиэтиленгликолей предпочтительно составляет менее 5 кДа. Для конъюгатов лиганд ASGPr-пространственный стабилизатор предпочтительный пространственный стабилизатор представляет собой полиэтиленгликоль, содержащий 1-24 этиленовых звеньев.
Конъюгат полинуклеотида РНКи и пептид доставки вводят млекопитающему в фармацевтически приемлемых носителях или разбавителях. Согласно одному варианту реализации изобретения пептид доставки и конъюгат полинуклеотида РНКи можно объединять в растворе до введения млекопитающему. Согласно другому варианту реализации изобретения пептид доставки и конъюгат полинуклеотида РНКи можно совместно вводить млекопитающему в виде отдельных растворов. Согласно другому варианту реализации изобретения пептид доставки и конъюгат полинуклеотида РНКи можно вводить млекопитающему последовательно. В случает последовательного введения пептид доставки можно вводить до введения конъюгата полинуклеотида РНКи. Альтернативно, в случае последовательного введения конъюгат полинуклеотида РНКи можно вводить до введения пептида доставки.
Другие объекты, признаки и преимущества согласно изобретению будут очевидны из следующего подробного описания, сопровождающегося рисунками.
КРАТКОЕ ОПИСАНИЕ ФИГУР
ФИГ.1. Таблица, в которой перечислены пептиды мелитина, подходящие для применения согласно изобретению.
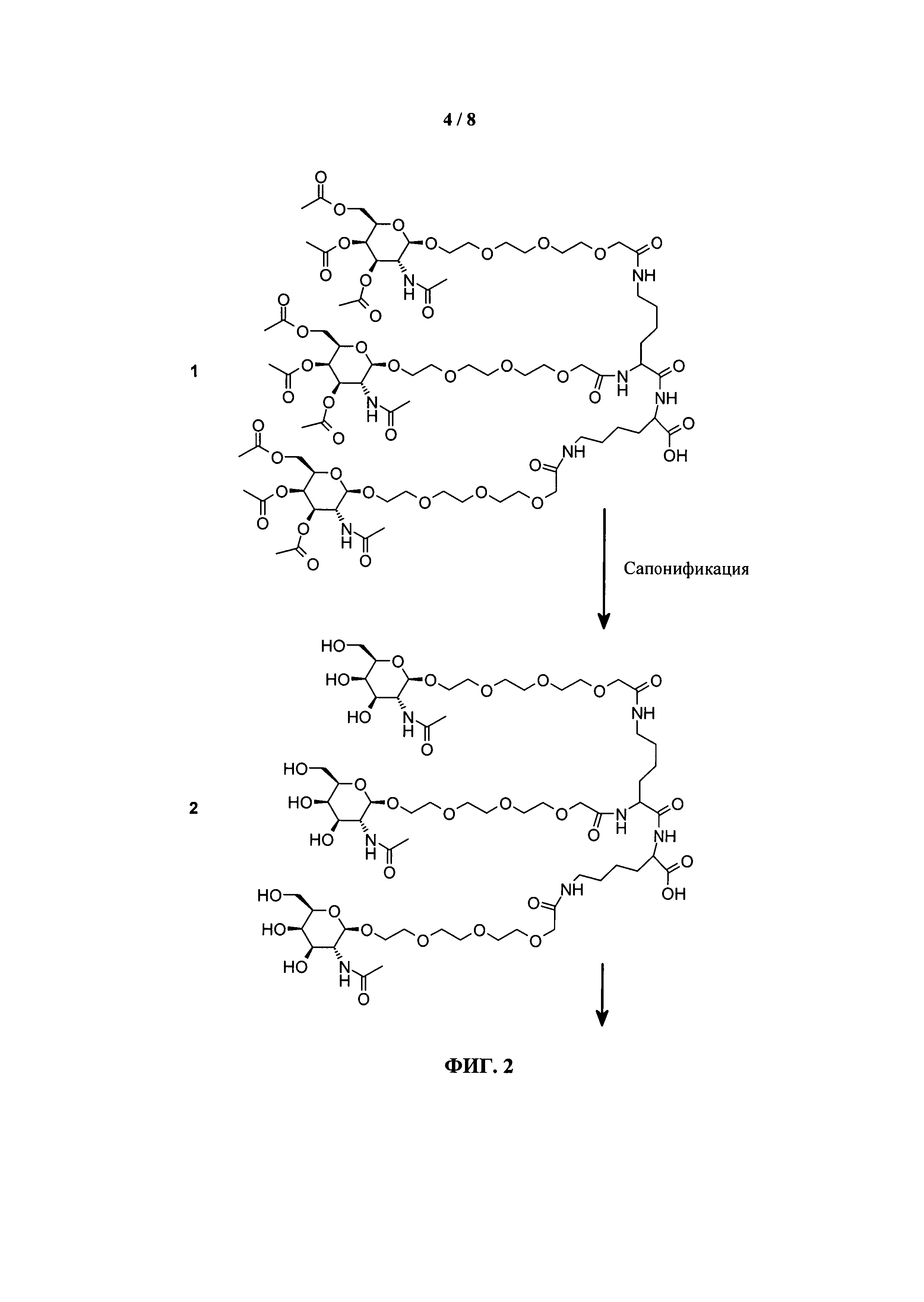
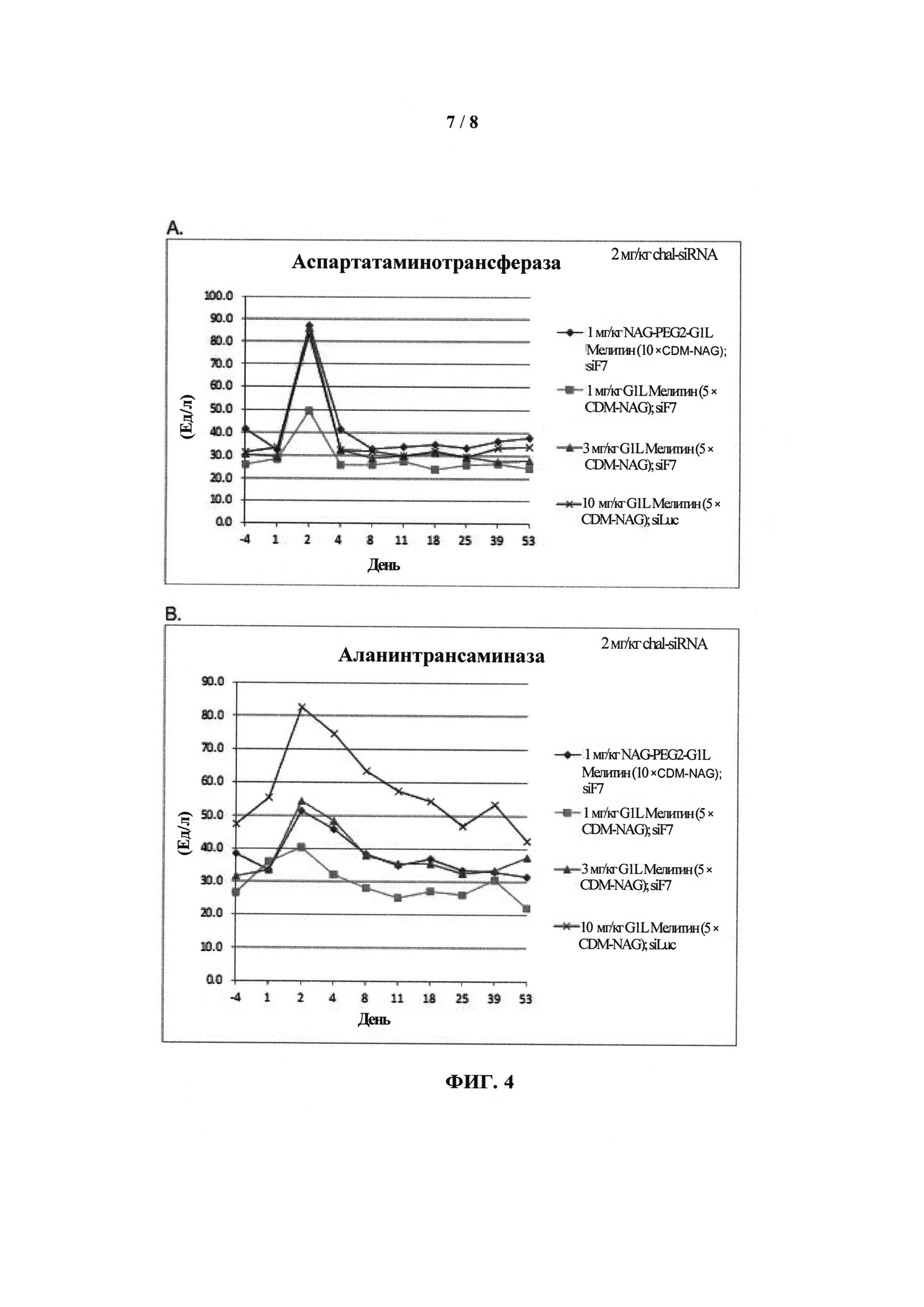
ФИГ.2. Рисунок, показывающий связь кластера GalNAc с РНК.
ФИГ.3. График, показывающий (А) уровень азота мочевины крови (BUN) и (В) уровень креатинина у приматов, которых лечили обратимо модифицированными пептидами мелитина для доставки миРНК и конъюгатами миРНК-холестерин.
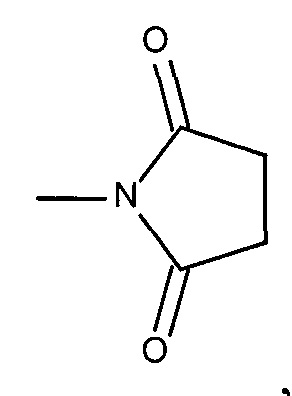
ФИГ.4. График, показывающий (А) уровень аспартатаминотрансферазы (AST) и (В) уровень аланинтрансаминазы (ALT) у приматов, которых лечили обратимо модифицированными пептидами мелитина для доставки миРНК и конъюгатами миРНК-холестерин.
ФИГ.5. График, показывающий снижение эндогенного уровня Фактора VII у приматов, которых лечили обратимо модифицированными пептидами мелитина для доставки миРНК и конъюгатами миРНК-холестерин.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описан усовершенствованный способ доставки полинуклеотидов интерферирующих РНК (РНКи) в клетки печени млекопитающего in vivo. Согласно изобретению, описана in vivo система доставки полинуклеотида РНКи, в которой используется маленький пептид доставки, мелитин, являющийся производным пептида пчелиного яда, и независимо нацеленный полинуклеотид РНКи. Применение нацеливающих на печень молекул конъюгатов полинуклеотидов РНКи и нацеливающих на рецептор асиалогликопротеина обратимо ингибированных пептидов мелитина обеспечивает эффективную доставку полинуклеотида РНКи в печень.
Поскольку мелитин и полинуклеотиды РНКи независимо нацелены на гепатоциты, концентрация мелитина и полинуклеотидов и отношение между ними ограничивается только растворимостью компонентов, а не растворимостью ассоциированного комплекса или способностью образовывать указанный комплекс. Также полинуклеотид и мелитин можно смешивать в любой момент времени до введения или даже вводить раздельно, что позволяет, соответственно, хранить компоненты отдельно друг от друга, в растворе или в сухом виде.
Изобретение включает системы доставки конъюгата, имеющие следующий состав:
Y-Мелитин-(L-М)x плюс N-T,
где N представляет собой полинуклеотид РНКи, Т представляет собой группу, нацеливающую полинуклеотид (гидрофобную группу, содержащую 20 или более атомов углерода, или галактозный кластер), Мелитин представляет собой пептид мелитина пчелиного яда или его производное, как описано в настоящей заявке, и маскирующий агент М содержит лиганд ASGPr, как описано в настоящей заявке, ковалентно связанный с Мелитином через физиологически лабильную обратимую связь L. Отщепление L приводит к регенерации немодифицированного амина Мелитина. Y является необязательным и, в случае его наличия, содержит полиэтиленгликоль (PEG) или конъюгат лиганд ASGPr-PEG, связанный с амино-концом, карбокси-концом или амино- или карбокси-концевым цистеином Мелитина. Присоединение Y к амино-концу или амино-концевому цистеину является предпочтительным. Х представляет собой целое число больше 1. В немодифицированном состоянии Мелитин является мембраноактивным. Однако пептид доставки Мелитин-(L-М)x не является мембраноактивным. Обратимая модификация первичных аминов Мелитина путем присоединения М приводит к обратимому ингибированию или инактивации мембранной активности Мелитина. Процент модифицированных первичных аминов Мелитина является достаточным для ингибирования мембранной активности полимера и обеспечения нацеливания на гепатоциты. Предпочтительно значение x - более 80% и, более предпочтительно, более 90% первичных аминов Мелитина, что определяется по числу аминов на Мелитине в отсутствие любых маскирующих агентов. Более конкретно, х имеет значение от более 80% и до 100% первичных аминов Мелитина. Отмечено, что мелитин, как правило, содержит 3-5 первичных аминов на амино-конце (если он не модифицирован) и, как правило, 2-4 лизиновых остатка. Таким образом, процентная модификация аминов отражает процентную модификацию аминов в популяции пептидов мелитина. При расщеплении обратимых связей L немодифицированные амины регенерируют, и, соответственно, Мелитин возвращается в его немодифицированное мембраноактивное состояние. Предпочтительная обратимая связь представляет собой рН-лабильную связь. Другая предпочтительная обратимая связь представляет собой расщепляемую протеазами связь. Мелитин-(L-М)x, ASGPr-нацеленный обратимо маскированный мембраноактивный полимер (пептид доставки) и T-N, конъюгат полинуклеотида, синтезируют или получают отдельно. Т и N не являются прямо или не прямо ковалентно связанными с Мелитином, L или М. Электростатическое или гидрофобное соединение полинуклеотида или конъюгата полинуклеотида с маскированным или немаскированным полимером не является необходимым для in vivo доставки полинуклеотида в печень. Маскированный полимер и конъюгат полинуклеотида могут поставляться в одном и том же контейнере или в отдельных контейнерах. Они могут быть объединены до введения, введены совместно или введены последовательно.
Гидрофильные группы указывают в качественном отношении, что указанная химическая группа предпочитает воду. Как правило, такие химические группы являются растворимыми в воде и являются донорами или акцепторами водородных связей с водой. Гидрофильная группа может быть заряженной или незаряженной. Заряженные группы могут быть положительно заряженными (анионными) или отрицательно заряженными (катионными) или заряженными как положительно, так и отрицательно (цвиттерионными). Примеры гидрофильных групп включают следующие химические группы: углеводы, полиоксиэтилен, некоторые пептиды, олигонуклеотиды, амины, амиды, алкоксиамиды, карбоновые кислоты, сульфаты и гидроксилы.
Гидрофобные группы указывают в качественном отношении, что химическая группа избегает воду. Как правило, такие химические группы не растворимы в воде и не склонны образовывать водородные связи. Липофильные группы растворяются в жирах, маслах, липидах и неполярных растворителях и имеют слабую способность или не имеют способности образовывать водородные связи. Углеводороды, содержащие два (2) или более атомов углерода, некоторые замещенные углеводороды, холестерин и производные холестерина являются примерами гидрофобных групп и соединений.
Гидрофобные группы предпочтительно представляют собой углеводороды, содержащие только атомы углерода и водорода. Однако допускается присутствие неполярных заместителей или неполярных гетероатомов, которые поддерживают гидрофобность и включают, например, атом фтора. Термин включает алифатические группы, ароматические группы, ацильные группы, алкильные группы, алкенильные группы, алкинильные группы, арильные группы, аралкильные группы, аралкенильные группы и аралкинильные группы, каждая из которых может быть прямой, разветвленной или циклической. Термин гидрофобная группа также включает: стерины, стероиды, холестерин и производные стероидов и холестерина.
В настоящем документе мембраноактивные пептиды являются поверхностно-активными, амфипатическими пептидами, которые способны оказывать один или более их следующих эффектов на биологическую мембрану: изменение или разрушение мембраны, которое позволяет не проникающим через мембрану молекулам входить в клетку или пересекать мембрану, формирование поры в мембране, фрагментацию мембран или разрушение или растворение мембран. В настоящей заявке мембрана или клеточная мембрана содержит липидный бислой. Изменение или разрушение мембраны можно функционально определить по активности пептида по меньшей мере в одном из следующих анализов: лизис эритроцитов (гемолиз), подтекание липосом, слияние липосом, клеточное слияние, лизис клеток и высвобождение из эндосом. Мембраноактивные пептиды, которые вызывают лизис клеточных мембран, также называются мембранолитическими пептидами. Пептиды, которые предпочтительно вызывают разрушение эндосом или лизосом по сравнению с плазматическими мембранами, считаются эндосомолитическими. Действие (эффект) мембраноактивных пептидов на клеточную мембрану может быть временным. Мембраноактивные пептиды обладают аффинностью в отношении мембраны и вызывают денатурацию или деформацию бислойных структур.
Доставка полинуклеотида в клетку опосредуется пептидом мелитина, разрушающим или дестабилизирующим плазматическую мембрану или внутреннюю мембрану везикулы (такую как мембрана эндосомы или лизосомы), включая образование поры в мембране или разрушение эндосомальных или лизосомальных везикул, что приводит к высвобождению содержимого везикулы в цитоплазму клетки.
Эндосомолитичесие пептиды представляют собой пептиды, которые в ответ на специфические для эндосом факторы окружения, такие как пониженный рН или присутствие литических ферментов (протеаз), способны приводить к разрушению или лизису эндосомы или обеспечивать высвобождение в норме не проникающего через клеточные мембраны соединения, такого как полинуклеотид или белок, из внутриклеточных заключенных в мембрану везикул, таких как эндосома или лизосома. В эндосоме происходит изменение физико-химических свойств эндосомолитических полимеров. Указанное изменение может представлять собой изменение растворимости полимера или способности взаимодействовать с другими соединениями или мембранами в результате изменения заряда, гидрофобности или гидрофильности. Примеры эндосомолитических пептидов включают рН-лабильные или чувствительные к ферментам группы или связи. Обратимо маскированный мембраноактивный пептид, в котором маскирующие агенты присоединены к полимеру через рН-лабильные связи, может, таким образом, считаться эндосомолитическим полимером.
Мелитин в настоящей заявке представляет собой малый амфипатический мембраноактивный пептид, содержащий от примерно 23 до примерно 32 аминокислот, являющийся производным встречающих в природе в пчелином яде пептидов мелитина. Природный мелитин содержит 26 аминокислот и является преимущественно гидрофобным на амино-конце и преимущественно гидрофильным (катионным) на карбокси-конце. Мелитин согласно изобретению может быть выделен из биологического источника или может являться синтетическим. Синтетический полимер создается или производится человеком с использованием химического процесса, а не получается в результате природного биологического процесса. В настоящей заявке мелитин включает природные пептиды пчелиного яда семейства мелитина, которые могут быть обнаружены, например, в яде следующих видов: Apis florea, Apis mellifera, Apis cerana, Apis dorsata, Vespula maculifrons, Vespa magnifica, Vespa velutina, Polistes sp. HQL-2001 и Polistes hebraeus. В настоящей заявке мелитин также включает синтетические пептиды, содержащие аминокислотную последовательность, идентичную или подобную природным пептидам мелитина. В частности, аминокислотная последовательность мелитина включает последовательности, показанные на Фиг.1. Помимо аминокислот, которые сохраняют свойственную мелитину высокую мембранную активность, могут быть добавлены 1-8 аминокислот к амино- или карбокси-концу пептида. В частности, могут быть добавлены цистеиновые остатки к амино- или карбокси-концу. Перечень на Фиг.1 не является полным, так как легко можно представить другие консервативные аминокислотные замены. Синтетические пептиды мелитина могут содержать природные аминокислоты в L-форме или энантиомерные аминокислоты в D-форме (инвертированные). Однако пептид мелитина должен содержать по существу все аминокислоты в L-форме, либо все аминокислоты в D-форме, но может содержать аминокислоты с противоположным стереоцентром, присоединенные к любому из амино- или карбокси-конца. Аминокислотная последовательность мелитина также может быть обращенной (ретро). Ретро-мелитин может содержать аминокислоты в L-форме или аминокислоты в D-форме (ретроинвертированный). Два пептида мелитина также могут быть ковалентно связаны с образованием димера мелитина. Мелитин может содержать модифицирующие группы, присоединенные либо к амино-концу, либо к карбокси-концу пептида, отличные от маскирующих агентов, которые усиливают тканевую направленность или облегчают in vivo циркуляцию. Однако в настоящей заявке мелитин не включает цепи или полимеры, содержащие более двух пептидов мелитина, ковалентно связанных друг с другом или с другим полимером или скаффолдом.
Маскирование
Пептиды мелитина согласно изобретению включают обратимо модифицированные пептиды мелитина, где обратимая модификация приводит к ингибированию мембранной активности, нейтрализации мелитина с уменьшением положительного заряда и образованию почти нейтрально заряженного полимера, и обеспечивает специфичное к клеточному типу нацеленное действие. Мелитин обратимо модифицирован путем обратимой модификации первичных аминов пептида.
Пептиды мелитина согласно изобретению способны разрушать плазматические мембраны или мембраны эндосом/лизосом. Однако мембранная активность приводит к токсичности при введении пептида in vivo. Таким образом, обратимое маскирование мембранной активности мелитина необходимо для его применения in vivo. Указанное маскирование осуществляют путем обратимого присоединения маскирующих агентов к мелитину с образованием обратимо маскированного мелитина, т.е. пептида доставки. Помимо ингибирования мембранной активности маскирующие агенты обеспечивают клеточно-специфические взаимодействия, т.е. нацеливание.
Важной чертой маскирующих агентов является то, что в агрегате они ингибируют мембранную активность полимера и обеспечивают in vivo нацеливание на гепатоциты. Мелитин является мембраноактивным в немодифицированном (немаскированным) состоянии и не мембраноактивным (инактивированным) в модифицированном (маскированном) состоянии. Количество маскирующих агентов, связанных с пептидом, является достаточным для достижения желаемого уровня инактивации. Желаемую степень модификации мелитина путем присоединения маскирующего агента (агентов) легко определить с использованием подходящих анализов активности пептида. Например, если мелитин обладает мембранной активностью в конкретном анализе, то маскирующий агент связан с указанным пептидом в количестве, достаточном для достижения желаемой степени подавления мембранной активности в указанном анализе. Предпочтительной является модификация ≥80% или ≥90% первичных аминогрупп на популяции пептидов мелитина по результатам определения количества первичных аминов на пептидах в отсутствие каких-либо маскирующих агентов. Также предпочтительной характеристикой маскирующих агентов является то, что их присоединение к пептиду снижает положительный заряд полимера, таким образом, приводя к образованию более нейтрального пептида доставки. Желательно, чтобы маскированный пептид сохранял растворимость в воде.
В настоящей заявке мелитин является маскированным, если модифицированный пептид не обладает мембранной активностью и обладает способностью специфического нацеливания на клетки (т.е. на гепатоциты) in vivo. Мелитин является обратимо маскированным, если расщепление связей, соединяющих маскирующие агенты с пептидом, приводит к восстановлению аминов пептида, что приводит к восстановлению мембранной активности.
Другим важным признаком является то, что маскирующие агенты ковалентно связаны с мелитином физиологически лабильными обратимыми связями. Благодаря использованию физиологически лабильных обратимых линкеров или связей маскирующие агенты можно отщеплять от пептида in vivo, что обеспечивает демаскирование пептида и восстановление активности демаскированного пептида. Путем выбора подходящей обратимой связи можно получать конъюгат, восстанавливающий активность мелитина после его доставки или нацеливания на желаемый тип клеток или определенную внутриклеточную локализацию. Обратимость связей обеспечивает селективную активацию мелитина.
Обратимые ковалентные связи включают обратимые или лабильные связи, которые могут быть выбраны из группы, включающей: физиологически лабильные связи, связи, чувствительные к физиологическим условиям в клетке, рН-лабильные связи, сильно рН-лабильные связи, крайне рН-лабильные связи и расщепляемые протеазами связи.
В настоящей заявке маскирующий агент предпочтительно представляет собой нейтральное (незаряженное) соединение, содержащее лиганд ASGPr и амино-реактивную группу, где реакция указанной амино-реактивной группы с амином пептида приводит к образованию связи лиганда ASGPr с пептидом через обратимую физиологически лабильную ковалентную связь. Амино-реактивные группы выбирают таким образом, чтобы расщепление в ответ на соответствующие физиологические условия (например, пониженное значение рН, такое как в эндосоме/лизосоме, или ферментативное расщепление, такое как в эндосоме/лизосоме) приводило к регенерации амина мелитина. Лиганд ASGPr представляет собой группу, как правило, сахарид, обладающую аффинностью к рецептору асиалогликопротеина. Предпочтительные маскирующие агенты согласно изобретению способны модифицировать полимер (образовывать обратимую связь с полимером) в водном растворе.
Предпочтительно амино-реактивная группа содержит дизамещенный малеиновый ангидрид. Предпочтительно маскирующий агент представлен структурой:

где R1 содержит лиганд рецептора асиалогликопротеина (ASGPr), и R2 представляет собой алкильную группу, такую как метильная (-СН3) группа, этильная (-СН2СН3) группа или пропильная (-СН2СН2СН3) группа.
Согласно некоторым вариантам реализации изобретения, галактозный лиганд связан с амино-реактивной группой через PEG-линкер, как показано с помощью структуры:

где n представляет собой целое число между 1 и 19.
Другая предпочтительная амино-реактивная группа содержит дипептид-амидобензильное амино-реактивное производное карбоната, представленное структурой:

где:
R1 представляет собой группу R аминокислоты 1,
R2 представляет собой группу R аминокислоты 2,
R3 представляет собой -CH2-O-C(O)-O-Z, где Z представляет собой галогенид,


и R4 содержит лиганд ASGPr.
В результате реакции активированного карбоната с амином мелитина лиганд ASGPr связывается с пептидом мелитина через поддающуюся расщеплению пептидазой дипептид-амидобензилкарбаматную связь.

Ферментативное расщепление дипептида приводит к отделению нацеливающего лиганда от пептида и вызывает реакцию элиминации, которая приводит к восстановлению амина пептида. Несмотря на то, что на приведенной выше структуре показан один маскирующий агент, связанный с пептидом мелитина, на практике с указанным пептидом мелитина связано несколько маскирующих агентов, предпочтительно таким образом, что более 80% аминов популяции пептидов мелитина являются модифицированными.
Дипептиды Glu-Gly, Ala-Cit, Phe-Cit («Cit» представляет собой аминокислоту цитруллин) показаны в Примере 3. В приведенной выше структуре Glu-Gly, Ala-Cit, Phe-Cit представляют собой R2-R1. Несмотря на то, что допускается присутствие заряженных аминокислот, предпочтительными являются нейтральные аминокислоты. Возможны другие комбинации аминокислот, при условии, что они расщепляются эндогенной протеазой. Кроме того, 3-5 аминокислот могут использоваться в качестве линкера между амидобензильной группой и нацеливающим лигандом.
Как и в случае маскирующих агентов на основе малеинового ангидрида, лиганд ASGPr может быть связан с поддающимся расщеплению пептидазой дипептид-амидобензилкарбонатом через PEG-линкер.
Мембраноактивный полиамин может быть конъюгирован с маскирующими агентами в присутствии избытка маскирующих агентов. Избыток маскирующих агентов может быть отделен от конъюгированного пептида доставки до введения указанного пептида доставки.
Согласно другому варианту реализации изобретения пептиды мелитина согласно изобретению также модифицированы на амино- или карбоксильном конце, путем ковалентного присоединения пространственного стабилизатора или конъюгата лиганд ASGPr-пространственный стабилизатор. Предпочтительной является модификация гидрофобного конца; амино-конца в случае мелитина, имеющего «прямую» последовательность, и карбокси-конца в случае ретро-мелитина. Предпочтительный пространственный стабилизатор представляет собой полиэтиленгликоль. Модификации амино- или карбокси-конца пептида могут осуществляться во время синтеза с использованием стандартных методов, известных в данной области техники. Альтернативно, модификации амино- или карбокси-конца можно осуществлять путем модификации цистеиновых остатков пептидов мелитина, включая амино- или карбокси-концевые цистеиновые остатки. Полиэтиленгликоли предпочтительно содержат 1-120 этиленовых звеньев. Согласно другому варианту реализации изобретения размер полиэтиленгликолей предпочтительно составляет менее 5 кДа. Для конъюгатов лиганд ASGPr-пространственный стабилизатор (NAG-PEG-модификация) предпочтительный пространственный стабилизатор представляет собой полиэтиленгликоль, содержащий 1-24 этиленовых звеньев. Концевая PEG-модификация в сочетании с обратимым маскированием также снижает токсичность пептидов доставки мелитина. Концевая NAG-PEG-модификация повышает эффективность.
Пространственный стабилизатор
В настоящей заявке пространственный стабилизатор представляет собой неионный гидрофильный полимер (природный, синтетический или не природный), который предотвращает или ингибирует внутримолекулярные или межмолекулярные взаимодействия молекулы, к которой он присоединен в отличие от молекулы, не содержащей пространственный стабилизатор. Пространственный стабилизатор препятствует вовлечению молекулы, к которой он присоединен, в электростатические взаимодействия. Электростатическое взаимодействие представляет собой нековалентное связывание двух или более веществ благодаря силам притяжения между положительными и отрицательными зарядами. Пространственные стабилизаторы могут ингибировать взаимодействие с компонентами крови и, таким образом, ингибировать опсонизацию, фагоцитоз и захват ретикулоэндотелиальной системой. Пространственные стабилизаторы, таким образом, могут повышать время циркуляции в кровотоке молекул, к которым они присоединены. Пространственные стабилизаторы также могут предотвращать агрегацию молекул. Предпочтительный пространственный стабилизатор представляет собой полиэтиленгликоль (PEG) или производное PEG. Молекулы PEG, подходящие для применения согласно изобретению, содержат примерно 1-120 этиленгликолевых мономеров.
Лиганд ASGPr
Нацеливающие группы или фрагменты улучшают фармакокинетические свойства или биораспределение конъюгата, к которому они присоединены, для улучшения клеточно-специфического распределения и клеточно-специфического захвата конъюгата. Галактоза и производные галактозы применяют для обеспечения нацеливания молекул на гепатоциты in vivo путем их связывания с рецептором асиалогликопротеина (ASGPr), экспрессируемым на поверхности гепатоцитов. В настоящей заявке лиганд ASGPr (или ASGPr-лиганд) содержит галактозу и производное галактозы, обладающее аффинностью к ASGPr, равной или большей по сравнению с аффинностью галактозы. Связывание нацеливающих групп, содержащих галактозу, с рецептором (рецепторами) ASGPr облегчает клеточно-специфическую направленность пептида доставки на гепатоциты и эндоцитоз указанного пептида доставки гепатоцитами.
Лиганды ASGPr могут быть выбраны из группы, включающей: лактозу, галактозу, N-ацетилгалактозамин (GalNAc), галактозамин, N-формилгалактозамин, N-ацетилгалактозамин, N-пропионилгалактозамин, N-н-бутаноилгалактозамин и N-изо-бутаноилгалактозамин (Iobst, S.T. and Drickamer, K. J.B.C. 1996, 277, 6686). Лиганды ASGPr могут быть мономерными (например, содержащими один галактозамин) или мультимерными (например, содержать много галактозаминов).
Согласно одному варианту реализации изобретения пептид мелитина обратимо маскируют путем присоединения маскирующих агентов, содержащих лиганды ASGPr, к ≥80% или ≥90% первичных аминов пептида.
Лабильная связь
Связь или линкер представляет собой соединение между двумя атомами, которое связывает одну химическую группу или интересующий сегмент с другой химической группой или интересующим сегментом одной или более ковалентными связями.
Например, связь может соединять маскирующий агент с пептидом. Образование связи может соединять две отдельные молекулы в одну молекулу или два атома в одну молекулу. Связь может иметь нейтральный заряд или может иметь положительный или отрицательный заряд. Обратимый или лабильный линкер включает обратимую или лабильную связь. Связь может необязательно включать спейсер, который увеличивает расстояние между двумя соединяемыми атомами. Спейсер может также обеспечивать дополнительную подвижность и/или длину связи. Спейсеры могут включать, но не ограничиваются указанными: алкильные группы, алкенильные группы, алкинильные группы, арильные группы, аралкильные группы, аралкенильные группы, аралкинильные группы; каждая из которых может содержать один или более гетероатомов, гетероциклов, аминокислот, нуклеотидов и сахаридов. Спейсерные группы хорошо известны в данной области техники, и предшествующий перечень не ограничивает объем настоящего изобретения.
Лабильная связь представляет собой ковалентную связь, отличную от ковалентной связи с атомом водорода, которая способна селективно разрушаться или расщепляться в условиях, которые не приводят к разрушению или расщеплению других ковалентных связей в той же молекуле. Более конкретно, лабильная связь представляет собой ковалентную связь, которая является менее стабильной (термодинамически) или более быстро разрушается (кинетически) при соответствующих условиях, чем другие не лабильные ковалентные связи в той же молекуле. Расщепление лабильной связи внутри молекулы может приводить к образованию двух молекул. Для специалистов в данной области техники расщепление или лабильность связи в целом описываются с помощью времени полужизни (t½) для расщепления связи (времени, требуемого для расщепления половины связей). Таким образом, лабильные связи включают связи, которые могут селективно расщепляться быстрее, чем другие связи в молекуле.
Подходящие условия определяются типом лабильной связи и хорошо известны в области органической химии. Лабильная связь может быть чувствительной к рН, окислительным или восстановительным условиям или агентам, температуре, концентрации солей, присутствию фермента (такого как эстеразы, включая нуклеазы, и протеазы) или присутствию добавляемого агента. Например, повышенное или пониженное значение рН является подходящим условием для рН-лабильной связи.
Скорость, с которой лабильная группа претерпевает превращение, можно контролировать путем изменения химических составляющих молекулы, содержащей указанную лабильную группу. Например, добавление конкретных химических групп (например, акцепторов или доноров электронов) вблизи лабильной группы может влиять на конкретные условия (например, рН), при которых будет происходить химическое превращение.
В настоящей заявке физиологически лабильная связь представляет собой лабильную связь, которая поддается расщеплению в условиях, которые в норме встречаются или аналогичны встречающимся в теле млекопитающего. Группы физиологически лабильных связей выбираются таким образом, что они претерпевают химическое превращение (например, расщепление) при определенных физиологических условиях.
В настоящей заявке связь, чувствительная к физиологическим условиям в клетке, представляет собой лабильную связь, которая поддается расщеплению в условиях, существующих внутри клеток млекопитающих. Условия внутри клеток млекопитающих включают химические условия, такие как рН, температура, окислительные или восстановительные условия или агенты и концентрация солей, встречающиеся или аналогичные встречающимся в клетках млекопитающих. Условия внутри клеток млекопитающих также включают наличие ферментативной активности, в норме присутствующей в клетках млекопитающих, например, активности протеолитических или гидролитических ферментов. Связь, чувствительная к физиологическим условиям в клетке, может также расщепляться в ответ на введение фармацевтически приемлемого экзогенного агента. Физиологически лабильные связи, которые расщепляются при соответствующих условиях со временем полужизни менее 45 мин, считаются сильно лабильными. Физиологически лабильные связи, которые расщепляются при соответствующих условиях со временем полужизни менее 15 мин, считаются крайне лабильными.
Химическое превращение (расщепление лабильной связи) может инициироваться путем добавления фармацевтически приемлемого агента в клетку или может происходить спонтанно, когда молекула, содержащая лабильную связь, достигает соответствующего внутри- и/или внеклеточного окружения. Например, рН-лабильная связь может расщепляться при перемещении молекулы в эндосому с повышенной кислотностью. Таким образом, рН-лабильная связь может считаться расщепляемой в эндосоме связью.
Ферментативно расщепляемые связи могут расщепляться под действием ферментов, таких как присутствующие в эндосоме или лизосоме ферменты или присутствующие в цитоплазме ферменты. Дисульфидная связь может расщепляться при перемещении молекулы в более восстановительные условия клеточной цитоплазмы. Таким образом, дисульфидная связь может считаться расщепляемой в цитоплазме связью.
В настоящей заявке рН-лабильная связь представляет собой лабильную связь, которая селективно разрушается в кислых условиях (рН<7). Такие связи также можно называть эндосомо-лабильными связями, так как клеточные эндосомы и лизосомы имеют рН менее 7. Термин «рН-лабильные» включает связи, которые являются рН-лабильными, сильно рН-лабильными и крайне рН-лабильными.
Реакция ангидрида с амином приводит к образованию амида и кислоты. Для многих ангидридов обратная реакция (образование ангидрида и амина) протекает очень медленно и является энергетически не выгодной. Однако если ангидрид представляет собой циклический ангидрид, то реакция с амином приводит к получению нафтиламина, молекулы, в которой одновременно присутствуют амид и кислота. Присутствие обеих реактивных групп (амида и карбоновой кислоты) в одной молекуле ускоряет обратную реакцию. В частности, продукт реакции первичных аминов с малеиновым ангидридом и производными малеинового ангидрида, полуамидами малеиновой кислоты, превращается обратно в амин и ангидрид в 1×109-1×1013 раз быстрее, чем его нециклические аналоги (Kirby, 1980).
Реакция амина с ангидридом с образованием амида и кислоты.
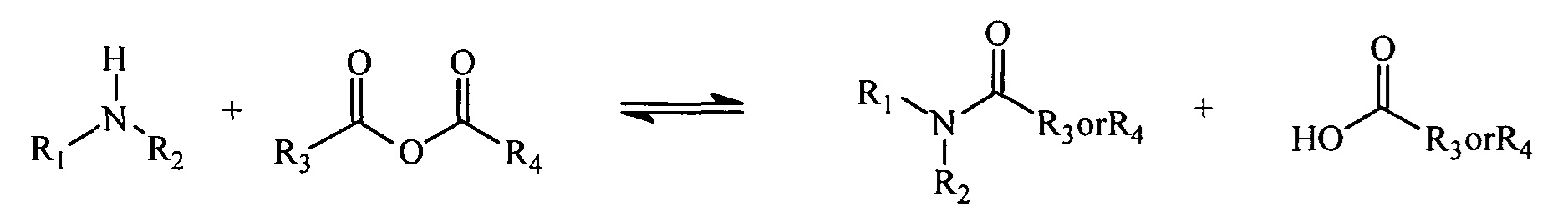
Реакция амина с циклическим ангидридом с образованием нафтиламина.

Расщепление нафтиламина с образованием амина и ангидрида является рН-зависимым процессом и сильно ускоряется при кислом значении рН. Указанная рН-зависимая реактивность может использоваться для получения обратимых рН-лабильных связей и линкеров. В качестве такой рН-чувствительной линкерной молекулы использовалась цис-аконитовая кислота. Сначала проводили сочетание γ-карбоксилата с молекулой. На втором этапе либо α-, либо β-карбоксилат сочетали со второй молекулой с образованием рН-чувствительной связи между двумя молекулами. Для расщепления указанного линкера при рН 5 время полужизни составляло между 8 и 24 часами.
Структуры цис-аконитового ангидрида и малеинового ангидрида.

Значение рН, при котором происходит расщепление, контролируют с помощью химических составляющих лабильного фрагмента. Скорость превращения полуамидов малеиновой кислоты в амины и малеиновые ангидриды сильно зависит от заместителя (R2 и R3) в системе малеинового ангидрида. Когда R2 представляет собой метил, скорость превращения в 50 раз выше, чем когда R2 и R3 представляют собой водород. Когда алкильные заместители присутствуют на обеих группах R2 и R3 (например, в случае 2,3-диметилмалеинового ангидрида), скорость существенно повышается: в 10,000 раз выше, чем в случае не замещенного малеинового ангидрида. Малеаматная связь, образованная в результате модификации амина 2,3-диметилмалеиновым ангидридом, расщепляется с восстановлением ангидрида и амина со временем полужизни между 4 и 10 мин. при рН 5. Предполагается, что если R2 и R3 представляют собой группы, которые больше водорода, то скорость превращения нафтиламина в амин и ангидрид выше, чем если R2 и/или R3 представляют собой водород.
Сильно рН-лабильная связь: Для расщепления сильно рН-лабильной связи время полужизни при рН 5 составляет менее 45 мин. Способы создания сильно рН-лабильных связей хорошо известны в области химии.
Крайне рН-лабильные связи: Для расщепления крайне рН-лабильной связи время полужизни при рН 5 составляет менее 15 мин. Способы создания крайне рН-лабильных связей хорошо известны в области химии.
Дизамещенные циклические ангидриды, в частности, применимы для присоединения маскирующих агентов к пептидам мелитина согласно изобретению. Они обеспечивают физиологически рН-лабильные связи, легко модифицируют амины, и их расщепление при пониженном значении рН, которое обнаруживается в клеточных эндосомах и лизосомах, приводит к восстановлению указанных аминов. Во-вторых, оказывается,, что α- или β-группа карбоновой кислоты, образованная в ходе реакции с амином, вносит только примерно 1/20 часть ожидаемого отрицательного заряда в заряд полимера (Rozema et al. Bioconjugate Chemistry, 2003). Таким образом, модификация пептида дизамещенными малеиновыми ангидридами приводит к эффективной нейтрализации положительного заряда пептида, а не к получению пептида с сильно отрицательным зарядом. Для in vivo доставки почти нейтральные пептиды доставки являются предпочтительными.
Конъюгат полинуклеотида РНКи
Изобретатели настоящего изобретения обнаружили, что конъюгация полинуклеотида РНКи с нацеливающей полинуклеотид группой, содержащей либо гидрофобную группу, либо галактозный кластер, и совместное введение указанного конъюгата полинуклеотида РНКи с пептидом доставки, описанным выше, обеспечивает эффективную функциональную доставку полинуклеотида РНКи в клетки печени, в частности, гепатоциты, in vivo. Под термином «функциональная доставка» подразумевается, что полинуклеотид РНКи доставляется в клетку и обладает ожидаемой биологической активностью, последовательность-специфическим подавлением экспрессии гена. Многие молекулы, включая полинуклеотиды, вводимые в сосудистую систему млекопитающего обычно выводятся из тела печенью. Выведение полинуклеотида печенью, где указанный полинуклеотид разрушается или перерабатывается другим образом для его удаления из тела, и где указанный полинуклеотид не вызывает последовательность-специфического подавления экспрессии гена, не считается функциональной доставкой.
Конъюгат полинуклеотида РНКи образуется путем ковалентного связывания полинуклеотида РНКи с нацеливающей полинуклеотид группой. Полинуклеотид синтезируют или модифицируют таким образом, что он содержит реактивную группу А.
Нацеливающая группа также синтезируют или модифицируют таким образом, что он содержит реактивную группу В. Реактивные группы А и В выбраны таким образом, что они могут быть связаны через ковалентную связь с использованием методов, известных в данной области техники.
Нацеливающая группа может быть связана с 3’- или 5’-концом полинуклеотида РНКи. В случае полинуклеотидов миРНК нацеливающая грцппа может быть связана со смысловой или антисмысловой нитью, хотя смысловая нить является предпочтительной.
Согласно одному варианту реализации изобретения группа, нацеливающая полинуклеотид, состоит из гидрофобной группы. Более конкретно, группа, нацеливающая полинуклеотид, состоит из гидрофобной группы, содержащей по меньшей мере 20 атомов углерода. Гидрофобные группы, используемые в качестве нацеливающих полинуклеотид групп в настоящей заявке называются гидрофобными нацеливающими группами. Примеры подходящих гидрофобных групп могут быть выбраны из группы, включающей: холестерин, дихолестерин, токоферол, дитокоферол, дидецил, дидодецил, диоктадецил, дидодецил, диоктадецил, изопреноид и холеамид. Гидрофобные группы, содержащие 6 или меньше атомов углерода, не являются эффективными в качестве нацеливающих полинуклеотид групп, тогда как гидрофобные группы, содержащие от 8 до 18 атомов углерода, обеспечивают повышение эффективности доставки полинуклеотида с повышением размера гидрофобной группы (т.е. повышением числа атомов углерода). Присоединение гидрофобной нацеливающей группы к полинуклеотиду РНКи не обеспечивает эффективную функциональную in vivo доставку полинуклеотида РНКи в отсутствие совместного введения пептида доставки. Несмотря на то, что другими авторами было описано, что конъюгаты миРНК-холестерин доставляют миРНК (миРНК-холестерин) в клетки печени in vivo в отсутствие любых дополнительных носителей для доставки, требуются высокие концентрации миРНК, и наблюдается низкая эффективность доставки. При комбинации с пептидами доставки, описанными в настоящей заявке, наблюдается значительное улучшение доставки полинуклеотида. При обеспечении конъюгата миРНК-холестерин вместе с пептидом доставки согласно изобретению эффективность указанного конъюгата миРНК-холестерин повышается примерно в 100 раз.
Гидрофобные группы, применимые в качестве нацеливающих полинуклеотид групп, могут быть выбраны из группы, состоящей из: алкильной группы, алкенильной группы, алкинильной группы, арильной группы, аралкильной группы, аралкенильной группы и аралкинильной группы, каждая из которых может быть прямой, разветвленной или циклической, холестерина, производного холестерина, стерина, стероида и стероидного производного. Гидрофобные нацеливающие группы предпочтительно представляют собой углеводороды, содержащие только атомы углерода и водорода. Однако возможно наличие заместителей или гетероатомов, которые поддерживают гидрофобность, например, фтора. Гидрофобная нацеливающая группа может быть присоединена к 3’- или 5’-концу полинуклеотида РНКи с использованием методов, известных в данной области техники. Для полинуклеотидов РНКи, содержащих 2 нити, таких как миРНК, гидрофобная группа может быть присоединена к любой из указанных нитей.
Согласно другому варианту реализации изобретения группа, нацеливающая полинуклеотид, содержит галактозный кластер (нацеливающая группа на основе галактозного кластера). В настоящей заявке галактозный кластер включает молекулу, содержащую от двух до четырех концевых производных галактозы. В настоящей заявке термин производное галактозы включает как галактозу, так и производные галактозы, обладающие аффинностью к рецептору асиалогликопротеина, равной или большей по сравнению с аффинностью галактозы. Концевое производное галактозы присоединено к молекуле через ее С-1 атом углерода. Рецептор асиалогликопротеина (ASGPr) является уникальным для гепатоцитов и связывает разветвленные гликопротеины с концевыми остатками галактозы. Предпочтительный галактозный кластер содержит три концевых галактозамина или производных галактозамина, каждый из которых обладает аффинностью к рецептору асиалогликопротеина. Более предпочтительный галактозный кластер содержит три концевых N-ацетилгалактозамина. Другие термины общепринятые в данной области техники, включают галактозу, содержащую три ветви, трехвалентную галактозу и тример галактозы. Известно, что кластеры производных галактозы, имеющие три ветви, связываются с ASGPr с более высокой аффинностью, чем со структурами производных галактозы, содержащих две ветви или одну ветвь (Baenziger and Fiete, 1980, Cell, 22, 611-620; Connolly et ah, 1982, J. Biol. Chem., 257, 939-945). Мультивалентность необходима для достижения наномолярной аффинности. Присоединение одного производного галактозы, имеющего аффинность к рецептору асиалогликопротеина, не обеспечивает функциональную доставку полинуклеотида РНКи в гепатоциты in vivo при совместном введении с пептидом доставки.

Галактозный кластер содержит три производных галактозы, каждое из которых связано с центральной точкой ветвления. Производные галактозы присоединены к центральной точке ветвления через атомы углерода сахаридов С-1. Производное галактозы предпочтительно связано с точкой ветвления через линкеры или спейсеры. Предпочтительный спейсер представляет собой подвижный гидрофильный спейсер (патент США 5885968; Biessen et al. J. Med. Chem. 1995, Vol.39, p.1538-1546). Предпочтительный подвижный гидрофильный спейсер представляет собой PEG-спейсер. Предпочтительный PEG-спейсер представляет собой PEG3-спейсер. Точка ветвления может представлять собой любую малую молекулу, которая допускает присоединение трех производных галактозы и также допускает присоединение указанной точки ветвления к полинуклеотиду РНКи. Пример группы точки ветвления представляет собой ди-лизин. Молекула ди-лизина содержит три аминогруппы, через которые могут быть присоединены три производных галактозы, и карбоксильную реактивную группу, через которую ди-лизин может присоединяться к полинуклеотиду РНКи. Присоединение точкой ветвления к полинуклеотиду РНКи может происходить через линкер или спейсер. Предпочтительный спейсер представляет собой подвижный гидрофильный спейсер. Предпочтительный подвижный гидрофильный спейсер представляет собой PEG-спейсер. Предпочтительный PEG-спейсер представляет собой PEG3-спейсер (три этиленовые единицы). Галактозный кластер может быть присоединен к 3’- или 5’-концу полинуклеотида РНКи с использованием методов, известных в данной области техники. В случае полинуклеотидов РНКи, содержащих 2 нити, таких как миРНК, Галактозный кластер может быть присоединен к любой из указанных нитей.
Предпочтительное производное галактозы представляет собой N-ацетилгалактозамин (GalNAc). Другие сахариды, обладающие аффинностью к рецептору асиалогликопротеина, могут быть выбраны из перечня, включающего: галактозу, галактозамин, N-формилгалактозамин, N-ацетилгалактозамин, N-пропионилгалактозамин, N-н-бутаноилгалактозамин и N-изо-бутаноилгалактозамин. Аффинность многочисленных производных галактозы к рецептору асиалогликопротеина была исследована (см., например: Iobst, S.T. abd Drickamer, K. J.B.С. 1996, 277, 6686), или ее с легкостью можно определить с использованием типичных методов, известных в данной области техники.

Один вариант реализации галактозного кластера
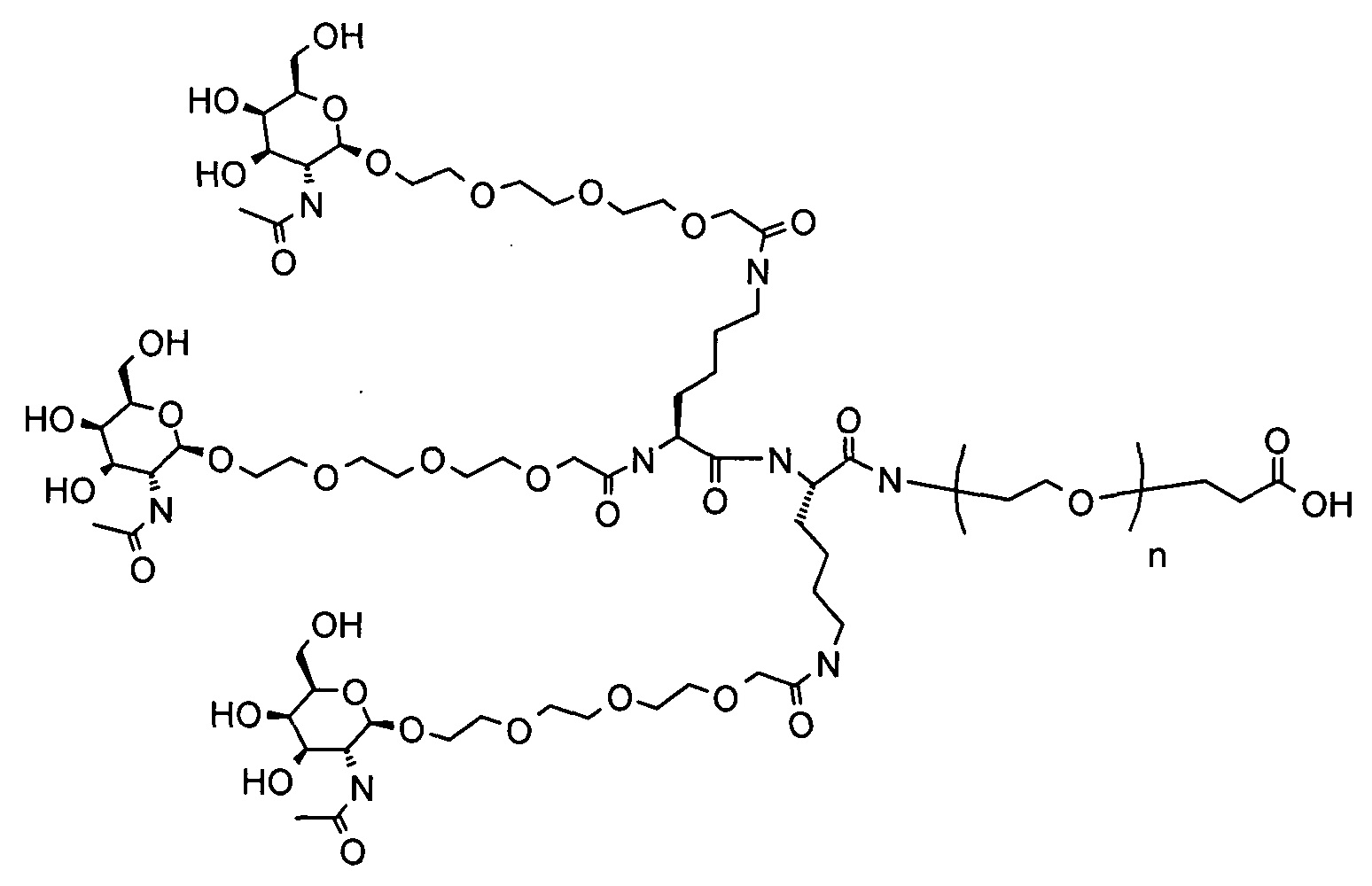
Галактозный кластер с PEG-спейсером между точкой ветвления и нуклеиновой кислотой
Термин полинуклеотид или нуклеиновая кислота или полинуклеиновая кислота представляет собой специальный термин, который относится к полимеру, содержащему по меньшей мере два нуклеотида. Нуклеотиды представляют собой мономерные единицы полинуклеотидных полимеров. Полинуклеотиды, содержащие менее 120 мономерных единиц, часто называют олигонуклеотидами. Природные нуклеиновые кислоты имеют дезоксирибозо- или рибозофосфатный скелет.Неприродные или синтетические полинуклеотиды представляют собой полинуклеотиды, которые были полимеризованы in vitro или в бесклеточной системе и содержат такие же или подобные основания, но могут иметь скелет, отличный от природного рибозо- или дезоксирибозофосфатного скелета. Полинуклеотиды можно синтезировать с использованием любого метода, известного в данной области техники. Полинуклеотидные скелеты, известные в данной области техники включают: ПНК (пептидонуклеиновые кислоты), фосфоротиоаты, фосфородиамидаты, морфолины и другие варианты фосфатного скелета нативных нуклеиновых кислот. Основания включают пурины и пиримидины, которые также включают природные соединения аденин, тимин, гуанин, цитозин, урацил, инозин и природные аналоги. Синтетические производные пуринов и пиримидинов включают, но не ограничиваются указанными, модификации, в результате которых к нуклеотиду присоединяют новые реактивные группы, включая, но не ограничиваясь указанными, амины, спирты, тиолы, карбоксилаты и алкилгалогениды. Термин «основание» включает любые из известных аналогов оснований ДНК и РНК. Полинуклеотид может включать рибонуклеотиды, дезоксирибонуклеотиды, синтетические нуклеотиды или любую подходящую комбинацию. Полинуклеотиды могут быть полимеризованы in vitro, могут являться рекомбинантными, содержать гибридные последовательности или производные указанных групп. Полинуклеотид может содержать концевой копирующий фрагмент на 5’-конце, 3’-конце или на обоих, 5’- и 3’-, концах. Кэпирующий фрагмент может представлять собой, но не ограничивается указанными, инвертированный дезоксифрагмент, лишенный азотистого основания, инвертированный дезокситимидиновый фрагмент, тимидиновый фрагмент или 3’-глицерильную модификацию.
Полинуклеотид интерферирующей РНК (РНКи) представляет собой молекулу, способную индуцировать РНК-интерференцию путем взаимодействия с системой пути РНК-интерференции клеток млекопитающих для разрушения или ингибирования трансляции транскриптов информационной РНК (иРНК) трансгена последовательность-специфичным образом. Два первичных полинуклеотида РНКи представляют собой малые (или короткие) интерферирующие РНК (миРНК) и микро РНК (микроРНК). Полинуклеотиды РНКи могут быть выбраны из группы, включающей: миРНК, микроРНК, двунитевую РНК (днРНК), короткую РНК, образующую «шпильку», (РНК-шпилька) и кассеты экспрессии, кодирующие РНК, способные вызывать РНК-интерференцию. миРНК имеет двунитевую структуру, как правило, включающую 15-50 пар оснований и предпочтительно 21-25 пар оснований и содержащую последовательность нуклеотидов, идентичную (абсолютно комплементарную) или почти идентичную (частично комплементарную) кодирующей последовательности в экспрессируемом гене-мишени или РНК в клетке. миРНК может содержать динуклеотидные 3’-«липкие концы». миРНК может состоять из двух гибридизованных полинуклеотидов или одного полинуклеотида, который образует структуру «шпильки». Молекула миРНК согласно изобретению содержит смысловой участок и антисмысловой участок. Согласно одному варианту реализации изобретения миРНК-конъюгат состоит из двух олигонуклеотидных фрагментов, где один фрагмент содержит нуклеотидную последовательность антисмысловой нити молекулы миРНК, и второй фрагмент содержит нуклеотидную последовательность смыслового участка молекулы миРНК. Согласно другому варианту реализации изобретения смысловая нить связана с антисмысловой нитью через линкерную молекулу, такую как полинуклеотидный линкер или не нуклеотидный линкер. Микро РНК (микроРНК) представляют собой генные продукты - малые некодирующие РНК, содержащие примерно 22 нуклеотида в длину, которые направлены на разрушение или подавление трансляции их иРНК-мишеней. Если комплементарность между микроРНК и иРНК-мишенью является частичной, то трансляция иРНК-мишени подавляется. Если комплементарность высокая, то иРНК-мишень расщепляется. В случае микроРНК комплекс связывается с сайтами-мишенями, обычно расположенными в 3' UTR иРНК, которые, как правило, имеют только частичную гомологию с микроРНК. «Seed»-область - участок, состоящий примерно из (7) следующих друг за другом нуклеотидов на 5'-конце микроРНК, в котором наблюдается абсолютное спаривание оснований с его мишенью - играет ключевую роль в специфичности микроРНК. Связывание комплекса RISC/микроРНК с иРНК может приводить либо к подавлению трансляции белка, либо к расщеплению и деградации иРНК. Недавно полученные данные указывают на то, что расщепление иРНК происходит преимущественно в том случае, если существует абсолютная гомология по всей длине микроРНК с ее мишенью, а не точное спаривание оснований только в «seed»-области (Pillai et al. 2007).
Кассеты экспрессии полинуклеотида РНКи могут транскрибироваться в клетке с получением малых РНК-«шпилек», которые могут функционировать как миРНК, отдельная смысловая и антисмысловая нить линейной миРНК или микроРНК. Транскрибируемая РНК-полимеразой III ДНК содержит промоторы, выбранные из перечня, включающего: U6-промоторы, H1-промоторы и тРНК-промоторы. Промоторы РНК-полимеразы II включают промоторы U1, U2, U4 и U5, промоторы РНК-«шпильки», промоторы микроРНК и промоторы иРНК.
Перечни известных последовательностей микроРНК можно найти в базах данных, которые поддерживаются исследовательскими организациями, такими как Институт Сенгера (Wellcome Trust Sanger Institute), Центр биоинформатики Пенна (Penn Center for Bioinformatics), Мемориальный онкологический центр им. Слоуна-Кеттеринга (Memorial Sloan Kettering Cancer Center), и Европейская молекулярно-биологическая лаборатория (European Молекулу Biology Laboratory) и другие. Известные эффективные последовательности миРНК и распознаваемые сайты связывания также хорошо представлены в соответствующей литературе. Молекулы РНКи легко конструируют и получают с помощью методов, известных в данной области техники. Кроме того, существуют автоматические инструменты, помогающие найти эффективные и специфические мотивы последовательностей (Pei et al., 2006, Reynolds et al., 2004, Khvorova et al., 2003, Schwarz et al., 2003, Ui-Tei et al., 2004, Heale et al., 2005, Chalk et al., 2004, Amarzguioui et al., 2004).
Полинуклеотиды согласно изобретению могут быть химически модифицированными. Не ограничивающие примеры указанных химических модификаций включают: включение фосфоротиоатных межнуклеотидных связей, 2'-O-метилрибонуклеотидов, 2'-дезокси-2'-фторрибонуклеотидов, 2'-дезоксирибонуклеотидов, нукеотидов с «универсальными основаниями», 5-С-метилнуклеотидов и инвертированного лишенного азотистого основания дезокси-остатка. Показано, что указанные химические модификации при использовании в различных конструкциях полинуклеотидов ингибируют активность полинуклеотида в клетках, в то же время повышая сывороточную стабильность указанных соединений. Химически модифицированные миРНК также могут минимизировать вероятность активации интерферона у людей.
Согласно одному варианту реализации изобретения химически модифицированный полинуклеотид РНКи согласно изобретению содержит дуплекс, включающий две нити, одна или обе из которых могут быть химически модифицированными, где каждая нить содержит от примерно 19 до примерно 29 нуклеотидов. Согласно одному варианту реализации изобретения полинуклеотид РНКи согласно изобретению содержит один или более модифицированных нуклеотидов с сохранением способности опосредовать РНК интерференцию внутри клетки или в воспроизведенной системе in vitro. Полинуклеотид РНКи может быть модифицирован, причем химически модифицированным может быть один или более (например, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) нуклеотидов. Полинуклеотид РНКи согласно изобретению может содержать модифицированные нуклеотиды как процент от общего числа нуклеотидов, присутствующих в полинуклеотиде РНКи. В таком случае полинуклеотид РНКи согласно изобретению может в общем содержать модифицированные нуклеотиды в от примерно 5 до примерно 100% положений нуклеотида (например, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% положений нуклеотида). Действительный процент модифицированных нуклеотидов, присутствующих в конкретном полинуклеотиде РНКи зависит от общего числа нуклеотидов, присутствующих в полинуклеотиде РНКи. Если полинуклеотид РНКи является однонитевым, то процентная модификация может быть основана на общем числе нуклеотидов, присутствующих в указанном однонитевом полинуклеотиде РНКи. Подобным образом, если полинуклеотид РНКи является двунитевым, то процентная модификация может быть основана на общем числе нуклеотидов, присутствующих в смысловой нити, антисмысловой нити или в смысловой и антисмысловой нитях. Кроме того, действительный процент модифицированных нуклеотидов, присутствующих в конкретном полинуклеотиде РНКи, также может зависеть от общего числа пуриновых и пиримидиновых нуклеотидов, присутствующих в полинуклеотиде РНКи. Например, когда все пиримидиновые нуклеотиды и/или все пуриновые нуклеотиды, присутствующие в полинуклеотиде РНКи, являются модифицированными.
Полинуклеотид РНКи модулирует экспрессию РНК, кодируемой геном. Поскольку множество генов могут иметь некоторую степень гомологии по последовательности друг с другом, может быть сконструирован полинуклеотид РНКи, направленный на класс генов с достаточной гомологией по последовательности. Таким образом, полинуклеотид РНКи может содержать последовательность, которая имеет комплементарность с последовательностями, которые содержатся в различных генах-мишенях, или которые являются уникальными для специфического гена-мишени. Таким образом, может быть сконструирован полинуклеотид РНКи, направленный на консервативные участки последовательности РНК, по которой различные гены имеют гомологию, таким образом, направленный на несколько генов в семействе генов (например, различные изоформы генов, сплайс-варианты, мутантные гены и т.д.). Согласно другому варианту реализации изобретения может быть сконструирован полинуклеотид РНКи, направленный на последовательность, которая является уникальной для специфической последовательности РНК одного гена.
Термин «комплементарность» относится к способности полинуклеотида образовывать водородную связь (связи) с другой полинуклеотидной последовательностью либо по классическому уотсон-криковскому типу, либо по неклассическим типам. В случае молекул полинуклеотида согласно настоящему изобретению свободная энергия связывания молекулы полинуклеотида с ее мишенью (эффекторный сайт связывания) или комплементарной последовательностью является достаточной для возможности поддержания соответствующей функции полинуклеотида, например, ферментативного расщепления иРНК или ингибирования трансляции. Способы определение свободных энергий связывания для молекул нуклеиновой кислоты хорошо известно в данной области техники (Frier et al. 1986, Turner et al. 1987). Процентная комплементарность указывает на процент оснований в непрерывной цепи первой молекулы полинуклеотида, которые могут формировать водородные связи (например, по типу спаривания оснований Уотсона-Крика) со второй последовательностью полинуклеотида (например, 5, 6, 7, 8, 9, 10 из 10 являются на 50%, 60%, 70%, 80%, 90% и 100% комплементарными). Абсолютная комплементарность означает, что все основания непрерывной цепи последовательности полинуклеотида образуют водородные связи с таким же числом следующих друг за другом оснований во второй последовательности полинуклеотида.
Под терминами ингибировать, подавлять или снижать экспрессию гена подразумевается, что экспрессия гена, измеренная по уровню РНК, транскрибируемой с указанного гена, или по уровню полипептида, белка или субъединицы белка, транслируемой с указанной РНК, снижается ниже уровня, наблюдаемого в отсутствие ингибирующего конъюгата полинуклеотида согласно изобретению. В результате ингибирования, подавления или снижения экспрессии гена с использованием полинуклеотида, который доставляется с помощью композиций согласно изобретению, уровень экспрессии предпочтительно ниже уровня, наблюдаемого в присутствии контрольной неактивной нуклеиновой кислоты, нуклеиновой кислоты с зашифрованной последовательностью или приводящими к инактивации ошибками или в отсутствие конъюгации полинуклеотида с маскированным полимером.
In vivo введение
В фармакологии и токсикологии способ введения представляет собой путь, по которому лекарственное средство, жидкость, яд или другое вещество приводят во взаимодействие с телом организма. В целом, способы введения лекарственных средств и нуклеиновых кислот для лечения млекопитающих хорошо известны в данной области техники и могут применяться для введения композиций согласно изобретению. Соединения согласно настоящему изобретению могут вводиться с помощью любого подходящего способа, наиболее предпочтительно, парентерально, в композиции, соответствующим образом адаптированной для указанного способа. Таким образом, соединения согласно настоящему изобретению можно вводить путем инъекции, например, внутривенной, внутримышечной, внутрикожной, подкожной или внутрибрюшинной. Соответственно, согласно настоящему изобретению также предложены фармацевтические композиции, содержащие фармацевтически приемлемый носитель или наполнитель.
Парентеральные пути введения включают внутрисосудистые (внутривенные, внутриартериальные), внутримышечные, интрапаренхиматозные, внутридермальные, субдермальные, подкожные, внутриопухолевые, внутрибрюшинные, интратекальные, субдуральные, эпидуральные и внутрилимфатические инъекции, для осуществления которых используют шприц и иглу или катетер. «Внутрисосудистый», В настоящей заявке относится к трубчатой структуре, называемой сосудом, которая связана с тканью или органом внутри тела организма. В полости указанной трубчатой структуры биологическая жидкость течет в направлении к части тела или от нее. Примеры биологических жидкостей включают кровь, спинномозговую жидкость (СМЖ), лимфу или желчь. Примеры сосудов включают артерии, артериолы, капилляры, венулы, синусоидные капилляры, вены, лимфатические сосуды, желчные протоки и протоки слюнных или других экзокринных желез. Внутрисосудистый способ включает доставку через кровеносные сосуды, такие как артерия или вена. Кровеносная система обеспечивает системное распространение фармацевтического средства.
Описанные композиции вводят в фармацевтически приемлемых растворах носителя. Термин «фармацевтически приемлемый» относится к таким свойствам и/или веществам, которые приемлемы для млекопитающего с фармакологической/токсикологической точки зрения. Фраза «фармацевтически приемлемый» относится к молекулярным субстанциям, композициям и свойствам, которые являются физиологически переносимыми и, как правило, не вызывают аллергической реакции или других нежелательных или токсических реакций при введении млекопитающему. Предпочтительно, В настоящей заявке термин «фармацевтически приемлемый» означает одобренный регулирующим федеральным органом или государственным правительством или приведенный в Фармакопее США или другой общепризнанной фармакопее для применения у животных и, более конкретно, у человека.
Конъюгат полинуклеотид РНКи-нацеливающая группа вводят совместно с пептидом доставки. Совместное введение означает, что полинуклеотид РНКи и пептид доставки вводят млекопитающему таким образом, что они присутствуют в теле млекопитающего в одно и тоже время. Конъюгат олигонуклеотид РНКи-нацеливающая группа и пептид доставки можно вводить одновременно, или они могут доставляться последовательно. Для одновременного введения их можно смешивать до введения. Для последовательного введения первым можно вводить конъюгат полинуклеотид РНКи-нацеливающая группа или пептид доставки.
В случае конъюгатов полинуклеотид РНКи-гидрофобная нацеливающая группа конъюгат РНКи можно вводить за 30 минут до введения пептида доставки. Также в случае конъюгатов полинуклеотид РНКи-гидрофобная нацеливающая группа пептид доставки можно вводить за два часа до введения конъюгата РНКи.
В случае конъюгатов полинуклеотид РНКи-нацеливающая группа на основе галактозного кластера конъюгат РНКи можно вводить за 15 минут до введения пептида доставки. Также для конъюгатов полинуклеотид РНКи-нацеливающая группа на основе галактозного кластера пептид доставки можно вводить за 15 минут до введения конъюгата РНКи.
Терапевтический эффект
Полинуклеотиды РНКи можно доставлять в исследовательских целях или для достижения изменения в клетке, которое является терапевтическим. In vivo доставка полинуклеотидов РНКи применима для реагентов исследований и для различных терапевтических, диагностических целей, для подтверждения мишени, исследования генома, генной инженерии и фармакогеномного применения. Авторы настоящего изобретения описали доставку полинуклеотида РНКи, приводящую к подавлению эндогенной экспрессии гена в гепатоцитах. Уровень экспрессии репортерного (маркерного) гена, измеренной после доставки полинуклеотида, дает достаточные основания ожидать близкие значения уровня экспрессии гена после доставки других полинуклеотидов. Уровень после проведения лечения, который считается благоприятным специалистами в данной области техники, различается в зависимости от заболевания. Например, гемофилия А и гемофилия В вызваны дефицитом Х-связанных факторов свертывания VIII и IX, соответственно. На течение указанных болезней сильно влияет доля фактора VIII или IX в сыворотке от нормального уровня: <2%, тяжелая; 2-5%, средней тяжести; и 5-30%, легкая форма. Таким образом, повышение уровня на 1%-2% от нормального уровня циркулирующего фактора у пациентов с тяжелой формой гемофилией может считаться благоприятным. Уровень более 6% приводит к предотвращению спонтанных кровотечений, но не вторичных по отношению к хирургическому вмешательству или повреждению кровотечений. Подобным образом, подавление гена не должно быть 100% для обеспечения терапевтического благоприятного эффекта. Специалист в области генной терапии сможет обоснованно прогнозировать благоприятный уровень экспрессии гена, специфичного для конкретного заболевания, на основе результатов достаточного уровня маркерного гена. В случае гемофилии, если уровень экспрессии маркерных генов с получением белка сравним по объему с 2% от нормального уровня фактора VIII, то имеются достаточные основания ожидать, что ген, кодирующий фактор VIII, также будет экспрессироваться на подобном уровне. Таким образом, репортерные или маркерные гены служат для получения полезного представления об экспрессии внутриклеточных белков в общем.
Печень представляет собой одну из наиболее важных тканей-мишеней для генной терапии, учитывая ее центральную роль в метаболизме (например, метаболизме липопротеинов при различных гиперхолестеринемиях) и секреции циркулирующих белков (например, факторов свертывания крови при гемофилии). Кроме того, распространены приобретенные нарушения, такие как хронический гепатит (например, вирусная инфекция гепатита В) и цирроз, которые также потенциально можно лечить с помощью терапевтического лечения печени на основе полинуклеотидов. Ряд заболеваний или состояний, оказывающие влияние на печень или находящиеся под влиянием печени, потенциально можно лечить путем снижения (подавления) экспрессии гена в печени. Такие заболевания и состояния печени могут быть выбраны из перечня, включающего: рак печени (включая гепатоклеточную карциному, НСС), вирусные инфекции (включая гепатит), метаболические нарушения, (включая гиперлипидемию и диабет), фиброз и острые повреждения печени.
Количество (доза) пептида доставки и конъюгата РНКи-полинуклеотид, которое предполагается вводить, можно определить эмпирическим путем. Авторы показали эффективное снижение экспрессии гена с использованием миРНК-конъюгата в концентрации 0,1-10 мг/кг массы тела животного и пептида доставки в концентрации 5-60 мг/кг массы тела животного. Предпочтительная концентрация для мышей миРНК-конъюгата составляет 0,25-2,5 мг/кг, и пептида доставки - 10-40 мг/кг. Более предпочтительно, пептид доставки вводят в концентрации примерно 12,5-20 мг/кг. Количество конъюгата РНКи-полинуклеотид можно с легкостью увеличивать, так как указанный конъюгат, как правило, не проявляет токсичности в более высоких дозах.
В настоящей заявке «in vivo» означает происходящий внутри организма, и более конкретно, относится к процессу, который осуществляется в живой ткани или на живой ткани целого живого многоклеточного организма (животного), такого как млекопитающее, в отличие от части организма или мертвого организма.
ПРИМЕРЫ
Пример 1. Синтез мелитина.
Все пептиды мелитина получали с использованием стандартных методов синтеза пептидов, известных в данной области техники. Подходящие пептиды мелитина могут состоять из аминокислот только в L-форме, аминокислот только в D-форме (инвертированные). Независимо от формы аминокислот, L- или D-формы, последовательность пептида мелитина может быть обратной (ретро).
Пример 2. Модификация мелитина.
Модификация производных мелитина по амино-концу. Готовили растворы CKLK-мелитин (20 мг/мл), ТСЕР-HCl (28,7 мг/мл, 100 мМ) и MES-Na (21,7 мг/мл, 100 мМ) в dH2O. В пробирке для сцинтилляционного анализа на 20 мл проводили реакцию между смесью CKLK-Мелитин (0,030 ммоль, 5 мл) и ТСЕР-HCl (1,7 молярных эквивалентов, 0,051 ммоль, 0,51 мл) и оставляли перемешиваться при комнатной температуре в течение 30 мин. Затем добавляли MES-Na (2 мл) и воду (1,88 мл) в количестве, достаточном для получения конечных концентраций 10 мг/мл Мелитина и 20 мМ MES-Na. Значение рН проверяли и доводили до рН 6,5-7. Готовили раствор NAG-PEG2-Br (100 мг/мл) в dH2O. Добавляли NAG-PEG2-Br (4,75 экв., 0,142 ммоль, 0,61 мл) и раствор оставляли перемешиваться при комнатной температуре в течение 48 часов.
Альтернативно, в пробирке для сцинтилляционного анализа на 20 мл проводили реакцию между Cys-мелитином (0,006 ммоль, 1 мл) и ТСЕР-HCl (1,7 молярных эквивалентов, 0,010 ммоль, 100 мкл) и оставляли перемешиваться при комнатной температуре в течение 30 мин. Добавляли MES-Na (400 мкл) и воду (390 мкл) в количестве, достаточном для получения конечных концентраций 10 мг/мл Мелитина и 20 мМ MES-Na. Значение рН проверяли и доводили до рН 6,5-7. Готовили раствор NAG-PEG8-Малеимид (100 мг/мл) в dH2O. Добавляли NAG-PEG8-Малеимид (2 экв., 0,012 ммоль, 110 мкл) и раствор оставляли перемешиваться при комнатной температуре в течение 48 часов.
Образцы очищали на колонке Luna (10 мкм, С18 100Å 21,2×250 мм). Буфер А: H2O 0,1% ТФУ, и Буфер В: MeCN, 10% Изопропиловый спирт, 0,1% ТФУ. Скорость потока 15 мл/мин., от 35% А до 62,5% B в течение 20 мин.
Другие модификации по амино-концу осуществляли с использованием такого же способа. Модификации по карбокси-концу осуществляли с использованием пептидов мелитина, содержащих карбокси-концевые цистеины, вместо пептидов мелитина, содержащих амино-концевые цистеины.
Соединения, которые использовали для модификации Cys-мелитина или мелитина-Cys:

N представляет собой целое число от 1 до 120 (молекулярная масса PEG до примерно 5 кДа)

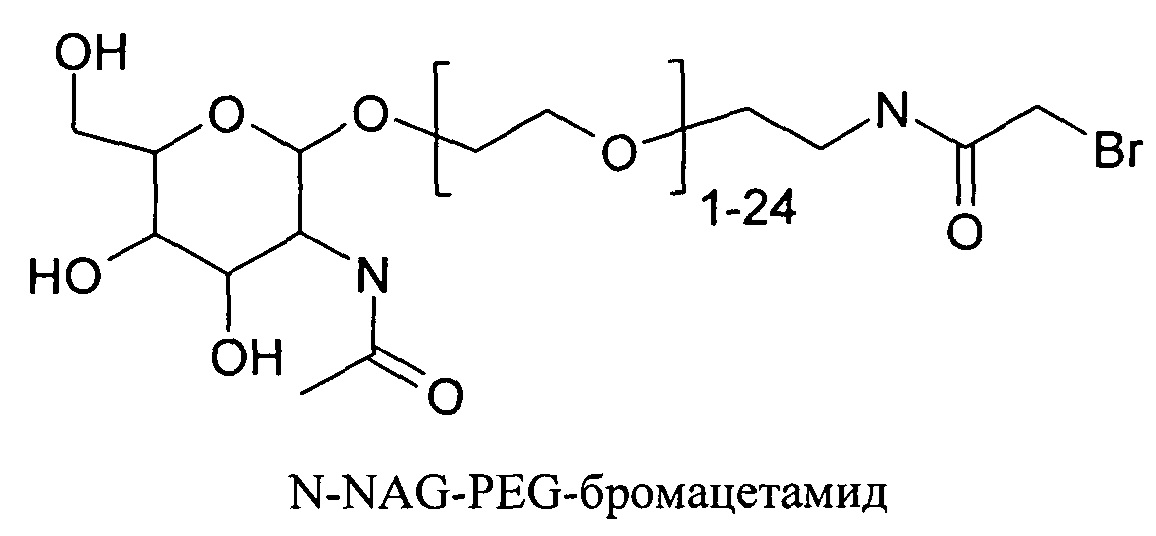
Пептиды, имеющие ацетил-, диметил- стеароил-, миристоил- и PEG-модификации амино- или карбокси-конца, но не концевых цистеиновых остатков, синтезировали на смоле в процессе синтеза пептидов с использованием типичных методов, известных в данной области техники.
Пример 3. Синтез маскирующих агентов.
А. рН-лабильные маскирующие агенты: Синтез пространственного стабилизатора CDM-PEG и направляющей группы CDM-NAG (N-ацетилгалактозамин). К раствору карбоксидиметилмалеинового ангидрида (CDM, 300 мг, 0,16 ммоль) в 50 мл метиленхлорида добавляли оксалилхлорид (2 г, 10 масс. экв.) и диметилформамид (5 мкл). Реакции позволяли продолжаться в течение ночи, после чего удаляли избыток оксалилхлорида и метиленхлорида посредством ротационного выпаривания с получением хлорангидрида CDM. Указанный хлорангидрид растворяли в 1 мл метиленхлорида. К указанному раствору добавляли 1,1 молярных эквивалентов монометилового эфира полиэтиленгликоля (средняя молекулярная масса MW=550) для получения CDM-PEG или (аминоэтокси)этокси-2-(ацетиламино)-2-дезокси-β-D-галактопиранозид (т.е. аминобисэтоксилэтил NAG) для получения CDM-NAG и пиридин (200 мкл, 1,5 экв.) в 10 мл метиленхлорида. Затем раствор перемешивали в течение 1,5 часов. После этого растворитель удаляли и полученное твердое вещество растворяли в 5 мл воды и очищали с помощью обращенно-фазовой ВЭЖХ с использованием градиента 0,1% ТФУ в воде/ацетонитрил.
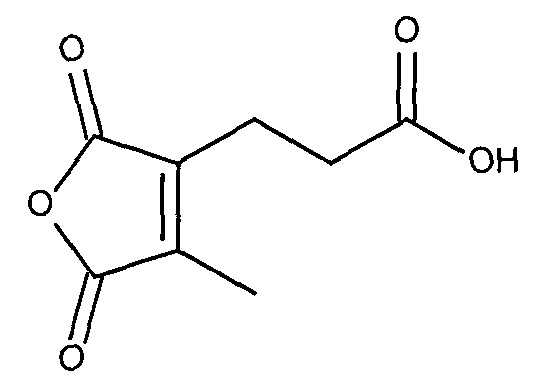

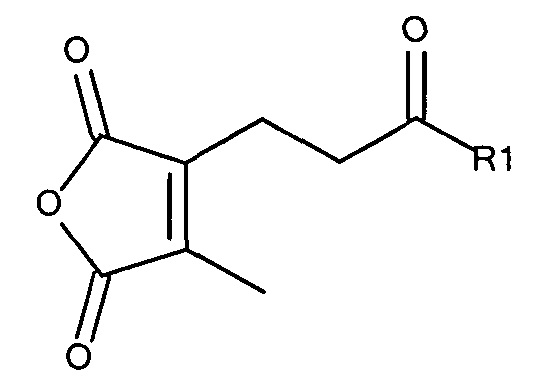
Типичный маскирующий агент, представляющий собой дизамещенный малеиновый ангидрид, R1 содержит нейтральный лиганд ASGPr. Предпочтительно маскирующий агент является незаряженным.

R представляет собой метил или этил, и n представляет собой целое число от 2 до 100. Предпочтительно PEG содержит от 5 до 20 этиленовых звеньев (n представляет собой целое число от 5 до 20). Более предпочтительно, PEG содержит 10-14 этиленовых звеньев (n представляет собой целое число от 10 до 14). PEG может иметь различную длину, и средняя длина составляет 5-20 или 10-14 этиленовых звеньев. Альтернативно, PEG может иметь монодисперсную, гомогенную или дискретную структуру; содержать, например, ровно 11 или 13 этиленовых звеньев.
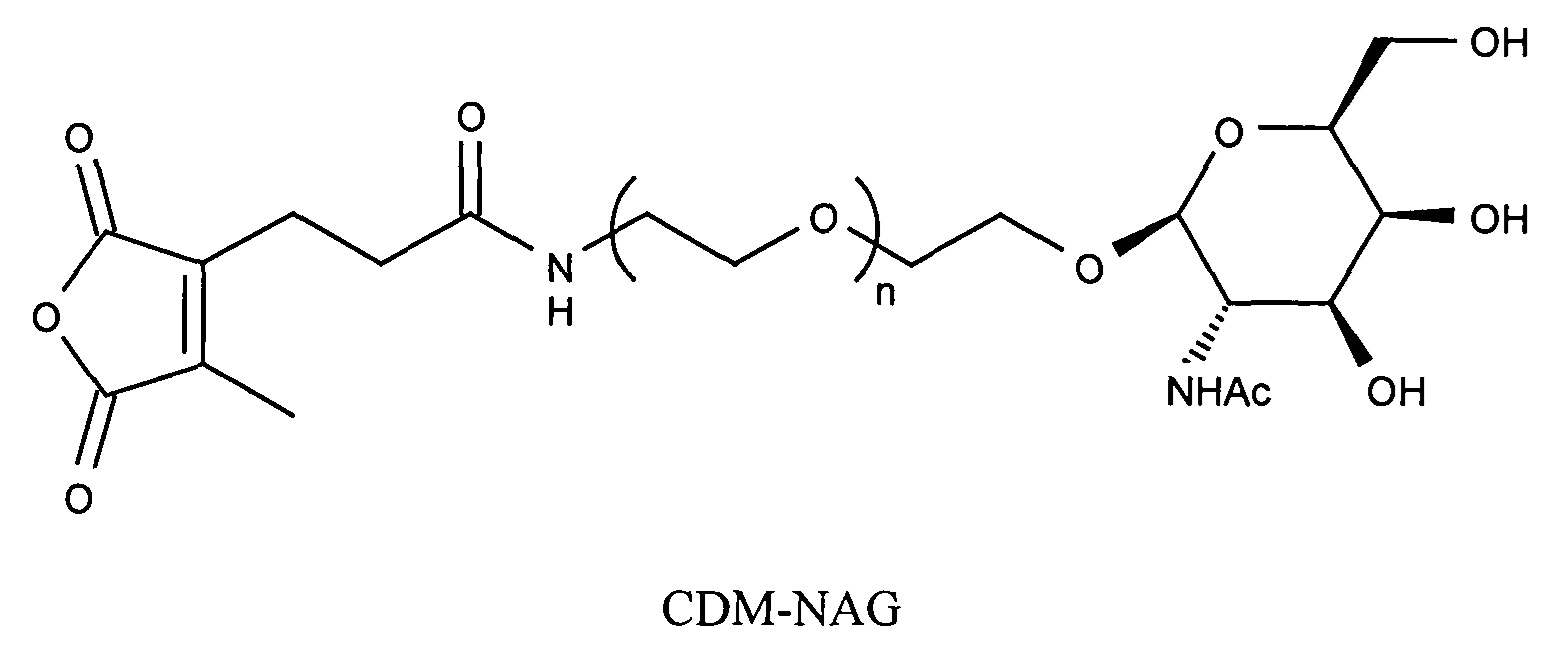
N представляет собой целое число от 1 до 10. Как показано выше, PEG-спейсер может быть расположен между ангидридной группой и лигандом ASGPr. Предпочтительно PEG-спейсер содержит 1-10 этиленовых звеньев.
Альтернативно, может использоваться алкильный спейсер между ангидридом и N-ацетилгалактозамином.

n представляет собой целое число от 0 до 6.
Могут использоваться другие спейсеры или линкеры между ангидридом и N-ацетилгалактозамином. Однако гидрофильный нейтральный (предпочтительно незаряженный) спейсер или линкер является предпочтительным.
В. Поддающиеся расщеплению протеазами (пептидазами) маскирующие агенты. Пептид мелитина также может быть обратимо модифицирован с использованием специальных поддающихся ферментативному расщеплению линкеров. В указанных поддающихся ферментативному расщеплению линкерах используется дипептид, связанный с активированным амидобензилом карбонатным фрагментом. Реакция активированного карбоната с амином пептида приводи к связыванию направленного соединения, такого как лиганд рецептора асиалогликопротеина, с пептидом мелитина через поддающуюся расщеплению пептидазой дипептид-амидобензилкарбаматную связь. Ферментативное расщепление дипептида приводит к отделению нацеливающего лиганда от пептида и инициирует реакцию элиминации, приводящую к восстановлению амина пептида. Синтезировали следующие поддающиеся ферментативному расщеплению линкеры:




Показаны дипептиды Glu-Gly, Ala-Cit, Phe-Cit ("Cit" представляет собой аминокислоту цитруллин). Допустимы другие комбинации аминокислот. Кроме того, 3-5 аминокислот могут использоваться в качестве линкера между амидобензильной группой и нацеливающим лигандом. Также другие активированные карбонаты, известные в данной области техники, легко можно использовать вместо пара-нитрофенола, используемого в указанных выше соединениях.
Пример 4. Обратимая модификация/маскирование мелитина.
А. Модификация маскирующими агентами на основе малеинового ангидрида. До проведения модификации 5× мг маскирующего агента, содержащего дизамещенный малеиновый ангидрид (например, CDM-NAG) лиофилизировали из 0,1% водного раствора ледяной уксусной кислоты. К высушенному указанному маскирующему агенту, содержащему дизамещенный малеиновый ангидрид, добавляли раствор × мг мелитина в 0,2× мл изотонической глюкозы и 10× мг свободного основания HEPES. После полного растворения ангидрида полученный раствор инкубировали в течение по меньшей мере 30 мин при комнатной температуре до его введения животному. В результате реакции маскирующего агента, содержащего дизамещенный малеиновый ангидрид, с пептидом получали:
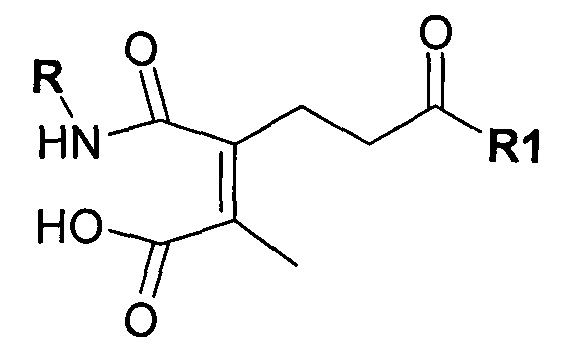
где R представляет собой мелитин, и R1 содержит лиганд ASGPr (например, NAG). Карбоксил-ангидрид, образованный в ходе реакции между ангидридом и полимерным амином, обладает ~1/20 ожидаемого заряда (Rozema et al. Bioconjugate Chemistry 2003). Следовательно, мембраноактивный полимер эффективно нейтрализован, а не превращен в сильно отрицательно заряженный полианион.
В. Модификация с помощью поддающихся расщеплению протеазами маскирующих агентов. 1× мг пептида и 10× мг основания HEPES в концентрации 1-10 мг/мл пептида маскировали путем добавления 2-6× мг амино-реактивных n-нитрофенилкарбонатных или N-гидроксисукцинимидкарбонатных производных NAG-содержащего поддающегося расщеплению протеазами субстрата. Затем раствор инкубировали по меньшей мере в течение 1 часа при комнатной температуре (RT) до введения животным.
Пример 5. миРНК.
миРНК имеют следующие последовательности:
Фактор VII - грызун
смысловая: (Chol)-5' GfcAfaAfgGfcGfuGfcCfaAfcUfcAf(invdT) 3' (Seq. ID 97)
антисмысловая: 5' pdTsGfaGfuUfgGfcAfcGfcCfuUfuGfcdTsdT 3' (Seq. ID 98) или
смысловая 5' GGAUfCfAUfCfUfCfAAGUfCfUfUfACfdTsdT 3' (Seq. ID 99)
антисмысловая 5' GUfAAGACfUfUfGAGAUfGAUfCfCfdTsdT 3' (Seq. ID 100)
Фактор VII = примат
Смысловая (chol)-5' uuAGGfuUfgGfuGfaAfiiGfgAfgCfuCfaGf(invdT) 3' (Seq. ID 101)
Антисмысловая 5' pCfsUfgAfgCfuCfcAfuUfcAfcCfaAfcdTsdT 3' (Seq. ID 102)
АроВ миРНК:
смысловая (cholC6SSC6)-5' GGAAUCuuAuAuuuGAUCcAsA 3' (Seq. ID 103)
антисмысловая 5' uuGGAUcAAAuAuAAGAuUCcscsU 3' (Seq. ID 104)
siLUC
смысловая (chol) 5'-uAuCfuUfaCfgCfuGfaGfuAfcUfuCfgAf(invdT)-3' (Seq. ID 105)
антисмысловая 5'-UfcGfaAfgUfaCfuCfaGfcGfuAfaGfdTsdT-3' (Seq. ID 106)
строчные буквы = 2'-O-СН3 замена
s = фосфоротиоатная связь
f после нуклеотида=2'-F замена
d перед нуклеотидом=2'-дезокси
Синтез РНК осуществляли на твердофазном носителе с помощью стандартного фосфорамидитного метода на приборе AKTA Oligopilot 100 (GE Healthcare, Фрайбург, Германия) с использованием стекла с контролируемым размером пор (CPG) в качестве твердофазного носителя.
Пример 6. Конъюгаты миРНК-направленная молекула.
А. Синтез кластера GalNAc. Направленный на нуклеотид лиганд, содержащий кластер GalNAc, синтезировали, как описано в публикации патента США 20010207799.

В. Конъюгаты кластер GalNAc-миРНК. Кластер GalNAc Примера 6А, выше, конъюгировали с миРНК, как показано на Фиг.2, и как описано ниже.
(1) Соединение 1 (150 мг, 0,082 ммоль, Фиг.2) растворяли в сухом метаноле (5,5 мл) и добавляли 42 мкл метилата натрия (25% раствор в МеОН). Смесь перемешивали в атмосфере аргона в течение 2 часов при комнатной температуре. Добавляли равное количество метанола, а также порции анионообменного материала Amberlite IR-120 для достижения рН ~7,0. Материал Amberlite удаляли посредством фильтрования. Раствор сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Соединение 2 получали с количественным выходом в виде белой пены. ТСХ (SiO2, дихлорметан (ДХМ)/МеОН 5:1+0,1% СН3СООН): Rf 2=0,03; для детектирующего раствора использовали серную кислоту (5%) в МеОН с последующим нагреванием. ИЭР-МС, прямой ввод, отрицательная ионизация; [М-Н]-1рассчитано: 1452,7; [М-Н]1-измерено: 1452,5.
(2) Соединение 2 (20 мг, 0,014 ммоль. Фиг.2) выпаривали совместно с пиридином и дихлорметаном. Осадок растворяли в безводном диметилформамиде (ДМФА, 0,9 мл) и добавляли раствор N-гидроксисукцинимида (NHS) в ДМФА (1,6 мг, 0,014 ммоль) при перемешивании в атмосфере аргона. При 0°С медленно добавляли раствор N,N’-дициклогексилкарбодиимида (DCC) в ДМФА (3,2 мг, 0,016 ммоль). Реакции позволяли нагреваться до комнатной температуры и смесь перемешивали в течение ночи. Соединение 3 использовали без дополнительной очистки для конъюгации с РНК.
(3) Синтез амино-модифицированной РНК. РНК, содержащую С-6-амино-линкер на 5'-конце смысловой нити, получали с помощью стандартного фосфорамидитного метода на твердофазном носителе в объеме 1215 мкмоль с использованием прибора АКТА Oligopilot 100 (GE Healthcare, Фрайбург, Германия) и стекла с контролируемым размером пор в качестве твердофазного носителя. РНК, содержащую 2'-O-метилнуклеотиды, получали с использованием соответствующих фосфорамидитов, 2'-O-метилфосфорамидитов и ТФУ-гексиламинолинкер-амидита. Расщепление и удаление защитных групп, а также очистку проводили с помощью методов, известных в данной области техники (Wincott F., et al, NAR 1995, 23, 14, 2677-84).
Амино-модифицированную РНК характеризовали с помощью анионообменной ВЭЖХ (чистота: 96,1%) и идентичность подтверждали с помощью ИЭР-МС ([М+Н]1+рассчитано: 6937,4; [М+Н]1+измерено: 6939,0. Последовательность: 5'-(NH2C6)GGAAUCuuAuAuuuGAUCcAsA-3'; u,c: 2'-O-метилнуклеотиды соответствующих оснований, s: фосфоротиоат.
(4) Конъюгация кластеров GalNAc с РНК. РНК (2,54 мкмоль), содержащую С-6 амино-линкер на 5'-конце, лиофилизировали и растворяли в 250 мкл буфера на основе бората натрия (0,1 моль/л бората натрия, рН 8,5, 0,1 моль/л KCl) и 1,1 мл ДМСО. После добавления 8 мкл N,N-диизопропилэтиламина (DIPEA) к раствору РНК медленно добавляли раствор соединения 3 (теор. 0,014 ммоль, Фиг.2) в ДМФА при непрерывном перемешивании. Реакционную смесь перемешивали при 35°С в течение ночи. За реакцией следили с помощью ОФ-ВЭЖХ (Resource RPC, 3 мл, буфер: А: 100 мМ ацетат триэтиламмония (ТЕАА, 2,0 М, рН 7,0) в воде. В: 100 мМ ТЕАА в 95% ацетонитриле, градиент: 5% В - 22% B в 20 CV). После осаждения РНК с использованием ацетата натрия (3 М) в EtOH при -20°С конъюгат РНК очищали с использованием условий, описанных выше. Чистые фракции объединяли и желаемое соединение, представляющее собой конъюгат 4, осаждали с использованием смеси ацетат натрия/ЕЮН с получением чистого конъюгата РНК. Конъюгат 4 выделяли с выходом 59% (1,50 мкмоль). Чистоту конъюгата 4 оценивали с помощью анионо-обменной ВЭЖХ (чистота: 85,5%) и идентичность подтверждали с помощью ИЭР-МС ([М+Н]1+рассчитано: 8374,4; [М+Н]1+измерено: 8376,0.
(5) Конъюгат 4 (смысловую нить) гибридизовали с 2'-O-метил-модифицированной антисмысловой нитью. Конъюгат миРНК получали путем смешивания эквимолярного раствора комплементарных нитей в буфере для гибридизации (20 мМ фосфат натрия, рН 6,8; 100 мМ хлорид натрия), нагревали на водяной бане при 85-90°С в течение 3 мин. и охлаждали до комнатной температуры в течение 3-4 часов. Образование дуплексов подтверждали с помощью нативного гель-электрофореза.
C. Конъюгаты гидрофобная группа-миРНК.
(1) Конъюгация миРНК с алкилъными группами. Модифицированную 5'-С10-NHS-эфиром смысловую нить миРНК (NHSC10-миРНК или СОС9-миРНК) получали с использованием модификатора 5'-карбоксигруппы C10-амидита от компании Glen Research (Вирджиния, США). Активированную РНК, все еще присоединенную к твердому носителю, использовали для конъюгации с липофильными аминами, перечисленными в Таблице 1, ниже. 100 мг смысловой нити CPG (нагрузка 60 мкмоль/г, 0,6 мкмоль РНК) смешивали с 0,25 ммоль соответствующего амина, полученного из компании Sigma Aldrich Chemie GmbH (Тауфкирхен, Германия) или Fluka (Sigma-Aldrich, Бухс, Швейцария).
Смесь перемешивали в течение 18 часов при 40°С. РНК отщепляли от твердого носителя и защитные группы удаляли с помощью водного раствора гидроксида аммония (NH3, 33%) при 45°С в течение ночи. 2'-защитную группу удаляли с помощью ТЕА×3HF при 65°С в течение 3,5 часов. Неочищенные олигорибонуклеотиды очищали с помощью ОФ-ВЭЖХ (Resource RPC, 3 мл, буфер: А: 100 мМ ТЕАА в воде. В: 100 мМ ТЕАА в 95% CH3CN, градиент: 3% В - 70% B в 15 CV, за исключением Nr 7: градиент от 3% В до 100% B в 15 CV).
Для получения миРНК но основе однонитевой РНК эквимолярные количества комплементарных смысловых и антисмысловых нитей смешивали в буфере для гибридизации (20 мМ фосфат натрия, рН 6,8; 100 мМ хлорид натрия), нагревали при 80°С в течение 3 мин. и охлаждали до комнатной температуры в течение 3-4 часов. миРНК, направленные против мРНК фактора VII, характеризовали с помощью гель-электрофореза.
(2) Конъюгация миРНК с холестерином - Конъюгаты миРНК-холестерин синтезировали с использованием стандартных методов, известных в данной области техники. Холестерин можно присоединять к 5'- или 3'-концу смысловой или антисмысловой нити миРНК. Предпочтительным является присоединение к 5'-концу смысловой нити миРНК. Конъюгат миРНК-холестерин также можно получать после синтеза миРНК с использованием нитей РНК, содержащих реактивную группу (например, тиол, амин или карбоксил) с помощью стандартных методов, известных в данной области техники.
In Vivo доставка миРНК
Пример 7. Введение полинуклеотидов РНКи in vivo и доставка в гепатоциты. Конъюгаты полинуклеотидов РНКи и маскированных пептидов мелитина синтезировали, как описано выше. Мыши шести-восьминедельного возраста (линия C57BL/6 или ICR, масса каждого животного ~18-20 г) были получены из компании Harlan Sprague Dawley (Индианаполис, Индиана). Мышей содержали по меньшей мере в течение 2 дней до инъекции. Животные имели неограниченный доступ к пище, представляющей собой корм для грызунов Harlan Teklad (Harlan, Мэдисон, Висконсин). Мышам инъецировали 0,2 мл раствора пептида доставки и 0,2 мл конъюгатов миРНК в хвостовую вену. В случае одновременного введения пептида доставки и миРНК конъюгат миРНК добавляли к модифицированному пептиду до инъекции и вводили общее количество. Композиция являлась растворимой и не агрегировала в физиологических условиях. Растворы вводили путем инфузии в хвостовую вену. Предполагается, что инъекции в другие сосуды, например, ретроорбитальная инъекция, являются настолько же эффективными.
Крысы Wistar Han массой 175-200 г были получены из компании Charles River (Уилмингтон, Массачусетс). Крыс содержали по меньшей мере в течение 1 недели до инъекции. Объем инъекции для крыс составлял, как правило, 1 мл.
Определения уровня АроВ в сыворотке. Мышей не кормили в течение 4 часов (16 ч для крыс) до забора сыворотки путем кровопускания из подчелюстной области. У крыс кровь собирали из яремной вены. Уровень белка АроВ в сыворотке определяли с помощью стандартных методов «сэндвич»-ИФА. Вкратце, поликлональные козьи анти-мышиные антитела к АроВ и кроличьи анти-мышиные антитела к АроВ (Biodesign International) использовали в качестве иммобилизированных и идентифицирующих антител, соответственно. После этого наносили конъюгированные с пероксидазой хрена (HRP) козьи анти-кроличьи антитела IgG (Sigma) для связывания комплекса АроВ/антитело. Затем измеряли абсорбцию в ходе колориметрической реакции с тетраметилбензидином (ТМВ, Sigma) с помощью ридера для микропланшетов Tecan Safire2 (Австрия, Европа) при 450 нм.
Измерение активности плазматического Фактора VII (F7). Образцы плазмы животных готовили путем забора крови (9 объемов) (путем кровопускания из подчелюстной области для мышей или из яремной вены для крыс) в центрифужные микропробирки, содержащие 0,109 моль/л антикоагулянта цитрата натрия (1 объем) в соответствии со стандартными методами. Активность F7 в плазме измеряли с помощью хромогенного метода с использованием набора BIOPHEN VII (Hyphen BioMed/Aniara, Мэйсон, Огайо) в соответствии с рекомендациями производителя. Абсорбцию в ходе колориметрического анализа измеряли с помощью ридера для микропланшетов Tecan Safire2 при 405 нм.
Пример 8. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина - Дозозависимый эффект пептида мелитина. Мелитин обратимо модифицировали CDM-NAG, как описано выше. Указанное количество мелитина затем вводили совместно с 200 мкг конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше.
Пример 9. In vivo снижение эндогенного уровня Фактора VII после доставки миРНК АроВ с помощью пептида доставки мелитина у крыс. Указанный мелитин обратимо модифицировали 5× CDM-NAG, как описано выше. Затем указанное количество мелитина, в мг на кг массы тела животного, вводили совместно с конъюгатом холестерин-миРНК Фактора VII в концентрации 3 мг/кг. Эффект на уровень Фактора VII определяли, как описано выше.
Пример 10. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина у мышей, мелитин в L-форме по сравнению с D-формой. Мелитин обратимо модифицировали CDM-NAG, как описано выше. Затем указанное количество мелитина вводили совместно с 50 мкг конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше.
Пример 11. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина у мышей; прямая последовательность по сравнению с обращенной (ретро) последовательностью. Мелитин обратимо модифицировали CDM-NAG (5×), как описано выше. Затем указанное количество мелитина вводили совместно с указанным количеством конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше.
Пример 12. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина у мышей, степень модификации мелитина. Мелитин обратимо модифицировали с помощью указанного количества CDM-NAG, как описано выше. Затем 50 мкг мелитина вводили совместно с 100 мкг конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше.
Процентную модификацию аминов мелитина определяли с помощью TNBS-анализа для свободных аминов пептида. 20 мкг пептида переносили в прозрачный 96-луночный планшет (NUNC 96), содержащий 190 мкл 50 мМ буфера BORAX (pH 9) и 16 мкг тринитробензолсульфоновой кислоты (TNBS). Образцам позволяли реагировать с TNBS в течение ~15 минут при комнатной температуре и затем измеряли A420 с помощью ридера для планшетов Safire. Процент модифицированных аминов рассчитывали следующим образом: (Аконтроль-Аобразец)/(Аконтроль-Апустая лунка)×100. Модификация более 80% аминов обеспечивала оптимальное маскирование и активность мелитина.
Пример 13. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина у мышей; производные пептида мелитина. Пептиды мелитина, содержащие указанную последовательность, обратимо модифицировали CDM-NAG (5×), как описано выше. Затем вводили указанное количество мелитина совместно с указанным количество конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше.
Пример 14. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина у мышей; поддающиеся ферментативному расщеплению маскирующие агенты. Мелитин обратимо модифицировали с помощью указанного количества поддающихся ферментативному расщеплению маскирующих агентов, как описано выше. Затем вводили 200-300 мкг маскированного мелитина совместно с 50-100 мкг конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше. Модифицированный поддающимся расщеплению пептидазой дипептид-амидобензилкарбаматом мелитин являлся эффективным пептидом для доставки миРНК. Предпочтительным является применение пептида мелитина в D-форме в комбинации с поддающимися ферментативному расщеплению маскирующими агентами. Несмотря на то, что требовалось большее количество пептида для такого же снижения уровня гена-мишени, терапевтический индекс был либо не изменен, либо улучшен (по сравнению с тем же пептидом, маскированным CDM-NAG) из-за более стабильного маскирования пептида.
Пример 15. In vivo снижение уровня эндогенного АроВ после доставки миРНК АроВ с помощью пептида доставки мелитина у мышей; пептиды мелитина, модифицированные на амино-конце. Пептиды мелитина, содержащие указанные PEG-модификации на амино-конце, синтезировали, как описано выше. Модифицированные PEG на амино-конце пептиды мелитина затем обратимо модифицировали 5× CDM-NAG, как описано выше. Затем указанное количество мелитина вводили совместно с 100-200 мкг конъюгата миРНК АроВ-холестерин. Эффект на уровень АроВ определяли, как описано выше. Добавление PEG размером менее 5 кДа приводило к снижению токсичности пептидов мелитина. Модификация PEG размером более 5 кДа по амино-концу приводила к снижению эффективности (данные не представлены).
Пример 16. Другие последовательности производных мелитина, которые, как известно, обладают мембранной активностью.
Пример 17. Снижение уровня Фактора VII у приматов после доставки миРНК Фактора VII с помощью пептида доставки мелитина. NAG-PEG2-G1L-мелитин маскировали путем проведения реакции с 10× CDM-NAG, как описано выше. G1L-мелитин маскировали путем проведения реакции с 5× CDM-NAG, как описано выше. На 1 день вводили маскированный NAG-PEG2-G1L-мелитин в концентрации 1 мг/кг, маскированный G1L-мелитин в концентрации 1 мг/кг или маскированный G1L-мелитин в концентрации 3 мг/кг совместно с конъюгатом холестерин-миРНК Фактора VII в концентрации 2 мг/кг приматам макакам-крабоедам (Масаса fascicularis) (самцам, 3,0-8,0 кг). 2 мл/кг вводили в подкожную вену с использованием внутривенного катетера 22-25 калибра. В качестве контроля другой группе приматов вводили G1L-мелитин в концентрации 10 мг/кг совместно с контрольной миРНК, холестерин-миРНК люциферазы, в концентрации 2 мг/кг. В указанные выше моменты времени (обозначенные на Фиг.3-5) собирали образцы крови и проводили исследование на Фактор VII и маркеры токсичности. Кровь собирали из бедренной вены. Приматов не кормили в течение ночи перед всеми заборами крови. Исследования крови на азот мочевины крови (BUN), аланинтрансаминазу (ALT), аспартатаминотрансферазу (AST) и креатинин проводили на приборе Cobas Integra 400 (Roche Diagnostics) в соответствии с рекомендациями производителя. Уровень Фактора VII определяли, как описано выше. Значительное снижение уровня Фактора VII наблюдали при дозе пептида менее 1 мг/кг. При дозе пептида 10 мг/кг пептида не наблюдали значительной токсичности. Таким образом, маскированные пептиды мелитина имели терапевтический индекс 5-10.
Пример 18. Снижение уровня АроВ у приматов после доставки миРНК АроВ с помощью пептида доставки мелитина. G1L-мелитин был маскирован путем реакции с 5× CDM-NAG, как описано выше. На 1 день приматам макакам-крабоедам (Масаса fascicularis) вводили маскированный G1L-мелитин в концентрации 2 мг/кг совместно с миРНК chol-АроВ в концентрации 2 мг/кг. В указанные моменты времени (Таблица 11) собирали образцы крови и проводили исследование на уровень белка АроВ и маркеры токсичности. Исследования крови на азот мочевины крови (BUN), аланинтрансаминазу (ALT), аспартатаминотрансферазу (AST) и креатинин проводили на приборе Cobas Integra 400 (Roche Diagnostics) в соответствии с рекомендациями производителя. Уровень АроВ определяли, как описано выше. Не наблюдалось повышения уровня BUN, креатинина или AST. Наблюдалось только временное несущественное повышение уровня AST на 2 день (1 день после инъекции). Снижение уровня АроВ достигало примерно 100% на 11 день, и уровень оставался низким в течение 31 дня.
Реферат
Изобретение относится к области биотехнологии, конкретно к композиции для направленной доставки представляющего интерес полинуклеотида РНК-интерференции в гепатоциты, и может быть использовано в медицине. Полинуклеотид РНК-интерференции вводят совместно с нацеливающим пептидом мелитина, модифицированным рецепторами асиалогликопротеина (ASGPr), для доставки в клетку печени млекопитающего. Указанные пептиды доставки обеспечивают функциональное проникновение через мембраны клеток печени для возможности перемещения полинуклеотида РНК-интерференции внутрь клеток. 3 н. и 17 з.п. ф-лы, 5 ил., 11 табл., 18 пр.

Комментарии