Комплексы нуклеиновых кислот - RU2568829C2
Код документа: RU2568829C2
Чертежи






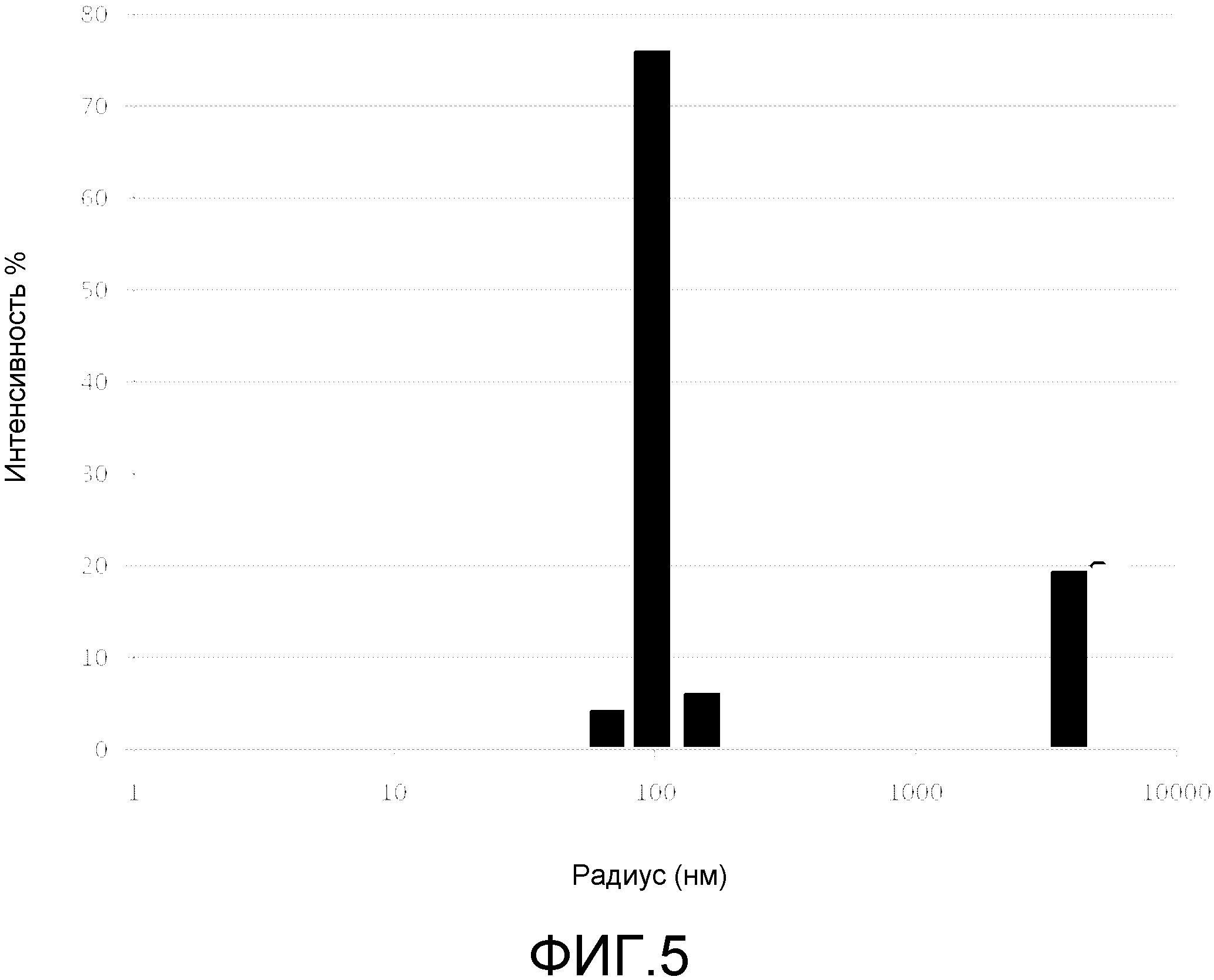

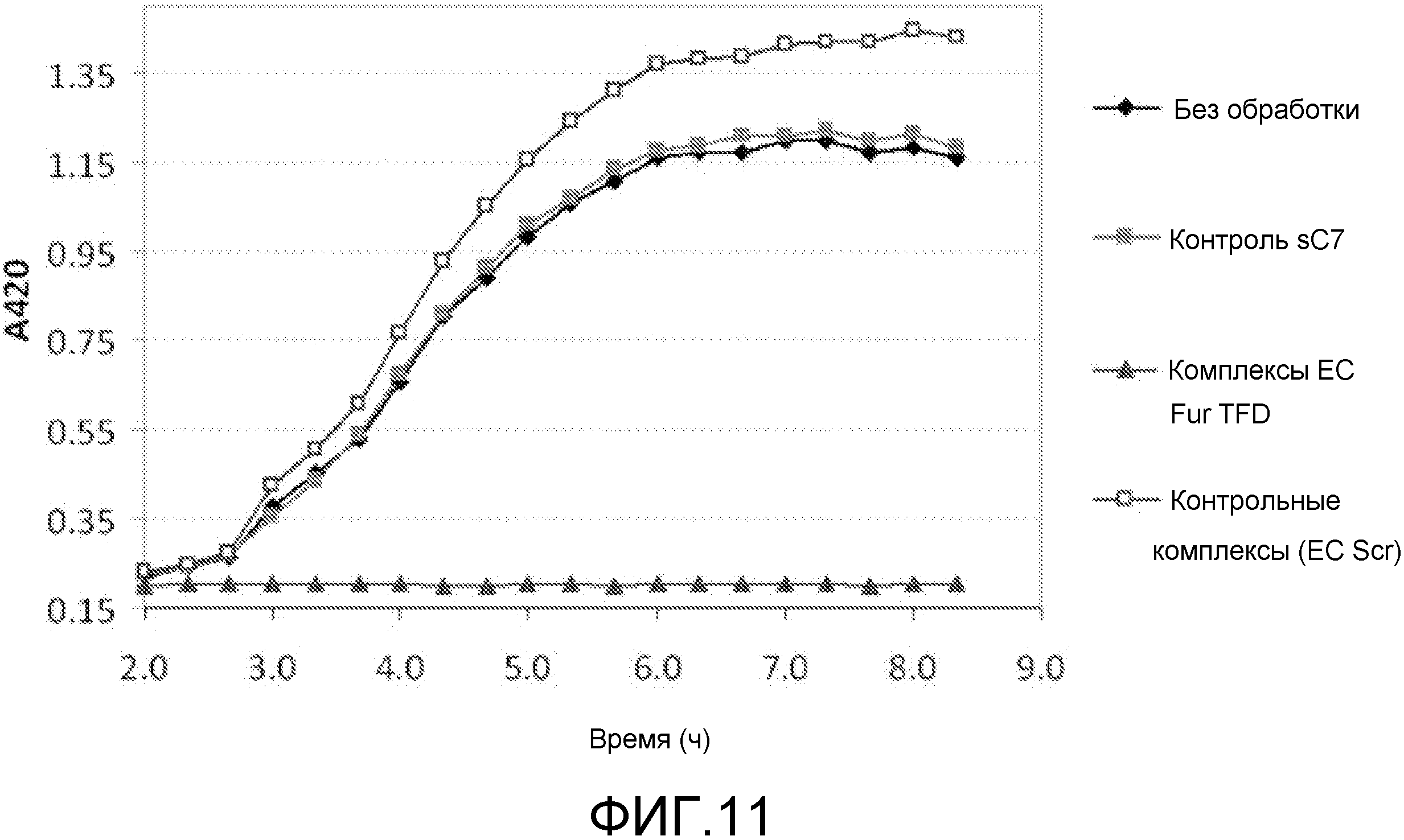
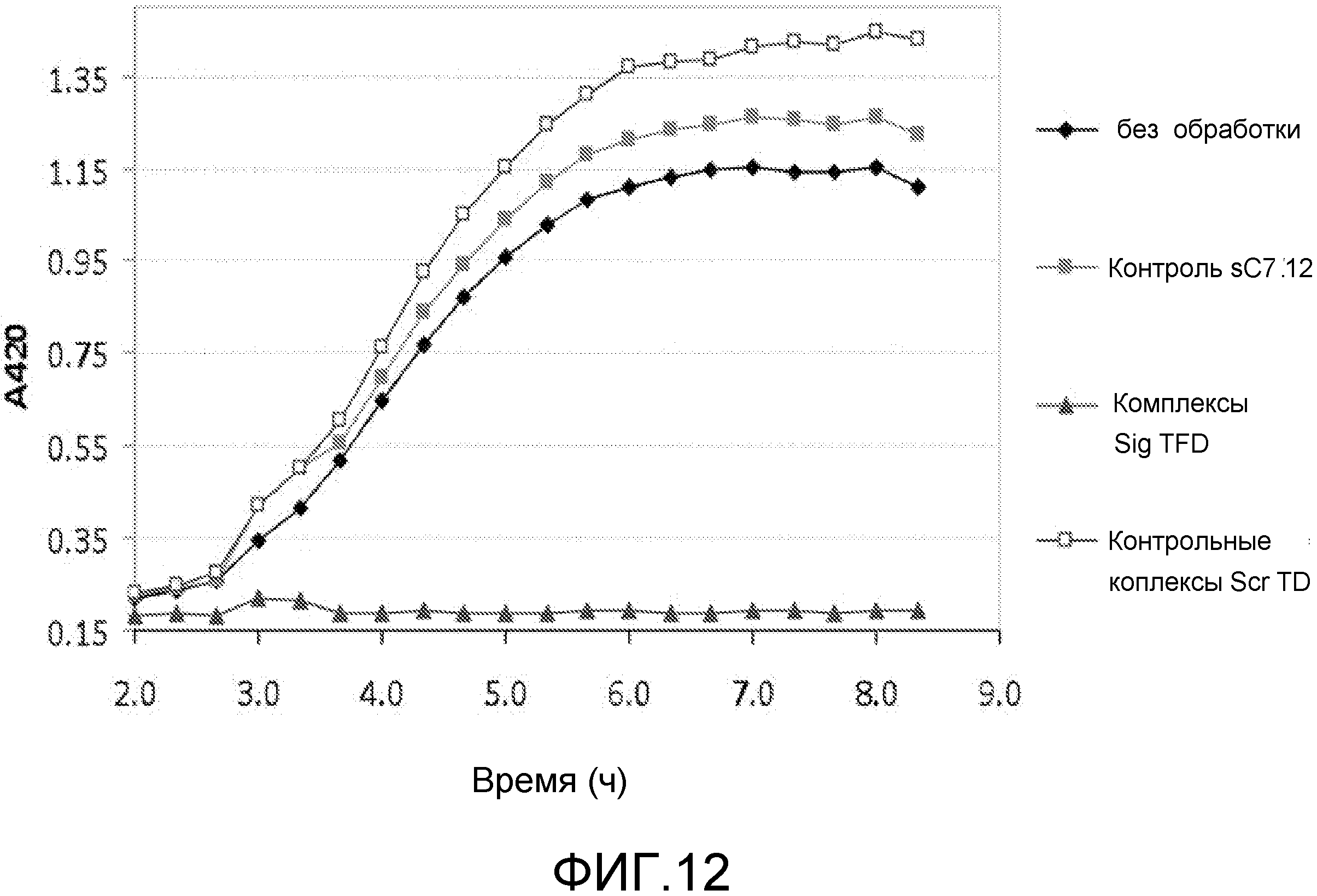
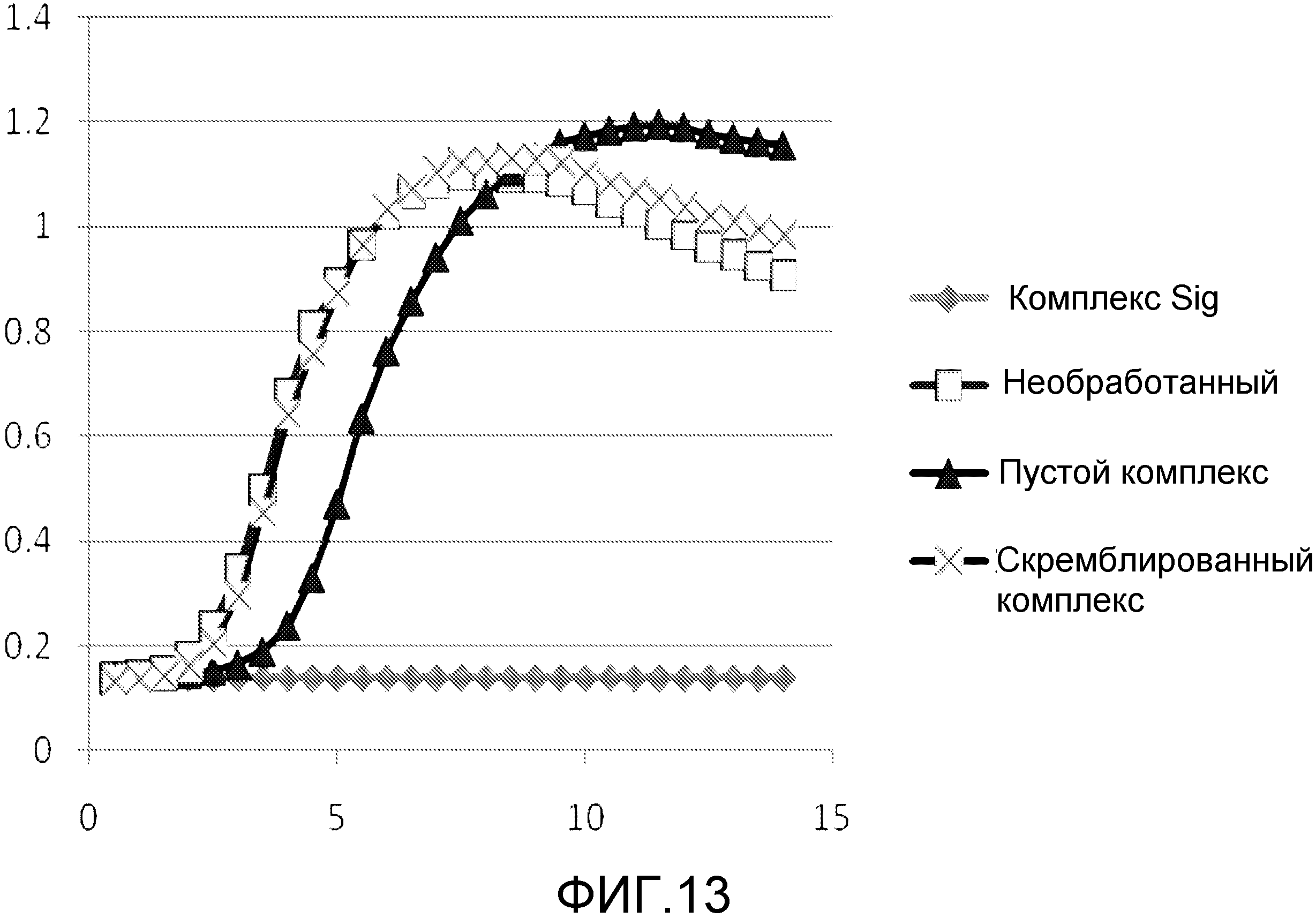
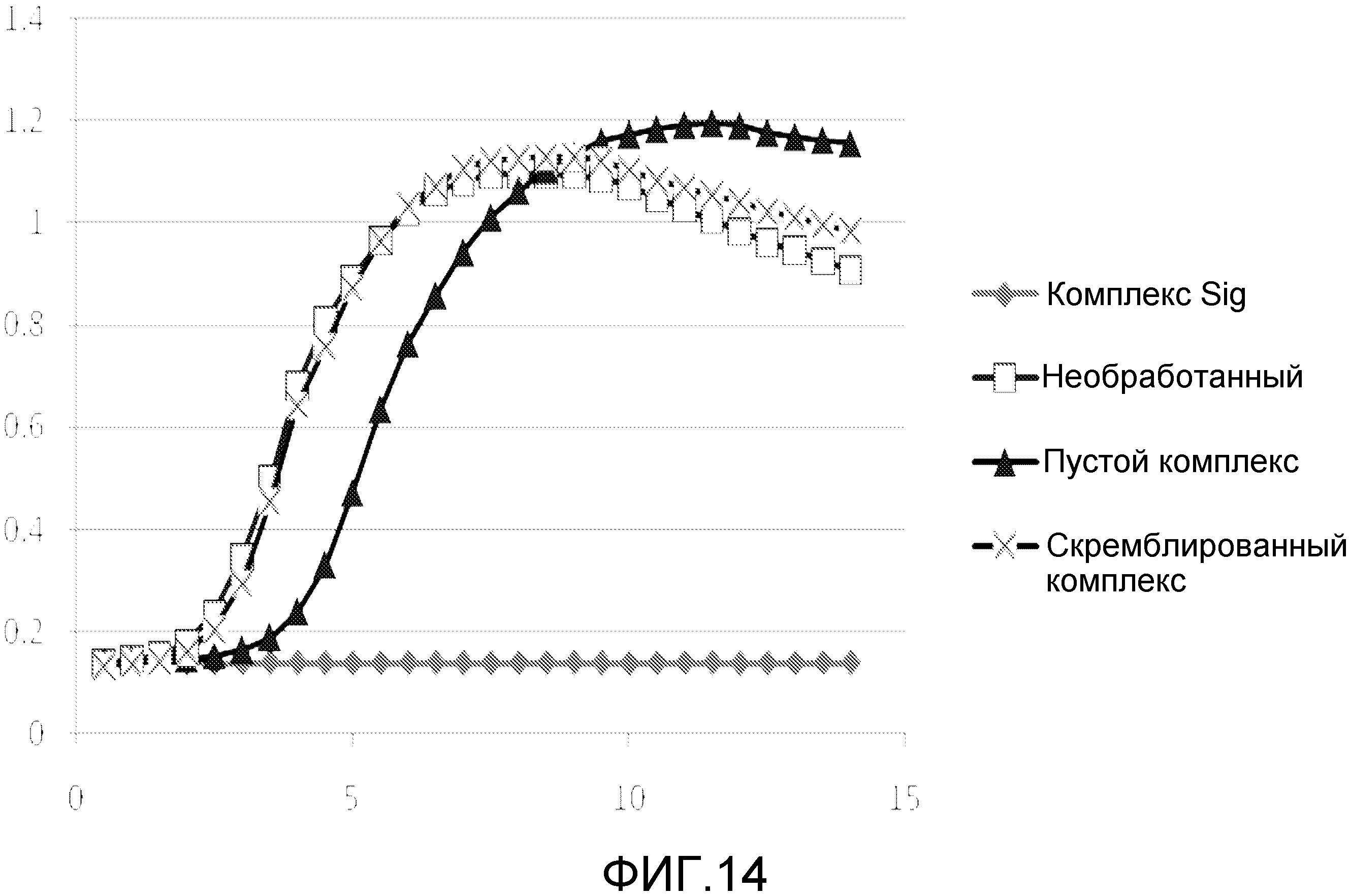
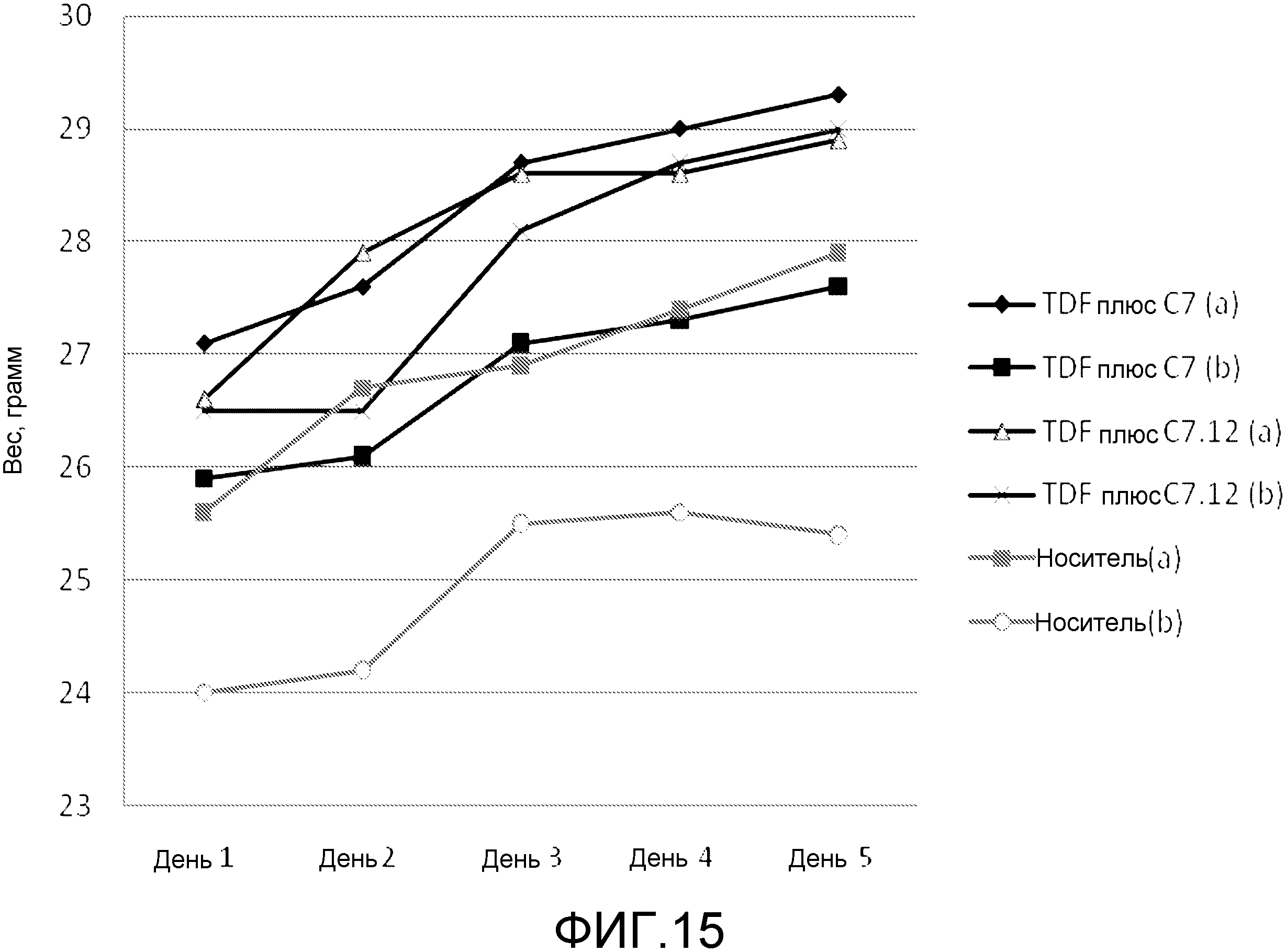
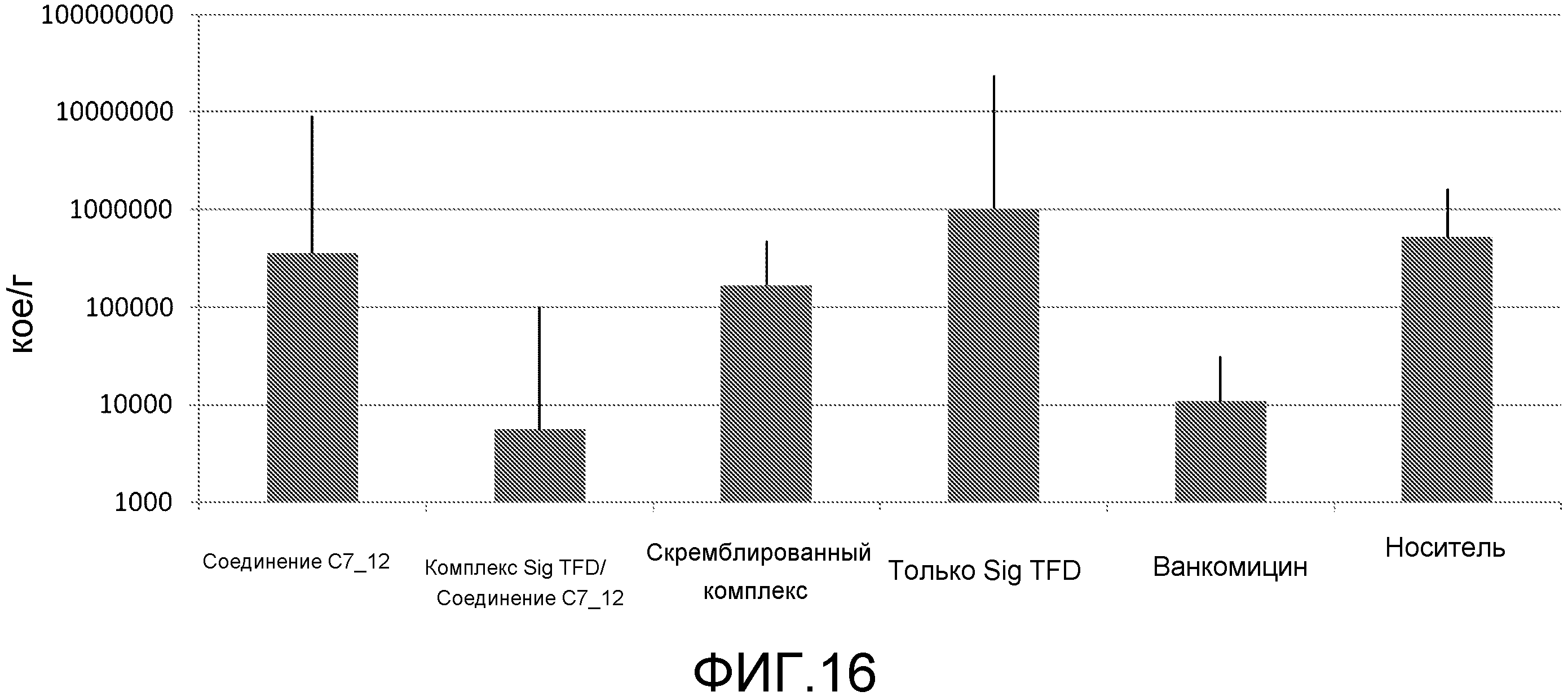
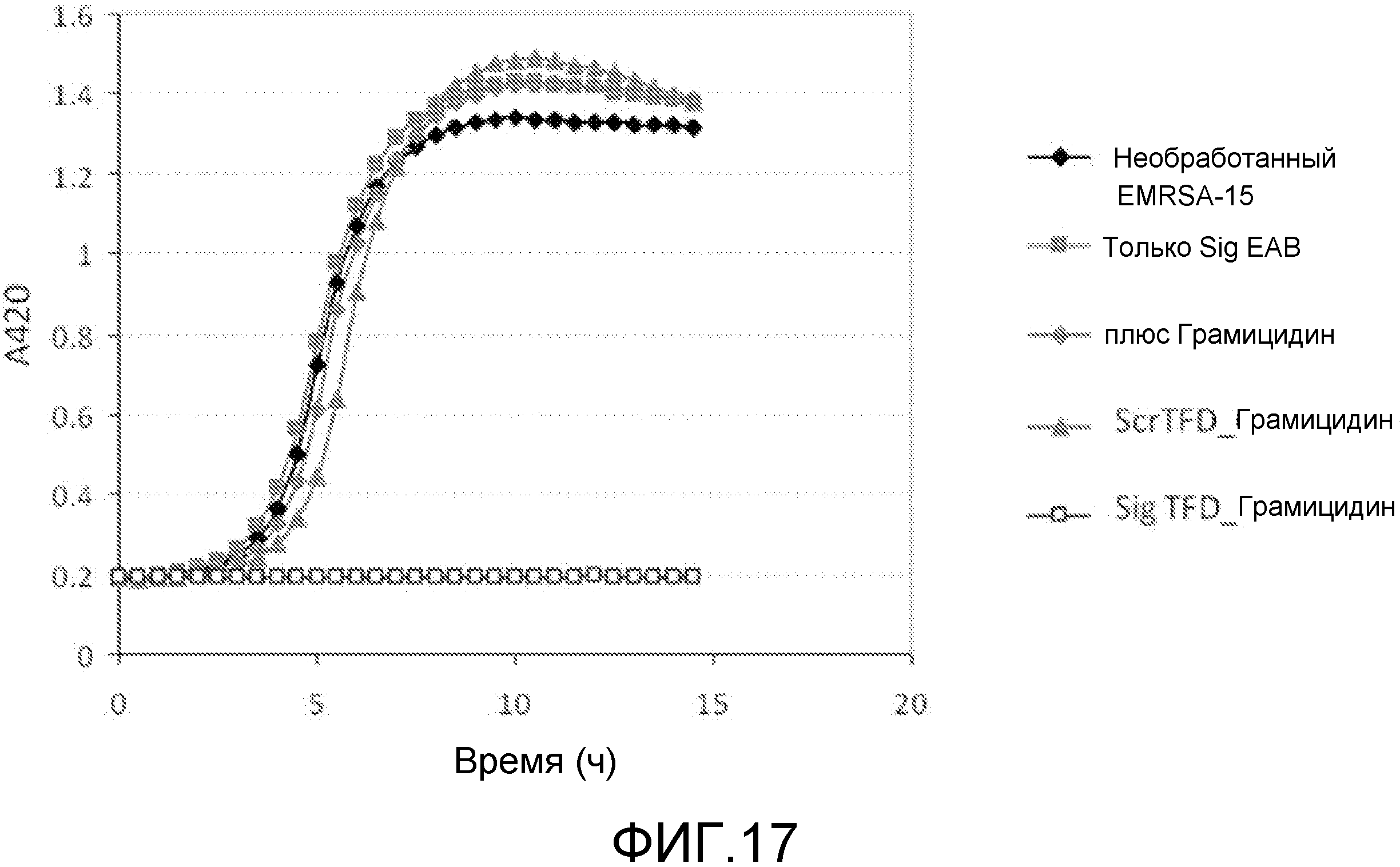
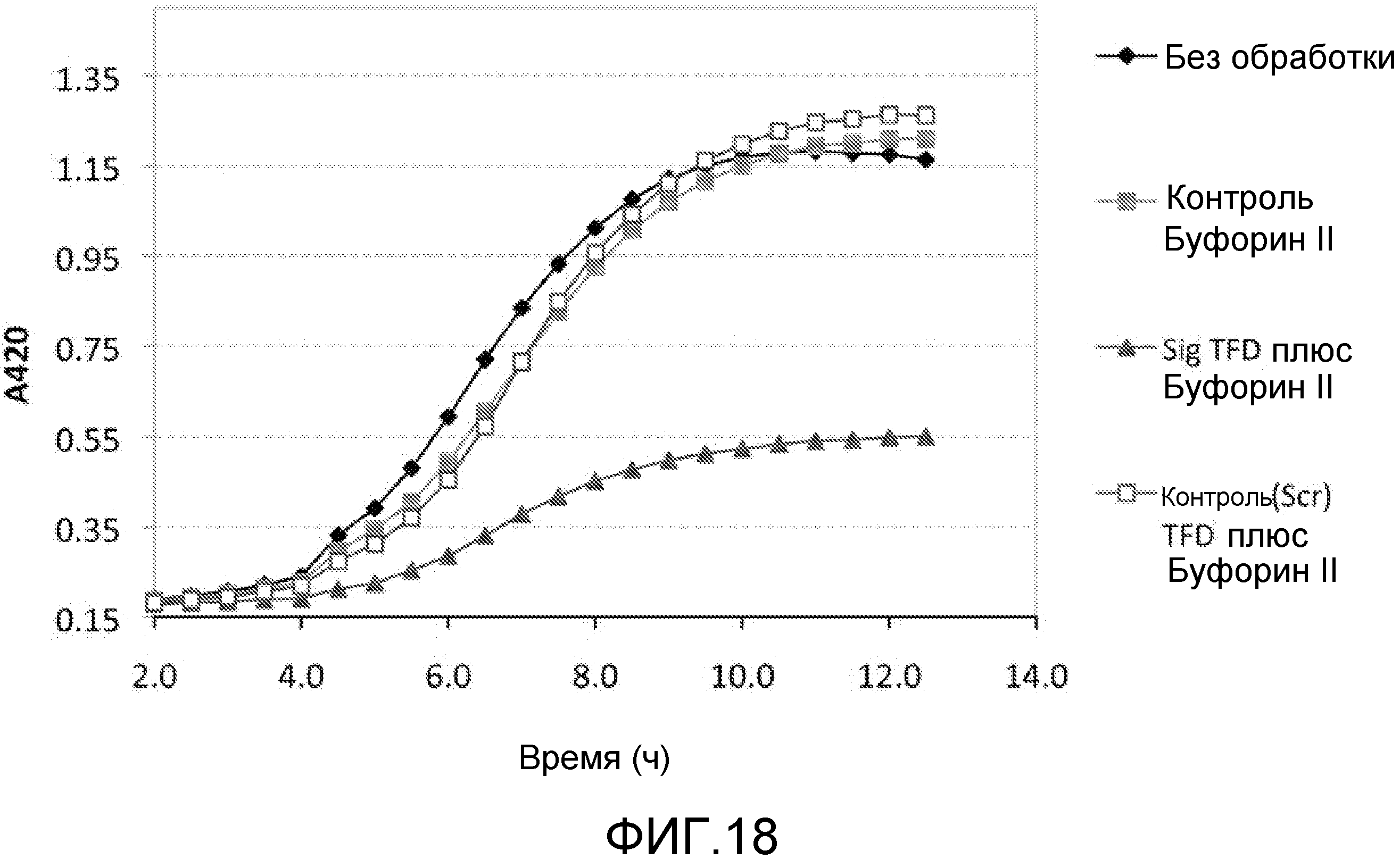
Описание
Настоящее изобретение относится к комплексам последовательностей нуклеиновых кислот. В частности, настоящее изобретение относится к комплексам ловушек факторов транскрипции, к их доставке в бактерии и к их композиции.
Контроль роста и вирулентности бактерий становится все большей проблемой, особенно при медицинском и ветеринарном применении, и может стать главной задачей здравоохранения. В данной области хорошо известно применение антибиотиков против патогенных бактерий. Однако масштабное применение антибиотиков приводит к возникновению бактерий, резистентных по меньшей мере к одному, и в некоторых случаях к нескольким антибиотикам (так называемые штаммы с множественной резистентностью к действию лекарственных средств). Ситуация усложняется уменьшением количества обычно используемых антибиотиков, уже созданных и находящихся в разработке. Действительно, резистентность антибиотиков является основной проблемой антибактериальных исследований и является угрозой для антибиотиков, находящихся в продаже, а также разрабатываемых антибиотиков. Следовательно, существует необходимость в новых антибактериальных средствах, которые могут использоваться для блокирования распространения бактерий и инфекции.
Терапия, основанная на ДНК может решить проблемы, ограничивающие существующую антибактериальную терапию, поскольку она может быть создана для лечения вероятно любого патогена, как путем предотвращения экспрессии генов, кодирующих механизм резистентности к антибиотикам, так и путем ингибирования роста путем модифицирования экспрессии незаменимых или адаптивных генов или оперонов, или путем такого же предотвращения возникновения вирулентности или патогенности. Кроме того, маловероятно, что бактерии выработают резистентность к этим средствам, так как для этого потребуется одновременные мутации, повреждающие фактор транскрипции и его родственный(-ые) сайт(-ы) связывания. Это особенно верно для средств, контролирующих несколько незаменимых генов. Альтернативно, ген может избежать контроля, опосредованного ловушкой фактора транскрипции, за счет мутации, так что ген будет постоянно экспрессироваться. Однако в случае ловушки фактора транскрипции, который действует одновременно на большее число генов, потребуется много таких генов для приобретения мутаций, переключающих их до непрерывной экспрессии, явления, которое считается маловероятным.
Ловушки фактора транскрипции (TFD) являются одним из таких терапевтических средств, основанных на ДНК. Олигонуклеотиды-ловушки разработаны для имитации связывающих сайтов факторов транскрипции и предотвращения связывания последних с их родственными геномными мишенями, с последующей модификацией генной экспрессии (Mann and Dzau (2000) J. Clin. Investigation 106: 1071-1075).
TFD обладают разными преимуществами по сравнению с другими терапевтическими средствами, основанными на ДНК. Механизм их действия является простым и прогнозируемым - они контролируют генную экспрессию за счет секвестирующих факторов транскрипции, предотвращая связывание последних с промоторами за счет заполнения клетки достаточным количеством копий специфических связывающих последовательностей (отсюда термин «ловушки»). Это противоположно антисмысловому принципу, где мишени трудно определить из-за сложной вторичной структуры иРНК. По сравнению с антисмысловыми способами, TFD имеют дополнительные преимущества, поскольку они действуют быстро, предупреждая экспрессию генов, тогда как антисмысловые способы имеют дело с последовательностями экспрессии. В результате, TFD являются эффективными при гораздо более низких концентрациях, поскольку одно взаимодействие фактора TFD-транскрипции может блокировать транскрипцию одного гена, который другими словами может дать начало многим тысячам копий иРНК, которые создают мишени для антисмыслового подхода.
К другим терапевтическим средствам, основанным на ДНК, относятся плазмиды, содержащие трансгены - для генной терапии, олигонуклеотиды - для применения в качестве антисмысловых и антигенных средств (Crooke S.T. (1998) Antisense Nucleic Acid Drug Dev. 8: 115-122), рибозимы, ДНКзимы, аптамеры и малые интерферирующие РНК (миРНК) (Stull R.A. et al (1995) Pharm Res. 12: 465-483; Patil S.D. and Burgess D.J. (2003) AAPS Newsmagazine 6: 27). Хотя большинство лекарственных средств, основанных на ДНК, находятся в доклинической разработке или на начальных этапах клинических испытаний, этот класс соединений, появившийся в последние годы, представляет чрезвычайно перспективные средства для лекарственной терапии широкого ряда заболеваний, включая рак, СПИД, неврологические расстройства, такие как болезнь Паркинсона и болезнь Альцгеймера, и сердечнососудистые расстройства.
Однако доставка терапевтических средств, основанных на ДНК, включая TFD, остается сложной задачей. Клеточные мембраны являются одним из главных препятствий, встречающихся при доставке больших гидрофильных терапевтических средств, таких как белки или нуклеиновые кислоты. Большинство попыток решить эту проблему направлено на доставку в эукариотические клетки, для разработки эффективных методов терапий для лечения рака человека, и тому подобного. В эукариотах различные клеточные компартменты (включая ядро) защищены биологическими мембранами, которые разделяют различные клеточные компартменты и предотвращают приток и отток растворов из клеток и органелл. Хотя эти барьеры являются важными для сохранения клетки, они представляют собой серьезную проблему при попытке доставить терапевтические средства в клетку или в определенные органеллы внутри клетки.
Большинство катионов не могут проникать через клеточные мембраны без специальных систем носителей из-за большого барьера свободной энергии, который представляет гидрофобная внутренняя часть мебраны. Для селективного накопления и сохранения в клетке, катионным соединениям необходима достаточная липофильность и делокализация их положительных зарядов для снижения изменения свободной энергии при движении из водной в гидрофобную среду. Это позволяет соединению пассивно пересекать плазматическую и митохондриальную мембраны и накапливаться в ответ на мембранный потенциал.
Транспорт белков в эукариотические клетки, в основном, опосредован эндоцитозом. Это высокоорганизованная транспортная система, в которой большие полярные молекулы абсорбируются при захвате в клеточную мембрану. Фагоцитоз и пиноцитоз являются нерецептор-опосредованными формами эндоцитоза, тогда как рецептор-опосредованный эндоцитоз является более специфичным активным явлением, где цитоплазматическая мембрана складывается вовнутрь с образованием окаймленных ямок. В этом случае белки или другие инициирующие частицы зажимают рецепторы/лиганды в плазматической мембране клетки или за счет неспецифического взаимодействия с поверхностью клетки, например, за счет зарядных взаимодействий. И только потом эти частицы захватываются. Эти внутренние почкующиеся везикулы почкуются с образованием цитоплазматических везикул.
Разработаны различные методики для переноса биологически активных молекул через эти барьеры in vivo и in vitro. Электропорация и микроинъекции являются грубыми и неподходящими к применению in vivo, поскольку эти способы вызывают разрушение клеточной мембраны до того, как вещества могут быть введены в клетку, и поэтому они ограничены небольшим количеством клеток.
Хотя применение внутриклеточных путей является привлекательным, один из существенных недостатков заключается в неизбежности выхода эндосом до появления лизосомальной активности. Липосомное инкапсулирование и рецептор-опосредованный эндоцитоз также ограничены их недостатком нацеленности и низким выходом доставки. Большинство исследовательских работ, проведенных на сегодняшний день, направлено на доставку молекул миРНК к эукариотическим клеткам. Обычно используется подход формирования липосом или комплексов с ковалентно присоединенными мишеневыми пептидами, которые направляют терапевтическое средство к соответствующей мишени внутри клетки.
Существует много факторов при выборе липидного компонента для такого механизма доставки. Липид-подобный компонент обычно является катионным и выполняет три функции:
1. конденсация нуклеиновой кислоты для того, чтобы доставка была более достижима;
2. защита нуклеиновой кислоты от деградации нуклеазами или неспецифической абсорбции белками плазмы и так далее, и
3. защита отрицательного заряда фосфатного скелета.
Третий пункт может быть преодолен при использовании синтетических скелетов с пониженным зарядом или без заряда.
Кроме того, для липосом или комплексов требуются определенные оптимальные физические свойства:
1. Хорошая резистентность, как в солевых, так и в биологических жидкостях. Это может быть количественно определено ξ-потенциалом, который измеряет притяжение или отталкивание между частицами.
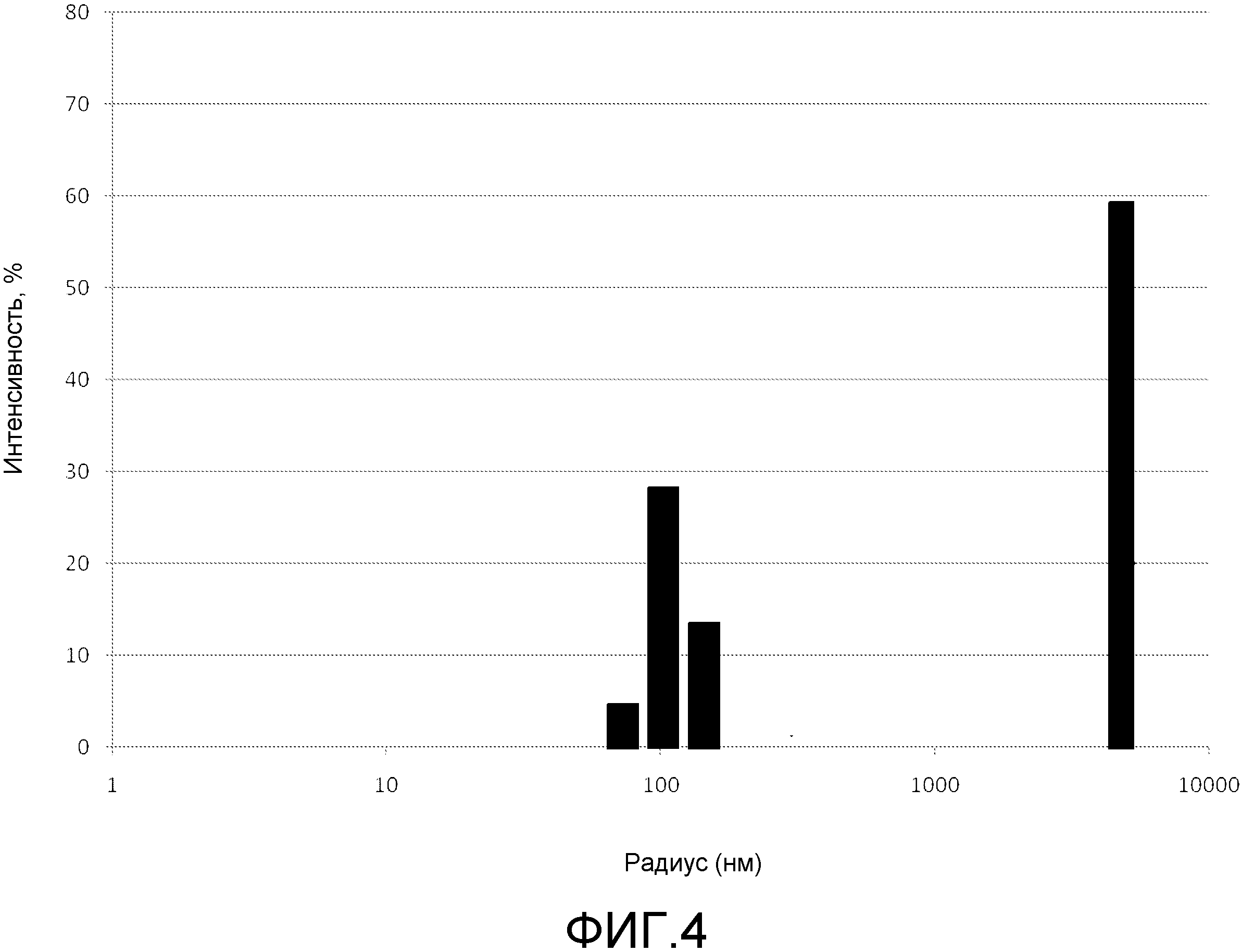
2. Ограниченное распределение частиц по размеру, для бактерий идеально между 50 и 100 нм;
3. Низкая токсичность, хотя большинство агентов трансфекции (липиды, липофильные катионы) проявляют умеренные уровни токсичности;
4. Практичные для производства, включая такие вопросы, как стоимость товаров.
Известно, что пептиды, используемые для эукариотической доставки, обычно пермеабилизируют мембраны, проникают в клетку через специфические рецепторы на клетках-мишенях или просто являются катионными (например, поли-аргинин). Использование пептидов со свойствами проникновения в клетку имеет несколько преимуществ, которые в основном связаны с различными модификациями, которые могут быть сделаны с пептидной последовательностью. Это позволяет создавать носители, направляющие различные клеточные субдомены и/или способные переносить различные типы грузов.
Классом мембранных перемещающих агентов являются пептиды, проникающие в клетку (CPP). Помимо того, что они являются мягким и эффективным средством достижения различных клеточных органелл in vitro, CPP используются для клеточной доставки некоторых агентов in vivo, с многообещающими результатами.
CPP обычно состоят менее, чем из 30 аминокислот, имеют суммарный положительный заряд и обладают способностью перемещать через плазматическую мембрану и переносить некоторые различные грузы внутрь цитоплазмы и ядра, по-видимому, не зависимо от энергии. Перемещение возникает за счет пока неизвестного механизма, на который не влияют различные ингибиторы эндоцитоза или низкие температуры (Langel, Ü., ed. (2002) Cell-Penetrating Peptides, Processes and Applications, CRC Press).
Термин CPP включает синтетические пептиды, проникающие в клетку, домены трансдукции белков и последовательности, перемещающие через мембрану, все из которых способны перемещаться через клеточную мембрану и получать доступ к внутренней части клетки.
Другие классы пептидов со способностью воздействовать на доставку, особенно в бактерии, являются пептидами с антибактериальными свойствами. Они включают антимикробные пептиды (AMP), пептиды, проникающие в клетку (CPP), пептиды, которые синтезируются вне рибосом, и гликопептиды. Все эти типы пептидов указаны в настоящем документе как антибактериальные белки (ABP).
АМР могут быть получены из бактериальных источников, в этом случае они называются бактериоцины, или из эукариотических источников, включая человека, амфибий, насекомых и так далее. АМР, представляющие особый интерес, являются теми, которые способны увеличивать проницаемость биологических мембран или обладают способностью перемещаться через мембраны для достижения их внутриклеточных мишеней. АМР обычно подразделяются на пять различных индивидуальных подгрупп на основании структурного сходства (Brogden, 2005 Nat. Rev. Microbiol. 3: 238-250):
1. Анионные пептиды представляют собой маленькие пептиды, обычно связанные в комплексы с цинком, и являются активными против грамотрицательных и грамположительных бактерий;
2. Линейные катионные α-спиральные пептиды (такие как буфорин), которые имеют менее 40 аминокислот в длину, имеют недостаток цистеина и характеризуются центральной шарнирной областью между двумя альфа-спиральными областями;
3. Катионные пептиды, которые обогащены определенными аминокислотами, такие как пролин- и аргинин-обогащенные апидаецины.
4. Анионные и катионные пептиды, образующие складчатые бета-слои за счет образования дисульфидных связей между цистеиновыми группами;
5. Анионные и катионные пептиды, которые являются фрагментами более крупных белков.
Механизмы действия AMP на микробное разрушение, являются различными и не ограничиваются какими-либо определенными подгруппами. Большинство из них убивают бактерии за счет образования пор в их мембранах, что приводит к тому, что клетка становится проницаемой. Предполагается, что существует три различных механизма пермеабилизации, которые могут быть как особым свойством пептида, так и действием концентрации используемого пептида:
1. Образование тороидальных пор за счет, например, магаинина, мелиттина;
2. Образование покрытия, например, из дермасептина S, цекропина или мелиттина;
3. Образование «бочарных клепок», например, при помощи аламетицина.
Некоторые АМР были описаны для случаев, когда конечная мишень не являлась мембраной, но была внутриклеточной по своей природе, вызывая необходимость переноса АМР через мембрану. Эта способность к переносу является особенно интересной, поскольку эти пептиды или синтетические пептиды, смоделированные на их основе, могут использоваться для доставки различных грузов, таких как терапевтические средства. Поэтому эти АМР могут быть классифицированы в соответствии с их способом внутриклеточного разрушения.
1. Связывание нуклеиновых кислот, например, буфорин, буфорин II и аналоги, и тахиплесин;
2. Флокуляция внутриклеточного содержимого, например, при помощи анионных пептидов;
3. Образование перегородок, например, микроцин 25;
4. Синтез клеточных стенок, например, мерсацидин;
5. Ингибирование синтеза нуклеиновых кислот, например, при помощи плевроцидина и дермасептина;
6. Ингибирование синтеза белков, например, при помощи плевроцидина и дермасептина;
7. Ингибирование ферментативной активности, например, апидаецин.
Пептиды, синтезированные вне рибосом, могут различаться структурно. Часто они являются циклизованными или разветвленными, содержат нестандартные аминокислоты или аминокислоты, которые были модифицированы для получения гидроксиаланина или гидроксисерина, и могут подлежать гидроксилированию, галогенированию или гликозилированию (Walsh et al. (2004) Science 303:1805-1810). Большинство этих пептидов ингибирует рост бактерий за счет пермеабилизации их мембран.
Задачи доставки пептидов и нуклеиновых кислот в бактерии аналогичны задачам, встречающимся в случае эукариотических клеток, но компоненты клеток являются различными. В частности, бактерии не обладают эндоцитозным механизмом для облегчения поступления терапевтического средства внутрь клетки. Однако очевидное преимущество в том, что бактерии не имеют ядерного компартмента, поэтому достаточно доставить терапевтическое средство в цитоплазму, чтобы получить доступ к бактериальному геному. Поэтому необходимо разрабатывать альтернативы системам эукариотической доставки. Сюда входит поиск путей получения доступа в клетку за счет пермеабилизации мембран(-ы). В лабораторных условиях доставка ДНК в клетки (трансфекция) достигается обработкой клеток анионными буферами, разрушающими клеточные мембраны за счет взаимодействия с распределением заряда, наиболее часто буферами, содержащими ионы кальция. Альтернативно, используется электропорация, когда клетки готовят в буферах с низкой проводимостью, и используются высокие напряжения для создания переходных пор в бактериальных мембранах некоторых клеток, хотя далеко не всех, что приводит к трансфекции меньшинства клеток.
Несомненно, использовать способ доставки ДНК терапевтических средств в бактерии в моделях на животных или в клинических условиях неудобно. Трансфекция in vivo может быть достигнута конъюгацией терапевтического средства с синтетическим катионным пептидом или АВР, разрушающим мембраны и обуславливающим вход через образующиеся поры или экструзии. Кроме того, способность некоторых АВР перемещать через мембраны является другой альтернативой разработки надежной стратегии доставки.
Исходя из эукариотической модели использования доставки пептидов, оптимальные характеристики бактериальной доставки пептидов включают:
1. бактериальную специфичность/предпочтительность, оптимизированную для прокариотов, по сравнению с эукариотами;
2. низкую вероятность появления стабильности. Катионные пептиды, например, могут быть резистентны за счет MRSA, который изменяет плотность заряда его внешней мембраны;
3. активность широкого спектра для использования в качестве основной системы доставки в бактерии; и
4. низкую токсичность для реципиента или ее отсутствие.
Точно так же, использование липид-подобных транспортных молекул должно быть приспособлено для специфического строения бактериальной мембраны. Например, грамотрицательные бактерии имеют наружную и внутреннюю мембрану, обе из которых нужно преодолеть перед доставкой терапевтического средства в бактерию.
На этом фоне настоящее изобретение представляет решение для составления композиции и доставки последовательностей нуклеиновых кислот, таких как TFD, в бактерии.
Конкретно, настоящее изобретение относится к антибактериальному комплексу, содержащему последовательность нуклеиновых кислот и одну или несколько групп доставки. Изобретатели обнаружили, что группы доставки, которые сами по себе обладают некоторой антибактериальной активностью, являются оптимальными. В частности, группа или группы доставки должны проявлять синергетический антибактериальный эффект при сочетании с последовательностью нуклеиновых кислот. Другими словами, комбинация группы доставки и последовательности нуклеиновых кислот должна демонстрировать улучшенное антибактериальное действие по сравнению с действием последовательности нуклеиновой кислоты или группы доставки по отдельности.
Группа доставки может быть выбрана из четвертичных аминных соединений и бис-аминоалканов и их ненасыщенных производных, где термин «аминоалканы», используемый в настоящем документе, относится к аминогруппам (предпочтительно, третичным аминогруппам), которые образуют часть гетероциклического кольца.
Примерами таких соединений являются соединения формулы (I):
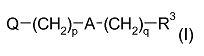
где Q выбран из:
(а) группы Q1, имеющей формулу:
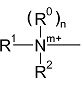
группы Q2, Q2-NH-, Q2-О- или Q2-S-, где Q2 выбран из моноциклических, бициклических и трициклических гетероароматических групп из 5-14 членов, из которых 1, 2 или 3 являются гетероатомными членами кольца, выбранными из N, O и S, при условии, что присутствует по меньшей мере один азотный кольцевой член, где гетероароматические группы необязательно замещены одним или двумя заместителями R4a, и где указанный один азотный кольцевой член может образовывать N-оксид или может быть замещен С1-4 алкилом, фенил-С1-4 алкилом или ди-фенил-С1-4 алкилом с образованием четвертичной группы, где фениловые группы в каждом случае необязательно замещены одним или двумя галогенами, метил или метокси-группами;
m равен 0 или 1;
n равен 0 или 1;
p и q являются одинаковыми или различными, и каждый является целым числом от 1 до 12;
А является связью или выбран из нафталина, бифенила, терфенила, фенантрена, флуорена, стильбена, группы C6H4(CH)rC6H4, группы C6H4-C≡C-C6H4, группы пиридин-2,6-диил-бис(бензол-1,4-диил), группы CH=CH-(CH2)s-(CH=CH)t-; и группы C≡C-(CH2)u-(C≡C)v-; где r равен 0-4, s равен 0-4, t равен 0 или 1; u равен 0-4 и v равен 0 или 1;
если n равен 1, то каждый из R0, R1 и R2 выбран из С1-4 алкила; и если n равен 0, то N, R1 и R2 вместе образуют моноциклическую, бициклическую или трициклическую гетероароматическую группу из 5-14 кольцевых членов, из которых один является атомом азота N, и 0, 1 или 2 других гетероатомных кольцевых члена выбраны из N, O и S, и где гетероароматическая группа необязательно замещена одним или более заместителями R4b; и R3 выбран из водорода, С1-4 алкила, галогена, моноциклических карбоциклических групп из 3-7 кольцевых членов, каждый необязательно замещен одни или двумя заместителями R4c, группы Q; группы -NH-Q2, группы -O-Q2 и группы -S-Q2; и R4a, R4b и R4c являются одинаковыми или различными и каждый выбран из С1-4 алкила, необязательно замещенного одним или более атомами фтора; С1-4 алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- и ди-С1-4 алкиламино; галогена; фенил-С1-2 алкила, где фениловая группа необязательно замещена одним или двумя метокси, метиловыми или галогеновыми заместителями; уреидо и гуанидинила.
В одном предпочтительном варианте Q является группой Q1:
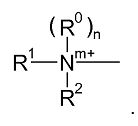
Соответственно, одна из предпочтительных подгрупп соединений в рамках формулы (I) представлена формулой (II):
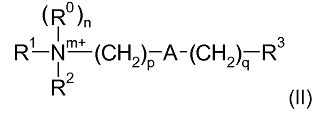
где R1, R2, m, p, A, q и R3 являются такими, как определено в отношении формулы (I).
Одна предпочтительная подгруппа соединений в рамках формулы (II), где R3 является Q1 и n в каждом случае равен 0, может быть представлена формулой (III):
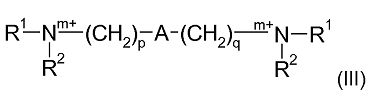
где R1, R2, m, p, A и q являются такими, как определено в отношении формулы (I).
В соединениях формул (I), (II) и (III), где m равен 1, атом азота N должен быть четвертичным азотом. Соответственно, соединения формул (I), (II) и (III), где m равен 1, включают один или более анионов в качестве противоионов, например, анионов, полученных из неорганических кислот, сульфоновых кислот и карбоновых кислот.
Если N, R1 и R2 вместе образуют моноциклическую, бициклическую или трициклическую гетероароматическую группу из 5-14 кольцевых членов, то обычно эта группа содержит атом азота N в качестве единственного гетероатомного кольцевого члена или содержит второй гетероатомный кольцевой член, выбранный из N, O и S.
Если N, R1 и R2 вместе образуют моноциклическую, бициклическую или трициклическую гетероароматическую группу, то атом азота N образует часть ароматического кольца. Предпочтительные гетероароматические группы являются моноциклическими ароматическими кольцами; бициклическими гетероциклическими кольцами, в которых оба кольца являются ароматическими; бициклическими гетероциклическими кольцами, в которых одно азотсодержащее кольцо является ароматическим, а другое кольцо является неароматическим; и трициклическими кольцами, в которых два кольца, включая азотсодержащее кольцо, являются ароматическими, а другое кольцо является неароматическим.
Если N, R1 и R2 вмести образуют моноциклическую, бициклическую или трициклическую гетероциклическую группу из 5-14 кольцевых членов, то эта гетероциклическая группа, предпочтительно, выбрана из хинолина; изохинолина; акридина; тетрагидроакридина и его кольцевых гомологов; пиридина; бензоимидазола; бензоксазола и бензотиазола. Под кольцевыми гомологами тетрагидроакридина подразумеваются соединения, содержащие центральную структуру:
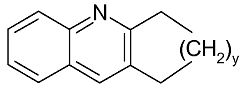
где y равен 1 или 3. Под тетрагидроакридином подразумевается соединение, имеющее центральную структуру, показанную выше, где y равен 2.
В предпочтительном варианте группа доставки является четвертичным производным хинолина или акридина, в частности, 1,2,3,4-тетра-гидро-9-амино-акридином. Подходящие производные 1,2,3,4-тетра-гидро-9-амино-акридина описаны в публикации US 3519631, содержание которой включено в настоящее описание в качестве ссылки. Особый интерес представляют соединения и формулы, представленные в Примерах 17-25 публикации US 3519631 и их аналоги. Подходящими производными хинолина являются соединения бис-хинолиния, такие как деквалиний и его аналоги.
Деквалиний (Фигура 1) является соединением бис-хинолиния, проявляет умеренное антимикробное действие и используется на протяжении 30 лет в качестве противомикробного средства в безрецептурных жидкостях для полоскания рта, местных мазях, пероральных и вагинальных красках и таблетках от ангины. Он является местным бактериостатином и также исследовался как ингибитор кальциевых каналов, как противогрибковое средство (Ng et al. (2007) Bioorg. Medicinal Chem. 15: 3422-3429), как ингибитор туберкулеза (Guiterrez-Lugo et al. (2009) J. Biomol. Screen. 14: 643-652) и как ингибитор протеинкиназы С (PKC; Abeywickrama et al. (2006) Bioorg. Medicinal Chem. 14: 7796-7803).
Деквалиний также используется для доставки терапевтических средств, основанных на ДНК и традиционных лекарственных средств, таких как пакситол, в митохондрии в экспериментах in vitro. В этих экспериментах деквалиний получали как боласомы способом сухой пленки. То есть деквалиний растворяли в органическом растворителе, таком как метанол, высушивали до конца в вакууме и повторно суспендировали в водном растворе, который затем обрабатывали ультразвуком для образования боласом, которые затем смешивали с ДНК для формирования комплексов. Показано, что эти комплексы способны доставлять ДНК в митохондрии по механизму, который предположительно включает конденсацию комплексов с внешней мембраной митохондрии (Weissig and Torchilin 2001 Adv. Drug Delivery Rev. 49:127-149; Weissig et al. 2001 J. Control. Release 75: 401-408). Хотя структура мембраны митохондрии не эквивалентна структуре, встречающейся в бактериях, они похожи. Это увеличивает вероятность того, что деквалиний может быть пригоден для доставки терапевтических средств в бактерии в условиях in vivo. Однако комплексы, образованные с деквалинием, являются нестабильными во времени в присутствии физиологических буферов и биологических буферов, и нестабильными к разбавлению.
Поэтому в особенно предпочтительном варианте этот комплекс включает аналоги деквалиния. Таким образом, можно разработать соединение деквалиния, которое обладает улучшенной стабильностью (как при разбавлении, так и в присутствии солей), и которое обладает похожей или улучшенной характеристикой токсичности, по сравнению с деквалинием. Был описан такой аналог, который образует более стабильные комплексы (Соединение 7, Galanakis et al. [J. Med. Chem. (1995) 35: 3536-3546]), которые были проанализированы по различным физико-химическим параметрам, таким как способность связывать ДНК до исключения флуоресцентного красителя SYBR-зеленого, размер образованных частиц, измеренный по динамическому рассеянию света и визуализированный электронной микроскопией, и их стабильность при повышенных концентрациях соли и при разбавлении и хранении в течение продолжительных периодов (Weissig et al. (2001) S. T. P. Pharma Sciences 11: 91-96).
Примерами деквалиния и его аналогов являются соединения формулы (IV):
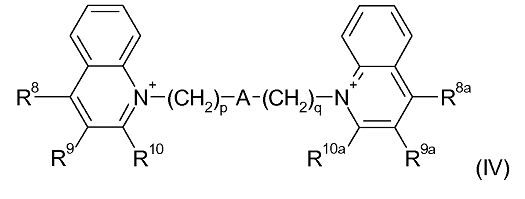
где:
p и q являются одинаковыми или различными, и каждый является целым числом от 1 до 12;
А является связью или выбран из нафталина, бифенила, терфенила, фенантрена, флуорена, стильбена, группы C6H4(CH)rC6H4, группы C6H4-C≡C-C6H4, группы пиридин-2,6-диил-бис(бензол-1,4-диил), группы CH=CH-(CH2)s-(CH=CH)t-; и группы C≡C-(CH2)u-(C≡C)v-; где r равен 0-4, s равен 0-4, t равен 0 или 1; u равен 0-4 и v равен 0 или 1;
R8, R9 и R10 являются одинаковыми или различными и каждый выбран из водорода; С1-4 алкила, необязательно замещенного одним или более атомами фтора; С1-4 алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- и ди-С1-4 алкиламино; галогена, фенил-С1-2 алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5; и R8a, R9a и R10a являются одинаковыми или различными и каждый выбран из водорода, С1-4 алкила, необязательно замещенного одним или более атомами фтора; С1-4 алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- или ди-С1-4 алкиламино; галогена, фенил-С1-2 алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
В рамках формулы (IV), одна подгруппа соединений является подгруппой, в которой А является связью, группой CH=CH-(CH2)s-(CH=CH)t; или группой C≡C-(CH2)u-(C≡C)v-. В рамках этой подгруппы, предпочтительно, А является связью, то есть, существует насыщенная алкиленовая цепь, находящаяся между атомами азота и двумя хинолиновыми кольцами.
Если А является связью, то обычно сумма p и q находится в диапазоне 3-22, предпочтительно, в диапазоне 6-20 и, более предпочтительно, 8-18. Отдельными примерами являются соединения, в которых p+q=8, или p+q=9, или p+q=10, или p+q=11, или p+q=12, или p+q=13, или p+q=14, или p+q=15, или p+q=16, или p+q=17, или p+q=18.
В каждом из вышеупомянутых вариантов и подгруппах соединений, каждый из R8 и R8a, предпочтительно, выбран из водорода; С1-4 алкокси; нитро; амино; моно- и ди-С1-4 алкиламино; и гуанидинила.
Более предпочтительно, каждый из R8 и R8a выбран из водорода; С1-4 алкокси; амино и гуанидинила.
Еще более предпочтительно, каждый из R8 и R8a выбран из метокси и амино.
В одном из вариантов оба R8 и R8a являются амино.
В другом варианте оба R8 и R8a являются метокси.
В другом варианте оба R8 и R8a являются гуанидинилом.
В каждом из вышеупомянутых вариантов и подгрупп соединений, предпочтительно:
R9 является водородом;
R9a является водородом;
R10 выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
R10a выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
и/или
R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
Более предпочтительно:
R9 является водородом;
R9a является водородом;
R10 выбран из водорода; амино; метила и трифторметила;
R10a выбран из водорода; амино; метила и трифторметила;
или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
и/или
R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
В одной особенно предпочтительной группе соединений в рамках формулы (IV):
А является связью;
сумма p и q находится в диапазоне 8-18;
каждый из R8 и R8a выбран из водорода; С1-4 алкокси; амино и гуанидинила;
R9 является водородом
R9a является водородом;
R10 выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
R10a выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
и/или
R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
В другой особенно предпочтительной группе соединений в рамках формулы (IV):
А является связью;
сумма p и q находится в диапазоне 8-18;
каждый из R8 и R8a является гуанидинилом;
R9 является водородом;
R9a является водородом;
R10 выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
R10a выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
и/или
R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
В другой особенно предпочтительной группе соединений в рамках формулы (IV):
А является связью;
сумма p и q находится в диапазоне 8-18;
каждый из R8 и R8a выбран из водорода, С1-4 алкокси и амино;
R9 является водородом;
R9a является водородом;
R10 выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
R10a выбран из водорода; амино; и С1-4 алкила, необязательно замещенного одним или более атомами фтора;
или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
и/или
R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
В рамках этой группы более предпочтительными являются соединения, в которых:
А является связью;
сумма p и q находится в диапазоне 8-18;
каждый из R8 и R8a выбран из водорода, метокси и амино;
R9 является водородом;
R9a является водородом;
R10 выбран из водорода; амино; метила и трифторметила;
R10a выбран из водорода; амино; метила и трифторметила;
или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
и/или
R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5.
В рамках формулы (IV) одна предпочтительная группа соединений может быть представлена формулой (V):
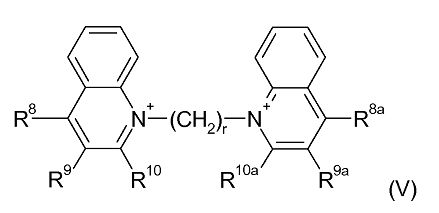
где:
r является целым числом от 2 до 24;
R8, R9 и R10 являются одинаковыми или различными и каждый выбран из водорода; С1-4 алкила, необязательно замещенного одним или более атомами фтора; С1-4 алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- и ди- С1-4 алкиламино; галогена, фенил-С1-2 алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5; и R8a, R9a и R10a являются одинаковыми или различными и каждый выбран из водорода, С1-4 алкила, необязательно замещенного одним или более атомами фтора; С1-4 алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- или ди-С1-4 алкиламино; галогена, фенил-С1-2 алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 3-5;
при условии, что:
(i) если оба R10 и R10a являются водородом или оба являются метилом, и оба R9 и R9a являются водородом, то по меньшей мере один из R8 и R8a является отличным от водорода, амино или диметиламино; и
(ii) если R10 и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 4, и R9 и R9a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 4, то по меньшей мере один из R8 и R8a является отличным от амино.
Предпочтительно, r является целым числом от 8 до 20, более предпочтительно, 10-18, например, любым числом из 10, 12, 13, 14, 15, 16, 17 и 18.
В одной группе соединений в рамках формулы (V), R8 и R8a выбраны из метокси и гуанидинила. В рамках этой группы соединений R9 и R9a обычно оба являются водородом, и R10 и R10a обычно выбраны из водорода, метила, трифторметила и амино.
В другой группе соединений в рамках формулы (V), R8 и R8a выбраны из водорода, амино, моно- и ди-С1-4 алкиламино; метокси и гуанидинила; оба R9 и R9a являются водородом, и оба R10 и R10a являются трифторметилом.
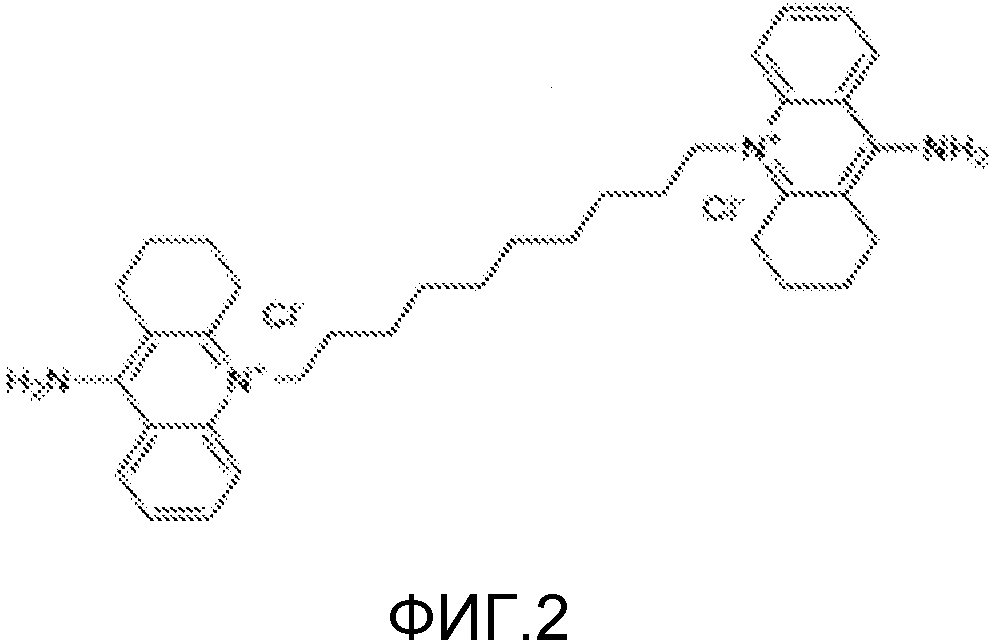
В другом варианте осуществления аналог может быть 10,10'-(декан-1,10-диил)бис(9-амино-1,2,3,4-тетрагидроакридиний)дихлоридом (Фигура 2). Это соединение упоминается в настоящем описании как Соединение 7 из-за его исходного обозначения в публикации Galanakis et al. (J. Med. Chem. (1995) 35: 3536-3546), где оно исследовалось как возможный ингибитор кальциевых каналов. Затем это соединение испытывалось в качестве средства доставки ДНК-терапевтических средств в митохондрии (Weissig et al. (2001) S. T. P. Pharma Sci. 11: 91-96), и в этой публикации была отмечена полезная стабильность комплексов, образованных аналогом Соединения 7. В следующей публикации (Weissig et al. (2006) J. Liposome Res. 16: 249-264) описано, что аналоги Соединения 7 обладают более низкой токсичностью in vitro по сравнению с деквалинием.
Аналоги деквалиния с более длинными алкиловыми цепями демонстрируют еще более низкую токсичность, были рассмотрены аналоги с различной длиной цепи (Weissig et al. (2006) J. Liposome Res. 16: 249-264). Так, предпочтительно, алкиловая цепь аналога деквалиния имеет 8-14 метиловых групп, но с примерами цепей, содержащих лишь 3 метиловых группы (Galankis et al. (1996) J. Med. Chem. 39: 3592-3595) и другими липофильными катионами, содержащими целых 36 метиловых групп в алкиловой цепи (Eaton et al. (2000) Angew. Chem. Int. Ed. 39: 4063-4067). Более предпочтительно, алкиловая цепь имеет 10 или 12 метиловых групп. В результате аналог Соединения 7 был определен с 12 метиловыми группами в алкиловой цепи, и упоминается в настоящем документе как соединение 7_12.
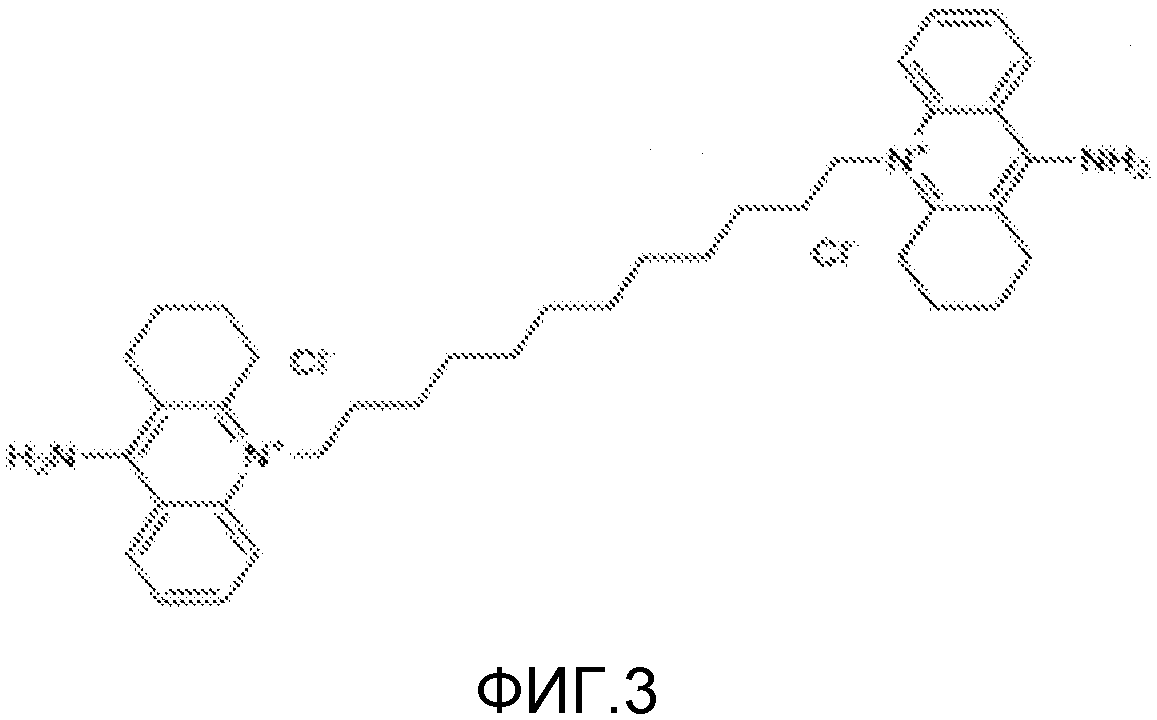
Другой подходящий аналог является 10,10'-(додекан-1,12-диил)бис(9-амино-1,2,3,4-тетрагидроакридиний)дихлоридом (Фигура 3), упоминаемым в настоящем документе как Соединение 7_12. Соединение 7_12 получено из соединения 7 и имеет С12 алкиловую цепь, а не С10 алкиловую цепь Соединения 7.
Другие подходящие аналоги деквалиния включают:
1-деканил-2-метил-4-аминохинолиния йодид
1-бутил-2-метил-4-аминохинолиния йодид
1,1,1-триэтил-1-(10-йоддекан-1-ил)аммония йодид
1-[1-(N,N,N-триэтиламмоний-1-ил)-2-метил-4-аминохинолиния дийодид
1,1'-(декан-1,10-диил)бис(4-аминопиридиний) дийодид
1-(4-пентин-1-ил)-4-аминопиридиния хлорид
1,1'-(дека-4,6-диин-1,10-диил)бис(4-аминопиридиний) дихлорид дегидрат
2,2'-N,N'-(декан-1,10-диил)бис(2,4-диаминопиридин) [соединение 8]
2,2'-N,N'-(декан-1,10-диил)бис(2-аминопиридин)
2,2'-N,N'-(декан-1,10-диил)бис(1-метил-2-аминопиридиний) дийодид
1-(4-пентин-1-ил)-2-метил-4-аминохинолиния йодид
1,1'-(дека-4,6-диин-1,10-диил)бис(4-амино-2-метилхинолиний) дийодид гидрат
1,1'-(декан-1,10-диил)бис(хинолиний) дийодид
1,1'-(декан-1,10-диил)бис(9-амино-1,2,3,4-тетра-гидроакридиний) дибромид гидрат
2,2'-(декан-1,10-диил)бис(хинолин)
2,2'-(декан-1,10-диил)бис(1-метилхинолиний) дийодид гидрат
2,2'-(декан-1,10-диил)бис(4-метоксихинолин)
2,2'-(декан-1,10-диил)бис(1-метил-4-метоксихинолиний) дийодид
2,2'-(додекан-1,12-диил)бис(1-метилхинолиний) дийодид
2,2'-(декан-1,10-диил)бис(изохинолиний) дийодид
1,1'-(декан-1,10-диил)бис(4-бромизохинолиний) дийодид
1,1'-(декан-1,10-диил)бис(1Н-бензимидазол)
1,1'-(декан-1,10-диил)бис(3-метилбензимидазолий) дийодид гемигидрат
1,1'-(декан-1,10-диил)бис(2-метилбензимидазол)
1,1'-(декан-1,10-диил)бис(2,3-диметилбензимидазолий) дийодид
1,10-бис[N-(акридин-9-ил)амино]декан дигидрохлорид дигидрат
1,1'-(1,10-декандиил)бис[4-амино-2-метил хинолиний] дийодид
1,1'-(1,10-декандиил)бис[4-аминохинолиний] дийодид
1,1'-(1,10-декандиил)бис[4-N,N-диметиламинохинолиний] дийодид
1,1'-(1,10-декандиил)бис[2-метилхинолиний] дийодид
1,1'-(1,10-декандиил)бис[хинолиний] дийодид
1,6-бис[N-(1-метилхинолиний-2-метил)амино] гексан дийодид
1,1'-(1,10-декандиил)бис[1-амино изохинолиний] дийодид
1,1'-(1,10-декандиил)бис[2-метилбензоксазолий] дийодид
1,1'-(1,10-декандиил)бис[2-метилбензотиазолий] дийодид
1,1'-(1,10-декандиил)бис[2-амино-1-метилбензимидазолий] дийодид
1,1'-[(Е)-5-децен-1,10-диил]бис[4-амино-2-метилхинолиний], дийодид
1,1'-[(Z)-5-децен-1,10-диил]бис[4-амино-2-метилхинолиний], дийодид
1,1'-(1,12-додекандиил)бис[4-амино-2-метилхинолиний], дийодид
1,1'-(1,14-тетрадекандиил)бис[4-амино-2-метилхинолиний], дийодид
1,1'-(1,16-гексадекандиил)бис[4-амино-2-метилхинолиний], дийодид
N-децил-4-аминохинальдиния йодид
1,1'-[бифенил-3,3'-диилбис(метилен)]-бис(4-аминохинолиний) дибромид гидрат (4)
1,1'-[бифенил-4,4'-диилбис(метилен)]бис(4-аминохинолиний) дифторацетат
1,1'-(фенантрен-3,6-диилбис(метилен)]бис(4-аминохинолиний) дибромид гидрат этаноат
1,1'-[флуорен-2,7-диилбис(метилен)]бис(4-аминохинолиний) дитрифторацетат
1,1'-[метиленбис(бензол-1,4-диилметилен)]бис(4-аминохинолиний) дибромид гидрат
1,1'-[этиленбис(бензол-1,4-диилметилен)]бис(4-аминохинолиний) дибромид гидрат
(Z)-1,1'-[стильбен-4,4'-диилбис(метилен)]-бис(4-аминохинолиний) дибромид сесквигидрат
(Е)-1,1'-[стильбен-4,4'-диилбис(метилен)]бис(4-аминохинолиний) дибромид дигидрат
1,1'-[этилен-1,2-диилбис(бензол-1,4-диилметилен)]бис(4-аминохинолиний) дибромид сесквигидрат
1,1'-[пропан-1,3-диилбис(бензол-1,4-диилметилен)]бис(4-аминохинолиний) дибромид гемигидрат этаноат
1,1'-[пиридин-2,6-диилбис(бензол-1,4-диилметилен)]-бис(4-аминохинолиний) дибромид гидрат
1,1'-[бутан-1,4-диилбис(бензол-1,4-диилметилен)]бис(4-аминохинолиний) дибромид гидрат
1,1'-[1,1:4',1”-терфенил-4,4”-диилбис(метилен)]бис(4-аминохинолиний) дибромид тригидрат
1,1'-[нафталин-2,6-диил(бис(метилен)]бис(4-аминохинолиний) дибромид гидрат
1,1'-[бензол-1,4-диилбис(метилен)]-бис(4-аминохинолиний) дибромид дигидрат
1,1'-[бензол-1,3-диилбис(метилен)]бис(4-аминохинолиний) дибромид гемигидрат
1,1'-(пропан-1,3-диил)бис(4-аминохинолиний) дийодид
1,1'-(бутан-1,4-диил)бис(4-аминохинолиний) дийодид
1,1'-(пентан-1,5-диил)бис(4-аминохинолиний) дийодид
1,1'-(гексан-1,6-диил)бис(4-аминохинолиний) дийодид
1,1'-(октан-1,8-диил)бис(4-аминохинолиний) дийодид
1,1'-(додекан-1,12-диил)бис(4-аминохинолиний) дибромид гемигидрат
1,10-бис[N-(2-метилхинолин-4-ил)амино]декан
1,12-бис[N-(2-метилхинолин-4-ил)амино]додекан
1,10-бис[(2-метилхинолин-4-ил)амино]декан
1,12-бис[(2-метилхинолин-4-ил)амино]додекан
1,10-бис(N-хинолин-4-иламино)декан
4,4'-[декан-1,10-диилбис(окси)]бис[хинолин]
4,4'-[декан-1,10-диилбис(тио)]бис[хинолин]
4,4'-додекан-1,12-диилбис[хинолин]
1,8-бис(N-хинолин-4-илдиамино)октан
1,8-бис[N-(1-метилхинолиний-4-ил)амино]октан дийодид гидрат
1,10-бис[N-(1-метилхинолиний-4-ил)амино]декан дийодид
4,4'-[декан-1,10-диилбис(окси)]бис[1-метилхинолиний] дийодид
4,4'-[декан-1,10-диилбис(тио)]бис[1-метилхинолиний] дийодид гидрат (10)
1,1'-диметил-4,4'-додекан-1,12-диилбис[хинолиний] дийодид
4,4'-декан-1,10-диилбис[хинолин]
1,1'-диметил-4,4'-декан-1,10-диилбис[хинолиний] дийодид
1,10-бис[N-(1-бензилхинолиний-4-ил)амино]декан дибромид
1,10-бис[N-(1-бензил-2-метилхинолиний-4-ил)амино]-декан бис(трифторацетат)
1,12-бис[N-(1-бензил-2-метилхинолиний-4-ил)амино]-додекан бис(трифторацетат)
1-[N-(1-бензил-2-метилхинолиний-4-ил)амино]-10-[N'-(2-метилхинолиний-4-ил)амино]декан бис(трифторацетат)
1-[N-(1-бензил-2-метилхинолиний-4-ил)амино]-12-[N'-(2-метилхинолиний-4-ил)амино]додекан бис(трифторацетат)-3,5-диметоксибензил йодид
1,10-бис[N-[1-(3,5-диметоксибензил)-2-метилхинолиний-4-ил]амино]декан бис(трифторацетат)
1-[N-[1-(3,5-диметоксибензил)-2-метилхинолиний-4-ил]амино]-10-[N'-(2-метилхинолиний-4-ил)амио]декан бис(трифторацетат)
1,1'-(3-йодпропилиден)бис[бензол]
1,10-бис[N-[1-(3,3-дифенилпроп-1-ил)-2-метилхинолиний-4-ил]амино]декан бис(трифторацетат)
4,7-дихлор-1-метилхинолиний йодид
1,10-бис[N-(7-хлор-1-метилхинолиний-4-ил)амино]-декан дийодид дигидрат.
Деквалиний и его соли имеются в продаже, например у компании (Sigma Aldrich). Способы получения соответствующих аналогов описаны в публикациях WO 97/48705, Galanakis et al. (1995) J. Med. Chem. 38: 595-606, Galanakis et al (1995) J. Med. Chem. 38: 3536-3546 and Galanakis et al. (1996) J. Med. Chem. 39: 3592-3595, Abeywickrama et al. (2006) Bioorganic Medicinal Chem. 14: 7796-7803, Qin et al. (2000) J. Med. Chem. 43:1413-1417, Campos Rosa et al. (1996) J. Med. Chem. 39: 4247-4254, содержание которых включено в настоящее описание в качестве ссылки. В частности, синтез Соединения 7 описан в публикации Galanakis et al. (1995) выше, а синтез Соединения 7_12 может быть выведен из него.
Соединения формул (IV) и (V) могут быть получены способами, которые аналогичны известным способам получения деквалиния, как описано и упомянуто выше.
Например, соединения формул (IV) и (V) могут быть получены путем взаимодействия соединения хинолина формулы (VI):
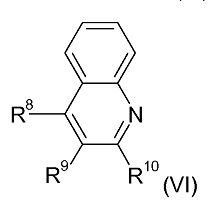
с соединением формулы I-(CH2)r-I. Реакция обычно выполняется при повышенной температуре, например, в диапазоне от 120°C до 160°C, например, примерно при 150°C.
Соединения хинолина формулы (VI) имеются в продаже или могут быть получены стандартными способами, хорошо известными специалистам, или способами, аналогичным им, смотри, например, Advanced Organic Chemistry by Jerry March, 4е издание, John Wiley & Sons, 1992, Organic Syntheses, тома 1-8, John Wiley, под редакцией Jeremiah P. Freeman (ISBN: 0-471-31192-8), 1995, Fiesers' Reagents for Organic Synthesis, тома 1-17, John Wiley, под редакцией Mary Fieser (ISBN: 0-471-58283-2), и Handbook of Heterocyclic Chemistry, A. R. Katritzky et al., 3е издание, Elsevier, 2010.
Соединения формулы (VI), где R8 является амино, а R9 и R10 связаны вместе с образованием алкиленовой цепи (CH2)w, могут быть получены при помощи следующей последовательности реакций:
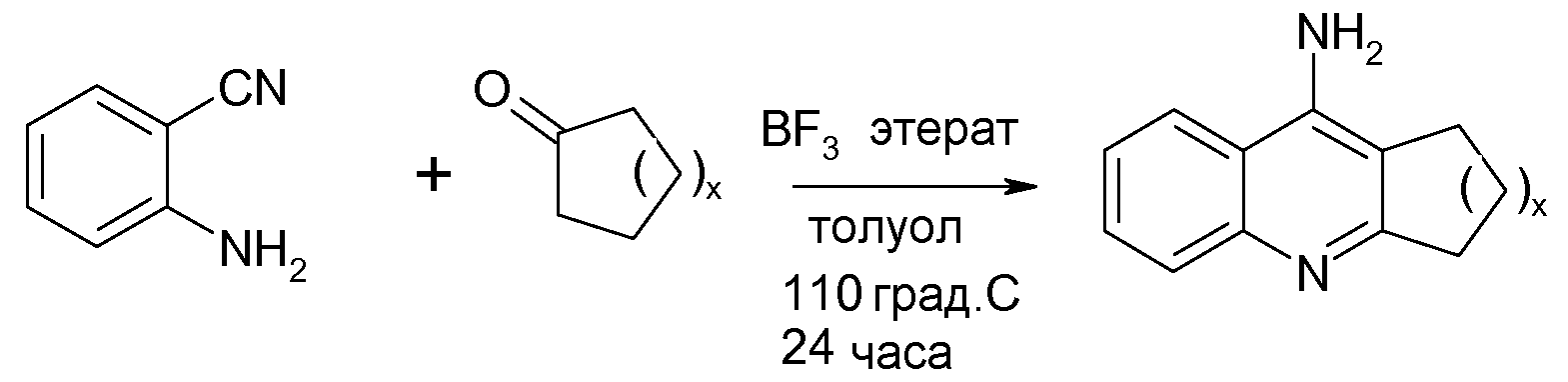
Аминогруппа затем превращается в другие функциональные группы стандартными способами, например диазотированием с последующей реакцией Зандмейера.
Последовательность нуклеиновых кислот может быть олигонуклеотидной последовательностью или полинуклеотидной последовательностью. Олигонуклеотидной последовательностью обычно считается линейная последовательность, содержащая до 20 нуклеотидов, соединенных фосфодиэфирными связями, тогда как полинуклеотидная последовательность обычно имеет более 20 нуклеотидов и может быть односпиральной или двухспиральной с различным количеством внутренних складок. Скелет также может быть модифицирован для встраивания синтетических химических веществ, известных как способные понижать заряд молекулы или увеличивающие ее стабильность в биологических жидкостях. Их примеры включают пептидные нуклеиновые кислоты (PNA), связанные нуклеиновые кислоты (LNA), морфолиноолигонуклеотиды и фосфоротиоатные нуклеотиды, а также их комбинации.
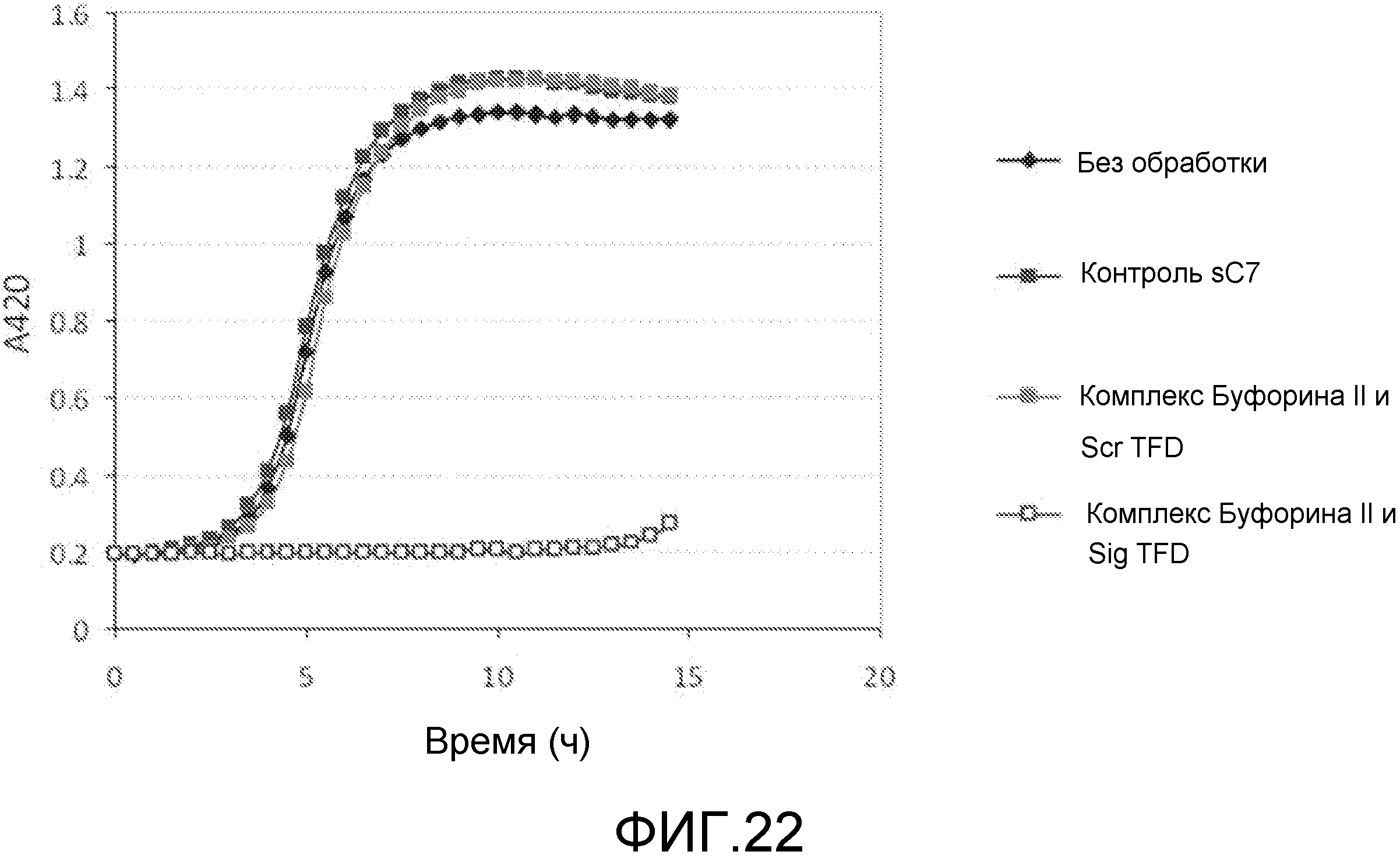
В одном из вариантов осуществления последовательность нуклеиновых кислот включает последовательность нативного клеточного связывающего сайта для фактора транскрипции. Такая последовательность упоминается как ловушка фактора транскрипции (TFD). Предпочтительно, ловушка содержит последовательность бактериального связывающего сайта Sig. Альтернативно, ловушка содержит последовательность бактериального связывающего сайта Fur.
Примеры подходящих последовательностей TFD представлены в SEQ ID NO: 11, 12, 13, 32, 33, 39, 40, 41, 42, 43 и 44.
TFD являются эффективными при наномолярных концентрациях и обладают эффективностью для предотвращения роста бактерий in vitro и in vivo при концентрациях лишь 1 нМ, хотя предполагается, что против некоторых бактерий и в более сложных условиях, таких как организм пациента, могут потребоваться более высокие концентрации. Поэтому предпочтительный диапазон должен быть около 10-100 нМ, и примерно до 1 мкМ. Следует понимать, что этот диапазон охватывает концентрации в пределах от около 10 нМ до 1 мкМ, такие как 20 нМ, 30 нМ, 40 нМ, 50 нМ, 60 нМ, 70 нМ, 80 нМ, 90 нМ, 150 нМ, 200 нМ, 500 нМ, 750 нМ и промежуточные значения, например, 27,2 нМ.
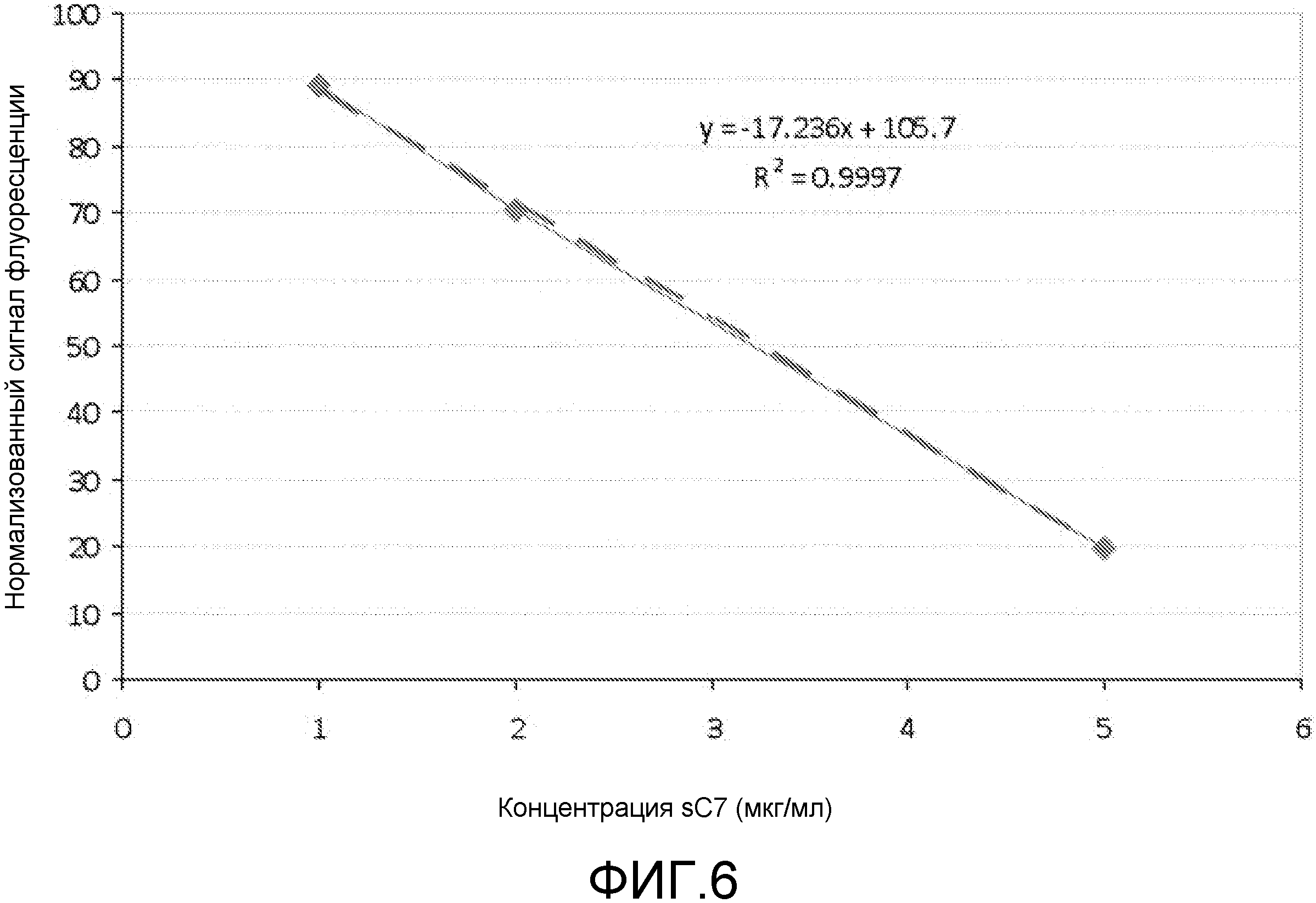
Если группа доставки является соединением любой из формул (I)-(V), таким как деквалиний или его аналоги, то комплексы образуются между нуклеиновой кислотой и этим соединением (например, девалинием или его аналогами) с использованием различных соотношений этих двух веществ. Это соотношение обычно упоминается как отношение N/P (см., например, Zhao et al. (2007) Biomacromolecules 8: 3493-3502), которое определяет какое количество положительных атомов азота в молекуле доставки приходится на отрицательно заряженный фосфатный атом в нуклеиновой кислоте, или на нуклеотид, если нет фосфатных атомов. Обычно комплексы образуются между деквалинием (или его аналогами) и TFD при отношении N/P между 0,1 и 1 (что является достаточным для достижения нейтрализации заряда). Следует понимать, что настоящее изобретение охватывает соотношения от 0,1 до 1, такие как 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 и промежуточные значения, например, 0,23.
Комплексы, способные трансфицировать бактерии in vitro, хорошо переносятся, что было показано в исследованиях на животных. Более того, компоненты таких комплексов могут использоваться при концентрациях ниже их известной максимально переносимой дозы (MTD). Максимальная переносимая доза (MTD) является максимальной дневной дозой, которая не вызывает очевидной токсичности. MIC можно оценить в исследованиях на животных как количество соединения, которое при введении в группу подопытных животных, не имеет измеримого действия на долговременную выживаемость. Например, введение комплекса, содержащего 1 мкМ нуклеотида TFD 100 с отношением N/P, равным 1, дает дозу примерно в 3 мг/кг аналога деквалиния. Следует понимать, что эта доза аналога деквалиния гораздо ниже MTD деквалиния. Аналоги деквалиния, такие как соединение 7, демонстрируют более низкую токсичность in vitro по сравнению с деквалинием (Weissig et al. (2006) J. Liposome Res. 16: 249-264). Поскольку деквалиний имеет MTD 15 мг/кг на мышах (Gamboa-Vujicic et al. (2006) J. Pharm. Sci. 82: 231-235), то предполагается, что эти комплексы будут хорошо переноситься. Специалист в данной области обладает достаточным навыком и знаниями для того, чтобы рассчитать и получить соответствующие концентрации.
В альтернативном варианте осуществления антибактериальный комплекс содержит последовательность нуклеиновой кислоты и антибактериальный пептид. Термин антибактериальный пептид включает и охватывает антимикробные пептиды, проникающие в клетку пептиды, пептиды, синтезированные вне рибосом, и гликопептиды.
Антимикробные пептиды (AMP, также называемые пептидами иммунной защиты) являются древними и природными антимикробными средствами, которые являются множеством разновидностей и широко распространенными. Они являются эволюционно консервативными компонентами врожденной иммунной реакции и встречаются у всех 15 классов живых организмов. Основные различия существуют между прокариотическими и эукариотическими клетками, которые могут представлять мишени для антимикробных пептидов. Эти пептиды являются сильными антибиотиками широкого спектра действия, которые демонстрируют потенциал как новые терапевтические средства. Было показано, что антимикробные пептиды убивают грамотрицательные и грамположительные бактерии (включая штаммы, резистентные к обычным антибиотикам), микобактерии (включая Mycobacterium tuberculosis), вирусы с оболочками и грибки. В отличие от большинства обычных антибиотиков, оказалось, что антимикробные пептиды могут также обладать способностью усиливать иммунитет, действуя в качестве иммуномодуляторов.
Антимикробные пептиды обычно содержат 12-50 аминокислот. Эти пептиды содержат два или более положительно заряженных остатков, предоставляемых аргинином, лизином или, в кислых средах, гистидином, и большую долю (обычно >50%) гидрофобного остатка. Вторичные структуры этих молекул следуют четырем мотивам, включая i) α-спиральный, ii) β-спиральный за счет присутствия двух или более дисульфидных связей, iii) β-шпилька или петля за счет присутствия одной дисульфидной связи и/или циклизации пептидной цепи, и iv) растянутый. Многие из этих пептидов неструктурированны в свободном растворе и сворачиваются в свою конечную конфигурацию при разделении на биологические мембраны. Пептиды содержат гидрофильные аминокислотные остатки, расположенные вдоль одной стороны, и гидрофобные аминокислотные остатки, расположены вдоль противоположной стороны спиральной молекулы. Эта амфифильность антимикробных пептидов позволяет им разделяться в мембранном липидном двойном слое. Эти пептиды обладают различными антимикробными свойствами, от пермеабилизации мембраны до действия на ряд цитоплазматических мишеней.
Способы действия, которыми антимикробные пептиды убивают бактерии, являются различными и включают разрушение мембран, вмешательство в метаболизм и направленное действие на цитоплазматические компоненты. Первоначальный контакт между пептидом и мишеневым организмом является электростатическим, поскольку большинство бактериальных поверхностей являются анионными. Их аминокислотный состав, амфифильность, катионный заряд и размер позволяют присоединяться и встраиваться в мембранные двойные слои для образования пор по механизму «бочарных клепок», «ковра» или «тороидальных пор». Проникнув в клетку, пептиды связываются с внутриклеточными молекулами, которые являются критическими для жизни клетки, и ингибируют таким образом синтез стенок клетки, изменяя цитоплазматическую мембрану, активируя аутолизин, ингибируя синтез ДНК, РНК и белков, и ингибируя некоторые ферменты. Однако во многих случаях точный механизм разрушения не известен. В отличие от многих обычных антибиотиков, эти пептиды являются бактериоцидами (киллерами бактерий) вместо бактериостатов (ингибиторов роста бактерий).
В борьбе между бактериальными клетками и клетками хозяина с антимикробными пептидами, антимикробные пептиды, предпочтительно, взаимодействуют с бактериальными клетками, а не с клетками млекопитающих, что позволяет им разрушать микроорганизмы, не будучи существенно токсичными для клеток млекопитающих. Поскольку поверхность бактериальных мембран более отрицательно заряжена, чем клетки млекопитающих, антимикробные пептиды обладают различной аффинностью по отношению к бактериальным мембранам и мембранам клеток млекопитающих.
Хорошо известно, что холестерин обычно в большой степени распределен в мембранах клеток млекопитающих в качестве средства стабилизации мембран, но отсутствует в мембранах бактериальных клеток. Присуствие холестерина также, в основном, снижает активность антимикробных пептидов за счет стабилизации липидного двойного слоя или за счет взаимодействий между холестерином и пептидом. Поэтому холестерин в клетках млекопитающих защищает клетки от атаки антимикробных пептидов.
Кроме того, хорошо известно, что трансмембранный потенциал влияет на взаимодействие пептида и липида. Отрицательный трансмембранный потенциал существует между внешним слоем и внутренним слоем клеточной мембраны. Этот внутренний отрицательный трансмембранный потенциал облегчает пермеабилизацию клетки, вероятно, за счет облегчения внедрения положительно заряженных пептидов в мембраны. Для сравнения, трансмембранный потенциал бактериальных клеток более отрицательный, чем в обычных клетках млекопитающих, поэтому бактериальная мембрана предрасположена к атаке положительно заряженными антимикробными пептидами.
Как рассмотрено выше, AMP являются уникальной и многообразной группой молекул, которые подразделяются на подгруппы на основании аминокислотного состава и структуры. База данных многих известных AMP представлена на странице http://www.bbcm.units.it/~tossi/pag1.htm. Другие группы пептидов с анти-инфекционными свойствами включают пептиды вне рибосом, примеры которых включают грамицидин, и, в качестве подгруппы, антибиотики с гликопептидами, где пептиды (которые обычно являются циклическими) являются гликозилированными. Их примеры включают полимиксин.
Авторы настоящего изобретения создали функциональную классификацию всех этих пептидов, которые в настоящем документе описываются термином антибактериальные пептиды (АВР), чтобы отличать их от АМР, на основании механизма бактериального разрушения, которая включает пептиды, полученные из других классов антибактериальных средств, таких как проникающие в клетку пептиды, пептиды, синтезированные вне рибосом, и гликопептиды. Следует понимать, что настоящее изобретение охватывает природные и неприродные синтетические пептиды.
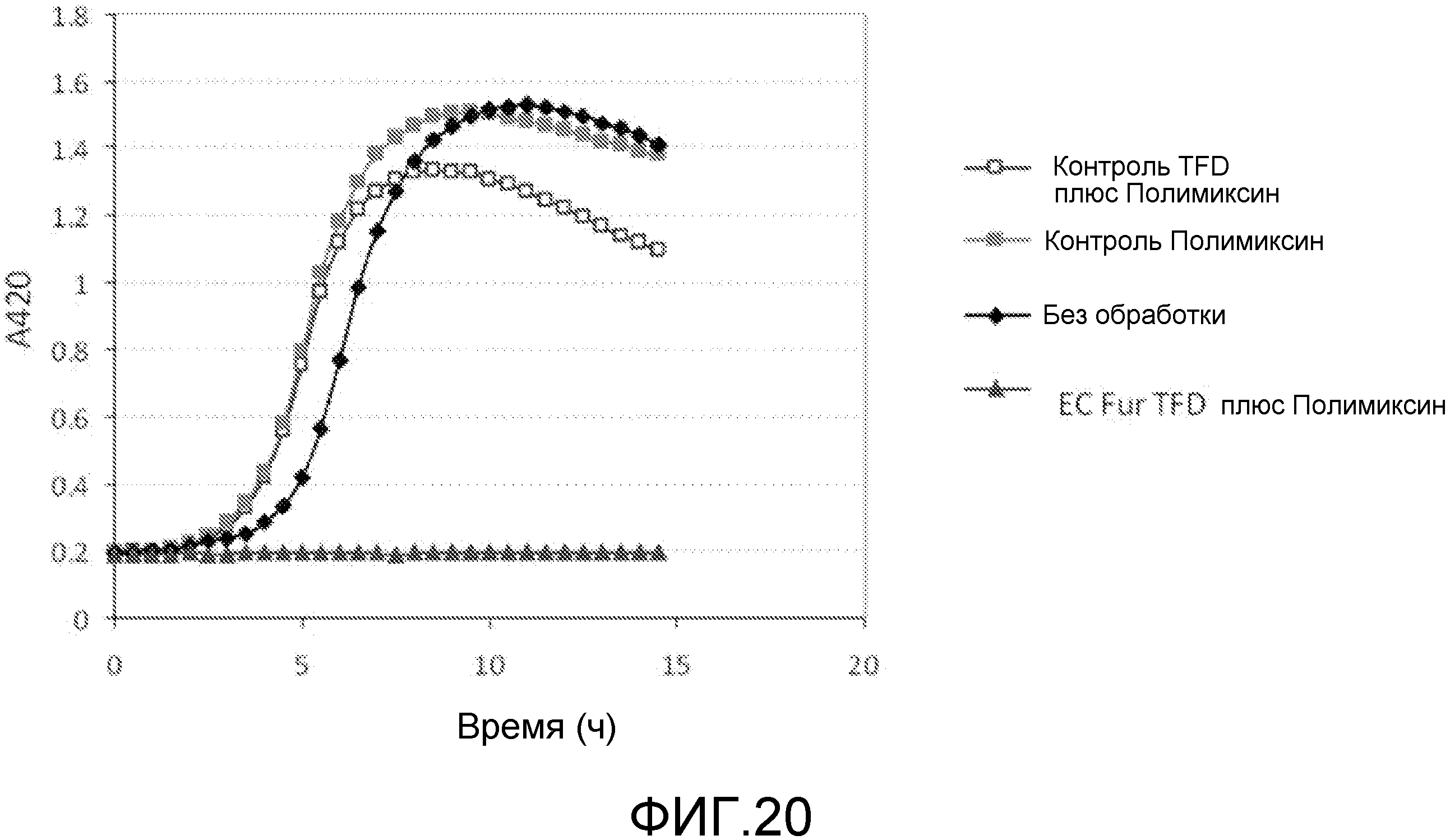
Класс I. ABP, которые являются активными по отношению к мембране (полимиксин, грамицидин) и нарушают вход, вызывая существенное повреждение перфорированных отверстий во внешней мембране и позволяя образовываться экструзиям (или «везикулам») внутренней бактериальной мембраны, через которые могут проходить большие молекулы. Некоторые из этих пептидов используются в клинической практике, однако существует проблема токсичности, поскольку они также повреждают эукариотические мембраны.
Степень резистентности против антибактериальных пептидов заметно низкая, и эти пептиды широко распространены в природе. Поскольку этот класс преимущественно катионный, то механизмы резистентности принимают форму изменения плотности заряда на внешней стороне мембраны бактерии, и такие изменения наблюдались в лабораторных условиях. Таким образом, относительно низкий уровень резистентности может отражать тот факт, что ABP не то, что эффективны, но даже с трудом резистентны.
Класс II. Этот класс гораздо меньше. Эти АВР не разрушают мембрану, а вместо этого имеют внутриклеточные мишени. Поэтому для достижения своих мишеней эти пептиды должны перемещаться через бактериальные мембраны. В результате они заметно менее токсичны, чем класс АВР I, и они не повреждают эукариотические мембраны, вызывая гемолиз и так далее. Хотя они являются катионными, их способность пересекать мембраны, предположительно, основывается не только на их заряде, но и на других более широких структурных свойствах, которые по большей части остаются неопределенными. Как следствие, механизмы устойчивости, предположительно, являются менее вероятными, поскольку для таких механизмов необходимо изменение гидрофобной природы самих бактериальных мембран.
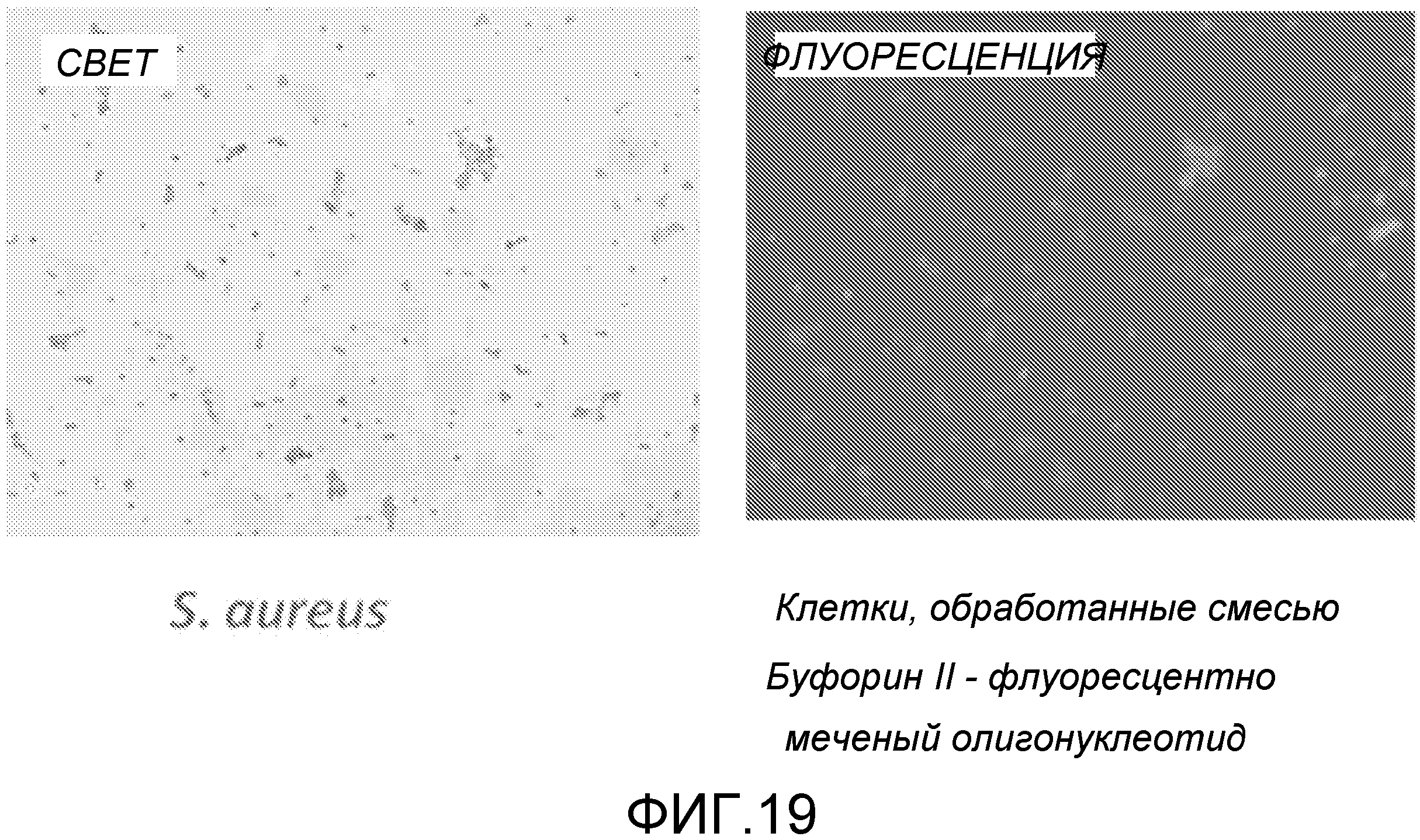
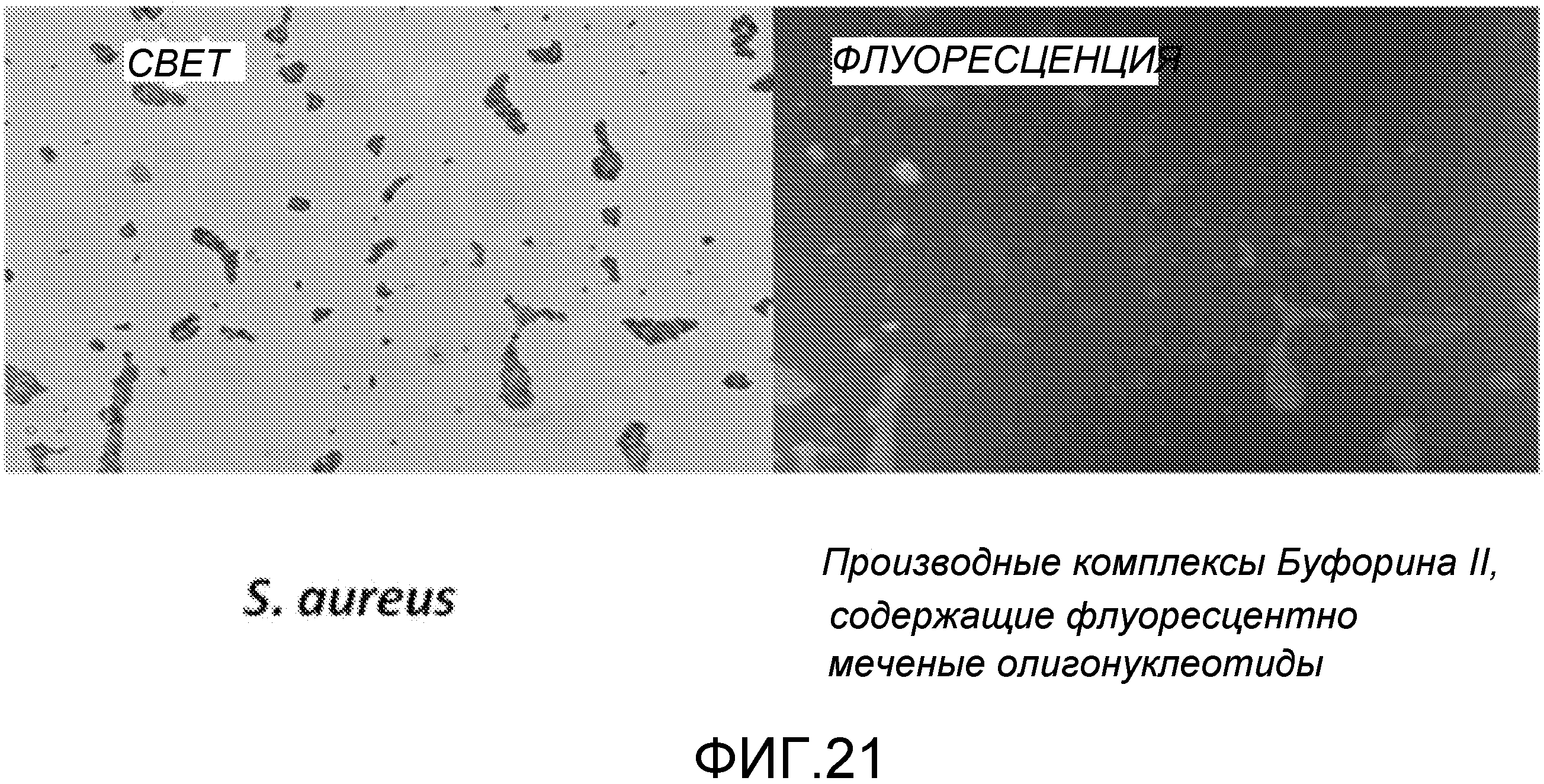
Примером способного к перемещению АВР является буфорин и укороченная форма буфорин II (BF2). Эти пептиды демонстрируют (слабо) широкий спектр действия против патогенных бактерий (Park et al. (2000) Proc. Natl. Acad. Sci. USA 97: 8245-8250). Они используются для перемещения через эукариотические мембраны и даже для доставки пептида размером 28 кДа (GFP) в линии клеток человека (Takeshima et al. (2003) J. Biol. Chem. 278: 1310-1315), хотя это было осуществлено при помощи эндоцитоза и, вероятно, за счет катионной природы пептида.
ABP могут быть природными пептидами, такими как грамицидин или буфорин. Альтернативно, АВР могут быть пептидомиметиками или синтетическим вариантом природного пептида, таким как буфорин II или полимиксин нонапептид.
Примеры антимикробных пептидов, способных пермеабилизировать биологические мембраны, представлены в публикации Papagianni et al ((2003) Biotechnol. Adv. 21: 465- 499) и включают дефенсины, плеврицидины, магаинины, дермасептины, апидаецины, цекропины, микроцины и педиоцины.
Примеры антимикробных пептидов, способных пермеабилизировать биологические мембраны, представлены в публикации Varra et al ((1992) Microbiol. Rev. 56: 395-411) и включают лантибиотики, гликопептидные антибиотики, катионные полипептиды, такие как полилизин и полиаргинин.
Типы и характеристики АВР представлены в Таблице 1:
АВР могут быть связаны с нуклеиновой кислотой за счет электростатических или ковалентных связей. В частности, если механизм разрушения АВР происходит за счет внутриклеточного направленного действия, а не за счет пермеабилизации мембраны, то комплекс в идеале включает ковалентную связь, такую как соответствующий линкер или кросс-линкер между последовательностью нуклеиновых кислот и АВР. Примером соответствующего линкера является линкер, связывающий карбоксильную группу с первичным амином. Например, подходящим линкером может быть EDC (1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорид).
Известно, что EDC используется в качестве карбоксил-активирующего средства для связывания первичных аминов для получения амидных связей, и обычно этот карбодиимид используется для поперечного сшивания белка с нуклеиновыми кислотами.
Хотя АВР обладают антимикробным действием сами по себе, было обнаружено, что такие пептиды действуют синергетически в комбинации с TFD для профилактики бактериального роста. Некоторые АВР обладают бактериостатическим действием, а другие быстро разрушают при контакте. Было обнаружено, что суб-летальные концентрации этих пептидов обеспечивают доступ TFD. Пептиды подвергают напряжению бактерии, делая их более восприимчивыми к TFD, которые затем блокируют напряжение, вызывая развитие стаза или гибель клетки.
Эти комплексы готовят так, что АВР содержатся в концентрации, которая обычно в 5-10 раз ниже, чем их минимальная ингибирующая концентрация (MIC). MIC соединения является минимальной концентрацией, при которой соединение предотвращает видимый рост бактерий. Обычно MIC определяется методом разбавления, где инокулированные культуры бактерий инкубируются в течение ночи с серийными концентрациями соединения, и та концентрация, которая предотвращает рост, принимается за MIC. Специалист в данной области обладает достаточными навыками и знаниями для того, чтобы рассчитать и получить соответствующие концентрации.
В следующем варианте антибактериальный комплекс по настоящему изобретению содержит а) последовательность нуклеиновых кислот, b) соединение четвертичного амина или бис-аминоалкана, или его ненасыщенного производного, где амино-компонент аминоалкана является аминогруппой, образующей часть гетероциклического кольца, и с) антибактериальный пептид.
Другими словами, антибактериальный комплекс по настоящему изобретению содержит а) последовательность нуклеиновых кислот, b) четвертичное производное хинолина или акридина, и с) антибактериальный пептид.
В особенно предпочтительном варианте, антибактериальный комплекс содержит а) ловушку фактора транскрипции, b) аналог деквалиния и, необязательно, c) антимикробный пептид.
В другом аспекте, настоящее изобретение относится к применению комплексов настоящего изобретения в соответствующей композиции для лечения одной или более бактериальных инфекций.
В частности, настоящее изобретение относится к способу лечения бактериальной инфекции у пациента, предусматривающему введение последовательности нуклеиновых кислот, входящей в состав композиции, описанной в настоящем документе. Пациентом может быть человек или животное. В настоящем изобретении представлена также последовательность нуклеиновых кислот, входящая в состав композиции, описанной в настоящем документе, для применения в медицине, например, для лечения или профилактики бактериальной инфекции у пациента, для применения последовательности нуклеиновых кислот, входящей в состав композиции, описанной в настоящем документе, для получения лекарственных средств для лечения бактериальной инфекции.
Настоящее изобретение, кроме того, относится к фармацевтической композиции или к лекарственному средству, содержащему последовательность нуклеиновых кислот, последовательность нуклеиновых кислот, по меньшей мере одну группу доставки, где группа доставки выбрана из соединений четвертичного амина; бис-аминоалканы и их ненасыщенные производные, где амино-компонент аминоалкана является аминогруппой, образующей часть гетероциклического кольца; и антибактериальный пептид и физиологически приемлемый носитель или эксципиент. Композиция может дополнительно содержать один или несколько антибиотиков или других антибактериальных соединений или композиций.
Количество последовательностей нуклеиновых кислот, необходимых для появления предполагаемого действия на экспрессию мишеневого гена, обладающих бактериостатическим или бактериоцидным действием, может составлять лишь около 5000 молекул на клетку. Было обнаружено, что целых 1000000 бактериальных клеток эффективно разрушаются лишь 1 нМ TFD (WO/2010/038083), что позволяет предположить, что для эффективности трансфекции достаточно менее 0,001% для достижения разрушения. По сравнению с другими подходами, основанными на нуклеиновых кислотах для сдерживания бактериальных инфекций, такими как антисмысловая стратегия, в данном случае количество молекул, необходимых, чтобы убить клетку, от 100 до 1000 раз меньше. Это частично отражает тот факт, что хотя оба подхода, антисмысловый и TFD, действуют для ингибирования генов, TFD действует на раннем этапе для профилактики транскрипции, тогда как антисмысловый подход, и большинство обычных итераций, стерически блокирует продукты транскрипции: многие тысячи молекул иРНК. Во-вторых, TFD были созданы для нацеленного действия на жизненно важные гены, которые являются положительно индуцированными и нуждаются в переключении для выживания, и положительно регулируемыми (фактор транскрипции управляет собственной выработкой). In vitro, эта последняя характеристика означает, что вероятно может присутствовать относительно небольшое количество копий фактора транскрипции, если ген не индуцирован, и поэтому небольшое количество TFD может блокировать индукцию.
Вполне возможно, что для терапии, есть еще факторы транскрипции в клетке за счет естественного разнообразия среди популяции бактерий или уже индуцированного гена. В этой ситуации ожидается, что потребуется большее количество TFD для возникновения терапевтического эффекта и предполагается, что увеличение дозы на коэффициент 100 (до 100 нМ) или улучшение эффективности трансфекции (на два порядка магнитуды) будет достаточно для появления благотворного эффекта. Трансфекция может быть количественно оценена флуоресцентной микроскопией (Zhang et al. (1996) J. Mol. Neurosci. 7: 13-28).
Фармацевтические композиции по настоящему изобретению, и использующиеся в соответствии с настоящим изобретением, могут содержать в качестве активного компонента или в дополнение к нему, к фармацевтически приемлемому эксципиенту или разбавителю любое подходящее связующее, смазывающее вещество, суспендирующее средство, средство для нанесения покрытия, солюбилизатор или другие материалы, хорошо известные специалистам в данной области. Такие материалы должны быть нетоксичными и не должны влиять на эффективность активного компонента. Приемлемые носители или разбавители для терапевтического применения хорошо известны в фармацевтике и описаны, например, в публикации Remington' Pharmaceutical Sciences, Mack Publishing Co. (A. R. Gennaro edit. 1985). Точная природа носителя или другого материала зависит от способа введения, который может быть пероральными или через инъекции, например, кожные, подкожные или внутривенные.
Активный компонент определяется как последовательность нуклеиновых кислот, такая как TFD, связанная в комплекс (или составленная в композицию) с группой доставки, группа доставки является группой доставки, выбранной из соединений четвертичного амина; с бис-аминоалканами и их ненасыщенными производными, где амино-компонент аминоалкана является аминогруппой, образующей часть гетероциклического кольца; и с антибактериальным пептидом. В комплексе/композиции соединение четвертичного амина, бис-аминоалкан или его ненасыщенное производное, такое как деквалиний или его аналоги, присутствуют в форме боласомы. Термин «боласома» используется в настоящем документе для описания везикул производного соединения, после того, как исходное соединение было обработано ультразвуком (см. Weissig and Torchilin (2001) Adv. Drug Delivery Rev. 49: 127-149).
Для доставки антибактериального комплекса по настоящему изобретению в область бактериальной инфекции могут использоваться различные способы. Способы для доставки in vivo и/или in vitro включают, но ими не ограничиваются, буккальную или пероральную доставку, внутривенную доставку, прямую инъекцию в область инфекции или непрямую инъекцию (например, подкожное, внутрибрюшинное, внутримышечное или другие способы инъекции), местное применение, прямое воздействие в водных растворах или в средах, трансфекцию (например, электропорацию фосфата кальция, на основе DEAE-декстрана, и опосредованную липидами), трансгенную экспрессию (например, систему экспрессии ловушек, доставляемую микроинъекциями, генерацию эмбриональных стволовых клеток, или ретровирусный перенос), или любые другие обычно используемые системы доставки нуклеиновых кислот, известные в данной области. Введение может быть в сочетании с соответствующей дозой антибиотика, и антибиотик(-и) вводится одновременно с последовательностью нуклеиновой кислоты, или самостоятельно.
Фармацевтические композиции для перорального введения могут быть в виде таблеток, капсул, порошков или жидкими. Таблетка может содержать твердый носитель, такой как желатин, или адъювант. Жидкие фармацевтические композиции обычно содержат жидкий носитель, такой как вода, нефтяные, животные или растительные масла, минеральное масло или синтетическое масло. Могут быть включены физиологический солевой раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль.
Для внутривенных, кожных или подкожных инъекций или инъекций в поврежденную область, активный компонент должен быть в форме парентерально приемлемого водного раствора, который является апирогенным и имеет соответствующий рН, тоничность и стабильность. Специалисты в данной области могут получить соответствующие растворы, используя, например, изотонические носители, такие как хлорид натрия, инъекция Рингера, лактированная инъекция Рингера, и при необходимости могут быть введены консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
Для некоторых вариантов применения может не требоваться фармацевтическая композиция. Например, антибактериальный комплекс по настоящему изобретению может переноситься как фармацевтическое средство само по себе, без необходимости в эксципиентах и/или носителях.
Альтернативно, антибактериальный комплекс может быть подходящим для применения в качестве антибактериального дезинфицирующего средства, и может также потребоваться его соответствующая водная форма. В этом случае комплекс может дополнительно включать водные и органические растворители и их комбинации.
Антибактериальный комплекс по настоящему изобретению может использоваться для лечения различных бактериальных инфекций, возникающих в организме человека. Могут быть описаны пять основных областей бактериальных инфекций.
Наиболее распространенными являются инфекции дыхательных путей, инфекции верхних дыхательных путей включают инфекции ушей, горла и носовых пазух, лечение которых может осуществляться местно или аэрозольно. К инфекциям нижних дыхательных путей относятся пневмония (которая вызывается различными бактериальными патогенами), бронхиты и инфекционное осложнение муковисцидоза.
Общей проблемой как в обществе, так и в стационарной практике являются инфекции мочевых путей, когда в моче выявляется инфекция, и необходимо введение антибактериальных средств в мочевой пузырь, простату, мочеточник и почки.
Инфекции возникают в кишечнике, где бактерии вызывают заболевания при инвазии в слизистую оболочку или за счет выработки токсинов, пример которых включает эпидемию холеры, и при использовании антибиотиков они поступают при проглатывании, либо внутривенно.
Распространенными являются инфекции кожи и мягких тканей, которые могут лечиться местным применением, а за ними следуют травматические повреждения или ожоги, которые дают возможность колонизации и ингрессии микроорганизмов, что приводит к инфекциям, которые являются локализованными или быстро распространяющимися в тканях. Микроорганизмы, отвечающие за кожные инфекции, часто возникают из нормальной флоры кожи, такой как Streptococcus pyogenes, вызывая поверхностные кожные инфекции (импетиго), целлюлиты (более глубоко расположенная инфекция, которая может распространяться в кровь) и некротизирующие фасцииты, быстро прогрессирующие инфекции, вызывающие угрозу жизни.
Наконец, инфекции центральной нервной системы, такие как бактериальный менингит, являются, вероятно, наиболее трудными для лечения, поскольку терапевтические средства должны преодолевать барьер между кровью и мозгом, как и патогенные бактерии.
Антибактериальный комплекс по настоящему изобретению может использоваться в комбинации с одним или несколькими антибиотиками, с которыми последовательность нуклеиновых кислот делает бактериальные клетки более чувствительными, и/или с другим антибактериальным средством. Подходящие антибиотики описаны в заявках WO 2009/044154 и WO 2010/038083, находящихся на совместном рассмотрении. Следует понимать, что списки, представленные в настоящем документе, могут не быть исчерпывающими. Настоящее изобретение относится к любым подходящим антибиотикам или антибактериальным соединениям или композициям.
Антибиотик или антибактериальное соединение могут одновременно вводиться вместе с антибактериальным комплексом по настоящему изобретению, или до него, или после него. Антибиотик/антибактериальное соединение и антибактериальный комплекс могут вводиться в одной или в разных композициях. Поэтому настоящее изобретение относится к комплексной терапии, в которой антибактериальный комплекс, определенный и/или описанный в настоящем документе, вводится индивиду в комбинации с одним или более антибиотиками или другими антибактериальными терапиями. Композиция может дополнительно содержать один или несколько антибиотиков или других антибактериальных соединений или композиций.
Подходящие TFD, входящие в рамки настоящего изобретения, и/или их мишени перечислены ниже. Представленные в настоящем документе последовательности иллюстрируют одинарные цепи связывающих сайтов. Однако следует понимать, что в природе и в TFD по настоящему изобретению последовательности являются двойными спиралями. Комплементарные спирали для последовательностей, перечисленных в настоящем документе, являются понятными и легко могут быть получены, например, при помощи публикации Molecular Cloning: A Laboratory Manual (3е Edition), 2001 by Joseph Sambrook and David Russell.
WhiB7
Связывающий сайт нативной WhiB7 в M. smegmatis str MC2 155 содержит:
5'- CACCAGCCGA AAAGGCCACG GACCCGCAGT CACCCGGATC CGTGGCCATT TTTGTCGGAC CCCCCGAGAA ATCTGGTCGC AGGATCCATC AGCTCAGACA GATCAC- 3' (SEQ ID NO:1)
WhiB7 TFD:
5' TGG CCA CGG ATC CGG GTG ACT GCG GGT CCG TGG CCT 3' (SEQ ID NO:2)
FadR
Нативный свзывающий сайт FadR в E. coli K12 содержит последовательность:
5' AGTAAGTTTC GAATGCACAA TAGCGTACAC TTGTACGCCG AACAAGTCCG ATCAGCCATT TAA-3' (SEQ ID NO:3)
Один пример последовательности FadR TFD содержит
5' TTT ATT CCG AAC TGA TCG GAC TTG TTC AGC GTA CAC GTG TTA GCT ATC CTG CGT GCT TCA 3' (SEQ ID NO:4)
YycG/YycF
Нативные связывающие центры для YycF и YycG в S. aureus (в промоторах LytM и Ssa) содержат
YycF_LytM
5'- GCTATTTTGTAATGACAATGTAATGAGTTTAGTAAAAA-3' (SEQ ID NO:5)
YycF_SsaA
5'- ATTACAAATTTGTAACAGACTTATTTTA-3' (SEQ ID NO:6)
Примеры последовательности YycG/YycF TFD содержат:
LytM TFD 5' GCT ATT TTG TAA TGA CAA TGT AAT GAG TTT AGT AAA AA 3' (SEQ ID NO:7)
SsaA TFD 5' ATT ACA AAT TTG TAA CAG ACT TAT TTT A 3' (SEQ ID NO:8)
Сигма 54 или SigB
Нативные связывающие сайты в S. aureus и K. pneumoniae содержат:
SA_sig: 5'- TTATTATATA CCCATCGAAA TAATTTCTAA TCTTC-3' (SEQ ID NO:9)
KP sig: 5'- CCGATAAGGG CGCACGGTTT GCATGGTTAT-3' (SEQ ID NO:10)
Fur
Консенсусные последовательности для связывания Fur в S. aureus и E. coli содержат:
SA_fur: 5'- ACT ACA AGT ACT ATT AGT AAT AGT TAA CCC TT-3' (SEQ ID NO:11). Консенсусная последовательность ('Fur BOX'), описанная в публикации Horsburgh, J. Bacteriology (2001) 183:468.
EC_fur: 5'- GATAATGATAATCATTATC-3' (SEQ ID NO:12). Консенсусная последовательность, описанная в публикации de Lorenzo, J. Mol. Biol. (1998) 283:537.
Нативная связывающая последовательность в H. pylori включает:
HP_fur: 5'- GTT GTC CCA TAA TTA TAG CAT AAA TGA TAA TGA AAA AGT AAA-3' (SEQ ID NO:13)
TcdR
Консенсусный связывающий сайт в C. difficile содержит:
5'- AAG TTT ACA AAA TTA TAT TAG AAT AAC TTT TTT A TT-3' (SEQ ID NO: 14). Консенсусная последовательность (TcdR, где -35 и -10 боксы подчеркнуты), описанная в публикации Dupuy, Mol. Micro. (2006) 55:1196.
Vfr
Консенсусными и двумя нативными связывающими сайтами в P. aeruginosa являются:
PA_Vfr: 5'- AAA TGT GAT CTA GAT CAC ATT T-3' (SEQ ID NO:15). Консенсусные последовательности, описанные в публикации Kanack, Microbiol. (2006) 55:1196.
PA_ToxA: 5'- CACTCTGCAA TCCAGTTCAT AAATCC-3' (SEQ ID NO:16)
PA_RegA: 5'- GTAACAGCGGAACCACTGCACAG -3' (SEQ ID NO:17)
NtrC
Нативный связывающий сайт в K. pneumoniae содержит:
5'- GCTTTGCACTACCGCGGCCCATCCCTGCCCCAAAACGATCGCT -3' (SEQ ID NO:18)
ArsR
Примеры нативных связывающих последовательностей содержат:
HP_AmiE: 5'- ATAATCATAA TGATTAAAGT TTTCATATTC ATTATAAATC CGTTTACACA ATTATT -3' (SEQ ID NO:19)
HP_RocF: 5'- GAAATTGTTC TATTTATTAT CCATTTGCTT ATTAATAATT 5 GGTTGTTAAT TTTGGTTTAG A -3' (SEQ ID NO:20)
Гликопептид-резистентная консенсусная последовательность (GISA)
Пример консенсусной последовательности, обнаруженной в промоторе tcaA, известном положительном регуляторе вирулентности (Maki, Antimicrobial Agents Chemother. (2004) 48:1953), может использоваться в антибактериальном комплексе по настоящему изобретению, например:
SA_TcaA: 5'- TGAACACCTTCTTTTTA -3' (SEQ ID NO:21)
AgrA
Примерами последовательностей для мотивов, обнаруженных в генах, положительно регулируемых Agr, регуляторно связанных с вирулентностью (Dunman, J. Bacteriol. (2001) 183:7341) являются:
SA_Agr_2093: 5'- AGA AAG ACA AAC AGG AGT AA -3' (SEQ ID NO:22)
SA_Agr_1269: 5'- GAA GAA ACA AAA AGC AGC AT -3' (SEQ ID NO:23)
Соответствующими последовательностями праймеров для S. aureus Sig TFD являются:
SAsigB FOR: GAA GAT TAG AAA TTA TTT CGA T GGG TAT ATA ATA A (SEQ ID NO:24); и
SASigB REV: TAT TAT ATA CCC ATC GAA ATA ATT TCT AAT CTT C A (SEQ ID NO:25).
Соответствующими последовательностями праймеров для S. aureus Fhu TFD являются:
SAfhu FOR: ACT ACA AGT ACT ATT AGT AAT AGT TAA CCC TA (SEQ ID NO:26); и
SAfhu REV: AGG GTT AAC TAT TAC TAA TAG TAC TTG TAG TA (SEQ ID NO:27)
Соответствующими последовательностями праймеров для S. aureus SsaA TFD являются:
SsaA FOR: ATT ACA AAT TTG TAA CAG ACT TAT TTT A SEQ ID NO:28); и
SsaA REV: AAA ATA AGT CTG TTA CAA ATT TGT AAT A SEQ ID NO:29
Для образования Sig гантели TFD (упоминаемой как SA3 TFD), могут быть синтезированы следующие фосфорилированные олигонуклеотиды:
SigDB_SA3: CTTGG TTTTT CCAAG GAA GAT TAG AAA TTA TTT CGA T GGG TAT ATA ATA (SEQ ID NO:30); и
SigDB_SA3: P-CCG TCT TTT TGA CGG TAT TAT ATA CCC ATC GAA ATA ATT TCT AAT CTT C (SEQ ID NO:31)
Последовательностями пар олигонуклеотидов, используемых для образования WaIR_TFD, являются:
WaIR1: 5'- P-CTT GGT TTT TCC AAG TAA TGA ATG AGT TTA AAG CCC ATG TAA AAG GGG TAT CAG TAC- 3' (SEQ ID NO:32); и
WaIR2: 5'- P-CCC TCT TTT TGA GGG GTA CTG ATA CCC CTT TTA CAT GGG CTT TAA ACT CAT TCA TTA- 3' (SEQ ID NO:33).
Другие подходящие праймеры для TFD включают:
fabBf: 5'- tct tta aat ggc tga tcg gac ttg - 3' (SEQ ID NO:34); и
fabBr 5'- agt aag ttt cga atg cac aat agc gta - 3' (SEQ ID NO:35).
Ks54f: P-CCG ATA AGG GCG CAC GGT TTG CAT GGT TAT A (SEQ ID NO:36); и
Ks54r: P-ATA ACC ATG CAA ACC GTG CGC CCT TAT CGG A (SEQ ID NO: 37).
Консенсусной последовательностью для WaIR TFD может быть TGT WAW NNN NNT GTA AW (SEQ ID NO:38), где: W является A или T.
Консенснусной последовательностью для SigB TFD может быть GKT TWA NNN NNN NNN NNN NNK GGT AW (SEQ ID NO:39), где: K является G или T; W является A или T.
Примером последовательности KP sig TFD является TGG CAC AGA TTT CGC T (SEQ ID NO:40)
Консенсусной последовательностельностью для KP_Sig TFD может быть TGG NNN NNN WTT TGC W (SEQ ID NO:41), где W является A или T.
Такие TFD могут быть получены и протестированы так, как описано в заявках, находящихся на совместном рассмотрении, WO 2009/044154 и WO 2009/044154.
Далее настоящее изобретение описано при помощи неограничивающих примеров и фигур, на которых:
Фигура 1. Химическая структура деквалиния.
Фигура 2. Химическая структура 10,10'-(декан-1,10-диил)бис(9-амино-(1,2,3,4-тетрагидроакридиний) дихлорида.
Фигура 3. Химическая структура 10,10'-(додекан-1,12-диил)бис(9-амино-(1,2,3,4-тетрагидроакридиний) дихлорида.
Фигура 4. Распределение по размеру 100 мкМ боласом sC7, измеренное по динамическому рассеянию света.
Фигура 5. Распределение по размеру 100 мкМ боласом sC7_12, измеренное по динамическому рассеянию света.
Фигура 6. Анализ связывания SYBR зеленого с ДНК для измерения связывания боласом Соединения 7 с TFD.
Фигура 7. Анализ связывания SYBR зеленого с ДНК для измерения связывания боласом Соединения 7_12 с TFD.
Фигура 8. Анализ связывания SYBR зеленого с ДНК для количественной оценки стабильности комплексов, образованных между боласомами соединения 7 и Sig_TFD.
Фигуры 9А и 9В. Электронная микрография комплексов TFD, образованных с боласомами Соединения 7 и Sig TFD.
Фигура 10. Биоанализы in vitro, демонстрирующие замедление роста EMRSA-15 с комплексами Sig, образованными с Соединением 7.
Фигура 11. Биоанализы in vitro, демонстрирующие замедление роста E. Coli с комплексами EC_Fur, образованными с Соединением 7.
Фигура 12. Биоанализы in vitro, демонстрирующие замедление роста EMRSA-15 с комплексами Sig, образованными с Соединением 7_12.
Фигура 13. Графики прошедшего времени от оптической плотности, демонстрирующие действие комплекса шпильки Sig TFD/Соединения 7_12 против скремблированного комплекса и пустого контроля на рост штамма MRSA.
Фигура 14. Графики прошедшего времени от оптической плотности, демонстрирующие действие комплекса шпильки Sig TFD/деквалиния против скремблированного комплекса и пустого контроля на рост штамма MRSA.
Фигура 15. График, иллюстрирующий прирост веса мышей, обработанных комплексом SA_Sig TFD/Соединения 7, комплекса SA_Sig TFD/Соединения 7_12 или солевого раствора, а) и b) показывают независимые повторы этого эксперимента.
Фигура 16. Гистограмма, демонстрирующая груз на почечную ткань после обработки мышей Соединением 7_12, комплексом SA_Sig TFD/Соединения 7_12, комплексом SA_Sig_Scr TFD/ Соединения 7_12, SA_Sig TFD, ванкомицином или носителем.
Фигура 17. Биоанализы in vitro, демонстрирующие замедление роста EMRSA-15 с Sig TFD, смешанным с грамицидином.
Фигура 18. Биоанализы in vitro, демонстрирующие замедление роста EMRSA-15 с Sig TFD, смешанным с буфорином II.
Фигура 19. Флуоресцентная микроскопия подтверждает доставку меченного красителем олигонуклеотида в MRSA при помощи комплексов производных буфорина II, образованных с Соединением 7.
Фигура 20. Биоанализы in vitro, демонстрирующие замедление роста E. coli с EC_FurTFD, смешанным с полимиксином.
Фигура 21. Флуоресцентная микроскопия подтверждает доставку меченого красителем олигонуклеотида в MRSA при помощи комплексов производных буфорина II, образованных с Соединением 7.
Фигура 22. Биоанализы in vitro, демонстрирующие замедление роста EMRSA-15 с производными комплексами буфорина II Sig TFD, образованными с Соединением 7.
Краткое описание последовательностей
SEQ ID NO:1 - нативный связывающий сайт WhiB7 в M. smegmatics str MC2 155
SEQ ID NO:2 - ловушка фактора транскрипции WhiB7
SEQ ID NO:3 - нативный связывающий сайт FadR в E. coli K12
SEQ ID NO:4 - ловушка фактора транскрипции FadR
SEQ ID NO:5 - нативный связывающий сайт для YycF/YycG в S. aureus
SEQ ID NO:6 - нативный связывающий сайт для YycF/YycG в S. aureus
SEQ ID NO:7 - ловушка LytM
SEQ ID NO:8 - ловушка SsaA
SEQ ID NO:9 - нативный связывающий сайт для SigB в S. aureus
SEQ ID NO:10 - нативный связывающий сайт для SigB в K. pneumoniae
SEQ ID NO:11 - консенсусная последовательность для связывания Fur в S. aureus
SEQ ID NO:12 - консенсусная последовательность для связывания Fur в E. coli
SEQ ID NO:13 - нативная связывающая последовательность для Fur в H. pylori
SEQ ID NO:14 - консенсусный связывающий сайт для TcdR в C. difficile
SEQ ID NO:15 - консенсусный связывающий сайт для Vfr в P. aeruginosa
SEQ ID NO:16 - нативный связывающий сайт для Vfr в P. aeruginosa
SEQ ID NO:17 - нативный связывающий сайт для Vfr в P. aeruginosa
SEQ ID NO:18 - нативный связывающий сайт для NtrC в K. pneumoniae
SEQ ID NO:19 - нативная связывающая последовательность для ArsR в H. pylori
SEQ ID NO:20 - нативная связывающая последовательность для ArsR в H. pylori
SEQ ID NO:21 - гликопептид-резистентная консенсусная последовательность в S. aureus
SEQ ID NO:22 - Agr связывающий мотив в S. aureus
SEQ ID NO:23 - Agr связывающий мотив в S. aureus
SEQ ID NO:24 и 25 - последовательности прямого и обратного праймера для препарата PCR SAsigB TFD
SEQ ID NO:26 и 27 - последовательности прямого и обратного праймера для препарата PCR SAfhu TFD
SEQ ID NO:28 и 29 - последовательности прямого и обратного праймера для препарата PCR SsaA TFD
SEQ ID NO:30 - олигонуклеотидная последовательность фосфорилированной гантели Sig TFD
SEQ ID NO:31 - олигонуклеотидная последовательность фосфорилированной гантели Sig TFD
SEQ ID NO:32 - фосфорилированный олигонуклеотид, включающий связывающий сайт для WaIR
SEQ ID NO:33 - фосфорилированный олигонуклеотид, включающий связывающий сайт для WaIR
SEQ ID NO:34 и 35 - прямой и обратный праймеры для промотора FabB
SEQ ID NO:36 и 37 - прямой и обратный праймеры для TFD, содержащие распознающую последовательность для фактора σ54 K. pneumoniae
SEQ ID NO:38 - консенсусная последовательность WaIR TFD
SEQ ID NO:39 - консенсусная последовательность SigB TFD
SEQ ID NO:40 - последовательность KP_Sig TFD
SEQ ID NO:41 - консенсусная последовательность KP_Sig TFD
SEQ ID NO:42 - грамотрицательная последовательность петли Sig TFD
SEQ ID NO:43 и 44 - последовательности прямого и обратного праймера для скремблированного связывающего сайта Sig S. aureus
SEQ ID NO:45 и 46 - прямые и обратные праймеры, используемые для амплификации мишеневой последовательности из вектора pGEMT-Easy
SEQ ID NO:47 и 48 - прямые и обратные праймеры для WhiB7 TFD
SEQ ID NO:49 - SA SIG петлевая TFD последовательность
SEQ ID NO:50 - SA_SIG скремблированная петлевая TFD последовательность
SEQ ID NO:51 - пептидная последовательность буфорина II
SEQ ID NO:52 - Tef-производный SASig TFD
ПРИМЕР 1. ОБРАЗОВАНИЕ КОМПЛЕКСОВ С АНАЛОГАМИ ДЕКВАЛИНИЯ И TFD
В статье Weissig et al. показано (WO99/013096), что деквалиний (DQA) может использоваться для доставки ДНК в митохондрии. При обработке ультразвуком DQA образует сферические агрегаты размером от около 70 до 700 мм, которые похожи на фосфолипидные везикулы. Эти агрегаты были названы «DQAсомами» в публикации W099/013096 и «боласомами» в публикации Weissig and Torchilin ((2001) Adv. Drug Delivery Rev. 49:127-149). Термин «боласома» используется в настоящем документе для описания везикул DQA и их аналогов после обработки соединений ультразвуком.
Комплексы, состоящие из олигонуклеотидов ловушек факторов транскрипции (TFD), самостоятельно связываются с соответствующим соединением доставки. Олигонуклеотид TFD содержит 40-100 нуклеотидов и имеет природный фосфатный скелет. Он самостоятельно гибридизуется с образованием связывающего сайта для мишеневого фактора транскрипции и имеет природную шпильку для защиты 5' и 3' концов, пример которой показан ниже (GN_SIG_HP):
В альтернативной конфигурации небольшие петли шпилек с обоих концов TFD действуют для защиты молекулы от разрушения и определяют гантелеобразную (DB) форму TFD.
Материалы и способы.
Получение соединений доставки. В 10 мл метанола растворяли 15 мг каждого соединения (Sygnature Ltd.) и высушивали до конца, используя ротационный испаритель, и повторно суспендировали в 5 мМ Hepes рН 7,4 до конечной концентрации 10 мМ. Соединение 7 легко растворялось с образованием прозрачного светло-желтого раствора. Соединение 7_12, растворенное после обработки в ультразвуковой ванне в течение 1 часа, образовало непрозрачный, светло-желтый раствор. Оба раствора обрабатывали ультразвуком на льду, используя прибор MSE Soniprep 150. Использовали следующие условия: 60 циклов 30 с включений (амплитуда 10 микрон) и 60 с выключений. После такой обработки образец Соединения 7_12 становился полностью прозрачным. Оба образца центрифугировали для удаления остатков и обозначали как sC7 (обработанное ультразвуком соединение 7) или sC7_12 (обработанное ультразвуком соединение 7_12). На этом этапе образовались везикулы или «боласомы».
Получение гантелеобразных комплексов TFD. 2 мкг TFD (олигонуклеотид из 32 пар оснований, который связали с лигандами для получения одномерного круга) смешивали с 1 мл 5 мМ буфера Hepes рН 7,4 или бульоном LB (бульон Luria Bertani): 1% (вес./об.) бакто-триптона, 5% (вес./об.) дрожжевого бакто-экстракта, 5% (вес./об.) NaCl), который затем смешивали с 1-10 мкл sC7 или sC7_12 при комнатной температуре.
Получение шпилек комплексов TFD. Олигонуклеотиды суспендировали в воде при концентрации 1 мМ (то есть 180 нмоль в 180 мкл). Суспензию разбавляли до 10 мкМ в воде и нагревали до 95°C в течение 2 минут в сухом нагревательном устройстве, после чего суспензию перестали нагревать и оставляли остывать до комнатной температуры. Для подтверждения того, что TFD гибридизовался правильно, 1 мкл TFD смешивали с 1 мкл 10xNED буфером 1, 6 мкл воды и 1 мкл экзонуклеазы I (NEB). Контрольная смесь не содержала 1 мкл TFD. Смесь инкубировали при 37°C в течение 30 минут, а затем разделили на 3% низкоплавком агарозном геле/TAE, окрашенном 0,5х SYBR зеленым. Подтверждение правильности TFD подтверждали по устойчивости к расщеплению экзонуклеазой.
Для получения комплексов доставки 10 мг соединения суспендировали в 12,5 мл 5 мМ Hepes рН 7,5 (конечная концентрация 0,8 мг/мл) и растворяли при помощи ультразвука (30×30 с вкл., 30 с выкл., на льду при 10 микрон). Для установления точной концентрации измеряли поглощение полученного раствора при 327 нм. 12,5 мкл соединения доставки смешивали с 40 мкл 10 мкМ TFD и 447,5 мкл 5 мМ Hepes (рН 7,5) и обрабатывали ультразвуком на ледяной бане, используя прибор MSE 150 Soniprep, подключенный к микродатчику. Тридцать циклов обработки ультразвуком проводили при 30 с вкл. (при 50% мощности, примерно 10 мк) и 30 с выкл.
Анализы связывания ДНК. Для определения доли TFD, связанных с везикулами, использовали анализ связывания с SYBR зеленым. Комплексы TFD получали так, как описано выше в буфере Hepes, делая поправку на то, что буфер содержит 5 мкл разбавленного 1 к 10 раствора красителя SYBR зеленого I (Invitrogen, 10000 х исходный раствор, полученный в ДМСО). Измеряли флуоресценцию (λEX 497 нм, λEМ 520 нм) для определения того, сколько боласом нужно добавить для погашения связывания SYBR зеленого с TFD.
Определение размеров. Размер боласом определили по динамическому рассеянию света, используя прибор Dynapro Titan DLS.
Визуализация частиц. Размер частиц измеряли, используя электронную микроскопию. Образцы напрямую окрашивали уранилацетатом перед визуализацией.
Результаты.
1.1 Распределение боласом sC7 по размеру
Боласомы sC7 готовили в 5 мМ буфере Hepes с концентрацией 10 мМ. Перед измерением их распределения по размеру при помощи динамического рассеяния света, боласомы разбавляли в этом же буфере в 1000 раз. Большая часть материала по весу имела диаметр свыше 3 мкм, что обусловленно неспецифическими агрегатами или пылью. Остальные частицы имели средний диаметр 68 нм (Фигура 4). Это отличается от опубликованного распределения везикул по размеру (Weissig et al. 2001 S. T. P. Pharma Sci. 11: 91-96: Таблица I, см. Соединение 7), где предполагается распределение частиц по размеру 169 нм +/-50 нм, и комментируется, что это распределение было узким. Значения для боласом sC7 являлись близкими к опубликованным значениям, хотя это отличие может отражать различные параметры эксперимента и измерительные приборы. Действительно, тот факт, что боласомы sC7 были стабильны, несмотря на разбавление, показывает, что они обладают повышенной стабильностью по сравнению с боласомами, образованными при обработке ультразвуком растворов деквалиния, посколько они опять становятся мономерами при разбавлении (которые имеют диаметр менее 10 нм).
Диаметры боласом sC7 и sC7_12 (смотри 1.2) представлены в Таблице 2:
1.2 Распределение боласом sC7_12 по размеру.
Боласомы sC7_12 готовили в 5 мМ буфере Hepes с концентрацией 10 мМ. Перед измерением их распределения по размеру при помощи динамического рассеяния света, боласомы разбавляли в этом же буфере в 1000 раз. Как описано в п. 1.1, сигнал от крупного материала отбрасывали. Оставшиеся частицы имели средний диаметр 48,4 нм или 197,7 нм, и находились в отношении 1:2,5 (Фигура 5). Это значительно отличается от диаметров боласом sC7. Однако эти частицы имели лучшее распределение по размеру, чем размеры, описанные другими авторами, для частиц, образованных при таких же концентрациях деквалиния, и были сравнимы со значениями, полученными Weissig для боласом, образованных Соединением 7 (Weissig et al. (2001) S. T. P. Pharma Sci. 11: 91-96).
1.3 Установление оптимальных условий связывания sC7 и sC7_12 с TFD по анализу связывания с ДНК
Краситель SYBR зеленый I специфически связывался с двухспиральной ДНК, в результате чего был сильный флуоресцентный сигнал. Измеряя изменение сигнала в присутствии различных концентраций и типов боласом, можно рассчитать максимальное количество боласом, необходимое для погашения связывания SYBR зеленого за счет исключения красителя боласомами. Это было достигнуто экстраполяцией линейной части кривой титрования, на которую нанесено количество боласом, добавленных к флуоресцентному сигналу. Используя фиксированную концентрацию 2 мкг TFD/мл, находили минимальную концентрацию боласом sC7 равную 6,13 мкг/мл (Фигура 6). При этих концентрациях не было обнаружено погашения мономерным C7.
Была обнаружена минимальная концентрация для боласом sC7_12, равная 9,26 мкг/мл (Фигура 7).
Минимальное необходимое количество боласом использовали при получении комплексов TFD. Такие концентрации использовали также для того, чтобы убедиться, что отклонение между образцами было минимальным при получении боласом. В целом, наблюдали отклонение около 20%, что не влияло на биологическую функцию.
Стабильность комплексов измеряли, контролируя нормализованную флуоресценцию за счет связывания красителя SYBR зеленого. Кривые титрования для комплексов TFD, образованных с боласомами sC7, оставались постоянными в течение более 72 часов при хранении при 4°C (Фигура 8), демонстрируя, что условия, показанные в настоящем документе, обеспечивают существенное улучшение стабильности образованных комплексов.
1.4 Диаграммы электронной микрографии комплексов боласом sC7 и TFD
Комплексы TFD, образованные между боласомами sC7 и TFD, визуализировали электронной микроскопией по отрицательному окрашиванию уранилацетатом. Два примера представлены на Фигурах 9А и 9В. Четко видны круглые частицы размером 50-100 нм при условии плотного окрашивания, а также видны гранулы во внутренней части, которые могут быть конденсированными структурами ДНК.
ПРИМЕР 2. ДОСТАВКА TFD В БОЛАСОМЕ СОЕДИНЕНИЯ 7 РАЗРУШАЕТ MRSA
Материалы и способы
Получение гантелей TFD присоединением лигандов (DB-TFD)
Синтезировали два олигонуклеотида, каждый содержал одну цепь сайта распознавания для S. aureus или сигма-белок. На каждом конце молекулы небольшая петля шпильки действовала для защиты молекулы от разрушения. Каждый олигонуклеотид повторно суспендировали в dH2O при концентрации 250 пмоль/мкл. Для образования Sig гантели TFD (упоминаемой как Sig TFD) синтезировали следующие фосфорилированные олигонуклеотиды:
SEQ ID NO:30 - SigDB1: CTT GGT TTT TCC AAG GAA GAT TAG AAA TTA TTT CGA TGG GTA TAT AAT A
SEQ ID NO:31 - SigDB2: P-CCG TCT TTT TGA CGG TAT TAT ATA CCC ATC GAA ATA ATT TCT AAT CTT C
При гибридизации они образовали следующую молекулу:

30 мкл каждого олигонуклеотида смешивали с 27 мкл dH2O и гибридизовали при помощи следующей программы PCR: ГИБРИДИЗАЦИЯ: 95°C 3 минуты, охлаждение при -0,1°C/с до 8°C, конец. После этого добавляли 10 мкл 10xNEB лигазного буфера и 3 мкл HC T4 ДНК лигазы (NEB). Эту смесь инкубировали в течение ночи при 16°C. Затем материал интенсивно расщепляли Т7 экзонуклеазой (NEB) для удаления всех негибридизованных олигонуклеотидов, а затем восстанавливали двумя циклами осаждения этанолом. Получали также DB_TFD, содержащий скремблированную версию связывающего сайта Sig, упоминаемый как Scr TFD. В этом случае использовали фосфорилированные праймеры:
SEQ ID NO:43 - SigScr_SA1: CTT GGT TTT TCC AAG TAG AAA GAA GAT TTA GGG CGA T TTT ATA ATA TAT
SEQ ID NO:44 - SigScr_SA2: CCG TCT TTT TGA CGG ATA TAT TAT AAA ATC GCC CTA AAT CTT CTT TCT A
Образование комплексов
Минимальное количество боласом sC7, необходимое для связывания 2 мкг любого TFD, устанавливали эмпирически, и соответствующее количество боласом смешивали с TFD в 5 мМ Hepes, рН 7,4, для образования комплексов. Разбавленные растворы наночастиц TFD использовали в последующих биоанализах.
Выполнение исследований роста в 96-луночных планшетах
Анализ роста выполняли, используя комплексы, состоящие из Sig TFD или Scr TFD, смешанные с боласомами sC7, для определения действия на рост клинически выделенного штамма MRSA. Анализы для определения действия на рост бактериальных клеток выполняли с использованием 96-луночных планшетов, где каждая лунка содержит 200 мкл бульона, содержащего среду LB. 1 мкл различных концентраций комплексов TFD добавляли в каждую лунку и контролировали действие на бактериальный рост S. aureus, измеряя поглощение бульона в интервалах во время инкубирования. Планшеты инкубировали при 37°C при встряхивании, и значения поглощения (при 450 нМ) считывали при помощи планшет-ридера.
Результаты
2.1 Комплексы TFD могут эффективно разрушать MRSA in vitro
Комплексы TFD получали с боласомами sC7, используя TFD, разрушающий клетки MRSA, называемый «Sig TFD» или скремблированную версию в качестве контроля, «Scr TFD». Штамм MRSA, EMRSA15, использовали для инокуляции бульона LB для получения конечной концентрации клеток 5×105/мл. Аликвоты по 200 мкл распределяли по лункам в 96-луночном планшете. В лунки добавляли различные концентрации комплекса Sig TFD, комплекса Scr TFD, эквивалентные концентрации боласом sC7 в качестве контроля любого антибактериального действия аналога деквалиния (контроль sC7) или не обрабатывали лунки (Фигура 10). Оба комплекса TFD содержали sC7 при концентрации 500 нг/мл и TFD при 5 мкг/мл. Контроль sC7 состоял из боласом при концентрации 500 нг/мл.
Рост клеток был в основном одинаков для необработанного образца, контроля sC7 и контрольного комплекса (состоящего из Scr TFD). Однако комплекс Sig TFD предотвращал бактериальный рост. Следовательно, комбинация боласомы sC7 с Sig TFD разрушала штамм MRSA, тогда как контрольный комплекс TFD - нет. Это произошло за счет эффективной доставки комплексами терапевтических TFD в MRSA. Действие только соединения доставки, сопровождающееся повреждением мембраны, не разрушает бактерии, а также на рост клеток не влияют контрольный комплекс или эквивалентное количество боласом sC7.
ПРИМЕР 3. ДОСТАВКА TFD БОЛАСОМОЙ СОЕДИНЕНИЯ 7 РАЗРУШАЕТ E. coli
Материалы и способы
Получение Fur TFD при помощи PCR
Fur TFD были созданы для внедрения связывающего сайта в транскрипционный регулятор ферментов синтеза жирных кислот, FadR, который является восходящим геном FabB в Escherichia coli. Ген FabB кодирует фермент, участвующий в синтезе жирных кислот (J. Bacteriology (2005) 183:5292). Использовали олигонуклеотиды для амплификации последовательности промоторов:
SEQ ID NO:34 - fabBf 5'- tct tta aat ggc tga tcg gac ttg - 3'
SEQ ID NO:35 - fabBr 5'- agt aag ttt cga atg cac aat agc gta - 3'
Полученный фрагмент связывали с лигандами в векторе pGEMTEasy (Promega) и синтезировали PCR TFD амплификацией PCR, используя олигонуклеотидные праймеры, созданные для гибридизации скелета вектора, немедленно фланкирующего внедрение, например:
SEQ ID NO:45 TEf: 5' - ggc cgc cat ggc ggc cgc ggg aat tc - 3'
SEQ ID NO:46 TEr: 5' - agg cgg ccg cga att cac tag tg - 3'.
Продукт PCR осадили этанолом и повторно суспендировали в буфере ТЕ (10 мМ Tris.HCl, 1 мМ ЭДТК, рН 8,0) при концентрации 500-1000 нг/мкл.
Получали так же контрольный TFD, имеющий последовательность, которая создает фрагменты PCR такого же размера при использовании реакции амплификации с геномной ДНК, выделенной из Mycobacterium smegmatis. Последовательность этих олигонуклеотидов:
SEQ ID NO:47 - WhiB7.f CAC CAG CCG AAA AGG CCA CGG
SEQ ID NO:48 - WhiB7.r CAA AAA TGG CCA CGG ATC CGG GTG
Результаты
3.1 Комплексы TFD могут эффективно разрушать E. coli in vitro
Комплексы TFD получали с TFD, активными против E. coli, EC Fur и контрольного TFD, EC FurScr TFD. Эксперимент проводили так, как описано в Примере 2.1, и получали такие же результаты (Фигура 11). И снова результаты показали, что комплексы, образованные с боласомами sC7 и EC Fur TFD, предотвращают рост E. coli (штамм DH10B) в среде с ограниченным содержанием железа.
ПРИМЕР 4. ДОСТАВКА TFD БОЛАСОМОЙ СОЕДИНЕНИЯ 7_12 РАЗРУШАЕТ MRSA
Материалы и способы
Комплексы TFD получали так, как описано в Примере 2, с Sig TFD или Scr TFD, за исключением того, что использовали боласомы sC7_12. Полученные комплексы TFD исследовали на их активность для профилактики роста штамма MRSA EMRSA15.
Результаты
4.1 Комплексы TFD могут эффективно разрушать MRSA in vitro
Комплексы TFD получали, используя TFD, разрушающий клетки MRSA, называемый «Sig TFD» или скремблированную версию, «Scr TFD», в качестве контроля, с боласомами sC7_12. Штамм MRSA, EMRSA15, использовали для инокуляции бульона LB для получения конечной концентрации клеток 5×105/мл. Аликвоты по 200 мкл распределяли по лункам в 96-луночном планшете. В лунки добавляли различные концентрации комплексов Sig TFD, комплексов Scr TFD, эквивалентные концентрации боласом sC7_12 в качестве контроля любого антибактериального действия аналога деквалиния (контроль sC7_12) или не обрабатывали лунки (Фигура 12). Оба комплекса TFD содержали sC7_12 при концентрации 800 нг/мл (1,3 мкМ) и TFD при 5 мкг/мл (153 нМ). Контроль sC7_12 состоял из боласом при концентрации 800 нг/мл.
Рост клеток был в основном одинаков для необработанного образца, контроля sC7_12 и контрольного комплекса (включающего Scr TFD). Однако комплекс Sig TFD предотвращал бактериальный рост. Следовательно, комбинация боласомы sC7_12 с Sig TFD разрушала штамм MRSA, тогда как контрольный комплекс TFD - нет. Это произошло за счет эффективной доставки комплексами терапевтических TFD в MRSA. Действие только соединения доставки, сопровождающееся повреждением мембраны, не разрушает клетки, а также на рост клеток не влияют контрольный комплекс или эквивалентное количество боласом sC7_12.
ПРИМЕР 5. ДОСТАВКА ШПИЛЬКИ TFD РАЗЛИЧНЫМИ СОЕДИНЕНИЯМИ ДОСТАВКИ РАЗРУШАЕТ MRSA
Комплексы TFD, содержащие шпильку TFD SA SIG и деквалиний, соединение 7 или соединение 7_12, получали способом, представленным в Примере 1. Распределение частиц образованных везикул измеряли при помощи прибора Malvern Nanosizer по стандартной методике, и оно представлено в Таблице 3:
Обнаружено, что распределение везикул по размеру не изменяется при использовании различных последовательностей TFD. Последовательность SA SIG HP (предназначенная для связывания альтернативного сигма-фактора в Staphylococcus aureus):
SEQ ID NO:49 - 5'-gcg aag cga aga tta gaa att att tcc atg ggt ata taa tac ttg gtt ttt cca agt att ata tac cca tgg aaa taa ttt cta atc ttc-3'
5.1. Эффективность SA_SIG_HP TFD, связанного в комплекс с Соединением 7_12
Комплекс TFD получали так, как описано в Примере 1 (упоминаемый как Sig) в виде двух контрольных ловушек, одна без TFD (пустая), а другая является скремблированной версией SA SIG HP (скремблированная), содержащей TFD SA_SIG_Scr_HP, который имеет следующую последовательность:
SEQ ID NO:50 - 5'-gcg aag cat ctt gta tgc aaa tag aat gaa taa tag ttt gac ttg gtt ttt cca agt caa act att att cat tct att tgc ata caa gat-3'
1 мкл каждого комплекса доставки добавляли к 200 мкл бульона LB, инокулированного с 1 мкл глицеринового исходного раствора штамма MRSA, EMSRA15, при концентрации 3×106 единиц, образующих колонию, на мкл. Культуры выращивали при 37°C при умеренном встряхивании, и измеряли оптическую плотностью культур в планшет-ридере с интервалами в полчаса.
Графики прошедшего времени против оптической плотности, представленные на Фигуре 13, демонстрируют, что комплекс Sig эффективно предотвращает рост штамма MRSA с концентрациями Соединения 7_12 500 нг/мл и 20 пмоль TFD. Бактерии, обработанные комплексом Scr (с такими же концентрациями Соединения 7_12 и TFD) росли медленнее, чем пустой контроль и необработанный образец. Это наблюдалось в предыдущих экспериментах, и интерпретируется как явление, обусловленное замедлением роста за счет действия доставки скремблированного TFD в клетку. Когда TFD ингибирует реакцию стресса, как это делает SA_SIG_HP, клетки не могут восстанавливаться. Рост пустого контроля и необработанного образца не был заметным.
Следовательно, комплексы, содержащие SIG_SA_HP TFD, предназначенные для блокирования важных путей в S. aureus, являются смертельными для бактериальных клеток, поскольку доставка только скремблированной версии TFD или доставка только носителя является неэффективной.
5.2 Эффективность SA_SIG_HP, связанного в комплекс с деквалинием.
Комплекс TFD получали так, как описано в разделе 5.1 выше, за исключением того, что используемая концентрация деквалиния была в 6 раз выше, чем концентрация Соединения 7_12. Точно так же получали две контрольные ловушки, одна без TFD (пустая), а другая - скремблированная версия SA SIG HP (скремблированная), содержащия TFD SA_SIG_Scr_HP.
1 мкл каждого комплекса доставки добавляли к 200 мкл бульона LB, инокулированного с 1 мкл глицеринового исходного раствора штамма MRSA, EMSRA15, при концентрации 3×106 единиц, образующих колонию, на мкл. Культуры выращивали при 37°C при умеренном встряхивании, и измеряли оптическую плотностью культур в планшет-ридере с интервалами в полчаса. Графики прошедшего времени против оптической плотности, представленные на Фигуре 14, демонстрируют, что антибактериальный Sig эффективно предотвращает рост штамма MRSA с концентрациями Соединения 7_12 3 мкг/мл и 10 пмоль TFD. Бактерии, обработанные антибактериальным Scr (с такими же концентрациями деквалиния и TFD) росли медленнее, чем пустой контроль и необработанный образец. Это наблюдалось в предыдущих экспериментах, и интерпретируется как явление, обусловленное замедлением роста за счет действия доставки скремблированного TFD в клетку. Когда TFD ингибирует реакцию стресса, как это делает SA_SIG_HP, клетки не могут восстанавливаться. Рост пустого контроля и необработанного образца не был заметным.
Следовательно, комплексы, содержащие SIG_SA_HP TFD, предназначенные для блокирования важных путей в S. aureus, являются смертельными для клеток, поскольку доставка только скремблированной версии TFD или доставка только носителя является неэффективной.
ПРИМЕР 6. ЭФФЕКТИВНОСТЬ SA Sig TFD СОЕДИНЕНИЕМ С7_12 ПРИ ЛЕЧЕНИИ MRSA НА МЫШИНОЙ МОДЕЛИ СЕПСИСА
Мышей, использованных в этом исследовании, самцов мышей CD1, закупили у компании Charles River (Margate UK), эти мыши были свободны от особых патогенов (16-18 г при поставке). Все мыши весили 22-25 г в начале эксперимента.
6.1. Исследование переносимости
Животных обрабатывали в группах по две мыши в обрабатываемой группе, поэтому в целом использовали шесть животных для этого исследования. Всех мышей взвешивали в 1 день исследования и случайным образом помещали в ящики. Мышей обрабатывали внутривенным введением следующего состава при 10 мл/кг:
- 100 мкМ SA Sig TFD (2 мг/мл; SEQ ID NO:9) и 525 мкМ (0,315 мг/мл) Соединения 7 в солевом растворе;
- 100 мкМ SA Sig TFD (2 мг/мл; SEQ ID NO:9) и 525 мкМ Соединения 7_12 (0,315 мг/мл) в солевом растворе; и
- Только солевым раствором.
Концентрации TFD и молекулы доставки выбирали так, чтобы они были примерно в десять раз больше, чем прогнозируемая эффективная доза.
После обработки мышей ежедневно взвешивали в течение 100 часов, а затем умерщвляли. Легкие, печень, селезенку и почки удаляли и визуально осматривали, и взвешивали. На Фигуре 15 показан прирост веса всех трех групп с индексами а) и б), обозначающими независиме экспериментальные повторы.
Не наблюдалось существенного различия между контрольными обработками (солевым раствором) и обработкой комбинациями TFD и соединениями доставки. Поэтому все варианты обработки оказались хорошо переносимыми при внутривенном введении. Не отмечено острых нарушений. После обработки мыши нормально питались и пили без каких-либо признаков расстройства. Прирост веса обработанных мышей был таким же, как и контрольных мышей, обработанных носителем. Аутопсия не показала больших аномальностей почек, легких, печени или ЖК тракта. Вес почек, легких и печени был в нормальном диапазоне. Все исследуемые соединения являются переносимыми и подходящими для дальнейшего введения вплоть до максимальной дозы, использованной в этом исследовании переносимости.
6.2. Исследование груза на ткани
Животных обрабатывали в группах по шесть мышей в обрабатываемой группе, поэтому в целом использовали сорок восемь животных для этого исследования. Готовили две 10 мл культуры Staphylococcus aureus EMRSA 16 и помещали на орбитальный встряхиватель (220 об./мин.) на ночь при 37°C. На следующий день культуры Staphylococcus aureus EMRSA 16 убирали из встряхивателя, гранулировали и дважды промывали, а затем повторно суспендировали в солевом растворе до оптической плотности 0,132 (1,5×108 колониеобразующих единиц на мл (кое/мл)). Этот исходный раствор Staphylococcus aureus EMRSA 16 затем дополнительно разбавляли 1:1,5 в солевом растворе (1×108 кое/мл), то есть 2,0×107 бактерий на мышь.
Затем все сорок восемь мышей инфицировали 0,2 мл 1,0×108/мл суспензии путем внутривенной инъекции в хвостовую вену мыши. Количество бактерий Staphylococcus aureus EMRSA 16 на мл в оставшихся суспензиях после инокуляции также подсчитывали, чтобы подтвердить ввод инфекции.
Мышей обрабатывали через 1, 9 и 17 часов после инфицирования соединениями или носителем, хотя ванкомицин вводили только один раз, через 1 час. Обработку проводили комбинацией комплексов антибиотиков, полученных с Соединением 7_12 и различными TFD, как показано в Таблице 3а.
Через 25 часов после инфицирования всех животных взвешивали, а затем умерщвляли. Почки сразу удаляли и гомогенизировали в ледяном стерильном фосфатно-солевом буферном растворе + 0,05% Твин 80. Органические гомогенаты количественно культивировали на агаре CLED и инкубировали при 37°C в течение 3 дней и подсчитывали колонии. Данные о культурных грузах анализировали тестом Крускал-Валлиса, используя Stats Direct.
6.3 Исследование груза на ткани
Инфекционную дозу вводили при концентрации 3,7×107 бактерий на мышь для того, чтобы убедиться, что была получена относительно острая инфекция, то есть, инфекция, восприимчивая к лечению. Мышей обрабатывали системной инъекцией (А) только соединения доставки (Соединения С7_12), (В) 1 нМ комплекса SA_Sig/Соединения 7_12, (С) 1 нМ скремблированного контрольного комплекса, (D) только 1 нМ SA_Sig TFD, (Е) ванкомицина, используемого в концентрации, достаточной для достижения 2-кратного снижения колониеобразующих единиц (кое) или (F) носителем. После обработки мышей умерщвляли и измеряли груз, обнаруженный в почках (см. Фигуру 16).
Статистический анализ результатов показал, что у мышей, обработанных антибактериальной ловушкой Sig, достигнуто такое же снижение груза, как и с ванкомицином. Все другие контрольные образцы показали такие же грузы, что и обработка носителем (Таблица 4).
Было обнаружено, что комплекс Sig в этом эксперименте обладает быстрой бактерицидной активностью при наномолярных концентрациях против MRSA in vitro и in vivo.
ПРИМЕР 7. ДОСТАВКА TFD, ОПОСРЕДОВАННАЯ АНТИБАКТЕРИАЛЬНЫМИ ПЕПТИДАМИ
Материалы и способы
Были проанализированы следующие антибактериальные пептиды на их способность доставлять TFD в бактериальные клетки: грамицидин, полимиксин нонапептид (оба приобретены у Sigma Aldrich) и буфорин II (Park et al. (2000) Proc. Natl. Acad. Sci. USA 97: 8245-8250). Обычно 1 мкг Sig DB-TFD и SigScr DB-TFD, как описано в Примере 1, смешивали с 0,2-5 мкг грамицидина в общем объеме 5 мкл 50 мМ NaCl. Из этого 1 мкл добавляли к 200 мкл бульона LB, инокулированного с разбавленным 1/100 глицериновым исходным раствором EMRSA-15 с исходной оптической плотностью 0,3 (поглощение при 600 нм) и переносили аликвоту в лунку 96-луночного планшета. Эксперименты выполняли в трех экземплярах. Планшеты инкубировали при 37°C при встряхивании, и значения поглощения (при 450 нМ) считывали при помощи планшет-ридера.
Результаты
7.1 Грамицидин эффективно доставляет TFD в S. aureus
Добавление 1 мкг Sig DB-TFD в среду LB, инокулированную с EMRSA-15 и с 150 нг/мкл грамицидина приводило к отсутствию бактериального роста. В отличие от TFD отдельно, только грамицидин или грамицидин, смешанный со скремблированной версией DB-TFD, вырос так же, как и необработанный контроль (Фигура 17).
7.2 Буфорин II эффективно доставляет TFD в S. aureus
21 аминокислота пептида буфорина II состояла из следующей последовательности: TRSSRAGLQFPVGRVHRLLRK (SEQ ID NO:51). Sig TFD, смешанные с буфорином II, замедляли рост EMRSA-15 при смешивании с мембрана-активным антимикробным пептидом буфорином II и предотвращали рост бактерий в 96-луночном планшете в анализе in vitro. Контрольный TFD, Scr, который был скремблированной версией последовательности в Sig TFD, не оказал заметного действия на рост по сравнению с необработанным бульоном или клетками, обработанными только пептидом (Фигура 18).
В качестве альтернативы, флуоресцентно меченый олигонуклеотид использовали в качестве замены TFD. Хотя он не обладает предсказуемой активностью как молекула TFD, флуоресцентно меченный олигонуклеотид включает флуоресцентную метку, поэтому его поглощение можно контролировать при помощи флуоресцентной световой микроскопии (Фигура 19).
7.3 Полимиксин эффективно доставляет TFD в E. coli
При смешивании с грамотрицательным активным антимикробным циклическим гликопептидом полимиксином, EC Fur TFD замедлял рост DH5a и предупреждал рост бактерий в 96-луночном планшете в анализе in vitro с использованием среды с ограниченным содержанием железа. Контрольный TFD, WhiB7 TFD, который был неродственной последовательностью такого же размера, что и Fur TFD, не оказал заметного действия на рост по сравнению с необработанным бульоном или клетками, обработанными только пептидом (Фигура 20).
ПРИМЕР 8. ДОСТАВКА КОМПЛЕКСОВ TFD/ДЕКВАЛИНИЯ, КОНЪЮГИРОВАННЫХ С БУФОРИНОМ II
Материалы и способы
Получение производных комплексов с антимикробным пептидом
Получали производные комплексов TFD с антимикробным пептидом буфорином II, используя кросс-линкер EDC (1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорид; Thermo Scientific) с последующей подгонкой двухстадийного протокола связывания, как описано производителем.
Пептид буфорина II синтезировали и лиофилизировали и повторно суспендировали при концентрации 1 мг/мл в активирующем буфере (0,1 М MES [2-(N-морфолино)этансульфоновая кислота], 0,5 М NaCl, рН 6,0). 1 мл этого раствора смешивали с 0,4 мг EDC и 1,1 мг Sulfo-NHS (Thermo Scientific) и инкубировали 5-120 минут при комнатной температуре, более типично 30 минут. После инкубирования добавляли 1,4 мкл 2-меркаптоэтанола для погашения EDC. Непрореагировавший EDC и Sulfo-NHS удалили из пептидного образца путем диализа, используя тюбинг с отсечкой низкого молекулярного веса (Pierce, Slide-A-Lyzer, 2K MWCO).
Концентрированные комплексы TFD получали, используя способы, описанные в Примерах 2 и 3. 35 мкл TFD при концентрации 1,5 мг/мл смешивали с 130 мкл PBS (фосфатно-солевой буферный раствор, 0,1 М буфера фосфата натрия, рН 7,2, 0,15 М NaCl) и 35 мкл обработанного ультразвуком Соединения 7 (боласомами) при концентрации 3,15 мг/мл. Типично, 90 мкл концентрированных комплексов TFD смешивали с 10 мкл производного буфорина II и оставляли реагировать на 2 часа при комнатной температуре. Реакцию гасили добавлением 10 мМ гидроксиламина.
Перед использованием в биоанализах производные наночастиц TFD разбавляли до соответствующей концентрации.
В качестве альтернативы, флуоресцентно меченный олигонуклеотид использовали в качестве замены TFD. Хотя он не обладал предсказуемой активностью как молекула TFD, флуоресцентно меченный олигонуклеотид включал флуоресцентную метку, поэтому его поглощение можно контролировать при помощи флуоресцентной световой микроскопии.
Результаты
8.1. Буфорин II-производные комплексы TFD эффективно доставляли олигонуклеотиды в S. aureus.
Производные комплексов TFD получали, как описано, за исключением того, что TFD заменяли на флуоресцентно меченный олигонуклеотид, Tef, содержащий краситель флуоресцеин на конце 5'. Последовательность этого олигонуклеотида:
SEQ ID NO:52 - Tef- флуоресцеин-AGG CGG CCG CGA ATT CAC TAG TGA.
Производные комплексы добавляли к 200 мкл бульона LB, инокулированного со штаммом MRSA, EMRSA-15, и выращивали в течение ночи при встряхивании при 37°C. На следующее утро клетки собирали центрифугированием и промывали четыре раза в равном объеме PBS. Каплю бактериальной суспензии помещали на предметное стекло и высушивали на воздухе. Затем клетки фиксировали нагреванием, пропуская стекло через пламя горелки Бунзена. Затем предметное стекло заполняли раствором метиленового голубого Леффлера (5 мг/мл метиленового голубого в 69:30:1 (об./об.) растворе воды:метанола: 1% (вес./об.) КОН) и оставляли стоять на 1 минуту, после чего избыток раствора смыли водой, а клетки визуализировали, используя флуоресцентный микроскоп Cairn CCD.
На светлопольном изображении (без флуоресценции) четко видно, что бактерии сгруппировались (Фигура 21), а на флуоресцентном изображении видно, что меченый олигонуклеотид стал интернализованным, что согласуется с тем, что производные наночастиц влияют на доставку. Рост бактерий в бульоне без производных комплексов не демонстрирует флуоресценцию.
8.2. Буфорин II-производные комплексы TFD могут предотвращать бактериальный рост MRSA
Производные комплексы получали так, чтобы они содержали Sig TFD или Scr TFD в качестве контроля (как в Примере 2). Концентрация компонента TFD в исходном растворе производных комплексов составила 8 мкМ, и эти комплексы разбавляли для получения рабочей концентрации 16 нМ TFD и 1,8 мкМ Соединения 7.
При этой концентрации производные комплексы, содержащие Sig TFD, полностью предотвращали рост штамма MRSA, тогда как производный комплекс, содержащий контрольный TFD, - нет. На самом деле рост был таким же, как и в необработаном образце и контрольном бульоне sC7, содержащем 1,8 мкМ боласом Соединения 7 (Фигура 22).
Следовательно, производные комплексов с буфорином II, доставляли Sig TFD в патогенные бактерии для предотвращения роста. Более того, эффективная используемая концентрация этих комплексов была ниже, чем концентрация для немодифицированных комплексов (раздел 4.1).
ПРИМЕР 9 ОБРАЗОВАНИЕ КОМПЛЕКСОВ С ДРУГИМИ АНАЛОГАМИ ДЕКВАЛИНИЯ
По общим способам синтеза, описанным в настоящем документе, были получены следующие аналоги деквалиния:
10,10'-(октан-1,8-диил)бис(9-амино-1,2,3,4-тетрагидроакридиний) дийодид;
10,10'-(додекан-1,12-диил)бис(9-амино-1,2,3,4-тетрагидроакридиний) дийодид;
10,10'-(тетрадекан-1,14-диил)бис(9-амино-1,2,3,4-тетрагидроакридиний) дийодид;
10,10'-(октадекан-1,18-диил)бис(9-амино-1,2,3,4-тетрагидроакридиний) дийодид;
5,5'-(додекан-1,12-диил)бис(11-амино-7,8,9,10-тетрагидро-6Н-циклогепта[b]хинолиний) дийодид;
1,1'-(декан-1,10-диил)бис(4-аминохинолиний) дийодид;
1,1'-(додекан-1,12-диил)бис(4-аминохинолиний) дийодид;
1,1'-(декан-1,10-диил)бис(4-метоксихинолиний) дийодид; и
1,1'-(декан-1,10-диил)бис(2-аминохинолиний) дийодид.
Соединения, перечисленные выше, могут использоваться в способах, описанных в Примерах 1-8 для получения дополнительных комплексов по настоящему изобретению.
Реферат
Группа изобретений относится к области медицины и касается антибактериального комплекса, содержащего последовательность нуклеиновой кислоты нативного клеточного связывающего сайта для бактериального фактора транскрипции и группу доставки, выбранную из соединений четвертичного амина и бис-аминоалканов и их ненасыщенных производных, при этом аминокомпонент аминоалкана является аминогруппой, образующей часть гетероциклического кольца. Антибактериальный комплекс и фармацевтическая композиция, содержащая его, применяются для лечения бактериальных инфекций. Группа изобретений обеспечивает средства, которые являются эффективными при низких концентрациях, обладают синергетическим антибактериальным эффектом. 5 н. и 17 з.п. ф-лы, 22 ил., 5 табл., 9 пр.
Формула
(a) последовательность нуклеиновой кислоты включает последовательность нативного клеточного связывающего сайта для бактериального фактора транскрипции; и
(b) группа доставки выбрана из соединений четвертичного амина и бис-аминоалканов и их ненасыщенных производных, при этом амино-компонент аминоалкана является аминогруппой, образующей часть гетероциклического кольца.
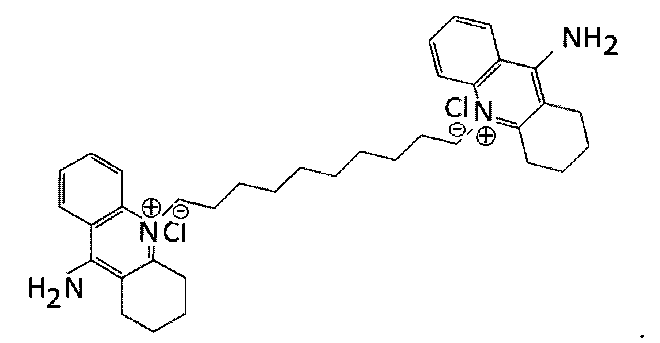
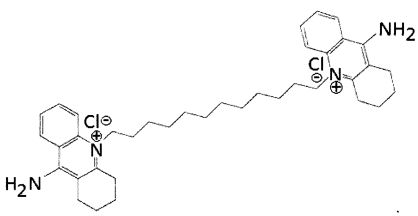
Q-(CH2)p-A-(CH2)q-R3
где Q выбран из:
(a) группы Q1, имеющей формулу:
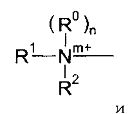
(b) группы Q2, Q2-NH-, Q2-0- или Q2-S-,
где Q2 выбран из моноциклических, бициклических и трициклических гетероароматических групп из 5-14 членов кольца, из которых 1, 2 или 3 являются гетероатомными членами кольца, выбранными из N, О и S, при условии, что присутствует по меньшей мере один азотный кольцевой член, где гетероароматические группы необязательно замещены одним или двумя заместителями R4a, и где указанный один азотный кольцевой член может образовывать N-оксид или может быть замещен C1-4 алкилом, фенил-С1-4 алкилом или ди-фенил-С1-4 алкилом с образованием четвертичной группы, где фениловые группы в каждом случае необязательно замещены одним или двумя галогенами, метилами или метокси-группами;
m равен 0 или 1;
n равен 0 или 1;
p и q являются одинаковыми или различными, и каждый является целым числом от 1 до 12;
целым числом от 1 до 12;
А является связью или выбран из нафталина, бифенила, терфенила, фенантрена, флуорена, стильбена, группы С6Н4(СН2)rC6H4, группы C6H4-C≡C-C6H4, группы пиридин-2,6-диил-бис(бензол-1,4-диил), группы СН=СН=(СН2)s-(СН=СН)t-; и группы C≡C-(СН2)u-(С≡С)v-; где r равен 0-4, s равен 0-4, t равен 0 или 1; и равен 0-4 и v равен 0 или 1;
если n равен 1, то каждый из R0, R1 и R2 выбран из C1-4алкила; и если n равен 0, то N, R1 и R2 вместе образуют моноциклическую, бициклическую или трициклическую гетероароматическую группу из 5-14 кольцевых членов, из которых один является атомом азота N, и 0, 1 или 2 других гетероатомных кольцевых члена выбраны из N, О и S, и где гетероароматическая группа необязательно замещена одним или более заместителями R4b; и R3 выбран из водорода, C1-4алкила, галогена, моноциклических карбоциклических групп из 3-7 кольцевых членов, каждый необязательно замещен одним или двумя заместителями R4c, группы Q; группы -NH-Q2, группы -O-Q2 и группы -S-Q2; и R4a, R4b и R4cявляются одинаковыми или различными и каждый выбран из C1-4алкила, необязательно замещенного одним или более атомами фтора; С1-4алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- и ди-С1-4алкиламино; галогена; фенил-С1-2алкила, где фениловая группа необязательно замещена одним или двумя метокси, метиловыми или галогеновыми заместителями; уреидо и гуанидинила.
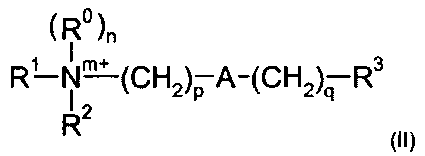
где R1, R2, m, р, A, q и R3 являются такими, как определено в п. 9.
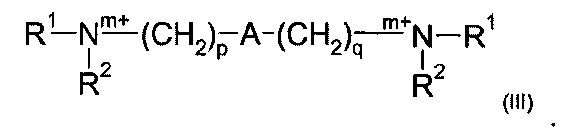
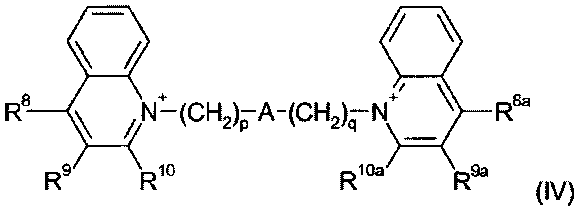
где:
р и q являются одинаковыми или различными, и каждый является целым числом от 1 до 12;
А является связью или выбран из нафталина, бифенила, терфенила, фенантрена, флуорена, стильбена, группы С6Н4(СН2)rC6H4, группы С6Н4-С=С-С6Н4, группы пиридин-2,6-диил-бис(бензол-1,4-диил), группы СН=СН-(СН2) s-(СН=СН)t-; и группы С≡С-(СН2)u-(С≡С)v-; где r равен 0-4, s равен 0-4, t равен 0 или 1; и равен 0-4 и v равен 0 или 1;
R8, R9 и R10 являются одинаковыми или различными и каждый выбран из водорода; C1-4алкила, необязательно замещенного одним или более атомами фтора; C1-4алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- и ди-С1-4алкиламино; галогена, фенил-С1-2алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9 и R10связываются вместе с образованием алкиленовой цепи (CH2)W, где w равен 3-5; и R8a, R9a и R10a являются одинаковыми или различными и каждый выбран из водорода; C1-4алкила, необязательно замещенного одним или более атомами фтора; С1-4алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно-или ди-С1-4алкиламино; галогена, фенил-С1-2алкила, при этом фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)W, где w равен 3-5.
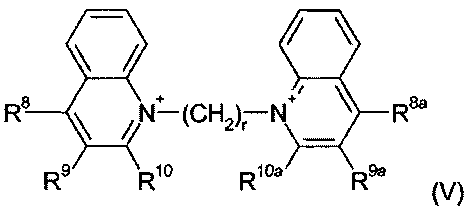
где:
r является целым числом от 2 до 24;
R8, R9 и R10 являются одинаковыми или различными и каждый выбран из водорода; C1-4алкила, необязательно замещенного одним или более атомами фтора; C1-4алкокси, необязательно замещенным одним или более атомами фтора; нитро; амино; моно- и ди-С1-4алкиламино; галогена, фенил-С1-2алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9 и R10связываются вместе с образованием алкиленовой цепи (CH2)W, где w равен 3-5; и R8a, R9a и R10a являются одинаковыми или различными и каждый выбран из водорода; C1-4алкила, необязательно замещенного одним или более атомами фтора; C1-4алкокси, необязательно замещенного одним или более атомами фтора; нитро; амино; моно- и ди-С1-4алкиламино; галогена, фенил-С1-2алкила, где фениловая группа необязательно замещена одним или двумя метокси, метил или галогеновыми заместителями; уреидо и гуанидинила; или R9a и R10aсвязываются вместе с образованием алкиленовой цепи (CH2)W, где w равен 3-5;
при условии, что:
(i) если оба R10 и R10a являются водородом или оба являются метилом, и оба R9 и R9a являются водородом, то по меньшей мере один из R8 и R8a является отличным от водорода, амино или диметиламино; и
(ii) если R9 и R10 связываются вместе с образованием алкиленовой цепи (CH2)W, где w равен 4, и R9a и R10a связываются вместе с образованием алкиленовой цепи (CH2)w, где w равен 4, то по меньшей мере один из R8 и R8a является отличным от амино.
а) последовательность нуклеиновой кислоты, которая содержит последовательность нативного клеточного связывающего сайта для фактора транскрипции; и
b)


Комментарии