Нуклеиновая кислота, композиция и конъюгат, содержащие ее, а также способ их получения и применения - RU2782211C2
Код документа: RU2782211C2
Чертежи














Описание
УРОВЕНЬ ТЕХНИКИ
[1] Вирусный гепатит типа В (также известный как гепатит типа В или гепатит В) представляет собой класс инфекционных заболеваний, которые являются серьезной угрозой для мира, в частности, Китая. В настоящее время двумя основными видами всемирно признанных лекарственных средств для предотвращения/лечения гепатита В являются интерфероны и аналоги нуклеозидов; однако такие лекарственные средства имеют различные недостатки (например, склонны к развитию лекарственной устойчивости после применения или имеют ограниченную применимость). Например, интерфероны склонны вызывать нежелательные реакции; а недостатки аналогов нуклеозидов заключаются в лекарственной устойчивости и рецидиве заболевания после отмены лекарственного средства. Таким образом, если экспрессия генов вируса может быть подавлена на уровне генов, чтобы блокировать продуцирование и репликацию вируса гепатита В (ВГВ), что существенно снизит метаболизм вируса и инфекцию клеток печени, несомненно, это будет самым превосходным средством для лечения гепатита В. Малая интерферирующая РНК (миРНК) может ингибировать или блокировать экспрессию любого гена-мишени, представляющего интерес, например, гена, запускающего заболевание, такое как рак, специфичным для последовательности образом, основанным на механизме РНК-интерференции (РНКи), что позволит достичь цели лечения заболеваний.
[2] Стабилизированная модификация миРНК и система ее доставки являются двумя ключевыми технологиями при разработке лекарственных средств на основе малых РНК.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[3] Согласно некоторым вариантам реализации настоящего изобретения предложен конъюгат миРНК, имеющий структуру, представленную Формулой (1):

в которой
n1 представляет собой целое число от 1 до 3, а n3 представляет собой целое число от 0 до 4;
каждый из m1, m2 и m3 независимо представляет собой целое число от 2 до 10;
каждый из R10, R11, R12, R13, R14 и R15 независимо представляет собой Н или выбран из группы, состоящей из C1-С10 алкила, C1-С10 галогеналкила и C1-С10 алкокси;
R3 представляет собой группу, имеющую структуру, представленную Формулой А59:

(А59),
в которой E1 представляет собой ОН, SH или BH2; и
Nu представляет собой миРНК.
[4] Каждый нуклеотид в миРНК независимо представляет собой модифицированный или немодифицированный нуклеотид. МиРНК содержит смысловую цепь и антисмысловую цепь, причем смысловая цепь содержит нуклеотидную последовательность 1, а антисмысловая цепь содержит нуклеотидную последовательность 2; нуклеотидная последовательность 1 и нуклеотидная последовательность 2 по меньшей мере частично обратнокомплементарны, что позволяет образовывать двухцепочечную область; нуклеотидная последовательность 1 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO:155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность 2 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO:156, и отличается от нее не более чем 3 нуклеотидами:
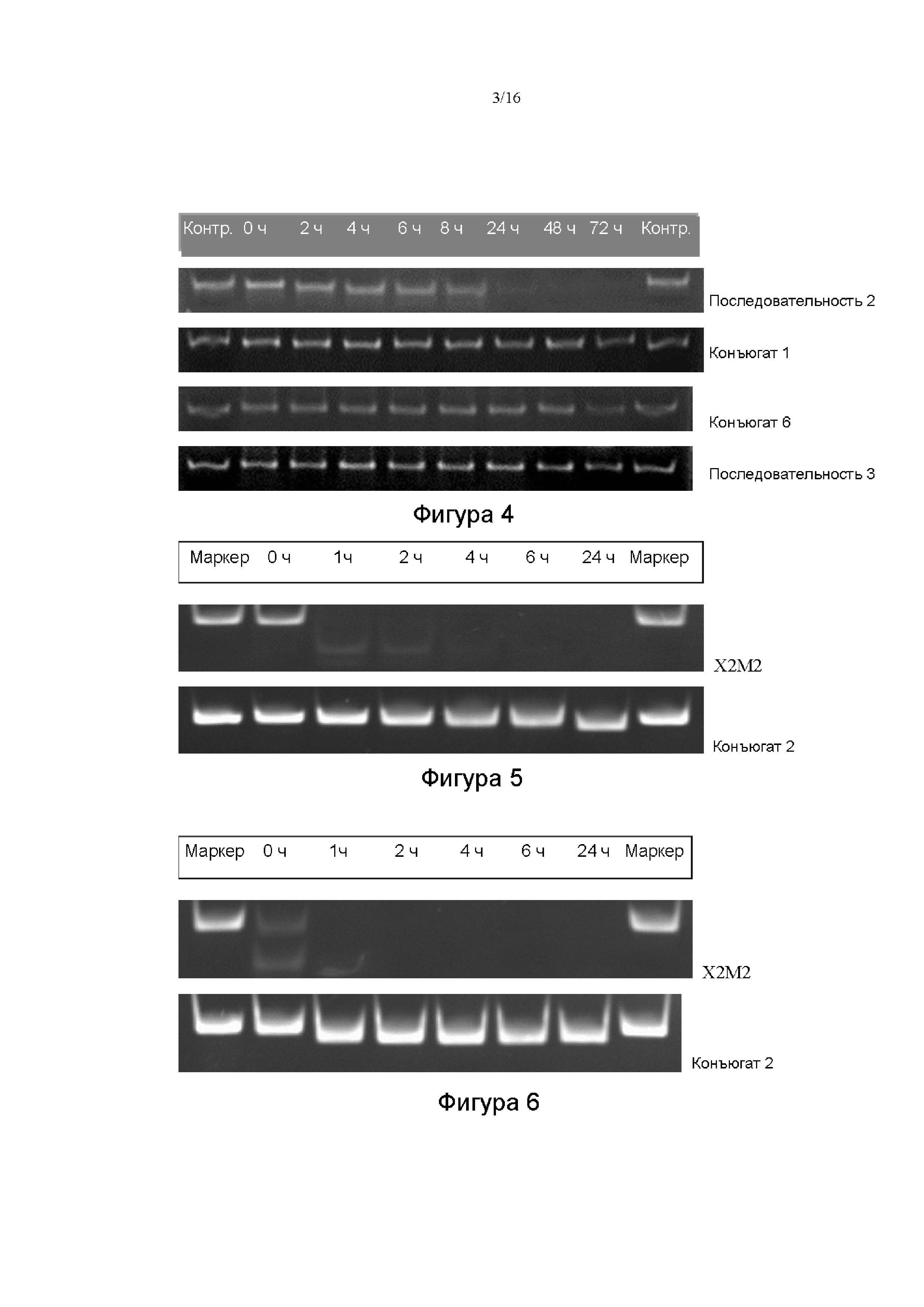
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которых
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность 1 содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность 2 содержит нуклеотид Z'B в положении, соответствующем Z'; нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи;
R2 представляет собой линейный алкилен от 1 до 20 атомов углерода в длину, причем один или более атомов углерода необязательно замещены любым одним или более из группы, состоящей из: С(О), NH, О, S, CH=N, S(O)2, С2-С10 алкилен, С2-С10 алкинилен, С6-С10 арилен, С3-С18 гетероциклилен и С5-С10 гетероарилен, и при этом R2 необязательно замещен любым одним или более из группы, состоящей из: C1-С10 алкил, С6-С10 арил, С5-С10 гетероарил, C1-С10 галогеналкил, -OC1-С10 алкил, -OC1-С10 алкилфенил, -C1-С10 алкил-ОН, -OC1-С10 галогеналкил, -SC1-С10 алкил, -SC1-С10 алкилфенил, -C1-С10 алкил-SH, -SC1-С10 галогеналкил, галоген, -ОН, -SH, -NH2, -C1-С10 алкил-NH2, -N(C1-С10 алкил)(С1-С10 алкил), -NH(C1-C10 алкил), циано, нитро, -СО2Н, -C(O)OC1-C10 алкил, -CON(C1-C10 алкил)(С1-С10 алкил), -CONH(C1-C10 алкил), -CONH2, -NHC(O)(C1-C10 алкил), -NHC(O)(фенил), -N(C1-C10 алкил)С(O)(С1-С10 алкил), -N(C1-C10 алкил)С(O)(фенил), -C(O)C1-C10 алкил, -C(O)C1-C10 алкилфенил, -C(O)C1-C10 галогеналкил, -OC(O)C1-С10 алкил, -SO2(C1-C10 алкил), -SO2(фенил), -SO2(C1-C10 галогеналкил), -SO2NH2, -SO2NH(C1-C10 алкил), -SO2NH(фенил), -NHSO2(C1-C10 алкил), -NHSO2(фенил) и -NHSO2(C1-C10 галогеналкил);
каждый L1 независимо представляет собой линейный алкилен от 1 до 70 атомов углерода в длину, причем один или более атомов углерода необязательно замещены любым одним или более из группы, состоящей из: С(О), NH, О, S, CH=N, S(O)2, С2-С10 алкилен, С2-С10 алкинилен, С6-С10 арилен, С3-С18 гетероциклилен и С5-С10 гетероарилен, и при этом L1 необязательно замещен любым одним или более из группы, состоящей из: C1-С10 алкил, С6-С110 арил, С5-С10 гетероарил, C1-С10 галогеналкил, -OC1-С10 алкил, -OC1-С10 алкилфенил, -C1-С10 алкил-ОН, -OC1-С10 галогеналкил, -SC1-С10 алкил, -SC1-С10 алкилфенил, -C1-С10 алкил-SH, -SC1-С10 галогеналкил, галоген, -ОН, -SH, -NH2, -C1-С10 алкил-NH2, -N(C1-С10 алкил)(С1-С10 алкил), -NH(C1-C10 алкил), циано, нитро, -СО2Н, -C(O)OC1-C10 алкил, -CON(C1-C10 алкил)(С1-С10 алкил), -CONH(C1-C10 алкил), -CONH2, -NHC(O)(C1-C10 алкил), -NHC(O)(фенил), -N(C1-C10 алкил)С(O)(С1-С10 алкил), -N(C1-C10 алкил)С(O)(фенил), -C(O)C1-C10 алкил, -C(O)C1-C10 алкилфенил, -C(O)C1-C10 галогеналкил, -OC(O)C1-С10 алкил, -SO2(C1-C10 алкил), -SO2(фенил), -SO2(C1-C10 галогеналкил), -SO2NH2, -SO2NH(C1-C10 алкил), -SO2NH(фенил), -NHSO2(C1-C10 алкил), -NHSO2(фенил) и -NHSO2(C1-C10 галогеналкил);

M1 представляет собой нацеливающую группу.
[5] Согласно некоторым вариантам реализации настоящего изобретения предложен способ получения конъюгата, включающий последовательное соединение нуклеозидных мономеров в направлении от 3' к 5' в соответствии с типом и последовательностью нуклеотидов смысловой цепи и антисмысловой цепи миРНК, соответственно, в условии твердофазного фосфоамидитного синтеза, причем соединение каждого нуклеозидного мономера включает четырехступенчатую реакцию снятия защиты, связывания, кэпирования, а также окисления или сульфуризации; выделение смысловой цепи и антисмысловой цепи миРНК; и ренатурацию; причем каждый нуклеотид в миРНК независимо представляет собой модифицированный или немодифицированный нуклеотид; миРНК содержит смысловую цепь и антисмысловую цепь, при этом смысловая цепь содержит нуклеотидную последовательность 1, а антисмысловая цепь содержит нуклеотидную последовательность 2; нуклеотидная последовательность 1 и нуклеотидная последовательность 2 по меньшей мере частично обратнокомплементарны, что позволяет образовывать двухцепочечную область;; нуклеотидная последовательность 1 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность 2 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 156, и отличается от нее не более чем 3 нуклеотидами:
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которых
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность 1 содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность 2 содержит нуклеотид Z'B в положении, соответствующем Z'; нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи.
[6] Кроме того, способ дополнительно включает приведение соединения, представленного Формулой (321), в контакт с нуклеозидным мономером или нуклеотидной последовательностью, соединенной с твердофазной подложкой, в условии реакции связывания в присутствии реагента для связывания, что обеспечивает связывание соединения, представленного Формулой (321), с нуклеотидной последовательностью за счет реакции связывания. Далее по тексту соединение, представленное Формулой (321), также называют конъюгирующей молекулой,
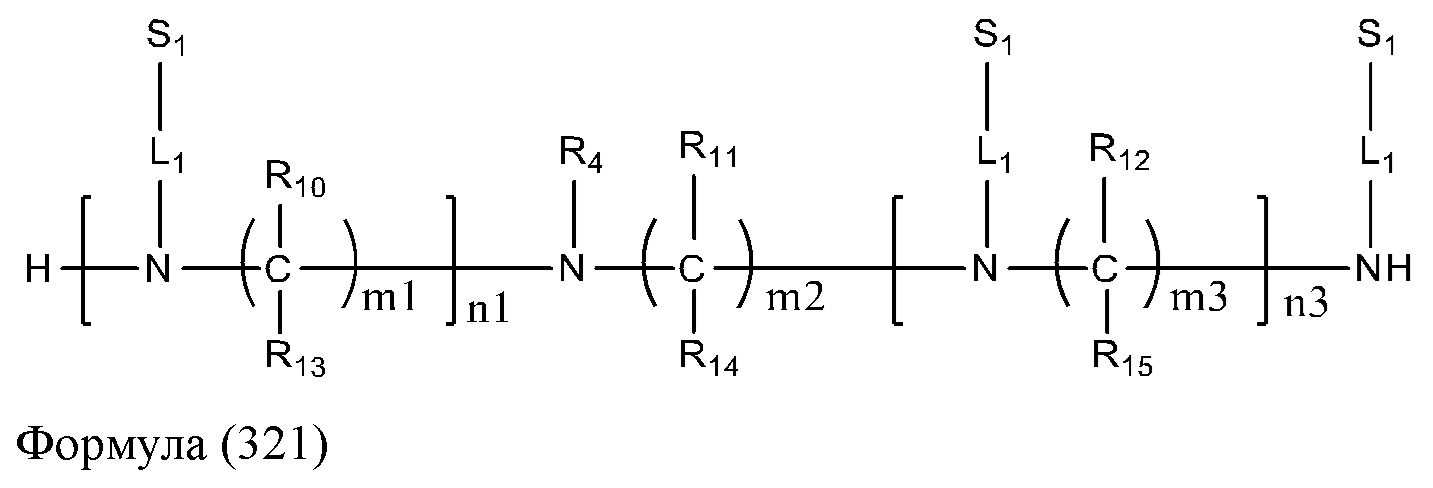
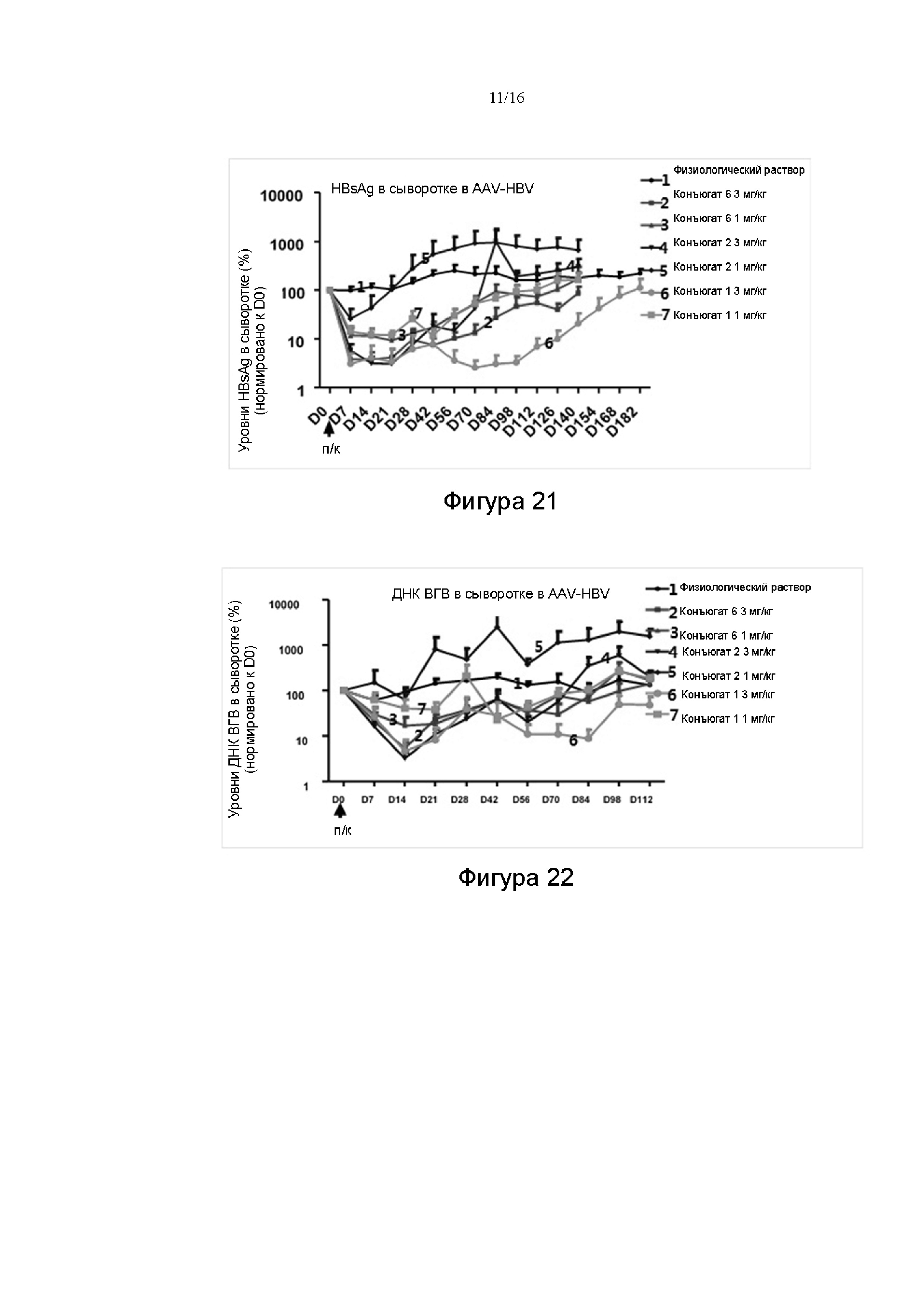
в которой
R4 представляет собой группу, способную связываться с миРНК, представленной Nu; согласно некоторым вариантам реализации настоящего изобретения R4 представляет собой группу, способную связываться с миРНК, представленной Nu, за счет ковалентной связи; согласно некоторым вариантам реализации настоящего изобретения R4 представляет собой группу, содержащую любую функциональную группу, которая может быть конъюгирована с миРНК, представленной Nu, за счет сложной фосфодиэфирной связи с помощью реакции;
каждый S1 независимо представляет собой группу в M1, образованную путем замещения всего активного гидроксила группой, представленной формулой YCOO-, где каждый Y независимо выбран из группы, состоящей из метила, трифторметила, дифторметила, монофторметила, трихлорметила, дихлорметила, монохлорметила, этила, н-пропила, изопропила, фенила, галогенфенила и алкилфенила;
определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14, R15, L1 и M1, соответственно, описаны выше.
[7] Согласно некоторым вариантам реализации настоящего изобретения предложена миРНК, способная ингибировать экспрессию гена вируса гепатита В (ВГВ), причем указанная миРНК содержит смысловую цепь и антисмысловую цепь, обе из которых содержат модифицированные фтором нуклеотиды и нуклеотиды с нефторной модификацией; при этом смысловая цепь содержит сегмент нуклеотидной последовательности I; антисмысловая цепь содержит сегмент нуклеотидной последовательности II; нуклеотидная последовательность I и нуклеотидная последовательность II по меньшей мере частично обратнокомплементарны, что позволяет образовывать двухцепочечную область; при этом нуклеотидная последовательность I содержит нуклеотидную последовательность А, которая имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность II содержит нуклеотидную последовательность В, которая имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 156, и отличается от нее не более чем 3 нуклеотидами:
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которых
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность А содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность В содержит нуклеотид Z'B в положении, соответствующем Z'; нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи; и
модифицированные фтором нуклеотиды расположены внутри нуклеотидных последовательностей А и В;
в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности 1 представляют собой модифицированные фтором нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности 2 представляют собой модифицированные фтором нуклеотиды.
[8] Согласно некоторым вариантам реализации настоящего изобретения предложена фармацевтическая композиция, содержащая миРНК, раскрытую в настоящем документе, и фармацевтически приемлемый носитель.
[9] Согласно некоторым вариантам реализации настоящего изобретения предложен конъюгат миРНК, который содержит миРНК, раскрытую в настоящем документе, и конъюгирующую группу, соединенную с помощью конъюгации с миРНК; миРНК содержит смысловую цепь и антисмысловую цепь, обе из которых содержат модифицированные фтором нуклеотиды и нуклеотиды с нефторной модификацией; причем смысловая цепь содержит сегмент нуклеотидной последовательности I; антисмысловая цепь содержит сегмент нуклеотидной последовательности II; нуклеотидная последовательность I и нуклеотидная последовательность II по меньшей мере частично обратнокомплементарны, что позволяет образовывать двухцепочечную область;; при этом нуклеотидная последовательность I содержит нуклеотидную последовательность А, которая имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность II содержит нуклеотидную последовательность В, которая имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 156, и отличается от нее не более чем 3 нуклеотидами:
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которой
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность А содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность В содержит нуклеотид Z'B в положении, соответствующем Z'; нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи; и
модифицированные фтором нуклеотиды расположены внутри нуклеотидных последовательностей А и В;
в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности 1 представляют собой модифицированные фтором нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности 2 представляют собой модифицированные фтором нуклеотиды.
[10] Согласно некоторым вариантам реализации настоящего изобретения предложено применение миРНК и/или фармацевтической композиции, и/или конъюгата миРНК согласно настоящему изобретению в изготовлении лекарственного средства для лечения и/или предотвращения патологических состояний или заболеваний, вызванных инфекцией вирусом гепатита В (ВГВ).
[11] Согласно некоторым вариантам реализации настоящего изобретения предложен способ лечения и/или предотвращения патологических состояний или заболеваний, вызванных инфекцией вирусом гепатита В (ВГВ), включающий введение эффективного количества миРНК и/или фармацевтической композиции, и/или конъюгата миРНК согласно настоящему изобретению пациенту, нуждающемуся в этом.
[12] Согласно некоторым вариантам реализации настоящего изобретения предложен способ ингибирования экспрессии генов ВГВ, включающий приведение эффективного количества модифицированной миРНК и/или фармацевтической композиции, и/или конъюгата миРНК согласно настоящему изобретению в контакт с пораженными гепатитом клетками, инфицированными ВГВ.
[13] Согласно некоторым вариантам реализации настоящего изобретения предложен набор, содержащий миРНК и/или фармацевтическую композицию, и/или конъюгат миРНК согласно настоящему изобретению.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[14] Все публикации, патенты и заявки на патенты, упомянутые в настоящем описании, включены в настоящую заявку посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент была специально и по отдельности указана для включения посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[15] На ФИГ. 1 показан полуколичественный результат испытания стабильности испытываемых конъюгатов миРНК в тритосоме в условиях in vitro.
[16] На ФИГ. 2 показан полуколичественный результат испытания стабильности испытываемых конъюгатов миРНК в тритосоме в условиях in vitro.
[17] На ФИГ. 3 показан полуколичественный результат испытания стабильности испытываемых конъюгатов миРНК в плазме человека в условиях in vitro.
[18] На ФИГ. 4 показан полуколичественный результат испытания стабильности испытываемых конъюгатов миРНК в плазме обезьяны в условиях in vitro.
[19] На ФИГ. 5 показан результат испытания стабильности испытываемого конъюгата миРНК в тритосомах печени крысы.
[20] На ФИГ. 6 показан результат испытания стабильности испытываемого конъюгата миРНК в лизосомах печени человека.
[21] На ФИГ. 7 показана метаболическая кривая в зависимости от времени, показывающая фармакокинетику/токсикокинетику (ФК/ТК) плазматической концентрации для конъюгата 1 в дозировке 10 мг/кг в плазме крысы.
[22] На ФИГ. 8 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК тканевой концентрации для конъюгата 1 в дозировке 10 мг/кг в печени и почках крысы.
[23] На ФИГ. 9 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК плазматической концентрации для конъюгата 1 в дозировке 50 мг/кг в плазме крысы.
[24] На ФИГ. 10 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК тканевой концентрации для конъюгата 1 в дозировке 50 мг/кг в печени и почках крысы.
[25] На ФИГ. 11 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК плазматической концентрации для конъюгата 6 в дозировке 10 мг/кг в плазме крысы.
[26] На ФИГ. 12 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК тканевой концентрации для конъюгата 6 в дозировке 10 мг/кг в печени и почках крысы.
[27] На ФИГ. 13 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК плазматической концентрации для конъюгата 6 в дозировке 50 мг/кг в плазме крысы.
[28] На ФИГ. 14 показана метаболическая кривая в зависимости от времени, показывающая ФК/ТК тканевой концентрации для конъюгата 6 в дозировке 50 мг/кг в печени и почках крысы.
[29] На ФИГ. 15 показана ингибирующая эффективность конъюгатов 5 и 7 в отношении экспрессии мРНК ВГВ в модели 44Bri на мышах.
[30] На ФИГ. 16 показана ингибирующая эффективность конъюгатов 1 и 6 в отношении экспрессии мРНК ВГВ в модели 44Bri на мышах.
[31] На ФИГ. 17 показана ингибирующая эффективность конъюгатов 5 и 6 в отношении экспрессии мРНК ВГВ в модели 44Bri на мышах.
[32] На ФИГ. 18 показана ингибирующая эффективность конъюгатов 5, 6, 9 и 10 в отношении экспрессии мРНК ВГВ в модели 44Bri на мышах.
[33] На ФИГ. 19 показана ингибирующая эффективность конъюгатов 1, 2, 3 и 4 в отношении экспрессии мРНК ВГВ в модели 44Bri на мышах.
[34] На ФИГ. 20 показана ингибирующая эффективность конъюгата 1 в отношении экспрессии мРНК ВГВ в модели 44Bri на мышах.
[35] На ФИГ. 21 показаны испытания зависимости от времени ингибирующей эффективности миРНК в конъюгатах миРНК 1 и 6 в отношении экспрессии HBsAg в сыворотке в модели AAV-HBV на мышах.
[36] На ФИГ. 22 показаны испытания зависимости от времени ингибирующей эффективности миРНК в конъюгатах миРНК 1 и 6 в отношении ДНК ВГВ в модели AAV-HBV на мышах.
[37] На ФИГ. 23 показано испытание зависимости от времени ингибирующей эффективности конъюгата 6 в отношении экспрессии HBsAg в сыворотке в модели с низкой концентрацией AAV-HBV на мышах.
[38] На ФИГ. 24 показано испытание зависимости от времени ингибирующей эффективности конъюгатов 5 и 6 в отношении экспрессии HBsAg в сыворотке в модели M-Tg.
[39] На ФИГ. 25 показаны испытания зависимости от времени ингибирующей эффективности конъюгатов 6 и 11 в отношении экспрессии HBsAg в сыворотке в модели M-Tg.
[40] На ФИГ. 26 показано испытание зависимости от времени ингибирующей эффективности конъюгата 1 в отношении экспрессии HBsAg в сыворотке в модели с 1,28 копии.
[41] На ФИГ. 27 показано испытание зависимости от времени ингибирующей эффективности конъюгата 1 в отношении ДНК ВГВ в модели с 1,28 копии.
[42] На ФИГ. 28A-28D показаны значения ИК50 для конъюгата 1 при нацеливании на GSCM, GSSM, PSCM и PSSM, соответственно.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[43] Конкретные варианты реализации настоящего изобретения подробно описаны ниже. Следует понимать, что конкретные варианты реализации, описанные в настоящем документе, предназначены только для иллюстрации и пояснения настоящего изобретения и не предназначены для ограничения настоящего изобретения в каком-либо отношении.
Определения
[44] Применительно к настоящему изобретению ген ВГВ относится к гену, имеющему последовательность ДНК, представленную под номером доступа в Genbank NC_003977.1.
[45] Применительно к настоящему изобретению, если не указано иное, С, G, U, А и Т обозначают состав оснований нуклеотидов; d обозначает, что один нуклеотид справа от буквы d представляет собой дезоксирибонуклеотид; буква m обозначает, что нуклеотид, стоящий слева от буквы m, представляет собой метокси-модифицированный нуклеотид; f обозначает, что нуклеотид, стоящий слева от буквы f, представляет собой модифицированный фтором нуклеотид; s обозначает, что два нуклеотида по обеим сторонам от буквы s соединены фосфотиоатной связью; Р1 обозначает, что нуклеотид, примыкающий к правой стороне Р1, представляет собой 5'-фосфатный нуклеотид или нуклеотид, модифицированный аналогом 5'-фосфата, в частности, модифицированный винилфосфатом нуклеотид (представленный как VP в приведенных ниже примерах), 5'-фосфатный нуклеотид (представленный как Р в приведенных ниже примерах) или 5'-тиофосфат-модифицированный нуклеотид (представленный как Ps в приведенных ниже примерах).
[46] Применительно к настоящему изобретению термин «модифицированный фтором нуклеотид» относится к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы нуклеотида фтором. Термин «нуклеотид с нефторной модификацией» относится к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы нуклеотида группой, отличной от фторгруппы, или к аналогу нуклеотида. «Аналог нуклеотида» относится к группе, которая может заместить нуклеотид в нуклеиновой кислоте, при этом она структурно отличается от аденинового рибонуклеотида, гуанинового рибонуклеотида, цитозинового рибонуклеотида, урацилового рибонуклеотида или тиминового дезоксирибонуклеотида, такой как изонуклеотид, нуклеотид мостиковой нуклеиновой кислоты (BNA) или ациклический нуклеотид. Метокси-модифицированный нуклеотид относится к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы метоксигруппой.
[47] Применительно к настоящему изобретению выражения «комплементарный» и «обратнокомплементарный» могут использоваться взаимозаменяемо и имеют общеизвестное значение в данной области техники, а именно, основания в одной цепи комплементарно спарены с основаниями в другой цепи молекулы двухцепочечной нуклеиновой кислоты. В ДНК пуриновое основание аденин (А) всегда спарено с пиримидиновым основанием тимином (Т) (или урацилом (U) в РНК); и пуриновое основание гуанин (G) всегда спарено с пиримидиновым основанием цитозином (С). Каждая пара оснований содержит пурин и пиримидин. Если аденины в одной цепи всегда спарены с тиминами (или урацилами) в другой цепи, а гуанины всегда спарены с цитозинами, эти две цепи считаются комплементарными друг другу; и последовательность цепи может быть выведена из последовательности ее комплементарной цепи. Соответственно, «неправильное спаривание» означает, что в двухцепочечной нуклеиновой кислоте основания в соответствующих сайтах (положениях) не представлены в виде комплементарно спаренных.
[48] Применительно к настоящему изобретению, если не указано иное, «преимущественно обратнокомплементарный» означает, что между двумя нуклеотидными последовательностями присутствует не более 3 неправильно спаренных оснований. «По существу обратнокомплементарный» означает, что между двумя нуклеотидными последовательностями присутствует не более 1 неправильно спаренного основания. «Полностью комплементарный» означает, что между двумя нуклеотидными последовательностями отсутствуют неправильно спаренные основания.
[49] Применительно к настоящему изобретению, если нуклеотидная последовательность имеет «различие по нуклеотидам» от другой нуклеотидной последовательности, основания нуклеотидов в одном и том же положении между ними изменены. Например, если нуклеотидное основание во второй последовательности представляет собой А, а нуклеотидное основание в том же положении в первой последовательности представляет собой U, С, G или Т, эти две нуклеотидные последовательности считаются имеющими различие по нуклеотиду в этом положении. Согласно некоторым вариантам реализации настоящего изобретения, если нуклеотид в некотором положении замещен лишенным азотистого основания нуклеотидом или аналогом нуклеотида, также считается, что в этом положении существует различие по нуклеотиду.
[50] Применительно к настоящему изобретению, в частности, в описании способа получения конъюгирующей молекулы или конъюгата миРНК согласно настоящему изобретению, если не указано иное, термин «нуклеозидный мономер» относится, в соответствии с видом и последовательностью нуклеотидов в миРНК или конъюгате миРНК, которые должны быть получены, к «немодифицированным или модифицированным РНК-фосфоамидитам, применяемым в твердофазном фосфоамидитном синтезе» (РНК-фосфоамидиты также называемые фосфоамидитами нуклеозидов в других местах). Твердофазный фосфоамидитный синтез представляет собой способ синтеза РНК, хорошо известный специалистам в данной области техники. Нуклеозидные мономеры, применяемые в настоящем изобретении, могут быть доступны коммерчески.
[51] Применительно к настоящему изобретению, если не указано иное, «конъюгирование» относится к двум или более химическим группам, каждая из которых имеет специфическую функцию, соединенным друг с другом за счет ковалентной связи. Соответственно, «конъюгат» относится к соединению, образованному с помощью ковалентной связи отдельных химических групп. Кроме того, «конъюгат миРНК» представляет собой соединение, образованное с помощью ковалентного присоединения миРНК и одной или более химических групп, каждая из которых имеет специфические функции. В этом случае конъюгат миРНК, раскрытый в настоящем документе, иногда сокращенно обозначается как «конъюгат». Конъюгат миРНК следует понимать в соответствии с контекстом как общий термин конъюгатов миРНК, первого конъюгата миРНК или второго конъюгата миРНК. Применительно к настоящему изобретению термин «конъюгирующая молекула» следует понимать как конкретное соединение, которое может быть конъюгировано с миРНК за счет реакций с получением в конечном итоге конъюгата миРНК согласно настоящему изобретению.
[52] в настоящем документе тире («-»), которое не расположено между двумя буквами или символами, используется для указания положения присоединения заместителя. Например, C1-С10 алкил-NH2 присоединен за счет C1-С10 алкила.
[53] в настоящем документе термин «необязательный» или «необязательно» означает, что описанное впоследствии событие или условие может происходить или может не происходить, и что описание включает случаи, когда событие или условие может происходить или может не происходить. Например, «необязательно замещенный алкил» включает оба «алкил» и «замещенный алкил», как определено ниже. Специалисты в данной области техники поймут, в отношении любой группы, содержащей один или более заместителей, что такие группы не предназначены для введения какого-либо замещения или профилей замещения, которые являются стерически непрактичными, синтетически неосуществимыми и/или нестабильными по своей природе.
[54] в настоящем документе термин «алкил» относится к линейной цепи и разветвленной цепи, содержащей указанное количество атомов углерода, обычно от 1 до 20 атомов углерода, например, от 1 до 10 атомов углерода, например, от 1 до 8 или от 1 до 6 атомов углерода. Например, C1-С6 алкил включает оба линейный и разветвленный алкил, содержащий от 1 до 6 атомов углерода. При обозначении алкильного остатка, содержащего определенное количество атомов углерода, подразумевается включение всех форм с разветвленной цепью и линейной цепью, содержащих такое количество атомов углерода; таким образом, например, «бутил» означает н-бутил, втор-бутил, изобутил и трет-бутил; «пропил» включает н-пропил и изопропил. Алкилен представляет собой подгруппу алкила, относящуюся к тем же остаткам, как и алкил, но имеющую два положения присоединения.
[55] в настоящем документе термин «алкенил» относится к ненасыщенной разветвленной или линейной алкильной группе, имеющей по меньшей мере одну двойную связь углерод-углерод, которая получается путем соответствующего удаления одной молекулы водорода от двух соседних атомов углерода исходного алкила. Группа может быть в цис- или транс-конфигурации двойной связи. Типичные алкенильные группы включают, но не ограничиваются ими, этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил; и тому подобное. Согласно определенным вариантам реализации настоящего изобретения алкенильная группа содержит от 2 до 20 атомов углерода, а в других вариантах реализации от 2 до 10, от 2 до 8 или от 2 до 6 атомов углерода. Алкенилен представляет собой подгруппу алкенила, относящуюся к тем же остаткам, как и алкенил, но имеющую два положения присоединения.
[56] в настоящем документе термин «алкинил» относится к ненасыщенной разветвленной или линейной алкильной группе, имеющей по меньшей мере одну тройную связь углерод-углерод, которая получается путем соответствующего удаления двух молекул водорода от двух смежных атомов углерода исходного алкила. Типичные алкинильные группы включают, но не ограничиваются ими, этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил; и тому подобное. Согласно определенным вариантам реализации настоящего изобретения алкинильная группа содержит от 2 до 20 атомов углерода, а в других вариантах реализации от 2 до 10, от 2 до 8 или от 2 до 6 атомов углерода. Алкинилен представляет собой подгруппу алкинила, относящуюся к тем же остаткам, как и алкинил, но имеющую два положения присоединения.
[57] в настоящем документе термин «алкокси» относится к алкильной группе с указанным количеством атомов углерода, присоединенной за счет кислородного мостика, такой как, например, метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, пентилокси, 2-пентилокси, изопентилокси, неопентилокси, гексилокси, 2-гексилокси, 3-гексилокси, 3-метилпентилокси и тому подобное. Алкоксигруппы обычно содержат от 1 до 10, от 1 до 8, от 1 до 6 или от 1 до 4 атомов углерода, присоединенных за счет кислородного мостика.
[58] в настоящем документе термин «арил» относится к радикалу, происходящему из ароматической моноциклической или полициклической углеводородной кольцевой системы путем удаления атома водорода от кольцевого атома углерода. Ароматическая моноциклическая или полициклическая углеводородная кольцевая система содержит только водород и углерод, включая от шести до восемнадцати атомов углерода, причем по меньшей мере одно кольцо в кольцевой системе является полностью ненасыщенным, т.е. оно содержит циклическую делокализованную (4n+2) π-электронную систему в соответствии с теорией Хюккеля. Арильные группы включают, но не ограничиваются ими, фенил, флуоренил, нафтил и тому подобное. Арилен представляет собой подгруппу арила, относящуюся к тем же остаткам, как и арил, но имеющую два положения присоединения.
[59] в настоящем документе термин «циклоалкил» относится к неароматическому углеродному кольцу, обычно содержащему от 3 до 7 кольцевых атомов углерода. Кольцо может быть насыщенным или может содержать одну или более двойных связей углерод-углерод. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил, а также мостиковые и каркасные кольцевые группы, такие как норборнан.
[60] в настоящем документе термин «гало-заместитель» или «галоген» относится к фторо, хлоро, бромо и йодо, а термин «галоген» включает фтор, хлор, бром и йод.
[61] в настоящем документе термин «галогеналкил» относится к алкилу, определенному выше, с указанным количеством атомов углерода, замещенному одним или более атомами галогена, до максимально допустимого числа атомов галогена. Примеры галогеналкила включают, но не ограничиваются ими, трифторметил, дифторметил, 2-фторэтил и пентафторэтил.
[62] «Гетероциклил» относится к стабильному 3-18-членному неароматическому кольцевому радикалу, который содержит от двух до двенадцати атомов углерода и от одного до шести гетероатомов, выбранных из азота, кислорода и серы. Если в описании не указано иное, гетероциклил представляет собой моноциклическую, бициклическую, трициклическую или тетрациклическую кольцевую систему, которая может содержать конденсированные или мостиковые кольцевые системы. Гетероатомы в гетероциклильном радикале необязательно могут быть окислены. Один или более атомов азота, если они присутствуют, необязательно являются кватернизованными. Гетероциклил является частично или полностью насыщенным. Гетероциклил может быть соединен с остальной частью молекулы за счет любого атома кольца. Примеры такого гетероциклила включают, но не ограничиваются ими, диоксанил, тиенил[1,3]дисульфонил, декагидроизохинолил, имидазолинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксапиперазинил, 2-оксапиперидинил, 2-оксапиримидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, хинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, трисульфонил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1-оксатиоморфолинил и 1,1-диоксатиоморфолинил.
[63] «Гетероарил» относится к радикалу, происходящему из 3-18-членного ароматического кольцевого радикала, который содержит от двух до семнадцати атомов углерода и от одного до шести гетероатомов, выбранных из азота, кислорода и серы, в настоящем документе гетероарил может представлять собой моноциклическую, бициклическую, трициклическую или тетрациклическую кольцевую систему, причем по меньшей мере одно кольцо в кольцевой системе является полностью ненасыщенным, т.е. содержит циклическую делокализованную (4n+2) π-электронную систему в соответствии с теорией Хюккеля. Гетероарил включает конденсированные или мостиковые кольцевые системы. Гетероатом в гетероарильном радикале необязательно окислен. Один или более атомов азота, если они присутствуют, необязательно являются кватернизованными. Гетероарил соединен с остальной частью молекулы за счет любого атома кольца. Примеры таких гетероарилов включают, но не ограничиваются ими, азепинил, акридинил, бензимидазолил, бензиндолил, 1,3-бензодиоксазолил, бензофуранил, бензоксазолил, бензо[d]тиазолил, бензотиадиазолил, бензо[b][1,4]диоксазолил, бензо[b][1,4]оксазолил, 1,4-бензодиоксазолил, бензонафтофуранил, бензодиазолил, бензодиоксафенил, бензопиранил, бензопиранонил, бензофуранил, бензофуранонил, бензотиенил, бензотиено[3,2-d] пиримидинил, бензотриазолил, бензо [4,6] имидазо[1,2-а] пиридинил, карбазолил, циннолинил, циклопента[d]пиримидинил, 6,7-дигидро-5Н-циклопента[4,5]-тиено[2,3-d]-пиримидинил, 5,6-дигидробензо[h]хиназолинил, 5,6-дигидробензо[h]циннолинил, 6,7-дигидро-5Н-бензо[6,7]циклогепта[1,2-с]пиридазинил, дибензофуранил, дибензотиенил, фуранил, фуранонил, фуро[3,2-с]пиридинил, 5,6,7,8,9,10-гексагилроциклогепта[d]пиримидинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридазинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридинил, изотиазолил, индазолил, имидазолил, индолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, 5,8-метано-5,6,7,8-тетрагидрохиназолинил, нафтиридинонил, 1,6-нафтиридинонил, оксадиазолил, 2-оксоазепинил, оксазолил, оксалил, 5,6,6а,7,8,9,10,10а-октагидробензо[h]хиназолинил, 1-фенил-1H-пирролил, феназинил, фенотиазинил, феноксазинил, фталил, птеридинил, пуринил, пирролил, пиразолил, пиразоло[3,4-d]пиримидинил, пиридинил, пиридо[3,2-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиразинил, пиримидинил, пиридазинил, пирролил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидрохинолинил, 5,6,7,8-тетрагидрохиназолинил, 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидинил, 6,7,8,9-тетрагидро-5Н-циклогепта[4,5]тиено[2,3-d]пиримидинил, 5,6,7,8-тетрагидропиридо [4,5-с] пиридазинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил, тиено[2,3-d]пиримидинил, тиено[3,2-d]пиримидинил, тиено[2,3-с]придинил и тиенил.
[64] В настоящем изобретении можно применять различные защищающие гидроксил группы. Как правило, защитные группы делают химические функциональные группы инертными к конкретным условиям реакции и могут быть присоединены к таким функциональным группам в молекуле и удалены от них без существенного повреждения остальной части молекулы. Типичные защищающие гидроксил группы раскрыты в Beaucage, et al., Tetrahedron 1992, 48, 2223-2311, а также в Greene and Wuts, Protective Groups in Organic Synthesis, Chapter 2, 2 изд., John Wiley & Sons, New York, 1991, каждый из которых тем самым полностью включен посредством ссылки. Согласно некоторым вариантам реализации настоящего изобретения защитная группа стабильна в основных условиях, но может быть удалена в кислых условиях. Согласно некоторым вариантам реализации настоящего изобретения неисключающие примеры защищающих гидроксил групп, применяемых в настоящем документе, включают диметокситритил (DMT), монометокситритил, 9-фенилксантен-9-ил (Pixyl) и 9-(п-метоксифенил)ксантен-9-ил (Мох). Согласно некоторым вариантам реализации настоящего изобретения неисключающие примеры защищающих гидроксил групп, применяемых в настоящем документе, включают Tr (тритил), MMTr (4-метокситритил), DMTr (4,4'-диметокситритил) и TMTr (4,4',4''-триметокситритил).
[65] в настоящем документе термин «субъект» относится к любому животному, например, млекопитающему или сумчатому. Субъект согласно настоящему изобретению включает, но не ограничивается ими, человека, примата, не относящегося к человеку (например, макаку резуса или другие виды макак), мышь, свинью, лошадь, осла, корову, овцу, крысу и любой вид домашней птицы.
[66] в настоящем документе «лечение» или «лечить», или «уменьшение», или «улучшение» используются в настоящем документе взаимозаменяемо. Эти термины относятся к способу получения предпочтительного или целевого результата, включая, но не ограничиваясь этим, терапевтическую пользу. «Терапевтическая польза» означает устранение или улучшение потенциального нарушения, подлежащего лечению. Также терапевтическая польза достигается путем устранения или уменьшения одного или более физиологических симптомов, ассоциированных с потенциальным расстройством, так, что у пациента наблюдается улучшение, несмотря на то, что пациент все еще может быть поражен потенциальным нарушением.
[67] В настоящей заявке «предотвращение» и «предотвращать» используются взаимозаменяемо. Эти термины относятся к способу получения предпочтительного или целевого результата, включая, но не ограничиваясь этим, профилактическую пользу. Для получения «профилактической пользы» конъюгат или композицию можно вводить пациенту, подверженному риску развития конкретного заболевания, или пациенту, сообщающему об одном или более физиологических симптомах заболевания, даже если диагноз этого заболевания не был установлен.
Модифицированная миРНК
[68] МиРНК согласно настоящему изобретению содержит нуклеотиды в качестве основных структурных блоков. Специалистам в данной области техники хорошо известно, что нуклеотид содержит фосфатную группу, рибозную группу и основание. Подробные иллюстрации, относящиеся к таким группам, в настоящем документе не представлены.
[69] В CN 102140458 B раскрыта миРНК, которая специфично ингибирует ген ВГВ, и исследованы различные стратегии химической модификации миРНК. В этом исследовании установлено, что различные стратегии модификации оказывают совершенно разное влияние на параметры миРНК, такие как стабильность, биологическая активность и цитотоксичность. В этом исследовании было доказано семь эффективных способов модификации. По сравнению с немодифицированной миРНК, миРНК, полученная с помощью одного из семи способов модификации, показала повышенную стабильность в крови, сохраняя при этом по существу аналогичную ингибирующую активность, как и у немодифицированной миРНК.
[70] Согласно настоящему изобретению предложена модифицированная миРНК, способная ингибировать экспрессию гена ВГВ, которая содержит смысловую цепь и антисмысловую цепь, причем каждый нуклеотид в миРНК представляет собой модифицированный нуклеотид, при этом смысловая цепь и антисмысловая цепь обе содержат модифицированные фтором нуклеотиды и нуклеотиды с нефторной модификацией; смысловая цепь содержит нуклеотидную последовательность I; антисмысловая цепь содержит нуклеотидную последовательность II; нуклеотидная последовательность I и нуклеотидная последовательность II по меньшей мере частично обратно комплементарны, что позволяет образовывать двухцепочечную область; причем нуклеотидная последовательность I содержит нуклеотидную последовательность А, которая имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность II содержит нуклеотидную последовательность В, которая имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 156, и отличается от нее не более чем 3 нуклеотидами:
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которых
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность А содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность В содержит нуклеотид Z'B в положении, соответствующем Z'; нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи;
модифицированные фтором нуклеотиды расположены внутри нуклеотидных последовательностей А и В;
в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности А представляют собой модифицированные фтором нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности В представляют собой модифицированные фтором нуклеотиды. Согласно некоторым вариантам реализации настоящего изобретения в нуклеотидной последовательности А присутствует не более 5 модифицированных фтором нуклеотидов; и в нуклеотидной последовательности В присутствует не более 7 модифицированных фтором нуклеотидов.
[71] В данном случае термин «соответствующий сайт» (соответствующее положение) означает нахождение в одном и том же положении в нуклеотидной последовательности при отсчете с одного и того же конца нуклеотидной последовательности. Например, первый нуклеотид на 3'-конце нуклеотидной последовательности А представляет собой нуклеотид в положении, соответствующем первому нуклеотиду на 3'-конце SEQ ID NO: 155.
[72] Согласно некоторым вариантам реализации настоящего изобретения смысловая цепь состоит исключительно из нуклеотидной последовательности I, а антисмысловая цепь состоит исключительно из нуклеотидной последовательности II.
[73] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность А содержит не более 1 нуклеотида, отличного от нуклеотидной последовательности, представленной в SEQ ID NO: 155; и/или нуклеотидная последовательность В содержит не более 1 нуклеотида, отличного от нуклеотидной последовательности, представленной в SEQ ID NO: 156.
[74] Согласно некоторым вариантам реализации настоящего изобретения различие по нуклеотидам между нуклеотидной последовательностью В и нуклеотидной последовательностью, представленной в SEQ ID NO: 156, включает различие в положении Z'B, причем Z'B выбран из А, С или G. Согласно некоторым вариантам реализации настоящего изобретения различие по нуклеотидам представляет собой различие в положении Z'B, причем Z'B выбран из А, С или G. Согласно некоторым вариантам реализации настоящего изобретения ZA представляет собой нуклеотид, комплементарный Z'B. Эти различия по нуклеотидам не будут значительно снижать способность миРНК ингибировать ген-мишень, и такие миРНК, содержащие различия по нуклеотидам, также включены в объем настоящего изобретения.
[75] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность А является преимущественно обратнокомплементарной, по существу обратнокомплементарной или полностью обратнокомплементарной нуклеотидной последовательности В. «Преимущественно обратнокомплементарный» относится к не более чем 3 неправильно спаренным основаниям в двух нуклеотидных последовательностях. «По существу обратнокомплементарный» относится к не более чем 1 неправильно спаренному основанию в двух нуклеотидных последовательностях. «Полностью обратнокомплементарный» относится к отсутствию неправильно спаренных оснований в двух нуклеотидных последовательностях.
[76] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность А представляет собой нуклеотидную последовательность, представленную в SEQ ID NO: 1; и нуклеотидная последовательность В представляет собой нуклеотидную последовательность, представленную в SEQ ID NO: 2:
5'-CCUUGAGGCAUACUUCAAZA-3' (SEQ ID NO: 1);
5'-Z'BUUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 2);
в которых Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи; ZA выбран из A, U, G или С; и Z'B представляет собой нуклеотид, комплементарный ZA; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности А представляют собой модифицированные фтором нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности В представляют собой модифицированные фтором нуклеотиды.
[77] Согласно некоторым вариантам реализации настоящего изобретения миРНК содержит смысловую цепь и антисмысловую цепь; причем смысловая цепь содержит сегмент нуклеотидной последовательности I, а антисмысловая цепь содержит сегмент нуклеотидной последовательности II; нуклеотидная последовательность I и нуклеотидная последовательность II обратнокомплементарны, что позволяет образовывать двухцепочечную область;; нуклеотидная последовательность I содержит нуклеотидную последовательность, представленную в SEQ ID NO: 1; и нуклеотидная последовательность II содержит нуклеотидную последовательность, представленную в SEQ ID NO: 2:
5'-CCUUGAGGCAUACUUCAAZA-3' (SEQ ID NO: 1);
5'-Z'BUUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 2);
в которых Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи; ZA выбран из A, U, G или С; и Z'B представляет собой нуклеотид, комплементарный ZA; в некоторых вариантах реализации ZA представляет собой А; и Z'B представляет собой U; и в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 SEQ ID NO: 1 в смысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой нуклеотиды с нефторной модификацией; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 SEQ ID NO: 2 в антисмысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой нуклеотиды с нефторной модификацией.
[78] Смысловая цепь и антисмысловая цепь имеют одинаковую или разную длину. Смысловая цепь содержит 19-23 нуклеотида в длину, а антисмысловая цепь содержит 20-26 нуклеотидов в длину. Таким образом, отношение длины смысловой цепи к длине антисмысловой цепи в миРНК согласно настоящему изобретению может составлять 19/20, 19/21, 19/22, 19/23, 19/24, 19/25, 19/26, 20/20, 20/21, 20/22, 20/23, 20/24, 20/25, 20/26, 21/20, 21/21, 21/22, 21/23, 21/24, 21/25, 21/26, 22/20, 22/21, 22/22, 22/23, 22/24, 22/25, 22/26, 23/20, 23/21, 23/22, 23/23, 23/24, 23/25 или 23/26. Согласно некоторым вариантам реализации настоящего изобретения отношение длины смысловой цепи к длине антисмысловой цепи в миРНК согласно настоящему изобретению составляет 19/21, 21/23 или 23/25.
[79] Согласно одному варианту реализации настоящего изобретения смысловая цепь и антисмысловая цепь имеют одинаковую длину. Нуклеотидная последовательность I дополнительно содержит нуклеотидную последовательность III; и нуклеотидная последовательность II дополнительно содержит нуклеотидную последовательность IV. Каждая из нуклеотидной последовательности III и нуклеотидной последовательности IV независимо имеет длину 1-4 нуклеотида; нуклеотидная последовательность III соединена с 5'-концом нуклеотидной последовательности А; нуклеотидная последовательность IV соединена с 3'-концом нуклеотидной последовательности В; и нуклеотидная последовательность III и нуклеотидная последовательность IV имеют одинаковую длину.
[80] Нуклеотидная последовательность III может быть комплементарна или может не быть комплементарна нуклеотидной последовательности IV. Чтобы повысить стабильность миРНК, согласно некоторым вариантам реализации настоящего изобретения, нуклеотидная последовательность III по меньшей мере частично комплементарна нуклеотидной последовательности IV; согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность III комплементарна более чем 80% или 90% оснований в нуклеотидной последовательности IV; согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность III по существу обратнокомплементарна или полностью обратнокомплементарна нуклеотидной последовательности IV; «по существу обратнокомплементарный» относится к не более чем 1 неправильно спаренному основанию в двух нуклеотидных последовательностях; «полностью обратнокомплементарный» относится к отсутствию неправильно спаренных оснований в двух нуклеотидных последовательностях; и согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность III полностью обратнокомплементарна нуклеотидной последовательности IV. Как таковые, смысловая цепь и антисмысловая цепь миРНК имеют одинаковую длину, и отношение их длин составляет 20/20, 21/21, 22/22 или 23/23. Согласно некоторым вариантам реализации настоящего изобретения отношение длины смысловой цепи к длине антисмысловой цепи в миРНК составляет 21/21 или 23/23.
[81] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность III и нуклеотидная последовательность IV обе имеют 1 нуклеотид в длину. Основание нуклеотидной последовательности III представляет собой А, а основание нуклеотидной последовательности IV представляет собой U; в этом случае отношение длины смысловой цепи к длине антисмысловой цепи составляет 20/20; согласно другому варианту нуклеотидная последовательность III и нуклеотидная последовательность IV обе имеют длину 2 нуклеотида; в направлении от 5'-конца к 3'-концу, состав оснований нуклеотидной последовательности III представляет собой GA, а состав оснований нуклеотидной последовательности IV представляет собой UC; в этом случае отношение длины смысловой цепи к длине антисмысловой цепи составляет 21/21; согласно другому варианту нуклеотидная последовательность III и нуклеотидная последовательность IV обе имеют длину 3 нуклеотида; в направлении от 5'-конца к 3'-концу, состав оснований нуклеотидной последовательности III представляет собой CGA, а состав оснований нуклеотидной последовательности IV представляет собой UCG; в этом случае отношение длины смысловой цепи к длине антисмысловой цепи составляет 22/22; согласно другому варианту нуклеотидная последовательность III и нуклеотидная последовательность IV обе имеют длину 4 нуклеотида; в направлении от 5'-конца к 3'-концу, состав оснований нуклеотидной последовательности III представляет собой CCGA, а состав оснований нуклеотидной последовательности IV представляет собой UCGG; в этом случае отношение длины смысловой цепи к длине антисмысловой цепи составляет 23/23. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность III и нуклеотидная последовательность IV обе имеют длину 2 нуклеотида; в направлении от 5'-конца к 3'-концу, состав оснований нуклеотидной последовательности III представляет собой GA, а состав оснований нуклеотидной последовательности IV представляет собой UC; в этом случае отношение длины смысловой цепи к длине антисмысловой цепи составляет 21/21.
[82] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность III имеет ту же длину, что и нуклеотидная последовательность IV и полностью обратнокомплементарна ей. Таким образом, если предложено основание нуклеотидной последовательности III, основание нуклеотидной последовательности IV также определено.
[83] Согласно некоторым вариантам реализации настоящего изобретения смысловая цепь и антисмысловая цепь имеют разные длины. Нуклеотидная последовательность II дополнительно содержит нуклеотидную последовательность V, которая имеет длину 1-3 нуклеотида и соединена с 3'-концом антисмысловой цепи с образованием 3'-липкого конца антисмысловой цепи. Таким образом, отношение длины смысловой цепи к длине антисмысловой цепи в миРНК согласно настоящему изобретению может составлять 19/20, 19/21, 19/22, 20/21, 20/22, 20/23, 21/22, 21/23, 21/24, 22/23, 22/24, 22/25, 23/24, 23/25 или 23/26. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность V содержит 2 нуклеотида в длину. Таким образом, отношение длины смысловой цепи к длине антисмысловой цепи в миРНК согласно настоящему изобретению может составлять 19/21, 21/23 или 23/25.
[84] Каждый нуклеотид в нуклеотидной последовательности V может представлять собой любой нуклеотид. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность V представляет собой 2 непрерывных тимидиновых дезоксирибонуклеотида (ТТ) или 2 непрерывных уридиновых рибонуклеотида (UU); согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность V является комплементарной нуклеотидам в соответствующих положениях мРНК-мишени.
[85] Согласно некоторым вариантам реализации настоящего изобретения смысловая цепь миРНК содержит нуклеотидную последовательность, представленную в SEQ ID NO: 1, а антисмысловая цепь миРНК содержит нуклеотидную последовательность, представленную в SEQ ID NO: 3:
5'-CCUUGAGGCAUACUUCAAZA-3' (SEQ ID NO: 1);
5'-Z'B UUGAAGUAUGCCUCAAGGUU-3' (SEQ ID NO: 3);
согласно другому варианту смысловая цепь миРНК содержит нуклеотидную последовательность, представленную в SEQ ID NO: 1, а антисмысловая цепь миРНК содержит нуклеотидную последовательность, представленную в SEQ ID NO:4:
5'-CCUUGAGGCAUACUUCAAZA-3' (SEQ ID NO: 1);
5'- Z'B UUGAAGUAUGCCUCAAGGUC-3' (SEQ ID NO: 4);
в которых нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи; ZA выбран из A, U, G или С; и Z'B представляет собой нуклеотид, комплементарный ZA.
[86] В соответствии с некоторыми вариантами реализации настоящего изобретения миРНК согласно настоящему изобретению представляет собой siHBa1 или siHBa2:
siHBa1
Смысловая цепь: 5'-CCUUGAGGCAUACUUCAAA-3' (SEQ ID NO: 5),
Антисмысловая цепь: 5'-UUUGAAGUAUGCCUCAAGGUU-3' (SEQ ID NO: 6),
siHBa2
Смысловая цепь: 5'-GACCUUGAGGCAUACUUCAAA-3' (SEQ ID NO: 7),
Антисмысловая цепь: 5'-UUUGAAGUAUGCCUCAAGGUCGG-3' (SEQ ID NO: 8).
[87] Как описано выше, все нуклеотиды в миРНК согласно настоящему изобретению представляют собой модифицированные нуклеотиды. Такие модификации на нуклеотидах не будут вызывать значительного уменьшения или потери функции конъюгата миРНК согласно настоящему изобретению для ингибирования экспрессии генов ВГВ. Например, могут быть выбраны модифицированные нуклеотиды, раскрытые J.K. Watts, G.F. Deleavey and М.J. Damha, Chemically Modified siRNA: tools and applications. Drug Discov Today, 2008. 13(19-20): p. 842-55.
[88] Согласно некоторым вариантам реализации настоящего изобретения, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 или 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи представляют собой нуклеотиды с нефторной модификацией; и нуклеотиды в положениях 2, 6, 14 и 16 или 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи представляют собой нуклеотиды с нефторной модификацией.
[89] Применительно к настоящему изобретению модифицированный фтором нуклеотид относится к нуклеотиду, образованному путем замещения 2'-гидроксила его рибозной группы фторгруппой, который имеет структуру, представленную Формулой (107). Нуклеотид с нефторной модификацией относится к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы группой, отличной от фтора, или к аналогу нуклеотида. Согласно некоторым вариантам реализации настоящего изобретения каждый нуклеотид с нефторной модификацией независимо выбран из группы, состоящей из нуклеотида, образованного путем замещения 2'-гидроксила его рибозной группы группой, отличной от фтора, и аналога нуклеотида.
[90] Нуклеотид, образованный путем замещения 2'-гидроксила рибозной группы группой, отличной от фтора, хорошо известен специалистам в данной области техники и может быть выбран из одного из 2'-алкокси-модифицированного нуклеотида, 2'-замещенного алкокси-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, 2'-замещенного алкил-модифицированного нуклеотида, 2'-амино-модифицированного нуклеотида, 2'-замещенного амино-модифицированного нуклеотида и 2'-дезоксинуклеотида.
[91] Согласно некоторым вариантам реализации настоящего изобретения 2'-алкокси-модифицированный нуклеотид представляет собой метокси-модифицированный нуклеотид (2'-ОМе), представленный Формулой (108). Согласно некоторым вариантам реализации настоящего изобретения 2'-замещенный алкокси-модифицированный нуклеотид представляет собой, например, 2'-O-метоксиэтокси-модифицированный нуклеотид (2'-МОЕ), представленный Формулой (109). Согласно некоторым вариантам реализации настоящего изобретения 2'-амино-модифицированный нуклеотид (2'-NH2) представляет собой тот, который представлен Формулой (110). Согласно некоторым вариантам реализации настоящего изобретения 2'-дезоксинуклеотид (ДНК) представляет собой тот, который представлен Формулой (111).


[92] «Аналог нуклеотида» относится к группе, которая может замещать нуклеотид в нуклеиновой кислоте, при этом она структурно отличается от аденинового рибонуклеотида, гуанинового рибонуклеотида, цитозинового рибонуклеотида, урацилового рибонуклеотида или тиминового дезоксирибонуклеотида. Согласно некоторым вариантам реализации настоящего изобретения аналог нуклеотида может представлять собой изонуклеотид, нуклеотид мостиковой нуклеиновой кислоты (BNA) или ациклический нуклеотид.
[93] BNA представляет собой нуклеотид, который ограничен или недоступен. BNA может содержать 5-, 6-членную или даже 7-членную кольцевую мостиковую структуру со сморщиванием «фиксированного» С3'-эндо-сахара. Мостик, как правило, встроен в 2'- и 4'-положение рибозы, чтобы получить 2',4'-BNA нуклеотид. Согласно некоторым вариантам реализации настоящего изобретения BNA может представлять собой LNA, ENA и сЕТ BNA, которые представлены Формулами (112), (113) и (114), соответственно.

[94] Ациклический нуклеотид представляет собой нуклеотид, в котором рибозное кольцо открыто. Согласно некоторым вариантам реализации настоящего изобретения ациклический нуклеотид может представлять собой нуклеотид незапертой нуклеиновой кислоты (UNA) и нуклеотид нуклеиновой кислоты на основе глицерина (GNA), которые представлены Формулами (115) и (116), соответственно.

в которых R представляет собой Н, ОН или алкокси (О-алкил).
[95] Изонуклеотид представляет собой нуклеотид, в котором положение основания на рибозном кольце изменяется. Согласно некоторым вариантам реализации настоящего изобретения изонуклеотид может представлять собой соединение, в котором основание перемещено из положения -1' в положение -2' или -3' на рибозном кольце, представленное Формулами (117) или (118), соответственно.
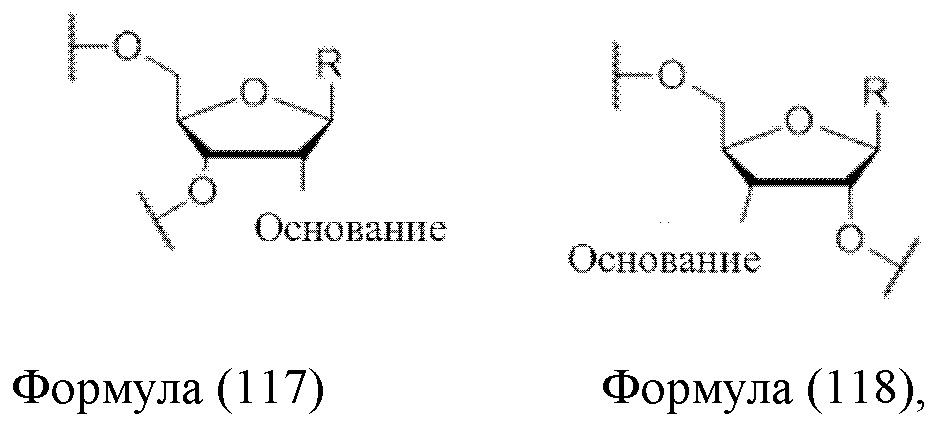
где «основание» представляет собой основание, такое как A, U, G, С или Т; R представляет собой Н, ОН, F или группу, отличную от фтора, описанную выше.
[96] Согласно некоторым вариантам реализации настоящего изобретения аналог нуклеотида выбран из группы, состоящей из изонуклеотида, LNA, ENA, сЕТ, UNA и GNA. Согласно некоторым вариантам реализации настоящего изобретения каждый нуклеотид с нефторной модификацией представляет собой метокси-модифицированный нуклеотид. Применительно к настоящему изобретению метокси-модифицированный нуклеотид относится к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы метоксигруппой.
[97] Применительно к настоящему изобретению термин «модифицированный фтором нуклеотид», «2'-фтор-модифицированный нуклеотид», «нуклеотид, в котором 2'-гидроксил рибозной группы замещен фтором», и «2'-фторрибозил» имеют одинаковое значение, относясь к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы фтором, имеющему структуру, представленную Формулой (107). «Метокси-модифицированный нуклеотид», «2'-метокси-модифицированный нуклеотид», «нуклеотид, в котором 2'-гидроксил рибозной группы замещен метокси» и «2'-метоксирибозил» имеют одинаковое значение, относясь к нуклеотиду, в котором 2'-гидроксил рибозной группы в нуклеотиде замещен метокси, имеющему структуру, представленную Формулой (108).
[98] Согласно некоторым вариантам реализации настоящего изобретения модифицированные фтором нуклеотиды расположены внутри нуклеотидных последовательностей А и В; в нуклеотидной последовательности А присутствует не более 5 модифицированных фтором нуклеотидов, и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 в нуклеотидной последовательности А представляют собой модифицированные фтором нуклеотиды; в нуклеотидной последовательности В присутствует не более 7 модифицированных фтором нуклеотидов, а нуклеотиды в положениях 2, 6, 14 и 16 в нуклеотидной последовательности В представляют собой модифицированные фтором нуклеотиды.
[99] Согласно некоторым вариантам реализации настоящего изобретения, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 или 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи представляют собой нуклеотиды с нефторной модификацией; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 или 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи представляют собой нуклеотиды с нефторной модификацией.
[100] Согласно некоторым вариантам реализации настоящего изобретения миРНК согласно настоящему изобретению представляет собой миРНК со следующими модификациями: в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 или 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и нуклеотиды в положениях 2, 6, 14 и 16 или 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды. [101] Согласно некоторым вариантам реализации настоящего изобретения миРНК согласно настоящему изобретению представляет собой миРНК со следующими модификациями: в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды;
согласно другому варианту, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды;
согласно другому варианту, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи миРНК представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды.
[102] Другими словами, рибозные группы в фосфатно-рибозном остове миРНК, соответственно, имеют следующие модифицирующие группы: в направлении от 5'-конца к 3'-концу, рибозные группы нуклеотидов в положениях 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой 2'-фторрибозил, а рибозные группы нуклеотидов в остальных положениях в смысловой цепи миРНК представляют собой 2'-метоксирибозил; и, в направлении от 5'-конца к 3'-концу, рибозные группы нуклеотидов в положениях 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи миРНК представляют собой 2'-фторрибозил, а рибозные группы нуклеотидов в остальных положениях в антисмысловой цепи миРНК представляют собой 2'-метоксирибозил;
согласно другому варианту, в направлении от 5'-конца к 3'-концу, рибозные группы нуклеотидов в положениях 5, 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой 2'-фторрибозил, а рибозные группы нуклеотидов в остальных положениях в смысловой цепи миРНК представляют собой 2'-метоксирибозил; и, в направлении от 5'-конца к 3'-концу, рибозные группы нуклеотидов в положениях 2, 6, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи миРНК представляют собой 2'-фторрибозил, а рибозные группы нуклеотидов в остальных положениях в антисмысловой цепи миРНК представляют собой 2'-метоксирибозил;
согласно другому варианту, в направлении от 5'-конца к 3'-концу, рибозные группы нуклеотидов в положениях 7, 8 и 9 нуклеотидной последовательности А в смысловой цепи миРНК представляют собой 2'-фторрибозил, а рибозные группы нуклеотидов в остальных положениях в смысловой цепи миРНК представляют собой 2'-метоксирибозил; и, в направлении от 5'-конца к 3'-концу, рибозные группы нуклеотидов в положениях 2, 6, 14 и 16 нуклеотидной последовательности В в антисмысловой цепи миРНК представляют собой 2'-фторрибозил, а рибозные группы нуклеотидов в остальных положениях в антисмысловой цепи миРНК представляют собой 2'-метоксирибозил.
[103] Согласно некоторым вариантам реализации настоящего изобретения миРНК согласно настоящему изобретению представляет собой siHBa1M1, siHBa1M2, siHBa2M1 или siHBa2M2:
siHBa1M1
Смысловая цепь: 5'-CmCmUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 9),
Антисмысловая цепь: 5'-UmUfUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmUmUm-3' (SEQ ID NO: 10)
siHBa1M2
Смысловая цепь: 5'-CmCmUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 11),
Антисмысловая цепь: 5'-UmUfUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmUmUm-3' (SEQ ID NO: 12),
siHBa2M1
Смысловая цепь: 5'-GmAmCmCmUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 13),
Антисмысловая цепь: 5'-UmUfUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmUmCmGmGm-3' (SEQ ID NO: 14),
siHBa2M2
Смысловая цепь: 5'-GmAmCmCmUmUmGfAmGfGfCfAmUmCmUmUmCmAmAmAm-3' (SEQ ID NO: 15),
Антисмысловая цепь: 5'-UmUfUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmUmCmGmGm-3' (SEQ ID NO: 16),
в которых С, G, U и А обозначают состав оснований нуклеотидов; m обозначает, что нуклеотид, стоящий слева от буквы m, представляет собой 2'-метокси-модифицированный нуклеотид; f обозначает, что нуклеотид, примыкающий к левой стороной буквы f, представляет собой 2'-фтор-модифицированный нуклеотид. МиРНК с указанными модификациями могут быть обеспечены не только с более низкими затратами, но также снижают склонность рибонуклеаз расщеплять нуклеиновую кислоту в крови так, чтобы повысить стабильность нуклеиновой кислоты и обеспечить более высокую устойчивость нуклеиновой кислоты к гидролизу нуклеазами.
[104] Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере часть фосфатных групп в фосфатно-рибозном остове по меньшей мере одной одиночной цепи в смысловой цепи и антисмысловой цепи миРНК согласно настоящему изобретению представляют собой фосфатные группы с модифицированными группами. Согласно некоторым вариантам реализации настоящего изобретения фосфатные группы с модифицированными группами представляют собой фосфотиоатные группы, образованные путем замещения по меньшей мере одного атома кислорода в сложной фосфодиэфирной связи в фосфатных группах атомом серы; и согласно некоторым вариантам реализации настоящего изобретения фосфатные группы с модифицированными группами представляют собой фосфотиоатные группы, имеющие структуру, представленную Формулой (101):


[105] Эта модификация стабилизирует двухцепочечную структуру миРНК, что поддерживает высокую специфичность и высокую аффинность спаривания оснований.
[106] Согласно некоторым вариантам реализации настоящего изобретения в миРНК согласно настоящему изобретению фосфотиоатная связь присутствует в по меньшей мере одном из следующих положений: положение между первым и вторым нуклеотидами на любом конце смысловой или антисмысловой цепи, положение между вторым и третьим нуклеотидами на любом конце смысловой или антисмысловой цепи или в любой их комбинации. Согласно некоторым вариантам реализации настоящего изобретения фосфотиоатная связь присутствует во всех вышеуказанных положениях, за исключением 5'-конца смысловой цепи. Согласно некоторым вариантам реализации настоящего изобретения фосфотиоатная связь присутствует во всех вышеуказанных положениях, за исключением 3'-конца смысловой цепи. Согласно некоторым вариантам реализации настоящего изобретения фосфотиоатная связь присутствует в по меньшей мере одном из следующих положений:
положение между первым и вторым нуклеотидами на 5'-конце смысловой цепи;
положение между вторым и третьим нуклеотидами на 5'-конце смысловой цепи;
положение между первым и вторым нуклеотидами на 3'-конце смысловой цепи;
положение между вторым и третьим нуклеотидами на 3'-конце смысловой цепи;
положение между первым и вторым нуклеотидами на 5'-конце антисмысловой цепи;
положение между вторым и третьим нуклеотидами на 5'-конце антисмысловой цепи;
положение между первым и вторым нуклеотидами на 3'-конце антисмысловой цепи; и
положение между вторым и третьим нуклеотидами на 3'-конце антисмысловой цепи.
[107] Согласно некоторым вариантам реализации настоящего изобретения миРНК согласно настоящему изобретению представляет собой siHBa1M1S, siHBa1M2S, siHBa2M1S или siHBa2M2S:
siHBa1M1S
Смысловая цепь: 5'-CmsCmsUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-(SEQ ID NO: 17),
Антисмысловая цепь: 5'-UmsUfsUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmsGmsUmsUm-3' (SEQ ID NO: 18),
siHBa1M2S
Смысловая цепь: 5'-CmsCmsUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 19),
Антисмысловая цепь: 5'-UmsUfsUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmsUmsUm-3' (SEQ ID NO: 20),
siHBa2M1S Смысловая цепь: 5'-GmsAmsCmCmUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 21),
Антисмысловая цепь: 5'-UmsUfsUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmUmCmsGmsGm-3' (SEQ ID NO: 22),
siHBa2M2S
Смысловая цепь: 5'-GmsAmsCmCmUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 23),
Антисмысловая цепь: 5'-UmsUfsUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmUmCmsGmsGm-3' (SEQ ID NO: 24),
в которых С, G, U и А обозначают состав оснований нуклеотидов; m обозначает, что нуклеотид, стоящий слева от буквы m, представляет собой метокси-модифицированный нуклеотид; f обозначает, что нуклеотид, стоящий слева от буквы f, представляет собой модифицированный фтором нуклеотид; s обозначает фосфотиоатную связь между двумя нуклеотидами по обеим сторонам от буквы.
[108] Согласно некоторым вариантам реализации настоящего изобретения 5'-концевой нуклеотид в антисмысловой цепи миРНК представляет собой 5'-фосфатный нуклеотид или нуклеотид, модифицированный аналогом 5'-фосфата.
[109] Обычные типы 5'-фосфатных нуклеотидов или нуклеотидов, модифицированных аналогом 5'-фосфата, хорошо известны специалистам в данной области техники; например, 5'-фосфатные нуклеотиды могут иметь следующую структуру:

в качестве другого примера, раскрытого в Anastasia Khvorova and Jonathan К. Watts, The chemical evolution of oligonucleotide therapies of clinical utility. Nature Biotechnology, 2017, 35(3): 238-48, приведены следующие четыре нуклеотида, которые модифицированы аналогом 5'-фосфата:

где
R представляет собой группу, выбранную из группы, состоящей из Н, ОН, метокси и F; «Основание» представляет собой основание, выбранное из A, U, С, G или Т.
[110] Согласно некоторым вариантам реализации настоящего изобретения 5'-фосфатный нуклеотид представляет собой нуклеотид с 5'-фосфатной модификацией, представленный Формулой (102); нуклеотид, модифицированный аналогом 5'-фосфата, представляет собой нуклеотид с 5'-(Е)-винилфосфонатной (Е-VP) модификацией, представленный Формулой (103), или модифицированный фосфотиоатом нуклеотид, представленный Формулой (105).
[111] Согласно некоторым вариантам реализации настоящего изобретения миРНК согласно настоящему изобретению представляет собой любую, выбранную из группы, состоящей из siHBa1M1P1, siHBa1M2P1, siHBa2M1P1, siHBa2M2P1, siHBa1M1SP1, siHBa1M2SP1, siHBa2M1SP1 и siHBa2M2SP1:
siHBa1M1P1
Смысловая цепь: 5'-CmCmUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 25),
Антисмысловая цепь: 5'-Р1-UmUfUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmUmUm-3' (SEQ ID NO: 26), siHBa1M2P1
Смысловая цепь: 5'-CmCmUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 27),
Антисмысловая цепь: 5'-Р1-UmUfUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmUmUm-3' (SEQ ID NO: 28),
siHBa2M1P1
Смысловая цепь: 5'-GmAmCmCmUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAm-3' (SEQ ID NO: 29),
Антисмысловая цепь: 5'-Р1-UmUfUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmUmCmGmGm-3' (SEQ ID NO: 30),
siHBa2M2P1
Смысловая цепь: 5'-GmAmCmCmUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3'(SEQ ID NO: 31),
Антисмысловая цепь: 5'-Р1-UmUfUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmUmCmGmGm-3' (SEQ ID NO: 32),
siHBa1M1SP1
Смысловая цепь: 5'-CmsCmsUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 33),
Антисмысловая цепь: 5'-Р1-UmsUfsUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmsUmsUm-3' (SEQ ID NO: 34),
siHBa1M2SP1
Смысловая цепь: 5'-CmsCmsUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 35),
Антисмысловая цепь: 5'-Р1-UmsUfsUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmsUmsUm-3' (SEQ ID NO: 36),
siHBa2M1SP1
Смысловая цепь: 5'-GmsAmsCmCmUmUmGmAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 37),
Антисмысловая цепь: 5'-Р1-UmsUfsUmGmAmAfGmUmAmUmGmCmCmUfCmAfAmGmGmUmCmsGmsGm-3' (SEQ ID NO: 38),
siHBa2M2SP1
Смысловая цепь: 5'-GmsAmsCmCmUmUmGfAmGfGfCfAmUmAmCmUmUmCmAmAmAm-3' (SEQ ID NO: 39),
Антисмысловая цепь: 5'-Р1-UmsUfsUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmUmCmsGmsGm-3' (SEQ ID NO: 40),
в которых С, G, U и А обозначают состав оснований нуклеотидов; m обозначает, что нуклеотид, стоящий слева от буквы m, представляет собой 2'-метокси-модифицированный нуклеотид; f обозначает, что нуклеотид, стоящий слева от буквы f, представляет собой 2'-фтор-модифицированный нуклеотид; s обозначает, что два нуклеотида по обеим сторонам от буквы s соединены фосфотиоатной связью; Р1 обозначает, что нуклеотид, примыкающий к правой стороне Р1, представляет собой 5'-фосфатный нуклеотид или нуклеотид, модифицированный аналогом 5'-фосфата.
[112] Авторы настоящего изобретения неожиданно обнаружили, что миРНК согласно настоящему изобретению обладают значительно повышенной стабильностью в плазме и лизосомах, сниженными нецелевыми эффектами, сохраняя при этом более высокую активность по подавлению генов.
[113] миРНК согласно настоящему изобретению могут быть получены с помощью обычных способов получения миРНК в данной области техники, например, с помощью способов твердофазного синтеза и жидкофазного синтеза. При этом для твердофазного синтеза уже доступны коммерческие услуги по требованиям заказчика. Модифицированные нуклеотиды могут быть введены в миРНК согласно настоящему изобретению с применением нуклеотидного мономера, имеющего соответствующую модификацию, при этом способы получения нуклеотидного мономера, имеющего соответствующую модификацию, и способы введения модифицированного нуклеотида в миРНК также хорошо известны специалистам в данной области техники.
Фармацевтическая композиция
[114] Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая миРНК, описанную выше, в качестве активного ингредиента и фармацевтически приемлемый носитель.
[115] Фармацевтически приемлемый носитель может представлять собой носитель, обычно применяемый в области введения миРНК, например, но не ограничиваясь этим, один или более из магнитных наночастиц (таких как наночастицы на основе Fe3O4 и Fe2O3), углеродных нанотрубок, мезопористого кремния, наночастиц фосфата кальция, полиэтиленимина (PEI), дендримера полиамидоамина (РАМАМ), поли-L-лизина (PLL), хитозана, 1,2-диолеоил-3-триметиламмоний-пропана (DOTAP), сополимера D- и L-молочной кислоты и гликолевой кислоты (PLGA), поли-2-аминоэтилэтиленфосфата (РРЕЕА), поли-2-диметиламиноэтилметакрилата (PDMAEMA) и их производных.
[116] Согласно некоторым вариантам реализации отсутствуют особые требования к содержанию миРНК и фармацевтически приемлемому носителю в фармацевтической композиции согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения массовое отношение миРНК к фармацевтически приемлемому носителю составляет 1:(1-500) и согласно некоторым вариантам реализации настоящего изобретения 1:(1-50).
[117] Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция согласно настоящему изобретению также может содержать другие фармацевтически приемлемые вспомогательные вещества, которые могут представлять собой один или более из различных обычных составов или соединений в данной области техники. Например, указанные другие фармацевтически приемлемые вспомогательные вещества могут содержать по меньшей мере один из буфера рН, защитного агента и регулятора осмотического давления.
[118] Буфер рН может представлять собой буферный раствор гидрохлорида трис-гидроксиметиламинометана с рН=7,5-8,5 и/или фосфатный буферный раствор с рН=5,5-8,5, предпочтительно фосфатный буферный раствор с рН=5,5-8,5.
[119] Защитный агент может представлять собой по меньшей мере один из инозита, сорбита, сахарозы, трегалозы, маннозы, мальтозы, лактозы и глюкозы. Содержание защитного агента может составлять от 0,01 масс. % до 30 масс. % на основании общей массы фармацевтической композиции.
[120] Регулятор осмотического давления может представлять собой хлорид натрия и/или хлорид калия. Содержание регулятора осмотического давления обеспечивает осмотическое давление фармацевтической композиции 200-700 милиосмоль/кг. В зависимости от целевого осмотического давления специалисты в данной области техники могут легко определить содержание регулятора осмотического давления. [121] Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция может представлять собой жидкий состав, например, раствор для инъекций; или лиофилизированный порошок для инъекций, который смешивают с жидким вспомогательным веществом для получения жидкого состава при введении. Жидкий состав можно вводить, но не ограничиваясь этим, путем подкожной, внутримышечной или внутривенной инъекции, а также можно вводить, но не ограничиваясь этим, в легкие путем распыления или другие органы (такие как печень) через легкие путем распыления. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическую композицию вводят с помощью внутривенной инъекции.
[122] Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция может быть в форме липосомного состава. Согласно некоторым вариантам реализации настоящего изобретения фармацевтически приемлемый носитель, применяемый в липосомном составе, содержит аминосодержащее соединение для трансфекции (далее по тексту также упоминаемое как органический амин), вспомогательный липид и/или пегилированный липид. При этом органический амин, вспомогательный липид и пегилированный липид могут быть выбраны, соответственно, из одного или более из аминосодержащих соединений для трансфекции или их фармацевтически приемлемых солей или производных, вспомогательных липидов и пегилированных липидов, описанных в CN 103380113 А, который полностью включен в настоящую заявку посредством ссылки.
[123] Согласно некоторым вариантам реализации настоящего изобретения органический амин может представлять собой соединение, представленное Формулой (201), описанное в CN 103380113 А, или его фармацевтически приемлемую соль:

в которой:
X101 и Х102 независимо друг от друга выбраны из О, S, N-A и С-А, где А представляет собой водород или С1-С20 углеводородную цепь;
Y и Z независимо друг от друга выбраны из С=O, C=S, S=O, СН-ОН и SO2;
R101, R102, R103, R104, R105, R106 и R107 независимо друг от друга выбраны из водорода; циклической или ациклической, замещенной или незамещенной, разветвленной или линейной алифатической группы; циклической или ациклической, замещенной или незамещенной, разветвленной или линейной гетероалифатической группы; замещенной или незамещенной, разветвленной или линейной ацильной группы; замещенной или незамещенной, разветвленной или линейной арильной группы или замещенной или незамещенной, разветвленной или линейной гетероарильной группы;
х представляет собой целое число от 1 до 10;
n представляет собой целое число от 1 до 3, m представляет собой целое число 0-20, р равно 0 или 1; при этом, если тир оба равны 0, то R102 представляет собой водород, и если по меньшей мере один из n или m равен 2, то R103 и азот в Формуле (201) образуют структуру, представленную Формулой (202) или (203):

в которых g, е и f независимо друг от друга представляют собой целое число 1-6, «НСС» представляет собой углеводородную цепь и каждый *N представляет собой атом азота, показанный в Формуле (201).
[124] Согласно некоторым вариантам реализации настоящего изобретения R103 представляет собой полиамин. Согласно другим вариантам реализации настоящего изобретения R103 представляет собой кеталь. Согласно некоторым вариантам реализации настоящего изобретения R101 и R102 в Формуле (201) независимо друг от друга представляют собой любую из замещенных или незамещенных, разветвленных или линейных алкильных или алкенильных групп, которые содержат 3-20 атомов углерода (например, 8-18 атомов углерода) и 0-4 двойные связи (например, 0-2 двойные связи).
[125] Согласно некоторым вариантам реализации настоящего изобретения, если n и m независимо друг от друга представляют собой 1-3, R103 представляет собой любую из следующих формул (204)-(213):








в которых каждый из g, е и f независимо представляет собой целое число от 1 до 6; каждый «НСС» представляет собой углеводородную цепь и каждый * представляет собой потенциальную точку присоединения R103 к атому азота в Формуле (201), где каждый Н в любом * положении может быть замещен, чтобы осуществить присоединение к атому азота в Формуле (201).
[126] Соединение, представленное в (201), может быть получено, как описано в CN 103380113 A.
[127] Согласно некоторым вариантам реализации настоящего изобретения органический амин может представлять собой органический амин, представленный Формулой (214), и/или органический амин, представленный Формулой (215):


[128] Вспомогательный липид представляет собой холестерин, аналог холестерина и/или производные холестерина.
[129] Пегилированный липид представляет собой 1,2-дипальмитоил-sn-глицеро-3-фосфатидилэтаноламин-N[метоксиполиэтиленгликоль]-2000.
[130] Согласно некоторым вариантам реализации настоящего изобретения молярное отношение между органическим амином, вспомогательным липидом и пегилированным липидом в фармацевтической композиции составляет (19,7-80):(19,7-80):(0,3-50); например, молярное отношение может составлять (50-70):(20-40):(3-20).
[131] Согласно некоторым вариантам реализации настоящего изобретения фармацевтические композиции, образованные миРНК согласно настоящему изобретению и вышеуказанными аминосодержащими агентами для трансфекции, имеют средний диаметр от приблизительно 30 нм до приблизительно 200 нм, как правило, от приблизительно 40 нм до приблизительно 135 нм, и более типично средний диаметр липосомных частиц составляет от приблизительно 50 нм до приблизительно 120 нм, от приблизительно 50 нм до приблизительно 100 нм, от приблизительно 60 нм до приблизительно 90 нм или от приблизительно 70 нм до приблизительно 90 нм, например, средний диаметр липосомных частиц составляет приблизительно 30, 40, 50, 60, 70, 75, 80, 85, 90, 100, 110, 120, 130, 140, 150 или 160 нм.
[132] Согласно некоторым вариантам реализации настоящего изобретения в фармацевтической композиции, образованной миРНК согласно настоящему изобретению и вышеуказанными аминосодержащими агентами для трансфекции, отношение (отношение масса/масса) миРНК к общим липидам, например, органическим аминам, вспомогательным липидам и/или пегилированным липидам, варьируется от приблизительно 1:1 до приблизительно 1:50, от приблизительно 1:1 до приблизительно 1:30, от приблизительно 1:3 до приблизительно 1:20, от приблизительно 1:4 до приблизительно 1:18, от приблизительно 1:5 до приблизительно 1:17, от приблизительно 1:5 до приблизительно 1:15, от приблизительно 1:5 до приблизительно 1:12, от приблизительно 1:6 до приблизительно 1:12 или от приблизительно 1:6 до приблизительно 1:10. Например, отношение миРНК согласно настоящему изобретению к общим липидам составляет приблизительно 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:16, 1:17 или 1:18 по массе.
[133] Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция может продаваться с каждым компонентом, предоставленным по отдельности, и может применяться в форме жидкого состава. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция, образованная миРНК согласно настоящему изобретению и вышеуказанным фармацевтически приемлемым носителем, может быть получена с помощью различных известных способов, за исключением замены существующего двухцепочечного олигонуклеотида миРНК согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция может быть получена в соответствии со следующим способом.
[134] Органические амины, вспомогательные липиды и пегилированные липиды суспендируют в спирте в молярном отношении, описанном выше, и смешивают до однородности с получением раствора липидов; спирт применяют в таком количестве, чтобы полученный раствор липидов присутствовал в общей массовой концентрации от 2 до 25 мг/мл (например, от 8 до 18 мг/мл). Спирт представляет собой фармацевтически приемлемый спирт, такой как спирт, который находится в жидкой форме при приблизительно комнатной температуре, например, один или более из этанола, пропиленгликоля, бензилового спирта, глицерина, ПЭГ 200, ПЭГ 300, ПЭГ 400, предпочтительно этанол.
[135] МиРНК согласно настоящему изобретению растворяют в забуференном солевом растворе для получения водного раствора миРНК. Забуференный солевой раствор имеет концентрацию от 0,05 до 0,5 М, такую как от 0,1 до 0,2 М. рН забуференного солевого раствора доводят до 4,0-5,5, например, от 5,0 до 5,2. Забуференный солевой раствор применяют в таком количестве, чтобы миРНК присутствовала в концентрации менее 0,6 мг/мл, например, от 0,2 до 0,4 мг/мл. Буферная соль может представлять собой одну или более, выбранных из группы, состоящей из растворимого ацетата и растворимого цитрата, такого как ацетат натрия и/или ацетат калия.
[136] Раствор липидов и водный раствор миРНК смешивают. Продукт, полученный после смешивания, инкубируют при температуре от 40 до 60°С в течение по меньшей мере 2 минут (например, от 5 до 30 минут) для получения инкубированного липидного состава. Отношение объемов раствора липидов к водному раствору миРНК составляет 1:(2-5), например, 1:4.
[137] Инкубированный липидный состав концентрируют или разбавляют, очищают, чтобы удалить примеси, и затем стерилизуют с получением фармацевтической композиции согласно настоящему изобретению, которая имеет следующие физико-химические параметры: рН от 6,5 до 8, процент инкапсуляции более 80%, размер частиц от 40 до 200 нм, индекс полидисперсности менее 0,30 и осмотическое давление от 250 до 400 мОсм/кг; например, физико-химические параметры могут быть следующими: рН от 7,2 до 7,6, процент инкапсуляции более 90%, размер частиц от 60 до 100 нм, индекс полидисперсности менее 0,20 и осмотическое давление от 300 до 400 мОсм/кг.
[138] При этом стадия концентрирования или разбавления может быть выполнена до, после или одновременно со стадией удаления примесей. Способ удаления примесей может представлять собой любой из различных существующих способов, таких как ультрафильтрация с применением колонки с полыми волокнами 100 кДа, фосфатно-солевой буфер (ФСБ) при рН=7,4 в качестве раствора для обмена при ультрафильтрации и система тангенциального потока. Способ стерилизации может представлять собой любой из различных существующих способов, таких как стерилизация с помощью фильтрации на фильтре с размером пор 0,22 мкм.
Первый конъюгат миРНК
[139] Согласно одному аспекту настоящего изобретения предложен первый конъюгат миРНК, который содержит описанную выше миРНК и присоединенную к ней конъюгирующую группу.
[140] Конъюгирующая группа, как правило, содержит по меньшей мере одну фармацевтически приемлемую нацеливающую группу и необязательный линкер. Кроме того, миРНК, линкер и нацеливающая группа соединены последовательно. Согласно некоторым вариантам реализации настоящего изобретения присутствует от 1 до 6 нацеливающих групп. Согласно некоторым вариантам реализации настоящего изобретения присутствует от 2 до 4 нацеливающих групп. Молекула миРНК может быть нековалентно или ковалентно конъюгирована с конъюгирующей группой, например, молекула миРНК ковалентно конъюгирована с конъюгирующей группой. Положение конъюгации между миРНК и конъюгирующей группой может быть на 3'-конце или 5'-конце смысловой цепи миРНК, или на 5'-конце антисмысловой цепи, или во внутренней последовательности миРНК. Согласно некоторым вариантам реализации настоящего изобретения положение конъюгации между миРНК и конъюгирующей группой находится на 3'-конце смысловой цепи миРНК.
[141] Согласно некоторым вариантам реализации настоящего изобретения конъюгирующая группа соединена с фосфатной группой, 2'-гидроксигруппой или основанием нуклеотида. Согласно некоторым вариантам реализации настоящего изобретения конъюгирующая группа может быть соединена с 3'-гидроксигруппой, если нуклеотиды соединены за счет 2'-5'-фосфодиэфирной связи. Если конъюгирующая группа соединена с концом миРНК, конъюгирующая группа, как правило, соединена с фосфатной группой нуклеотида; если конъюгирующая группа соединена с внутренней последовательностью миРНК, конъюгирующая группа, как правило, соединена с рибозным кольцом или основанием. Для конкретных типов соединения можно сослаться на: Muthiah Manoharan et al. siRNA conjugates carrying sequentially assembled trivalent N-acetylgalactosamine linked through nucleosides elicit robust gene silencing in vivo in hepatocytes. ACS Chemical biology, 2015, 10(5): 1181-7.
[142] Согласно некоторым вариантам реализации настоящего изобретения миРНК и конъюгирующая группа могут быть соединены с помощью кислото-лабильной или восстанавливаемой химической связи, и эти химические связи могут быть разрушены в кислой среде эндосом клетки, что приводит миРНК в свободное состояние. Для неразрушаемых видов конъюгации конъюгирующая группа может быть соединена со смысловой цепью миРНК, что сводит к минимуму влияние конъюгации на активность двухцепочечного олигонуклеотида.
[143] Согласно некоторым вариантам реализации настоящего изобретения фармацевтически приемлемая нацеливающая группа может представлять собой обычный лиганд в области введения двухцепочечного олигонуклеотида, например, различные лиганды, описанные в WO 2009082607 A2, который полностью включен в настоящую заявку посредством ссылки.
[144] Согласно некоторым вариантам реализации настоящего изобретения фармацевтически приемлемая нацеливающая группа может быть выбрана из одного или более из лигандов, образованных следующими нацеливающими молекулами или их производными: липофильных молекул, таких как холестерин, желчных кислот, витаминов (таких как витамин Е), молекул липидов с разной длиной цепи; полимеров, таких как полиэтиленгликоль; полипептидов, таких как пептид для проникновения в клетки; аптамеров; антител; квантовых точек; сахаридов, таких как лактоза, полилактоза, манноза, галактоза, N-ацетилгалактозамин (GalNAc); фолиевой кислоты; или рецепторных лигандов, экспрессируемых в паренхимных клетках печени, таких как асиалогликопротеин, асиало-сахарный остаток, липопротеины (такие как липопротеин высокой плотности, липопротеин низкой плотности), глюкагон, нейротрансмиттеры (такие как адреналин), факторы роста, трансферрин и тому подобное.
[145] Согласно некоторым вариантам реализации настоящего изобретения каждый лиганд независимо представляет собой лиганд, способный связываться с поверхностным рецептором клетки. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой лиганд, способный связываться с поверхностным рецептором гепатоцитов. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой лиганд, способный связываться с поверхностным рецептором гепатоцитов млекопитающего. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой лиганд, способный связываться с поверхностным рецептором гепатоцитов человека. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой лиганд, способный связываться с печеночным поверхностным рецептором асиалогликопротеина (ASGP-R). Типы этих лигандов хорошо известны специалистам в данной области техники, и они, как правило, выполняют функцию связывания со специфическими рецепторами на поверхности клетки-мишени, что опосредует доставку двухцепочечного олигонуклеотида, связанного с лигандом, в клетку-мишень.
[146] Согласно некоторым вариантам реализации настоящего изобретения фармацевтически приемлемая нацеливающая группа может представлять собой любой лиганд, который связывается с рецепторами асиалогликопротеина (ASGP-R) на поверхности гепатоцитов млекопитающего. Согласно одному варианту реализации настоящего изобретения каждый лиганд независимо выбран из асиалогликопротеина, такого как асиалооросомукоид (ASOR) или асиалофетуин (ASF). Согласно некоторым вариантам реализации настоящего изобретения лиганд представляет собой сахарид или его производные.
[147] Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой сахарид. Согласно некоторым вариантам реализации настоящего изобретения каждый лиганд представляет собой сахарид. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой моносахарид, полисахарид, модифицированный моносахарид, модифицированный полисахарид или их производные. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд может представлять собой моносахарид, дисахарид или трисахарид. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один лиганд представляет собой модифицированный сахарид. Согласно некоторым вариантам реализации настоящего изобретения каждый лиганд представляет собой модифицированный сахарид. Согласно некоторым вариантам реализации настоящего изобретения каждый лиганд независимо выбран из группы, состоящей из полисахаридов, модифицированных полисахаридов, моносахаридов, модифицированных моносахаридов, производных полисахаридов и производных моносахаридов. Согласно некоторым вариантам реализации настоящего изобретения каждый лиганд или по меньшей мере один лиганд может быть независимо выбран из группы, состоящей из глюкозы и ее производных, маннозы и ее производных, галактозы и ее производных, ксилозы и ее производных, рибозы и ее производных, фукозы и ее производных, лактозы и ее производных, мальтозы и ее производных, арабинозы и ее производных, фруктозы и ее производных, а также сиаловой кислоты.
[148] Согласно некоторым вариантам реализации настоящего изобретения каждый лиганд может быть независимо выбран из группы, состоящей из D-маннопиранозы, L-маннопиранозы, D-арабинозы, D-ксилофуранозы, L-ксилофуранозы, D-глюкозы, L-глюкозы, D-галактозы, L-галактозы, α-D-маннофуранозы, β-D-маннофуранозы, α-D-маннопиранозы, β-D-маннопиранозы, α-D-глюкопиранозы, β-D-глюкопиранозы, α-D-глюкофуранозы, β-D-глюкофуранозы, α-D-фруктофуранозы, α-D-фруктопиранозы, α-D-галактопиранозы, β-D-галактопиранозы, α-D-галактофуранозы, β-D-галактофуранозы, глюкозамина, сиаловой кислоты, галактозамина, N-ацетилгалактозамина, N-трифторацетилгалактозамина, N-пропионилгалактозамина, N-n-бутирилгалактозамина, N-изобутирилгалактозамина, 2-амино-3-O-[(R)-1-карбоксиэтил]-2-дезокси-β-D-глюкопиранозы, 2-дезокси-2-метиламино-L-глюкопиранозы, 4,6-дидезокси-4-формамидо-2,3-ди-О-метил-D-маннопиранозы, 2-дезокси-2-сульфоамино-D-глюкопиранозы, N-гликолил-α-нейраминовой кислоты, 5-тио-β-D-глюкопиранозы, метил-2,3,4-трис-O-ацетил-1-тио-6-О-тритил-α-D-глюкопиранозида, 4-тио-β-D-галактопиранозы, этил-3,4,6,7-тетра-O-ацетил-2-дезокси-1,5-дитио-α-D-глюкогептопиранозида, 2,5-ангидро-D-аллононитрила, рибозы, D-рибозы, D-4-тиорибозы, L-рибозы, L-4-тиорибозы. Другие наборы лигандов могут быть найдены, например, в раскрытии CN 105378082 A, который полностью включен в настоящую заявку посредством ссылки.
[149] Согласно некоторым вариантам реализации настоящего изобретения фармацевтически приемлемая нацеливающая группа в первом конъюгате миРНК может представлять собой галактозу или N-ацетилгалактозамин, причем молекулы галактозы или N-ацетилгалактозамина могут быть моно-, би-, три- или тетравалентными. Следует понимать, что термины моно-, би-, три- или тетравалентный, описанные в настоящем документе, соответственно, означают, что молярное отношение молекулы двухцепочечного олигонуклеотида к молекуле галактозы или N-ацетилгалактозамина в конъюгате олигонуклеотида составляет 1:1, 1:2, 1:3 или 1:4, причем конъюгат олигонуклеотида образован из двухцепочечной олигонуклеотидной молекулы и конъюгирующей группы, содержащей молекулу галактозы или N-ацетилгалактозамина в качестве нацеливающей группы. Согласно некоторым вариантам реализации настоящего изобретения фармацевтически приемлемая нацеливающая группа представляет собой N-ацетилгалактозамин. Согласно некоторым вариантам реализации настоящего изобретения, если двухцепочечный олигонуклеотид согласно настоящему изобретению конъюгирован с конъюгирующей группой, содержащей N-ацетилгалактозамин, молекула N-ацетилгалактозамина является трехвалентной или четырехвалентной. Согласно некоторым вариантам реализации настоящего изобретения, если двухцепочечный олигонуклеотид согласно настоящему изобретению конъюгирован с конъюгирующей группой, содержащей N-ацетилгалактозамин, молекула N-ацетилгалактозамина является трехвалентной.
[150] Нацеливающая группа может быть соединена с молекулой миРНК за счет соответствующего линкера, и соответствующий линкер может быть выбран специалистом в данной области техники в соответствии с конкретным типом нацеливающей группы. Типы этих линкеров и нацеливающих групп, а также виды соединения с миРНК можно найти в раскрытии WO 2015006740 A2, который полностью включен в настоящую заявку посредством ссылки.
[151] Согласно некоторым вариантам реализации настоящего изобретения, если нацеливающая группа представляет собой N-ацетилгалактозамин, подходящий линкер может иметь следующую структуру, представленную Формулой (301):

в которой
к представляет собой целое число от 1 до 3;
LA представляет собой цепную группу, содержащую амидную связь, которая имеет структуру, представленную Формулой (302), причем каждый LA соответствующим образом соединен с нацеливающей группой и группой LC за счет простой эфирной связи на двух своих концах:

LB представляет собой цепную группу, содержащую N-ацилпирролидин, которая имеет структуру, представленную Формулой (303), причем цепная группа содержит карбонильную группу на одном конце и соединена с группой LC за счет амидной связи, а также содержит оксигруппу на другом конце и соединена с миРНК за счет сложной фосфоэфирной связи:

LC представляет собой двухвалентную или четырехвалентную соединяющую группу на основе гидроксиметиламинометана, дигидроксиметиламинометана или тригидроксиметиламинометана, причем группа LC соединена с каждой из групп LA посредством простой эфирной связи за счет атома кислорода и соединена с группой LB посредством амидной связи за счет атома азота.
[152] Согласно некоторым вариантам реализации настоящего изобретения, если n=3 и LC представляет собой четырехвалентную соединяющую группу на основе тригидроксиметиламинометана, первый конъюгат миРНК, образованный путем соединения молекул N-ацетилгалактозамина с молекулой миРНК за счет -(LA)3-тригидроксиметиламинометан-LB- в качестве линкера, имеет структуру, представленную Формулой (304):

в которой структура двойной спирали представляет собой миРНК.
[153] Аналогичным образом, положение конъюгации между миРНК и конъюгирующей группой может находиться на 3'-конце или 5'-конце смысловой цепи миРНК, или на 5'-конце антисмысловой цепи, или во внутренней последовательности миРНК.
[154] Согласно некоторым вариантам реализации настоящего изобретения 3'-конец смысловой цепи миРНК согласно настоящему изобретению ковалентно конъюгирован с тремя молекулами N-ацетилгалактозамина (GalNAc) за счет линкера -(LA)3-тригидроксиметиламинометан-LB- с получением первого конъюгата миРНК, в котором молярное отношение молекулы миРНК к молекуле GalNAc составляет 1:3 (далее по тексту упоминается как (GalNAc)3-миРНК), и этот конъюгат имеет структуру, представленную Формулой (305):

в которой структура двойной спирали представляет миРНК; и линкер соединен с 3'-концом смысловой цепи миРНК.
[155] Согласно некоторым вариантам реализации настоящего изобретения, если нацеливающая группа представляет собой N-ацетилгалактозамин, подходящий линкер может иметь структуру, представленную Формулой (306):

в которой,
1 представляет собой целое число от 0 до 3;
* представляет собой положение, соединенное с нацеливающей группой простой эфирной связью на линкере; и
# представляет собой положение, соединенное с миРНК сложной фосфоэфирной связи на линкере.
[156] Согласно некоторым конкретным вариантам реализации настоящего изобретения, если l=2, конъюгат миРНК имеет структуру, представленную Формулой (307):

в которой структура двойной спирали обозначает миРНК; и линкер соединен с 3'-концом смысловой цепи миРНК.
[157] Указанные выше конъюгаты могут быть синтезированы в соответствии со способом, подробно описанным в предшествующем уровне техники. Например, в WO 2015006740 А2 подробно описано получение различных конъюгатов. Первый конъюгат миРНК согласно настоящему изобретению может быть получен с помощью способов, хорошо известных специалистам в данной области техники. В качестве другого примера в WO 2014025805 A1 описан способ получения конъюгата, имеющего структуру, представленную Формулой (305). В качестве дополнительного примера Rajeev et al., ChemBioChem 2015, 16, 903-908, описали способ получения конъюгата, имеющего структуру, представленную Формулой (307).
Второй конъюгат миРНК
[158] Согласно некоторым вариантам реализации настоящего изобретения предложен второй конъюгат миРНК, который имеет структуру, представленную Формулой (1):


в которой n1 представляет собой целое число от 1 до 3, а n3 представляет собой целое число от 0 до 4;
каждый из m1, m2 и m3 независимо представляет собой целое число от 2 до 10;
каждый из R10, R11, R12, R13, R14 и R15 независимо представляет собой Н или выбран из группы, состоящей из C1-С10 алкила, C1-С10 галогеналкила и C1-С10 алкокси;
R3 представляет собой группу, имеющую структуру, представленную Формулой (А59):

в которой
E1 представляет собой ОН, SH или ВН2;
Nu представляет собой миРНК;
каждый нуклеотид в миРНК, представленной Nu, независимо представляет собой модифицированный или немодифицированный нуклеотид. МиРНК, представленная Nu, содержит смысловую цепь и антисмысловую цепь, причем смысловая цепь содержит нуклеотидную последовательность 1, а антисмысловая цепь содержит нуклеотидную последовательность 2; нуклеотидная последовательность 1 и нуклеотидная последовательность 2 по меньшей мере частично обратнокомплементарны, что позволяет образовывать двухцепочечную область;; нуклеотидная последовательность 1 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность 2 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 156, и отличается от нее не более чем 3 нуклеотидами:
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которой
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность 1 содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность 2 содержит нуклеотид Z'В в положении, соответствующем Z'; нуклеотид Z'В представляет собой первый нуклеотид на 5'-конце антисмысловой цепи;
R2 представляет собой линейный алкилен от 1 до 20 атомов углерода в длину, причем один или более атомов углерода необязательно замещены одной или более группами, выбранными из группы, состоящей из: С(О), NH, О, S, CH=N, S(O)2, С2-С10 алкилен, С2-С10 алкинилен, С6-С10 арилен, С3-С18 гетероциклилен и С5-С10 гетероарилен, и при этом R2 необязательно содержит один или более заместителей, выбранных из группы, состоящей из: C1-С10 алкил, С6-С10 арил, С5-С10 гетероарил, C1-С10 галогеналкил, -OC1-С10 алкил, -OC1-С10 алкилфенил, -C1-С10 алкил-ОН, -OC1-С10 галогеналкил, -SC1-С10 алкил, -SC1-С10 алкилфенил, -C1-С10 алкил-SH, -SC1-С10 галогеналкил, галоген, -ОН, -SH, -NH2, -C1-С10 алкил-КНг, -N(C1-C10 алкил)(С1-С10 алкил), -NH(C1-C10 алкил), циано, нитро, -СО2Н, -C(О)OC1-C10 алкил, -CON(C1-C10 алкил)(С1-С10 алкил), -CONH(C1-C10 алкил), -CONH2, -NHC(О)(C1-C10 алкил), -NHC(О)(фенил), -N(C1-C10 алкил)С(O)(С1-С10 алкил), -N(C1-С10 алкил)С(О)(фенил), -C(О)C1-C10 алкил, -C(О)C1-C10 алкилфенил, -C(О)C1-С10 галогеналкил, -OC(О)C1-C10 алкил, -SO2(C1-C10 алкил), -SO2(фенил), -SO2(C1-С10 галогеналкил), -SO2NH2, -SO2NH(C1-C10 алкил), -SO2NH(фенил), -NHSO2(C1-С10 алкил), -NHSO2(фенил) и -NHSO2(C1-C10 галогеналкил);
каждый L1 независимо представляет собой линейный алкилен от 1 до 70 атомов углерода в длину, причем один или более атомов углерода необязательно замещены одной или более группами, выбранными из группы, состоящей из: С(О), NH, О, S, CH=N, S(О)2, С2-С10 алкилен, С2-С10 алкинилен, С6-С10 арилен, С3-С18 гетероциклилен и С5-С10 гетероарилен, и при этом L1 необязательно содержит один или более заместителей, выбранных из группы, состоящей из: C1-С10 алкил, С6-С10 арил, С5-С10 гетероарил, C1-С10 галогеналкил, -OC1-С10 алкил, -OC1-С10 алкилфенил, -C1-С10 алкил-ОН, -OC1-С10 галогеналкил, -SC1-С10 алкил, -SC1-С10 алкилфенил, -C1-С10 алкил-SH, -SC1-С10 галогеналкил, галоген, -ОН, -SH, -NH2, -C1-С10 алкил-NH2, -N(C1-C10 алкил)(С1-С10 алкил), -NH(C1-C10 алкил), циано, нитро, -СО2Н, -C(О)OC1-C10 алкил, -CON(C1-С10 алкил)(С1-С10 алкил), -CONH(C1-C10 алкил), -CONH2, -NHC(О)(C1-C10 алкил), -NHC(О)(фенил), -N(C1-C10 алкил)С(О)(С1-С10 алкил), -N(C1-C10 алкил)С(О)(фенил), -C(О)C1-C10 алкил, -C(О)C1-C10 алкилфенил, -C(О)C1-C10 галогеналкил, -OC(О)C1-С10 алкил, -SO2(C1-C10 алкил), -SO2(фенил), -SO2(C1-C10 галогеналкил), -SO2NH2, -SO2NH(C1-C10 алкил), -SO2NH(фенил), -NHSO2(C1-C10 алкил), -NHSO2(фенил) и -NHSO2(C1-C10 галогеналкил).
[159] Согласно некоторым вариантам реализации настоящего изобретения L1 может быть выбран из группы, состоящей из групп А1-А26 и любой их комбинации, причем структуры и определения А1-А26 приведены далее:






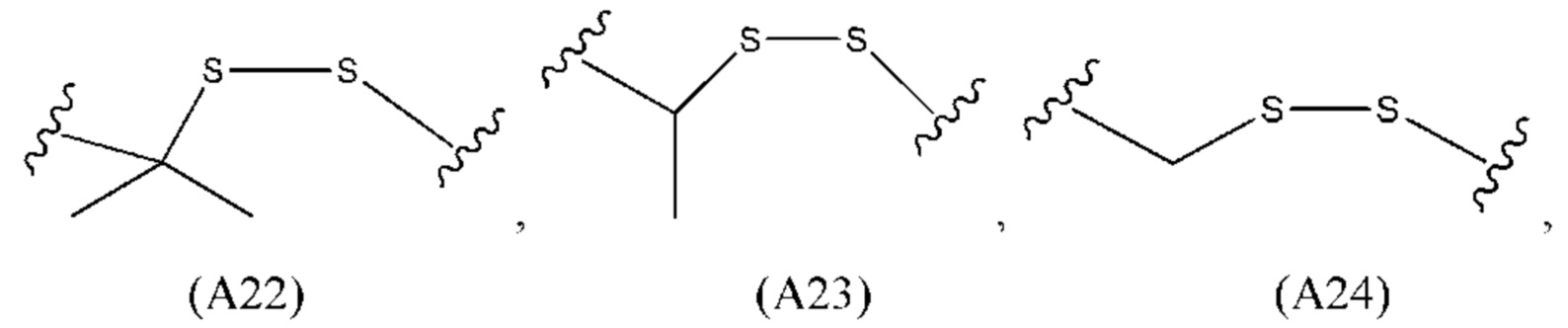

где каждый j1 независимо представляет собой целое число от 1 до 20;
каждый j2 независимо представляет собой целое число от 1 до 20;
R' представляет собой C1-С10 алкил;
Ra выбран из группы, состоящей из А27-А45 и любой их комбинации:




Rb представляет собой C1-С10 алкил; и
-

[160] Специалисты в данной области техники поймут, что, несмотря на то, что для удобства L1 определен как линейный алкил, он не может представлять собой линейную группу или не может называться по-другому, например, амином или алкенилом, полученным с помощью указанной выше замены и/или замещения. Для целей настоящего изобретения длина L1 представляет собой количество атомов в цепи, соединяющей две точки присоединения. Для этой цели кольцо, полученное путем замещения атома углерода линейного алкилена, такого как гетероциклилен или гетероарилен, считается как один атом.
[161] M1 представляет собой нацеливающую группу, определения и варианты которой аналогичны тем, которые описаны выше. Согласно некоторым вариантам реализации настоящего изобретения каждый M1 независимо выбран из одного из лигандов, которые обладают аффинностью в отношении рецептора асиалогликопротеина на поверхности гепатоцитов млекопитающего.
[162] Если M1 представляет собой лиганд, который обладает аффинностью в отношении рецептора асиалогликопротеина (ASGP-R) на поверхности гепатоцита млекопитающего, согласно некоторым вариантам реализации настоящего изобретения n1 может представлять собой целое число от 1 до 3, а n3 может представлять собой целое число от 0 до 4, чтобы гарантировать, что количество лиганда M1 в конъюгате может составлять по меньшей мере 2. Согласно некоторым вариантам реализации настоящего изобретения n1+n3≥2, поэтому количество лиганда M1 в конъюгате может составлять по меньшей мере 3, это обеспечивает более легкое связывание лиганда M1 с рецептором асиалогликопротеина на поверхности гепатоцитов, что может облегчать эндоцитоз конъюгата в клетки. Эксперименты показали, что, если количество лиганда M1 превышает 3, легкость связывания лиганда M1 с рецептором асиалогликопротеина на поверхности гепатоцитов существенно не увеличивается. Таким образом, с учетом различных аспектов, таких как удобство синтеза, стоимость структуры/способа и эффективность доставки, согласно некоторым вариантам реализации настоящего изобретения, n1 представляет собой целое число от 1 до 2, n3 представляет собой целое число от 0 до 1 и n1+n3=от 2 до 3.
[163] Согласно некоторым вариантам реализации настоящего изобретения, если m1, m2 и m3 независимо друг от друга выбраны из целого числа 2-10, стерические взаимные положения среди многих лигандов M1 могут быть соответствующими для связывания лигандов M1 с рецептором асиалогликопротеина на поверхности гепатоцитов. Для того чтобы конъюгат согласно настоящему изобретению имел более простую структуру, более легкий синтез и/или уменьшенную стоимость, согласно некоторым вариантам реализации настоящего изобретения, m1, m2 и m3 независимо друг от друга представляют собой целые числа 2-5, согласно некоторым вариантам реализации настоящего изобретения m1=m2=m3.
[164] Специалисты в данной области техники поймут, что, если R10, R11, R12, R13, R14 и R15 независимо друг от друга представляют собой Н, C1-С10 алкил, C1-С10 галогеналкил и C1-С10 алкокси, они не изменят свойства конъюгата согласно настоящему изобретению и все смогут достичь цели настоящего изобретения. Согласно некоторым вариантам реализации настоящего изобретения R10, R11, R12, R13, R14 и R15 независимо друг от друга выбраны из Н, метила и этила. Согласно некоторым вариантам реализации настоящего изобретения R10, R11, R12, R13, R14 и R15 представляют собой Н.
[165] R3 представляет собой группу, имеющую структуру, представленную Формулой А59, где E1 представляет собой ОН, SH или ВН2, и с учетом доступности исходных материалов, согласно некоторым вариантам реализации настоящего изобретения, E1 представляет собой ОН или SH.
[166] Согласно некоторым вариантам реализации настоящего изобретения R2 выбран для того чтобы обеспечить соединение между группой, представленной Формулой (А59), и атомом N на азотистом остове. Применительно к настоящему изобретению «азотистый остов» относится к цепной структуре, в которой атом углерода, присоединенный к R10, R11, R12, R13, R14 и R15, и атомы N соединены друг с другом. Согласно некоторым вариантам реализации настоящего изобретения R2 может представлять собой любую соединяющую группу, способную присоединять группу, представленную Формулой (А59), к атому N на азотистом остове с помощью подходящих средств. Согласно некоторым вариантам реализации настоящего изобретения, в случае если конъюгат миРНК согласно настоящему изобретению получен с помощью способа твердофазного синтеза, группа R2 должна иметь и положение, соединяющееся с атомом N на азотистом остове, и положение, соединяющееся с атомом Р в R3. Согласно некоторым вариантам реализации настоящего изобретения в R2 положение, соединяющееся с атомом N на азотистом остове, образует амидную связь с атомом N, а положение, соединяющееся с атомом Р в R3, образует сложную фосфоэфирную связь с атомом Р. Согласно некоторым вариантам реализации настоящего изобретения R2 представляет собой В5, В6, В5' или В6':

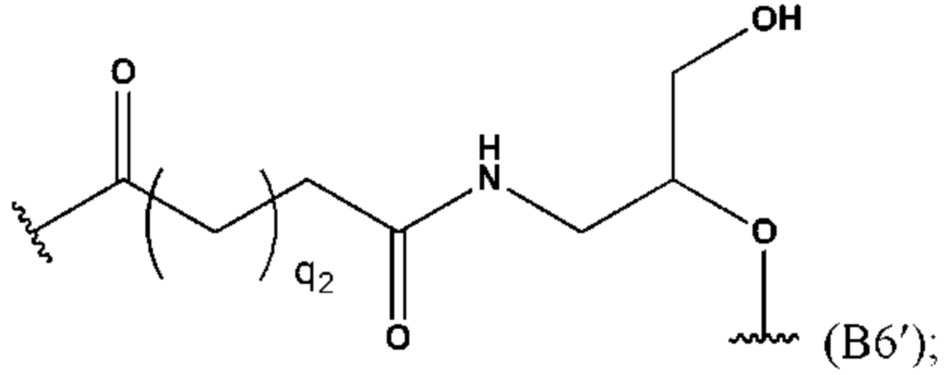
в которых представляет собой положение, в котором группа присоединена
ковалентно;
q2 представляет собой целое число от 1 до 10; согласно некоторым вариантам реализации настоящего изобретения q2 представляет собой целое число от 1 до 5.
[167] L1 применяется для соединения лиганда M1 с атомом N на азотистом остове, что обеспечивает функцию нацеливания на печень для второго конъюгата миРНК согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения L1 выбран из соединенных комбинаций одной или более из Формул А1-А26. Согласно некоторым вариантам реализации настоящего изобретения L1 выбран из соединенных комбинаций одной или более из Формул А1, А4, А5, А6, А8, А10, A11 и А13. Согласно некоторым вариантам реализации настоящего изобретения L1 выбран из соединенных комбинаций по меньшей мере двух из Формулы А1, А4, А8, А10 и A11. Согласно некоторым вариантам реализации настоящего изобретения L1 выбран из соединенных комбинаций по меньшей мере двух из Формулы A1, А8 и А10.
[168] Согласно некоторым вариантам реализации настоящего изобретения длина L1 может составлять от 3 до 25, от 3 до 20, от 4 до 15 или от 5 до 12 атомов. Согласно некоторым вариантам реализации настоящего изобретения L1 содержит 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60 атомов в длину.
[169] Согласно некоторым вариантам реализации настоящего изобретения j1 представляет собой целое число от 2 до 10 и согласно некоторым вариантам реализации настоящего изобретения представляет собой целое число от 3 до 5. j2 представляет собой целое число от 2 до 10 и согласно некоторым вариантам реализации настоящего изобретения представляет собой целое число от 3 до 5. R' представляет собой С1-С4 алкил и согласно некоторым вариантам реализации настоящего изобретения представляет собой метил, этил и изопропил. Ra представляет собой один из А27, А28, А29, А30 и А31 и согласно некоторым вариантам реализации настоящего изобретения представляет собой А27 или А28. Rb представляет собой С1-С5 алкил и согласно некоторым вариантам реализации настоящего изобретения представляет собой метил, этил, изопропил и бутил. Согласно некоторым вариантам реализации настоящего изобретения j1, j2, R', Ra и Rb Формул A1-A26, соответственно, выбраны, чтобы обеспечить соединение между лигандами M1 и атомом N на азотистом остове, а также чтобы создать стерическое взаимное расположение среди лигандов M1, более подходящее для связывания лигандов M1 с рецептором асиалогликопротеина на поверхности гепатоцитов.
[170] Согласно некоторым вариантам реализации настоящего изобретения второй конъюгат миРНК согласно настоящему изобретению имеет структуру, представленную Формулой (3), (4), (5), (6), (7), (8), (9), (10), (11), (12), (13), (14), (15), (16), (17), (18), (19), (20), (21) или (22):









[171] Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 может быть соединен с любым возможным положением в последовательности миРНК (представленной Nu в приведенных выше Формулах), например, атом Р в Формуле А59 может быть соединен с любым нуклеотидом в смысловой или антисмысловой цепи миРНК. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 соединен с любым нуклеотидом в смысловой цепи миРНК. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 может быть соединен с концом смысловой или антисмысловой цепи миРНК. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 соединен с концом смысловой цепи миРНК. Указанный конец относится к первым 4 нуклеотидам, отсчитанным от одного конца смысловой или антисмысловой цепи. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 соединен с любым концом смысловой цепи или антисмысловой цепи миРНК. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 соединен с 3'-концом смысловой цепи миРНК. В случае если атом Р в Формуле А59 соединен с вышеуказанным положением в смысловой цепи миРНК, после проникновения в клетки, конъюгат согласно настоящему изобретению может высвобождать отдельную антисмысловую цепь миРНК во время раскручивания, что блокирует трансляцию мРНК ВГВ в белок и ингибирует экспрессию гена вируса гепатита В (ВГВ).
[172] Атом Р в Формуле А59 может быть соединен с любым возможным положением нуклеотида в миРНК, представленной Nu, например, с положением 5', 2' или 3' или с основанием нуклеотида. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 может быть соединен с положением 2', 3' или 5' нуклеотида в миРНК путем образования сложной фосфодиэфирной связи. Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 соединен с атомом кислорода, образованным в результате депротонирования 3'-гидроксила нуклеотида на 3'-конце смысловой цепи в миРНК, или атом Р в Формуле А59 соединен с нуклеотидом путем замещения атома водорода в 2'-гидроксиле нуклеотида смысловой цепи в миРНК, или атом Р в Формуле А59 соединен с нуклеотидом путем замещения атома водорода в 5'-гидроксиле нуклеотида на 5'-конце смысловой цепи в миРНК.
[173] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 1 содержит не более 1 нуклеотида, отличного от нуклеотидной последовательности, представленной в SEQ ID NO: 1; и/или нуклеотидная последовательность 2 содержит не более 1 нуклеотида, отличного от нуклеотидной последовательности, представленной в SEQ ID NO: 2.
[174] Согласно некоторым вариантам реализации настоящего изобретения различия по нуклеотидам между нуклеотидной последовательностью 2 и нуклеотидной последовательностью, представленной в SEQ ID NO: 2, включают различие в положении нуклеотида Z'В, и Z'В выбран из А, С или G; согласно некоторым вариантам реализации настоящего изобретения различие по нуклеотидам представляет собой различие в положении нуклеотида Z'В, и Z'В выбран из А, С или G; согласно некоторым вариантам реализации настоящего изобретения ZA представляет собой нуклеотид, комплементарный Z'В. Эти определенные различия по нуклеотидам не будут значительно снижать способность второго конъюгата миРНК ингибировать ген-мишень, и, следовательно, вторые конъюгаты миРНК, содержащие определенные различия по нуклеотидам, также включены в объем настоящего изобретения.
[175] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 1 является преимущественно обратнокомплементарной, по существу обратнокомплементарной или полностью обратнокомплементарной нуклеотидной последовательности 2. «Преимущественно обратнокомплементарный» относится не более чем к 3 неправильным спариваниям в двух нуклеотидных последовательностях. «По существу обратнокомплементарный» относится не более чем к 1 неправильному спариванию в двух нуклеотидных последовательностях. «Полностью обратнокомплементарный» относится к отсутствию неправильных спариваний в двух нуклеотидных последовательностях.
[176] Согласно некоторым вариантам реализации настоящего изобретения смысловая цепь также содержит нуклеотидную последовательность 3, а антисмысловая цепь дополнительно содержит нуклеотидную последовательность 4. Каждая из нуклеотидных последовательностей 3 и 4 независимо имеет длину 1-4 нуклеотида. Нуклеотиды в нуклеотидной последовательности 3 соответствуют таковым в соответствующих положениях в нуклеотидной последовательности 4. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 4 по меньшей мере частично комплементарна нуклеотидам в соответствующих положениях в мРНК-мишени. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 4 полностью комплементарна нуклеотидам в соответствующих положениях в мРНК-мишени.
[177] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 3 соединена с 5'-концом нуклеотидной последовательности 1, а нуклеотидная последовательность 4 соединена с 3'-концом нуклеотидной последовательности 2. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 3 имеет ту же длину, что и нуклеотидная последовательность 4 и обратнокомплементарна ей. Таким образом, согласно некоторым вариантам реализации настоящего изобретения смысловая цепь и антисмысловая цепь могут содержать 19-23 нуклеотида в длину.
[178] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 3 и нуклеотидная последовательность 4 обе имеют длину 1 нуклеотид. Основание нуклеотидной последовательности 3 представляет собой А; в этом случае двухцепочечная область может содержать 20 нуклеотидов в длину, т.е. отношение длины смысловой цепи к длине антисмысловой цепи составляет 20/20; согласно другому варианту нуклеотидная последовательность 3 и нуклеотидная последовательность 4 обе имеют длину 2 нуклеотида; в направлении от 5'-конца к 3'-концу, основания нуклеотидной последовательности 3 представляют собой G и А последовательно; в этом случае двухцепочечная область может содержать 21 нуклеотид в длину, т.е. отношение длины смысловой цепи к длине антисмысловой цепи составляет 21/21; согласно другому варианту нуклеотидная последовательность 3 и нуклеотидная последовательность 4 обе имеют длину 3 нуклеотида; в направлении от 5'-конца к 3'-концу, основания нуклеотидной последовательности 3 представляют собой С, G и А последовательно; в этом случае двухцепочечная область может содержать 22 нуклеотида в длину, т.е. отношение длины смысловой цепи к длине антисмысловой цепи составляет 22/22; согласно другому варианту нуклеотидная последовательность 3 и нуклеотидная последовательность 4 обе имеют длину 4 нуклеотида; в направлении от 5'-конца к 3'-концу, основания нуклеотидной последовательности 3 представляют собой С, С, G и А последовательно; в этом случае двухцепочечная область может содержать 23 нуклеотида в длину, т.е. отношение длины смысловой цепи к длине антисмысловой цепи составляет 23/23.
[179] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 3 содержит 2 нуклеотида в длину; в направлении от 5'-конца к 3'-концу, основания нуклеотидной последовательности 3 представляют собой G и G последовательно.
[180] Следует понимать, что нуклеотидная последовательность 3 и нуклеотидная последовательность 4 имеют одинаковую длину и являются комплементарными друг другу. Таким образом, после обеспечения оснований нуклеотидной последовательности 3, основания нуклеотидной последовательности 4 также определены.
[181] Согласно некоторым вариантам реализации настоящего изобретения миРНК, представленная Nu в Формуле (1), дополнительно содержит нуклеотидную последовательность 5, которая имеет длину 1-3 нуклеотида и соединена с 3'-концом антисмысловой цепи с образованием 3'-липкого конца антисмысловой цепи. Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 5 содержит 1 или 2 нуклеотида в длину. Таким образом, отношение длины смысловой цепи к длине антисмысловой цепи в миРНК, представленной Nu, может составлять 19/20, 19/21, 20/21, 20/22, 21/22, 21/23, 22/23, 22/24, 23/24 или 23/25.
[182] Согласно некоторым вариантам реализации настоящего изобретения нуклеотидная последовательность 5 содержит 2 нуклеотида в длину. Кроме того, в направлении от 5'-конца к 3'-концу, нуклеотидная последовательность 5 представляет собой 2 последовательных тимидиновых дезоксирибонуклеотида, 2 последовательных уридиновых рибонуклеотида или 2 нуклеотида, комплементарных мРНК-мишени. Таким образом, согласно некоторым вариантам реализации настоящего изобретения отношение длины смысловой цепи к длине антисмысловой цепи в миРНК, представленной Nu, составляет 19/21 или 21/23. в настоящем документе конъюгат, содержащий миРНК, проявляет лучшую подавляющую активность в отношении мРНК АРОС3.
[183] Согласно некоторым вариантам реализации настоящего изобретения смысловая цепь содержит нуклеотидную последовательность, представленную в SEQ ID NO: 1, и антисмысловая цепь содержит нуклеотидную последовательность, представленную в SEQ ID NO: 3 или SEQ ID NO: 4:
5'-CCUUGAGGCAUACUUCAAZA-3' (SEQ ID NO: 1),
5'-Z'BUUGAAGUAUGCCUCAAGGUU-3' (SEQ ID NO: 3),
5'-Z'BUUGAAGUAUGCCUCAAGGUC-3' (SEQ ID NO: 4),
в которых нуклеотид Z'B представляет собой первый нуклеотид с 5'-конца антисмысловой цепи; ZA выбран из A, U, G или С; и Z'B представляет собой нуклеотид, комплементарный ZA.
[184] Согласно некоторым вариантам реализации настоящего изобретения миРНК, представленная Nu, представляет собой siHBa1 или siHBa2:
siHBa1
Смысловая цепь: 5'-CCUUGAGGCAUACUUCAAA-3' (SEQ ID NO: 5),
Антисмысловая цепь: 5'-UUUGAAGUAUGCCUCAAGGUU-3' (SEQ ID NO: 6),
siHBa2
Смысловая цепь: 5'-GACCUUGAGGCAUACUUCAAA-3' (SEQ ID NO: 7),
Антисмысловая цепь: 5'-UUUGAAGUAUGCCUCAAGGUCGG-3' (SEQ ID NO: 8).
[185] Как описано выше, каждый из нуклеотидов в миРНК, представленной Nu в Формуле (1), независимо представляет собой модифицированные или немодифицированные нуклеотиды. Согласно некоторым вариантам реализации настоящего изобретения нуклеотиды в миРНК, представленной Nu, представляют собой немодифицированные нуклеотиды; согласно некоторым вариантам реализации настоящего изобретения некоторые или все нуклеотиды в миРНК, представленной Nu, представляют собой модифицированные нуклеотиды. Такие модификации на нуклеотидах не будут вызывать значительного уменьшения или потери функции второго конъюгата миРНК согласно настоящему изобретению в отношении ингибирования экспрессии генов ВГВ.
[186] Согласно некоторым вариантам реализации настоящего изобретения миРНК в конъюгате содержит по меньшей мере один модифицированный нуклеотид. Применительно к настоящему изобретению термин «модифицированный нуклеотид», применяемый в настоящем документе, относится к нуклеотиду, образованному путем замещения 2'-гидроксила рибозной группы другими группами, аналогу нуклеотида или нуклеотиду с модифицированным основанием. Такие модифицированные нуклеотиды не будут вызывать значительного уменьшения или потери функции конъюгата миРНК в отношении ингибирования экспрессии генов. Например, могут быть выбраны модифицированные нуклеотиды, раскрытые J.K. Watts, G. F. Deleavey and М. J.Damha, Chemically Modified siRNA: tools and applications. Drug Discov Today, 2008.13(19-20): p. 842-55.
[187] Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один нуклеотид в смысловой или антисмысловой цепи представляет собой модифицированный нуклеотид, и/или по меньшей мере один фосфат представляет собой фосфатную группу с модифицированными группами. Другими словами, по меньшей мере часть фосфатных и/или рибозных групп в фосфатно-рибозном остове по меньшей мере одной одиночной цепи в смысловой цепи и антисмысловой цепи представляют собой фосфатные и/или рибозные группы с модифицированными группами.
[188] Согласно некоторым вариантам реализации настоящего изобретения все нуклеотиды в смысловой цепи и/или антисмысловой цепи представляют собой модифицированные нуклеотиды. Согласно некоторым вариантам реализации настоящего изобретения каждый нуклеотид в смысловой цепи и антисмысловой цепи независимо представляет собой модифицированный фтором нуклеотид или нуклеотид с нефторной модификацией.
[189] Авторы настоящего изобретения неожиданно обнаружили, что второй конъюгат миРНК, раскрытый в настоящем документе, достиг высокой степени равновесия между стабильностью в сыворотке и эффективностью подавления генов в экспериментах на животных.
[190] Согласно некоторым вариантам реализации настоящего изобретения модифицированные фтором нуклеотиды расположены внутри нуклеотидных последовательностей 1 и 2; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности 1 представляют собой модифицированные фтором нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности 2 представляют собой модифицированные фтором нуклеотиды.
[191] Согласно некоторым вариантам реализации настоящего изобретения в нуклеотидной последовательности 1 присутствует не более 5 модифицированных фтором нуклеотидов; согласно некоторым вариантам реализации настоящего изобретения в нуклеотидной последовательности 2 присутствует не более 7 модифицированных фтором нуклеотидов.
[192] Согласно некоторым вариантам реализации настоящего изобретения, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 или 5, 7, 8 и 9 нуклеотидной последовательности 1 в смысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи представляют собой нуклеотиды с нефторной модификацией; в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 или 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности 2 в антисмысловой цепи представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи представляют собой нуклеотиды с нефторной модификацией.
[193] Определения и варианты модифицированных фтором нуклеотидов и нуклеотидов с нефторной модификацией, соответственно, описаны выше.
[194] Согласно некоторым вариантам реализации настоящего изобретения, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 5, 7, 8 и 9 нуклеотидной последовательности 1 в смысловой цепи миРНК, представленной Nu, представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 8, 9, 14 и 16 нуклеотидной последовательности 2 в антисмысловой цепи миРНК, представленной Nu, представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды;
согласно другому варианту, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 7, 8 и 9 нуклеотидной последовательности 1 в смысловой цепи миРНК, представленной Nu, представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности 2 в антисмысловой цепи миРНК, представленной Nu, представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды;
согласно другому варианту, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 5, 7, 8 и 9 нуклеотидной последовательности 1 в смысловой цепи миРНК, представленной Nu, представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в смысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды; и, в направлении от 5'-конца к 3'-концу, нуклеотиды в положениях 2, 6, 14 и 16 нуклеотидной последовательности 2 в антисмысловой цепи миРНК, представленной Nu, представляют собой модифицированные фтором нуклеотиды, а нуклеотиды в остальных положениях в антисмысловой цепи миРНК представляют собой метокси-модифицированные нуклеотиды.
[195] Согласно некоторым вариантам реализации настоящего изобретения нуклеотид содержит модификации на фосфатных группах. Согласно некоторым вариантам реализации настоящего изобретения модификация на фосфатной группе представляет собой фосфотиоатную модификацию, представленную Формулой (101) ниже, т.е. замещение немостикового атома кислорода в сложной фосфодиэфирной связи атомом серы так, что сложная фосфодиэфирная связь изменяется на сложную фосфотиодиэфирную связь. Эта модификация стабилизирует структуру миРНК, сохраняя при этом высокую специфичность и высокую аффинность спаривания оснований.

[196] Согласно некоторым вариантам реализации настоящего изобретения в миРНК, представленной Nu, фосфотиоатная связь присутствует в по меньшей мере одном из следующих положений: между первым и вторым нуклеотидами с любого конца смысловой или антисмысловой цепи, между вторым и третьим нуклеотидами с любого конца смысловой цепи или антисмысловой цепи или в любой их комбинации. Согласно некоторым вариантам реализации настоящего изобретения фосфотиоатная связь присутствует во всех вышеуказанных положениях, за исключением 5'-конца смысловой цепи. Согласно некоторым вариантам реализации настоящего изобретения фосфотиоатная связь присутствует во всех вышеуказанных положениях, за исключением 3'-конца смысловой цепи. Согласно некоторым вариантам реализации настоящего изобретения фосфотиоатная связь присутствует в по меньшей мере одном из следующих положений:
между первым и вторым нуклеотидами с 5'-конца смысловой цепи;
между вторым и третьим нуклеотидами с 5'-конца смысловой цепи;
между первым и вторым нуклеотидами с 3'-конца смысловой цепи;
между вторым и третьим нуклеотидами с 3'-конца смысловой цепи;
между первым и вторым нуклеотидами с 5'-конца антисмысловой цепи;
между вторым и третьим нуклеотидами с 5'-конца антисмысловой цепи;
между первым и вторым нуклеотидами с 3'-конца антисмысловой цепи; и
между вторым и третьим нуклеотидами с 3'-конца антисмысловой цепи.
[197] Согласно некоторым вариантам реализации настоящего изобретения 5'-концевой нуклеотид в последовательности антисмысловой цепи молекулы миРНК, представленной Nu, представляет собой 5'-фосфатный нуклеотид или нуклеотид, модифицированный аналогом 5'-фосфата.
[198] Согласно некоторым вариантам реализации настоящего изобретения 5'-фосфатный нуклеотид или нуклеотид, модифицированный аналогом 5'-фосфата, представляет собой 5'-фосфат-модифицированный нуклеотид, представленный Формулой (102), нуклеотид, содержащий Е-винилфосфонатную модификацию (Е-VP), представленный Формулой (103), или 5'-фосфотиоат-модифицированный нуклеотид, представленный Формулой (105).
[199] Авторы согласно настоящему изобретению неожиданно обнаружили, что второй конъюгат миРНК согласно настоящему изобретению проявляет значительно улучшенную стабильность в сыворотке и более низкий нецелевой эффект без существенного снижения активности подавления в отношении мРНК ВГВ и, кроме того, проявляет более высокое ингибирующее действие на липиды крови. Таким образом, согласно некоторым вариантам реализации настоящего изобретения миРНК, представленные Nu во втором конъюгате миРНК согласно настоящему изобретению, могут представлять собой те, которые представлены в таблице 1:

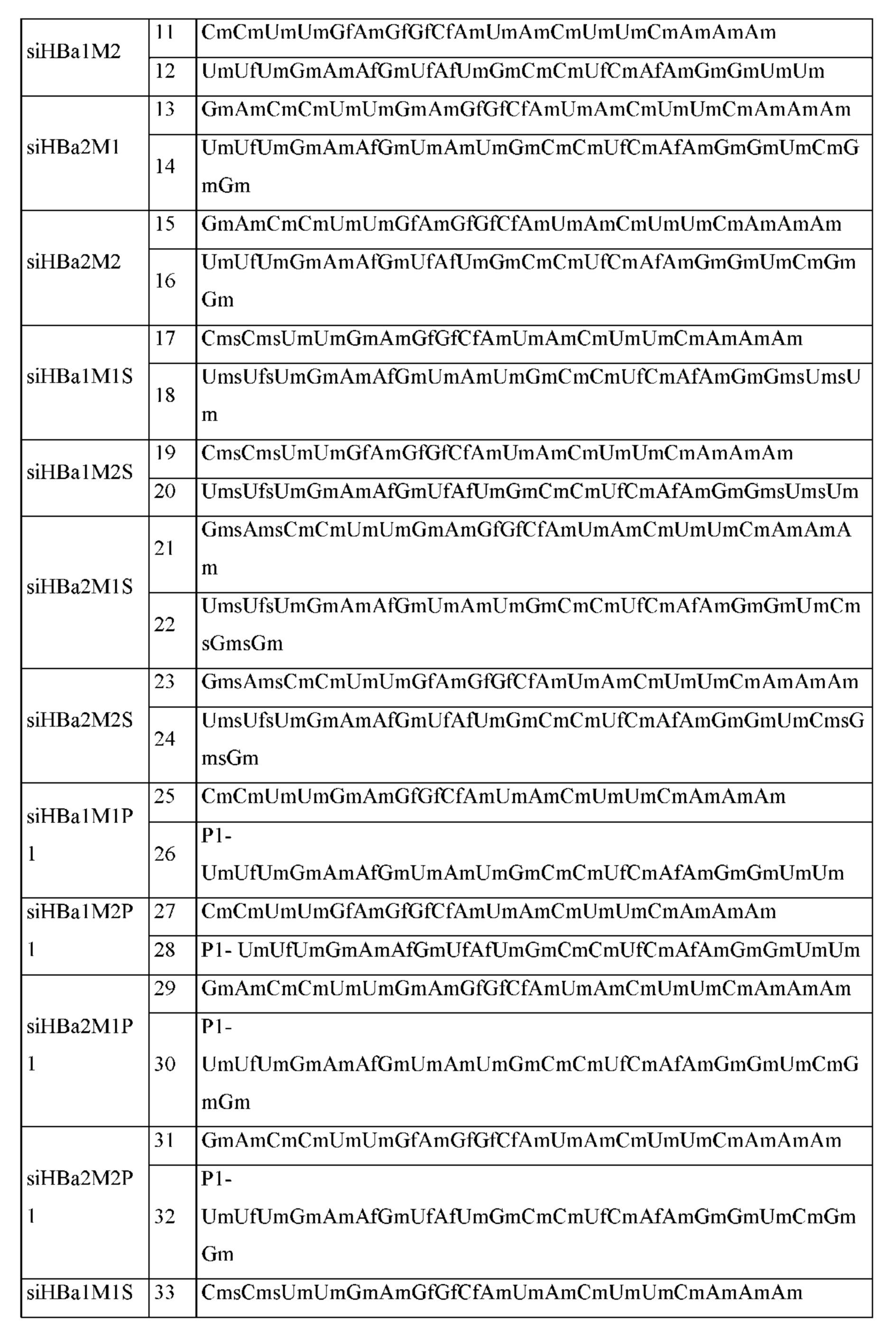

[200] В миРНК или конъюгате миРНК согласно настоящему изобретению каждая пара смежных нуклеотидов соединена за счет сложной фосфодиэфирной связи или сложной фосфотиодиэфирной связи. Немостиковый атом кислорода или серы в сложной фосфодиэфирной связи или сложной фосфотиодиэфирной связи заряжен отрицательно и может присутствовать в форме гидроксила или сульфгидрила. Кроме того, ион водорода в гидроксиле или сульфгидриле может быть частично или полностью замещен катионом. Катион может представлять собой любой катион, такой как катион металла, катион аммония NH4+ или органической катион аммония. Для того чтобы повысить растворимость, согласно некоторым вариантам реализации настоящего изобретения, катион выбран из одного или более из катиона щелочного металла, катиона аммония, образованного третичным амином, и катиона четвертичного аммония. Ион щелочного металла может представлять собой K+ и/или Na+, а катион, образованный третичным амином, может представлять собой катион аммония, образованный триэтиламином, и/или катион аммония, образованный N,N-диизопропилэтиламином. Таким образом, миРНК или конъюгат миРНК согласно настоящему изобретению может по меньшей мере частично присутствовать в форме соли. Согласно одному варианту реализации настоящего изобретения немостиковый атом кислорода или атом серы в сложной фосфодиэфирной связи или сложной фосфотиодиэфирной связи по меньшей мере частично связывается с ионом натрия, и, таким образом, миРНК или конъюгат миРНК согласно настоящему изобретению присутствует или частично присутствует в форме натриевой соли.
[201] Специалистам в данной области техники хорошо известно, что модифицированный нуклеотид может быть введен в миРНК согласно настоящему изобретению с помощью нуклеозидного мономера с соответствующей модификацией. Способы получения нуклеозидного мономера, имеющего соответствующую модификацию, и способы введения модифицированного нуклеотида в миРНК также хорошо известны специалистам в данной области техники. Все модифицированные нуклеозидные мономеры могут быть доступны коммерчески или получены с помощью известных способов. Получение второго конъюгата миРНК
[202] Второй конъюгат миРНК, описанный выше, может быть получен с помощью любых соответствующих путей синтеза.
[203] Согласно некоторым вариантам реализации настоящего изобретения второй конъюгат миРНК согласно настоящему изобретению может быть получен с помощью следующего способа, включающего: последовательное соединение нуклеозидных мономеров в направлении от 3' к 5' в соответствии с типом и последовательностью нуклеотидов в смысловой цепи и антисмысловой цепи двухцепочечного олигонуклеотида, соответственно, в условии твердофазного фосфоамидитного синтеза, причем стадия соединения каждого нуклеозидного мономера включает четырехступенчатую реакцию снятия защиты, связывания, кэпирования и окисления или сульфуризации; выделение смысловой цепи и антисмысловой цепи миРНК; и ренатурацию; при этом каждый нуклеотид в миРНК независимо представляет собой модифицированный или немодифицированный нуклеотид. МиРНК, представленная Nu, содержит смысловую цепь и антисмысловую цепь, причем смысловая цепь содержит нуклеотидную последовательность 1, а антисмысловая цепь содержит нуклеотидную последовательность 2; нуклеотидная последовательность 1 и нуклеотидная последовательность 2 по меньшей мере частично обратнокомплементарны, что позволяет образовывать двухцепочечную область;; нуклеотидная последовательность 1 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 155, и отличается от нее не более чем 3 нуклеотидами; и нуклеотидная последовательность 2 имеет ту же длину, что и нуклеотидная последовательность, представленная в SEQ ID NO: 156, и отличается от нее не более чем 3 нуклеотидами:
5'-CCUUGAGGCAUACUUCAAZ-3' (SEQ ID NO: 155);
5'-Z'UUGAAGUAUGCCUCAAGG-3' (SEQ ID NO: 156);
в которых
Z представляет собой A; Z' представляет собой U;
нуклеотидная последовательность 1 содержит нуклеотид ZA в положении, соответствующем Z;
нуклеотидная последовательность 2 содержит нуклеотид Z'B в положении, соответствующем Z'; нуклеотид Z'В представляет собой первый нуклеотид с 5'-конца антисмысловой цепи.
[204] Кроме того, способ дополнительно включает: приведение соединения, представленного Формулой (321), в контакт с нуклеозидным мономером или нуклеотидной последовательностью, соединенной с твердофазной подложкой, в условии реакции связывания и в присутствии связывающего агента, что приводит к связыванию соединения, представленного Формулой (321), с нуклеотидной последовательностью за счет реакции связывания. Далее по тексту соединение, представленное Формулой (321), также упоминается как конъюгирующая молекула.

в которой
R4 представляет собой группу, способную связываться с миРНК, представленной Nu. Согласно некоторым вариантам реализации настоящего изобретения R4 представляет собой группу, способную связываться с миРНК, представленной Nu, за счет ковалентной связи; согласно некоторым вариантам реализации настоящего изобретения R4 представляет собой группу, содержащую любую функциональную группу, которая может быть конъюгирована с миРНК за счет сложной фосфодиэфирной связи с помощью реакции;
Каждый S1 независимо представляет собой M1, который представляет собой группу, образованную замещением всего активного гидроксила группой YCOO-, где каждый Y независимо выбран из группы, состоящей из метила, трифторметила, дифторметила, монофторметила, трихлорметила, дихлорметила, монохлорметила, этила, н-пропила, изопропила, фенила, галогенфенила и алкилфенила.
Определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14, R15, L1, M1, соответственно, описаны выше.
[205] R4 выбран, чтобы обеспечить соединение с атомом N на азотистом остове и обеспечить подходящий реакционный сайт для синтеза конъюгата миРНК, представленного Формулой (1). Согласно некоторым вариантам реализации настоящего изобретения R4 содержит соединяющую группу R2 или защищенную соединяющую группу R2 и может образовывать функциональную группу, представленную Формулой (А59), с миРНК за счет реакции.
[206] Согласно некоторым вариантам реализации настоящего изобретения R4 содержит первую функциональную группу, которая может реагировать с группой на миРНК или нуклеозидном мономере с образованием сложного фосфитного эфира, и вторую функциональную группу, которая может образовывать ковалентную связь с гидроксигруппой или аминогруппой, или содержит твердофазную подложку, присоединенную за счет ковалентной связи. Согласно некоторым вариантам реализации настоящего изобретения первая функциональная группа представляет собой фосфоамидит, гидроксил или защищенный гидроксил. Согласно некоторым вариантам реализации настоящего изобретения вторая функциональная группа представляет собой фосфоамидит, карбоксил или карбоксилатную соль. Согласно некоторым вариантам реализации настоящего изобретения вторая функциональная группа представляет собой твердофазную подложку, соединенную с остальной частью молекулы за счет ковалентной связи, которая образована гидроксигруппой или аминогруппой. Согласно некоторым вариантам реализации настоящего изобретения твердофазная подложка соединена за счет сложной фосфоэфирной связи, сложной карбоксиэфирной связи или амидной связи. Согласно некоторым вариантам реализации настоящего изобретения твердофазная подложка представляет собой смолу.
[207] Согласно некоторым вариантам реализации настоящего изобретения первая функциональная группа содержит гидрокси, -ORk или группу, представленную Формулой (С3); вторая функциональная группа содержит группу, представленную Формулой (С1), (С2), (С3), (С1')или (С3'):



в которых q1 представляет собой целое число 1-4, X представляет собой О или NH, М+ представляет собой катион, Rk представляет собой защищающую гидроксил группу, SPS представляет собой твердофазную подложку и

[208] Согласно некоторым вариантам реализации настоящего изобретения первая функциональная группа содержит фосфоамидитную функциональную группу, такую как группа, представленная Формулой (С3). Фосфоамидитная группа может образовывать сложный фосфитный эфир с гидроксилом в любом положении на нуклеотиде (таком как 2'- или 3'-гидрокси) с помощью реакции связывания, а сложный фосфитный эфир может образовывать сложную фосфодиэфирную связь или сложную фосфотиоэфирную связь, представленную Формулой (А59), за счет окисления или сульфуризации, так, чтобы конъюгировать конъюгирующую молекулу с миРНК. в настоящем документе, даже если вторая функциональная группа не существует, соединение, представленное Формулой (321), все же может быть конъюгировано с нуклеотидом, без отрицательного влияния на получение конъюгата миРНК, представленного Формулой (1). При таких обстоятельствах, после получения смысловой или антисмысловой цепи миРНК с помощью такого способа как твердофазный фосфоамидитный синтез, соединение, представленное Формулой (321), подвергают взаимодействию с гидроксилом на концевом нуклеотиде нуклеотидной последовательности и полученный сложный фосфитный эфир образует сложную фосфодиэфирную связь или фосфотиоатную связь в результате последующего окисления или сульфуризации, что приводит к конъюгации соединения, представленного Формулой (321), с миРНК.
[209] Согласно некоторым вариантам реализации настоящего изобретения первая функциональная группа содержит защищенную гидроксигруппу. Согласно некоторым вариантам реализации настоящего изобретения вторая функциональная группа содержит группу, которая может реагировать с твердофазной подложкой, чтобы обеспечить конъюгирующую молекулу, содержащую твердофазную подложку. Согласно некоторым вариантам реализации настоящего изобретения вторая функциональная группа содержит карбоксил, карбоксилат или фосфоамидит, например, функциональная группа, представленная Формулой (C1), (С2) или (С3). Если вторая функциональная группа содержит карбоксил или карбоксилат, соединение, представленное Формулой (321), может реагировать за счет реакции этерификации или амидирования с гидрокси- или аминогруппой на твердофазной подложке, такой как смола, с образованием конъюгирующей молекулы, содержащей твердофазную подложку, присоединенную за счет карбоксилатной сложноэфирной связи или амидной связи. Если вторая функциональная группа содержит фосфоамидитную функциональную группу, соединение, представленное Формулой (321), может быть связано с гидроксигруппой на универсальной твердофазной подложке, такой как смола, и путем окисления образует конъюгирующую молекулу, содержащую твердофазную подложку, присоединенную за счет сложной фосфодиэфирной связи. Затем, начиная с указанного выше продукта, соединенного с твердофазной подложкой, нуклеозидные мономеры последовательно соединяют с помощью способа твердофазного фосфоамидитного синтеза с получением тем самым смысловой или антисмысловой цепи миРНК, соединенной с конъюгирующей группой. Во время твердофазного фосфоамидитного синтеза снимают защиту с первой функциональной группы, а затем связывают ее с фосфоамидитной группой на нуклеозидном мономере в условии реакции связывания.
[210] Согласно некоторым вариантам реализации настоящего изобретения первая функциональная группа содержит гидроксигруппу или защищенную гидроксигруппу, а вторая функциональная группа содержит твердофазную подложку, присоединенную за счет сложной карбоксиэфирной связи, амидной связи или сложной фосфоэфирной связи, как представлено Формулой (С1'), или (С3'). При таких обстоятельствах, начиная с соединения, представленного Формулой (321), вместо твердофазной подложки, нуклеозидные мономеры последовательно соединяют с помощью способа твердофазного фосфоамидитного синтеза с получением тем самым смысловой или антисмысловой цепи миРНК, соединенной с конъюгирующей группой. Согласно некоторым вариантам реализации настоящего изобретения карбоксилат может быть представлен как -СОО-М+, где М+ представляет собой катион, такой как один из катиона металла, катиона аммония NH4+ и органического катиона аммония. Согласно одному варианту реализации настоящего изобретения катион металла может представлять собой катион щелочного металла, такой как K+ или Na+. Чтобы повысить растворимость и облегчить реакцию, согласно некоторым вариантам реализации настоящего изобретения, органический катион аммония представляет собой катион аммония, образованный третичным амином, или катион четвертичного аммония, такой как катион аммония, образованный триэтиламином или N,N-диизопропилэтиламином. Согласно некоторым вариантам реализации настоящего изобретения карбоксилат представляет собой карбоксилат триэтиламина или карбоксилат N,N-диизопропилэтиламина.
[211] Согласно некоторым вариантам реализации настоящего изобретения R4 содержит структуру, представленную Формулой (В9), (В10), (В9'), (B10'), (В11), (В12), (В11') или (В 12'):




в которых q1 представляет собой целое число 1-4, q2 представляет собой целое число от 1 до 10, X представляет собой О или NH, М+ представляет собой катион, Rk представляет собой защищающую гидроксил группу, SPS представляет собой твердофазную подложку и

Согласно некоторым вариантам реализации настоящего изобретения q1 равно 1 или 2. Согласно некоторым вариантам реализации настоящего изобретения q2 представляет собой целое число от 1 до 5. Согласно некоторым вариантам реализации настоящего изобретения R4 содержит структуру, представленную Формулой (В9) или (В10). Согласно некоторым вариантам реализации настоящего изобретения R4 содержит структуру, представленную Формулой (В11) или (В12).
[212] Согласно некоторым вариантам реализации настоящего изобретения Rk представляет собой один или более из Tr (тритил), MMTr (4-метокситритил), DMTr (4,4'-диметокситритил) и TMTr (4,4',4''-триметокситритил). Согласно некоторым вариантам реализации настоящего изобретения Rk может представлять собой DMTr, т.е. 4,4'-диметокситритил.
[213] Определение L1 описано выше.
[214] Согласно некоторым вариантам реализации настоящего изобретения L1 применяют для соединения лиганда M1 с атомом N на азотистом остове, что обеспечивает функцию нацеливания на печень для олигонуклеотидного конъюгата. Согласно некоторым вариантам реализации настоящего изобретения L1 содержит любую из Формул А1-А26 или их комбинацию.
[215] В соответствии с вариантами реализации, описанными выше, специалисты в данной области техники легко поймут, что по сравнению со способами твердофазного фосфоамидитного синтеза, хорошо известными в данной области техники, конъюгат миРНК, в котором конъюгирующая молекула соединена с любым возможным положением нуклеотидной последовательности, может быть получен с помощью вышеуказанной первой функциональной группы и необязательной второй функциональной группы. Например, конъюгирующая молекула соединена с концом нуклеотидной последовательности или с каждым концом нуклеотидной последовательности. Соответственно, если не указано иное, в следующем описании, касающемся получения конъюгата, при ссылке на такие реакции как «снятие защиты», «связывание», «кэпирование», «окисление», «сульфуризация» следует понимать, что к этим реакциям также будут применимы условия реакции и агенты, участвующие в способах твердофазного фосфоамидитного синтеза, хорошо известные в данной области техники. Примерные условия реакции и агенты будут подробно описаны ниже.
[216] Согласно некоторым вариантам реализации настоящего изобретения каждый S1 независимо представляет собой M1. Согласно некоторым вариантам реализации настоящего изобретения каждый S1 независимо представляет собой группу, образованную в результате защиты по меньшей мере одного активного гидроксила в M1 с применением защищающей гидроксил группы. Согласно некоторым вариантам реализации настоящего изобретения S1 независимо представляет собой группу, образованную в результате защиты всех активных гидроксилов в M1 с применением защищающих гидроксил групп. Согласно некоторым вариантам реализации настоящего изобретения любая защищающая гидроксил группа, известная специалистам в данной области техники, может применяться для защиты активного гидроксила на M1. Согласно некоторым вариантам реализации настоящего изобретения защищенный гидроксил выражается Формулой YCOO-, где каждый Y независимо выбран из группы, состоящей из C1-С10 алкила и С6-С10 ар ила, которая необязательно замещена одним или более заместителями, выбранными из группы, состоящей из галогена и C1-С6 алкила. Согласно некоторым вариантам реализации настоящего изобретения каждый Y независимо выбран из группы, состоящей из метила, трифторметила, дифторметила, монофторметила, трихлорметила, дихлорметила, монохлорметила, этила, н-пропила, изопропила, фенила, галогенфенила и C1-С6 алкилфенила.
[217] Согласно некоторым вариантам реализации настоящего изобретения каждый S1 независимо выбран из группы, состоящей из Формул А46-А54:



[218] Согласно некоторым вариантам реализации настоящего изобретения S1 представляет собой Формулу А49 или А50.
[219] Согласно некоторым вариантам реализации настоящего изобретения каждый Y независимо выбран из одного из метила, трифторметила, дифторметила, монофторметила, трихлорметила, дихлорметила, монохлорметила, этила, н-пропила, изопропила, фенила, галогенфенила и алкилфенила. Для упрощения конъюгирующей молекулы согласно настоящему изобретению, согласно некоторым вариантам реализации настоящего изобретения, Y представляет собой метил.
[220] Как упоминалось ранее, способ получения второго конъюгата миРНК дополнительно включает следующую стадию: синтез другой цепи миРНК (например, если смысловая цепь миРНК, соединенная с конъюгирующей молекулой, синтезируется на вышеуказанной стадии, способ дополнительно включает синтез антисмысловой цепи миРНК методом твердофазного синтеза и наоборот); выделение смысловой цепи и антисмысловой цепи; и ренатурацию. В частности, на стадии выделения твердофазную подложку, соединенную с нуклеотидной последовательностью и/или конъюгирующей молекулой, отщепляют и в это же время удаляют необходимую защитную группу (в этом случае каждая группа S1 в соединении, представленном Формулой (321), превращается в соответствующий лиганд M1), что обеспечивает смысловую цепь (или антисмысловую цепь) миРНК, соединенную с конъюгирующей молекулой и соответствующей антисмысловой цепью (или смысловой цепью). Смысловую цепь и антисмысловую цепь ренатурируют с образованием двухцепочечной РНК-структуры, что обеспечивает конъюгат миРНК, представленный Формулой (1).
[221] Согласно некоторым вариантам реализации настоящего изобретения способ получения второго конъюгата миРНК включает следующие стадии: приведение соединения, представленного Формулой (321), в контакт с первым нуклеозидным мономером на 3'-конце смысловой или антисмысловой цепи в условии реакции связывания в присутствии связывающего агента, что обеспечивает связывание соединения, представленного Формулой (321), с первым нуклеотидом в последовательности; последовательное соединение нуклеозидных мономеров в направлении от 3' к 5' для синтеза смысловой или антисмысловой цепи миРНК в соответствии с требуемым типом и последовательностью нуклеотидов смысловой или антисмысловой цепи в условии твердофазного фосфоамидитного синтеза; причем соединение Формулы (321) представляет собой соединение, в котором R4 содержит первую функциональную группу, содержащую защищенную гидроксигруппу, и вторую функциональную группу, содержащую группу, представленную Формулой (С1') или (С3'), при этом перед связыванием с первым нуклеозидным мономером с соединения Формулы (321) снимают защиту; и соединение каждого нуклеозидного мономера включает четырехступенчатую реакцию снятия защиты, связывания, кэпирования и окисления или сульфуризации; с получением таким образом смысловой или антисмысловой цепи нуклеиновой кислоты, соединенной с конъюгирующей молекулой; последовательное соединение нуклеозидных мономеров в направлении от 3' к 5' для синтеза смысловой или антисмысловой цепи нуклеиновой кислоты в соответствии с типом и последовательностью нуклеотидов смысловой или антисмысловой цепи в условии твердофазного фосфоамидитного синтеза; причем соединение каждого нуклеозидного мономера включает четырехступенчатую реакцию снятия защиты, связывания, кэпирования и окисления или сульфуризации; удаление защитных групп и отщепление твердофазной подложки; выделение и очистку смысловой цепи и антисмысловой цепи нуклеиновой кислоты; и ренатурацию.
[222] Согласно некоторым вариантам реализации настоящего изобретения способ получения конъюгата миРНК включает следующие стадии: последовательное соединение нуклеозидных мономеров в направлении от 3' к 5' для синтеза смысловой цепи или антисмысловой цепи в соответствии с типом и последовательностью нуклеотидов смысловой или антисмысловой цепи в двухцепочечном олигонуклеотиде; причем соединение каждого нуклеозидного мономера включает четырехступенчатую реакцию снятия защиты, связывания, кэпирования и окисления или сульфуризации с получением таким образом смысловой цепи, соединенной с твердофазной подложкой, и антисмысловой цепи, соединенной с твердофазной подложкой; приведение соединения, представленного Формулой (321), в контакт со смысловой цепью, соединенной с твердофазной подложкой, или антисмысловой цепью, соединенной с твердофазной подложкой, в условии реакции связывания в присутствии связывающего агента, что приводит к связыванию соединения, представленного Формулой (321), со смысловой цепью или антисмысловой цепью; причем соединение Формулы (321) представляет собой соединение, в котором R4 содержит фосфоамидитную группу в качестве первой функциональной группы; удаление защитных групп и отщепление твердофазной подложки; соответственно, выделение и очистку смысловой или антисмысловой цепи миРНК; и ренатурацию; при этом смысловая или антисмысловая цепь миРНК соединена с конъюгирующей молекулой.
[223] Согласно некоторым вариантам реализации настоящего изобретения атом Р в Формуле А59 соединен с 3'-концом смысловой цепи миРНК, и способ получения конъюгата миРНК согласно настоящему изобретению включает:
(1) удаление защищающей гидроксил группы Rk в соединении Формулы (321) (при этом соединение Формулы (321) представляет собой соединение, в котором R4 содержит первую функциональную группу и вторую функциональную группу, причем первая функциональная группа содержит защищенную гидроксигруппу ORk и вторая функциональная группа содержит структуру, представленную Формулой (С1') или (С3')); приведение продукта со снятой защитой в контакт с нуклеозидным мономером с получением нуклеозидного мономера, соединенного с твердофазной подложкой за счет конъюгирующей молекулы, в условии реакции связывания в присутствии связывающего агента;
(2) начиная с нуклеозидного мономера, соединенного с твердофазной подложкой за счет конъюгирующей молекулы, синтез смысловой цепи миРНК в направлении от 3' к 5' с помощью способа твердофазного фосфоамидитного синтеза;
(3) синтез антисмысловой цепи миРНК с помощью способа твердофазного фосфоамидитного синтеза; и
(4) выделение смысловой цепи и антисмысловой цепи миРНК и их ренатурацию с получением конъюгата миРНК согласно настоящему изобретению;
при этом на стадии (1) способ удаления защитной группы Rk в соединении Формулы (321) включает приведение соединения Формулы (321) в контакт с агентом для снятия защиты в условии снятия защиты. Условие снятия защиты включает температуру 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С, а также время реакции 30-300 секунд и, согласно некоторым вариантам реализации настоящего изобретения, 50-150 секунд. Агент для снятия защиты может быть выбран из одной или более из трифторуксусной кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты и монохлоруксусной кислоты, и согласно некоторым вариантам реализации настоящего изобретения агент для снятия защиты представляет собой дихлоруксусную кислоту. Молярное отношение агента для снятия защиты к соединению, представленному Формулой (321), может составлять от 10:1 до 1000:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 50:1 до 500:1.
[224] Условие реакции связывания и связывающий агент могут представлять собой любые условия и агенты, подходящие для вышеуказанной реакции связывания. Согласно некоторым вариантам реализации настоящего изобретения можно применять те же условия и агент, как и в реакции связывания в способе твердофазного синтеза.
[225] Согласно некоторым вариантам реализации настоящего изобретения условие реакции связывания включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С. Молярное отношение соединения Формулы (321) к нуклеозидному мономеру может составлять от 1:1 до 1:50 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:2 до 1:5. Молярное отношение соединения Формулы (321) к связывающему агенту может составлять от 1:1 до 1:50 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:3 до 1:10. Время реакции может составлять 200-3000 секунд и, согласно некоторым вариантам реализации настоящего изобретения, 500-1500 секунд. Связывающий агент может быть выбран из одного или более из 1Н-тетразола, 5-этилтио-1Н-тетразола и 5-бензилтио-1Н-тетразола и согласно некоторым вариантам реализации настоящего изобретения представляет собой 5-этилтио-1Н-тетразол. Реакция связывания может быть выполнена в органическом растворителе. Органический растворитель может быть выбран из одного или более из безводного ацетонитрила, безводного ДМФА и безводного дихлорметана и согласно некоторым вариантам реализации настоящего изобретения представляет собой безводный ацетонитрил. Количество органического растворителя может составлять 3-50 л/моль и согласно некоторым вариантам реализации настоящего изобретения 5-20 л/моль по отношению к соединению, представленному Формулой (321).
[226] На стадии (2) смысловую цепь S конъюгата миРНК синтезируют в направлении от 3' к 5' с помощью способа твердофазного фосфоамидитного синтеза, начиная с нуклеозидного мономера, соединенного с твердофазной подложкой за счет конъюгирующей молекулы, полученной на предшествующей стадии. В этом случае конъюгирующая молекула соединена с 3'-концом полученной смысловой цепи.
[227] В качестве других условий твердофазного синтеза на стадиях (2) и (3), включая условие снятия защиты с нуклеозидного мономера, тип и количество агента для снятия защиты, условие реакции связывания, тип и количество связывающего агента, условие реакции кэпирования, тип и количество кэпирующего агента, условие реакции окисления, тип и количество окисляющего агента, условие реакции сульфуризации, а также тип и количество агента для сульфуризации, можно применять различные агенты, количества и условия, общепринятые в данной области техники.
[228] Согласно некоторым вариантам реализации настоящего изобретения, например, твердофазный синтез на стадиях (2) и (3), можно применять следующие условия:
[229] Условие снятия защиты для нуклеозидного мономера включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С, а также время реакции 30-300 секунд и, согласно некоторым вариантам реализации настоящего изобретения, 50-150 секунд. Агент для снятия защиты может быть выбран из одной или более из трифторуксусной кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты и монохлоруксусной кислоты и согласно некоторым вариантам реализации настоящего изобретения представляет собой дихлоруксусную кислоту. Молярное отношение агента для снятия защиты к защитной группе 4,4'-диметокситритил на твердофазной подложке составляет от 2:1 до 100:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 3:1 до 50:1.
[230] Условие реакции связывания включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С. Молярное отношение последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, к нуклеозидному мономеру составляет от 1:1 до 1:50 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:5 до 1:15. Молярное отношение последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, к связывающему агенту составляет от 1:1 до 1:100 и согласно некоторым вариантам реализации настоящего изобретения составляет от 1:50 до 1:80. Выбор времени реакции и связывающего агента может быть таким же, как указано выше.
[231] Условие реакции кэпирования включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С, а также время реакции 5-500 секунд и, согласно некоторым вариантам реализации настоящего изобретения, 10-100 секунд. Выбор кэпирующего агента может быть таким же, как указано выше. Молярное отношение общего количества кэпирующего агента к последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, может составлять от 1:100 до 100:1 и согласно некоторым вариантам реализации настоящего изобретения составляет от 1:10 до 10:1. В случае если в качестве кэпирующего агента применяют эквимолярное количество уксусного ангидрида и N-метилимидазола, молярное отношение уксусного ангидрида, N-метилимидазола и последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, может составлять 1:1:10-10:10:1 и согласно некоторым вариантам реализации настоящего изобретения составляет 1:1:2-2:2:1.
[232] Условие реакции окисления включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С, а также время реакции 1-100 секунд и, согласно некоторым вариантам реализации настоящего изобретения, 5-50 секунд. Согласно некоторым вариантам реализации настоящего изобретения окисляющий агент представляет собой йод (согласно некоторым вариантам реализации настоящего изобретения обеспечен в виде раствора йода в воде). Молярное отношение окисляющего агента к последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой на стадии связывания, может составлять от 1:1 до 100:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 5:1 до 50:1. Согласно некоторым вариантам реализации настоящего изобретения реакцию окисления выполняют в смешанном растворителе, в котором отношение тетрагидрофуран:вода:пиридин составляет 3:1:1-1:1:3. Условие реакции сульфуризации включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С, а также время реакции 50-2000 секунд и, согласно некоторым вариантам реализации настоящего изобретения, 100-1000 секунд. Согласно некоторым вариантам реализации настоящего изобретения агент для сульфуризации представляет собой ксантановый гидрид. Молярное отношение агента для сульфуризации к последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой на стадии связывания, составляет от 10:1 до 1000:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 10:1 до 500:1. Согласно некоторым вариантам реализации настоящего изобретения реакцию сульфуризации выполняют в смешанном растворителе, в котором соотношение ацетонитрил:пиридин составляет 1:3-3:1.
[233] Способ дополнительно включает выделение смысловой цепи и антисмысловой цепи миРНК после соединения всех нуклеозидных мономеров и перед ренатурацией. Способы выделения хорошо известны специалистам в данной области техники и обычно включают отщепление синтезированной нуклеотидной последовательности от твердофазной подложки, удаление защитных групп на основаниях, фосфатных группах и лигандах, очистку и обессоливание.
[234] Общепринятые способы отщепления и снятия защиты при синтезе миРНК можно применять для отщепления синтезированной нуклеотидной последовательности от твердофазной подложки и удаления защитных групп на основаниях, фосфатных группах и лигандах. Например, приведение полученной нуклеотидной последовательности, соединенной с твердофазной подложкой, в контакт с концентрированным водным раствором аммиака; во время снятия защиты защитная группа YCOO- в группах А46-А54 превращается в гидроксильную группу, и, таким образом, группы Si превращаются в соответствующие группы M1, что обеспечивает конъюгат, представленный Формулой (1); причем концентрированный водный раствор аммиака может представлять собой водный раствор аммиака с концентрацией 25-30% по массе. Количество концентрированного водного раствора аммиака может составлять от 0,2 мл/мкмоль до 0,8 мл/мкмоль по отношению к целевой миРНК.
[235] Если на синтезированной нуклеотидной последовательности имеется по меньшей мере несколько защит 2'-TBDMS, способ дополнительно включает приведение нуклеотидной последовательности, удаленной от твердофазной подложки, в контакт с тригидрофторидом триэтиламина для снятия защиты 2'-TBDMS. в настоящем документе полученная целевая последовательность миРНК содержит соответствующий нуклеозид, имеющий свободный 2'-гидроксил. Количество чистого тригидрофторида триэтиламина составляет 0,4 мл/мкмоль - 1,0 мл/мкмоль по отношению к целевой последовательности миРНК. Таким образом, может быть получен конъюгат миРНК, представленный Формулой (1).
[236] Способы очистки и обессоливания хорошо известны специалистам в данной области техники. Например, очистку нуклеиновой кислоты можно выполнять с применением колонки для очистки методом препаративной ионной хроматографии с градиентным элюированием NaBr или NaCl; после сбора и объединения продукта обессоливание можно выполнять с применением колонки для очистки методом хроматографии с обращенной фазой.
[237] Немостиковый атом кислорода или серы в сложной фосфодиэфирной связи или сложной фосфотиодиэфирной связи между нуклеотидами в полученном конъюгате миРНК по существу связывается с ионом натрия, и конъюгат миРНК по существу присутствует в форме натриевой соли. Можно применять хорошо известные ионообменные способы, в которых ион натрия может быть заменен ионом водорода и/или другими катионами, что обеспечивает другие формы конъюгатов миРНК. Катионы представляют собой те, которые описаны выше.
[238] Во время синтеза чистоту и молекулярную массу последовательности нуклеиновой кислоты можно определить в любое время, чтобы лучше контролировать качество синтеза. Такие способы определения хорошо известны специалистам в данной области техники. Например, чистоту нуклеиновой кислоты можно определить с помощью ионообменной хроматографии, а молекулярную массу можно определить с помощью жидкостной хроматографии-масс-спектрометрии (ЖХ-МС).
[239] Способы ренатурации также хорошо известны специалистам в данной области техники. Например, синтезированная смысловая цепь (S-цепь) и антисмысловая цепь (AS-цепь) могут быть просто смешаны в воде для инъекции в эквимолярном отношении, нагреты до 70-95°С, а затем охлаждены при комнатной температуре с образованием двухцепочечной структуры за счет водородной связи. Следовательно, может быть получен второй конъюгат миРНК согласно настоящему изобретению.
[240] После получения конъюгат, согласно некоторым вариантам реализации настоящего изобретения второй конъюгат миРНК, синтезированный таким способом, также можно охарактеризовать с помощью средств, таких как определение молекулярной массы с применением таких способов как ЖХ-МС, чтобы подтвердить, что синтезированный конъюгат миРНК представляет собой разработанный второй конъюгат миРНК, представляющий интерес, и последовательность синтезированной миРНК представляет собой последовательность миРНК, которую необходимо синтезировать, например, представляет собой одну из последовательностей, перечисленных в таблице 1 выше.
[241] Соединение, представленное Формулой (321), может быть получено с помощью следующего способа, включающего: приведение соединения, представленного Формулой (313), в контакт с циклическим ангидридом в органическом растворителе в условии реакции этерификации в присутствии основания и катализатора этерификации; выделение соединения, представленного Формулой (321), с помощью ионного обмена:

при этом определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14, R15, L1, S1, соответственно, описаны выше;
R6 представляет собой группу для обеспечения R4 Формулы (321). Согласно некоторым вариантам реализации настоящего изобретения, например, R6 имеет структуру, представленную Формулой (А61):

в которой,
Ri представляет собой любую группу, способную соединяться с атомом N на азотистом остове, соединяться с RkO и соединяться со свободной гидроксигруппой; Rk представляет собой защищающую гидроксил группу. В этом случае получают соединение, представленное Формулой (321), где R4 содержит первую функциональную группу в качестве защищающей гидроксил группы и вторую функциональную группу, содержащую группу, представленную Формулой (С1) или (С2).
[242] Условие реакции этерификации включает температуру реакции 0-100°С и время реакции 8-48 часов. Согласно некоторым вариантам реализации настоящего изобретения условие реакции этерификации включает температуру реакции 10-40°С и время реакции 20-30 часов.
[243] Согласно некоторым вариантам реализации настоящего изобретения органический растворитель содержит один или более из эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран. Согласно некоторым вариантам реализации настоящего изобретения простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир. Согласно некоторым вариантам реализации настоящего изобретения галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой дихлорметан. Количество органического растворителя составляет 3-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 5-20 л/моль по отношению к соединению, представленному Формулой (313).
[244] Согласно некоторым вариантам реализации настоящего изобретения циклический ангидрид представляет собой один из янтарного ангидрида, глутарового ангидрида, адипинового ангидрида или пимелинового ангидрида, и согласно некоторым вариантам реализации настоящего изобретения циклический ангидрид представляет собой янтарный ангидрид. Молярное отношение циклического ангидрида к соединению, представленному Формулой (313), составляет от 1:1 до 10:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 2:1 до 5:1.
[245] Катализатор этерификации может представлять собой любой катализатор, способный катализировать этерификацию, такой как 4-диметиламинопиридин. Молярное отношение катализатора к соединению, представленному Формулой (313), составляет от 1:1 до 10:1 и согласно некоторым вариантам реализации настоящего изобретения составляет от 2:1 до 5:1.
[246] Согласно некоторым вариантам реализации настоящего изобретения основание может представлять собой любое неорганическое основание, органическое основание или их комбинацию. Учитывая растворимость и стабильность продукта, основание представляет собой органическое основание третичного амина. Согласно некоторым вариантам реализации настоящего изобретения органическое основание третичного амина представляет собой триэтиламин или N,N-диизопропилэтиламин. Молярное отношение органического основания третичного амина к соединению, представленному Формулой (313), составляет от 1:1 до 20:1 и согласно некоторым вариантам реализации настоящего изобретения составляет от 3:1 до 10:1.
[247] Ионный обмен выполняет функцию превращения соединения, представленного Формулой (321), в целевую форму карбоновой кислоты или соли карбоновой кислоты, и способы ионного обмена хорошо известны специалистам в данной области техники. Указанная выше конъюгирующая молекула, в которой катион представляет собой М+, может быть получена с применением подходящего ионообменного раствора и условия ионного обмена, которые не описаны подробно в настоящем документе. Согласно некоторым вариантам реализации настоящего изобретения в реакции ионного обмена применяют раствор фосфата триэтиламина. Согласно некоторым вариантам реализации настоящего изобретения концентрация раствора фосфата триэтиламина составляет 0,2-0,8 М. Согласно некоторым вариантам реализации настоящего изобретения концентрация раствора фосфата триэтиламина составляет 0,4-0,6 М. Согласно некоторым вариантам реализации настоящего изобретения количество раствора фосфата триэтиламина составляет 3-6 л/моль, а в дополнительном варианте реализации 4-5 л/моль по отношению к соединению, представленному Формулой (313).
[248] Соединение, представленное Формулой (321), может быть выделено из реакционной смеси с применением любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (321), может быть выделено с помощью удаления растворителя за счет выпаривания с последующей хроматографией, например, с применением следующих хроматографических условий для выделения: (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование 1 масс. %о триэтиламином в дихлорметан : метанол = 100:18-100:20; или (2) очистка с обращенной фазой: наполнитель с обращенной фазой С18 и С8, градиентное элюирование метанол : ацетонитрил = 0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (321), который может быть непосредственно использован в последующих реакциях.
[249] Согласно некоторым вариантам реализации настоящего изобретения способ получения соединения, представленного Формулой (321), дополнительно включает: приведение продукта, полученного в результате вышеуказанной реакции ионного обмена, в контакт с твердофазной подложкой с амино- или гидроксигруппами в органическом растворителе в условии реакции конденсации в присутствии конденсирующего агента и органического основания третичного амина. В этом случае получают соединение, представленное Формулой (321), где R4 содержит первую функциональную группу, содержащую защищающую гидроксил группу, и вторую функциональную группу, имеющую структуру, представленную Формулой (С1').
[250] Твердофазная подложка представляет собой одну из подложек, применяемых в твердофазном синтезе миРНК, некоторые из которых хорошо известны специалистам в данной области техники. Например, твердофазная подложка может быть выбрана из твердофазных подложек, содержащих активную функциональную гидрокси- или аминогруппу. Согласно некоторым вариантам реализации настоящего изобретения твердофазная подложка представляет собой амино или гидрокси-смолу. Для облегчения последующего твердофазного синтеза нуклеиновой кислоты амино- или гидрокси-смола, согласно некоторым вариантам реализации настоящего изобретения, имеет следующие параметры: размер частиц 100-400 меш и поверхностное содержание аминогрупп или гидроксигрупп 0,2-0,5 ммоль/г. Отношение соединения, представленного Формулой (321), к твердофазной подложке составляет от 10 мкмоль соединения на грамм твердофазной подложки (мкмоль/г) до 400 мкмоль/г. Согласно некоторым вариантам реализации настоящего изобретения отношение соединения Формулы (321) к твердофазной подложке составляет от 50 мкмоль/г до 200 мкмоль/г.
[251] Органический растворитель может представлять собой любой подходящий растворитель или смешанные растворители, известные специалистам в данной области техники. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой один или более из ацетонитрила, эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран; простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир; галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой ацетонитрил. Количество органического растворителя составляет 20-200 л/моль, согласно некоторым вариантам реализации настоящего изобретения 50-100 л/моль по отношению к соединению, представленному Формулой (321).
[252] Конденсирующий агент может представлять собой гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония, 3-диэтоксифосфорил-1,2,3-бензотризин-4(3Н)-он и/или гексафторфосфат О-бензотриазолтетраметилурония. Согласно некоторым вариантам реализации настоящего изобретения конденсирующий агент представляет собой гексафторфосфат О-бензотриазолтетраметилурония. Молярное отношение конденсирующего агента к соединению, представленному Формулой (321), составляет от 1:1 до 20:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:1 до 5:1.
[253] Согласно некоторым вариантам реализации настоящего изобретения органическое основание третичного амина представляет собой триэтиламин и/или N,N-диизопропилэтиламин и, согласно некоторым вариантам реализации настоящего изобретения, N,N-диизопропилэтиламин. Молярное отношение органического основания третичного амина к соединению, представленному Формулой (321), составляет от 1:1 до 20:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:1 до 5:1.
[254] Согласно некоторым вариантам реализации настоящего изобретения способ получения соединения, представленного Формулой (321), дополнительно включает: приведение полученного продукта конденсации в контакт с кэпирующим агентом и катализатором ацилирования в органическом растворителе в условии реакции кэпирования и выделение соединения, представленного Формулой (321). Реакция кэпирования используется для удаления любой активной функциональной группы, которая не вступает в реакцию полностью, чтобы избежать образования ненужных побочных продуктов в последующих реакциях. Условие реакции кэпирования включает температуру реакции 0-50°С и, согласно некоторым вариантам реализации настоящего изобретения, 15-35°С, а также время реакции 1-10 часов и, согласно некоторым вариантам реализации настоящего изобретения, 3-6 часов, кэпирующий агент может представлять собой кэпирующий агент, применяемый в твердофазном синтезе миРНК, который хорошо известен специалистам в данной области техники.
[255] Согласно некоторым вариантам реализации настоящего изобретения кэпирующий агент состоит из кэпирующего агента A (capA) и кэпирующего агента В (сарВ). СарА представляет собой N-метилимидазол и согласно некоторым вариантам реализации настоящего изобретения обеспечен в виде смешанного раствора N-метилимидазола в пиридине/ацетонитриле, причем объемное отношение пиридина к ацетонитрилу составляет от 1:10 до 1:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:3 до 1:1. Согласно некоторым вариантам реализации настоящего изобретения отношение общего объема пиридина и ацетонитрила к объему N-метилимидазола составляет от 1:1 до 10:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 3:1 до 7:1. Кэпирующий реагент В представляет собой уксусный ангидрид. Согласно некоторым вариантам реализации настоящего изобретения сарВ обеспечен в виде раствора уксусного ангидрида в ацетонитриле, причем объемное отношение уксусного ангидрида к ацетонитрилу составляет от 1:1 до 1:10 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:2 до 1:6.
[256] Согласно некоторым вариантам реализации настоящего изобретения отношение объема смешанного раствора N-метилимидазола в пиридине/ацетонитриле к массе соединения Формулы (321) составляет 5 мл/г-50 мл/г и, согласно некоторым вариантам реализации настоящего изобретения, 15 мл/г-30 мл/г. Отношение объема раствора уксусного ангидрида в ацетонитриле к массе соединения Формулы (321) составляет 0,5 мл/г-10 мл/г и, согласно некоторым вариантам реализации настоящего изобретения, 1 мл/г-5 мл/г.
[257] Согласно некоторым вариантам реализации настоящего изобретения кэпирующий агент содержит эквимолярное количество уксусного ангидрида и N-метилимидазола. Органический растворитель представляет собой один или более из ацетонитрила, эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой ацетонитрил. Количество органического растворителя составляет 10-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 5-30 л/моль по отношению к соединению, представленному Формулой (321).
[258] Катализатор ацилирования может быть выбран из любого катализатора, который можно применять для конденсации путем этерификации или амидной конденсации, такого как щелочные гетероциклические соединения. Согласно некоторым вариантам реализации настоящего изобретения катализатор ацилирования представляет собой 4-диметиламинопиридин. Массовое отношение катализатора к соединению, представленному Формулой (321), может составлять от 0,001:1 до 1:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 0,01:1 до 0,1:1.
[259] Соединение, представленное Формулой (321), может быть выделено из реакционной смеси с помощью любых подходящих способов. Согласно некоторым вариантам реализации настоящего изобретения соединение Формулы (321) может быть получено путем тщательной промывки органическим растворителем и фильтрации для удаления не вступивших в реакцию реагентов, избыточного кэпирующего агента и других примесей, при этом органический растворитель выбран из ацетонитрила, дихлорметана или метанола. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой ацетонитрил.
[260] Согласно некоторым вариантам реализации настоящего изобретения получение конъюгирующей молекулы, представленной Формулой (321), включает приведение соединения, представленного Формулой (313), в контакт с фосфодиамидитом в органическом растворителе в условии реакции связывания в присутствии связывающего агента, и выделение соединения, представленного Формулой (321). В этом случае получают соединение, представленное Формулой (321), в котором R4 содержит первую функциональную группу, содержащую защищающую гидроксил группу, и вторую функциональную группу, содержащую структуру, представленную Формулой (С3).
[261] Согласно некоторым вариантам реализации настоящего изобретения условие реакция связывания включает температуру реакции 0-50°С, например, 15-35°С. Молярное отношение соединения Формулы (313) к фосфодиамидиту может составлять от 1:1 до 1:50, например, от 1:5 до 1:15. Молярное отношение соединения Формулы (313) к связывающему агенту может составлять от 1:1 до 1:100, например, от 1:50 до 1:80. Время реакции может составлять 200-3000 секунд, например, 500-1500 секунд. Фосфодиамидит может представлять собой, например, бис(диизопропиламино)(2-цианоэтокси)фосфин, который может быть доступен коммерчески или синтезирован в соответствии со способами, хорошо известными в данной области техники. Связывающий агент выбран из одного или более из 1H-тетразола, 5-этилтио-1H-тетразола и 5-бензилтио-1H-тетразола, например, 5-этилтио-1H-тетразол. Реакцию связывания можно выполнять в органическом растворителе. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель выбран из одного или более из безводного ацетонитрила, безводного ДМФА и безводного дихлорметана, например, представляет собой безводный ацетонитрил. Количество органического растворителя может составлять 3-50 л/моль, например, 5-20 л/моль, по отношению к соединению, представленному Формулой (313). При выполнении реакции связывания гидроксигруппа в соединении (313) реагирует с фосфодиамидитом с образованием фосфоамидитной группы. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (321), который может быть непосредственно использован в последующих реакциях.
[262] Согласно некоторым вариантам реализации настоящего изобретения способ получения соединения, представленного Формулой (321), дополнительно включает: приведение выделенного продукта в контакт с твердофазной подложкой с гидроксильными группами в органическом растворителе в условии реакции связывания в присутствии связывающего агента с последующим кэпированием, окислением и выделением, чтобы получить соединение, представленное Формулой (321), где R4 представляет собой первую функциональную группу, содержащую защищающую гидроксил группу, и вторую функциональную группу, имеющую структуру, представленную Формулой (С3').
[263] Согласно некоторым вариантам реализации настоящего изобретения твердофазная подложка представляет собой подложку, хорошо известную в области твердофазного синтеза нуклеиновой кислоты, такую как коммерчески доступная универсальная твердофазная подложка со снятой защитой, например, подложка для синтеза олигонуклеотидов NittoPhase®HL UnyLinker™ 300, Kinovate Life Sciences, представленная Формулой B80:

[264] Реакция снятия защиты хорошо известна в данной области техники. Согласно некоторым вариантам реализации настоящего изобретения условие снятия защиты включает температуру 0-50°С, например, 15-35°С, и время реакции 30-300 секунд, например, 50-150 секунд. Агент для снятия защиты может быть выбран из одной или более из трифторуксусной кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты и монохлоруксусной кислоты. Согласно некоторым вариантам реализации настоящего изобретения агент для снятия защиты представляет собой дихлоруксусную кислоту. Молярное отношение агента для снятия защиты к защитной группе-DMTr (4,4'-диметокситритил) на твердофазной подложке может составлять от 2:1 до 100:1, например, от 3:1 до 50:1. С помощью такого удаления защиты на поверхности твердофазной подложки получают реакционноспособные свободные гидроксигруппы, чтобы облегчить последующую реакцию связывания.
[265] Условие реакции связывания и связывающий агент могут быть выбраны, как указано выше. При такой реакции связывания свободные гидроксигруппы, образованные в реакции снятия защиты, реагируют с фосфоамидитными группами с образованием сложноэфирной фосфитной связи.
[266] Согласно некоторым вариантам реализации настоящего изобретения условие реакции кэпирования включает температуру 0-50°С, например, 15-35°С, и время реакции 5-500 секунд, например, 10-100 секунд. Реакцию кэпирования выполняют в присутствии кэпирующего агента. Выбор и количество кэпирующего агента описаны выше.
[267] Условие реакции окисления может включать температуру 0-50°С, например, 15-35°С, и время реакции 1-100 секунд, например, 5-50 секунд. Окисляющий агент может представлять собой, например, йод (согласно некоторым вариантам реализации настоящего изобретения обеспечен в виде раствора йода в воде). Согласно некоторым вариантам реализации настоящего изобретения молярное отношение окисляющего агента к сложноэфирной фосфитной группе составляет от 1:1 до 100:1, предпочтительно от 5:1 до 50:1. Согласно некоторым вариантам реализации настоящего изобретения реакцию окисления выполняют в смешанном растворителе, в котором соотношение тетрагидрофуран:вода:пиридин составляет 3:1:1-1:1:3.
[268] Согласно некоторым вариантам реализации настоящего изобретения R6 представляет собой группу, представленную Формулой В7 или В8:


в которых q2 определен выше.
[269] В этом случае соединение, представленное Формулой (313), может быть получено с помощью следующего способа получения, включающего: приведение соединения, представленного Формулой (314), в контакт с соединением, представленным Формулой (А-1) или (А-2), в органическом растворителе в условии реакции амидирования в присутствии агента для амидной конденсации и органического основания третичного амина, а также выделение:


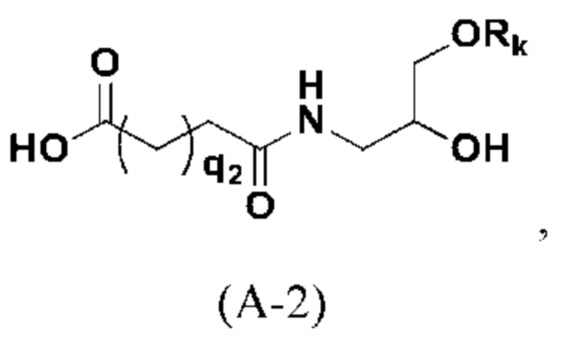
при этом определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14, R15, L1, S1, q2 и Rk, соответственно, описаны выше.
[270] Условие реакции амидирования может включать температуру реакции 0-100°С и время реакции 1-48 часов. Согласно некоторым вариантам реализации настоящего изобретения условие реакции амидирования включает температуру реакции 10-40°С и время реакции 2-16 часов.
[271] Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой один или более из спиртового растворителя, эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения спиртовой растворитель представляет собой один или более из метанола, этанола и пропанола и, в дополнительных вариантах, представляет собой этанол. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран. Согласно некоторым вариантам реализации настоящего изобретения простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир. Согласно некоторым вариантам реализации настоящего изобретения галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой дихлорметан. Количество органического растворителя составляет 3-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 3-20 л/моль по отношению к соединению, представленному Формулой (314).
[272] Согласно некоторым вариантам реализации настоящего изобретения агент для амидной конденсации представляет собой гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония, 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он, гидрохлорид 4-(4,6-диметокситриазин-2)-ил)-4-метилморфолина, 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин (EEDQ) или гексафторфосфат О-бензотриазолтетраметилурония и в других вариантах представляет собой 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он. Молярное отношение агента для амидной конденсации к соединению, представленному Формулой (314), может составлять от 1:1 до 10:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 2,5:1 до 5:1.
[273] Согласно некоторым вариантам реализации настоящего изобретения органическое основание третичного амина представляет собой триэтиламин или N,N-диизопропилэтиламин и согласно некоторым вариантам реализации настоящего изобретения представляет собой N,N-диизопропилэтиламин. Молярное отношение третичного амина к соединению, представленному Формулой (314), может составлять от 3:1 до 20:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 5:1 до 10:1.
[274] Соединения Формулы (А-1) и (А-2) могут быть получены с помощью любых подходящих способов. Например, если Rk представляет собой группу DMTr, соединение Формулы (А-1) может быть получено путем взаимодействия глицерата кальция с DMTrCl. Аналогичным образом, соединение Формулы (А-2) может быть получено путем приведения 3-амино-1,2-пропандиола в контакт с циклическим ангидридом и последующей реакции с DMTrCl, причем циклический ангидрид может содержать 4-13 атомов углерода и, в некоторых вариантах реализации, 4-8 атомов углерода. Специалисты в данной области техники легко поймут, что наборы различных циклических ангидридов соответствуют различным значениям q2 в соединении Формулы (А-2). Например, если циклический ангидрид представляет собой янтарный ангидрид, q2=1; если циклический ангидрид представляет собой глутаровый ангидрид, q2=2 и так далее.
[275] Согласно некоторым вариантам реализации настоящего изобретения соединение Формулы (313) также можно получить путем последовательного взаимодействия соединения, представленного Формулой (314), с циклическим ангидридом, 3-амино-1,2-пропандиолом и DMTrCl. Специалисты в данной области техники легко поймут, что эти варианты не будут влиять на структуру и функцию соединения Формулы (313), и эти варианты могут быть легко осуществлены специалистами в данной области техники на основе вышеуказанных способов.
[276] Аналогичным образом, соединение, представленное Формулой (313), может быть выделено из реакционной смеси с помощью любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (313), может быть выделено с помощью удаления растворителя путем выпаривания с последующей хроматографией, например, с применением следующих двух наборов хроматографических условий для выделения: (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование простой петролейный эфир:этилацетат:дихлорметан:N,N-диметилформамид=1:1:1:0,5-1:1:1:0,6; и (2) очистка с обращенной фазой: наполнители с обращенной фазой С18 и С8, градиентное элюирование метанол:ацетонитрил=0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (313), который может быть непосредственно использован в последующих реакциях.
[277] Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (314), может быть получено с помощью следующего способа получения, включающего приведение соединения, представленного Формулой (315), в контакт с галогенуксусной кислотой в органическом растворителе в условии реакции снятия защиты, а затем выделение:

в которой R7 выбран из групп, представленных Формулой (330), (331), (332) и (333), и согласно некоторым вариантам реализации настоящего изобретения R7 имеет структуру, представленную Формулой (330):




при этом определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14, R15, L1 и S1, соответственно, описаны выше.
[278] Галогенуксусная кислота может быть выбрана из одной или более из дихлоруксусной кислоты, трихлоруксусной кислоты, монохлоруксусной кислоты и трифторуксусной кислоты и, согласно некоторым вариантам реализации настоящего изобретения, представляет собой дихлоруксусную кислоту.
[279] Условие реакции снятия защиты может включать температуру реакции 0-100°С и время реакции 0,1-24 часа и, согласно некоторым вариантам реализации настоящего изобретения, температуру реакции 10-40°С и время реакции 0,5-16 часов.
[280] Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой один или более из эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран. Согласно некоторым вариантам реализации настоящего изобретения простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир. Согласно некоторым вариантам реализации настоящего изобретения галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой дихлорметан. Количество органического растворителя составляет 3-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 5-20 л/моль по отношению к соединению, представленному Формулой (315).
[281] Молярное отношение галогенуксусной кислоты к соединению, представленному Формулой (315), составляет от 5:1 до 100:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 10:1 до 50:1.
[282] Аналогичным образом, соединение, представленное Формулой (314), может быть выделено из реакционной смеси с помощью любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (314), может быть выделено с помощью удаления растворителя путем выпаривания с последующей хроматографией, например, с применением следующих двух наборов хроматографических условий для выделения, (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование дихлорметан:метанол=100:30-100:40; и (2) очистка с обращенной фазой: наполнители с обращенной фазой С18 и С8, градиентное элюирование метанол:ацетонитрил=0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (314), который может быть непосредственно использован в последующих реакциях.
[283] Соединение, представленное Формулой (315), может быть получено с помощью следующего способа, включающего приведение соединения, представленного Формулой (317), в контакт с соединением, представленным Формулой (316), в органическом растворителе в условии реакции конденсации в присутствии агента для амидной конденсации и органического основания третичного амина, а также выделение:
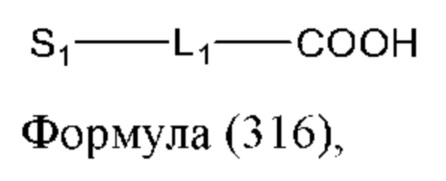

при этом определения и варианты n1, n3, m1, m2, m3, R7, R10, R11, R12, R13, R14, R15, L1 и S1, соответственно, описаны выше.
[284] Соединение Формулы (316) может представлять собой то, которое описано в J. Am. Chem. Soc. 2014, 136, 16958-16961. Согласно другому варианту соединения Формулы (316) могут быть получены специалистами в данной области техники с помощью различных способов. Например, некоторые соединения Формулы (316) могут быть получены в соответствии со способами, описанными в примере 1 патента США 8106022 В2, который полностью включен в настоящую заявку посредством ссылки.
[285] Согласно некоторым вариантам реализации настоящего изобретения условие реакции конденсации включает температуру реакции 0-100°С и время реакции 0,1-24 часа. Согласно некоторым вариантам реализации настоящего изобретения условие реакции конденсации включает температуру реакции 10-40°С и время реакции 0,5-16 часов.
[286] Молярное отношение соединения, представленного Формулой (316), к соединению, представленному Формулой (317), может составлять от 2:1 до 10:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 2,5:1 до 5:1.
[287] Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой один или более из ацетонитрила, эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран. Согласно некоторым вариантам реализации настоящего изобретения простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир. Согласно некоторым вариантам реализации настоящего изобретения галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой ацетонитрил. Количество органического растворителя может составлять 3-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 5-20 л/моль по отношению к соединению, представленному Формулой (317).
[288] Агент для амидной конденсации представляет собой гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония, 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT), гексафторфосфат О-бензотриазолтетраметилурония или гидрохлорид 4-(4,6-диметокситриазин-2-ил)-4-метилморфолина и согласно некоторым вариантам реализации настоящего изобретения представляет собой гидрохлорид 4-(4,6-диметокситриазин-2-ил)-4-метилморфолина. Молярное отношение агента для амидной конденсации к соединению, представленному Формулой (317), составляет от 2:1 до 10:1 и согласно некоторым вариантам реализации настоящего изобретения составляет от 2,5:1 до 5:1.
[289] Органическое основание третичного амина представляет собой N-метилморфолин, триэтиламин или N,N-диизопропилэтиламин и, согласно некоторым вариантам реализации настоящего изобретения, N-метилморфолин. Молярное отношение третичного амина к соединению, представленному Формулой (317), может составлять от 3:1 до 20:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 5:1 до 10:1.
[290] Аналогичным образом, соединение, представленное Формулой (315), может быть выделено из реакционной смеси с помощью любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (315), выделяют с помощью удаления растворителя путем выпаривания с последующей хроматографией, например, с применением следующих двух наборов хроматографических условий для выделения, (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование дихлорметан:метанол=100:5-100:7; (2) очистка с обращенной фазой: наполнители с обращенной фазой С18 и С8, градиентное элюирование метанол:ацетонитрил=0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель непосредственно удаляют с получением неочищенного продукта соединения, представленного Формулой (315), который можно непосредственно использовать в последующих реакциях.
[291] Согласно некоторым вариантам реализации настоящего изобретения соединение Формулы (317) реагирует с достаточным количеством одного соединения Формулы (316) в одной партии с получением целевого соединения Формулы (315), причем все группы S1-L1 являются идентичными. Согласно некоторым вариантам реализации настоящего изобретения соединение Формулы (317) реагирует с различными соединениями Формулы (316) в произвольных партиях, т.е. с соединениями Формулы (316), имеющими различные L1 и/или S1, с получением соединения Формулы (315) с двумя или более типами S1 и/или L1 в нем. Например, 1 экв. соединения Формулы (317) сначала может быть приведен в контакт с 2 экв. первого соединения Формулы (316), чтобы присоединить первые группы S1-L1 к двум концевым первичным аминогруппам в соединении Формулы (317), а затем приведен в контакт с (n3+n1-1) экв. второго соединения Формулы (316), чтобы присоединить вторые группы S1-L1 к (n3+n1-1) вторичных аминогрупп в соединении Формулы (317), причем определения и диапазоны n3 и n1 описаны выше.
[292] Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (317), может быть получено с помощью следующего способа, включающего приведение соединения, представленного Формулой (318), в контакт с водным раствором метиламина в условии реакции снятия защиты в присутствии органического растворителя, а также выделение:

при этом определения и варианты n1, n3, m1, m2, m3, R7, R10, R11, R12, R13, R14 и R15, соответственно, описаны выше.
[293] Условие реакции снятия защиты включает температуру реакции 0-150°С и время реакции 5-72 часа и, согласно некоторым вариантам реализации настоящего изобретения, температуру реакции 20-80°С и время реакции 10-30 часов.
[294] Органический растворитель выбран из спиртов, согласно некоторым вариантам реализации настоящего изобретения, он представляет собой один из метанола, этанола и изопропанола и согласно некоторым вариантам реализации настоящего изобретения представляет собой метанол. Количество органического растворителя может составлять 1-20 л/моль и согласно некоторым вариантам реализации настоящего изобретения составляет 1,5-10 л/моль по отношению к соединению, представленному Формулой (318).
[295] Концентрация водного раствора метиламина может составлять 30%-40% по массе, и молярное отношение метиламина к соединению, представленному Формулой (318), может составлять от 10:1 до 500:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 50:1 до 200:1.
[296] Аналогичным образом, соединение, представленное Формулой (317), может быть выделено из реакционной смеси с применением любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (317), может быть выделено с помощью удаления растворителя путем выпаривания с последующей хроматографией, например, с применением следующих двух наборов хроматографических условий для выделения, (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование дихлорметан:метанол:водный раствор аммиака (25 масс. %)=1:1:0,05-1:1:0,25; и (2) очистка с обращенной фазой: наполнители с обращенной фазой С18 и С8, градиентное элюирование метанол:ацетонитрил=0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (317), который может быть непосредственно использован в последующих реакциях.
[297] Соединение, представленное Формулой (318), может быть получено с помощью следующего способа, включающего приведение соединения, представленного Формулой (319), в контакт с трифенилхлорметаном (TrCl), дифенилэтилфенилхлорметаном, фенилдиэтилфенилхлорметаном или триэтилфенилхлорметаном (согласно некоторым вариантам реализации настоящего изобретения с трифенилхлорметаном (TrCl)) в условии реакции замещения в присутствии органического растворителя, а также выделение:

при этом определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14 и R15, соответственно, описаны выше.
[298] Условие реакции замещения может включать температуру реакции 0-100°С и время реакции 5-72 часа и, согласно некоторым вариантам реализации настоящего изобретения, температуру реакции 10-40°С и время реакции 10-30 часов.
[299] Трифенилхлорметан (TrCl), дифенилэтилфенилхлорметан, фенилдиэтилфенилхлорметан или триэтилфенилхлорметан доступны коммерчески. Молярное отношение трифенилхлорметана (TrCl), дифенилэтилфенилхлорметана, фенилдиэтилфенилхлорметана или триэтилфенилхлорметана к соединению, представленному Формулой (319), может составлять от 1:1 до 10:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 1:1 до 3:1.
[300] Органический растворитель может представлять собой один или более из эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран. Согласно некоторым вариантам реализации настоящего изобретения простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир. Согласно некоторым вариантам реализации настоящего изобретения галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой дихлорметан. Количество органического растворителя может составлять 3-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 5-20 л/моль по отношению к соединению, представленному Формулой (319).
[301] Аналогичным образом, соединение, представленное Формулой (318), может быть выделено из реакционной смеси с помощью любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (318), может быть выделено с помощью удаления растворителя путем выпаривания с последующей хроматографией, например, с применением следующих двух наборов хроматографических условий для выделения, (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование метанол: дихлорметан=0,01:1-0,5:1 или градиентное элюирование метанол:дихлорметан:этилацетат:простой петролейный эфир=0,1:1:1:1-1:1:1:1; и (2) очистка с обращенной фазой: наполнители с обращенной фазой С18 и С8, градиентное элюирование метанол:ацетонитрил=0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (318), который может быть непосредственно использован в последующих реакциях.
[302] Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (319), может быть получено с помощью следующего способа, включающего приведение соединения, представленного Формулой (320), в контакт с этилтрифторацетатом в органическом растворителе в условии реакции замещения, а также выделение:

при этом определения и варианты n1, n3, m1, m2, m3, R10, R11, R12, R13, R14 и R15, соответственно, описаны выше.
[303] Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой один или более из ацетонитрила, эпоксидного растворителя, простого эфирного растворителя, галогеналканового растворителя, диметилсульфоксида, N,N-диметилформамида и N,N-диизопропилэтиламина. Согласно некоторым вариантам реализации настоящего изобретения эпоксидный растворитель представляет собой диоксан и/или тетрагидрофуран. Согласно некоторым вариантам реализации настоящего изобретения простой эфирный растворитель представляет собой простой диэтиловый эфир и/или простой трет-бутилметиловый эфир. Согласно некоторым вариантам реализации настоящего изобретения галогеналкановый растворитель представляет собой один или более из дихлорметана, трихлорметана и 1,2-дихлорэтана. Согласно некоторым вариантам реализации настоящего изобретения органический растворитель представляет собой ацетонитрил. Количество органического растворителя составляет 1-50 л/моль и, согласно некоторым вариантам реализации настоящего изобретения, 1-20 л/моль по отношению к соединению, представленному Формулой (320).
[304] Условие реакции замещения может включать температуру реакции 0-100°С и время реакции 5-72 часа и, согласно некоторым вариантам реализации настоящего изобретения, температуру реакции 10-40°С и время реакции 10-30 часов.
[305] Соединение, представленное Формулой (320), может быть доступно коммерчески или получено специалистами в данной области техники с помощью известных способов. Например, в случае если m1=m2=m3=3, n1=1, n3=2 и R10, R11, R12, R13, R14 и R15 все представляют собой Н, соединение, представленное Формулой (320), доступно коммерчески от Alfa Aesar Inc.
[306] Молярное отношение этилтрифторацетата к соединению, представленному Формулой (320), может составлять от 2:1 до 10:1 и, согласно некоторым вариантам реализации настоящего изобретения, от 3:1 до 5:1.
[307] Аналогичным образом, соединение, представленное Формулой (319), может быть выделено из реакционной смеси с применением любых подходящих способов выделения. Согласно некоторым вариантам реализации настоящего изобретения соединение, представленное Формулой (319), может быть выделено с помощью удаления растворителя путем выпаривания с последующей хроматографией, например, с применением следующих двух наборов хроматографических условий для выделения: (1) очистка с обычной фазой: силикагелевый наполнитель с 200-300 меш, градиентное элюирование метанол: дихлорметан=0,01:1-0,5:1 или градиентное элюирование метанол:дихлорметан:этилацетат:простой петролейный эфир=0,1:1:1:1-1:1:1:1; и (2) очистка с обращенной фазой: наполнители с обращенной фазой С18 и С8, градиентное элюирование метанол:ацетонитрил=0,1:1-1:0,1. Согласно некоторым вариантам реализации настоящего изобретения растворитель может быть непосредственно удален с получением неочищенного продукта соединения, представленного Формулой (319), который может быть непосредственно использован в последующих реакциях.
[308] Первый или второй конъюгаты миРНК согласно настоящему изобретению также можно применять в комбинации с другими фармацевтически приемлемыми вспомогательными веществами, которые могут представлять собой один или более из различных составов или соединений, общепринятых в данной области техники. Подробная информация представлена в приведенном выше описании фармацевтических композиций согласно настоящему изобретению.
Применение модифицированной миРНК, фармацевтической композиции, первого конъюгата миРНК и второго конъюгата миРНК согласно настоящему изобретению
[309] Согласно некоторым вариантам реализации настоящего изобретения предложено применение миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК согласно настоящему изобретению в изготовлении лекарственного средства для лечения и/или предотвращения патологических состояний или заболеваний, вызванных инфекцией вирусом гепатита В (ВГВ).
[310] В соответствии с некоторыми вариантами реализации настоящего изобретения предложен способ лечения патологических состояний или заболеваний, вызванных инфекцией вирусом гепатита В (ВГВ), включающий введение пациенту эффективного количества миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК согласно настоящему изобретению.
[311] В соответствии с другими вариантами реализации настоящего изобретения предложен способ ингибирования экспрессии генов ВГВ в пораженных гепатитом клетках, хронически инфицированных ВГВ, включающий приведение миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК согласно настоящему изобретению в контакт с пораженными гепатитом клетками, хронически инфицированными ВГВ.
[312] Патологическое состояние или заболевание, вызванное инфекцией вирусом гепатита В (ВГВ), выбрано из хронических заболеваний печени, воспаления, фиброзных заболеваний и пролиферативных заболеваний.
[313] Цель лечения гепатита В может быть достигнута на основе механизма РНК-интерференции (РНКи) путем введения пациенту, нуждающемуся в этом, миРНК и/или фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК согласно настоящему изобретению. Таким образом, миРНК и/или фармацевтическая композиция и конъюгаты миРНК согласно настоящему изобретению можно применять для предотвращения и/или лечения гепатита В или для получения лекарственного средства для предотвращения и/или лечения гепатита В.
[314] В настоящем документе термин «введение/вводить» относится к доставке модифицированной миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК согласно настоящему изобретению в организм субъекта с помощью способа или пути, который по меньшей мере частично локализует модифицированную миРНК, фармацевтическую композицию, первый конъюгат миРНК и/или второй конъюгат миРНК согласно настоящему изобретению в целевом сайте для получения целевого эффекта. Подходящие пути введения для способов согласно настоящему изобретению включают местное введение и системное введение. Обычно местное введение приводит к доставке большего количества модифицированной миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК в конкретный сайт по сравнению со всем телом субъекта; тогда как системное введение приводит к доставке модифицированной миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК по существу по всему телу субъекта. Принимая во внимание, что настоящее изобретение предназначено для обеспечения средств для предотвращения и/или лечения дислипидемии, согласно некоторым вариантам реализации настоящего изобретения применяется способ введения, способный доставлять лекарственные средства в печень.
[315] Введение субъекту можно осуществлять с помощью любых подходящих путей, известных в данной области техники, включая, но не ограничиваясь ими, пероральный или парентеральный путь, такой как внутривенное введение, внутримышечное введение, подкожное введение, трансдермальное введение, внутритрахеальное введение (аэрозоль), легочное введение, назальное введение, ректальное введение и местное введение (включая буккальное введение и подъязычное введение). Частота введения может составлять один или более раз в сутки, еженедельно, один раз в две недели, один раз в три недели, ежемесячно или ежегодно.
[316] Доза миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК согласно настоящему изобретению может представлять собой обычную дозу в данной области техники, которая может быть определена в соответствии с различными параметрами, в частности, возрастом, массой и полом субъекта. Токсичность и эффективность могут быть измерены в клеточных культурах или на экспериментальных животных с помощью стандартных фармацевтических процедур, например, путем определения ЛД50 (летальная доза, вызывающая гибель 50% популяции) и ЭД50 (доза, которая может вызывать 50% от максимальной интенсивности ответа при количественном ответе и которая приводит к тому, что 50% экспериментальных субъектов имеют положительный ответ при качественном ответе). Диапазон доз для человека может быть получен на основании данных, полученных из анализов клеточных культур и исследований на животных.
[317] При введении фармацевтической композиции или конъюгата миРНК согласно настоящему изобретению, например, самцам или самкам мышей C57BL/6J или С3Н/HeNCrIVr в возрасте 6-12 недель и с массой тела 18-25 г, и при расчете на основании количества миРНК в фармацевтической композиции или конъюгате миРНК: (i) для первого конъюгата миРНК и/или второго конъюгата миРНК дозировка его миРНК может составлять 0,001-100 мг/кг массы тела и, согласно другим вариантам реализации настоящего изобретения, 0,01-50 мг/кг массы тела, а в других дополнительных вариантах реализации составляет 0,05-20 мг/кг массы тела, а в других дополнительных вариантах реализации составляет 0,1-10 мг/кг массы тела; (ii) для фармацевтической композиции, образованной миРНК и фармацевтически приемлемым носителем, дозировка ее миРНК может составлять 0,001-50 мг/кг массы тела и согласно другим вариантам реализации настоящего изобретения составляет 0,01-10 мг/кг массы тела, а в других дополнительных вариантах реализации составляет 0,05-5 мг/кг массы тела, а в других дополнительных вариантах реализации составляет 0,1-3 мг/кг массы тела.
[318] Кроме того, при введении миРНК и/или фармацевтической композиции, и/или конъюгатов миРНК согласно настоящему изобретению в пораженные гепатитом клетки, хронически инфицированные ВГВ, цель, заключающаяся в ингибировании экспрессии гена ВГВ в пораженных гепатитом клетках, хронически инфицированных ВГВ, также может быть достигнута с помощью механизма РНК-интерференции. Согласно некоторым предпочтительным вариантам реализации настоящего изобретения клетки представляют собой клетки HepG2.2.15.
[319] В случае если экспрессию генов ВГВ в клетках ингибируют с применением способа, предусмотренного настоящим изобретением, количество миРНК в обеспеченной миРНК, фармацевтической композиции, первом конъюгате миРНК и/или втором конъюгате миРНК, как правило, представляет собой количество, достаточное для снижения экспрессии гена-мишени и получения внеклеточной концентрации от 1 пМ до 1 мкМ или от 0,01 нМ до 100 нМ, или от 0,05 нМ до 50 нМ, или от 0,05 нМ до приблизительно 5 нМ на поверхности клеток-мишеней. Количество, требуемое для достижения этой локальной концентрации, будет варьироваться в зависимости от различных факторов, включая способ доставки, место доставки, количество клеточных слоев между местом доставки и целевыми клетками или тканями, путь доставки (местный или системный) и т.д. Концентрация в месте доставки может быть значительно выше, чем концентрация на поверхности целевых клеток или тканей.
Набор
[320] Согласно настоящему изобретению предложен набор, содержащий эффективное количество по меньшей мере одного из модифицированной миРНК, фармацевтической композиции, первого конъюгата миРНК и/или второго конъюгата миРНК.
[321] Согласно некоторым вариантам реализации настоящего изобретения наборы, раскрытые в настоящем документе, обеспечивают модифицированную миРНК в одном контейнере. Согласно некоторым вариантам реализации настоящего изобретения набор согласно настоящему изобретению содержит контейнер, содержащий фармацевтически приемлемые вспомогательные вещества. Согласно некоторым вариантам реализации настоящего изобретения наборы согласно настоящему изобретению дополнительно содержат дополнительные ингредиенты, такие как стабилизаторы или консерванты. Согласно некоторым вариантам реализации настоящего изобретения набор содержит по меньшей мере один дополнительный терапевтический агент в контейнере, отличном от контейнера, содержащего модифицированную миРНК согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения набор содержит инструкцию по смешиванию модифицированной миРНК с фармацевтически приемлемыми носителями и/или адъювантами или другими ингредиентами (если таковые имеются).
[322] В наборах согласно настоящему изобретению модифицированная миРНК и фармацевтически приемлемые носители и/или адъюванты, а также модифицированная миРНК, фармацевтическая композиция, первый конъюгат миРНК и/или второй конъюгат миРНК, и/или конъюгат, и/или фармацевтически приемлемые адъюванты могут быть обеспечены в любой форме, например, в жидкой форме, сухой форме или лиофилизированной форме. Согласно некоторым вариантам реализации настоящего изобретения модифицированная миРНК и фармацевтически приемлемые носители и/или адъюванты, а также фармацевтическая композиция и/или конъюгат и необязательные фармацевтически приемлемые адъюванты являются по существу чистыми и/или стерильными. Согласно некоторым вариантам реализации настоящего изобретения в наборах согласно настоящему изобретению может быть обеспечена стерильная вода. Предпочтительные эффекты
[323] Согласно некоторым вариантам реализации настоящего изобретения миРНК, композиция миРНК или конъюгат миРНК согласно настоящему изобретению могут иметь более высокую стабильность, более низкую токсичность и/или более высокую активность в условиях in vivo. Согласно некоторым вариантам реализации настоящего изобретения миРНК, композиция миРНК или конъюгат миРНК согласно настоящему изобретению проявляют процент ингибирования экспрессии гена ВГВ по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% в условиях in vivo. Согласно некоторым вариантам реализации настоящего изобретения миРНК, композиция миРНК или конъюгат миРНК согласно настоящему изобретению проявляют процент ингибирования экспрессии гена ВГВ в печени по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% в условиях in vivo. Согласно некоторым вариантам реализации настоящего изобретения миРНК, композиция миРНК или конъюгат миРНК согласно настоящему изобретению проявляют процент ингибирования экспрессии гена ВГВ в печени по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% в моделях на животных в условиях in vivo. Согласно некоторым вариантам реализации настоящего изобретения миРНК, композиция миРНК или конъюгат миРНК согласно настоящему изобретению проявляют процент ингибирования экспрессии поверхностного антигена ВГВ по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% в условиях in vivo. Согласно некоторым вариантам реализации настоящего изобретения двухцепочечный олигонуклеотид, композиция или олигонуклеотидный конъюгат согласно настоящему изобретению не проявляют существенный нецелевой эффект. Нецелевой эффект может представлять собой, например, ингибирование нормальной экспрессии гена, который не является геном-мишенью. Считается, что если связывание/ингибирование экспрессии нецелевого гена на 50%, 40%, 30%, 20% или 10% ниже, чем активности мишени, то нецелевой эффект не является существенным.
[324] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению обладают более низкой токсичностью на уровне животных.
[325] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению могут оставаться неразрушенными до 72 часов в плазме человека, проявляя превосходную стабильность в плазме человека.
[326] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению могут оставаться неразрушенными до 72 часов в плазме яванских макак, проявляя превосходную стабильность в плазме обезьян.
[327] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению могут оставаться неразрушенными в течение по меньшей мере 24 часов в лизате лизосом, полученных от человека и крысы, проявляя удовлетворительную стабильность.
[328] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению могут быть специфически и значительно обогащены в печени и остаются стабильными, проявляя высокую степень нацеливания.
[329] Согласно некоторым вариантам реализации настоящего изобретения в нескольких экспериментах с различными временными точками испытания конъюгаты миРНК согласно настоящему изобретению проявляют высокую ингибирующую активность в отношении экспрессии мРНК ВГВ у мышей в условиях in vivo.
[330] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению проявляют длительную и действенную ингибирующую эффективность в отношении сывороточного HBsAg в различных моделях на животных, проявляя обычную зависимость от дозы.
[331] Согласно некоторым вариантам реализации настоящего изобретения конъюгаты миРНК согласно настоящему изобретению не только обладают более высокой активностью in intro, но также проявляют низкие нецелевые эффекты.
[332] Настоящее изобретение будет дополнительно описано далее с использованием примеров получения и экспериментальных примеров, но не ограничивается ими ни в каком отношении.
Примеры
[333] Далее настоящее изобретение будет подробно описано со ссылкой на примеры. Если не указано иное, агенты и культуральные среды, применяемые в следующих примерах, являются коммерчески доступными, и все применяемые процедуры, такие как электрофорез нуклеиновых кислотах и ПЦР в режиме реального времени, выполняют в соответствии со способами, описанными в Molecular Cloning (Cold Spring Harbor Laboratory Press (1989)).
[334] Если не указано иное, все отношения реагентов, представленные ниже, рассчитаны как отношения по объему (об./об.).
[335] Мыши C57BL/6J-Tg (Alb1HBV) 44Bri/J, трансгенные по ВГВ, приобретены в Департаменте исследований на лабораторных животных Научно-медицинского центра Пекинского университета. Мышей с S/COV>10 отбирают перед экспериментами; далее по тексту иногда также упоминается как модель 44Bri на мышах;
[336] Мыши, трансгенные по ВГВ, названные M-Tg HBV, приобретены в Департаменте животных Шанхайского центра общественного здравоохранения. Способы получения трансгенных мышей были описаны как Ren J. et al., in J. Medical Virology. 2006, 78:551-560; далее по тексту также иногда упоминается как модель M-Tg;
[337] Трансгенные мыши AAV-HBV: получены в соответствии с литературным способом (Xiaoyan Dong et al., Chin J Biotech 2010, May 25; 26(5): 679-686) с применением вируса rAAV8-1.3HBV, типа D (ayw) (приобретен у FivePlus Molecular Medicine Institute Co. Ltd., Пекин, 1×1012 вирусных геномов (в.г.)/мл, серия №2016123011). rAAV8-1.3HBV разбавляли до 5×1011 в.г./мл стерильным ФСБ. По 200 мкл разбавленного rAAV8-1.3HBV вводили путем инъекции каждой мыши, т.е. 1×1011 в.г.на мышь. Орбитальную кровь (приблизительно 100 мкл) брали у всех мышей на 28 день после инъекции вируса, чтобы собрать сыворотку для определения ДНК HBsAg и ВГВ; далее по тексту также упоминается как модель AAV-HBV на мышах;
[338] Трансгенные мыши с низкой концентрацией AAV-HBV: применяли по существу тот же способ создания модели, который описан выше, различие заключалось в том, что вирус разбавляли до 1×1011 в.г./мл стерильным ФСБ перед экспериментом. Каждой мыши вводили путем инъекции 100 мкл вируса, т.е. 1×1010 в.г.на мышь; далее по тексту также иногда упоминается как модель с низкой концентрацией AAV-HBV на мышах;
[339] Мыши, трансгенные по ВГВ: C57BL/6-HBV, название линии: B6-Tg HBV/Vst (1,28 копии, генотип А) приобретены у Beijing Vitalstar Biotechnology Co., Ltd. Мышей с COI>104 отбирают перед экспериментами; далее по тексту также иногда упоминается как модель с 1,28 копии.
Пример получения 1
Получение конъюгатов 1-11
[340] В этом примере получения синтезировали конъюгат 1 (далее по тексту также упоминается как конъюгат L10-siHBa1M1SVP), конъюгат 2 (далее по тексту также упоминается как конъюгат L10-siHBa1M1SP), конъюгат 3 (далее по тексту также упоминается как конъюгат L10-siHBa1M1SPsT), конъюгат 4 (далее по тексту также упоминается как конъюгат L10-siHBa1M1SPs), конъюгат 5 (далее по тексту также упоминается как конъюгат L10-siHBa1M2S), конъюгат 6 (далее по тексту также упоминается как конъюгат L10-siHBa1M2S), конъюгат 7 (далее по тексту также упоминается как конъюгат L10-siHBa2M1S) конъюгат 8 (далее по тексту также упоминается как конъюгат L10-siHBa1M1S), конъюгат 9 (далее по тексту также упоминается как конъюгат L10-siHBa1M2S), конъюгат 10 (далее по тексту также упоминается как конъюгат L10-siHBa2M2S) и конъюгат 11 (далее по тексту также упоминается как конъюгат L10-siHBa2M1S). Конъюгаты представляли собой те, которые были образованы с помощью конъюгации конъюгирующей молекулы L-9, соответственно, с миРНК, пронумерованными L10-siHBa1M1SVP, L10-siHBa1M1SP, L10-siHBa1M1SPsT, L10-siHBa1M1SPs, L10-siHBa1M2S, L10-siHBa1M2S, L10-siHBa2M1S, L10-siHBa1MIS, L10-siHBa1M2S, L10-siHBa2M2S или L10-siHBa2M1S. Конъюгированные последовательности миРНК в конъюгатах представлены в таблице 3.
(1-1) Синтез соединения L-10:
[341] Соединение L-10 синтезировали в соответствии со следующим способом:

(1-1-1) Синтез GAL-5 (концевой сегмент конъюгирующей молекулы)
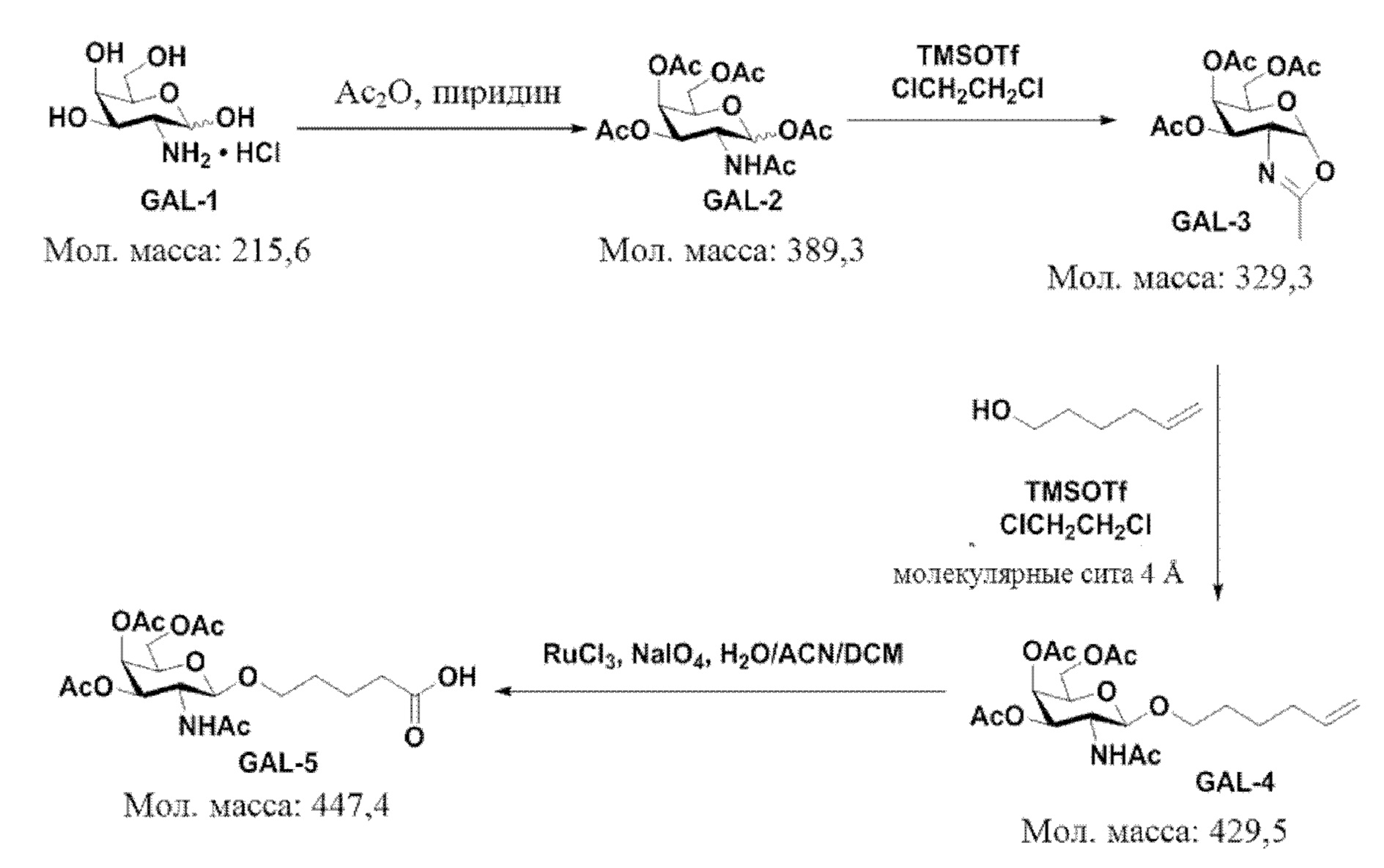
(1-1-1a) Синтез GAL-2
[342] 100,0 г GAL-1 (гидрохлорида N-ацетил-D-галактозамина, № CAS 1772-03-8, приобретен у Ningbo Hongxiang Bio-Chem Co., Ltd., 463,8 ммоль) растворяли в 1000 мл безводного пиридина, к которому добавляли 540 мл уксусного ангидрида (приобретен у Enox Inc., 5565,6 ммоль) на бане с ледяной водой для взаимодействия при перемешивании при комнатной температуре в течение 1,5 часов. Полученный реакционный раствор выливали в 10 л ледяной воды и подвергали вакуумной фильтрации при пониженном давлении. Остаток промывали 2 л ледяной воды и затем добавляли смешанный растворитель ацетонитрил/толуол (отношение об./об.=1:1) до полного растворения. Растворитель удаляли с помощью выпаривания с получением 130,0 г продукта GAL-2 в виде белого твердого вещества.
(1-1-1b) Синтез GAL-3
[343] GAL-2 (35,1 г, 90,0 ммоль), полученный на стадии (1-1-1a), растворяли в 213 мл безводного 1,2-дихлорэтана, к которому добавляли 24,0 г TMSOTf (№ CAS 27607-77-8, приобретен у Macklin Inc., 108,0 ммоль) на бане с ледяной водой и в атмосфере азота для взаимодействия при комнатной температуре в течение ночи.
[344] 400 мл дихлорметана добавляли к реакционному раствору для разбавления, фильтровали через диатомит, а затем добавляли 1 л насыщенного водного раствора бикарбоната натрия и перемешивали до однородности. Выделяли органическую фазу. Оставшуюся водную фазу экстрагировали дважды, каждый раз с применением 300 мл дихлорэтана, и все органические фазы объединяли и промывали с применением 300 мл насыщенного водного раствора бикарбоната натрия и 300 мл насыщенного рассола, соответственно. Органическую фазу, полученную в результате промывки, выделяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 26,9 г продукта GAL-3 в виде светло-желтого вязкого сиропа.
(1-1-1c) Синтез GAL-4
[345] GAL-3 (26,9 г, 81,7 ммоль), полученный на стадии (1-1-1b), растворяли в 136 мл безводного 1,2-дихлорэтана, добавляли 30 г порошка сухого молекулярного сита


[346] GAL-4 (14,9 г, 34,7 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-1с), растворяли в смешанном растворителе из 77 мл дихлорметана и 77 мл ацетонитрила, добавляли 103 мл деионизированной воды и 29,7 г периодата натрия (№ CAS 7790-28-5, приобретен у Aladdin Inc., 138,8 ммоль), соответственно, и перемешивали на ледяной бане в течение 10 минут. Трихлорид рутения (№ CAS 14898-67-0, доступен у Energy Chemical, 238 мг, 1,145 ммоль) добавляли для взаимодействия при комнатной температуре в течение ночи. Полученный реакционный раствор разбавляли путем добавления 300 мл воды при перемешивании и доводили до рН приблизительно 7,5, добавляя насыщенный бикарбонат натрия. Органическую фазу выделяли и удаляли. Водную фазу трижды экстрагировали, каждый раз с применением 200 мл дихлорметана, а органическую фазу, полученную в результате экстракции, удаляли. Водную фазу, полученную в результате экстракции, доводили до рН приблизительно 3 с применением сухого вещества лимонной кислоты, трижды экстрагировали, каждый раз с применением 200 мл дихлорметана, и полученные органические фазы объединяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 6,5 г продукта GAL-5 в виде белого пенистого твердого вещества. Н1-ЯМР (400 МГц, ДМСО) δ 12,01 (br, 1H), 7,83 (d, J=9,2 Hz, 1H), 5,21 (d, J=3,2 Hz, 1H), 4,96 (dd, J=11,2, 3,2 Гц, 1H), 4,49 (d, J=8,4 Гц, 1H), 4,07-3,95 (m, 3H), 3,92-3,85 (m, 1H), 3,74-3,67 (m, 1H), 3,48-3,39 (m, 1H), 2,20 (t, J=6,8 Гц, 2H), 2,11 (s, 3H), 2,00 (s, 3H), 1,90 (s, 3H), 1,77 (s, 3H), 1,55-1,45 (m, 4H).
(1-1-2) Синтез M-11-T3:

[347] J-0 (1,883 r, 10 ммоль, приобретен у Alfa Aesar) растворяли в 25 мл ацетонитрила, добавляли триэтиламин (4,048 г, 40 ммоль) и охлаждали до 0°С на бане с ледяной водой. Этилтрифторацетат (5,683 г, 40 ммоль) добавляли для взаимодействия при комнатной температуре в течение 22 часов. Растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение 18 часов с получением 5,342 г неочищенного твердого продукта М-11-Т3, который непосредственно использовали в последующей реакции без дальнейшей очистки. MS m/z: C15H22F9N4O3, [М+Н]+, вычислено: 477,35, измерено: 477,65.
(1-1-3) Синтез М-11-Т3-Tr:

[348] Неочищенный продукт М-11-Т3 (5,342 г, 10 ммоль) растворяли в 50 мл дихлорметана. К полученному реакционному раствору добавляли TrCl (3,345 г, 12 ммоль) и триэтиламин (1,518 г, 15 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 20 часов. Реакционный раствор дважды промывали, каждый раз с применением 20 мл насыщенного раствора бикарбоната натрия и один раз с применением 20 мл насыщенного рассола. Полученную органическую фазу высушивали с применением безводного сульфата натрия и фильтровали. Органический растворитель удаляли с помощью выпаривания при пониженном давлении, а остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением 7,763 г неочищенного твердого продукта М-11-Т3-Tr. MS m/z: C34H36F9N4O3, [M+Na]+, вычислено: 741,25, измерено: 741,53. Неочищенный твердый продукт М-11-Т3-Tr затем использовали на следующей стадии для синтеза М-18-Tr без очистки.
(1-1-4) Синтез М-18-Tr:

[349] Неочищенный продукт М-11-Т3-Tr (7,763 г, 10 ммоль), полученный на стадии (1-1-3), растворяли в 100 мл метанола и добавляли 100 мл водного раствора метиламина (40 масс. %) для взаимодействия при перемешивании при 50°С в течение 23 часов. Нерастворимые частицы удаляли с помощью фильтрации. Растворитель выпаривали при пониженном давлении и к остатку добавляли 200 мл смешанного растворителя ДХМ:метанол в объемном отношении 1:1, промывали с применением 50 мл насыщенного раствора бикарбоната натрия. Водную фазу экстрагировали трижды, каждый раз с применением 50 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, а остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи и очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с применением градиентного элюирования дихлорметан:метанол:водный раствор аммиака (25 масс. %)=1:1:0,05-1:1:0,25. Элюат собирали, растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе с получением 2,887 г чистого продукта М-18-Tr. Н1-ЯМР (400 МГц, ДМСО) δ 7,47-7,39 (m, 6Н), 7,32-7,24 (m, 6Н), 7,19-7,12 (m, 3Н), 2,60-2,47 (m, 4Н), 2,46-2,19 (m, 13Н), 1,70-1,55 (m, 4Н), 1,40 (р, J=6,8 Гц, 2Н), MS m/z: C28H39N4, [М+Н]+, вычислено: 431,65, измерено: 432,61.
(1-1-5) Синтез L-5-Tr:

[350] М-18-Tr (2,02 г, 4,69 ммоль), полученный на стадии (1-1-4), и GAL-5 (6,93 г, 15,48 ммоль), полученный на стадии (1-1-1), смешали и растворяли в 47 мл ацетонитрила и добавляли N-метилморфолин (3,13 г, 30,96 ммоль) и гидрохлорид 4-(4,6-диметокситриазин-2-ил)-4-метилморфолина (DMTMM, 4,28 г, 15,48 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 2 часов. Полученный реакционный раствор разбавляли 200 мл дихлорметана. Органическую фазу промывали с применением 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного рассола, высушивали с применением безводного сульфата натрия и фильтровали. Затем растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с помощью градиентного элюирования дихлорметан:метанол=100:5-100:7. Элюат собирали и выпаривали до сухого состояния при пониженном давлении с получением 7,49 г чистого продукта L-5-Tr. Н1-ЯМР (400 МГц, ДМСО) δ 7,83-7,10 (m, 4Н), 7,67-7,60 (m, 1H), 7,44-7,34 (m, 6Н), 7,33-7,24 (m, 6Н), 7,20-7,15 (m, 3Н), 5,22 (s, 3Н), 4,97 (d, J=11,3 Гц, 3Н), 4,49 (d, J=8,4 Гц, 3Н), 4,06-3,07 (m, 9Н), 3,95-3,83 (m, 3Н), 3,77-3,64 (m, 3Н), 3,45-3,35 (m, 3Н), 3,12-2,87 (m, 8Н), 2,30-2,15 (m, 3Н), 2,11-1,98 (m, 22Н), 1,95-1,84 (m, 11Н), 1,81-1,61 (m, 14Н), 1,54-1,36 (m, 14Н). MS m/z: C85H119N7O30, [М+Н]+, вычислено: 1718,81, измерено: 1718,03.
(1-1-6) Синтез L-8:

[351] L-5-Tr (5,94 г, 3,456 ммоль), полученный на стадии (1-1-5), растворяли в 69 мл дихлорметана и добавляли дихлоруксусную кислоту (13,367 г, 103,67 ммоль) для взаимодействия при комнатной температуре в течение 2 часов. Полученный реакционный раствор разбавляли путем добавления 100 мл дихлорметана, промывали и доводили до рН=7-8 с применением насыщенного раствора бикарбоната натрия. Выделенную водную фазу экстрагировали шесть раз, каждый раз с применением 30 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Затем растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). В колонку вносили 10 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали 1 масс. %о триэтиламином и элюировали с помощью градиентного элюирования дихлорметан:метанол=100:30-100:40. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 4,26 г чистого продукта L-8. L-8. Н1-ЯМР (400 МГц, ДМСО) δ 7,84 (d, J=9,0 Гц, 3Н), 7,27-7,23 (m, 1H), 7,13-7,18 (m, 1H), 5,22 (d, J=3,1 Гц, 3Н), 4,97 (dd, J=11,3, 3,1 Гц, 3Н), 4,48 (d, J=8,4 Гц, 3Н), 4,09-3,98 (m, 9Н), 3,88 (dd, J=19,3, 9,3 Гц, 3Н), 3,75-3,66 (m, 3Н), 3,44-3,38 (m, 3Н), 3,17-3,30 (m, 4Н), 3,10-2,97 (m, 4Н), 2,35-2,20 (m, 6Н), 2,15-2,08 (m, 9Н), 2,07-1,98 (m, 13Н), 1,94-1,87 (m, 9Н), 1,81-1,74 (m, 9Н), 1,65-1,42 (m, 18Н). MS m/z: C85H119N7O30, [М+Н]+, вычислено: 1477,59, измерено: 1477,23.
(1-1-7а) Синтез А-1

[352] DMTrCl (хлорид 4,4'-диметокситритила, 38,12 г, 112,5 ммоль) растворяли в 450 мл безводного пиридина и добавляли гидрат DL-глицерата кальция (12,88 г, 45,0 ммоль) для взаимодействия при 45°С в течение 22 часов. Реакционный раствор фильтровали. Остаток промывали с применением 200 мл ДХМ, и фильтрат концентрировали до сухого состояния при пониженном давлении. Остаток повторно растворяли в 500 мл дихлорметана и дважды промывали, каждый раз с применением 200 мл 0,5 М фосфата триэтиламина (рН=7-8). Выделенную водную фазу дважды экстрагировали, каждый раз с применением 200 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток очищали с применением колонки с силикагелем с обычной фазой (200-300 меш), которую элюировали с помощью градиентного элюирования простой петролейный эфир:этилацетат:дихлорметан:метанол=1:1:1:0,35-1:1:1:0,55. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении. Остаток повторно растворяли в 500 мл дихлорметана и промывали один раз с применением 200 мл 0,5 М фосфата триэтиламина. Выделенную водную фазу дважды экстрагировали, каждый раз с применением 200 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении (пониженное давление в вакуумном масляном насосе) до сухого состояния в течение ночи с получением 20,7 г продукта А-1 в виде белого твердого вещества. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,46 (ddd, J=6,5, 2,3, 1,1 Гц, 1H), 7,40-7,28 (m, 7Н), 6,89-6,81 (m, 4Н), 4,84 (d, J=5,0 Гц, 1H), 4,36-4,24 (m, 1H), 4,29 (s, 6Н), 3,92 (dd, J=12,4, 7,0 Гц, 1H), 3,67 (dd, J=12,3, 7,0 Гц, 1H), 2,52 (q, J=6,3 Гц, 6Н), 1,03 (t, J=6,3 Гц, 9Н). MS m/z: C24H23O6, [М-Н]-, вычислено: 407,15, измерено: 406,92.
(1-1-7b) Синтез L-7:

[353] L-8 (2,262 г, 1,532 ммоль), полученный на стадии (1-1-6), и А-1 (2,342 г, 4,596 ммоль), полученный на стадии (1-1-7а), смешивали и растворяли в 16 мл дихлорметана, добавляли 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT, 1,375 г, 4,596 ммоль), а затем добавляли диизопропилэтиламин (1,188 г, 9,191 ммоль) для взаимодействия при перемешивании при 25°С в течение 2 часов. Органическую фазу промывали с применением 10 мл насыщенного раствора бикарбоната натрия. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 10 мл дихлорметана. Все органические фазы объединяли и промывали с применением 10 мл насыщенного рассола, выделенную водную фазу дважды экстрагировали, каждый раз с применением 10 мл дихлорметана, полученные органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением 4,900 г неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 120 г силикагеля с обычной фазой (200-300 меш), добавляли 20 мл триэтиламина для нейтрализации кислотности силикагеля, уравновешивали простым петролейным эфиром, содержащим 1 масс. % триэтиламина, и элюировали с помощью градиентного элюирования простой петролейный эфир:этилацетат:дихлорметан:N,N-диметилформамид=1:1:1:0,5-1:1:1:0,6. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 2,336 г чистого продукта L-7. Н1-ЯМР (400 МГц, ДМСО) δ 7,90-7,78 (m, 4Н), 7,75-7,64 (m, 1H), 7,38-7,18 (m, 9Н), 6,91-6,83 (m, 4Н), 5,25-5,10 (m, 4Н), 4,97 (dd, J=11,2, 3,2 Гц, 3Н), 4,48-4,30 (m, 4Н), 4,02 (s, 9Н), 3,93-3,84 (m, 3Н), 3,76-3,66 (m, 9Н), 3,45-3,35 (m, 3Н), 3,24-2,98 (m, 10Н), 2,30-2,20 (m, 2Н), 2,11-1,88 (m, 3H), 1,80-1,40 (m, 28Н). MS m/z: C90H128N7O35, [M-DMTr]+, вычислено: 1564,65, измерено: 1564,88.
(1-1-8) Синтез конъюгирующей молекулы L-9:

[354] L-7 (2,300 г, 1,26 ммоль), полученный на стадии (1-1-7b), янтарный ангидрид (0,378 г, 3,78 ммоль) и 4-диметиламинопиридин (DMAP, 0,462 г, 3,78 ммоль) смешивали и растворяли в 13 мл дихлорметана, затем добавляли DIPEA (0,814 г, 6,30 ммоль) и перемешивали при 25°С в течение 24 часов. Реакционный раствор промывали с применением 5 мл 0,5 М фосфата триэтиламина. Водную фазу трижды экстрагировали, каждый раз с применением 5 мл дихлорметана. Все органические фазы объединяли, и растворитель выпаривали при пониженном давлении с получением 2,774 г неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 60 г силикагеля с обычной фазой (200-300 меш), добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали дихлорметаном и элюировали с помощью градиентного элюирования дихлорметан (содержащий 1 масс. %о триэтиламина):метанол=100:18-100:20. Элюат собирали, и растворитель выпаривали при пониженном давлении с получением 1,874 г чистого продукта конъюгирующей молекулы L-9. Н1-ЯМР (400 МГц, ДМСО) δ 8,58 (d, J=4,2 Гц, 1H), 7,94-7,82 (m, 3Н), 7,41-7,29 (m, 5Н), 7,22 (d, J=8,1 Гц, 5Н), 6,89 (d, J=8,3 Гц, 4Н), 5,49-5,37 (m, 1H), 5,21 (d, J=3,0 Гц, 3Н), 4,97 (d, J=11,1 Гц, 3Н), 4,49 (d, J=8,2 Гц, 3Н), 4,02 (s, 9Н), 3,88 (dd, J=19,4, 9,4 Гц, 3Н), 3,77-3,65 (m, 9Н), 3,50-3,39 (m, 6Н), 3,11-2,90 (m, 5Н), 2,61-2,54 (m, 4Н), 2,47-2,41 (m, 2Н), 2,26-2,17 (m, 2Н), 2,15-1,95 (m, 22Н), 1,92-1,84 (m, 9Н), 1,80-1,70 (m, 10Н), 1,65-1,35 (m, 17Н), 1,31-1,19 (m, 4Н), 0,96 (t, J=7,1 Гц, 9Н), MS m/z: C94H132N7O38, [M-DMTr]+, вычислено: 1664,72, измерено: 1665,03.
(1-1-9) Синтез соединения L-10:

[355] На этой стадии соединение L-10 получали путем соединения конъюгирующей молекулы L-9 с твердофазной подложкой.
[356] Конъюгирующую молекулу L-9 (0,233 г, 0,1126 ммоль), полученную на стадии (1-1-8), гексафторфосфат О-бензотриазолтетраметилурония (HBTU, 0,064 г, 0,1689 ммоль) и диизопропилэтиламин (DIEA, 0,029 г, 0,2252 ммоль) смешивали и растворяли в 19 мл ацетонитрила и перемешивали при комнатной температуре в течение 5 минут. Аминометиловую смолу (0,901 г, 100-200 меш, нагрузка аминогруппами: 400 мкмоль/г, приобретена у Tianjin Nankai HECHENG S&T Co., Ltd.) добавляли в реакционную жидкость. Реакцию выполняли на шейкере при 25°С и 220 об/мин в течение 15 часов с последующей фильтрацией. Остаток дважды промывали, каждый раз с применением 30 мл ДХМ, затем три раза, каждый раз с применением 30 мл ацетонитрила и один раз с применением 30 мл простого этилового эфира, и высушивали в течение 2 часов с помощью вакуумного масляного насоса. Затем выполняли реакцию кэпирования путем добавления исходных материалов (СарА, СарВ, 4-диметиламинопиридина (DMAP) и ацетонитрила) в соответствии с отношением зарядов, представленным в таблице 2. Реакцию выполняли на шейкере при 25°С и 200 об./мин в течение 5 часов. Реакционную жидкость фильтровали. Остаток промывали трижды, каждый раз с применением 30 мл ацетонитрила, растворитель выпаривали до сухого состояния, и смесь высушивали в течение ночи при пониженном давлении с помощью вакуумного масляного насоса с получением 1,100 г соединения L-10 (т.е. конъюгирующая молекула L-9 соединена с твердофазной подложкой), с нагрузкой 90,8 мкмоль/г.

В приведенной выше таблице СарА и СарВ представляют собой растворы кэпирующих агентов. СарА представляет собой 20% раствор по объему N-метилимидазола в смеси пиридин/ацетонитрил, причем объемное отношение пиридина к ацетонитрилу составляет 3:5. СарВ представляет собой 20% раствор по объему уксусного ангидрида в ацетонитриле.
(1-2) Синтез смысловых цепей конъюгатов 1-11
[357] Нуклеозидные мономеры соединяли один за другим в направлении от 3' к 5' в соответствии с последовательностью расположения нуклеотидов в смысловой цепи с помощью способа твердофазного фосфоамидитного синтеза, циклы начинали с соединения L-10, полученного на вышеуказанной стадии. Соединение каждого нуклеозидного мономера включало четырехступенчатую реакцию снятия защиты, связывания, кэпирования и окисления или сульфуризации. При этом, если два нуклеотида соединены за счет фосфоэфирной связи, четырехступенчатую реакцию снятия защиты, связывания, кэпирования и окисления включали во время присоединения последующего нуклеозидного мономера; и если два нуклеотида соединены за счет фосфотиоатной связи, четырехступенчатую реакцию снятия защиты, связывания, кэпирования и сульфуризации включали во время присоединения последующего нуклеозидного мономера. Условие синтеза было задано следующим образом.
[358] Нуклеозидные мономеры обеспечены в 0,1 М растворе ацетонитрила. Условие реакции снятия защиты является идентичным на каждой стадии, т.е. температура 25°С, время реакции 70 секунд, в качестве агента для снятия защиты применяют раствор дихлоруксусной кислоты в дихлорметане (3% об./об.) и молярное отношение дихлоруксусной кислоты к защитной группе 4,4'-диметокситритил на твердофазной подложке 5:1.
[359] Условие реакции связывания является идентичным на каждой стадии, включая температуру 25°С, молярное отношение последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, к нуклеозидным мономерам 1:10, молярное отношение последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, к связывающему агенту 1:65, время реакции 600 секунд и 0,5 М раствор 5-этилтио-1H-тетразола в ацетонитриле в качестве связывающего агента.
[360] Условие для реакции кэпирования является идентичным на каждой стадии, включая температуру 25°С и время реакции 15 секунд, в качестве кэпирующего агента применяют смешанный раствор Сар А и Сар В в молярном отношении 1:1 и молярное отношение кэпирующего агента к последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой, составляет 1:1:1 (ангидрид:N-метилимидазол:последовательность нуклеиновой кислоты, соединенная с твердофазной подложкой).
[361] Условие реакции окисления является идентичным на каждой стадии, включая температуру 25°С, время реакции 15 секунд и 0,05 М раствор йода в воде в качестве окисляющего агента; и молярное отношение йода к последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой на стадии связывания, 30:1. Реакцию проводят в смешанном растворителе, в котором отношение тетрагидрофуран:вода:пиридин составляет 3:1:1.
[362] Условие для реакции сульфуризации является идентичным на каждой стадии, включая температуру 25°С, время реакции 300 секунд и ксантановый гидрид в качестве агента сульфуризации; молярное отношение агента сульфуризации к последовательности нуклеиновой кислоты, соединенной с твердофазной подложкой на стадии связывания, 120:1. Реакцию проводят в смешанном растворителе, в котором отношение ацетонитрил: пиридин составляет 1:1.
[363] Условия отщепления и удаления защитной группы являются следующими: добавление синтезированной нуклеотидной последовательности, соединенной с подложкой, в 25 масс. % водный раствор аммиака для взаимодействия в течение 16 часов при 55°С, при этом количество водного раствора аммиака составляет 0,5 мл/мкмоль. Жидкость удаляют, а остаток концентрируют в вакууме до сухого состояния.
[364] Очистка и обессоливание: очистку нуклеиновой кислоты осуществляют с помощью колонки для препаративной ионной хроматографии (Source 15Q) с градиентным элюированием NaCl. В частности, элюент А: 20 мМ фосфат натрия (рН=8,1), растворитель: вода/ацетонитрил=9:1 (об./об.); элюент В: 1,5 М хлорид натрия, 20 мМ фосфат натрия (рН=8,1), растворитель: вода/ацетонитрил=9:1 (об./об.); градиент элюирования: элюент А:элюент В=100:0-50:50. Элюат собирают, объединяют и обессоливают, используя колонку для хроматографии с обращенной фазой. Конкретные условия включают применение колонки с сефадексом (наполнитель: сефадекс-G25) для обессоливания и деионизированной воды для элюирования.
[365] Определение: чистоту определяли с помощью ионообменной хроматографии (ИХ-ВЭЖХ); и молекулярную массу анализировали методом жидкостной хроматографии-масс-спектрометрии (ЖХ-МС).
(1-3) Синтез антисмысловых цепей конъюгатов 1-11
(1-3А) Получение антисмысловой цепи конъюгатов 1, 6 и 11
[366] Антисмысловые цепи (AS) конъюгатов 1 и 2 синтезировали путем запуска циклов с применением универсальной твердофазной подложки (загруженных UnyLinker™ твердых подложек NittoPhase®HL, Kinovate Life Sciences Inc.) в соответствии с твердофазным фосфоамидитным синтезом. Реакции снятия защиты, связывания, кэпирования, окисления или сульфуризации, отщепления, снятия защиты, очистки и обессоливания в способе твердофазного синтеза проводили в тех же условиях, как и при синтезе смысловой цепи.
[367] При этом модифицированный винилфосфатом и 2'-метокси уридиновый мономер (VP-Um) синтезируют в соответствии со следующим способом:

(1-3-1) Синтез VP-U-2
[368] Молекулу VP-U-2 синтезировали в соответствии со следующим способом:

[369] 2'-метокси-модифицированный урациловый нуклеозид (2'-OMe-U, 51,30 г, 91,6 ммоль), трет-бутилдифенилхлорсилан (TBDPSCl, 50,35 г, 183,2 ммоль) и имидазол (12,47 г, 183,2 ммоль) смешивали и растворяли в 450 мл N,N-диметилформамида (ДМФА) для взаимодействия при перемешивании при комнатной температуре в течение 20 часов. ДМФА удаляли с помощью выпаривания, а остаток растворяли в 600 мл дихлорметана и промывали с применением 300 мл насыщенного раствора бикарбоната натрия. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 300 мл дихлорметана. Все органические фазы объединяли, промывали 5% щавелевой кислотой до тех пор, пока рН водной фазы не достигал <5. Растворитель выпаривали до сухого состояния с получением неочищенного продукта VP-U-1, который непосредственно использовали в последующем синтезе VP-U-2.
[370] Неочищенный продукт VP-U-1 растворяли в 100 мл дихлорметана и затем перемешивали в течение 10 минут на ледяной бане. 450 мл 2% раствора п-толуолсульфоновой кислоты (со смешанным растворителем из метанола и дихлорметана в объемном отношении 3:7), предварительно охлажденного в холодильнике при 4°С, добавляли для взаимодействия в течение 10 минут. Реакцию останавливали путем добавления 200 мл насыщенного раствора бикарбоната натрия. Полученную органическую фазу промывали путем добавления насыщенного раствора бикарбоната натрия до рН=8. Водные фазы объединяли и дважды экстрагировали, каждый раз с применением 200 мл дихлорметана. Все органические фазы объединяли и промывали один раз с применением 200 мл насыщенного рассола. Растворитель удаляли с помощью выпаривания, и остаток очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром и элюировали с помощью градиентного элюирования простой петролейный эфир:этилацетат:дихлорметан:метанол=1:1:1:0,05-1:1:1:0,25. Элюат собирали, растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе с получением в общей сложности 40,00 г чистого продукта VP-U-2. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,96 (d, J=7,8 Гц, 1H), 7,64 (dtd, J=5,l, 4,0, 2,2 Гц, 4Н), 7,41-7,30 (m, 6Н), 6,79 (d, J=4,7 Гц, 1H), 5,73 (d, J=7,6 Гц, 1H), 4,94 (t, J=7,0 Гц, 1H), 4,12 (td, J=4,6, 3,9 Гц, 1H), 4,05 (dd, J=4,8, 4,0 Гц, 1H), 3,96 (t, J=4,7 Гц, 1H), 3,68 (ddd, J=11,8, 7,0, 4,6 Гц, 1H), 3,57-3,46 (m, 1H), 3,39 (s, 3Н), 1,05 (s, 8Н). MS m/z: C26H33N2O6Si, [М+Н]+, вычислено: 497,21, измерено: 497,45. (1-3-2) Синтез VP-U-4:

[371] VP-U-2 (19,84 г, 40,0 ммоль), дициклогексилкарбодиимид (DCC, 16,48 г, 80,0 ммоль), пиридин (4,20 г, 53,2 ммоль) и трифторуксусную кислоту (6,61 г, 53,2 ммоль) смешивали и растворяли в 200 мл диметилсульфоксида (ДМСО) для взаимодействия при перемешивании при комнатной температуре в течение 20 часов. Тетраэтилметилендифосфат (21,44 г, 74,4 ммоль) растворяли отдельно в 120 мл ТГФ, охлаждали на ледяной бане, добавляли t-BuOK (11,36 г, 101,2 ммоль) при температуре ледяной бани для взаимодействия в течение 10 минут, нагревали до комнатной температуры для взаимодействия в течение 0,5 часа и добавляли в вышеупомянутый реакционный раствор на приблизительно 1 час. Реакцию проводили при температуре ледяной бани в течение 1 часа, а затем нагревали до комнатной температуры для взаимодействия в течение 18 часов. Реакцию останавливали путем добавления воды. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 200 мл дихлорметана. Все органические фазы объединяли и промывали один раз с применением 200 мл насыщенного рассола. Растворитель выпаривали до сухого состояния, и остаток очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром и элюировали с помощью градиентного элюирования простой петролейный эфир:этилацетат=1:1-1:4. Элюат собирали, растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе с получением в общей сложности 14,00 г чистого продукта VP-U-4. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,96 (d, J=7,8 Гц, 1H), 7,64 (dtd, J=5,1, 4,0, 2,2 Гц, 4Н), 7,41-7,30 (m, 6Н), 6,82-6,71 (m, 2Н), 5,90 (ddd, J=25,9, 15,0, 1,0 Гц, 1H), 5,73 (d, J=7,6 Гц, 1H), 4,36-4,21 (m, 3Н), 4,18 (t, J=4,9 Гц, 1H), 4,05 (ddq, J=9,7, 8,5, 6,9 Гц, 2Н), 3,87 (t, J=4,8 Гц, 1H), 3,39 (s, 3Н), 1,32 (td, J=6,9, 0,7 Гц, 6Н), 1,05 (s, 8Н). MS m/z: C31H42N2O8PSi, [М+Н]+, вычислено: 629,24, измерено: 629,51.
(1-3-3) Синтез VP-U-5:
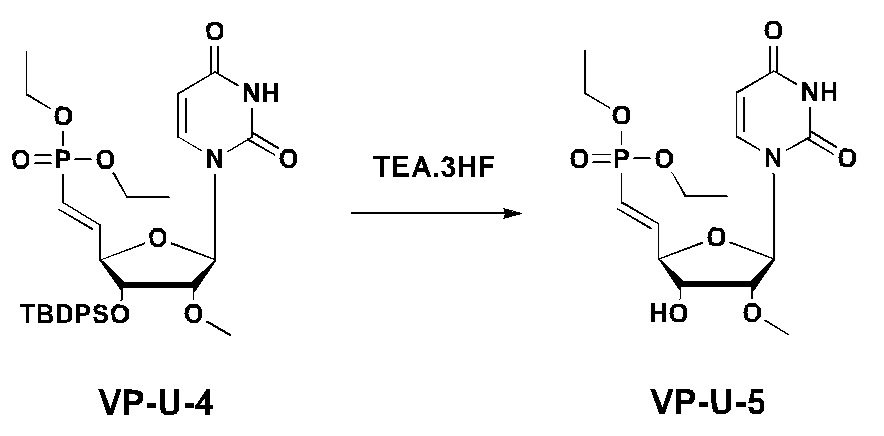
VP-U-4 (14,00 г, 22,29 ммоль) растворяли в 100 мл тетрагидрофурана, добавляли тригидрофторид триэтиламина (17,96 г, 111,45 ммоль) и перемешивали при комнатной температуре в течение 20 часов для полного взаимодействия. Растворитель непосредственно выпаривали до сухого состояния и остаток растворяли в дихлорметане; вышеуказанные стадии выпаривания и растворения дополнительно повторяли дважды, каждый раз с применением 50 мл дихлорметана, чтобы получить неочищенный продукт. Неочищенный продукт очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром и элюировали с помощью градиентного элюирования простой петролейный эфир:этилацетат:дихлорметан:метанол=1:1:1:0,05-1:1:1:0,25. Элюат собирали, растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе с получением в общей сложности 6,70 г чистого продукта VP-U-5. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,96 (d, J=7,8 Гц, 1H), 6,77 (dd, J=15,0, 6,2 Гц, 1H), 5,99-5,82 (m, 2Н), 5,73 (d, J=7,6 Гц, 1H), 5,27 (d, J=5,1 Гц, 1H), 5,10 (dd, J=5,3, 4,7 Гц, 1H), 4,29 (ddq, J=9,8, 8,6, 7,0 Гц, 2Н), 4,17 (ddd, J=6,2, 5,2, 1,0 Гц, 1H), 4,12-3,98 (m, 3Н), 3,39 (s, 2Н), 1,32 (td, J=6,9, 0,6 Гц, 6Н). MS m/z: C15H24N2O8P, [М+Н]+, вычислено: 391,13, измерено: 391,38.
(1-3-4) Синтез VP-U-6:

[372] VP-U-5 (391 мг, 1,0 ммоль), трифторацетат пиридина (0,232 г, 1,2 ммоль), N-метилимидазол (0,099 г, 1,2 ммоль) и бис-(диизопропиламино)(2-цианоэтокси)фосфин (0,452 г, 1,5 ммоль) добавляли в 10 мл безводного дихлорметана в атмосфере аргона для взаимодействия при перемешивании при комнатной температуре в течение 5 часов. Растворитель выпаривали до сухого состояния, а затем остаток очищали с помощью колоночной хроматографии (силикагель с обычной фазой 200-300 меш, с градиентным элюированием дихлорметан:ацетонитрил (с 0,5 масс. % триэтиламина)=3:1-1:3). Элюат собирали и концентрировали для удаления растворителя с получением в общей сложности 508 мг целевого продукта VP-U-6. Р31-ЯМР (161 МГц, ДМСО-d6) δ 150,34, 150,29, 17,07, 15,50. MS m/z: C24H41N4O9P2, [М+Н]+, вычислено: 591,23, измерено: 591,55. Было указано, что VP-U-6 представляет собой целевой продукт VP-Um, который участвует в синтезе цепей РНК в качестве нуклеозидного мономера.
(1-3В) Получение антисмысловой цепи конъюгатов 2 и 10
[373] Антисмысловые цепи конъюгатов 2 и 10 отличаются от таковых конъюгатов 1 и 11 только модификацией первого 5'-концевого нуклеотида. Во время получения антисмысловой цепи в соответствии со способом твердофазного фосфоамидитного синтеза, после присоединения 2'-метокси-модифицированного уридинового мономера в качестве последнего нуклеозидного мономера, который должен быть присоединен, мономер Формулы (CPR-I) (приобретен у Suzhou GenePharma Inc. каталожный номер 13-2601-XX) соединяли с 5'-концом антисмысловой цепи с помощью четырехступенчатой реакции снятия защиты, связывания, кэпирования и окисления с образованием 5'-фосфоэфирной модификации.
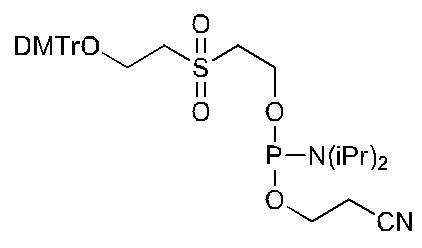
(CPR-I)
[374] Во время синтеза универсальная твердофазная подложка, которая будет применена, условия снятия защиты, связывания, кэпирования, реакции окисления или сульфуризации, отщепления и снятия защиты, очистки и обессоливания аналогичны тем, которые
применяли при синтезе смысловой цепи.
(1-3С) Получение антисмысловой цепи конъюгатов 3, 4 и 9
[375] Для синтеза антисмысловой цепи применяли процедуру синтеза, аналогичную таковой для конъюгатов 2 и 19, за исключением того, что при соединении мономера CPR-I вышеуказанное условие реакции окисления заменяли условием реакции сульфуризации, что позволило получить антисмысловую цепь конъюгатов 3, 4 и 9 с 5'-фосфотиоатной модификацией.
(1-3D) Получение антисмысловой цепи конъюгатов 5, 7 и 8
[376] Антисмысловые цепи (AS) конъюгатов 5, 7 и 8 синтезировали путем запуска циклов с применением универсальной твердофазной подложки (загруженные UnyLinker™ твердые подложки NittoPhase®HL, Kinovate Life Sciences Inc.) в соответствии с твердофазным фосфоамидитным синтезом. Реакции снятия защиты, связывания, кэпирования, окисления или сульфуризации, отщепления, снятия защиты, очистки и обессоливания в способе твердофазного синтеза проводили в тех же условиях, как и при синтезе смысловой цепи.
(1-4) Синтез конъюгатов 1-11
[377] Для конъюгата 1 цепь S и цепь AS, соответственно, растворяли в воде для инъекций с получением раствора 40 мг/м. Их смешивают в эквимолярном отношении, нагревают при 50°С в течение 15 минут и затем охлаждают до комнатной температуры так, что они могут образовывать двухцепочечную структуру за счет водородных связей. Конъюгат разбавляли до концентрации 0,2 мг/мл ультрачистой водой (приготовленной с помощью прибора для чистой воды Milli-Q, с удельным сопротивлением 18,2 МОм*см (25°С)). Молекулярную массу измеряли с помощью прибора для ЖХ-МС (приобретен у Waters Corp., модель: LCT Premier). Поскольку измеренные значения соответствовали вычисленным значениям, было подтверждено, что синтезированный конъюгат 1 представлял собой разработанную последовательность двухцепочечной нуклеиновой кислоты, представляющую интерес, с конъюгирующей молекулой L-9.
[378] Смысловые нити и соответствующие антисмысловые нити конъюгатов 2-11, синтезированные как описано выше, ренатурировали в соответствии с этим же способом с образованием двухцепочечных структур; и молекулярные массы конъюгатов измеряли следующим образом:
Конъюгат 2: вычисленные значения S: 7516,37, AS: 7065,58;
измеренные значения: S: 7516,6, AS: 7064,5;
Конъюгат 3: вычисленные значения S: 7504,34, AS: 7139,68;
измеренные значения: S: 7515,6, AS: 7138,9;
Конъюгат 4: вычисленные значения S: 7516,37, AS: 7081,64;
измеренные значения: S: 7515,6, AS: 7080,9;
Конъюгат 5: вычисленные значения S: 7504,34, AS: 6961,52;
измеренные значения: S: 7503,4, AS: 6960,9;
Конъюгат 6: вычисленные значения S: 7504,34, AS: 7037,51;
измеренные значения: S: 7503,6, AS: 7036,9;
Конъюгат 7: вычисленные значения S: 8218,83, AS: 7703,05;
измеренные значения: S: 8218, AS: 7702,5;
Конъюгат 8: вычисленные значения S: 7516,37, AS: 6985,58;
измеренные значения: S: 7516,5, AS: 6984,9;
Конъюгат 9: вычисленные значения S: 7504,34, AS: 7041,52;
измеренные значения: S: 7503,6, AS: 7040,8;
Конъюгат 10: вычисленные значения S: 7504,34, AS: 7057,58,
измеренные значения: S: 7503,6, AS: 7057;
измеренные значения соответствовали вычисленным значениям, это свидетельствует о том, что синтезированные конъюгаты представляли собой конъюгаты миРНК с целевыми последовательностями.
Конъюгаты 1-11 имеют структуру, представленную Формулой (3).
Пример получения 2
Получение конъюгатов 12-26 и сравнительного конъюгата 1
[379] Ожидалось, что рассматриваемые конъюгаты могут быть получены с применением того же способа, как и в Примере получения 1, за исключением того, что: 1) миРНК имеют последовательности, представленные в таблице 1, соответственно, соответствующие конъюгатам 12-26 и сравнительному конъюгату 1; и 2) в случае если целевая последовательность содержит немодифицированный нуклеотид, в условиях расщепления и снятия защиты, после обработки водным раствором аммиака, продукт растворяют в N-метилпирролидоне в количестве 0,4 мл/мкмоль с последующим добавлением 0,3 мл/мкмоль триэтиламина и 0,6 мл/мкмоль тригидрофторида триэтиламина, по отношению к количеству одиночной цепи нуклеиновой кислоты, что приводит к удалению защитной группы 2'-TBDMS на рибозе.
[380] Последовательности конъюгированных миРНК в конъюгатах согласно настоящему изобретению представлены в таблице 3. При этом миРНК, содержащаяся в сравнительном конъюгате 1, представляет собой миРНК для отрицательного контроля (далее по тексту также упоминается как NC), которая не проявляет ингибирующий эффект в отношении гена ВГВ.






(3-1) Синтез соединений Р-10
[381] Соединения Р-10 синтезировали в соответствии со следующим способом:

(3-1-1) Синтез GAL5-C4-1
[382] GAL-5 (13,43 г, 30,0 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-1) выше, гидрохлорид трет-бутил-4-аминобутирата (5,87 г, 30,0 ммоль), гексафторфосфат О-бензотриазолтетраметилурония (13,65 г, 36,0 ммоль) и диизопропилэтиламин (11,63 г, 90,0 ммоль) добавляли в 40 мл N,N-диметилформамида, растворяли до однородности и затем перемешивали при комнатной температуре для (3-1) Синтез соединений Р-10
[381] Соединения Р-10 синтезировали в соответствии со следующим способом:

(3-1-1) Синтез GAL5-C4-1
[382] GAL-5 (13,43 г, 30,0 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-1) выше, гидрохлорид трет-бутил-4-аминобутирата (5,87 г, 30,0 ммоль), гексафторфосфат O-бензотриазолтетраметилурония (13,65 г, 36,0 ммоль) и диизопропилэтиламин (11,63 г, 90,0 ммоль) добавляли в 40 мл N,N-диметилформамида, растворяли до однородности и затем перемешивали при комнатной температуре для взаимодействия в течение 5 часов. К полученному реакционному раствору добавляли 300 мл насыщенного водного раствора бикарбоната натрия, трижды экстрагировали, каждый раз с применением 200 мл этилацетата. Все органические фазы объединяли и промывали один раз с применением 200 мл насыщенного рассола. Органическую фазу выделяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении до сухого состояния с получением 30,3 г неочищенного продукта GAL5-C4-1 в виде масла, который непосредственно использовали в следующей реакции.
(3-1-2) Синтез GAL5-C4-2
[383] Неочищенный продукт GAL5-C4-1 (30,3 г, 30 ммоль), полученный на стадии (3-1-1), растворяли в 180 мл муравьиной кислоты и перемешивали при комнатной температуре для взаимодействия в течение 16 часов. Растворитель выпаривали до сухого состояния. Остаток очищали с помощью колоночной хроматографии (силикагель с обычной фазой с 200-300 меш, градиентное элюирование дихлорметан : метанол = 100:18-100:20). Элюат собирали и концентрировали для удаления растворителей с получением в общей сложности 14,84 г целевого продукта GAL5-C4-2.
(3-1-3) Синтез Р-6:
[384] M-18-Tr (2,02 г, 4,69 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-4), и GAL5-C4-2 (8,24 г, 15,48 ммоль), полученный на стадии (3-1-2) смешивали и растворяли в 47 мл ацетонитрила, добавляли N-метилморфолин (3,13 г, 30,96 ммоль), а затем гидрохлорид 4-(4,6-диметокситриазин-2-ил)-4-метилморфолина (DMTMM, 4,28 г, 15,48 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 2 часов. Полученный реакционный раствор разбавляли 20 мл дихлорметана. Полученную органическую фазу промывали с применением 10 мл насыщенного раствора бикарбоната натрия и 10 мл насыщенного рассола, соответственно. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта, который очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с помощью градиентного элюирования дихлорметан : метанол = 100:5-100:7. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением в общей сложности 8,27 г чистого продукта Р-6.
(3-1-4) Синтез Р-7:
[385] Р-6 (6,82 г, 3,456 ммоль), полученный на стадии (3-1-3) выше, растворяли в 69 мл дихлорметана и добавляли дихлоруксусную кислоту (13,367 г, 103,67 ммоль) для взаимодействия при комнатной температуре в течение 2 часов. Полученный реакционный раствор разбавляли путем добавления 100 мл дихлорметана, промывали и доводили до рН=7-8 насыщенным раствором бикарбоната натрия. Выделенную водную фазу экстрагировали шесть раз, каждый раз с применением 30 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Затем растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). В колонку вносили 10 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали 1 масс. %о триэтиламином и элюировали с помощью градиентного элюирования дихлорметан : метанол = 100:30-100:40. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением в общей сложности 4,82 г Р-7. MS m/z: C78H127N10033, [М+Н]+, вычислено: 1732,91, измерено: 1735,73.
(3-1-5) Синтез Р-8:

(А-1)
[386] Р-7 (2,653 г, 1,532 ммоль) и А-1 (2,342 г, 4,596 ммоль) смешивали и растворяли в 16 мл дихлорметана, добавляли 3-диэтоксифосфорил-1,2,3-бензотризин-4(3Н)-он (DEPBT) (1,375 г, 4,596 ммоль) с последующим добавлением диизопропилэтиламина (1,188 г, 9,191 ммоль) для взаимодействия при перемешивании при 25°С в течение 2 часов. Органическую фазу промывали с применением 10 мл насыщенного раствора бикарбоната натрия. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 10 мл дихлорметана. Все органические фазы объединяли и промывали с применением 10 мл насыщенного рассола. Выделенную водную фазу дважды экстрагировали, каждый раз с применением 10 мл дихлорметана, и полученные органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении и высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 120 г силикагеля с обычной фазой (200-300 меш), добавляли 20 мл триэтиламина для нейтрализации кислотности силикагеля, уравновешивали простым петролейным эфиром, содержащим 1 масс. % триэтиламина, и элюировали с помощью градиентного элюирования простой петролейный эфир : этилацетат : дихлорметан : N,N-диметилформамид = 1:1:1:0,5-1:1:1:0,6. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением в общей сложности 2,793 г чистого продукта Р-8.
(3-1-6) Синтез Р-9:
[387] Р-8 (490 мг, 0,231 ммоль), янтарный ангидрид (69 мг, 0,693 ммоль) и 4-диметиламинопиридин (DMAP, 68 мг, 0,554 ммоль) смешивали и растворяли в 2,3 мл дихлорметана и добавляли диизопропилэтиламин (DIEA, 149 мг, 1,155 ммоль) для взаимодействия при перемешивании при 25°С в течение 21 часа. К полученному реакционному раствору добавляли 50 мл дихлорметана для разбавления и затем промывали с применением 100 мл 0,5 М фосфата триэтиламина. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 10 мл дихлорметана. Все органические фазы объединяли, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 80 г силикагеля с обычной фазой (200-300 меш), добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали дихлорметаном и элюировали с помощью градиентного элюирования дихлорметан (содержащий 1 масс. %о триэтиламина) : метанол = 100:18-100:20. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением в общей сложности 200 мг чистого продукта конъюгирующей молекулы Р-9. MS m/z: C106H153N10041, [M-DMTr]+, вычислено: 1921,05, измерено: 1920,97.
(3-1-7) Синтез Р-10:
[388] Р-10 получали, применяя тот же способ, как и на стадии (1-1-9) примера получения 1, за исключением того, что: конъюгирующую молекулу Р-9 использовали для замены конъюгирующей молекулы L-9, чтобы получить таким образом конъюгирующую молекулу Р-9, соединенную с твердофазной подложкой.
(3-2) Синтез конъюгата Р10-siHBa1M1SVP
[389] Конъюгат 27 получали, применяя тот же способ, как и на стадиях (1-2), (1-3А) и (1-4) примера получения 1, за исключением того, что соединение Р-10 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат P10-siHBa1M1SVP со структурой, представленной Формулой (4).
Пример получения 4
Получение конъюгата R5-siHBa1M1SVP (конъюгат 28)
(4-1) Синтез соединения R-5
[390] Соединение R-5 синтезировали следующим способом:
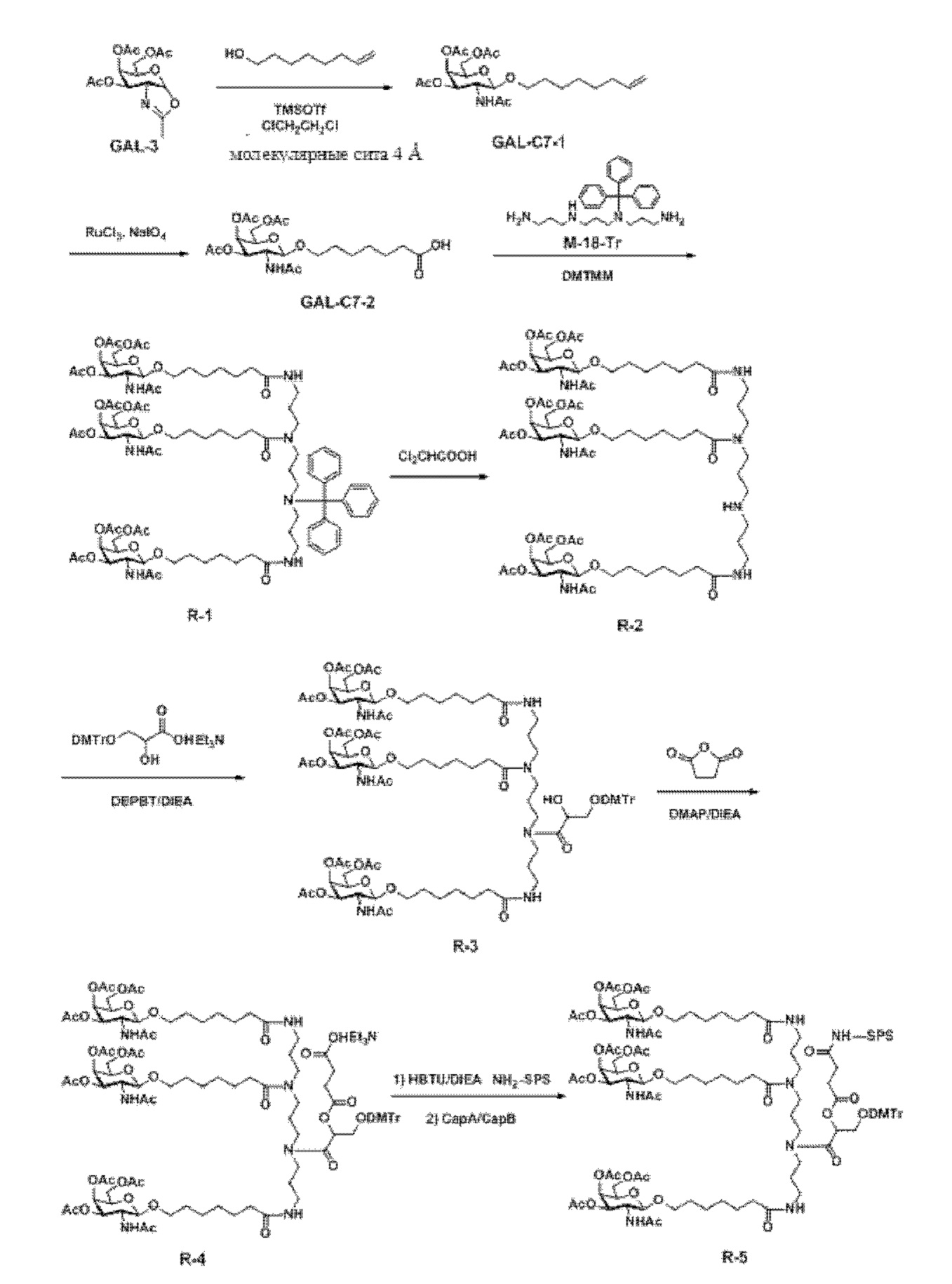
(4-1-1) Синтез GAL-C7-1
[391] GAL-3 (26,4 г, 80,2 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-1b), растворяли в 134 мл безводного 1,2-дихлорэтана и добавляли 60 г порошка молекулярного сита 4А, а затем 7-октен-1-ол (11,3 г, 88,2 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 10 минут. Триметилсилилтрифторметансульфонат (8,9 г, 40,1 ммоль) добавляли на ледяной бане и в атмосфере азота для взаимодействия при перемешивании при комнатной температуре в течение 24 часов. Порошок молекулярного сита 4А удаляли с помощью фильтрации. Для промывки в фильтрат добавляли 500 мл насыщенного водного раствора бикарбоната натрия. Выделяли органическую фазу. Водную фазу экстрагировали один раз с применением 100 мл дихлорметана. Все органические фазы объединяли и промывали один раз с применением 250 мл насыщенного рассола. Органическую фазу выделяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении до сухого состояния с получением 33,3 г продукта GAL-C7-1 в виде желтого сиропа, который непосредственно использовали в следующей реакции окисления без очистки.
(4-1-2) Синтез GAL-C7-2
[392] GAL-C7-1 (33,3 г, 72,8 ммоль), полученный на стадии (4-1-1), растворяли в смешанном растворителе из 160 мл дихлорметана и 160 мл ацетонитрила, добавляли 216 мл воды и твердого периодата натрия (62,3 г, 291,2 ммоль), соответственно, перемешивали на бане с ледяной водой в течение 10 минут и добавляли катализатор трихлорид рутения (498 мг, 2,4 ммоль). Реакционную смесь естественным образом нагревали до комнатной температуры и перемешивали в течение 23 часов. Полученный реакционный раствор разбавляли путем добавления 200 мл воды при перемешивании и доводили рН до 7,5 путем добавления насыщенного раствора бикарбоната натрия. Органическую фазу отделяли и удаляли. Водную фазу трижды экстрагировали, каждый раз с применением дихлорметана. Органические фазы, полученные в результате экстракции, удаляли. Водную фазу, полученную в результате экстракции, доводили до рН приблизительно 3 с помощью сухого вещества лимонной кислоты и трижды экстрагировали, каждый раз с применением 200 мл дихлорметана, полученные органические фазы объединяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении, а затем остаток очищали с помощью колоночной хроматографии (силикагель с обычной фазой с 200-300 меш, с градиентным элюированием дихлорметан : метанол = 100:18-100:20) с получением 22,4 г продукта GAL-C7-2 в виде белого пенистого вещества. MS m/z: C21H32N011, [М+Н]+, вычислено: 476,50, измерено: 475,94.
(4-1-3) Синтез R-1:
[393] M-18-Tr (2,02 г, 4,69 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-4), и GAL-C7-2 (7,36 г, 15,48 ммоль) смешивали и растворяли в 47 мл ацетонитрила, добавляли N-метилморфолин (3,13 г, 30,96 ммоль), а затем гидрохлорид 4-(4,6-диметокситриазин-2-ил)-4-метилморфолина (DMTMM, 4,28 г, 15,48 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 2 часов. Полученный реакционный раствор разбавляли 200 мл дихлорметана. Органическую фазу промывали с применением 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного рассола, соответственно. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта, который очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с помощью градиентного элюирования дихлорметан : метанол = 100:5-100:7. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 7,82 г чистого продукта R-1.
(4-1-4) Синтез R-2:
[394] R-1 (6,23 г, 3,456 ммоль) растворяли в 69 мл дихлорметана и добавляли дихлоруксусную кислоту (13,367 г, 103,67 ммоль) для взаимодействия при комнатной температуре в течение 2 часов. Полученный реакционный раствор разбавляли путем добавления 100 мл дихлорметана, промывали и доводили до рН=7-8 насыщенным раствором бикарбоната натрия. Выделенную водную фазу экстрагировали шесть раз, каждый раз с применением 30 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Затем растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали с помощью колонки с силикагелем с обычной фазой (200-300 меш). В колонку вносили 10 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали 1 масс. %о триэтиламином и элюировали с помощью градиентного элюирования дихлорметан : метанол = 100:30-100:40. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 4,49 г чистого продукта R-2.
(4-1-5) Синтез R-3:
[395] R-2 (2,391 г, 1,532 ммоль) и А-1 (2,342 г, 4,596 ммоль) смешивали и растворяли в 16 мл дихлорметана, добавляли 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT, 1,375 г, 4,596 ммоль), а затем диизопропилэтиламин (1,188 г, 9,191 ммоль) для взаимодействия при перемешивании при 25°С в течение 2 часов. Органическую фазу промывали с применением 10 мл насыщенного раствора бикарбоната натрия. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 10 мл дихлорметана. Органическую фазу промывали с применением 10 мл насыщенного рассола. Выделенную водную фазу дважды экстрагировали, каждый раз с применением 10 мл дихлорметана, и полученные органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 120 г силикагеля с обычной фазой (200-300 меш), добавляли 20 мл триэтиламина для нейтрализации кислотности силикагеля и уравновешивали простым петролейным эфиром, содержащим 1 масс. % триэтиламина, и элюировали с помощью градиентного элюирования простой петролейный эфир:этилацетат : дихлорметан : N,N-диметилформамид = 1:1:1:0,5-1:1:1:0,6. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 2,642 г чистого продукта R-3.
(4-1-6) Синтез R-4:
[396] R-3 (795 мг, 0,4074 ммоль), янтарный ангидрид (82 мг, 0,8148 ммоль) и 4-диметиламино пиридин (DMAP, 100 мг, 0,8148 ммоль) смешивали и растворяли в 4 мл дихлорметана и добавляли диизопропилэтиламин (DIEA, 100 мг, 0,8148 ммоль) для взаимодействия при перемешивании при 25°С в течение 18 часов. Полученный реакционный раствор промывали с применением 5 мл 0,5 М фосфата триэтиламина. Водную фазу трижды экстрагировали, каждый раз с применением 5 мл дихлорметана. Все органические фазы объединяли, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 30 г силикагеля с обычной фазой (200-300 меш), добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали дихлорметаном и элюировали с помощью градиентного элюирования дихлорметан (содержащий 1 масс. %о триэтиламина) : метанол = 100:18-100:20. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 505 мг чистого продукта конъюгирующей молекулы R-4.
(4-1-7) Синтез R-5
[397] R-5 получали, применяя тот же способ, как и на стадии (1-1-9) примера получения 1, за исключением того, что: конъюгирующую молекулу R-4 использовали для замены конъюгирующей молекулы L-9, чтобы получить таким образом конъюгирующую молекулу R-4, соединенную с твердофазной подложкой.
(4-2) Синтез конъюгата R5-siHBa1M1SVP
[398] Конъюгат 28 получали, применяя тот же способ, как и на стадиях (1-2), (1-3А) и (1-4) примера получения 1, за исключением того, что соединение R-5 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат R5-siHBa1M1SVP со структурой, представленной Формулой (7).
Пример получения 5
Получение LA5-siHBa1M1SVP (конъюгат 29)
[399] Ожидалось, что соединение LA-5 можно синтезировать в соответствии со следующим технологическим путем:

[400] Конъюгат 29 получали, применяя тот же способ, как и на стадиях (1-2), (1-3А) и (1-4) примера получения 1, за исключением того, что соединение LA-5 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат LA5-siHBa1M1SVP со структурой, представленной Формулой (12).
Пример получения 6
Получение конъюгата LB5-siHBa1M1SVP (конъюгат 30)
(6-1) Синтез соединения LB-5
[401] Соединение LB-5 синтезировали в соответствии со следующим способом:

(6-1-1) Синтез LB-1:
[402] L-8 (5,0 г, 3,386 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-6), адипиновый ангидрид (870 мг, 6,772 ммоль) и 4-диметиламинопиридин (DMAP, 827 мг, 6,772 ммоль) смешивали и растворяли в 130 мл дихлорметана, затем добавляли диизопропилэтиламин (DIEA, 2,2 г, 16,931 ммоль) для взаимодействия при перемешивании при 25°С в течение 4 часов. К полученному реакционному раствору добавляли 70 мл дихлорметана для разбавления и затем промывали с применением 0,5 М фосфата триэтиламина. Выделенную водную фазу экстрагировали четыре раза, каждый раз с применением 10 мл дихлорметана. Все органические фазы объединяли, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 120 г силикагеля с обычной фазой (200-300 меш), добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали дихлорметаном и элюировали с помощью градиентного элюирования простой петролейный эфир : этилацетат : дихлорметан : метанол = 1:1:1:0,2-1:1:1:1. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 4,267 г чистого продукта LB-1.
(6-1-2) Синтез LB-2:
[403] LB-1 (4,697 г, 2,753 ммоль, комбинация 2 партий), полученный в соответствии со способом, описанным на стадии (6-1-1), 3-амино-1,2-пропандиол (313 мг, 3,442 ммоль), гидрохлорид 4-(4,6-диметокситриазин-2-ил)-4-метилморфолина (DMTMM, 953 мг, 3,442 ммоль) и N-метилморфолин (700 мг, 6,884 ммоль) последовательно добавляли к смеси из 30 мл ацето нитрила и 3 мл метанола для взаимодействия при перемешивании при комнатной температуре в течение ночи. Растворитель выпаривали до сухого состояния, и остаток очищали с помощью колоночной хроматографии (силикагель с обычной фазой с 200-300 меш, градиентное элюирование дихлорметан : метанол = 1:0,07-1:0,5). Элюат собирали и концентрировали для удаления растворителей с получением 3,27 г целевого продукта LB-2.
(6-1-3) Синтез LB-3:
[404] LB-2 (2,27 г, 1,353 ммоль) растворяли в 14 мл безводного пиридина и добавляли хлорид 4,4'-диметокситритила (688 мг, 2,03 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение ночи. Реакцию останавливали путем добавления 150 мл метанола. Растворитель выпаривали до сухого состояния, и остаток очищали с помощью колоночной хроматографии (силикагель с обычной фазой с 200-300 меш, градиентное элюирование дихлорметан : метанол = 1:0,05-1:0,2). Элюат собирали и концентрировали для удаления растворителя с получением 1,647 г целевого продукта LB-3.
(6-1-4) Синтез LB-4:
[405] LB-3 (822 мг, 0,415 ммоль), янтарный ангидрид (83 г, 0,83 ммоль) и 4-диметиламино пиридин (DMAP, 102 мг, 0,83 ммоль) смешивали и растворяли в 4 мл дихлорметана, добавляли DIEA (270 мг, 2,075 ммоль) и перемешивали при 25°С для взаимодействия в течение ночи. Полученный реакционный раствор трижды промывали с применением 0,5 М фосфата триэтиламина. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 2 мл дихлорметана. Все органические фазы объединяли, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли силикагелем с обычной фазой (200-300 меш), добавляли 5 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали простым петролейным эфиром и элюировали с помощью градиентного элюирования дихлорметан (содержащий 1 масс. %о триэтиламина):метанол=100:5-100:20. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 787 мг чистого продукта конъюгирующей молекулы LB-4.
(6-1-5) Синтез LB-5
[406] LB-5 получали, применяя тот же способ, как и на стадии (1-1-9) примера получения 1, за исключением того, что: конъюгирующую молекулу LB-4 использовали для замены конъюгирующей молекулы L-9, чтобы получить таким образом конъюгирующую молекулу LB-4, соединенную с твердофазной подложкой.
(6-2) Синтез конъюгата LB5-siHBa1M1SVP
[407] Конъюгат 30 получали, применяя тот же способ, как и на стадиях (1-2), (1-3А) и (1-4) примера получения 1, за исключением того, что соединение LB-5 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат LB5-siHBa1M1SVP со структурой, представленной Формулой (13).
Пример получения 7
Получение конъюгата VS-siHBa1M1SVP (конъюгат 31)
[408] Ожидалось, что соединение V-8 может быть синтезировано в соответствии со следующим технологическим путем:

[409] Конъюгат 31 получали, применяя тот же способ, как и на стадиях (1-2), (1-3А) и (1-4) примера получения 1, за исключением того, что соединение V-8 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат VS-siHBa1M1SVP со структурой, представленной Формулой (14).
Пример получения 8
Получение конъюгата WS-siHBa1M1SVP (конъюгат 32)
(8-1) Синтез соединения W-8
[410] Соединение W-8 синтезировали в соответствии со следующим способом:

(8-1-1) Синтез W-1:
[411] W-0 (2,024 г, 10 ммоль) растворяли в 25 мл ацетонитрила, добавляли триэтиламин (4,048 г, 40 ммоль) и охлаждали до приблизительно 0°С на бане с ледяной водой. Этилтрифторацетат (5,683 г, 40 ммоль) добавляли для взаимодействия при комнатной температуре в течение 22 часов. Растворитель удаляли с помощью выпаривания при пониженном давлении, и остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение 18 часов с получением 5,835 г неочищенного твердого продукта W-1.
(8-1-2) Синтез W-2:
[412] Неочищенный продукт W-1 (5,835 г, 10 ммоль) растворяли в 50 мл дихлорметана. К полученному реакционному раствору добавляли TrCl (3,345 г, 12 ммоль) и триэтиламин (1,518 г, 15 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 20 часов. Полученный реакционный раствор дважды промывали, каждый раз с применением 20 мл насыщенного раствора бикарбоната натрия и один раз с применением 20 мл насыщенного рассола. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Органический растворитель удаляли с помощью выпаривания при пониженном давлении, а остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением 8,012 г неочищенного твердого продукта W-2. Неочищенный твердый продукт W-2 использовали в последующей реакции снятия защиты без обработки.
(8-1-3) Синтез W-3:
[413] Неочищенный продукт W-2 (8,012 г, 10 ммоль) растворяли в 100 мл метанола и добавляли 100 мл водного раствора метиламина (40 масс. %) для взаимодействия при перемешивании при 50°С в течение 23 часов. Нерастворимые частицы удаляли с помощью фильтрации. Растворитель удаляли с помощью выпаривания при пониженном давлении. К остатку добавляли 200 мл смешанного растворителя ДХМ: метанол в объемном отношении 1:1, и полученную органическую фазу промывали с применением 50 мл насыщенного раствора бикарбоната натрия. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 50 мл дихлорметана. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи и очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с помощью градиентного элюирования дихлорметан: метанол: водный раствор аммиака (25 масс. %) = 1:1:0,05-1:1:0,25. Элюат собирали. Растворитель удаляли с помощью выпаривания при пониженном давлении, а остаток высушивали во вспененном состоянии в вакуумном масляном насосе с получением 3,062 г чистого продукта W-3.
(8-1-4) Синтез W-4:
[414] W-3 (0,675 г, 1,517 ммоль) и GAL-C7-2 (2,60 г, 5,46 ммоль) смешивали и растворяли в 47 мл ацетонитрила, добавляли диизопропилэтиламин (1,57 г, 12,14 ммоль), а затем 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT, 1,816 г, 6,04 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 2,5 часов. Полученный реакционный раствор разбавляли 100 мл дихлорметана. Полученную органическую фазу промывали с применением 80 мл насыщенного раствора бикарбоната натрия и 80 мл насыщенного рассола, соответственно. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта, который очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с помощью градиентного элюирования дихлорметан : метанол = 100:5-100:7. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 1,610 г чистого продукта W-4.
(8-1-5) Синтез W-5:
[415] W-4 (1,61 г, 0,886 ммоль) растворяли в 125 мл дихлорметана и добавляли дихлоруксусную кислоту (3,5 мл, 42,43 ммоль) для взаимодействия при комнатной температуре в течение 1 часа. Полученный реакционный раствор нейтрализовали путем добавления 150 мл пиридина. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). В колонку вносили 10 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали 1 масс. %о триэтиламином и элюировали с помощью градиентного элюирования дихлорметан : метанол = 100:30-100:40. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 1,26 г чистого продукта W-5.
(8-1-6) Синтез W-6:
[416] W-5 (1,25 г, 0,793 ммоль) и А-1 (1,21 г, 2,38 ммоль), полученные в соответствии со способом, описанным на стадии (1-1-7а), смешивали и растворяли в 12 мл дихлорметана и добавляли 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT, 0,712 г, 2,38 ммоль), а затем диизопропилэтиламин (0,615 г, 4,76 ммоль) для взаимодействия при перемешивании при 25°С в течение 3 часов. Органическую фазу промывали с применением 80 мл насыщенного раствора бикарбоната натрия. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 10 мл дихлорметана. Все органические фазы объединяли и промывали с применением 10 мл насыщенного рассола. Полученные органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, а остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 185 г силикагеля с обычной фазой (200-300 меш), добавляли 20 мл триэтиламина для нейтрализации кислотности силикагеля, уравновешивали простым петролейным эфиром, содержащим 1 масс. % триэтиламина, и элюировали с помощью градиентного элюирования простой петролейный эфир : этилацетат : дихлорметан : N,N-диметилформамид = 1:1:1:0,1-1:1:1:0,7. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 1,57 г чистого продукта W-6.
(8-1-7) Синтез W-7:
[417] W-6 (1,238 г, 0,63 ммоль), янтарный ангидрид (0,189 г, 1,89 ммоль) и 4-диметиламинопиридин (DMAP, 0,231 г, 1,89 ммоль) смешивали и растворяли в 7 мл дихлорметана, а затем добавляли DIEA (0,407 г, 3,15 ммоль) для взаимодействия при перемешивании при 25°С в течение 24 часов. Полученный реакционный раствор промывали с применением 5 мл 0,5 М фосфата триэтиламина. Выделенную водную фазу трижды экстрагировали, каждый раз с применением 5 мл дихлорметана. Все органические фазы объединяли, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 30 г силикагеля с обычной фазой (200-300 меш), добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали дихлорметаном и элюировали с помощью градиентного элюирования дихлорметан (содержащий 1 масс. %о триэтиламина) : метанол = 100:18-100:20. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 1,033 г чистого продукта конъюгирующей молекулы W-7. MS m/z: C101H146N7038, [M-DMTr]+, вычислено: 1763,92, измерено: 1763,21.
(8-1-8) Синтез W-8
[418] W-8 получали, применяя тот же способ, как и на стадии (1-1-9) примера получения 1, за исключением того, что: конъюгирующую молекулу W-7 использовали для замены конъюгирующей молекулы L-9, чтобы получить таким образом конъюгирующую молекулу W-7, соединенную с твердофазной подложкой.
(8-2) Синтез конъюгата W8-siHBa1M1SVP
[419] Конъюгат 32 получали, применяя тот же способ, как и на стадиях (1-2), (1-3 А) и (1-4) примера получения 1, за исключением того, что соединение W-8 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат WS-siHBa1M1SVP со структурой, представленной Формулой (15).
Пример получения 9
Получение конъюгата XS-siHBa1M1SVP (конъюгат 33)
[420] Ожидалось, что соединение Х-8 может быть синтезировано в соответствии со следующим технологическим путем:

[421] Конъюгат 33 получали, применяя тот же способ, как и на стадиях (1-2), (1-3 А) и (1-4) примера получения 1, за исключением того, что соединение Х-8 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат XS-siHBa1M1SVP со структурой, представленной Формулой (21).
Пример получения 10
Получение конъюгата Z5-siHBa1M1SVP (конъюгат 34)
(10-1) Синтез соединения Z-5
[422] Соединение Z-5 синтезировали в соответствии со следующим способом:

(10-1-1) Синтез Z-1:
[423] W-3 (1,50 г, 3,37 ммоль), полученный в соответствии со способом, описанным на стадии (8-1-3), и GAL5-C4-2 (7,18 г, 13,48 ммоль), полученный в соответствии со способом, описанным на стадии (3-1-2) смешивали и растворяли в 34 мл дихлорметана и добавляли диизопропилэтиламин (3,48 г, 26,96 ммоль), а затем 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT, 4,04 г, 13,48 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 4,5 часа. Полученный жидкий раствор разбавляли 100 мл дихлорметана. Органическую фазу промывали с применением 80 мл насыщенного раствора бикарбоната натрия и 80 мл насыщенного рассола, соответственно. Все органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта, который очищали с применением колонки с силикагелем с обычной фазой (200-300 меш). Колонку заполняли простым петролейным эфиром, добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля и элюировали с помощью градиентного элюирования дихлорметан : метанол = 30:1-15:1. Элюат собирали, и проводили экстракцию с помощью выпаривания при пониженном давлении с получением 3,97 г чистого продукта Z-1. MS m/z: C98H143N10033, [М+Н]+, вычислено: 1987,98, измерено: 1987,90.
(10-1-2) Синтез Z-2:
[424] Z-1 (3,97 г, 2,00 ммоль) растворяли в 250 мл дихлорметана и добавляли дихлоруксусную кислоту (10,941 г, 84,85 ммоль) для взаимодействия при комнатной температуре в течение 1 часа. Добавляли пиридин для нейтрализации полученного реакционного раствора до нейтрального. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. В колонку загружали 220 г силикагеля с обычной фазой с 200-300 меш и добавляли 10 масс. % пиридина для нейтрализации кислотности силикагеля, уравновешивали 1 масс. %о пиридином и элюировали с помощью градиентного элюирования дихлорметан : метанол = 10:1-2:1. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 3,49 г чистого продукта Z-2. MS m/z: C79H129N10033, [М+Н]+, вычислено: 1746,94, измерено: 1746,90.
(10-1-3) Синтез Z-3:
[425] Z-2 (3,49 г, 2,0 ммоль) и А-1 (3,06 г, 6,0 ммоль), полученные в соответствии со способом, описанным на стадии (1-1-7а), смешивали и растворяли в 30 мл дихлорметана и добавляли 3-диэтоксифосфорилокси-1,2,3-бензотризин-4(3Н)-он (DEPBT, 1,80 г, 6,0 ммоль), а затем диизопропилэтиламин (1,55 г, 12,0 ммоль) для взаимодействия в течение 3 часов при перемешивании при 25°С. К полученному реакционному раствору добавляли 100 мл дихлорметана для разбавления. Органическую фазу дважды промывали с применением 30 мл насыщенного раствора бикарбоната натрия. Водную фазу экстрагировали 10 мл дихлорметана. Все органические фазы объединяли и промывали с применением 50 мл насыщенного рассола. Полученные органические фазы объединяли, высушивали с применением безводного сульфата натрия и фильтровали. Растворитель удаляли с помощью выпаривания при пониженном давлении, а остаток высушивали во вспененном состоянии в вакуумном масляном насосе в течение ночи с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 200 г силикагеля с обычной фазой (200-300 меш), добавляли 20 мл триэтиламина для нейтрализации кислотности силикагеля. Колонку уравновешивали простым петролейным эфиром, содержащим 1 масс. % триэтиламина, и элюировали с помощью градиентного элюирования дихлорметан : метанол = 25:1-15:1. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 2,2 г чистого продукта Z-3. MS m/z: C103H151N10038, [М+Н]+, вычислено: 2136,02, измерено: 2136,20.
(10-1-4) Синтез Z-4:
[426] Z-3 (2,10 г, 0,983 ммоль) растворяли в 14,8 мл дихлорметана, содержащего DIEA (0,635 г, 4,915 ммоль), к полученному раствору добавляли 4-диметиламинопиридин (DMAP, 240 мг, 1,966 ммоль) и перемешивали до получения прозрачного раствора. Добавляли янтарный ангидрид (197 мг, 1,966 ммоль) для взаимодействия при перемешивании при 25°С в течение 18 часов. К полученному реакционному раствору добавляли 50 мл дихлорметана для разбавления и промывали с применением 80 мл 0,5 М фосфата триэтиламина. Водную фазу экстрагировали дважды, каждый раз с применением 50 мл дихлорметана. Все органические фазы объединяли, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением неочищенного продукта. Неочищенный продукт подвергали очистке на колонке. Колонку заполняли 188 г силикагеля с обычной фазой (200-300 меш), добавляли 1 масс. % триэтиламина для нейтрализации кислотности силикагеля, уравновешивали дихлорметаном и элюировали с помощью градиентного элюирования дихлорметан (содержащий 1 масс. ‰ триэтиламина) : метанол = 10:1-3:1. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 1,95 г чистого продукта конъюгирующей молекулы Z-4. MS m/z: C107H155N10041, [М+Н]+, вычислено: 1935,07, измерено: 1935,29.
(10-1-5) Синтез Z-5
[427] Z-5 получали, применяя тот же способ, как и на стадии (1-1-9) примера получения 1, за исключением того, что: конъюгирующую молекулу Z-4 использовали для замены конъюгирующей молекулы L-9, чтобы получить таким образом конъюгирующую молекулу Z-4, соединенную с твердофазной подложкой.
(10-2) Синтез конъюгата Z5-siHB1M1SVP
[428] Конъюгат 34 получали, применяя тот же способ, как и на стадиях (1-2), (1-3А) и (1-4) примера получения 1, за исключением того, что соединение Z-5 использовали для замены соединения L-10, чтобы начать синтез смысловой цепи. Ожидалось, что может быть получен конъюгат Z5-siHB1M1SVP со структурой, представленной Формулой (22).
Пример получения 11: этот пример получения использовали для иллюстрации получения конъюгатов 35-49
[429] В этом примере получения синтезировали конъюгаты 35-49. Последовательности конъюгированных миРНК в конъюгатах представлены в таблице 3.
(11-1) Синтез конъюгирующей молекулы FIN-2
[430] Конъюгирующую молекулу FIN-2 синтезировали в соответствии со способом получения, описанным в Rajeev et al., ChemBioChem 2015, 16, 903-908, в соответствии со следующим технологическим путем:
(11-1-1) Синтез PRO-10

(11-1-1а) Синтез PRO-7
[431] 2,93 г PRO-6 (L-гидроксипролин, № CAS 51-35-4, приобретен у Energy Chemical, 22,4 ммоль) растворяли в 22,5 мл 1,4-диоксана (№ CAS 123-91-1) и добавляли 34 мл 10% (масс./масс.) водного раствора Na2CO3 в виде суспензии. 6,95 г Fmoc-Cl (9-флуоренилметилхлорформиат, № CAS 28920-43-6, приобретен у Energy Chemical, 26,8 ммоль) растворяли в 34 мл 1,4-диоксана, добавляли в вышеуказанную суспензию на ледяной бане и естественным образом нагревали до комнатной температуры для взаимодействия в течение ночи. Реакционный раствор выливали в 150 мл ледяной воды и трижды экстрагировали, каждый раз с применением 100 мл простого метил-трет-бутилового эфира, и полученные органические фазы удаляли. Оставшуюся водную фазу доводили до рН≤5 концентрированной соляной кислотой, дважды экстрагировали, каждый раз с применением 100 мл этилацетата. Полученные органические фазы объединяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении с получением 7,83 г продукта PRO-7 в виде белого пенистого твердого вещества. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,91 (t, J=7,2 Гц, 2H), 7,67 (d, J=7,5 Гц, 2H), 7,48-7,39 (m, 2H), 7,38-7,27 (m, 2H), 5,17 (s, 1H), 4,27 (s, 2H), 4,23-4,11 (m, 2H), 3,55-3,41 (m, 3H), 2,31-2,10 (m, 1H), 2,08-1,88 (m, 1H). HRMS (ESI) m/z, вычислено для C20H19NO5 [M-H]-: 352,1190, измерено: 352,1033.
(11-1-1b) Синтез PRO-8
[432] 7,83 г PRO-7 (22,2 ммоль) растворяли в 80 мл ТГФ (№ CAS 109-99-9), нагревали до 65°С на масляной бане, добавляли 36,6 мл 2 моль/л раствора ВН3-Me2S в ТГФ (№ CAS 13292-87-0, приобретен у J&K Scientific Ltd., 73,2 ммоль) с обратным холодильником, и непрерывно нагревали с обратным холодильником для взаимодействия в течение 3 часов. Реакционный раствор выливали, а оставшееся твердое вещество растворяли в метаноле. К полученному реакционному раствору при перемешивании добавляли метанол до тех пор, пока не прекращалось выделение газа, непрерывно перемешивали в течение 30 минут. Растворитель удаляли с помощью выпаривания при пониженном давлении, а затем остаток трижды очищали с применением простого петролейного эфира с получением 7,1 г продукта PRO-8 в виде белого твердого вещества. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,91 (t, J=6,7 Гц, 2H), 7,67 (d, J=7,2 Гц, 2H), 7,49-7,39 (m, 2H), 7,38-7,26 (m, 2H), 5,18 (dd, J=6,1, 3,8 Гц, 1Н), 4,28 (s, 2H), 4,23-4,13 (m, 2H), 3,55-3,38 (m, 2H), 2,32-2,11 (m, 1H), 2,08-1,89 (m, 1H). HRMS (ESI) m/z, вычислено для C20H21NO4 [M+Na]+362,1368, измерено: 362,1012.
(11-1-1с) Синтез PRO-9
[433] 7,1 г PRO-8 (21 ммоль) растворяли в 100 мл пиридина и добавляли 14,2 г DMTr-Cl (хлорида 4,4'-диметокситритила, 42 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 5 часов. Растворитель удаляли с помощью выпаривания при пониженном давлении. Полученный неочищенный продукт растворяли в этилацетате и фильтровали для удаления солевых примесей. Растворитель удаляли с помощью выпаривания при пониженном давлении, а затем остаток очищали с применением колонки с силикагелем. Для очистки неочищенный продукт, растворенный в ДХМ, загружали на колонку с силикагелем, предварительно обработанную пиридином для подщелачивания колонки. DMTr-Cl элюировали ДХМ, содержащим 1% (об./об.) пиридина, а затем продукт элюировали этилацетатом. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 8,2 г продукта PRO-9 в виде белого твердого вещества. HRMS (ESI) m/z, вычислено для C41H39NO6 [M+Na]+664,2675, измерено: 664,2348; С18 ОФ-ВЭЖХ (серия № JJS160324-1); чистота: 94,20%.
(11-1-1d) Синтез PRO-10
[434] 8,2 г PRO-9 (12,8 ммоль) растворяли в 64 мл ДМФА и добавляли 40 мл пиперидина (384 ммоль) для взаимодействия при перемешивании при комнатной температуре в течение 30 минут. Реакционный раствор выливали в 300 мл ледяной воды и трижды экстрагировали, каждый раз с применением 150 мл этилацетата. Полученные органические фазы объединяли и промывали с применением 200 мл насыщенного рассола, а органическую фазу, полученную в результате промывки, высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении, а затем остаток очищали с применением колонки с силикагелем. Для очистки неочищенный продукт, растворенный в ДХМ, загружали на колонку с силикагелем, предварительно обработанную пиридином для подщелачивания колонки. Fmoc элюировали ДХМ, содержащим 1% (об./об.) пиридина, и затем продукт элюировали этилацетатом. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 4,65 г продукта PRO-10 в виде белого твердого вещества. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,40 (d, J=7,2 Гц, 2Н), 7,35-7,18 (m, 7H), 6,93-6,84 (m, 4H), 4,56 (d, J=3,9 Гц, 1H), 4,12 (s, 1H), 3,74 (s, 6H), 3,46-3,37 (m, 1H), 2,88 (ddd, J=18,5, 10,0, 5,5 Гц, 2Н), 2,75 (dd, J=8,7, 5,8 Гц, 1H), 2,62 (dd, J=11,0, 2,7 Гц, 1H), 1,74-1,65 (m, 1H), 1,40 (ddd, J=12,9, 8,5, 5,9 Гц, 1H); HRMS (ESI) m/z, вычислено для C26H29NO4 [M+Na]+ 442,1994, измерено: 442,1999; С18 ОФ-ВЭЖХ (серия № JJS160329-1), чистота: 97,07%.
(11-1-2) Синтез FIN-1

[435] GAL-5 (4,5 г, 10 ммоль), полученный в соответствии со способом, описанным на стадии (1-1-1), растворяли в 40 мл ДМФА, последовательно добавляя 3,9 г DIEA (N,N-диизопропилэтиламина, № CAS 7087-68-5, приобретен у Aladdin Inc., 30 ммоль) и 3,8 г HBTU (гексафторфосфат бензотриазол-N,N,N',N'-тетраметилурония, № CAS 94790-37-2, приобретен у Aladdin Inc., 11 ммоль) и перемешивали при комнатной температуре в течение 10 минут.PRO-10 (4,2 г, 10 ммоль), полученный на стадии (11-1-1d), растворяли в 40 мл ДМФА и затем добавляли в указанный выше реакционный раствор. Полученный реакционный раствор высушивали путем добавления безводного сульфата натрия и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор выливали в 120 мл ледяной воды и трижды экстрагировали, каждый раз с применением 60 мл этилацетата. Полученные органические фазы объединяли, промывали с применением 20 мл воды и 20 мл насыщенного рассола, соответственно. Органическую фазу, полученную в результате промывки, выделяли и высушивали с применением безводного сульфата натрия. Растворитель удаляли с помощью выпаривания при пониженном давлении, а затем остаток очищали с применением колонки с силикагелем. Для очистки образец загружали на колонку с силикагелем, предварительно обработанную пиридином для подщелачивания колонки, и элюировали раствором дихлорметана (ДХМ), содержащим 1% (об./об.) триэтиламина и 1% (об./об.) метанола. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 6,5 г продукта FIN-1 в виде светло-желтого пенистого твердого вещества. Н1-ЯМР (400 МГц, ДМСО-d6) δ 7,83 (d, J=9,2 Гц, 1H), 7,32 (t, J=6,6 Гц, 4H), 7,20 (td, J=8,9, 3,5 Гц, 5Н), 6,93 - 6,84 (m, 4H), 5,21 (d, J=3,2 Гц, 1H), 5,04 - 4,90 (m, 2H), 4,49 (s, 1H), 4,40 (d, J=4,4 Гц, 0,8H), 4,31 (d, J=5,0 Гц, 0,2H), 4,15 (s, 1H), 4,03 (s, 3Н), 3,93 (s, 1H), 3,74 (s, 7H), 3,59 (dt, J=12,0, 6,0 Гц, 1H), 3,50 - 3,40 (m, 1H), 3,39-3,25 (m, 3Н), 3,13 (dd, J=8,9, 5,2 Гц, 1Н), 3,00 (dq, J=9,3, 5,3, 4,3 Гц, 1H), 2,22 (s, 2H), 2,07 (s, 3Н), 1,99 (s, 3Н), 1,90 (s, 4H), 1,74 (s, 3H), 1,50 (s, 3Н), 1,36 (s, 1H). С18 ОФ-ВЭЖХ (серия №: LJ160422), чистота: 95,45%. (11-1-3) Синтез FIN-2

[436] FIN-1 (3,0 г, 3,53 ммоль), полученный на стадии (11-1-2), и ацетонитрил нагревали для азеотропной дегидратации, подвергали вакуумной сушке при пониженном давлении, растворяли в 10 мл ДМФА (высушивали погружением в молекулярное сито), добавляли 2,13 г РА (бис(диизопропиламино)(2-цианоэтокси)фосфин, Adamas Inc., каталожный номер продукта 11356 В, 7,06 ммоль) и 346 мг тетразола (№ CAS 288-94-8, приобретен у Aladdin Inc., 4,94 ммоль) в атмосфере азота и перемешивали для взаимодействия при комнатной температуре. Реакционную смесь дополняли 10 мл ДМФА и непрерывно перемешивали для взаимодействия в течение 1 часа. Растворитель удаляли с помощью выпаривания при пониженном давлении, а затем остаток очищали с помощью колоночной хроматографии на силикагеле. Для очистки неочищенный продукт, растворенный в ДХМ, загружали на колонку с силикагелем, предварительно обработанную пиридином для подщелачивания колонки, и элюировали этилацетатом. Элюат собирали, и растворитель удаляли с помощью выпаривания при пониженном давлении с получением 4,5 г неочищенного продукта в виде бесцветного сиропа. Неочищенный продукт полностью растворяли в 50% (об./об.) водном растворе ацетонитрила и очищали с применением колонки среднего давления (С-18, 330 г, 300 Å), предварительно обработанной 1% (об./об.) раствором пиридина в ацетонитриле для подщелачивания колонки. Пик продукта собирали с помощью градиентного элюирования, а растворитель удаляли с помощью выпаривания при пониженном давлении с получением 2,2 г продукта конъюгирующей молекулы FIN-2 в виде белого порошка. Р31-ЯМР (162 МГц, CDCl3) δ 148,04, 147,94, 147,62, 147,19, чистота Р31-ЯМР: 92%; чистота С18 ОФ-ВЭЖХ: 90,54%.
(11-2) Соединение конъюгирующей молекулы FIN-2 с твердофазной подложкой
[437] Конъюгирующую группу (FIN_FIN_FIN) соединяли с 3'-концом смысловой цепи РНК путем соединения конъюгирующей молекулы FIN-2, полученной на стадии (11-1-3), с универсальной твердофазной подложкой (загруженными UnyLinker™ твердыми подложками NittoPhase®HL) с применением способа твердофазного синтеза нуклеиновых кислот в течение трех реакционных циклов.
[438] Соединение конъюгирующей группы FIN_FIN_FIN выполняли в соответствии со способом, описанным в Rajeev et al., Chem Bio Chem 2015, 16, 903-908. В частности, сначала удаляли защищающую гидроксил группу из вышеупомянутой универсальной твердофазной подложки, а затем твердофазную подложку, которую впоследствии приводили в контакт и связывали с конъюгирующей молекулой FIN-2 в условии реакции связывания в присутствии связывающего агента, и конъюгирующую молекулу FIN, соединенную с твердофазной подложкой, получали после реакции кэпирования и окисления.
Кроме того, защищающую гидроксил группу DMTr удаляли из конъюгирующей молекулы FIN, соединенной с твердофазной подложкой, и твердофазную подложку затем приводили в контакт и связывали с другой конъюгирующей молекулой FIN-2 с последующей реакцией кэпирования и окисления. В результате повторения вышеуказанных стадий удаления защитных групп-связывания-кэпирования-окисления был присоединена третья конъюгирующая молекула FIN-2, и таким образом была получена конъюгирующая группа (FIN_FIN_FIN), соединенная с твердофазной подложкой.
[439] В реакциях, описанных выше, условия реакции снятия защиты, связывания, кэпирования и окисления, а также количества растворителей и реагентов аналогичны тем, которые применяли в способе твердофазного синтеза нуклеиновых кислот, описанном выше на стадии (1-2).
(11-3) Синтез конъюгатов 35-49
[440] Рассматриваемые конъюгаты получали с помощью тех же способов, как на стадиях (1-2)-(1-4) примера получения 1, за исключением того, что: 1) соединение, полученное на стадии (11-2), использовали для того чтобы начать синтез смысловой цепи; и 2) конъюгированные миРНК имели последовательности, соответствующие конъюгатам 35-49, представленным в таблице 3.
[441] Молекулярную массу измеряли с помощью прибора для ЖХ-МС (жидкостная хроматография-масс-спектрометрия, приобретенного у Waters Corp., модель: LCT Premier). Результаты показали, что измеренные значения соответствовали вычисленным значениям, и, таким образом, было подтверждено, что синтезированные конъюгаты представляли собой разработанные соединения, представляющие интерес, которые имеют структуру, представленную Формулой (307).
Пример получения 12
Получение сравнительного конъюгата 2
[442] В этом примере получения синтезировали сравнительный конъюгат 2. Последовательность конъюгированной миРНК в этом конъюгате представлена в таблице 3. Этот конъюгат имеет ту же структуру, что и соединение AD-66810, описанное в заявке на патент США 15/597225.
(12-1) Синтез (GalNAc)3 конъюгирующей молекулы
[443] Соединение 30, т.е. конъюгирующая молекула, содержащая вышеупомянутый линкер -(LA)3-тригидроксиметиламинометан-LB- и нацеливающую группу, молекулу N-ацетилгалактозамина (где каждый LA может быть соединен с одной молекулой N-ацетилгалактозамина так, что один линкер может быть соединен с тремя молекулами N-ацетилгалактозамина), синтезировали в соответствии со способом получения, описанным в WO 2014025805 A1. Эта конъюгирующая молекула также может упоминаться как (GalNAc)3 конъюгирующая молекула, и структура соединения 30 представлена следующим образом:

(12-2) Соединение (GalNAc)3 конъюгирующей молекулы с твердофазной подложкой
[444] Конъюгирующую группу (GalNAc)3 соединяли с твердофазной подложкой с помощью того же способа, как и на стадии (1-1-9) примера получения 1, с получением конъюгирующей группы (GalNAc)3, соединенной с твердофазной подложкой.
(12-3) Синтез сравнительного конъюгата 2
[445] Сравнительный конъюгат 2 получали с помощью того же способа, как и на стадиях (1-2), (1-3D) и (1-4) примера получения 1, за исключением того, что: 1) соединение, полученное на стадии (12-2), использовали для того чтобы начать синтез смысловой цепи; и 2) конъюгированная миРНК имела последовательность, представленную под №AD-66810 в таблице 1.
[446] Молекулярную массу измеряли методом жидкостной хроматографии-масс-спектрометрии (ЖХ-МС, приобретен у Waters Corp., модель: LCT Premier). Результаты показали, что измеренные значения соответствовали вычисленным значениям, и, таким образом, было подтверждено, что синтезированный конъюгат представлял собой разработанное целевое соединение, которое имеет структуру, представленную Формулой (305).
Экспериментальный пример 1
Токсичность конъюгатов миРНК согласно настоящему изобретению
[447] У мышей C57BL/6J конъюгат 1 (0,9 масс. % водный раствор NaCl, объем введения 10 мл/кг, концентрации 10 мг/мл и 20 мг/мл, причем каждую концентрацию использовали для 6 мышей: трех самцов и трех самок) вводили подкожно каждой мыши в однократной дозе 100 мг/кг или 200 мг/кг (на основании миРНК). В течение периода лечения выполняли непрерывное клиническое наблюдение, которое не выявило гибели животных и каких-либо клинических симптомов, ассоциированных с нежелательными ответами на лекарственные средства. Через 24 часа после введения брали образцы крови для клинической патологии, и мышей умерщвляли. Результаты показывают, что при исследовании клинической патологии и макроскопической анатомии не были обнаружены какие-либо отклонения. Таким образом, вышеприведенные результаты свидетельствуют о том, что конъюгаты согласно настоящему изобретению имеют относительно низкую токсичность на уровне животных.
Экспериментальный пример 2
Этот эксперимент проиллюстрировал стабильность конъюгатов миРНК согласно настоящему изобретению (Экспериментальный пример 2-1) Стабильность конъюгатов миРНК согласно настоящему изобретению в лизате лизосом в условиях in vitro. [448] Приготовление испытываемых образцов, обработанных лизатом лизосом: сравнительный конъюгат 2 и конъюгаты 49, 36, 37, 38, 39, 43, 45 (каждый обеспечен в форме 0,9 масс. % водного раствора NaCl, в котором концентрация миРНК составляет 20 мкМ, 6 мкл для каждой группы) тщательно перемешивали по отдельности с 27,2 мкл водного раствора цитрата натрия (рН=5,0), 4,08 мкл деионизированной воды и 2,72 мкл тритосом (приобретены у Xenotech Inc., каталожный номер R0610LT, серия №1610069) и инкубировали при постоянной температуре 37°С. Образцы объемом 5 мкл отбирали в каждой временной точке 0 ч, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч, 24 ч и 48 ч, соответственно, добавляли к 15 мкм 9 М мочевины для денатурации и добавляли 4 мкл 6× буфера для загрузки (приобретен у Solarbio Inc., каталожный номер 20160830), затем немедленно криоконсервировали в морозильнике при -80°С, чтобы остановить реакцию. 0 часов представляет собой момент времени, когда образец отбирали немедленного после того, как образцы, подлежащие испытанию, тщательно смешали с лизатом лизосом.
[449] Получение контрольных образцов, не обработанных лизатом лизосом: 1,5 мкл каждого из указанных выше конъюгатов в эквимолярном количестве (20 мкМ) тщательно смешивали с 7,5 мкл водного раствора цитрата натрия (рН=5,0) и 1 мкл деионизированной воды, добавляли к 30 мкл 9 М раствора мочевины для денатурации, и добавляли 8 мкл 6× буфера для загрузки, затем немедленно криоконсервировали в морозильнике при -80°С, чтобы остановить реакцию. Контрольный образец для каждого конъюгата отмечен на электрофореграмме как Con.
[450] Готовили 16 масс. % неденатурирующий полиакриламидный гель. По 20 мкл каждого из испытываемых образцов и контрольных образцов, описанных выше, наносили на гель для проведения электрофореза при постоянном токе 20 мА в течение 10 минут, а затем при постоянном токе 40 мА в течение 30 минут. После завершения электрофореза гель помещали на шейкер и окрашивали красителем Gelred (BioTium, каталожный номер 13G1203) в течение 10 минут. Гель подвергали визуализации, наблюдению и фото копированию. Результаты показаны на Фиг. 1.
[451] На Фиг. 1 показан полуколичественный результат определения стабильности испытываемых конъюгатов миРНК в тритосоме в условиях in vitro. Результаты свидетельствуют о том, что конъюгаты согласно настоящему изобретению могут оставаться неразрушенными в течение длительного времени в тритосоме, проявляя хорошую стабильность.
[452] Как следует из результатов на Фиг. 1, миРНК с конкретными модификациями согласно настоящему изобретению проявляют удовлетворительную стабильность в лизате лизосом.
(Экспериментальный пример 2-2)
Стабильность конъюгатов миРНК в лизате лизосом в условиях in vitro
[453] Стабильность измеряли с помощью того же способа, как и в экспериментальном примере 2-1, за исключением того, что образцы, подлежащие испытанию, представляют собой конъюгаты 1 и 6, последовательности 1 и 2 и отрицательный контроль NS, а период инкубации с тритосомами составляет 0 ч, 5 мин, 15 мин, 30 мин, 1 ч, 2 ч, 4 ч и 8 ч, соответственно. При этом последовательности Последовательностей 1 и 2 показаны ниже и могут быть получены с помощью способов твердофазного синтеза, обычно используемых в данной области техники:
Последовательность 1:
Смысловая цепь: CCUUGAGGCAUACUUCAAA (SEQ ID NO: 143)
Антисмысловая цепь: UUUGAAGUAUGCCUCAAGGUC (SEQ ID NO: 144)
Последовательность 2:
Смысловая цепь: CmsCmsUmUmGiAmGiGfCfAmUmAmCmUmUmCmAmAmAm (SEQ ID NO:145)
Антисмысловая цепь: VP-UmsUfsUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmsUmsCm (SEQ ID NO: 146)
[454] Результаты электрофореза неденатурирующего полиакриламидного геля приведены на Фиг. 2.
[455] На Фиг. 2 показан полуколичественный результат определения стабильности испытываемых конъюгатов миРНК в тритосоме в условиях in vitro. Результаты свидетельствуют о том, что конъюгаты согласно настоящему изобретению могут оставаться неразрушенными в течение длительного времени в тритосоме, проявляя хорошую стабильность.
(Экспериментальный пример 2-3)
Стабильность в плазме человека
[456] Конъюгаты 1 и 6, последовательности 2 и 3 и отрицательный контроль NS (каждый обеспечен в виде 0,9 масс. % водного раствора NaCl, в котором концентрация миРНК составляет 20 мкМ, 12 мкл для каждой группы) по отдельности тщательно смешивали с 108 мкл 90% плазмы человека (разведенной в ФСБ) и инкубировали при постоянной температуре 37°С. Образцы объемом 10 мкл отбирали в каждой временной точке 0 ч, 2 ч, 4 ч, 6 ч, 8 ч, 24 ч, 48 ч и 72 ч, соответственно, и немедленно замораживали в жидком азоте и криоконсервировали в морозильнике при -80°С. После отбора образцов в каждой временной точке каждый крио консервированный образец разводили в 5 раз 1×ФСБ (рН=7,4) и затем отбирали в объеме 10 мкл для применения. В это же самое время каждый из образцов, подлежащих испытанию, отбирали в эквимолярных количествах (2 мкМ, 2 мкл) и тщательно перемешивали с 8 мкл 1×ФСБ (рН=7,4) с получением 10 мкл образцов, не обработанных плазмой человека (обозначено как Con). Готовили 20 масс. % неденатурирующий полиакриламидный гель. Каждый вышеупомянутый криоконсервированный образец смешивали с 4 мкл буфера для загрузки (водный раствор 20 мМ ЭДТА, 36 масс. % глицерина и 0,06 масс. % бромфенолового синего) и затем наносили на вышеуказанный гель для проведения электрофореза при постоянном токе 80 мА в течение 60 минут. После завершения электрофореза гель окрашивали 1× красителем Sybr Gold (Invitrogen, каталожный номер 11494) в течение 15 минут с последующей визуализацией. Результаты показаны на Фиг. 3. При этом последовательность Последовательности 3 показана ниже и может быть получена с помощью способов твердофазного синтеза, обычно применяемых в данной области техники:
Последовательность 3:
Смысловая цепь: CmsCmsUmUmGiAmGiGfCfAmUmAmCmUmUmCmAmAmAm (SEQ ID NO: 147)
Антисмысловая цепь:
VPUmsUfsUmGmAmAfGmUfAfUmGmCmCmUfCmAfAmGmGmsUmsUm (SEQ ID NO: 148)
[457] На Фиг. 3 показан полуколичественный результат определения стабильности испытываемых конъюгатов в плазме человека в условиях in vitro.
[458] Как следует из результатов на Фиг. 3, в плазме человека конъюгаты согласно настоящему изобретению остаются неразрушенными до 72 часов, проявляя превосходную стабильность в плазме человека.
(Экспериментальный пример 2-4)
Стабильность конъюгатов в плазме обезьяны
[459] Конъюгаты 1 и 6, а также последовательности 2 и 3 (каждый обеспечен в форме 0,9 масс. % водного раствора NaCl, в котором концентрация миРНК составляет 20 мкМ, 12 мкл для каждой группы) тщательно перемешивали по отдельности с 108 мкл 90% плазмы яванской макаки (плазма обезьяны, приобретенная у HONGQUAN Bio, каталожный номер HQ70082, разводили в ФСБ) и инкубировали при постоянной температуре 37°С. Образцы объемом 10 мкл отбирали в каждой временной точке 0 ч, 2 ч, 4 ч, 6 ч, 8 ч, 24 ч, 48 ч и 72 ч, соответственно, и немедленно замораживали в жидком азоте и криоконсервировали в морозильнике при -80°С. После отбора образцов в каждой временной точке каждый образец разводили в 5 раз 1×ФСБ (рН=7,4) и затем отбирали в объеме 10 мкл для применения. В это же время каждый из образцов, подлежащих испытанию, отбирали в эквимолярных количествах (2 мкМ, 2 мкл) и тщательно перемешивали с 8 мкл 1×ФСБ (рН=7,4) с получением 10 мкл образцов, не обработанных плазмой обезьяны (обозначено как Con). Готовили 20 масс. % неденатурирующий полиакриламидный гель. Каждый криоконсервированный образец смешивали целиком с 4 мкл буфера для загрузки (водный раствор 20 мМ ЭДТА, 36 масс. % глицерина и 0,06 масс. % бромфенолового синего) и затем наносили на вышеуказанный гель для выполнения электрофореза при постоянном токе 80 мА в течение 60 минут. После завершения электрофореза гель окрашивали 1× красителем Sybr Gold (Invitrogen, каталожный номер 11494) в течение 15 минут с последующей визуализацией. Результаты показаны на Фиг. 4.
[460] На Фиг. 4 показан полуколичественный результат определения стабильности испытываемой миРНК в плазме обезьяны в условиях in vitro.
[461] Как следует из результатов, представленных на Фиг. 4, в плазме яванских макак конъюгаты миРНК согласно настоящему изобретению остаются неразрушенными до 72 часов, проявляя превосходную стабильность в плазме обезьян.
(Экспериментальный пример 2-5)
Этот эксперимент иллюстрировал стабильность конъюгатов миРНК согласно настоящему изобретению в лизате лизосом в условиях in vitro.
[462] Последовательность отрицательного контроля Х2М2, использованная в этом экспериментальном примере, представлена ниже:
Смысловая цепь: 5'-CmCmUmUmGAGGCmAUmACmUmUmCmAAAdT-S-dT-3' (SEQ ID NO: 149)
Антисмысловая цепь: 5'-UfUmUfGAAGUfAUGCCUfCAAGGdT-S-dT-3' (SEQ ID NO: 150).
[463] Эту миРНК синтезировали с помощью способа твердофазного фосфоамидитного синтеза. Отрицательный контроль и конъюгат 2 изготавливали с 0,9 масс. % водным раствором NaCl, соответственно, с получением водных растворов с концентрацией 20 мкМ (на основе концентрации миРНК), которые были помечены как Х2М2 и конъюгат 2.
1) Определение стабильности в лизате лизосом, полученных от крысы
[464] Получение испытываемых образцов, обработанных лизатом лизосом: 6 мкл каждого из конъюгата 2 и Х2М2 (20 мкМ) тщательно смешивали по отдельности с 27,2 мкл водного раствора цитрата натрия (рН=5,0), 4,08 мкл деионизированной воды и 2,72 мкл лизата лизосом мыши (тритосомы печени крысы, приобретенные у Xenotech Inc., каталожный номер R0610.LT, серия №1610069, с конечной концентрацией кислой фосфатазы 0,2 мЕд/мкл) и инкубировали при постоянной температуре 37°С. По 5 мкл смешанного раствора отбирали в каждой временной точке 0 ч, 1 ч, 2 ч, 4 ч, 6 ч и 24 ч, соответственно, добавляли к 15 мкл 9 М раствора мочевины для денатурации, и добавляли 4 мкл 6× буфера для загрузки (приобретен у Solarbio Inc., каталожный номер 20160830), затем немедленно криоконсервировали в морозильнике при -80°С, чтобы остановить реакцию. 0 ч представляет собой временную точку, когда образец отбирали немедленно после того, как образцы, подлежащие испытанию, тщательно смешали с лизатом лизосом.
[465] Получение контрольных образцов, не обработанных лизатом лизосом: 1,5 мкл каждого из конъюгата 2 и Х2М2 (20 мкМ) в эквимолярных количествах тщательно смешивали с 7,5 мкл водного раствора цитрата натрия (рН=5,0) и 1 мкл деионизированной воды, добавляли к 30 мкл 9 М раствора мочевины для денатурации, и добавляли 8 мкл 6× буфера для загрузки, затем немедленно криоконсервировали в морозильнике при -80°С, чтобы остановить реакцию. Для каждого изображения электрофореза соответствующий контрольный образец помечали как М. Готовили 16 масс. % неденатурирующий полиакриламидный гель. По 20 мкл каждого испытываемого образца и контрольного образца, описанного выше, наносили на гель для проведения электрофореза при постоянном токе 20 мА в течение 10 минут, а затем при постоянном токе 40 мА в течение 30 минут. После завершения электрофореза гель помещали на шейкер и окрашивали красителем Gelred (BioTium, каталожный номер 13G1203) в течение 10 минут. Гель подвергали визуализации, наблюдению и фотокопированию. Результаты показаны на Фиг. 5.
2) Определение стабильности в лизате лизосом человека
[466] Стабильность Х2М2 и конъюгата 2 в лизате лизосом человека измеряли с помощью того же способа, как и в 1), за исключением того, что лизат лизосом мыши заменяли лизатом лизосом человека (лизосомы печени человека, приобретенные у Xenotech Inc., каталожный номер R0610.L, серия №1610316). Результаты показаны на Фиг. 6.
[467] Результаты на Фиг. 5 и 6 свидетельствуют о том, что конъюгаты миРНК согласно настоящему изобретению могут оставаться неразрушенными в течение по меньшей мере 24 часов как в лизате лизосом, происходящих от человека, так и в лизате лизосом мыши, проявляя удовлетворительную стабильность.
Экспериментальный пример 3
Результаты фармакокинетического исследования конъюгатов 1 и 6 на крысах в условиях in vivo
[468] В этом экспериментальном примере конъюгаты 1 и 6 вводили крысам в каждой экспериментальной группе (по 10 крыс в каждой группе, пять самцов и пять самок) путем подкожной инъекции, соответственно, в однократной дозе 10 мг/кг и 50 мг/кг. Затем в каждой временной точке измеряли концентрацию лекарственного средства в плазме, тканях печени и почек крыс.
[469] Крысы SD, использованные в этом экспериментальном примере, были предоставлены Beijing Vital River Laboratory Animal Technology Co., Ltd.
[470] Сначала крыс SD случайным образом разделяли на группы в соответствии с массой тела и полом с применением системы PRISTIMAdata, версия 7.2.0, а затем, соответственно, каждой группе вводили конъюгаты в соответствии с планируемой дозировкой. Дозировки лекарственного средства для всех животных вычисляли в соответствии с массой тела (однократное введение (подкожно), дозировка введения 10 мг/кг и 50 мг/кг в виде 0,9% водного раствора NaCl, содержащего 1 мг/мл и 5 мг/мл конъюгатов, и объем введения 10 мл/кг). Цельную кровь крыс собирали из яремной вены перед введением и через 5 минут (±30 секунд), 30 минут (±1 минута), 1 час (±2 минуты), 2 часа (±2 минуты), 6 часов (±5 минут), 24 часа (±10 минут), 48 часов (±20 минут), 72 часа (±20 минут), 120 часов (±30 минут) и 168 часов (±30 минут) после введения. Затем образцы цельной крови центрифугировали при 1800×g при 2-8°С в течение 10 минут для отделения плазмы. Приблизительно 70 мкл образца плазмы помещали в одну пробирку, а оставшуюся часть образца помещали в другую, обе пробирки криоконсервировали при температуре от -70 до -86°С для определения. Ткани печени и почек собирали через 24, 48, 72, 120 и 168 часов после введения с помощью способа, включающего анестезию крыс пентобарбиталом натрия в соответствии с их массой (60 мг/кг, внутрибрюшинная инъекция), эвтаназию крыс путем взятия крови из брюшной аорты и выполнение исследования макроскопической анатомии. Образцы печени и почек каждой крысы отбирали и хранили в криопробирке объемом 1 мл при температуре ниже -68°С до определения и анализа.
[471] Концентрации конъюгатов 24 и 25 в плазме, тканях печени и почек крыс измеряли количественно с помощью высокоэффективной жидкостной хроматографии с флуоресцентным определением (ВЭЖХ-ФО) в соответствии со следующими конкретными стадиями:
(1) измельчение ткани до получения массы ткани не более 80 мг, затем добавление раствора для лизиса тканей и клеток (поставщик: Epicentre, каталожный номер МТС096Н) с получением 66,7 мг/мл гомогената ткани;
(2) обработку гомогената ткани ультразвуком (150 Вт, 30 с) для разрушения клеток;
(3) для образцов ткани добавление 75 мкл образцов ткани в 96-луночный планшет для ПЦР, добавление 5 мкл протеиназы К (поставщик: Invitrogen, каталожный номер 25530-015) и 10 мкл смешанного водного раствора 10 масс. % ацетонитрила и 0,01 масс. % твин-20; для образцов плазмы добавление 20 мкл плазмы в 96-луночный планшет для ПЦР, добавление 45 мкл раствора для лизиса тканей и клеток, 5 мкл протеиназы К и 20 мкл смешанного водного раствора 10 масс. % ацетонитрила и 0,01 масс. % твин-20;
(4) блокирование планшетов, помещение их в прибор для ПЦР (поставщик: Applied Biosystems, модель: система GeneAmp® PCR 9700) и инкубирование при 65°С в течение 45 минут;
(5) после окончания инкубации добавление 10 мкл 3 М водного раствора KCl (поставщик: Sigma-Aldrich, каталожный номер 60135-250ML), тщательное встряхивание и центрифугирование при 3200 rcf при 4°С в течение 15 минут;
(6) для образцов ткани добавление 80 мкл надосадочной жидкости в 120 мкл раствора смеси для гибридизации (состав: 0,5 мл 6 мкМ ПНК-зонда (поставщик: TAHE-PNA), 1 мл 200 мМ Trizma/pH=8, 5 мл 8 М водного раствора мочевины, 3,5 мл H2O, 2 мл ацетонитрила);
для образцов плазмы добавление 40 мкл надосадочной жидкости в 160 мкл раствора смеси для гибридизации (состав: 0,5 мл 6 мкМ ПНК-зонда, 1 мл 200 мМ Trizma/pH=8, 5 мл 8 М водного раствора мочевины, 7,5 мл H2O, 2 мл ацетонитрила);
(7) блокирование планшетов, помещение их в прибор для ПЦР, инкубация при 95°С в течение 15 минут, затем немедленно помещение на лед на 5 минут;
(8) перенос образцов в новые 96-луночные планшеты с коническим дном, встряхивание и центрифугирование при 3200 rcf в течение 1 минуты;
(9) впрыскивание образцов для определения и количественного анализа с применением ВЭЖХ-ФО (поставщик жидкофазных систем: Thermo Fisher, модель хроматографа: ultimate 3000).
[472] Результаты анализа можно найти на Фиг. 7-14, при этом на Фиг. 7-10 показаны метаболические кривые зависимости от времени ФК/ТК плазматических концентраций в плазме крысы и ФК/ТК концентраций в тканях печени и почек крысы для конъюгата 1 в дозировке 10 мг/кг или 50 мг/кг, соответственно; и Фиг. 11-14 показаны метаболические кривые зависимости от времени ФК/ТК плазматических концентраций в плазме крови крысы и ФК/ТК концентраций в тканях печени и почек крысы для конъюгата 6 в дозировке 10 мг/кг или 50 мг/кг, соответственно. В частности, Фиг. 7 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК плазматической концентрации для конъюгата 1 в дозировке 10 мг/кг в плазме крысы.
Фиг. 8 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК тканевых концентраций для конъюгата 1 в дозировке 10 мг/кг в печени и почках крысы.
Фиг. 9 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК плазматической концентрации для конъюгата 1 в дозировке 50 мг/кг в плазме крысы.
Фиг. 10 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК тканевых концентраций для конъюгата 1 в дозировке 50 мг/кг в печени и почках крысы.
Фиг. 11 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК плазматической концентрации для конъюгата 6 в дозировке 10 мг/кг в плазме крысы.
Фиг. 12 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК тканевых концентраций для конъюгата 6 в дозировке 10 мг/кг в печени и почках крысы.
Фиг. 13 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК плазматической концентрации для конъюгата 6 в дозировке 50 мг/кг в плазме крысы.
Фиг. 14 представляет собой метаболическую кривую в зависимости от времени, показывающую ФК/ТК тканевых концентраций для конъюгата 6 в дозировке 50 мг/кг в печени и почках крысы.
[473] Как следует из результатов на Фиг. 7-14, концентрации для конъюгатов 1 и 6 в плазме крысы быстро снижались ниже предела определения в течение нескольких часов, в то время как концентрации в ткани печени крысы поддерживались на относительно высоком и стабильном уровне на протяжении по меньшей мере 168 часов, как при низкой дозировке (10 мг/кг), так и относительно высокой дозировке (50 мг/кг). Это свидетельствует о том, что конъюгат миРНК согласно настоящему изобретению может быть специфически и значительно обогащен в печени и может оставаться стабильным, проявляя высокую степень нацеливания.
Экспериментальный пример 4 - Этот эксперимент иллюстрирует ингибирующую эффективность конъюгатов миРНК согласно настоящему изобретению в отношении экспрессии мРНК ВГВ в условиях in vivo.
[474] В этом экспериментальном примере изучали ингибирующую эффективность конъюгатов 5 и 7 в отношении экспрессии мРНК ВГВ у мышей C57BL/6J-Tg(Alb1HBV)44Bri/J, трансгенных по ВГВ.
[475] Содержание HBsAg в сыворотке мышей измеряли с применением набора для анализа поверхностного антигена вируса гепатита В (твердофазный иммуноферментный анализ, ИФА) (Shanghai Kehua Bio-engineering Co., Ltd.). Мышей с S/COV>10 отбирали и случайным образом разделяли на группы (все самки, по 4 мыши в каждой группе) и, соответственно, нумеровали как конъюгат 5 и конъюгат 7, а в качестве контрольной группы добавляли группу, получавшую физиологический раствор (NS). Дозировки лекарственного средства для всех животных вычисляли в соответствии с массой тела (однократное введение (подкожно), дозировка введения 1 мг/кг и 0,1 мг/кг в форме 0,9% водного раствора NaCl, содержащего 0,2 мг/мл и 0,02 мг/мл конъюгатов, и объем введения 5 мл/кг). Животных умерщвляли на 14 день после введения. Затем печень собирали и хранили с РНК (Sigma Aldrich), а ткань печени гомогенизировали с помощью гомогенизатора ткани. Затем общую РНК экстрагировали и получали с применением тризола в соответствии со стандартными процедурами экстракции общей РНК.
[476] Уровень экспрессии мРНК ВГВ в ткани печени определяли с помощью флуоресцентной кПЦР в режиме реального времени. В частности, экстрагированную общую РНК подвергали обратно транскрипции с получением кДНК с применением набора для обратной транскрипции ImProm-II™ (Promega) в соответствии с инструкцией, а затем определяли ингибирующую эффективность миРНК в отношении экспрессии мРНК ВГВ в ткани печени с применением набора для флуоресцентной кПЦР (Beijing Cowin Biosicences Co., Ltd). В способе флуоресцентной кПЦР в качестве гена для внутреннего контроля применяли ген β-актина, ВГВ и β-актин определяли с применением праймеров для ВГВ и β-актина, соответственно.
[477] Последовательности праймеров для определения приведены в таблице 4.

[478] В этом способе флуоресцентной кПЦР экспрессию мРНК ВГВ выражали как остаточную экспрессию гена Х ВГВ и вычисляли с помощью следующего уравнения:
Остаточная экспрессия гена Х ВГВ = (количество копий гена Х ВГВ в испытываемой группе/количество копий гена β-актина в испытываемой группе)/(количество копий гена ВГВ в контрольной группе/количество копий гена β-актина в контрольной группе) × 100%, что отмечено на фигурах как экспрессия мРНК Х ВГВ/β-актина.
[479] Затем процент ингибирования конъюгата в отношении мРНК вычисляли в соответствии с уравнением:
Процент ингибирования конъюгата в отношении мРНК = (1-остаточная экспрессия гена Х ВГВ) × 100%,
где контрольная группа представляла собой группу контрольных мышей, которым вводили NS в этом эксперименте, и каждая испытываемая группа представляла собой группу мышей, которым вводили разные конъюгаты миРНК, соответственно. Результаты показаны на Фиг. 15.
[480] В других экспериментах дополнительно выполняли несколько испытаний в соответствии со следующими условиями:
Испытания выполняли с применением того же способа, который описан выше, за исключением того, что введенный конъюгат миРНК заменяли конъюгатами 1 и 6 и данные собирали на 14 день. Результаты показаны на Фиг. 16; и
Испытания выполняли с применением того же способа, который описан выше, за исключением того, что конъюгаты миРНК для введения заменяли конъюгатами 5 и 6 и данные собирали на 7 день. Результаты показаны на Фиг. 17; и
Испытания выполняли с применением того же способа, который описан выше, за исключением того, что конъюгаты миРНК для введения заменяли конъюгатами 9, 10, 5 и 6 и данные собирали на 7 день. Результаты показаны на Фиг. 18; и
Испытания выполняли с применением того же способа, который описан выше, за исключением того, что конъюгаты миРНК для введения заменяли конъюгатами 1, 2, 3 и 4 (по 5 мышей в каждой группе) и данные собирали на 28 день. Каждый конъюгат вводили в двух дозировках 1 мг/кг и 0,3 мг/кг (причем объем введения оставался одинаковым, в то время как концентрации растворов конъюгатов корректировали соответствующим образом). Результаты показаны соответствующим образом на Фиг. 19.
Испытания выполняли с применением того же способа, который описан выше, за исключением того, что введенный конъюгат миРНК заменяли конъюгатом 1 и данные собирали на 14 день. Каждый конъюгат вводили в двух дозировках 1 мг/кг и 0,1 мг/кг (причем объем введения оставался неизменным, в то время как концентрации растворов конъюгатов корректировали соответствующим образом). Результаты показаны соответствующим образом на Фиг. 20.
[481] Как следует из приведенных выше результатов, в нескольких экспериментах с различными временными точками испытания все конъюгаты согласно настоящему изобретению, описанные выше, проявляют высокую ингибирующую активность в отношении экспрессии мРНК ВГВ у мышей в условиях in vivo.
Экспериментальный пример 5 - Этот эксперимент иллюстрирует испытание зависимости от времени ингибирующей эффективности конъюгатов миРНК согласно настоящему изобретению в отношении HBsAg и ДНК ВГВ в сыворотке мышей, трансгенных по ВГВ.
[482] Применяли модель AAV-HBV на мышах. После успешного создания моделей на животных этих мышей случайным образом разделяли на группы на основании содержания HBsAg в сыворотке (по 5 мышей в каждой группе). Конъюгаты 1 и 6, сравнительный конъюгат 2 и NS в качестве пустого контроля вводили, соответственно, каждой группе. Дозировки лекарственного средства для всех животных вычисляли в соответствии с массой тела (однократное введение (подкожно), дозировка введения 3 мг/кг и 1 мг/кг в форме 0,9% водного раствора NaCl, содержащего 0,3 мг/мл и 0,1 мг/мл конъюгатов, и объем введения 5 мл/кг). Кровь брали из орбитального венозного сплетения мыши перед введением (обозначено как DO) и на 7, 14, 21, 28, 56, 84, 112, 140, 154, 168 и 182 день после введения, и измеряли уровень HBsAg в сыворотке в каждой временной точке. Во время эксперимента определение у субъекта завершают, если содержание HBsAg в сыворотке в результате испытания сопоставимо с исходным значением или превышает его.
[483] В каждой временной точке брали приблизительно 100 мкл орбитальной крови, при этом объем сыворотки после центрифугирования составлял по меньшей мере 20 мкл. Содержание HBsAg в сыворотке крови измеряли с применением набора HBsAg CLIA (Autobio, CL0310). Уровень экспрессии ДНК ВГВ измеряли путем экстракции ДНК из сыворотки в соответствии с инструкцией набора QIAamp 96 DNA Blood Kit, а затем проводили кПЦР.
[484] Нормированный уровень экспрессии HBsAg = (содержание HBsAg после введения/содержание HBsAg до введения) × 100%.
Процент ингибирования в отношении HBsAg = (1-содержание HBsAg после введения/содержание HBsAg перед введением) × 100%, причем содержание HBsAg выражали в эквивалентах (UI) HBsAg на миллилитр (мл) сыворотки.
[485] Нормированный уровень экспрессии ДНК ВГВ = (содержание ДНК ВГВ после введения/содержание ДНК ВГВ перед введением) × 100%.
Процент ингибирования в отношении ДНК ВГВ = (1-содержание ДНК ВГВ после введения/содержание ДНК ВГВ до введения) × 100%,
причем содержание ДНК ВГВ выражали в копиях ДНК ВГВ на миллилитр (мл) сыворотки.
[486] Результаты показаны на Фиг. 21 и 22.
[487] Как следует из результатов на Фиг. 21, группа отрицательного контроля NS не проявляет ингибирующий эффект в различных временных точках после введения; напротив, каждый конъюгат миРНК проявляет превосходный ингибирующий эффект на HBsAg в различных временных точках после введения. В частности, конъюгат 1 постоянно проявлял высокий процент ингибирования в отношении HBsAg в сыворотке в течение периода до 140 дней, это указывает на стабильное и эффективное ингибирование экспрессии гена ВГВ в течение более длительного периода времени.
[488] Как следует из результатов Фиг. 22, конъюгат миРНК в каждом примере также проявил эффективное ингибирование экспрессии ДНК ВГВ и поддерживал более высокий процент ингибирования в течение периода до 84 дней.
[489] Напротив, несмотря на то, что сравнительный конъюгат 2 достиг ингибирующих эффектов на мРНК, сопоставимых с таковыми для отдельных конъюгатов в экспериментах в условиях in vivo, продолжительность ингибирующих эффектов, как показано на Фиг. 21 и 22, была значительно короче, чем у конъюгатов 1 и 6 при аналогичном уровне дозы.
[490] В соответствии с теми же способами, как и описанные выше, выполняли четыре дополнительных испытания, в которых измеряли сывороточный HBsAg, за исключением того, что:
в модели с низкой концентрацией AAV-HBV на мышах вводили 3 мг/кг и 1 мг/кг конъюгата 6, соответственно; испытание продолжалось до 140 дня; и результаты показаны на Фиг. 23;
в моделях M-Tg вводили 3 мг/кг (3 мг на 1 кг) и 1 мг/кг (1 мг на 1 кг) конъюгатов 5 и 6 (ФСБ для контрольной группы), соответственно; испытание продолжалось до 70 дня; и результаты показаны на Фиг. 24; мышей приобрели в Департаменте животных Шанхайского центра общественного здравоохранения. Способы получения трансгенных мышей были описаны Ren J. et al., in J. Medical Virology. 2006, 78:551-560;
в моделях M-Tg вводили 5 мг/кг, 1 мг/кг и 0,2 мг/кг конъюгатов 11 и 6 (ФСБ для контрольной группы) и 5 мг/кг сравнительного конъюгата 2, соответственно; испытание продолжалось до 78 дня; и результаты показаны на Фиг. 25;
в моделях с 1,28 копии вводили 3 мг/кг и 1 мг/кг конъюгата 1, соответственно; испытание продолжалось до 210 дня; и результаты показаны на Фиг. 26 и 27.
[491] Для различных доз введения, описанных выше, каждый конъюгат вводили в одном и том же объеме введения, тогда как концентрацию раствора корректировали соответствующим образом так, чтобы осуществлять введение в соответствующей дозе.
[492] На основании результатов на Фиг. 22-27 следует, что конъюгаты миРНК согласно настоящему изобретению проявляли постоянную и действенную ингибирующую эффективность в отношении сывороточного HBsAg в различных моделях на животных и обычную зависимость от дозы. Экспериментальный пример 6 - Этот эксперимент иллюстрирует, что конъюгаты миРНК согласно настоящему изобретению не только обладают более высокой активностью в условиях in vitro, но также проявляют низкий нецелевой эффект.
[493] (6-1) Клетки HEK293A, использованные в этом экспериментальном примере, были предоставлены лабораторией нуклеиновых кислот Института молекулярной медицины Пекинского университета, и культивированы в полной среде DMEM (компания Hyclone), содержащей 20% фетальной бычьей сыворотки (ФБС, компания Hyclone), 0,2% (об./об.) пенициллина-стрептомицина (Gibco, компания Invitrogen), при 37°С в инкубаторе, содержащем 5% CO2/95% воздуха.
[494] В этом экспериментальном примере активность в отношении мишени и нецелевой эффект конъюгата 1 изучали в системе psiCHECK в условиях in vitro. В частности, тестировали активность конъюгата 1 в отношении нацеливания на полностью совпадающую последовательность-мишень (в которой нуклеотидная последовательность полностью комплементарна нуклеотидной последовательности по всей длине смысловой/антисмысловой цепи конъюгата 1) или нацеливания на область затравочной последовательности, соответствующей последовательности-мишени (в которой нуклеотидная последовательность комплементарна нуклеотидной последовательности положений 1-8 смысловой/антисмысловой цепи конъюгата 1).
[495] В соответствии со способом, описанным Kumico Ui-Tei et al., Functional dissection of siRNA sequence by systematic DNA substitution: modified siRNA with a DNA seed arm is a powerful tool for mammalian gene silencing with significantly reduced off-target effect. Nucleic Acids Research, 2008.36(7), 2136-2151, плазмиды для определения конструировали и совместно трансфецировали с конъюгатами миРНК, которые подлежат определению, в клетки НЕК293А; и уровни экспрессии двойного репортерного гена люциферазы отражают активность в отношении мишени и нецелевой эффект конъюгатов миРНК. Конкретные стадии описаны далее:
[496] [1] Конструирование плазмиды для определения
[497] Четыре рекомбинантные плазмиды конструировали с применением плазмиды psiCHECK™-2 (Promega™), в которой GSCM представляет собой целевую плазмиду; и PSCM, GSSM и PSSM представляют собой нецелевые плазмиды:
[498] (1) GSCM, содержащая последовательность-мишень, причем последовательность-мишень полностью комплементарна всей 21 нуклеотидной последовательности антисмысловой цепи в конъюгате 1.
[499] (2) PSCM, содержащая последовательность-мишень, причем последовательность-мишень идентична всей 21 нуклеотидной последовательности антисмысловой цепи в конъюгате 1.
[500] (3) GSSM, содержащая последовательность-мишень, причем последовательность-мишень полностью комплементарна нуклеотидной последовательности в положениях 1-8 с 5'-конца антисмысловой цепи в конъюгате 1, тогда как оставшаяся часть последовательности-мишени соответствует нуклеотидной последовательности в положениях 9-21 с 5'-конца антисмысловой цепи в конъюгате 1, но полностью не совпадает для спаривания; т.е. если нуклеотид в любом положении в положениях 9-21 с 5'-конца антисмысловой цепи в конъюгате 1 представляет собой G, С, А или U, нуклеотид в соответствующем положении в последовательности-мишени представляет собой Т, А, С или G.
[501] (4) PSSM, содержащая последовательность-мишень, причем последовательность-мишень полностью комплементарна нуклеотидной последовательности в положениях 1-8 с 5'-конца смысловой цепи в конъюгате 1, тогда как оставшаяся часть последовательности-мишени соответствует нуклеотидной последовательности в положениях 9-19 с 5'-конца смысловой цепи в конъюгате 1, но полностью не совпадает для спаривания; т.е. если нуклеотид в любом положении в положениях 9-19 с 5'-конца смысловой цепи в конъюгате 1 представляет собой G, С, А или U, нуклеотид в соответствующем положении в последовательности-мишени представляет собой Т, А, С или G. Для того чтобы длина была одинаковой с целевой последовательностью в GSSM, на 3'-конце целевой последовательности в PSSM добавляли два СС.
[502] Последовательность-мишень встраивали в сайт Xho I/Not I плазмиды psiCHECK™-2.
[503] [2] Трансфекция
[504] В 96-луночном планшете миРНК и каждую из указанных выше плазмид совместно трансфецировали в соответствии с инструкцией для Lipofectamine™ 2000 (Invitrogen), причем каждая плазмида соответствовала нескольким конкретным концентрациям конъюгата А1. В частности, 10 нг плазмиды трансфецировали на лунку, используя 0,2 мкл Lipofectamine™ 2000 на лунку; конечная концентрация (на основании концентрации миРНК) конъюгата 1 составляла от 100 нМ до 0,0001 нМ (4-кратное последовательное разведение 11 концентраций), с 3 повторными лунками на группу.
[505] [3] Определение
[506] Через 24 часа после совместной трансфекции клетки HEK293A лизировали с применением набора для анализа двойного репортерного гена люциферазы (Promega, каталожный номер Е2940) в соответствии с инструкцией по определению уровня экспрессии двойного репортерного гена люциферазы. Для испытываемой группы каждой конкретной концентрации в качестве контроля (Con) использовали клетки, не обработанные конъюгатом. Уровень белка люциферазы Renilla (Ren) нормировали к уровню белка люциферазы светлячка (Fir).
[507] Кривые зависимости ответа от дозы строили по результатам измерения активности при различных концентрациях миРНК, и кривые аппроксимировали, используя функцию log (ингибитор) в зависимости от ответа - переменный наклон программного обеспечения Graphpad 5.0. ИК50 миРНК, нацеленной на GSCM, вычисляли на основании кривой зависимости ответа от дозы по следующей Формуле:

в которой:
Y представляет собой уровень экспрессии остаточной мРНК,
Х представляет собой логарифм концентрации трансфецированной миРНК,
Bot представляет собой значение Y в нижней части стационарной стадии,
Тор представляет собой значение Y в верхней части стационарной стадии,
LogIC50 представляет собой значение X, при котором Y представляет собой медианное значение между низом и верхом асимптоты, a HillSlope (угловой коэффициент Хилла) представляет собой наклон кривой.
[508] ИК50 конъюгата 1, нацеленного на GSCM, вычисляли на основании кривой зависимости эффекта от дозы. Результаты показаны на Фигурах 28A-28D, которые свидетельствуют о том, что значение ИК50 для конъюгата 1, соответствующего GSCM, составляло 0,0513 нМ. Конъюгат 1, соответствующий PSCM, GSSM или PSSM, не проявляет значительного ингибирующего эффекта при каждой концентрации миРНК, это свидетельствует о том, что конъюгат миРНК согласно настоящему изобретению обладает не только более высокой активностью в условиях in vitro, но также проявляет низкий нецелевой эффект.
[509] В соответствии с приведенными выше результатами конъюгат 1 проявляет превосходный ингибирующий эффект на экспрессию мРНК-мишени в целевой плазмиде с низким ИК50; при этом он не проявляет ингибирующий эффект на экспрессию трех нецелевых плазмид. Таким образом, конъюгат 1 не только обладает превосходной ингибирующей эффективностью в отношении мРНК-мишени, но также проявляет низкий нецелевой эффект.
[510] Варианты реализации настоящего изобретения подробно описаны выше, но настоящее изобретение не ограничено конкретными подробностями вышеописанных вариантов реализации. Различные простые изменения технического решения настоящего изобретения могут быть выполнены в пределах объема технической концепции настоящего изобретения, и эти простые изменения находятся в пределах объема настоящего изобретения.
[511] Следует отметить, что каждый из конкретных технических признаков, описанных в вышеупомянутых вариантах реализации, может быть объединен любым подходящим способом, при условии, что не возникает противоречие. Чтобы избежать ненужного повторения, различные возможные способы комбинирования далее не будут описаны в настоящем изобретении.
[512] Кроме того, различные варианты реализации настоящего изобретения также могут быть выполнены в любой комбинации, при условии, что не возникает противоречие идее настоящего изобретения, это также следует рассматривать как раскрытие настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Suzhou Ribo Life Science Co.,Ltd
<120> НУКЛЕИНОВАЯ КИСЛОТА, КОМПОЗИЦИЯ И КОНЪЮГАТ, СОДЕРЖАЩИЕ ЕЕ, И СПОСОБ
ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
<130> 11460pRIBO
<150> CN201711249333.8
<151> 2017-12-01
<150> CN201711482970.X
<151> 2018-12-29
<160> 156
<170> SIPOSequenceListing 1.0
<210> 1
<211> 19
<212> РНК
<213> Искуственная последовательность
<220>
<221> разные признаки
<222> (19)..(19)
<223> n is A, U, G или C
<400> 1
ccuugaggca uacuucaan 19
<210> 2
<211> 19
<212> РНК
<213> Искуственная последовательность
<220>
<221> разные признаки
<222> (1)..(1)
<223> n is A, U, G или C
<400> 2
nuugaaguau gccucaagg 19
<210> 3
<211> 21
<212> РНК
<213> Искуственная последовательность
<220>
<221> разные признаки
<222> (1)..(1)
<223> n is A, U, G или C
<400> 3
nuugaaguau gccucaaggu u 21
<210> 4
<211> 21
<212> РНК
<213> Искуственная последовательность
<220>
<221> разные признаки
<222> (1)..(1)
<223> n is A, U, G или C
<400> 4
nuugaaguau gccucaaggu c 21
<210> 5
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 5
ccuugaggca uacuucaaa 19
<210> 6
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 6
uuugaaguau gccucaaggu u 21
<210> 7
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 7
gaccuugagg cauacuucaa a 21
<210> 8
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 8
uuugaaguau gccucaaggu cgg 23
<210> 9
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 9
ccuugaggca uacuucaaa 19
<210> 10
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 10
uuugaaguau gccucaaggu u 21
<210> 11
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 11
ccuugaggca uacuucaaa 19
<210> 12
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 12
uuugaaguau gccucaaggu u 21
<210> 13
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 13
gaccuugagg cauacuucaa a 21
<210> 14
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 14
uuugaaguau gccucaaggu cgg 23
<210> 15
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 15
gaccuugagg cauacuucaa a 21
<210> 16
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 16
uuugaaguau gccucaaggu cgg 23
<210> 17
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 17
ccuugaggca uacuucaaa 19
<210> 18
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 18
uuugaaguau gccucaaggu u 21
<210> 19
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 19
ccuugaggca uacuucaaa 19
<210> 20
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 20
uuugaaguau gccucaaggu u 21
<210> 21
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 21
gaccuugagg cauacuucaa a 21
<210> 22
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 22
uuugaaguau gccucaaggu cgg 23
<210> 23
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 23
gaccuugagg cauacuucaa a 21
<210> 24
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 24
uuugaaguau gccucaaggu cgg 23
<210> 25
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 25
ccuugaggca uacuucaaa 19
<210> 26
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 26
uuugaaguau gccucaaggu u 21
<210> 27
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 27
ccuugaggca uacuucaaa 19
<210> 28
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 28
uuugaaguau gccucaaggu u 21
<210> 29
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 29
gaccuugagg cauacuucaa a 21
<210> 30
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 30
uuugaaguau gccucaaggu cgg 23
<210> 31
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 31
gaccuugagg cauacuucaa a 21
<210> 32
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 32
uuugaaguau gccucaaggu cgg 23
<210> 33
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 33
ccuugaggca uacuucaaa 19
<210> 34
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 34
uuugaaguau gccucaaggu u 21
<210> 35
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 35
ccuugaggca uacuucaaa 19
<210> 36
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 36
uuugaaguau gccucaaggu u 21
<210> 37
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 37
gaccuugagg cauacuucaa a 21
<210> 38
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 38
uuugaaguau gccucaaggu cgg 23
<210> 39
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 39
gaccuugagg cauacuucaa a 21
<210> 40
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 40
uuugaaguau gccucaaggu cgg 23
<210> 41
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 41
ccuugaggca uacuucaaa 19
<210> 42
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 42
uuugaaguau gccucaaggu u 21
<210> 43
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 43
ccuugaggca uacuucaaa 19
<210> 44
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 44
uuugaaguau gccucaaggu u 21
<210> 45
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 45
ccuugaggca uacuucaaa 19
<210> 46
<211> 21
<212> ДНК/РНК
<213> Искуственная последовательность
<400> 46
tuugaaguau gccucaaggu u 21
<210> 47
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 47
ccuugaggca uacuucaaa 19
<210> 48
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 48
uuugaaguau gccucaaggu u 21
<210> 49
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 49
ccuugaggca uacuucaaa 19
<210> 50
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 50
uuugaaguau gccucaaggu u 21
<210> 51
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 51
ccuugaggca uacuucaaa 19
<210> 52
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 52
uuugaaguau gccucaaggu u 21
<210> 53
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 53
gaccuugagg cauacuucaa a 21
<210> 54
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 54
uuugaaguau gccucaaggu cgg 23
<210> 55
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 55
ccuugaggca uacuucaaa 19
<210> 56
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 56
uuugaaguau gccucaaggu u 21
<210> 57
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 57
ccuugaggca uacuucaaa 19
<210> 58
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 58
uuugaaguau gccucaaggu u 21
<210> 59
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 59
gaccuugagg cauacuucaa a 21
<210> 60
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 60
uuugaaguau gccucaaggu cgg 23
<210> 61
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 61
gaccuugagg cauacuucaa a 21
<210> 62
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 62
uuugaaguau gccucaaggu cgg 23
<210> 63
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 63
ccuugaggca uacuucaaa 19
<210> 64
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 64
uuugaaguau gccucaaggu u 21
<210> 65
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 65
gaccuugagg cauacuucaa a 21
<210> 66
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 66
uuugaaguau gccucaaggu cgg 23
<210> 67
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 67
ccuugaggca uacuucaaa 19
<210> 68
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 68
uuugaaguau gccucaaggu u 21
<210> 69
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 69
ccuugaggca uacuucaaa 19
<210> 70
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 70
uuugaaguau gccucaaggu u 21
<210> 71
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 71
gaccuugagg cauacuucaa a 21
<210> 72
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 72
uuugaaguau gccucaaggu cgg 23
<210> 73
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 73
gaccuugagg cauacuucaa a 21
<210> 74
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 74
uuugaaguau gccucaaggu cgg 23
<210> 75
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 75
gaccuugagg cauacuucaa a 21
<210> 76
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 76
uuugaaguau gccucaaggu cgg 23
<210> 77
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 77
ccuugaggca uacuucaaa 19
<210> 78
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 78
uuugaaguau gccucaaggu u 21
<210> 79
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 79
ccuugaggca uacuucaaa 19
<210> 80
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 80
uuugaaguau gccucaaggu u 21
<210> 81
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 81
gaccuugagg cauacuucaa a 21
<210> 82
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 82
uuugaaguau gccucaaggu cgg 23
<210> 83
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 83
gaccuugagg cauacuucaa a 21
<210> 84
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 84
uuugaaguau gccucaaggu cgg 23
<210> 85
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 85
gaccuugagg cauacuucaa a 21
<210> 86
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 86
uuugaaguau gccucaaggu cgg 23
<210> 87
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 87
ccuugaggca uacuucaaa 19
<210> 88
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 88
uuugaaguau gccucaaggu u 21
<210> 89
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 89
ccuugaggca uacuucaaa 19
<210> 90
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 90
uuugaaguau gccucaaggu u 21
<210> 91
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 91
ccuugaggca uacuucaaa 19
<210> 92
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 92
uuugaaguau gccucaaggu u 21
<210> 93
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 93
ccuugaggca uacuucaaa 19
<210> 94
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 94
uuugaaguau gccucaaggu u 21
<210> 95
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 95
ccuugaggca uacuucaaa 19
<210> 96
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 96
uuugaaguau gccucaaggu u 21
<210> 97
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 97
ccuugaggca uacuucaaa 19
<210> 98
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 98
uuugaaguau gccucaaggu u 21
<210> 99
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 99
ccuugaggca uacuucaaa 19
<210> 100
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 100
uuugaaguau gccucaaggu u 21
<210> 101
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 101
ccuugaggca uacuucaaa 19
<210> 102
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 102
uuugaaguau gccucaaggu u 21
<210> 103
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 103
ccuugaggca uacuucaaa 19
<210> 104
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 104
uuugaaguau gccucaaggu u 21
<210> 105
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 105
ccuugaggca uacuucaaa 19
<210> 106
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 106
uuugaaguau gccucaaggu u 21
<210> 107
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 107
ccuugaggca uacuucaaa 19
<210> 108
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 108
uuugaaguau gccucaaggu u 21
<210> 109
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 109
gaccuugagg cauacuucaa a 21
<210> 110
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 110
uuugaaguau gccucaaggu cgg 23
<210> 111
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 111
gaccuugagg cauacuucaa a 21
<210> 112
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 112
uuugaaguau gccucaaggu cgg 23
<210> 113
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 113
gaccuugagg cauacuucaa a 21
<210> 114
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 114
uuugaaguau gccucaaggu cgg 23
<210> 115
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 115
gaccuugagg cauacuucaa a 21
<210> 116
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 116
uuugaaguau gccucaaggu cgg 23
<210> 117
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 117
gaccuugagg cauacuucaa a 21
<210> 118
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 118
uuugaaguau gccucaaggu cgg 23
<210> 119
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 119
gaccuugagg cauacuucaa a 21
<210> 120
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 120
uuugaaguau gccucaaggu cgg 23
<210> 121
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 121
ccuugaggca uacuucaaa 19
<210> 122
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 122
uuugaaguau gccucaaggu c 21
<210> 123
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 123
ccuugaggca uacuucaaa 19
<210> 124
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 124
uuugaaguau gccucaaggu c 21
<210> 125
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 125
ccuugaggca uacuucaaa 19
<210> 126
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 126
uuugaaguau gccucaaggu u 21
<210> 127
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 127
ccuugaggca uacuucaaa 19
<210> 128
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 128
uuugaaguau gccucaaggu u 21
<210> 129
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 129
ccuugaggca uacuucaaa 19
<210> 130
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 130
uuugaaguau gccucaaggu u 21
<210> 131
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 131
ccuugaggca uacuucaaa 19
<210> 132
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 132
uuugaaguau gccucaaggu u 21
<210> 133
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 133
gaccuugagg cauacuucaa a 21
<210> 134
<211> 23
<212> РНК
<213> Искуственная последовательность
<400> 134
uuugaaguau gccucaaggu cgg 23
<210> 135
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 135
ccuugaggca uacuucaaa 19
<210> 136
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 136
uuugaaguau gccucaaggu u 21
<210> 137
<211> 21
<212> ДНК/РНК
<213> Искуственная последовательность
<400> 137
ccuugaggca uacuucaaat t 21
<210> 138
<211> 21
<212> ДНК/РНК
<213> Искуственная последовательность
<400> 138
uuugaaguau gccucaaggt t 21
<210> 139
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 139
uucuccgaac gugucacgu 19
<210> 140
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 140
acgugacacg uucggagaau u 21
<210> 141
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 141
gugugcacuu cgcuucaca 19
<210> 142
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 142
ugugaagcga agugcacacu u 21
<210> 143
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 143
ccuugaggca uacuucaaa 19
<210> 144
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 144
uuugaaguau gccucaaggu c 21
<210> 145
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 145
ccuugaggca uacuucaaa 19
<210> 146
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 146
uuugaaguau gccucaaggu c 21
<210> 147
<211> 19
<212> РНК
<213> Искуственная последовательность
<400> 147
ccuugaggca uacuucaaa 19
<210> 148
<211> 21
<212> РНК
<213> Искуственная последовательность
<400> 148
uuugaaguau gccucaaggu u 21
<210> 149
<211> 21
<212> ДНК/РНК
<213> Искуственная последовательность
<400> 149
ccuugaggca uacuucaaat t 21
<210> 150
<211> 21
<212> ДНК/РНК
<213> Искуственная последовательность
<400> 150
uuugaaguau gccucaaggt t 21
<210> 151
<211> 20
<212> ДНК
<213> Искуственная последовательность
<400> 151
ccgtctgtgc cttctcatct 20
<210> 152
<211> 20
<212> ДНК
<213> Искуственная последовательность
<400> 152
taatctcctc ccccaactcc 20
<210> 153
<211> 24
<212> ДНК
<213> Искуственная последовательность
<400> 153
agcttctttg cagctccttc gttg 24
<210> 154
<211> 24
<212> ДНК
<213> Искуственная последовательность
<400> 154
ttctgaccca ttcccaccat caca 24
<210> 155
<211> 19
<212> РНК
<213> Искуственная последовательность
<220>
<221> разные признаки
<222> (19)..(19)
<223> n为A
<400> 155
ccuugaggca uacuucaan 19
<210> 156
<211> 19
<212> РНК
<213> Искуственная последовательность
<220>
<221> разные признаки
<222> (1)..(1)
<223> n为U
<400> 156
nuugaaguau gccucaagg 19
<---
Реферат
Изобретение относится к области биотехнологии, в частности к новым антисмысловым конъюгатам, и может быть использовано в медицине. Изобретение позволяет получить конъюгат для ингибирования экспрессии гена вируса гепатита В, содержащий малую интерферирующую РНК (миРНК), представляющую собой направленный на ген-мишень модифицированный нуклеотид, и нацеливающий лиганд, который способен связываться с рецепторами асиалогликопротеина (ASGP-R) на поверхности гепатоцитов млекопитающих. Изобретение может быть применимо в медицинской практике в качестве лекарственного средства при лечении патологических состояний или заболеваний, вызванных инфекцией вирусом гепатита B (ВГВ), например хронических заболеваний печени, гепатита, фиброза печени и пролиферативных заболеваний печени. 3 н. и 22 з.п. ф-лы, 6 пр., 4 табл., 28 ил.
Формула









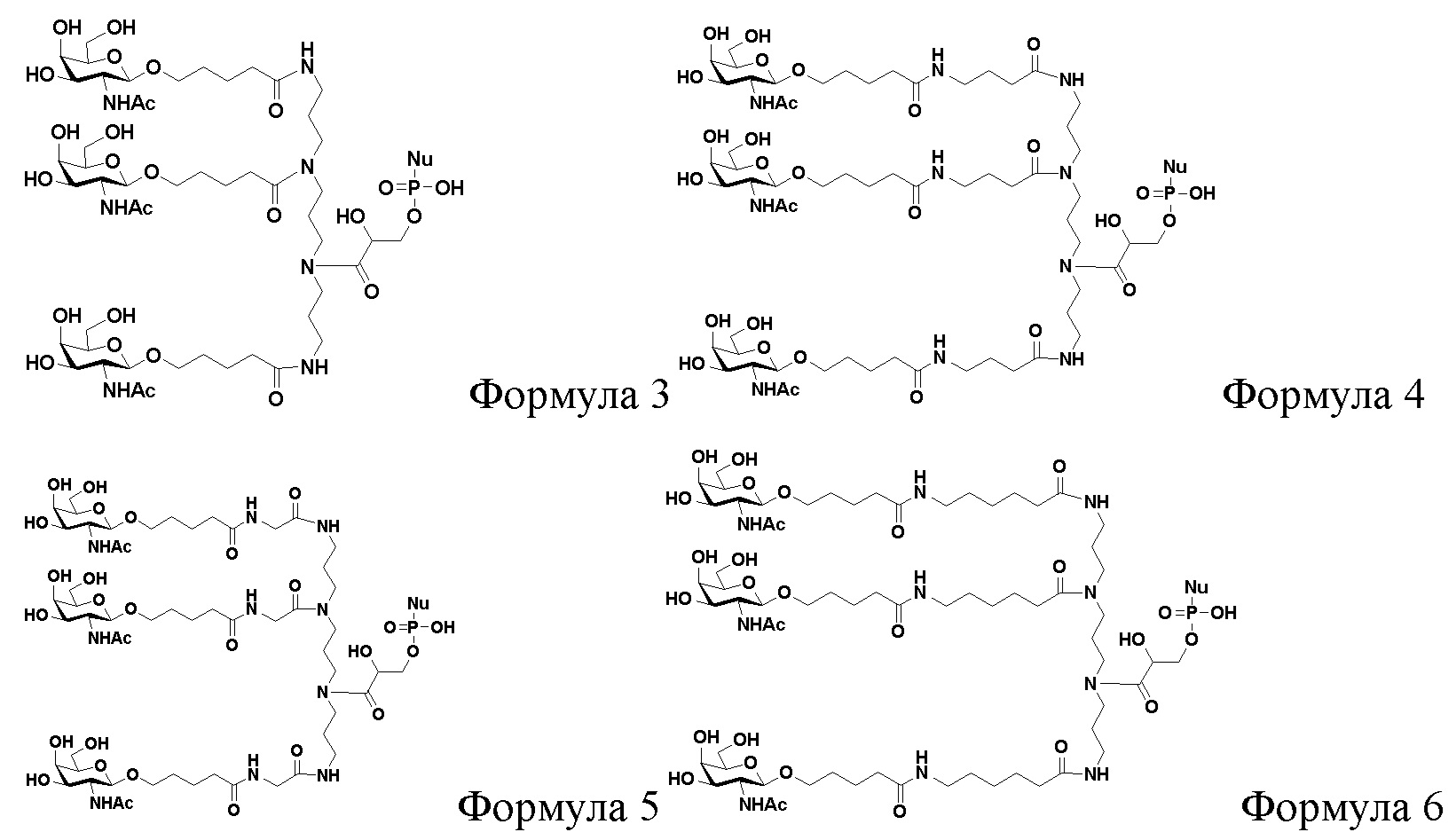




Документы, цитированные в отчёте о поиске
Конъюгат мирнк и способ его получения

Комментарии